JP2014521641A - ホモアルギニンプロドラッグおよび/またはアンフェタミンおよび他の興奮剤の抱合体、ならびに同物を作製および使用するためのプロセス - Google Patents
ホモアルギニンプロドラッグおよび/またはアンフェタミンおよび他の興奮剤の抱合体、ならびに同物を作製および使用するためのプロセス Download PDFInfo
- Publication number
- JP2014521641A JP2014521641A JP2014522802A JP2014522802A JP2014521641A JP 2014521641 A JP2014521641 A JP 2014521641A JP 2014522802 A JP2014522802 A JP 2014522802A JP 2014522802 A JP2014522802 A JP 2014522802A JP 2014521641 A JP2014521641 A JP 2014521641A
- Authority
- JP
- Japan
- Prior art keywords
- amphetamine
- homoarginine
- prodrug
- composition
- salt
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/16—Amides, e.g. hydroxamic acids
- A61K31/165—Amides, e.g. hydroxamic acids having aromatic rings, e.g. colchicine, atenolol, progabide
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/54—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic compound
- A61K47/542—Carboxylic acids, e.g. a fatty acid or an amino acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0053—Mouth and digestive tract, i.e. intraoral and peroral administration
- A61K9/006—Oral mucosa, e.g. mucoadhesive forms, sublingual droplets; Buccal patches or films; Buccal sprays
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/70—Web, sheet or filament bases ; Films; Fibres of the matrix type containing drug
- A61K9/7007—Drug-containing films, membranes or sheets
Landscapes
- Health & Medical Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- General Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Nutrition Science (AREA)
- Physiology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Medicinal Preparation (AREA)
Abstract
ヒト対象においてアンフェタミンの副作用を低減または予防することができる、ホモアルギニンアンフェタミンプロドラッグおよび/または抱合体組成物、それらの塩、またはそれらの組み合わせ、およびヒト対象においてアンフェタミンの副作用を低減または予防する方法を開示する。本技術は、ヒト対象においてアンフェタミンの副作用を低減または予防するホモアルギニンアンフェタミンプロドラッグおよび/または抱合体の改良型投薬形態に関する。加えて、本明細書で説明される技術はまた、概して、ヒトにおいてアンフェタミンの副作用を低減または予防する方法にも関する。
【選択図】図1
【選択図】図1
Description
本技術は、ヒト対象においてアンフェタミンの副作用を低減または予防するホモアルギニンアンフェタミンプロドラッグおよび/または抱合体の改良型投薬形態に関する。加えて、本明細書で説明される技術はまた、概して、ヒトにおいてアンフェタミンの副作用を低減または予防する方法にも関する。
アンフェタミンおよびその誘導体を含む興奮剤は、交感神経系および/または中枢神経系(CNS)の活性を強化し、例えば、注意欠陥過活動性障害(ADHD)、注意力欠如障害(ADD)、肥満、ナルコレプシー、食欲抑制、うつ病、不安、および覚醒状態を主に包含する、一連の状態および疾患の治療のために処方される。
児童における注意欠陥過活動性障害(ADHD)は、多年にわたって興奮剤で治療されてきた。しかしながら、つい最近では、成人人口におけるADHD治療のための処方数の増加が、小児科市場の成長を凌ぐ場合もある。メチルフェニダート(例えば、Ritalin(登録商標)という商標の下でNovartis International AG(Basel,Switzerlandにある)から市販されている)、および非刺激性アトモキセチン(Strattera(登録商標)としてEli Lilly and Company(Indianapolis,INにある)から市販されている)等のADHDの治療に現在使用されている種々の薬剤があるが、アンフェタミンが、ADHD治療における先駆物質であった。また、教室での試験中に、非興奮剤は、ADHD罹患児童の挙動および注意を向上させることにおいて、アンフェタミン誘導体ほど効果的ではないことが示されている。
ADHDの初期薬物療法は、例えば、リバウンド症候群、心臓血管系ストレス/障害(例えば、心拍数の増加、高血圧症、心筋症)、または他の副作用(例えば、不眠症、陶酔感、精神病エピソード)、依存症、および乱用を引き起こす、興奮性活性成分の治療効果の急速消失を含む、一連の潜在的に望ましくない副作用を誘起する興奮剤(例えば、英国にあるSmith Kline and Frenchから市販されている純硫酸デキストロアンフェタミンである、Dexedrine(登録商標))の即効性即時放出製剤に限定された。
挙動悪化(リバウンド/「機能停止」)は、典型的には、午後または早朝に、薬剤の消失としてADHDがある児童の大部分で観察される。リバウンド症状は、例えば、興奮性、不機嫌、服薬していない状態よりも悪い過活動性、悲しみ、号泣、および稀な症例では精神病エピソードを含む。症状は、迅速に治まるか、または数時間続く場合がある。非常に重度のリバウンド/機能停止を体験し得るため、治療を中断しなければならない患者もいる。リバウンド/機能停止効果はまた、予測されるリバウンド/機能停止の負の転帰および副作用を予防する意図で、興奮剤の追加の投与量を投与するように患者を誘うことによって、常習的挙動を生じ得る。
メチルフェニダートおよびアンフェタミン等の興奮剤は、例えば、心拍数の増加、高血圧症、動悸、頻脈、および孤立した症例では心筋症、卒中、心筋梗塞、および突然死を含む、心臓血管系事象につながり得る、ノルアドレナリンおよびドーパミン作用を呈することが知られている。その結果として、現在入手可能な興奮剤は、既存の構造的な心臓の異常または他の重度の心臓適応症がある患者を、さらに大きい健康リスクにさらし、頻繁に、この集団では使用されないか、または慎重に使用される。しかしながら、例えば、心拍数および血圧への興奮剤の心臓血管系作用は、投与された投与量に依存していることが注目に値する。結果として、治療的に有益な持続時間にわたって最低有効興奮剤血中濃度を維持する治療が、より少ない心臓血管系リスク/副作用を実証すると考えられる。
アンフェタミンおよびその誘導体の多く(例えば、メタンフェタミン、3,4−メチレンジオキシ−メタンフェタミン/「エクスタシー」)は、陶酔感、長期間の覚醒/覚醒状態、または急速な減量等の種々の目的で、あるいは、リバウンド症状が、例えば、不安またはうつ病で発現することを防止するように、過剰な自己投薬習慣を身に付けた実際のADHD患者によって、広く乱用されている。潜在的な乱用者によって所望される効果は、中枢神経系の刺激に起因するものであって、1970年に規制物質法(Controlled Substance Act;CSA)の成立後は、アンフェタミン(d−およびl−アンフェタミン単独、ならびに両方の任意の組み合わせがスケジュールIIである)およびそのある誘導体のためのスケジュールIIまたはスケジュールI分類さえ促した。両方の分類は、乱用の高い傾向によって定義される。スケジュールII薬剤が、容認された医学的用途を有する一方で、スケジュールI物質は、CSAに準拠しない。今までのところ、持続放出製剤およびそれらのプロドラッグを伴う組成物を含む、全てのアンフェタミン製品は、アンフェタミン乱用および依存の可能性について患者に知らせるように薬剤ラベル上に黒い枠で囲まれた警告文を含む義務がある。
従来技術では、アンフェタミンのほとんどの副作用は、(典型的には4〜6時間以内に)治療有効性を下回るレベルまで迅速に失われる、興奮剤の血中濃度の大きな初期急上昇によって引き起こされることが観察されている。結果として、デキストロアンフェタミン(d−アンフェタミン)の高い効力が、より安全で乱用の可能性が低い治療成果および計画を生成する目標で、よりゆっくりとアンフェタミンを血流中に送達することによって達成される、ますます持続放出型のプロファイルを伴う一連の新しい薬剤によって、後に変調された。薬剤血中濃度の急上昇をより小さくするための方法および技術は、例えば、混合塩および異性体組成物(すなわち、d−アンフェタミンおよび効力が低いl−アンフェタミンの異なる塩)、除放/制御/持続放出製剤(例えば、Wayne,PAにあるShire U.S.,Inc.から市販されているAdderall X(登録商標))、つい最近では、アンフェタミンのプロドラッグ(同様にShireから市販されているVyvanse(商標))の使用を含む。理想的な薬物療法オプションは、心臓血管系ストレスおよび挙動悪化を最小限化するために、その後に長期のフェードアウト期間が続く、長期間にわたって狭い治療域内で興奮剤血中濃度を生じるべきであり、また、乱用防止性質も呈するであろう。
即時放出製剤のほかに、複数の日常投与と対比した1日1回投与の投薬計画の便宜性を提供する、治療オプションを提供する目的で、より新しい持続放出製剤が開発されてきた。そのような製剤はまた、陶酔的応答を付与する、または与えるという目的も有する。持続放出製剤は、一般的には、比較的定義された期間にわたって消化管による活性薬剤物質の吸収を遅延および延長させる、ポリマーまたはポリマーブレンドで被覆された薬剤粒子から成る。そのような製剤は、頻繁に、親水性ハイドロコロイドゲル化ポリマーマトリクス(例えば、ヒドロキシプロピルメチルセルロース、ヒドロキシプロピルセルロース、またはプルラン)内に治療薬/活性成分/薬剤を埋め込む。この投与製剤は、ひいては、ヒトおよび動物の胃の中で見出されるような酸性媒質に進入すると、ゲルになり、その後すぐに、治療薬/活性成分/薬剤をゆっくりと流出させる。しかしながら、投与製剤は、ヒトおよび動物の腸の中で見出されるようなアルカリ性媒質の中で溶解し、同時に、制御されない方式でより迅速に薬剤を解放する。アクリル樹脂、アクリルラテックス分散、酢酸フタル酸セルロース、およびフタル酸ヒドロキシプロピルメチルセルロース等のいくつかの製剤は、酸性環境に耐性を持ち、独力で、または親水性ポリマーとの混合のいずれかで、分散・浸食機構を介して、高pHのみにおいて活性成分を分注することによって、腸の中で向上した持続放出を提供する。
持続放出製剤は、即時放出錠剤と比べて改良され拡張された投薬形態を提供することにおいて適度に効果的である。それにもかかわらず、そのような製剤は、ポリマー材料の破壊により、治療薬の一貫性がない異常または早期放出を潜在的に受け、また、通常は、単純な物理的手順を利用して、活性成分の容易な抽出を可能にする。1日1回の投与製剤は、即時放出製剤よりも大量のアンフェタミンを含有するため、潜在的な乱用者にとってより魅力的であり、その結果として、薬剤物質の抽出性を追加の望ましくない性質にする。それはまた、少なくとも部分的に、ADHD患者であり、持続放出アンフェタミンカプセルを保有している学童による薬剤の販売または取引によって特に明白である、薬剤流用の増加の理由でもある。次いで、入手した興奮剤は、高用量を摂取すること、または薬剤物質を粉砕した後に鼻で吸い込むことのいずれかによって、障害がない級友によって乱用される。
特許文献1(出願人New River Pharmaceuticalsに対する、以降では「第’486号特許」)は、アンフェタミンに共有結合した化学部分(つまり、L−リジン)を含む化合物、またはそれらの組成物、および同物を使用する方法を説明すると考えられる。これらの化合物およびそれらの組成物は、アンフェタミンの乱用および過剰摂取を低減または予防するために有用であるとされている。第’486号特許はまた、l−リジン以外の任意のアミノ酸(表46)を使用することが、l−リジン−d−アンフェタミン(Lys−Amp、Vyvanse(商標))によって実証される同一の生体内性質を生じないであろうことも説明する。ヒトでは、標準アミノ酸抱合体のうちの少なくともいくらかが吸収され、開裂したアンフェタミンよりもむしろ無傷の抱合体として循環系に進入する。血流中の無傷の抱合体の存在は、予期しない副作用につながり得る。結果として、当技術分野内では、アンフェタミンのより安全な投薬形態、および治療的に有効であり、持続放出および持続治療効果を提供することができ、血流中の無傷のアンフェタミン抱合体の存在により起こり得る副作用を制限することができる、患者準拠治療計画の必要性が依然として存在している([a]非特許文献1[b]非特許文献2[c]非特許文献3[d]非特許文献4[e]非特許文献5)。
Boellner,S.W.;et al.Pharmacokinetics of lisdexamfetamine dimesylate and its active metabolite,d−amphetamine,with increasing oral doses of lisdexamfetamine dimesylate in children with attention−deficit/hyperactivity disorder:a single−dose,randomized,open−label,crossover study.Clinical Therapeutics 2010,32(2),252−264.
Krishnan,S.M.;et al.Metabolism,distribution and elimination of lisdexamfetamine dimesylate:open−label,single−centre,phase I study in healthy adult volunteers.Clinical Drug Investigation 2008,28(12),745−755.
Krishnan,S.;et al.Relative bioavailability of lisdexamfetamine 70−mg capsules in fasted and fed healthy adult volunteers and in solution:a single−dose,crossover pharmacokinetic study.Journal of Clinical Pharmacology 2008,48(30),293−302.
Krishnan,S.M.;et al.Multiple daily−dose pharmacokinetics of lisdexamfetamine dimesylate in healthy adult volunteers.Current Medical Research and Opinion 2008,24(1),33−40.
Emer,J.;et al.Lisdexamfetamine dimesylate:linear dose−proportionality,low intersubject and intrasubject variability,and safety in an open−label single−dose pharmacokinetic study in healthy adult volunteers.Journal of Clinical Pharmacology 2010,50(9),1001−1010
一般に、少なくとも1つの態様における本明細書で説明される技術は、経口投与時に安全な治療域内でヒトの血液系の中へアンフェタミンの低速/持続/制御送達を可能にするだけでなく、血流中の検出可能なプロドラッグの量も制限する、ホモアルギニンアンフェタミン抱合体/プロドラッグの改良型投薬形態を対象とする。
したがって、本明細書で説明される技術は、定量限界を下回る無傷のホモアルギニンアンフェタミン抱合体の血漿中濃度をヒト対象において呈する、ホモアルギニンアンフェタミンの少なくとも1つの抱合体、その塩、またはその組み合わせを含む、1つ以上の組成物を提供する。抱合体を形成するようにホモアルギニン非標準アミノ酸に化学的結合した(好ましくは共有結合した)アンフェタミンは、通常の代謝プロセスによって、体内でその活性形態に変換される。
いかなる特定の理論によっても拘束されることを望むわけではないが、本技術のホモアルギニンアンフェタミン抱合体は、長期間にわたってアンフェタミンの制御された血中レベルを提供することによって、アンフェタミンの他の持続放出形態よりも安全であり、したがって、従来の興奮剤治療オプションと関連付けられるリバウンド効果、心臓血管系ストレス、および陶酔感を予防すると考えられる。さらに、無傷のホモアルギニンアンフェタミン抱合体がヒトの血流に吸収されないため、ホモアルギニンアンフェタミン抱合体は、無傷のアンフェタミン抱合体として血流に進入する他のアンフェタミン抱合体で起こり得る副作用を低減または予防すると考えられる。
本明細書で説明される技術はさらに、少なくとも1つのホモアルギニンアンフェタミン抱合体をヒト対象に経口投与することによって、アンフェタミン副作用を低減または予防する方法を提供する。本技術のホモアルギニンアンフェタミン抱合体の経口投与後のアンフェタミンの放出は、長期間にわたって次第に起こり、それによって、ヒト患者の血流中の薬剤レベルの意図しない上昇(例えば、血中レベル濃度の急上昇)を排除することができる。例えば、25mgのホモアルギニンアンフェタミンの単回経口投与後、ヒトにおいてアンフェタミンの最大血漿中濃度に達するまで約3時間かかる。その後、アンフェタミンは、約45時間の期間にわたってゆっくりと排除される。再度、いかなる特定の理論によっても拘束されることを望むわけではないが、また、血中レベルのそのような急上昇は、陶酔効果のある薬剤による「恍惚状態」および/または血圧および心拍数の増加のような心臓血管系作用につながり得ることも考えられる。加えて、持続血中レベルが、他の従来の治療よりも長い持続時間にわたって有効治療域内で達成され、それにより、リバウンド効果を予防する。また、アンフェタミンの持続血中レベルが、無傷の抱合体の吸収を通してではなく、開裂したアンフェタミンの結果として達成され、それにより、血流中の無傷の抱合体の存在から生じる、副作用、毒性、および/または未知あるいは不要な作用の可能性を低減させる。
本技術のホモアルギニンアンフェタミン抱合体は、好ましくは、注射または鼻腔内投与経路を通して投与されたときに、薬理活性を全く持たないか、または大幅に減少した薬理活性を有する。しかしながら、それらは、経口で生物学的に利用可能なままである。再度、いかなる特定の理論によっても拘束されることを望むわけではないが、生物学的利用能は、経口投与後の化学結合(例えば、共有結合)の加水分解の結果であり得る。化学結合の加水分解は、時間依存性であり、それにより、無傷の抱合体の利用可能性を制限しながら、アンフェタミンが長期間にわたってその活性形態で利用可能となることを可能にする。少なくとも1つの実施形態では、本技術の組成物が非経口経路によって送達されたときに、アンフェタミンの放出が軽減または排除される。
本技術のいくつかの実施形態では、アンフェタミンは、アンフェタミンの代謝産物、その塩、その誘導体、またはその混合物であり得る。アンフェタミンは、デキストロ(d−)、レボ(l−)、またはラセミの形態であり得る。1つの好ましいアンフェタミンは、d−アンフェタミンである。
別の態様では、本明細書で説明される技術は、少なくとも1つのホモアルギニンアンフェタミンの投与量を含むように製剤化された組成物を、必要としている患者に経口投与するステップを含む、CNS(中枢神経系)の刺激を必要とする障害または症状があるヒト患者において興奮剤の副作用を低減または予防する方法を提供し、投与量は、約5mgから約40mgのアンフェタミン遊離塩基の当量を提供し、抱合体またはその塩は、経口投与ステップ後にヒトの血流中の定量限界を下回る。代替として、用量はまた、約9mgから約30mgのアンフェタミン遊離塩基の当量で提供されてもよい。
さらなる態様では、本明細書で説明される技術は、ヒトにおいてアンフェタミンまたはアンフェタミン誘導体の副作用を低減または予防するための1つ以上の組成物であって、少なくとも1つの経口投与されるホモアルギニンアンフェタミン抱合体またはその塩、あるいは少なくとも1つのホモアルギニンアンフェタミン誘導体抱合体またはその塩を含む、組成物(複数可)を提供し、抱合体またはその塩のいずれか一方は、約5mgから約40mgの範囲内のアンフェタミン遊離塩基と同等な量で組成物中に存在し、抱合体またはその塩のいずれか一方は、経口投与後にヒトの血流中の定量限界を下回る。
本技術の少なくとも1つの実施形態では、組成物中のアンフェタミンへのホモアルギニン非標準アミノ酸の化学結合(好ましくは共有結合)は、活性剤/成分の薬理活性を正常用量範囲内で維持しながら、治療的と見なされる用量を上回る用量での興奮剤の毒性を減少させることによって、組成物が患者に投与されるときに過剰摂取の潜在性を大幅に減少させることができる。いかなる特定の理論によっても拘束されることを望むわけではないが、アンフェタミンと抱合されたホモアルギニンは、アンフェタミンの薬理活性を減少または排除し得ることが考えられる。したがって、活性を回復させることは、ホモアルギニンアンフェタミン抱合体からのアンフェタミンの放出を必要とする。
本発明の他の目的、利点、および実施形態が、以下で説明され、本発明のこの説明および実践から明白となるであろう。
本明細書で説明される技術は、血流中の無傷のアンフェタミン抱合体の存在から示され、観察され、または潜在的に体験される、副作用または他の不要な作用を低減または予防する、ホモアルギニンアンフェタミン抱合体、それらの塩、またはそれらの組み合わせの1つ以上の改良型投薬形態に関する。好ましい改良型組成物および/または投薬形態は、経口薄片に製剤化されるホモアルギニンアンフェタミン二塩酸塩の塩である。ヒト対象においてアンフェタミンの副作用を低減または予防する方法も開示される。
本明細書で使用されるように、「非標準」アミノ酸とは、「標準的な」20個のアミノ酸のうちの1つではない、自然発生アミノ酸を指す。非標準アミノ酸は、遺伝子コドンも持たず、天然起源のタンパク質にも組み込まれない。非標準アミノ酸の1つのカテゴリは、他のアミノ酸の代謝産物である。
本明細書で使用されるように、「アンフェタミン」は、限定されないが、アンフェタミン(アルファ−メチル−フェネチルアミン)、メタンフェタミン、p−メトキシアンフェタミン、メチレンジオキシアンフェタミン、2,5−ジメトキシ−4−メチルアンフェタミン、2,4,5−トリメトキシアンフェタミン、および3,4−メチレンジオキシ−メタンフェタミン等の、中枢神経系刺激活性を有する交感神経フェネチルアミン誘導体のうちのいずれかを意味するものとする。
本明細書で使用されるように、「プロドラッグ」は、体内で代謝されて活性にされるまで、自然には活性ではない薬剤の形態を意味するものとする。
本明細書で使用されるように、「製造業者の指示と矛盾する方式で」または類似表現は、限定されないが、ラベル上で説明される、または免許を受けた医師によって指図される量よりも多い量を消費すること、および/または本組成物が注射、吸引、または喫煙し得るように、任意の手段で(例えば、粉砕、破壊、融解、分離等)投薬製剤を改変することを含むように意図されている。
本明細書で使用されるように、「減少させられる」、「低減させられる」、「軽減される」、または「低下させられる」等の語句は、薬理活性の少なくとも10%変化を含むように意図されており、より大きい割合の変化が、乱用の可能性および過剰摂取の可能性の低減のために好ましい。例えば、変化はまた、25%、35%、45%、55%、65%、75%、85%、95%、96%、97%、98%、99%よりも大きく、またはその中のありとあらゆる増分であってもよい。
本明細書で使用されるように、「血流中で実質的に検出不可能である」という語句は、少なくとも1.00ng/mLの定量限界を下回る濃度を指す。
本明細書で使用されるように、「定量限界を下回る」(LLOQ)という語句は、概して、濃度を指し、それを下回ると、有効LC−MS/MS(液体クロマトグラフィ質量分析/タンデム質量分析)方法ならびに関連較正曲線および標準を用いた、1つ以上の選択された活性薬理成分(複数可)(「API(複数可)」、例えば、アンフェタミン)に関するヒト体液サンプル(例えば、血漿サンプル)の分析は、正確なデータを生じない場合がある。言い換えると、ヒト体液サンプルの分析によりLLOQである濃度値であった場合、1つ以上の選択された活性薬理成分(複数可)の濃度が所与のLLOQ値を上回らないことを正確に結論付けることができる。実施例として、ホモアルギニンアンフェタミンプロドラッグの少なくとも25mg用量を含有する経口溶液の投与は、1.00ng/mLのLLOQを超える無傷のホモアルギニンアンフェタミンプロドラッグの血漿中濃度を生じない。
例えば、以下の方法によって、より低い定量限界(LLOQ)を判定することができる。血漿サンプルが、有効LC−MS/MS方法を用いて、アンフェタミンについて分析される(3回ずつ)。較正曲線は、血漿較正標準の濃度に対して内部標準(アンフェタミン−d5)に対するアンフェタミンのピーク面積比を描画することによって作成される。次いで、較正曲線は、重量線形最小二乗回帰分析によって適合され、1.00ng/mLの濃度(LLOQ)まで直線状であることが分かる。LLOQにおける精度および正確度は、1.00ng/mL血漿標準の6つのサンプルを分析し、「逆算された」濃度値を得るように最小二乗回帰線の導出された方程式に観察されたピーク面積を入れることによって、検証される。
本開示で使用され得る、いくつかの略称は、DCC=ジシクロヘキシルカルボジイミド、NHS=N−ヒドロキシスクシンイミド、EtOAc=酢酸エチル、MsOH=メタンスルホン酸、EDCI=1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド、PyBrOP=ヘキサフルオロリン酸ブロモ−トリス−ピロリジノホスホニウム、NMM=N−メチルモルホリンまたは4−メチルモルホリン、TEA=トリエチルアミン、CDI=カルボニルジイミダゾール、IPAC=酢酸イソプロピル、DEA=ジエチルアミン、BOP=ヘキサフルオロリン酸(ベンゾトリアゾール−1−イルオキシ)トリス(ジメチルアミノ)ホスホニウムを含む。
本明細書で説明される技術によれば、ホモアルギニンは、アンフェタミンのホモアルギニンプロドラッグを産生するように、アンフェタミン(d−、l−、またはラセミ形態、あるいはその混合物)に化学(好ましくは共有)結合することができる。アンフェタミンの代謝産物および誘導体もまた、同一の潜在的利益で修飾されることができる。アンフェタミンの代謝産物の実施例は、N−ヒドロキシアンフェタミン、4−ヒドロキシアンフェタミン、α−ヒドロキシアンフェタミン、ノルエフェドリン、4−ヒドロキシノルエフェドリン、フェニルアセトンオキシム、フェニルアセトン、および1−フェニル−2−プロパノールを含む。
形成および利用することができるホモアルギニンアンフェタミンプロドラッグの塩は、メシル酸塩、塩酸塩、硫酸塩、シュウ酸塩、トリフラート、クエン酸塩、リンゴ酸塩、酒石酸塩、リン酸塩、硝酸塩、安息香酸、酢酸塩、炭酸塩、水酸化物、ナトリウム、カリウム、マグネシウム、カルシウム、亜鉛、およびアンモニウム塩を含むが、それらに限定されない。さらに、いくつかの実施形態によれば、塩は、複数の形態(例えば、ジ−、トリ−、またはテトラ−)で必要とされてもよい。遊離塩基、遊離酸、または中性形態等の他の誘導体形態もまた、調製されてもよい。
概して、ホモアルギニンをアンフェタミンと抱合するために、ホモアルギニンがアンフェタミンと反応させられる前に、アミノ基およびグアニジノ基が、好ましくは保護される。反応物中のアミノ基およびグアニジノ基を保護するための作用物質および方法が、当技術分野で公知である。アミノ基を保護するために使用され得る保護基の例は、フルオレニルメチルオキシカルボニル(Fmoc)、炭酸t−ブチル(Boc)、トリフルオロ酢酸(TFA)、およびベンジルオキシカルボニル(Z)を含むが、それらに限定されない。グアニジノ基の追加の保護が、必要であり得る。グアニジノ基を保護するために使用され得る保護基の例は、炭酸t−ブチル(Boc)、ベンジルオキシカルボニル(Z)、およびニトロを含むが、それらに限定されない。任意の標準結合手順を用いた結合後、対応する塩形態を生じるように、例えば、水素ガスまたは任意の他の水素化物ドナー分子の存在下でパラジウム炭素等の触媒を使用する接触水素化を介して、および/または塩酸、硫酸、臭化水素酸、またはメタンスルホン酸等の種々の強酸を用いて、保護基に応じて脱保護が起こり得る。パラジウム炭素の代わりに使用することができる他の触媒の例は、三塩化チタン(TiCl3)、二塩化スズ(SnCl2)、ラネーニッケル、酸化白金(IV)(PtO2)、二ヨウ化サマリウム(SmI2)、Ushibara触媒(例えば、U−Ni−A、U−Ni−B、U−Ni−BA、U−Ni−AA、U−Ni−NH3、U−Co−A、U−Co−B、U−Fe(II)、式中、A=酸、B=塩基、BA=アルミニウムを伴う塩基、AA=アルミニウムを伴う酸)、および鉄金属を含む。塩形態はまた、最初に生成物を遊離塩基化し、次いで、任意の酸を添加することによって切り替えられてもよい。中性、遊離塩基、または陰イオン塩もまた、形成されてもよい。
アミノ基およびグアニジノ基が保護されるアミノ酸を、N−保護アミノ酸と呼ぶことができる。結合反応の前にアミノ酸を保護するか、または市販のN−保護アミノ酸を直接使用するか、どちらかを行うことができる。好ましくは、N−保護アミノ酸の中のカルボン酸基は、アンフェタミンとのN−保護アミノ酸の反応を助けるように、酸活性化剤(カップリング試薬と呼ばれることもある)によって活性化される。ペプチド結合を形成するアミノ酸の反応についての一般情報は、例えば、参照することによりその全体が本明細書に組み込まれる、G.C.Barett,D.T.Elmare,Amino Acids and Peptides,page 151−156,Cambridge University Press,UK(1st edition,1998)、Jones,J.,Amino Acid and Peptide Synthesis,pages 25−41,Oxford University Press,UK(2nd edition,2002)で見出すことができる。
当技術分野で周知である酸活性化剤(カップリング試薬)の1つのカテゴリは、カルボジイミドである。カルボジイミド酸活性化剤の例は、ジシクロヘキシルカルボジイミド(DCC)、1−エチル−3−(3’−ジメチルアミノプロピル)−カルボジイミド(EDCI)、およびジイソプロピルカルボジイミド(DIPCDI)を含むが、それらに限定されない。使用することができる他のカップリング試薬の例は、ヘキサフルオロリン酸ブロモ−トリス−ピロリジノホスホニウム、ヘキサフルオロリン酸(ベンゾトリアゾール−1−イルオキシ)−トリス−(ジメチルアミノ)ホスホニウム、PCl5/PhH、SOCl2、N2H4、1−エトキシカルボニル−2−エトキシ−1,2−ジヒドロキノリン、他のホスホニウム試薬、およびウロニウム試薬を含む。適切なハロゲン化アシルまたは無水物の使用も考慮される。
次いで、保護基に応じて、上記で説明されるようなN−保護アミノ酸およびアンフェタミンの反応に起因するアンフェタミンのN−保護アミノ酸抱合体は、アンフェタミンのアミノ酸抱合体の対応する最終塩形態を産生するように、例えば、水素化を介して、1ステップで、または、例えば、塩酸、臭化水素酸、硫酸、またはメタンスルホン酸等の強酸を用いた処理が後に続く水素化を介して、2ステップで、脱保護または非保護することができる。
以下のスキーム1は、本明細書で説明される技術による、ホモアルギニンに化学結合したアンフェタミンの誘導体の合成のための例示的な経路を概説する。この例示的な反応式では、ホモアルギニンアンフェタミンのHCl塩形態が産生される。手順は、出発物質として炭酸tert−ブチル(Boc)およびニトロ保護ホモアルギニン(Boc−ホモアルギニン(ニトロ))を使用する。この例示的な反応式では、カップリング剤EDCIが、Boc−ホモアルギニンに添加される。次いで、N−ヒドロキシコハク酸イミド(NHS)が、ジメチルホルムアミド(DMF)中の反応混合物に添加される。Boc−ホモアルギニン(ニトロ)の安定しているが依然として活性化されたコハク酸エステルが形成される。次いで、対応する保護されたプロドラッグである、Boc−ホモアルギニン(ニトロ)−Ampを作製するように、アンフェタミンが、Boc−ホモアルギニン(ニトロ)の結果として生じるコハク酸エステルに添加される。この保護されたプロドラッグは、例示的な反応スキーム1およびスキーム2の中のホモアルギニンアンフェタミンの塩酸塩である、アンフェタミンのプロドラッグを産生するように、メタンスルホン酸(MsOH)または塩酸等の強酸が後に続く水素化を使用して、脱保護または非保護することができる。
(触媒および/または水素を伴う、または伴わない)ニトロ基を脱保護し得る代替的な反応条件は、シクロヘキサジエンを伴うパラジウム炭素触媒、ギ酸およびメタノールを伴うパラジウム炭素触媒、6というpHにおける塩化チタン、ギ酸を伴う二塩化スズ、1N硫酸を用いた電解、ならびに水および酸の存在下の酸素ガスを含む。
本明細書で説明される技術で使用することができる他の溶媒の例は、酢酸イソプロピル(IPAC)、アセトン、およびジクロロメタン(DCM)、ジメチルホルムアミド(DMF)、2−メチルテトラヒドロフラン(2−MeTHF)、酢酸エチル、クロロホルム、ジメチルスルホキシド、ジオキサン、ジエチルエーテル、メチルt−ブチルエーテル、ヘキサン、ヘプタン、メタノール、エタノール、イソプロパノール、およびブタノールを含むが、それらに限定されない。異なる溶媒の混合物もまた、使用することができる。第3級アミン等の共同塩基が、本明細書で説明される技術の結合反応において添加されてもよく、または添加されなくてもよい。好適な共同塩基の例は、1−メチルモルホリン(NMM)、4−メチルモルホリン、トリエチルアミン(TEA)、アンモニア、または任意の第3級アミン塩基を含むが、それらに限定されない。
ホモアルギニンに化学結合されるアンフェタミンは、d−形態、l−形態、またはラセミ形態であり得るか、あるいはその混合物であり得る。本明細書で説明される技術のいくつかの実施形態によれば、d−アンフェタミン(デキストロアンフェタミン)およびホモアルギニンは、アンフェタミンプロドラッグを作製するために使用される。いくつかの他の実施形態によれば、d−アンフェタミンのプロドラッグは、l−アンフェタミンのプロドラッグまたはl−アンフェタミン自体と組み合わせて使用することができる。
本技術のホモアルギニンアンフェタミンプロドラッグは、注射または鼻腔内投与経路を通して投与されたときに、薬理活性を全く持たないか、または大幅に減少した薬理活性を有する。しかしながら、それらは、経口で生物学的に利用可能なままである。生物学的利用能は、経口投与後の共有結合の加水分解の結果である。化学結合の加水分解は、時間依存性であり、それによりアンフェタミン、および4−ヒドロキシアンフェタミンおよび4−ヒドロキシノルエフェドリン等の他の代謝産物が長期間にわたってそれらの活性形態で利用可能となることを可能にする。したがって、本技術のプロドラッグ化合物は、長期間にわたってアンフェタミンまたは別の興奮剤を放出し、遊離アンフェタミンと比較して、最大濃度(Cmax)または同等Cmaxの急上昇をほとんどまたは全く伴わずに、治療的曲線下面積(AUC)を提供することができる。いかなる特定の理論によっても拘束されることを望むわけではないが、ホモアルギニンがプロドラッグを産生するために使用されるため、酵素によるプロドラッグの生体内分解は、d−アンフェタミンのより低い暴露につながる、より遅い速度で起こるであろうと考えられる。これは、この種類のプロドラッグが、ゆっくりと、好ましくは、生体内条件下でのみ、アンフェタミンを放出することを可能にするであろう。別の理論は、無傷のホモアルギニンアンフェタミンが、例えば、アミノ酸輸送体によって認識されていない、または腸内流出物輸送体のための物質である、非常に極性のアミノ酸側鎖により、腸の中で吸収されにくい、またはゆっくりと吸収されることであり得る。アンフェタミンの放出が、例えば、腸壁の中で起こり、ホモアルギニンアンフェタミン抱合体が、繰り返し取り込まれ、腸細胞から送出される場合、無傷のプロドラッグは、一度に短期間にわたって加水分解酵素に暴露されるのみである。その結果として、ホモアルギニンアンフェタミンの投与用量の大部分は、アンフェタミンを放出するように吸収および流出の多数の反復を受けなければならず、長期かつ減衰したプロファイルをもたらすであろう。
当業者によって理解されるように、薬剤製品は、同一の活性成分(複数可)を含有し、同一の投薬形態、投与経路であり、強度または濃度が同一である場合、薬学的同等物と見なされる。薬学的に同等の薬剤製品は、同一の投薬形態で同量の活性成分を含有するように、および同一または包括的または他の適用可能標準(すなわち、強度、質、純度、および同一性)を満たすように、製剤化されるが、それらは、形状、スコアリングコンフィギュレーション(scoring configuration)、放出機構、包装、賦形剤(色、香味料、防腐剤を含む)、有効期限、およびある制限を伴って標識等の特性が異なってもよい。薬剤製品は、それらが薬学的同等物である場合のみ、または標識で特定される条件下で患者に投与されるときに同一の臨床効果および安全プロファイルを有すると期待できる場合に、治療的同等物であると見なされる。他方で、「生物学的同等物」という用語は、類似実験条件下で研究されたときに、同程度の生物学的利用能を示す、薬学的同等物または薬学的代替製品を表す。
いったん産生されると、本技術のアンフェタミン(または別の興奮剤)のプロドラッグは、経口送達経路を通して投与することができ、いったん投与されると、消化条件下で興奮剤を放出するであろう。いかなる特定の理論によっても拘束されることを望むわけではないが、任意の無傷のホモアルギニンアンフェタミンは、消化管をさらに下って、例えば、より腸の下部で吸収される可能性が高く、そこでは、pHがより高く、より多くのプロドラッグが非イオン化形態で存在する。プロドラッグの親水性および極性性質、ならびに上記で説明されるような化学結合の加水分解の遅い速度により、高レベルの薬剤が、偶発的または意図的のいずれかで投与された場合、プロドラッグは、大量の興奮剤を放出する前に、また吸収されて無傷のプロドラッグとして血流に到達することなく、代謝および/または排出経路によって取り除かれるであろう。また、長期間にわたるアンフェタミン(または別の興奮剤)の遅い減衰した放出は、アンフェタミン治療を制限または終了し得る、薬剤誘発性副作用を緩和または軽減するはずである。これらの副作用は、心拍数および呼吸数の増加、血圧の上昇、眼の瞳孔の散大、および食欲の減少を含む((Adderall(登録商標)ラベル、Dexedrine(登録商標)ラベル)。他の副作用は、不安、ぼやけた視界、不眠、および目まいを含む。また、アンフェタミンは、強力な精神刺激薬であり、薬物乱用の傾向がある([a]Maxwell,J.C.;et al.The prevalence of methamphetamine and amphetamine abuse in North America:a review of the indicators,1992−2007.Drug and Alcohol Review 2008,27,229−235.[b]Amphetamine−type stimulants:a report from the WHO meeting on amphetamines,MDMA and other psychostimulants,Geneva,12−15 November 1996)。
興奮剤の薬物乱用は、しばしば、事象の深刻化によって特徴付けられる。第1に、大幅な「感情の沸き上がり」または恍惚状態が、増加する経口投与量から得られる場合がある。ホモアルギニンアンフェタミンプロドラッグの性質により、これらの乱用の潜在的経路は、プロドラッグの極性性質を介して軽減することができる。つまり、いったん治療レベルよりも高いレベルで投与されると、身体が吸収せず、後に、アンフェタミンに分解することなく、全ての残りのプロドラッグを排出するであろう。経口量が達成可能量を超える場合、喫煙、鼻で吸い込むこと、または注射を含む、他の経路を探索することができる。本明細書で説明される技術によれば、アンフェタミンまたは別の興奮剤の放出は、所望の生理学的条件下でのみ起こるであろう。好ましくは、他の投与経路(例えば、鼻腔内または静脈内)は、感知できない程度にしかプロドラッグを分解しない。また、好ましくは、外部手段(化学的、酵素的、またはその他)も、感知できない程度にしかプロドラッグを分解しないであろう。外部手段を通して達成することができるプロドラッグの分解率は、好ましくは、約50%未満、代替として約25%未満、代替として約20%未満、代替として約10%未満である。
本明細書で説明される技術は、ホモアルギニンによるアンフェタミンの共有結合修飾を利用し、挙動悪化またはリバウンド効果を引き起こすその潜在性を減少させる。アンフェタミンが、本技術のホモアルギニン抱合体を形成するように共有結合修飾され、1日の長さ全体にわたってゆっくりと放出するため、活性成分/薬剤/治療化合物の遅い連続放出により、リバウンド効果がほとんどまたは全く起こり得ないことが考えられる。
本明細書で説明される技術の化合物、組成物、および方法はまた、リバウンドの可能性の低減、乱用または依存症の可能性の低減を提供し、および/またはアンフェタミンの興奮剤関連毒性を向上させるとも考えられる。血中レベルの急上昇を制限することによって、投与量は、他の治療で投与される不必要なレベルを伴わずに、臨床的に有意な効果のために必要とされるレベルで保たれる。血中レベルのこれらの急上昇は、薬物乱用で遭遇する陶酔感に加えて、より高い血圧および急速な心拍数の形態の心臓血管系毒性につながり得ることが、広く支持されている。また、全日治療では、再投与のリスクが低下させられ、したがって、追加の毒性または薬物乱用の問題を予防する。例えば、メチルフェニダートの長期放出製剤は、瞬間放出製剤と比較して、乱用傾向を低減させることが示されている(Parasrampuria,D.A.;et al.Assessment of Pharmacokinetics and Pharmacodynamic Effects Related to Abuse Potential of a Unique Oral Osmotic−Controlled Extended−Release Methylphenidate Formulation in Humans.The Journal of Clinical Pharmacology 2007,47(12),1476−1488)。
本明細書で説明される技術のホモアルギニンアンフェタミンプロドラッグは、中枢神経系(CNS)の刺激を必要とする任意の症状に使用することができる。これらの症状は、例えば、注意欠陥過活動性障害(ADHD)、注意力欠如障害(ADD)、肥満、ナルコレプシー、食欲抑制、うつ病、不安、離脱(例えば、アルコール離脱または薬物離脱)、および覚醒状態を含む。アンフェタミン等のいくつかの興奮剤はまた、興奮剤(例えば、コカイン、メタンフェタミン)乱用および依存症を治療することにおいて有用性を実証してきた。アンフェタミン興奮剤はまた、戦場での覚醒を向上させるため、および疲労に対抗するために、広範囲に使用されてきた。
本技術の1つ以上の実施形態は、適正な投薬量で送達されたときに、アンフェタミンが治療的に有効となることを可能にする、アンフェタミン組成物を提供するが、アンフェタミンの治療域内の用量を超える用量で与えられたときに、アンフェタミンの吸収速度または生物学的利用能の程度を低減させる。
1つ以上の実施形態では、本技術のアンフェタミンプロドラッグ組成物は、非抱合アンフェタミンまたは標準アミノ酸と抱合されたアンフェタミンと比較して、大幅に低い毒性を有する。1つ以上の実施形態では、本技術のアンフェタミンプロドラッグ組成物は、経口投与による過剰摂取の可能性を低減または排除することができる。例えば、ホモアルギニンアンフェタミンの加水分解に関与する酵素は、大量のプロドラッグによって飽和することができ、その結果として、抱合体を効率的に加水分解できなくなるであろう。これにより、遊離アンフェタミンへの暴露を制限することができる一方で、薬学的に不活性なプロドラッグは、重篤な有害作用を伴わずに排除および排出されるであろう。
1つ以上の実施形態では、本技術のホモアルギニンアンフェタミンプロドラッグはさらに、親水性ポリマーおよび/または不水溶性ポリマーを含む、ポリマーブレンドを含んでもよい。ポリマーは、乱用抵抗を低減させることなく、本技術のアンフェタミンプロドラッグの持続放出/乱用抵抗性質をさらに強化するために、業界標準に従って使用されてもよい。例えば、組成物は、重量で約70%から約100%の本技術のアンフェタミンプロドラッグ、約0.01%から約10%の親水性ポリマー(例えば、ヒドロキシプロピルメチルセルロース)、約0.01%から約2.5%の不水溶性ポリマー(例えば、アクリル樹脂)、約0.01%から約1.5%の添加剤(例えば、ステアリン酸マグネシウム)、および重量で約0.01%から約1%の着色剤を含む場合がある。
持続放出製剤で使用するために好適な親水性ポリマーは、アカシア、トラガカントガム、ローカストビーンガム、グアーガム、またはカラヤガム等の1つ以上の天然あるいは部分または完全合成親水性ゴム、メチルセルロース、ヒドロキシメチルセルロース、ヒドロキシプロピルメチルセルロース、ヒドロキシプロピルセルロース、ヒドロキシエチルセルロース、カルボキシメチルセルロース等の修飾セルロース物質、寒天、ペクチン、カラギーン、およびアルギン酸塩等のタンパク性物質、カルボキシポリメチレン、ゼラチン、カゼイン、ゼイン、ベントナイト、ケイ酸アルミニウムマグネシウム、多糖類、修飾デンプン誘導体、および当業者に公知である他の親水性ポリマー等の他の親水性ポリマー、またはそのようなポリマーの組み合わせを含む。これらの親水性ポリマーは、ゲル化し、水性酸性媒質の中でゆっくり溶解し、それにより、アンフェタミンプロドラッグが胃の中でゲルから拡散することを可能にするであろう。ゲルは、腸に到達するとき、より高いpHの媒質の中で制御された量で溶解し、さらなる持続放出を可能にするであろう。好ましい親水性ポリマーは、Methocel E1OM等のMethocelエーテルとして知られている、The Dow Chemical Companyによって製造されているもの等のヒドロキシプロピルメチルセルロースである。
本技術の1つ以上の実施形態による他の製剤はさらに、限定されないが、ステアリン酸マグネシウム、ステアリン酸カルシウム、ステアリン酸亜鉛、粉末ステアリン酸、硬化植物油、タルク、ポリエチレングリコール、および鉱油等の潤滑剤、Emerald Green Lake、FD&C赤色40号、FD&C黄色6号、D&C黄色10号、またはFD&C青色1号、および他の種々の認定着色添加物(21 CFR、第74部を参照)等の着色剤、蔗糖、乳糖、ゼラチン、デンプン糊、アカシア、トラガカント、ポビドン、ポリエチレングリコール、プルラン、およびコーンシロップ等の結合剤、コロイド状二酸化ケイ素およびタルク等の流動促進剤、ラウリル硫酸ナトリウム、ジオクチルスルホコハク酸ナトリウム、トリエタノールアミン、ポリオキシエチレンソルビタン、ポロキサルコル、および第4級アンモニウム塩等の界面活性剤、防腐剤および安定剤、乳糖、マンニトール、グルコース、果糖、キシロース、ガラクトース、蔗糖、麦芽糖、キシリトール、ソルビトール、塩化物、カリウム、ナトリウム、およびマグネシウムの硫酸塩およびリン酸塩等の賦形剤、および/または当業者に公知である任意の他の医薬品添加剤を含む、医薬品添加剤を含んでもよい。1つの好ましい実施形態では、本技術の持続放出製剤はさらに、ステアリン酸マグネシウムおよびEmerald Green Lakeを含む。
本技術の少なくとも1つのホモアルギニンアンフェタミンプロドラッグを含む、本技術の組成物はさらに、賦形剤を用いて製剤化することができ、医薬品製造の当業者に公知である任意の適切な方法に従って製造されてもよい。例えば、プロドラッグおよび親水性ポリマーは、湿式造粒を形成するように、一定分量の水とともにミキサの中で混合されてもよい。造粒は、興奮剤プロドラッグの親水性ポリマーカプセル化顆粒を得るように乾燥させられてもよい。結果として生じる造粒は、粉砕され、仕分けられ、次いで、例えば、不水溶性ポリマーおよび/または追加の親水性ポリマー等の種々の医薬品添加剤と混合されてもよい。次いで、製剤は、錠剤化されてもよく、さらに、胃液の中で急速に溶解または分散する保護被覆で保護された膜であってもよい。
上記の添加剤は、本技術のホモアルギニンアンフェタミンプロドラッグ組成物が持続放出および乱用抵抗性質を有するために必要とされないことに留意されたい。本技術のホモアルギニンアンフェタミンプロドラッグ自体は、上記の添加剤を添加することなく、即時放出の組み合わせと比較して向上した結果をもたらす、長期間にわたる消化管の中への興奮剤の放出、および乱用の予防を制御することができる。本技術の1つ以上の実施形態では、経口で取り入られたときに治療的有効量のアンフェタミン放出を達成しながら、鈍化または低減した薬物動態曲線(例えば、低減した陶酔作用)を達成するために、さらなる持続放出添加剤は必要とされない。
本明細書で説明される技術の化合物および組成物は、種々の投薬形態に製剤化し、好ましくは、任意の経口送達経路を通して、投与することができる。いったん投与されると、プロドラッグは、消化条件下でアンフェタミンを放出するであろう。現在または将来、当業者に公知である、任意の生物学的に容認可能な投薬形態あるいはそれらの組み合わせが、本技術とともに使用するために考慮される。好ましい投薬形態の実施例は、限定ではないが、噛み砕ける錠剤、迅速に溶解する錠剤、発泡性錠剤、再構成可能な粉末、エリキシル剤、液体、溶液、懸濁液、乳剤、錠剤、多層錠剤、二重層錠剤、カプセル、軟質ゼラチンカプセル、硬質ゼラチンカプセル、カプレット、トローチ、ドロップ、噛み砕けるドロップ、ビーズ、粉末、顆粒、粒子、微粒子、分散性顆粒、カシェ、薄片、経口膜、経皮パッチ、およびそれらの組み合わせを含む。好ましい投薬形態は、カプセル、薄片、および溶液製剤を含むが、それらに限定されない。
経口投与に好適な本技術の製剤は、カプセル、カプレット、経口薄膜または片、あるいは錠剤等の離散単位として提示することができる。これらの経口製剤はまた、水性液体または非水性液体中の溶液または懸濁液を含むこともできる。製剤は、水中油型液体乳剤または油中水型液体乳剤等の乳剤であり得る。油は、精製および滅菌された液体を調製された経腸製剤に添加することによって投与することができ、それは次いで、飲み込むことができない患者の栄養チューブの中に入れることができる。
カプセル形態が選択された場合、例えば、カプセル製剤で使用される賦形剤を、バルク剤/結合剤、崩壊剤、潤滑剤、および担体といった、4つの別個のグループに分けることができる。好ましいカプセル製剤は、種々の種類の微結晶性セルロース等の約50重量%から約90重量%のバルク剤、クロスカルメロースナトリウム等の約1重量%から約5重量%の崩壊剤、ステアリン酸マグネシウムまたは他の脂肪酸塩等の約0.5%から約2.5%の潤滑剤を含む。担体は、硬質ゼラチンカプセルのいずれかであり得、好ましくは、#3または#4硬質ゼラチンカプセル等のより小さいサイズのものを使用することができる。
例えば、適切な媒介物(植物油が一般的に使用される)の中で本技術の製剤を分散させ高粘度の混合物を形成することによって、軟質ゲルまたは軟質ゼラチンカプセルが調製されてもよい。次いで、この混合物は、軟質ゲル業界の当業者に公知である技術および機械を使用して、ゼラチンベースの膜でカプセル化することができる。次いで、そのように形成された個々の単位が、一定重量まで乾燥させられる。
例えば、本技術の製剤を、飲み込まれるよりもむしろ噛み砕かれることを目的としている、比較的軟質の香味付けされた錠剤投薬形態を形成するように設計されている賦形剤と混合することによって、噛み砕ける錠剤が調製されてもよい。従来の錠剤機械および手順、つまり、直接圧縮および造粒の両方、すなわち、または圧縮前のスラッギングを利用することができる。噛み砕ける錠剤が製薬業界で非常に一般的な投薬形態であるため、医薬品固形投薬形態の生産に関与する個人は、使用されるプロセスおよび機械に熟知している。
例えば、錠剤上に連続膜層を堆積させるように、回転パン被覆方法またはエアサスペンション方法等の技法を使用して錠剤を被覆することによって、膜で被覆された錠剤が調製されてもよい。
例えば、本技術の製剤を、結合品質を崩壊品質に追加することを目的としている賦形剤と混合することによって、圧縮錠剤が調製されてもよい。混合物は、直接圧縮されるか、または造粒され、次いで、当業者に公知である方法および機械を使用して圧縮されるか、いずれかができる。次いで、結果として生じた圧縮錠剤投薬単位は、市場の必要性、すなわち、単位用量、ロール、バルク瓶、ブリスターパックに従って包装される。
ホモアルギニンアンフェタミンプロドラッグの1つの好ましい製剤は、高速溶解経口膜または薄片である。ホモアルギニンアンフェタミンの水溶性は、極めて高く、経口薄片投薬形態に特に適するようになる。例えば、l−ホモアルギニン−d−アンフェタミン二塩酸塩の水溶性は、5,000mg/mlを上回る。そのような高い水溶性は、可溶性を強化するために複雑な製剤または成分を必要とすることなく、ホモアルギニンアンフェタミンプロドラッグが高速溶解経口薄膜または片に製剤化されることを可能にする。加えて、プロドラッグが経時的にアンフェタミンを次第に放出するため、追加の賦形剤および製剤は、1日1回の投与には必要ではなく、膜に添加される必要がないであろう。経口膜または薄片を作製するために必要とされる方法および他の成分が、当技術分野で公知である。潜在的な膜形成剤は、プルラン、ヒドロキシプロピルメチルセルロース、ヒドロキシプロピルセルロース、ポリビニルピロリドン、ポリビニルアルコール、アルギン酸ナトリウム、ポリエチレングリコール、キサンタンガム、トラガカントガム、グアーガム、アカシアガム、アラビアガム、ポリアクリル酸、アミラーゼ、デンプン、デキストリン、ペクチン、キチン、キトサン、レバン、エルシナン、コラーゲン、ゼラチン、ゼイン、グルテン、大豆タンパク分離物、乳漿タンパク分離物、カゼイン、およびそれらの混合物を含む。
また、唾液刺激剤、可塑剤、冷却剤、界面活性剤、乳化剤、増粘剤、結合剤、甘味料、香味料、着色剤、防腐剤、または矯味樹脂が、経口膜または薄片で採用されてもよい。好ましい作用物質は、プルラン、ステアリン酸トリエタノールアミン、メチルセルロース、デンプン、トリアセチン、ポリソルベート80、キサンタンガム、マルチトール、ソルビトール、およびグリセロールを含む。
本明細書で説明される技術はまた、広範囲の材料から調製され得る、生物学的に容認可能な担体の使用も考慮する。それらに限定されないが、そのような材料は、特定の薬用組成物を調製するために、希釈剤、結合剤および接着剤、潤滑剤、可塑剤、崩壊剤、着色剤、増量物質、香味料、甘味料、ならびに緩衝剤および吸着剤等の様々な材料を含む。
結合剤は、ヒドロキシプロピルメチルセルロース、エチルセルロース、または他の好適なセルロース誘導体、ポビドン、アクリルおよびメタクリル酸共重合体、医薬シロップ、ガム、乳清、デンプン、および誘導体等の乳誘導体、ならびに当業者に公知である他の従来の結合剤等の広範囲の材料から選択されてもよい。例示的な非限定的溶媒は、水、エタノール、イソプロピルアルコール、塩化メチレン、またはそれらの混合物および組み合わせである。例示的な非限定的増量物質は、砂糖、乳糖、ゼラチン、デンプン、および二酸化ケイ素を含む。
好ましい可塑剤は、制限ではないが、フタル酸ジエチル、セバシン酸ジエチル、クエン酸トリエチル、クロトン酸、プロピレングリコール、フタル酸ブチル、セバシン酸ジブチル、ヒマシ油、およびそれらの混合物から成る群より選択されてもよい。明白であるように、可塑剤は、本質的に疎水性ならびに親水性であり得る。フタル酸ジエチル、セバシン酸ジエチル、およびヒマシ油等の不水溶性の疎水性物質が、ビタミンB6およびビタミンC等の水溶性ビタミンの放出を遅延させるために使用される。対照的に、カプセル化された膜の溶解を補助する、不水溶性ビタミンが採用されるときに、親水性可塑剤が使用され、栄養組成物の放出を補助するチャネルを表面に作製する。
特に上述される成分に加えて、本技術の製剤は、着香料、防腐剤、および酸化防止剤等の他の好適な作用物質を含むことができると理解されたい。そのような酸化防止剤は、食品に容認可能となり、例えば、ビタミンE、カロチン、BHT、または当業者に公知である他の酸化防止剤を含むことができる。
含まれ得る他の化合物は、例えば、医学的に不活性な成分、例えば、錠剤またはカプセル用の乳糖、デキストロース、サッカロース、セルロース、デンプン、またはリン酸カルシウム、軟質カプセル用のオリーブ油またはオレイン酸エチル、および懸濁液または乳剤用の水または植物油等の固体および液体希釈剤、タルク、ステアリン酸、ステアリン酸マグネシウムまたはカルシウム、および/またはポリエチレングリコール等の潤滑剤、コロイド粘土等のゲル化剤、トラガカントガムまたはアルギン酸ナトリウム等の増粘剤、デンプン、アラビアガム、ゼラチン、メチルセルロース、カルボキシメチルセルロース、またはポリビニルピロリドン等の結合剤、デンプン、アルギン酸、アルギン酸塩、またはデンプングリコール酸ナトリウム等の崩壊剤、発泡混合物、染料、甘味料、レシチン、ポリソルベート、またはラウリル硫酸等の湿潤剤、および保湿剤、防腐剤、緩衝剤、および酸化剤等の他の治療的に容認可能な副成分であり、これらは製剤用の既知の添加剤である。
経口投与のために、希釈、分散、および/または界面活性剤を含有する、微粉末または顆粒が、ドラフトの中、水またはシロップの中、乾燥状態のカプセルまたは小袋の中、懸濁化剤が含まれ得る非水性懸濁液の中、あるいは水またはシロップ中の懸濁液の中で、提示されてもよい。所望または必要である場合、着香料、防腐剤、懸濁化剤、増粘剤、または乳化剤を含むことができる。
経口投与のための液体分散は、シロップ、乳剤、または懸濁液であってもよい。シロップは、担体として、例えば、サッカロース、あるいはグリセロールおよび/またはマンニトールおよび/またはソルビトールを伴うサッカロースを含有してもよい。懸濁液および乳剤は、担体、例えば、天然ガム、寒天、アルギン酸ナトリウム、ペクチン、メチルセルロース、カルボキシメチルセルロース、またはポリビニルアルコールを含有してもよい。
成人または小児のための用量範囲は、患者の年齢、体重、および状態を含む、多くの要因に依存するであろう。本明細書で説明される技術の1つの興奮剤のプロドラッグの好適な経口投薬量は、その興奮剤を使用する治療で典型的に見出されるものの同等物であり得る。例えば、アンフェタミン塩の典型的な投薬量は、約1mgから約100mgに及ぶことができるが、より高い投薬量が、後日、承認されてもよい。プロドラッグの好ましい用量は、約5mgから約40mgの範囲内のアンフェタミン遊離塩基と等モルの用量である。プロドラッグのさらに好ましい用量は、約9mgから約30mgの範囲内のアンフェタミン遊離塩基と等モルの用量である。例えば、約25mgから約75mgの範囲内の好ましい二塩化ホモアルギニンアンフェタミンプロドラッグの用量は、約9mgから約30mgの好ましい範囲内でアンフェタミン遊離塩基含量を提供するであろう。本技術のプロドラッグの分子量、プロドラッグからのアンフェタミンの放出率(放出%)、および必要アンフェタミンの所望の投薬形態を使用して、以下の方程式を生成することができる。
離散単位で提供される錠剤、カプセル、および他の提示形態は、従来、本発明のプロドラッグ化合物のうちの1つ以上の1日用量、またはその適切な一部を含有する。例えば、単位は、約1mgから約1000mg、代替として約5mgから約500mg、代替として約5mgから約250mg、代替として約10mgから約100mgの本明細書で説明される技術のプロドラッグ化合物のうちの1つ以上を含有してもよい。プロドラッグの好ましい単位は、約9mgから約27mgの範囲内のアンフェタミン遊離塩基と等モルの用量である。
本技術の投薬形態が、当業者に公知である任意の放出形態を組み合わせることも可能である。これらの従来の放出形態は、即時放出、長期放出、パルス放出、可変放出、制御放出、時限放出、持続放出、遅延放出、長時間作用、およびそれらの組み合わせを含む。即時放出、長期放出、パルス放出、可変放出、制御放出、時限放出、持続放出、遅延放出、長時間作用特性、およびそれらの組み合わせを得る能力が、当技術分野で公知である。
本技術の組成物は、部分的、すなわち、分割用量で、24時間期間中に1回以上、24時間期間中に単回用量、24時間期間中に2倍用量、または24時間期間中に2倍以上の用量で投与されてもよい。分割、2倍、または他の複数の用量が、同時に、または24時間期間中の異なる時間に服用されてもよい。用量は、相互に関して、または異なる投与時間における個々の構成要素に関して、不均等な用量であってもよい。
同様に、本技術の組成物は、ブリスターパック、子供のいたずら防止性質の個別ホイル包装、または他のそのような医薬品包装の中で提供されてもよい。さらに、本技術の組成物はさらに、個人が処方された治療のための製品として本組成物を識別することを可能にする指標を含むか、または伴ってもよい。指標は、加えて、本組成物を投与するための上記の特定期間の指示を含んでもよい。例えば、指標は、本組成物の投与のための特定または一般の時刻を示す、時間指標であってもよく、または指標は、本組成物の投与のための曜日を示す、曜日指標であってもよい。ブリスターパック、子供のいたずら防止性質の個別ホイル包装、または他の複合包装はまた、第2の医薬品を含んでもよい。
本技術の組成物の薬理活性は、当技術分野で公知である標準薬理学モデルを使用して実証することができると理解されるであろう。さらに、本技術の組成物は、部位特異的な送達のための好適なポリマーマトリクスまたは膜に組み込むか、またはカプセル化することができ、あるいは部位特異的な送達を達成することが可能な特定の標的剤で機能化することができると理解されるであろう。これらの技法、ならびに他の薬剤送達技法が、当技術分野で周知である。
本技術の1つ以上の実施形態では、本組成物の可溶性および溶解速度は、例えば、腸内で、粘膜面で、または血流中で遭遇する、異なる生理学的条件下で実質的に変化させることができる。本技術の1つ以上の実施形態では、本組成物の可溶性および溶解速度は、特に治療のために意図された用量を上回る用量で、アンフェタミンの生物学的利用能を実質的に減少させることができる。本技術の一実施形態では、生物学的利用能の減少は、鼻腔内投与時に起こる。別の実施形態では、生物学的利用能の減少は、静脈内または動脈内投与時に起こる。別の実施形態では、生物学的利用能の減少は、皮下投与時に起こる。別の実施形態では、生物学的利用能の減少は、筋内投与時に起こる。別の実施形態では、生物学的利用能の減少は、直腸投与時に起こる。別の実施形態では、生物学的利用能の減少は、膣内投与時に起こる。別の実施形態では、生物学的利用能の減少は、空洞内注射時に起こる。別の実施形態では、生物学的利用能の減少は、腹腔内注射時に起こる。別の実施形態では、生物学的利用能の減少は、吸入時に起こる。別の実施形態では、生物学的利用能の減少は、経皮投与時に起こる。別の実施形態では、生物学的利用能の減少は、口腔または舌下投与時に起こる。
本技術の説明された実施形態のそれぞれについて、以下の特性のうちの1つ以上を実現することができる。ホモアルギニンアンフェタミンプロドラッグの心臓血管系毒性は、非抱合アンフェタミンのものよりも大幅に低い。共有結合ホモアルギニンは、挙動悪化またはリバウンド効果の可能性を低減または排除する。共有結合ホモアルギニンアンフェタミンは、鼻腔内投与による乱用の可能性を低減または排除する。共有結合ホモアルギニンアンフェタミンは、種々の形態の注射による乱用の可能性を低減する。共有結合ホモアルギニンアンフェタミンは、吸入による乱用の可能性を低減する。共有結合ホモアルギニンアンフェタミンは、経皮投与による乱用の可能性を低減する。共有結合ホモアルギニンアンフェタミンは、口腔または舌下投与による乱用の可能性を低減する。共有結合ホモアルギニンアンフェタミンは、膣内または直腸投与による乱用の可能性を低減する。
別の実施形態は、本技術の興奮剤の少なくとも1つのホモアルギニンプロドラッグの治療的有効量を提供する、アンフェタミンまたは別の興奮剤組成物を安全に送達するための方法を提供し、ホモアルギニンは、例えば、非抱合興奮剤を送達することと比較して、アンフェタミンまたは別の興奮剤の吸収速度を低減させることができる。
別の実施形態は、本技術の興奮剤の少なくとも1つのホモアルギニンプロドラッグを患者に提供することによって、興奮剤の毒性を低減させるための方法を提供し、ホモアルギニン部分は、興奮剤の治療範囲内の用量を超える用量で与えられたときに、薬理活性興奮剤(すなわち、アンフェタミン等の放出された興奮剤)のクリアランス速度を増加させることができる。
別の実施形態は、本技術の少なくとも1つのホモアルギニン興奮剤プロドラッグを患者に提供することによって、興奮剤の毒性を低減させるための方法を提供し、ホモアルギニン部分は、非抱合興奮剤の治療範囲内の用量を超える用量で与えられたときに、興奮剤の毒性レベル以上に増加しない、血清放出曲線を提供することができる。
別の実施形態は、本技術の少なくとも1つのホモアルギニン興奮剤プロドラッグを提供する、興奮剤組成物の生物学的利用能を低減させるための方法を提供し、興奮剤プロドラッグは、例えば、非抱合興奮剤の治療範囲内の用量を超える用量で与えられたときに、治療的に有効な生物学的利用能を提供するが、非抱合興奮剤と比較して急上昇または増加した血清中濃度を予防する、定常状態血清放出曲線を維持することができる。
別の実施形態は、本技術の少なくとも1つのアンフェタミンまたは別の興奮剤のホモアルギニン、プロドラッグを患者に投与するステップを含む、治療的に有効な生物学的利用能の曲線を依然として提供しながら、アンフェタミンまたは別の興奮剤のCmaxまたは同等Cmaxの急上昇を予防するための方法を提供する。
別の実施形態は、本技術の少なくとも1つのホモアルギニン興奮剤プロドラッグを患者に投与することによって、患者における有毒放出プロファイルを予防するための方法を提供し、興奮剤プロドラッグは、特に処方量を上回る用量で服用されたときに、治療的に有効な生物学的利用能を提供するが、非抱合興奮剤と比較して急上昇または増加した血清中濃度を予防する、定常状態血清放出曲線を維持することができる。
本技術の別の実施形態は、組成物を、それを必要としている患者に提供する、投与する、または処方することによって、興奮剤の乱用を低減または予防するための方法であり、該組成物は、本組成物が製造業者の指示と矛盾する方式で使用されたときに、興奮剤の薬理活性が減少させられるように、本技術の少なくとも1つのホモアルギニン興奮剤プロドラッグを含む。
本技術の別の実施形態は、本技術の興奮剤の少なくとも1つのホモアルギニンプロドラッグを提供することによって、アンフェタミン等の興奮剤の乱用を低減または予防するための方法であり、該プロドラッグは、本組成物が製造業者の指示と矛盾する方式で使用されたときに、興奮剤の薬理活性が大幅に減少させられるように、ホモアルギニンに共有結合した興奮剤を含む。
本技術の別の実施形態は、本明細書で説明される技術のアンフェタミン組成物を、それを必要としている患者に提供する、投与する、または処方することによって、アンフェタミンまたは興奮剤治療の挙動悪化またはリバウンド効果を予防する方法であり、該組成物は、アンフェタミンまたは興奮剤治療からの挙動悪化またはリバウンド効果の潜在性を減少させることができる、アンフェタミンまたはその誘導体の少なくとも1つのホモアルギニンプロドラッグを含む。
本技術の別の実施形態は、組成物が製造業者の指示と矛盾する方式で使用されたときに、興奮剤の薬理活性を減少させることができる、本技術の少なくとも1つのホモアルギニン興奮剤プロドラッグを含む組成物を、それを必要としているヒトまたは動物に提供する、投与する、または処方することによって、興奮剤の陶酔作用を低減または予防するための方法である。
本技術の別の実施形態は、組成物が製造業者の指示と矛盾する方式で使用されたときに、興奮剤の薬理活性を減少させることができる、本技術の少なくとも1つのホモアルギニン興奮剤プロドラッグを含む組成物を消費することを含む、興奮剤の陶酔作用を低減または予防するための方法である。好ましくは、本プロドラッグは、鼻腔内および静脈内経路を介して投与されたときに効率的に加水分解せず、治療的経口用量と同等の用量が、鼻で吸い込まれるか、または注射されたときに、陶酔感を誘発しないだろう。
本技術の別の実施形態は、先行方法のうちのいずれかであり、使用される興奮剤組成物は、経口投与のために適合され、興奮剤プロドラッグは、本組成物が、鼻腔内または静脈内等の非経口で投与されたときに、ホモアルギニン部分からの興奮剤の放出に抵抗する。好ましくは、興奮剤は、胃、腸管、または血清の中に存在する水および/または酵素の存在下で、ホモアルギニン部分から放出されてもよい。随意に、使用される興奮剤組成物は、錠剤、噛み砕ける錠剤、経口溶解錠剤、カプセル、経口溶液、経口懸濁液、薄片、または本明細書で論議される他の経口投薬形態の形態であってもよい。しかしながら、そのような投薬形態が、容易に投与され、特に児童において、患者コンプライアンスを増加させる可能性が高いため、経口薄片投薬形態が好ましい。
記載された方法のうちの1つ以上について、使用される本技術の組成物は、大幅な陶酔感を伴わずに、治療効果をもたらしてもよい。好ましくは、本技術の興奮剤組成物は、興奮剤単独と比較したときに、治療的に同等のAUCを提供することができるが、陶酔感をもたらすCmaxまたは同等Cmaxを提供しない。
本技術の別の実施形態は、本技術の興奮剤プロドラッグ組成物を患者に経口投与することを含む、アンフェタミンまたはその誘導体等の興奮剤の乱用を低減または予防するための方法であり、該組成物は、本組成物が製造業者の指示と矛盾する方式で使用されたときに、興奮剤の薬理活性を減少させることができる、本技術の少なくとも1つのホモアルギニン興奮剤プロドラッグを含む。
別の実施形態は、本技術の興奮剤プロドラッグ組成物を、それを必要としている患者に経口投与することを含む、興奮剤の陶酔作用を低減または予防するための方法であり、該組成物は、本組成物が製造業者の指示と矛盾する方式で使用されたときに、興奮剤の薬理活性を減少させることができる、本技術の興奮剤の少なくとも1つのホモアルギニンプロドラッグを含む。
一実施形態では、ホモアルギニンアンフェタミン抱合体の心臓血管系毒性またはストレスは、アンフェタミンが非抱合状態で送達されるときのアンフェタミンのものより低くあり得る。
本明細書で説明される技術およびその利点は、以下の実施例を参照することにより、より良く理解されるであろう。これらの実施例は、本技術の具体的実施形態を説明するように提供される。これらの具体的実施例を提供することによって、出願者らは、本技術の範囲および精神を限定しない。本明細書で説明される技術の全範囲は、本明細書に添付する請求項、およびこれらの請求項の任意の改変、修正、または同等物によって定義される主題を包含することが、当業者によって理解されるであろう。
実施例1:非標準アミノ酸型(hArg−Amp)および標準アミノ酸抱合体(Vyvanse(商標)、Lys−Amp)の極性親水性プロドラッグの投与後の放出されたd−アンフェタミンの薬物動態パラメータの比較動物実験
実施例1:非標準アミノ酸型(hArg−Amp)および標準アミノ酸抱合体(Vyvanse(商標)、Lys−Amp)の極性親水性プロドラッグの投与後の放出されたd−アンフェタミンの薬物動態パラメータの比較動物実験
本技術の非標準アミノ酸抱合体、ホモアルギニンアンフェタミン、および標準アミノ酸抱合体である、Shire,Incorporated(Wayne,PA)から市販されているVyvanse(商標)(Lys−Amp)の経口投与後のd−アンフェタミンの薬物動態パラメータが、この実施例ではラットにおいて研究されている。この実施例で使用されるホモアルギニンアンフェタミン抱合体は、hArg−Ampの塩酸塩である。結果は、以下の表に記録されている。
表1
表1
本研究は、本技術のプロドラッグのCmaxが、より低い心臓血管系作用(血圧、心拍数)につながり得る、d−アンフェタミンの標準アミノ酸抱合体であるVyvanse(商標)のCmaxよりも大幅に低いことを示す。アンフェタミンの迅速な放出(より高いCmax)は、血圧および心拍数の有意な増加をすでに実証している。ある患者集団では、これらの心臓血管系副作用は、用量制限的であり得るか、または興奮剤治療の終了を引き起こし得る。
ラットにおけるhArg−Ampおよびd−アンフェタミンの非経口投与後のd−アンフェタミンの薬物動態パラメータも研究されている。本研究は、潜在的に、他の経路と対比した腸内で遭遇する酵素の違いにより、hArg−Ampが非経口経路(鼻腔内、静脈内)を通して服用されたときに、アンフェタミンの放出がわずかしか(<25%)起きないことを示す。Adderall XR(登録商標)またはアンフェタミンの他の制御放出製剤が注射されるか、または鼻で吸い込まれたとき、アンフェタミンの薬物動態パラメータは、有意に変化し、個人は、陶酔感を生じるためにこれらの変化を使用することができる。
実施例2:Boc−hArg(NO 2 )−Ampの調製
実施例2:Boc−hArg(NO 2 )−Ampの調製
Boc−hArg(NO2)−OH(2.667g、8mmol)を、DMF(25ml)中で溶解させた。次いで、EDCI(2.30g、12mmol)、NHS(1.012g、8.8mmol)、d−アンフェタミン(1.269g、9.6mmol)、およびDIEA(1.138g、8.8mmol)を、連続的に添加した。透明な反応混合物を室温で16時間撹拌した。反応混合物をpH3の水(150ml)で急冷し、生成物をEtOAc(3×50ml)で抽出した。抽出物を合わせてpH3の水で、その後に飽和NaClで洗浄した。EtOAc層を無水MgSO4上で乾燥させた。生成物をEtOAc−ヘキサンから2回再結晶させ、2.36gの所望の保護生成物を生じた。
1H NMR(DMSO−d6)δを使用して、生成物を分析した。結果は、0.9−1.1(m、3H、Amp CH3)、1.1−1.2(m、2H、hArg γ CH2)、1.2−1.5(m、13H、Boc CH3、hArg β、δ CH2)、2.55−2.75(m、2H、Amp β CH2)、3.1(m、2H、hArg ε CH2)、3.75(m、1H、Amp α CH)、3.95(m、1H、hArg α CH)、6.65(t、1H、hArgグアニジノNH)、7.1−7.3(m、5H、Amp Ar−H)、7.6−8.2(br m、2H、hArgグアニジンNHおよびアミドNH)、8.5(br s、1H、hArg NH−NO2)を示す。これらの結果は、提案された構造と一致している。
実施例3:hArg−Amp・2HCl(l−ホモアルギニン−d−アンフェタミン二塩酸塩)の調製
実施例3:hArg−Amp・2HCl(l−ホモアルギニン−d−アンフェタミン二塩酸塩)の調製
Boc−hArg(NO2)−Amp(1.5g)をHPLCグレードMeOH(120ml)中で溶解させ、透明な溶液に、Pd−C触媒(10%、Aldrich)を添加した。小型撹拌棒をフラスコの中に入れ、2−プロパノール溶液中の5−6N HCl(1.5ml)を取り込んだ後に、反応混合物を、遅い水素気流下で一晩撹拌した。一晩の反応後、溶液を濾過し、溶媒を蒸発させた。白色結晶性生成物を真空下で乾燥させ、1.61gのBoc−hArg−Amp中間生成物を生じた。
生成物(1.6g)を80mlのHPLCグレードMeOH中で溶解させ、2−プロパノール中の5−6N HCl(3.2mL)を溶液に添加した。反応混合物を一晩撹拌し、溶媒を除去し、最小量のMeOH中で再溶解させた。最終生成物をMTBEと衝突させ、1.12gの白色粉末をもたらすように、真空下で30℃にて約20時間乾燥させた。
1H NMR(DMSO−d6)δを使用して、白色粉末を分析した。結果は、0.9−1.1(m、3H、Amp CH3)、1.1−1.2(m、2H、hArg γ CH2)、1.35(m、2H、hArg β CH2)、1.55(m、2H、hArg δ CH2)、2.75(d、2H、Amp β CH2)、3.0(m、2H、hArg ε CH2)、3.75(m、1H、Amp α CH)、4.05(m、1H、hArg α CH)、7.1−7.2(m、5H、Amp Ar−H)、7.2−7.8(br m、3H、アミドNH、HCl)、8.0(t、1H、hArgグアニジノNH)、8.2(br s、2H、アミドまたはグアニジノNH2)、8.75(d、1H、アミドNH);13C NMR(DMSO−d6)δ21.08(Amp CH3)、21.36(hArg γ)、28.23(hArg δ)、32.28(hArg β)、40.18(Amp β)、42.19(hArg ε)、46.88(Amp α)、52.23(hArg α)、126.54(p−Ar)、128.52(m−Ar)、129.60(o−Ar)、139.34(Ar)、157.61(C=O)、167.95(グアニジノC);M+1=306を示す。これらの結果は、提案された構造と一致している。
B=0.1% TFA/MeCN;方法:0〜15分:85/15→60/40、15〜25分:60/40→0/100;流速:1mL/分;UV検出:230nm;保持時間:8.92。
実施例4:Boc−hArg(NO 2 )−Ampの代替的な調製
実施例4:Boc−hArg(NO 2 )−Ampの代替的な調製
50Lのガラス裏地付き反応器を、20℃にて0.96kg(1.0eq)のBoc−l−hArg(NO2)−OH、0.37kg(1.1eq)のN−ヒドロキシスクシンイミド(NHS)、0.85kg(1.5eq)のN−(3−ジメチルアミノプロピル)−N’−エチルカルボジイミド塩酸塩(EDCI)、および5.6kgのDMSOで充填した。温度を30℃以下に維持しながら、ゆっくりと0.48kg(1.2eq)のd−アンフェタミンを溶液に投入した。混合物を24.5℃まで冷却し、0.33kg(1.1eq)の4−メチルモルホリンを反応器に投入した。15〜30℃の反応温度を維持しながら、溶液を撹拌した。
合計3.8時間の反応時間後、22.42kgの2−メチルテトラヒドロフラン(2−MeTHF)を溶液に投入し、混合物を13.5℃まで冷却した。10%酢酸溶液(17.16kgの水の中の2.01kg酢酸)を、10分の期間にわたってゆっくりと反応器に投入した。温度は、添加中に24.8℃を超えなかった。内容物を23℃で5分間撹拌し、次いで、10分間分相させた。水層(25.9kg)を排出し、5%重炭酸ナトリウム(23.0kgの水の中の1.30kgの重炭酸ナトリウム)の溶液を、22.2℃を超えない温度で10分の期間にわたって反応器に投入した。混合物を21.1℃で5分間撹拌し、次いで、20分間分相させた。水層(27.4kg)を排出し、11.94kgの水を残りの内容物に投入した。混合物を23℃で5分間撹拌し、次いで、10分間分相させた。水層(13.6kg)を排出した。
内容物の温度を76.5℃に調整し、ディーン・スターク装置を反応器に取り付け、共沸蒸留によって混合物から水を除去した。約11L(1075mLの水を含む)の溶媒を、17時間の期間にわたって元の21Lの溶液体積から除去した。撹拌を通して沈殿物を懸濁させたまま、残りの混合物を1.1時間の期間にわたって26.0℃まで冷却した。撹拌しながら、内容物の温度を後に5.0℃に調整し、次いで、4.8時間保持した。懸濁液を、18インチブフナー漏斗を通して濾過した。濾過ケーキを2.33kgの2−メチルテトラヒドロフランで洗浄し、次いで、新しい専用濾過反応器の中へ移した。固体を、真空下の濾過反応器の中で窒素パージを用いて65℃にて29時間乾燥させた。収率は、0.96kgのBoc−l−hArg(NO2)−OHから0.81kg(62%)のBoc−l−hArg(NO2)−d−アンフェタミンであった。HPLC−UV分析は、93.6%の純度を示した。
実施例5:hArg−Amp・2HClの代替的な調整
実施例5:hArg−Amp・2HClの代替的な調整
30Lガラス反応器を、窒素で5分間浄化し、次いで、1.01kg(1.0eq)のBoc−l−hArg(NO2)−Amp、0.50kg(0.10eq)の10%炭素上パラジウム(50%湿潤)、22.36kgのメタノール、および0.56kg(2.5eq)の36%塩酸で充填した。内容物の温度を19.2℃に調整し、撹拌を開始した。混合物が発泡し始めるまで、真空を3回引いて上部空間から空気を除去し、真空を毎回窒素で破壊した。真空を3回引き、毎回水素で破壊した。水素で充填されたバルーンを、ガスマニホールドを介して反応器に取り付け、反応の全体を通して適切な水素圧を維持するように、必要に応じて監視および補給した。反応は5.5時間後に完了し、そのときに、いかなる残留出発物質も検出されなかった。
0.50kgの濾過助剤Celatom Fw−60および0.039kgの炭素の上層を含有する、新しい濾過反応器の中で、濾過パッドを調製した。濾過反応器を通して、反応混合物を濾過した。30L反応器を、1.38kgのメタノールで洗い流し、濾過反応器を通して濾過した。濾液を合わせて、45ミクロンフィルタを通して50Lガラス反応器の中へ移した。元の濾液を保持する容器を、1.22kgのメタノールで洗い流し、45ミクロンフィルタを通して同一の50L反応器に投入した。
Boc−l−hArg−d−アンフェタミン中間物の溶液を含有する反応器を、窒素で5分間浄化した。窒素スイープは、(生成されたイソブチレンの除去を促進するように)脱保護プロセスの全体を通して継続した。反応器を、1.35kg(5.9eq)の36%塩酸で充填した。内容物の温度を、3時間にわたって65.6℃に調整した。内容物の温度を28℃に調整した。混合物を反応器から20L回転蒸発器(ロータバップ)の中へ移し、溶媒を44.9°Cおよび44ミリバールで16.9時間蒸発させた。残りの内容物を26.4℃まで冷却した。
ロータバップバルブを3.70kgの水で充填し、残留物を溶解させた。結果として生じた溶液をロータバップから清潔な50Lガラス反応器の中へ移し、内容物の温度を21.9℃に調整した。ロータバップバルブを0.59kgの水で洗い流し、洗浄液を50L反応器に添加した。反応器を7.32kgのメチルtert−ブチルエーテル(MTBE)で充填した。混合物を21.4℃で8分間撹拌し、次いで、10分間分相させた。有機層(MTBE)を破棄し、反応器を再び7.30kgのMTBEで充填した。内容物を24.3℃で5分間撹拌し、次いで、20分間分相させた。有機層を破棄し、反応器を3度目に7.31kgのMTBEで充填した。混合物を22.6℃で6分間撹拌し、次いで、24分間分相させた。有機層を破棄し、残りの水流を清潔なロータバップバルブの中へ移した。
次いで、ロータバップバルブに4.72kgのエタノール(200プルーフ)を添加し、水の除去を加速した。溶液を55.0℃および47ミリバールで3.3時間濃縮した。ロータバップバルブを2度目に4.70kgのエタノールで充填した。溶媒を52.8℃および16ミリバールで21.5時間蒸発させた。ロータバップバルブを3度目に4.70kgのエタノールで充填した。溶液を53.0℃および18ミリバールで24.1時間濃縮した。ロータバップバルブを4度目に4.71kgのエタノールで充填した。溶媒を53.1℃および21ミリバールで19.2時間蒸発させた。残りの固体をロータバップバルブの中で70±5℃にて96時間乾燥させた。l−hArg−d−アンフェタミン・2HClの収率は0.83kg(103%)であった。HPLC−UVによる純度は99.0%であった。
実施例6:hArg−Amp対Lys−Ampの薬物動態学的研究
実施例6:hArg−Amp対Lys−Ampの薬物動態学的研究
雄のSprague−Dawleyラットを一晩絶食させ、l−ホモアルギニン−d−アンフェタミン(hArg−Amp)またはl−リジン−d−アンフェタミン(Vyvanse(商標)、Lys−Amp)のいずれか一方を強制経口投与によって投与した。水は自由に提供された。用量は、d−アンフェタミンの同等な1.5mg/kg遊離塩基当量で計算された。ELISA(Neogen Corp.Lexington,KY)を使用して、d−アンフェタミンの血漿中濃度を計算した。
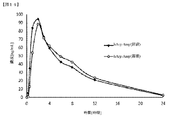
l−ホモアルギニン−d−アンフェタミンまたはl−リジン−d−アンフェタミンによって放出されたd−アンフェタミンの平均血漿中濃度曲線(n=5)が、図1に示されている。この研究の薬物動態(PK)パラメータが、表2に記載されている。
表2 hArg−AmpおよびLys−Ampの薬物動態性質
表2 hArg−AmpおよびLys−Ampの薬物動態性質
この薬物動態学的(PK)研究は、標準アミノ酸(Lys−Amp)と比較した、ホモアルギニンアンフェタミンプロドラッグのTmaxの偏移を明確に実証する。
図2〜4は、図1および表2で反映されるデータを視認する異なる方法を表す。以下でさらに論議されるように、これらの図は、最初の数時間の間のLys−Ampと比べたhArg−Ampの差異を強調表示する。
図2は、Lys−AmpおよびhArg−Ampの両方から放出されたd−アンフェタミンの相対血中レベルを実証する。グラフは、同等の血中レベルが以降の時点まで起こらないこと、および血中レベルが急上昇するか、またはLys−Ampよりも有意なCmaxを有すると考えられないことを示す。hArg−Ampから放出されたd−アンフェタミンの量は、漸進的であり、本研究の持続時間にわたってLys−Ampよりも安定した濃度を維持する。対照的に、放出されたd−アンフェタミンのLys−Amp血中レベルは、3時間で「急上昇」し、hArg−Ampから得られた血中レベルよりも迅速に消失した。
図3および4は、図2で説明される本研究から得られた血中レベルの差異を示す。示されているように、両方の抱合体(Lys−AmpおよびhArg−Amp)の初期血中レベルは、非常に異なり、hArg−Ampがより漸進的な速度でアンフェタミンを放出する。これらの血中レベルの差異は、興奮剤治療のより重要な作用持続時間中に小さくなり、より重要なことには、差異は、以降の時点で再びより大きく、hArg−Ampが、Lys−Ampと比較したときに、アンフェタミンのより一貫した用量を維持することを示唆する。hArg−Ampのより長い放出の持続時間は、挙動悪化が起こるさらに低い可能性を示唆するであろう。
他の経口研究が同様に行われており、以下の表3で要約されている。4つの経口研究(n=媒介物につき30)の平均PK結果が、図5に記録されている。
表3 ラットにおける6つの経口研究の平均結果(n=化合物につき30)
実施例7:Amp、Lys−Amp、およびhArg−Ampの鼻腔内研究
表3 ラットにおける6つの経口研究の平均結果(n=化合物につき30)
実施例7:Amp、Lys−Amp、およびhArg−Ampの鼻腔内研究
雄のSprague−Dawleyラットを一晩絶食させ、hArg−Amp、Lys−Amp、またはd−アンフェタミンのいずれか一方を鼻腔内投与によって投与した。用量は、d−アンフェタミンの同等な1.5mg/kg遊離塩基当量で計算された。ELISAを使用して、d−アンフェタミンの血漿中濃度を測定した。hArg−AmpまたはLys−Ampによって放出されたd−アンフェタミンの平均血漿中濃度曲線(n=5)が、図6に示されている。本研究の薬物動態パラメータが、表4に記載されている。hArg−AmpもLys−Ampも、有意な放出が観察されず(<50%)、より少ない放出が、投与の最初の1時間以内に観察された(<25%)。Lys−Ampからの観察されたレベルは、以前に公開されたデータよりも有意に高い。
表4 d−Amp、hArg−Amp、およびLys−Ampの鼻腔内性質
実施例8:d−Amp、hArg−Amp、およびLys−Ampの静脈内研究
表4 d−Amp、hArg−Amp、およびLys−Ampの鼻腔内性質
雄のSprague−Dawleyラットに、尾静脈を通した静脈内投与によって、hArg−Amp、Lys−Amp、またはd−アンフェタミンを投与した。用量は、d−アンフェタミンの同等な1.5mg/kg遊離塩基当量で計算された。ELISAを使用して、d−アンフェタミンの血漿中濃度を測定した。hArg−AmpまたはLys−Ampによって放出されたd−アンフェタミンの平均血漿中濃度曲線(n=5)が、図7に示されている。本研究の薬物動態パラメータが、表5に記載されている。hArg−AmpもLys−Ampも、有意な放出が観察されなかった(<15%)が、hArg−Ampは有意に少なかった。Lys−Ampからの観察されたレベルは、以前に公開されたデータよりも有意に高い。hArg−Ampから放出されたd−アンフェタミンの初期急上昇は、迅速に消失した。
表5 d−Amp、hArg−Amp、およびLys−Ampの静脈内性質
表5 d−Amp、hArg−Amp、およびLys−Ampの静脈内性質
上記の実施例における研究の結果は、ホモアルギニンアンフェタミン抱合体を使用することによって、経口薬物動態性質の予期しない変化を明確に示す。アンフェタミンに付着した基としてホモアルギニンを使用することによって、抱合体は、Tmaxを(より早く、または後に)偏移させ、曲線形状を修正し、Cmaxを低下させ、Cmaxを上昇させることができる。加えて、hArg−AmpのTmaxの偏移は、心臓血管系副作用および毒性の多くがTmaxおよびCmaxに関係するという点で、臨床的に有意であり得る。結果は、ホモアルギニンを使用することによって、AUCを有意に変化させることなく、Tmaxの偏移が、より低いCmaxとともに起こることを実証する。加えて、hArg−Amp対Lys−Ampの取り込みの傾斜は、より漸進的であると考えられ、したがって、より遅い発現につながり、副作用をさらに緩和することができる。
本技術の上記に記載されるアンフェタミン抱合体は、ホモアルギニンアンフェタミン抱合体を使用することによって、AUCおよび潜在的な臨床効果を依然として維持しながら、Tmaxの偏移が起こることを実証する。ホモアルギニンを使用することによって、hArg−Ampが、IN(鼻腔内)またはIV(静脈内)経路を介してわずかな放出を示すが、依然として類似AUCを維持することを実証できる。
実施例9:hArg−Amp−2HClおよびLys−Ampの薬物動態学的研究
実施例9:hArg−Amp−2HClおよびLys−Ampの薬物動態学的研究
hArg−Amp−2HClおよびLys−Ampの経口溶液を、等モル用量(それぞれ、4.20mg/kgおよび5.05mg/kg)でラットに投与した。プロドラッグから放出されたd−アンフェタミンおよび無傷のプロドラッグの結果として生じたPK曲線が、それぞれ、図8および9に示されている。hArg−Amp−2HClおよびLys−Ampはまた、等モル用量(それぞれ、1.5mg/kgおよび1.8mg/kg)でイヌに経口投与された。d−アンフェタミンおよび無傷のプロドラッグの結果として生じたPK曲線が、それぞれ、図10および11に示されている。ラットおよびイヌの研究のPKパラメータが、それぞれ、表6および7に要約されている。
表6 ラットにおける経口投与後のhArg−Amp−2HClおよびLys−AmpのPKパラメータ
表7 イヌにおける経口投与後のhArg−Amp−2HClおよびLys−AmpのPKパラメータ
表6 ラットにおける経口投与後のhArg−Amp−2HClおよびLys−AmpのPKパラメータ
表7 イヌにおける経口投与後のhArg−Amp−2HClおよびLys−AmpのPKパラメータ
ラットでは、hArg−Amp−2HClは、Lys−Ampと比較したとき、減衰した様式でd−アンフェタミンを放出した。hArg−Amp−2HClから放出されたd−アンフェタミンの血漿中濃度は、Lys−Ampと比較して、よりゆっくりとtmaxまで増加し、また、tmax後によりゆっくりと減少した。d−アンフェタミンへの全身暴露(AUC)は、Lys−Ampと比較して、hArg−Amp−2HClについて25%低減させられた。hArg−Amp−2HClから放出されたd−アンフェタミンのCmaxは、Lys−Ampに対するCmaxの約60%であった。加えて、hArg−Amp−2HClから放出されたd−アンフェタミンのピーク血漿中濃度は、Lys−Ampと比較したとき、1時間遅く到達された。また、無傷のプロドラッグ濃度は、Lys−AmpよりもhArg−Amp−2HClについて有意に低かった(それぞれ、hArg−Amp−2HClおよびLys−Ampについて、Cmax値は、3.1ng/mLおよび90.2ng/mLであり、AUC値は、1.8ng/mL×hおよび74.9ng/mL×hであった)。
イヌでは、hArg−Amp−2HClおよびLys−Ampは、放出されたd−アンフェタミンに基づいて、生物学的に同等であった。その結果として、ラットにおけるhArg−Amp−2HClによるd−アンフェタミン血漿中濃度の遅い発現が、イヌでは観察されなかった。しかしながら、無傷のプロドラッグのイヌ血漿中濃度は、ラットで見出された結果と同様に、Lys−AmpよりもhArg−Amp−2HClについてかなり低かった。
実施例10:ヒトにおけるhArg−Amp−2HClおよびLys−Ampの薬物動態学的研究
実施例10:ヒトにおけるhArg−Amp−2HClおよびLys−Ampの薬物動態学的研究
hArg−Amp−2HClの25mg溶液を、固定条件下で24人の健康なボランティアに経口投与されたVyvanse(登録商標)の30mg溶液(d−アンフェタミン等価用量)と比較した、単回用量、2期間、2治療、2シーケンスの交差研究が行われた。結果として生じたPK曲線およびPKパラメータが、図12および13ならびに表8で要約されている。
表8 ヒトにおける経口投与後のhArg−Amp−2HClおよびLys−AmpのPKパラメータ
表8 ヒトにおける経口投与後のhArg−Amp−2HClおよびLys−AmpのPKパラメータ
ヒトでは、hArg−Amp−2HClからのd−アンフェタミンの放出は、Lys−Ampと比較して減衰された。しかしながら、tmaxの前の時点にわたってhArg−Amp−2HClによって生じさせられたd−アンフェタミン血漿中濃度の初期増加は、ラットよりもヒト対象において速く、Lys−Ampに類似した。ヒトにおいてhArg−Amp−2HClから放出されたd−アンフェタミンのCmaxおよびAUC値の両方は、Lys−Ampのそれぞれの値の約3分の2であった。これらの値は、ラットで観察されたデータにより密接に類似している。しかし、ラットのデータと一致せずに、hArg−Amp−2HClおよびLys−Ampから放出されたd−アンフェタミンのtmax値が、ヒトにおいて非常に類似した(hArg−Amp−2HClについては3.15時間、およびLys−Ampについては2.85時間)一方で、ラットにおけるd−アンフェタミンのピーク血漿中濃度は、Lys−Ampと比較したとき、hArg−Amp−2HClについて1時間遅く発生した。つまり、予想外に、ラットにおけるhArg−Amp−2HClとLys−Ampとの間のd−アンフェタミンのピーク血漿中濃度の偏移は、ヒトでは観察されなかった。
加えて、ヒトにおける25mgのhArg−Amp−2HClの経口投与後に、無傷のプロドラッグが血漿中で検出されなかった(すなわち、全ての血漿中濃度が1.00ng/mLの定量下限を下回った)。しかしながら、無傷のLys−Ampの血漿中濃度が、依然として有意であり、同一のモル投与量レベルでヒトにおいて検出可能であった。この結果は、驚くべきものであり、動物で観察されたデータに反する。
実施例11:イヌにおけるl−ホモアルギニン−d−アンフェタミン(hArg−Amp)HCIの経口PK
実施例11:イヌにおけるl−ホモアルギニン−d−アンフェタミン(hArg−Amp)HCIの経口PK
hArg−Ampの経口溶液および経口薄膜(OTF)を、1.5mg/kgのアンフェタミンでイヌに投与した。両方の投薬形態について、プロドラッグから放出されたd−アンフェタミンおよび無傷のプロドラッグの結果として生じたPK曲線が、それぞれ、図14および15に示されている。どちらの投薬形態も、hArg−Ampが、24時間期間にわたって類似量のd−アンフェタミンを放出した。両方の投薬形態は、放出されたアンフェタミンに基づいて、生物学的に同等であった。
本技術のホモアルギニンアンフェタミンプロドラッグは、アミド結合の生体外加水分解に対して化学的に安定であり、経口摂取前にアンフェタミンを改ざんまたは除去することを防止する。また、本技術のホモアルギニンアンフェタミンプロドラッグの経口投与を通したアンフェタミンの制御放出は、製剤に関係しない、分子の固有の性質である。したがって、本技術のプロドラッグは、異なる投薬形態に容易に製剤化することができる。ラット、イヌ、およびヒトの研究からのデータの比較から分かるように、無傷のプロドラッグの吸収は、プロドラッグの予測性質ではない。無傷のホモアルギニンアンフェタミンプロドラッグの血漿中濃度は、ラットおよびイヌの両方について検出されたが、ヒトでは検出可能な限界を下回った。この研究は、特に、無傷のプロドラッグLys−Ampが、ラット、イヌ、およびヒトの血漿サンプル中で検出されたため、驚くべきものである。
本発明は、本発明に関連する技術分野の当業者が同発明を実践することを可能にするよう、そのような完全、明確、簡潔、および正確な用語で説明されている。先述の内容は、本発明の好ましい実施形態を説明し、添付の請求項に記載されるような本発明の精神または範囲から逸脱することなく、それに修正が行われてもよいことを理解されたい。
Claims (20)
- 少なくとも1つのホモアルギニンアンフェタミン二塩酸塩プロドラッグまたはホモアルギニンアンフェタミン誘導体二塩酸塩プロドラッグ、あるいはそれらの組み合わせの投与量を含む、少なくとも1枚の薄膜または細片を経口投与するステップを含み、前記投与量は、約5mgから約40mgの範囲内のアンフェタミン遊離塩基と同等であり、前記プロドラッグは、前記経口投与ステップ後にヒトの血流中の定量限界を下回る、前記ヒトにおけるアンフェタミンまたはアンフェタミン誘導体の副作用を低減または予防する方法。
- 前記プロドラッグは、前記経口投与ステップ後に前記ヒトの血流中で1.00ng/mLのレベルを下回る、請求項1に記載の方法。
- 前記投与量は、約9mgから約30mgの範囲内のアンフェタミン遊離塩基と同等である、請求項1に記載の方法。
- ヒトにおいてアンフェタミンまたはアンフェタミン誘導体の副作用を低減または予防するための組成物であって、前記組成物は、少なくとも1つの経口投与されるホモアルギニンアンフェタミンプロドラッグまたはその塩、あるいは少なくとも1つのホモアルギニンアンフェタミン誘導体プロドラッグまたはその塩を含み、前記プロドラッグまたはその塩のいずれか一方は、約5mgから約40mgの範囲内のアンフェタミン遊離塩基と同等な量で前記組成物中に存在し、前記プロドラッグまたはその塩のいずれか一方は、経口投与後に前記ヒトの血流中の定量限界を下回る、組成物。
- 前記プロドラッグまたはその塩のいずれか一方は、経口投与後に前記ヒトの血流中で1.00ng/mLのレベルを下回る、請求項4に記載の組成物。
- 前記プロドラッグまたはその塩のいずれか一方は、薄膜または細片投薬形態で提供される、請求項4に記載の組成物。
- 前記ホモアルギニンアンフェタミンプロドラッグは、ホモアルギニンアンフェタミン二塩酸塩である、請求項4に記載の組成物。
- 前記ホモアルギニンアンフェタミン誘導体プロドラッグは、ホモアルギニンアンフェタミン誘導体二塩酸塩である、請求項4に記載の組成物。
- 前記プロドラッグまたはその塩の量は、約9mgから約30mgの範囲内のアンフェタミン遊離塩基と同等である、請求項4に記載の組成物。
- 少なくとも1つのホモアルギニンアンフェタミン抱合体またはその塩、あるいは少なくとも1つのホモアルギニンアンフェタミン誘導体抱合体またはその塩の投与量を含む、少なくとも1枚の薄膜または細片をヒトに経口投与するステップを含み、前記投与量は、約5mgから約40mgの範囲内のアンフェタミン遊離塩基と同等であり、前記抱合体は、前記経口投与ステップ後にヒトの血流中の定量限界を下回る、前記ヒトにおけるアンフェタミンまたはアンフェタミン誘導体の副作用を低減または予防する方法。
- ヒトにおいてアンフェタミンまたはアンフェタミン誘導体の副作用を低減または予防するための組成物であって、前記組成物は、少なくとも1つの経口投与されるホモアルギニンアンフェタミン抱合体またはその塩、あるいは少なくとも1つのホモアルギニンアンフェタミン誘導体抱合体またはその塩を含み、前記抱合体またはその塩のいずれか一方は、約5mgから約40mgの範囲内のアンフェタミン遊離塩基と同等な量で前記組成物中に存在し、前記抱合体またはその塩のいずれか一方は、経口投与後に前記ヒトの血流中の定量限界を下回る、組成物。
- 前記抱合体またはその塩のいずれか一方は、経口投与後に前記ヒトの血流中で1.00ng/mLのレベルを下回る、請求項11に記載の組成物。
- 前記抱合体またはその塩のいずれか一方は、薄膜または細片投薬形態で提供される、請求項11に記載の組成物。
- 前記ホモアルギニンアンフェタミン抱合体は、ホモアルギニンアンフェタミン二塩酸塩である、請求項11に記載の組成物。
- 前記ホモアルギニンアンフェタミン誘導体抱合体は、ホモアルギニンアンフェタミン誘導体二塩酸塩である、請求項11に記載の組成物。
- 前記抱合体またはその塩の量は、約9mgから約30mgの範囲内のアンフェタミン遊離塩基と同等である、請求項11に記載の組成物。
- 少なくとも1つのホモアルギニンアンフェタミン二塩酸塩プロドラッグまたはホモアルギニンアンフェタミン誘導体二塩酸塩プロドラッグ、あるいはそれらの組み合わせの投与量を含む、少なくとも1枚の薄膜または細片を経口投与するステップを含み、前記投与量は、約5mgから約40mgの範囲内のアンフェタミン遊離塩基と同等であり、前記プロドラッグは、前記経口投与ステップ後にヒトの血流中の定量限界を下回る、前記ヒトにおいてADD、ADHD、またはCNS疾患または障害を低減または予防する方法。
- ヒトにおいてADD、ADHD、または負のCNSの興奮剤副作用、あるいは精神刺激薬副作用、疾患、または障害を低減または予防するための組成物であって、前記組成物は、少なくとも1つの経口投与されるホモアルギニンアンフェタミンプロドラッグまたはその塩、あるいは少なくとも1つのホモアルギニンアンフェタミン誘導体プロドラッグまたはその塩を含み、前記プロドラッグまたはその塩のいずれか一方は、約5mgから約40mgの範囲内のアンフェタミン遊離塩基と同等な量で前記組成物中に存在し、前記プロドラッグまたはその塩のいずれか一方は、経口投与後に前記ヒトの血流中の定量限界を下回る、組成物。
- 少なくとも1つのホモアルギニンアンフェタミン抱合体またはその塩、あるいは少なくとも1つのホモアルギニンアンフェタミン誘導体抱合体またはその塩の投与量を含む、少なくとも1枚の薄膜または細片をヒトに経口投与するステップを含み、前記投与量は、約5mgから約40mgの範囲内のアンフェタミン遊離塩基と同等であり、前記抱合体は、前記経口投与ステップ後にヒトの血流中の定量限界を下回る、前記ヒトにおけるADD、ADHD、または負のCNS副作用を低減または予防する方法。
- ヒトにおいて興奮剤の副作用を低減または予防するための組成物であって、前記組成物は、少なくとも1つの経口投与されるホモアルギニンアンフェタミン抱合体またはその塩、あるいは少なくとも1つのホモアルギニンアンフェタミン誘導体抱合体またはその塩を含み、前記抱合体またはその塩のいずれか一方は、約5mgから約40mgの範囲内のアンフェタミン遊離塩基と同等な量で前記組成物中に存在し、前記抱合体またはその塩のいずれか一方は、経口投与後に前記ヒトの血流中の定量限界を下回る、組成物。
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| PCT/US2011/045954 WO2013019187A1 (en) | 2011-07-29 | 2011-07-29 | Homoarginine prodrugs and/or conjugates of amphetamine and other stimulants and processes for making and using the same |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2014521641A true JP2014521641A (ja) | 2014-08-28 |
| JP2014521641A5 JP2014521641A5 (ja) | 2014-10-09 |
Family
ID=47629539
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014522802A Pending JP2014521641A (ja) | 2011-07-29 | 2011-07-29 | ホモアルギニンプロドラッグおよび/またはアンフェタミンおよび他の興奮剤の抱合体、ならびに同物を作製および使用するためのプロセス |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US20140171510A1 (ja) |
| EP (1) | EP2739140A4 (ja) |
| JP (1) | JP2014521641A (ja) |
| AU (1) | AU2011374269A1 (ja) |
| CA (1) | CA2843390A1 (ja) |
| WO (1) | WO2013019187A1 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2021504324A (ja) * | 2017-11-30 | 2021-02-15 | スペックジーエックス エルエルシー | アシル化アンフェタミン誘導体を調製するためのプロセス |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2014144115A1 (en) * | 2013-03-15 | 2014-09-18 | Shire Llc | Fixed dose combination treatment for schizophrenia |
| JP2020500220A (ja) | 2016-11-15 | 2020-01-09 | クラリア ファーマ ホールディング エービー | 医薬製剤 |
| CA3059781A1 (en) * | 2017-04-10 | 2018-10-18 | Shire Pharmaceuticals Inc. | Methods of treatment using an amphetamine prodrug |
| GB201709141D0 (en) | 2017-06-08 | 2017-07-26 | Klaria Pharma Holding Ab | Pharmaceutical formulation |
| WO2019136224A1 (en) * | 2018-01-05 | 2019-07-11 | Shire Human Genetic Therapies, Inc. | Amphetamine-guanfacine combinations for treatment of neuropsychiatric disorders |
| WO2019199724A1 (en) * | 2018-04-10 | 2019-10-17 | Shire Pharmaceuticals, Inc. | Salts of amphetamine-homoarginine conjugate prodrug |
| WO2019199731A1 (en) * | 2018-04-10 | 2019-10-17 | Shire Pharmaceuticals Inc. | Amphetamine prodrug and crystalline froms thereof |
| GB201808462D0 (en) * | 2018-05-23 | 2018-07-11 | Klaria Pharma Holding Ab | Pharmaceutical formulation |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2010512413A (ja) * | 2006-12-11 | 2010-04-22 | ケムファーム・インコーポレーテッド | アンフェタミンの非標準アミノ酸結合体およびそれらの製造方法および使用方法 |
| JP2010518113A (ja) * | 2007-02-08 | 2010-05-27 | ケムファーム・インコーポレーテッド | アンフェタミンおよび他の刺激薬の極性親水性プロドラッグ、およびそれらの製造方法および使用方法 |
-
2011
- 2011-07-29 JP JP2014522802A patent/JP2014521641A/ja active Pending
- 2011-07-29 CA CA 2843390 patent/CA2843390A1/en not_active Abandoned
- 2011-07-29 EP EP11870434.5A patent/EP2739140A4/en not_active Withdrawn
- 2011-07-29 US US14/235,743 patent/US20140171510A1/en not_active Abandoned
- 2011-07-29 WO PCT/US2011/045954 patent/WO2013019187A1/en active Application Filing
- 2011-07-29 AU AU2011374269A patent/AU2011374269A1/en not_active Abandoned
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2010512413A (ja) * | 2006-12-11 | 2010-04-22 | ケムファーム・インコーポレーテッド | アンフェタミンの非標準アミノ酸結合体およびそれらの製造方法および使用方法 |
| JP2010518113A (ja) * | 2007-02-08 | 2010-05-27 | ケムファーム・インコーポレーテッド | アンフェタミンおよび他の刺激薬の極性親水性プロドラッグ、およびそれらの製造方法および使用方法 |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2021504324A (ja) * | 2017-11-30 | 2021-02-15 | スペックジーエックス エルエルシー | アシル化アンフェタミン誘導体を調製するためのプロセス |
| JP7263350B2 (ja) | 2017-11-30 | 2023-04-24 | スペックジーエックス エルエルシー | アシル化アンフェタミン誘導体を調製するためのプロセス |
Also Published As
| Publication number | Publication date |
|---|---|
| EP2739140A1 (en) | 2014-06-11 |
| AU2011374269A1 (en) | 2014-02-20 |
| US20140171510A1 (en) | 2014-06-19 |
| EP2739140A4 (en) | 2015-06-03 |
| WO2013019187A1 (en) | 2013-02-07 |
| CA2843390A1 (en) | 2013-02-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP2101571B1 (en) | Ornithine conjugates of amphetamine and processes for making and using the same | |
| EP2109465B1 (en) | Polar hydrophilic prodrugs of amphetamine and other stimulants and processes for making and using the same | |
| JP2014521641A (ja) | ホモアルギニンプロドラッグおよび/またはアンフェタミンおよび他の興奮剤の抱合体、ならびに同物を作製および使用するためのプロセス | |
| KR101159477B1 (ko) | 남용 방지성 암페타민 화합물 | |
| US20220064116A1 (en) | D-amphetamine compounds, compositions, and processes for making and using the same |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20140722 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20140722 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20150629 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20151208 |