JP2013505201A - 広域反応性中和抗hiv抗体を誘導するための配合物 - Google Patents
広域反応性中和抗hiv抗体を誘導するための配合物 Download PDFInfo
- Publication number
- JP2013505201A JP2013505201A JP2012503432A JP2012503432A JP2013505201A JP 2013505201 A JP2013505201 A JP 2013505201A JP 2012503432 A JP2012503432 A JP 2012503432A JP 2012503432 A JP2012503432 A JP 2012503432A JP 2013505201 A JP2013505201 A JP 2013505201A
- Authority
- JP
- Japan
- Prior art keywords
- ligand
- mper
- tnd
- hiv
- epitope
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/62—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being a protein, peptide or polyamino acid
- A61K47/64—Drug-peptide, drug-protein or drug-polyamino acid conjugates, i.e. the modifying agent being a peptide, protein or polyamino acid which is covalently bonded or complexed to a therapeutically active agent
- A61K47/646—Drug-peptide, drug-protein or drug-polyamino acid conjugates, i.e. the modifying agent being a peptide, protein or polyamino acid which is covalently bonded or complexed to a therapeutically active agent the entire peptide or protein drug conjugate elicits an immune response, e.g. conjugate vaccines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/19—Cytokines; Lymphokines; Interferons
- A61K38/21—Interferons [IFN]
- A61K38/212—IFN-alpha
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/12—Viral antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/12—Viral antigens
- A61K39/21—Retroviridae, e.g. equine infectious anemia virus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/69—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit
- A61K47/6905—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being a colloid or an emulsion
- A61K47/6911—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being a colloid or an emulsion the form being a liposome
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/18—Antivirals for RNA viruses for HIV
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/545—Medicinal preparations containing antigens or antibodies characterised by the dose, timing or administration schedule
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55555—Liposomes; Vesicles, e.g. nanoparticles; Spheres, e.g. nanospheres; Polymers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55561—CpG containing adjuvants; Oligonucleotide containing adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55572—Lipopolysaccharides; Lipid A; Monophosphoryl lipid A
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/10—Dispersions; Emulsions
- A61K9/127—Liposomes
- A61K9/1271—Non-conventional liposomes, e.g. PEGylated liposomes, liposomes coated with polymers
- A61K9/1272—Non-conventional liposomes, e.g. PEGylated liposomes, liposomes coated with polymers with substantial amounts of non-phosphatidyl, i.e. non-acylglycerophosphate, surfactants as bilayer-forming substances, e.g. cationic lipids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2740/00—Reverse transcribing RNA viruses
- C12N2740/00011—Details
- C12N2740/10011—Retroviridae
- C12N2740/16011—Human Immunodeficiency Virus, HIV
- C12N2740/16111—Human Immunodeficiency Virus, HIV concerning HIV env
- C12N2740/16134—Use of virus or viral component as vaccine, e.g. live-attenuated or inactivated virus, VLP, viral protein
Abstract
Description
本発明は、米国国立衛生研究所によって授与された助成金番号第AI 067854号のもとに米国政府の援助を受けて作成された。米国政府は、本発明において特定の権利を有する。
本発明は、一般的に、抗HIV−1抗体を誘導する際に使用するのに適した配合物に、そして特に、広域(broadly)反応性抗HIV−1抗体の誘導のためのHIV−1 gp41膜近位外部領域(MPER)ペプチド−リポソーム・コンジュゲートとともにToll様受容体(TLR)アゴニストを含む配合物に関する。本発明はまた、こうした配合物を用いて中和抗HIV−1抗体を誘導する方法にも関する。
実験詳細
被験体
トリニダード血清転換コホートが先に記載された(Blattnerら, J. Infect. Dis. 189:1793−1801(2004))。簡潔には、性行為感染症(STD)クリニック由来の患者をHIV感染に関して監視し、そして血清転換に際して登録した。感染は、異性との性的接触を通じて起こり、そしてサブタイプBウイルスがすべての感染の原因であった。本研究における関心対象の患者、SC42は、感染までの5年間、抗ウイルス療法に関して未処置であった。
全長gp160のクローニング戦略が先に記載されてきている(Weiら, Nature 422:307−312(2003)、Liら, J. Virol. 79:10108−10125(2005))。簡潔には、QIAmpウイルスRNAミニキット(Qiagen、カリフォルニア州バレンシア)を用いて患者血漿試料からウイルスRNAを抽出し、そして続いて、SuperScript II(Invitrogen Corp.、カリフォルニア州カールスバッド)およびランダム六量体プライマーを用いて、cDNAに逆転写した。以下のプライマーとともに、入れ子PCRによって、全長エンベロープ配列を生成した:第1周期プライマー 5’OUT 5’−TAGAGCCCTGGAAGCATCCAGGAAG−3’、nt 5852−5876および3’OUT 5’−TTGCTACTTGTGATTGCTCCATG T−3’ nt 8912−8935;ならびに第二周期プライマー、5’Intopo 5’−CACCTAGGCATCTCCTATGGCAGGAAGA AG−3’、nt 5957−5982および3’IN 5’−GTCTCGAGATACTGCTCCCACCC−3’、nt 8881−8903。PCR産物を精製し、そして次いで、製造者の指示にしたがって、定方向クローニングベクターpcDNA 3.1D/V5−His−TOPO(Invitrogen)内に直接連結した。このpcDNA 3.1D/V5−His−TOPOベクターは、サイトメガロウイルス・プロモーターを含有し、該プロモーターは、続く偽ウイルス産生のためのエンベロープタンパク質発現を可能にする。
製造者の指示にしたがってQuikChange XL部位特異的突然変異誘発キット(Invitrogen Corp)を用いて、HS−MPER内にS669L突然変異を導入して、HS−MPER/S669Lを生成し、そしてHS−MPER内にK665N突然変異を導入して、HS−MPER/K665Nを生成した。HS−MPER内にS669L突然変異を導入するためのプライマーは: fN−MPER_S669L(5’−GGATAAGTGGGCAAGTTTGTGGAATTGGTTTGAC−3’)およびr7534.5_S669L(5’−GTCAAACCAATTCCACAAACTTGCCCACTTATCC−3’)であり; HS−MPER内にK665Nを導入するためのプライマーは: fHS−MPER_K665N(5’−gaattattagaattggataaCtgggcaagttcgtgg−3’)およびr7534.5_K665N(5’−CCACGAACTTGCCCAGTTATCCAATTCTAATAATTC−3’)であった。
マイナーな修飾を伴い、先に記載される方法(Liら, J. Virol. 79:10108−10125(2005))から修飾した方法にしたがって、env−偽ウイルスの産生および力価決定を行った。FuGENE(登録商標)HDトランスフェクション試薬(Roche Applied Science、スイス・バーゼル)を用い、env欠損HIV−1骨格(pSG3Δenv)とともに、pcDNA3.1D/V5−His−TOPOベクター中の全長envクローンを293T細胞内に同時トランスフェクションした。インキュベーション24〜36時間後に組織培養液を採取し、そして新鮮なウシ胎児血清をウイルスストックに添加して、最終濃度20%を作製した。
先に記載されるように(Liら, J. Virol. 79:10108−10125(2005))、96ウェル平底プレート上のJC53−BL細胞に対して、偽ウイルスに関する中和アッセイを行った。簡潔には、連続希釈血清試料または精製Abを試験ウイルスとインキュベーションした後、JC53−BL細胞を添加した。BriteLiteTMアッセイ系で各ウェルの相対発光単位(RLU)を測定し、そしてウイルス対照に比較してウイルス感染を50%阻害可能である血清の最高希釈として(血清試料の場合)またはAbの最低濃度として(精製Abの場合)IC50を決定した。
中和アッセイからペプチド吸収中和アッセイを修飾した。ウイルス添加前に1時間、適切に希釈したペプチドと連続希釈血清試料または精製Abをプレインキュベーションした後、通常の中和アッセイを行った。
先に記載されるように(Alamら, J. Immunol. 178:4424−4435(2007))、20℃で維持したBIAcore 3000(BIAcore Inc、ニュージャージー州ピスカタウェイ)上でSPR結合アッセイを行った。記載されるように(Alamら, J. Immunol. 178:4424−4435(2007)、Alamら, AIDS Res. Hum. Retroviruses 20:836−845(2004))、SP62ペプチド−gp4 652−671
適合度アッセイ
重要でない修飾を伴って、先に記載されるように(Luら, J. Virol. 78:4628−4637(2004))、二重感染適合度アッセイを行った。env PCR産物、およびレポーター遺伝子を含むNL4−3バックグラウンドベクターを同時トランスフェクションすることによって、TND_669SまたはTND_669L envおよびマーカー配列(ネズミチフス菌(Salmonella enterica serovar Typhimurium)ヒスチジノール・デヒドロゲナーゼ[hisD]遺伝子またはヒト胎盤熱安定性アルカリホスファターゼ[PLAP]遺伝子のいずれか)を含有するHIV−1感染性キメラウイルスを生成した。二重感染適合度アッセイにおいて、特定の投入比(レポーター遺伝子のリアルタイムPCRによって決定されるようなもの)の2つのキメラウイルスを用いて、PBMCを同時感染させた(MOI=0.001)。リアルタイムRT−PCRを用いて、対応するマーカー(hisDまたはPLAP)によって、培養中の2つのEnv種を含むウイルスの相対産生を測定した。特定の時点(第4日、第7日および第10日)で、総ウイルス集団中の個々のウイルスの割合を計算することによって、二重感染中の個々のウイルスの産生を決定した。先に記載されるように(Wuら, J. Virol. 80:2380−2389(2006))、以下の等式によって、個々のウイルスの相対適合度値(1+S)を決定した:
(1+S=exp(d)=exp{ln[(TM(t2)xTL(t1))/(TL(t2)xTM(t1))]/Δt}
1+S=exp、ここでSは選択係数であり; Mt、M0、L1、およびL0は、それぞれ、接種物中の時点tでの、より適合した変異体またはより適合しない変異体の比率、および最初の比率(0)である。
TND_669Sエンベロープの同定
SC42の血漿試料から複数の長期Envクローンを得て、EnvクローンからNL4−3 Env−偽型化ウイルスを作製し、そして自己血清および異種血清に対する、選択したEnvクローンの中和感受性を試験した。自己血清による中和に非常に感受性であるエンベロープ株を同定した。慢性感染HIV+被験体から得たエンベロープ・クローンであるTND_669Sは、自己および異種血清の両方による中和に対して、予期されない高感度を示した。TND_669Sは、同時期のおよび27ヶ月(登録後)自己血清によって、それぞれ、845および1,353の力価で中和され、一方、その中和感受性が同じ時点(登録15ヶ月後)から得られたエンベロープ・クローンに典型的であり、そしてそのエンベロープ配列に基づいて比較のために遡及的に選択された別の単離体であるTND_669Lは、同時期の自己血清中和に感受性でなく、そして登録27ヶ月後の自己血清によって、わずか26の力価でしか中和されなかった(図1)。次いで、TND_669SおよびTND_669L Env−偽ウイルスを異種患者血清パネル、ならびに陽性対照として用いるいくつかのHIV+血清/Abに対して試験した。TND_669S Env−偽ウイルスは、トリニダード・コホート内で、異種血清による中和に、最大47倍より感受性であることが示された。試験した14人の患者血清の中で、7つは、TND_669L偽ウイルスよりも10倍より効率的にTND_669S偽ウイルスを中和した(図1)。
TND_669Sエンベロープの中和感受性増加の原因となる遺伝子変動に関して、TND_669SおよびTND_669L gp160のタンパク質およびDNA配列を調べた。2つのenv DNA配列間には6ヌクレオチドの相違がある。しかし、これらのうち5つは同義の(synomonous)突然変異であり、TND_669SおよびTND_669L Env間に単一のアミノ酸相違を生じる。単一アミノ酸相違は、MPER中、2F5エピトープのC末端近傍および4E10エピトープの2aa上流である、669位に位置する(図2)。TND_669Lは2F5コンセンサス配列を含有し、一方、TND_669SはL669S突然変異を含有する。患者SC42の登録15ヶ月後の血漿から得られる10のクローンのうち3つは、この突然変異を含有し、一方、この突然変異は、登録1週間後の血漿または登録5年後の血漿のいずれにも見られなかった。興味深いことに、LANLデータベース中、ほぼ1000の全長Env配列のうちわずか1つがこのL669S突然変異を含有する。
L669S突然変異の位置に基づいて、2F5および4E10 mAbに対するTND_669SおよびTND_669Lの感受性を試験した。驚くべきことではないが、TND_669Sは2F5 mAbに非常に感受性であり、一方、TND_669Lは中程度にしか感受性でなかった(図3)。興味深いことに、TND_669Sはまた、TND_669Lに比較して、4E10 mAbによる中和に非常に感受性である。図3に示すように、TND_669S Env−偽ウイルスに対する2F5および4E10 mAbのIC50は、TND_669L Env−偽ウイルスに対するものより、それぞれ、279倍および275倍低かった。TND_669SおよびTND_669Lの平均IC50は、2F5に関して、それぞれ0.014(±0.0056)および3.92(±1.52)μg/mlであり、そして4E10に関して、それぞれ0.031(±0.012)および8.49(±1.29)μg/mlであった。
L669S突然変異が単独で、表現型変化の原因であることを確認するため、部位特異的突然変異誘発によって、TND_669S内に、S669L突然変異を導入した。生じたTND_669S/S669Lは、2F5に対して、TND_669Lのものと匹敵する、中程度の感受性しか示さず、TND_669SにおけるL669S突然変異が単独で、中和に対する感受性増加に寄与していることが確認された。次に、L669S突然変異と関連する表現型変化におけるウイルス骨格の役割を調べた。別の初代単離体、QZ4734のエンベロープ内に、L669S突然変異を導入した。L669S突然変異は、QZ4734 Env−偽ウイルスを、2F5 mAbによる中和に対して、2対数規模より高く感受性にした(図15)。さらに、L669S突然変異を共有する他の2つのクローンは、2F5に対する類似の度合いの感受性増加を示した(図16)。これらの発見によって、L669Sが、ウイルス骨格に関わらず、MPER抗体による中和に対するHIV−1エンベロープの感受性を増加させうることが示唆される。
2F5耐性Env変異体の性質決定によって、DKWコア領域中のK665N突然変異が2F5結合を抑止し、そして2F5耐性を生じることが示されてきている(Purtscherら, Aids 10:587−593(1996))。これによって、2F5エピトープEQELLELDKWASLWNのコア領域中のDKWが2F5結合に必須であることが示唆される。2F5によるTND_669Sエンベロープの強力な中和もまた、慣用的な2F5エピトープのコアアミノ酸への2F5 mAbの結合によって仲介されるかどうかを試験するため、TND_669S/K665N突然変異体を作製し、そして2F5および4E10 mAbに対するその感受性を試験した。TND_669Sエンベロープ内にK665N突然変異を導入すると、完全な2F5耐性表現型が生じ、一方、4E10に対するエンベロープの感受性は影響を受けなかった。
L669S置換がMPER中和感受性を増加させる能力に関与するありうる機構を調べるため、コンセンサス2F5エピトープ(2F5656−670)またはL669S置換を含む2F5エピトープ(2F5656−670/L669S)のいずれかを含有するペプチドを合成し、そして続いて、これらが2F5 mAb中和活性を吸収する能力に関して試験した。中和アッセイ前に、2F5 mAbをF5conまたはF5mutペプチドのいずれかであらかじめ吸収した。驚くべきことに、F5mutは、2F5 mAb中和をF5conより強力には阻害しなかった。図6Aおよび6Bに示すように、どちらのペプチドも、用量依存性方式で、TND_669S Env偽ウイルスの2F5中和を阻害した。しかし、3μMのF5mut(2F5 mAbのIC50を0.951μg/mlまで減少させた)および0.3μMのF5con(2F5 mAbのIC50を0.911μg/mlまで減少させた)によって達成される阻害が匹敵するレベルであることによって明らかであるように、F5conは、2F5中和を阻害する際、より効率的である(図4B)。
L669S突然変異が2F5 mAbに対する2F5エピトープのアビディティーを増進する可能性を調べるため、コンセンサス2F5エピトープ(2F5656−670)またはL669S突然変異を含む2F5エピトープ(2F5656−670/L669S)のいずれかを含有するペプチドを、各ペプチドのスクランブル化型とともに、2F5結合熱力学に関して、BIAcore SPR(表面プラズモン共鳴)において試験した。F5conおよびF5mutペプチドに関する平衡解離定数(KD)は、それぞれ11.0および28.1nMであり(図5)、F5conがF5mutよりもわずかに高いアビディティーで2F5に結合するが、この2.7倍の相違が有意な相違ではないことが示される。結合ELISAデータによってもまた、2F5 mAbによる2つのペプチドの結合間に有意な相違がないことが確認された(図5)。これによって、MPER配列の示差的な感受性には、中和抗体のこの領域の曝露を改変する、MPERにおけるコンホメーション変化などの、他の要因が関与している可能性が示唆される。
HIV−1ウイルスにおいて、MPERはエンベロープ脂質二重層に極近接している。直接結合SPRアッセイは、2F5 mAbがF5conおよびF5conペプチドに匹敵するアビディティーで結合することを示した。脂質環境において、エピトープへの2F5 mAbの結合に対するL669S置換のありうる影響をさらに調べるため、リン脂質含有リポソームに係留されたペプチドを用いて、SPR結合アッセイを行った。図6に示すように、L669S置換を含有するペプチドは、注入を停止した10秒後、616.7の反応単位(バックグラウンドを減じたもの)で2F5 mAbに結合する一方、コンセンサス2F5エピトープは、494.6の反応単位で2F5に結合し、脂質環境において、L669S置換を含む2F5ペプチドが、コンセンサス2F5 mAbよりも強く、2F5 mAbに結合することが示された。
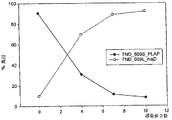
MPER構造における改変が適合度欠損を生じるかどうかを決定するため、NL4−3骨格、ならびにそれぞれTND_669SおよびTND_669Lエンベロープ配列を含有する複製コンピテント組換えウイルスを用いて、末梢血リンパ球における二重感染競合アッセイによって、TND_669SおよびTND_669Lウイルスの相対適合度を調べた。9:1の投入比(TND_669S:TND_669L)で、感染4日後、TND_669Sウイルスよりも、TND_669Lウイルスが増殖し(図7)、TND_669SウイルスにおけるL669S突然変異に関連する適合度の有意な喪失が示唆された。計算される相対適合度(1+S)は1.86である。適合度相違をさらに定量化するため、1:4の比(TND_669S:TND_669L)もまた調べ、そしてTND_669Sウイルスの適合度低下が確認された(データ未提示)。
gp41 MPERペプチド・リポソーム・コンジュゲートの説明:
図8は、合成リポソームにコンジュゲート化可能なHIV−1 gp41 MPERペプチド各々のアミノ酸配列を示す。これらの配列が用いられてきているが、7つ組反復2(HR2)領域(aa 637−683)の全体を含む、より長いgp41配列、ならびにHR2領域とともにHR1領域を含む、より長い配列を用いてもよい(aa 549−602)。SP62ペプチドは、2F5 mAbエピトープを提示し、一方、MPER656ペプチドには、2F5および4E10 mAb gp41エピトープ両方が含まれる(WO 2008/127651を参照されたい)。MPERペプチド配列の2つの変異体には、SP62−L669SおよびMPER656−L669Sが含まれる。L669S突然変異は、自己および異種血清両方による中和に非常に感受性である、慢性感染HIV−1+被験体から得られたHIV−1エンベロープ・クローン(TND_669S)において同定された(実施例1を参照されたい)。TND_669Sは、2F5および4E10 mAbの両方による中和に非常に感受性である(TND_669Lに比較した際、約300倍低いIC50を伴う)(Shen J. Virology 83:3617−25(2009))。該突然変異は、mAb 2F5−ペプチド・リポソーム複合体(SP62−L669Sペプチド−リポソーム)の有意により緩慢な解離速度を伴う、より好ましいmAb結合動力学を生じた。SP62−リポソームのトリプトファン(W)侵入深度分析によって、L669S置換がコア2F5および4E10エピトープの配向を改変可能であり、そしてこれらをB細胞認識によりアクセス可能にすることが示唆された。したがって、SP62−L669SおよびMPER656−L669Sペプチドを持つリポソームの両方の型におけるL669S置換の使用は、好ましく曝露されたコアMPER中和エピトープおよび免疫後の中和抗体誘導の潜在能力を持つ、新規免疫原を提供する。
図9に示すToll様受容体リガンドを、gp41 MPERペプチド免疫原とともに、リポソーム型で配合した。図9に言及されるリガンドは、例のみであり、そしてTLRアゴニストの他の型(Takedaら, Annu. Rev. Immunol., 21:335−376(2003))もまた、類似のリポソーム内に取り込み可能である。
MPER中和mAb、4E10および2F5の長いCDR H3ループは、ビリオン膜脂質と相互作用すると仮定される疎水性面を有する(Ofekら, J. Virol. 78:10724(2004); Cardosoら, Immunity 22:163−173(2005))。4E10(scFv)および2F5(IgG)のCDRH3突然変異体が構築されてきており(図13を参照されたい)、そして中和MPER mAbの結合が経時的に起こり、そしてgp41の融合前中間体状態への結合前に、ウイルス膜脂質へのmAbの結合によって開始されることが見出されてきている。4E10 scFvは、名目(nominal)エピトープ・ペプチドおよび三量体gp41融合中間体タンパク質の両方に強く結合するが、HIV−1およびSIVビリオンの両方に弱く結合し、そしてしたがって、4E10がウイルス膜脂質に結合するが、gp41の融合前状態には結合しないことが示される。4E10のCDR H3ループの疎水性面上の位でのアラニン置換(W100a/W100b/L100cA)は、gp41エピトープへの同様の結合を示したが、同じ置換は、4E10がHIV−1ウイルス膜に結合する能力を妨害した(図14)。gp41中間体タンパク質に結合するが、HIV−1ウイルス膜に結合しない、4E10 CDR H3突然変異体は、HIV−1中和に失敗した。同様に、HIV−1ビリオンへの結合が妨害されるが、gp41エピトープ・ペプチドへの結合が妨害されていない、2F5 CDR H3突然変異体は、HIV−1中和に失敗した(図14)。gp41融合中間体タンパク質による4E10のHIV−1中和活性の遮断によって、4E10がウイルス融合前gp41に結合しないことがさらに示唆された。これらの結果によって、中和MPER mAbの結合が経時的に起こり、そしてgp41の融合前中間体状態への結合前に、ウイルス膜脂質へのmAbの結合によって開始されるというモデルが裏付けられる。この結果の重要な暗示は、HIV−1膜が、4E10および2F5による結合および中和の、さらなる構造構成要素を構成することである。したがって、免疫原が4E10および2F5様抗体反応を誘導するには、脂質構成要素が必要である可能性もある。
HIV−1 gp41 MPERペプチド(図8)を、上に概略し、そして先に記載されるように(Alamら, J. Immunol. 178:4424−4435(2007))、合成リポソームにコンジュゲート化してもよい。超音波処理したMPERペプチド−リポソームの各々を調製し、そして次いで可溶性IFNαタンパク質と混合し、そして次いで、乾燥させ、そして再水和させて、サイトカインを被包してもよい。短時間ボルテックスした後、被包したIFNαとともに再水和させたリポソームを30分間超遠心することによって、収集してもよい。第一の設計において、リポソームをoCpG(TLR9)、MPL−A(TLR4)またはR848(TLR7/9)のいずれかにコンジュゲート化する(図11)。これらのアジュバント化リポソーム構築物各々を、図8に示す、列挙するMPERペプチド各々を用いて調製することも可能である。第二の設計を図12に示し、そしてこれには、複数のTLRリガンドが含まれ、TLR9+TLR4およびTLR9+TLR 7/8が同じリポソーム内に取り込まれる。これらの構築物の設計は、TLR誘発において相乗作用を提供し、そして多重反応性B細胞を活性化する際に、TLRリガンドの強度を潜在的に増進することも可能である。
実施例4
実験詳細
2匹の免疫動物由来の代表的なデータによって、MPERペプチド・リポソームでの反復免疫後のMPER特異的抗体反応の誘導のためのプライム/ブースト戦略の適用を示す(図17を参照されたい)。動物を、交互に、そして定期的な間隔で、まずSP62リポソームで(4x)、そして次いでEnv gp140(2x)タンパク質で免疫した。最後の2回の免疫には、全長MPER−656リポソームが含まれる(上記免疫原の説明を参照されたい)。示す配列を持つMPERペプチドへの結合のSPR分析によって、免疫血清における結合反応を測定した。示す事後出血(post−bleed)時点で、各免疫動物由来の出血試料を収集した。各MPER残基の単一アミノ酸置換を含む、ビオチン化アラニン置換MPERペプチドを用いて、BIAcore A100上で、免疫血清のエピトープマッピングを行った。上部に円で囲んだ残基は、MPERペプチドへの結合に必要な非常に重要な残基(赤(下線)で示したものは、アラニン置換ペプチドへの結合に際して>50%減少を伴う)を示す。青の残基(下線なし)は、関与の度合いがより低い残基を示す(結合の<20〜50%の減少)。
提示する実験データは、HIV−1エンベロープタンパク質のgp41上の中和エピトープをターゲティングする抗体の誘導における、設計されたMPERリポソーム免疫原の適用を示す。該データは、構築されたMPERペプチド・リポソームがモルモットなどの小動物および非ヒト霊長類(NHP)で免疫原性であり、そして誘導される抗体反応が、gp41 MPER上のコア中和エピトープに特異的であることを示す。これらの研究はまた、MPER特異的反応増進における、そして2F5コア残基DKWを含むコア中和エピトープへの抗体反応の集束における、プライム−ブースト戦略の適用も示す。提示する免疫スキームにおいて、データは、最初の反応における、コアDKWのN末端にある残基から、後の時点で誘導されるコア中和エピトープの3つの残基すべて(DKW)を含む反応への結合エピトープのシフトを示す。MPERリポソームでの最後の免疫は、広域中和mAb 2F5のコアDKW残基への抗体反応の集束を生じた。これらのデータは、モルモット(図17)およびNHP(図18)のような実験動物におけるMPER特異的抗体誘導のための、リポソーム型MPER免疫原の設計の適用を示す。こうしたMPER免疫原設計は、ヒト試験の候補でありうる。
図18Aに示すように、MPER特異的結合反応は、gp140 Envタンパク質でのプライミング後には誘導されず、MPERリポソームでのブースト後に誘導された。MPERペプチドへの結合反応は、gp140タンパク質での複数の免疫後には検出されなかった。同じ動物をMPER−656リポソームでブーストすると、2F5名目エピトープ・ペプチドに特異的なMPER特異的反応が生じた。
上に引用するすべての文書および他の情報供給源は、その全体が本明細書に援用される。
Claims (23)
- 被験体において、抗HIV−1抗体の産生を誘導する方法であって、前記被験体に、前記誘導を達成するのに十分な量のリポソーム−ペプチド・コンジュゲートを投与する工程を含み、前記ペプチドが、前記リポソーム表面上に提示される膜近位外部領域(MPER)エピトープを含み、そして前記コンジュゲートがToll様受容体(TLR)リガンドを含む、前記方法。
- 前記ペプチドが疎水性リンカーをさらに含む、請求項1記載の方法。
- 前記リンカーが、前記MPERエピトープに対してC末端である、請求項2記載の方法。
- 前記リンカーがGTH1である、請求項2記載の方法。
- 前記エピトープが配列ELDKWAまたはNWFNITを含む、請求項1記載の方法。
- 前記エピトープが配列QQEKNEQELLELDKWASLWNを含む、請求項5記載の方法。
- 前記エピトープが配列QQEKNEQELLELDKWASSWNを含む、請求項5記載の方法。
- 前記エピトープが配列NEQELLELDKWASLWNWFNITNWLWYIKを含む、請求項5記載の方法。
- 前記エピトープが配列NEQELLELDKWASSWNWFNITNWLWYIKを含む、請求項5記載の方法。
- 前記TRLリガンドがTRL9リガンドである、請求項1記載の方法。
- 前記TRL9リガンドがオリゴCpGである、請求項10記載の方法。
- 前記TRLリガンドがTRL7/8リガンドである、請求項1記載の方法。
- 前記TRL7/8リガンドがR848である、請求項12記載の方法。
- 前記TRLリガンドがTRL4リガンドである、請求項1記載の方法。
- 前記TRL4リガンドがモノホスホリルリピドAである、請求項14記載の方法。
- 前記コンジュゲートがTRL9リガンドおよびTRL7/8リガンドを含む、請求項1記載の方法。
- 前記TRL9リガンドがオリゴCpGであり、そして前記TRL7/8リガンドがR−848である、請求項16記載の方法。
- 前記コンジュゲートがTRL9リガンドおよびTRL4リガンドを含む、請求項1記載の方法。
- 前記TRL9リガンドがオリゴCpGであり、そして前記TRL4リガンドがR−848である、請求項18記載の方法。
- 前記コンジュゲートがさらに、被包されたインターフェロン−αを含む、請求項1記載の方法。
- 前記コンジュゲートがプライムまたはブーストとして投与される、請求項1記載の方法。
- リポソーム表面上に提示されるMPERエピトープ、および前記リポソームにコンジュゲート化された少なくとも1つのTRLリガンドを含む、免疫原。
- 前記リポソーム内に被包されたインターフェロン−αをさらに含む、請求項22記載の免疫原。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US16662509P | 2009-04-03 | 2009-04-03 | |
| US61/166,625 | 2009-04-03 | ||
| PCT/US2010/001017 WO2010114628A2 (en) | 2009-04-03 | 2010-04-05 | Formulation for inducing broadly reactive neutralizing anti-hiv antibodies |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2013505201A true JP2013505201A (ja) | 2013-02-14 |
| JP2013505201A5 JP2013505201A5 (ja) | 2013-11-21 |
Family
ID=42828908
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2012503432A Pending JP2013505201A (ja) | 2009-04-03 | 2010-04-05 | 広域反応性中和抗hiv抗体を誘導するための配合物 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US9402917B2 (ja) |
| EP (1) | EP2413951A4 (ja) |
| JP (1) | JP2013505201A (ja) |
| AU (1) | AU2010232915A1 (ja) |
| CA (1) | CA2757240A1 (ja) |
| WO (1) | WO2010114628A2 (ja) |
Families Citing this family (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU2006235507B2 (en) | 2005-04-12 | 2012-08-30 | Duke University | Method of inducing neutralizing antibodies to human immunodeficiency virus |
| EP2139516A4 (en) * | 2007-04-13 | 2011-06-29 | Univ Duke | METHOD FOR INDUCING NEUTRALIZING ANTIBODIES AGAINST THE HUMAN IMMUNODEFICIENCY VIRUS |
| US20120070488A1 (en) * | 2007-09-28 | 2012-03-22 | Duke University | Method of inducing neutralizing antibodies to human immunodeficiency virus |
| US20140322262A1 (en) * | 2007-09-28 | 2014-10-30 | Duke University | Method of inducing neutralizing antibodies to human immunodeficiency virus |
| JP2013505201A (ja) | 2009-04-03 | 2013-02-14 | デューク ユニバーシティー | 広域反応性中和抗hiv抗体を誘導するための配合物 |
| JP2013520498A (ja) * | 2010-02-25 | 2013-06-06 | デューク ユニバーシティー | 防御的抗hiv−1抗体の産生を誘導する方法 |
| WO2012101509A2 (en) * | 2011-01-28 | 2012-08-02 | Sanofi Pasteur Sa | Immunological compositions against hiv |
| WO2014020205A2 (es) * | 2012-07-31 | 2014-02-06 | Universidad De Granada | Inmunógenos anti-vih mejorados |
| CA2889064A1 (en) * | 2012-10-19 | 2014-04-24 | The Council Of The Queensland Institute Of Medical Research | Improved human herpesvirus immunotherapy |
| WO2015048635A1 (en) | 2013-09-27 | 2015-04-02 | Duke University | Mper-liposome conjugates and uses thereof |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2006512391A (ja) * | 2002-12-30 | 2006-04-13 | スリーエム イノベイティブ プロパティズ カンパニー | 組み合わせ免疫賦活薬 |
| WO2008127651A1 (en) * | 2007-04-13 | 2008-10-23 | Duke University | Method of inducing neutralizing antibodies to human immunodeficiency virus |
Family Cites Families (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2157900A1 (en) | 1993-03-11 | 1994-09-15 | Angeline Douvas | Therapeutic strategies for immunoinfective cluster virus infections |
| ATE246513T1 (de) | 1993-05-27 | 2003-08-15 | Entremed Inc | Zubereitungen und verfahren für die behandlung von krebs und hyperproliferierenden krankheiten |
| CA2185129A1 (en) | 1994-03-14 | 1995-09-21 | Angeline Douvas | Methods to diagnose and treat hiv-1 infection |
| US6156337A (en) | 1994-07-08 | 2000-12-05 | Opperbas Holding B.V. | Method for high loading of vesicles with biopolymeric substances |
| US6207646B1 (en) | 1994-07-15 | 2001-03-27 | University Of Iowa Research Foundation | Immunostimulatory nucleic acid molecules |
| EP1250933A1 (en) * | 2001-04-17 | 2002-10-23 | Istituto Superiore di Sanità | Vaccines including as an adjuvant high dose type I IFN |
| JP2007524603A (ja) | 2003-03-27 | 2007-08-30 | ザ ユニバーシティー オブ テキサス | Hiv/エイズの受動免疫治療用ループス抗体 |
| AU2006235507B2 (en) | 2005-04-12 | 2012-08-30 | Duke University | Method of inducing neutralizing antibodies to human immunodeficiency virus |
| US20080057075A1 (en) | 2005-04-12 | 2008-03-06 | Haynes Barton F | Method of inducing neutralizing antibodies to human immunodeficiency virus |
| WO2008142133A1 (en) | 2007-05-24 | 2008-11-27 | Glaxosmithkline Biologicals S.A | Lyophilised antigen composition |
| US20120070488A1 (en) | 2007-09-28 | 2012-03-22 | Duke University | Method of inducing neutralizing antibodies to human immunodeficiency virus |
| US20140322262A1 (en) | 2007-09-28 | 2014-10-30 | Duke University | Method of inducing neutralizing antibodies to human immunodeficiency virus |
| WO2009111304A2 (en) | 2008-02-29 | 2009-09-11 | President And Fellows Of Harvard College | A fusion-intermediate state of hiv-1 gp41 targeted by broadly neutralizing antibodies |
| SI2340038T1 (en) | 2008-10-10 | 2018-05-31 | Children's Medical Center Corporation | A biochemically stabilized HIV-1 ENV TRIMER vaccine |
| US8936789B2 (en) | 2008-10-16 | 2015-01-20 | New York Bood Center, Inc. | Immunoenhancer-linked oligomeric HIV envelope peptides |
| US20120177721A1 (en) * | 2009-04-03 | 2012-07-12 | Alam S Munir | Formulation |
| JP2013505201A (ja) | 2009-04-03 | 2013-02-14 | デューク ユニバーシティー | 広域反応性中和抗hiv抗体を誘導するための配合物 |
-
2010
- 2010-04-05 JP JP2012503432A patent/JP2013505201A/ja active Pending
- 2010-04-05 WO PCT/US2010/001017 patent/WO2010114628A2/en active Application Filing
- 2010-04-05 EP EP10759166.1A patent/EP2413951A4/en not_active Withdrawn
- 2010-04-05 US US13/262,706 patent/US9402917B2/en active Active
- 2010-04-05 AU AU2010232915A patent/AU2010232915A1/en not_active Abandoned
- 2010-04-05 CA CA2757240A patent/CA2757240A1/en not_active Abandoned
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2006512391A (ja) * | 2002-12-30 | 2006-04-13 | スリーエム イノベイティブ プロパティズ カンパニー | 組み合わせ免疫賦活薬 |
| WO2008127651A1 (en) * | 2007-04-13 | 2008-10-23 | Duke University | Method of inducing neutralizing antibodies to human immunodeficiency virus |
Non-Patent Citations (5)
| Title |
|---|
| JPN6013008064; J.IMMUNOL. VOL.178, NO.3, 20070201, P.1564-1572 * |
| JPN6014024763; J Immunol, vol.178, p.4424-4435 (2007) * |
| JPN6014024765; PNAS, vol.107, p.5972-5977 (2010) * |
| JPN6014024767; J Virol, vol.82, p.115-125 (2008) * |
| JPN6014024768; J Virol, vol.82, p.6869-6879 (2008) * |
Also Published As
| Publication number | Publication date |
|---|---|
| EP2413951A4 (en) | 2015-05-20 |
| AU2010232915A1 (en) | 2011-10-20 |
| WO2010114628A2 (en) | 2010-10-07 |
| US20120128758A1 (en) | 2012-05-24 |
| US9402917B2 (en) | 2016-08-02 |
| CA2757240A1 (en) | 2010-10-07 |
| EP2413951A2 (en) | 2012-02-08 |
| WO2010114628A9 (en) | 2010-11-25 |
| WO2010114628A3 (en) | 2011-03-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US9402917B2 (en) | Methods for the induction of broadly anti-HIV-1 neutralizing antibody responses employing liposome-MPER peptide compositions | |
| Dennison et al. | Induction of antibodies in rhesus macaques that recognize a fusion-intermediate conformation of HIV-1 gp41 | |
| US10588960B2 (en) | Liposome-peptide conjugate and method of using same to induce production of anti-HIV antibodies | |
| Liu et al. | The development of HIV vaccines targeting gp41 membrane-proximal external region (MPER): challenges and prospects | |
| US20150147387A1 (en) | Method of inducing antibodies to human immunodeficiency virus involving the administration of mper peptide-liposome conjugates | |
| US20080057075A1 (en) | Method of inducing neutralizing antibodies to human immunodeficiency virus | |
| JP2015508279A (ja) | Hivgp−120改変体の迅速選択法 | |
| Yu et al. | The binding of HIV-1 gp41 membrane proximal domain to its mucosal receptor, galactosyl ceramide, is structure-dependent | |
| US20120070488A1 (en) | Method of inducing neutralizing antibodies to human immunodeficiency virus | |
| US10076567B2 (en) | MPER-liposome conjugates and uses thereof | |
| US20140322262A1 (en) | Method of inducing neutralizing antibodies to human immunodeficiency virus | |
| US20110293697A1 (en) | HIV-1 Immunogenic Compositions | |
| Vaine et al. | Improved induction of antibodies against key neutralizing epitopes by HIV-1 gp120 DNA prime-protein boost vaccination compared to gp120 protein only vaccination | |
| Koornneef et al. | CoPoP liposomes displaying stabilized clade C HIV-1 Env elicit tier 2 multiclade neutralization in rabbits | |
| US20110159037A1 (en) | Methods of treating and protecting against human immunodeficiency virus | |
| IL300527A (en) | COMPOSITIONS AND METHODS RELATED TO EBOLA VIRUS VACCINES | |
| Watson | Lipopeptide immunogens targeting the membrane proximal region of HIV-1 gp41 | |
| Melnychuk | Optimization of an HIV-1 clade C DNA vaccine | |
| WO2017007646A1 (en) | Hiv-1 clade c envelope glycoproteins | |
| AU2014202366A1 (en) | Method of Inducing Neutralizing Antibodies to Human Immunodeficiency Virus | |
| JP2015532591A (ja) | Hivgp120変異体のための迅速な免疫原選択改良法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130405 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20130405 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20131003 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20140616 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20140916 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20140924 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20141016 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20141023 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20150128 |