JP2012180304A - 鶏のカンピロバクター感染を制御するための飲料 - Google Patents
鶏のカンピロバクター感染を制御するための飲料 Download PDFInfo
- Publication number
- JP2012180304A JP2012180304A JP2011043933A JP2011043933A JP2012180304A JP 2012180304 A JP2012180304 A JP 2012180304A JP 2011043933 A JP2011043933 A JP 2011043933A JP 2011043933 A JP2011043933 A JP 2011043933A JP 2012180304 A JP2012180304 A JP 2012180304A
- Authority
- JP
- Japan
- Prior art keywords
- lactic acid
- acid bacteria
- drinking water
- chicken
- campylobacter
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Landscapes
- Fodder In General (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Feed For Specific Animals (AREA)
Abstract
【課題】養鶏場の鶏のカンピロバクターによる汚染を防除する効果的な方法の提供。
【解決手段】乳酸菌を通常の飲用水に浮遊または懸濁させた鶏用飲用水であり、好ましくはさらに腸内乳酸菌の増殖を促進するオリゴ糖を加えたものである。乳酸菌は、鶏腸内のpHを約5に維持する性状を有する菌であることが望ましく,乳酸菌とオリゴ糖さらには乳糖を加えた飲用水を、鶏に一日飲用させるだけで鶏の腸管に存在するカンピロバクターを長期間排除することができる。出荷前の鶏にこの飲用水を飲用させることによりカンピロバクターに起因する食中毒の発生は抑制される。
【選択図】なし
【解決手段】乳酸菌を通常の飲用水に浮遊または懸濁させた鶏用飲用水であり、好ましくはさらに腸内乳酸菌の増殖を促進するオリゴ糖を加えたものである。乳酸菌は、鶏腸内のpHを約5に維持する性状を有する菌であることが望ましく,乳酸菌とオリゴ糖さらには乳糖を加えた飲用水を、鶏に一日飲用させるだけで鶏の腸管に存在するカンピロバクターを長期間排除することができる。出荷前の鶏にこの飲用水を飲用させることによりカンピロバクターに起因する食中毒の発生は抑制される。
【選択図】なし
Description
本発明は、養鶏場における鶏のカンピロバクター汚染を制御する飲料に関する。
カンピロバクター属菌は、グラム陰性、両端又は一端に長い鞭毛を持つ微好気性の螺旋形桿菌で、家畜、家禽、伴侶動物および野生動物の消化管や生殖器などに広く分布している。
近年、カンピロバクターは先進国では小児と青年層を中心に主に食中毒による散発性下痢症から最も高率に分離され、ヨーロッパではカンピロバクターが原因である食中毒が年間約20万件発生している(非特許文献1)。日本では平成21年の食中毒発生状況によるとカンピロバクター食中毒の発生件数は345件で原因物質別で第1位となっている(厚生労働省食中毒統計)。食中毒統計に報告される事件数は実際の被害実数の氷山の一角にすぎないことも指摘されている(非特許文献2)。またカンピロバクター感染症は食中毒としてだけではなく人獣共通感染症として公衆衛生上重要なテーマの一つとなっている。また、臨床症状としては、重症度に違いはあるものの、通常は単純な急性胃腸炎として経過し、多くは数日以内に軽快するが、合併症として、ギランバレー症候群などを併発することがある。
近年、カンピロバクターは先進国では小児と青年層を中心に主に食中毒による散発性下痢症から最も高率に分離され、ヨーロッパではカンピロバクターが原因である食中毒が年間約20万件発生している(非特許文献1)。日本では平成21年の食中毒発生状況によるとカンピロバクター食中毒の発生件数は345件で原因物質別で第1位となっている(厚生労働省食中毒統計)。食中毒統計に報告される事件数は実際の被害実数の氷山の一角にすぎないことも指摘されている(非特許文献2)。またカンピロバクター感染症は食中毒としてだけではなく人獣共通感染症として公衆衛生上重要なテーマの一つとなっている。また、臨床症状としては、重症度に違いはあるものの、通常は単純な急性胃腸炎として経過し、多くは数日以内に軽快するが、合併症として、ギランバレー症候群などを併発することがある。
カンピロバクター食中毒の感染源としては食品、保菌動物の糞便、井戸水、未殺菌乳などが知られている。特に、先進諸国で感染源として最も重要視されているのが鶏肉で、鶏肉の汚染率は他の畜肉に比べ非常に高く、検査した鶏肉の100%が汚染されていた例も報告されている(非特許文献3)。これは、養鶏場において、鶏が高率にカンピロバクターを保菌していることに由来する(非特許文献4、5、6)。
養鶏場におけるカンピロバクター汚染が制御出来ればカンピロバクター食中毒の減少に多大な貢献ができるため、ワクチン(特許文献1参照)や生薬(特許文献2、3参照)あるいはβ−1,4−マンノビオース(特許文献4参照)などが検討されている。
鶏肉のカンピロバクター汚染の直接の原因としては、食鳥処理場における交差汚染が非常に重要である。カンピロバクター汚染鶏群の処理後にカンピロバクター非汚染鶏群を処理した場合に鶏肉がカンピロバクターに汚染される。また、まな板の上での鶏肉の解体時に汚染してしまうという二次的な汚染によることも多々ある。
養鶏場におけるカンピロバクター汚染が制御出来ればカンピロバクター食中毒の減少に多大な貢献ができるため、ワクチン(特許文献1参照)や生薬(特許文献2、3参照)あるいはβ−1,4−マンノビオース(特許文献4参照)などが検討されている。
鶏肉のカンピロバクター汚染の直接の原因としては、食鳥処理場における交差汚染が非常に重要である。カンピロバクター汚染鶏群の処理後にカンピロバクター非汚染鶏群を処理した場合に鶏肉がカンピロバクターに汚染される。また、まな板の上での鶏肉の解体時に汚染してしまうという二次的な汚染によることも多々ある。
消化管には多数の細菌が腸内細菌叢を形成している。これらの腸内細菌叢の中には生体にとって有用であるとされる乳酸菌やビフィズス菌に代表される善玉菌や生体によって有害とされている悪玉菌とが存在する。消化管内において乳酸菌やビフィズス菌を増加させると、結果として悪玉菌が減少し、腸内環境が改善される。これにもとづき、乳酸菌やビフィズス菌そのものであるプロバイオティクス、乳酸菌やビフィズス菌の増殖を促進させるものとしてオリゴ糖などのプレバイオティクスまたそれらを組み合わせたシンバイオティクスが。ヒトでは健康食品または医療品として、家畜では家畜用飼料または飼料添加物として利用されている
養鶏関係ではプレバイオティクスであるオリゴ糖を飼料に添加して鶏に投与することにより、鶏の腸管内の善玉菌である乳酸菌やビフィズス菌の増殖を促進し、ヒトの食中毒起因菌であるサルモネラの増殖抑制に効果があるとされているが、顕著な効果は得られていない(非特許文献7)。乳酸菌を動物へ用いる例として,ラクトバシラス・ロイテリおよびラクトバシラス・クリスパータスからなる生菌剤によるサルモネラ菌の腸管定着防止(特許文献5)、抗体と乳酸菌を投与するコクジウム症予防及び治療剤(特許文献6)、強制換羽障害防止剤(特許文献7)等があるが、本発明とは使用目的が異なっている。また、カンピロバクターに対して、オリゴ糖を飼料に添加することによって増殖が抑制されたという報告(非特許文献8)もあるが、感染初期段階には増殖を遅延させる効果はあるものの既にカンピロバクターに汚染されている鶏に対してはその改善は困難なようである。
Rinyら、Clin. Microbiol.Rev. 2008, 21; 505-518
日本カンピロバクター研究会誌, 2008, 1; 43
Suzukiら、J. Vet. Med. Sci. 2008, 71; 255-261
Natherら、Poult. Sci. 2009, 88;1299-1305
Newellら、Appl. Environ. Microbiol.2003, 69; 4343-4351
Onoら、Int. J. Food Microbiol.1999, 47; 211-219
深田恒夫ら、鶏病研報, 1995, 31; 113-117
向原要一ら、鶏病研報, 1993, 28; 203-205
鶏のカンピロバクター汚染を制御する有効な手法は確立されていない。そのため、養鶏場はカンピロバクターに汚染されたままの鶏を市場へ出荷しており、これが原因による食中毒の発生が絶えない。
本発明の目的は、鶏の体内から効率よくカンピロバクターを排除する効果を有する乳酸菌を含む飲用水の提供である。さらに養鶏場のカンピロバクター感染鶏群に対し、本飲用水を飲水投与することによりカンピロバクターを体内から排除する手法を提供することである
すなわち、本発明は、乳酸菌を通常の飲用水に浮遊または懸濁させた鶏用飲用水であり、好ましくはさらに腸内乳酸菌の増殖を促進するオリゴ糖を加えたものである。乳酸菌は、鶏腸内のpHを約5に維持する性状を有する菌であることが望ましく,鶏の盲腸内から常法により分離、選択が可能である。本発明に使用した分離株Lactobacillus salivarius B-22は特許微生物寄託センターへ寄託されている(受託番号:FERM P-22045)。これらの乳酸菌を最終濃度で107CFU/mL以上好ましくは108CFU/mL以上となるよう飲水に懸濁すればよい。
乳酸菌に添加するオリゴ糖は、フラクトオリゴ糖が好ましいが、特に限定されない。添加濃度が5%から10%の範囲では、濃度に比例してカンピロバクターの発育は阻止される。さらに糖分として乳糖を5%程度添加すればなおよい。本発明の飲用水は、投与期間が1日の飲水投与で持続効果が得られる特徴を有する。この特徴は、食鳥処理場へ出荷する前の作業量の軽減に貢献する。本発明により、多忙な養鶏業者にも受け入れ可能な、簡便かつ安価なカンピロバクターの汚染防止方法が提供できる。
本発明の飲用水を出荷前の鶏に一日間飲用させるだけで,鶏の腸管に存在するカンピロバクターを長期間排除することができ、鶏のカンピロバクターに起因する食中毒の発生を防止できる。
例1
鶏の盲腸内から分離し、かつ高度にカンピロバクター・ジェジュニの発育を阻止する乳酸菌、ラクトバシラス・サリバリウス(Lactobacillu salivarius) B-22株をMRS液体培地で37℃、18時間培養し、培養菌液を7,500rpm、5分間遠心後、沈渣を水に浮遊(108CFU/mL濃度、浮遊液という。)させた。またフラクトオリゴ糖をこの浮遊液に5%濃度で添加し、試験区用の飲用水とした。
鶏の盲腸内から分離し、かつ高度にカンピロバクター・ジェジュニの発育を阻止する乳酸菌、ラクトバシラス・サリバリウス(Lactobacillu salivarius) B-22株をMRS液体培地で37℃、18時間培養し、培養菌液を7,500rpm、5分間遠心後、沈渣を水に浮遊(108CFU/mL濃度、浮遊液という。)させた。またフラクトオリゴ糖をこの浮遊液に5%濃度で添加し、試験区用の飲用水とした。
試験1
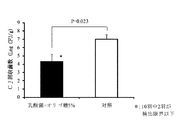
試験区として鶏10羽、対照区として鶏10羽を用いた。4日齢時、試験区及び対照区の鶏にカンピロバクター・ジェジュニを107CFU/羽ずつ経口投与チューブを用いてそ嚢内に接種し感染させた。8日齢時、対照区の鶏に乳酸菌及びオリゴ糖を含む上記の飲用水を1日間不断飲水投与し、投与終了後に鶏を安楽死させ盲腸内容物を採材し、盲腸内のカンピロバクター・ジェジュニ生菌数の測定を行った。結果、試験区10羽の平均菌数(対数)は4.32±0.90(標準誤差:SE)
Log10CFU/gで、対照区10羽の平均菌数は7.00±0.57 (SE) Log10CFU/gであった。また両区には有意差(危険率5%)が認められた。試験区については10羽中2羽でカンピロバクター・ジェジュニ生菌数が検出限界以下であった。(図1参照)。
試験区として鶏10羽、対照区として鶏10羽を用いた。4日齢時、試験区及び対照区の鶏にカンピロバクター・ジェジュニを107CFU/羽ずつ経口投与チューブを用いてそ嚢内に接種し感染させた。8日齢時、対照区の鶏に乳酸菌及びオリゴ糖を含む上記の飲用水を1日間不断飲水投与し、投与終了後に鶏を安楽死させ盲腸内容物を採材し、盲腸内のカンピロバクター・ジェジュニ生菌数の測定を行った。結果、試験区10羽の平均菌数(対数)は4.32±0.90(標準誤差:SE)
Log10CFU/gで、対照区10羽の平均菌数は7.00±0.57 (SE) Log10CFU/gであった。また両区には有意差(危険率5%)が認められた。試験区については10羽中2羽でカンピロバクター・ジェジュニ生菌数が検出限界以下であった。(図1参照)。
試験2
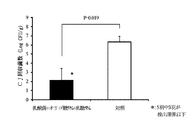
試験区として鶏20羽、対照区として鶏10羽を用いた。39日齢時、試験区及び対照区の鶏にカンピロバクター・ジェジュニを107CFU/羽ずつ経口投与チューブを用いてそ嚢内に接種し感染させた。43日齢時、対照区の鶏に乳酸菌及びオリゴ糖を含む上記の飲用水を1日間不断飲水投与し、投与終了後に鶏を安楽死させ盲腸内容物を採材し、盲腸内のカンピロバクター・ジェジュニ生菌数の測定を行った。結果、試験区20羽の平均菌数(対数)は5.35±0.39 (SE) Log10CFU/gで、対照区10羽の平均菌数は6.56±0.38 (SE) Log10CFU/gであった。また両区には有意差(危険率5%)が認められた。試験区については20羽中1羽でカンピロバクター・ジェジュニ生菌数が検出限界以下であった(図2参照)。
試験区として鶏20羽、対照区として鶏10羽を用いた。39日齢時、試験区及び対照区の鶏にカンピロバクター・ジェジュニを107CFU/羽ずつ経口投与チューブを用いてそ嚢内に接種し感染させた。43日齢時、対照区の鶏に乳酸菌及びオリゴ糖を含む上記の飲用水を1日間不断飲水投与し、投与終了後に鶏を安楽死させ盲腸内容物を採材し、盲腸内のカンピロバクター・ジェジュニ生菌数の測定を行った。結果、試験区20羽の平均菌数(対数)は5.35±0.39 (SE) Log10CFU/gで、対照区10羽の平均菌数は6.56±0.38 (SE) Log10CFU/gであった。また両区には有意差(危険率5%)が認められた。試験区については20羽中1羽でカンピロバクター・ジェジュニ生菌数が検出限界以下であった(図2参照)。
例2
上記例1と同じラクトバシラス・サリバリウス浮遊液(濃度:108CFU/mL)に、フラクトオリゴ糖及び乳糖をそれぞれ5%濃度となるよう添加して、試験区用の飲用水とした。
上記例1と同じラクトバシラス・サリバリウス浮遊液(濃度:108CFU/mL)に、フラクトオリゴ糖及び乳糖をそれぞれ5%濃度となるよう添加して、試験区用の飲用水とした。
試験1
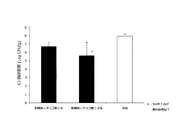
試験区として鶏5羽、対照区として鶏5羽を用いた。4日齢時、試験区及び対照区の鶏にカンピロバクター・ジェジュニを107CFU/羽ずつ経口投与チューブを用いてそ嚢内に接種し感染させた。8日齢時、対照区の鶏に乳酸菌、オリゴ糖、乳糖を含む上記の飲用水を1日間不断飲水投与し、投与終了後に鶏を安楽死させ盲腸内容物を採材し、盲腸内のカンピロバクター・ジェジュニ生菌数の測定を行った。結果、試験区5羽の平均菌数(対数)は2.13±1.31 (SE) Log10CFU/gで、対照区5羽の平均菌数は6.35±0.61 (SE) Log10CFU/gであった。また両区には有意差(危険率5%)が認められた。試験区については5羽中3羽でカンピロバクター・ジェジュニ生菌数が検出限界以下であった。(図3参照)。
試験区として鶏5羽、対照区として鶏5羽を用いた。4日齢時、試験区及び対照区の鶏にカンピロバクター・ジェジュニを107CFU/羽ずつ経口投与チューブを用いてそ嚢内に接種し感染させた。8日齢時、対照区の鶏に乳酸菌、オリゴ糖、乳糖を含む上記の飲用水を1日間不断飲水投与し、投与終了後に鶏を安楽死させ盲腸内容物を採材し、盲腸内のカンピロバクター・ジェジュニ生菌数の測定を行った。結果、試験区5羽の平均菌数(対数)は2.13±1.31 (SE) Log10CFU/gで、対照区5羽の平均菌数は6.35±0.61 (SE) Log10CFU/gであった。また両区には有意差(危険率5%)が認められた。試験区については5羽中3羽でカンピロバクター・ジェジュニ生菌数が検出限界以下であった。(図3参照)。
試験2
試験区として鶏11羽、対照区として鶏11羽を用いた。32日齢時、試験区及び対照区の鶏にカンピロバクター・ジェジュニを107CFU/羽ずつ経口投与チューブを用いてそ嚢内に接種し感染させた。36日齢時、対照区の鶏に乳酸菌及びオリゴ糖を含む上記の飲用水を1日間不断飲水投与し、投与終了後に鶏を安楽死させ盲腸内容物を採材し、盲腸内のカンピロバクター・ジェジュニ生菌数の測定を行った。結果、試験区11羽の平均菌数(対数)は4.23±0.95 (SE)
Log10 CFU/gで、対照区11羽の平均菌数は7.36±0.24 (SE)
Log10 CFU/gであった。また両区には有意差(危険率1%)が認められた。試験区については11羽中3羽でカンピロバクター・ジェジュニ生菌数が検出限界以下であった(図4参照)。
試験区として鶏11羽、対照区として鶏11羽を用いた。32日齢時、試験区及び対照区の鶏にカンピロバクター・ジェジュニを107CFU/羽ずつ経口投与チューブを用いてそ嚢内に接種し感染させた。36日齢時、対照区の鶏に乳酸菌及びオリゴ糖を含む上記の飲用水を1日間不断飲水投与し、投与終了後に鶏を安楽死させ盲腸内容物を採材し、盲腸内のカンピロバクター・ジェジュニ生菌数の測定を行った。結果、試験区11羽の平均菌数(対数)は4.23±0.95 (SE)
Log10 CFU/gで、対照区11羽の平均菌数は7.36±0.24 (SE)
Log10 CFU/gであった。また両区には有意差(危険率1%)が認められた。試験区については11羽中3羽でカンピロバクター・ジェジュニ生菌数が検出限界以下であった(図4参照)。
例3
例1,2と同じラクトバシラス・サリバリウス B-22株浮遊液(濃度:108CFU/mL)に、フラクトオリゴ糖を5%または10%濃度となるように添加し、試験区用の飲用水とした。
試験区としてそれぞれ鶏5羽、対照区として鶏5羽を用いた。4日齢時、試験区及び対照区の鶏にカンピロバクター・ジェジュニを107CFU/羽ずつ経口投与チューブを用いてそ嚢内に接種し感染させた。8日齢時、対照区の鶏に乳酸菌及びオリゴ糖を含む上記の飲用水を1日間不断飲水投与し、投与終了後に鶏を安楽死させ盲腸内容物を採材し、盲腸内のカンピロバクター・ジェジュニ生菌数の測定を行った。結果、乳酸菌+オリゴ糖5%試験区5羽の平均菌数(対数)は6.70±0.53 (SE) Log10CFU/g、乳酸菌+オリゴ糖10%試験区5羽の平均菌数は5.60±1.61 (SE) Log10CFU/gで、対照区5羽の平均菌数は7.92±0.26 (SE) Log10CFU/gであった。また試験区と対照区には有意差(危険率5%)が認められなかったが、試験区は減少傾向が認められ、乳酸菌+オリゴ糖10%試験区については5羽中1羽でカンピロバクター・ジェジュニ生菌数が検出限界以下であった(図5参照)。
例1,2と同じラクトバシラス・サリバリウス B-22株浮遊液(濃度:108CFU/mL)に、フラクトオリゴ糖を5%または10%濃度となるように添加し、試験区用の飲用水とした。
試験区としてそれぞれ鶏5羽、対照区として鶏5羽を用いた。4日齢時、試験区及び対照区の鶏にカンピロバクター・ジェジュニを107CFU/羽ずつ経口投与チューブを用いてそ嚢内に接種し感染させた。8日齢時、対照区の鶏に乳酸菌及びオリゴ糖を含む上記の飲用水を1日間不断飲水投与し、投与終了後に鶏を安楽死させ盲腸内容物を採材し、盲腸内のカンピロバクター・ジェジュニ生菌数の測定を行った。結果、乳酸菌+オリゴ糖5%試験区5羽の平均菌数(対数)は6.70±0.53 (SE) Log10CFU/g、乳酸菌+オリゴ糖10%試験区5羽の平均菌数は5.60±1.61 (SE) Log10CFU/gで、対照区5羽の平均菌数は7.92±0.26 (SE) Log10CFU/gであった。また試験区と対照区には有意差(危険率5%)が認められなかったが、試験区は減少傾向が認められ、乳酸菌+オリゴ糖10%試験区については5羽中1羽でカンピロバクター・ジェジュニ生菌数が検出限界以下であった(図5参照)。
例4
例1と同一条件で培養、遠心処理したラクトバシラス・サリバリウス B-22株の沈渣を水に108、107、106CFU/mL濃度となるように浮遊させた。またフラクトオリゴ糖をこの浮遊液に5%濃度で添加し、試験区用の飲用水とした。
試験区としてそれぞれ鶏5羽、対照区として鶏5羽を用いた。4日齢時、試験区及び対照区の鶏にカンピロバクター・ジェジュニを107CFU/羽ずつ経口投与チューブを用いてそ嚢内に接種し感染させた。8日齢時、対照区の鶏に乳酸菌及びオリゴ糖を含む上記の飲用水を1日間不断飲水投与し、投与終了後に鶏を安楽死させ盲腸内容物を採材し、盲腸内のカンピロバクター・ジェジュニ生菌数の測定を行った。結果、乳酸菌+オリゴ糖5%試験区5羽の平均菌数(対数)は6.90±0.21(SE)Log10CFU/gで、対照区5羽の平均菌数8.6±0.21(SE)Log10CFU/gと比べ有意な差(危険率5%)が認められた。また、乳酸菌1/10量+オリゴ糖5%試験区と対照区には有意な差は認められなかったが、乳酸菌1/10量+オリゴ糖5%試験区の5羽中1羽でカンピロバクター・ジェジュニが検出されなかったことから、乳酸菌1/10量においても有効であることが確認された。乳酸菌1/100量+オリゴ糖5%試験区では効果が認められなかった
例1と同一条件で培養、遠心処理したラクトバシラス・サリバリウス B-22株の沈渣を水に108、107、106CFU/mL濃度となるように浮遊させた。またフラクトオリゴ糖をこの浮遊液に5%濃度で添加し、試験区用の飲用水とした。
試験区としてそれぞれ鶏5羽、対照区として鶏5羽を用いた。4日齢時、試験区及び対照区の鶏にカンピロバクター・ジェジュニを107CFU/羽ずつ経口投与チューブを用いてそ嚢内に接種し感染させた。8日齢時、対照区の鶏に乳酸菌及びオリゴ糖を含む上記の飲用水を1日間不断飲水投与し、投与終了後に鶏を安楽死させ盲腸内容物を採材し、盲腸内のカンピロバクター・ジェジュニ生菌数の測定を行った。結果、乳酸菌+オリゴ糖5%試験区5羽の平均菌数(対数)は6.90±0.21(SE)Log10CFU/gで、対照区5羽の平均菌数8.6±0.21(SE)Log10CFU/gと比べ有意な差(危険率5%)が認められた。また、乳酸菌1/10量+オリゴ糖5%試験区と対照区には有意な差は認められなかったが、乳酸菌1/10量+オリゴ糖5%試験区の5羽中1羽でカンピロバクター・ジェジュニが検出されなかったことから、乳酸菌1/10量においても有効であることが確認された。乳酸菌1/100量+オリゴ糖5%試験区では効果が認められなかった
例5
乳酸菌およびオリゴ糖5%を1日間飲水投与後の盲腸内容物pH値とカンピロバクター・ジェジュニ生菌数の関係を調べたところ、カンピロバクター・ジェジュニが盲腸内容から検出できなかった(検出限界以下:200CFU/g)検体の盲腸内容pH値は何れも低い値を示した(図6参照)。このことはカンピロバクター・ジェジュニ の発育条件がpH4.9〜9.0の低いpH域では死滅または発育できないことを意味する。
乳酸菌およびオリゴ糖5%を1日間飲水投与後の盲腸内容物pH値とカンピロバクター・ジェジュニ生菌数の関係を調べたところ、カンピロバクター・ジェジュニが盲腸内容から検出できなかった(検出限界以下:200CFU/g)検体の盲腸内容pH値は何れも低い値を示した(図6参照)。このことはカンピロバクター・ジェジュニ の発育条件がpH4.9〜9.0の低いpH域では死滅または発育できないことを意味する。
FERM P−22045
Claims (9)
- 乳酸菌とオリゴ糖または乳酸菌とオリゴ糖および乳糖を水に混和したことを特徴とする鶏のカンピロバクター感染を制御するための飲用水。
- 乳酸菌が鶏の盲腸から分離された株であることを特徴とする請求項1に記載の飲用水。
- 乳酸菌がラクトバシラス・サリバリウス B-22 (Lactobacillus salivarius
B-22)株であることを特徴とする請求項1〜2に記載の飲用水。 - 乳酸菌を少なくとも107CFU/mL含むことを特徴とする請求項1〜3に記載の飲用水。
- 乳酸菌を少なくとも108CFU/mL含むことを特徴とする請求項1〜4に記載の飲用水。
- オリゴ糖がフラクトオリゴ糖であることを特徴とする請求項1〜5に記載の飲用水。
- オリゴ糖を5〜10%含有することを特徴とする請求項1〜6に記載の飲用水。
- さらに、乳糖を5〜10%含有することを特徴とする請求項1〜7に記載の飲用水。
- 鶏に請求項1〜8に記載の飲用水を投与してカンピロバクター感染を防止または治療する方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2011043933A JP2012180304A (ja) | 2011-03-01 | 2011-03-01 | 鶏のカンピロバクター感染を制御するための飲料 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2011043933A JP2012180304A (ja) | 2011-03-01 | 2011-03-01 | 鶏のカンピロバクター感染を制御するための飲料 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2012180304A true JP2012180304A (ja) | 2012-09-20 |
Family
ID=47011811
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011043933A Pending JP2012180304A (ja) | 2011-03-01 | 2011-03-01 | 鶏のカンピロバクター感染を制御するための飲料 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP2012180304A (ja) |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2004250365A (ja) * | 2003-02-19 | 2004-09-09 | Calpis Co Ltd | 強制換羽傷害防御剤、強制換羽方法及び飢餓時傷害防御剤 |
| JP2008543290A (ja) * | 2005-06-14 | 2008-12-04 | エルベル・アクチエンゲゼルシヤフト | プロバイオティック健康及び体調増進食品、餌及び/又は飲料水添加物並びにその使用 |
| WO2009156307A1 (en) * | 2008-06-24 | 2009-12-30 | Nestec S.A. | Probiotics, secretory iga and infection |
-
2011
- 2011-03-01 JP JP2011043933A patent/JP2012180304A/ja active Pending
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2004250365A (ja) * | 2003-02-19 | 2004-09-09 | Calpis Co Ltd | 強制換羽傷害防御剤、強制換羽方法及び飢餓時傷害防御剤 |
| JP2008543290A (ja) * | 2005-06-14 | 2008-12-04 | エルベル・アクチエンゲゼルシヤフト | プロバイオティック健康及び体調増進食品、餌及び/又は飲料水添加物並びにその使用 |
| WO2009156307A1 (en) * | 2008-06-24 | 2009-12-30 | Nestec S.A. | Probiotics, secretory iga and infection |
Non-Patent Citations (3)
| Title |
|---|
| JPN6014039810; Polish Journal of Veterinary Sciences Vol.12, No.1, 2009, pp.15-20 * |
| JPN6014039812; Journal of Food Protection Vol.70, No.4, 2007, pp.867-873 * |
| JPN6014039813; 鶏病研究会報 Vol.28, No.4, 1993, pp.203-205 * |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4846795B2 (ja) | プロバイオティック健康及び体調増進食品、餌及び/又は飲料水添加物並びにその使用 | |
| CN107073049B (zh) | 益生菌和益生元组合物 | |
| JP6452607B2 (ja) | プロバイオティクス組成物及びプレバイオティクス組成物 | |
| Getachew | A review on effects of probiotic supplementation in poultry performance and cholesterol levels of egg and meat | |
| CN101415342A (zh) | 饮食用组合物 | |
| Blatchford et al. | Prebiotic mechanisms, functions and applications-A review. | |
| Fathi | Effects of Lactobacillus cultures as probiotic on blood parameters, plasma enzymes activities and mortality in broiler chicken | |
| WO1991011510A1 (en) | Lactobacillus acidophilus f-133, lactic acid bacterium preparation prepared therefrom, and process for preparing the same | |
| Spring | Competitive exclusion of Salmonella using bacterial cultures and oligosaccharides. | |
| JP2012180304A (ja) | 鶏のカンピロバクター感染を制御するための飲料 | |
| US20200190464A1 (en) | Novel lactobacillus having antiviral effect and composition thereof | |
| JP2012125225A (ja) | 鶏のカンピロバクター感染を制御するための飼料 | |
| Mosenthin et al. | Biology of nutrition in growing animals | |
| Roos | Preselected pre-and probiotics combined with specific parent stock vaccination as preventive strategy targeting antibiotic-resistant Enterobacteriaceae in Broilers | |
| RU2642444C1 (ru) | Способ коррекции дисбиоза молодняка сельскохозяйственных животных | |
| Saleem | Comparative Study of Antibody Titers against Newcastle Disease in E. coli Infected and Non-Infected Broiler Chickens | |
| Lourenço et al. | Instant Insights: Antibiotics in poultry production | |
| Ricke | Alternatives to antibiotics in preventing zoonoses and other pathogens in poultry: prebiotics and related compounds SC Ricke, University of Arkansas, USA, AVS Perumalla, Kerry, USA; and Navam S. Hettiarachchy, University of Arkansas, USA | |
| Dixon | In vitro evaluation of the potential for select bacteria and yeast as probiotics in poultry production | |
| Geigerová et al. | Selection of prebiotic oligosaccharides suitable for | |
| Mikis | In vivo study of gastrointestinal tract survival and intestinal mucosa adhesion of Lactobacillus plantarum 2035 using a rat model |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20130918 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20141014 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20141211 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20150721 |