JP2012167152A - 微小管集合構造体及びその製造方法 - Google Patents
微小管集合構造体及びその製造方法 Download PDFInfo
- Publication number
- JP2012167152A JP2012167152A JP2011027769A JP2011027769A JP2012167152A JP 2012167152 A JP2012167152 A JP 2012167152A JP 2011027769 A JP2011027769 A JP 2011027769A JP 2011027769 A JP2011027769 A JP 2011027769A JP 2012167152 A JP2012167152 A JP 2012167152A
- Authority
- JP
- Japan
- Prior art keywords
- polysaccharide
- microtubule
- cellulose
- refrigerant
- solvent
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
- 0 CC1C=CC*1C Chemical compound CC1C=CC*1C 0.000 description 1
- FGUFEPJSTYZTML-UHFFFAOYSA-N C[N]1(C)CCC1 Chemical compound C[N]1(C)CCC1 FGUFEPJSTYZTML-UHFFFAOYSA-N 0.000 description 1
Images
Landscapes
- Polysaccharides And Polysaccharide Derivatives (AREA)
Abstract
【課題】多糖類で形成された、多数の管状構造が集合してなる微小管集合構造体及びその製造方法を提供すること。
【解決手段】主鎖を構成する単糖がピラノース構造を取り、そのイス型構造のエカトリアルにある水酸基どうしの結合で連なるシート状コンホメーションを取れる多糖類で形成された微小管状体の集合体である微小管集合構造体、及び前記多糖類を含有する多糖類含有液を収容した容器を冷媒に挿入することにより、冷媒液面の鉛直上方向に前記多糖類含有液中の溶媒を凍結成長させ、その後に凍結した溶媒を除去することを特徴とする微小管集合構造体の製造方法。
【選択図】図1
【解決手段】主鎖を構成する単糖がピラノース構造を取り、そのイス型構造のエカトリアルにある水酸基どうしの結合で連なるシート状コンホメーションを取れる多糖類で形成された微小管状体の集合体である微小管集合構造体、及び前記多糖類を含有する多糖類含有液を収容した容器を冷媒に挿入することにより、冷媒液面の鉛直上方向に前記多糖類含有液中の溶媒を凍結成長させ、その後に凍結した溶媒を除去することを特徴とする微小管集合構造体の製造方法。
【選択図】図1
Description
この発明は微小管集合構造体及びその製造方法に関し、さらに詳しくは、特定の物質で管構造が形成され、しかもその管構造が軸線方向に長い空孔を形成してなる構造である微小管集合構造体及びその簡易な製造方法に関する。
非特許文献1では、トリアセチルセルロースのクロロホルム溶液と水とによるW/Oエマルションをガラス製基板の表面に薄膜状に展開し、ガラス製基板上に展開されたW/Oエマルションの薄膜を飽和水蒸気中に置くことにより、高揮発性のクロロホルムを蒸発させてエマルション内に鋳型としての水滴を形成し、この水滴の周囲にトリアセチルセルロースを沈澱させ、その後に溶媒(クロロホルム)及び水を蒸発させることで、トリアセチルセルロースのハニカムフィルムを作成でき、更に加水分解することでセルロースのハニカムフィルムが得られることが報告されている(非特許文献1の第18頁左欄の「Experimental Part」欄、第18頁右欄の「Result and Discussion」欄及び第20頁右欄の「Conclusion」欄を参照)。
特許文献1には、「微生物セルロースからなるハニカム状多孔質体」及び「孔径が10nm〜1000μm、厚みが0.1〜10μmである、微生物セルロースからなるハニカム多孔質体」が記載されている(特許文献1の特許請求範囲における請求項1及び請求項3参照)。
非特許文献1により得られたセルロースからなるフィルム状のハニカム構造体は、作成原理上、孔の軸線方向長さが数mm以上となるような長い空孔を作成することは困難である。
また、特許文献1により得られるセルロースからなるハニカム状多孔質体も、特許文献1の発明の詳細な説明における発明を実施するための最良の形態に記載されている通り、多孔質体の高さもしくは厚み(ハニカム状多孔質体の貫通孔の長さ)は0.1〜10μmの範囲の値しかとれず、孔の軸線方向長さが数mm以上となるような長い空孔は作成できない。
特許文献2には、「シリカゾルのpHの調整及び不純物の除去を行う前処理ステップと、前処理が終了してから所定時間経過後に、試料を一定方向で冷媒に挿入して凍結させることによってハニカム形状を形成する一方向凍結ステップとを有し、前記一方向凍結ステップで、試料を冷媒に挿入する挿入速度を制御することにより、凍結後に得られるハニカム開孔径を制御することを特徴とするシリカゲルの製造方法」及び「凍結ゲル化法によって一体成型されるシリカゲルであって、ハニカム形状を有し、壁面の比表面積が800〜900m2/gで、ハニカム開孔径が5〜50μmであることを特徴とするシリカゲル」が記載されている(特許文献2の特許請求の範囲における請求項1及び請求項5参照)。
特許文献3には、「シリカ粒子を含むコロイダルシリカ水溶液が充填された容器を冷媒に挿入し、急冷させて上記コロイダルシリカ水溶液中の水分を一方向へ細く柱状に凍結成長させ、その後水分を乾燥除去して、シリカ成分から成りかつ互いに略平行に略貫通した細孔を有する略ハニカム構造のナノポーラスシリカを製造することを特徴とするナノポーラスシリカの製造方法。」及び「請求項1〜9のいずれかに記載のナノポーラスシリカの製造方法により得られたことを特徴とするナノポーラスシリカ。」が記載され、その「ナノポーラスの細孔長/細孔径が10000以上であること」も記載されている(特許文献3の特許請求の範囲における請求項1、請求項10及び請求項11参照)。
特許文献2及び3によりシリカで形成されたハニカム構造体が知られており、これらの方法によれば原理上、長い空孔を有するハニカム構造体を作成できるが、多糖類例えばセルロースにより形成された長い空孔を持つハニカム構造体は未だ知られていない。
「Fabrication of Honeycomb-Patterned Cellulose Films」 W. Kasai, T. Kondo; Macromol. Biosci., 2004, 4, 17.
この発明の課題は、多糖類で形成された、多数の管状構造が集合してなる微小管集合構造体及びその製造方法を提供することに、ある。
本発明は、
(1) 主鎖を構成する単糖がピラノース構造を取り、そのイス型構造のエカトリアルにある水酸基どうしの結合で連なるシート状コンホメーションを取れる多糖類で形成された微小管状体の集合体である微小管集合構造体であり、
(2) 前記シート状コンホメーションを取れる多糖類が、1位の水酸基がそのイス型構造のエカトリアルにあってグリコシド結合し、かつ、2,3,4位のいずれかの水酸基がそのイス型構造のエカトリアルにあってグリコシド結合してなる前記(1)に記載の微小管集合構造体であり、
(3) 前記多糖類が、アニオン性セルロース、カチオン性セルロース、ヒドロキシエチルセルロース、セルロース、グアーガム、キサンタンガム、グルコマンナン、アガロース、キチン、アルギン酸、及びアラビアガムから選ばれる少なくとも一種である前記(1)又は(2)に記載の微小管集合構造体、
(4) 主鎖を構成する単糖がピラノース構造を取り、そのイス型構造のエカトリアルにある水酸基どうしの結合で連なるシート状コンホメーションを取れる多糖類を含有する多糖類含有液を収容した容器を冷媒に挿入することにより、冷媒液面の鉛直上方向に前記多糖類含有液中の溶媒を凍結成長させ、その後に溶媒を除去することを特徴とする(1)〜(3)のいずれか一項に記載の微小管集合構造体の製造方法
に関するものである。
(1) 主鎖を構成する単糖がピラノース構造を取り、そのイス型構造のエカトリアルにある水酸基どうしの結合で連なるシート状コンホメーションを取れる多糖類で形成された微小管状体の集合体である微小管集合構造体であり、
(2) 前記シート状コンホメーションを取れる多糖類が、1位の水酸基がそのイス型構造のエカトリアルにあってグリコシド結合し、かつ、2,3,4位のいずれかの水酸基がそのイス型構造のエカトリアルにあってグリコシド結合してなる前記(1)に記載の微小管集合構造体であり、
(3) 前記多糖類が、アニオン性セルロース、カチオン性セルロース、ヒドロキシエチルセルロース、セルロース、グアーガム、キサンタンガム、グルコマンナン、アガロース、キチン、アルギン酸、及びアラビアガムから選ばれる少なくとも一種である前記(1)又は(2)に記載の微小管集合構造体、
(4) 主鎖を構成する単糖がピラノース構造を取り、そのイス型構造のエカトリアルにある水酸基どうしの結合で連なるシート状コンホメーションを取れる多糖類を含有する多糖類含有液を収容した容器を冷媒に挿入することにより、冷媒液面の鉛直上方向に前記多糖類含有液中の溶媒を凍結成長させ、その後に溶媒を除去することを特徴とする(1)〜(3)のいずれか一項に記載の微小管集合構造体の製造方法
に関するものである。
この発明によると、微小な管が集合してなる微小管集合構造体を提供すること、及びこの微小管集合構造体を容易に製造する方法を提供するという技術的効果が奏される。
この発明に係る微小管集合構造体は、主鎖を構成する単糖がピラノース構造を取り、そのイス型構造のエカトリアルにある水酸基どうしの結合で連なるシート状コンホメーションを取れる多糖類で形成させる。
上記多糖類は、例えば、
(1) ピラノース構造を取り、1位の水酸基がそのイス型構造のエカトリアルにあってグリコシド結合し、かつ、
(2) ピラノース構造を取り、2,3,4位のいずれかの水酸基がそのイス型構造のエカトリアルにあってグリコシド結合する
コンホメーションをとることができる単糖が主鎖を構成するものが挙げられる。
(1) ピラノース構造を取り、1位の水酸基がそのイス型構造のエカトリアルにあってグリコシド結合し、かつ、
(2) ピラノース構造を取り、2,3,4位のいずれかの水酸基がそのイス型構造のエカトリアルにあってグリコシド結合する
コンホメーションをとることができる単糖が主鎖を構成するものが挙げられる。
以下、上記単糖を具体的に説明するが、これに限定されない。
前記単糖は、例えばグルコピラノース、ガラクトピラノース、マンノピラノース、グロピラノース、グルクロン酸、ガラクツロン酸、マンヌロン酸、グルロン酸、グルコサミン等が挙げられる。これら単糖は、架橋化合物となっていてもよい。
グルコースピラノースである式(1)に示されるβ−D−グルコピラノース及び式(2)に示されるβ−L−グルコピラノースが上記(1)の条件を満たすとき、2,3,4位のいずれの水酸基も上記(2)の条件を満たすことができる。それゆえに、これらは上記単糖に該当する。
式(5)に示されるβ−D−ガラクトピラノース及び式(6)に示されるβ−L−ガラクトピラノースが上記(1)の条件を満たすとき、2,3位の水酸基が上記(2)の条件を満たすことができ、式(7)に示されるα−D−ガラクトピラノース及び式(8)に示されるα−L−ガラクトピラノースが上記(1)の条件を満たすとき、4位の水酸基のみが上記(2)の条件を満たすことができる。それゆえに、これらは上記単糖に該当する。
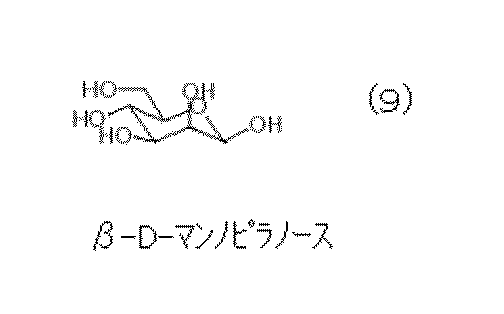
式(9)に示されるβ−D−マンノピラノース及び式(10)に示されるβ−L−マンノピラノースが上記(1)の条件を満たすとき、3,4位の水酸基が上記(2)の条件を満たすことができ、式(11)に示されるα−D−マンノピラノース及び式(12)に示されるα−L−マンノピラノースが上記(1)の条件を満たすとき、2位の水酸基のみが上記(2)の条件を満たすことができる。それゆえに、これらは上記単糖に該当する。
式(13)に示されるβ−D−グロピラノース及び式(14)に示されるβ−L−グロピラノースが上記(1)の条件を満たすとき、2位の水酸基のみが上記(2)の条件を満たすことができ、式(15)に示されるα−D−グロピラノース及び式(16)に示されるα−L−グロピラノースが上記(1)の条件を満たすとき、3,4位の水酸基が上記(2)の条件を満たすことができる。それゆえに、これらは上記単糖に該当する。
グルクロン酸はグルコピラノースの6位がカルボン酸に酸化された構造であり、ピラノースの環の立体化学はグルコピラノースと同一である。これらの光学異性体及び1位の構造異性体を表す名称及び構造は、対応するそれと同一である。それゆえに、これらは上記単糖に該当する。
マンヌロン酸はマンノピラノースの6位がカルボン酸に酸化された構造であり、ピラノースの環の立体化学はマンノピラノースと同一である。これらの光学異性体及び1位の構造異性体を表す名称及び構造は、対応するそれと同一である。それゆえに、これらは上記単糖に該当する。
グルロン酸はグロピラノースの6位がカルボン酸に酸化された構造であり、ピラノースの環の立体化学はグロピラノースと同一である。これらの光学異性体及び1位の構造異性体を表す名称及び構造は、対応するそれと同一である。それゆえに、これらは上記単糖に該当する。
アミノ糖であるN−アセチルグルコサミンはグルコピラノースの2位水酸基がアセトアミド基に置換された構造であり、ピラノースの環の立体化学はグルコピラノースと同一である。これらの光学異性体及び1位の構造異性体を表す名称及び構造は、対応するそれと同一である。それゆえに、これらは上記単糖に該当する。
架橋化合物である3,6−アンヒドロ−α−L−ガラクトースは、α−L−ガラクトースの3位と6位の水酸基が縮合、環化したものであり、ピラノースの環の立体化学は、α−L−ガラクトースと同一である。それゆえに、これらは上記単糖に該当する。
本発明における多糖類の主鎖を構成する単糖は、例示に限定されるものではなく、上記(1)及び(2)の条件を同時に満たすものであれば使用することができる。
本発明における多糖類は、上記(1)及び(2)を同時に満たすコンホメーションをとることができる単糖から構成させる多糖、及びその誘導体である。
上記多糖としては、
1位及び4位水酸基が主鎖を担う結合に使用されるβ−D−グルコピラノースから構成されるセルロース、キサンタンガム、
1位及び4位水酸基が主鎖を担う結合に使用されるβ−D−グルコピラノース及びβ−D−マンノピラノースから構成されるグルコマンナン、
1位及び4位水酸基が主鎖を担う結合に使用されるβ−D−マンノピラノースから構成されるグアーガム、
1位及び3位水酸基が主鎖を担う結合に使用されるβ−D−ガラクトピラノースから構成されるアラビアガム、
1位及び3位水酸基が主鎖を担う結合に使用されるβ−D−ガラクトース、及び1位及び4位水酸基が主鎖を担う結合に使用される3,6−アンヒドロ−α−L−ガラクトースから構成されるアガロース、
1位及び4位水酸基が主鎖を担う結合に使用されるβ−D−マンヌロン酸及びα−L−グルロン酸から構成されるアルギン酸
1位及び4位水酸基が主鎖を担う結合に使用されるβ−D−N−アセチルグルコサミンから構成されるキチン
等を挙げることができる。
1位及び4位水酸基が主鎖を担う結合に使用されるβ−D−グルコピラノースから構成されるセルロース、キサンタンガム、
1位及び4位水酸基が主鎖を担う結合に使用されるβ−D−グルコピラノース及びβ−D−マンノピラノースから構成されるグルコマンナン、
1位及び4位水酸基が主鎖を担う結合に使用されるβ−D−マンノピラノースから構成されるグアーガム、
1位及び3位水酸基が主鎖を担う結合に使用されるβ−D−ガラクトピラノースから構成されるアラビアガム、
1位及び3位水酸基が主鎖を担う結合に使用されるβ−D−ガラクトース、及び1位及び4位水酸基が主鎖を担う結合に使用される3,6−アンヒドロ−α−L−ガラクトースから構成されるアガロース、
1位及び4位水酸基が主鎖を担う結合に使用されるβ−D−マンヌロン酸及びα−L−グルロン酸から構成されるアルギン酸
1位及び4位水酸基が主鎖を担う結合に使用されるβ−D−N−アセチルグルコサミンから構成されるキチン
等を挙げることができる。
その他、多糖として、キシログルカン、ヒアルロン酸、キトサン、ヘパリン、コンドロイチン硫酸A、コンドロイチン硫酸B、コンドロイチン硫酸C、コンドロイチン硫酸D、コンドロイチン硫酸E、ケラタン硫酸(ケラト硫酸)、カラギーナン、グルクロノキシラン、アラビノキシラン、ローカストビーンガム(イナゴマメガム、カロブガム)、フェヌグリークガム等を挙げることができる。
多糖の誘導体としては、アニオン性セルロース、カチオン性セルロース、ヒドロキシエチルセルロース、メチルセルロース、アセチルセルロース、ニトロセルロース、カルボキシメチルグアーガム、酸化グアーガム、リン酸化グアーガム、カチオン変性グアーガム、両性グアーガム等を挙げることができる。前記アニオン性セルロースとしては、例えば2,2,6,6-テトラメチルピペリジン1-オキシル(以下、TEMPOと略することがある。)でセルロースを酸化してなるTEMPO酸化セルロース、カルボキシメチルセルロース等を挙げることができる。カチオン性セルロースは例えばヒドロキシエチルセルロースにアルカリ性条件下で、グリシジルトリメチルアンモニウムクロライド又は3−クロル−2−ヒドロキシプロピルトリメチルアンモニウムクロライドを反応させて得ることができる。これらの内、アニオン性及び/又はカチオン性を有するものは、それらの塩類であってもよい。アニオン性を有するものの塩類としては、リチウム、ナトリウム、カリウム等のアルカリ金属塩、マグネシウム、カルシウム等のアルカリ土類金属塩、及びアンモニウム塩等が挙げられる。カチオン性を有するものの塩類としては、塩酸塩、硫酸塩等の無機塩類、蟻酸塩、酢酸塩等の有機酸塩類が挙げられる。
この発明に係る微小管集合構造体は、前記、主鎖を構成する単糖がピラノース構造を取り、そのイス型構造のエカトリアルにある水酸基どうしの結合で連なるシート状コンホメーションを取れる多糖類により、微小な管が形成され、しかもその管が集合した構造となっている。
微小管集合構造体における管の平均開口径は、通常0.1〜100μmである。なお、微小管集合構造体における管の開口径の測定はSEMにより行うことができる。
この管の開口形状は、この微小管集合構造体を製造する条件によって、多角形、楕円形、円形等のように様々な形状を採りえる。典型的には、この管の開口形状は、四角形、五角形、六角形等の多角形状である。
この管の軸線方向長さは、この発明の方法によると、理論的には、無制限である。この管の軸線方向長さが無制限であることは、理想的には、管の端部から軸線方向に沿って観察すると管の端部における開口から管の他端部における開口まで、開口が複数に分割されずにそのまま貫通していることを意味する。したがって、この発明に係る理想的な微小管集合構造体は、言わばストローを束ねた状態であると形容することができる。
一方、いわゆる多孔体と称されるものは、その表面に開口する凹部があり、その凹部が多孔体の内部に存在する空孔と貫通孔をもって連絡し、前記空孔と他の空孔とが貫通孔をもって連絡し、空孔同士が孔でもって連絡し、その空孔が他の表面に開口する凹部と貫通孔をもって連絡するという形式で貫通孔が形成されることがある。従来から知られている多孔体に形成される貫通孔は、多孔体の表面に形成される貫通孔の開口部から他の表面に形成される開口部までの軸線が存在しない。したがって、この発明に係る微小管集合構造体は、軸線を有する管を有するという点において、従来の多孔体と区別される。
このような特殊な管構造を有する微小管集合構造体は、この発明の方法によって製造することができる。
この発明に係る微小管集合構造体の製造方法は、前記、主鎖を構成する単糖がピラノース構造を取り、そのイス型構造のエカトリアルにある水酸基どうしの結合で連なるシート状コンホメーションを取れる多糖類を含有する多糖類含有液を収容した容器を冷媒に挿入することにより、冷媒液面の鉛直上方向に前記多糖類含有液中の溶媒を凍結成長させ、その後に溶媒を除去することを特徴とする。
前記多糖類含有液における多糖類の含有濃度は、多糖類の種類によって含有濃度上限値及び含有濃度下限値が相違するが、いずれの多糖類であっても共通して適正であるとされる含有濃度範囲は、通常、0.1質量%以上25質量%以下であり、好ましくは0.5質量%以上15質量%以下である。多糖類の含有濃度が前記上限値を超えると、多糖類の種類にもよるが、多糖類分散液の粘度が高くなるために均質な濃度の分散液が得られにくい、微小管の壁が厚くなり十分な開口が得られないといった不都合を生じることがある。前記下限値未満の含有濃度であると微小管の壁が薄くなり、微小管同士に貫通孔ができることがある。
前記多糖類含有液を収容する容器は、冷媒中に挿入され、しかも徐々に挿入されるのであるから、容器における冷媒中に浸漬している部分と容器における冷媒直上の部分とで生じる温度差によって破損を生じさせない程度の物理特性例えば膨張率を有し、また、軸線方向の長さのある微小管を形成することができるように所定長さの高さを有する有底の形状であればよい。また、この容器の形状は、微小管集合構造体の用途に応じて、決定されることもできる。
この発明における多糖類含有液の溶媒としては、多糖類を均質に分散あるいは溶解し、且つ凝固点を有するものであれば特に制限はなく、通常、水、メタノール、エタノール、1−プロパノール、2−プロパノール、1−ブタノール、t-ブタノール、酢酸、ジメチルスルホキシド、ジメチルホルムアミド、ジメチルアセトアミド、アセトニトリル等の極性溶媒が挙げられる。この中でも、入手容易で安価であるという点で水が好適である。これら溶媒は一種単独で用いてもよいし、二種以上を併用してもよい。
この発明における冷媒としては、多糖類含有液の溶媒を凍結できる温度においても凍らない液体(不凍液)であれば特に制限はなく、通常、水、食塩水、エチレングリコール、四塩化炭素、アセトニトリル、エタノール、アセトン、ジエチルエーテル、液体窒素、液体水素、液体ヘリウム等が挙げられる。この中でも、入手容易で安価な上、比較的低温においても凍らないという点で液体窒素が好適である。また、冷媒としては液体のみならず、冷却装置等により冷却された空間(例えば多糖類含有液を凍結できる温度にまで冷却された空気)も用いることができる。
これら冷媒を冷却する手段として、寒剤及び/又は冷却装置を利用してもよい。寒剤としては、氷、食塩と氷の混合物、酢酸ナトリウムと氷との混合物、塩化カルシウムと氷との混合物、塩化アンモニウムと氷との混合物、硝酸アンモニウムと氷との混合物、塩化アンモニウムと硝酸カリウムと氷との混合物、臭化ナトリウムと氷との混合物、塩化ナトリウムと氷との混合物、塩化カリウムと氷との混合物、塩化マグネシウムと氷との混合物、塩化亜鉛と氷との混合物、ドライアイス等が挙げられる。これら寒剤の使用方法としては、冷媒とは接触せずに冷媒容器などを介して間接的に冷却する方法、冷媒に直接混合する方法を適宜選択する必要がある。冷却装置としては、投げ込み型冷却器等が挙げられる。冷却装置は、直接冷媒と接触してもよい。
多糖類含有液と冷媒の温度に特に制限はなく、多糖類含有液の温度は多糖類含有液の溶媒の凝固点よりも高く、多糖類含有液の溶媒の沸点よりも低ければよい。また、冷媒の温度は多糖類含有液の溶媒を凍結できる温度ならば特に制限はない。例えば水を溶媒として用いた場合、多糖類含有液の温度は水の凝固点である0℃よりも高く、水の沸点である100℃よりも低ければよく、冷媒は水の凝固点である0℃よりも低ければよい。
この発明の方法においては、多糖類含有液を収容する容器を冷媒中に徐々に浸漬していくのであり、そのときの浸漬していく速度に特に制限はないが、通常、3〜300μm/秒が好適である。より好ましくは、10〜100μm/秒である。凍結速度が遅すぎる場合には生産性の面で不適当である。また、凍結速度が早過ぎる場合には貫通孔の直線性が損なわれるといった不都合を生じることがある。
この発明の方法では、多糖類含有液を収容する容器を冷媒に徐々に浸漬していくと、冷媒に浸漬した容器内において、冷媒に浸漬した部分より上部から冷媒に浸漬した底部にかけて、冷媒に浸漬する前の多糖類含有液温度から冷媒温度の範囲の温度勾配が生じる。
本発明の方法は、次のような原理により本発明の効果が得られるものと推測している。
始めに、多糖類含有液を収容する容器底部が冷媒に接触すると、溶媒が凝固点以下に冷却されることにより、溶媒が凝固した多数の結晶核が生ずる。
始めに、多糖類含有液を収容する容器底部が冷媒に接触すると、溶媒が凝固点以下に冷却されることにより、溶媒が凝固した多数の結晶核が生ずる。
そして、多糖類含有液を収容する容器を徐々に冷媒中に浸漬していくと、生成した結核から冷媒液面の鉛直上方向に柱状結晶が成長する。溶質である多糖類は、柱状結晶の成長に伴いその外周部に押しやられ、壁状に集合していく。
この多糖類の主鎖を構成する単糖が、ピラノース構造を取り、そのイス型構造のエカトリアルにある水酸基どうしの結合で連なる場合、シート状コンホメーションをとることができ、柱状結晶の周囲に押し集められた多糖類は膜状に積層する。
例えばセルロースは、「セルロースの科学」朝倉書店 磯貝明 編において、D−グルコピラノースがβ−1,4結合で連なる構造をしており、一方の2位水酸基と他方の6位水酸基、及び/又は一方の3位水酸基と他方の5位の酸素原子が水素結合で結合することで、隣り合う単糖同士が強固に固定された直線かつ平面状のコンホメーションをとることが記されている。この構造が長く連なることから、一分子は一直線上に張られたリボン状になっていると形容することができる。また、このリボン状の一分子が、面を約45°傾けた状態で、横方向約0.5nm間隔、縦方向約0.6nm間隔で並行に束ねられ、セルロースミクロフィブリルとしての結晶構造が形作られており、この形状は、同一面に隣り合う分子間に存在する親水性の水素結合、及び面間に存在する疎水的なファンデルワールス力によるものであることが記されている。
このように、セルロースは親水性及び疎水性の相互作用を有することから、このセルロースは緻密な膜状構造、積層構造、更には本発明に係る微小管の壁を形成することができると考えられる。
セルロース以外でも本発明に係る多糖類のようにシート状コンホメーションをとり得る多糖類であれば、そのような多糖類は、本発明に係る工程に供されて処理されると、膜状構造、積層構造、更には本発明に係る微小管の壁を形成できると考えられる。
一方、澱粉は、D−グルコピラノースがα−1,4結合で連なる構造をしているおり、隣り合う単糖同士が水素結合を形成することがなく、比較的フレキシブルに様々なコンホメーションを取り得る。常温では澱粉粒は6コの単糖で1つのピッチを形成する螺旋構造をとる分子が二分子で二重螺旋を作り、それらが更に集まって巨大な塊状態になっている。この澱粉粒は熱水中では溶解してしまうことから、その相互作用は弱いことが伺える。
それゆえに澱粉は、本発明における工程に供されて処理されるとしても、平面的なコンホメーションをとり得ず、膜状構造、積層構造も形成できない。
多糖類含有液を収容する容器を冷媒中に完全に浸漬すると、多糖類含有液中の溶媒が凝固し、凝固した縦長の柱状結晶の周囲に多糖類分子が壁体のように集約された状態になる。この状態を溶媒が水の場合で例えると、霜柱のような氷の柱一本一本の周囲に多糖類分子により壁体が形成された有様であり、換言すると、多糖類分子の集合によって多数の管状壁体が形成され、それら多数の管状壁体における縦長の孔中に氷が充填された有様である。このような状態になったものを、仮に多糖類含有液凝固体と称する。
この発明の方法では、得られた多糖類含有液凝固体を冷媒から取り出し、凝固した溶媒を除去すると、この発明に係る微小管集合構造体が得られる。
凝固した溶媒の除去方法としては、柱状結晶の周囲に集約された多糖類の構造が損なわれなければ、どのような溶媒除去方法を採用してもよい。例えば凍結乾燥を用いれば溶媒が昇華するため、溶媒の融解、多糖類の再分散を抑えられるため好適である。また、多糖類が分散しないような非親和性の溶媒に一旦凍結置換すれば、風乾又は熱乾してもよい。
かくしてこの発明の方法により、この発明に係る微小管集合構造体が製造される。
この微小管集合構造体は、既に説明したように、軸線の長い微小な管が集合した構造を有する。
この微小管集合構造体は、その特殊な構造の故に、例えば触媒の担体、吸着剤、分離剤、複合材、化粧品、医薬等の分野に使用されることができる。
以下、実施例及び比較例によって本発明を更に詳しく説明するが、本発明はその要旨を超えない限り、以下の実施例に制約されるものではない。
(実施例1)
撹拌装置を備えた5L容ガラス製容器に、セルロースである針葉樹晒クラフトパルプをカナディアンスタンダードフリーネス400に調整した、濃度1.5質量%である水分散液4000gを投入し、5L容ガラス製容器の内容物を緩やかに撹拌し、N−オキシル化合物である2,2,6,6−テトラメチル−1−ピペリジン−N−オキシルの水溶液(濃度0.6質量%)125gと触媒であるハロゲン化アルカリ金属塩として臭化ナトリウムの水溶液(濃度6.0質量%)125gとを加えてセルローススラリーとした。
撹拌装置を備えた5L容ガラス製容器に、セルロースである針葉樹晒クラフトパルプをカナディアンスタンダードフリーネス400に調整した、濃度1.5質量%である水分散液4000gを投入し、5L容ガラス製容器の内容物を緩やかに撹拌し、N−オキシル化合物である2,2,6,6−テトラメチル−1−ピペリジン−N−オキシルの水溶液(濃度0.6質量%)125gと触媒であるハロゲン化アルカリ金属塩として臭化ナトリウムの水溶液(濃度6.0質量%)125gとを加えてセルローススラリーとした。
このセルローススラリーに次亜塩素酸ナトリウム水溶液(塩素濃度8質量%)320gを投入し、室温で5L容ガラス製容器の内容物を撹拌しつつ内容物のpHが10.5を保持するように30質量%水酸化ナトリウム水溶液を断続的に5L容ガラス製容器内に滴下した。次亜塩素酸ナトリウム水溶液を投入した後に約90分が経過した時点で5L容ガラス製容器の内容物のpHが殆ど変化しなくなったことを確認した上で内容物の撹拌を停止し、その停止時点をもってTEMPO酸化反応の終了時点とした。
それまでに滴下した30質量%水酸化ナトリウム水溶液の全量は24gであった。酸化反応後時点におけるセルローススラリーを200メッシュのナイロン製濾布で濾過した後、残存する水溶性薬品を除去するために濾過物を5L容ガラス製容器に投入し、約3000gのイオン交換水を加えて5L容ガラス製容器の内容物を撹拌し、200メッシュのナイロン製濾布で前記内容物を濾過する操作を3回繰り返した。濾過残渣として、濃度が4.1質量%であるTEMPO酸化セルロースのスラリー1230gを得た。
なお、TEMPO酸化セルロースのスラリーの濃度は110℃で2時間加熱乾燥した後の残存物の重量から求めた。
TAPPI STANDARD METHOD T237 cm−98に準じた方法で測定したTEMPO酸化セルロースのスラリーのカルボン酸量は対セルロース乾燥重量1gあたり1.2meqだった。
得られたTEMPO酸化セルロースのスラリー61gとイオン交換水64gとを家庭用ジューサーミキサーにより解繊処理を行い、スラリーが半透明なゼリー状になることを確認した後、更にイオン交換水125gをこのスラリーに加えて解繊処理を続け、1.0質量%濃度のほぼ無色透明でゼリー状のTEMPO酸化セルロースの微細化物の水分散液を得た。この水分散液がこの発明における多糖類含有液である。得られたTEMPO酸化セルロースの微細化物の水性分散液を、外径12mm、内径10mm、長さ120mmのポリプロピレン製の試験管に充填した。この試験管を28μm/秒の速度で液体窒素の中に挿入し、氷晶柱を作成した。
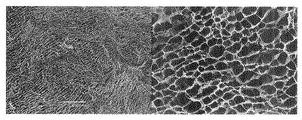
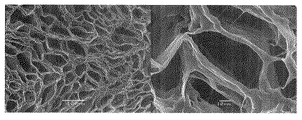
その試験管内に形成された氷晶柱を、凍結状態を維持したまま容器ごと切断して長さ10mmの円柱片を切り出した。円柱片を−10℃、1mmHg以下の条件下に72時間保持することにより、凍結状態を維持したまま水を除去(凍結乾燥)した。乾燥物の上面(上記切断面)のSEM観察結果を図1に示す。
なお、図1を始めとする各図における右側の写真は倍率1000倍のSEM写真であり、左側の写真は倍率200倍のSEM写真である。
図1によると、この乾燥物は、開口断面が五角形、六角形等の多角形状である管状体が多数集合してなる微小管集合構造体であった。
(実施例2)
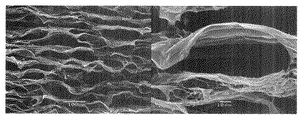
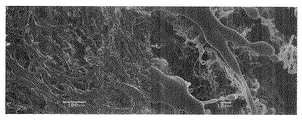
実施例1において、濃度が1.0質量%であるTEMPO酸化セルロースの微細化物の水分散液の代わりに濃度を1.0質量%に希釈したグルコマンナン(清水化学(株)製 商品名「レオレックスRS」)の水溶液(この水溶液は、この発明における多糖類含有液に相当する。)を用いた以外は実施例1と同様にして乾燥物を得た。この乾燥物の上面(上記切断面)のSEM観察結果を図2に示す。
実施例1において、濃度が1.0質量%であるTEMPO酸化セルロースの微細化物の水分散液の代わりに濃度を1.0質量%に希釈したグルコマンナン(清水化学(株)製 商品名「レオレックスRS」)の水溶液(この水溶液は、この発明における多糖類含有液に相当する。)を用いた以外は実施例1と同様にして乾燥物を得た。この乾燥物の上面(上記切断面)のSEM観察結果を図2に示す。
図2によると、この乾燥物は、開口断面が四角形、五角形、六角形等の多角形状や円形、楕円形である管状体が多数集合してなる微小管集合構造体であった。
(実施例3)
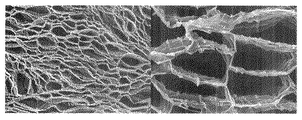
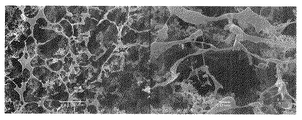
実施例1において、濃度が1.0質量%であるTEMPO酸化セルロースの微細化物の水分散液の代わりに濃度を1.0質量%に希釈したグアーガムの水溶液(このグアーガムの水溶液は、この発明における多糖類含有液に相当する。)を用いた以外は実施例1と同様にして乾燥物を得た。この乾燥物の上面(上記切断面)のSEM観察結果を図3に示す。
実施例1において、濃度が1.0質量%であるTEMPO酸化セルロースの微細化物の水分散液の代わりに濃度を1.0質量%に希釈したグアーガムの水溶液(このグアーガムの水溶液は、この発明における多糖類含有液に相当する。)を用いた以外は実施例1と同様にして乾燥物を得た。この乾燥物の上面(上記切断面)のSEM観察結果を図3に示す。
図3によると、この乾燥物は、開口断面が明確な稜を有してはいないが多角形状や楕円形である管状体が多数集合してなる微小管集合構造体であった。
(実施例4)
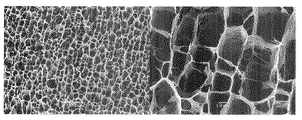
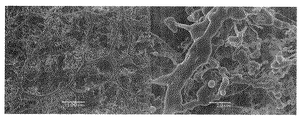
実施例1において、濃度が1.0質量%であるTEMPO酸化セルロースの微細化物の水分散液の代わりに濃度を1.0質量%に希釈したキサンタンガム(三晶(株)製 商品名「KELZAN」)の水溶液(この発明における多糖類含有液に相当する。)を用いた以外は実施例1と同様にして乾燥物を得た。この乾燥物の上面(上記切断面)のSEM観察結果を図4に示す。
実施例1において、濃度が1.0質量%であるTEMPO酸化セルロースの微細化物の水分散液の代わりに濃度を1.0質量%に希釈したキサンタンガム(三晶(株)製 商品名「KELZAN」)の水溶液(この発明における多糖類含有液に相当する。)を用いた以外は実施例1と同様にして乾燥物を得た。この乾燥物の上面(上記切断面)のSEM観察結果を図4に示す。
図4によると、この乾燥物は、開口断面が明確な稜を有してはいないが四角形などの多角形状である管状体が多数集合してなる微小管集合構造体であった。
(実施例5)
実施例1において、濃度が1.0質量%であるTEMPO酸化セルロースの微細化物の水分散液の代わりに濃度を1.0質量%に希釈したアガロース(伊那食品工業(株)製 商品名「かんてんパウダー」)の水溶液(この発明における多糖類含有液に相当する。)を用いた以外は実施例1と同様にして乾燥物を得た。この乾燥物の上面(上記切断面)のSEM観察結果を図5に示す。
実施例1において、濃度が1.0質量%であるTEMPO酸化セルロースの微細化物の水分散液の代わりに濃度を1.0質量%に希釈したアガロース(伊那食品工業(株)製 商品名「かんてんパウダー」)の水溶液(この発明における多糖類含有液に相当する。)を用いた以外は実施例1と同様にして乾燥物を得た。この乾燥物の上面(上記切断面)のSEM観察結果を図5に示す。
図5によると、この乾燥物は、開口断面が明確な稜を有してはいないが三角形、四角形などの多角形状である管状体が多数集合してなる微小管集合構造体であった。
(実施例6)
実施例1において、濃度が1.0質量%であるTEMPO酸化セルロースの微細化物の水分散液の代わりに濃度を1.0質量%に希釈したアルギン酸(富士化学工業(株)製 商品名「スノーアルギンSSH」)の水溶液(この発明における多糖類含有液に相当する。)を用いた以外は実施例1と同様にして乾燥物を得た。この乾燥物の上面(上記切断面)のSEM観察結果を図6に示す。
実施例1において、濃度が1.0質量%であるTEMPO酸化セルロースの微細化物の水分散液の代わりに濃度を1.0質量%に希釈したアルギン酸(富士化学工業(株)製 商品名「スノーアルギンSSH」)の水溶液(この発明における多糖類含有液に相当する。)を用いた以外は実施例1と同様にして乾燥物を得た。この乾燥物の上面(上記切断面)のSEM観察結果を図6に示す。
図6によると、この乾燥物は、開口断面が明確な稜を有してはいないが、三角形、菱形、台形などの多角形状である管状体が多数集合してなる微小管集合構造体であった。
(実施例7)
カニから剥離した殻125gを、水酸化カリウム水溶液(濃度2モル/L)3000gに浸漬し、殻を浸した水酸化カリウム水溶液を6時間還流することにより、殻に付着したタンパク質を分解し、分解物を溶出させた。この殻を水洗後、塩酸(濃度1モル/L)2400gに浸漬、室温で6時間撹拌することにより、殻に含まれていた炭酸カルシウムを溶出させた。溶出された殻を水洗した後、この殻をエタノール3Lに浸漬し、その状態でエタノールを6時間還流することにより、殻に含まれる色素を溶出させた。脱色された殻を水洗し、乾燥することにより、15gのキチンが得られた。得られたキチン15gに、濃度が1%となるようイオン交換水を加えて全体を1500gとしたものを、石臼式摩砕機(増幸産業(株)製 スーバーマスコロイダー 型式MKCA6-2)にて処理することによりスラリーを得た。石臼式摩砕機における砥石にはMKG-C80#が使用され、その回転数は1500rpmであった。石臼式摩砕処理の処理条件としては、クリアランス150μm、4パスであった。得られたスラリーの一部を40℃恒温槽中に2日間放置し、水を一部除去した。その結果、スラリー濃度が2.0質量%であるキチンの水分散液(この発明における多糖類含有液に相当する。)を得た。
カニから剥離した殻125gを、水酸化カリウム水溶液(濃度2モル/L)3000gに浸漬し、殻を浸した水酸化カリウム水溶液を6時間還流することにより、殻に付着したタンパク質を分解し、分解物を溶出させた。この殻を水洗後、塩酸(濃度1モル/L)2400gに浸漬、室温で6時間撹拌することにより、殻に含まれていた炭酸カルシウムを溶出させた。溶出された殻を水洗した後、この殻をエタノール3Lに浸漬し、その状態でエタノールを6時間還流することにより、殻に含まれる色素を溶出させた。脱色された殻を水洗し、乾燥することにより、15gのキチンが得られた。得られたキチン15gに、濃度が1%となるようイオン交換水を加えて全体を1500gとしたものを、石臼式摩砕機(増幸産業(株)製 スーバーマスコロイダー 型式MKCA6-2)にて処理することによりスラリーを得た。石臼式摩砕機における砥石にはMKG-C80#が使用され、その回転数は1500rpmであった。石臼式摩砕処理の処理条件としては、クリアランス150μm、4パスであった。得られたスラリーの一部を40℃恒温槽中に2日間放置し、水を一部除去した。その結果、スラリー濃度が2.0質量%であるキチンの水分散液(この発明における多糖類含有液に相当する。)を得た。
実施例1において、濃度が1.0質量%であるTEMPO酸化セルロースの微細化物の水分散液の代わりに濃度を2.0質量%に希釈したキチンの水分散液(この発明における多糖類含有液に相当する。)を用いた以外は実施例1と同様にして乾燥物を得た。この乾燥物の上面(上記切断面)のSEM観察結果を図7に示す。
図7によると、この乾燥物は、開口断面が明確な稜を有してはいないが、台形、長方形、四角形などの多角形状である管状体が多数集合してなる微小管集合構造体であった。
(実施例8)
実施例1において、濃度が1.0質量%であるTEMPO酸化セルロースの微細化物の水分散液の代わりに濃度を5.0質量%に希釈したヒドロキシエチルセルロース(ダイセル化学工業(株)製 商品名「SP800」)の水溶液(この水溶液は、この発明における多糖類含有液に相当する。)を用いた以外は実施例1と同様にして乾燥物を得た。この乾燥物の上面(上記切断面)のSEM観察結果を図8に示す。
実施例1において、濃度が1.0質量%であるTEMPO酸化セルロースの微細化物の水分散液の代わりに濃度を5.0質量%に希釈したヒドロキシエチルセルロース(ダイセル化学工業(株)製 商品名「SP800」)の水溶液(この水溶液は、この発明における多糖類含有液に相当する。)を用いた以外は実施例1と同様にして乾燥物を得た。この乾燥物の上面(上記切断面)のSEM観察結果を図8に示す。
図8によると、この乾燥物は、開口断面が、明確な稜を有してはいないものもあるが、三角形、台形、長方形、四角形、五角形などの多角形状である管状体が多数集合してなる微小管集合構造体であった。
(実施例9)
実施例1において、濃度が1.0質量%であるTEMPO酸化セルロースの微細化物の水分散液の代わりに濃度を10.0質量%に希釈したアラビアガム(三栄薬品貿易(株)製 商品名「アラビアガム末」)の水溶液を用いた以外は実施例1と同様にして乾燥物を得た。この乾燥物の上面(上記切断面)のSEM観察結果を図9に示す。
実施例1において、濃度が1.0質量%であるTEMPO酸化セルロースの微細化物の水分散液の代わりに濃度を10.0質量%に希釈したアラビアガム(三栄薬品貿易(株)製 商品名「アラビアガム末」)の水溶液を用いた以外は実施例1と同様にして乾燥物を得た。この乾燥物の上面(上記切断面)のSEM観察結果を図9に示す。
図9によると、この乾燥物は、開口断面が、明確な稜を有してはいないものもあるが、三角形、台形、長方形、四角形、五角形などの多角形状である管状体が多数集合してなる微小管集合構造体であった。
(比較例1)
実施例1において、濃度が1.0質量%であるTEMPO酸化セルロースの微細化物の水分散液の代わりに濃度を1.0質量%に希釈したデキストリンの水溶液を用いた以外は実施例1と同様にして乾燥物を得た。この乾燥物の上面(上記切断面)のSEM観察結果を図10に示す。
実施例1において、濃度が1.0質量%であるTEMPO酸化セルロースの微細化物の水分散液の代わりに濃度を1.0質量%に希釈したデキストリンの水溶液を用いた以外は実施例1と同様にして乾燥物を得た。この乾燥物の上面(上記切断面)のSEM観察結果を図10に示す。
図10によると、この乾燥物は、管状体の形成が認められず、単に多孔質であることが認められる微小多孔質体であった。
(比較例2)
実施例1において、濃度が1.0質量%であるTEMPO酸化セルロースの微細化物の水分散液の代わりに濃度を1.0質量%に希釈した酵素変性デキストリンの水溶液を用いた以外は実施例1と同様にして乾燥物を得た。この乾燥物の上面(上記切断面)のSEM観察結果を図11に示す。
実施例1において、濃度が1.0質量%であるTEMPO酸化セルロースの微細化物の水分散液の代わりに濃度を1.0質量%に希釈した酵素変性デキストリンの水溶液を用いた以外は実施例1と同様にして乾燥物を得た。この乾燥物の上面(上記切断面)のSEM観察結果を図11に示す。
図11によると、この乾燥物は、管状体の形成が認められず、単に多孔質であることが認められる微小多孔質体であった。
(比較例3)
実施例1において、濃度が1.0質量%であるTEMPO酸化セルロースの微細化物の水分散液の代わりに澱粉の10質量%水分散液を糊化させたものを用いた以外は実施例1と同様にして乾燥物を得た。この乾燥物の上面(上記切断面)のSEM観察結果を図12に示す。
実施例1において、濃度が1.0質量%であるTEMPO酸化セルロースの微細化物の水分散液の代わりに澱粉の10質量%水分散液を糊化させたものを用いた以外は実施例1と同様にして乾燥物を得た。この乾燥物の上面(上記切断面)のSEM観察結果を図12に示す。
図12によると、この乾燥物は、管状体の形成が認められず、底面のある孔の存在を認めることのできる微小多孔質体であった。
(比較例4)
実施例1において、濃度が1.0質量%であるTEMPO酸化セルロースの微細化物の水分散液の代わりにヒドロキシエチルスターチの1.0質量%水分散液を糊化させたものを用いた以外は実施例1と同様にして乾燥物を得た。この乾燥物の上面(上記切断面)のSEM観察結果を図13に示す。
実施例1において、濃度が1.0質量%であるTEMPO酸化セルロースの微細化物の水分散液の代わりにヒドロキシエチルスターチの1.0質量%水分散液を糊化させたものを用いた以外は実施例1と同様にして乾燥物を得た。この乾燥物の上面(上記切断面)のSEM観察結果を図13に示す。
図13によると、この乾燥物は、管状体の形成が認められず、単に多孔質であることが認められる微小多孔質体であった。
(比較例5)
実施例1において、濃度が1.0質量%であるTEMPO酸化セルロースの微細化物の代わりに酸化澱粉の1.0質量%水分散液を糊化させたものを用いた以外は実施例1と同様にして乾燥物を得た。この乾燥物の上面(上記切断面)のSEM観察結果を図14に示す。
実施例1において、濃度が1.0質量%であるTEMPO酸化セルロースの微細化物の代わりに酸化澱粉の1.0質量%水分散液を糊化させたものを用いた以外は実施例1と同様にして乾燥物を得た。この乾燥物の上面(上記切断面)のSEM観察結果を図14に示す。
図14によると、この乾燥物は、管状体の形成が認められず、単に多孔質であることが認められる微小多孔質体であった。
(比較例6)
実施例1において、濃度が1.0質量%であるTEMPO酸化セルロースの微細化物の代わりにリン酸エステル化澱粉の1.0質量%水分散液を糊化させたものを用いた以外は実施例1と同様にして乾燥物を得た。この乾燥物の上面(上記切断面)のSEM観察結果を図15に示す。
実施例1において、濃度が1.0質量%であるTEMPO酸化セルロースの微細化物の代わりにリン酸エステル化澱粉の1.0質量%水分散液を糊化させたものを用いた以外は実施例1と同様にして乾燥物を得た。この乾燥物の上面(上記切断面)のSEM観察結果を図15に示す。
図15によると、この乾燥物は、管状体の形成が認められず、単に多孔質であることが認められる微小多孔質体であった。
主鎖を構成する単糖がピラノース構造を取り、そのイス型構造のエカトリアルにある水酸基どうしの結合で連なるシート状コンホメーションを取れる多糖類で形成された微小管状体の集合体であるから、(1)ピラノース骨格における水酸基をさらに別の基に誘導することにより、或いは(2)微小な管を多数備えていることを利用することにより、触媒担体、吸着剤、分離剤、フィルター、複合化材、医薬品の担体、音を吸収する吸音材、衝撃を緩和する衝撃緩衝材、油を吸収する吸油材等に利用することができる。
Claims (4)
- 主鎖を構成する単糖がピラノース構造を取り、そのイス型構造のエカトリアルにある水酸基どうしの結合で連なるシート状コンホメーションを取れる多糖類で形成された微小管状体の集合体である微小管集合構造体。
- 前記シート状コンホメーションを取れる多糖類が、1位の水酸基がそのイス型構造のエカトリアルにあってグリコシド結合し、かつ、2,3,4位のいずれかの水酸基がそのイス型構造のエカトリアルにあってグリコシド結合してなる前記請求項1に記載の微小管集合構造体。
- 多糖類が、アニオン性セルロース、カチオン性セルロース、ヒドロキシエチルセルロース、グアーガム、キサンタンガム、グルコマンナン、アガロース、キチン、アルギン酸、又はアラビアガムから選ばれる少なくとも一種である、請求項1又は2に記載の微小管集合構造体。
- 主鎖を構成する単糖がピラノース構造を取り、そのイス型構造のエカトリアルにある水酸基どうしの結合で連なるシート状コンホメーションを取れる多糖類を含有する多糖類含有液を収容した容器を冷媒に挿入することにより、冷媒液面の鉛直上方向に前記多糖類含有液中の溶媒を凍結成長させ、その後に凍結した溶媒を除去することを特徴とする請求項1〜3のいずれか一項に記載の微小管集合構造体の製造方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2011027769A JP2012167152A (ja) | 2011-02-10 | 2011-02-10 | 微小管集合構造体及びその製造方法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2011027769A JP2012167152A (ja) | 2011-02-10 | 2011-02-10 | 微小管集合構造体及びその製造方法 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2012167152A true JP2012167152A (ja) | 2012-09-06 |
Family
ID=46971611
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011027769A Withdrawn JP2012167152A (ja) | 2011-02-10 | 2011-02-10 | 微小管集合構造体及びその製造方法 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP2012167152A (ja) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPWO2023067749A1 (ja) * | 2021-10-21 | 2023-04-27 | ||
| JPWO2023190596A1 (ja) * | 2022-03-29 | 2023-10-05 |
-
2011
- 2011-02-10 JP JP2011027769A patent/JP2012167152A/ja not_active Withdrawn
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPWO2023067749A1 (ja) * | 2021-10-21 | 2023-04-27 | ||
| WO2023067749A1 (ja) * | 2021-10-21 | 2023-04-27 | 国立大学法人東北大学 | ハニカム構造体およびその製造方法 |
| US20250230590A1 (en) * | 2021-10-21 | 2025-07-17 | Tohoku University | Honeycomb structure and method for manufacturing same |
| JPWO2023190596A1 (ja) * | 2022-03-29 | 2023-10-05 | ||
| WO2023190596A1 (ja) * | 2022-03-29 | 2023-10-05 | 京セラ株式会社 | 新規複合材料、複合材料の製造方法、及びコンポジット |
| JP7777315B2 (ja) | 2022-03-29 | 2025-11-28 | 京セラ株式会社 | 新規複合材料、複合材料の製造方法、及びコンポジット |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Fu et al. | Natural polysaccharide-based aerogels and their applications in oil–water separations: a review | |
| Ferreira et al. | Fundamentals of cellulose lightweight materials: bio-based assemblies with tailored properties | |
| Ganesan et al. | Review on the production of polysaccharide aerogel particles | |
| Douglass et al. | A review of cellulose and cellulose blends for preparation of bio-derived and conventional membranes, nanostructured thin films, and composites | |
| Mikkonen et al. | Prospects of polysaccharide aerogels as modern advanced food materials | |
| Budtova et al. | Biorefinery approach for aerogels | |
| US5739316A (en) | Cross-linked cellulose hydrate membranes | |
| Nemoto et al. | Simple freeze-drying procedure for producing nanocellulose aerogel-containing, high-performance air filters | |
| Takeshita et al. | Formation of nanofibrous structure in biopolymer aerogel during supercritical CO2 processing: The case of chitosan aerogel | |
| US9328211B2 (en) | Porous cellulose body and method for producing same | |
| Sehaqui et al. | Functional cellulose nanofiber filters with enhanced flux for the removal of humic acid by adsorption | |
| Chen et al. | Preparation of high-strength α-chitin nanofiber-based hydrogels under mild conditions | |
| EP2361144A2 (en) | High flux high efficiency nanofiber membranes and methods of production thereof | |
| JP2012167218A (ja) | 微小管集合構造体及びその製造方法 | |
| da Rosa et al. | Cellulose and chitin twisted structures: From nature to applications | |
| CN110467421B (zh) | 一种功能性纤维素气凝胶复合材料及其制备方法 | |
| CN114316375B (zh) | 一种多级孔结构复合气凝胶及其制备方法 | |
| CN104587516B (zh) | 一种透明的可降解细菌纤维素再生膜及其制备方法和应用 | |
| JP2012167152A (ja) | 微小管集合構造体及びその製造方法 | |
| JP6522396B2 (ja) | セルロース多孔質体の製造方法 | |
| Zhou et al. | Cellulose-based polymers | |
| CN106519307A (zh) | 一种细菌纤维素/富勒烯复合材料及其制备方法 | |
| Demina et al. | Polysaccharide-based aerogels fabricated via supercritical fluid drying: a systematic review | |
| JP4063913B2 (ja) | キトサンとアニオン性多糖類水溶液とからなる紡糸用組成物およびその繊維 | |
| KR102893786B1 (ko) | 다공성 미소섬유상 셀룰로오스 필름 및 이의 제조방법 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A300 | Withdrawal of application because of no request for examination |
Free format text: JAPANESE INTERMEDIATE CODE: A300 Effective date: 20140513 |