JP2009503093A - インスリン産生細胞の機能を保持する方法 - Google Patents
インスリン産生細胞の機能を保持する方法 Download PDFInfo
- Publication number
- JP2009503093A JP2009503093A JP2008525132A JP2008525132A JP2009503093A JP 2009503093 A JP2009503093 A JP 2009503093A JP 2008525132 A JP2008525132 A JP 2008525132A JP 2008525132 A JP2008525132 A JP 2008525132A JP 2009503093 A JP2009503093 A JP 2009503093A
- Authority
- JP
- Japan
- Prior art keywords
- insulin
- patient
- dose
- use according
- medicament
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/22—Hormones
- A61K38/28—Insulins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
Abstract
Description
本発明はインスリン産生能力があるにもかかわらず不当に早い時期にインスリンを放出するインスリン関連性疾患の患者において、膵臓への負担を減らし、インスリン産生細胞の寿命を延ばす方法に関するものである。
現在、世界中で少なくとも2億人が真性糖尿病(以後、糖尿病とする)にかかっている。糖尿病の2つの主要サブタイプは1型と2型である。1型糖尿病が2億人の糖尿病患者の約10%を占める。1型糖尿病は膵臓のランゲルハンス島にあるインスリン分泌性β細胞の自己免疫破壊によっておきる。2型糖尿病は患者の残る90%を占め、罹患率は増加しつつある。2型糖尿病は必ずとは言わないまでも肥満と関係していることが多く、これまでは遅発性または成人期発生性糖尿病とされていたにもかかわらず、今ではより若い人々に広がりつつある。2型糖尿病はインスリン抵抗性と不適切なインスリン分泌との組み合わせによっておきる。
侵襲されていない健常者では、基礎的グルコースレベルが固有のフィードバック・ループによって毎日同一に保持される傾向がある。血中グルコース濃度のあらゆる増加傾向は、インスリン分泌の増加およびグルカゴンの分泌抑制によって相殺される。これらは肝グルコース産生(グルコース新生およびグリコーゲン貯蔵庫からの放出)と組織のグルコース取り込みとを調節して血中グルコース濃度を一定に保つ。患者の体重が増加するか、もしくはその他の何らかの理由でインスリン抵抗性になった場合、血中グルコースレベルは増加し、その結果インスリン抵抗性を補うためにインスリン分泌が増加する。こうして、グルコースおよびインスリン濃度の変化を最小にし、その一方でグルコースの比較的正常な産生および利用が維持されるように、グルコースおよびインスリンレベルが調節される。
糖尿病の重要な特徴はβ細胞機能不全である。1型および2型糖尿病の両方における疾患の進行中の早期におきる1つの異常は、食べることにより誘起される速やかなインスリン反応の喪失である。したがって、肝臓はグルコースを生産し続け、それは消化され、食事の基礎的成分から吸収されるグルコースに加わる。
インスリン治療は1型糖尿病の標準的治療である、というのはハネムーン期にはほとんどの患者が確定されていないからである。初期2型糖尿病は食事療法および運動で処置できる。大部分の早期2型糖尿病患者は現在は経口的抗糖尿病薬で治療されているが成功例は限られている。患者は病気が進むにつれてインスリン治療に移行する。しかしこれらの治療では治癒しない。
Clee,S.M.,et al.Nature Genetics 38;688−693、2006 Nathan,D.M.et al.,N Engl J Med 353:2643−53、2005 Shapiro et al.,Diabetes July 2002,5:2148 Hirschberg B et al.,Diabetes/Metabolism Research and Reviews 2003;19:175−178
ハネムーン期の1型糖尿病、初期相2型糖尿病および膵島移植患者における膵臓への負担を減らし、インスリン産生細胞の寿命を延長するために有用な方法および組成物が提供される。この方法の実施形態は、血清プロインスリンレベルを十分に減らしおよび/またはグルコース可動域を十分にコントロールする量のインスリンを使用して、食事関連性初期相インスリン反応を模する様態でインスリンを投与することを含む。初期相動態を模して、投与後約12分〜約30分以内にピーク血清インスリンレベルに到達させることができる。血清インスリンレベルは投与の約2または3時間以内にベースラインに戻ることもある。一実施形態において、インスリン治療を必要とする患者にインスリンを食事時間に投与する、すなわち、食事開始前約10分以内、より好ましくは約5分以内、または食事開始後30、25、15、または10分以内に投与する。(正常な胃内空化を有する患者では、食事後のより短い時間が好ましく、より長い時間が適するのは胃内空化が遅い患者である)。好ましい実施形態において、単位量吸入器の使用によってフマリルジケトピペラジンとインスリンとの錯体の乾燥粉末組成物を吸入させることによって、肺内デリバリーが実現する。本明細書に使用される用語“フマリルジケトピペラジン”(FDKP)はその塩類も含むものとする。好ましい投与量はフマリルジケトピペラジンと錯化したインスリンまたはその同等物約15〜90IUの範囲、または24IUより多い量である。
発明について述べる前に、以後使われる幾つかの用語を理解することが有用であると思われる:
乾燥粉末:本明細書に使用される“乾燥粉末”とは噴射剤、担体またはその他の液体に懸濁または溶解されていない微細な粒状組成物を言う。水分子が全くないことを意味するものではない。
発明の一つの局面は、β細胞機能を保持し、それによって糖尿病性疾患の進行を止め、または弱めることである。β細胞機能は、1型および2型に、およびβ細胞移植処置後に種々のメカニズムによって発生するインスリンに対する過剰需要によって誘起される侵襲を弱めることによって保持される。本明細書に記載されるように、増加したグルコース濃度への被曝を減らし、それによってグルコース毒性を弱めることによっても機能を保持することができる。過剰のインスリン需要、血中グルコースレベルのコントロールの低下、およびその結果としてのβ細胞への侵襲が、機能の喪失およびβ細胞の死と関係する。血中グルコース濃度の急性変動に起因する酸化ストレスによる膵臓の微小血管の損傷も役割を演じているかも知れない。ここに記載されるように、生理的食事時の初期相インスリン放出を模するインスリン製剤の非静脈内投与によって、生合成需要は減り、侵襲は緩和する。
(2型糖尿病患者における吸入TECHNOSPHERE(登録商標)/インスリンの効果および安全性に関する無作為化二重盲検プラセボ対照研究)
小型の肺吸入器によって運搬されるTECHNOSPHERE(登録商標)乾燥粉末肺インスリンは、正常な食事関連性の第一相または初期相インスリン放出を模するバイオアベイラビリティを有する。この多施設、無作為化、二重盲検、プラセボ対照研究は食事療法または経口剤治療では十分にコントロールされない2型真性糖尿病患者(HbA1c>6.5%〜10.5%)で行われた。合計123名の患者が参加し、治療に同意した119名の患者集団(ITT)を1:1に無作為化し、ヒトインスリン(rDNA由来)6〜48単位を含む単位量投与カートリッジから食事時吸入TECHNOSPHERE(登録商標)/インスリンを投与するか、または吸入TECHNOSPHERE(登録商標)/プラセボ(PBO)を投与した。
(ヒトにおいて速やかにバイオアベイラブルに吸入されるインスリンの初期相インスリン反応を模することは、より緩徐なバイオアベイラビリティを有するインスリンと比較して食後のグルコース排出を加速する。)
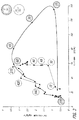
2型糖尿病の12名の患者群におけるイソグリセミック・クランプ中の、時間とインスリン濃度とグルコース排出速度との関係を研究した。各患者に24IU(国際単位)の皮下インスリン(アクトラピド(登録商標)、ノボノルディスク社(Novo Nordisk))または48UのTECHNOSPHERE(登録商標)/インスリン(TI、マンカインド社(MannKind Corporation))を別々の日にクロスオーバーデザインで投与した。グルコース排出速度(GIR)は540分間の研究期間中、120mg/dLの安定血中グルコースを維持するために必要なグルコース注入量によって測定した(図3)。
(肺インスリンによるヒトの治療は血清プロインスリンレベルを下げる)
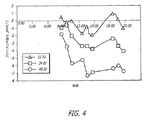
TECHNOSPHERE(登録商標)/インスリン(TI)の吸入は第一相反応に比較して血清インスリンの上昇をもたらす。この研究ではTIの薬物動態および完全プロインスリン(iPi)放出に与えるその影響を研究した。2型糖尿病の24名の患者に異なる4種類のインスリン量、すなわち組換えレギュラーヒトインスリン 0、12IU、24IU、または48IUのいづれかの量を含むTECHNOSPHERE(登録商標)ベースを別々の日に、標準食の開始5分後に投与した。血中グルコース(BG)、血清インスリンおよび血清iPiを各食事開始前(0分)、各食事開始後60および120分に測定した。
(肺インスリンで治療した糖尿病性脂肪ラットにおけるβ細胞の評価)
糖尿病性脂肪ラットは2型糖尿病のモデルである。2つの系統、ZDFおよびWDFが入手できる。WDF系統に高スクロース食を約1週間食べさせることによって糖尿病を起こすことができる。或いはZDFラットでは齢約13週に糖尿病が自発的に発生する。
(肺インスリンで治療したNODマウスのβ細胞の評価)
NOD(非肥満性糖尿病)マウスは1型糖尿病のモデルである。糖尿病は齢約12−14週に自発的に発生する。バラツキは雄よりも雌の方が小さい。
Claims (30)
- インスリン関連性疾患を有するインスリン非依存性患者のインスリン産生細胞を保持するための薬剤の製造におけるインスリン組成物の使用であって、ここで、前記薬剤の少なくとも1つの用量が前記患者に投与され、前記薬剤は生理的食事関連性初期相インスリン反応を模し、そして前記インスリン産生細胞の機能を保持する、使用。
- 前記患者がハネムーン期の1型糖尿病、前糖尿病またはインスリン産生細胞移植体レシピエントからなる群から選択される、請求項1記載の使用。
- 前記薬剤が経口的に投与される、請求項1記載の使用。
- 前記薬剤が吸入される、請求項1記載の使用。
- 前記薬剤が乾燥粉末処方物を含む、請求項4記載の使用。
- 前記薬剤が15gを超える炭水化物を含む任意の食事時に投与される、請求項1記載の使用。
- 前記薬剤が血清プロインスリンレベルを低下させるために十分なインスリン用量を含む、請求項1記載の使用。
- 前記薬剤がグルコース可動域を制御するために十分なインスリン用量を含む、請求項1記載の使用。
- 前記用量が血中グルコースレベルを制御するために十分である、請求項7または8のいずれかに記載の使用。
- 前記用量が肝臓からのグルコース放出を低減するために十分である、請求項7または8のいずれかに記載の使用。
- 前記薬剤が投与後約15分以内に血清インスリンレベルのピークを誘起する、請求項1記載の使用。
- 前記ピーク血清インスリンレベルが少なくとも60mU/Lである、請求項11記載の使用。
- 前記インスリン組成物が、インスリンと結合したフマリルジケトピペラジン(FDKP)を含む、請求項1記載の使用。
- 前記用量が約15IU〜約90IUのFDKPインスリンに等しい範囲内にある、請求項12記載の使用。
- 前記患者がさらにインスリン感作物質またはインスリン分泌促進剤で処置される、請求項1記載の使用。
- インスリン関連性疾患を有するインスリン非依存性患者の、食後の膵臓へのストレスを減らす薬剤の製造におけるインスリン組成物の使用であって、ここで、前記薬剤の少なくとも1つの用量が前記患者に投与され、前記薬剤は生理的食事関連性初期相インスリン反応を模し、そして前記用量は血中グルコースレベルをコントロールし、血清プロインスリンレベルを低減するのに十分であり、それによって膵臓ストレスは弱まる、使用。
- 移植体レシピエントのインスリン産生細胞移植体の寿命を延長する薬剤の製造におけるインスリン組成物の使用であって、ここで、前記薬剤の少なくとも1つの用量が前記移植体レシピエントに投与され、前記薬剤は生理的食事関連性初期相インスリン反応を模し、そして前記用量は血中グルコースレベルを制御し、血清プロインスリンレベルを低減するのに十分であり、それによって膵臓ストレスは弱まり、インスリン産生細胞の寿命は長くなる、使用。
- インスリン関連性疾患を有するインスリン非依存性患者のインスリン産生細胞の機能を保持する薬剤の製造におけるインスリン組成物の使用であって、ここで、前記患者は少なくともある量の前記薬剤と免疫抑制剤とを投与され、前記薬剤は生理的食事関連性初期相インスリン反応を模し、ここで、前記薬剤および前記免疫抑制剤は自己免疫反応を緩徐にする、使用。
- 徐放性インスリン処方物を含む、患者のインスリン産生細胞の保持に有効な組成物。
- インスリン処方物を含む遅効性製剤を含んでなる、患者のインスリン産生細胞の保持に有効な組成物。
- ハネムーン期の1型糖尿病患者、前糖尿病患者およびインスリン産生細胞移植体レシピエントからなる群から選択されるインスリン関連性疾患を有するインスリン非依存性患者のインスリン産生細胞の機能を保持する薬剤の製造におけるインスリン組成物の使用であって、ここで、前記薬剤の少なくとも1つの用量が前記患者に投与され、前記薬剤は生理的食事関連性初期相インスリン反応を模し、前記インスリン産生細胞の機能を保持する、使用。
- インスリン関連性疾患を有し、あるインスリン用量の基礎的インスリン以外のインスリン組成物では治療されていない患者のインスリン産生細胞の機能を保持する薬剤の製造におけるインスリン組成物の使用であって、ここで、少なくとも1つの用量の前記薬剤が食事時間に前記患者に投与され、前記薬剤は生理的食事関連性初期相インスリン反応を模し、前記患者における前記インスリン産生細胞の機能を保持する、使用。
- インスリン関連性疾患を有し、初期相インスリン放出を失っており、あるインスリン用量で8%未満の血清グリケート化ヘモグロビン(HbA1c)レベルを有している患者のインスリン産生細胞の機能を保持する薬剤の製造におけるインスリン組成物の使用であって、前記薬剤の少なくとも1つの用量を前記患者に食事時間に投与し、前記薬剤は生理的食事関連性初期相インスリン反応を模し、そして前記患者の前記インスリン産生細胞の機能を保持する、使用。
- 前記薬剤が15gを超える炭水化物を含む任意の食事と共に投与される、請求項22記載の使用。
- 前記患者が食事性インスリン治療体系で処置されていない、請求項22記載の使用。
- 前記患者が上昇した血清プロインスリンレベルを有する、請求項22記載の使用。
- 前記患者がグルコース可動域の平均振幅の増加を有する、請求項22記載の使用。
- 前記患者が酸化ストレス増加の証拠を有する、請求項22記載の使用。
- 前記血清HbA1cレベルが7%未満である、請求項22記載の使用。
- 前記血清HbA1cレベルが6.5%未満である、請求項22記載の使用。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US70429505P | 2005-08-01 | 2005-08-01 | |
| PCT/US2006/030014 WO2007016600A2 (en) | 2005-08-01 | 2006-08-01 | Method of preserving the function of insulin-producing cells |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015002059A Division JP2015091854A (ja) | 2005-08-01 | 2015-01-08 | インスリン産生細胞の機能を保持する方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2009503093A true JP2009503093A (ja) | 2009-01-29 |
| JP2009503093A5 JP2009503093A5 (ja) | 2009-09-03 |
Family
ID=37561086
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008525132A Pending JP2009503093A (ja) | 2005-08-01 | 2006-08-01 | インスリン産生細胞の機能を保持する方法 |
| JP2015002059A Pending JP2015091854A (ja) | 2005-08-01 | 2015-01-08 | インスリン産生細胞の機能を保持する方法 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015002059A Pending JP2015091854A (ja) | 2005-08-01 | 2015-01-08 | インスリン産生細胞の機能を保持する方法 |
Country Status (10)
| Country | Link |
|---|---|
| EP (1) | EP1915171B1 (ja) |
| JP (2) | JP2009503093A (ja) |
| CN (1) | CN101232899A (ja) |
| AU (1) | AU2006275424B2 (ja) |
| BR (1) | BRPI0614489A2 (ja) |
| CA (1) | CA2617226A1 (ja) |
| DK (1) | DK1915171T3 (ja) |
| ES (1) | ES2439455T3 (ja) |
| MX (1) | MX2008001643A (ja) |
| WO (1) | WO2007016600A2 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2015027543A (ja) * | 2009-03-04 | 2015-02-12 | マンカインド コーポレイション | 改善された乾燥粉末薬物送達システム |
Families Citing this family (34)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9006175B2 (en) | 1999-06-29 | 2015-04-14 | Mannkind Corporation | Potentiation of glucose elimination |
| JP4681231B2 (ja) | 2002-03-20 | 2011-05-11 | マンカインド コーポレイション | 吸入装置 |
| EP1786784B1 (en) | 2004-08-20 | 2010-10-27 | MannKind Corporation | Catalysis of diketopiperazine synthesis |
| DK2322180T3 (en) | 2004-08-23 | 2015-06-15 | Mannkind Corp | Diketopiperazinsalte for drug delivery |
| KR101643478B1 (ko) | 2005-09-14 | 2016-07-27 | 맨카인드 코포레이션 | 활성제에 대한 결정질 미립자 표면의 친화력의 증가를 기반으로 하는 약물 제제화의 방법 |
| MX360812B (es) | 2006-02-22 | 2018-11-16 | Mannkind Corp | Un método para mejorar las propiedades farmacéuticas de micropartículas que contienen dicetopiperazina y un agente activo. |
| KR101655053B1 (ko) | 2008-06-13 | 2016-09-07 | 맨카인드 코포레이션 | 건조 분말 흡입기 및 약물 투여 시스템 |
| US8485180B2 (en) | 2008-06-13 | 2013-07-16 | Mannkind Corporation | Dry powder drug delivery system |
| ES2904623T3 (es) | 2008-06-20 | 2022-04-05 | Mannkind Corp | Aparato interactivo para establecer un perfil en tiempo real de esfuerzos de inhalación |
| TWI532497B (zh) * | 2008-08-11 | 2016-05-11 | 曼凱公司 | 超快起作用胰島素之用途 |
| US8314106B2 (en) | 2008-12-29 | 2012-11-20 | Mannkind Corporation | Substituted diketopiperazine analogs for use as drug delivery agents |
| PT2379100E (pt) * | 2009-01-08 | 2015-02-09 | Mannkind Corp | Tratamento de hiperglicemia com glp-1 |
| DK2405963T3 (da) | 2009-03-11 | 2013-12-16 | Mannkind Corp | Apparat, system og fremgangsmåde til at måle modstand i en inhalator |
| KR101875969B1 (ko) | 2009-06-12 | 2018-07-06 | 맨카인드 코포레이션 | 한정된 비표면적을 갖는 디케토피페라진 마이크로입자 |
| US9016147B2 (en) | 2009-11-03 | 2015-04-28 | Mannkind Corporation | Apparatus and method for simulating inhalation efforts |
| EP2582421A1 (en) | 2010-06-21 | 2013-04-24 | MannKind Corporation | Dry powder drug delivery system and methods |
| AU2012236150B2 (en) | 2011-04-01 | 2016-03-31 | Mannkind Corporation | Blister package for pharmaceutical cartridges |
| WO2012174472A1 (en) | 2011-06-17 | 2012-12-20 | Mannkind Corporation | High capacity diketopiperazine microparticles |
| CA2852536A1 (en) | 2011-10-24 | 2013-05-02 | Mannkind Corporation | Methods and compositions for treating pain |
| JP6312262B2 (ja) | 2012-07-12 | 2018-04-18 | マンカインド コーポレイション | 乾燥粉末薬物送達システム |
| US9897565B1 (en) | 2012-09-11 | 2018-02-20 | Aseko, Inc. | System and method for optimizing insulin dosages for diabetic subjects |
| US9171343B1 (en) | 2012-09-11 | 2015-10-27 | Aseko, Inc. | Means and method for improved glycemic control for diabetic patients |
| EP2911690A1 (en) | 2012-10-26 | 2015-09-02 | MannKind Corporation | Inhalable influenza vaccine compositions and methods |
| KR102391750B1 (ko) | 2013-03-15 | 2022-04-28 | 맨카인드 코포레이션 | 미세결정성 디케토피페라진 조성물 및 방법 |
| CN105451716A (zh) | 2013-07-18 | 2016-03-30 | 曼金德公司 | 热稳定性干粉药物组合物和方法 |
| CA2920488C (en) | 2013-08-05 | 2022-04-26 | Mannkind Corporation | Insufflation apparatus and methods |
| US9233204B2 (en) | 2014-01-31 | 2016-01-12 | Aseko, Inc. | Insulin management |
| US9486580B2 (en) | 2014-01-31 | 2016-11-08 | Aseko, Inc. | Insulin management |
| US10307464B2 (en) | 2014-03-28 | 2019-06-04 | Mannkind Corporation | Use of ultrarapid acting insulin |
| US10561806B2 (en) | 2014-10-02 | 2020-02-18 | Mannkind Corporation | Mouthpiece cover for an inhaler |
| EP3050023B1 (en) | 2014-10-27 | 2021-08-25 | Aseko, Inc. | Subcutaneous outpatient management |
| US11081226B2 (en) | 2014-10-27 | 2021-08-03 | Aseko, Inc. | Method and controller for administering recommended insulin dosages to a patient |
| CA2993275C (en) | 2015-08-20 | 2022-06-21 | Aseko, Inc. | Diabetes management therapy advisor |
| CN110187123B (zh) * | 2019-05-06 | 2022-07-22 | 天津医科大学总医院 | 一种糖尿病早期诊断生物标志物及其应用 |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2002512607A (ja) * | 1997-04-02 | 2002-04-23 | パーデュー・リサーチ・ファウンデーション | タンパク質の経口デリバリー法 |
| WO2004012720A1 (en) * | 2002-07-26 | 2004-02-12 | Pfizer Limited | Process for making orally consumable dosage forms |
| WO2004080401A2 (en) * | 2003-03-06 | 2004-09-23 | Emisphere Technologies, Inc. | Oral insulin therapies and protocol |
| WO2005067964A1 (en) * | 2004-01-12 | 2005-07-28 | Mannkind Corporation | A method of reducing serum proinsulin levels in type 2 diabetics |
Family Cites Families (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DK1808438T3 (da) * | 1999-06-29 | 2014-10-27 | Mannkind Corp | Rensning og stabilisering af peptid og proteiner i lægemidler |
-
2006
- 2006-08-01 CA CA002617226A patent/CA2617226A1/en not_active Abandoned
- 2006-08-01 BR BRPI0614489-6A patent/BRPI0614489A2/pt not_active Application Discontinuation
- 2006-08-01 AU AU2006275424A patent/AU2006275424B2/en not_active Ceased
- 2006-08-01 ES ES06789148.1T patent/ES2439455T3/es active Active
- 2006-08-01 CN CNA2006800283625A patent/CN101232899A/zh active Pending
- 2006-08-01 MX MX2008001643A patent/MX2008001643A/es not_active Application Discontinuation
- 2006-08-01 DK DK06789148.1T patent/DK1915171T3/da active
- 2006-08-01 EP EP06789148.1A patent/EP1915171B1/en not_active Not-in-force
- 2006-08-01 WO PCT/US2006/030014 patent/WO2007016600A2/en active Application Filing
- 2006-08-01 JP JP2008525132A patent/JP2009503093A/ja active Pending
-
2015
- 2015-01-08 JP JP2015002059A patent/JP2015091854A/ja active Pending
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2002512607A (ja) * | 1997-04-02 | 2002-04-23 | パーデュー・リサーチ・ファウンデーション | タンパク質の経口デリバリー法 |
| WO2004012720A1 (en) * | 2002-07-26 | 2004-02-12 | Pfizer Limited | Process for making orally consumable dosage forms |
| WO2004080401A2 (en) * | 2003-03-06 | 2004-09-23 | Emisphere Technologies, Inc. | Oral insulin therapies and protocol |
| WO2005067964A1 (en) * | 2004-01-12 | 2005-07-28 | Mannkind Corporation | A method of reducing serum proinsulin levels in type 2 diabetics |
| JP2007517892A (ja) * | 2004-01-12 | 2007-07-05 | マンカインド コーポレイション | 2型糖尿病における血清プロインスリンレベルを低下させる方法 |
Non-Patent Citations (7)
| Title |
|---|
| CSNC200900243049; 医学のあゆみ Vol.156, 1991, pp.1055-8 * |
| JPN6010065295; Diabetes Technol Ther Vol.4, 2002, pp.589-94 * |
| JPN6010065296; Diabetologia Vol.44(Suppl.1), 2001, p.A212 * |
| JPN6011064829; Lancet Vol.333, 1989, pp.1235-6 * |
| JPN6011064830; Endocrinol Metab Clin North Am Vol.33, 2004, pp.75-92 * |
| JPN6011064831; 医学のあゆみ Vol.156, 1991, pp.1055-8 * |
| JPN6011064832; Am J Med Vol.108(6A), 2000, pp.15S-22S * |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2015027543A (ja) * | 2009-03-04 | 2015-02-12 | マンカインド コーポレイション | 改善された乾燥粉末薬物送達システム |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2007016600A2 (en) | 2007-02-08 |
| MX2008001643A (es) | 2008-04-07 |
| BRPI0614489A2 (pt) | 2011-03-29 |
| ES2439455T3 (es) | 2014-01-23 |
| CN101232899A (zh) | 2008-07-30 |
| JP2015091854A (ja) | 2015-05-14 |
| AU2006275424A1 (en) | 2007-02-08 |
| DK1915171T3 (da) | 2013-12-09 |
| EP1915171B1 (en) | 2013-11-20 |
| AU2006275424B2 (en) | 2013-01-10 |
| WO2007016600A3 (en) | 2007-05-31 |
| CA2617226A1 (en) | 2007-02-08 |
| EP1915171A2 (en) | 2008-04-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2015091854A (ja) | インスリン産生細胞の機能を保持する方法 | |
| US20070027063A1 (en) | Method of preserving the function of insulin-producing cells | |
| RU2688663C2 (ru) | Применение сверхбыстродействующего инсулина | |
| JP5719099B2 (ja) | 糖尿病治療における優れた血糖コントロール | |
| JP5918539B2 (ja) | Glp−1を用いる高血糖症の治療方法 | |
| Rabiee et al. | Pancreatic polypeptide administration enhances insulin sensitivity and reduces the insulin requirement of patients on insulin pump therapy | |
| JP2015013892A (ja) | Glp−1による副作用を防止する方法 | |
| JP2007517892A (ja) | 2型糖尿病における血清プロインスリンレベルを低下させる方法 | |
| EP1758611A2 (en) | Use of liver-selective glucokinase activators | |
| US20210361746A1 (en) | Composition and method for reducing hypoglycemia events in diabetes treatment | |
| Khan et al. | DIABETES AND ITS TREATMENT BY GLUCAGON-LIKE PEPTIDE 1 ANALOGS AND DI-PEPTIDYL PEPTIDASE 4 INHIBITORS |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| RD03 | Notification of appointment of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7423 Effective date: 20090619 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20090714 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20090717 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20090717 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20111207 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120307 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20120628 |
|
| RD03 | Notification of appointment of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7423 Effective date: 20120712 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20120724 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20121029 |
|
| A911 | Transfer of reconsideration by examiner before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20121113 |
|
| A912 | Removal of reconsideration by examiner before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A912 Effective date: 20130111 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20140314 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20140409 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20141007 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20141010 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20141107 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20141112 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20141208 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20141212 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20150108 |