JP2006517543A - ポルフィリン架橋体を有する導電性ポリマー - Google Patents
ポルフィリン架橋体を有する導電性ポリマー Download PDFInfo
- Publication number
- JP2006517543A JP2006517543A JP2006501343A JP2006501343A JP2006517543A JP 2006517543 A JP2006517543 A JP 2006517543A JP 2006501343 A JP2006501343 A JP 2006501343A JP 2006501343 A JP2006501343 A JP 2006501343A JP 2006517543 A JP2006517543 A JP 2006517543A
- Authority
- JP
- Japan
- Prior art keywords
- substituted
- electronic functional
- functional unit
- monomer units
- crosslinked polymer
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 150000004032 porphyrins Chemical class 0.000 title claims abstract description 67
- 229920001940 conductive polymer Polymers 0.000 title description 15
- 239000000178 monomer Substances 0.000 claims abstract description 122
- 229920000642 polymer Polymers 0.000 claims abstract description 62
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 claims abstract description 53
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical compound C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 claims abstract description 52
- YLQBMQCUIZJEEH-UHFFFAOYSA-N Furan Chemical compound C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 claims abstract description 45
- 229920006037 cross link polymer Polymers 0.000 claims abstract description 42
- 229930192474 thiophene Natural products 0.000 claims abstract description 34
- 125000001072 heteroaryl group Chemical group 0.000 claims abstract description 16
- 239000000758 substrate Substances 0.000 claims abstract description 14
- 230000027756 respiratory electron transport chain Effects 0.000 claims abstract description 11
- 238000004132 cross linking Methods 0.000 claims abstract description 6
- IEQIEDJGQAUEQZ-UHFFFAOYSA-N phthalocyanine Chemical compound N1C(N=C2C3=CC=CC=C3C(N=C3C4=CC=CC=C4C(=N4)N3)=N2)=C(C=CC=C2)C2=C1N=C1C2=CC=CC=C2C4=N1 IEQIEDJGQAUEQZ-UHFFFAOYSA-N 0.000 claims abstract 6
- 229920001577 copolymer Polymers 0.000 claims description 69
- KXSFECAJUBPPFE-UHFFFAOYSA-N 2,2':5',2''-terthiophene Chemical group C1=CSC(C=2SC(=CC=2)C=2SC=CC=2)=C1 KXSFECAJUBPPFE-UHFFFAOYSA-N 0.000 claims description 46
- 238000000034 method Methods 0.000 claims description 38
- PAYRUJLWNCNPSJ-UHFFFAOYSA-N Aniline Chemical compound NC1=CC=CC=C1 PAYRUJLWNCNPSJ-UHFFFAOYSA-N 0.000 claims description 37
- 239000011701 zinc Substances 0.000 claims description 26
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 claims description 25
- -1 oligothiophene Natural products 0.000 claims description 25
- 229910052725 zinc Inorganic materials 0.000 claims description 25
- 239000000463 material Substances 0.000 claims description 24
- UHOVQNZJYSORNB-UHFFFAOYSA-N monobenzene Natural products C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 claims description 23
- 229910052751 metal Inorganic materials 0.000 claims description 20
- 239000002184 metal Substances 0.000 claims description 20
- 239000011521 glass Substances 0.000 claims description 18
- 125000003118 aryl group Chemical group 0.000 claims description 17
- 238000006116 polymerization reaction Methods 0.000 claims description 16
- 150000002240 furans Chemical class 0.000 claims description 14
- 150000003577 thiophenes Chemical class 0.000 claims description 14
- 150000003233 pyrroles Chemical class 0.000 claims description 13
- 239000000126 substance Substances 0.000 claims description 12
- 150000001448 anilines Chemical class 0.000 claims description 11
- 229920001519 homopolymer Polymers 0.000 claims description 10
- 150000002678 macrocyclic compounds Chemical class 0.000 claims description 7
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 7
- 230000000379 polymerizing effect Effects 0.000 claims description 7
- 150000001555 benzenes Chemical class 0.000 claims description 5
- 125000001624 naphthyl group Chemical group 0.000 claims description 5
- 230000003381 solubilizing effect Effects 0.000 claims description 4
- 238000011065 in-situ storage Methods 0.000 claims description 3
- 238000010276 construction Methods 0.000 claims 4
- 238000006056 electrooxidation reaction Methods 0.000 claims 1
- 239000002759 woven fabric Substances 0.000 claims 1
- 125000000524 functional group Chemical group 0.000 abstract description 3
- 239000008204 material by function Substances 0.000 abstract 1
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 33
- 239000000243 solution Substances 0.000 description 25
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 24
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 22
- 238000006243 chemical reaction Methods 0.000 description 19
- 238000002484 cyclic voltammetry Methods 0.000 description 18
- 238000000576 coating method Methods 0.000 description 16
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 12
- ARRNBPCNZJXHRJ-UHFFFAOYSA-M hydron;tetrabutylazanium;phosphate Chemical compound OP(O)([O-])=O.CCCC[N+](CCCC)(CCCC)CCCC ARRNBPCNZJXHRJ-UHFFFAOYSA-M 0.000 description 12
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 12
- 239000011248 coating agent Substances 0.000 description 10
- 239000000047 product Substances 0.000 description 10
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 9
- 230000015572 biosynthetic process Effects 0.000 description 9
- 230000003647 oxidation Effects 0.000 description 8
- 238000007254 oxidation reaction Methods 0.000 description 8
- 229910052697 platinum Inorganic materials 0.000 description 8
- 238000003786 synthesis reaction Methods 0.000 description 8
- 230000000694 effects Effects 0.000 description 7
- 238000012360 testing method Methods 0.000 description 7
- 238000002371 ultraviolet--visible spectrum Methods 0.000 description 7
- 239000012458 free base Substances 0.000 description 6
- 238000004519 manufacturing process Methods 0.000 description 6
- 239000000203 mixture Substances 0.000 description 6
- 238000005481 NMR spectroscopy Methods 0.000 description 5
- 238000000921 elemental analysis Methods 0.000 description 5
- 230000009467 reduction Effects 0.000 description 5
- 230000004044 response Effects 0.000 description 5
- 238000001228 spectrum Methods 0.000 description 5
- 238000004809 thin layer chromatography Methods 0.000 description 5
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 4
- 229930002875 chlorophyll Natural products 0.000 description 4
- 235000019804 chlorophyll Nutrition 0.000 description 4
- ATNHDLDRLWWWCB-AENOIHSZSA-M chlorophyll a Chemical compound C1([C@@H](C(=O)OC)C(=O)C2=C3C)=C2N2C3=CC(C(CC)=C3C)=[N+]4C3=CC3=C(C=C)C(C)=C5N3[Mg-2]42[N+]2=C1[C@@H](CCC(=O)OC\C=C(/C)CCC[C@H](C)CCC[C@H](C)CCCC(C)C)[C@H](C)C2=C5 ATNHDLDRLWWWCB-AENOIHSZSA-M 0.000 description 4
- 229910052736 halogen Inorganic materials 0.000 description 4
- 150000002367 halogens Chemical class 0.000 description 4
- 230000006872 improvement Effects 0.000 description 4
- JZRYQZJSTWVBBD-UHFFFAOYSA-N pentaporphyrin i Chemical compound N1C(C=C2NC(=CC3=NC(=C4)C=C3)C=C2)=CC=C1C=C1C=CC4=N1 JZRYQZJSTWVBBD-UHFFFAOYSA-N 0.000 description 4
- 239000000377 silicon dioxide Substances 0.000 description 4
- 239000007787 solid Substances 0.000 description 4
- 239000002904 solvent Substances 0.000 description 4
- UGNWTBMOAKPKBL-UHFFFAOYSA-N tetrachloro-1,4-benzoquinone Chemical compound ClC1=C(Cl)C(=O)C(Cl)=C(Cl)C1=O UGNWTBMOAKPKBL-UHFFFAOYSA-N 0.000 description 4
- FIDQDDFTUULQAU-UHFFFAOYSA-N 21,23-diphenylporphyrin Chemical compound C1(=CC=CC=C1)N1C=2C=CC1=CC=1C=CC(=CC3=CC=C(N3C3=CC=CC=C3)C=C3C=CC(C2)=N3)N1 FIDQDDFTUULQAU-UHFFFAOYSA-N 0.000 description 3
- 230000007423 decrease Effects 0.000 description 3
- 229920001746 electroactive polymer Polymers 0.000 description 3
- 239000010408 film Substances 0.000 description 3
- 229920001002 functional polymer Polymers 0.000 description 3
- 239000011244 liquid electrolyte Substances 0.000 description 3
- 229910052760 oxygen Inorganic materials 0.000 description 3
- VLTRZXGMWDSKGL-UHFFFAOYSA-M perchlorate Inorganic materials [O-]Cl(=O)(=O)=O VLTRZXGMWDSKGL-UHFFFAOYSA-M 0.000 description 3
- VLTRZXGMWDSKGL-UHFFFAOYSA-N perchloric acid Chemical compound OCl(=O)(=O)=O VLTRZXGMWDSKGL-UHFFFAOYSA-N 0.000 description 3
- 229920000123 polythiophene Polymers 0.000 description 3
- 238000002360 preparation method Methods 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 239000000523 sample Substances 0.000 description 3
- QENGPZGAWFQWCZ-UHFFFAOYSA-N 3-Methylthiophene Chemical compound CC=1C=CSC=1 QENGPZGAWFQWCZ-UHFFFAOYSA-N 0.000 description 2
- RBIGKSZIQCTIJF-UHFFFAOYSA-N 3-formylthiophene Chemical compound O=CC=1C=CSC=1 RBIGKSZIQCTIJF-UHFFFAOYSA-N 0.000 description 2
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 2
- KMTRUDSVKNLOMY-UHFFFAOYSA-N Ethylene carbonate Chemical compound O=C1OCCO1 KMTRUDSVKNLOMY-UHFFFAOYSA-N 0.000 description 2
- 101000878457 Macrocallista nimbosa FMRFamide Proteins 0.000 description 2
- YIYFFLYGSHJWFF-UHFFFAOYSA-N [Zn].N1C(C=C2N=C(C=C3NC(=C4)C=C3)C=C2)=CC=C1C=C1C=CC4=N1 Chemical class [Zn].N1C(C=C2N=C(C=C3NC(=C4)C=C3)C=C2)=CC=C1C=C1C=CC4=N1 YIYFFLYGSHJWFF-UHFFFAOYSA-N 0.000 description 2
- 238000010521 absorption reaction Methods 0.000 description 2
- ZOIORXHNWRGPMV-UHFFFAOYSA-N acetic acid;zinc Chemical compound [Zn].CC(O)=O.CC(O)=O ZOIORXHNWRGPMV-UHFFFAOYSA-N 0.000 description 2
- 150000001450 anions Chemical class 0.000 description 2
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 230000005540 biological transmission Effects 0.000 description 2
- 239000002322 conducting polymer Substances 0.000 description 2
- 238000007334 copolymerization reaction Methods 0.000 description 2
- 239000010949 copper Substances 0.000 description 2
- PBTPREHATAFBEN-UHFFFAOYSA-N dipyrromethane Chemical compound C=1C=CNC=1CC1=CC=CN1 PBTPREHATAFBEN-UHFFFAOYSA-N 0.000 description 2
- 230000001747 exhibiting effect Effects 0.000 description 2
- CNUDBTRUORMMPA-UHFFFAOYSA-N formylthiophene Chemical compound O=CC1=CC=CS1 CNUDBTRUORMMPA-UHFFFAOYSA-N 0.000 description 2
- 229910052740 iodine Inorganic materials 0.000 description 2
- 239000011630 iodine Substances 0.000 description 2
- 150000002500 ions Chemical class 0.000 description 2
- 238000004502 linear sweep voltammetry Methods 0.000 description 2
- 238000011068 loading method Methods 0.000 description 2
- 238000001819 mass spectrum Methods 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 239000001301 oxygen Substances 0.000 description 2
- 229920000128 polypyrrole Polymers 0.000 description 2
- RUOJZAUFBMNUDX-UHFFFAOYSA-N propylene carbonate Chemical compound CC1COC(=O)O1 RUOJZAUFBMNUDX-UHFFFAOYSA-N 0.000 description 2
- JUJWROOIHBZHMG-RALIUCGRSA-N pyridine-d5 Chemical compound [2H]C1=NC([2H])=C([2H])C([2H])=C1[2H] JUJWROOIHBZHMG-RALIUCGRSA-N 0.000 description 2
- 238000010992 reflux Methods 0.000 description 2
- 238000001878 scanning electron micrograph Methods 0.000 description 2
- 238000004626 scanning electron microscopy Methods 0.000 description 2
- 239000000741 silica gel Substances 0.000 description 2
- 229910002027 silica gel Inorganic materials 0.000 description 2
- 238000003756 stirring Methods 0.000 description 2
- 239000003115 supporting electrolyte Substances 0.000 description 2
- KBLZDCFTQSIIOH-UHFFFAOYSA-M tetrabutylazanium;perchlorate Chemical compound [O-]Cl(=O)(=O)=O.CCCC[N+](CCCC)(CCCC)CCCC KBLZDCFTQSIIOH-UHFFFAOYSA-M 0.000 description 2
- GKXDJYKZFZVASJ-UHFFFAOYSA-M tetrapropylazanium;iodide Chemical compound [I-].CCC[N+](CCC)(CCC)CCC GKXDJYKZFZVASJ-UHFFFAOYSA-M 0.000 description 2
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 2
- 229920002554 vinyl polymer Polymers 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- 239000004246 zinc acetate Substances 0.000 description 2
- OHZAHWOAMVVGEL-UHFFFAOYSA-N 2,2'-bithiophene Chemical compound C1=CSC(C=2SC=CC=2)=C1 OHZAHWOAMVVGEL-UHFFFAOYSA-N 0.000 description 1
- HIXDQWDOVZUNNA-UHFFFAOYSA-N 2-(3,4-dimethoxyphenyl)-5-hydroxy-7-methoxychromen-4-one Chemical compound C=1C(OC)=CC(O)=C(C(C=2)=O)C=1OC=2C1=CC=C(OC)C(OC)=C1 HIXDQWDOVZUNNA-UHFFFAOYSA-N 0.000 description 1
- CSDSSGBPEUDDEE-UHFFFAOYSA-N 2-formylpyridine Chemical compound O=CC1=CC=CC=N1 CSDSSGBPEUDDEE-UHFFFAOYSA-N 0.000 description 1
- JKTYGPATCNUWKN-UHFFFAOYSA-N 4-nitrobenzyl alcohol Chemical compound OCC1=CC=C([N+]([O-])=O)C=C1 JKTYGPATCNUWKN-UHFFFAOYSA-N 0.000 description 1
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 1
- 239000004971 Cross linker Substances 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 241000408529 Libra Species 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- YZCKVEUIGOORGS-IGMARMGPSA-N Protium Chemical compound [1H] YZCKVEUIGOORGS-IGMARMGPSA-N 0.000 description 1
- 241000720974 Protium Species 0.000 description 1
- OXLVMVIUBXHTSA-UHFFFAOYSA-N [Mg].N1C(C=C2N=C(C=C3NC(=C4)C=C3)C=C2)=CC=C1C=C1C=CC4=N1 Chemical class [Mg].N1C(C=C2N=C(C=C3NC(=C4)C=C3)C=C2)=CC=C1C=C1C=CC4=N1 OXLVMVIUBXHTSA-UHFFFAOYSA-N 0.000 description 1
- 238000002835 absorbance Methods 0.000 description 1
- 150000001299 aldehydes Chemical class 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 239000012736 aqueous medium Substances 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 239000012298 atmosphere Substances 0.000 description 1
- 239000003181 biological factor Substances 0.000 description 1
- 239000011449 brick Substances 0.000 description 1
- 150000001793 charged compounds Chemical class 0.000 description 1
- 230000009920 chelation Effects 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- SURLGNKAQXKNSP-DBLYXWCISA-N chlorin Chemical compound C\1=C/2\N/C(=C\C3=N/C(=C\C=4NC(/C=C\5/C=CC/1=N/5)=CC=4)/C=C3)/CC\2 SURLGNKAQXKNSP-DBLYXWCISA-N 0.000 description 1
- OEYIOHPDSNJKLS-UHFFFAOYSA-N choline Chemical compound C[N+](C)(C)CCO OEYIOHPDSNJKLS-UHFFFAOYSA-N 0.000 description 1
- 229960001231 choline Drugs 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 239000000084 colloidal system Substances 0.000 description 1
- 238000004440 column chromatography Methods 0.000 description 1
- 238000010668 complexation reaction Methods 0.000 description 1
- 150000001875 compounds Chemical class 0.000 description 1
- 230000021615 conjugation Effects 0.000 description 1
- 150000004696 coordination complex Chemical group 0.000 description 1
- 229910052802 copper Inorganic materials 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 239000012043 crude product Substances 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- 238000000151 deposition Methods 0.000 description 1
- 230000008021 deposition Effects 0.000 description 1
- 238000001212 derivatisation Methods 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 239000003599 detergent Substances 0.000 description 1
- 239000011903 deuterated solvents Substances 0.000 description 1
- 238000002848 electrochemical method Methods 0.000 description 1
- 239000002659 electrodeposit Substances 0.000 description 1
- 238000004070 electrodeposition Methods 0.000 description 1
- 238000001663 electronic absorption spectrum Methods 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- RTZKZFJDLAIYFH-UHFFFAOYSA-N ether Substances CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 1
- 239000004744 fabric Substances 0.000 description 1
- 238000010265 fast atom bombardment Methods 0.000 description 1
- KTWOOEGAPBSYNW-UHFFFAOYSA-N ferrocene Chemical compound [Fe+2].C=1C=C[CH-]C=1.C=1C=C[CH-]C=1 KTWOOEGAPBSYNW-UHFFFAOYSA-N 0.000 description 1
- 238000013467 fragmentation Methods 0.000 description 1
- 238000006062 fragmentation reaction Methods 0.000 description 1
- 238000003306 harvesting Methods 0.000 description 1
- 150000002390 heteroarenes Chemical class 0.000 description 1
- 230000002209 hydrophobic effect Effects 0.000 description 1
- 238000007654 immersion Methods 0.000 description 1
- 230000003100 immobilizing effect Effects 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 238000011835 investigation Methods 0.000 description 1
- 239000003446 ligand Substances 0.000 description 1
- 230000031700 light absorption Effects 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 239000004973 liquid crystal related substance Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- YACKEPLHDIMKIO-UHFFFAOYSA-N methylphosphonic acid Chemical compound CP(O)(O)=O YACKEPLHDIMKIO-UHFFFAOYSA-N 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 239000002121 nanofiber Substances 0.000 description 1
- 239000002105 nanoparticle Substances 0.000 description 1
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 1
- 239000012299 nitrogen atmosphere Substances 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 239000007800 oxidant agent Substances 0.000 description 1
- 239000003973 paint Substances 0.000 description 1
- 230000000243 photosynthetic effect Effects 0.000 description 1
- 150000003057 platinum Chemical class 0.000 description 1
- 229920000767 polyaniline Polymers 0.000 description 1
- 229920000867 polyelectrolyte Polymers 0.000 description 1
- 150000004033 porphyrin derivatives Chemical class 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 238000003672 processing method Methods 0.000 description 1
- 238000006862 quantum yield reaction Methods 0.000 description 1
- 239000000376 reactant Substances 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 238000001223 reverse osmosis Methods 0.000 description 1
- 125000006850 spacer group Chemical group 0.000 description 1
- 238000004611 spectroscopical analysis Methods 0.000 description 1
- 238000004544 sputter deposition Methods 0.000 description 1
- 125000005504 styryl group Chemical group 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- 239000004753 textile Substances 0.000 description 1
- 239000010409 thin film Substances 0.000 description 1
- 238000009966 trimming Methods 0.000 description 1
- 238000001075 voltammogram Methods 0.000 description 1
- 150000003751 zinc Chemical class 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G73/00—Macromolecular compounds obtained by reactions forming a linkage containing nitrogen with or without oxygen or carbon in the main chain of the macromolecule, not provided for in groups C08G12/00 - C08G71/00
- C08G73/06—Polycondensates having nitrogen-containing heterocyclic rings in the main chain of the macromolecule
- C08G73/0605—Polycondensates containing five-membered rings, not condensed with other rings, with nitrogen atoms as the only ring hetero atoms
- C08G73/0611—Polycondensates containing five-membered rings, not condensed with other rings, with nitrogen atoms as the only ring hetero atoms with only one nitrogen atom in the ring, e.g. polypyrroles
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G61/00—Macromolecular compounds obtained by reactions forming a carbon-to-carbon link in the main chain of the macromolecule
- C08G61/02—Macromolecular compounds containing only carbon atoms in the main chain of the macromolecule, e.g. polyxylylenes
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G61/00—Macromolecular compounds obtained by reactions forming a carbon-to-carbon link in the main chain of the macromolecule
- C08G61/12—Macromolecular compounds containing atoms other than carbon in the main chain of the macromolecule
- C08G61/122—Macromolecular compounds containing atoms other than carbon in the main chain of the macromolecule derived from five- or six-membered heterocyclic compounds, other than imides
- C08G61/123—Macromolecular compounds containing atoms other than carbon in the main chain of the macromolecule derived from five- or six-membered heterocyclic compounds, other than imides derived from five-membered heterocyclic compounds
- C08G61/124—Macromolecular compounds containing atoms other than carbon in the main chain of the macromolecule derived from five- or six-membered heterocyclic compounds, other than imides derived from five-membered heterocyclic compounds with a five-membered ring containing one nitrogen atom in the ring
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G73/00—Macromolecular compounds obtained by reactions forming a linkage containing nitrogen with or without oxygen or carbon in the main chain of the macromolecule, not provided for in groups C08G12/00 - C08G71/00
- C08G73/02—Polyamines
- C08G73/026—Wholly aromatic polyamines
- C08G73/0266—Polyanilines or derivatives thereof
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01G—CAPACITORS; CAPACITORS, RECTIFIERS, DETECTORS, SWITCHING DEVICES, LIGHT-SENSITIVE OR TEMPERATURE-SENSITIVE DEVICES OF THE ELECTROLYTIC TYPE
- H01G9/00—Electrolytic capacitors, rectifiers, detectors, switching devices, light-sensitive or temperature-sensitive devices; Processes of their manufacture
- H01G9/20—Light-sensitive devices
- H01G9/2059—Light-sensitive devices comprising an organic dye as the active light absorbing material, e.g. adsorbed on an electrode or dissolved in solution
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K30/00—Organic devices sensitive to infrared radiation, light, electromagnetic radiation of shorter wavelength or corpuscular radiation
- H10K30/451—Organic devices sensitive to infrared radiation, light, electromagnetic radiation of shorter wavelength or corpuscular radiation comprising a metal-semiconductor-metal [m-s-m] structure
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/10—Organic polymers or oligomers
- H10K85/111—Organic polymers or oligomers comprising aromatic, heteroaromatic, or aryl chains, e.g. polyaniline, polyphenylene or polyphenylene vinylene
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/10—Organic polymers or oligomers
- H10K85/111—Organic polymers or oligomers comprising aromatic, heteroaromatic, or aryl chains, e.g. polyaniline, polyphenylene or polyphenylene vinylene
- H10K85/113—Heteroaromatic compounds comprising sulfur or selene, e.g. polythiophene
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/10—Organic polymers or oligomers
- H10K85/141—Organic polymers or oligomers comprising aliphatic or olefinic chains, e.g. poly N-vinylcarbazol, PVC or PTFE
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/30—Coordination compounds
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K30/00—Organic devices sensitive to infrared radiation, light, electromagnetic radiation of shorter wavelength or corpuscular radiation
- H10K30/50—Photovoltaic [PV] devices
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K71/00—Manufacture or treatment specially adapted for the organic devices covered by this subclass
- H10K71/10—Deposition of organic active material
- H10K71/12—Deposition of organic active material using liquid deposition, e.g. spin coating
- H10K71/125—Deposition of organic active material using liquid deposition, e.g. spin coating using electrolytic deposition e.g. in-situ electropolymerisation
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E10/00—Energy generation through renewable energy sources
- Y02E10/50—Photovoltaic [PV] energy
- Y02E10/542—Dye sensitized solar cells
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E10/00—Energy generation through renewable energy sources
- Y02E10/50—Photovoltaic [PV] energy
- Y02E10/549—Organic PV cells
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Health & Medical Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Medicinal Chemistry (AREA)
- Polymers & Plastics (AREA)
- Power Engineering (AREA)
- Microelectronics & Electronic Packaging (AREA)
- Inorganic Chemistry (AREA)
- Physics & Mathematics (AREA)
- Electromagnetism (AREA)
- Polyoxymethylene Polymers And Polymers With Carbon-To-Carbon Bonds (AREA)
- Photovoltaic Devices (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
Abstract
本発明は、構造Q−(L)n−P−(L’)m−Q’を有する架橋モノマーであって、式中、Q及びQ’が重合可能な単位であり、L及びL’がQとPの間、及びPとQ’の間に直接又は間接の電子伝達をもたらすリンカーであり、又Pが電子機能性単位であるモノマーに関し、且つ又このようなモノマーから調製したポリマーに関する。Qは例えばチオフェン、フラン及びピロールなどのヘテロ芳香族環とすることができる。電子機能性基は、例えばポルフィリン、フタロシアニン、又は置換されたフタロシアニンとすることができる。本発明は又、基材と記述したものなどの架橋ポリマーとを含む電子機能材料にも関する。
Description
本発明は、導電性電子機能ポリマーにおける改良、このような電子機能ポリマーを合成する方法における改良、並びにこのようなポリマーの使用に関する。
本明細書全体にわたるどんな従来技術の考察も、このような従来技術が当分野において広く知られ、又通常の一般的知識の一部を形成することを容認するものと決して考えるべきではない。
ポルフィリンは、電子移動媒介能力を有するほかに、クロロフィルの光捕集能力、及びヘムの酸素結合能力の基礎を提供する興味ある分子構造体である。
ポルフィリンは、電子移動に参加することが可能ないくつかの電子機能性基又は単位の1つである。
ポリマーの構造中へのポルフィリン基の導入は、ポリマー中にポルフィリンの性質を導入することを目的としている。これらの性質には、金属結合性、レドックス活性、光活性、及び光捕集性が含まれる。次いで、これらの性質を示すポリマーは、デバイス中に組み込み、又はデバイス表面に塗布することができる。このデバイスはある用途範囲に使用することができる。
ポルフィリン基をポリマー鎖上に固定化し、又はポリマー鎖中に組み込むことを可能にする手順が知られている。この手順は:
(i)ビニルモノマーとコポリマーを形成させること、
(ii)予め形成されたポリマーにポルフィリンを共有結合させることにより、又は
(iii)天然若しくは合成ポルフィリンに結合した基(ビニル)を重合させること
により達成できる。
(i)ビニルモノマーとコポリマーを形成させること、
(ii)予め形成されたポリマーにポルフィリンを共有結合させることにより、又は
(iii)天然若しくは合成ポルフィリンに結合した基(ビニル)を重合させること
により達成できる。
ポルフィリンは、導電性ポリマー混合物に、単に添加されてもいる。
ポルフィリン含有ポリマーの合成及び用途が概説されている(Bao,Z;Yu,L.Trends in Polymer Science、1995、3、159、及びその中で引用されている参考文献)。
特に興味深い方法は、ポルフィリンに電解重合可能な基を結合させることを包含する。次いで、この方法の生成物を使用して、白金若しくはITOガラスなどの電極上にポリマー材料の薄い被膜を形成することができる
ポルフィリン含有モノマーを使用して不溶性被膜を電着させ、且つ、化学的及び生物学的検知、太陽エネルギー変換などを含む、ある用途範囲向けに使用されるデバイスを生産することができる。
スルホン化ポルフィリンが、導電性ポリマー構造体中に対イオンとして組み込まれている。
従来のポルフィリン含有ポリマー及び重合可能なモノマーが有する限界の1つは、ポリマーに大きなポルフィリン部分を固定化し又は一体化することにより、ポリマー内の電子伝達性が甚だしく中断されていることである。このことは、これらのポルフィリン−ポリマー被膜が導電性に乏しいことに反映されている。
さらに、ポリマー鎖中にポルフィリンを組み込むことにより、そのために選択されたポリマーの特性をしばしば変化させている。
その上、知られているポルフィリン含有モノマーを重合させる能力に限界がある恐れがある。
2つ以上の選択された重合可能なモノマー単位をポルフィリンに結合させ、且つそのモノマー単位をその後単独重合させ又は共重合させることは、ポリマー及びポルフィリン両者の所望の特性を保持しているポルフィリン架橋ポリマーをもたらす可能性を有する。
このようなポルフィリン架橋ポリマーを提供し、それにより従来技術の少なくとも1つの欠点を克服し又は改良すること、或いは有用な代替物を少なくとも提供することが本発明の目的である。
本発明は、ポリマーの重合されたモノマー単位に、電子機能性単位が架橋しているポリマーを提供する。
典型的には、1対又は1カルテット(四つ組)の、ポリマーの重合されたモノマー単位に電子機能性単位が架橋している。
本発明のいわゆる「電子機能性単位架橋ポリマー」を調製するのに有用な、重合可能なモノマー単位の架橋対、若しくは架橋カルテットをも提供する。
特に本発明は、電子機能性単位架橋ポリマーであって、そのポリマーがホモポリマーと対照されるコポリマーとして調製される架橋ポリマーを提供する。
他の性状の中でも、これらのコポリマーは向上した光起電力性能を示す。
本明細書全体にわたって用語「電子機能性」は、電子を供与若しくは受容するのに適応された、又は、ポルフィリンにより例示される固有の光起電力性状又は化学的輸送性状を有する基若しくは単位を指すものと解釈される。
他の電子機能性単位には、ドイツ特許第4242676A1号において参照されるテトラピロールポルフィン、クロリン、及びコリンから由来する四窒素含有マクロ環が含まれる。
第1の態様により、本発明は、重合可能なモノマー単位の架橋対であって、構造:
(式中、Q及びQ’は重合可能なモノマー単位であり、Pは電子機能性単位であり、又L及びL’はQとPの間、及びPとQ’の間に直接又は間接の電子伝達をもたらすリンカーであり、式中、n=0、1、2又は3、且つm=0、1、2又は3である)を有する架橋対にある。
(式中、Q及びQ’は重合可能なモノマー単位であり、Pは電子機能性単位であり、又L及びL’はQとPの間、及びPとQ’の間に直接又は間接の電子伝達をもたらすリンカーであり、式中、n=0、1、2又は3、且つm=0、1、2又は3である)を有する架橋対にある。
Q及びQ’は一般式
(式中、Rは任意の適切な重合可能な若しくは重合可能ではない官能基とすることができ、且つXは、S、NH又はOから選択することができる)のヘテロ芳香環であることが好ましい。適切なヘテロ芳香族化合物には、チオフェン、置換されたチオフェン、オリゴチオフェン、フラン、置換されたフラン、ピロール、及び置換されたピロールが含まれる。
(式中、Rは任意の適切な重合可能な若しくは重合可能ではない官能基とすることができ、且つXは、S、NH又はOから選択することができる)のヘテロ芳香環であることが好ましい。適切なヘテロ芳香族化合物には、チオフェン、置換されたチオフェン、オリゴチオフェン、フラン、置換されたフラン、ピロール、及び置換されたピロールが含まれる。
Q及びQ’は、架橋した重合可能なモノマー単位であるモノマー単位がホモポリマーとして重合することを可能にする分子の大きさのものであることがより好ましい。
Q及びQ’は同一とすることができ又は異なることができ、Q及びQ’は同一であることが好ましい。
リンカーL及びL’は、
(式中、n=0、1、2若しくは3、m=0、1、2若しくは3であり、Arはフェニル、ナフチル、ポリアリール、ヘテロアリール、及びフェロセニル又は類似の金属サンドイッチ錯体を含む群から選択される)を含む群から選択されることが好ましい。
(式中、n=0、1、2若しくは3、m=0、1、2若しくは3であり、Arはフェニル、ナフチル、ポリアリール、ヘテロアリール、及びフェロセニル又は類似の金属サンドイッチ錯体を含む群から選択される)を含む群から選択されることが好ましい。
L及びL’は同一とすることができ又は異なることができ、L及びL’は同一であることが好ましい。
電子機能性単位Pは、ポルフィリン、置換されたポルフィリン、フタロシアニン、置換されたフタロシアニン、又は他の四窒素含有マクロ環を含む群から選択することが好ましい。
電子機能性単位Pは、金属に配位でき、又は配位しなくてもよい。電子機能性単位は、金属に配位することが好ましい。この金属は亜鉛であるのが好ましい。
第2の態様により、本発明は、電子機能性単位架橋ポリマーであって、構造:
(式中、Pは電子機能性単位であり、Q及びQ’は本ポリマーのモノマー単位であり、L及びL’はQとPの間、及びPとQ’の間に直接又は間接の電子伝達をもたらすリンカーであり、式中、n=0、1、2又は3、且つm=0、1、2又は3である)を含む架橋ポリマーにある。
(式中、Pは電子機能性単位であり、Q及びQ’は本ポリマーのモノマー単位であり、L及びL’はQとPの間、及びPとQ’の間に直接又は間接の電子伝達をもたらすリンカーであり、式中、n=0、1、2又は3、且つm=0、1、2又は3である)を含む架橋ポリマーにある。
Q及びQ’、L及びL’、並びにPの優先度(preferments)は、Q及びQ’の分子の大きさを、重合可能な架橋したモノマー単位のモノマー単位がホモポリマーとして重合することを可能にする分子の大きさとする優先度を除いて、第1の態様における優先度と同じである。
第3の態様により、本発明は、重合可能なモノマー単位の架橋カルテットであって、構造:
(式中、Pは電子機能性単位であり、Q及びQ’は重合可能なモノマー単位であり、L及びL’はQとPの間、及びPとQ’の間に直接又は間接の電子伝達をもたらすリンカーであり、式中、n=0、1、2又は3、且つm=0、1、2又は3である)を有する架橋カルテットにある。
(式中、Pは電子機能性単位であり、Q及びQ’は重合可能なモノマー単位であり、L及びL’はQとPの間、及びPとQ’の間に直接又は間接の電子伝達をもたらすリンカーであり、式中、n=0、1、2又は3、且つm=0、1、2又は3である)を有する架橋カルテットにある。
Q及びQ’、L及びL’、並びにPの優先度は、第1の態様についての優先度と同じである。
第4の態様により、本発明は、電子機能性単位架橋ポリマーであって、構造:
(式中、Pは電子機能性単位であり、Q及びQ’はポリマーのモノマー単位であり、L及びL’はQとPの間、及びPとQ’の間に直接又は間接の電子伝達をもたらすリンカーであり、式中、n=0、1、2又は3、且つm=0、1、2又は3である)を含む架橋ポリマーにある。
(式中、Pは電子機能性単位であり、Q及びQ’はポリマーのモノマー単位であり、L及びL’はQとPの間、及びPとQ’の間に直接又は間接の電子伝達をもたらすリンカーであり、式中、n=0、1、2又は3、且つm=0、1、2又は3である)を含む架橋ポリマーにある。
Q及びQ’、L及びL’、並びにPの優先度は、Q及びQ’の分子の大きさを、重合可能な架橋したモノマー単位であるモノマー単位がホモポリマーとして重合することを可能にする分子の大きさとする優先度を除いて、第1の態様における優先度と同じである。
第5の態様により、本発明は、本発明の第2の態様による電子機能性単位架橋ポリマーであって、そのポリマーがQ及びQ’のモノマー単位と、少なくとも1種の他のモノマー単位とのコポリマーである架橋ポリマーにある。他のモノマー単位は置換された芳香族若しくはヘテロ芳香族環とすることが好ましい。他のモノマー単位は、ベンゼン、置換されたベンゼン、アニリン、置換されたアニリン、チオフェン、置換されたチオフェン、オリゴチオフェン、フラン、置換されたフラン、ピロール、及び置換されたピロールから構成される群から選択されることがより好ましい。
第6の態様により、本発明は、本発明の第4の態様による電子機能性単位架橋ポリマーであって、そのポリマーがQ及びQ’のモノマー単位と、少なくとも1種の他のモノマー単位とのコポリマーである架橋ポリマーにある。他のモノマー単位は置換された芳香族若しくはヘテロ芳香族環とすることが好ましい。他のモノマー単位は、ベンゼン、置換されたベンゼン、アニリン、置換されたアニリン、チオフェン、置換されたチオフェン、オリゴチオフェン、フラン、置換されたフラン、ピロール、及び置換されたピロールから構成される群から選択されることがより好ましい。
第7の態様により、本発明は、可溶化基をさらに含む前記の態様のいずれか一態様によるモノマー単位の架橋対、モノマー単位の架橋カルテット、ポリマー、又はコポリマーにある。好ましい可溶化基はSO3 −である。
第8の態様により、本発明は、電子機能材料であって、基材と、第2の態様による又は第4〜第7の態様のいずれか一態様による電子機能性単位架橋ポリマー又はコポリマーとを含む材料にある。この電子機能材料は、光起電性材料であることが好ましい。その基材は織物、ガラス、又は金属であることが好ましい。
第9の態様により、本発明は、第1の態様によるモノマー単位の架橋対を調製する方法であって、前記方法がチオフェンカルボアルデヒドをジピリルメタン化合物と反応させるステップを含む方法にある。
第10の態様により、本発明は、第2又は第4〜第7の態様のいずれか一態様によるポリマーを形成する方法であって、それぞれ第1又は第3の態様による重合可能なモノマー単位の架橋対又はカルテットのモノマー単位を重合させるステップを含む方法にある。この重合は酸化によって実施でき、それは化学的又は電気化学的とすることができる。この重合は、電解重合であることが好ましい。
第11の態様により、本発明は、電子機能材料を調製する方法であって、それぞれ第1又は第3の態様による重合可能なモノマー単位の架橋対又はカルテットに基材を接触させるステップと、そのモノマーをその後重合させるステップとを含む方法にある。
第12の態様により、本発明は、第11の態様により電子機能材料を調製する方法であって、重合可能なモノマー単位の架橋対又はカルテットに、ベンゼン、置換されたベンゼン、アニリン、置換されたアニリン、チオフェン、置換されたチオフェン、オリゴチオフェン、フラン、置換されたフラン、ピロール、及び置換されたピロールから構成される群から選択された少なくとも1種の他のモノマー単位を付加するステップをさらに含む方法にある。
第13の態様により、本発明は、光捕集する方法であって、第2又は第4〜第7の態様のいずれか一態様によるポリマー又はコポリマーを表面に塗布するステップと、得られた表面に光を当てるステップ又は前記表面を光に曝露するステップと、得られた電流を捕集するステップとを含む方法にある。
第14の態様により、本発明は、光捕集する方法であって、それぞれ第1又は第3の態様の重合可能なモノマー単位の架橋対又はカルテットを含む群から選択された1つ又は複数の成分を表面に塗布するステップと、場合によって他のモノマー、ポリマー、又はコポリマーの存在下で、このような単位をそのままで(in situ)重合させるステップと、得られた表面に光を当てるステップ又は前記表面を光に曝露するステップと、得られた電流を捕集するステップとを含む方法にある。適切な他のモノマー単位には、ベンゼン、置換されたベンゼン、アニリン、置換されたアニリン、チオフェン、置換されたチオフェン、オリゴチオフェン、フラン、置換されたフラン、ピロール、及び置換されたピロールが含まれる。
第15の態様により、本発明は、第2又は第4〜第7の態様のいずれか一態様によるポリマーを組み込んでいる光起電力装置にある。
本発明のさらなる実施形態も構想され、それにはエレクトロクロミズム、サーモクロミズム、光学活性、金属キレート化、分子識別、化学検知、高陽極酸化安定性、及び液晶効果を呈する成分の付加、並びに又その後の化学的誘導体化、例えば酵素又は他の生物学的因子の結合、に適した官能性の付加が含まれる。
文脈上明らかに他の方法を要しない限り、本説明及び特許請求範囲全体にわたり、語「含む(comprise)」、「含んでいる(comprising)」などは、排他的若しくは網羅的意味と対照される包括的意味として、すなわち「含んでいるが、限定されない(including,but not limited to)」の意味として解釈すべきである。
本発明に従って新規なポリマーの調製を可能にする有機合成手順及び重合プロトコルを開発してきている。ポリマー又はコポリマーは、直接的に、又は共役鎖若しくは芳香族基を経由するかいずれかによって、ポルフィリンにより架橋される。このような構造により、ポリマー又はコポリマーの中断性が著しく軽減されて、ポルフィリン部分と導電性ポリマー又はコポリマーとの間の相互作用が可能になる。これらのポルフィリン架橋ポリマーは、他のポルフィリン含有構造と比較して向上した光起電性及び電子移動性能を有し、且つ、ポルフィリン又は他のテトラピロール性マクロ環への結合が可能な化学薬品に対して敏感な導電性ポリマーをもたらす。
このポリマーが、選択された架橋した重合可能モノマー単位の重合によって調製したホモポリマー、又は本明細書において記述するコポリマーである場合、ポリマーを形成する能力を向上できる。理論に捉われようとすることなく、ポルフィリン部分の間隔によりポリマーの中断性が軽減されると考えられる。この間隔は、ホモポリマーを形成する場合適正な寸法のモノマー単位を選択することにより、又は適正なモノマー比率のコポリマーを形成することにより、達成できると考えられる。
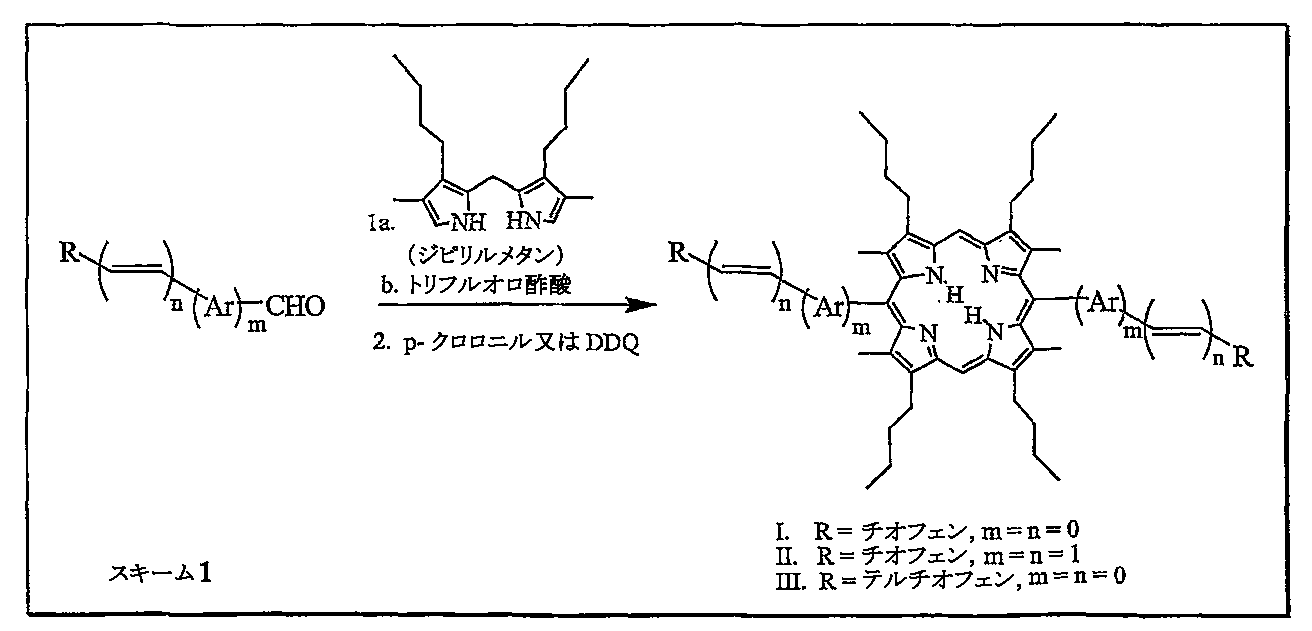
モノマーとしてチオフェン(X=S、R=H)又はテルチオフェン(X=S、R=チオフェン)を有する重合可能なモノマー単位の架橋した1対を、上記に示している。電気化学的又は化学的重合により上述のポルフィリン架橋ポリマーがもたらされる。このポリマーは、ポルフィリン部分の光を捕集する能力、及び導電性ポリマー「主鎖」に空孔を通す能力のために、良好な光起電力性能を示す。
スキーム1に例示する合成方法論を開発しており、それにより重合可能なモノマー単位である広く様々な架橋対の合成が可能になっている。具体的には、I〜IIIが合成されている。
テルチオフェン誘導体(III)を電気化学的に重合させて、そのCVが導電性ポリマーに見合うものである青色被膜を形成することができる。
これだけでなく、ポルフィリン架橋コポリマーの調製に使用する場合これらの材料は大いに興味がある。すなわち、(III)及びテルチオフェンを含有するコポリマー(元素分析を使用して確認した比率1:2)を生成させている。このポリマーは電子機能性であり、導電性ポリマーに期待されるUV−可視スペクトルを示す。このポルフィリンテルチオフェンの、他のチオフェンとの共重合だけでなく、ピロール及びその誘導体との共重合も可能である。
ポルフィリンチオフェン(I及びII)について同様の化学作用を起こすこともできる。したがって、電子機能性ポリマー及びコポリマーの調製においてこれらの材料は極めて価値がある。
ポルフィリン部分を使用する最大の利点の1つは、適正な金属原子を挿入することにより、ポルフィリンの電子状態を「調整」する能力である。したがって、銅及び亜鉛誘導体、(銅−III)及び(亜鉛−III)を調製しており、又上記に示した方法でテルチオフェンとのコポリマー架橋剤として作用することを示している。
重合反応に注入したエネルギーの、より正確なin situでの制御をもたらすので、電気化学的方法による重合が好ましい。ポリピロール及びポリアニリンについて、得られた材料の性状を操作し且つ改良するためこの方法を有利に使用することができることが実証されている。
スキーム1において概説した化学作用及び化合物を利用することにより、本発明に従って様々なポルフィリン誘導体を作製することができる。したがってチオフェンアルデヒドを伸張させることにより、より短いポルフィリン−チオフェン構造体(IV)を調製することができるように、伸張したポルフィリン−チオフェン構造体(II)として、重合可能なモノマー単位の架橋対を調製することができる。
この化学作用を用いて同様に、置換されたビチオフェン、テルチオフェン及びオリゴマーを作ることもできる。したがって、対応するアルデヒドからビチオフェン(V)及びテルチオフェン(VI)が容易に入手可能である。ピロール又はフラン誘導体(VIIa、b)、(VIIIa、b)及び(IX)を同様に調製することができる。
(II)などの生成物における芳香環を、フェロセンなどの様々な他の有用な誘導体で置き換えることができる。したがって、スキーム1に概説した手順を用いて、適正なテルチオフェン−フェロセンアルデヒドから、ビステルチオフェン−フェロセン−ポルフィリン(X)を容易に調製することができる。このことは、ポルフィリン部分に極めて接近して、架橋モノマー単位にレドックス活性官能性を導入する方法を提供する。
スキーム1におけるジピリルメタン反応物をピロールで置き換えるステップは、重合可能なモノマー単位の架橋したカルテットを作製する方法を提供する。テトラテルチオフェンポルフィリン(XI)がこうして容易に調製されており、電気化学的に重合されて、青色の導電性ポリマー被膜を生じることが示されている。
このアプローチを用いて、他の光活性な官能性を開発することができる。例えば、テルチオフェンメチルホスホネートのピリジンアルデヒド、ビピリジンアルデヒド、又はテルピリジンアルデヒドとの反応によりポリピリジン官能基化テルチオフェン(XII〜XIV)が得られる(Collis,G.E.、Burrell,A.K.、及びOfficer,D.L.、Tetrahedron Letters、2001、42、8733〜8735)。適切な金属配位子誘導体によるこれらの架橋モノマー単位の錯化は、(XV)などのビステルチオフェン金属錯体架橋モノマー単位をもたらす。これらの架橋モノマー単位は、ポルフィリンテルチオフェンに類似した光捕集性架橋導電性ポリマーを提供する可能性を有する。
本明細書における好ましい実施形態を、チオフェン系モノマー単位の架橋対又は架橋カルテットに関して記述しているが、すべてのこの化学作用は、ピロール及びフランなどの他のヘテロ芳香族誘導体に適用可能であることを当分野における技術者は理解するであろう。例えば、ヘテロ芳香族−ポルフィリンモノマー(XVI)は、チオフェン、ピロール、及びフランにより調製し、且つ重合させることができる。したがって、記述した方法論を用い(XVII)などのオリゴマーを得ることが可能である。
ポルフィリン基を電子伝達で結合した導電性ポリマーの多くの用途は、「可溶性」形態のポリマーを生成させることから利益を得る。そうすると、本発明のこのような材料は、塗料としての又はデバイス製作のための、その後の処理を受けやすくなる。電解流体力学的処理方法により、所望される場合コロイドでも又は真に可溶性のポリマーでも生成させることが可能になる。これらの処理方法は、本発明のポリマーのコロイド状の形態、ナノ粒子、又はナノ繊維を生成させるのに使用することができる。別法として、(XVIII)
などのモノマーによりコポリマーを形成することによって、又は溶解性を誘発するため対イオンとして高分子電解質を使用することによって、可溶性の形態の光活性ポリマーを調製することができる。
などのモノマーによりコポリマーを形成することによって、又は溶解性を誘発するため対イオンとして高分子電解質を使用することによって、可溶性の形態の光活性ポリマーを調製することができる。
本発明のポリマー又特にコポリマーの好ましい用途は、光起電性の材料、又特に織物を生産することにある。本発明のモノマー中に基材を浸漬し引き続いて酸化剤に曝すことにより、基材上への直接的な化学的重合が達成される。この方法は、布地、ガラス、又は他の構造材料を含む導電性若しくは非導電性基材のいずれにも適用可能である。
下記の図及び実施例を参照して、ここに好ましい実施形態を記述するであろう。
実施例において、1H核磁気共鳴(NMR)スペクトルは、Tecmag Libra拡張を有するJEOL社JMN−GX270 FT−NMR分光計を使用し270.19MHzで、又Bruker社400Avance実行X−WIN−NMRソフトウェアを使用し400.132MHzで得られた。化学シフトはTMSに対する、又はTMSが存在しない場合重水素化溶媒中の残留プロチウム(CDCl3、7.25ppm;ピリジン−d5、7.00、7.35、8.50ppm;DMSO−d6、2.50ppm;MeOD−d4、3.35ppm)に対するものである。13C NMR化学シフトは、CDCl3(77.0ppm)、ピリジン−d5(123.4、135.3、149.8ppm)、MeOD−d4(49.0ppm)に対するものである。電子吸収スペクトルは、Shimadzu社UV−3101PC UV−可視−NIR走査分光光度計を使用して得られた。質量スペクトルは、Varian社VG70−250S二重焦点磁場型質量分析計を使用して記録した。高速原子衝撃(FAB)高分解度質量スペクトル(HRMS)により分析した試料は、p−ニトロベンジルアルコールマトリックス中に支持し、又VG−OPUSソフトウェアを通したデータは、誤差±5ppmで分子イオン配合を示した。主要なフラグメンテーションは、基準ピーク強度に対する百分率として示される。シリカ(0.032〜0.063mm、Merck社Kieselgel 60)を使用してクロマトグラフィを実施した。前被覆シリカプレート(Merck社Kieselgel 60F254)を使用して薄層クロマトグラフィを実施した。
実施例において使用したクロマトグラフィ溶媒は、実験室グレードであった。逆浸透により水を精製した。使用したすべての他の溶媒は、他に指定しない限りARグレードであった。ヨウ素はM&B社を供給源とし、純度>99.8%まで再昇華させた。Na2S2O3・5H2OはBDH社を供給源とし、GPグレードであった。3−チオフェンカルボキシアルデヒド(98%)はAldrich社を供給源としていた。3’−ホルミル−2,2’:5’,2”−テルチオフェンは、Massey大学で開発した手順(Collis,G.E.、Burrell,A.K.、及びOfficer,D.L.、Tetrahedron Letters、2001、42、8733〜8735)により調製した。ジピリルメタンは、報告された手順(Sessler,J.L.、Johnson,M.R.、Creager,S.E.、Fettinger,J.C.、及びIbers,J.A.、Journal of the American Chemical Society、1990、112、9310〜9329)により調製した。
反応は、不活性雰囲気下で実施し、且つ周囲光から遮断した。
(実施例1)
5,15−ビス(3’−チエニル)−2,8,12,18−テトラ−n−ブチル−3,7,13,17−テトラメチルポルフィン(I)の合成
室温において3−ホルミルチオフェン(30.6mL、0.349ミリモル)及びジピリルメタン(100mg、0.349ミリモル)を脱気した無水CH2Cl2(35mL)中に溶解した。次いで、TFA(26.9mL、0.349ミリモル、1.0当量)を添加し、この溶液をN2下で攪拌した。TLCによるベースライン材料の最初の兆候において(≒15分;シリカゲル、CH2Cl2)、DBU(52.2mL、0.349ミリモル、1.0当量)の添加により反応を止めた。次いで、p−クロラニル(214mg、0.873ミリモル、2.5当量)を添加し、この溶液を室温で4時間攪拌した。次にEt3N(36mL、0.258ミリモル)を添加し、反応液を激しく1.5時間攪拌した。次いで過剰のEt3N(0.723mL、5.190ミリモル)を添加し、反応液を15分攪拌した(p−クロラニルによりメタノール中に可溶である錯体を形成させる)。メタノールによる溶液から生成物を沈殿させ、ろ過し、且つ高真空下で乾燥して、紫色結晶性固体として生成物(I)(69.3mg、53%)をもたらした。
5,15−ビス(3’−チエニル)−2,8,12,18−テトラ−n−ブチル−3,7,13,17−テトラメチルポルフィン(I)の合成
室温において3−ホルミルチオフェン(30.6mL、0.349ミリモル)及びジピリルメタン(100mg、0.349ミリモル)を脱気した無水CH2Cl2(35mL)中に溶解した。次いで、TFA(26.9mL、0.349ミリモル、1.0当量)を添加し、この溶液をN2下で攪拌した。TLCによるベースライン材料の最初の兆候において(≒15分;シリカゲル、CH2Cl2)、DBU(52.2mL、0.349ミリモル、1.0当量)の添加により反応を止めた。次いで、p−クロラニル(214mg、0.873ミリモル、2.5当量)を添加し、この溶液を室温で4時間攪拌した。次にEt3N(36mL、0.258ミリモル)を添加し、反応液を激しく1.5時間攪拌した。次いで過剰のEt3N(0.723mL、5.190ミリモル)を添加し、反応液を15分攪拌した(p−クロラニルによりメタノール中に可溶である錯体を形成させる)。メタノールによる溶液から生成物を沈殿させ、ろ過し、且つ高真空下で乾燥して、紫色結晶性固体として生成物(I)(69.3mg、53%)をもたらした。
(実施例2)
5,15−ビス([2’,2”:5”,2””−テルチオフェン]−3”−イル)−2,8,12,18−テトラ−n−ブチル−3,7,13,17−テトラメチルポルフィン(III)の合成
RTにおいて3’−ホルミル−2,2’:5’,2”−テルチオフェン(96.5mg、349マイクロモル)及びジピリルメタン(100mg、349マイクロモル)を脱気した乾燥CH2Cl2(35mL)中に溶解した。TFA(26.9μL、349マイクロモル、1.0当量)を添加し、この溶液をN2下で攪拌した。TLCによるベースライン材料の最初の兆候において(≒15分;シリカゲル、CH2Cl2)、DBU(52.2μL、349マイクロモル、1.0当量)の添加により反応を止めた。次いで、p−クロラニル(214.5mg、873マイクロモル、2.5当量)を添加し、この溶液をRTで4時間攪拌した。次にEt3N(36μL、258マイクロモル)を添加し、反応液を激しく1時間攪拌した。過剰のEt3N(723μL、5.190ミリモル)を添加し、反応液を15分攪拌した。次いでMeOHによる溶液から生成物を沈殿させ、褐紫色固体として生成物(III)(76.9mg、41%)をもたらした。
5,15−ビス([2’,2”:5”,2””−テルチオフェン]−3”−イル)−2,8,12,18−テトラ−n−ブチル−3,7,13,17−テトラメチルポルフィン(III)の合成
RTにおいて3’−ホルミル−2,2’:5’,2”−テルチオフェン(96.5mg、349マイクロモル)及びジピリルメタン(100mg、349マイクロモル)を脱気した乾燥CH2Cl2(35mL)中に溶解した。TFA(26.9μL、349マイクロモル、1.0当量)を添加し、この溶液をN2下で攪拌した。TLCによるベースライン材料の最初の兆候において(≒15分;シリカゲル、CH2Cl2)、DBU(52.2μL、349マイクロモル、1.0当量)の添加により反応を止めた。次いで、p−クロラニル(214.5mg、873マイクロモル、2.5当量)を添加し、この溶液をRTで4時間攪拌した。次にEt3N(36μL、258マイクロモル)を添加し、反応液を激しく1時間攪拌した。過剰のEt3N(723μL、5.190ミリモル)を添加し、反応液を15分攪拌した。次いでMeOHによる溶液から生成物を沈殿させ、褐紫色固体として生成物(III)(76.9mg、41%)をもたらした。
(実施例3)
5,15−ビス([2’,2”:5”,2””−テルチオフェン]−3”−イル)−2,8,12,18−テトラ−n−ブチル−3,7,13,17−テトラメチルポルフィリナト亜鉛(II)(Zn−III)の合成
RTにおいて攪拌しながらMeOH(1.0mL)中のZn(OAc)2・2H2O(42.9mg、196マイクロモル、1.2当量)の溶液を、CHCl3(18mL)中のビステルチエニルポルフィリン(II)(177mg、163マイクロモル)の溶液に添加した。30分後に、TLC(Rf=0.25、シリカ、CH2Cl2:ヘキサン(1:2))によって、反応が完結したことを判断した。MeOHにより粗生成物を沈殿させ、得られた固体をCH2Cl2/MeOHから再結晶させ、れんが赤色粉末として(Zn−III)(189mg、100%)をもたらした。
5,15−ビス([2’,2”:5”,2””−テルチオフェン]−3”−イル)−2,8,12,18−テトラ−n−ブチル−3,7,13,17−テトラメチルポルフィリナト亜鉛(II)(Zn−III)の合成
RTにおいて攪拌しながらMeOH(1.0mL)中のZn(OAc)2・2H2O(42.9mg、196マイクロモル、1.2当量)の溶液を、CHCl3(18mL)中のビステルチエニルポルフィリン(II)(177mg、163マイクロモル)の溶液に添加した。30分後に、TLC(Rf=0.25、シリカ、CH2Cl2:ヘキサン(1:2))によって、反応が完結したことを判断した。MeOHにより粗生成物を沈殿させ、得られた固体をCH2Cl2/MeOHから再結晶させ、れんが赤色粉末として(Zn−III)(189mg、100%)をもたらした。
(実施例4)
5,15−ビス([2’,2”:5”,2””−テルチオフェン]−3”−イル)−2,8,12,18−テトラ−n−ブチル−3,7,13,17−テトラメチルポルフィリナト銅(II)(Cu−III)の合成
N2雰囲気下で攪拌しながらMeOH(10.0mL)中のCu(OAc)2・H2O(111mg、508マイクロモル、1.2当量)の溶液を、CHCl3(50mL)中の遊離塩基(III)(500mg、461マイクロモル)の還流溶液に添加した。15時間後、TLC分析によりすべての(III)が金属化したことが示された。真空中で溶媒を除去し、残渣をカラムクロマトグラフ(シリカ、37mm直径×90mm、CH2Cl2:ヘキサン(1:2))に掛け、主要な赤色着色帯のものを集めた。CH2Cl2:MeOHから再結晶させ、紫色固体として(Cu−III)(437.5mg、83%)をもたらした。UV−可視(CH2Cl2):λmax[nm](ε×10−3)414(379)、536(22.0)、574(20.3)。FAB−LRMS:m/z(帰属%)1142〜1149においてクラスタ、1143(90、M+)。HRMS:M+(C64H64N4CuS6)の計算値:1143.2751、実測:1143.2753。
5,15−ビス([2’,2”:5”,2””−テルチオフェン]−3”−イル)−2,8,12,18−テトラ−n−ブチル−3,7,13,17−テトラメチルポルフィリナト銅(II)(Cu−III)の合成
N2雰囲気下で攪拌しながらMeOH(10.0mL)中のCu(OAc)2・H2O(111mg、508マイクロモル、1.2当量)の溶液を、CHCl3(50mL)中の遊離塩基(III)(500mg、461マイクロモル)の還流溶液に添加した。15時間後、TLC分析によりすべての(III)が金属化したことが示された。真空中で溶媒を除去し、残渣をカラムクロマトグラフ(シリカ、37mm直径×90mm、CH2Cl2:ヘキサン(1:2))に掛け、主要な赤色着色帯のものを集めた。CH2Cl2:MeOHから再結晶させ、紫色固体として(Cu−III)(437.5mg、83%)をもたらした。UV−可視(CH2Cl2):λmax[nm](ε×10−3)414(379)、536(22.0)、574(20.3)。FAB−LRMS:m/z(帰属%)1142〜1149においてクラスタ、1143(90、M+)。HRMS:M+(C64H64N4CuS6)の計算値:1143.2751、実測:1143.2753。
(実施例5)
5,10,15,20−テトラキス([2’,2”:5”,2””−テルチオフェン]3”−イル)ポルフィン(XI)の合成
室温においてN2下で3’−ホルミル−2,2’:5’,2”−テルチオフェン(158mg、0.572ミリモル)及びピロール(39.65μL、0.572ミリモル)を脱気した無水CH2Cl2(57mL)中に溶解した。BF3・OEt2(7.0μL、57マイクロモル、0.1当量)を添加し、この溶液を暗所で2時間攪拌した。p−クロラニル(105mg、0.429ミリモル、0.75当量)を添加し、この溶液を還流温度で2時間攪拌した。次に過剰のEt3Nを添加し、減圧下で溶媒を除去した。残渣をカラムクロマトグラフ(80mm×37mm直径、CH2Cl2:ヘキサン(1:1))に掛け、最初の主なポルフィリン着色帯(Rf=0.15、CH2Cl2:ヘキサン(1:1))のものを集めた。次いで、MeOHによるCH2Cl2の溶液から生成物を析出させ、次いでろ過し、且つ高真空下で乾燥して、1H NMRによると4つの異性体の分離不可能な混合物を含有する紫色粉末として生成物(XI)(62.4mg、34%)をもたらした。
5,10,15,20−テトラキス([2’,2”:5”,2””−テルチオフェン]3”−イル)ポルフィン(XI)の合成
室温においてN2下で3’−ホルミル−2,2’:5’,2”−テルチオフェン(158mg、0.572ミリモル)及びピロール(39.65μL、0.572ミリモル)を脱気した無水CH2Cl2(57mL)中に溶解した。BF3・OEt2(7.0μL、57マイクロモル、0.1当量)を添加し、この溶液を暗所で2時間攪拌した。p−クロラニル(105mg、0.429ミリモル、0.75当量)を添加し、この溶液を還流温度で2時間攪拌した。次に過剰のEt3Nを添加し、減圧下で溶媒を除去した。残渣をカラムクロマトグラフ(80mm×37mm直径、CH2Cl2:ヘキサン(1:1))に掛け、最初の主なポルフィリン着色帯(Rf=0.15、CH2Cl2:ヘキサン(1:1))のものを集めた。次いで、MeOHによるCH2Cl2の溶液から生成物を析出させ、次いでろ過し、且つ高真空下で乾燥して、1H NMRによると4つの異性体の分離不可能な混合物を含有する紫色粉末として生成物(XI)(62.4mg、34%)をもたらした。
(実施例6)
テルチオフェンによるIIIの電解共重合
好ましい重合可能なテルチオフェンモノマー単位の架橋対、すなわち実施例2において調製したIII、のサイクリックボルタンメトリ及び電解共重合を、例としてのみここに記述する。0.1M過塩素酸テトラブチルアンモニウム支持電解質を含有するジクロロメタン中のサイクリックボルタンメトリにより、Ag/Ag+に対し約0.70Vでコモノマー酸化が開始されることが判明した。
テルチオフェンによるIIIの電解共重合
好ましい重合可能なテルチオフェンモノマー単位の架橋対、すなわち実施例2において調製したIII、のサイクリックボルタンメトリ及び電解共重合を、例としてのみここに記述する。0.1M過塩素酸テトラブチルアンモニウム支持電解質を含有するジクロロメタン中のサイクリックボルタンメトリにより、Ag/Ag+に対し約0.70Vでコモノマー酸化が開始されることが判明した。
サイクリックボルタンモグラムにおける交差の存在により証明されるように、この酸化過程はPt裸表面を幾分修飾する。これはオリゴマー又はポリマー生成物の堆積によるものである。
Pt作用電極を使用して電流密度0.5mA/cm2を適用している間、クロノポテンシオグラムを記録した。Pt上に≒0.80Vの定常状態電位が発生した。重合時間の間この電位が上昇しなかったという事実は、導電性ポリマーが堆積したことを示す。
一定の電位0.90Vを印加している間Pt作用電極を使用して、クロノアンペログラムをも記録した。最初の立上げ後、電極上に導電性ポリマー生成物が堆積されるにつれ、電流が定常的に増加した。
IIIとテルチオフェンとの等モル混合物溶液から電着されたコポリマーの元素分析は、その組成がIII:テルチオフェン:過塩素酸塩対イオンについて1:2:4であることを示した。
白色光源としてハロゲンランプを使用し、通常は光電気化学セルに500W/m2の強度をふり向けた。線形掃引ボルタンメトリを用いることにより、暗所における又は明所における光電気化学セルから電流−電圧(I−V)曲線が得られた。次いでI−V曲線を使用して開路電圧(Voc)、短絡電流(Isc)、フィルファクタ、及びエネルギー変換効率(ECE)を測定した。いくつかの結果を表1に示している。
(実施例8)
光電気化学セル
ポリ(III−co−TTh)の高められた光起電力性能をさらに研究した。
光電気化学セル
ポリ(III−co−TTh)の高められた光起電力性能をさらに研究した。
ポルフィリン架橋コポリマーであるポリ(III−co−TTh)を調製し且つ光電気化学セルに組み込んで、光起電力応答について試験した。
ポルフィリン空洞中に亜鉛を配位する効果をも研究した。
試薬及び材料
実施例2において記述するようにトランス−5,15−ビス([2,2’;5’,2”−テルチオフェン]−3’イル)−2,8,12,18−テトラ−n−ブチル−3,7,13,17−テトラメチルポルフィリン(III)を合成した。2,2’;5’,2”−テルチオフェン(TTh)(Aldrich社)、過塩素酸テトラブチルアンモニウム(TBAP、Fluka社)、ヨウ素(Univar、Ajax、Aldrich社、99.8%)、メタノール(Univar、Ajax社)、アセトニトリル(ACN、Univar、Ajax社)、ジクロロメタン(DCM、Univar、Ajax社)、イソプロパノール(Univar、Ajax社)、ヨウ化テトラプロピルアンモニウム(Aldrich社、>=98%)、エチレンカーボネート(Aldrich社、99%)、酢酸亜鉛(Fluka社)、プロピレンカーボネート(Aldrich社、99%)。ITO被覆ガラス(=<10Ωsq−1)は、Delta Technologies Limited社(米国)から購入し、所要の大きさに切断し、液体洗剤で洗浄し、ミリQ水で続いてイソプロパノールで完全にすすぎ、且つ乾燥させた。ポリマーで被覆する前に、UVO洗浄機(Model No.42−220、Jelight Co.Inc.社、米国)内でITO被覆ガラスを処理した。エチレンカーボネート/プロピレンカーボネート(1:1重量)中に、I2(60mM)及びヨウ化テトラプロピルアンモニウム(500mM)を溶解することにより液体電解質を調製した。Dynavac社MagnetronスパッタコータModel SC100MSを使用してITO被覆ガラス上に白金の薄層をスパッタ被覆した。電流50mA及びAr圧力2×10−3ミリバールでスパッタを実施した。Pt厚さ10Åをスパッタ被覆した。これらの試料は、ポリマー被覆したITO被覆ガラスに対する対向電極として使用した。
実施例2において記述するようにトランス−5,15−ビス([2,2’;5’,2”−テルチオフェン]−3’イル)−2,8,12,18−テトラ−n−ブチル−3,7,13,17−テトラメチルポルフィリン(III)を合成した。2,2’;5’,2”−テルチオフェン(TTh)(Aldrich社)、過塩素酸テトラブチルアンモニウム(TBAP、Fluka社)、ヨウ素(Univar、Ajax、Aldrich社、99.8%)、メタノール(Univar、Ajax社)、アセトニトリル(ACN、Univar、Ajax社)、ジクロロメタン(DCM、Univar、Ajax社)、イソプロパノール(Univar、Ajax社)、ヨウ化テトラプロピルアンモニウム(Aldrich社、>=98%)、エチレンカーボネート(Aldrich社、99%)、酢酸亜鉛(Fluka社)、プロピレンカーボネート(Aldrich社、99%)。ITO被覆ガラス(=<10Ωsq−1)は、Delta Technologies Limited社(米国)から購入し、所要の大きさに切断し、液体洗剤で洗浄し、ミリQ水で続いてイソプロパノールで完全にすすぎ、且つ乾燥させた。ポリマーで被覆する前に、UVO洗浄機(Model No.42−220、Jelight Co.Inc.社、米国)内でITO被覆ガラスを処理した。エチレンカーボネート/プロピレンカーボネート(1:1重量)中に、I2(60mM)及びヨウ化テトラプロピルアンモニウム(500mM)を溶解することにより液体電解質を調製した。Dynavac社MagnetronスパッタコータModel SC100MSを使用してITO被覆ガラス上に白金の薄層をスパッタ被覆した。電流50mA及びAr圧力2×10−3ミリバールでスパッタを実施した。Pt厚さ10Åをスパッタ被覆した。これらの試料は、ポリマー被覆したITO被覆ガラスに対する対向電極として使用した。
設備及び方法
EG&G社PAR363ポテンシオスタット/ガルバノスタット、Bioanalytical Systems社CV27ボルタンモグラフ、Chart v3.5.7/EChem v1.3.2によるMacLab400ソフトウェア(ADInstruments社)及びMacintosh社コンピュータから構成される電気化学ハードウェア系を使用してコポリマーの電解合成及び試験を達成した。作用電極(白金円板、又はITO被覆ガラス、又はそれらの上にポリマー被覆を有するこれらの基材)、白金網補助電極、及び塩橋を有するAg/Ag+比較電極から構成される三電極型電気化学セルを使用した。コポリマー試料は、元素分析(The Campbell Microanalytical Laboratory、Otago大学、ニュージーランド)にも掛けた。Shimadzu社UV1601分光光度計を使用し、又300〜1100nmの範囲にわたり走査して、コポリマー(酸化及び還元状態)のUV−可視スペクトルが得られた。Leica−stereo SS440顕微鏡を使用して、コポリマー被膜(溶液側)について走査電子顕微鏡観察(SEM)試験を行った。HP34401Aマルチメータ及び定電流電源系(EG&G社PAR363ポテンシオスタット/ガルバノスタット)に接続した4点プローブを使用して導電率測定を行った。新たに調製した被膜(デジタル測微計(Mitutoyo社、日本)を用い、厚さ7〜33μm)を使用し、電気化学的に調製したポリマーを試験した。電流−電圧(I−V)曲線を得るために、ハロゲンランプ(Wiko Ltd社からのSoLux MR−16)と、Macintosh社コンピュータ/Chart v3.5.7/EChem v1.3.2によるMacLab400ソフトウェア(ADInstruments社)/CV27ボルタンモグラフ(Bioanalytical Systems社)から構成される設備とを使用して、光起電力装置試験を行った。500Wm−2の光強度を使用した。
EG&G社PAR363ポテンシオスタット/ガルバノスタット、Bioanalytical Systems社CV27ボルタンモグラフ、Chart v3.5.7/EChem v1.3.2によるMacLab400ソフトウェア(ADInstruments社)及びMacintosh社コンピュータから構成される電気化学ハードウェア系を使用してコポリマーの電解合成及び試験を達成した。作用電極(白金円板、又はITO被覆ガラス、又はそれらの上にポリマー被覆を有するこれらの基材)、白金網補助電極、及び塩橋を有するAg/Ag+比較電極から構成される三電極型電気化学セルを使用した。コポリマー試料は、元素分析(The Campbell Microanalytical Laboratory、Otago大学、ニュージーランド)にも掛けた。Shimadzu社UV1601分光光度計を使用し、又300〜1100nmの範囲にわたり走査して、コポリマー(酸化及び還元状態)のUV−可視スペクトルが得られた。Leica−stereo SS440顕微鏡を使用して、コポリマー被膜(溶液側)について走査電子顕微鏡観察(SEM)試験を行った。HP34401Aマルチメータ及び定電流電源系(EG&G社PAR363ポテンシオスタット/ガルバノスタット)に接続した4点プローブを使用して導電率測定を行った。新たに調製した被膜(デジタル測微計(Mitutoyo社、日本)を用い、厚さ7〜33μm)を使用し、電気化学的に調製したポリマーを試験した。電流−電圧(I−V)曲線を得るために、ハロゲンランプ(Wiko Ltd社からのSoLux MR−16)と、Macintosh社コンピュータ/Chart v3.5.7/EChem v1.3.2によるMacLab400ソフトウェア(ADInstruments社)/CV27ボルタンモグラフ(Bioanalytical Systems社)から構成される設備とを使用して、光起電力装置試験を行った。500Wm−2の光強度を使用した。
光起電力装置の製作及び試験
ITO被覆ガラス上にコポリマーを電着させ、アセトニトリルですすぎ、次いで乾燥させた。一般に、ポリマー又はコポリマー被膜は、ポリマーの化学ポテンシャルの低下により高い開路電圧(Voc)を得るために[2]、光起電力装置として組み立てる前に、0.1M TBAP/DCM中で−0.8Vにおいて完全に電解還元した。コポリマーで被覆したITO被覆ガラス電極と、PtスパッタしたITO被覆ガラス電極との間に液体電解質をサンドイッチ状にはさむことにより、装置を組み立てた。このことは、これら2つの電極間のスペーサとしてパラフィルムの縁取りをすることにより行った。線形掃引ボルタンメトリ(LSV)によって光起電力装置を試験した。電流がゼロである場合開路電圧(Voc)をもたらし、又電圧がゼロである場合短絡電流(Isc)をもたらす。
ITO被覆ガラス上にコポリマーを電着させ、アセトニトリルですすぎ、次いで乾燥させた。一般に、ポリマー又はコポリマー被膜は、ポリマーの化学ポテンシャルの低下により高い開路電圧(Voc)を得るために[2]、光起電力装置として組み立てる前に、0.1M TBAP/DCM中で−0.8Vにおいて完全に電解還元した。コポリマーで被覆したITO被覆ガラス電極と、PtスパッタしたITO被覆ガラス電極との間に液体電解質をサンドイッチ状にはさむことにより、装置を組み立てた。このことは、これら2つの電極間のスペーサとしてパラフィルムの縁取りをすることにより行った。線形掃引ボルタンメトリ(LSV)によって光起電力装置を試験した。電流がゼロである場合開路電圧(Voc)をもたらし、又電圧がゼロである場合短絡電流(Isc)をもたらす。
結果
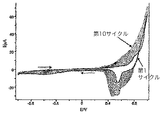
ポリ(III−co−TTh)
最初に、ポルフィリン架橋ビステルチオフェンであるIIIの電解活性を検討した(図1(a))。テルチオフェン単独のCV(図1(b))、及びIIIの類似体であるジフェニルポルフィリンのCV(図1(c))と比較すると、IIIは、ポルフィリン部分により2つのレドックス過程(ピークA/B及びC/D)を経ることが見出された。図1(a)におけるピークCの陽極性電位で、テルチオフェン部分の電解酸化が明らかになる。他の還元ピーク(図1(a)においてEと表示される)は、溶液中に溶解したO2の還元によるものであった。陽極性の上方限界を1.2から2.0Vまで変化させたが、これらの条件はどれも導電性、電解活性ポリマー被膜の形成をもたらさなかった。さらに、ガルバノスタット方法又はポテンシオスタット方法のいずれを使用しても白金電極上にホモポリマー被膜を得ることができなかった。これらの条件下でIIIがホモポリマーを形成することが可能ではないことはおそらく、分子サイズが大きいとすれば、立体障害によるものである。このため、IIIをテルチオフェン(TTh)と共重合させることを考慮した。
ポリ(III−co−TTh)
最初に、ポルフィリン架橋ビステルチオフェンであるIIIの電解活性を検討した(図1(a))。テルチオフェン単独のCV(図1(b))、及びIIIの類似体であるジフェニルポルフィリンのCV(図1(c))と比較すると、IIIは、ポルフィリン部分により2つのレドックス過程(ピークA/B及びC/D)を経ることが見出された。図1(a)におけるピークCの陽極性電位で、テルチオフェン部分の電解酸化が明らかになる。他の還元ピーク(図1(a)においてEと表示される)は、溶液中に溶解したO2の還元によるものであった。陽極性の上方限界を1.2から2.0Vまで変化させたが、これらの条件はどれも導電性、電解活性ポリマー被膜の形成をもたらさなかった。さらに、ガルバノスタット方法又はポテンシオスタット方法のいずれを使用しても白金電極上にホモポリマー被膜を得ることができなかった。これらの条件下でIIIがホモポリマーを形成することが可能ではないことはおそらく、分子サイズが大きいとすれば、立体障害によるものである。このため、IIIをテルチオフェン(TTh)と共重合させることを考慮した。
モノマーIIIとのテルチオフェンの電気化学的共重合
定電位若しくは定電流いずれかのサイクリックボルタンメトリ(CV)を使用して、白金電極上にTThとのIIIのコポリマーを首尾よく電着することができることを見出した。このコポリマーのポテンシオダイナミックな成長は、III(5mM)/テルチオフェン(5mM)/TBAP(0.1M)/DCMを含有するコモノマー溶液から−1.0〜+1.0Vの電位範囲にわたって100mVs−1で行われた。成長の間に得られたサイクリックボルタンモグラム(図2)は、サイクル回数の増加による予想されたレドックス電流の増加を示し、導電性電解活性ポリマーの成長を示した。IIIとTThの等モル混合物を含有するモノマー溶液からのコポリマーの成長を、元素分析(ポルフィリン部分からのN2.52%、テルチオフェン部分からのS16.48%、及びCl6.30%)により確認した。この結果は、このポリマー材料がIII単位1:テルチオフェン単位2:過塩素酸塩対アニオン4の比率を有することを示唆している。この高い負荷量は、3チオフェン単位毎に1過塩素酸塩対アニオンを有するコポリマー形成を示すものである。その他の記述として、このコポリマーはポリ(III−co−TTh)と呼ぶ。図2における第1サイクルに基づいて、ポリ(III−co−TTh)のポテンシオスタット成長のため選択した電位は+0.90Vであった。導電性ポリマー成長に典型的であるクロノアンペログラムが得られ;最初の立上りの後、コポリマーが成長を続けるにつれて電流が定常的に増加し、表面積の増加をもたらした。一定電流密度0.5mAcm−2でポリ(III−co−TTh)のガルバノスタット成長が行われた。得られたクロノポテンシオグラムは最初の立上り、次いで導電性電解活性ポリマーの成長について予想された電位の低下を示した。10分後、成長中に得られた電位は+0.80Vであった。
定電位若しくは定電流いずれかのサイクリックボルタンメトリ(CV)を使用して、白金電極上にTThとのIIIのコポリマーを首尾よく電着することができることを見出した。このコポリマーのポテンシオダイナミックな成長は、III(5mM)/テルチオフェン(5mM)/TBAP(0.1M)/DCMを含有するコモノマー溶液から−1.0〜+1.0Vの電位範囲にわたって100mVs−1で行われた。成長の間に得られたサイクリックボルタンモグラム(図2)は、サイクル回数の増加による予想されたレドックス電流の増加を示し、導電性電解活性ポリマーの成長を示した。IIIとTThの等モル混合物を含有するモノマー溶液からのコポリマーの成長を、元素分析(ポルフィリン部分からのN2.52%、テルチオフェン部分からのS16.48%、及びCl6.30%)により確認した。この結果は、このポリマー材料がIII単位1:テルチオフェン単位2:過塩素酸塩対アニオン4の比率を有することを示唆している。この高い負荷量は、3チオフェン単位毎に1過塩素酸塩対アニオンを有するコポリマー形成を示すものである。その他の記述として、このコポリマーはポリ(III−co−TTh)と呼ぶ。図2における第1サイクルに基づいて、ポリ(III−co−TTh)のポテンシオスタット成長のため選択した電位は+0.90Vであった。導電性ポリマー成長に典型的であるクロノアンペログラムが得られ;最初の立上りの後、コポリマーが成長を続けるにつれて電流が定常的に増加し、表面積の増加をもたらした。一定電流密度0.5mAcm−2でポリ(III−co−TTh)のガルバノスタット成長が行われた。得られたクロノポテンシオグラムは最初の立上り、次いで導電性電解活性ポリマーの成長について予想された電位の低下を示した。10分後、成長中に得られた電位は+0.80Vであった。
ポリ(III−co−TTh)の重合後サイクリックボルタンメトリ
コポリマー成長後、サイクリックボルタンメトリを使用して1.0M NaNO3/H2O溶液中における、又0.1M TBAP/ACN溶液中におけるポリ(III−co−TTh)修飾白金電極について検討した。しかし、0.1M TBAP/ACN中に非常に安定なレドックス対(図3においてA/Bと表示される)が観察されたが、1M NaNO3支持電解質を含有する水溶液中にはポリマー主鎖ピークは観察されなかった。このことは、一般にポリピロールよりもポリチオフェンが疎水性であり、したがって水性媒質では電気化学的スイッチングがあまり効率的ではない[3]事実による。観察されたレドックス対(A/Bと表示される)は、コポリマー主鎖の酸化/還元に帰されるものである。このサイクルボルタンモグラムは、Cutlerらにより得られた他の置換されたポリ(テルチオフェン)被膜のCVにおいて非定形的ではないものである[25、32]。
コポリマー成長後、サイクリックボルタンメトリを使用して1.0M NaNO3/H2O溶液中における、又0.1M TBAP/ACN溶液中におけるポリ(III−co−TTh)修飾白金電極について検討した。しかし、0.1M TBAP/ACN中に非常に安定なレドックス対(図3においてA/Bと表示される)が観察されたが、1M NaNO3支持電解質を含有する水溶液中にはポリマー主鎖ピークは観察されなかった。このことは、一般にポリピロールよりもポリチオフェンが疎水性であり、したがって水性媒質では電気化学的スイッチングがあまり効率的ではない[3]事実による。観察されたレドックス対(A/Bと表示される)は、コポリマー主鎖の酸化/還元に帰されるものである。このサイクルボルタンモグラムは、Cutlerらにより得られた他の置換されたポリ(テルチオフェン)被膜のCVにおいて非定形的ではないものである[25、32]。
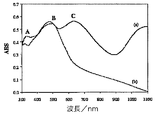
ポリ(III−co−TTh)のUV−可視分光法、導電率、及び走査電子顕微鏡法
ポリ(III−co−TTh)被膜(ITO被覆ガラス上に電着された)のUV−可視スペクトルを記録した(図4)。酸化された状態で、ポリ(III−co−TTh)のスペクトル(図4(a))は、導電性状態にあるポリチオフェンについて予想される330nmにおける鋭いピーク(A)、505nm(B)及び650nm(C)における2つのブロードピーク、及び890nmからより長い波長に伸びる自由キャリヤテールを示す。その還元状態のスペクトル(図4(b))は、650nmにおけるピークCも、自由キャリヤテールも失われていることを示す。これは導電率の低下と一致している。ポリ(テルチオフェン)[5]と比較するとポリ(III−co−TTh)は、酸化状態及び還元状態両方について505nmにおいて安定な吸収ピーク(B)を示し、このピークはポリ(テルチオフェン)のスペクトルには存在せず、ポルフィリン部分の吸収に帰属させることができる[34]。ポリ(III−co−TTh)の導電率が0.24Scm−1であることを測定した。又ポリ(III−co−TTh)の溶液側の走査電子顕微鏡写真(図5)は、開放気孔性の形態を示しており、このことは、大きな表面積によって光電気化学セルから得ることが可能な電流が増加されるはずである点で、光起電力装置に有利であろう。
ポリ(III−co−TTh)被膜(ITO被覆ガラス上に電着された)のUV−可視スペクトルを記録した(図4)。酸化された状態で、ポリ(III−co−TTh)のスペクトル(図4(a))は、導電性状態にあるポリチオフェンについて予想される330nmにおける鋭いピーク(A)、505nm(B)及び650nm(C)における2つのブロードピーク、及び890nmからより長い波長に伸びる自由キャリヤテールを示す。その還元状態のスペクトル(図4(b))は、650nmにおけるピークCも、自由キャリヤテールも失われていることを示す。これは導電率の低下と一致している。ポリ(テルチオフェン)[5]と比較するとポリ(III−co−TTh)は、酸化状態及び還元状態両方について505nmにおいて安定な吸収ピーク(B)を示し、このピークはポリ(テルチオフェン)のスペクトルには存在せず、ポルフィリン部分の吸収に帰属させることができる[34]。ポリ(III−co−TTh)の導電率が0.24Scm−1であることを測定した。又ポリ(III−co−TTh)の溶液側の走査電子顕微鏡写真(図5)は、開放気孔性の形態を示しており、このことは、大きな表面積によって光電気化学セルから得ることが可能な電流が増加されるはずである点で、光起電力装置に有利であろう。
ポリ(III−co−TTh)を組み込んだ装置の光起電力試験
光電気化学セル
光電気化学セルとして製作するために、白金円板電極の代わりにITO被覆ガラス電極上にコポリマー、ポリ(III−co−TTh)を電着させた。ポリ(III−co−TTh)被膜が成長した後、それらを組み立てて光起電力装置とする前に、0.10M TBAP/DCN溶液中において−0.8Vで還元した。すべての光電気化学セルは、走査速度100mVs−1で電位限界−0.4〜+1.2Vの間においてサイクリックボルタンメトリによりITO被覆ガラス上に成長させたポリ(III−co−TTh)から組み立てた。
最初、光起電力装置は、走査速度100mVs−1で電位限界−0.4〜+1.2Vの間において、III(5mM)/2(1mM)/TBAP(0.1M)/DCMを含有するモノマー溶液からサイクリックボルタンメトリにより成長させたコポリマーから作製した。ポリマー被膜の厚さは、成長の間サイクルの回数を制御することにより決定した(表2)。光起電力装置を製作するとき液体電解質を使用した。表2は、光起電力装置として製作した場合、これらの完全に還元されたコポリマーから得られた光起電力特性を要約している。500Wm−2ハロゲン光源によりこれらのセルを試験し、試験面積は0.04cm2であった。最良のセルは、CVにより15サイクルの間成長させたコポリマーを組み込み、光起電力特性:Voc=212mV、Isc=435μAcm−2、フィルファクタ=0.30、及びエネルギー変換効率(ECE)=0.055%を有していた。
光電気化学セル
光電気化学セルとして製作するために、白金円板電極の代わりにITO被覆ガラス電極上にコポリマー、ポリ(III−co−TTh)を電着させた。ポリ(III−co−TTh)被膜が成長した後、それらを組み立てて光起電力装置とする前に、0.10M TBAP/DCN溶液中において−0.8Vで還元した。すべての光電気化学セルは、走査速度100mVs−1で電位限界−0.4〜+1.2Vの間においてサイクリックボルタンメトリによりITO被覆ガラス上に成長させたポリ(III−co−TTh)から組み立てた。
最初、光起電力装置は、走査速度100mVs−1で電位限界−0.4〜+1.2Vの間において、III(5mM)/2(1mM)/TBAP(0.1M)/DCMを含有するモノマー溶液からサイクリックボルタンメトリにより成長させたコポリマーから作製した。ポリマー被膜の厚さは、成長の間サイクルの回数を制御することにより決定した(表2)。光起電力装置を製作するとき液体電解質を使用した。表2は、光起電力装置として製作した場合、これらの完全に還元されたコポリマーから得られた光起電力特性を要約している。500Wm−2ハロゲン光源によりこれらのセルを試験し、試験面積は0.04cm2であった。最良のセルは、CVにより15サイクルの間成長させたコポリマーを組み込み、光起電力特性:Voc=212mV、Isc=435μAcm−2、フィルファクタ=0.30、及びエネルギー変換効率(ECE)=0.055%を有していた。
光起電力装置応答へのコポリマー成長間のIII:TThモノマーモル比の影響
最良の光起電力装置を得るためにコポリマー組成をさらに最適化させた。コポリマー成長について一連のIII:TThモノマーのモル比を検討した。次のIII:TThのコモノマーモル比:5:1、5:2、5:5、2:5、及び1:5mMを選択した。又、堆積させたコポリマーは、光電気化学セルとして組み立てる前に−0.8Vで完全に還元した。表3は、これらの還元したコポリマーから得られた光起電力特性結果を要約している。その結果は、エネルギー変換効率及び短絡電流(Isc)が、コポリマー成長の間の被膜の厚さ及びモノマーモル比によって影響を受けることを示している。図6は、III:TThについての種々のモノマーモル比から得られた最良のエネルギー変換効率結果を示している。最良の光起電力装置(ECE=0.090%)は、III(5mM)/TTh(5mM)/TBAP(0.1M)/DCMを含有するモノマー溶液から100mVs−1で電位限界−0.4V/+1.2Vによりサイクリックボルタンメトリにより20サイクル成長させたコポリマーを組み込んでいた。この装置は、500Wm−2のハロゲンランプ強度下でVoc=246mV、Isc=581μAcm−2、フィルファクタ=0.31、及びECE=0.090%を有していた。これらの結果は、ポリ(III−co−TTh)成長の間に使用したモノマーモル比が、光起電力応答に影響することを示している。表3は又、ポリマー厚さ(成長サイクルの回数)の増加に関して、ECE及びIscは共に同一の傾向を有することをも示している。一方他の2つの特性値、Voc及びフィルファクタは、ポリマー被膜の厚さには独立であるように見える。これらの傾向は、被膜厚さ及び短絡電流が、これらの光電気化学セルのエネルギー変換効率に影響する2つの支配的なパラメータであったことを示唆している。
最良の光起電力装置を得るためにコポリマー組成をさらに最適化させた。コポリマー成長について一連のIII:TThモノマーのモル比を検討した。次のIII:TThのコモノマーモル比:5:1、5:2、5:5、2:5、及び1:5mMを選択した。又、堆積させたコポリマーは、光電気化学セルとして組み立てる前に−0.8Vで完全に還元した。表3は、これらの還元したコポリマーから得られた光起電力特性結果を要約している。その結果は、エネルギー変換効率及び短絡電流(Isc)が、コポリマー成長の間の被膜の厚さ及びモノマーモル比によって影響を受けることを示している。図6は、III:TThについての種々のモノマーモル比から得られた最良のエネルギー変換効率結果を示している。最良の光起電力装置(ECE=0.090%)は、III(5mM)/TTh(5mM)/TBAP(0.1M)/DCMを含有するモノマー溶液から100mVs−1で電位限界−0.4V/+1.2Vによりサイクリックボルタンメトリにより20サイクル成長させたコポリマーを組み込んでいた。この装置は、500Wm−2のハロゲンランプ強度下でVoc=246mV、Isc=581μAcm−2、フィルファクタ=0.31、及びECE=0.090%を有していた。これらの結果は、ポリ(III−co−TTh)成長の間に使用したモノマーモル比が、光起電力応答に影響することを示している。表3は又、ポリマー厚さ(成長サイクルの回数)の増加に関して、ECE及びIscは共に同一の傾向を有することをも示している。一方他の2つの特性値、Voc及びフィルファクタは、ポリマー被膜の厚さには独立であるように見える。これらの傾向は、被膜厚さ及び短絡電流が、これらの光電気化学セルのエネルギー変換効率に影響する2つの支配的なパラメータであったことを示唆している。
亜鉛をポルフィリンの空洞中に組み込んだ光起電力装置
光合成系による太陽光の捕集は、クロロフィル分子の配列を使用することに掛かっている。
光合成系による太陽光の捕集は、クロロフィル分子の配列を使用することに掛かっている。
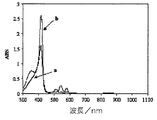
クロロフィルはマグネシウム含有ポルフィリンである。ポルフィリン化学における40年を超える研究を行っており、クロロフィルの光捕集過程の特定の態様に似せて機能させることを試み、その試みの大部分は亜鉛系ポルフィリン系を含む[6]。亜鉛はポルフィリンに導入しやすく、又亜鉛ポルフィリンはマグネシウムポルフィリンよりも安定なので、このような研究には亜鉛は好ましい金属である。
我々は、ポルフィリンコポリマーの使用が、ポリチオフェン系光起電力装置の光捕集能力を高めることの実証に着手してきている。遊離塩基ポルフィリンでこの効果を実証しており、次のステップは、分子フォトニックデバイスにおいて亜鉛ポルフィリンを広範に使用するものとし、ポルフィリンの空洞の中に亜鉛をキレート化することにより、包含されるポルフィリンの光捕集性状を改良する試みであった[7]。DCM中のモノマー濃度0.04mMにおいて、亜鉛を組み込んだ、若しくは亜鉛を組み込まないモノマーIIIの典型的なUV−可視スペクトルを記録した(図7)。それらのスペクトルは、亜鉛を配位したモノマーIIIが、亜鉛を組み込まないものよりも高い光吸収を有することを示している。モノマーIII内の亜鉛は、300〜600nm間の光捕集性を高め、このことは光起電力性能をより良好に高めるのに有用であるはずである。ポリ(III−co−TTh)のさらなる検討は、亜鉛を組み込んだポリ(III−co−TTh)被膜の試料から得られたものと、結果を比較することにより行った。この研究において、すべての還元されたポリ(III−co−TTh)(5:5)修飾ITO被覆ガラス電極を、メタノール中の酢酸亜鉛(0.001M)+TBAP(0.1M)含有溶液に2日間曝露した。これらのコポリマー修飾ITO被覆ガラス電極はアセトニトリルで完全にすすぎ、且つ乾燥させた。
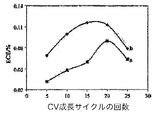
表4は、亜鉛浸漬した、又亜鉛浸漬しないこれらの還元されたコポリマーから得られた光起電力特性結果を要約する。その結果は、コポリマーを亜鉛浸漬した後ECE、フィルファクタ、及びIscの値はすべて増加するが、Vocの値は低下することを示している。図8は、亜鉛浸漬ポリ(III−co−TTh)及び遊離塩基ポリ(III−co−TTh)の両方についてのECE値を比較している。最良の結果は、15回成長させたコポリマーについてであり、その場合、金属化しない試料と比較してECE値は2倍になった(0.06〜0.12%)。
コポリマーの厚さにかかわらず、遊離塩基コポリマーに対して、亜鉛を組み込んだポリ(III−co−TTh)についてのECE値は常に増加を示していた。これは、亜鉛がポルフィリン部分に配位され、それにより光起電力装置の量子収率を増加させるためであろう。このことは、ポリマー内の亜鉛の元素分析により支持され、元素分析は亜鉛:ポルフィリンのモル比が1:4であることを示している。これにより、ポルフィリン部位の4つに1つが金属化されている可能性が示唆される。
結論
2,2’:5’,2”−テルチオフェン(TTh)、ポリ(III−co−TTh)と共にトランス−5,15−ビス([2’2”5”2”−テルチオフェン]−3’イル)−2,8,12,18−テトラ−n−ブチル−3,7,13,17−テトラメチルポルフィリン(III)を含有するコポリマー堆積物を首尾よく電解合成した。一般に、このコポリマーは低い導電率を有していたが、UV−可視スペクトルは、完全に酸化された(導電性)状態と、完全に還元された(半導電性)状態との間の予想される吸光度の差異を依然示していた。ポリ(III−co−TTh)は、ポリマー主鎖に架橋している光捕集部分(ポルフィリン)を含有する。ポリ(III−co−TTh)が成長している間III:TThについてのモノマーモル比は、光起電力応答に大きな影響を有していた(図2)。光起電力装置向けのIII:TThについての最良のモル比は、1:1である。これは、成長中の種々のモノマーモル比から生成されるコポリマー主鎖におけるIIIとTThの種々の百分率のためである。Yohannesらにより記述されているポリ(3−メチルチオフェン)からのデバイス[1](Voc=140mV、Isc=0.35μAcm−2)と比較してVoc及びIscにおける顕著な改良が得られている。その上、我々の最近の研究、例えばCutlerらなど[25、32]、と比較し、これらのデバイスのECE及びIsc値も又、ポリ(テルチオフェン)及びポリ(ニトロスチリルテルチオフェン)について報告されているものよりも著しく高い。エネルギー変換効率対ポリマー厚さの傾向は、Isc応答における傾向と類似している(表3)。このことから再び、IscがECEに影響を及ぼす支配的パラメータであることが確認される。モノマーIII:TThについてのモル比1:1からサイクリックボルタンメトリにより成長させ、光起電力装置として組み立てる前に亜鉛浸漬した本コポリマーから、最良の装置を作製した。この装置は、Voc=185mV、Isc=881μAcm−2(Yohannesら[1]と比較して、半分の光強度で、2500倍を超える改良)、フィルファクタ=0.36、エネルギー変換効率=0.12%を有していた。
2,2’:5’,2”−テルチオフェン(TTh)、ポリ(III−co−TTh)と共にトランス−5,15−ビス([2’2”5”2”−テルチオフェン]−3’イル)−2,8,12,18−テトラ−n−ブチル−3,7,13,17−テトラメチルポルフィリン(III)を含有するコポリマー堆積物を首尾よく電解合成した。一般に、このコポリマーは低い導電率を有していたが、UV−可視スペクトルは、完全に酸化された(導電性)状態と、完全に還元された(半導電性)状態との間の予想される吸光度の差異を依然示していた。ポリ(III−co−TTh)は、ポリマー主鎖に架橋している光捕集部分(ポルフィリン)を含有する。ポリ(III−co−TTh)が成長している間III:TThについてのモノマーモル比は、光起電力応答に大きな影響を有していた(図2)。光起電力装置向けのIII:TThについての最良のモル比は、1:1である。これは、成長中の種々のモノマーモル比から生成されるコポリマー主鎖におけるIIIとTThの種々の百分率のためである。Yohannesらにより記述されているポリ(3−メチルチオフェン)からのデバイス[1](Voc=140mV、Isc=0.35μAcm−2)と比較してVoc及びIscにおける顕著な改良が得られている。その上、我々の最近の研究、例えばCutlerらなど[25、32]、と比較し、これらのデバイスのECE及びIsc値も又、ポリ(テルチオフェン)及びポリ(ニトロスチリルテルチオフェン)について報告されているものよりも著しく高い。エネルギー変換効率対ポリマー厚さの傾向は、Isc応答における傾向と類似している(表3)。このことから再び、IscがECEに影響を及ぼす支配的パラメータであることが確認される。モノマーIII:TThについてのモル比1:1からサイクリックボルタンメトリにより成長させ、光起電力装置として組み立てる前に亜鉛浸漬した本コポリマーから、最良の装置を作製した。この装置は、Voc=185mV、Isc=881μAcm−2(Yohannesら[1]と比較して、半分の光強度で、2500倍を超える改良)、フィルファクタ=0.36、エネルギー変換効率=0.12%を有していた。
Claims (54)
- Q及びQ’が、
置換された芳香族、アニリン、置換されたアニリン、チオフェン、置換されたチオフェン、オリゴチオフェン、フラン、置換されたフラン、ピロール、及び置換されたピロール
を含む群から選択される置換された芳香環又はヘテロ芳香環である、請求項1に記載の重合可能なモノマー単位の架橋対。 - Pが、
ポルフィリン、
置換されたポルフィリン、
フタロシアニン、
置換されたフタロシアニン、
四窒素含有マクロ環
を含む群から選択される、前記請求項のいずれか一項に記載の重合可能なモノマー単位の架橋対。 - Q及びQ’が、前記重合可能なモノマー単位の架橋対のモノマー単位がホモポリマーとして重合することを可能にする十分な分子の大きさのものである、請求項1から4までのいずれか一項に記載の重合可能なモノマー単位の架橋対。
- Q及びQ’が、
置換された芳香族、アニリン、置換されたアニリン、チオフェン、置換されたチオフェン、オリゴチオフェン、フラン、置換されたフラン、ピロール、及び置換されたピロール
を含む群から選択される置換された芳香環又はヘテロ芳香環である、請求項6に記載の電子機能性単位架橋ポリマー。 - Pが、
ポルフィリン、
置換されたポルフィリン、
フタロシアニン、
置換されたフタロシアニン、
四窒素含有マクロ環
を含む群から選択される、請求項6から8までのいずれか一項に記載の電子機能性単位架橋ポリマー。 - 前記モノマー単位Q及びQ’と、少なくとも1種の他のモノマー単位とのコポリマーである、請求項6から9までのいずれか一項に記載の電子機能性単位架橋ポリマー。
- 前記他のモノマー単位が、置換された芳香環又はヘテロ芳香環である、請求項10に記載の電子機能性単位架橋ポリマー。
- 前記他のモノマー単位が、
置換された芳香族、アニリン、置換されたアニリン、チオフェン、置換されたチオフェン、オリゴチオフェン、フラン、置換されたフラン、ピロール、及び置換されたピロール
を含む群から選択される、請求項11に記載の電子機能性単位架橋ポリマー。 - 前記他のモノマー単位が、テルチオフェンである、請求項12に記載の電子機能性単位架橋ポリマー。
- 前記電子機能性単位が金属を配位している、請求項6から13までのいずれか一項に記載の電子機能性単位架橋ポリマー。
- 前記金属が亜鉛である、請求項14に記載の電子機能性単位架橋ポリマー。
- 電解重合により調製された、請求項6から15までのいずれか一項に記載の電子機能性単位架橋ポリマー。
- Q及びQ’が、
置換された芳香族、アニリン、置換されたアニリン、チオフェン、置換されたチオフェン、オリゴチオフェン、フラン、置換されたフラン、ピロール、及び置換されたピロール
を含む群から選択される置換された芳香環又はヘテロ芳香環である、請求項17に記載の重合可能なモノマー単位の架橋カルテット。 - Pが、
ポルフィリン、
置換されたポルフィリン、
フタロシアニン、
置換されたフタロシアニン、
四窒素含有マクロ環
を含む群から選択される、請求項17又は18に記載の重合可能なモノマー単位の架橋カルテット。 - Q及びQ’が、前記重合可能なモノマー単位の架橋カルテットのモノマー単位がホモポリマーとして重合することを可能にする十分な分子の大きさのものである、請求項17から20までのいずれか一項に記載の重合可能なモノマー単位の架橋カルテット。
- Q及びQ’が、
置換された芳香族、アニリン、置換されたアニリン、チオフェン、置換されたチオフェン、オリゴチオフェン、フラン、置換されたフラン、ピロール、及び置換されたピロール
を含む群から選択される置換された芳香環又はヘテロ芳香環である、請求項22に記載の電子機能性単位架橋ポリマー。 - Pが、
ポルフィリン、
置換されたポルフィリン、
フタロシアニン、
置換されたフタロシアニン、
四窒素含有マクロ環
を含む群から選択される、請求項22から23までのいずれか一項に記載の電子機能性単位架橋ポリマー。 - 前記モノマー単位Q及びQ’と、少なくとも1種の他のモノマー単位とのコポリマーである、請求項22から25までのいずれか一項に記載の電子機能性単位架橋ポリマー。
- 前記他のモノマー単位が、置換された芳香環又はヘテロ芳香環である、請求項26に記載の電子機能性単位架橋ポリマー。
- 前記他のモノマー単位が、
置換された芳香族、アニリン、置換されたアニリン、チオフェン、置換されたチオフェン、オリゴチオフェン、フラン、置換されたフラン、ピロール、及び置換されたピロール
を含む群から選択される、請求項27に記載の電子機能性単位架橋ポリマー。 - 前記他のモノマー単位が、テルチオフェンである、請求項28に記載の電子機能性単位架橋ポリマー。
- Pの前記少なくとも1種の他のモノマー単位との比率が1:2である、請求項26から29までのいずれか一項に記載の電子機能性単位架橋ポリマー。
- 前記電子機能性単位が、金属を配位している、請求項22から30までのいずれか一項に記載の電子機能性単位架橋ポリマー。
- 前記金属が亜鉛である、請求項31に記載の電子機能性単位架橋ポリマー。
- 電解重合により調製された、請求項22から32までのいずれか一項に記載の電子機能性単位架橋ポリマー。
- 可溶化基をさらに含む前記請求項のいずれか一項に記載のモノマー単位の架橋対、モノマー単位の架橋カルテット、ポリマー、又はコポリマー。
- 前記可溶化基がSO3 −部分を含む、請求項34に記載のモノマー単位の架橋対、モノマー単位の架橋カルテット、ポリマー、又はコポリマー。
- 基材と、請求項6から16まで又は22から33までのいずれか一項に記載の電子機能性単位架橋ポリマーとを含む電子機能材料。
- 基材と、請求項10から16まで又は26から33までのいずれか一項に記載のコポリマーとを含む電子機能材料。
- 請求項1から5まで又は17から21までのいずれか一項に記載の重合可能なモノマー単位の架橋対又はカルテットによって基材を処理するステップと、前記重合可能なモノマー単位の架橋対又はカルテットをその後重合させるステップとを含む電子機能材料を調製する方法。
- 重合させるステップの前に少なくとも1種の他のモノマー単位を付加するステップをさらに含む、それぞれ請求項38に記載の電子機能材料を調製する方法。
- 前記少なくとも1種の他のモノマー単位が、置換された芳香族、アニリン、置換されたアニリン、チオフェン、置換されたチオフェン、オリゴチオフェン、フラン、置換されたフラン、ピロール、及び置換されたピロールを含む群から選択される、請求項39に記載の方法。
- 前記基材が織物、ガラス、又は金属である、請求項36又は37に記載の電子機能材料。
- 前記基材が織物、ガラス、又は金属である、請求項38から40までのいずれか一項に記載の方法。
- 前記重合させるステップが化学的又は電気化学的酸化によるものである、請求項38から40までのいずれか一項に記載の方法。
- 請求項6から16まで又は22から33までのいずれか一項に記載のポリマー又はコポリマーを表面に塗布するステップと、得られた前記表面に光を当てるステップ又は前記表面を光に曝露するステップと、得られた電流を捕集するステップとを含む光捕集する方法。
- それぞれ、請求項1から5まで又は17から21までのいずれか一項に記載の重合可能なモノマー単位の架橋対又はカルテットを含む群から選択された1つ又は複数の成分を表面に塗布するステップと、場合によって他のモノマー、ポリマー、又はコポリマーの存在下で、このような単位をそのまま(in situ)で重合させるステップと、得られた前記表面に光を当てるステップ又は前記表面を光に曝露するステップと、得られた電流を捕集するステップとを含む光捕集する方法。
- 前記他のモノマーが、ベンゼン、置換されたベンゼン、アニリン、置換されたアニリン、チオフェン、置換されたチオフェン、オリゴチオフェン、フラン、置換されたフラン、ピロール、及び置換されたピロールからなる群から選択される、請求項44又は45に記載の方法。
- 請求項6から16まで又は22から33までのいずれか一項に記載のポリマーを組み込んでいる光起電力装置。
- 実質的に、実施例のいずれか1つを参照して本明細書において記述されている重合可能なモノマー単位の架橋対。
- 実質的に、実施例のいずれか1つを参照して本明細書において記述されている電子機能性単位架橋ポリマー。
- 実質的に、実施例のいずれか1つを参照して本明細書において記述されている重合可能なモノマー単位の架橋カルテット。
- 実質的に、実施例のいずれか1つを参照して本明細書において記述されている基材と電子機能性単位架橋ポリマーとを含む電子機能材料。
- 実質的に、実施例のいずれか1つを参照して本明細書において記述されている電子機能材料を調製する方法。
- 実質的に、実施例のいずれか1つを参照して本明細書において記述されている光捕集する方法。
- 実質的に、実施例のいずれか1つを参照して本明細書において記述されている光起電力装置。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| AU2003900404A AU2003900404A0 (en) | 2003-01-31 | 2003-01-31 | Conducting polymers with porphyrin cross-linkers |
| PCT/AU2004/000111 WO2004067533A1 (en) | 2003-01-31 | 2004-01-30 | Conducting polymers with porphyrin cross-linkers |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2006517543A true JP2006517543A (ja) | 2006-07-27 |
| JP2006517543A5 JP2006517543A5 (ja) | 2007-03-08 |
Family
ID=30005105
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2006501343A Pending JP2006517543A (ja) | 2003-01-31 | 2004-01-30 | ポルフィリン架橋体を有する導電性ポリマー |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US20070295398A1 (ja) |
| EP (1) | EP1594876A4 (ja) |
| JP (1) | JP2006517543A (ja) |
| AU (1) | AU2003900404A0 (ja) |
| WO (1) | WO2004067533A1 (ja) |
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2009520861A (ja) * | 2005-12-23 | 2009-05-28 | コミツサリア タ レネルジー アトミーク | 増感錯体、その製造方法、それを備えた無機/有機ハイブリッド型半導性材料、及び、該材料を備えた太陽電池 |
| US7884357B2 (en) | 2006-05-18 | 2011-02-08 | Sony Corporation | Organic electronic device, method for production thereof, and organic semiconductor molecule |
| JP2013518151A (ja) * | 2010-01-30 | 2013-05-20 | 海洋王照明科技股▲ふん▼有限公司 | フルオレニルポルフィリン−アントラセンを含むコポリマー、その製造方法およびその応用 |
| JP2013521348A (ja) * | 2010-03-23 | 2013-06-10 | ▲海▼洋王照明科技股▲ふん▼有限公司 | フルオレニル含有ポルフィリン―ベンゼン共重合体、及びその製造方法と応用 |
| JP2014057003A (ja) * | 2012-09-13 | 2014-03-27 | Daicel Corp | 太陽電池及びその製造方法 |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| NZ541788A (en) * | 2005-08-11 | 2007-12-21 | Auckland Uniservices Ltd | Conducting polymers and their use in oligonucleotide (ODN) probes |
| US7901852B2 (en) * | 2008-02-29 | 2011-03-08 | Freescale Semiconductor, Inc. | Metrology of bilayer photoresist processes |
| CN101948566B (zh) * | 2010-06-23 | 2012-09-19 | 中国科学院化学研究所 | 一种用于抗真菌、抗癌及细胞成像的多功能聚合物及其制备方法 |
| TWI499611B (zh) * | 2013-11-14 | 2015-09-11 | Univ Nat Chiao Tung | 共軛高分子化合物 |
| US10214626B2 (en) | 2016-12-09 | 2019-02-26 | International Business Machines Corporation | Renewable cross-linker for increased bio-content from fructose |
| SE543571C2 (en) * | 2019-02-07 | 2021-03-30 | Christian Strietzel | Conducting redox oligomers |
| CN112430311B (zh) * | 2019-08-26 | 2023-05-23 | 上海戎科特种装备有限公司 | 含卟啉共轭环电致变色共聚物及其制备方法、共聚物薄膜与应用 |
| CN112225883B (zh) * | 2020-10-12 | 2023-05-26 | 湘潭大学 | 四种D-A’-(π-A)2型聚合吡啶衍生物合金属配合物及其制备方法与用途 |
| US20240208921A1 (en) * | 2022-12-14 | 2024-06-27 | University Of Cincinnati | Synthesis of Thiophene Derivatized Polyphenolic Calixarenes |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6127356A (en) * | 1993-10-15 | 2000-10-03 | Duke University | Oxidant scavengers |
| JP2001342190A (ja) * | 2000-06-02 | 2001-12-11 | Japan Science & Technology Corp | 新規なテトラピロリル置換ポルフィリン及びその製法 |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH05100446A (ja) * | 1991-10-04 | 1993-04-23 | Matsushita Electric Ind Co Ltd | 電子写真用感光体 |
| JPH0572762A (ja) * | 1991-09-13 | 1993-03-26 | Matsushita Electric Ind Co Ltd | 電子写真用感光体 |
| JPH0572777A (ja) * | 1991-09-13 | 1993-03-26 | Matsushita Electric Ind Co Ltd | 電子写真用感光体 |
| DE4242676A1 (de) * | 1992-12-17 | 1994-06-23 | Basf Ag | Polymere makrocyclische Verbindungen |
| FR2798146B1 (fr) * | 1999-08-12 | 2002-04-12 | Univ Joseph Fourier | Electropolymeres photogreffables, leur procede d'obtention et leurs applications comme supports de sondes de reconnaissance specifique dans des biocapteurs electroniques |
| JP4278080B2 (ja) * | 2000-09-27 | 2009-06-10 | 富士フイルム株式会社 | 高感度受光素子及びイメージセンサー |
-
2003
- 2003-01-31 AU AU2003900404A patent/AU2003900404A0/en not_active Abandoned
-
2004
- 2004-01-30 JP JP2006501343A patent/JP2006517543A/ja active Pending
- 2004-01-30 EP EP04706576A patent/EP1594876A4/en not_active Withdrawn
- 2004-01-30 WO PCT/AU2004/000111 patent/WO2004067533A1/en not_active Ceased
- 2004-01-30 US US10/544,085 patent/US20070295398A1/en not_active Abandoned
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6127356A (en) * | 1993-10-15 | 2000-10-03 | Duke University | Oxidant scavengers |
| JP2001342190A (ja) * | 2000-06-02 | 2001-12-11 | Japan Science & Technology Corp | 新規なテトラピロリル置換ポルフィリン及びその製法 |
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2009520861A (ja) * | 2005-12-23 | 2009-05-28 | コミツサリア タ レネルジー アトミーク | 増感錯体、その製造方法、それを備えた無機/有機ハイブリッド型半導性材料、及び、該材料を備えた太陽電池 |
| US9196847B2 (en) | 2005-12-23 | 2015-11-24 | Commissariat A L'energie Atomique | Sensitizing complexes, process for the preparation thereof, semiconductive inorganic/organic hybrid material comprising them, and photovoltaic cell comprising said material |
| US7884357B2 (en) | 2006-05-18 | 2011-02-08 | Sony Corporation | Organic electronic device, method for production thereof, and organic semiconductor molecule |
| JP2013518151A (ja) * | 2010-01-30 | 2013-05-20 | 海洋王照明科技股▲ふん▼有限公司 | フルオレニルポルフィリン−アントラセンを含むコポリマー、その製造方法およびその応用 |
| JP2013521348A (ja) * | 2010-03-23 | 2013-06-10 | ▲海▼洋王照明科技股▲ふん▼有限公司 | フルオレニル含有ポルフィリン―ベンゼン共重合体、及びその製造方法と応用 |
| JP2014057003A (ja) * | 2012-09-13 | 2014-03-27 | Daicel Corp | 太陽電池及びその製造方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| US20070295398A1 (en) | 2007-12-27 |
| WO2004067533A1 (en) | 2004-08-12 |
| EP1594876A4 (en) | 2008-07-09 |
| AU2003900404A0 (en) | 2003-02-13 |
| EP1594876A1 (en) | 2005-11-16 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Cosnier et al. | Electropolymerization: concepts, materials and applications | |
| Zhu et al. | Conducting polymetallorotaxanes: metal ion mediated enhancements in conductivity and charge localization | |
| US7186355B2 (en) | Insulated nanoscopic pathways, compositions and devices of the same | |
| Roncali | Linearly extended π-donors: when tetrathiafulvalene meets conjugated oligomers and polymers | |
| Cui et al. | Tuning of resistive memory switching in electropolymerized metallopolymeric films | |
| Reddinger et al. | Tunable redox and optical properties using transition metal-complexed polythiophenes | |
| JP2006517543A (ja) | ポルフィリン架橋体を有する導電性ポリマー | |
| Too et al. | Photovoltaic devices based on polythiophenes and substituted polythiophenes | |
| Sauvage et al. | Conjugated polyrotaxanes: improvement of the polymer properties by using sterically hindered coordinating units | |
| Sharma et al. | Cross-Linked naphthalene diimide-based polymer as a cathode material for high-performance organic batteries | |
| Cameron et al. | Metal− Metal Interactions in a Novel Hybrid Metallopolymer | |
| KR102429713B1 (ko) | 고성능 소듐이온 배터리를 위한 공유결합 유기 나노시트 및 이의 제조 방법 | |
| US10121971B2 (en) | Cellulose-polymer composites for solar cells | |
| Li et al. | Very stable, highly electroactive polymers of zinc (II)-5, 15-bisthienylphenyl porphyrin exhibiting charge-trapping effects | |
| Oyaizu et al. | BODIPY-sensitized photocharging of anthraquinone-populated polymer layers for organic photorechargeable air battery | |
| Chen et al. | Photoelectrochemical cells based on a novel porphyrin containing light harvesting conducting copolymer | |
| MacLean et al. | Bithiophene–bithiazole copolymers and their metal complexes | |
| AU2006243103B2 (en) | Conductive material and conductive film and process for producing them | |
| Saito et al. | Poly (1, 5-naphthyridine-2, 6-diyl) Having a Highly Extended and Electron-Withdrawing. pi.-Conjugation System. Preparation, Optical Properties, and Electrochemical Redox Reaction | |
| Fatuch et al. | Synthesis and characterization of aniline copolymers containing carboxylic groups and their application as sensitizer and hole conductor in solar cells | |
| Soganci et al. | Synthesis of a carbazole substituted unusual cobalt (ii) dioxime complex to design conducting polymers with caged metal centers for enhanced optical and electrical properties | |
| EP2537875A1 (en) | Novel polyazomethine | |
| Abd-El-Aziz et al. | Novel synthesis and electropolymerization of metallo-conjugated thiophene derivatives | |
| Paul-Roth et al. | Selective anodic preparation of 1D or 2D electroactive deposits from 5, 15-bis-(9H-fluoren-2-yl)-10, 20-diphenyl porphyrins | |
| Vacareanu et al. | Electrogeneration of N-substituted polyaniline micro/nanoparticles with potential for energy storage |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20070117 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20070117 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20100601 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20101105 |