JP2006022033A - Neovascularization inhibitor - Google Patents
Neovascularization inhibitor Download PDFInfo
- Publication number
- JP2006022033A JP2006022033A JP2004200790A JP2004200790A JP2006022033A JP 2006022033 A JP2006022033 A JP 2006022033A JP 2004200790 A JP2004200790 A JP 2004200790A JP 2004200790 A JP2004200790 A JP 2004200790A JP 2006022033 A JP2006022033 A JP 2006022033A
- Authority
- JP
- Japan
- Prior art keywords
- extract
- seaweed
- alcohol
- angiogenesis
- angiogenesis inhibitor
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Abstract
Description
本発明は血管新生抑制剤に関し、より詳細には、生体内で血管の新生を抑制することにより、癌の増殖または転移、糖尿病性網膜症、慢性関節リウマチなどの血管新生病を予防または治療し得る、血管新生抑制剤に関する。 The present invention relates to an angiogenesis inhibitor, and more specifically, prevents or treats angiogenesis diseases such as cancer growth or metastasis, diabetic retinopathy, rheumatoid arthritis, etc. by inhibiting angiogenesis in vivo. The present invention relates to an angiogenesis inhibitor obtained.
血管新生は、発生、創傷治癒等において重要な役割を果たす。その一方で、血管新生は、癌の増殖または転移、糖尿病性網膜症、加齢性黄斑変性、慢性関節リウマチ、乾癬などの血管新生病にも関与することが知られている。 Angiogenesis plays an important role in development, wound healing, and the like. On the other hand, angiogenesis is known to be involved in angiogenic diseases such as cancer growth or metastasis, diabetic retinopathy, age-related macular degeneration, rheumatoid arthritis, and psoriasis.
血管新生は、既存の血管から新たに血管が形成される過程であると理解されている。血管新生は、血管内皮細胞によるプロテアーゼの産生後、内皮細胞の遊走、増殖および分化を経て起こる。 Angiogenesis is understood as the process by which new blood vessels are formed from existing blood vessels. Angiogenesis occurs through the migration, proliferation and differentiation of endothelial cells after the production of proteases by vascular endothelial cells.
上記血管新生病と血管新生との関係については、近年、血管内皮細胞に特異的に働き、血管新生を促進する因子であるVEGF(血管内皮成長因子:Vascular Endothelial Growth Factor)、アンジオポエチンなどのリガンドおよびそのレセプター系が次々と見出されたことにより明確にされてきた。したがって、血管新生を抑制することがこれら疾病の予防および治療に有効であると考えられている。 Regarding the relationship between the above-mentioned angiogenic diseases and angiogenesis, in recent years, ligands such as VEGF (Vascular Endothelial Growth Factor), angiopoietin, which are specific factors that act on vascular endothelial cells and promote angiogenesis, and The receptor system has been clarified as it was discovered one after another. Therefore, suppressing angiogenesis is considered effective for the prevention and treatment of these diseases.
従来より、このような血管新生の抑制を目的とした種々の血管抑制剤が知られている。このような血管抑制剤としては、例えば、内皮由来過分極因子(EDHF;Endothelium−Derived Hyperpolarizing Factor)の作用を阻害し、かつ血管新生を抑制する物質として、K+チャンネルブロッカーを有効成分として含有するもの(特許文献1)、カルボリン誘導体を有効成分とするもの(特許文献2)、アスペルギルス(Aspergillus)属に属する特定の菌株が生産する化合物を有効成分として含有するもの(特許文献3)、ドコサペンタエン酸(DPA)またはその誘導体を有効成分とするもの(特許文献4)、およびポリアルコキシフラボノイドを有効成分として含有するもの(特許文献5)が知られている。 Conventionally, various blood vessel inhibitors for the purpose of suppressing such angiogenesis are known. As such a vascular inhibitor, for example, a K + channel blocker is contained as an active ingredient as a substance that inhibits the action of endothelium-derived hyperpolarizing factor (EDHF) and suppresses angiogenesis. (Patent Document 1), a compound containing a carboline derivative as an active ingredient (Patent Document 2), a compound containing a compound produced by a specific strain belonging to the genus Aspergillus (Patent Document 3), docosapenta Those containing enoic acid (DPA) or a derivative thereof as an active ingredient (Patent Document 4) and those containing polyalkoxyflavonoids as an active ingredient are known (Patent Document 5).
しかし、このような従来の血管新生抑制剤は、細胞毒性が高く、副作用の発生が懸念される、製品を得るまでに多く製造工程を必要とする、あるいは上記血管新生病の予防または治療を目的とする上で、血管新生に対する抑制効果が未だ充分とはいえず、実用性の点で懸念される、などの問題が指摘されている。特に、このような疾病の予防または治療にあたっては、長期間に継続して行うことが必要なため、効果的な血管新生の抑制と副作用の回避との両方を達成し得る血管新生抑制剤が所望されている。 However, such conventional anti-angiogenic agents are highly cytotoxic and are likely to cause side effects, require many production steps until products are obtained, or are intended to prevent or treat the above-mentioned angiogenic diseases On the other hand, it has been pointed out that the inhibitory effect on angiogenesis is still not sufficient, and there are concerns about practicality. In particular, since prevention or treatment of such diseases requires continuous treatment over a long period of time, an angiogenesis inhibitor that can achieve both effective inhibition of angiogenesis and avoidance of side effects is desirable. Has been.
本発明は、上記問題の解決を課題とするものであり、その目的とするところは、血管新生をより効果的に抑制し得るとともに、生体に対する安全性が向上した、血管新生抑制剤を提供することにある。 An object of the present invention is to provide an angiogenesis inhibitor that can more effectively suppress angiogenesis and has improved safety with respect to a living body. There is.
本発明は、褐藻類こんぶ目こんぶ科のマコンブ(Laminaria japonica)、褐藻類こんぶ目ちがいそ科のアラメ(Eisenia bicyclis)、サガラメ(Eisenia arborea)、ツルアラメ(Ecklonia stlonifera)、クロメ(Ecklonia kurome)、カジメ(Ecklonia cava)、ワカメ(Undaria pinnatifida)、アオワカメ(Undaria peterseniana)、ヒロメ(Undaria undarioides)、アイヌワカメ(Alaria praelomga)、およびチガイソ(Alaria crassifolia);褐藻類ひばまた目ほんだわら科のホンダワラ(Sargassum fuluvellum)、ヒジキ(Hizikia fusiforme)、およびアカモク(Sargassum horneri);褐藻類まがまつも目もずく科のモズク(Nemacystus decipieus)およびオキナワモズク(Cladosiphon okamuranus);および、紅藻類スギノリ目すぎのり科に属する海藻;からなる群より選択される少なくとも1種の海藻由来の抽出物を有効成分として含有する、血管新生抑制剤である。 The present invention relates to brown algae (Aminifera), laminaria japonica, brown algae (Eisenia bilocris), red sea urchin (Eisenia arborea), vine (Eckneria ck). (Ecklonia cava), sea turtle (Undaria pinnatifida), green sea turtle (Undaria peterenia), brown sea bream (Undaria unarrioides), brown sea turtle (Aldaria peas) ), Hinoki (Hizikia fusiforme), and red mosquito (Sargassum horneri); brown alga (Megacystus depipieus) and Okinawa moss (Cladosifonus algae); An angiogenesis inhibitor comprising, as an active ingredient, an extract derived from at least one seaweed selected from the group consisting of;
好ましい実施形態では、上記抽出物は、上記海藻由来の熱水粗抽出物を含有する50(v/v)%以上のC1〜C3アルコール液の上清から得られた抽出物である。 In a preferred embodiment, the extract is an extract obtained from a supernatant of 50 (v / v)% or more C1-C3 alcohol solution containing the hot water crude extract derived from the seaweed.
さらに好ましい実施形態では、上記抽出物は、上記上清の濃縮物を、40(v/v)%から90(v/v)%のC1〜C3アルコール水溶液を用いるカラムクロマトグラフィーにかけることにより得られた画分由来の抽出物である。 In a more preferred embodiment, the extract is obtained by subjecting the concentrate of the supernatant to column chromatography using 40 (v / v)% to 90 (v / v)% C1-C3 alcohol aqueous solution. It is an extract derived from the obtained fraction.
さらにより好ましい実施形態では、上記カラムクロマトグラフィーに用いる吸着剤はスチレン−ジビニルベンゼン系吸着剤である。 In an even more preferred embodiment, the adsorbent used in the column chromatography is a styrene-divinylbenzene adsorbent.
本発明は、海藻由来の抽出物を有効成分として含有する血管新生抑制剤であって、該抽出物が該抽出物に含まれる固形分の重量を基準としてフロロタンニンを15重量%以上の割合で含有する、血管新生抑制剤である。 The present invention is an angiogenesis inhibitor containing an extract derived from seaweed as an active ingredient, and the extract contains fluorotannin in a proportion of 15% by weight or more based on the weight of solids contained in the extract. Contains an angiogenesis inhibitor.
本発明はまた、フロロタンニンを有効成分として含有する、血管新生抑制剤である。 The present invention is also an angiogenesis inhibitor containing phlorotannin as an active ingredient.
好ましい実施形態では、上記フロロタンニンは海藻由来である。 In a preferred embodiment, the fluorotannin is derived from seaweed.
本発明はまた、血管新生抑制剤の製造方法であって、
褐藻類こんぶ目こんぶ科のマコンブ(Laminaria japonica)、褐藻類こんぶ目ちがいそ科のアラメ(Eisenia bicyclis)、サガラメ(Eisenia arborea)、ツルアラメ(Ecklonia stlonifera)、クロメ(Ecklonia kurome)、カジメ(Ecklonia cava)、ワカメ(Undaria pinnatifida)、アオワカメ(Undaria peterseniana)、ヒロメ(Undaria undarioides)、アイヌワカメ((Alaria praelomga)、およびチガイソ(Alaria crassifolia);褐藻類ひばまた目ほんだわら科のホンダワラ(Sargassum fuluvellum)、ヒジキ(Hizikia fusiforme)、およびアカモク(Sargassum horneri);褐藻類まがまつも目もずく科のモズク(Nemacystus decipieus)およびオキナワモズク(Cladosiphon okamuranus);および、紅藻類スギノリ目すぎのり科に属する海藻;からなる群より選択される少なくとも1種の海藻を、60℃から100℃の熱水中で抽出して熱水粗抽出物を得る工程;
該熱水粗抽出物に、C1〜C3アルコールまたはC1〜C3アルコール水溶液と合わせて、50(v/v)%以上の該アルコールを含有するアルコール液を得る工程;ならびに
該アルコール液の上清を分取する工程;
を包含する、方法である。
The present invention is also a method for producing an angiogenesis inhibitor,
Brown algae (Epidonia varneur), brown algae (Eisenia biloclis), brown turtle (Eisenia arborea) , Seaweed (Undaria pinnatifida), green sea turtle (Undaria peterseniana), Japanese flounder (Undaria uniaroides), brown squirrel (Alaria promagida) H zikia fusiforme, and red moss (Sargassum horneri); brown algae moths (Nemacytus decipieus) and Okinawa mosquito (Cladosifon okamuranus); Extracting at least one selected seaweed from hot water at 60 ° C. to 100 ° C. to obtain a hot water crude extract;
Combining the C1 to C3 alcohol or the C1 to C3 alcohol aqueous solution with the hot water crude extract to obtain an alcohol liquid containing 50% (v / v)% or more of the alcohol; Sorting step;
A method comprising
好ましい実施形態では、さらに、上記上清を濃縮して、該上清の濃縮物を得る工程;および該上清の濃縮物を、40(v/v)%から90(v/v)%のC1〜C3のアルコール水溶液を用いるカラムに通す工程;を包含する。 In a preferred embodiment, the step of further concentrating the supernatant to obtain a concentrate of the supernatant; and the concentration of the supernatant of 40 (v / v)% to 90 (v / v)% Passing through a column using an aqueous C1-C3 alcohol solution.
さらに好ましい実施形態では、上記カラムはスチレン−ジビニルベンゼン系吸着剤を含有する。 In a further preferred embodiment, the column contains a styrene-divinylbenzene adsorbent.
本発明によれば、血管新生をより効果的に抑制し得るとともに、生体に対する安全性をも向上させることができる。このため、本発明の血管新生抑制剤は日常的な使用がより可能となり、食品分野、医薬分野などの種々の分野における汎用性を高めることができる。本発明の血管新生抑制剤はまた、固形腫瘍(胃癌、大腸癌、肺癌、膵臓癌等)の増殖・転移、糖尿病性網膜症、黄斑変性症、網膜静脈閉鎖症、網膜動脈閉鎖症等の網膜疾患、新生血管性緑内障、リュウマチ、リュウマチ性関節炎、乾癬等の各種炎症性疾患、アテローム性動脈硬化症、心筋梗塞等の病的状態に対する予防または治療の目的に利用することができる。 ADVANTAGE OF THE INVENTION According to this invention, while being able to suppress angiogenesis more effectively, the safety | security with respect to a biological body can also be improved. For this reason, the angiogenesis inhibitor of the present invention can be more routinely used, and versatility can be enhanced in various fields such as the food field and the pharmaceutical field. The angiogenesis inhibitor of the present invention is also used for the growth and metastasis of solid tumors (gastric cancer, colon cancer, lung cancer, pancreatic cancer, etc.), retina such as diabetic retinopathy, macular degeneration, retinal vein occlusion, retinal artery occlusion It can be used for the purpose of prevention or treatment of diseases, neovascular glaucoma, rheumatism, rheumatoid arthritis, various inflammatory diseases such as psoriasis, pathological conditions such as atherosclerosis and myocardial infarction.
まず、本発明の第一の血管新生抑制剤について説明する。 First, the first angiogenesis inhibitor of the present invention will be described.
本発明の第一の血管新生抑制剤は、海藻由来の抽出物を有効成分として含有する。 The first angiogenesis inhibitor of the present invention contains an extract derived from seaweed as an active ingredient.
本発明に用いられる海藻の例としては、褐藻類のこんぶ目こんぶ科、褐藻類こんぶ目ちがいそ科、褐藻類ひばまた目ほんだわら科、褐藻類ながまつも目もずく科、または紅藻類スギノリ目すぎのり科に属する海藻が挙げられる。 Examples of the seaweed used in the present invention include the brown algae Kombu Kombu family, the brown algae Kombu Ogura family, the brown algae Hiba mata Hidawara family, the brown algae Nagamatsu and Mizushi family, or the red algae Suginori Examples include seaweeds belonging to the Suginori family.
上記海藻に包含される、具体的な例としては、褐藻類こんぶ目こんぶ科のマコンブ(Laminaria japonica)、褐藻類こんぶ目ちがいそ科のアラメ(Eisenia bicyclis)、サガラメ(Eisenia arborea)、ツルアラメ(Ecklonia stlonifera)、クロメ(Ecklonia kurome)、カジメ(Ecklonia cava)、ワカメ(Undaria pinnatifida)、アオワカメ(Undaria peterseniana)、ヒロメ(Undaria undarioides)、アイヌワカメ((Alaria praelomga)、およびチガイソ(Alaria crassifolia);褐藻類ひばまた目ほんだわら科のホンダワラ(Sargassum fuluvellum)、ヒジキ(Hizikia fusiforme)、およびアカモク(Sargassum horneri);褐藻類まがまつも目もずく科のモズク(Nemacystus decipieus)およびオキナワモズク(Cladosiphon okamuranus);ならびに紅藻類スギノリ目すぎのり科に属する海藻;が挙げられる。本発明に用いられる海藻としては、特に、海藻自体の生産量が比較的多く入手が容易であり、かつ後述する血管新生に対する抑制作用を有する抽出物の画分がより得られ易いという理由から、アラメ、クロメ、ワカメ、ヒジキが好ましい。 Specific examples included in the seaweed include the brown algae Kombu Kombu (Laminaria japonica), the brown algae Osmophila Alame (Eisenia bicyclis), Sagarame (Eisenia arborea), tsuru arame stlonifera), chromate (Ecklonia kurome), beforehand (Ecklonia cava), seaweed (Undaria pinnatifida), Aowakame (Undaria peterseniana), spread (Undaria undarioides), Ainu wakame ((Alaria praelomga), and Chigaiso (Alaria crassifolia); brown algae Hibamata Hondawara Honda Sahara (Sa rgasssum fluvellum, hijiki fusiforme, and red spider (Sargassum horneri); brown algae (Nemacytus decipeius) and red moss As the seaweed used in the present invention, a fraction of an extract having a relatively large production amount of seaweed itself and easily available and having an inhibitory action on angiogenesis described later is obtained. Alame, chrome, seaweed, and hinoki are preferred because they are easily treated.
本明細書において、海藻とは、これらの海藻の全草自体、あるいは根、茎、および葉を包含する少なくとも一つの部位を包含していう。本発明に用いられる海藻の形態は、未加工のもの、断片、細片または粉末を包含する。さらに、本発明に用いられる海藻は、乾燥物または生の状態のもののいずれをも包含する。 In the present specification, the seaweed includes the whole grass of these seaweeds themselves or at least one part including roots, stems, and leaves. The seaweed forms used in the present invention include raw ones, fragments, strips or powders. Furthermore, the seaweed used in the present invention includes both dry matter and raw state.
また、本発明において、抽出物とは、上記のような海藻を、水、極性または非極性の溶媒、あるいはこれらの混合物を抽出溶媒として用い適切な条件で抽出された抽出物を意味する。抽出物の形態は特に限定されず、抽出液、あるいは当該抽出液を当業者が通常用いる手段により濃縮または乾燥して得られる粉末またはペースト状物も含まれる。 In the present invention, the extract means an extract obtained by extracting the seaweed as described above using water, a polar or nonpolar solvent, or a mixture thereof as an extraction solvent under appropriate conditions. The form of the extract is not particularly limited, and includes an extract, or a powder or paste obtained by concentrating or drying the extract by means usually used by those skilled in the art.
本発明に用いられる海藻由来の抽出物は、好ましくは、上述したような種類の海藻由来の水および/またはアルコール(例えば、メタノール、エタノール、またはプロパノール)かえら抽出されたもの、より好ましくは、上述したような種類の海藻由来の熱水粗抽出物を含有するC1〜C3アルコール液の上清から得られたもの、である。特に、「海藻由来の熱水粗抽出物を含有するC1〜C3アルコール液の上清から得られたもの」は、後述するような操作を通じて、上記海藻から熱水粗抽出物を得、次いで、これにC1〜C3アルコールまたはC1〜C3アルコール水溶液と合わせた、80%(v/v)%以上のC1〜C3アルコール液から、上清を分取して得ることができる。 The seaweed-derived extract used in the present invention is preferably extracted from water and / or alcohol (for example, methanol, ethanol, or propanol) derived from the kind of seaweed as described above, more preferably It was obtained from the supernatant of the C1-C3 alcohol liquid containing the hot water crude extract derived from the kind of seaweed. In particular, “what was obtained from the supernatant of a C1-C3 alcohol solution containing a seaweed-derived hot water crude extract” obtained a hot water crude extract from the seaweed through an operation as described below, It can be obtained by fractionating the supernatant from 80% (v / v)% or more of C1-C3 alcohol solution combined with C1-C3 alcohol or C1-C3 alcohol aqueous solution.
本発明の第一の血管新生抑制剤において、上記抽出物は、当該抽出物に含まれる固形分の重量を基準として、フロロタンニンを好ましくは15重量%以上、より好ましくは18重量%〜100重量%、さらにより好ましくは30重量%〜99重量%、さらにより好ましくは60重量%〜99重量%、さらにより好ましくは60重量%〜99重量%の割合で含有する。
ここで、本明細書中に用いられる用語「抽出物に含まれる固形分の重量」とは、上記抽出物を構成する液体成分を取除く(例えば、蒸発させる)ことにより、固体成分として残存し得る物質の重量を指して言う。当該抽出物がこのような範囲をフロロタンニン含量を満足することにより、血管新生に対する抑制作用は著しく向上する。なお、本明細書中に用いられる用語「フロロタンニン」とは、一般に海藻タンニンとも呼ばれるポリフェノールの一種であり、フロログルシノールを基本骨格単位とする、フロロタンニン類全体を包含する高分子化合物を指して言う。本発明に用いられ得るフロロタンニンは、1種の当該フロロタンニン類または複数の当該フロロタンニン類でなる混合物のいずれをも包含する。
In the first angiogenesis inhibitor of the present invention, the extract is preferably 15% by weight or more, more preferably 18% by weight to 100% by weight of fluorotannin based on the weight of the solid content contained in the extract. %, Even more preferably from 30% to 99% by weight, even more preferably from 60% to 99% by weight, even more preferably from 60% to 99% by weight.
Here, the term “weight of solids contained in the extract” as used herein means that the liquid component constituting the extract is removed (for example, evaporated) to remain as a solid component. Refers to the weight of the substance to obtain. When the extract satisfies the phlorotannin content in such a range, the inhibitory action on angiogenesis is remarkably improved. The term “fluoro tannin” used in the present specification is a kind of polyphenol generally called seaweed tannin, and refers to a high molecular compound including the entire fluoro tannin having phloroglucinol as a basic skeleton unit. Say. The fluorotannin that can be used in the present invention includes any one kind of the fluorotannins or a mixture of a plurality of the fluorotannins.
次に、本発明の第二の血管新生抑制剤について説明する。 Next, the second angiogenesis inhibitor of the present invention will be described.
本発明の第二の血管新生抑制剤は、海藻由来の抽出物を有効成分として含有し、該抽出物は該抽出物に含まれる固形分の重量を基準としてフロロタンニンを15重量%以上、好ましくは18重量%〜100重量%、より好ましくは30重量%〜99重量%、さらにより好ましくは60重量%〜99重量%、さらにより好ましくは60重量%〜99重量%の割合で含有する。 The second angiogenesis inhibitor of the present invention contains an extract derived from seaweed as an active ingredient, and the extract contains 15% by weight or more of fluorotannin, preferably based on the weight of solids contained in the extract. Is contained in a proportion of 18 wt% to 100 wt%, more preferably 30 wt% to 99 wt%, even more preferably 60 wt% to 99 wt%, and even more preferably 60 wt% to 99 wt%.
本発明の第二の血管新生抑制剤は、海藻中に含まれるフロロタンニンが上記範囲で含有されていることが重要である。よって、この含有量の範囲を満足する限り、使用され得る海藻の種類は特に限定されない。本発明の第二の血管新生抑制剤に含まれる抽出物として使用可能な海藻の例としては、褐藻類または紅藻類に属する海藻が挙げられる。また、これら褐藻類または紅藻類のより具体的な例としては、褐藻類のこんぶ目こんぶ科、褐藻類こんぶ目ちがいそ科、褐藻類ひばまた目ほんだわら科、褐藻類ながまつも目もずく科、または紅藻類スギノリ目すぎのり科に属する海藻が挙げられるが、これらもまた特に限定されない。 In the second angiogenesis inhibitor of the present invention, it is important that phlorotannins contained in seaweed are contained in the above range. Therefore, as long as this content range is satisfied, the type of seaweed that can be used is not particularly limited. Examples of seaweed that can be used as the extract contained in the second angiogenesis inhibitor of the present invention include seaweeds belonging to brown algae or red algae. In addition, more specific examples of these brown algae or red algae include the brown algae Kombu Kombu family, the brown algae Kombu Komiso family, the brown algae Hiba or Hamawara family, the brown algae Nagamatsu and Mizukumaku family. In addition, seaweeds belonging to the family of red seaweeds are also not particularly limited.
本発明の第二の血管新生抑制剤に用いられ得る海藻のさらに具体的な例としては、上記本発明の第一の血管新生抑制剤に用いられる海藻と同様のものが包含される。 More specific examples of seaweed that can be used in the second angiogenesis inhibitor of the present invention include those similar to the seaweed used in the first angiogenesis inhibitor of the present invention.
本発明の第一および第二の血管新生抑制剤において、当該抑制剤に用いられる海藻由来の抽出物は、特に限定されないが、例えば、以下のようにして製造される。 In the first and second angiogenesis inhibitors of the present invention, the seaweed-derived extract used for the inhibitor is not particularly limited, and is produced, for example, as follows.
まず、上記海藻を熱水中に所定時間浸漬することにより、熱水粗抽出物が製造される。 First, a hot water crude extract is produced by immersing the seaweed in hot water for a predetermined time.
この浸漬における当該海藻と熱水との量比は特に限定されないが、例えば、海藻100g(乾燥重量)に対して、好ましくは1リットル〜10リットル、より好ましくは2リットル〜5リットルの熱水が使用される。 The quantity ratio between the seaweed and hot water in this immersion is not particularly limited. For example, 1 liter to 10 liters, more preferably 2 liters to 5 liters of hot water is used per 100 g of seaweed (dry weight). used.
使用される熱水の温度(抽出温度)は、好ましくは60℃〜100℃、より好ましくは80℃〜100℃、さらにより好ましくは90℃〜100である。なお、上記海藻を浸漬している間は、本発明に用いられる有効成分がより抽出されやすくする目的で、熱水の温度を低下させることのないよう、当業者に公知の手段を用いて加熱することにより温度を維持することが好ましい。 The temperature (extraction temperature) of the hot water used is preferably 60 ° C to 100 ° C, more preferably 80 ° C to 100 ° C, and even more preferably 90 ° C to 100 ° C. In addition, while the seaweed is immersed, for the purpose of facilitating extraction of the active ingredient used in the present invention, it is heated using means known to those skilled in the art so as not to lower the temperature of hot water. It is preferable to maintain the temperature by doing so.
熱水中に浸漬する時間(抽出時間)は、使用する抽出温度によって変化するため、必ずしも限定されないが、例えば、熱水をほぼ100℃に維持する場合、好ましくは1分〜120分、より好ましくは10分〜60分である。抽出時間をこのような範囲内で行うことにより、本発明に用いられる有効成分がより効率良く抽出され得るとともに、不要物の過度の抽出を防止することができる。 The time of immersion in hot water (extraction time) varies depending on the extraction temperature to be used, and thus is not necessarily limited. For example, when hot water is maintained at approximately 100 ° C., preferably 1 minute to 120 minutes, more preferably Is from 10 to 60 minutes. By performing the extraction time within such a range, the active ingredient used in the present invention can be extracted more efficiently, and excessive extraction of unnecessary materials can be prevented.
上記浸漬の後、例えば、室温まで放冷され、濾過または遠心分離により海藻が取り除かされる。こうして熱水粗抽出物を得ることができる。なお、得られた熱水粗抽出物は、その後、予め不純物を除去する目的で、ヘキサン、クロロホルムなどの有機溶媒と合わせ、有機層が取り除かれた水層由来のものであってもよい。さらに、得られた熱水粗抽出物は、後述の工程に対し、そのまま用いられてもよく、あるいは必要に応じ、当業者に公知の手段を用いて水分を蒸発させた乾固物またはペースト状物の形態で用いられてもよい。 After the immersion, for example, it is allowed to cool to room temperature, and seaweed is removed by filtration or centrifugation. Thus, a hot water crude extract can be obtained. In addition, the obtained hot water crude extract may be derived from an aqueous layer from which the organic layer has been removed by combining with an organic solvent such as hexane or chloroform for the purpose of removing impurities in advance. Further, the obtained hot water crude extract may be used as it is for the steps described below, or, if necessary, a dry solid or a paste obtained by evaporating water using a means known to those skilled in the art. It may be used in the form of a thing.
次いで、当該熱水粗抽出物にC1〜C3アルコールまたはC1〜C3アルコール水溶液が合わされ、好ましくは50(v/v)%以上、より好ましくは60(v/v)%〜98(v/v)%の当該アルコール濃度を有するC1〜C3アルコール液が調製される。ここで、調製され得るC1〜C3アルコール液の濃度は、好ましくはこのような範囲において、当業者によって任意の濃度に設定され得る。すなわち、使用する海藻の種類、使用部位、産地、採取時期、採取後の保存状態等によって、本発明において重要な血管新生を抑制する成分の含量が変動することがある。また、後述する一連の抽出操作においても、得られる成分含量に誤差が生じることもある。よって、当業者は。このような条件に応じて、当該調製され得るアルコール液の濃度を好ましくはこのような範囲内で任意に設定することができる。 Next, the C1-C3 alcohol or the C1-C3 alcohol aqueous solution is combined with the crude hot water extract, preferably 50 (v / v)% or more, more preferably 60 (v / v)% to 98 (v / v). A C1-C3 alcohol solution having a% alcohol concentration is prepared. Here, the concentration of the C1-C3 alcohol solution that can be prepared can be set to any concentration by those skilled in the art, preferably within such a range. That is, the content of components that suppress angiogenesis important in the present invention may vary depending on the type of seaweed used, the site of use, the production area, the collection time, the storage state after collection, and the like. In addition, an error may occur in the obtained component content even in a series of extraction operations described later. Therefore, those skilled in the art. According to such conditions, the concentration of the alcohol solution that can be prepared can be arbitrarily set within this range.
より具体的には、当該熱水粗抽出物を、1個〜3個の炭素原子を有するアルコールまたは所定濃度に調製された1個〜3個の炭素数を有するアルコール水溶液(含水アルコール)と合わすことにより、上記のようなアルコール濃度を有するアルコール液が調製される。このような操作において使用可能な1個〜3個の炭素原子を有するアルコールの例としては、メタノール、エタノールおよびプロパノール、ならびにそれらの組合わせが挙げられる。生体に対する安全性をさらに向上させることを考慮すれば、エタノールを用いることが好ましい。このようなアルコールまたは含水アルコールの使用量は、合わせる熱水粗抽出物の量によって変化するため特に限定されない。 More specifically, the crude hot water extract is combined with an alcohol having 1 to 3 carbon atoms or an aqueous alcohol solution (hydrous alcohol) having 1 to 3 carbon atoms prepared to a predetermined concentration. Thus, an alcohol liquid having the alcohol concentration as described above is prepared. Examples of alcohols having 1 to 3 carbon atoms that can be used in such operations include methanol, ethanol and propanol, and combinations thereof. In consideration of further improving the safety to the living body, it is preferable to use ethanol. The amount of such alcohol or hydrous alcohol used is not particularly limited because it varies depending on the amount of hot water crude extract to be combined.
その後、このC1〜C3アルコール液の上清が分取される。 Thereafter, the supernatant of the C1-C3 alcohol solution is collected.
上記アルコール濃度に設定されたアルコール液を調製することにより、当該アルコール液に不溶な物質が沈殿する場合がある。上清の分取はこの沈殿物を除去する目的で行われ、上清は当業者に周知の方法(例えば、濾過または遠心分離)によって取り出すことができる。 By preparing an alcohol solution set to the alcohol concentration, a substance insoluble in the alcohol solution may precipitate. The supernatant is collected for the purpose of removing this precipitate, and the supernatant can be removed by methods well known to those skilled in the art (for example, filtration or centrifugation).
このようにして本発明に用いられる海藻由来の抽出物を製造することができる。なお、得られた海藻由来の抽出物は、本発明における血管新生抑制作用を高める目的で精製が行われてもよい。この精製は、例えば、上記で得られた上清を、当業者に周知の手段を用いて濃縮することにより濃縮物を得た後、好ましくは40(v/v)%〜90(v/v)%、より好ましくは50(v/v)%〜80(v/v)%のC1〜C3アルコール(好ましくはエタノール)水溶液を用いるカラムに通すことによって行われる。このカラムクロマトグラフィーに有用な吸着剤は、好ましくは芳香族系吸着剤であり、より具体的な例としては、スチレン−ジビニルベンゼン系吸着剤が挙げられる。スチレン−ジビニルベンゼン系吸着剤は、例えば、ダイヤイオンHP20という商品名で三菱化学(株)より市販されている。なお、本発明においては、血管新生抑制作用をさらに高める目的で、上記C1〜C3アルコール水溶液を用いる精製を行う前に、上記カラムに対し、水(例えば、蒸留水)を用いて予備的な精製を行うことが好ましい。さらに、この水を用いる予備的な精製は複数回に分けて行うことが好ましい。 Thus, the seaweed-derived extract used in the present invention can be produced. The obtained seaweed-derived extract may be purified for the purpose of enhancing the anti-angiogenic activity in the present invention. This purification is performed by, for example, concentrating the supernatant obtained above using a means well known to those skilled in the art, and then preferably 40 (v / v)% to 90 (v / v) )%, More preferably 50 (v / v)% to 80 (v / v)%, by passing through a column using an aqueous solution of C1-C3 alcohol (preferably ethanol). The adsorbent useful for this column chromatography is preferably an aromatic adsorbent, and a more specific example is a styrene-divinylbenzene adsorbent. The styrene-divinylbenzene adsorbent is commercially available from Mitsubishi Chemical Corporation under the trade name Diaion HP20, for example. In the present invention, for the purpose of further enhancing the angiogenesis inhibitory effect, preliminary purification using water (for example, distilled water) is performed on the column before the purification using the C1-C3 alcohol aqueous solution. It is preferable to carry out. Further, the preliminary purification using water is preferably performed in a plurality of times.
上記クロマトグラフィーを行うことにより、より血管新生抑制作用が高められた画分を抽出することができる。得られた画分は、本発明の血管新生抑制剤としてそのまま使用することができる。 By performing the chromatography, it is possible to extract a fraction having an enhanced angiogenesis inhibitory effect. The obtained fraction can be used as it is as an angiogenesis inhibitor of the present invention.
本発明の血管新生抑制剤は、経口による投与または摂取を目的としたもの、経皮吸収を目的としたもの、あるいは皮膚外用剤を目的としたもののいずれの目的にも使用することができる。 The angiogenesis inhibitor of the present invention can be used for any purpose, including those intended for oral administration or ingestion, those intended for percutaneous absorption, and those intended for external preparations for skin.
本発明の血管新生抑制剤はまた、有効成分である上記海藻由来の抽出物以外に、目的に応じて他の成分を含有していてもよい。本発明に含有され得る他の成分の例としては、水;アルコール;食肉加工品;米、小麦、トウモロコシ、ジャガイモ、スイートポテト、大豆、コンブ、ワカメ、テングサなどの一般食品材料およびそれらの粉末;デンプン、水飴、乳糖、グルコース、果糖、スクロース、マンニトールなどの糖類;香辛料、甘味料、食用油、ビタミン類などの一般的な食品添加物;界面活性剤;賦形剤;着色料;保存料;コーティング助剤;ラクトース;デキストリン;コーンスターチ;ソルビトール;結晶性セルロース;ポリビニルピロリドン;油分;保湿剤;増粘剤;防腐剤;香料;ならびにこれらの組み合わせが挙げられる。本発明の血管新生抑制剤はさらに、必要に応じて他の薬剤(漢方薬を包含する)を含有していてもよい。このような他の成分および/または他の薬剤の含有量は、特に限定されず、当業者によって適切な量が選択され得る。 The angiogenesis inhibitor of the present invention may also contain other components depending on the purpose in addition to the seaweed-derived extract as an active ingredient. Examples of other ingredients that may be included in the present invention include water; alcohol; processed meat products; rice, wheat, corn, potatoes, sweet potatoes, soy, kombu, wakame, tengusa and other common food materials and their powders; Sugars such as starch, starch syrup, lactose, glucose, fructose, sucrose, mannitol; general food additives such as spices, sweeteners, edible oils, vitamins; surfactants; excipients; coloring agents; preservatives; Coating aids; lactose; dextrin; corn starch; sorbitol; crystalline cellulose; polyvinyl pyrrolidone; oils; moisturizers; thickeners; The angiogenesis inhibitor of the present invention may further contain other drugs (including traditional Chinese medicine) as necessary. The content of such other components and / or other drugs is not particularly limited, and an appropriate amount can be selected by those skilled in the art.
さらに、本発明の血管新生抑制剤は、必ずしもインビボまたはインビトロのいずれに限定されることなく、さらに血管新生に対する抑制作用を発揮させたい任意の用途において広範に利用され得る。すなわち、本発明の血管新生抑制剤は、特に限定されないが、例えば、健康食品などの食品組成物に添加される添加物の一種として使用されてもよく、家畜または養殖魚などの生産分野に利用される飼料組成物として、そのままあるいは他の飼料用材料と組み合わせて使用されてもよく、あるいは医薬品、医薬部外品などの医薬組成物として、そのままあるいは他の医薬組成物と組み合わせて使用されてもよい。 Furthermore, the angiogenesis inhibitor of the present invention is not necessarily limited to in vivo or in vitro, and can be widely used in any application where it is desired to exert an inhibitory effect on angiogenesis. That is, the angiogenesis inhibitor of the present invention is not particularly limited, but may be used, for example, as a kind of additive added to food compositions such as health foods and used in the production field of livestock or farmed fish. The feed composition may be used as it is or in combination with other feed materials, or it may be used as it is or in combination with other pharmaceutical compositions as a pharmaceutical composition such as pharmaceuticals and quasi drugs. Also good.
本発明の血管新生抑制剤が食品組成物として使用される場合、その形態には固定食品に限定されず、飲料(例えば、液体飲料)のようなものを包含される。より具体的な例としては液状、ペースト状、固形状等の形態でなる、茶飲料、コーヒー飲料、清涼飲料、乳飲料、菓子類、シロップ類、果実加工品、野菜加工品、漬物類、畜肉製品、魚肉製品、珍味類、缶・ビン詰類、即席飲食物、内服液、肝油ドロップ、口中清涼剤、ゼリーなどが挙げられるが特にこれらに限定されない。本発明のβ−グルクロニダーゼ阻害剤を含有するこのような食品組成物は、当業者に公知の手法を用いて製造され得る。 When the angiogenesis inhibitor of the present invention is used as a food composition, the form is not limited to a fixed food, but includes a beverage (for example, a liquid beverage). More specific examples include tea drinks, coffee drinks, soft drinks, milk drinks, confectionery, syrups, processed fruit products, processed vegetable products, pickles, and livestock meat in the form of liquids, pastes, solids, etc. Examples include, but are not limited to, products, fish products, delicacies, cans / bottles, instant food / drinks, oral liquids, liver oil drops, mouth fresheners, and jelly. Such a food composition containing the β-glucuronidase inhibitor of the present invention can be produced using techniques known to those skilled in the art.
本発明の血管新生抑制剤が医薬組成物として使用される場合、その投与剤形は特に限定されず、日本薬局方に記載の方法にしたがって適切な剤形に加工される。投与剤形のより具体的な例としては、経口投与を目的とする医薬組成物の場合、カプセル剤、錠剤、粉剤、顆粒剤、細粒剤、徐放剤、液剤などの剤形が挙げられ、そして非経口投与を目的とする医薬組成物の場合、注射剤、輸液剤、点眼剤、軟膏剤、クリーム剤、貼付剤などの剤形が挙げられる。用量は、対象となる者の体重等の条件によって容易に変動し得るため、当業者によって適宜選択され得る。 When the angiogenesis inhibitor of the present invention is used as a pharmaceutical composition, its dosage form is not particularly limited, and is processed into an appropriate dosage form according to the method described in the Japanese Pharmacopoeia. More specific examples of dosage forms include, for pharmaceutical compositions intended for oral administration, dosage forms such as capsules, tablets, powders, granules, fine granules, sustained release agents, and liquids. In the case of pharmaceutical compositions intended for parenteral administration, dosage forms such as injections, infusions, eye drops, ointments, creams, patches and the like can be mentioned. Since the dose can be easily varied depending on conditions such as the body weight of the subject person, it can be appropriately selected by those skilled in the art.
本発明の血管新生抑制剤は、その使用形態に応じて当該分野で通常用いる方法によって製造され、その形態に応じた方法で適宜に適量摂取または適用することができる。 The angiogenesis inhibitor of the present invention can be produced by a method usually used in the field depending on its use form, and can be appropriately ingested or applied by a method according to its form.
以下、本発明を実施例によって具体的に記述する。しかし、これらによって本発明は制限されるものではない。 Hereinafter, the present invention will be described specifically by way of examples. However, the present invention is not limited by these.
<実施例1:アラメ抽出物の製造>
凍結乾燥した100gのアラメをミキサーにかけ、乾燥粉末を調製した。これに、2Lの蒸留水を添加し、100℃にて10分間加熱して抽出を行い、抽出残渣を濾過にて取除いて、熱水粗抽出物(700ml)を得、これにエタノールを添加して90(v/v)%のエタノール液に調製した。
<Example 1: Production of arame extract>
100 g of lyophilized arame was placed in a mixer to prepare a dry powder. To this was added 2 L of distilled water, extraction was performed by heating at 100 ° C. for 10 minutes, and the extraction residue was removed by filtration to obtain a hot water crude extract (700 ml), to which ethanol was added Thus, a 90 (v / v)% ethanol solution was prepared.
その後、得られたエタノール液を濾過して上清のみを取出した。次いで、この上清を減圧濃縮して、350mlのエタノール可溶画分を得た。このエタノール可溶画分を350mlのクロロホルムと合わせ分液抽出して得られた水層のうち、50mlをスチレン−ジビニルベンゼン吸着剤(三菱化学(株)製ダイヤイオンHP20)を含有するカラム(φ3.8cm×30cm)に充填し、溶出液として(A)蒸留水(500ml)、(B)蒸留水(500mL)、(C)30(v/v)%エタノール水溶液(500ml)、(D)60(v/v)%エタノール水溶液(500ml)、および(E)100(v/v)%エタノール(500ml)を用いて順次溶出し、粗画分(A)、(B)、(C)、(D)および(E)をそれぞれ500ml分割収集した。次いで、粗画分(A)、(B)、(C)、(D)および(E)の溶媒をそれぞれ減圧下にて留去した後、再度40mlの蒸留水に溶解または再懸濁して凍結乾燥し、アラメ画分(A)、(B)、(C)、(D)および(E)を得た。 Thereafter, the obtained ethanol solution was filtered to remove only the supernatant. Subsequently, the supernatant was concentrated under reduced pressure to obtain 350 ml of an ethanol-soluble fraction. A column (φ3) containing 50 ml of a styrene-divinylbenzene adsorbent (Diaion HP20 manufactured by Mitsubishi Chemical Corporation) of the aqueous layer obtained by separating and extracting the ethanol soluble fraction with 350 ml of chloroform. (A) Distilled water (500 ml), (B) Distilled water (500 mL), (C) 30 (v / v)% ethanol aqueous solution (500 ml), (D) 60 Elution was successively performed using (v / v)% ethanol aqueous solution (500 ml) and (E) 100 (v / v)% ethanol (500 ml), and crude fractions (A), (B), (C), ( D) and (E) were collected in 500 ml portions. Next, after the solvents of the crude fractions (A), (B), (C), (D) and (E) were distilled off under reduced pressure, they were again dissolved or resuspended in 40 ml of distilled water and frozen. It dried and obtained the lamé fraction (A), (B), (C), (D) and (E).
<実施例2:細胞培養および管腔染色>
血管新生キット(倉敷紡績(株)製Cat No.KZ−1000)を用い、同キットに添付の取扱い説明書にしたがって、以下を行った:まず、同キットの細胞について、輸送中のダメージを回復させるために、この細胞を37℃、5%CO2インキューベーターにて3時間静置した。各ウェルの培地を、培地中の最終濃度が50μg/mlとなるように実施例1で得られたアラメ画分(D)、および培地中の最終濃度が10ng/mlとなるようにVEGF(血管内皮成長因子:Vascular Endothelial Growth Factor)をそれぞれ添加した新たな培地に置き換え、37℃、5%CO2インキュベーターにて培養を行った。培地の交換を、培養開始後、第4日目、第7日目、および第9日目にそれぞれ同様の方法で行った。
<Example 2: Cell culture and luminal staining>
Using an angiogenesis kit (Cat No. KZ-1000 manufactured by Kurashiki Boseki Co., Ltd.), the following was performed according to the instruction manual attached to the kit: First, the cells in the kit were recovered from damage during transportation. The cells were allowed to stand for 3 hours at 37 ° C., 5% CO 2 incubator. The culture medium in each well was mixed with the arame fraction (D) obtained in Example 1 so that the final concentration in the medium was 50 μg / ml, and VEGF (blood vessel so that the final concentration in the medium was 10 ng / ml. The medium was replaced with a fresh medium supplemented with endothelial growth factor (Vascular Endothelial Growth Factor), and cultured in a 37 ° C., 5% CO 2 incubator. The medium was changed in the same manner on the fourth day, the seventh day, and the ninth day after the start of the culture.
培養開始後第11日目に、上記ウェルに対し、管腔染色キット(CD31染色用)(倉敷紡績(株)製Cat No.KZ−1225)を用いた染色を以下のようにして行った:まず、上記ウェルから培地を除去し、ダルベッコリン酸緩衝液PBS(−)1mlで細胞を洗浄した後、氷冷70%メタノール1mlを各ウェルに添加し、室温で30分間静置することにより細胞を固定した。次いで、エタノールを除去した後、1%BSAを含むPBS(−)(以下、ブロッキング剤という)1mlを各ウェルに添加し、細胞を洗浄した。さらに、ブロッキング剤で4000倍まで希釈した1次抗体0.5mlを各ウェルに添加し、37℃で60分間インキュベートした。1次抗体を除去し、ブロッキング剤で細胞を3回洗浄した後、ブロッキング剤で500倍にまで希釈した2次抗体0.5mlを各ウェルに添加し、37℃で60分間インキュベートした。インキュベート後、2次抗体を除去し、各ウェルを1mlのミリQ水で3回洗浄した。 On day 11 after the start of culture, the wells were stained with a luminal staining kit (for CD31 staining) (Katashibo Industries, Ltd. Cat No. KZ-1225) as follows: First, after removing the medium from the wells and washing the cells with 1 ml of Dulbecco's phosphate buffer PBS (−), 1 ml of ice-cold 70% methanol was added to each well and left at room temperature for 30 minutes to leave the cells. Fixed. Next, after removing ethanol, 1 ml of PBS (-) containing 1% BSA (hereinafter referred to as a blocking agent) was added to each well to wash the cells. Further, 0.5 ml of a primary antibody diluted to 4000 times with a blocking agent was added to each well and incubated at 37 ° C. for 60 minutes. After removing the primary antibody and washing the cells three times with a blocking agent, 0.5 ml of a secondary antibody diluted 500-fold with the blocking agent was added to each well and incubated at 37 ° C. for 60 minutes. After incubation, the secondary antibody was removed and each well was washed 3 times with 1 ml of milliQ water.
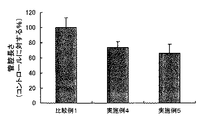
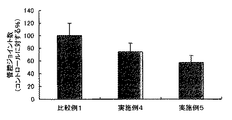
他方、2錠のBCIP/NBT(ブロモクロロインドリルリン酸/ニトロブルーテトラゾリウム)を20mlのミリQ水に溶解し、濾過した溶液を基質溶液とした。上記ウェルに、この基質溶液を0.5mlづつ添加し、管腔が深紫色になるまで(約10分間)37℃でインキュベートした。基質溶液を除去し、各ウェルを1mlのミリQ水で3回洗浄した後、プレートをそのまま静置して自然乾燥した。1ウェルあたり、の代表的な3視野をデジタルスチルカメラを備える倒立顕微鏡((株)ニコン製DIAPHOT−TMD)を用い、倍率40倍で撮影し、その画像を専用の解析ソフト(倉敷紡績(株)製血管新生定量ソフト)に取り込んで、当該画像内に存在する血管の管腔長さ、管腔面積、管腔ジョイント数(分岐点の数)および管腔パス数(分岐して得られた枝の数)の解析を行った。得られた、当該長さ、面積、ジョイント数およびパス数について、後述の比較例1(コントロール)で得られた結果を100%として再計算を行った。 On the other hand, two tablets of BCIP / NBT (bromochloroindolyl phosphate / nitroblue tetrazolium) were dissolved in 20 ml of milli-Q water, and the filtered solution was used as a substrate solution. 0.5 ml of this substrate solution was added to the wells and incubated at 37 ° C. until the lumen became deep purple (about 10 minutes). The substrate solution was removed and each well was washed three times with 1 ml of milliQ water, and then the plate was left to stand and air dried. Using a inverted microscope equipped with a digital still camera (DIAPHOT-TMD manufactured by Nikon Corporation), three representative fields per well were photographed at a magnification of 40 times, and the images were analyzed using dedicated analysis software (Kurashiki Spinning Co., Ltd.) ) Angiogenesis quantification software), and the lumen length, lumen area, number of lumen joints (number of branch points) and number of lumen paths (obtained by branching) in the image The number of branches was analyzed. The obtained length, area, number of joints, and number of passes were recalculated with the result obtained in Comparative Example 1 (control) described later as 100%.
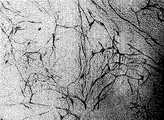
本実施例で得られた画像を示す写真を図1に示す。また、コントロールに対して得られた、当該画像が示す、管腔長さ、管腔面積、管腔ジョイント数および管腔パス数の結果をそれぞれ図4〜図7に示す。 A photograph showing an image obtained in this example is shown in FIG. In addition, the results of the lumen length, the lumen area, the number of lumen joints, and the number of lumen paths, which are obtained for the control and indicated by the image, are shown in FIGS. 4 to 7, respectively.
<実施例3:細胞培養および管腔染色>
各ウェルの培地に対し、培地中の最終濃度が5μg/mlとなるように実施例1で得られたアラメ画分(D)、および培地中の最終濃度が10ng/mlとなるようにVEGFをそれぞれ添加した培地を用いたこと以外は、実施例2と同様にしてインキュベートおよび管腔染色を行った。
<Example 3: Cell culture and luminal staining>
For the medium in each well, add the lamé fraction (D) obtained in Example 1 so that the final concentration in the medium is 5 μg / ml, and VEGF so that the final concentration in the medium is 10 ng / ml. Incubation and luminal staining were performed in the same manner as in Example 2 except that each of the added media was used.
本実施例で得られた顕微鏡写真を図2に示す。また、コントロールに対して得られた、当該画像が示す、管腔長さ、管腔面積、管腔ジョイント数および管腔パス数の結果をそれぞれ図4〜図7に示す。 A photomicrograph obtained in this example is shown in FIG. In addition, the results of the lumen length, the lumen area, the number of lumen joints, and the number of lumen paths, which are obtained for the control and indicated by the image, are shown in FIGS. 4 to 7, respectively.
<比較例1:細胞培養および管腔染色>
各ウェルの培地に対し、実施例1で得られたアラメ画分(D)を含有させることなく、培地中の最終濃度が10ng/mlとなるようにVEGFを添加した培地(コントロール)を用いたこと以外は、実施例2と同様にしてインキュベートおよび管腔染色を行った。
<Comparative Example 1: Cell culture and luminal staining>
A medium (control) to which VEGF was added so that the final concentration in the medium was 10 ng / ml was used without containing the alame fraction (D) obtained in Example 1 for the medium in each well. Except that, incubation and luminal staining were performed in the same manner as in Example 2.
本比較例で得られた画像を示す写真を図3に示す。また、本比較例(コントロール)で得られた、当該画像が示す、管腔長さ、管腔面積、管腔ジョイント数および管腔パス数をそれぞれ100%とした際の結果を図4〜図7に示す。 A photograph showing an image obtained in this comparative example is shown in FIG. In addition, the results obtained in this comparative example (control) shown in the image, when the lumen length, the lumen area, the number of lumen joints, and the number of lumen paths are 100%, are shown in FIGS. 7 shows.
図1〜図3に示されるように、コントロールの培地を用いた比較例1の顕微鏡写真では、一連のインキュベートを行うことにより、ウェル内に血管(図中、複雑に分岐した枝状のもの)が新たに多く形成されているのに対し、実施例2(図1)および実施例3(図2)の顕微鏡写真によれば、そのような枝状のものがほとんど形成されていない。このことから、本実施例に用いたアラメ画分(D)は、血管新生に対してその新生を抑制する効果を有していることがわかる。特に、実施例3(培地最終濃度5μg/ml)に対して、より高濃度(培地最終濃度50μg/ml)に設定された実施例2では、血管新生がほとんど生じておらず、血管新生に対する抑制効果がより高められていたことがわかる。 As shown in FIGS. 1 to 3, in the photomicrograph of Comparative Example 1 using a control medium, blood vessels (branches in a complicated branch in the figure) were formed in the well by performing a series of incubations. However, according to the micrographs of Example 2 (FIG. 1) and Example 3 (FIG. 2), such a branch is hardly formed. From this, it can be seen that the alame fraction (D) used in this example has an effect of suppressing the neovascularization. In particular, in Example 2 set to a higher concentration (final medium concentration 50 μg / ml) than in Example 3 (final medium concentration 5 μg / ml), almost no angiogenesis occurred, and angiogenesis was suppressed. It turns out that the effect was improved more.
また、図4〜図7に示されるように、実施例2および3で使用したアラメ画分(D)は、コントロール(比較例1)に対して、血管の管腔長さ、管腔面積、管腔ジョイント数、および管腔パス数のいずれにおいても低い値を示しており、充分な血管新生抑制効果を有していることがわかる。さらに、上記顕微鏡写真と同様、アラメ画分(D)の濃度を高くするほど、管腔長さ、管腔面積、管腔ジョイント数および管腔パス数のいずれにおいても、その値は低減する傾向にあることもわかる。 Moreover, as shown in FIGS. 4 to 7, the alame fraction (D) used in Examples 2 and 3 was compared to the control (Comparative Example 1), the lumen length of the blood vessel, the lumen area, Both the number of luminal joints and the number of luminal paths show low values, which indicates that they have a sufficient anti-angiogenic effect. Further, as in the above micrograph, the higher the concentration of the lamé fraction (D), the lower the value in any of the lumen length, lumen area, number of lumen joints and number of lumen paths. You can also see that
<実施例4:アラメ抽出物の製造>
凍結乾燥した100gのアラメをミキサーにかけ、乾燥粉末を調製した。これに、2Lの蒸留水を添加し、100℃にて10分間加熱して抽出を行い、抽出残渣を濾過にて取除いて、熱水粗抽出物(700ml)を得た。次いで、得られた熱水粗抽出物のうち、ビーカーに取分けた100mlの当該抽出液に、これにエタノールを添加して90(v/v)%のエタノール液に調製した。
<Example 4: Production of arame extract>
100 g of lyophilized arame was placed in a mixer to prepare a dry powder. To this was added 2 L of distilled water, extraction was performed by heating at 100 ° C. for 10 minutes, and the extraction residue was removed by filtration to obtain a crude hot water extract (700 ml). Next, among the obtained hot water crude extract, ethanol was added to 100 ml of the extract extracted in a beaker to prepare a 90 (v / v)% ethanol solution.
その後、得られたエタノール液を濾過して上清のみを取出した。次いで、この上清を減圧濃縮かつ凍結乾燥して、0.9gのエタノール可溶画分(F)を得た。 Thereafter, the obtained ethanol solution was filtered to remove only the supernatant. Then, the supernatant was concentrated under reduced pressure and lyophilized to obtain 0.9 g of an ethanol-soluble fraction (F).
血管新生キット(倉敷紡績(株)製Cat No.KZ−1000)を用い、同キットに添付の取扱い説明書にしたがって、以下を行った:まず、同キットの細胞について、輸送中のダメージを回復させるために、この細胞を37℃、5%CO2インキューベーターにて3時間静置した。各ウェルの培地を、培地中の最終濃度が50μg/mlとなるように上記で得られたエタノール画分(F)、および培地中の最終濃度が10ng/mlとなるようにVEGF(血管内皮成長因子:Vascular Endothelial Growth Factor)をそれぞれ添加した新たな培地に置き換え、37℃、5%CO2インキュベーターにて培養を行った。培地の交換を、培養開始後、第4日目、第7日目、および第9日目にそれぞれ同様の方法で行った。 Using an angiogenesis kit (Cat No. KZ-1000 manufactured by Kurashiki Boseki Co., Ltd.), the following was performed according to the instruction manual attached to the kit: First, the cells in the kit were recovered from damage during transportation. The cells were allowed to stand for 3 hours at 37 ° C., 5% CO 2 incubator. The medium in each well was divided into the ethanol fraction (F) obtained above so that the final concentration in the medium was 50 μg / ml, and VEGF (vascular endothelial growth) so that the final concentration in the medium was 10 ng / ml. The medium was replaced with a fresh medium supplemented with each factor (Vascular Endothelial Growth Factor), and cultured in a 37 ° C., 5% CO 2 incubator. The medium was changed in the same manner on the fourth day, the seventh day, and the ninth day after the start of the culture.
培養開始後第11日目に、上記ウェルに対し、管腔染色キット(CD31染色用)(倉敷紡績(株)製Cat No.KZ−1225)を用いた染色を以下のようにして行った:まず、上記ウェルから培地を除去し、ダルベッコリン酸緩衝液PBS(−)1mlで細胞を洗浄した後、氷冷70%メタノール1mlを各ウェルに添加し、室温で30分間静置することにより細胞を固定した。次いで、エタノールを除去した後、1%BSAを含むPBS(−)(以下、ブロッキング剤という)1mlを各ウェルに添加し、細胞を洗浄した。さらに、ブロッキング剤で4000倍まで希釈した1次抗体0.5mlを各ウェルに添加し、37℃で60分間インキュベートした。1次抗体を除去し、ブロッキング剤で細胞を3回洗浄した後、ブロッキング剤で500倍にまで希釈した2次抗体0.5mlを各ウェルに添加し、37℃で60分間インキュベートした。インキュベート後、2次抗体を除去し、各ウェルを1mlのミリQ水で3回洗浄した。 On day 11 after the start of culture, the wells were stained with a luminal staining kit (for CD31 staining) (Katashibo Industries, Ltd. Cat No. KZ-1225) as follows: First, after removing the medium from the wells and washing the cells with 1 ml of Dulbecco's phosphate buffer PBS (−), 1 ml of ice-cold 70% methanol was added to each well and left at room temperature for 30 minutes to leave the cells. Fixed. Next, after removing ethanol, 1 ml of PBS (-) containing 1% BSA (hereinafter referred to as a blocking agent) was added to each well to wash the cells. Further, 0.5 ml of a primary antibody diluted to 4000 times with a blocking agent was added to each well and incubated at 37 ° C. for 60 minutes. After removing the primary antibody and washing the cells three times with a blocking agent, 0.5 ml of a secondary antibody diluted 500-fold with the blocking agent was added to each well and incubated at 37 ° C. for 60 minutes. After incubation, the secondary antibody was removed and each well was washed 3 times with 1 ml of milliQ water.
他方、2錠のBCIP/NBT(ブロモクロロインドリルリン酸/ニトロブルーテトラゾリウム)を20mlのミリQ水に溶解し、濾過した溶液を基質溶液とした。上記ウェルに、この基質溶液を0.5mlづつ添加し、管腔が深紫色になるまで(約10分間)37℃でインキュベートした。基質溶液を除去し、各ウェルを1mlのミリQ水で3回洗浄した後、プレートをそのまま静置して自然乾燥した。1ウェルあたり、の代表的な3視野をデジタルスチルカメラを備える倒立顕微鏡((株)ニコン製DIAPHOT−TMD)を用い、倍率40倍で撮影し、その画像を専用の解析ソフト(倉敷紡績(株)製血管新生定量ソフト)に取り込んで、当該画像内に存在する血管の管腔長さ、管腔面積、管腔ジョイント数(分岐点の数)および管腔パス数(分岐して得られた枝の数)の解析を行った。得られた、当該長さ、面積、ジョイント数およびパス数について、上記比較例1(コントロール)で得られた結果を100%として再計算を行った。 On the other hand, two tablets of BCIP / NBT (bromochloroindolyl phosphate / nitroblue tetrazolium) were dissolved in 20 ml of milliQ water, and the filtered solution was used as a substrate solution. 0.5 ml of this substrate solution was added to the wells and incubated at 37 ° C. until the lumen became deep purple (about 10 minutes). The substrate solution was removed and each well was washed three times with 1 ml of milliQ water, and then the plate was left to stand and air dried. Using a inverted microscope equipped with a digital still camera (DIAPHOT-TMD manufactured by Nikon Corporation), three representative fields per well were photographed at a magnification of 40 times, and the images were analyzed using dedicated analysis software (Kurashiki Spinning Co., Ltd.) ) Angiogenesis quantification software), and the lumen length, lumen area, number of lumen joints (number of branch points) and number of lumen paths (obtained by branching) in the image The number of branches was analyzed. The obtained length, area, number of joints, and number of passes were recalculated with the result obtained in Comparative Example 1 (control) as 100%.
コントロールに対する、本実施例で得られた画像が示す、管腔長さ、管腔面積、管腔ジョイント数および管腔パス数の結果をそれぞれ図8〜図11に示す。 The results of the lumen length, the lumen area, the number of lumen joints, and the number of lumen paths shown in the images obtained in this example with respect to the control are shown in FIGS.
<実施例5:アラメ抽出物の製造>
凍結乾燥した100gのアラメをミキサーにかけ、乾燥粉末を調製した。これに、2Lの蒸留水を添加し、100℃にて10分間加熱して抽出を行い、抽出残渣を濾過にて取除いて、熱水粗抽出物(700ml)を得た。次いで、得られた熱水粗抽出物のうち、ビーカーに取分けた100mlの当該抽出液、これにエタノールを添加して60(v/v)%のエタノール液に調製した。
<Example 5: Production of arame extract>
100 g of lyophilized arame was placed in a mixer to prepare a dry powder. To this was added 2 L of distilled water, extraction was performed by heating at 100 ° C. for 10 minutes, and the extraction residue was removed by filtration to obtain a crude hot water extract (700 ml). Next, of the obtained hot water crude extract, 100 ml of the extracted solution separated in a beaker, and ethanol was added thereto to prepare a 60 (v / v)% ethanol solution.
その後、得られたエタノール液を濾過して上清のみを取出した。次いで、この上清を減圧濃縮かつ凍結乾燥して、1.2gのエタノール可溶画分(G)を得た。 Thereafter, the obtained ethanol solution was filtered to remove only the supernatant. Subsequently, the supernatant was concentrated under reduced pressure and freeze-dried to obtain 1.2 g of an ethanol-soluble fraction (G).
エタノール可溶画分(F)の代わりに、このエタノール可溶画分(G)を用い、各ウェルの培地に対し、培地中の最終濃度が50μg/mlとなるように当該エタノール可溶画分(G)、および培地中の最終濃度が10ng/mlとなるようにVEGFをそれぞれ添加した培地を用いたこと以外は、実施例4と同様にしてインキュベートおよび管腔染色を行った。 This ethanol soluble fraction (G) is used instead of the ethanol soluble fraction (F), and the ethanol soluble fraction is adjusted so that the final concentration in the medium is 50 μg / ml with respect to the medium in each well. Incubation and luminal staining were performed in the same manner as in Example 4 except that (G) and a medium to which VEGF was added so that the final concentration in the medium was 10 ng / ml were used.
コントロールに対する、本実施例で得られた画像が示す、管腔長さ、管腔面積、管腔ジョイント数および管腔パス数の結果をそれぞれ図8〜図11に示す。 The results of the lumen length, the lumen area, the number of lumen joints, and the number of lumen paths shown in the images obtained in this example with respect to the control are shown in FIGS.
図8〜図11に示されるように、実施例4および5で使用したエタノール可溶画分(F)および(G)は、コントロール(比較例1)に対して、血管の管腔長さ、管腔面積、管腔ジョイント数、および管腔パス数のいずれにおいても低い値を示しており、充分な血管新生抑制効果を有していることがわかる。 As shown in FIGS. 8 to 11, the ethanol-soluble fractions (F) and (G) used in Examples 4 and 5 were compared to the control (Comparative Example 1), the lumen length of the blood vessel, A low value is shown in any of the luminal area, the luminal joint number, and the luminal path number, and it can be seen that it has a sufficient anti-angiogenic effect.
<実施例6:フロロタンニンの定量>
実施例1で得られたアラメ画分(A)〜(E)、ならびに実施例4および5で得られたエタノール可溶画分(F)および(G)、をそれぞれ100mgづつ正確に量りとり、各画分の総フロロタンニン量を、フロログルシノールを標準物質として用いるFolin−Denis法(日本食品科学工学会誌,2002年,第49巻,pp.507−511)により測定した。得られたそれぞれの総フロロタンニン量(%)を表1および表2に示す。
<Example 6: Quantification of fluorotannin>
Alame fractions (A) to (E) obtained in Example 1 and ethanol soluble fractions (F) and (G) obtained in Examples 4 and 5 were accurately weighed in 100 mg each, The total amount of phlorotannins in each fraction was measured by the Folin-Denis method using phloroglucinol as a standard substance (Journal of Japan Society for Food Science and Technology, Vol. 49, pp. 507-511). Table 1 and Table 2 show the total amount (%) of each obtained fluorotannin.
表1に示されるように、実施例1で得られたアラメ画分(A)〜(E)はいずれもフロロタンニンが含まれている一方で、その含有量は画分によって著しく異なっていることがわかる。特に、このアラメ画分(D)の結果と、実施例2で得られた顕微鏡写真(図1および図2)、ならびに管腔長さ、管腔面積、管腔ジョイント数および管腔パス数の結果を考慮すれば、上記で示された血管新生抑制効果は、アラメ画分(D)に主成分として含まれるフロロタンニンが大きく寄与している可能性が考えられる。また、表2に示されるように、エタノール可溶画分を得るために、上記熱水粗抽出物にエタノールを添加して調製されるエタノール液は、その調製濃度が特に60(v/v)%〜98(v/v)%の範囲内にある(実施例4は90(v/v)%に、実施例5は60(v/v)%に調製された)場合、いずれもエタノール可溶画分の重量を基準として、すでに20重量%近くもの高い割合で含まれていることがわかる。 As shown in Table 1, all of the lamée fractions (A) to (E) obtained in Example 1 contain phlorotannins, but their contents differ markedly depending on the fractions. I understand. In particular, the results of this alame fraction (D) and the micrographs obtained in Example 2 (FIGS. 1 and 2), as well as the lumen length, lumen area, number of lumen joints and number of lumen passes. Considering the results, it is considered that the angiogenesis inhibitory effect shown above may be largely contributed by fluorotannin contained as a main component in the alame fraction (D). Moreover, as shown in Table 2, in order to obtain an ethanol-soluble fraction, an ethanol solution prepared by adding ethanol to the hot water crude extract has a preparation concentration of particularly 60 (v / v). % To 98 (v / v)% (Example 4 prepared to 90 (v / v)%, Example 5 prepared to 60 (v / v)%) It can be seen that it is already contained at a high rate of nearly 20% by weight based on the weight of the melt fraction.
<実施例7:食品組成物の調製>
上記実施例1で得られたアラメ画分(D)を用いて、以下の組成を有する食品組成物を調製した。
<Example 7: Preparation of food composition>
A food composition having the following composition was prepared using the alame fraction (D) obtained in Example 1 above.
成分 重量(g)
アラメ画分(D) 0.6
大豆サポニン 2.0
黒酢エキス 2.0
リンゴファイバー 2.0
レシチン 1.0
フラクトオリゴ糖 2.0
果糖 1.0
粉末酢 0.1
シクロデキストリン 1.0
蜂蜜 1.0
骨粉 1.0
デキストリン 4.9。
Ingredient Weight (g)
Alame fraction (D) 0.6
Soy Saponin 2.0
Black vinegar extract 2.0
Apple fiber 2.0
Lecithin 1.0
Fructooligosaccharide 2.0
Fructose 1.0
Powdered vinegar 0.1
Cyclodextrin 1.0
Honey 1.0
Bone meal 1.0
Dextrin 4.9.
各成分を流動造粒機中で混合した後、水を噴霧して造粒を行い、入風温度80℃で乾燥して、顆粒状食品を得た。 Each component was mixed in a fluid granulator, granulated by spraying water, and dried at an inlet temperature of 80 ° C. to obtain a granular food product.
本発明の血管新生抑制剤は、食品として広く用いられ得る海藻に由来する抽出物を有効成分として含有するため、安全性が高く、日常的な使用が可能であり、食品分野、医薬分野などの種々の分野における汎用性を高めることができる。本発明の血管新生抑制剤はまた、生体内の血管新生を抑制する効果を有するため、糖尿病性網膜症、黄斑変性症、網膜静脈閉鎖症、網膜動脈閉鎖症等の網膜疾患、新生血管性緑内障、リュウマチ、リュウマチ性関節炎、乾癬等の各種炎症性疾患、アテローム性動脈硬化症、固形腫瘍(胃癌、大腸癌、肺癌、膵臓癌等)の増殖・転移、心筋梗塞等の病的状態に対する予防または治療の目的に利用することができる。 Since the angiogenesis inhibitor of the present invention contains an extract derived from seaweed that can be widely used as food as an active ingredient, it is highly safe and can be used on a daily basis. The versatility in various fields can be improved. Since the angiogenesis inhibitor of the present invention also has an effect of suppressing angiogenesis in vivo, retinal diseases such as diabetic retinopathy, macular degeneration, retinal vein occlusion, retinal artery occlusion, and neovascular glaucoma Prevention of pathological conditions such as rheumatism, rheumatoid arthritis, various inflammatory diseases such as psoriasis, atherosclerosis, proliferation / metastasis of solid tumors (gastric cancer, colon cancer, lung cancer, pancreatic cancer, etc.), myocardial infarction It can be used for therapeutic purposes.
Claims (10)
褐藻類こんぶ目こんぶ科のマコンブ(Laminaria japonica)、褐藻類こんぶ目ちがいそ科のアラメ(Eisenia bicyclis)、サガラメ(Eisenia arborea)、ツルアラメ(Ecklonia stlonifera)、クロメ(Ecklonia kurome)、カジメ(Ecklonia cava)、ワカメ(Undaria pinnatifida)、アオワカメ(Undaria peterseniana)、ヒロメ(Undaria undarioides)、アイヌワカメ(Alaria praelomga)、およびチガイソ(Alaria crassifolia);褐藻類ひばまた目ほんだわら科のホンダワラ(Sargassum fuluvellum)、ヒジキ(Hizikia fusiforme)、およびアカモク(Sargassum horneri);褐藻類まがまつも目もずく科のモズク(Nemacystus decipieus)およびオキナワモズク(Cladosiphon okamuranus);および、紅藻類スギノリ目すぎのり科に属する海藻;からなる群より選択される少なくとも1種の海藻を、60℃から100℃の熱水中で抽出して熱水粗抽出物を得る工程;
該熱水粗抽出物に、C1〜C3アルコールまたはC1〜C3アルコール水溶液と合わせて、50(v/v)%以上の該アルコールを含有するC1〜C3アルコール液を得る工程;ならびに
該C1〜C3アルコール液の上清を分取する工程;
を包含する、方法。 A method for producing an angiogenesis inhibitor,
Brown algae (Epidonia varneur), brown algae (Eisenia biloclis), brown turtle (Eisenia arborea) , Sea turtles (Undaria pinnatifida), green sea turtles (Undaria peterseniana), white turtles (Undaria unisariidae), brown turtles Ikia fusiforme, and the red seaweed (Sargassum horneri); the brown alga (Megatus decipius) and the red seaweed (Cladosifon okamuranus); Extracting at least one selected seaweed from hot water at 60 ° C. to 100 ° C. to obtain a hot water crude extract;
Combining the C1 to C3 alcohol or the C1 to C3 alcohol aqueous solution with the hot water crude extract to obtain a C1 to C3 alcohol liquid containing 50% (v / v)% or more of the alcohol; and the C1 to C3 Separating the supernatant of the alcohol solution;
Including the method.
The method according to claim 9, wherein the column contains a styrene-divinylbenzene adsorbent.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004200790A JP2006022033A (en) | 2004-07-07 | 2004-07-07 | Neovascularization inhibitor |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004200790A JP2006022033A (en) | 2004-07-07 | 2004-07-07 | Neovascularization inhibitor |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2006022033A true JP2006022033A (en) | 2006-01-26 |
| JP2006022033A5 JP2006022033A5 (en) | 2007-08-02 |
Family
ID=35795571
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2004200790A Pending JP2006022033A (en) | 2004-07-07 | 2004-07-07 | Neovascularization inhibitor |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP2006022033A (en) |
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2007217339A (en) * | 2006-02-16 | 2007-08-30 | Kanehatsu Foods Co Ltd | Anti-allergic substance |
| JP2008214245A (en) * | 2007-03-02 | 2008-09-18 | Nagase & Co Ltd | Aldose reductase inhibitor and method for producing the same |
| US8722098B2 (en) * | 2007-09-06 | 2014-05-13 | Pukyong National University Industry-Academic Cooperation | Ecklonia cava extracts for alleviating or preventing asthmatic reactions |
| US20140377305A1 (en) * | 2012-04-02 | 2014-12-25 | Maruhachi Muramatsu, Inc. | Method for treating disease associated with transcription activation by nf-kb |
| KR101516317B1 (en) * | 2012-09-27 | 2015-04-30 | 재단법인 제주테크노파크 | Anti-inflammatory Composition Using an Extract of Undariopsis peterseniana |
| JP2019081734A (en) * | 2017-10-31 | 2019-05-30 | 日本メナード化粧品株式会社 | Wnt EXPRESSION INHIBITOR |
-
2004
- 2004-07-07 JP JP2004200790A patent/JP2006022033A/en active Pending
Non-Patent Citations (1)
| Title |
|---|
| JPN6010058469, Koyanagi,Satoru et al, "Oversulfation of fucoidan enhances its anti−angiogenic and antitumor activities", Biochemical Pharmacology, 2003, 65(2), pp.173−179 * |
Cited By (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2007217339A (en) * | 2006-02-16 | 2007-08-30 | Kanehatsu Foods Co Ltd | Anti-allergic substance |
| JP2008214245A (en) * | 2007-03-02 | 2008-09-18 | Nagase & Co Ltd | Aldose reductase inhibitor and method for producing the same |
| US8722098B2 (en) * | 2007-09-06 | 2014-05-13 | Pukyong National University Industry-Academic Cooperation | Ecklonia cava extracts for alleviating or preventing asthmatic reactions |
| US20140377305A1 (en) * | 2012-04-02 | 2014-12-25 | Maruhachi Muramatsu, Inc. | Method for treating disease associated with transcription activation by nf-kb |
| US10463705B2 (en) * | 2012-04-02 | 2019-11-05 | Maruhachi Muramatsu, Inc. | Method for treating disease associated with transcription activation by NF-κB |
| KR101516317B1 (en) * | 2012-09-27 | 2015-04-30 | 재단법인 제주테크노파크 | Anti-inflammatory Composition Using an Extract of Undariopsis peterseniana |
| JP2019081734A (en) * | 2017-10-31 | 2019-05-30 | 日本メナード化粧品株式会社 | Wnt EXPRESSION INHIBITOR |
| JP7152737B2 (en) | 2017-10-31 | 2022-10-13 | 日本メナード化粧品株式会社 | Wnt expression inhibitor |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4538338B2 (en) | β-glucuronidase inhibitor | |
| JP6046056B2 (en) | Olive extract containing derhamnosylacteoside | |
| JP2003135028A (en) | Functional food for health | |
| JP2006022033A (en) | Neovascularization inhibitor | |
| KR20170109703A (en) | A pharmaceutical composition for preventing or treating cancer comprising fractions of herbal mixture extract | |
| JP2006241039A (en) | Urease inhibitor | |
| CA2548899A1 (en) | Marine algae extract and lipase inhibitor containing the same | |
| JP4720504B2 (en) | Plant seed extract composition and method for producing the same | |
| KR101768084B1 (en) | Extract of ginseng and method of preparing the same | |
| JP2008214245A (en) | Aldose reductase inhibitor and method for producing the same | |
| JP2006219376A (en) | Urease inhibitor | |
| JP2008214246A (en) | Age production inhibitor and method for producing the same | |
| JP4789453B2 (en) | Anthocyanin absorption promoter | |
| JP2006016340A (en) | Blood uric acid level reduction agent having extract of punica granatum l. as active ingredient | |
| KR20180128781A (en) | A method for manufacturing kolaviron | |
| KR102336045B1 (en) | Novel compound and composition comprising the same for preventing or treating cancer | |
| JP5749469B2 (en) | Antihypertensive | |
| KR20180024614A (en) | Anti-Hyperlipidemic or Anti-Obesity Composition Using Myrciaphenone A | |
| KR101830567B1 (en) | Anti-Hyperlipidemic or Anti-Obesity Composition Using trans-nerolidol | |
| JP2017192312A (en) | Food and drink comprising tomatoside a and used for inhibiting increased blood glucose | |
| JP5016200B2 (en) | A composition for preventing and / or treating a tumor, comprising a material derived from acacia bark | |
| KR20150048698A (en) | Composition Comprising Water Extracts from Pleurotus eryngii var. ferulea (Pf.). for Treating or Preventing hyperlipidemia | |
| KR20160015676A (en) | Anti-atopy composition comprising mojabanchromanol b as active ingredient and method for preparing the same | |
| KR20130099467A (en) | Food composition for preventing or improving diabetes contaning extract of lespedeza daurica | |
| KR20130099476A (en) | Food composition for preventing or improving diabetes contaning extract of lespedeza maximowiczii |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20070618 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20070618 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20101109 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20110420 |