【0001】
【発明の属する技術分野】
本発明は、水不溶性のカルボキシメチルセルロース架橋体およびその製造方法に関する。
【0002】
【従来の技術】
カルボキシメチルセルロース(CMC)は、セルロールの多価カルボキシメチルエーテルであり、食品及び医薬品への添加が公的に認められた安全性の高い材料である。その性質はカルボキシメチル基の置換度によって異なるが、現在、上記の用途で市販されている置換度0.5以上のカルボキシメチルセルロースはいずれも水に可溶であるため、体内埋め込み用途で使用される医療用具のような、湿潤環境下で使用される有形材料として用いる場合には、通常架橋することが必要となる。カルボキシメチルセルロースの架橋方法としては、酸存在下で多官能性エポキシ化合物と反応させる方法(特許文献1参照)、活性化剤存在下で多官能性アミン化合物と反応させる方法(特許文献2参照)、活性化剤を単独で作用させ内部エステル結合を形成させる方法(特許文献3参照)が開示されている。また、カルボキシメチルセルロースに多価金属イオンを添加することにより、配位結合による架橋が形成されることも公知である。しかしながら、多官能性化合物や多価金属イオンを用いる方法では、これらの物質が架橋剤として架橋体に残留することになり、架橋体の分解に伴い溶出してくるという欠点があった。また、活性化剤を単独で作用させる方法も、活性化剤やその反応副生成物が、洗浄によっては除去できない、化学的に結合した状態で架橋体に残留する可能性が否定できなかった。このように従来カルボキシメチルセルロースの有形材料を得るために架橋させる方法には、架橋剤、活性化剤、多価金属イオン、反応副生成物の残留という、安全面での課題が残されていた。
架橋剤、活性化剤、多官能性化合物、または多価金属イオンを用いることなしに、水溶性の高分子有機化合物から、有形の医療用の身体埋入材を得る方法として、ポリビニルアルコールの水溶液を凍結させて、次いで解凍させることで高含水性ゲルを得る方法が開示されている(特許文献4参照)。また、ポリビニルアルコールを凍結解除(融解)することで医用材料に利用可能な含水ゲルを得る方法が開示されている(特許文献5参照)。また、ヒアルロン酸および高分子化合物を含有するpH3.5以下の水溶液または分散液を凍結し、次いで解凍することで生体適合性の良好な医用材料に利用可能なヒアルロン酸ゲル組成物を得る方法が開示されている(特許文献6参照)。この方法では、ヒアルロン酸ゲル組成物に含まれる高分子化合物としてカルボキシメチルセルロースをあげており、実施例10では、カルボキシメチルセルロースの硝酸水溶液を凍結し、解凍することでスポンジ状のカルボキシメチルセルロースゲルを得ている。しかし、ここで記載されたカルボキシメチルセルロースゲルは、水に対する溶解性が非常に高く、硝酸水溶液を除去するための水洗すら不可能なものであり、得られたカルボキシメチルセルロースゲルを、その後同質量のヒアルロン酸ゲルと混合してスラリー溶液とし、自然乾燥してフィルム状のヒアルロン酸ゲル組成物として用いている。
【0003】
【特許文献1】
特開昭61−502729号公報
【特許文献2】
特開2001−501228号公報
【特許文献3】
特開平2−504163号公報
【特許文献4】
特開平5−111531号公報
【特許文献5】
特開昭59−56446号公報
【特許文献6】
国際公開第00/49084号パンフレット
【0004】
【発明が解決しようとする課題】
本発明は、架橋剤、活性化剤、多価金属イオン、反応副生成物等を使用することなしに得ることができ、かつ単独で体内埋め込み用の医療用具の有形材料として利用可能なカルボキシメチルセルロース架橋体およびその製造方法を提供する。
【0005】
【課題を解決するための手段】
本発明者は、研究の結果、ある特定の性状を有するカルボキシメチルセルロースの酸性溶液を凍結させて、次いで解凍することにより、架橋剤、活性化剤、多価金属イオン等の化学物質を使用することなしに、単独で体内埋め込み用途で使用される医療用具として利用可能な水不溶性の有形材料を得ることに成功した。すなわち、本発明は、pH0.2〜3.5のカルボキシメチルセルロースの酸性溶液を凍結させて、その後解凍させることにより得られるカルボキシメチルセルロース架橋体を提供する。
本発明のカルボキシメチルセルロース架橋体において、カルボキシメチルセルロースの粘度(1%溶液、25℃)は、1,000〜12,000mPa・sであることが好ましい。
本発明のカルボキシメチルセルロース架橋体において、カルボキシメチルセルロースのエーテル化度は、0.75〜1.0であることが好ましい。
本発明のカルボキシメチルセルロース架橋体において、酸性溶液に含まれるカルボキシメチルセルロースは、ナトリウム塩であってもよい。
【0006】
本発明者は、研究の結果、ある特定の方法でカルボキシメチルセルロースの酸性溶液を凍結させて、次いで解凍することにより、架橋剤、活性化剤、多価金属イオン等の化学物質を使用することなしに、体内埋め込み用途で使用される医療用具の有形材料として有用な水不溶性のカルボキシメチルセルロース架橋体を得ることに成功した。
すなわち、本発明は、また、カルボキシメチルセルロースを0.2〜5質量%の濃度で含むpH0.2〜3.5の酸性溶液を、−5℃〜−30℃の温度で凍結させて、その後0℃〜70℃の温度で解凍させることを含み、該凍結および解凍を2回以上繰り返すことによりカルボキシメチルセルロース架橋体を製造する方法を提供する。
本発明は、また、カルボキシメチルセルロースを0.2〜5質量%の濃度で含むpH0.2〜3.5の酸性溶液を、酸性溶液が凍結させないようにして5℃以下の温度まで予備冷却して、次いで酸性溶液を−5℃〜−30℃の温度で凍結させて、その後0℃〜70℃の温度で解凍させることによりカルボキシメチルセルロース架橋体を製造する方法を提供する。
本発明のカルボキシメチルセルロース架橋体を製造する方法において、酸性溶液中に含まれるカルボキシメチルセルロースは、ナトリウム塩であってもよい。本発明は、また、本発明の方法により得られるカルボシキメチルセルロース架橋体を提供する。
【0007】
本発明は、さらにまた、本発明のカルボキシメチルセルロース架橋体を含む組成物を提供する。
本発明の組成物は、好ましくはカルボキシメチルセルロース以外の高分子化合物を含まない。
本発明の組成物は、さらに可塑剤を含んでもよい。
本発明の組成物は、さらに架橋に関与しないカルボキシメチルセルロースのナトリウム塩を含んでもよい。
本発明は、さらにまた、本発明のカルボキシメチルセルロース単独またはカルボキシメチルセルロースを含む組成物からなる医療用具を提供する。
本発明の医療器具は、好ましくは体内の埋め込み用途に使用される。
【0008】
【発明の実施の形態】
本発明において、カルボキシメチルセルロース架橋体は、カルボキシメチルセルロースの酸性溶液を凍結させて、その後解凍させることで得られる。
カルボキシメチルセルロースは、現在一般にエーテル化度0.5〜1.5、粘度10〜12,000Pa・s(1%溶液、25℃)のものが入手可能であり、これらのカルボキシメチルセルロースは、通常はナトリウム塩として提供される。したがって、本発明において、カルボキシメチルセルロースといった場合、そのナトリウム塩も含む。
【0009】
上記した現在入手可能なカルボキシメチルセルロースはいずれも、後に詳しく述べる手順で、その酸性溶液を凍結させて、その後解凍させることでカルボキシメチルセルロース架橋体を得ることができる。しかし、分子量が低いカルボキシメチルセルロースは、形成されるカルボキシメチルセルロース架橋体の水に対する溶解性が高く、架橋体中に残存する酸性溶液を除去するために水中に浸漬しただけで容易に溶解してしまうため、体内埋め込み用途で使用される医療用具の有形材料に適さない。したがって、カルボキシメチルセルロースは、ある程度高分子量であることが好ましい。本発明では、カルボキシメチルセルロースの分子量の指標として、1%溶液の25℃における粘度を用いる。本発明において、カルボキシメチルセルロースは、粘度(1%溶液、25℃)が1,000mPa・s以上であることが好ましく、より好ましくは5,000mPa・s以上である。カルボキシメチルセルロースの粘度が上記の範囲であれば、得られるカルボキシメチルセルロース架橋体は、前記の酸性溶液除去の操作中に溶解してしまうことがない。
【0010】
本発明では、上記したように、比較的粘度が高いカルボキシメチルセルロースを使用することが好ましい。しかし、高粘度のカルボキシメチルセルロースは、当然のことながら溶液の状態での取り扱い性に劣る。特に、セルロースの酸エーテル誘導体であるカルボキシメチルセルロースは、そのエーテル化度によっては酸性溶液中で流動性が急激に低下し、取り扱い性が著しく悪化するとともに得られる架橋体の品質に悪影響が生じる。すなわち、カルボキシメチルセルロースのエーテル化度は、酸性溶液の状態での取り扱い性、凍結・解凍後の架橋体形成の可否および得られる架橋体の品質に大きく影響する。本発明において、カルボキシメチルセルロースのエーテル化度は、0.75〜1.0であることが好ましい。エーテル化度が0.7以下では酸性溶液中で流動性が急激に低下して取り扱いが困難になるとともに、凍結させる際に溶液に温度ムラが生じて得られる架橋体が不均質になる傾向があり、一方、エーテル化度が1.0を超えるとカルボキシメチルセルロース架橋体の形成が困難になる。
【0011】
カルボキシメチルセルロースは、水溶性であることから、最も望ましい溶媒は水である。ただし、エチルアルコール、ベンジルアルコール、(モノ、ジ、トリ)エタノールアミン、N,N−ジメチルアセトアミド、エチレングリコール、プロピレングリコール、ジメチルスルホキシド、グリセリンといった水系溶剤(水素結合性の極性溶媒)を20v/v%以下、より好ましくは10v/v%以下の濃度になるような範囲で少量加えることにより、異なる性状の架橋体を得ることができる。
【0012】
上記したように、本発明では、比較的高粘度のカルボキシメチルセルロースを使用することが好ましいため、取り扱い性の観点から、カルボキシメチルセルロースの酸性溶液は、低濃度の溶液であることが好ましい。具体的には、本発明において、溶液中のカルボキシメチルセルロースの濃度は0.2〜5w/v%、より好ましくは0.5〜2w/v%である。溶液中のカルボキシメチルセルロースの濃度が上記の範囲であれば、取り扱い性に優れ、かつカルボキシメチルセルロース架橋体の形成が阻害されない。
【0013】
本発明において、上記所望の濃度のカルボキシメチルセルロース溶液をpH0.2〜3.5の酸性溶液にしてから、凍結させて、その後解凍させることでカルボキシメチルセルロース架橋体を得るが、溶液の好適なpHは、カルボキシメチルセルロースのエーテル化度によって若干異なる。そのため、粘度およびエーテル化度の異なる複数種類のカルボキシメチルセルロース(ナトリウム塩)を含む溶液に、酸を加えて種々のpHに調整した酸性溶液を凍結させて、その後解凍させて、カルボキシメチルセルロース架橋体の形成の可否を確認した。
【0014】
実験例1
粘度およびエーテル化度が異なる以下の3種のCMCダイセル(登録商標)(カルボキシメチルセルロースのナトリウム塩、ダイセル化学工業株式会社製)をRO水(逆浸透水)に溶解し、各々以下の濃度の水溶液を調製した。
CMCダイセル(登録商標)品番1180(粘度:1,000〜1,300mPa・s/1%水溶液、エーテル化度:0.6〜0.8)、0.5w/v%水溶液
CMCダイセル(登録商標)品番2340(粘度:5,000〜8,000mPa・s/1%水溶液、エーテル化度:0.8〜1.0)、0.5w/v%水溶液
CMCダイセル(登録商標)品番1390(粘度:3,000〜6,00mPa・s/1%水溶液、エーテル化度:1.0〜1.5)、0.8w/v水溶液
なお、上記のCMCダイセル(登録商標)の粘度及びエーテル化度は、いずれもメーカーのカタログ値による。
【0015】
これらのカルボキシメチルセルロース水溶液を数本のガラス試験管に分取後、それぞれの試験管に1N塩酸を加えて表1に示す所定のpH(0.2〜4.0)に調整した。これらの試験管の内容物を−25℃の低温恒温槽中で凍結させて、その後15〜25℃の水浴中で解凍させるという操作を3回を繰り返した後、カルボキシメチルセルロース架橋体の形成の有無を観察した。結果を表1に示した。表1から明らかなように、エーテル化度0.6〜1.0のカルボキシメチルセルロース(品番1180、品番2340)では、pHが0.2〜3.5の酸性溶液とした場合に固形状の架橋体の形成が観察され、エーテル化度1.0〜1.5のカルボキシメチルセルロース(品番1390)では、pHが0.2〜2.5の酸性溶液とした場合に、固形状の架橋体の形成が観察された。
【0016】
【表1】
【0017】
以上の結果から、エーテル化度0.5〜1.0のカルボキシメチルセルロースを用いる場合、酸性溶液のpHは0.2〜3.5であることが必須であり、pH0.5〜2.5であることが好ましい。一方、エーテル化度1.0〜1.5のカルボキシメチルセルロースを用いる場合、pH0.2〜2.5であることが必須であり、pH0.5〜1.5が好ましい。各エーテル化度のカルボキシメチルセルロースにおいて、酸性溶液のpHが上記の必須範囲から外れると、酸性溶液を凍結させて、その後解凍させた際に実質的に架橋は形成されなくなる。
【0018】
この溶液を所望のpHに調整する方法としては、酸を加えるのが最も簡便である。加える酸としては、架橋体からの除去が容易であるという点で塩酸、硝酸といった低粘度の無機酸が好ましい。また、酸の代わりに酸性塩を加えてもよく、酸と塩とを公知の配合で加えることにより、溶液にpH緩衝能を持たせることも可能である。なお、カルボキシメチルセルロースは、酸性の溶媒には実質的に溶解しないので、まずカルボキシメチルセルロースを上記の溶媒に溶解させた後に、酸または酸性塩を加えて溶液のpHを調整することが肝要である。
【0019】
実験例2
上記したように、カルボキシメチルセルロースのエーテル化度によっては、溶液を酸性化した際にゼリー状に固まって流動性が低下し、溶液の取り扱い性が著しく悪化する可能性がある。そのため、粘度およびエーテル化度が異なる以下の3種のカルボキシメチルセルロースをRO水に溶解させて、それぞれ0.6w/v%の水溶液を調製し、これに1N塩酸を加えてpHを1.5に調整し、この溶液をシャーレに流し込む際の取り扱い性について評価した。
CMCダイセル(登録商標)品番1190(粘度:1,300m〜2,000Pa・s/1%水溶液、エーテル化度:0.6〜0.8)
CMCダイセル(登録商標)品番2280(粘度:8,000mPa・s〜、エーテル化度:0.7〜0.85)
CMCダイセル(登録商標)品番1390(粘度:3,000〜6,000mPa・s/1%水溶液、エーテル化度:1.0〜1.5)
水溶液に塩酸を加える前の溶液の粘度は、メーカーのカタログ値の通り、品番2280>品番1390>品番1190の順であり、品番1190の粘度が最も低かった。
その後、それぞれの溶液に1N塩酸を加えたところ、エーテル化度が0.7以上である品番2280および品番1390では、溶液の性状はほとんど変化せず、比較的に容易に流し込めたのに対し、エーテル化度が0.7未満(0.68:メーカー発行の試験成績書による)である品番1190は、溶液がゼリー状に固まって実質的に流動性を失い、シャーレに流し込むことができなかった。
【0020】
本発明において、酸性溶液を凍結させる際の温度は自由に選択することができるが、温度が極端に低いと溶液が急激に冷却されるため、溶液に温度ムラが生じやすくなるため望ましくない。本発明に適した凍結温度は−3℃〜−40℃であり、より好ましくは−5℃〜−30℃である。凍結温度が上記の範囲であれば、急冷却による溶液の温度ムラが生じにくく、かつ溶液を凍結させるのに十分である。酸性溶液を凍結させる際、大きな氷晶の形成を抑えることが重要である。本明細書で氷晶といった場合、氷に現われる数多くの巨視的結晶系の一つを意味する。このような氷晶が形成されると、それに沿ってカルボキシメチルセルロースの繊維が配向した不均質な架橋体が得られる。このような架橋体は、配向軸に沿って破壊しやすい傾向がある。大きな氷晶の形成を抑えるには、温度を段階的にあるいは連続的に下げる、−5℃〜−10℃の比較的高い温度で時間をかけて凍結させるといった方法があるが、好ましくは酸性溶液を凍結させる前に、酸性溶液を凍結させることなしに、あらかじめ5℃以下の温度まで予備冷却する。このように予め5℃以下の温度まで予備冷却すると、溶液を凍結させる際に温度ムラが生じにくく、また、溶液中に氷晶の核となる構造が増加する結果、形成される氷晶は微細で均質なものとなる。
【0021】
酸性溶液を凍結させた後、酸性溶液をその状態で一定時間保持することは特に必要ではない。すなわち、酸性溶液が十分に凍結したことが確認できれば、その後直ちに酸性溶液を解凍させてもよい。酸性溶液が十分に凍結していることは、目視または触れてみて確認する。また、あらかじめ同じ容器に同じ液量の酸性溶液を入れて、凍結するまでの時間を確認しておき、この時間に対して一定の余裕を持たせて、例えばこの時間の1.5倍以上を冷却時間と設定してもよい。
【0022】
本発明において、凍結させた溶液を解凍させる際の温度も自由に選択することができるが、あまり高い温度を加えると架橋体を構成するカルボキシメチルセルロースが酸化分解されて、その分子鎖が切断されるため、架橋体が脆く、弱いものになるので望ましくない。本発明に適した解凍温度は0℃〜70℃であり、好ましくは0〜50℃である。上記の温度で解凍させれば、得られるカルボキシメチルセルロース架橋体が機械的強度に優れており、体内埋め込み用途に使用する医療用具の有形材料として好適である。
【0023】
本発明において、上記した手順により、酸性溶液を凍結させて、その後解凍させることでカルボキシメチルセルロース架橋体を得ることができる。ただし、本発明において、酸性溶液を凍結させて、その後解凍させる手順は2回以上繰り返すことが好ましい。凍結させて、その後解凍させる手順を2回以上繰り返すと、得られる架橋体が緻密化し、湿潤環境下での耐久性が向上する。一例をあげると、後に示す実施例16から明らかなように、凍結および解凍の手順を1回実施して得られたカルボキシメチルセルロース架橋体(実施例1)に比べて、凍結および解凍の手順を3回繰り返して得られたカルボキシメチルセルロース架橋体(実施例2)は、擬似体液中浸漬実験において溶解するまでに要する時間が著しく延長されている。
なお、凍結させて、その後解凍させる手順を繰り返す回数は、使用するカルボキシメチルセルロースの粘度およびエーテル化度、またはカルボキシメチルセルロース架橋体に求められる機械的強度に応じて適宜選択すればよい。ただし、凍結させて、その後解凍させる手順は、少なくとも2回繰り返すことが好ましく、より好ましくはこの手順を3回繰り返す。
【0024】
所望のカルボキシメチルセルロース架橋体が得られたら、酸性溶液から架橋体を取り出し、水中に浸漬させて架橋体中に残存する酸性の溶液を除去する。浸漬中に架橋体が著しく膨張して破壊してしまう場合には、ある程度浸漬した段階で一度架橋体を乾燥させて、その後、再び水に浸漬すると架橋体の破壊は起こりにくくなる。この場合も含め、カルボキシメチルセルロース架橋体を乾燥させる前には、架橋体から可能な限り酸性の溶液を除去しておくことが望ましい。具体的には、架橋体を浸漬した水のpHが3以上、より好ましくは4以上であることを確認した後で、架橋体を乾燥することが望ましい。強酸性のまま架橋体を乾燥させると、得られる架橋体が脆くなる場合もある。
【0025】
水に浸漬させて酸を十分に除去した後の架橋体は、含水ゲルの状態である。含水ゲル中には気泡が捕捉されている場合もあるが、このような場合ゲルを真空度100〜500mmHg程度の比較的穏やかな減圧環境下に置くことにより、ゲルに損傷を与えることなく気泡を除去することができる。
カルボキシメチルセルロース架橋体は、このまま含水ゲルの状態で各種用途に使用してもよく、または各種乾燥方法により乾燥させてから各種の用途に使用してもよい。乾燥方法は、架橋体の性状に悪影響を及ぼすことなしに、乾燥させることができる限り特に限定されず、たとえば、室温下に放置して乾燥してもよく、オーブン中で加熱乾燥してもよい。また、架橋体を再度凍結させて、減圧することで凍結乾燥してもよい。さらにまた、カルボキシメチルセルロース架橋体を、水と相溶性があり、かつカルボキシメチルセルロースを溶解させない、例えばエチルアルコールのような有機溶媒中に浸漬することによっても乾燥することができる。カルボキシメチルセルロース架橋体は、使用する乾燥方法によって異なる性状を有する有形材料とすることができる。例えば、架橋体を凍結乾燥した場合には白色のスポンジ状の多孔体が得られる。室温下に放置して乾燥した場合、またはオーブン中で加熱乾燥させた場合にはほぼ無色透明のフィルムが得られる。これらの材料を水に浸漬すると、前者はほぼ元の含水ゲル状態に戻り、後者は含水して軟化するがフィルム形状は保たれる。また、有機溶媒中に浸漬させて乾燥した場合には白色のフィルムが得られる。このフィルムは、水に浸漬したとき、前記の室温下に放置して乾燥して、またはオーブン中で加熱乾燥して得られるフィルムよりも膨張の程度が大きい。
【0026】
このようにして得られる本発明のカルボキシメチルセルロース架橋体は、機械的強度に優れている。また、カルボキシメチルセルロース自体が日本薬局方でも安全性が高いことが認められていることに加えて、本発明の架橋体は、架橋剤、活性化剤、多価金属イオン等の化学物質を使用することなしに得ることができるから、湿潤環境下で使用する医療用具、特に体内埋め込み用途で使用される医療用具の有形材料として単独で使用することができる。このような体内埋め込み用途で使用される医療用具としては、例えば、医薬品/因子/遺伝子等のキャリア材、各種補綴材、血管塞栓材、止血材、癒着防止材などが挙げられる。
【0027】
本発明のカルボキシメチルセルロース架橋体は、純水中においては長期にわたって安定であるが、例えば生体中のように、塩が存在する環境下では比較的短期間で溶解する。これは、カルボキシメチルセルロースのカルボキシメチル基がイオン交換によって解離することが原因と考えられる。この特徴は、医療用途、特に体内埋め込み用途で使用するとき、非常に大きな利点となる。すなわち、この材料はある目的を持って体内に埋め込むことができ、目的を果たした後には体外に排出されるという極めて好ましい特徴を有している。
【0028】
本発明のカルボキシメチルセルロース架橋体は、非生物由来の材料であるカルボキシメチルセルロースを原料とするため、生物由来のヒアルロン酸等に比べてウイルスやタンパク等の抗原性物質が混入するリスクが低く、より安全性が優れている。
本発明のカルボキシメチルセルロース架橋体は、比較的安価な材料であるカルボキシメチルセルロースを原料とするため、ヒアルロン酸等の高価な材料を原料とする医療材料に比べて体内埋め込み用途の医療用具をはるかに安価で提供することができる。
【0029】
これらの医療用具は、本発明のカルボキシメチルセルロース架橋体を用いて公知の方法により作製することができる。なお、医療用具の有形材料として使用する場合、カルボキシメチルセルロース架橋体は、エチレンオキサイドガスやガンマ線等の公知の方法により適宜滅菌される。
【0030】
上記したように、本発明のカルボキシメチルセルロース架橋体は、単独で医療用具、特に体内埋め込み用途で使用される医療用具の有形材料として使用することができるが、特定の機能や特性を与える目的で他の成分を含めた組成物として使用してもよい。ただし、この組成物は、好ましくはカルボキシメチルセルロース以外の高分子化合物を含まない。
組成物に含めてもよい他の成分としては、たとえば、低分子量のポリエチレングリコール(分子量200〜600程度)、グリセリン、エチレングリコール、プロピレングリコール等の可塑剤が挙げられる。これらの可塑剤を含む溶液にカルボキシメチルセルロース架橋体、例えば、カルボキシメチルセルロース架橋体を室温下で放置して乾燥して、またはオーブン中で加熱乾燥して得たフィルム等を浸漬させて、その後乾燥することにより、架橋体(フィルム)の柔軟性を向上させることができる。組成物に可塑剤を含める場合、組成物の全質量に対して、10〜70質量部、好ましくは20〜50質量部含有させる。
【0031】
また、組成物に含めてもよい他の成分としては、架橋に関与しないカルボキシメチルセルロースが挙げられる。酸性溶液を凍結させて、その後解凍させることで得られたカルボキシメチルセルロース架橋体またはその乾燥物を、さらにカルボキシメチルセルロースのナトリウム塩を含む溶液に浸漬することで、架橋体中に架橋に関与しないカルボキシメチルセルロースを含めることができる。このような架橋に関与しないカルボキシメチルセルロースを含む組成物は、湿潤時に強力な付着性を示す。組成物に含める架橋に関与しないカルボキシメチルセルロースは、架橋体を形成するカルボキシメチルセルロースとは異なり、そのエーテル化度および粘度は特に限定されない。但し、組成物の湿潤時の付着力は、含めるカルボキシメチルセルロースのエーテル化度に依存し、エーテル化度が高いほど組成物の付着力が増加する。架橋に関与しないカルボキシメチルセルロースを含める場合、組成物全質量に対して、2〜50質量部、好ましくは5〜30質量部の含量で組成物に含める。架橋に関与しないカルボキシメチルセルロースの含量が上記の範囲であれば、架橋に関与しないカルボキシメチルセルロースを含める前の元の架橋体の柔軟性を損なうことなしに、組成物の付着力を増加させることができる。
【0032】
【実施例】
以下実施例を用いて本発明をさらに説明する。
実施例1
CMCダイセル(登録商標)品番2340(粘度:5,000〜8,000mPa・s/1%水溶液、エーテル化度:0.8〜1.0)をRO水に溶解して0.6w/v%の水溶液を調製し、これに1N塩酸を加えてpHを1.5に調整した。この溶液15mlを内径9cmのプラスチック製シャーレに入れ、低温恒温槽中で−25℃で2時間冷却することにより溶液を凍結させた。このとき、凍結した溶液の表面には、様々な方向に直線状に伸びる長さ数mmから数cmの氷晶が多数観察された。シャーレを低温恒温槽から取り出して15〜20℃の水浴中で内容物を解凍させたところ、上記の氷晶に沿って長短さまざまな長さのカルボキシメチルセルロースの繊維が配向した、不均質なゲル状の架橋体の形成が観察された。このゲルをピンセットを用いてシャーレから取り出し、流水に3時間さらして塩酸を除去することにより、ゲル状のカルボキシメチルセルロース架橋体が得られたが、この操作中に前記の配向した繊維に沿って数箇所の破れが発生した。
【0033】
実施例2
CMCダイセル(登録商標)品番2340(粘度:5,000〜8,000mPa・s/1%水溶液、エーテル化度:0.8〜1.0)をRO水に溶解して0.6w/v%水溶液を調製し、これに1N塩酸を加えてpHを1.5に調整した。この溶液15mLを内径9cmのプラスチック製シャーレに入れ、低温恒温槽中で溶液を凍結させることなしに−3℃で1時間予備冷却した後、低温恒温槽の温度を−25℃まで下げてさらに2時間冷却することにより溶液を凍結させた。このとき、凍結させた溶液の表面は平滑であり、実施例1で見られたような氷晶は全く観察されなかった。シャーレを低温恒温槽から取り出して15〜20℃の水浴中で内容物を解凍させたところ、配向した繊維の無い均質なゲル状の架橋体の形成が観察された。このゲルをピンセットを用いてシャーレから取り出し、流水に3時間さらして塩酸を除去することにより、実施例1のような破れを発生することなくゲル状のカルボキシメチルセルロース架橋体を得た。
【0034】
比較例
CMCダイセル(登録商標)品番1140(粘度:100〜200mPa・s/1%水溶液、エーテル化度0.6〜0.8)をRO水に溶解して1.0w/v%水溶液を調製し、これに1N硝酸を加えてpHを1.0に調整した。この溶液15mLを内径9cmのプラスチック製シャーレに入れ、低温恒温槽中で−20℃で冷却することにより溶液を凍結させた。凍結した状態で3日間放置した後、シャーレを取り出し、25℃の水浴中で内容物を解凍したところ、実施例1と同様に長短なまざまな長さのカルボキシメチルセルロースの繊維が配向した、不均質なゲル状の架橋体の形成が観察された。このゲルは実施例1のゲルよりも強度が低く、ピンセットを用いてシャーレから取り出すことができなかったため、シャーレに入れたまま流水に3時間さらして硝酸を除去しようと試みたが、著しく膨潤した後、水に溶解してしまい有形材料を得ることができなかった。
【0035】
実施例3
CMCダイセル(登録商標)品番1180(粘度:1,000〜1,300mPa・s/1%水溶液、エーテル化度0.6〜0.8)をRO水に溶解して0.8w/v%水溶液を調製し、これに1N硝酸を加えてpHを1.5に調整した。この溶液15mLを内径9cmのプラスチック製シャーレに入れ、低温恒温槽中で溶液を凍結させることなしに−3℃で1時間予備冷却した後、低温恒温槽の温度を−25℃まで下げてさらに2時間冷却することにより溶液を凍結させた。シャーレを低温恒温槽から取り出して15〜20℃の水浴中で内容物を解凍させたところ、配向した繊維の無い均質なゲル状の架橋体の形成が観察された。このゲルは実施例1のゲルよりもやや強度が低かったため、ピンセットを用いて慎重にシャーレから取り出し、流水に3時間さらして塩酸を除去することにより、ゲル状のカルボキシメチル架橋体を得た。その間、このゲルは実施例1のゲルと比べてやや膨潤する傾向を示したが、水に溶解することは無かった。
【0036】
実施例4
凍結および解凍を2回繰り返したこと以外は実施例2と同じ方法で、ゲル状のカルボキシメチルセルロース架橋体を得た。
【0037】
実施例5
凍結および解凍を3回繰り返したこと以外は実施例2と同じ方法で、ゲル状のカルボキシメチルセルロース架橋体を得た。
【0038】
実施例6
凍結および解凍を5回繰り返したこと以外は実施例2と同じ方法で、ゲル状のカルボキシメチルセルロース架橋体を得た。
【0039】
実施例7
溶液のpHを0.5にしたことと、凍結および解凍を3回繰り返したこと以外は実施例2と同じ方法で、ゲル状のカルボキシメチルセルロース架橋体を得た。
【0040】
実施例8
溶液のpHを2.5にしたことと、凍結および解凍を3回繰り返したこと以外は実施例2と同じ方法で、ゲル状のカルボキシメチルセルロース架橋体を得た。
【0041】
実施例9
CMCダイセル(登録商標)品番2280(粘度:11,500mPa・s、エーテル化度:0.75)をRO水に溶解して0.5w/v%水溶液を調製し、これに1N塩酸を加えてpHを1.5に調整した。この溶液15mLを内径9cmのプラスチック製シャーレに入れ、低温恒温槽中で溶液を凍結させることなしに−3℃で1時間予備冷却した後、温度を−25℃に下げてさらに2時間冷却させて溶液を凍結させた。シャーレを低温恒温槽から取り出して、15〜20℃の水浴中で内容物を解凍させた。以上の凍結と解凍の操作を3回繰り返した後、流水に3時間さらして塩酸を除去することにより、ゲル状のカルボシキメチルセルロース架橋体を得た。
【0042】
実施例10
CMCダイセル(登録商標)品番1390(粘度:3,000〜6,000mPa・s/1%水溶液、エーテル化度:1.0〜1.5)をRO水に溶解して1.0w/v%水溶液を調製し、これに1N塩酸を加えてpHを0.8に調整した。この溶液15mLを内径9cmのプラスチック製シャーレに入れ、低温恒温槽中で溶液を凍結させることなしに−3℃で1時間予備冷却した後、低温恒温槽の温度を−25℃に下げてさらに2時間冷却することにより溶液を凍結させた。シャーレを低温恒温槽から出して、15〜20℃の水浴中で内容物を解凍させた。以上の凍結および解凍の操作を3回繰り返した後、流水に3時間さらして塩酸を除去することにより、ゲル状のカルボキシメチルセルロース架橋体を得た。
【0043】
実施例11
実施例2と同じ方法で得たゲル状のカルボキシメチルセルロース架橋体を40℃のオーブン中で乾燥することにより、ほぼ無色透明のフィルムを得た。
【0044】
実施例12
実施例2と同じ方法で得たゲル状のカルボキシメチルセルロース架橋体を凍結乾燥することにより、スポンジ状の多孔体を得た。
【0045】
実施例13
実施例2と同じ方法で得たゲル状のカルボキシメチルセルロース架橋体をエタノール中で脱水後、風乾することにより、白色のフィルムを得た。
【0046】
実施例14
擬似体液中浸漬実験
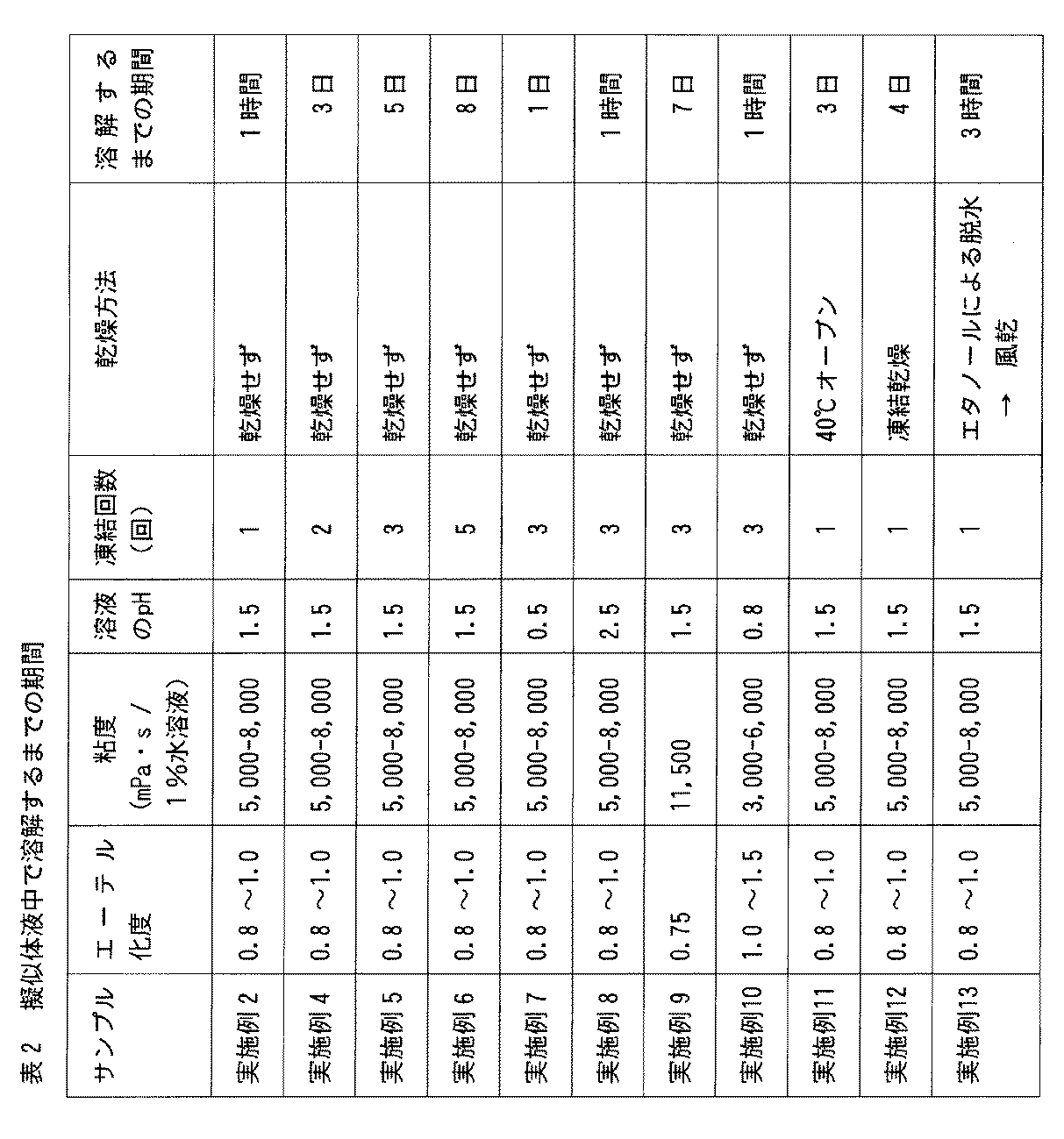
実施例2、4〜13のカルボキシメチルセルロース架橋体とその乾燥物をそれぞれ90mLの擬似体液(pH7.4リン酸緩衝生理食塩水;37℃)に浸漬した。浸漬開始後1時間、3時間、6時間、24時間(=1日)、その後は1日ごとに観察を行い、それぞれの材料が溶解するまでの期間を調べた(材料の辺縁部が不明瞭になった時点をもって「溶解」とした)。結果を表2に示した。表2から明らかなように、実施例2、4〜12のカルボキシメチルセルロース架橋体は、擬似体液中に浸漬後1時間〜8日経過した時点で溶解した。このことから、これらのカルボキシメチルセルロース架橋体は、体内に埋め込まれた場合、いずれも一定期間の経過後、体液に溶解することが予想される。また、表2から、本発明のカルボキシメチルセルロース架橋体は、用いるカルボキシメチルセルロースの種類(具体的には、粘度とエーテル化度)、溶液のpH、凍結および解凍の回数、乾燥の有無/方法によって、溶解するまでの期間を調節可能であることを示していた。
【0047】
【表2】
【0048】
実施例15
CMCダイセル(登録商標)品番1350(粘度:200〜300mPa・s、エーテル化度1.0〜1.5)の1w/v%水溶液20mLを内径9cmのプラスチック製シャーレに入れ、その中に実施例4と同じ方法で得たゲル状の架橋体を浸漬した後、40℃のオーブン中で乾燥した。また、実施例12と同じ方法で得た多孔体を同様に上記の水溶液に浸漬した後、−25℃の低温恒温槽中で凍結し、減圧することで凍結乾燥させた。得られたフィルム及び多孔体は、それぞれ実施例11、12のフィルム及び多孔体と比較して、濡れた手指に対して著しく強い付着性を示した。
【0049】
【発明の効果】
本発明によって得られるカルボキシメチルセルロース架橋体は、機械的強度に優れており、湿潤環境下で使用する医療用具の有形材料として好適である。本発明では、このような水不溶性の有形材料であるカルボキシメチルセルロース架橋体を、架橋剤、活性化剤、多価金属イオン等の化学物質を使用することなしに得ることができる。
本発明のカルボキシメチルセルロース架橋体は、非生物由来の材料であるカルボキシメチルセルロースを原料とするため、生物由来のヒアルロン酸等に比べてウイルスやタンパク等の抗原性物質が混入するリスクが低く、より安全性に優れている。
本発明のカルボキシメチルセルロース架橋体は、比較的安価な材料であるカルボキシメチルセルロースを原料とするため、ヒアルロン酸等の高価な材料を原料とする医療材料に比べて体内埋め込み用途の医療用具をはるかに安価で提供することができる。
本発明のカルボキシメチルセルロース架橋体は、純水中においては長期にわたって安定であるが、例えば生体中のように、塩が存在する環境下では比較的短期間で溶解する。これは、カルボキシメチルセルロースのカルボキシメチル基がイオン交換によって解離することが原因と考えられる。この特徴は、医療用途、特に体内埋め込み用途で使用するとき、非常に大きな利点となる。すなわち、この材料はある目的を持って体内に埋め込むことができ、目的を果たした後には体外に排出されるという極めて好ましい特徴を有している。このような特徴が要求される用途としては、例えば、医薬品/因子/遺伝子等のキャリア材、各種補綴材、血管塞栓材、止血材、癒着防止材などが挙げられるが、本発明の用途はこれらに限定されるものではない。[0001]
TECHNICAL FIELD OF THE INVENTION
The present invention relates to a water-insoluble cross-linked carboxymethyl cellulose and a method for producing the same.
[0002]
[Prior art]
Carboxymethylcellulose (CMC) is a polyvalent carboxymethyl ether of cellulose, and is a highly safe material that has been officially approved for addition to foods and pharmaceuticals. Its properties vary depending on the degree of substitution of the carboxymethyl group, but at present, carboxymethylcellulose with a degree of substitution of 0.5 or more, which is commercially available for the above-mentioned applications, is soluble in water and is used for implanting in the body. When used as a tangible material used in a humid environment such as a medical device, it is usually necessary to crosslink. As a method for crosslinking carboxymethyl cellulose, a method of reacting with a polyfunctional epoxy compound in the presence of an acid (see Patent Document 1), a method of reacting with a polyfunctional amine compound in the presence of an activator (see Patent Document 2), A method in which an activator acts alone to form an internal ester bond (see Patent Document 3) is disclosed. It is also known that the addition of polyvalent metal ions to carboxymethylcellulose forms crosslinks by coordination bonds. However, the method using a polyfunctional compound or a polyvalent metal ion has a drawback that these substances remain in the crosslinked product as a crosslinking agent and elute with the decomposition of the crosslinked product. Also, in the method in which the activator acts alone, the possibility that the activator and its reaction by-product cannot be removed by washing and remain in the crosslinked body in a chemically bonded state cannot be denied. As described above, conventionally, the method of crosslinking to obtain a tangible material of carboxymethylcellulose has left a safety problem in that a crosslinking agent, an activator, a polyvalent metal ion, and a reaction by-product remain.
As a method of obtaining a tangible medical body implant from a water-soluble high molecular organic compound without using a crosslinking agent, an activator, a polyfunctional compound, or a polyvalent metal ion, an aqueous solution of polyvinyl alcohol is used. A method for obtaining a highly hydrous gel by freezing and then thawing is disclosed (see Patent Document 4). Further, there is disclosed a method of obtaining a hydrogel that can be used for medical materials by freezing (thawing) polyvinyl alcohol (see Patent Document 5). Further, there is a method of obtaining a hyaluronic acid gel composition which can be used for medical materials having good biocompatibility by freezing and then thawing an aqueous solution or dispersion having a pH of 3.5 or less containing hyaluronic acid and a polymer compound. It is disclosed (see Patent Document 6). In this method, carboxymethylcellulose is used as a polymer compound contained in the hyaluronic acid gel composition. In Example 10, a sponge-like carboxymethylcellulose gel was obtained by freezing and thawing a nitric acid aqueous solution of carboxymethylcellulose. I have. However, the carboxymethylcellulose gel described here has a very high solubility in water and cannot be washed even with water to remove the aqueous nitric acid solution. It is mixed with an acid gel to form a slurry solution, air-dried, and used as a film-shaped hyaluronic acid gel composition.
[0003]
[Patent Document 1]
JP-A-61-502729
[Patent Document 2]
JP 2001-501228 A
[Patent Document 3]
JP-A-2-504163
[Patent Document 4]
JP-A-5-111531
[Patent Document 5]
JP-A-59-56446
[Patent Document 6]
WO 00/49084 pamphlet
[0004]
[Problems to be solved by the invention]
The present invention provides a carboxymethyl cellulose that can be obtained without using a cross-linking agent, an activator, a polyvalent metal ion, a reaction by-product, and the like, and that can be used alone as a tangible material of a medical device for implantation into the body. A crosslinked product and a method for producing the same are provided.
[0005]
[Means for Solving the Problems]
As a result of the research, the present inventor has found that by using an acidic solution of carboxymethylcellulose having a certain property, the solution is frozen and then thawed to use a chemical substance such as a crosslinking agent, an activator, or a polyvalent metal ion. Without them, they succeeded in obtaining a water-insoluble tangible material that could be used as a medical device used alone for implantable applications. That is, the present invention provides a crosslinked carboxymethylcellulose obtained by freezing and then thawing an acidic solution of carboxymethylcellulose having a pH of 0.2 to 3.5.
In the crosslinked carboxymethylcellulose of the present invention, the viscosity of carboxymethylcellulose (1% solution, 25 ° C.) is preferably 1,000 to 12,000 mPa · s.
In the crosslinked carboxymethylcellulose of the present invention, the degree of etherification of carboxymethylcellulose is preferably from 0.75 to 1.0.
In the crosslinked carboxymethylcellulose of the present invention, carboxymethylcellulose contained in the acidic solution may be a sodium salt.
[0006]
As a result of research, the inventor has found that by freezing and then thawing an acidic solution of carboxymethylcellulose in a specific method, the use of chemicals such as cross-linking agents, activators, and polyvalent metal ions is eliminated. In addition, the inventors succeeded in obtaining a water-insoluble crosslinked carboxymethylcellulose useful as a tangible material of a medical device used for implantation in the body.
That is, the present invention also freezes an acidic solution having a pH of 0.2 to 3.5 containing carboxymethylcellulose at a concentration of 0.2 to 5% by mass at a temperature of −5 ° C. to −30 ° C. A method for producing a crosslinked carboxymethylcellulose by repeating thawing and thawing two or more times, including thawing at a temperature of from 70 ° C to 70 ° C.
In the present invention, an acidic solution containing carboxymethylcellulose at a concentration of 0.2 to 5% by mass and having a pH of 0.2 to 3.5 is pre-cooled to a temperature of 5 ° C. or lower so that the acidic solution is not frozen. And then freezing the acidic solution at a temperature of -5C to -30C, followed by thawing at a temperature of 0C to 70C, to provide a method for producing a carboxymethylcellulose cross-linked body.
In the method for producing a crosslinked carboxymethylcellulose of the present invention, carboxymethylcellulose contained in the acidic solution may be a sodium salt. The present invention also provides a crosslinked carboxymethylcellulose obtained by the method of the present invention.
[0007]
The present invention further provides a composition comprising the crosslinked carboxymethyl cellulose of the present invention.
The composition of the present invention preferably does not contain a polymer compound other than carboxymethylcellulose.
The composition of the present invention may further include a plasticizer.
The composition of the present invention may further comprise a sodium salt of carboxymethylcellulose that does not participate in crosslinking.
The present invention further provides a medical device comprising the carboxymethylcellulose of the present invention alone or a composition containing carboxymethylcellulose.
The medical device of the present invention is preferably used for implantation in a body.
[0008]
BEST MODE FOR CARRYING OUT THE INVENTION
In the present invention, the crosslinked carboxymethylcellulose is obtained by freezing and then thawing an acidic solution of carboxymethylcellulose.
Carboxymethylcellulose is currently generally available with a degree of etherification of 0.5 to 1.5 and a viscosity of 10 to 12,000 Pa · s (1% solution, 25 ° C.). Provided as salt. Therefore, in the present invention, carboxymethyl cellulose includes its sodium salt.
[0009]
Any of the currently available carboxymethylcellulose described above can be obtained by freezing and then thawing the acidic solution by a procedure described in detail below to obtain a crosslinked carboxymethylcellulose. However, carboxymethylcellulose having a low molecular weight has high solubility in water of the formed carboxymethylcellulose crosslinked product, and is easily dissolved only by immersion in water to remove the acidic solution remaining in the crosslinked product. It is not suitable for tangible materials of medical devices used for implanting applications. Therefore, carboxymethyl cellulose preferably has a high molecular weight to some extent. In the present invention, the viscosity of a 1% solution at 25 ° C. is used as an index of the molecular weight of carboxymethyl cellulose. In the present invention, carboxymethylcellulose preferably has a viscosity (1% solution, 25 ° C.) of 1,000 mPa · s or more, more preferably 5,000 mPa · s or more. When the viscosity of carboxymethylcellulose is in the above range, the obtained crosslinked carboxymethylcellulose does not dissolve during the operation of removing the acidic solution.
[0010]
In the present invention, as described above, it is preferable to use carboxymethyl cellulose having a relatively high viscosity. However, high-viscosity carboxymethylcellulose is, of course, inferior in handleability in a solution state. In particular, carboxymethylcellulose, which is an acid ether derivative of cellulose, has a drastic decrease in fluidity in an acidic solution depending on the degree of etherification, which significantly deteriorates handleability and adversely affects the quality of the obtained crosslinked product. That is, the degree of etherification of carboxymethylcellulose greatly affects the handleability in the state of an acidic solution, the possibility of forming a crosslinked body after freezing and thawing, and the quality of the obtained crosslinked body. In the present invention, the degree of etherification of carboxymethyl cellulose is preferably from 0.75 to 1.0. When the degree of etherification is 0.7 or less, the fluidity rapidly decreases in an acidic solution, making it difficult to handle, and the resulting crosslinked product tends to be heterogeneous due to temperature unevenness in the solution when frozen. On the other hand, when the degree of etherification exceeds 1.0, it becomes difficult to form a crosslinked carboxymethylcellulose.
[0011]
Since carboxymethylcellulose is water-soluble, the most desirable solvent is water. However, an aqueous solvent (hydrogen bonding polar solvent) such as ethyl alcohol, benzyl alcohol, (mono, di, tri) ethanolamine, N, N-dimethylacetamide, ethylene glycol, propylene glycol, dimethyl sulfoxide, and glycerin is used at 20 v / v. % Or less, more preferably 10 v / v% or less, by adding a small amount in such a range that a crosslinked product having different properties can be obtained.
[0012]
As described above, in the present invention, since it is preferable to use carboxymethyl cellulose having a relatively high viscosity, the acidic solution of carboxymethyl cellulose is preferably a low-concentration solution from the viewpoint of handleability. Specifically, in the present invention, the concentration of carboxymethylcellulose in the solution is 0.2 to 5 w / v%, more preferably 0.5 to 2 w / v%. When the concentration of carboxymethylcellulose in the solution is within the above range, the handleability is excellent and the formation of a crosslinked carboxymethylcellulose is not hindered.
[0013]
In the present invention, the carboxymethylcellulose solution having the desired concentration is converted into an acidic solution having a pH of 0.2 to 3.5, then frozen and then thawed to obtain a crosslinked carboxymethylcellulose. , Slightly depending on the degree of etherification of carboxymethylcellulose. Therefore, an acid solution adjusted to various pHs by adding an acid to a solution containing a plurality of types of carboxymethylcellulose (sodium salt) having different viscosities and degrees of etherification is frozen, and then thawed to form a crosslinked carboxymethylcellulose. The formation was confirmed.
[0014]
Experimental example 1
The following three types of CMC Daicel (registered trademark) (sodium salt of carboxymethylcellulose, manufactured by Daicel Chemical Industries, Ltd.) having different viscosities and degrees of etherification are dissolved in RO water (reverse osmosis water), and each of the aqueous solutions having the following concentrations: Was prepared.
CMC Daicel (registered trademark) product number 1180 (viscosity: 1,000 to 1,300 mPa · s / 1% aqueous solution, degree of etherification: 0.6 to 0.8), 0.5 w / v% aqueous solution
CMC Daicel (registered trademark) product number 2340 (viscosity: 5,000 to 8,000 mPa · s / 1% aqueous solution, degree of etherification: 0.8 to 1.0), 0.5 w / v% aqueous solution
CMC Daicel (registered trademark) product number 1390 (viscosity: 3,000 to 6,000 mPa · s / 1% aqueous solution, degree of etherification: 1.0 to 1.5), 0.8 w / v aqueous solution
The viscosity and the degree of etherification of CMC Daicel (registered trademark) are all based on the manufacturer's catalog values.
[0015]
These carboxymethylcellulose aqueous solutions were fractionated into several glass test tubes, and each test tube was adjusted to a predetermined pH (0.2 to 4.0) shown in Table 1 by adding 1N hydrochloric acid. The operation of freezing the contents of these test tubes in a low-temperature constant temperature bath at −25 ° C. and then thawing in a water bath at 15 to 25 ° C. was repeated three times. Was observed. The results are shown in Table 1. As is clear from Table 1, carboxymethylcellulose having a degree of etherification of 0.6 to 1.0 (Part No. 1180, Part No. 2340) has a solid cross-linking when an acidic solution having a pH of 0.2 to 3.5 is used. A carboxymethylcellulose (product number 1390) having a degree of etherification of 1.0 to 1.5 was observed to form a solid cross-linked body when an acidic solution having a pH of 0.2 to 2.5 was used. Was observed.
[0016]
[Table 1]
From the above results, when using carboxymethylcellulose having a degree of etherification of 0.5 to 1.0, it is essential that the pH of the acidic solution is 0.2 to 3.5, and that the pH of the acidic solution is 0.5 to 2.5. Preferably, there is. On the other hand, when carboxymethylcellulose having a degree of etherification of 1.0 to 1.5 is used, the pH must be 0.2 to 2.5, and the pH is preferably 0.5 to 1.5. When the pH of the acidic solution is out of the above-mentioned essential range in carboxymethylcellulose of each degree of etherification, the acidic solution is frozen, and subsequently thawed, substantially no cross-links are formed.
[0018]
The simplest way to adjust this solution to a desired pH is to add an acid. As the acid to be added, a low-viscosity inorganic acid such as hydrochloric acid or nitric acid is preferable in that it is easily removed from the crosslinked body. In addition, an acid salt may be added instead of the acid, and the solution can have a pH buffering ability by adding the acid and the salt in a known formulation. Since carboxymethylcellulose does not substantially dissolve in an acidic solvent, it is important to first dissolve carboxymethylcellulose in the above-mentioned solvent and then adjust the pH of the solution by adding an acid or an acid salt.
[0019]
Experimental example 2
As described above, depending on the degree of etherification of carboxymethylcellulose, when the solution is acidified, it solidifies in a jelly-like form, lowers the fluidity, and may significantly deteriorate the handleability of the solution. Therefore, the following three carboxymethyl celluloses having different viscosities and degrees of etherification are dissolved in RO water to prepare 0.6 w / v% aqueous solutions, and 1N hydrochloric acid is added thereto to adjust the pH to 1.5. It was adjusted, and the handleability when pouring this solution into a petri dish was evaluated.
CMC Daicel (registered trademark) product number 1190 (viscosity: 1,300 m to 2,000 Pa · s / 1% aqueous solution, degree of etherification: 0.6 to 0.8)
CMC Daicel (registered trademark) product number 2280 (viscosity: 8,000 mPa · s or more, degree of etherification: 0.7 to 0.85)
CMC Daicel (registered trademark) product number 1390 (viscosity: 3,000 to 6,000 mPa · s / 1% aqueous solution, degree of etherification: 1.0 to 1.5)
The viscosity of the solution before adding hydrochloric acid to the aqueous solution was in the order of part number 2280> part number 1390> part number 1190 according to the catalog value of the manufacturer, and the viscosity of part number 1190 was the lowest.
Then, when 1N hydrochloric acid was added to each solution, the properties of the solutions hardly changed in the product numbers 2280 and 1390 having a degree of etherification of 0.7 or more, and the solution was relatively easily poured. In the case of No. 1190 having a degree of etherification of less than 0.7 (0.68: according to the test report issued by the manufacturer), the solution hardened in a jelly state and substantially lost fluidity, and could not be poured into a petri dish. Was.
[0020]
In the present invention, the temperature at which the acidic solution is frozen can be freely selected. However, if the temperature is extremely low, the solution is rapidly cooled, and the temperature tends to be uneven, which is not desirable. Freezing temperatures suitable for the present invention are between -3C and -40C, more preferably between -5C and -30C. When the freezing temperature is in the above range, unevenness in the temperature of the solution due to rapid cooling hardly occurs, and it is sufficient to freeze the solution. When freezing acidic solutions, it is important to suppress the formation of large ice crystals. As used herein, reference to ice crystals means one of the many macroscopic crystal systems that appear on ice. When such ice crystals are formed, a heterogeneous crosslinked body in which the carboxymethylcellulose fibers are oriented along the ice crystals is obtained. Such a crosslinked body tends to be easily broken along the orientation axis. In order to suppress the formation of large ice crystals, there are methods such as lowering the temperature stepwise or continuously, and freezing at a relatively high temperature of -5 ° C to -10 ° C over time. Is pre-cooled to a temperature below 5 ° C. without freezing the acidic solution before freezing. Preliminarily pre-cooling to a temperature of 5 ° C. or less in this way makes it difficult for the solution to freeze, resulting in less temperature unevenness, and increases the nucleus structure of the ice crystal in the solution, resulting in the formation of fine ice crystals. And become homogeneous.
[0021]
After freezing the acidic solution, it is not particularly necessary to keep the acidic solution in that state for a certain period of time. That is, if it can be confirmed that the acidic solution has been sufficiently frozen, the acidic solution may be thawed immediately thereafter. Visual or touch to confirm that the acidic solution is sufficiently frozen. In addition, the same amount of acidic solution is put in the same container in advance, and the time until freezing is confirmed, and a certain margin is provided for this time, for example, 1.5 times or more of this time. The cooling time may be set.
[0022]
In the present invention, the temperature at which the frozen solution is thawed can also be freely selected, but if too high a temperature is applied, carboxymethylcellulose constituting the crosslinked body is oxidatively decomposed and its molecular chain is cut. Therefore, the crosslinked body becomes brittle and weak, which is not desirable. Thawing temperatures suitable for the present invention are between 0 ° C and 70 ° C, preferably between 0 and 50 ° C. When thawed at the above temperature, the obtained crosslinked carboxymethylcellulose has excellent mechanical strength and is suitable as a tangible material of a medical device used for implanting in a body.
[0023]
In the present invention, a crosslinked carboxymethylcellulose can be obtained by freezing and then thawing the acidic solution according to the above-described procedure. However, in the present invention, it is preferable that the procedure of freezing the acid solution and then thawing it is repeated twice or more. When the procedure of freezing and then thawing is repeated two or more times, the resulting crosslinked body becomes denser and the durability in a wet environment is improved. As an example, as apparent from Example 16 to be described later, the freezing and thawing procedures were performed by 3 times as compared with the carboxymethylcellulose crosslinked product (Example 1) obtained by performing the freezing and thawing procedures once. The cross-linked carboxymethylcellulose (Example 2) obtained by repeating the procedure many times is significantly prolonged until it is dissolved in the immersion test in the simulated body fluid.
The number of times of repeating the procedure of freezing and then thawing may be appropriately selected according to the viscosity and the degree of etherification of carboxymethylcellulose to be used or the mechanical strength required for the crosslinked carboxymethylcellulose. However, the procedure of freezing and then thawing is preferably repeated at least twice, more preferably this procedure is repeated three times.
[0024]
When the desired crosslinked carboxymethylcellulose is obtained, the crosslinked product is taken out of the acidic solution and immersed in water to remove the acidic solution remaining in the crosslinked product. When the crosslinked product is significantly expanded and broken during immersion, the crosslinked product is dried once at a stage of immersion to some extent, and then immersed again in water, so that the crosslinked product is less likely to be broken. Before drying the crosslinked carboxymethylcellulose, including in this case, it is desirable to remove the acidic solution as much as possible from the crosslinked product. Specifically, it is desirable to dry the crosslinked body after confirming that the pH of the water in which the crosslinked body is immersed is 3 or more, more preferably 4 or more. When the crosslinked product is dried while being strongly acidic, the obtained crosslinked product may become brittle.
[0025]
The crosslinked body after immersion in water to sufficiently remove the acid is in a state of a hydrogel. Air bubbles may be trapped in the hydrogel, but in such a case, the gel is placed in a relatively gentle vacuum environment of a vacuum degree of about 100 to 500 mmHg so that air bubbles can be generated without damaging the gel. Can be removed.
The crosslinked carboxymethylcellulose may be used as it is in the form of a hydrogel for various applications, or may be dried by various drying methods and then used for various applications. The drying method is not particularly limited as long as it can be dried without adversely affecting the properties of the crosslinked body. For example, the drying method may be performed by leaving the composition at room temperature, or may be dried by heating in an oven. . Alternatively, the crosslinked body may be frozen again and lyophilized by reducing the pressure. Further, the crosslinked carboxymethylcellulose can be dried by immersing it in an organic solvent such as ethyl alcohol, which is compatible with water and does not dissolve carboxymethylcellulose. The crosslinked carboxymethyl cellulose can be a tangible material having different properties depending on the drying method used. For example, when the crosslinked body is freeze-dried, a white sponge-like porous body is obtained. When left to dry at room temperature or when dried by heating in an oven, an almost colorless and transparent film is obtained. When these materials are immersed in water, the former returns to almost the original hydrogel state, and the latter is softened by being hydrated, but the film shape is maintained. When immersed in an organic solvent and dried, a white film is obtained. When immersed in water, the film has a greater degree of expansion than a film obtained by drying at room temperature or drying by heating in an oven.
[0026]
The thus obtained crosslinked carboxymethylcellulose of the present invention has excellent mechanical strength. In addition to the fact that carboxymethylcellulose itself has been recognized as having high safety by the Japanese Pharmacopoeia, the crosslinked product of the present invention uses a chemical substance such as a crosslinking agent, an activator, or a polyvalent metal ion. Therefore, it can be used alone as a tangible material of a medical device used in a humid environment, in particular, a medical device used for implantation in the body. Examples of the medical device used for such an implantable purpose include a carrier material such as a drug / factor / gene, various prosthetic materials, a vascular embolus material, a hemostatic material, and an adhesion preventing material.
[0027]
The crosslinked carboxymethylcellulose of the present invention is stable in pure water for a long period of time, but dissolves in a relatively short period of time in an environment where a salt is present, such as in a living body. This is considered to be because the carboxymethyl group of carboxymethyl cellulose is dissociated by ion exchange. This feature is a huge advantage when used in medical applications, especially implantable applications. That is, this material has a very favorable characteristic that it can be implanted into the body for a certain purpose, and is discharged outside the body after the purpose is achieved.
[0028]
Since the crosslinked carboxymethylcellulose of the present invention uses carboxymethylcellulose, which is a non-living material, as a raw material, the risk of contaminating antigenic substances such as viruses and proteins is lower than that of hyaluronic acid or the like derived from living organisms, and is more safe. Excellent in nature.
Since the crosslinked carboxymethylcellulose of the present invention uses carboxymethylcellulose, which is a relatively inexpensive material, as a raw material, a medical device for implanting in the body is much cheaper than a medical material using expensive materials such as hyaluronic acid as a raw material. Can be provided.
[0029]
These medical devices can be manufactured by a known method using the crosslinked carboxymethyl cellulose of the present invention. When used as a tangible material of a medical device, the crosslinked carboxymethylcellulose is appropriately sterilized by a known method such as ethylene oxide gas or gamma ray.
[0030]
As described above, the crosslinked carboxymethylcellulose of the present invention can be used alone as a tangible material of a medical device, particularly a medical device used for implanting in the body. May be used as a composition containing the components of However, this composition preferably does not contain a polymer compound other than carboxymethylcellulose.
Other components that may be included in the composition include, for example, plasticizers such as low molecular weight polyethylene glycol (molecular weight of about 200 to 600), glycerin, ethylene glycol, propylene glycol, and the like. Crosslinked carboxymethylcellulose in a solution containing these plasticizers, for example, dried by leaving the crosslinked carboxymethylcellulose at room temperature, or immersed in a film obtained by heating and drying in an oven, and then dried. Thereby, the flexibility of the crosslinked body (film) can be improved. When the composition contains a plasticizer, it is contained in an amount of 10 to 70 parts by mass, preferably 20 to 50 parts by mass, based on the total mass of the composition.
[0031]
Other components that may be included in the composition include carboxymethyl cellulose that does not participate in crosslinking. The acidic solution is frozen, and then the carboxymethylcellulose crosslinked product obtained by thawing or the dried product thereof is further immersed in a solution containing a sodium salt of carboxymethylcellulose, so that the carboxymethylcellulose not participating in crosslinking in the crosslinked product Can be included. Compositions containing carboxymethylcellulose that do not participate in such crosslinking exhibit strong adhesion when wet. Carboxymethylcellulose that does not participate in crosslinking included in the composition is different from carboxymethylcellulose that forms a crosslinked body, and its degree of etherification and viscosity are not particularly limited. However, the adhesive strength of the composition when wet depends on the degree of etherification of carboxymethylcellulose to be included, and the higher the degree of etherification, the greater the adhesive strength of the composition. When carboxymethylcellulose not involved in crosslinking is included, it is included in the composition at a content of 2 to 50 parts by mass, preferably 5 to 30 parts by mass based on the total mass of the composition. If the content of carboxymethylcellulose not involved in crosslinking is in the above range, the adhesion of the composition can be increased without impairing the flexibility of the original crosslinked body before including carboxymethylcellulose not involved in crosslinking. .
[0032]
【Example】
Hereinafter, the present invention will be further described using examples.
Example 1
CMC Daicel (registered trademark) product number 2340 (viscosity: 5,000 to 8,000 mPa · s / 1% aqueous solution, degree of etherification: 0.8 to 1.0) is dissolved in RO water and 0.6 w / v% Was prepared and 1N hydrochloric acid was added thereto to adjust the pH to 1.5. 15 ml of this solution was placed in a plastic petri dish having an inner diameter of 9 cm, and cooled in a low-temperature constant temperature bath at -25 ° C for 2 hours to freeze the solution. At this time, a large number of ice crystals having a length of several mm to several cm extending linearly in various directions were observed on the surface of the frozen solution. When the petri dish was taken out of the low-temperature constant temperature bath and the contents were thawed in a water bath at 15 to 20 ° C., a heterogeneous gel was formed in which carboxymethylcellulose fibers of various lengths were oriented along the above-mentioned ice crystals. The formation of a crosslinked product was observed. The gel was removed from the Petri dish using tweezers, and exposed to running water for 3 hours to remove hydrochloric acid. As a result, a gel-like carboxymethylcellulose crosslinked product was obtained. During this operation, several gels were formed along the oriented fibers. Torn part occurred.
[0033]
Example 2
CMC Daicel (registered trademark) product number 2340 (viscosity: 5,000 to 8,000 mPa · s / 1% aqueous solution, degree of etherification: 0.8 to 1.0) is dissolved in RO water and 0.6 w / v% An aqueous solution was prepared, and the pH was adjusted to 1.5 by adding 1N hydrochloric acid. 15 mL of this solution was put into a plastic petri dish having an inner diameter of 9 cm, pre-cooled at −3 ° C. for 1 hour without freezing the solution in a low-temperature constant temperature bath, and then the temperature of the low-temperature constant temperature bath was lowered to −25 ° C. The solution was frozen by cooling for hours. At this time, the surface of the frozen solution was smooth, and no ice crystals as observed in Example 1 were observed. When the petri dish was taken out of the low-temperature constant temperature bath and the content was thawed in a water bath at 15 to 20 ° C., formation of a homogeneous gel-like crosslinked body without oriented fibers was observed. This gel was taken out of the petri dish using tweezers, and exposed to running water for 3 hours to remove hydrochloric acid, thereby obtaining a gel-like crosslinked carboxymethylcellulose without breaking as in Example 1.
[0034]
Comparative example
CMC Daicel (registered trademark) product number 1140 (viscosity: 100 to 200 mPa · s / 1% aqueous solution, degree of etherification 0.6 to 0.8) is dissolved in RO water to prepare a 1.0 w / v% aqueous solution, 1N nitric acid was added thereto to adjust the pH to 1.0. 15 mL of this solution was placed in a plastic petri dish having an inner diameter of 9 cm, and the solution was frozen by cooling at −20 ° C. in a low-temperature constant temperature bath. After leaving it in a frozen state for 3 days, the petri dish was taken out, and the contents were thawed in a water bath at 25 ° C. As in Example 1, carboxymethylcellulose fibers of various lengths, short and long, were oriented. The formation of a homogeneous gel-like crosslinked product was observed. Since this gel was lower in strength than the gel of Example 1 and could not be taken out of the petri dish using tweezers, an attempt was made to remove nitric acid by exposing the petri dish to running water for 3 hours while keeping the petri dish, but it swelled significantly. Later, it was dissolved in water and a tangible material could not be obtained.
[0035]
Example 3
CMC Daicel (registered trademark) product number 1180 (viscosity: 1,000 to 1,300 mPa · s / 1% aqueous solution, degree of etherification 0.6 to 0.8) is dissolved in RO water to obtain a 0.8 w / v% aqueous solution Was prepared, and the pH was adjusted to 1.5 by adding 1N nitric acid. 15 mL of this solution was put into a plastic petri dish having an inner diameter of 9 cm, pre-cooled at −3 ° C. for 1 hour without freezing the solution in a low-temperature constant temperature bath, and then the temperature of the low-temperature constant temperature bath was lowered to −25 ° C. The solution was frozen by cooling for hours. When the petri dish was taken out of the low-temperature constant temperature bath and the content was thawed in a water bath at 15 to 20 ° C., formation of a homogeneous gel-like crosslinked body without oriented fibers was observed. Since this gel was slightly lower in strength than the gel of Example 1, it was carefully removed from the Petri dish using tweezers, and exposed to running water for 3 hours to remove hydrochloric acid, thereby obtaining a gel-like carboxymethyl crosslinked product. During this time, this gel showed a tendency to swell slightly compared to the gel of Example 1, but did not dissolve in water.
[0036]
Example 4
A gel crosslinked carboxymethylcellulose was obtained in the same manner as in Example 2 except that freezing and thawing were repeated twice.
[0037]
Example 5
A gel crosslinked carboxymethylcellulose was obtained in the same manner as in Example 2 except that freezing and thawing were repeated three times.
[0038]
Example 6
A gel crosslinked carboxymethylcellulose was obtained in the same manner as in Example 2, except that the freezing and thawing were repeated five times.
[0039]
Example 7
A gel crosslinked carboxymethylcellulose was obtained in the same manner as in Example 2, except that the pH of the solution was set to 0.5 and freezing and thawing were repeated three times.
[0040]
Example 8
A gel crosslinked carboxymethylcellulose was obtained in the same manner as in Example 2 except that the pH of the solution was set to 2.5 and freezing and thawing were repeated three times.
[0041]
Example 9
CMC Daicel (registered trademark) product number 2280 (viscosity: 11,500 mPa · s, degree of etherification: 0.75) was dissolved in RO water to prepare a 0.5 w / v% aqueous solution, and 1N hydrochloric acid was added thereto. The pH was adjusted to 1.5. 15 mL of this solution was put into a plastic Petri dish having an inner diameter of 9 cm, and after pre-cooling at -3 ° C for 1 hour without freezing the solution in a low-temperature constant temperature bath, the temperature was lowered to -25 ° C and further cooled for 2 hours. The solution was frozen. The petri dish was taken out of the low-temperature constant temperature bath, and the contents were thawed in a water bath at 15 to 20 ° C. After repeating the above-mentioned operation of freezing and thawing three times, it was exposed to running water for 3 hours to remove hydrochloric acid, thereby obtaining a gel-like crosslinked carboxymethylcellulose.
[0042]
Example 10
CMC Daicel (registered trademark) product number 1390 (viscosity: 3,000 to 6,000 mPa · s / 1% aqueous solution, degree of etherification: 1.0 to 1.5) is dissolved in RO water and 1.0 w / v% An aqueous solution was prepared, and the pH was adjusted to 0.8 by adding 1N hydrochloric acid. 15 mL of this solution was put into a plastic petri dish having an inner diameter of 9 cm, pre-cooled at −3 ° C. for 1 hour without freezing the solution in a low-temperature constant temperature bath, and then the temperature of the low-temperature constant temperature bath was lowered to −25 ° C. for another 2 hours. The solution was frozen by cooling for hours. The petri dish was taken out of the low-temperature constant temperature bath, and the contents were thawed in a water bath at 15 to 20 ° C. After repeating the above freezing and thawing operations three times, the gel was exposed to running water for 3 hours to remove hydrochloric acid, thereby obtaining a gel-like crosslinked carboxymethylcellulose.
[0043]
Example 11
The gel-like crosslinked carboxymethylcellulose obtained in the same manner as in Example 2 was dried in an oven at 40 ° C. to obtain a substantially colorless and transparent film.
[0044]
Example 12
The gel-like crosslinked carboxymethylcellulose obtained in the same manner as in Example 2 was freeze-dried to obtain a sponge-like porous body.
[0045]
Example 13
The gel-like carboxymethylcellulose crosslinked product obtained in the same manner as in Example 2 was dehydrated in ethanol and air-dried to obtain a white film.
[0046]
Example 14
Immersion experiment in simulated body fluid
The crosslinked carboxymethylcellulose of Examples 2, 4 to 13 and the dried product thereof were immersed in 90 mL of a simulated body fluid (pH 7.4 phosphate buffered saline; 37 ° C.). Observations were made at 1 hour, 3 hours, 6 hours, 24 hours (= 1 day) after the start of immersion, and thereafter every day, and the period until each material was dissolved was examined (the margins of the material were not When it became clear, it was referred to as "dissolution"). The results are shown in Table 2. As is evident from Table 2, the crosslinked carboxymethylcellulose of Examples 2, 4 to 12 dissolved in the simulated body fluid 1 hour to 8 days after immersion. From this, it is expected that all of these cross-linked carboxymethyl celluloses will dissolve in body fluids after a certain period of time when implanted in the body. Also, from Table 2, the crosslinked carboxymethylcellulose of the present invention depends on the type of carboxymethylcellulose used (specifically, the viscosity and the degree of etherification), the pH of the solution, the number of times of freezing and thawing, and the presence / absence of drying. It showed that the time to dissolution could be adjusted.
[0047]
[Table 2]
[0048]
Example 15
20 mL of a 1 w / v% aqueous solution of CMC Daicel (registered trademark) product number 1350 (viscosity: 200 to 300 mPa · s, degree of etherification 1.0 to 1.5) was placed in a plastic petri dish having an inner diameter of 9 cm, and the example was placed therein. The gel-like crosslinked body obtained in the same manner as in No. 4 was immersed, and then dried in an oven at 40 ° C. The porous body obtained in the same manner as in Example 12 was similarly immersed in the above aqueous solution, frozen in a low-temperature constant temperature bath at −25 ° C., and lyophilized by reducing the pressure. The obtained film and porous body showed remarkably strong adhesion to wet fingers as compared with the films and porous bodies of Examples 11 and 12, respectively.
[0049]
【The invention's effect】
The crosslinked carboxymethylcellulose obtained by the present invention has excellent mechanical strength and is suitable as a tangible material of a medical device used in a wet environment. In the present invention, such a crosslinked carboxymethylcellulose, which is a water-insoluble tangible material, can be obtained without using a chemical substance such as a crosslinking agent, an activator, or a polyvalent metal ion.
Since the crosslinked carboxymethylcellulose of the present invention uses carboxymethylcellulose, which is a non-living material, as a raw material, the risk of contaminating antigenic substances such as viruses and proteins is lower than that of hyaluronic acid or the like derived from living organisms, and is more safe. Excellent in nature.
Since the crosslinked carboxymethylcellulose of the present invention uses carboxymethylcellulose, which is a relatively inexpensive material, as a raw material, a medical device for implanting in the body is much cheaper than a medical material using expensive materials such as hyaluronic acid as a raw material. Can be provided.
The crosslinked carboxymethylcellulose of the present invention is stable in pure water for a long period of time, but dissolves in a relatively short period of time in an environment where a salt is present, such as in a living body. This is considered to be because the carboxymethyl group of carboxymethyl cellulose is dissociated by ion exchange. This feature is a huge advantage when used in medical applications, especially implantable applications. That is, this material has a very favorable characteristic that it can be implanted into the body for a certain purpose, and is discharged outside the body after the purpose is achieved. Examples of applications in which such characteristics are required include carrier materials for pharmaceuticals / factors / genes, various prosthetic materials, vascular embolization materials, hemostatic materials, adhesion prevention materials, and the like. However, the present invention is not limited to this.
