JP2004002412A - Therapeutic agent of nerve damage - Google Patents
Therapeutic agent of nerve damage Download PDFInfo
- Publication number
- JP2004002412A JP2004002412A JP2003128508A JP2003128508A JP2004002412A JP 2004002412 A JP2004002412 A JP 2004002412A JP 2003128508 A JP2003128508 A JP 2003128508A JP 2003128508 A JP2003128508 A JP 2003128508A JP 2004002412 A JP2004002412 A JP 2004002412A
- Authority
- JP
- Japan
- Prior art keywords
- substances
- nerve
- dendritic cell
- therapeutic agent
- cells
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Abstract
Description
【0001】
【発明の属する技術分野】
本発明は、神経再生を促し、脊髄損傷を含む中枢神経系損傷や脳梗塞等の神経機能不全疾患の治療薬、特に遺伝子治療に応用可能な治療薬に関する。
【0002】
【従来の技術】
脊髄損傷の多くは外傷性で、その原因は交通事故、スポーツ、労災などであるが、非外傷性のものとしては、炎症、出血、腫瘍、脊椎変形などが原因となっている。病態は、脊髄実質に出血、浮腫を基板とした脊髄の挫滅と圧迫病変であり、損傷部位に対応する神経障害が生じる。主な臨床症状として、障害レベル以下に、不全あるいは完全運動及び知覚麻痺が出現し、また、頚髄損傷では、特有な合併症として呼吸麻痺と過高熱(または過低熱)がみられる。上記神経障害の改善、特に運動障害の改善は、寝たきり老人増加の防止やQOL(Quality of Life)の向上に直結しており、近年の平均寿命の延長とともにその重要性が高まりつつある。
【0003】
上記脊髄損傷の治療法として行われているのは、物理的な圧迫や傷害を除去するための外科的手術と、受傷急性期の脊髄浮腫に対してのステロイド療法である(非特許文献1参照)。ステロイド剤の中ではメチルプレドニゾロンの大量投与が脊髄損傷に伴う神経症状の改善に有効であると報告されている(非特許文献2参照)が、ステロイド剤の大量投与は全身的副作用も強く発現し、コントロールが難しいことに加えて、感染症を伴う脊髄損傷では感染防御機能低下をきたすという問題点がある。また、さらに現在ステロイド大量投与療法の有効性についてさえ議論されている。以上の様に現在まで、脊髄損傷に対する有効な治療薬はなく、新しい治療薬の開発が切望されている。上記以外の脊髄損傷の治療方法として報告されているものは、インビトロで炎症関連サイトカインにより前処理された神経膠星状細胞を中枢神経系(CNS)中の損傷部位に、治療上有効な量を移植する方法(特許文献1参照)や、同種の単核貪食細胞(単球、マクロファージ等)を、損傷または疾患部位に、あるいはその近傍の中枢神経系(CNS)に投与することにより、哺乳動物CNSにおける神経軸索再生を促進する方法(特許文献2及び非特許文献3〜6参照)などである。また、明確な機序は不明であるが、spinal cord homogenateによるvaccinationや髄鞘蛋白質であるmyelin basic proteinに特異的なT細胞を投与することにより、脊髄損傷後の運動維持の回復を促進させたという報告もなされている(非特許文献7、8参照)。
【0004】
他方、樹状細胞(Dendritic Cell:DC)は造血幹細胞由来の樹枝状形態をとる細胞集団で、生体内に広く分布している。未成熟樹状細胞は、それぞれの組織に侵入したウイルスや細菌をはじめとする異物を認識して取り込み、リンパ系器官T細胞領域への移動の過程で消化分解してペプチドを生成し、MHC分子に結合させて細胞表面に提示することにより抗原特異的なT細胞を活性化して免疫応答を誘導する抗原提示細胞としての役割を担っている(非特許文献9、10参照)。
【0005】
樹状細胞は、その分布が広範であるものの各組織における密度が高くなかったために多数の細胞の調製は困難であったが、未熟な前駆細胞の培養に分化増殖因子を添加することによりインビトロで多数の細胞が容易に調製可能になったことを受け、免疫賦活化剤として樹状細胞を利用することが検討され始めている(非特許文献11参照)。とりわけ、微弱な腫瘍免疫応答に対して樹状細胞に抗原をパルスすることにより特異的に免疫応答を増強しようとするものである。動物実験では、腫瘍由来のタンパク質や抗原ペプチドを提示した樹状細胞により特異的CD8+細胞障害性T細胞が誘導されることが示されており、ヒトでも同様に腫瘍由来のタンパク質や抗原ペプチドを樹状細胞とともに生体に戻すことにより腫瘍の減少あるいは消失が報告されている。一方、サイトカインであるIL−12は主に抗原提示細胞である上記樹状細胞やB細胞から分泌され、T細胞やNK細胞に働き、その高い抗腫瘍活性が報告されている(非特許文献12、13参照)。このように、IL−12は癌の治療薬として注目されており、癌に対する新しい免疫療法として臨床治験が行われていたが、神経系に対しては従来全く用いられていなかった。
【0006】
他方、動物モデルを用いた脊髄損傷の研究において最も重要なことの一つに運動機能評価が挙げられる。かかる運動機能評価は簡便で、かつ高い再現性を有することが望まれている。しかし、従来の運動機能評価法は、動物の歩行動作を多岐にわたるチェック項目での合計点(最高21点)で評価するBBBスコア法(非特許文献14)など、後肢個々の関節の動き、及びそれらの協調運動や全体としての歩行状態に注目したものが多く、運動の様子をビデオテープに録画して、録画後に詳細な計測を必要とするものもあり、煩雑で、実験者による個人差を生じやすいという問題があった。
【0007】
【特許文献1】
特表2000−503983号公報
【特許文献2】
特表平11−13370号公報
【非特許文献1】
N. Engl. J. Med. 322, 1405−1411, 1990、J. Neurosurg 93, 1−7, 2000
【非特許文献2】
J. Spinal Disord. 5(1), 125−131, 1992
【非特許文献3】
J. Mol. Med. 77, 713−717, 1999
【非特許文献4】
J. Neurosci. 19(5), 1708−16, 1999
【非特許文献5】
Neurosurgery 44(5), 1041−5, 1999
【非特許文献6】
Trends. Neurosci 22(7), 295−9, 1999
【非特許文献7】
Neuron 24, 639−647, 1999
【非特許文献8】
Lancet 354, 286−287, 2000
【非特許文献9】
Ann. Rev. Immunol. 9, 271−296, 1991
【非特許文献10】
J. Exp. Med. 185, 2133−2141, 1997
【非特許文献11】
J. Exp. Med. 183, 7−11, 1996
【非特許文献12】
J. Exp. Med. 178, 1223−1230, 1993
【非特許文献13】
J. Exp. Med. 189, 1121−1128, 1999
【非特許文献14】
J Neurosung 93, 266−75, 2000
【0008】
【発明が解決しようとする課題】
脊髄損傷を含む中枢神経系の損傷は極めて治療困難な疾患で、前記のように現在まで有効な治療法がなく、新たな治療法の開発が強く望まれている。また高齢化に伴い、神経系疾患に罹患する患者数は増加する傾向にあり、大きな社会問題となっている。しかし、中枢神経系は再生が極めて困難な臓器であり、また免疫反応が起こりにくい特殊な臓器である。前記のSchwartzらによるマクロファージを用いて中枢神経系(CNS)の神経軸索再生を促進させる方法においては、マクロファージのいかなる機能が軸索の再生に働きかけるのかは明らかではなかった。また、マクロファージ等の細胞を用いる場合、投与方法が限定されるばかりでなく、その取り扱いが繁雑で、生細胞を用いるだけに再現性のある治療効果が得られにくいという問題があった。本発明の課題は、損傷部位局所に注入するだけでなく、皮下又はリンパ節近傍や静脈内投与を含む様々な投与法が可能であり、取り扱いが簡便でかつ長期保存が可能で、いつでも大量に調製することができる、優れた神経再生促進作用を有する脊髄損傷を含む中枢神経系損傷や脳梗塞等の神経機能不全疾患の治療薬を提供することにある。
【0009】
【課題を解決するための手段】
中枢神経系は他の組織と異なり、免疫系から隔絶された組織である。しかし、最近、本発明者らはマウス脳腫瘍モデルを用いた実験により、何の刺激もされていない未熟なT細胞は中枢神経系内へ侵入できないが、脳内の抗原により活性化されたT細胞は血液脳関門を通過して、脳腫瘍と反応しうることを報告している(Neuro−Oncology 1, S105, 1999)。また、神経特異的なT細胞を投与することにより、中枢神経損傷の機能回復を促進したという報告がある(Lancet 354, 286−287, 2000)。神経特異的なT細胞が血液脳関門を通過して中枢神経系内でどういう形で機能するかは、何らかのサイトカインの放出を介してなのか、直接神経細胞や軸索に付着して作用するのかなど未だ不明であるが、免疫系の介入による神経再生の可能性が示されている。一方、神経特異的なT細胞を誘導するためには、抗原提示細胞により神経系の抗原を取り込み、細胞内で処理した抗原ペプチドをT細胞へ提示する必要がある。
【0010】
本発明者らは、脊髄損傷時において損傷組織の排除は極めて重要な第一段階であり、抗原を取り込み、T細胞に対する抗原提示能力が最も高い樹状細胞の特定のサブセットを脊髄損傷モデルマウスの損傷部位に直接移植することにより、脊髄機能の回復が促進されることを初めて実証した。上記の脊髄機能の回復促進の実証には、本発明者らにより確立された脊髄損傷マウスにおける運動機能評価方法が用いられた。この運動機能評価方法は、薬物の鎮静効果などの解析を目的として運動量の計測に使用されていた装置を脊髄損傷後の運動機能評価に応用したものである。本発明者らは、T細胞の活性化を含む中枢神経系内の環境変化をもたらす樹状細胞から分泌される物質や樹状細胞を誘導・増殖若しくは活性化する物質をターゲットとし、候補物質を脊髄損傷モデルマウス損傷部位に投与し、上記の脊髄損傷マウスにおける運動機能評価方法によりスクリーニングしたところ、癌の治療薬としては広く用いられているが、神経系では全く用いられていないIL−12や、GM−CSFが、樹状細胞と同様に脊髄機能の回復を促進することを見い出した。また、上記のように、樹状細胞サブセットを損傷脊髄内に移植することにより、有意な運動機能の回復が認められたことから、樹状細胞から分泌される神経再生を促す物質の解析を行ったところ、樹状細胞が神経栄養因子を発現し、また実際に分泌していることを確認した。本発明はこれらの知見により完成するに至ったものである。
【0011】
すなわち本発明は、樹状細胞から分泌される物質、樹状細胞を誘導・増殖させる物質、樹状細胞を活性化する物質、神経組織中の神経栄養因子の発現を誘導する物質、及び神経組織中のマイクログリア、マクロファージを誘導・増殖させる物質から選ばれる1種又は2種以上の物質、又は樹状細胞を有効成分とすることを特徴とする神経損傷又は神経機能不全疾患治療薬(請求項1)や、樹状細胞から分泌される物質、樹状細胞を誘導・増殖させる物質、樹状細胞を活性化する物質、神経組織中の神経栄養因子の発現を誘導する物質、及び神経組織中のマイクログリア、マクロファージを誘導・増殖させる物質が、サイトカインであることを特徴とする請求項1記載の神経損傷又は神経機能不全疾患治療薬(請求項2)や、樹状細胞から分泌されるサイトカインが、インターロイキン(IL)−12であることを特徴とする請求項2記載の神経損傷又は神経機能不全疾患治療薬(請求項3)や、樹状細胞を誘導・増殖させるサイトカインが、顆粒球−マクロファージコロニー刺激因子(GM−CSF)であることを特徴とする請求項2記載の神経損傷又は神経機能不全疾患治療薬(請求項4)や、神経組織中の神経栄養因子の発現を誘導するサイトカインが、顆粒球−マクロファージコロニー刺激因子(GM−CSF)であることを特徴とする請求項2記載の神経損傷又は神経機能不全疾患治療薬(請求項5)や、神経組織中のマイクログリア、マクロファージを誘導・増殖させるサイトカインが、顆粒球−マクロファージコロニー刺激因子(GM−CSF)であることを特徴とする請求項2記載の神経損傷又は神経機能不全疾患治療薬(請求項6)や、樹状細胞から分泌される物質、樹状細胞を誘導・増殖させる物質、及び樹状細胞を活性化する物質から選ばれる1種又は2種以上の物質が、該物質を発現することができるベクターであることを特徴とする請求項1〜6記載の神経損傷又は神経機能不全疾患治療薬(請求項7)に関する。
【0012】
また本発明は、樹状細胞が、神経栄養因子NT−3を分泌する樹状細胞サブセットであることを特徴とする請求項1記載の神経損傷又は神経機能不全疾患治療薬(請求項8)や、神経栄養因子NT−3を分泌する樹状細胞サブセットが、NT−3に加えて、CNTF、TGF−β1、IL−6を発現する未成熟樹状細胞サブセット、又はNT−3に加えて、CNTF、TGF−β1、IL−6、EGFを発現する成熟樹状細胞サブセットであることを特徴とする請求項8記載の神経損傷又は神経機能不全疾患治療薬(請求項9)や、神経栄養因子NT−3を分泌する樹状細胞サブセットが、細胞表面にCD11cの表面マーカーを有する未成熟樹状細胞サブセット、又は該未成熟樹状細胞に由来する成熟樹状細胞サブセットであることを特徴とする請求項8又は9記載の神経損傷又は神経機能不全疾患治療薬(請求項10)や、成熟樹状細胞サブセットが、未成熟樹状細胞を成熟させるための刺激剤の存在下で、未成熟樹状細胞サブセットをインビトロで培養することにより得られる成熟樹状細胞サブセットであることを特徴とする請求項9又は10記載の神経損傷又は神経機能不全疾患治療薬(請求項11)や、成熟樹状細胞サブセットが、神経系のタンパク質若しくはペプチド、又はそれらをコードする遺伝子の発現系が導入された成熟樹状細胞サブセットであることを特徴とする請求項9〜11のいずれか記載の神経損傷又は神経機能不全疾患治療薬(請求項12)や、請求項1〜12のいずれか記載の神経損傷又は神経機能不全疾患治療剤を、神経損傷部位、皮下若しくはリンパ節近傍、又は静脈内へ投与することを特徴とする神経損傷又は神経機能不全疾患の治療方法(請求項13)に関する。
【0013】
【発明の実施の形態】
本発明の神経損傷又は神経機能不全疾患治療薬としては、樹状細胞から分泌される物質や、樹状細胞を誘導・増殖させる物質や、樹状細胞を活性化する物質や、神経組織中の神経栄養因子の発現を誘導する物質や、神経組織中のマイクログリア、マクロファージを誘導・増殖させる物質であって、神経損傷又は神経機能不全疾患の予防効果、症状改善効果又は治療効果を有する物質(以下これら物質を総称して「樹状細胞関連有効物質」という)や、それら物質の混合物を有効成分とするものを挙げることができ、上記樹状細胞から分泌される物質としてはIL−12、IL−1α、IL−1β、IFN−γなどのサイトカインを好適に例示することができ、樹状細胞を誘導・増殖させる物質としてはGM−CSF、IL−4などのサイトカインを好適に例示することができ、樹状細胞を活性化する物質としてはIL−1β,CD40Lなどを好適に例示することができ、損傷後の神経組織中の神経栄養因子の発現を誘導する物質としてはGM−CSFなどのサイトカインを好適に例示することができ、損傷後の神経組織中のマイクログリア、マクロファージを誘導・増殖させる物質としてはGM−CSF、M−CSFなどのサイトカインを好適に例示することができる。上記神経栄養因子としては、インビボでの神経再生効果やマイクログリアの増殖、食作用の増強を誘導するNT−3、損傷脊髄の運動ニューロンの変性、脱落を抑制するBDNF、コリン作動性ニューロンの神経栄養因子NGF、脊髄の運動知覚両神経に対し変性・細胞死保護の効果を有するCNTFなどを挙げることができる。
【0014】
樹状細胞から分泌される物質や、樹状細胞を誘導・増殖させる物質や、樹状細胞を活性化する物質や、神経組織中の神経栄養因子の発現を誘導する物質や、神経組織中のマイクログリア、マクロファージを誘導・増殖させる物質としては、樹状細胞の誘導・増殖作用等を有するそれぞれ公知の物質を用いることができるが、例えば、樹状細胞から分泌される物質は、樹状細胞をインビトロで培養することにより得ることができ、樹状細胞の誘導・増殖作用を有する物質は、候補物質の存在下に樹状細胞をインビトロで培養し、樹状細胞の誘導・増殖の程度を測定・評価することにより得ることができ、樹状細胞を活性化する物質は、候補物質の存在下に樹状細胞をインビトロで培養し、樹状細胞の神経栄養因子産生能の程度を測定・評価することにより得ることができ、神経組織中の神経栄養因子の発現を誘導する物質は、候補物質を投与した損傷した神経組織中の神経栄養因子の発現・誘導の程度を測定・評価することにより得ることができ、神経組織中のマイクログリア、マクロファージを誘導・増殖させる物質は、候補物質を投与した損傷した神経組織中の、貧食能が強い活性型マイクログリア及び脊髄外から流入したモノサイト由来のマクロファージと考えられるアメーバ状(ameboid)細胞や、貧食能は乏しいが種々の神経栄養因子やサイトカインを分泌する活性型マイクログリアと考えられる分枝状(ramified)細胞の誘導・増殖の程度を測定・評価することにより得ることができる。
【0015】
上記樹状細胞関連有効物質を神経損傷又は神経機能不全疾患治療薬として用いる場合は、薬学的に許容される通常の担体、結合剤、安定化剤、賦形剤、希釈剤、pH緩衝剤、崩壊剤、可溶化剤、溶解補助剤、等張剤などの各種調剤用配合成分を添加することができる。またかかる治療剤は、経口的又は非経口的に投与することができる。すなわち通常用いられる投与形態、例えば粉末、顆粒、カプセル剤、シロップ剤、懸濁液等の剤型で経口的に投与することができ、あるいは、例えば溶液、乳剤、懸濁液等の剤型にしたものを注射の型で非経口に局所に投与することができる他、スプレー剤の型で鼻孔内投与することもできる。
【0016】
また、上記樹状細胞関連有効物質として、該物質を発現することができるベクターを用いることができ、遺伝子治療として、かかるベクターを局所投与する場合、樹状細胞関連有効物質を有効成分とする治療薬を局所投与する場合に比べて、該物質の安定した発現により、樹状細胞関連有効物質を局所に安定的に供給することが可能になる。多くの樹状細胞関連有効物質は半減期がきわめて短く、不安定であるのに対して、樹状細胞関連有効物質を発現することができるベクターを用いて、神経損傷部位の細胞へ遺伝子導入することにより、所定の期間の安定した発現を得ることができる。このようなベクターとしては、ヘルペスウイルス(HSV)ベクター、アデノウイルスベクター、ヒト免疫不全ウイルス(HIV)ベクター等のウイルスベクターを好適に挙げることができるが、これらウイルスベクターの中でもHSVベクターが好ましい。HSVベクターは、神経親和性が高く、HSVが細胞の染色体DNAに組み込まれないため安全であり、また、導入遺伝子の発現期間を調節することが可能である。また、樹状細胞関連有効物質を発現するウイルスベクターは、常法により調製することができる。
【0017】
また、本発明の神経損傷又は神経機能不全疾患治療薬としては、樹状細胞、特に好ましくは神経栄養因子NT−3を分泌する樹状細胞サブセットを有効成分とするものを挙げることができ、上記神経栄養因子NT−3を分泌する樹状細胞サブセットとしては、インビボでの神経再生効果やマイクログリアの増殖、食作用の増強を誘導するNT−3に加えて、脊髄運動知覚両神経に対し変性・細胞死保護の効果が示すCNTF、マイクログリアやマクロファージ由来の細胞障害性物質の放出の抑制作用を有するTGF−β1、各種ニューロン(コリン・カテコールアミン・ドーパミン作動性)に対する保護効果を誘導するIL−6を発現する未成熟樹状細胞サブセットや、NT−3に加えて、CNTF、TGF−β1、IL−6、神経保護効果の認められているEGFを発現する成熟樹状細胞サブセットが好ましく、細胞表面にCD11cの表面マーカーを有する未成熟樹状細胞サブセットや該未成熟樹状細胞に由来する成熟樹状細胞サブセットを例示することができる。
【0018】
そして、上記成熟樹状細胞サブセットとして、LPS、IL−1、TNF−α、CD40L等の未成熟樹状細胞を成熟させるための刺激剤の存在下で、未成熟樹状細胞サブセットをインビトロで培養することにより得られる成熟樹状細胞サブセットを用いることもできる。この場合、NT−3等の神経栄養因子の発現が変化して、より高い再生効果を誘導することができる可能性がある。また、MBP(myelin basic protein)、MAG(myelin−associated glycoprotein)等のミエリン蛋白やNogo等の神経軸索の伸展を抑制する因子などの神経系のタンパク質若しくはペプチド、又はそれらをコードする遺伝子がインテグレイトされたウイルスベクター等の発現系が導入された(取り込まれた)成熟樹状細胞サブセットを用いることもできる。
【0019】
神経栄養因子NT−3を分泌する樹状細胞サブセットは、例えば、末梢血等に対し密度遠心分離処理等の前処理を行った後、樹状細胞表面抗原に対するモノクローナル抗体を用いてFACSでソートする方法や、樹状細胞表面抗原に対する磁気ビーズ結合モノクローナル抗体を用いる分離方法等により樹状細胞サブセットを分離し、それらの中からNT−3を分泌する樹状細胞サブセットを選択することにより得ることができる。かかる神経栄養因子NT−3を分泌する樹状細胞サブセットは脊髄等の神経損傷部位に移植することができる。また、特に、上記神経系のタンパク質若しくはペプチド、又はそれらをコードする遺伝子の発現系が導入された(取り込まれた)成熟樹状細胞サブセットは、皮下又はリンパ節近傍へ投与することができる。以上のように、本発明の神経損傷又は神経機能不全疾患の治療方法としては、前記樹状細胞関連有効物質や神経栄養因子NT−3を分泌する同種の樹状細胞サブセットを有効成分とする神経損傷又は神経機能不全疾患治療剤を、神経損傷部位、皮下若しくはリンパ節近傍、又は静脈内に投与(移植)する方法を例示することができる。
【0020】
【実施例】
以下に、実施例を挙げてこの発明を更に具体的に説明するが、この発明の技術的範囲はこれらの実施例に限定されるものではない。
実施例1(脊髄損傷モデルBALB/cマウスの作製)
生後6週齢のBALB/c雌マウス(n=9)をそれぞれ用い、エーテル麻酔下に第8胸椎椎弓切除を行い、尖刃にて脊髄を左半切した脊髄損傷モデルマウス(損傷群;◇)を作製した。脊髄損傷後にこのマウスは左下肢の麻痺を呈した。コントロール(対照群;□)として椎弓切除のみを行った、生後6週齢のBALB/c雌マウス(n=9)を用いた。手術後、急性期として2、4日目、亜急性期として7日目、慢性期として14、21、28、56日目の上記各マウスの自発運動量を、行動解析装置SCANETMV−10(東洋産業;426mm四方の正方形内に縦横に走行する近赤外線センサー144組を上下に2段重ねに設置した装置)を用いて計測し運動機能評価を行った。なお、自発運動量の計測としては、大小2種類の水平方向の動き(Movement1、2;M1、M2と略し、M1は12mm以上、M2は60mm以上動きがあったとき動作をしたとみなし、運動量を計測する)、垂直方法の動き(Rearing;RGと略し、6.75cm以上の立ち上がり動作の回数を計測する)の形で検出し計測し、1匹あたり10分間の計測を行うように設定した。BALB/c雌マウスを用いた場合の結果を図1に示す。なお、図中のp値はStudent’s t testを用いて算出した(*:p<0.05、**:p<0.01)。これら対照群と損傷群との各運動機能評価を比較した結果、水平方向の運動評価を示すM1(図1上段)、M2(図1中段)では、急性期・亜急性期においては有意差が認められたが、慢性期では有意差は認められなかった。一方、垂直方向の運動評価を示すRGでは両群間において慢性期まで明らかな有意差が認められた(図1下段)。
【0021】
実施例2(脊髄損傷モデルC57BL/6マウスの作製)
また、上記生後6週齢のBALB/c雌マウス(n=9)に代えて、生後6週齢のC57BL/6雌マウス(n=16)を用いる以外は実施例1と同様に行動解析装置SCANETMV−10を用いて運動機能評価を行った。結果を図2に示す。なお、図中のp値はStudent’s t testを用いて算出した(**:p<0.01)。これら対照群(□)と損傷群(◇)との各運動機能評価を比較した結果、急性期・亜急性期・慢性期を通じて、水平方向の運動評価を示すM1(図2上段)、M2(図2中段)では明らかな有意差は認められなかった。一方、垂直方向の運動評価を示すRGでは両群間において慢性期まで明らかな有意差が認められた(図2下段)。以上2種類の異なる系統のマウスの実験結果より、水平運動量(M1、M2)は健側の下肢及び両上肢により代償され、左下肢の麻痺を正確に評価できなかったのに対して、垂直方向運動(RG)は脊髄損傷後の運動機能を正確に評価しうることが示された。
【0022】
実施例3(脊髄損傷に対する樹状細胞の効果)
実施例1と同様の手術により脊髄損傷モデルマウス(BALB/c雌マウス)を作製し、直ちにRPMI1640培地のみ[コントロール(◇)、図3;n=14、図4;n=6]、又は、脾臓から単離した樹状細胞を含む抗原提示細胞[5×105個/マウス,n=13(図3;○)]若しくは免疫磁気ビーズ法にてCD11c(+)のサブセットをソートすることによって得られた樹状細胞[1×105個/マウス,n=6(図4;○)]を脊髄損傷部位に移植した。また、脊髄損傷を加えないコントロールとして椎弓切除のみ施行したマウスを用いた[図3;□(n=6)]。実施例1と同様に2、4、7、14、21、28、56日目の各マウスの垂直方向の自発運動量を、行動解析装置SCANETMV−10を用いて計測し運動機能評価を行った。それらの結果を図3及び図4に示す。なお、図中のp値はStudent’s t testを用いて算出した(*:p<0.05、**:p<0.01)。これらの結果から、CD11c(+)樹状細胞サブセットを損傷部位に投与することにより、コントロールと比較して垂直方向の運動量に有意な差が認められた。以上のことから、神経損傷部位に樹状細胞を投与することにより脊髄機能の回復が促進されることが明らかになった。
【0023】
実施例4(脊髄損傷に対するIL−12の効果)
生後6週齢のBALB/c雌マウスを用いて、実施例1と同様に手術し脊髄損傷モデルマウスを作製した。また、脊髄損傷を加えないコントロールとして椎弓切除のみを行った、生後6週齢のBALB/c雌マウス(□;n=6)を用いた。脊髄損傷直後に、生理食塩水のみ(◇;n=14)又はIL−12(100ng/マウス;ファーミンジェン社製,○;n=14)を5μl脊髄損傷部位に投与した後、実施例1と同様に2、4、7、14、21、28日目の各マウスの垂直方向の自発運動量を、行動解析装置SCANETMV−10を用いて計測し運動機能評価を行った。その結果を図5に示す。なお、図中のp値はStudent’s t testを用いて算出した(*:p<0.05、**:p<0.01)。これらの結果から、IL−12を損傷部位に投与することにより、生理食塩水の投与と比較して垂直方向の運動量において明らかな有意差が認められた。以上のことから、神経損傷部位にIL−12を投与することにより、上記樹状細胞を用いた場合と同様に、脊髄機能の回復が促進されることが明らかになった。
【0024】
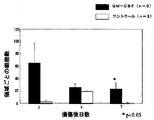
実施例5(脊髄損傷に対するGM−CSFの効果)
生後6週齢のBALB/c雌マウスを用いて、実施例1と同様に手術し脊髄損傷モデルマウスを作製した。また、脊髄損傷を加えないコントロールとして椎弓切除のみを行った、生後6週齢のBALB/c雌マウス(□;n=6)を用いた。脊髄損傷直後に、生理食塩水のみ(◇;n=7)又はGM−CSF(10ng/マウス;Genzyme社製,○;n=6)を5μl脊髄損傷部位に投与した後、実施例1と同様に2、4、7、14、21、28日目の各マウスの垂直方向の自発運動量を、行動解析装置SCANETMV−10を用いて計測し運動機能評価を行った。その結果を図6に示す。なお、図中のp値はStudent’s t testを用いて算出した(**:p<0.01)。これらの結果から、GM−CSFを損傷部位に投与することにより、生理食塩水の投与と比較して垂直方向の運動量において明らかな有意差が認められた。以上のことから、神経損傷部位にGM−CSFを投与することにより、上記樹状細胞を用いた場合と同様に、脊髄機能の回復が促進されることが明らかになった。
【0025】
実施例6(未成熟樹状細胞サブセット及び成熟樹状細胞サブセットの調製)
生後6週齢のBALB/c雌成熟マウスの脾臓より、免疫磁気ビーズ法にてCD11c陽性のサブセットを分離することにより未成熟樹状細胞を得た。具体的には、まず脾臓を100U/mlコラーゲナーゼ(Worthington Biochemical Corporation社)にてホモジェネートした後、分離しにくい被膜部分をさらに400U/mlコラーゲナーゼにて37℃、5%CO2下に20分間インキュベートして、細胞を分離した。得られた細胞を35%BSA溶液中に浮遊させて、遠心管中でさらにRPMI1640+10%胎仔血清を重層させた後、4℃、3000rpm、30分間遠心し、35%BSA溶液とRPMI1640+10%胎仔血清溶液との境界層の細胞を回収した。次に得られた細胞に対して、CD11c抗原に対する磁気ビーズ結合モノクローナル抗体(2×108ビーズ、Miltenyi Biotec社)を4℃15分間反応させ、ビーズ結合細胞を磁気により分離することにより、未成熟樹状細胞サブセットが濃縮された画分を得た。また、得られた未成熟樹状細胞サブセットをRPMI1640+10%胎仔血清の培養液中で37℃、5%CO2下24時間培養することにより成熟樹状細胞サブセットを得た。
【0026】
実施例7(樹状細胞における神経栄養因子の遺伝子発現)
未成熟樹状細胞サブセット及び成熟樹状細胞サブセットのそれぞれの細胞からTRIzol(Life Technologies社)を用いて全RNAを抽出し、各5μgの全RNAからAMV(Avian Myeloblastosis Virus)逆転写酵素とオリゴ(dT)プライマーを用いて、42℃で60分間インキュベートし、総量200μlのcDNAを合成した。β−アクチンのプライマーを用いてPCRを施行し、遺伝子発現を確認した後、各神経栄養因子についてそれぞれの条件下でPCRを行った。PCRは1μlのcDNAをテンプレートとしてExtaq(TAKARA社)の反応酵素を用いて、サーマルサイクラー(Perkin−Elmer社)により遺伝子を増幅した。用いたプライマーとPCR条件を[表1]に示す。なお混入したゲノミックDNAから増幅された遺伝子産物でないことを示すために、コントロールとして全RNAをテンプレートとして、それぞれPCR反応を行った。未成熟樹状細胞サブセットにおける結果を図7に、成熟樹状細胞サブセットにおける結果を図8にそれぞれ示す。
【0027】
【表1】
【0028】
未成熟樹状細胞では、インビボでの神経再生効果やマイクログリアの増殖、食作用の増強を誘導するNT−3、脊髄運動知覚両神経に対し変性・細胞死保護の効果を有するCNTF、マイクログリアやマクロファージ由来の細胞障害性物質の放出の抑制作用を有するTGF−β1、各種ニューロン(コリン・カテコールアミン・ドーパミン作動性)に対する保護効果を誘導するIL−6の発現が確認された(図7)。また、成熟樹状細胞では、NT−3、CNTF、TGF−β1、IL−6に加え、神経保護効果の認められているEGFの発現が確認された(図8)。それぞれの遺伝子について、ゲルからcDNAを抽出して塩基配列を解析し、発現産物がそれぞれNT−3、CNTF、TGF−β1、IL−6及びEGFであることを確認した。
【0029】
実施例8(神経栄養因子NT−3の分泌)
さらに神経再生のために最も重要と考えられている神経栄養因子の一つであるNT−3に関して、実際に樹状細胞から分泌されているかをNT−3イムノアッセイシステム(Promega社製)を用いたELISA法にて解析した。実施例1と同様にして、生後6週齢のBALB/c雌成熟マウスの脾臓から、免疫磁気ビーズ法によりCD11c陽性の未成熟樹状細胞分離した。このCD11c陽性の未成熟樹状細胞1×105個を、RPMI1640+10%胎仔血清の培養液中で37℃、5%CO2下24時間インキュベートした後、その培養上清を回収した。コントロールとしてRPMI1640のみ、及びCD4陽性T細胞、CD8陽性T細胞それぞれ1×105個を用いた。2種の抗NT−3抗体を用いたサンドイッチELISA法により上清中のNT−3を定量的に解析した結果、1×105個の樹状細胞が24時間で約1.75ngのNT−3を分泌していることが明らかになった。RPMI1640のみ、及びCD4陽性T細胞、CD8陽性T細胞では分泌は認められなかった(図9)。
【0030】
実施例9(脊髄損傷に対する樹状細胞の効果の再確認)
生後6週齡のBALB/c雌マウスをエーテル麻酔下に第8胸椎椎弓切除を行い、顕微鏡下で左側脊髄を半切した脊髄損傷モデルマウスを作製した。脊髄損傷部位に直ちに樹状細胞1×106個を移植した後(DC,n=17)、本発明者らが開発した下肢の運動機能評価法(行動解析装置SCANET MV−10を用いて、立ち上がり回数を自動的に解析する、RGスコア)、及びすでに確立された下肢の運動機能評価法の一つであるBBBスケール(0−21点の間で評価し、0点は全く下肢運動が認められない、21点は正常)を用いて、経時的に評価を行った。コントロールとしてRPMI1640(RPMI,n=18)、及びCD8陽性T細胞(T,n=10)を同様に損傷脊髄部位に移植した。結果を図10に示す。図10からもわかるように、2つの評価法(RGスコア及びBBBスケール)で共に、コントロールのT細胞やRPMIの場合と比較して、DC移植群で統計学的有意に高いスコアを示した。従って、神経栄養因子NT−3を分泌する樹状細胞サブセットを脊髄損傷部位に移植することにより、脊髄機能の回復が促進されることが再確認することができた。
【0031】
実施例10(樹状細胞移植による内在性マイクログリアの活性化)
樹状細胞移植により内在性マイクログリアや、損傷部の血管から侵入したマクロファージの反応性に変化がみられるかどうかを検討するため、それらを認識するMac−1抗体を用いて、免疫組織染色を行い、陽性細胞数の経時的な変化を調べた。まず、損傷後2,4,7,14日の樹状細胞移植マウスについて、2%パラフォルムアルデヒドで経心臓的灌流固定を行い、凍結切片を作製した(n=3)。コントロールとして、RPMI1640移植群を用いた(n=3)。次に、一次抗体として抗マウスMac−1抗体(Pharmingen社)を利用した免疫組織染色を行った。計測領域に関しては、細胞を移植する際に用いたgelfoam(変性コラーゲン)の最も遠位部、及びそこから1mm離れた地点それぞれで、背側から腹側に至る部分として、損傷辺縁部、頭側・尾側の3つに分類した。計測するMac−1陽性細胞の種類に関しては、脊髄外より流入したモノサイト由来のマクロファージと貪食能が特に強い活性型マイクログリアとの両方が含まれるアメーバ状細胞と、貪食能に関しては乏しい活性型マイクログリアと考えられる分枝状細胞の2つに分けて行った。
【0032】
損傷辺縁部から頭側にかけての代表的切片の染色像を図11に示す。両群ともに、損傷後2日では細胞浸潤は乏しいが、4日では損傷辺縁部ではアメーバ状細胞の著明な浸潤が認められた。損傷後4日以降では、樹状細胞移植群において、頭側の遠隔部にMac−1陽性細胞の浸潤が認められたものの、コントロール群ではそのような変化は乏しかった。
【0033】
次にそれぞれMac−1陽性細胞を画像解析装置(Flovel社)を用いて定量的に解析した。図12にアメーバ状細胞数の領域別の経時的変化を示す。アメーバ状細胞の浸潤はほとんど損傷辺縁部に限局していた。損傷辺縁部や尾側において両群間で明らかな細胞数の違いを認めなかったが、頭側ではとくに損傷後14日目に樹状細胞移植群で陽性細胞が多く認められた。一方、図13は分枝状細胞数の領域別の経時的変化を示しているが、細胞数はすべての領域、計測日で樹状細胞移植群において多い結果となった。樹状細胞移植群で、頭側でアメーバ状の活性型マイクログリアの増加がみられたことは、特にアメーバ状細胞は貪食能が強いため、損傷部から離れた場所で神経軸索伸展を阻害する変性ミエリンや損傷組織に由来する蛋白質の除去を行っていると考えられる。一方、広範囲で分枝状の活性型マイクログリアの増加がみられたことは、活性型マイクログリア自身がNT−3、CNTF、IL−6、TGF−β1、EGF、bFGF、NGF、BDNF、GDNFなどの神経栄養因子を分泌することにより、神経機能の回復を促進させたと考えられる。
【0034】
実施例11(樹状細胞移植による内在性神経幹細胞/前駆細胞の解析)
樹状細胞移植による内在性神経幹細胞/前駆細胞の反応性を検討するため、それらを認識するMusashi−1抗体を用いて、免疫組織染色を行い、陽性細胞数の経時的な変化を調べた。まず、損傷後2、4、7日の樹状細胞移植マウスについて、2%パラフォルムアルデヒドで経心臓的灌流固定を行い、凍結切片を作製した(n=3)。コントロールとして、RPMI1640移植群を用いた(n=3)。次に、一次抗体として抗マウスMusashi−1抗体を利用した免疫組織染色を行った。Musashi−1は1994年にOkanoらにより同定された分子量約38kDaのRNA結合タンパクであり(Neuron, 1994)、マウスのMusashi−1に対するモノクローナル抗体を用いた解析では神経幹細胞/前駆細胞に強く発現することが報告されている(Dev. Biol. 1996, J. Neurosci. 1997, Dev. Neurosci. 2000)。計測領域に関しては、細胞を移植する際に用いたgelfoam(変性コラーゲン)の最も遠位部、及びそこから1mm離れた地点それぞれで、背側から腹側に至る部分として、損傷辺縁部、遠位部(頭側・尾側)の2つに分類した(図14)。
損傷辺縁部から頭側にかけての代表的切片の染色像を図15に示す。両群ともに、損傷後2日では差はみられないが、損傷後4日以降では、樹状細胞移植群において、辺縁部、遠位部ともにMusashi−1陽性細胞が多く認められたものの、コントロール群ではそのような変化は乏しかった。
【0035】
次にMusashi−1陽性細胞を画像解析装置(Flovel社)を用いて定量的に解析した。図16にMusashi−1陽性細胞数の領域別経時変化を示す。損傷後4日以降で損傷辺縁部や遠位部ともに、コントロールと比較して樹状細胞移植により有意なMusashi−1陽性細胞数の増加を認めた。特に損傷辺縁部では、損傷後2日から4日の間に樹状細胞移植群でMusashi−1陽性細胞の著しい増加が認められた。
以上、樹状細胞の移植により、内在性神経幹細胞/前駆細胞が増殖誘導されることが明らかになった。
【0036】
実施例12(GM−CSF投与後の損傷神経組織における神経栄養因子の発現誘導)
生後6週齢のBALB/c雌マウスを用いて、脊髄損傷モデルマウスを作成した。損傷直後に、生理食塩水のみ又はGM−CSF(250pg/マウス;Genzyme社製)を5μl脊髄損傷部位に投与し、2日目に脊髄を摘出した。摘出した脊髄は液体窒素中で凍結後80℃にて保存し、TRIzol(Life Technologies社製)を用いて全RNAを抽出した。各5μgの全RNAからAMV(Avian Myeloblastosis Virus)逆転写酵素とオリゴ(dT)プライマーを用いて、42℃で60分間インキュベートし、総量200μlのcDNAを合成した。β−アクチンのプライマーを用いてPCRを施行し、遺伝子発現を確認した後、各神経栄養因子についてそれぞれの条件下でPCRを行った。PCRは1μlのcDNAをテンプレートとしてExtaq(TAKARA社製)の反応酵素を用いて、サーマルサイクラー(Perkin−Elmer社)により遺伝子を増幅した。用いたプライマーとPCR条件を[表2]に示す。なお混入したゲノミックDNAから増幅された遺伝子産物ではないことを示すために、コントロールとして全RNAをテンプレートとして、それぞれPCR反応を行った。
【0037】
【表2】
【0038】
損傷脊髄にGM−CSFを投与することにより、インビボでの神経再生効果やマイクログリアの増殖、食作用の増強を誘導する神経栄養因子NT−3、損傷脊髄の運動ニューロンの変性、脱落を抑制する神経栄養因子BDNF、コリン作動性ニューロンの神経栄養因子NGF、及び脊髄の運動知覚両神経に対し変性・細胞死保護の効果を有する神経栄養因子CNTFの発現が誘導されることが明らかになった(図17)。
【0039】
実施例13(GM−CSF投与による内在性マイクログリアの活性化)
GM−CSFはインビトロでマイクログリア及びマクロファージの増殖や活性化に関与することが知られているが、中枢神経系組織内のマイクログリア及び損傷部血管から侵入したマクロファージに対する反応性を解析するため、それらを認識するMac−1抗体を用いて、免疫組織染色を行い、陽性細胞数の経時的な変化を調べた。まず、損傷後2、4、7日のGM−CSF投与マウスについて、2%パラフォルムアルデヒドで経心臓的灌流固定を行い、凍結切片を作製した(n=3)。コントロールとして、生理食塩水投与マウスを用いた(n=3)。次に、一次抗体として抗マウスMac−1抗体(Pharmingen社)を利用した免疫組織染色を行った。計測領域に関しては、細胞を移植する際に用いたgelfoam(変性コラーゲン)の最も遠位部から背側及び腹側1mm離れた領域を解析した(図18)。計測するMac−1陽性細胞の種類に関しては、貧食能が強い活性型マイクログリア及び脊髄外から流入したモノサイト由来のマクロファージと考えられるアメーバ状(ameboid)細胞と、貧食能は乏しいが種々の神経栄養因子やサイトカインを分泌する活性型マイクログリアと考えられる分枝状(ramified)細胞の2つに分けて、画像解析装置(Flovel社)を用いて定量的に解析した。
【0040】
図19及び20にアメーバ状及び分岐状細胞数の経時的変化を示す。GM−CSF投与群では損傷後2日目から多くのアメーバ状細胞を認め、7日目においてコントロールと比較して有意な細胞数の増加を認めた。また、分岐状細胞に関しても、コントロールと比較して損傷後4日目、7日目において有意な細胞数の増加を認めた。GM−CSF投与群でアメーバ状細胞の増加がみられたことは、特にアメーバ状細胞は貧食能が強いため、神経軸索伸展を阻害する変性ミエリンや損傷組織に由来する蛋白質の除去を行っていると考えられる。また分岐状細胞の増加がみられたことは、活性型マイクログリア自身がNT−3、BDNF、NGF、CNTF等の神経栄養因子を分泌することにより、神経機能の回復を促進させたと考えられる。
【0041】
実施例14(GM−CSF投与による内在性神経幹細胞/前駆細胞の増殖誘導)GM−CSF投与による中枢神経系内の神経幹細胞/前駆細胞に対する反応性を解析するため、それらを認識するMusashi−1抗体を用いて、免疫組織染色を行い、陽性細胞数の経時的な変化を調べた。まず、損傷後2、4、7日のGM−CSF投与マウスについて、2%パラフォルムアルデヒドで経心臓的灌流固定を行い、凍結切片を作製した(n=3)。コントロールとして、生理食塩水投与マウスを用いた(n=3)。次に、一次抗体として抗Musashi−1抗体を利用した免疫組織染色を行った。計測領域に関しては、細胞を移植する際に用いたgelfoamの最も遠位部から背側及び腹側0.5mm離れた領域を画像解析装置を用いて定量的に解析した(図21)。図22にMusashi−1陽性細胞数の経時的変化を示す。GM−CSF投与群では損傷後2日目からコントロールと比較して多数のMusashi−1陽性細胞を認め、7日目において有意な細胞数の増加を認めた。以上、GM−CSF投与により、内在性神経幹細胞/前駆細胞が増殖誘導されることが明らかになった。
【0042】
以上のことより、損傷部位への樹状細胞移植により、自身の分泌する神経栄養因子、内在性マイクログリアの活性化を介した神経栄養因子の分泌及び神経軸索伸展の阻害因子の除去作用、並びに、内在性神経幹細胞/前駆細胞の増殖誘導による新たな神経細胞の再生及び再髄鞘化などを介して、神経機能が回復されたと考えられる。また、損傷部位へのGM−CSF投与により、神経細胞内における神経栄養因子の発現誘導、内在性マイクログリアの活性化を介した神経栄養因子の分泌及び神経軸索伸展の阻害因子の除去作用、並びに、内在性神経幹細胞/前駆細胞の増殖誘導による新たな神経細胞の再生及び再髄鞘化などを介して、神経機能が回復されたと考えられる。
【0043】
【発明の効果】
本発明の神経損傷又は神経機能不全疾患治療薬は、損傷部位局所に注入するだけでなく、皮下又はリンパ節近傍や静脈内投与を含む様々な投与法が可能であり、優れた神経機能回復作用を有すため、脊髄損傷を含む中枢神経系損傷や脳梗塞等の神経機能不全疾患等の疾患に有用である。また、IL−12、GM−CSFなどの樹状細胞関連有効物質は、取り扱いが簡便でかつ長期保存が可能で、いつでも大量に調製することができる点で有用であり、遺伝子治療などへの応用が可能である。
【0044】
【配列表】
【図面の簡単な説明】
【図1】脊髄損傷モデルBALB/cマウスの運動機能評価の結果を示す図である。
【図2】脊髄損傷モデルC57BL/6マウスの運動機能評価の結果を示す図である。
【図3】脊髄損傷に対する樹状細胞を含む抗原提示細胞の効果を示す図である。
【図4】脊髄損傷に対するCD11c(+)の樹状細胞の効果を示す図である。
【図5】脊髄損傷に対する本発明のIL−12の効果を示す図である。
【図6】脊髄損傷に対する本発明のGM−CSFの効果を示す図である。
【図7】RT−PCRによる未成熟樹状細胞サブセットにおける神経栄養因子の発現結果を示す図である。
【図8】RT−PCRによる成熟樹状細胞サブセットにおける神経栄養因子の発現結果を示す図である。
【図9】ELISAによる樹状細胞等のNT−3の分泌結果を示す図である。
【図10】脊髄損傷に対する神経栄養因子を分泌する樹状細胞サブセットの効果を示す図である。
【図11】樹状細胞(DC)、RPMI1640(RPMI)移植群それぞれにおける、抗Mac−1抗体を用いた免疫染色の結果、特に損傷辺縁部から頭側にかけての経時的な代表的切片を示す写真である。
【図12】樹状細胞、RPMI1640移植群それぞれにおける、Mac−1陽性アメーバ状細胞数の領域別の経時的変化を示す図である。
【図13】樹状細胞、RPMI1640移植群それぞれにおける、Mac−1陽性分枝状細胞数の領域別の経時的変化を示す図である。
【図14】Musashi−1陽性細胞数計測のための領域設定を示す写真である。
【図15】樹状細胞(DC)、RPMI1640(RPMI)移植群それぞれにおける、抗Musashi−1抗体を用いた免疫染色の結果、特に損傷辺縁部から頭側にかけて経時的な代表的切片を示す写真である。
【図16】樹状細胞、RPMI1640移植群それぞれにおける、Musashi−1陽性細胞数の領域別の経時的変化を示す図である。
【図17】RT−PCRによるGM−CSF投与後の脊髄損傷部位における神経栄養因子の発現結果を示す図である。
【図18】Mac−1陽性細胞数計測のための領域設定を示す図である。
【図19】GM−CSF投与群、コントロール(生理食塩水投与)群それぞれにおける内在性マイクログリア細胞(アメーバ状)数の経時的変化示す図である。
【図20】GM−CSF投与群、コントロール(生理食塩水投与)群それぞれにおける内在性マイクログリア細胞(分岐状)の経時的変化示す図である。
【図21】Musashi−1陽性細胞数計測のための領域設定を示す図である。
【図22】GM−CSF投与群、コントロール(生理食塩水投与)群それぞれにおける、Musashi−1陽性細胞数の経時的変化を示す図である。[0001]
BACKGROUND OF THE INVENTION
The present invention relates to a therapeutic agent that promotes nerve regeneration and can be applied to neurological dysfunction diseases such as central nervous system damage including spinal cord injury and cerebral infarction, and particularly applicable to gene therapy.
[0002]
[Prior art]
Most spinal cord injuries are traumatic and are caused by traffic accidents, sports, work accidents, etc., but non-traumatic ones are caused by inflammation, bleeding, tumors, spinal deformities, and the like. The pathological condition is crushing and compression lesions of the spinal cord with hemorrhage in the spinal cord parenchyma and edema as the substrate, and neuropathy corresponding to the damaged site occurs. Major clinical symptoms include failure or complete motor and sensory paralysis below the impairment level, and cervical spinal cord injury includes respiratory paralysis and hyperthermia (or hypothermia) as specific complications. The improvement of the above-mentioned neurological disorders, particularly the improvement of movement disorders, is directly linked to the prevention of bedridden elderly people and the improvement of QOL (Quality of Life), and its importance is increasing along with the extension of the average life span in recent years.
[0003]
As a treatment method for the spinal cord injury, a surgical operation for removing physical compression or injury and a steroid therapy for spinal cord edema in an acute injury stage (see Non-Patent Document 1). ). Among steroids, it has been reported that large doses of methylprednisolone are effective in improving neurological symptoms associated with spinal cord injury (see Non-Patent Document 2), but large doses of steroids have strong systemic side effects. In addition to being difficult to control, there is a problem that spinal cord injury associated with infection causes a decrease in the protective function of infection. Moreover, even the effectiveness of high-dose steroid therapy is currently being discussed. As described above, there is no effective therapeutic agent for spinal cord injury until now, and development of a new therapeutic agent is eagerly desired. Other reported methods of treating spinal cord injury include the use of a therapeutically effective amount of astrocytes pretreated with inflammation-related cytokines in vitro at the site of injury in the central nervous system (CNS). A mammal by administering a transplantation method (see Patent Document 1) or homologous mononuclear phagocytic cells (monocytes, macrophages, etc.) at the site of injury or disease or in the vicinity of the central nervous system (CNS). And a method of promoting nerve axon regeneration in the CNS (see
[0004]
On the other hand, dendritic cells (DC) are cell populations having a dendritic form derived from hematopoietic stem cells, and are widely distributed in the living body. The immature dendritic cells recognize and take up foreign substances such as viruses and bacteria that have invaded each tissue, and digest and decompose them in the process of migration to the lymphoid organ T-cell region to produce MHC molecules. It plays a role as an antigen-presenting cell that induces an immune response by activating antigen-specific T cells by binding to and presenting on the cell surface (see Non-Patent
[0005]
Although dendritic cells are widely distributed, the density in each tissue was not high, so it was difficult to prepare a large number of cells, but in vitro by adding differentiation growth factors to immature progenitor cell cultures. In response to the fact that a large number of cells can be easily prepared, the use of dendritic cells as an immunostimulating agent has begun to be studied (see Non-Patent Document 11). In particular, it seeks to specifically enhance the immune response by pulsing antigens into dendritic cells against a weak tumor immune response. In animal experiments, it has been shown that dendritic cells presenting tumor-derived proteins and antigen peptides induce specific CD8 + cytotoxic T cells. It has been reported that tumors are reduced or eliminated by returning them to living bodies together with dendritic cells. On the other hand, IL-12, which is a cytokine, is secreted mainly from the above-described dendritic cells and B cells, which are antigen-presenting cells, acts on T cells and NK cells, and its high antitumor activity has been reported (Non-patent Document 12). 13). Thus, IL-12 has been attracting attention as a therapeutic agent for cancer, and clinical trials have been conducted as a new immunotherapy for cancer, but it has never been used for the nervous system.
[0006]
On the other hand, motor function evaluation is one of the most important in the study of spinal cord injury using animal models. Such motor function evaluation is desired to be simple and have high reproducibility. However, conventional motor function evaluation methods include the movement of individual joints in the hind limbs, such as the BBB score method (Non-Patent Document 14), which evaluates the walking behavior of animals with a total score (up to 21 points) of various check items, and Many of them focused on their coordinated movements and the overall walking state. Some of them recorded video on the videotape and required detailed measurement after recording. There was a problem that it was likely to occur.
[0007]
[Patent Document 1]
JP 2000-503983 A [Patent Document 2]
Japanese National Patent Publication No. 11-13370 [Non-Patent Document 1]
N. Engl. J. et al. Med. 322, 1405-1411, 1990, J. MoI. Neurosurg 93, 1-7, 2000
[Non-Patent Document 2]
J. et al. Spinal Disorder. 5 (1), 125-131, 1992
[Non-Patent Document 3]
J. et al. Mol. Med. 77, 713-717, 1999
[Non-Patent Document 4]
J. et al. Neurosci. 19 (5), 1708-16, 1999
[Non-Patent Document 5]
Neurosurgery 44 (5), 1041-5, 1999
[Non-Patent Document 6]
Trends. Neurosci 22 (7), 295-9, 1999
[Non-Patent Document 7]
Neuron 24, 639-647, 1999
[Non-Patent Document 8]
Lancet 354, 286-287, 2000
[Non-patent document 9]
Ann. Rev. Immunol. 9, 271-296, 1991
[Non-Patent Document 10]
J. et al. Exp. Med. 185, 2133-2141, 1997
[Non-Patent Document 11]
J. et al. Exp. Med. 183, 7-11, 1996
[Non-Patent Document 12]
J. et al. Exp. Med. 178, 1223-1230, 1993
[Non-Patent Document 13]
J. et al. Exp. Med. 189, 1121-1128, 1999
[Non-Patent Document 14]
J Neurosung 93, 266-75, 2000
[0008]
[Problems to be solved by the invention]
Injuries to the central nervous system, including spinal cord injury, are extremely difficult to treat. As described above, there is no effective treatment to date, and the development of a new treatment is strongly desired. As the population ages, the number of patients suffering from nervous system diseases tends to increase, which is a major social problem. However, the central nervous system is an organ that is extremely difficult to regenerate and is a special organ that is unlikely to cause an immune reaction. In the above-mentioned method of promoting nerve axon regeneration of the central nervous system (CNS) using macrophages by Schwartz et al., It was not clear what functions of macrophages act on axon regeneration. In addition, when cells such as macrophages are used, there is a problem that not only the administration method is limited, but the handling is complicated and it is difficult to obtain a reproducible therapeutic effect only by using living cells. The object of the present invention is not only to inject locally into the damaged site, but also to various administration methods including subcutaneous or near lymph node and intravenous administration, easy handling and long-term storage, It is an object of the present invention to provide a therapeutic agent for neurological dysfunction diseases such as central nervous system injury and cerebral infarction including spinal cord injury having an excellent nerve regeneration promoting action, which can be prepared.
[0009]
[Means for Solving the Problems]
Unlike other tissues, the central nervous system is isolated from the immune system. Recently, however, the present inventors have conducted experiments using a mouse brain tumor model that immature T cells that have not been stimulated cannot invade the central nervous system, but are activated by antigens in the brain. Have reported that they can cross the blood brain barrier and react with brain tumors (Neuro-Oncology 1, S105, 1999). In addition, there is a report that administration of nerve-specific T cells promoted functional recovery of central nerve damage (Lancet 354, 286-287, 2000). Whether nerve-specific T cells function through the blood-brain barrier and function in the central nervous system through the release of some cytokines or do they act directly on nerve cells and axons? Although it is still unknown, the possibility of nerve regeneration by immune system intervention has been shown. On the other hand, in order to induce nerve-specific T cells, it is necessary to take up antigens of the nervous system by antigen-presenting cells and present antigen peptides processed in the cells to T cells.
[0010]
The present inventors have shown that the elimination of damaged tissue during spinal cord injury is an extremely important first step, and a specific subset of dendritic cells that take up antigen and have the highest antigen-presenting ability to T cells are extracted from spinal cord injury model mice. For the first time, it has been demonstrated that restoration of spinal cord function is facilitated by direct transplantation to the site of injury. In order to demonstrate the above-described promotion of recovery of spinal cord function, the method for evaluating motor function in spinal cord injury mice established by the present inventors was used. This motor function evaluation method is an application of a device used for measurement of momentum for the purpose of analyzing the sedative effect of drugs to the evaluation of motor function after spinal cord injury. The present inventors target substances that are secreted from dendritic cells that cause environmental changes in the central nervous system including T cell activation, and substances that induce, proliferate or activate dendritic cells, When administered to the injury site of a spinal cord injury model mouse and screened by the method for evaluating motor function in the above spinal cord injury mouse, IL-12 or IL-12 which is widely used as a therapeutic agent for cancer but not used at all in the nervous system , GM-CSF was found to promote recovery of spinal cord function as well as dendritic cells. In addition, as mentioned above, significant denaturation of motor function was observed by transplanting dendritic cell subsets into the injured spinal cord, so we analyzed substances that stimulate nerve regeneration secreted from dendritic cells. As a result, it was confirmed that dendritic cells expressed and actually secreted neurotrophic factor. The present invention has been completed based on these findings.
[0011]
That is, the present invention relates to a substance secreted from dendritic cells, a substance that induces and proliferates dendritic cells, a substance that activates dendritic cells, a substance that induces expression of neurotrophic factors in neural tissue, and neural tissue One or more substances selected from substances that induce and proliferate microglia, macrophages, or dendritic cells as an active ingredient, a therapeutic agent for nerve injury or dysfunction (claim) 1), substances secreted from dendritic cells, substances that induce and proliferate dendritic cells, substances that activate dendritic cells, substances that induce the expression of neurotrophic factors in neural tissue, and neural tissues The agent for inducing or proliferating microglia or macrophages is a cytokine, which is a therapeutic agent for nerve injury or neurological dysfunction (Claim 2) or secreted from dendritic cells. The therapeutic agent for nerve damage or neurological dysfunction according to
[0012]
Further, in the present invention, the dendritic cell is a dendritic cell subset secreting the neurotrophic factor NT-3, The therapeutic agent for nerve injury or neurological dysfunction according to claim 1 (claim 8) A subset of dendritic cells secreting neurotrophic factor NT-3, in addition to NT-3, an immature dendritic cell subset expressing CNTF, TGF-β1, IL-6, or NT-3, The therapeutic agent for nerve injury or neurological dysfunction according to
[0013]
DETAILED DESCRIPTION OF THE INVENTION
Examples of the therapeutic agent for nerve injury or neurological dysfunction according to the present invention include substances secreted from dendritic cells, substances that induce and proliferate dendritic cells, substances that activate dendritic cells, Substance that induces expression of neurotrophic factor, substance that induces and proliferates microglia and nerve macrophages in nerve tissue, and has a preventive effect, symptom improvement effect or therapeutic effect on nerve damage or neurological dysfunction disease ( Hereinafter, these substances are collectively referred to as “dendritic cell-related active substances”), and those containing a mixture of these substances as active ingredients. The substances secreted from the dendritic cells include IL-12, IL-1α, IL-1β, IFN-γ and other cytokines can be preferably exemplified, and as a substance that induces and proliferates dendritic cells, GM-CSF, IL-4 and other cytokines As a substance that activates dendritic cells, IL-1β, CD40L and the like can be preferably exemplified, and a substance that induces expression of neurotrophic factor in nerve tissue after injury Can be preferably exemplified by cytokines such as GM-CSF, and as a substance that induces and proliferates microglia and nerve macrophages in damaged nerve tissues, cytokines such as GM-CSF and M-CSF are preferably exemplified. can do. Examples of the neurotrophic factor include in vivo nerve regeneration effect, microglial proliferation, NT-3 which induces enhancement of phagocytosis, BDNF which suppresses degeneration and loss of motor neurons in injured spinal cord, nerves of cholinergic neurons Examples thereof include trophic factor NGF and CNTF, which has an effect of protecting against degeneration and cell death against both motor sensory nerves of the spinal cord.
[0014]
Substances secreted from dendritic cells, substances that induce and proliferate dendritic cells, substances that activate dendritic cells, substances that induce the expression of neurotrophic factors in neural tissues, As the substance that induces and proliferates microglia and macrophages, each known substance having an action of inducing and proliferating dendritic cells can be used. For example, substances secreted from dendritic cells include dendritic cells. Can be obtained by in vitro culturing, and a substance having an action of inducing and proliferating dendritic cells can be obtained by culturing dendritic cells in vitro in the presence of a candidate substance, The substance that activates dendritic cells can be obtained by measurement and evaluation. The dendritic cells are cultured in vitro in the presence of a candidate substance, and the degree of neurotrophic factor production ability of the dendritic cells is measured / evaluate The substance that induces the expression of neurotrophic factor in nerve tissue can be obtained by measuring and evaluating the degree of expression and induction of neurotrophic factor in damaged nerve tissue to which the candidate substance is administered. The substance that induces and proliferates microglia and macrophages in the nerve tissue is derived from the activated microglia with strong phagocytosis and monosite that flows from outside the spinal cord in the damaged nerve tissue to which the candidate substance is administered The degree of induction / proliferation of ameboid cells considered to be macrophages of the human body, and branched cells considered to be active microglia that secrete various neurotrophic factors and cytokines, although poor phagocytosis It can be obtained by measuring and evaluating.
[0015]
When the above dendritic cell-related active substance is used as a therapeutic agent for nerve injury or neurological dysfunction, a pharmaceutically acceptable carrier, binder, stabilizer, excipient, diluent, pH buffer, Various preparation ingredients such as a disintegrant, a solubilizer, a solubilizer, and an isotonic agent can be added. Such therapeutic agents can be administered orally or parenterally. That is, it can be administered orally in commonly used dosage forms, such as powders, granules, capsules, syrups, suspensions, etc., or, for example, in dosage forms such as solutions, emulsions, suspensions, etc. In addition to the topical administration parenterally in the form of injection, it can also be administered intranasally in the form of a spray.
[0016]
Further, as the dendritic cell-related active substance, a vector capable of expressing the substance can be used. When such a vector is locally administered as gene therapy, a treatment using the dendritic cell-related active substance as an active ingredient Compared to when the drug is administered locally, stable expression of the substance makes it possible to stably supply the dendritic cell-related active substance locally. Many dendritic cell-related active substances have very short half-lives and are unstable, whereas genes that can express dendritic cell-related active substances are used to introduce genes into cells at the site of nerve injury Thus, stable expression for a predetermined period can be obtained. Suitable examples of such vectors include viral vectors such as herpes virus (HSV) vectors, adenovirus vectors, and human immunodeficiency virus (HIV) vectors. Among these viral vectors, HSV vectors are preferred. HSV vectors have high neurophilicity, are safe because HSV is not integrated into the chromosomal DNA of cells, and can regulate the expression period of the transgene. Moreover, the viral vector which expresses a dendritic cell related active substance can be prepared by a conventional method.
[0017]
Examples of the therapeutic agent for nerve damage or neurological dysfunction according to the present invention include dendritic cells, particularly preferably those having dendritic cell subsets secreting neurotrophic factor NT-3 as active ingredients. Dendritic cell subsets that secrete the neurotrophic factor NT-3 include in vivo nerve regeneration, microglial proliferation and phagocytosis, in addition to NT-3 that induces degeneration of spinal motor sensory neurons. CNTF, which shows the effect of protecting cell death, TGF-β1 which has an action of suppressing the release of cytotoxic substances derived from microglia and macrophages, and IL- which induces the protective effect on various neurons (choline / catecholamine / dopaminergic) In addition to immature dendritic cell subset expressing NT6, NT-3, CNTF, TGF-β1, IL-6, neuroprotective effect Recognized mature dendritic cell subsets that express EGF are preferred, and examples include immature dendritic cell subsets that have a CD11c surface marker on the cell surface and mature dendritic cell subsets derived from the immature dendritic cells. Can do.
[0018]
Then, the immature dendritic cell subset is cultured in vitro in the presence of a stimulant for maturation of immature dendritic cells such as LPS, IL-1, TNF-α, and CD40L as the mature dendritic cell subset. The mature dendritic cell subset obtained by doing can also be used. In this case, the expression of neurotrophic factors such as NT-3 may change, and a higher regeneration effect may be induced. In addition, a protein or peptide of the nervous system such as a myelin protein such as MBP (myelin basic protein) or MAG (myelin-associated glycoprotein), a factor that suppresses the extension of nerve axons such as Nogo, or a gene encoding them is It is also possible to use mature dendritic cell subsets into which (incorporated) an expression system such as a virus vector that has been introduced.
[0019]
Dendritic cell subsets secreting neurotrophic factor NT-3 are sorted by FACS using a monoclonal antibody against dendritic cell surface antigens after, for example, pretreatment such as density centrifugation for peripheral blood and the like By separating a dendritic cell subset by a method or a separation method using a magnetic bead-binding monoclonal antibody against a dendritic cell surface antigen, and selecting a dendritic cell subset secreting NT-3 from them it can. The dendritic cell subset secreting such neurotrophic factor NT-3 can be transplanted to a nerve injury site such as spinal cord. In particular, mature dendritic cell subsets into which (incorporated) the expression system for the above-mentioned nervous system proteins or peptides or genes encoding them can be administered subcutaneously or in the vicinity of lymph nodes. As described above, as a method for treating nerve damage or neurological dysfunction disease of the present invention, a nerve comprising the same dendritic cell subset secreting the above-mentioned dendritic cell-related active substance and neurotrophic factor NT-3 as an active ingredient. Examples thereof include a method of administering (transplanting) a therapeutic agent for an injured or neurological dysfunction disease at the site of nerve injury, subcutaneously or near a lymph node, or intravenously.
[0020]
【Example】
Hereinafter, the present invention will be described more specifically with reference to examples. However, the technical scope of the present invention is not limited to these examples.
Example 1 (Preparation of spinal cord injury model BALB / c mouse)
A 6-week-old BALB / c female mouse (n = 9) was used, and the 8th thoracic vertebral arch was excised under ether anesthesia, and the spinal cord was cut into the left half with a sharp blade (injury group; ◇ ) Was produced. After spinal cord injury, the mouse exhibited left lower limb paralysis. As a control (control group; □), a 6-week-old BALB / c female mouse (n = 9) that had undergone only laminectomy was used. After the operation, the spontaneous momentum of each mouse on
[0021]
Example 2 (Production of spinal cord injury model C57BL / 6 mice)
Moreover, it replaced with the said 6-week-old BALB / c female mouse (n = 9), and the behavioral-analysis apparatus similarly to Example 1 except using a C57BL / 6 female mouse (n = 16) 6-week-old. Motor function evaluation was performed using SCANETTMV-10. The results are shown in FIG. In addition, p value in the figure was calculated using Student's t test (**: p <0.01). As a result of comparison of each motor function evaluation between the control group (□) and the injury group (◇), M1 (upper part of FIG. 2), M2 (upper row in FIG. 2) showing the motor evaluation in the horizontal direction throughout the acute phase, subacute phase, and chronic phase. In the middle part of FIG. 2, no obvious significant difference was observed. On the other hand, in the RG showing the motion evaluation in the vertical direction, a clear significant difference was recognized between the two groups until the chronic stage (lower part of FIG. 2). From the above experimental results of two different strains of mice, the horizontal momentum (M1, M2) was compensated by the lower limbs and both upper limbs of the healthy side, and the paralysis of the left lower limb could not be accurately evaluated, whereas the vertical direction It has been shown that exercise (RG) can accurately assess motor function after spinal cord injury.
[0022]
Example 3 (Effect of dendritic cells on spinal cord injury)
A spinal cord injury model mouse (BALB / c female mouse) was prepared by the same operation as in Example 1, and immediately RPMI1640 medium alone [control (◇), FIG. 3; n = 14, FIG. 4; n = 6], or By sorting antigen-presenting cells including dendritic cells isolated from spleen [5 × 10 5 cells / mouse, n = 13 (FIG. 3; ◯)] or a subset of CD11c (+) by immunomagnetic bead method The obtained dendritic cells [1 × 10 5 cells / mouse, n = 6 (FIG. 4; ◯)] were transplanted to the spinal cord injury site. Moreover, the mouse | mouth which performed only the laminectomy was used as a control which does not add spinal cord injury [FIG. 3; □ (n = 6)]. In the same manner as in Example 1, the spontaneous exercise amount in the vertical direction of each mouse on
[0023]
Example 4 (Effect of IL-12 on spinal cord injury)
Using 6-week-old BALB / c female mice aged in the same manner as in Example 1, spinal cord injury model mice were prepared. In addition, BALB / c female mice of 6 weeks old (□; n = 6), in which only laminectomy was performed, were used as a control without adding spinal cord injury. Immediately after spinal cord injury, 5 μl of saline alone (◇; n = 14) or IL-12 (100 ng / mouse; Pharmingen, ○; n = 14) was administered to the site of spinal cord injury. In the same manner as above, the spontaneous movement amount in the vertical direction of each mouse on
[0024]
Example 5 (Effect of GM-CSF on spinal cord injury)
Using 6-week-old BALB / c female mice aged in the same manner as in Example 1, spinal cord injury model mice were prepared. In addition, BALB / c female mice of 6 weeks old (□; n = 6), in which only laminectomy was performed, were used as a control without adding spinal cord injury. Immediately after spinal cord injury, 5 μl of saline alone (◇; n = 7) or GM-CSF (10 ng / mouse; Genzyme, ○; n = 6) was administered to the spinal cord injury site, and the same as in Example 1 In addition, the spontaneous exercise amount in the vertical direction of each mouse on
[0025]
Example 6 (Preparation of immature dendritic cell subset and mature dendritic cell subset)
Immature dendritic cells were obtained by isolating CD11c positive subsets from the spleen of 6-week-old BALB / c female mature mice by immunomagnetic bead method. Specifically, first, the spleen was homogenized with 100 U / ml collagenase (Worthington Biochemical Corporation), and then the hard-to-separate coating was further treated with 400 U / ml collagenase at 37 ° C. under 5% CO 2 for 20 minutes. Incubate to separate the cells. The obtained cells were suspended in a 35% BSA solution, and further RPMI 1640 + 10% fetal serum was overlaid in a centrifuge tube, and then centrifuged at 4 ° C., 3000 rpm, 30 minutes, and 35% BSA solution and RPMI 1640 + 10% fetal serum solution The cells in the boundary layer were collected. Next, the obtained cells were reacted with a magnetic bead-bound monoclonal antibody against CD11c antigen (2 × 10 8 beads, Miltenyi Biotec) for 15 minutes at 4 ° C., and the bead-bound cells were separated magnetically to immature. A fraction enriched in dendritic cell subsets was obtained. Moreover, the mature dendritic cell subset was obtained by culturing the obtained immature dendritic cell subset in a culture solution of RPMI 1640 + 10% fetal serum at 37 ° C. under 5% CO 2 for 24 hours.
[0026]
Example 7 (Neurotrophic factor gene expression in dendritic cells)
Total RNA was extracted from each cell of the immature dendritic cell subset and mature dendritic cell subset using TRIzol (Life Technologies), and AMV (Avian Myeloblastosis Virus) reverse transcriptase and oligo (oligo) from each 5 μg of total RNA. dT) The primer was used and incubated at 42 ° C. for 60 minutes to synthesize a total amount of 200 μl of cDNA. PCR was performed using a β-actin primer, and after confirming gene expression, PCR was performed under the respective conditions for each neurotrophic factor. In PCR, a gene was amplified by a thermal cycler (Perkin-Elmer) using Extaq (TAKARA) as a template with 1 μl of cDNA as a template. The primers and PCR conditions used are shown in [Table 1]. In order to show that the product was not a gene product amplified from the mixed genomic DNA, PCR was performed using total RNA as a template as a control. The results for the immature dendritic cell subset are shown in FIG. 7, and the results for the mature dendritic cell subset are shown in FIG.
[0027]
[Table 1]
[0028]
In immature dendritic cells, NT-3 induces nerve regeneration effects, microglial proliferation and enhancement of phagocytosis in vivo, CNTF and microglia have effects of degeneration and cell death protection for both spinal motor sensory nerves. Furthermore, expression of IL-6 that induces protective effects on TGF-β1 and various neurons (choline / catecholamine / dopaminergic activity) having an inhibitory action on the release of cytotoxic substances derived from macrophages was confirmed (FIG. 7). Moreover, in mature dendritic cells, in addition to NT-3, CNTF, TGF-β1, and IL-6, expression of EGF, which is recognized to have a neuroprotective effect, was confirmed (FIG. 8). For each gene, cDNA was extracted from the gel and the nucleotide sequence was analyzed, and it was confirmed that the expression products were NT-3, CNTF, TGF-β1, IL-6 and EGF, respectively.
[0029]
Example 8 (secretion of neurotrophic factor NT-3)
Further, NT-3 immunoassay system (Promega) was used to determine whether NT-3, which is one of the most important neurotrophic factors for nerve regeneration, is actually secreted from dendritic cells. Analysis was performed by ELISA. In the same manner as in Example 1, CD11c-positive immature dendritic cells were separated from the spleen of a 6-week-old BALB / c female mature mouse by immunomagnetic bead method. After 1 × 10 5 CD11c-positive immature dendritic cells were incubated in RPMI1640 + 10% fetal serum culture solution at 37 ° C. under 5% CO 2 for 24 hours, the culture supernatant was recovered. As a control, only RPMI 1640, and 1 × 10 5 CD4 positive T cells and CD8 positive T cells were used. As a result of quantitative analysis of NT-3 in the supernatant by sandwich ELISA using two kinds of anti-NT-3 antibodies, 1 × 10 5 dendritic cells were found to have about 1.75 ng of NT- in 24 hours. 3 was revealed to be secreted. Secretion was not observed in RPMI 1640 alone, CD4-positive T cells, and CD8-positive T cells (FIG. 9).
[0030]
Example 9 (Reconfirmation of the effect of dendritic cells on spinal cord injury)
A 6-week-old BALB / c female mouse was subjected to excision of the 8th thoracic vertebral arch under ether anesthesia, and a spinal cord injury model mouse was prepared in which the left spinal cord was half-cut under a microscope. Immediately after transplanting 1 × 10 6 dendritic cells into the spinal cord injury site (DC, n = 17), using the lower limb motor function evaluation method developed by the present inventors (behavioral analysis device SCANET MV-10, RG score) which automatically analyzes the number of rises, and BBB scale (evaluated between 0-21 points), which is one of the already established methods of evaluating the lower limb motor function. No, 21 points are normal), and the evaluation was performed over time. As controls, RPMI 1640 (RPMI, n = 18) and CD8 positive T cells (T, n = 10) were similarly transplanted into the damaged spinal cord region. The results are shown in FIG. As can be seen from FIG. 10, both of the two evaluation methods (RG score and BBB scale) showed a statistically significantly higher score in the DC transplanted group than in the case of control T cells or RPMI. Therefore, it was reconfirmed that the restoration of spinal cord function was promoted by transplanting a dendritic cell subset secreting neurotrophic factor NT-3 to the site of spinal cord injury.
[0031]
Example 10 (Activation of endogenous microglia by dendritic cell transplantation)
In order to investigate whether dendritic cell transplantation shows changes in the reactivity of endogenous microglia or macrophages invading from damaged blood vessels, immunohistochemical staining was performed using a Mac-1 antibody that recognizes them. The change in the number of positive cells over time was examined. First, transcardiac perfusion fixation was performed with 2% paraformaldehyde on dendritic cell transplanted
[0032]
FIG. 11 shows a stained image of a representative section from the damaged marginal part to the head side. In both groups, cell infiltration was poor on the 2nd day after injury, but on the 4th day, there was marked infiltration of amoeba cells on the margin of the injury. After 4 days after injury, in the dendritic cell transplantation group, infiltration of Mac-1 positive cells was observed in the remote part of the head, but such change was scarce in the control group.
[0033]
Next, each Mac-1-positive cell was quantitatively analyzed using an image analyzer (Flovel). FIG. 12 shows time-dependent changes in the number of amoeba cells by region. Infiltration of amoeboid cells was almost confined to the damaged margin. Although there was no obvious difference in the number of cells between the two groups at the injured margin and the caudal side, many positive cells were observed in the dendritic cell transplantation group particularly on the 14th day after injury on the cranial side. On the other hand, FIG. 13 shows the time-dependent changes in the number of branched cells by region, but the number of cells was large in the dendritic cell transplantation group in all regions and measurement days. In the dendritic cell transplantation group, the increase in cranial amoebic active microglia was observed, especially because amoeboid cells have strong phagocytic ability and inhibited nerve axon extension at a location away from the damaged area It is considered that proteins derived from denatured myelin and damaged tissues are removed. On the other hand, an increase in a wide range of branched active microglia was observed because the active microglia itself was NT-3, CNTF, IL-6, TGF-β1, EGF, bFGF, NGF, BDNF, GDNF. It is thought that the recovery of nerve function was promoted by secreting such neurotrophic factors.
[0034]
Example 11 (Analysis of endogenous neural stem / progenitor cells by dendritic cell transplantation)
In order to examine the reactivity of endogenous neural stem cells / progenitor cells by dendritic cell transplantation, immunohistochemical staining was performed using Musashi-1 antibody that recognizes them, and changes in the number of positive cells over time were examined. First, transcardiac perfusion fixation was performed with 2% paraformaldehyde on dendritic cell transplanted
FIG. 15 shows a stained image of a representative section from the damaged marginal part to the head side. In both groups, no difference was observed on the 2nd day after the injury, but after 4 days after the injury, many dendritic cell transplantation groups showed many Musashi-1 positive cells in both the marginal part and the distal part. Such changes were scarce in the control group.
[0035]
Next, Musashi-1 positive cells were quantitatively analyzed using an image analyzer (Flovel). FIG. 16 shows the time-dependent changes in the number of Musashi-1 positive cells by region. From 4 days after the injury, a significant increase in the number of Musashi-1-positive cells was observed by dendritic cell transplantation compared to the control in both the marginal area and the distal area. In particular, at the margin of injury, a marked increase in Musashi-1-positive cells was observed in the dendritic cell transplant group between 2 and 4 days after injury.
As described above, it has been clarified that dendritic cell transplantation induces proliferation of endogenous neural stem / progenitor cells.
[0036]
Example 12 (Expression induction of neurotrophic factor in damaged nerve tissue after GM-CSF administration)
A spinal cord injury model mouse was prepared using a 6-week-old BALB / c female mouse. Immediately after the injury, 5 μl of saline alone or GM-CSF (250 pg / mouse; manufactured by Genzyme) was administered to the site of spinal cord injury, and the spinal cord was excised on the second day. The excised spinal cord was frozen in liquid nitrogen and stored at 80 ° C., and total RNA was extracted using TRIzol (manufactured by Life Technologies). Each 5 μg of total RNA was incubated with AMV (Avian Myeloblastosis Virus) reverse transcriptase and oligo (dT) primer for 60 minutes at 42 ° C. to synthesize a total amount of 200 μl of cDNA. PCR was performed using a β-actin primer, and after confirming gene expression, PCR was performed under the respective conditions for each neurotrophic factor. In PCR, a gene was amplified by a thermal cycler (Perkin-Elmer) using a reaction enzyme of Extaq (manufactured by TAKARA) using 1 μl of cDNA as a template. The primers and PCR conditions used are shown in [Table 2]. In order to show that the product was not a gene product amplified from the mixed genomic DNA, PCR was performed using total RNA as a template as a control.
[0037]
[Table 2]
[0038]
Administration of GM-CSF to the injured spinal cord suppresses neurotrophic factor NT-3, which induces nerve regeneration effects, microglia proliferation and phagocytosis in vivo, and degeneration and loss of motor neurons in the injured spinal cord It was revealed that the expression of neurotrophic factor BDNF, cholinergic neuron neurotrophic factor NGF, and neurotrophic factor CNTF, which has the effect of protecting against degeneration and cell death, in both spinal motor sensory neurons ( FIG. 17).
[0039]
Example 13 (Activation of endogenous microglia by GM-CSF administration)
GM-CSF is known to be involved in the proliferation and activation of microglia and macrophages in vitro, but in order to analyze the reactivity to microglia and macrophages invading from damaged blood vessels in the central nervous system tissue, Using a Mac-1 antibody that recognizes them, immunohistochemical staining was performed, and changes in the number of positive cells over time were examined. First, GM-CSF-administered
[0040]
19 and 20 show changes over time in the number of amoebic and branched cells. In the GM-CSF administration group, many amoeba-like cells were observed from the second day after injury, and a significant increase in the number of cells was observed on the seventh day compared with the control. Further, regarding the branched cells, a significant increase in the number of cells was observed on the 4th and 7th days after the injury as compared with the control. In the GM-CSF administration group, the increase in amoeboid cells was observed, especially because amoeboid cells have strong phagocytic activity, so that demyelin that inhibits nerve axon extension and proteins derived from damaged tissues are removed. It is thought that. The increase in the number of branched cells is thought to be due to the fact that activated microglia themselves secrete neurotrophic factors such as NT-3, BDNF, NGF, and CNTF, thereby promoting the recovery of nerve function.
[0041]
Example 14 (Induction of proliferation of endogenous neural stem cells / progenitor cells by administration of GM-CSF) In order to analyze the reactivity to neural stem cells / progenitor cells in the central nervous system by administration of GM-CSF, Musashi-1 which recognizes them Using an antibody, immunohistochemical staining was performed, and changes in the number of positive cells over time were examined. First, GM-CSF-administered
[0042]
Based on the above, transplantation of dendritic cells to the injured site removes the neurotrophic factor secreted by itself, the secretion of neurotrophic factor through the activation of endogenous microglia, and the inhibitory factor of nerve axon extension, In addition, it is considered that the nerve function was restored through regeneration and remyelination of new nerve cells by inducing proliferation of endogenous neural stem / progenitor cells. In addition, administration of GM-CSF to the site of injury induces the expression of neurotrophic factor in nerve cells, secretion of neurotrophic factor through activation of endogenous microglia, and removal of an inhibitor of nerve axon extension, In addition, it is considered that the nerve function was restored through regeneration and remyelination of new nerve cells by inducing proliferation of endogenous neural stem / progenitor cells.
[0043]
【The invention's effect】
The therapeutic agent for nerve injury or neurological dysfunction according to the present invention can be administered not only locally to the site of injury but also various administration methods including subcutaneous or near lymph node and intravenous administration, and has an excellent nerve function recovery action. Therefore, it is useful for diseases such as central nervous system damage including spinal cord injury and neurological dysfunction diseases such as cerebral infarction. In addition, dendritic cell-related active substances such as IL-12 and GM-CSF are useful in that they are easy to handle and can be stored for a long period of time, and can be prepared in large quantities at any time. Is possible.
[0044]
[Sequence Listing]
[Brief description of the drawings]
FIG. 1 is a diagram showing the results of motor function evaluation of a spinal cord injury model BALB / c mouse.
FIG. 2 shows the results of motor function evaluation of spinal cord injury model C57BL / 6 mice.
FIG. 3 shows the effect of antigen-presenting cells including dendritic cells on spinal cord injury.
FIG. 4 shows the effect of dendritic cells of CD11c (+) on spinal cord injury.
FIG. 5 is a graph showing the effect of IL-12 of the present invention on spinal cord injury.
FIG. 6 is a diagram showing the effect of GM-CSF of the present invention on spinal cord injury.
FIG. 7 shows the results of expression of neurotrophic factor in immature dendritic cell subsets by RT-PCR.
FIG. 8 shows the results of expression of neurotrophic factor in mature dendritic cell subsets by RT-PCR.
FIG. 9 is a view showing the secretion results of NT-3 such as dendritic cells by ELISA.
FIG. 10 shows the effect of dendritic cell subsets secreting neurotrophic factors on spinal cord injury.
FIG. 11 shows the results of immunostaining using an anti-Mac-1 antibody in the dendritic cell (DC) and RPMI 1640 (RPMI) transplantation groups, and particularly representative sections over time from the damaged margin to the head side. It is a photograph shown.
FIG. 12 is a graph showing time-dependent changes in the number of Mac-1 positive amoeboid cells by region in each dendritic cell and RPMI1640 transplantation group.
FIG. 13 is a graph showing time-dependent changes in the number of Mac-1-positive branched cells in each dendritic cell and RPMI1640 transplantation group.
FIG. 14 is a photograph showing region setting for measuring the number of Musashi-1 positive cells.
FIG. 15 shows the results of immunostaining using an anti-Musashi-1 antibody in the dendritic cell (DC) and RPMI 1640 (RPMI) transplantation groups, and particularly representative sections over time from the damaged margin to the head. It is a photograph.
FIG. 16 is a graph showing time-dependent changes in the number of Musashi-1 positive cells in each dendritic cell and RPMI1640 transplantation group.
FIG. 17 is a view showing the expression result of neurotrophic factor in the spinal cord injury site after GM-CSF administration by RT-PCR.
FIG. 18 is a diagram showing region settings for measuring the number of Mac-1 positive cells.
FIG. 19 shows changes over time in the number of endogenous microglia cells (amoeba-like) in each of the GM-CSF administration group and the control (saline administration) group.
FIG. 20 is a graph showing changes over time of endogenous microglia cells (branched) in each of a GM-CSF administration group and a control (saline administration) group.
FIG. 21 is a diagram showing region settings for measuring the number of Musashi-1 positive cells.
FIG. 22 is a graph showing changes over time in the number of Musashi-1 positive cells in each of the GM-CSF administration group and the control (saline administration) group.
Claims (13)
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2003128508A JP2004002412A (en) | 2001-03-12 | 2003-05-06 | Therapeutic agent of nerve damage |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2001069123 | 2001-03-12 | ||
| JP2001338772 | 2001-11-02 | ||
| JP2003128508A JP2004002412A (en) | 2001-03-12 | 2003-05-06 | Therapeutic agent of nerve damage |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2002571102A Division JP3607271B2 (en) | 2001-03-12 | 2002-03-12 | Nerve injury treatment |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2006060358A Division JP2006152001A (en) | 2001-03-12 | 2006-03-06 | Remedy for nerve damage |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2004002412A true JP2004002412A (en) | 2004-01-08 |
| JP2004002412A5 JP2004002412A5 (en) | 2005-09-15 |
Family
ID=30448990
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2003128508A Pending JP2004002412A (en) | 2001-03-12 | 2003-05-06 | Therapeutic agent of nerve damage |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP2004002412A (en) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2006085587A1 (en) * | 2005-02-09 | 2006-08-17 | Keio University | Neurosphere-forming agent |
| WO2022194094A1 (en) * | 2021-03-15 | 2022-09-22 | 上海萨美细胞技术有限公司 | Use of cell-free fat extract for treating spinal cord injury |
-
2003
- 2003-05-06 JP JP2003128508A patent/JP2004002412A/en active Pending
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2006085587A1 (en) * | 2005-02-09 | 2006-08-17 | Keio University | Neurosphere-forming agent |
| WO2022194094A1 (en) * | 2021-03-15 | 2022-09-22 | 上海萨美细胞技术有限公司 | Use of cell-free fat extract for treating spinal cord injury |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20070243160A1 (en) | Remedies for nerve damages | |
| Vartanian et al. | Interferon-γ-induced oligodendrocyte cell death: implications for the pathogenesis of multiple sclerosis | |
| Fee et al. | Activated/effector CD4+ T cells exacerbate acute damage in the central nervous system following traumatic injury | |
| Imitola et al. | Cytokines in multiple sclerosis: from bench to bedside | |
| Tator | Biology of neurological recovery and functional restoration after spinal cord injury | |
| Arruda et al. | Increase of interleukin-6 mRNA in the spinal cord following peripheral nerve injury in the rat: potential role of IL-6 in neuropathic pain | |
| Eddleston et al. | Molecular profile of reactive astrocytes—implications for their role in neurologic disease | |
| Sayed et al. | Meningeal mast cells affect early T cell central nervous system infiltration and blood-brain barrier integrity through TNF: a role for neutrophil recruitment? | |
| Fischer et al. | Brain dendritic cells and macrophages/microglia in central nervous system inflammation | |
| Jones et al. | Pathological CNS autoimmune disease triggered by traumatic spinal cord injury: implications for autoimmune vaccine therapy | |
| US9072740B2 (en) | Methods of improving central nervous system functioning | |
| JP3984959B2 (en) | Method for inducing proliferation of neural stem cells | |
| JPH09508116A (en) | Use of IL-10 to stimulate peripheral blood mononuclear cytolytic activity | |
| US20080031859A1 (en) | Central nervous system neural progenitor cell which induces synapse-forming neurons in the spinal cord | |
| AU2002225864A1 (en) | Methods of improving central nervous system functioning | |
| Wang et al. | Neuroprotective effect of vaccination with autoantigen-pulsed dendritic cells after spinal cord injury | |
| JP2004002412A (en) | Therapeutic agent of nerve damage | |
| JP2006152001A (en) | Remedy for nerve damage | |
| WO2006052660A9 (en) | Il-7 receptor blockade to suppress immunity | |
| US20240002798A1 (en) | Method for preparing immunogenicity-enhanced cd103+ fcgr3+ dendritic cell by treatment with interleukin-33 and pharmaceutical composition comprising same dendritic cell for cancer immunotherapy | |
| JP2007130026A (en) | Method of inducing growth of nerve stem cells | |
| EP4282423A1 (en) | Pharmaceutical composition for prevention or treatment of inflammatory disease or pain, comprising mesenchymal stem cells expressing ptx-3, timp1 and bdnf as active ingredient | |
| US20240131119A1 (en) | Use of pertussis toxin as a therapeutic agent | |
| Compston | Future options for therapies to limit damage and enhance recovery | |
| Georganta | POSTGRADUATE STUDIES PROGRAMME |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20050314 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20050314 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20050405 |
|
| A871 | Explanation of circumstances concerning accelerated examination |
Free format text: JAPANESE INTERMEDIATE CODE: A871 Effective date: 20051124 |
|
| A975 | Report on accelerated examination |
Free format text: JAPANESE INTERMEDIATE CODE: A971005 Effective date: 20051219 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20060105 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20060306 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20060718 |
|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7422 Effective date: 20060724 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20070123 |