FR2492402A1 - Diesel fuels contg. fatty acid ester(s) - obtd. e.g. by methanolysis of vegetable or animal fats or oils - Google Patents
Diesel fuels contg. fatty acid ester(s) - obtd. e.g. by methanolysis of vegetable or animal fats or oils Download PDFInfo
- Publication number
- FR2492402A1 FR2492402A1 FR8022531A FR8022531A FR2492402A1 FR 2492402 A1 FR2492402 A1 FR 2492402A1 FR 8022531 A FR8022531 A FR 8022531A FR 8022531 A FR8022531 A FR 8022531A FR 2492402 A1 FR2492402 A1 FR 2492402A1
- Authority
- FR
- France
- Prior art keywords
- sep
- acid
- composition according
- oil
- esters
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10L—FUELS NOT OTHERWISE PROVIDED FOR; NATURAL GAS; SYNTHETIC NATURAL GAS OBTAINED BY PROCESSES NOT COVERED BY SUBCLASSES C10G OR C10K; LIQUIFIED PETROLEUM GAS; USE OF ADDITIVES TO FUELS OR FIRES; FIRE-LIGHTERS
- C10L1/00—Liquid carbonaceous fuels
- C10L1/02—Liquid carbonaceous fuels essentially based on components consisting of carbon, hydrogen, and oxygen only
- C10L1/026—Liquid carbonaceous fuels essentially based on components consisting of carbon, hydrogen, and oxygen only for compression ignition
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E50/00—Technologies for the production of fuel of non-fossil origin
- Y02E50/10—Biofuels, e.g. bio-diesel
Landscapes
- Chemical & Material Sciences (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Engineering & Computer Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Fats And Perfumes (AREA)
- Liquid Carbonaceous Fuels (AREA)
Abstract
Description
Compositions combustibles renfermant des esters d'acides gras, utilisables comme carburants Diesel. Combustible compositions containing esters of fatty acids, suitable for use as diesel fuels.
L'invention concerne de nouvelles compositions combustibles, en particulier des carburants pour moteurs Diesel qui renferment une proportion importante de certains esters d'acides gras. Selon l'invention, le combustible (ou carburant) peut hêtre essentiellement constitué d'un ou plusieurs esters d'acides gras ou d'un mélange de tels esters avec un gazole classique, auxquels on peut ajouter des additifs usuels. The invention relates to novel fuel compositions, particularly fuels for diesel engines which contain a significant proportion of certain fatty acid esters. According to the invention, the fuel (or fuel) may consist essentially of one or more fatty acid esters or a mixture of such esters with a conventional gas oil, to which may be added conventional additives.
Les corps gras (huiles et graisses) d'origine végétale et animale ont été souvent proposés comme combustibles de substitution pour les moteurs Diesel. On a préconisé aussi bien de mélanges ces produits aux gazoles, que de les employer tels quels. Leur indice de cétane, qui reflète la tendance à l'auto-inflammation est en général acceptable, bien que plus faible que celui des gazoles. Fats (oils and fats) of vegetable and animal origin have often been proposed as alternative fuels for diesel engines. It has been advocated as well mixtures of these products with gas oils, that to use them as such. Their cetane number, which reflects the tendency to self-ignition is generally acceptable, although lower than that of gas oils.
Cependant, certaines caractéristiques physico-chimiques de ces corps gras sont tràs différentes de celles qu'on exige d'un combustible du type gazole, en particulier du point de vue de la condensation en carbone des molécules, de la viscosité et du domaine de distillation des produits considérés. Ainsi par exemple, un des constituants les plus fréquemment rencontrés dans les corps gras d'origine végétale ou animale, le tris-oléate de glycérol renferme 57 atomes de carbone, alors que les constituants hydrocarbonés d'un gazole renferment en général de 9 à 18 atomes de carbone. En outre, les huiles et graisses sont beaucoup plus visqueuses que les gazoles et-ne distillent pas, comme les fractions pétrolières moyennes, à la pression atmosphérique.Ces particularités constituent un obstacle certain à la mise en oeuvre des corps gras d'origine végétale ou animale comme combustibles Diesel (ou comme constituants de combustibles Diesel). However, certain physicochemical characteristics of these fats are very different from those required of a fuel of the diesel type, in particular from the point of view of the carbon condensation of the molecules, the viscosity and the distillation domain. products considered. For example, one of the constituents most frequently found in fats of vegetable or animal origin, glycerol tris-oleate contains 57 carbon atoms, whereas the hydrocarbon constituents of a gas oil generally contain from 9 to 18 carbon atoms. carbon atoms. In addition, the oils and fats are much more viscous than diesel and do not distil, like the average petroleum fractions, at atmospheric pressure. These particularities constitute a definite obstacle to the use of fats of vegetable origin or as diesel fuels (or as constituents of diesel fuels).
On a maintenant découvert qu'il entait possible d'obtenir, à partir des corps gras, en particulier des huiles et graisses d'origine végétale et animale, des produits présentant des caracteristiques beaucoup mieux adaptées à une utilisation comme combustibles dans des moteurs Diesel. It has now been discovered that it is possible to obtain, from fats, in particular oils and fats of vegetable and animal origin, products having characteristics much better adapted for use as fuels in diesel engines.
D'une manière générale, les compositions combustibles de l'in- vention peuvent être définies comme comprenant
- une proportion de O à 90 % en volume d'au moins un gazole classique ; et
- une proportion de 100 à 10 % en volume d'au moins un ester d'acide gras répondant à la formule générale R1-C00-R2 dans laquelle R représente un radical aliphatique substantiellement linéaire, saturé ou insaturé, renfermant de 5 à 23 atomes de carbone et R2 représente un radical aliphatique saturé ou insaturé,linéaire ou ramifié, renfermant de 1 à 12 atomes de carbone.In general, the fuel compositions of the invention can be defined as comprising
a proportion of 0 to 90% by volume of at least one conventional diesel fuel; and
a proportion of 100 to 10% by volume of at least one fatty acid ester corresponding to the general formula R1-C00-R2 in which R represents a substantially linear aliphatic radical, saturated or unsaturated, containing from 5 to 23 atoms of carbon and R2 represents a linear or branched, saturated or unsaturated aliphatic radical containing from 1 to 12 carbon atoms.
Les compositions de ce type utilisables selon l'invention comme combustibles pour moteur Diesel sont celles qui présentent un indice de cétane satisfaisant aux spécifications (pour les Etats Unis, 11 indice de cétane doit être d'au moins 40 ; il est en général de 40 à 47 ; pour la France, il doit être d'au moins 50 ; il est en général de 50 à 55)
L'indice de cétane des combustibles est déterminé d'après la norme ASM D 613-65. The compositions of this type which can be used according to the invention as diesel engine fuels are those which have a cetane number satisfying the specifications (for the United States, the cetane number must be at least 40, it is in general 40 to 47, for France, it must be at least 50, it is generally 50 to 55)
The cetane number for fuels is determined according to ASM D 613-65.
De manière préférée, la partie "acide gras" des esters utilisés dans l'invention dérive des acides R COOR dans lesquels le radical aliphatique R1 linéaire, saturé ou insaturé, renferme de Il à 23 atomes de carbone ; elle dérive plus particulièrement
- d'acides gras saturés, tels que l'acide laurique, l'acide myristique, l'acide palmitique, l'acide stéarique, l'acide arachidique, l'acide béhénique, ou l'acide lignocérique.Preferably, the "fatty acid" part of the esters used in the invention is derived from R COOR acids in which the linear, saturated or unsaturated aliphatic radical R1 contains from 11 to 23 carbon atoms; it derives more particularly
saturated fatty acids, such as lauric acid, myristic acid, palmitic acid, stearic acid, arachidic acid, behenic acid, or lignoceric acid.
- a'acides gras à 1 insaturation éthylénique, tels que l'acide lauroléique, l'acide myristoléique, l'acide palmitoléique, l'acide oléique, l'acide gadoléique ou l'acide érucique. fatty acids with ethylenic unsaturation, such as lauroleic acid, myristoleic acid, palmitoleic acid, oleic acid, gadoleic acid or erucic acid.
- ou encore d'acides gras à 2 insaturations éthyléniques ou davantage tels que l'acide linoléique ou l'acide linolénique. or else fatty acids with 2 or more ethylenic unsaturations such as linoleic acid or linolenic acid.
La partie "acide gras" des esters utilisés dans l'invention peut encore dériver de mélanges d'acides gras contenant des proportions prépondérantes de certains des acides mentionnés ci-dessus et provenant notamment des corps gras naturels d'origine végétale ou animale. The "fatty acid" part of the esters used in the invention may further derive from mixtures of fatty acids containing predominant proportions of some of the acids mentioned above and originating in particular from natural fats of vegetable or animal origin.
Parmi les corps gras d'origine végétale, on peut citer les huiles de colza, par exemple celle dont la composition en acides gras montre des proportions prépondérantes d'acide érucique (env. 50 0,o), d'acide linoléique (env. 14 %), d'acide oléique (env. 13 zou et d'acide gadoléique (env. 10 %), et celles ne contenant que de faibles proportions d'acide érucique;
ou l'huile de tournesol dont la composition en acides gras révèle des proportions prépondérantes d'acide linoléique (env. 60 %), et d'acide oléique (env. 26 %). Among the fatty substances of plant origin, mention may be made of rapeseed oils, for example those whose fatty acid composition shows predominant proportions of erucic acid (about 50%), linoleic acid (approx. 14%), oleic acid (about 13% and gadoleic acid (about 10%), and those containing only small proportions of erucic acid;
or sunflower oil whose fatty acid composition shows predominant proportions of linoleic acid (about 60%), and oleic acid (about 26%).
On peut encore citer l'huile de coprah, l'huile de mais, l'huile de coton, l'huile de soja ou l'huile d'arachide. Other examples include coconut oil, corn oil, cottonseed oil, soybean oil or peanut oil.
Parmi les corps gras d'origine animale, on peut citer par exemple le saindoux, dont la composition en acides gras révèle des proportions prépondérantes d'acide oléique (env. 42 %), d'acide palmitique (env. Among the fatty substances of animal origin, mention may be made, for example, of lard, whose fatty acid composition reveals predominant proportions of oleic acid (about 42%), palmitic acid (approx.
27 %) et d'acide stéarique (env. 19 yO);
ou le suif de boeuf, dont la composition en acides gras montre des proportions prépondérantes d'acide oléique (env. 36 %), d'acide palmitique (env. 26 9 et d'acide stéarique (env. 23 5'). 27%) and stearic acid (about 19 yO);
or beef tallow, whose fatty acid composition shows predominant proportions of oleic acid (about 36%), palmitic acid (about 26% and stearic acid (about 23%).
La partie "alcool" des esters utilisés dans l'invention dérive de monoalcools aliphatiques saturés ou insaturés,linéaires ou ramifiés, ayant de 1 à 12 atomes de carbone. Pour des raisons de commodité, elle dérive le plus souvent du méthanol. Mais elle peut encore dériver par exemple de méthanol, du n-propanol, de l'isopropanol, du n-butanol, de l'isobutanol, etc. ou encore de l'éthyl 2-hexanol ou du dodécanol. The "alcohol" part of the esters used in the invention is derived from saturated or unsaturated aliphatic monoalcohols, linear or branched, having from 1 to 12 carbon atoms. For the sake of convenience, it is most often derived from methanol. But it can still derive for example from methanol, n-propanol, isopropanol, n-butanol, isobutanol, etc. or else ethyl 2-hexanol or dodecanol.
Les esters d'acides gras considérés dans l'invention peuvent être obtenus avantageusement par alcoolyse (ou transestérification) au moyen d'un monoalcool RȎH, des esters de glycérol contenus dans les corps gras naturels (huiles ou graisses) d'origine végétale ou animale. The fatty acid esters considered in the invention can advantageously be obtained by alcoholysis (or transesterification) using a R monoH monohydric alcohol, glycerol esters contained in natural fats (oils or fats) of plant or animal origin. .
Cette alcoolyse peut être effectuée avantageusement sur les huiles et graisses à l'état brut, c'est-à-dire sans qu'il soit nécessaire de les séparer en leurs divers constituants glycéridiques. This alcoholysis can be carried out advantageously on the oils and fats in the raw state, that is to say without it being necessary to separate them into their various glyceride constituents.
Ainsi par exemple, la préparation des esters méthyliques dérivés des triglycérides est réalisée par alcoolyse au méthanol dans des conditions conriiesdans l'art (décrites par exemple dans le brevet américain 2360844). For example, the preparation of methyl esters derived from triglycerides is carried out by methanol alcoholysis under conditions conriiesen the art (described for example in US Patent 2360844).
Les esters d'acides gras utilisés dans l'invention peuvent encore - bien que cela soit moins avantageux - être synthétisés à partir des acides gras eux-mêmesj lorsqu'ils sont aisément disponibles. The fatty acid esters used in the invention may still - although less desirable - be synthesized from the fatty acids themselves when readily available.
Dans ce cas, on opère par simple estérification de l'acide gras
R1 COOR au moyen du monoalcool aliphatique approprié R20R, selon toute technique usuelle. In this case, one operates by simple esterification of the fatty acid
R1 COOR by means of the appropriate aliphatic monohydric alcohol R20R, according to any usual technique.
Les esters d'acides gras considérés dans l'invention, tels qu'ils ont été définis plus haut,peuvent être utilisés seuls ou en mélanges entre eux comme constituants essentiels des compositions combustibles (notamment pour les moteurs Diesel) selon l'invention. The fatty acid esters considered in the invention, as defined above, may be used alone or in mixtures with one another as essential constituents of the fuel compositions (especially for diesel engines) according to the invention.
Ils peuvent aussi être utilisés en mélange avec des gazoles classiques, en proportions variées. Les avantages de 11 emploi des esters d'acides gras se manifestent principalement dans ce cas lorsqu'on met en jeu au moins 30 0,0, en volume d'ester d'ester graspour gras pour 70% de gazole. They can also be used in mixture with conventional gas oils, in various proportions. The advantages of using the fatty acid esters are chiefly apparent in this case when at least 0.0, by volume of fatty ester of fatty ester is used for 70% of gas oil.
Par gazoles classiques, on entend dans l'invention, des coupes d'origine pétrolière bouillant dans un intervalle allant de 1200-1900C a 300 -380 C, présentant un poids moléculaire moyen d'environ 200 (le poids moléculaire des constituants des gazoles pouvant aller d'environ 130 à environ 250). Ils présentent en outre une teneur variable en hydrocarbures aromatiques (par exemple de 20 à 35 % en poids). Leur viscosité cinématique à 20 C est en général de quelques centistokes, par exemple d'environ 4 à 9 cSt. Ils ont un indice de cétane de l'ordre de 38à58. By conventional gas oils is meant in the invention, cuts of petroleum origin boiling in a range from 1200-1900C to 300 -380 C, having an average molecular weight of about 200 (the molecular weight of the constituents of gas oils can go from about 130 to about 250). They also have a variable content of aromatic hydrocarbons (for example from 20 to 35% by weight). Their kinematic viscosity at 20 ° C is generally a few centistokes, for example about 4 to 9 cSt. They have a cetane number of about 38 to 58.
Ces gazoles peuvent provenir de la distillation atmosphérique du pétrole brut ou d'autres opérations de raffinage telles que le craquage ou l'hydrocraquage. These gas oils can come from the atmospheric distillation of crude oil or other refining operations such as cracking or hydrocracking.
Contrairement aux combustibles de synthèse ou d'origine autre que pétrolière (charbon, biomasse), qui sont en général mal adaptés à l'utilisation dans les moteurs Diesel, les produits considérés dans l'invention présentent en général de très bons indices de cétane, et en mélange avec des gazoles, ils présentent des "indices de mélange" particulièrement élevés,
("L'indice de cétane de mélange" d'un produit est l'indice de cétane calculé que devrait présenter ledit produit pour que, connaissant l'indice de cétane du gazole utilisé, la moyenne pondérée - par les proportions de gazole et de produit - entre l'indice de cétane du gazole et l"'indice de mélange" du produit soit égale à l'indice de cétane mesuré pour le mélange)0
Un autre avantage des esters d'acides gras utilisés dans l'inven- tion est que leur préparation peut être réalisée sans que l'on fasse appel à aucun produit d'origine pétrolière, les alcools (méthanol, éthanol,etc) pouvant eux-mêmes hêtre obtenus à partir de biomasse. Unlike synthetic fuels or non-oil fuels (coal, biomass), which are generally poorly suited for use in diesel engines, the products considered in the invention generally have very good cetane numbers, and when mixed with gas oils, they exhibit particularly high "mixing indices",
("The Cetane Mix Index" of a product is the calculated cetane number that the product should present so that, knowing the cetane number of the gas oil used, the weighted average - by the proportions of diesel and product - between the cetane number of the gas oil and the "melt index" of the product is equal to the cetane number measured for the mixture) 0
Another advantage of the fatty acid esters used in the invention is that their preparation can be carried out without the use of any product of petroleum origin, the alcohols (methanol, ethanol, etc.) being able to same beech obtained from biomass.
Les disponibilités en matières premières sont variées et multiples : huile de colza en France et dans divers autres pays occidentaux, corps gras animaux (suif, saindoux, etc.), cultures tropicales. The availability of raw materials is varied and multiple: rapeseed oil in France and in various other Western countries, animal fats (tallow, lard, etc.), tropical crops.
Les esters d'acides gras considérés dans l'invention, tels qu'ils ont été définis précédemment,peuvent présenter une insaturation éthylénique plus ou moins importante selon la nature des produits qui ont servi à leur préparation. The esters of fatty acids considered in the invention, as defined above, may exhibit ethylenic unsaturation more or less important depending on the nature of the products used in their preparation.
Dans certains cas, on peut astre amené, sans sortir du cadre de l'invention, à soumettre les esters d'acides gras à une hydrogènation sélective destinée à en réduire l'insaturation. Cette hydrogènation sélective peut être effectuée suivant toute technique appropriée. In certain cases, it is possible, without departing from the scope of the invention, to subject the fatty acid esters to a selective hydrogenation intended to reduce the unsaturation thereof. This selective hydrogenation can be carried out using any suitable technique.
Ce traitement a pour effet d'élever l'indice de cétane du produit, ce qui peut être avantageux, notamment lorsque l'ester d'acide gras (ou le mélange d'esters d'acides gras) est utilisé en mélange avec des gazoles à forte teneur en aromatiques, qui présentent en général des indices de cétane un peu faibles. This treatment has the effect of raising the cetane number of the product, which can be advantageous, especially when the fatty acid ester (or the mixture of fatty acid esters) is used in mixture with gas oils with a high aromatic content, which generally have slightly low cetane numbers.
Cependant, il n'est pas toujours bénéfique d'abaisser le degré dtinsaturation des esters d'acides gras considérés dans l'invention, car, à mesure que lton s'approche de la saturation complète des doubles liaisons éthyléniques, on risque de détériorer le comportement à basse température des esters d'acides gras, et en particulier de provoquer leur précipitation à froid dans les gazoles. However, it is not always beneficial to lower the degree of unsaturation of the fatty acid esters contemplated in the invention since, as it approaches the complete saturation of the ethylenic double bonds, there is a risk of deteriorating the low temperature behavior of fatty acid esters, and in particular to cause their cold precipitation in gas oils.
Dans leur utilisation comme carburants pour moteurs Diesel,on peut ajouter aux compositions de l'invention divers additifs usuels compatibles avec les esters d'acides gras mis en jeu. Ainsi, il peut être recommandé de leur incorporer des additifs anti-oxydants. On peut aussi leur ajouter des additifs-améliorant les caractéristiques à froid, des additifs anti-fumées, etc. In their use as fuels for diesel engines, can be added to the compositions of the invention various customary additives compatible with the fatty acid esters involved. Thus, it may be recommended to incorporate antioxidant additives. They can also be added additives-improving cold characteristics, anti-smoke additives, etc.
Les exemples suivants illustrent l'invention et ne doivent en aucune manière être considérés comme limitatifs. The following examples illustrate the invention and should in no way be considered as limiting.
On décrit tout d'abord la préparation des esters méthyliques de l'huile de colza, du saindoux et du suif qui seront, entre autres, utilisés dans les exemples illustrant l'invention. First of all, the preparation of the methyl esters of rapeseed oil, lard and tallow, which will be used among others in the examples illustrating the invention.
PREPARATION A
Préparation des esters méthyliques de l'huile de colza.PREPARATION A
Preparation of the methyl esters of rapeseed oil.
Dans un réacteur de Grignard en verre, de 10 litres,muni d'un agitateur, d un thermomètre, d'une vanne de fond de cuve et d'un chan fage extérieur, on introduit 5 kg d'huile de colza raffinée, préalablement déshydratée pendant 2 heures à 1000C,sous une pression de 6,5 à 7 millibars
Les principales caractéristiques de l'huile de colza ainsi traitée sont indiquées dans le tableau 1 que l'on trouvera plus loin. Elle présente en outre un indice de saponification de 192 (mg KOH/g).In a 10-liter glass Grignard reactor equipped with an agitator, thermometer, bottom-bottom valve and outer chanter, 5 kg of refined rapeseed oil are introduced beforehand. dehydrated for 2 hours at 1000C under a pressure of 6.5 to 7 millibars
The main characteristics of the rapeseed oil thus treated are shown in Table 1 which will be found later. It also has a saponification number of 192 (mg KOH / g).
L'agitation étant mise en marche, l'huile est chauffée à 55-600C après quoi, on y incorpore, en 5 minutes, une solution constituée de 876 g de méthanol absolu et de 9 g de sodium métallique. On laisse réagir pendant 1 heure puis on arrête l'agitation. With stirring turned on, the oil is heated to 55-600 ° C whereupon a solution consisting of 876 g of absolute methanol and 9 g of sodium metal is incorporated in the course of 5 minutes. Allowed to react for 1 hour then stop stirring.
Après 30 minutes de décantation, la phase inférieure constituée pour 11 essentiel de glycérol (650 g) est éliminée par la vanne de fond de cuve. On ajoute alors à la phase organique contenue dans le réacteur 520 cm3 d'eau distillée préalablement chauffée à 600C. Après une vigoureuse agitation d'une durée de 15 minutes, le mélange est laissé au repos pendant le même temps. La phase aqueuse de lavage décantée est éliminée comme précédemment0 L'opération de lavage est renouvelée deux fois avec 320 cm3 doleau. After 30 minutes of decantation, the bottom phase consisting essentially of glycerol (650 g) is removed by the bottom valve. 520 cm3 of distilled water previously heated to 600 ° C. are then added to the organic phase contained in the reactor. After vigorous stirring for 15 minutes, the mixture is allowed to stand for the same time. The aqueous decanted washing phase is removed as before. The washing operation is repeated twice with 320 cm 3 of water.
La phase organique récupérée est séchée sur sulfate de sodium anhydre, filtrée sommairement puis évaporée à 1000C sous pression réduite (6,5 à 7 millibars) pendant 1 heure, afin d'en éliminer les dernières traces de méthanol. The recovered organic phase is dried over anhydrous sodium sulphate, filtered briefly and then evaporated at 1000C under reduced pressure (6.5 to 7 millibars) for 1 hour, in order to remove the last traces of methanol.
On obtient finalement 4750 g du produit recherché dont l'analyse révèle une teneur en esters méthyliques supérieure à 95 96 en poids. Les principales caractéristiques de ces esters sont également données au tableau 1. Finally, 4750 g of the desired product are obtained, the analysis of which reveals a methyl ester content greater than 95% by weight. The main characteristics of these esters are also given in Table 1.
PREPARATION 3
Préparation des esters méthyliques du saindoux.PREPARATION 3
Preparation of methyl esters of lard.
Dans des conditions opératoires identiques à celles décrites ci-dessus (préparation A), on effectue l'alcoolyse de 6 kg de saindoux d'origine commerciale, préalablement déshydraté à 1000C sous une pression de 6,5 à 7 millibars, pendant 2 heures. Under the same operating conditions as those described above (preparation A), the alcoholysis of 6 kg of commercial lard, previously dehydrated at 1000C under a pressure of 6.5 to 7 millibars, is carried out for 2 hours.
Le saindoux ainsi traité présente les caractéristiques suivantes
Indice d'acide 1,3 (mg KOH/g)
Indice de saponification 199 (mg KOE/g)
L'alcoolyse est effectuée avec 1090 g de méthanol absolu et 14 g de sodium.The lard thus treated has the following characteristics
Acid number 1.3 (mg KOH / g)
Saponification index 199 (mg KOE / g)
The alcoholysis is carried out with 1090 g of absolute methanol and 14 g of sodium.
L'analyse de la phase organique obtenue (6241 g) révèle une teneur en esters méthyliques d'environ 97 % en poids. Les principales caractéristiques de ces esters sont données au tableau 2. Analysis of the organic phase obtained (6241 g) reveals a methyl ester content of about 97% by weight. The main characteristics of these esters are given in Table 2.
PREPARATION C
Préparation des esters méthyliques du suif.PREPARATION C
Preparation of methyl esters of tallow
Comme décrit précédemment (préparation A), on effectue l'alcoolyse de 6 kg de suif industriel, préalablement déshydraté dans les conditions déjà mentionnées. As previously described (preparation A), the alcoholysis of 6 kg of industrial tallow, previously dehydrated under the conditions already mentioned, is carried out.
Les caractéristiques du suif ainsi traité sont
Indice d'acide 2,25 (mg KOH/g)
Indice de saponification 196 (mg KOH/g)
L'alcoolyse est effectuée au moyen de 1073 g de méthanol anhydre et 15 g de sodium métallique.The characteristics of the tallow thus treated are
Acid number 2.25 (mg KOH / g)
Saponification index 196 (mg KOH / g)
The alcoholysis is carried out using 1073 g of anhydrous methanol and 15 g of sodium metal.
L'analyse de la phase organique obtenue (6190 g) révèle une teneur en esters méthyliques d'environ 97 % en poids. Les principales caractéristiques de ces esters sont données au tableau 2 ci-après. Analysis of the organic phase obtained (6190 g) reveals a methyl ester content of about 97% by weight. The main characteristics of these esters are given in Table 2 below.
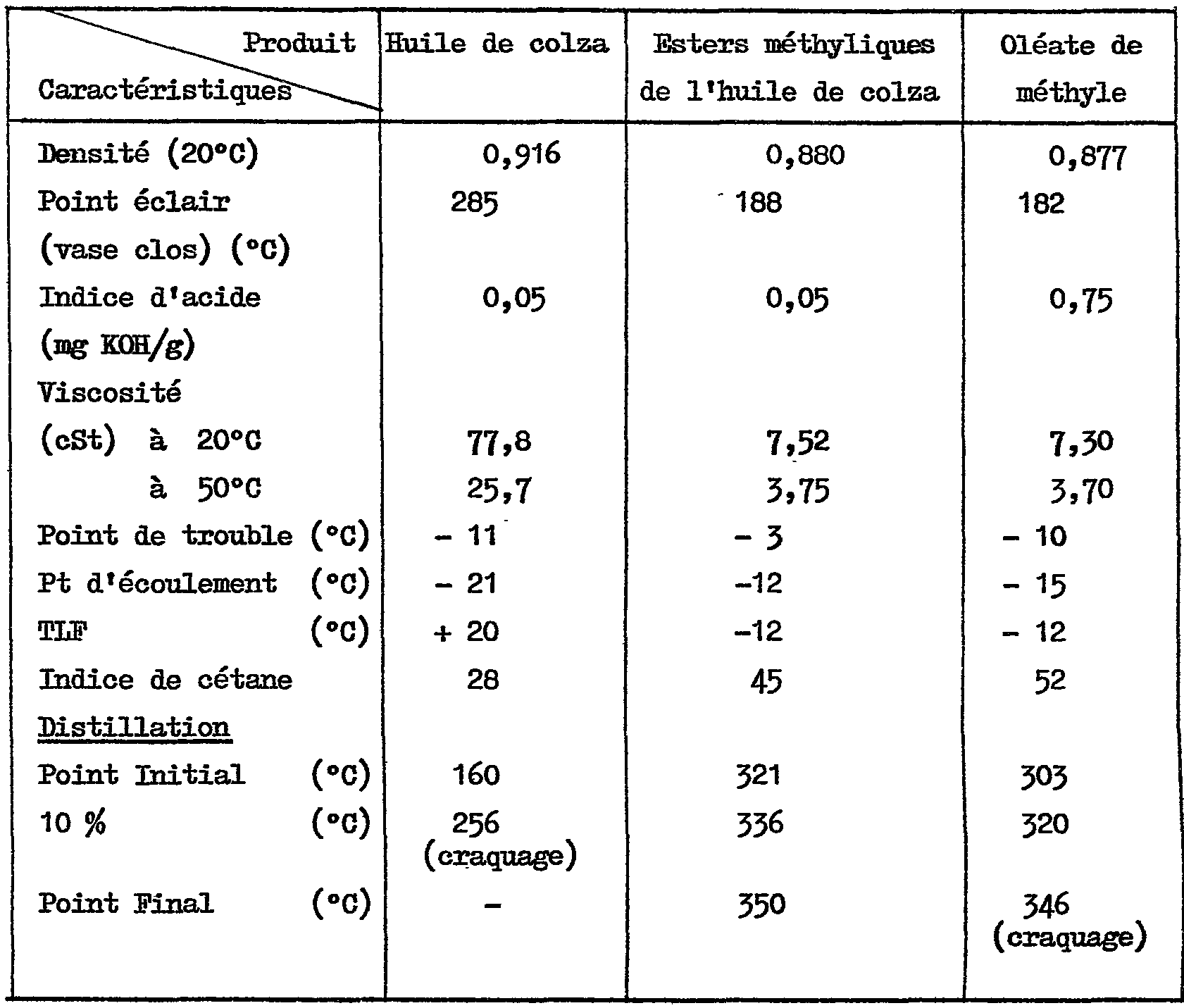
On présente dans le tableau 1 ci-après une comparaison entre diverses caractéristiques de l'huile de colza et les caractéristiques correspondantes du mélange d'esters méthyliques qui en dérive par alcoolyse au méthanol, réalisée par exemple selon la préparation A décrite plus haut. Table 1 below gives a comparison between various characteristics of the rapeseed oil and the corresponding characteristics of the mixture of methyl esters derived therefrom by alcoholysis with methanol, carried out for example according to Preparation A described above.
On a également indiqué les propriétés correspondantes de l'oléate de méthyle. The corresponding properties of methyl oleate have also been reported.
TABLEAU 1
TABLE 1
<tb> <SEP> 1 <SEP> I
<tb> <SEP> Produit <SEP> Ruile <SEP> de <SEP> colsa <SEP> Esters <SEP> méthyliques <SEP> Oléate <SEP> de
<tb> Caractéristiques <SEP> de <SEP> l'huile <SEP> de <SEP> colza <SEP> méthyle
<tb> <SEP> colsa <SEP> méthyle
<tb> Densité <SEP> (200C) <SEP> 0,916 <SEP> 0,880 <SEP> 0,877
<tb> Point <SEP> éclair <SEP> 285 <SEP> - <SEP> 188 <SEP> 182
<tb> (vase <SEP> clos) <SEP> (Oc)
<tb> Indice <SEP> d'acide <SEP> 0,05 <SEP> 0,05 <SEP> 0,75
<tb> (mg <SEP> R/g)
<tb> Viscosité
<tb> (cSt) <SEP> à <SEP> 200G <SEP> 77,8 <SEP> 7,52 <SEP> 7,30
<tb> <SEP> à <SEP> 500C <SEP> 25,7 <SEP> 3,75 <SEP> 3,70
<tb> Point <SEP> de <SEP> trouble <SEP> (OC) <SEP> - <SEP> 11 <SEP> - <SEP> 3 <SEP> - <SEP> 10
<tb> Pt <SEP> d'écoulement <SEP> (OC) <SEP> - <SEP> 21 <SEP> -12 <SEP> - <SEP> 15
<tb> eLF <SEP> (OC) <SEP> + <SEP> 20 <SEP> -12 <SEP> - <SEP> 12
<tb> Indice <SEP> de <SEP> cétane <SEP> 28 <SEP> 45 <SEP> 52
<tb> Distillation
<tb> Point <SEP> Initial <SEP> (OC) <SEP> 160 <SEP> 321 <SEP> 303
<tb> 10 <SEP> % <SEP> (oc3 <SEP> 256 <SEP> 336 <SEP> - <SEP> 320
<tb> <SEP> (craquage)
<tb> Point <SEP> Final <SEP> (OG) <SEP> - <SEP> 350 <SEP> 346
<tb> <SEP> (craquage)
<tb>
Ces indications permettent de mettre en évidence les avantages que présentent les esters méthyliques de l'huile de colza sur l'huile de colza elle-même, principalement du point de vue de l'indice de cétane, de la densité, de la viscosité, de la température limite de filtrabilité, ainsi que de l'intervalle de distillation.<tb><SEP> 1 <SEP> I
<tb><SEP> Product <SEP> Ruile <SEP> of <SEP> colsa <SEP> Esters <SEP> Methyl <SEP> Oleate <SEP> of
<tb> Characteristics <SEP> of <SEP> oil <SEP> of <SEP> rapeseed <SEP> methyl
<tb><SEP> colsa <SEP> methyl
<tb> Density <SEP> (200C) <SEP> 0.916 <SEP> 0.880 <SEP> 0.877
<tb> Point <SEP> flash <SEP> 285 <SEP> - <SEP> 188 <SEP> 182
<tb> (vase <SEP> closed) <SEP> (Oc)
<tb><SEP> acid number <SEP> 0.05 <SEP> 0.05 <SEP> 0.75
<tb> (mg <SEP> R / g)
<tb> Viscosity
<tb> (cSt) <SEP> to <SEP> 200G <SEP> 77.8 <SEP> 7.52 <SEP> 7.30
<tb><SEP> to <SEP> 500C <SEP> 25.7 <SEP> 3.75 <SEP> 3.70
<tb> Point <SEP> of <SEP> disorder <SEP> (OC) <SEP> - <SEP> 11 <SEP> - <SEP> 3 <SEP> - <SEP> 10
<tb> Flow Pt <SEP><SEP> (OC) <SEP> - <SEP> 21 <SEP> -12 <SEP> - <SEP> 15
<tb> eLF <SEP> (OC) <SEP> + <SEP> 20 <SEP> -12 <SEP> - <SEP> 12
<tb><SEP> Index of <SEP> cetane <SEP> 28 <SEP> 45 <SEP> 52
<tb> Distillation
<tb> Point <SEP> Initial <SEP> (OC) <SEP> 160 <SEP> 321 <SEP> 303
<tb> 10 <SEP>% <SEP> (oc3 <SEP> 256 <SE> 336 <SEP> - <SEP> 320
<tb><SEP> (cracking)
<tb> Point <SEP> Final <SEP> (OG) <SEP> - <SEP> 350 <SEP> 346
<tb><SEP> (cracking)
<Tb>
These indications make it possible to demonstrate the advantages that the methyl esters of rapeseed oil have over the rapeseed oil itself, mainly from the point of view of the cetane number, the density, the viscosity, the filterability limit temperature, as well as the distillation range.
Les propriétés des esters méthyliques de l'huile de colza et de l'oléate de méthyle sont,de façon inattendue, tout à fait satisfaisantes pour qu'on puisse en envisager l'emploi dans des combustibles Diesel. The properties of the methyl esters of rapeseed oil and methyl oleate are, unexpectedly, quite satisfactory for their use in diesel fuels.
On présente d'autre part dans le tableau 2 ci-après les caractéristiques des esters méthyliques du saindoux et du suif, préparés comme décrit plus haut (préparations B et C, respectivement). Table 2 below shows the characteristics of the methyl esters of lard and tallow, prepared as described above (preparations B and C, respectively).
TABLEAU 2
TABLE 2
<tb> <SEP> Produits <SEP> Esters <SEP> méthyliques <SEP> Esters <SEP> méthyliques
<tb> <SEP> Caractéristiques <SEP> du <SEP> saindoux <SEP> du <SEP> suif
<tb> <SEP> 0,870 <SEP> 0,872
<tb> Densité <SEP> (à <SEP> 200C) <SEP> 0,870 <SEP> 0,872
<tb> Point <SEP> éclair <SEP> (OC) <SEP> 180 <SEP> 181
<tb> <SEP> (vase <SEP> clos)
<tb> Indice <SEP> d'acide <SEP> 0,01 <SEP> 0,05
<tb> <SEP> (mg <SEP> HOH/g)
<tb> Viscosité <SEP> (à <SEP> 50 C)(cSt) <SEP> 4,05 <SEP> 3,90
<tb> Indice <SEP> de <SEP> cétane <SEP> 56 <SEP> 58
<tb> Distillation
<tb> Point <SEP> Initial <SEP> (OG) <SEP> 309 <SEP> 302
<tb> Point <SEP> Final <SEP> (OG) <SEP> 340 <SEP> 340
<tb>
D'après ces résultats, on constate que les esters méthyliques du saindoux et du suif sont, de façon surprenante, tout à fait appropriés pour une utilisation dans des combustibles pour moteurs Diesel.<tb><SEP> Products <SEP> Esters <SEP> Methylics <SEP> Esters <SEP> Methyl
<tb><SEP><SEP><SEP><SEP> Lard <SEP> Characteristics of Tallow
<tb><SEP> 0.870 <SEP> 0.872
<tb> Density <SEP> (at <SEP> 200C) <SEP> 0.870 <SEQ> 0.872
<tb> Point <SEP> Flash <SEP> (OC) <SEP> 180 <SEP> 181
<tb><SEP> (vase <SEP> closed)
<tb><SEP> acid number <SEP> 0.01 <SEP> 0.05
<tb><SEP> (mg <SEP> HOH / g)
<tb> Viscosity <SEP> (at <SEP> 50 C) (cSt) <SEP> 4.05 <SEP> 3.90
<tb><SEP>Index><SEP> Cetane <SEP> 56 <SEP> 58
<tb> Distillation
<tb> Point <SEP> Initial <SEP> (OG) <SEP> 309 <SEP> 302
<tb> Point <SEP> Final <SEP> (OG) <SEP> 340 <SEP> 340
<Tb>
From these results it is found that the methyl esters of lard and tallow are, surprisingly, quite suitable for use in diesel fuels.
Dans le tableau 3 présenté ci-après,on a indiqué l'indice de cétane de compositions combustibles constituées d'esters d'acides gras utilisés seuls ou en mélange en diverses proportions avec deux gazoles différents, l'un ayant un indice de cétane de 54, l'autre de 45. In Table 3 presented below, the cetane number of fuel compositions consisting of esters of fatty acids used alone or in a mixture in various proportions with two different gas oils has been indicated, one having a cetane number of 54, the other 45.
Les esters d'acides gras considérés étaient les esters méthyliques de l'huile de colza, l'oléate de méthyle (provenant de deux lots différents) ; les esters-méthyliques du saindoux les les esters méthyliques du suif le stéarate de méthyle ; et le stéarate de d'éthyl-2 hexyle. The fatty acid esters considered were the methyl esters of rapeseed oil, methyl oleate (from two different lots); methyl esters of lard; methyl esters of tallow; methyl stearate; and 2-ethylhexyl stearate.
Pour les mélanges avec les gazoles,on a également indiqué "l'indice de cétane de mélange" (calculé) de l'ester d'acide gras considéré. For mixtures with gas oils, the "cetane number of mixture" (calculated) of the fatty acid ester in question was also indicated.
A titre de comparaison, on a rappelé la valeur de l'indice de cétane de l'huile de colza et on a indiqué l'indice de cétane de mélanges à 50 % en volume avec un gazole d'indice de cétane 54, de saindoum et de suif respectivement. By way of comparison, the value of the cetane number of the rapeseed oil was recalled and the cetane number of mixtures at 50% by volume with cetane number 54 diesel fuel of saindoum and tallow respectively.
TABLEAU 3
TABLE 3
<tb> <SEP> GAZOLE <SEP> I <SEP> (IC=54) <SEP> GAZOLE <SEP> II <SEP> (10=45) <SEP>
<tb> <SEP> Compositions <SEP> ï <SEP> Indice <SEP> de <SEP> Indice <SEP> de <SEP> Indice <SEP> de <SEP> Indice <SEP> de
<tb> <SEP> cétane <SEP> cétane
<tb> <SEP> mesuré <SEP> mélange <SEP> mesuré <SEP> mélange
<tb> (*) <SEP> Huile <SEP> de <SEP> colza
<tb> <SEP> 100 <SEP> % <SEP> vol <SEP> 28 <SEP> - <SEP> 28 <SEP>
<tb> Esters <SEP> méthyliques
<tb> du <SEP> colza
<tb> <SEP> 100 <SEP> % <SEP> vol <SEP> 45
<tb> <SEP> 90 <SEP> % <SEP> " <SEP> 48 <SEP> 47'3 <SEP>
<tb> <SEP> 75 <SEP> % <SEP> " <SEP> 49 <SEP> 47,3
<tb> <SEP> 50 <SEP> % <SEP> " <SEP> 51 <SEP> 48
<tb> Oléate <SEP> de <SEP> méthyle
<tb> <SEP> 100 <SEP> % <SEP> vol <SEP> 52 <SEP> (le <SEP> lot) <SEP> 50,5 <SEP> (2ème <SEP> lot)
<tb> <SEP> 90 <SEP> 5% <SEP> " <SEP> 53 <SEP> 52,9 <SEP> 54,5 <SEP> 55,6
<tb> <SEP> 75 <SEP> % <SEP> " <SEP> 58 <SEP> 59,3 <SEP> 50,4 <SEP> 52,2
<tb> <SEP> 50 <SEP> % <SEP> " <SEP> 56 <SEP> 58 <SEP> 49,9 <SEP> 54,8
<tb> (*) <SEP> Saindoux
<tb> <SEP> 50 <SEP> % <SEP> vol <SEP> 50,4 <SEP> 46,8
<tb> Esters <SEP> méthyliques
<tb> du <SEP> saindoux
<tb> <SEP> 100 <SEP> % <SEP> vol <SEP> 56 <SEP> - <SEP> 56 <SEP>
<tb> <SEP> 75 <SEP> % <SEP> " <SEP> 57,5 <SEP> 58,7 <SEP> 56,7 <SEP> 60,6
<tb> <SEP> 50 <SEP> % <SEP> " <SEP> 57 <SEP> 60 <SEP> 52,5 <SEP> 60
<tb> (*) <SEP> Suif
<tb> <SEP> 50 <SEP> % <SEP> vol <SEP> 49,9 <SEP> 45,8
<tb> Esters <SEP> méthyliques
<tb> au <SEP> suif <SEP> 75 <SEP> % <SEP> vol <SEP> 60 <SEP> 62
<tb> Esters <SEP> méthyliques
<tb> du <SEP> suif <SEP> 75 <SEP> % <SEP> vol <SEP> 60 <SEP> 62
<tb> <SEP> 50 <SEP> % <SEP> " <SEP> 58 <SEP> 62
<tb> Stéarate <SEP> de <SEP> méthyle
<tb> <SEP> 50 <SEP> % <SEP> vol <SEP> 66,5 <SEP> 79
<tb> Stéarate <SEP> d'éthyl
<tb> 2 <SEP> hexyle <SEP> 50 <SEP> % <SEP> vol <SEP> 61,7 <SEP> 69,4
<tb> (*) Ces essais sont donnés à titre de comparaison. <tb><SEP> GAS <SEP> I <SEP> (IC = 54) <SEP> GAS <SEP> II <SEP> (10 = 45) <SEP>
<tb><SEP> Compositions <SEP> ï <SEP><SEP> Index of <SEP><SEP><SEP> Index <SEP><SEP> Index <SEP> Index
<tb><SEP> cetane <SEP> cetane
<tb><SEP> measured <SEP> mixture <SEP> measured <SEP> mixture
<tb> (*) <SEP> Oil <SEP> of <SEP> rapeseed
<tb><SEP> 100 <SEP>% <SEP> flight <SEP> 28 <SEP> - <SEP> 28 <SEP>
<tb> Esters <SEP> Methyl
<tb> of <SEP> rapeseed
<tb><SEP> 100 <SEP>% <SEP> flight <SEP> 45
<tb><SEP> 90 <SEP>% <SEP>"<SEP> 48 <SEP>47'3<SEP>
<tb><SEP> 75 <SEP>% <SEP>"<SEP> 49 <SEP> 47.3
<tb><SEP> 50 <SEP>% <SEP>"<SEP> 51 <SEP> 48
<tb> Oleate <SEP> of <SEP> Methyl
<tb><SEP> 100 <SEP>% <SEP> vol <SEP> 52 <SEP> (the <SEP> batch) <SEP> 50.5 <SEP> (2nd <SEP> batch)
<tb><SEP> 90 <SEP> 5% <SEP>"<SEP> 53 <SEP> 52.9 <SEP> 54.5 <SE> 55.6
<tb><SEP> 75 <SEP>% <SEP>"<SEP> 58 <SEP> 59.3 <SEP> 50.4 <SE> 52.2
<tb><SEP> 50 <SEP>% <SEP>"<SEP> 56 <SEP> 58 <SEP> 49.9 <SEP> 54.8
<tb> (*) <SEP> Lard
<tb><SEP> 50 <SEP>% <SEP> flight <SEP> 50.4 <SEP> 46.8
<tb> Esters <SEP> Methyl
<tb> of <SEP> lard
<tb><SEP> 100 <SEP>% <SEP> flight <SEP> 56 <SEP> - <SEP> 56 <SEP>
<tb><SEP> 75 <SEP>% <SEP>"<SEP> 57.5 <SEP> 58.7 <SEP> 56.7 <SEP> 60.6
<tb><SEP> 50 <SEP>% <SEP>"<SEP> 57 <SEP> 60 <SEP> 52.5 <SEP> 60
<tb> (*) <SEP> Tallow
<tb><SEP> 50 <SEP>% <SEP> flight <SEP> 49.9 <SEP> 45.8
<tb> Esters <SEP> Methyl
<tb> to <SEP> tallow <SEP> 75 <SEP>% <SEP> flight <SEP> 60 <SEP> 62
<tb> Esters <SEP> Methyl
<tb> of <SEP> tallow <SEP> 75 <SEP>% <SEP> flight <SEP> 60 <SEP> 62
<tb><SEP> 50 <SEP>% <SEP>"<SEP> 58 <SEP> 62
<tb> Stearate <SEP> of <SEP> Methyl
<tb><SEP> 50 <SEP>% <SEP> flight <SEP> 66.5 <SEP> 79
<tb> Stearate <SEP> of ethyl
<tb> 2 <SEP> hexyl <SEP> 50 <SEP>% <SEP> vol <SEP> 61.7 <SEP> 69.4
<tb> (*) These tests are given for comparison.
Comme on le voit,les compositions selon l'invention présentent des indices de cétane (et, le cas échéant, des "indices de cétane de mélange") tout à fait satisfaisants, contrairement aux corps gras, utilisés seuls (huile de colza) ou même en mélange avec un gazole (saindoux et suif). As can be seen, the compositions according to the invention exhibit cetane numbers (and, where appropriate, "cetane mixture indices") quite satisfactory, unlike fatty substances, used alone (rapeseed oil) or even when mixed with a diesel fuel (lard and tallow).
ESSAIS SUR MOTEUR DIESEL
Certaines des compositions de l'invention ont été testées sur un moteur Diesel de tracteur agricole (tournant à 2400 tours/minute) pendant 50 heures chacune.TESTING ON DIESEL ENGINE
Some of the compositions of the invention have been tested on an agricultural tractor diesel engine (rotating at 2400 rpm) for 50 hours each.
Il s'agissait - d'oléate de méthyle pur (2ème lot) ; - d'un mélange 75 % - 25 % d'oléate de méthyle dans un gazole américain
d'indice de cétane 45 ; - d'esters méthyliques du saindoux purs ; - d'un mélange 75 % - 25 % esters méthyliques du saindoux dans
le gazole américain d'indice de cétone 45 - d'un mélange 50 % - 50 % d'esters méthyliques du suif dans un gazole
d'indice de cétane 54.(Les pourcentages sont en volume).It was - pure methyl oleate (2nd batch); - a blend of 75% - 25% methyl oleate in an American diesel
cetane number 45; - pure methyl esters of lard; - a mixture of 75% - 25% methyl esters of lard in
ketone index 45 - 50% - 50% methyl esters of tallow in a diesel fuel
cetane number 54. (The percentages are by volume).
Ces essais n'ont conduit à aucun incident de fonctionnement. On n'a pas observé de dépôts au niveau des injecteurs Par ailleurs, on a constaté un maintien normal du rendement énergétique du moteur. These tests did not lead to any operating incidents. No deposits were observed at the level of the injectors. Furthermore, a normal maintenance of the energy efficiency of the engine was observed.
Claims (15)
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| FR8022531A FR2492402A1 (en) | 1980-10-21 | 1980-10-21 | Diesel fuels contg. fatty acid ester(s) - obtd. e.g. by methanolysis of vegetable or animal fats or oils |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| FR8022531A FR2492402A1 (en) | 1980-10-21 | 1980-10-21 | Diesel fuels contg. fatty acid ester(s) - obtd. e.g. by methanolysis of vegetable or animal fats or oils |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| FR2492402A1 true FR2492402A1 (en) | 1982-04-23 |
| FR2492402B1 FR2492402B1 (en) | 1984-02-10 |
Family
ID=9247169
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| FR8022531A Granted FR2492402A1 (en) | 1980-10-21 | 1980-10-21 | Diesel fuels contg. fatty acid ester(s) - obtd. e.g. by methanolysis of vegetable or animal fats or oils |
Country Status (1)
| Country | Link |
|---|---|
| FR (1) | FR2492402A1 (en) |
Cited By (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2560210A1 (en) * | 1983-12-30 | 1985-08-30 | Inst Francais Du Petrole | Process for the manufacture of a methyl, ethyl, propyl or butyl ester of a fatty acid suitable for use as diesel fuel |
| FR2603296A1 (en) * | 1986-09-02 | 1988-03-04 | Hans Junek | PROCESS AND DEVICE FOR THE MANUFACTURE OF A MIXTURE OF FATTY ACID ESTERS FOR USE AS FUEL OR AS FUEL |
| WO1992011345A1 (en) * | 1990-12-17 | 1992-07-09 | Henkel Kommanditgesellschaft Auf Aktien | Mixtures of fatty acid low-alkyl esters with improved cold stability |
| DE4135294A1 (en) * | 1991-10-25 | 1993-04-29 | Tessol Kraftstoffe Mineraloele | Fuel mixt. used for diesel engines or as heating oil e.g. in ships - comprises vegetable and/or animal oil and aliphatic fatty acid ester |
| EP0543356A3 (en) * | 1991-11-22 | 1993-10-20 | Roehm Gmbh | Process for making compositions with improved low temperature behaviour |
| WO1994010267A1 (en) * | 1992-10-26 | 1994-05-11 | Exxon Chemical Patents Inc. | Oil additives and compositions |
| EP0716139A1 (en) * | 1994-12-07 | 1996-06-12 | Veba Oel Ag | Fuel for high compression Diesel engines |
| EP0717096A1 (en) * | 1994-12-15 | 1996-06-19 | ALPHA TRADING S.p.A. | Fuels having a low impact on the environment |
| DE19529846A1 (en) * | 1995-08-12 | 1997-02-13 | Guenther Dr Boehmke | Mfg. fuels, e.g. for diesel or petrol engines with direct injection systems - by reacting fatty acid glycerine ester(s) in animal or vegetable fats or oils, with alkylene oxide(s) in presence of alkali catalysts and opt. solvents |
| DE19807519A1 (en) * | 1998-02-21 | 1999-08-26 | Ex Rohr Center Gmbh | Diesel fuel substitute and process for its manufacture |
| WO2004010782A3 (en) * | 2002-07-26 | 2004-04-08 | Novance | Method for fighting against non-persistent virus propagation, composition and use |
| WO2006067234A1 (en) * | 2004-12-24 | 2006-06-29 | Shell Internationale Research Maatschappij B.V. | Altering properties of fuel compositions |
| WO2007000428A1 (en) * | 2005-06-29 | 2007-01-04 | Basf Aktiengesellschaft | Biodiesel fuel mixture containing polyoxymethylene dialkyl ether |
| WO2007100309A1 (en) * | 2006-03-02 | 2007-09-07 | Ozeryansky Oleksandr Adolfovic | Versatile additive to lubricating and fuel materials and fuels containing said additive |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB9204709D0 (en) * | 1992-03-03 | 1992-04-15 | Exxon Chemical Patents Inc | Additives for oils |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2384866A (en) * | 1942-03-24 | 1945-09-18 | Sol B Wiczer | Motor fuel |
-
1980
- 1980-10-21 FR FR8022531A patent/FR2492402A1/en active Granted
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2384866A (en) * | 1942-03-24 | 1945-09-18 | Sol B Wiczer | Motor fuel |
Cited By (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2560210A1 (en) * | 1983-12-30 | 1985-08-30 | Inst Francais Du Petrole | Process for the manufacture of a methyl, ethyl, propyl or butyl ester of a fatty acid suitable for use as diesel fuel |
| FR2603296A1 (en) * | 1986-09-02 | 1988-03-04 | Hans Junek | PROCESS AND DEVICE FOR THE MANUFACTURE OF A MIXTURE OF FATTY ACID ESTERS FOR USE AS FUEL OR AS FUEL |
| WO1992011345A1 (en) * | 1990-12-17 | 1992-07-09 | Henkel Kommanditgesellschaft Auf Aktien | Mixtures of fatty acid low-alkyl esters with improved cold stability |
| DE4135294A1 (en) * | 1991-10-25 | 1993-04-29 | Tessol Kraftstoffe Mineraloele | Fuel mixt. used for diesel engines or as heating oil e.g. in ships - comprises vegetable and/or animal oil and aliphatic fatty acid ester |
| EP0543356A3 (en) * | 1991-11-22 | 1993-10-20 | Roehm Gmbh | Process for making compositions with improved low temperature behaviour |
| WO1994010267A1 (en) * | 1992-10-26 | 1994-05-11 | Exxon Chemical Patents Inc. | Oil additives and compositions |
| EP0716139A1 (en) * | 1994-12-07 | 1996-06-12 | Veba Oel Ag | Fuel for high compression Diesel engines |
| DE4443549A1 (en) * | 1994-12-07 | 1996-06-13 | Veba Oel Ag | Fuel for high compression compression ignition engines |
| EP0717096A1 (en) * | 1994-12-15 | 1996-06-19 | ALPHA TRADING S.p.A. | Fuels having a low impact on the environment |
| DE19529846C2 (en) * | 1995-08-12 | 2000-01-20 | Guenther Boehmke | Process for the production of fuels from natural raw materials |
| DE19529846A1 (en) * | 1995-08-12 | 1997-02-13 | Guenther Dr Boehmke | Mfg. fuels, e.g. for diesel or petrol engines with direct injection systems - by reacting fatty acid glycerine ester(s) in animal or vegetable fats or oils, with alkylene oxide(s) in presence of alkali catalysts and opt. solvents |
| DE19807519A1 (en) * | 1998-02-21 | 1999-08-26 | Ex Rohr Center Gmbh | Diesel fuel substitute and process for its manufacture |
| EP0937767A3 (en) * | 1998-02-21 | 2000-03-29 | Ex-Rohr Center GmbH | Gas oil extender and process for its preparation |
| DE19807519C2 (en) * | 1998-02-21 | 2002-01-17 | Ex Rohr Ct Gmbh | Process for the production of diesel fuel substitutes |
| WO2004010782A3 (en) * | 2002-07-26 | 2004-04-08 | Novance | Method for fighting against non-persistent virus propagation, composition and use |
| WO2006067234A1 (en) * | 2004-12-24 | 2006-06-29 | Shell Internationale Research Maatschappij B.V. | Altering properties of fuel compositions |
| JP2008525556A (en) * | 2004-12-24 | 2008-07-17 | シエル・インターナシヨネイル・リサーチ・マーチヤツピイ・ベー・ウイ | Variation characteristics of fuel composition |
| WO2007000428A1 (en) * | 2005-06-29 | 2007-01-04 | Basf Aktiengesellschaft | Biodiesel fuel mixture containing polyoxymethylene dialkyl ether |
| JP2008545028A (en) * | 2005-06-29 | 2008-12-11 | ビーエーエスエフ ソシエタス・ヨーロピア | Biodiesel fuel mixture containing polyoxymethylene dialkyl ether |
| WO2007100309A1 (en) * | 2006-03-02 | 2007-09-07 | Ozeryansky Oleksandr Adolfovic | Versatile additive to lubricating and fuel materials and fuels containing said additive |
Also Published As
| Publication number | Publication date |
|---|---|
| FR2492402B1 (en) | 1984-02-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| FR2492402A1 (en) | Diesel fuels contg. fatty acid ester(s) - obtd. e.g. by methanolysis of vegetable or animal fats or oils | |
| EP0832172B1 (en) | Bifunctional cold resistance additive for fuels, and fuel composition | |
| CA2281635C (en) | Additive for fuel oiliness | |
| CA2710839C (en) | Terpolymer as an additive improving the cold flow of liquid hydrocarbons | |
| FR2507205A1 (en) | SYNTHETIC LIQUID FUEL AND ITS MIXTURES FOR DEVICES THAT USE PETROLEUM | |
| WO2009106743A2 (en) | Difunctional additives for liquid hydrocarbons, obtained by grafting from copolymers of ethylene and/or propylene and vinyl esters | |
| US20110154727A1 (en) | Fuel formulations | |
| FR2498622A1 (en) | Diesel fuels based on gas oil and methanol - contg. lower alkyl fatty acid ester | |
| FR2894978A1 (en) | Component improving cetane in diesel fuels and useful to prepare diesel fuels, comprises a stearic acid ester comprised e.g. in (a pure state added with a mixture of) vegetable or animal oil esters in crude or partially hydrogenated form | |
| FR2710652A1 (en) | Cold operability additive composition of middle distillates. | |
| EP4437067A1 (en) | Marine fuel base comprising a component of renewable origin and method for manufacturing same | |
| FR3057877A1 (en) | COMBINATION OF FUEL ADDITIVES | |
| US20080168705A1 (en) | Biofuel Composition | |
| EP1888719A1 (en) | A new biodiesel composition | |
| EP1252270B1 (en) | Temperature stable emulsified fuel | |
| EP3529338B1 (en) | Combination of additives for fuel | |
| FR2496119A1 (en) | Diesel fuels based on gas oil and methanol - contg. lower alkyl fatty acid ester | |
| FR2894977A1 (en) | Component improving cetane in diesel fuels and useful to prepare diesel fuels, comprises a stearic acid ester comprised e.g. in (a pure state added with a mixture of) vegetable or animal oil esters in crude or partially hydrogenated form | |
| FR2497223A1 (en) | Diesel fuels based on gas oil, butanol and acetone - contg. lower alkyl fatty acid ester | |
| FR2497222A1 (en) | Non-petroleum diesel fuels - comprising fatty acid ester and alcohol | |
| GB2387175A (en) | Oxidised fuel formulations | |
| FR3143624A1 (en) | Fuel composition comprising a renewable base, a fatty acid ester and an alkyl-phenol additive | |
| JP2012503040A (en) | Method for improving the oxidative stability of biodiesel measured by the ransimate test | |
| EP2094820A2 (en) | Diesel fuel containing long-chain glycerol acetals | |
| FR3141186A1 (en) | Composition of low sulfur marine fuel |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| ST | Notification of lapse |