EP0511166A1 - Process for photochemical and thermic stabilization of polyamide fibre material with a fiberaffinitive copper complex and an oxalicacid diarylamide - Google Patents
Process for photochemical and thermic stabilization of polyamide fibre material with a fiberaffinitive copper complex and an oxalicacid diarylamide Download PDFInfo
- Publication number
- EP0511166A1 EP0511166A1 EP92810286A EP92810286A EP0511166A1 EP 0511166 A1 EP0511166 A1 EP 0511166A1 EP 92810286 A EP92810286 A EP 92810286A EP 92810286 A EP92810286 A EP 92810286A EP 0511166 A1 EP0511166 A1 EP 0511166A1
- Authority
- EP
- European Patent Office
- Prior art keywords
- formula
- hydrogen
- c5alkyl
- substituted
- radical
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
Classifications
-
- D—TEXTILES; PAPER
- D06—TREATMENT OF TEXTILES OR THE LIKE; LAUNDERING; FLEXIBLE MATERIALS NOT OTHERWISE PROVIDED FOR
- D06M—TREATMENT, NOT PROVIDED FOR ELSEWHERE IN CLASS D06, OF FIBRES, THREADS, YARNS, FABRICS, FEATHERS OR FIBROUS GOODS MADE FROM SUCH MATERIALS
- D06M15/00—Treating fibres, threads, yarns, fabrics, or fibrous goods made from such materials, with macromolecular compounds; Such treatment combined with mechanical treatment
- D06M15/19—Treating fibres, threads, yarns, fabrics, or fibrous goods made from such materials, with macromolecular compounds; Such treatment combined with mechanical treatment with synthetic macromolecular compounds
- D06M15/37—Macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds
- D06M15/59—Polyamides; Polyimides
-
- D—TEXTILES; PAPER
- D06—TREATMENT OF TEXTILES OR THE LIKE; LAUNDERING; FLEXIBLE MATERIALS NOT OTHERWISE PROVIDED FOR
- D06P—DYEING OR PRINTING TEXTILES; DYEING LEATHER, FURS OR SOLID MACROMOLECULAR SUBSTANCES IN ANY FORM
- D06P1/00—General processes of dyeing or printing textiles, or general processes of dyeing leather, furs, or solid macromolecular substances in any form, classified according to the dyes, pigments, or auxiliary substances employed
- D06P1/44—General processes of dyeing or printing textiles, or general processes of dyeing leather, furs, or solid macromolecular substances in any form, classified according to the dyes, pigments, or auxiliary substances employed using insoluble pigments or auxiliary substances, e.g. binders
- D06P1/64—General processes of dyeing or printing textiles, or general processes of dyeing leather, furs, or solid macromolecular substances in any form, classified according to the dyes, pigments, or auxiliary substances employed using insoluble pigments or auxiliary substances, e.g. binders using compositions containing low-molecular-weight organic compounds without sulfate or sulfonate groups
- D06P1/642—Compounds containing nitrogen
- D06P1/649—Compounds containing carbonamide, thiocarbonamide or guanyl groups
- D06P1/6495—Compounds containing carbonamide -RCON= (R=H or hydrocarbons)
-
- D—TEXTILES; PAPER
- D06—TREATMENT OF TEXTILES OR THE LIKE; LAUNDERING; FLEXIBLE MATERIALS NOT OTHERWISE PROVIDED FOR
- D06P—DYEING OR PRINTING TEXTILES; DYEING LEATHER, FURS OR SOLID MACROMOLECULAR SUBSTANCES IN ANY FORM
- D06P1/00—General processes of dyeing or printing textiles, or general processes of dyeing leather, furs, or solid macromolecular substances in any form, classified according to the dyes, pigments, or auxiliary substances employed
- D06P1/44—General processes of dyeing or printing textiles, or general processes of dyeing leather, furs, or solid macromolecular substances in any form, classified according to the dyes, pigments, or auxiliary substances employed using insoluble pigments or auxiliary substances, e.g. binders
- D06P1/64—General processes of dyeing or printing textiles, or general processes of dyeing leather, furs, or solid macromolecular substances in any form, classified according to the dyes, pigments, or auxiliary substances employed using insoluble pigments or auxiliary substances, e.g. binders using compositions containing low-molecular-weight organic compounds without sulfate or sulfonate groups
- D06P1/642—Compounds containing nitrogen
- D06P1/6423—Compounds containing azide or oxime groups
-
- D—TEXTILES; PAPER
- D06—TREATMENT OF TEXTILES OR THE LIKE; LAUNDERING; FLEXIBLE MATERIALS NOT OTHERWISE PROVIDED FOR
- D06P—DYEING OR PRINTING TEXTILES; DYEING LEATHER, FURS OR SOLID MACROMOLECULAR SUBSTANCES IN ANY FORM
- D06P3/00—Special processes of dyeing or printing textiles, or dyeing leather, furs, or solid macromolecular substances in any form, classified according to the material treated
- D06P3/02—Material containing basic nitrogen
- D06P3/04—Material containing basic nitrogen containing amide groups
- D06P3/24—Polyamides; Polyurethanes
- D06P3/241—Polyamides; Polyurethanes using acid dyes
Definitions
- the present invention relates to a process for the photochemical and thermal stabilization of polyamide fiber material with a fiber-complex copper complex compound and an oxalic acid diarylamide, an agent containing these compounds and the use of this agent for the photochemical and thermal stabilization of polyamide fiber material.
- the present invention accordingly relates to a process for the photochemical and thermal stabilization of polyamide fiber material, which is characterized in that the fiber material with a composition comprising a water-soluble, fiber-affine oxalic acid diarylamide of the general formula wherein R1 and R2, independently of one another, are hydrogen, unsubstituted or substituted by halogen, hydroxy, C1-C5alkoxy, carboxyl groups, carbamyl groups or C1-C12alkoxycarbonyl groups, C1-C18alkyloxy, C3-C5alkenyloxy, unsubstituted or substituted by halogen or C1-C5alkylbisalkyl Acyloxy containing carbon atoms, unsubstituted or substituted by halogen or C1-C4alkyl benzoyloxy or a radical of the formula -A-SO3M, A is the direct bond or a divalent radical of the formula -OQ- and Q is unsubstitute
- C1-C-undalkyl and C1-C5alkoxy represent such groups or group components which have 1 to 5, in particular 1 to 3, carbon atoms.
- groups are: methyl, ethyl, n-propyl, isopropyl, n-butyl, sec-butyl, tert-butyl, amyl or isoamyl or methoxy, ethoxy, isopropoxy, isobutoxy, tert-butoxy or tert-amyloxy .
- C1-C12alkoxy means, in addition to the radicals mentioned under C1-Coxyalkoxy, for example pentyloxy, hexyloxy, heptyloxy, octyloxy, nonyloxy, decyloxy, undecyloxy, dodecyloxy or the corresponding isomeric compounds.
- the C1-C18alkyl radicals for the definition of R1 and R2 or the C1-C12alkyl radicals for the definition of R3 and R4 can be branched or unbranched.
- radicals include, for example, both the representatives defined under C1-C5alkyl and alkyl radicals with a higher number of carbon, such as Pentyl, neopentyl, tert -pentyl, hexyl, isohexyl, heptyl, octyl, iso-octyl, nonyl, decyl, undecyl, dodecyl, tridecyl, tetradecyl, pentadecyl, hexadecyl, heptadecyl or octadecyl.
- C1-C6alkylene in the definition of Q means a divalent, saturated hydrocarbon radical such as methylene, ethylene, propylene, trimethylene, tetramethylene, ethylethylene, pentamethylene or hexamethylene.
- Phenyl-C1-C5alkyl means, for example, phenethyl, phenylpropyl, phenylbutyl or preferably benzyl.
- Halogen means fluorine, bromine or preferably chlorine.
- Lithium, sodium or potassium may be mentioned as examples of the alkali metals defined as M.
- Sodium is preferred.
- the hydroxyalkyl radical means e.g. Hydroxyethyl.
- An example of an alkoxyalkoxy radical is methoxyethoxy (also called 2-oxabutyloxy, -O-CH2-CH2-O-CH3), an alkoxyalkoxyalkoxy radical is ethoxyethoxyethoxy (also 3,6-dioxaoctyloxy, -O-CH2-CH2-O-CH2-CH2- O-CH2-CH3 called) and a dialkylamino radical may be mentioned diethylamino.
- a particularly suitable sulfonamide radical is the sulfonamide, N-methylsulfonamide and N, N-dimethylsulfonamide radical.
- Two adjacent radicals R5 - R8 can also be attached together with the C atoms are bound to form a condensed benzene residue.
- Such bisazomethines are derived from 2-hydroxy-2-naphthaldehyde, 3-hydroxy-2-naphthaldehyde or 1-hydroxy-2-naphthaldehyde.
- Aromatic radicals for X1 and Y1 are especially unsubstituted or substituted naphthyl and especially phenyl radicals.
- X1 and Y1 can form a cycloaliphatic radical, e.g. Cyclopentylene, cyclohexylene or cycloheptylene may be linked.
- Aryl for the definition of R10 in formula (3) means naphthyl or preferably phenyl.
- An oxalic acid diarylamide of the general formula is preferred in the process according to the invention used where R12 unsubstituted or substituted by hydroxy or alkoxy C1-C5alkyloxy, unsubstituted or substituted by C1-C5alkyl benzyloxy or a radical of the formula -A-SO3M, R13 and R14 independently of one another are hydrogen, halogen, C1-C12alkyl or phenyl-C1-C5alkyl, r is 1 or 0 and A and M have the meaning given in formula (1).
- Oxalic acid diarylamides of the formula are very particularly preferred correspond to what R15 C1-C12alkyl means and R12, R13, M and r have the meaning given in formula (5).
- Oxalic acid diarylamides of the formula are of very special importance or the formula correspond to what R16 is ethyl or ethoxy.
- Preferred copper complex compounds which are used in the process according to the invention correspond to the formula wherein R17 to R20 are each independently hydrogen, hydroxy, bromine, methyl, tert. Butyl, methoxy, methoxyethoxy, ethoxyethoxyethoxy or diethylamino, X2 is hydrogen, methyl, ethyl, or phenyl and Y2 is hydrogen or R19 and R20 together form a condensed benzene residue or X2 and Y2 together form a cyclohexylene radical.
- compositions which contain an oxalic acid diarylamide of the formula (5) and a copper complex compound of the formula (9) are preferably used in the present process.
- Another object of the invention are the agents used in the process according to the invention for the photochemical and thermal stabilization of polyamide fiber material. They are characterized in that they are a water-soluble, fiber-affine oxalic acid diarylamide of the general formula wherein R1 and R2, independently of one another, are hydrogen, unsubstituted or substituted by halogen, hydroxy, C1-C5alkoxy, carboxyl groups, carbamyl groups or C1-C12alkoxycarbonyl groups, C1-C18alkyloxy, C3-C5alkenyloxy, unsubstituted or substituted by halogen or C1-C5alkylbisalkyl Acyloxy containing carbon atoms, unsubstituted or substituted by halogen or C1-C4alkyl benzoyloxy or a radical of the formula -A-SO3M, A is the direct bond or a divalent radical of the formula -OQ- and Q is C1-C6al
- Agents which contain an oxalic acid diarylamide of the formula (5) and a copper complex compound of the formula (9) are preferred.
- the oxalic acid diarylamides used in the process according to the invention are partly. known and partly they also represent new compounds.
- the production takes place according to methods known per se, such as, for. B. are described in US-A-3,529,982.
- the compounds are obtained by amidating oxalic acid or its esters, in particular alkyl esters, in the first stage on one side with approximately equimolar amounts of the corresponding aniline compound in a manner known per se.
- a preferred method is, for example, that oxalic acid, oxalic acid half-ester or oxalic acid diester with the same or different ester residues with approximately equimolar amounts of the aniline compound in the melt or in organic solvents which are inert to the reactants in the presence of anhydrous boric acid at temperatures between approximately 50 and 200 ° C. be condensed.
- the remaining carboxyl group or carboxylate group of the oxalic acid halimide is condensed in the second stage with a second aniline different from the one in the first stage under analogous conditions, one generally being expedient by 50 to 100 ° C higher temperature, which is approximately between 100 and 250 ° C, is selected.
- a second aniline different from the one in the first stage under analogous conditions, one generally being expedient by 50 to 100 ° C higher temperature, which is approximately between 100 and 250 ° C, is selected.
- approximately equimolar amounts are used.
- Suitable inert organic solvents are in particular those with a boiling point above about 160 ° C., for example higher benzene hydrocarbons or halogenated benzenes such as di- or trichlorobenzenes.
- the second amide group can also be introduced by half-saponification of the amide ester prepared in the first stage to give the amide acid, conversion into the amide acid halide and subsequent amidation of the acid halide group.
- the copper complex compounds of the general formulas (2) to (4) are known, for example, from EP-A-0.051.188, EP-A-0.113.856 and EP-A-0.162.811 and can be prepared by known processes.
- the agent according to the invention containing an oxalic acid diarylamide of the formula (1) and a copper complex compound of the formula (2), (3) or (4) is applied according to the invention from an aqueous bath.
- the amount of compounds added depends on the substrate and the desired stabilization. In general, 0.005 to 1.0%, preferably 0.05 to 0.5% of the copper complex compound and 0.05 to 10%, preferably 0.1 to 5.0% of the oxalic acid diarylamide, in each case based on the substrate, are added.
- the copper complex compounds are water-insoluble, they are expediently used as finely divided dispersions which are obtained by grinding in the presence of customary dispersants.
- the agent according to the invention can be applied before or after dyeing or preferably during dyeing, using an exhaust process at liquor ratios of 1: 5 to 1: 500, preferably 1:10 to 1:50.
- the compounds are expediently added to the dyebath.
- the agent according to the invention can also be used continuously, e.g. can be applied using a padder, low application systems or hot application systems.
- the liquor application is expediently 30-400% by weight, preferably 75-250% by weight.
- the fiber material is subjected to a heat treatment.
- the fixation process can also be carried out using the cold dwell method.
- the heat treatment is preferably carried out by a steaming process with treatment in a steamer with possibly superheated steam at a temperature of 98 to 105 ° C during e.g. 1 to 7, preferably 1 to 5 minutes.
- the fixation of the dyes, the oxalic acid diarylamide and the copper complex compound according to the cold residence process can be carried out by storing the impregnated and preferably rolled-up goods at room temperature (15 to 30 ° C), e.g. take place for 3 to 24 hours, the cold residence time being known to depend on the type of dye applied.
- the dyeings produced are rinsed and dried in the customary manner.
- the agent according to the invention containing an oxalic acid diarylamide and a copper complex compound is used for the photochemical and thermal stabilization of polyamide fiber materials and their dyeings. In their application, it is characterized by high light stability and good fiber affinity and gives the fiber materials treated with these compounds improved photochemical stability.
- Synthetic polyamide such as e.g. Polyamide 6, polyamide 66 or polyamide 12 understood.
- fiber mixtures e.g. of polyamide 6 / polyester or of polyurethane and polyamide, e.g. Jersey material made of polyamide / polyurethane in a mixing ratio of 70:30.
- Fiber blends made of polypropylene and polyamide are also suitable.
- the pure or mixed polyamide material can be in various processing forms, e.g. as fiber, yarn, fabric, knitted fabric or carpet.
- Mainly polyamide material also in mixtures with polyurethane or polypropylene, which is exposed to light and heat and e.g. Present as a car upholstery fabric, carpet or swimwear fabric is particularly suitable for the use of the agents according to the invention.
- the coloring is carried out in the usual way, e.g. with metal complex, anthraquinone or azo dyes and mixtures of these dyes.
- metal complex anthraquinone or azo dyes and mixtures of these dyes.
- the known types in particular the 1: 2 chromium or 1: 2 cobalt complexes of mono- or disazo or azomethine dyes, which are described in large numbers in the literature, are used as metal complex dyes.
- dyes from other dye classes are of course also possible, such as Disperse or reactive dyes.
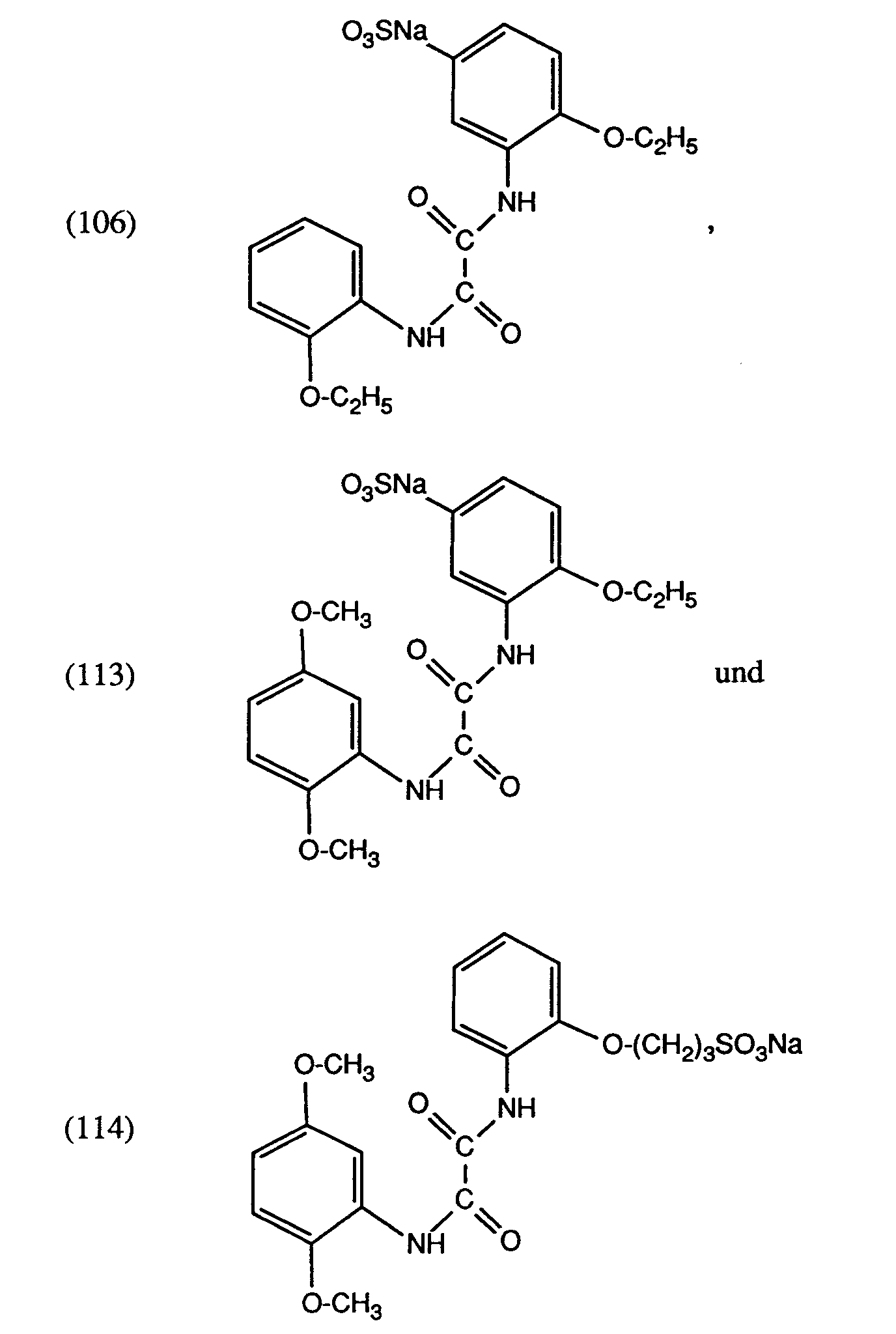
- Example 2 38 mmol of optionally substituted sulfanilic or metanilic acid are added to a melt of 40 mmol of substituted oxalic acid anilide monoalkyl ester and 80 to 200 mmol of imidazole at 100 ° C. The mixture is heated to 100 ° C. for 1 ⁇ 2 hour, then to 130 ° C. for 1 to 3 hours. The completeness of the turnover is checked by means of thin layer chromatography. After cooling, the reaction mass is introduced into about 200 ml of water. The precipitate is filtered off, washed with water and dried. In the case of the compounds (103) and (104), acetone is used instead of the water, in the case of the compounds (105), (106) and (113) ethanol is used for the workup. The yields are shown in Table I.
- the compounds are prepared analogously to compound (115) by reacting 2-ethoxy-2'-hydroxy-oxalic acid bis-anilide.
- a ®AHIBA dyeing machine 2 swatches of 10 g each of a PA 6 knitted fabric are dyed at a liquor ratio of 1:25. All dyebaths each contain the following additives: 0.5 g / l mono-Na phosphate, 1.5 g / l di-Na phosphate and the dyes of the formulas (I) and (II. All additives are dissolved before addition The pH of the dye liquor is 7.5. While fleet 1 contains no further additives, fleet 2 still contains 1% of the compound of the formula (101), dissolved in water, added.
- the liquor 3 also contains 0.25% of a 20% grinding (with a 20% proportion of a condensation product of naphthalenesulfonic acid and formaldehyde as a dispersant) of the copper complex of the formula (129)
- the liquors prepared in this way are heated to 40 ° C., treated with the textile material, treated at this temperature for 10 minutes and heated at 2 ° C./minute to 95 ° C. After a dyeing time of 20 minutes at 95 ° C, 2% acetic acid (80%) are added and dyeing is continued for 25 minutes. Then it is cooled to 60 ° C., rinsed with cold water, centrifuged and dried at 120 ° C. for 2 minutes.
- DIN 75.202 FAKRA
- Table 2 The result shows on the one hand the stabilizing effect of the compound of the formula (101), but also the gain in stability by the compound of the formula (129).
- the finished dyeings are tested as described in Example 29 for their light fastness and tear strength and elongation after exposure.
- the results are summarized in Table 5: The results of the table show that compounds (106), (113) and (114) can significantly improve the stability effect of the copper complex at a high level.
Landscapes
- Engineering & Computer Science (AREA)
- Textile Engineering (AREA)
- Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Coloring (AREA)
- Chemical Or Physical Treatment Of Fibers (AREA)
- Treatments For Attaching Organic Compounds To Fibrous Goods (AREA)
Abstract
Description
Die vorliegende Erfindung betrifft ein Verfahren zur photochemischen und thermischen Stabilisierung von Polyamid-Fasermaterial mit einer faseraffinen Kupferkomplexverbindung und einem Oxalsäurediarylamid, ein Mittel enthaltend diese Verbindungen sowie die Verwendung dieses Mittels zur photochemischen und thermischen Stabilisierung von Polyamid-Fasermaterial.The present invention relates to a process for the photochemical and thermal stabilization of polyamide fiber material with a fiber-complex copper complex compound and an oxalic acid diarylamide, an agent containing these compounds and the use of this agent for the photochemical and thermal stabilization of polyamide fiber material.
Es ist z. B. aus der DE-A-4,005,014 bekannt, Oxalsäurediarylamide in Kombination mit Kupferverbindungen zur Herstellung lichtechter und photochemisch stabiler Färbungen auf Polyamidfasern zu verwenden. Die dabei eingesetzten wasserunlöslichen Oxalsäurediarylamide sind jedoch nur beschränkt faseraffin, besitzen schlechte Nassechtheiten, sind mangelhaft sublimationsbeständig und nicht in allen Applikationsverfahren einsetzbar.It is Z. B. from DE-A-4,005,014 known to use oxalic acid diarylamides in combination with copper compounds for the production of lightfast and photochemically stable dyeings on polyamide fibers. However, the water-insoluble oxalic acid diarylamides used in this process have only a limited affinity for fibers, have poor wet fastness properties, are poorly resistant to sublimation and cannot be used in all application processes.
Es wurde nun gefunden, dass eine Auswahl von wasserlöslichen, faseraffinen Oxalsäurediarylamiden, wie sie beispielsweise in den US-Patentschriften 3,529,982, 3,542,573 und 4,003,875 beschrieben sind, diesen Einschränkungen nicht unterliegen und überraschenderweise die Stabilisierungseffekte von Kupferkomplexen, die beispielsweise aus der US-A 4,655,783 bekannt sind, noch verbessern können.It has now been found that a selection of water-soluble, fiber-affine oxalic acid diarylamides, such as are described, for example, in US Pat. Nos. 3,529,982, 3,542,573 and 4,003,875, are not subject to these restrictions and, surprisingly, the stabilizing effects of copper complexes, which are known, for example, from US Pat. No. 4,655,783 are, can still improve.
Gegenstand der vorliegenden Erfindung ist demnach ein Verfahren zur photochemischen und thermischen Stabilisierung von Polyamid-Fasermaterial, das dadurch gekennzeichnet ist, dass man das Fasermaterial mit einer Zusammensetzung enthaltend ein wasserlösliches, faseraffines Oxalsäurediarylamid der allgemeinen Formel
worin
R₁ und R₂, unabhängig voneinander Wasserstoff, unsubstituiertes oder durch Halogen, Hydroxy, C₁-C₅Alkoxy, Carboxylgruppen, Carbamylgruppen oder C₁-C₁₂Alkoxycarbonylgruppen substituiertes C₁-C₁₈Alkyloxy, C₃-C₅Alkenyloxy, unsubstituiertes oder durch Halogen oder C₁-C₅Alkyl substituiertes Benzyloxy, aliphatisches bis zu 18 Kohlenstoffatome enthaltendes Acyloxy, unsubstituiertes oder durch Halogen oder C₁-C₄Alkyl substituiertes Benzoyloxy oder einen Rest der Formel -A-SO₃M bedeuten,
A die direkte Bindung oder einen zweiwertigen Rest der Formel -O-Q- bedeutet und
Q unsubstituiertes oder durch Hydroxy substituiertes C₁-C₆Alkylen, M Wasserstoff oder Alkalimetall bedeutet,
R₃ und R₄, unabhängig voneinander Wasserstoff, Halogen, C₁-C₁₂Alkyl, Halogenalkyl, Phenyl oder Phenyl-C₁-C₅Alkyl bedeutet oder jeweils zwei orthoständige Reste R₃ und/oder R₄ zusammen einen ankondensierten sechsgliedrigen aromatischen Kohlenstoffring bilden und worin
m und n gleich 1 oder 2 und
p und q gleich 1,2 oder 3 sind und
wobei in der Verbindung der Formel (1) mindestens eine Sulfogruppe vorhanden ist,
und eine Kupferkomplexverbindung der Formel
worin
R′ Wasserstoff oder C₁-C-₅Alkyl,
R₅, R₆, R₇ und R₈ je Wasserstoff, Halogen, Hydroxy, Hydroxyalkyl, C₁-C₅Alkyl, C₁-C₅Alkoxy, Alkoxyalkoxy, Alkoxyalkoxyalkoxy, Carboxymethoxy, Alkylamino, Dialkylamino, -SO₂NH₂, -SO₂NHR, Sulfo oder -SO₂N(R)₂ bedeuten,
R C₁-C₅Alkyl oder C₁-C₅Alkoxyalkyl ist oder
R₅ und R₆ oder R₆ und R₇ oder R₇ und R₈ zusammen mit den C-Atomen, an die sie gebunden sind, einen Benzolrest bilden,
X₁ und Y₁ je Wasserstoff, C₁-C₅Alkyl oder einen aromatischen Rest bedeuten oder
X₁ und Y₁ zusammen mit den C-Atomen, an die sie gebunden sind, einen cycloaliphatischen Rest mit 5-7 C-Atomen bilden,
oder einen Kupferkomplex der Formel
worin
R₉ und R₁₀ unabhängig voneinander einen unsubstituierten oder substituierten C₁-C₅Alkyl- oder Arylrest bedeuten,
oder einen Kupferkomplex von Phenolen der Formel
worin
R₁₁ Wasserstoff, Hydroxy, Alkyl oder Cycloalkyl bedeutet und der Ring A gegebenenfalls weiter substituiert sein kann, behandelt.The present invention accordingly relates to a process for the photochemical and thermal stabilization of polyamide fiber material, which is characterized in that the fiber material with a composition comprising a water-soluble, fiber-affine oxalic acid diarylamide of the general formula
wherein
R₁ and R₂, independently of one another, are hydrogen, unsubstituted or substituted by halogen, hydroxy, C₁-C₅alkoxy, carboxyl groups, carbamyl groups or C₁-C₁₂alkoxycarbonyl groups, C₁-C₁₈alkyloxy, C₃-C₅alkenyloxy, unsubstituted or substituted by halogen or C₁-C₅alkylbisalkyl Acyloxy containing carbon atoms, unsubstituted or substituted by halogen or C₁-C₄alkyl benzoyloxy or a radical of the formula -A-SO₃M,
A is the direct bond or a divalent radical of the formula -OQ- and
Q is unsubstituted or substituted by hydroxy C₁-C₆alkylene, M is hydrogen or alkali metal,
R₃ and R₄, independently of one another, are hydrogen, halogen, C₁-C₁₂alkyl, haloalkyl, phenyl or phenyl-C₁-C₅alkyl or two ortho radicals R₃ and / or R₄ together form a fused-on six-membered aromatic carbon ring and in which
m and n are 1 or 2 and
p and q are equal to 1, 2 or 3 and
wherein at least one sulfo group is present in the compound of the formula (1),
and a copper complex compound of the formula
wherein
R ′ is hydrogen or C₁-C-₅alkyl,
R₅, R₆, R₇ and R₈ each represent hydrogen, halogen, hydroxy, hydroxyalkyl, C₁-C₅alkyl, C₁-C₅alkoxy, alkoxyalkoxy, alkoxyalkoxyalkoxy, carboxymethoxy, alkylamino, dialkylamino, -SO₂NH₂, -SO₂NHR, sulfo or -SO₂N (R) ₂,
R is C₁-C₅alkyl or C₁-C₅alkoxyalkyl or
R₅ and R₆ or R₆ and R₇ or R₇ and R₈ together with the carbon atoms to which they are attached form a benzene radical,
X₁ and Y₁ each represent hydrogen, C₁-C₅alkyl or an aromatic radical or
X₁ and Y₁ together with the carbon atoms to which they are attached form a cycloaliphatic radical with 5-7 carbon atoms,
or a copper complex of the formula
wherein
R₉ and R₁₀ independently of one another represent an unsubstituted or substituted C₁-C₅alkyl or aryl radical,
or a copper complex of phenols of the formula
wherein
R₁₁ is hydrogen, hydroxy, alkyl or cycloalkyl and the ring A may optionally be further treated.
Bei der Definition der Reste R, R′ und R₁ bis R₈ stellen C₁-C-₅Alkyl und C₁-C₅Alkoxy solche Gruppen oder Gruppenbestandteile dar, die 1 bis 5, insbesondere 1 bis 3 Kohlenstoffatome aufweisen. Beispiele für derartige Gruppen sind: Methyl, Ethyl, n-Propyl, Isopropyl, n-Butyl, sek.Butyl, tert.Butyl, Amyl oder Isoamyl bzw. Methoxy, Ethoxy, Isopropoxy, Isobutoxy, tert.-Butoxy oder tert.-Amyloxy.In the definition of the radicals R, R 'and R₁ to R₈, C₁-C-undalkyl and C₁-C₅alkoxy represent such groups or group components which have 1 to 5, in particular 1 to 3, carbon atoms. Examples of such groups are: methyl, ethyl, n-propyl, isopropyl, n-butyl, sec-butyl, tert-butyl, amyl or isoamyl or methoxy, ethoxy, isopropoxy, isobutoxy, tert-butoxy or tert-amyloxy .
C₁-C₁₂Alkoxy bedeutet neben den unter C₁-C₅Alkoxy erwähnten Resten zum Beispiel Pentyloxy, Hexyloxy, Heptyloxy, Octyloxy, Nonyloxy, Decyloxy, Undecyloxy, Dodecyloxy oder die entsprechenden isomeren Verbindungen.C₁-C₁₂alkoxy means, in addition to the radicals mentioned under C₁-Coxyalkoxy, for example pentyloxy, hexyloxy, heptyloxy, octyloxy, nonyloxy, decyloxy, undecyloxy, dodecyloxy or the corresponding isomeric compounds.
Die C₁-C₁₈Alkylreste für die Definition von R₁ und R₂ bzw. die C₁-C₁₂Alkylreste für die Definition von R₃ und R₄ können verzweigt oder unverzweigt sein. Als Beispiele Reste kommen beispielsweise sowohl die unter C₁-C₅Alkyl definierten Vertreter als auch Alkylreste mit höherer Kohlenstoffanzahl in Betracht, wie z.B. Pentyl, Neopentyl, tert.Pentyl, Hexyl, Isohexyl, Heptyl, Octyl, iso-Octyl, Nonyl, Decyl, Undecyl, Dodecyl, Tridecyl, Tetradecyl, Pentadecyl, Hexadecyl, Heptadecyl oder Octadecyl.The C₁-C₁₈alkyl radicals for the definition of R₁ and R₂ or the C₁-C₁₂alkyl radicals for the definition of R₃ and R₄ can be branched or unbranched. Examples of radicals include, for example, both the representatives defined under C₁-C₅alkyl and alkyl radicals with a higher number of carbon, such as Pentyl, neopentyl, tert -pentyl, hexyl, isohexyl, heptyl, octyl, iso-octyl, nonyl, decyl, undecyl, dodecyl, tridecyl, tetradecyl, pentadecyl, hexadecyl, heptadecyl or octadecyl.
C₁-C₆Alkylen bei der Definition von Q bedeutet einen zweiwertigen, gesättigten Kohlenwasserstoffrest wie z.B. Methylen, Ethylen, Propylen, Trimethylen, Tetramethylen, Ethylethylen, Pentamethylen oder Hexamethylen.
Phenyl-C₁-C₅Alkyl bedeutet beispielsweise Phenethyl, Phenylpropyl, Phenylbutyl oder vorzugsweise Benzyl.C₁-C₆alkylene in the definition of Q means a divalent, saturated hydrocarbon radical such as methylene, ethylene, propylene, trimethylene, tetramethylene, ethylethylene, pentamethylene or hexamethylene.
Phenyl-C₁-C₅alkyl means, for example, phenethyl, phenylpropyl, phenylbutyl or preferably benzyl.
Halogen bedeutet Fluor, Brom oder vorzugsweise Chlor.Halogen means fluorine, bromine or preferably chlorine.
Als Beispiele der als M definierten Alkalimetalle seien Lithium, Natrium oder Kalium genannt. Bevorzugt ist Natrium.Lithium, sodium or potassium may be mentioned as examples of the alkali metals defined as M. Sodium is preferred.
Bei den Resten R₅- R₈ bedeutet der Hydroxyalkylrest z.B. Hydroxyethyl. Als Beispiel eines Alkoxyalkoxyrestes sei Methoxyethoxy (auch 2-Oxabutyloxy, -O-CH₂-CH₂-O-CH₃ genannt), eines Alkoxyalkoxyalkoxyrestes sei Ethoxyethoxyethoxy (auch 3,6-Dioxaoctyloxy, -O-CH₂-CH₂-O-CH₂-CH₂-O-CH₂-CH₃ genannt) und eines Dialkylarninorestes sei Diethylamino erwähnt. Als geeigneter Sulfonamidrest sind vor allem der Sulfonamid-, N-Methylsulfonamid- und N,N-Dimethylsulfonamidrest zu nennen.In the R₅- R₈ radicals, the hydroxyalkyl radical means e.g. Hydroxyethyl. An example of an alkoxyalkoxy radical is methoxyethoxy (also called 2-oxabutyloxy, -O-CH₂-CH₂-O-CH₃), an alkoxyalkoxyalkoxy radical is ethoxyethoxyethoxy (also 3,6-dioxaoctyloxy, -O-CH₂-CH₂-O-CH₂-CH₂- O-CH₂-CH₃ called) and a dialkylamino radical may be mentioned diethylamino. A particularly suitable sulfonamide radical is the sulfonamide, N-methylsulfonamide and N, N-dimethylsulfonamide radical.
Zwei benachbarte Reste R₅ - R₈ können auch zusammen mit den C-Atomen, an die sie gebunden sind, einen ankondensierten Benzolrest bilden. Solche Bisazomethine leiten sich ab von 2-Hydroxy-2-naphthaldehyd, 3-Hydroxy-2-naphthaldehyd oder 1-Hydroxy-2-naphthaldehyd.Two adjacent radicals R₅ - R₈ can also be attached together with the C atoms are bound to form a condensed benzene residue. Such bisazomethines are derived from 2-hydroxy-2-naphthaldehyde, 3-hydroxy-2-naphthaldehyde or 1-hydroxy-2-naphthaldehyde.
Als aromatische Reste kommen für X₁ und Y₁ vor allem unsubstituierte oder substituierte Naphthyl- und insbesondere Phenylreste in Betracht. Ausserdem können X₁ und Y₁ zu einem cycloaliphatischen Rest, z.B. Cyclopentylen, Cyclohexylen oder Cycloheptylen verknüpft sein.Aromatic radicals for X₁ and Y₁ are especially unsubstituted or substituted naphthyl and especially phenyl radicals. In addition, X₁ and Y₁ can form a cycloaliphatic radical, e.g. Cyclopentylene, cyclohexylene or cycloheptylene may be linked.
Aryl für die Definition von R₁₀ in Formel (3) bedeutet Naphthyl oder vorzugsweise Phenyl.Aryl for the definition of R₁₀ in formula (3) means naphthyl or preferably phenyl.
Vorzugsweise wird bei dem erfindungsgemässen Verfahren ein Oxalsäurediarylamid der allgemeinen Formel
verwendet, worin
R₁₂ unsubstituiertes oder durch Hydroxy oder Alkoxy substituiertes C₁-C₅Alkyloxy, unsubstituiertes oder durch C₁-C₅Alkyl substituiertes Benzyloxy oder einen Rest der Formel -A-SO₃M,
R₁₃ und R₁₄ unabhängig voneinander Wasserstoff, Halogen, C₁-C₁₂Alkyl oder Phenyl-C₁-C₅Alkyl,
r 1 oder 0 bedeuten und
A und M die in Formel (1) angegebene Bedeutung haben.An oxalic acid diarylamide of the general formula is preferred in the process according to the invention
used where
R₁₂ unsubstituted or substituted by hydroxy or alkoxy C₁-C₅alkyloxy, unsubstituted or substituted by C₁-C₅alkyl benzyloxy or a radical of the formula -A-SO₃M,
R₁₃ and R₁₄ independently of one another are hydrogen, halogen, C₁-C₁₂alkyl or phenyl-C₁-C₅alkyl,
r is 1 or 0 and
A and M have the meaning given in formula (1).
Im Vordergrund des Interesses stehen dabei Verbindungen, bei denen Q Ethylen, Trimethylen oder
bedeutet.In the foreground of interest are compounds in which Q is ethylene, trimethylene or
means.
Ganz besoders bevorzugt sind Oxalsäurediarylamide, die der Formel
entsprechen, worin
R₁₅ C₁-C₁₂Alkyl bedeutet und
R₁₂, R₁₃, M und r die in Formel (5) angegebene Bedeutung haben.Oxalic acid diarylamides of the formula are very particularly preferred
correspond to what
R₁₅ C₁-C₁₂alkyl means and
R₁₂, R₁₃, M and r have the meaning given in formula (5).
Von ganz besoderer Bedeutung sind Oxalsäurediarylamide, die der Formel
oder der Formel
entsprechen, worin
R₁₆ Ethyl oder Ethoxy bedeutet.Oxalic acid diarylamides of the formula are of very special importance
or the formula
correspond to what
R₁₆ is ethyl or ethoxy.
Bevorzugte Kupferkomplexverbindungen, die in dem erfindungsgemässen Verfahren Verwendung finden, entsprechen der Formel
worin
R₁₇ bis R₂₀ unabhängig voneinander je Wasserstoff, Hydroxy, Brom, Methyl, tert. Butyl, Methoxy, Methoxyethoxy, Ethoxyethoxyethoxy oder Diethylamino,
X₂ Wasserstoff, Methyl, Ethyl, oder Phenyl und
Y₂ Wasserstoff bedeuten oder
R₁₉ und R₂₀ zusammen einen ankondensierten Benzolrest oder
X₂ und Y₂ zusammen einen Cyclohexylenrest bilden.Preferred copper complex compounds which are used in the process according to the invention correspond to the formula
wherein
R₁₇ to R₂₀ are each independently hydrogen, hydroxy, bromine, methyl, tert. Butyl, methoxy, methoxyethoxy, ethoxyethoxyethoxy or diethylamino,
X₂ is hydrogen, methyl, ethyl, or phenyl and
Y₂ is hydrogen or
R₁₉ and R₂₀ together form a condensed benzene residue or
X₂ and Y₂ together form a cyclohexylene radical.
Von ganz besonderem Interesse sind dabei Kupferkomplexverbindungen der Formel (9), worin R₁₇, R₁₈, R₁₉, R₂₀, X₂ und X₃ Wasserstoff bedeuten.Of particular interest are copper complex compounds of formula (9), wherein R₁₇, R₁₈, R₁₉, R₂₀, X₂ and X₃ are hydrogen.
Vorzugsweise werden bei dem vorliegenden Verfahren Zusammensetzungen verwendet, die ein Oxalsäurediarylamid der Formel (5) und eine Kupferkomplexverbindung der Formel (9) enthalten.Compositions which contain an oxalic acid diarylamide of the formula (5) and a copper complex compound of the formula (9) are preferably used in the present process.
Von ganz besonderem Interesse sind dabei Zusammensetzungen, die ein Oxalsäurediarylamid der Formel (7) und eine Kupferkomplexverbindung der Formel (9) oder Mischungen, die ein Oxalsäurediarylamid der Formel (8) und eine Kupferkomplexverbindung der Formel (9) enthalten, worin
R₁₇, R₁₈, R₁₉, R₂₀, X₂ und X₃ Wasserstoff bedeuten.Of particular interest are compositions which contain an oxalic acid diarylamide of the formula (7) and a copper complex compound of the formula (9) or mixtures which contain an oxalic acid diarylamide of the formula (8) and a copper complex compound of the formula (9), in which
R₁₇, R₁₈, R₁₉, R₂₀, X₂ and X₃ are hydrogen.
Einen weiteren Erfindungsgegenstand stellen die in dem erfindungsgemässen Verfahren verwendeten Mittel zur photochemischen und thermischen Stabilisierung von Polyamid-Fasermaterial dar. Sie sind dadurch gekennzeichnet, dass sie ein wasserlösliches, faseraffines Oxalsäurediarylamid der allgemeinen Formel
worin
R₁ und R₂, unabhängig voneinander Wasserstoff, unsubstituiertes oder durch Halogen, Hydroxy, C₁-C₅Alkoxy, Carboxylgruppen, Carbamylgruppen oder C₁-C₁₂Alkoxycarbonylgruppen substituiertes C₁-C₁₈Alkyloxy, C₃-C₅Alkenyloxy, unsubstituiertes oder durch Halogen oder C₁-C₅Alkyl substituiertes Benzyloxy, aliphatisches bis zu 18 Kohlenstoffatome enthaltendes Acyloxy, unsubstituiertes oder durch Halogen oder C₁-C₄Alkyl substituiertes Benzoyloxy oder einen Rest der Formel -A-SO₃M bedeuten,
A die direkte Bindung oder einen zweiwertigen Rest der Formel -O-Q- bedeutet und
Q unsubstituiertes oder durch Hydroxy substituiertes C₁-C₆Alkylen,
M Wasserstoff oder Alkalimetall bedeutet,
R₃ und R₄, unabhängig voneinander Wasserstoff, Halogen, C₁-C₁₂Alkyl, Halogenalkyl, Phenyl oder Phenyl-C₁-C₅Alkyl bedeutet oder jeweils zwei orthoständige Reste R₃ und/oder R₄ zusammen einen ankondensierten sechsgliedrigen aromatischen Kohlenstoffring bilden und
m und n gleich 1 oder 2 und
p und q gleich 1,2 oder 3 sind
und wobei in der Verbindung der Formel (1) mindestens eine Sulfogruppe vorhanden ist,
und eine Kupferkomplexverbindung der Formel
R′Wasserstoff oder C₁-C₅Alkyl,
R₅, R₆, R₇ und R₈ je Wasserstoff, Halogen, Hydroxy, Hydroxyalkyl, C₁-C₅Alkyl, C₁-C₅Alkoxy, Alkoxyalkoxy, Alkoxyalkoxyalkoxy, Carboxymethoxy, Alkylamino, Dialkylamino, -SO₂NH₂, -SO₂NHR, Sulfo oder -SO₂N(R)₂ bedeuten, wobei
R C₁-C₅Alkyl oder C₁-C₅Alkoxyalkyl ist oder
R₅ und R₆ oder R₆ und R₇ oder R₇ und R₈ zusammen mit den C-Atomen, an die sie gebunden sind, einen Benzolrest bilden,
X₁ und Y₁ je Wasserstoff, C₁-C₅Alkyl oder einen aromatischen Rest bedeuten oder
X₁ und Y₁ zusammen mit den C-Atomen, an die sie gebunden sind, einen cycloaliphatischen Rest mit 5-7 C-Atomen bilden,
oder einen Kupferkomplex der Formel
worin
R₉ und R₁₀ unabhängig voneinander Wasserstoff oder einen unsubstituierten oder substituierten C₁-C₅Alkyl- oder Arylrest bedeuten,
oder einen Kupferkomplex von Phenolen der Formel
worin
R₁₁ Wasserstoff, Hydroxy, Alkyl oder Cycloalkyl bedeutet und der Ring A gegebenenfalls weiter substituiert sein kann.Another object of the invention are the agents used in the process according to the invention for the photochemical and thermal stabilization of polyamide fiber material. They are characterized in that they are a water-soluble, fiber-affine oxalic acid diarylamide of the general formula
wherein
R₁ and R₂, independently of one another, are hydrogen, unsubstituted or substituted by halogen, hydroxy, C₁-C₅alkoxy, carboxyl groups, carbamyl groups or C₁-C₁₂alkoxycarbonyl groups, C₁-C₁₈alkyloxy, C₃-C₅alkenyloxy, unsubstituted or substituted by halogen or C₁-C₅alkylbisalkyl Acyloxy containing carbon atoms, unsubstituted or substituted by halogen or C₁-C₄alkyl benzoyloxy or a radical of the formula -A-SO₃M,
A is the direct bond or a divalent radical of the formula -OQ- and
Q is C₁-C₆alkylene which is unsubstituted or substituted by hydroxy,
M represents hydrogen or alkali metal,
R₃ and R₄, independently of one another, are hydrogen, halogen, C₁-C₁₂alkyl, haloalkyl, phenyl or phenyl-C₁-C₅alkyl or two ortho radicals R₃ and / or R₄ together form a fused-on six-membered aromatic carbon ring and
m and n are 1 or 2 and
p and q are 1, 2 or 3
and wherein at least one sulfo group is present in the compound of the formula (1),
and a copper complex compound of the formula
R'hydrogen or C₁-C₅alkyl,
R₅, R₆, R₇ and R₈ each represent hydrogen, halogen, hydroxy, hydroxyalkyl, C₁-C₅alkyl, C₁-C₅alkoxy, alkoxyalkoxy, alkoxyalkoxyalkoxy, carboxymethoxy, alkylamino, dialkylamino, -SO₂NH₂, -SO₂NHR, sulfo or -SO₂N (R) ₂, in which
R is C₁-C₅alkyl or C₁-C₅alkoxyalkyl or
R₅ and R₆ or R₆ and R₇ or R₇ and R₈ together with the carbon atoms to which they are attached form a benzene radical,
X₁ and Y₁ each represent hydrogen, C₁-C₅alkyl or an aromatic radical or
X₁ and Y₁ together with the carbon atoms to which they are attached form a cycloaliphatic radical with 5-7 carbon atoms,
or a copper complex of the formula
wherein
R₉ and R₁₀ independently of one another are hydrogen or an unsubstituted or substituted C₁-C₅alkyl or aryl radical,
or a copper complex of phenols of the formula
wherein
R₁₁ is hydrogen, hydroxy, alkyl or cycloalkyl and the ring A may optionally be further substituted.
Vorzugsweise kommen Mittel in Betracht, die ein Oxalsäurediarylamid der Formel (5) und eine Kupferkomplexverbindung der Formel (9) enthalten.Agents which contain an oxalic acid diarylamide of the formula (5) and a copper complex compound of the formula (9) are preferred.
Die bei dem erfindungsgemässen Verfahren verwendeten Oxalsäurediarylamide sind z.T. bekannt und z.T. stellen sie auch neue Verbindungen dar. Die Herstellung geschieht nach an sich bekannten Methoden, wie sie z. B. in der US-A-3,529,982 beschrieben sind. Man gelangt zu den Verbindungen, indem man in an sich bekannter Weise Oxalsäure oder deren Ester, insbesondere Alkylester in der ersten Stufe halbseitig mit etwa äquimolaren Mengen der entsprechenden Anilinverbindung amidiert. Eine bevorzugte Methode besteht zum Beispiel darin, dass Oxalsäure, Oxalsäurehalbester oder Oxalsäurediester mit gleichartigen oder verschiedenartigen Esterresten mit etwa äquimolaren Mengen der Anilinverbindung in der Schmelze oder in gegenüber den Reaktionspartnern inerten organischen Lösungsmitteln in Gegenwart von wasserfreier Borsäure bei Temperaturen zwischen etwa 50 und 200°C kondensiert werden. Nach Isolierung des so erhaltenen Amid-Esters bzw. der Amid-Säure werden in der zweiten Stufe die noch verbliebene Carboxylgruppe bzw. Carboxylatgruppe des Oxalsäurehalbimids mit einem zweiten, von dem in der ersten Stufe verschiedenen Anilin unter analogen Bedingungen kondensiert, wobei im allgemeinen zweckmässig eine um 50 bis 100°C höhere Temperatur, die etwa zwischen 100 und 250°C liegt, gewählt wird. Auch hier werden etwa äquimolare Mengen eingesetzt.The oxalic acid diarylamides used in the process according to the invention are partly. known and partly they also represent new compounds. The production takes place according to methods known per se, such as, for. B. are described in US-A-3,529,982. The compounds are obtained by amidating oxalic acid or its esters, in particular alkyl esters, in the first stage on one side with approximately equimolar amounts of the corresponding aniline compound in a manner known per se. A preferred method is, for example, that oxalic acid, oxalic acid half-ester or oxalic acid diester with the same or different ester residues with approximately equimolar amounts of the aniline compound in the melt or in organic solvents which are inert to the reactants in the presence of anhydrous boric acid at temperatures between approximately 50 and 200 ° C. be condensed. After isolation of the amide ester or amide acid thus obtained, the remaining carboxyl group or carboxylate group of the oxalic acid halimide is condensed in the second stage with a second aniline different from the one in the first stage under analogous conditions, one generally being expedient by 50 to 100 ° C higher temperature, which is approximately between 100 and 250 ° C, is selected. Here, too, approximately equimolar amounts are used.
Geeignete inerte organische Lösungsmittel, wie vorstehend erwähnt, sind insbesondere solche mit einem oberhalb etwa 160°C liegenden Siedepunkt, also zum Beispiel höhere Benzolkohlenwasserstoffe oder halogenierte Benzole wie die Di- oder Trichlorbenzole.Suitable inert organic solvents, as mentioned above, are in particular those with a boiling point above about 160 ° C., for example higher benzene hydrocarbons or halogenated benzenes such as di- or trichlorobenzenes.
Die Einführung der zweiten Amidgruppe kann andererseits auch durch halbseitige Verseifung des in der ersten Stufe hergestellten Amid-Esters zur Amid-Säure, Überführung in das Amid-Säurehalogenid und nachfolgende Amidierung der Säurehalogenidgruppe erfolgen.On the other hand, the second amide group can also be introduced by half-saponification of the amide ester prepared in the first stage to give the amide acid, conversion into the amide acid halide and subsequent amidation of the acid halide group.
Die so erhaltenen Oxylsäurediarylamide, die noch freie Hydroxygruppen enthalten, werden anschliessend in bekannter Weise verethert.The oxyacid diarylamides thus obtained, which still contain free hydroxyl groups, are then etherified in a known manner.
Die Kupferkomplexverbindungen der allgemeinen Formeln (2) bis (4) sind z.B. aus den EP-A-0,051,188, EP-A-0,113,856 und EP-A-0,162,811 bekannt und können nach bekannten Verfahren hergestellt werden.The copper complex compounds of the general formulas (2) to (4) are known, for example, from EP-A-0.051.188, EP-A-0.113.856 and EP-A-0.162.811 and can be prepared by known processes.
Das erfindungsgemässe Mittel enthaltend ein Oxalsäurediarylamid der Formel (1) und eine Kupferkomplexverbindung der Formel (2), (3) oder (4) wird erfindungsgemäss aus wässrigem Bad appliziert. Die Menge der zugesetzten Verbindungen hängt vom Substrat und der gewünschten Stabilisierung ab. Im allgemeinen setzt man 0,005 bis 1,0 %, vorzugsweise 0,05 bis 0,5 % der Kupferkomplexverbindung und 0,05 bis 10%, vorzugsweise 0,1 bis 5,0% des Oxalsäurediarylamids, jeweils bezogen auf das Substrat, zu.The agent according to the invention containing an oxalic acid diarylamide of the formula (1) and a copper complex compound of the formula (2), (3) or (4) is applied according to the invention from an aqueous bath. The amount of compounds added depends on the substrate and the desired stabilization. In general, 0.005 to 1.0%, preferably 0.05 to 0.5% of the copper complex compound and 0.05 to 10%, preferably 0.1 to 5.0% of the oxalic acid diarylamide, in each case based on the substrate, are added.
Sind die Kupferkomplexverbindungen wasserunlöslich, werden sie zweckmässig als fein verteilte Dispersionen eingesetzt, die durch Mahlen in Gegenwart üblicher Dispergiermittel erhalten werden.If the copper complex compounds are water-insoluble, they are expediently used as finely divided dispersions which are obtained by grinding in the presence of customary dispersants.
Die Applikation des erfindungsgemässen Mittels kann vor oder nach dem Färben oder vorzugsweise während des Färbens, nach einem Ausziehverfahren bei Flottenverhältnissen von 1:5 bis 1:500, vorzugsweise 1:10 bis 1:50 erfolgen. Zweckmässigerweise werden die Verbindungen dem Färbebad zugesetzt.The agent according to the invention can be applied before or after dyeing or preferably during dyeing, using an exhaust process at liquor ratios of 1: 5 to 1: 500, preferably 1:10 to 1:50. The compounds are expediently added to the dyebath.
Das erfindungsgemässe Mittel kann aber auch kontinuierlich, z.B. mittels Foulard, Niedrigauftragssystemen oder Heissapplikationssystemen appliziert werden.However, the agent according to the invention can also be used continuously, e.g. can be applied using a padder, low application systems or hot application systems.
Beim Kontinue-Verfahren beträgt der Flottenauftrag zweckmässig 30-400 Gew.-%, vorzugsweise 75-250 Gew.-%. Zur Fixierung der applizierten Farbstoffe und des erfindungsgemässen Mittels wird das Fasermaterial einer Hitzebehandlung unterworfen. Der Fixierprozess kann auch nach der Kaltverweilmethode erfolgen.In the continuous process, the liquor application is expediently 30-400% by weight, preferably 75-250% by weight. To fix the applied dyes and the agent according to the invention, the fiber material is subjected to a heat treatment. The fixation process can also be carried out using the cold dwell method.
Die Hitzebehandlung erfolgt vorzugsweise durch ein Dämpfverfahren unter Behandlung in einem Dämpfer mit gegebenenfalls überhitztem Dampf bei einer Temperatur von 98 bis 105°C während z.B. 1 bis 7, vorzugsweise 1 bis 5 Minuten. Die Fixierung der Farbstoffe, des Oxalsäurediarylamids und der Kupferkomplexverbindung gemäss dem Kaltverweilverfahren kann durch Lagerung der imprägnierten und vorzugsweise aufgerollten Ware bei Raumtemperatur (15 bis 30°C), z.B. während 3 bis 24 Stunden erfolgen, wobei die Kaltverweilzeit bekanntlich von der Art des applizierten Farbstoffes abhängig ist.The heat treatment is preferably carried out by a steaming process with treatment in a steamer with possibly superheated steam at a temperature of 98 to 105 ° C during e.g. 1 to 7, preferably 1 to 5 minutes. The fixation of the dyes, the oxalic acid diarylamide and the copper complex compound according to the cold residence process can be carried out by storing the impregnated and preferably rolled-up goods at room temperature (15 to 30 ° C), e.g. take place for 3 to 24 hours, the cold residence time being known to depend on the type of dye applied.
Nach Beendigung des Färbeprozesses bzw. der Fixierung werden die hergestellten Färbungen auf übliche Weise gespült und getrocknet.After the dyeing process or fixation has ended, the dyeings produced are rinsed and dried in the customary manner.
Das erfindungsgemässe Mittel enthaltend ein Oxalsäurediarylamid und eine Kupferkomplexverbindung findet Verwendung zur photochemischen und thermischen Stabilisierung von Polyamidfasermaterialien und deren Färbungen. In ihrer Anwendung zeichnet es sich durch eine hohe Lichtstabilität und eine gute Faseraffinität aus und verleiht den mit diesen Verbindungen behandelten Fasermaterialien eine verbesserte photochemische Stabilität.The agent according to the invention containing an oxalic acid diarylamide and a copper complex compound is used for the photochemical and thermal stabilization of polyamide fiber materials and their dyeings. In their application, it is characterized by high light stability and good fiber affinity and gives the fiber materials treated with these compounds improved photochemical stability.
Unter Polyamidfasermaterial wird dabei synthetisches Polyamid, wie z.B. Polyamid 6, Polyamid 66 oder auch Polyamid 12 verstanden. Neben den reinen Polyamidfasern kommen vor allem Fasermischungen, z.B. von Polyamid 6/Polyester oder aus Polyurethan und Polyamid in Betracht, so z.B. Trikotmaterial aus Polyamid/Polyurethan im Mischungsverhältnis 70:30. Ebenso kommen Fasermischungen aus Polypropylen und Polyamid in Frage. Grundsätzlich kann das reine oder gemischte Polyamidmaterial in verschiedenen Verarbeitungsformen vorliegen, wie z.B. als Faser, Garn, Gewebe, Gewirke oder Teppiche.Synthetic polyamide, such as e.g. Polyamide 6, polyamide 66 or polyamide 12 understood. In addition to the pure polyamide fibers, there are mainly fiber mixtures, e.g. of polyamide 6 / polyester or of polyurethane and polyamide, e.g. Jersey material made of polyamide / polyurethane in a mixing ratio of 70:30. Fiber blends made of polypropylene and polyamide are also suitable. In principle, the pure or mixed polyamide material can be in various processing forms, e.g. as fiber, yarn, fabric, knitted fabric or carpet.
Vor allem Polyamidmaterial, auch in Mischungen mit Polyurethan oder Polypropylen, das Licht und Hitze ausgesetzt ist und z.B. als Autopolsterstoff, Teppich oder Badebekleidungsstoff vorliegt, eignet sich besonders für die Anwendung der erfindungsgemässen Mittel.Mainly polyamide material, also in mixtures with polyurethane or polypropylene, which is exposed to light and heat and e.g. Present as a car upholstery fabric, carpet or swimwear fabric is particularly suitable for the use of the agents according to the invention.
Die Färbung erfolgt in üblicher Weise, z.B. mit Metallkomplex-, Anthrachinon- oder Azofarbstoffen und Mischungen dieser Farbstoffe. Als Metallkomplexfarbstoffe werden die bekannten Typen, insbesondere die 1:2-Chrom- oder 1:2-Kobaltkomplexe von Mono- oder Disazo- oder Azomethinfarbstoffen eingesetzt, die in der Literatur in grosser Zahl beschrieben sind. Neben diesen kommen natürlich auch Farbstoffe aus anderen Farbstoffklassen in Frage, wie z.B. Dispersions- oder auch Reaktivfarbstoffe.The coloring is carried out in the usual way, e.g. with metal complex, anthraquinone or azo dyes and mixtures of these dyes. The known types, in particular the 1: 2 chromium or 1: 2 cobalt complexes of mono- or disazo or azomethine dyes, which are described in large numbers in the literature, are used as metal complex dyes. In addition to these, dyes from other dye classes are of course also possible, such as Disperse or reactive dyes.
Die folgenden Beispiele dienen der Veranschaulichung der Erfindung. Teile bedeuten Gewichtsteile und Prozent Gewichtsprozente. Die Prozentangaben betreffend die Zusätze der einzelnen Färbe- bzw. Behandlungsbäder beziehen sich, wenn nicht anders angegeben, auf das Fasermaterial.The following examples serve to illustrate the invention. Parts mean parts by weight and percentages by weight. Unless stated otherwise, the percentages relating to the additions of the individual dyeing or treatment baths relate to the fiber material.
In einer Suspension aus 4,9 g (14,3 mmol) 2-Ethoxy-2′-hydroxy-oxalsäurebis-anilid-Natriumsalz, hergestellt durch Kristallisation von 2-Ethoxy-2′-hydroxy-bis-anilid in Natronlauge, und 200 ml Aceton wird eine Lösung aus 1,75 g (14,3 mmol) 1,3-Propansulton und 50 ml Aceton gegeben. Nach einer Stunde Erwärmen unter Rückfluss und Abkühlen wird der entstandene Niederschlag abgesaugt und getrocknet. Man erhält 5,45 g der Verbindung der Formel
welche aus Ethanol/Wasser (8:2) zu einer farblosen Substanz umkristallisiert wird.
Ausbeute 86%; Fp 236 -238°C.
Elementaranalyse für C₁₉H₂₁N₂O₇SNa ·0,25 H₂O:
- Gefunden:
- 50,91% C; 4,83% H; 6,30% N; 7,08% S
- Berechnet:
- 50,87% C; 4,75% H; 6,24% N; 7,14%
which is recrystallized from ethanol / water (8: 2) to a colorless substance.
Yield 86%; F p 236 -238 ° C.
Elemental analysis for C₁₉H₂₁N₂O₇SNa0.25 H₂O:
- Found:
- 50.91% C; 4.83% H; 6.30% N; 7.08% S
- Calculated:
- 50.87% C; 4.75% H; 6.24% N; 7.14%
Zu einer Schmelze aus 9,48 g (40 mmol) 2-Ethoxy-oxalsäureanilidmonoethylester und 5,44 g Imidazol werden bei 100°C 8,02 g (38 mmol) 2-Ethylsulfanilsäure-Natriumsalz zugegeben. Es wird ½ Stunde auf 110°C, anschliessend 2 Stunden auf 130°C erhitzt. Nach Abkühlen wird die Reaktionsmasse in 200 ml Wasser eingetragen. Der Niederschlag wird abgesaugt, mit 50 ml Eiswasser gewaschen und getrocknet. Man erhält 6,95 g der Verbindung der Formel
Ausbeute 44%; Fp > 300°C
Elementaranalyse für C₁₈H₁₉N₂O₆SNa ·0,25 H₂O:
- Gefunden:
- 51,6% C; 4,7% H; 6,8% N; 7,5% S
- Berechnet:
- 51,60% C; 4,69% H; 6,68% N; 7,65% S
Yield 44%; F p > 300 ° C
Elemental analysis for C₁₈H₁₉N₂O₆SNa0.25 H₂O:
- Found:
- 51.6% C; 4.7% H; 6.8% N; 7.5% S
- Calculated:
- 51.60% C; 4.69% H; 6.68% N; 7.65% S
Analog zu Beispiel 2 werden zu einer Schmelze aus 40 mmol substituiertem Oxalsäureanilidmonoalkylester und 80 bis 200 mmol Imidazol bei 100°C 38 mmol gegebenenfalls substituierter Sulfanil- bzw. Metanilsäure zugegenen. Es wird ½ Stunde auf 100°C, anschliesssend 1 bis 3 Stunden auf 130°C erhitzt. Die Vollständigkeit des Umsatzes wird mittels Dünnschichtchromatographie überprüft. Nach Abkühlen wird die Reaktionsmasse in ca. 200 ml Wasser eingetragen. Der Niederschlag wird abgesaugt, mit Wasser gewaschen und getrocknet. Im Falle der Verbindungen (103) und (104) wird anstelle des Wassers Aceton, im Falle der Verbindungen (105), (106) und (113) Ethanol zur Aufarbeitung verwendet. Die Ausbeuten sind Tabelle I zu entnehmen.Analogously to Example 2, 38 mmol of optionally substituted sulfanilic or metanilic acid are added to a melt of 40 mmol of substituted oxalic acid anilide monoalkyl ester and 80 to 200 mmol of imidazole at 100 ° C. The mixture is heated to 100 ° C. for ½ hour, then to 130 ° C. for 1 to 3 hours. The completeness of the turnover is checked by means of thin layer chromatography. After cooling, the reaction mass is introduced into about 200 ml of water. The precipitate is filtered off, washed with water and dried. In the case of the compounds (103) and (104), acetone is used instead of the water, in the case of the compounds (105), (106) and (113) ethanol is used for the workup. The yields are shown in Table I.
Zu einer Lösung aus 4,51 g (14,25 mmol) 2,5-Dimethoxy-4′-hydroxy-oxalsäure-bis-anilid und 100 ml Dimethylformamid werden 4,2 g (21,4 mmol) 30%ige methanolische Lösung von Natriummethylat sowie 4,42 g (21,4 mmol) 3-chlor-2-hydroxypropansulfonsäure-Natriumsalz gegeben. Nach 15-stündigem Rühren bei 150°C wird der entstandene Niederschlag (NaCl) abfiltriert und das Filtrat bei 75°C,/0,13 Pa eingedampft. Der Rückstand wird in Wasser aufgenommen. Nach Zugabe von Natriumchlorid wird ein Rohprodukt ausgefällt, welches abgesaugt und aus Dimethylformamid/Ethanol umkristallisiert wird. Es werden 3,8 g eines weissen Pulvers erhalten.To a solution of 4.51 g (14.25 mmol) of 2,5-dimethoxy-4'-hydroxy-oxalic acid bis-anilide and 100 ml of dimethylformamide are 4.2 g (21.4 mmol) of 30% methanolic solution of sodium methylate and 4.42 g (21.4 mmol) of 3-chloro-2-hydroxypropanesulfonic acid sodium salt. After stirring for 15 hours at 150 ° C., the precipitate formed (NaCl) is filtered off and the filtrate is evaporated at 75 ° C./0.13 Pa. The residue is taken up in water. After adding sodium chloride, a crude product is precipitated, which is filtered off with suction and recrystallized from dimethylformamide / ethanol. 3.8 g of a white powder are obtained.
Die Verbindungen werden analog Verbindung (115) durch Umsetzung von 2-Ethoxy-2′-hydroxy-oxalsäure-bis-anilid hergestellt.The compounds are prepared analogously to compound (115) by reacting 2-ethoxy-2'-hydroxy-oxalic acid bis-anilide.
Die Verbindungen werden analog Beispiel 1 hergestellt.The compounds are prepared analogously to Example 1.
5,07 g (20 mmol) 2,5-Dimethoxy-oxalsäureanilid-monomethylester und 2g (18 mmol) 4-Aminophenol werden in Gegenwart katalytischer Mengen Bortrifluorid unter leichtem Vakuum auf 150°C erwärmt und entstehender Alkohol abdestilliert. Nach 5,5 Stunden wird abgekühlt und die Reaktionsmasse mit 40 ml Ethanol versetzt. Durch Kristallisation bei -5°C werden 3,4 g Rohprodukt erhalten, welches durch Waschen mit heissem Trichlorethylen gereinigt wird.
Fp. 204-205°C
Elementaranalyse für C₁₆H₁₆N₂O₅:
- Gefunden:
- 60,58% C; 5,19% H; 8,88% N;
- Berechnet:
- 60,75% C; 5,1% H; 8,86% N;
Mp 204-205 ° C
Elemental analysis for C₁₆H₁₆N₂O₅:
- Found:
- 60.58% C; 5.19% H; 8.88% N;
- Calculated:
- 60.75% C; 5.1% H; 8.86% N;
8,3 g (41,5 mmol) 4-Hydroxy-oxalsäureanilid-monoethylester und 6,85 g (50 mmol) 2-Methoxy-5-methylanilin werden unter leichtem Vakuum auf 130°C erwärmt und entstehender Alkohol abdestilliert. Nach 7 Stunden wird abgekühlt und die Reaktionsmasse mit 100 ml Aceton verrührt. Unlösliches Nebenprodukt wird abfiltriert und das Filtrat in 130 ml Wasser gegeben, wobei das Produkt ausfällt.
Ausbeute 6,27 g
Fp. 189-190°C
Elementaranalyse für C₁₆H₁₆N₂O₄:
- Gefunden:
- 64,0% C; 5,4% H; 9,4% N;
- Berechnet:
- 63,99% C; 5,3% H; 9,32% N;
Yield 6.27 g
Mp 189-190 ° C
Elemental analysis for C₁₆H₁₆N₂O₄:
- Found:
- 64.0% C; 5.4% H; 9.4% N;
- Calculated:
- 63.99% C; 5.3% H; 9.32% N;
In einem ®AHIBA-Färbeapparat werden bei einem Flottenverhältnis von 1:25 2 Muster von je 10 g einer PA 6-Maschenware gefärbt. Alle Färbebäder enthalten jeweils folgende Zusätze: 0,5 g/l Mono-Na-phosphat, 1,5 g/l Di-Na-phosphat sowie die Farbstoffe der Formeln (I) und (II. Alle Zusätze werden vor Zugabe gelöst. Der pH-Wert der Färbeflotte beträgt 7,5.
Während die Flotte 1 keine weiteren Zusätze enthält, wird der Flotte 2 noch 1 % der Verbindung der Formel (101), in Wasser gelöst, zugesetzt. Die Flotte 3 enthält neben 1 % der Verbindung der Formel (101) noch 0,25% einer 20%igen Mahlung (mit einem 20%igen Anteil eines Kondensationsproduktes aus Naphthalinsulfonsäure und Formaldehyd als Dispergator) des Kupferkomplexes der Formel (129)
While fleet 1 contains no further additives, fleet 2 still contains 1% of the compound of the formula (101), dissolved in water, added. In addition to 1% of the compound of the formula (101), the liquor 3 also contains 0.25% of a 20% grinding (with a 20% proportion of a condensation product of naphthalenesulfonic acid and formaldehyde as a dispersant) of the copper complex of the formula (129)
Die so vorbereiteten Flotten erwärmt man auf 40°C, geht mit dem Textilmaterial ein, behandelt bei dieser Temperatur 10 Minuten und erwärmt mit 2°C/Minute auf 95°C. Nach einer Färbezeit von 20 Minuten bei 95°C werden 2% Essigsäure (80%ig) zugesetzt und 25 Minuten weitergefärbt. Danach kühlt man auf 60°C ab, spült mit kaltem Wasser, zentrifugiert und trocknet bei 120°C während 2 Minuten.The liquors prepared in this way are heated to 40 ° C., treated with the textile material, treated at this temperature for 10 minutes and heated at 2 ° C./minute to 95 ° C. After a dyeing time of 20 minutes at 95 ° C, 2% acetic acid (80%) are added and dyeing is continued for 25 minutes. Then it is cooled to 60 ° C., rinsed with cold water, centrifuged and dried at 120 ° C. for 2 minutes.
Die Färbungen werden auf ihre Lichtechtheiten nach SN-ISO 105-B02 (=XENON) und DIN 75.202 (FAKRA) geprüft. Zur Ermittlung der photochemischen Stabilität werden die gefärbten Muster von 12x4,5 cm auf Karton aufgezogen und während 216 Stunden (= 3 FAKRA-Cyclen) nach DIN 75.202 belichtet, sodann nach SN 198.461 auf Reissfestigkeit geprüft. Die Ergebnisse sind in Tabelle 2 aufgeführt.
Das Ergebnis zeigt einerseits die stabilisierende Wirkung der Verbindung der Formel (101), aber auch den Zugewinn an Stabilität durch die Verbindung der Formel (129).The dyeings are tested for lightfastness according to SN-ISO 105-B02 (= XENON) and DIN 75.202 (FAKRA). To determine the photochemical stability, the colored samples of 12x4.5 cm are mounted on cardboard and exposed for 216 hours (= 3 FAKRA cycles) in accordance with DIN 75.202, then tested for tear resistance in accordance with SN 198.461. The results are shown in Table 2.
The result shows on the one hand the stabilizing effect of the compound of the formula (101), but also the gain in stability by the compound of the formula (129).
Wie in Beispiel 29 beschrieben, werden 2 Färbungen angefertigt. Es werden dieselben Farbstoffe eingesetzt, die Zusätze jedoch verändert. Die Flotte 1 enthält 0,25% der 20%igen Mahlung der Verbindung der Formel (129), die Flotte 2 dagegen neben 0,25% Substanz der Formel (129) noch 1% der Verbindung der Formel (102).As described in Example 29, 2 stains are made. The same dyes are used, but the additives are changed. The liquor 1 contains 0.25% of the 20% grinding of the compound of the formula (129), while the liquor 2 , in addition to 0.25% substance of the formula (129), still contains 1% of the compound of the formula (102).
Die Bestimmung der Lichtechtheiten und Reissfestigkeit erfolgt ebenfalls wie in Beispiel 1 angegeben mit folgenden Ergebnissen (Tabelle 3):
Auch hier ist ersichtlich, dass der Stabilisierungseffekt der Verbindung der Formel (102) durch die Verbindung der Formel (129) verbessert wird.The light fastness and tear resistance are also determined as indicated in Example 1 with the following results (Table 3):
It can also be seen here that the stabilizing effect of the compound of the formula (102) is improved by the compound of the formula (129).
Man bereitet 3 Stück PA 6 - Maschenware und stellt 3 Flotten wie in Beispiel 29 beschrieben, jedoch ohne den Zusatz von Farbstoff her ("Blindfärbung"). Die Flotten 1 bis 3 enthalten ebenfalls 0,25% einer 20%igen Mahlung der Verbindung der Formel (129). Die Flotten 2 und 3 enthalten zusätzlich noch die Verbindungen der Formel
und
In diesen Flotten wird das textile Material 216 Stunden nach FAKRA belichtet und nach SN 198 481 auf Reissfestigkeit und Dehnung geprüft. Folgende Resultate werden erhalten (Tablette 4):
and
In these fleets, the textile material is exposed for 216 hours according to FAKRA and tested for tensile strength and elongation according to SN 198 481. The following results are obtained (tablet 4):
Man bereitet 4 Muster eines PA 66 - Trikots und stellt eine Flotte wie in Beispiel 29 beschrieben her, mit dem Unterschied, dass Flotte 1 keine weiteren Zusätze enthält und die Flotten 2 bis 4 jedoch noch 1 % der Verbindungen der Formel
enthalten.4 samples of a PA 66 jersey are prepared and a liquor is produced as described in Example 29, with the difference that liquor 1 contains no further additives and liquors 2 to 4, however, still contain 1% of the compounds of the formula
contain.
Die fertig hergestellten Färbungen werden wie in Beispiel 29 beschrieben, auf ihre Lichtechtheit sowie Reissfestigkeit und Dehnung nach dem Belichten geprüft. Die Ergebnisse sind in Tabelle 5 zusammengefasst:
Aus den Ergebnissen der Tabelle ist ersichtlich, dass die Verbindungen (106), (113) und (114) den Stabilitätseffekt des Kupferkomplexes auf hohem Niveau noch deutlich verbessern können.The finished dyeings are tested as described in Example 29 for their light fastness and tear strength and elongation after exposure. The results are summarized in Table 5:
The results of the table show that compounds (106), (113) and (114) can significantly improve the stability effect of the copper complex at a high level.
Claims (14)
R₁ und R₂, unabhängig voneinander, Wasserstoff, unsubstituiertes oder durch Halogen, Hydroxy, C₁-C₅Alkoxy, Carboxylgruppen, Carbamylgruppen oder C₁-C₁₂Alkoxycarbonylgruppen substituiertes C₁-C₁₈Alkyloxy, C₃-C₄Alkenyloxy,unsubstituiertes oder durch Halogen oder C₁-C₅Alkyl substituiertes Benzyloxy, aliphatisches bis zu 18 Kohlenstoffatome enthaltendes Acyloxy, unsubstituiertes oder durch Halogen oder C₁-C₄Alkyl substituiertes Benzoyloxy oder einen Rest der Formel -A-SO₃M bedeuten,
A die direkte Bindung oder einen zweiwertigen Rest der Formel -O-Q- bedeutet,
Q unsubstituiertes oder durch Hydroxy substituiertes C₁-C₆Alkylen,
M Wasserstoff oder Alkalimetall
R₃ und R₄, unabhängig voneinander Wasserstoff, Halogen, C₁-C₁₂Alkyl, Halogenalkyl, Phenyl oder Phenyl-C₁-C₅Alkyl bedeutet oder jeweils zwei orthoständige Reste R₃ und/oder R₄ zusammen einen ankondensierten sechsgliedrigen aromatischen Kohlenstoffring bilden und
m und n gleich 1 oder 2 und
p und q gleich 1,2 oder 3 sind und
wobei in der Verbindung der Formel (1) mindestens eine Sulfogruppe vorhanden ist,
und eine Kupferkomplexverbindung der Formel
R′Wasserstoff oder C₁-C₅Alkyl,
R₅, R₆, R₇ und R₈ je Wasserstoff, Halogen, Hydroxy, Hydroxyalkyl, C₁-C₅Alkyl, C₁-C₅Alkoxy, Alkoxyalkoxy, Alkoxyalkoxyalkoxy, Carboxymethoxy, Alkylamino, Dialkylamino, -SO₂NH₂, -SO₂NHR, Sulfo oder -SO₂N(R)₂ bedeuten, wobei
R C₁-C₅Alkyl oder C₁-C₅Alkoxyalkyl ist oder
R₅ und R₆ oder R₆ und R₇ oder R₇ und R₈ zusammen mit den C-Atomen, an die sie gebunden sind, einen Benzolrest bilden,
X₁ und Y₁ je Wasserstoff, C₁-C₅Alkyl oder einen aromatischen Rest bedeuten oder
X₁ und Y₁ zusammen mit den C-Atomen, an die sie gebunden sind, einen cycloaliphatischen Rest mit 5-7 C-Atomen bilden,
oder einen Kupferkomplex der Formel
R₉ und R₁₀ unabhängig voneinander Wasserstoff oder einen unsubstituierten oder substituierten C₁-C₅Alkyl- oder Arylrest bedeuten,
oder einen Kupferkomplex von Phenolen der Formel
R₁₁ Wasserstoff, Hydroxy, Alkyl oder Cycloalkyl bedeutet und der Ring A gegebenenfalls weiter substituiert sein kann, behandelt.Process for the photochemical and thermal stabilization of polyamide fiber material, characterized in that the fibers with a composition containing an oxalic acid diarylamide of the general formula
R₁ and R₂, independently of one another, are hydrogen, unsubstituted or substituted by halogen, hydroxy, C₁-C₅alkoxy, carboxyl groups, carbamyl groups or C₁-C₁₂alkoxycarbonyl groups, C₁-C₁₈alkyloxy, C₃-C₄alkenyloxy, unsubstituted or substituted by halogen or C₁-C₅alkoxyalkyl 18 carbon atoms containing acyloxy, unsubstituted or substituted by halogen or C₁-C₄alkyl benzoyloxy or a radical of the formula -A-SO₃M,
A denotes the direct bond or a divalent radical of the formula -OQ-,
Q is C₁-C₆alkylene which is unsubstituted or substituted by hydroxy,
M is hydrogen or alkali metal
R₃ and R₄, independently of one another, represent hydrogen, halogen, C₁-C₁₂alkyl, haloalkyl, phenyl or phenyl-C₁-C₅alkyl, or two ortho radicals R₃ and / or R₄ together form a fused-on six-membered aromatic carbon ring and
m and n are 1 or 2 and
p and q are equal to 1, 2 or 3 and
wherein at least one sulfo group is present in the compound of the formula (1),
and a copper complex compound of the formula
R'hydrogen or C₁-C₅alkyl,
R₅, R₆, R₇ and R₈ each represent hydrogen, halogen, hydroxy, hydroxyalkyl, C₁-C₅alkyl, C₁-C₅alkoxy, alkoxyalkoxy, alkoxyalkoxyalkoxy, carboxymethoxy, alkylamino, dialkylamino, -SO₂NH₂, -SO₂NHR, sulfo or -SO₂N (R) ₂, in which
R is C₁-C₅alkyl or C₁-C₅alkoxyalkyl or
R₅ and R₆ or R₆ and R₇ or R₇ and R₈ together with the carbon atoms to which they are attached form a benzene radical,
X₁ and Y₁ each represent hydrogen, C₁-C₅alkyl or an aromatic radical or
X₁ and Y₁ together with the carbon atoms to which they are attached form a cycloaliphatic radical with 5-7 carbon atoms,
or a copper complex of the formula
R₉ and R₁₀ independently of one another are hydrogen or an unsubstituted or substituted C₁-C₅alkyl or aryl radical,
or a copper complex of phenols of the formula
R₁₁ is hydrogen, hydroxy, alkyl or cycloalkyl and the ring A may optionally be further treated.
R₁₂ unsubstituiertes oder durch Hydroxy oder Alkoxy substituiertes C₁-C₅Alkyloxy, unsubstituiertes oder durch C₁-C₅Alkyl substituiertes Benzyloxy oder einen Rest der Formel -A-SO₃M,
R₁₃ und R₁₄ unabhängig voneinander Wasserstoff, Halogen, C₁-C₁₂Alkyl oder Phenyl-C₁-C₅Alkyl,
r 1 oder 0 bedeuten und
A und M die in Anspruch 1 angegebene Bedeutung haben.A method according to claim 1, characterized in that an oxalic acid diarylamide of the general formula
R₁₂ unsubstituted or substituted by hydroxy or alkoxy C₁-C₅alkyloxy, unsubstituted or substituted by C₁-C₅alkyl benzyloxy or a radical of the formula -A-SO₃M,
R₁₃ and R₁₄ independently of one another are hydrogen, halogen, C₁-C₁₂alkyl or phenyl-C₁-C₅alkyl,
r is 1 or 0 and
A and M have the meaning given in claim 1.
Q Ethylen, Trimethylen oder
Q ethylene, trimethylene or
R₁₅ C₁-C₁₂Alkyl bedeutet und
R₁₂, R₁₃, M und r die in Anspruch 2 angegebene Bedeutung haben.Method according to one of claims 1 to 3, characterized in that the oxalic acid diarylamide of the formula
R₁₅ C₁-C₁₂alkyl means and
R₁₂, R₁₃, M and r have the meaning given in claim 2.
R₁₆ Ethyl oder Ethoxy bedeutet.Method according to one of claims 1 to 3, characterized in that the oxalic acid diarylamide of the formula
R₁₆ is ethyl or ethoxy.
R₁₆ die in Anspruch 5 angegebene Bedeutung hat.Method according to one of claims 1, 2 or 4, characterized in that the oxalic acid diarylamide of the formula
R₁₆ has the meaning given in claim 5.
R₁₇ bis R₂₀ unabhängig voneinander je Wasserstoff, Hydroxy, Brom, Methyl, tert. Butyl, Methoxy, Methoxyethoxy, Ethoxyethoxyethoxy oder Diethylamino,
X₂ Wasserstoff, Methyl, Ethyl oder Phenyl und
Y₂ Wasserstoff bedeuten oder
R₁₉ und R₂₀ zusammen einen ankondensierten Benzolrest oder
X₂ und Y₂ zusammen einen Cyclohexylenrest bilden.Method according to one of claims 1 to 6, characterized in that a copper complex of the formula
R₁₇ to R₂₀ are each independently hydrogen, hydroxy, bromine, methyl, tert. Butyl, methoxy, methoxyethoxy, ethoxyethoxyethoxy or diethylamino,
X₂ is hydrogen, methyl, ethyl or phenyl and
Y₂ is hydrogen or
R₁₉ and R₂₀ together form a condensed benzene residue or
X₂ and Y₂ together form a cyclohexylene radical.
R₁₇, R₁₈, R₁₉, R₂₀, X₂ und X₃ Wasserstoff bedeuten.A method according to claim 7, characterized in that one uses a copper complex of formula (9), wherein
R₁₇, R₁₈, R₁₉, R₂₀, X₂ and X₃ are hydrogen.
R₁₈, R₁₉, R₂₀, R₂₁, X₂ und X₃ Wasserstoff bedeuten, verwendet.Process according to one of claims 1 to 8, characterized in that a mixture of an oxalic acid diarylamide of the formula (7) and a copper complex compound of the formula (9), in which
R₁₈, R₁₉, R₂₀, R₂₁, X₂ and X₃ are hydrogen used.
R₁₇, R₁₈, R₁₉, R₂₀, X₂ und X₃ Wasserstoff bedeuten, verwendet.Process according to one of Claims 1 to 8, characterized in that a mixture of an oxalic acid diarylamide of the formula (8) and a copper complex compound of the formula (9), in which
R₁₇, R₁₈, R₁₉, R₂₀, X₂ and X₃ are hydrogen used.
R₁ und R₂, unabhängig voneinander Wasserstoff, unsubstituiertes oder durch Halogen, Hydroxy, C₁-C₅Alkoxy, Carboxylgruppen, Carbamylgruppen oder C₁-C₁₂Alkoxycarbonylgruppen substituiertes C₁-C₁₈Alkyloxy, C₃-C₄Alkenyloxy, unsubstituiertes oder durch Halogen oder C₁-C₅Alkyl substituiertes Benzyloxy, aliphatisches bis zu 18 Kohlenstoffatome enthaltendes Acyloxy, unsubstituiertes oder durch Halogen oder C₁-C₄Alkyl substituiertes Benzoyloxy oder einen Rest der Formel -A-SO₃M bedeuten,
A die direkte Bindung oder einen zweiwertigen Rest der Formel -O-Q-,
Q unsubstituiertes oder durch Hydroxy substituiertes C₁-C₆Alkylen,
M Wasserstoff oder Alkalimetall bedeutet,
R₃ und R₄, unabhängig voneinander Wasserstoff, Halogen, C₁-C₁₂Alkyl, Halogenalkyl, Phenyl oder Phenyl-C₁-C₅Alkyl bedeutet oder jeweils zwei orthoständige Reste R₃ und/oder R₄ zusammen einen ankondensierten sechsgliedrigen aromatischen Kohlenstoffring bilden,
m und n gleich 1 oder 2 und
p und q gleich 1,2 oder 3 sind und
wobei in der Verbindung der Formel (1) mindestens eine Sulfogruppe vorhanden ist,
und eine Kupferkomplexverbindung der Formel
R′ Wasserstoff oder C₁-C₅Alkyl, R₅, R₆, R₇ und R₈ je Wasserstoff, Halogen, Hydroxy, Hydroxyalkyl, C₁-C₅Alkyl, C₁-C₅Alkoxy, Alkoxyalkoxy, Alkoxyalkoxyalkoxy, Carboxymethoxy, Alkylamino, Dialkylamino, -SO₂NH₂, -SO₂NHR, Sulfo oder -SO₂N(R)₂ bedeuten, wobei
R C₁-C₅Alkyl oder C₁-C₅Alkoxyalkyl ist oder
R₅ und R₆ oder R₆ und R₇ oder R₇ und R₈ zusammen mit den C-Atomen, an die sie gebunden sind, einen Benzolrest bilden,
X₁ und Y₁ je Wasserstoff, C₁-C₅Alkyl oder einen aromatischen Rest bedeuten oder
X₁ und Y₁ zusammen mit den C-Atomen, an die sie gebunden sind, einen cycloaliphatischen Rest mit 5-7 C-Atomen bilden,
oder einen Kupferkomplex der Formel
R₉ und R₁₀ unabhängig voneinander Wasserstoff oder einen unsubstituierten oder substituierten C₁-C₅Alkyl- oder Arylrest bedeuten,
oder einen Kupferkomplex von Phenolen der Formel
R₁₁ Wasserstoff, Hydroxy, Alkyl oder Cycloalkyl bedeutet und der Ring A gegebenenfalls weiter substituiert sein kann.Composition containing an oxalic acid diarylamide of the general formula
R₁ and R₂, independently of one another, are hydrogen, unsubstituted or substituted by halogen, hydroxy, C₁-C₅alkoxy, carboxyl groups, carbamyl groups or C₁-C₁₂alkoxycarbonyl groups, C₁-C₁₈alkyloxy, C₃-C₄alkenyloxy, unsubstituted or substituted by halogen or C₁-C₅alkylbisalkyl Acyloxy containing carbon atoms, unsubstituted or substituted by halogen or C₁-C₄alkyl benzoyloxy or a radical of the formula -A-SO₃M,
A is the direct bond or a divalent radical of the formula -OQ-,
Q is C₁-C₆alkylene which is unsubstituted or substituted by hydroxy,
M represents hydrogen or alkali metal,
R₃ and R₄, independently of one another, are hydrogen, halogen, C₁-C₁₂alkyl, haloalkyl, phenyl or phenyl-C₁-C₅alkyl or two ortho radicals R₃ and / or R₄ together form a fused-on six-membered aromatic carbon ring,
m and n are 1 or 2 and
p and q are equal to 1, 2 or 3 and
wherein at least one sulfo group is present in the compound of the formula (1),
and a copper complex compound of the formula
R ′ is hydrogen or C₁-C₅alkyl, R₅, R₆, R₇ and R₈ are each hydrogen, halogen, hydroxy, hydroxyalkyl, C₁-C₅alkyl, C₁-C₅alkoxy, alkoxyalkoxy, alkoxyalkoxyalkoxy, carboxymethoxy, alkylamino, dialkylamino, -SO₂NH₂, -SO₂NHR, sulfo -SO₂N (R) ₂ mean, wherein
R is C₁-C₅alkyl or C₁-C₅alkoxyalkyl or
R₅ and R₆ or R₆ and R₇ or R₇ and R₈ together with the carbon atoms to which they are attached form a benzene radical,
X₁ and Y₁ each represent hydrogen, C₁-C₅alkyl or an aromatic radical or
X₁ and Y₁ together with the carbon atoms to which they are attached form a cycloaliphatic radical with 5-7 carbon atoms,
or a copper complex of the formula
R₉ and R₁₀ independently of one another are hydrogen or an unsubstituted or substituted C₁-C₅alkyl or aryl radical,
or a copper complex of phenols of the formula
R₁₁ is hydrogen, hydroxy, alkyl or cycloalkyl and the ring A may optionally be further substituted.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CH1252/91 | 1991-04-26 | ||
| CH125291 | 1991-04-26 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| EP0511166A1 true EP0511166A1 (en) | 1992-10-28 |
Family
ID=4206047
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| EP92810286A Withdrawn EP0511166A1 (en) | 1991-04-26 | 1992-04-16 | Process for photochemical and thermic stabilization of polyamide fibre material with a fiberaffinitive copper complex and an oxalicacid diarylamide |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US5338319A (en) |
| EP (1) | EP0511166A1 (en) |
| JP (1) | JPH05186969A (en) |
| KR (1) | KR920020009A (en) |
| BR (1) | BR9201524A (en) |
| CA (1) | CA2067059A1 (en) |
| MX (1) | MX9201869A (en) |
Families Citing this family (35)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5865471A (en) | 1993-08-05 | 1999-02-02 | Kimberly-Clark Worldwide, Inc. | Photo-erasable data processing forms |
| US6017471A (en) | 1993-08-05 | 2000-01-25 | Kimberly-Clark Worldwide, Inc. | Colorants and colorant modifiers |
| US5721287A (en) | 1993-08-05 | 1998-02-24 | Kimberly-Clark Worldwide, Inc. | Method of mutating a colorant by irradiation |
| US5773182A (en) | 1993-08-05 | 1998-06-30 | Kimberly-Clark Worldwide, Inc. | Method of light stabilizing a colorant |
| US6211383B1 (en) | 1993-08-05 | 2001-04-03 | Kimberly-Clark Worldwide, Inc. | Nohr-McDonald elimination reaction |
| US5733693A (en) | 1993-08-05 | 1998-03-31 | Kimberly-Clark Worldwide, Inc. | Method for improving the readability of data processing forms |
| US5645964A (en) | 1993-08-05 | 1997-07-08 | Kimberly-Clark Corporation | Digital information recording media and method of using same |
| US5700850A (en) | 1993-08-05 | 1997-12-23 | Kimberly-Clark Worldwide | Colorant compositions and colorant stabilizers |
| US5681380A (en) | 1995-06-05 | 1997-10-28 | Kimberly-Clark Worldwide, Inc. | Ink for ink jet printers |
| US6017661A (en) | 1994-11-09 | 2000-01-25 | Kimberly-Clark Corporation | Temporary marking using photoerasable colorants |
| US5685754A (en) | 1994-06-30 | 1997-11-11 | Kimberly-Clark Corporation | Method of generating a reactive species and polymer coating applications therefor |
| US6071979A (en) | 1994-06-30 | 2000-06-06 | Kimberly-Clark Worldwide, Inc. | Photoreactor composition method of generating a reactive species and applications therefor |
| US6242057B1 (en) | 1994-06-30 | 2001-06-05 | Kimberly-Clark Worldwide, Inc. | Photoreactor composition and applications therefor |
| US6008268A (en) | 1994-10-21 | 1999-12-28 | Kimberly-Clark Worldwide, Inc. | Photoreactor composition, method of generating a reactive species, and applications therefor |
| ES2148776T3 (en) | 1995-06-05 | 2000-10-16 | Kimberly Clark Co | PRE-DYES AND COMPOUNDS THAT CONTAIN THEM. |
| US5786132A (en) | 1995-06-05 | 1998-07-28 | Kimberly-Clark Corporation | Pre-dyes, mutable dye compositions, and methods of developing a color |
| ATE206150T1 (en) | 1995-06-28 | 2001-10-15 | Kimberly Clark Co | DYE-STABILIZED COMPOSITIONS |
| US6099628A (en) | 1996-03-29 | 2000-08-08 | Kimberly-Clark Worldwide, Inc. | Colorant stabilizers |
| US5855655A (en) | 1996-03-29 | 1999-01-05 | Kimberly-Clark Worldwide, Inc. | Colorant stabilizers |
| US5782963A (en) | 1996-03-29 | 1998-07-21 | Kimberly-Clark Worldwide, Inc. | Colorant stabilizers |
| SK102397A3 (en) | 1995-11-28 | 1998-02-04 | Kimberly Clark Co | Colorant stabilizers |
| US5891229A (en) | 1996-03-29 | 1999-04-06 | Kimberly-Clark Worldwide, Inc. | Colorant stabilizers |
| US6524379B2 (en) | 1997-08-15 | 2003-02-25 | Kimberly-Clark Worldwide, Inc. | Colorants, colorant stabilizers, ink compositions, and improved methods of making the same |
| US5969014A (en) * | 1997-09-23 | 1999-10-19 | Clariant Finance (Bvi) Limited | Synergistic polyamide stabilization method |
| BR9906513A (en) | 1998-06-03 | 2001-10-30 | Kimberly Clark Co | New photoinitiators and applications for the same |
| BR9906580A (en) | 1998-06-03 | 2000-09-26 | Kimberly Clark Co | Neonanoplast and microemulsion technology for inks and inkjet printing |
| US6228157B1 (en) | 1998-07-20 | 2001-05-08 | Ronald S. Nohr | Ink jet ink compositions |
| EP1117698B1 (en) | 1998-09-28 | 2006-04-19 | Kimberly-Clark Worldwide, Inc. | Chelates comprising chinoid groups as photoinitiators |
| ES2195869T3 (en) | 1999-01-19 | 2003-12-16 | Kimberly Clark Co | NEW COLORS, COLOR STABILIZERS, INK COMPOUNDS AND IMPROVED METHODS FOR MANUFACTURING. |
| US6331056B1 (en) | 1999-02-25 | 2001-12-18 | Kimberly-Clark Worldwide, Inc. | Printing apparatus and applications therefor |
| US6294698B1 (en) | 1999-04-16 | 2001-09-25 | Kimberly-Clark Worldwide, Inc. | Photoinitiators and applications therefor |
| US6368395B1 (en) | 1999-05-24 | 2002-04-09 | Kimberly-Clark Worldwide, Inc. | Subphthalocyanine colorants, ink compositions, and method of making the same |
| GB0219260D0 (en) * | 2002-08-19 | 2002-09-25 | Clariant Gmbh | Improvements in or relating to organic compounds |
| US8522585B1 (en) | 2006-05-23 | 2013-09-03 | Pmx Industries Inc. | Methods of maintaining and using a high concentration of dissolved copper on the surface of a useful article |
| CN101215782B (en) * | 2008-01-08 | 2010-06-09 | 上海大学 | Light ageing resisting finishing method for aromatic polyamide fabric |
Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4003875A (en) * | 1966-02-07 | 1977-01-18 | Ciba-Geigy Corporation | Asymmetrical oxalic acid diaryl amide stabilizers |
| EP0113856A1 (en) * | 1982-12-20 | 1984-07-25 | Bayer Ag | Process for improving the fastness to light of polyamide dyeings |
| EP0162811A1 (en) * | 1984-05-22 | 1985-11-27 | Ciba-Geigy Ag | Process for the photochemical stabilisation of materials containing polyamide fibres |
| EP0200843A1 (en) * | 1985-05-09 | 1986-11-12 | Ciba-Geigy Ag | Process for the photochemical stabilisation of undyed and dyed polyamide fibrous material and its mixtures |
| US4902299A (en) * | 1989-02-28 | 1990-02-20 | E. I. Du Pont De Nemours And Company | Nylon fabrics with cupric salt and oxanilide for improved dye-lightfastness |
| FR2643395A1 (en) * | 1989-02-22 | 1990-08-24 | Sandoz Sa | NOVEL METHOD FOR DYING POLYAMIDE FIBERS |
Family Cites Families (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CH501699A (en) * | 1965-12-08 | 1971-02-26 | Ciba Geigy Ag | Use of symmetrical oxalic acid diarylamides as ultraviolet protection agents for organic materials outside the textile industry |
| DE1618196B1 (en) * | 1966-02-07 | 1971-12-09 | Ciba Geigy | Use of asymmetric oxalic acid diarylamides as ultraviolet protection agents |
| DE3565136D1 (en) * | 1984-12-21 | 1988-10-27 | Ciba Geigy Ag | Process for the photochemical stabilisation of synthetic fibrous materials containing polyamide fibres |
-
1992
- 1992-04-16 EP EP92810286A patent/EP0511166A1/en not_active Withdrawn
- 1992-04-20 US US07/870,650 patent/US5338319A/en not_active Expired - Fee Related
- 1992-04-23 MX MX9201869A patent/MX9201869A/en unknown
- 1992-04-24 BR BR929201524A patent/BR9201524A/en not_active Application Discontinuation
- 1992-04-24 JP JP4105104A patent/JPH05186969A/en not_active Withdrawn
- 1992-04-24 CA CA002067059A patent/CA2067059A1/en not_active Abandoned
- 1992-04-24 KR KR1019920006924A patent/KR920020009A/en not_active Application Discontinuation
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4003875A (en) * | 1966-02-07 | 1977-01-18 | Ciba-Geigy Corporation | Asymmetrical oxalic acid diaryl amide stabilizers |
| EP0113856A1 (en) * | 1982-12-20 | 1984-07-25 | Bayer Ag | Process for improving the fastness to light of polyamide dyeings |
| EP0162811A1 (en) * | 1984-05-22 | 1985-11-27 | Ciba-Geigy Ag | Process for the photochemical stabilisation of materials containing polyamide fibres |
| EP0200843A1 (en) * | 1985-05-09 | 1986-11-12 | Ciba-Geigy Ag | Process for the photochemical stabilisation of undyed and dyed polyamide fibrous material and its mixtures |
| FR2643395A1 (en) * | 1989-02-22 | 1990-08-24 | Sandoz Sa | NOVEL METHOD FOR DYING POLYAMIDE FIBERS |
| US4902299A (en) * | 1989-02-28 | 1990-02-20 | E. I. Du Pont De Nemours And Company | Nylon fabrics with cupric salt and oxanilide for improved dye-lightfastness |
Also Published As
| Publication number | Publication date |
|---|---|
| KR920020009A (en) | 1992-11-20 |
| BR9201524A (en) | 1992-12-01 |
| CA2067059A1 (en) | 1992-10-27 |
| US5338319A (en) | 1994-08-16 |
| JPH05186969A (en) | 1993-07-27 |
| MX9201869A (en) | 1992-10-01 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP0511166A1 (en) | Process for photochemical and thermic stabilization of polyamide fibre material with a fiberaffinitive copper complex and an oxalicacid diarylamide | |
| EP0200843B1 (en) | Process for the photochemical stabilisation of undyed and dyed polyamide fibrous material and its mixtures | |
| EP0466647B1 (en) | Process for the photochemical and thermal stabilisation of polyamide fiber materials | |
| EP0459950B1 (en) | Stabilisation of dyes on polyamide fibres | |
| EP0345212A1 (en) | Process to prevent yellowing of polyamide fibres finished with stain-proofing agents | |
| EP0280654B1 (en) | Process for improving the photochemical stability of dyeings on fibrous polyester materials | |
| EP0162811A1 (en) | Process for the photochemical stabilisation of materials containing polyamide fibres | |
| DE4410539A1 (en) | Use of 4 H-3,1-benzoxazin-4-one compounds to improve the light fastness of textile materials | |
| DE2721084A1 (en) | MIXTURES OF OPTICAL BRIGHTENERS | |
| EP0038296B1 (en) | Bisazo compounds | |
| EP0507732B1 (en) | Asymmetric oxalic acid diarylamides | |
| EP0546993A1 (en) | Water soluble triazine derivatives for the photochemical and thermal stabilisation of polyamide fiber materials | |
| EP0742270A2 (en) | Mixtures of phthalocyanine reactive dyes | |
| EP0252009B1 (en) | 1,4-distyryl benzene compounds and their mixtures with other 1,4-distyryl benzene compounds | |
| EP0502820B1 (en) | New semicarbazides and their use for the stabilization of polyamide fibres and their colours | |
| DE2237289C3 (en) | Use of 5,8-disubstituted 1-nitrobenzoylaminoanthraquinone compounds as water-insoluble, non-viable anthraquinone dyes for dyeing cellulose fibers and synthetic fibers, in particular water-swellable cellulose fibers | |
| EP0621266A1 (en) | Sterically hindered phenols and their use for the stabilisation of polyamide fibres | |
| EP0618205A1 (en) | Water soluble triazine derivatives for the photochemical and thermal stabilisation of polyamide fiber materials | |
| EP0474594B1 (en) | Process for dyeing of wool and mixtures thereof with other fibres with reactive dyestuffs | |
| EP0026414B1 (en) | Water soluble monoazo compounds, their preparation and their use as dyestuffs in dyeing and printing textile materials, as well as the amines per se | |
| EP0360735A1 (en) | Process for trichromic dyeing or printing | |
| EP0703227A1 (en) | Watersoluble antioxidants, process of their preparation, and their use for the photochemical and thermical stabilisation of polyamide fibers | |
| DE1670908A1 (en) | Novel benzimidazole compounds, processes for their preparation and their use as optical brightening agents | |
| EP0702011B1 (en) | Water soluble piperidine-triazine compounds for use as stabilizers for polyamide fibers | |
| DE1644088A1 (en) | Process for the production of new azo dyes |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PUAI | Public reference made under article 153(3) epc to a published international application that has entered the european phase |
Free format text: ORIGINAL CODE: 0009012 |
|
| AK | Designated contracting states |
Kind code of ref document: A1 Designated state(s): AT BE CH DE DK ES FR GB GR IT LI LU NL PT SE |
|
| 17P | Request for examination filed |
Effective date: 19930126 |
|
| 17Q | First examination report despatched |
Effective date: 19940428 |
|
| STAA | Information on the status of an ep patent application or granted ep patent |
Free format text: STATUS: THE APPLICATION IS DEEMED TO BE WITHDRAWN |
|
| 18D | Application deemed to be withdrawn |
Effective date: 19940909 |