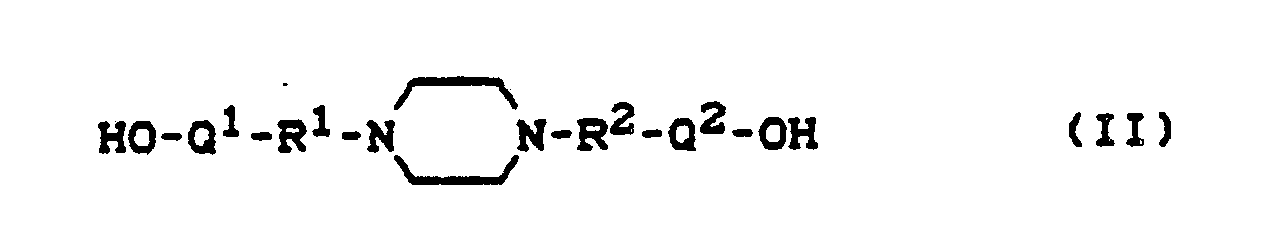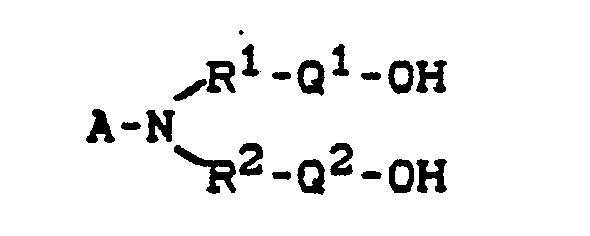EP0342439A2 - Process for the aftertreatment of dyed textile materials - Google Patents
Process for the aftertreatment of dyed textile materials Download PDFInfo
- Publication number
- EP0342439A2 EP0342439A2 EP89108065A EP89108065A EP0342439A2 EP 0342439 A2 EP0342439 A2 EP 0342439A2 EP 89108065 A EP89108065 A EP 89108065A EP 89108065 A EP89108065 A EP 89108065A EP 0342439 A2 EP0342439 A2 EP 0342439A2
- Authority
- EP
- European Patent Office
- Prior art keywords
- parts
- groups
- polyurethanes
- aftertreatment
- bis
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
Classifications
-
- D—TEXTILES; PAPER
- D06—TREATMENT OF TEXTILES OR THE LIKE; LAUNDERING; FLEXIBLE MATERIALS NOT OTHERWISE PROVIDED FOR
- D06P—DYEING OR PRINTING TEXTILES; DYEING LEATHER, FURS OR SOLID MACROMOLECULAR SUBSTANCES IN ANY FORM
- D06P1/00—General processes of dyeing or printing textiles, or general processes of dyeing leather, furs, or solid macromolecular substances in any form, classified according to the dyes, pigments, or auxiliary substances employed
- D06P1/44—General processes of dyeing or printing textiles, or general processes of dyeing leather, furs, or solid macromolecular substances in any form, classified according to the dyes, pigments, or auxiliary substances employed using insoluble pigments or auxiliary substances, e.g. binders
- D06P1/52—General processes of dyeing or printing textiles, or general processes of dyeing leather, furs, or solid macromolecular substances in any form, classified according to the dyes, pigments, or auxiliary substances employed using insoluble pigments or auxiliary substances, e.g. binders using compositions containing synthetic macromolecular substances
- D06P1/5264—Macromolecular compounds obtained otherwise than by reactions involving only unsaturated carbon-to-carbon bonds
- D06P1/5285—Polyurethanes; Polyurea; Polyguanides
-
- D—TEXTILES; PAPER
- D06—TREATMENT OF TEXTILES OR THE LIKE; LAUNDERING; FLEXIBLE MATERIALS NOT OTHERWISE PROVIDED FOR
- D06P—DYEING OR PRINTING TEXTILES; DYEING LEATHER, FURS OR SOLID MACROMOLECULAR SUBSTANCES IN ANY FORM
- D06P5/00—Other features in dyeing or printing textiles, or dyeing leather, furs, or solid macromolecular substances in any form
- D06P5/02—After-treatment
- D06P5/04—After-treatment with organic compounds
- D06P5/08—After-treatment with organic compounds macromolecular
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10S—TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10S8/00—Bleaching and dyeing; fluid treatment and chemical modification of textiles and fibers
- Y10S8/916—Natural fiber dyeing
- Y10S8/917—Wool or silk
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10S—TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10S8/00—Bleaching and dyeing; fluid treatment and chemical modification of textiles and fibers
- Y10S8/92—Synthetic fiber dyeing
- Y10S8/924—Polyamide fiber
Definitions
- the invention relates to a process for the aftertreatment of textile materials dyed with anionic dyes from natural and synthetic polyamides with polyurethanes containing quaternary ammonium groups.
- Printed or dyed textile materials made from natural or synthetic polyamides often have insufficient fastness to washing, especially at higher temperatures, since the bound dye is partially dissolved during washing.
- Japanese patent application 64-212 412 describes the use of dispersed or dissolved tertiary ammonium groups and blocked isocyanate groups-containing polyurethanes for the treatment of fiber materials.
- the polyurethanes are soluble or dispersible in water.
- Suitable compounds A) are in particular hydroxyalkylamines of the general formula in the Q1 and Q2 independently of one another are a radical of the general formula - [(O-CH2- ) n - (O-CH2-CH2) m ] r
- a C1-C18-alkyl, C5-C8-cycloalkyl, C7-C9-aralkyl or a radical of the formula or HO-Q1-R1- R1, R2 and R4 independently of one another are C2-C6-alkylene, C5-C8-cycloalkylene or C7-C9-aralkylene
- R3 is hydrogen or methyl
- n and r represent the numbers 0 to 30, and bis (hydroxyalkyl) piperazines of the general formula where the
- Examples of compounds of the general formula (I) are N-methyl-diethanolamine, N-methyl-bis- (2-hydroxypropyl) -amine, N-ethyl-diethanolamine, N-butyldiethanolamine, N-butyl-bis- (2-hydroxypropyl) ) amine, N-octadecyldiethanolamine, N-butyl-bis- (2-hydroxylbutyl) -amine, N-butyl-bis- (3-hydroxy-2-butyl) -amine, N, N-bis- (2-hydroxyethyl ) -cyclohexylamine, N, N-bis- (2-hydroxypropyl) -cyclohexylamine, N-benzyl-diethanolamine, N-benzyl-bis- (2-hydroxypropyl) -amine, N, N-bis- (hydroxyethyl) - and N , N-bis (2'-hydroxypropyl) -1-amino-3-dimethyl
- Examples of the compounds of the general formula (II) are N, N'-bis (2-hydroxyethyl) piperazine, N, N'-bis (2-hydroxypropyl) piperazine, N, N'-bis (2 -hydroxybutyl- ⁇ ) -piperazine and their reaction products with ethylene oxide and / or propylene oxide.
- the compounds (I) can also be reacted with the polyisocyanates in a mixture with other compounds D) known in polyurethane chemistry and having at least two zerewitinoffactive hydrogen atoms.
- these mixing components D) are known, inter alia, from DE-A-28 32 253, pages 11 to 20. They have molecular weights between about 60 to 10,000. In addition to compounds containing amino, thiol and / or carboxyl groups, this is preferably taken to mean hydroxyl groups, in particular compounds having 2 to 8 hydroxyl groups and having molecular weights between 800 and 6000. For example, 2 to 4 hydroxyl groups are polyesters , Polyethers, polythioethers, polyacetals, polycarbonates and polyesteramides, as are known per se for the production of homogeneous or cellular polyurethanes.
- polyethers which are obtained by adding one or more alkylene oxides (ethylene oxide and especially propylene oxide) to divalent or polyvalent "starters” (for example propylene glycol, glycerol, sorbitol, formose or trimethylolpropane), and polyethers which are polyadducts made from diisocyanates Hydrazine and / or diamines and / or glycols or polymers and / or graft polymers, preferably made of styrene and acrylonitrile, in dispersed or dissolved form.
- polyesters including polycarbonates, as are usually used as a soft segment.
- the preferred compounds of this type have melting points below 60, preferably below 45 ° C. Compounds containing hydroxyl groups with a functionality of 2 are preferred.
- this is preferably understood to mean compounds with molecular weights between 60 and 400 which have at least two hydroxyl groups and / or amino groups and / or thiol groups and / or carboxyl groups and / or hydrazide groups and are known as chain extenders or crosslinking agents. These compounds generally have 2 to 8, preferably 2 to 4, hydrogen atoms which are reactive toward isocyanates.
- Examples include ethylene glycol, 1,4-butanediol, 2,2-dimethylpropanediol, trimethylolpropane, hydrazine, ethylenediamine, 3,3'-dimethyl-4,4'-diaminodicyclohexylmethane, 3,5-diethyl-2,4 (and / or 2,6) -diaminotoluene or adipic acid dihydrazide or their mixtures.
- Chain terminators E) can also be used in the reaction of A) with B).
- all monofunctional, preferably relatively low molecular weight (molecular weight up to 400) compounds with an NCO-reactive group e.g. Monoalcohols such as methanol, n-octanol, isopropanol, isooctyl alcohol or stearyl alcohol; primary or secondary monoamines such as ethylamine, di-n-butylamine, di-isopropylamine, stearylamine, 4-amino-2,2,6,6-tetramethylpiperidine, acethydrazide, stearyl hydrazide, aniline or thiol compounds such as octyl mercaptan.
- Monoalcohols such as methanol, n-octanol, isopropanol, isooctyl alcohol or stearyl alcohol
- primary or secondary monoamines such as ethylamine, di-n-butylamine, di-isopropylamine,
- Monofunctional compounds containing tertiary amino groups are particularly preferred.
- Examples include 1-amino-2-diethylaminoethane, 1-amino-3-dimethylaminopropane, 1-amino-3-diethylaminopropane, 4-amino-1-diethylaminopentane, furthermore 2- (dimethylamino) -ethanol, 2-diethylaminoethanol, 2- Dibutylaminoethanol, N-methyl-N- (2-dimethylaminoethyl) ethanolamine, N-methyl-N- (3-dimethylaminopropyl) ethanolamine, N-methyl-N- (2-dimethylaminoethoxyethyl) ethanolamine, N- (2-hydroxyethyl ) -2-aza-bicyclo (2,2,1) -heptane, N, N-bis- (3-dimethylaminopropyl) -N- (2-hydroxyethyl) -amine and their reaction
- Suitable starting components B) are aliphatic, cycloaliphatic, araliphatic and aromatic polyisocyanates as described, for example, by W. Siefken in Justus Liebigs Annalen der Chemie, 562, pages 75 to 136. Aliphatic diisocyanates are preferred.
- isocyanatomethane, -ethane, -propane, -butane, -pentane, -hexane, 6-chlorohexyl isocyanate, stearyl isocyanate or benzyl isocyanate and mixtures of these isocyanates are suitable.
- the starting components A) and B) and, if appropriate, starting components D) and E) which are also used are generally known, in accordance with one-stage or multi-stage processes, while maintaining an equivalent ratio from isocyanate groups to isocyanate-reactive groups from 0.8: 1 to 1: 1 at temperatures from 20 to 150 ° C., preferably 50 to 100 ° C., in the absence or in the presence of inert solvents such as benzene, chlorobenzene, toluene, acetone, Methyl ethyl ketone, ethyl acetate, tetrahydrofuran, dioxane, dimethylformamide, dimethyl sulfoxide or N-methyl-pyrrolidone reacted.
- inert solvents such as benzene, chlorobenzene, toluene, acetone, Methyl ethyl ketone, ethyl acetate, tetrahydrofuran, dio
- Aids and additives of a conventional type e.g. Water, catalysts, surface-active additives, reaction retarders, plasticizers or fungistatic or bacteriostatic substances, stabilizers and light stabilizers can also be used.
- quaternizing agents preferably those which introduce an optionally substituted C1-C4-alkyl radical or a C7-C9-aralkyl radical into the molecule, at temperatures from 30 ° to 120 ° C, preferably 40 ° to 80 ° C, optionally with the use of solvents such as alcohols, ketones or ethers, for example Methanol, ethanol, isopropanol, acetone, acetonitrile, tetrahydrofuran.
- solvents such as alcohols, ketones or ethers, for example Methanol, ethanol, isopropanol, acetone, acetonitrile, tetrahydrofuran.
- quaternizing agents are methyl chloride, methyl bromide, dimethyl sulfate, diethyl sulfate, benzyl chloride, ethylene chlorohydrin, p-toluenesulfonic acid ester, chloroacetic ester and epichlorohydrin.
- Tertiary nitrogen atoms can also be converted into a cationic charge state which enables solubility or dispersion in water by protonation.
- these include, for example, inorganic acids such as chlorine, bromine and hydrogen iodide, perchloric, perbromo, sulfuric and phosphoric acids as well as organic acids such as formic, acetic, mono-, di- and trichloroacetic, propionic, lactic , Methanesulfonic, benzenesulfonic or toluenesulfonic acid into consideration.
- the proportions are chosen so that 0.5 to 10 equivalents, preferably 0.7 to 1.0 equivalents, of the quaternizing agent are used per tertiary amino group.
- the tertiary amino groups not converted into quaternary ammonium groups are then preferably neutralized by adding one of the above-mentioned inorganic or organic acids.
- the textile materials used for the aftertreatment can be wool, silk and synthetic polyamides such as polymers of ⁇ -caprolactam and polymers of dicarboxylic acid and diamines, for example of adipic acid and hexamethylene diamine.
- the textile materials can be in the form of flake, sliver, yarn or piece goods.
- the aftertreatment method is preferred of dyed wool applied. This can be unchlorinated or chlorinated wool or finished with a synthetic resin pretreatment. Particularly good effects are obtained in the aftertreatment of dyeings on chlorinated wool or wool which has been made felt-free by a synthetic resin pretreatment.
- the chlorination of the wool can be carried out continuously or discontinuously with hypochlorous acid or with chloroisocyanurate using the customary method.
- the felt-free finish can be done by various known methods, e.g. according to the HERCOSETT process. These processes, also known as superwashing equipment, are chlorination processes and processes in which the fiber is coated with a resin, e.g. a polyurethane, polyacrylic, melamine / polyalkyleneimine / epichlorohydrin or polyamide / epichlorohydrin resin is treated.
- a resin e.g. a polyurethane, polyacrylic, melamine / polyalkyleneimine / epichlorohydrin or polyamide / epichlorohydrin resin is treated.
- the polyurethanes suitable according to the invention are preferably added to the aftertreatment baths in the form of aqueous solutions, the amounts of the polyurethanes being able to vary within wide limits.
- the aftertreatment of the textile material is expediently carried out in such a way that the dyed material, preferably wool which has already been treated free of felt, is introduced into an aqueous liquor which contains the condensation products suitable according to the invention and has a pH of between 6 and 10.
- the liquor is added by adding alkaline compounds e.g. Ammonia or soda, adjusted to pH 8-10.
- the temperature of the treatment bath is raised to 50 ° to 80 ° C. in the course of 20 to 30 minutes and left for 5 to 30 minutes.
- the material is then rinsed with cold water, acidified with acetic acid, dewatered and dried.
- the aftertreatment can be carried out by the exhaust process or else continuously or semi-continuously by padding or spraying with subsequent exposure to heat.
- the effect of the polyurethanes with quaternary ammonium groups suitable according to the invention can be increased from case to case by the use of nonionic, cationic or amphoteric, surface-active substances.
- nonionic, cationic or amphoteric, surface-active substances are, for example, ethylene and / or propylene oxide adducts of fatty amines can be quaternized and / or sulfated. They are known to the person skilled in the art as a leveling agent for wool dyes.
- the amount of such products used is 50 to 100%, preferably 70 to 80%, of the amount of the condensation products according to the invention.
- the fastness properties of the dyed textile materials in particular the wet fastness properties, such as the sweat fastness according to IWS-TM 174 (test method for alkaline sweat fastness) and the wash fastness according to IWS-TM 193 (test method for fastness to washing) are significantly improved with the aid of the method according to the invention, without the rubbing rights being adversely affected.
- Suitable dyes are the dyes usually used for dyeing fibers containing polyamide groups, e.g. Acid dyes, metal complex dyes, which can contain water-solubilizing groups such as sulfonic acid or carboxylic acid groups or also sulfonamide or alkylsulfone residues, and reactive dyes. They are described in more detail in the Color Index. Dyes of this type, which otherwise have good fastness properties, result in few true colors on keratin-containing materials that have been treated with felt-free materials, particularly in the case of deep shades.
- reaction mixture was diluted with 100 parts of acetone and 50 parts of dimethyl sulfate were added dropwise at 40 to 45 ° C. The mixture was then stirred at 40 to 45 ° C for 30 minutes and at 50 to 60 ° C for 2 hours.
- reaction mixture 261 parts were at 40 to 45 ° C. mixed with 66 parts of dimethyl sulfate. The mixture was then diluted with 150 parts of water and stirred at 40 to 45 ° C. for 2 hours. After distilling off the acetone in a water jet vacuum, the residue was dissolved in 225 parts of 1-methoxy-propanol-2 and 213 parts of water.
- reaction mixture 208 parts were diluted with 100 parts of acetone and 50 parts of dimethyl sulfate were added at 40 to 50 ° C. After 30 minutes, 200 parts of water were added and the mixture was stirred at 50 to 60 ° C. for 2 hours.
- reaction mixture 224 parts were diluted with 100 parts of acetone and 49 parts of dimethyl sulfate were added at 40 to 50 ° C. After stirring for 30 minutes at 40 to 50 ° C., the mixture was diluted with 200 ml of water and stirred at 50 to 60 ° C. for a further 2 hours.
- Yarns made of wool which have been equipped with Hercosett 57 "Superwash” chlorination and treatment with an adipic acid / diethylenetriamine-epichlorohydrin reaction product
- the dyebath is heated to boiling within 60 minutes and dyed at this temperature for 60 minutes.
- the dyeing is then rinsed and after-treated at 50 ° C. for 30 minutes with a liquor which is in liters 1.6 of the reaction product according to Example 1 and 4.0 g sodium sulfate calc. contains and is adjusted to pH 7.5 to 8.0 with ammonia solution, with no bleeding of the coloration occurring. Then the color is rinsed, acidified with acetic acid, dehydrated and dried.
- the HERCOSETT-finished wool yarns are dyed as described in Example 14 and then treated at 50 ° C. for 30 minutes with a liquor in liters 2.0 g of the reaction product according to Example 8 and 4.0 g sodium sulfate calc. contains and is adjusted to pH 7.5 to 8.0 with ammonia solution, with no bleeding of the coloration occurring. The dyeing is then rinsed, acidified with acetic acid, dehydrated and dried.
- the dye liquor is then heated to boiling within 30 minutes and kept at this temperature for 60 minutes. After rinsing, the dyeing is aftertreated at 50 ° C for 30 minutes with a liquor in liters 2.5 g of the reaction product according to Example 2 and 4.0 g sodium sulfate calc.
- the coloring contains and is adjusted to pH 7.5 to 8.0 with ammonia solution, with no bleeding of the color.
- the dyeing is then rinsed, acidified with acetic acid, dehydrated and dried.
- the coloring has a significantly increased level of authenticity; this happens without deterioration in rubbing fastness.
- the aftertreatment is carried out as described in Example 14.
- the dyeing obtained in this way has very good fastness properties, this is done without deterioration in rub fastness.
- Wool yarn skeins equipped with HERCOSETT 57 are placed at room temperature in a 1:25 liquor ratio in a dye liquor, in liters 1.2 g of the red dye of FR-PS 1 389 345, Example 1 2.0 g sodium sulfate calc. 2.0 g acetic acid (60%) 0.4 g of an auxiliary mixture consisting of 50 parts of the reaction product from 1 mol of N-methyl-stearylamine and 20 mol of EO and 50 parts of the reaction product from 1 mol of N-ethyl-stearylamine and 35 mol of EO contains. Both dyeing and post-treatment are carried out as described in Example 14, but with the difference that the post-treatment is carried out with 1.2 g of the reaction product according to Example 4 carries out.
- Wool comb which was previously chlorinated as usual, is dyed in a liquor ratio of 1:10 as described in Example 14 and after-rinsed in a liquor at 50 ° C. for 5 minutes, which 4.8 g of the reaction product according to Example 12 contains.
- the pH of the treatment bath is then adjusted to approximately 7.5 to 8.0 by adding ammonia solution.
- the coloring is treated at 50 ° C for a further 25 minutes.
- the ridge is then rinsed, acidified with acetic acid, dewatered and dried.
- the aftertreatment is carried out as described in Example 14, but with the difference that the aftertreatment is carried out with 3.2 g of the reaction product according to Example 11 carries out.
- the dyeing obtained in this way has very good fastness properties; this happens without deterioration in rubbing fastness.
- the dye liquor is then heated to boiling within 60 minutes and kept at this temperature for 60 minutes. After rinsing, the dyeing is aftertreated at 50 ° C for 30 minutes with a liquor in liters 3.5 g of the reaction product according to Example 13 contains and is adjusted to pH 7.5 to 8.0 with ammonia solution, with no bleeding of the color.
- the dyeing is then rinsed, acidified with acetic acid, dehydrated and dried.
- the dyeing has a significantly higher level of fastness than that of the non-aftertreated dyeing; this happens without deterioration in rubbing fastness.
Abstract
Gegenstand der Erfindung ist ein Verfahren zur Nachbehandlung von mit anionischen Farbstoffen gefärbten Textilmaterialien aus natürlichen und synthetischen Polyamiden mit quartäre Ammoniumgruppen aufweisenden Polyurethanen.The invention relates to a process for the aftertreatment of textile materials dyed with anionic dyes from natural and synthetic polyamides with quaternary ammonium-containing polyurethanes.
Description
Gegenstand der Erfindung ist ein Verfahren zur Nachbehandlung von mit anionischen Farbstoffen gefärbten Textilmaterialien aus natürlichen und synthetischen Polyamiden mit quartäre Ammoniumgruppen aufweisenden Polyurethanen.The invention relates to a process for the aftertreatment of textile materials dyed with anionic dyes from natural and synthetic polyamides with polyurethanes containing quaternary ammonium groups.
Bedruckte oder gefärbte Textilmaterialien aus natürlichen oder synthetischen Polyamiden weisen oft eine ungenügende Waschechtheit, vor allem bei höherer Temperatur auf, da der gebundene Farbstoff beim Waschen teilweise gelöst wird.Printed or dyed textile materials made from natural or synthetic polyamides often have insufficient fastness to washing, especially at higher temperatures, since the bound dye is partially dissolved during washing.
Die Verwendung von Polyurethanen zur Behebung dieser Nachteile ist bekannt.The use of polyurethanes to overcome these disadvantages is known.
So ist aus der japanischen Patentanmeldung 54-151 689 bekannt, Mischungen von mit Hydrogensulfit blockierte Isocyanatgruppen aufweisenden Urethanharzen mit Harnstoff zur Verbesserung der Farbechtheit gefärbter Gewebe einzusetzen.It is known from Japanese patent application 54-151 689 to use mixtures of urethane resins containing hydrogen sulfite-blocked isocyanate groups with urea to improve the color fastness of dyed fabrics.
Die japanische Patentanmeldung 64-212 412 beschreibt die Verwendung dispergierter oder gelöster tertiäre Ammoniumgruppen und blockierte Isocyanatgruppen ausweisender Polyurethane zur Behandlung von Fasermaterialien.Japanese patent application 64-212 412 describes the use of dispersed or dissolved tertiary ammonium groups and blocked isocyanate groups-containing polyurethanes for the treatment of fiber materials.
Quaternäre Ammoniumgruppen aufweisende Polyurethane sind an sich bekannt (vgl. D. Dieterich in Houben-Weyl, Bd. E 20, Teil 2, S. 1687, Thieme-Verlag, Stuttgart 1987).Polyurethanes containing quaternary ammonium groups are known per se (cf. D. Dieterich in Houben-Weyl, vol. E 20, part 2, p. 1687, Thieme-Verlag, Stuttgart 1987).
Erfindungsgemäß geeignete Polyurethane erhält man vorzugsweise durch Umsetzung von
- A) tertiäre Aminogruppen und mindestens zwei Hydroxylgruppen aufweisenden Verbindungen
mit - B) Polyisocyanaten
und - C) Quaternierungsmitteln.
- A) tertiary amino groups and compounds containing at least two hydroxyl groups
With - B) polyisocyanates
and - C) Quaternizing agents.
Die Polyurethane sind in Wasser löslich oder dispergierbar.The polyurethanes are soluble or dispersible in water.
Geeignete Verbindungen A) sind insbesondere Hydroxyalkylamine der allgemeinen Formel
Q¹ und Q² unabhängig voneinander einen Rest der allgemeinen Formel
-[(O-CH₂-)n-(O-CH₂-CH₂)m]r
A C₁-C₁₈-Alkyl, C₅-C₈-Cycloalkyl, C₇-C₉-Aralkyl oder einen Rest der Formel
R¹, R² und R⁴ unabhängig voneinander C₂-C₆-Alkylen, C₅-C₈-Cycloalkylen oder C₇-C₉-Aralkylen,
R³ Wasserstoff oder Methyl,
R⁵ C₁-C₁₈-Alkyl, C₅-C₈-Cycloalkyl, C₇-C₉-Aralkyl oder einen Rest der Formel
HO-Q¹-R¹-
und
m, n und r die Zahlen 0 bis 30 bedeuten,
und Bis-(hydroxyalkyl)-piperazine der allgemeinen Formel
Q¹ and Q² independently of one another are a radical of the general formula
- [(O-CH₂- ) n - (O-CH₂-CH₂) m ] r
A C₁-C₁₈-alkyl, C₅-C₈-cycloalkyl, C₇-C₉-aralkyl or a radical of the formula
R¹, R² and R⁴ independently of one another are C₂-C₆-alkylene, C₅-C₈-cycloalkylene or C₇-C₉-aralkylene,
R³ is hydrogen or methyl,
R⁵ C₁-C₁₈-alkyl, C₅-C₈-cycloalkyl, C₇-C₉-aralkyl or a radical of the formula
HO-Q¹-R¹-
and
m, n and r represent the numbers 0 to 30,
and bis (hydroxyalkyl) piperazines of the general formula
Beispiele für Verbindungen der allgemeinen Formel (I) sind N-Methyl-diethanolamin, N-Methyl-bis-(2-hydroxypropyl)-amin, N-Ethyl-diethanolamin, N-Butyldiethanolamin, N-Butyl-bis-(2-hydroxypropyl)-amin, N-Octadecyldiethanolamin, N-Butyl-bis-(2-hydroxylbutyl)-amin, N-Butyl-bis-(3-hydroxy-2-butyl)-amin, N,N-Bis-(2-hydroxyethyl)-cyclohexylamin, N,N-Bis-(2-hydroxypropyl)-cyclohexylamin, N-Benzyl-diethanolamin, N-Benzyl-bis-(2-hydroxypropyl)-amin, N,N-Bis-(hydroxyethyl)- und N,N-Bis-(2′-hydroxypropyl)-1-amino-3-dimethylaminopropan, N,N-Bis-(hydroxyethyl)- und N,N-Bis-(2′-hydroxypropyl)-1-amino-3-diethylaminopropan, N,N′-Dimethyl-N,N′-bis-(2-hydroxyethyl)-ethylendiamin, N,N′-Dimethyl-N,N′-bis-(2-hydroxypropyl)-propylendiamin-1,3, N,N′-Dibutyl-N,N′-bis-(2-hydroxyethyl)-hexandiamin-1,6, N,N′-Dicyclohexyl- N,N′-bis-(2-hydroxyethyl)-ethylendiamin, N,N′-Dibenzyl-N,N′-bis-(2-hydroxyethyl)-ethylendiamin, Tris-(2-hydroxyethyl)- und Tris-(2-hydroxypropyl)-amin, N,N,N′,N′-Tetrakis-(2-hydroxyethyl)- und N,N,N′,N′-Tetrakis-(2-hydroxypropyl)-ethylendiamin, -tetramethylendiamin, -hexamethylendiamin und deren Umsetzungsprodukte mit Ethylenoxid und/oder Propylenoxid.Examples of compounds of the general formula (I) are N-methyl-diethanolamine, N-methyl-bis- (2-hydroxypropyl) -amine, N-ethyl-diethanolamine, N-butyldiethanolamine, N-butyl-bis- (2-hydroxypropyl) ) amine, N-octadecyldiethanolamine, N-butyl-bis- (2-hydroxylbutyl) -amine, N-butyl-bis- (3-hydroxy-2-butyl) -amine, N, N-bis- (2-hydroxyethyl ) -cyclohexylamine, N, N-bis- (2-hydroxypropyl) -cyclohexylamine, N-benzyl-diethanolamine, N-benzyl-bis- (2-hydroxypropyl) -amine, N, N-bis- (hydroxyethyl) - and N , N-bis (2'-hydroxypropyl) -1-amino-3-dimethylaminopropane, N, N-bis (hydroxyethyl) - and N, N-bis (2'-hydroxypropyl) -1-amino-3- diethylaminopropane, N, N'-dimethyl-N, N'-bis- (2-hydroxyethyl) -ethylenediamine, N, N'-dimethyl-N, N'-bis- (2-hydroxypropyl) -propylenediamine-1,3, N, N'-dibutyl-N, N'-bis- (2-hydroxyethyl) -hexanediamine-1,6, N, N'-dicyclohexyl- N, N'-bis (2-hydroxyethyl) ethylenediamine, N, N'-dibenzyl-N, N'-bis (2-hydroxyethyl) ethylenediamine, tris- (2-hydroxyethyl) - and tris- (2 -hydroxypropyl) amine, N, N, N ', N'-tetrakis (2-hydroxyethyl) - and N, N, N', N'-tetrakis (2-hydroxypropyl) ethylenediamine, tetramethylene diamine, hexamethylene diamine and their reaction products with ethylene oxide and / or propylene oxide.
Beispiele für die Verbindungen der allgemeinen Formel (II) sind N,N′-Bis-(2-hydroxyethyl)-piperazin, N,N′-Bis-(2-hydroxypropyl)-piperazin, N,N′-Bis-(2-hydroxybutyl-δ)-piperazin und deren Umsetzungsprodukte mit Ethylenoxid und/oder Propylenoxid.Examples of the compounds of the general formula (II) are N, N'-bis (2-hydroxyethyl) piperazine, N, N'-bis (2-hydroxypropyl) piperazine, N, N'-bis (2 -hydroxybutyl-δ) -piperazine and their reaction products with ethylene oxide and / or propylene oxide.
Die Verbindungen (I) können auch in Mischung mit anderen, in der Polyurethanchemie bekannten, mindestens zwei zerewitinoffaktive Wasserstoffatome aufweisenden Verbindungen D) mit den Polyisocyanaten umgesetzt werden.The compounds (I) can also be reacted with the polyisocyanates in a mixture with other compounds D) known in polyurethane chemistry and having at least two zerewitinoffactive hydrogen atoms.
Beispiele dieser Mischkomponenten D) sind u.a. aus der DE-A-28 32 253, Seiten 11 bis 20, bekannt. Sie haben Molekulargewichte zwischen etwa 60 bis 10 000. Vorzugsweise versteht man hierunter neben Amino-, Thiol- und/oder Carboxylgruppen aufweisenden Verbindungen Hydroxylgruppen, insbesondere 2 bis 8 Hydroxylgruppen aufweisende Verbindungen mit Molekulargewichten zwischen 800 und 6000. Beispielsweise sind 2 bis 4 Hydroxylgruppen aufweisende Polyester, Polyether, Polythioether, Polyacetale, Polycarbonate und Polyesteramide, wie sie für die Herstellung von homogenen oder zellförmigen Polyurethanen an sich bekannt sind, zu nennen.Examples of these mixing components D) are known, inter alia, from DE-A-28 32 253, pages 11 to 20. They have molecular weights between about 60 to 10,000. In addition to compounds containing amino, thiol and / or carboxyl groups, this is preferably taken to mean hydroxyl groups, in particular compounds having 2 to 8 hydroxyl groups and having molecular weights between 800 and 6000. For example, 2 to 4 hydroxyl groups are polyesters , Polyethers, polythioethers, polyacetals, polycarbonates and polyesteramides, as are known per se for the production of homogeneous or cellular polyurethanes.
Besonders bevorzugt sind Polyether, die durch Addition von einem oder mehreren Alkylenoxiden (Ethylenoxid und besonders Propylenoxid) an zwei- oder mehrwertige "Starter" (z.B. Propylenglykol, Glycerin, Sorbit, Formose oder Trimethylolpropan) erhalten werden, sowie Polyether, welche Polyadditionsprodukte aus Diisocyanaten aus Hydrazin und/oder Diaminen und/oder Glykolen oder Polymerisate und/oder Pfropfpolymerisate, vorzugsweise aus Styrol und Acrylnitril, dispergiert oder gelöst enthalten. Weiter geeignet sind Polyester, einschließlich Polycarbonaten, wie sie üblicherweise als Weichsegment verwendet werden. Die bevorzugten Verbindungen dieser Art haben Schmelzpunkte unterhalb von 60, vorzugsweise unterhalb von 45°C. Bevorzugt werden Hydroxylgruppen aufweisende Verbindungen mit einer Funktionalität von 2.Particularly preferred are polyethers which are obtained by adding one or more alkylene oxides (ethylene oxide and especially propylene oxide) to divalent or polyvalent "starters" (for example propylene glycol, glycerol, sorbitol, formose or trimethylolpropane), and polyethers which are polyadducts made from diisocyanates Hydrazine and / or diamines and / or glycols or polymers and / or graft polymers, preferably made of styrene and acrylonitrile, in dispersed or dissolved form. Also suitable are polyesters, including polycarbonates, as are usually used as a soft segment. The preferred compounds of this type have melting points below 60, preferably below 45 ° C. Compounds containing hydroxyl groups with a functionality of 2 are preferred.
Ebenso versteht man hierunter vorzugsweise Verbindungen mit Molekulargewichten zwischen 60 und 400, die mindestens zwei Hydroxylgruppen und/oder Aminogruppen und/oder Thiolgruppen und/oder Carboxylgruppen und/oder Hydrazidgruppen aufweisen und als Kettenverlängerungsmittel oder Vernetzungsmittel bekannt sind. Diese Verbindungen weisen in der Regel 2 bis 8, vorzugsweise 2 bis 4, gegenüber Isocyanaten reaktionsfähige Wasserstoffatome auf. Beispielsweise genannt seien Ethylenglykol, Butandiol-1,4, 2,2-Dimethylpropandiol, Trimethylolpropan, Hydrazin, Ethylendiamin, 3,3′-Dimethyl-4,4′-diaminodicyclohexylmethan, 3,5-Diethyl-2,4(und/oder 2,6)-diaminotoluol oder Adipinsäuredihydrazid oder ihre Gemische.Likewise, this is preferably understood to mean compounds with molecular weights between 60 and 400 which have at least two hydroxyl groups and / or amino groups and / or thiol groups and / or carboxyl groups and / or hydrazide groups and are known as chain extenders or crosslinking agents. These compounds generally have 2 to 8, preferably 2 to 4, hydrogen atoms which are reactive toward isocyanates. Examples include ethylene glycol, 1,4-butanediol, 2,2-dimethylpropanediol, trimethylolpropane, hydrazine, ethylenediamine, 3,3'-dimethyl-4,4'-diaminodicyclohexylmethane, 3,5-diethyl-2,4 (and / or 2,6) -diaminotoluene or adipic acid dihydrazide or their mixtures.
Bei der Reaktion von A) mit B) können auch Kettenabbrecher E) eingesetzt werden.Chain terminators E) can also be used in the reaction of A) with B).
In Frage kommen beispielsweise alle monofunktionellen vorzugsweise relativ niedermolekularen (Molekulargewicht bis 400) Verbindungen mit einer gegenüber NCO reaktiven Gruppe z.B. Monoalkohole wie Methanol, n-Octanol, Isopropanol, Isooctylalkohol oder Stearylalkohol; primäre oder sekundäre Monoamine wie Ethylamin, Di-n-butylamin, Di-isopropylamin, Stearylamin, 4-Amino-2,2,6,6-tetramethylpiperidin, Acethydrazid, Stearylhydrazid, Anilin oder Thiolverbindungen wie Octylmercaptan.For example, all monofunctional, preferably relatively low molecular weight (molecular weight up to 400) compounds with an NCO-reactive group, e.g. Monoalcohols such as methanol, n-octanol, isopropanol, isooctyl alcohol or stearyl alcohol; primary or secondary monoamines such as ethylamine, di-n-butylamine, di-isopropylamine, stearylamine, 4-amino-2,2,6,6-tetramethylpiperidine, acethydrazide, stearyl hydrazide, aniline or thiol compounds such as octyl mercaptan.
Besonders bevorzugt sind tertiäre Aminogruppen aufweisende monofunktionelle Verbindungen. Beispiele hierfür sind 1-Amino-2-diethylaminoethan, 1-Amino-3-dimethylaminopropan, 1-Amino-3-diethylaminopropan, 4-Amino-1-diethylaminopentan, ferner 2-(Dimethylamino)-ethanol, 2-Diethylaminoethanol, 2-Dibutylaminoethanol, N-Methyl-N-(2-dimethylaminoethyl)-ethanolamin, N-Methyl-N-(3-dimethylaminopropyl)-ethanolamin, N-Methyl-N-(2-dimethylaminoethoxyethyl)-ethanolamin, N-(2-Hydroxyethyl)-2-aza-bicyclo(2,2,1)-heptan, N,N-Bis-(3-dimethylaminopropyl)-N-(2-hydroxyethyl)-amin sowie deren Umsetzungsprodukte mit Ethylen- und/oder Propylenoxid.Monofunctional compounds containing tertiary amino groups are particularly preferred. Examples include 1-amino-2-diethylaminoethane, 1-amino-3-dimethylaminopropane, 1-amino-3-diethylaminopropane, 4-amino-1-diethylaminopentane, furthermore 2- (dimethylamino) -ethanol, 2-diethylaminoethanol, 2- Dibutylaminoethanol, N-methyl-N- (2-dimethylaminoethyl) ethanolamine, N-methyl-N- (3-dimethylaminopropyl) ethanolamine, N-methyl-N- (2-dimethylaminoethoxyethyl) ethanolamine, N- (2-hydroxyethyl ) -2-aza-bicyclo (2,2,1) -heptane, N, N-bis- (3-dimethylaminopropyl) -N- (2-hydroxyethyl) -amine and their reaction products with ethylene and / or propylene oxide.
Als Ausgangskomponenten B) eignen sich aliphatische, cycloaliphatische, araliphatische und aromatische Polyisocyanate wie sie z.B. von W. Siefken in Justus Liebigs Annalen der Chemie, 562, Seiten 75 bis 136, beschrieben werden. Bevorzugt sind aliphatische Diisocyanate. In Frage kommen beispielsweise Tetramethylendiisocyanat; Hexamethylendiisocyanat; Dekamethylendiisocyanat; 1,3-Di-(3- isocyanatopropoxy)-2,2-dimethylpropan; Cyclohexandiisocyanat-(1,4); Methylcyclohexandiisocyanat-(2,4); Methylcyclohexandiisocyanat-(2,6); 1,3-Diisocyanatocyclohexan, Gemische aus Methylcyclohexandiisocyanat-(2,4) und Methylcyclohexandiisocyanat-(2,6); Dicyclohexylmethan- 4,4′-diisocyanat; 1-Isocyanato-3-isocyanatomethyl-3,5,5- trimethylcyclohexan (Isophorondiisocyanat); 1,2-Di-(isocyanatomethyl)-cyclobutan; m- und p-Xylylendiisocyanat sowie α,α,α′,α′-Tetramethyl-m- und/oder -p-xylylendiisocyanat oder -hexahydroxylylendiisocyanat. Bei cycloaliphatischen Diisocyanaten können beliebige Stereoisomere oder ihre Gemische Verwendung finden. Selbstverständlich können auch Mischungen dieser Isocyanate eingesetzt werden.Suitable starting components B) are aliphatic, cycloaliphatic, araliphatic and aromatic polyisocyanates as described, for example, by W. Siefken in Justus Liebigs Annalen der Chemie, 562, pages 75 to 136. Aliphatic diisocyanates are preferred. In The question comes, for example, tetramethylene diisocyanate; Hexamethylene diisocyanate; Decamethylene diisocyanate; 1,3-di- (3-isocyanatopropoxy) -2,2-dimethylpropane; Cyclohexane diisocyanate (1.4); Methylcyclohexane diisocyanate (2,4); Methylcyclohexane diisocyanate- (2.6); 1,3-diisocyanatocyclohexane, mixtures of methylcyclohexane diisocyanate (2,4) and methylcyclohexane diisocyanate (2,6); Dicyclohexylmethane 4,4'-diisocyanate; 1-isocyanato-3-isocyanatomethyl-3,5,5-trimethylcyclohexane (isophorone diisocyanate); 1,2-di (isocyanatomethyl) cyclobutane; m- and p-xylylene diisocyanate and α, α, α ', α'-tetramethyl-m- and / or -p-xylylene diisocyanate or -hexahydroxylylene diisocyanate. Any stereoisomers or their mixtures can be used in cycloaliphatic diisocyanates. Mixtures of these isocyanates can of course also be used.
Bei Verwendung von drei- und mehr zerewitinoffaktive Wasserstoffatome aufweisenden Ausgangskomponenten kann die Mitverwendung monofunktioneller Isocyanate vorteilhaft bzw. erforderlich sein. In Frage kommen beispielsweise Isocyanatomethan, -ethan, -propan, -butan, -pentan, -hexan, 6-Chlorhexylisocyanat, Stearylisocyanat oder Benzylisocyanat sowie Gemische dieser Isocyanate.When using starting components containing three or more Zerewitinoffactive hydrogen atoms, the concomitant use of monofunctional isocyanates may be advantageous or necessary. For example, isocyanatomethane, -ethane, -propane, -butane, -pentane, -hexane, 6-chlorohexyl isocyanate, stearyl isocyanate or benzyl isocyanate and mixtures of these isocyanates are suitable.
Zur Herstellung der erfindungsgemäß geeigneten Polyurethane werden die Ausgangskomponenten A) und B) sowie gegebenenfalls mitverwendete Ausgangskomponenten D) und E) nach an sich bekannten Ein- oder Mehrstufenverfahren im allgemeinen unter Einhaltung eines Äquivalentverhält nisses von Isocyanatgruppen zu gegenüber Isocyanatgruppen reaktionsfähigen Gruppen von 0,8:1 bis 1:1 bei Temperaturen von 20 bis 150°C, vorzugsweise 50 bis 100°C, in Abwesenheit oder in Gegenwart inerter Lösungsmittel wie Benzol, Chlorbenzol, Toluol, Aceton, Methylethylketon, Essigsäureethylester, Tetrahydrofuran, Dioxan, Dimethylformamid, Dimethylsulfoxid oder N-Methyl-pyrrolidon zur Reaktion gebracht.To produce the polyurethanes suitable according to the invention, the starting components A) and B) and, if appropriate, starting components D) and E) which are also used are generally known, in accordance with one-stage or multi-stage processes, while maintaining an equivalent ratio from isocyanate groups to isocyanate-reactive groups from 0.8: 1 to 1: 1 at temperatures from 20 to 150 ° C., preferably 50 to 100 ° C., in the absence or in the presence of inert solvents such as benzene, chlorobenzene, toluene, acetone, Methyl ethyl ketone, ethyl acetate, tetrahydrofuran, dioxane, dimethylformamide, dimethyl sulfoxide or N-methyl-pyrrolidone reacted.
Dabei können Hilfs- und Zusatzmittel üblicher Art, z.B. Wasser, Katalysatoren, oberflächenaktive Zusatzstoffe, Reaktionsverzögerer, Weichmacher oder fungistatisch oder bakteriostatisch wirkende Substanzen, Stabilisatoren und Lichtschutzmittel mitverwendet werden.Aids and additives of a conventional type, e.g. Water, catalysts, surface-active additives, reaction retarders, plasticizers or fungistatic or bacteriostatic substances, stabilizers and light stabilizers can also be used.
Die anschließende Überführung der tertiären Aminogruppen in quaternäreAmmoniumgruppen erfolgt durch Umsetzung mit Quaternierungsmitteln, vorzugsweise solchen, die einen gegebenenfalls substituierten C₁-C₄-Alkylrest oder einen C₇-C₉-Aralkylrest in das Molekül einführen, bei Temperaturen von 30° bis 120°C, vorzugsweise 40° bis 80°C, gegebenenfalls unter Mitverwendung von Lösemitteln wie Alkoholen, Ketonen oder Ethern, z.B. Methanol, Ethanol, Isopropanol, Aceton, Acetonitril, Tetrahydrofuran. Beispiele für Quaternierungsmittel sind Methylchlorid, Methylbromid, Dimethylsulfat, Diethylsulfat, Benzylchlorid, Ethylenchlorhydrin, p-Toluolsulfonsäureester, Chloressigester und Epichlorhydrin.The subsequent conversion of the tertiary amino groups into quaternary ammonium groups takes place by reaction with quaternizing agents, preferably those which introduce an optionally substituted C₁-C₄-alkyl radical or a C₇-C₉-aralkyl radical into the molecule, at temperatures from 30 ° to 120 ° C, preferably 40 ° to 80 ° C, optionally with the use of solvents such as alcohols, ketones or ethers, for example Methanol, ethanol, isopropanol, acetone, acetonitrile, tetrahydrofuran. Examples of quaternizing agents are methyl chloride, methyl bromide, dimethyl sulfate, diethyl sulfate, benzyl chloride, ethylene chlorohydrin, p-toluenesulfonic acid ester, chloroacetic ester and epichlorohydrin.
Es kann vorteilhaft sein, nur einen Teil der vorhandenen tertiären Stickstoffatome zu quaternieren. Ein Teil der tertiären Stickstoffatome kann auch durch Protonierung in einen die Löslichkeit bzw. die Dispergierung in Wasser ermöglichenden kationischen Ladungszustand überführt werden. Hierzu kommen beispielsweise anorganische Säuren wie Chlor-, Brom- und Iodwasserstoff-, Perchlor-, Perbrom-, Schwefel- und Phosphorsäure sowie auch organische Säuren wie Ameisen-, Essig-, Mono-, Di- und Trichloressig-, Propion-, Milch-, Methansulfon-, Benzolsulfon- oder Toluolsulfonsäure in Betracht.It can be advantageous to quaternize only part of the tertiary nitrogen atoms present. A part of Tertiary nitrogen atoms can also be converted into a cationic charge state which enables solubility or dispersion in water by protonation. These include, for example, inorganic acids such as chlorine, bromine and hydrogen iodide, perchloric, perbromo, sulfuric and phosphoric acids as well as organic acids such as formic, acetic, mono-, di- and trichloroacetic, propionic, lactic , Methanesulfonic, benzenesulfonic or toluenesulfonic acid into consideration.
Die Mengenverhältnisse werden so gewählt, daß pro tertiäre Aminogruppe 0,5 bis 10 Äquivalente, vorzugsweise 0,7 bis 1,0 Äquivalente des Quaternierungsmittels angewendet werden. Die nicht in quaternäre Ammoniumgruppen überführten tertiären Aminogruppen werden vorzugsweise anschließend durch Zusatz einer der obengenannten anorganischen oder organischen Säuren neutralisiert.The proportions are chosen so that 0.5 to 10 equivalents, preferably 0.7 to 1.0 equivalents, of the quaternizing agent are used per tertiary amino group. The tertiary amino groups not converted into quaternary ammonium groups are then preferably neutralized by adding one of the above-mentioned inorganic or organic acids.
Das erfindungsgemäße Verfahren zur Nachbehandlung von Fasermaterialien mit den vorstehend beschriebenen quaternäre Ammoniumgruppen enthaltenden Polyurethanen wird nach an sich bekannten Methoden durchgeführt.The process according to the invention for the aftertreatment of fiber materials with the above-described polyurethanes containing quaternary ammonium groups is carried out according to methods known per se.
Bei den zur Nachbehandlung eingesetzten Textilmaterialien kann es sich um Wolle, Seide und synthetische Polyamide wie Polymere von ε-Caprolactam und Polymere aus Dicarbonsäure und Diaminen, z.B. aus Adipinsäure und Hexamethylendiamin handeln. Die Textilmaterialien können in Form von Flocke, Kammzug, Garn oder Stückware vorliegen. Bevorzugt wird das Verfahren zur Nachbehandlung von gefärbter Wolle angewendet. Dabei kann es sich um unchlorierte oder chlorierte oder durch eine Kunstharzvorbehandlung filzfrei ausgerüstete Wolle handeln. Besonders gute Effekte werden bei der Nachbehandlung von Färbungen auf chlorierter oder durch eine Kunstharzvorbehandlung filzfrei ausgerüsteter Wolle erhalten.The textile materials used for the aftertreatment can be wool, silk and synthetic polyamides such as polymers of ε-caprolactam and polymers of dicarboxylic acid and diamines, for example of adipic acid and hexamethylene diamine. The textile materials can be in the form of flake, sliver, yarn or piece goods. The aftertreatment method is preferred of dyed wool applied. This can be unchlorinated or chlorinated wool or finished with a synthetic resin pretreatment. Particularly good effects are obtained in the aftertreatment of dyeings on chlorinated wool or wool which has been made felt-free by a synthetic resin pretreatment.
Die Chlorierung der Wolle kann nach üblichem Verfahren kontinuierlich oder diskontinuierlich mit unterchloriger Säure oder mit Chlorisocyanurat vorgenommen werden.The chlorination of the wool can be carried out continuously or discontinuously with hypochlorous acid or with chloroisocyanurate using the customary method.
Die Filzfreiausrüstung kann nach verschiedenen bekannten Verfahren erfolgen, z.B. nach dem HERCOSETT-Verfahren. Bei diesen auch als Superwash-Ausrüstung bekannten Verfahren handelt es sich um Chlorierungsverfahren und um Verfahren, bei denen die Faser mit einem Harz, z.B. einem Polyurethan-, Polyacryl-, Melamin/Polyalkylenimin/Epichlorhydrin- oder Polyamid/Epichlorhydrin-Harz behandelt wird.The felt-free finish can be done by various known methods, e.g. according to the HERCOSETT process. These processes, also known as superwashing equipment, are chlorination processes and processes in which the fiber is coated with a resin, e.g. a polyurethane, polyacrylic, melamine / polyalkyleneimine / epichlorohydrin or polyamide / epichlorohydrin resin is treated.
Verfahren dieser Art sind beispielsweise beschrieben bei M. Bahra, Zeitschrift für die gesamte Textilindustrie, 1964, Nr. 6, S. 519-522; G. Meier, Textilpraxis international, 1975, Heft 1, S. 76 bis 79 und Heft 3, S. 304 bis 306; R.R.D. Holt, Journal of the Society of Dyers and Colourists, 1975, Nr. 2, S. 38 bis 44.Methods of this type are described, for example, in M. Bahra, Journal for the Whole Textile Industry, 1964, No. 6, pp. 519-522; G. Meier, Textilpraxis international, 1975, Issue 1, pp. 76 to 79 and Issue 3, pp. 304 to 306; R.R.D. Holt, Journal of the Society of Dyers and Colorists, 1975, No. 2, pp. 38 to 44.
Die erfindungsgemäß geeigneten Polyurethane werden den Nachbehandlungsbädern vorzugsweise in Form wäßriger Lösungen zugesetzt, wobei die Mengen der Polyurethane in weiten Grenzen schwanken können.The polyurethanes suitable according to the invention are preferably added to the aftertreatment baths in the form of aqueous solutions, the amounts of the polyurethanes being able to vary within wide limits.
Im allgemeinen hat sich ein Zusatz von 0,5 bis 6, vorzugsweise 1 bis 4 Gew.-%, bezogen auf das Gewicht der Fasermaterialien, bewährt.In general, an addition of 0.5 to 6, preferably 1 to 4% by weight, based on the weight of the fiber materials, has proven useful.
Die Nachbehandlung des Textilmaterials wird zweckmäßig in der Weise durchgeführt, daß man das gefärbte Material, vorzugsweise bereits filzfrei ausgerüstete Wolle, in eine wäßrige Flotte einbringt, die die erfindungsgemäß geeigneten Kondensationsprodukte enthält und einen pH-Wert zwischen 6 und 10 aufweist. Vorzugsweise wird die Flotte durch Zusatz alkalischer Verbindungen, z.B. Ammoniak oder Soda, auf einen pH-Wert von 8 bis 10 eingestellt.The aftertreatment of the textile material is expediently carried out in such a way that the dyed material, preferably wool which has already been treated free of felt, is introduced into an aqueous liquor which contains the condensation products suitable according to the invention and has a pH of between 6 and 10. Preferably the liquor is added by adding alkaline compounds e.g. Ammonia or soda, adjusted to pH 8-10.
Man steigert die Temperatur des Behandlungsbades im Verlauf von 20 bis 30 Minuten auf 50° bis 80°C und läßt sie während 5 bis 30 Minuten dabei. Anschließend wird das Material mit kaltem Wasser gespült, mit Essigsäure abgesäuert, entwässert und getrocknet.The temperature of the treatment bath is raised to 50 ° to 80 ° C. in the course of 20 to 30 minutes and left for 5 to 30 minutes. The material is then rinsed with cold water, acidified with acetic acid, dewatered and dried.
Die Nachbehandlung kann, wie oben beschrieben, nach dem Ausziehverfahren oder auch kontinuierlich oder halbkontinuierlich durch Foulardieren oder Sprühen mit anschließender Hitzeeinwirkung erfolgen.As described above, the aftertreatment can be carried out by the exhaust process or else continuously or semi-continuously by padding or spraying with subsequent exposure to heat.
Die Wirkung der erfindungsgemäß geeigneten Polyurethane mit quaternären Ammoniumgruppen kann von Fall zu Fall durch Mitverwendung von nichtionischen, kationischen oder amphoteren, grenzflächenaktiven Substanzen erhöht werden. Solche Substanzen sind beispielsweise Ethylen- und/oder Propylenoxid-Addukte von Fettaminen, die quaterniert und/oder sulfatiert sein können. Sie sind dem Fachmann als Egalisiermittel für Wollfarbstoffe bekannt.The effect of the polyurethanes with quaternary ammonium groups suitable according to the invention can be increased from case to case by the use of nonionic, cationic or amphoteric, surface-active substances. Such substances are, for example, ethylene and / or propylene oxide adducts of fatty amines can be quaternized and / or sulfated. They are known to the person skilled in the art as a leveling agent for wool dyes.
Die Einsatzmenge solcher Produkte beträgt 50 bis 100 %, bevorzugt 70 bis 80 %, der Menge der erfindungsgemäßen Kondensationsprodukte.The amount of such products used is 50 to 100%, preferably 70 to 80%, of the amount of the condensation products according to the invention.
Es wurde überraschend gefunden, daß mit Hilfe des erfindungsgemäßen Verfahren die Echtheitseigenschaften der gefärbten Textilmaterialien besonders die Naßechtheiten wie die Schweißechtheit nach IWS-TM 174 (Prüfmethode für alkalische Schweißechtheit) und die Waschechtheit nach IWS-TM 193 (Prüfmethode für Waschechtheit) erheblich verbessert werden, ohne daß die Reibechten negativ beeinträchtigt werden.It was surprisingly found that the fastness properties of the dyed textile materials, in particular the wet fastness properties, such as the sweat fastness according to IWS-TM 174 (test method for alkaline sweat fastness) and the wash fastness according to IWS-TM 193 (test method for fastness to washing) are significantly improved with the aid of the method according to the invention, without the rubbing rights being adversely affected.
Als Farbstoffe kommen die üblicherweise für das Färben von Polyamidgruppen enthaltenden Fasern verwendeten Farbstoffe, z.B. Säurefarbstoffe, Metallkomplexfarbstoffe, die wasserlöslichmachende Gruppen wie Sulfonsäure- oder Carbonsäuregruppen oder auch Sulfonamid- oder Alkylsulfonreste enthalten können, sowie Reaktivfarbstoffe in Frage. Sie sind im Colour Index näher beschrieben. Solche Farbstoffe, die sonst gute Echtheitseigenschaften besitzen, ergeben auf filzfrei ausgerüsteten, keratinhaltigen Materialien - besonders bei tiefen Farbtönen - wenige echte Färbungen.Suitable dyes are the dyes usually used for dyeing fibers containing polyamide groups, e.g. Acid dyes, metal complex dyes, which can contain water-solubilizing groups such as sulfonic acid or carboxylic acid groups or also sulfonamide or alkylsulfone residues, and reactive dyes. They are described in more detail in the Color Index. Dyes of this type, which otherwise have good fastness properties, result in few true colors on keratin-containing materials that have been treated with felt-free materials, particularly in the case of deep shades.
Die in den Beispielen und Herstellungsvorschriften an gegebenen Teile sind, wenn nicht anders vermerkt, Gewichtsteile. Die angegebenen Farbstoffnamen beziehen sich auf die Angaben in Colour Index, 3. Auflage, Band 5 (1971).The in the examples and manufacturing instructions Unless otherwise noted, given parts are parts by weight. The dye names given refer to the information in Color Index, 3rd edition, volume 5 (1971).
93,5 Teile N,N-Bis-(2-hydroxyethyl)-cyclohexylamin wurden in 120 Teilen Aceton gelöst und bei 50 bis 60° C tropfenweise mit 84 Teilen Hexamethylendiisocyanat versetzt und anschließend 10 Stunden bei 50 bis 60° C gerührt. IR-spektroskopisch war kein Isocyanat mehr nachweisbar.93.5 parts of N, N-bis (2-hydroxyethyl) cyclohexylamine were dissolved in 120 parts of acetone and 84 parts of hexamethylene diisocyanate were added dropwise at 50 to 60 ° C. and the mixture was then stirred at 50 to 60 ° C. for 10 hours. No isocyanate was detectable by IR spectroscopy.
Das Reaktionsgemisch wurde mit 100 Teilen Aceton verdünnt und bei 40 bis 45° C tropfenweise mit 50 Teilen Dimethylsulfat versetzt. Anschließend wurde 30 Minuten bei 40 bis 45° C und 2 Stunden bei 50 bis 60° C gerührt.The reaction mixture was diluted with 100 parts of acetone and 50 parts of dimethyl sulfate were added dropwise at 40 to 45 ° C. The mixture was then stirred at 40 to 45 ° C for 30 minutes and at 50 to 60 ° C for 2 hours.
500 Teile Wasser wurden zugetropft und im Wasserstrahlvakuum bie 30 bis 40° C das Aceton abdestilliert.500 parts of water were added dropwise and the acetone was distilled off in a water jet vacuum at 30 to 40 ° C.
Man erhielt eine klare, rotbraune Lösung mit einem Trockengehalt von 43 % und einer Viskosität von 111,6 mPa.s bei 20° C.A clear, red-brown solution with a dry content of 43% and a viscosity of 111.6 mPa.s at 20 ° C. was obtained.
117 Teile N,N-Bis-(2-hydroxyethyl)-benzylamin wurden in 80 Teilen Aceton gelöst und mit 0,5 Teilen Zinn(II)-octoat versetzt. Dann wurden bei 50 bis 60° C tropfenweise 101 Teile Hexamethylendiisocyanat hinzugefügt. Nach fünfstündigem Rühren bei 50 bis 60° C zeigte das IR-Spektrum keine NCO-Bande mehr.117 parts of N, N-bis (2-hydroxyethyl) benzylamine were dissolved in 80 parts of acetone and mixed with 0.5 part of stannous octoate. Then 101 parts of hexamethylene diisocyanate were added dropwise at 50 to 60 ° C. After stirring for five hours at 50 to 60 ° C, the IR spectrum showed no more NCO band.
261 Teile des Reaktionsgemischs wurden bei 40 bis 45° C mit 66 Teilen Dimethylsulfat versetzt. Anschließend wurde mit 150 Teilen Wasser verdünnt und 2 Stunden bei 40 bis 45° C gerührt. Nach dem Abdestillieren des Acetons im Wasserstrahlvakuum wurde der Rückstand mit 225 Teilen 1-Methoxy-propanol-2 und 213 Teilen Wasser gelöst.261 parts of the reaction mixture were at 40 to 45 ° C. mixed with 66 parts of dimethyl sulfate. The mixture was then diluted with 150 parts of water and stirred at 40 to 45 ° C. for 2 hours. After distilling off the acetone in a water jet vacuum, the residue was dissolved in 225 parts of 1-methoxy-propanol-2 and 213 parts of water.
Man erhielt eine klare Lösung mit einem Trockengehalt von 28 %.A clear solution with a dry matter content of 28% was obtained.
47,6 Teile N-Methyldiethanolamin und 0,15 Teile Zinn(II)-octoat wurden in 160 Teilen Aceton gelöst und bei 50 bis 60° C mit 67,2 Teilen Hexamethylendiisocyanat tropfenweise versetzt. Nach fünfstündigem Rühren bei 50 bis 60° C ließen sich IR-spektroskopisch keine Isocyanatgruppen mehr nachweisen. Das Reaktionsgemisch wurde mit 200 Teilen Propandiol-1,2 und 46 Teilen Benzylchlorid versetzt und bei 50 bis 60° C 2 Stunden gerührt. Nach dem Abdestillieren des Acetons im Wasserstrahlvakuum wurde 2 Stunden bei 80 bis 90° C gerührt. Das Reaktionsgemisch wurde mit 150 Teilen Wasser verdünnt. Im Wasserstrahlvakuum wurden ca. 150 Teile Destillat abdestilliert, um eventuelle Reste Benzylchlorid und Aceton zu entfernen.47.6 parts of N-methyldiethanolamine and 0.15 part of stannous octoate were dissolved in 160 parts of acetone and 67.2 parts of hexamethylene diisocyanate were added dropwise at 50 to 60.degree. After stirring for five hours at 50 to 60 ° C, no isocyanate groups could be detected by IR spectroscopy. The reaction mixture was mixed with 200 parts of 1,2-propanediol and 46 parts of benzyl chloride and stirred at 50 to 60 ° C for 2 hours. After distilling off the acetone in a water jet vacuum, the mixture was stirred at 80 to 90 ° C. for 2 hours. The reaction mixture was diluted with 150 parts of water. About 150 parts of distillate were distilled off in a water jet vacuum in order to remove any residues of benzyl chloride and acetone.
Man erhielt 385 Teile eines gelblichen klaren Reaktionsproduktes mit einem Trockengehalt von 57 %.This gave 385 parts of a yellowish clear reaction product with a dry matter content of 57%.
93,5 Teile N,N-Bis-(2-hydroxyethyl)-cyclohexylamin wurden mit 80 Teilen Aceton vermischt und bei 50 bis 60°C mit 87 Teilen eines Gemischs aus 2,4- und 2,6-Diisocyanatotoluol (Gewichtsverhältnis 65:35) tropfenweise versetzt. Anschließend wurde 4 Stunden bei 55 bis 60°C gerührt bis IR-spektroskopisch keine Isocyanatgruppen mehr nachweisbar waren.93.5 parts of N, N-bis (2-hydroxyethyl) cyclohexylamine were mixed with 80 parts of acetone and at 50 to 60 ° C. with 87 parts of a mixture of 2,4- and 2,6-diisocyanatotoluene (weight ratio 65: 35) added dropwise. The mixture was then stirred at 55 to 60 ° C. for 4 hours until isocyanate groups were no longer detectable by IR spectroscopy.
208 Teile des Reaktionsgemischs wurden mit 100 Teilen Aceton verdünnt und bei 40 bis 50°C mit 50 Teilen Dimethylsulfat versetzt. Nach 30 Minuten wurde mit 200 Teilen Wasser versetzt und 2 Stunden bei 50 bis 60°C gerührt.208 parts of the reaction mixture were diluted with 100 parts of acetone and 50 parts of dimethyl sulfate were added at 40 to 50 ° C. After 30 minutes, 200 parts of water were added and the mixture was stirred at 50 to 60 ° C. for 2 hours.
Nach dem Abdestillieren des Acetons im Wasserstrahlvakuum wurde der Rückstand mit 180 Teilen Propandiol-1,2 und 20 Teilen Wasser vermischt.After distilling off the acetone in a water jet vacuum, the residue was mixed with 180 parts of 1,2-propanediol and 20 parts of water.
Man erhielt eine klare Lösung mit einem Trockengehalt von 47 % und einer Viskosität von 698 mPa.s bei 20°C.A clear solution with a dry content of 47% and a viscosity of 698 mPa.s at 20 ° C. was obtained.
97,5 Teile N,N-Bis-(2-hydroxyethyl)-benzylamin wurden mit 100 Teilen Aceton vermischt und bei 50 bis 60°C mit 87 Teilen eines Gemischs aus 2,4- und 2,6-Diisocyanatotoluol (Gewichtsverhältnis 65:35) tropfenweise versetzt. Nach vierstündigem Rühren ließen sich im IR-Spektrum keine Isocyanatgruppen mehr nachweisen.97.5 parts of N, N-bis (2-hydroxyethyl) benzylamine were mixed with 100 parts of acetone and at 50 to 60 ° C. with 87 parts of a mixture of 2,4- and 2,6-diisocyanatotoluene (weight ratio 65: 35) added dropwise. After four hours of stirring, no isocyanate groups could be detected in the IR spectrum.
224 Teile des Reaktionsgemischs wurden mit 100 Teilen Aceton verdünnt und bei 40 bis 50°C mit 49 Teilen Dimethylsulfat versetzt. Nach 30 Minuten Rühren bei 40 bis 50°C wurde mit 200 ml Wasser verdünnt und noch 2 Stunden bei 50 bis 60°C gerührt.224 parts of the reaction mixture were diluted with 100 parts of acetone and 49 parts of dimethyl sulfate were added at 40 to 50 ° C. After stirring for 30 minutes at 40 to 50 ° C., the mixture was diluted with 200 ml of water and stirred at 50 to 60 ° C. for a further 2 hours.
Nach dem Abdestillieren des Acetons im Wasserstrahlvakuum wurde der Rückstand mit 230 Teilen Propandiol-1,2, 70 Teilen Eisessig und 44 Teilen Wasser gelöst. Man erhielt eine Lösung mit einem Feststoffgehalt von 40 % und einer Viskosität von 107 mPa.s bei 20°C.After distilling off the acetone in a water jet vacuum, the residue was dissolved with 230 parts of 1,2-propanediol, 70 parts of glacial acetic acid and 44 parts of water. A solution with a solids content of 40% and a viscosity of 107 mPa.s at 20 ° C. was obtained.
65,4 Teile N,N-Dimethyl-N′,N′-bis-(2-hydroxypropyl)-1,3-propandiamin wurde bei 70 bis 80° tropfenweise mit 48,4 Teilen Hexamethylendiisocyanat versetzt und anschließend 3 Stunden bei 90 bis 100° gerührt.65.4 parts of N, N-dimethyl-N ', N'-bis (2-hydroxypropyl) -1,3-propanediamine was added dropwise at 70 to 80 ° with 48.4 parts of hexamethylene diisocyanate and then for 3 hours at 90 to 100 ° stirred.
Anschließend wurden 120 Teile 1,2-Propandiol zugesetzt und bei 70 bis 80° 38 Teile Benzylchorid zugetropft. Nach sechsstündigem Rühren bei 70 bis 80° wurde mit 250 Teilen Wasser verdünnt. Im Wasserstrahlvakuum wurden bei 50 bis 60° zur Entfernung nichtumgesetzter Anteile ca. 100 Teile Destillat abgenommen.Then 120 parts of 1,2-propanediol were added and 38 parts of benzyl chloride were added dropwise at 70 to 80 °. After stirring for six hours at 70 to 80 °, the mixture was diluted with 250 parts of water. About 100 parts of distillate were removed in a water jet vacuum at 50 to 60 ° to remove unreacted portions.
Man erhielt eine klare gelbliche Lösung mit einem Trockengehalt von 45 %.A clear yellowish solution with a dry matter content of 45% was obtained.
Nach Verdünnung auf eine Konzentration von 25 % wurde eine Viskosität von 13,6 mPa.s eine 20° gefunden.After dilution to a concentration of 25%, a viscosity of 13.6 mPa.s at 20 ° was found.
81 Teile N,N′-Bis-(2-hydroxypropyl)-piperazin wurden in 150 Teilen Aceton gelöst, mit 0,1 Teilen Zinn(II)-octoat und anschließend bei 50 bis 55° mit 64 Teilen Hexamethylendiisocyanat versetzt. Nach fünfstündigem Rühren bei 50 bis 60° wurde mit 100 Teilen 1,2-Propandiol versetzt und bei 80 bis 90° das Aceton abdestilliert. 63 Teile Benzylchlorid wurden zugesetzt und die Mischung 5 Stunden bei 80 bis 90° gerührt. Nach der Verdünnung mit 300 Teilen Wasser wurde mit ca. 5 Teilen Essigsäure auf pH 5 gestellt. Im Wasserstrahlvakuum wurden bei 70 bis 80° ca. 100 Teile Destillat abdestilliert, um flüchtige Anteile zu entfernen. Nach Zusatz von 160 Teilen Wasser erhielt man eine rötlich gefärbte Lösung mit einem Trockengehalt von 51 %.81 parts of N, N'-bis (2-hydroxypropyl) piperazine were dissolved in 150 parts of acetone, 0.1 part of stannous octoate and then 64 parts of hexamethylene diisocyanate were added at 50 to 55 °. After stirring for five hours at 50 to 60 °, 100 parts of 1,2-propanediol were added and the acetone was distilled off at 80 to 90 °. 63 parts of benzyl chloride were added and the mixture was stirred at 80 to 90 ° for 5 hours. After dilution with 300 parts of water, the pH was adjusted to 5 with about 5 parts of acetic acid. In a water jet vacuum, about 100 parts of distillate were distilled off at 70 to 80 ° in order to remove volatile constituents. After adding 160 parts of water, a reddish-colored solution with a dry matter content of 51% was obtained.
Nach Verdünnung mit Wasser auf eine Konzentration von 40 % wurde eine Viskosität von 55,9 mPa.s gefunden.After dilution with water to a concentration of 40%, a viscosity of 55.9 mPa.s was found.
143 Teile Polyethertetraol der OH-Zahl 224 (mittleres Molgewicht: 1000), das durch Addition von zunächst Propylenoxid (PO) und anschließend Ethylenoxid (EO) im Gewichtsverhältnis 55:45 an Ethylendiamin hergestellt wurde, versetzt man bei Raumtemperatur (RT) mit 76 Teilen Hexadecylisocyanat und rührt 2 Stunden bei 80°C nach. Nach Zugabe von 34 Teilen Hexamethylendiisocyanat (HDI) rührt man eine weitere Stunde bei 80°C. Anschließend wird das Reaktionsgemisch mit 25 Teilen N,N- Bis-(dimethylaminopropyl)-N-(2-hydroxypropyl)-amin versetzt und solange bei 80°C gerührt bis IR-spektroskopisch kein Isocyanat mehr nachweisbar ist. Hierauf gibt man 56 Teile Benzylchlorid zu und erhitzt weitere 3 Stunden auf 90°C. Die resultierende, auf 60°C abgekühlte Schmelze wird in 779 Teilen entmineralisiertem Wasser gelöst. Man erhält ein hellbraunes, schwach trübes Produkt mit einem Feststoffgehalt von ca. 30 %.
pH: 7,3
Viskosität: 640 mPa.s/50°C143 parts of polyether tetraol with an OH number of 224 (average molecular weight: 1000), which was prepared by adding propylene oxide (PO) and then ethylene oxide (EO) in a weight ratio of 55:45 to ethylenediamine, are mixed with 76 parts at room temperature (RT) Hexadecyl isocyanate and stirred at 80 ° C for 2 hours. After adding 34 parts of hexamethylene diisocyanate (HDI), the mixture is stirred at 80 ° C. for a further hour. The reaction mixture is then washed with 25 parts of N, N Bis- (dimethylaminopropyl) -N- (2-hydroxypropyl) amine are added and the mixture is stirred at 80 ° C. until isocyanate is no longer detectable by IR spectroscopy. Then 56 parts of benzyl chloride are added and the mixture is heated at 90 ° C. for a further 3 hours. The resulting melt, cooled to 60 ° C., is dissolved in 779 parts of demineralized water. A light brown, slightly cloudy product with a solids content of approx. 30% is obtained.
pH: 7.3
Viscosity: 640 mPa.s / 50 ° C
178,5 Teile Polyetherdiol der OH-Zahl 158 (mittleres Molgewicht: 709), das durch Addition von zunächst PO und anschließend EO im Gewichtsverhältnis 80:20 an Stearylamin hergestellt wurde, versetzt man bei RT mit 63 Teilen HDI und rührt 3 Stunden bei 90°C. Nach Zugabe von 22,3 Teilen N,N-Dimethylaminoethanol wird solange bei 90°C nachgerührt bis IR-spektroskopisch kein Isocyanat mehr nachweisbar ist. Hierauf tropft man bei 40°C 57,2 Teile Dimethylsulfat über 30 Minuten zu, erhitzt eine weitere Stunden auf 80°C und löst die resultierende Schmelze in 748,8 Teilen entmineralisiertem Wasser. Man erhält ein gelbliches, fast klares Produkt mit einem Feststoffgehalt von ca. 30 %.
pH: 6,6
Viskosität: 420 mPa.s/25°C178.5 parts of polyether diol with OH number 158 (average molecular weight: 709), which was prepared by adding PO and then EO in a weight ratio of 80:20 to stearylamine, are added at RT with 63 parts of HDI and stirred for 3 hours at 90 ° C. After addition of 22.3 parts of N, N-dimethylaminoethanol, stirring is continued at 90 ° C. until isocyanate is no longer detectable by IR spectroscopy. 57.2 parts of dimethyl sulfate are then added dropwise at 40 ° C. over 30 minutes, the mixture is heated at 80 ° C. for a further hour and the resulting melt is dissolved in 748.8 parts of demineralized water. A yellowish, almost clear product with a solids content of approx. 30% is obtained.
pH: 6.6
Viscosity: 420 mPa.s / 25 ° C
119 Teile Polyetherdiol der OH-Zahl 158 (mittleres Molgewicht: 709), das durch Addition von zunächst PO und anschließend EO im Gewichtsverhältnis 80:20 an Stearylamin hergestellt wurde, versetzt man bei RT mit 72,8 Teilen HDI und rührt Stunden bei 80°C nach. Nach Zugabe von 19,8 Teilen N-Methyldiethanolamin rührt man eine weitere Stunde bei 80°C. Anschließend wird das Reaktionsgemisch mit 17,8 Teilen Dimethylaminoethanol versetzt und solange bei 80°C weitergerührt, bis IR-spektroskopisch kein Isocyanat mehr nachweisbar ist. Hierauf gibt man 65,4 Teile Benzylchlorid zu und erhitzt weitere 3 Stunden auf 90°C. Die resultierende Schmelze wird bei 60°C in 688 Teilen entmineralisiertem Wasser gelöst. Man erhält ein gelbliches, fast klares Produkt mit einem Feststoffgehalt von ca. 30 %.
pH: 5,2
Viskosität: 3700 mPa.s/25°C119 parts of polyether diol with OH number 158 (average molecular weight: 709), which was prepared by adding PO and then EO in a weight ratio of 80:20 to stearylamine, are added at RT with 72.8 parts of HDI and stirred at 80 ° for hours C after. After adding 19.8 parts of N-methyldiethanolamine, the mixture is stirred at 80 ° C. for a further hour. Then 17.8 parts of dimethylaminoethanol are added to the reaction mixture and stirring is continued at 80 ° C. until isocyanate is no longer detectable by IR spectroscopy. Then 65.4 parts of benzyl chloride are added and the mixture is heated at 90 ° C. for a further 3 hours. The resulting melt is dissolved in 688 parts of demineralized water at 60 ° C. A yellowish, almost clear product with a solids content of approx. 30% is obtained.
pH: 5.2
Viscosity: 3700 mPa.s / 25 ° C
100 Teile Polyetherdiol der OH-Zahl 224 (mittleres Molgewicht: 500) das durch Addition von zunächst PO und anschließend EO im Gewichtsverhältnis 80:20 an Benzylamin hergestellt wurde, 94 Teile HDI, 24 Teile N-Methyldiethanolamin, 37 Teile Diethylaminoethanol (anstelle von Dimethylaminoethanol) und 66 Teile Benzylchlorid werden analog Beispiel 8 umgesetzt und in 749 Teilen entmineralisiertem Wasser gelöst. Man erhält ein hellbraunes, fast klares Produkt mit einem Feststoffgehalt von ca. 30 %.
pH: 6,8
Viskosität: 340 mPa.s/25°C100 parts of polyether diol with OH number 224 (average molecular weight: 500) which was prepared by adding PO and then EO in a weight ratio of 80:20 to benzylamine, 94 parts of HDI, 24 parts of N-methyldiethanolamine, 37 parts of diethylaminoethanol (instead of dimethylaminoethanol ) and 66 parts of benzyl chloride are reacted analogously to Example 8 and dissolved in 749 parts of demineralized water. You get a light brown, almost clear product with a solids content of approx. 30%.
pH: 6.8
Viscosity: 340 mPa.s / 25 ° C
100 Teile Polyetherdiol der OH-Zahl 224 (mittleres Molgewicht: 500), das durch Addition von PO an N-Methyldiethanolamin hergestellt wurde, 94 Teile HDI, 24 Teile N-Methyldiethanolamin, 45 Teile 95 %iges 2-(2-Dimethylaminoethoxy)-ethanol (anstelle von Dimethylaminoethanol) und 66 Teile Benzylchlorid werden analog Beispiel 8 umgesetzt und in 766 Teilen entmineralisiertem Wasser gelöst. Man erhält ein hellbraunes, schwach trübes Produkt mit einem Feststoffgehalt von ca. 30 %.
pH: 8,2
Viskosität: 34 mPa.s/25°C100 parts of polyether diol with OH number 224 (average molecular weight: 500), which was prepared by adding PO to N-methyldiethanolamine, 94 parts of HDI, 24 parts of N-methyldiethanolamine, 45 parts of 95% 2- (2-dimethylaminoethoxy) - ethanol (instead of dimethylaminoethanol) and 66 parts of benzyl chloride are reacted analogously to Example 8 and dissolved in 766 parts of demineralized water. A light brown, slightly cloudy product with a solids content of approx. 30% is obtained.
pH: 8.2
Viscosity: 34 mPa.s / 25 ° C
125 Teile des in Beispiel 12 beschriebenen Polyetherdiols der OH-Zahl 224 werden bei RT mit 59 Teilen HDI versetzt und 3 Stunden bei 80°C nachgerührt. Nach Zugabe von 43 Teilen N,N-Bis-(3-dimethylaminopropyl)-N-(2-hydroxypropyl)-amin wird solange bei 80°C weitergerührt bis IR-spektroskopisch kein Isocyanat mehr nachweisbar ist. Hierauf gibt man 75 Teile Benzylchlorid zu und erhitzt weitere 3 Stunden auf 90°C. Die resultierende Schmelze wird bei 60°C in 705 Teilen entmineralisiertem Wasser gelöst. Man erhält ein gelbliches, fast klares Produkt mit einem Feststoffgehalt von ca. 30 %.
pH: 8,0
Auslaufviskosität: 14 s (4 mm-Fordbecher/25°C)125 parts of the polyether diol of OH number 224 described in Example 12 are mixed at room temperature with 59 parts of HDI and stirred at 80 ° C. for 3 hours. After adding 43 parts of N, N-bis (3-dimethylaminopropyl) -N- (2-hydroxypropyl) amine, stirring is continued at 80 ° C. until isocyanate can no longer be detected by IR spectroscopy. Then 75 parts of benzyl chloride are added and the mixture is heated at 90 ° C. for a further 3 hours. The resulting melt is demineralized at 60 ° C in 705 parts Water dissolved. A yellowish, almost clear product with a solids content of approx. 30% is obtained.
pH: 8.0
Outlet viscosity: 14 s (4 mm Ford cup / 25 ° C)
Garne aus Wolle, die mit Hercosett 57 "Superwash" ausgerüstet wurden (Chlorierung und Behandlung mit einem Adipinsäure/Diethylentriamin-Epichlorhydrin-Umsetzungsprodukt), werden im Flottenverhältnis von 1:20 bei Raumtemperatur während 15 Minuten mit einer Färbeflotte behandelt, die im Liter
1,0 g des Farbstoffes C.I. Acid Blue 49 (= Nr. 62 095)
2,0 g Natriumsulfat kalz.
1,5 g Essigsäure (40 %)
0,5 g des Egalisierhilfsmittels der Formel
1.0 g of the dye CI Acid Blue 49 (= No. 62 095)
2.0 g sodium sulfate calc.
1.5 g acetic acid (40%)
0.5 g of the leveling aid of the formula
Man erhitzt das Färbebad innerhalb von 60 Minuten zum Kochen und färbt während 60 Minuten bei dieser Temperatur. Anschließend wird die Färbung gespült und bei 50°C während 30 Minuten mit einer Flotte nachbehandelt, die im Liter
1,6 des Reaktionsproduktes gemäß Beispiel 1 und
4,0 g Natriumsulfat kalz.
enthält und mit Ammoniaklösung auf pH 7,5 bis 8,0 eingestellt ist, wobei kein Ausbluten der Färbung auftritt. Dann wird die Färbung gespült, mit Essigsäure abgesäuert, entwässert und getrocknet.The dyebath is heated to boiling within 60 minutes and dyed at this temperature for 60 minutes. The dyeing is then rinsed and after-treated at 50 ° C. for 30 minutes with a liquor which is in liters
1.6 of the reaction product according to Example 1 and
4.0 g sodium sulfate calc.
contains and is adjusted to pH 7.5 to 8.0 with ammonia solution, with no bleeding of the coloration occurring. Then the color is rinsed, acidified with acetic acid, dehydrated and dried.
Die Echtheitsprüfungen zeigen, daß das Echtheitsniveau durch die Nachbehandlung wesentlich verbessert wird, so daß die IWS-Spezifikationen (IWS-TM 193, IWS-TM 174) erreicht sind; dies geschieht ohne Verschlechterung der Reibechtheit.The authenticity tests show that the level of authenticity is significantly improved by the aftertreatment, so that the IWS specifications (IWS-TM 193, IWS-TM 174) are achieved; this happens without deterioration in rubbing fastness.
Man färbt die HERCOSETT-ausgerüsteten Wollgarne wie in Beispiel 14 beschrieben und behandelt sie anschließend bei 50°C während 30 Minuten mit einer Flotte, die im Liter
2,0 g des Reaktionsproduktes gemäß Beispiel 8 und
4,0 g Natriumsulfat kalz.
enthält und mit Ammoniaklösung auf pH 7,5 bis 8,0 eingestellt ist, wobei kein Ausbluten der Färbung auftritt. Anschließend wird die Färbung gespült, mit Essigsäure abgesäuert, entwässert und getrocknet.The HERCOSETT-finished wool yarns are dyed as described in Example 14 and then treated at 50 ° C. for 30 minutes with a liquor in liters
2.0 g of the reaction product according to Example 8 and
4.0 g sodium sulfate calc.
contains and is adjusted to pH 7.5 to 8.0 with ammonia solution, with no bleeding of the coloration occurring. The dyeing is then rinsed, acidified with acetic acid, dehydrated and dried.
Man erhält auf diese Weise eine wesentliche Verbesserung der Echtheitseigenschaften der Färbung; dies geschieht ohne Verschlechterung der Reibechtheit.A significant improvement in the fastness properties of the dyeing is obtained in this way; this happens without deterioration in rubbing fastness.
Wolkammzüge, die vorher mit HERCOSETT 57 ausgerüstet wurden, werden in einem Flottenverhältnis von 1:10 bei Raumtemperatur in ein Färbebad eingebracht, das im Liter
1 g des Farbstoffes C.I. Acid Red 296 (= Nr. 15 575)
1 g Natriumsulfat kalz.
2,5 g Essigsäure (60 %)
0,6 g des in Beispiel 14 verwendeten Egalisiermittels
enthält. Anschließend wird die Färbeflotte innerhalb von 30 Minuten zum Kochen erhitzt und 60 Minuten bei dieser Temperatur gehalten. Nach dem Spülen wird die Färbung bei 50°C während 30 Minuten mit einer Flotte nachbehandelt, die im Liter
2,5 g des Reaktionsproduktes gemäß Beispiel 2 und
4,0 g Natriumsulfat kalz.
enthält und mit Ammoniaklösung auf pH 7,5 bis 8,0 gestellt ist, wobei kein Ausbluten der Färbung auftritt. Anschließend wird die Färbung gespült, mit Essigsäure abgesäuert, entwässert und getrocknet. Die Färbung weist ein wesentlich erhöhtes Echtheitsniveau auf; dies geschieht ohne Verschlechterung der Reibechtheit.Wolkamm trains that were previously equipped with HERCOSETT 57 are placed in a liquor ratio of 1:10 at room temperature in a dye bath, which is in liters
1 g of the dye CI Acid Red 296 (= No. 15 575)
1 g sodium sulfate calc.
2.5 g acetic acid (60%)
0.6 g of the leveling agent used in Example 14
contains. The dye liquor is then heated to boiling within 30 minutes and kept at this temperature for 60 minutes. After rinsing, the dyeing is aftertreated at 50 ° C for 30 minutes with a liquor in liters
2.5 g of the reaction product according to Example 2 and
4.0 g sodium sulfate calc.
contains and is adjusted to pH 7.5 to 8.0 with ammonia solution, with no bleeding of the color. The dyeing is then rinsed, acidified with acetic acid, dehydrated and dried. The coloring has a significantly increased level of authenticity; this happens without deterioration in rubbing fastness.
Auf Spulen aufgewickeltes, filzfrei ausgerüstetes Wollgarn wird in einem Flottenverhältnis von 1:15, wie in Beispiel 14 beschrieben, gefärbt, jedoch unter Verwendung einer Färbeflotte, die im Liter
1,6 g des Farbstoffes C.I. Acid Green 50 (= C.I. 44 090)
0,75 g Natriumsulfat kalz.
2,0 g Essigsäure (60 %)
0,5 g des Umsetzungsproduktes aus 1 Mol N-Methyl-stearylamin und 30 Mol Ethylenoxid
enthält.Wool yarn finished on bobbins, finished with a felt-free finish, is dyed in a liquor ratio of 1:15, as described in Example 14, but using a dye liquor which is in liters
1.6 g of the dye CI Acid Green 50 (= CI 44 090)
0.75 g sodium sulfate calc.
2.0 g acetic acid (60%)
0.5 g of the reaction product from 1 mol of N-methyl-stearylamine and 30 mol of ethylene oxide
contains.
Die Nachbehandlung erfolgt wie in Beispiel 14 beschrieben. Die so erhaltene Färbung weist sehr gute Echtheitseigenschaften auf, dies geschieht ohne Verschlechterung der Reibechtheit.The aftertreatment is carried out as described in Example 14. The dyeing obtained in this way has very good fastness properties, this is done without deterioration in rub fastness.
Mit HERCOSETT 57 ausgerüstete Wollgarnstränge werden bei Raumtemperatur im Flottenverhältnis 1:25 in einer Färbeflotte eingebracht, die im Liter
1,2 g des roten Farbstoffes der FR-PS 1 389 345, Beispiel 1
2,0 g Natriumsulfat kalz.
2,0 g Essigsäure (60 %)
0,4 g eines Hilfsmittelgemisches bestehend aus 50 Teilen des Umsetzungsproduktes aus 1 Mol N-Methyl-stearylamin und 20 Mol EO und 50 Teilen des Umsetzungsproduktes aus 1 Mol N-Ethyl-stearylamin und 35 Mol EO
enthält. Man verfährt sowohl beim Färben als auch beim Nachbehandeln wie in Beispiel 14 beschrieben, jedoch mit dem Unterschied, daß man die Nachbehandlung mit
1,2 g des Reaktionsproduktes gemäß Beispiel 4
durchführt.Wool yarn skeins equipped with HERCOSETT 57 are placed at room temperature in a 1:25 liquor ratio in a dye liquor, in liters
1.2 g of the red dye of FR-PS 1 389 345, Example 1
2.0 g sodium sulfate calc.
2.0 g acetic acid (60%)
0.4 g of an auxiliary mixture consisting of 50 parts of the reaction product from 1 mol of N-methyl-stearylamine and 20 mol of EO and 50 parts of the reaction product from 1 mol of N-ethyl-stearylamine and 35 mol of EO
contains. Both dyeing and post-treatment are carried out as described in Example 14, but with the difference that the post-treatment is carried out with
1.2 g of the reaction product according to Example 4
carries out.
Auch hierbei erzielt man eine wesentliche Verbesserung der Echtheitseigenschaften der Färbung; dies geschieht ohne Verschlechterung der Reibechtheit.Here, too, a significant improvement in the fastness properties of the dyeing is achieved; this happens without deterioration in rubbing fastness.
Wollkammzug, der vorher wie üblich vorchloriert wurde, wird in einem Flottenverhältnis von 1:10 wie in Beispiel 14 beschrieben gefärbt und nach dem Spülen in einer Flotte bei 50°C während 5 Minuten nachbehandelt, die
4,8 g des Reaktionsproduktes gemäß Beispiel 12
enthält. Anschließend wird der pH-Wert des Behandlungsbades durch Zusatz von Ammoniaklösung auf ca. 7,5 bis 8,0 eingestellt. Die Färbung wird weitere 25 Minuten bei 50°C behandelt.Wool comb, which was previously chlorinated as usual, is dyed in a liquor ratio of 1:10 as described in Example 14 and after-rinsed in a liquor at 50 ° C. for 5 minutes, which
4.8 g of the reaction product according to Example 12
contains. The pH of the treatment bath is then adjusted to approximately 7.5 to 8.0 by adding ammonia solution. The coloring is treated at 50 ° C for a further 25 minutes.
Anschließend wird der Kammzug gespült, mit Essigsäure abgesäuert, entwässert und getrocknet.The ridge is then rinsed, acidified with acetic acid, dewatered and dried.
Die Echtheitsprüfungen zeigen, daß das Echtheitsniveau durch die Nachbehandlung wesentlich verbessert wurde, so daß die IWS-Spezifikationen (IWS-TM 193 und IWS-TM 174) erreicht sind; dies geschieht ohne Verschlechterung der Reibechtheit.The authenticity tests show that the authenticity level has been significantly improved by the aftertreatment, so that the IWS specifications (IWS-TM 193 and IWS-TM 174) are achieved; this happens without deterioration in rubbing fastness.
Auf Spulen aufgewickeltes, filzfrei ausgerüstetes Wollgarn wird in einem Flottenverhältnis von 1:12, wie in Beispiel 14 beschrieben, gefärbt, jedoch unter Verwendung einer Färbeflotte, die im Liter
1,0 g des Farbstoffes C.I. Acid Green 50 (= C.I. 44 090)
1,0 g Natriumsulfat kalz.
2,0 g Essigsäure (60 %)
0,5 g des Umsetzungsproduktes aus 1 Mol N-Methyl-stearylamin und 30 Mol Ethylenoxid
enthält.Wool yarn finished on bobbins, finished with a felt-free finish, is dyed in a liquor ratio of 1:12, as described in Example 14, but using a dye liquor which is in liters
1.0 g of the dye CI Acid Green 50 (= CI 44 090)
1.0 g sodium sulfate calc.
2.0 g acetic acid (60%)
0.5 g of the reaction product from 1 mol of N-methyl-stearylamine and 30 mol of ethylene oxide
contains.
Die Nachbehandlung erfolgt wie in Beispiel 14 beschrieben, jedoch mit dem Unterschied, daß man die Nachbehandlung mit
3,2 g des Reaktionsproduktes gemäß Beispiel 11
durchführt. Die so erhaltene Färbung weist sehr gute Echtheitseigenschaften auf; dies geschieht ohne Verschlechterung der Reibechtheit.The aftertreatment is carried out as described in Example 14, but with the difference that the aftertreatment is carried out with
3.2 g of the reaction product according to Example 11
carries out. The dyeing obtained in this way has very good fastness properties; this happens without deterioration in rubbing fastness.
Wollkammzüge, die vorher mit HERCOSETT 57 ausgerüstet wurden, werden in einem Flottenverhältnis von 1:10 bei Raumtemperatur in ein Färbebad eingebracht, das im Liter
1 g des Farbstoffes C.I. Acid Red 296 (= Nr. 15 675)
1 g Natriumsulfat kalz.
2,5 g Essigsäure (60 %)
0,6 g des in Beispiel 14 verwendeten Egalisierhilfsmittels
enthält. Anschließend wird die Färbeflotte innerhalb von 60 Minuten zum Kochen erhitzt und 60 Minuten bei dieser Temperatur gehalten. Nach dem Spülen wird die Färbung bei 50°C während 30 Minuten mit einer Flotte nachbehandelt, die im Liter
3,5 g des Reaktionsproduktes gemäß Beispiel 13
enthält und mit Ammoniaklösung auf pH 7,5 bis 8,0 gestellt ist, wobei kein Ausbluten der Färbung entsteht. Anschließend wird die Färbung gespült, mit Essigsäure abgesäuert, entwässert und getrocknet. Die Färbung weist ein wesentlich erhöhtes Echtheitsniveau auf als das der nicht nachbehandelten Färbung; dies geschieht ohne Verschlechterung der Reibechtheit.Wool combs, which were previously equipped with HERCOSETT 57, are placed in a liquor ratio of 1:10 at room temperature in a dye bath, which is in liters
1 g of the dye CI Acid Red 296 (= No. 15 675)
1 g sodium sulfate calc.
2.5 g acetic acid (60%)
0.6 g of the leveling aid used in Example 14
contains. The dye liquor is then heated to boiling within 60 minutes and kept at this temperature for 60 minutes. After rinsing, the dyeing is aftertreated at 50 ° C for 30 minutes with a liquor in liters
3.5 g of the reaction product according to Example 13
contains and is adjusted to pH 7.5 to 8.0 with ammonia solution, with no bleeding of the color. The dyeing is then rinsed, acidified with acetic acid, dehydrated and dried. The dyeing has a significantly higher level of fastness than that of the non-aftertreated dyeing; this happens without deterioration in rubbing fastness.
Claims (10)
A) tertiäre Aminogruppen und mindestens zwei Hydroxylgruppen aufweisenden Verbindungen
mit
B) Polyisocyanaten
und
C) Quaternierungsmitteln
erhältlich sind.2. The method according to claim 1, characterized in that the polyurethanes by reacting
A) tertiary amino groups and compounds containing at least two hydroxyl groups
With
B) polyisocyanates
and
C) Quaternizing agents
are available.
Q¹ und Q² unabhängig voneinander einen Rest der allgemeinen Formel
-[(O-CH₂-)n-(O-CH₂-CH₂)m]r
A C₁-C₁₈-Alkyl, C₅-C₈-Cycloalkyl, C₇-C₉-Aralkyl oder einen Rest der Formel
R¹, R² und R⁴ unabhängig voneinander C₂-C₆-Alkylen, C₅-C₈-Cycloalkylen oder C₇-C₉-Aralkylen,
R³ Wasserstoff oder Methyl,
R⁵ C₁-C₁₈-Alkyl, C₅-C₈-Cycloalkyl, C₇-C₉-Aralkyl oder einen Rest der Formel
HO-Q¹-R¹-
und
m, n und r die Zahlen 0 bis 30 bedeuten.3. The method according to claim 2, characterized in that in the preparation of the polyurethanes as component A) hydroxylalkylamines of the general formulas
Q¹ and Q² independently of one another are a radical of the general formula
- [(O-CH₂- ) n - (O-CH₂-CH₂) m ] r
A C₁-C₁₈-alkyl, C₅-C₈-cycloalkyl, C₇-C₉-aralkyl or a radical of the formula
R¹, R² and R⁴ independently of one another are C₂-C₆-alkylene, C₅-C₈-cycloalkylene or C₇-C₉-aralkylene,
R³ is hydrogen or methyl,
R⁵ C₁-C₁₈-alkyl, C₅-C₈-cycloalkyl, C₇-C₉-aralkyl or a radical of the formula
HO-Q¹-R¹-
and
m, n and r represent the numbers 0 to 30.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE3816699 | 1988-05-17 | ||
| DE3816699A DE3816699A1 (en) | 1988-05-17 | 1988-05-17 | METHOD FOR TREATING DYED TEXTILE MATERIALS |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| EP0342439A2 true EP0342439A2 (en) | 1989-11-23 |
| EP0342439A3 EP0342439A3 (en) | 1991-09-18 |
| EP0342439B1 EP0342439B1 (en) | 1994-01-19 |
Family
ID=6354499
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| EP89108065A Expired - Lifetime EP0342439B1 (en) | 1988-05-17 | 1989-05-04 | Process for the aftertreatment of dyed textile materials |
Country Status (3)
| Country | Link |
|---|---|
| US (1) | US4964875A (en) |
| EP (1) | EP0342439B1 (en) |
| DE (2) | DE3816699A1 (en) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1211346A1 (en) * | 2000-12-01 | 2002-06-05 | Bayer Ag | Non-felting wool and process for giving an anti-felting finish |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5714802A (en) * | 1991-06-18 | 1998-02-03 | Micron Technology, Inc. | High-density electronic module |
| GB9202375D0 (en) * | 1992-02-05 | 1992-03-18 | Ici Plc | Process |
| US6136433A (en) * | 1997-05-01 | 2000-10-24 | Basf Corporation | Spinning and stability of solution-dyed nylon fibers |
| US20100261813A1 (en) * | 2007-03-21 | 2010-10-14 | Barrett Richard Bobsein | Thickener composition and method for thickening aqueous systems |
| US9970155B2 (en) | 2013-03-05 | 2018-05-15 | Nike, Inc. | Acid dyeing of polyurethane materials |
| US9863089B2 (en) | 2013-03-05 | 2018-01-09 | Nike, Inc. | Method for dyeing golf balls and dyed golf balls |
| CN107217518B (en) * | 2017-07-24 | 2019-06-07 | 北京泛博化学股份有限公司 | A kind of secured elevator of perspiration resistance and preparation method thereof, application |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2303034A1 (en) * | 1975-03-06 | 1976-10-01 | Iws Nominee Co Ltd | CROSS-LINKABLE POLYMER COMPOUND, ITS PREPARATION PROCESS AND ITS APPLICATION |
| GB2006279A (en) * | 1977-10-21 | 1979-05-02 | Bayer Ag | Process for the after-treatment of reactive dyeings |
| GB2093076A (en) * | 1981-02-13 | 1982-08-25 | Sandoz Ltd | Aftertreatment of Direct or Reactive Dyeings on Cellulose Fibres |
Family Cites Families (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4098772A (en) * | 1976-03-11 | 1978-07-04 | The Upjohn Company | Thermoplastic polyurethanes prepared with small amounts of monohydric alcohols |
| DE2626495A1 (en) * | 1976-06-12 | 1977-12-29 | Bayer Ag | QUARTERLY REACTIVE COMPOUNDS |
| JPS54151689A (en) * | 1978-05-17 | 1979-11-29 | Dai Ichi Kogyo Seiyaku Co Ltd | Improving of abrasion fastness |
| IT1198254B (en) * | 1986-12-24 | 1988-12-21 | Raffineria Olii Lubirificanti | PROCEDURE FOR IMPROVING THE DYEABILITY OF FABRIC OR NON-WOVEN TEXTILE MANUFACTURES |
-
1988
- 1988-05-17 DE DE3816699A patent/DE3816699A1/en not_active Withdrawn
-
1989
- 1989-05-04 DE DE89108065T patent/DE58906730D1/en not_active Expired - Fee Related
- 1989-05-04 EP EP89108065A patent/EP0342439B1/en not_active Expired - Lifetime
- 1989-05-09 US US07/349,742 patent/US4964875A/en not_active Expired - Lifetime
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2303034A1 (en) * | 1975-03-06 | 1976-10-01 | Iws Nominee Co Ltd | CROSS-LINKABLE POLYMER COMPOUND, ITS PREPARATION PROCESS AND ITS APPLICATION |
| GB2006279A (en) * | 1977-10-21 | 1979-05-02 | Bayer Ag | Process for the after-treatment of reactive dyeings |
| GB2093076A (en) * | 1981-02-13 | 1982-08-25 | Sandoz Ltd | Aftertreatment of Direct or Reactive Dyeings on Cellulose Fibres |
Non-Patent Citations (1)
| Title |
|---|
| CHEMICAL ABSTRACTS, vol. 104, no. 6, 10 Februar 1986 Columbus, Ohio, USA "Dyeing of fabrics with high color yield." Seite 77; rechte Spalte; ref. no. 35417 * |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1211346A1 (en) * | 2000-12-01 | 2002-06-05 | Bayer Ag | Non-felting wool and process for giving an anti-felting finish |
Also Published As
| Publication number | Publication date |
|---|---|
| EP0342439B1 (en) | 1994-01-19 |
| DE58906730D1 (en) | 1994-03-03 |
| US4964875A (en) | 1990-10-23 |
| DE3816699A1 (en) | 1989-11-30 |
| EP0342439A3 (en) | 1991-09-18 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP0571867A1 (en) | Crosslinkers for textile printing binders | |
| DE2912864A1 (en) | LAYERED POLYURETHANE MATERIAL AND METHOD FOR MANUFACTURING THE MATERIAL | |
| EP0342439B1 (en) | Process for the aftertreatment of dyed textile materials | |
| DE1495840C3 (en) | Process for the production of polyurethane elastomers | |
| DE1495830B2 (en) | METHOD FOR PREPARING SOLUTIONS OF POLYURETHANE ELASTOMERS | |
| EP0358087B1 (en) | Quaternized condensation products | |
| DE1300689B (en) | Process for the production of polyurethane elastomers | |
| EP0057398B1 (en) | Process for the post-treatment of dyed, shrink-proofed fibrous material | |
| DE2739378A1 (en) | WATER-SOLUBLE CATIONIC OLIGOURETHANE RESINS AND THEIR USE FOR THE TREATMENT OF BARE OR LEATHER | |
| DE2058502C3 (en) | Polyurethane elastomers | |
| DE1495806A1 (en) | Process for the production of polyurethane elastomers | |
| DE3610053C2 (en) | ||
| EP0985747B1 (en) | Process for manufacturing cellulosic fibres | |
| DE1494610A1 (en) | Process for the production of elastic threads and fibers with improved dyeing properties | |
| DE1495830C3 (en) | Process for the preparation of solutions of polyurethane elastomers | |
| DE19501055A1 (en) | Process for the production of patterned textiles | |
| DE1494613C3 (en) | Process for the production of crosslinked rubber elastic threads and fibers | |
| DE3607963A1 (en) | CONDENSATION PRODUCTS AND METHOD FOR TREATING DYED POLYAMIDES | |
| DE1204406B (en) | Use of an additive to improve the colorability, the lightfastness and the exhaust gas fastness to materials that can be processed on elastic polyurethane moldings | |
| DE2035172A1 (en) | Felt finishing of wool fabrics | |
| EP0963478A1 (en) | Carbamate modified low-molecular polymer compound and the use thereof for after-treatment of dyed or printed cellulose textile material | |
| DE4415451A1 (en) | Hydrophilically modified poly:isocyanate utilisation for high quality | |
| EP0824156A1 (en) | Watersoluble ureaderivatives polymers with quaternary ammonium groups and their use | |
| DE2504081C3 (en) | Process for tanning or retanning of pelts or leather with hydrophilic oligourethanes | |
| DE19615898A1 (en) | Dyeing of fibres with amino group-containing dyes to give high wet fastness |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PUAI | Public reference made under article 153(3) epc to a published international application that has entered the european phase |
Free format text: ORIGINAL CODE: 0009012 |
|
| 17P | Request for examination filed |
Effective date: 19890504 |
|
| AK | Designated contracting states |
Kind code of ref document: A2 Designated state(s): CH DE FR GB IT LI |
|
| PUAL | Search report despatched |
Free format text: ORIGINAL CODE: 0009013 |
|
| AK | Designated contracting states |
Kind code of ref document: A3 Designated state(s): CH DE FR GB IT LI |
|
| 17Q | First examination report despatched |
Effective date: 19920720 |
|
| GRAA | (expected) grant |
Free format text: ORIGINAL CODE: 0009210 |
|
| AK | Designated contracting states |
Kind code of ref document: B1 Designated state(s): CH DE FR GB IT LI |
|
| GBT | Gb: translation of ep patent filed (gb section 77(6)(a)/1977) |
Effective date: 19940125 |
|
| REF | Corresponds to: |
Ref document number: 58906730 Country of ref document: DE Date of ref document: 19940303 |
|
| ITF | It: translation for a ep patent filed |
Owner name: SOCIETA' ITALIANA BREVETTI S.P.A. |
|
| ITTA | It: last paid annual fee | ||
| ET | Fr: translation filed | ||
| PLBE | No opposition filed within time limit |
Free format text: ORIGINAL CODE: 0009261 |
|
| STAA | Information on the status of an ep patent application or granted ep patent |
Free format text: STATUS: NO OPPOSITION FILED WITHIN TIME LIMIT |
|
| 26N | No opposition filed | ||
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: DE Payment date: 20010418 Year of fee payment: 13 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: GB Payment date: 20010502 Year of fee payment: 13 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: CH Payment date: 20010514 Year of fee payment: 13 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: FR Payment date: 20010523 Year of fee payment: 13 |
|
| REG | Reference to a national code |
Ref country code: GB Ref legal event code: IF02 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: GB Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20020504 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: LI Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20020531 Ref country code: CH Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20020531 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: DE Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20021203 |
|
| GBPC | Gb: european patent ceased through non-payment of renewal fee |
Effective date: 20020504 |
|
| REG | Reference to a national code |
Ref country code: CH Ref legal event code: PL |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: FR Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20030131 |
|
| REG | Reference to a national code |
Ref country code: FR Ref legal event code: ST |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: IT Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES;WARNING: LAPSES OF ITALIAN PATENTS WITH EFFECTIVE DATE BEFORE 2007 MAY HAVE OCCURRED AT ANY TIME BEFORE 2007. THE CORRECT EFFECTIVE DATE MAY BE DIFFERENT FROM THE ONE RECORDED. Effective date: 20050504 |