-
Die
vorliegende Erfindung ist gerichtet auf Färbemittel-Verbindungen. Noch
spezieller ist die vorliegende Erfindung gerichtet auf dimere Azopyridon-Färbemittel-Verbindungen,
die insbesondere geeignet sind zur Verwendung in Heißschmelz-
oder Phasenumwandlungs-Tinten (bzw. -Druckfarben). Eine Ausführungsform der
vorliegenden Erfindung ist gerichtet auf Verbindungen der Formel
worin
(A) R
1 (i) eine Alkylengruppe mit mindestens
12 Kohlenstoff-Atomen ist, worin die Alkylengruppe linear, verzweigt,
gesättigt,
ungesättigt,
zyklisch, unsubstituiert oder substituiert sein kann, (B) R
2 und R
2' unabhängig voneinander
sind (i) eine Alkylgruppe, (ii) eine Arylgruppe, (iii) eine Arylalkylgruppe,
(iv) eine Alkylarylgruppe, (v) eine Alkoxygruppe, (vi) eine Aryloxygruppe,
(vii) eine Arylalkyloxygruppe, (viii) eine Alkylaryloxygruppe, (ix) eine
Polyalkylenoxygruppe, (x) eine Polyarylenoxygruppe, (xi) eine Polyarylalkylenoxygruppe,
(xii) eine Polyalkylarylenoxygruppe, (xiii) eine heterozyklische
Gruppe, (xiv) eine Silylgruppe, (xv) eine Siloxangruppe, (xvi) eine
Polysilylengruppe, (xvii) eine Polysiloxangruppe oder (xviii) eine
Gruppe gemäß der Formel.
worin r und s unabhängig voneinander
ganze Zahlen sind, die die Zahl an -CH
2- Wiederholungseinheiten
angeben, (C) R
3 und R
3' unabhängig voneinander
sind (i) eine Alkylgruppe, (ii) eine Arylgruppe, (iii) eine Arylalkylgruppe
oder (iv) eine Alkylarylgrup pe, (D) X und X' unabhängig voneinander sind (i) eine
direkte Bindung, (ii) ein Sauerstoffatom, (iii) ein Schwefelatom,
(iv) eine Gruppe der Formel -NR
40-, worin
R
40 ein Wasserstoffatom, eine Alkylgruppe,
eine Arylgruppe, eine Arylalkylgruppe oder eine Alkylarylgruppe
ist, oder (v) eine Gruppe der Formel -CR
50R
60-, worin R
50 und
R
60 unabhängig voneinander sind ein Wasserstoffatom,
eine Alkylgruppe, eine Arylgruppe, eine Arylalkylgruppe oder eine
Alkylarylgruppe sind, und (E) Z und Z' unabhängig voneinander sind (i) ein
Wasserstoffatom, (ii) ein Halogenatom, (iii) eine Nitrogruppe, (iv)
eine Alkylgruppe, (v) eine Arylgruppe, (vi) eine Arylalkylgruppe,
(vii) eine Alkylarylgruppe, (viii) eine Gruppe der Formel
worin R
70 eine
Alkylgruppe, eine Arylgruppe, eine Arylalkylgruppe, eine Alkylarylgruppe,
eine Alkoxygruppe, eine Aryloxygruppe, eine Arylalkyloxygruppe,
eine Alkylaryloxygruppe, eine Polyalkylenoxygruppe, eine Polyarylenoxygruppe,
eine Polyarylalkylenoxygruppe, eine Polyalkylarylenoxygruppe, eine
heterozyklische Gruppe, eine Silylgruppe, eine Siloxangruppe, eine
Polysilylengruppe oder eine Polysiloxangruppe ist, (ix) eine Sulfonylgruppe
der Formel -SO
2R
80,
worin R
80 ein Wasserstoffatom, eine Alkylgruppe,
eine Arylgruppe, eine Arylalkylgruppe, eine Alkylarylgruppe, eine
Alkyloxygruppe, eine Aryloxygruppe, eine Arylalkyloxygruppe, eine
Alkylaryloxygruppe, eine Polyalkylenoxygruppe, eine Polyarylenoxygruppe,
eine Polyarylalkylenoxygruppe, eine Polyalkylarylenoxygruppe, eine
heterozyklische Gruppe, eine Silylgruppe, eine Siloxangruppe, eine
Polysilylengruppe oder eine Polysiloxangruppe ist, oder (x) eine
Phosphorylgruppe der Formel -PO
3R
90, worin R
90 ein Wasserstoffatom,
eine Alkylgruppe, eine Arylgruppe, eine Arylalkylgruppe, eine Alkylarylgruppe,
eine Alkoxygruppe, eine Aryloxygruppe, eine Arylalkyloxygruppe,
eine Alkylaryloxygruppe, eine Polyalkylenoxygruppe, eine Polyarylenoxygruppe,
eine Polyarylalkylenoxygruppe, eine Polyalkylarylenoxygruppe, eine
heterozyklische Gruppe, eine Silylgruppe, eine Siloxangruppe, eine
Polysilylengruppe oder eine Polysiloxangruppe ist.
-
Allgemein
liegen Phasen-Umwandlungs-Tinten bzw. -Druckfarben (manchmal auch
bezeichnet als „Heißschmelz-Tinten
bzw. -Druckfarben")
in der festen Phase bei Umgebungstemperatur vor, jedoch existieren in
der flüssigen
Phase bei der erhöhten
Betriebstemperatur einer Tintenstrahl-Druckvorrichtung. Bei der Strahl-Betriebstemperatur
werden Tröpfchen
von flüssiger
Tinte aus der Druckvorrichtung ausgestoßen und dann, wenn die Tinten-Tröpfchen mit
der Oberfläche
des Aufzeichnungs-Substrats in Kontakt kommen, entweder direkt oder über ein
als Zwischenmedium fungierendes erhitztes Übertragungs-Band oder eine Übertragungs-Trommel,
verfestigen sie sich schnell unter Bildung eines vorbestimmten Musters
aus verfestigten Tinten-Tropfen. Phasen-Umwandlungs-Tinten wurden auch in anderen
Druck-technologischen Verfahren verwendet, wie beispielsweise Tiefdruck,
wie beispielsweise offenbart wurde in dem US-Patent Nr. 5,496,879 und in den deutschen
Patentveröffentlichungen
Nrn.
DE 4205636AL und
DE 4205713AL .
-
Phasen-Umwandlungs-Tinten
für das
Farbdrucken umfassen typischerweise eine Phasenumwandlungs-Tintenträger-Zusammensetzung,
die kombiniert ist mit einem mit einer Phasen-Umwandlungs-Tinte
verträglichen
Färbemittel.
In einer speziellen Ausführungsform
kann eine Reihe von gefärbten
Phasen-Umwandlungs-Tinten gebildet werden durch Zusammengeben von
Druckfarben-Träger-Zusammensetzungen
mit kompatiblen subtraktiven Primär-Färbemitteln. Die subtraktiven
primären
gefärbten
Phasen-Umwandlungs-Tinten können vier
Komponenten-Farbstoffe umfassen, nämlich Cyan, Magenta, Gelb und
Schwarz, obwohl die Tinte nicht auf diese vier Farben beschränkt sind.
Diese subtraktiven Primär-Färbemittel
können
gebildet werden unter Verwendung eines einzigen Farbstoffs oder
einer Mischung von Farbstoffen. Beispielsweise kann Magenta erhalten
werden durch Verwendung einer Mischung aus Solvent Red-Farbstoffen, oder
ein gemischtes Schwarz kann erhalten werden durch Mischen einiger
Farbstoffe. Das US-Patent Nr. 4,889,560, das US-Patent Nr. 4,889,761
und das US-Patent-Nr.
5,372,852 lehren, dass die verwendeten subtraktiven Primär-Färbemittel Farbstoffe
von den Klassen des Color-Index (C.I) Lösungsmittel-Farbstoffe (Solvent
Dyes), Disperse-Farbstoffe (Disperse Dyes), modifizierte saure und
Direkt-Farbstoffe (Acid and Direct Dyes) und basische Farbstoffe (Basic
Dyes) umfassen können.
Die Färbemittel
können
auch Pigmente einschließen,
wie beispielsweise offenbart ist in dem US-Patent Nr. 5,221,335.
Das US-Patent Nr. 5,621,022 offenbart die Verwendung einer speziellen
Klasse von Polymeren von Farbstoffen in Phasen-Umwandlungs-Tinten-(bzw. -Druckfarben-)
Zusammensetzungen.
-
Phasen-Umwandlungs-Tinten
wurden auch verwendet für
Anwendungen wie beispielsweise Postmarken und industrielles Markieren
und Etikettieren.
-
Phasen-Umwandlungs-Tinten
sind wünschenswert
für Tintenstrahl-Drucker,
weil sie bei Raumtemperatur während
des Versands, der Lagerung über
lange Zeit und dergleichen in fester Phase bleiben. Darüber hinaus
werden die Probleme, die mit dem Verstopfen von Düsen als
Ergebnis der Tinten-Verdampfung bei flüssigen Tintenstrahl-Tinten verbunden
sind, in weitem Umfang eliminiert, wodurch die Zuverlässigkeit
des Tintenstrahl-Druckens verbessert wird. Weiter verfestigen sich
in Phasen-Umwandlungs-Tintenstrahl-Druckern,
in denen die Tinten-Tröpfchen
direkt auf das End-Aufzeichnungs-Substrat aufgebracht werden (beispielsweise Papier,
Transparent-Material
und dergleichen), die Tröpfchen
unmittelbar bei Kontakt mit dem Substrat, so dass eine Wanderung
von Druckfarbe bzw. Tinte entlang dem Druckmedium verhindert wird
und die Punkt-Qualität
verbessert wird.
-
Von
möglichem
Hintergrund-Interesse in Bezug auf die vorliegende Erfindung sind
die folgenden Druckschriften: „S.
Wang et al., J. Am. Chem. Soc., Band 120, Seite 5695 (2000)"; sowie die Druckschriften GB-A
1,455,632, EP-A 0 247 737, EP-A 0 319 234, EP-A 0 314 002, EP-A
0 302 401, EP-A 0 268 897.
-
Zwar
sind bekannte Zusammensetzungen und Verfahren geeignet für die für sie beabsichtigten
Zwecke, doch bleibt ein Bedarf für
neue gelbe Färbemittel-Zusammensetzungen.
Darüber
hinaus bleibt ein Bedarf für
gelbe Färbemittel-Zusammensetzungen,
die besonders geeignet sind zur Verwendung in Phasen-Umwandlungs-Tinten
bzw. -Druckfarben. Weiter bleibt ein Bedarf für gelbe Färbemittel mit erwünschter
thermischer Stabilität.
Zusätzlich
bleibt ein Bedarf für
gelbe Färbe mittel,
die nur minimale unerwünschte
Entfärbung zeigen,
wenn sie erhöhten
Temperaturen ausgesetzt werden. Es besteht auch ein Bedarf für gelbe
Färbemittel, die
eine erwünschte
Brillanz (Glanz) zeigen. Weiter besteht ein Bedarf für gelbe
Färbemittel,
die einen erwünschten
Farbton zeigen. Weiter besteht ein Bedarf für gelbe Färbemittel, die von einer gewünschten
Chrominanz sind. Zusätzlich
besteht ein Bedarf für
gelbe Färbemittel,
die erwünschte
hochklassige charakteristische Lichtbeständigkeits-Eigenschaften aufweisen. Ein Bedarf
bleibt auch für
gelbe Färbemittel,
die eine erwünscht
angenehme Farbe aufweisen. Darüber
hinaus bleibt ein Bedarf für
gelbe Färbemittel,
die erwünschte charakteristische
Löslichkeits-Eigenschaften
in Phasen-Übergangs-Tintenträger-Zusammensetzungen
zeigen. Weiter bleibt ein Bedarf für gelbe Färbemittel, die es möglich machen,
dass Phasen-Umwandlungs-Tinten bzw. -Druckfarben bei Temperaturen
oberhalb von 135° C
als Tintenstrahl ausgestoßen
werden, wobei sie trotzdem eine thermische Stabilität beibehalten.
Zusätzlich
bleibt ein Bedarf für
gelbe Färbemittel,
die Phasen-Umwandlungs-Tinten erlauben, die Bilder mit geringer
Polhöhe
erzeugen. Es besteht auch ein Bedarf für gelbe Färbemittel, die Phasen-Umwandlungs-Tinten
zugänglich
machen, die Bilder erzeugen, die sich einer lithographischen Dünnbildqualität annähern. Darüber hinaus
besteht ein Bedarf für
gelbe Färbemittel,
die oxidative Stabilität
zeigen. Weiter besteht ein Bedarf für gelbe Färbemittel, die nicht aus Phasen-Umwandlungs-Tinten-Trägern ausfallen.
Darüber
hinaus besteht ein Bedarf für
gelbe Färbemittel,
die nicht in benachbart gedruckte Farbe unterschiedlicher Färbung diffundieren,
wenn sie in Phasen-Umwandlungs-Tinten bzw. -Druckfarben eingeschlossen
werden. Ein Bedarf bleibt auch für
gelbe Färbemittel,
die nicht aus Medien wie beispielsweise Phasen-Umwandlungs-Tinten-Trägern in
Band-Kleber, Papier
oder dergleichen auslaugen. Darüber
hinaus bleibt ein Bedarf für
gelbe Färbemittel,
die dann, wenn sie in Phasen-Umwandlungs-Tinten eingeschlossen werden,
nicht zu einem Verstopfen eines Phasen-Umwandlungs-Tintenstrahl-Druckkopfs
führen. Weiter
besteht ein Bedarf für
gelbe Färbemittel,
die den Erhalt von Phasen-Umwandlungs-Tinten
bzw. -Druckfarben ermöglichen,
die Bilder mit scharfen Kanten erzeugen, die im Verlauf der Zeit
scharf bleiben. Zusätzlich besteht
ein Bedarf für
gelbe Färbemittel,
die die Herstellung von Phasen-Umwandlungs-Tinten ermöglichen, die
Bilder erzeugen, die ihre hohe Bild-Qualität in warmen Klimazonen beibehalten.
Weiter besteht ein Bedarf für
gelbe Färbemittel,
die die Herstellung von Phasen-Umwandlungs-Tinten bzw. -Druckfarben ermöglichen, die
Bilder in wünschenswert
hoher optischer Dichte erzeugen. Darüber hinaus gibt es einen Bedarf
für gelbe Färbemittel,
die aufgrund ihrer guten Löslichkeit
in Phasen-Umwandlungs-Tinten-Trägern
die Erzeugung von Bildern mit geringer Polhöhe ohne Verlust von wünschenswert
hoher optischer Dichte erlauben. Ein Bedarf bleibt auch für gelbe
Färbemittel,
die die Verwendung von wesentlich reduzierten Mengen von Färbemittel
in beispielsweise einer Tinte bzw. Druckfarbe erlauben, ohne die
Farb- und Spektral-Eigenschaften (L*a*b*) der Druckfarbe zu verringern
oder die optische Dichte oder Farbe der mit der Tinte erzeugten
Bilder bzw. Drucke zu beeinträchtigen.
Darüber
hinaus bleibt ein Bedarf für
gelbe Färbemittel,
die die Herstellung kostengünstiger Tinten
bzw. Druckfarben erlauben.
-
Die
vorliegende Erfindung ist gerichtet auf Verbindungen der Formel
wie sie
in Anspruch 1 definiert sind. Bevorzugte Ausführungsformen sind in den Unteransprüchen beansprucht.
-
Die
vorliegende Erfindung ist gerichtet auf Färbemittel-Verbindungen der
Formel
worin
R
1 steht für (i) eine Alkylen-Gruppe mit
wenigstens 12 Kohlenstoff-Atomen (einschließlich linearer, verzweigter,
gesättigter,
ungesättigter,
zyklischer, unsubstituierter und substituierter Alkylen-Gruppen,
und worin Hetero-Atome wie beispielsweise Sauerstoff, Stickstoff,
Schwefel, Silicium, Phosphor entweder in der Alkylen-Gruppe zugegen
sein können
oder nicht zugegen sein können),
in einer weiteren Ausführungsform
mit wenigstens 14 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 16 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 18 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 20 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 22 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 24 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 26 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 28 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 30 Kohlenstoff-Atomen,
in noch einer weiteren Ausführungsform
mit wenigstens 32 Kohlenstoff-Atomen,
in noch einer weiteren Ausführungsform
mit wenigstens 34 Kohlenstoff-Atomen,
und in noch einer weiteren Ausführungsform
mit wenigstens 36 Kohlenstoff-Atomen,
und in einer Ausführungsform
mit nicht mehr als 200 Kohlenstoff-Atomen, in einer weiteren Ausführungsform
mit nicht mehr als 100 Kohlenstoff-Atomen, in noch einer weiteren
Ausführungsform
mit nicht mehr als 75 Kohlenstoff-Atomen, in noch einer weiteren
Ausführungsform
mit nicht mehr als 60 Kohlenstoff-Atomen, in einer weiteren Ausführungsform
mit nicht mehr als 50 Kohlenstoff-Atomen und in noch einer weiteren
Ausführungsform
mit nicht mehr als 40 Kohlenstoff-Atomen.
-
R1 ist eine lineare Alkylen-Gruppe, die wenigstens
12 Kohlenstoff-Atome aufweist, die eine verzweigte Alkylen-Gruppe,
eine gesättigte
Alkylen-Gruppe, eine ungesättigte
Alkylen-Gruppe sein kann, aliphatische zyklische Einheiten darin
einschließen
kann, eine unsubstituierte Alkylen-Gruppe, eine substituierte Alkylen-Gruppe,
eine Alkylen-Gruppe,
in der Hetero-Atome in der Alkylen-Gruppe vorliegen können, die
gewählt sind
aus Sauerstoff, Stickstoff, Schwefel, Silicium oder Phosphor. Bevorzugt
ist, dass R1 eine Alkylen-Gruppe ist, in
der keine Hetero-Atome in der Alkylen-Gruppe zugegen sind. Es ist
weiter bevorzugt, dass R1 eine Alkylen-Gruppe
mit etwa 36 Kohlenstoff-Atomen
ist. Vorzugsweise ist R1 eine verzweigte
Alkylen-Gruppe mit 36 Kohlenstoff-Atomen, die ungesättigte Stellen und zyklische
Gruppen einschließen
kann.
-
Einige
spezielle Beispiele geeigneter R
1-Gruppen
schließen
ein, sind jedoch nicht beschränkt
auf: N-Hexandiyl der Formel -(CH
2)
6-, n-Octandiyl der Formel -(CH
2)
8-, n-Decandiyl
der Formel -(CH
2)
10-,
n-Dodecandiyl der Formel -(CH
2)
12-,
3-Methyl-1,5-pentandiyl
der Formel
1,4-Cyclohexandimethylen
der Formel (von der beabsichtigt ist, dass sie nicht auf irgendeine
besondere Stereochemie beschränkt
ist und alle cis- und trans-Isomere einschließt)
4,4'-Isopropylidendicyclohexandiyl der Formel
(von der beabsichtigt ist, dass sie nicht auf irgendeine besondere
Stereochemie beschränkt
ist und alle cis- und trans-Isomere einschließt)
4,4'-Bicyclohexandiyl der Formel (von der
beabsichtigt ist, dass sie nicht auf irgendeine besondere Stereochemie
beschränkt
ist und alle cis- und trans-Isomere einschließt)
eine verzweigte Alkylen-Gruppe
mit 36 Kohlenstoff-Atomen, einschließlich der Isomere, der Formel
und andere
verzweigte Alkylen-Isomere (die ungesättigte Stellen und zyklische
Gruppen einschließen
können),
4,8-Bis(methylen-)tricyclo[5210
2,6]decandiyl
der Formel (von der beabsichtigt ist, dass sie nicht auf irgendeine
besondere Stereochemie beschränkt
ist und alle cis- und trans-Isomere einschließt)
-
R
2 und R
2' stehen jeweils
unabhängig
von der jeweils anderen Gruppe für
(i) eine Alkyl-Gruppe (einschließlich linearer, verzweigter,
gesättigter,
ungesättigter,
zyklischer, unsubstituierter und substituierter Alkyl-Gruppen, und
worin Hetero-Atome wie beispielsweise Sauerstoff, Stickstoff, Schwefel,
Silicium, Phosphor entweder in der Alkyl-Gruppe zugegen sein können oder
nicht zugegen sein können),
in einer Ausführungsform
mit wenigstens 1 Kohlenstoff-Atom, in einer weiteren Ausführungsform
mit wenigstens 8 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 10 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 12 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 14 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 16 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 18 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 20 Kohlenstoff-Atomen,
in noch einer weiteren Ausführungsform
mit wenigstens 22 Kohlenstoff-Atomen,
in noch einer weiteren Ausführungsform
mit wenigstens 24 Kohlenstoff-Atomen,
in noch einer weiteren Ausführungsform
mit wenigstens 26 Kohlenstoff-Atomen,
in noch einer weiteren Ausführungsform
mit wenigstens 28 Kohlenstoff-Atomen,
in noch einer weiteren Ausführungsform
mit wenigstens 30 Kohlenstoff-Atomen,
in noch einer weiteren Ausführungsform
mit wenigstens 32 Kohlenstoff-Atomen,
in noch einer weiteren Ausführungsform
mit wenigstens 34 Kohlenstoff-Atomen,
und in noch einer weiteren Ausführungsform
mit wenigstens 36 Kohlenstoff-Atomen,
und in einer Ausführungsform
mit nicht mehr als 200 Kohlenstoff-Atomen, in einer weiteren Ausführungsform
mit nicht mehr als 100 Kohlenstoff-Atomen, in noch einer anderen
Ausführungsform
mit nicht mehr als 75 Kohlenstoff-Atomen, in noch einer weiteren
Ausführungsform mit
nicht mehr als 60, in einer weiteren Ausführungsform mit nicht mehr als
50 Kohlenstoff-Atomen, und in noch weiteren Ausführungsform mit nicht mehr als
40 Kohlenstoff-Atomen, obwohl die Zahl der Kohlenstoff-Atome außerhalb
dieser Bereiche liegen kann; (ii) eine Aryl-Gruppe (einschließlich, unsubstituierter
und substituierter Aryl-Gruppen), in einer Ausführungsform mit wenigstens 6
Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform mit wenigstens 10
Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform mit wenigstens 13 Kohlenstoff-Atomen,
in noch einer weiteren Ausführungsform
mit wenigstens 14 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 16 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 17 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 18 Kohlenstoff-Atomen,
in noch einer weiteren Ausführungsform
mit wenigstens 19 Kohlenstoff Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 20 Kohlenstoff-Atomen,
in noch einer weiteren Ausführungsform
mit wenigstens 21 Kohlenstoff-Atomen,
in noch einer weiteren Ausführungsform
mit wenigstens 22 Kohlenstoff-Atomen,
in noch einer weiteren Ausführungsform
mit wenigstens 23 Kohlenstoff-Atomen,
und in einer weiteren Ausführungsform
mit nicht mehr als 100 Kohlenstoff-Atomen, in noch einer anderen Ausführungsform
mit nicht mehr als 75 Kohlenstoff-Atomen, und in noch einer weiteren Ausführungsform
mit nicht mehr als 50 Kohlenstoff-Atomen, obwohl die Zahl der Kohlenstoff-Atome
außerhalb
dieser Bereiche liegen kann; (iii) eine Arylalkyl-Gruppe (einschließlich, unsubstituierter
und substituierter Arylalkyl-Gruppen) in einer Ausführungsform mit
wenigsten 7 Kohlenstoff-Atomen, in einer weiteren Ausführungsform
mit wenigstens 8 Kohlenstoff-Atomen, in einer weiteren Ausführungsform
mit wenigstens 10 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 12 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 14 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 16 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 18 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 20 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 22 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 24 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 26 Kohlenstoff-Atomen, in einer weiteren Ausführungsform
mit wenigstens 28 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 30 Kohlenstoff-Atomen in noch einer weiteren Ausführungsform
mit wenigstens 32 Kohlenstoff-Atomen, in einer weiteren Ausführungsform
mit wenigstens 34 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 36 Kohlenstoff-Atomen, in einer weiteren Ausführungsform
mit wenigstens 38 Kohlenstoff-Atomen,
in noch einer weiteren Ausführungsform
mit wenigstens 40 Kohlenstoff-Atomen
und in noch einer weiteren Ausführungsform mit
wenigstens 42 Kohlenstoff- Atomen,
und in einer weiteren Ausführungsform
mit nicht mehr als 200 Kohlenstoff-Atomen, in einer anderen Ausführungsform
mit nicht mehr als 100 Kohlenstoff-Atomen, und in noch einer anderen Ausführungsform
mit nicht mehr als 44 Kohlenstoff-Atomen, obwohl die Zahl der Kohlenstoff-Atome außerhalb
dieser Bereiche liegen kann; (iv) eine Alkylaryl-Gruppe (einschließlich, unsubstituierter
und substituierter Alkylaryl-Gruppen) in einer Ausführungsform
mit wenigstens 7 Kohlenstoff-Atomen, in einer weiteren Ausführungsform
mit wenigstens 8 Kohlenstoff-Atomen, in einer weiteren Ausführungsform
mit wenigstens 10 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 12 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 14 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 16 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 18 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 20 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 22 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 24 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 26 Kohlenstoff-Atomen, in einer weiteren Ausführungsform
mit wenigstens 28 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 30 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 32 Kohlenstoff-Atomen, in einer weiteren Ausführungsform
mit wenigstens 34 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 36 Kohlenstoff-Atomen, in einer weiteren Ausführungsform
mit wenigstens 38 Kohlenstoff-Atomen,
in noch einer weiteren Ausführungsform
mit wenigstens 40 Kohlenstoff-Atomen
und in noch einer weiteren Ausführungsform
mit wenigstens 42 Kohlenstoff-Atomen,
und in einer weiteren Ausführungsform
mit nicht mehr als 200 Kohlenstoff-Atomen, in anderen Ausführungsform
mit nicht mehr als 100 Kohlenstoff-Atomen, und in noch einer anderen
Ausführungsform
mit nicht mehr als 44 Kohlenstoff-Atomen, obwohl die Zahl der Kohlenstoff-Atome
außerhalb
dieser Bereiche liegen kann; (v) eine Alkoxy-Gruppe (einschließlich linearer,
verzweigter, gesättigter,
ungesättigter,
zyklischer, unsubstituierter und substituierter Alkoxy-Gruppen,
und worin Hetero-Atome wie beispielsweise Sauerstoff, Stickstoff,
Schwefel, Silicium, Phosphor entweder in dem Alkyl-Abschnitt der
Alkoxy-Gruppe zugegen sein können
oder nicht zugegen sein können),
in einer Ausführungsform
mit wenigstens 1 Kohlenstoff-Atom, in einer weiteren Ausführungsform mit
wenigstens 8 Kohlenstoff-Atomen, in einer weiteren Ausführungsform
mit wenigstens 10 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 12 Kohlenstoff Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 14 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 16 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 18 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 20 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 22 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 24 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 26 Kohlenstoff-Atomen, in einer weiteren Ausführungsform
mit wenigstens 28 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform mit
wenigstens 30 Kohlenstoff Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 32 Kohlenstoff-Atomen, in einer weiteren Ausführungsform
mit wenigstens 34 Kohlenstoff-Atomen, und in noch einer weiteren
Ausführungsform
mit wenigstens 36 Kohlenstoff-Atomen, und in einer weiteren Ausführungsform
mit nicht mehr als 200 Kohlenstoff-Atomen, in einer weiteren Ausführungsform
mit nicht mehr als 100 Kohlenstoff-Atomen, in noch einer anderen
Ausführungsform
mit nicht mehr als 75 Kohlenstoff-Atomen, in noch einer anderen
Ausführungsform
mit nicht mehr als 60 Kohlenstoff-Atomen, in noch einer anderen
Ausführungsform mit
nicht mehr als 50 Kohlenstoff-Atomen und in noch einer weiteren
Ausführungsform
mit nicht mehr als 40 Kohlenstoff-Atomen, obwohl die Zahl der Kohlenstoff-Atome
außerhalb
dieser Bereiche liegen kann; (vi) eine Aryloxy-Gruppe (einschließlich, unsubstituierter
und substituierter Aryloxy-Gruppen), in einer Ausführungsform mit
wenigstens 6 Kohlenstoff-Atomen,
in einer weiteren Ausführungsform
mit wenigstens 10 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 13 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 14 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 16 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 17 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 18 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 19 Kohlenstoff-Atomen, in noch einer weiteren Ausfüh rungsform
mit wenigstens 20 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 21 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 22 Kohlenstoff-Atomen, und in noch einer weiteren
Ausführungsform
mit wenigstens 23 Kohlenstoff-Atomen, und in einer weiteren Ausführungsform
mit nicht mehr als 100 Kohlenstoff Atomen, in einer anderen Ausführungsform
mit nicht mehr als 75 Kohlenstoff-Atomen, und in noch einer anderen
Ausführungsform
mit nicht mehr als 50 Kohlenstoff-Atomen, obwohl die Zahl der Kohlenstoff-Atome
außerhalb
dieser Bereiche liegen kann; (vii) eine Arylalkyloxy-Gruppe (einschließlich, unsubstituierter
und substituierter Arylalkyloxy-Gruppen), in einer Ausführungsform
mit wenigstens 7 Kohlenstoff-Atomen, in einer weiteren Ausführungsform
mit wenigstens 8 Kohlenstoff-Atomen, in einer weiteren Ausführungsform
mit wenigstens 10 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 12 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 14 Kohlenstoff-Atomen,
in noch einer weiteren Ausführungsform
mit wenigstens 16 Kohlenstoff-Atomen,
in noch einer weiteren Ausführungsform
mit wenigstens 18 Kohlenstoff-Atomen,
in noch einer weiteren Ausführungsform
mit wenigstens 20 Kohlenstoff-Atomen,
in noch einer weiteren Ausführungsform
mit wenigstens 22 Kohlenstoff-Atomen,
in noch einer weiteren Ausführungsform
mit wenigstens 24 Kohlenstoff-Atomen,
in noch einer weiteren Ausführungsform
mit wenigstens 26 Kohlenstoff-Atomen,
in einer weiteren Ausführungsform
mit wenigstens 28 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 30 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 32 Kohlenstoff-Atomen, in einer weiteren Ausführungsform
mit wenigstens 34 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 36 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 38 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 40 Kohlenstoff-Atomen, und in noch einer weiteren
Ausführungsform
mit wenigstens 42 Kohlenstoff-Atomen, und in einer weiteren Ausführungsform
mit nicht mehr als 200 Kohlenstoff-Atomen, in einer weiteren Ausführungsform
mit nicht mehr als 100 Kohlenstoff-Atomen und in noch einer weiteren
Ausführungsform
mit nicht mehr als 44 Kohlenstoff-Atomen, obwohl die Zahl der Kohlenstoff-Atome außerhalb
dieser Bereiche liegen kann; (viii) eine Alkylaryloxy-Gruppe (ein schließlich, unsubstituierter
und substituierter Alkylaryloxy-Gruppen), in einer Ausführungsform
mit wenigstens 7 Kohlenstoff-Atomen, in einer weiteren Ausführungsform
mit wenigstens 8 Kohlenstoff Atomen, in einer weiteren Ausführungsform
mit wenigstens 10 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 12 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 14 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 16 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 18 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 20 Kohlenstoff-Atomen,
in noch einer weiteren Ausführungsform
mit wenigstens 22 Kohlenstoff-Atomen,
in noch einer weiteren Ausführungsform
mit wenigstens 24 Kohlenstoff-Atomen,
in noch einer weiteren Ausführungsform
mit wenigstens 26 Kohlenstoff Atomen, in einer weiteren Ausführungsform
mit wenigstens 28 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 30 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 32 Kohlenstoff-Atomen, in einer weiteren Ausführungsform
mit wenigstens 34 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 36 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 38 Kohlenstoff-Atomen, in noch einer weiteren Ausführungsform
mit wenigstens 40 Kohlenstoff-Atomen, und in noch einer weiteren
Ausführungsform
mit wenigstens 42 Kohlenstoff-Atomen, und in einer weiteren Ausführungsform
mit nicht mehr als 200 Kohlenstoff-Atomen, in einer weiteren Ausführungsform
mit nicht mehr als 100 Kohlenstoff-Atomen und in noch einer weiteren
Ausführungsform
mit nicht mehr als 44 Kohlenstoff-Atomen, obwohl die Zahl der Kohlenstoff-Atome außerhalb
dieser Bereiche liegen kann; (ix) eine Polyalkylenoxy-Gruppe worin
der Alkyl-Teil der wiederkehrenden Alkylenoxy-Gruppen typischerweise
1 bis 12 Kohlenstoff-Atome aufweist, obwohl die Zahl von Kohlenstoff-Atomen
außerhalb
dieser Bereiche liegen kann, wie beispielsweise eine Polyethylenoxy-Gruppe,
eine Polypropylenoxy-Gruppe, eine Polybutylenoxy-Gruppe, und worin
die Zahl der wiederkehrenden Alkylenoxy-Gruppen typischerweise 2
bis 50 wiederkehrende Alkylenoxy-Gruppen ist, obwohl die Zahl der
wiederkehrenden Einheiten außerhalb
dieser Bereiche liegen kann; (x) eine Polyarylenoxy-Gruppe, worin
der Aryl-Teil der wiederkehrenden Arylenoxy-Gruppen typischerweise 6 bis 14 Kohlenstoff-Atomen
aufweist, obwohl die Zahl an Kohlenstoff-Atomen außerhalb
dieser Bereiche liegen kann, wie beispielsweise eine Polyphenylenoxy-Gruppe,
eine Polynaphthalinoxy-Gruppe, eine Polyphenanthrenoxy-Gruppe, und worin
die Zahl der wiederkehrenden Arylenoxy-Gruppen typischerweise 2 bis
20 wiederkehrende Arylenoxy-Gruppen ist, obwohl die Zahl von wiederkehrenden
Einheiten außerhalb
dieser Bereiche liegen kann; (xi) eine Polyarylalkylenoxy-Gruppe,
worin der Arylalkyl-Abschnitt der wiederkehrenden Arylalkylenoxy-Gruppen
typischerweise 7 bis 50 Kohlenstoff-Atome aufweist, obwohl die Zahl
von Kohlenstoff-Atomen
außerhalb
dieser Bereiche liegen kann, wie beispielsweise eine Polybenzylenoxy-Gruppe,
eine Polyphenylethylenoxy-Gruppe, und worin die Zahl der wiederkehrenden
Arylalkylenoxy-Gruppen typischerweise 2 bis 20 wiederkehrende Arylalkylenoxy-Gruppen
ist, obwohl die Zahl von wiederkehrenden Einheiten außerhalb
dieser Bereiche liegen kann; (xii) eine Polyalkylarylenoxy-Gruppe,
worin der Alkylaryl-Abschnitt
der wiederkehrenden Alkylarylenoxy-Gruppen typischerweise 7 bis
50 Kohlenstoff-Atome aufweist, obwohl die Zahl von Kohlenstoff-Atomen
außerhalb
dieser Bereiche liegen kann, wie beispielsweise eine Polytoluoloxy-Gruppe,
und worin die Zahl der wiederkehrenden Alkylarylenoxy-Gruppen typischerweise
2 bis 20 wiederkehrende Alkylarylenoxy-Gruppen ist, obwohl die Zahl
von wiederkehrenden Einheiten außerhalb dieser Bereiche liegen
kann; (xiii) eine heterozyklische Gruppe (einschließlich, unsubstituierter
und substituierter heterozyklischer Gruppen), typischerweise mit
2 bis 12 Kohlenstoff-Atomen und typischerweise mit 4 bis 18 Ring-Atomen,
obwohl die Zahl von Kohlenstoff-Atomen und die Zahl von Ring-Atomen
außerhalb
dieser Bereiche liegen kann, worin die Hetero-Atome in den heterozyklischen
Gruppen sein können
(jedoch nicht beschränkt
sind auf) Stickstoff, Sauerstoff, Schwefel, Silicium, Phosphor sowie
Mischungen daraus; (xiv) eine Silyl-Gruppe (einschließlich, unsubstituierter
und substituierter Silyl-Gruppen); (xv) eine Siloxan-Gruppe (einschließlich, unsubstituierter
und substituierter Siloxan-Gruppen); (xvi) eine Polysilylen-Gruppe
(einschließlich, unsubstituierter
und substituierter Polysilylen-Gruppen), typischerweise mit 2 bis
100 wiederkehrenden Silylen-Einheiten; (xvii) eine Polysiloxan-Gruppe
(einschließlich,
unsubstituierter und substituierter Polysiloxan-Gruppen), typischerweise
mit 2 bis 200 wiederkehrenden Siloxan-Einheiten, obwohl die Zahl
wiederkehrender Siloxan-Einheiten
außerhalb
dieses Bereichs liegen kann; oder (xviii) eine Gruppe der Formel
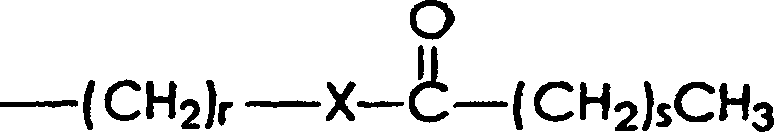
worin r eine ganze Zahl ist,
die die Zahl von wiederkehrenden -CH
2-Gruppen
wiedergibt, die in einer Ausführungsform
wenigstens 1 ist, in einer weiteren Ausführungsform wenigstens 5 ist
und in noch einer weiteren Ausführungsform
wenigstens 10 ist, und in einer Ausführungsform nicht mehr als 100
ist, in einer weiteren Ausführungsform
nicht mehr als 50 ist, und in noch einer weiteren Ausführungsform
nicht mehr als 25 ist, obwohl der Wert von r außerhalb dieser Bereiche liegen
kann; und worin s eine ganze Zahl ist, die die Zahl von wiederkehrenden
-CH
2-Gruppen wiedergibt, die in einer Ausführungsform
wenigstens 1 ist, in einer weiteren Ausführungsform wenigstens 5 ist,
und in einer noch weiteren Ausführungsform
wenigstens 10 ist, und die in einer Ausführungsform nicht größer als
100 ist, in einer weiteren Ausführungsform
nicht größer als
50 ist, und in einer noch weiteren Ausführungsform nicht größer als
25 ist, obwohl der Wert von s außerhalb dieser Bereiche liegen
kann, worin die Substituenten an den substituierten Alkyl-, Aryl-,
Arylalkyl-, Alkylaryl-, Alkoxy-, Aryloxy-, Arylalkyloxy-, Alkylaryloxy-,
Polyalkylenoxy-, Polyarylenoxy-, Polyarylalkylenoxy-, Polyalkylarylenoxy-,
heterozyklischen, Silyl-, Siloxy-, Polysilylen- und Polysiloxy-Gruppen
sind: Hydroxy-Gruppen, Halogen-Atome, Cyano-Gruppen, Ether-Gruppen,
Aldehyd-Gruppen,
Keton-Gruppen, Carbonsäure-Gruppen,
Ester-Gruppen, Amid-Gruppen, Carbonyl-Gruppen, Thiocarbonyl-Gruppen,
Sulfat-Gruppen, Sulfonat-Gruppen, Sulfid-Gruppen, Sulfoxid-Gruppen, Phosphat-Gruppen,
Nitril-Gruppen, Mercapto-Gruppen, Nitro-Gruppen, Nitroso-Gruppen,
Sulfon-Gruppen, Acyl-Gruppen, Säureanhydrid-Gruppen, Azid-Gruppen,
Cyanato-Gruppen, Isocyanato-Gruppen, Thiocyanato-Gruppen, Isothiocyanato-Gruppen, Mischungen
daraus, worin die Substituenten in den Silylen-, Siloxy-, Polysilylen-
und Polysiloxy-Gruppen auch sein können: Alkyl-Gruppen, Aryl-Gruppen, Arylalkyl-Gruppen
und Alkylaryl-Gruppen, worin zwei oder mehr Substituenten miteinander
unter Bildung eines Rings verbunden sein können und worin R
2 und
R
2' gleich
zueinander oder voneinander verschieden sein können.
-
Vorzugsweise
sind R2 und R2' jeweils unabhängig voneinander
lineare Alkyl-Gruppen. Bevorzugt ist auch, dass R2 und
R2' jeweils
unabhängig
voneinander verzweigte Alkyl-Gruppen
sind. Weiter bevorzugt ist, dass R2 und
R2' jeweils
unabhängig
voneinander gesättigte
Alkyl-Gruppen sind. Es ist weiter bevorzugt, dass R2 und
R2' jeweils
unabhängig
voneinander ungesättigte
Alkyl-Gruppen sind. Auch bevorzugt sind R2 und
R2' jeweils
unabhängig
voneinander Alkyl-Gruppen, die darin aliphatische zyklische Einheiten
einschließen.
Weiter bevorzugt ist, dass R2 und R2' jeweils
unabhängig
voneinander ungesättigte
Alkyl-Gruppen sind. Vorzugsweise sind R2 und
R2' jeweils
unabhängig
voneinander substituierte Alkyl-Gruppen. Es ist weiter bevorzugt, dass
R2 und R2' jeweils unabhängig voneinander
Alkyl-Gruppen sind, in denen Hetero-Atome in den Alkyl-Gruppen zugegen
sind, die gewählt
sind aus Sauerstoff, Stickstoff, Schwefel, Silicium oder Phosphor.
Auch bevorzugt ist, dass R2 und R2' jeweils
unabhängig
voneinander Alkyl-Gruppen sind, in denen keine Hetero-Atome in den
Alkyl-Gruppen zugegen sind. Weiter bevorzugt sind R2 und
R2' jeweils
unabhängig
voneinander Alkyl-Gruppen
mit wenigstens 8 Kohlenstoff-Atomen. Auch bevorzugt ist, dass R2 und R2' jeweils unabhängig voneinander
Alkyl-Gruppen mit wenigstens 12 Kohlenstoff-Atomen sind.
-
Vorzugsweise
sind R2 und R2' jeweils unabhängig voneinander
Aryl-Gruppen mit wenigstens 10 Kohlenstoff-Atomen, Arylalkyl-Gruppen
mit wenigstens 10 Kohlenstoff-Atomen,
Alkylaryl-Gruppen mit wenigstens 10 Kohlenstoff-Atomen, Alkoxy-Gruppen
mit wenigstens 8 Kohlenstoff-Atomen, Aryloxy-Gruppen mit wenigstens
10 Kohlenstoff-Atomen, Arylalkyoxy-Gruppen mit wenigstens 10 Kohlenstoff-Atomen,
Alkylaryloxy-Gruppen mit wenigstens 10 Kohlenstoff-Atomen, Polyalkylenoxy-Gruppen,
in denen der Alkyl-Teil der wiederkehrenden Alkylenoxy-Gruppen 1
bis 12 Kohlenstoff-Atome
aufweist und worin die Zahl der wiederkehrenden Alkylenoxy-Gruppen
2 bis 50 wiederkehrende Alkylenoxy-Gruppen ist, Polyarylenoxy-Gruppen,
in denen der Aryl-Teil
der wiederkehrenden Arylenoxy-Gruppen 6 bis 14 Kohlenstoff-Atome
aufweist und worin die Zahl der wiederkehrenden Arylenoxy-Gruppen
2 bis 20 wiederkehrende Arylenoxy-Gruppen ist, Polyarylalkylenoxy-Gruppen,
worin der Arylalkyl-Teil der wiederkehrenden Arylalkylenoxy-Gruppen
7 bis 50 Kohlenstoff-Atome aufweist und worin die Zahl der wiederkehrenden
Arylalkylenoxy-Gruppen typischerweise 2 bis 20 wiederkehrende Arylalkylenoxy-Gruppen
ist, Polyalkylarylenoxy-Gruppen, worin der Alkylaryl-Teil der wiederkehrenden Alkylarylenoxy-Gruppen
7 bis 50 Kohlenstoff-Atome
aufweist und worin die Zahl der wiederkehrenden Alkylarylenoxy-Gruppen
2 bis 20 wiederkehrende Alkylarylenoxy-Gruppen ist, eine heterozyklische
Gruppe mit 2 bis 12 Kohlenstoff-Atomen und mit 4 bis 18 Ring-Atomen,
worin die Hetero-Atome in den heterozyklischen Gruppen Stickstoff,
Sauerstoff, Schwefel, Silicium oder Phosphor sind, eine Silyl-Gruppe,
eine Siloxan-Gruppe, eine Polysilylen-Gruppe mit 2 bis 100 wiederkehrende
Silylen-Einheiten oder eine Polysiloxan-Gruppe mit 2 bis 200 wiederkehrenden
Siloxan-Einheiten.
-
Einige
spezielle Beispiele geeigneter Gruppen R
2 und
R
2' schließen ein
(sind jedoch nicht beschränkt auf):
Ethyl der Formel -CH
2CH
3,
n-Butyl der Formel -(CH
2)
3CH
3, n-Octyl
der Formel -(CH
2)
7CH
3, n-Decyl der Formel -(CH
2)
9CH
3, n-Dodecyl der
Formel -(CH
2)
11CH
3, n-Tetradecyl der Formel -(CH
2)
13CH
3, Cetyl der
Formel -(CH
2)
15CH
3, Stearyl der Formel -(CH
2)
17CH
3, 2-Ethylhexyl
der Formel
Abietyl einschließlich Gruppen
der Formel
sowie hydrierte und dehydrierte
Isomere der obigen Formel, die auch Derivate des von Kollophonium-Harz
abgeleiteten Naturprodukts Abietinsäure sind, wie beispielsweise
Didehydroabietyl, 3-Propyloctadecanoyl der Formel
2,2-Dimethyl-1,3-dioxolan-4-methylen
der Formel
-
R3 und R3' steht jeweils
unabhängig
von der jeweils anderen Gruppe für:
(i) eine Alkyl-Gruppe
(einschließlich
linearer, verzweigter, gesättigter,
ungesättigter,
zyklischer, unsubstituierter und substituierter Alkyl-Gruppen, und
worin Hetero-Atome wie beispielsweise Sauerstoff, Stickstoff, Schwefel,
Silicium, Phosphor und dergleichen entweder in der Alkyl-Gruppe
zugegen sein können
oder nicht zugegen sein können)
typischerweise mit 1 bis 100 Kohlenstoff-Atomen, vorzugsweise mit
1 bis 10 Kohlenstoff-Atomen,
und noch mehr bevorzugt mit 1 bis 5 Kohlenstoff-Atomen, obwohl die
Zahl von Kohlenstoff-Atomen außerhalb
dieser Bereiche liegen kann; (ii) eine Aryl-Gruppe (einschließlich unsubstituierter
und substituierter Aryl-Gruppen), typischerweise mit 6 bis 100 Kohlenstoff-Atomen
und vorzugsweise mit 6 bis 10 Kohlenstoff-Atomen, obwohl die Zahl von
Kohlenstoff-Atomen außerhalb
dieser Bereiche liegen kann; (iii) eine Arylalkyl-Gruppe (einschließlich unsubstituierter
und substituierter Arylalkyl-Gruppen),
typischerweise mit 7 bis 100 Kohlenstoff-Atomen und vorzugsweise
mit 7 bis 10 Kohlenstoff-Atomen, obwohl die Zahl von Kohlenstoff-Atomen
außerhalb
dieser Bereiche liegen kann; oder (iv) eine Alkylaryl-Gruppe (einschließlich unsubstituierter
und substituierter Alkylaryl-Gruppen), typischerweise mit 7 bis
100 Kohlenstoff Atomen und vorzugsweise mit 7 bis 10 Kohlenstoff
Atomen, obwohl die Zahl von Kohlenstoff-Atomen außerhalb
dieser Bereiche liegen kann, und worin die Substituenten an den
substituierten Alkyl-, Aryl-, Arylalkyl- und Alkylaryl-Gruppen sein
können
(jedoch nicht beschränkt sind
auf) Hydroxy-Gruppen, Halogen-Atome, Amin-Gruppen, Imin-Gruppen, Ammonium-Gruppen,
Pyridin-Gruppen, Pyridinium-Gruppen, Ether-Gruppen, Aldehyd-Gruppen, Ester-Gruppen,
Amid-Gruppen, Carbonyl-Gruppen, Thiocarbonyl-Gruppen, Sulfat-Gruppen,
Sulfonat-Gruppen, Sulfid-Gruppen, Sulfoxid-Gruppen, Phosphin-Gruppen, Phosphonium-Gruppen,
Phosphat-Gruppen, Nitril-Gruppen,
Mercapto-Gruppen, Nitro-Gruppen, Nitroso-Gruppen, Sulfon-Gruppen,
Acyl-Gruppen, Säureanhydrid-Gruppen,
Azid-Gruppen, Cyanato-Gruppen, Isocyanato-Gruppen, Thiocyanato-Gruppen, Isothiocyanato-Gruppen,
Mischungen daraus, worin zwei oder mehr Substituenen miteinander
unter Bildung eines Rings verbunden sein können und worin R3 und
R3' gleich
miteinander sein können
oder voneinander verschieden sein können.
-
Spezielle
Beispiele geeigneter Gruppen R3 und R3' schließen ein:
Methyl (-CH3), lineare Alkyl-Gruppen der
Formel -(CH2)cCH3, worin c eine ganze Zahl von 1, 2, 3, 4,
5, 6, 7, 8 oder 9 ist.
-
X
und X' stehen jeweils
abhängig
vom jeweils anderen Rest für:
(i) eine direkte Bindung; (ii) ein Sauerstoff-Atom; (iii) ein Schwefel-Atom;
(iv) eine Gruppe der Formel -NR40-, worin
R40 steht für ein Wasserstoff-Atom, eine
Alkyl-Gruppe (einschließlich
linearer, verzweigter, gesättigter,
ungesättigter,
zyklischer, unsubstituierter und substituierter Alkyl-Gruppen, und
worin Hetero-Atome wie beispielsweise Sauerstoff, Stickstoff, Schwefel,
Silicium, Phosphor und dergleichen entweder in der Alkyl-Gruppe
zugegen sein können
oder nicht zugegen sein können),
typischerweise mit 1 bis 50 Koh lenstoff-Atomen, vorzugsweise mit
2 bis 20 Kohlenstoff-Atomen und noch mehr bevorzugt mit 4 bis 12
Kohlenstoff-Atomen, obwohl die Zahl von Kohlenstoff-Atomen außerhalb
dieser Bereiche liegen kann; eine Aryl-Gruppe (einschließlich substituierter
Aryl-Grupen), typischerweise mit 6 bis 50 Kohlenstoff-Atomen, vorzugsweise
mit 6 bis 20 Kohlenstoff Atomen und noch mehr bevorzugt mit 6 bis
10 Kohlenstoff-Atomen, obwohl die Zahl von Kohlenstoff-Atomen außerhalb
dieser Bereiche liegen kann; eine Arylalkyl-Gruppe (einschließlich substituierter
Arylalkyl-Gruppen), typischerweise mit 7 bis 100 Kohlenstoff-Atomen,
vorzugsweise mit 7 bis 50 Kohlenstoff-Atomen und noch mehr bevorzugt
mit 7 bis 20 Kohlenstoff-Atomen, obwohl die Zahl von Kohlenstoff-Atomen
außerhalb
dieser Bereiche liegen kann; oder eine Alkylaryl-Gruppe (einschließlich substituierter
Alkylaryl-Gruppen), typischerweise mit 7 bis 100 Kohlenstoff Atomen,
vorzugsweise mit 7 bis 50 Kohlenstoff-Atomen und noch mehr bevorzugt
mit 7 bis 20 Kohlenstoff-Atomen, obwohl die Zahl von Kohlenstoff-Atomen
außerhalb
dieser Bereiche liegen kann; oder (v) eine Gruppe der Formel -CR50R60-, worin R50 und R60 jeweils
unabhängig
von der anderen Gruppen stehen für
ein Wasserstoff-Atom, eine Alkyl-Gruppe (einschließlich linearer,
verzweigter, gesättigter,
ungesättigter,
zyklischer, unsubstituierter und substituierter Alkyl-Gruppen, und
worin Hetero-Atome wie beispielsweise Sauerstoff, Stickstoff, Schwefel,
Silicium, Phosphor entweder in der Alkyl-Gruppe zugegen sein können oder
nicht zugegen sein können),
typischerweise mit 1 bis 50 Kohlenstoff-Atomen, vorzugsweise mit
2 bis 20 Kohlenstoff-Atomen und noch mehr bevorzugt mit 4 bis 12
Kohlenstoff-Atomen, obwohl die Zahl von Kohlenstoff-Atomen außerhalb
dieser Bereiche liegen kann; eine Aryl-Gruppe (einschließlich substituierter
Aryl-Gruppen), typischerweise mit 6 bis 50 Kohlenstoff-Atomen, vorzugsweise
mit 6 bis 20 Kohlenstoff-Atomen und noch mehr bevorzugt mit 6 bis
10 Kohlenstoff-Atomen,
obwohl die Zahl von Kohlenstoff-Atomen außerhalb dieser Bereiche liegen
kann; eine Arylalkyl-Gruppe (einschließlich substituierter Arylalkyl-Gruppen),
typischerweise mit 7 bis 100 Kohlenstoff-Atomen, vorzugsweise mit
7 bis 50 Kohlenstoff-Atomen
und noch mehr bevorzugt mit 7 bis 20 Kohlenstoff-Atomen, obwohl
die Zahl von Kohlenstoff-Atomen außerhalb dieser Bereiche liegen
kann; oder eine Alkylaryl-Gruppe
(einschließlich
substituierter Alkylaryl-Gruppen), typischerweise mit 7 bis 100
Kohlenstoff-Atomen, bevorzugt mit 7 bis 50 Kohlenstoff-Atomen und
noch mehr be vorzugt mit 7 bis 20 Kohlenstoff-Atomen, obwohl die
Zahl von Kohlenstoff-Atomen außerhalb
dieser Bereiche liegen kann, worin die Substituenten an den substituierten
Alkyl-, Aryl-, Arylalkyl-, und Alkyaryl-Gruppen sein können (jedoch
nicht beschränkt
sind auf): Hydroxy-Gruppen, Halogen-Atome, Amin-Gruppen, Imin-Gruppen,
Ammonium-Gruppen, Pyridin-Gruppen, Pyridinium-Gruppen, Ether-Gruppen,
Aldehyd-Gruppen,
Ester-Gruppen, Amid-Gruppen, Carbonyl-Gruppen, Thiocarbonyl-Gruppen,
Sulfat-Gruppen, Sulfonat-Gruppen, Sulfid-Gruppen, Sulfoxid-Gruppen,
Phosphin-Gruppen,
Phosphonium-Gruppen, Phosphat-Gruppen, Nitril-Gruppen, Mercapto-Gruppen, Nitro-Gruppen,
Nitroso-Gruppen, Sulfon-Gruppen, Acyl-Gruppen, Säureanhydrid-Gruppen, Azid-Gruppen,
Cyanato-Gruppen, Isocyanato-Gruppen, Thiocyanato-Gruppen, Isothiocyanato-Gruppen, Mischungen
daraus, worin zwei oder mehr Substituenten miteinander unter Bildung
eines Rings verbunden sein können
und worin X und X' gleich
miteinander sein können
oder voneinander verschieden sein können.
-
Die
Reste Z und Z' stehen
jeweils unabhängig
von dem jeweils anderen Rest für
(i) ein Wasserstoff-Atom; (ii) ein Halogen-Atom, einschließlich Fluor,
Chlor, Brom und Iod; (iii) eine Nitro-Gruppe; (iv) eine Alkyl-Gruppe
(einschließlich
linearer, verzweigter, gesättigter,
ungesättigter,
zyklischer, unsubstituierter und substituierter Alkyl-Gruppen, und
worin Hetero-Atome wie beispielsweise Sauerstoff, Stickstoff, Schwefel,
Silicium und Phosphor entweder in der Alkyl-Gruppe zugegen sein
können
oder nicht zugegen sein können),
typischerweise mit 1 bis 50 Kohlenstoff-Atomen, vorzugsweise mit
1 bis 20 Kohlenstoff-Atomen und noch mehr bevorzugt mit 1 bis 10
Kohlenstoff-Atomen, obwohl die Zahl von Kohlenstoff-Atomen außerhalb
dieser Bereiche liegen kann; (v) eine Aryl-Gruppe (einschließlich substituierter
Aryl-Gruppen), typischerweise mit 6 bis 50 Kohlenstoff-Atomen, vorzugsweise
mit 6 bis 14 Kohlenstoff-Atomen und noch mehr bevorzugt mit 6 bis
10 Kohlenstoff-Atomen, obwohl die Zahl von Kohlenstoff-Atomen außerhalb
dieser Bereiche liegen kann; (vi) eine Arylalkyl-Gruppe (einschließlich substituierter
Arylalkyl-Gruppen), typischerweise mit 7 bis 50 Kohlenstoff Atomen, vorzugsweise
mit 7 bis 25 Kohlenstoff-Atomen und noch mehr bevorzugt mit 7 bis
15 Kohlenstoff-Atomen, obwohl die Zahl von Kohlenstoff-Atomen außerhalb
dieser Bereiche liegen kann; (vii) eine Alkylaryl-Gruppe (einschließlich substituierter
Alkylaryl- Gruppen),
typischerweise mit 7 bis 50 Kohlenstoff-Atomen, vorzugsweise mit
7 bis 25 Kohlenstoff Atomen und noch mehr bevorzugt mit 7 bis 15
Kohlenstoff Atomen, obwohl die Zahl von Kohlenstoff-Atomen außerhalb
dieser Bereiche liegen kann; (viii) eine Gruppe der Formel
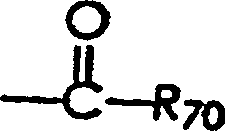
worin R
70 eine
Alkyl-Gruppe ist (einschließlich
linearer, verzweigter, gesättigter,
ungesättigter,
zyklischer, unsubstituierter und substituierter Alkyl-Gruppen, und
worin Hetero-Atome wie beispielsweise Sauerstoff, Stickstoff, Schwefel,
Silicium, Phosphor und dergleichen entweder in der Alkyl-Gruppe
zugegen sein können
oder nicht zugegen sein können),
typischerweise mit 1 bis 50 Kohlenstoff-Atomen, vorzugsweise mit
1 bis 20 Kohlenstoff-Atomen und noch mehr bevorzugt mit 1 bis 10
Kohlenstoff Atomen, obwohl die Zahl von Kohlenstoff-Atomen außerhalb
dieser Bereiche liegen kann; eine Aryl-Gruppe (einschließlich substituierter
Aryl-Gruppen), typischerweise mit 6 bis 50 Kohlenstoff-Atomen, vorzugsweise
mit 6 bis 20 Kohlenstoff-Atomen und noch mehr bevorzugt mit 6 bis
14 Kohlenstoff-Atomen, obwohl die Zahl von Kohlenstoff-Atomen außerhalb
dieser Bereiche liegen kann; eine Arylalkyl-Gruppe (einschließlich substituierter
Arylalkyl-Gruppen), typischerweise mit 7 bis 50 Kohlenstoff-Atomen,
vorzugsweise mit 7 bis 25 Kohlenstoff-Atomen und noch mehr bevorzugt
mit 7 bis 15 Kohlenstoff-Atomen, obwohl die Zahl von Kohlenstoff-Atomen
außerhalb
dieser Bereiche liegen kann; eine Alkylaryl-Gruppe (einschließlich substituierter
Alkylaryl-Gruppen), typischerweise mit 7 bis 50 Kohlenstoff-Atomen,
vorzugsweise mit 7 bis 25 Kohlenstoff-Atomen und noch mehr bevorzugt mit 7
bis 15 Kohlenstoff-Atomen, obwohl die Zahl von Kohlenstoff-Atomen
außerhalb
dieser Bereiche liegen kann; eine Alkoxy-Gruppe (einschließlich linearer,
verzweigter, gesättigter,
ungesättigter,
zyklischer, unsubstituierter und substituierter Alkoxy-Gruppen,
und worin Hetero-Atome wie beispielsweise Sauerstoff, Stickstoff,
Schwefel, Silicium, und Phosphor entweder in dem Alkyl-Teil der
Alkoxy-Gruppe zugegen sein können
oder nicht zugegen sein können),
typischerweise mit 1 bis 50 Kohlenstoff-Atomen, vorzugsweise mit
4 bis 20 Kohlenstoff-Atomen und noch mehr bevorzugt mit 8 bis 12
Kohlenstoff-Atomen, obwohl die Zahl von Kohlenstoff-Atomen außerhalb dieser
Bereiche liegen kann; eine Aryloxy-Gruppe (einschließlich substituierter
Aryloxy-Gruppen), typischerweise mit 6 bis 50 Kohlenstoff-Atomen, vorzugsweise
mit 6 bis 20 Kohlenstoff-Atomen und noch mehr bevorzugt mit 6 bis
14 Kohlenstoff-Atomen, obwohl die Zahl von Kohlenstoff-Atomen außerhalb
dieser Bereiche liegen kann; eine Arylalkyloxy-Gruppe (einschließlich substituierter
Arylalkyloxy-Gruppen), typischerweise mit 7 bis 50 Kohlenstoff-Atomen,
vorzugsweise mit 7 bis 25 Kohlenstoff-Atomen und noch mehr bevorzugt
mit 7 bis 15 Kohlenstoff-Atomen,
obwohl die Zahl von Kohlenstoff-Atomen außerhalb dieser Bereiche liegen
kann; eine Alkylaryloxy-Gruppe (einschließlich substituierter Alkylaryloxy-Gruppen),
typischerweise mit 7 bis 50 Kohlenstoff-Atomen, vorzugsweise mit
7 bis 25 Kohlenstoff-Atomen und noch mehr bevorzugt mit 7 bis 15
Kohlenstoff-Atomen, obwohl die Zahl von Kohlenstoff-Atomen außerhalb
dieser Bereiche liegen kann; eine Polyalkylenoxy-Gruppe, in der
der Alkyl-Teil der wiederkehrenden Alkylenoxy-Gruppen typischerweise
1 bis 12 Kohlenstoff-Atome aufweisen kann, obwohl die Zahl von Kohlenstoff-Atomen
außerhalb
dieser Bereiche liegen kann, wie beispielsweise eine Polyethylenoxy-Gruppe,
eine Polypropylenoxy-Gruppe, eine Polybutylenoxy-Gruppe, und worin
die Zahl an wiederkehrenden Alkylenoxy-Gruppen typischerweise 2
bis 50 wiederkehrende Alkylenoxy-Gruppen ist, obwohl die Zahl an
wiederkehrenden Einheiten außerhalb
dieser Bereiche liegen kann; eine Polyarylenoxy-Gruppe, worin der
Aryl-Teil der wiederkehrenden Arylenoxy-Gruppen typischerweise 6
bis 14 Kohlenstoff-Atome aufweist, obwohl die Zahl von Kohlenstoff
Atomen außerhalb
dieser Bereiche liegen kann, wie beispielsweise eine Polyphenylenoxy-Gruppe,
eine Polynaphthalinoxy-Gruppe, eine Polyphenanthrenoxy-Gruppe, und
worin die Zahl an wiederkehrenden Arylenoxy-Gruppen typischerweise 2 bis 20 wiederkehrende
Arylenoxy-Gruppen ist, obwohl die Zahl an wiederkehrender Einheiten
außerhalb
dieser Bereiche liegen kann; eine Polyarylalkylenoxy-Gruppe, worin
der Arylalkyl-Teil der wiederkehrenden Arylalkylenoxy-Gruppen typischerweise
7 bis 50 Kohlenstoff-Atome aufweist, obwohl die Zahl von Kohlenstoff-Atomen
außerhalb
dieser Bereiche liegen kann, wie beispielsweise eine Polybenzylen-oxy-Gruppe,
eine Polyphenylethylenoxy-Gruppe, und worin die Zahl wiederkehrender
Arylalkylenoxy-Gruppen typischerweise 2 bis 20 wiederkehrende Arylalkylenoxy-Gruppen
ist, obwohl die Zahl an wiederkehrender Einheiten außerhalb
dieser Bereiche liegen kann; eine Polyalkylarylenoxy-Gruppe, worin
der Alkylaryl-Teil der wiederkehrenden Alkylarylenoxy-Gruppen typischerweise
7 bis 50 Kohlenstoff-Atome
aufweist, obwohl die Zahl von Kohlenstoff-Atomen außerhalb
dieser Bereiche liegen kann, wie beispielsweise eine Polytoluoloxy-Gruppe,
und worin die Zahl wiederkehrender Alkylarylenoxy-Gruppen typischerweise
2 bis 20 wiederkehrende Alkylarylenoxy-Gruppen ist, obwohl die Zahl
an wiederkehrender Einheiten außerhalb
dieser Bereiche liegen kann; eine heterozyklische Gruppe (einschließlich unsubstituierter
und substituierter heterozyklischer Gruppen), typischerweise mit
2 bis 12 Kohlenstoff Atomen und typischerweise mit 4 bis 18 Ring-Atomen,
obwohl die Zahl von Kohlenstoff-Atomen und die Zahl an Ring-Atomen
außerhalb
dieser Bereiche liegen kann, worin die Hetero-Atome in den heterozyklischen
Gruppen sein können
(jedoch nicht beschränkt
sind auf) Stickstoff, Sauerstoff, Schwefel, Silicium, Phosphor sowie Mischungen
daraus; eine Silyl-Gruppe (einschließlich unsubstituierter und
substituierter Silyl-Gruppen), eine Siloxan-Gruppe (einschließlich unsubstituierter
und substituierter Siloxan-Gruppen), eine Polysilylen-Gruppe (einschließlich unsubstituierter
und substituierter Polysilylen-Gruppen), typischerweise mit 2 bis
100 wiederkehrenden Silylen-Einheiten;
oder eine Polysiloxan-Gruppe (einschließlich unsubstituierter und
substituierter Polysiloxan-Gruppen), typischerweise mit 2 bis 200
wiederkehrenden Siloxan-Einheiten,
obwohl die Zahl an wiederkehrender Siloxan-Einheiten außerhalb
dieses Bereichs liegen kann; (ix) eine Sulfonyl-Gruppe der Formel
-SO
2R
80, worin R
80 steht für ein Wasserstoff-Atom, eine
Alkyl-Gruppe (einschließlich
linearer, verzweigter, gesättigter,
ungesättigter,
zyklischer, unsubstituierter und substituierter Alkyl-Gruppen, und
worin Hetero-Atome wie beispielsweise Sauerstoff, Stickstoff, Schwefel,
Silicium und Phosphor entweder in der Alkyl-Gruppe zugegen sein
können
oder nicht zugegen sein können),
typischerweise mit 1 bis 50 Kohlenstoff-Atomen, vorzugsweise mit
1 bis 20 Kohlenstoff-Atomen und noch mehr bevorzugt mit 1 bis 10
Kohlenstoff-Atomen, obwohl die Zahl von Kohlenstoff-Atomen außerhalb
dieser Bereiche liegen kann; eine Aryl-Gruppe (einschließlich substituierter
Aryl-Gruppen), typischerweise mit 6 bis 50 Kohlenstoff-Atomen, vorzugsweise
mit 6 bis 20 Kohlenstoff-Atomen und noch mehr bevorzugt mit 6 bis
14 Kohlenstoff-Atomen, obwohl die Zahl von Kohlenstoff-Atomen außerhalb
dieser Bereiche liegen kann; eine Arylalkyl-Gruppe (einschließlich substituierter
Arylalkyl-Gruppen), typischerweise mit 7 bis 50 Kohlenstoff-Atomen,
vorzugsweise mit 7 bis 25 Kohlenstoff-Atomen und noch mehr bevorzugt
mit 7 bis 15 Kohlenstoff-Atomen, obwohl die Zahl von Kohlenstoff-Atomen
außerhalb dieser
Bereiche liegen kann; eine Alkylaryl-Gruppe (einschließlich substituierter
Alkylaryl-Gruppen), typischerweise mit 7 bis 50 Kohlenstoff Atomen,
vorzugsweise mit 7 bis 25 Kohlenstoff-Atomen und noch mehr bevorzugt mit 7
bis 15 Kohlenstoff-Atomen, obwohl die Zahl von Kohlenstoff-Atomen
außerhalb
dieser Bereiche liegen kann; eine Alkoxy-Gruppe (einschließlich linearer,
verzweigter, gesättigter,
ungesättigter,
zyklischer, unsubstituierter und substituierter Alkoxy-Gruppen,
und worin Hetero-Atome wie beispielsweise Sauerstoff, Stickstoff,
Schwefel, Silicium und Phosphor entweder in dem Alkyl-Teil der Alkoxy-Gruppe
zugegen sein können oder
nicht zugegen sein können),
typischerweise mit 1 bis 50 Kohlenstoff-Atomen, vorzugsweise mit
4 bis 20 Kohlenstoff-Atomen und noch mehr bevorzugt mit 8 bis 12
Kohlenstoff-Atomen, obwohl die Zahl von Kohlenstoff-Atomen außerhalb
dieser Bereiche liegen kann; eine Aryloxy-Gruppe (einschließlich substituierter
Aryloxy-Gruppen), typischerweise mit 6 bis 50 Kohlenstoff-Atomen,
vorzugsweise mit 6 bis 20 Kohlenstoff-Atomen und noch mehr bevorzugt
mit 6 bis 14 Kohlenstoff-Atomen, obwohl die Zahl von Kohlenstoff-Atomen
außerhalb dieser
Bereiche liegen kann; eine Arylalkyloxy-Gruppe (einschließlich substituierter
Arylalkyloxy-Gruppen),
typischerweise mit 7 bis 50 Kohlenstoff-Atomen, vorzugsweise mit
7 bis 25 Kohlenstoff-Atomen und noch mehr bevorzugt mit 7 bis 15
Kohlenstoff Atomen, obwohl die Zahl von Kohlenstoff-Atomen außerhalb
dieser Bereiche liegen kann; eine Alkylaryloxy-Gruppe (einschließlich substituierter
Alkylaryloxy-Gruppen), typischerweise mit 7 bis 50 Kohlenstoff-Atomen,
vorzugsweise mit 7 bis 25 Kohlenstoff-Atomen und noch mehr bevorzugt
mit 7 bis 15 Kohlenstoff-Atomen, obwohl die Zahl von Kohlenstoff-Atomen
außerhalb
dieser Bereiche liegen kann; eine Polyalkylenoxy-Gruppe, in der
der Alkyl-Teil der wiederkehrenden Alkylenoxy-Gruppe typischerweise
1 bis 12 Kohlenstoff-Atome aufweisen kann, obwohl die Zahl von Kohlenstoff-Atomen
außerhalb
dieser Bereiche liegen kann, wie beispielsweise eine Polyethylenoxy-Gruppe,
eine Polypropylenoxy-Gruppe, eine Polybutylenoxy-Gruppe, und worin
die Zahl an wiederkehrenden Alkylenoxy-Gruppen typischerweise 2
bis 50 wiederkehrende Alkylenoxy- Gruppen
ist, obwohl die Zahl an wiederkehrenden Einheiten außerhalb
dieser Bereiche liegen kann; eine Polyarylenoxy-Gruppe, worin der
Aryl-Teil der wiederkehrenden Arylenoxy-Gruppen typischerweise 6
bis 14 Kohlenstoff-Atome aufweist, obwohl die Zahl von Kohlenstoff-Atomen
außerhalb
dieser Bereiche liegen kann, wie beispielsweise eine Polyphenylenoxy-Gruppe,
eine Polynaphthalinoxy-Gruppe, eine Polyphenanthrenoxy-Gruppe, und
worin die Zahl an wiederkehrenden Arylenoxy-Gruppen typischerweise
2 bis 20 wiederkehrende Arylenoxy-Gruppen ist, obwohl die Zahl an
wiederkehrender Einheiten außerhalb
dieser Bereiche liegen kann; eine Polyarylalkylenoxy-Gruppe, worin der
Arylalkyl-Teil der wiederkehrenden Arylalkylenoxy-Gruppen typischerweise
7 bis 50 Kohlenstoff Atome aufweist, obwohl die Zahl von Kohlenstoff-Atomen außerhalb
dieser Bereiche liegen kann, wie beispielsweise eine Polybenzylenoxy-Gruppe,
eine Polyphenylethylenoxy-Gruppe, und worin die Zahl wiederkehrender
Arylalkylenoxy-Gruppen typischerweise 2 bis 20 wiederkehrende Arylalkylenoxy-Gruppen ist, obwohl
die Zahl an wiederkehrender Einheiten außerhalb dieser Bereiche liegen
kann; eine Polyalkylarylenoxy-Gruppe, worin der Alkylaryl-Teil der
wiederkehrenden Alkylarylenoxy-Gruppen typischerweise 7 bis 50 Kohlenstoff-Atome
aufweist, obwohl die Zahl von Kohlenstoff-Atomen außerhalb
dieser Bereiche liegen kann, wie beispielsweise eine Polytoluoloxy-Gruppe,
und worin die Zahl wiederkehrender Alkylarylenoxy-Gruppen typischerweise
2 bis 20 wiederkehrende Alkylarylenoxy-Gruppen ist, obwohl die Zahl
an wiederkehrender Einheiten außerhalb
dieser Bereiche liegen kann; eine heterozyklische Gruppe (einschließlich unsubstituierter
und substituierter heterozyklischer Gruppen), typischerweise mit
2 bis 12 Kohlenstoff-Atomen und typischerweise mit 4 bis 18 Ring-Atomen,
obwohl die Zahl von Kohlenstoff-Atomen und die Zahl an Ring-Atomen
außerhalb
dieser Bereiche liegen kann, worin die Hetero-Atome in den heterozyklischen Gruppen
sein können
(jedoch nicht beschränkt
sind auf) Stickstoff, Sauerstoff, Schwefel, Silicium, Phosphor sowie
Mischungen daraus; eine Silyl-Gruppe (einschließlich unsubstituierter und
substituierter Silyl-Gruppen), eine Siloxan-Gruppe (einschließlich unsubstituierter
und substituierter Siloxan-Gruppen), eine Polysilylen-Gruppe (einschließlich unsubstituierter
und substituierter Polysilylen-Gruppen),
typischerweise mit 2 bis 100 wiederkehrenden Silylen-Einheiten;
oder eine Polysiloxan-Gruppe (einschließlich unsubstituierter und
substituierter Polysiloxan- Gruppen),
typischerweise mit 2 bis 200 wiederkehrenden Siloxan-Einheiten,
obwohl die Zahl an wiederkehrender Siloxan-Einheiten außerhalb
dieses Bereichs liegen kann; oder (x) eine Phosphoryl-Gruppe der
Formel -PO
3R
90,
worin R
90 steht für ein Wasserstoff-Atom, eine Alkyl-Gruppe
(einschließlich
linearer, verzweigter, gesättigter,
ungesättigter,
zyklischer, unsubstituierter und substituierter Alkyl-Gruppen, und
worin Hetero-Atome
wie beispielsweise Sauerstoff, Stickstoff, Schwefel, Silicium und
Phosphor entweder in der Alkyl-Gruppe zugegen sein können oder
nicht zugegen sein können),
typischerweise mit 1 bis 50 Kohlenstoff-Atomen, vorzugsweise mit
1 bis 20 Kohlenstoff-Atomen
und noch mehr bevorzugt mit 1 bis 10 Kohlenstoff-Atomen, obwohl
die Zahl von Kohlenstoff Atomen außerhalb dieser Bereiche liegen
kann; eine Aryl-Gruppe (einschließlich substituierter Aryl-Gruppen),
typischerweise mit 6 bis 50 Kohlenstoff-Atomen, vorzugsweise mit 6 bis 20 Kohlenstoff-Atomen
und noch mehr bevorzugt mit 6 bis 14 Kohlenstoff-Atomen, obwohl
die Zahl von Kohlenstoff-Atomen außerhalb dieser Bereiche liegen
kann; eine Arylalkyl-Gruppe (einschließlich substituierter Arylalkyl-Gruppen),
typischerweise mit 7 bis 50 Kohlenstoff-Atomen, vorzugsweise mit
7 bis 25 Kohlenstoff-Atomen und noch mehr bevorzugt mit 7 bis 15
Kohlenstoff-Atomen, obwohl die Zahl von Kohlenstoff-Atomen außerhalb
dieser Bereiche liegen kann; eine Alkylaryl-Gruppe (einschließlich substituierter
Alkylaryl-Gruppen), typischerweise mit 7 bis 50 Kohlenstoff-Atomen,
vorzugsweise mit 7 bis 25 Kohlenstoff-Atomen und noch mehr bevorzugt
mit 7 bis 15 Kohlenstoff-Atomen, obwohl die Zahl von Kohlenstoff-Atomen außerhalb
dieser Bereiche liegen kann; eine Alkoxy-Gruppe (einschließlich linearer,
verzweigter, gesättigter,
ungesättigter,
zyklischer, unsubstituierter und substituierter Alkoxy-Gruppen,
und worin Hetero-Atome wie beispielsweise Sauerstoff, Stickstoff
Schwefel, Silicium und Phosphor entweder in dem Alkyl-Teil der Alkoxy-Gruppe
zugegen sein können
oder nicht zugegen sein können),
typischerweise mit 1 bis 50 Kohlenstoff-Atomen, vorzugsweise mit
4 bis 20 Kohlenstoff-Atomen und noch mehr bevorzugt mit 8 bis 12
Kohlenstoff-Atomen, obwohl die Zahl von Kohlenstoff-Atomen außerhalb
dieser Bereiche liegen kann; eine Aryloxy-Gruppe (einschließlich substituierter
Aryloxy-Gruppen), typischerweise mit 6 bis 50 Kohlenstoff-Atomen, vorzugsweise
mit 6 bis 20 Kohlenstoff-Atomen und noch mehr bevorzugt mit 6 bis
14 Kohlenstoff-Atomen,
obwohl die Zahl von Kohlenstoff-Atomen außerhalb dieser Bereiche liegen kann;
eine Arylalkyloxy-Gruppe (einschließlich substituierter Arylalkyloxy-Gruppen),
typischerweise mit 7 bis 50 Kohlenstoff-Atomen, vorzugsweise mit
7 bis 25 Kohlenstoff-Atomen und noch mehr bevorzugt mit 7 bis 15
Kohlenstoff-Atomen, obwohl die Zahl von Kohlenstoff-Atomen außerhalb
dieser Bereiche liegen kann; eine Alkylaryloxy-Gruppe (einschließlich substituierter
Alkylaryloxy-Gruppen), typischerweise mit 7 bis 50 Kohlenstoff-Atomen,
vorzugsweise mit 7 bis 25 Kohlenstoff-Atomen und noch mehr bevorzugt
mit 7 bis 15 Kohlenstoff-Atomen, obwohl die Zahl von Kohlenstoff-Atomen außerhalb
dieser Bereiche liegen kann; eine Polyalkylenoxy-Gruppe, in der
der Alkyl-Teil der wiederkehrenden Alkylenoxy-Gruppe typischerweise
1 bis 12 Kohlenstoff-Atome aufweisen kann, obwohl die Zahl von Kohlenstoff-Atomen
außerhalb
dieser Bereiche liegen kann, wie beispielsweise eine Polyethylenoxy-Gruppe,
eine Polypropylenoxy-Gruppe, eine Polybutylenoxy-Gruppe, und worin
die Zahl an wiederkehrenden Alkylenoxy-Gruppen typischerweise 2
bis 50 wiederkehrende Alkylenoxy-Gruppen
ist, obwohl die Zahl an wiederkehrenden Einheiten außerhalb
dieser Bereiche liegen kann; eine Polyarylenoxy-Gruppe, worin der
Aryl-Teil der wiederkehrenden Arylenoxy-Gruppen typischerweise 6
bis 14 Kohlenstoff-Atome aufweist, obwohl die Zahl von Kohlenstoff-Atomen
außerhalb
dieser Bereiche liegen kann, wie beispielsweise eine Polyphenylenoxy-Gruppe,
eine Polynaphthalinoxy-Gruppe, eine Polyphenanthrenoxy-Gruppe, und
worin die Zahl an wiederkehrenden Arylenoxy-Gruppen typischerweise
2 bis 20 wiederkehrende Arylenoxy-Gruppen ist, obwohl die Zahl an
wiederkehrender Einheiten außerhalb
dieser Bereiche liegen kann; eine Polyarylalkylenoxy-Gruppe, worin
der Arylalkyl-Teil der wiederkehrenden Arylalkylenoxy-Gruppen typischerweise
7 bis 50 Kohlenstoff-Atome aufweist, obwohl die Zahl von Kohlenstoff-Atomen
außerhalb
dieser Bereiche liegen kann, wie beispielsweise eine Polybenzylen-oxy-Gruppe,
eine Polyphenylethylenoxy-Gruppe, und worin die Zahl wiederkehrender
Arylalkylenoxy-Gruppen typischerweise 2 bis 20 wiederkehrende Arylalkylenoxy-Gruppen
ist, obwohl die Zahl an wiederkehrender Einheiten außerhalb
dieser Bereiche liegen kann; eine Polyalkylarylenoxy-Gruppe, worin
der Alkylaryl-Teil der wiederkehrenden Alkylarylenoxy-Gruppen typischerweise
7 bis 50 Kohlenstoff-Atome aufweist, obwohl die Zahl von Kohlenstoff-Atomen
außerhalb
dieser Bereiche liegen kann, wie beispielsweise eine Polytoluoloxy-Gruppe,
und worin die Zahl wiederkehrender Alkylarylenoxy- Gruppen typischerweise 2
bis 20 wiederkehrende Alkylarylenoxy-Gruppen ist, obwohl die Zahl
an wiederkehrender Einheiten außerhalb dieser
Bereiche liegen kann; eine heterozyklische Gruppe (einschließlich unsubstituierter
und substituierter heterozyklischer Gruppen), typischerweise mit
2 bis 12 Kohlenstoff-Atomen und typischerweise mit 4 bis 18 Ring-Atomen,
obwohl die Zahl von Kohlenstoff-Atomen und die Zahl an Ring-Atomen außerhalb
dieser Bereiche liegen kann, worin die Hetero-Atome in den heterozyklischen
Gruppen sein können
(jedoch nicht beschränkt
sind auf) Stickstoff, Sauerstoff, Schwefel, Silicium, Phosphor,
sowie Mischungen daraus; eine Silyl-Gruppe (einschließlich unsubstituierter
und substituierter Silyl-Gruppen), eine Siloxan-Gruppe (einschließlich unsubstituierter
und substituierter Siloxan-Gruppen), eine Polysilylen-Gruppe (einschließlich unsubstituierter
und substituierter Polysilylen-Gruppen), typischerweise mit 2 bis
100 wiederkehrenden Silylen-Einheiten; oder eine Polysiloxan-Gruppe (einschließlich unsubstituierter
und substituierter Polysiloxan-Gruppen), typischerweise mit 2 bis
200 wiederkehrenden Siloxan-Einheiten, obwohl die Zahl an wiederkehrender
Siloxan-Einheiten außerhalb
dieses Bereichs liegen kann; worin die Substituenten an den substituierten
Alkyl-, Aryl-, Arylalkyl-, Alkylaryl-, Alkoxy-, Aryloxy- Arylalkyloxy-, Alkylaryloxy-,
Polyalkylenoxy-, Polyarylenoxy-, Polyarylalkylenoxy-, Polyalkylarylenoxy-,
heterozyklischen, Silyl-, Siloxy- Polysilylen-, und Polysiloxy-Gruppen sind: Hydroxy-Gruppen,
Halogen-Atome, Cyano-Gruppen, Ether-Gruppen, Aldehyd-Gruppen, Keton-Gruppen,
Carbonsäure-Gruppen,
Ester-Gruppen, Amid-Gruppen,
Carbonyl-Gruppen, Thiocarbonyl-Gruppen, Sulfat-Gruppen, Sulfonat-Gruppen, Sulfid-Gruppen,
Sulfoxid-Gruppen, Phosphat-Gruppen, Nitril-Gruppen, Mercapto-Gruppen,
Nitro-Gruppen, Nitroso-Gruppen, Sulfon-Gruppen, Acyl-Gruppen, Säureanhydrid-Gruppen, Azid-Gruppen,
Cyanato-Gruppen, Isocyanato-Gruppen, Thiocyanato-Gruppen, Isothiocyanato-Gruppen,
Mischungen daraus, worin die Substituenten an den Silylen-, Siloxy-,
Polysilylen- und Polysiloxy-Gruppen auch sein können: Alkyl-Gruppen, Aryl-Gruppen, Arylalkyl-Gruppen
und Alkylaryl-Gruppen, worin zwei oder mehrere Substituenten miteinander
unter Bildung eines Rings verbunden sein können, und worin Z und Z' gleich miteinander
oder verschieden voneinander sein können. Bis zu 4 Z-Gruppen können in
dem Molekül
zugegen sein; bis zu 4 Z'-Gruppen
können
in dem Molekül
zugegen sein.
-
Die
Gruppen Z und X können
miteinander unter Bildung eines Rings verbunden sein, und die Gruppen Z' und X' können miteinander
unter Bildung eines Rings verbunden sein.
-
Einige
spezielle Beispiele von Färbemitteln
dieser Formel schließen
ein:
worin
C
36H
64+n eine verzweigte
Alkylen-Gruppe ist, die Unsättigungs-Stellen
und zyklische Gruppen einschließen
kann, worin n eine ganze Zahl aus der Gruppe 0, 1, 2, 3, 4, 5, 6,
7, 8, 9 oder 10 ist und worin ein Isomer davon eine Verbindung der
folgenden Formel ist:
worin
C
36H
64+n eine verzweigte
Alkylen-Gruppe ist, die Unsättigungs-Stellen
und zyklische Gruppen einschließen
kann, worin n eine ganze Zahl aus der Gruppe 0, 1, 2, 3, 4, 5, 6,
7, 8, 9 oder 10 ist und worin ein Isomer davon eine Verbindung der
folgenden Formel ist:
worin
C
36H
64+n eine verzweigte
Alkylen-Gruppe ist, die Unsättigungs-Stellen
und zyklische Gruppen einschließen
kann, worin n eine ganze Zahl aus der Gruppe 0, 1, 2, 3, 4, 5, 6,
7, 8, 9 oder 10 ist und worin ein Isomer davon eine Verbindung der
folgenden Formel ist:
worin
C
36H
64+n eine verzweigte
Alkylen-Gruppe ist, die Unsättigungs-Stellen
und zyklische Gruppen einschließen
kann, worin n eine ganze Zahl aus der Gruppe 0, 1, 2, 3, 4, 5, 6,
7, 8, 9 oder 10 ist und worin ein Isomer davon eine Verbindung der
folgenden Formel ist:
worin
C
36H
64+n eine verzweigte
Alkylen-Gruppe ist, die Unsättigungs-Stellen
und zyklische Gruppen einschließen
kann, worin n eine ganze Zahl aus der Gruppe 0, 1, 2, 3, 4, 5, 6,
7, 8, 9 oder 10 ist und worin ein Isomer davon eine Verbindung der
folgenden Formel ist:
-
Die
Verbindungen der vorliegenden Erfindung gemäß der Formel
können hergestellt
werden nach irgendeinem gewünschten
oder wirksamen Verfahren. Beispielsweise können sie hergestellt werden
durch Diazotierung des entsprechend substituierten dimeren Anilins
mit Nitrosylschwefelsäure
unter Bedingungen kalter Temperatur. Dem folgt ein Kuppeln mit dem
entsprechend substituierten Pyridon in einer ge pufferten alkalisch-wässrigen
Lösung
unter Bedingungen kalter Temperatur gemäß der folgenden Gleichung:
-
Noch
spezieller wird das entsprechend substituierte Dianilin zuerst einer
Diazotierungsreaktion unterworfen, indem man es in Essigsäure, die
mit einem Lösungsmittel
verdünnt
ist, und gegebenenfalls einer zweiten Säure wie beispielsweise Schwefelsäure, Dodecylbenzolsulfonsäure, Propionsäure, Chlorwasserstoffsäure, Phosphorsäure und
irgendeiner anderen Säure
die nützlich
für eine
Diazotierungsreaktion ist, sowie Mischungen daraus löst. Das
Lösungsmittel
kann irgendein beliebiges Lösungsmittel
sein, das in einer Diazotierungsreaktion nützlich ist, wie beispielsweise
Wasser, Aceton, Dimethylformamid, Dimethylacetamid, Tetrahydrofuran,
Dimethoxyethan, Analoge, höher
siedende Ether-Lösungsmittel
sowie Mischungen daraus.
-
Das
Lösungsmittel
und das Dianilin sind in irgendwelchen gewünschten oder wirksamen relativen Mengen
zugegen. Wenn – für Zwecke
einer Bestimmung relativer Mengen – der Begriff „Lösungsmittel" so definiert ist,
dass er einschließt,
welches Lösungsmittel
auch immer gewählt
wurde, plus irgendeiner beliebigen Menge von Essigsäure und
einer zweiten, in der Mischung vorhandenen Säure, sind die Reaktanden in
diesem kombinierten Lösungsmittel
in relativen Mengen von in einer Ausführungsform wenigstens 100 g
substituiertes Dianilin pro Liter Lösungsmittel, in einer anderen
Ausführungsform
wenigstens 200 g substituiertes Dianilin pro Liter Lösungsmittel
und in noch einer anderen Ausführungsform
wenigstens 230 g substituiertes Dianilin pro Liter Lösungsmittel
und einer Ausführungsform
nicht mehr als 400 g substituiertes Dianilin pro Liter Lösungsmittel
und in einer weiteren Ausführungsform
nicht mehr als 300 g substituiertes Dianilin pro Liter Lösungsmittel und
in noch einer weiteren Ausführungsform
nicht mehr als 270 g substituiertes Dianilin pro Liter Lösungsmittel zugegen,
obwohl die relativen Mengen außerhalb
dieser Bereiche liegen können.
-
Die
Essigsäure
ist in irgendeiner gewünschten
oder wirksamen Menge zugegen, in einer Ausführungsform wenigstens 1 g Essigsäure pro
g substituiertes Dianilin, in einer weiteren Ausführungsform
wenigstens 2 g Essigsäure
pro g substituiertes Dianilin und in noch einer weiteren Ausführungsform
wenigstens 3 g Essigsäure
pro g substituiertes Dianilin, und in einer Ausführungsform nicht mehr als 10
g Essigsäure
pro g substituiertes Dianilin, in einer weiteren Ausführungsform
nicht mehr als 7 g Essigsäure
pro g substituiertes Dianilin und in noch einer weiteren Ausführungsform
nicht mehr als 5 g Essigsäure
pro g substituiertes Dianilin, obwohl die relativen Mengen außerhalb
dieser Bereiche liegen können.
-
Wenn
sie zugegen ist, ist die gegebenenfalls vorhandene zweite Säure zugegen
in irgendeiner gewünschten
oder wirksamen Menge, in einer Ausführungsform wenigstens 0,05
g Säure
pro g substituiertes Dianilin, und in einer weiteren Ausführungsform
wenigstens 0,1 g Säure
pro g substituiertes Dianilin und in einer Ausführungsform nicht mehr als 0,5
g Säure
pro g substituiertes Dianilin, in einer weiteren Ausführungsform nicht
mehr als 0,3 g Säure
pro g substituiertes Dianilin, und in einer noch weiteren Ausführungsform
nicht mehr als 0,2 g Säure
pro g substituiertes Dianilin, obwohl die relativen Mengen außerhalb
dieser Bereiche liegen können.
-
In
der Mischung, die das gewählte
Lösungsmittel,
irgendeine gegebenenfalls vorhandene zweite Säure und Essigsäure umfasst,
ist die Essigsäure
zugegen in einer gewünschten
oder wirksamen Menge, in einer Ausführungsform wenigstens 50 Vol.-%
der Mischung, in einer weiteren Ausführungsform wenigstens 70 Vol.-%
der Mischung und in einer noch weiteren Ausführungsform wenigstens 75 Vol.-%
der Mischung, und in noch einer weiteren Ausführungsform wenigstens 95 Vol.-%
der Mischung, obwohl die relative Menge außerhalb dieser Bereiche liegen
kann.
-
Nach
vollständigem
Lösen der
Komponenten wird die Mischung abgekühlt, in einer Ausführungsform auf
eine Temperatur von nicht mehr als +15° C, in noch einer Ausführungsform
auf eine Temperatur nicht über +10° C und in
noch einer weiteren Ausführungsform
auf eine Temperatur nicht über
+5° C, und
in noch einer weiteren Ausführungsform
auf eine Temperatur nicht über
+3° C und
in einer Ausführungsform
auf eine Temperatur nicht unter –5° C und in einer weiteren Ausführungsform
auf eine Temperatur nicht unter –10° C, obwohl die Temperatur außerhalb
dieser Bereiche liegen kann.
-
Danach
wird der Mischung Nitrosylschwefelsäure in irgendeiner gewünschten
oder wirksamen Menge zugesetzt, in einer Ausführungsform wenigstens 2 Mol
Nitrosylschwefelsäure
pro Mol substituiertes Dianilin (d. h. wenigstens 1 Mol Nitrosylschwefelsäure pro
Mol Anilin-Einheit in dem Dianilin), und in einer anderen Ausführungsform
wenigstens 2,1 Mol Nitrosylschwefelsäure pro Mol substituiertes
Dianilin, und in einer Ausführungsform
nicht mehr als 3 Mol Nitrosylschwefelsäure pro Mol substituiertes
Dianilin und in einer weiteren Ausführungsform nicht mehr als 2,5
Mol Nitrosylschwefelsäure
pro Mol substituiertes Dianilin, und in einer noch weiteren Ausführungsform
nicht mehr als 2,25 Mol Nitrosylschwefelsäure pro Mol substituiertes
Dianilin obwohl die relativen Mengen außerhalb dieser Bereiche liegen
können.
In einer speziellen Ausführungsform
wird die Nitrosylschwefelsäure
tropfenweise mit einer solchen Geschwindigkeit zugesetzt, dass die
Temperatur der Reaktionsmischung 15° C nicht übersteigt.
-
Die
Reaktion unter Bildung eines Diazonium-Salzes ist im wesentlichen
augenblicklich, und bei Vervollständigung der Zugabe der Nitrosylschwefelsäure ist
die Reaktion im wesentlichen vollständig, obwohl – sofern
erwünscht – ein qualitativer
Test durchgeführt
werden kann, um die Vollständigkeit
der Reaktion zu bestätigen.
-
Danach
kann ein restlicher Überschuss
Nitrosylschwefelsäure,
der in der Reaktionsmischung zugegen ist, durch die Zugabe eines
Abfangmittels abgefangen werden, wie beispielsweise Sulfaminsäure, Harnstoff sowie
Mischungen daraus, und zwar in jeder gewünschten oder wirksamen Menge,
in einer Ausführungsform wenigstens
0,01 Mol Abfangmittel pro Mol Nitrosylschwefelsäure (d. h. pro Mol Nitrosylschwefelsäure, die
ursprünglich
der Reaktionsmischung zugesetzt wurde), in einer weiteren Ausführungsform
wenigstens 0,05 Mol Abfangmittel pro Mol Nitrosylschwefelsäure und
in noch einer weiteren Ausführungsform
wenigstens 0,1 Mol Abfangmittel pro Mol Nitrosylschwefelsäure, und
in einer Ausführungsform
nicht mehr als 0,5 Mol Abfangmittel pro Mol Nitrosylschwefelsäure, in
einer weiteren Ausführungsform
nicht mehr als 0,3 Mol Abfangmittel pro Mol Nitrosylschwefelsäure und
in noch einer weiteren Ausführungsform
nicht mehr als 0,2 Mol Abfangmittel pro Mol Nitrosylschwefelsäure, obwohl
die Menge außerhalb
dieser Bereiche liegen. Bei vollständigem Ablauf der Reaktion
enthält
die Reaktionsmischung das entsprechende Diazonium-Salz.
-
Eine
Vorstufen-Lösung
des Pyridons, das die gewünschten
Substituenten daran aufweist, wird in einem passenden Lösungsmittel
hergestellt, wie beispielsweise einer Mischung aus Wasser, organischen
Lösungsmitteln
einschließlich
niederer Alkohole wie beispielsweise Methanol, Ethanol, Isopropanol,
mit Wasser mischbaren, nicht-basischen organischen Lösungsmitteln
wie beispielsweise Tetrahydrofuran, Aceton, Dimethoxyethan, N,N-Dimethylformamid,
N,N-Dimethylacetamid sowie Mischungen daraus. Mischungen aus Wasser
mit einem organischen Lösungsmittel
können
hilfreich sein zur Erleichterung einer Solvatisierung anorganischer
oder organischer Salze, die ein Reaktions-Nebenprodukt sind. In diesem Fall sind
Wasser und das organische Lösungsmittel
zugegen in beliebigen gewünschten
und wirksamen relativen Mengen, in einer Ausführungsform wenigstens 0,25
g organisches Lösungsmittel
pro g Wasser, in einer weiteren Ausführungsform wenigsten 0,3 g
organisches Lösungsmittel
pro g Wasser, und in noch einer weiteren Ausführungsform wenigstens 0,4 g
organisches Lösungsmittel
pro g Wasser, und in einer Ausführungsform
nicht mehr als 4 g organisches Lösungsmittel
pro g Wasser, in einer weiteren Ausführungsform nicht mehr als 3
g organisches Lösungsmittel
pro g Wasser und in noch einer weiteren Ausführungsform nicht mehr als 2
g organi sches Lösungsmittel
pro g Wasser, obwohl die relativen Mengen außerhalb dieser Bereiche liegen
können.
-
Das
Pyridon ist in der Vorstufen-Lösung
zugegen in irgendeiner gewünschten
oder wirksamen Menge, in einer Ausführungsform wenigstens 10 g
Pyridon pro Liter Lösungsmittel,
in einer weiteren Ausführungsform wenigstens
30 g Pyridon pro Liter Lösungsmittel
und in noch einer weiteren Ausführungsform
wenigstens 50 g Pyridon pro Liter Lösungsmittel, und in einer Ausführungsform
nicht mehr als 200 g Pyridon pro Liter Lösungsmittel, in einer weiteren
Ausführungsform
nicht mehr als 100 g Pyridon pro Liter Lösungsmittel und in einer noch
weiteren Ausführungsform
nicht mehr als 70 g Pyridon pro Liter Lösungsmittel, obwohl die relativen Mengen
außerhalb
dieser Bereiche liegen können.
-
Die
Pyridon-Vorstufen-Lösung
wird bei einem alkalischen pH-Wert gehalten, typischerweise wenigstens
10, und in einer Ausführungsform
nicht mehr als 14, und in einer Ausführungsform nicht mehr als 12,
obwohl der pH-Wert außerhalb
dieser Bereiche liegen kann. Die Pyridon-Vorstufen-Lösung kann
eine Mischung aus einer Base und einem gegebenenfalls vorhandenen
puffernden Salz enthalten.
-
Beispiele
geeigneter Basen schließen
ein: Mineralbasen wie beispielsweise Natriumhydroxid, Kaliumhydroxid
sowie mit Wasser mischbare organische tertiäre Amine wie beispielsweise
Triethanolamin, N,N-Diethylethanolamin sowie Mischungen daraus,
die in irgendeiner gewünschten
oder wirksamen Menge zugegen sind, in einer Ausführungsform wenigstens 1 Mol
Base pro Mol Pyridon und in einer anderen Ausführungsform wenigstens 2 Mol
Base pro Mol Pyridon und in noch einer anderen Ausführungsform
wenigstens 3 Mol Base pro Mol Pyridon und in noch einer anderen
Ausführungsform
wenigstens 5 Mol Base pro Mol Pyridon und in einer Ausführungsform
nicht mehr als 10 Mol Base pro Mol Pyridon und in einer weiteren
Ausführungsform nicht
mehr als 7 Mol Base pro Mol Pyridon und in noch einer weiteren Ausführungsform
nicht mehr als 5 Mol Base pro Mol Pyridon, obwohl die relativen
Mengen außerhalb
dieser Bereiche liegen können.
-
Beispiele
geeigneter, gegebenenfalls vorhandener puffernder Salze schließen diejenigen
ein, die dem grundsätzlich
sauren Lösungsmittel
entsprechen, beispielsweise, wenn das grundsätzlich saure Lösungsmittel Essigsäure ist,
schließen
geeignete Puffer Natriumacetat, Kaliumacetat, Natriumhydrogenphosphat,
Citronensäure
sowie Mischungen daraus ein. Wenn zugegen, ist das gegebenenfalls
vorhandene Puffer-Salz in irgendeiner gewünschten und wirksamen Menge
zugegen, in einer Ausführungsform
wenigstens 1 Mol Puffer pro Mol Pyridon, in einer weiteren Ausführungsform
wenigstens 2 Mol Puffer pro Mol Pyridon, in noch einer weiteren
Ausführungsform
wenigstens 3 Mol Puffer pro Mol Pyridon und in noch einer weiteren
Ausführungsform
wenigstens 5 Mol Puffer pro Mol Pyridon und in einer Ausführungsform
nicht mehr als 10 Mol Puffer pro Mol Pyridon und in noch einer Ausführungsform
nicht mehr als 7 Mol Puffer pro Mol Pyridon und in noch einer anderen
Ausführungsform
nicht mehr als 5 Mol Puffer pro Mol Pyridon, obwohl die relativen
Mengen außerhalb dieser
Bereiche liegen können.
In einer speziellen Ausführungsform
kann im Anschluss an das Lösen
des Pyridons die so gebildete Vorstufen-Pyridon-Lösung filtriert
werden, um irgendwelche ungelöster
Feststoffe zu entfernen.
-
Die
Lösung,
die das Diazonium-Salz enthält,
die bei einer kalten Temperatur gehalten wird, wird dann langsam
der Pyridon-Lösung
in irgendwelchen gewünschten
oder wirksamen relativen Mengen zugesetzt, in einer Ausführungsform
wenigstens 2 Mol Pyridon pro Mol Diazonium-Salz, in einer weiteren
Ausführungsform wenigstens
2,1 Mol Pyridon pro Mol Diazonium-Salz, in einer noch weiteren Ausführungsform
wenigstens 2,25 Mol Pyridon pro Mol Diazonium-Salz und in einer
Ausführungsform
nicht mehr als 4 Mol Pyridon pro Mol Diazonium-Salz und in einer
weiteren Ausführungsform
nicht mehr als 3 Mol Pyridon pro Mol Diazonium-Salz und in noch
einer weiteren Ausführungsform
nicht mehr als 2,5 Mol Pyridon pro Mol Diazonium-Salz, obwohl die relativen
Mengen außerhalb
dieser Bereiche liegen können,
was zur unmittelbaren Bildung eines helbgelben Niederschlags führt. Danach
kann der gelbe Niederschlag durch Filtration gewonnen und – sofern
erwünscht – gewaschen
werden.
-
Vorstufen-Dianiline
können
hergestellt werden nach irgendeinem gewünschten oder wirksamen Verfahren,
wie beispielsweise dasjenige, das offenbart ist in (beispielsweise) „The Chemistry
of Isatoic Anhydride", G.M.
Coppola, Synthesis, Seite 505 (190); „Isatoic Anhydride; IV. Reactions
with Various Nucleophiles",
R. P. Staiger et al., J. Org. Chem., Band 24, Seite 1214 (1959);
R. P. Staiger et al., J. Chem. Eng. Data B. Seite 454 (1963) und
in dem US-Patent Nr. 4,016,143.
-
Vorstufen-Pyridone
können
hergestellt werden nach irgendeinem gewünschten oder wirksamen Verfahren,
wie beispielsweise dasjenige, das offenbart ist in (beispielsweise) „Investigation
of the Reaction Conditions for the Synthesis of 4,6-Disubstituted-3-cyano-2-pyridones and 4-Methyl-3-cyano-6-hydroxy-2-pyridone", D. Z. Mijin et
al., J. Serb. Chem. Soc., Band 59, Nr. 12, Seite 959 (1994); „Synthesis
of Isoquinoline Alkaloids, II, The Synthesis and Reactions of 4-Methyl-3-pyridinecarboxaldehyde
and Other 4-Methyl-3-substituted Pyridines,
J. M. Bobbitt et al., J. Org. Chem, Band 25, Seite 560 (1960); "Synthesis and Dyeing
Characteristics of 5-(4-Arylazophenyl)azo-3-cyano-4-methyl-6-hydroxy-2-pyridones", J. M. Kanhere et
al., "Indian Journal
of Textile Research.",
Band 13, Seite 213 (1988); "Synthesis
of Some Pyridone Azo Dyes from 1-Substituted 2-Hydroxy-6-pyridone
Derivatives and their Colour Assessment", C. Chen et al., "Dyes and Pigments", Band 15, Seite 69 (1991); "Synthesis of 3-Cyano-6-hydroxy-5-(2-(perfluoroalkyl)phenylazo)-2-pyridones
and their Application for Dye Diffusion Thermal Transfer Printing", M. Matsui et al.,
Bull. Chem. Soc. Jpn., 1993, Band 66, Iss. 6, Seiten 1790-4; "Synthesis of N-alkylcyanopyridones", B. Peng et al.,
Faming Zhuanli Shenging Gongkai Shuomingshu (1997), CN 1158845; "Synthesis of 1-Butyl-3-cyano-4-methyl-6-hydroxypyrid-2-one", X. Kong et al.,
Huaxue Shiji (1998), 20(1), 58-59; "Regioselective Conversion of 3-Cyano-6-hydroxy-2-pyridones
into 3-Cyano-6-amino-2-pyridones", A. R. Katritzky
et al., J. Heterocycl. Chem. (1995), 32(3), 1007-10; "The Synthesis of
Some Hetarylazopyridone Dyes and Solvent Effects on their Absorption
Spectra", N. Ertan et
al., Dyes Pigm. (1995), 27(4), 313-20; "Process for the Preparation of Pyridone
Compounds", H. Schmid.
DE 4314430 (1994); "Tautomerism of 4-Methyl-6-hydroxy-2-pyridone-derivates", H. Liu et al.,
Dalian Ligong Daxue Xuebao (1992), 32(4), 405-11; "Preparation of 1-Alkyl-3-cyano-4-methyl-6-hydroxy-2-pyridone-type Mixed
Azo Coupling Components",
J. Prikryl et al., Czech. (1991) 8 ff. CODEN: CZXXA9 CS 273045 B1 19911220
CAN 118:256604 AN1993:256604 CAPLUS; "Structural Characteristics of Hydroxypyridone
Derivatives", Q.
Peng et al., Dalian Ligong Daxue Xuebao (1991), 31(3), 279-86; und "6-Hydroxypyridin-2-ones", F. Schmidt.
DE 2845863 (1980).
-
Zwar
ist es nicht erwünscht,
durch irgendeine spezielle Theorie beschränkt zu sein; jedoch wird angenommen,
dass das Struktur-Merkmal der ortho-Substitution der Färbemittel-Moleküle gemäß der vorliegenden Erfindung
die Bildung starker intramolekularer Wasserstoff-Bindungen zwischen
der Azo-Gruppe, der Hydroxyl-Gruppe und der Carbonyl-Gruppe ermöglicht,
die dem Färbemittel
unter Bedingungen von sichtbarem Licht Starrheit und signifikante
Photostabilität
verleiht. Es wird angenommen, dass sich diese Bindungen wie folgt ausbilden
(wobei hier sowohl das Enol-Tautomer als auch das Hydrazon-Tautomer
gezeigt werden, in denen diese Art von Molekül existiert, wie gelehrt wird
beispielsweise von „Synthesis
of Some Pyridone Azo Dyes from 1-Substituted 2-Hydroxy-6-pyridone Derivatives and their
Colour Assessment",
C. Chen et al., Dyes and Pigments, Band 15, Seite 69 (1991).
-
-
Es
wird angenommen, dass dieses Struktur-Merkmal dem Färbemittel-Molekül auch thermische
Stabilität
und chemische Stabilität
verleihen kann. Weiter wird trotz der Tatsache, dass es nicht erwünscht ist,
auf irgendeine spezielle Theorie beschränkt zu sein, angenommen, dass
das Einschließen
von Alkyl- oder Alkylen-Gruppen mit wenigstens 12 Kohlenstoff-Atomen,
insbesondere (obwohl nicht notwendigerweise) verzweigten Alkyl-Gruppen
diesen Typs in das Färbemittel-Molekül weiter
eine Diffusion oder Auslaufen des Färbemittel-Moleküls von einem
Medium wie beispielsweise in Phasen-Umkehr-Tinten-Vehikel in benachbarte
Farben unterschiedlicher Farben (was zu einem zwischen den Farben
auftretenden Ausbluten führt),
benachbarte ungedruckte Bereiche (was zu Kanten-Ungenauigkeit führt), Band-Klebemittel
(was zu Kanten-Ungenauigkeit und möglicherweise zu Unleserlichkeit
führt)
reduziert. Darüber
hinaus wird angenommen, dass durch Einschließen von zwei Azopyridon-Chromophoren
in das Färbemittel-Molekül die Spektralstärke des
Färbemittels wesentlich
erhöht
wird, was die Verwendung wesentlich reduzierter Mengen an Färbemittel
in beispielsweise einer Tinte erlaubt, ohne die Farbe und die Spektral-Eigenschaften
(L*a*b*) der Tinte zu verringern oder die optische Dichte oder Farbe
der Drucke, die mit der Tinte gebildet wurden, zu beeinträchtigen.
-
Zusätzlich zu
der Tatsache, dass sie zur Verwendung in Phasen-Umkehr-Tinten geeignet
sind, können die
Färbemittel
gemäß der vorliegenden
Erfindung verwendet werden in Anwendungen wie beispielsweise Textil-Färben, biologischen
Färbe-Anwendungen,
die sich auf Chromophore mit hoher spektraler Stärke verlassen, elektronische
Anwendungen wie beispielsweise organische Photoleiter, optische
Filter und Farbfilter für
Flüssigkristall-Anzeigesysteme.
-
Spezielle
Ausführungsformen
der Erfindung werden nun im Detail beschrieben. Alle Teile und Prozentwerte
sind auf das Gewicht bezogene Angaben, so lange nichts anderes angegeben
ist.
-
Beispiel I
-
Ein
Färbemittel
der Formel
worin
C
36H
64+n eine verzweigte
Alkylen-Gruppe war, die ungesättigte
Stellen und zyklische Gruppen einschließen kann, worin n eine ganze
Zahl von 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 oder 10 ist, und worin ein
Isomer davon die folgende Formel hatte:
wurde
wie folgt hergestellt:
Ein Dimer-Ester-Anthranilat der Formel
worin C
36H
64+n eine verzweigte Alkylen-Gruppe war,
die ungesättigte
Stellen und zyklische Gruppen einschließen kann, worin n eine ganze
Zahl von 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 oder 10 ist, und worin ein
Isomer davon die folgende Formel hatte:
wurde
wie folgt hergestellt: In einen 3-Liter-Kessel, der mit einem mechanischen
Rührer,
einem Wasserkühler und
einem Thermometer ausgestattet war, wurden aufeinander folgend gegeben:
Isatonsäureanhydrid
(203,9 g, 1,25 Mol) PRIPOL
® 2033 (C-36-Dimerdiol-Mischung,
einschließlich
Isomere der Formel:
sowie
andere verzweigte Isomere, die ungesättigte Stellen und zyklische
Gruppen einschließen
können;
267 g, 0,5 Mol; weitere Information über C
36-Dimer-Diole
dieses Typs sind offenbart in beispielsweise „Dimer Acids", Kirk-Othmer Encyclopedia
of Chemical Technology, Band 8, 4. Ausgabe (1992), Seiten 223 bis
237); 1,4-Diazabicyclo[2.2.2]octan
(28 g, 0,25 Mol) und Toluol (750 ml). Die heterogene Mischung, die
so gebildet worden war, wurde auf 115° C (Innentemperatur) erwärmt. Während der
folgenden Reaktion wurde die Entwicklung von gasförmigem CO
2-Nebenprodukt
beobachtet. Nach etwa 3 h Erhitzungszeit war die Reaktion abgeschlossen.
Die Mischung wurde auf Raumtemperatur abgekühlt, und eine 1,0-molare wässrige Lösung von Natriumhydroxid
(500 ml, 0,5 Mol) wurde der Mischung zugesetzt. Die Mischung wurde
in zwei 2-Liter-Trenn-Trichter aufgeteilt. In jeden Trichter wurde
Ethylacetat gegeben (350 ml), gefolgt von der Zugabe von Kochsalzlösung (gesättigte wässrige Natriumchlorid-Lösung), wodurch
das Volumen-Verhältnis
von organischer Phase zu wässriger
Phase etwa 2:1 betrug. Die organische Phase wurde mit 5 × 300 ml-Aliquots
von Kochsalzlösung
gewaschen, bis der pH-Wert neutral war. Die erhaltenen Extrakte
an organischer Schicht wurden zusammengegeben, über wasserfreiem MgSO
4-Pulver getrocknet und dann filtriert. Die
Lösungsmittel wurden
durch Destillation im Vakuum mit einem Rotationsverdampfer entfernt,
was ein Bernstein-farbenes viskoses Öl ergab, das anschließend unter
Hoch-Vakuum getrocknet wurde und 372 g (96 % Ausbeute) an Produkt
ergab. Die Reinheit des Dimer-Ester-Anthranilat-Produkts wurde als
sehr hoch beobachtet, und zwar durch
1H-NMR-Spektroskopie,
was einen geschätzten
Wert von 97 % ergab, wobei 3 % dem restlichen Toluol-Lösungsmittel
zugeschrieben wurden.
1H-NMR-Spektral-Zuordnung
(300 MHz, CDCl
3): 7,85 ppm (Doppel, 2H-Integration),
7,22 ppm (Triplett, 2H), 6,60 ppm (überlagertes Douplett + Triplett,
4H), 5,7 ppm (breites Singlett), 4,25 ppm (Triplett, CH
2OC=O,
4H), 1,75 ppm bis 0,8 ppm (aliphatisches CH, CH
2,
CH
3-Protonen, 3 Signale, die einen Gesamtwert
von 80H bei der Integration ergaben).
-
In
einen 2-Liter-Rundboden-Kolben, der mit einem mechanischen Rührer und
einer Dean-Stark-Falle ausgestattet war, wurden gegeben: Dodecylamin
(185,0 g, 1,0 Mol; Schmelzpunkt: 30 bis 32° C), gefolgt von Ethylcyanoacetat
(135,6 g, 1,2 Mol, Dichte: 1,06 g pro ml). Die Mischung wurde gerührt und
auf 120° C
erhitzt, und zwar für
eine Zeitdauer von 1 h, und während
dieser Zeit wurden ein flüssiges
Nebenprodukt abdestilliert. Der heißen Reaktionsmischung wurden
unter Rühren
dann schrittweise zugesetzt das Lösungsmittel N,N-Dimethylformamid
(320 g, erhalten von Firma Caledon Labs, Brampton, Ontario), Ethylacetoacetat
(260,0 g, 2,0 Mol, Dichte: 1,02 g pro ml) und Piperazin (192,2 g,
2,0 Mol). Die resultierende Mischung wurde auf 110° C Innentemperatur
für 4 h
erhitzt, während
welcher Zeit ein flüssiges
Nebenprodukt abdestilliert wurde. Eine golden-braune viskose Lösung, die
daraus resultierte, wurde auf Raumtemperatur abgekühlt. Die
Lösung
wurde vorsichtig unter kräftigem
Rühren
in eine hergestellte Lösung
von Methanol (1.624 g), entionisiertes Wasser (684 g) und konzentrierte
Salpetersäure
(322 g, 3,6 Mol) gegossen. Ein festes Material fiel unmittelbar
aus, und die resultierende Aufschlämmung wurde für weitere
30 min gerührt.
Die Aufschlämmung
wurde im Vakuum filtriert, und der feste Filterkuchen wurde mehre
Male mit 500 ml-Portionen einer Lösungsmittel-Mischung gewaschen,
die 70 Vol. % Methanol und 30 Vol.-% Wasser umfasste, bis die Leitfähigkeit
des Filtrats niedrig war. Der feste Kuchen wurde bei 40° C unter
Vakuum 24 h lang getrocknet und ergab 277 g (87 % Ausbeute) des Dodecylpyridon-Produkts
in Form eines hell-beigen Feststoffs. 1H-NMR-Spektralanalyse
zeigte an, dass das Produkt von hoher Reinheit war, ohne Beweisanzeichen
von kontaminierenden Stoffen, die etwa 2 % der Produkt-Ausbeute übersteigen. 1H-NMR-Spektral-Zuordnungen (300 MHz, DMSO-d6): 5,6 ppm (Singlett, H in der Ringposition
C-5), 3,88 ppm (breites Triplett, 2H, CH2 benachbart
dem Ring N), 2,2 ppm (Singlett, 3H, CH3 in der
Ring-Position C-4), 1,6 ppm bis 0,8 ppm (CH2 und
CH3-Protonen der Dodecyl-Gruppe, 3 Signale, für die sich bei der Integration
insgesamt 65H ergaben).
-
In
einen 1-Liter-Rundboden-Kolben, der mit einem mechanischen Rührer, einem
Tropftrichter und einem Thermometer ausgerüstet war, wurden gegeben: das
Anthranilat, wie es oben hergestellt worden war (108 g, 0,139 Mol),
gefolgt von schrittweise 210 ml Eisessig, 18 ml konzentrierte Schwefelsäure, 20
ml entionisiertes Wasser und 20 ml Propionsäure. Die dunkle Lösung wurde
auf eine Innentemperatur von +3° bis
+5° C abgekühlt. Nitrosylschwefelsäure (NSA,
handelsübliche
Lösung,
die 40 Gew.-% NSA in Schwefelsäure
enthielt; 56 ml, 0,285 Mol) wurden dann in den Tropftrichter gegeben
und langsam in die Dianthranilat-Lösung eingetropft, wobei man
die Innentemperatur zwischen +3° und
+5° C hielt
und die Emission von NOx Gasen minimierte.
Nach etwa 1,5 h war die NSA-Zugabe vollständig abgeschlossen. Eine kleine
Teilmenge von Sulfaminsäure
(1 g, 0,01 Mol) wurde dann der Mischung zugesetzt, um dadurch irgendwelches
zurückgebliebenes NSA
abzufangen, und die Mischung wurde für weitere 15 min gerührt.
-
Die
Lösung
von Dodecylpyridon wurde hergestellt unter Verwendung eines graduierten
Zehn-Liter-Bechers, der mit einem mechanischen Rührer ausgestattet war. In dieses
Gefäß wurden
gegeben: Natriumhydroxid (55 g, 1,39 Mol) und Natriumacetat (114
g, 1,39 Mol), gefolgt von entionisiertem Wasser (3,5 1) und Isopropanol
(2,5 1). Sobald sich alle Komponenten der Reaktionsmischung gelöst hatten,
wurde das wie oben beschrieben hergestellte Dodecylpyridon der Lösung zugesetzt,
und diese wurde intensiv gerührt,
bis alle Pyridon-Feststoff-Anteile gelöst waren. Die kalte Diazoniumsalz-Lösung wurde
dann langsam in die Dodecylpyridon-Kupplungslösung bei Raumtemperatur eingegossen.
Ein vollständig
hellgelber Niederschlag wurde gebildet, und nach vollständigem Ablauf
der Reaktion wurde die Reaktionsaufschlämmung für weitere 0,5 h gerührt, bevor
man das Färbemittel-Material
gewann. Die gelbe Aufschlämmung
wurde im Vakuum filtriert durch eine hydrophobe Membran mit einer
Porenweite von 3 Mikron. Der gelbe Filterkuchen wurde dann erneut
in einer 20:80-Mischung von Isopropanol:entionisiertem Wasser aufgeschlämmt, 30
min lang gerührt
und dann erneut filtriert. Der Filterkuchen wurde dann der nachfolgend
beschriebenen Behandlung mehrere Male unterworfen: Erneutes Dispergieren
in 1 l entionisierten Wassers, Rühren
für 30
min, anschließend
Filtration durch eine 3 Mikron starke hydrophobe Membran, bis der
pH-Wert des resultierenden Filtrats größer war als 5,0 und die Leitfähigkeit
des Filtrats niedrig war. Der Kuchen wurde dann in einem Vakuum-Ofen
bei 30° C über 36 h getrocknet,
was 192,6 g (96,3 % Ausbeute) des rohen Produkts als senfgelbes
granulatförmiges
Pulver erbrachte, das ein Schmelzpunktbereich von 123 bis 134° C hatte.
-
Das
Rohprodukt wurde weiter durch Rühren
in 2 Liter einer heißen
Mischung aus 1:1-Aceton
und Isopropanol gereinigt und ergab so ein helloranggelbes-farbenes
Pulver. Dieses gereinigte Material hatte einen Schmelzpunkt von
128 bis 134° C,
ein Wellenlängen-Maximum (UV/vis)
von 430 nm (Toluol) und eine Spektralstärke in Toluol von 5,37 × 104 ml pro Gramm-Zentimeter. 1H-NMR-Spektral-Zuordnungen
(300 MHz, CDCl3): 8,18 ppm (Doublett, 2H-Integration,
aromatische H), 8,05 ppm (Doublett, 2H-Integration, aromatische H), 7,65 ppm
(Triplett, 2H-Integration, aromatische H); 7,30 ppm (Triplett, 2H-Integration,
aromatisches H), 4,45 ppm (Doublett von Doubletts, 4H-Integration, CH2 benachbarte Esterfunktion), 4,00 ppm (Doublett
von Doubletts, 4H-Integration,
CH2 benachbart Pyridon), 2,65 ppm (Singlett,
6H-Integration, CH3 im Pyridon-Ring), 1,90
bis 0,80 ppm (Multipletts, CH, CH2, CH3 nach Integrieren für > 60H, alle anderen Alkyl-Protonen).
-
Beispiel II
-
Ein
Färbemittel
der Formel, die in Beispiel I gezeigt ist, wurde wie folgt hergestellt:
Ein Dimerester-Anthranilat der Formel, die in Beispiel I gezeigt
ist, wurde hergestellt, wie dies in Beispiel I beschrieben ist.
In einen 1-Liter-Rundboden-Kolben, der mit einem mechanischen Rührer, einem
Tropftrichter und einem Thermometer ausgestattet war, wurde unter
Bewegen bzw. Rühren
das Dianthranilat (54,4 g, 0,070 Mol) gegeben, gefolgt von einer
hergestellten Lösung,
die 173 ml Eisessig, 43 ml entionisiertes Wasser und 15 ml konzentrierte Schwefelsäure enthielt.
Die resultierende dunkle Lösung
wurde abgekühlt
auf eine Innentemperatur von +3 bis +5° C. Nitrosylschwefelsäure (NSA,
im Handel erhältliche
Lösung,
enthaltend 40 Gew.-% NSA in Schwefelsäure, 45,6 g, 0,144 Mol) wurde
in den Tropftrichter gegeben und dann langsam in die Lösung mit
einer Geschwindigkeit eingetropft, durch die die Innentemperatur
zwischen 0° C
und +8° C
gehalten wurde. Nach 20 min war die NSA-Zugabe vollständig abgeschlossen,
und die Mischung wurde für
weitere 15 min gerührt,
wobei sie auf 0° C
abgekühlt
wurde. Harnstoff (0,2 g, 3,3 mMol) wurde dann der Mischung zugesetzt,
um irgendwelches restliches NSA-Reagenz abzufangen, und die Mischung
wurde weitere 15 min gerührt.
-
Eine
Kupplungs-Lösung
von Dodecylpyridon wurde in einem 2-Liter-Kessel hergestellt, der
mit einem mechanischen Rührer
ausgestattet war. In dieses Gefäß wurde
Dodecylpyridon (45,7 g, 0,144 Mol) gegeben, das hergestellt worden
war, wie es in Beispiel I beschrieben ist, gefolgt von 457 ml Isopropanol.
Eine Lösung von
Natriumhydroxid (21,5 g, 0,538 Mol), Natriumacetat-trihydrat (73,2
g, 0,538 Mol) und 457 ml entionisiertes Wasser wurden hergestellt
und dann der intensiv gerührten
Dispersion des Pyridons in Isopropanol zugesetzt. Eine braune Lösung wurde
nach 15 min Rühren
bei Raumtemperatur gebildet. Die kalte Diazonium-Salz-Lösung wurde
dann langsam in die unter kräftigem
Rühren
befindliche Dodecylpyridon-Kupplungs-Lösung gegossen. Es bildete sich
unverzüglich
ein hellgelber Niederschlag, und nach vollständiger Zugabe der Diazonium-Salz-Lösung wurde
die gelbe Aufschlämmung
weitere 30 min lang gerührt.
-
Die
gelbe Aufschlämmung
wurde danach unter Vakuum durch ein hydrophobes Membran-Medium mit einer
Porenweite von 3 Mikron filtriert. Der gelbe Farbstoff-Kuchen wurde
dann in einer 50:50-Mischung aus Isopropanol und entionisiertem
Wasser erneut dispergiert und 30 min lang gerührt. Der Filterkuchen wurde
danach der folgenden Behandlung einige Male unterzogen: Erneutes
Dispergieren in 1 l einer 50:50-Mischung von Isopropanol und entionisiertem
Wasser, Rühren
für 30
min und Filtration durch eine hydrophobe Membran mit einer Porenweite
von 3 Mikron, bis der pH-Wert des resultierenden Filtrats größer war
als 5,0 und die Leitfähigkeit
des Filtrats niedrig war. Dem Filterkuchen wurden dann zwei abschließende Spülungen mit
1-Liter-Volumenmengen mit Methanol gegeben. Der Kuchen wurde dann
in einem Vakuum-Ofen bei 40° C
36 h lang getrocknet, was 90 g (89,6 % Ausbeute) des Rohprodukts
als hellgelbes Pulver ergab; Schmelzpunktbereich: 121 bis 133° C; Wellenlängen-Maximum
(UV/vis): 430 nm (Toluol) und Spektralstärke in Toluol 5,14 × 104 ml/g.cm. Sofern erwünscht, kann dieses Material
weiter durch Umkristallisieren gereinigt werden, wie in Beispiel
I beschrieben ist.
-
Beispiel III
-
Ein
Färbemittel
der Formel
worin
C
36H
64+n eine verzweigte
Alkylengruppe ist, welche ungesättigt
sein kann und zyklische Gruppen enthalten kann, worin n eine ganze
Zahl von 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 oder 10 ist, und worin ein
Isomer davon die folgende Formel aufweist:
wurde
wie folgt hergestellt.
-
Ein
Dimerester-Anthranilat der Formel
worin C
36H
64+n eine verzweigte Alkylengruppe ist, welche
ungesättigt
sein kann und zyklische Gruppen enthalten kann, worin n eine ganze
Zahl von 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 oder 10 ist, und worin ein
Isomer davon die folgende Formel aufweist:
wurde
wie in Beispiel I beschrieben hergestellt.
-
In
einen 2-Liter-Kolben, der mit einem Magnetrührstab und einem Temperaturthermostat
ausgerüstet war,
wurden Octadecylamin (Stearylamin, 18,9 g, 0,07 Mol) gegeben, gefolgt
von Cyanoacetat (7,9 g, 0,07 Mol; Dichte: 1,06 g/ml). Die resultierende
Mischung wurde gerührt
und auf 120° C
Innentemperatur 1 h lang erhitzt, und während dieser Zeit wurde ein
flüssiges
Nebenprodukt abdestilliert. Der heißen Reaktionsmischung wurden
dann nacheinander Ethylacetoacetat (10,08 g, 0,0775 Mol, Dichte:
1,02 g/ml), Piperidin (11,0 g, 0,13 Mol, Dichte: 0,861 g/ml) und
eine Lösungsmittel-Mischung
(60 ml) zugesetzt, die 5 Gew.-Teile Toluol und 1 Gew.-Teil 1,2-Dimethoxyethan
enthielt. Die Reaktion lief unter Rühren bei 120° C für weitere
24 h ab. Die Lösungsmittel wurden
dann im Vakuum abdestilliert, und die verbleibende viskose Lösung wurde
sorgfältig
in eine unter Rühren
befindliche Lösung
von Methanol (80 ml), entionisiertem Wasser (20 ml) und konzentrierte
Chlorwasserstoffsäure
(16 ml, 2,5 Mol) gegossen. Ein fester Niederschlag bildete sich
unverzüglich,
und die Aufschlämmung
wurde unter Vakuum filtriert, gefolgt von einem Spülen des
festen Kuchens mit 2 × 50
ml-Portionen 80 %igen wässrigen
Methanols. Der so erhaltene Kuchen wurde dann an der Luft 24 h lang
getrocknet und ergab 24,5 g (0,061 Mol, 87 % Ausbeute) des N-Stearylpyridon-Produkts
als hellbraunes Pulver.
-
In
einen 1-Liter-Rundboden-Kolben der mit einem mechanischen Rührer, einem
Tropftrichter und einem Thermometer ausgestattet war, wurden das
wie oben beschrieben hergestellte Dimerester-Anthranilat (87 g,
0,112 Mol) gegeben, gefolgt nacheinander von 170 ml Eisessig, 17
ml konzentrierte Schwefelsäure,
17 ml entionisiertes Wassers und 17 ml Propionsäure. Die dunkle Lösung wurde
auf eine Innentemperatur von +3° C
bis +5° C
unter Rühren
abgekühlt.
Nitrosylschwefelsäure
(NSA, im Handel erhältliche
Lösung,
enthaltend 40 Gew.-% NSA in Schwefelsäure, 71 g, 0,224 Mol) wurde
dann in den Tropftrichter gegeben und wurde langsam in die Lösung eingetropft
und zwar derart, dass die Innentemperatur zwischen 0° und +8° C gehalten
wurde. Nach 1 h war die NSA-Zugabe
abgeschlossen, und die Mischung wurde für weitere 0,5 h unter Abkühlen gerührt. Sulfaminsäure (1 g,
0,01 Mol) wurde dann der Mischung zugesetzt, um irgendwelches rückständige NSA abzufangen,
und die Mischung wurde für
weitere 15 min gerührt.
-
Die
Lösung
von Stearylpyridon wurde in einem 4-Liter-Kolben hergestellt, der
mit einem mechanischen Rührer
ausgestattet war. In dieses Gefäß wurde
Natriumhydroxid (45 g, 1,12 Mol) und Natriumacetat (92 g, 1,12 Mol)
gegeben, gefolgt von entionisiertem Wasser (2 l) und Isopropanol
(1,5 l). Sobald sich alle Komponenten der Mischung gelöst hatten,
wurde ein Überschuss
Stearylpyridon (139,5 g, 0,35 Mol) der Lösung unter kräftigem Rühren zugesetzt.
Die Mischung wurde 30 min lang bewegt, wonach irgendwelche nicht
gelösten
Feststoffe durch Filtration entfernt wurden. Die Pyridon-Lösung wurde
dann in ein 10-Liter-Glasgefäß überführt, das
mit einem mechanischen Rührer
ausgestattet war. Die kalte Diazoniumsalz-Lösung wurde dann langsam in
die unter kräftigem
Rühren
befindliche Stearylpyridon-Lösung
bei Raumtemperatur gegossen. Ein hellgelber Niederschlag bildete
sich unverzüglich,
und die Viskosität
der Aufschlämmung
erhöhte
sich, sobald die Diazoniumsalz-Lösung
zugesetzt wurde, was weitere 1,0 l entionisierten Wassers erforderte,
um ein Rühren
zu unterstützen.
Die Aufschlämmung
wurde 1 h bei Raumtemperatur vor Gewinnen des Färbemittel-Materials gerührt. Die
Aufschlämmung
wurde dann unter Vakuum durch ein hydrophobes Membranmedium mit
3 Mikron Porenweite filtriert. Das gesamte Färbemittel-Material von dem
Filterkuchen wurde dann in 4 l Di-chlormethan-Lösungsmittel gerührt und
in zwei 2 Liter-Trenntrichter aufgeteilt. Mehrere Extraktionen der
Dichlormethan-Schicht wurden durchgeführt, wofür man ein 1 Liter-Mengen entionisierten
Wassers verwendete, bis bei Messung die am Ende erhaltene wässrige Schicht
einen pH-Wert von etwa 5 und eine niedrige Leitfähigkeit hatte. Das Dichlormethan-Lösungsmittel
wurde im Vakuum durch Destillation entfernt, wodurch ein gelbbrauner
Rohstoff zurückblieb.
Das Rohprodukt wurde in siedendem Isopropanol (etwa 3 l) umkristallisiert
und ergab ein hellorange-farbenes körniges Pulver, Schmelzpunktbereich:
122 bis 123° C.
Eine 1H-NMR-Spektral-Analyse zeigte, dass
dieses Material von hoher Reinheit ist und in Übereinstimmung mit der gezeigten
Struktur steht.
-
Beispiel IV (außerhalb
des Umfangs der Ansprüche)
-
Ein
Färbemittel
der Formel
(einschließlich der
Isomere sowohl der cis- als auch der trans-Konfiguration innerhalb
des zentralen Cyclohexan-Rings) wurde wie folgt hergestellt:
Ein
Dimerester-Anthranilat der Formel
(einschließlich der
Isomere sowohl der cis- als auch der trans-Konfiguration innerhalb
des zentralen Cyclohexan-Rings) wurde wie folgt hergestellt: 1,4-Cyclohexandimethanol
(144,2 g, 1,0 Mol), Isatonsäureanhydrid (408
g, 2,50 Mol; erhalten von der Firma Sigma-Aldrich Co.) und Triethylamin (22,4
g, 0,20 Mol; erhalten von der Firma Sigma-Aldrich Co.) in 500 ml
N,N-Dimethylformamid in einem 4-Liter-Becher wurde gerührt und
auf 100° C
2,5 h lang erhitzt. Die Reaktionslösung wurde dann auf 50° C abgekühlt und
mit 2 l Methanol behandelt. Die resultierende weiße Suspension
wurde 2 h lang gerührt,
gefolgt von einer Filtration und einem Waschen des Feststoffs in
Filtertrichter mit 5 × 100
ml-Portionen Methanol. Trocknen bei 60° C für 24 h ergab 195,5 g eines
weißen
Feststoffs, der identifiziert wurde als reines 1,4-Cyclohexandimethyl-Dianthranilat
(mehr als 99 % nach
1H-NMR-Spektroskopie).
Der Schmelzpunkt dieses Produkts betrug 144 bis 145° C.
-
Dodecylpyridon
wurde hergestellt, wie dies in Beispiel I beschrieben ist.
-
Einer
Suspension des 1,4-Dimethylcyclohexan-Dianthranilats, das wie oben
beschrieben hergestellt worden war (19,1 g, 0,050 Mol) in 100 ml
Eisessig wurde konzentrierte Schwefelsäure (10 ml) zugesetzt, gefolgt
anschließend
von 20 ml Wasser. Die resultierende Suspension wurde in einem Eis-Salz-Bad
abgekühlt, und
die Temperatur wurde zwischen +3 und +6° C gehalten, als Nitrosylschwefelsäure (NSA;
im Handel erhältliche
Lösung,
enthaltend 40 Gew.-% NSA in Schwefelsäure; erhalten von der Firma
Sigma-Aldrich Co.;
21 ml, 0,105 Mol) langsam in die gerührte Mischung im Verlauf von
45 min eingetropft wurde. Die resultierende Suspension wurde bei
etwa 5° C
1 h lang gerührt.
Die Kuppler-Lösung
von Dodecylpyridon wurde unter Suspendieren des Dodecylpyridons,
das wie in Beispiel I beschrieben hergestellt worden war (31 g,
0,105 Mol) 800 ml Wasser und Zusetzen von Natriumhydroxid (20 g,
0,50 Mol), Natriumacetat (49 g, 0,60 Mol) und Isopropanol (400 ml).
Die resultierende trübe
Lösung
wurde kräftig
gerührt,
während
die Suspension des diazotierten Dianthranilats langsam hineingegossen
wurde. Es bildete sich sofort eine hellgelbe Suspension. Die Suspension wurde
bei Raumtemperatur 1 h lang gerührt,
gefolgt von einer Filtration und einem Waschen des Feststoffs mit 3 × 500 ml-Portionen
Wasser. Der feuchte Kuchen wurde in 2 Liter Wasser redispergiert
und wurde dann filtriert und mit 3 × 100 ml Wasser gewaschen,
gefolgt von 3 × 100
ml Isopropanol. Der feuchte Kuchen wurde dann in 100 ml Isopropanol
bei 80° C
1 h lang gerührt.
Eine Filtration und ein Waschen mit Isopropanol, gefolgt von einem
Trocknen an der Luft für
24 h ergab das Rohprodukt als grüngelben
Feststoff (26,7 g). Das Produkt wurde in 400 ml Dichlormethan gerührt, und
die so erhaltene Suspension wurde dann mit 100 ml Methanol behandelt.
Die Mischung wurde filtriert, und der Feststoff wurde mit 4 × 50 ml-Portionen
Methanol gewaschen. Der gesammelte Feststoff wurde getrocknet bei
60 ° C und
ergab 23,1 g (44 % Ausbeute) des Färbemittels in Form eines hellgelben
Pulvers.
-
Beispiel V
-
Verschiedene
charakteristische Eigenschaften der in den Beispielen I bis IV hergestellten
Färbemittel wurden
gemessen. Eine Struktur-Bestätigung
der Anilinie, Pyridone und synthetisierten Färbemittel wurde erhalten durch
1H-NMR-Spektroskopie unter Verwendung eines
300 MHz- (7-Tesla-)Kernmagnet-Resonanz-Spektrometers der Firma Bruker
(Avance DPX300) mit einer Breitband-X-Transmitter-4-Kernsonde (Zwei-Kanal-System) und Durchführen der
NMR-Analyse an einer 50 mg Probe, die in deuterierten Lösungsmitteln
wie beispielsweise deuteriertem Chloroform (CDCl
3)
oder Hexa-deuterodimethylsulfoxid (DMSO-d
6) gelöst war.
Schmelzpunkte wurden bestimmt durch das Differential-Scanning-Calorimetrie-Verfahren
unter Verwendung eines Calorimeters der Firma TA Instruments (DSC
2010), und wobei eine 10-mg-Probe des Färbemittels über einen Heizzyklus bei einer
Heizrate von 10° C/min
bis zu einem Maximum von 250° C
erhitzt wurde. Für
einige der beispielhaften Färbemittel
wurde der quantitative Gew.-% Gehalt an Kohlenstoff (C), Wasserstoff
(H) und Stickstoff (N) durch Verbrennungsanalyse unter Verwendung
eines Analyzers der Firma LECO (CHNS 932) an einer 2-mg-Probe des Färbemittels
bestimmt. Wellenlänge-Maximum
(UV/vis) und Spektralstärken
der Färbemittel
wurden gemessen entweder in Toluol-Lösungsmittel oder Dichlormethan-Lösungsmittel
unter Verwendung eines Hewlett-Packard 8452A-Diode-Array-Spektrophotometers
bei einer Konzentration von etwa 0,01 bis 0,02 mg/ml. Die Ergebnisse
für das
mittlere Molekulargewicht (MW), den Schmelzpunkt-Bereich (mp, °C), das Wellenlängen-Maximum
in Toluol (λ
max, nm), Spektralstärke (in Toluol, Ausnahme in
den Fällen,
in denen es angegeben ist) (SS, mL*g
–1cm
–1)
und das molare Absorptionsvermögen (ε, L*Mol
–1cm
–1)
sind in der nachfolgenden Tabelle gezeigt. Das molare Absorptionsvermögen ε ist definiert
als der molare Extinktions-Koeffizient des Färbemittels und wird ausgedrückt durch
das Beer-Lambert-Gesetz:
worin
die Färbemittel-Konzentration
die Einheit „Mol
pro Liter" hat und
die Weglänge
1 cm ist. Darüber
hinaus ist das molare Absorptionsvermögen ε (L*Mol
–1cm
–1)
= Spektralstärke
(mL*g
–1cm
–1) × (Molekulargewicht
des Färbemittels) ÷ 1.000.
-
Zu
Vergleichszwecken werden diese Werte auch geliefert für im Handel
erhältliches
NEOPEN 075 YELLOW von der Firma BASF.
- +
als Wert in Klammern erhalten unter Verwendung einer umkristallisierten
Probe
- * gemessen in Dichlormethan
- ** außerhalb
des Umfangs der Ansprüche
-
Beispiel VI
-
Tinten-
bzw. Druckfarbenzusammensetzungen enthaltend die Färbemittel
der Beispiele I, II, III und IV und – für Vergleichszwecke – das im
Handel erhältliche
Produkt NEOPEN 075 YELLOW von der Firma BASF wurden wie folgt hergestellt:
- Tinte A: In einem Becher aus nicht-rostendem Stahl wurden zusammengegeben:
209,68 g Polyethylen-Wachs (PE 655, erhalten von der Firma Baker
Petrolite, Tulsa, OK, mit der Formel CH3(CH2)50CH3),
95,54 g Stearylstearamid-Wachs (KEMAMIDE® S-180,
erhalten von der Firma Crompton Corporation, Greenwich, CT), 114,76 g
Tetramid-Harz, erhalten
aus der Reaktion eines Äquivalents
Dimer-Disäure
mit zwei Äquivalenten
Ethylendiamin und UNICID® 700 (ein Carbonsäue-Derivat
eines langkettigen Alkohols, erhalten von der Firma Baker Petrolite,
Tulsa, OK), hergestellt wie beschrieben in Beispiel 1 des US-Patents
Nr. 6,174,937, dessen Offenbarung vollständig durch die Inbezugnahme
in die vorliegende Beschreibung übernommen
wird; 49,81 g eines Urethan-Harzes,
erhalten aus der Reaktion von zwei Äquivalenten ABITOL® E
Hydroabietylalkohol und einem Äquivalent
Isophoron-Diisocyanat, hergestellt wie beschrieben in Beispiel 1
des US-Patents Nr. 5,782,966; 20,23 g eines Urethan-Harzes, das
das Addukt von drei Äquivalenten
Stearylisocyanat und einem Alkohol auf Glycerin-Basis war, hergestellt
wie beschrieben in Beispiel 4 des US-Patents Nr. 6,309,453; und
1,01 g NAUGUARD® 445
Oxidationsinhibitor. Die Materialien wurden bei einer Temperatur
von etwa 135° C
in einem Ofen zusammengeschmolzen, anschließend durch Rühren in
einem Temperatur-kontrollierten Mantel bei etwa 135° C für etwa 0,2
h gemischt. Dieser Mischung wurde dann zugesetzt 24,58 g des wie
in Beispiel I beschrieben hergestellten gelben Farbstoffs. Nach
Rühren über weitere
2 h wurde die so gebildete gelbe Druckfarbe bzw. Tinte durch einen
erhitzten MOTT®-Apparat
filtriert, wofür
ein NAE 0,2 Mikrofilter und (oben drauf) ein Whatman #3-Filterpapier
verwendet wurde, und zwar unter einem Druck unter 15 PSI. Die filtrierte
Phasen-Umkehr-Tinte wurde in Formen gegossen, und man ließ sie unter
Bildung von Stiften verfestigen. Die so hergestellte gelbe Phasen-Umkehr-Tinte zeigte
eine Viskosität
von etwa 10,7 Centipoise, gemessen mit einem Rheometrics-Cone-Plate
Viskosimeter bei etwa 140° C,
Schmelzpunkte von etwa 85° C
und 105° C
(gemessen mittels eines Differential-Scanning-Calorimeters unter
Verwendung eines DuPont 2100 Calorimeters, einer Glassübergangs-Temperatur
(Tg) von etwa 15° C und eine Spektral-Stärke von
etwa 2.314 ml Absorptionsvermögen
pro Gramm bei 428 nm bestimmt unter Verwendung einer spektrophotographischen
Vorgehensweise basierend auf der Messung des Färbemittels in Lösung durch
Lösung
des festen Farbstoffs in n-Butanol und Messen des Absorptionsvermögens unter
Verwendung eines Spektrophotometers der Firma Perkin Elmer Lambda
2S UV/VIS.
- Tinte B: Tinte B wurde hergestellt in einer Weise, die ähnlich der,
der zur Herstellung von Tinte A verwendet wurde, jedoch wurde eine
unterschiedliche Formulierung für
die Tinten-Zusammensetzung verwendet, wie sie in der nachfolgenden
Tabelle gezeigt ist. Die Eigenschaften der Tinte B wurden erhalten
unter Anwendung derselben Verfahrensweisen wie derjenigen, wie sie
für Tinte
A angewendet wurden. Wie in der Tabelle gezeigt ist, besteht der
herausragende Unterschied zwischen Tinte A und Tinte B in der relativen
Farbstoff-Konzentration der Tinte. Die spektrale Stärke der
Tinte, die ein Färbemittel
enthält,
sinkt mit abnehmender Farbstoff-Konzentration der Tinte. Die Viskositäten der
Tinte A und der Tinte B sind im wesentlichen dieselbe.
- Tinte C: Eine Tinte wurde nach der Verfahrensweise hergestellt,
wie sie für
Tinte A beschrieben ist, mit der Ausnahme, dass anstelle des Färbemittels
von Beispiel I das Färbemittel
von Beispiel Π verwendet
wurde. Die Eigenschaften der Tinte C wurden erhalten unter Anwendung
derselben Verfahrensweisen wie derjenigen, die für Tinte A beschrieben wurden.
- Tinte D (Vergleich): Eine Tinte wurde hergestellt nach dem Verfahren,
wie es für
Tinte A beschrieben wurde, mit der Ausnahme, dass anstelle des Färbemittels
aus Beispiel I das im Handel erhältliche
Färbemittel
NEOPEN 075 (erhalten von der Firma BASF) verwendet wurde. Die Eigenschaften
der Tinte D wurden unter Verwendung derselben Verfahrensweisen wie
derjenigen erhalten, wie sie für
Tinte A verwendet wurden. Färbemittel-freie
Tinten-Basis: Eine farblose Phasen-Umkehr-Tinten-Basis wurde in
der kompletten Weise wie für Tinte
A hergestellt, mit der Ausnahme, dass kein Färbemittel verwendet wurde.
Die farblose Tinten-Basis wurde hergestellt für den Zweck einer Bewertung
des Ausmaßes
der Farbdiffusion in die farblose Tinten-Basis.
-
Die
folgende Tabelle fasst die Zusammensetzungen der verschiedenen Tinten
und die Mengen der Komponenten darin zusammen (Gew.-%-Zahlen sind
in der Tabelle angegeben).
- *
ABITOL E-basiertes Urethan-Harz
- ** Glycerin-Alkohol-basiertes Urethan-Harz
-
Die
so hergestellten gelben Tinten wurden erfolgreich auf HAMMERMILL
LASERPRINT®-Papier
in einem XEROX® PHASER
850-Drucker gedruckt, der Gebrauch von einem Druckverfahren macht,
in dem die Tinte zuerst in einem bildweise angelegten Muster auf
ein Zwischen-Übertragungs-Element
strahlenmäßig übertragen
wird, gefolgt von einer Übertragung
des bildweise angelegten Musters von dem Zwischen-Übertragungs-Element auf ein
End-Aufzeichnungs-Substrat. Die Bilder mit durchgehender Fläche und
einer Auflösung von
355 dpi × 464
dpi wurden von dem Drucker erzeugt, und ihre Farb-Raum-Daten wurden
erhalten auf dem ACS® Specro Sensor® II
Calorimeter in Übereinstimmung
mit den Messverfahren, die niedergelegt sind in ASTM 1E805 (Standard
Practice of Instrumental Methods of Color or Color Difference Measurements
of Materials) unter Anwendung der passenden Kalibrierungs-Standards,
wie sie von dem Hersteller des Geräts zur Verfügung gestellt wurden. Für Zwecke
der Verfizierung und Quantifizierung der insgesamt erreichten calorimetrischen
Leistung der Tinten wurde die Messung der Daten reduziert über eine
Tristimulus-Integration, gefolgt von der Verfahrensweise nach ASTM
E308 (Standard Method for Computing the Colors of Objects using the
CIE System) um zu berechnen: die 1976 CIE L* (Helligkeit), a* (rote-Farbeigenschaftlgrüne Farbeigenschaft)
und b*(gelbe Farbeigenschaft/blaue Farbeigenschaft) bzw. die entsprechenden
CIELAB-Werte für
jede Probe der Phasen-Übertragungs-Tinte.
Darüber
hinaus wurden die Werte für
die Ziele CIELAB-Psychometric Chroma
(C*ab) und der CIELAB-Psychometric Hue Angle
nach der Publikation CIE 15.2, Calorimetrie (zweite Auflage, Central
Bureau de la CIE, Wien, 1986) berechnet.
-
Gedruckte
Proben der gelben Tinten wurden hinsichtlich ihrer charakteristischen
Farbeigenschaften bewertet, die in der nachfolgenden Tabelle angegeben
sind. Wie für
einen Fachmann mit Erfahrung in diesem technischen Bereich offensichtlich
ist, geben die CIE L*a*b*-Werte für Tinten, die mit Färbemitteln
gemäß der vorliegenden
Erfindung hergestellt wurden, eine exzellente gedruckte Tinte mit
gelbem Farbton wieder. Die nachfolgende Tabelle listet auf Die Viskosität (η; Centipoise)
der Tinten bei 140° C,
die Spektralstärke
in n-Butanol (SS; mL*g–1cm–1)
der Tinten und die CIE L*a*b-Farb- Koordinaten der Drucke, die mit den
Tinten unter Verwendung des XEROX PHASER® 850
hergestellt wurden.
-
-
Die
Farbwerte in der obigen Tabelle zeigen an, dass die Färbemittel
von Beispiel I und das Färbemittel von
Beispiel III in Heißschmelz-Tinte
mit guter gelber Farbe verwendet werden können, wie durch die oben b*-Werte
der Drucke belegt wird. Eine niedrigere Konzentration des Färbemittels
von Beispiel I wurde in Tinte B verwendet, die einen ähnlichen
Grad gelber Farbe erzeugte, wie durch den Wert von b* belegt wird,
verglichen mit der Vergleichs-Tinte D, die mit dem im Handel erhältlichen
Färbemittel
NEOPEN 075 und bei höherer Färbemittel-Konzentration
formuliert wurde.
-
Beispiel VII
-
Die
Löslichkeit
der Färbemittel
der Beispiele I und III und – für Vergleichsbeispiele – des im
Handel erhältlichen
NEOPEN 075 Farbstoffs in einem Phasen-Umkehr-Tinten-Träger wurde
untersucht. Tinten-Zusammensetzungen, die diese Färbemittel
enthalten (Tinten A und C bzw. D), wurden hergestellt, wie in Beispiel VI
beschrieben. Da Phasen-Umkehr-Tinten
einem Bereich von Temperaturen während
des Aufwärm-
und Stand-by- Modus
des Druckers die auch während
des Betriebs unterworfen sind, ist es wünschenswert, dass die Färbemittel
vollständig
in den Tinten bei Temperaturen bis hinab zu 125° C löslich sind. Die Löslichkeit
jedes Färbemittels
in der jeweiligen Tinte wurde bei verschiedenen Temperaturen getestet,
indem man die Tinten zuerst auf 145° C erhitzte und sie anschließend abkühlte, gefolgt
von einem erneuten Erhitzen. Die Ergebnisse waren die folgenden:
-
Wie
die Ergebnisse anzeigen, blieben die Färbemittel der Beispiele I und
III vollständig
löslich
in den jeweiligen Tinten bei Temperaturen gleich oder höher 125 ° C.
-
Beispiel VIII
-
Tinten
wurden wie in Beispiel VI beschrieben hergestellt, die das Färbemittel
von Beispiel I und das Färbemittel
von Bespiel III – für Vergleichszwecke – den im
Handel erhältlichen
NEOPEN 075 Farbstoff enthielten (Tinten A und C bzw. D). Die thermische
Stabilität
des Färbemittels
in den Tinten wurde bewertet durch Erhitzen der Test-Tinten für einige
Tage auf Temperaturen von 145°C.
Ein Abbau der Färbemittel
wurde bewertet durch Überwachen
der Änderung
(Verlust) der Spektral-Stärke
der Tinte bei einer gegebenen Test-Temperatur als Funktion der Zeit.
Die verbleibende Spektralstärke
wurde hier als Maß von
zurückbleibendem,
unzerfallenem Färbemittel
in der Tinte für
jeden Tag des Erhitzens auf 145° C
herangezogen. Die Ergebnisse waren wie folgt:
-
Wie
die Ergebnisse anzeigen, zeigen die Färbemittel von Beispiel I und
Beispiel III klar überlegene thermische
Stabilität
in den Tinten A und C, verglichen mit der Tinte D, die mit dem im
Handel erhältlichen
Färbemittel
NEOPEN 075 formuliert worden war.
-
Beispiel IX
-
Tinten
wurden hergestellt, wie dies in Beispiel VI beschrieben ist, die
das Färbemittel
von Beispiel I, das Färbemittel
von Beispiel III und – für Vergleichszwecke – den im
Handel erhältlichen
Farbstoff NEOPEN 075 enthielten (Tinten A, B, C und D). Eine klare
Tinte wurde auch von derselben Zusammensetzung wie der Basis-Träger der
gelben Tinten von Bespiel VI hergestellt, der jedoch kein Färbemittel
enthielt.
-
Ein
Färbemittel-Abbau
führt nicht
nur zu einem Rückgang
in der spektralen Stärke
(wie in Bespiel VIII gezeigt wurde), sondern kann auch eine unerwünschte Farbe
als Ergebnis der Färbemittel-Abbau-Reaktion
in der Tinte erzeugen. Diese beiden Phänomene können in nachteiliger Weise
die Farbqualität
von Drucken aus den jeweiligen Tinten beeinträchtigen, wenn das Färbemittel
nicht thermisch stabil ist und aus Sicht der praktischen Anwendung
ist es die insgesamt auftretende Farbänderung der Tinte (gemessen
als ΔE-Änderung der Farbwerte), die
das meiste ausmacht, wenn man die thermische Stabilität des Färbemittels
bewertet.
-
Ein
Test der thermischen Stabilität
wurde durchgeführt,
indem man die Test-Tinten und die farblose Basis-Tinte in einem
Drucker erhitzte und die Farbänderung
der Drucke als Funktion der Zeit maß (bezeichnet als „No-standby-Test"). Die Farbänderungen
der resultierenden Drucke wurden anhand der CIELAB-Werte überwacht
und ausgedrückt
als ΔE,
relativ zu den anfänglichen
CIELAB-Werten. Die Farbänderung
jeder Probe wurde bestimmt entsprechend den hier oben beschriebenen
Verfahrensweisen zum Erhalt der CIELAB-Werte. Farbänderungen
wurden bestimmt entsprechend dem Verfahren gemäß ASTM D2244-89 (Standard Test
Method for Calculation of Color Differences from instrumentally
Measured Color Coordinates) (ΔE
= ((L*
1 – L*
2)
2 + (a*
1 – a*
2)
2 + (b*
1 – b*
2)
2]
1/2).
Die Ergebnisse für
die Tinten A, C und D sowie für
die klare Tinten-Basis waren die folgenden:
-
Wie
die Daten angeben, zeigten die Tinten A und B, die das Färbemittel
von Beispiel I enthielten, eine wesentlich bessere Farbstabilität als die
Vergleichs-Tinte D, die NEOPEN 075 enthielt. Darüber hinaus können die
Farbänderungen,
die in den Tinten A und B beobachtet wurden, die das Färbemittel
von Beispiel I enthielten, in weitem Umfang einer Entfärbung der
Tintenbasis zugeschrieben werden, wie dies durch die Daten für die farblose
Tintenbasis gezeigt wird, was einen weiteren Beleg für die exzellent
thermische Stabilität
des Färbemittels
von Beispiel I liefert. Tinte C, die das Färbemittel von Beispiel III
enthielt, zeigte ebenfalls eine bessere Farbstabilität als Tinte
D.
-
Beispiel X
-
Die
Tinten A, B, C und D, die wie in Beispiel VI beschrieben hergestellt
worden waren, wurden hinsichtlich Diffusion getestet. Eine klare
Tintenbasis wurde ebenfalls hergestellt, wie dies in Beispiel VI
beschrieben ist. Dieses Bewertungsverfahren für die Diffusion machte Gebrauch
von gedruckten Bildern, um das Vermögen des Färbemittels von einem gelben
Tinten-Pixel zum Diffundieren in benachbarte farblose Tinten-Pixels zu
testen, die das gelbe Tinten-Pixel umgaben. Die Test-Drucke wurden
in der Weise hergestellt, dass sie für etwa 20 % einzelner gelber
Pixels enthielten, die von 80 % klarer Tinten-Pixels umgeben waren.
Die Drucke wurden bei 45° C
und 60° C über eine
Zahl von Tagen hinsichtlich der Gesamt-Farbänderung analysiert, die bei
Verwendung eines Farbbild-Katalysators nachgewiesen wurde, und die
Response über
die Zeit wurde gemessen als Änderung
in Delta E (ΔE)
und ist in der nachfolgenden Tabelle gezeigt. Die Farbdifferenz
jeder Probe wurde bestimmt nach den oben zum Erhalt der CIELAB-Werte
beschriebenen Verfahrensweisen. Farbdifferenzen wurden bestimmt
in Entsprechung zu ASTM D2244-89 (Standard Test Method for Calculation
of Color Differences From instrumentally Mesured Color Coordinates)
(ΔE = ((L*
1 – L*
2)
2 + (a*
1 – a*
2)
2 + (b*
1 – b*
2)
2]
1/2). Ein
Erhitzen der Drucke diente zum Imitieren der Bedingungen, wenn Drucke
in warmen Klimazonen behandelt werden oder durch Hochgeschwindigkeits-Dokumenten-Bearbeitungsgeräte durchgeschickt
werden. Die Druck-Tests bei 60° C
wurden konzipiert als beschleunigter Test, um Information über Färbemitteldiffusion über längere Zeiträume bei
Temperaturen unter 60° C
zu bieten.
- ΔE nach ausgedehntem
Erwärmen
auf 45 ° C;
- --- = nicht gemessen
- ΔE nach ausgedehntem
Erwärmen
auf 60 ° C;
- --- = nicht gemessen
-
Wie
die Daten angeben, waren bei Test-Temperaturen von 45° C und 60° C alle untersuchten
Färbemittel
in umgebende klare Basis-Pixels diffundiert, wie aus der Farbänderung
offensichtlich wird und als Änderung
des Delta E (ΔE)
gemessen wurde. Jedoch gingen die Färbemittel der Beispiele I,
II und III (Tinten A, B und C) eine Diffusion in einem signifikant
geringerem Grad ein als das Vergleichsfärbemittel NEOPEN 075 in Tinte
D. Daher sind die Färbemittel
der Beispiele I, II und III dem Vergleichsfärbemittel NEOPEN 075 aus dem Handel
in ihrem Vermögen
für eine
minimale Farb-Diffusion überlegen.
-
Beispiel XI
-
Die
Tinten mit den Färbemitteln
der Beispiele I und III (Tinten A bzw. C) wurden hinsichtlich der
Farbdiffusion getestet. Tinten-Zusammensetzungen wurden hergestellt,
die die Färbemittel
der Beispiele I und III (Tinten A und C) und – für Vergleichszwecke – das im
Handel erhältliche
Färbemittel
NEOPEN 075 enthielten (Tinte D), und zwar wie in Beispiel VI. Eine
farblose Tinte wurde auch aus derselben Zusammensetzung wie der
Basis-Träger
der gelben Tinten von Beispiel VI hergestellt, der jedoch keine
Färbemittel
enthielt. Dieses Diffusions-Bewertungs-Verfahren beinhaltete das
Erzeugen von Text-Drucken
der gelben Tinten, das Aufbringen eines SCOTCH®-Klebebandes
(erhalten von der Firma 3M, St. Paul, MN auf einen Teilabschnitt
des Textes und Untersuchen des Ausmaßes der Färbemittel-Diffusion in das
Klebematerial über
die Zeit. Die Text-Druck-Proben
wurden bei Raumtemperatur und bei 60° C untersucht, um zu beobachten,
wie Hitze das Vermögen
zur Diffusion des Färbemittels
verstärkte.
Dieser Test simulierte die reale Situation, wenn man SCOTCH®-Klebeband-Etiketten
auf Drucke aufbringt, die mit Tinten erzeugt wurden, die die Färbemittel
enthielten. Ein Erhitzen dieser Drucke diente zum Imitieren der
Bedingungen, wenn Drucke in warmen Klimazonen behandelt werden oder
durch Hochgeschwindigkeits-Dokumenten-Verarbeitungsgeräte hindurch
geschickt werden. Die bei 60° C
erhaltenen Druck-Tests waren als beschleunigte Tests konzipiert,
um Information über
die Färbemittel-Diffusion über lange
Zeiträume
bei Temperaturen unter 60° C
zu bieten. Ein Bewertungs-System wurde entwickelt, um den Grad der
relativen Färbemittel-Diffusion
der einzelnen Tinten-Beispiele zu bewerten, und zwar bei einer Bewertungsskala
von 1 bis 5, wobei eine Bewertung von 5 für keine merkliche Färbemittel-Diffusion
in dem betroffenen Text-Bereich steht und 1 für eine übermäßig starke Färbemittel-Diffusion
steht, die zu vollständig
unleserlichen Text-Buchstaben
in dem betroffenen Bereich führt.
-
Nach
sieben Tagen bei 60° C
zeigte der gedruckte Text-Bereich bei Verwendung von Vergleichs-Tinte D
mit dem im Handel erhältlichen
Färbemittel
NEOPEN 075 eine übermäßig starke
Färbemittel-Diffusion
in das aufgebrachte Band, was zu total unleserlichen Text-Buchstaben
führte,
und diese Tinte wurde eine Bewertung von 1 zuerkannt.
-
Bei
den Tinten A und C, die die Färbemittel
der Beispiele I und III enthielten, war das Ausmaß einer Diffusion
nur minimal bemerkbar, und der gedruckte Text, der unter dem Klebeband
stand, war noch lesbar, selbst unter Bedingungen einer Temperatur
von 60° C,
und den Tinten A und C wurde jeweils eine relative Bewertung von
3 zuerkannt. Der bei einer Erhitzungstemperatur von 60° C durchgeführte beschleunigte
Test lieferte Ergebnisse, die klar eine in starkem Maße verbesserte
Diffusions-Leistung der Färbemittel
der Beispiele I und III zeigen, verglichen mit dem im Handel erhältlichen
Färbemittel
NEOPEN 075. Der Diffusionstest mit aufgebrachtem Klebeband unter
Raumtemperatur-Bedingungen
(20° C)
zeigte, dass das Ausmaß der
Färbemittel-Diffusion
praktisch vernachlässigbar
für alle
Beispiel-Tinten A, C und D waren. Die nachfolgende Tabelle fasst
die Färbemittel-Diffusions-Testwerte
für die
Tinten A, C und D nach sieben Tagen Alterns sowohl bei Erhitzungs-Bedingungen
von Raumtemperatur (20° C)
als auch bei Erhitzungsbedingungen von 60° C zusammen.
-
-
Beispiel XII
-
Die
großflächigen Drucke
mit einer Auflösung
von 355 dpi × 464
dpi, gedruckt auf Hammermill-Papiere unter Verwendung eines PHASER® 850-Druckers
mit den Tinten A, C und D wurden auf Lichtbeständigkeit getestet. Die Drucke
wurden mit einer 2500-W-Xenon-Bogenlampe
in einem Fade-Ometer (Firma Atlas-Electric Devices Co., Chicago,
IL) für
unterschiedliche Zeiträume
bei Raumtemperatur bestrahlt. Der Farbunterschied jeder bestrahlten
Probe relativ zu der jeweiligen unbestrahlten Kontroll-Probe wurde
bestimmt nach den Verfahrensweisen, die oben zum Erhalt der CIELAB-Werte
beschrieben wurden. Farbunterschiede wurden bestimmt im Anschluss
an ASTM D224489 (Standard Test Method for Calculation of Color Differences
From instrumentally Mesured Color Coordinates) (ΔE = [(L*1 – L*2)2 + (a*1 – a*2)2 + (b*1 – b*2)2]1/2).
Die nachfolgende Tabelle zeigt die Werte von ΔE, die die Änderung der Farbwerte als Funktion
der Zeit angeben.
-
-
Wie
die Daten angeben, zeigten alle diese gelben Tinten eine exzellente
Lichtbeständigkeit,
wobei der ΔE-Wert
wesentlich geringer war als 10, und zwar selbst nach 100 h Bestrahlungszeit.
-
Beispiel XIII
-
Eine
Phasen-Umkehr-Tinte gemäß der vorliegenden
Erfindung wird wie folgt hergestellt: Eine feste Tinten-Träger-Zusammensetzung
wird hergestellt, wie beschrieben in Beispiel 11 des US-Patents
Nr. 5,780,528. Dieser Zusammensetzung wird etwa 2 Gew.-% des gelben
Färbemittels
zugesetzt, das beschrieben wurde in Beispiel I. Nach Rühren für etwa 3
weitere Stunden wird die so gebildete gelbe Tinte durch einen erhitzten
MOTT® Apparat
unter Verwendung eines #3 Whatman-Filter-Papiers und einem Druck
von etwa 15 psi filtriert. Die filtrierte Phasen-Umkehr-Tinte wird
dann in Formen gegossen, und man ließ das Material erhärten unter
Bildung von Tinten-Stiften.
-
Es
wird davon ausgegangen, dass die so hergestellte gelbe Phasen-Umkehr-Tinte
eine Viskosität
von etwa 11 bis 13 Centipoise zeigt, gemessen mittels eines Konus-Platten-Viscometers der Firma
Rheometrics bei etwa 140° C,
einen Schmelzpunkt von etwa 80° C,
gemessen durch Differential-Scanning-Calorimetrie unter Verwendung
eines DuPont 2100 Calorimeters, eine Glassübergangs-Temperatur (Tg) von etwa 14° C und eine Spektralstärke (bestimmt
unter Verwendung eines spektrophotometrischen Verfahrens, das auf
der Messung des Färbemittels
in Lösung
durch Lösen
der festen Tinte in Toluol und Messen des Absorptionsvermögens unter
Verwendung eines Spektrophotometers der Firma Perkin Elmer (Lambda
2S UV/VIS) von etwa 150 ml Absorptionsvermögen pro Gramm bei etwa 555
nm zeigt.
-
Beispiel XIV
-
In
einen 2-Liter-Rundboden-Kolben, der mit einem mechanischen Rührer und
einer Dean-Stark-Falle ausgestattet war, wurde Octylamin gegeben
(194 g, 1,5 Mol), gefolgt von Ethylcyanoacetat (203 g, 1,8 Mol). Die
so gebildete Mischung wurde gerührt
und danach für
einen Zeitraum von 1 h auf 140° C
erhitzt; während dieser
Zeit bildete sich ein Nebenprodukt, das man abdestillieren ließ.
-
Der
heißen
Reaktionsmischung wurden dann nacheinander zugegeben: Ein Dimethylformamid-Lösungsmittel
(375 ml), Ethylacetoacetat (390 g, 3,0 Mol) und Piperazin (258 g,
3,0 Mol). Die so gebildete Mischung wurde für eine Zeit von 4 h auf 110° C erhitzt;
während
dieser Zeit wurde noch mehr Nebenprodukt abdestilliert. Die resultierende
Lösung
kann dann auf Raumtemperatur abkühlen.
-
Die
Lösung
wurde dann vorsichtig unter starkem Rühren in eine hergestellte,
bei Raumtemperatur gehaltene Lösung
von Methanol (2 1) entionisiertem Wasser (2 1) und konzentrierter
Salpetersäure
(448 g, 5 Mol) gegossen. Es bildete sich sofort ein fester Niederschlag,
und die resultierende Aufschlämmung
wurde 30 min lang gerührt.
Die Aufschlämmung
wurde dann unter Vakuum filtriert, und der feste Kuchen wurde in
dem Trichter mit 1-Liter-Portionen einer Lösungsmittel-Mischung gespült, die
50 Vol.-% Methanol und 50 Vol.-% Wasser enthielt. Der Feststoff
wurde bei 40° C
unter Vakuum 24 h lang getrocknet und ergab das Octylpyridon-Produkt als
hellbeige-farbenen Feststoff (Ausbeute 343 g; 87 %). Eine 1H-NMR-Spektral-Analyse zeigte an, dass das Produkt
von hoher Reinheit war, ohne Nachweis von verunreinigenden Substanzen,
die etwa 2 % der Produktausbeute überschritten.
-
Beispiel XV
-
In
einen 1-Liter-Rundboden-Kolben, der mit einem mechanischen Rührer und
einer Dean-Stark-Falle ausgestattet war wurde geschmolzenes Stearylamin
(135,0 g, 0,5 Mol), gefolgt von Ethylcyanoacetat (67,8 g, 0,6 Mol;
Dichte: 1,06 g/ml) gefüllt.
Die so gebildete Mischung wurde gerührt und dann auf 120° C für eine Zeit von
1 h erhitzt; während
dieser Zeit war ein gebildetes Nebenprodukt abdestilliert.
-
Der
heißen,
bei 120° C
Innentemperatur gerührten
Reaktionsmischung wurden dann nacheinander zugesetzt: Dimethylformamid
(190 g), Ethylacetoacetat (130,0 g, 1,0 Mol; Dichte: 1,02 g/ml)
und Piperazin (86,2 g, 1,0 Mol). Die so gebildete Mischung wurde
für 6 h
auf eine Temperatur von 120° C
erhitzt; während dieser
Zeit war noch mehr Nebenprodukt abdestilliert. Die resultierende
Lösung
ließ man
dann auf Raumtemperatur abkühlen.
-
Die
Lösung
wurde dann sorgfältig
unter starkem Rühren
in eine bei Raumtemperatur befindliche Lösung von Methanol (1.975 g)
und konzentrierte Salpetersäure
(180 g, 2,0 Mol) gegossen. Ein fester Niederschlag bildete sich
fast sofort, und die resultierende Aufschlämmung wurde für 30 min
gerührt.
Die Aufschlämmung
wurde dann unter Vakuum in einem Buchner-Trichter mit einem Durchmesser
von 25 cm filtriert, und der feste Kuchen wurde in dem Trichter
mit 500 ml-Portionen einer Lösungsmittel-Mischung gespült, die
50 Vol.-% Methanol und 50 Vol.-% Wasser enthielt, bis die Leitfähigkeit
des Filtrats niedrig war. Der Feststoff wurde bei 60° C 48 h lang
getrocknet und ergab des Stearylpyridon-Produkt als hellbeige-farbenen
Feststoff (Ausbeute: 169,5 g, 84 %). Eine 1H-NMR-Spektral-Analyse
zeigte, dass das Produkt von hoher Reinheit war, ohne Hinweis auf
kontaminierende Substanzen, die etwa 2 % der Gesamt-Produktausbeute überstiegen.
-
Beispiel XVI
-
1,12-Dodecandiol
(50,6 g, 0,25 Mol; erhalten von der Firma TCI America, Portland,
OR), Isatonsäureanhydrid
(114,3 g, 0,70 Mol) und Triethylamin (10,1 g, 0,10 Mol) in 125 ml
Dimethylformamid wurden gerührt und
auf 100° C
für 3,5
h erhitzt. Die Lösung
wurde dann auf 30° C
abgekühlt
und wurde dann zuerst mit Methanol (600 ml) und dann mit Wasser
(200 ml) behandelt. Das resultierende ausfallende Öl wurde
von der Überstandsflüssigkeit
durch Dekantieren abgetrennt. Das Öl wurde dann in 500 ml Methanol
gerührt,
was Kristalle dazu brachte, sich zu bilden. Die Kristall-Suspension
wurde nach 2 h abfiltriert, und der Feststoff wurde mit 3 × 50-ml
Mengen Methanol gewaschen und wurde dann an der Luft unter Erhalt
von 47 g eines hellbeige-farbenen Feststoffs getrocknet, der durch 1H-NMR als hochgradig reines (> 98 %) 1,12-Dodecandiyl-Dianthranilat spezifiziert
wurde. Der Schmelzpunkt dieses Produkts, gemessen durch Differential-Scanning-Calorimetrie,
betrug 62,5° C.
-
Beispiel XVII
-
Eine
Mischung von 4,4'-Isopropylidendicyclohexanol
(240 g, 1,0 Mol; erhalten von der Firma Sigma-Aldrich), Isatonsäureanhydrid
(490 g, 3,0 Mol) und 1,4-Diazabicyclo[2.2.2]Octan
(29,0 g, 0,25 Mol) in 500 ml Dimethylformamid wurde bei 130° C 2 h lang
gerührt.
Die Lösung
wurde dann auf etwa 50° C
abgekühlt
und wurde dann zuerst mit 800 ml Methanol und dann mit 100 ml Wasser
behandelt. Die resultierende trübe
Lösung bildete
Kristalle aus, die nach 1 h abfiltriert wurden. Der Feststoff wurde
mit 3 ×200
ml-Portionen Methanol gewaschen und wurde dann bei 60° C unter
Erhalt von 86 g (18 % Ausbeute) eines bräunlichen Feststoffs getrocknet,
der mittels 1H-NMR in der Weise beurteilt wurde, dass
er das erwartete 4,4'- Isopropylidendicyclohexandiyl-Dianthranilat
war, und zwar in etwa 95 %iger Reinheit. Das Produkt wurde aus Dimethylformamid/Methanol
umkristallisiert und ergab 33,5 g eines weißen Feststoffs, der mittels 1H-NMR in der Weise beurteilt wurde, dass
er das hochgradig reine (> 99
%) Dianthranilat war. Der Schmelzpunkt dieses Produktes, gemessen durch
Differential-Scanning-Calorimetrie, betrug 211 ° C.
-
Beispiel XVIII
-
Eine
Mischung aus 4,4'-Bicyclohexanol
(49,5 g, 0,25 Mol; erhalten von der Firma Sigma-Aldrich), Isatonsäureanhydrid
(122 g, 0,75 Mol) und 1,4-Diazabicyclo[2.2.2]octan (66,0 g, 0,50
Mol) in 200 ml Dimethylformamid wurden bei 120° C 1 h lang gerührt, und
die Mischung wurde dann auf etwa 80° C abgekühlt. Die Lösung wurde dann zuerst mit
Dimethylformamid (100 ml) und dann mit Methanol (900 ml) behandelt.
Die resultierende Suspension wurde 2 h lang gerührt und wurde dann filtriert.
Der Feststoff wurde mit 4 × 100
ml-Portionen Methanol gewaschen und wurde bei 60° C 20 h lang getrocknet. Das
4,4'-Bicyclohexandiyldianthranilat-Produkt
wurde erhalten als Creme-Feststoff (58,2 g, 53 % Ausbeute), der
mittels 1H-NMR-Spektroskopie in der Weise
beurteilt wurde, dass er rein war (> 98 %). Der Schmelzpunkt dieses Produktes
war gemessen mittels Differential-Scanning-Calorimetrie, 236° C.
-
Beispiel XIX
-
4,8-Bis(hydroxymethyl-)tricyclo[5.2.1.02,6]decan (98,2 g, 0,50 Mol; Isomeren-Mischung;
erhalten von der Firma TCI America, Portland, Oregan), Isatonsäureanhydrid
(204 g, 1,25 Mol), 1,4-Diazabicyclo[2.2.2]octan (28,2 g, 0,25 Mol)
und Dimethylformamid (250 ml) wurden in einen 2-Liter-Becher gegeben,
und die resultierende Mischung wurde auf 120° C 3 h lang erhitzt. Die Lösung wurde
dann auf Raumtemperatur abgekühlt und
wurde dann zuerst mit 1.000 ml Methanol und danach mit 200 ml Wasser
behandelt. Es wurde eine Zwei-Phasen-Mischung erhalten. Die untere
Schicht wurde durch Dekantieren abgetrennt und wurde dann mit 2 × 300 ml-Portionen
mit Methanol unter kräftigem
Rühren
des Methanols mit der unteren Schicht und anschließendes Abtrennen
der abgetrennten Schichten mittels Dekantieren extrahiert. Das resultierende
braune Öl
wurde in einem Kugelrohr-Destillations-Apparat 2 h lang auf 140° C unter
Vakuum zum Entfer nen der überwiegenden
Menge des restlichen Lösungsmittels
und der flüchtigen
Nebenprodukte erhitzt. Das 4,8-Bis(hydroxymethyl-)tricyclo[5.2.1.02,6]decandianthranilat-Produkt wurde erhalten als glasartiger
Feststoff (59,5 g, 27 % Ausbeute), der mittels 1H-NMR in der Weise
beurteilt wurde, dass er in etwa 98 %iger Reinheit vorlag.

































































