-
Die
vorliegende Anmeldung betrifft neue substituierte Spiroisoxazoline,
Verfahren zu Ihrer Herstellung und ihre Verwendung zur Bekämpfung
von tierischen Schädlingen, vor allem von Arthropoden und
insbesondere von Insekten.
-
Es
ist bekannt, dass bestimmte substituierte Spiroisoxazoline fungizid
wirksam sind (
WO 2008/013925 und
WO2008/013622 ) oder
als Mittel zur Krebsbekämpfung eingesetzt werden können
(
JP-A-05247006 ).
-
Über
die Verwendung von substituierten Spiroisoxazolinen zur Bekämpfung
von tierischen Schädlingen, insbesondere als Pflanzenschutzmittel,
ist jedoch nichts bekannt.
-
Moderne
Planzenschutzmittel müssen vielen Anforderungen genügen,
beispielsweise in Bezug auf Höhe, Dauer und Breite ihrer
Wirkung und möglichen Verwendung. Es spielen Fragen der
Toxizität, der Kombinierbarkeit mit anderen Wirkstoffen
oder Formulierhilfsmitteln eine Rolle sowie die Frage des Aufwands,
der für die Synthese eines Wirkstoffs betrieben werden
muss. Ferner können Resistenzen auftreten. Aus all diesen Gründen
kann die Suche nach neuen Pflanzenschutzmitteln nie als abgeschlossen
betrachtet werden und es besteht ständig Bedarf an neuen
Verbindungen mit gegenüber den bekannten Verbindungen zumindest
in Bezug auf einzelne Aspekte verbesserten Eigenschaften.
-
Aufgabe
der vorliegenden Erfindung war es, Verbindungen bereitzustellen,
durch die das Spektrum der Schädlingsbekämpfungsmittel
unter verschiedenen Aspekten verbreitert wird.
-
Es
wurde nun überraschenderweise gefunden, dass bestimmte
substituierte Spiroisoxazoline sowie deren N-Oxide und Salze biologische
Eigenschaften aufweisen und sich insbesondere zur Bekämpfung
von tierischen Schädlingen eignen, und deshalb besonders
gut im agrochemischen Bereich und im Bereich der Tiergesundheit
einsetzbar sind.
-
Die
erfindungsgemäßen Spiroisoxazoline sind durch
die Formel (I)
charakterisiert, wobei
die
chemische Gruppierung A
1 für CR
1 oder Stickstoff, A
2 für
CR
2 oder Stickstoff, A
3 für
CR
3 oder Stickstoff, und A
4 für
CR
4 oder Stickstoff stehen, wobei aber höchstens
drei der chemischen Gruppierungen A
1 bis
A
4 gleichzeitig für Stickstoff
stehen, und wobei
R
1, R
2,
R
3 und R
4 unabhängig
voneinander für Wasserstoff, Halogen, CN, NO
2,
gegebenenfalls substituiertes C
1-C
6-Alkyl, C
1-C
6-Halogenalkyl, C
3-C
6-Cycloalkyl, C
3-C
6-Halogencycloalkyl, C
1-C
6-Alkoxy, C
1-C
6-Halogenalkoxy, C
1-C
6-Alkylthio, C
1-C
6-Halogenalkylthio, C
1-C
6-Alkylsulfinyl, C
1-C
6-Halogenalkylsulfinyl, C
1-C
6-Alkylsulfonyl, C
1-C
6-Halogenalkylsulfonyl, C
1-C
6-Alkylamino, N,N-Di(C
2-C
6)alkylamino oder C
2-C
4-Alkoxycarbonyl, stehen,
wenn keine
der Gruppierungen A
1 bis A
4 für
Stickstoff steht, können R
3 und
R
4 gemeinsam mit dem Kohlenstoff an das
sie gebunden sind einen 5-gliedrigen Ring bilden, der 0, 1 oder
2 Stickstoffatome und/oder 0 oder 1 Sauerstoffatom und/oder 0 oder
1 Schwefelatom enthält, oder
wenn keine der Gruppierungen
A
1 bis A
4 für
Stickstoff steht, können R
3 und
R
4 gemeinsam mit dem Kohlenstoff an das
sie gebunden sind einen 6-gliedrigen Ring bilden, der 0, 1 oder
2 Stickstoffatome enthält;
die chemische Gruppierung
B
1 für CR
5 oder
Stickstoff, B
2 für CR
6 oder
Stickstoff, B
3 für CR
7 oder
Stickstoff, und B
4 für CR
8 oder Stickstoff stehen, wobei aber höchstens
drei der chemischen Gruppierungen B
1 bis
B
4 gleichzeitig für Stickstoff
stehen, und wobei
R
5, R
6,
R
7 und R
8 unabhängig
voneinander für Wasserstoff, Halogen, CN, NO
2,
gegebenenfalls substituiertes C
1-C
6-Alkyl, C
1-C
6-Halogenalkyl, C
3-C
6-Cycloalkyl, C
3-C
6-Halogencyclo-C
1-C
3-alkyl, C
3-C
6-Cycloalkyl-C
1-C
3-alkyl, C
2-C
6-Alkenyl, C
2-C
6-Halogenalkenyl, C
1-C
6-Alkoxy, C
1-C
6-Halogenalkoxy, C
1-C
6-Alkylthio, C
1-C
6-Halogenalkylthio, C
1-C
6-Alkylsulfinyl, C
1-C
6-Halogenalkylsulfinyl, C
1-C
6-Alkylsulfonyl, C
1-C
6-Halogenalkylsulfonyl, C
1-C
6-Alkylamino, N,N Di(C
2-C
6)alkylamino C
2-C
4-Alkylaminocarbonyl, N,N-Di(C
3-C
9)alkylamino-carbonyl, C
1-C
6-Alkylaminosulfonyl C
1-C
6-Halogenalkylaminosulfonyl oder C
2-C
4-Alkoxycarbonyl
stehen;
D für eine Gruppierung -C(=O)-, -CH
2-, CH(OH), -C(Hal)- oder -C(Hal)
2- steht, wobei Hal ausgewählt ist
unter Fluor, Chlor, Brom und Iod;
E für Methylen oder
Ethylen steht;
L für eine bivalente chemische Gruppierung
steht, die ausgewählt ist unter den Gruppierungen -NHC(=O)-, -NR
9C(=O)-, -CH
2NHC(=O)-,
-CH
2NR
9C(=O)-, -C(=O)NH,
-C(=O)NR
9, -C(=O)NHCH
2-,
-C(=O)NR
9CH
2-, -CH=N-OCH
2C(=O)NH-, -CH=N-OCH
2C(=O)NR
9-, -CH
2NHC(=O)NH-,
-CH
2NHC(=O)NR
9-,
-NH(C=O)NH-, -NH(=O)NR
9-, -NR
9(C=O)NH-,
-NR
9(=O)NR
9-, -C(=O)-,
-CH
2-, -(CH
2)
2-, -(CH
2)
3-, -Si-, -O-, -S(O)
p-,
und -CH
2-S(O)
p-,
-SO(=N-CN)- und -S(=N-CN)-, wobei
p für 0, 1 oder
2 und
R
9 für gegebenenfalls
substituiertes C
1-C
6-Alkyl,
Aryl(C
1-C
3)-alkyl,
Heteroaryl(C
1-C
3)-alkyl,
C
2-C
6-Alkenyl, C
2-C
6-Alkinyl, C
3-C
6-Cycloalkyl,
C
4-C
7-Alkylcycloalkyl
und C
4-C
7-Cycloalkylalkyl,
C
2-C
7-Alkylcarbonyl, C
2-C
7-Alkoxycarbonyl
steht;
m für 0 oder 1 steht;
Q für Wasserstoff,
gegebenenfalls substituiertes C
1-C
6-Alkyl, C
2-C
6-Alkenyl, C
2-C
6-Alkinyl, C
3-C
6-Cycloalkyl, C
4-C
7-Alkylcycloalkyl, C
4-C
7-Cycloalkylalkyl, C
2-C
7-Alkylcarbonyl, C
1-C
6-Alkylaldehyd, C
1-C
6-Hydroxyalkyle, C
2-C
7-Alkoxycarbonyl, C
1-C
6-Halogenalkyl, für Formyl, Hydroxy,
Halogen, Cyano oder für eine Gruppierung OR
10,
NR
9R
11 oder Q1 steht,
wobei
R
10 ausgewählt ist unter
gegebenenfalls substituierten C
1-C
6-Alkyl, C
2-C
6-Alkenyl, C
2-C
6 Alkinyl, C
3-C
6-Cycloalkyl, C
4-C
7-Alkylcycloalkyl und C
4-C
7-Cycloalkylalkyl,
R
11 ausgewählt
ist unter Wasserstoff, der Gruppierung Q2 und gegebenenfalls mit
R
13 substituierten C
1-C
6-Alkyl, C
2-C
6-Alkenyl, C
2-C
6-Alkinyl, C
3-C
6-Cycloalkyl, C
4-C
7-Alkylcycloalkyl und C
4-C
7-Cycloalkylalkyl,
Q1 für Phenyl,
heterocyclischen Ring oder einen 8, 9 oder 10-gliedrigen bicyclischen
Ring steht, die gegebenenfalls substituiert sind,
Q2 jeweils
unabhängig voneinander für Phenyl oder 5- oder
6-gliedrigen heterocyclischen Ring steht, die gegebenenfalls substituiert
sind; oder
L, Q und R
3 zusammen mit
dem Kohlenstoffen an die sie gebunden sind einen gegenenfalls substituierten
5- oder 6-gliedrigen Ring bilden, der gegebenenfalls 0, 1 oder 2
Stickstoffatome und/oder 0 oder 1 Sauerstoffatom und/oder 0 oder
1 Schwefelatom enthält.
-
Bevorzugt
sind Verbindungen der Formel (I) in denen
die chemische Gruppierung
A1 für CR1 oder
Stickstoff, A2 für CR2 oder
Stickstoff, A3 für CR3 oder
Stickstoff, und A4 für CR4 oder Stickstoff stehen, wobei aber höchstens
drei der chemischen Gruppierungen A1 bis
A4 gleichzeitig für Stickstoff
stehen, und wobei
R1, R2,
R3 und R4 unabhängig
voneinander für Wasserstoff, Halogen, CN, NO2,
gegebenenfalls substituiertes C1-C6-Alkyl, C1-C6-Halogenalkyl, C3-C6-Cycloalkyl, C3-C6-Halogencycloalkyl, C1-C6-Alkoxy, C1-C6-Halogenalkoxy, C1-C6-Alkylthio, C1-C6-Halogenalkylthio, C1-C6-Alkylsulfinyl, C1-C6-Halogenalkylsulfinyl, C1-C6-Alkylsulfonyl, C1-C6-Halogenalkylsulfonyl, C1-C6-Alkylamino, N,N-Di(C2-C6)alkylamino oder C2-C4-Alkoxycarbonyl, stehen,
wenn keine
der Gruppierungen A1 bis A4 für
Stickstoff steht, können R3 und
R4 gemeinsam mit dem Kohlenstoff an das
sie gebunden sind einen 5-gliedrigen Ring bilden, der 0, 1 oder
2 Stickstoffatome und/oder 0 oder 1 Sauerstoffatom und/oder 0 oder
1 Schwefelatom enthält, oder
wenn keine der Gruppierungen
A1 bis A4 für
Stickstoff steht, können R3 und
R4 gemeinsam mit dem Kohlenstoff an das
sie gebunden sind einen 6-gliedrigen Ring bilden, der 0, 1 oder
2 Stickstoffatome enthält;
die chemische Gruppierung
B1 für CR5 oder
Stickstoff, B2 für CR6 oder
Stickstoff, B3 für CR7 oder
Stickstoff, und B4 für CR8 oder Stickstoff stehen, wobei aber höchstens
drei der chemischen Gruppierungen B1 bis
B4 gleichzeitig für Stickstoff
stehen, und wobei
R5, R6,
R7 und R8 unabhängig
voneinander für Wasserstoff, Halogen, CN, NO2,
gegebenenfalls substituiertes C1-C6-Alkyl, C1-C6-Halogenalkyl, C3-C6-Cycloalkyl, C3-C6-Halogencyclo-C1-C3-alkyl, C3-C6-Cycloalkyl-C1-C3-alkyl, C2-C6-Alkenyl, C2-C6-Halogenalkenyl, C1-C6-Alkoxy, C1-C6-Halogenalkoxy, C1-C6-Alkylthio, C1-C6-Halogenalkylthio, C1-C6-Alkylsulfinyl, C1-C6-Halogenalkylsulfinyl, C1-C6-Alkylsulfonyl, C1-C6-Halogenalkylsulfonyl, C1-C6-Alkylamino, N,N-Di(C2-C6)alkylamino C2-C4-Alkylaminocarbonyl, N,N-Di(C3-C9)alkylaminocarbonyl, C1-C6-Alkylaminosulfonyl C1-C6-Halogenalkylaminosulfonyl oder C2-C4-Alkoxycarbonyl
stehen;
D für eine Gruppierung -C(=O)-, -CH2-, CH(OH), -C(Hal)- oder -C(Hal)2- steht, wobei Hal ausgewählt ist
unter Fluor, Chlor, Brom und Iod;
E für Methylen oder
Ethylen steht;
L für eine bivalente chemische Gruppierung
steht, die ausgewählt ist unter den Gruppierungen -NHC(=O)-, -NR9C(=O)-, -CH2NHC(=O)-,
-CH2NR9C(=O)-, -C(=O)NH,
-C(=O)NR9, -C(=O)NHCH2-,
-C(=O)NR9CH2-, -CH=N-OCH2C(=O)NH-, -CH=N-OCH2C(=O)NR9-, -CH2NHC(=O)NH-,
-CH2NHC(=O)NR9-,
-NH(C=O)NH-, -NH(=O)NR9-, -NR9(C=O)NH-,
-NR9(=O)NR9-, -C(=O)-,
-CH2-, -(CH2)2-, -(CH2)3-, -Si-, -O-, -S(O)p-,
und -CH2-S(O)p-,
-SO(=N-CN)- und -S(=N-CN)-, wobei
p für 0, 1 oder
2 und
R9 für gegebenenfalls
substituiertes C1-C6-Alkyl,
Aryl(C1-C3)-alkyl,
Heteroaryl(C1-C3)-alkyl,
C2-C6-Alkenyl, C2-C6-Alkinyl, C3-C6-Cycloalkyl,
C4-C7-Alkylcycloalkyl
und C4-C7-Cycloalkylalkyl,
C2-C7-Alkylcarbonyl, C2-C7-Alkoxycarbonyl
steht;
m für 0 oder 1 steht;
Q für Wasserstoff,
gegebenenfalls substituiertes C1-C6-Alkyl, C2-C6-Alkenyl, C2-C6-Alkinyl, C3-C6-Cycloalkyl, C4-C7-Alkylcycloalkyl, C4-C7-Cycloalkylalkyl, C2-C7-Alkylcarbonyl, C1-C6-Alkylaldehyd, C1-C6-Hydroxyalkyle, C2-C7-Alkoxycarbonyl, C1-C6-Halogenalkyl, für Formyl, Hydroxy,
Halogen, Cyano oder für eine Gruppierung OR10,
NR9R11 oder Q1 steht,
wobei
R10 ausgewählt ist unter
gegebenenfalls substituierten C1-C6-Alkyl, C2-C6-Alkenyl, C2-C6-Alkinyl, C3-C6-Cycloalkyl, C4-C7-Alkylcycloalkyl und C4-C7-Cycloalkylalkyl,
R11 ausgewählt
ist unter Wasserstoff, der Gruppierung Q2 und gegebenenfalls mit
R13 substituierten C1-C6-Alkyl, C2-C6-Alkenyl, C2-C6-Alkinyl, C3-C6-Cycloalkyl, C4-C7-Alkylcycloalkyl und C4-C7-Cycloalkylalkyl,
Q1 für Phenyl
oder gegebenenfalls mit Z substituierten heterocyclischen Ring oder
einen 8, 9 oder 10-gliedrigen bicyclischen Ring steht,
Q2 jeweils
unabhängig voneinander für Phenyl, oder 5- oder
6-gliedrigen heterocyclischen Ring steht, die gegebenenfalls substituiert
sind;
Z für Halogen, gegebenenfalls substituiertes
C1-C6-Alkyl, C1-C6-Halogenalkyl,
C3-C6-Cycloalkyl,
C3-C6-Halogencycloalkyl,
C1-C6-Alkoxy, C1-C6-Halogenalkoxy,
C1-C6-Alkylthio,
C1-C6-Halogenalkylthio,
C1-C6-Alkylsulfinyl, C1-C6-Halogenalkylsulfinyl,
C1-C6-Alkylsulfonyl,
C1-C6-Halogenalkylsulfonyl,
C1-C6-Alkylamino, N,N-Di-(C1-C6)alkylamino,
N,N-Di-(C1-C6)alkylsulfinyl,
-CN, -NO2, -C(O)NR12R13, -C(O)OR14, -C(S)NR12R13, -C(S)OR14, -S(O)2NR15R16, -S(O)R17, -S(O)(=NR18)R19 und gegebenenfalls mit R20 substituiertes
Phenyl und Pyridinyl steht, wobei
R12 ausgewählt
ist unter Wasserstoff, gegebenenfalls substituiertes C1-C6-Alkyl, C2-C6-Alkenyl, C2-C6-Alkinyl, C3-C6-Cycloalkyl, C2-C7-Alkylcarbonyl und C2-C7-Alkoxycarbonyl,
R13 ausgewählt
ist unter Wasserstoff oder gegebenenfalls mit R21 substituiertes
C1-C6-Alkyl, C2-C6-Alkenyl, C2-C6-Alkinyl, C3-C6-Cycloalkyl,
C4-C7-Alkylcycloalkyl
und C4-C7-Cycloalkylalkyl,
R14 ausgewählt ist unter Wasserstoff,
gegebenenfalls mit R21 substituiertes C1-C6-Alkyl, C1-C6-Halogenlkyl, C2-C6-Alkenyl, C2-C6-Halogenalkenyl,
C2-C6-Alkinyl, C3-C6-Cycloalkyl,
C3-C6-Halogencycloalkyl,
C4-C7-Alkylcycloalkyl
und C4-C7-Cycloalkylalkyl,
R15 ausgewählt ist unter Wasserstoff,
gegebenfalls substituiertes C1-C6-Alkyl, C1-C6-Halogenalkyl, C2-C6-Alkenyl, C2-C6-Alkinyl, C3-C6-Cycloalkyl, C4-C7-Alkylcycloalkyl, C4-C7-Cycloalkylalkyl, C2-C7-Alkylcarbonyl und C2-C7-Alkoxycarbonyl,
R16 ausgewählt
ist unter Wasserstoff oder gegebenenfalls mit R22 substituiertes
C1-C6-Alkyl, C2-C6-Alkenyl, C2-C6-Alkinyl, C3-C6-Cycloalkyl,
C4-C7-Alkylcycloalkyl
und C4-C7-Cycloalkylalkyl,
R17 ausgewählt ist unter gegebenenfalls
mit R24 substituiertes C1-C6-Alkyl, C2-C6-Alkenyl, C2-C6-Alkinyl, C3-C6-Cycloalkyl, C4-C7-Alkylcycloalkyl und C4-C7-Cycloalkylalkyl,
R18 ausgewählt
ist unter Wasserstoff, C1-C6-Alkyl,
C1-C6-Halogenalkyl,
C2-C6-Alkenyl, C2-C6-Alkinyl, C3-C6-Cycloalkyl,
C4-C7-Alkylcycloalkyl,
C4-C7-Cycloalkylalkyl,
C2-C7-Alkylcarbonyl
und C2-C7-Alkoxycarbonyl,
R19 ausgewählt ist unter Wasserstoff,
gegebenenfalls mit R24 substituiertes C1-C6-Alkyl, C2-C6-Alkenyl, C2-C6-Alkinyl, C3-C6-Cycloalkyl,
C4-C7-Alkylcycloalkyl
und C4-C7-Cycloalkylalkyl,
R20 ausgewählt ist unter Halogen,
-OH, -NH2, -COOH, -CN, -NO2,
C1-C6-Alkyl, C1-C6-Halogenalkyl,
C1-C6-Alkoxy, C1-C6-Halogenalkoxy,
C1-C6-Alkylthio,
C1-C6-Halogenalkylthio, C1-C6-Alkylsulfinyl,
C1-C6-Halogenalkylsulfinyl,
C1-C6-Alkylsulfonyl,
C1-C6-Halogenalkylsulfonyl,
C1-C6-Alkylamino,
N,N-Di-(C1-C6)alkylamino,
C2-C6-Alkylcarbonyl,
C2-C6-Alkoxycarbonyl,
C2-C7-Alkylaminocarbonyl
und N,N-Di-(C1-C6)alkylaminocarbonyl,
R21 ausgewählt ist unter für
Halogen, C1-C6-Alkyl,
C1-C6-Alkoxy, C1-C6-Alkylthio, C1-C6-Alkylsulfinyl,
C1-C6-Alkylsulfonyl,
-CN, -NO2 und Q2,
R22 ausgewählt
ist unter Wasserstoff, gegebenenfalls mit R23 substituiertes
C1-C6-Alkyl, C1-C6-Alkoxy, C1-C6-Alkylthio, C1-C6-Alkylsulfinyl,
C1-C6-Alkylsulfonyl,
-CN, -NO2, gegebenenfalls mit R22 substituiertes
Phenyl oder Pyridyl,
R23 ausgewählt
ist unter Halogen, -OH, -NH2, -COOH, -CN,
-NO2, oder gegebenenfalls subsitutiertes
C1-C6-Alkyl, C1-C6-Halogenalkyl,
C1-C6-Alkoxy, C1-C6-Halogenalkoxy,
C1-C6-Alkylthio,
C1-C6-Halogenalkylthio,
C1-C6-Alkylsulfinyl,
C1-C6-Halogenalkylsulfinyl,
C1-C6-Alkylsulfonyl,
C1-C6-Halogenalkylsulfonyl,
C1-C6-Alkylamino, N,N-Di-(C1-C6)alkylamino,
C2-C4-Alkylcarbonyl,
C2-C4-Alkoxycarbonyl,
C2-C7-Alkylaminocarbonyl,
und N,N-Di-(C1-C6)alkylaminocarbonyl,
R24 ausgewählt ist unter Halogen,
-CN, -NO2, C1-C6-Alkyl, C1-C6-Alkoxy, C1-C6-Alkylthio, C1-C6-Alkylsulfinyl, C1-C6-Alkylsulfonyl, C2-C7-Alkylcarbonyl, C2-C7-Alkoxycarbonyl, C2-C7-Alkylaminocarbonyl, und für gegebenenfalls
mit R25 substituiertes Phenyl oder Pyridyl,
wobei
R25 ausgewählt ist unter
Halogen, -OH, -NH2, -COOH, -CN -NO2, C1-C6-Alkyl,
C1-C6-Halogenalkyl,
C1-C6-Alkoxy, C1-C6-Halogenalkoxy,
C1-C6-Alkylthio,
C1-C6-Halogenalkylthio,
C1-C6-Alkylsulfinyl,
C1-C6-Halogenalkylsulfinyl,
C1-C6-Alkylsulfonyl,
C1-C6-Halogenalkylsulfonyl,
C1-C6-Alkylamino,
N,N-Di-(C1-C6)alkylamino,
C2-C4-Alkylcarbonyl,
C2-C4-Alkoxycarbonyl,
C2-C7-Alkylaminocarbonyl,
N,N-Di-(C1-C6)alkylaminocarbonyl;
oder
L, Q und R3 zusammen mit dem Kohlenstoffen
an die sie gebunden sind einen gegenenfalls substituierten 5- oder
6-gliedrigen Ring bilden, der gegebenenfalls 0, 1 oder 2 Stickstoffatome
und/oder 0 oder 1 Sauerstoffatom und/oder 0 oder 1 Schwefelatom
enthält.
-
Erfindungsgemäß steht ”Alkyl” – in
Alleinstellung oder als Bestandteil einer chemischen Gruppe – für geradkettige
oder verzweigte Kohlenstoffwasserstoffe, vorzugsweise mit 1 bis
6 Kohlenstoffatomen, wie beispielsweise Methyl, Ethyl, n-Propyl,
Isopropyl, n-Butyl, Isobutyl, sec-Butyl, tert-Butyl, Pentyl, 1-Methylbutyl, 2-Methylbutyl,
3-Methylbutyl, 1,2-Dimethylpropyl, 1,1-Dimethylpropyl, 2,2-Dimethylpropyl,
1-Ethylpropyl, Hexyl, 1-Methylpentyl, 2-Methylpentyl, 3-Methylpentyl,
4-Methylpentyl, 1,2-Dimethylpropyl, 1,3-Dimethylbutyl, 1,4-Dimethylbutyl,
2,3-Dimethylbutyl, 1,1-Dimethylbutyl, 2,2-Dimethylbutyl, 3,3-Dimethylbutyl,
1,1,2-Trimethylpropyl, 1,2,2-Trimethylpropyl, 1-Ethylbutyl und 2-Ethylbutyl.
Ferner bevorzugt für Alkyle mit 1 bis 4 Kohlenstoffatomen,
wie unter anderem Methyl, Ethyl, Ethyl, n-Propyl, Isopropyl, n-Butyl,
Isobutyl, sec-Butyl oder tert-Butyl. Die erfindungsgemäßen
Alkyle können mit einem oder mehreren, gleichen oder verschiedenen
Resten substituiert sein.
-
Erfindungsgemäß steht ”Alkenyl” – in
Alleinstellung oder als Bestandteil einer chemischen Gruppe – für
geradkettige oder verzweigte Kohlenstoffwasserstoffe, vorzugsweise
mit 2 bis 6 Kohlenstoffatomen und mindestens einer Doppelbindung,
wie beispielsweise Vinyl, 2-Propenyl, 2-Butenyl, 3-Butenyl, 1-Methyl-2-propenyl,
2-Methyl-2-propenyl, 2-Pentenyl, 3-Pentenyl, 4-Pentenyl, 1-Methyl-2-butenyl,
2-Methyl-2-butenyl, 3-Methyl-2-butenyl, 1-Methyl-3-butenyl, 2-Methyl-3-butenyl,
3-Methyl-3-butenyl, 1,1-Dimethyl-2-propenyl, 1,2-Dimethyl-2-propenyl,
1-Ethyl-2-propenyl, 2-Hexenyl, 3-Hexenyl, 4-Hexenyl, 5-Hexenyl,
1-Methyl-2-pentenyl, 2-Methyl-2-pentenyl, 3-Methyl-2-pentenyl, 4-Methyl-2-pentenyl,
3-Methyl-3-pentenyl, 4-Methyl-3-pentenyl, 1-Methyl-4-pentenyl, 2-Methyl-4-pentenyl,
3-Methyl-4-pentenyl, 4-Methyl-4-pentenyl, 1,1-Dimethyl-2-butenyl, 1,1-dimethyl-3-butenyl,
1,2-Dimethyl-2-butenyl, 1,2-Dimethyl-3-butenyl, 1,3-Dimethyl-2-butenyl,
2,2-Dimethyl-3-butenyl, 2,3-Dimethyl-2-butenyl, 2,3-Dimethyl-3-butenyl,
1-Ethyl-2-butenyl, 1-Ethyl-3-butenyl, 2-Ethyl-2-butenyl, 2-Ethyl-3-butenyl,
1,1,2-Trimethyl-2-propenyl, 1-Ethyl-l-methyl-2-propenyl und 1-Ethyl-2-methyl-2-propenyl.
Ferner bevorzugt für Alkenyle mit 2 bis 4 Kohlenstoffatomen,
wie unter anderem 2-Propenyl, 2-Butenyl oder 1-Methyl-2-propenyl.
Die erfindungsgemäßen Alkenyle können
mit einem oder mehreren, gleichen oder verschiedenen Resten substituiert
sein.
-
Erfindungsgemäß steht ”Alkinyl” – in
Alleinstellung oder als Bestandteil einer chemischen Gruppe – für geradkettige
oder verzweigte Kohlenstoffwasserstoffe, vorzugsweise mit 2 bis
6 Kohlenstoffatomen und mindestens einer Dreifachbindung wie beispielsweise
2-Propinyl, 2-Butinyl, 3-Butinyl, 1-Methyl-2-propinyl, 2-Pentinyl,
3-Pentinyl, 4-Pentinyl, 1-Methyl-3-butinyl, 2-Methyl-3-butinyl,
1-Methyl-2-butinyl, 1,1-dimethyl-2-propinyl, 1-Ethyl-2-propinyl,
2-Hexinyl, 3-Hexinyl, 4-Hexinyl, 5-Hexinyl, 1-Methyl-2-pentinyl,
1-Methyl-3-pentinyl, 1-Methyl-4-pentinyl, 2-Methyl-3-pentinyl, 2-Methyl-4-pentinyl,
3-Methyl-4-pentinyl, 4-Methyl-2-pentinyl, 1,1-Dimethyl-3-butinyl,
1,2-Dimethyl-3-butinyl, 2,2-Dimethyl-3-butinyl, 1-Ethyl-3-butinyl,
2-Ethyl-3-butinyl, 1-Ethyl-l-methyl-2-propinyl und 2,5-Hexadiynyl.
Ferner bevorzugt für Alkinyle mit 2 bis 4 Kohlenstoffatomen
wie unter anderem Ethinyl, 2-Propinyl oder 2-Butinyl-2-propenyl.
Die erfindungsgemäßen Alkinyle können
mit einem oder mehreren, gleichen oder verschiedenen Resten substituiert
sein.
-
Erfindungsgemäß steht ”Cycloalkyl” – in
Alleinstellung oder als Bestandteil einer chemischen Gruppe – für
mono-, bi- oder tricyclische Kohlenwasserstoffe, vorzugsweise mit
3 bis 10 Kohlenstoffen wie beispielsweise Cyclopropyl, Cyclobutyl,
Cyclopentyl, Cyclohexyl, Cycloheptyl, Cyclooctyl, Bicyclo[2.2.1]heptyl,
Bicyclo[2.2.2]octyl oder Adamantyl. Ferner bevorzugt für
Cycloalkyle mit 3, 4, 5, 6 oder 7 Kohlenstoffatomen, wie unter anderem
Cyclopropyl oder Cyclobutyl. Die erfindungsgemäßen
Cycloalkyle können mit einem oder mehreren, gleichen oder
verschiedenen Resten substituiert sein.
-
Erfindungsgemäß steht ”Alkylcycloalkyl” für
mono-, bi- oder tricyclisches Alkylcycloalkyl, vorzugsweise mit
4 bis 10 oder 4 bis 7 Kohlenstoffatomen, wie beispielsweise Ethylcyclopropyl,
Isopropylcyclobutyl, 3-Methylcyclopentyl und 4-Methyl-cyclohexyl.
Ferner bevorzugt für Alkylcycloalkyle mit 4, 5 oder 7 Kohlenstoffatomen
wie unter anderen Ethylcyclopropyl oder 4-Methyl-cyclohexyl. Die
erfindungsgemäßen Alkylcycloalkyle können
mit einem oder mehreren, gleichen oder verschiedenen Resten substituiert
sein.
-
Erfindungsgemäß steht ”Cycloalkylalkyl” für
mono, bi- oder tricyclisches Cycloalkylalkyl, vorzugsweise mit 4
bis 10 oder 4 bis 7 Kohlenstoffatomen, wie beispielsweise Cyclopropylmethyl,
Cyclobutylmethyl, Cyclopentylmethyl, Cyclohexylmethyl und Cyclopentylethyl.
Ferner bevorzugt für Cycloalkylalkyle mit 4, 5 oder 7 Kohlenstoffatomen
wie unter anderen Cyclopropylmethyl oder Cyclobutylmethyl. Die erfindungsgemäßen
Cycloalkylalkyle können mit einem oder mehreren, gleichen
oder verschiedenen Resten substituiert sein.
-
Erfindungsgemäß steht ”Halogen” für
Fluor, Chlor, Brom oder Iod, insbesondere für Fluor, Chlor
oder Brom.
-
Die
erfindungsgemäßen mit Halogen substituierten chemischen
Gruppen, wie beispielsweise Halogenalkyl, Halogencycloalkyl, Halogenalkyloxy,
Halogenalkylthio, Halogenalkylsunfinyl oder Halogenalkylsulfonyl
sind einfach oder mehrfach bis zur maximal möglichen Substituentenzahl
mit Halogen substituiert. Bei mehrfacher Substitution mit Halogen,
können die Halogenatome gleich oder verschieden sein und
können alle an eines oder an mehrere Kohlenstoffatome gebunden
sein. Dabei steht Halogen insbesondere für Fluor, Chlor,
Brom oder Iod, vorzugsweise für Fluor, Chlor oder Brom
und besonders bevorzugt für Fluor.
-
Erfindungsgemäß steht ”Halogencycloalkyl” für
mono-, bi- oder tricyclisches Halogencycloalkyl, vorzugsweise mit
3 bis 10 Kohlenstoffatomen, wie unter anderen 1-Fluor-cyclopropyl,
2-Fluorcyclopropyl oder 1-Fluor-cyclobutyl. Ferner bevorzugt für
Halogencycloalkyl mit 3, 5 oder 7 Kohlenstoffatomen. Die erfindungsgemäßen
Halogencycloalkyle können mit einem oder mehreren, gleichen
oder verschiedenen Resten substituiert sein.
-
Erfindungsgemäß steht ”Halogenalkyl” ”Halogenalkenyl” oder ”Halogenalkinyl” für
mit Halogen substituierte Alkyle, Alkenyle oder Alkinyle mit vorzugsweise
1 bis 9 gleichen oder verschiedenen Halogenatomen, wie beispielsweise
Monohaloalkyl (= Monohalogenalkyl) wie CH2CH2Cl, CH2CH2F, CHClCH3, CHFCH3, CH2Cl, CH2F; Perhaloalkyl wie CCl3 oder
CF3 oder CF2CF3; Polyhaloalkyl wie CHF2,
CH2F, CH2CHFCl,
CHCl2, CF2CF2H, CH2CF3. Entsprechendes gilt für Haloalkenyl
und andere durch Halogen substituierten Reste. Haloalkoxy ist z.
B. OCF3, OCHF2,
OCH2F, OCF2CF3, OCH2CF3 und OCH2CH2Cl;
-
Weitere
Beispiele für Halogenalkyle sind Trichlormethyl, Chlordifluormethyl,
Dichlorfluormethyl, Chlormethyl, Brommethyl, 1-Fluorethyl, 2-Fluorethyl,
2,2-Difluorethyl, 2,2,2-Trifluorethyl, 2,2,2-Trichlorethyl, 2-Chlor-2,2-dfluorethyl,
Pentafluorethyl und Pentafluor-tert-butyl. Bevorzugt sind Halogenalkyle
mit 1 bis 4 Kohlenstoffatomen und 1 bis 9, vorzugsweise 1 bis 5
gleichen oder verschiedenen Halogenatomen, die ausgewählt
sind unter Fluor, Chlor oder Brom. Besonders bevorzugt sind Halogenalkyle
mit 1 oder 2 Kohlenstoffatomen und mit 1 bis 5 gleichen oder verschiedenen
Halogenatomen, die ausgewählt sind unter Fluor oder Chlor,
wie unter anderen Difluormethyl, Trifluormethyl oder 2,2-Difluorethyl.
-
Erfindungsgemäß steht ”Hydroxyalkyl” für
geradkettigen oder verzweigten Alkohol, vorzugsweise mit 1 bis 6
Kohlenstoffatomen, wie beispielsweise Methanol, Ethanol, n-Propanol,
Isopropanol, n-Butanol, Isobutanol, sec-Butanol und tert-Butanol.
Ferner bevorzugt für Hydroxyalkylgruppen mit 1 bis 4 Kohlenstoffatomen. Die
erfindungsgemäßen Hydroxyalkylgruppen können
mit einem oder mehreren, gleichen oder verschiedenen Resten substituiert
sein
-
Erfindungsgemäß steht ”Alkoxy” für
geradkettiges oder verzweigtes O-Alkyl, vorzugsweise mit 1 bis 6 Kohlenstoffatomen,
wie beispielsweise Methoxy, Ethoxy, n-Propoxy, Isopropoxy, n-Butoxy,
Isobutoxy, sec-Butoxy und tert-Butoxy. Ferner bevorzugt für
Alkoxygruppen mit 1 bis 4 Kohlenstoffatomen. Die erfindungsgemäßen
Alkoxygruppen können mit einem oder mehreren, gleichen
oder verschiedenen Resten substituiert sein.
-
Erfindungsgemäß steht ”Halogenalkoxy” für
mit Halogen substituiertes geradkettiges oder verzweigtes O-Alkyl,
vorzugsweise mit 1 bis 6 Kohlenstoffatomen , wie unter anderem Difluormethoxy,
Trifluormethoxy, 2,2-Difluorethoxy, 1,1,2,2-Tetrafluorethoxy, 2,2,2-Trifluorethoxy
und 2-Chlor-1,1,2-trifluorethoxy. Ferner bevorzugt für
Halogenalkoxygruppen mit 1 bis 4 Kohlenstoffatomen. Die erfindungsgemäßen
Halogenalkoxygruppen können mit einem oder mehreren, gleichen
oder verschiedenen Resten substituiert sein.
-
Erfindungsgemäß steht ”Alkylthio” für
geradkettiges oder verzweigtes S-Alkyl, vorzugsweise mit 1 bis 6
Kohlenstoffatomen, wie beispielsweise Methylthio, Ethylthio, n-Propylthio,
Isopropylthio, n-Butylthio, Isobutylthio, sec-Butylthio und tert-Butylthio.
Ferner bevorzugt für Alkylthiogruppen mit 1 bis 4 Kohlenstoffatomen. Die
erfindungsgemäßen Alkylthiogruppen können
mit einem oder mehreren, gleichen oder verschiedenen Resten substituiert
sein.
-
Beispiele
für Halogenalkylthioalkyle, d. h. mit Halogen substituierte
Alkylthiogruppen, sind unter anderem Difluormethylthio, Trifluormethylthio,
Trichlormethylthio, Chlordifluormethylthio, 1-Fluorethylthio, 2-Fluorethylthio,
2,2-Difluorethylthio, 1,1,2,2-Tetrafluorethylthio, 2,2,2-Trifluorethylthio
oder 2-Chlor-1,1,2-trifluorethylthio.
-
Erfindungsgemäß steht ”Alkylsulfinyl” für
geradkettiges oder verzweigtes Alkylsulfinyl, vorzugsweise mit 1
bis 6 Kohlenstoffatomen wie beispielsweise Methylsulfinyl, Ethylsulfinyl,
n-Propylsulfinyl, Isopropylsulfinyl, n-Butylsulfinyl, Isobutylsulfinyl,
sec-Butylsulfinyl und tert-Butylsulfinyl. Ferner bevorzugt für
Alkylsulfinylgruppen mit 1 bis 4 Kohlenstoffatomen. Die erfindungsgemäßen
Alkylsulfinylgruppen können mit einem oder mehreren, gleichen
oder verschiedenen Resten substituiert sein.
-
Beispiele
für Halogenalkylsulfinylgrupen, d. h. mit Halogen substituierte
Alkylsulfinylgruppen, sind unter anderem Difluormethylsulfinyl,
Trifluormethylsulfinyl, Trichlormethylsulfinyl, Chlordifluormethylsulfinyl, 1-Fluorethylsulfinyl,
2-Fluorethylsulfinyl, 2,2-Difluorethylsulfinyl, 1,1,2,2-Tetrafluorethylsulfinyl,
2,2,2-Trifluorethylsulfinyl und 2-Chlor-1,1,2-trifluorethylsulfinyl.
-
Erfindungsgemäß steht ”Alkylsulfonyl” für
geradkettiges oder verzweigtes Alkylsulfonyl, vorzugsweise mit 1
bis 6 Kohlenstoffatomen wie beispielsweise Methylsulfonyl, Ethylsulfonyl,
n-Propylsulfonyl, Isopropylsulfonyl, n-Butylsulfonyl, Isobutylsulfonyl,
sec-Butylsulfonyl und tert-Butylsulfonyl. Ferner bevorzugt für
Alkylsulfonylgruppen mit 1 bis 4 Kohlenstoffatomen. Die erfindungsgemäßen
Alkylsulfonylgruppen können mit einem oder mehreren, gleichen
oder verschiedenen Resten substituiert sein.
-
Beispiele
für Halogenalkylsulfonylgrupen, d. h. mit Halogen substituierte
Alkylsulfonylgruppen sind unter anderem Difluormethylsulfonyl, Trifluormethylsulfonyl,
Trichlormethylsulfonyl, Chlordifluormethylsulfonyl, 1-Fluorethylsulfonyl,
2-Fluorethylsulfonyl, 2,2-Difluorethylsulfonyl, 1,1,2,2-Tetrafluorethylsulfonyl,
2,2,2-Trifluorethylsulfonyl und 2-Chlor-1,1,2-trifluorethylsulfonyl.
-
Erfindungsgemäß steht ”Alkylcarbonyl” für
geradkettiges oder verzweigtes Alkyl-C(=O), vorzugsweise mit 2 bis
7 Kohlenstoffatomen, wie Methylcarbonyl, Ethylcarbonyl, n-Propylcarbonyl,
Isopropylcarbonyl, sec-Butylcarbonyl und tert-Butylcarbonyl. Ferner
bevorzugt für Alkylcarbonyle mit 1 bis 4 Kohlenstoffatomen. Die
erfindungsgemäßen Alkylcarbonyle können
mit einem oder mehreren, gleichen oder verschiedenen Resten substituiert
sein.
-
Erfindungsgemäß steht ”Cycloalkylcarbonyl” für
geradkettiges oder verzweigtes Cycloalkylcarbonyl, vorzugsweise
mit 3 bis 10 Kohlenstoffatomen im Cycloalkylteil, wie beispielsweise
Cyclopropylcarbonyl, Cyclobutylcarbonyl, Cyclopentylcarbonyl, Cyclohexyl-carbonyl,
Cycloheptylcarbonyl, Cyclooctylcarbonyl, Bicyclo[2.2.1]heptyl, Bycyclo[2.2.2]octylcarbonyl
und Adamantylcarbonyl. Ferner bevorzugt für Cycloalkylcarbonyl mit
3, 5 oder 7 Kohlenstoffatomen im Cycloalkylteil. Die erfindungsgemäßen
Cycloalkylcarbonylgruppen können mit einem oder mehreren,
gleichen oder verschiedenen Resten substituiert sein.
-
Erfindungsgemäß steht ”Alkoxycarbonyl” – in
Alleinstellung oder als Bestandteil einer chemischen Gruppe – für
geradkettiges oder verzweigtes Alkoxycarbonyl, vorzugsweise mit
1 bis 6 Kohlenstoffatomen oder 1 bis 4 Kohlenstoffatomen im Alkoxyteil,
wie beispielsweise Methoxycarbonyl, Ethoxycarbonyl, n-Propoxycarbonyl,
Isopropoxycarbonyl, sec-Butoxycarbonyl und tert-Butoxycarbonyl.
Die erfindungsgemäßen Alkoxycarbonylgruppen können
mit einem oder mehreren, gleichen oder verschiedenen Resten substituiert
sein.
-
Erfindungsgemäß steht ”Alkylaminocarbonyl” für
geradkettiges oder verzweigtes Alkylaminocarbonyl mit vorzugsweise
1 bis 6 Kohlenstoffatomen oder 1 bis 4 Kohlenstoffatomen im Alkylteil,
wie beispielsweise Methylaminocarbonyl, Ethylaminocarbonyl, n-Proylaminocarbonyl,
Isopropylaminocarbonyl, sec-Butylaminocarbonyl und tert-Butylaminocarbonyl.
Die erfindungsgemäßen Alkylaminocarbonylgruppen
können mit einem oder mehreren, gleichen oder verschiedenen
Resten substituiert sein.
-
Erfindungsgemäß steht ”N,N-Dialkylamino-carbonyl” für
geradkettiges oder verzweigtes N,N-Dialkylaminocarbonyl mit vorzugsweise
1 bis 6 Kohlenstoffatomen oder 1 bis 4 Kohlenstoffatomen im Alkylteil,
wie beispielsweise N,N-Dimethylamino-carbonyl, N,N-Diethylamino-carbonyl,
N,N-Di(n-propylamino)-carbonyl, N,N-Di-(isopropylamino)-carbonyl
und N,N-Di-(sec-butylamino)-carbonyl. Die erfindungsgemäßen
N,N-Dialkylamino-carbonylgruppen können mit einem oder
mehreren, gleichen oder verschiedenen Resten substituiert sein.
-
Erfindungsgemäß steht ”Aryl” für
ein mono-, bi- oder polycyclisches aromatisches System mit vorzugsweise
6 bis 14, insbesondere 6 bis 10 Ring-Kohlenstoffatomen, wie beispielsweise
Phenyl, Naphthyl, Anthryl, Phenanthrenyl, vorzugsweise Phenyl. Ferner
steht Aryl auch für mehrcyclische Systeme, wie Tetrahydronaphtyl,
Indenyl, Indanyl, Fluorenyl, Biphenyl, wobei die Bindungsstelle
am aromatischen System ist. Die erfindungsgemäßen
Arylgruppen können mit einem oder mehreren, gleichen oder
verschiedenen Resten substituiert sein.
-
Beispiele
substitutierter Aryle stellen die Arylalkyle dar, die gleichfalls
mit einem oder mehreren, gleichen oder verschiedenen Resten im Alkyl-
und/oder Arylteil substituiert sein können. Beispiele solcher
Arylalkyle sind unter anderem Benzyl und 1-Phenylethyl.
-
Erfindungsgemäß steht ”Heterocyclus”, ”heterocyclischer
Ring” oder ”heterocyclisches Ringsystem” für
ein carbocyclisches Ringsystem mit mindestens einem Ring, in dem
mindestens ein Kohlenstoffatom durch ein Heteroatom ersetzt ist,
vorzugsweise durch ein Heteroatom aus der Gruppe N, O, S, P, B,
Si, Se und der gesättigt, ungesättigt oder heteroaromatisch
ist und dabei unsubstituiert oder mit einem Substituenten Z substituiert
sein kann, wobei die Bindungsstelle an einem Ringatom lokalisiert
ist. Wenn nicht anders definiert, enthält der heterocyclische
Ring vorzugsweise 3 bis 9 Ringatome, insbesondere 3 bis 6 Ringatome,
und ein oder mehrere, vorzugsweise 1 bis 4, insbesondere 1, 2 oder
3 Heteroatome im heterocyclischen Ring, vorzugsweise aus der Gruppe
N, O, und S, wobei jedoch nicht zwei Sauerstoffatome direkt benachbart
sein sollen. Die heterocyclischen Ringe enthalten gewöhnlicherweise
nicht mehr als 4 Stickstoffatome, und/oder nicht mehr als 2 Sauerstoffatome
und/oder nicht mehr als 2 Schwefelatome. Ist der Heterocyclylrest
oder der heterocyclische Ring gegebenenfalls substituiert, kann
er mit anderen carbocyclischen oder heterocyclischen Ringen annelliert sein.
Im Falle von gegebenenfalls substituiertem Heterocyclyl werden erfindungsgemäß auch
mehrcyclische Systeme umfaßt, wie beispielsweise 8-Aza-bicyclo[3.2.1]octanyl
oder 1-Aza-bicyclo[2.2.1]heptyl. Im Falle von gegebenenfalls substituiertem
Heterocyclyl werden erfindungsgemäß auch spirocyclische
Systeme umfaßt, wie beispielsweise 1-Oxa-5-aza-spiro[2.3]hexyl.
-
Erfindungsgemäße
Heterocyclylgruppen sind beispielsweise Piperidinyl, Piperazinyl,
Morpholinyl, Thiomorpholinyl, Dihydropyranyl, Tetrahydropyranyl,
Dioxanyl, Pyrrolinyl, Pyrrolidinyl, Imidazolinyl, Imidazolidinyl, Thiazolidinyl,
Oxazolidinyl, Dioxolanyl, Dioxolyl, Pyrazolidinyl, Tetrahydrofuranyl,
Dihydrofuranyl, Oxetanyl, Oxiranyl, Azetidinyl, Aziridinyl, Oxazetidinyl,
Oxaziridinyl, Oxazepanyl, Oxazinanyl, Azepanyl, Oxopyrrolidinyl, Dioxopyrrolidinyl,
Oxomorpholinyl, Oxopiperazinyl und Oxepanyl.
-
Eine
besondere Bedeutung kommt Heteroarylen, also heteroaromatischen
Systemen zu. Erfindungsgemäß steht der Ausdruck
Heteroaryl für heteroaromatische Verbindungen, d. h. vollständig
ungesättigte aromatische heterocyclische Verbindungen,
die unter die vorstehende Definiton von Heterocyclen fallen. Vorzugsweise
für 5- bis 7-gliedrige Ringe mit 1 bis 3, vorzugsweise
1 oder 2 gleichen oder verschiedenen Heteroatomen aus der oben genannten
Gruppe. Erfindungsgemäße Heteroaryle sind beispielsweise
Furyl, Thienyl, Pyrazolyl, Imidazolyl, 1,2,3- und 1,2,4-Triazolyl,
Isoxazolyl, Thiazolyl, Isothiazolyl, 1,2,3-, 1,3,4-, 1,2,4- und 1,2,5-Oxadiazolyl,
Azepinyl, Pyrrolyl, Pyridyl, Pyridazinyl, Pyrimidinyl, Pyrazinyl,
1,3,5-, 1,2,4- und 1,2,3-Triazinyl, 1,2,4-, 1,3,2-, 1,3,6- und 1,2,6-Oxazinyl,
Oxepinyl, Thiepinyl, 1,2,4-Triazolonyl und 1,2,4-Diazepinyl. Die erfindungsgemäßen
Heteroarylgruppen können ferner mit einem oder mehreren,
gleichen oder verschiedenen Resten substituiert sein.
-
Substituierte
Gruppen, wie ein substituierter Alkyl-, Alkenyl-, Alkinyl-, Cycloalkyl-,
Aryl-, Phenyl-, Benzyl-, Heterocyclyl- und Heteroarylrest, bedeuten
beispielsweise einen vom unsubstituierten Grundkörper abgeleiteten
substituierten Rest, wobei die Substituenten beispielsweise einen
oder mehrere, vorzugsweise 1, 2 oder 3 Reste aus der Gruppe Halogen,
Alkoxy, Alkylthio, Hydroxy, Amino, Nitro, Carboxy oder eine der
Carboxygruppe äquivalente Gruppe, Cyano, Isocyano, Azido,
Alkoxycarbonyl, Alkylcarbonyl, Formyl, Carbamoyl, Mono- und N,N-Dialkylamino-carbonyl,
substituiertes Amino, wie Acylamino, Mono- und N,N-Dialkylamino,
Trialkylsilyl und gegebenenfalls substituiertes Cycloalkyl, gegebenenfalls
substituiertes Aryl, gegebenenfalls substituiertes Heterocyclyl,
wobei jeder der letztgenannten cyclischen Gruppen auch über
Heteroatome oder divalente funktionelle Gruppen wie bei den genannten
Alkylresten gebunden sein kann, und Alkylsulfinyl, wobei beide Enantiomere
der Alkylsulfonylgruppe umfasst sind, Alkylsulfonyl, Alkylphosphinyl,
Alkylphosphonyl und, im Falle cyclischer Reste (= ”cyclischer
Grundkörper”), auch Alkyl, Haloalkyl, Alkylthio-alkyl,
Alkoxy-alkyl, gegebenfalls substituiertes Mono- und N,N-Dialkyl-aminoalkyl
und Hydroxyalkyl bedeutet.
-
Im
Begriff ”substituierte Gruppen” wie substituiertes
Alkyl etc. sind als Substituenten zusätzlich zu den genannten
gesättigten kohlenwasserstoffhaltigen Resten entsprechende
ungesättigte aliphatische und aromatische Reste, wie gegebenenfalls
substituiertes Alkenyl, Alkinyl, Alkenyloxy, Alkinyloxy, Alkenylthio,
Alkinylthio, Alkenyloxycarbonyl, Alkinyloxycarbonyl, Alkenylcarbonyl,
Alkinylcarbonyl, Mono- und N,N-Dialkenylamino-carbonyl, Mono- und
Dialkinylaminocarbonyl, Mono- und N,N-Dialkenylamino, Mono- und
N,N-Dialkinylamino, Trialkenylsilyl, Trialkinylsilyl, gegebenenfalls
substituiertes Cycloalkenyl, gegebenenfalls substituiertes Cycloalkinyl,
Phenyl, Phenoxy etc. eingeschlossen. Im Falle von substituierten
cyclischen Resten mit aliphatischen Anteilen im Ring werden auch
cyclische Systeme mit solchen Substituenten umfaßt, die
mit einer Doppelbindung am Ring gebunden sind, z. B. mit einer Alkylidengruppe
wie Methyliden oder Ethyliden oder einer Oxogruppe, Iminogruppe
oder substituierten Iminogruppe.
-
Wenn
zwei oder mehrere Reste einen oder mehrere Ringe bilden, so können
diese carbocyclisch, heterocyclisch, gesättigt, teilgesättigt,
ungesättigt, beispielsweise auch aromatisch und weiter
substituiert sein.
-
Die
beispielhaft genannten Substituenten (”erste Substituentenebene”)
können, sofern sie kohlenwasserstoffhaltige Anteile enthalten,
dort gegebenenfalls weiter substituiert sein (”zweite Substitutentenebene”), beispielsweise
durch einen der Substituenten, wie er für die erste Substituentenebene
definiert ist. Entsprechende weitere Substituentenebenen sind möglich.
Vorzugsweise werden vom Begriff ”substituierter Rest” nur ein
oder zwei Substitutentenebenen umfasst.
-
Bevorzugte Substituenten für
die Substituentenebenen sind beispielsweise
-
Amino,
Hydroxy, Halogen, Nitro, Cyano, Isocyano, Mercapto, Isothiocyanato,
Carboxy, Carbonamid, SF5, Aminosulfonyl,
Alkyl, Cycloalkyl, Alkenyl, Cycloalkenyl, Alkinyl, N-Monoalkyl-amino,
N,N-Dialkylamino, N-Alkanoylamino, Alkoxy, Alkenyloxy, Alkinyloxy,
Cycloalkoxy, Cycloalkenyloxy, Alkoxycarbonyl, Alkenyloxycarbonyl,
Alkinyloxycarbonyl, Aryloxycarbonyl, Alkanoyl, Alkenylcarbonyl,
Alkinylcarbonyl, Arylcarbonyl, Alkylthio, Cycloalkylthio, Alkenylthio,
Cycloalkenylthio, Alkinylthio, Alkylsulfenyl und Alkylsulfinyl,
wobei beide Enantiomere der Alkylsulfinylgruppe umfasst sind, Alkylsulfonyl,
N-Mono-alkylaminosulfonyl, N,N-Dialkyl-aminosulfonyl, Alkylphosphinyl,
Alkylphosphonyl, wobei für Alkylphosphinyl bzw. Alkylphosphonyl
beide Enantiomere umfasst sind, N-Alkyl-aminocarbonyl, N,N-Dialkyl-amino-carbonyl,
N-Alkanoyl-amino-carbonyl, N-Alkanoyl-N-alkyl-aminocarbonyl, Aryl,
Aryloxy, Benzyl, Benzyloxy, Benzylthio, Arylthio, Arylamino, Benzylamino,
Heterocyclyl und Trialkylsilyl.
-
Substituenten,
die aus mehreren Substituentenebenen zusammengesetzt sind, sind
bevorzugt Alkoxyalkyl, Alkylthioalkyl, Alkylthioalkoxy, Alkoxyalkoxy,
Phenethyl, Benzyloxy, Halogenalkyl, Halogencycloalkyl, Halogenalkoxy,
Halogenalkylthio, Halogenalkylsulfinyl, Halogenalkylsulfonyl, Halogenalkanoyl,
Halogenalkylcarbonyl, Halogenalkoxycarbonyl, Halogenalkoxyalkoxy,
Halogenalkoxyalkylthio, Halogenalkoxyalkanoyl, Halogenalkoxyalkyl.
-
Bei
Resten mit C-Atomen sind solche mit 1 bis 6 C-Atomen, vorzugsweise
1 bis 4 C-Atomen, insbesondere 1 oder 2 C-Atomen bevorzugt. Bevorzugt
sind in der Regel Substituenten aus der Gruppe Halogen, z. B. Fluor
und Chlor, (C1-C4)Alkyl,
vorzugsweise Methyl oder Ethyl, (C1-C4)Haloalkyl, vorzugsweise Trifluormethyl,
(C1-C4)Alkoxy, vorzugsweise
Methoxy oder Ethoxy, (C1-C4)Haloalkoxy,
Nitro und Cyano. Besonders bevorzugt sind dabei die Substituenten
Methyl, Methoxy, Fluor und Chlor.
-
Substituiertes
Amino wie mono- oder disubstituiertes Amino bedeutet einen Rest
aus der Gruppe der substituierten Aminoreste, welche beispielsweise
durch einen bzw. zwei gleiche oder verschiedene Reste aus der Gruppe
Alkyl, Hydroxy, Amino, Alkoxy, Acyl und Aryl N-substituiert sind;
vorzugsweise N-Mono- und N,N-Dialkylamino, (z. B. Methylamino, Ethylamino,
N,N-Dimethylamino, N,N-Diethylamino, N,N-Di-n-propylamino, N,N-Diisopropylamino
oder N,N-Dibutylamino), N-Mono- oder N,N-Dialkoxyalkylaminogruppen
(z. B. N-Methoxymethylamino, N-Methoxyethylamino, N,N-Di-(methoxymethyl)-amino
oder N,N-Di-(methoxyethyl)-amino), N-Mono- und N,N-Diarylamino,
wie gegebenenfalls substituierte Aniline, Acylamino, N,N-diacylamino,
N-Alkyl-N-arylamino, N-Alkyl-N-acylamino sowie gesättigte
N-Heterocyclen; dabei sind Alkylreste mit 1 bis 4 C-Atomen bevorzugt;
Aryl ist dabei vorzugsweise Phenyl oder substituiertes Phenyl; für
Acyl gilt dabei die weiter unten genannte Definition, vorzugsweise
(C1-C4)Alkanoyl.
Entsprechenes gilt für substituiertes Hydroxylamino oder
Hydrazinn.
-
Erfindungsgemäß umfasst
der Begriff ”cyclische Aminogruppen” heteroaromatische
oder aliphatische Ringsysteme mit einem oder mehreren Stickstoffatomen.
Die Heterocyclen sind gesättigt oder ungesättigt,
bestehen aus einem oder mehreren, gegebenenfalls kondensierten Ringsystemen
und beinhalten gegebenenfalls weitere Heteroatome, wie beispielsweise
ein oder zwei Stickstoff-, Sauerstoff- und/oder Schwefelatome. Ferner
umfasst der Begriff auch solche Gruppen, die einen Spiroring oder
verbrücktes Ringsystem aufweisen. Die Anzahl der Atome,
die die cyclische Aminogruppe bilden, ist beliebig und kann z. B.
im Falle eines Einringsystems aus 3 bis 8 Ringatomen und im Falle
eines Zweiringsystems aus 7 bis 11 Atomen.
-
Beispielhaft
für cyclische Aminogruppen mit gesättigten und
ungesättigten monocyclischen Gruppen mit einem Stickstoffatom
als Heteroatom seien 1-Azetidinyl, Pyrrolidino, 2-Pyrrolidin-1-yl,
1-Pyrrolyl, Piperidino, 1,4-Dihydropyrazin-1-yl, 1,2,5,6-Tetrahydropyrazin-1-yl,
1,4-Dihydropyridin-1-yl, 1,2,5,6-Tetrahydropyridin-1-yl, Homopiperidinyl
genannt; beispielhaft für cyclische Aminogruppen mit gesättigten
und ungesättigten monocyclischen Gruppen mit zwei oder
mehreren Stickstoffatomen als Heteroatome seien 1-Imidazolidinyl, 1-Imidazolyl,
1-Pyrazolyl, 1-Triazolyl, 1-Tetrazolyl, 1-Piperazinyl, 1-Homopiperazinyl,
1,2-Dihydro-piperazin-1-yl, 1,2-Dihydro-pyrimidin-1-yl, Perhydropyrimidin-1-yl,
1,4-Diazacycloheptan-1-yl, genannt; beispielhaft für cyclische
Aminogruppen mit gesättigten und ungesättigten
monocyclischen Gruppen mit einem oder zwei Sauerstoffatomen und
einem bis drei Stickstoffatomen als Heteroatome, wie beispielsweise
Oxazolidin-3-yl, 2,3-Dihydroisoxazol-2-yl, Isoxazol-2-yl, 1,2,3-Oxadiazin-2-yl,
Morpholino, beispielhaft für cyclische Aminogruppen mir
gesättigten und ungesättigten monocyclischen Gruppen
mit einem bis drei Stickstoffatomen und einem bis zwei Schwefelatomen
als Heteroatome seien Thiazolidin-3-yl, Isothiazolin-2-yl, Thiomorpholino, oder
Dioxothiomorpholino genannt; beispielhaft für cyclische
Aminogruppen mit gesättigten und ungesättigten kondensierten
cyclischen Gruppen seien Indol-1-yl, 1,2-Dihydrobenzimidazol-1-yl,
Perhydropyrrolo[1,2-a]pyrazin-2-yl genannt; beispielhaft für
cyclische Aminogruppen mit spirocyclischen Gruppen sei das 2-Azaspiro[4,5]decan-2-yl
genannt; beispielhaft für cyclische Aminogruppen mit verbrückten
heterocyclischen Gruppen sei das 2-Azabicyclo[2,2,1]heptan-7-yl
genannt.
-
Substituiertes
Amino schließt auch quartäre Ammoniumverbindungen
(Salze) mit vier organischen Substituenten am Stickstoffatom ein.
-
Gegebenenfalls
substituiertes Phenyl ist vorzugsweise Phenyl, das unsubstituiert
oder ein- oder mehrfach, vorzugsweise bis zu dreifach durch gleiche
oder verschiedene Reste aus der Gruppe Halogen, (C1-C4)Alkyl, (C1-C4)Alkoxy, (C1-C4)Alkoxy-(C1-C4)alkoxy, (C1-C4)Alkoxy-(C1-C4)alkyl, (C1-C4)Halogenalkyl, (C1-C4)Halogenalkoxy, (C1-C4)Alkylthio, (C1-C4)Halogenalkylthio, Cyano, Isocyano und Nitro
substituiert ist, z. B. o-, m- und p-Tolyl, Dimethylphenyle, 2-,
3- und 4-Chlorphenyl, 2-, 3- und 4-Fluorphenyl, 2-, 3- und 4-Trifluormethyl-
und -Trichlormethylphenyl, 2,4-, 3,5-, 2,5- und 2,3-Dichlorphenyl,
o-, m- und p-Methoxyphenyl.
-
Gegebenenfalls
substituiertes Cycloalkyl ist vorzugsweise Cycloalkyl, das unsubstituiert
oder ein- oder mehrfach, vorzugsweise bis zu dreifach durch gleiche
oder verschiedene Reste aus der Gruppe Halogen, Cyano, (C1-C4)Alkyl, (C1-C4)Alkoxy, (C1-C4)Alkoxy-(C1-C4)alkoxy, (C1-C4)Alkoxy-(C1-C4)alkyl, (C1-C4)Halogenalkyl und
(C1-C4)Halogenalkoxy
substituiert ist, insbesondere durch einen oder zwei (C1-C4)Alkylreste substituiert ist,
-
Gegebenenfalls
substituiertes Heterocyclyl ist vorzugsweise Heterocyclyl, das unsubstituiert
oder ein- oder mehrfach, vorzugsweise bis zu dreifach durch gleiche
oder verschiedene Reste aus der Gruppe Halogen, Cyano, (C1-C4)Alkyl, (C1-C4)Alkoxy, (C1-C4)Alkoxy-(C1-C4)alkoxy, (C1-C4)Alkoxy-(C1-C4)alkyl, (C1-C4)Halogenalkyl,
(C1-C4)Halogenalkoxy,
Nitro und Oxo substituiert ist, insbesondere ein- oder mehrfach
durch Reste aus der Gruppe Halogen, (C1-C4)Alkyl, (C1-C4)Alkoxy, (C1-C4)Halogenalkyl und Oxo, ganz besonders durch
einen oder zwei (C1-C4)Alkylreste
substituiert ist.
-
Beispiele
für Alkyl substituierte Heteroaryle sind Furylmethyl, Thienylmethyl,
Pyrazolylmethyl, Imidazolylmethyl, 1,2,3- und 1,2,4-Triazolylmethyl,
Isoxazolylmethyl, Thiazolylmethyl, Isothiazolylmethyl, 1,2,3-, 1,3,4-,
1,2,4- und 1,2,5-Oxadiazolylmethyl, Azepinylmethyl, Pyrrolylmethyl,
Pyridylmethyl, Pyridazinylmethyl, Pyrimidinylmethyl, Pyrazinylmethyl,
1,3,5-, 1,2,4- und 1,2,3-Triazinylmethyl, 1,2,4-, 1,3,2-, 1,3,6-
und 1,2,6-Oxazinylmethyl, Oxepinylmethyl, Thiepinylmethyl und 1,2,4-Diazepinylmethyl.
-
Erfindungsgemäße
Aryle oder heterocyclische Verbindungen, insbesondere wenn es sich
um Q1 handelt, sind beispielsweise chemischen Gruppierungen G-1
bis G-63, wobei n für eine ganzzahlige Zahl von 1 bis 7
steht, und Z die in dieser Anmeldung genannten Bedeutungen hat.
-
-
-
-
Erfindungsgemäße
heterocyclische Verbindungen, insbesondere wenn es sich um Q1 handelt,
sind ferner beispielsweise die chemischen Gruppierungen G-64 bis
G-90, wobei n für eine ganzzahlige Zahl von 1 bis 5 steht,
und Z die in dieser Anmeldung genannten Bedeutungen hat
oder die chemischen Gruppierungen
G-91 bis G-98, wobei n für eine ganzzahlige Zahl von 1
bis 5 steht, G für ein Heteroatom aus der Reihe Sauerstoff,
Schwefel oder Stickstoff steht und Z die in dieser Anmeldung genannten
Bedeutungen hat. Sollte G für Stickstoff stehen, dann kann
auch dieser Stickstoff mit Z substituiert sein.
-
-
Erfindungsgemäß geeignete
Salze der erfindungsgemäßen Verbindungen, beispielsweise
Salze mit Basen oder Säureadditionssalze, sind alle üblichen
nicht toxischen Salze, vorzugsweise landwirtschaftlich und/oder
physiologisch annehmbare Salze. Beispielsweise Salze mit Basen oder
Säureadditionssalze. Bevorzugt werden Salze mit anorganischen
Basen, wie beispielsweise Alkalimetallsalze (z. B. Natrium-, Kalium- oder
Cäsiumsalze), Erdalkalimetallsalze (z. B. Calzium- oder
Magnesiumsalze), Ammoniumsalze oder Salze mit organischen Basen,
insbesondere mit organischen Aminen, wie beispielsweise Triethylammonium-,
Dicyclohexylammonium-, N,N'-Dibenzylethylendiammonium-, Pyridinium-,
Picolinium- oder Ethanolammoniumsalze, Salze mit anorganischen Säuren
(z. B. Hydrochloride, Hydrobromide, Dihydrosulfate, Trihydrosulfate,
oder Phosphate), Salze mit organischen Carbonsäuren oder
organischen Sulfosäuren (z. b. Formiate, Acetate, Trifluoracetate,
Maleate, Tartrate, Methansulfonate, Benzolsulfonate oder 4-Toluolsulfonate).
Bekannterweise können tert-Amine, wie beispielsweise manche
der erfindungsgemäßen Verbindungen, N-Oxide bilden,
welche ebenfalls erfindungsgemäße Salze darstellen.
-
In
einer Ausführungsform bezieht sich die Erfindung auf Verbindungen
der Formel (I-a)
worin die Gruppierungen und
Substituenten A
1, A
2,
A
3, A
4, D, R
5, R
6, R
7 und
R
8 die oben angegebene Bedeutungen haben,
während L, m und Q jeweils einer Zeile der Tabelle 1 entspricht,
bzw. auf die Verwendung der Verbindung (I-a) zur Bekämpfung
von tierischen Schädlingen.
-
In
einer noch weiteren Ausführungsform bezieht sich die Erfindung
auf Verbindungen der Formel (I-b)
worin die Gruppierungen und
Substituenten A
1, A
2,
A
3, A
4, D, R
6, R
7 und R
8 die oben angegebene Bedeutungen haben,
während L, m und Q jeweils einer Zeile der Tabelle 1 entspricht,
bzw. auf die Verwendung der Verbindung (I-b) zur Bekämpfung
von tierischen Schädlingen.
-
In
einer noch weiteren Ausführungsform bezieht sich die Erfindung
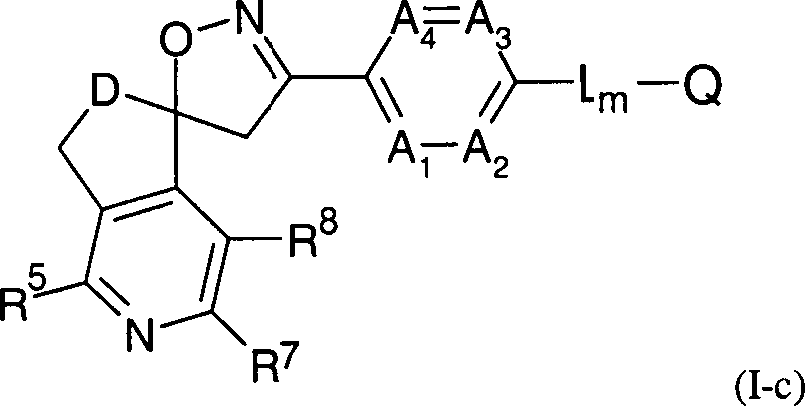
auf Verbindungen der Formel (I-c)
worin die Gruppierungen und
Substituenten A
1, A
2,
A
3, A
4, D, R
5, R
7 und R
8 die oben angegebene Bedeutungen haben,
während L, m und Q jeweils einer Zeile der Tabelle 1 entspricht,
bzw. auf die Verwendung der Verbindung (I-c) zur Bekämpfung
von tierischen Schädlingen.
-
In
einer noch weiteren Ausführungsform bezieht sich die Erfindung
auf Verbindungen der Formel (I-d)
worin die Gruppierungen und
Substituenten A
1, A
2,
A
3, A
4, D, R
5, R
6 und R
8 die oben angegebene Bedeutungen haben,
während L, m und Q jeweils einer Zeile der Tabelle 1 entspricht,
bzw. auf die Verwendung der Verbindung (I-d) zur Bekämpfung
von tierischen Schädlingen.
-
In
einer noch weiteren Ausführungsform bezieht sich die Erfindung
auf Verbindungen der Formel (I-e)
worin die Gruppierungen und
Substituenten A
1, A
2,
A
3, A
4, D, R
5, R
6 und R
7 die oben angegebene Bedeutungen haben,
während L, m und Q jeweils einer Zeile der Tabelle 1 entspricht,
bzw. auf die Verwendung der Verbindung (I-e) zur Bekämpfung
von tierischen Schädlingen.
-
In
einer Ausführungsform bezieht sich die Erfindung auf Verbindungen
der Formel (I-f)
worin die Gruppierungen und
Substituenten A
1, A
2,
A
3, A
4, D, R
5, R
6, R
7 und
R
8 die oben angegebene Bedeutungen haben,
während L, m und Q jeweils einer Zeile der Tabelle 1 entspricht,
bzw. auf die Verwendung der Verbindung (I-f) zur Bekämpfung
von tierischen Schädlingen.
-
In
einer noch weiteren Ausführungsform bezieht sich die Erfindung
auf Verbindungen der Formel (I-g)
worin die Gruppierungen und
Substituenten A
1, A
2,
A
3, A
4, D, R
6, R
7 und R
8 die oben angegebene Bedeutungen haben,
während L, m und Q jeweils einer Zeile der Tabelle 1 entspricht,
bzw. auf die Verwendung der Verbindung (I-g) zur Bekämpfung
von tierischen Schädlingen.
-
In
einer noch weiteren Ausführungsform bezieht sich die Erfindung
auf Verbindungen der Formel (I-h)
worin die Gruppierungen und
Substituenten A
1, A
2,
A
3, A
4, D, R
5, R
7 und R
8 die oben angegebene Bedeutungen haben,
während L, m und Q jeweils einer Zeile der Tabelle 1 entspricht,
bzw. auf die Verwendung der Verbindung (I-h) zur Bekämpfung
von tierischen Schädlingen.
-
In
einer noch weiteren Ausführungsform bezieht sich die Erfindung
auf Verbindungen der Formel (I-i)
worin die Gruppierungen und
Substituenten A
1, A
2,
A
3, A
4, D, R
5, R
6 und R
8 die oben angegebene Bedeutungen haben,
während L, m und Q jeweils einer Zeile der Tabelle 1 entspricht,
bzw. auf die Verwendung der Verbindung (I-i) zur Bekämpfung
von tierischen Schädlingen.
-
In
einer noch weiteren Ausführungsform bezieht sich die Erfindung
auf Verbindungen der Formel (I-j)
worin die Gruppierungen und
Substituenten A
1, A
2,
A
3, A
4, D, R
5, R
6 und R
7 die oben angegebene Bedeutungen haben,
während L, m und Q jeweils einer Zeile der Tabelle 1 entspricht,
bzw. auf die Verwendung der Verbindung (I-j) zur Bekämpfung
von tierischen Schädlingen.
-
In
einer Ausführungsform bezieht sich die Erfindung auf Verbindungen
der Formel (I-k)
worin die Gruppierungen und
Substituenten A
1, A
2,
A
3, A
4, R
5, R
6, R
7 und
R
8 die oben angegebene Bedeutungen haben,
während L, m und Q jeweils einer Zeile der Tabelle 1 entspricht,
bzw. auf die Verwendung der Verbindung (I-k) zur Bekämpfung
von tierischen Schädlingen.
-
In
einer noch weiteren Ausführungsform bezieht sich die Erfindung
auf Verbindungen der Formel (I-l)
worin die Gruppierungen und
Substituenten A
1, A
2,
A
3, A
4, R
6, R
7 und R
8 die oben angegebene Bedeutungen haben,
während L, m und Q jeweils einer Zeile der Tabelle 1 entspricht,
bzw. auf die Verwendung der Verbindung (I-1) zur Bekämpfung
von tierischen Schädlingen.
-
In
einer noch weiteren Ausführungsform bezieht sich die Erfindung
auf Verbindungen der Formel (I-m)
worin die Gruppierungen und
Substituenten A
1, A
2,
A
3, A
4, R
5, R
7 und R
8 die oben angegebene Bedeutungen haben,
während L, m und Q jeweils einer Zeile der Tabelle 1 entspricht,
bzw. auf die Verwendung der Verbindung (I-m) zur Bekämpfung
von tierischen Schädlingen.
-
In
einer noch weiteren Ausführungsform bezieht sich die Erfindung
auf Verbindungen der Formel (I-n)
worin die Gruppierungen und
Substituenten A
1, A
2,
A
3, A
4, R
5, R
6 und R
8 die oben angegebene Bedeutungen haben,
während L, m und Q jeweils einer Zeile der Tabelle 1 entspricht,
bzw. auf die Verwendung der Verbindung (I-n) zur Bekämpfung
von tierischen Schädlingen.
-
In
einer noch weiteren Ausführungsform bezieht sich die Erfindung
auf Verbindungen der Formel (I-o)
worin die Gruppierungen und
Substituenten A
1, A
2,
A
3, A
4, R
5, R
6 und R
7 die oben angegebene Bedeutungen haben,
während L, m und Q jeweils einer Zeile der Tabelle 1 entspricht,
bzw. auf die Verwendung der Verbindung (I-o) zur Bekämpfung
von tierischen Schädlingen.
-
In
einer Ausführungsform bezieht sich die Erfindung auf Verbindungen
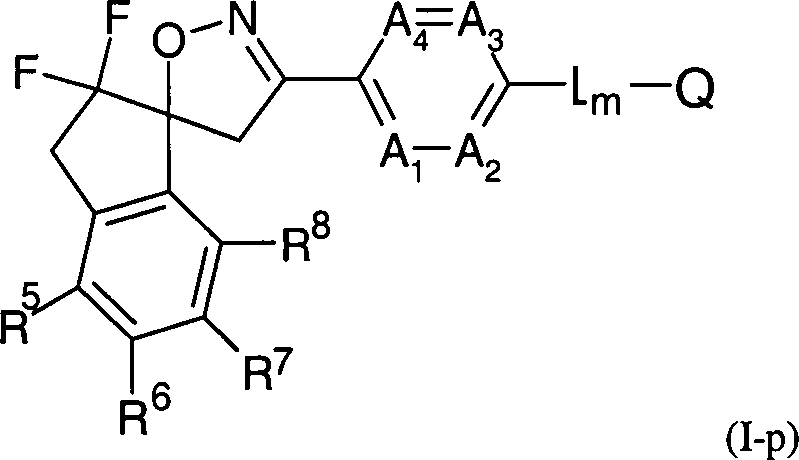
der Formel (I-p)
worin die Gruppierungen und
Substituenten A
1, A
2,
A
3, A
4, R
5, R
6, R
7 und
R
8 die oben angegebene Bedeutungen haben,
während L, m und Q jeweils einer Zeile der Tabelle 1 entspricht,
bzw. auf die Verwendung der Verbindung (I-p) zur Bekämpfung
von tierischen Schädlingen.
-
In
einer noch weiteren Ausführungsform bezieht sich die Erfindung
auf Verbindungen der Formel (I-q)
worin die Gruppierungen und
Substituenten A
1, A
2,
A
3, A
4, R
6, R
7 und R
8 die oben angegebene Bedeutungen haben,
während L, m und Q jeweils einer Zeile der Tabelle 1 entspricht,
bzw. auf die Verwendung der Verbindung (I-q) zur Bekämpfung
von tierischen Schädlingen.
-
In
einer noch weiteren Ausführungsform bezieht sich die Erfindung
auf Verbindungen der Formel (I-r)
worin die Gruppierungen und
Substituenten A
1, A
2,
A
3, A
4, R
5, R
7 und R
8 die oben angegebene Bedeutungen haben,
während L, m und Q jeweils einer Zeile der Tabelle 1 entspricht,
bzw. auf die Verwendung der Verbindung (I-r) zur Bekämpfung
von tierischen Schädlingen.
-
In
einer noch weiteren Ausführungsform bezieht sich die Erfindung
auf Verbindungen der Formel (I-s)
worin die Gruppierungen und
Substituenten A
1, A
2,
A
3, A
4, R
5, R
6 und R
8 die oben angegebene Bedeutungen haben,
während L, m und Q jeweils einer Zeile der Tabelle 1 entspricht,
bzw. auf die Verwendung der Verbindung (I-s) zur Bekämpfung
von tierischen Schädlingen.
-
In
einer noch weiteren Ausführungsform bezieht sich die Erfindung
auf Verbindungen der Formel (I-t)
worin die Gruppierungen und
Substituenten A
1, A
2,
A
3, A
4, R
5, R
6 und R
7 die oben angegebene Bedeutungen haben,
während L, m und Q jeweils einer Zeile der Tabelle 1 entspricht,
bzw. auf die Verwendung der Verbindung (I-t) zur Bekämpfung
von tierischen Schädlingen.
-
In
einer Ausführungsform bezieht sich die Erfindung auf Verbindungen
der Formel (I-u)
worin die Gruppierungen und
Substituenten A
1, A
2,
A
3, A
4, R
5, R
6, R
7 und
R
8 die oben angegebene Bedeutungen haben,
während L, m und Q jeweils einer Zeile der Tabelle 1 entspricht,
bzw. auf die Verwendung der Verbindung (I-u) zur Bekämpfung
von tierischen Schädlingen.
-
In
einer noch weiteren Ausführungsform bezieht sich die Erfindung
auf Verbindungen der Formel (I-v)
worin die Gruppierungen und
Substituenten A
1, A
2,
A
3, A
4, R
6, R
7 und R
8 die oben angegebene Bedeutungen haben,
während L, m und Q jeweils einer Zeile der Tabelle 1 entspricht,
bzw. auf die Verwendung der Verbindung (I-v) zur Bekämpfung
von tierischen Schädlingen.
-
In
einer noch weiteren Ausführungsform bezieht sich die Erfindung
auf Verbindungen der Formel (I-w)
worin die Gruppierungen und
Substituenten A
1, A
2,
A
3, A
4, R
5, R
7 und R
8 die oben angegebene Bedeutungen haben,
während L, m und Q jeweils einer Zeile der Tabelle 1 entspricht,
bzw. auf die Verwendung der Verbindung (I-w) zur Bekämpfung
von tierischen Schädlingen.
-
In
einer noch weiteren Ausführungsform bezieht sich die Erfindung
auf Verbindungen der Formel (I-x)
worin die Gruppierungen und
Substituenten A
1, A
2,
A
3, A
4, R
5, R
6 und R
8 die oben angegebene Bedeutungen haben,
während L, m und Q jeweils einer Zeile der Tabelle 1 entspricht,
bzw. auf die Verwendung der Verbindung (I-x) zur Bekämpfung
von tierischen Schädlingen.
-
In
einer noch weiteren Ausführungsform bezieht sich die Erfindung
auf Verbindungen der Formel (I-y)
worin die Gruppierungen und
Substituenten A
1, A
2,
A
3, A
4, R
5, R
6 und R
7 die oben angegebene Bedeutungen haben,
während L, m und Q jeweils einer Zeile der Tabelle 1 entspricht,
bzw. auf die Verwendung der Verbindung (I-y) zur Bekämpfung
von tierischen Schädlingen.
-
In
einer Ausführungsform bezieht sich die Erfindung auf Verbindungen
der Formel (I-z)
worin die Gruppierungen und
Substituenten A
1, A
2,
A
3, A
4, R
5, R
6, R
7 und
R
8 die oben angegebene Bedeutungen haben,
während L, m und Q jeweils einer Zeile der Tabelle 1 entspricht,
bzw. auf die Verwendung der Verbindung (I-z) zur Bekämpfung
von tierischen Schädlingen.
-
In
einer noch weiteren Ausführungsform bezieht sich die Erfindung
auf Verbindungen der Formel (I-aa)
worin die Gruppierungen und
Substituenten A
1, A
2,
A
3, A
4, R
6, R
7 und R
8 die oben angegebene Bedeutungen haben,
während L, m und Q jeweils einer Zeile der Tabelle 1 entspricht,
bzw. auf die Verwendung der Verbindung (I-aa) zur Bekämpfung
von tierischen Schädlingen.
-
In
einer noch weiteren Ausführungsform bezieht sich die Erfindung
auf Verbindungen der Formel (I-ab)
worin die Gruppierungen und
Substituenten A
1, A
2,
A
3, A
4, R
5, R
7 und R
8 die oben angegebene Bedeutungen haben,
während L, m und Q jeweils einer Zeile der Tabelle 1 entspricht,
bzw. auf die Verwendung der Verbindung (I-ab) zur Bekämpfung
von tierischen Schädlingen.
-
In
einer noch weiteren Ausführungsform bezieht sich die Erfindung
auf Verbindungen der Formel (I-ac)
worin die Gruppierungen und
Substituenten A
1, A
2,
A
3, A
4, R
5, R
6 und R
8 die oben angegebene Bedeutungen haben,
während L, m und Q jeweils einer Zeile der Tabelle 1 entspricht,
bzw. auf die Verwendung der Verbindung (I-ac) zur Bekämpfung
von tierischen Schädlingen.
-
In
einer noch weiteren Ausführungsform bezieht sich die Erfindung
auf Verbindungen der Formel (I-ad)
worin die Gruppierungen und
Substituenten A
1, A
2,
A
3, A
4, R
5, R
6 und R
7 die oben angegebene Bedeutungen haben,
während L, m und Q jeweils einer Zeile der Tabelle 1 entspricht,
bzw. auf die Verwendung der Verbindung (I-ad) zur Bekämpfung
von tierischen Schädlingen. Tabelle 1:
| m | L | Q |
| 1 | -NH-C(=O)- | H |
| 1 | -NH-C(=O)- | O-(C1-C6)-Alkyl |
| 1 | -NH-C(=O)- | (C1-C6)-Alkyl |
| 1 | -NH-C(=O)- | (C3-C6)-Cycloalkyl |
| 1 | -NH-C(=O)- | (C1-C6)-Halogenalkyl |
| 1 | -NH-C(=O)- | (C2-C6)-Alkenyl |
| 1 | -NH-C(=O)- | (C2-C6)-Alkinyl |
| 1 | -NH-C(=O)- | Aryl |
| 1 | -NH-C(=O)- | Heteroaryl |
| 1 | -N(C1-C6-Alkyl)-C(=O) | H |
| 1 | -N(C1-C6-Alkyl)-C(=O) | (C1-C6)-Alkyl |
| 1 | -N(C1-C6-Alkyl)-C(=O) | (C3-C6)-Cycloalkyl |
| 1 | -N(C1-C6-Alkyl)-C(=O) | (C1-C6)-Halogenalkyl |
| 1 | -N(C1-C6-Alkyl)-C(=O) | (C2-C6)-Alkenyl |
| 1 | -N(C1-C6-Alkyl)-C(=O) | (C2-C6)-Alkinyl |
| 1 | -N(C1-C6-Alkyl)-C(=O) | Aryl |
| 1 | -N(C1-C6-Alkyl)-C(=O) | Heteroaryl |
| 1 | -NH-C(=O)-NH-C(=O)- | (C1-C6)-Alkyl |
| 1 | -NH-C(=O)-NH-C(=O)- | (C3-C6)-Cycloalkyl |
| 1 | -NH-C(=O)-NH-C(=O)- | (C1-C6)-Halogenalkyl |
| 1 | -NH-C(=O)-NH-C(O)- | (C2-C6)-Alkenyl |
| 1 | -NH-C(=O)-NH-C(=O)- | (C2-C6)-Alkinyl |
| 1 | -NH-C(=O)-NH-C(=O)- | Aryl |
| 1 | -NHC(=O)-NH-C(=O)- | Heteroaryl |
| 1 | -NH-C(=O)-NH-SO2- | (C1-C6)-Alkyl |
| 1 | -NH-C(=O)-NH-SO2- | (C3-C6)-Cycloalkyl |
| 1 | -NH-C(=O)-NH-SO2- | (C1-C6)-Halogenalkyl |
| 1 | -NH-C(=O)-NH-SO2- | (C2-C6)-Alkenyl |
| 1 | -NH-C(=O)-NH-SO2- | (C2-C6)-Alkinyl |
| 1 | -NH-C(=O)-NH-SO2- | Aryl |
| 1 | -NH-C(=O)-NH-SO2- | Heteroaryl |
| 1 | -NH-C(=O)-NH- | (C1-C6)-Alkyl |
| 1 | -NH-C(=O)-NH- | (C3-C6)-Cycloalkyl |
| 1 | -NH-C(=O)-NH- | (C1-C6)-Halogenalkyl |
| 1 | -NHC(=O)-NH- | (C2-C6)-Alkenyl |
| 1 | -NH-C(=O)-NH- | (C2-C6)-Alkinyl |
| 1 | -NH-C(=O)-NH- | Aryl |
| 1 | -NH-C(=O)-NH- | Heteroaryl |
| 1 | -C(=O)NH- | (C1-C6)-Alkyl |
| 1 | -C(=O)NH- | (C3-C6)-Cycloalkyl |
| 1 | -C(=O)NH- | (C1-C6)-Halogenalkyl |
| 1 | -C(=O)-NH- | (C2-C6)-Alkenyl |
| 1 | -C(=O)-NH- | (C2-C6)-Alkinyl |
| 1 | -C(=O)-NH- | Aryl |
| 1 | -C(=O)-NH- | Heteroaryl |
| 1 | -C(=O)-NH-C(=O)-NH- | (C1-C6)-Alkyl |
| 1 | -C(=O)-NH-C(=O)-NH- | (C3-C6)-Cycloalkyl |
| 1 | -C(=O)-NH-C(=O)-NH- | (C1-C6)-Halogenalkyl |
| 1 | -C(=O)-NH-C(=O)-NH- | (C2-C6)-Alkenyl |
| 1 | -C(=O)-NH-C(=O)-NH- | (C2-C6)-Alkinyl |
| 1 | -C(=O)-NH-C(=O)-NH- | Aryl |
| 1 | -C(=O)-NH-C(=O)-NH- | Heteroaryl |
| 1 | -C(=O)-NH-C(=O)- | (C1-C6)-Alkyl |
| 1 | -C(=O)-NH-C(=O)- | (C3-C6)-Cycloalkyl |
| 1 | -C(=O)-NH-C(=O)- | (C1-C6)-Halogenalkyl |
| 1 | -C(=O)-NH-C(=O)- | (C2-C6)-Alkenyl |
| 1 | -C(=O)-NH-C(=O)- | (C2-C6)-Alkinyl |
| 1 | -C(=O)-NH-C(=O)- | Aryl |
| 1 | -C(=O)-NH-C(=O)- | Heteroaryl |
| 1 | -C(=S)-NH- | (C1-C6)-Alkyl |
| 1 | -C(=S)-NH- | (C3-C6)-Cycloalkyl |
| 1 | -C(=S)-NH- | (C1-C6)-Halogenalkyl |
| 1 | -C(=S)-NH- | (C2-C6)-Alkenyl |
| 1 | -C(=S)-NH- | (C2-C6)-Alkinyl |
| 1 | -C(=S)NH- | Aryl |
| 1 | -C(=S)NH- | Heteroaryl |
| 1 | -C(=S)-N(C1-C6-Alkyl)- | (C1-C6)-Alkyl |
| 1 | -C(=S)-N(C1-C6-Alkyl)- | (C3-C6)-Cycloalkyl |
| 1 | -C(=S)-N(C1-C6-Alkyl)- | (C1-C6)-Halogenalkyl |
| 1 | -C(=S)-N(C1-C6-Alkyl)- | (C2-C6)-Alkenyl |
| 1 | -C(=S)-N(C1-C6-Alkyl)- | (C2-C6)-Alkinyl |
| 1 | -C(=S)-N(C1-C6-Alkyl)- | Aryl |
| 1 | -C(=S)-N(C1-C6-Alkyl)- | Heteroaryl |
| 1 | -CH=N-OCH2-SO2- | (C1-C6)-Alkyl |
| 1 | -CH=N-OCH2-SO2- | (C3-C6)-Cycloalkyl |
| 1 | -CH=N-OCH2-SO2- | (C1-C6)-Halogenalkyl |
| 1 | -CH=N-OCH2-SO2- | (C2-C6)-Alkenyl |
| 1 | -CH=N-OCH2-SO2- | (C2-C6)-Alkinyl |
| 1 | -CH=N-OCH2-SO2- | Aryl |
| 1 | -CH=N-OCH2-SO2- | Heteroaryl |
| 1 | -CH=N-OCH2- | (C1-C6)-Alkyl |
| 1 | -CH=N-OCH2- | (C3-C6)-Cycloalkyl |
| 1 | -CH=N-OCH2- | (C1-C6)-Halogenalkyl |
| 1 | -CH=N-OCH2- | (C2-C6)-Alkenyl |
| 1 | -CH=N-OCH2- | (C2-C6)-Alkinyl |
| 1 | -CH=N-OCH2- | Aryl |
| 1 | -CH=N-OCH2- | Heteroaryl |
| 1 | -CH=N-OCH2C(=O)-NH- | (C1-C6)-Alkyl |
| 1 | -CH=N-OCH2C(=O)-NH- | (C3-C6)-Cycloalkyl |
| 1 | -CH=N-OCH2C(=O)-NH- | (C1-C6)-Halogenalkyl |
| 1 | -CH=N-OCH2C(=O)-NH- | (C2-C6)-Alkenyl |
| 1 | -CH=N-OCH2C(=O)-NH- | (C2-C6)-Alkinyl |
| 1 | -CH=N-OCH2C(=O)-NH- | Aryl |
| 1 | -CH=N-OCH2C(=O)-NH- | Heteroaryl |
| 1 | -CH=N-OCH2C(=S)-NH- | (C1-C6)-Alkyl |
| 1 | -CH=N-OCH2C(=S)-NH- | (C3-C6)-Cycloalkyl |
| 1 | -CH=N-OCH2C(=S)-NH- | (C1-C6)-Halogenalkyl |
| 1 | -CH=N-OCH2C(=S)-NH- | (C2-C6)-Alkenyl |
| 1 | -CH=N-OCH2C(=S)NH- | (C2-C6)-Alkinyl |
| 1 | -CH=N-OCH2C(=S)-NH- | Aryl |
| 1 | -CH=N-OCH2C(=S)-NH- | Heteroaryl |
| 1 | -CH2NHC(=O)- | (C1-C6)-Alkyl |
| 1 | -CH2NHC(=O)- | (C3-C6)-Cycloalkyl |
| 1 | -CH2NH-C(=O)- | (C1-C6)-Halogenalkyl |
| 1 | -CH2NHC(=O)- | (C2-C6)-Alkenyl |
| 1 | -CH2NHC(=O)- | (C2-C6)-Alkinyl |
| 1 | -CH2NH-C(=O)- | Aryl |
| 1 | -CH2NH-C(=O)- | Heteroaryl |
| 1 | -CH(C1-C6-Alkyl)-NH- | H |
| 1 | -CH(C1-C6-Alkyl)-NH- | (C1-C6)-Alkyl |
| 1 | -CH(C1-C6-Alkyl)-NH- | (C3-C6)-Cycloalkyl |
| 1 | -CH(C1-C6-Alkyl)-NH- | (C1-C6)-Halogenalkyl |
| 1 | -CH(C1-C6-Alkyl)-NH- | (C2-C6)-Alkenyl |
| 1 | -CH(C1-C6-Alkyl)-NH- | (C2-C6)-Alkinyl |
| 1 | -CH(C1-C6-Alkyl)-NH- | Aryl |
| 1 | -CH(C1-C6-Alkyl)-NH- | Heteroaryl |
| 1 | -CH(C1-C6-Alkyl)-NH-C(=O)- | (C1-C6)-Alkyl |
| 1 | -CH(C1-C6-Alkyl)-NH-C(=O)- | (C3-C6)-Cycloalkyl |
| 1 | -CH(C1-C6-Alkyl)-NH-C(=O)- | (C1-C6)-Halogenalkyl |
| 1 | -CH(C1-C6-Alkyl)-NH-C(=O)- | (C2-C6)-Alkenyl |
| 1 | -CH(C1-C6-Alkyl)-NH-C(=O)- | (C2-C6)-Alkinyl |
| 1 | -CH(C1-C6-Alkyl)-NH-C(=O)- | Aryl |
| 1 | -CH(C1-C6-Alkyl)-NH-C(=O)- | Heteroaryl |
| 1 | -CH(C1-C6-Alkyl)-NH-C(=O)-NH- | (C1-C6)-Alkyl |
| 1 | -CH(C1-C6-Alkyl)-NH-C(=O)-NH- | (C3-C6)-Cycloalkyl |
| 1 | -CH(C1-C6-Alkyl)-NH-C(=O)-NH- | (C1-C6)-Halogenalkyl |
| 1 | -CH(C1-C6-Alkyl)-NH-C(=O)-NH- | (C2-C6)-Alkenyl |
| 1 | -CH(C1-C6-Alkyl)-NH-C(=O)-NH- | (C2-C6)-Alkinyl |
| 1 | -CH(C1-C6-Alkyl)-NH-C(=O)-NH- | Aryl |
| 1 | -CH(C1-C6-Alkyl)-NH-C(=O)-NH- | Heteroaryl |
| 1 | -CH(C1-C6-Alkyl)-N(C1-C6-Alkyl)- | H |
| 1 | -CH(C1-C6-Alkyl)-N(C1-C6-Alkyl)-C(=O)- | (C1-C6)-Alkyl |
| 1 | -CH(C1-C6-Alkyl)-N(C1-C6-Alkyl)-C(=O)- | (C3-C6)-Cycloalkyl |
| 1 | -CH(C1-C6-Alkyl)-N(C1-C6-Alkyl)-C(=O)- | (C1-C6)-Halogenalkyl |
| 1 | -CH(C1-C6-Alkyl)-N(C1-C6-Alkyl)-C(=O)- | (C2-C6)-Alkenyl |
| 1 | -CH(C1-C6-Alkyl)-N(C1-C6-Alkyl)-C(=O)- | (C2-C6)-Alkinyl |
| 1 | -CH(C1-C6-Alkyl)-N(C1-C6-Alkyl)-C(=O)- | Aryl |
| 1 | -CH(C1-C6-Alkyl)-N(C1-C6-Alkyl)-C(=O)- | Heteroaryl |
| 1 | -CH(C1-C6-Alkyl)-N(C1-C6-Alkyl)- | (C1-C6)-Alkyl |
| 1 | -CH(C1-C6-Alkyl)-N(C1-C6-Alkyl)- | (C3-C6)-Cycloalkyl |
| 1 | -CH(C1-C6-Alkyl)-N(C1-C6-Alkyl)- | (C1-C6)-Halogenalkyl |
| 1 | -CH(C1-C6-Alkyl)-N(C1-C6-Alkyl)- | (C2-C6)-Alkenyl |
| 1 | -CH(C1-C6-Alkyl)-N(C1-C6-Alkyl)- | (C2-C6)-Alkinyl |
| 1 | -CH(C1-C6-Alkyl)-N(C1-C6-Alkyl)- | Aryl |
| 1 | -CH(C1-C6-Alkyl)-N(C1-C6-Alkyl)- | Heteroaryl |
| 1 | -CH2NHC(=S)- | (C1-C6)-Alkyl |
| 1 | -CH2NH-C(=S)- | (C3-C6)-Cycloalkyl |
| 1 | -CH2NH-C(=S)- | (C1-C6)-Halogenalkyl |
| 1 | -CH2NH-C(=S)- | (C2-C6)-Alkenyl |
| 1 | -CH2NH-C(=S)- | (C2-C6)-Alkinyl |
| 1 | -CH2NH-C(=S)- | Aryl |
| 1 | -CH2NH-C(=S)- | Heteroaryl |
| 1 | -CH2-S(O)p- | (C1-C6)-Alkyl |
| 1 | -CH2-S(O)p- | (C3-C6)-Cycloalkyl |
| 1 | -CH2-S(O)p- | (C1-C6)-Halogenalkyl |
| 1 | -CH2-S(O)p- | (C2-C6)-Alkenyl |
| 1 | -CH2-S(O)p- | (C2-C6)-Alkinyl |
| 1 | -CH2-S(O)p- | Aryl |
| 1 | -CH2-S(O)p- | Heteroaryl |
| 1 | -CH2-SO2-NH- | (C1-C6)-Alkyl |
| 1 | -CH2-SO2-NH- | (C3-C6)-Cycloalkyl |
| 1 | -CH2-SO2-NH- | (C1-C6)-Halogenalkyl |
| 1 | -CH2-SO2-NH- | (C2-C6)-Alkenyl |
| 1 | -CH2-SO2-NH- | (C2-C6)-Alkinyl |
| 1 | -CH2-SO2-NH- | Aryl |
| 1 | -CH2-SO2-NH- | Heteroaryl |
| 1 | -CH2-NH-SO2- | (C1-C6)-Alkyl |
| 1 | -CH2-NH-SO2- | (C3-C6)-Cycloalkyl |
| 1 | -CH2-NH-SO2- | (C1-C6)-Halogenalkyl |
| 1 | -CH2-NH-SO2- | (C2-C6)-Alkenyl |
| 1 | -CH2-NH-SO2- | (C2-C6)-Alkinyl |
| 1 | -CH2-NH-SO2- | Aryl |
| 1 | -CH2-NH-SO2- | Heteroaryl |
| 1 | -CH2-NH-C(=O)- | (C1-C6)-Alkyl |
| 1 | -CH2-NH-C(=O)- | (C3-C6)-Cycloalkyl |
| 1 | -CH2-NH-C(=O)- | (C1-C6)-Halogenalkyl |
| 1 | -CH2-NH-C(=O)- | (C2-C6)-Alkenyl |
| 1 | -CH2-NH-C(=O)- | (C2-C6)-Alkinyl |
| 1 | -CH2-NH-C(=O)- | Aryl |
| 1 | -CH2-NH-C(=O)- | Heteroaryl |
| 1 | -CH2-NH-C(=O)-NH- | (C1-C6)-Alkyl |
| 1 | -CH2-NH-C(=O)-NH- | (C3-C6)-Cycloalkyl |
| 1 | -CH2-NH-C(=O)-NH- | (C1-C6)-Halogenalkyl |
| 1 | -CH2-NH-C(=O)-NH- | (C2-C6)-Alkenyl |
| 1 | -CH2-NH-C(=O)-NH- | (C2-C6)-Alkinyl |
| 1 | -CH2-NH-C(=O)-NH- | Aryl |
| 1 | -CH2-NH-C(=O)-NH- | Heteroaryl |
| 1 | -CH2-NH-C(=O)-NH-SO2- | (C1-C6)-Alkyl |
| 1 | -CH2-NH-C(=O)-NH-SO2- | (C3-C6)-Cycloalkyl |
| 1 | -CH2-NH-C(=O)-NH-SO2- | (C1-C6)-Halogenalkyl |
| 1 | -CH2-NH-C(=O)-NH-SO2- | (C2-C6)-Alkenyl |
| 1 | -CH2-NH-C(=O)-NH-SO2- | (C2-C6)-Alkinyl |
| 1 | -CH2-NH-C(=O)-NH-SO2- | Aryl |
| 1 | -CH2-NH-C(=O)-NH-SO2- | Heteroaryl |
| 1 | -SO2-NH-C(=O)-NH- | (C1-C6)-Alkyl |
| 1 | -CH2-NH-C(=O)-NH- | (C3-C6)-Cycloalkyl |
| 1 | -SO2-NH-C(=O)-NH- | (C1-C6)-Halogenalkyl |
| 1 | -SO2-NH-C(=O)-NH- | (C2-C6)-Alkenyl |
| 1 | -SO2-NH-C(=O)-NH- | (C2-C6)-Alkinyl |
| 1 | -SO2-NH-C(=O)-NH- | Aryl |
| 1 | -SO2-NH-C(=O)-NH- | Heteroaryl |
| 1 | -CH2-SO2-NH-C(=O)- | (C1-C6)-Alkyl |
| 1 | -CH2-SO2-NH-C(=O)- | (C3-C6)-Cycloalkyl |
| 1 | -CH2-SO2-NH-C(=O)- | (C1-C6)-Halogenalkyl |
| 1 | -CH2-SO2-NH-C(=O)- | (C2-C6)-Alkenyl |
| 1 | -CH2-SO2-NH-C(=O)- | (C2-C6)-Alkinyl |
| 1 | -CH2-SO2-NH-C(=O)- | Aryl |
| 1 | -CH2-SO2-NH-C(=O)- | Heteroaryl |
| 1 | -SO2-NH-C(=O)- | (C1-C6)-Alkyl |
| 1 | -SO2-NH-C(=O)- | (C3-C6)-Cycloalkyl |
| 1 | -SO2-NH-C(=O)- | (C1-C6)-Halogenalkyl |
| 1 | -SO2-NH-C(=O)- | (C2-C6)-Alkenyl |
| 1 | -SO2-NH-C(=O)- | (C2-C6)-Alkinyl |
| 1 | -SO2-NH-C(=O)- | Aryl |
| 1 | -SO2-NH-C(=O)- | Heteroaryl |
| 1 | -C(=O)-NH-SO2- | (C1-C6)-Alkyl |
| 1 | -C(=O)-NH-SO2- | (C3-C6)-Cycloalkyl |
| 1 | -C(=O)-NH-SO2- | (C1-C6)-Halogenalkyl |
| 1 | -C(=O)-NH-SO2- | (C2-C6)-Alkenyl |
| 1 | -C(=O)-NH-SO2- | (C2-C6)-Alkinyl |
| 1 | -C(=O)-NH-SO2- | Aryl |
| 1 | -C(=O)-NH-SO2- | Heteroaryl |
| 1 | -CH2-SO(=N-CN)- | (C1-C6)-Alkyl |
| 1 | -CH2-SO(=N-CN)- | (C3-C6)-Cycloalkyl |
| 1 | -CH2-SO(=N-CN)- | (C1-C6)-Halogenalkyl |
| 1 | -CH2-SO(=N-CN)- | (C2-C6)-Alkenyl |
| 1 | -CH2-SO(=N-CN)- | (C2-C6)-Alkinyl |
| 1 | -CH2-SO(=N-CN)- | Aryl |
| 1 | -CH2-SO(=N-CN)- | Heteroaryl |
| 1 | -CH2-S(=N-CN)- | (C1-C6)-Alkyl |
| 1 | -CH2-S(=N-CN)- | (C3-C6)-Cycloalkyl |
| 1 | -CH2-S(=N-CN)- | (C1-C6)-Halogenalkyl |
| 1 | -CH2-S(=N-CN)- | (C2-C6)-Alkenyl |
| 1 | -CH2-S(=N-CN)- | (C2-C6)-Alkinyl |
| 1 | -CH2-S(=N-CN)- | Aryl |
| 1 | -CH2-S(=N-CN)- | Heteroaryl |
| 1 | -CH2- | (C1-C6)-Alkyl |
| 1 | -CH2- | (C3-C6)-Cycloalkyl |
| 1 | -CH2- | (C1-C6)-Halogenalkyl |
| 1 | -CH2- | (C2-C6)-Alkenyl |
| 1 | -CH2- | (C2-C6)-Alkinyl |
| 1 | -CH2- | Aryl |
| 1 | -CH2- | Heteroaryl |
| 1 | -O- | (C1-C6)-Alkyl |
| 1 | -O- | (C3-C6)-Cycloalkyl |
| 1 | -O- | (C1-C6)-Halogenalkyl |
| 1 | -O- | (C2-C6)-Alkenyl |
| 1 | -O- | (C2-C6)-Alkinyl |
| 1 | -O- | Aryl |
| 1 | -O- | Heteroaryl |
| 1 | -NH- | (C1-C6)-Alkyl |
| 1 | -NH- | (C3-C6)-Cycloalkyl |
| 1 | -NH- | (C1-C6)-Halogenalkyl |
| 1 | -NH- | (C2-C6)-Alkenyl |
| 1 | -NH- | (C2-C6)-Alkinyl |
| 1 | -NH- | Aryl |
| 1 | -NH- | Heteroaryl |
| 1 | -N(C1-C6-Alkyl)- | (C1-C6)-Alkyl |
| 1 | -N(C1-C6-Alkyl)- | (C3-C6)-Cycloalkyl |
| 1 | -N(C1-C6-Alkyl)- | (C1-C6)-Halogenalkyl |
| 1 | -N(C1-C6-Alkyl)- | (C2-C6)-Alkenyl |
| 1 | -N(C1-C6-Alkyl)- | (C2-C6)-Alkinyl |
| 1 | -N(C1-C6-Alkyl)- | Aryl |
| 1 | -N(C1-C6-Alkyl)- | Heteroaryl |
| 1 | -NH(C=O)NH- | (C1-C6)-Alkyl |
| 1 | -NH(C=O)NH- | (C3-C6)-Cycloalkyl |
| 1 | -NH(C=O)NH- | (C1-C6)-Halogenalkyl |
| 1 | -NH(C=O)NH- | (C2-C6)-Alkenyl |
| 1 | -NH(C=O)NH- | (C2-C6)-Alkinyl |
| 1 | -NH(C=O)NH- | Aryl |
| 1 | -NH(C=O)NH- | Heteroaryl |
| 1 | -NH(C=S)NH- | (C1-C6)-Alkyl |
| 1 | -NH(C=S)NH- | (C3-C6)-Cycloalkyl |
| 1 | -NH(C=S)NH- | (C1-C6)-Halogenalkyl |
| 1 | -NH(C=S)NH- | (C2-C6)-Alkenyl |
| 1 | -NH(C=S)NH- | (C2-C6)-Alkinyl |
| 1 | -NH(C=S)NH- | Aryl |
| 1 | -NH(C=S)NH- | Heteroaryl |
| 1 | -CH2NHC(=O)NH- | (C1-C6)-Alkyl |
| 1 | -CH2NHC(=O)NH- | (C3-C6)-Cycloalkyl |
| 1 | -CH2NHC(=O)NH- | (C1-C6)-Halogenalkyl |
| 1 | -CH2NHC(=O)NH- | (C2-C6)-Alkenyl |
| 1 | -CH2NHC(=O)NH- | (C2-C6)-Alkinyl |
| 1 | -CH2NHC(=O)NH- | Aryl |
| 1 | -CH2NHC(=O)NH- | Heteroaryl |
| 1 | -CH2NHC(=S)NH- | (C1-C6)-Alkyl |
| 1 | -CH2NHC(=S)NH- | (C3-C6)-Cycloalkyl |
| 1 | -CH2NHC(=S)NH- | (C1-C6)-Halogenalkyl |
| 1 | -CH2NHC(=S)NH- | (C2-C6)-Alkenyl |
| 1 | -CH2NHC(=S)NH- | (C2-C6)-Alkinyl |
| 1 | -CH2NHC(=S)NH- | Aryl |
| 1 | -CH2NHC(=S)NH- | Heteroaryl |
| 1 | -C(=O)NHCH2- | (C1-C6)-Alkyl |
| 1 | -C(=O)NHCH2- | (C3-C6)-Cycloalkyl |
| 1 | -C(=O)NHCH2- | (C1-C6)-Halogenalkyl |
| 1 | -C(=O)NHCH2- | (C2-C6)-Alkenyl |
| 1 | -C(=O)NHCH2- | (C2-C6)-Alkinyl |
| 1 | -C(=O)NHCH2- | Aryl |
| 1 | -C(=O)NHCH2- | Heteroaryl |
| 1 | -C(=S)NHCH2- | (C1-C6)-Alkyl |
| 1 | -C(=S)NHCH2- | (C3-C6)-Cycloalkyl |
| 1 | -C(=S)NHCH2- | (C1-C6)-Halogenalkyl |
| 1 | -C(=S)NHCH2- | (C2-C6)-Alkenyl |
| 1 | -C(=S)NHCH2- | (C2-C6)-Alkinyl |
| 1 | -C(=S)NHCH2- | Aryl |
| 1 | -C(=S)NHCH2- | Heteroaryl |
| 1 | SO2-N(C1-C6-Alkyl)- | (C1-C6)-Alkyl |
| 1 | SO2-N(C1-C6-Alkyl)- | (C3-C6)-Cycloalkyl |
| 1 | SO2-N(C1-C6-Alkyl)- | (C1-C6)-Halogenalkyl |
| 1 | SO2-N(C1-C6-Alkyl)- | (C2-C6)-Alkenyl |
| 1 | SO2-N(C1-C6-Alkyl)- | (C2-C6)-Alkinyl |
| 1 | SO2-N(C1-C6-Alkyl)- | Aryl |
| 1 | SO2-N(C1-C6-Alkyl)- | Heteroaryl |
| 1 | SO2-N(C1-C6-Alkyl)-CH2 | Aryl |
| 1 | SO2-N(C1-C6-Alkyl)-CH2 | Heteroaryl |
| 1 | SO2-NH- | (C1-C6)-Alkyl |
| 1 | SO2-NH- | (C3-C6)-Cycloalkyl |
| 1 | SO2-NH- | (C1-C6)-Halogenalkyl |
| 1 | SO2-NH- | (C2-C6)-Alkenyl |
| 1 | SO2-NH- | (C2-C6)-Alkinyl |
| 1 | SO2-NH- | Aryl |
| 1 | SO2-NH- | Heteroaryl |
| 1 | SO2-NH-CH2- | (C1-C6)-Alkyl |
| 1 | SO2-NH-CH2- | (C3-C6)-Cycloalkyl |
| 1 | SO2-NH-CH2- | (C1-C6)-Halogenalkyl |
| 1 | SO2-NH-CH2- | (C2-C6)-Alkenyl |
| 1 | SO2-NH-CH2- | (C2-C6)-Alkinyl |
| 1 | SO2-NH-CH2- | Aryl |
| 1 | SO2-NH-CH2- | Heteroaryl |
| 1 | S(O)p- | (C1-C6)-Alkyl |
| 1 | S(O)p- | (C3-C6)-Cycloalkyl |
| 1 | S(O)p- | (C1-C6)-Halogenalkyl |
| 1 | S(O)p- | (C2-C6)-Alkenyl |
| 1 | S(O)p- | (C2-C6)-Alkinyl |
| 1 | S(O)p- | Aryl |
| 1 | S(O)p- | Heteroaryl |
| 1 | SO(=N-CN)- | (C1-C6)-Alkyl |
| 1 | SO(=N-CN)- | (C3-C6)-Cycloalkyl |
| 1 | SO(=N-CN)- | (C1-C6)-Halogenalkyl |
| 1 | SO(=N-CN)- | (C2-C6)-Alkenyl |
| 1 | SO(=N-CN)- | (C2-C6)-Alkinyl |
| 1 | SO(=N-CN)- | Heteroaryl |
| 1 | SO(=N-CN)- | Aryl |
| 1 | S(=N-CN)- | (C1-C6)-Alkyl |
| 1 | S(=N-CN)- | (C3-C6)-Cycloalkyl |
| 1 | S(=N-CN)- | (C1-C6)-Halogenalkyl |
| 1 | S(=N-CN)- | (C2-C6)-Alkenyl |
| 1 | S(=N-CN)- | (C2-C6)-Alkinyl |
| 1 | S(=N-CN)- | Aryl |
| 1 | S(=N-CN)- | Heteroaryl |
| 0 | -- | CN |
| 0 | -- | gegebenenfalls
mit Z substituiertes Phenyl |
| 0 | -- | gegebenenfalls
mit Z substituiertes Pyridyl |
| 0 | -- | gegebenenfalls
mit Z substituiertes Heteroaryl |
| 0 | -- | gegebenenfalls
mit Z substituiertes Tetrazolyl |
| 0 | -- | gegebenenfalls
mit Z substituiertes Triazolyl |
| 0 | -- | gegebenenfalls
mit Z substituiertes Pyrazolyl |
| 0 | -- | gegebenenfalls
mit Z substituiertes Imidazolyl |
| 0 | -- | gegebenenfalls
mit Z substituiertes Pyrrolyl |
| 0 | -- | CHO |
| 0 | -- | CH(C1-C6-Alkyl)-OH |
| 0 | -- | CH(C1-C6-Alkyl)-Hal |
-
Die
in den nachfolgenden Tabellen 2 bis 16 genannten erfindungsgemäßen
Verbindungen sind bevorzugt, ganz besonders bevorzugt jedoch im
Hinblick auf ihre Verwendung.
-
Tabelle 2:
-
Verbindung
der Formel I-a, I-f, I-k, I-p, I-u oder I-z, worin B1 für
CR5, B2 für
CR6, B3 für
CR7, und B4 für CR8 steht und wobei die Kombination von R5, R6, R7 und
R8 jeweils einer Zeile der Tabelle A entspricht.
-
Tabelle 3:
-
Verbindung
der Formel I-a, I-f, I-k, I-p, I-u oder I-z, worin B1 für
CR5, B2 für
CR6, B3 für
CR7, und B4 für CR8 steht und wobei die Kombination von R5, R6, R7 und
R8 jeweils einer Zeile der Tabelle A entspricht.
-
Tabelle 4:
-
Verbindung
der Formel I-a, I-f, I-k, I-p, I-u oder I-z, worin A1,
A2, A3 und A4 jeweils für die Gruppierung C-H
steht, B1 für CR5,
B2 für CR6,
B3 für CR7,
und B4 für CR8 steht
und wobei die Kombination von R5, R6, R7 und R8 jeweils einer Zeile der Tabelle A entspricht.
-
Tabelle 5:
-
Verbindung
der Formel I-a, I-f, I-k, I-p, I-u oder I-z, worin A1,
A2 und A4 jeweils
für die Gruppierung C-H und A3 für
die Gruppierung C-R3 steht, mit R3 = CH3 und B1 für CR5,
B2 für CR6,
B3 für CR7,
und B4 für CR8 steht und
wobei die Kombination von R5, R6,
R7 und R8 jeweils
einer Zeile der Tabelle A entspricht.
-
Tabelle 6:
-
Verbindung
der Formel I-a, I-f, I-k, I-p, I-u oder I-z, worin A1,
A2 und A4 jeweils
für die Gruppierung C-H und A3 für
die Gruppierung C-R3 steht, mit R3 = NH-CO-CH3 und
B1 für CR5,
B2 für CR6,
B3 für CR7,
und B4 für CR8 steht
und wobei die Kombination von R5, R6, R7 und R8 jeweils einer Zeile der Tabelle A entspricht.
-
Tabelle 7:
-
Verbindung
der Formel I-a, I-f, I-k, I-p, I-u oder I-z, worin A1,
A2 und A4 jeweils
für die Gruppierung C-H und A3 für
die Gruppierung C-R3 steht, mit R3 = Br und B1 für
CR5, B2 für
CR6, B3 für
CR7, und B4 für
CR8 steht und wobei die Kombination von
R5, R6, R7 und R8 jeweils
einer Zeile der Tabelle A entspricht.
-
Tabelle 8:
-
Verbindung
der Formel I-a, I-f, I-k, I-p, I-u oder I-z, worin A1,
A2 und A4 jeweils
für die Gruppierung C-H und A3 für
die Gruppierung C-R3 steht, mit R3 = CN und B1 für
CR5, B2 für
CR6, B3 für
CR7, und B4 für
CR8 steht und wobei die Kombination von
R5, R6, R7 und R8 jeweils
einer Zeile der Tabelle A entspricht.
-
Tabelle 9:
-
Verbindung
der Formel I-a, I-f, I-k, I-p, I-u oder I-z, worin A1,
A2 und A4 jeweils
für die Gruppierung C-H und A3 für
die Gruppierung C-R3 steht, mit R3 = Cl und B1 für
CR5, B2 für
CR6, B3 für
CR7, und B4 für
CR8 steht und wobei die Kombination von
R5, R6, R7 und R8 jeweils
einer Zeile der Tabelle A entspricht.
-
Tabelle 10:
-
Verbindung
der Formel I-a, I-f, I-k, I-p, I-u oder I-z, worin A1,
A2 und A4 jeweils
für die Gruppierung C-H und A3 für
die Gruppierung C-R3 steht, mit R3 = NO2 und B1 für CR5,
B2 für CR6,
B3 für CR7,
und B4 für CR8 steht und
wobei die Kombination von R5, R6,
R7 und R8 jeweils
einer Zeile der Tabelle A entspricht.
-
Tabelle 11:
-
Verbindung
der Formel I-a, I-f, I-k, I-p, I-u oder I-z, worin die Gruppierung
-Lm-Q für -NH-CO-CH3,
B1 für CR5,
B2 für CR6,
B3 für CR7,
und B4 für CR8 steht
und wobei die Kombination von R5, R6, R7 und R8 jeweils einer Zeile der Tabelle A entspricht.
-
Tabelle 12:
-
Verbindung
der Formel I-a, I-f, I-k, I-p, I-u oder I-z, worin die Gruppierung
-Lm-Q für -CO-NH-CH2-pyrid-2-yl,
B1 für CR5,
B2 für CR6,
B3 für CR7,
und B4 für CR8 steht
und wobei die Kombination von R5, R6, R7 und R8 jeweils einer Zeile der Tabelle A entspricht.
-
Tabelle 13:
-
Verbindungen
der Formel I-a, I-f, I-k, I-p, I-u oder I-z, worin die Gruppierung
-Lm-Q für -CO-NH-CH2-CF3, B1 für
CR5, B2 für
CR6, B3 für
CR7, und B4 für
CR8 steht und wobei die Kombination von
R5, R6, R7 und R8 jeweils
einer Zeile der Tabelle A entspricht.
-
Tabelle 14:
-
Verbindungen
der Formel I-a, I-f, I-k, I-p, I-u oder I-z, worin die Gruppierung
-Lm-Q für -CH2-NH-CO-CH3, B1 für
CR5, B2 für
CR6, B3 für
CR7, und B4 für
CR8 steht und wobei die Kombination von
R5, R6, R7 und R8 jeweils
einer Zeile der Tabelle A entspricht.
-
Tabelle 15:
-
Verbindungen
der Formel I-a, I-f, I-k, I-p, I-u oder I-z, worin die Gruppierung
-Lm-Q für -CN, B1 für
CR5, B2 für
CR6, B3 für
CR7, und B4 für
CR8 steht und wobei die Kombination von
R5, R6, R7 und R8 jeweils
einer Zeile der Tabelle A entspricht.
-
Tabelle 16:
-
Verbindungen
der Formel I-a, I-f, I-k, I-p, I-u oder I-z, worin die Gruppierung
-L
m-Q für N-1,2,4-Triazol-1-yl,
B
1 für CR
5,
B
2 für CR
6,
B
3 für CR
7,
und B
4 für CR
8 steht
und wobei die Kombination von R
5, R
6, R
7 und R
8 jeweils einer Zeile der Tabelle A entspricht. Tabelle A:
| R5 | R6 | R7 | R8 |
| Cl | H | Cl | H |
| Br | H | Br | H |
| Br | Br | Br | H |
| Cl | Cl | Cl | H |
| CF3 | Cl | CF3 | H |
| Cl | Cl | CF3 | H |
| CF3 | Cl | Cl | H |
| CF3 | H | CF3 | H |
| CF3 | H | Cl | H |
| CF3 | H | Br | H |
| Cl | H | CF3 | H |
| Br | H | CF3 | H |
| Cl | H | H | H |
| CF3 | H | H | H |
-
Die
erfindungsgemäßen Verbindungen können
in Abhängigkeit von der Art der Substituenten als geometrische
und/oder als optisch aktive Isomere oder entsprechende Isomerengemische
in unterschiedlicher Zusammensetzung vorliegen. Diese Stereoisomere
sind beispielsweise Enantiomere, Diastereomere, Atropisomere oder
geometrische Isomere. Die Erfindung umfasst somit reine Stereoisomere
als auch beliebige Gemische dieser Isomere.
-
Die
erfindungsgemäßen Verbindungen können
gegebenenfalls in verschiedenen polymorphen Formen oder als Mischung
verschiedener polymorpher Formen vorliegen. Sowohl die reinen Polymorphe
als auch die Polymorphgemische sind Gegenstand der Erfindung und
können erfindungsgemäß verwendet werden.
-
Schließlich
wurde gefunden, dass die neuen Verbindungen der Formel (I) sich
bei guter Pflanzenverträglichkeit, günstiger Warmblütertoxizität
und guter Umweltverträglichkeit vor allem zur Bekämpfung
von tierischen Schädlingen, insbesondere von Arthropoden,
Insekten, Spinnentieren, Helminthen, Nematoden und Mollusken, die
in der Landwirtschaft, in den Forsten, im Vorrats- und Materialschutz
sowie auf dem Hygienesektor oder im Bereich der Tiergesundheit vorkommen,
eignen. Gleichfalls können die erfindungsgemäßen Verbindungen
im Bereich der Tiergesundheit verwendet werden, beispielsweise zur
Bekämpfung von Endo- und/oder Ectoparasiten.
-
Die
erfindungsgemäßen Verbindungen können
als Mittel zur Bekämpfung tierischer Schädlinge,
vorzugsweise als Pflanzenschutzmittel eingesetzt werden. Sie sind
gegen normal sensible und resistente Arten sowie gegen alle oder
einzelne Entwicklungsstadien wirksam.
-
Die
erfindungsgemäßen Verbindungen können
in allgemein bekannte Formulierungen überführt
werden. Solche Formulierungen enthalten im Allgemeinen von 0,01
bis 98 Gew.-% Wirkstoff, vorzugsweise von 0,5 bis 90 Gew.-%.
-
Die
erfindungsgemäßen Verbindungen können
in ihren handelsüblichen Formulierungen sowie in den aus
diesen Formulierungen bereiteten Anwendungsformen in Mischung mit
anderen Wirkstoffen oder Synergisten vorliegen. Synergisten sind
Verbindungen, durch die die Wirkung der Wirkstoffe gesteigert wird,
ohne daß der zugesetzte Synergist selbst aktiv wirksam
sein muß.
-
Der
Wirkstoffgehalt der aus den handelsüblichen Formulierungen
bereiteten Anwendungsformen kann in weiten Bereichen variieren.
Die Wirkstoffkonzentration der Anwendungsformen kann von 0,00000001
bis zu 95 Gew.-% Wirkstoff, vorzugsweise von 0,00001 bis 1 Gew.-%
liegen.
-
Die
Anwendung geschieht in einer den Anwendungsformen angepaßten üblichen
Weise.
-
Erfindungsgemäß können
alle Pflanzen und Pflanzenteile behandelt werden. Unter Pflanzen
werden hierbei alle Pflanzen und Pflanzenpopulationen verstanden,
wie erwünschte und unerwünschte Wildpflanzen oder
Kulturpflanzen (einschließlich natürlich vorkommender
Kulturpflanzen). Kulturpflanzen können Pflanzen sein, die
durch konventionelle Züchtungs- und Optimierungsmethoden
oder durch biotechnologische und gentechnologische Methoden oder Kombinationen
dieser Methoden erhalten werden können, einschließlich
der transgenen Pflanzen und einschließlich der durch Sortenschutzrechte
schätzbaren oder nicht schätzbaren Pflanzensorten.
Unter Pflanzenteilen sollen alle oberirdischen und unterirdischen
Teile und Organe der Pflanzen, wie Sproß, Blatt, Blüte
und Wurzel verstanden werden, wobei beispielhaft Blätter,
Nadeln, Stengel, Stämme, Blüten, Fruchtkörper,
Früchte und Saatgut sowie Wurzeln, Knollen und Rhizome
aufgeführt werden. Zu den Pflanzenteilen gehört
auch Erntegut sowie vegetatives und generatives Vermehrungsmaterial,
beispielsweise Stecklinge, Knollen, Rhizome, Ableger und Saatgut.
-
Die
erfindungsgemäße Behandlung der Pflanzen und Pflanzenteile
mit den Wirkstoffen erfolgt direkt oder durch Einwirkung auf deren
Umgebung, Lebensraum oder Lagerraum nach den üblichen Behandlungsmethoden,
z. B. durch Tauchen, Sprühen, Verdampfen, Vernebeln, Streuen,
Aufstreichen, Injizieren und bei Vermehrungsmaterial, insbesondere
bei Saatgut, weiterhin durch ein- oder mehrschichtiges Umhüllen.
-
Wie
bereits oben erwähnt, können erfindungsgemäß alle
Pflanzen und deren Teile behandelt werden. In einer bevorzugten
Ausführungsform werden wild vorkommende oder durch konventionelle
biologische Zuchtmethoden, wie Kreuzung oder Protoplastenfusion
erhaltenen Pflanzenarten und Pflanzensorten sowie deren Teile behandelt.
In einer weiteren bevorzugten Ausführungsform werden transgene
Pflanzen und Pflanzensorten, die durch gentechnologische Methoden
gegebenenfalls in Kombination mit konventionellen Methoden erhalten
wurden (Genetically Modified Organisms) und deren Teile behandelt.
Die Begriffe ”Teile” bzw. ”Teile von
Pflanzen” oder ”Pflanzenteile” wurden
oben erläutert.
-
Besonders
bevorzugt werden erfindungsgemäß Pflanzen der
jeweils handelsüblichen oder in Gebrauch befindlichen Pflanzensorten
behandelt. Unter Pflanzensorten versteht man Pflanzen mit neuen
Eigenschaften (”Traits”), die sowohl durch konventionelle
Züchtung, durch Mutagenese oder durch rekombinante DNA-Techniken
gezüchtet worden sind. Dies können Sorten, Bio-
und Genotypen sein.
-
Im
Bereich Tiergesundheit, d. h. auf dem veterinärmedizinischen
Gebiet, wirken die Wirkstoffe gemäß der vorliegenden
Erfindung gegen tierische Parasiten, insbesondere Ektoparasiten
oder Endoparasiten. Der Begriff Endoparasiten schließt
insbesondere Helminthen wie Cestoden, Nematoden oder Trematoden,
und Protozoen wie Coccidien ein. Ektoparasiten sind typischerweise
und vorzugsweise Arthropoden, insbesondere Insekten wie Fliegen
(stechend und leckend), parasitische Fliegenlarven, Läuse,
Haarlinge, Federlinge, Flöhe und dergleichen; oder Akariden
wie Zecken, zum Beispiel Schildzecken oder Lederzecken, oder Milben
wie Räudemilben, Laufmilben, Federmilben und dergleichen.
-
Außerdem
wurde gefunden, daß die erfindungsgemäßen
Verbindungen eine hohe insektizide Wirkung gegen Insekten zeigen,
die technische Materialien zerstören. Unter technischen
Materialien sind im vorliegenden Zusammenhang nicht-lebende Materialien
zu verstehen, wie vorzugsweise Kunststoffe, Klebstoffe, Leime, Papiere
und Kartone, Leder, Holz, Holzverarbeitungsprodukte und Anstrichmittel.
-
Weiter
können die erfindungsgemäßen Verbindungen
allein oder in Kombinationen mit anderen Wirkstoffen als Antifouling-Mittel
eingesetzt werden.
-
Die
Wirkstoffe eignen sich auch zur Bekämpfung von tierischen
Schädlingen im Haushalts-, Hygiene- und Vorratsschutz,
insbesondere von Insekten, Spinnentieren und Milben, die in geschlossenen
Räumen, wie beispielsweise Wohnungen, Fabrikhallen, Büros,
Fahrzeugkabinen u. ä. vorkommen. Sie können zur
Bekämpfung dieser Schädlinge allein oder in Kombination
mit anderen Wirk- und Hilfsstoffen in Haushaltsinsektizid-Produkten
verwendet werden. Sie sind gegen sensible und resistente Arten sowie
gegen alle Entwicklungsstadien wirksam.
-
Die
erfindungsgemäßen Verbindungen können
nach üblichen, dem Fachmann bekannten Methoden hergestellt
werden.
-
Gemäß Reaktionsschema
1 werden substituierte Spiroisoxazoline mittels 1,3-dipolarer Cycloaddition aus
(Hetero)arylnitril-N-Oxiden (A-3) und exo-Methylengruppen-haltigen
cyclischen Carbonylverbindungen (A-4) erhalten. Reaktionsschema
1
-
Diese
Reaktion verläuft über die in-situ erzeugten substituierten
(Hetero)arylhydroxamsäurehalogenide der allgemeinen Formel
A-2, wobei Hal bevorzugt Cl oder Br ist, die zu (Hetero)arylnitril-N-Oxiden
(A-3) dehydrohalogeniert werden. A-3 reagiert dann über
eine 1,3-dipolarer Cycloaddition mit exo-Methylengruppen-haltigen
cyclischen Carbonylverbindungen (A-4) unter Bildung der erfindungsgemässen
substituierten Spiroisoxazoline (I) (vgl. auch Houben-Weyl,
Methoden der Organischen Chemie, Band E5, „Nitriloxide",
4. Auflage, 1965, G. Thieme Verlag, Stuttgart New York, S. 1591–1610).
-
In
einer typischen Reaktionsdurchführung wird ein geeignetes
Halogenierungsmittel wie beispielsweise Natriumhypochlorid, N-Halogen-succinimid
(Hal = Brom, Chlor) oder Chloramin-T mit dem substituierten (Het)arylaldoxime
der allgemeinen Formel (A-1) in Gegenwart eines oder mehrerer Verdünnungsmittel
mit einem „Olefin”, gemäß Reaktionschema
1 mit dem exo-Methylengruppen-haltigen cyclischen Carbonylverbindungen
der allgemeinen Formel (A-4), umsetzt. In Abhängigkeit
der Reaktionsbedingungen können ein oder mehrere geeignete
basische Reaktionshilfsmittel oder auch Säurebindemittel
eingesetzt werden, wie beispielsweise Pyridin oder Triethylamin,
um die Dehydrohalogenierungsreaktion zu beeinflussen.
-
Die
1,3-dipolare Cycloaddition kann in Gegenwart verschiedenster Verdünnungsmittel
durchgeführt werden, wie beispielsweise Ethern (z. B. Diethylether,
Tetrahydrofuran, Dioxan), Halogenkohlenwasserstoffe (z. B. Methylenchlorid)
oder aromatische Kohlenwasserstoffe (z. B. Toluol). Die 1,3-dipolare
Cycloaddition kann in einem Temperaturbereich von Raumtemperatur
bis Rückflusstemperatur des jeweiligen Verdünnungsmittels
erfolgen. Die Menge des Verdünnungsmittels ist so gewählt,
dass das Reaktionsgemisch während des ganzen Verfahrens
gut rührbar ist.
-
Die
Cycloadditionsreaktion von Nitril-N-Oxiden mit Olefinen sind allgemein
bekannt (vgl. z. B. G. A. Lee Synthesis 6, 508–509,
1982; S. Kanemasa et al., Tetrahedron 56, 1057–1064, 2000).
-
Die
Halogenierung wird nach allgemein bekannte Methoden durchgeführt.
Als Halogenierungsmittel zur Herstellung der Verbindungen A-2 können
alle geeigneten Halogenierungsmittel, z. B. Brom, Chlor, Iod, 1,3-Dihalogen-5,5-dimethylhydantoine
(z. B. 1,3-Dichlor-5,5-dimethyl-hydantoin 1,3-Dibrom-5,5-dimethylhydantoin),
Benzyltrimethyl-ammoniumtetrachloroiodat, Natriumhypochlorit und
N-Halogen-Verbindungen, wie N-Halogen-amine (z. B. 1-Chlormethyl-4-fluordiazoniabicyclo[2.2.2]octan-bis-(tetrafluoroborat),
N,N-Dihalogen-amine), N-Chlor-morpholin, N-Halogen-carbonsäureamide,
N-Halogen-carbamidsäureester, N-Halogenharstoff, N-Halogen-sulfonylamide,
N-Halogen-disulfonylamide, N-Halogen-sulfonylimide (z. B. N-fluor-bis[(trifluormethyl)sulfonyl]imid)
und N-Halogen-carbonsäurediamide (z. B. N-Chlorphthalimid, N-Brom-phthalimid,
N-Iod-phthalimid, N-Chlor-succinimid, N-Brom-succinimid, N-Chlor-saccharin, N-Brom-saccharin
oder N-Iod-succinimid) und N-Halogen-benzotriazole (z. B. 1-Chlor-benzotriazol)
oder auch polymergebundene Halogenierungsreagenzien verwendet werden.
-
Bevorzugt
werden N-Brom-succinimid und N-Chlor-succinimid eingesetzt.
-
Die
substituierten (Hetero)arylaldoxime der allgemeinen Formel (A-1)
können in bekannter Weise aus (Hetero)aromatischen Aldehyden
(A-5) mit Hydroxylamin-hydrochlorid, gegebenenfalls in Gegenwart
eines Verdünnungsmittels (z. B. Acetonitril oder N,N-Dimethylformamid)
und gegebenenfalls in Gegenwart eines basischen Reaktionshilfsmittels
(z. B. Kaliumcarbonat oder Triethylamin) bei Temperaturen von 0°C
bis 100°C gemäß Reaktionsschema 2 erhalten
werden (vgl.
Houben-Weyl, Methoden der Organischen Chemie,
Band X/4, 4. Auflage, 1968, G. Thieme Verlag, Stuttgart New York,
S. 55; Band 14b, 4. Auflage, 1990, G. Thieme Verlag, Stuttgart New
York, S. 287;
J. P. Freeman Chem. Rev. 73, 283–292,
1973). Reaktionsschema
2
-
Ausgehend
von Aldehyden (A-5), ist die Herstellung von Verbindungen der Formel
A-1, für den Fall dass A
1, A
2, A
3 und A
4 jeweils für Kohlenstoff steht,
R
1, R
2, R
4 jeweils für H und R
3 für
CN steht und m für 0 steht und Q für die Gruppierung
N-1,2,4-Triazol-1-yl steht in
WO
2008/019760 beschrieben. Weitere Verbindungen können
analog dargestellt werden.
-
Verbindungen
der Formel A-1 (und der Formel A-2) können Isomerenrein,
als E- oder Z-Isomer (syn- versus anti-Form) als auch in Form von
Gemischen verwendet werden.
-
Aldehyde
der Formel (A-5) sind allgemein bekannt und sind mit allgemein bekannten
Methoden herstellbar ((z. B. 4-(1H-Pyrazol-1-yl)-benzaldehyd und
4-(2H-1,2,3-triazol-2-yl)-benzaldehyd (vgl.
A. Tanaka et al.,
J. Med. Chem. 41, 2390–2410, 1998) 4-(1H-Imidazol-1-yl)-benzaldehyd
(vgl.
P. Cozzi et al. J. Med. Chem. 36, 2964–2972,
1993), 4-(1H-1,2,3-triazol-1-yl)-benzaldehyd (vgl.
Y.
Ding et al., Bioorg. Med. Chem. Lett. 17, 814–815, 2007),
3-Brom-4-(1H-imidazol-1-yl)-benzaldehyd (vgl.
WO 2005/016862 ), 6-(1H-Imidazol-1-yl)-3-pyridin-carboxaldehyd
(vgl.
WO 89/08108 )
oder 6-(1H-1,2,4-triazol-1-yl)-3-pyridin-carboxaldehyd, 5-Formyl-2-(4-nitro-1H-pyrazol-1-yl)-benzonitril,
5-Formyl-(1H-tetrazol-1-yl)-benzonitril, 1-(2-Cyan-4-formyl-phenyl)- 1H-pyrazol-4-carbonitril
und 3-Chlor-4-(1H-1,2,4-triazol-1-yl)-benzaldehyd (vgl.
WO 2008/019760 )). Reaktionsschema
3
-
Die
im Reaktionschema 1 als ”Olefin” bezeichnete Verbindung
(A-4) ist aus bicyclischen Carbonylverbindungen (A-6) und (A-8)
zugänglich und kann entsprechend dem Reaktionsschema 3
hergestellt werden.
-
Ausgehend
von kommerziell erhältlichen oder literaturbekannten bicyclischen
Carbonylverbindungen A-6 (D = CH
2) sind
die Verbindungen A-8 (D = CHHal, C(Hal)
2)
und A-4 (D = CH
2, CHHal, C(Hal)
2)
darstellbar. Vertreter der Verbindung A-6 sind beispielsweise α-Indanon
(B
1-B
4 = CH; D,
E = CH
2), 6,7-Dihydro-5H-cyclopenta[b]pyridin-5-one
(B
1 = N; B
2-B
4 = CH; D, E = CH
2;
vgl.
F. Zymalkowski, H. Rimek, J. Arch. Pharm. 294, 759–765,
1961), 6,7-Dihydro-5H-cyclopenta[c]pyridin-5-one (B
2 = N; B
1, B
3-B
4 = CH; D, E =
CH
2; vgl.
M. Ohba, R. Izuta Heterocycles
55, 823–826, 2001), 5,6-Dihydro-7H-cyclopenta[c]pyridin-7-one
(B
1-B
2, B
4 = CH; B
3 = N; D,
E = CH
2; vgl.
D. Binder Monatshefte
für Chemie 105, 203–208, 1974), 5,6-Dihydro-7H-cyclopenta[b]pyridin-7-one
(B
1-B
3 = CH; B
4 = N; D, E = CH
2;
vgl.
A. Gomtsyan et al., J. Med, Chem. 51, 392–395,
2008), α-Tetralon (B
1-B
4 = CH, D = CH
2 und
E = (CH
2)
2), 7,8-Dihydro-6H-quinolin-5-one
(B
1 = N; B
2-B
4 = CH; D = CH
2,
E = (CH
2)
2; vgl.
WO 2006/060344 ,
WO 2006/034090 ), 7,8-Dihydroisoquinolin-5(6H)-one
(B
2 = N; B
1, B
3-B
4 = CH; D = CH
2, E = (CH
2)
2; vgl.
WO 2007/060198 A1 ,
WO 2002/076950 A2 ),
5,6-Dihydro-isoquinolin-8(7H)-one (B
1-B
2, B
4 = CH; B
3 = N; D = CH
2, E
= (CH
2)
2; vgl.
WO 99/28300 ,
WO 2002/076950 ) und 6,7-Dihydro-5H-quinolin-8-one
(B
1-B
3 = CM; B
4 = N; D = CH
2, E
= (CH
2)
2; vgl.
WO 2005/085228 ,
WO 2006/060346 .
-
Die
Darstellung von α-halogenierten und α,α-dihalogenierten
bicyclischen Carbonylverbindungen A-8 mit D = CHHal oder C(Hal)2 erfolgt mit geeigneten Halogenierungsmitteln.
Als Halogenierungsmittel zur Herstellung der Verbindungen (A-8)
sind die vorgenannten Halogenierungsmittel geeignet. Weiterhin kann
ein dreistufiges Verfahren zur Herstellung von α,α-difluorierten
Ketonen mit Selectfluor® (F-TEDA-BF4), beispielsweise unter Bildung leicht zugänglicher
Imin-Intermediate der Formel A-7 mit D = CF2,
E = CH2 oder (CH2)2; R' = n-Butyl, verwendet werden (vgl. Reaktionsschema
3).
-
In
einem ersten Reaktionsschritt werden die bicyclischen Carbonylverbindungen
A-6 mit einem geringfügigen Überschuss Alkylamin
(z. B. n-Butylamin) in Cyclohexan und in Gegenwart kalatytischer
Mengen Trifluoressigsäure am Wasserabscheider unter Rückflusstemperatur
gerührt. Im zweiten Reaktionsschritt erfolgt die Fluorierung
mit Selectfluor® (F-TEDA-BF4) und in einem dritten Reaktionsschritt
werden die rohen bicyclischen Imme (A-7) unter Bildung der α,α-difluorierten
bicyclischen Carbonylverbindungen (A-8) hydrolysiert (vgl. I.
Pravst et al., Synthesis 18, 3140–46, 205). Die
von I. Pravst et al. (2005) beschriebene Darstellung des
2,2-Difluor-2,3-dihydro-1H-inden-1-ons (B1-B4 = CH; D = CF2,
E = CH2), 2,2-Difluoro-3,4-dihydro-2H-naphthalen-1-ons
(B1-B4 = CH; D =
CF2, E = (CH2)2) und 2,2-Difluoro-3,4-dihydro-5-methoxy-2H-naphthalen-1-ons (B1 = C-OCH3, B1-B4 = CH; D = CF2, E = (CH2)2) lässt
sich in analoger Weise auch auf die Herstellung neuer, α,α-dihalogenierter
bicyclischer Carbonylverbindungen (A-8) übertragen.
-
Desweiteren
ist die Synthese von α-fluorierten Carbonylverbindungen
(A-8; D = CHF, CF2) auch unter sehr milden
Reaktionsbedingungen, beispielsweise in Gegenwart von Mangan(IV)-dioxid
und Pyridinium-polyhydrogenfluorid (MnO2/PyHF)
bekannt. Hierbei fungiert das MnO2/PyHF-Gemisch
als Vorläufer für das in-situ gebildete Mangan(IV)-tetrafluorid
(vgl. R. Moughamir et al., Alpha-fluorination of ketones
by F+ transfer using a precursor of MnF4 in International Electronic
Conference an Synthetic Chemistry, 5th, 6th, Sept. 1–30,
2001 und 2002 und 7th, 8th, Nov. 1–30, 2003 und 2004, Ed.
J. A. Seijas; S. 243–249 (2004). Zur selektiven α-Fluorierung
von α-Tetralon (B1-B4 =
CH, D = CH2 und E = (CH2)2) wurden beispielsweise auch die nachfolgend
aufgeführten Fluorierungsmittel erfolgreich eingesetzt:
N-Fluor-ortho-benzoldisulfonamid (NFOBS) (vgl. F. A. Davis
et al., J. Org. Chem. 60, 4730–4737, 1995), N-Fluor-bis(trifluoromethylsulfonyl)imid
(vgl. W. Ving et al., Tetrahedron 52, 15–22, 1996)
oder Xenondifluorid in Acetonitril (vgl. Ch. A. Ramsden,
R. G. Smith Org. Lett. 1, 1591–1594, 1999).
-
Die
Darstellung von α-mono und α,α-dichlorierten
bicyclischen Carbonylverbindungen A-8 mit D = CHCl oder CCl2) ist literaturbekannt und kann gemäß der
beschiebenen Herstellungsmethoden erfolgen. Beispielsweise sind
2-Chlor-2,3-dihydro-1H-inden-1-on (B1-B4 = CH; D = CHCl, E = CH2)
und 2,2-Dichlor-2,3-dihydro-1H-inden-1-on (B1-B4 = CH; D = CCl2,
E = CH2) mittels Chlorierung mit einer Lewissäure
wie z. B. Aluminium(III)-chlorid in Dichlormethan (vgl. Y.
-D. Park et al., Synthesis 7, 1136–1140, 2005)
und das 2,2-Dichloro-3,4-dihydro-2H-naphthalen-1-on (B1-B4 = CH; D = CCl2,
E = (CH2)2) mittels
Chlorierung mit Mangan(IV)-chlorid-in-situ erzeugt aus MnO2/TMS-Cl oder Acetylchlorid (vgl. F.
Bellesia et al., J. Chem. Res., Synopses 6, 188–189, 1990)
zugänglich. Die Chlorierung kann auch mit Mangan(III)-acetat
in Gegenwart von Lithiumchlorid (vgl. T. Tsuruta et al.,
Bull. Chem. Soc. Jap. 58, 142–145, 1985) durchgeführt
werden.
-
Die
Darstellung von α-mono und α,α-dibromierten
bicyclischen Carbonylverbindungen A-8 mit D = CHBr oder CBr2) ist literaturbekannt und kann gemäß der
beschiebenen Herstellungsmethoden erfolgen. Beispielsweise sind
2-Brom-2,3-dihydro-5-methoxy-1H-inden-1-on (B2 =
C-OCH3, B1, B3-B4 = CH; D = CHBr,
E = CH2) und 2-Brom-3,4-dihydro-6-methoxy-2H-naphthalen-1-on
(B2 = C-OCH3, B1, B3, B4 =
CH; D = CHBr, E = (CH2)2)
mittels Bromierung mit N-Brom-succinimid in Gegenwart von para-Toluolsulfonsäure
ohne Verdünnungsmittel (vgl. I. Pravst et al.,
Tetrahedron Lett. 47, 4707–4710, 2006) und 2,2-Dibrom-3,4-dihydro-2H-naphthalen-1-on
(B1-B4 = CH; D =
CBr2, E = (CH2)2), 2,2,5-Tribrom-3,4-dihydro-2H-naphthalen-1-on
(B1 = C-Br, B2-B4 = CH; D = CBr2,
E = (CH2)2) oder
2,2-Dibrom-3,4-dihydro-5,6,7-trimethoxy-2H-naphthalen-1-on (B1 = H, B2-B4 = C-OCH3; D = CBr2, E = (CH2)2) mittels Bromierung mit N-Methylpyrrolidin-2-on-hydrotribromid
(MPHT) in Acetonitril (vgl. A. Bekaert et al., Tetrahedron
Lett. 46, 4187–4191, 2005) zugänglich.
-
Wege
zur Einführung einer exo-Methylengruppe in bicyclische
Carbonylverbindungen A-4 mit D = CH2 sind
bekannt und erfolgen gemäß allgemein bekannter
Herstellungsmethoden (vgl. Reaktionsschema 3). Beispielsweise sind
2,3-Dihydro-1-methylen-1H-inden (B1-B4 = CH; D, E = CH2)
und 1,2,3,4-Tetrahydro-1-methylen-naphthalen (B1-B4 = CH; D = CH2,
E = (CH2)2) mittels
[(Trimethylsilyl)methyl]lithium/wasserfreies Cerium(III)-chlorid
(vgl. C. R. Johnson, B. D. Tait J. Org. Chem. 52, 281–283,
1987), 7-Methoxy-1-methylen-1,2,3,4-tetrahydro-naphthalen
(B1-B2, B4 = CH, B3 = C-OCH3; D = CH2, E = (CH2)2) mit 1-tert-Butyl-1H-tetrazol-5-ylmethyl-sulfon,
NaHMDS bei –78°C in Tetrahydrofuran (vgl. „Julia-Kocienski
Reaktionsbedingungen" C. Aissa J. Org. Chem. 71, 360–363,
2006), 1,2,3,4-Tetrahydro-1-methylen-5-nitro-naphthalen
(B1 = C-NO2, B2-B4 = CH; D = CH2, E = (CH2)2) mittels Wittig-Reaktion mit Methyltriphenylphosphoniumbromid
oder in Gegenwart des Tebbe Reagenz (μ-chloro-μ-methylen[bis(cyclopentadienyl)titanium]dimethyl-aluminium)
(vgl. M. Barker et al., J. Med. Chem. 49, 4216–4231,
2006) und 5,6,7,8-Tetrahydro-5-methylen-2-naphthalen-carbonitril
(B1, B3-B4 = CH, B2 = C-CN;
D = CH2, E = (CH2)2) mittels Wittig-Reaktion mit Methyltriphenylphosphonium-bromid,
KHMDS in THF (vgl. P. C. Lobben, L. A. Paquette J. Org.
Chem. 63, 6990–6993, 1998) zugänglich.
-
Es
sind auch einige exo-Methylengruppen-haltige α,α-dihalogenierte
cyclischen Carbonylverbindungen (A-4, D = CHF, CF2)
bekannt geworden (vgl. Reaktionsschema 3).
-
Beispielsweise
sind 2-Fluor-2,3-dihydro-1-methylen-1H-inden (B
1-B
4 = CH; D = CHF, E = CH
2)
und 2-Fluor-1,2,3,4-tetrahydro-1-methylen-naphthalen (B
1-B
4 = CH; D = CHF, E = (CH
2)
2) (vgl.
B. Greedy et al., Angew.
Chem. Int. Ed. 42, 3291–3294, 20057), 1,1,2,2,4,5,6,7-Octafluoro-2,3-dihydro-3-methylen-1H-inden (B
1-B
4 = CF; D, E =
CF
2) (vgl.
I. P. Chuikov et al.,
Izv. Akad. Nauk SSSR, Ser. Khim. 7, 1654–1660, 1988)
und das N-(6,6-Difluoro-5,6,7,8-tetrahydro-5-methylen-2-naphthalenyl)-2,2,2-trifluoro-acetamid
(B
1, B
3-B
4 = CH, B
2 = C-NH-CO-CF
3; D = CF
2, E = (CH
2)
2) (vgl.
JP-Pat. 2004196702 A )
bekannt. Reaktionsschema
4
-
Verbindungen
der Formel (I), in welcher Q für einen 5-gliedrigen N-verknüpften
heterocyclischen Ring steht und m gleich 0 ist können auch
durch direkten Austausch von (Hetero)Arylhalogen in Verbindungen
der Formel A-9, worin Hal für ein Halogenatom steht erhalten
werden. Dabei können können die Verbindungen der Formel
(I), die mit einem N-haltigen Heterocyclus (Q-H) gemäß Reaktionsschema
4 substituiert sind, entstehen. Geeignete N-haltige Hetereocyclen
sind beispielsweise gegebenenfalls substituierte Pyrazole, Imidazole oder
Triazole. Halogenverbindungen der Formel A-9, worin Hal für
Brom steht, können in Gegenwart von Kupferiodid und einem
geeigneten Palladiumkatalysator mit N-haltigen Hetereocyclen reagieren,
vgl. z. B.
Cristau et al., Eur. J. Org. Chem. 695–709,
2004. Für die Substitution von Fluor in Verbindungen
der Formel A-9, worin Hal für Fluor steht, verläuft
die Reaktion in polaren aprotischen Lösungsmitteln (z.
B. N,N-Dimethylformamid oder N,N-Dimethylacetamid) und in Gegenwart
einer anorganischen Base (z. B. Natrium oder Kaliumcarbonat). Reaktionsschema
5
-
Eine
alternative Darstellung von Verbindungen der Formel (I) verläuft
unter Suzuki Reaktionsbedingunggen, d. h. es erfolgt eine Palladium-katalysierte
Kreuzkupplungsreaktion eines Arylhaogenids der Formel A-10, worin
Hal für Iod oder Brom steht, mit entsprechenden (Hetero)arylboronsäuren
(Q-B(OH)2) gemäß Reaktionsschema
5.
-
Zahlreiche
Palladiumkatalysatoren sind für diese Reaktionsdurchführung
beschrieben, ein bekannter Katalysator ist das Tetrakis(triphenylphosphin)palladium(0).
Als geeignete Lösungsmittel werden Ether, (z. B. Tetrahydrofuran,
Diethylether, Dioxan) und Nitrile (z. B. Acetonitril) verwendet.
Die Heteroarylboronsäuren (Q-B(OH)2)
sind kommerziell erhältlich oder lassen sich nach bekannten
Methoden darstellen. Zur Einführung der heterocyclischen
Gruppierung Q in Verbindungen der Formel (I) können weitere
literaturbekannte Reaktionen (z. B. Heck-, Stille-, Kumada- oder
Buchwald-Hartwig Kupplung) verwendet werden (vgl. Review über „Pd”-Chemie,
enthält geeignete Methoden zur Einführung von
Q: J. J. Li, G. W. Gribble (Eds.) Palladium in Heterocyclic
Chemistry: A Guide for the Synthetic Chemist, Elsevier, Oxford,
UK, 2000).
-
Weiterhin
können heterocyclische Ringsysteme Q auch direkt an gewissen
Vorstufen der erfindungsgemäßen Verbindung der
Formel (I) aufgebaut werden. Solche Synthesen sind bekannt und basieren
oftmals auf der Verwendung von funktionellen Gruppen wie z. B. Ketone,
Ester, Säuren, Aldehyde, Nitrile (vgl. z. B.
Tanaka
et al. J. Med. Chem. 41, 2390–2410, 1998 und die
darin zitierte Literatur). Reaktionsschema
6
-
Erfindungsgemäße
Verbindungen der Formel (I-za) lassen sich herstellen, indem man
die Carbonsäure in Verbindung A-11 aktiviert und diese
Verbindung dann mit dem Amin A-12 gegebenenfalls in Gegenwart eines
Kupplungsreagens und eines basischen Reaktionshilfsmittels umsetzt.
Kupplungsreagenzien, die sich zur Herstellung einer Ester- oder
Amidbindung eignen, sind bekannt (vgl. z. B.
Bodansky et
al., Peptide Synthesis 2nd ed. Wiley & Sons, New York 1976 oder
Gross,
Meienhofer, The Peptides: Analysis, Synthesis, Biology (Academic
Press, New York 1979). Reaktionsschema
7
-
Erfindungsgemäße
Verbindungen der Formel (I-za) lassen sich ebenfalls über
eine Kupplungsreaktion darstellen, und zwar durch das Umsetzen von
einer Verbindung A-10, wobei Hal für Brom oder Iod steht,
mit einem Amin A-12 und Kohlenmonoxid unter Palladium Katalyse.
-
Geeignete
Palladium-Katalysatoren enthalten Palladium in den Oxidationsstufen
0 oder 2 (z. B. [Tetrakis(triphenylphosphin)palladium(0)], PdCl
2(PPh
3)
2,
Pd(PPh
3)
4, Pd(C
5H
7O
2)
2, [Palladium(II)acetylacetonat], Pd
2(dba)
3, [Tris(dibenzylidenaceton)dipalladium(0)]
und [1,1'-Bis(diphenylphosphino)ferrocene]dichloropalladium(II)).
Die Durchführung der Reaktion nach Reaktionsschema 7 verläuft
bevorzugt in flüssiger Phase, weshalb besonders solche
Palladium-Katalysatoren geeignet sind, die eine gute Löslichkeit
in der flüssigen Phase des Reaktionsgemisches haben. Bevorzugte
Lösungsmittel zur Durchführung der Reaktion nach
Reaktionsschema 7 sind Ether (z. B. 1,2-Dimethoxyethan) Amide (z.
B. N,N-Dimethylformamid) und nichthalogenierte aromatische Kohlenwasserstoffe
(z. B. Toluol). Die Reaktionstemperatur zur Durchführung
der Reaktion gemäß Reaktionsschema 7 kann im Bereich
von 25°C bis 150°C, bevorzugt im Bereich von 60°C
bis 110°C erfolgen. Allgemeine Methoden zur Durchführungen
von Aminocarbonylierungsreaktionen unter Verwendung von Arylbromiden
und Aminen sind literaturbekannt (vgl.
J. J. Li, G. W. Gribble
(Eds.) Palladium in Heterocyclic Chemistry: A Guide for the Synthetic
Chemist, Elsevier, Oxford, UK, 2000). Reaktionsschema
8
-
Verbindungen
der Formel I-zb, wobei R10 bevorzugt für
Methyl oder Ethyl steht, lassen sich durch Esterspaltung des Carbonsäureester
in die Verbindung A-11 überführen. Die Esterspaltung
kann mit allen bekannten Verfahren durchgeführt werden;
beispielsweise durch Umsetzung von (I-zb) mit wässriger
Lithiumhydroxid-Lösung in Tetrahydrofuran und anschliessendem
Ansäuern.
-
Es
ist bekannt, dass manche Reaktionen und Herstellungsverfahren besonders
gut in Gegenwart von Verdünnungs- bzw. Lösungsmittel
und basischer oder saurer Reaktionshilfsmitteln durchführbar
sind. Mischungungen der Verdünnungs- bzw. Lösungsmittel
sind ebenfalls einsetzbar. Die Verdünnungs- bzw. Lösungsmittel
werden vorteilhafterweise in einer solchen Menge eingesetzt, dass
das Reaktionsgemisch während des ganzen Verfahrens gut
rührbar ist.
-
Als
Verdünnungs- bzw. Lösungsmittel zur Durchführung
der erfindungsgemäßen Verfahren kommen grundsätzlich
alle unter den spezifischen Reaktionsbedingungen inerten organischen
Lösungsmittel in Frage. Als Beispiele sind zu nennen: Halogenkohlenwasserstoffe
(z. B. Chlorkohlenwasserstoffe, wie Tetraethylen, Tetrachlorethan,
Dichlorpropan, Methylenchlorid, Dichlorbutan, Chloroform, Tetrachlorkohlenstoff,
Trichlorethan, Trichlorethylen, Pentachlorethan, Difluorbenzol,
1,2-Dichlorethan, Chlorbenzol, Brombenzol, Dichlorbenzol, Chlortoluol,
Trichlorbenzol), Alkohole (z. B. Methanol, Ethanol, Isopropanol,
Butanol), Ether (z. B. Ethylpropylether, Methyl-tert-butylether,
n-Butylether, Anisol, Phenetol, Cyclohexylmethylether, Dimethylether,
Diethylether, Diproplether, Diisopropylether, Di-n-butylether, Diisobutylether,
Diisoamylether, Ethylenglycoldimethylether, Tetrahydrofuran, Dioxan,
Dichlordiethylether und Polyether des Ethylenoxids und/oder Propylenoxids),
Amine (z. B. Trimethyl-, Triethyl-, Tripropyl-, Tributylamin, N-Methylmorpholin,
Pyridin und Tetramethylendiamin), Nitrokohlenwasserstoffe (z. B.
Nitromethan, Nitroethan, Nitropropan, Nitrobenzol, Chlornitrobenzol,
o-Nitrotoluol; Nitrile wie Acetonitril, Propionitril, Butyronitril,
Isobutyronitril, Benzonitril, m-Chlorbenzonitril), Tetrahydrothiophendioxid,
Dimethylsulfoxid, Tetramethylensulfoxid, Dipropylsulfoxid, Benzylmethylsulfoxid, Diisobutylsulfoxid,
Dibutylsulfoxid, Diisoamylsulfoxid, Sulfone (z. B. Dimethyl-, Diethyl-,
Dipropyl-, Dibutyl-, Diphenyl-, Dihexyl-, Methylethyl-, Ethylpropyl-,
Ethylisobutyl- und Pentamethylensulfon), aliphatische, cycloaliphatische
oder aromatische Kohlenwasserstoffe (z. B. Pentan, Hexan, Heptan,
Oktan, Nonan und technische Kohlenwasserstoffe), ferner sogenannte ”White
Spirits” mit Komponenten mit Siedepunkten im Bereich von beispielsweise
40°C bis 250°C, Cymol, Benzinfraktionen innerhalb
eines Siedeinterwalles von 70°C bis 190°C, Cyclohexan,
Methylcyclohexan, Petrolether, Ligroin, Octan, Benzol, Toluol, Chlorbenzol,
Brombenzol, Nitrobenzol, Xylol, Ester (z. B. Methyl-, Ethyl-, Butyl-,
Isobutylacetat, Dimethyl-, Dibutyl-, Ethylencarbonat); Amide (z.
B. Hexamethylenphosphorsäuretriamid, Formamid, N-Methylformamid,
N,N-Dimethyl-formamid, N,N-Dipropyl-formamid, N,N-Dibutyl-formamid,
N-Methylpyrrolidin, N-Methyl-caprolactam, 1,3-Dimethyl-3,4,5,6-tetrahydro-2(1H)-pyrimidin,
Octylpyrrolidon, Octylcaprolactam, 1,3-Dimethyl-2-imidazolindion,
N-Formyl-piperidin, N,N'-1,4-Diformyl-piperazin) und Ketone (z.
B. Aceton, Acetophenon, Methylethylketon, Methylbutylketon).
-
Als
basische Reaktionshilfsmittel zur Durchführung der erfindungsgemäßen
Verfahren können alle geeigneten Säurebindemittel
eingesetzt werden. Als Beispiele sind zu nennen Erdalkali- oder
Alkalimetallverbindungen (z. B. Hydroxide, Hydride, Oxide und Carbonate
des Lithiums, Natriums, Kaliums, Magnesiums, Calciums und Bariums),
Amidinbasen oder Guanidinbasen (z. B. 7-Methyl-1,5,7-triaza-bicyclo(4.4.0)dec-5-en (MTBD);
Diazabicyclo(4.3.0)nonen (DBN), Diazabicyclo(2.2.2)octan (DABCO),
1,8-Diazabicyclo(5.4.0)undecen (DBU), Cyclohexyltetrabutyl-guanidin
(CyTBG), Cyclohexyltetramethylguanidin (CyTMG), N,N,N,N-Tetramethyl-1,8-naphthalindiamin,
Pentamethylpiperidin) und Amine, insbesondere tertiäre
Amine, (z. B. Triethylamin, Trimethylamin, Tribenzylamin, Triisopropylamin,
Tributylamin, Tricyclohexylamin, Triamylamin, Trihexylamin, N,N-Dimethylanilin,
N,N-Dimethyl-toluidin, N,N-Dimethyl-p-aminopyridin, N-Methyl-pyrrolidin,
N-Methyl-piperidin, N-Methyl-imidazol, N-Methyl-pyrazol, N-Methyl-morpholin,
N-Methyl-hexamethylendiamin, Pyridin, 4-Pyrrolidinopyridin, 4-Dimethylamino-Pyridin,
Chinolin, α-Picolin, β-Picolin, Isochinolin, Pyrimidin,
Acridin, N,N,N',N'-Tetramethylendiamin, N,N,N',N'-Tetraethylendiamin,
Chinoxalin, N-Propyl-diisopropylamin, N-Ethyl-diisopropylamin, N,N'-Dimethyl-cyclohexylamin,
2,6-Lutidin, 2,4-Lutidin oder Triethyldiamin).
-
Als
saure Reaktionshilfsmittel zur Durchführung der erfindungsgemäßen
Verfahren können alle Mineralsäuren (z. B. Halogenwasserstoff-säuren
wie Fluorwasserstoffsäure, Chlorwasserstoffsäure,
Bromwasserstoffsäure oder Iodwasserstoffsäure
sowie Schwefelsäure, Phosphorsäure, Phosphorige
Säure, Salpetersäure), Lewis Säuren (z.
B. Aluminium(III)-chlorid, Bortrifluorid oder sein Etherat, Titan(V)chlorid,
Zinn(V)-chlorid, und organische Säuren (z. B. Ameisensäure,
Essigsäure, Propionsäure, Malonsäure,
Milchsäure, Oxalsäure, Fumarsäure, Adipinsäure,
Stearinsäure, Weinsäure, Ölsäure,
Methansulfonsäure, Benzoesäure, Benzolsul-fonsäure
oder para-Toluolsulfonsäure eingesetzt werden.
-
Sofern
in den Reaktionsschemata Schutzgruppen vorgesehen sind, können
alle allgemein bekannten Schutzgruppen verwendet werden. Insbesondere
solche, die von Greene T. W., Wuts P. G. W. in Protective Groups
in Organic Synthesis; John Wiley & Sons, Inc. 1999, „Protection
for the hydroxyl group including 1,2- and 1,3-diols" beschrieben
sind.
-
Weiterhin
eignen sich auch Schutzgruppen
-
- vom Typ eines substituierten Methylethers (z. B. Methoxymethylether
(MOM), Methylthiomethylether (MTM), (Phenyl-dimethylsilyl)methoxymethylether
(SNOM-OR), Benzyloxymethylether (BOM-OR) para-Methoxybenzyloxymethylether
(PMBM-OR), para-Nitrobenzyloxymethyl-ether, ortho-Nitrobenzyloxymethylether (NBOM-OR),
(4-Methoxyphenoxy)-methylether (p-AOM-OR), Guaiacolmethylether (GUM-OR),
tert-Butoxymethylether, 4-Pentyloxy-methylether (POM-OR), Silyloxymethylether,
2-Methoxyethoxy-methylether (MEM-OR), 2,2,2-Trichlorethoxymethylether,
Bis(2-chlorethoxy)methylether, 2-(Trimethyl-silyl)ethoxymethylether
(SEM-OR), Methoxymethylether (MM-OR)),
- vom Typ eines substituierten Ethylethers (z. B. 1-Ethoxyethylether
(EE-OR), 1-(2-Chlorethoxy)ethylether (CEE-OR), 1-[2-(Trimethylsilyl)ethoxy]ethylether
(SEE-OR), 1-Methyl-1-methoxyethylether (MIP-OR), 1-Methyl-1-benzyloxyethylether
(MBE-OR), 1-Methyl-1-benzyloxy-2-fluor-ethylether (MIP-OR), 1-Methyl-1-phenoxyethylether,
2,2,-Trichlorethylether, 1,1-Dianisyl-2,2,2-trichlorethylether (DATE-OR),
1,1,1,3,3,3-Hexafluor-2-phenylisopropylether (HIP-OR), 2-Trimethylsilylethylether,
2-(Benzylthio)ethylether, 2-(Phenylselenyl)ethylether), eines Ethers
(z. B. Tetrahydropyranylether (THP-OR), 3-Brom-tetrahydropyranylether (3-BrTHP-OR),
Tetrahydrothiopyranylether, 1-Methoxy-cyclohexylether, 2- und 4-Picolylether,
3-Methyl-2-picolyl-N-oxido-ether, 2-Quinolinylmethylether (Qm-OR),
1-Pyrenylmethylether, Dipenylmethylether (DPM-OR), para,para'-Dinitrobenzhydrylether
(DNB-OR), 5-Dibenzosuberylether, Triphenylmethylether (Tr-OR), alpha-Naphthyldiphenylmethylether,
para-Methoxy-phenyldiphenylmethylether (MMTrOR), Di(para-methoxy-phenyl)phenylmethylether
(DMTr-OR), Tri(para-methoxy-phenyl)phenylmethylether (TMTr-OR), 4-(4'-Brom-phenacyloxy) phenyldiphenylmethylether,
4,4',4''-Tris(4,5-dichlorphthalimido-phenyl)methylether (CPTr-OR),
4,4',4''-Tris(benzoyloxyphenyl)-methylether (TBTr-OR), 4,4'-Dimethoxy-3''-[N-(imidazolylmethyl)]-tritylether
(IDTr-OR), 4,4'-Dimethoxy-3''-[N-(imidazolylethyl)carbamoyl]tritylether
(IETr-OR), 1,1-Bis(4-methoxy-phenyl)-1'-pyrenyl-methylether (Bmpm-OR),
9-Anthrylether, 9-(9-Phenyl)xanthenylether (Pixyl-OR), 9-(9-Phenyl-10-oxo)anthryl
(Tritylon-Ether), 4-Methoxy-tetrahydropyranylether (MTHP-OR), 4-Methoxytetrahydrothiopyranylether,
4-Methoxy-tetrahydrothiopyranyl-S,S-dioxid, 1-[(2-Chlor-4-methyl)phenyl]-4-methoxypiperidin-4-yl-ether
(CTMP-OR), 1-(2-Fluorphenyl)-4-methoxypiperidin-4-yl-ether (Fpmp-OR), 1,4-Dioxan-2-yl-ether,
Tetrahydrofuranylether, Tetrahydrothiofuranylether, 2,3,3a,4,5,6,7,7a-Octahydro-7,8,8-trimethyl-4,7-methanbenzofuran-2-yl-ether
(MBF-OR), tert-Butylether, Allylether, Propargylether, para-Chlor-phenylether,
para-Methoxy-phenylether, para-Nitro-phenylether, para-2,4-Dinitro-phenylether (DNP-OR),
2,3,5,6-Tetrafluor-4-(trifluormethyl)phenylether, Benzylether (Bn-OR)),
- vom Typ eines sustituierten Benzylethers (z. B. para-Methoxy-benzylether
(MPM-OR), 3,4-Dimethoxy-benzylether (DMPM-OR), ortho-Nitro-benzylether,
para-Nitro-benzylether, para-Halobenzylether, 2,6-Dichlor-benzylether,
para-Aminoacyl-benzylether (PAB-OR), para-Azidobenzylether (Azb-OR),
4-Azido-3-chlor-benzylether, 2-Trifluormethyl-benzylether, para(Methylsulfinyl)benzylether
(Msib-OR)),
- vom Typ eines Silylethers (z. B. Trimethylsilylether (TMS-OR),
Triethylsilylether (TES-OR), Triisopropylsilylether (TIPS-OR), Dimethylisopropylsilylether
(IPDMS-OR), Diethylisopropylsilylether (DEIPS-OR), Dimethylhexylsilylether
(TDS-OR), tert-Butyldimethylsilylether (TBDMS-OR), tert-Butyldiphenylsilylether(TBDPS-OR),
Tribenzylsilylether, Tri-para-xylylsilylether, Triphenylsilylether
(TPS-OR), Diphenylmethylsilylether (DPMS-OR), Di-tert-butylmethylsilylether
(DTBMS-OR), Tris(trimethylsilyl)silylether (Sisylether), Di-tert-butylmethylsilylether
(DTBMS-OR), Tris(trimethylsilyl)silylether (Sisylether), (2-Hydroxystyryl)-dimethylsilylether
(HSDMS-OR), (2-Hydroxystyryl)diisopropylsilylether (HSDIS-OR), tert-Butylmethoxyphenyl-silylether
(TBMPS-OR), tert-Butoxydiphenylsilylether (DPTBOS-OR)),
- vom Typ eines Esters (z. B. Formiatester, Benzoylformiatester,
Acetatester (Ac-OR), Chloracetatester, Dichloracetatester, Trichloracetatester,
Trifluoracetatester, (TFA-OR), Methoxyacetatester, Triphenylmethoxyacetatester,
Phenoxyacetatester, para-Chlorphenoxyacetatester, Phenylacetatester,
Diphenylacetatester (DPA-OR), Nicotinatester, 3-Phenylpropionatester,
4-Pentoatester, 4-Oxo-pentoatester (Levulinate) (Lev-OR) 4,4-(Ethylendithio)pentanoatester
(LevS-OR), 5-[3-Bis(4-methoxyphenyl)hydroxy-methoxyphenoxy]-levulinatester,
Pivaloatester (Pv-OR), 1-Adamantanoatester, Crotonatester, 4-Methoxy-crotonatester, Benzoatester (Bz-OR),
para-Phenyl-benzoatester, 2,4,6-Trimethyl-benzoatester (Mesitoate),
4-(Methylthiomethoxy)-butyratester (MTMB-OR), 2-(Methylthiomethoxymethyl)-benzoatester
(MTMT-OR),
- vom Typ eines Esters (z. B. Methylcarbonat, Methoxymethylcarbonat,
9-Fluorenylmethylcarbonat (Fmoc-OR), Ethylcarbonat, 2,2,2-Trichlorethylcarbonat
(Troc-OR), 1,1-Dimethyl-2,2,2-trichlorethylcarbonat (TCBOC-OR), 2-(Trimethylsilyl)ethylcarbonat
(TMSEC-OR), 2-(Phenylsulfonyl)ethylcarbonat (Psec-OR), 2-(Triphenylphosphonio)-ethylcarbonat
(Peoc-OR), tert-Butylcarbonat (Boc-OR), Isobutylcarbonat, Vinylcarbonat,
Allylcarbonat (Alloc-OR), para-Nitro-phenylcarbonat, Benzylcarbonat
(Z-OR), para-Methoxy-benzylcarbonat, 3,4-Dimethoxy-benzylcarbonat,
ortho-Nitro-benzylcarbonat, para-Nitro-benzylcarbonat, 2-Dansylethylcarbonat
(Dnseoc-OR), 2-(4-Nitrophenyl)ethylcarbonat (Npeoc-OR), 2-(2,4-Dinitrophenyl)ethylcarbonat
(Dnpeoc)), und vom Typ eines Sulfats (z. B. Allylsulfonat (Ms-OR),
Methansulfonat (Ms-OR), Benzylsulfonat, Tosylat (Ts-OR), 2-[(4-Nitrophenyl)ethyl]sulfonat
(Npes-OR)).
-
Als
Katalysatoren zur Durchführung einer katalytischen Hydrierung
im erfindungsgemäßen Verfahren sind alle üblichen
Hydrierkatalysatoren, wie beispielsweise Platin-Katalysatoren (z.
B. Platin-Platte, Platin-Schwamm, Platin-Schwarz, kolloidales Platin,
Platinoxid, Platindraht), Palladium-Katalysatoren (z. B. Palladium-Schwamm,
Palladium-Schwarz, Palladiumoxid, Palladium-Kohle, kolloidales Palladium,
Palladium-Bariumsulfat, Palladium-Bariumcarbonat, Palladium-Hydroxid,
Nickel-Katalysatoren (z. B. reduziertes Nickel, Nickeloxid, Raney-Nickel),
Ruthenium-Katalysatoren, Cobalt-Katalysatoren (z. B. reduziertes
Cobalt, Raney-Cobalt), Kupfer-Katalysatoren (z. B. reduziertes Kupfer,
Raney-Kupfer, Ullmann-Kupfer) geeignet. Bevorzugt werden Edelmetalllkatalysatoren
(z. B. Platin- und Palladium- oder Ruthenium-Katalysatoren) verwendet,
die gegebenenfalls auf einem geeigneten Träger (z. B. Kohlenstoff
oder Silizium) aufgebraucht sind, Rhodium-Katalysatoren (z. B. Tris(triphenylphosphin)rhodium(I)-chlorid
in Gegenwart von Triphenylphosphin). Ferner können ”chiralen
Hydrierkatalysatoren” (z. B. solche die chirale Diphosphinliganden
enhalten wie (2S,3S)-(–)-2,3-Bis(diphenylphosphino)-butan
[(S,S)-Chiraphos] oder (R)-(+)-2,2'- bzw. (S)-(–)-2,2'-Bis(diphenylphosphino)-1,1'-binaphthalin
[R(+)-BINAP bzw. S(–)-BINAP]) verwendet werden, wodurch
der Anteil eines Isomers im Isomerengemisch erhöht wird
bzw. das Entstehen eines anderen Isomers (vollständig)
unterdrückt wird.
-
Die
Herstellung von Salzen der erfindungsgemäßen Verbindungen
erfolgt nach Standardverfahren. Representative Säureadditionssalze
sind beispielsweise solche die durch Reaktion mit anorganischen
Säuren, wie beispielsweise Schwefelsäure, Salzsäure,
Bromwasserstoffsäure, Phosphorsäure oder organischen
Carbonsäuren wie Essigsäure, Trifluoressigsäure,
Zitronensäure, Bernsteinsäure, Buttersäure,
Milchsäure, Ameisensäure, Fumarsäure,
Maleinsäure, Malonsäure, Camphersäure,
Oxalsäure, Phthalsäure, Propionsäure, Glycolsäure,
Glutarsäure, Stearinsäure, Salicylsäure,
Sorbinsäure, Weinsäure, Zimtsäure, Valeriansäure,
Pikrinsäure, Benzoesäure oder organischen Sulfonsäuren
wie Methansulfonsäure und 4-Toluolsulfonsäure
gebildet werden.
-
Representativ
sind auch Salze von erfindungsgemäßen Verbindungen,
die aus organischen Basen, wie beispielsweise Pyridin oder Triethylamine
gebildet werden, oder solche, die aus anorganischen Basen, wie beispielsweise
Hydride, Hydroxide oder Karbonate des Natriums, Lithiums, Calciums,
Magnesiums oder Bariums, gebildet werden, wenn die Verbindungen
der allgemeinen Formel (I) ein zu dieser Salzbildung geeignetes Strukturelement
aufweist.
-
Synthesemethoden
zur Darstellung heterocyclischer N-Oxide und tert-Aminen sind bekannt
bekannt. Sie können mit Peroxysäuren (z. B. Peressigsäure
und meta-Chlor-perbenzoesäure (MCPBA), Wasserstoffperoxid),
Alkylhydroperoxide (z. B. tert-Butylhydroperoxid), Natriumperborat
und Dioxiranen (z. B. Dimethyldioxiran) erhalten werden. Diese Methoden
sind beispielsweise von T. L. Gilchrist, in Comprehensive
Organic Synthesis, Vol. 7, S. 748–750, 1992, S. V. Ley,
(Ed.), Pergamon Press; M. Tisler, B. Stanovnik,
in Comprehensive Heterocyclic Chemistry, Vol. 3, S. 18–20,
1984, A. J. Boulton, A. McKillop, (Eds.), Pergamon Press; M.
R. Grimmett, B. R. T. Keene in Advances in Heterocyclic Chemistry,
Vol. 43, S. 149–163, 1988, A. R. Katritzky, (Ed.), Academic
Press; M. Tisler, B. Stanovnik, in Advances in
Heterocyclic Chemistry, Vol. 9, S. 285–291, 1968, A. R.
Katritzky, A. J. Boulton (Eds.), Academic Press; G.
W. H. Cheeseman, E. S. G. Werstiuk in Advances in Heterocyclic Chemistry,
Vol. 22, S. 390–392, 1978, A. R. Katritzky, A. J. Boulton,
(Eds.), Academic Press beschrieben.
-
ZITATE ENTHALTEN IN DER BESCHREIBUNG
-
Diese Liste
der vom Anmelder aufgeführten Dokumente wurde automatisiert
erzeugt und ist ausschließlich zur besseren Information
des Lesers aufgenommen. Die Liste ist nicht Bestandteil der deutschen
Patent- bzw. Gebrauchsmusteranmeldung. Das DPMA übernimmt
keinerlei Haftung für etwaige Fehler oder Auslassungen.
-
Zitierte Patentliteratur
-
- - WO 2008/013925 [0002]
- - WO 2008/013622 [0002]
- - JP 05247006 A [0002]
- - WO 2008/019760 [0128, 0130]
- - WO 2005/016862 [0130]
- - WO 89/08108 [0130]
- - WO 2006/060344 [0132]
- - WO 2006/034090 [0132]
- - WO 2007/060198 A1 [0132]
- - WO 2002/076950 A2 [0132]
- - WO 99/28300 [0132]
- - WO 2002/076950 [0132]
- - WO 2005/085228 [0132]
- - WO 2006/060346 [0132]
- - CH 2004196702 A [0140]
-
Zitierte Nicht-Patentliteratur
-
- - auch Houben-Weyl,
Methoden der Organischen Chemie, Band E5, „Nitriloxide”,
4. Auflage, 1965, G. Thieme Verlag, Stuttgart New York, S. 1591–1610 [0121]
- - G. A. Lee Synthesis 6, 508–509, 1982; S. Kanemasa
et al., Tetrahedron 56, 1057–1064, 2000 [0124]
- - Houben-Weyl, Methoden der Organischen Chemie, Band X/4, 4.
Auflage, 1968, G. Thieme Verlag, Stuttgart New York, S. 55; Band
14b, 4. Auflage, 1990, G. Thieme Verlag, Stuttgart New York, S.
287 [0127]
- - J. P. Freeman Chem. Rev. 73, 283–292, 1973 [0127]
- - A. Tanaka et al., J. Med. Chem. 41, 2390–2410, 1998 [0130]
- - P. Cozzi et al. J. Med. Chem. 36, 2964–2972, 1993 [0130]
- - Y. Ding et al., Bioorg. Med. Chem. Lett. 17, 814–815,
2007 [0130]
- - F. Zymalkowski, H. Rimek, J. Arch. Pharm. 294, 759–765,
1961 [0132]
- - M. Ohba, R. Izuta Heterocycles 55, 823–826, 2001 [0132]
- - D. Binder Monatshefte für Chemie 105, 203–208,
1974 [0132]
- - A. Gomtsyan et al., J. Med, Chem. 51, 392–395, 2008 [0132]
- - I. Pravst et al., Synthesis 18, 3140–46, 205 [0134]
- - I. Pravst et al. (2005) [0134]
- - R. Moughamir et al., Alpha-fluorination of ketones by F+ transfer
using a precursor of MnF4 in International Electronic Conference
an Synthetic Chemistry, 5th, 6th, Sept. 1–30, 2001 und
2002 und 7th, 8th, Nov. 1–30, 2003 und 2004, Ed. J. A.
Seijas; S. 243–249 (2004) [0135]
- - F. A. Davis et al., J. Org. Chem. 60, 4730–4737,
1995 [0135]
- - W. Ving et al., Tetrahedron 52, 15–22, 1996 [0135]
- - Ch. A. Ramsden, R. G. Smith Org. Lett. 1, 1591–1594,
1999 [0135]
- - Y. -D. Park et al., Synthesis 7, 1136–1140, 2005 [0136]
- - F. Bellesia et al., J. Chem. Res., Synopses 6, 188–189,
1990 [0136]
- - T. Tsuruta et al., Bull. Chem. Soc. Jap. 58, 142–145,
1985 [0136]
- - I. Pravst et al., Tetrahedron Lett. 47, 4707–4710,
2006 [0137]
- - A. Bekaert et al., Tetrahedron Lett. 46, 4187–4191,
2005 [0137]
- - C. R. Johnson, B. D. Tait J. Org. Chem. 52, 281–283,
1987 [0138]
- - „Julia-Kocienski Reaktionsbedingungen” C.
Aissa J. Org. Chem. 71, 360–363, 2006 [0138]
- - M. Barker et al., J. Med. Chem. 49, 4216–4231, 2006 [0138]
- - P. C. Lobben, L. A. Paquette J. Org. Chem. 63, 6990–6993,
1998 [0138]
- - B. Greedy et al., Angew. Chem. Int. Ed. 42, 3291–3294,
20057 [0140]
- - I. P. Chuikov et al., Izv. Akad. Nauk SSSR, Ser. Khim. 7,
1654–1660, 1988 [0140]
- - Cristau et al., Eur. J. Org. Chem. 695–709, 2004 [0141]
- - J. J. Li, G. W. Gribble (Eds.) Palladium in Heterocyclic Chemistry:
A Guide for the Synthetic Chemist, Elsevier, Oxford, UK, 2000) [0143]
- - Tanaka et al. J. Med. Chem. 41, 2390–2410, 1998 [0144]
- - Bodansky et al., Peptide Synthesis 2nd ed. Wiley & Sons, New York
1976 [0145]
- - Gross, Meienhofer, The Peptides: Analysis, Synthesis, Biology
(Academic Press, New York 1979 [0145]
- - J. J. Li, G. W. Gribble (Eds.) Palladium in Heterocyclic Chemistry:
A Guide for the Synthetic Chemist, Elsevier, Oxford, UK, 2000 [0147]
- - Greene T. W., Wuts P. G. W. in Protective Groups in Organic
Synthesis [0153]
- - John Wiley & Sons,
Inc. 1999, „Protection for the hydroxyl group including
1,2- and 1,3-diols” [0153]
- - T. L. Gilchrist, in Comprehensive Organic Synthesis, Vol.
7, S. 748–750, 1992, S. V. Ley, (Ed.), Pergamon Press [0158]
- - M. Tisler, B. Stanovnik, in Comprehensive Heterocyclic Chemistry,
Vol. 3, S. 18–20, 1984, A. J. Boulton, A. McKillop, (Eds.),
Pergamon Press [0158]
- - M. R. Grimmett, B. R. T. Keene in Advances in Heterocyclic
Chemistry, Vol. 43, S. 149–163, 1988, A. R. Katritzky,
(Ed.), Academic Press [0158]
- - M. Tisler, B. Stanovnik, in Advances in Heterocyclic Chemistry,
Vol. 9, S. 285–291, 1968, A. R. Katritzky, A. J. Boulton
(Eds.), Academic Press [0158]
- - G. W. H. Cheeseman, E. S. G. Werstiuk in Advances in Heterocyclic
Chemistry, Vol. 22, S. 390–392, 1978, A. R. Katritzky,
A. J. Boulton, (Eds.), Academic Press [0158]