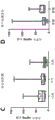CN114040730A - 脱细胞肌腱基质方法及其用途 - Google Patents
脱细胞肌腱基质方法及其用途 Download PDFInfo
- Publication number
- CN114040730A CN114040730A CN201980092758.3A CN201980092758A CN114040730A CN 114040730 A CN114040730 A CN 114040730A CN 201980092758 A CN201980092758 A CN 201980092758A CN 114040730 A CN114040730 A CN 114040730A
- Authority
- CN
- China
- Prior art keywords
- tendon
- matrix
- dtm
- decellularized
- composition
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/36—Materials for grafts or prostheses or for coating grafts or prostheses containing ingredients of undetermined constitution or reaction products thereof, e.g. transplant tissue, natural bone, extracellular matrix
- A61L27/3683—Materials for grafts or prostheses or for coating grafts or prostheses containing ingredients of undetermined constitution or reaction products thereof, e.g. transplant tissue, natural bone, extracellular matrix subjected to a specific treatment prior to implantation, e.g. decellularising, demineralising, grinding, cellular disruption/non-collagenous protein removal, anti-calcification, crosslinking, supercritical fluid extraction, enzyme treatment
- A61L27/3687—Materials for grafts or prostheses or for coating grafts or prostheses containing ingredients of undetermined constitution or reaction products thereof, e.g. transplant tissue, natural bone, extracellular matrix subjected to a specific treatment prior to implantation, e.g. decellularising, demineralising, grinding, cellular disruption/non-collagenous protein removal, anti-calcification, crosslinking, supercritical fluid extraction, enzyme treatment characterised by the use of chemical agents in the treatment, e.g. specific enzymes, detergents, capping agents, crosslinkers, anticalcification agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/02—Prostheses implantable into the body
- A61F2/08—Muscles; Tendons; Ligaments
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/32—Bones; Osteocytes; Osteoblasts; Tendons; Tenocytes; Teeth; Odontoblasts; Cartilage; Chondrocytes; Synovial membrane
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/48—Reproductive organs
- A61K35/52—Sperm; Prostate; Seminal fluid; Leydig cells of testes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/36—Materials for grafts or prostheses or for coating grafts or prostheses containing ingredients of undetermined constitution or reaction products thereof, e.g. transplant tissue, natural bone, extracellular matrix
- A61L27/3641—Materials for grafts or prostheses or for coating grafts or prostheses containing ingredients of undetermined constitution or reaction products thereof, e.g. transplant tissue, natural bone, extracellular matrix characterised by the site of application in the body
- A61L27/3645—Connective tissue
- A61L27/3662—Ligaments, tendons
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/50—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L27/52—Hydrogels or hydrocolloids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/50—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L27/54—Biologically active materials, e.g. therapeutic substances
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/40—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices characterised by a specific therapeutic activity or mode of action
- A61L2300/404—Biocides, antimicrobial agents, antiseptic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/40—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices characterised by a specific therapeutic activity or mode of action
- A61L2300/412—Tissue-regenerating or healing or proliferative agents
- A61L2300/414—Growth factors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2430/00—Materials or treatment for tissue regeneration
- A61L2430/10—Materials or treatment for tissue regeneration for reconstruction of tendons or ligaments
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2430/00—Materials or treatment for tissue regeneration
- A61L2430/40—Preparation and treatment of biological tissue for implantation, e.g. decellularisation, cross-linking
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Engineering & Computer Science (AREA)
- Biomedical Technology (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Transplantation (AREA)
- Oral & Maxillofacial Surgery (AREA)
- Dermatology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Botany (AREA)
- Molecular Biology (AREA)
- Rheumatology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Vascular Medicine (AREA)
- Rehabilitation Therapy (AREA)
- Cell Biology (AREA)
- General Chemical & Material Sciences (AREA)
- Dispersion Chemistry (AREA)
- Reproductive Health (AREA)
- Biotechnology (AREA)
- Developmental Biology & Embryology (AREA)
- Immunology (AREA)
- Virology (AREA)
- Zoology (AREA)
- Pharmacology & Pharmacy (AREA)
- Heart & Thoracic Surgery (AREA)
- Cardiology (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Materials For Medical Uses (AREA)
- Surgical Instruments (AREA)
Abstract
提供了制备脱细胞的的肌腱基质(DTM)和DTM水凝胶的方法。这些组合物和水凝胶可以用于修复肌腱损伤且在某些情况下可以通过注射、关节镜操作或作为传统外科修复的附属物使用。
Description
对相关申请的交叉引用
本申请是要求2018年12月20日提交的美国临时申请No. 62/782,903和2019年8月23日提交的美国临时申请No. 62/890,865的权益的国际申请,它们各自通过引用以其整体并入本文。
发明领域
本文所述的发明一般涉及脱细胞肌腱基质,以及制备和使用脱细胞肌腱基质的方法。
发明背景
再生医学是一门新兴学科,已经确定了细胞外基质材料的许多用途。肌腱是连接肌肉和骨骼的纤维结缔组织。肌肉和肌腱之间的连接被称为肌腱连接或肌腱-肌肉插入点;肌腱和骨骼之间的连接被称为骨腱连接。这也称为肌腱插入或肌腱末端,并且这里的疾病称为肌腱末端病。后一种连接,即肌腱和骨骼之间的连接(肌腱胶原纤维插入骨基质之处)是肌腱损伤的常见位置。通常这些损伤是由于过度使用、内源性肌腱变性(肌腱病变)或跌打损伤引起的。
肌腱损伤导致特征明确的细胞和组织变化,它们共同导致肌腱生物力学特性的改变。例如,Arya和Kulig, J. Appl. Physiol. 108:670-675 (2010)。过度使用、内源性变性或外伤造成的损伤可能表现为肌腱撕裂。撕裂按严重程度分类,从一级轻微撕裂,到二级中度至重度撕裂,且最后是三级完全撕裂。它们还以其它方式分类,例如部分或完全,在身体的不同解剖区域,如肩袖、跟腱、四头肌腱、二头肌腱等。
撕裂通常需要手术干预。在一些方面,本发明提供了生产用于修复包括撕裂在内的肌腱损伤的组合物的方法。
此外,本发明的组合物诱导组织再生,其加速肌腱再生长、肌腱愈合或天然肌腱插入骨的重建。本发明的方法保留存在于细胞外基质中的内源性生长因子并提供用于肌腱再生、愈合和/或修复的组合物。
发明概述
在一个方面,本发明提供了一种生产组合物的方法,该组合物包含基质金属蛋白酶(MMP)和/或胶原酶消化的肌腱组织、抗微生物剂和无菌水性载体溶液。
在另一个方面,本发明提供了脱细胞肌腱基质(DTM)组合物,其中所述DTM组合物通过包括以下步骤的方法制备: (i) 切碎肌腱组织样品; (ii) 将切碎的肌腱组织样品脱细胞; (iii) 研磨; (iv) 消化; (v) 停止和中和; (vi) 洗涤; 和 (vii) 冻干。
在一个方面, 本发明提供了用于制备保存生长因子的脱细胞肌腱基质的方法。
在一些实施方案中,本公开内容提供了脱细胞肌腱基质(DTM)组合物,其包含基质金属蛋白酶(MMP)消化的肌腱组织。在一些实施方案中,本公开内容提供了脱细胞肌腱基质(DTM)组合物,其包含胶原酶消化的肌腱组织。在一些实施方案中,所述组合物包含胶原蛋白消化物。在一些实施方案中,所述组合物进一步包含抗微生物剂。在一些实施方案中,所述组合物进一步包含无菌水性载体溶液。在一些实施方案中,所述脱细胞肌腱基质(DTM)是保留至少50%存在于切碎的肌腱组织中的生长因子的蛋白。在一些实施方案中,所述组合物是可模制的。在一些实施方案中,所述组合物能够基本上粘附到解剖形貌。
在一些实施方案中,本公开内容还提供了制备脱细胞肌腱基质(DTM)组合物的方法,所述方法包括一个或多个选自以下的步骤: 切碎肌腱组织样品; 将切碎的肌腱组织样品脱细胞; 研磨; 消化; 停止和中和; 洗涤;和冻干。在一些实施方案中,所述方法包括用选自MMP-2、MMP-9、MMP-14或其组合的基质金属蛋白酶(MMP)消化。在一些实施方案中,所述方法包括用本文所述的胶原酶消化。在一些实施方案中,所述方法包括用本文所述的DNA酶脱细胞。
本公开内容还提供了脱细胞肌腱基质(DTM)组合物,其中所述DTM组合物通过包括一个或多个选自以下的步骤的方法制备: 切碎肌腱组织样品; 将切碎的肌腱组织样品脱细胞; 消化;和冻干。 在一些实施方案中,本公开内容提供了脱细胞肌腱基质(DTM)组合物,其中所述DTM组合物通过包括一个或多个选自以下的步骤的方法制备: 切碎肌腱组织样品;将切碎的肌腱组织样品脱细胞; 研磨; 消化;停止; 中和; 洗涤;和冻干。 在一些实施方案中,所述脱细胞的步骤包括将切碎的肌腱组织样品暴露于包含一种或多种选自离液盐、非离子去污剂、两性离子去污剂、阳离子去污剂、阴离子去污剂或其组合的组分的溶液。在一些实施方案中,所述脱细胞的步骤包括将切碎的肌腱组织样品暴露于DNA酶、RNA酶或其组合。在一些实施方案中,所述脱细胞的步骤包括将切碎的肌腱组织样品暴露于DNA酶。在一些实施方案中,所述消化步骤包括用包含基质金属蛋白酶(MMP)的溶液消化。在一些实施方案中,所述基质金属蛋白酶(MMP)选自MMP-2、MMP-9、MMP-14或其组合。 在一些实施方案中,所述停止和/或中和步骤包括用包含一种或多种蛋白酶抑制剂的溶液停止和/或中和,所述一种或多种蛋白酶抑制剂选自 TAPI-0、TAPI-1、TAPI-2、马立马司他(marimastat)、膦酰二肽(phosphoramidon)、木犀草素、PMSF、胃酶抑素 A、亮抑酶肽、E-64、原钒酸钠或其组合。
本公开内容还提供了一种刺激肌腱再生的方法,所述方法包括一个或多个选自以下的步骤:将本文所述的DTM组合物重悬在药学上可接受的载体中;和将重悬的DTM组合物施用于需要刺激肌腱再生的肌腱部位。在一些实施方案中,重悬的DTM组合物是可模制的。在一些实施方案中,重悬的DTM组合物具有油灰稠度。在一些实施方案中,重悬的DTM组合物是凝胶。在一些实施方案中,重悬的DTM组合物是糊剂。在一些实施方案中,重悬的DTM组合物是触变的。在一些实施方案中,重悬的DTM组合物是粘弹性的。在一些实施方案中,重悬的DTM组合物是可注射的。在一些实施方案中,重悬的DTM组合物是可涂抹的。
本公开内容还提供了脱细胞肌腱基质(DTM)水凝胶,其包含本文所述的重悬的DTM组合物,以及1-乙基-3-[3-二甲基氨基丙基]碳二亚胺(EDC)和PEG-N-羟基琥珀酰亚胺(NHS)酯中的一种或多种。在一些实施方案中,所述水凝胶是可模制的。在一些实施方案中,所述水凝胶具有油灰稠度。在一些实施方案中,所述水凝胶是糊剂。在一些实施方案中,所述水凝胶是触变的。在一些实施方案中,所述水凝胶是粘弹性的。在一些实施方案中,所述水凝胶是可注射的。在一些实施方案中,所述水凝胶是可涂抹的。
本公开内容还提供了软铸脱细胞肌腱基质(DTM)物体,其中所述软铸物体通过包括以下一个或多个步骤的方法制备:将本文所述的脱细胞肌腱基质(DTM)组合物重悬在生理缓冲液中;将DTM组合物与PEG-N-羟基琥珀酰亚胺(NHS)酯混合以制备软水凝胶;将软水凝胶转移到三维模具中;固化聚合反应;和使聚合反应失活。
本公开内容还提供了脱细胞肌腱基质(DTM)水凝胶,其包含本文所述的重悬的DTM组合物,进一步包含1-乙基-3-[3-二甲基氨基丙基]碳二亚胺(EDC)和选自与(EDC)偶联剂连接的N-羟基琥珀酰亚胺(NHS)或N-羟基磺基琥珀酰亚胺(sulfoNHS)的水溶性偶联剂。
本公开内容还提供了一种在对象中治疗肌腱撕裂和/或刺激肌腱再生的方法, 所述方法包括以下一项或多项:获得脱细胞肌腱基质(DTM)组合物,其包含基质金属蛋白酶(MMP)或胶原酶消化的肌腱组织;将DTM组合物重悬于药学上可接受的载体中;和将重悬的DTM组合物施用于需要刺激肌腱再生的肌腱部位。
本公开内容还提供了一种由天然肌腱产生的脱细胞肌腱基质,所述脱细胞肌腱基质包含大于90重量%的天然肌腱中的TGF-β。在一些实施方案中,所述脱细胞肌腱基质包含大于95重量%的天然肌腱中的TGF-β。在一些实施方案中,所述脱细胞肌腱基质包含大于99重量%的天然肌腱中的TGF-β。在一些实施方案中,权利要求18-20中任一项的所述脱细胞肌腱基质,包含小于5重量%的天然肌腱中的细胞材料。在一些实施方案中,本文所述的脱细胞肌腱基质包含小于2重量%的天然肌腱中的细胞材料。在一些实施方案中,本文所述的脱细胞肌腱基质包含小于1重量%的天然肌腱中的细胞材料。在一些实施方案中,本文所述的脱细胞肌腱基质包含小于0.1重量%的天然肌腱中的细胞材料。在一些实施方案中,本文所述的脱细胞肌腱基质包含基本上不含产生TGF-β的细胞。在一些实施方案中,本文所述的脱细胞肌腱基质包含小于5重量%的天然肌腱中的DNA。 在一些实施方案中,本文所述的脱细胞肌腱基质包含小于2重量%的天然肌腱中的DNA。 在一些实施方案中,本文所述的脱细胞肌腱基质包含小于1重量%的天然肌腱中的DNA。 在一些实施方案中,本文所述的脱细胞肌腱基质包含小于0.1重量%的天然肌腱中的DNA。 在一些实施方案中,本文所述的脱细胞肌腱基质基本上不含DNA。
本公开内容还提供了一种从肌腱制备脱细胞肌腱基质(DTM)组合物的方法,所述方法包括以下一项或多项:使肌腱脱细胞从而产生脱细胞的肌腱;使脱细胞的肌腱与包含基质金属蛋白酶(MMP)的酶溶液接触以产生消化的、脱细胞的肌腱; 冻干消化的、脱细胞的肌腱以产生冻干的肌腱;和重构冻干的肌腱以产生脱细胞的肌腱基质。在一些实施方案中,所述方法包括使肌腱与DNA酶溶液接触。在一些实施方案中,所述 DNA酶溶液包含约10至约100单位的DNA酶/毫升的溶剂,约25 至约75单位的DNA酶/毫升的溶剂,约40至约60单位的DNA酶/毫升的溶剂,约40至约60单位的DNA酶/毫升的溶剂,或约50单位的DNA酶/毫升的溶剂。在一些实施方案中,所述脱细胞包括使肌腱与约4 毫升至约50 毫升的 DNA酶溶液/1克肌腱接触。在一些实施方案中,所述脱细胞包括使肌腱与约5 毫升至约10 毫升的DNA酶溶液/1克肌腱接触。在一些实施方案中,所述脱细胞包括使肌腱与约10 毫升至约50 毫升的DNA酶溶液/1克肌腱接触。在一些实施方案中,所述接触发生约1小时的时段,并且任选地在摇床上发生。在一些实施方案中,所述脱细胞进一步包括用磷酸盐缓冲盐水洗涤肌腱。在一些实施方案中,所述脱细胞进一步包括过滤肌腱。在一些实施方案中,所述冻干包括在-80℃冷冻消化的、脱细胞的肌腱至少约30分钟。在一些实施方案中,所述方法进一步包括使用在约1500G至约2500G之间的离心约1分钟至约15分钟过滤通过70微米过滤器。在一些实施方案中,所述 MMP 包含胶原酶。在一些实施方案中,所述胶原酶选自I型胶原酶、III型胶原酶及其组合。在一些实施方案中,酶溶液中I型胶原酶的浓度为约2 毫克/毫升。在一些实施方案中,酶溶液中III型胶原酶的浓度为约1毫克/毫升。在一些实施方案中,所述脱细胞的肌腱与约10 毫升至约50 毫升的酶溶液/1克肌腱接触。在一些实施方案中,所述脱细胞的肌腱与约5 毫升至约10 毫升的酶溶液/1克肌腱接触。在一些实施方案中,所述脱细胞的肌腱与酶溶液接触约24小时。在一些实施方案中,所述脱细胞的肌腱与酶溶液接触约12小时。在一些实施方案中,所述脱细胞的肌腱与酶溶液接触约1小时、约2小时、约3小时、约4小时、约5小时、约6小时、约7小时、约8小时、约9小时、约10小时、约11小时、约12小时、约13小时、约14小时、约15小时、约16小时、约17、约18小时、约19小时、约20小时、约21小时、约22小时、约23小时或约24小时。在一些实施方案中,所述脱细胞的肌腱与酶溶液在约37℃接触。在一些实施方案中,所述重构包括将约2微升至约5微升的溶剂与约1毫克冻干的肌腱混合。
附图的简要说明
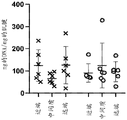
图1A-B示出了处理天然髌腱和跟腱之前肌腱中的DNA含量(图1A)和蛋白含量(图1B)的天然肌腱表征。测量结果描绘了来自总共6个供体的肌腱。
图2A-B示出了基于肌腱类型和位置的天然TGF-β浓度。示出了在天然肌腱样品(处理之前)中发现的TGF-β3浓度(图2A)和TGF-β1浓度(图2B)。
图3示出了使用DNA酶和去污剂脱细胞的比较。测量了在天然肌腱、用 DNA酶50U处理1小时的肌腱、用 DNA酶50U处理2小时的肌腱以及使用 SDS 或 EDTA 的传统脱细胞的方法处理的肌腱中的髌腱和跟腱二者中的 DNA 含量。
图4示出了使用各种酶试剂(包括C-1胶原酶I、C-3胶原酶III、C-1胶原酶I和C-3胶原酶III、以及胃蛋白酶)消化肌腱样品的肌腱总蛋白。
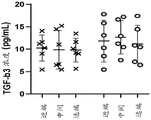
图5示出了将肌腱处理成脱细胞肌腱基质之前和之后的TGF-β浓度。通过对髌腱和跟腱二者的所有近端、中间质和远端部分进行平均来测量天然肌腱。
图6A-B示出了脱细胞肌腱基质处理促进具有从未拉伸的构象(图6B)拉伸(图6A)而不被扯断的能力的弹性特性。DTM 以无菌冻干粉的形式储存稳定,并可以重构成油灰或可注射溶液。此图象显示了DTM油灰,其可通过将冻干的DTM以3-5 ul/mg重悬而形成。该油灰是可塑的/可拉伸的,用于手术应用到所需的修复区域。
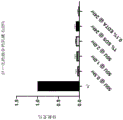
图7A-C示出了DNA酶处理有效地使肌腱组织脱细胞。使用不同浓度的DNA酶(10U、50U 和 100U)经1 小时使肌腱脱细胞。1X PBS用作无脱细胞的的对照。使用 DNEasy试剂盒(Qiagen)测定DNA浓度。该数据表明,低至50U的DNA酶就可以有效地使组织脱细胞。
图8示出了DNA酶处理在使肌腱脱细胞的方面与标准去污剂方法一样有效。将 50U的DNA酶与传统的去污剂、1% SDS和0.1% EDTA进行比较。DNA酶 50U在0.5小时、1 小时和 2小时时进行测试,而标准 SDS和EDTA方案要求进行 24 小时脱细胞。使用 DNEasy 试剂盒(Qiagen,n=3)测定 DNA 浓度。所有值均标准化为无脱细胞的。Tukey 的(Tukey's) HSD 多重比较事后检验显示 DNA酶处理或经DNA酶脱细胞的不同时间与 SDS 和 EDTA 之间相比没有显著差异。
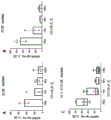
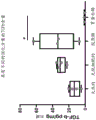
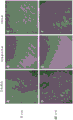
图9A-H示出了跟腱基质比髌腱具有更多的蛋白含量。将跟腱和髌腱分为由肌腱的近端、中心/中端和远端组成的1/3 部分。(A-D)使用 BCA 蛋白定量试剂盒 (ThermoScientific)测量天然肌腱的总蛋白。(E-H)使用 TGF-β磁珠面板 Milliplex 试剂盒(Millipore Sigma,#TGFBMAG-64K-03)测量 TGF-β。方差分析(ANOVA)显示肌腱区域之间没有统计学上的显著差异,因此整个肌腱可以通过处理使用。当比较两种不同的肌腱 (D) 时总蛋白没有差异 (P=0.93),但 (H) 跟腱中的 TGF-β 在统计学上高于髌腱 (P =0.0045)。
图10示出了过滤有效地消除了胶原酶活性。用胶原酶处理脱细胞的肌腱以改善DTM 的形状因子。100 kDa 过滤器在消除最终产品中的胶原酶活性方面非常有效。方差分析表明各组具有显著差异(F (4, 22) =18.06, p<0.0001)。重要的是,天然样品和 100kDa 过滤样品之间的胶原酶活性没有显著差异。
图11示出了DTM比用胃蛋白酶使肌腱脱细胞的标准方法保留了更多的生物活性。脱细胞后,使用含有 1(92.5 g肌腱/g 胶原酶 1)和 3(185 g肌腱/1 g Col 3) 型胶原酶的溶液或使用胃蛋白酶(根据先前公开的方法(Farnebo 等人 2014,PMID:24341855))消化肌腱。方差分析表明组间存在显著差异,F (3,11) =5.056, p=0.0193。Tukey的HSD事后显示胃蛋白酶具有显著更少的 TGF-β(P= 0.0249)。
图12A-C示出了铺在不同表面上的细胞增殖的差异。组织培养板未经处理(对照,“TC 处理”)、用胶原蛋白或用 DTM 涂布。原代肌腱细胞(ZenBio #TEN-F)以 20,000 个细胞/孔铺板,并在铺板后 (A) 48 小时或 (B) 7 天使用 Presto Blue (Thermo Fisher)量化细胞活力,产生显著不同的生长速率(C)。(ANOVA = F (3,26) = 10.6, p<0.0001)。
图13A-F示出了铺在不同表面上的细胞在形态和/或增殖方面的差异。组织培养板未经处理(对照,“TC 处理”)、用胶原蛋白或用 DTM 涂布。原代肌腱细胞(ZenBio #TEN-F)以 20,000 个细胞/孔铺板。活细胞图像经3 天通过延时摄影(time laps video)拍摄,显示不同表面处理之间显著不同的细胞形态和增殖率(图 6)。活细胞成像的静止图像在 48小时时拍摄,并显示与标准组织培养物 (D) 或胶原蛋白涂布的板 (E)相比,肌腱细胞在DTM 上更快速地粘附、增殖,并具有增加的粘着斑和更自然的细胞形态(F)。
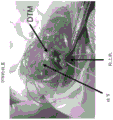
图14A-C示出了DTM的外科应用的图像。DTM 可形成油灰或可注射溶液。在这种情况下,将油灰放置在更大的结节上,并通过手术连接冈上肌以固定 DTM。
图15示出了经两个处理步骤来自四种不同供体的四个样品的归一化 TGFb 含量。对于每种供体,第一列代表天然肌腱中 TGFb 的量,第二列代表脱细胞的肌腱中 TGFb 的量,且第三列代表消化的肌腱中 TGFb 的量。
发明详述
除非另有定义,本文使用的所有技术和科学术语具有与本发明所属领域的技术人员通常理解的相同的含义。本文提及的所有专利和出版物均通过引用整体并入。
定义
如本文所用,术语“共同施用(co-administration)”、“共同施用(co-administering)”、“与……组合施用(administered in combination with)”、“与……组合施用(administering in combination with)”、“同时(simultaneous)”和“同时(concurrent)”包括施用两种或更多种活性药物成分。共同施用包括以分开的组合物同时施用、以分开的组合物在不同时间施用或以其中存在两种或更多种活性药物成分的组合物施用。优选以分开的组合物同时施用和以其中两种药剂都存在的组合物施用。
术语“体内”是指在对象的体内发生的事件。
术语“体外”是指在对象的体外发生的事件。体外测定包括使用活细胞或死细胞的基于细胞的测定,并也可以包括不使用完整细胞的无细胞测定。
如本文所用,“治疗(treatment)”、“治疗(treating)”、“缓解(palliating)”和“改善(ameliorating)”可互换使用。这些术语是指获得有益或期望结果,包括但不限于治疗益处和/或预防益处的方法。治疗益处意指根除或改善所治疗的潜在病症。而且,通过根除或改善与潜在病症相关的一种或多种生理症状来实现治疗益处,从而在患者中观察到改善,尽管患者可能仍受到潜在病症的折磨。
术语“有效量”或“治疗有效量”是指足以实现预期应用(包括但不限于疾病治疗)的如本文所述的化合物或化合物组合的量。治疗有效量可根据预期应用(体外或体内)、或所治疗的对象和疾病状况(例如,对象的体重、年龄和性别)、疾病状况的严重程度、施用方式等而变化,其可以由本领域普通技术人员容易地确定。该术语还适用于在靶细胞中诱导特定响应(例如,血小板粘附和/或细胞迁移的减少)的剂量。具体剂量将根据所选择的特定化合物、要遵循的给药方案、该化合物是否与其它化合物联合施用、施用时间、施用的组织以及其中携带化合物的物理递送系统而变化。
如本文所用的术语“治疗效果”包括治疗益处和/或预防益处。预防作用包括延迟或消除疾病或病症的出现,延迟或消除疾病或病症的症状的发作,减缓、停止或逆转疾病或病症的进展,或其任何组合。
如本文所用,“供体”是指肌腱结缔组织的哺乳动物来源。供体可以是人或其它动物来源,包括尸体肌腱组织。“同种异体”供体组织是来自相同物种的非遗传相同成员的供体组织,例如,从一个人类对象中收获的供体组织,然后将所得组合物施用于不同的人类对象。肌腱结缔组织可从另一物种的供体收获,用于本文方法中以产生脱细胞肌腱基质组合物;此类组合物是“异种”脱细胞肌腱基质组合物。优选的异种移植来源是猪、马、牛、绵羊、狗和啮齿动物。无论来源如何,异种移植肌腱组织可能是来自尸体供体的新鲜或新鲜冷冻组织。优选的同种异体移植来源是跟腱和髌腱。这些肌腱很容易获得并且尺寸相对较大。它们还广泛用于自体移植和同种异体移植应用,用于重建撕裂或受损韧带和肌腱。
如本文所用,“脱细胞”是指肌腱结缔组织的细胞成分的一般(至少80%)、几乎完全(至少95%)或基本完全(至少99%)去除。
如本文所用,“基质金属蛋白酶”是指基质金属蛋白酶(MMP)家族的蛋白。基质金属蛋白酶 (MMP) 包括锌依赖性内切蛋白酶的一个大家族,它们共同能够降解所有细胞外基质 (ECM) 成分。该术语包括每个 MMP 家族成员的脱辅基-和活化形式。该术语包括MMP-2、MMP-9、MMP-14、它们的同系物、衍生物和片段。Fanjul-Fernandez 等人 在综述文章Biochim. Biophy. Acta 1803:3-19 (2010)中总结了哺乳动物MMP家族。
本领域已知多种生长因子,包括: IGF-1 (胰岛素样生长因子1,或生长调节素C)、TGF-β (转化生长因子β)、 PDGF (血小板衍生生长因子)、VEGF (血管内皮生长因子(VEGF),也称为血管通透性因子(VPF))、 bFGF (碱性成纤维细胞生长因子或成纤维细胞生长因子2 (FGF2))、GDF-5 (生长分化因子5)、GDF-6 (生长分化因子6)、GDF-7 (生长分化因子7)、HGF (肝细胞生长因子或分散因子)。不受理论的束缚,本领域已知在肌腱的细胞外基质中发现的上述生长因子的非限制性列表。
短语“药学上可接受的”是指在合理的医学判断范围内,适用于与人和动物组织接触而无过度毒性、刺激性、过敏反应或与合理的收益/风险比相称的其它问题或并发症的那些化合物、材料、组合物和/或剂型。
“药学上可接受的载体”或“药学上可接受的赋形剂”旨在包括任何和所有溶剂、分散介质、包衣、抗菌剂和抗真菌剂、等渗剂和吸收延迟剂以及惰性成分。此类药学上可接受的载体或药学上可接受的赋形剂用于活性药物成分的用途是本领域众所周知的。除非任何常规的药学上可接受的载体或药学上可接受的赋形剂与 DTM 成分不相容,否则考虑其在本发明的治疗组合物中的用途。另外的活性药物成分,如其它药物,也可以加入到所描述的组合物和方法中。
当本文使用范围来描述例如物理或化学性质如分子量或化学式时,旨在包括其中的范围和具体实施方案的所有组合和亚组合。当提及数字或数值范围时使用术语“约”意味着所指的数字或数值范围是实验变异性内(或统计实验误差内)的近似值,因此数字或数值范围可以变化。该变化通常为所述数字或数值范围的0%至15%,优选0%至10%,更优选0%至5%。术语“包含”(以及相关术语,如“包含”或“包含”或“具有”或“包括”)包括那些实施方案,如例如,任何物质的组合物、方法或过程“由所描述的特征组成”或“基本上由所描述的特征组成”的实施方案。
在两个或多个核酸或多肽的上下文中,术语“序列同一性”、“同一性百分比(percent identity)”和“序列同一性百分比”是指相同的或具有特定百分比的相同的核苷酸或氨基酸残基的两个或更多个序列或子序列,在比较和比对(必要时引入缺口)以获得最大对应时,不考虑任何保守氨基酸取代作为序列同一性的一部分。可以使用序列比较软件或算法或通过目视检查来测量同一性百分比。可用于获得氨基酸或核苷酸序列的比对的各种算法和软件是本领域已知的。确定序列同一性百分比的合适程序包括例如可从美国政府的国家生物技术信息中心 BLAST 网站(U.S. Government's National Center forBiotechnology Information BLAST website)获得的 BLAST 程序套件。两个序列之间的比较可以使用 BLASTN 或 BLASTP 算法进行。BLASTN用于比较核酸序列,而BLASTP用于比较氨基酸序列。可从 DNASTAR 获得的ALIGN、ALIGN-2(Genentech,South San Francisco,California)或 MegAlign是可用于比对序列的额外的公众可得的软件程序。本领域技术人员可以通过特定的比对软件确定最大比对的适当参数。在某些实施方案中,使用比对软件的默认参数。
为免生疑问,结合本发明的特定方面、实施方案或实施例描述的特定特征(例如整数、特征、值、用途、疾病、式、化合物或组)旨在应理解为适用于本文描述的任何其它方面、实施方案或实施例,除非与其不相容。因此,可以在适当的情况下结合本文定义的任何定义、权利要求或实施方案来使用此类特征。本说明书中公开的所有特征(包括任何随附的权利要求、摘要和附图)和/或如此公开的任何方法或过程的所有步骤,可以以任何组合方式组合,除了其中至少一些特征和/或步骤是相互排斥的组合以外。本发明不限于任何公开的实施方案的任何细节。本发明扩展到本说明书(包括任何随附的权利要求、摘要和附图)中公开的特征的任何新颖的一个或新颖的组合,或扩展到如此公开的任何方法或过程的步骤的任何新颖的一个或任何新颖的组合。
制备脱细胞肌腱基质的方法
本公开的实施方案的一个目标是通过开发温和且特异性的脱细胞和消化方案来产生在基质中保留生长因子(特别是TGF-β)的DTM。传统上的去污剂是刺激性的,且可以去除或变性蛋白以及细胞材料。
用于脱细胞基质的典型消化技术使用通用蛋白酶,最常见的是胃蛋白酶,它不加选择地将所有蛋白切割成小多肽。在此应用中,使用专门用于切割胶原蛋白的酶来将肌腱分解成更小的部分,其然后可以形成自组装肽。胶原蛋白,主要是 I 型胶原蛋白,形成肌腱的结构骨架。通过专门切割胶原蛋白,我们消化了肌腱,但保留了附着的生长因子的生物活性。
胶原酶是消化在肌腱中常见的三螺旋天然胶原纤维的内肽酶。胶原酶切割在序列Pro-X-Gly-Pro(在胶原蛋白中以高频率发现)中的中性氨基酸 (X)和甘氨酸之间的键。细菌胶原酶,如由溶组织梭菌制造的细菌胶原酶,可以攻击几乎所有类型的胶原蛋白,并降解不溶于水的天然胶原蛋白和水溶性变性胶原蛋白二者。梭菌胶原酶通过三螺旋中的多次切断消化天然三螺旋 I、II 和 III 型胶原蛋白的能力是一个主要的区别因素。梭菌胶原酶代表异常大的金属蛋白酶,该蛋白酶家族在活性位点的中心共享一个含锌基序(Gonzales和Robert-Baudouy 1996)。
基质金属蛋白酶 (MMP) 还具有以非常特定的序列切割胶原纤维的能力。由于它们的三螺旋结构,I、II 和 III 型间质胶原蛋白对蛋白水解攻击具有高度抵抗力,但可以在特定位点被 MMP 胶原酶切割。MMP -2 和 -9 在结构水平上密切相关,并已证明对 I 型和 III 型胶原蛋白具有胶原酶活性,产生经典的 3/4 和 1/4 片段。MMP-1、MMP-8、MMP-13、MT-MMPs也有一些有限的胶原酶活性。
在一个方面, 本发明提供了一种生产组合物的方法,该组合物包含基质金属蛋白酶(MMP)消化的肌腱组织、抗微生物剂和无菌水性载体溶液。在一些实施方案中,所述基质金属蛋白酶(MMP)选自MMP-2、MMP-9、MMP-14或其组合。 在一个方面,MMP被设计成具有组成型活性。本领域技术人员将理解可以使用其它MMP。可以使用胶原酶、明胶酶、溶基质素和膜型 MMP (MT-MMP)。在某些实施方案中,胶原酶可用于使肌腱脱细胞和/或消化脱细胞的肌腱。如本文所述,胶原酶能够将三螺旋原纤维胶原蛋白降解成有区别的3/4和1/4片段。这些胶原蛋白是骨骼、软骨和牙本质的主要成分。胶原酶包括 1 型胶原酶、2 型胶原酶、3 型胶原酶、8 型胶原酶、13 型胶原酶、14 型胶原酶和 18 型胶原酶。可使用的一种或多种 MMP的非限制性实例包括MMP1 (间质胶原酶、CLG、CLGN)、MMP2 (明胶酶-A、72 kDa 明胶酶)、MMP3 (溶基质素1、CHDS6、MMP-3、SL-1、STMY、STMY1、STR1)、MMP7 (基质溶解因子、PUMP 1、MMP-7、MPSL1、PUMP-1)、MMP8 (嗜中性粒细胞胶原酶、CLG1、HNC、MMP-8、PMNL-CL)、MMP9 (明胶酶-B、92 kDa 明胶酶、CLG4B、GELB、MANDP2、MMP-9)、MMP10 (溶基质素2、SL-2、STMY2)、MMP11 (溶基质素3、SL-3、ST3、STMY3)、MMP12 (巨噬细胞金属弹性蛋白酶、HME、ME、MME、MMP-12)、MMP13 (胶原酶3、CLG3、MANDP1、MMP-13)、MMP14 (MT1-MMP、MMP-14、MMP-X1、MT-MMP、MT-MMP 1、MT1-MMP、MT1MMP、MTMMP1、WNCHRS)、MMP15 (MT2-MMP、MT2-MMP、MTMMP2、SMCP-2、MMP-15、MT2MMP)、MMP16 (MT3-MMP、C8orf57、MMP-X2、MT-MMP2、MT-MMP3、MT3-MMP)、MMP17 (MT4-MMP、MT4-MMP、MMP-17、MT4MMP、MTMMP4)、MMP18 (胶原酶4、xcol4、爪蟾胶原酶)、MMP19 (RASI-1,有时称为溶基质素-4、MMP18、RASI-1、CODA)、MMP20 (釉质溶解素、AI2A2、MMP-20)、MMP21 (X-MMP、MMP-21、HTX7)、MMP23A (CA-MMP)、MMP23B (MIFR、MIFR-1、MMP22)、MMP24 (MT5-MMP、MMP-24、MMP25、MT-MMP 5、MT-MMP5、MT5-MMP、MT5MMP、MTMMP5)、MMP25 (MT6-MMP、MMP-25、MMP20、MMP20A、MMPL1、MT-MMP 6、MT-MMP6、MT6-MMP、MT6MMP、MTMMP6)、MMP26 (基质溶解因子-2、endometase)、MMP27 (MMP-22、C-MMP、MMP-27)和MMP28(Epilysin、EPILYSIN、MM28、MMP-25、MMP-28)。
用于酶促消化脱细胞的肌腱的胶原酶浓度可因所使用的特定胶原酶而异。在某些实施方案中,1型胶原酶可用于酶促消化脱细胞的肌腱。在某些实施方案中,3型胶原酶可用于酶促消化脱细胞的肌腱。用于酶促消化脱细胞的肌腱的胶原酶浓度可为约0.1毫克(mg)/毫升(mL)、约0.2 mg/mL、约0.3 mg/mL、约0.4 mg/mL、约0.5 mg/mL、约0.6 mg/mL、约0.7mg/mL、约0.8 mg/mL、约0.9 mg/mL、约1.0 mg/mL、约1.1 mg/mL、约1.2 mg/mL、约1.3 mg/mL、约1.4 mg/mL、约1.5 mg/mL、约1.6 mg/mL、约1.7 mg/mL、约1.8 mg/mL、约1.9 mg/mL、约2.0 mg/mL、约2.1 mg/mL、约2.2 mg/mL、约2.3 mg/mL、约2.4 mg/mL、约2.5 mg/mL、约2.6mg/mL、约2.7 mg/mL、约2.8 mg/mL、约2.9 mg/mL、约3.0 mg/mL、约3.1 mg/mL、约3.2 mg/mL、约3.3 mg/mL、约3.4 mg/mL、约3.5 mg/mL、约3.6 mg/mL、约3.7 mg/mL、约3.8 mg/mL、约3.9 mg/mL、约4.0 mg/mL、约5.0 mg/mL、约6.0 mg/mL、约7.0 mg/mL、约8.0 mg/mL、约9.0mg/mL,或约10.0 mg/mL。在某些实施方案中,用于酶促消化脱细胞的肌腱的胶原酶浓度为约1.0 mg/mL。在其它实施方案中,用于酶促消化脱细胞的肌腱的胶原酶浓度为约2.0 mg/mL。
抗微生物剂是用于肠胃外制剂的合适试剂,例如烷基醇或芳基醇,如苯甲醇、氯丁醇或2-乙氧基乙醇。氨基芳基酸酯也是合适的,例如对羟基苯甲酸甲酯、乙酯、丙酯或丁酯及其组合。烷基酸和芳基酸也可能是合适的,例如苯甲酸或山梨酸;双胍,例如氯己定或酚,例如苯酚或3-甲酚。在一些实施方案中,使用化学相容的抗微生物剂的组合。
在一个方面,本发明提供了一种脱细胞肌腱基质(DTM)组合物,其中所述DTM组合物通过包括以下步骤的方法制备: (i) 切碎肌腱组织样品; (ii) 将切碎的肌腱组织样品脱细胞; (iii) 消化;和(iv) 冻干。
在另一个方面,本发明提供了脱细胞肌腱基质(DTM)组合物,其中所述DTM组合物通过包括以下步骤的方法制备: (i) 切碎肌腱组织样品; (ii) 将切碎的肌腱组织样品脱细胞; (iii) 研磨; (iv) 消化; (v) 停止和中和; (vi) 洗涤;和(vii) 冻干。
在一些情况下,在脱细胞、研磨、消化、冻干和/或洗涤之前,肌腱基质可以以约40%、约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%或约99重量%的分离的肌腱组织的部分存在。
在一些情况下,在脱细胞、研磨、消化、冻干和/或洗涤之前,肌腱基质可以以约50%至约90%、约50%至约80%、约50%至约70%、约50%至约60%、约50%至约55%, 60%至约90%、约60%至约80%、约60%至约70%、约60%至约65%, 70%至约90%、约70%至约80%、约70%至约75%、80%至约90%、约80%至约85%或约85%至约90重量%的分离的肌腱组织的部分存在。
在一些情况下,在脱细胞、研磨、消化、冻干和/或洗涤之前,肌腱基质可以以小于约90%、小于约85%、小于约80%、小于约75%、小于约70%、小于约65%、小于约60%、小于约55%、小于约50%、小于约45%、小于约40%、小于约35%、小于约30%、小于约25%、小于约20%、小于约15%、或小于约10重量%的分离的肌腱组织的部分存在。
在一些情况下,在脱细胞、研磨、消化、冻干和/或洗涤之前,肌腱基质可以以约40%、约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%或约99体积%的分离的肌腱组织的部分存在。
在一些情况下,在脱细胞、研磨、消化、冻干和/或洗涤之前,肌腱基质可以以约50%至约90%、约50%至约80%、约50%至约70%、约50%至约60%、约50%至约55%, 60%至约90%、约60%至约80%、约60%至约70%、约60%至约65%, 70%至约90%、约70%至约80%、约70%至约75%、 80%至约90%、约80%至约85%或约85%至约90体积%的分离的肌腱组织的部分存在。
在一些情况下,在脱细胞、研磨、消化、冻干和/或洗涤之前,肌腱基质可以以小于约90%、小于约85%、小于约80%、小于约75%、小于约70%、小于约65%、小于约60%、小于约55%、小于约50%、小于约45%、小于约40%、小于约35%、小于约30%、小于约25%、小于约20%、小于约15%、或小于约10体积%的分离的肌腱组织的部分存在。
在一些情况下,在脱细胞、研磨、消化、冻干和/或洗涤之后,肌腱基质可以以约40%、约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%或约99重量%的脱细胞、研磨、消化、冻干和/或洗涤的肌腱组织的部分存在。
在一些情况下,在脱细胞的、研磨、消化、冻干和/或洗涤之后,肌腱基质可以以约50%至约90%、约50%至约80%、约50%至约70%、约50%至约60%、约50%至约55%, 60%至约90%、约60%至约80%、约60%至约70%、约60%至约65%, 70%至约90%、约70%至约80%、约70%至约75%、80%至约90%、约80%至约85%或约85%至约90重量%的脱细胞的、研磨、消化、冻干和/或洗涤的肌腱组织的部分存在。
在一些情况下,在脱细胞、研磨、消化、冻干和/或洗涤后,肌腱基质可以以脱细胞、研磨、消化、冻干和/或洗涤的肌腱组织的按重量计大于约99%、大于约95%、大于约90%、大于约85%、大于约80%、大于约 75%、大于约70%、大于约65%、大于约60%、大于约55%、大于约50%、大于约45%、大于约40%、大于约35%、大于约30%、大于约25%、大于约20%、大于约15%或大于约10%的部分存在。
在一些情况下,在脱细胞、研磨、消化、冻干和/或洗涤后,肌腱基质可以以脱细胞、研磨、消化、冻干和/或洗涤的肌腱组织的按体积计约40%、约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%或约99%的部分存在。
在一些情况下,在脱细胞、研磨、消化、冻干和/或洗涤后,肌腱基质可以以脱细胞、研磨、消化、冻干和/或洗涤的肌腱组织的按体积计约50%至约90%、约50%至约80%、约50%至约70%、约50%至约60%、约50%至约55%、60%至约90%、约60%至约80%、约60%至约70%、约60%至约65%、70%至约90%、约70%至约80%、约70%至约75%、80%至约90%、约80%至约85%或约85%至约90%的部分存在。
在一些情况下,在脱细胞、研磨、消化、冻干和/或洗涤后,肌腱基质可以以脱细胞、研磨、消化、冻干和/或洗涤的肌腱组织的按体积计大于约99%、大于约95%、大于约90%、大于约85%、大于约80%、大于约75%、大于约70%、大于约65%、大于约60%、大于约55%、大于约50%、大于约45%、大于约40%、大于约35%、大于约30%、大于约25%、大于约20%、大于约15%或大于约10%的部分存在。
在一个方面中,脱细胞步骤包括将切碎的肌腱组织样品暴露于包含一种或多种选自离液盐、非离子去污剂、两性离子去污剂、阳离子去污剂、阴离子去污剂或其组合的组分的溶液。在一些方面中,脱细胞步骤包括一个或多个冷冻/解冻循环。在一些方面中,脱细胞步骤还包括用DNA酶和/或RNA酶处理。在一些方面中,脱细胞步骤还包括在平衡盐溶液例如汉克平衡盐溶液的磷酸盐缓冲盐水中洗涤一次或多次。
在一些实施方案中,将切碎的肌腱组织样品在超纯水中漂洗,然后使用包含1% w/v十二烷基硫酸钠(SDS)的溶液在适度搅拌下脱细胞。在一些实施方案中,适度搅拌是间歇性的。
在另一方面中,使用包含离子去污剂、非离子去污剂、阴离子去污剂或阳离子去污剂中的一种或多种的溶液使切碎的肌腱组织样品脱细胞。在一些方面中,脱细胞溶液还包含离液盐。在一些实施方案中,离液盐是尿素。在一些实施方案中,脱细胞溶液包含0.5 M尿素至8 M尿素。在一些实施方案中,脱细胞溶液包含2 M至5 M尿素。在一些实施方案中,脱细胞溶液包含约3 M尿素。
在一些方面中,脱细胞溶液包含表面活性剂和离液盐。在一些方面中,脱细胞溶液还包含消泡剂,例如Antifoam 204。
在另一方面中,该方法还包括沉淀细胞蛋白的步骤,该方法还包括用浓缩的cosmotropic溶液处理切碎的肌腱组织样品。在一些实施方案中,浓缩的cosmotropic溶液是硫酸铵。Cosmotropic盐析例如根据Wingfield, Curr. Protoc. Protein Sci., 附录3:附录–3F (2001)总结的方法完成。
切碎可以使用本领域已知的方法来完成,例如,首先从肌腱组织样品中去除鞘、脂肪和滑膜组织。然后,将肌腱组织标本切成大约1至4 mm3大小的块,然后用磷酸盐缓冲盐水(PBS)洗涤。
在一个方面中,停止和中和步骤包括用包含一种或多种蛋白酶抑制剂的溶液停止和中和,所述蛋白酶抑制剂选自TAPI-0、TAPI-1、TAPI-2、马立马司他、膦酰二肽、木犀草素、PMSF、胃蛋白酶抑制剂A、亮抑酶肽、E-64、原钒酸钠或其组合。
脱细胞可以通过本领域已知的方法进行监测,包括将脱细胞的样品和对照样品(即起始供体肌腱组织的未处理样品)切片,然后用苏木精-伊红染色和马森-戈德纳三色染色来分别检测细胞组分和胶原纤维结构。DNA可能从脱细胞的样品和未经处理的起始样品中提取;脱细胞样品应有至多为相当的起始重量的四分之一的DNA被回收,参见,例如,Seif-Naraghi等人,Acta Biomater.8:3695-3703 (2012)。
脱细胞组织具有所有或大部分组织区域的细胞外基质(ECM)组分,包括血管树的ECM组分。ECM组分可以包括以下的任何一种或任何组合:纤连蛋白、原纤蛋白、层粘连蛋白、弹性蛋白、胶原蛋白家族的成员(例如,胶原蛋白I、III和IV)、ECM相关生长蛋白(包括生长因子和细胞因子)、糖胺聚糖、基质、网状纤维和血小板反应蛋白,它们可以保持限定的组织结构,如基底层。成功的脱细胞可以定义为使用标准组织学染色程序在组织切片中没有可检测到的肌丝、内皮细胞、平滑肌细胞和细胞核或去除超过97%的可检测DNA(例如,如通过荧光测定法测量)的。残留的细胞碎片可以从脱细胞的组织中去除。
ECM的形态和结构可以在脱细胞过程期间和之后保持。本文所用的“形态”是指ECM的整体形状,而本文所用的“结构”是指外表面、内表面和其间的ECM。ECM 的形态和结构可以在视觉上和/或组织学上进行检查。
可以将一种或多种化合物施加到脱细胞组织中或脱细胞组织上以例如保存脱细胞组织,或制备脱细胞组织用于再细胞化或整合或植入宿主。此类化合物包括但不限于一种或多种生长因子(例如,VEGF、DKK-1、FGF、BMP-1、BMP-4、SDF-1、IGF和HGF)、免疫调节剂(例如,细胞因子、糖皮质激素、IL2R拮抗剂、白三烯拮抗剂)和/或改变凝血级联反应的因子(例如,阿司匹林、肝素结合蛋白和肝素)。此外,脱细胞组织可以进一步用例如辐射(例如UV、γ)处理以减少或消除残留在脱细胞组织上或脱细胞组织中的任何类型的微生物的存在。
在一些方面中,本发明提供一种制备脱细胞肌腱基质(DTM)组合物的方法,使用该方法制备的组合物还包括保留切碎的肌腱组织中存在的至少100%、至少99%、至少98%、至少97%、至少96%、至少95%、至少94%、至少93%、至少92%、至少91%、至少90%的生长因子。在一些方面中,使用制备脱细胞肌腱基质(DTM)组合物的方法制备组合物,使用该方法制备的组合物还包括保留切碎的肌腱组织中存在的至少85%、至少80%、至少75%、至少70%、至少65%、至少60%、至少55%、至少50%、至少45%或至少40%的生长因子。在一些方面中,本发明提供一种制备脱细胞肌腱基质(DTM)组合物的方法,使用该方法制备的组合物还包括保留切碎的肌腱组织中存在的至少99%、至少98%、至少97%、至少96%、至少95%、至少94%、至少93%、至少92%、至少91%、至少90%、至少89%、至少88%、至少87%、至少86%、至少85%、至少84%、至少83%、至少82%、至少81%、至少80%、至少79%、至少78%、至少77%、至少76%、至少75%、至少74%、至少73%、至少72%、至少71%、至少70%、至少69%、至少68%、至少67%、至少66%、至少65%、至少64%、至少63%、至少62%、至少61%、至少60%、至少59%、至少58%、至少57%、至少56%、至少55%、至少54%、至少53%、至少52%、至少51%、至少50%、至少49%、至少48%、至少47%、至少46%、至少45%,至少44%,至少43%,至少42%,至少41%,至少40%、至少39%、至少38%、至少37%、至少36%、至少35%、至少34%、至少33%、至少32%、至少31%,至少31%、至少30%、至少29%、至少28%、至少27%、至少26%、至少25%、至少24%、至少23%、至少22%、至少21%、至少20%、至少19%、至少18%、至少17%、至少16%、至少15%、至少14%、至少13%、至少12%、至少11%或至少10%的生长因子。在一些方面中,本发明提供一种制备脱细胞肌腱基质(DTM)组合物的方法,其中使用该方法制备的组合物保留了脱细胞前切碎的肌腱组织中存在的约70%至约100%的生长因子。在一些方面中,本发明提供一种制备脱细胞肌腱基质(DTM)组合物的方法,其中使用该方法制备的组合物保留了脱细胞前切碎的肌腱组织中存在的约70%至约75%的生长因子。在一些方面中,本发明提供一种制备脱细胞肌腱基质(DTM)组合物的方法,其中使用该方法制备的组合物保留了脱细胞前切碎的肌腱组织中存在的约75%至约80%的生长因子。在一些方面中,本发明提供一种制备脱细胞肌腱基质(DTM)组合物的方法,其中使用该方法制备的组合物保留了脱细胞前切碎的肌腱组织中存在的约80%至约85%的生长因子。在一些方面中,本发明提供一种制备脱细胞肌腱基质(DTM)组合物的方法,其中使用该方法制备的组合物保留了脱细胞前切碎的肌腱组织中存在的约85%至约90%的生长因子。在一些方面中,本发明提供一种制备脱细胞肌腱基质(DTM)组合物的方法,其中使用该方法制备的组合物保留了脱细胞前切碎的肌腱组织中存在的约90%至约95%的生长因子。在一些方面中,本发明提供一种制备脱细胞肌腱基质(DTM)组合物的方法,其中使用该方法制备的组合物保留了脱细胞前切碎的肌腱组织中存在的约95%至约100%的生长因子。在一些方面中,本发明提供一种制备脱细胞肌腱基质(DTM)组合物的方法,其中使用该方法制备的组合物保留了脱细胞前切碎的肌腱组织中存在的约75%至约95%的生长因子。在一些方面中,本发明提供一种制备脱细胞肌腱基质(DTM)组合物的方法,其中使用该方法制备的组合物保留了脱细胞前切碎的肌腱组织中存在的约70%至约80%的生长因子。在一些方面中,本发明提供一种制备脱细胞肌腱基质(DTM)组合物的方法,其中使用该方法制备的组合物保留了脱细胞前切碎的肌腱组织中存在的约80%至约90%的生长因子。在一些实施方案中,生长因子选自IGF-1、TGF-β、PDGF、VEGF、bFGF、GDF-5、GDF-6、GDF-7、HGF及其组合。在一些实施方案中,生长因子至少包括TGF-β。
在一些方面中,本发明提供一种制备脱细胞肌腱基质(DTM)组合物的方法,该方法还包括保留切碎的肌腱组织中存在的至少90%的细胞因子,其中生长因子选自: IGF-1、TGF-β、PDGF、VEGF、bFGF、GDF-5、GDF-6、GDF-7、HGF及其组合。在一些方面中,制备脱细胞肌腱基质(DTM)组合物的方法,该方法还包括保留切碎的肌腱组织中存在的至少99%、至少98%、至少97%、至少96%、至少95%、至少94%、至少93%、至少92%、至少91%、至少90%、至少89%、至少88%、至少87%、至少86%、至少85%、至少84%、至少83%、至少82%、至少81%、至少80%、至少79%、至少78%、至少77%、至少76%、至少75%、至少74%、至少73%、至少72%、至少71%、至少70%、至少69%、至少68%、至少67%、至少66%、至少65%、至少64%、至少63%、至少62%、至少61%、至少60%、至少59%、至少58%、至少57%、至少56%、至少55%、至少54%,至少53%、至少52%、至少51%、至少50%、至少49%、至少48%、至少47%、至少46%、至少45%、至少44%,至少43%、至少42%、至少41%、至少40%、至少39%、至少38%、至少37%、至少36%、至少35%、至少34%、至少33%、至少32%、至少31%、至少31%、至少30%、至少29%、至少28%、至少27%、至少26%、至少25%、至少24%、至少23%、至少22%、至少21%、至少20%、至少19%、至少18%、至少17%、至少16%、至少15%、至少14%、至少13%、至少12%、至少11%或至少10%的生长因子,其中所述生长因子选自IGF-1、TGF-β、PDGF、VEGF、bFGF、GDF-5、GDF-6、GDF-7、HGF及其组合。
在一些方面中,本发明提供一种制备脱细胞肌腱基质(DTM)组合物的方法,该方法还包括保留切碎的肌腱组织中存在的至少90%的TGF-β。在一些方面中,本发明提供一种制备脱细胞肌腱基质(DTM)组合物的方法,该方法还包括保留切碎的肌腱组织中存在的至少95%的TGF-β。在一些方面中,本发明提供一种制备脱细胞肌腱基质(DTM)组合物的方法,该方法还包括保留切碎的肌腱组织中存在的至少99%的TGF-β。在一些方面中,制备脱细胞肌腱基质(DTM)组合物的方法,该方法还包括保留天然肌腱(native tendon)中按重量计至少99%、至少98%、至少97%、至少96%、至少95%、至少94%、至少93%、至少92%、至少91%、至少90%、至少89%、至少88%、至少87%、至少86%、至少85%、至少84%、至少83%、至少82%、至少81%、至少80%、至少79%、至少78%、至少77%、至少76%、至少75%、至少74%、至少73%、至少72%、至少71%、至少70%、至少69%、至少68%、至少67%、至少66%、至少65%、至少64%、至少63%、至少62%、至少61%、至少60%、至少59%、至少58%、至少57%、至少56%、至少55%、至少54%、至少53%、至少52%、至少51%、至少50%、至少49%,至少48%、至少47%、至少46%、至少45%、至少44%、至少43%、至少42%、至少41%、至少40%、至少39%、至少38%、至少37%、至少36%、至少35%、至少34%、至少33%、至少32%、至少31%、至少31%、至少30%、至少29%、至少28%、至少27%、至少26%、至少25%、至少24%、至少23%、至少22%、至少21%、至少20%、至少19%、至少18%、至少17%、至少16%、至少15%、至少14%、至少13%、至少12%、至少11%或至少10%的TGF-β。
在一些方面中,制备脱细胞肌腱基质(DTM)组合物的方法,该方法还包括保留切碎的肌腱组织中存在的至少85%、至少80%、至少75%、至少70%、至少65%、至少60% 、至少55%、至少50%、至少45%或至少40%的生长因子,其中所述生长因子选自IGF-1、TGF-β、PDGF、VEGF、bFGF、GDF-5、GDF-6、GDF-7、HGF及其组合。
在一些方面中,制备脱细胞肌腱基质(DTM)组合物的方法,该方法还包括将脱细胞组织或DTM中存在的生长因子的浓度增加至少500%、至少250%、至少200%、至少150%、至少100%、至少95%、至少90%、至少85%、至少80%、至少75%、至少70%、至少65%、至少60%、至少55%、至少50%、至少45%、至少40%、至少35%、至少30%、至少25%、至少20%、至少15%、至少10%、至少5%,其中所述生长因子选自IGF-1、TGF-β、PDGF、VEGF、bFGF、GDF-5、GDF-6、GDF-7、HGF及其组合。
在一个方面中,该组合物保留上述生长因子中的2种或更多种、上述生长因子中的3种或更多种、上述生长因子中的4种或更多种、上述生长因子中的5种或更多种、上述生长因子中的6种或更多种、上述生长因子中的7种或更多种。在一个方面中,该组合物保留HGF和一种或多种选自IGF-1、TGF-β、PDGF、VEGF、bFGF、GDF-5、GDF-6和GDF-7的生长因子。在一个方面中,该组合物保留IGF-1和HGF。
在一个方面中,DTM组合物还包括保留切碎的肌腱组织中存在的至少85%、至少84%、至少83%、至少82%、至少81%、至少80%、至少79%、至少78%、至少77%、至少76%、至少75%、至少74%、至少73%、至少72%、至少71%、至少70%、至少69%、至少68%、至少67%、至少66%、至少65%、至少64%、至少63%、至少62%、至少61%、至少60%、至少59%、至少58%、至少57%、至少56%、至少55%、至少54%、至少53%、至少52%、至少51%、至少50%、至少49%、至少48%、至少47%、至少46%、至少45%、至少44%、至少43%、至少42%、至少41%、至少40%、至少39%、至少38%、至少37%、至少36%、至少35%、至少34%、至少33%、至少32%、至少31%、至少31%、至少30%、至少29%、至少28%、至少27%、至少26%、至少25%、至少24%、至少23%、至少22%、至少21%、至少20%、至少19%、至少18%、至少17%、至少16%、至少15%、至少14%、至少13%、至少12%、至少11%或至少10%的IGF-1和HGF。
在一些方面中,本发明提供一种制备脱细胞肌腱基质(DTM)组合物的方法,该方法还包括去除切碎的肌腱组织中存在的至少90%的细胞材料。在一些方面中,本发明提供一种制备脱细胞肌腱基质(DTM)组合物的方法,该方法还包括去除切碎的肌腱组织中存在的至少95%的细胞材料。在一些方面中,本发明提供一种制备脱细胞肌腱基质(DTM)组合物的方法,该方法还包括去除切碎的肌腱组织中存在的至少99%的细胞材料。在一些方面中,制备脱细胞肌腱基质(DTM)组合物的方法,该方法还包括去除天然肌腱中按重量计至少99%、至少98%、至少97%、至少96%、至少95%、至少94%、至少93%、至少92%、至少91%、至少90%、至少89%、至少88%、至少87%、至少86%、至少85%、至少84%、至少83%、至少82%、至少81%、至少80%、至少79%、至少78%、至少77%、至少76%、至少75%、至少74%、至少73%、至少72%、至少71%、至少70%、至少69%、至少68%、至少67%、至少66%、至少65%、至少64%、至少63%、至少62%、至少61%、至少60%、至少59%、至少58%、至少57%、至少56%、至少55%、至少54%,至少53%、至少52%、至少51%、至少50%、至少49%、至少48%、至少47%、至少46%、至少45%、至少44%,至少43%、至少42%、至少41%、至少40%、至少39%、至少38%、至少37%、至少36%、至少35%、至少34%、至少33%、至少32%、至少31%、至少31%、至少30%、至少29%、至少28%、至少27%、至少26%、至少25%、至少24%、至少23%、至少22%、至少21%、至少20%、至少19%、至少18%、至少17%、至少16%、至少15%、至少14%、至少13%、至少12%、至少11%或至少10%的细胞材料。在某些实施方案中,本发明提供一种制备脱细胞肌腱基质(DTM)组合物的方法,并且该DTM基本上不含细胞材料。在某些实施方案中,本发明提供一种制备脱细胞肌腱基质(DTM)组合物的方法,并且该DTM基本上不含产生TGF-β的细胞。
在一些方面中,本发明提供一种制备脱细胞肌腱基质(DTM)组合物的方法,该方法还包括去除切碎的肌腱组织中存在的至少90%的核酸(例如DNA或RNA)。在一些方面中,本发明提供一种制备脱细胞肌腱基质(DTM)组合物的方法,该方法还包括去除切碎的肌腱组织中存在的至少95%的核酸(例如DNA或RNA)。在一些方面中,本发明提供一种制备脱细胞肌腱基质(DTM)组合物的方法,该方法还包括去除切碎的肌腱组织中存在的至少99%的核酸(例如DNA或RNA)。在一些方面中,制备脱细胞肌腱基质(DTM)组合物的方法,该方法还包括去除天然肌腱中按重量计至少99%、至少98%、至少97%、至少96%、至少95%、至少94%、至少93%、至少92%、至少91%、至少90%、至少89%、至少88%、至少87%、至少86%、至少85%、至少84%、至少83%、至少82%、至少81%、至少80%、至少79%、至少78%、至少77%、至少76%、至少75%、至少74%、至少73%、至少72%、至少71%、至少70%、至少69%、至少68%、至少67%、至少66%、至少65%、至少64%、至少63%、至少62%、至少61%、至少60%、至少59%、至少58%、至少57%、至少56%、至少55%、至少54%,至少53%、至少52%、至少51%、至少50%、至少49%、至少48%、至少47%、至少46%、至少45%、至少44%,至少43%、至少42%、至少41%、至少40%、至少39%、至少38%、至少37%、至少36%、至少35%、至少34%、至少33%、至少32%、至少31%、至少31%、至少30%、至少29%、至少28%、至少27%、至少26%、至少25%、至少24%、至少23%、至少22%、至少21%、至少20%、至少19%、至少18%、至少17%、至少16%、至少15%、至少14%、至少13%、至少12%、至少11%或至少10%的核酸(例如DNA或RNA)。在某些实施方案中,本发明提供一种制备脱细胞肌腱基质(DTM)组合物的方法,并且该DTM基本上不含核酸(例如DNA或RNA)。
各种方法是本领域已知的,例如由Gilpin和Yang, Biomed. Res. Int. 2017:9831534 (2017)总结的那些。许多方法包括强力去污剂提取和在极端的非生理性pH下使用混杂蛋白酶(例如胃蛋白酶)进行长时间处理。本发明的方法和过程不同于本领域已知的那些,通过使用在生理pH下具有活性的更少的混杂蛋白酶。不受理论的束缚,本发明的方法和过程更少蛋白变性并且在脱细胞的肌腱基质中保留更多功能性生长因子。在一些方面中,MMP2、MMP9、MMP14或其组合用于制备本发明的脱细胞肌腱基质组合物。Eckhard等人, Data Brief, 7: 299–310 (2017)使用全蛋白组方法绘制了MMP家族(包括MMP2、MMP9和MMP14)的目标裂解位点。
DTM水凝胶
在另一方面中,本公开提供脱细胞肌腱基质水凝胶。可以通过控制温度或pH,利用胃蛋白酶处理的单体胶原蛋白的内在聚合能力来制备水凝胶。这些方法是众所周知的,但有些不可预测,例如Drake等人, Biochemistry 5:301-312 (1966)详细介绍了胶原蛋白可聚合蛋白水解片段的制备。其他方法,例如Bahney等人, FASEB J, 25:1486-1496 (2011)和Ungerleider等人, Methods, 84:53-59 (2015)所教导的方法,也是众所周知的。当应用于富含蛋白的细胞外基质组织时,这些众所周知的方法尤其不可预测。
通过使用碳二亚胺交联剂化学可以实现更可靠和更好控制的交联。在一些实施方案中,水凝胶是通过混合DTM组合物并与羧基反应性交联剂例如1-乙基-3-(3-二甲氨基丙基)碳二亚胺“EDC”反应来制备的。EDC交联在酸性(例如约pH 4.5)条件下最有效,并且在不含外来羧基和胺的缓冲液中表现最佳。MES缓冲液(4-吗啉代乙磺酸)是一种合适的碳二亚胺反应缓冲液。磷酸盐缓冲液和中性pH(最高7.2)条件与反应化学相容,但效率较低;增加反应溶液中EDC的量可以容易地补偿任何降低的效率。EDC与N-羟基琥珀酰亚胺(NHS)或其水溶性类似物(Sulfo-NHS)1:1混合以进一步改善交联。EDC将NHS与羧基偶联,形成比O-酰基异脲中间体稳定得多的NHS酯,同时允许在生理pH下与伯胺有效结合。
在另一方面中,DTM水凝胶是通过在无菌的药学上可接受的注射溶液中重构DTM而形成的。
注射用药物组合物
在一个方面中,本发明提供一种用于修复或治疗肌腱撕裂的药物组合物。在一个优选的实施方案中,本发明提供包含直接施用于肌腱损伤位置的DTM水凝胶的药物组合物。在一个方面中,肌腱损伤的位置是一级撕裂。在另一方面中,肌腱损伤的位置是二级撕裂。在一个方面中,肌腱损伤的位置是三级撕裂。
通常配制药物组合物以提供治疗有效量的DTM水凝胶,该药物组合物还包含一种或多种药学上可接受的赋形剂、载体,包括惰性固体稀释剂和填充剂、稀释剂,包括无菌水溶液和各种有机溶剂、渗透增强剂、增溶剂和助剂。
在制备本公开的组合物时,包含脱细胞肌腱基质的组合物还可包含赋形剂。合适的赋形剂的一些实例包括乳糖、右旋糖、蔗糖、山梨糖醇、甘露糖醇、淀粉、阿拉伯树胶、磷酸钙、藻酸盐、黄蓍胶、明胶、硅酸钙、微晶纤维素、PEG、聚乙烯吡咯烷酮、纤维素、水、无菌盐水、糖浆和甲基纤维素。制剂可另外包含:润滑剂如滑石、硬脂酸镁和矿物油;润湿剂;乳化剂和助悬剂;防腐剂,例如羟基苯甲酸甲酯和羟基苯甲酸丙酯;甜味剂;和调味剂。可以配制本公开的组合物以通过采用本领域已知的程序在植入患者体内后提供活性成分(例如生长因子)的快速、持续或延迟释放。
在一些情况下,本文所述的药物组合物可包含赋形剂,其可提供长期保存、增量含有有效活性成分的制剂、促进药物吸收、降低粘度、增加风味或提高药物组合物的溶解度。赋形剂的非限制性实例可包括抗粘剂、粘合剂(例如蔗糖、乳糖、淀粉、纤维素、明胶或聚乙二醇)、包衣(例如羟丙基甲基纤维素或明胶)、崩解剂、助流剂、润滑剂或防腐剂(例如酸、酯、酚、汞化合物或铵化合物)。本公开的药物组合物可包含按重量或体积计约1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、45%、50%或大于约50%的赋形剂。例如,药物组合物可包含按体积计5%的赋形剂。在另一个实例中,药物组合物可包含按重量计8%的赋形剂。预期可以基于药物组合物中的活性成分来选择一种或多种媒介物。
在某些实施方案中,本公开的药物组合物可包含一种或多种增溶剂。如本文所用,“增溶剂”包括诸如以下化合物:三醋精、柠檬酸三乙酯、油酸乙酯、辛酸乙酯、十二烷基硫酸钠、多库酯钠、维生素E TPGS、二甲基乙酰胺、N-甲基吡咯烷酮、N-羟乙基吡咯烷酮、聚乙烯吡咯烷酮、羟丙基甲基纤维素、羟丙基环糊精、乙醇、正丁醇异丙醇、胆固醇、胆汁盐、聚乙二醇200-600、四氢呋喃聚乙二醇醚(glycofurol)、二乙二醇单乙醚(transcutol)、丙二醇和异山梨醇二甲醚等。 本公开的药物组合物可包含按重量或按体积计约1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30 %、35%、40%、45%、50%或大于约50%的增溶剂。例如,药物组合物可包含按体积计10%的增溶剂。在另一个实例中,药物组合物可包含按重量计5%的增溶剂。
在一些实施方案中,组合物包含稳定剂。在一些实施方案中,稳定剂选自例如脂肪酸、脂肪醇、醇、长链脂肪酸酯、长链醚、脂肪酸的亲水衍生物、聚乙烯吡咯烷酮、聚乙烯醚、聚乙烯醇、烃、疏水聚合物、吸湿聚合物及其组合。在一些实施方案中,还使用稳定剂的酰胺类似物。其他有用的组合物包含一种或多种抗氧化剂以在需要时增强化学稳定性。合适的抗氧化剂包括,仅作为例子,抗坏血酸和焦亚硫酸钠。在一个实施方案中,抗氧化剂选自金属螯合剂、含硫醇的化合物和其他通用稳定剂。
其他有用的组合物包含一种或多种表面活性剂以增强物理稳定性或用于其他目的。合适的非离子表面活性剂包括聚氧乙烯脂肪酸甘油酯和植物油、聚氧乙烯、氢化蓖麻油、聚氧乙烯烷基醚、烷基苯基醚、辛苯聚醇10 和辛苯聚醇40。
在一些实施方案中,本文公开的组合物包含防腐剂。适用于本文所述组合物的防腐剂包括但不限于苯甲酸、硼酸、对羟基苯甲酸酯、酚、氯化酚类化合物、醇、四元化合物(quaternary compound)、季铵化合物(例如苯扎氯铵、十六烷基三甲基溴化铵或十六烷基氯化吡啶)、稳定的二氧化氯、汞制剂(例如 硼酸汞苯(merfen)或硫柳汞),或其混合物。在一些实施方案中,防腐剂是对羟基苯甲酸甲酯。在一些实施方案中,对羟基苯甲酸甲酯的浓度为按重量或体积计约0.05%至约1.0%、约0.1%至约0.2%。
在一些实施方案中,本公开的组合物可包含碱,且该碱可包括硬脂富马酸钠、鲸蜡基硫酸二乙醇胺(diethanolamine cetyl sulfate)、异硬脂酸酯、聚乙氧基化蓖麻油、benzalkoniurα chloride、nonoxyl 10、辛苯聚醇9、十二烷基硫酸钠、脱水山梨糖醇酯(脱水山梨糖醇单月桂酸酯、脱水山梨糖醇单油酸酯、脱水山梨糖醇单棕榈酸酯、脱水山梨糖醇单硬脂酸酯、脱水山梨糖醇倍半油酸酯、脱水山梨糖醇三油酸酯、脱水山梨糖醇三硬脂酸酯、脱水山梨糖醇月桂酸酯、脱水山梨糖醇油酸酯、脱水山梨糖醇棕榈酸酯、脱水山梨糖醇硬脂酸酯、脱水山梨糖醇二油酸酯、脱水山梨糖醇倍半异硬脂酸酯、脱水山梨糖醇倍半硬脂酸酯、脱水山梨糖醇三异硬脂酸酯)、卵磷脂、其药学上可接受的盐、其组合或其衍生物。
在一个实施方案中,DTM水凝胶药物组合物中脱细胞肌腱基质(DTM)的浓度选自约0.2 mg/mL至20 mg/mL;0.2 mg/mL至19 mg/mL;0.2 mg/mL至18 mg/mL;0.2 mg/mL至17 mg/mL;0.2 mg/mL至16 mg/mL;0.2 mg/mL至15 mg/mL;0.2 mg/mL至14 mg/mL;0.2 mg/mL至13mg/mL;0.2 mg/mL至12 mg/mL;0.2 mg/mL至11 mg/mL; 0.2 mg/mL至10 mg/mL; 0.2 mg/mL至9 mg/mL; 0.2 mg/mL至8 mg/mL; 0.2 mg/mL至7 mg/mL; 0.2 mg/mL至6 mg/mL; 0.3mg/mL至6 mg/mL; 0.4 mg/mL至6 mg/mL;0.5 mg/mL至6 mg/mL; 0.6 mg/mL至6 mg/mL;0.7 mg/mL至6 mg/mL; 0.8 mg/mL至6 mg/mL;0.9 mg/mL至6 mg/mL;1 mg/mL至6 mg/mL;2mg/mL至6 mg/mL;3 mg/mL至6 mg/mL;约3 mg/mL;约4 mg/mL;约5 mg/mL;和约6 mg/mL。
在一个实施方案中,DTM水凝胶药物组合物中脱细胞肌腱基质(DTM)的浓度选自约1.0 mg/mL至6 mg/mL;1.1 mg/mL至6 mg/mL;1.2 mg/mL至6 mg/mL;1.3 mg/mL至6 mg/mL;1.4 mg/mL至6 mg/mL;1.5 mg/mL至6 mg/mL;1.6 mg/mL至6 mg/mL;1.7 mg/mL至6 mg/mL;1.8 mg/mL至6 mg/mL;1.9 mg/mL至6 mg/mL;2.0 mg/mL至6 mg/mL;2.1 mg/mL至6 mg/mL;2.2 mg/mL至6 mg/mL;2.3 mg/mL至6 mg/mL;2.4 mg/mL至6 mg/mL;2.5 mg/mL至6 mg/mL;2.6 mg/mL至6 mg/mL;2.7 mg/mL至6 mg/mL;2.8 mg/mL至6 mg/mL;2.9 mg/mL至6 mg/mL;3.0 mg/mL至6 mg/mL;3.1 mg/mL至6 mg/mL;3.2 mg/mL至6 mg/mL;3.3 mg/mL至6 mg/mL;3.4 mg/mL至6 mg/mL;3.5 mg/mL至6 mg/mL;3.6 mg/mL至6 mg/mL;3.7 mg/mL至6 mg/mL;3.8 mg/mL至6 mg/mL;3.9 mg/mL至6 mg/mL;4.0 mg/mL至6 mg/mL;4.1 mg/mL至6 mg/mL;4.2 mg/mL至6 mg/mL;4.3 mg/mL至6 mg/mL;4.4 mg/mL至6 mg/mL;4.5 mg/mL至6 mg/mL;4.6 mg/mL至6 mg/mL;4.7 mg/mL至6 mg/mL;4.8 mg/mL至6 mg/mL;4.9 mg/mL至6 mg/mL;5.0 mg/mL至6 mg/mL;5.1 mg/mL至6 mg/mL;5.2 mg/mL至6 mg/mL;5.3 mg/mL至6 mg/mL;5.4 mg/mL至6 mg/mL;5.5 mg/mL至6 mg/mL;5.6 mg/mL至6 mg/mL;5.7 mg/mL至6 mg/mL;5.8 mg/mL至6 mg/mL;和 6 mg/mL。
在一个实施方案中,药物组合物中的DTM水凝胶百分比(%)选自本发明的药物组合物中提供的约独立地小于例如药物组合物的100%、90%、80%、70%、60%、50%、40%、30%、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.4%、0.3%、0.2%、0.1%、0.09%、0.08%、0.07%、0.06%、0.05%、0.04%、0.03%、0.02%、0.01%、0.009%、0.008%、0.007%、0.006%、0.005%、0.004%、0.003%、0.002%、0.001%、0.0009%、0.0008%、0.0007%、0.0006%、0.0005%、0.0004%、0.0003%、0.0002%或0.0001% w/w、w/v 或v/v。
该组合物还可包含一种或多种药学上可接受的添加剂和赋形剂。此类添加剂和赋形剂包括但不限于防粘剂、消泡剂、缓冲剂、聚合物、抗氧化剂、防腐剂、螯合剂、粘度调节剂、张力剂、助悬剂、粘合剂、填充剂、增塑剂、润滑剂及其混合物。
也可以使用乙醇、甘油、丙二醇和液体聚乙二醇(及其合适的混合物)、环糊精衍生物和植物油。适当的流动性可以例如通过使用包衣如卵磷脂以在分散的情况下维持所需粒度和通过使用表面活性剂来保持。各种抗菌剂和抗真菌剂可以导致防止微生物的作用,例如对羟基苯甲酸酯、氯丁醇、苯酚、山梨酸和硫柳汞。
该组合物还可包含肽。该组合物还可包含蛋白。该组合物还可包含氨基酸。该组合物还可包含水。
该组合物还可包含至少一种生长因子。在一些情况下,所述至少一种生长因子可以包括胰岛素样生长因子-1、胰岛素样生长因子结合蛋白-3、血管内皮生长因子(VEGF)、肝细胞生长因子(HGF)、胎盘生长因子(PLGF)或其任何组合。所述至少一种生长因子可以增强活力、增强产品稳定性、细胞分化、保持干性(sternness)、减少抗炎或其任何组合。可以将至少一种生长因子添加到组合物中。可以将至少一种生长因子添加到组合物的子组分中。可以将至少一种生长因子添加到粘度调节组分、多个分离的干细胞、分离的诱导性组分、分离的支架组分或其任何组合中。例如,可以将至少一种生长因子添加到本公开的包含脱细胞肌腱基质的组合物中以在移植到宿主中时增强宿主组织与组合物的整合。可以在形成组合物之前添加至少一种生长因子。可以在形成组合物之后添加至少一种生长因子。
该组合物还可包含以下至少一种:趋化因子配体2、巨噬细胞炎性蛋白-1(MIP-1)α、MIP-1β、MIP-2、β-趋化因子配体-5、β-趋化因子配体-20、α-趋化因子配体-14、脂多糖诱导的α-趋化因子、粒细胞-巨噬细胞集落刺激因子、白细胞介素IL-1β、乙酸肉豆蔻酸佛波醇酯(phorbol myristate acetate)、表皮生长因子、成纤维细胞生长因子、血管内皮生长因子、结缔组织生长因子、血小板衍生生长因子、胰岛素样生长因子、神经生长因子、肝细胞生长因子、集落刺激因子、干细胞因子、角质形成细胞生长因子、粒细胞集落刺激因子、粒细胞巨噬细胞集落刺激因子、神经胶质衍生神经营养因子、睫状神经营养因子、内皮单核细胞激活多肽、上皮中性粒细胞激活肽、促红细胞生成素、骨形态发生蛋白、脑源性神经营养因子、转化生长因子β、肿瘤坏死因子或其任何组合。该组合物还可包含至少一种激素。 在一些情况下,至少一种激素可以是催乳素或瘦素。
在某些情况下,可能有六个主要的生长因子家族(EGF、FGF、IGF、PDGF、TGF和VEGF)与愈合相关。此类生长因子的实例可包括但不限于血小板衍生生长因子(PDGF-A、PDGF-B、PDGF-C和PDGF-D)、胰岛素样生长因子I和II(IGF-I和IGF-II)、酸性和碱性成纤维细胞生长因子(aFGF和bFGF)、α和β转化生长因子(TGF-a和TGF-β(例如TGF-β1、TGFβ2、TGFβ3))、表皮生长因子(EGF)等。这些生长因子可以刺激参与愈合的一种或多种细胞的有丝分裂,并且可以组合。
与本文公开的组合物共同施用的其他阳性血管生成剂可以包括但不限于例如HGF、TNF-a、血管生成素、IL-8等。另外的药剂的其他实例可包括血小板衍生生长因子(PDGF)(例如,贝卡普勒明(rhPDGF-BB)例如REGRANEX®、腺苷-A2A受体激动剂;角质细胞生长因子(KGF-2、雷匹夫明;乳铁蛋白(LF);胸腺素β-4(Tβ4);凝血酶衍生的激活受体肽(TP508;CHRYSALIN®;编码血小板衍生生长因子(PDGF-B)的腺病毒载体;自体骨髓干细胞(BMSC);以及工程化活组织移植物(例如Apligraf等)。也可以组合抗生素和抗菌溃疡剂。免疫抑制治疗(例如皮质类固醇、放射疗法、化学疗法)可以与本文公开的组合物组合。
本领域技术人员将理解,另外的药剂可以与本文公开的组合物共同施用或分开施用。
根据需要,本发明的组合物可以以所需量与如上列举的各种其他成分一起包含在适当的溶剂中,然后过滤灭菌。通常,通过将各种已灭菌的活性成分掺入包含基本分散介质和上述列举的那些所需其他成分的无菌媒介物中来制备分散体。
其他药物组合物
药物组合物也可以由本文所述的组合物和一种或多种适用于舌下、口腔、直肠、骨内、眼内、鼻内、硬膜外或椎管内施用的药学上可接受的赋形剂制备。此类药物组合物的制剂是本领域公知的。参见,例如,Anderson等人编辑,Handbook of Clinical Drug Data,第10版, McGraw-Hill, 2002;以及Pratt和Taylor编辑,Principles of Drug Action,第3版,Churchill Livingston, N.Y., 1990,其各自以其整体通过引用并入本文。
本发明的组合物也可以经由浸渍或涂覆的装置如缝合线,例如缝合锚钉来递送。此类施用方法可以例如帮助预防或改善肌腱损伤或受伤。本发明的组合物可以例如通过缝合线或缝线锚钉的局部递送来施用。在一些实施方案中,本发明的化合物与基质混合。此类基质可以是聚合物基质,并且可以用于将化合物结合到支架上。适用于此类用途的聚合物基质包括,例如,基于内酯的聚酯或共聚酯,如聚丙交酯、聚己内酯乙交酯、聚原酸酯、聚酐、聚氨基酸、多糖、聚磷腈(polyphosphazenes)、聚(醚-酯)共聚物(例如PEO-PLLA);聚二甲基硅氧烷、聚(乙烯-醋酸乙烯酯)、基于丙烯酸酯的聚合物或共聚物(例如聚甲基丙烯酸羟乙基甲酯、聚乙烯吡咯烷酮)、氟化聚合物如聚四氟乙烯和纤维素酯;和聚醚醚酮(PEEK)。金属或生物复合材料,例如聚乳酸(PLA)和β-三磷酸钙(β-TCP)也是合适的。也可以使用PLA/羟基磷灰石,参见例如Dorozhkin, Biomatter, 1:3-56 (2011)。合适的基质可以是非降解的或可以随时间降解,从而释放一种或多种化合物。本发明的组合物可直接施用于肌腱受伤部位和/或直接施用于肌腱损伤部位。在一些方面中,本发明的组合物邻近肌腱受伤部位和/或邻近肌腱损伤部位施用。在另一方面中,本发明的组合物施用于需要再生的肌腱。
DTM水凝胶可以通过各种方法(如浸涂/旋涂、喷涂、浸涂和/或刷涂)施用于缝合线、缝合锚钉或医疗装置的表面。化合物可以在溶剂中施用并且可以使溶剂蒸发,从而在缝合线、缝合锚钉或医疗装置上形成水凝胶层。或者,化合物可位于缝合线、缝合锚钉或医疗装置的主体中,例如在微通道或微孔中。当植入时,化合物从缝合线、缝合锚钉或医疗装置的主体中扩散出来以接触肌腱。此类缝合线、缝合锚钉或医疗装置可通过将制造为包含此类微孔或微通道的缝合线、缝合锚钉或医疗装置浸入本发明组合物在合适溶剂中的溶液中,然后蒸发溶剂来制备。缝合线、缝合锚钉或医疗装置表面上的过量水凝胶可以经由另外的短暂溶剂清洗去除。在再其他实施方案中,本发明的化合物可以共价连接至缝合线、缝线锚钉或医疗装置。可以使用在体内降解、导致释放本发明化合物的共价接头。任何生物不稳定的键(linkage)都可用于此目的,例如酯键、酰胺键或酸酐键。
在一些方面中,本发明的DTM水凝胶直接施用于肌腱。在一些方面中,使用范围从10号针到25号针的外科或医用针将本发明的DTM水凝胶直接施用于肌腱。 针可以是10号、11号、12号、13号、14号、15号、16号、18号、20号、22号、23号、24号或25号。在一些方面中,针是16号到20号。可以调节DTM水凝胶的粘度以优化通过特定规格针头(例如16号或20号)递送的组合物。
本发明的DTM水凝胶的流变特性可以与特定的医用或外科针头规格相匹配,以实现最佳注射。例如,本发明的DTM水凝胶的动态粘度为约0.05 Pa*s至约1.0 Pa*s。
本发明还提供试剂盒。试剂盒包含单独或组合在合适的包装中的冻干的DTM组合物和碳二亚胺交联剂,以及可包括使用说明、临床研究讨论和副作用列表的书面材料。在一些实施方案中,该试剂盒还包括用于将组合物施用于有需要的肌腱的施药器。在一些实施方案中,该试剂盒还包括能够进行混合的可移除附件。在一个方面中,该试剂盒包括具有冻干DTM的注射器、具有水性重悬缓冲液的第二注射器,以及连接注射器以允许在两个注射器之间混合的混合连接器。此类试剂盒还可包括信息,如科学文献参考、包装插页材料、临床试验结果和/或这些的总结等,其指示或确定组合物的活性和/或优势,和/或描述剂量、施用、副作用、药物相互作用或其他对医疗保健提供者有用的信息。此类信息可能基于各种研究的结果,例如使用实验动物涉及体内模型的研究和基于人类临床试验的研究。
治疗肌腱的方法
在一方面,本发明的组合物用于刺激肌腱再生,所述方法包括:(i)将根据本发明的DTM组合物重悬于药学上可接受的载体中; (ii) 将重悬的 DTM 组合物应用于需要刺激肌腱再生的肌腱部位。
在另一方面,在治疗有需要的对象之前立即制备DTM水凝胶,方法包括:(i)将根据本发明的DTM组合物重悬于药学上可接受的载体中;(ii) 制备 DTM 水凝胶; 和(iii) 将DTM 水凝胶应用于需要刺激肌腱再生的肌腱部位。在某些方面,需要刺激肌腱再生的肌腱部位是一级撕裂。在某些方面,需要刺激肌腱再生的肌腱部位是二级撕裂;在另一方面,需要刺激肌腱再生的肌腱部位是三级撕裂。在某些方面,所述部位是完全撕裂。
在某些方面,需要刺激肌腱再生的肌腱部位是具有急性损伤的部位。在某些方面,需要刺激肌腱再生的肌腱部位选自肱骨外上髁炎、跟腱炎、腓骨肌腱炎、髌骨、股四头肌肌腱炎及其组合。
在某些方面,DTM水凝胶使用碳二亚胺化学制备。在某些方面,DTM水凝胶通过在药学上可接受的注射用无菌溶液中重构DTM来制备。
在一方面,本发明的DTM组合物通过单针注射应用于需要修复的肌腱部位。在一方面,本发明的DTM组合物的应用是图像引导的。在某些方面,使用关节镜将本发明的DTM组合物应用于需要修复的肌腱部位。在另一方面,在开放的手术程序过程中,将本发明的DTM组合物直接应用于需要修复的肌腱部位。
在某些方面,本发明的组合物经由图像引导注射施用至一个或多个关节。 X 射线、计算机断层扫描 (CT) 或超声是引导关节注射的有用成像方法。
尽管已经参考其各种版本以相当多的细节对本发明进行了描述,但其他版本也是可能的。因此,所附权利要求的精神和范围不应限于本文包含的优选版本的描述。
读者的注意力涉及所有与本说明书同时提交并与本说明书一起公开供公众查阅的论文和文献,且所有这些论文和文献的内容通过引用并入本文。 除非另有明确说明,否则在本说明书(包括任何随附的权利要求、摘要和附图)中公开的所有特征可以被用于相同、等效或相似目的的替代特征替换。因此,除非另有明确说明,所公开的每个特征仅是等效或相似特征的通用系列的一个实例。
实施例
现在参考以下实施例描述本文所包含的实施方案。提供这些实施例仅用于说明的目的,并且本文所包含的公开内容绝不应被解释为限于这些实施例,而应被解释为包括由于本文所提供的教导而变得显而易见的任何和所有变体。
实施例1 脱细胞肌腱基质的制备
将人类尸体的跟腱用磷酸盐缓冲盐水 (PBS)、 pH7.4 清洗,然后从肌腱组织样品中除去鞘、脂肪和滑膜组织。然后将肌腱组织样品切碎成尺寸为大约 1 到 4 mm3 的块,然后用磷酸盐缓冲盐水 (PBS) 洗涤。
将切碎的肌腱块浸入含有 1% w/v 十二烷基硫酸钠 (SDS) 的脱细胞溶液中,并适度搅拌。切碎的材料用超纯水多次交换以去除残留的 SDS 和细胞成分。
然后将材料快速冷冻,然后研磨,产生具有一系列粒径的非均质材料。然后将所得材料重悬在 MMP 消化缓冲液中。培养该悬浮液。
然后添加终止溶液以停止 MMP 消化;然后更换缓冲液并中和溶液。然后用洗涤缓冲液的多次缓冲液交换洗涤材料,且然后冻干。
通过将天然肌腱起始材料的 SYTO Green 11(核)染色与最终 DTM 产物进行比较来测定脱细胞。使用苏木精&伊红、4',6-二脒基-2-苯基吲哚 (DAPI) 染色、琼脂糖凝胶电泳和残余 DNA 定量进一步确证脱细胞。DTM 产物基本上没有核染色。残余 DNA 存在的浓度为或低于约2 ng/mL。
MALDI-TOF 质谱法用于证明 DTM 产物中存在 TGF-β。
实施例2 DTM 水凝胶的表征
DTM 水凝胶是通过将本发明的 DTM 重悬在药学上可接受的注射用无菌溶液中而制备。然后采用以下方法(根据 Zuidema 等人,J. Biomed. Mater. Res. B Appl.Biomater., 102:1063-73 (2014))用于表征所得 DTM 水凝胶:(1) 时间扫描以确定水凝胶的胶凝时间。(2) 应变扫描以确定水凝胶相对于应变的线性-粘弹性区域。(3) 频率扫描以确定水凝胶的线性平衡模量平台。(4) 使用从应变和频率扫描中获得的值进行时间扫描,以准确报告平衡模量和胶凝时间。
实施例 3 用于维持天然生长因子概况的DTM 处理
开发了脱细胞和酶处理技术以产生保留 TGF-β 生物活性的脱细胞肌腱基质油灰,以促进组织再生。
肌腱的再生能力很差,且通常通过疤痕愈合,而不是通过类似天然的组织结构愈合,从而导致机械强度降低。因此,肌腱修复(如肩袖修复)的失败率在 20% 到 90% 的范围,取决于患者年龄、撕裂大小和其他生物学因素。对刺激肌腱愈合以产生更强的再生以改善患者结果存在未满足的临床需求。
脱细胞细胞外基质 (ECM) 已被频繁用作用于组织工程的再生材料,因为它保留了组织固有的蛋白和生长因子,且还可以提供结构支持。有多种可驱动肌腱重塑的生长因子,特别是转化生长因子 β (TGF-β),已对其在再生愈合中的作用进行了研究。已经表明,TGF-β 信号传导在发育过程中对肌腱的形成至关重要。受伤后,TGF-β 被暂时调节以通过刺激胶原蛋白生成和血管生成促进愈合。此外,据报道外源性 TGF-β1 注射增加 I 型和III 型胶原蛋白 mRNA,并且在该组中还发现被修复肌腱的生物力学功能增加。
目的 - (i) 开发脱细胞技术,(ii) 开发酶消化脱细胞肌腱的方法,以及 (iii)表征脱细胞肌腱基质 (DTM) 的蛋白谱。
天然肌腱表征 - 目标是确定哪些肌腱最适合开发同种异体移植产物。
髌骨和跟腱的特征在于 DNA 含量和天然蛋白浓度。还确定了每个来源(即近端与远端)内的位置和蛋白谱之间的任何差异。如图1 A-B 和 2A-B所示,未发现髌骨和跟腱之间的显著差异。使用 DNEasy 试剂盒 (Qiagen) 测量 DNA 含量。使用 BCA 试剂盒(ThermoScientific)测量总蛋白含量。 由于 TGF-β 是肌腱愈合中的关键生长因子,因此确定每种肌腱(髌骨 对(vs) 肌腱)及其位置(近端、中端、远端)中预处理(天然)TGF-β 的浓度(参见例如图 2A-B)非常重要。
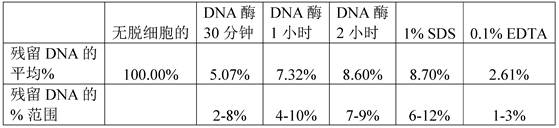
无去污剂脱细胞 - 与传统的基于去污剂的方法相比,该研究的目的是开发一种更温和且更快速的脱细胞方法。将 DNA酶与去污剂(如 SDS 和 EDTA)进行比较,后者通常处理时间很长(1-2 周)。 测试了DNA酶的不同时间和浓度。如图 3 所示,确定使用 DNA酶50U 脱细胞 1 小时与天然 DNA 含量有显著差异,并表明与传统方法等效。
胶原酶消化使蛋白含量最大化 - 酶消化使得将脱细胞肌腱操作为适合手术的形式,如可注射系统或油灰。酶消化被修改以最大化生长因子的功能。如图 4 所示,将胶原酶I、III 和两者的组合与胃蛋白酶消化进行了比较。所有肌腱样品均以每mg 组织的总蛋白(μg)/(μg 蛋白/mg 组织)进行测量。为了制备酶溶液,以2 mg /1 mL PBS使用胶原酶 I(Life Technologies),对于胶原酶 III (MP Biomedicals) 为1 mg/1 mL PBS,对于胃蛋白酶 (Sigma) 为 1 mg/1 mL 0.1 M HCl。所有样品均温育24小时。
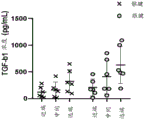
脱细胞肌腱基质 (DTM) 保持 TGF-β 蛋白 - 为确保我们的脱细胞肌腱基质(DTM) 保持生物活性,将天然组织的 TGF-β水平与加工产物进行比较。 TGF-β I、II 和III 在肌腱愈合和修复中都起着重要作用。在酶消化和最后的冻干步骤之后,基于 BCA 结果测量每个样品 30 μg 的总蛋白。TGF-β Milliplex 试剂盒 (Millipore Sigma) 用于测量所有 DTM 样品。如图 5 所示,DTM 的最终原型保留了TGFβI、II 和 III。如图 6A-B 所示,DTM 处理促进了具有拉伸能力的弹性特性(图 6A)而没有被扯断。
对刺激肌腱愈合以产生更强的再生从而改善患者结果存在未满足的临床需求。目前的肌腱修复护理标准具有很高的失败率,部分原因是过度的疤痕导致关节的生物力学功能降低。在该研究中,开发了一种生成脱细胞肌腱基质油灰的技术,所述油灰保留了 TGF-β生物活性,以促进组织再生。正在进行其他测试,如专注于对 DTM 的细胞响应的体外测定和体内肩袖修复模型,以进一步表征在促进肌腱修复中的 DTM 功效。
实施例4 肌腱脱细胞&酶消化和脱细胞肌腱基质 (DTM)的重构
与传统的基于去污剂的方法相比,目的是开发一种更温和且更快速的脱细胞方法。
将 DNA酶与去污剂(如 SDS 和 EDTA)进行比较,后者的处理时间通常很长(1-2周)。测试了DNA酶的不同时间和浓度。确定使用 DNA酶 50U 脱细胞 1 小时与天然 DNA 含量有显著差异,并表明与传统方法等效。DTM是根据以下程序制备的。
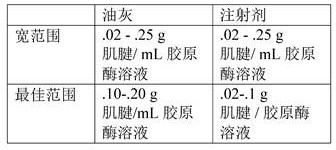
肌腱脱细胞方法 - 首先,对肌腱进行称重和记录。接下来,肌腱被切碎成大小均匀的更小的块。接下来,为了脱细胞,将切碎的块置于 DNA酶溶液中(参见例如下表;0.5 g肌腱/mL DNA酶溶液;DNA酶溶液:每 1 mL 1X PBS 50U DNA酶 I;对于 2 克切碎的肌腱,放置在 4 mL 1X PBS 中并添加200U DNA酶)。接下来,伴随温和振摇在 56℃温育 1 小时。接下来,为了清洗 DTM,以初始体积的两倍添加 1X PBS(如果添加了 1 mL DNA酶溶液,则添加 2 mL 的 1X PBS)。 接下来,将 DTM 放置在 70 um 细胞过滤器上,并以 2000 G 离心5-10 分钟。 最后,在-80 ℃冷冻至少 30 分钟,并将管放入冻干机中。
酶消化(可注射 DTM) - 首先,对脱细胞肌腱进行称重和记录。 接下来,为了产生注射剂,称出 .02-.10 g肌腱并添加 1 mL 胶原酶溶液(I 型胶原酶 @ 2 mg/mL,III 型胶原酶 @ 1 mg/mL 在 1X PBS 中)。接下来,在 37℃温育 24 小时。 接下来,为清洗 DTM,以初始体积的两倍添加 1X PBS(如果添加了 1 mL 胶原酶溶液,则添加 2 mL 的 1X PBS)。接下来,将 DTM 放置在 70 um 细胞过滤器上,并以 2000 G 离心 5-10 分钟。 接下来,将DTM 放入一个新的装有 1 mL PBS 的微量离心管,并涡旋 30 秒。接下来,将此溶液放入100 KDa 过滤器中,并以 12,000 G 旋转 5 分钟。 最后,在-80 ℃冷冻至少 30 分钟,并将管放入冻干机中。
酶消化 (油灰 DTM) - 首先,对脱细胞肌腱进行称重和记录。 接下来,为了产生油灰,称出 .10-.20 g肌腱并添加 1 mL 胶原酶溶液(I 型胶原酶 @ 2 mg/mL,III 型胶原酶 @ 1 mg/mL 在 1X PBS 中)。 接下来,在 37℃ 温育 12 小时。 接下来,为了清洗 DTM,以初始体积的两倍添加 1X PBS(如果添加了 1 mL 胶原酶溶液,则添加 2 mL 的 1XPBS)。接下来,将 DTM 放置在 70 um 细胞过滤器上,并以 2000 G 离心 5-10 分钟。接下来,将 DTM 放入一个新的装有 1 mL PBS 的微量离心管,并涡旋 30 秒。接下来,将此溶液放入 100 KDa 过滤器中,并以 12,000 G 旋转 5 分钟。最后,在-80 ℃冷冻至少 30 分钟,并冻干。
重构 - 添加 2-5 uL 的 1X PBS/mg 肌腱,并可以添加额外的 PBS,直到达到所需的稠度。
经1 小时使用不同浓度的 DNA酶(10U、50U 和 100U)使肌腱脱细胞(参见,例如,图 7)。1X PBS用作无脱细胞的对照。使用 DNEasy 试剂盒 (Qiagen) 测定 DNA 浓度。该数据表明,低至 50U 的 DNA酶在使组织脱细胞中是有效的。如图 8 所示,将 50U 的 DNA酶与传统去污剂、1% SDS 和 0.1% EDTA 进行比较。在 0.5 小时、1 小时和 2 小时对DNA酶50U 进行测试,而标准 SDS 和 EDTA 草案要求进行 24 小时脱细胞。使用 DNEasy 试剂盒(Qiagen,n=3)测定 DNA 浓度。所有值均标准化为无脱细胞。 Tukey的HSD 多重比较事后测试表明DNA酶处理的不同时间或用DNA酶脱细胞对(versus)SDS 和 EDTA 脱细胞之间没有显著差异。下表还表明在各种脱细胞方法和/或不同时间段后,髌骨和跟腱中残留的 DNA百分比:
对天然肌腱进行表征以确定哪些肌腱最适合开发同种异体移植产物。
髌骨和跟腱的特征在于 DNA 含量和天然蛋白浓度。我们还旨在确定每种来源(即近端对(vs.)远端)内位置和蛋白谱之间的任何差异。未发现肌腱不同区域之间的总蛋白或TGFβ含量的显著差异。然而,我们确实发现跟腱具有更高的蛋白相对含量。跟腱和髌腱分为1/3 部分,由肌腱的近端、中间质/中端和远端组成。(图9A-D) 使用 BCA 蛋白定量试剂盒(Thermo Scientific)测量天然肌腱的总蛋白。(图9E-H) 使用 TGF-β磁珠面板 Milliplex试剂盒(Millipore Sigma,#TGFBMAG-64K-03)测量 TGF-β。方差分析显示肌腱区域之间没有统计学上的显著差异,因此整个肌腱可以通过处理使用。当比较两种不同的肌腱时(图9D) 总蛋白没有差异 (P=0.93),但 (图 9H) 跟腱中的 TGF-β 在统计学上高于髌腱 (P =0.0045)。
| F 值 | p 值 | 显著性 | |
| 9A | F (2,15) =0.01075 | 0.9893 | 无 |
| 9B | F (2,15) =1.069 | 0.3680 | 无 |
| 9C | F (2,33) =0.9342 | 0.4030 | 无 |
| 9E | F (2,15) =1.849 | 0.1915 | 无 |
| 9F | F (2,15) =0.3373 | 0.7190 | 无 |
| 9G | F (2,33) =0.7912 | 0.4617 | 无 |
如图 10 所示,过滤有效地消除了胶原酶活性。用胶原酶处理脱细胞肌腱以改善DTM 的形状因子(form-factor)。100 kDa 过滤器在消除最终产物中的胶原酶活性方面非常有效。方差分析表明各组具有显著差异(F (4, 22) = 18.06, p<0.0001)。重要的是,天然样品和 100 kDa 过滤样品之间的胶原酶活性没有显著差异。
| 比较 | p 值 | 显著性 |
| 天然的对(vs.)脱细胞的 | 0.9919 | 无 |
| 天然的对胶原酶 无过滤器 | <0.0001 | **** |
| 天然的对胶原酶 70 um 过滤器 | 0.0116 | * |
| 天然的对胶原酶 100 kDa 过滤器 | 0.9635 | 无 |
| 脱细胞的对胶原酶 无过滤器 | <0.0001 | **** |
| 脱细胞的对胶原酶 70 um 过滤器 | 0.0381 | * |
| 脱细胞的对胶原酶 100 kDa 过滤器 | >0.9999 | 无 |
| 胶原酶 无过滤器对胶原酶 70 um 过滤器 | 0.0021 | ** |
| 胶原酶 无过滤器对胶原酶 100 kDa 过滤器 | <0.0001 | **** |
| 胶原酶 70 um 过滤器对胶原酶 100 kDa 过滤器 | 0.003 | ** |
如图 11 所示,与用胃蛋白酶使肌腱脱细胞的标准方法相比,DTM 中保留了更多的生物活性。脱细胞后使用含有 1型胶原酶(92.5 g肌腱/g 胶原酶 1)和 3(185 g肌腱/1g胶原酶 3)的溶液或使用胃蛋白酶消化肌腱,考虑到在先公开的方法(Farnebo 等人 2014,PMID : 24341855)。方差分析表明组间存在显著差异,F (3,11) = 5.056,p = 0.0193。Tukey的HSD 事后显示胃蛋白酶具有显著更少的 TGF-b(P = 0.0249)。
如图15所示,经两个处理步骤,来自四种不同供体的四个样品的标准化 TGFb 含量。对于每种供体,第一列代表天然肌腱中TGFb 的量,第二列代表脱细胞肌腱中 TGFb 的量,和第三列代表消化肌腱中TGFb 的量。下表还描述了经过加工步骤的百分比变化(从天然肌腱到胶原酶加工后测量的百分比增加):
| 供体 | TGF-b的增加% |
| #1 | 590.16 |
| #2 | 677.04 |
| #3 | 144.75 |
| #4 | 210.36 |
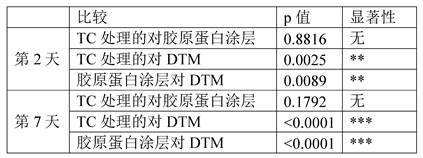
研究了铺在不同表面上的细胞增殖的差异(参见例如图12A-C)。组织培养板未经处理(对照,“TC 处理”),用胶原蛋白或用DTM 涂布。原代肌腱细胞 (ZenBio #TEN-F) 以20,000 个细胞/孔铺板,并在铺板后 (A) 48 小时或 (B) 7 天使用 Presto Blue(Thermo Fisher) 量化细胞活力,产生显著不同的生长速率 (C )。 (方差分析 = F (3,26) = 10.6, p<O.0001)。
Claims (55)
1.一种包含基质金属蛋白酶 (MMP) 消化的肌腱组织的脱细胞肌腱基质 (DTM) 组合物。
2.权利要求1所述的脱细胞肌腱基质(DTM)组合物,进一步包含抗微生物剂。
3.权利要求1所述的脱细胞肌腱基质(DTM)组合物,进一步包含无菌水性载体溶液。
4.权利要求1-3中任一项所述的脱细胞肌腱基质(DTM),其中所述DTM富含蛋白质,保留了存在于切碎的肌腱组织中的至少50%的生长因子。
5.一种制备脱细胞肌腱基质 (DTM) 组合物的方法,所述方法包括一个或多个选自以下的步骤:
切碎肌腱组织样品;
使切碎的肌腱组织样品脱细胞;
研磨;
消化;
停止;
中和;
洗涤;和
冻干。
6.权利要求5所述的方法,其中所述消化步骤包括用选自MMP-2、MMP-9、MMP-14及其组合的基质金属蛋白酶(MMP)消化。
7.一种脱细胞肌腱基质 (DTM) 组合物,其中所述DTM 组合物通过包括选自以下的一个或多个步骤的方法而制备:
切碎肌腱组织样品;
使切碎的肌腱组织样品脱细胞;
消化;和
冻干。
8.一种脱细胞肌腱基质 (DTM) 组合物,其中所述DTM 组合物通过包括选自以下的一个或多个步骤的方法而制备:
切碎肌腱组织样品;
使切碎的肌腱组织样品脱细胞;
研磨;
消化;
停止和中和;
洗涤;和
冻干。
9.权利要求7或8中任一项所述的组合物,其中所述脱细胞步骤包括将切碎的肌腱组织样品暴露于包含一种或多种选自以下的组分的溶液:离液盐、非离子去污剂、两性离子去污剂、阳离子去污剂、阴离子去污剂或其组合。
10.权利要求7或8中任一项所述的组合物,其中所述消化步骤包括用包含基质金属蛋白酶(MMP)的溶液消化。
11.权利要求10所述的组合物,其中所述基质金属蛋白酶(MMP)选自MMP-2、MMP-9、MMP-14或其组合。
12.权利要求7或8中任一项所述的组合物,其中所述停止和中和步骤包括用包含一种或多种选自TAPI-0、TAPI-1、TAPI-2、马立马司他、膦酰二肽、木犀草素、PMSF、胃酶抑素 A、亮抑酶肽、E-64、原钒酸钠或其组合的蛋白酶抑制剂的溶液停止和中和。
13.一种刺激肌腱再生的方法,所述方法包括:(i) 将根据权利要求1或7的DTM组合物重悬在药学上可接受的载体中;和(ii) 将所述重悬的 DTM 组合物应用于需要刺激肌腱再生的肌腱部位。
14.一种脱细胞肌腱基质 (DTM) 水凝胶,包含重悬的根据权利要求 1 或 4 的 DTM组合物、l-乙基-3-[3-二甲基氨基丙基]碳二亚胺 (EDC) 和 PEG-N-羟基琥珀酰亚胺(NHS) 酯。
15.一种软铸脱细胞肌腱基质 (DTM) 物体,其中所述软铸物体通过包括选自以下的一个或多个步骤的方法制备:
将根据权利要求1或4的脱细胞肌腱基质(DTM)组合物重悬在生理缓冲液中;
将 DTM 组合物与 PEG-N-羟基琥珀酰亚胺 (NHS) 酯混合以产生软水凝胶;
将软水凝胶转移到三维模具;和,
固化和灭活聚合反应。
16.一种脱细胞肌腱基质 (DTM) 水凝胶,包含重悬的根据权利要求 1 或 7 的 DTM组合物,还包含1-乙基-3-[3-二甲基氨基丙基]碳二亚胺 (EDC) 和水溶性偶联剂,所述水溶性偶联剂选自与(EDC)偶联剂连接的N-羟基琥珀酰亚胺(NHS)或N-羟基磺基琥珀酰亚胺(sulfoNHS)。
17.一种在对象中治疗肌腱撕裂和/或刺激肌腱再生的方法,所述方法包括:
获得包含基质金属蛋白酶 (MMP) 消化的肌腱组织的脱细胞肌腱基质 (DTM) 组合物;
将所述DTM 组合物重悬在药学上可接受的载体中;和
将所述重悬的DTM组合物应用于需要刺激肌腱再生的肌腱部位。
18.一种由天然肌腱产生的脱细胞肌腱基质,所述脱细胞肌腱基质包含大于90重量%的天然肌腱中的TGF-β。
19.权利要求18所述的脱细胞肌腱基质,所述脱细胞肌腱基质包含大于95重量%的天然肌腱中的TGF-β。
20.权利要求18所述的脱细胞肌腱基质,所述脱细胞肌腱基质包含大于99重量%的天然肌腱中的TGF-β。
21.权利要求18-20中任一项所述的脱细胞肌腱基质,包含小于5重量%的天然肌腱中的细胞材料。
22.权利要求18-20中任一项所述的脱细胞肌腱基质,包含小于2重量%的天然肌腱中的细胞材料。
23.权利要求18-20中任一项所述的脱细胞肌腱基质,包含小于1重量%的天然肌腱中的细胞材料。
24.权利要求18-20中任一项所述的脱细胞肌腱基质,包含小于0.1重量%的天然肌腱中的细胞材料。
25.权利要求18-24中任一项所述的脱细胞肌腱基质,其中所述脱细胞肌腱基质基本上不含产生TGF-β的细胞。
26.权利要求18-25中任一项所述的脱细胞肌腱基质,包含小于5重量%的天然肌腱中的DNA。
27.权利要求18-25中任一项所述的脱细胞肌腱基质,包含小于2重量%的天然肌腱中的DNA。
28.权利要求18-25中任一项所述的脱细胞肌腱基质,包含小于1重量%的天然肌腱中的DNA。
29.权利要求18-25中任一项所述的脱细胞肌腱基质,包含小于0.1重量%的天然肌腱中的DNA。
30.权利要求18-25中任一项所述的脱细胞肌腱基质,其中所述脱细胞肌腱基质基本上不含DNA。
31.一种从肌腱生产脱细胞肌腱基质 (DTM) 组合物的方法,所述方法包括:
使肌腱脱细胞,从而产生脱细胞肌腱;
使脱细胞肌腱与包含基质金属蛋白酶 (MMP) 的酶溶液接触以产生消化的脱细胞肌腱;
冻干消化的脱细胞肌腱以产生冻干的肌腱;和
重构所述冻干肌腱以产生脱细胞肌腱基质。
32.权利要求31所述的方法,其中所述脱细胞包括使所述肌腱与DNA酶溶液接触。
33.权利要求32所述的方法,其中所述DNA酶溶液包含每毫升溶剂约10至约100单位的DNA酶、每毫升溶剂约25至约75单位的DNA酶、每毫升溶剂约40至约60单位的DNA酶、每毫升溶剂约 40 至约 60 单位的 DNA酶或每毫升溶剂约 50 单位的DNA酶。
34.权利要求32-33中任一项所述的方法,其中所述脱细胞包括使所述肌腱与每1克肌腱约4毫升至约50毫升的DNA酶溶液接触。
35.权利要求34所述的方法,其中所述脱细胞包括使所述肌腱与每1克肌腱约5毫升至约10毫升的DNA酶溶液接触。
36.权利要求34所述的方法,其中所述脱细胞包括使所述肌腱与每1克肌腱约10毫升至约50毫升的DNA酶溶液接触。
37.权利要求34-36中任一项所述的方法,其中所述接触发生约1小时的时段,并且任选地在摇床上发生。
38.权利要求31-37中任一项所述的方法,其中所述脱细胞还包括用磷酸盐缓冲盐水洗涤所述肌腱。
39.权利要求31-38中任一项所述的方法,其中所述脱细胞还包括过滤所述肌腱。
40.权利要求31-39中任一项所述的方法,其中所述冻干包括在-80℃将消化的脱细胞肌腱冷冻至少约30分钟。
41.权利要求39所述的方法,其中使用约1500G至约2500G的离心将所述肌腱过滤通过70微米过滤器,持续约1分钟至约15分钟。
42.权利要求31-41中任一项所述的方法,其中所述MMP包括胶原酶。
43.权利要求42所述的方法,其中所述胶原酶选自I型胶原酶、III型胶原酶及其组合。
44.权利要求43所述的方法,其包括I型胶原酶,其中酶溶液中所述I型胶原酶的浓度为每毫升约2毫克。
45.权利要求43所述的方法,其包括III型胶原酶,其中酶溶液中所述III型胶原酶的浓度为每毫升约1毫克。
46.权利要求31-45中任一项所述的方法,其中所述脱细胞肌腱与每1克肌腱约10毫升至约50毫升的酶溶液接触。
47.权利要求18-45中任一项所述的方法,其中所述脱细胞肌腱与每1克肌腱约5毫升至约10毫升的酶溶液接触。
48.权利要求31-47中任一项所述的方法,其中将所述脱细胞肌腱与酶溶液接触约24小时。
49.权利要求31-47中任一项所述的方法,其中将所述脱细胞肌腱与酶溶液接触约12小时。
50.权利要求31-49中任一项所述的方法,其中在约37℃使所述脱细胞肌腱与酶溶液接触。
51.权利要求31-50中任一项所述的方法,其中所述重构包括将约2微升至约5微升的溶剂与约1毫克冻干肌腱混合。
52.根据权利要求31-51中任一项所述的方法生产的脱细胞肌腱基质。
53.根据权利要求31-51中任一项所述的方法生产的用于植入对象的脱细胞肌腱基质。
54.一种用于植入患者的组织再生支架,其包含根据权利要求31-51中任一项所述的方法生产的脱细胞肌腱基质材料。
55.如权利要求18-30和52-54中任一项所述的脱细胞肌腱基质材料,进一步包含赋形剂。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201862782903P | 2018-12-20 | 2018-12-20 | |
| US62/782903 | 2018-12-20 | ||
| US201962890865P | 2019-08-23 | 2019-08-23 | |
| US62/890865 | 2019-08-23 | ||
| PCT/US2019/068112 WO2020132608A1 (en) | 2018-12-20 | 2019-12-20 | Decellularized tendon matrix methods and uses thereof |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN114040730A true CN114040730A (zh) | 2022-02-11 |
Family
ID=71101957
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201980092758.3A Pending CN114040730A (zh) | 2018-12-20 | 2019-12-20 | 脱细胞肌腱基质方法及其用途 |
Country Status (9)
| Country | Link |
|---|---|
| US (1) | US20220047775A1 (zh) |
| EP (1) | EP3897456A4 (zh) |
| JP (1) | JP2022514775A (zh) |
| KR (1) | KR20220002245A (zh) |
| CN (1) | CN114040730A (zh) |
| AU (1) | AU2019404558B2 (zh) |
| CA (1) | CA3124665A1 (zh) |
| MX (1) | MX2021007422A (zh) |
| WO (1) | WO2020132608A1 (zh) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN117018293A (zh) * | 2023-08-07 | 2023-11-10 | 武汉理工大学 | 一种细胞外基质创面修复支架及其制备方法与应用 |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| MX2023000120A (es) * | 2020-06-20 | 2023-02-09 | The Steadman Clinic And Steadman Philippon Res Institute | Metodos de matriz de tendon descelularizada y usos de los mismos. |
Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2013165740A (ja) * | 2010-05-14 | 2013-08-29 | Waseda Univ | 無細胞化方法及び人体移植用人工組織 |
| US20130236439A1 (en) * | 2012-03-08 | 2013-09-12 | Lifecell Corporation | Enzyme-activated collagen and tissue matrices |
| US20140350677A1 (en) * | 2011-12-09 | 2014-11-27 | The Board Of Trustees Of The Leland Stanford Junior University | Decellularized composite tissue bioscaffolds for musculoskeletal tissue interface reconstruction and methods of production |
| US20160053250A1 (en) * | 2013-04-05 | 2016-02-25 | Claudia Zylberberg | Matrix metalloproteinasses and uses thereof |
| WO2017143344A1 (en) * | 2016-02-18 | 2017-08-24 | The Curators Of The University Of Missouri | Injectable nanomaterial-extracellular matrix constructs |
| CN107737373A (zh) * | 2017-12-07 | 2018-02-27 | 山东隽秀生物科技股份有限公司 | 一种肌腱修复材料的制备方法 |
Family Cites Families (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2010101883A2 (en) * | 2009-03-06 | 2010-09-10 | Mayo Foundation For Medical Education And Research | Tendon or ligament tissue engineering |
| US8968785B2 (en) * | 2009-10-02 | 2015-03-03 | Covidien Lp | Surgical compositions |
| WO2014144215A1 (en) * | 2013-03-15 | 2014-09-18 | The Board Of Trustees Of The Leland Stanford Junior University | Injectable composition for in-situ repair and regeneration of an injured ligament or tendon and methods of use |
| JP6454125B2 (ja) * | 2014-10-14 | 2019-01-16 | 地方独立行政法人東京都立産業技術研究センター | コラーゲンゲルの作製方法 |
-
2019
- 2019-12-20 JP JP2021536113A patent/JP2022514775A/ja active Pending
- 2019-12-20 WO PCT/US2019/068112 patent/WO2020132608A1/en not_active Ceased
- 2019-12-20 CA CA3124665A patent/CA3124665A1/en active Pending
- 2019-12-20 EP EP19898521.0A patent/EP3897456A4/en active Pending
- 2019-12-20 CN CN201980092758.3A patent/CN114040730A/zh active Pending
- 2019-12-20 KR KR1020217022979A patent/KR20220002245A/ko active Pending
- 2019-12-20 AU AU2019404558A patent/AU2019404558B2/en active Active
- 2019-12-20 MX MX2021007422A patent/MX2021007422A/es unknown
- 2019-12-20 US US17/415,501 patent/US20220047775A1/en active Pending
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2013165740A (ja) * | 2010-05-14 | 2013-08-29 | Waseda Univ | 無細胞化方法及び人体移植用人工組織 |
| US20140350677A1 (en) * | 2011-12-09 | 2014-11-27 | The Board Of Trustees Of The Leland Stanford Junior University | Decellularized composite tissue bioscaffolds for musculoskeletal tissue interface reconstruction and methods of production |
| US20130236439A1 (en) * | 2012-03-08 | 2013-09-12 | Lifecell Corporation | Enzyme-activated collagen and tissue matrices |
| US20160053250A1 (en) * | 2013-04-05 | 2016-02-25 | Claudia Zylberberg | Matrix metalloproteinasses and uses thereof |
| WO2017143344A1 (en) * | 2016-02-18 | 2017-08-24 | The Curators Of The University Of Missouri | Injectable nanomaterial-extracellular matrix constructs |
| CN107737373A (zh) * | 2017-12-07 | 2018-02-27 | 山东隽秀生物科技股份有限公司 | 一种肌腱修复材料的制备方法 |
Non-Patent Citations (1)
| Title |
|---|
| LING-JU NING等: ""preparation and characterization of decellularized tendon slices for tendon tissue engineering",Ling-Ju Ning等,《J Biomed Mater Res Part A》,第1448-1456页", 《J BIOMED MATER RES PART A》, 31 December 2012 (2012-12-31), pages 1448 - 1456 * |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN117018293A (zh) * | 2023-08-07 | 2023-11-10 | 武汉理工大学 | 一种细胞外基质创面修复支架及其制备方法与应用 |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2020132608A1 (en) | 2020-06-25 |
| EP3897456A1 (en) | 2021-10-27 |
| MX2021007422A (es) | 2021-12-10 |
| AU2019404558A1 (en) | 2021-08-12 |
| KR20220002245A (ko) | 2022-01-06 |
| EP3897456A4 (en) | 2022-09-21 |
| CA3124665A1 (en) | 2020-06-25 |
| JP2022514775A (ja) | 2022-02-15 |
| AU2019404558B2 (en) | 2025-08-21 |
| US20220047775A1 (en) | 2022-02-17 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US12090175B2 (en) | Compositions and methods for tissue repair with extracellular matrices | |
| Kawecki et al. | A review of decellurization methods caused by an urgent need for quality control of cell‐free extracellular matrix'scaffolds and their role in regenerative medicine | |
| US10729729B2 (en) | Compositions and methods for treating and preventing tissue injury and disease | |
| US20180125897A1 (en) | Decellularized Adipose Cell Growth Scaffold | |
| JP6545102B2 (ja) | 心病態を治療する方法 | |
| US11246891B2 (en) | Compositions and methods for treating and preventing tissue injury and disease | |
| US20250367241A1 (en) | Compositions and methods for treating and preventing tissue injury and disease | |
| US20160271187A1 (en) | Compositions and methods for treating and preventing tissue injury and disease | |
| AU2019404558B2 (en) | Decellularized tendon matrix methods and uses thereof | |
| US20200353008A1 (en) | Compositions and methods for treating nerve injury | |
| Goncharuk et al. | Matrix Metalloproteinase-9 is involved in the fibrotic process in denervated muscles after sciatic nerve trauma and recovery | |
| HK40068683A (zh) | 脱细胞肌腱基质方法及其用途 | |
| CN112839687A (zh) | 脱细胞的肌肉基质 | |
| HK40086575A (zh) | 脱细胞肌腱基质方法及其用途 | |
| US20230226257A1 (en) | Decellularized tendon matrix methods and uses thereof | |
| HK1212380B (zh) | 用於治疗和预防组织损伤和疾病的组合物和方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| REG | Reference to a national code |
Ref country code: HK Ref legal event code: DE Ref document number: 40068683 Country of ref document: HK |