CN107428816B - 针对肿瘤抗原ny-eso-1的mhc i和mhc ii-限制表位的癌症的组合t细胞受体基因疗法 - Google Patents
针对肿瘤抗原ny-eso-1的mhc i和mhc ii-限制表位的癌症的组合t细胞受体基因疗法 Download PDFInfo
- Publication number
- CN107428816B CN107428816B CN201680015622.9A CN201680015622A CN107428816B CN 107428816 B CN107428816 B CN 107428816B CN 201680015622 A CN201680015622 A CN 201680015622A CN 107428816 B CN107428816 B CN 107428816B
- Authority
- CN
- China
- Prior art keywords
- tcr
- seq
- acid sequence
- amino acid
- amino acids
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 102100025570 Cancer/testis antigen 1 Human genes 0.000 title claims abstract description 69
- 101000856237 Homo sapiens Cancer/testis antigen 1 Proteins 0.000 title claims abstract description 69
- 206010028980 Neoplasm Diseases 0.000 title claims abstract description 55
- 238000001415 gene therapy Methods 0.000 title claims abstract description 9
- 239000000427 antigen Substances 0.000 title claims description 52
- 108091007433 antigens Proteins 0.000 title claims description 51
- 102000036639 antigens Human genes 0.000 title claims description 51
- 201000011510 cancer Diseases 0.000 title abstract description 19
- 108700042075 T-Cell Receptor Genes Proteins 0.000 title description 2
- 108091008874 T cell receptors Proteins 0.000 claims abstract description 237
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 claims abstract description 204
- 210000001744 T-lymphocyte Anatomy 0.000 claims abstract description 96
- 210000004027 cell Anatomy 0.000 claims abstract description 79
- 150000007523 nucleic acids Chemical class 0.000 claims abstract description 46
- 108020004707 nucleic acids Proteins 0.000 claims abstract description 45
- 102000039446 nucleic acids Human genes 0.000 claims abstract description 45
- 150000001413 amino acids Chemical class 0.000 claims abstract description 37
- 230000027455 binding Effects 0.000 claims abstract description 36
- 102000004169 proteins and genes Human genes 0.000 claims abstract description 23
- 108090000623 proteins and genes Proteins 0.000 claims abstract description 21
- 238000002659 cell therapy Methods 0.000 claims abstract description 13
- 201000010099 disease Diseases 0.000 claims abstract description 13
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims abstract description 13
- 108010047041 Complementarity Determining Regions Proteins 0.000 claims abstract description 12
- 238000011282 treatment Methods 0.000 claims abstract description 9
- 230000002062 proliferating effect Effects 0.000 claims abstract description 8
- 238000009169 immunotherapy Methods 0.000 claims abstract description 6
- 238000003745 diagnosis Methods 0.000 claims abstract description 5
- 230000002265 prevention Effects 0.000 claims abstract description 5
- 108010046732 HLA-DR4 Antigen Proteins 0.000 claims abstract 4
- 108010058597 HLA-DR Antigens Proteins 0.000 claims description 17
- 102000006354 HLA-DR Antigens Human genes 0.000 claims description 17
- 239000008194 pharmaceutical composition Substances 0.000 claims description 12
- 239000003814 drug Substances 0.000 claims description 10
- 238000004519 manufacturing process Methods 0.000 claims description 8
- 108091005461 Nucleic proteins Proteins 0.000 claims description 3
- 238000002360 preparation method Methods 0.000 claims description 2
- 125000003275 alpha amino acid group Chemical group 0.000 claims 40
- 101100005713 Homo sapiens CD4 gene Proteins 0.000 claims 1
- 241000699670 Mus sp. Species 0.000 abstract description 26
- 210000001266 CD8-positive T-lymphocyte Anatomy 0.000 abstract description 8
- 238000011830 transgenic mouse model Methods 0.000 abstract description 8
- 102000018713 Histocompatibility Antigens Class II Human genes 0.000 abstract description 7
- 241000699660 Mus musculus Species 0.000 abstract description 7
- 230000003612 virological effect Effects 0.000 abstract description 6
- 108010027412 Histocompatibility Antigens Class II Proteins 0.000 abstract description 5
- 102000008949 Histocompatibility Antigens Class I Human genes 0.000 abstract description 3
- 108010088652 Histocompatibility Antigens Class I Proteins 0.000 abstract description 3
- 102000006707 alpha-beta T-Cell Antigen Receptors Human genes 0.000 abstract description 3
- 108010087408 alpha-beta T-Cell Antigen Receptors Proteins 0.000 abstract description 3
- 101100112922 Candida albicans CDR3 gene Proteins 0.000 description 31
- 230000009258 tissue cross reactivity Effects 0.000 description 31
- 235000018102 proteins Nutrition 0.000 description 17
- 230000014509 gene expression Effects 0.000 description 16
- 108090000765 processed proteins & peptides Proteins 0.000 description 16
- 241000699666 Mus <mouse, genus> Species 0.000 description 15
- 239000013604 expression vector Substances 0.000 description 13
- 201000001441 melanoma Diseases 0.000 description 12
- 108010074032 HLA-A2 Antigen Proteins 0.000 description 11
- 102000025850 HLA-A2 Antigen Human genes 0.000 description 11
- 210000001519 tissue Anatomy 0.000 description 10
- 239000013598 vector Substances 0.000 description 9
- 238000012546 transfer Methods 0.000 description 7
- 235000001014 amino acid Nutrition 0.000 description 6
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 6
- 241000282412 Homo Species 0.000 description 5
- 101100096028 Mus musculus Smok1 gene Proteins 0.000 description 5
- 229940079593 drug Drugs 0.000 description 5
- 238000000034 method Methods 0.000 description 5
- 210000004881 tumor cell Anatomy 0.000 description 5
- 102100035361 Cerebellar degeneration-related protein 2 Human genes 0.000 description 4
- 101000737796 Homo sapiens Cerebellar degeneration-related protein 2 Proteins 0.000 description 4
- 230000002950 deficient Effects 0.000 description 4
- 230000001965 increasing effect Effects 0.000 description 4
- 210000000265 leukocyte Anatomy 0.000 description 4
- 239000002773 nucleotide Substances 0.000 description 4
- 125000003729 nucleotide group Chemical group 0.000 description 4
- 238000003259 recombinant expression Methods 0.000 description 4
- 230000001177 retroviral effect Effects 0.000 description 4
- 206010005003 Bladder cancer Diseases 0.000 description 3
- 108090000695 Cytokines Proteins 0.000 description 3
- 102000004127 Cytokines Human genes 0.000 description 3
- 101000737793 Homo sapiens Cerebellar degeneration-related antigen 1 Proteins 0.000 description 3
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 3
- 108091054438 MHC class II family Proteins 0.000 description 3
- 206010030155 Oesophageal carcinoma Diseases 0.000 description 3
- 210000000173 T-lymphoid precursor cell Anatomy 0.000 description 3
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 description 3
- 238000003556 assay Methods 0.000 description 3
- 238000003501 co-culture Methods 0.000 description 3
- 239000012636 effector Substances 0.000 description 3
- 238000000684 flow cytometry Methods 0.000 description 3
- 230000006870 function Effects 0.000 description 3
- 238000002649 immunization Methods 0.000 description 3
- 230000003053 immunization Effects 0.000 description 3
- 238000011534 incubation Methods 0.000 description 3
- 239000011886 peripheral blood Substances 0.000 description 3
- 102000004196 processed proteins & peptides Human genes 0.000 description 3
- 206010042863 synovial sarcoma Diseases 0.000 description 3
- 201000005112 urinary bladder cancer Diseases 0.000 description 3
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical group N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 2
- 241000196324 Embryophyta Species 0.000 description 2
- 208000000461 Esophageal Neoplasms Diseases 0.000 description 2
- 102100040485 HLA class II histocompatibility antigen, DRB1 beta chain Human genes 0.000 description 2
- 108010039343 HLA-DRB1 Chains Proteins 0.000 description 2
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 description 2
- 108060003951 Immunoglobulin Proteins 0.000 description 2
- 108010002350 Interleukin-2 Proteins 0.000 description 2
- 241001465754 Metazoa Species 0.000 description 2
- 108010004729 Phycoerythrin Proteins 0.000 description 2
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 description 2
- 230000001154 acute effect Effects 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 230000009260 cross reactivity Effects 0.000 description 2
- 238000012258 culturing Methods 0.000 description 2
- 230000006378 damage Effects 0.000 description 2
- 230000000694 effects Effects 0.000 description 2
- 230000008030 elimination Effects 0.000 description 2
- 238000003379 elimination reaction Methods 0.000 description 2
- 201000004101 esophageal cancer Diseases 0.000 description 2
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 2
- 230000005714 functional activity Effects 0.000 description 2
- 238000010230 functional analysis Methods 0.000 description 2
- 210000004602 germ cell Anatomy 0.000 description 2
- 208000014829 head and neck neoplasm Diseases 0.000 description 2
- 210000005260 human cell Anatomy 0.000 description 2
- 102000018358 immunoglobulin Human genes 0.000 description 2
- 230000001939 inductive effect Effects 0.000 description 2
- 201000005202 lung cancer Diseases 0.000 description 2
- 208000020816 lung neoplasm Diseases 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- 210000003071 memory t lymphocyte Anatomy 0.000 description 2
- 238000010172 mouse model Methods 0.000 description 2
- 239000002245 particle Substances 0.000 description 2
- 210000005259 peripheral blood Anatomy 0.000 description 2
- 229920001184 polypeptide Polymers 0.000 description 2
- 230000004044 response Effects 0.000 description 2
- 206010041823 squamous cell carcinoma Diseases 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- 230000008685 targeting Effects 0.000 description 2
- 238000002560 therapeutic procedure Methods 0.000 description 2
- 230000026683 transduction Effects 0.000 description 2
- 238000010361 transduction Methods 0.000 description 2
- 230000009261 transgenic effect Effects 0.000 description 2
- 239000013603 viral vector Substances 0.000 description 2
- 206010069754 Acquired gene mutation Diseases 0.000 description 1
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 description 1
- 208000014697 Acute lymphocytic leukaemia Diseases 0.000 description 1
- 208000031261 Acute myeloid leukaemia Diseases 0.000 description 1
- 206010052747 Adenocarcinoma pancreas Diseases 0.000 description 1
- 108010088751 Albumins Proteins 0.000 description 1
- 102000009027 Albumins Human genes 0.000 description 1
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 1
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 1
- 108700028369 Alleles Proteins 0.000 description 1
- 102000006306 Antigen Receptors Human genes 0.000 description 1
- 108010083359 Antigen Receptors Proteins 0.000 description 1
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 description 1
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 241000283725 Bos Species 0.000 description 1
- 206010006187 Breast cancer Diseases 0.000 description 1
- 208000026310 Breast neoplasm Diseases 0.000 description 1
- 201000009030 Carcinoma Diseases 0.000 description 1
- 208000017897 Carcinoma of esophagus Diseases 0.000 description 1
- 206010057248 Cell death Diseases 0.000 description 1
- 208000005243 Chondrosarcoma Diseases 0.000 description 1
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 description 1
- 206010009944 Colon cancer Diseases 0.000 description 1
- 208000001333 Colorectal Neoplasms Diseases 0.000 description 1
- 241000195493 Cryptophyta Species 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- 238000002965 ELISA Methods 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 241000233866 Fungi Species 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 102100040505 HLA class II histocompatibility antigen, DR alpha chain Human genes 0.000 description 1
- 108010059234 HLA-DPw4 antigen Proteins 0.000 description 1
- 108010067802 HLA-DR alpha-Chains Proteins 0.000 description 1
- 108010001336 Horseradish Peroxidase Proteins 0.000 description 1
- 206010062016 Immunosuppression Diseases 0.000 description 1
- 102000008070 Interferon-gamma Human genes 0.000 description 1
- 108010074328 Interferon-gamma Proteins 0.000 description 1
- 108090000172 Interleukin-15 Proteins 0.000 description 1
- 108010002586 Interleukin-7 Proteins 0.000 description 1
- 208000031422 Lymphocytic Chronic B-Cell Leukemia Diseases 0.000 description 1
- 206010025323 Lymphomas Diseases 0.000 description 1
- 206010025327 Lymphopenia Diseases 0.000 description 1
- 102000043131 MHC class II family Human genes 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 208000000172 Medulloblastoma Diseases 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 206010027476 Metastases Diseases 0.000 description 1
- 206010027480 Metastatic malignant melanoma Diseases 0.000 description 1
- 241001529936 Murinae Species 0.000 description 1
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 description 1
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 description 1
- 108091007491 NSP3 Papain-like protease domains Proteins 0.000 description 1
- 206010029260 Neuroblastoma Diseases 0.000 description 1
- 206010061535 Ovarian neoplasm Diseases 0.000 description 1
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 description 1
- 206010060862 Prostate cancer Diseases 0.000 description 1
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 1
- 208000007660 Residual Neoplasm Diseases 0.000 description 1
- 240000002967 Sium sisarum Species 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 208000005718 Stomach Neoplasms Diseases 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- 108020005038 Terminator Codon Proteins 0.000 description 1
- 210000000447 Th1 cell Anatomy 0.000 description 1
- 210000004241 Th2 cell Anatomy 0.000 description 1
- 241000703392 Tribec virus Species 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 230000033289 adaptive immune response Effects 0.000 description 1
- 208000009956 adenocarcinoma Diseases 0.000 description 1
- 230000001464 adherent effect Effects 0.000 description 1
- 230000009824 affinity maturation Effects 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 229960002685 biotin Drugs 0.000 description 1
- 235000020958 biotin Nutrition 0.000 description 1
- 239000011616 biotin Substances 0.000 description 1
- 210000001185 bone marrow Anatomy 0.000 description 1
- 239000012888 bovine serum Substances 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 239000005018 casein Substances 0.000 description 1
- BECPQYXYKAMYBN-UHFFFAOYSA-N casein, tech. Chemical compound NCCCCC(C(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(CC(C)C)N=C(O)C(CCC(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(C(C)O)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(COP(O)(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(N)CC1=CC=CC=C1 BECPQYXYKAMYBN-UHFFFAOYSA-N 0.000 description 1
- 235000021240 caseins Nutrition 0.000 description 1
- 230000022534 cell killing Effects 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- 208000032852 chronic lymphocytic leukemia Diseases 0.000 description 1
- 201000010989 colorectal carcinoma Diseases 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 150000001875 compounds Chemical class 0.000 description 1
- 210000004748 cultured cell Anatomy 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- 150000001945 cysteines Chemical class 0.000 description 1
- 230000009089 cytolysis Effects 0.000 description 1
- 210000001151 cytotoxic T lymphocyte Anatomy 0.000 description 1
- 238000012217 deletion Methods 0.000 description 1
- 230000037430 deletion Effects 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 1
- 239000003937 drug carrier Substances 0.000 description 1
- -1 e.g. Proteins 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 201000005619 esophageal carcinoma Diseases 0.000 description 1
- 210000003527 eukaryotic cell Anatomy 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 230000001605 fetal effect Effects 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 230000002538 fungal effect Effects 0.000 description 1
- 206010017758 gastric cancer Diseases 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 1
- 239000010931 gold Substances 0.000 description 1
- 229910052737 gold Inorganic materials 0.000 description 1
- 201000010536 head and neck cancer Diseases 0.000 description 1
- 201000003911 head and neck carcinoma Diseases 0.000 description 1
- 210000002443 helper t lymphocyte Anatomy 0.000 description 1
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 1
- 231100000844 hepatocellular carcinoma Toxicity 0.000 description 1
- 238000011577 humanized mouse model Methods 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 230000005847 immunogenicity Effects 0.000 description 1
- 230000001506 immunosuppresive effect Effects 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 230000002458 infectious effect Effects 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 238000003780 insertion Methods 0.000 description 1
- 230000037431 insertion Effects 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 229960003130 interferon gamma Drugs 0.000 description 1
- 239000000543 intermediate Substances 0.000 description 1
- 238000010212 intracellular staining Methods 0.000 description 1
- FZWBNHMXJMCXLU-BLAUPYHCSA-N isomaltotriose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1OC[C@@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@@H](OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C=O)O1 FZWBNHMXJMCXLU-BLAUPYHCSA-N 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 201000005296 lung carcinoma Diseases 0.000 description 1
- 210000001165 lymph node Anatomy 0.000 description 1
- 210000004698 lymphocyte Anatomy 0.000 description 1
- 231100001023 lymphopenia Toxicity 0.000 description 1
- 239000006249 magnetic particle Substances 0.000 description 1
- 230000036210 malignancy Effects 0.000 description 1
- 230000003211 malignant effect Effects 0.000 description 1
- 208000026037 malignant tumor of neck Diseases 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 239000003550 marker Substances 0.000 description 1
- 230000001394 metastastic effect Effects 0.000 description 1
- 208000021039 metastatic melanoma Diseases 0.000 description 1
- 206010061289 metastatic neoplasm Diseases 0.000 description 1
- 239000000203 mixture Substances 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 230000001613 neoplastic effect Effects 0.000 description 1
- 231100000956 nontoxicity Toxicity 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 238000011275 oncology therapy Methods 0.000 description 1
- 201000008968 osteosarcoma Diseases 0.000 description 1
- 210000001672 ovary Anatomy 0.000 description 1
- 201000002094 pancreatic adenocarcinoma Diseases 0.000 description 1
- 230000002688 persistence Effects 0.000 description 1
- 239000008363 phosphate buffer Substances 0.000 description 1
- 239000002953 phosphate buffered saline Substances 0.000 description 1
- 239000013612 plasmid Substances 0.000 description 1
- 239000013641 positive control Substances 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 210000004986 primary T-cell Anatomy 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- 238000004393 prognosis Methods 0.000 description 1
- 210000001236 prokaryotic cell Anatomy 0.000 description 1
- 230000005855 radiation Effects 0.000 description 1
- 230000007115 recruitment Effects 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 230000003248 secreting effect Effects 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 230000019491 signal transduction Effects 0.000 description 1
- 238000007860 single-cell PCR Methods 0.000 description 1
- 235000020183 skimmed milk Nutrition 0.000 description 1
- 230000037439 somatic mutation Effects 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 235000010356 sorbitol Nutrition 0.000 description 1
- 230000009870 specific binding Effects 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 230000010473 stable expression Effects 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 238000011301 standard therapy Methods 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 210000000130 stem cell Anatomy 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 201000011549 stomach cancer Diseases 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 210000001550 testis Anatomy 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- 210000001541 thymus gland Anatomy 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 238000013518 transcription Methods 0.000 description 1
- 230000005026 transcription initiation Effects 0.000 description 1
- 230000010474 transient expression Effects 0.000 description 1
- 230000014621 translational initiation Effects 0.000 description 1
- 108091005703 transmembrane proteins Proteins 0.000 description 1
- 102000035160 transmembrane proteins Human genes 0.000 description 1
- 238000002054 transplantation Methods 0.000 description 1
- 238000002255 vaccination Methods 0.000 description 1
- 210000005167 vascular cell Anatomy 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/7051—T-cell receptor (TcR)-CD3 complex
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; AVICULTURE; APICULTURE; PISCICULTURE; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K67/00—Rearing or breeding animals, not otherwise provided for; New or modified breeds of animals
- A01K67/027—New or modified breeds of vertebrates
- A01K67/0275—Genetically modified vertebrates, e.g. transgenic
- A01K67/0278—Knock-in vertebrates, e.g. humanised vertebrates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/14—Blood; Artificial blood
- A61K35/17—Lymphocytes; B-cells; T-cells; Natural killer cells; Interferon-activated or cytokine-activated lymphocytes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
- C07K14/4701—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals not used
- C07K14/4748—Tumour specific antigens; Tumour rejection antigen precursors [TRAP], e.g. MAGE
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; AVICULTURE; APICULTURE; PISCICULTURE; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2217/00—Genetically modified animals
- A01K2217/05—Animals comprising random inserted nucleic acids (transgenic)
- A01K2217/052—Animals comprising random inserted nucleic acids (transgenic) inducing gain of function
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; AVICULTURE; APICULTURE; PISCICULTURE; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2227/00—Animals characterised by species
- A01K2227/10—Mammal
- A01K2227/105—Murine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Immunology (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Zoology (AREA)
- Toxicology (AREA)
- Gastroenterology & Hepatology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Molecular Biology (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Cell Biology (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Engineering & Computer Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Environmental Sciences (AREA)
- Biotechnology (AREA)
- Virology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biodiversity & Conservation Biology (AREA)
- Animal Husbandry (AREA)
- Communicable Diseases (AREA)
- Oncology (AREA)
- Hematology (AREA)
- Biomedical Technology (AREA)
- Developmental Biology & Embryology (AREA)
- Epidemiology (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
本发明涉及免疫疗法的领域,特别是癌症的过继性T细胞疗法或T细胞受体(TCR)基因疗法。本发明提供编码TCR构建体的至少一种T细胞受体α链构建体和/或TCR β链构建体的核酸,所述TCR构建体能够特异性地结合来自与人MHC复合的NY‑ESO‑1(也称为CTAG‑1)的表位,其中TCR α链构建体和/或TCR β链构建体包含与选自SEQ ID NO:1‑20的氨基酸具有至少90%的序列同一性的互补决定区3(CDR3)。本发明提供限制于来自存在于MHC I上的NY‑ESO‑1的表位的TCR构建体,并且首次提供限制于来自存在于MHC II分子上的NY‑ESO‑1的表位的TCR构建体,从而使得含重组CD4+和重组CD8+T细胞二者的组合过继性T细胞疗法成为可能。本发明还提供对应于所述TCR构建体的蛋白和宿主细胞,以及这样的构建体的医学应用,特别是在增生性或病毒性疾病的诊断、预防和/或治疗中的医学应用,其中,优选地,限制于MHC I和MHC II分子的两种TCR构建体在药剂盒中提供。本发明还涉及人TCR基因座和人HLA‑DR4的转基因小鼠,ABabDR4小鼠。
Description
本发明涉及免疫疗法领域,特别是癌症的过继性T细胞疗法或T细胞受体(TCR)基因疗法。本发明提供编码TCR构建体的至少一种T细胞受体α链构建体和/或TCR β链构建体的核酸,所述TCR构建体能够特异性地结合来自与人MHC复合的NY-ESO-1 (也称为CTAG-1)的表位,其中TCR α链构建体和/或TCR β链构建体包含与选自SEQ ID NO: 1-20的氨基酸具有至少90%的序列同一性的互补决定区3 (CDR3)。本发明提供限制于来自存在于MHC I上的NY-ESO-1的表位的TCR构建体,和限制于来自存在于MHC II分子上的NY-ESO-1的表位的TCR构建体,从而使得含重组CD4+和重组CD8+ T细胞二者的组合过继性T细胞疗法成为可能。本发明还提供对应的蛋白和宿主细胞,以及这样的构建体的医学应用,特别是在增生性或病毒性疾病的诊断、预防和/或治疗中的医学应用,其中,优选地,限制于MHC I和MHC II分子的两种TCR构建体在药剂盒中提供。本发明还涉及人TCR基因座和人HLA-DR4的转基因小鼠,ABabDR4小鼠。
尽管对诊断患有癌症的患者可用的诊断和治疗选项有显著的技术进步,预后通常仍然是差的并且许多患者不能被治愈。免疫疗法对诊断患有各种肿瘤的患者的有效(仍是靶向)治疗保持有前景,具有根除恶性肿瘤细胞而不损害正常组织的可能性。理论上,免疫系统的T细胞能够识别对肿瘤细胞特异性的蛋白模式并通过多种效应机制介导它们的破坏。然而,在实践中,患者的T细胞通常对肿瘤抗原是耐受的。过继性T-细胞疗法试图利用和放大患者自身T细胞的肿瘤-根除能力,然后将这些T细胞以它们有效地消除残余肿瘤,但不损害健康组织的这样一种状态返回给患者。虽然这种方法对肿瘤免疫学领域并不是新的,但在过继性T细胞疗法的临床用途中的许多缺点仍损害这种方法在癌症治疗中的全面应用。
TCR是免疫球蛋白超家族的异二聚体细胞表面蛋白,其与参与介导信号转导的CD3复合体的不变蛋白关联。TCR以αβ和γδ形式存在,其在结构上是类似的,但有截然不同的结构位置和可能有截然不同的功能。天然的异二聚体αβTCR的α和β链是跨膜蛋白,其各自包含两个细胞外结构域,一个近膜恒定结构域,和一个远膜可变结构域。每个恒定和可变结构域包括链内二硫键。可变结构域包含类似于抗体的互补决定区(CDR)的高度多态环。
每个TCR链的可变区包含可变和连接段,和在β链的情况下也包含多样性段。每个可变区包含嵌入在框架序列中的3个CDR (互补决定区),一个是称为CDR3的高变区。存在由它们的框架,CDR1和CDR2序列,和由部分限定的CDR3序列鉴别的几种类型的α链可变(Vα)区和几种类型的β链可变(Vβ)区。独特的TRAV或TRBV号通过IMGT命名法给予Vα或Vβ。T细胞受体特异性主要由CDR3区决定。
TCR基因疗法的使用克服了许多当前的问题。它允许配备患者的具有所需特异性的自身T细胞,并在短时间内生成足够数量的T细胞,避免它们的耗尽。TCR可被转导进入中央记忆T细胞或具有干细胞特征的T细胞,其可确保在转移时有更好的持久性和功能。TCR-基因工程T细胞可被输入由化学疗法或放射呈现淋巴细胞减少的癌症患者,允许有效的移植但抑制免疫抑制。
基因疗法要克服的最大障碍仍然是鉴定可消灭癌症而不引起对正常组织的不需要的毒性所靶向的抗原(Restifo et al, 2012, Nature Reviews 12, 269-281)。癌症-睾丸抗原通常由睾丸和胎儿卵巢中的生殖细胞表达,但它们也由许多类型的肿瘤表达。癌症-睾丸抗原由于它们在许多肿瘤类型中的共享表达和它们在正常组织中表达的缺乏而成为最吸引人的靶标。升高针对这组抗原的特异性T细胞在癌症疗法中提出了一个好的机会。
NY-ESO蛋白构成癌症-睾丸抗原的一个亚家族,其主要,但并非排他性地在生殖系中表达。然而,它们也在各种人类癌症如黑素瘤、肺癌、滑膜肉瘤,以及头和颈癌、食管癌和膀胱癌中表达,在那里它们与恶性肿瘤相关,并且可加速恶性肿瘤。NY-ESO-1抗原在肿瘤中的这种特异性表达和不在正常的周围健康组织中表达,使得该家族的抗原对于靶向过继性T细胞转移是非常有意义的。使用具有基因工程TCR的自身T细胞靶向NY-ESO-1的最近报告显示了在47%的转移性黑素瘤患者和80%的转移性滑膜肉瘤患者中客观临床反应的证据,他们中的全部均用标准疗法大量进行过预治疗。未观察到针对正常组织的毒性(Robbins etal., 2011, J. Clin. Oncol. 29, 917-924)。
到目前为止,已对源自人患者或转基因小鼠的NY-ESO-1的MHC I限制的表位具有特异性的TCR进行了鉴定(Robbins et al., 2011, J. Clin. Oncol. 29, 917-924;Linnemann et al., 2013, Nature Med. 19, 1534-1541);并且公开了对源自人患者的NY-ESO-1的MHC II (HLA-DP4)限制的表位具有特异性的TCR (Zhao et al., 2006, JImmunother. 29(4):398-406)。
然而,需要增加疗法的效率。在该技术领域中的缺点可涉及TCR对基因疗法的不满意的亲和力,或涉及T细胞在宿主中的不满意的效率。例如,Schietinger et al. (2010,J. Exp. Med. 207, 2469-2477)和Bos et al. (2010, Cancer Res. 70(21), 8368-8377)描述了,在小鼠模型中,CD8+细胞单独通常不足以根除肿瘤,但CD4+和CD8+T细胞的协同作用可能是需要的。
鉴于上述缺点,本发明人解决了提供能够特异性地结合肿瘤抗原例如NY-ESO-1的新的TCR构建体的问题,特别是识别分别与人MHC II或人MHC I复合的此类抗原的表位的TCR构建体。这个问题由权利要求的主题解决。
本发明人惊奇地发现,靶向来自源自小鼠的肿瘤抗原例如NY-ESO-1的表位的TCR构建体在关于它们的亲和力和/或功能性特征(例如在响应用各个肽/MHC复合体刺激时的IFN-γ产生)方面优于源自人患者的TCR构建体。
特别是,本发明提供编码TCR构建体的至少一种T细胞受体(TCR) α链构建体和/或TCR β链构建体的核酸,所述TCR构建体能够特异性地结合来自与人MHC复合的NY-ESO-1(也即:CTAG-1)的表位,其中TCR α链构建体和/或TCR β链构建体包含互补决定区3(CDR3),其具有与选自SEQ ID NO: 1-20的氨基酸至少70%、至少80%、至少90%、至少95%或优选100%的序列同一性。
在本发明的上下文中,“a”被理解为意指“一个或多个”,除非另外明确说明。因此,例如,如果本发明的TCR构建体包含α和β链构建体二者,如为整个发明首选的,它可由者一个或者两个核酸编码。α和β链构建体一起能够特异性地结合来自与人MHC复合的NY-ESO-1的表位。如同中间产物,α和β链构建体本身也是本发明的主题。
SEQ ID NO: 1-20对应于本发明鉴定的TCR的CDR3区并示于本申请的表1和2中。SEQ ID NO: 1-9对应于本发明的TCR α链构建体的CDR3区,其能够识别HLA-DRA/HLA-DRB1*0401 (HLA-DR4)-,即MHC II-限制的NY-ESO-1116-135表位(LPVPGVLLKEFTVSGNILTI, SEQ IDNO: 21),SEQ ID NO: 10-18对应于本发明的TCR β链构建体的CDR3区,其能够识别HLA-DR4-限制的NY-ESO-1116-135表位。这些是首次分离的对NY-ESO-1的HLA-DR4-限制的表位有特异性的TCR。它们源自人TCR基因座和人HLA-DR4的转基因小鼠。
因此,在一个优选的实施方案中,本发明的TCR构建体能够特异性地结合由与HLA-DR4复合的NY-ESO-1116-135表位(SEQ ID NO: 21)组成的表位,其中TCR α链构建体包含与选自SEQ ID NO: 1-9的氨基酸具有至少90%序列同一性,优选100%序列同一性的CDR3。TCR β链构建体包含与选自SEQ ID NO: 10-18的氨基酸具有至少90%序列同一性,优选100%序列同一性的互补决定区3 (CDR3)。当然,TCR α和β链构建体以能够识别MHC分子上的表位的方式在本发明的TCR构建体中配对,特别是,如在表1中教导的。TCR α和/或β链构建体可包含在表3中示出的CDR1、CDR2和CDR3区。优选地,TCR α和/或β链构建体包含如在表1中所示的CDR3区和可变区。
TCR α链构建体可包含含有与SEQ ID 22-30具有至少80%、至少90%或100%序列同一性的序列的可变区,其任选地由具有选自SEQ ID 31-39的密码子-优化的序列的核酸编码。TCR α链构建体优选地包含具有与SEQ ID NO: 40-48的任一个至少80%、至少90%或100%序列同一性的序列,并任选地由具有SEQ ID NO: 49-57的任一个的序列的密码子-优化的核酸编码。
表1 从ABabDR4小鼠分离的识别NY-ESO-1116-135的HLA-DR4限制的TCR的列表
TCR β链构建体可包含含有与SEQ ID NO: 58-66具有至少80%、至少90%或100%序列同一性的序列的可变区,其任选地由具有选自SEQ ID NO: 67-75的序列的密码子-优化的核酸编码。TCR β链构建体优选地包含具有与SEQ ID NO: 76-84的任一个至少80%、至少90%或100%序列同一性的序列并任选地由SEQ ID NO: 85-93的任一个的密码子-优化的核酸编码。
由在它们的可变区内或经历它们的全长的一定序列同一性限定的构建体优选地包含与限定的CDR3区(如例如在表1中所示的)具有100%同一性的各个CDR3区。
本发明还提供单链核酸构建体,其中,例如TCR α和β链构建体由P2A元件分离。在这样的单链核酸构建体中,完整的TCR构建体可由SEQ ID NO: 94-102的任一个的核酸编码。
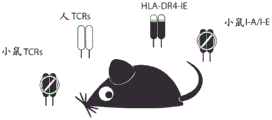
本发明还涉及一种小鼠,其包含编码完整未重排的人TCR α和β基因座的核酸,并在其CD4+ T细胞上表达源自基因座的重排TCR,还表达融合至小鼠I-E的非-抗原-结合结构域的人HLA-DR4,其中小鼠缺乏小鼠TCR和小鼠MHC II类分子。因此,AbabDR4用具有HLA-DR4限制的CD4+ T细胞表达多样化的人TCR库。本发明的上述TCR构建体,其识别与HLA-DR4复合的NY-ESO-1表位,都源自这样的称为ABabDR4小鼠的小鼠,这也是本发明的目的。本发明还涉及这些小鼠用于制备对存在于HLA-DR4上的表位有特异性的TCR,特别是本发明的TCR构建体的用途。
与人类不同,ABabDII小鼠或ABabDR4小鼠对人肿瘤相关抗原(TAA),例如NY-ESO-1是不耐受的。因此,当用人TAA接种疫苗时,ABabDII小鼠生成针对那些外来抗原的有效的适应性免疫应答,包括高亲合力抗原特异性T细胞的扩增。在用合适的人TAA免疫后,可提取编码ABabDII小鼠的高亲合力TCR的遗传信息。这些TCR可随后通过逆转录病毒转导,在来自肿瘤患者的T细胞中重新表达。那些重新定向的T细胞可转移回到与肿瘤作斗争的患者中(WO2014118236的图1)。
使用人TCR转基因小鼠,未由小鼠基因组编码的任何人肽序列因此适合于免疫并将产生具有最佳亲和力的TCR。最佳亲和力意指T细胞被限制于人自身-MHC分子并识别作为异物的肽抗原,例如代表了非-耐受库。通过使用肽/MHC多聚体,转基因小鼠的特异性T细胞可被分选,例如通过单细胞PCR分离人TCR,为有效表达优化TCR,同时避免与内源性TCR错配并用来用病毒载体转导患者的T细胞(Uckert et al., 2009, Cancer ImmunolImmunother 58, 809-22; Kammertoens et al., 2009, Eur J Immunol 39, 2345-53。
本发明的上述TCR构建体源自人TCR基因座和人MHC (特别是HLA-DR4)的转基因小鼠,即ABabDR4小鼠。“源自”意欲指TCR构建体(或各自的α/β链构建体)的至少CDR3序列,优选地,可变区与在以下实施例中由小鼠TCR提供的序列相同或与以下实施例中小鼠TCR提供的序列具有以上限定的序列同一性水平。可能的是,但不需要,核酸在物理上源自(如通过PCR)编码小鼠TCR的核酸。如在其它地方详细描述的,修饰是可能的。
在ABabDII小鼠中的CD8+ T细胞带有人T细胞受体(TCR),其识别由人MHC I类分子呈递的抗原,HLA-A*0201 (HLA-A2) (Li et al., 2010, Nature Medicine 16, 1029–34)。识别限制于HLA-A2的NY-ESO-1表位且源自ABabDII小鼠的TCR先前已被描述(Linnemann et al., Nature Medicine 19, 1534-1541)。本发明提供识别限制于HLA-A2的NY-ESO-1表位(SEQ ID NO: 103)和源自ABabDII小鼠的TCR,其显示在功能上优于源自人患者的各个TCR,TCR 1G4。
表2 从ABabDII小鼠分离的识别NY-ESO-1157-165的TCR-ESO序列
因此,本发明还提供能够识别与MHC I (特别是HLA-A2)组合的NY-ESO-1表位的TCR构建体。SEQ ID NO: 19对应于本发明的TCR α链构建体的CDR3区,其能够识别HLA-A2-,即MHC I-限制的NY-ESO-1157-165表位(SLLMWITQC, SEQ ID NO: 103),SEQ ID NO: 20对应于本发明的TCR β链构建体的CDR3区,其能够识别HLA-A2限制的NY-ESO-1157-165表位。令人惊奇地发现,由本发明提供的这种TCR具有如下所示的比先前已从人分离的其它TCR更高的亲和力。
这种TCR构建体能够特异性地结合由与HLA-A2复合的SEQ ID NO: 103组成的表位,其中TCR α链构建体包含具有与SEQ ID NO: 19至少90%序列同一性,优选100%序列同一性的互补决定区3 (CDR3)和/或TCR β链构建体包含具有与SEQ ID NO: 20至少90%序列同一性,优选100%序列同一性的互补决定区3 (CDR3)。
所述TCR α链构建体可包含含有与SEQ ID 104具有至少80%、至少90%或100%序列同一性的序列的可变区,其任选地由SEQ ID 105的密码子-优化的核酸编码。TCR α链构建体可包含与SEQ ID NO: 106具有至少80%、至少90%或100%序列同一性的序列,并任选地由SEQ ID NO: 107的密码子-优化的核酸编码。
所述TCR β链构建体可包含含有与SEQ ID 106具有至少80%、至少90%或100%序列同一性的序列的可变区,其任选地由SEQ ID 108的密码子-优化的核酸编码。TCR β链构建体可包含与SEQ ID NO: 109具有至少80%、至少90%或100%序列同一性的序列,其任选地由SEQ ID NO: 110的密码子-优化的核酸编码。
TCR构建体可包含示于表3的CDR1、CDR2和CDR3区。TCR构建体也可包含于表2中所示的CDR3区和可变区。
表3 本发明的TCR构建体的CDR1、CDR2和CDR3
本发明还提供单链核酸构建体,其中,例如TCR α和β链构建体由P2A元件分离。图4提供示例性构建体。这样的TCR构建体可由SEQ ID NO: 111的核酸编码。
以上提供的所有的核酸序列已被密码子-优化用于人细胞的表达。
本发明的TCR α链构建体和/或TCR β链构建体或TCR构建体优选地是载体。合适的载体包括设计用于增殖和扩大,或用于表达或二者的那些,例如质粒和病毒。载体可以是适合于在宿主细胞中表达的表达载体,所述宿主细胞选自人T细胞或人T细胞前体,优选地,人T细胞例如CD8+ T细胞、CD4+ T细胞、中枢-记忆T细胞、效应子-记忆T细胞、干细胞-样T细胞。载体可以是病毒载体,例如逆转录病毒,特别是γ-逆转录病毒或慢病毒载体。合适的表达载体的实例包括示于图4的逆转录病毒载体MP71。重组表达载体包含调节序列,例如转录和翻译起始和终止密码子,其对载体被引入其中且将在其中进行本发明核酸的表达的宿主细胞类型(如细菌、真菌、植物,或动物)是特异性的。而且,本发明的载体可包括一个或多个标记基因,其允许选择转化或转染的宿主。重组表达载体可包含天然的或优选地,异源启动子,其可操作地连接于编码本发明的构建体的核苷酸序列,或连接于与编码本发明的构建体的核苷酸序列互补或与编码本发明的构建体的核苷酸序列杂交的核苷酸序列。启动子的选择包括,如强、弱、诱导型、组织-特异性和发育-特异性启动子。启动子可以是非-病毒启动子或病毒启动子。优选地,它是异源启动子,即非天然连接于人T细胞的TCR的启动子,例如长末端重复启动子,其适合于人T细胞中表达。本发明的重组表达载体可被设计用于瞬时表达、稳定表达,或者二者。同样,重组表达载体可被制备用于组成型表达或用于诱导型表达。
本发明还提供一种蛋白,即α或β链构建体,或者优选地,包含α和β链构建体二者的TCR受体构建体,其能够特异性地结合与表位NY-ESO-1116-135组合的HLA-DR4,或与表位NY-ESO-1157-165组合的HLA-A2。该蛋白优选地由本发明的核酸编码。
如本文所用的,术语“能够特异性地结合”或“识别”给定的抗原或“对给定的抗原具有特异性”,意指TCR构建体可特异性地结合和在免疫学上识别所述表位,优选NY-ESO-1,更优选具有高亲和力。例如,在与用低浓度的各表位,如NY-ESO-1表位,例如HLA-A2限制的NY-ESO-1157-165表位或HLA-DR4-限制的NY-ESO-1116-135表位(如约10-11 mol/l、10-10 mol/l、10-9 mol/l、10-8 mol/l、10-7 mol/l、10-6 mol/l、10-5 mol/l)(但不是没有表位)或用对照肽表位脉冲的靶细胞共同培养时,如果表达TCR的T细胞分泌至少约200 pg/ml或更多(如250 pg/ml或更多、300 pg/ml或更多、400 pg/ml或更多、500 pg/ml或更多、600 pg/ml或更多、700 pg/ml或更多、1000 pg ml或更多、2,000 pg/ml或更多、2,500 pg/ml或更多、5,000pg/ml或更多)的干扰素γ (IFN-γ),则TCR可被认为是“能够特异性地结合”NY-ESO-1。备选地或另外地,在与用低浓度的适宜的肽脉冲的靶细胞共同培养后,如果表达TCR的T细胞分泌IFN-γ的未转导背景水平的至少两倍的IFN-γ时,则TCR可被认为对NY-ESO-1表位具有“抗原特异性”。如上所述的这样的“特异性”可– 例如 – 用ELISA分析。
亲和力可通过技术人员熟知的方法,例如通过BiaCore分析。100µM或更高,更优选10µM或更高的TCR亲和力或T细胞亲合力被认为是高亲和力的。
基于由本发明提供的限定的CDR3和可变区序列,进行TCR序列的亲和力成熟是可能的(Chervin et al. J Immunol Methods. 2008; 339(2): 175–84); Robbins et al.J Immunol. 2008; 180: 6116–31)。非-同义核苷酸取代,其导致CDR3序列中的氨基酸改变,可导致TCR对靶抗原的亲和力提高。此外,在可变TRA和TRB区的其它部分中的TCR序列变化可改变TCR对肽-MHC复合体的亲和力。这可增加TCR对肽-MHC的总亲和力,但包含非特异性识别和增加的交叉反应性的风险(Linette et al. Blood. 2013;122(6):863–72)。优选地,从提供的特异性序列变化的TCR保留对于提供的靶抗原的排他特异性,即它们不是交叉反应性的,最重要的是它们对人自身-肽不具有交叉反应性。TCR的潜在的交叉反应性可针对在具有正确的MHC等位基因的细胞上加载的已知自身-肽进行测试(Morgan et al.,2013, J. Immunother. 36, 133-151)。因此,优选地,表达本发明的TCR构建体的T细胞的过继性转移对健康组织没有显著的负面作用。
本发明的TCR α和/或β链构建体可包含对应于其天然的配对物的所有的特征或结构域,但这不是必需的。优选地,TCR α和/或β链构建体包含至少可变区,或可变和恒定区,例如,具有与人可变或恒定TCR区至少60%、至少70%、至少80%、至少90%或至少95%序列同一性的可变和/或恒定区。对于过继性TCR疗法,优选TCR构建体包含含有可变、恒定和跨膜区的全长TCR α和β链。TCR构建体优选地具有基本上或完全的人源以最大限度地减少免疫原性。然而,为防止与内源性TCR链配对,本发明的构建体与人序列比较,优选地包含一个或多个,如1-5、1-10或1-20个氨基酸交换、插入或缺失,如提供另外的半胱氨酸以便能够形成另外的二硫键(Sommermeyer et al., 2010, J. Immunol. 184, 6223-31)。为此,TCR α和β链构建体的恒定区也可以是鼠恒定区。
所述构建体也可以是嵌段抗原受体,或其部分,其中,例如人TCR可变区可连接于不同的免疫球蛋白恒定结构域,例如IgG恒定结构域,或能够特异性地结合抗原例如NY-ESO-1的抗体结构域。
单链构建体(scTCR)以及异二聚体TCR构建体被包括在内。scTCR可包含第一个TCR链构建体(如α链)的可变区和整个(全长)第二个TCR链(如β链),或反之亦然。而且,scTCR可任选地含一个或多个接头,其将两个或更多个多肽连接在一起。接头可以是例如将两个如本文描述的单链连接在一起的肽。本发明的这样一种scTCR也被提供,其融合于细胞因子,如人细胞因子,例如IL-2、IL-7或IL-15。
根据本发明的TCR构建体也可以多聚体复合体的形式提供,其包含至少两个scTCR分子,其中所述scTCR分子各自融合于至少一个生物素部分,和其中所述scTCRs通过生物素-链霉抗生物素相互作用互相连接,以允许所述多聚体复合体形成。还提供高级多聚体复合体,其包含两个以上,如4个本发明的scTCR。
本发明的TCR构建体可被修饰以包含可检测的标记,例如,放射性同位素、荧光团(如异硫氰酸荧光素(FITC)、藻红蛋白(PE))、酶(如碱性磷酸酶、辣根过氧化物酶),和颗粒(如金粒或磁性颗粒)。
本发明还提供包含本发明的核酸或蛋白的宿主细胞。宿主细胞可以是真核细胞,如植物、动物、真菌,或藻类,或可以是原核细胞,如细菌或原生动物。宿主细胞可以是培养的细胞或原代细胞,即直接从生物体,如人中分离的。宿主细胞可以是粘附细胞或悬浮的细胞,即在悬液中生长的细胞。为了产生重组TCR、多肽或蛋白的目的,宿主细胞优选地是哺乳动物细胞。最优选地,宿主细胞是人细胞。虽然宿主细胞可具有任何细胞类型,可源自任何类型的组织,并可具有任何发育阶段,宿主细胞优选地是外周血白细胞(PBL)或外周血单核细胞(PBMC)。更优选地,宿主细胞是T细胞或T细胞前体,特别是,人T细胞。T细胞可以是任何T细胞,例如培养的T细胞,例如原代T细胞,或来自培养的T细胞系的T细胞,例如Jurkat,SupTl等,或从哺乳动物获得的T细胞,优选地,它是来自人患者的T细胞或T细胞前体。T细胞可从许多来源,例如血、骨髓、淋巴结、胸腺,或其它组织或液体获得。T细胞也可被富集或纯化。优选地,T细胞是人T细胞。更优选地,T细胞是从人,如人患者分离的T细胞。T细胞可以是任何类型的T细胞并可具有任何发育阶段,包括但不限于,CD4+和/或CD8+、CD4+辅助T细胞,如Th1和Th2细胞、CD8+ T细胞(如细胞毒性T细胞)、肿瘤浸润细胞(TILs)、效应细胞、中枢效应细胞、记忆T细胞、幼稚T细胞等,优选中枢-记忆T细胞。
优选地,宿主细胞是人CD4-阳性T细胞,其中本发明的TCR构建体被限制于MHC II表位,或人CD8-阳性T细胞,其中本发明的TCR构建体被限制于MHC I表位。
本发明还提供一种药用组合物,其包含
a) 核酸,优选地,表达载体,其适合于在人T细胞中表达,编码本发明的TCR构建体,所述TCR构建体能够特异性地结合来自与人MHC复合的NY-ESO-1的表位,或
b) 包含本发明的TCR构建体的蛋白,所述TCR构建体能够特异性地结合来自与人MHC复合的NY-ESO-1的表位,或
c) 本发明的宿主细胞,如人T细胞,其表达能够特异性地结合来自与人MHC复合的NY-ESO-1的表位的TCR构建体。
在一个优选的实施方案中,用于药用组合物的本发明的TCR构建体是如本文公开的、能够识别限制于HLA-DR4的表位的TCR构建体。
备选地,TCR构建体是如本文公开的、能够识别限制于HLA-A02的表位的本发明的TCR构建体。
本发明还提供一种优选地用于医学,特别是用于治疗人患者的药剂盒,其包含,作为第一组分
a) 核酸,优选地,表达载体,编码能够特异性地结合来自与人MHC II复合的限定抗原的表位的TCR构建体,或
b) 蛋白,其包含能够特异性地结合来自与人MHC II复合的限定抗原的表位的TCR构建体,或
c) 宿主细胞,其表达能够特异性地结合来自与人MHC II复合的限定抗原的表位的TCR构建体,
和
i) 核酸,优选地,表达载体,其编码能够特异性地结合来自与人MHC I复合的所述限定抗原的表位的TCR构建体,或
ii) 蛋白,其包含能够特异性地结合来自与人MHC I复合的所述限定抗原的表位的TCR构建体,或
iii) 宿主细胞,其表达能够特异性地结合来自与人MHC I复合的所述限定抗原的表位的TCR构建体。
所述限定的抗原优选地是选自癌症-睾丸-抗原例如NY-ESO-1的肿瘤-相关或肿瘤-特异性抗原。特别是,表位分别是SEQ ID NO: 21 (HLA-DR4-限制)和103 (HLA-A02-限制)的表位。备选地,抗原可以是体细胞突变抗原、病毒抗原、肿瘤驱动抗原(tumor drivingantigen)、肿瘤-相关抗原、分化抗原如癌症-睾丸抗原。优选地,TCR构建体是人TCR,基本上人TCR,如上所述,或源自人TCR,如源自如上所述的人源化小鼠。
到目前为止,过继性T细胞转移至人只专注于给予CD8+或者CD4+ T细胞。然而,本发明人已提供在人中进行过继性T细胞疗法的方法,其包括具有对限定的肿瘤相关抗原NY-ESO-1有特异性的TCR构建体的CD8+和CD4+ T细胞的转移,其允许两种细胞类型的合作。备选地,编码所述TCR构建体的核酸或各个蛋白也可被用来转移所需特异性至患者的内源性T细胞。CD4+细胞,如通过分泌细胞因子例如IFN-γ和IL-2,可促进CD8+细胞募集至肿瘤并发挥细胞溶解的功能。这能够更有效地消除肿瘤细胞,和退化或优选地消除肿瘤。优选没有复发。
特别是,本发明提供如上所述的药剂盒,其包含所述药用组合物,所述药用组合物含有,作为第一组分,
a) 核酸,优选地,表达载体,其适合于在人T细胞中表达,编码本发明的TCR构建体,所述TCR构建体能够特异性地结合来自与人HLA-DR4复合的NY-ESO-1的表位,并包含与SEQ ID NO: 1-18的任一个具有优选地至少80%序列同一性的CDR3区,
b) 蛋白,其包含本发明的TCR构建体,所述TCR构建体能够特异性地结合来自与人HLA-DR4复合的NY-ESO-1的表位,且包含与SEQ ID NO: 1-18的任一个具有优选地至少80%序列同一性的CDR3区,或
c) 本发明的宿主细胞,如人T细胞,其表达TCR构建体,所述TCR构建体能够特异性地结合来自与HLA-DR4复合的NY-ESO-1的表位,且包含与SEQ ID NO: 1-18的任一个具有优选地至少80%序列同一性的CDR3区。
所述药剂盒优选地包含作为第二组分的药用组合物,其包含
i) 核酸,优选地,表达载体,其编码能够特异性地结合来自与人MHC I复合的所述限定抗原的表位的TCR构建体,如本发明的TCR构建体,其包含与SEQ ID NO: 19-20具有优选地至少80%序列同一性的CDR3区,或
ii) 蛋白,其包含能够特异性地结合来自与人MHC I复合的所述限定抗原的表位的TCR构建体,如本发明的TCR构建体,其包含与SEQ ID NO: 19-20具有优选地至少80%序列同一性的CDR3区,或
iii) 宿主细胞,其表达能够特异性地结合来自与人MHC I复合的所述限定抗原的表位的TCR构建体,如本发明的TCR构建体,其包含与SEQ ID NO: 19-20具有优选地至少80%序列同一性的CDR3区。
本发明的药剂盒的组分可被配制用于同时给予或以任何顺序给予。所述组分也可重复给予。Tran et al. (Science, 2014年5月9日;344 (6184): 641-5)描述了一种可能的给药方案。
可用于本发明的药学上可接受的载体或稀释剂的实例包括稳定剂例如SPGA、碳水化合物(如山梨醇、甘露醇、淀粉、蔗糖、葡萄糖、右旋糖酐),蛋白例如白蛋白或酪蛋白,包含蛋白的试剂例如牛血清或脱脂乳和缓冲剂(如磷酸盐缓冲液例如磷酸盐缓冲盐水)。
本发明的药用组合物或本发明的药剂盒可被用于诊断、预防和/或治疗疾病,例如增生性、感染性或病毒性疾病。疾病优选地为肿瘤疾病,例如良性或恶性肿瘤疾病。在一个优选的实施方案中,增殖性细胞或肿瘤表达NY-ESO-1,和TCR构建体能够识别来自NY-ESO-1的至少一个表位。优选地,疾病被治疗。得病的风险的减少也被认为是预防疾病,优选地,经治疗的受试者的风险被减少至低于在比较人群中的正常水平,优选地,风险被减少至少10%、至少25%、至少50%或至少75%,或100%。
本发明还提供一种治疗罹患如上面指定的疾病,特别是,肿瘤或肿瘤疾病的受试者的方法,其包括给予本发明的核酸、蛋白或宿主细胞。优选地,受试者是需要这样的治疗的受试者,即患者。在优选的实施方案中,受试者是哺乳动物受试者,优选罹患肿瘤或肿瘤疾病的人患者。活性剂以有效量给予。
在本发明的上下文中,术语“肿瘤”或“肿瘤疾病”表示选自黑素瘤、肝细胞癌、肝内和肝外胆血管细胞癌、鳞状细胞癌、腺癌以及未分化的头、颈、肺或食管癌、直肠结肠癌、软骨肉瘤、骨肉瘤、成神经管细胞瘤、成神经细胞瘤、头或颈的非-鳞状细胞癌、卵巢肿瘤、淋巴瘤、急性和慢性淋巴细胞性白血病、急性和慢性骨髓性白血病、膀胱癌、前列腺癌、胰腺腺癌、乳腺癌和胃癌的疾病。表达NY-ESO-1的肿瘤优选地选自黑素瘤、肺癌、滑膜肉瘤,和头颈癌、食管癌和膀胱癌。
本发明的一个优选的医学用途涉及免疫疗法,优选过继性T细胞疗法。本发明的产品和方法特别可用于过继性T细胞疗法的情况。给予本发明的化合物可例如包括给予,例如输注本发明的T细胞至所述患者。优选这样的T细胞是用本发明的核酸体外转导的患者的自体T细胞。
备选地,患者也可给予本发明的核酸,特别是表达载体,用于T细胞体内转导。
本发明的蛋白TCR构建体还可例如用于发现受试者是否表达NY-ESO-1,且特别是,是否是根据SEQ ID NO: 21的表位的诊断目的。为此,这样的构建体优选被标记以便于检测。优选地,在HLA-DR4上呈递所述表位的患者通过本发明的过继性T细胞疗法治疗。
本发明还涉及一种制备本发明的宿主细胞的方法,其包括引入编码能够特异性地结合来自与人MHC复合的NY-ESO-1的表位的TCR构建体的表达载体至合适的宿主细胞,优选地,从患者分离的人T细胞中。
本发明在以下实施例中参考附图和序列得到进一步的说明,然而并不限于此。为了本发明的目的,在此引用的所有参考文献通过引用以其整体结合到本文中。
图1 得自ABabDII小鼠的NY-ESO157-特异性TCR-ESO与患者-衍生的TCR 1G4的功能比较. (a) 得自人供体的PBMC用ABabDII-衍生的TCR-ESO或人-衍生的TCR 1G4转导并用NY-ESO157-HLA-A2-特异性多聚体染色。门控CD3+细胞。(b) T2细胞用递增量的NY-ESO157天然的肽脉冲并与TCR-转导的T细胞共培养。(c) 通过TCR-转导的T细胞与不同的肿瘤细胞系(SK.Mel37: HLA-A2+/NY-ESO+,SK.Mel29.MiG: HLA-A2+/NY-ESO−,SK.Mel29.MiG.NY-ESO: HLA-A2+/NY-ESO+,Mel324: HLA-A2+/NY-ESO−,Mel295;HLA-A2+/NY-ESO+)共培养后生产IFNγ。b和c中的图表示测定内重复的平均数± s.d。
图2 对于整个TCRαβ基因座和对于融合于小鼠I-E的非-抗原-结合结构域的人MHCII类分子HLA-DR4,ABabDR4小鼠是转基因的。ABabDR4小鼠对于小鼠TCR和小鼠MHC II类分子是缺乏的。因此,AbabDR4用具有HLA-DR4限制的CD4 T细胞表达多样化的人TCR库。
图3 得自用NY-ESO-1 DNA免疫的ABabDR4小鼠的外周血白细胞用抗-CD3/CD28dynabead、不相关的肽,或NY-ESO116-135再刺激过夜并对IFNγ细胞内染色。对淋巴细胞和CD3阳性细胞门控标绘的细胞。
图4 逆转录病毒TCR-载体MP71的结构示意图(Linnemann et al., 2013, NatureMedicine 19, 1534-1541)。
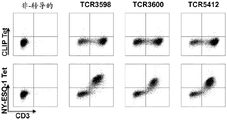
图5 TCR-缺乏和表达CD4的Jurkat细胞用NY-ESO-1-反应性TCR转导并用NY-ESO-1116-135/DR4-四聚体(NY-ESO-1 Tet)或CLIP/DR4-四聚体(CLIP Tet)作为对照染色。
图6 来自人PBMC的TCR-转导的或非-转导的(对照) CD4+ T细胞与天然表达HLA-DR4和/或NY-ESO-1的不同的黑素瘤细胞系共培养并对IFNγ进行细胞内染色。显示的百分比是指转导的CD4+ T细胞(TCR-转导的样品)或总CD4+ T细胞(非-转导的样品)。显示了重复的平均值与标准偏差。通过流式细胞术分析所有黑素瘤细胞系的HLA-DR表达。
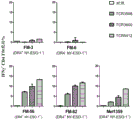
图7 ABabDR4小鼠-衍生的但并非人-衍生的NY-ESO-1116-135-反应性TCR识别表达HLA-DR4/NY-ESO-1的黑素瘤细胞系。用源自ABabDR4小鼠(3600、5712、3598_2)或源自健康人供体(NY1、NY2、NY3)的NY-ESO-1116-135-反应性TCR转导的CD4 T细胞与IFNγ-预处理的表达HLA-DR4和/或NY-ESO-1的黑素瘤细胞系共同培养。加入NY-ESO-1116-135肽(NY116)作为阳性对照。培养过夜后,在上清液中测定IFNγ。显示了测定内重复的平均值与标准偏差。通过流式细胞术分析所有黑素瘤细胞系的HLA-DR表达。
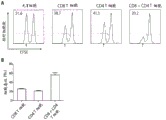
图8 用NY-ESO-1-反应性TCR转导的CD8和CD4 T细胞在肿瘤细胞杀伤中显示出协作效应。TCR-ESO-转导的CD8 T细胞和/或TCR3598_2-转导的CD4 T细胞与CFSE-标记的黑素瘤细胞系FM-3一起培养,所述黑素瘤细胞系FM-3用NY-ESO-1116-135和NY-ESO-1157-165肽载荷(低CFSE荧光)和未载荷(高CFSE荧光)。CFSE-标记的靶和对照细胞以1:1的比例,各8x104个细胞培养。TCR-转导的CD8和CD4 T细胞数各自是6x104。培养过夜后,FM-3的细胞数通过流式细胞术测量。(A) 与TCR-转导的T细胞一起培养后的FM-3细胞的代表性直方图被示出。数目表示NY-ESO-1肽-载荷的FM-3细胞的百分比(小箭头)。(B) 条形图表明如A中所示通过杀伤靶细胞测定的TCR-转导的CD4和/或CD8 T细胞的细胞毒性。显示了测定内重复的平均值与标准偏差。
实施例
实施例1 –在ABabDII小鼠中对NY-ESO-1157-165特异性的HLA-A02-限制的人TCR的产生
如在Li et al. (2010, Nature Medicine 16, 1029-1034)中所述产生ABabDII小鼠。对NY-ESO-1157-165特异性的大量CD8+群从接种疫苗的小鼠分离并按照在Linnemannet al. (2013, Nature Medicine 19, 1534-1541)中公开的方案,通过TCR基因捕获分析。
产生如表2中所示的和通过根据SEQ ID NO:18和19的CDR3序列表征的TCR-ESO。
用于全长构建体的最佳序列在SEQ ID NO: 106/107和SEQ ID NO: 110/111中提供。SEQ ID NO: 112对应于下文所用的单链核酸构建体。
实施例2 – HLA-A02-限制的人TCR的功能分析
得自ABabDII小鼠的NY-ESO157-165-特异性TCR-ESO,如实施例1中生成的,与黑素瘤患者-衍生的TCR 1G4比较(Chen, et al., 2005, J. Exp. Med. 201, 1243–55)。两种TCR识别表位157-165 (SEQ ID NO: 103)。TCR在来自人供体的PBMC的人T细胞中表达(图1a)。用ABabDII-衍生的TCR-ESO转导的T细胞证实增加的抗原敏感性并在识别肽-荷载的T2细胞时诱导比用人-衍生的TCR 1G4转导的T细胞更高的最大IFNγ水平(图1b)。此外,TCR-ESO-转导的人T细胞在与表达HLA-A2+癌细胞的NY-ESO共同培养后产生比1G4-转导的T细胞更多的IFNγ (图1c)。
与从人供体分离的TCR比较,得自ABabDII小鼠的TCR令人吃惊地显示卓越的功能活性。
实施例3 – 在ABabDR4小鼠中对NY-ESO-1116-135特异性的HLA-DR4-限制的人TCR的产生
针对NY-ESO-1的HLA-DR4-限制的TCR在人TCR基因座/HLA-DRA-IE/HLA-DRB1*0401-IE转基因(ABabDR4)小鼠中饲养(图2)。这些小鼠通过使HLA-DRA-IE/HLA-DRB1*0401-IE转基因小鼠(Ito et al., 1996, J Exp Med 183(6): 2635-2644)与人TCR基因座转基因小鼠(Li et al., 2010, Nat. Medicine 16(9):1029-1034)杂交来生成。这个模型的优点是在ABabDR4小鼠中的T细胞表达多样化的人TCR库,但不能经受对在其中人和小鼠序列彼此不同的区域中的人肿瘤抗原的耐受机制。本发明人发现用NY-ESO-1免疫ABabDR4小鼠导致在人类中不能发现的高亲和力TCR的生成。由于HLA-DR4-IE作为独有的MHC II类限制分子,免疫ABabDR4小鼠生成识别具有HLA-DR4限制的免疫抗原的CD4+ T细胞。
在用NY-ESO-1116-135肽或全长NY-ESO-1 DNA接种后,从ABabDR4小鼠生成对与HLA-DR4组合的NY-ESO-1116-135肽有特异性的TCR。对NY-ESO-1116-135特异性的大量CD4+群被分离和TCR链通过cDNA末端的5’快速扩增来提取。图3显示来自用抗-CD3/CD28 dynabead、不相关的肽或NY-ESO116-135再刺激过夜的ABabDR4小鼠的外周血白细胞的特异性活性,如通过IFNγ的生产所证明的。
生成通过根据SEQ ID NO:1和10、2和11、3和12、4和13、5和14、6和15、7和16、8和17和9和18的CDR3序列表征的TCR,如表1中所示。本发明因此提供对于NY-ESO-1的第一个HLA-DR4限制的人TCR。
用于全长构建体的最优序列在SEQ ID NO: 40-48/49-57和SEQ ID NO: 76-84/85-93中提供。SEQ ID NO: 94-102对应于用于以下实验的单链核酸构建体。
实施例4 –HLA-DR4-限制的人TCR的功能分析
为证实分离的TCR赋予对相关肽/MHC复合体的特异性结合,TCR-缺乏和表达CD4的Jurkat细胞用如在实施例3中制备的NY-ESO-1-反应性TCR转导,并用NY-ESO-1116-135/DR4-四聚体(NY-ESO-1 Tet)或CLIP/DR4-四聚体(CLIP Tet)作为对照染色(TCR3598、TCR3600和TCR5412的数据在图5中显示)。特异性被证实。
分离的TCR也赋予针对表达NY-ESO-1的细胞的功能活性。这被与天然表达HLA-DR4和/或NY-ESO-1和对IFNγ细胞内染色的不同黑素瘤细胞系共同培养的来自人PBMC的TCR-转导的或非-转导(对照) CD4+ T细胞证明(TCR3598、TCR3600和TCR5412的数据在图6中显示)。
TCR5412的转移导致IFN-γ CD4+细胞的更高比例。因此,包含SEQ ID NO:3和12的CDR3序列的TCR构建体在本发明的情况中是特别优选的。
实施例5 –对NY-ESO-1表位特异性的CD4+和CD8+ T细胞的组合的过继性T细胞转移
对NY-ESO-1特异性的MHC I和MHC II限制的TCR的组合应用在癌症的过继性T细胞疗法的小鼠模型中进行试验。NY-ESO-1和HLA-A2阳性肿瘤细胞系在HLA-DR4-IExRag-/-小鼠中移植,并用MHC I-限制的TCR转导的鼠CD8 T细胞或者用MHC II-限制的TCR转导的鼠CD4 T细胞或者二者的混合物治疗。随时间的推移监测接受者小鼠的肿瘤排斥反应和复发。对于用MHC I和MHC II限制的TCR二者治疗,期望没有复发。
Claims (16)
1.编码TCR构建体的至少一种T细胞受体(TCR) α链构建体和TCR β链构建体的一个或两个核酸,所述TCR构建体能够特异性地结合来自与HLA-DR4复合的由SEQ ID:21组成的NY-ESO-1的表位,
其中所述TCRα链构建体包含由SEQ ID NO: 23的氨基酸46-51的氨基酸序列组成的互补决定区(CDR)CDR1、由SEQ ID NO: 23的氨基酸69-74的氨基酸序列组成的CDR2和由SEQID NO: 23的氨基酸109-123的氨基酸序列组成的CDR3,和所述TCRβ链构建体包含由SEQ IDNO: 59的氨基酸46-50的氨基酸序列组成的CDR1、由SEQ ID NO: 59的氨基酸68-73的氨基酸序列组成的CDR2和由SEQ ID NO: 59的氨基酸111-125的氨基酸序列组成的CDR3,或
其中所述TCRα链构建体包含由SEQ ID NO: 22的氨基酸49-54的氨基酸序列组成的CDR1、由SEQ ID NO: 22的氨基酸72-76的氨基酸序列组成的CDR2和由SEQ ID NO: 22的氨基酸111-123的氨基酸序列组成的CDR3,和所述TCRβ链构建体包含由SEQ ID NO: 58的氨基酸46-50的氨基酸序列组成的CDR1、由SEQ ID NO: 58的氨基酸68-73的氨基酸序列组成的CDR2和由SEQ ID NO: 58的氨基酸111-123的氨基酸序列组成的CDR3,或
其中所述TCRα链构建体包含由SEQ ID NO: 24的氨基酸46-51的氨基酸序列组成的CDR1、由SEQ ID NO: 24的氨基酸69-75的氨基酸序列组成的CDR2和由SEQ ID NO: 24的氨基酸110-122的氨基酸序列组成的CDR3,和所述TCRβ链构建体包含由SEQ ID NO: 60的氨基酸46-50的氨基酸序列组成的CDR1、由SEQ ID NO: 60的氨基酸68-73的氨基酸序列组成的CDR2和由SEQ ID NO: 60的氨基酸111-124的氨基酸序列组成的CDR3,或
其中所述TCRα链构建体包含由SEQ ID NO: 27的氨基酸49-53的氨基酸序列组成的CDR1、由SEQ ID NO: 27的氨基酸71-74的氨基酸序列组成的CDR2和由SEQ ID NO: 27的氨基酸109-121的氨基酸序列组成的CDR3,和所述TCRβ链构建体包含由SEQ ID NO: 63的氨基酸46-50的氨基酸序列组成的CDR1、由SEQ ID NO: 63的氨基酸68-73的氨基酸序列组成的CDR2和由SEQ ID NO: 63的氨基酸111-121的氨基酸序列组成的CDR3。
2.权利要求1的核酸,其中所述TCRα链构建体包含由SEQ ID NO: 23的氨基酸46-51的氨基酸序列组成的CDR1、由SEQ ID NO: 23的氨基酸69-74的氨基酸序列组成的CDR2和由SEQ ID NO: 23的氨基酸109-123的氨基酸序列组成的CDR3,和所述TCRβ链构建体包含由SEQ ID NO: 59的氨基酸46-50的氨基酸序列组成的CDR1、由SEQ ID NO: 59的氨基酸68-73的氨基酸序列组成的CDR2和由SEQ ID NO: 59的氨基酸111-125的氨基酸序列组成的CDR3。
3.权利要求1的核酸,其中
a)所述TCRα链构建体包含由SEQ ID NO: 23的氨基酸序列组成的可变区和所述TCRβ链构建体包含由SEQ ID NO: 59的氨基酸序列组成的可变区,或
b)所述TCRα链构建体包含由SEQ ID NO: 22的氨基酸序列组成的可变区和所述TCRβ链构建体包含由SEQ ID NO: 58的氨基酸序列组成的可变区,或
c)所述TCRα链构建体包含由SEQ ID NO: 24的氨基酸序列组成的可变区和所述TCRβ链构建体包含由SEQ ID NO: 60的氨基酸序列组成的可变区,或
d)所述TCRα链构建体包含由SEQ ID NO: 27的氨基酸序列组成的可变区和所述TCRβ链构建体包含由SEQ ID NO: 63的氨基酸序列组成的可变区。
4.权利要求3的核酸,其中所述TCRα链构建体包含由SEQ ID NO: 23的氨基酸序列组成的可变区和所述TCRβ链构建体包含由SEQ ID NO: 59的氨基酸序列组成的可变区。
5.一种蛋白,其由任一项前述权利要求的核酸编码。
6.一种包含任一项前述权利要求的核酸或蛋白的宿主细胞。
7.权利要求6的宿主细胞,其中所述宿主细胞是人CD4+ T细胞。
8.一种药用组合物,其包含
a) 权利要求1的核酸,其编码能够特异性地结合来自与HLA-DR4复合的由SEQ ID:21组成的NY-ESO-1的表位的TCR构建体,或
b) 权利要求5的蛋白,其包含能够特异性地结合来自与HLA-DR4复合的由SEQ ID:21组成的NY-ESO-1的表位的TCR构建体,或
c) 权利要求6的宿主细胞,其表达能够特异性地结合来自与HLA-DR4复合的由SEQ ID:21组成的NY-ESO-1的表位的TCR构建体。
9.权利要求8的药用组合物,其包含权利要求2的核酸、由所述核酸编码的蛋白或包含所述核酸的宿主细胞。
10.一种用于医学的药剂盒,其包含:权利要求8或9的任一项的药用组合物作为第一组分,
和,以下作为第二组分,
i) 核酸,其编码能够特异性地结合来自与人MHC I复合的所述限定抗原的表位的TCR构建体,或
ii) 蛋白,其包含能够特异性地结合来自与人MHC I复合的所述限定抗原的表位的TCR构建体,或
iii) 宿主细胞,其表达能够特异性地结合来自与人MHC I复合的所述限定抗原的表位的TCR构建体。
11.权利要求8或9的任一项的药用组合物在制备药物中的用途,所述药物用于增生性疾病的诊断、预防和/或治疗,其中增殖性细胞或肿瘤表达NY-ESO-1。
12.权利要求8或9的任一项的药用组合物在制备用于免疫疗法的药物中的用途。
13.权利要求8或9的任一项的药用组合物在制备用于过继性T细胞疗法或TCR基因疗法的药物中的用途。
14.权利要求10的药剂盒在制备药剂盒中的用途,所述药剂盒用于增生性疾病的诊断、预防和/或治疗,其中增殖性细胞或肿瘤表达NY-ESO-1。
15.权利要求10的药剂盒在制备用于免疫疗法的药剂盒中的用途。
16.权利要求10的药剂盒在制备用于过继性T细胞疗法或TCR基因疗法的药剂盒中的用途。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN202111497633.4A CN114195883A (zh) | 2015-03-13 | 2016-03-11 | 针对抗原ny-eso-1的mhci和mhcii表位的癌症组合t细胞受体基因疗法 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP15159001.5A EP3067366A1 (en) | 2015-03-13 | 2015-03-13 | Combined T cell receptor gene therapy of cancer against MHC I and MHC II-restricted epitopes of the tumor antigen NY-ESO-1 |
| EP15159001.5 | 2015-03-13 | ||
| PCT/EP2016/055242 WO2016146505A1 (en) | 2015-03-13 | 2016-03-11 | Combined t cell receptor gene therapy of cancer against mhc i and mhc ii-restricted epitopes of the tumor antigen ny-eso-1 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202111497633.4A Division CN114195883A (zh) | 2015-03-13 | 2016-03-11 | 针对抗原ny-eso-1的mhci和mhcii表位的癌症组合t细胞受体基因疗法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN107428816A CN107428816A (zh) | 2017-12-01 |
| CN107428816B true CN107428816B (zh) | 2022-01-14 |
Family
ID=52669528
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202111497633.4A Pending CN114195883A (zh) | 2015-03-13 | 2016-03-11 | 针对抗原ny-eso-1的mhci和mhcii表位的癌症组合t细胞受体基因疗法 |
| CN201680015622.9A Active CN107428816B (zh) | 2015-03-13 | 2016-03-11 | 针对肿瘤抗原ny-eso-1的mhc i和mhc ii-限制表位的癌症的组合t细胞受体基因疗法 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202111497633.4A Pending CN114195883A (zh) | 2015-03-13 | 2016-03-11 | 针对抗原ny-eso-1的mhci和mhcii表位的癌症组合t细胞受体基因疗法 |
Country Status (14)
| Country | Link |
|---|---|
| US (1) | US10781243B2 (zh) |
| EP (3) | EP3067366A1 (zh) |
| JP (2) | JP6998211B2 (zh) |
| CN (2) | CN114195883A (zh) |
| AU (1) | AU2016232441B2 (zh) |
| CA (1) | CA2974955A1 (zh) |
| DK (1) | DK3268385T3 (zh) |
| ES (1) | ES2784315T3 (zh) |
| HK (1) | HK1247212A1 (zh) |
| HU (1) | HUE049444T2 (zh) |
| PL (1) | PL3268385T3 (zh) |
| PT (1) | PT3268385T (zh) |
| SI (1) | SI3268385T1 (zh) |
| WO (1) | WO2016146505A1 (zh) |
Families Citing this family (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9511151B2 (en) | 2010-11-12 | 2016-12-06 | Uti Limited Partnership | Compositions and methods for the prevention and treatment of cancer |
| US10988516B2 (en) | 2012-03-26 | 2021-04-27 | Uti Limited Partnership | Methods and compositions for treating inflammation |
| US9603948B2 (en) | 2012-10-11 | 2017-03-28 | Uti Limited Partnership | Methods and compositions for treating multiple sclerosis and related disorders |
| WO2015063616A2 (en) | 2013-11-04 | 2015-05-07 | Uti Limited Partnership | Methods and compositions for sustained immunotherapy |
| DE102016123893A1 (de) | 2016-12-08 | 2018-06-14 | Immatics Biotechnologies Gmbh | T-Zellrezeptoren mit verbesserter Bindung |
| EP3354658A1 (en) * | 2017-01-25 | 2018-08-01 | Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft | Novel t cell receptors and immune therapy using the same for the treatment of cancer and infectious diseases |
| US11236145B2 (en) | 2017-03-23 | 2022-02-01 | Immatics Biotechnologies Gmbh | T cell receptors and immune therapy using the same against PRAME positive cancers |
| CN110945120A (zh) * | 2017-04-07 | 2020-03-31 | 优迪有限合伙公司 | 测量纳米药物中受体-配体相互作用的效力的测定 |
| CN109837245A (zh) * | 2017-11-25 | 2019-06-04 | 深圳宾德生物技术有限公司 | 一种tcr敲除的靶向ny-eso-1的t细胞受体基因修饰t细胞及其制备方法和应用 |
| CN111819194A (zh) * | 2018-02-26 | 2020-10-23 | 基因医疗免疫疗法有限责任公司 | Nyeso t细胞受体(tcr) |
| CN110856751A (zh) | 2018-08-24 | 2020-03-03 | 合成免疫股份有限公司 | 包含核酸及tcr修饰的免疫细胞的治疗剂及其应用 |
| EP3760217A1 (en) * | 2019-07-01 | 2021-01-06 | Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft | Cd5 specific t cell receptor cell or gene therapy |
| US20220273714A1 (en) * | 2019-07-19 | 2022-09-01 | The Regents Of The University Of California | T-cell receptors and methods of use thereof |
| CN112390875B (zh) * | 2019-08-16 | 2023-01-24 | 香雪生命科学技术(广东)有限公司 | 一种识别afp的高亲和力t细胞受体 |
| CN113512124A (zh) * | 2020-04-10 | 2021-10-19 | 香雪生命科学技术(广东)有限公司 | 一种识别hpv16的高亲和力tcr |
| CN112501269B (zh) * | 2020-12-15 | 2022-02-18 | 清华大学 | 一种快速鉴定高亲和力tcr抗原交叉反应活性的方法 |
| CN114121142B (zh) * | 2021-09-02 | 2023-10-31 | 四川大学华西医院 | 一种新型基因修饰增强型ny-eso-1特异型tcr-t模型构建方法及应用 |
Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2000060055A1 (en) * | 1999-04-01 | 2000-10-12 | The Brigham And Women's Hospital, Inc. | Modified dendritic cells and uses therefor |
| WO2001055393A2 (en) * | 2000-01-28 | 2001-08-02 | The Government Of The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Mhc class ii restricted t cell epitopes from the cancer antigen ny-eso-1 |
| WO2003068800A2 (en) * | 2002-02-13 | 2003-08-21 | Ludwig Institute For Cancer Research | Isolated peptides which bind to hla molecules and uses thereof |
| WO2006031221A1 (en) * | 2004-09-13 | 2006-03-23 | Government Of The United States Of America, Represented By The Secretary, Department Of Health And Human Services | Compositions comprising t cell receptors and methods of use thereof |
| CN1989153A (zh) * | 2004-05-19 | 2007-06-27 | 阿维德克斯有限公司 | 高亲和力ny-eso t细胞受体 |
| CN101381402A (zh) * | 2008-10-20 | 2009-03-11 | 中国人民解放军第三军医大学 | Ny-eso-1肿瘤抗原模拟表位及其应用 |
| WO2013177247A1 (en) * | 2012-05-22 | 2013-11-28 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Murine anti-ny-eso-1 t cell receptors |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2002059263A2 (en) * | 2000-12-19 | 2002-08-01 | Sunol Molecular Corporation | Transgenic animals comprising a humanized immune system |
| EP2857508A3 (en) * | 2007-03-05 | 2015-04-15 | International Institute of Cancer Immunology, Inc. | Cancer antigen-specific T-cell receptor gene, peptide encoded by the gene, and use of them |
| RS56339B1 (sr) | 2010-09-20 | 2017-12-29 | Biontech Cell & Gene Therapies Gmbh | Antigen-specifični t ćelijski receptori i t ćelijski epitopi |
| AU2014211454B2 (en) | 2013-01-29 | 2018-04-05 | Max-Delbruck-Centrum Fur Molekulare Medizin (Mdc) Berlin-Buch | High avidity binding molecules recognizing MAGE-A1 |
| RU2578009C2 (ru) * | 2013-05-08 | 2016-03-20 | Закрытое акционерное общество "ЕВРОГЕН" | Способ идентификации нативных пар фрагментов днк или рнк, присутствующих в одних и тех же живых клетках |
| JP6164759B2 (ja) * | 2013-11-21 | 2017-07-19 | Repertoire Genesis株式会社 | T細胞受容体およびb細胞受容体レパトアの解析システムならびにその治療および診断への利用 |
-
2015
- 2015-03-13 EP EP15159001.5A patent/EP3067366A1/en not_active Withdrawn
-
2016
- 2016-03-11 US US15/558,021 patent/US10781243B2/en active Active
- 2016-03-11 EP EP20150462.8A patent/EP3666793A3/en active Pending
- 2016-03-11 PT PT167122621T patent/PT3268385T/pt unknown
- 2016-03-11 CA CA2974955A patent/CA2974955A1/en active Pending
- 2016-03-11 CN CN202111497633.4A patent/CN114195883A/zh active Pending
- 2016-03-11 ES ES16712262T patent/ES2784315T3/es active Active
- 2016-03-11 WO PCT/EP2016/055242 patent/WO2016146505A1/en active Application Filing
- 2016-03-11 CN CN201680015622.9A patent/CN107428816B/zh active Active
- 2016-03-11 AU AU2016232441A patent/AU2016232441B2/en active Active
- 2016-03-11 SI SI201630678T patent/SI3268385T1/sl unknown
- 2016-03-11 PL PL16712262T patent/PL3268385T3/pl unknown
- 2016-03-11 JP JP2017548167A patent/JP6998211B2/ja active Active
- 2016-03-11 HU HUE16712262A patent/HUE049444T2/hu unknown
- 2016-03-11 DK DK16712262.1T patent/DK3268385T3/da active
- 2016-03-11 EP EP16712262.1A patent/EP3268385B1/en active Active
-
2018
- 2018-05-21 HK HK18106557.2A patent/HK1247212A1/zh unknown
-
2021
- 2021-06-15 JP JP2021099266A patent/JP2021151249A/ja active Pending
Patent Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2000060055A1 (en) * | 1999-04-01 | 2000-10-12 | The Brigham And Women's Hospital, Inc. | Modified dendritic cells and uses therefor |
| WO2001055393A2 (en) * | 2000-01-28 | 2001-08-02 | The Government Of The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Mhc class ii restricted t cell epitopes from the cancer antigen ny-eso-1 |
| WO2003068800A2 (en) * | 2002-02-13 | 2003-08-21 | Ludwig Institute For Cancer Research | Isolated peptides which bind to hla molecules and uses thereof |
| CN1989153A (zh) * | 2004-05-19 | 2007-06-27 | 阿维德克斯有限公司 | 高亲和力ny-eso t细胞受体 |
| WO2006031221A1 (en) * | 2004-09-13 | 2006-03-23 | Government Of The United States Of America, Represented By The Secretary, Department Of Health And Human Services | Compositions comprising t cell receptors and methods of use thereof |
| CN101381402A (zh) * | 2008-10-20 | 2009-03-11 | 中国人民解放军第三军医大学 | Ny-eso-1肿瘤抗原模拟表位及其应用 |
| WO2013177247A1 (en) * | 2012-05-22 | 2013-11-28 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Murine anti-ny-eso-1 t cell receptors |
Also Published As
| Publication number | Publication date |
|---|---|
| EP3067366A1 (en) | 2016-09-14 |
| DK3268385T3 (da) | 2020-04-06 |
| JP2018509163A (ja) | 2018-04-05 |
| CA2974955A1 (en) | 2016-09-22 |
| US10781243B2 (en) | 2020-09-22 |
| EP3268385A1 (en) | 2018-01-17 |
| PT3268385T (pt) | 2020-04-08 |
| AU2016232441B2 (en) | 2020-08-27 |
| JP6998211B2 (ja) | 2022-02-04 |
| PL3268385T3 (pl) | 2020-06-29 |
| US20180057560A1 (en) | 2018-03-01 |
| EP3666793A2 (en) | 2020-06-17 |
| EP3268385B1 (en) | 2020-01-08 |
| EP3666793A3 (en) | 2020-07-29 |
| JP2021151249A (ja) | 2021-09-30 |
| CN107428816A (zh) | 2017-12-01 |
| WO2016146505A1 (en) | 2016-09-22 |
| ES2784315T3 (es) | 2020-09-24 |
| HUE049444T2 (hu) | 2020-09-28 |
| SI3268385T1 (sl) | 2020-07-31 |
| AU2016232441A1 (en) | 2017-08-10 |
| CN114195883A (zh) | 2022-03-18 |
| HK1247212A1 (zh) | 2018-09-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN107428816B (zh) | 针对肿瘤抗原ny-eso-1的mhc i和mhc ii-限制表位的癌症的组合t细胞受体基因疗法 | |
| US11447536B2 (en) | High avidity antigen recognizing constructs | |
| AU2020257113B2 (en) | Claudin-18.2-specific immunoreceptors and t cell epitopes | |
| US10725044B2 (en) | T cell receptors and immune therapy using the same | |
| JP2019506154A (ja) | 組換えt細胞受容体を含む組成物及びライブラリー並びに組換えt細胞受容体を使用する方法 | |
| US20220064257A1 (en) | Specific t cell receptors against epitopes of mutant myd88l265p protein for adoptive t cell therapy | |
| JP2022546106A (ja) | Ebv-由来抗原に特異的なtcr構築物 | |
| KR20240034205A (ko) | 항EGFRviii 항체, 폴리펩타이드, 상기 폴리펩타이드를 발현하는 세포, 상기 세포를 포함하는 의약 조성물, 상기 세포의 제조 방법 및 상기 폴리펩타이드를 코딩하는 염기서열을 포함하는 폴리뉴클레오티드 또는 벡터 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| GR01 | Patent grant | ||
| GR01 | Patent grant |