CN102341126A - 用于磁共振成像的钆表现脂质纳米颗粒 - Google Patents
用于磁共振成像的钆表现脂质纳米颗粒 Download PDFInfo
- Publication number
- CN102341126A CN102341126A CN2010800105605A CN201080010560A CN102341126A CN 102341126 A CN102341126 A CN 102341126A CN 2010800105605 A CN2010800105605 A CN 2010800105605A CN 201080010560 A CN201080010560 A CN 201080010560A CN 102341126 A CN102341126 A CN 102341126A
- Authority
- CN
- China
- Prior art keywords
- compositions
- lipid
- chelate
- dtpa
- metallo
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K49/00—Preparations for testing in vivo
- A61K49/06—Nuclear magnetic resonance [NMR] contrast preparations; Magnetic resonance imaging [MRI] contrast preparations
- A61K49/08—Nuclear magnetic resonance [NMR] contrast preparations; Magnetic resonance imaging [MRI] contrast preparations characterised by the carrier
- A61K49/085—Nuclear magnetic resonance [NMR] contrast preparations; Magnetic resonance imaging [MRI] contrast preparations characterised by the carrier conjugated systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K49/00—Preparations for testing in vivo
- A61K49/06—Nuclear magnetic resonance [NMR] contrast preparations; Magnetic resonance imaging [MRI] contrast preparations
- A61K49/18—Nuclear magnetic resonance [NMR] contrast preparations; Magnetic resonance imaging [MRI] contrast preparations characterised by a special physical form, e.g. emulsions, microcapsules, liposomes
- A61K49/1818—Nuclear magnetic resonance [NMR] contrast preparations; Magnetic resonance imaging [MRI] contrast preparations characterised by a special physical form, e.g. emulsions, microcapsules, liposomes particles, e.g. uncoated or non-functionalised microparticles or nanoparticles
- A61K49/1821—Nuclear magnetic resonance [NMR] contrast preparations; Magnetic resonance imaging [MRI] contrast preparations characterised by a special physical form, e.g. emulsions, microcapsules, liposomes particles, e.g. uncoated or non-functionalised microparticles or nanoparticles coated or functionalised microparticles or nanoparticles
- A61K49/1824—Nuclear magnetic resonance [NMR] contrast preparations; Magnetic resonance imaging [MRI] contrast preparations characterised by a special physical form, e.g. emulsions, microcapsules, liposomes particles, e.g. uncoated or non-functionalised microparticles or nanoparticles coated or functionalised microparticles or nanoparticles coated or functionalised nanoparticles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K49/00—Preparations for testing in vivo
- A61K49/06—Nuclear magnetic resonance [NMR] contrast preparations; Magnetic resonance imaging [MRI] contrast preparations
- A61K49/08—Nuclear magnetic resonance [NMR] contrast preparations; Magnetic resonance imaging [MRI] contrast preparations characterised by the carrier
- A61K49/10—Organic compounds
- A61K49/12—Macromolecular compounds
- A61K49/126—Linear polymers, e.g. dextran, inulin, PEG
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K49/00—Preparations for testing in vivo
- A61K49/06—Nuclear magnetic resonance [NMR] contrast preparations; Magnetic resonance imaging [MRI] contrast preparations
- A61K49/18—Nuclear magnetic resonance [NMR] contrast preparations; Magnetic resonance imaging [MRI] contrast preparations characterised by a special physical form, e.g. emulsions, microcapsules, liposomes
- A61K49/1806—Suspensions, emulsions, colloids, dispersions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K49/00—Preparations for testing in vivo
- A61K49/06—Nuclear magnetic resonance [NMR] contrast preparations; Magnetic resonance imaging [MRI] contrast preparations
- A61K49/18—Nuclear magnetic resonance [NMR] contrast preparations; Magnetic resonance imaging [MRI] contrast preparations characterised by a special physical form, e.g. emulsions, microcapsules, liposomes
- A61K49/1806—Suspensions, emulsions, colloids, dispersions
- A61K49/1812—Suspensions, emulsions, colloids, dispersions liposomes, polymersomes, e.g. immunoliposomes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K49/00—Preparations for testing in vivo
- A61K49/06—Nuclear magnetic resonance [NMR] contrast preparations; Magnetic resonance imaging [MRI] contrast preparations
- A61K49/18—Nuclear magnetic resonance [NMR] contrast preparations; Magnetic resonance imaging [MRI] contrast preparations characterised by a special physical form, e.g. emulsions, microcapsules, liposomes
- A61K49/1818—Nuclear magnetic resonance [NMR] contrast preparations; Magnetic resonance imaging [MRI] contrast preparations characterised by a special physical form, e.g. emulsions, microcapsules, liposomes particles, e.g. uncoated or non-functionalised microparticles or nanoparticles
- A61K49/1821—Nuclear magnetic resonance [NMR] contrast preparations; Magnetic resonance imaging [MRI] contrast preparations characterised by a special physical form, e.g. emulsions, microcapsules, liposomes particles, e.g. uncoated or non-functionalised microparticles or nanoparticles coated or functionalised microparticles or nanoparticles
- A61K49/1824—Nuclear magnetic resonance [NMR] contrast preparations; Magnetic resonance imaging [MRI] contrast preparations characterised by a special physical form, e.g. emulsions, microcapsules, liposomes particles, e.g. uncoated or non-functionalised microparticles or nanoparticles coated or functionalised microparticles or nanoparticles coated or functionalised nanoparticles
- A61K49/1878—Nuclear magnetic resonance [NMR] contrast preparations; Magnetic resonance imaging [MRI] contrast preparations characterised by a special physical form, e.g. emulsions, microcapsules, liposomes particles, e.g. uncoated or non-functionalised microparticles or nanoparticles coated or functionalised microparticles or nanoparticles coated or functionalised nanoparticles the nanoparticle having a magnetically inert core and a (super)(para)magnetic coating
- A61K49/1881—Nuclear magnetic resonance [NMR] contrast preparations; Magnetic resonance imaging [MRI] contrast preparations characterised by a special physical form, e.g. emulsions, microcapsules, liposomes particles, e.g. uncoated or non-functionalised microparticles or nanoparticles coated or functionalised microparticles or nanoparticles coated or functionalised nanoparticles the nanoparticle having a magnetically inert core and a (super)(para)magnetic coating wherein the coating consists of chelates, i.e. chelating group complexing a (super)(para)magnetic ion, bound to the surface
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K51/00—Preparations containing radioactive substances for use in therapy or testing in vivo
- A61K51/02—Preparations containing radioactive substances for use in therapy or testing in vivo characterised by the carrier, i.e. characterised by the agent or material covalently linked or complexing the radioactive nucleus
- A61K51/04—Organic compounds
- A61K51/0404—Lipids, e.g. triglycerides; Polycationic carriers
- A61K51/0408—Phospholipids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K51/00—Preparations containing radioactive substances for use in therapy or testing in vivo
- A61K51/02—Preparations containing radioactive substances for use in therapy or testing in vivo characterised by the carrier, i.e. characterised by the agent or material covalently linked or complexing the radioactive nucleus
- A61K51/04—Organic compounds
- A61K51/0497—Organic compounds conjugates with a carrier being an organic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K51/00—Preparations containing radioactive substances for use in therapy or testing in vivo
- A61K51/02—Preparations containing radioactive substances for use in therapy or testing in vivo characterised by the carrier, i.e. characterised by the agent or material covalently linked or complexing the radioactive nucleus
- A61K51/04—Organic compounds
- A61K51/06—Macromolecular compounds, carriers being organic macromolecular compounds, i.e. organic oligomeric, polymeric, dendrimeric molecules
- A61K51/065—Macromolecular compounds, carriers being organic macromolecular compounds, i.e. organic oligomeric, polymeric, dendrimeric molecules conjugates with carriers being macromolecules
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K51/00—Preparations containing radioactive substances for use in therapy or testing in vivo
- A61K51/12—Preparations containing radioactive substances for use in therapy or testing in vivo characterised by a special physical form, e.g. emulsion, microcapsules, liposomes, characterized by a special physical form, e.g. emulsions, dispersions, microcapsules
- A61K51/1217—Dispersions, suspensions, colloids, emulsions, e.g. perfluorinated emulsion, sols
- A61K51/1227—Micelles, e.g. phospholipidic or polymeric micelles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K51/00—Preparations containing radioactive substances for use in therapy or testing in vivo
- A61K51/12—Preparations containing radioactive substances for use in therapy or testing in vivo characterised by a special physical form, e.g. emulsion, microcapsules, liposomes, characterized by a special physical form, e.g. emulsions, dispersions, microcapsules
- A61K51/1241—Preparations containing radioactive substances for use in therapy or testing in vivo characterised by a special physical form, e.g. emulsion, microcapsules, liposomes, characterized by a special physical form, e.g. emulsions, dispersions, microcapsules particles, powders, lyophilizates, adsorbates, e.g. polymers or resins for adsorption or ion-exchange resins
- A61K51/1244—Preparations containing radioactive substances for use in therapy or testing in vivo characterised by a special physical form, e.g. emulsion, microcapsules, liposomes, characterized by a special physical form, e.g. emulsions, dispersions, microcapsules particles, powders, lyophilizates, adsorbates, e.g. polymers or resins for adsorption or ion-exchange resins microparticles or nanoparticles, e.g. polymeric nanoparticles
- A61K51/1251—Preparations containing radioactive substances for use in therapy or testing in vivo characterised by a special physical form, e.g. emulsion, microcapsules, liposomes, characterized by a special physical form, e.g. emulsions, dispersions, microcapsules particles, powders, lyophilizates, adsorbates, e.g. polymers or resins for adsorption or ion-exchange resins microparticles or nanoparticles, e.g. polymeric nanoparticles micro- or nanospheres, micro- or nanobeads, micro- or nanocapsules
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B82—NANOTECHNOLOGY
- B82Y—SPECIFIC USES OR APPLICATIONS OF NANOSTRUCTURES; MEASUREMENT OR ANALYSIS OF NANOSTRUCTURES; MANUFACTURE OR TREATMENT OF NANOSTRUCTURES
- B82Y5/00—Nanobiotechnology or nanomedicine, e.g. protein engineering or drug delivery
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Nanotechnology (AREA)
- Engineering & Computer Science (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Radiology & Medical Imaging (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Physics & Mathematics (AREA)
- Optics & Photonics (AREA)
- Dispersion Chemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biophysics (AREA)
- Molecular Biology (AREA)
- Immunology (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicinal Preparation (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Magnetic Resonance Imaging Apparatus (AREA)
Abstract
表现金属离子的脂质纳米颗粒和将组合物用于磁共振成像的方法。
Description
【相关申请的交叉引用】
本申请要求2009年2月13日提交的美国临时申请No.61/152,459和2009年3月24日提交的美国临时申请No.61/162,989的权益。各申请通过引用整体并入本文。
【政府特许权利的声明】
本发明是在美国国立卫生研究院(National Institutes for Health)/美国国立过敏性和传染性疾病研究院(National Institute of Allergyand Infectious Diseases)授予的合同号No.AI 52663的政府支持下完成的。政府对此发明具有某些权利。
【发明背景】
淋巴结牵连的早期诊断对于确定大部分类型癌症的治疗方案而言是必要的。淋巴结切除术和组织学评价是目前的基本标准,但仍不理想,因为它是侵入性的并且可产生假阳性。磁共振(MR)成像已成为用于探测癌症向淋巴结的扩散的有力的且非侵入性的工具。标准的MR成像依靠大小和形态标准来确定包括淋巴结转移的隐性淋巴组织,它具有低到60%的准确度。MR对比增强剂由于其在早期肿瘤探测中的有效性而被更广泛的使用。对比增强剂以不同的引起“充盈缺损”的速率扩散入转移性的淋巴结和健康的淋巴结。与尺寸标准相对比而言,用来自对照剂的充盈缺损来预测淋巴结转移可将灵敏度从29%提高至93%。
通常有两种类型的MR对比增强剂。超顺磁对比剂具有低r2/r1比,并且在T2-和T2*-加权像中产生了黑斑。这些通常是基于氧化铁颗粒并被称为阴性对比剂。另一方面,顺磁性对比剂增加了r1弛豫性,并且具有高r2/r1比,在T1加权MR图像中产生了亮斑。这些对比剂被称为阳性对比剂,并且通常是钆(Gd3+)的络合物。
T1缩短几乎贯穿在与水中质子的偶极-偶极相互作用中,因此具有7个未配对电子的Gd3+对于T1驰豫剂而言是最佳选择。因为Gd3+是重金属毒素,它通常作为紧密结合的线性的或肉眼可见的螯合物递送。Gd3+的螯合形式通过阻止细胞摄取游离Gd3+以及通过限制导致肾毒性的几乎唯一的经肾过滤清除至而降低了毒性。尽管毒性降低,但钆螯合物的快速清除以及小分子尺寸意味着低水平的Gd3+积聚于淋巴结内,使得这些试剂成为对MR淋巴系统造影术不利的选择。此外,FDA提出了关于在急性或慢性肾功能不全患者中用商品化钆对比剂鉴定灌注良好的组织和器官所引起的严重肾源性系统纤维化之风险的警告。
含Gd3+的脂质体和脂质纳米颗粒对于淋巴结的MR对比成像而言具有若干优势。脂质体以及脂质纳米颗粒可通过封装或在其表面结合大量Gd3+来降低毒性。不过,静脉内(IV)施用脂质体的快速清除机制未显著提高淋巴结内的脂质体相关Gd3+积聚。只有血液中的一部分脂质纳米颗粒被网状内皮细胞吞噬,且只有一部分那些细胞向淋巴系统移动。因此,IV施用脂质体提供了间接靶向淋巴系统和淋巴结。不过,此途径导致了大部分携带Gd3+的脂质体经由血液中的网状内皮细胞被排除。血液中脂质体的药物代谢动力学可经由大小和表面修饰被优化成适于淋巴结积聚。将脂质体直径减小到200nm以下减少了吞噬细胞依赖性清除,并增加了在血液中的循环时间。在脂质体表面加上聚乙二醇(PEG,通常称为PEG化)也增加了脂质体的循环时间和稳定性。
目前,螯合二亚乙基三胺五乙酰基(DTPA)的钆提供了在磁共振成像中用于鉴定发病组织的对比度。不幸的是,被批准用于临床的可溶性Gd-DTPA络合物诸如OMNISCAN在数分钟内即被清除,且不提供在淋巴组织内足够的浓度或时间。此外,钆的残余部分可在肾功能不全患者中导致纤维化。
尽管在对比剂的开发中有所进展,但仍存在对具有较长体内寿命的改良对比剂的需求,在待分析的组织中提供足够的浓度,并且降低残余钆浓度以避免副作用。本发明致力于满足此需求,并且提供进一步的相关优越性。
【发明简述】
本发明提供了表现金属离子的组合物及使用所述组合物的方法。
一方面,本发明提供了包含脂质、含聚亚烷基脂质和含脂质金属螯合物的组合物。
代表性的脂质包括磷脂、鞘脂、胆固醇和类固醇衍生物、胆汁酸和衍生物、心脂、酰基甘油酯及衍生物、糖脂、酰基肽、脂肪酸、基于碳水化合物的聚合物、官能化硅石、聚酸酐聚合物、聚乳酸-乙醇酸聚合物和生物聚合物。在一个实施方式中,脂质是磷脂。代表性的磷脂包括1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱(DSPC);二棕榈酰磷脂酰胆碱;二肉豆蔻酰磷脂酰胆碱;二油酰磷脂酰胆碱;源于蛋、大豆、亚麻子等的反式酯化磷脂;以及用磷脂酰乙醇胺、磷脂酰甘油、磷脂酰丝氨酸和磷脂酸取代的磷脂酰胆碱。
代表性的含聚亚烷基脂质包括含聚氧乙烯脂质或含聚氧丙烯脂质。在一个实施方式中,含聚亚烷基脂质是用聚乙二醇官能化的磷脂诸如N-(羰基-甲氧基聚乙二醇-2000)-1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺(mPEG-2000-DSPE)。
代表性的含脂质金属螯合物包括1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-N-二亚乙基三胺五乙酰基(DSPE-DTPA)、四氮杂环十二烷、四乙酰基(钆二酰胺)-PE和脂质-官能化的-[N,N-双[2-[双(羧甲基)氨基]-乙基]-甘氨酸根合-(5″)]。在一个实施方式中,含脂质金属螯合物包含PEG化的脂质部分。在一个实施方式中,含脂质金属螯合物是PEG化的DTPA。在另外的实施方式中,含脂质金属螯合物是DSPE-BOPTA、DSPE-DO3A和DSPE-DOTA。
在一个实施方式中,所述组合物还包括靶向部分。代表性的靶向部分包括:蛋白质、多肽、肽、抗体或其片段、小分子、糖或多糖或它们的衍生物以及核酸。
在一个实施方式中,本发明的组合物具有纳米颗粒的形式。在一个实施方式中,纳米颗粒具有大约5nm至大约2μm的直径。在一个实施方式中,纳米颗粒具有大约50nm至大约100μm的直径。
本发明的组合物可还包括金属离子。合适的金属离子包括顺磁性金属离子和放射性同位素离子。代表性的顺磁性金属离子包括Gd3+、Cu2+、Fe3+、Fe2+和Mn2+离子。代表性的放射性同位素离子包括68Ga、55Co、86Y、90Y、177Lu和111In离子。
在另一方面,本发明提供了包括载体和本发明多个纳米颗粒的可施用组合物。合适的载体包括药学可接受载体,诸如注射用盐水或注射用右旋糖。
在进一步的方面,本发明提供了用于组织成像的方法,包括给待成像受试者施用有效量的本发明的组合物。可用所述方法成像的代表性组织包括淋巴、心血管、肝脏、肾脏、脑、心脏、肌肉和胃肠道组织,以及可经由淋巴或血管(血液)系统入手的其它组织。
在另一方面,本发明提供了用于递送放射性癌症治疗剂至癌细胞的方法,包括对癌细胞施用有效量的含放射性同位素阴离子的本发明的组合物。
【附图说明】
参照以下详述并与附图结合,将更容易意识到并更好的理解本发明的前述方面和许多伴随优势。
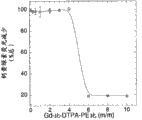
图1是以针对本发明代表性制剂之Gd3+:DTPA-PE(m/m)比以函数形式描述钙黄绿素荧光减少的图。所述制剂与钙黄绿素一起温育并检测其荧光。游离Gd3+与钙黄绿素结合并减少其荧光。
图2A和2B以Gd3+浓度的函数形式比较弛豫性。图2A比较了Gd3+剂量对T1驰豫率的影响;用针对与其它制剂相比较的本发明代表性制剂(Gd-DPTA-PE:mPEG-PE:DSPC)的标准自旋回波序列在1.5T磁共振(MR)扫描仪上测量Gd3+浓度(μmol/mL)的R1(1/T1)值。图2B比较了Gd3+剂量对T2驰豫率的影响;用针对与其它制剂相比较的本发明代表性制剂(Gd-DPTA-PE:mPEG-PE:DSPC)的标准自旋回波序列在1.5T磁共振(MR)扫描仪上测量Gd3+浓度(μmol/mL)的R2(1/T2)值。
图3描述了在注射本发明的代表性制剂(Gd-DPTA-PE:mPEG-PE:DSPC)后直至24小时的豚尾猴(M.Nemestrina)之腹腔的时间进程冠状位图像。图3A~3D是施用20分钟之前(3A)和之后(3B)、施用6小时(3C)和施用24小时(3D)的肝脏时间序列图像。上部的图描述了淋巴结的时间序列图像。所述淋巴结和肝脏显示出相较于背景组织的高对比度。
图4A是皮下注射本发明之代表性制剂(Gd-DPTA-PE:mPEG-PE:DSPC)24.4μmol/kg后直至24小时比较豚尾猴(M.Nemestrina)中淋巴结(LN1、LN2和LN3)和肝脏(肝脏)之MR动态对比增强图像强度的图。结果是针对图3A-3D中所显示图像的。图4B是相较于邻近对照组织而言的组织特异性MR信号(淋巴结)之时间进程的图。
图5A~5D是静脉内注射本发明之代表性制剂(0.01mmol/kgGd-DPTA-PE:mPEG-PE:DSPC)后:施剂前(5A);5分钟(5B);14分钟(5C);和24小时(5D)的大鼠时间进程MR图像。在5分钟和14分钟时对比度增强主要定位于淋巴结内的脉管系统和血管化组织中。5C中的箭头指示钆开始经由输送胆汁的途径排入胃肠道。到24小时时(5D)大部分对比剂被清除且残余部分出现在肠内。
图6A~6C是静脉内注射商品化的基于钆的对比剂(0.05mmol/kgGd-DPTA,OMNISCAN)后:施剂前(6A);5分钟(6B);和15分钟(6C)的大鼠时间进程MR图像。在5分钟或15分钟,对比度增强扩散到各处并且不局限于脉管系统、灌注良好的组织或淋巴结。对比介质向外围和远端的散布是明显的。
图7A~7D比较了静脉内注射商品化的基于钆的对比剂后(0.05mmol/kg Gd-DPTA,OMNISCAN,施剂前(7A);5分钟(7B);和15分钟(7C))的大鼠时间进程MR图像和施用本发明之代表性制剂(0.01mmol/kg Gd-DPTA-PE:mPEG-PE:DSPC)后15分钟时大鼠的MR图像。
图8A~8F比较了静脉内注射本发明之代表性制剂(Gd-DPTA-PE:mPEG-PE:DSPC):0.0mmol/kg(8A);0.00125mmol/kg(8B);0.0025mmol/kg(8C);0.005mmol/kg(8D);和0.010mmol/kg(8E和8F)后大鼠的剂量响应MR图像。淋巴结在图8F中非常明显。
图9A~9C比较了静脉内注射两种商品化的基于钆的对比剂(0.05mmol/kg MS-325,9A;0.05mmol/kg MAGNEVIST Gd-DPTA,9B)和本发明之代表性制剂(0.01mmol/kg Gd-DPTA-PE:mPEG-PE:DSPC,9C)后大鼠的MR图像。在施用后大约1至2分钟接近最高增强时获取图像。
图10是代表性的含脂质钆螯合物:DSPE-DOTA-Gd的制备示意图。
图11描述了用于制备代表性的含脂质螯合物的三种金属螯合物:p-SCN-Bn-DOTA;CHX-A″-DTPA;和p-SCN-Bn-DTPA。
图12是代表性的含脂质钆螯合物的制备示意图。
【发明详述】
本发明提供了表现金属离子的组合物和使用所述组合物的方法。在一个实施方式中,所述组合物是包括顺磁性金属离子在内的脂质纳米颗粒并且可用于磁共振成像。在另一实施方式中,所述组合物是包括放射性同位素离子在内的脂质纳米颗粒并且可用于放射性癌症治疗剂的递送。
一方面,本发明提供了用于磁共振成像的组合物和方法。所述组合物和方法增强了钆在淋巴管中的散布和积聚。本发明提供了适于静脉内和皮下施用的钆组合物(在此称为″Gd-DTPA-脂质纳米颗粒″)。皮下施用允许直接进入淋巴系统。所述组合物增强了淋巴结内的T1加权MR信号,以及增加了对比剂在淋巴内的滞留时间。静脉内施用后,所述组合物作为血管成像剂展示出超过可溶性Gd-DTPA至少100倍的增强,并且主要通过输送胆汁而非肾清除来排除。所述组合物对于猕猴内淋巴结的MR显像显示出信噪比显著增加了300倍以上。
本发明的组合物包括脂质、含聚亚烷基脂质和含脂质金属螯合物。在一个实施方式中,所述组合物还包括螯合的金属离子。
在一个实施方式中,本发明的组合物是螯合物-(或金属螯合物-)表现颗粒。用于此处时,术语“表现”指颗粒呈现或具有可利用的螯合物或螯合金属,以发挥活性。如上所提及,在一个实施方式中,本发明的组合物是具有螯合钆离子(Gd+3)的脂质纳米颗粒(例如,Gd-DTPA-脂质纳米颗粒)。在所述脂质纳米颗粒中,螯合的钆离子被表现。
本发明的脂质纳米颗粒是生物相容的并且容易施用。所述纳米颗粒具有从约5nm至约2μm的直径。在一个实施方式中,所述纳米颗粒具有从约10nm至约100μm的直径。在一个实施方式中,所述纳米颗粒具有约70nm的直径。
如上所述,本发明的组合物(例如,脂质纳米颗粒)包括脂质、含聚亚烷基脂质和含脂质金属螯合物。
【脂质】本发明纳米颗粒的脂质组分包含纳米颗粒核心。
可用于组合物中的代表性脂质包括:磷脂、鞘脂、胆固醇和类固醇衍生物、胆汁酸和衍生物、心脂、酰基甘油酯及衍生物、糖脂、酰基肽、脂肪酸、基于碳水化合物的聚合物(例如,纤维素聚合物)、适当官能化的硅石、亲脂性的聚合物(例如,聚酸酐、聚乳酸-乙醇酸)和亲脂性的生物聚合物(例如,蛋白质、糖聚合物)。
在一个实施方式中,所述脂质是二硬脂酰基酰胺基甲基胺。
在一个实施方式中,脂质是磷脂。代表性的磷脂包括:1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱(DSPC);二棕榈酰磷脂酰胆碱;二肉豆蔻酰磷脂酰胆碱;二油酰磷脂酰胆碱;源于蛋、大豆、亚麻子等的反式酯化磷脂;以及用磷脂酰乙醇胺、磷脂酰甘油、磷脂酰丝氨酸和磷脂酸取代的磷脂酰胆碱。在一个实施方式中,所述磷脂是1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱(DSPC)。
【含聚亚烷基脂质】本发明纳米颗粒的含聚亚烷基脂质组分用作表面水合剂。
代表性的含聚亚烷基脂质包括含聚氧乙烯脂质和含聚氧丙烯脂质。在一个实施方式中,含聚亚烷基脂质是用聚乙二醇官能化的磷脂(例如,PEG化磷脂)。合适的PEG化磷脂包括具有平均分子量从约500至约20,000的聚乙二醇。在一个实施方式中,PEG化磷脂是N-(羰基-甲氧基聚乙二醇-2000)-1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺(mPEG-2000-DSPE)(在此又称为″mPEG-DSPE″和″mPEG-PE″)。
除了含聚亚烷基脂质之外,在另外的实施方式中,表面水合剂是亲水的生物材料诸如碳水化合物聚合物、聚胺、聚乙烯吡咯烷酮、聚(天冬氨酸)或聚(L-氨基酸)。
其它可用的表面水合剂包括:聚乙氧基、聚甲二醇或丙二醇和脂质或其它疏水部分(例如,长链烃)的共价缀合物。
表面水合剂优选以组合物(即,脂质、含聚亚烷基脂质(表面水合剂)和含脂质金属螯合物)的约5至约50摩尔百分率存在。
【含脂质金属螯合物】本发明纳米颗粒的含脂质金属螯合物组分表现在纳米颗粒的表面上并用于螯合金属离子。合适的含脂质金属螯合物包括两个部分:(1)脂质部分(2)金属螯合物部分。
代表性的含脂质金属螯合物包括:1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-N-二亚乙基三胺五乙酰基(DSPE-DTPA)、四氮杂环十二烷、四乙酰基(钆二酰胺或OMNISCAN)-PE和脂质-官能化的-[N,N-双[2-[双(羧甲基)氨基]乙基]-甘氨酸根合-(5″)](MAGNEVIST)。
代表性的金属螯合物包括BOPTA、DO3A和DOTA螯合物。
在一个实施方式中,金属螯合物包括PEG化的脂质部分。代表性的PEG化金属螯合物包括:DSPE-BOPTA、DSPE-DO3A和DSPE-DOTA。在一个实施方式中,所述金属螯合物是PEG化的DTPA(DPTA-PE)。
金属螯合物优选以脂质、含聚亚烷基脂质(表面水合剂)和金属螯合物的约5至约50摩尔百分率存在。
【螯合的金属离子】本发明的组合物是金属离子的有效载体。在这些实施方式中,所述组合物(例如,脂质纳米颗粒)还包括螯合的金属离子。
对于MR应用,可用的金属离子包括顺磁性金属离子。代表性的顺磁性金属离子包括Gd3+、Cu2+、Fe3+、Fe2+和Mn2+离子。
对于其它应用诸如成像和治疗性离子递送,可用的金属离子包括放射性同位素离子。代表性的放射性同位素离子包括68Ga、55Co、86Y、90Y、177Lu和111In的离子。
对于包括螯合的金属离子的实施方式而言,金属离子:金属螯合物的比率是0.1~1.0∶1.0(小于或等于1∶1)。
【靶向剂】本发明的组合物可用于靶向特异组织。在这些实施方式中,所述组合物(例如,脂质纳米颗粒)还包括靶向部分。代表性的靶向部分包括蛋白质、多肽和肽;抗体及其衍生物(片段);小分子;糖、多糖、和衍生物;以及核酸,诸如核苷酸聚合物(例如,适配体)、DNA;和RNA。代表性的靶向部分靶子包括癌细胞和感染病毒的细胞。
【脂质纳米颗粒制剂】本发明的脂质纳米颗粒可配制入用于施用的组合物。用于施用的合适组合物包括载体和多个脂质纳米颗粒。代表性的载体包括药学可接受载体,诸如注射用盐水或注射用右旋糖。
本发明的脂质纳米颗粒不是脂质体且在配制时不形成脂质体。
【用于组织成像的方法】在另一方面,本发明提供了用于组织(例如,被遮蔽组织)成像的方法。在一个实施方式中,所述方法包括给待成像受试者施用诊断有效量的本发明的组合物。所述组合物可利用多种技术(包括皮下和静脉内)施用。该方法对诸如淋巴、心血管、肝脏、肾脏、脑、心脏、肌肉和胃肠道组织以及可经由淋巴或血管(血液)系统入手的其它组织的成像有效。该方法可对以上组织有效成像以确定该组织是否被遮蔽。对于磁共振成像方法而言,所述组合物包括顺磁性金属离子(例如,Gd3+)。
通常,有效量是从约0.001至约5mmol金属/kg受试者。在一个实施方式中,有效量是从约0.005至约0.050mmol金属/kg受试者。在一个实施方式中,有效量是约0.010mmol金属/kg受试者。
【用于放射性癌症治疗剂递送的方法】在另一方面,本发明提供了用于将放射性癌症治疗剂递送至癌细胞的方法。在一个实施方式中,该方法包括给需要其治疗的受试者施用治疗有效量的本发明的组合物,其中的螯合的金属离子是放射性同位素(例如,68Ga、55Co、86Y、90Y、177Lu和111In)。所述组合物可利用多种技术包括皮下和静脉内施用。该方法对于递送至组织诸如淋巴、心血管、肝脏、肾脏、脑、心脏、肌肉和胃肠道组织以及可经由淋巴或血管(血液)系统入手的其它组织有效。
以下是本发明之代表性脂质纳米颗粒的制备、定性和成像结果的描述。
脂质纳米颗粒被制备成含10个摩尔百分率的表面结合DTPA。这些脂质纳米颗粒包含二硬脂酰基-磷脂酰胆碱和PEG化脂质,mPEG-2000-DSPE。它们被允许以不同的Gd3+-比-DTPA-PE之摩尔比与Gd3+络合(表示为Gd3+..Cl-)。通过游离Gd3+淬灭钙黄绿素荧光的能力确定混合物中游离Gd3+的存在。以高达4的Gd3+-比-DTPA-PE摩尔比,通过钙黄绿素淬灭检验未探测到游离Gd3+。在6或更高的Gd3+-比-DTPA-PE摩尔比,探测到游离的或未结合的Gd3+(见图1)。为了确定Gd3+对DTPA-表现脂质纳米颗粒的影响,我们通过光子相关光谱法测定颗粒直径。DTPA-表现脂质纳米颗粒的直径是Gd3+浓度依赖性的。在Gd3+-比-DTPA摩尔比等于或低于1时,Gd3+的存在不影响脂质纳米颗粒的直径。在Gd3+-比-DTPA摩尔比为2时,Gd3+-DTPA脂质纳米颗粒的表观直径增加至约2-至3-倍,而与DTPA-脂质纳米颗粒相关的Gd程度则未明显降低(见表1)。室温下经24小时均探测到这些脂质纳米颗粒呈现稳定,因为直径无显著变化。总之,这些数据显示Gd3+-比-DTPA比影响了Gd3+掺入Gd-DTPA脂质纳米颗粒的程度和它们的表观直径。在Gd3+-比-DTPA摩尔比等于或低于2时,大体上所有的Gd3+均与脂质纳米颗粒相联。在一个实施方式中,本发明的组合物中的Gd3+-比-DTPA摩尔比大约是1。
通过比较各种Gd3+制剂对Gd3+之R1(1/T1)弛豫性的影响来确定Gd3+-表现脂质纳米颗粒的对比特性。脂质纳米颗粒由携带或不携带PEG化脂质的二硬脂酰基-磷脂酰胆碱(DSPC)(mPEG-2000-DSPE,在此称为″mPEG-DSPE″或″mPEG-PE″)组成,并且有1的固定的Gd3+-比-DTPA摩尔比。用1.5T MR扫描仪收集T1和T2测量值。临床使用的Gd-DTPA制剂(OMNISCAN,购自GE Healthcare,Princeton,NJ)包括在内作为比较。如图2A中所示,本发明之代表性组合物,包含mPEG-PE的Gd-DTPA脂质纳米颗粒(Gd-DTPA-PE:mPEG-PE:DSPC),展示出比其他制剂(包括OMNISCAN和不包含mPEG之脂质纳米颗粒)显著较高的R1值。对于T2测量而言,mPEG对Gd-DTPA脂质纳米颗粒的作用较小(见图2B)。不过,两种Gd-DTPA脂质纳米颗粒组合物(Gd-DTPA-PE:mPEG-PE:DSPC和Gd-DTPA-PE:DSPC)的R1和R2值均显著高于可溶性Gd-DTPA商品化制剂(OMNISCAN)或溶液中游离Gd3+(Gd w/o DTPA)的相应数值。据我们所知,关于本发明的Gd-DTPA纳米颗粒的R1值是包括那些用包含PEG的Gd3+表现脂质体所报道数值在内的迄今为止所观察到的最高数值。事实上这些结果比用含有表现与蛋反式酯化(transesterified)PE联接之PEG(MW=5000)而非与DSPE联接之mPEG的蛋凝集素和胆固醇之Gd-DTPA脂质体收集到的数据高10倍以上。
两种包含Gd3+的纳米颗粒制剂均具有比可溶性Gd-DTPA高的R1值。正如所预期的,无Gd3+的DSPC和DSPC加mPEG-2000-PE对照制剂显示对弛豫性无显著影响。所述数据显示含PEG的Gd-DTPA-脂质纳米颗粒相较于其他制剂而言使得R1得到了极大的提高。在与商品化的OMNISCAN比较时,R1弛豫性获得了高达100倍的增加。无表面PEG的Gd-DTPA纳米颗粒制剂(Gd-DTPA-PE:DSPC)也显示比OMNISCAN高的R1值,但比含PEG-的Gd-DTPA-脂质纳米颗粒制剂(Gd-DTPA-PE:mPEG-PE:DSPC)低得多(见图2A)。
因为MR成像中Gd3+所产生的阳性对比度取决于低R2/R1比,所以此外还测定了R2数值的变化。图2B证明了各种Gd3+制剂对R2(1/T2)弛豫性测量的影响。PEG化的Gd-DTPA-脂质纳米颗粒(Gd-DTPA-PE:mPEG-PE:DSPC和Gd-DTPA-PE:DSPC)再次显示出相较于其它制剂而言R2有较大的增加,不过变化的数量级较小。mPEG化Gd-DTPA-脂质纳米颗粒(Gd-DTPA-PE:mPEG-PE:DSPC)显示出相较于OMNISCAN而言R2约有8倍的增加。DSPC(无mPEG)纳米颗粒制剂(Gd-DTPA-PE:DSPC)中的Gd-DTPA显示出R2比R1有较大的增加,这可能限制了其作为阳性对比制剂的效力。无Gd3+的DSPC和DSPC加mPEG-2000-PE对照制剂(DTPA-PE:mPEG-PE:DSPC和DTPA-PE:DSPC)再次显示出对弛豫性无影响。弛豫性实验显示,mPEG化Gd-DTPA-脂质纳米颗粒制剂相较于其它制剂而言大大提高了R1弛豫性。不过,在高浓度时(大于3μmol/ml),T1溢出进入T2变得显著,导致T1信号明显减少(数据未显示)。用最小的Gd3+浓度可获得最佳的T1组织对比度。这些数据清楚证明了比商品化产物OMNISCAN所提供的高的多的对比“效力”。
下文描述了利用含mPEG-2000-PE的Gd-DTPA脂质纳米颗粒(Gd-DTPA-PE:mPEG-PE:DSPC或″Gd-DTPA脂质纳米颗粒″)进行灵长类的MR成像研究。
图3A-3D显示对比前和皮下注射Gd3+-DTPA-脂质纳米颗粒后直到24小时两者的豚尾猴(M.Nemestrina)腹腔的若干冠状位MR图像。附属的淋巴结明显可见相较于周围组织而言具有高度的强度增加(图3的上部图)。尽管持续到24小时,在早达20分钟时就可观察到淋巴结的增强。图4显示动态的对比增强MRI的时间进程,显示了相对于时间而言的各个器官的相对强度。此数据显示,Gd3+-DTPA-脂质纳米颗粒在注射后20分钟内迅速到达淋巴结组织,并且保持对比度增强至少24小时。与在静脉内施用可溶性Gd-DTPA(OMNISCAN制品)处理的动物淋巴系统中20分钟内消散的低信号相比,单次皮下Gd-DTPA脂质纳米颗粒施剂提供了针对延长时间的大大增强的信号。
Gd-DTPA-脂质纳米颗粒的MR成像增强特性可用于使生成血管图像增强所需要的静脉内剂量最小化并且还减少了肾的负担。在大鼠中施用0.01mmol/kg Gd-DTPA纳米颗粒(约1/5的用于人的通用剂量)在5分钟内产生了明显可辨别的大鼠中央和外周脉管系统的高质量MR图像(图5B)。它在15分钟内开始经由胆道和消化道清除(图5C),并在24小时时清除过程看起来似乎完成了(图5D)。相反,0.05mmol可溶性Gd-DTPA(OMNISCAN)产生了具有无血管清晰度的扩散对比定位;它还呈现出散布至外围远端(图6A)。在有限剂量响应研究中,相较于目前的Gd-DTPA制剂而言,在大鼠中只需要大约10至20倍更低剂量的Gd-DTPA-脂质纳米颗粒来产生大鼠中相当或更高清晰度的对比增强MR图像。DTPA-脂质纳米颗粒中的0.0025mmol/kg Gd产生了与0.05mmol/kg Gd-DTPA(OMNISCAN)制剂质量相当的图像。因此,Gd-DTPA-脂质纳米颗粒可克服目前获批的Gd对比剂由于肾功能不全和神经中毒性而造成的难题。
具有表面结合钆离子的本发明PEG化脂质纳米颗粒在对比增强MR淋巴系统造影术和血管成像中展示出超越其它制品的大提高。这些脂质纳米颗粒在皮下注射后显示出在淋巴结内高度积聚。在注射后20分钟内,淋巴组织中开始对比增强并且保持24小时。当静脉内给予时,此制剂以比目前制剂高得多的灵敏度产生了高质量的脉管系统图像。静脉内施用的脂质纳米颗粒几乎专门经由输送胆汁的途径被清除并且表现出在24小时内完成。通过在脂质纳米颗粒中添加mPEG的表面修饰经由与水分子的协同增加了Gd3+的MR信号。这导致了更高的R1弛豫性和淋巴结图像增强。脂质纳米颗粒制剂可允许使用低剂量来达到高信噪MR对比率用于增加转移性结节辨别力,并得到适于成像的更宽的时间框架。MR对比所需Gd3+的潜在较低剂量和更有利的排除路径可提供更高的安全裕度。
本发明制剂以比目前可用且已批准的对比剂相对较低的剂量提供了有效的对比。图8A~8F比较静脉内注射本发明之代表性制剂(Gd-DPTA-PE:mPEG-PE:DSPC):0.0mmol/kg(8A);0.00125mmol/kg(8B);0.0025mmol/kg(8C);0.005mmol/kg(8D);和0.010mmol/kg(8E和8F)后大鼠的剂量响应MR图像。淋巴结在图8F中是明显可见的。
如上所述,本发明制剂提供了超过目前可用且已批准对比剂的优越性。图9A~9C比较了静脉内注射两种商品化的基于钆的对比剂(0.05mmol/kg MS-325,EPIX Pharmaceuticals,Inc.,Cambridge,MA,图9A;和0.05mmol/kg MAGNEVIST Gd-DPTA,BayerHealthCare Pharmaceuticals,图9B)和本发明之代表性制剂(0.01mmol/kg Gd-DPTA-PE:mPEG-PE:DSPC,图9C)后大鼠的MR图像。在施用后约1至2分钟接近峰值增强时获取图像。正如从图像中可见的,本发明的代表性制剂展示了比目前可用试剂显著较大的对比。
图10是关于通过将DSPE与p-SCN-Bn-DOTA反应并随后进行Gd金属化而制备用于本发明之代表性Gd络合物(DSPE-DOTA-Gd)的合成示意图。图11描述了与磷脂反应且可用于本发明中的三种代表性螯合剂(异硫氰酸根,-N=C=S或-NCS)(p-SCN-Bn-DOTA,CHX-A″-DTPA,和p-SCN-Bn-DTPA)。图12描述了四种代表性的亲脂性化合物(DSA,二醚PE,DSPE-PEG(2000)胺,和DSPE)以及通过将DSPE与p-SCN-Bn-DOTA反应并随后进行Gd金属化而制备本发明中有效的代表性Gd络合物(DSPE-DOTA-Gd)的合成示意图。本发明中可用的含脂质金属螯合物如图10和12中所示较容易制备。将合适的反应性金属螯合物(例如,异硫氰酸根-官能化的金属螯合物,见图11)与含合适反应基团(例如,DSPE,DSPE-PEG(2000)胺,二醚PE,DSA中的氨基,见图10和12)的脂质化合物反应,以提供其中脂质部分与金属螯合物共价偶联的含脂质金属螯合物。对于异硫氰酸根-官能化的金属螯合物和反应性含胺脂质而言,产物含脂质金属螯合物包括将脂质与螯合物偶联的硫脲(-NH-C(=S)-NH-)连接。应意识到其它合适的反应性金属螯合物(例如,异氰酸根)和含合适反应性基团(例如,醇)的脂质化合物可提供本发明中可用的含脂质金属螯合物。螯合物的金属化提供了含金属离子的化合物。
【表1】Gd3+比DTPA摩尔比对Gd3+-脂质纳米颗粒a的颗粒大小和稳定性的影响。
aDTPA被表现于由DSPC、mPEG-PE和DTPA-PE(8∶1∶0.9摩尔比)组成的脂质纳米颗粒上,如实施例1中所述。
b纳米颗粒以指示的DTPA比Gd3+摩尔比暴露于GdCl3。
c用光子相关光谱法测量表现DTPA的纳米颗粒的直径,且数据表示为在指示时间点的一式四份样品的平均值±SD。
d用钙黄绿素荧光淬灭检验估计未结合的或游离的Gd3+的存在。
以下实施例的目的在于举例说明而非限制本发明。
【实施例】
【实施例1】
【材料和方法】
【脂质纳米颗粒制备】将1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱(DSPC,Avanti Polar Lipids,AL)、N-(羰基-甲氧基聚乙二醇-2000)-1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺(mPEG-2000-DSPE,Genzyme,MA)和1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-N-DTPA(DSPE-DTPA,Avanti Polar Lipids,AL)以8∶2∶1的比例在氯仿中组合(DSPC:mPEG-DSPE:DSPE-DTPA),并在氮和随后在高真空中过夜干燥成薄膜。含各种分子量(或链长)之PEG聚合物的mPEG-DSPE也可购自Genzyme,MA。此时向膜加磷酸缓冲盐(PBS,pH 7.4)并在浴式超声波破碎仪(Laboratory Supplies Company,New York)中进行超声处理。利用Malvern Zetasizer 5000光子相关光谱仪(MalvernInstruments,PA)通过动态光散射测量的囊泡直径是50nm。将悬浮液中的纳米颗粒与六水氯化钆(III)(Aldrich,St Louis,MO)以指定摩尔比混合20分钟以形成Gd-DTPA-脂质纳米颗粒。为了测定未结合的Gd3+,将纳米颗粒与钙黄绿素(0.5μM)(Sigma,St Louis,MO)在PBS,pH 7.4中一起温育,用Victor3V 1420多标记计数仪(PerkinElmer,Waltham,MA)在485/535nm测量荧光。游离的离子Gd3+以[Gd3+]依赖方式淬灭钙黄绿素荧光。为了测定最终的Gd浓度,用诱导式偶联血浆原子发射光谱法测定元素Gd质量。在此处所述研究中使用了所述颗粒连同无Gd3+之对照颗粒。
【弛豫性研究】用0~5μmol/ml之间的Gd3+浓度制备Gd-DTPA-脂质纳米颗粒的稀释液。为了比较从具有0~5μmol/ml之Gd3+浓度的商品化试剂诸如OMNISCAN(Gd-DTPA-BMA)制备若干样品。以体积顶盘管作为RF接收器在1.5T MR扫描仪上利用标准自旋回波序列测量驰豫时间T1。对于T1测量,将TE固定在9ms,并且7个TR分别是133、200、300、500、750、1000和2000ms。对于T2测量,将TR固定在2000ms,并且四个TE分别是15、30、45和60ms。使成像强度适合获得相应的T1和T2值,将其针对Gd3+浓度作图。
【灵长类淋巴的MRI研究】在1.5T MR扫描仪中利用用于动态对比增强(DCE)MRI的Gd-DTPA-脂质纳米颗粒进行淋巴结体内成像。经由吸入异氟醚(1~2%)麻醉豚尾猴(M.Nemestrina),并在实验过程中严密监测。记录灵长类的对比前图像,以确定正确的淋巴结位置和调整成像参数。将动物从MR扫描仪上取下,并在四个位点进行皮下注射。每个注射位点分别接受2、5、5和8.5mL的6.1μmol/mlGd-DTPA-脂质纳米颗粒,以允许探测剂量效应和从注射位点的对比扩散。对于灵长类研究而言,Gd的总剂量估计为24.4μmol/kg。在Signa 1.5T扫描仪上利用12×12英寸2的表面盘管记录图像。利用标准的自旋回波成像序列:TR=500ms、TE=15ms、切片厚度3mm、21个切片、切片间隙=0.5mm、FOV(视野)=320×320mm2、矩阵大小=512×512、这给出了0.63×0.63mm2的面内分辨率,且时间分辨率是3.1分钟。
【大鼠血管的MRI研究】在3.0T MR扫描仪中利用用于动态对比增强(DCE)MRI的Gd-DTPA-脂质纳米颗粒进行大鼠体内成像。经由吸入异氟醚(1~2%)麻醉大鼠(SD),并在实验过程中严密监测。记录大鼠的对比前图像以确定恰当的位置、方向并调整成像参数。将动物从MR扫描仪上取下,并经由股静脉注射400μL指定的Gd对照介质。在Signa 1.5T扫描仪上利用12×12英寸的表面盘管记录图像。使用标准的自旋回波成像序列:TR=500ms、TE=15ms、切片厚度3mm、21个切片、切片间隙=0.5mm、FOV(视野)=320×320mm2、矩阵大小=512×512、这给出了0.63×0.63mm2的面内分辨率,且时间分辨率是3.1分钟。
尽管举例说明并描述了本发明的优选实施方式,但应当认识到其中可做不脱离本发明精神和范围的各种改变。
Claims (39)
1.组合物,包含:
(a)脂质;
(b)含聚亚烷基脂质;和
(c)含脂质金属螯合物.
2.权利要求1的组合物,其中的脂质选自:磷脂、鞘脂、胆固醇和类固醇衍生物、胆汁酸和衍生物、心脂、酰基甘油酯及衍生物、糖脂、酰基肽、脂肪酸、基于碳水化合物的聚合物、官能化硅石、聚酸酐聚合物、聚乳酸-乙醇酸聚合物和生物聚合物。
3.权利要求1的组合物,其中的脂质是磷脂。
4.权利要求3的组合物,其中的磷脂选自1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱(DSPC);二棕榈酰磷脂酰胆碱;二肉豆蔻酰磷脂酰胆碱;二油酰磷脂酰胆碱;源于蛋、大豆、亚麻子等的反式酯化磷脂;以及用磷脂酰乙醇胺、磷脂酰甘油、磷脂酰丝氨酸和磷脂酸取代的磷脂酰胆碱。
5.权利要求1的组合物,其中的含聚亚烷基脂质选自含聚氧乙烯脂质和含聚氧丙烯脂质。
6.权利要求1的组合物,其中的含聚亚烷基脂质是用聚乙二醇官能化的磷脂。
7.权利要求6的组合物,其中用聚乙二醇官能化的磷脂包含具有平均分子量为约500至约20,000的聚乙二醇。
8.权利要求7的组合物,其中用聚乙二醇官能化的磷脂是N-(羰基-甲氧基聚乙二醇-2000)-1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺(mPEG-2000-DSPE)。
9.权利要求1的组合物,其中含脂质金属螯合物选自:1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-N-二亚乙基三胺五乙酰基(DSPE-DTPA)、四氮杂环十二烷、四乙酰基(钆二酰胺)-PE,脂质-官能化的-[N,N-双[2-[双(羧甲基)氨基]-乙基]-甘氨酸根合-(5″)]。
10.权利要求1的组合物,其中含脂质金属螯合物包含PEG化的脂质部分。
11.权利要求1的组合物,其中含脂质金属螯合物是PEG化DTPA。
12.权利要求1的组合物,其中含脂质金属螯合物选自:DSPE-BOPTA、DSPE-DO3A和DSPE-DOTA。
13.权利要求1的组合物,其中含聚亚烷基脂质以占脂质、含聚亚烷基脂质和含脂质金属螯合物的约5至约50摩尔百分率存在。
14.权利要求1的组合物,其中含脂质金属螯合物以占脂质、含聚亚烷基脂质和含脂质金属螯合物的约5至约50摩尔百分率存在。
15.权利要求1~14中任一项的组合物,其还包含靶向部分。
16.权利要求15的组合物,其中靶向部分选自:蛋白质、多肽、肽、抗体或其片段、小分子、糖或多糖或它们的衍生物以及核酸。
17.权利要求15的组合物,其中的靶向部分靶向癌细胞或感染病毒的细胞。
18.权利要求1~17中任一项的组合物,其为纳米颗粒形式。
19.权利要求18的组合物,其中纳米颗粒具有约5nm至约2μm的直径。
20.权利要求18的组合物,其中纳米颗粒具有约50nm至约100μm的直径。
21.权利要求1~20中任一项的组合物,其还包含螯合的金属离子。
22.权利要求21的组合物,其中螯合的金属离子∶金属螯合物的比率是0.1~1.0∶1.0。
23.权利要求21或22的组合物,其中的螯合的金属离子是顺磁性金属离子。
24.权利要求23的组合物,其中的顺磁性金属离子选自:Gd3+、Cu2+、Fe3+、Fe2+和Mn2+。
25.权利要求21或22的组合物,其中螯合的金属离子是放射性同位素离子。
26.权利要求25的组合物,其中的放射性同位素离子选自:68Ga、55Co、86Y、90Y、177Lu和111In的离子。
27.组合物,其包含载体和权利要求18的多个纳米颗粒。
28.权利要求27的组合物,其中载体是药学可接受载体。
29.权利要求27的组合物,其中的载体是注射用盐水或注射用右旋糖。
30.用于组织成像的方法,包括给待成像受试者施用有效量的权利要求21~29中任一项的组合物。
31.权利要求30的方法,其中组合物是皮下施用的。
32.权利要求30的方法,其中组合物是静脉内施用的。
33.权利要求30的方法,其中的组织选自:淋巴、心血管、肝脏、肾脏、脑、心脏、肌肉和胃肠道组织,以及可经由淋巴或血管(血液)系统入手的其它组织。
34.权利要求30的方法,其中的有效量是约0.001至约5mmol金属/kg受试者。
35.权利要求30的方法,其中的有效量是约0.005至约0.050mmol顺磁性金属/kg受试者。
36.权利要求30的方法,其中的有效量是约0.01mmol顺磁性金属/kg受试者。
37.用于递送放射性癌症治疗剂至癌细胞的方法,包括对癌细胞施用有效量的权利要求25或26的组合物。
38.权利要求37的方法,其中的组合物是皮下施用的。
39.权利要求37的方法,其中的组合物是静脉内施用的。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN201610996986.1A CN106362171A (zh) | 2009-02-13 | 2010-02-16 | 用于磁共振成像的钆表现脂质纳米颗粒 |
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US15245909P | 2009-02-13 | 2009-02-13 | |
| US61/152,459 | 2009-02-13 | ||
| US16298909P | 2009-03-24 | 2009-03-24 | |
| US61/162,989 | 2009-03-24 | ||
| PCT/US2010/024324 WO2010094043A2 (en) | 2009-02-13 | 2010-02-16 | Gadolinium expressed lipid nanoparticles for magnetic resonance imaging |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201610996986.1A Division CN106362171A (zh) | 2009-02-13 | 2010-02-16 | 用于磁共振成像的钆表现脂质纳米颗粒 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN102341126A true CN102341126A (zh) | 2012-02-01 |
Family
ID=42562321
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201610996986.1A Pending CN106362171A (zh) | 2009-02-13 | 2010-02-16 | 用于磁共振成像的钆表现脂质纳米颗粒 |
| CN2010800105605A Pending CN102341126A (zh) | 2009-02-13 | 2010-02-16 | 用于磁共振成像的钆表现脂质纳米颗粒 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201610996986.1A Pending CN106362171A (zh) | 2009-02-13 | 2010-02-16 | 用于磁共振成像的钆表现脂质纳米颗粒 |
Country Status (5)
| Country | Link |
|---|---|
| US (2) | US20120087857A1 (zh) |
| EP (1) | EP2398503B1 (zh) |
| JP (2) | JP5847588B2 (zh) |
| CN (2) | CN106362171A (zh) |
| WO (1) | WO2010094043A2 (zh) |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2833926A4 (en) * | 2012-04-05 | 2015-11-25 | Univ Florida | NEUROPHILIC NANOPARTICLES |
| WO2016073348A1 (en) * | 2014-11-03 | 2016-05-12 | Albert Einstein College Of Medicine, Inc. | Modified paramagnetic nanoparticles for targeted delivery of therapeutics and methods thereof |
| GB201509934D0 (en) | 2015-06-08 | 2015-07-22 | King S College London | Nanoparticles |
| WO2016205384A1 (en) * | 2015-06-15 | 2016-12-22 | The University Of Washington | Multiple drug lipid nanoparticle composition and related methods for extended drug levels in blood and lymph tissue |
| CN107412790B (zh) * | 2017-09-08 | 2019-02-22 | 丽水市中心医院 | 一种核磁共振纳米材料的制备方法 |
| EP3787696A4 (en) * | 2018-04-30 | 2022-05-18 | Bar-Ilan University | POLYMERIC CORE-SHELL PARTICLES |
| CN113543771A (zh) * | 2019-01-24 | 2021-10-22 | 阿尔兹卡生物科学公司 | 用于错误折叠蛋白质成像的功能化脂质体 |
| US11116854B2 (en) * | 2020-01-29 | 2021-09-14 | Texas Children's Hospital | Targeted contrast agents for MRI of amyloid deposition |
| CN113730614B (zh) * | 2021-09-09 | 2022-02-22 | 南京市第一医院 | 一种镥标记的纳米载体及其制备方法 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1535163A (zh) * | 2001-05-30 | 2004-10-06 | ˹������˹�о�ѧԺ | 核酸传递系统 |
| US20050112065A1 (en) * | 2003-07-09 | 2005-05-26 | Drummond Daryl C. | Remote detection of substance delivery to cells |
Family Cites Families (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5833948A (en) * | 1995-06-15 | 1998-11-10 | Bracco Research S.A. | Blood-pool imaging composition comprising micelles containing a lipophilic chelating agent and a non-ionic surfactant |
| EP1105162A1 (en) * | 1998-08-10 | 2001-06-13 | Bracco Research S.A. | Combination of a positive mri contrast agent with a negative mri contrast agent |
| US20030082103A1 (en) * | 2000-10-11 | 2003-05-01 | Targesome, Inc. | Targeted therapeutic lipid constructs having cell surface targets |
| AU2003303954A1 (en) * | 2002-10-25 | 2004-10-11 | Emory University | Multifunctional magnetic nanoparticle probes for intracellular molecular imaging and monitoring |
| AU2004308757B2 (en) * | 2003-12-22 | 2010-06-17 | Bracco Suisse S.A. | Assembly of gas-filled microvesicle with active component for contrast imaging |
| CA2563619A1 (en) * | 2004-04-20 | 2005-11-03 | Emory University | Multimodality nanostructures, methods of fabrication thereof, and methods of use thereof |
| BRPI0518952A2 (pt) * | 2004-12-17 | 2008-12-16 | Koninkl Philips Electronics Nv | mÉtodo para a produÇço de um agente de contraste marcador ou um agente terapÊutico, agentes de contraste marcadores, e, uso dos agentes de contraste marcadores ou dos agentes terapÊuticos de marcaÇço |
| US8753673B2 (en) * | 2006-05-23 | 2014-06-17 | Taiwan Liposome Co. Ltd. | Liposome composition for delivery of a therapeutic agent to eyes |
| JP5249248B2 (ja) * | 2007-03-05 | 2013-07-31 | ワシントン ユニバーシティー | 膜組み込みペプチドのためのナノ粒子輸送システム |
| KR20080094473A (ko) * | 2007-04-20 | 2008-10-23 | 한국화학연구원 | 음이온성 지질나노입자 및 이의 제조방법 |
| WO2009110939A2 (en) * | 2007-12-10 | 2009-09-11 | Massachusetts Institute Of Technology | Drug delivery system for pharmaceuticals and radiation |
-
2010
- 2010-02-16 CN CN201610996986.1A patent/CN106362171A/zh active Pending
- 2010-02-16 EP EP10741884.0A patent/EP2398503B1/en active Active
- 2010-02-16 CN CN2010800105605A patent/CN102341126A/zh active Pending
- 2010-02-16 WO PCT/US2010/024324 patent/WO2010094043A2/en active Application Filing
- 2010-02-16 JP JP2011550316A patent/JP5847588B2/ja active Active
-
2011
- 2011-08-11 US US13/208,100 patent/US20120087857A1/en not_active Abandoned
-
2015
- 2015-11-25 JP JP2015229868A patent/JP6072205B2/ja active Active
-
2016
- 2016-12-05 US US15/369,661 patent/US11207430B2/en active Active
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1535163A (zh) * | 2001-05-30 | 2004-10-06 | ˹������˹�о�ѧԺ | 核酸传递系统 |
| US20050112065A1 (en) * | 2003-07-09 | 2005-05-26 | Drummond Daryl C. | Remote detection of substance delivery to cells |
Non-Patent Citations (1)
| Title |
|---|
| SJOERD HAK ET AL: "A high relaxivity Gd(III)DOTA-DSPE-based liposomal contrast agent for magnetic resonance imaging", 《EUROPEAN JOURNAL OF PHARMACEUTICS AND BIOPHARMACEUTICS》, vol. 72, 10 October 2008 (2008-10-10) * |
Also Published As
| Publication number | Publication date |
|---|---|
| CN106362171A (zh) | 2017-02-01 |
| JP2016094425A (ja) | 2016-05-26 |
| JP5847588B2 (ja) | 2016-01-27 |
| US11207430B2 (en) | 2021-12-28 |
| US20120087857A1 (en) | 2012-04-12 |
| US20170173190A1 (en) | 2017-06-22 |
| EP2398503A4 (en) | 2015-05-06 |
| WO2010094043A2 (en) | 2010-08-19 |
| EP2398503B1 (en) | 2018-10-31 |
| WO2010094043A3 (en) | 2011-01-06 |
| JP6072205B2 (ja) | 2017-02-01 |
| EP2398503A2 (en) | 2011-12-28 |
| JP2012518012A (ja) | 2012-08-09 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN102341126A (zh) | 用于磁共振成像的钆表现脂质纳米颗粒 | |
| Veiseh et al. | Specific targeting of brain tumors with an optical/magnetic resonance imaging nanoprobe across the blood-brain barrier | |
| Jia et al. | Active-target T1-weighted MR imaging of tiny hepatic tumor via RGD modified ultra-small Fe3O4 nanoprobes | |
| Gao et al. | Tumor-penetrating peptide conjugated and doxorubicin loaded T1-T2 dual mode MRI contrast agents nanoparticles for tumor theranostics | |
| Villaraza et al. | Macromolecules, dendrimers, and nanomaterials in magnetic resonance imaging: the interplay between size, function, and pharmacokinetics | |
| Kozlowska et al. | Molecular and magnetic resonance imaging: The value of immunoliposomes | |
| Jacques et al. | New classes of MRI contrast agents | |
| EP0247156B1 (en) | Polychelating agents for image and spectral enhancement (and spectral shift) | |
| KR100278513B1 (ko) | 이중 코팅을 갖는 철-함유 나노입자 및 진단 및 치료에 있어서의 그의 용도 | |
| AU2004244811B9 (en) | Magnetic nanoparticles linked to a ligand | |
| US20090035223A1 (en) | Biomimetic iron-oxide-containing lipoprotein and related materials | |
| Yon et al. | Gadolinium-based contrast agents: From gadolinium complexes to colloidal systems | |
| WO2009142754A1 (en) | Dendritic conjugates and methods of use | |
| WO2006003731A1 (ja) | 高分子ミセル型mri造影剤 | |
| US6468505B1 (en) | Technique to monitor drug delivery noninvasively in vivo | |
| Ma et al. | Deposition of gadolinium onto the shell structure of micelles for integrated magnetic resonance imaging and robust drug delivery systems | |
| CN103446588B (zh) | 靶向型诊疗联用药物及其制备方法和应用 | |
| Sobhani et al. | Novel MR imaging nanoprobe for hepatocellular carcinoma detection based on manganese–zinc ferrite nanoparticles: In vitro and in vivo assessments | |
| Mustafa et al. | Dendrimer-functionalized LAPONITE® nanodisks loaded with gadolinium for T 1-weighted MR imaging applications | |
| Bai et al. | Modular design of Bi-specific nanoplatform engaged in malignant lymphoma immunotherapy | |
| US9682157B2 (en) | PH-sensitive imaging agents | |
| CN104159617B (zh) | 具有PEG取代的α-羟基膦酸酯壳的超顺磁纳米颗粒 | |
| WO2011028658A1 (en) | Gadolinium-linked nanoclusters | |
| Huang et al. | Gadolinium-conjugated star-block copolymer polylysine-modified polyethylenimine as high-performance T 1 MR imaging blood pool contrast agents | |
| Richard et al. | Nanoparticles for imaging and tumor gene delivery |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| RJ01 | Rejection of invention patent application after publication | ||
| RJ01 | Rejection of invention patent application after publication |
Application publication date: 20120201 |