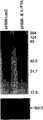CN100558410C - 调节凋亡的核酸,多肽,以及方法 - Google Patents
调节凋亡的核酸,多肽,以及方法 Download PDFInfo
- Publication number
- CN100558410C CN100558410C CNB038161540A CN03816154A CN100558410C CN 100558410 C CN100558410 C CN 100558410C CN B038161540 A CNB038161540 A CN B038161540A CN 03816154 A CN03816154 A CN 03816154A CN 100558410 C CN100558410 C CN 100558410C
- Authority
- CN
- China
- Prior art keywords
- apoptosis
- cell
- eif
- rat
- phm6
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
- C07K14/4701—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals not used
- C07K14/4747—Apoptosis related proteins
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/0004—Oxidoreductases (1.)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6876—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes
Landscapes
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Zoology (AREA)
- Engineering & Computer Science (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Genetics & Genomics (AREA)
- Wood Science & Technology (AREA)
- General Health & Medical Sciences (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Microbiology (AREA)
- Medicinal Chemistry (AREA)
- Biotechnology (AREA)
- Analytical Chemistry (AREA)
- General Engineering & Computer Science (AREA)
- Biophysics (AREA)
- Toxicology (AREA)
- Physics & Mathematics (AREA)
- Gastroenterology & Hepatology (AREA)
- Immunology (AREA)
- Biomedical Technology (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Enzymes And Modification Thereof (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Peptides Or Proteins (AREA)
Abstract
本发明涉及分离的和/或纯化的大鼠凋亡特异性真核起始因子-5A(eIF-5A)以及脱氧8-羟-2,7,10-三氨基癸酸合成酶(DHS)核酸和多肽。本发明还涉及利用凋亡特异性eIF-5A和DHS调节凋亡的方法,以及可用于所述方法中的凋亡特异性eIF-5A和DHS的反义寡核苷酸和表达载体。
Description
发明领域
本发明涉及凋亡特异性真核起始因子-5A(eIF-5A)和脱氧8-羟-2,7,10-三氨基癸酸合成酶(DHS)核酸和多肽,以及利用凋亡特异性eIF-5A和DHS调节细胞的凋亡的方法。
发明背景
凋亡是遗传学编程的细胞事件,它的特征在于明确的形态学特点,如细胞皱缩,染色质浓缩,细胞核断裂,以及细胞膜起泡。Kerr等(1972)Br.J.Cancer,26,239-257;Wyllie等(1980)Int.Rev.Cytol.,68,251-306。它在正常的组织发育和体内稳态中发挥重要作用,并且,凋亡程序的缺陷被认为导致了从神经变性和自身免疫性疾病到肿瘤的多种人类疾病。Thompson(1995)Science,267,1456-1462;Mullauer等(2001)Mutat.Res,488,211-231。尽管业已充分表征了凋亡细胞的形态学特征,调节这一过程的分子途径才刚刚开始阐明。
被认为在凋亡中发挥关键作用的一组蛋白是半胱氨酸蛋白酶家族,它被称为caspases,它似乎是大部分凋亡途径所必须的。Creagh&Martin(2001)Biochem.Soc.Trans,29,696-701;Dales等(2001)Leuk.Lyniphoina,41,247-253。Caspases反应于凋亡刺激,通过裂解各种细胞蛋白而启动凋亡,所述裂解导致了凋亡的典型的表现,包括细胞皱缩,细胞膜起泡和DNA断裂。Chang&Yang(2000)Microbiol.Mol.Biol.Rev.,64,821-846。
促凋亡蛋白,如Bax或Bak也在所述凋亡途径发挥关键作用,它是通过释放caspase-激活分子,如线粒体细胞色素c,以便通过凋亡促进细胞的死亡而发挥作用的。Martinou&Green(2001)Nat.Rev.Mol.Cell.Biol.,2,63-67;Zou等(1997)Cell,90,405-413。诸如Bcl-2的抗凋亡蛋白,能通过拮抗促凋亡蛋白Bax和Bak的活性而促进细胞的存活。Tsujimoto(1998)Genes Cells,3,697-707;Kroemer(1997)Nature Med.,3,614-620。Bax∶Bcl-2的比例,被认为是决定细胞命运的一条途径;过量的Bax能促进凋亡,而过量的Bc1-2能促进细胞存活。Salomons等(1997)Iras.J.Cancer,71,959-965;Wallace-Brodeur&Lowe(1999)Cell Mol.Life Sci.,55,64-75。
与凋亡相关的另一种关键的蛋白,是由肿瘤阻抑基因p53编码的蛋白。该蛋白是能调节细胞生长的转录因子,并且诱导受到损伤和遗传学上不稳定的细胞的凋亡,一般认为是通过上调Bax进行的。Bold等(1997)Surgical Oracology,6,133-142;Ronen等,1996;Schuler&Green(2001)Biochem.Soc.Tra7ls.,29,684-688;Ryan等(2001)Curr.Opin.Cell Biol.,13,332-337;等(2001)Biochem.Biophys.Acta,1551,F1-F37。
表征发生凋亡的细胞的独特的形态学特征,业已产生了多种用于评估凋亡的发生和发展的方法。可用于它们的检测的凋亡细胞的一个这样的特征是flippase的激活,它导致了磷脂酰丝氨酸——通常定位于质膜内小叶的磷脂的外在化。Fadok等(1992)J.Immzznol.,149,4029-4035。具有外在化的磷脂酰丝氨酸的凋亡的细胞,可以通过用荧光染料偶联的磷脂酰丝氨酸-结合蛋白——膜联蛋白V染色进行检测。可以通过用荧光素-标记的脱氧核苷酸标记DNA片段的暴露的3′-OH末端,检测在凋亡过程中发生的特征性DNA断裂。可以将诸如Hoescht33258的能结合核酸的荧光染料,用于检测凋亡细胞中的染色质浓缩和细胞核断裂。还可以通过存在于细胞提取物中的caspase蛋白裂解活性的程度,了解细胞群的凋亡的程度。
作为遗传学上确定的方法,像任何其他发育程序一样,凋亡可以通过突变中断。凋亡途径的改变,被认为在包括癌症的多种疾病过程中发挥关键作用。Wyllie等(1980)Int.Rev.Cytol.,68,251-306;Thompson(1995)Science,267,1456-1462;Sen&D′Incalci(1992)FEBS Letters,307,122-127;McDonnell等(1995)Seminars inCancer and Biology,6,53-60。对癌症发生和进展的研究,传统上一直集中在细胞增殖方面。不过,凋亡在肿瘤发生中的重要作用最近业已明确。实际上,对凋亡的了解,大多是利用肿瘤模型获得的,因为在肿瘤细胞中凋亡的控制总是以某种方式改变的。Bold等(1997)Surgical Oncology,6,133-142。
在肿瘤发生期间,凋亡可以通过多种信号启动。细胞外信号包括生长或存活因子消耗,缺氧和离子化辐射。可以启动凋亡的内部信号包括DNA损伤,缩短的端粒,以及致癌突变。它们能产生不适当的增殖信号。Lowe&Lin(2000)Carcinogenesis 21,485-495。离子化辐射以及几乎所有用于治疗恶性肿瘤的细胞毒性化疗试剂,都被认为通过启动内源凋亡机制而起到诱导细胞死亡的作用。Rowan&Fisher(1997)Leukemia,11,457-465;Kerr等(1994)Cancer,73,2013-2026;Martin&Schwartz(1997)Oncology Research,9,1-5。
有证据表明,在癌症进展的早期,肿瘤细胞对能诱导凋亡的试剂(如离子化辐射或化疗药物)是敏感的。不过,随着肿瘤的进展,所述细胞产生了对凋亡刺激的抗性。Naik等(1996)Genes andDevelopment,10,2105-2116。这可以解释为什么早期癌症对治疗的反应比晚期病变的反应好。晚期癌症产生的对化疗和放疗的抗性,似乎与所述凋亡途径的改变相关,这种改变限制了肿瘤细胞对凋亡刺激的反应的能力。Reed等(1996)Journal of Cellular Biology,60,23-32;Meyn等(1996)Cancer Metastasis Reviews,15,119-131;Hannun(1997)Blood,89,1845-1853;Reed(1995)Toxicology Letters,82-83,155-158;Hickman(1996)European Journal of Cancer,32A,921-926。化疗的抗性分别与慢性淋巴细胞白血病和结肠癌中的抗凋亡基因bcl-2的超量表达和促凋亡bax基因的缺失或突变相关。
肿瘤细胞成功地建立播散性转移瘤的能力,似乎与所述凋亡途径的改变相关。Bold等(1997)Surgical Oncology,6,133-142。例如,肿瘤抑制基因p53的突变被认为出现在70%的肿瘤中。Evan等(1995)Curr.Opin.Cell Biol.,7,825-834。使p53失活的突变,限制了细胞反应于DNA损伤而诱导凋亡的能力,使所述细胞容易发生进一步的突变。Ko&Prives(1996)Genes and Development,10,1054-1072。
因此,凋亡与肿瘤转化和肿瘤转移的发生和进展密切相关,并且对相关的凋亡途径的更好的理解,可能导致用于通过基因治疗方法调节凋亡途径而治疗癌症的新的潜在目标。Bold等(1997)SurgicalOncology,6,133-142。
已知脱氧8-羟-2,7,10-三氨基癸酸合成酶(DHS)和含有8-羟-2,7,10-三氨基癸酸真核翻译起始因子-5A(eIF-5A),在包括细胞生长和分化的很多细胞过程中发挥重要作用。Hypusine——一种独特的氨基酸,存在于所有检查过的真核细胞和古细菌中,但不存在于真细菌中,而eIF-5A是唯一已知的含有8-羟-2,7,10-三氨基癸酸的蛋白。Park(1988)J.Biol.Chem.,263,7447-7449;Schümann&Klink(1989)System.Appl.Microbiol.,11,103-107;Bartig等(1990)System.Appl.Microbiol.,13,112-116;Gordon等(1987a)J.Biol.Chem.,262,16585-16589。活性eIF-5A是通过两个翻译后步骤形成的:第一个步骤是,通过脱氧8-羟-2,7,10-三氨基癸酸合成酶的催化,将亚精胺的4-氨基丁基部分转移到前体eIF-5A的特殊赖氨酸的α-氨基上,形成脱氧8-羟-2,7,10-三氨基癸酸残基;第二个步骤包括通过脱氧8-羟-2,7,10-三氨基癸酸羟化酶使该4-氨基丁基部分羟基化,以便形成8-羟-2,7,10-三氨基癸酸。
eIF-5A的氨基酸序列在不同物种之间是相当保守的,并且在eIF-5A中的8-羟-2,7,10-三氨基癸酸残基周围的氨基酸序列存在严格的保守性,这表明,这种修饰对于存活来说可能是重要的。Park等(1993)Biofactors,4,95-104。这一假设得到了有关发现的进一步支持,即到目前为止,均存在于酵母中的eIF-5A的两种同工型的失活,或DHS基因的失活,能催化它们的失活的第一个步骤,阻断细胞分裂。Schnier等(1991)Mol.Cell.Biol.,11,3105-3114;Sasaki等(1996)FEBS Lett.,384,151-154;Park等(1998)J.Biol.Chem.,273,1677-1683。不过,消耗酵母中的eIF-5A蛋白,仅仅导致了总体蛋白合成的小的减弱,这表明eIF-5A可能是mRNA的特定亚型的翻译所必须的,而不是蛋白总体合成所必须的。Kang等(1993),“起始因子eIF-5A消耗对细胞增殖和蛋白合成的影响”,Tuite,M.(ed.),Protein Synthesis and Targeting in Yeast,NATO Series H。最近有关能结合eIF-5A的配体拥有高度保守的基序的发现,也支持了eIF-5A的重要作用的观点。Xu&Chen(2001)J.Biol.Chem.,276,2555-2561。另外,发现修饰过的eIF-5A的8-羟-2,7,10-三氨基癸酸残基是与RNA的序列特异性结合所必须的,并且结合不会提供对核糖核酸酶的保护作用。
eIF-5A的第一种cDNA是在1989年由Smit-McBride等克隆的,从这时候起,业已从包括酵母,大鼠,鸡胚胎,苜蓿和番茄在内的各种真核生物中克隆了eIF-5A的cDNA或基因。Smit-McBride等(1989a)J.Biol.Chez.,264,1578-1583;Schnier等(1991)(酵母);Sano,A.(1995)in Imahori,M.等(eds),Polyamine,Basic and ClinicalAspects,VNU Science Press,The Netherlands,81-88(大鼠);Rinaudo&Park(1992)FASEB J.,6,A453(鸡胚胎);Pay等(1991)Plant Mol.Biol.,17,927-929(苜蓿);Wang等(2001)J.Biol.Chem.,276,17541-17549(番茄)。
另外,eIF-5A的细胞内消耗,导致了特定mRNAs在细胞核中的明显积累,它表明eIF-5A可能负责特殊类型的mRNAs从细胞核到细胞质的穿梭运输。Liu&Tartakoff(1997)Supplement to MolecularBiology of the Cell,8,426a.Abstract No.2476,37th AmericanSociety for Cell Biology Annual Meeting。eIF-5A在核孔相关的核内丝上的积累,以及它与一般细胞核输出受体的相互作用,进一步暗示了eIF-5A是核质穿梭蛋白,而不是多核糖体的成分。Rosorius等(1999)J.Cell Science,112,2369-2380。
业已在各种人类组织和哺乳动物细胞系中研究了eIF-5A mRNA的表达。例如,业已在血清剥夺之后,在添加血清之后,在人类成纤维细胞中观察到了eIF-5A表达的改变。Pang&Chen(1994)J.CellPhysio.,160,531-538。另外,业已在衰老的成纤维细胞中观察到了脱氧8-羟-2,7,10-三氨基癸酸合成酶活性和前体eIF-5A的丰度的与衰老相关的减弱,不过,尚未确定这种现象体现了同工型的不同改变的平均效果的可能性。Chen&Chen(1997b)J.Cell Physiol.,170,248-254。
研究业已表明,eIF-5A可能是诸如1型人类免疫病毒Rev蛋白和1型人类T细胞白血病病毒Rex蛋白的病毒蛋白的细胞目标。Ruhl等(1993)J.Cell Biol.,123,1309-1320;Katahira等(1995)J.Virol.,69,3125-3133。初步研究表明,eIF-5A可能通过与诸如Rev的其他RNA-结合蛋白相互作用靶定RNA,这表明了这些病毒蛋白可能募集eIF-5A,进行病毒RNA加工。Liu等(1997)Biol.Signals,6,166-174。
已知脱氧8-羟-2,7,10-三氨基癸酸合成酶和eIF-5A在包括细胞生长和衰老在内的关键的细胞过程中发挥重要的作用。例如,脱氧8-羟-2,7,10-三氨基癸酸合成酶表述在植物中的反义减弱,导致了叶片和果实的衰老延缓,这表明在植物中存在衰老诱导的eIF-5A的同工型。参见WO 01/02592;PCT/US01/44505;美国申请号09/909,796。在酵母中编码脱氧8-羟-2,7,10-三氨基癸酸合成酶或eIF-5A的基因的失活,导致了细胞分裂的抑制。Schnier等(1991)Mol.Cell.Biol.,11,3105-3114;Sasaki等(1996)FEBS Lett.,384,151-154;Park等(1998)J.Biol.Chem.,273,1677-1683。
业已将亚精胺类似物成功地用于体外抑制脱氧8-羟-2,7,10-三氨基癸酸合成酶,并且用于在体内抑制8-羟-2,7,10-三氨基癸酸的形成,它伴随着蛋白合成和细胞生长的抑制。Jakus等(1993)J.Biol.Chem.,268,13151-13159;Park等(1994)J.Biol.Chem.,269,27827-27832。多胺本身,特别是腐胺和亚精胺似乎同样在细胞增殖和分化中发挥重要作用。Tabor&Tabor(1984)Anne.Rev.Biochem.,53,749-790;Pegg(1988)Cancer Res.,48,759-774。例如,其中的多胺生物合成途径业已被阻断的酵母突变体,是不能生长的,除非提供外源多胺。Cohn等(1980)J.Bacteriol.,134,208-213。
业已证实多胺能保护细胞免受凋亡的诱导。例如,业已通过亚精胺和精胺处理阻断了胸腺细胞的凋亡,这种作用的机制,似乎是抑制内切内切酶激活。Desiderio等(1995)Cell Growth Differ.,6,505-513;Brune等(1991) Exp.Cell Res.,195,323-329。另外,业已证实外源多胺能阻遇B细胞受体介导的凋亡,以及在单细胞寄生虫——克氏锥虫中的凋亡。Nitta等(2001)Exptl.Cell Res.,265,174-183;Piacenza等(2001)Proc.Natl.Acad.Sci.,USA,98,7301-7306。业已发现,低浓度的精胺和亚精胺能减少在新生大鼠的正常发育期间神经细胞减少的数量,并且在脑局部缺血期间保护脑免受神经原的损伤。Gilad等(1985)Brain Res.,348,363-366;Gilad&Gilad(1991)Exp.Neurol.,111,349-355。多胺还能抑制衰老,它是植物组织的编程的细胞死亡的一种形式。业已证实,亚精胺和腐胺能延缓康乃馨花和脱落的萝卜叶在收获后的衰老。Wang&Baker(1980)Hort Science,15,805-806(康乃馨花);Altman(1982)Physio.Plant.,54,189-193(脱落的萝卜叶)。
不过,在其他研究中,业已观察到了反应于外源多胺出现的凋亡的诱导。例如,人类乳腺癌细胞系通过诱导凋亡对多胺类似物作出反应,并且业已证实了过量的腐胺能诱导DH23A细胞的凋亡。McCloskey等(1995)Cancer Res.,55,3233-3236;Tome等(1997)Biochem.J.,328,847-854。
来自用多胺进行的以上实验的结果总体上表明,eIF-5A的特殊同工型的存在在凋亡诱导中发挥作用。具体地讲,以上数据与存在通过DHS激活的eIF-5A的凋亡特异性同工型的观点一致。这种DHS反应需要亚精胺这一事实与业已证实多胺能诱导凋亡相关的蛋白水解的关键执行者caspase的激活的发现一致。Stefanelli等(2000)Biochem.J.,347,875-880;Stefanelli等(1999)FEBS Lett.,451,95-98。在类似的静脉中,多胺合成的抑试剂可以延缓凋亡。Das等(1997)Oncol.Res.,9,565-572;Monti等(1998)Life Sci.,72,799-806;Ray等(2000)Am.J.Physiol.,278,C480-C489;Packham&Cleveland(1994)Mol.Cell Biol.,14,5741-5747。
有关外源多胺能抑制和促进凋亡的发现,可以通过以下事实解释:根据所使用的水平,它们能够抑制导致eIF-5A激活,并因此阻碍凋亡的DHS反应,或通过毒性作用诱导凋亡。有关低浓度的外源多胺能阻断植物和动物系统的凋亡的发现,与低浓度的多胺以及它们的类似物起着DHS反应的竞争抑试剂的作用这一事实吻合。实际上,甚至是外源亚精胺——它是DHS反应的底物——也能通过底物阻碍所述反应。Jakus等(1993)J.Biol.Chem.,268,13153-13159。
不过,所有多胺以及它们的类似物在高浓度下都是有毒的,并且能够诱导凋亡。这是由于两种原因而出现的结果,尽管它们能够抑制eIF-5A的推测的凋亡特异性同工型的激活。首先,激活的eIF-5A具有长的半衰期。Torrelio等(1987)Biochem.Biophys.Res.Commun.,145,1335-1341;Dou&Chen(1990)Biochim.Biophys.Acta.,1036,128-137。因此,通过抑制脱氧8-羟-2,7,10-三氨基癸酸合成酶活性而导致的激活的凋亡特异性eIF-5A的缺失,可能不会及时出现以阻断通过亚精胺的毒性作用所导致的凋亡。其次,多胺是脱氧8-羟-2,7,10-三氨基癸酸反应的竞争性抑试剂,因此即使是在有毒的浓度下,也不太可能完全阻断所述反应。
本发明涉及在即将诱导凋亡之前上调的eIF-5A cDNA的克隆。这种凋亡特异性eIF-5A,可能是介入导致凋亡的疾病状态的合适的目标,因为它似乎在与凋亡途径相关的下游效应物和转录因子的转录后调节水平上起作用。具体地讲,凋亡特异性eIF-5A,似乎能选择性地促进编码下游效应物的mRNAs和凋亡的转录因子从细胞核转运到细胞质中,它们随后在细胞质中翻译。启动凋亡的最终决定,似乎源于内部和外部促凋亡和抗凋亡信号之间的复杂的相互作用。Lowe&Lin(2000)Carcinogenesis,21,485-495。通过它的促进下游凋亡效应物和转录因子的翻译的能力,所述凋亡相关的eIF-5A似乎能调整以上信号之间的平衡,以便有利于凋亡。
正如前面所披露的,业已明确的是,抗肿瘤试剂能诱导凋亡,并且凋亡途径的改变,可以减弱药物诱导的细胞死亡。Schmitt&Lowe(1999)J Pathol.,187,127-137。例如,很多抗癌药物能上调p53,并且业已丧失了p53的肿瘤细胞会产生对这些药物的耐药性。不过,几乎所有的化疗剂都能不依赖于p53而诱导凋亡,如果使用的剂量足够,表明即使是耐药性肿瘤,通向凋亡的途径也没有完全阻断。Wallace-Brodeur&Lowe(1999)Cell Mol.Life Sci.,55,64-75。这表明,凋亡eIF-5A的诱导——尽管它可能不会纠正突变的基因——可能也能够避开p53依赖性途径,并且通过促进其他途径诱导凋亡。
与凋亡相关的eIF-5A的诱导具有选择性地靶定癌细胞的潜力,同时对正常的相邻的细胞少有或没有作用。这是由于在肿瘤细胞中表达的促有丝分裂致癌基因的表达,提供了不存在于正常细胞中的特殊类型的mRNA形式的凋亡信号。Lowe等(1993)Cell,74,954-967;Lowe&Lin(2000)Carcinogenesis,21,485-495。例如,野生型p53在p53-突变型肿瘤细胞中的恢复,可能直接诱导凋亡,以及提高肿瘤细胞系和异种移植物的药物敏感性(Spitz等,1996;Badie等,1998)。
凋亡-eIF-5A的选择性源于以下事实:即它能通过介导从细胞核到细胞质的转运,选择性地促进编码下游凋亡效应物和转录因子的mRNAs的翻译。因此,为了使凋亡eIF-5A能发挥作用,必须转录编码所述效应物和转录因子的mRNAs。由于mRNAs能在癌细胞中转录,而不能在相邻的正常细胞中转录,可以预计凋亡eIF-5A能够促进癌细胞中的凋亡,但是对正常细胞少有(如果有)影响。因此,用凋亡相关的eIF-5A恢复肿瘤细胞的凋亡潜力,可能通过选择性地靶定肿瘤细胞减轻癌症患者所经受的毒性和副作用。诱导凋亡eIF-5A,还具有加强肿瘤细胞对抗癌药物的反应的潜力,并因此改善这些试剂对耐药性肿瘤的效果。后者又会导致较低剂量的抗癌药物对患者的效力和较低的毒性。
发明概述
本发明提供了分离的和/或纯化的大鼠凋亡特异性eIF-5A和DHS核酸和多肽,以及凋亡特异性eIF-5A和DHS的反义寡核苷酸和表达载体。本发明还提供了分离的和/或纯化的人eIf-5A2(在这里又被称为增殖性eIF-5A)。本发明还提供了利用凋亡特异性eIF-5A和DHS调节凋亡的方法。
附图简述
图1表示大鼠凋亡特异性eIF-5A的3′末端的核苷酸序列和导出的氨基酸序列。
图2表示大鼠凋亡特异性eIF-5A的5′末端的核苷酸序列和导出的氨基酸序列。
图3表示大鼠黄体凋亡特异性eIF-5A全长cDNA的核苷酸序列。
图4表示大鼠凋亡特异性DHS cDNA的3′末端的核苷酸序列和导出的氨基酸序列。
图5是大鼠黄体凋亡特异性eIF-5A cDNA的全长核苷酸序列与人eIF-5A的核苷酸序列(获取号BC000751或NM_001970,SEQ ID NO:3)的比对。
图6是大鼠黄体凋亡特异性eIF-5A cDNA的全长核苷酸序列与人eIF-5A的核苷酸序列(获取号NM-020390,SEQ ID NO:4)的比时。
图7是大鼠黄体凋亡特异性eIF-5A cDNA的全长核苷酸序列与小鼠eIF-5A的核苷酸序列(获取号BC003889)的比对。小鼠核苷酸序列(获取号BC003889)是SEQ ID NO:5。
图8是大鼠黄体凋亡特异性eIF-5A的导出的全长氨基酸序列与人eIF-5A的导出的氨基酸序列(获取号BC000751或NM_001970)的比对。
图9是大鼠黄体凋亡特异性eIF-5A的导出的全长氨基酸序列与人eIF-5A的导出的氨基酸序列(获取号NM_020390)的比对。
图10是大鼠黄体凋亡特异性eIF-5A的导出的全长氨基酸序列与小鼠eIF-5A的导出的氨基酸序列(获取号BC003889)的比对。
图11是大鼠黄体凋亡特异性DHS cDNA的部分长度的核苷酸序列与人DHS的核苷酸序列(获取号BC000333,SEQ ID NO:8)的比对。
图12是大鼠黄体凋亡特异性eIF-5A cDNA的限制图。
图13是部分长度的大鼠黄体凋亡特异性DHS cDNA的限制图。
图14是用32P-dCTP-标记的大鼠黄体凋亡特异性eIF-5A cDNA的3′-末端探测的总RNA的Northern印迹(图14A)和溴化乙锭染色的凝胶(图14B)。
图15是用32P-dCTP-标记的大鼠黄体凋亡特异性DHS cDNA的3′-末端探测的总RNA的Northern印迹(图15A)和溴化乙锭染色的凝胶(图15B)。
图16表示DNA序列梯实验,其中,在注射PGF-2α之后,检查了超数排卵的大鼠黄体中凋亡的程度。
图17是从凋亡的大鼠黄体中分离的基因组DNA分离的琼脂糖凝胶,表示用PGF-2α处理大鼠之后的DNA序列梯。
图18表示DNA序列梯实验,其中,在暴露于前列腺素F-2α(PGF-2α)之前用亚精胺处理过的大鼠中检查了超数排卵的大鼠黄体的分散细胞中的凋亡的程度。
图19表示DNA序列梯实验,其中,在用亚精胺和/或PGF-2α处理过的大鼠中检查了超数排卵的大鼠黄体中凋亡的程度。
图20是用32P-dCTP-标记的部分长度大鼠黄体凋亡特异性eIF-5AcDNA探测的大鼠基因组DNA的Southern印迹。
图21表示pHM6,它是哺乳动物表位标记表达载体(RocheMolecular Biochemicals)。
图22是32P-dCTP-标记的大鼠黄体凋亡特异性DHS cDNA的3′非翻译区探测的通过血清剥夺而诱导凋亡之后,从COS-7细胞中分离的总RNA的Northern印迹(图22A)和溴化乙锭染色的凝胶(图22B)。
图23是表示COS-7细胞的瞬时转染方法的流程图。
图24是在用pHM6转染之后,在COS-7细胞中的外源蛋白的瞬时表达的Western印迹。
图25表示在用含有有义方向的全长大鼠凋亡特异性eIF-5A的pHM6瞬时转染COS-7细胞时,通过caspase活性增强所体现的凋亡增强。
图26表示在用含有有义方向的全长大鼠凋亡特异性eIF-5A的pHM6瞬时转染COS-7细胞时,通过DNA断裂增强所体现的凋亡增强。
图27表示在用含有有义方向的全长大鼠凋亡特异性eIF-5A的pHM6瞬时转染COS-7细胞时,通过细胞核断裂增强所体现的凋亡增强。
图28表示在用含有有义方向的全长大鼠凋亡特异性eIF-5A的pHM6瞬时转染COS-7细胞时,通过细胞核断裂增强所体现的凋亡增强。
图29表示在用含有有义方向的全长大鼠凋亡特异性eIF-5A的pHM6瞬时转染COS-7细胞时,通过磷脂酰丝氨酸暴露所体现的凋亡增强。
图30表示在用含有有义方向的全长大鼠凋亡特异性eIF-5A的pHM6瞬时转染COS-7细胞时,通过增强了的磷脂酰丝氨酸暴露体现的增强了的凋亡。
图31表示在用含有有义方向的全长大鼠凋亡特异性eIF-5A的pHM6瞬时转染COS-7细胞时,通过细胞核断裂增强所体现的凋亡增强。
图32表示在用含有有义方向的全长大鼠凋亡特异性eIF-5A的pHM6瞬时转染COS-7细胞时凋亡增强。
图33表示在用含有有义方向的全长大鼠凋亡特异性eIF-5A的pHM6瞬时转染COS-7细胞时Bcl-2的下调。图33A是考马斯亮兰染色的蛋白印迹;图33B是相应的Western印迹。
图34是用Bcl-2作探针检测的,用含有沿有义方向的全长大鼠凋亡特异性eIF-5A的pHM6瞬时转染的COS-7细胞的考马斯亮兰染色的蛋白印迹(图34A)和相应的Western印迹(图34B)。
图35是用c-Myc作探针检测的,用含有沿有义方向的全长大鼠凋亡特异性eIF-5A的pHM6瞬时转染的COS-7细胞的考马斯亮兰染色的蛋白印迹(图35A)和相应的Western印迹(图35B)。
图36是用p53作探针检测的,用含有沿有义方向的全长大鼠凋亡特异性eIF-5A的pHM6瞬时转染的COS-7细胞的考马斯亮兰染色的蛋白印迹(图36A)和相应的Western印迹(图36B)。
图37是用抗-[HA]过氧化物酶探针检测的在COS-7细胞中pHM6-全长大鼠凋亡特异性eIF-5A表达的考马斯亮兰染色的蛋白印迹(图37A)和相应的Western印迹(图37B),以及用p53作探针检测的在COS-7细胞中pHM6-全长大鼠凋亡特异性eIF-5A表达的考马斯亮兰染色的蛋白印迹(图37C)和相应的Western印迹(图37D)。
图38是从RKO细胞中分离的人eIF5A2与人eIF5A2的序列(Genbank获取号XM_113401)的比对。
图39是表示在瞬时转染之后,在RKO和RKO-E6细胞中出现的凋亡百分比的曲线图。用pHM6-LacZ或pHM6-eIF5A1瞬时转染RKO和RKO-E6细胞。相对于没有用放线菌素D处理过的pHM6-LacZ转染的细胞,用放线菌素D处理过的,并且用pHM6-eIF5A1转染的RKO细胞表现出凋亡增强了240%。相对于没有用放线菌素D处理过的,用pHM6-LacZ转染的细胞,用放线菌素D处理过的,并且用pHM6-eIF5A1转染的RKO-E6细胞表现出凋亡增加了105%。
图40是表示在瞬时转染之后,在RKO细胞中出现的凋亡的百分比的曲线图。用pHM6-LacZ,pHM6-eIF5A1,pHM6-eIF5A2,或pHM6-截短的eIF5A1瞬时转染RKO细胞。相对于pHM6-LacZ转染的对照细胞,用pHM6-eIF5A1转染的细胞表现出凋亡增加了25%。对于用pHM6-eIF5A2或pHM6-截短的eIF5A1转染的细胞来说,这种增加不明显。
图41是表示在瞬时转染之后出现在RKO细胞中的凋亡的百分比的曲线图。不对RKO细胞进行转染,或者用pHM6-LacZ或pHM6-eIF5A1瞬时转染。在对转染效率进行校正之后,60%的用pHM6-eIF5A1转染的细胞是凋亡的。
图42提供了在瞬时转染之后,RKO细胞凋亡的流式细胞术分析的结果。RKO细胞是未转染过的,或是用pHM6-LacZ,pHM6-eIF5A1,pHM6-eIF5A2,或pHM6-截短的eIF5A1瞬时转染过的。该表表示了根据每一个门的峰下面的面积计算的发生凋亡的细胞的百分比。在对未转染过的细胞中的背景凋亡和转染效率进行校正之后,80%的用pHM6-eIF5A1转染的细胞表现出凋亡。用pHM6-LacZ,pHM6-eIF5A2或pHM6-截短的eIF5A1转染的细胞,仅表现出背景水平的凋亡。
图43提供了在用0.25μg/ml的放线菌素D处理0,3,7,24,和48小时之后,从RKO细胞中提取的蛋白的Western印迹。上部的图片表示用抗-p53作为第一抗体的Western印迹。中间的图片表示用抗-eIF5A1作为第一抗体的Western印迹。底部的图片表示在化学发光检测之后,用考马斯亮兰染色的用于抗-eIF5A1印迹的膜,用于证实相同的加样量。通过放线菌素D处理使p53和eIF5A1都得到了上调。
发明详述
本发明部分基于编码参与凋亡的(凋亡特异性)从大鼠黄体中分离的eIF-5A的全长cDNA的发现和表征。因此,在一种实施方案中,本发明提供了包括编码大鼠凋亡特异性eIF-5A多肽的核苷酸序列的分离的核酸。本发明还提供了包括大鼠凋亡特异性eIF-5A多肽的氨基酸序列的纯化的多肽。大鼠凋亡特异性eIF-5A多肽表示大鼠特异性的任何以下多肽,它在进行凋亡的细胞中的表达有所不同,并且是由于脱氧8-羟-2,7,10-三氨基癸酸残基的形成导致的,这种脱氧8-羟-2,7,10-三氨基癸酸残基的形成是通过在脱氧8-羟-2,7,10-三氨基癸酸合成酶的催化作用下将亚精胺的4-氨基丁基部分转移到前体eIF-5A的特殊的保守赖氨酸的α-氨基上,以及通过脱氧8-羟-2,7,10-三氨基癸酸羟化酶使4-氨基丁基部分羟化形成8-羟-2,7,10-三氨基癸酸,从而激活eIF-5A。
另外,可以将本发明的核酸和多肽-大鼠凋亡特异性eIF-5A序列用于从其他细胞,组织,器官,或动物中分离凋亡特异性核酸和多肽,其中使用本发明所提供的说明以及本领域技术人员所熟知的技术。本发明还提供了适合用作检测编码本发明的大鼠凋亡特异性eIF-5A多肽的核酸的引物或杂交探针的核酸分子。
本发明的核酸可以是DNA,RNA,DNA/RNA双链体,蛋白-核酸(PNA),或它们的衍生物。在本文中,当核酸或多肽基本上不含细胞材料或不含化学前体或其他化学物质时,就被说成是“分离的”或“纯化的”。应当理解的是,术语分离的或纯化的不表示含有大量其他序列片段的文库类型的制剂。可以将本发明的核酸或多肽纯化到均匀或达到其他纯度。纯化的水平基于预期的用途。关键特征是该制剂可以实现所述核酸或多肽的理想的功能,即使在存在大量其他成分的情况下也是如此。
所述分离的多肽可以从天然表达它的细胞中纯化,从业已改变成能表达它的(重组的)细胞中纯化,或利用已知的蛋白合成方法合成。例如,蛋白的重组生产包括将编码诱导凋亡性eIF-5A或DHS的核酸分子克隆到表达载体上。将所述表达载体导入宿主细胞,并且在所述宿主细胞中表达所述蛋白。然后可以采用标准的蛋白纯化技术,通过任何合适的纯化方案,从所述细胞中分离所述蛋白。
编码本发明的大鼠凋亡特异性eIF-5A多肽的分离的核酸,优选具有SEQ ID NO:1的核苷酸序列,而本发明的纯化的多肽具有SEQ ID NO:2的氨基酸序列。本发明的大鼠凋亡特异性eIF-5A核酸和多肽还包括分别与SEQ ID NO:1和SEQ ID NO:2具有显著序列同一性或同源性的序列,以及它的功能性衍生物和变体。
在本文中,术语“显著的序列同一性”或“显著的同源性”被用于表示与另一种序列具有显著的结构或功能同一性的序列。具有显著的序列同一性或显著的同源性序列之间的任何结构或功能上的差别都是微不足道的;就是说,它们不会影响所述序列在所需要的用途中发挥指定作用的能力。例如,差别可能是由于不同物种之间密码子使用上的固有的变化所导致的。如果在两种或两种以上不同序列之间存在大量的序列重叠或类似性,或者如果即使是在序列长度或结构不同的情况下不同的序列也表现出类似的生理学特征,就认为结构差别是微不足道的。例如,所述特征包括在特定条件下杂交的能力,或者对于蛋白来说,免疫学交叉反应性,类似的酶促活性等。技术人员可以通过本领域已知的方法方便地确定每一种这样的特征。
另外,如果在两种核苷酸序列之间具有至少大约70%或更高,更优选80%或更高,甚至更优选大约90%或更高,最优选大约95%或更高的序列相似性,就认为这两种核苷酸序列是“基本上互补的”。如果多肽的活性,或功能上相关的部分之间具有至少50%,优选至少70%,更优选至少80%,甚至更优选至少90%,最优选至少95%的相似性,就认为这两种氨基酸序列是基本上同源的。
为了确定两种序列的百分同一性,出于最佳比较目的对所述序列进行比对(例如,可以在第一种或第二种氨基酸或核酸序列中之一或两者上引入空位,以便进行最佳比对,并且出于比较的目的可以忽略非同源性序列)。在优选实施方案中,出于比较目的,对参考序列的至少30%,40%,50%,60%,70%,80%,或90%或更大的长度进行了比对。然后比较了在相应的氨基酸位置或核苷酸位置上的氨基酸残基或核苷酸。当第一种序列上的位置被第二种序列上的相应位置上的相同的氨基酸残基或核苷酸所占据时,这两个分子在该位置上就是相同的(在本文中,氨基酸或核酸“同一性”等同于氨基酸或核酸“同源性”)。两种序列之间的百分同一性是这两个序列之间所共有的相同位置数量的函数,考虑到了为了两个序列的最佳比对需要引入的空位的数量和每一个空位的长度。
两个序列之间的序列比较和百分同一性和相似性的确定,可以用数学算法完成。(Computational Molecular Biology,Lesk,A.M.,ed.,Oxford University Press,New York,1988;Biocomputing:Informatics and Genome Projects,Smith,D.W.,ed.,AcademicPress,New York,1993;Computer Analysis of sequence Data,Part 1,Griffin,A.M.,and Griffin,H.G.,eds.,Humana Press,New Jersey,1994;Sequence Analysis in Molecular Biology,von Heinje,G.,Academic Press,1987;and sequence Analysisprimer,Gribskov,M.and Devereux,J.,eds.,M Stockton Press,New York,1991)。
还可以将本发明的核酸和蛋白序列用作“查询序列”对序列数据库进行检索,例如,鉴定其他家族成员或相关的序列。所述检索可以用Altschul等((1990)J.Mol Biol.215:403-10)的NBLAST和XBLAST程序(2.0版)进行。BLAST核苷酸检索可以用NBLAST程序进行。BLAST蛋白检索可以用XBLAST程序进行,以便获得与本发明的蛋白同源的氨基酸序列。为了获得用于比较目的的带空位的比对,可以采用披露于以下文献中的带空位的BLAST:Altschul等(1997)Nucleic Acids Res.25(17):3389-3402。在采用BLAST和带空位的BLAST程序时,可以采用相应程序(例如,XBLAST和NBLAST)的默认参数。
术语核酸的“功能性衍生物”,在本文中被用于表示基因或核苷酸序列的同源物或类似物。功能性衍生物能够保留特定基因的至少一部分功能,使它能够用于本发明。本文所披露的凋亡特异性eIF-5A多肽的“功能性衍生物”是凋亡特异性eIF-5A的片段,变体,类似物,或化学衍生物,它保留了至少一部分凋亡特异性eIF-5A活性或与对凋亡特异性eIF-5A特异的抗体的免疫交叉反应性。凋亡特异性eIF-5A多肽的片段表示该分子的任何亚型。
功能性变体还可以包含类似氨基酸的取代,它不会导致功能上的改变或导致不明显的改变。对功能重要的氨基酸可以通过本领域所公知的方法鉴定,如定点诱变或丙氨酸扫描诱变(Cunningham等(1989)Science 244:1081-1085)。后一种方法能够在分子的每一个残基上导入单个丙氨酸突变。然后检查所得到的突变分子的生物学活性,如激酶活性或将其用于诸如体外增殖活性的分析。还可以通过诸如结晶,核磁共振或光亲和标记的结构分析,确定对结合配偶体/底物结合重要的位点(Smith等(1992)J.Mol.Biol.224:899-904;de Vos等(1992)Science 255:306-312)。
“变体”表示与完整的基因或它的片段基本上相似的分子,如具有一个或多个取代的核苷酸的核苷酸取代变体,不过,它保留了与特定基因杂交或编码能与天然DNA杂交的mRNA转录物的能力。“同源物”表示来自不同的动物属或种的片段或变体序列。“类似物”表示基本上类似于或相对整个分子或它的变体或片段起作用的非天然分子。
变体肽包括天然存在的变体,以及通过本领域众所周知的方法生产的变体。所述变体可以利用分子技术和本文所披露的序列信息方便地鉴定/制备。另外,可以根据与本发明的eIF-5A或DHS蛋白的序列和/或结构同源性,方便地从其他蛋白中区分所述变体。所存在的同源性/同一性程度主要取决于该蛋白是功能性变体或是非功能性变体,存在于共生同源物家族中的趋异量,以及直向同源物之间的进化距离。
本发明的eIF-5A或DHS蛋白的非天然存在的变体,可以利用重组技术方便地制备。所述变体包括,但不局限于所述蛋白的氨基酸序列上的缺失,添加和取代。例如,一种类型的取代是保守性氨基酸取代。所述取代是通过具有类似特征的另一种氨基酸取代蛋白上的特定氨基酸。通常被认为是保守性取代的是脂族氨基酸Ala,Val,Leu和Ile之间的彼此取代;羟基残基Ser和Thr的相互交换;酸性残基Asp和Glu的交换;酰胺残基Asn和Gln之间的取代;碱性残基Lys和Arg之间的交换;以及芳族残基Phe和Tyr之间的取代。有关哪一种氨基酸改变可能在表型上是沉默的指导,披露于以下文献中:Bowie等,Science247:1306-1310(1990)。
另外,但同样优选的是,编码本发明的大鼠凋亡特异性eIF-5A多肽的核酸,能在高严格条件下与互补于SEQ ID NO:1的核苷酸杂交。本文所使用的术语“杂交”通常被用于表示在适当严格条件下的核酸杂交,这种条件是本领域技术人员根据探针序列和靶序列的性质很容易得出的。杂交和洗涤条件为本领域技术人员所熟知,并且条件的调整取决于需要的严格性,可以通过改变孵育时间,温度,和/或溶液的离子强度方便地实现。例如,参见Sambrook,J.等,Molecular Cloning:A Laboratory Manual,2nd edition,Cold Spring Harbour Press,Cold Spring Harbor,New York,1989。
条件的选择是通过被杂交的序列的长度,特别是探针序列的长度,核酸的相对G-C含量以及允许的错配量决定的。当需要在具有较低程度的互补性的两条链之间具有部分杂交时,低严格性条件是优选的。当需要完美的或接近完美的互补性时,高严格性条件是优选的。对典型的高严格性条件来说,所述杂交溶液含有6×S.S.C.,0.01 M EDTA,1×Denhardt′s溶液和0.5%SDS。对于克隆DNA的片段来说,杂交大约在68℃下进行大约3-4小时,而对于总的真核DNA来说,杂交进行大约12-16小时。对于较低严格性来说,将杂交温度降低到低于双链体的解链温度(Tm)大约42℃。已知Tm是G-C含量和双链体长度以及溶液的离子强度的函数。
在本文中,短语“与相应部分杂交的”DNA或RNA分子表示杂交的分子,例如,寡核苷酸,多核苷酸或任何分子序列(有义或反义方向)能够识别另一个核酸分子上的具有大致相同的大小并且具有能够在合适条件下实现杂交的与其足够的序列相似性的序列,并且与其杂交。例如,长度为100个核苷酸的有义分子能够识别核苷酸序列的大约100个核苷酸的部分,并且与其杂交,只要在两个序列之间存在大约70%或更高的序列相似性就行。应当理解的是,“相应部分”的大小,允许在杂交中存在某些错配,因此,“相应部分”可能小于或大于与它杂交的分子,例如,大或者小20-30%,优选大或小不超过大约12-15%。
另外,多肽的功能性变体,还可以包括类似氨基酸的取代,它不会导致功能上的改变或导致不明显的改变。对功能重要的氨基酸可以通过本领域所公知的方法鉴定,如定点诱变或丙氨酸扫描诱变(Cunningham等,Science 244:1081-1085(1989))。后一种方法在分子的每一个残基上引入一个丙氨酸突变。然后检测所得到的突变分子的生物学活性或用于分析。
例如,凋亡特异性eIF-5A的类似物表示基本上类似于完整蛋白或它的片段的非天然存在的蛋白或肽模拟物。凋亡特异性eIF-5A的化学衍生物,包括正常情况下不是所述肽或肽片段的一部分的其他化学部分。可以通过让所述肽的靶定的氨基酸残基与有机衍生化试剂起反应,将修饰导入肽或它的片段,所述有机衍生化试剂能够与选定的侧链或末端残基起反应。
从大鼠黄体中分离的编码凋亡特异性eIF-5A的全长cDNA的最初发现和表征,导致了编码DHS的部分长度的cDNA克隆的发现和表征,后者也是从大鼠黄体中分离的,并且与凋亡相关。因此,在其他实施方案中,本发明提供了包括编码大鼠凋亡特异性DHS多肽的核苷酸序列的分离的核酸。还提供了包括大鼠凋亡特异性DHS多肽的氨基酸序列的纯化的多肽。大鼠凋亡特异性DHS多肽,表示对大鼠特异的任何合适的多肽,它在凋亡细胞中的表达不同,并且它能催化脱氧8-羟-2,7,10-三氨基癸酸残基的形成,这是通过将亚精胺的4-氨基丁基部分转移到失活的eIF-5A的特殊的保守性赖氨酸的α-氨基上形成脱氧8-羟-2,7,10-三氨基癸酸,从而激活eIF-5A。
编码本发明的大鼠凋亡特异性DHS多肽的分离的核酸优选具有SEQ ID NO:6的核苷酸序列,而本发明的纯化的多肽具有SEQ ID NO:7的氨基酸序列。本发明的大鼠凋亡特异性DHS核酸和多肽还包括分别与SEQ ID NO:6和SEQ ID NO:7具有显著序列同一性或同源性的序列,以及前面业已披露过的它们的功能性衍生物和变体。另外,并且同样优选的是,本发明的分离的核酸具有能够在严格条件下与SEQ IDNO:6的互补体杂交的核苷酸序列,该序列同样在前面披露过。
就本文所披露的大鼠凋亡特异性eIF-5A序列的核酸和多肽而言,可以将本发明的大鼠凋亡特异性DHS序列的核酸和多肽用于从包括人类在内的其他动物中分离凋亡特异性DHS核酸和多肽。从动物和人类体内分离所述DHS序列,可以通过本领域公知的方法和本文所提供的指导,根据物种之间至少80%的序列同一性实现。本发明还提供了适合作为用于检测编码本发明的大鼠凋亡特异性DHS多肽的引物或杂交探针的核酸分子。
凋亡特异性eIF-5A和DHS是用于调节凋亡,包括造成疾病过程的凋亡的合适的目标,因为它可能在参与凋亡途径的下游效应物和转录因子的转录后调节方面发挥作用。因此,本发明还提供了通过给所述细胞施用能够调节凋亡特异性eIF-5A和/或DHS功能的试剂而调节细胞的凋亡的方法。本领域技术人员应当理解的是,所述试剂可以是仅仅调节凋亡特异性eIF-5A功能的试剂,仅仅调节凋亡特异性DHS功能的试剂,或调节凋亡特异性eIF-5A和DHS功能这两者的试剂。
可以通过细胞中凋亡特异性eIF-5A和/或DHS功能的正常水平的任何合适的改变而调节凋亡。正如本文所的目的所在,修饰或改变可以是完整的或部分的,并且可以包括转录或翻译控制的改变或改变所述细胞中的凋亡特异性eIF-5A和/或DHS功能的其他改变。凋亡特异性eIF-5A或DHS功能表示与脱氧8-羟-2,7,10-三氨基癸酸残基形成相关的任何活性,该残基的形成是通过以下过程实现的:将亚精胺的4-氨基丁基部分转移到前体eIF-5A特殊的保守性赖氨酸的α-氨基上,这一过程是通过DHS催化的,并且通过脱氧8-羟-2,7,10-三氨基癸酸羟化酶羟化该4-氨基丁基部分,以便形成8-羟-2,7,10-三氨基癸酸,从而激活eIF-5A。
在本发明的一种实施方案中,所述试剂能够抑制凋亡特异性eIF-5A和/或DHS功能,从而抑制凋亡。抑制凋亡,表示在强度和/或数量方面的任何减少,和/或在凋亡所特有的任何或全部业已明确的形态学特征,例如,细胞皱缩,染色质浓缩,细胞核断裂,和细胞膜起泡发作的推迟。
能够抑制凋亡特异性eIF-5A和/或DHS功能的一种试剂是反义寡核苷酸。所述反义寡核苷酸优选具有编码凋亡特异性eIF-5A多肽和/或凋亡特异性DHS多肽的一部分的核苷酸序列。很多编码凋亡特异性eIF-5A多肽和/或DHS多肽的合适的核酸序列为本领域所熟知。例如,SEQ ID NOS:1,3,4,5,11,15,19,20,和21(凋亡特异性eIF-5A核酸序列),SEQ ID NOS:6和8(凋亡特异性DHS核酸序列),SEQ IDNOS:12和16(凋亡特异性eIF-5A多肽序列),和SEQ ID NO:7(凋亡特异性DHS多肽序列),或它的一部分,提供了合适的序列。其他合适的序列可以使用已知序列作探针,按照本文所披露的方法发现。
因此,本发明还提供了编码凋亡特异性eIF-5A多肽和/或凋亡特异性DHS多肽的一部分,或其互补体的反义寡核苷酸。本发明的反义寡核苷酸可以是RNA或DNA形式的,例如,cDNA,基因组DNA,或合成的RNA或DNA。所述DNA可以是双链的或单链的,并且如果是单链,可以是编码链或非编码链。寡聚化合物与它的靶核酸的特异性杂交,导致了对所述核酸正常功能的干扰,通常被称为“反义的”。要干扰的DNA的功能包括复制和转录。例如,要干扰的RNA的功能包括将RNA转运到蛋白翻译位点,由RNA翻译成蛋白,剪接RNA以便形成一种或多种mRNA类型,以及可以通过RNA进行或促进的催化活性。所述反义寡核苷酸的总体效果是抑制凋亡特异性eIF-5A和/或DHS的表达,和/或所产生的活化的凋亡特异性eIF-5A的数量。
另外,可以通过施用能够抑制DHS酶促反应的化学试剂而抑制凋亡特异性DHS对凋亡特异性eIF-5A的激活。例如,当在通过注射PGF-2α诱导凋亡之后,用亚精胺,即一种DHS反应的抑试剂处理所述动物时,DNA序列梯的出现反映出在大鼠黄体中的凋亡被推迟(图18-19)。Jakus等,(1993)J.Biol.Chem.268:13151-13159。
还可以通过添加能降解凋亡特异性eIF-5A DNA,RNA,或蛋白,或能降解凋亡特异性DHS DNA,RNA,或蛋白的试剂,抑制或显著减弱凋亡,从而防止通过凋亡特异性DHS激活凋亡特异性eIF-5A。在本发明的另一种实施方案中,内源哺乳动物凋亡特异性DHS,凋亡特异性eIF-5A,或这两者的表述的抑制,是通过使用核酶影响的。合适药物的例子包括能通过凋亡特异性DHS抑制凋亡特异性eIF-5A激活的药物,能通过脱氧8-羟-2,7,10-三氨基癸酸羟化酶抑制凋亡特异性eIF-5A激活的药物,能抑制凋亡特异性DHS的转录和/或翻译的药物,能抑制凋亡特异性脱氧8-羟-2,7,10-三氨基癸酸羟化酶的转录和/或翻译的药物,以及能抑制凋亡特异性eIF-5A的转录或翻译的药物。能通过凋亡特异性DHS抑制eIF-5A激活的药物的例子包括亚精胺,1,3-二氨基-丙烷,1,4-二氨基-丁烷(腐胺),1,7-二氨基-庚烷,或1,8-二氨基-辛烷。
还可以通过灭活细胞中的编码凋亡特异性eIF-5A的基因,抑制凋亡特异性eIF-5A。所述灭活可以通过去除所述细胞中的基因,或通过向所述基因中导入缺失或突变,以便灭活所述基因而实现。所述基因还可以通过在该基因中插入另一个DNA片段而灭活,从而不发生内源凋亡特异性eIF-5A蛋白的表达。同样,可以通过灭活细胞中的编码凋亡特异性DHS的基因,抑制凋亡特异性eIF-5A的激活。用于将突变,如缺失和插入导入真核细胞的基因的方法为本领域所公知,例如,美国专利号5,464,764。可用于细胞中基因突变的寡核苷酸和表达载体,可以按照本领域所公知的方法和本文所提供的指导制备;例如,用于制备和表达反义寡核苷酸的方法,可用于制备用于在细胞中使基因突变的寡核苷酸和表达载体。
还可以通过抑制细胞中编码凋亡特异性eIF-5A的基因的表达,抑制凋亡特异性eIF-5A的表达。所述灭活可以通过共抑制实现,例如,通过将编码凋亡特异性eIF-5A的核苷酸序列导入细胞,以便发生共抑制。同样,可以通过共抑制而抑制细胞中编码凋亡特异性DHS的基因的表达,抑制凋亡特异性eIF-5A的激活。用于共抑制的寡核苷酸和表达载体可以按照本领域所公知的方法和本文所提供的指导制备;例如,用于制备和表达反义寡核苷酸的方法可用于制备用于共抑制的寡核苷酸和表达载体。用于共抑制的方法为本领域所公知,例如,参见美国专利号5,686,649。
抑制(例如,通过反义,突变或共抑制)的一个结果是,减少了内源可翻译的凋亡特异性eIF-5A或DHS-编码mRNA的量。因此,减少了所产生的凋亡特异性DHS蛋白的数量,从而减少了激活的eIF-5A的量,后者又减少了凋亡特异性蛋白的翻译。由于从头开始的蛋白合成是凋亡开始所必须的,由此抑制或延缓了凋亡。
在本发明的另一种实施方案中,所述试剂能够诱导凋亡特异性eIF-5A或DES功能,从而诱导凋亡。诱导凋亡,表示任何或所有业已明确的凋亡所特有的形态学特征出现的强度或数量方面的任何增加或加速,所述形态学特征例如,细胞皱缩,染色质浓缩,细胞核断裂,以及细胞膜起泡。
任何能诱导凋亡特异性eIF-5A和/或DHS功能的合适的试剂都可以使用。本领域技术人员可以理解的是,可以施用失活的和活性形式的凋亡特异性eIF-5A。如果施用失活形式的,或8-羟-2,7,10-三氨基癸酸-未修饰形式,天然的凋亡特异性DHS将会激活eIF-5A。编码凋亡特异性eIF-5A多肽和/或DHS多肽的很多合适的核酸序列为本领域所公知。例如,SEQ ID NOS:1,3,4,5,11,15,19,20,和21(凋亡特异性eIF-5A核酸序列),SEQ ID NOS:6和8(凋亡特异性DHS核酸序列),SEQ ID NOS:12和16(凋亡特异性eIF-5A多肽序列),和SEQ ID NO:7(凋亡特异性DHS多肽序列),或它们的部分,提供了合适的序列。其他合适的序列可以利用所述已知序列作探针,按照本文所披露的方法去发现。
例如,可以给细胞施用裸露的核酸(裸露的DNA载体,如寡核苷酸或质粒),或多肽,包括重组生产的多肽。重组生产的多肽表示将编码eIF-5A或DHS蛋白的DNA序列置于合适的表达载体中,下面将对此作详细说明。用所述表达载体转染所述宿主,然后生产所需要的多肽。然后从所述宿主细胞中分离所述多肽。例如,重组凋亡诱导性eIF-5A蛋白,可以由本领域技术人员用中国仓鼠卵巢(CHO)细胞制备,并且通过重组DHS激活。Wang等(2001)J.Biol.Chem.,276,17541-17549;Eriksson等,(2001)Semin.Hemato.,38,24-31。所述多肽还可以是合成的,它是使用公知的蛋白合成方法合成的。
多肽摄取可以使用配体,例如,源于炭疽的配体而加速,所述配体介导将它吸收到多种细胞中。Liu等(2001)J.Biol.Chem.,276,46326-46332。还可以使用脂质体将重组蛋白施用于哺乳动物的靶细胞,组织或器官。包含所述蛋白的脂质体是通过静脉内途径施用的。可以通过将特定细胞受体的配体掺入到所述脂质体中实现靶向。例如,参见Kaneda,Adv Drug Delivery Rev 43:197-205(2000)。
能够诱导凋亡特异性eIF-5A或DHS功能的一种优选的试剂是表达载体。因此,本发明提供了具有可操作地与编码凋亡特异性eIF-5A多肽和/或DHS多肽的核酸连接的表达载体。本发明的表达载体可以是RNA或DNA形式的,例如,cDNA,基因组DNA,或合成的RNA或DNA。所述DNA可以是双链的或单链的,并且如果是单链,它可以是编码链或非编码链。任何合适的表达载体(例如,参见Pouwels等,Cloning Vectors:A Laboratory Manual(Elsevior,N.Y.:1985))都可以使用。所述表达载体优选具有可操作地连接在编码凋亡特异性(相关的)eIF-5A多肽和/或凋亡特异性(相关)DHS多肽的核苷酸序列上的启动子序列。
在所述表达载体中,需要的核酸和启动子是可操作地连接的,以便所述启动子能够驱动所述核酸的表达。只要所述核酸能够表达,任何合适的启动子都可以使用。所述合适的启动子的例子包括各种病毒启动子,真核启动子,以及组成型活性启动子。只要保持这种可探作地连接,所述表达载体可以包括一种以上核酸(例如,编码凋亡特异性eIF-5A和/或DHS的核酸)。所述表达载体可任选包括其他因子,如聚腺苷酸化序列,核糖体进入位点,转录调节因子(例如,增强子,沉默子等),用于增强载体或转录物在细胞内的稳定性或需要的转录物的在细胞内的翻译或加工的其他序列(例如,分泌信号,前导序列等),或其他任何合适的因子。
表达载体可来自源于病毒,如腺病毒,腺伴随病毒,疱疹病毒,逆转录病毒或慢病毒。可以将本发明的表达载体转染到宿主细胞中,所述宿主细胞包括,但不局限于细菌物种,哺乳动物或昆虫宿主细胞系统,包括杆状病毒系统(例如,参见Luckow等,Bio/Technology,6,47(1988)),和建立的细胞系,如293,COS-7,C127,3T3,CHO,HeLa,BHK等。
腺病毒是优选的,这是因为与质粒和其他病毒载体(例如,单纯疱疹病毒)不同,腺病毒载体能够在分裂的和非分裂的细胞中实现基因转移,能够在诸如心肌的心血管相关部位,血管内皮,和骨骼肌中实现高水平的蛋白表达。另外,通过腺病毒载体转移的基因在染色体外部位起作用,因此,具有较小的将转移的基因不适当地插入宿主基因组的重要部位的风险。同样理想的是,所述腺病毒载体缺乏至少一种病毒复制所需要的基因功能。所述腺病毒载体优选缺乏腺病毒基因组的E1,E2,和/或E4区的至少一种必须基因功能。更优选的是,所述载体还缺乏腺病毒基因组的E3区的至少一部分(例如,E3区的XbaI位点缺失)。
可以通过简单地将病毒添加到培养基中,将重组腺病毒送递到培养的细胞中。可以通过将病毒颗粒直接注射到血流或注射到需要的组织中,实现宿主动物/人类的感染。通过让所述病毒与脂质体(例如,Lipofectin,Life Technologies)或聚乙二醇复合,延长所述病毒在血清中的半衰期。所述腺病毒载体通常是通过病毒纤维蛋白的按钮结构域与柯萨奇病毒和腺病毒受体CAR之间的相互作用进入细胞的。可以通过遗传工程改造使所述病毒能表达对特定细胞受体特异的配体,将所述病毒载体导向于特殊细胞或不能表达CAR的细胞。
在另一种实施方案中,可以通过用化学物质化学上调内源凋亡特异性eIF-5A或凋亡特异性DHS,或这两者的转录,或通过化学增强凋亡特异性eIF-5A的激活,启动或增强凋亡。在一种这样的实施方案中,给所述动物/人的癌细胞或肿瘤施用PGF-2α,以便上调DHS和eIF-5A的转录。
凋亡特异性eIF-5A是调节凋亡的合适目标,包括导致疾病过程的凋亡,因为它可能在参与凋亡途径的下游效应物和转录因子的转录后调节中起作用。本发明的单独或组合调节凋亡特异性eIF-5A和凋亡特异性DHS的方法,可以在动物细胞中进行,导致了凋亡的诱导或增强,并且产生了用于治疗和预防疾病的新方法和组合物,所述疾病是由与细胞不能够发生凋亡相关的病原学的原因导致的。
很多重要的人类疾病是由凋亡控制的异常导致的。这些异常可能导致细胞数量(例如,癌)的病理学增加或细胞的损伤性丧失(例如,变性疾病)。作为非限定性例子,本发明的方法和组合物可用于预防和治疗以下与凋亡相关的疾病和失调:神经学/神经变性疾病(例如,阿尔茨海默病,帕金森氏病,亨廷顿氏病,肌萎缩性脊髓侧索硬化症(LouGehrig′s病),自身免疫病(例如,类风湿性关节炎,系统性红斑狼疮(SLE),多发性硬化,杜兴肌营养不良(DMD),运动神经元病,局部缺血,慢性心力衰竭,中风,婴儿脊肌萎缩,心脏骤停,肾衰竭,特异性皮炎,脓毒症和脓毒性休克,AIDS,肝炎,青光眼,糖尿病(1型和2型),哮喘,色素性视网膜炎,骨质疏松,异种移植排斥,以及烧伤。
本发明的方法可用于治疗性处理具有癌细胞或患有肿瘤的动物,其处理量分别足以杀死癌细胞或抑制肿瘤的进展。足以实现这一目的的剂量,被定义为治疗有效剂量。能实现这一用途的量取决于疾病的严重程度,以及动物自身的免疫系统的一般状态。
肿瘤生长的抑制,意味着抑制或减弱肿瘤的进展,例如,肿瘤的生长,入侵,转移和/或复发。本发明的方法可用于治疗任何合适的肿瘤,例如,包括乳腺,心脏,肺,小肠,结肠,脾,肾脏,膀胱,头和颈,卵巢,前列腺,脑,胰腺,皮肤,骨骼,骨髓,血液,胸腺,子宫,睾丸,子宫颈或肝脏的肿瘤。动物,优选哺乳动物,更优选人类,可以利用本发明的组合物和方法进行治疗。因此,本发明的方法可以在体外,离体或体内实施。
用药方案还可以根据疾病状态和所述动物的状况改变,并且通常从单一的药团剂量或连续的输液到每天多次施用(例如,每隔4-6小时施用一次)之间变化,或根据治疗和动物的状况确定。不过,应当指出的是,本发明并不局限于任何特定剂量。
在本发明中,任何合适的方法或途径都可用于施用,例如,口服,静脉内,腹膜内,皮下,或肌内施用。所施用的拮抗剂的剂量取决于多种因素,例如,包括所施用的分子的类型,要治疗的肿瘤的类型和严重程度以及施用途径。不过,应当强调是,本发明不局限于任何特定的施用方法或途径。
在一种替代实施方案中,本发明的方法可以与一种或多种传统治疗方法组合使用。例如,可以使用合适的抗肿瘤试剂,如化疗试剂或放疗。在另一种替代实施方案中,本发明的方法可以与一种或多种合适的佐剂组合使用,例如,细胞因子(例如,IL-10和IL-13),或其他免疫刺激剂。
在另一种替代实施方案中,可以用凋亡特异性eIF-5A和增殖性eIF-5A进行与凋亡相关的疾病诊断,增殖性eIF-5A与凋亡特异性eIF-5A的差别在于,它们是通过不同的启动子从不同的部位转录的;不过,这两种成分在结构上是同源的,在羧基末端存在差别。本发明的诊断方法包括比较存在于特定细胞中的增殖性eIF-5A的量,和存在于相同细胞中的凋亡特异性eIF-5A的量。在正常发挥作用期间,细胞所具有的增殖性eIF-5A(本文还称之为eIF-5A2)的量,大于凋亡特异性eIF-5A(本文还称之为eIF-5A1)的量。不过,在某些癌细胞中,正常的调节机制出错,并且,凋亡特异性eIF-5A的量,相对增殖性eIF-5A的量发生了改变。这种改变,使得有可能在所述细胞发生任何表型变化之前诊断细胞为癌细胞。
在另一种实施方案中,可以将增殖性eIF-5A与凋亡特异性eIF-5A的比例用于药物筛选。这种方法还涉及比较存在于特定细胞中的增殖性eIF-5A的量,和存在于相同细胞中的凋亡特异性eIF-5A的量。将增殖性eIF-5A与凋亡特异性eIF-5A的正常比例,与在所述细胞接触药物候选物之后增殖性eIF-5A与凋亡特异性eIF-5A的比例进行比较。在接触之后增殖性eIF-5A与凋亡特异性eIF-5A的比例的改变,可用于鉴定具有凋亡调节活性的所述候选物。可以将具有凋亡调节活性的候选物用于治疗与凋亡相关的疾病,通过抑制或诱导凋亡实现这一目的。另外,可以将增殖性eIF-5A与凋亡特异性eIF-5A的比例的改变,用于调节凋亡,还可将它用于治疗本文所披露的与异常凋亡相关的任何状况。
使用这种方法,可以有效筛选大量的潜在候选物,即文库,以便确定该文库中的能调节凋亡的成员。任何候选物或候选物的文库都可以利用该方法筛选。例如,生物学反应调节物业已表现出作为凋亡调节剂的前景,包括能改变信号传导途径的单克隆抗体,诸如TRAIL的细胞因子(Apo2配体),类维生素A/类固醇家族核受体的配体,和能结合并且抑制蛋白激酶的小分子化合物,可以利用本发明的方法筛选它们的确定的凋亡调节活性。
一种合适的候选物是蛋白激酶C-α反义寡核苷酸,ISIS 3521(ISIS Pharmaceuticals,Inc.,Carlsbad,CA),它具有抗肿瘤活性。其他特异性候选物包括caspases(Idun Pharmaceuticals,SanDiego,CA),已知它在导致癌和神经变性疾病的多种细胞类型中在凋亡的启动和执行方面发挥关键作用;GENA SENSETM(Genta,Inc.,Berkeley Heights,NJ),它是能阻断Bcl-2产生的反义药物;INGN 241(Introgen Therapeutics,Inc.,Houston,TX),它是基因治疗导向P53;rituximab(IDEC Corporation,Osaka,Japan),它是抗-CD20单克隆抗体;以及心血管疾病和癌症的一般凋亡驱动治疗(EgeraTherapeutics Inc.,Quebec,Canada)。
应当理解的是,当本发明的核酸和多肽用于动物的预防或治疗目的时,应当以还包括可以药用的载体的组合物形式施用。例如,合适的可以药用的载体包括下列成分中一种或多种:水,盐水,磷酸缓冲的盐溶液,葡萄糖,甘油和乙醇等,以及它们的组合。可以药用的载体还可以包括微量的辅助物质,如湿润剂或乳化剂,防腐剂或缓冲物,它们能增加所述结合蛋白的保质期或效果。正如本领域所熟知的,可以配制注射的组合物,以便在给动物施用之后提供所述活性成分的快速,持续或延迟的释放。
本发明的组合物可以是多种形式的。其中包括,例如,固体,半固体和液体剂型,如片剂,药丸,粉末,液体溶液,分散液或悬浮液,脂质体,栓剂,可注射的和可输液的溶液。优选的剂型取决于预期的施用方式和治疗用途。
所述组合物能够以药物学领域所熟知的方式制备。在制备所述组合物时,所述活性成分通常与载体混合,或用载体稀释,和/或包在载体内,例如,所述载体可以是胶囊,药袋,纸或其他溶剂形式的。在所述载体被用作稀释剂时,它可以是固体,半固体,或液体材料,它起着活性成分的媒介物,赋形剂或介质的作用。因此,所述组合物可以是片剂,锭剂,药袋,扁胶囊,酏剂,悬浮液,气溶胶(固体或存在于液体介质中),例如,含有重量百分比为多达10%的活性化合物的软膏,软的和硬的明胶胶囊,栓剂,注射液,悬浮液,无菌包装的粉末以及外用膏贴。
现在已经对本发明进行了总体上的说明,通过参考以下实施例可以更好地理解本发明,这些实施例是以说明形式提供的。提供这些实施例是为了帮助理解本发明,而不是要,并且不应当被理解成以任何方式限定本发明的范围。这些实施例不包括对常规方法的详细说明。这些方法为本领域普通技术人员所熟知,并且披露于多种文献中。常规方法,如用于构建载体和质粒的方法,将编码多肽的核酸插入所述载体和质粒的方法,将质粒导入宿主细胞的方法,以及表达和测定基因和基因产物的方法的详细说明,可以从多种文献中获得,包括Sambrook,J.等,(1989)Molecular Cloning:A Laboratory Manual,2ed.,Cold SpringHarbor Laboratory Press。本文中所提到的所有文献都以它们的整体形式收作本文参考。
实施例
实施例1
本实施例证明了编码具有细胞凋亡特异性表达的大鼠eIF-5A核酸的全长cDNA的分离和表征。
超数排卵和大鼠黄体中凋亡的诱导
用50IU的PMSG(怀孕母马的血清促性腺激素)进行皮下注射并且在60-65小时之后用50IU的HCG(人绒毛膜促性腺激素)进行皮下注射,使不成熟的(21-30日龄)的雌性大鼠超数排卵。在用HCG处理7天之后,通过皮下注射500mg的PGF-2α诱导黄体凋亡。在PGF-2α处理之后的各个时间点(例如1,8,和24小时,处死大鼠),并且将黄体取出,放置在液氮中。通过在即将用PGF-2α处理之前处死大鼠,获得对照黄体组织。
大鼠卵巢黄体细胞的分散
在超数排卵后6-9天,通过多位点皮下注射500mg的PGF-2α处理大鼠。15-30分钟之后,将所述卵巢从超数排卵的大鼠体内取出,放入放置在冰上的EBSS(Gibco)中,吸水干燥,并且称重。修剪掉结缔组织,并且用剃须刀片将所述卵巢切碎,用2倍EBSS洗涤2次。通过在5ml的EBSS中涡旋搅拌6.5mg的胶原酶(Sigma,Catologue#C 5138)制备胶原酶溶液。将来自8个卵巢的切碎的组织添加到装在50ml锥形烧瓶中的5ml的溶解在EBSS中的胶原酶中,并且通过吸入Diamed吸液管中若干次,进行柔和地搅拌。然后将装有切碎的组织的烧瓶放入37℃的水浴中20分钟,在95%的空气,5%的二氧化碳中轻柔振荡(GFL培养箱上的位置45)。
在进行该孵育之后,将所述烧瓶放置在冰上,并且用塑料吸液管将细胞悬浮液转移到装有Swiss Nitex Nylon Monofilament(75m)的Nitex过滤器上。将滤液收集到15ml Falcon试管中。将胶原酶溶液(6.5mg胶原酶/5ml EBSS)的第二份等分样品(2.5ml)添加到留在50ml锥形烧瓶中的切碎的组织中,用吸液管轻柔地搅拌,孵育10分钟,并且按上述方法过滤。合并这两种滤液,并且在室温下,在临床离心机上离心(大约200g)5分钟。除了大约2ml上清液之外,用吸液管吸出所有的上清液,并且弃去,将沉淀的细胞重新悬浮在所述剩余的2ml上清液中。
通过添加5ml MEM洗涤所述细胞2次,并且按上述方法离心和重新悬浮。将洗涤过的细胞重新悬浮在装在50ml锥形烧瓶中的30ml含有10mm谷胺酰胺的MEM中,并且在37℃下,在95%的空气,5%CO2中孵育1小时,不进行振荡。然后按照上述方法使所述细胞沉淀,并且重新悬浮在含有10mM谷胺酰胺的MEM中。
用血细胞计数器测定分散的细胞的浓度,并且利用台盼兰染料评估存活力。将2-5×105细胞的等分样品放入12×75mm的试管中,并且在37℃下,在95%的空气,5%CO2中不进行振荡地孵育2-5小时。通过评估DNA序列梯的程度,监测在此期间的凋亡的发展。
通过DNA序列梯观察大鼠黄体中的凋亡
通过DNA序列梯确定凋亡的程度。使用QIAamp DNA Blood试剂盒(Qiagen),按照生产商的说明,从分散的黄体细胞或从切除的黄体组织中分离基因组DNA。在通过PGF-2α处理而诱导凋亡之前,在诱导凋亡之后1和24小时,切除黄体组织。通过在室温下将500ng的DNA与0.2μCi[α-32P]dCTP,1mM Tris,0.5mM EDTA,3单位的Klenow酶,和dATP,dGTP,和dTTP备0.2pM一起温育30分钟,对分离的DNA进行末端标记。按照Sambrook等的方法,通过让样品通过1ml的Sepadex G-50柱,除去未掺入的核苷酸。然后通过Tris-乙酸-EDTA(1.8%)凝胶电泳分离所述样品。在室温下,在真空中让所述凝胶干燥30分钟,并且在-80℃下曝光于X-光胶片24小时。
在一个实验中,在超数排卵的大鼠黄体中的凋亡的程度,是在注射PGF-2α之后0,1,或24小时检测的,在0小时的对照中,在不注射PGF-2α的情况下取出卵巢。体现与凋亡相关的核酸酶活性的低分子量DNA片段的序列梯,在用PGF-2α处理之前切除的对照黄体组织中没有出现,不过,在诱导凋亡后1小时之内可以分辨,并且在诱导凋亡后24小时很明显,所述结果如图16所示。在该附图中,上部图片是用32P-dCTP-标记的大鼠黄体凋亡特异性DHS cDNA的3′~非翻译区探测的Northern印迹的放射自显影图。下部图片是溴化乙锭染色的总RNA的凝胶。每一个泳道含有10μg RNA。数据表明,在血清剥夺之后,存在eIF-5A转录物的下调。
在另一个实验中,相应的对照动物用盐水取代PGF-2α进行处理。在用盐水或PGF-2α处理15分钟之后,将黄体从动物体内取出。在从动物体内取出所述组织之后3小时和6小时,从黄体中分离基因组DNA。在从PGF-2α处理过的动物体内取出所述组织之后6小时,出现了DNA序列梯和增强了的基因组DNA的末端标记,而在取出组织之后3小时没有出现。参见图17。在用PGF-2α处理15分钟之后切除的黄体中,也出现了反映凋亡的DNA序列梯,并且在体外条件下,在EBSS(Gibco)中保持了6小时时间。在基因组DNA的更广泛的末端标记中,也出现了与凋亡相关的核酸醇活性。
在另一个实验中,通过皮下注射500μg的PGF-2α诱导了超数排卵。对照大鼠用等体积的盐溶液处理。15-30分钟之后,将卵巢取出,并且用胶原酶分解。将来自用PGF-2α处理的大鼠的分散的细胞,在10mm谷胺酰胺+10mm亚精胺中孵育1小时,在不含亚精胺的10mm谷胺酰胺中再孵育5小时(泳道2),或在10mm谷胺酰胺+10mm亚精胺中孵育1小时,并且在10mm谷胺酰胺+1mm亚精胺中再孵育5小时(泳道3)。用胶原酶分散来自用盐水处理的大鼠的对照细胞,并且仅在谷胺酰胺中孵育1小时,以及再孵育5小时(泳道1).使用Klenow酶,用[α-32P]-dCTP对来自每一种样品的500ng DNA进行标记,在1.8%的琼脂糖凝胶上分离,并且对胶片曝光24小时,结果如图18所示。
在另一种实施方案中,按照每100g体重使用1mg亚精胺的用量,对超数排卵的大鼠进行皮下注射,在用500μg PGF-2α进行皮下注射之前24,12,和2小时,送递3个相等的0.333mg/100g体重的剂量。将对照大鼠分成三组:不注射,三次注射亚精胺,但没有PGF-2α;以及在PGF-2α处理之前三次注射等体积的盐水。在前列腺素处理之后1小时35分钟或3小时45分钟,从所述大鼠的正面取出卵巢,并且用于分离DNA。利用Klenow酶,用[α-32P]-dCTP标记来自每一种样品的500ng DNA,在1.8%的琼脂糖凝胶上分离,并且对胶片曝光24小时:泳道1,无注射(在与泳道3-5相同的时间处死动物);泳道2,用亚精胺注射3次(在与泳道3-5相同的时间处死动物);泳道3,用盐水注射三次,然后注射PGF-2α(在用PGF-2α处理之后1小时35分钟处死动物);泳道4,用亚精胺注射3次,然后注射PGF-2α(在用PGF-2α处理之后1小时35分钟处死动物);泳道5,用亚精胺注射3次,然后注射PGF-2α(在用PGF-2α处理之后1小时35分钟处死动物);泳道6,用亚精胺注射3次,然后注射PGF-2α(在用PGF-2α处理之后3小时45分钟处死动物);泳道7,用亚精胺注射3次,然后注射PGF-2α(在用PGF-2α处理之后3小时45分钟处死动物)。结果如图19所示。
RNA分离
从在PGF-2α诱导凋亡之后不同时间的大鼠体内取出的黄体组织中分离总RNA。简单地讲,在液氮中研磨所述组织(5g)。将研磨的粉末与30ml胍盐缓冲液(4M异硫氰酸胍,2.5mM NaOAc,pH 8.5,0.8%β-巯基乙醇)混合。通过四层米拉布对所述混合物进行过滤,并且在4℃以10,000g的速度离心30分钟。然后以11,200g的速度对上清液进行氯化铯密度梯度离心20小时。用75%的乙醇漂洗沉淀的RNA,重新悬浮在600ml DEPC-处理过的水中,并且在-70℃下,用1.5ml的95%乙醇和60ml的3M NaOAc使RNA沉淀。
基因组DNA分离和序列梯
使用QIAamp DNA Blood试剂盒(Qiagen),按照生产商的说明,从提取的黄体组织或分散的黄体细胞中分离基因组DNA。通过将500ngDNA与0.2μCi[α-32P]dCTP,1mM Tris,0.5mM EDTA,3个单位的Klenow酶,以及dATP,dGTP,和dTTP各0.2pM一起在室温下孵育30分钟,对所述DNA进行末端标记。按照Maniatis等披露的方法,通过让样品通过1ml Sephadex G-50柱,除去未结合的核苷酸。然后通过Tris-乙酸-EDTA(2%)凝胶电泳分离所述样品。在室温下,在真空条件下,让所述凝胶干燥30分钟,并且在-80℃下曝光于X-光胶片24小时。
质粒DNA分离,DNA测序
将上文的Sambrook等所披露的碱性裂解方法用于分离质粒DNA。利用双脱氧测序方法对全长阳性cDNA克隆进行测序。Sanger等,Proc.Natl.Acad.Sci.USA,74:5463-5467。利用BLAST检索(GenBank,Bethesda,MD),编辑并且分析开放读框,利用BCM Search Launcher完成序列比对:Multiple sequece Alignments Pattern-InducedMultiple Alignment Method(参见F.Corpet,Nuc.Acids Res.,16:10881-10890,(1987))。序列和序列比对如图5-11所示。
大鼠黄体RNA的Northern印迹杂交
在1%变性的甲醛琼脂糖凝胶上,从处于凋亡的各个阶段的大鼠黄体中分离20mg总RNA,并且固定在尼龙膜上。利用随机引物试剂盒(Boehringer),用32P-dCTP标记的全长大鼠凋亡特异性eIF-5A cDNA(SEQ ID NO:1)检测膜7×107。另外,利用随机引物试剂盒(Boehringer),用32P-dCTP标记的全长大鼠凋亡特异性DHS cDNA(SEQID NO:6)检测所述膜(7×107cpm)。在室温下,用1×SSC,0.1% SDS洗涤所述膜1次,在65℃下用0.2×SSC,0.1%SDS洗涤3次。干燥所述膜,并且在-70℃下曝光于X-光胶片过夜。
正如可以看到的,在凋亡的黄体组织中,eIF-5A和DHS都得到了上调。在通过PGF-2α处理诱导凋亡之后,凋亡特异性eIF-5A的表达明显增强——在零时间较低,在处理1小时之内显著提高,在处理8小时之内进一步提高,并且在处理24小时之内略有提高(图14)。在零时间,DHS的表达较低,在处理1小时之内显著提高,在处理8小时之内仍然进一步提高,并且在处理24小时之内再次略有提高(图15)。
利用基于酵母、真菌和人类eIF-5A序列的引物,制备凋亡的大鼠黄体RT-PCR产物
利用根据酵母,真菌和人类eIF-5A序列设计的一对寡核苷酸引物,通过RT-PCR,用凋亡的大鼠黄体RNA模板制备相当于所述基因3′末端的部分长度的凋亡特异性eIF-5A序列(SEQ ID NO:11)。用于分离大鼠eIF-5A基因的3′末端的上游引物是具有20个核苷酸的简并引物:5′TCSAARACHGGNAAGCAYGG 3′(SEQ ID NO:9),其中,S选自C和G;R选自A和G;H选自A,T,和C;Y选自C和T;而N是任何核酸。用于分离大鼠eIF-5A基因的3′末端的下游引物是具有42个核苷酸的引物:5′GCGAAGCTTCCATGG CTCGAGTTTTTTTTTTTTTTTTTTTTT 3′(SEQ ID NO:10)。进行逆转录酶聚合酶链式反应(RT-PCR)。简单地讲,使用5mg下游引物,合成了cDNA的第一条链。然后,使用上游和下游引物,将所述第一条链用作RT-PCR模板。
在琼脂糖凝胶上对RT-PCR产物进行分离,发现了900bp片段的存在,通过平端连接,将它亚克隆到pBluescriptTM(StratageneCloning Systems,LaJolla,CA)上,并且测序(SEQ ID NO:11)。所述3′末端的cDNA序列是SEQ ID NO:11,所述3′末端的氨基酸序列是SEQ ID NO:12。参见图1-2。
通过RT-PCR,用凋亡的大鼠黄体RNA模板,制备了相当于所述基因的5′末端并且与3′末端重叠的所述部分长度的凋亡特异性eIF-5A序列(SEQ ID NO:15)。所述5′引物是具有以下序列的24-聚体,5′CAGGTCTAGAGTTGGAATCGAAGC 3′(SEQ ID NO:13),该引物是根据人eIF-5A序列设计的。3′引物是具有以下序列的30-聚体,5′ATATCTCGAGCCTT GATTGCAACAGCTGCC 3′(SEQ ID NO:14),它是根据所述3′末端RT-PCR片段设计的。进行逆转录酶-聚合酶链式反应(RT-PCR)。简单地讲,使用5mg下游引物,合成了cDNA的第一条链。然后使用所述上游和下游引物,将所述第一条链用作RT-PCR的模板。
在琼脂糖凝胶上分离所述RT-PCR产物,发现了500bp片段的存在,利用分别存在于上游和下游的XbaI和XhoI克隆位点,将该片段亚克隆到pBluescriptTM(Stratagene Cloning Systems,LaJolla,CA)上,并且测序(SEQ ID NO:15)。5′末端的cDNA序列是SEQ ID NO:15,而5′末端的氨基酸序列是SEQ ID NO:16。参见图2。
叠加大鼠凋亡特异性eIF-5A的3′和5′末端的序列(分别为SEQ IDNO:11和SEQ ID NO:15),并且得到了全长cDNA序列(SEQ ID NO:1)。对该全长序列进行比对,并且与GeneBank数据库中的序列进行比较。参见图1-2。所述cDNA克隆编码具有154个氨基酸的多肽(SEQ IDNO:2),它的计算分子量为16.8Kda。在图3中示出了通过RT-PCR获得的大鼠凋亡特异性黄体eIF-5A基因的全长cDNA,并且相应的导出的氨基酸序列是SEQ ID NO:9。将eIF-5a的导出的全长氨基酸序列与人和小鼠eIF-5A序列进行比对。参见图7-9。
利用基于人DHS序列的引物制备凋亡的大鼠黄体RT-PCR产物
使用根据人DHS序列设计的一对寡核苷酸引物,通过RT-PCR,用凋亡的大鼠黄体RNA模板,制备相当于所述基因的3′末端的部分长度的凋亡特异性DHS序列(SEQ ID NO:6)。所述5′引物是具有以下序列的20-聚体,5′GTCTGTGTATTATTGGGCCC 3′(SEQ ID NO.17);所述3′引物是具有以下序列的42-聚体,5′GCGAAGCTTCCATGGCTCGAGTTTTTTTTTTTTTTTTTTTTT 3′(SEQ ID NO:10)。进行逆转录酶-聚合醇链式反应(RT-PCR)。简单地讲,使用5mg下游引物,合成了cDNA的第一条链。然后使用所述上游和下游引物,将所述第一条链用作RT-PCR的模板。
在琼脂糖凝胶上分离所述RT-PCR产物,发现了606bp片段的存在,通过平端连接将该片段亚克隆到pBluescriptTM(StratageneCloning Systems,LaJolla,CA)上,并且测序(SEQ ID NO:6)。在图4中示出了通过RT-PCR获得的大鼠凋亡特异性黄体DHS基因的部分长度的cDNA的核苷酸序列(SEQ ID NO:6),并且,相应的导出的氨基酸序列是SEQ ID NO:7。
基因组DNA的分离和Southern分析
从切除的大鼠卵巢中分离基因组DNA,用于Southern印迹。将大约100mg的卵巢组织分割成小片,并且放入15ml的试管中。用1ml的PBS洗涤所述组织2次,柔和地振荡所述组织悬浮液,然后用吸液管除去PBS。将所述组织重新悬浮在2.06ml的DNA-缓冲液(0.2MTris-HCl pH 8.0和0.1mM EDTA)中,并且添加240μl的10%SDS和100μl的蛋白酶K(Boehringer Manheim;10mg/ml)。将所述组织放入振荡的水浴中,在45℃下过夜。第二天,再加入100μl的蛋白酶K(10mg/ml),并且,再将所述组织悬浮液放置45℃的水浴中再孵育4小时。在所述孵育之后,用等体积的苯酚∶氯仿∶异戊醇(25∶24∶1)提取所述组织悬浮液1次,用等体积的氯仿∶异戊醇(24∶1)提取1次。在所述提取之后,添加1/10体积的3M乙酸钠(pH 5.2)和2倍体积的乙醇。将通过Bunsen燃烧器密封并且制成钩子形状的玻璃吸液管,用于将DNA丝从溶液中拉出,并且将所述DNA转移到干净的微量离心管中。用70%的乙醇洗涤所述DNA 1次,并且风干10分钟。将所述DNA沉淀溶解在500ul的10mM Tris-HCl(pH8.0)中,添加10μl的RNase A(10mg/ml),并且在37℃下孵育所述DNA1小时。用苯酚∶氯仿∶异戊醇(25∶24∶1)提取所述DNA 1次,并且通过添加1/10体积的3M乙酸钠(pH 5.2)和2倍体积的乙醇使DNA沉淀。通过在4℃下以13,000×g的速度离心10分钟,使所述DNA沉淀。用70%的乙醇洗涤所述DNA沉淀,并且通过在4℃下旋转所述DNA过夜,将它溶解在200μl 10mM Tris-HCl(pH 8.0)。
为了进行Southern印迹分析,用各种限制酶消化从大鼠卵巢中分离的基因组DNA,所述酶不能裂解内源基因或者只能裂解1次。为了实现这一目的,让10μg基因组DNA,20μl 10×反应缓冲液和100U的限制酶在200μl的总反应体积中反应5-6小时。将消化的DNA加样到0.7%的琼脂糖凝胶上,并且以40伏的电压电泳6小时,或以15伏的电压电泳过夜。在电泳之后,在0.2N HCl中对所述凝胶进行10分钟的脱嘌呤处理,然后用变性溶液(0.5M NaOH,1.5M NaCl)进行2次15分钟的洗涤,并且用中和缓冲液(1.5M NaCl,0.5M Tris-HCl pH7.4)进行2次15分钟的洗涤。将所述DNA转移到尼龙膜上,并且使所述膜在杂交溶液(40%甲酰胺,6×SSC,5×Denhart′s溶液(1×Denhart′s溶液是0.02%Ficoll,0.02%PVP,和0.02%BSA),0.5%SDS,和1.5mg的变性鲑鱼精子DNA)中预杂交。通过随机引发用[α-32P]-dCTP标记大鼠eIF-5A cDNA的3′UTR的700bp的PCR片段(650bp的3′UTR和50bp的编码区),并且以1×106cpm/ml的用量添加到所述膜上。
类似地,用[α-32p]-dCTP对大鼠DHS cDNA的606bp的PCR片段(450bp的编码区和156bp的3′UTR)进行随机引发的标记,并且以1×106cpm/ml的用量添加到第二个相同的膜上。在42℃下让所述印迹杂交过夜,然后在42℃下用2×SSC和0.1%SDS洗涤2次,并且在42℃下用1×SSC和0.1%SDS洗涤2次。然后让所述印迹对胶片曝光3-10天。
按图20所示,用限制酶裂解大鼠黄体基因组DNA,并且用32P-dCTP-标记的全长eIF-5A cDNA检测。在严格条件下进行的杂交,发现了全长cDNA探针与每一种限制酶消化的DNA样品的若干个限制片段的杂交,这表明了若干种eIF-5A的同工型的存在。特别要指出的是,在用EcoRV消化大鼠基因组DNA时,它在凋亡特异性eIF-5A的开放读框中具有限制位点,在Southern印迹中可以检测到eIF-5A的凋亡特异性的同工型的两个限制片段。在图20中,这两个片段用双箭头标明。相当于eIF-5A的凋亡特异性的同工型的限制片段,在标有EcoR1和BamH1的泳道中通过单箭头标出,这些限制酶在它们的开放读框内没有裂解位点。以上结果表明,所述凋亡特异性eIF-5A在大鼠体内是单拷贝基因。如图5-13所示,eIF-5A基因在物种之间是高度保守的,因此,可以预料的是,在任何物种内的同工型之间存在显著的保守性。
图21表示用32P-dCTP-标记的部分长度的大鼠黄体凋亡特异性DHScDNA探测的大鼠基因组DNA的Southern印迹。用EcoRV裂解所述基因组DNA,这种限制酶不能裂解用作探针的所述部分长度的cDNA。出现了两个限制片段,表明了存在两个拷贝的所述基因,或者所述基因包括具有EcoRV位点的内含子。
实施例2
本实施例证实了用凋亡特异性eIF-5A和DHS对凋亡的调节。
COS-7细胞的培养和RNA的分离
将编码野生型T抗原的SV40的突变体转化过的非洲绿猴肾成纤维细胞样细胞系COS-7用于所有基于转染的实验。在Dulbecco′s改进的Eagle′s培养基(DMEM)中培养COS-7细胞,所述培养基每升含有0.584克L-谷胺酰胺,每升含有4.5g葡萄糖,和0.37%的碳酸氢钠。所述培养基补充有10%的胎牛血清(FBS)和100个单位的青霉素/链霉素。让所述细胞在37℃下在5%二氧化碳和95%空气的潮湿环境中生长。每隔3-4天,通过用0.25%胰蛋白酶和1mM EDTA的溶液分离贴壁细胞,对所述细胞进行继代培养。以1∶10的分流比,将分离的细胞分配到装有新鲜培养基的新的培养皿中。
在150-mm组织培养处理过的培养皿(Corning)中生长用于分离RNA的COS-7细胞。通过用胰蛋白酶-EDTA溶液分离,收获所述细胞。将所述分离的细胞收集到离心管中,并且通过以3000rpm的速度离心5分钟使所述细胞沉淀。除去上清液,并且在液氮中对所述细胞沉淀进行快速冷冻。使用GenElute哺乳动物总RNA微量制备试剂盒(Sigma),按照生产商的说明,从所述冷冻的细胞中分离RNA。
重组质粒的构建和COS-7细胞的转染
利用哺乳动物表位标记表达载体pHM6(Roche MolecularBiochemicals)构建携带沿有义方向的大鼠凋亡eIF-5A的全长编码序列和沿反义方向的大鼠凋亡eIF-5A的3′非翻译区(UTR)的重组质粒,如图21所示。所述载体包括以下部分:CMV启动子-人巨细胞病毒立即早期启动子/增强子;HA-来自流感血细胞凝集素的九肽表位标记;BGH pA-牛生长激素聚腺苷酸化信号;f1 ori-f1起点;SV40 ori-SV40早期启动子和起点;新霉素-新霉素抗性(G418)基因;SV40 pA-SV40聚腺苷酸化信号;Col E1-ColE1起点;氨苄青霉素-氨苄青霉素抗性基因。通过PCR,由pBluescript上的原始大鼠eIF-5A RT-PCR(SEQ IDNO:1)扩增大鼠凋亡eIF-5A的全长编码序列和大鼠凋亡eIF-5A的3′UTR。为了扩增所述全长eIF-5A,使用了以下引物:正向引物5′GCCAAGCTTAATGGCAGATGATTTGG3′(SEQ.ID NO:18)(Hind3),和反向引物5′CTGAATTCCAGT TATTTTGCCATGG 3′(SEQ.ID NO:22)(EcoR1)。为了扩增所述3′UTR大鼠eIF-5A,使用了以下引物:正向引物5′AATGAATTCCGCCATGACAGAGGAGGC 3′(SEQ.ID NO:23)(EcoR1),和反向引物5′GCGAAGCTTCCATGGCTCGAGTTTTTTTTTTTTTTTTTTTTT 3′(SEQ.ID NO:10)(Hind3)。
在琼脂糖凝胶电泳之后分离的全长大鼠eIF-5A PCR产物的长度为430bp,而3′UTR大鼠eIF-5A PCR产物的长度为697bp。将这两种PCR产物亚克隆到pHM6的Hind 3和EcoR1位点上,以便制备pHM6-全长eIF-5A和pHM6-反义3′UTReIF-5A。按读框亚克隆全长大鼠eIF-5A PCR产物,使来自流感血细胞凝集素(HA)的九肽表位标记存在于多克隆位点的上游,以便可以利用抗-[HA]-过氧化物酶抗体检测所述重组蛋白。表达是由人巨细胞病毒立即早期启动子/增强子启动的,以便确保在哺乳动物细胞系中的高水平表达。所述质粒的特征还在于新霉素抗性(G418)基因,它允许选择稳定的转化体,以及SV40早期启动子和起点,它允许在诸如COS-7的能表达SV40大T抗原的细胞中进行附加体复制。
对于用于蛋白提取的细胞来说,将用于转染实验的COS-7细胞在24孔细胞培养平板(Corning)中培养,或者对于用于染色的细胞来说,放在4腔室的培养载玻片(Falcon)中培养。让所述细胞在补充了10%FBS,但缺乏青霉素/链霉素的DMEM培养基中生长到50-70%的汇合度。通过将0.32μg的质粒DNA稀释在42.5μl的无血清的DMEM中,制备足够24孔平板或培养载玻片的一个孔使用的转染培养基,并且,在室温下孵育所述混合物15分钟。将1.6μl的转染试剂——LipofectAMINE(Gibco,BRL)稀释在42.5μl的无血清的DMEM中,并且在室温下孵育5分钟。在5分钟之后,将所述LipofectAMINE混合物添加到所述DNA混合物中,并且在室温下一起孵育30-60分钟。用无血清DMEM洗涤要转染的细胞,然后在顶部覆盖转染培养基,并且将所述细胞放回所述生长室4小时。
在孵育之后,向所述细胞中添加0.17ml的DMEM+20%FBS。在染色或者收获进行Western印迹分析之前诱导凋亡前,将所述细胞再培养40小时。作为对照,还进行了模拟转染,其中,将所述质粒DNA从转染介质中省去。
蛋白提取和Western印迹
从转染过的细胞中分离用于Western印迹的蛋白,这是通过用PBS(8g/L NaCl,0.2g/L KCl,1.44g/L Na2HPO4,和0.24g/L KH2PO4)洗涤所述细胞2次,然后添加150μl的热的SDS凝胶加样缓冲液(50mMTris-HCl pH6.8,100mM二硫苏糖醇,2% SDS,0.1%溴酚蓝,和10%甘油)而进行的。将所述细胞裂解液收集到微量离心管中,在95℃下加热10分钟,然后以13,000×g的速度离心10分钟。将上清液转移到新的离心管中,并且在-20℃下保存待用。
为了进行Western印迹,在12%SDS-聚丙烯酰胺凝胶上分离2.5或5μg的总蛋白。将分离的蛋白转移到聚偏1,1-二氟乙烯膜上。然后将所述膜在封闭溶液(溶解在PBS中的5%脱脂奶粉,0.02%叠氮化钠)中孵育1小时,并且用PBS-T(PBS+0.05%Tween-20)洗涤3次,每次15分钟。在4℃下,在PBS-T中保存所述膜过夜。第二天,在室温下在回温之后,用1μg/ml聚乙烯醇封闭所述膜30分钟。用去离子水漂洗所述膜5次,然后在溶于PBS的5%的牛奶中封闭30分钟。在与所述膜一起培养之前,在5%的牛奶中用第一抗体与培养30分钟。
使用了若干种第一抗体。以1∶5000的稀释比例使用抗[HA]-过氧化物酶抗体(Roche Molecular Biochemicals),以便检测所述重组蛋白的表达。由于这种抗体偶联在过氧化物酶上,不需要第二抗体,洗涤所述印迹,并且通过化学发光进行显影。所使用的其他第一抗体是来自Oncogene的,能识别p53(Ab-6),Bcl-2(Ab-1),和c-Myc(Ab-2)的单克隆抗体。p53的单克隆抗体是以0.1μg/ml的稀释比例使用的,而Bcl-2和c-Myc的单克隆抗体都是以0.83μg/ml的稀释比例使用的。在用第一抗体孵育60-90分钟之后,用PBS-T洗涤所述膜3次,每次15分钟。然后再用溶于PBS的1%的牛奶稀释第二抗体,并且孵育所述膜60-90分钟。在将p53(Ab-6)用作第一抗体时,所使用的第二抗体是以1∶1000的比例稀释的与碱性磷酸酶(Rockland)偶联的山羊抗-小鼠IgG。在将Bcl-2(Ab-1)和c-Myc(Ab-2)用作所述第一抗体时,以1∶5000的稀释比例使用与过氧化物酶(Sigma)偶联的兔抗-小鼠IgG。在用所述第二抗体孵育之后,用PBS-T洗涤所述膜3次。
使用了两种检测方法,以便对所述印迹进行显影,这两种方法是比色方法和化学发光方法。只有当p53(Ab-6)被用作第一抗体,同时使用所述碱性磷酸酶偶联的第二抗体时才使用所述比色方法。通过在黑暗中在以下溶液中孵育所述印迹观察结合的抗体,该溶液包括0.33mg/mL氮蓝四唑,0.165mg/mL 5-溴-4-氯-3-吲哚磷酸酯,100mMNaCl,5mM MgCl2,和100mM Tris-HCl(pH 9.5)。通过在溶于PBS的2mM EDTA中孵育所述印迹,终止所述颜色反应。将化学发光检测方法用于所有其他的第一抗体,包括抗-[HA]过氧化物酶,Bcl-2(Ab-1),和c-Myc(Ab-2)。将ECL Plus Western印迹检测试剂盒(AmershamPharmacia Biotech)用于检测过氧化物酶-偶联的结合抗体。简单地讲,将所述膜轻微地吸水干燥,然后,在黑暗中用试剂A和试剂B的40∶1的混合物孵育5分钟。将所述膜吸干,放置在乙酸酯片材之间,并且曝光于X-光胶片10秒到10分钟。
在COS 7细胞中诱导凋亡
将两种方法用于诱导转染过的COS 7细胞的凋亡:血清剥夺和用放线菌素D,链霉菌(Calbiochem)处理。对这两种处理来说,在转染之后40小时除去培养基。对于血清饥饿实验来说,用无血清和无抗生素DMEM取代所述培养基。将在补充了10%FBS的无抗生素的DMEM中生长的细胞用作对照。对于凋亡的放线菌素D诱导来说,用补充了10%FBS和溶解在甲醇中的1μg/ml放线菌素D的无抗生素的DMEM取代所述培养基。对照细胞是在补充了10%FBS和等体积的甲醇的无抗生素的DMEM中生长的。在这两种方法中,凋亡的细胞的百分比是在48小时之后通过用Hoescht或膜联蛋白V-Cy3染色测定的。如图22所示,还通过Northern印迹分析,证实了凋亡的诱导。
Hoescht染色
将细胞核染料Hoescht用于标记转染过的COS-7细胞的细胞核,以便根据诸如细胞核断裂和浓缩的形态学特征,鉴定凋亡的细胞。在即将使用之前,制备由无水甲醇和冰醋酸的3∶1的混合物组成的固定剂。将等体积的固定剂添加到生长在培养载玻片上的COS-7细胞的培养基中,并且孵育2分钟。将所述培养基/固定剂混合物从所述细胞上除去,并且弃去,并且将1ml的固定剂添加到所述细胞上。在5分钟之后,将所述固定剂器弃去,并且将1ml新的固定剂添加到所述细胞上,并且孵育5分钟。将所述固定剂弃去,并且将所述细胞风干4分钟,然后添加1ml的Hoescht染料(0.5μg/ml Hoescht 33258,溶解在PBS中)。在黑暗中孵育10分钟之后,将染色溶液弃去,并且用去离子水洗涤3次,每次1分钟。在洗涤之后,将1ml的McIlvaine′s缓冲液(0.021M柠檬酸,0.058M Na2HPO4·7H2O;pH 5.6)添加到所述细胞上,并且在黑暗中孵育20分钟。弃去所述缓冲液,并且在黑暗中将所述细胞风干5分钟,并且除去分隔所述培养载玻片的孔的腔室。将数滴用于发出荧光的Vectashield封固剂(Vector Laboratories)添加到所述载玻片上,并且用盖玻片覆盖。染色的细胞在荧光显微镜下观察,使用紫外线过滤器。将染成亮的或断裂的细胞核,统计为凋亡的细胞。
膜联蛋白V-Cy3染色
将膜联蛋白V-Cy3凋亡检测试剂盒(Sigma)用于对凋亡的细胞上的外在化的磷脂酰丝氨酸进行荧光标记。按照生产商的方法使用该试剂盒,进行了以下改进。简单地讲,用PBS将生长在四个腔室的培养载玻片上的转染过的COS-7细胞洗涤2次,用1×结合缓冲液洗涤3次。添加150μl染色溶液(1μg/ml AnnCy3,溶解在1×结合缓冲液)中,并且将所述细胞在黑暗中孵育10分钟。然后除去染色溶液,并且用1×结合缓冲液洗涤所述细胞5次。将所述腔室的壁从所述培养载玻片上除掉,并且将若干滴1×结合缓冲液放置在所述细胞上,并且用盖玻片覆盖。通过荧光显微镜分析所述染色的细胞,使用绿色滤光器观察所述阳性染色的(凋亡的)细胞的红色荧光。通过在可见光下统计所述细胞的数量,确定总的细胞群。
实施例3
本实施例证实了用凋亡特异性eIF-5A和DHS对凋亡的调节
使用在前面的实施例中所披露的通用方案和方法,图23是说明用于瞬时转染COS-7细胞的方案的流程图,其中,无血清培养基中的细胞与lipofectAMINE中的质粒DNA一起孵育4小时,添加血清,并且将所述细胞再孵育40小时。然后,在分析之前(即不做进一步的处理),将所述细胞放在含有血清的常规培养基中孵育48小时,剥夺血清48小时,以便在分析之前诱导凋亡,或者用放线菌素D处理48小时,以便在分析之前诱导凋亡。
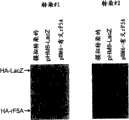
图22表示在用pHM6转染之后在COS-7细胞中外源蛋白的瞬时表达的Western印迹。在模拟转染,或者用pHM6-LacZ,pHM6-反义3′rF5A(pHM6-反义3′UTR大鼠凋亡eIF-5A),或pHM6-有义rF5A(pHM6-全长大鼠凋亡eIF-5A)转染48小时之后,从COS-7细胞中分离蛋白。通过SDS-PAGE分级分离来自每一种样品的5μg的蛋白,转移到PVDF膜上,并且用抗-[HA]-过氧化物酶进行Western印迹。通过化学发光检测结合的抗体,并且曝光于X-光胶片30秒。LacZ(泳道2)和有义大鼠凋亡eIF-5A(泳道4)的表达清晰可见。
如上文所述,COS-7细胞是模拟转染的或用pHM6-有义rF5A转染的(pHM6-全长大鼠eIF-5A)转染。转染40小时之后,通过血清剥夺48小时,诱导所述细胞发生凋亡。使用荧光测定均匀caspase分析试剂盒(Roche Diagnostics)测定转染过的细胞提取物中caspase的蛋白水解活性。还利用FragEL DNA断裂凋亡检测试剂盒(Oncogene)测定了DNA断裂,该试剂盒能用荧光素标记的脱氧核苷酸标记DNA片段的暴露的3’-OH末端。
其他COS-7细胞是模拟转染或用pHM6-有义rF5A转染的(pHM6-全长大鼠eIF-5A)。转染40小时之后,让所述细胞在含有血清的正规培养基(未做进一步的处理)中再生长48小时,通过血清剥夺48小时,诱导进行凋亡,或通过用0.5μg/ml的放线菌素D处理48小时诱导进行凋亡。所述细胞用Hoescht 33258染色,它表示伴随凋亡的细胞核断裂,或用膜联蛋白V-Cy3染色,它表示磷脂酰丝氨酸暴露伴随的凋亡。还通过荧光显微镜,使用绿色滤光器观察染色的细胞,并且统计数量,以便确定发生凋亡的细胞的百分比。在可见光下计数总的细胞群。
图25表示通过caspase活性增强体现的凋亡增强,此时,COS-7细胞是用含有沿有义方向的全长大鼠凋亡-诱导的eIF-5A的pHM6瞬时转染的。大鼠凋亡-诱导的eIF-5A的表达,导致caspase活性增加了60%。
图26表示通过DNA断裂增加体现的凋亡增强,此时,COS-7细胞是用含有沿有义方向的全长大鼠凋亡-诱导的eIF-5A的pHM6瞬时转染的。大鼠凋亡-诱导的eIF-5A的表达,导致DNA断裂增加了273%。图27表示通过细胞核断裂增加体现的凋亡的检测,此时,COS-7细胞是用含有沿有义方向的全长大鼠凋亡-诱导的eIF-5A的pHM6瞬时转染的。在表达大鼠凋亡-诱导的eIF-5A的细胞中,断裂的细胞核的出现率较高。图28表示通过细胞核断裂增加体现的凋亡增强,此时,COS-7细胞是用含有沿有义方向的全长大鼠凋亡-诱导的eIF-5A的pHM6瞬时转染的。与非血清饥饿和血清饥饿的样品对照相比,大鼠凋亡-诱导的eIF-5A的表达导致细胞核断裂分别增加了27%和63%。
图29表示通过磷脂酰丝氨酸暴露体现的凋亡的检测,此时,COS-7细胞是用含有沿有义方向的全长大鼠凋亡-诱导的eIF-5A的pHM6瞬时转染的。图30表示通过磷脂酰丝氨酸暴露的增加体现的凋亡增强,此时,COS-7细胞是用含有沿有义方向的全长大鼠凋亡-诱导的eIF-5A的pHM6瞬时转染的。与非血清饥饿和血清饥饿的样品对照相比,大鼠凋亡-诱导的eIF-5A的表达,分别导致了磷脂酰丝氨酸暴露增加了140%和198%。
图31表示通过细胞核断裂增加体现的凋亡增强的检测,此时,COS-7细胞是用含有沿有义方向的全长大鼠凋亡-诱导的eIF-5A的pHM6瞬时转染的。与未处理的和处理过的样品对照相比,大鼠凋亡-诱导的eIF-5A的表这,导致细胞核破裂分别增加了115%和62%。图32表示在以下条件下凋亡增强的比较,其中,COS-7细胞是用含有沿有义方向的全长大鼠凋亡-诱导的eIF-5A的pHM6瞬时转染的,对所述细胞不进行进一步的处理,或进行处理,以便诱导凋亡。
实施例4
本实施例证实了在施用凋亡特异性eIF-5A和DHS之后对凋亡活性的调节。
另外,对COS-7细胞进行模拟转染,用pHM6-LacZ转染或用pHM6-有义rF5A(pHM6-全长大鼠eIF-5A)转染,并且孵育40小时。通过SDS-PAGE分离从每一种样品中提取的5μg的蛋白样品,转移到PVDF膜上,并且用能识别Bcl-2的单克隆抗体进行Western印迹。将与过氧化物酶偶联的兔抗-小鼠IgG用作第二抗体,并且通过化学发光和对X-光胶片进行曝光检测结合的抗体。结果如图32所示。与用pHM6-LacZ转染的细胞相比,在用pHM6-有义rF5A转染的细胞中可检测的Bcl-2较少;因此,Bcl-2被下调了。
另外,对COS-7细胞进行模拟转染,用pHM6-反义3′rF5A(大鼠凋亡特异性eIF-5A的pHM6-反义3′UTR)转染或用pHM6-有义rF5A(pHM6-全长大鼠凋亡特异性eIF-5A)转染。在转染之后40小时,通过血清剥夺48小时,诱导所述细胞发生凋亡。通过SDS-PAGE分离从每一种样品中提取的5μg的蛋白样品,转移到PVDF膜上,并且用能识别Bcl-2的单克隆抗体进行Western印迹。将与过氧化物酶偶联的兔抗-小鼠IgG用作第二抗体,并且通过化学发光和对X-光胶片进行曝光检测结合的抗体。
另外,对COS-7细胞进行模拟转染,用pHM6-LacZ转染或用pHM6-有义rF5A(pHM6-全长大鼠eIF-5A)转染,并且培养40小时。通过SDS-PAGE分离从每一种样品中提取的5μg的蛋白样品,转移到PVDF膜上,并且用能识别p53的单克隆抗体进行Western印迹。将与碱性磷酸酶偶联的兔抗-小鼠IgG用作第二抗体,并且通过比色分析检测结合的抗体。
最后,对COS-7细胞进行模拟转染,用pHM6-LacZ转染或用pHM6-有义rF5A(pHM6-全长大鼠eIF-5A)转染,并且孵育40小时。通过SDS-PAGE分离从每一种样品中提取的5μg的蛋白样品,转移到PVDF膜上,并且用能识别p53的单克隆抗体检测。用抗[HA]-过氧化物酶探测相应的蛋白印迹,以便确定大鼠凋亡特异性eIF-5A表达的水平。将与碱性磷酸酶偶联的山羊抗-小鼠IgG用作第二抗体,并且通过化学发光检测结合的抗体。
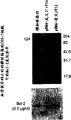
图33表示Bcl-2的下调,此时,COS-7细胞是用含有沿有义方向的全长大鼠凋亡-诱导的eIF-5A的pHM6瞬时转染的。上部图片表示考马斯亮兰染色的蛋白印迹;下部图片表示相应的Western印迹。与用pHM6-LacZ转染的细胞相比,在用pHM6-有义rF5A转染的细胞中可检测的Bcl-2较少。
图34表示Bcl-2的上调,此时,COS-7细胞是用含有沿反义方向的全长大鼠凋亡-诱导的eIF-5A的pHM6瞬时转染的。上部图片表示考马斯亮兰染色的蛋白印迹;下部图片表示相应的Western印迹。与用模拟转染或用含有pHM6-有义rF5A的pHM6-LacZ转染的细胞相比,在用pHM6-反义3′rF5A转染的细胞中可检测的Bcl-2较多。
图35表示c-Myc的上调,此时,COS-7细胞是用含有沿有义方向的全长大鼠凋亡-诱导的eIF-5A的pHM6瞬时转染的。上部图片表示考马斯亮兰染色的蛋白印迹;下部图片表示相应的Western印迹。与用pHM6-LacZ或模拟对照转染的细胞相比,在用pHM6-有义3′rF5A转染的细胞中,可检测的Bcl-2更多。
图36表示c-Myc的上调,此时,COS-7细胞是用含有沿有义方向的全长大鼠凋亡-诱导的eIF-5A的pHM6瞬时转染的。上部图片表示考马斯亮兰染色的蛋白印迹;下部图片表示相应的Western印迹。与用pHM6-LacZ或模拟对照转染的细胞相比,在用pHM6-有义3′rF5A转染的细胞中可检测的p53更多。
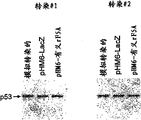
图37表示p53上调对COS-7细胞中pHM6-全长大鼠凋亡-诱导的eIF-5A的表达的依赖性。在用抗[HA]-过氧化物酶探测的Western印迹上,上部图片表示考马斯亮兰染色的蛋白印迹,而下部图片表示相应的Western印迹。与第二种转染相比,在第一种转染中有更多可检测的大鼠凋亡-诱导的eIF-5A。在用抗-p53探测的Western印迹中,上部图片表示相应的考马斯亮兰染色的蛋白印迹,而下部图片表示使用p53的对于第一种转染来说,与pHM6-LacZ转染或模拟对照转染的细胞相比,在用pHM6-有义rF5A转染的细胞中可检测的p53更多。对于第二种转染来说,其中,大鼠凋亡-诱导的eIF-5A的表达较少,而在用pHM6-有义rF5A,pHM6-LacZ或模拟对照转染的细胞之间p53的水平没有可检测的差别。
实施例5
本实施例证实了凋亡特异性eIF-5A能够在具有活性p53的细胞(RKO细胞)和没有活性p53的细胞(RKO-E6细胞)中诱导凋亡,这表明,凋亡特异性eIF-5A可以通过除了p53途径以外的途径启动凋亡。这还支持了我们的论点:即它能在多种不同类型的癌的上游起作用,而且有可能杀死这些癌细胞。
本实施例证实了eIF-5A的活性位点是所述蛋白的5’末端(即参见使用截短的eIF-5A1的实验),它最有可能包括RNA结合结构域。
另外,本实施例证实了人eIF-5A2最有可能是增殖性eIF-5A,因为它不能够诱导凋亡。因此,人们认为在人类数据库中的两个eIF-5A基因凋亡特异性eIf-5A1是凋亡基因,而eIF-5A2是增殖基因。
RKO和RKO-E6细胞的培养
将RKO(美国典型培养物保藏中心CRL-2577)——能表达野生型p53的人结肠癌细胞系,和RKO-E6(美国典型培养物保藏中心CRL-2578)——源于RKO的,包括稳定整合了人类乳头瘤病毒E6癌基因,能导致正常的p53水平和功能减弱的细胞系,用于基于转染的实验。在含有非必需氨基酸,Earle′s盐,和L-谷胺酰胺的最低必需培养基Eagle(MEM)中培养RKO和RKO-E6细胞。在该培养基中补充了10%的胎牛血清(FBS)和100单位的青霉素/链霉素。让所述细胞在37℃下,在5%二氧化碳和95%空气的潮湿环境中生长。每隔3-4天对所述细胞进行继代培养,包括用0.25%胰蛋白酶和1mM EDTA的溶液分离贴壁细胞。以1∶10-1∶12的分流比将分离的细胞分配到装有新的培养基的培养皿中。
人eIFSA2的克隆
使用针对可以从GenBank获得的人eIF5A2的序列(ACCESSION XM113401)设计的引物,通过RT-PCR,用从RKO中分离的RNA分离人eIF5A2。图38提供了从RKO细胞中分离的eIF-5A与人eIF-5A2的序列的比对。RNA是用GenElute哺乳动物总RNA微量制备试剂盒(Sigma)从RKO细胞中分离的。用于扩增eIF5A2的正向引物具有以下序列5′AAACTACCATCTCCCCTGCC 3′(SEQ.ID 24),而反向引物具有以下序列5′TGCCCTACACAGGCTGAAAG 3′(SEQ ID NO:25)。将所得到的936bp的PCR产物亚克隆到pGEM-T Easy载体(Promega)上,并且测序。
然后将pGEM-T Easy-eIF5A2构建体用作模板,制备eIF5A2 PCR片断,将该片断亚克隆到所述哺乳动物表达载体pHM6(Roche)的读框内。用于扩增人eIF5A2的正向引物是5′ATCAAGCTTGCCCACCATGGCAGACG 3′(SEQ ID NO:26),而反向引物是5′AACGAATTCCATGCCTGATGTTTCCG 3′(SEQ ID NO:27)。所得到的505bp的PCR产物用Hind 3和EcoR 1消化,并且亚克隆到pHM6的Hind3和EcoR1位点上。
pHM6-截短的eIF5A1的构建
为了确定eIF5A1的羧基末端区对于它的凋亡-诱导活性是否重要,构建了羧基末端缺失的eIF5A1。编码1-127号氨基酸的截短的eIF5A1是使用pBS-大鼠eIF5A1作模板通过PCR制备的。正向PCR引物是5′GCCAAGCTTAATGGCAGATGATTTGG 3′(SEQ ID NO:18),而反向引物是5′TCCGAATTCGTACTTCTGCTCAATC 3′(SEQ ID NO:28)。用EcoR 1和Hind 3消化所得到的390bp的PCR产物,并且亚克隆到pHM6的EcoR 1和Hind 3位点上。
转染
对于要用于Hoescht染色的细胞来说,将用于转染实验的RKO或RKO-E6细胞放在8孔腔室培养载玻片(Falcon)上培养,或对于要通过流式细胞术分析的细胞来说,放入6孔平板上培养。让所述细胞在补充了10%FBS,但缺少青霉素/链霉素的MEM培养基中生长到70-80%的汇合度。足够8孔培养载玻片的1个孔的转染培养基是通过以下方法制备的:将0.425μg的质粒DNA稀释在22μl的无血清的MEM中,并且在室温下孵育该混合物15分钟。将0.85μl的转染试剂LipofectAMINE(Gibco,BRL)稀释在22μl的无血清的MEM中,并且在室温下孵育5分钟。5分钟之后,将LipofectAMINE混合物添加到所述DNA混合物中,并且在室温下孵育30-60分钟。用无血清的MEM洗涤要转染的细胞1次,然后将44μl的MEM添加到所运转染培养基中,并且将该培养基覆盖在所述细胞上。将所述细胞放回到所述生长室中4小时。在所述孵育之后,向所述细胞中添加88μl的MEM+20%FBS。然后将所述细胞再培养44小时,并且按照前面所述的方法,用Hoescht 33258染色。在另一组实验中,在转染之后用0.25μg/ml放线菌素D处理8孔培养载玻片上的RKO或RKO-E6细胞24小时,并且随后用Hoescht染色20小时。在6孔平板上进行的转染,是以相同的方式进行的,所不同的是,所有的试剂都增加了4.81倍。在转染之后48小时,收获6孔平板上的转染过的RKO细胞,并且固定,以便按上述方法通过流式细胞术分析。
转染效率的确定
通过用5-溴-4-氯-3-吲哚-β-D-半乳糖吡喃糖苷(X-GAL)对pHM6-LacZ-转染的细胞进行染色,确定转染效率。染成兰色的细胞是表达LacZ的转染的细胞,并且,转染效率是通过染成兰色的细胞的数量除以总细胞数量计算的。在转染之后,对转染的细胞进行48小时的染色。用PBS洗涤所述细胞2次,然后在室温下,在0.5%戊二醛/PBS中固定10分钟。用1mM MgCl2/PBS洗涤所述细胞3次,然后用染色溶液[溶解在PBS中的5mM K4Fe(CN)6·3H2O,5mM K3Fe(CN)6,1mM MgCl2,0.1% X-GAL]洗涤,直到出现染成兰色的细胞。
Hoescht染色
将细胞核染料Hoescht用于标记转染过的RKO和RKO-E6细胞的细胞核,以便根据细胞核的断裂和浓缩,鉴定凋亡的细胞。在即将使用之前制备由无水甲醇和冰醋酸的3∶1的混合物组成的固定剂。将等体积的固定剂添加到生长在培养载玻片上的细胞培养基中,并且孵育2分钟。将所述培养基/固定剂混合物从细胞上除去,并且弃去,将1ml固定剂添加到所述细胞上。5分钟之后弃去所述固定剂,并且将1ml新的固定剂添加到所述细胞上,并且孵育5分钟。将所述固定剂弃去,并且将所述细胞风干4分钟,然后添加1ml的Hoescht染料(0.5μg/mlHoescht 33258,溶解在PBS中)。在黑暗中孵育10分钟之后,将所述染色溶液弃去,并且用去离子水洗涤所述载玻片3次,每次1分钟。在洗涤之后,将1ml的McIlvaine′s缓冲液(0.021M柠檬酸,0.058M Na2HPO4·7H2O;pH 5.6)添加到所述细胞上,并且在黑暗中孵育20分钟。将所述缓冲液弃去,并且在黑暗中将所述细胞风干5分钟,除去分隔所述培养载玻片的孔的腔室。将若干滴Vectashield荧光封固剂(Vector Laboratories)添加到所述载玻片上,并且用盖玻片覆盖。在荧光显微镜下使用UV滤光器观察染色的细胞。将被染亮的细胞或具有断裂的细胞核统计为凋亡细胞。
通过流式细胞术检测DNA断裂
在凋亡期间产生的DNA片断是用荧光素-FragELTM DNA断裂检测试剂盒(Oncogene Research Products),用荧光素标记的脱氧核苷酸标记的。在转染之后,通过胰蛋白酶处理48小时,收获在6孔培养平板上用各种构建体转染的细胞,并且按照生产商的说明固定和标记。简单地讲,在4℃下,以1000×g的速度使所述细胞沉淀5分钟,并且用PBS(8g/L NaCl,0.2g/L KCl,1.44g/L Na2HPO4,和0.24g/L KH2PO4)洗涤1次。将所述细胞重新悬浮在4%甲醛(PBS)中,并且在室温下孵育10分钟。再次使所述细胞沉淀,重新悬浮在1ml 80%的乙醇中,并且在4℃下保存。在分析的当天,将1ml的固定细胞(浓度为1×106细胞/ml)转移到微量离心管中,并且通过以1000×g的速度离心5分钟使细胞沉淀。将沉淀的细胞重新悬浮在200μl的1×TBS(20mM TrispH 7.6,140mM NaCl),并且在室温下孵育10-15分钟。然后再次使所述细胞沉淀,并且重新悬浮在100μl的20g/ml蛋白酶K中,并且在室温下孵育5分钟。使所述细胞沉淀,并且重新悬浮在100μl的1×TdT平衡缓冲液中,并且在室温下孵育10-30分钟。然后通过离心使所述细胞沉淀,并且重新悬浮在60μl的TdT标记反应混合物中,并且在黑暗中孵育1-1.5小时。在培养之后,通过离心使所述细胞沉淀,并且在200μl的1×TBS洗涤2次。将所述细胞重悬浮在最终体积为0.5ml的1×TBS中,并且在装配有488nm氩离子激光光源的流式细胞计上分析。
蛋白提取和Western印迹
从转染的细胞中分离蛋白进行Western印迹,包括用PBS洗涤所述细胞2次,然后添加150μl热的SDS凝胶加样缓冲液(50mMTris-HCl pH 6.8,100mM二硫苏糖醇,2%SDS,0.1%溴酚蓝,和10%甘油)。将所述细胞裂解液收集到微量离心管中,在95℃下加热10分钟,然后以13,000×g的速度离心10分钟。将上清液转移到新的微量离心管中,并且在-20℃下保存待用。
为了进行Western印迹,在12%SDS-聚丙烯酰胺凝胶上分离5μg或10μg的总蛋白。将分离的蛋白转移到聚偏二氟乙烯膜上。然后在封闭溶液(5%脱脂奶粉,0.02%叠氮化钠,溶解在PBS中)培养所述膜,并且用PBS-T(PBS+0.05%Tween-20)洗涤3次,每次15分钟。将所述膜放置在PBS-T中,在4℃下保存过夜。在第二天,在回温到室温之后,用1μg/ml的聚乙烯醇封闭所述膜30秒。用去离子水漂洗所述膜5次,然后,用溶于PBS的5%的牛奶封闭30分钟。在与所述膜培养之前,在溶于PBS/0.025%Tween-20的5%牛奶溶液中将所述第一抗体预孵育30分钟。
所述膜用购自Oncogene的能识别p53的单克隆抗体(Ab-6),或在鸡体内制备的针对与人eIF5A1的c-末端同源的合成肽(氨基-CRLPEGDLGKEIEQKYD-羧基)的多克隆抗体吸印所述膜。p53的单克隆抗体是以0.1μg/ml的稀释液形式使用的,并且抗eIF5A1的抗体是以1∶1000的稀释比例使用的。在用第一抗体孵育60-90分钟之后,用PBS-T洗涤所述膜3次,每次15分钟。然后用溶于PBS/0.025%Tween-20的1%的牛奶稀释第二抗体,并且与所述膜一起孵育60-90分钟。在将p53(Ab-6)用作第一抗体时,所使用的第二抗体是稀释比例为1∶1000的与碱性磷酸酶偶联的山羊抗小鼠IgG(Rockland)。在将抗-eIF5A1用作第一抗体时,与过氧化物酶偶联的兔抗鸡IgY(Gallus Immunotech)是以1∶10000的稀释比例使用的。在用所述第二抗体孵育之后,用PBS-T洗涤所述膜3次。
用两种检测方法显现所述印迹:比色方法和化学发光方法。只有在将p53(Ab-6)用作第一抗体,同时使用碱性磷酸酶偶联的第二抗体时才使用比色法。通过在黑暗中在0.33mg/mL氮蓝四唑,0.165mg/mL5-溴-4-氯-3-吲哚磷酸酯,100mM NaCl,5mM MgCl2,和100mM Tris-HCl(pH 9.5)的溶液中培养所述印迹,观察结合的抗体。通过在溶于PBS的2mM EDTA中孵育所述印迹终止颜色反应。将化学发光检测方法用于所有其他的第一抗体,包括抗-[HA]-过氧化物酶和抗-eIF5A1。将ECLPlus Western印迹检测试剂盒(Amersham Pharmacia Biotech)用于检测过氧化物酶-偶联的结合抗体。简单地讲,将所述膜轻微地吸水干燥,然后在黑暗中用试剂A和试剂B的40∶1的混合物中孵育5分钟。将所述膜吸干,放置在两层乙酸酯之间,并且曝光于X-光胶片10秒到30分钟。
图39表示表明在瞬时转染之后出现在RKO和RKO-E6细胞中的凋亡的百分比的曲线图。用pHM6-LacZ或pHM6-eIF5A1瞬时转染RKO和RKO-E6细胞,24小时之后,用0.25μg/ml放线菌素D或等体积的甲醇(对照)处理所述细胞。随后用Hoescht 20对所述细胞进行20小时染色,并且在荧光显微镜下用UV滤光器观察。将由于浓缩的染色质而染亮的细胞统计为凋亡。与用pHM6-LacZ转染的没有用放线菌素D处理过的细胞相比,上面的实验揭示了用放线菌素D处理过的并且用pHM6-eIF5A1转染的RKO细胞表现出凋亡提高了240%。与用pHM6-LacZ转染过的没有用放线菌素D处理过的细胞相比,用放线菌素D处理过的并且用pHM6-eIF5A1转染的RKO-E6细胞表现出凋亡提高了105%。
图40提供了表示在瞬时转染之后在RKO细胞中出现的凋亡的百分比的曲线图。用pHM6-LacZ,pHM6-eIF5A1,pHM6-eIF5A2,或pHM6-截短的eIF5A1瞬时转染RKO细胞。44小时后用Hoescht对所述细胞进行染色,并且在荧光显微镜下用UV滤光器观察。将由于浓缩的染色质而染亮的细胞统计为凋亡。与用pHM6-LacZ转染过的对照细胞相比,用pHM6-eIF5A1转染的细胞表现出凋亡增加了25%。对于用pHM6-eIF5A1或pHM6-截短的eIF5A1转染的细胞来说,这种增加不明显。
图41提供了表示在瞬时转染之后出现在RKO细胞中的凋亡的百分比的曲线图。不对RKO细胞进行转染,或者用pHM6-LacZ或pHM6-eIF5A1进行瞬时转染。44小时后用Hoescht对所述细胞进行染色,并且在荧光显微镜下用UV滤光器观察。将由于浓缩的染色质而染亮的细胞统计为凋亡的细胞。在对转染效率进行校正之后,用pHM6-eIF5A1转染的60%的细胞是凋亡的细胞。
图42提供了在瞬时转染之后RKO细胞凋亡的流式细胞术分析。不对细胞进行转染或者用pHM6-LacZ,pHM6-eIF5A1,pHM6-eIF5A2,或pHM6-截短的eIF5A1进行瞬时转染。48小时之后,收获所述细胞并且固定。用荧光素偶联的脱氧核苷酸标记体现凋亡的断裂的DNA,并且在装配有488nm氩离子激光光源的流式细胞计上进行分析。出现在门E下面的荧光来自非-凋亡的细胞,而出现在门F下面的荧光来自发生凋亡的细胞。该表示出了根据每一个门的峰下面的面积计算的发生凋亡的细胞的百分比。在对未转染的细胞中的背景凋亡和转染效率进行校正之后,用pHM6-eIF5A1转染的80%的细胞表现出凋亡。用pHM6-LacZ转染,pHM6-eIF5A2或pHM6-截短的eIF5A1转染的细胞仅表现出背景水平的凋亡。
图43提供了从用0.25μg/ml放线菌素D处理0,3,7,24,和48小时的RKO细胞中提取的蛋白的Western印迹。在12%SDS-聚丙烯酰胺凝胶上分离5μg(对于抗-eIF5A1来说)或10μg(对抗-p53来说)总蛋白,并且转移到聚偏二氟乙烯膜上。上部图片表示用抗p53作为第一抗体的Western印迹。中间的图片表示抗-eIF5A1作为第一抗体的Western印迹。下部的图片表示用于用考马斯亮兰对抗-eIF5A1印迹进行染色的膜,然后进行化学发光检测,以便证实加样量相等。在用放线菌素D处理之后,p53和eIF5A1都得到了上调。
序列表
<110>SENESCO,INC.
<120>调节凋亡的核酸,多肽,以及方法
<130>10799/83
<140>PCT/US03/14049
<141>2003-05-07
<150>10/141,647
<151>2002-05-07
<150>10/200,148
<151>2002-07-23
<160>30
<170>PatentIn Ver.2.1
<210>1
<211>1139
<212>DNA
<213>大鼠(Rattus sp.)
<220>
<221>CDS
<222>(33)..(494)
<400>1
caggtctaga gttggaatcg aagcctctta aa atg gca gat gat ttg gac ttc 53
Met Ala Asp Asp Leu Asp Phe
1 5
gag aca gga gat gca ggg gcc tca gcc acc ttc cca atg cag tgc tca 101
Glu Thr Gly Asp Ala Gly Ala Ser Ala Thr Phe Pro Met Gln Cys Ser
10 15 20
gca tta cgt aag aat ggt ttt gtg gtg ctc aag ggc cgg cca tgt aag 149
Ala Leu Arg Lys Asn Gly Phe Val Val Leu Lys Gly Arg Pro Cys Lys
25 30 35
atc gtc gag atg tct act tcg aag act ggc aag cat ggc cat gcc aag 197
Ile Val Glu Met Ser Thr Ser Lys Thr Gly Lys His Gly His Ala Lys
40 45 50 55
gtc cat ctg gtt ggt att gat att ttt act ggg aag aaa tat gaa gat 245
Val His Leu Val Gly Ile Asp Ile Phe Thr Gly Lys Lys Tyr Glu Asp
60 65 70
atc tgc ccg tcg act cat aac atg gat gtc ccc aac atc aaa agg aat 293
Ile Cys Pro Ser Thr His Asn Met Asp Val Pro Asn Ile Lys Arg Asn
75 80 85
gat ttc cag ctg att ggc atc cag gat ggg tac cta tcc ctg ctc cag 341
Asp Phe Gln Leu Ile Gly Ile Gln Asp Gly Tyr Leu Ser Leu Leu Gln
90 95 100
gac agt ggg gag gta cga gag gac ctt cgt ctg cct gag gga gac ctt 389
Asp Ser Gly Glu Val Arg Glu Asp Leu Arg Leu Pro Glu Gly Asp Leu
105 110 115
ggc aag gag att gag cag aag tat gac tgt gga gaa gag atc ctg atc 437
Gly Lys Glu Ile Glu Gln Lys Tyr Asp Cys Gly Glu Glu Ile Leu Ile
120 125 130 135
aca gtg ctg tcc gcc atg aca gag gag gca gct gtt gca atc aag gcc 485
Thr Val Leu Ser Ala Met Thr Glu Glu Ala Ala Val Ala Ile Lys Ala
140 145 150
atg gca aaa taactggctt ccagggtggc ggtggtggca gcagtgatcc 534
Met Ala Lys
atgagcctac agaggcccct cccccagctc tggctgggcc cttggctgga ctcctatcca 594
atttatttga cgttttattt tggttttcct caccccttca aactgtcggg gagaccctgc 654
ccttcaccta gctcccttgg ccaggcatga gggagccatg gccttggtga agctacctgc 714
ctcttctctc gcagccctga tgggggaaag ggagtgggta ctgcctgtgg tttaggttcc 774
cctctccctt tttcttttta attcaatttg gaatcagaaa gctgtggatt ctggcaaatg 834
gtcttgtgtc ctttatccca ctcaaaccca tctggtcccc tgttctccat agtccttcac 894
ccccaagcac cactgacaga ctggggacca gcccccttcc ctgcctgtgt ctcttcccaa 954
acccctctat aggggtgaca agaagaggag ggggggaggg gacacgatcc ctcctcaggc 1014
atctgggaag gccttgcccc catgggcttt accctttcct gtgggctttc tccctgacac 1074
atttgttaaa aatcaaacct gaataaaact acaagtttaa tatgaaaaaa aaaaaaaaaa 1134
aaaaa 1139
<210>2
<211>154
<212>PRT
<213>大鼠
<400>2
Met Ala Asp Asp Leu Asp Phe Glu Thr Gly Asp Ala Gly Ala Ser Ala
1 5 10 15
Thr Phe Pro Met Gln Cys Ser Ala Leu Arg Lys Asn Gly Phe Val Val
20 25 30
Leu Lys Gly Arg Pro Cys Lys Ile Val Glu Met Ser Thr Ser Lys Thr
35 40 45
Gly Lys His Gly His Ala Lys Val His Leu Val Gly Ile Asp Ile Phe
50 55 60
Thr Gly Lys Lys Tyr Glu Asp Ile Cys Pro Ser Thr His Asn Met Asp
65 70 75 80
Val Pro Asn Ile Lys Arg Asn Asp Phe Gln Leu Ile Gly Ile Gln Asp
85 90 95
Gly Tyr Leu Ser Leu Leu Gln Asp Ser Gly Glu Val Arg Glu Asp Leu
100 105 110
Arg Leu Pro Glu Gly Asp Leu Gly Lys Glu Ile Glu Gln Lys Tyr Asp
115 120 125
Cys Gly Glu Glu Ile Leu Ile Thr Val Leu Ser Ala Met Thr Glu Glu
130 135 140
Ala Ala Val Ala Ile Lys Ala Met Ala Lys
145 150
<210>3
<211>462
<212>DNA
<213>人(Homo sapiens)
<400>3
atggcagatg acttggactt cgagacagga gatgcagggg cctcagccac cttcccaatg 60
cagtgctcag cattacgtaa gaatggcttt gtggtgctca aaggccggcc atgtaagatc 120
gtcgagatgt ctacttcgaa gactggcaag cacggccacg ccaaggtcca tctggttggt 180
attgacatct ttactgggaa gaaatatgaa gatatctgcc cgtcaactca taatatggat 240
gtccccaaca tcaaaaggaa tgacttccag ctgattggca tccaggatgg gtacctatca 300
ctgctccagg acagcgggga ggtacgagag gaccttcgtc tccctgaggg agaccttggc 360
aaggagattg agcagaagta cgactgtgga gaagagatcc tgatcacggt gctgtctgcc 420
atgacagagg aggcagctgt tgcaatcaag gccatggcaa aa 462
<210>4
<211>462
<212>DNA
<213>人(Homo sapiens)
<220>
<221>修饰的碱基
<222>(455)..(456)
<223>a,t,c或g
<400>4
atggcagacg aaattgattt cactactgga gatgccgggg cttccegcac ttaccctatg 60
cagtgctcgg ccttgcgcaa aaacggcttc gtggtgctca aaggacgacc atgcaaaata 120
gtggagatgt caacttccaa aactggaaag catggtcatg ccaaggttca ccttgttgga 180
attgatattt tcacgggcaa aaaatatgaa gatatttgtc cttctactca caacatggat 240
gttccaaata ttaagagaaa tgattatcaa ctgatatgca ttcaagatgg ttacctttcc 300
ctgctgacag aaactggtga agttcgtgag gatcttaaac tgccagaagg tgaactaggc 360
aaagaaatag agggaaaata caatgcaggt gaagatgtac aggtgtctgt catgtgtgca 420
atgagtgaag aatatgctgt agccataaaa ccctnngcaa at 462
<210>5
<211>462
<212>DNA
<213>大鼠
<400>5
atggcagatg atttggactt cgagacagga gatgcagggg cctcagccac cttcccaatg 60
cagtgctcag cattacgtaa gaatggtttt gtggtgctca aaggccggcc atgtaagatc 120
gtcgagatgt ctacttcgaa gactggcaag catggccatg ccaaggtcca tctggttggc 180
attgacattt ttactgggaa gaaatatgaa gatatctgcc cgtcgactca taatatggat 240
gtccccaaca tcaaacggaa tgacttccag ctgattggca tccaggatgg gtacctatcc 300
ctgctccagg acagtgggga ggtacgagag gaccttcgtc tgcctgaagg agaccttggc 360
aaggagattg agcagaagta tgactgtgga gaagagatcc tgatcacagt gctgtctgcc 420
atgacagagg aggcagctgt tgcaatcaag gccatggcaa aa 462
<210>6
<211>606
<212>DNA
<213>大鼠
<220>
<221>CDS
<222>(1)..(453)
<400>6
gct gtg tat tat tgg gcc cat aag aac cac ata cct gtg ctg agt cct 48
Ala Val Tyr Tyr Trp Ala His Lys Asn His Ile Pro Val Leu Ser Pro
1 5 10 15
gca ctc aca gac ggc tca ctg ggt gac atg atc ttt ttc cat tcc tat 96
Ala Leu Thr Asp Gly Ser Leu Gly Asp Met Ile Phe Phe His Sar Tyr
20 25 30
aaa aac cca ggc ttg gtc ctg gac atc gtt gaa gac ctg cgg ctc atc 144
Lys Asn Pro Gly Leu Val Leu Asp Ile Val Glu Asp Leu Arg Leu Ile
35 40 45
aac atg cag gcc att ttc gcc aag cgc act ggg atg atc atc ctg ggt 192
Asn Met Gln Ala Ile Phe Ala Lys Arg Thr Gly Met Ile Ile Leu Gly
50 55 60
gga ggc gtg gtc aag cac cac atc gcc aat gct aac ctc atg cgg aat 240
Gly Gly Val Val Lys His His Ile Ala Asn Ala Asn Leu Met Arg Asn
65 70 75 80
gga gct gac tac gct gtt tat atc aac aca gcc cag gag ttt gat ggc 288
Gly Ala Asp Tyr Ala Val Tyr Ile Asn Thr Ala Gln Glu Phe Asp Gly
85 90 95
tca gac tca gga gcc cgg cca gat gag gct gtc tcc tgg ggc aag atc 336
Ser Asp Ser Gly Ala Arg Pro Asp Glu Ala Val Ser Trp Gly Lys Ile
100 105 110
cgg atg gat gca cag cca gta aag gtc tat gct gat gca tct ctg gtt 384
Arg Met Asp Ala Gln Pro Val Lys Val Tyr Ala Asp Ala Ser Leu Val
115 120 125
ttc ccc ttg ctg gtg gct gag aca ttc gcc caa aag gca gat gcc ttc 432
Phe Pro Leu Leu Val Ala Glu Thr Phe Ala Gln Lys Ala Asp Ala Phe
130 135 140
aga gct gag aag aat gag gac tgagcagatg ggtaaagacg gaggcttctg 483
Arg Ala Glu Lys Asn Glu Asp
145 150
ccacaccttt atttattatt tgcataccaa cccctcctgg gccctctcct tggtcagcag 543
catcttgaga ataaatggcc tttttgttgg tttctgtaaa aaaaggactt taaaaaaaaa 603
aaa 606
<210>7
<211>151
<212>PRT
<213>大鼠
<400>7
Ala Val Tyr Tyr Trp Ala His Lys Asn His Ile Pro Val Leu Ser Pro
1 5 10 15
Ala Leu Thr Asp Gly Ser Leu Gly Asp Met Ile Phe Phe His Ser Tyr
20 25 30
Lys Asn Pro Gly Leu Val Leu Asp Ile Val Glu Asp Leu Arg Leu Ile
35 40 45
Asn Met Gln Ala Ile Phe Ala Lys Arg Thr Gly Met Ile Ile Leu Gly
50 55 60
Gly Gly Val Val Lys His His Ile Ala Asn Ala Asn Leu Met Arg Asn
65 70 75 80
Gly Ala Asp Tyr Ala Val Tyr Ile Asn Thr Ala Gln Glu Phe Asp Gly
85 90 95
Ser Asp Ser Gly Ala Arg Pro Asp Glu Ala Val Ser Trp Gly Lys Ile
100 105 110
Arg Met Asp Ala Gln Pro Val Lys Val Tyr Ala Asp Ala Ser Leu Val
115 120 125
Phe Pro Leu Leu Val Ala Glu Thr Phe Ala Gln Lys Ala Asp Ala Phe
130 135 140
Arg Ala Glu Lys Asn Glu Asp
145 150
<210>8
<211>453
<212>DNA
<213>人(Homo sapiens)
<400>8
tccgtgtatt actgggccca gaagaaccac atccctgtgt ttagtcccgc acttacagac 60
ggctcgctgg gcgacatgat cttcttccat tcctacaaga acccgggcct ggtcctggac 120
atcgttgagg acctgaggct catcaacaca caggccatct ttgccaagtg cactgggatg 180
atcattctgg gcgggggcgt ggtcaagcac cacattgcca atgccaacct catgcggaac 240
ggggccgact acgctgttta catcaacaca gcccaggagt ttgatggctc tgactcaggt 300
gcccgaccag acgaggctgt ctcctggggc aagatccggg tggatgcaca gcccgtcaag 360
gtctatgctg acgcctccct ggtcttcccc ctgcttgtgg ctgaaacctt tgcccagaag 420
atggatgcct tcatgcatga gaagaacgag gac 453
<210>9
<211>20
<212>DNA
<213>人工序列
<220>
<223>人工序列说明:引物
<220>
<221>修饰的碱基
<222>(12)
<223>a,t,c或g
<400>9
tcsaarachg gnaagcaygg 20
<210>10
<211>42
<212>DNA
<213>人工序列
<220>
<223>人工序列说明:引物
<400>10
gcgaagcttc catggctcga gttttttttt tttttttttt tt 42
<210>11
<211>972
<212>DNA
<213>大鼠
<220>
<221>CDS
<222>(1)..(327)
<400>11
tcg aag acc ggt aag cac ggc cat gcc aag gtc cat ctg gtt ggt att 48
Ser Lys Thr Gly Lys His Gly His Ala Lys Val His Leu Val Gly Ile
1 5 10 15
gat att ttt act ggg aag aaa tat gaa gat atc tgc ccg tcg act cat 96
Asp Ile Phe Thr Gly Lys Lys Tyr Glu Asp Ile Cys Pro Ser Thr His
20 25 30
aac atg gat gtc ccc aac atc aaa agg aat gat ttc cag ctg att ggc 144
Asn Met Asp Val Pro Asn Ile Lys Arg Asn Asp Phe Gln Leu Ile Gly
35 40 45
atc cag gat ggg tac cta tcc ctg ctc cag gac agt ggg gag gta cga 192
Ile Gln Asp Gly Tyr Leu Ser Leu Leu Gln Asp Ser Gly Glu Val Arg
50 55 60
gag gac ctt cgt ctg cct gag gga gac ctt ggc aag gag att gag cag 240
Glu Asp Leu Arg Leu Pro Glu Gly Asp Leu Gly Lys Glu Ile Glu Gln
65 70 75 80
aag tat gac tgt gga gaa gag atc ctg atc aca gtg ctg tcc gcc atg 288
Lys Tyr Asp Cys Gly Glu Glu Ile Leu Ile Thr Val Leu Ser Ala Met
85 90 95
aca gag gag gca gct gtt gca atc aag gcc atg gca aaa taactggctt 337
Thr Glu Glu Ala Ala Val Ala Ile Lys Ala Met Ala Lys
100 105
ccagggtggc ggtggtggca gcagtgatcc atgagcctac agaggcccct cccccagctc 397
tggctgggcc cttggctgga ctcctatcca atttatttga cgttttattt tggttttcct 457
caccccttca aactgtcggg gagaccctgc ccttcaccta gctcccttgg ccaggcatga 517
gggagccatg gccttggtga agctacctgc ctcttctctc gcagccctga tgggggaaag 577
ggagtgggta ctgcctgtgg tttaggttcc cctctccctt tttcttttta attcaatttg 637
gaatcagaaa gctgtggatt ctggcaaatg gtcttgtgtc ctttatccca ctcaaaccca 697
tctggtcccc tgttctccat agtccttcac ccccaagcac cactgacaga ctggggacca 757
gcccccttcc ctgcctgtgt ctcttcccaa acccctctat aggggtgaca agaagaggag 817
ggggggaggg gacacgatcc ctcctcaggc atctgggaag gccttgcccc catgggcttt 877
accctttcct gtgggctttc tccctgacac atttgttaaa aatcaaacct gaataaaact 937
acaagtttaa tatgaaaaaa aaaaaaaaaa aaaaa 972
<210>12
<211>109
<212>PRT
<213>大鼠
<400>12
Ser Lys Thr Gly Lys His Gly His Ala Lys Val His Leu Val Gly Ile
1 5 10 15
Asp Ile Phe Thr Gly Lys Lys Tyr Glu Asp Ile Cys Pro Ser Thr His
20 25 30
Asn Met Asp Val Pro Asn Ile Lys Arg Asn Asp Phe Gln Leu Ile Gly
35 40 45
Ile Gln Asp Gly Tyr Leu Ser Leu Leu Gln Asp Ser Gly Glu Val Arg
50 55 60
Glu Asp Leu Arg Leu Pro Glu Gly Asp Leu Gly Lys Glu Ile Glu Gln
65 70 75 80
Lys Tyr Asp Cys Gly Glu Glu Ile Leu Ile Thr Val Leu Ser Ala Met
85 90 95
Thr Glu Glu Ala Ala Val Ala Ile Lys Ala Met Ala Lys
100 105
<210>13
<211>24
<212>DNA
<213>人工序列
<220>
<223>人工序列说明:引物
<400>13
caggtctaga gttggaatcg aagc 24
<210>14
<211>30
<212>DNA
<213>人工序列
<220>
<223>人工序列说明:引物
<400>14
atatctcgag ccttgattgc aacagctgcc 30
<210>15
<211>489
<212>DNA
<213>大鼠
<220>
<221>CDS
<222>(33)..(485)
<400>15
caggtctaga gttggaatcg aagcctctta aa atg gca gat gat ttg gac ttc 53
Met Ala Asp Asp Leu Asp Phe
1 5
gag aca gga gat gca ggg gcc tca gcc acc ttc cca atg cag tgc tca 101
Glu Thr Gly Asp Ala Gly Ala Ser Ala Thr Phe Pro Met Gln Cys Ser
10 15 20
gca tta cgt aag aat ggt ttt gtg gtg ctc aag ggc cgg cca tgt aag 149
Ala Leu Arg Lys Asn Gly Phe Val Val Leu Lys Gly Arg Pro Cys Lys
25 30 35
atc gtc gag atg tct act tcg aag act ggc aag cat ggc cat gcc aag 197
Ile Val Glu Met Ser Thr Ser Lys Thr Gly Lys His Gly His Ala Lys
40 45 50 55
gtc cat ctg gtt ggt att gat att ttt act ggg aag aaa tat gaa gat 245
Val His Leu Val Gly Ile Asp Ile Phe Thr Gly Lys Lys Tyr Glu Asp
60 65 70
atc tgc ccg tcg act cat aac atg gat gtc ccc aac atc aaa agg aat 293
Ile Cys Pro Ser Thr His Asn Met Asp Val Pro Asn Ile Lys Arg Asn
75 80 85
gat ttc cag ctg att ggc atc cag gat ggg tac cta tcc ctg ctc cag 341
Asp Phe Gln Leu Ile Gly Ile Gln Asp Gly Tyr Leu Ser Leu Leu Gln
90 95 100
gac agt ggg gag gta cga gag gac ctt cgt ctg cct gag gga gac ctt 389
Asp Ser Gly Glu Val Arg Glu Asp Leu Arg Leu Pro Glu Gly Asp Leu
105 110 115
ggc aag gag att gag cag aag tat gac tgt gga gaa gag atc ctg atc 437
Gly Lys Glu Ile Glu Gln Lys Tyr Asp Cys Gly Glu Glu Ile Leu Ile
120 125 130 135
aca gtg ctg tcc gcc atg aca gag gag gca gct gtt gca atc aag gct 485
Thr Val Leu Ser Ala Met Thr Glu Glu Ala Ala Val Ala Ile Lys Ala
140 145 150
cgag 489
<210>16
<211>151
<212>PRT
<213>大鼠
<400>16
Met Ala Asp Asp Leu Asp Phe Glu Thr Gly Asp Ala Gly Ala Ser Ala
1 5 10 15
Thr Phe Pro Met Gln Cys Ser Ala Leu Arg Lys Asn Gly Phe Val Val
20 25 30
Leu Lys Gly Arg Pro Cys Lys Ile Val Glu Met Ser Thr Ser Lys Thr
35 40 45
Gly Lys His Gly His Ala Lys Val His Leu Val Gly Ile Asp Ile Phe
50 55 60
Thr Gly Lys Lys Tyr Glu Asp Ile Cys Pro Ser Thr His Asn Met Asp
65 70 75 80
Val Pro Asn Ile Lys Arg Asn Asp Phe Gln Leu Ile Gly Ile Gln Asp
85 90 95
Gly Tyr Leu Ser Leu Leu Gln Asp Ser Gly Glu Val Arg Glu Asp Leu
100 105 110
Arg Leu Pro Glu Gly Asp Leu Gly Lys Glu Ile Glu Gln Lys Tyr Asp
115 120 125
Cys Gly Glu Glu Ile Leu Ile Thr Val Leu Ser Ala Met Thr Glu Glu
130 135 140
Ala Ala Val Ala Ile Lys Ala
145 150
<210>17
<211>20
<212>DNA
<213>人工序列
<220>
<223>人工序列说明:引物
<400>17
gtctgtgtat tattgggccc 20
<210>18
<211>42
<212>DNA
<213>人工序列
<220>
<223>人工序列说明:引物
<400>18
gcgaagcttc catggctcga gttttttttt tttttttttt tt 42
<210>19
<211>18
<212>DNA
<213>人工序列
<220>
<223>入工序列说明:引物
<400>19
ttgaaggggt gaggaaaa 18
<210>20
<211>15
<212>DNA
<213>人工序列
<220>
<223>人工序列说明:引物
<400>20
ttgagtggga taaag 15
<210>21
<211>18
<212>DNA
<213>人工序列
<220>
<223>人工序列说明:引物
<400>21
aatcatctgc cattttaa 18
<210>22
<211>26
<212>DNA
<213>人工序列
<220>
<223>人工序列说明:引物
<400>22
gccaagctta atggcagatg atttgg 26
<210>23
<211>25
<212>DNA
<213>人工序列
<220>
<223>人工序列说明:引物
<400>23
ctgaattcca gttattttgc catgg 25
<210>24
<211>27
<212>DNA
<213>人工序列
<220>
<223>人工序列说明:引物
<400>24
aatgaattcc gccatgacag aggaggc 27
<210>25
<211>20
<212>DNA
<213>人工序列
<220>
<223>人工序列说明:引物
<400>25
aaactaccat ctcccctgcc 20
<210>26
<211>20
<212>DNA
<213>人工序列
<220>
<223>人工序列说明:引物
<400>26
tgccctacac aggctgaaag 20
<210>27
<211>26
<212>DNA
<213>人工序列
<220>
<223>人工序列说明:引物
<400>27
atcaagcttg cccaccatgg cagacg 26
<210>28
<211>26
<212>DNA
<213>人工序列
<220>
<223>人工序列说明:引物
<400>28
aacgaattcc atgcctgatg tttccg 26
<210>29
<211>25
<212>DNA
<213>人工序列
<220>
<223>人工序列说明:引物
<400>29
tccgaattcg tacttctgct caatc 25
<210>30
<211>17
<212>PRT
<213>人工序列
<220>
<223>人工序列说明:合成肽
<400>30
Cys Arg Leu Pro Glu Gly Asp Leu Gly Lys Glu Ile Glu Gln Lys Tyr
1 5 10 15
Asp
Claims (6)
1.真核起始因子5A在制备用于调节细胞的凋亡的药物中的用途。
2.如权利要求1的用途,其中,所述真核起始因子5A由表达载体表达,所述表达载体包括可操作地与编码大鼠凋亡特异性真核起始因子5A多肽的核苷酸序列连接的启动子序列。
3.如权利要求2的用途,其中,所述核苷酸序列由SEQ ID NO:1组成。
4.如权利要求1的用途,其中,所述细胞包含在动物体内。
5.如权利要求4的用途,其中,所述药物是给动物施用的。
6.一种鉴定凋亡的调节的方法,包括:
(i)提供测试细胞;
(ii)让所述测试细胞与药物候选物接触;和
(iii)测定在存在所述药物候选物的情况下,所述测试细胞中大鼠增殖性真核起始因子5A与大鼠凋亡特异性真核起始因子5A的比例是否改变,
其中,大鼠增殖性真核起始因子5A与大鼠凋亡特异性真核起始因子5A的比例的改变是凋亡调节的指标。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US10/141,647 US7166467B2 (en) | 2001-07-23 | 2002-05-07 | Nucleic acids, polypeptides, compositions, and methods for modulating apoptosis |
| US10/141,647 | 2002-05-07 | ||
| US10/200,148 | 2002-07-23 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN1741820A CN1741820A (zh) | 2006-03-01 |
| CN100558410C true CN100558410C (zh) | 2009-11-11 |
Family
ID=36093912
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CNB038161540A Expired - Fee Related CN100558410C (zh) | 2002-05-07 | 2003-05-07 | 调节凋亡的核酸,多肽,以及方法 |
Country Status (4)
| Country | Link |
|---|---|
| JP (1) | JP4754819B2 (zh) |
| CN (1) | CN100558410C (zh) |
| HK (1) | HK1088824A1 (zh) |
| IL (1) | IL198348A0 (zh) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1973562A2 (en) * | 2005-12-13 | 2008-10-01 | Senesco Technologies, Inc. | Use of eif-5a to kill multiple myeloma cells |
| WO2009144933A1 (ja) | 2008-05-27 | 2009-12-03 | 国立大学法人東京大学 | アポトーシス誘導薬 |
| CN114231551B (zh) * | 2021-12-24 | 2023-09-29 | 云南大学 | 蛋白在促进昆虫淋巴细胞凋亡和/或防治害虫中的应用 |
Family Cites Families (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2296105A1 (en) * | 1997-06-30 | 1999-01-14 | Max-Planck-Gesellschaft Zur Forderung Der Wissenschaften E.V. | Novel inhibitor of cellular proliferation |
| US6538182B1 (en) * | 1999-07-06 | 2003-03-25 | Senesco, Inc. | DNA encoding a plant deoxyhypusine synthase, a plant eukaryotic initiation factor 5A, transgenic plants and a method for controlling senescence programmed and cell death in plants |
| AU6401200A (en) * | 1999-08-06 | 2001-03-05 | Pharmacia & Upjohn Company | Crystallization and structure determination of staphylococcus aureus elongation factor |
-
2003
- 2003-05-07 JP JP2004503607A patent/JP4754819B2/ja not_active Expired - Fee Related
- 2003-05-07 CN CNB038161540A patent/CN100558410C/zh not_active Expired - Fee Related
-
2006
- 2006-08-21 HK HK06109240.3A patent/HK1088824A1/xx not_active IP Right Cessation
-
2009
- 2009-04-23 IL IL198348A patent/IL198348A0/en unknown
Non-Patent Citations (5)
| Title |
|---|
| Deoxyhypusine synthase from rat testis:purification andcharacterization. WOLFF等人.Journal of Biological Chemistry,Vol.270 No.15. 1995 * |
| Deoxyhypusine synthase from rat testis:purification andcharacterization.. WOLFF等人.Journal of Biological Chemistry,Vol.270 No.15. 1995 |
| Sequence determination and cDNA cloningofeukaryoticinitiation factor 4D,the hypusine-containingprotein. Smit-McBride Z等人.J Biol Chem,Vol.264 No.3. 1989 |
| Sequence determination and cDNA cloningofeukaryoticinitiation factor 4D,the hypusine-containingprotein. Smit-McBride Z等人.J Biol Chem,Vol.264 No.3. 1989 * |
| 反义核酸及反义核酸技术. 韩雪清.中国兽医科技,第27卷第11期. 1997 |
Also Published As
| Publication number | Publication date |
|---|---|
| CN1741820A (zh) | 2006-03-01 |
| HK1088824A1 (en) | 2006-11-17 |
| JP2005524410A (ja) | 2005-08-18 |
| JP4754819B2 (ja) | 2011-08-24 |
| IL198348A0 (en) | 2011-07-31 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US7872112B2 (en) | Expression vector encoding apoptosis-specific eIF-5A | |
| US20140212969A1 (en) | Nucleic Acids, Polypetides, and Methods for Modulating Apoptosis | |
| CN101164624B (zh) | 核酸,多肽,以及调节细胞凋亡的方法 | |
| AU2002324519A1 (en) | Nucleic acids, polypeptides, and methods for modulating apoptosis | |
| CN1732018B (zh) | 核酸、多肽和调节细胞凋亡的方法 | |
| CN100558410C (zh) | 调节凋亡的核酸,多肽,以及方法 | |
| JP2005524410A5 (zh) |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| REG | Reference to a national code |
Ref country code: HK Ref legal event code: DE Ref document number: 1088824 Country of ref document: HK |
|
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| REG | Reference to a national code |
Ref country code: HK Ref legal event code: GR Ref document number: 1088824 Country of ref document: HK |
|
| C17 | Cessation of patent right | ||
| CF01 | Termination of patent right due to non-payment of annual fee |
Granted publication date: 20091111 Termination date: 20130507 |