CAMPO DA INVENÇÃO
[001] A invenção refere-se à administração de uma vacina bacteriana para a profilaxia ou tratamento da asma.
HISTÓRICO DA INVENÇÃO
[002] A asma é uma doença inflamatória crônica das vias aéreas caracterizada pela obstrução reversível das mesmas, e tem sido tradicionalmente classificada como extrínseca (devido à reação alérgica a alérgenos inalados como pólen e ácaro de pó doméstico) ou intrínseca (não é devido à alergia clássica), cujo mecanismo é desconhecido. Esta última forma tem sido chamada de asma "idiopática".
[003] Em um estudo recentemente relatado baseado em indivíduos com diagnóstico de asma, esta foi classificada baseada em diferenças nas contagens de eosinófilos e neutrófilos no escarro (Simpson et al, 2006). Os indivíduos no estudo foram divididos em diferentes subtipos de asma baseados na presença desses tipos de células comparados aos indivíduos saudáveis. Muitos subtipos de asma foram identificados incluindo asma neutrofflica (>61% neutrófilos) e asma eosinofílica (>1,01% eosinófilos). O grupo da asma neutrofflica compreendeu aproximadamente 20% do número geral dos asmáticos. O estudo ainda observou neutrofilia persistente na maioria desses indivíduos em intervalos de período curto (4 semanas) e período longo (média de 5,3 anos) entre amostragem, apesar de nenhum indivíduo ter relatado infecção do trato respiratório durante o mês anterior à avaliação. Enquanto indivíduos com asma foram observados com níveis mais altos de bactérias intracelulares e macrófagos do que os indivíduos saudáveis, não foram encontradas diferenças significativas entre os grupos de asmáticos neutrofilicos e os outros grupos asmáticos. De fato, os níveis de bactériasencontrados foram dados como menores em relação àqueles com infecção bacteriana aguda, e o relatório concluiu que não houve evidência de infecção bacteriana para explicar o processo inflamatório da asma neutrofílica.
[004] A Haemophilus influenzaeNão-tipável (NTHi) é a bactéria patogênica mais comum associada à bronquite crônica (BC) (Sethi, 2001). A NTHi pode ser encontrada nas vias aéreas superiores (por exemplo, nariz, orelha média, garganta e seios) de indivíduos saudáveis e pacientes com BC (Sethi, 2001), bem como diversos locais do trato respiratório, incluindo o lúmen, aderindo às células epiteliais da mucosa no interstício da submucosa (Moller, 1998). Estudos de BC obstrutiva e não-obstrutiva observaram que uma grande parte dos pacientes possui infecção persistente com NTHi (Murphy, 2004).
[005] Tanto NTHi quanto Staphylococcus aureusdemonstraram previamente induzir a liberação de histamina estimulada mediada e não mediada por IgE de mastócitos obtidos pela lavagem broncoalveolar das vias aéreas de pacientes com BC. No caso de NTHi, foi observado que a exotoxina pode ser responsável pela estimulação da liberação de histamina mediada por IgE (Clementsen, 1990). Células imunológicas isoladas de pacientes com BC durante exacerbações agudas demonstraram ser sensíveis e hiperativas às próprias bactérias dos pacientes (Nom, 1994). Diversos estudos também observaram anticorpos IgE específicos produzidos em resposta à infecção respiratória por fungos (por exemplo, Aspergillus) e vírus (por exemplo, vírus respiratório sincicial, vírus parainfluenza, [Welliver, 1982]) e bactérias, (S. pneumoniae[Kjaergard, 1996; Tee, 1982; Pauwels, 1980], S. aureus [Rhode, 2004; Tee, 1982], Pseudomonas aeruginosa [Shen, 1981], e Myeoplasma pneumoniae [Seggev, 1996]), Anticorpos IgE específicos para NTHi também foram identificados no soro sanguíneo de pacientes com BC (Kjaergard, 1996; Tee 1982) e fibrose cística (Tee, 1982).
[006] Em um estudo de pacientes com asma brônquica, anticorpos IgE para NTHi foram observados em 29%. Anticorpos para NTHi e/ou Streptococcus pneumoniaetambém foram encontrados em 22% dos pacientes com ausência de hipersensibilidade mediada por IgE. No entanto, níveis mais altos de anticorpos IgE bacterianos foram encontrados em pacientes com anticorpos IgE demonstráveis a vários antígenos inalantes (sugerindo um fenótipo alérgico) (Pauwels, 1980). Apesar de se imaginar que as infecções bacterianas podem atuar na indução e exacerbação da asma, tem sido considerado que a exacerbação da asma é predominantemente causada por infecção virai. De fato, o efeito clínico das vacinas bacterianas no tratamento da asma tem sido questionado levando às recomendações internacionais da OMS de que essas vacinas não possuem função no tratamento moderno da asma.
[007] Apesar da grande quantidade de pesquisas focadas na intervenção e tratamento terapêutico da asma, a doença continua sendo um problema crescente, sério e dispendioso nas sociedades ocidentais modernas.
SUMÁRIO DA INVENÇÃO
[008] De maneira geral, a invenção origina-se do reconhecimento por parte dos inventores de que a Haemophilus influenzaeNão-tipável (NTHi) pode agir como causadora da asma grave como um resultado da colonização persistente e/ou exposição recorrente à NTHi. Em especial, os inventores descobriram que o anticorpo IgE para NTHi é um mediador altamente significativo da asma (geralmente em uma situação complexa multifatorial). Sem se limitar a essa teoria, os inventores acreditam que a redução de NTHi inalada/colonizadora nas vias aéreas inferiores diminui ou essencialmente evita a ativação do mecanismo que provoca a asma. Reduzindo a indução da asma, a terapia com vacina contra NTHi conforme descrita aqui também pode reduzir as necessidades de tratamento da asma e medicação associada à asma.
[009] Assim, em um aspecto da invenção, é apresentado um método para a profilaxia ou tratamento da asma em um indivíduo, que compreende aadministração de uma quantidade eficaz de uma vacina contra NTHi a um indivíduo.
[0010] A vacina pode ser qualquer vacina contra NTHi que induza uma resposta do sistema imunológico eficaz contra a bactéria. Normalmente, será uma vacina oral contra NTHi, e principalmente uma vacina oral inativada contra NTHi.
[0011] Em outro aspecto da invenção, é apresentada uma vacina oral para a profilaxia ou tratamento da asma, compreendendo ao menos um antígeno de NTHi com um portador fisiologicamente aceitável.
[0012] Em outro aspecto da invenção, é apresentado o uso de ao menos um antígeno para provocar uma resposta do sistema imunológico contra NTHi para a profilaxia ou tratamento da asma em um indivíduo.
[0013] O antígeno pode, por exemplo, ser selecionado do grupo que consiste em isolados de NTHi inativadas, frações de NTHi e componentes da membrana externa de antigênicos (por exemplo, antígenos de superficie ou seus fragmentos) de NTHi.
[0014] Normalmente, a NTHi inativada inteira será usada em uma vacina ou método para a profilaxia ou tratamento da asma conforme descrito na presente invenção.
[0015] O indivíduo pode ter asma diagnosticada ou pode ser um indivíduo do grupo de risco, como um fumante ou ex-fumante, ou com infecções recorrentes das vias aéreas, tosse crônica e escarro (por exemplo, como uma bronquite crônica) e/ou asma intrínseca. Em pelo menos uma forma, o indivíduo terá um ou mais parâmetros indicativos da exposição à NTHi como um nível elevado de neutrofilia, a presença de NTHi em escarro ou saliva, e/ou anticorpos específicos para NTHi. Ao menos algumas configurações da invenção possuem uma aplicação específica na profilaxia ou tratamento da asma neutrofilica.
[0016] De forma vantajosa, a administração de uma vacina contraNTHi, de acordo com uma ou mais configurações da invenção, pode levar a uma redução de anticorpos NTHi e/ou dos sintomas ou gravidade da asma (por exemplo, asma intrínseca ou neutrofilica) no indivíduo.
[0017] Através dessa especificação, o termo "compreende" ou variações como "compreendendo" designa a inclusão de um elemento, totalidade ou etapa determinada, ou grupo de elementos, totalidades ou etapas, mas não a exclusão de qualquer outro elemento, totalidade ou etapa, ou grupo de elementos, totalidades ou etapas.
[0018] Todas as publicações mencionadas nesta especificação estão incorporadas neste documento por referência. Quaisquer discussões em relação a documentos, atos, materiais, dispositivos, artigos ou similares que foram incluídos nesta especificação servem apenas para apresentar um contexto para a presente invenção. Não devem ser interpretados como reconhecimento de que todos ou quaisquer destes assuntos formam parte do fundamento do estado da técnica ou eram de conhecimento geral no campo pertinente a presente invenção, uma vez que já existiam antes da data de prioridade deste pedido.
[0019] As características e vantagens desta invenção ficarão mais claras a partir das seguintes descrições detalhadas das respectivas configurações.
BREVE DESCRIÇÃO DOS DESENHOS ANEXOS
[0020] A Figura 1 mostra um gráfico exibindo o número médio de NTHi isolado em um colutório do grupo de estudos com placebo; A Figura 2 mostra um gráfico exibindo níveis séricos de IgG específico para NTHi no grupo de placebo e no grupo de tratamento imunizado com uma vacina oral inativada contra NTHi; e A Figura 3 mostra um gráfico exibindo os níveis de saliva de IgG específico para NTHi no grupo de placebo e no grupo de tratamento imunizado com uma vacina oral inativada contra NTHi.
DESCRIÇÃO DETALHADA DAS CONFIGURAÇÕES DA INVENÇÃO
[0021] A asma é clinicamente definida por sibilo, obstrução reversível das vias aéreas e hiperatividade brônquica. A causa mais comum da asma é a hipersensibilidade mediada por IgE a alérgenos inalados resultando na classificação da asma como "extrínseca" ou "intrínseca". Entretanto, indivíduos com asma há muito tempo podem desenvolver tosse e escarro originado de pulmão afetado e infecção associada recorrente das vias aéreas. Também existem, por exemplo, indivíduos que sofrem de bronquite com tosse e escarro existentes há muito tempo que desenvolvem sibilo, e indivíduos com asma recorrente e infecção das vias aéreas.
[0022] Convencionalmente, cuidadosos estudos da asma têm sido realizados para analisar grupos discretos e, geralmente, indivíduos com asma claramente definida (por exemplo, asma extrínseca clássica) são separados de outros grupos (por exemplo, aqueles com patologia das vias aéreas relacionadas ao fumo) levando aos estudos sendo conduzidos em grupos definidos de asmáticos isolados de outros grupos de asmáticos. No entanto, esta é uma categorização artificial e, ainda, é mais realista considerar a asma como um espectro de patologia das vias aéreas, conforme ilustrado no Esquema 1.
[0023] Muitas observações diferentes foram feitas em relação a manifestações clínicas diferentes da asma, podendo ser resumidas da seguinte forma: • A indução do anticorpo IgE a antígenos inalados (por exemplo, pólen) origina a asma alérgica clássica, em que ocorre a ligação de IgE específica a alérgenos aos mastócitos causando a perda de grânulos dos mastócitos e liberando mediadores como a histamina, que origina os sintomas alérgicos.
[0024] • A colonização das vias aéreas afetadas e intermitenteinfecção virai podem levar ao fluxo de neutrofilia nos brônquios (bronquite aguda) (geralmente associada ao sibilo — que se imagina que sucede a "inflamação" do brônquio).
[0025] • O fumo, que traz danos ao pulmão, pode deixar as viasaéreas do indivíduo expostas à infecção.
[0026] No entanto, muitos indivíduos com diagnóstico clínico de asma são "uma combinação" com relação a esses componentes e propõe-se que este espectro da patologia de asma possa ser conciliado pelo reconhecimento de que diferentes caminhos patogênicos podem levar à asma, e que esses caminhos podem coexistir. Em especial, sem se limitar à teoria, os inventores acreditam que a causa predominante do sibilo em muitos asmáticos sem hipersensibilidade clássica demonstrável a alérgenos (por exemplo, testes negativos para anticorpo IgE de poeira doméstica, pólen e similares, e/ou aqueles que possuem contagem elevada de eosinófilos) é devido a uma reação mediada por anticorpo IgE à colonização e/ou exposição recorrente a NTHi em combinação com a habilidade de NTHi de induzir e ativar neutrófilos. Especificamente, a vacina contra NTHi pode reduzir a carga de NTHi nas vias aéreas estreitas, e fornecer tratamento eficaz para a denominada "asma intrínseca".
[0027] De forma geral, o beneficio da vacina contra NTHi pode surgir daqueles indivíduos que possuem um ou mais parâmetros indicativos de exposição à NTHi como níveis elevados de neutrófilos (com ou sem níveis elevados de eosinófilos), infecção atual de NTHi, como por exemplo, indicado por NTHi no escarro ou saliva e/ou anticorpo específico para NTHi, e aqueles indivíduos com vias aéreas afetadas pelo fumo (doença pulmonarobstrutiva crônica (DPOC)) ou bronquite crônica (especialmente os indivíduos com sibilo). Reconhece-se, por exemplo, que indivíduos com vias aéreas afetadas estão altamente propensos à infecção/colonização por NTHi e outras patogêneses bacterianas. Enquanto que os danos às vias aéreas resultam do fumo, a asma extrínseca também pode afetar as vias aéreas (portanto, um acesso tardio de tosse e escarro associado à infecção por NTHi). Pode haver benefícios em indivíduos asmáticos com mecanismos combinados (por exemplo, indivíduos atópicos com anticorpo IgE para NTHi), e o tratamento da asma e sintomas da asma em geral como resultado da diminuição ou prevenção da indução da produção de IgE resultante da exposição à NTHi.
[0028] Os níveis de anticorpos podem ser medidos em amostras sanguíneas, séticas, plasmáticas, de escarro ou saliva utilizando qualquer protocolo de ensaio convencionalmente conhecido, incluindo ensaio imunoabsorvente ligado a enzima (ELISA) ou outro imunoensaio. Anticorpo específico para NTHi pode ser selecionado de um ou mais IgA, IgM, IgG e IgE e respectivas subclasses, tais como IgGl e/ou IgG3. Anticorpo IgE específico para NTHi e/ou IgE total serão de forma geral medidos em amostra de escarro ou saliva. Os níveis neutrofilicos também podem ser medidos em saliva ou escarro usando qualquer ensaio apropriado convencionalmente conhecido, incluindo avaliação microscópica pela coloração celular. Da mesma forma, qualquer método conhecido na técnica pode ser empregado para determinar a contagem de NTHi/nível da infecção por NTHi. Os níveis de anticorpos e neutrófilos e contagem de NTHi podem ser comparados com o(s) nível(eis) correspondente(s) de referência originado(s) dos asmáticos extrínsecos clássicos (por exemplo, exibindo eosinofílico e/ou hipersensibilidade) ou por exemplo, um controle não-asmático ou outro grupo apropriado de referência. Métodos estatísticos para diferenciar os grupos da asma são, por exemplo, descritos em Simpson et al, 2006.
[0029] A vacina utilizada em um método da invenção conterá normalmente isolado(s) de NTHi inteiro(s) inativado(s) (ou seja, atenuado(s)) (por exemplo, inativado com formalina). Entretanto, antígeno de NTHi solúvel ou particulado compreendendo ou consistindo em membrana celular externa e/ou antígenos de superfície pode ser utilizado também, ou em substituição a organismos inteiros mortos. Em uma ou mais configurações, a fração da membrana celular externa ou proteína(s) da membrana do(s) isolado(s) NTHi selecionado(s) será(ão) utilizada(s). Por exemplo, OMP P6 de NTHi é uma lipoproteina 16-kDa altamente conservada (Nelson, 1988) que é um alvo do anticorpo bactericida humano e induz proteção em animais e humanos. Em doença pulmonar obstrutiva crônica (DPOC), OMP P6 mostrou evocar uma resposta proliferativa do linfócito que está associada com uma proteção relativa da infecção por NTHi (Abe, 2002). Assim, P6 de OMP ou quaisquer outras proteínas de NTHi da membrana externa adequada , polipeptídeos (por exemplo, P2, P4 e P26) ou fragmentos antigênicos de tais proteínas ou polipeptídeos podem ser aplicados na vacina contra NTHi.
[0030] O antígeno solúvel e/ou particulado pode ser preparado pelo rompimento de isolado(s) de NTHi selecionado(s) viável(eis) ou inativado(s). Uma fração para uso na vacina pode então ser preparada por centrifugação, filtragem e/ou outras técnicas adequadas conhecidas. Qualquer método que alcance o nível exigido de rompimento celular pode ser empregado, incluindo destruição ou dissolução utilizando surfactantes e agitação adequados, e a combinação de tais técnicas. Quando o método de destruição é empregado, o isolado pode estar sujeito a algumas etapas de destruição para obter o grau exigido de rompimento celular ou a geração de uma substância solúvel e/ou particulada de tamanho específico ou de faixa de tamanho.
[0031] O isolado Hl-164 não tipável de H Influenzae (HunterImmunology Limited, Frenchs Forest, NSW 2086, Australia), é particularmente adequado para uso em vacinas para a profilaxia ou tratamentoda asma, conforme descrito aqui.
[0032] A vacina compreenderá normalmente o(s) isolado(s) bacteriano(s) selecionado(s) e/ou antígenos em uma quantidade de 0,1% a 100% do peso da composição da vacina. Uma dosagem eficaz da vacina levará em conta o modo proposto de distribuição e natureza da vacina (por exemplo, pó, líquido, aerossol etc). Para vacinas inteiras inativadas, a dosagem de, ou cada, isolado bacteriano administrado estará normalmente em uma faixa de aproximadamente 109a 1012 bactérias inativadas, e mais preferencialmente a partir de 1010 a aproximadamente 1011 bactérias inativadas. A dosagem ideal da vacina pode ser determinada pela administração de diferentes dosagens a diferentes grupos de mamíferos para testes antes da infecção subseqüente de animais em cada grupo com NTHi, e determinando o nível de dosagem exigido para atingir uma depuração satisfatória do patógeno.
[0033] A vacina pode ser administrada de acordo com qualquer regime adequado para provocar uma resposta do sistema imunológico eficaz contra a infecção por NTHi. Por exemplo, uma única dose da vacina pode ser administrada uma vez ao ano antes do inverno. Uma ou mais doses "de reforço" da vacina também podem ser administradas em um intervalo de algumas semanas ou meses. Outra alternativa é a administração de algumas doses da vacina no curso de algumas semanas para provocar uma resposta do sistema imunológico eficaz contra infecção e/ou colonização por NTHi.
[0034] A vacina pode ser liofilizada reconstituída utilizando um tampão ou fluido fisiologicamente aceitável. A vacina também pode conter um ou mais agentes anti-aglomerantes, conservantes como timerosal ou que sejam adequados para o modo proposto de administração, estabilizadores, tais como aminoácidos e componentes de açúcares, agentes adoçantes como sacarose, lactose ou sacarina, surfactantes, agentes de tamponamento de pH e modificadores de pH, como hidróxido de sódio, ácido clorídrico, fosfatomonossódico e/ou fosfato dissódico, um portador farmaceuticamente aceitável como soro fisiológico, solventes e meio de dispersão e preparos isotônicos. A vacina pode compreender também um ou mais adjuvantes, como por exemplo subunidades B da toxina da cólera e adjuvantes de alume convencionais. Normalmente, mas não exclusivamente, a vacina não é adjuvante.
[0035] O uso de tais ingredientes e meios na vacina é bem conhecido na técnica. Exceto à medida que qualquer meio ou agente convencional for incompatível com o(s) isolado(s) de NTHi ou antígenos, ou o modo proposto de administração, seu uso da vacina que pode ser empregado em métodos incorporados pela invenção é especificamente incluído. Agentes ativos suplementares para impulsionar a resposta do sistema imunológico incluindo, por exemplo, microorganismos probióticos, frações e respectivos produtos biológicos, e citocinas pertinentes, também podem ser incluídas na vacina. Portadores farmaceuticamente aceitáveis e combinações de ingredientes úteis nas composições da vacina da presente invenção podem, por exemplo, ser encontrados em manuais e textos bem conhecidos pelos especialistas, como "Remington"The Science and Practice of Pharmacy (Mack Publishing Co., 1995), cujo conteúdo está incorporado neste documento na íntegra como referência. Exemplos específicos de adjuvantes incluem a subunidade B da toxina da cólera e adjuvantes de alume convencionais.
[0036] A vacina bacteriana oral inativada pode ser administrada como pó seco ou em sua forma líquida. A administração pode ser realizada, por exemplo, por injeção (subcutânea ou intravenosa), oralmente como por unidade de dosagem (comprimido, cápsula ou na forma líquida de dosagem), por instilação ou como spray.
[0037] Formas específicas adequadas da vacina contra NTHi que podem ser administradas de acordo com uma ou mais configurações da invenção incluem comprimidos, cápsulas e drágeas entericamente revestidas.
[0038] A vacina será geralmente administrada a um ser humano, deacordo com a invenção, podendo ser administrada também a qualquer mamífero asmático. A invenção será descrita abaixo por meio de exemplos não-delimitadores.
EXEMPLO 1 Indivíduos com doença crônica das vias aéreas possuem níveis mais altos de anticorpo IgE para NTHi
[0039] Um estudo foi realizado em que indivíduos com doença pulmonar obstrutiva crônica (DPOC) e um grupo de controle com indivíduos de mesma idade foram avaliados pelos níveis de IgE total e IgE específica para NTHi na saliva, soro sanguíneo e escarro. Foram aplicadas uma avaliação física e um questionário amplo que incluíram dados como a idade, sexo, hábito de fumar e sintomas respiratórios. Foi registrado o uso de corticosteróides e antibióticos de todos os indivíduos. A função do pulmão foi avaliado por espirometria. Nenhum dos indivíduos dos grupos de controle de indivíduos saudáveis era fumante ativo ou possuía um histórico de fumo. Todos, com exceção de um dos indivíduos no grupo de DPOC apresentaram sibilo, que foi definido como uma respiração ofegante ou chiado no peito a qualquer momento. Nenhum dos indivíduos observados havia tido infecção respiratória no mês anterior. O estado clínico de todos os pacientes era estável. Foram coletadas amostras de saliva e sangue.
1.1 Metodologia
1.1.1 Saliva
[0040] Toda a saliva estimulada por parafina foi coletada e mantida por 10 minutos em tubos congelados por sucção moderada, purificada por centrifugação a 20.000 x g por 20 minutos a 4°C, e o sobrenadante foi mantido congelado a -70°C até a análise.
1.1.2 Soro sanguíneo
[0041] Uma amostra de dez mililitros de sangue foi coletada por venipuntura de rotina, coagulando a temperatura ambiente, centrifugada a 5.000 x g a 4°C por 10 minutos, e o soro foi mantido a -70°C até a análise.
1.1.3 Solução de escarro
[0042] De modo geral, os indivíduos foram instruídos a expectorarem ao acordar e manter as amostras congeladas. As amostras de escarro foram avaliadas pela contaminação orofaringea por microscópio de acordo com os critérios estabelecidos por Courcol et al (1985). A solução de escarro foi preparada a partir de amostras aceitáveis por centrifugação a 4°C por 60 minutos a 30.000 x g e mantidas a -70°C até a análise.
1.1.4 Preparo de antígenos de NTHi
[0043] Um extrato de zwittergent de OMP de NTHi foi preparado conforme descrito por Murphy et ai (1988). P6, uma lipoproteína 16-kDa altamente conservada de NTHi foi purificada usando eletroforese em gel de poliacrilamida de preparação (PAGE) pelo método dodecil sulfato de sódio (SDS), conforme descrito por Kyd et all (1994). A preparação SDS-PAGE para purificação de P6 foi realizada usando uma Célula Bio-Rad 491 (BioRad, Hercules, CA). SDS-PAGE foi realizada utilizando o Sistema PHAST (Pharmacia Piscataway, NJ) para analisar zwittergent de OMP e frações P6 com géis gradientes de 10-15%. Padrões de peso molecular baixo (Pharmacia) foram conduzidos com cada gel. Os géis foram tingidos com azul de Coomassie e nitrato de prata.
1.1.5 Ensaio imunoabsorvente ligado a enzima IgE (ELISA)
[0044] IgE de cabra (Tago, Inc. CA) a uma concentração de 2,0 pg/ml foi utilizada para a medição do total de IgE em amostras. Os anticorpos IgE foram medidos por ELISA. Resumidamente, as placas de 96 cavidades de fundo plano ELISA (Immunoplate 1, Polysorp, Nunc, Roskilde, Dinamarca) foram revestidas durante a noite a 4°C com 100 1.11 de antígeno na concentração adequada no tampão de bicarbonato de sódio (pH 9,6) ou apenas no tampão de bicarbonato de sódio. As cavidades foram lavadas três vezes com PBS de pH 7,2 contendo 0,05% (vlv) de Tween 20 (PBS/Tween) e em seguida 100 pl de 1% (p/v) de BSA (classificação do radioimunoensaio;Sigma, St Lois, MO) em PBS/T foi adicionado e mantido por 60 minutos a 37°C. As cavidades foram lavadas com PBS/T e em seguida 100 pl de amostra diluída em 1% BSA/PBS/T foram adicionados a cada cavidade. As placas foram incubadas por mais 60 minutos a 37 °C, após o qual foram lavadas e 100 J.ll de IgE de cabra biotinilada (Tago, Inc. Califórnia, EUA) diluído 1:1000 em 1% BSA/PBS/T foi adicionado e incubado por outros 60 minutos a 37°C. Após a lavagem, 100 pl de estreptavidina conjugada com peroxidase (Tago) diluída 1:40.000 em 1% BSA/PBS/T foi adicionado em cada cavidade e incubado por 45 minutos a 37°C. Após a lavagem, 100 pi de substrato de enzima 3.3', 5.5'-tetrametil-benzidina (Sigma) em tampão de substrato foi adicionado em cada cavidade e incubado por 15 a 30 minutos em temperatura ambiente. A reação foi interrompida com 100 pi de ácido sulfúrico (1,0 M) e a absorvência foi lida a 490 nm em um leitor de placa ELISA. As curvas padrão foram geradas realizando cinco diluições de duas vezes de IgE de cabra (2,0 pg/ml) (Bioclone, Austrália) para a medição de IgE total em amostras e coleta de soro sanguíneo de 10 indivíduos com bronquite crônica para a medição de IgE e IgE P6 de OMP em amostras. As curvas e amostras padrão foram testadas duas vezes. A absorvência das amostras em cavidades de tampão de carbonato foi subtraída de cada cavidade revestida com anticorpo para dar o resultado final. A faixa de sensibilidade para IgE total foi de 0,15 a 2,43 ng/ml. As titulações em checkerboard foram conduzidas para otimizar todas as concentrações de anticorpos e faixas úteis de concentrações padrão de proteína e diluições de amostra.
1.2 Níveis séricos de IgE e escarro nos grupos de controle e de tratamento
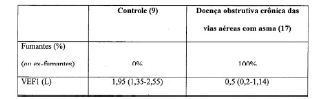
[0045] Os anticorpos de IgE total e IgE para NTHi foram medidos por ensaio ELISA conforme descrito no Exemplo 1.1.5. O perfil do paciente está apresentado na Tabela 1 a. Os valores obtidos estão mostrados na Tabela 1 b (valores apresentados representam o erro padrão da média +/-). Tabela 1 a: Perfil do indivíduo
Tabela lb: OMP de IgE total, IgE para NTHi, e IgE para P6 de NTHi em indivíduos com infecção recorrente das vias aéreas e asma
ND = Não detectável UE = Unidades Elisa
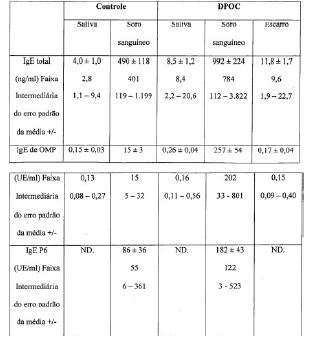
[0046] A relação entre o nível de IgE e a doença respiratória alérgica em indivíduos foi avaliada. O perfil do paciente é mostrado na Tabela 2a.Resumidamente, observou-se que os indivíduos com bronquite aguda recorrente com broncoespasmo (sendo que a maioria fuma e possui doença crônica precoce das vias aéreas) possuem altos níveis de anticorpo IgE independentemente da existência de doença alérgica. Os níveis de IgE específica para NTHi e IgE total estão exibidos na Tabela 2b (valores apresentados representam o erro padrão da média +/-). Tabela 2a: Perfil do indivíduo
Tabela 2b: IgE total e IgE específico para antígenos de NTHi (OMP & P6)
ND = Não detectável UE = Unidades Elisa
[0047] Os resultados presentes nos Exemplos 1.2 e 1.3 não mostram diferenças significativas no nível de IgE total nos grupos de controle e de DPOC no soro sanguíneo e saliva. No entanto, foi observado um aumento significativo no anticorpo IgE em OMP no grupo de DPOC comparado ao grupo de controle (P<0,01), e tanto o anticorpo IgE em OMP quanto o anticorpo IgE P6 foram detectados no escarro. Os resultados mostram que o anticorpo IgE específico de NTHi é comum no soro sanguíneo e secreções em indivíduos com doença crônica das vias aéreas e asma (sibilo).
[0048] Indivíduos que tinham DPOC moderada a grave e foram tratados com a vacina oral no grupo de tratamento ativo tiveram uma redução de 50% na aplicação das terapias broncodilatadoras. Além disso, descobriu-se que as contagens de eosinófilos após a administração de uma dose tripla da vacina oral contra NTHi foram reduzidas significativamente apenas no grupo de tratamento ativo. Conclui-se que a terapia oral contra NTHi reduz as aplicações de terapias broncodilatadoras em episódios agudos e também reduz a contagem de eosinófilos que estão associados às reações alérgicas específicas a NTHi.
EXEMPLO 2
[0049] Um estudo clínico duplo-cego controlado com placebo foi realizado com 64 indivíduos que fumavam 10 cigarros por dia nos últimos dois anos que foram recrutados e alotados em grupos de tratamento oral contra NTHi ou de placebo em um estudo duplo-cego. Os indivíduos foram divididos randomicamente em grupos ativos e de placebo e receberam três doses do medicamento de estudo em intervalos mensais. Cada dose consistiu em dois comprimidos por dia durante três dias. Cada comprimido ativo continha 45mg de NTHi inativado com formalina (equivalente a 10" bactérias inativadas por comprimido ativo). Foram coletadas amostras de sangue,saliva, colutório, material coletado da garganta e narinas (para avaliação microbiológica) em sete visitas quinzenais.
2.1 Detecção de NTHi e medição de IgG especifica para NTHi
[0050] Surpreendentemente, as medições nos grupos de tratamento por vacina e por placebo no inverno detectou NTHi em ambos os grupos, indicando exposição aleatória à bactéria. A Fig. 1 mostra o nível médio de NTHi nos colutórios do grupo administrado com placebo em cada visita.
[0051] IgG específica para NTHi foi medida na saliva e soro sanguíneo pelo ensaio ELISA. Resumidamente, as cavidades das placas Nunc Maxisorp de 96 cavidades foram revestidas com preparação de antígeno para destruição de H. influenzae164. Após a incubação durante a noite a 2-8°C, as placas foram lavadas e as amostras de saliva ou soro sanguíneo em várias diluições foram adicionadas. Após a incubação em temperatura ambiente por 60 minutos, as placas foram lavadas, e foi adicionado o anticorpo IgG anti- humano conjugado por peroxidase de raiz-forte (número de catálogo Chemicon AP112P). Após incubação por mais 60 minutos em temperatura ambiente, as placas foram lavadas, e foi adicionado o substrato TMB (número de catálogo Biomediq 50-76-00) antes da incubação adicional por 10 minutos em temperatura ambiente, e a reação sendo interrompida por adição do ácido fosfórico 1M. A absorvência foi lida em um leitor de microplaca BioRad no modo de comprimento de onda dual com um filtro primário de 450nm e filtro de referência de 655nm. Foi utilizada uma curva padrão para determinar as unidades ELISA em cada amostra.
[0052] Os níveis de IgG específica para NTHi no soro sanguíneo e saliva dos grupos de tratamento por placebo eram mais altos e mais variáveis do que os níveis no grupo de tratamento por vacina (ver Fig. 2 e Fig. 3). Os inventores acreditam nisto porque o alcance de NTHi às vias aéreas inferiores no grupo administrado com placebo resulta na produção sistêmica de IgG, e que essencialmente evitou-se que NTHi atingisse as vias aéreas inferiores nogrupo de tratamento por vacina. Para testar isso, foram preparados gráficos para mostrar a relação entre o número de visitas em que NTHi foi detectada no colutório e a alteração Log em IgG do soro sanguíneo entre as visitas 1 e 6. Os indivíduos ativos e de placebo foram agrupados de acordo com o número de visitas (se tiveram de O a 1 ou 2 a 4 visitas) em que NTHi foi encontrada no colutório. No grupo de placebo, aumentos positivos em IgG do soro sanguíneo foram associados ao crescente número de detecções de NTHi. Tal fato não foi observado no grupo de tratamento ativo. A diferença entre a alteração ativa e de placebo em IgG foi estatisticamente significativa (p=0,0186), indicando que IgG do soro sanguíneo no grupo de placebo foi de fato gerado por NTHi como resultado da bactéria alcançando as vias aéreas inferiores. Além disso, quanto maior a presença de NTHi nas lavagens de placebo, maior o nível de anticorpo IgG. Acredita-se também que tal fato aplica-se à aparência de IgG específica para NTHi salivar no grupo de placebo.
2.2 Discussão
[0053] Foi medido o anticorpo IgG do soro sanguíneo como um marcador da eficácia da vacina. Foi descoberta uma aparente ausência de resposta de IgG no grupo de tratamento por vacina, enquanto que se observou um aumento em IgG do soro sanguíneo no grupo de tratamento com placebo de pacientes. Sem se limitar à teoria, os inventores acreditam que aumento de IgG observado no grupo administrado com placebo reflete uma resposta do sistema imunológico às bactérias de contaminação que alcançam as vias aéreas inferiores, onde a absorção de bactérias pelas células apresentadoras de antígeno e transporte aos linfonodos de drenagem induz uma resposta IgG antibacteriana. Ao contrário, a ausência de tal resposta no grupo de tratamento por vacina indica que as bactérias estão sendo essencialmente impedidas (por uma resposta imunológica da mucosa específica de vacina) de atingir as vias aéreas inferiores. Uma comparação da resposta de IgG em indivíduos comNTHi detectada nas vias aéreas superiores nas visitas O a 1 ou 2 a 4 também mostrou aumento em IgG no grupo de placebo, mas não no grupo de tratamento (vacina) ativo. Supõe-se assim que a medição de IgG do soro sanguíneo após a vacinação oral contra NTHi reflete a exposição à infecção e o grau ao qual isso é prevenido pela imunização da mucosa. A resposta IgG da saliva reflete aquilo observado no soro sanguíneo.
[0054] De maneira geral, este estudo demonstra a detecção de NTHi no trato respiratório superior de indivíduos nos grupos de tratamento e de placebo, e que o tratamento com terapia de vacina oral inativada contra NTHi levou a uma redução de IgG específica para NTHi no soro sanguíneo e saliva no grupo de tratamento, indicando que a vacina obteve sucesso na limitação ou prevenção do acesso de NTHi às vias aéreas inferiores (ou seja, menos alérgenos para desencadear a asma).
[0055] Portanto, apenas no grupo de placebo a NTHi obteve acesso nas vias aéreas inferiores, conforme evidenciado por estimulação do anticorpo IgG, e uma "imunização" oral com vacina contra NTHi reduziu alérgenos de NTHi nas vias aéreas.
EXEMPLO 3 A vacina inativada contra NTHi com administração oral a indivíduos com doença moderada ou grave das vias aéreas reduz a aplicação da terapia antiasma.
[0056] 140 indivíduos humanos com doença das vias aéreas de leve amoderada ou moderada a grave foram recrutados para um estudo duplo-cego controlado com placebo para avaliar o efeito de uma vacina oral inativada contra a Haemophilus influenzaeNão-tipável (NTHi) no número e gravidade da obstrução reversível das vias aéreas com sibilo, e a administração de medicamento concomitante, bem como a presença de NTHi e outras bactérias nas vias aéreas.
[0057] Foi observada uma redução no uso de medicação antiasma (broncodilatadores, esteróides etc) e infecção reduzida por NTHi no grupo detratamento comparado ao grupo de controle. Particularmente, foram obtidas um redução específica de NTHi das vias aéreas de indivíduos com níveis altos de anticorpo IgE (soro sanguíneo e secreções) para NTHi, e uma redução dos sintomas de asma com uma conseqüente redução na necessidade de medicamentos para asma.
[0058] Apesar de a invenção ter sido descrita com referência a exemplos específicos, os especialistas observarão que numerosas variações e/ou modificações poderão ser realizadas sem divergir da intenção e escopo da invenção. As presentes configurações serão, portanto, consideradas em todos os aspectos como ilustrativas e não restritivas.
REFERÊNCIAS
[0059] 1. Abe Y, Murphy TF, Sethi S, Faden HS, Dmochowski J,Harauchi Y, Thanavala YM. Lymphocyte proliferative response to P6 of Haemophilus influenzae is associated with relative protection from exacerbations of chronic obstructive pulmonary disease. Am JRespir Crit Care Med 2002; 165: 967-71.
[0060] 2. Clementsen P, Milman N, Kilian M. et al. Endotoxin fromHaemophilus influenzae enhances IgE- mediated and non -immunological histamine release. Allergy 1990; 45: 1017.
[0061] 3. Courcol RJ, Damien JM, Ramon P, C Voisin C, Martin GR.Presence of alveolar macrophages as a criterion for determining the suitability of sputum specimens for bacterial culture. Eur J Clin Microbial 1985; 3: 122- 25.
[0062] 4. Kjaergard LL, Larsen FO, Norn S, Clementsen P, StahlSkov P, Permin H. Basophil-bound IgE and serem IgE directed against Haemophilus influenzae and Streptococcus pneumonias in patients with chronic bronchitis during acute exacerbations. APMIS 1996; 104: 61-67.
[0063] 5. Kyd JM, Taylor D, Cripps AW. Conservation of immuneresponses to proteins isolated by preparative polyacrylamide gelelectrophoresis from the outer membrane of nontypable Haemophilus influenzae. Infect Immun 1994; 62: 5652-58.
[0064] 6. Molier LVM, Timens W, van der Bij W et al. Haemophilusinfluenzae in lung explants of patients with end-stage pulmonary disease. Am JRespir Crit Care Med 1998; 157: 95056.
[0065] 7. Murphy TF, Bartos LC. Purification and analysis withmonoclonal antibodies of P2, the major outer membrane protein of nontypable Haemophilus influenzae. Infect Immun 1988; 56:1084-89.
[0066] 8. Murphy TF, Brauer AL, Schiffmacher AT, Sethi S.Persistent colonization by Haemophilus influenzae in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2004; 170: 266-72.
[0067] 9. Nelson, M.B., M.A. Apicelli., Murphy, T.F., Vankeulen, H.,Spotila, L.D., Rekosh, D. Cloning and sequencing of Haemophilus influenza outer membrane protein P6. Infect. Immun. 1988; 56: 128-134.
[0068] 10. Norn S, Jensen L, Kjaergard LL, Permin H, Stahl Skov P,Espersen F. Bacteria-induced IgE-mediated histamine release: Examination of patients with chronic bronchitis (CB) during acute exacerbations. Agents Actions 41, Special Conference Issue 1994: C22-C23.
[0069] 11. Pauwels R, Verschraegen G, Van Der Straiten M. IgEantibodies to bacteria with bronchial asthma. Allergy 1980; 157: 665-9.
[0070] 12. Rohde G, Gevaert P, Holtappels G et al. Increased IgE-antibodies to Staphylococcus aureus enterotoxins in patients with COPD. Respir Med 2004; 98: 858-64.
[0071] 13. Seggev JS, Sedmak GV, Kurup VP. Isotype-specificantibody responses to acute Mycoplasma pneumoniae infection. Ann Allergy Asthma Immunol 1996; 77: 67-73.
[0072] 14. Sethi S, Murphy TF. Bacterial infection in chronicobstructive pulmonary disease in 2000: a state-of-the-art review. Clin Microbiol Rev 2001; 14: 336-363.
[0073] 15. Shen J, Brackett R, Fischer T, Holder A, Kellogg F,Michael JG. Specific Pseudomonas immunoglobulin E antibodies in sera of patients with cystic fibrosis. Infect Immun 1981; 32: 967-68.
[0074] 16. Simpson, J. L., Scott, R., Boyle, MJ. , Gibson, P.G.Inflammatory subtypes in asthma: Assessment and identification using induced sputum. Respirology 2006; 11, 54- 61.
[0075] 17. Tee RD, Pepys J. Specific IgE serum antibodies tobacterial antigens in allergic lung disease. Clin Allergy 1982; 12: 439-50.
[0076] 18. Welliver RC, Wong DT, Middleton E Jr, Sun M,McCarthy N, Ogra PL. Role of parainfluenza virus- specific IgE in pathogenesis of croup and wheezing subsequent to infection. J Pediatrics 1982; 101: 889-96.