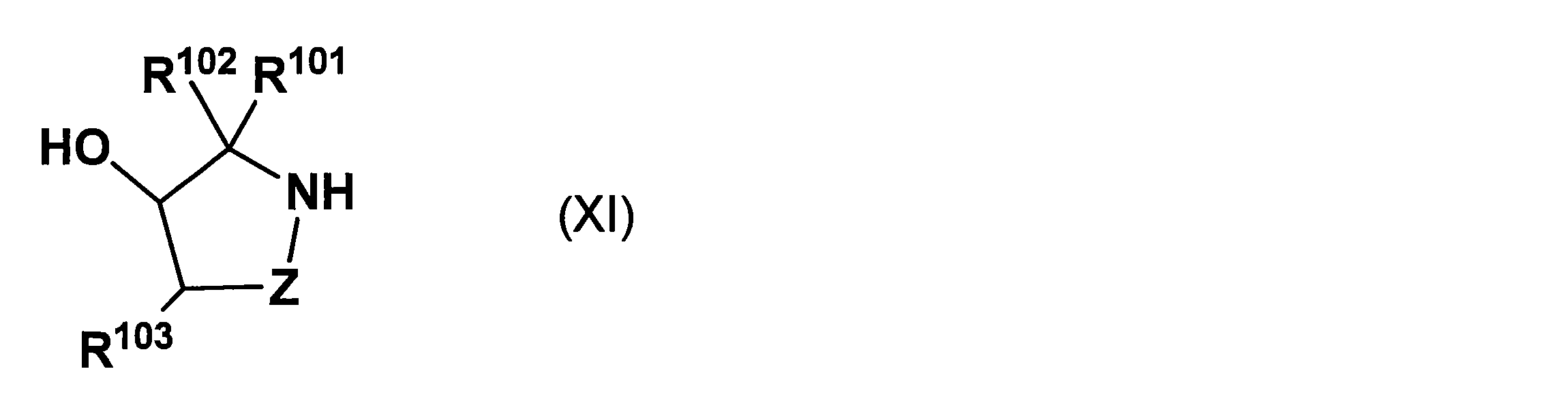WO2012039448A1 - 不斉補助基 - Google Patents
不斉補助基 Download PDFInfo
- Publication number
- WO2012039448A1 WO2012039448A1 PCT/JP2011/071559 JP2011071559W WO2012039448A1 WO 2012039448 A1 WO2012039448 A1 WO 2012039448A1 JP 2011071559 W JP2011071559 W JP 2011071559W WO 2012039448 A1 WO2012039448 A1 WO 2012039448A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- group
- substituent
- general formula
- hydrogen atom
- represented
- Prior art date
Links
- 0 C*(*)=C1N*C(**)[C@]1OC Chemical compound C*(*)=C1N*C(**)[C@]1OC 0.000 description 2
- OSZMNJRKIPAVOS-OAHLLOKOSA-N C([C@@H]1c2ccccc2)NCc2c1cccc2 Chemical compound C([C@@H]1c2ccccc2)NCc2c1cccc2 OSZMNJRKIPAVOS-OAHLLOKOSA-N 0.000 description 1
- OFFVWTYDALUKOC-KFJBMODSSA-N CC1C=CC([C@]2(CNCCC2)O)=CC1 Chemical compound CC1C=CC([C@]2(CNCCC2)O)=CC1 OFFVWTYDALUKOC-KFJBMODSSA-N 0.000 description 1
- BIROJEPKFSFHEY-MRVPVSSYSA-N CO[C@]1(CNCCC1)C=C Chemical compound CO[C@]1(CNCCC1)C=C BIROJEPKFSFHEY-MRVPVSSYSA-N 0.000 description 1
- DATJETPTDKFEEF-RXMQYKEDSA-N N#C[C@@H]1CNCC1 Chemical compound N#C[C@@H]1CNCC1 DATJETPTDKFEEF-RXMQYKEDSA-N 0.000 description 1
- SOIZBCZOBJUNFN-UHFFFAOYSA-N OC(CNC1)(c2ccccc2)c2c1cccc2 Chemical compound OC(CNC1)(c2ccccc2)c2c1cccc2 SOIZBCZOBJUNFN-UHFFFAOYSA-N 0.000 description 1
- KJBQDFYSFZZSMZ-UHFFFAOYSA-N OC1(CNCCC1)c1ccccc1 Chemical compound OC1(CNCCC1)c1ccccc1 KJBQDFYSFZZSMZ-UHFFFAOYSA-N 0.000 description 1
- OKPFEYWKOQFZAB-OAHLLOKOSA-N O[C@@]1(CNC2)c3c2cccc3-c2ccccc12 Chemical compound O[C@@]1(CNC2)c3c2cccc3-c2ccccc12 OKPFEYWKOQFZAB-OAHLLOKOSA-N 0.000 description 1
- SOIZBCZOBJUNFN-OAHLLOKOSA-N O[C@](CNC1)(c2ccccc2)c2c1cccc2 Chemical compound O[C@](CNC1)(c2ccccc2)c2c1cccc2 SOIZBCZOBJUNFN-OAHLLOKOSA-N 0.000 description 1
- OKPFEYWKOQFZAB-HNNXBMFYSA-N O[C@]1(CNC2)c3c2cccc3-c2c1cccc2 Chemical compound O[C@]1(CNC2)c3c2cccc3-c2c1cccc2 OKPFEYWKOQFZAB-HNNXBMFYSA-N 0.000 description 1
- QJCKXDFFCNBXOG-QVDQXJPCSA-N O[C@]1(CNCC1)C1C=CC=CC1 Chemical compound O[C@]1(CNCC1)C1C=CC=CC1 QJCKXDFFCNBXOG-QVDQXJPCSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D207/00—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D207/02—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D207/04—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D207/10—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D207/12—Oxygen or sulfur atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D207/00—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D207/02—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D207/04—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D207/10—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D207/16—Carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D209/00—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D209/56—Ring systems containing three or more rings
- C07D209/58—[b]- or [c]-condensed
- C07D209/62—Naphtho [c] pyrroles; Hydrogenated naphtho [c] pyrroles
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D211/00—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings
- C07D211/04—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D211/06—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D211/36—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D211/40—Oxygen atoms
- C07D211/42—Oxygen atoms attached in position 3 or 5
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D211/00—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings
- C07D211/04—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D211/06—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D211/36—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D211/40—Oxygen atoms
- C07D211/44—Oxygen atoms attached in position 4
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D211/00—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings
- C07D211/04—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D211/06—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D211/36—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D211/60—Carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals
- C07D211/62—Carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals attached in position 4
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D217/00—Heterocyclic compounds containing isoquinoline or hydrogenated isoquinoline ring systems
- C07D217/22—Heterocyclic compounds containing isoquinoline or hydrogenated isoquinoline ring systems with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to carbon atoms of the nitrogen-containing ring
- C07D217/24—Oxygen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D221/00—Heterocyclic compounds containing six-membered rings having one nitrogen atom as the only ring hetero atom, not provided for by groups C07D211/00 - C07D219/00
- C07D221/02—Heterocyclic compounds containing six-membered rings having one nitrogen atom as the only ring hetero atom, not provided for by groups C07D211/00 - C07D219/00 condensed with carbocyclic rings or ring systems
- C07D221/04—Ortho- or peri-condensed ring systems
- C07D221/06—Ring systems of three rings
- C07D221/10—Aza-phenanthrenes
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D221/00—Heterocyclic compounds containing six-membered rings having one nitrogen atom as the only ring hetero atom, not provided for by groups C07D211/00 - C07D219/00
- C07D221/02—Heterocyclic compounds containing six-membered rings having one nitrogen atom as the only ring hetero atom, not provided for by groups C07D211/00 - C07D219/00 condensed with carbocyclic rings or ring systems
- C07D221/04—Ortho- or peri-condensed ring systems
- C07D221/18—Ring systems of four or more rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H1/00—Processes for the preparation of sugar derivatives
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H19/00—Compounds containing a hetero ring sharing one ring hetero atom with a saccharide radical; Nucleosides; Mononucleotides; Anhydro-derivatives thereof
- C07H19/02—Compounds containing a hetero ring sharing one ring hetero atom with a saccharide radical; Nucleosides; Mononucleotides; Anhydro-derivatives thereof sharing nitrogen
- C07H19/04—Heterocyclic radicals containing only nitrogen atoms as ring hetero atom
- C07H19/06—Pyrimidine radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H19/00—Compounds containing a hetero ring sharing one ring hetero atom with a saccharide radical; Nucleosides; Mononucleotides; Anhydro-derivatives thereof
- C07H19/02—Compounds containing a hetero ring sharing one ring hetero atom with a saccharide radical; Nucleosides; Mononucleotides; Anhydro-derivatives thereof sharing nitrogen
- C07H19/04—Heterocyclic radicals containing only nitrogen atoms as ring hetero atom
- C07H19/16—Purine radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H21/00—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H21/00—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids
- C07H21/02—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids with ribosyl as saccharide radical
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H21/00—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids
- C07H21/04—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids with deoxyribosyl as saccharide radical
Definitions
- the present invention relates to a novel compound that can act as an auxiliary group for asymmetric induction in the production of a phosphorus atom-modified nucleic acid derivative.
- Nucleic acid derivatives such as oligonucleotides are useful for various uses such as treatment and prevention of diseases, diagnosis, and nanomaterials.
- nucleolytic enzymes for example, “Frontiers of Nucleic Acid Drugs”, Chapter 1, Development of Nucleic Acid Drugs, Chemical Creation of Phosphorus Atom-Modified Nucleic Acids, pp .67-75, written by Takeshi Wada, CMC Publishing Co., Ltd., published February 2009).
- nucleic acid derivatives that has stability against degradation by nucleolytic enzymes and retains affinity for complementary DNA / RNA sequences derived from in vivo or in vitro by controlling the stereotype at the phosphorus atom. Offer is desired.
- nucleic acid derivatives in which phosphorus atoms are modified with sulfur atoms or boron atoms, and several methods for controlling the stereostructure of phosphorus atoms in the production of such derivatives are provided.
- a compound represented by the general formula (3) is used as an activator, and via a compound represented by the general formula (13) as a reaction intermediate, A method for producing a highly regular phosphorous atom-modified nucleic acid derivative (oxazaphosphoridine method) is disclosed.
- an optically active nucleoside 3′-phosphoramidite represented by the general formula (1) is produced, and this compound is used as a starting material (monomer) together with an activator represented by the general formula (3).
- this method produces a compound represented by the general formula (13) by reacting a nucleoside and appropriately protecting it and then reacting with an electrophile to produce a compound represented by the general formula (13).
- it is unstable and difficult to apply industrially.
- asymmetric auxiliary group for asymmetric induction (hereinafter sometimes referred to as “asymmetric auxiliary group” in the present specification) in the method for producing a phosphorus atom-modified nucleic acid derivative.
- a compound represented by Formula 3 is reacted with a phosphorus atom of a nucleic acid derivative, and in Formula D4, D is Formula A (the residue of the compound of Formula 3), or represented by Formula 5
- a method for producing a phosphorus atom-modified nucleic acid derivative with high asymmetric yield by producing a compound and then removing the asymmetric auxiliary group is disclosed. The outline of this method is shown in the following scheme.
- This method using an asymmetric auxiliary group can use an achiral H-phosphonate monoester that is chemically stable and can be synthesized in large quantities as a starting material, and is isolated by forming an optically active monomer in the reaction system. This is industrially advantageous over the method described in JP-A-2005-89441 in that the condensation reaction can be performed without purification.
- the compound used for the introduction of the asymmetric auxiliary group in the above method is a compound having the following structure (a compound represented by Formula 3 in the above publication).
- W 1 and W 2 are each independently -NG 5- , -O-, or -S-, and G 1 , G 2 , G 3 , G 4 , and G 5 are each independently hydrogen Represents an atom, an alkyl group, an aralkyl group, a cycloalkyl group, a cycloalkylalkyl group, a heterocyclic group, a heteroaryl group, or an aryl group, or of G 1 , G 2 , G 3 , G 4 , and G 5 Together to form a G 6 saturated, partially unsaturated or unsaturated monocyclic, polycyclic, condensed or non-condensed hydrocarbon ring group or hetero atom containing Represents a cyclic group (however, no more than 4 of G 1 , G 2 , G 3 , G 4 ,
- An object of the present invention is to provide means for efficiently producing a phosphorus atom-modified nucleic acid derivative having high stereoregularity. More specifically, an object of the present invention is to provide an asymmetric auxiliary group useful for efficiently producing a phosphorus atom-modified nucleic acid derivative having high stereoregularity, and a compound for introducing the asymmetric auxiliary group. It is to provide.
- the inventors of the present invention conducted intensive research to solve the above-mentioned problems.
- the asymmetric auxiliary group introduced using the four types of compounds disclosed in International Publication WO 2010/064146 is chemically bonded to the phosphorus atom.
- the asymmetric auxiliary group introduced using the compounds represented by Formula Q and Formula R among the above four compounds is subjected to strong acidic conditions such as 1% trifluoroacetic acid (TFA) /
- strong acidic conditions such as 1% trifluoroacetic acid (TFA) /
- TFA trifluoroacetic acid
- this acidic condition is a condition in which elimination (deprination) of an adenine base whose base moiety is protected with an acyl-type protecting group (generally an acyl-type protecting group is introduced into the adenine base) occurs.
- an asymmetric auxiliary group using a compound represented by the following general formula (I) that is not specifically disclosed in International Publication WO 2010/064146.
- removal of the asymmetric auxiliary group is performed under milder acidic conditions, for example, by removing the 5'-end dimethoxytrityl (DMTr) group in the nucleic acid synthesis cycle, thereby extending the chain length. It can be performed by the S N 1 mechanism under the conditions of 3% dichloroacetic acid (DCA) / dichloromethane used in the process, and a long-chain nucleic acid derivative can be produced very efficiently by using this asymmetric auxiliary group. I found.
- DCA dichloroacetic acid
- the asymmetric auxiliary group introduced using the compounds represented by Formula O and Formula ⁇ P is a basic condition such as ammonia. Treatment with water at 55 ° C. for 12 hours can be eliminated as an aziridine compound.
- the removal of the asymmetric protecting group by this basic condition does not cause a problem when synthesizing relatively short DNA strands.
- the synthesis of long DNA or chemically unstable RNA strands causes chain degradation.
- Bs represents a nucleobase
- Ph represents a phenyl group
- Nu represents a nucleophile
- DMTr represents a dimethoxytrityl group
- the present inventors have introduced an asymmetric auxiliary group using a compound represented by the following general formula (XI) that is not specifically disclosed in International Publication WO 2010/064146.
- the reaction proceeds with a high asymmetric yield, and the asymmetric auxiliary group can be removed by a ⁇ -elimination mechanism under milder basic conditions, and a long-chain nucleic acid derivative can be obtained by using this asymmetric auxiliary group. It has been found that it can be produced very efficiently.
- the present invention has been completed based on these findings.
- R 1 and R 2 are each independently a hydrogen atom, an alkyl group which may have a substituent, an alkenyl group which may have a substituent, or an alkynyl which may have a substituent.
- R 3 has a substituent An aryl group which may be substituted or an alkyl group which may have a substituent;
- R 4 and R 5 each independently have a hydrogen atom, an alkyl group which may have a substituent, or a substituent;
- Y is -Y 1 -Y 2 - indicates, Y 1 is -C (R 6) (R 7 ) - (R 6 ⁇ R 7 each independently represent a hydrogen atom, an optionally substituted alkyl group, which may have a substituent alken
- a good alkenyl group, an alkynyl group which may have a substituent, an alkoxy group which may have a substituent Represents an aralkyl group which may have a substituent, or an aryl group which may have a substituent), or a salt thereof.
- R 1 and R 2 are a hydrogen atom or an alkyl group
- R 3 is a phenyl group
- R 4 and R 5 are a hydrogen atom or an alkyl group
- Y is —C ( R 6) (R 7) - (R 6 and R 7 are each independently a hydrogen atom or an alkyl group, when R 7 represents an alkyl group is R 7 combine with the phenyl group represented by R 3 ring
- the above compound or a salt thereof which is an o-phenylene group or a naphthalene-1,2-diyl group.
- R 1 , R 2 , R 3 , R 4 , R 5 and Y are as defined above;
- R 11 represents a hydrogen atom or a hydroxyl-protecting group;
- R 12 , R 13 and R 14 Each independently represents a hydrogen atom, an alkoxy group, a fluorine atom, or a protected hydroxyl group;
- R 15 represents a hydrogen atom, a hydroxyl protecting group, or a solid phase carrier bonded via a linker as necessary;
- n is an integer of 0 or 1 or more).
- R 1 , R 2 , R 3 , R 4 , R 5 and Y are as defined above;
- R 21 represents a hydroxyl-protecting group;
- R 22 represents a hydrogen atom, an alkoxy group, a fluorine atom, Or a protected hydroxyl group;
- Bs represents a nucleobase).
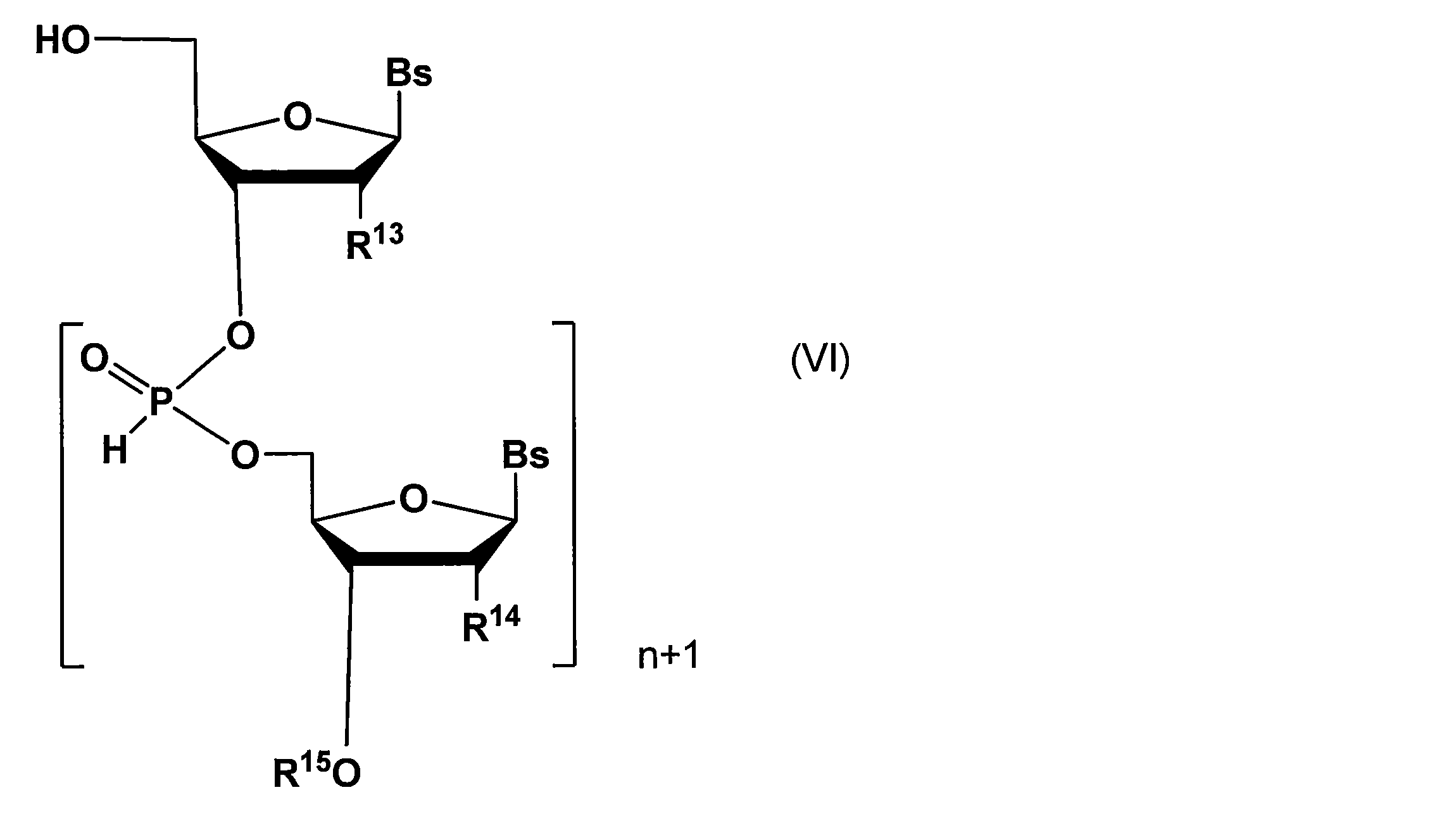
- a method for producing a nucleic acid derivative comprising the following steps: (a) The following general formula (V): (Wherein R 13 , R 14 , R 15 , and n are as defined above) And a nucleotide derivative represented by the above general formula (IV) (wherein R 1 , R 2 , R 3 , R 4 , R 5 , and Y are as defined above; R 21 is R 22 represents a protective group for hydroxyl group; R 22 represents a hydrogen atom, an alkoxy group, a fluorine atom, or a protected hydroxyl group; Bs represents a nucleobase, and is reacted with the above general formula (III) (where R 1 , R 2 , R 3 , R 4 , R 5 , Y, and n are as defined above; R 11 represents a hydroxyl-protecting group; R 12 , R 13 , and R 14 are each independently a hydrogen atom , An alkoxy
- 3% dichloroacetic acid (DCA) / dichloromethane can be used as the acidic condition for removing the asymmetric auxiliary group represented by the general formula (II) in the step (c).
- the modification of the phosphorus atom in the step (d) includes a group represented by X (X is an alkylthio group which may have a substituent, an alkenylthio group which may have a substituent, a substituent.
- alkynylthio which may have a substituent arylthio group, a thiol group, an alkoxy group which may have a substituent, -BH 3, -Se -, have a substituent
- a good alkenyl group, an alkynyl group which may have a substituent, or an ant which may have a substituent The a group) represented by indicating the Le group) can be introduced on the phosphorus atom.
- R 101 and R 102 each independently represents a hydrogen atom, an alkyl group which may have a substituent, an alkenyl group which may have a substituent, or an alkynyl which may have a substituent.
- R 103 represents a cyano group, a halogen atom, a substituent
- Z represents —Z 1 —Z 2 —, and Z 1 represents —C (R 104 ) (R 105 ) — (R 104 and R 105 each independently represents a hydrogen atom or an alkyl which may have a substituent.
- Z 2 is a single bond Or -C (R 106 ) (R 107 )-(R 106 and R 107 are each independently a hydrogen atom, an optionally substituted alkyl group, an optionally substituted alkenyl group, or a substituted group.
- An alkynyl group which may have a group, an alkoxy group which may have a substituent, an aralkyl group which may have a substituent, or an aryl group which may have a substituent) Or a salt thereof is provided.
- R 101 and R 102 are a hydrogen atom or an alkyl group
- R 103 is a cyano group
- Z is —C (R 104 ) (R 105 ) —
- R 104 and R 105 Is a hydrogen atom or an alkyl group), or a salt thereof
- R 101 and R 102 are a hydrogen atom
- R 103 is a cyano group
- Z is- There is provided the above compound or a salt thereof which is C (R 104 ) (R 105 ) — (where R 104 and R 105 are hydrogen atoms).
- R 101 , R 102 , R 103 , and Z are as defined above;
- R 111 represents a hydrogen atom or a hydroxyl-protecting group;
- R 112 and R 114 are each independently a hydrogen atom, an alkoxy group, A fluorine atom or a protected hydroxyl group;
- R 113 represents a hydrogen atom, a hydroxyl protecting group, or a solid phase carrier bonded via a linker as necessary;
- Bs represents a nucleobase;
- m represents 1 or more A nucleic acid derivative represented by the following formula:
- R 101 , R 102 , R 103 , and Z are as defined above;
- R 121 represents a hydroxyl-protecting group;
- R 122 represents a hydrogen atom, an alkoxy group, a fluorine atom, or a protected hydroxyl group.
- the nucleotide derivative is provided as follows: Bs represents nucleobase).
- a method for producing a nucleic acid derivative comprising the following steps: (a) The following general formula (XIII '): Wherein R 101 , R 102 , R 103 , and Z are as defined above, and R 112 and R 114 each independently represent a hydrogen atom, an alkoxy group, a fluorine atom, or a protected hydroxyl group; R 113 Indicates a solid phase carrier bound via a linker as necessary; p indicates 0 or an integer of 1 or more; Bs indicates a nucleobase) And a nucleotide derivative represented by the above general formula (XIV) (wherein R 121 represents a hydroxyl-protecting group; R 122 represents a hydrogen atom, an alkoxy group, a fluorine atom, or a protected hydroxyl group) after reacting the shown), using an electrophilic agent X (X is a thiol group, -BH 3, -Se - introducing shown), by
- alkyl group a linear, branched, cyclic, or a combination thereof can be used.
- a C 1 to C 15 alkyl group is preferable, and a C 1 to C 10 alkyl group is preferable. More preferred are C 1 -C 6 alkyl groups.
- the same applies to the alkyl part of other substituents having an alkyl part for example, an alkoxy group, a halogenated alkyl group, etc.).
- alkenyl group an alkenyl group composed of linear, branched, cyclic, or a combination thereof can be used.
- a C 2 to C 15 alkenyl group is preferable, and a C 2 to C 10 alkenyl group is More preferred is a C 2 -C 6 alkenyl group.
- the number of double bonds contained in the alkenyl group is not particularly limited, and is, for example, 1 to several, preferably about 1 or 2.
- the cyclic alkenyl group includes a partially saturated carbocyclic group in which any number of double bonds excluding at least one double bond of aryl groups are replaced with a single bond, or a heteroaryl group.
- a partially saturated heterocyclic group in which any number of double bonds excluding at least one double bond among the heavy bonds is replaced with a single bond is also included.
- alkynyl group a linear or branched alkynyl group can be used.
- a C 2 to C 15 alkynyl group is preferable, a C 2 to C 10 alkynyl group is more preferable, and a C 2 to C 6 group is preferable. More preferred is an alkynyl group.
- the number of triple bonds contained in the alkynyl group is not particularly limited, but is, for example, 1 to several, preferably about 1 or 2.
- the alkynyl group may contain 1 to several double bonds.
- the alkynyl group may be combined with a cyclic alkyl group or a cyclic alkenyl group.
- ethynyl group prop-1-in-1-yl, prop-2-yn-1-yl, but-1-in-1-yl group, but-3-in-1-yl group, 1-methylprop -2-In-1-yl, penta-1-in-1-yl group, penta-4-in-1-yl group, hexa-1-in-1-yl group, hexa-5-in-1- Yl group, hepta-1-in-1-yl group, hepta-6-in-1-yl group, octa-1-in-1-yl group, octa-7-in-1-yl group, nona-1 -In-1-yl group, Nona-8-in-1-yl group, Dec-1-in-1-yl group, Deca-9-in-1-yl group, Undec-1-in-1-yl group Group, undec-10-in-1-yl group, dodec-1-in-1-yl group, dodec-11-in-1-yl
- aryl group a monocyclic or condensed polycyclic aromatic hydrocarbon group can be used, and examples thereof include a phenyl group, a 1-naphthyl group, a 2-naphthyl group, an anthranyl group, and a phenanthryl group.
- a phenyl group is preferred.
- aryl group used in the present specification includes heteroaryl groups.
- the heteroaryl group a monocyclic or condensed polycyclic aromatic heterocyclic group can be used.
- the number of ring-constituting heteroatoms is not particularly limited, but is about 1 to several, preferably about 1 to 5. When two or more ring heteroatoms are contained, they may be the same or different. Examples of the hetero atom include, but are not limited to, an oxygen atom, a nitrogen atom, or a sulfur atom.
- Examples of the monocyclic heteroaryl group include 2-furyl group, 3-furyl group, 2-thienyl group, 3-thienyl group, 1-pyrrolyl group, 2-pyrrolyl group, 3-pyrrolyl group, 2-oxazolyl group.
- Examples of the condensed polycyclic heteroaryl group include 2-benzofuranyl group, 3-benzofuranyl group, 4-benzofuranyl group, 5-benzofuranyl group, 6-benzofuranyl group, 7-benzofuranyl group, 1-isobenzofuranyl group, 4-isobenzofuranyl group, 5-isobenzofuranyl group, 2-benzo [b] thienyl group, 3-benzo [b] thienyl group, 4-benzo [b] thienyl group, 5-benzo [b] thienyl Group, 6-benzo [b] thienyl group, 7-benzo [b] thienyl group, 1-benzo [c] thienyl group, 4-benzo [c] thienyl group, 5-benzo [c] thienyl group, 1-indolyl Group, 1-indolyl group, 2-indolyl group, 3-indolyl group, 4-indolyl group, 5-ind
- alkoxy group examples include a methoxy group, an ethoxy group, an n-propoxy group, an isopropoxy group, an n-butoxy group, an isobutoxy group, a sec-butoxy group, a tert-butoxy group, an n-pentyloxy group, and an isopentyloxy group.
- alkoxy group used in the present specification includes an alkenyloxy group and an alkynyloxy group in addition to an alkyloxy group.
- alkenyl part of the alkenyloxy group and the alkynyl part in the alkynyloxy group the alkenyl group and alkynyl group described above can be used.
- Aralkyl group means a group in which one or two or more of the above aryl groups are substituted on the above alkyl group, and when two or more aryl groups are substituted, they may be the same or different .
- benzyl group pyridylmethyl group, 1-naphthylmethyl group, 2-naphthylmethyl group, anthracenylmethyl group, phenanthrenylmethyl group, acenaphthylenylmethyl group, diphenylmethyl group, 1-phenethyl group, Examples thereof include, but are not limited to, a 2-phenethyl group and a 1- (1-naphthyl) ethyl group.
- halogen atom examples include a fluorine atom, a chlorine atom, a bromine atom, and an iodine atom.
- alkyl part, alkenyl part, alkynyl part, and aryl part of the alkylthio group, alkenylthio group, alkynylthio group, and arylthio group the alkyl group, alkenyl group, alkynyl group, and aryl group described above can be used. .
- the halogenated alkyl group means a group in which one or more halogen atoms are substituted on the above alkyl group, and when two or more halogen atoms are substituted, they may be the same or different. Good.
- fluoromethyl group, difluoromethyl group, trifluoromethyl group chloromethyl group
- substituents when “may have a substituent” for a certain functional group, one or more substituents are present at chemically possible positions on the functional group. Means there is.
- the kind of substituents present in the functional group, the number of substituents, and the substitution position are not particularly limited, and when two or more substituents are present, they may be the same or different.
- Examples of the substituent present in the functional group include a halogen atom, an oxo group, a thioxo group, a nitro group, a nitroso group, a cyano group, an isocyano group, a cyanato group, a thiocyanato group, an isocyanato group, an isothiocyanato group, a hydroxy group, and a sulfanyl group.
- substituents may be further substituted with one or more other substituents.
- substituents include, for example, C 1 -C 6 halogenated alkyl groups (eg, chloromethyl group, dichloromethyl group, trichloromethyl group, difluoromethyl group, trifluoromethyl group, 2,2,2-trifluoro group).
- the first embodiment of the present invention is an embodiment in which the compound represented by the general formula (I) is used as an acid-removable asymmetric auxiliary group.
- R 1 and R 2 each independently have a hydrogen atom, an alkyl group which may have a substituent, an alkenyl group which may have a substituent, or a substituent.
- R 1 and R 2 each independently represent a hydrogen atom or an alkyl group, and it is more preferable that both R 1 and R 2 are hydrogen atoms.
- R 3 represents an aryl group which may have a substituent or an alkyl group which may have a substituent, preferably an aryl group, and more preferably a phenyl group.
- R 4 and R 5 are each independently a hydrogen atom, an alkyl group which may have a substituent, an alkenyl group which may have a substituent, an alkynyl group which may have a substituent, or a substituent.
- An alkoxy group which may have a substituent, an aralkyl group which may have a substituent, or an aryl group which may have a substituent is shown.
- R 4 and R 5 each independently represent a hydrogen atom or an alkyl group, and it is more preferable that both R 4 and R 5 are hydrogen atoms.
- Y represents —Y 1 —Y 2 —
- Y 1 represents —C (R 6 ) (R 7 ) — or an o-aryldiyl group which may have a substituent
- R 6 and R 7 are each independently a hydrogen atom, an alkyl group which may have a substituent, an alkenyl group which may have a substituent, an alkynyl group which may have a substituent, or a substituent.
- R 6 and R 7 each independently represent a hydrogen atom or an alkyl group
- the o-aryldiyl group represented by Y include, but are not limited to, an o-phenylene group or a naphthalene-1,2-diyl group.
- the aryl ring of the aryldiyl group may be bonded to the aryl group represented by R 3 to form a ring.
- Y 2 represents a single bond or —C (R 8 ) (R 9 ) —.
- R 8 and R 9 are each independently a hydrogen atom, an alkyl group which may have a substituent, an alkenyl group which may have a substituent, an alkynyl group which may have a substituent, or a substituent.
- An alkoxy group which may have a substituent, an aralkyl group which may have a substituent, or an aryl group which may have a substituent is shown.
- Y 2 is preferably a single bond. In this case, Y represents —C (R 6 ) (R 7 ) — or an o-aryldiyl group which may have a substituent.
- Preferred compounds included in the general formula (I) are exemplified below, but are not limited thereto.
- More preferable compounds include the following compounds, but are not limited thereto.
- the compound represented by the general formula (I) may form an acid addition salt, but any acid addition salt is included in the scope of the present invention.
- mineral acid salts such as hydrochloride, sulfate and nitrate, organic acid salts such as acetate, p-toluenesulfonate, methanesulfonate, maleate and oxalate can be used. It is not limited to.
- any stereoisomer in a pure form of the compound represented by the general formula (I), any mixture of stereoisomers, racemate, diastereomer mixture and the like are also included in the scope of the present invention. It is preferred to use an optically pure form of the compound.
- any hydrate or solvate of the compound represented by the general formula (I) or a salt thereof is also included in the scope of the present invention. The same applies to the nucleic acid derivative represented by the general formula (II).
- the group represented by the above general formula (II) is introduced onto the phosphorus atom of the nucleic acid derivative as an asymmetric auxiliary group.
- examples of the nucleic acid derivative include phosphorothioate, boranophosphate, alkyl phosphonate, alkenyl phosphonate, alkynyl phosphonate, aryl phosphonate, phosphoroselenoate, or phosphoramidate. It is not limited to these.
- Preferred examples of the nucleic acid derivative to which the asymmetric auxiliary group represented by the general formula (II) is bonded include, for example, a nucleic acid derivative represented by the general formula (III).
- examples of the hydroxyl-protecting group include a dimethoxytrityl group, an acetyl group, a benzoyl group, a methoxybenzoyl group, a trifluoroacetyl group, and a trimethylsilyl group, but are not limited thereto. There is no.
- protecting group of the hydroxyl group reference can be made to, for example, Green, et al., Protective Groups, Organic, Synthesis, 3rd Edition, 1999, John, Wiley, Sons, Inc.
- a natural or non-natural nucleobase which may have a protecting group can be used, for example, a pyrimidine base such as cytosine, thymine or uracil, or a purine base such as adenine or guanine can be used.
- a pyrimidine base such as cytosine, thymine or uracil
- a purine base such as adenine or guanine
- the base include 5-methylcytosine, 5-hydroxymethylcytosine, 5-fluorouracil, 5-methyluracil, 2-thiouracil, 6-azauracil, 5-hydroxyuracil, 2,6-diaminopurine, 8-azaadenine.
- a modified base such as 8-azaguanine or isoguanine may be used, but is not limited thereto.
- the linker means a generally linear divalent group that intervenes between the solid phase carrier and the nucleic acid derivative.
- the linker may be a linear group that may have a substituent.
- alkylene groups branched chain alkylene groups, peptide linkers, and the like can be used.
- a 3-aminopropyl group, a succinyl group, a 2,2′-diethanolsulfonyl group, a long chain alkylamino (LCAA) group and the like can be used, but are not limited thereto.
- the type of the solid phase carrier is not particularly limited, but, for example, fixed pore glass (CPG), oxalylated-constant glass (eg, Nucleic® Acids® Research, 19, 1527, 1991), TentaGel support-aminopolyethylene glycol derivatization support (Tetrahedron Letters, 34, 3373, 1993), Poros-polystyrene / divinylbenzene copolymer, and the like, but are not limited thereto.
- CPG fixed pore glass
- oxalylated-constant glass eg, Nucleic® Acids® Research, 19, 1527, 1991
- TentaGel support-aminopolyethylene glycol derivatization support Tetrahedron Letters, 34, 3373, 1993
- Poros-polystyrene / divinylbenzene copolymer and the like, but are not limited thereto.
- the method for producing a nucleic acid derivative of the present invention using the above asymmetric auxiliary group typically comprises the following steps: (a) a nucleic acid derivative represented by the general formula (V) and a general formula (IV).
- the compound of the general formula (IV) used in the above-described method is obtained by activating the achiral mononucleotide monomer as necessary, for example, according to the method described in International Publication WO 2010/064146. It can manufacture by making the compound represented react.
- the compound represented by the general formula (IV) is a tricyclic active intermediate and is obtained from a reaction intermediate produced from a compound represented by Formula®Q and Formula®R disclosed in International Publication WO 2010/064146. Have high reactivity.
- 3% dichloroacetic acid (DCA) / dichloromethane can be used as acidic conditions for removing the asymmetric auxiliary group represented by the general formula (II) in step (b).
- This acidic condition is a condition for removing an asymmetric auxiliary group (1% trifluoroacetic acid (TFA) / dichloromethane introduced using the compound represented by Formula Q and FormulaFormR disclosed in International Publication WO 2010/064146. ) And a milder acidic condition than that of an adenine base in which the base moiety is protected with an acyl-type protecting group.
- reaction mechanism by which the asymmetric auxiliary group represented by the general formula (II) is eliminated under acidic conditions is presumed to be the following S N 1 (E1 reaction) mechanism.
- the following reaction scheme shows one preferred embodiment of the asymmetric auxiliary group represented by the general formula (II).
- the second embodiment of the present invention is an embodiment in which the compound represented by the general formula (XI) is used as a base-elimination type asymmetric auxiliary group.
- R 101 and R 102 each independently have a hydrogen atom, an alkyl group that may have a substituent, an alkenyl group that may have a substituent, or a substituent.
- R 101 and R 102 are preferably hydrogen atoms or alkyl groups, and both R 101 and R 102 are more preferably hydrogen atoms.
- R 103 represents a cyano group, a halogen atom, a halogenated alkyl group which may have a substituent, a halogenated alkanoyl group which may have a substituent, a sulfonyl group, or a halogen which may have a substituent. Represents an alkylsulfonyl group or a nitro group. R 103 is preferably a cyano group.
- Z represents -Z 1 -Z 2-
- Z 1 represents -C (R 104 ) (R 105 )-.
- R 104 and R 105 are each independently a hydrogen atom, an alkyl group which may have a substituent, an alkenyl group which may have a substituent, an alkynyl group which may have a substituent, or a substituent.
- An alkoxy group which may have a substituent, an aralkyl group which may have a substituent, or an aryl group which may have a substituent is shown.
- R 104 and R 105 are preferably hydrogen atoms or alkyl groups, and both R 104 and R 105 are more preferably hydrogen atoms.
- Z 2 represents a single bond or —C (R 106 ) (R 107 ) —.
- R 106 and R 107 are each independently a hydrogen atom, an alkyl group which may have a substituent, an alkenyl group which may have a substituent, an alkynyl group which may have a substituent, or a substituent.
- An alkoxy group which may have a substituent, an aralkyl group which may have a substituent, or an aryl group which may have a substituent is shown.
- Z 2 is preferably a single bond or —C (R 106 ) (R 107 ) — (R 106 and R 107 represent a hydrogen atom), and more preferably Z 2 is a single bond.
- R 101 and R 102 are a hydrogen atom or an alkyl group
- R 103 is a cyano group
- Z is —C (R 104 ) (R 105 ) — or —C (R 104 ) ( R 105 ) —CH 2 — (where R 104 and R 105 are a hydrogen atom or an alkyl group) is preferred
- R 101 and R 102 are a hydrogen atom
- R 103 is a cyano group
- Z is — More preferred is a compound that is C (R 104 ) (R 105 ) — (where R 104 and R 105 are hydrogen atoms).
- More preferable compounds include the following compounds, but are not limited thereto.
- the compound represented by the general formula (XI) may form an acid addition salt, but any acid addition salt is included in the scope of the present invention.
- mineral acid salts such as hydrochloride, sulfate and nitrate, organic acid salts such as acetate, p-toluenesulfonate, methanesulfonate, maleate and oxalate can be used. It is not limited to.
- any stereoisomer in a pure form of the compound represented by the general formula (XI), any mixture of stereoisomers, racemate, diastereomer mixture, and the like are also included in the scope of the present invention. It is preferred to use an optically pure form of the compound.
- any hydrate or solvate of the compound represented by the general formula (XI) or a salt thereof is also included in the scope of the present invention. The same applies to the nucleic acid derivative represented by the general formula (XII).
- the group represented by the general formula (XII) is introduced onto the phosphorus atom of the nucleic acid derivative as an asymmetric auxiliary group.
- examples of the nucleic acid derivative include, but are not limited to, phosphorothioate, boranophosphate, phosphoroselenoate, and the like.
- the group represented by the general formula (XII) is introduced onto the phosphorus atom of the nucleic acid derivative as an asymmetric auxiliary group.
- examples of the nucleic acid derivative include, but are not limited to, phosphorothioate, boranophosphate, phosphoroselenoate, and the like.
- nucleic acid derivative to which the asymmetric auxiliary group represented by the general formula (XII) is bonded include, for example, a nucleic acid derivative represented by the general formula (XIII).
- the hydroxyl protecting group, nucleobase, linker, and solid phase carrier are the same as those described in the general formula (III).
- the method for producing a nucleic acid derivative of the present invention using the above asymmetric auxiliary group typically comprises the following steps: (a) a nucleic acid derivative represented by the general formula (XIII ′) and a general formula (XIV) After reacting with the nucleotide derivative represented (wherein R 121 represents a hydroxyl-protecting group; R 122 represents a hydrogen atom, an alkoxy group, a fluorine atom, or a protected hydroxyl group), an electrophile is used.
- a nucleic acid derivative represented by the general formula (XV) is produced by introducing X and removing the protecting group of the hydroxyl group represented by R 121 , and the above reaction is repeated as necessary to represent the nucleic acid derivative represented by the general formula (XV).
- This method can be performed in the same manner as the cycle indicated by Route A in the scheme described in the background art of the reaction process of International Publication WO 2010/064146.
- the compound of the general formula (XIV) used in the above-described method is obtained by activating the achiral mononucleotide monomer as necessary, for example, according to the method described in International Publication WO 2010/064146. It can manufacture by making the compound represented react.
- the compound represented by the general formula (XIV) is a tricyclic active intermediate, and is obtained from a reaction intermediate produced from a compound represented by Formula®O and Formula®P disclosed in International Publication WO ⁇ 2010/064146. Have high reactivity.
- basic conditions for removing the asymmetric auxiliary group represented by the general formula (II) in step (b) include 10% DBU / acetonitrile (room temperature 15 minutes), 10% piperidine / acetonitrile (room temperature 15 minutes), or aqueous ammonia (room temperature 12 hours), etc.
- the conditions are asymmetry introduced using the compounds represented by Formula®O and Formula®P disclosed in International Publication WO 2010/064146.
- the basic conditions are milder than the basic conditions for removing the auxiliary groups (conditions in which ammonia water is used for 12 hours at 55 ° C. for elimination as an aziridine compound). Since the asymmetric auxiliary group represented by the general formula (II) can be removed by the ⁇ elimination mechanism shown below under such a relaxed condition, a long-chain nucleic acid derivative can be produced very efficiently. There are features.
- Example 1 (a) 3-Cyano-3-phenylisobenzofuran-1 (3H) -one (1).
- N-Boc-3-piperidone (1 g, 5 mmol) azeotropically dried with dehydrated toluene was dissolved in dehydrated tetrahydrofuran (10 mL).
- 1.08M phenylmagnesium bromide in tetrahydrofuran (6.9 mL, 7.5 mmol) was slowly added at ⁇ 30 ° C. and the reaction was stirred at ⁇ 30 ° C. for 30 min. The reaction was gradually warmed to room temperature and stirred for an additional 12 hours.
- Example 2 (a) Basic procedure for solid-phase synthesis of X-phosphonate DNA using an acid-removable asymmetric auxiliary group (general formula I) 5'-O- (DMTr) nucleoside (0.5 ⁇ mol) bound to HCP or CPG via a succinyl linker or oxalyl linker is treated with a 3% dichloroacetic acid / dichloromethane solution to remove the 5'-DMTr group and dichloromethane And dry under vacuum.
- the chain extension reaction is achieved by repeating the following steps (a) and (b).
- (a) The condensation reaction (5 minutes) is carried out in a corresponding monomer solution activated in advance in an argon atmosphere.
- Preparation of the pre-activated (R P )-and (S P ) -monomer solutions is carried out by the following method.
- 8-diazabicyclo [5.4.0] undec-7-enium 5'-O- (DMTr) -2'-deoxynucleoside-3'-ylphosphonate (25 ⁇ mol) was azeotropically dried with dehydrated toluene and dehydrated acetonitrile-N- Dissolve in cyanomethylpyrrolidine solution (volume ratio 9: 1).
- Add triphenylphosphine dichloride (62.5 ⁇ mol) to the reaction mixture and stir for 10 minutes.
- Compound 2a, 4a, or 6a (30 ⁇ mol; compound 2b, 4b, or 6b in the case of “S P ” solution) is added and stirred for another 10 minutes to obtain a pre-activated monomer solution.
- N-propyl phosphoramidate (f)
- the oligonucleoside H phosphonate bonded to HCP or CPG obtained through the above method via an oxalyl linker was treated with a carbon tetrachloride-propylamine (9: 1 volume ratio) solution at room temperature for 1 hour, and then methanol. Wash. The organic solvent is collected, concentrated to dryness under reduced pressure, treated with 25% aqueous ammonia at room temperature for 12 hours, and washed with water. The aqueous solution is collected and concentrated under reduced pressure, and the residue is purified by reverse phase HPLC to give stereocontrolled N-propyl phosphoramidate DNA.
- Example 3 (a) Basic procedure for solid-phase synthesis of X-phosphonate RNA using an acid-removable asymmetric auxiliary group (general formula I) 5'-O- (DMTr) nucleoside (0.5 ⁇ mol) bound to HCP or CPG via a succinyl linker or oxalyl linker is treated with a 3% dichloroacetic acid / dichloromethane solution to remove the 5'-DMTr group and dichloromethane And dry under vacuum.
- the chain extension reaction is achieved by repeating the following steps (a) and (b).
- (a) The condensation reaction (15 minutes) is carried out in a corresponding monomer solution * activated in advance in an argon atmosphere.
- Preparation of the pre-activated (R P )-and (S P ) -monomer solutions is carried out by the following method.
- 8-diazabicyclo [5.4.0] undec-7-enium 5'-O- (DMTr) -2'-O- (TBS) ribonucleoside-3'-ylphosphonate 25 ⁇ mol was azeotropically dried with dehydrated toluene, Dissolve in dehydrated acetonitrile-N-cyanomethylpyrrolidine solution (volume ratio 9: 1).
- triphenylphosphine dichloride (62.5 ⁇ mol) to the reaction mixture and stir for 10 minutes.
- Compound 2a, 4a, or 6a (30 ⁇ mol; in the case of “S P ” solution, compound 2b, 4b, 6b) is added and stirred for another 10 minutes to obtain a pre-activated monomer solution.
- the filtrate is diluted with a 25% aqueous ammonia-ethanol solution (volume ratio 3: 1), sealed in a flask, and treated at room temperature for 12 hours.
- the solution is concentrated under reduced pressure and the residue is purified by reverse phase HPLC.
- Fractions containing the desired phosphorothioate RNA protected at the 2 ′ position with a TBS group are collected and lyophilized.
- the residue is treated with a dehydrated tetrahydrofuran solution of 1 molar tetrabutylammonium fluoride for 24 hours. Add 0.05 molar triethylammonium acetate buffer (pH 6.9) and concentrate and remove tetrahydrofuran.
- the residue is desalted with Sep-Pak PLUS tC 18 and purified by reverse phase HPLC to give a stereocontrolled phosphorothioate RNA.
- the filtrate is diluted with 25% aqueous ammonia-ethanol solution (volume ratio 3: 1), sealed in a flask and treated at room temperature for 12 hours.
- the solution is concentrated under reduced pressure and the residue is purified by reverse phase HPLC.
- Fractions containing boranophosphate RNA protected at the 2 ′ position with a TBS group are collected and lyophilized.
- the residue is treated with a dehydrated tetrahydrofuran solution of 1 molar tetrabutylammonium fluoride for 24 hours. Add 0.05 molar triethylammonium acetate buffer (pH 6.9) and concentrate and remove tetrahydrofuran.
- the residue is desalted with Sep-Pak PLUS tC 18 and purified by reverse phase HPLC to yield sterically controlled boranophosphate RNA.
- the filtrate is diluted with 25% aqueous ammonia-ethanol solution (volume ratio 3: 1), sealed in a flask and treated at room temperature for 12 hours.
- the solution is concentrated under reduced pressure and the residue is purified by reverse phase HPLC.
- Fractions containing hydroxymethylphosphonate RNA of interest 2'-position protected with TBS group are collected and lyophilized.
- the residue is treated with a dehydrated tetrahydrofuran solution of 1 molar tetrabutylammonium fluoride for 24 hours. Add 0.05 molar triethylammonium acetate buffer (pH 6.9) and concentrate and remove tetrahydrofuran.
- the residue is desalted with Sep-Pak PLUS tC 18 and purified by reverse phase HPLC to give a stereocontrolled hydroxymethylphosphonate RNA.
- Fractions containing the desired phosphoramidate RNA protected at the 2 ′ position with a TBS group are collected and lyophilized.
- the residue is treated with a dehydrated tetrahydrofuran solution of 1 molar tetrabutylammonium fluoride for 24 hours.
- the residue is desalted with Sep-Pak PLUS tC 18 and purified by reverse phase HPLC to give a stereocontrolled phosphoramidate RNA.
- N-propyl phosphoramidate (f)
- the oligonucleoside H phosphonate bonded to HCP or CPG obtained through the above method via an oxalyl linker was treated with a carbon tetrachloride-propylamine (9: 1 volume ratio) solution at room temperature for 1 hour, and then methanol. Wash. The organic solvent is collected and concentrated to dryness under reduced pressure. Dilute with 25% aqueous ammonia-ethanol solution (volume ratio 3: 1), seal in a flask, and treat at room temperature for 12 hours. The solution is concentrated under reduced pressure and the residue is purified by reverse phase HPLC.
- Example 4 (a) Basic procedure for solid-phase synthesis of X-phosphonate DNA using base-removable asymmetric auxiliary groups (general formula XI) A 5′-O- (DMTr) nucleoside (0.5 ⁇ mol) linked to HCP or CPG via a succinyl linker or oxalyl linker is used for synthesis. Chain extension is achieved by repeating the steps described in Table 1. After the chain length extension, the asymmetric auxiliary group is removed with an anhydrous 10% DBU / acetonitrile solution at room temperature for 15 minutes and washed with acetonitrile.
- base-removable asymmetric auxiliary groups generally formula XI
- DMTr 5′-O- (DMTr) nucleoside (0.5 ⁇ mol) linked to HCP or CPG via a succinyl linker or oxalyl linker is used for synthesis.
- Chain extension is achieved by repeating the steps described in Table 1. After the chain length extension, the asymmetric
- the 5'-O-DMTr group is then removed with a 3% dichloroacetic acid / dichloromethane solution and washed with dichloromethane.
- a solid support containing 0.5 micromolar oligonucleotide is suspended in 25% aqueous ammonia (1 mL) and treated at 55 ° C. for 12 hours to remove the protecting group at the nucleobase site and simultaneously remove the oligomer from HCP or CPG. Release. After centrifugation, the supernatant is transferred to a round bottom flask and the solid support is washed with water (2 x 0.5 mL).
- Activated (R P )-and (S P ) -monomer solutions are prepared by the following method. 8-diazabicyclo [5.4.0] undec-7-enium 5'-O- (DMTr) -2'-deoxynucleoside-3'-ylphosphonate (25 ⁇ mol) was azeotropically dried with dehydrated toluene and dehydrated acetonitrile-N- Dissolve in cyanomethylpyrrolidine solution (volume ratio 9: 1). Add triphenylphosphine dichloride (62.5 ⁇ mol) to the reaction mixture and stir for 10 minutes. Compound 8a or 12a (30 ⁇ mol; compound 8b or 12b in the case of “S P ” solution) is added and stirred for another 10 minutes to obtain a pre-activated monomer solution.
- DMTr deoxynucleoside-3'-ylphosphonate
- Example 5 (a) Basic procedure for solid-phase synthesis of X-phosphonate RNA using acid-removable asymmetric auxiliary groups (general formula XI) 5′-O- (DMTr) ribonucleoside (0.5 ⁇ mol) bound to HCP or CPG via a succinyl linker or oxalyl linker is used for synthesis.
- the chain extension reaction is achieved by repeating the steps described in Table 2. After the chain length extension, the asymmetric auxiliary group is removed with an anhydrous 10% DBU / acetonitrile solution at room temperature for 15 minutes and washed with acetonitrile.
- the 5'-O-DMTr group is then removed with a 3% dichloroacetic acid / dichloromethane solution and washed with dichloromethane.
- a solid support containing 0.5 micromolar oligonucleotide is suspended in a 25% ammonia water-ethanol mixture (volume ratio 3: 1, 1 mL) and treated at room temperature for 48 hours to remove the protecting group at the nucleobase site.
- the oligomer is released from HCP or CPG. After centrifugation, the supernatant is transferred to a round bottom flask and the solid support is washed with water (2 x 0.5 mL).
- Activated (R P )-and (S P ) -monomer solutions are prepared by the following method. 8-diazabicyclo [5.4.0] undec-7-enium 5'-O- (DMTr) -2'-O- (TBS) ribonucleoside-3'-ylphosphonate (25 ⁇ mol) was azeotropically dried with dehydrated toluene, Dissolve in dehydrated acetonitrile-N-cyanomethylpyrrolidine solution (volume ratio 9: 1). Add triphenylphosphine dichloride (62.5 ⁇ mol) to the reaction mixture and stir for 10 minutes.
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Biochemistry (AREA)
- Molecular Biology (AREA)
- Genetics & Genomics (AREA)
- General Health & Medical Sciences (AREA)
- Biotechnology (AREA)
- Engineering & Computer Science (AREA)
- Saccharide Compounds (AREA)
- Indole Compounds (AREA)
- Other In-Based Heterocyclic Compounds (AREA)
- Pyrrole Compounds (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
Description
より具体的には、上記の4種の化合物のうちFormula Q及びFormula Rで表される化合物を用いて導入された不斉補助基は、強い酸性条件、例えば1% トリフルオロ酢酸(TFA)/ジクロロメタンを用いてカチオンを発生させることにより下記のSN1機構で脱離させることができる。しかしながら、この酸性条件はアシル型の保護基で塩基部位を保護したアデニン塩基(一般的にはアデニン塩基にはアシル型の保護基が導入されている)の脱離(デプリネーション)が生じる条件であることから、この不斉補助基を用いる場合にはアデニン塩基をアミジン型、トリチル型、又はジアシル型などの保護基で保護しなければならないという問題が生じる(下記のスキーム中、Bsは核酸塩基、Meはメチル基、Phはフェニル基を示す)。
本発明はこれらの知見を基にして完成されたものである。
(a)下記一般式(V):
で表される核酸誘導体と、上記一般式(IV)で表されるヌクレオチド誘導体(ただし、R1、R2、R3、R4、R5、及びYは上記と同義であり;R21は水酸基の保護基を示し;R22は水素原子、アルコキシ基、フッ素原子、又は保護された水酸基を示し;Bsは核酸塩基を示す)とを反応させて、上記一般式(III)(ただし、R1、R2、R3、R4、R5、Y、及びnは上記と同義であり;R11は水酸基の保護基を示し;R12、R13、及びR14はそれぞれ独立に水素原子、アルコキシ基、フッ素原子、又は保護された水酸基を示し;R15は必要に応じてリンカーを介して結合した固相担体を示し;Bsは核酸塩基を示す)で表される核酸誘導体を製造する工程;
(b)上記工程(a)により得られた一般式(III)で表される核酸誘導体からR11で表される水酸基の保護基を除去し、必要に応じて、得られた核酸誘導体と一般式(IV)で表されるヌクレオチド誘導体とを反応させる工程を繰り返す工程;
(c)酸性条件下において一般式(II)で表される不斉補助基を除去して下記一般式(VI):
(d)上記工程(c)で得られた核酸誘導体のリン原子を修飾した後、必要に応じて保護基を脱離する工程
を含む方法が提供される。
また、工程(d)におけるリン原子の修飾としては、Xで表される基(Xは置換基を有していてもよいアルキルチオ基、置換基を有していてもよいアルケニルチオ基、置換基を有していてもよいアルキニルチオ基、置換基を有していてもよいアリールチオ基、チオール基、置換基を有していてもよいアルコキシ基、-BH3、-Se-、置換基を有していてもよいアルキル基、置換基を有していてもよいアルケニル基、置換基を有していてもよいアルキニル基、置換基を有していてもよいアリール基、置換基を有していてもよいアシル基、又は-N(R116)(R117)(R116及びR117はそれぞれ独立に水素原子、置換基を有していてもよいアルキル基、置換基を有していてもよいアルケニル基、置換基を有していてもよいアルキニル基、又は置換基を有していてもよいアリール基を示す)で表される基を示す)をリン原子上に導入することができる。
(a)下記一般式(XIII'):
で表される核酸誘導体と、上記一般式(XIV)で表されるヌクレオチド誘導体(ただし、R121は水酸基の保護基を示し;R122は水素原子、アルコキシ基、フッ素原子、又は保護された水酸基を示す)とを反応させた後に、求電子剤を用いてX(Xはチオール基、-BH3、-Se-を示す)を導入し、R121が示す水酸基の保護基を除去することにより下記一般式(XV):
(b)上記工程(a)により得られた上記一般式(XV)で表される核酸誘導体から塩基性条件下において一般式(XII)で表される不斉補助基を除去して下記一般式(XVII):
を含む方法が提供される。
アルキルチオ基、アルケニルチオ基、アルキニルチオ基、及びアリールチオ基のアルキル部分、アルケニル部分、アルキニル部分、及びアリール部分としては上記に説明したアルキル基、アルケニル基、アルキニル基、及びアリール基を用いることができる。
一般式(I)において、R1及びR2はそれぞれ独立に水素原子、置換基を有していてもよいアルキル基、置換基を有していてもよいアルケニル基、置換基を有していてもよいアルキニル基、置換基を有していてもよいアルコキシ基、置換基を有していてもよいアラルキル基、又は置換基を有していてもよいアリール基を示す。好ましくはR1及びR2はそれぞれ独立に水素原子又はアルキル基を示し、R1及びR2がともに水素原子であることがさらに好ましい。
R4及びR5はそれぞれ独立に水素原子、置換基を有していてもよいアルキル基、置換基を有していてもよいアルケニル基、置換基を有していてもよいアルキニル基、置換基を有していてもよいアルコキシ基、置換基を有していてもよいアラルキル基、又は置換基を有していてもよいアリール基を示す。好ましくはR4及びR5はそれぞれ独立に水素原子又はアルキル基を示し、R4及びR5がともに水素原子であることがさらに好ましい。
Y2は単結合又は-C(R8)(R9)-を示す。R8及びR9はそれぞれ独立に水素原子、置換基を有していてもよいアルキル基、置換基を有していてもよいアルケニル基、置換基を有していてもよいアルキニル基、置換基を有していてもよいアルコキシ基、置換基を有していてもよいアラルキル基、又は置換基を有していてもよいアリール基を示す。Y2は単結合であることが好ましく、この場合、Yは-C(R6)(R7)-を示すか、又は置換基を有していてもよいo-アリールジイル基を示す。
この方法は、背景技術において国際公開WO 2010/064146の反応工程を説明したスキーム中のRoute Bで示したサイクルと同様に行うことができる。
一般式(XI)において、R101及びR102はそれぞれ独立に水素原子、置換基を有していてもよいアルキル基、置換基を有していてもよいアルケニル基、置換基を有していてもよいアルキニル基、置換基を有していてもよいアルコキシ基、置換基を有していてもよいアラルキル基、置換基を有していてもよいアリール基を示す。R101及びR102は水素原子又はアルキル基であることが好ましく、R101及びR102がともに水素原子であることがより好ましい。
この方法は、背景技術において国際公開WO 2010/064146の反応工程を説明したスキーム中のRoute Aで示したサイクルと同様に行うことができる。
1H NMR (300 MHz, CDCl3) δ 8.01 (1H, d, J = 7.8 Hz), 7.81 (1H, t, J = 7.2 Hz), 7.71 (1H, t, J = 7.2 Hz), 7.56 (1H, d, J = 7.8 Hz), 7.52-7.40 (5H, m); 13C NMR (75.5 MHz, CDCl3) δ 167.3, 146.6, 135.8, 133.6, 131.4, 130.7, 129.3, 126.3, 125.7, 123.9, 123.2, 115.8, 79.6.
1H NMR (300 MHz, CDCl3) δ 7.22-7.18 (9H, m), 4.42 (1H, d, J = 11.7 Hz), 4.09 (1H, d, J = 11.7 Hz), 3.53 (1H, d, J = 12.0 Hz), 3.23 (1H, d, J = 12.0 Hz), 1.64 (2H, brs); 13C NMR (75.5 MHz, CDCl3) δ 145.4, 143.1, 140.8, 133.0, 128.2, 128.1, 127.5, 127.0, 125.7, 125.6, 77.3, 64.4, 51.7; ESI TOF-MS m/z Calcd for C15H16NO [M+H]+ 226.12, found 226.15.
1H NMR (300 MHz, CD3OD) δ 7.53 (2H, d, J = 6.9 Hz), 7.34 (2H, t, J = 6.9 Hz), 7.25 (1H, d, J = 6.9 Hz), 4.20-3.88 (1H, m), 3.88-3.71 (1H, m), 3.42-3.18 (1H, m), 3.08-2.93 (1H, m), 2.13-1.77 (3H, m), 1.58-1.47 (1H, m), 1.46 (9H, s); 13C NMR (75.5 MHz, CD3OD) δ 157.2, 147.5, 129.2, 128.1, 126.3, 81.0, 79.5, 72.4, 37.8, 28.7, 22.3.
1H NMR (300 MHz, CD3OD) δ 7.53-7.46 (2H, m), 7.37-7.29 (2H, m), 7.26-7.18 (1H, m), 3.08-2.99 (1H, m), 2.93-2.85 (1H, m), 2.81-2.72 (1H, m), 2.68-2.56 (1H, m), 2.13-1.80 (3H, m), 1.61-1.51 (1H, m); 13C NMR (75.5 MHz, CD3OD) δ 148.7, 129.2, 127.9, 125.8, 71.8, 57.4, 46.3, 37.2, 23.4; ESI TOF-MS m/z Calcd for C11H16NO [M+H]+ 178.12, found 178.14.
1H NMR (300 MHz, CDCl3) δ 7.52-7.28 (5H, m), 3.80-3.54 (4H, m), 2.42-2.10 (2H, m), 1.93 (1H, brs), 1.48 (9H, s).
1H NMR (300 MHz, CDCl3) δ 7.52-7.46 (2H, m), 7.41-7.24 (3H, m), 3.34 (1H, dt, J = 10.8, 7.8 Hz), 3.20-3.09 (2H, m), 3.03 (1H, d, J = 12.0 Hz), 2.27 (1H, ddd, J = 13.4, 9.3, 7.5 Hz), 2.18-2.06 (1H, m), 1.95 (1H, brs); 13C NMR (75.5 MHz, CD3OD) δ 146.0, 129.2, 128.0, 126.4, 83.1, 61.9, 46.8, 42.9; ESI TOF-MS m/z Calcd for C10H14NO [M+H]+ 164.11, found 164.13.
1H NMR (300 MHz, CDCl3) δ 4.64 (1H, q, J = 4.5 Hz),3.87-3.62 (3H, m), 3.47-3.31 (1H, m), 3.15-2.99 (1H, m), 2.46 (1H, brs), 1.47 (9H, s); ESI TOF-MS m/z Calcd for C10H14NO [M+H]+ 164.11, found 164.13.
1H NMR (300 MHz, CD3OD) δ 4.49 (1H, dt, J = 6.0, 3.6 Hz), 3.39 (1H, dd, J = 11.9, 8.1 Hz), 3.08 (1H, dd, 12.3, 5.4 Hz), 3.00 (1H, dd, J = 11.9, 5.7 Hz), 2.92-2.85 (1H, m), 2.80 (1H, dd, J = 12.3, 3.6 Hz); 13C NMR (100 MHz, CD3OD) δ 121.7, 77.5, 55.5, 50.8, 39.1; ESI TOF-MS m/z Calcd for C5H9N2O [M+H]+ 113.07, found 113.07.
(a)酸除去型不斉補助基を用いるX-ホスホネートDNAの固相合成の基本手順(一般式 I)
HCP若しくはCPGにサクシニルリンカー若しくはオキザリルリンカーを介して結合した5'-O-(DMTr)ヌクレオシド(0.5μmol)を3%ジクロロ酢酸/ジクロロメタン溶液で処理し、5'-DMTr基を除去し、ジクロロメタンで洗浄し、真空下で乾燥する。鎖長延長反応は以下の(a)、(b)の工程を繰り返し行なうことで達成する。(a)縮合反応(5分)は、事前に活性化した対応するモノマー溶液をアルゴン雰囲気下で行なう。縮合後、固相担体を脱水アセトニトリルと脱水ジクロロメタンで洗浄する。(b) 5'-O-DMTrと不斉補助基の除去は3%ジクロロメタン/(ジクロロメタン-トリエチルシラン(体積比で1:1))溶液で処理することで同時に行い、続いてジクロロメタン及び脱水アセトニトリルで洗浄する。鎖長延長後、樹脂上にできたオリゴヌクレオシドHホスホネートはXホスホネートDNAに下に示す方法で変換する。
上記の方法で得られた、HCP若しくはCPGにサクシニルリンカーを介して結合したオリゴヌクレオシドHホスホネートを、10重量%S8/(二琉化炭素-ピリジン-トリエチルアミン)溶液(体積比35:35:1)に室温で3時間処理し、続いて二硫化炭素、ピリジン、アセトニトリルで洗浄する。樹脂を25%アンモニア水で室温12時間処理し、水で洗浄する。水溶液を集め、減圧下濃縮し、残渣を逆相HPLCで精製し、立体を制御したホスホロチオエートDNAを得る。
上記の方法で得られた、HCP若しくはCPGにオキザリルリンカーを介して結合したオリゴヌクレオシドHホスホネートに対し、脱水ジメチルホルムアミド、N,O-ビス(トリメチルシリル)アセトアミド、ボランジメチルスルフィドを加える。15分後、樹脂をジメチルホルムアミド、アセトニトリル、メタノールの順に洗浄する。樹脂をアンモニア/メタノール溶液で室温12時間処理し、メタノールで洗浄する。メタノール溶液を集め、減圧下濃縮し、残渣を逆相HPLCで精製し、立体を制御したボラノホスフェートDNAを得る。
上記の方法で得られた、HCP若しくはCPGにオキザリルリンカーを介して結合したオリゴヌクレオシドHホスホネートを、0.1Mトリメチルシリルクロリド/(ピリジン:1-メチル-2-ピロリドン(体積比1:9))溶液で室温10分間、ガス状のホルムアルデヒドで室温30分間処理し、次に1-メチル-2-ピロリドン、アセトニトリルで洗浄する。樹脂を25%アンモニア水で室温12時間処理し、水で洗浄する。水溶液を集め、減圧下濃縮し、残渣を逆相HPLCで精製し、立体を制御したヒドロキシメチルホスホネートDNAを得る。
上記の方法で得られた、HCP若しくはCPGにオキザリルリンカーを介して結合したオリゴヌクレオシドHホスホネートを、四塩化炭素-1、4-ジオキサン(体積比4:1)の飽和アンモニア溶液に0℃で30分間処理し、1、4-ジオキサンで洗浄する。有機溶媒を集め、減圧下濃縮乾燥し、25%アンモニア水で室温12時間処理し、水で洗浄する。水溶液を集め、減圧下濃縮し、残渣を逆相HPLCで精製し、立体を制御したホスホロアミデートDNAを得る。
上記の方法で得られた、HCP若しくはCPGにオキザリルリンカーを介して結合したオリゴヌクレオシドHホスホネートを、四塩化炭素-プロピルアミン(体積比9:1)溶液に室温で1時間処理し、メタノールで洗浄する。有機溶媒を集め、減圧下濃縮乾燥し、25%アンモニア水で室温12時間処理し、水で洗浄する。水溶液を集め、減圧下濃縮し、残渣を逆相HPLCで精製し、立体を制御したN-プロピルホスホロアミデートDNAを得る。
上記の方法で得られた、HCP若しくはCPGにオキザリルリンカーを介して結合したオリゴヌクレオシドHホスホネートを、四塩化炭素-2-ジメチルアニモエチルアミン(体積比9:1)溶液に室温で1時間処理し、アセトニトリルで洗浄する。有機溶媒を集め、減圧下濃縮乾燥し、25%アンモニア水で室温12時間処理し、水で洗浄する。水溶液を集め、減圧下濃縮し、残渣を逆相HPLCで精製し、立体を制御したN-[(2-ジメチルアミノ)エチル]ホスホロアミデートDNAを得る。
(a)酸除去型不斉補助基を用いるX-ホスホネートRNAの固相合成の基本手順(一般式 I)
HCP若しくはCPGにサクシニルリンカー若しくはオキザリルリンカーを介して結合した5'-O-(DMTr)ヌクレオシド(0.5μmol)を3%ジクロロ酢酸/ジクロロメタン溶液で処理し、5'-DMTr基を除去し、ジクロロメタンで洗浄し、真空下で乾燥する。鎖長延長反応は以下の(a)、(b)の工程を繰り返し行なうことで達成する。(a)縮合反応(15分)は、事前に活性化した対応するモノマー溶液*をアルゴン雰囲気下で行なう。縮合後、固相担体を脱水アセトニトリルと脱水ジクロロメタンで洗浄する。(b) 5'-O-DMTrと不斉補助基の除去は3%ジクロロメタン/(ジクロロメタン-トリエチルシラン(体積比で1:1))溶液で処理することで同時に行い、続いてジクロロメタン及び脱水アセトニトリルで洗浄する。鎖長延長後、樹脂上にできたオリゴヌクレオシドHホスホネートはXホスホネートRNAに下に示す方法で変換する。
上記の方法で得られた、HCP若しくはCPGにサクシニルリンカーを介して結合したオリゴヌクレオシドHホスホネートを、10重量%S8/(二琉化炭素-ピリジン-トリエチルアミン)溶液(体積比35:35:1)に室温で3時間処理し、続いて二硫化炭素、ピリジン、エタノールで洗浄する。次に樹脂を25%アンモニア水-エタノール溶液(体積比3:1)で室温2時間処理し、樹脂をフィルターでろ別する。ろ液を25%アンモニア水-エタノール溶液(体積比3:1)で希釈し、フラスコ内に密閉し、室温で12時間処理する。溶液を減圧下濃縮し、残渣を逆相HPLCで精製する。目的とする2'位がTBS基で保護されたホスホロチオエートRNAを含むフラクションを集め、凍結乾燥する。残渣を1モル濃度テトラブチルアンモニウムフルオリドの脱水テトラヒドロフラン溶液で24時間処理する。0.05モル濃度のトリエチルアンモニウムアセテートバッファー(pH6.9)を加え、テトラヒドロフランを濃縮除去する。残渣をSep-Pak PLUS tC18で脱塩し、逆相HPLCで精製し、立体を制御したホスホロチオエートRNAを得る。
上記の方法で得られた、HCP若しくはCPGにオキザリルリンカーを介して結合したオリゴヌクレオシドHホスホネートに対し、脱水ジメチルホルムアミド、N,O-ビス(トリメチルシリル)アセトアミド、ボランジメチルスルフィドを加える。15分後、樹脂をジメチルホルムアミド、アセトニトリル、エタノールの順に洗浄する。次に樹脂を25%アンモニア水-エタノール溶液(体積比3:1)で室温2時間処理し、樹脂をフィルターでろ別する。ろ液を25%アンモニア水-エタノール溶液(体積比3:1)で希釈し、フラスコ内に密閉し、室温で12時間処理する。溶液を減圧下濃縮し、残渣を逆相HPLCで精製する。目的とする2'位がTBS基で保護されたボラノホスフェートRNAを含むフラクションを集め、凍結乾燥する。残渣を1モル濃度テトラブチルアンモニウムフルオリドの脱水テトラヒドロフラン溶液で24時間処理する。0.05モル濃度のトリエチルアンモニウムアセテートバッファー(pH6.9)を加え、テトラヒドロフランを濃縮除去する。残渣をSep-Pak PLUS tC18で脱塩し、逆相HPLCで精製し、立体を制御したボラノホスフェートRNAを得る。
上記の方法で得られた、HCP若しくはCPGにオキザリルリンカーを介して結合したオリゴヌクレオシドHホスホネートを、0.1Mトリメチルシリルクロリド/(ピリジン:1-メチル-2-ピロリドン(体積比1:9))溶液で室温10分間、ガス状のホルムアルデヒドで室温30分間処理し、次に1-メチル-2-ピロリドン、エタノールで洗浄する。次に樹脂を25%アンモニア水-エタノール溶液(体積比3:1)で室温2時間処理し、樹脂をフィルターでろ別する。ろ液を25%アンモニア水-エタノール溶液(体積比3:1)で希釈し、フラスコ内に密閉し、室温で12時間処理する。溶液を減圧下濃縮し、残渣を逆相HPLCで精製する。目的とする2'位がTBS基で保護されたヒドロキシメチルホスホネートRNAを含むフラクションを集め、凍結乾燥する。残渣を1モル濃度テトラブチルアンモニウムフルオリドの脱水テトラヒドロフラン溶液で24時間処理する。0.05モル濃度のトリエチルアンモニウムアセテートバッファー(pH6.9)を加え、テトラヒドロフランを濃縮除去する。残渣をSep-Pak PLUS tC18で脱塩し、逆相HPLCで精製し、立体を制御したヒドロキシメチルホスホネートRNAを得る。
上記の方法で得られた、HCP若しくはCPGにオキザリルリンカーを介して結合したオリゴヌクレオシドHホスホネートを、四塩化炭素-1、4-ジオキサン(体積比4:1)の飽和アンモニア溶液に0℃で30分間処理し、1、4-ジオキサンで洗浄する。有機溶媒を集め、減圧下濃縮乾燥する。25%アンモニア水-エタノール溶液(体積比3:1)で希釈し、フラスコ内に密閉し、室温で12時間処理する。溶液を減圧下濃縮し、残渣を逆相HPLCで精製する。目的とする2'位がTBS基で保護されたホスホロアミデートRNAを含むフラクションを集め、凍結乾燥する。残渣を1モル濃度テトラブチルアンモニウムフルオリドの脱水テトラヒドロフラン溶液で24時間処理する。0.05モル濃度のトリエチルアンモニウムアセテートバッファー(pH6.9)を加え、テトラヒドロフランを濃縮除去する。残渣をSep-Pak PLUS tC18で脱塩し、逆相HPLCで精製し、立体を制御したホスホロアミデートRNAを得る。
上記の方法で得られた、HCP若しくはCPGにオキザリルリンカーを介して結合したオリゴヌクレオシドHホスホネートを、四塩化炭素-プロピルアミン(体積比9:1)溶液に室温で1時間処理し、メタノールで洗浄する。有機溶媒を集め、減圧下濃縮乾燥する。25%アンモニア水-エタノール溶液(体積比3:1)で希釈し、フラスコ内に密閉し、室温で12時間処理する。溶液を減圧下濃縮し、残渣を逆相HPLCで精製する。目的とする2'位がTBS基で保護されたN-プロピルホスホロアミデートRNAを含むフラクションを集め、凍結乾燥する。残渣を1モル濃度テトラブチルアンモニウムフルオリドの脱水テトラヒドロフラン溶液で24時間処理する。0.05モル濃度のトリエチルアンモニウムアセテートバッファー(pH6.9)を加え、テトラヒドロフランを濃縮除去する。残渣をSep-Pak PLUS tC18で脱塩し、逆相HPLCで精製し、立体を制御したN-プロピルホスホロアミデートRNAを得る。
上記の方法で得られた、HCP若しくはCPGにオキザリルリンカーを介して結合したオリゴヌクレオシドHホスホネートを、四塩化炭素-2-ジメチルアニモエチルアミン(体積比9:1)溶液に室温で1時間処理し、アセトニトリルで洗浄する。有機溶媒を集め、減圧下濃縮乾燥する。25%アンモニア水-エタノール溶液(体積比3:1)で希釈し、フラスコ内に密閉し、室温で12時間処理する。溶液を減圧下濃縮し、残渣を逆相HPLCで精製する。目的とする2'位がTBS基で保護されたN-[(2-ジメチルアミノ)エチル]ホスホロアミデートRNAを含むフラクションを集め、凍結乾燥する。残渣を1モル濃度テトラブチルアンモニウムフルオリドの脱水テトラヒドロフラン溶液で24時間処理する。0.05モル濃度のトリエチルアンモニウムアセテートバッファー(pH6.9)を加え、テトラヒドロフランを濃縮除去する。残渣をSep-Pak PLUS tC18で脱塩し、逆相HPLCで精製し、立体を制御したN-[(2-ジメチルアミノ)エチル]ホスホロアミデートRNAを得る。
(a)塩基除去型不斉補助基を用いるX-ホスホネートDNAの固相合成の基本手順(一般式 XI)
HCP若しくはCPGにサクシニルリンカー若しくはオキザリルリンカーを介して結合した5'-O-(DMTr)ヌクレオシド(0.5μmol)を合成に用いる。鎖長延長反応はTable1に記す工程を繰返し行なうことで達成する。鎖長延長後、不斉補助基は無水10%DBU/アセトニトリル溶液を用い室温15分で除去し、アセトニトリルで洗浄する。次に5'-O-DMTr基を3%ジクロロ酢酸/ジクロロメタン溶液で除去し、ジクロロメタンで洗浄する。HCP若しくはCPG上のオリゴマーをOリングの付いたスクリューキャップ式のエッペンドルフチューブに移す。0.5マイクロモルのオリゴヌクレオチドを含む固相担体を25%のアンモニア水(1mL)に懸濁させ、55℃で12時間処理し、核酸塩基部位の保護基を除去し、同時にHCP若しくはCPGからオリゴマーを遊離させる。遠心分離後、上清を丸底フラスコへ移し、固相担体を水(0.5mLで2回)で洗浄する。遠心分離後、集めた上清を減圧下乾燥する。残渣を水(1mL)で希釈し、Sep-Pak PLUS tC18にロードし、水で平衡化する。まず塩を除くために水(20mL)を流し、次に脱塩済みの立体を制御したXホスホネートDNAを50%アセトニトリル水溶液(10mL)で溶出させ、逆相UPLCとMALDI-TOF MSで分析する。
(a)酸除去型不斉補助基を用いるX-ホスホネートRNAの固相合成の基本手順(一般式 XI)
HCP若しくはCPGにサクシニルリンカー若しくはオキザリルリンカーを介して結合した5'-O-(DMTr)リボヌクレオシド(0.5μmol)を合成に用いる。鎖長延長反応はTable2に記す工程を繰返し行なうことで達成する。鎖長延長後、不斉補助基は無水10%DBU/アセトニトリル溶液を用い室温15分で除去し、アセトニトリルで洗浄する。次に5'-O-DMTr基を3%ジクロロ酢酸/ジクロロメタン溶液で除去し、ジクロロメタンで洗浄する。HCP若しくはCPG上のオリゴマーをOリングの付いたスクリューキャップ式のエッペンドルフチューブに移す。0.5マイクロモルのオリゴヌクレオチドを含む固相担体を25%のアンモニア水-エタノール混合液(体積比3:1、1mL)に懸濁させ、室温で48時間処理し、核酸塩基部位の保護基を除去し、同時にHCP若しくはCPGからオリゴマーを遊離させる。遠心分離後、上清を丸底フラスコへ移し、固相担体を水(0.5mLで2回)で洗浄する。遠心分離後、集めた上清を減圧下乾燥し、残渣を逆相HPLCで精製する。2'位をTBS基で保護したXホスホネートRNAを含むフラクションを集め、凍結乾燥する。残渣を1モル濃度テトラブチルアンモニウムフルオリドの脱水テトラヒドロフラン溶液を用い室温で24時間処理する。0.05モル濃度のトリエチルアンモニウムアセテートバッファー(pH6.9)を加え、テトラヒドロフランを濃縮除去する。残渣をSep-Pak PLUS tC18で脱塩し、逆相HPLCで精製し、立体を制御したXホスホネートRNAを得る。
Claims (16)
- 下記の一般式(I):
- R1及びR2が水素原子又はアルキル基であり、R3がフェニル基であり、R4及びR5が水素原子又はアルキル基であり、Yが-C(R6)(R7)-(R6及びR7はそれぞれ独立に水素原子又はアルキル基であり、R7がアルキル基を示す場合にはR7はR3が示すフェニル基と結合して環を形成していてもよい)、o-フェニレン基、又はナフタレン-1,2-ジイル基である請求項1に記載の化合物又はその塩。
- 核酸誘導体の製造方法であって、下記の工程:
(a)下記一般式(V):
で表される核酸誘導体と、上記一般式(IV)で表されるヌクレオチド誘導体(ただし、R1、R2、R3、R4、R5、及びYは上記と同義であり;R21は水酸基の保護基を示し;R22は水素原子、アルコキシ基、フッ素原子、又は保護された水酸基を示し;Bsは核酸塩基を示す)とを反応させて、上記一般式(III)(ただし、R1、R2、R3、R4、R5、Y、及びnは上記と同義であり;R11は水酸基の保護基を示し;R12、R13、及びR14はそれぞれ独立に水素原子、アルコキシ基、フッ素原子、又は保護された水酸基を示し;R15は必要に応じてリンカーを介して結合した固相担体を示し;Bsは核酸塩基を示す)で表される核酸誘導体を製造する工程;
(b)上記工程(a)により得られた一般式(III)で表される核酸誘導体からR11で表される水酸基の保護基を除去し、必要に応じて、得られた核酸誘導体と一般式(IV)で表されるヌクレオチド誘導体とを反応させる工程を繰り返す工程;
(c)酸性条件下において一般式(II)で表される不斉補助基を除去して下記一般式(VI):
(d)上記工程(c)で得られた核酸誘導体のリン原子を修飾した後、必要に応じて保護基を脱離する工程
を含む方法。 - 工程(c)における酸性条件として3% ジクロロ酢酸(DCA)/ジクロロメタンを用いる請求項7に記載の方法。
- リン原子の修飾として、Xで表される基(Xは置換基を有していてもよいアルキルチオ基、置換基を有していてもよいアルケニルチオ基、置換基を有していてもよいアルキニルチオ基、置換基を有していてもよいアリールチオ基、チオール基、置換基を有していてもよいアルコキシ基、-BH3、-Se-、置換基を有していてもよいアルキル基、置換基を有していてもよいアルケニル基、置換基を有していてもよいアルキニル基、置換基を有していてもよいアリール基、置換基を有していてもよいアシル基、又は-N(R116)(R117)(R116及びR117はそれぞれ独立に水素原子、置換基を有していてもよいアルキル基、置換基を有していてもよいアルケニル基、置換基を有していてもよいアルキニル基、又は置換基を有していてもよいアリール基を示す)で表される基を示す)をリン原子上に導入する請求項7又は8に記載の方法。
- 下記の一般式(XI):
- R101及びR102が水素原子又はアルキル基であり、R103がシアノ基であり、Zが-C(R104)(R105)-(R104及びR105は水素原子又はアルキル基である)である請求項10に記載の化合物又はその塩。
- R101及びR102が水素原子であり、R103がシアノ基であり、Zが-C(R104)(R105)-(R104及びR105は水素原子である)である請求項10に記載の化合物又はその塩。
- 核酸誘導体の製造方法であって、下記の工程:
(a)下記一般式(XIII'):
で表される核酸誘導体と、上記一般式(XIV)で表されるヌクレオチド誘導体(ただし、R121は水酸基の保護基を示し;R122は水素原子、アルコキシ基、フッ素原子、又は保護された水酸基を示す)とを反応させた後に、求電子剤を用いてX(Xはチオール基、-BH3、-Se-を示す)を導入し、R121が示す水酸基の保護基を除去することにより下記一般式(XV):
(b)上記工程(a)により得られた上記一般式(XV)で表される核酸誘導体から塩基性条件下において一般式(XII)で表される不斉補助基を除去して下記一般式(XVII):
を含む方法。
Priority Applications (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US13/825,627 US10428019B2 (en) | 2010-09-24 | 2011-09-22 | Chiral auxiliaries |
| EP11826893.7A EP2620428B1 (en) | 2010-09-24 | 2011-09-22 | Asymmetric auxiliary group |
| JP2012535064A JP5868324B2 (ja) | 2010-09-24 | 2011-09-22 | 不斉補助基 |
| DK11826893.7T DK2620428T3 (da) | 2010-09-24 | 2011-09-22 | Asymmetrisk hjælpegruppe |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US38601610P | 2010-09-24 | 2010-09-24 | |
| US61/386,016 | 2010-09-24 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2012039448A1 true WO2012039448A1 (ja) | 2012-03-29 |
Family
ID=45873932
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/JP2011/071559 WO2012039448A1 (ja) | 2010-09-24 | 2011-09-22 | 不斉補助基 |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US10428019B2 (ja) |
| EP (1) | EP2620428B1 (ja) |
| JP (3) | JP5868324B2 (ja) |
| DK (1) | DK2620428T3 (ja) |
| WO (1) | WO2012039448A1 (ja) |
Cited By (42)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2014010250A1 (en) | 2012-07-13 | 2014-01-16 | Chiralgen, Ltd. | Asymmetric auxiliary group |
| WO2014012081A2 (en) | 2012-07-13 | 2014-01-16 | Ontorii, Inc. | Chiral control |
| WO2015107425A2 (en) | 2014-01-16 | 2015-07-23 | Wave Life Sciences Pte. Ltd. | Chiral design |
| US9394333B2 (en) | 2008-12-02 | 2016-07-19 | Wave Life Sciences Japan | Method for the synthesis of phosphorus atom modified nucleic acids |
| WO2017015575A1 (en) | 2015-07-22 | 2017-01-26 | Wave Life Sciences Ltd. | Oligonucleotide compositions and methods thereof |
| US9605019B2 (en) | 2011-07-19 | 2017-03-28 | Wave Life Sciences Ltd. | Methods for the synthesis of functionalized nucleic acids |
| US9617547B2 (en) | 2012-07-13 | 2017-04-11 | Shin Nippon Biomedical Laboratories, Ltd. | Chiral nucleic acid adjuvant |
| US9744183B2 (en) | 2009-07-06 | 2017-08-29 | Wave Life Sciences Ltd. | Nucleic acid prodrugs and methods of use thereof |
| WO2017190041A1 (en) | 2016-04-29 | 2017-11-02 | Sarepta Therapeutics, Inc. | Oligonucleotide analogues targeting human lmna |
| WO2018005805A1 (en) | 2016-06-30 | 2018-01-04 | Sarepta Therapeutics, Inc. | Exon skipping oligomers for muscular dystrophy |
| WO2018118627A1 (en) | 2016-12-19 | 2018-06-28 | Sarepta Therapeutics, Inc. | Exon skipping oligomer conjugates for muscular dystrophy |
| WO2018118599A1 (en) | 2016-12-19 | 2018-06-28 | Sarepta Therapeutics, Inc. | Exon skipping oligomer conjugates for muscular dystrophy |
| WO2018118662A1 (en) | 2016-12-19 | 2018-06-28 | Sarepta Therapeutics, Inc. | Exon skipping oligomer conjugates for muscular dystrophy |
| US10144933B2 (en) | 2014-01-15 | 2018-12-04 | Shin Nippon Biomedical Laboratories, Ltd. | Chiral nucleic acid adjuvant having immunity induction activity, and immunity induction activator |
| US10149905B2 (en) | 2014-01-15 | 2018-12-11 | Shin Nippon Biomedical Laboratories, Ltd. | Chiral nucleic acid adjuvant having antitumor effect and antitumor agent |
| WO2019059973A1 (en) | 2017-09-22 | 2019-03-28 | Sarepta Therapeutics, Inc. | OLIGOMERIC CONJUGATES FOR THE EXON JUMP FOR MUSCLE DYSTROPHY |
| WO2019067979A1 (en) | 2017-09-28 | 2019-04-04 | Sarepta Therapeutics, Inc. | POLYTHERAPIES FOR TREATING MUSCLE DYSTROPHY |
| WO2019067981A1 (en) | 2017-09-28 | 2019-04-04 | Sarepta Therapeutics, Inc. | POLYTHERAPIES FOR TREATING MUSCLE DYSTROPHY |
| WO2019067975A1 (en) | 2017-09-28 | 2019-04-04 | Sarepta Therapeutics, Inc. | POLYTHERAPIES FOR TREATING MUSCLE DYSTROPHY |
| US10322173B2 (en) | 2014-01-15 | 2019-06-18 | Shin Nippon Biomedical Laboratories, Ltd. | Chiral nucleic acid adjuvant having anti-allergic activity, and anti-allergic agent |
| US10428019B2 (en) | 2010-09-24 | 2019-10-01 | Wave Life Sciences Ltd. | Chiral auxiliaries |
| US10450568B2 (en) | 2015-10-09 | 2019-10-22 | Wave Life Sciences Ltd. | Oligonucleotide compositions and methods thereof |
| WO2020023688A1 (en) | 2018-07-27 | 2020-01-30 | Sarepta Therapeutics, Inc. | Exon skipping oligomers for muscular dystrophy |
| WO2020123574A1 (en) | 2018-12-13 | 2020-06-18 | Sarepta Therapeutics, Inc. | Exon skipping oligomer conjugates for muscular dystrophy |
| US10724035B2 (en) | 2016-05-04 | 2020-07-28 | Wave Life Sciences Ltd. | Oligonucleotide compositions and methods thereof |
| US10758629B2 (en) | 2018-05-29 | 2020-09-01 | Sarepta Therapeutics, Inc. | Exon skipping oligomer conjugates for muscular dystrophy |
| WO2020214763A1 (en) | 2019-04-18 | 2020-10-22 | Sarepta Therapeutics, Inc. | Compositions for treating muscular dystrophy |
| US10882884B2 (en) | 2016-05-18 | 2021-01-05 | Eth Zurich | Stereoselective synthesis of phosphorothioate oligoribonucleotides |
| US11013757B2 (en) | 2016-06-03 | 2021-05-25 | Wave Life Sciences Ltd. | Oligonucleotides, compositions and methods thereof |
| US11060089B2 (en) | 2016-04-18 | 2021-07-13 | Sarepta Therapeutics, Inc. | Antisense oligomers and methods of using the same for treating diseases associated with the acid alpha-glucosidase gene |
| US11407775B2 (en) | 2016-03-13 | 2022-08-09 | Wave Life Sciences Ltd. | Compositions and methods for phosphoramidite and oligonucleotide synthesis |
| US11555189B2 (en) | 2017-10-18 | 2023-01-17 | Sarepta Therapeutics, Inc. | Antisense oligomer compounds |
| US11597927B2 (en) | 2017-06-02 | 2023-03-07 | Wave Life Sciences Ltd. | Oligonucleotide compositions and methods of use thereof |
| US11596646B2 (en) | 2017-10-12 | 2023-03-07 | Wave Life Sciences Ltd. | Oligonucleotide compositions and methods thereof |
| US11603532B2 (en) | 2017-06-02 | 2023-03-14 | Wave Life Sciences Ltd. | Oligonucleotide compositions and methods of use thereof |
| US11608355B2 (en) | 2017-09-18 | 2023-03-21 | Wave Life Sciences Ltd. | Technologies for oligonucleotide preparation |
| WO2023055774A1 (en) | 2021-09-30 | 2023-04-06 | Sarepta Therapeutics, Inc. | Antisense oligonucleotides having one or more abasic units |
| EP4219717A2 (en) | 2018-06-13 | 2023-08-02 | Sarepta Therapeutics, Inc. | Exon skipping oligomers for muscular dystrophy |
| US11718638B2 (en) | 2017-06-21 | 2023-08-08 | Wave Life Sciences Ltd. | Compounds, compositions and methods for synthesis |
| US11739325B2 (en) | 2017-08-08 | 2023-08-29 | Wave Life Sciences Ltd. | Oligonucleotide compositions and methods thereof |
| US11873316B2 (en) | 2016-11-23 | 2024-01-16 | Wave Life Sciences Ltd. | Compositions and methods for phosphoramidite and oligonucleotide synthesis |
| WO2024064237A2 (en) | 2022-09-21 | 2024-03-28 | Sarepta Therapeutics, Inc. | Dmd antisense oligonucleotide-mediated exon skipping efficiency |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US11591362B2 (en) | 2017-03-29 | 2023-02-28 | Roche Innovation Center Copenhagen A/S | Orthogonal protecting groups for the preparation of stereodefined phosphorothioate oligonucleotides |
| AU2020241559A1 (en) * | 2019-03-20 | 2021-11-11 | Wave Life Sciences Ltd. | Technologies useful for oligonucleotide preparation |
Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE1144279B (de) * | 1957-09-26 | 1963-02-28 | Robins Co Inc A H | Verfahren zur Herstellung von 3-Aryl-3-hydroxypyrrolidinen und deren Salzen |
| JPS61280473A (ja) * | 1985-02-01 | 1986-12-11 | ラボラトワ−ル エル ラフオン | 3−フエニル−テトラヒドロピリジン誘導体及びその製造方法 |
| WO2000023444A1 (en) * | 1998-10-21 | 2000-04-27 | Abbott Laboratories | 5,7-disubstituted-4-aminopyrido[2,3-d]pyrimidine compounds |
| JP2005089441A (ja) | 2003-08-08 | 2005-04-07 | Toudai Tlo Ltd | 立体規則性の高いリン原子修飾ヌクレオチド類縁体の製造法 |
| WO2010064146A2 (en) | 2008-12-02 | 2010-06-10 | Chiralgen, Ltd. | Method for the synthesis of phosphorus atom modified nucleic acids |
| WO2010106414A1 (en) | 2009-03-16 | 2010-09-23 | Nokia Corporation | A controller for a directional antenna and associated apparatus and methods |
| WO2011045702A1 (en) * | 2009-10-15 | 2011-04-21 | Pfizer Inc. | Pyrrolo[2,3-d] pyrimidine compounds |
Family Cites Families (678)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2878264A (en) * | 1959-03-17 | Substituted amino alcohols | ||
| DE133885C (ja) | ||||
| US3135766A (en) | 1961-10-03 | 1964-06-02 | Mead Johnson & Co | 3-substituted-3-pyrrolidinols |
| US3484473A (en) | 1967-05-12 | 1969-12-16 | Buckman Labor Inc | Methylene bisesters of thiolsulfonic acids |
| DE1934150A1 (de) | 1968-07-10 | 1970-01-15 | Pennwalt Corp | Neue 1-Alkanoyloxy-1,2,4,5-tetrahydro-3H,3-benzazepine |
| US3687808A (en) | 1969-08-14 | 1972-08-29 | Univ Leland Stanford Junior | Synthetic polynucleotides |
| US3745162A (en) * | 1970-08-31 | 1973-07-10 | Robins Co Inc A H | 1,2,3,4-tetrahydroisoquinoline-2-(thio)-carboxamides |
| GB1448437A (en) | 1973-02-24 | 1976-09-08 | Beecham Group Ltd | Diphenylpropylamines |
| US4022791A (en) * | 1975-06-03 | 1977-05-10 | Pfizer Inc. | 2-Aminomethyl-3,4-dihydronaphthalenes |
| GB1504424A (en) * | 1975-08-09 | 1978-03-22 | Beecham Group Ltd | Isoquinoline-derived aminoethers |
| BR7807288A (pt) | 1977-11-08 | 1979-06-12 | Genentech Inc | Processo para sintese de polinucleotidos |
| DD133885B1 (de) | 1978-01-04 | 1981-02-25 | Hans Lehmann | Mittel zur bekaempfung von phytopathogenen bakterien und pilzen |
| US5132418A (en) | 1980-02-29 | 1992-07-21 | University Patents, Inc. | Process for preparing polynucleotides |
| US4458066A (en) | 1980-02-29 | 1984-07-03 | University Patents, Inc. | Process for preparing polynucleotides |
| US4500707A (en) | 1980-02-29 | 1985-02-19 | University Patents, Inc. | Nucleosides useful in the preparation of polynucleotides |
| US4973679A (en) | 1981-03-27 | 1990-11-27 | University Patents, Inc. | Process for oligonucleo tide synthesis using phosphormidite intermediates |
| US4668777A (en) | 1981-03-27 | 1987-05-26 | University Patents, Inc. | Phosphoramidite nucleoside compounds |
| US4415732A (en) | 1981-03-27 | 1983-11-15 | University Patents, Inc. | Phosphoramidite compounds and processes |
| US4542142A (en) | 1982-11-22 | 1985-09-17 | Roussel Uclaf | Insecticidal cyclopropane carboxylic acid derivatives with 3-unsaturated-side chain |
| DE3329892A1 (de) | 1983-08-18 | 1985-03-07 | Köster, Hubert, Prof. Dr., 2000 Hamburg | Verfahren zur herstellung von oligonucleotiden |
| US5118800A (en) | 1983-12-20 | 1992-06-02 | California Institute Of Technology | Oligonucleotides possessing a primary amino group in the terminal nucleotide |
| US5643889A (en) | 1984-07-11 | 1997-07-01 | Temple University-Of The Commonwealth System Of Pennsylvania | Cholesterol conjugates of 2'5'-oligoadenylate derivatives and antiviral uses thereof |
| FR2567892B1 (fr) | 1984-07-19 | 1989-02-17 | Centre Nat Rech Scient | Nouveaux oligonucleotides, leur procede de preparation et leurs applications comme mediateurs dans le developpement des effets des interferons |
| US5367066A (en) | 1984-10-16 | 1994-11-22 | Chiron Corporation | Oligonucleotides with selectably cleavable and/or abasic sites |
| FR2575751B1 (fr) | 1985-01-08 | 1987-04-03 | Pasteur Institut | Nouveaux nucleosides de derives de l'adenosine, leur preparation et leurs applications biologiques |
| US4659774A (en) | 1985-11-01 | 1987-04-21 | American Hoechst Corporation | Support for solid-phase oligonucleotide synthesis |
| US4840956A (en) * | 1986-02-18 | 1989-06-20 | Warner-Lambert Company | Novel disubstituted-7-pyrrolidinoquinoline antibacterial agents |
| US4735949A (en) * | 1986-02-18 | 1988-04-05 | Warner-Lambert Company | Disubstituted-7-pyrrolidinonaphthyridine antibacterial agents |
| IL83663A0 (en) | 1986-10-27 | 1988-01-31 | Robins Co Inc A H | Preparation of 3-pyrrolidinols |
| JP2828642B2 (ja) | 1987-06-24 | 1998-11-25 | ハワード フローレイ インスティテュト オブ イクスペリメンタル フィジオロジー アンド メディシン | ヌクレオシド誘導体 |
| US5200553A (en) | 1987-07-30 | 1993-04-06 | Kupat Holim Health Insurance Institution Of The General Federation Of Labor | Biologically active carboxylic acid esters |
| US4923901A (en) | 1987-09-04 | 1990-05-08 | Millipore Corporation | Membranes with bound oligonucleotides and peptides |
| US5175273A (en) | 1988-07-01 | 1992-12-29 | Genentech, Inc. | Nucleic acid intercalating agents |
| US4945158A (en) | 1988-08-12 | 1990-07-31 | American Cyanamid Company | Antidiabetic phosphonates |
| US4943629A (en) | 1988-08-12 | 1990-07-24 | American Cyanamid Company | Antidiabetic alpha-substituted phosphonates |
| US5047524A (en) | 1988-12-21 | 1991-09-10 | Applied Biosystems, Inc. | Automated system for polynucleotide synthesis and purification |
| US5262530A (en) | 1988-12-21 | 1993-11-16 | Applied Biosystems, Inc. | Automated system for polynucleotide synthesis and purification |
| JP2794461B2 (ja) | 1989-08-17 | 1998-09-03 | 有機合成薬品工業株式会社 | ホスホアミダイト化合物及びそれを用いたオリゴリボヌクレオチドの固相合成法 |
| US5141813A (en) | 1989-08-28 | 1992-08-25 | Clontech Laboratories, Inc. | Multifunctional controlled pore glass reagent for solid phase oligonucleotide synthesis |
| US5134066A (en) | 1989-08-29 | 1992-07-28 | Monsanto Company | Improved probes using nucleosides containing 3-dezauracil analogs |
| CA2029273A1 (en) | 1989-12-04 | 1991-06-05 | Christine L. Brakel | Modified nucleotide compounds |
| WO1991009594A1 (en) * | 1989-12-28 | 1991-07-11 | Virginia Commonwealth University | Sigma receptor ligands and the use thereof |
| US5130302A (en) | 1989-12-20 | 1992-07-14 | Boron Bilogicals, Inc. | Boronated nucleoside, nucleotide and oligonucleotide compounds, compositions and methods for using same |
| US5646265A (en) | 1990-01-11 | 1997-07-08 | Isis Pharmceuticals, Inc. | Process for the preparation of 2'-O-alkyl purine phosphoramidites |
| US5587361A (en) | 1991-10-15 | 1996-12-24 | Isis Pharmaceuticals, Inc. | Oligonucleotides having phosphorothioate linkages of high chiral purity |
| HUT63170A (en) | 1990-01-11 | 1993-07-28 | Isis Pharmaceuticals Inc | Process and composition for detecting and modifying rna activity and gene expression |
| US5635488A (en) | 1991-10-15 | 1997-06-03 | Isis Pharmaceuticals, Inc. | Compounds having phosphorodithioate linkages of high chiral purity |
| US5914396A (en) | 1990-01-11 | 1999-06-22 | Isis Pharmaceuticals, Inc. | 2'-O-modified nucleosides and phosphoramidites |
| US5212295A (en) | 1990-01-11 | 1993-05-18 | Isis Pharmaceuticals | Monomers for preparation of oligonucleotides having chiral phosphorus linkages |
| US5457191A (en) | 1990-01-11 | 1995-10-10 | Isis Pharmaceuticals, Inc. | 3-deazapurines |
| US6339066B1 (en) | 1990-01-11 | 2002-01-15 | Isis Pharmaceuticals, Inc. | Antisense oligonucleotides which have phosphorothioate linkages of high chiral purity and which modulate βI, βII, γ, δ, Ε, ζ and η isoforms of human protein kinase C |
| US5620963A (en) | 1991-10-15 | 1997-04-15 | Isis Pharmaceuticals, Inc. | Oligonucleotides for modulating protein kinase C having phosphorothioate linkages of high chiral purity |
| US5506212A (en) | 1990-01-11 | 1996-04-09 | Isis Pharmaceuticals, Inc. | Oligonucleotides with substantially chirally pure phosphorothioate linkages |
| US5587470A (en) | 1990-01-11 | 1996-12-24 | Isis Pharmaceuticals, Inc. | 3-deazapurines |
| US5681941A (en) | 1990-01-11 | 1997-10-28 | Isis Pharmaceuticals, Inc. | Substituted purines and oligonucleotide cross-linking |
| US5459255A (en) | 1990-01-11 | 1995-10-17 | Isis Pharmaceuticals, Inc. | N-2 substituted purines |
| US7101993B1 (en) | 1990-01-11 | 2006-09-05 | Isis Pharmaceuticals, Inc. | Oligonucleotides containing 2′-O-modified purines |
| US5852188A (en) | 1990-01-11 | 1998-12-22 | Isis Pharmaceuticals, Inc. | Oligonucleotides having chiral phosphorus linkages |
| US5292875A (en) | 1990-04-20 | 1994-03-08 | Lynx Therapeutics, Inc. | Method of synthesizing sulfurized oligonucleotide analogs |
| US5151510A (en) | 1990-04-20 | 1992-09-29 | Applied Biosystems, Inc. | Method of synethesizing sulfurized oligonucleotide analogs |
| ES2139578T3 (es) | 1990-05-23 | 2000-02-16 | Isis Pharmaceuticals Inc | Composiciones y procedimiento para modular la actividad del arn mediante la modificacion de la estructura protectora 5' del arn. |
| US5783682A (en) | 1990-07-27 | 1998-07-21 | Isis Pharmaceuticals, Inc. | Oligonucleotide mimics having nitrogen-containing linkages |
| US5541307A (en) | 1990-07-27 | 1996-07-30 | Isis Pharmaceuticals, Inc. | Backbone modified oligonucleotide analogs and solid phase synthesis thereof |
| US5378825A (en) | 1990-07-27 | 1995-01-03 | Isis Pharmaceuticals, Inc. | Backbone modified oligonucleotide analogs |
| US5138045A (en) | 1990-07-27 | 1992-08-11 | Isis Pharmaceuticals | Polyamine conjugated oligonucleotides |
| US6121433A (en) | 1990-07-27 | 2000-09-19 | Isis Pharmaceuticals, Inc. | Oligomeric compounds having nitrogen-containing linkages |
| US5688941A (en) | 1990-07-27 | 1997-11-18 | Isis Pharmaceuticals, Inc. | Methods of making conjugated 4' desmethyl nucleoside analog compounds |
| US5602240A (en) | 1990-07-27 | 1997-02-11 | Ciba Geigy Ag. | Backbone modified oligonucleotide analogs |
| US5386023A (en) | 1990-07-27 | 1995-01-31 | Isis Pharmaceuticals | Backbone modified oligonucleotide analogs and preparation thereof through reductive coupling |
| CA2088258C (en) | 1990-07-27 | 2004-09-14 | Phillip Dan Cook | Nuclease resistant, pyrimidine modified oligonucleotides that detect and modulate gene expression |
| US5834607A (en) | 1990-07-27 | 1998-11-10 | Isis Pharmaceuticals, Inc. | Amines and methods of making and using the same |
| US5623070A (en) | 1990-07-27 | 1997-04-22 | Isis Pharmaceuticals, Inc. | Heteroatomic oligonucleoside linkages |
| US5608046A (en) | 1990-07-27 | 1997-03-04 | Isis Pharmaceuticals, Inc. | Conjugated 4'-desmethyl nucleoside analog compounds |
| US5610289A (en) | 1990-07-27 | 1997-03-11 | Isis Pharmaceuticals, Inc. | Backbone modified oligonucleotide analogues |
| US5677437A (en) | 1990-07-27 | 1997-10-14 | Isis Pharmaceuticals, Inc. | Heteroatomic oligonucleoside linkages |
| US6087482A (en) | 1990-07-27 | 2000-07-11 | Isis Pharmaceuticals, Inc. | Heteroatomic oligonucleoside linkages |
| US5618704A (en) | 1990-07-27 | 1997-04-08 | Isis Pharmacueticals, Inc. | Backbone-modified oligonucleotide analogs and preparation thereof through radical coupling |
| US5489677A (en) | 1990-07-27 | 1996-02-06 | Isis Pharmaceuticals, Inc. | Oligonucleoside linkages containing adjacent oxygen and nitrogen atoms |
| WO1994022886A1 (en) | 1993-03-30 | 1994-10-13 | Isis Pharmaceuticals, Inc. | Heteroatomic oligonucleoside linkages |
| US5998603A (en) | 1994-09-29 | 1999-12-07 | Isis Pharmaceuticals, Inc. | 4'-desmethyl nucleoside analogs, and oligomers thereof |
| US5223618A (en) | 1990-08-13 | 1993-06-29 | Isis Pharmaceuticals, Inc. | 4'-desmethyl nucleoside analog compounds |
| US5792844A (en) | 1990-07-27 | 1998-08-11 | Isis Pharmaceuticals, Inc. | Oligonucleoside linkages containing adjacent nitrogen atoms |
| US5432272A (en) | 1990-10-09 | 1995-07-11 | Benner; Steven A. | Method for incorporating into a DNA or RNA oligonucleotide using nucleotides bearing heterocyclic bases |
| US5512668A (en) | 1991-03-06 | 1996-04-30 | Polish Academy Of Sciences | Solid phase oligonucleotide synthesis using phospholane intermediates |
| US20020183502A1 (en) | 1991-05-21 | 2002-12-05 | Mesmaeker Alain De | Backbone-modified oligonucleotide analogs and methods for using same |
| US7015315B1 (en) | 1991-12-24 | 2006-03-21 | Isis Pharmaceuticals, Inc. | Gapped oligonucleotides |
| JPH04348077A (ja) | 1991-05-24 | 1992-12-03 | Nec Corp | 薄膜トランジスタ |
| US6414112B1 (en) | 1991-05-24 | 2002-07-02 | Ole Buchardt | Peptide nucleic acids having 2,6-diaminopurine nucleobases |
| CA2111108A1 (en) | 1991-06-10 | 1992-12-23 | Joong Myung Cho | Hepatitis c diagnostics and vaccines |
| US5359052A (en) | 1991-08-05 | 1994-10-25 | Polish Academy Of Sciences | Chalcophospholanes useful in the synthesis of oligonucleoside phosphorothioates, phosphorodithioates and related selenates |
| US5646267A (en) | 1991-08-05 | 1997-07-08 | Polish Academy Of Sciences | Method of making oligonucleotides and oligonucleotide analogs using phospholanes and enantiomerically resolved phospholane analogues |
| US7119184B2 (en) | 1991-08-12 | 2006-10-10 | Isis Pharmaceuticals, Inc. | Oligonucleotides having A-DNA form and B-DNA form conformational geometry |
| US6369209B1 (en) | 1999-05-03 | 2002-04-09 | Isis Pharmaceuticals, Inc. | Oligonucleotides having A-DNA form and B-DNA form conformational geometry |
| US5576302A (en) | 1991-10-15 | 1996-11-19 | Isis Pharmaceuticals, Inc. | Oligonucleotides for modulating hepatitis C virus having phosphorothioate linkages of high chiral purity |
| US5599797A (en) | 1991-10-15 | 1997-02-04 | Isis Pharmaceuticals, Inc. | Oligonucleotides having phosphorothioate linkages of high chiral purity |
| US5654284A (en) | 1991-10-15 | 1997-08-05 | Isis Pharmaceuticals, Inc. | Oligonucleotides for modulating RAF kinase having phosphorothioate linkages of high chiral purity |
| US5661134A (en) | 1991-10-15 | 1997-08-26 | Isis Pharmaceuticals, Inc. | Oligonucleotides for modulating Ha-ras or Ki-ras having phosphorothioate linkages of high chiral purity |
| AU2874892A (en) | 1991-10-15 | 1993-05-21 | Isis Pharmaceuticals, Inc. | Oligonucleotides having chiral phosphorus linkages |
| US5607923A (en) | 1991-10-15 | 1997-03-04 | Isis Pharmaceuticals, Inc. | Oligonucleotides for modulating cytomegalovirus having phosphorothioate linkages of high chiral purity |
| EP0538194B1 (de) | 1991-10-17 | 1997-06-04 | Novartis AG | Bicyclische Nukleoside, Oligonukleotide, Verfahren zu deren Herstellung und Zwischenprodukte |
| US5594121A (en) | 1991-11-07 | 1997-01-14 | Gilead Sciences, Inc. | Enhanced triple-helix and double-helix formation with oligomers containing modified purines |
| US5484908A (en) | 1991-11-26 | 1996-01-16 | Gilead Sciences, Inc. | Oligonucleotides containing 5-propynyl pyrimidines |
| US6235887B1 (en) | 1991-11-26 | 2001-05-22 | Isis Pharmaceuticals, Inc. | Enhanced triple-helix and double-helix formation directed by oligonucleotides containing modified pyrimidines |
| US5359044A (en) | 1991-12-13 | 1994-10-25 | Isis Pharmaceuticals | Cyclobutyl oligonucleotide surrogates |
| DE69232032T3 (de) | 1991-12-24 | 2012-09-13 | Isis Pharmaceutical, Inc. | Antisense oligonukleotide |
| GB9213601D0 (en) | 1992-06-26 | 1992-08-12 | Mastico Robert A | Protein based delivery system |
| US7067497B2 (en) | 1992-09-29 | 2006-06-27 | Isis Pharmaceuticals, Inc. | Modulation of telomere length by oligonucleotides having a G-core sequence |
| US6444656B1 (en) | 1992-12-23 | 2002-09-03 | Biochem Pharma, Inc. | Antiviral phosphonate nucleotides |
| US6005107A (en) | 1992-12-23 | 1999-12-21 | Biochem Pharma, Inc. | Antiviral compounds |
| DK0677056T3 (da) | 1993-01-25 | 1996-08-05 | Hybridon Inc | Oligonukleotid-alkylphosphonater og -alkylphosphonothioater |
| AU6551094A (en) | 1993-03-31 | 1994-10-24 | Sterling Winthrop Inc. | Bifunctional nucleosides, oligomers thereof, and methods of making and using the same |
| AU6449294A (en) | 1993-03-31 | 1994-10-24 | Sterling Winthrop Inc. | Novel 5'-substituted nucleosides and oligomers produced therefrom |
| US5955591A (en) | 1993-05-12 | 1999-09-21 | Imbach; Jean-Louis | Phosphotriester oligonucleotides, amidites and method of preparation |
| US6015886A (en) | 1993-05-24 | 2000-01-18 | Chemgenes Corporation | Oligonucleotide phosphate esters |
| DE69412704T2 (de) | 1993-06-10 | 1999-02-04 | Idemitsu Petrochemical Co | Spritzgiessform |
| US5502177A (en) | 1993-09-17 | 1996-03-26 | Gilead Sciences, Inc. | Pyrimidine derivatives for labeled binding partners |
| US5643989A (en) | 1993-10-29 | 1997-07-01 | Azdel, Inc. | Fiber reinforced functionalized polyolefin composites |
| US5457187A (en) | 1993-12-08 | 1995-10-10 | Board Of Regents University Of Nebraska | Oligonucleotides containing 5-fluorouracil |
| DE4435728A1 (de) | 1994-01-19 | 1995-07-20 | Boehringer Mannheim Gmbh | Biotinsilan-Verbindungen und diese Verbindungen enthaltende Bindematrix |
| US6117679A (en) | 1994-02-17 | 2000-09-12 | Maxygen, Inc. | Methods for generating polynucleotides having desired characteristics by iterative selection and recombination |
| KR970701264A (ko) | 1994-02-22 | 1997-03-17 | 안네 제케르 | 지질분해효소의 변이체 제조방법(a method of preparing a viriant of a lipolytic enzyme) |
| US5596091A (en) | 1994-03-18 | 1997-01-21 | The Regents Of The University Of California | Antisense oligonucleotides comprising 5-aminoalkyl pyrimidine nucleotides |
| EP0759073A1 (en) | 1994-05-11 | 1997-02-26 | Novo Nordisk A/S | AN ENZYME WITH ENDO-1,3(4)-$g(b)-GLUCANASE ACTIVITY |
| US5525711A (en) | 1994-05-18 | 1996-06-11 | The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Pteridine nucleotide analogs as fluorescent DNA probes |
| EP0685475B1 (en) | 1994-05-31 | 1999-01-13 | Bayer Ag | Amino-benzofuryl-and thienyl-derivatives |
| HRP950288A2 (en) | 1994-05-31 | 1997-08-31 | Bayer Ag | Oxalylamino-benzofuran- and benzothienyl-derivatives |
| US6239116B1 (en) | 1994-07-15 | 2001-05-29 | University Of Iowa Research Foundation | Immunostimulatory nucleic acid molecules |
| US6207646B1 (en) | 1994-07-15 | 2001-03-27 | University Of Iowa Research Foundation | Immunostimulatory nucleic acid molecules |
| JP3468773B2 (ja) | 1994-07-15 | 2003-11-17 | ザ ユニバーシティ オブ アイオワ リサーチ ファウンデーション | 免疫調節オリゴヌクレオチド |
| CA2199464A1 (en) | 1994-09-07 | 1996-03-14 | Radhakrishnan Iyer | Oligonucleotide prodrugs |
| US5681940A (en) | 1994-11-02 | 1997-10-28 | Icn Pharmaceuticals | Sugar modified nucleosides and oligonucleotides |
| WO1996019572A1 (en) | 1994-12-22 | 1996-06-27 | Hybridon, Inc. | Synthesis of stereospecific oligonucleotide phosphorothioates |
| GB9501465D0 (en) | 1995-01-25 | 1995-03-15 | King S College London | Nucleoside phosphorothioate derivatives,synthesis and use thereof |
| ATE327244T1 (de) | 1995-03-06 | 2006-06-15 | Isis Pharmaceuticals Inc | Verfahren zur synthese von 2'-0-substituierten pyrimidinen und oligomere davon |
| US6166197A (en) | 1995-03-06 | 2000-12-26 | Isis Pharmaceuticals, Inc. | Oligomeric compounds having pyrimidine nucleotide (S) with 2'and 5 substitutions |
| EP0739983B1 (en) | 1995-04-27 | 2009-12-30 | Takara Bio Inc. | Gene encoding lacto-n-biosidase |
| ATE271128T1 (de) | 1995-05-11 | 2004-07-15 | Applied Research Systems | Inhibitoren der il-6 aktivitaet |
| AU5855296A (en) | 1995-05-19 | 1996-11-29 | Glycomed Incorporated | Collection of activated glycoside compounds and their biolog ical use |
| EP0836612B1 (en) | 1995-05-23 | 2000-07-26 | Hybridon, Inc. | Novel synthons for stereoselective oligonucleotide synthesis |
| AU5871196A (en) | 1995-05-23 | 1996-12-24 | Hybridon, Inc. | Methods and compounds for the synthesis of oligonucleotides and the oligonucleotides thereby produced |
| WO1996039154A1 (en) | 1995-06-06 | 1996-12-12 | Isis Pharmaceuticals, Inc. | Oligonucleotides having phosphorothioate linkages of high chiral purity |
| US5932450A (en) | 1995-06-07 | 1999-08-03 | Gen-Probe Incorporated | Enzymatic synthesis of oligonucleotides using digestible templates |
| DE69635849T2 (de) | 1995-06-29 | 2006-10-19 | Takara Bio Inc., Otsu | Für Endoglycoceramidase kodierendes Gen |
| US5824503A (en) | 1995-06-29 | 1998-10-20 | Takara Shuzo Co, Ltd. | Gene encoding endoglycoceramidase activator |
| US6017700A (en) | 1995-08-04 | 2000-01-25 | Bayer Corporation | Cationic oligonucleotides, and related methods of synthesis and use |
| US5936080A (en) | 1996-05-24 | 1999-08-10 | Genta Incorporated | Compositions and methods for the synthesis of organophosphorus derivatives |
| WO1997009443A1 (en) | 1995-09-05 | 1997-03-13 | Michigan State University | PROCESS FOR THE ISOLATION AND PURIFICATION OF TAXOL AND TAXANES FROM TAXUS spp |
| US5734041A (en) | 1995-10-20 | 1998-03-31 | Mcgill University | Preparation of chiral phosphorothioate oligomers |
| US6476216B1 (en) | 1995-10-20 | 2002-11-05 | Mcgill University | Preparation of phosphorothioate oligomers |
| US6160109A (en) | 1995-10-20 | 2000-12-12 | Isis Pharmaceuticals, Inc. | Preparation of phosphorothioate and boranophosphate oligomers |
| US7018793B1 (en) | 1995-12-07 | 2006-03-28 | Diversa Corporation | Combinatorial screening of mixed populations of organisms |
| CA2246503A1 (en) | 1996-02-15 | 1997-08-21 | National Institutes Of Health | Rnase l activators and antisense oligonucleotides effective to treat rsv infections |
| US6214805B1 (en) | 1996-02-15 | 2001-04-10 | The United States Of America As Represented By The Department Of Health And Human Services | RNase L activators and antisense oligonucleotides effective to treat RSV infections |
| GB9604669D0 (en) | 1996-03-05 | 1996-05-01 | Ciba Geigy Ag | Chemical compounds |
| US5824669A (en) | 1996-03-22 | 1998-10-20 | Nitromed, Inc. | Nitrosated and nitrosylated compounds and compositions and their use for treating respiratory disorders |
| ATE377074T1 (de) | 1996-05-10 | 2007-11-15 | Novozymes As | Methode zur bereitstellung von dna sequenzen |
| US5856465A (en) | 1996-05-24 | 1999-01-05 | Polska Akademia Nauk Centrum Badan Molekularnych I Makromolekularnych | Compositions and methods for the synthesis of chirally pure organophosphorus nucleoside derivatives |
| US5898031A (en) | 1996-06-06 | 1999-04-27 | Isis Pharmaceuticals, Inc. | Oligoribonucleotides for cleaving RNA |
| DE19622783A1 (de) | 1996-06-07 | 1997-12-11 | Hoechst Ag | Isolierung der Biosynthesegene für Pseudo-Oligosaccharide aus Streptomyces glaucescens GLA.O und ihre Verwendung |
| US6130038A (en) | 1996-07-16 | 2000-10-10 | Gen-Probe Incorporated | Method for amplifying target nucleic acids using modified primers |
| DE69734783T2 (de) | 1996-07-24 | 2006-08-17 | Buchardt, Dorte | Peptidnukleinsäuren mit erhöhter bindungsaffinität, sequenzspezifität und löslichkeit |
| AU4156197A (en) | 1996-08-21 | 1998-03-06 | Hybridon, Inc. | Oligonucleotide prodrugs |
| US6056973A (en) | 1996-10-11 | 2000-05-02 | Sequus Pharmaceuticals, Inc. | Therapeutic liposome composition and method of preparation |
| GB9621522D0 (en) | 1996-10-16 | 1996-12-04 | Biocompatibles Ltd | Synthesis of phosphorus compounds |
| US6172209B1 (en) | 1997-02-14 | 2001-01-09 | Isis Pharmaceuticals Inc. | Aminooxy-modified oligonucleotides and methods for making same |
| US6639062B2 (en) | 1997-02-14 | 2003-10-28 | Isis Pharmaceuticals, Inc. | Aminooxy-modified nucleosidic compounds and oligomeric compounds prepared therefrom |
| US6369237B1 (en) | 1997-03-07 | 2002-04-09 | President And Fellows Of Harvard College | DNA glycosylase inhibitors, and uses related thereto |
| US6015887A (en) | 1997-04-11 | 2000-01-18 | Isis Pharmaceuticals, Inc. | Chiral peptide nucleic acids and methods for preparing same |
| US6468983B2 (en) | 1997-04-21 | 2002-10-22 | The Cleveland Clinic Foundation | RNase L activators and antisense oligonucleotides effective to treat telomerase-expressing malignancies |
| PL184612B1 (pl) | 1997-04-25 | 2002-11-29 | Pan | Sposób wytwarzania modyfikowanych P chiralnych analogów nukleotydów |
| NZ501289A (en) | 1997-05-28 | 2001-06-29 | Nielsen Peter E | Conjugated peptide nucleic acids having enhanced cellular uptake |
| WO1999000377A1 (en) | 1997-06-27 | 1999-01-07 | The Procter & Gamble Company | Pro-fragrance cyclic acetals |
| AU8512598A (en) | 1997-07-25 | 1999-02-16 | Hybridon, Inc. | Oligonuclotides having 3' terminal stereospecific phosphorothioates |
| US6767739B2 (en) | 2001-07-30 | 2004-07-27 | Isis Pharmaceuticals Inc. | Antisense modulation of microsomal triglyceride transfer protein expression |
| US6383808B1 (en) | 2000-09-11 | 2002-05-07 | Isis Pharmaceuticals, Inc. | Antisense inhibition of clusterin expression |
| GB9717158D0 (en) | 1997-08-13 | 1997-10-22 | King S College London | Solution synthesis of oligonucleotides and their phosphorothioate analogues |
| US6750344B1 (en) | 1997-09-05 | 2004-06-15 | Isis Pharmaceuticals, Inc. | Amine compounds and combinatorial libraries comprising same |
| US6794499B2 (en) | 1997-09-12 | 2004-09-21 | Exiqon A/S | Oligonucleotide analogues |
| DE19741715A1 (de) | 1997-09-22 | 1999-03-25 | Hoechst Ag | Pentopyranosyl-Nucleosid, seine Herstellung und Verwendung |
| US6232463B1 (en) | 1997-10-09 | 2001-05-15 | Isis Pharmaceuticals, Inc. | Substituted purines and oligonucleotide cross-linking |
| US6528640B1 (en) | 1997-11-05 | 2003-03-04 | Ribozyme Pharmaceuticals, Incorporated | Synthetic ribonucleic acids with RNAse activity |
| US6617438B1 (en) | 1997-11-05 | 2003-09-09 | Sirna Therapeutics, Inc. | Oligoribonucleotides with enzymatic activity |
| US6080543A (en) | 1997-12-08 | 2000-06-27 | E. & J. Gallo Winery | Detection of fungal pathogens |
| US6582936B1 (en) | 1997-12-12 | 2003-06-24 | The Regents Of The University Of California | Methods for making nucleic acids |
| US6248519B1 (en) | 1998-03-11 | 2001-06-19 | E & J Gallo Winery | Detection of fermentation-related microorganisms |
| US7045610B2 (en) | 1998-04-03 | 2006-05-16 | Epoch Biosciences, Inc. | Modified oligonucleotides for mismatch discrimination |
| WO1999056755A1 (en) | 1998-05-06 | 1999-11-11 | University Of Iowa Research Foundation | Methods for the prevention and treatment of parasitic infections and related diseases using cpg oligonucleotides |
| AU760795B2 (en) | 1998-05-14 | 2003-05-22 | Coley Pharmaceutical Gmbh | Methods for regulating hematopoiesis using CpG-oligonucleotides |
| US6867294B1 (en) | 1998-07-14 | 2005-03-15 | Isis Pharmaceuticals, Inc. | Gapped oligomers having site specific chiral phosphorothioate internucleoside linkages |
| US6242589B1 (en) | 1998-07-14 | 2001-06-05 | Isis Pharmaceuticals, Inc. | Phosphorothioate oligonucleotides having modified internucleoside linkages |
| JP2002521489A (ja) | 1998-07-27 | 2002-07-16 | ユニバーシティ オブ アイオワ リサーチ ファウンデーション | CpGオリゴヌクレオチドの立体異性体および関連する方法 |
| US7049302B1 (en) | 1998-08-10 | 2006-05-23 | Antigenics Inc. | Compositions of CPG and saponin adjuvants and uses thereof |
| US6995259B1 (en) | 1998-10-23 | 2006-02-07 | Sirna Therapeutics, Inc. | Method for the chemical synthesis of oligonucleotides |
| US6451524B1 (en) | 1998-11-25 | 2002-09-17 | Isis Pharmaceuticals, Inc. | Identification of disease predictive nucleic acids |
| AU1742600A (en) | 1998-11-25 | 2000-06-13 | Isis Pharmaceuticals, Inc. | Identification of disease predictive nucleic acids |
| DE69941223D1 (de) | 1998-12-21 | 2009-09-17 | Billig Fritz | Chemisch modifizierte enzymen mit mehrfachgeladenen varianten |
| AU1853600A (en) | 1999-01-06 | 2000-07-24 | Choong-Chin Liew | Method for the detection of gene transcripts in blood and uses thereof |
| US6265172B1 (en) | 1999-02-08 | 2001-07-24 | University Of Kentucky | Diagnostic test and therapy for manganese superoxide dismutate (mNsod) associated diseases |
| US6121437A (en) | 1999-03-16 | 2000-09-19 | Isis Pharmaceuticals, Inc. | Phosphate and thiophosphate protecting groups |
| US6506594B1 (en) | 1999-03-19 | 2003-01-14 | Cornell Res Foundation Inc | Detection of nucleic acid sequence differences using the ligase detection reaction with addressable arrays |
| GB9907245D0 (en) | 1999-03-29 | 1999-05-26 | Goldsborough Andrew | Cleavage of nucleic acids from solid supports |
| JP3072345B1 (ja) | 1999-03-31 | 2000-07-31 | 農林水産省家畜衛生試験場長 | 豚丹毒菌の組換えサブユニットワクチン |
| US5998148A (en) | 1999-04-08 | 1999-12-07 | Isis Pharmaceuticals Inc. | Antisense modulation of microtubule-associated protein 4 expression |
| US6977245B2 (en) | 1999-04-12 | 2005-12-20 | The United States Of America As Represented By The Department Of Health And Human Services | Oligodeoxynucleotide and its use to induce an immune response |
| US6300069B1 (en) | 1999-05-03 | 2001-10-09 | Qiagen Gmbh | Generation and amplification of nucleic acids from ribonucleic acids |
| US6656730B1 (en) | 1999-06-15 | 2003-12-02 | Isis Pharmaceuticals, Inc. | Oligonucleotides conjugated to protein-binding drugs |
| US6271004B1 (en) | 1999-06-25 | 2001-08-07 | Display Systems Biotech A/S | Method for improved reverse transcription at high temperatures |
| US6066500A (en) | 1999-06-25 | 2000-05-23 | Isis Pharmaceuticals Inc. | Antisense modulation of Beta catenin expression |
| US6414135B1 (en) | 1999-07-07 | 2002-07-02 | Isis Pharmaceuticals, Inc. | C3′-methylene hydrogen phosphonate monomers and related compounds |
| US20030092647A1 (en) | 2001-08-08 | 2003-05-15 | Crooke Rosanne M. | Antisense modulation of cholesteryl ester transfer protein expression |
| US6147200A (en) | 1999-08-19 | 2000-11-14 | Isis Pharmaceuticals, Inc. | 2'-O-acetamido modified monomers and oligomers |
| US7264932B2 (en) | 1999-09-24 | 2007-09-04 | Applera Corporation | Nuclease inhibitor cocktail |
| EP1700603A3 (en) | 1999-09-25 | 2007-06-13 | Coley Pharmaceutical GmbH | Immunostimulatory nucleic acids |
| JP2003510290A (ja) | 1999-09-27 | 2003-03-18 | コーリー ファーマシューティカル グループ,インコーポレイテッド | 免疫刺激核酸誘導インターフェロンに関する方法 |
| US6949520B1 (en) | 1999-09-27 | 2005-09-27 | Coley Pharmaceutical Group, Inc. | Methods related to immunostimulatory nucleic acid-induced interferon |
| US20020082227A1 (en) | 1999-09-30 | 2002-06-27 | Scott Henry | Use of oligonucleotides for inhibition of complement activation |
| WO2001025488A2 (en) | 1999-10-06 | 2001-04-12 | Quark Biotech, Inc. | Method for enrichment of natural antisense messenger rna |
| GB9924285D0 (en) | 1999-10-14 | 1999-12-15 | Avecia Ltd | Process |
| US20010055761A1 (en) | 1999-10-29 | 2001-12-27 | Agilent Technologies | Small scale dna synthesis using polymeric solid support with functionalized regions |
| FR2800750B1 (fr) * | 1999-11-05 | 2003-01-31 | Centre Nat Rech Scient | Proteines membranaires ctl (choline transporter like) impliquees dans le transport de la choline |
| AU1656601A (en) | 1999-11-12 | 2001-06-12 | Isis Pharmaceuticals, Inc. | Gapped oligomers having site specific chiral phosphorothioate internucleoside linkages |
| US6322985B1 (en) | 1999-12-27 | 2001-11-27 | Technion Research And Development Foundation Ltd. | Abundant, well distributed and hyperpolymorphic simple sequence repeats in prokaryote genomes and use of same for prokaryote classification and typing |
| EP1244906A1 (en) | 1999-12-30 | 2002-10-02 | Cabot Corporation | Sensors with improved properties |
| WO2001050349A1 (en) | 1999-12-30 | 2001-07-12 | Rutgers, The State University Of New Jersey | Electronic document customization and transformation utilizing user feedback |
| US6649750B1 (en) | 2000-01-05 | 2003-11-18 | Isis Pharmaceuticals, Inc. | Process for the preparation of oligonucleotide compounds |
| US6159697A (en) | 2000-01-19 | 2000-12-12 | Isis Pharmaceuticals, Inc. | Antisense modulation of Smad7 expression |
| US7585847B2 (en) | 2000-02-03 | 2009-09-08 | Coley Pharmaceutical Group, Inc. | Immunostimulatory nucleic acids for the treatment of asthma and allergy |
| US6495677B1 (en) | 2000-02-15 | 2002-12-17 | Kanda S. Ramasamy | Nucleoside compounds |
| EP1130091A3 (en) | 2000-03-01 | 2001-11-14 | Message Pharmaceuticals, Inc. | Bacterial RNaseP Proteins and their use in identifying antibacterial compounds |
| GB0004889D0 (en) | 2000-03-01 | 2000-04-19 | Avecia Ltd | Synthesis of oligonucleotides |
| WO2001070663A2 (en) | 2000-03-17 | 2001-09-27 | Corixa Corporation | Novel amphipathic aldehydes and their use as adjuvants and immunoeffectors |
| EP1278728B1 (en) * | 2000-04-20 | 2004-08-25 | F. Hoffmann-La Roche Ag | Pyrrolidine and piperidine derivatives and their use for the treatment of neurodegenerative disorders |
| DE10019756A1 (de) | 2000-04-20 | 2001-10-25 | Bayer Ag | Verfahren zur Herstellung von superabsorbierenden Polymeren aus Polyacrylnitrilen |
| US20020013287A1 (en) | 2000-05-09 | 2002-01-31 | Reliable Biopharmaceuticals, Inc. St Louis Missouri | Polymeric compounds useful as prodrugs |
| US6492171B2 (en) | 2000-05-16 | 2002-12-10 | Isis Pharmaceuticals, Inc. | Antisense modulation of TERT expression |
| US6815542B2 (en) | 2000-06-16 | 2004-11-09 | Ribapharm, Inc. | Nucleoside compounds and uses thereof |
| WO2002012263A1 (en) | 2000-08-03 | 2002-02-14 | Roche Diagnostics Gmbh | Nucleic acid binding compounds containing pyrazolo[3,4-d]pyrimidine analogues of purin-2,6-diamine and their uses |
| US6725412B1 (en) | 2000-08-15 | 2004-04-20 | Dolby Laboratories Licensing Corporation | Low latency data encoder |
| US6809195B1 (en) | 2000-08-16 | 2004-10-26 | Isis Pharmaceuticals, Inc. | Process for the preparation of oligonucleotides |
| US6559279B1 (en) | 2000-09-08 | 2003-05-06 | Isis Pharmaceuticals, Inc. | Process for preparing peptide derivatized oligomeric compounds |
| JP2005500806A (ja) | 2000-09-15 | 2005-01-13 | コーリー ファーマシューティカル ゲーエムベーハー | CpGに基づく免疫アゴニスト/免疫アンタゴニストの高スループットスクリーニングのためのプロセス |
| EP1191097A1 (en) | 2000-09-21 | 2002-03-27 | Leids Universitair Medisch Centrum | Induction of exon skipping in eukaryotic cells |
| GB0024752D0 (en) | 2000-10-10 | 2000-11-22 | Univ Belfast | Oxidative halogenation of aromatic compounds |
| KR100860893B1 (ko) | 2000-10-18 | 2008-09-29 | 글락소스미스클라인 바이오로지칼즈 에스.에이. | 백신 |
| US6372492B1 (en) | 2000-10-30 | 2002-04-16 | Isis Pharmaceuticals, Inc. | Antisense modulation of talin expression |
| US6682889B1 (en) | 2000-11-08 | 2004-01-27 | Becton, Dickinson And Company | Amplification and detection of organisms of the Chlamydiaceae family |
| NL1016978C2 (nl) | 2000-12-22 | 2002-06-25 | Robert Jan Colenbrander | Inrichting en werkwijze voor het verpakken en bereiden van voedsel en werkwijze voor het vervaardigen van een dergelijke inrichting. |
| PL207405B1 (pl) | 2001-01-22 | 2010-12-31 | Isis Pharmaceuticals Inc | Pochodne nukleozydów, zawierająca je kompozycja farmaceutyczna i ich zastosowanie |
| US8008459B2 (en) | 2001-01-25 | 2011-08-30 | Evolva Sa | Concatemers of differentially expressed multiple genes |
| AU2002227883A1 (en) | 2001-01-25 | 2002-08-06 | Evolva Biotech A/S | A library of a collection of cells |
| EP1354035B1 (en) | 2001-01-26 | 2016-08-24 | Commonwealth Scientific and Industrial Research Organisation | Methods and means for producing efficient silencing construct using recombinational cloning |
| US20050277133A1 (en) | 2001-05-18 | 2005-12-15 | Sirna Therapeutics, Inc. | RNA interference mediated treatment of polyglutamine (polyQ) repeat expansion diseases using short interfering nucleic acid (siNA) |
| US20030207804A1 (en) | 2001-05-25 | 2003-11-06 | Muthiah Manoharan | Modified peptide nucleic acids |
| GB0113523D0 (en) | 2001-06-04 | 2001-07-25 | Torotrak Dev Ltd | An Hydraulic control circuit for a continuosly variable transmission |
| US20030069410A1 (en) | 2001-06-14 | 2003-04-10 | Isis Pharmaceuticals, Inc. | Methods for preparing oligonucleotides having chiral phosphorothioate linkages |
| US20050019915A1 (en) | 2001-06-21 | 2005-01-27 | Bennett C. Frank | Antisense modulation of superoxide dismutase 1, soluble expression |
| AU2002322358B2 (en) | 2001-06-29 | 2009-06-18 | Novartis Vaccines And Diagnostics, Inc. | HCV E1E2 vaccine compositions |
| EP1499627A2 (en) | 2001-07-03 | 2005-01-26 | ISIS Pharmaceuticals, Inc. | Nuclease resistant chimeric oligonucleotides |
| US7205399B1 (en) | 2001-07-06 | 2007-04-17 | Sirna Therapeutics, Inc. | Methods and reagents for oligonucleotide synthesis |
| US6440739B1 (en) | 2001-07-17 | 2002-08-27 | Isis Pharmaceuticals, Inc. | Antisense modulation of glioma-associated oncogene-2 expression |
| US7425545B2 (en) | 2001-07-25 | 2008-09-16 | Isis Pharmaceuticals, Inc. | Modulation of C-reactive protein expression |
| US6455308B1 (en) | 2001-08-01 | 2002-09-24 | Isis Pharmaceuticals, Inc. | Antisense modulation of serum amyloid A4 expression |
| US7888324B2 (en) | 2001-08-01 | 2011-02-15 | Genzyme Corporation | Antisense modulation of apolipoprotein B expression |
| US7407943B2 (en) | 2001-08-01 | 2008-08-05 | Isis Pharmaceuticals, Inc. | Antisense modulation of apolipoprotein B expression |
| US7227014B2 (en) | 2001-08-07 | 2007-06-05 | Isis Pharmaceuticals, Inc. | Antisense modulation of apolipoprotein (a) expression |
| US7259150B2 (en) | 2001-08-07 | 2007-08-21 | Isis Pharmaceuticals, Inc. | Modulation of apolipoprotein (a) expression |
| AU2002361468A1 (en) | 2001-08-14 | 2003-03-18 | The Government Of The United States Of America As Represented By The Secretary Of Health And Human S | Method for rapid generation of mature dendritic cells |
| EP1418877A2 (en) | 2001-08-24 | 2004-05-19 | Massachusetts Institute Of Technology | Reagents that facilitate the purification of compounds synthesized on a solid support |
| US7049122B2 (en) | 2001-09-21 | 2006-05-23 | Academia Sinica | Mutant-type lipases and applications thereof |
| US6933288B2 (en) | 2002-02-04 | 2005-08-23 | Isis Pharmaceuticals, Inc. | Pyranosyl cytosines: pharmaceutical formulations and methods |
| JP4348044B2 (ja) | 2002-02-12 | 2009-10-21 | 株式会社キラルジェン | 立体規則性の高いジヌクレオシドホスホロチオエートの製造法 |
| US20030159938A1 (en) | 2002-02-15 | 2003-08-28 | George Hradil | Electroplating solution containing organic acid complexing agent |
| US20040149587A1 (en) | 2002-02-15 | 2004-08-05 | George Hradil | Electroplating solution containing organic acid complexing agent |
| US8232383B2 (en) | 2002-02-20 | 2012-07-31 | Sirna Therapeutics, Inc. | RNA interference mediated inhibition of gene expression using chemically modified short interfering nucleic acid (siNA) |
| US20050096284A1 (en) | 2002-02-20 | 2005-05-05 | Sirna Therapeutics, Inc. | RNA interference mediated treatment of polyglutamine (polyQ) repeat expansion diseases using short interfering nucleic acid (siNA) |
| CA2477795A1 (en) | 2002-02-28 | 2003-09-12 | Kandasamy Sakthivel | Nucleoside 5'-monophosphate mimics and their prodrugs |
| US7285658B2 (en) | 2002-02-28 | 2007-10-23 | Biota, Inc. | Nucleotide mimics and their prodrugs |
| US7288376B2 (en) | 2002-03-22 | 2007-10-30 | Council Of Scientific And Industrial Research | Method of detection of SP-A2 gene variants useful for prediction of predisposition to aspergillosis |
| US20040102394A1 (en) | 2002-11-23 | 2004-05-27 | Isis Pharmaceuticals Inc. | Modulation of huntingtin interacting protein 2 expression |
| US7247621B2 (en) | 2002-04-30 | 2007-07-24 | Valeant Research & Development | Antiviral phosphonate compounds and methods therefor |
| WO2003097662A1 (en) | 2002-05-15 | 2003-11-27 | Isis Pharmaceuticals, Inc. | Antisense modulation of apolipoprotein b expression |
| US20040014957A1 (en) | 2002-05-24 | 2004-01-22 | Anne Eldrup | Oligonucleotides having modified nucleoside units |
| US20040014108A1 (en) | 2002-05-24 | 2004-01-22 | Eldrup Anne B. | Oligonucleotides having modified nucleoside units |
| US7507808B2 (en) | 2002-12-12 | 2009-03-24 | Isis Pharmaceuticals, Inc. | Modulation of endothelial lipase expression |
| WO2003106477A1 (en) | 2002-06-01 | 2003-12-24 | Isis Pharmaceuticals, Inc. | Oligomeric compounds that include carbocyclic nucleosides and their use in gene modulation |
| CN1662253A (zh) | 2002-06-20 | 2005-08-31 | 赛托斯生物技术公司 | 用作佐剂的包装的病毒样颗粒:制备方法与用途 |
| WO2004003228A1 (en) | 2002-07-01 | 2004-01-08 | Unisearch Limited | Genotyping method |
| EP2333062A1 (en) | 2002-07-10 | 2011-06-15 | Max-Planck-Gesellschaft zur Förderung der Wissenschaften e.V. | RNA-interference by single-stranded RNA molecules |
| US20040023905A1 (en) | 2002-07-31 | 2004-02-05 | Isis Pharmaceuticals Inc. | Antisense modulation of LAR expression |
| US20080274989A1 (en) | 2002-08-05 | 2008-11-06 | University Of Iowa Research Foundation | Rna Interference Suppression of Neurodegenerative Diseases and Methods of Use Thereof |
| US20050255086A1 (en) | 2002-08-05 | 2005-11-17 | Davidson Beverly L | Nucleic acid silencing of Huntington's Disease gene |
| US20050042646A1 (en) | 2002-08-05 | 2005-02-24 | Davidson Beverly L. | RNA interference suppresion of neurodegenerative diseases and methods of use thereof |
| AU2003261449A1 (en) | 2002-08-07 | 2004-02-25 | Compositions for rna interference and methods of use thereof | |
| WO2004014312A2 (en) | 2002-08-08 | 2004-02-19 | Sirna Therapeutics, Inc. | Small-mer compositions and methods of use |
| AR040996A1 (es) | 2002-08-19 | 2005-04-27 | Coley Pharm Group Inc | Acidos nucleicos inmunoestimuladores |
| UA88255C2 (en) | 2002-08-19 | 2009-10-12 | Коли Фармасьютикал Групп, Инк. | Immunostimulatory oligonucleotide |
| US7414116B2 (en) | 2002-08-23 | 2008-08-19 | Illumina Cambridge Limited | Labelled nucleotides |
| CA2498777C (en) | 2002-09-13 | 2015-01-13 | Replicor, Inc. | Non-sequence complementary antiviral oligonucleotides |
| US7030230B2 (en) | 2002-10-25 | 2006-04-18 | Isis Pharmaceuticals, Inc. | Process of purifying phosphoramidites |
| DE20216677U1 (de) | 2002-10-29 | 2003-03-13 | Trw Automotive Electron & Comp | Luftausströmer mit Getränkehalter |
| SI2241325T1 (sl) | 2002-10-29 | 2012-05-31 | Coley Pharm Group Inc | Uporaba CPG oligonukleotidov pri zdravljenju okužbe z virusom hepatitisa C |
| WO2004044136A2 (en) | 2002-11-05 | 2004-05-27 | Isis Pharmaceuticals, Inc. | Compositions comprising alternating 2’-modified nucleosides for use in gene modulation |
| WO2004041889A2 (en) | 2002-11-05 | 2004-05-21 | Isis Pharmaceuticals, Inc. | Polycyclic sugar surrogate-containing oligomeric compounds and compositions for use in gene modulation |
| AU2003295389A1 (en) | 2002-11-05 | 2004-06-03 | Isis Pharmaceuticals, Inc. | Conjugated oligomeric compounds and their use in gene modulation |
| WO2004044134A2 (en) | 2002-11-05 | 2004-05-27 | Isis Pharmaceuticals, Inc. | Phosphorous-linked oligomeric compounds and their use in gene modulation |
| US7381527B2 (en) | 2002-11-06 | 2008-06-03 | Council Of Scientific And Industrial Research | Method of detection of SP-A2 gene variants |
| US7511131B2 (en) | 2002-11-13 | 2009-03-31 | Genzyme Corporation | Antisense modulation of apolipoprotein B expression |
| EP1569695B1 (en) | 2002-11-13 | 2013-05-15 | Genzyme Corporation | Antisense modulation of apolipoprotein b expression |
| PT2284266E (pt) | 2002-11-14 | 2013-12-17 | Thermo Fisher Scient Biosciences Inc | Siarn contra tp53 |
| CA2518475C (en) | 2003-03-07 | 2014-12-23 | Alnylam Pharmaceuticals, Inc. | Irna agents comprising asymmetrical modifications |
| WO2004080466A1 (en) | 2003-03-07 | 2004-09-23 | Ribapharm Inc. | Cytidine analogs and methods of use |
| WO2004083432A1 (en) | 2003-03-21 | 2004-09-30 | Academisch Ziekenhuis Leiden | Modulation of exon recognition in pre-mrna by interfering with the secondary rna structure |
| GB0306657D0 (en) | 2003-03-24 | 2003-04-30 | Avecia Ltd | Process and compounds |
| KR20050115913A (ko) | 2003-03-26 | 2005-12-08 | 사이토스 바이오테크놀로지 아게 | Melan―a 펩티드 유사체-바이러스-양-입자컨쥬게이트 |
| US7537767B2 (en) | 2003-03-26 | 2009-05-26 | Cytis Biotechnology Ag | Melan-A- carrier conjugates |
| ITRM20030149A1 (it) | 2003-04-02 | 2004-10-03 | Giuliani Spa | Oligonucleotidi (odn) antisenso per smad7 e loro usi in campo medico |
| US7598227B2 (en) | 2003-04-16 | 2009-10-06 | Isis Pharmaceuticals Inc. | Modulation of apolipoprotein C-III expression |
| US20090247488A1 (en) | 2003-04-25 | 2009-10-01 | Carina Cannizzaro | Anti-inflammatory phosphonate compounds |
| CN101410120A (zh) | 2003-04-25 | 2009-04-15 | 吉里德科学公司 | 抗炎的膦酸酯化合物 |
| US7407965B2 (en) | 2003-04-25 | 2008-08-05 | Gilead Sciences, Inc. | Phosphonate analogs for treating metabolic diseases |
| US7432261B2 (en) | 2003-04-25 | 2008-10-07 | Gilead Sciences, Inc. | Anti-inflammatory phosphonate compounds |
| EP1617848A2 (en) | 2003-04-25 | 2006-01-25 | Gilead Sciences, Inc. | Anti-cancer phosphonate conjugates |
| WO2005002626A2 (en) | 2003-04-25 | 2005-01-13 | Gilead Sciences, Inc. | Therapeutic phosphonate compounds |
| US7470724B2 (en) | 2003-04-25 | 2008-12-30 | Gilead Sciences, Inc. | Phosphonate compounds having immuno-modulatory activity |
| US7452901B2 (en) | 2003-04-25 | 2008-11-18 | Gilead Sciences, Inc. | Anti-cancer phosphonate analogs |
| WO2004096233A2 (en) | 2003-04-25 | 2004-11-11 | Gilead Sciences, Inc. | Nucleoside phosphonate conjugates |
| US20050261237A1 (en) | 2003-04-25 | 2005-11-24 | Boojamra Constantine G | Nucleoside phosphonate analogs |
| SG182849A1 (en) | 2003-04-25 | 2012-08-30 | Gilead Sciences Inc | Antiviral phosphonate analogs |
| US7045306B2 (en) | 2003-04-28 | 2006-05-16 | The General Hospital Corporation | Method for identifying compounds in vitro that modulate the dysregulation of transcription of transcription mediated by mutant huntingtin protein |
| US7214491B2 (en) | 2003-05-07 | 2007-05-08 | E. I. Du Pont De Nemours And Company | Δ-12 desaturase gene suitable for altering levels of polyunsaturated fatty acids in oleaginous yeasts |
| AU2004239114B2 (en) | 2003-05-14 | 2008-03-13 | Japan Science And Technology Agency | Inhibition of the expression of huntingtin gene |
| JP4579911B2 (ja) | 2003-06-03 | 2010-11-10 | アイシス・ファーマシューティカルズ・インコーポレイテッド | スルビビン発現の調節 |
| AU2004257149A1 (en) | 2003-06-20 | 2005-01-27 | Coley Pharmaceutical Gmbh | Small molecule toll-like receptor (TLR) antagonists |
| US7683036B2 (en) | 2003-07-31 | 2010-03-23 | Regulus Therapeutics Inc. | Oligomeric compounds and compositions for use in modulation of small non-coding RNAs |
| JP2011088935A (ja) | 2003-08-08 | 2011-05-06 | Chiralgen Ltd | リン原子修飾ヌクレオチド類縁体の製造のための光学活性ヌクレオシド3’−ホスホロアミダイト |
| US7825235B2 (en) | 2003-08-18 | 2010-11-02 | Isis Pharmaceuticals, Inc. | Modulation of diacylglycerol acyltransferase 2 expression |
| CA2535802A1 (en) | 2003-08-21 | 2005-03-03 | Griffith University | Novel sulfenamides |
| RU2006108577A (ru) | 2003-08-21 | 2007-09-27 | Гриффит Юниверсити (Au) | Новые сульфенамиды |
| AU2004269026B2 (en) | 2003-08-27 | 2010-02-25 | Biota Scientific Management Pty Ltd | Novel tricyclic nucleosides or nucleotides as therapeutic agents |
| ATE555118T1 (de) | 2003-08-28 | 2012-05-15 | Takeshi Imanishi | Neue synthetische nukleidsäuren vom typ mit quervernetzter n-o-bindung |
| WO2005028494A1 (ja) | 2003-09-02 | 2005-03-31 | Takeshi Wada | 5'-ホスフィチル化モノマーおよびh-ホスホネートオリゴヌクレオチド誘導体の製造方法 |
| WO2005023828A1 (ja) | 2003-09-02 | 2005-03-17 | Takeshi Wada | リボヌクレオチド又はリボヌクレオチド誘導体の製造方法 |
| US20050053981A1 (en) | 2003-09-09 | 2005-03-10 | Swayze Eric E. | Gapped oligomeric compounds having linked bicyclic sugar moieties at the termini |
| US20050074801A1 (en) | 2003-09-09 | 2005-04-07 | Monia Brett P. | Chimeric oligomeric compounds comprising alternating regions of northern and southern conformational geometry |
| ES2662196T3 (es) | 2003-09-09 | 2018-04-05 | Geron Corporation | Oligonucleótidos modificados para la inhibición de la telomerasa |
| US8680063B2 (en) | 2003-09-12 | 2014-03-25 | University Of Massachusetts | RNA interference for the treatment of gain-of-function disorders |
| ES2808561T3 (es) | 2003-09-12 | 2021-03-01 | Univ Massachusetts | Interferencia por ARN para el tratamiento de trastornos de ganancia de función |
| WO2005046939A1 (en) | 2003-10-16 | 2005-05-26 | Form Puller Tool Co., Inc. | Device for removing modular forms |
| AP2006003611A0 (en) | 2003-10-30 | 2006-06-30 | Coley Pharm Gmbh | C-class oligonucleotide analogs with enhanced immunostimulatory potency |
| US20050239102A1 (en) | 2003-10-31 | 2005-10-27 | Verdine Gregory L | Nucleic acid binding oligonucleotides |
| US7846436B2 (en) | 2003-11-28 | 2010-12-07 | Chemgenes Corporation | Oligonucleotides and related compounds |
| WO2005063983A1 (en) | 2003-12-29 | 2005-07-14 | Galapagos Genomics N.V. | Modulators of bone homeostasis identified in a high-throughput screen |
| JP4945129B2 (ja) | 2004-01-27 | 2012-06-06 | 株式会社キラルジェン | フルオラス担体およびそれを用いたオリゴヌクレオチド誘導体の製造方法 |
| US20050176045A1 (en) | 2004-02-06 | 2005-08-11 | Dharmacon, Inc. | SNP discriminatory siRNA |
| EP1725250A2 (en) | 2004-02-18 | 2006-11-29 | Frutarom Ltd. | Method for the preparation of peptide-oligonucleotide conjugates |
| JP3976742B2 (ja) | 2004-02-27 | 2007-09-19 | 江守商事株式会社 | インターフェロンアルファを誘導する免疫刺激オリゴヌクレオチド |
| WO2005085272A1 (ja) | 2004-03-05 | 2005-09-15 | Takeshi Wada | ボラノホスフェートモノマーおよびそれを用いたオリゴヌクレオチド誘導体の製造方法 |
| JP4865544B2 (ja) | 2004-03-25 | 2012-02-01 | 株式会社キラルジェン | 立体規則性の高いリボヌクレオチド類縁体及びデオキシリボヌクレオチド類縁体の製造法 |
| US20050244869A1 (en) | 2004-04-05 | 2005-11-03 | Brown-Driver Vickie L | Modulation of transthyretin expression |
| US20050267300A1 (en) | 2004-04-05 | 2005-12-01 | Muthiah Manoharan | Processes and reagents for oligonucleotide synthesis and purification |
| TWI350168B (en) * | 2004-05-07 | 2011-10-11 | Incyte Corp | Amido compounds and their use as pharmaceuticals |
| EP1753881A2 (en) | 2004-05-27 | 2007-02-21 | The Government of the United States of America as represented by The Secretary of the Department of Health and Human Services | Differential expression of molecules associated with acute stroke |
| US7759318B1 (en) | 2004-05-28 | 2010-07-20 | Isis Pharmaceuticals, Inc. | Identification of novel pathways, genes and promoter motifs regulating adipogenesis |
| AU2005252662B2 (en) | 2004-06-03 | 2011-08-18 | Isis Pharmaceuticals, Inc. | Double strand compositions comprising differentially modified strands for use in gene modulation |
| EP2500430B1 (en) | 2004-06-28 | 2017-03-08 | The University Of Western Australia | Antisense oligonucleotides for inducing exon skipping and methods of use thereof |
| CA2576860A1 (en) | 2004-08-10 | 2006-02-23 | Isis Pharmaceuticals, Inc. | Antisense modulation of apolipoprotein b expression |
| WO2006022323A1 (ja) | 2004-08-26 | 2006-03-02 | Nippon Shinyaku Co., Ltd. | ホスホロアミダイト化合物及びオリゴrnaの製法 |
| CA2578046A1 (en) | 2004-09-07 | 2006-03-16 | Archemix Corp. | Aptamer medicinal chemistry |
| US7884086B2 (en) | 2004-09-08 | 2011-02-08 | Isis Pharmaceuticals, Inc. | Conjugates for use in hepatocyte free uptake assays |
| WO2006031461A2 (en) | 2004-09-09 | 2006-03-23 | Isis Pharmaceuticals, Inc. | Pyrrolidinyl groups for attaching conjugates to oligomeric compounds |
| JP2008513507A (ja) | 2004-09-17 | 2008-05-01 | アイシス ファーマシューティカルズ インコーポレイティッド | 増強されたアンチセンスオリゴヌクレオチド |
| US20090036355A1 (en) | 2004-10-13 | 2009-02-05 | Sanjay Bhanot | Antisense Modulation of PTP1B Expression |
| US8212011B2 (en) | 2004-11-03 | 2012-07-03 | University Of Kansas | Novobiocin analogues |
| EP1807440B1 (en) | 2004-11-03 | 2020-02-19 | The University of Kansas | Novobiocin analogues as anticancer agents |
| US7622451B2 (en) | 2004-11-03 | 2009-11-24 | University Of Kansas | Novobiocin analogues as neuroprotective agents and in the treatment of autoimmune disorders |
| US9120774B2 (en) | 2004-11-03 | 2015-09-01 | University Of Kansas | Novobiocin analogues having modified sugar moieties |
| US8212012B2 (en) | 2004-11-03 | 2012-07-03 | University Of Kansas | Novobiocin analogues having modified sugar moieties |
| KR100721928B1 (ko) | 2004-11-05 | 2007-05-28 | 주식회사 바이오씨에스 | CpG 올리고데옥시뉴클레오티드를 함유하는 피부질환의치료 또는 예방용 약학적 조성물 |
| EP1657307A1 (en) | 2004-11-16 | 2006-05-17 | Immunotech S.A. | Oligonucleotides that induce the secretion of GM-CSF |
| AU2005313883B2 (en) | 2004-12-09 | 2011-03-31 | Alnylam Pharmaceuticals, Inc. | Compositions and methods for inducing an immune response in a mammal and methods of avoiding an immune response to oligonucleotide agents such as short interfering RNAs |
| WO2006065751A2 (en) | 2004-12-13 | 2006-06-22 | Government Of The United States Of America, Represented By The Secretary, Department Of Health And Human Services | Cpg oligonucleotide prodrugs, compositions thereof and associated therapeutic methods |
| WO2006066260A2 (en) | 2004-12-17 | 2006-06-22 | Thiosense, Inc. | Compositions of and methods for producing phosphorus-chiral monomers and oligomers |
| US20070099851A1 (en) | 2004-12-30 | 2007-05-03 | Linn Gregory S | Stable analogues of ribose-1-phosphate and methods for treating diabetes and other metabolic disorders |
| US20060183763A1 (en) | 2004-12-31 | 2006-08-17 | Pfizer Inc | Novel pyrrolidyl derivatives of heteroaromatic compounds |
| KR100980898B1 (ko) | 2005-01-28 | 2010-09-07 | 권형주 | 마이코박테리아 유래 면역기능 증진, 면역질환 치료, 아토피성 피부질환 및/또는 면역세포 생존용 올리고뉴크레오타이드 |
| CN101160401A (zh) | 2005-02-24 | 2008-04-09 | 科勒制药集团公司 | 免疫刺激寡核苷酸 |
| ATE534652T1 (de) | 2005-04-01 | 2011-12-15 | Univ California | Phosphono-pent-2-en-1-yl-nukleoside und analoga |
| SI1877070T1 (sl) | 2005-05-05 | 2009-06-30 | Antisense Pharma Gmb H | Terapevtska uporaba TGF-beta2 protismiselnih oligonukleotidov |
| US7902352B2 (en) | 2005-05-06 | 2011-03-08 | Medtronic, Inc. | Isolated nucleic acid duplex for reducing huntington gene expression |
| WO2006121960A2 (en) | 2005-05-06 | 2006-11-16 | Medtronic, Inc. | Methods and sequences to suppress primate huntington gene expression |
| EP2548560B1 (en) | 2005-06-23 | 2015-06-03 | Isis Pharmaceuticals, Inc. | Compositions and methods for modulation of SMN2 splicing |
| US9133517B2 (en) | 2005-06-28 | 2015-09-15 | Medtronics, Inc. | Methods and sequences to preferentially suppress expression of mutated huntingtin |
| ATE522626T1 (de) | 2005-06-28 | 2011-09-15 | Medtronic Inc | Verfahren und nukleotid-sequenzen, die bevorzugt die expression eines mutierten huntingtin-genes unterdrücken |
| EP1948600B1 (en) | 2005-07-05 | 2014-04-16 | The President & Fellows Of Harvard College | Liver targeted conjugates |
| JP4984634B2 (ja) | 2005-07-21 | 2012-07-25 | ソニー株式会社 | 物理情報取得方法および物理情報取得装置 |
| ES2372538T3 (es) | 2005-07-28 | 2012-01-23 | Id-Fish Technology, Inc. | Procedimiento para mejorar la permeabilidad celular a partículas foráneas. |
| WO2007027775A2 (en) | 2005-08-29 | 2007-03-08 | Isis Pharmaceuticals, Inc. | Methods for use in modulating mir-122a |
| US8501703B2 (en) | 2005-08-30 | 2013-08-06 | Isis Pharmaceuticals, Inc. | Chimeric oligomeric compounds for modulation of splicing |
| US7700567B2 (en) | 2005-09-29 | 2010-04-20 | Supergen, Inc. | Oligonucleotide analogues incorporating 5-aza-cytosine therein |
| US20070077993A1 (en) | 2005-09-30 | 2007-04-05 | Midgley Timothy M | Method and apparatus for collecting user game play data and crediting users in a gaming environment |
| CN104278037B (zh) | 2005-10-12 | 2020-09-15 | 艾德拉药物股份有限公司 | 基于变异应答调制Toll样受体的免疫调节寡核苷酸(IRO)化合物 |
| US9308252B2 (en) | 2005-10-27 | 2016-04-12 | Cook Biotech, Inc. | Extracellular matrix materials as vaccine adjuvants for diseases associated with infectious pathogens or toxins |
| US8883969B2 (en) | 2005-10-28 | 2014-11-11 | Tosoh Corporation | Method for production of carotenoid-synthesizing microorganism and method for production of carotenoid |
| CN101365801B (zh) | 2005-10-28 | 2013-03-27 | 阿尔尼拉姆医药品有限公司 | 抑制亨廷顿基因表达的组合物和方法 |
| BRPI0618473A2 (pt) | 2005-11-11 | 2011-08-30 | Pfizer | combinações e métodos de uso de um oligodeoxinucleotìdeo imunomodulador |
| WO2007064291A1 (en) | 2005-11-30 | 2007-06-07 | Jyoti Chattopadhyaya | Method and compounds for rna synthesis |
| EP1957507B1 (en) | 2005-12-02 | 2018-10-24 | Ionis Pharmaceuticals, Inc. | Antibacterial 4,5-substituted aminoglycoside analogs having multiple substituents |
| US8076303B2 (en) | 2005-12-13 | 2011-12-13 | Spring Bank Pharmaceuticals, Inc. | Nucleotide and oligonucleotide prodrugs |
| MEP0808A (xx) * | 2005-12-21 | 2010-02-10 | Pfizer Prod Inc | Karbonilamino pirolopirayoli, snažni inhibitori kinaza |
| AU2007210038B2 (en) | 2006-01-26 | 2013-01-10 | Ionis Pharmaceuticals, Inc. | Compositions and their uses directed to huntingtin |
| AU2007211080B9 (en) | 2006-01-27 | 2012-05-03 | Isis Pharmaceuticals, Inc. | 6-modified bicyclic nucleic acid analogs |
| US20080045473A1 (en) | 2006-02-15 | 2008-02-21 | Coley Pharmaceutical Gmbh | Compositions and methods for oligonucleotide formulations |
| JP4713514B2 (ja) | 2006-02-20 | 2011-06-29 | エフ.ホフマン−ラ ロシュ アーゲー | 改善された標識試薬 |
| IN2014CN00532A (ja) | 2006-03-06 | 2015-04-03 | Japan Tobacco Inc | |
| US8383660B2 (en) * | 2006-03-10 | 2013-02-26 | Pfizer Inc. | Dibenzyl amine compounds and derivatives |
| EP2001871B1 (en) | 2006-03-31 | 2014-07-16 | Applied Biosystems, LLC | Rhodamine-labeled oligonucleotides |
| WO2007118222A2 (en) | 2006-04-06 | 2007-10-18 | Ibis Biosciences, INC | Compositions for the use in identification of fungi |
| KR101176697B1 (ko) * | 2006-04-20 | 2012-08-23 | 에프. 호프만-라 로슈 아게 | 케모카인 수용체의 다이아제판 유도체 조절자 |
| DK2020449T3 (da) | 2006-04-24 | 2013-01-14 | Sigma Alimentos Sa De Cv | Fremgangsmåde til detektion og multipel, simultan kvantificering af patogener ved hjælp af real-time polymerasekædereaktion |
| AU2007243412A1 (en) | 2006-04-25 | 2007-11-08 | Immune Disease Institute Inc. | Targeted delivery to leukocytes using non-protein carriers |
| GB0608838D0 (en) | 2006-05-04 | 2006-06-14 | Novartis Ag | Organic compounds |
| WO2007131232A2 (en) | 2006-05-05 | 2007-11-15 | Isis Pharmaceuticals, Inc. | Compositions and their uses directed to ptpr alpha |
| DK2458006T3 (en) | 2006-05-05 | 2018-08-27 | Ionis Pharmaceuticals Inc | Compounds and Methods for Modulating ApoB Expression. |
| US20090012120A1 (en) | 2006-05-10 | 2009-01-08 | Board Of Trustees Of Michigan State University | Synthesis of N-heterocycles, beta-amino acids, and allyl amines via aza-payne mediated reaction of ylides and hydroxy aziridines |
| WO2007134181A2 (en) | 2006-05-11 | 2007-11-22 | Isis Pharmaceuticals, Inc. | 5'-modified bicyclic nucleic acid analogs |
| US7666854B2 (en) | 2006-05-11 | 2010-02-23 | Isis Pharmaceuticals, Inc. | Bis-modified bicyclic nucleic acid analogs |
| EP2034015B1 (en) | 2006-05-31 | 2012-07-11 | Toray Industries, Inc. | Immunostimulatory oligonucleotide and pharmaceutical application thereof |
| US8097596B2 (en) | 2006-06-30 | 2012-01-17 | Lakewood-Amedex, Inc. | Compositions and methods for the treatment of muscle wasting |
| CA2662704A1 (en) | 2006-07-07 | 2008-01-10 | University Of Massachusetts | Rna silencing compositions and methods for the treatment of huntington's disease |
| US20090093425A1 (en) | 2006-07-12 | 2009-04-09 | The Regents Of The University Of California | Transducible delivery of nucleic acids by reversible phosphotriester charge neutralization protecting groups |
| EP2051977A2 (en) * | 2006-07-20 | 2009-04-29 | Amgen Inc. | SUBSTITUTED AZOLE AROMATIC HETEROCYCLES AS INHIBITORS OF LLbeta-HSD-1 |
| GB0614947D0 (en) | 2006-07-27 | 2006-09-06 | Isis Innovation | Epitope reduction therapy |
| US8101585B2 (en) | 2006-08-04 | 2012-01-24 | Isis Pharmaceuticals, Inc. | Compositions and methods for the modulation of JNK proteins |
| AT504194B1 (de) | 2006-09-07 | 2008-07-15 | Oesterr Rotes Kreuz | Bakteriennachweis |
| US8138330B2 (en) | 2006-09-11 | 2012-03-20 | Sigma-Aldrich Co. Llc | Process for the synthesis of oligonucleotides |
| PT2078080E (pt) | 2006-09-27 | 2015-09-18 | Coley Pharm Gmbh | Análogos dos oligonucleotídeos cpg que contêm análogos t hidrofóbicos com atividade imunoestimulante potenciada |
| US8535764B2 (en) | 2006-10-18 | 2013-09-17 | The Nanosteel Company, Inc. | Protective coating for concrete delivery system components |
| CA2667816A1 (en) | 2006-10-23 | 2008-05-02 | Irm Llc | Compositions and methods for inhibiting cathepsin proteases |
| CN101558157A (zh) | 2006-10-26 | 2009-10-14 | 科勒制药有限责任公司 | 寡核糖核苷酸及其应用 |
| FR2908414B1 (fr) | 2006-11-13 | 2012-01-20 | Centre Nat Rech Scient | Immobilisation de proteines membranaires sur un support par l'intermediaire d'une molecule amphiphile |
| MX2009005252A (es) * | 2006-11-17 | 2009-05-28 | Abbott Lab | Aminopirrolidinas como antagonistas del receptor de quimiocina. |
| US8093222B2 (en) | 2006-11-27 | 2012-01-10 | Isis Pharmaceuticals, Inc. | Methods for treating hypercholesterolemia |
| AU2007325767A1 (en) | 2006-11-27 | 2008-06-05 | Isis Pharmaceuticals, Inc. | Methods for treating hypercholesterolemia |
| JP2010512421A (ja) | 2006-12-12 | 2010-04-22 | イデラ ファーマシューティカルズ インコーポレイテッド | Tlr9の合成アゴニスト |
| UY30892A1 (es) | 2007-02-07 | 2008-09-02 | Smithkline Beckman Corp | Inhibidores de la actividad akt |
| EP2125852B1 (en) | 2007-02-15 | 2016-04-06 | Ionis Pharmaceuticals, Inc. | 5'-substituted-2'-f modified nucleosides and oligomeric compounds prepared therefrom |
| US9347061B2 (en) | 2007-03-24 | 2016-05-24 | Genzyme Corporation | Administering antisense oligonucleotides complementary to human apolipoprotein B |
| US7960353B2 (en) | 2007-05-10 | 2011-06-14 | University Of Kansas | Novobiocin analogues as neuroprotective agents and in the treatment of autoimmune disorders |
| SI2158316T1 (sl) | 2007-05-11 | 2015-08-31 | Adynxx Inc. | Genska ekspresija in bolečina |
| US8222407B2 (en) | 2007-05-24 | 2012-07-17 | Kyorin Pharmaceutical Co., Ltd. | Mutilin derivative having heterocyclic aromatic ring carboxylic acid structure in substituent at 14-position |
| GB0710186D0 (en) | 2007-05-29 | 2007-07-04 | Texas Instr Denmark | PWM loop with minimum allasing error property |
| EP2170917B1 (en) | 2007-05-30 | 2012-06-27 | Isis Pharmaceuticals, Inc. | N-substituted-aminomethylene bridged bicyclic nucleic acid analogs |
| CA2690091A1 (en) | 2007-06-05 | 2008-12-11 | Nsab, Filial Af Neurosearch Sweden Ab, Sverige | New disubstituted phenylpyrrolidines as modulators of cortical catecholaminergic neurotransmission |
| US8278426B2 (en) | 2007-06-08 | 2012-10-02 | Isis Pharmaceuticals, Inc. | Carbocyclic bicyclic nucleic acid analogs |
| US20100298280A1 (en) | 2007-06-13 | 2010-11-25 | Petra Kioschis-Schneider | Compounds for the Modulation of Huntingtin Aggregation, Methods and Means for Identifying Such Compounds |
| DE602007005629D1 (de) | 2007-06-18 | 2010-05-12 | Commissariat Energie Atomique | Reversibles siRNA-Silencing eines mutierten und endogenen Huntington-Wildtypgens und dessen Anwendung zur Behandlung von Morbus Huntington |
| GB0712494D0 (en) | 2007-06-27 | 2007-08-08 | Isis Innovation | Substrate reduction therapy |
| ATE538127T1 (de) | 2007-07-05 | 2012-01-15 | Isis Pharmaceuticals Inc | 6-disubstituierte bicyclische nukleinsäureanaloga |
| JP5737937B2 (ja) | 2007-07-09 | 2015-06-17 | イデラ ファーマシューティカルズ インコーポレイテッドIdera Pharmaceuticals, Inc. | 安定化免疫調節rna(simra)化合物 |
| TWI413530B (zh) | 2007-07-20 | 2013-11-01 | Kao Corp | 有機聚矽氧 |
| EP2185723A4 (en) | 2007-07-31 | 2011-01-12 | Univ Saskatchewan | EFFECT OF A GENETIC VARIATION IN THE GENESIS OF PROMELANIN CONCENTRATING HORMONE ON THE MEAT PROPERTIES IN BOVINE ANIMALS |
| US7812003B2 (en) | 2007-08-02 | 2010-10-12 | Safe Stephen H | Antisense microRNA and uses therefor |
| JP2010536787A (ja) | 2007-08-15 | 2010-12-02 | イデラ ファーマシューティカルズ インコーポレイテッド | Toll様受容体モジュレータ |
| WO2009046141A2 (en) | 2007-10-01 | 2009-04-09 | Isis Pharmaceuticals, Inc. | Antisense modulation of fibroblast growth factor receptor 4 expression |
| KR100886139B1 (ko) | 2007-11-13 | 2009-02-27 | 주식회사 삼천리제약 | 올리고뉴클레오타이드의 제조방법 |
| TW200930375A (en) | 2007-12-21 | 2009-07-16 | Exelixis Inc | Benzofuropyrimidinones |
| TWI340765B (en) | 2007-12-26 | 2011-04-21 | Ind Tech Res Inst | Oligonucleotide sequences and dna chip for identifying filamentous microorganisms and the identification method thereof |
| WO2009089659A1 (en) | 2008-01-18 | 2009-07-23 | Shanghai Targetdrug Co., Ltd. | Pyrollidine-based compounds |
| JP2011515653A (ja) | 2008-02-04 | 2011-05-19 | ガラパゴス・ナムローゼ・フェンノートシャップ | 神経変性疾患の治療に有用な標的配列及びそれらの同定方法 |
| JP2009190983A (ja) | 2008-02-12 | 2009-08-27 | Tokyo Institute Of Technology | オリゴヌクレオチド誘導体 |
| US8426378B2 (en) | 2008-03-21 | 2013-04-23 | Isis Pharmaceuticals, Inc. | Oligomeric compounds comprising tricyclic nucelosides and methods for their use |
| US20110130440A1 (en) | 2008-03-26 | 2011-06-02 | Alnylam Pharmaceuticals, Inc. | Non-natural ribonucleotides, and methods of use thereof |
| CN107753499A (zh) | 2008-04-03 | 2018-03-06 | 春堤制药公司 | 用于治疗病毒感染的化合物和方法 |
| DE112009001327A5 (de) | 2008-04-04 | 2011-03-31 | Universität Hamburg | Verfahren zur stereoselektiven Synthese von Phosphor-Verbindungen |
| WO2009124238A1 (en) | 2008-04-04 | 2009-10-08 | Isis Pharmaceuticals, Inc. | Oligomeric compounds comprising neutrally linked terminal bicyclic nucleosides |
| US8679750B2 (en) | 2008-05-09 | 2014-03-25 | The University Of British Columbia | Methods and compositions for the treatment of Huntington'S disease |
| CA2726866A1 (en) | 2008-05-09 | 2009-11-12 | The University Of British Columbia | Methods and compositions for the treatment of huntington's disease |
| JP5727367B2 (ja) | 2008-05-15 | 2015-06-03 | ダイナバックス テクノロジーズ コーポレイション | 免疫賦活オリゴヌクレオチドを使用する長期疾患改良 |
| US8541388B2 (en) | 2008-05-22 | 2013-09-24 | Isis Pharmaceuticals, Inc. | Methods for modulating expression of RBP4 |
| WO2009143387A2 (en) | 2008-05-22 | 2009-11-26 | Isis Pharmaceuticals, Inc. | Modulation of smrt expression |
| WO2009143391A2 (en) | 2008-05-22 | 2009-11-26 | Isis Pharmaceuticals, Inc | Methods for modulation expression of creb |
| WO2009148605A2 (en) | 2008-06-04 | 2009-12-10 | Isis Pharmaceuticals, Inc. | Methods for treating hypercholesterolemia |
| EP2320895A2 (en) | 2008-07-03 | 2011-05-18 | Exelixis, Inc. | Cdk modulators |
| US8410070B2 (en) | 2008-09-12 | 2013-04-02 | University Of Louisville Research Foundation, Inc. | Compositions and methods for treating cancer, inhibiting proliferation, and inducing cell death |
| WO2010030858A1 (en) | 2008-09-15 | 2010-03-18 | Enanta Pharmaceuticals, Inc. | 4'-allene-substituted nucleoside derivatives |
| WO2010039543A2 (en) | 2008-09-23 | 2010-04-08 | Traversa Therapeutics, Inc. | Self delivering bio-labile phosphate protected pro-oligos for oligonucleotide based therapeutics and mediating rna interference |
| DK2361256T3 (da) | 2008-09-24 | 2013-07-01 | Isis Pharmaceuticals Inc | Cyclohexenyl-nukleinsyreanaloger |
| EP2356129B1 (en) | 2008-09-24 | 2013-04-03 | Isis Pharmaceuticals, Inc. | Substituted alpha-l-bicyclic nucleosides |
| JP2012504962A (ja) | 2008-10-07 | 2012-03-01 | プレジデント・アンド・フェロウズ・オブ・ハーバード・カレッジ | テロメラーゼ阻害剤およびその使用方法 |
| NZ591391A (en) | 2008-10-22 | 2012-10-26 | Quark Pharmaceuticals Inc | Non-invasive methods for treating eye disorders using a topical oligonucleotide composition |
| US8987435B2 (en) | 2008-10-24 | 2015-03-24 | Isis Pharmaceuticals, Inc. | Oligomeric compounds and methods |
| CN102264374B (zh) | 2008-10-24 | 2015-01-07 | Isis制药公司 | 5′和2′双取代的核苷和由其制备的低聚化合物 |
| CA2747999A1 (en) | 2008-12-23 | 2010-07-01 | Girindus America, Inc. | Sulfurizing reagents and their use for oligonucleotides synthesis |
| WO2010080953A1 (en) | 2009-01-08 | 2010-07-15 | Isis Pharmaceuticals, Inc. | Transgenic murine model of human lipoprotein metabolism, hypercholesterolemia and cardiovascular disease |
| KR20100087540A (ko) | 2009-01-28 | 2010-08-05 | 삼성전자주식회사 | 잉크젯 기록용 잉크 조성물 |
| WO2010091301A1 (en) | 2009-02-06 | 2010-08-12 | Isis Pharmaceuticals, Inc. | Oligomeric compounds and excipients |
| AU2010213795A1 (en) | 2009-02-10 | 2011-08-04 | Idera Pharmaceuticals, Inc. | Synthetic RNA-based agonists of TLR7 |
| JP5766617B2 (ja) | 2009-02-20 | 2015-08-19 | ユニバーシティ・オブ・カンザス | 修飾された糖部分を有するノボビオシン類似体 |
| AU2010221419B2 (en) * | 2009-03-02 | 2015-10-01 | Alnylam Pharmaceuticals, Inc. | Nucleic acid chemical modifications |
| EP2408796B1 (en) | 2009-03-16 | 2020-04-22 | Ionis Pharmaceuticals, Inc. | Targeting Apolipoprotein B for the reduction of Apolipoprotein C-III |
| US8653254B2 (en) | 2009-03-31 | 2014-02-18 | Takeda Pharmaceutical Company Limited | Process for producing nucleoside |
| US8987222B2 (en) | 2009-04-08 | 2015-03-24 | University Of Massachusetts | Single nucleotide polymorphism (SNP) targeting therapies for the treatment of huntington'S disease |
| CA2759098A1 (en) | 2009-04-14 | 2010-10-21 | Smith Holdings, Llc | Methods and compositions for the treatment of medical conditions involving cellular programming |
| WO2010129853A2 (en) | 2009-05-07 | 2010-11-11 | The Regents Of The University Of California | TRANSDUCIBLE DELIVERY OF NUCLEIC ACIDS USING MODIFIED dsRNA BINDING DOMAINS |
| KR20120052909A (ko) | 2009-06-01 | 2012-05-24 | 더 리전트 오브 더 유니버시티 오브 캘리포니아 | 핵산 수송용 조성물 및 이의 사용 방법 |
| AU2010256461B2 (en) | 2009-06-05 | 2016-03-17 | Access To Advanced Health Institute | Synthetic glucopyranosyl lipid adjuvants |
| SI3305302T1 (sl) | 2009-06-17 | 2018-12-31 | Biogen Ma Inc. | Sestave in metode za modulacijo združevanja smn2 pri subjektu |
| JP5670097B2 (ja) | 2009-06-19 | 2015-02-18 | 花王株式会社 | 二層分離型毛髪化粧料 |
| JPWO2010150789A1 (ja) | 2009-06-23 | 2012-12-10 | 武田薬品工業株式会社 | 核酸の合成法 |
| WO2011005764A1 (en) | 2009-07-06 | 2011-01-13 | Ada Technologies, Inc. | Electrochemical device and method for long-term measurement of hypohalites |
| AU2010270714B2 (en) | 2009-07-06 | 2015-08-13 | Wave Life Sciences Ltd. | Novel nucleic acid prodrugs and methods use thereof |
| US8927513B2 (en) | 2009-07-07 | 2015-01-06 | Alnylam Pharmaceuticals, Inc. | 5′ phosphate mimics |
| WO2011005942A2 (en) | 2009-07-08 | 2011-01-13 | Idera Pharmaceuticals, Inc. | Oligonucleotide-based compounds as inhibitors of toll-like receptors |
| EP2458005A1 (en) | 2009-07-23 | 2012-05-30 | Galaxy Pharma Inc. | Fgf21 cis-element binding substance |
| WO2011015572A1 (en) | 2009-08-03 | 2011-02-10 | Galapagos Nv | Molecular targets and compounds, and methods to identify the same, useful in the treatment of neurodegenerative diseases |
| WO2011015573A1 (en) | 2009-08-03 | 2011-02-10 | Galapagos Nv | Molecular targets and compounds, and methods to identify the same, useful in the treatment of neurodegenerative diseases |
| UA107360C2 (en) | 2009-08-05 | 2014-12-25 | Biogen Idec Inc | Bicyclic aryl sphingosine 1-phosphate analogs |
| US9012421B2 (en) | 2009-08-06 | 2015-04-21 | Isis Pharmaceuticals, Inc. | Bicyclic cyclohexose nucleic acid analogs |
| US8927553B2 (en) | 2009-08-10 | 2015-01-06 | Daljit Singh Dhanoa | Deuterium-enriched alkyl sulfonamides and uses thereof |
| NZ599032A (en) | 2009-09-11 | 2014-09-26 | Isis Pharmaceuticals Inc | Modulation of huntingtin expression |
| US8470987B2 (en) * | 2009-09-16 | 2013-06-25 | Chiralgen, Ltd. | Protective group for synthesis of RNA and derivative |
| EP2480667A4 (en) | 2009-09-25 | 2013-07-03 | Isis Pharmaceuticals Inc | MODULATION OF TTC39 EXPRESSION FOR HDL INCREASE |
| TWI475051B (zh) | 2009-11-18 | 2015-03-01 | Kao Corp | Organic polysiloxane |
| JP5809408B2 (ja) | 2009-11-25 | 2015-11-10 | 花王株式会社 | 毛髪化粧料 |
| EP2512246B1 (en) * | 2009-12-17 | 2015-09-30 | Merck Sharp & Dohme Corp. | Aminopyrimidines as syk inhibitors |
| CN102812361A (zh) | 2009-12-28 | 2012-12-05 | 阿茨拉实验室有限公司 | 诊断凝胶组合物、制造诊断凝胶组合物的方法 |
| CN111700901A (zh) | 2010-01-08 | 2020-09-25 | Ionis制药公司 | 血管生成素样3表达的调节 |
| US8750507B2 (en) | 2010-01-25 | 2014-06-10 | Cisco Technology, Inc. | Dynamic group creation for managed key servers |
| JP6006120B2 (ja) | 2010-02-08 | 2016-10-12 | アイオーニス ファーマシューティカルズ, インコーポレーテッドIonis Pharmaceuticals,Inc. | 対立遺伝子多様体の選択的低減 |
| EP2534262B1 (en) | 2010-02-08 | 2016-12-14 | Ionis Pharmaceuticals, Inc. | Selective reduction of allelic variants |
| CN102753553B (zh) | 2010-02-10 | 2016-03-30 | 葛兰素史密丝克莱恩有限责任公司 | 6-氨基-2-{[(1s)-1-甲基丁基]氧基}-9-[5-(1-哌啶基)-7,9-二氢-8h-嘌呤-8-酮马来酸盐 |
| CN102918052A (zh) * | 2010-03-05 | 2013-02-06 | 国立大学法人东京大学 | 硫代磷酸核糖核苷的制造方法 |
| WO2011127175A1 (en) | 2010-04-06 | 2011-10-13 | Isis Pharmaceuticals, Inc. | Modulation of cd130 (gp130) expression |
| WO2011127307A1 (en) | 2010-04-07 | 2011-10-13 | Isis Pharmaceuticals, Inc. | Modulation of cetp expression |
| WO2011133871A2 (en) | 2010-04-22 | 2011-10-27 | Alnylam Pharmaceuticals, Inc. | 5'-end derivatives |
| WO2011139699A2 (en) | 2010-04-28 | 2011-11-10 | Isis Pharmaceuticals, Inc. | 5' modified nucleosides and oligomeric compounds prepared therefrom |
| KR101869570B1 (ko) | 2010-04-28 | 2018-06-20 | 아이오니스 파마수티컬즈, 인코포레이티드 | 변형된 뉴클레오사이드 및 그로부터 제조된 올리고머 화합물 |
| US20130156845A1 (en) | 2010-04-29 | 2013-06-20 | Alnylam Pharmaceuticals, Inc. | Lipid formulated single stranded rna |
| EP2563921B1 (en) | 2010-04-30 | 2016-11-23 | Cellectis | Method for modulating double-strand break-induced homologous recombination |
| GB201008902D0 (en) | 2010-05-27 | 2010-07-14 | Imp Innovations Ltd | Membrane enhanced polymer sythesis |
| JP2013541510A (ja) | 2010-08-31 | 2013-11-14 | メルク・シャープ・エンド・ドーム・コーポレイション | 新規の単一の化学物質、およびオリゴヌクレオチドの送達方法 |
| EP2620428B1 (en) | 2010-09-24 | 2019-05-22 | Wave Life Sciences Ltd. | Asymmetric auxiliary group |
| US9238812B2 (en) | 2010-09-30 | 2016-01-19 | Lsip, Llc | Agent for suppressing expression of dominant mutant gene |
| KR101381048B1 (ko) | 2010-10-20 | 2014-04-14 | 씨제이제일제당 (주) | O-포스포세린 생산 균주 및 이로부터 생산된 o-포스포세린으로부터 l-시스테인 또는 이의 유도체의 생산방법 |
| EP3766975A1 (en) | 2010-10-29 | 2021-01-20 | Sirna Therapeutics, Inc. | Rna interference mediated inhibition of gene expression using short interfering nucleic acid (sina) |
| WO2012065143A1 (en) | 2010-11-12 | 2012-05-18 | The General Hospital Corporation | Polycomb-associated non-coding rnas |
| US8822671B2 (en) | 2010-11-30 | 2014-09-02 | The University Of Tokyo | 2'-O-modified RNA |
| WO2012092367A1 (en) | 2010-12-28 | 2012-07-05 | University Of Rochester | Nucleic acid binding compounds, methods of making, and use thereof |
| EP3467109A1 (en) | 2011-02-08 | 2019-04-10 | Ionis Pharmaceuticals, Inc. | Oligomeric compounds comprising bicyclic nucleotides and uses thereof |
| EP2673286B1 (en) | 2011-02-12 | 2019-07-03 | University of Iowa Research Foundation | Therapeutic compounds |
| US9353371B2 (en) | 2011-05-02 | 2016-05-31 | Ionis Pharmaceuticals, Inc. | Antisense compounds targeting genes associated with usher syndrome |
| FR2975600B1 (fr) | 2011-05-24 | 2013-07-05 | Assist Publ Hopitaux De Paris | Agents pour le traitement de tumeurs |
| WO2013013068A2 (en) | 2011-07-19 | 2013-01-24 | University Of Idaho | Embodiments of a probe and method for targeting nucleic acids |
| JP6128529B2 (ja) | 2011-07-19 | 2017-05-17 | ウェイブ ライフ サイエンシズ リミテッドWave Life Sciences Ltd. | 官能化核酸の合成のための方法 |
| US10202599B2 (en) | 2011-08-11 | 2019-02-12 | Ionis Pharmaceuticals, Inc. | Selective antisense compounds and uses thereof |
| US9976138B2 (en) | 2011-08-29 | 2018-05-22 | Ionis Pharmaceuticals, Inc. | Methods and compounds useful in conditions related to repeat expansion |
| US20140080896A1 (en) | 2011-08-30 | 2014-03-20 | The Regents Of The University Of California | Identification of small molecules that facilitate therapeutic exon skipping |
| US9896729B2 (en) | 2011-08-31 | 2018-02-20 | The University Of Manchester | Method for diagnosing a neurodegenerative disease |
| WO2013036833A1 (en) | 2011-09-09 | 2013-03-14 | Mayo Foundation For Medical Education And Research | Detecting frontotemporal dementia and amyotrophic lateral sclerosis |
| ES2832531T3 (es) | 2011-11-30 | 2021-06-10 | Sarepta Therapeutics Inc | Oligonucleótidos para el tratamiento de enfermedades por expansión de repeticiones |
| JP2015502365A (ja) | 2011-12-12 | 2015-01-22 | オンコイミューニン,インコーポレイティド | オリゴヌクレオチドのイン−ビボ送達 |
| CA2859581C (en) | 2011-12-16 | 2022-03-22 | National University Corporation Tokyo Medical And Dental University | Chimeric double-stranded nucleic acid |
| CN102675386B (zh) | 2011-12-24 | 2014-07-02 | 河南科技大学 | 一种龙胆苦苷分离提纯方法 |
| WO2013134558A1 (en) | 2012-03-07 | 2013-09-12 | The Texas A & M University System | Cancer treatment targeting non-coding rna overexpression |
| CN106749272B (zh) | 2012-03-13 | 2019-08-30 | 吉利德科学公司 | 用于抗病毒治疗的2’-取代的卡巴-核苷类似物 |
| KR20130114435A (ko) | 2012-04-09 | 2013-10-17 | 삼성전자주식회사 | 다수의 전극을 갖는 생분자 검출 장치 |
| PT2841578T (pt) | 2012-04-23 | 2017-08-10 | Biomarin Tech Bv | Resumo |
| WO2013177219A1 (en) | 2012-05-22 | 2013-11-28 | Idenix Pharmaceuticals, Inc. | D-amino acid compounds for liver disease |
| IN2014DN10144A (ja) | 2012-05-30 | 2015-08-21 | Hokkaido System Science Co Ltd | |
| EP2872485B1 (en) | 2012-07-13 | 2020-12-16 | Wave Life Sciences Ltd. | Asymmetric auxiliary group |
| CN104661664B (zh) | 2012-07-13 | 2020-07-03 | 波涛生命科学有限公司 | 手性控制 |
| US9617547B2 (en) | 2012-07-13 | 2017-04-11 | Shin Nippon Biomedical Laboratories, Ltd. | Chiral nucleic acid adjuvant |
| CN104717982B (zh) | 2012-08-06 | 2018-08-28 | 阿尔尼拉姆医药品有限公司 | 碳水化合物共轭物及其制备改进工艺 |
| KR102237882B1 (ko) | 2012-08-15 | 2021-04-07 | 아이오니스 파마수티컬즈, 인코포레이티드 | 변형된 캡핑 프로토콜을 이용하는 올리고머 화합물 제조 방법 |
| EP2906256B1 (en) | 2012-10-12 | 2018-08-22 | Ionis Pharmaceuticals, Inc. | Selective antisense compounds and uses thereof |
| EP2906697A4 (en) | 2012-10-15 | 2016-06-22 | Ionis Pharmaceuticals Inc | METHODS OF MONITORING C9ORF72 EXPRESSION |
| AU2013331434B2 (en) | 2012-10-15 | 2019-08-08 | Ionis Pharmaceuticals, Inc. | Compositions for modulating C90RF72 expression |
| ES2762326T5 (es) | 2012-10-15 | 2023-04-27 | Ionis Pharmaceuticals Inc | Métodos para modular la expresión de C9ORF72 |
| EP2725029A1 (en) | 2012-10-29 | 2014-04-30 | Laboratoire Biodim | New antibacterial compounds and biological applications thereof |
| MX2015005500A (es) | 2012-10-29 | 2016-02-09 | Cocrystal Pharma Inc | Nucleotidos de pirimidina y sus profarmacos de monofosfato para el tratamiento de infecciones virales y cancer. |
| JP6358955B2 (ja) | 2012-10-31 | 2018-07-18 | 武田薬品工業株式会社 | 新規修飾核酸 |
| RU2653438C2 (ru) | 2012-11-15 | 2018-05-08 | Рош Инновейшен Сентер Копенгаген А/С | Конъюгаты олигонуклеотидов |
| US9725723B2 (en) | 2012-11-26 | 2017-08-08 | Roche Innovation Center Copenhagen A/S | Compositions and methods for modulation of FGFR3 expression |
| EP2935304A1 (en) | 2012-12-19 | 2015-10-28 | IDENIX Pharmaceuticals, Inc. | 4'-fluoro nucleosides for the treatment of hcv |
| JP6580993B2 (ja) | 2013-01-30 | 2019-09-25 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | Lnaオリゴヌクレオチド糖質コンジュゲート |
| WO2014118272A1 (en) | 2013-01-30 | 2014-08-07 | Santaris Pharma A/S | Antimir-122 oligonucleotide carbohydrate conjugates |
| CA2899924A1 (en) | 2013-02-04 | 2014-08-07 | Isis Pharmaceuticals, Inc. | Selective antisense compounds and uses thereof |
| AU2014219019B2 (en) | 2013-02-22 | 2020-04-16 | Sirna Therapeutics, Inc. | Short interfering nucleic acid (siNA) molecules containing a 2' internucleoside linkage |
| AU2014222150A1 (en) | 2013-03-01 | 2015-09-10 | National University Corporation Tokyo Medical And Dental University | Chimeric single-stranded antisense polynucleotides and double-stranded antisense agent |
| CN105072911A (zh) | 2013-03-28 | 2015-11-18 | 先正达参股股份有限公司 | 控制新烟碱抗性有害生物的方法 |
| JP2016520536A (ja) | 2013-03-28 | 2016-07-14 | シンジェンタ パーティシペーションズ アーゲー | ネオニコチノイド抵抗性有害生物の防除方法 |
| PE20152002A1 (es) | 2013-05-01 | 2016-01-21 | Isis Pharmaceuticals Inc | Composiciones y metodos para modular la expresion de ttr y vhb |
| JP2016520310A (ja) | 2013-05-24 | 2016-07-14 | ロシュ・イノベーション・センター・コペンハーゲン・アクティーゼルスカブRoche Innovation Center Copenhagen A/S | B細胞cll/リンパ腫11a(bcl11a)のオリゴヌクレオチドモデュレーター及びその使用 |
| EP3015467A4 (en) | 2013-05-24 | 2016-11-02 | Ajinomoto Kk | PROCESS FOR THE PRODUCTION OF MORPHOLINO-OLIGONUCLEOTIDE |
| JP6472087B2 (ja) | 2013-05-30 | 2019-02-27 | 国立大学法人 東京医科歯科大学 | 治療用オリゴヌクレオチドを送達するための二本鎖剤 |
| CN105324119A (zh) | 2013-06-16 | 2016-02-10 | 国立大学法人东京医科齿科大学 | 具有外显子跳跃效应的双链反义核酸 |
| CA2916252A1 (en) | 2013-06-21 | 2014-12-24 | Isis Pharmaceuticals, Inc. | Compositions and methods for modulation of target nucleic acids |
| LT3013959T (lt) | 2013-06-27 | 2020-03-10 | Roche Innovation Center Copenhagen A/S | Priešprasmiai oligomerai ir konjugatai, nukreirti į pcsk9 |
| TW202246503A (zh) | 2013-07-19 | 2022-12-01 | 美商百健Ma公司 | 用於調節τ蛋白表現之組合物 |
| EP3024936B1 (en) | 2013-07-25 | 2019-09-04 | Exicure, Inc. | Spherical nucleic acid-based constructs as immunostimulatory agents for prophylactic and therapeutic use |
| EP3027617A4 (en) | 2013-07-31 | 2017-04-12 | Ionis Pharmaceuticals, Inc. | Methods and compounds useful in conditions related to repeat expansion |
| US20160214974A1 (en) | 2013-09-06 | 2016-07-28 | Syngenta Participations Ag | Insecticidal compounds |
| US10385088B2 (en) | 2013-10-02 | 2019-08-20 | Modernatx, Inc. | Polynucleotide molecules and uses thereof |
| EP3052521A1 (en) | 2013-10-03 | 2016-08-10 | Moderna Therapeutics, Inc. | Polynucleotides encoding low density lipoprotein receptor |
| WO2015051366A2 (en) | 2013-10-04 | 2015-04-09 | Novartis Ag | Novel formats for organic compounds for use in rna interference |
| KR20160062069A (ko) | 2013-10-11 | 2016-06-01 | 아이오니스 파마수티컬즈, 인코포레이티드 | C9orf72 발현을 조절하기 위한 조성물 |
| EP3058069B1 (en) | 2013-10-14 | 2019-07-24 | Ionis Pharmaceuticals, Inc. | Methods for modulating expression of c9orf72 antisense transcript |
| US20160230172A1 (en) | 2013-10-14 | 2016-08-11 | Ionis Pharmaceuticals, Inc. | Compositions for modulating expression of c9orf72 antisense transcript |
| BR112016010175A2 (pt) | 2013-11-11 | 2017-10-03 | Sangamo Biosciences Inc | Repressor genético, seus usos, e composição farmacêutica |
| CN105722980A (zh) | 2013-11-14 | 2016-06-29 | 罗氏创新中心哥本哈根有限公司 | Apob反义缀合物化合物 |
| EP3053585A1 (en) | 2013-12-13 | 2016-08-10 | Moderna Therapeutics, Inc. | Alternative nucleic acid molecules and uses thereof |
| WO2015108048A1 (ja) | 2014-01-15 | 2015-07-23 | 株式会社新日本科学 | 抗腫瘍作用を有するキラル核酸アジュバンド及び抗腫瘍剤 |
| JPWO2015108047A1 (ja) | 2014-01-15 | 2017-03-23 | 株式会社新日本科学 | 免疫誘導活性を有するキラル核酸アジュバンド及び免疫誘導活性剤 |
| US10322173B2 (en) | 2014-01-15 | 2019-06-18 | Shin Nippon Biomedical Laboratories, Ltd. | Chiral nucleic acid adjuvant having anti-allergic activity, and anti-allergic agent |
| CA2936712A1 (en) | 2014-01-16 | 2015-07-23 | Meena | Chiral design |
| ES2856403T3 (es) | 2014-03-18 | 2021-09-27 | Univ Massachusetts | Composiciones a base de rAAV y procedimientos para el tratamiento de la esclerosis lateral amiotrofica |
| US9926556B2 (en) | 2014-04-28 | 2018-03-27 | Ionis Pharmaceuticals, Inc. | Linkage modified oligomeric compounds |
| WO2015168589A2 (en) | 2014-05-01 | 2015-11-05 | Isis Pharmaceuticals, Inc. | Compositions and methods for modulating angiopoietin-like 3 expression |
| NZ725542A (en) | 2014-05-08 | 2024-02-23 | Sangamo Biosciences Inc | Methods and compositions for treating huntington’s disease |
| CN107075514A (zh) | 2014-05-20 | 2017-08-18 | 衣阿华大学研究基金会 | 亨廷顿氏病的治疗化合物 |
| US20160017327A1 (en) | 2014-07-11 | 2016-01-21 | The Johns Hopkins University | Phosphorodiamidate morpholino oligomers (pmos) and their use in suppression of mutant huntingtin expression and attenuation of neurotoxicity |
| US20170204152A1 (en) | 2014-07-16 | 2017-07-20 | Moderna Therapeutics, Inc. | Chimeric polynucleotides |
| EP2982758A1 (en) | 2014-08-04 | 2016-02-10 | Centre Hospitalier Universitaire Vaudois (CHUV) | Genome editing for the treatment of huntington's disease |
| CN106573877B (zh) | 2014-08-07 | 2021-04-13 | 武田药品工业株式会社 | 阳离子脂质 |
| WO2016024205A1 (en) | 2014-08-15 | 2016-02-18 | Pfizer Inc. | Oligomers targeting hexanucleotide repeat expansion in human c9orf72 gene |
| WO2016027168A2 (en) | 2014-08-20 | 2016-02-25 | Lifesplice Pharma Llc | Splice modulating oligonucleotides and methods of use thereof |
| WO2016037191A1 (en) | 2014-09-05 | 2016-03-10 | Health Research, Inc. | Use of huntingtin-derived plasmids and peptides for active immunization as a huntington's disease (hd) therapeutic |
| JP2017536366A (ja) | 2014-11-19 | 2017-12-07 | ロシュ イノベーション センター コペンハーゲン エーエス | Lnaキラルホスホロチオエート |
| JP6689279B2 (ja) | 2014-12-16 | 2020-05-20 | ロシュ イノベーション センター コペンハーゲン エーエス | キラル毒性のスクリーニング方法 |
| SI3237618T1 (sl) | 2014-12-24 | 2019-09-30 | Uniqure Ip B.V. | RNA inducirana supresija huntingtin gena |
| US9688707B2 (en) | 2014-12-30 | 2017-06-27 | Ionis Pharmaceuticals, Inc. | Bicyclic morpholino compounds and oligomeric compounds prepared therefrom |
| US10793855B2 (en) | 2015-01-06 | 2020-10-06 | Ionis Pharmaceuticals, Inc. | Compositions for modulating expression of C9ORF72 antisense transcript |
| WO2016127002A1 (en) | 2015-02-04 | 2016-08-11 | Bristol-Myers Squibb Company | Lna oligonucleotides with alternating flanks |
| EP3254104B1 (en) | 2015-02-04 | 2021-08-25 | Bristol-Myers Squibb Company | Methods of selecting therapeutic molecules |
| EP3253875B1 (en) | 2015-02-04 | 2020-01-08 | H. Hoffnabb-La Roche Ag | Tau antisense oligomers and uses thereof |
| TN2017000354A1 (en) | 2015-02-10 | 2019-01-16 | Genzyme Corp | VARIANT RNAi |
| AU2016219263B2 (en) | 2015-02-13 | 2022-12-01 | Alnylam Pharmaceuticals, Inc. | Patatin-like phospholipase domain containing 3 (PNPLA3) iRNA compositions and methods of use thereof |
| US10370659B2 (en) | 2015-02-23 | 2019-08-06 | Ionis Pharmaceuticals, Inc. | Compounds and methods for increasing antisense activity |
| US20180036335A1 (en) | 2015-03-03 | 2018-02-08 | Ionis Pharmaceuticals, Inc. | Compositions for modulating mecp2 expression |
| WO2016145142A1 (en) | 2015-03-10 | 2016-09-15 | Emory University | Nucleotide and nucleoside therapeutics compositions and uses related thereto |
| WO2016154096A1 (en) | 2015-03-20 | 2016-09-29 | Ionis Pharmaceuticals, Inc. | Modulation of smggds expression |
| EP3277814B1 (en) | 2015-04-03 | 2020-06-03 | University of Massachusetts | Oligonucleotide compounds for targeting huntingtin mrna |
| US10851371B2 (en) | 2015-04-10 | 2020-12-01 | Ionis Pharmaceuticals, Inc. | Modulation of SMN expression |
| WO2016167780A1 (en) | 2015-04-16 | 2016-10-20 | Ionis Pharmaceuticals, Inc. | Compositions for modulating expression of c9orf72 antisense transcript |
| PL3283080T3 (pl) | 2015-04-16 | 2020-07-27 | Ionis Pharmaceuticals, Inc. | Kompozycja do modulowania ekspresji c9orf72 |
| WO2016209862A1 (en) | 2015-06-23 | 2016-12-29 | Alnylam Pharmaceuticals, Inc. | Glucokinase (gck) irna compositions and methods of use thereof |
| AU2016285724A1 (en) | 2015-06-29 | 2017-11-16 | Ionis Pharmaceuticals, Inc. | Modified CRISPR RNA and modified single CRISPR RNA and uses thereof |
| US10494632B2 (en) | 2015-07-10 | 2019-12-03 | Alnylam Pharmaceuticals, Inc. | Insulin-like growth factor binding protein, acid labile subunit (IGFALS) compositions and methods of use thereof |
| CN109477106B (zh) | 2015-07-10 | 2022-10-04 | Ionis制药公司 | 二酰基甘油酰基转移酶2(dgat2)的调节剂 |
| EP3919619A1 (en) | 2015-07-17 | 2021-12-08 | Alnylam Pharmaceuticals, Inc. | Multi-targeted single entity conjugates |
| MA43072A (fr) | 2015-07-22 | 2018-05-30 | Wave Life Sciences Ltd | Compositions d'oligonucléotides et procédés associés |
| TW201718620A (zh) | 2015-07-27 | 2017-06-01 | 阿尼拉製藥公司 | 黃嘌呤脫氫酶(XDH)iRNA組成物及其使用方法 |
| DK3329002T3 (da) | 2015-07-31 | 2021-01-11 | Alnylam Pharmaceuticals Inc | Transthyretin (ttr)-irna-sammensætninger og fremgangsmåder til anvendelse deraf til behandling eller forebyggelse af ttr-forbundne sygdomme |
| WO2017032726A1 (en) | 2015-08-24 | 2017-03-02 | Roche Innovation Center Copenhagen A/S | Lna-g process |
| CN114668774A (zh) | 2015-08-25 | 2022-06-28 | 阿尔尼拉姆医药品有限公司 | 治疗前蛋白转化酶枯草杆菌蛋白酶kexin(pcsk9)基因相关障碍的方法和组合物 |
| PE20181131A1 (es) | 2015-09-02 | 2018-07-17 | Alnylam Pharmaceuticals Inc | COMPOSICIONES DE ARNi PARA LIGANDO 1 DE MUERTE CELULAR PROGRAMADA 1 (PD-L1) Y METODOS DE USO DE LAS MISMAS |
| US20180273573A1 (en) | 2015-10-01 | 2018-09-27 | Memorial Sloan-Kettering Cancer Center | Inhibitors of menaquinone biosynthesis |
| WO2017059446A1 (en) | 2015-10-01 | 2017-04-06 | Memorial Sloan-Kettering Cancer Center | Anthranilyl-adenosinemonosulfamate analogs and uses thereof |
| WO2017055423A1 (en) | 2015-10-02 | 2017-04-06 | Roche Innovation Center Copenhagen A/S | Oligonucleotide conjugation process |
| IL258230B (en) | 2015-10-09 | 2022-09-01 | Wave Life Sciences Ltd | Oligonucleotide preparations and methods thereof |
| US10955407B2 (en) | 2015-10-22 | 2021-03-23 | Roche Innovation Center Copenhagen A/S | In vitro toxicity screening assay |
| WO2017068087A1 (en) | 2015-10-22 | 2017-04-27 | Roche Innovation Center Copenhagen A/S | Oligonucleotide detection method |
| WO2017079291A1 (en) | 2015-11-02 | 2017-05-11 | Ionis Pharmaceuticals, Inc. | Compounds and methods for modulating c90rf72 |
| CA3004799C (en) | 2015-11-12 | 2024-05-14 | F. Hoffmann-La Roche Ag | Oligonucleotides for inducing paternal ube3a expression |
| WO2017160741A1 (en) | 2016-03-13 | 2017-09-21 | Wave Life Sciences Ltd. | Compositions and methods for phosphoramidite and oligonucleotide synthesis |
| DK3430141T3 (da) | 2016-03-14 | 2021-03-01 | Hoffmann La Roche | Oligonukleotider til reduktion af PD-L1-ekspression |
| KR102372122B1 (ko) | 2016-03-18 | 2022-03-07 | 로슈 이노베이션 센터 코펜하겐 에이/에스 | 아실-보호된 l-lna-구아노신 단량체 |
| WO2017165489A1 (en) | 2016-03-23 | 2017-09-28 | Emory University | Antiviral agents for treating zika and dengue virus infections |
| AU2017248637A1 (en) | 2016-04-13 | 2018-09-27 | Ionis Pharmaceuticals, Inc. | Methods for reducing C9ORF72 expression |
| WO2017178656A1 (en) | 2016-04-14 | 2017-10-19 | Roche Innovation Center Copenhagen A/S | TRITYL-MONO-GalNAc COMPOUNDS AND THEIR USE |
| MA45290A (fr) | 2016-05-04 | 2019-03-13 | Wave Life Sciences Ltd | Procédés et compositions d'agents biologiquement actifs |
| JP7097820B2 (ja) | 2016-05-12 | 2022-07-08 | ロシュ イノベーション センター コペンハーゲン エーエス | ヌクレオシドまたはオリゴヌクレオチドへの、立体的に規定されたオキサザホスホリジンホスホルアミダイト単量体のカップリングの増大法 |
| ES2954252T3 (es) | 2016-05-13 | 2023-11-21 | Hoffmann La Roche | Matrices y dispositivos de recogida de muestras basados en proteínas |
| US10882884B2 (en) | 2016-05-18 | 2021-01-05 | Eth Zurich | Stereoselective synthesis of phosphorothioate oligoribonucleotides |
| CN109562122A (zh) | 2016-06-03 | 2019-04-02 | 波涛生命科学有限公司 | 寡核苷酸、组合物及其方法 |
| CN109310765A (zh) | 2016-06-20 | 2019-02-05 | 领先基因生物技术股份有限公司 | 抗体-药物偶联物 |
| WO2018022473A1 (en) | 2016-07-25 | 2018-02-01 | Wave Life Sciences Ltd. | Phasing |
| JP7296882B2 (ja) | 2016-11-23 | 2023-06-23 | ウェイブ ライフ サイエンシズ リミテッド | ホスホラミダイト及びオリゴヌクレオチド合成のための組成物及び方法 |
-
2011
- 2011-09-22 EP EP11826893.7A patent/EP2620428B1/en active Active
- 2011-09-22 WO PCT/JP2011/071559 patent/WO2012039448A1/ja active Application Filing
- 2011-09-22 US US13/825,627 patent/US10428019B2/en active Active
- 2011-09-22 DK DK11826893.7T patent/DK2620428T3/da active
- 2011-09-22 JP JP2012535064A patent/JP5868324B2/ja active Active
-
2016
- 2016-01-05 JP JP2016000684A patent/JP6450692B2/ja active Active
-
2018
- 2018-08-21 JP JP2018154836A patent/JP2019006793A/ja active Pending
Patent Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE1144279B (de) * | 1957-09-26 | 1963-02-28 | Robins Co Inc A H | Verfahren zur Herstellung von 3-Aryl-3-hydroxypyrrolidinen und deren Salzen |
| JPS61280473A (ja) * | 1985-02-01 | 1986-12-11 | ラボラトワ−ル エル ラフオン | 3−フエニル−テトラヒドロピリジン誘導体及びその製造方法 |
| WO2000023444A1 (en) * | 1998-10-21 | 2000-04-27 | Abbott Laboratories | 5,7-disubstituted-4-aminopyrido[2,3-d]pyrimidine compounds |
| JP2005089441A (ja) | 2003-08-08 | 2005-04-07 | Toudai Tlo Ltd | 立体規則性の高いリン原子修飾ヌクレオチド類縁体の製造法 |
| WO2010064146A2 (en) | 2008-12-02 | 2010-06-10 | Chiralgen, Ltd. | Method for the synthesis of phosphorus atom modified nucleic acids |
| WO2010106414A1 (en) | 2009-03-16 | 2010-09-23 | Nokia Corporation | A controller for a directional antenna and associated apparatus and methods |
| WO2011045702A1 (en) * | 2009-10-15 | 2011-04-21 | Pfizer Inc. | Pyrrolo[2,3-d] pyrimidine compounds |
Non-Patent Citations (7)
| Title |
|---|
| GIJSEN ET AL.: "Development of two diastereoselective routes towards trans-4- aminomethyl-piperidin-3-ol building blocks", TETRAHEDRON, vol. 64, no. 10, 2008, pages 2456 - 2464, XP022439735 * |
| GREEN ET AL.: "Protective Groups in Organic Synthesis", 1999, JOHN WILEY & SONS, INC |
| KIHARA; ET AL M: "New Norepinephrine Potentiators: Synthesis and Structure-Activity Relationships of a Series of 4-Phenyl-1,2,3,4-tetrahydroisoquinolin-4-ols", CHEMICAL & PHARMACEUTICAL BULLETIN, vol. 42, no. 1, 1994, pages 67 - 73, XP055099194 * |
| NUCLEIC ACIDS RESEARCH, vol. 19, 1991, pages 1527 |
| TETRAHEDRON LETTERS, vol. 34, 1993, pages 3373 |
| TETRAHEDRON, vol. 64, 2008, pages 2456 - 2464 |
| WADA, T.: "Frontier of Development of Nucleic acid Medicine", February 2009, CMC PUBLICATION, article "Development of nucleic acid medicines, 3.3 Chemical synthesis of phosphorus atom-modified nucleic acids", pages: 67 - 75 |
Cited By (67)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9394333B2 (en) | 2008-12-02 | 2016-07-19 | Wave Life Sciences Japan | Method for the synthesis of phosphorus atom modified nucleic acids |
| US9695211B2 (en) | 2008-12-02 | 2017-07-04 | Wave Life Sciences Japan, Inc. | Method for the synthesis of phosphorus atom modified nucleic acids |
| US10307434B2 (en) | 2009-07-06 | 2019-06-04 | Wave Life Sciences Ltd. | Nucleic acid prodrugs and methods of use thereof |
| US9744183B2 (en) | 2009-07-06 | 2017-08-29 | Wave Life Sciences Ltd. | Nucleic acid prodrugs and methods of use thereof |
| US10428019B2 (en) | 2010-09-24 | 2019-10-01 | Wave Life Sciences Ltd. | Chiral auxiliaries |
| US9605019B2 (en) | 2011-07-19 | 2017-03-28 | Wave Life Sciences Ltd. | Methods for the synthesis of functionalized nucleic acids |
| WO2014012081A2 (en) | 2012-07-13 | 2014-01-16 | Ontorii, Inc. | Chiral control |
| US9598458B2 (en) | 2012-07-13 | 2017-03-21 | Wave Life Sciences Japan, Inc. | Asymmetric auxiliary group |
| US9617547B2 (en) | 2012-07-13 | 2017-04-11 | Shin Nippon Biomedical Laboratories, Ltd. | Chiral nucleic acid adjuvant |
| JP2015528002A (ja) * | 2012-07-13 | 2015-09-24 | ウェイブ ライフ サイエンス プライベート リミテッド | キラル制御 |
| US10590413B2 (en) | 2012-07-13 | 2020-03-17 | Wave Life Sciences Ltd. | Chiral control |
| EP3812370A1 (en) | 2012-07-13 | 2021-04-28 | Wave Life Sciences Ltd. | Asymmetric auxiliary group |
| US10167309B2 (en) | 2012-07-13 | 2019-01-01 | Wave Life Sciences Ltd. | Asymmetric auxiliary group |
| US9982257B2 (en) | 2012-07-13 | 2018-05-29 | Wave Life Sciences Ltd. | Chiral control |
| JP2019069971A (ja) * | 2012-07-13 | 2019-05-09 | ウェイブ ライフ サイエンシズ リミテッドWave Life Sciences Ltd. | キラル制御 |
| EP4219516A2 (en) | 2012-07-13 | 2023-08-02 | Wave Life Sciences Ltd. | Chiral control |
| JP7004637B2 (ja) | 2012-07-13 | 2022-02-04 | ウェイブ ライフ サイエンシズ リミテッド | キラル制御 |
| WO2014010250A1 (en) | 2012-07-13 | 2014-01-16 | Chiralgen, Ltd. | Asymmetric auxiliary group |
| US10149905B2 (en) | 2014-01-15 | 2018-12-11 | Shin Nippon Biomedical Laboratories, Ltd. | Chiral nucleic acid adjuvant having antitumor effect and antitumor agent |
| US10322173B2 (en) | 2014-01-15 | 2019-06-18 | Shin Nippon Biomedical Laboratories, Ltd. | Chiral nucleic acid adjuvant having anti-allergic activity, and anti-allergic agent |
| US10144933B2 (en) | 2014-01-15 | 2018-12-04 | Shin Nippon Biomedical Laboratories, Ltd. | Chiral nucleic acid adjuvant having immunity induction activity, and immunity induction activator |
| EP4137572A1 (en) | 2014-01-16 | 2023-02-22 | Wave Life Sciences Ltd. | Chiral design |
| WO2015107425A2 (en) | 2014-01-16 | 2015-07-23 | Wave Life Sciences Pte. Ltd. | Chiral design |
| US10160969B2 (en) | 2014-01-16 | 2018-12-25 | Wave Life Sciences Ltd. | Chiral design |
| US11634710B2 (en) | 2015-07-22 | 2023-04-25 | Wave Life Sciences Ltd. | Oligonucleotide compositions and methods thereof |
| US10479995B2 (en) | 2015-07-22 | 2019-11-19 | Wave Life Sciences Ltd. | Oligonucleotide compositions and methods thereof |
| WO2017015575A1 (en) | 2015-07-22 | 2017-01-26 | Wave Life Sciences Ltd. | Oligonucleotide compositions and methods thereof |
| US10450568B2 (en) | 2015-10-09 | 2019-10-22 | Wave Life Sciences Ltd. | Oligonucleotide compositions and methods thereof |
| US11407775B2 (en) | 2016-03-13 | 2022-08-09 | Wave Life Sciences Ltd. | Compositions and methods for phosphoramidite and oligonucleotide synthesis |
| US11060089B2 (en) | 2016-04-18 | 2021-07-13 | Sarepta Therapeutics, Inc. | Antisense oligomers and methods of using the same for treating diseases associated with the acid alpha-glucosidase gene |
| WO2017190041A1 (en) | 2016-04-29 | 2017-11-02 | Sarepta Therapeutics, Inc. | Oligonucleotide analogues targeting human lmna |
| US10724035B2 (en) | 2016-05-04 | 2020-07-28 | Wave Life Sciences Ltd. | Oligonucleotide compositions and methods thereof |
| US10882884B2 (en) | 2016-05-18 | 2021-01-05 | Eth Zurich | Stereoselective synthesis of phosphorothioate oligoribonucleotides |
| US11013757B2 (en) | 2016-06-03 | 2021-05-25 | Wave Life Sciences Ltd. | Oligonucleotides, compositions and methods thereof |
| WO2018005805A1 (en) | 2016-06-30 | 2018-01-04 | Sarepta Therapeutics, Inc. | Exon skipping oligomers for muscular dystrophy |
| US11873316B2 (en) | 2016-11-23 | 2024-01-16 | Wave Life Sciences Ltd. | Compositions and methods for phosphoramidite and oligonucleotide synthesis |
| US11395855B2 (en) | 2016-12-19 | 2022-07-26 | Sarepta Therapeutics, Inc. | Exon skipping oligomer conjugates for muscular dystrophy |
| US11642364B2 (en) | 2016-12-19 | 2023-05-09 | Sarepta Therapeutics, Inc. | Exon skipping oligomer conjugates for muscular dystrophy |
| WO2018118627A1 (en) | 2016-12-19 | 2018-06-28 | Sarepta Therapeutics, Inc. | Exon skipping oligomer conjugates for muscular dystrophy |
| US10888578B2 (en) | 2016-12-19 | 2021-01-12 | Sarepta Therapeutics, Inc. | Exon skipping oligomer conjugates for muscular dystrophy |
| EP4122497A1 (en) | 2016-12-19 | 2023-01-25 | Sarepta Therapeutics, Inc. | Exon skipping oligomer conjugates for muscular dystrophy |
| US11000600B2 (en) | 2016-12-19 | 2021-05-11 | Sarepta Therapeutics, Inc. | Exon skipping oligomer conjugates for muscular dystrophy |
| EP4115908A1 (en) | 2016-12-19 | 2023-01-11 | Sarepta Therapeutics, Inc. | Exon skipping oligomer conjugates for muscular dystrophy |
| WO2018118599A1 (en) | 2016-12-19 | 2018-06-28 | Sarepta Therapeutics, Inc. | Exon skipping oligomer conjugates for muscular dystrophy |
| WO2018118662A1 (en) | 2016-12-19 | 2018-06-28 | Sarepta Therapeutics, Inc. | Exon skipping oligomer conjugates for muscular dystrophy |
| US11382981B2 (en) | 2016-12-19 | 2022-07-12 | Sarepta Therapeutics, Inc. | Exon skipping oligomer conjugates for muscular dystrophy |
| US11603532B2 (en) | 2017-06-02 | 2023-03-14 | Wave Life Sciences Ltd. | Oligonucleotide compositions and methods of use thereof |
| US11597927B2 (en) | 2017-06-02 | 2023-03-07 | Wave Life Sciences Ltd. | Oligonucleotide compositions and methods of use thereof |
| US11718638B2 (en) | 2017-06-21 | 2023-08-08 | Wave Life Sciences Ltd. | Compounds, compositions and methods for synthesis |
| US11739325B2 (en) | 2017-08-08 | 2023-08-29 | Wave Life Sciences Ltd. | Oligonucleotide compositions and methods thereof |
| US11608355B2 (en) | 2017-09-18 | 2023-03-21 | Wave Life Sciences Ltd. | Technologies for oligonucleotide preparation |
| WO2019059973A1 (en) | 2017-09-22 | 2019-03-28 | Sarepta Therapeutics, Inc. | OLIGOMERIC CONJUGATES FOR THE EXON JUMP FOR MUSCLE DYSTROPHY |
| WO2019067981A1 (en) | 2017-09-28 | 2019-04-04 | Sarepta Therapeutics, Inc. | POLYTHERAPIES FOR TREATING MUSCLE DYSTROPHY |
| WO2019067979A1 (en) | 2017-09-28 | 2019-04-04 | Sarepta Therapeutics, Inc. | POLYTHERAPIES FOR TREATING MUSCLE DYSTROPHY |
| WO2019067975A1 (en) | 2017-09-28 | 2019-04-04 | Sarepta Therapeutics, Inc. | POLYTHERAPIES FOR TREATING MUSCLE DYSTROPHY |
| US11596646B2 (en) | 2017-10-12 | 2023-03-07 | Wave Life Sciences Ltd. | Oligonucleotide compositions and methods thereof |
| US11555189B2 (en) | 2017-10-18 | 2023-01-17 | Sarepta Therapeutics, Inc. | Antisense oligomer compounds |
| US11491238B2 (en) | 2018-05-29 | 2022-11-08 | Sarepta Therapeutics, Inc. | Exon skipping oligomer conjugates for muscular dystrophy |
| US11338041B2 (en) | 2018-05-29 | 2022-05-24 | Sarepta Therapeutics, Inc. | Exon skipping oligomer conjugates for muscular dystrophy |
| US10758629B2 (en) | 2018-05-29 | 2020-09-01 | Sarepta Therapeutics, Inc. | Exon skipping oligomer conjugates for muscular dystrophy |
| US10765760B2 (en) | 2018-05-29 | 2020-09-08 | Sarepta Therapeutics, Inc. | Exon skipping oligomer conjugates for muscular dystrophy |
| EP4219717A2 (en) | 2018-06-13 | 2023-08-02 | Sarepta Therapeutics, Inc. | Exon skipping oligomers for muscular dystrophy |
| WO2020023688A1 (en) | 2018-07-27 | 2020-01-30 | Sarepta Therapeutics, Inc. | Exon skipping oligomers for muscular dystrophy |
| WO2020123574A1 (en) | 2018-12-13 | 2020-06-18 | Sarepta Therapeutics, Inc. | Exon skipping oligomer conjugates for muscular dystrophy |
| WO2020214763A1 (en) | 2019-04-18 | 2020-10-22 | Sarepta Therapeutics, Inc. | Compositions for treating muscular dystrophy |
| WO2023055774A1 (en) | 2021-09-30 | 2023-04-06 | Sarepta Therapeutics, Inc. | Antisense oligonucleotides having one or more abasic units |
| WO2024064237A2 (en) | 2022-09-21 | 2024-03-28 | Sarepta Therapeutics, Inc. | Dmd antisense oligonucleotide-mediated exon skipping efficiency |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2019006793A (ja) | 2019-01-17 |
| JP2016128431A (ja) | 2016-07-14 |
| JP6450692B2 (ja) | 2019-01-09 |
| DK2620428T3 (da) | 2019-07-01 |
| US20130178612A1 (en) | 2013-07-11 |
| US10428019B2 (en) | 2019-10-01 |
| EP2620428A1 (en) | 2013-07-31 |
| JP5868324B2 (ja) | 2016-02-24 |
| JPWO2012039448A1 (ja) | 2014-02-03 |
| EP2620428A4 (en) | 2014-05-21 |
| EP2620428B1 (en) | 2019-05-22 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6450692B2 (ja) | 不斉補助基 | |
| US11718638B2 (en) | Compounds, compositions and methods for synthesis | |
| JP6178744B2 (ja) | モルホリノオリゴマーの合成方法 | |
| EP0983248B1 (en) | Analogs of duocarmycin and cc-1065 | |
| EP3684755A1 (en) | Technologies for oligonucleotide preparation | |
| WO2005115975A1 (ja) | アリールアルキルアミン化合物及びその製法 | |
| CN107250137B (zh) | 作为长效dpp-iv抑制剂的取代的氨基六元饱和杂脂环类 | |
| TW202237847A (zh) | 聚-𠰌啉代寡核苷酸缺口體 | |
| AU2005221959C1 (en) | Novel indole derivative for alkylating specific base sequence of DNA and alkylating agent and drug each comprising the same | |
| KR20000064764A (ko) | 인돌릴말레이미드의제조방법 | |
| CN105189464B (zh) | 作为n型钙通道阻滞剂的环戊基吡唑 | |
| JP5070543B2 (ja) | β−アミノエステルの製造方法 | |
| WO2023179773A1 (en) | Bicyclic heterocycles and their ligands for targeted delivery of therapeutic agents | |
| EP3653623A1 (en) | Method for producing (2s)-2-[(1h-pyrazol-1-yl)methyl]-1,3-oxazinane derivative | |
| CN116789641A (zh) | 二氢异喹啉类化合物及其医药用途 | |
| JP5268052B2 (ja) | 不斉アミノ化反応用触媒 | |
| CN111393375A (zh) | 一种氮取代的六元芳杂环酮类化合物及其药物组合物、制备方法和用途 | |
| JPWO2016047644A1 (ja) | 光学活性α−トリフルオロメチル−β−アミノ酸誘導体の製造方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 11826893 Country of ref document: EP Kind code of ref document: A1 |
|
| ENP | Entry into the national phase |
Ref document number: 2012535064 Country of ref document: JP Kind code of ref document: A |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 13825627 Country of ref document: US |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 2011826893 Country of ref document: EP |