人間の心臓は右半分と左半分の両方とも心室と心房から構成される。これらの空洞は心臓の隔壁によって分離され、隔壁は心房中隔と心室中隔に分類される。
心房と心室の間、かつ心房と接続した動脈内に位置する、機械弁のように機能する心臓弁のために、血液は心室を通って一方向にのみ流れることができる。上大静脈および下大静脈が右心房に流れ込む。それらは、体循環からの酸素を使い切った血液(静脈血)を心臓に供給する。心室収縮(心収縮)のときに血液が心房に逆流するのを防止する、機械弁のような三尖弁が、右心房と左心室の間に位置している。三尖弁は、靱帯によって心室筋組織にフラップ状に固定された三つの断片(弁尖とも呼ばれる)で構成される(そのため、「フラップ弁」とも呼ばれる)。二つの肺動脈が共通幹(肺動脈幹)を経由して心臓の右心室から出る。心室と肺動脈幹の間にも弁(いわゆる肺動脈弁)が存在する。この種の弁は、その形状のために半月弁とも呼ばれる。肺動脈は、酸素を使い切った血液を肺循環に供給する。
続いて、酸素の豊富な血液(動脈血)が通常、四つの肺静脈を通って肺循環から左心房に流れる。そこから、血液はさらなるフラップ弁、すなわち僧帽弁を通って左心室に到達する。流出は、肺動脈と同様に半月弁(大動脈弁)を有する大動脈によって実行される。
心臓のサイクルの間、はじめに心房が満たされ心室は同時に血液を動脈内に吐き出す。心室筋組織が弛緩すると、心室内の圧力低下のためにフラップ弁が開き、血液が心房から流れ込む(心収縮(auricular systole))。これは、心房の収縮によって補助される。心室収縮がその後に続く。すなわち、心室筋組織が収縮し、圧力が上昇し、フラップ弁が閉じ、そして血液が開いた半月弁を通って動脈内へと流れることができる。弛緩期(心臓拡張期)中の動脈からの血液の逆流は、流れの方向が弁のみによって定められるように半月弁を閉じることによって防止される。
四つの心臓弁は、心臓内で機械弁のように動作し、誤った方向への血液の逆流を防止する。心臓のいずれの半分もフラップ弁(房室弁)と半月弁とを有する。房室弁は心房と心室との間に位置し、二尖弁/僧帽弁および三尖弁と呼ばれる。半月弁は心室と血管流との間に位置し、それぞれ肺動脈弁および大動脈弁と呼ばれる。
心臓の左側にある弁(大動脈弁および僧帽弁)は、心臓の右側にある弁(肺動脈弁および三尖弁)よりも顕著に影響を受けることが多いものの、弁の欠陥、すなわち心臓弁の機能障害は、四つの心臓弁のいずれにも影響を与えうる。機能障害は、狭窄(constriction, stenosis)、不全症または二つの組み合わせ(組み合わせ欠陥)を包含することができる。
医学において、「大動脈弁閉鎖不全症(aortic valve insufficiency)」または略して「大動脈弁不全症(aortic insufficiency)」という用語は、心臓の大動脈弁の閉鎖の欠陥およびその結果としての大動脈から左心室への血液の拡張期逆流のことを指す。大動脈弁不全症の重症度および大動脈の枯渇に対する抵抗の程度に応じて、逆流の量は左心室の排出量(通常の心拍出量は40〜70ml)の最大三分の二にまでなり得る。これは、特徴的な高血圧の振幅となって現れる。この逆流血液は左心室の拡張期充満を増大させ、心臓のこの部分の血液量が過剰となり、結果として遠心性肥大(eccentric hypertrophy)となる。
大動脈弁の狭窄は、大動脈弁の不完全な開きによって引き起こされる心臓弁膜症である。大動脈弁が狭窄を起こすと、左心室と大動脈の間に圧較差(pressure gradient)が生じる。弁がさらに狭窄すると、左心室と大動脈の間の圧較差がさらに高くなる。例えば、軽度の大動脈弁狭窄では、圧較差は20mmHgになり得る。これは、収縮期のピークにおいて、左心室が140mmHgの圧力を発生させる間、大動脈に伝わる圧力が120mmHgに過ぎないことを意味する。
大動脈弁狭窄を起こした個体では、狭窄した大動脈弁によって生じた増大した負荷を克服するために、左心室は増大した圧力を発生させて左心室から血液を排出しなければならない。大動脈弁狭窄がさらに深刻になると、左心室の収縮期圧と動脈の収縮期圧の間の圧較差がさらに高くなる。左心室によって発生する増大した圧力のために、左心室の心筋(筋肉)は肥大する(筋肉量が増加する)。
大動脈弁狭窄の状況で起こる狭心症は、大動脈弁狭窄によって生じた圧較差を克服するために必要となる増大した圧力の持続生成によって生じる左心室肥大に続発する症状である。左心室の心筋(すなわち、心臓の筋肉)が厚くなる一方で、心筋に血液を供給する動脈は有意に長くなったり大きくなったりはしないので、心筋は虚血性になる(すなわち、適切な血液供給を受けられなくなる)。虚血は、最初は運動時、すなわち心筋が増大した負荷を埋め合わせるために増大した血液供給を必要とするときに明らかになるかもしれない。個人は、労作性狭心症を訴えるかもしれない。この段階では、画像を用いた負荷試験が虚血を示唆することもある。
僧帽弁閉鎖不全症は、人間医学および少なくとも一部の動物種においてよく見られる弁欠陥である。これは、閉鎖の欠陥すなわち心臓の僧帽弁の「漏れ」を引き起こし、駆出期(収縮期)中の左心室から左心房への血液の逆流につながる。
僧帽弁は、心臓の左心房と左心室の間で機械弁のように機能する。僧帽弁は心室の充満期(拡張期)に開き、心房からの血液の流入を可能にする。駆出期(収縮期)の開始時に、心室内での急激な圧力増加により僧帽弁が閉鎖し、心房を「封鎖」する。その際、わずか約8mmHgの圧力が心房内に広がり、同時に心室内の約120mmHgの収縮期圧によって血液はその通常経路に沿って大動脈内に送られる。
しかしながら、深刻な僧帽弁閉鎖不全症の場合、逆流時の開口は40mm2よりも大きくなり、逆流量は60mlよりも大きくなる。これは、深刻かつ時には生死にかかわる変化となり得る。
急性期には、左心室と左心房が通常の大きさの場合、心房内で、したがって肺静脈内でも顕著な圧力増加が生じる。これは最大100mmHgにもなることがあり、肺動脈が正常の状態であると仮定すると、急性の肺水腫を引き起こす。圧倒的な血液の逆流によって動脈内への流出が不十分になり、全ての臓器への血流量が低下する可能性がある。
深刻な心臓弁狭窄または心臓弁不全症を治療するためには、狭窄したまたは病変した心臓弁の弁機能を体内プロテーゼが遂行する必要がある。この点の本質は、心臓の移植部位、すなわち置換すべき(病変した)心臓弁の平面内に、体内プロテーゼをしっかりと位置決めおよび固定して、ときにはかなり大きくなる力が弁プロテーゼに作用した場合にも、弁プロテーゼが変位したりずれたりしないようにすることである。また、心収縮中の効果的な封止も僧帽弁および心拡張時の大動脈弁にとっては受容である。
本発明は、心臓弁の狭窄(stenosis, narrowing)および/または心臓弁不全症の治療に用いられる体内プロテーゼ用の拡張ステントに関する。さらに、本発明は、心臓弁の狭窄および/または心臓弁不全症を治療するためにカテーテルを用いて移植部位に搬送可能であるステントを備える、折り畳みおよび拡張可能なプロテーゼに関する。本発明のステントおよびステントに取り付けられた弁プロテーゼを用いて、四つの異なる心臓弁、特に肺動脈弁および大動脈弁のいずれかを置換することができるが、以下では、簡単のために、病変した大動脈弁の治療への本発明の適用について説明する。
上述の弁プロテーゼを位置決めし固定するために、弁プロテーゼ100が適切に固定される心臓弁ステント10が本発明の少なくとも特定の実施形態で採用される。心臓弁狭窄または心臓弁不全症を治療するための、心臓弁ステント10およびステント10に固定された弁プロテーゼ100からなる医療機器を、以下では単に体内プロテーゼ(endoprosthesis)1と呼ぶ。
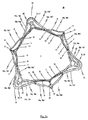
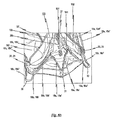
図1dは、心臓弁狭窄または心臓弁不全症を治療するための体内プロテーゼ1の側面斜視図である。体内プロテーゼ1は、本発明の第1実施形態に係る弁プロテーゼ100を保持する心臓弁ステント10を備える。図2dは、同様に、心臓弁狭窄または心臓弁不全症を治療するための別の体内プロテーゼ1の側面斜視図であり、本発明の第2実施形態に係る心臓弁ステント10が採用される。
以下の説明は、本発明の好適な実施形態を詳細に説明するための図面を参照して行われる。本発明の特定の実施形態に係る心臓弁ステント10(以下、単に「ステント」と呼ぶ)は、ステント10が折り畳まれた状態である第1の予め定義された形状から、ステント10が拡張された状態である第2の予め定義された形状に変形可能な拡張構造を有する。図1aは、本発明の第1実施形態に係るステント10の側面図であり、ステント10が折り畳まれた状態である。図2aは、本発明の第2実施形態に係る折り畳まれたステント10を示す。
二つの実施形態において、ステント10とステントに取り付けられた弁プロテーゼは、挿入カテーテルシステム(図には明示せず)を使用して第1の形状(図1aおよび図2aを参照)で患者の体内に低侵襲的に挿入される。挿入の間は、ステント10に固定された弁プロテーゼ100も同様に折り畳まれた状態である。しかしながら、明瞭さのために、図1aと図2aの両方とも、ステント10に固定された弁プロテーゼ100の表示が省かれている。
患者の心臓に移植部位に到達すると、ステント10は拡張された形状に変形する。ステント10に固定された弁プロテーゼ100も展開し拡張される。ステント10の拡張された形状は、プログラミングによって設定された恒久的な形状である。完全に展開し拡張された弁プロテーゼ100が同様に固定された、本発明の第1/第2実施形態に係る完全に拡張されたステント10が、図1dおよび図2dに示されている。ステント10の第2形状、すなわち完全に拡張したが移植されていない状態のステント10の形状が、完全に拡張し移植された状態のステント10の形状と異なっていてもよい点に注意するのが重要である。なぜなら、移植された状態では、完全に拡張したステント10の形状は、移植部位における生体構造によって少なくとも部分的に制限されるからである。
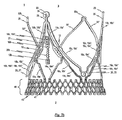
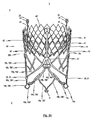
図1bおよび図1cは、弁プロテーゼ100が除かれた異なる視点からの本発明の第1実施形態に係る完全に拡張されたステント10を示す。図2bおよび図2cは、同様に弁プロテーゼ100が除かれた異なる視点からの本発明の第2実施形態に係る完全に拡張されたステント10を示す。
以下、ステント10の第1実施形態の説明において図1aから図1eを最初に参照する。
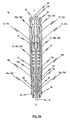
第1実施形態に係るステント10は、チューブ、特に金属管の一部から一体的に切断された構造をしている。ステント10の設計を形作るために使用された切断パターンが、図1eの二次元投影図の中に描かれている。
詳細には、ステント10は、ステントを肺動脈弁または大動脈弁の平面内に自ら位置決めさせる機能を担う三つの位置決めアーチ15a、15b、15cを有する。位置決めアーチ15a、15b、15cは、心臓の移植部位(図18a参照)においてステント10を位置決めする間、治療対象の(病変した)心臓弁の嚢(pocket)Tに係合する丸まったヘッド部20を有する。
生体弁のものと一致する対称性を提供する他、三つの位置決めアーチ15a、15b、15cは回転の精度、回転対称性および回転安定性を提供する。当然ながら、ステント10は全部で三つの位置決めアーチの使用に限定されるものではない。
それぞれがステント10の下端2の方を向く位置決めアーチ15a、15b、15cのヘッド部20は、位置決めアーチ15a、15b、15cが置換される心臓弁Hの嚢Tに係合するときに血管壁が損傷しないように丸くされている。ステント10の移植中の移動及び位置の分析を改善するため、位置決めアーチ15a、15b、15cのヘッド部20上にまたはその内部に基準マーカ21が設けられる。赤外線または超音波によって活性化可能な放射線を通さない(radio opaque)マーカが特に適している。
位置決めアーチ15a、15b、15cはそれぞれ、ステント10の下端で閉鎖する本質的にU字形またはV字形の構造を呈する。したがって、各位置決めアーチ15a、15b、15cは、関連する位置決めアーチ15a、15b、15cのヘッド部20からステント10の上端3に向けてそれぞれ延び出す全部で二つのアーム(腕部)15a’、15a”、15b’、15b”、15c’、15c”を有する。そうすることで、二つの隣合う位置決めアーチのそれぞれの隣接するアームが、接続部22を介して互いに接続される。
適切なカテーテルシステムを用いてステント10およびステントに取り付けられた弁プロテーゼを移植および外植するため、ステント10はその上端3にカテーテル保持手段23を備えている。接続部22はそれぞれ、接続ウェブ25を介してカテーテル保持手段23と接続される。接続ウェブ25は、以下では「第2接続ウェブ25」と呼ばれる。
カテーテル保持手段23は、それぞれが対応する長円形の小穴24を有する長円形のヘッド部を備える。カテーテル保持手段23の形状は、ステント10の移植/外植に使用されるカテーテルシステムのカテーテルの先端のクラウンを補完する。カテーテル先端のクラウンは、カテーテル保持手段23の負側として構成された突出要素を有する。代替的には、突出要素が小穴24の補完的な形状であり、カテーテル保持ヘッドとして構成される。これは、ステント10の上部領域3と解放可能に係合するようにクラウンの突出要素を形成し、カテーテル先端にステント10を解放可能に取り付けることで実現可能である。
第1接続ウェブ17は、ステント10の長手方向Lに本質的に延出し、上端部17dと下端部17pとを有する。上端部17dは、上述した第2接続ウェブ25に加えて、二つの隣合う位置決めアーチ15a、15b、15cの二つのアーム15a’、15a”、15b’、15b”、15c’、15c”の間の接続部22の中に開く。図1bから分かるように、第1接続ウェブ17は本質的に逆Y字形の構成を有し、その下端部17pで分岐して二つの隣合う保持アーチ16a、16b、16cのそれぞれのアーム16a’、16a”、16b’、16b”、16c’、16c”に道を譲る。
それぞれの位置決めアーチ15と保持アーチ16の間には、締結アーチ(fastening arch)19がある。図1bに特に明瞭に示すように、締結アーチは締結部11の下端から延出し、ステント10の下端で閉鎖する実質的にU字形またはV字形の構造を有する。図1dに示されるように、締結アーチは弁プロテーゼ100の下端を支持する役割を果たす。プロテーゼ100は、締結アーチ19a、19b、19cが弁材料のポケット内に配置されるような形状とされる。
このステント設計は軸対称の構造を実現し、各位置決めアーチ15a、15b、15cが一つの締結アーチ19a、19b、19cと一つの保持アーチ16a、16b、16cに割り当てられる。したがって、図1aから図1dに描かれた第1実施形態のステント10は、図1dに例示として描かれたように、弁プロテーゼ100を収容するためのステント10の保持セグメントを構成する全部で三つの保持アーチ16a、16b、16cを備える。
ステント10が第1の(折り畳まれた)形状である、図1aに示すステント10の状態では、位置決めアーチ15a、15b、15cのそれぞれのアーム15a’、15a”、15b’、15b”、15c’、15c”は、締結アーチ19a、19b、19cのそれぞれのアーム19a’、19a”、19b’、19b”、19c’、19c”と直接隣接し、アーム19a’、19a”、19b’、19b”、19c’、19c”は関連する保持アーチ16a、16b、16cのそれぞれのアーム16a’、16a”、16b’、16b”、16c’、16c”と直接隣接する。
第1実施形態に従ったステント10が第2の拡張された形状で示されている図1bを参照する。各位置決めアーチ15a、15b、15c、関連する締結アーチ19a、19b、19cおよび保持アーチ16a、16b、16cのそれぞれが、ステント10の下端2に向けて閉鎖する本質的にU字形またはV字形の構造を呈することが、この図から特に認識できる。具体的には、各位置決めアーチ15a、15b、15cは、関連する締結アーチ19a、19b、19cの本質的にU字形またはV字形の構造が取られたチューブの一部の材料片から切り出される。このことは、図1eに描かれた切断パターンから理解することができる。
図1aと図1bを比較すると、ステント10の拡張時、すなわちステント10が第1形状から第2形状に変形するとき、ステント10の長手方向Lの長さが短くなる一方、同時に断面が拡大することが分かる。ステント10の拡張状態では、位置決めアーチ15a、15b、15cは、ステント10の上端3と比較して、ステント10の下端2における半径方向でより大きく拡大する。半径方向により大きく突出するので、位置決めアーチ15a、15b、15cを、置換される心臓弁Hの心臓弁嚢Tの中に特に簡単な態様で展開することができる。
ステント10の拡張状態時にステント10から半径方向に既に突出している位置決めアーチ15a、15b、15cのために、心臓の移植部位でステント10およびステントに取り付けられた弁プロテーゼの特定の固定が達成されているときでさえも、位置決めアーチ15a、15b、15cから血管壁に作用する接触力はステント10を移植部位にしっかりと固定するには不十分であることに注意する。ステント10の下端2を形成する上述した保持アーチ16a、16b、16cは、この理由のために設けられている。保持アーチ16a、16b、16cは、拡張状態時にステント10の周囲から半径方向に突出し、その結果、保持アーチ16a、16b、16cは半径方向に作用する接触力を持ってステントの展開される血管壁を押しつける。加えて、保持アーチ16a、16b、16cの閉鎖端部が外方に広がり、ステント10の周囲からさらに半径方向に突出する。この形状により、保持アーチ16a、16b、16cの端部を生体弁輪(native valve annulus )の下方に位置づけるか、または少なくとも生体弁輪の上に位置づけることが可能になり、これによってステント10およびステントに取り付けられた弁プロテーゼがさらに固定される。
保持アーチ16a、16b、16cに加えて、ステント10は補助アーチ(auxiliary arch)18a、18b、18cをさらに備える。補助アーチ18a、18b、18cは、ステント10の移植部位で血管壁に対して半径方向に作用する接触力を同様に及ぼし、これによって移植部位におけるステント10およびステントに取り付けられた弁プロテーゼの固定がさらに改善される。
図1bから分かるように、ステント10は、ステント10の下端2に向けて閉鎖する全部で三つの本質的にU字形またはV字形の補助アーチ18a、18b、18cを備える。各補助アーチ18a、18b、18cは、第1の保持アーチ16a、16b、16cを、第1の保持アーチと隣合う第2の保持アーチと接続する。
拡張されたステント10の下端領域2の上面図(図1c参照)では、下端領域2は、保持アーチ16a、16b、16cの個々のアーム16a’、16a”、16b’、16b”、16c’、16c”および補助アーチ18a、18b、18cの個々のアーム18a’、18a”、18b’、18b”、18c’、18c”から形成された、12角形の多角形構造を呈する。このステント設計は、特に、ステント10の下端領域2の周りに一様に分布した全部で6つのアーチ16a、16b、16c、18a、18b、18cを提供する。アーチのそれぞれは血管壁を押しつけ、ステント10が拡張され移植された状態においてステント10およびステントに取り付けられた弁プロテーゼを効果的に適切な位置に保持する。
要約すると、一方で保持アーチ16a、16b、16cを設け、他方で補助アーチ18a、18b、18cを設けることで、これらのアーチのそれぞれの下端部によって血管壁に半径方向の力が及ぼされる。これにより、ステント10に固定された弁プロテーゼ100の血管壁に対する強固な封止と、心臓の移植部位におけるステント10のしっかりとした固定の両方を確実に行うことができる。
保持アーチ16a、16b、16cおよび補助アーチ18a、18b、18cによって血管壁に及ぼされる接触力に加えて、ステント10が完全に拡張したが移植されていない状態のときに、ステント10の上端領域3を下端領域2と比較して半径方向に10%から25%だけ大きく拡張させることも考えられる。こうすると、ステント10は、下端領域2に向けて先細であるわずかに凹形の構造となる。しかしながら、移植された状態のステントの形状は移植側の生体組織によって制限されるので、完全に拡張し移植された状態では、ステント10の上端部3は下端領域2と比較して10%から25%だけ半径方向に拡張されないことがある。しかしながら、ステント10の上端部3は、ステント10の制約を受ける下端部2の環の直径と比較して、やや半径方向に広がる傾向にある。これにより、血管壁を押しつけるステント10の上端領域2によってステント10が血管内にしっかりと固定される。
ステント10およびステントに取り付けられた弁プロテーゼが中に展開された心臓および血管の蠕動運動の間でさえも、ステント10に固定された弁プロテーゼのステント10に対する縦方向の変位が確実に最小となるように、図面に示された本発明のステント10の実施形態は、ステント10の長手方向Lに延び、弁プロテーゼ100の組織部分をステント10に固定する手段である複数の締結部11をステント10に備えている。心臓弁狭窄または心臓弁不全症を治療するための体内プロテーゼ1の側面斜視図である図1dを参照する。体内プロテーゼ1は、本発明の第1実施形態にしたがった、弁プロテーゼ100を保持するステント10を備える。弁プロテーゼ100は、生体材料または合成材料で作られた少なくとも一つの弁尖102を備える。
ブタやウマなどの動物から除去された生体弁、心膜などの結合組織から作成された人工の生体弁、細胞培養で育成された組織、ニチノールなどの人工材料および人工繊維を含む、任意の適切な材料で弁プロテーゼを作成できることは認められよう。
詳細には、ステント10の第1接続ウェブ17は、上端17dを介して接続部22と接続し、下端17pを介して締結部11の上端13と接続する。一つのおよび同一の接続ウェブ17と接続された締結部の下端14はそれぞれ、ステント10の下端2に向けて閉鎖する本質的にU字形またはV字形の補助アーチ18a、18b、18cを介して互いに接続される。
具体的には、本発明の第1実施形態のステント10の拡張された状態が図1dに示されており、ここではステント10によって引き伸ばされた糸101または細いワイヤによって弁プロテーゼ100が上記ステント10に固定されている。弁プロテーゼ100が配置されたステント10の中央領域および下端領域2を拡大することで、体内プロテーゼの展開が実現されることは容易に理解される。同時に、保持アーチ16a、16b、16cおよび補助アーチ18a、18b、18cの下端部が、(図1dに不図示の)血管壁に半径方向の力を及ぼす。
図1dから理解できるように、ステント10のそれぞれの締結部11内に規定の複数の締結穴12が構成されており、これらが締結部11に沿った予め定められた長手方向位置に分布するように配置されている。弁プロテーゼ100の組織部分をステント10に固定する糸101または細いワイヤは、それぞれの締結穴12を通して導かれる。
体内プロテーゼ1を構成する部品、すなわちステント10と弁プロテーゼ100の両方が、外科的処置の直前まで互いに接続されなくてもよい。そのように構成された体内プロテーゼ1は、弁プロテーゼ100の組織の構造的劣化を起こすことなく、拡張された形状で長期間保存することができる。外科的処置の直前に体内プロテーゼ1を圧縮して折り畳み形状にされる。続いて、体内プロテーゼ1は、体内プロテーゼ1の移植に用いられるカテーテルシステム内に挿入される準備ができる。
当然、体内プロテーゼ1を構成する部品、すなわちステント10と弁プロテーゼ100の両方が、外科的処置の直前まで接続されないことも想定可能である。この場合、ステント10は第2の形状、すなわち拡張された状態で保存され、外科的処置の直前まで第1の(折り畳まれた)形状にされない。
図1bおよび図1dから、それぞれの締結部11が、ステント10の保持アーチ16a、16b、16cのそれぞれのアーム16a’、16a”、16b’、16b”、16c’、16c”内に構成されることが分かる。締結部11内に構成される締結穴12の大きさは、弁プロテーゼ100の組織部分をステント10に締結するために使用される糸101またはワイヤの太さに適合させるべきである。
締結穴12の断面形状も、弁プロテーゼ100の締結に使用される糸101またはワイヤの断面形状に適合させてもよい。これにより、ステント10に対して予め定められた正確な位置に弁プロテーゼ100を固定することができる。弁プロテーゼ100をステント10に固定するために複数の締結穴12を設けることによって、ステント10への弁プロテーゼ100正確な位置決めが実現される。
締結穴12は、弁プロテーゼ100をステント10に固定するために使用される糸101またはワイヤの太さおよび/または断面形状に適合されているので、体内プロテーゼ1が移植されるとき、心臓の蠕動運動に起因するステント10と弁プロテーゼ100との間の相対移動を効果的に防ぐことができる。体内プロテーゼ1が完全に拡張して移植された状態にあるとき、弁プロテーゼ100は、弁プロテーゼの固定に使用される糸101またはワイヤの摩擦で引き起こされる摩耗が最小化されるような、最小限の遊びでステント10に締結される。
弁組織、すなわち弁プロテーゼ100の組織部分がステント10にしっかりと締結されるが、弁組織は、折り畳まれるときにステントが伸びるようにして損傷を与えることなく変形できるようなものでなければならない。
上述したように、それぞれの締結部11内に構成された締結穴12は、弁プロテーゼ100をステント10に固定するために使用される糸101の直径に応じて、および/または弁プロテーゼ100の組織部分をステント10に固定するために利用される縫製技術に応じて、直径、数または断面形状(長円形、四角形など)が異なっていてもよい。少なくとも一つの締結穴12の直径、数および/または断面形状は、体内プロテーゼ1(すなわち、心臓弁狭窄および/または心臓弁不全症の治療に用いられる医療機器)の種類の表示としての役割を果たしてもよい。この点において、少なくとも一つの締結穴12の直径、数および/または断面形状を、ステント10に固定されるように適合された弁プロテーゼ100の異なるサイズまたは種類を区別するための表示として使用してもよいし、あるいは、弁プロテーゼ100が既にステント10に固定されている場合、体内プロテーゼ1の異なるサイズまたは種類を区別するための表示として使用してもよい。例えば、ステントに固定された小さいサイズの弁プロテーゼ100を有する小さなサイズのステント10、あるいは小さなサイズの弁プロテーゼ100を運ぶように適合され構成された小さなサイズのステント10は、円形の締結穴12を有してもよく、一方、ステントに固定された大きなサイズの弁プロテーゼ100を有する大きなサイズのステント10、あるいは大きなサイズの弁プロテーゼ100を運ぶように適合され構成された大きなサイズのステント10は、三角形の締結穴12を有してもよい。これにより、執刀医/心臓スタッフが、測定の必要なしに、異なる弁のサイズ、ステントの種類、および/または弁プロテーゼの種類を簡単にかつ視覚的に見分けることが可能になる。
図1a〜eに示す第1実施形態では、ステント10の締結部11(その上に弁プロテーゼ100が縫製されるか縫製可能である)は、ステント10が圧縮されるとき、例えばステント10が図1aに示す第1の(折り畳まれた)形状であるときに、自身の形状を変化させない。この事象は、標準のチューブ状ステントが使用されるときに発生する。したがって、糸が摩耗するリスクは最小限になる。
しかしながら、本発明の第16および第17実施形態で詳細に説明するように、保持アーチと、保持アーチの各アームに設けられる締結部とは、ステント10が折り畳まれるときにその形状が変化しないように構成されてもよい。詳細には、本発明のステント設計の第16および第17実施形態によると、ステントが拡張されるとき保持アーチは曲がっているが、ステントが折り畳まれているときには相対的に直線である。
第2実施形態に係るステント10が図2aから図2cに描かれており、これは図1aから図1cに示したステント10の第1実施形態と構造および機能が類似している。図1eに係る切断パターンと原則として同等である、図2eに示す切断パターンにも同様のことが当てはまる。したがって、共通する特徴の詳細な説明は省略される。
相違点は、ステント10の上端3に設けられたカテーテル保持手段23の構成に見られる。本発明の第1実施形態のステント10と対照的に、本質的に丸い構成のヘッド部が第2実施形態におけるカテーテル保持手段23として使用されており、いずれの場合も本質的に長円形の小穴24が設けられている。ヘッド部の丸い構成のために、損傷または障害を与える危険性が低下する。それゆえ、ヘッド部の本質的に丸い構成はより傷つけないようになっている(atraumatic)。
既に示したように、本発明の特定の実施形態に係るステント10は、チューブの一部から、特に金属管から一体的に切断された構造を呈する。締結アーチ19a、19b、19cおよび保持アーチ16a、16b、16cが、各位置決めアーチ15a、15b、15cに割り当てられており、各保持アーチ16a、16b、16cは補助アーチ18a、18b、18cによって隣合う保持アーチと接続される。特定の数の締結穴12を有する締結部11が、保持アーチ16a、16b、16cの各アーム16a’、16a”、16b’、16b”、16c’、16c”内に構成される。
図1eおよび図2eはそれぞれ、本発明の第1または第2実施形態に従ったステント10の展開図を示す。これらの展開図はそれぞれ、本発明の第1または第2実施形態に従ったステント10の製造に使用可能である切断パターンの二次元投影図に対応する。これにより、チューブの一部、特に金属管から一体的なステント10を切り出すことが可能になる。一方では、本発明のステント10は、ステント10の個々の部品(位置決めアーチ、保持アーチ、補助アーチ)の間の固定ジョイントまたは他の類似の接続デバイスを省略している。他方では、位置決めアーチ15a、15b、15cによって提供されるような位置決め機能と、保持アーチ16a、16b、16cの各アーム16a’、16a”、16b’、16b”、16c’、16c”内に構成された締結穴11によって提供されるような弁プロテーゼ100の規定の締結の機能とが、長手方向の広がりが最小限であるステント10に与えられる。
保持アーチ16a、16b、16cに加えて、ステント10は、心臓の移植部位にステント10を特にしっかりと固定可能にする補助アーチ18a、18b、18cをさらに備える。
本発明の第3実施形態に係るステント10も、チューブの一部、特に金属管から切り出された一体構造を有する。ステント設計を形成するために使用される切断パターンが、図3の二次元投影図に示される。
ステントの第3実施形態と第1および第2実施形態との間の相違点は、図3に示す二次元の切断パターンの参照によって理解することができる。第1または第2実施形態の場合のように、ステント10の第三実施形態は、全部で三つの位置決めアーチ15a、15b、15cを有している。位置決めアーチは、肺動脈弁または大動脈弁の平面内に心臓弁ステントを自動的に位置決めする機能を引き受ける。
ステント10はニチノールから作られる。ステントが拡張された状態のとき、すなわち切替温度を越えて恒久的形状となったとき、図1b、図1d、図2bおよび図2dに示すように位置決めアーチが半径方向に広がるだけでなく同時にステント10の方向にわずかに凸状に曲がるとなるように、位置決めアーチ15a、15b、15cが製造時に適切な熱処理によって調整される。この手段により、位置決めアーチ15a、15b、15cのヘッド部20を理想的なかたちで拡張ステント10の長手軸Lと平行にすることが可能になる。結果として、心臓弁ステント10の移植の間、位置決めアーチ15a、15b、15cのヘッド部20を生体弁Hの嚢T(図12a参照)の中に特に容易に挿入することができる。とりわけ、位置決めアーチ15a、15b、15cを生体弁Hの嚢Tの中に挿入するときに周囲組織への損傷が最小となる。生体弁の弁尖を各アーチの底部で挟むことによって、位置決めアーチ15a、15b、15c生体弁の弁尖にさらにクリップ力を及ぼすことができる。
加えて、位置決めアーチ15a、15b、15cの凸状の湾曲によって、移植部位でステント10を特にしっかりと支持できるようになるが、これは位置決めアーチ15a、15b、15cが生体心臓弁Hの嚢Tおよびその周囲の組織により適合しているからである。
第1および第2実施形態に係るステント10(例えば、図1b、1c、1d、2b、2c、2d)におけるように、第3実施形態のステント10は、小穴24を有するカテーテル保持手段23を備える。上述の実施形態と同様に、適切なカテーテルシステムがカテーテル保持手段23と切り離し可能に結合され、低侵襲の血管を横断する(transvascular)ステント10の移植および外植を容易に行えるようにする。
第1および第2実施形態のステント10と同様に、保持アーチ16a、16b、16cおよび補助アーチ18a、18b、18cは、ステント10を移植部位に半径方向にしっかりと固定し、締結アーチ19a、19b、19cによってステント10に締結された弁プロテーゼを拡張する役に立つ。ステントの本実施形態の保持アーチ16a、16b、16cおよび補助アーチ18a、18b、18cもまた移植された弁プロテーゼを封止する機能があることを説明するために、さらなる議論は必要がない。同様に、保持アーチ16a、16b、16cおよび位置決めアーチ15a、15b、15cがペーパークリップのように生体心臓弁Hを挟み、その結果心臓の移植部位にステント10をしっかりと固定することに貢献する。
第3実施形態に係るステント10は、各保持アーチ16a、16b、16cのそれぞれのアーム16a’、16a”、16b’、16b”、16c’、16c”が、締結部11から心臓弁ステントの下端2に延び、接続部30によって互いに接続される点で、第1および第2実施形態とは相違する。図1b、1c、1d、2b、2c、2dに係る実施形態のU字形またはV字形の接続部30と比較すると、接続部30は異なる形状を有する。特に、接続部20は、締結アーチの対応する接続部30’の直上にくびれ部を有している。保持アーチおよび締結アーチのくびれ部は、各補助アーチ18a、18b、18cの下端で拡張されたヘッド31を収容する。
図3を詳細に観察すると、保持アーチ16a、16b、16cの二つのアーム16a’、16a”、16b’、16b”、16c’、16c”を接続する各接続部30は、略O字形の構成を有する。この形状は、弁プロテーゼ100をステント10に締結するためのより大きな空間を提供し、弁プロテーゼとステントの間で荷重伝達がなされている間に体内プロテーゼの移植された状態で生じうる荷重ピークの発生に効果的に対抗する。
接続部30の代替的形状は、ステントが拡張された状態で移植部位に位置決めされるとき、保持アーチ16a、16b、16cの下端と血管壁との間の実効接触面積をさらに増大させる。このため、弁プロテーゼが取り付けられたステントと血管壁との間の封止を改善することができる。さらに、保持アーチ16a、16b、16cを介して血管壁に伝達される、ステントの拡張状態時に作用する半径方向の力が、分離した接触面積にわたって分配され、これにより荷重ピークの発生に対抗する。保持アーチ16a、16b、16cから血管壁に対する損傷の危険性も軽減される。
締結アーチ19a、19b、19cの二つのアーム19a’、19a”、19b’、19b”、19c’、19c”を接続する各接続部30’は、弁プロテーゼ100のステント10への固定を補助する、より角の多い形状を有する。
保持アーチ16および締結アーチ19の閉鎖端部の代替的な形状は、短縮された補助アーチ18a、18b、18cの拡大ヘッド部31を収容する。拡大ヘッド部31により、補助アーチを用いて弁材料100を支持することが可能になり、また、追加の半径方向の力を与えることができる。ヘッド部31は、ステントに取り付けられる弁プロテーゼ100をさらに安定にする、弁プロテーゼ100の追加取付具のための締結穴12を備える。追加の締結穴12は、ステント10内での弁100の位置合わせミスの可能性を低減し、また体内プロテーゼ1が移植された後の弁100のあらゆる縦方向移動を最小化する。加えて、また保持アーチ16a、16b、16cに関連して既に述べたように、拡大されたヘッド部31には拡張された接触面積が与えられ、これは移植部位におけるステント10の固定を強化する一方で、血管壁に対する損傷の危険性を最小化する。
図3の切断パターンから分かるように、それぞれの保持アーチ16a、16b、16cの上側アーム部は、関連する締結部11の下側領域14と接続される。その一方、補助アーチ18a、18b、18cの上側アーム部は、関連する締結部11の中央領域と接続される。こうすると、ステント10の全体サイズを拡大することなく、保持アーチ16a、16b、16cのアーム16a’、16a”、16b’、16b”、16c’、16c”並びに補助アーチ18a、18b、18cのアーム18a’、18a”、18b’、18b”、18c’、18c”と締結部11との間をしっかりと接続することができる。
第3実施形態のステントと第1および第2実施形態のステントとのさらなる相違点は、切り欠き26を含むことである。図3に示すように、切り欠き26は締結部11の下端に位置し、補助アーチ18a、18b、18cと保持アーチ16a、16b、16cのアーム内に形成される。ステントの強度が確実に維持されるように、切り欠きはアームから切り出されるのではなくアーム内に成形される。切り欠き26は、縫合糸またはワイヤ用の追加ガイドおよび固定点として機能する。
切り欠き26を収容するために、補助アーチ18a、18b、18cは、締結部11の下端からではなく、締結部11の全長に沿った中間から延出する。この構成は、短縮された補助アーチから欠落しかねない十分な柔軟性を各補助アーチ18a、18b、18cに与える。
図4は、本発明の第4実施形態に係るステント10の平面展開図であり、本発明の第4実施形態に係るステント10の製造に適した切断パターンの二次元投影図に対応する。
ステント10の第4実施形態は、第3実施形態と類似している。しかしながら、第4実施形態のステントは、弁プロテーゼを締結するために追加の締結穴12aが設けられている。具体的には、追加の締結穴12aは、第1接続ウェブ17の下端17pにある。追加の締結穴12aは、締結部11と接続部22の間の第1接続ウェブ17上の小穴として構成される。当然ながら、追加の締結穴12aを小穴として構成せずに、第1接続ウェブ内に直接形成することも想定される。追加の締結穴12aにより、弁プロテーゼの上側領域をステント10に対してさらにしっかりと固定することが可能になる。
追加の締結穴12aの大きさは、弁プロテーゼをステント10に締結するために使用される特定の糸またはワイヤの太さに適合させてもよい。追加の締結穴12aの断面形状も、弁プロテーゼを締結するために使用される糸またはワイヤの断面形状に適合させてもよい。弁プロテーゼを心臓弁ステントに固定するための複数の追加の締結穴12aが存在するために、心臓弁ステントに対する弁プロテーゼの締結位置を正確に定めることができる。
締結穴12aの代わりに、ステント10の同じ領域に一つ以上の切り欠きが設けられていてもよい。これらの切り欠きは締結穴12aと同じ機能を果たし、ステント100内での弁プロテーゼのさらなる固定に貢献する。
本発明の第5実施形態に係るステント10が、ステントの拡張された状態で図5a−図5cに示されている。図5aおよび図5bはステント10の側面図であり、図5cはステント10の上端3の平面図である。図5dは、本発明の第5実施形態に係るステントの平面展開図であり、本発明の第5実施形態に係るステントの製造に適した切断パターンの二次元投影図に対応する。ステントはチューブの一部、特に金属管から一体的に切り出される。
第5実施形態に係るステント10は、第3実施形態のステントと構造および機能の点で類似する。特に、第5実施形態のステント10は、全部で三つの位置決めアーチ15a、15b、15cを同様に有しており、これらが肺動脈弁または大動脈弁の平面内でステント10を自動的に位置決めする機能を引き受ける。ステント10の他の実施形態のように、位置決めアーチ15a、15b、15cは丸いヘッド部20を有し、これが心臓の移植部位(図18a参照)におけるステント10の位置決めの間、治療される生体の心臓弁Hの嚢に係合する。
全部で三つの保持アーチ16a、16b、16cと三つの締結アーチ19a、19b、19cも設けられる。
第5実施形態のステント10は、締結部11内に締結穴12に加えてさらに切り欠き26aが設けられている点で、第3実施形態のステントと相違する。図5dから分かるように、弁プロテーゼ100の組織部分の追加固定手段として、および縫合糸またはワイヤのガイドとして機能する一連の切り欠き26aが設けられる。これらの追加切り欠き26aは、体内プロテーゼ1が移植されるとき、縫合糸またはワイヤの移動を最小化し、第1接続ウェブ17とのこすれによる糸またはワイヤの摩耗を低減する。追加切り欠き26aによって弁プロテーゼの上側領域を心臓弁ステント10にしっかりと締結することができ、プロテーゼの移動を最小限とし、これによって縫合糸またはワイヤの摩擦により生じる摩耗の可能性がさらに最小化される。
当然ながら、追加ノッチ26aを縫合糸またはワイヤの太さに適合させることも考えられる。とりわけ、縫合糸またはワイヤの損傷を最小化するように追加ノッチ26aの半径を定めてもよい。
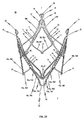
ステント10の第5実施形態は、位置決めアーチ15a、15b、15cからステント10の上端3に向けて延びる放射アーチ32a、32b、32cを備える。図5aおよび図5bに最も明瞭に示されているように、ステント10は三つの放射アーチ32a、32b、32cを有し、各アーチ32a、32b、32cは、各位置決めアーチ15a、15b、15cの二つのアーム15a’、15a”、15b’、15b”、15c’、15c”の間に位置している。各放射アーチ32a、32b、32cは、各位置決めアーチ15a、15b、15cとはおおよそ逆の形状を有しており、位置決めアーチ15a、15b、15cのそれぞれ一つと反対の方向に延出する。
図5dに示す切断パターンから特によく分かるように、放射アーチ32の各アーム32’、32”は、ステント10の全長の略中点で、反対側の位置決めアーチ15a、15b、15cのアーム15a’、15a”、15b’、15b”、15c’、15c”と融合する。
各放射アーチ32a、32b、32cの二つのアーム32’、32”は、丸い接続部またはヘッド部33によってステント10の上端3で互いに接続される。このヘッド部33は丸いだけでなく、ステント10が拡張され移植される状態にあるとき、血管の内壁に対して可能な限り大きな接触面積で接触するように先端が広がっている。
各放射アーチ32a、32b、32cのヘッド部33は、移植前および移植中にステント10をカテーテル内に保持し、および/または移植後にステントを取り戻すことのできる追加手段としても機能する。
図5cは、ステント10の上端3からみた斜視平面図であり、ステント10が拡張された状態にあるとき、ステント10の周囲外方に半径方向に延出するように放射アーチ32a、32b、32cがプログラムされている様子を示す。こうすると、ステント10の上端領域によって、血管壁に対して増大した接触力を与えることができる。したがって、その場所でステント10を固定するときの安全性が増加し、これによってステントが移動する可能性が低下する。したがって、拡張された状態では、位置決めアーチのクランプ効果に加えて、全てがステント10の周囲から半径方向外方に突出する保持アーチ16a、16b、16c、補助アーチ18a、18b、18cおよび放射アーチ32a、32b、32cによって及ぼされる半径方向の力によって、第5実施形態のステント10が適切な位置に固定される。
カテーテル保持手段23または締結小穴24を有する締結手段が位置する平面を越えて、放射アーチ32a、32b、32cがステント10の長手方向Lに突出しないことが、図5dに示す切断パターンから分かる。これは、放射アーチ32a、32b、32cのヘッド部33と干渉することなく、カテーテル保持手段23が適切な移植カテーテル内の対応手段と協働できるようにしている。実際、上述したように、ヘッド部33自体をステント10の外植を遂行するための追加のカテーテル保持手段または追加手段として使用することができる。
原理上、半径方向の接触力をさらに増大するために、ステント10は三つより多い数の放射アーチ32を備えてもよい。例えば、移植部位においてステント10をさらに良好に固定可能とするために、放射アーチ32a、32b、32cの一部または全てに鉤状(barb)要素を設けることも可能である。
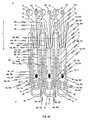
本発明の第6実施形態に係るステント10を図6a−6dおよび図6f−6iに示す。図6a−6cは、拡張された状態にあるステント10の様々な側面斜視図である。一方、第6実施形態に係るステントの平面展開図を図6dに示す。この平面展開図は、第6実施形態に係るステントの製造に適した切断パターンの二次元投影図に対応する。
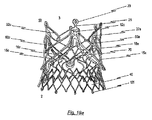
図6eは、心臓弁狭窄または心臓弁不全症を治療するための体内プロテーゼの側面斜視図であり、体内プロテーゼは、本発明の第6実施形態と同様の、弁プロテーゼを保持するための心臓弁ステントを備える。詳細には、図6eは、弁プロテーゼ100をステント10に固定する方法の一例として、ステント10に取り付けられた弁プロテーゼ100を示す。この例は、本明細書で述べるステント実施形態に適用可能である。
図6fは、心臓弁狭窄または心臓弁不全症を治療するための体内プロテーゼの側面斜視図であり、体内プロテーゼは、本発明の第6実施形態に係る、弁プロテーゼを保持するための心臓弁ステントを備える。
図6gおよび図6hは、図6fに示した体内プロテーゼの様々な側面詳細図である。図6iは、図6fに示した体内プロテーゼの下端部の平面図である。
上述した実施形態にあるように、第6実施形態のステント10は、チューブの一部、特に金属管から切断された一体構造として構成される。切断パターンは、図6に二次元投影図として示されている。
ステント10の第6実施形態は、原理上、第5実施形態と構造および機能の点で類似している。繰り返しを避けるために、第5実施形態の上記説明を参照する。特に、ステント10の上側領域における半径方向に作用する接触力を増大させるために、本質的にU字形またはV字形の放射アーチ32a、32b、32cが同様に設けられる。
弁プロテーゼの組織部分をさらに締結するために、追加締結部11aを備えた固定ブリッジ27が設けられている点で、第6実施形態は第5実施形態と相違する。心膜などの生体材料のシートから構築された弁が弁プロテーゼとして使用されるとき、すなわち、弁プロテーゼが数片の材料で構成されるとき、追加締結部11aを備えた固定ブリッジ27の存在は特に有利となる。心膜弁が使用されるとき、心膜材料がステント10にしっかりと取り付けられることを保証するために注意を払わなければならない。この理由のため、第6実施形態に係るステント10は、それぞれが追加締結部11aを備える全部で三つの固定ブリッジ27を有する。各固定ブリッジ27は第1接続ウェブ17の一つに取り付けられ、ステント10の下端2の方向に延出する。
固定ブリッジ27に設けられた追加締結部11aは、心膜材料または弁プロテーゼをステント10に締結するために使用される糸または細いワイヤを固定するための締結穴12bおよび/または他の締結手段、例えば切り欠き26bをさらに有しており、これによって弁プロテーゼの移動を最小限に、好ましくはゼロにすることができる。当然ながら、その直径が弁プロテーゼを締結するために使用される糸またはワイヤの太さに適合された締結穴または締結小穴を設けることも想定される。一般に、締結穴12bまたは切り欠き26bの半径は、摩擦により生ずる糸またはワイヤの摩耗をできるだけ最小とするように設定されるべきである。
心臓弁狭窄または心臓弁不全症を治療するための体内プロテーゼ1の側面図を表す図6eおよび図6fを参照する。図6fに示した実施形態では、ステント10は、弁プロテーゼ100を保持するための、本発明の第6実施形態にしたがうステントに対応する。第6実施形態に関して弁プロテーゼ100をステント10に固定する方法の説明は、本明細書に記載の他の実施形態に係るステント10にも適用可能である。
弁プロテーゼ100は、生体材料または合成材料で作られた少なくとも一つの弁尖102(図6i参照)を備える。特に、図6eは体内プロテーゼ1の側面斜視図を表し、心臓弁ステント10が部分的に拡張された状態で示されている。図6fは体内プロテーゼ1の側面斜視図を表し、心臓弁ステント10が完全に拡張された状態で示されている。図6g−iは、図6fに示した体内プロテーゼ1の様々な詳細斜視図である。詳細には、図6gは保持アーチ16aのヘッド部30の詳細斜視図であり、図6hは追加締結部11aの詳細斜視図である。図6iは図6fに示した体内プロテーゼ1の下端部2の平面図である。
ステント10が展開された心臓および血管の蠕動運動の間でさえも、ステント10に固定された弁プロテーゼ100のステント10に対する長手方向の変位が最小になるように、本発明の第6実施形態に係るステント10は、ステント10の長手方向Lに延びる複数の締結部11を備える。加えて、第6実施形態に係るステント100には、それぞれが第1接続ウェブ17の一つに取り付けられステント10の下端2の方向に延出する追加締結部11aが設けられる。締結部11および追加締結部11aの両方によって、弁プロテーゼ100の組織部分がステント10に固定される。
詳細には、弁プロテーゼ100の組織部分は、締結部11および追加締結部11aの締結穴12、12bをそれぞれ通して導かれる糸101または細いワイヤによって、ステント10に締結される。これにより、ステント10に対して予め定義された正確な位置に、弁プロテーゼ100をステント10に固定することが可能になる。弁プロテーゼ100をステント10に固定するための複数の締結穴12を設けることによって、ステント10上での弁プロテーゼ100の正確な位置決めが実現される。
本発明の第6実施形態に係るステントの変形例であるステント10を備えた体内プロテーゼ1を示す図6eを参照する。図6eに示したステント10は、まだ完全には拡張されていない。本発明の第6実施形態に係るステント10が完全に拡張された体内プロテーゼ1は、図6fに示されている。
図18a−cを参照して詳細に後述するように、本発明に係るステント10は、心尖から(すなわちトランスアピカル(transapical))、または大腿動脈および大動脈弓を通して(すなわちトランスフェモラル(transfemoral))心臓の移植部位に到達する挿入カテーテルシステムを介して、侵襲を最小限にして折り畳まれた状態で前進する。挿入手順の間、弁プロテーゼ100が固定されたステント10は、カテーテルシステムの先端K内に折り畳まれた状態で収容される(図18a参照)。心臓の移植部位に到達すると、弁プロテーゼ100が固定されたステント10は、カテーテルシステムの搬送部の近位側Kの部分を選択的に操作することによって順に解放される。
図18a−cに示す挿入手順は、大腿動脈および大動脈弓を通して(すなわち経大腿)心臓の移植部位に体内プロテーゼ1が挿入される挿入手順であることに注意するのが重要である。しかしながら、本発明は図18a−cを参照して説明される特定の搬送アクセスに限定されない。むしろ、体内プロテーゼ1の移植のために様々なアプローチを使用することができる。例えば、心尖から移植部位に体内プロテーゼを運ぶ、大動脈弁を治療するためのトランスアピカルアプローチなどである。
詳細には、第1解放ステップの間、ステント10の残りの部分、特に保持アーチ16a、16b、16c、補助アーチ18a−cおよび放射アーチ32a−cが依然として折り畳まれた状態(図18a参照)である一方、ステント10の位置決めアーチ15a−cが解放されるように、挿入カテーテルシステムの搬送部の近位側Kが操作される。第1解放ステップ中に解放される位置決めアーチ15a−cは、半径方向外方に拡張し展開する。その後、カテーテルシステムの搬送部の近位側Kを適切に移動することによって、拡張された位置決めアーチ15a−cを患者の生体心臓弁Hの嚢Tの中に挿入することができる(図18a参照)。
後に続く第2解放ステップでは、ステント10の下端部2を形成するアーチ(補助アーチ18a−cおよび保持アーチ16a、16b、16c)が解放される一方、ステント10の上端部3は依然として挿入カテーテルシステムの搬送部の近位側Kにしっかりと固定され、解放されることがないように、挿入カテーテルシステムの搬送部の近位側Kが操作される(図18a参照)。
ステント10に配置された位置決めアーチ15a−cおよび保持アーチ16a、16b、16cは、下側方向に、すなわちステント10の下端部2に向けて凸状および円弧状にカーブしていてもよく、このような丸みのある形状は、動脈の損傷を低減するとともに自己拡張中の展開を容易にすることができる。このような設計により、近隣の組織または血管を損傷することなく、生体心臓弁の嚢内に位置決めアーチ15a−cをより容易に挿入することが可能になる。
図6eには、弁プロテーゼ100が上記ステント10に固定された本発明の一実施形態に係るステント10を有する体内プロテーゼ1の第2解放ステップ後の状態が示されている。第2解放ステップでは、カテーテル保持手段23を備える上端部3のみが挿入カテーテルシステムの先端Kにしっかりと接続され、ステント10の残りの部分は既に解放され半径方向に拡張されている。図6eから、保持アーチ16a、16b、16cおよび補助アーチ18a−cの自己拡張のために、これらに固定された弁プロテーゼ100が既に(少なくとも部分的に)拡張されていることが分かる。
図6eに示すように、ステント10の上端3は依然として挿入カテーテルシステムの搬送部(図6eには明示されていない)内の袖状部P内に収容されている。機能の確認が可能になる程度まで弁プロテーゼ100の展開および位置決めが行われるまで、この状態が維持される。
機能テストによって弁プロテーゼ100が十分に機能することが分かると、カテーテル保持手段23を有するステント10の上端3が完全に解放される(図18c参照)ように、袖状部Pを遠位に引き戻すことができる。
糸101を用いて弁プロテーゼ100をステント10に固定する方法が図6eからさらに理解される。二つの隣合う保持アーチ16a、16bの間に延びる固定ブリッジ27の締結穴12bに縫い付けられた心膜弁プロテーゼ100が図示の実施形態で用いられる。図6cおよび図6fを参照のこと。弁プロテーゼ100は、実質的に円形の断面を有する事実上の管状であってもよい。ステント10の下端2では、弁プロテーゼ100はビード(bead)105状になる。体内プロテーゼ1の平面図では環状であるこのビード105は、弁プロテーゼ100を自身の上に巻き上げて弁プロテーゼ100の下端部を裏返すことによって形成される。図6eに示すように、環状ビード105は糸101によって縁取り(overedge)されている。環状のビード105は異なる構造であってもよい。
弁プロテーゼ100の下端にある環状ビード105は、蠕動運動があった場合でも、弁プロテーゼ100の周辺領域を体内プロテーゼ1の移植部位における血管にしっかりと固定することができ、また血管壁をしっかりと封止することができる。
弁プロテーゼ100の下端の環状ビード105は、ステント10の下端部2で良好な接触とより一様な構造とを提供して、移植状態の体内プロテーゼ1を固定するのに必要な半径方向力をより均一に分布させる。この点において、体内プロテーゼ1の移植後に封止および漏れの防止を実現することができる。時間が経過すると、組織が成長して体内プロテーゼ1をさらに固定し、体内プロテーゼ1の移植された状態の血管に対する任意の移動または漏れを防止する。生体血管内に体内プロテーゼ1を移植するとき、環状ビード105の周辺領域と血管壁との間のあらゆる漏れは、体内プロテーゼ1と病変した生体弁輪との間の良好な接触と半径方向圧力とによって封止される。したがって、ビード形状の領域105は、特に心臓サイクルの充満期(心臓拡張期)の間、しっかりとした封止を提供する。
図6iは、例えば図6fに示された体内プロテーゼ1の下端2の平面図であり、図6fに示された体内プロテーゼの流入側から見た図である。ここでは、体内プロテーゼ1のステント10が完全に拡張された状態で示されている。
図6iに示すように、弁プロテーゼ100の弁尖102は、心臓の拡張期の開始時と同様に、半分閉鎖された位置にある。
図6fおよび図6gに詳細に示されているように、追加締結部11aを備える固定ブリッジ27は、弁膜材料または弁プロテーゼ100の組織部分をステント10に締結するために用いられる糸または細いワイヤを固定するための切り欠き26bを有しており、弁プロテーゼの移動を最小限に、好ましくはゼロにすることができる。さらに、弁プロテーゼ100をステント10に固定するための締結手段として、補助アーチ18a−cが使用される。
図6fおよび図6gから、締結アーチ19a−cのそれぞれのヘッド部30’と補助アーチ18a−cのそれぞれのヘッド部31とがその中で係合する円周フラップを形成するように、弁プロテーゼ100の下側が裏返されていることが分かる。体内プロテーゼ1が移植されるとき、心臓の蠕動運動に起因するステント10と弁プロテーゼ100の間の相対運動が効果的に防止されるように、弁プロテーゼ100は遊びが最小限となるようにステント10に締結される。
本発明のステント10の第7実施形態を、図7a−cを参照して以下に説明する。ここで、図7bおよび図7cはそれぞれ、第7実施形態に係る完全に拡張されたステント10の斜視図である。
下端部を除き、第7実施形態に係るステント10は、図6a−dおよび図6f−iを参照して上述した本発明の第6実施形態に係るステントに本質的に対応している。
したがって、第7実施形態に係るステント10は全部で三つの位置決めアーチ15a、15b、15cを有しており、これらは肺動脈弁または大動脈弁の弁平面内でのステント10の自動位置決め機能を引き受ける。ステント10の他の実施形態のように、位置決めアーチ15a、15b、15cは、心臓の移植部位におけるステント10の位置決め中に(図18a参照)、治療される生体心臓弁Hの嚢に係合する丸いヘッド部20を有する。
全部で三つの保持アーチ16a、16b、16cも設けられる。しかしながら、第6実施形態のステント設計とは異なり、第17実施形態に係るステント設計では、各保持アーチ16a、16b、16cの二つのアーム16a’、16a”、16b’、16b”、16c’、16c”は、ほぼO字形構成を有する接続部を介して互いに接続されない。むしろ、第7実施形態では、保持アーチ16a、16b、16cの各アームの下端部が環状カラー40に融合するが、これについては以下でさらに詳細に説明する。
本発明の第6実施形態におけるように、第7実施形態に係るステント設計には追加締結部11aを備える固定ブリッジ27が設けられ、弁プロテーゼの組織部分または弁プロテーゼの一部をさらに締結する。各固定ブリッジ27は第1接続ウェブ17の一つに取り付けられ、ステント10の下端2の方向に延出する。固定ブリッジ27に設けられた追加締結部11aは、弁膜材料または弁プロテーゼの組織部分をステント10に締結するために使用される糸または細いワイヤを固定する締結穴12bおよび切り欠き26bをさらに有し、弁プロテーゼの移動を最小限に、好ましくは移動しないようにすることができる。当然ながら、弁プロテーゼの組織部分を締結するために使用される糸またはワイヤの太さにその直径が適合された締結穴または締結小穴を設けることも想定される。
ステント10の第7実施形態は、位置決めアーチ15a、15b、15cからステント10の上端3に向けて延出する放射アーチ32a、32b、32cも備える。図7bおよび図7cに最も明瞭に示されているように、ステント10は、各位置決めアーチ15a、15b、15cの二つのアーム15a’、15a”、15b’、15b”、15c’、15c”の間に各アーチ32a、32b、32cが配置された、三つの放射アーチ32a、32b、32cを有する。各放射アーチ32a、32b、32cは、各位置決めアーチ15a、15b、15cとはおおよそ反対の形状を有し、位置決めアーチ15a、15b、15cのそれぞれ一つと反対方向に延びる。
体内プロテーゼ1の移植された状態では、心臓サイクルの充満期(心臓拡張期)の間にかなりの力が弁プロテーゼ100に作用し、この力は弁プロテーゼ100に固定されたステントに伝達されるので、弁プロテーゼ100の固定されたステント10を移植部位にしっかりと固定することが重要なのは明らかである。以下で述べるステント10の第7−第11実施形態は、保持アーチ、補助アーチおよび放射アーチの上述の実施形態に追加して提供可能であり、移植部位においてステント10、体内プロテーゼ1をそれぞれさらにしっかりと固定することができ、また体内プロテーゼ1の位置変位を防止することができる、さらなる手段を含む。
詳細には、図7b−cに示すステント10の追加固定手段として、ステント10の下端部2を形成する少なくとも一つの環状カラー(襟状部)40が第7実施形態にしたがって提供される。
図7aは、本発明の第7実施形態に係る別の心臓弁ステントの平面展開図である。図7aの平面展開図は、第7実施形態にしたがった心臓弁ステントをチューブの一部、特に金属管から一体的に切り出して第7実施形態に係る心臓弁ステントを製造するのに使用可能である切断パターンの二次元投影図に対応する。
環状カラー40のステント本体への接続とは別に、図7aに示すステント設計は、図7b−cに示すステント10の設計に対応する。詳細には、図7aの展開図に示すステント設計によると、第7実施形態の修正では、締結アーチ19a、19b、19cと保持アーチ16a、16b、16cとがステントに設けられる。図7aの展開図に示すように、一つの結アーチ19a、19b、19cと一つの保持アーチ16a、16b、16cとが各位置決めアーチ15a、15b、15cに割り当てられる。各保持アーチ16a、16b、16cは、補助アーチ18a、18b、18cによって隣合う保持アーチと接続される。保持アーチ16a、16b、16cの各アーム16a’、16a”、16b’、16b”、16c’、16c”に、複数の締結穴12を持つ締結部が設けられる。
しかしながら、例えば第6実施形態のステント設計とは異なり、図7aのステント設計では、各保持アーチ16a、16b、16cの二つのアーム16a’、16a”、16b’、16b”、16c’、16c”と、各締結アーチ19a、19b、19cの二つのアーム19a’、19a”、19b’、19b”、19c’、19c”のいずれも、ほぼO字形構成を有する接続部を介して互いに接続されない。むしろ、図7aに示すステント設計では、保持アーチ16a、16b、16cの各アームの下端部と、締結アーチ19a、19b、19cの各アームの下端部とが、図7b−cに示すステント設計の環状カラーと同一の構成を有する環状カラー40に融合する。
図7aに示すステント設計とは異なり、図b−cに示すステント10には、保持アーチ16a、16b、16cの各保持アーム16a’、16a”、16b’、16b”、16c’、16c”の下端部のそれぞれまたは一部と単に接続される環状カラー40が設けられるが、この理由は、図7b−cに示すステント10には、図7aに示すステント設計のような締結アーチが設けられていないからである。しかしながら、図7aに示すステント設計には、保持アーチ16a、16b、16cの各保持アーム16a’、16a”、16b’、16b”、16c’、16c”の下端部のそれぞれまたは一部と接続されるとともに、締結アーチ19a−cの各アーム19a’、19a”、19b’、19b”、19c’、19c”の下端部のそれぞれまたは一部と接続される環状カラー40が設けられる。
しかしながら、一般に、第7実施形態のステント10では、環状カラー40は、補助アーチ18a、18b、18cの各アーム18a’、18a”、18b’、18b”、18c’、18c”の下端部のそれぞれまたは一部と接続されてもよい。これは、図7aの平面展開図、図7bの側面図または図7cの斜視図から特に理解することができる。
環状カラー40は、上記ステント10の非拡張状態時にステント10の長手軸と平行に走り、横方向ウェブ42(図7a参照)により相互接続される複数の支持ウェブ41を有する。ステント10の拡張状態時には、支持ウェブ41と横方向ウェブ42とが菱形状、または蛇紋状(serpentine)の環状カラー40を形成し、体内プロテーゼ1、ステント10それぞれの移植状態時に血管壁と接触する。図7bおよび図7cは、拡張状態にある環状カラー40を示す。
環状カラー40は、自己拡張により発現する半径方向の力を血管壁に伝達する経路となる支持体として機能する。ステント10の比較的広い接触面積が血管壁と相互作用するので、また環状カラー40の菱形状、または蛇紋状構造のために、半径方向の力が増大するにもかかわらず、動脈または組織に損傷を与える危険性を低減することができる。
したがって、環状カラー40を設けることによって自己拡張後のステント10の剛性を高めるだけでなく、ステント10の移植部位での固定を改善すなわち強化することができる。加えて、環状カラー40の環状の断面形状は、血管壁と体内プロテーゼ1の間の封止も改善する。
このような環状カラー40は、自己拡張可能な支持構造として有利に構成される。これは、半径方向外向きに作用する接触圧およびその設計のために、移植部位におけるステント10の固定がさらに改善されるという有利な効果を与え、その結果、弁プロテーゼ100を備えるステント10の変位または回転をさらに防止することができる。
本発明のステント10の第8実施形態を図8a−cに示す。詳細には、図8bおよび図8cはそれぞれ第8実施形態のステント10の斜視図であり、ステント10が完全に拡張されている。図8aは、本発明の第8実施形態に係る心臓弁ステントの平面展開図である。図8aの平面展開図は、第8実施形態にしたがった心臓弁ステントをチューブの一部、特に金属管から一体的に切り出す製造に適用可能である切断パターンの二次元投影図に対応する。
上端部を除き、第8実施形態に係るステント10は、図5a−dを参照して上述した本発明の第5実施形態に係るステントと本質的に対応している。
したがって、第8実施形態のステント10は全部で三つの位置決めアーチ15a、15b、15cを有し、肺動脈弁または大動脈弁の弁平面内でのステント10の自動位置決め機能を引き受ける。ステント10の他の実施形態のように、位置決めアーチ15a、15b、15cは丸いヘッド部20を有し、ヘッド部は心臓の移植部位でのステントの位置決め中に、治療される生体心臓弁Hの嚢に係合する(図18a参照)。
全部で三つの保持アーチ16a、16b、16cおよび三つの締結アーチ19a、19b、19cも設けられる。
さらに、第8実施形態のステント10には、締結部11内の締結穴12に加えて、弁プロテーゼ100の組織部分の追加固定手段および縫合糸またはワイヤのガイドとして機能する切り欠き26aが設けられる。これらの追加切り欠き26aは、縫合糸またはワイヤの移動を最小化し、これによって、体内プロテーゼ1が移植されるとき、第1接続ウェブ17上でのこすれによる糸またはワイヤの摩耗が低減される。追加切り欠き26aは、弁プロテーゼの上側領域が心臓弁ステント10にしっかりと締結されるようにし、プロテーゼの移動を最小限にし、これによって縫合糸またはワイヤの摩擦により生じる摩耗の可能性をさらに最小化する。
全部で三つの保持アーチ16a、16b、16cおよび三つの締結アーチ19a、19b、19cも設けられる。
しかしながら、第7実施形態(図7a−c参照)とは対照的に、ステント10の下端部2は第8実施形態で変更されないが、ステント10の上端部3には上部環状カラー40’が形成される。図8bおよび図8cに示すように、環状カラー40’は支持ウェブ41および横方向ウェブ42で構成され、拡張状態時に菱形の支持構造を形成する。
図8aに係る切断パターンの図から、第8実施形態で利用される上部環状カラー40’は放射アーチ32a、32b、32cの上側ヘッド部と接続されることが分かる。他方、上部環状カラー40’は、拡張状態時(図8b、図8c参照)にカテーテル保持手段23が位置づけられる面から離して配置されるように第2接続ウェブ25と接続される。具体的には、第8実施形態の環状カラー40’は、カテーテル保持手段23が位置する平面と、隣合う位置決めアーチ15a−cの二つのアームの接続部22が位置する平面との間に置かれる。この目的のために、第5実施形態の接続ウェブと比較して、接続ウェブ25は幾分長くなるように構成される。
第8実施形態で利用される上部環状カラー40’は、第7実施形態で利用される下部環状カラー40と機能の点で類似するので、明確さのためにこれ以上は説明しない。特に、上部環状カラー40’は、移植状態にある体内プロテーゼの移動を防止するように適切に固定し、また半径方向力を一様に分布させる。
以下では、図9aおよび図9bを参照して本発明に係るステント10の第9実施形態を説明する。図9bは、第9実施形態に係るステント10の拡張された状態の斜視図である。図9aは、本発明の第9実施形態に係る心臓弁ステントの平面図である。図9aの平面図は、心臓弁ステントをチューブの一部から、特に金属管から一体的に切り出すために、本発明の第9実施形態に係る心臓弁ステントの製造に適用可能である切断パターンの二次元投影図に対応する。
上部環状カラー40’はステント10の上端部3に同様に形成されるので、第9実施形態に係るステント10は、図8a−cに係る上述のステント(第8実施形態)と類似している。第8実施形態と比較して、第9実施形態の上部環状カラー40’は、ステント10の長手方向により長くなるように構成される。具体的には、図9bおよび図8bを比較すると、第9実施形態では、環状カラー40’として互いに頂上に位置する二つの菱形環状体が使用されていることが分かる。これは、ステント10が上端部3から及ぼす半径方向の接触力を増大させる。図9a−bに係る実施形態では、対応する細長い接続ウェブ25が利用される。
図10は、本発明の第10実施形態に係る心臓弁ステント10の平面展開図である。この平面図は、チューブの一部から、特に金属管から、本発明の第10実施形態に係る心臓弁ステント10を一体部品として切り出すために使用可能な切断パターンの二次元投影図である。
図8a−bを参照して上述した第8実施形態および図9a−bを参照して上述した第9実施形態と同じく、本発明のステント10の第10実施形態は、図5a−dを参照して上述した実施形態と本質的に対応している。
しかしながら、例えば第8実施形態(図8a−c参照)とは対照的に、ステント10の上端部3は第10実施形態で変更されないが、ステント10の下端部2には下部環状カラー40が形成される。図10に示すように、環状カラー40は支持ウェブ41および横方向ウェブ42で構成され、拡張状態時に菱形の支持構造を形成する。
図10に係る切断パターンの図から、第10実施形態で利用される下部環状カラー40は、保持アーチ16a、16b、16c、締結アーチ19a、19b、19cおよび補助アーチ18a、18b、18cの下側ヘッド部と接続されることが分かる。他方、下部環状カラー40は、拡張状態時にカテーテル保持手段23が位置づけられる面から離して配置されるように、保持アーチ16a、16b、16c、締結アーチ19a、19b、19cおよび補助アーチ18a、18b、18cと接続される。
第10実施形態で利用される下部環状カラー40は、第7実施形態で利用される下部環状カラー40と機能の点で類似するので、明確さのためにこれ以上は説明しない。
図11は、本発明の第11実施形態に係る心臓弁ステント10の平面展開図である。
上端部および下端部を除き、第11実施形態に係るステント10は、図5a−dを参照して上述した本発明の第5実施形態に係るステントと類似する。
したがって、第11実施形態のステント10は全部で三つの位置決めアーチ15a、15b、15cを有し、肺動脈弁または大動脈弁の弁平面内でのステント10の自動位置決め機能を引き受ける。ステント10の他の実施形態のように、位置決めアーチ15a、15b、15cは丸いヘッド部20を有し、ヘッド部は心臓の移植部位でのステントの位置決め中に、治療される生体心臓弁Hの嚢に係合する(図18a参照)。
全部で三つの保持アーチ16a、16b、16cおよび三つの締結アーチ19a、19b、19cも設けられる。
ステント10の第11実施形態は、位置決めアーチ15a、15b、15cからステント10の上端3に向けて延出する放射アーチ32a、32b、32cも備える。図11に示すように、ステント10は、各位置決めアーチ15a、15b、15cの二つのアーム15a’、15a”、15b’、15b”、15c’、15c”の間に各アーチ32a、32b、32cが配置された、三つの放射アーチ32a、32b、32cを有する。各放射アーチ32a、32b、32cは、各位置決めアーチ15a、15b、15cとはおおよそ反対の形状を有し、位置決めアーチ15a、15b、15cのそれぞれ一つと反対方向に延びる。
ステント10の下端部2および上端部2’を形成する二つの環状カラー40、40’が第11実施形態にしたがってステント10の追加固定手段として設けられている点で、ステントの第11実施形態(図11参照)は図5a−dを参照して上述した本発明の第5実施形態とは異なる。図7a−cを参照して上述した第7実施形態のように、下部環状カラー40は、保持アーチ16a、16b、16cのそれぞれの保持アーム16a’、16a”、16b’、16b”、16c’、16c”の下端部、および締結アーチ19a−cのそれぞれのアーム19a’、19a”、19b’、19b”、19c’、19c”の下端部に接続されるが、このことは図11にしたがった切断パターンから特に理解することができる。他方、第11実施形態で利用される上部環状カラー40’は、放射アーチ32a、32b、32cの上側ヘッド部に接続される。詳細には、第11実施形態の環状カラー40’は、カテーテル保持手段23が位置する平面と、隣合う位置決めアーチ15a−cの二つのアームの接続部22が位置する平面の間に置かれる。
本発明の第10実施形態に関して上述したように、上部環状カラーおよび下部環状カラー40、40’は、上記ステント10の非拡張状態時にステント10の長手軸と平行に走り、横方向ウェブ42(図11参照)によって相互接続される複数の支持ウェブ41を有する。ステント10の拡張状態時には、支持ウェブ41および横方向ウェブ42とが菱形状、または蛇紋状の環状カラー40、40’を形成し、体内プロテーゼ1、ステント10それぞれの移植状態時に血管壁と接触する。
図8aおよび図9aに係る切断パターンを比較すると、第11実施形態に係るステント10は、第8実施形態(図8a−c参照)に係るステント10に基本的に由来することが分かる。固定を改善するために、追加の(下部)環状カラー40が、ステント10の下端部2に形成される。この追加の下部環状カラーは、第7実施形態(図7a−c)で利用された下部環状カラーと実質的に対応する。繰り返しを避けるために、第7および第8実施形態に対する上記記載を参照する。
当然ながら、環状カラー40または40’は、弁プロテーゼが位置する平面内に原理的に配置することができる。保持アーチ16a、16b、16cまたは補助締結アーチ19a−cの全ての端部に対して環状カラー40を接続することは必須ではない。また、必ずしも放射アーチ32の全ての端部に上部環状カラー40’を接続しなければならない訳ではない。
図12は、本発明の第12実施形態に係る心臓弁ステントの平面展開図である。図12に示す展開図は、第12実施形態に係るステントを製造するための切断パターンとしても用いることができる。第12実施形態に係るステントの側面図または斜視図は図面には表れない。
上述の要素と概ね同様である図12内の要素は、同様の要素について図1ないし11で使用された参照番号と同一の参照番号を有する。
原理的に、第12実施形態に係るステントは、図5a−dを参照して上述した第5実施形態のステントと同様である。繰り返しを避けるために、第5実施形態の上記記載が参照される。
簡単に要約すると、第12実施形態のステントは、全部で三つの位置決めアーチ15a、15b、15cを同様に有しており、これらが肺動脈弁または大動脈弁の平面内でステントを自動的に位置決めする機能を引き受ける。ステントの他の実施形態のように、位置決めアーチ15a、15b、15cは丸いヘッド部20を有し、これが心臓の移植部位(図18a参照)におけるステント10の位置決めの間、治療される生体の心臓弁Hの嚢に係合する。
第12実施形態のステントには、全部で三つの保持アーチ16a、16b、16cが設けられる。しかしながら、第12実施形態に係るステントの図12に示された切断パターンによると、締結アーチが省かれてもよい。もちろん、例えば第5実施形態のステントに関して述べたように、第12実施形態に係るステント構造にそのような締結アーチを設けることも可能である。
加えて、ステントの上部領域3で半径方向に作用する接触力を増加させるために、本質的にU字形またはV字形の放射アーチ32a、32b、32cが同様に設けられる。第12実施形態に係るステントの放射アーチ32a、32b、32cは、位置決めアーチ15a、15b、15cからステントの上端3に向けて延出する。図12に示す切断パターンによると、第12実施形態のステントは、三つの放射アーチ32a、32b、32cを有し、各アーチ32a、32b、32cは、各位置決めアーチ15a、15b、15cの二つのアーム15a、15a’、15b、15b’、15c、15c’の間に位置している。各放射アーチ32a、32b、32cは、各位置決めアーチ15a、15b、15cとはおおよそ逆の形状を有しており、位置決めアーチ15a、15b、15cのそれぞれ一つと反対の方向に延出する。放射アーチ32の各アーム32’、32”は、ステントの全長の略中点で、反対側の位置決めアーチ15a、15b、15cのアーム15a’、15a”、15b’、15b”、15c’、15c”と融合する。
各放射アーチ32a、32b、32cの二つのアーム32’、32”は、丸い接続部またはヘッド部によってステントの上端3で互いに接続される。このヘッド部は丸いだけでなく、第12実施形態のステントが拡張され移植される状態にあるとき、血管の内壁に対して可能な限り大きな接触面積で接触するように先端が広がっている。
各放射アーチ32a、32b、32cのヘッド部は、移植前および移植中に第12実施形態に係るステントをカテーテル内に保持し、および/または移植後にステントを取り戻すことのできる追加手段としても機能する。
保持アーチ16a、16b、16cに加えて、第12実施形態のステントは、補助アーチ18a、18b、18cをさらに備える。補助アーチ18a、18b、18cは、ステントが移植された状態で血管壁に対して半径方向に作用する接触力を同様に及ぼし、これによって移植部位におけるステントの固定がさらに改善される。
要約すると、一方で保持アーチ16a、16b、16cを設け、他方で補助アーチ18a、18b、18cを設けることで、これらのアーチのそれぞれの下端部によって血管壁に半径方向の力が及ぼされる。これにより、ステントに固定された弁プロテーゼの血管壁に対する強固な封止と、心臓の移植部位におけるステントのしっかりとした固定の両方を確実に行うことができる。
図12に係る切断パターンから分かるように、第12実施形態に係るステントは、ステントの下端2に向けて閉鎖する全部で三つの本質的にU字形またはV字形の補助アーチ18a、18b、18cを備える。各補助アーチ18a、18b、18cは、第1の保持アーチ16a、16b、16cを、第1の保持アーチと隣合う第2の保持アーチと接続する。
図12に係る切断パターンには明示されていないが、第12実施形態に係るステントが拡張した状態にあるとき、ステントの周囲外方に半径方向に延出するように放射アーチ32a、32b、32cがプログラムされていることが好ましい。こうすると、第12実施形態のステントが拡張され移植された状態のとき、ステントの上端領域によって血管壁に対して増大した接触力を与えることができる。したがって、その場所でステントを固定するときの安全性が増加し、これによってステントが移動する可能性が低下する。したがって、拡張され移植された状態では、位置決めアーチのクランプ効果に加えて、その全てがステントの周囲から半径方向外方に突出する保持アーチ16a、16b、16c、補助アーチ18a、18b、18cおよび放射アーチ32a、32b、32cによって及ぼされる半径方向の力によって、第12実施形態のステントが適切な位置に固定される。
カテーテル保持手段23または締結小穴24を有する締結手段が位置する平面を越えて、放射アーチ32a、32b、32cがステントの長手方向Lに突出しないことが、図12に示す切断パターンから分かる。これにより、放射アーチ32a、32b、32cのヘッド部と干渉することなく、カテーテル保持手段23が適切な移植カテーテル内の対応手段と協働できるようにしている。実際、上述したように、ヘッド部自体を第12実施形態のステントの外植を遂行するための追加のカテーテル保持手段または追加手段として使用することができる。
第5実施形態と同様に、半径方向の接触力をさらに増大するために、第12実施形態に係るステントは三つより多い数の放射アーチ32を備えてもよい。例えば、移植部位においてステント10を固定するために、放射アーチ32a、32b、32cの一部または全てに鉤状要素を設けることも可能である。
既に示したように、第12実施形態に係るステントは、チューブの一部から、特に金属管から一体的に切断された構造を呈する。本発明の他の実施形態と同様に、第12実施形態に係るステントにおいて、保持アーチ16a、16b、16cが各位置決めアーチ15a、15b、15cに割り当てられており、各保持アーチ16a、16b、16cは補助アーチ18a、18b、18cによって隣合う保持アーチと接続される。特定の数の締結穴12を有する少なくとも一つの締結部11が、保持アーチ16a、16b、16cの各アーム16a’、16a”、16b’、16b”、16c’、16c”内に構成される。
第12実施形態のステントは、特に、図5a−dに参照番号26aで示した追加の切り欠きが設けられている点で、第5実施形態のステントと相違する。追加の切り欠きの代わりに、第12実施形態に係るステントは、弁プロテーゼの組織部分または弁プロテーゼの一部をさらに締結するための第1および第2の追加締結部11a、11bを備える。
詳細には、弁プロテーゼの組織部分または弁プロテーゼの一部をさらに締結するために第1追加締結部11aが設けられる。これらの第1追加締結部11aには、弁膜材料または弁プロテーゼの組織部分をステントに締結するために用いられる糸または細いワイヤを固定するための補助締結穴12bおよび/または他の締結手段、例えば切り欠きが設けられており、弁プロテーゼの移動を最小限に、好ましくはゼロにすることができる。第1追加締結部11aは、二つの隣接する保持アーチ16a、16b、16cの第1および第2アーム16a’、16a”、16b’、16b”、16c’、16c”の間に配置され、第1接続ウェブ17のそれぞれの下端17dからステントの下端3の方向に延出する。第1接続ウェブ17には、既に述べた第2追加締結部11bが設けられる。
第1追加締結部11aに加えて、第12実施形態に係るステントは、第2追加締結部11bをさらに備える。詳細には、第12実施形態に係るステントの各第1接続ウェブ17には、少なくとも一つの第2追加締結部11bが設けられる。第2追加締結部11bの少なくとも一つは、追加補助締結穴12cおよび/または他の締結手段を備える部分である。第2追加締結部11bの少なくとも一つは、本質的に、第12実施形態に係るステントの長手方向Lに延出する。
例えば図5dに示した切断パターンと図12に示した切断パターンとを比較すると、第12実施形態に係るステントの第1接続ウェブ17のそれぞれには、一つの第2追加締結部11bが設けられることが分かる。この点に関して、第12実施形態に係るステントには、第2追加締結部11bが設けられる。第2追加締結部11bの上端部は、二つの隣合う位置決めアーチ15a、15b、15cの二つのアーム15a’、15a”、15b’、15b”、15c’、15c”の間の接続部22の中に開く。
他方、第12実施形態に係るステント設計では、第2追加締結部11bを有する第1接続ウェブ17は、それぞれ、第1接続ウェブ17の下端部で分岐して二つの隣合う保持アーチ16a、16b、16cのそれぞれのアーム16a’、16a”、16b’、16b”、16c’、16c”に道を譲るような構造を呈する。
詳細には、第2追加締結部11bを有する第1接続ウェブ17は、その上端17dを介して接続部22と接続し、第1追加締結部11aの上端と接続するとともに、その下端17pを介して保持アーチ16a、16b、16cのそれぞれのアーム16a’、16a”、16b’、16b”、16c’、16c”の上端と接続する。
第2追加締結部11bの追加補助締結穴12cおよび/または他の締結手段は、弁膜材料または弁プロテーゼの組織部分をステントに締結するために用いられる糸または細いワイヤを固定する役割を果たし、弁プロテーゼの移動を最小限に、好ましくはゼロにすることができる。
第12実施形態に係るステントの第1および第2追加締結部11a、11bに関して、締結穴12b、12cまたは締結小穴を設けることも当然想定可能である。穴の直径は、弁プロテーゼの組織部分の締結に用いられる糸またはワイヤの太さに適合される。締結穴12b、12cまたは締結小穴は、摩擦で引き起こされる糸またはワイヤの摩耗をできる限り最小化するような半径にされることが好ましい。
補助および追加補助締結穴12b、12cを有する第1および第2追加締結部11a、11bが存在することは、心膜などの生体材料のシートから構築される弁が、いくつかの材料片で構成される弁プロテーゼを含む体内プロテーゼとして使用されるとき、特に有利である。
心膜弁を使用するとき、心膜材料がステントにしっかりと取り付けられることを保証するために注意を払わなければならない。この理由のため、第12実施形態に係るステントは、それぞれが補助締結穴12bを備える全部で三つの第1追加締結部11aと、それぞれが追加補助締結穴12cを備える全部で三つの第2追加締結部11bとを有する。
上述の相違点は別として、第12実施形態のステントは、少なくとも一つのいわゆる「弁尖保護アーチ」が設けられている点で、第5実施形態のステントとは特に相違する。
詳細には、図12に示す切断パターンによると、第12実施形態のステントには、全部で三つの弁尖保護アーチ50a、50b、50cが設けられている。弁尖保護アーチはそれぞれ二つの弁尖保護アームを備える。第12実施形態に係るステントの構造では、各位置決めアーチ15a、15b、15cの間に弁尖保護アーチ50a、50b、50cが設けられることが、図12に示す切断パターンから分かる。それゆえ、第12実施形態に係るステントでは、一つの弁尖保護アーチ50a、50b、50cが各位置決めアーチ15a、15b、15cに割り当てられている。
各弁尖保護アーチ50a、50b、50cは、ステントの下端2で閉鎖する実質的にU字形またはV字形の構造を有する。特に、各弁尖保護アーチ50a、50b、50cは、対応する弁尖保護アーチ50a、50b、50cが間に配置される位置決めアーチ15a、15b、15cの形状とほぼ同様である。さらに、各弁尖保護アーチ50a、50b、50cは位置決めアーチ15a、15b、15cと同じ方向に延出する。
第12実施形態のステント設計では、弁尖保護アーチ50a、50b、50cの各アームは、放射アーチ32a、32b、32cのアーム全長の略中点で、反対側の放射アーチ32a、32b、32cと融合する。第12実施形態のステント設計によると、弁尖保護アーチ50a、50b、50cは、保持アーチ16a、16b、16cの各アーム16a’、16a”、16b’、16b”、16c’、16c”に構成された少なくとも一つの締結部11の下端部が位置する平面を越えて、ステントの長手方向Lに突出しないことが、図12に示す切断パターンから分かる。弁尖保護アーチ50a、50b、50cは、位置決めアーチ15a、15b、15cがステント10の拡大中に展開可能であり、弁尖保護アーチ50a、50b、50cが展開中に干渉しないような長さまで、締結部11の下端よりも下方に延出してもよい。
その際、挿入手順中に、弁プロテーゼが固定されたステントを、心臓の移植部位への到達時に連続して解放することができる。第1解放ステップの間、ステントの残りの部分、特に弁尖保護アーチ50a、50b、50c、保持アーチ16a、16b、16c、補助アーチ18a−cおよび放射アーチ32a−cが依然として折り畳まれた状態(図18a参照)である一方、ステントの位置決めアーチ15a−cが解放されるように操作される。第1解放ステップ中に解放される位置決めアーチ15a−cは、半径方向外方に拡張し展開する。その後、カテーテルシステムの搬送部の近位側Kを適切に移動することによって、拡張された位置決めアーチ15a−cを患者の生体心臓弁Hの嚢Tの中に挿入することができる(図18a参照)。
後に続く第2解放ステップでは、弁尖保護アーチ50a、50b、50cが解放される一方、ステントの残りの部分、特に保持アーチ16a、16b、16c、補助アーチ18a−cおよび放射アーチ32a−cが依然として折り畳まれた状態であるように、挿入カテーテルシステムの搬送部の近位側Kが操作される。第2解放ステップ中に解放される弁尖保護アーチ50a、50b、50cは、半径方向外方に拡張し展開する。拡張した弁尖保護アーチ50a、50b、50cは、病変した弁尖、すなわち生体(病変した)心臓弁の弁尖を、近隣の組織すなわち血管壁に押し付ける。
後に続く第3解放ステップでは、ステントの下端部2を形成するアーチ(補助アーチ18a−cおよび保持アーチ16a、16b、16c)が解放される一方、ステントの上端3は依然としてスリーブ状部を用いることによって搬送部の近位側Kにしっかりと固定され、解放されることがないように、挿入カテーテルシステムの搬送部の近位側Kが操作される(図18a参照)。放射アーチ32a−cは依然として折り畳まれた状態のままである。
機能テストは、ステントに固定された弁プロテーゼ100が満足に機能し、放射アーチ32a、32b、32cを解放しないようにカテーテルシステムの近位側Kのスリーブ状部をステント10の下端部の方向にさらに遠位に押し付けることができることを示している。
続いて、図18cに示すように、カテーテル保持手段23を有するステント10の上端部3が完全に解放される。これは、カテーテルシステムの搬送部のスリーブ状部を、ステント10の下端部3の方向にさらに遠位に押し付けることによって達成することができる。
ステントに配置された位置決めアーチ15a−cと保持アーチ16a、16b、16cは、ステントの下端部の方向に、すなわちステントの下端2に向けて、凸状でアーチ形に曲がっていてもよい。このような丸みのある形態は、動脈の損傷を軽減するとともに、自己拡大中の展開を容易にすることができる。このような設計によって、近隣の組織または血管壁を相応に傷つけることなく、生体心臓弁の嚢内への位置決めアーチ15a−cの挿入を容易にすることができる。
図12に係る切断パターンには明示されていないが、第12実施形態に係るステントが拡張した状態にあるとき、ステントの周囲外方に半径方向に延出するように弁尖保護アーチ50a、50b、50cがプログラムされていることが好ましい。こうすると、第12実施形態のステントが拡張され移植された状態のとき、生体(病変した)心臓弁の弁尖に対する接触力を増大することができる。これによって、その場所でステントを固定するときの安全性が増加する。
ステントが拡張され移植された状態のとき、位置決めアーチ15a、15b、15cが生体弁尖の外側に置かれる場合に、弁尖保護アーチ50a、50b、50cは、病変した弁尖、すなわち生体心臓弁の弁尖が、ステントに固定された弁プロテーゼの弁尖組織に影響を与えないようにする。加えて、弁尖保護アーチ50a、50b、50cは、移動に対抗する追加の固定および保持を提供してもよい。この特徴は、病変した弁尖を邪魔にならないように押し出す位置決めアーチが設けられていない従来のステント設計で知られるケージと比較して特有のものである。
上述の特徴に加えて、第12実施形態に係るステント設計は、追加アーチが設けられている点で、例えば第5実施形態のステント設計とはさらに相違している。ステントが拡張された状態では、これらの追加アーチ(以下「エクストラアーチ」と呼ぶ)はそれぞれ、ステントの下端2で閉鎖する実質的にU字形またはV字形の構造を有する。特に、各エクストラアーチは保持アーチ16a、16b、16cおよび補助アーチ18a、18b、18cと同じ方向に延出し、それらの間に配置される。
詳細には、図12に示す切断パターンによると、第12実施形態のステントには全部で6つのエクストラアーチ60a−fが設けられ、それぞれが二つのアームを備えている。これらのエクストラアーチ60a−fは、ステントが移植された状態で血管壁に対して半径方向に作用する接触力を与え、これによって移植部位におけるステントの固定をさらに改善している。
一方で保持アーチ16a、16b、16cおよび補助アーチ18a、18b、18cを設け、他方でエクストラアーチ60a−fを設けることで、これらのアーチのそれぞれの下端部によって血管壁に半径方向の力が及ぼされる。これにより、ステントに固定された弁プロテーゼが血管壁に対して強固に封止され、また心臓の移植部位においてステントがしっかりと固定される。
図12に係る切断パターンから分かるように、第12実施形態に係るステントは、ステントの下端2に向けて閉鎖する全部で三つの本質的にU字形またはV字形のエクストラアーチ60a−fを備える。各エクストラアーチは、保持アーチ16a、16b、16cを、保持アーチ16a、16b、16cと隣合う補助アーチ18a、18b、18cと接続する。このため、第12実施形態に係るステントでは、各保持アーチ16a、16b、16cと各補助アーチ18a、18b、18cに対して一つのエクストラアーチが割り当てられる。
このステント設計は、ステントの下端領域2に実質的に均一に分配される全部で12本のアーチ(保持アーチ16a、16b、16c、補助アーチ18a、18b、18c、およびエクストラアーチ60a−f)を提供する。各アーチは血管壁を押し、ステントが拡張し移植された状態でステントを適所に効率的に保持する。したがって、拡張したステントの下端領域2の上面図(明示せず)において、ステントの下端領域2は、保持アーチ16a、16b、16cの個々のアーム16a’、16a”、16b’、16b”、16c’、16c”、補助アーチ18a、18b、18cの個々のアーム18a’、18a”、18b’、18b”、18c’、18c”、およびエクストラアーチ60a、60b、60c、60d、60e、60fの個々のアームから形成された複数の頂点を有する多角形構造を呈する。この点において、第12実施形態に係るステントは、移植された状態のステントの固定を助け移動に抵抗する実質的に一様な半径方向力を提供する連続設計を備えた下端部2を有する。このような半径方向力は、漏れの危険性を最小化する助けにもなる。
他方、第12実施形態に係るステントのエクストラアーチ60a−fは、ステントの全長を増加させなくてもよい。このため、このステント設計は一様な変形方向力を与えるが、神経束の進入する場所で環の下方にステントの下端部がある場合でも、神経束に接触するリスクおよび心臓ブロックのリスクを軽減することができる。
本発明の第13実施形態に係るステント10が図13bおよび図13cに示されている。詳細には、図13bおよび図13cは拡張した状態のステント10の様々な側面図であり、第13実施形態に係るステントの平面展開図は図13aに示されている。図13aに示す展開図は、第13実施形態に係るステントの製造に適した切断パターンの二次元投影図に対応する。上述の要素と概ね同様である図13a−c内の要素は同一の参照番号を有する。
上述の実施形態と同様に、第13実施形態のステント10は、チューブの一部から、特に金属管から切断された一体構造として構成される。その切断パターンは、図13aに二次元投影図として示されている。
ステント10の第13実施形態は、上述の第12実施形態と構造および機能の点で類似している。繰り返しを避けるために、第12実施形態の上記説明を参照する。
したがって、第13実施形態に係るステント10には、対応する保持アーチ16a、16b、16cが設けられる。一つの保持アーチ16a、16b、16cは、各位置決めアーチ15a、15b、15cに割り当てられる。各保持アーチ16a、16b、16cは、補助アーチ18a、18b、18cによって隣合う保持アーチに接続される。また、ステント10の第13実施形態によると、複数の締結穴12を備える少なくとも一つの締結部11が、保持アーチ16a、16b、16cの各アーム16a’、16a”、16b’、16b”、16c’、16c”に構成される。
少なくとも一つの締結部11に加えて、第13実施形態に係るステント10は、弁プロテーゼまた弁プロテーゼの一部をさらに締結するための第1および第2の追加締結部11a、11bを備える。この点において、ステント10は、弁プロテーゼの材料を取り付ける、改良された複数の締結部11、11a、11bを持つ構成を有する。
第12実施形態と同様に、図13bまたは図13cに示すステント10には、全部で三つの弁尖保護アーチ50a、50b、50cが設けられている。弁尖保護アーチ50a、50b、50cはそれぞれ二つの弁尖保護アームを備える。各位置決めアーチ15a、15b、15cの間に一つの弁尖保護アーチ50a、50b、50cが設けられることが、図13aに示す切断パターンから分かる。それゆえ、第13実施形態に係るステント設計では、一つの弁尖保護アーチ50a、50b、50cが各位置決めアーチ15a、15b、15cに割り当てられている。
図13bまたは図13cに示すように、弁尖保護アーチ50a、50b、50cの各アームは、放射アーチ32a、32b、32cのアーム全長の略中点で、反対側の放射アーチ32a、32b、32cのアームと融合する。第12実施形態に係るステント設計と同様に、第13実施形態に係るステント10の弁尖保護アーチ50a、50b、50cは、保持アーチ16a、16b、16cの各アーム16a’、16a”、16b’、16b”、16c’、16c”に構成された少なくとも一つの締結部11の下端部が位置する平面へと、ステントの長手方向Lに突出する。この点において、第12実施形態のステント設計に関連して上述したように、挿入手順中に、第13実施形態のステントを連続して解放することができる。
上述したように、弁尖保護アーチ50a、50b、50cの各アームは、放射アーチ32a、32b、32cのアーム全長の略中点で、反対側の放射アーチ32a、32b、32cのアームと融合する。しかしながら、第12実施形態とは異なり、第13実施形態のステント設計では、放射アーチ32a、32b、32cのアーム32a’、32a”、32b’、32b”、32c’、32c”は、反対側の位置決めアーチ15a、15b、15cのアーム15a’、15a”、15b’、15b”、15c’、15c”とは融合しない。第13実施形態のステント設計によると、放射アーチ32a、32b、32cの各アーム32a’、32a”、32b’、32b”、32c’、32c”は、位置決めアーチ15a、15b、15cのアーム15a’、15a”、15b’、15b”、15c’、15c”と直接には接続しない。
むしろ、第13実施形態に係るステント設計の弁尖保護アームは、第2接続ウェブ25のうち一つと、すなわちステント10の接続部22をカテーテル保持手段23と接続するウェブのうち一つと、直接に接続される。上述したように、ステント10の接続部22を使用して、二つの隣合う位置決めアーチ15a、15b、15cのそれぞれ二つの隣接するアーム15b”、15c’、15c”、15a’、15a”、15b’を接続する。この点において、弁嚢内の病変した弁尖の背後に位置決めアーチ15a、15b、15cが配置されるまで、弁尖保護アーチ50a、50b、50cを解放することなく位置決めアーチ15a、15b、15cの展開が強化される。
図13aの二次元切断パターンから特に理解できるように、第13実施形態のステント設計には、全部で6つのエクストラアーチ60a−fが設けられる。エクストラアーチはそれぞれ、ステント10の下端2に向けて閉鎖する実質的にU字形またはV字形の構造を有する。特に、各エクストラアーチ60a−fは、対応するエクストラアーチ60a−fがその間に設けられる保持アーチ16a、16b、16cと補助アーチ18a、18b、18cと同一方向に延出する。
図13bまたは図13cを参照すると、第13実施形態のステント設計は、ステント10の下端領域2に実質的に均一に分配される全部で12本のアーチ(保持アーチ16a、16b、16c、補助アーチ18a、18b、18c、およびエクストラアーチ60a−f)を提供する。ステント10が拡張し移植された状態で、下端部2のこの特定の構造は血管壁を押してステント10を適所に保持する。
第12実施形態に係るステント設計と同様に、第13実施形態のステント10の下端領域2は、保持アーチ16a、16b、16cの個々のアーム16a’、16a”、16b’、16b”、16c’、16c”、補助アーチ18a、18b、18cの個々のアーム18a’、18a”、18b’、18b”、18c’、18c”、およびエクストラアーチ60a、60b、60c、60d、60e、60fの個々のアームから形成された18個の頂点を有する多角形構造を呈する。この点において、第13実施形態に係るステントは、移植された状態のステント10の固定を助け移動に抵抗する実質的に一様な半径方向力を提供する連続設計を備えた下端部2を有する。このような一様な半径方向力は、ステント10およびステントに固定された弁プロテーゼが拡張され移植された状態での血液漏れのリスクを最小化する助けにもなる。
第13実施形態に係るステント10は、ステント10の下端2に追加締結部が設けられている点でも第12実施形態のステントと相違する。詳細には、図13bまたは図13cによると、第13実施形態のステント10には、三つの本質的にU字形またはV字型の補助アーチ18a、18b、18cが設けられている。各補助アーチ18a、18b、18cには、それぞれのヘッド部31に設けられた追加締結部が下端部に設けられている。
図13aから分かるように、補助アーチ18a、18b、18cのそれぞれのヘッド部31に設けられた締結部内に、複数の締結穴12dが画成されている。さらに、第13実施形態のステント設計では、各保持アーチ16a、16b、16cのそれぞれのアーム16a’、16a”、16b’、16b”、16c’、16c”が締結部11から心臓弁ステント10の下端2に向けて延出し、接続部30によって互いに接続される。この接続部30には締結穴12eが設けられる。
この点において、締結穴12dを有する補助アーチ18a、18b、18と、締結穴12eを有する接続部30が、ステント10の下端部2に追加の締結穴12d、12eを提供する。これらの追加締結穴12d、12eは、ステント10の下端部2の連続設計に等しく分配されるように配置される。弁プロテーゼ100をステント10に取り付ける糸101または細いワイヤが、それぞれの締結穴12d、12eを通して導かれてもよい。
こうして、弁プロテーゼまたは弁プロテーゼの一部をさらに締結するための追加締結穴12d、12eがステント10の下端部2に設けられる。ステント10の下端部2における追加締結穴12d、12eの存在は、弁プロテーゼのバルブスカートを取り付け、漏れを最小にする追加の構造を提供してもよい。加えて、ステント10の下端部2における追加締結穴12d、12eは、弁プロテーゼが固定されたステントを移植するために弁がカテーテル内へと折り畳まれるときに、弁プロテーゼのスカートが移動しないようにする助けとなってもよい。
図14bは、本発明の第14実施形態に係るステント10の側面図である。ここでは、ステント10が完全に拡張した状態である。第14実施形態に係るステント10は、チューブの一部から、特に金属管から一体的に切断された構造をしている。第14実施形態に係るステント10の設計を形成するために使用される切断パターンは、図14aに二次元投影図として示されている。
上述の要素と概ね同様である図14aおよび図14b内の要素は同一の参照番号を有する。
下端部2の構造を除いて、第14実施形態に係るステント10は、図13aおよび図13bを参照して上述した本発明の第13実施形態に係るステントと実質的に同様である。
したがって、第14実施形態に係るステント10は全部で三つの位置決めアーチ15a、15b、15cを有しており、これらはステント10の自動位置決め機能を引き受ける。ステント10の他の実施形態のように、位置決めアーチ15a、15b、15cは、心臓の移植部位におけるステント10の位置決め中に(図18a参照)、治療される生体心臓弁Hの嚢に係合する丸いヘッド部20を有する。
ステント10の第14実施形態は、放射アーチ32a、32b、32cも備える。図14bに最も明瞭に示されているように、ステント10は、各位置決めアーチ15a、15b、15cの二つのアーム15a’、15a”、15b’、15b”、15c’、15c”の間に各アーチ32a、32b、32cが配置された、三つの放射アーチ32a、32b、32cを有する。各放射アーチ32a、32b、32cは、各位置決めアーチ15a、15b、15cとはおおよそ反対の形状を有し、位置決めアーチ15a、15b、15cのそれぞれ一つと反対方向に延びる。
第13実施形態と同様に、第14実施形態のステント設計では、放射アーチ32a、32b、32cの各アーム32a’、32a”、32b’、32b”、32c’、32c”は、反対側の位置決めアーチ15a、15b、15cのアーム15a’、15a”、15b’、15b”、15c’、15c”と直接には接続しない。むしろ、放射アーチ32a、32b、32cの各アーム32a’、32a”、32b’、32b”、32c’、32c”は、弁尖保護アームと直接接続される。弁尖保護アームは、第2接続ウェブ25のうち一つと、すなわちステント10の接続部22をカテーテル保持手段23と接続するウェブのうち一つと、直接に接続される。この点において、弁嚢内の病変した弁尖の背後に位置決めアーチ15a、15b、15cが配置されるまで、弁尖保護アーチ50a、50b、50cを解放することなく位置決めアーチ15a、15b、15cの展開が強化される。
全部で三つの保持アーチ16a、16b、16cも設けられる。各位置決めアーチ15a、15b、15cに対して一つの保持アーチ16a、16b、16cが割り当てられる。また、本発明のステント10の第14実施形態によると、保持アーチ16a、16b、16cの各アーム16a’、16a”、16b’、16b”、16c’、16c”に、複数の締結穴12を有する少なくとも一つの締結部11が構成される。
少なくとも一つの締結部11に加えて、第14実施形態に係るステント10は、弁プロテーゼの組織部分または弁プロテーゼの一部をさらに締結するための第1および第2追加締結部11a、11bを備える。この点において、ステント10は、弁プロテーゼの材料を取り付ける強化された複数の締結部11、11a、11bを持つ構成を有する。
第12または第13実施形態と同様に、図14bに示すステント10には、全部で三つの弁尖保護アーチ50a、50b、50cが設けられている。弁尖保護アーチ50a、50b、50cはそれぞれ二つの弁尖保護アームを備える。図14aの切断パターンに示すように、各位置決めアーチ15a、15b、15cの間に一つの弁尖保護アーチ50a、50b、50cが設けられる。すなわち、一つの弁尖保護アーチ50a、50b、50cが各位置決めアーチ15a、15b、15cに割り当てられる。
弁尖保護アーチ50a、50b、50cの各アームは、アーム全長の略中点で反対側の放射アーチ32a、32b、32cのアームと融合する。第13実施形態と同様に、放射アーチ32a、32b、32cのアーム32a’、32a”、32b’、32b”、32c’、32c”は、反対側の位置決めアーチ15a、15b、15cのアーム15a’、15a”、15b’、15b”、15c’、15c”とは融合しない。なぜなら、放射アーチ32a、32b、32cの各アーム32a’、32a”、32b’、32b”、32c’、32c”は、反対側の位置決めアーチ15a、15b、15cのアーム15a’、15a”、15b’、15b”、15c’、15c”と直接には接続しないからである。むしろ、第14実施形態に係るステント設計の弁尖保護アームは、第2接続ウェブ25のうち一つと、すなわちステント10の接続部22をカテーテル保持手段23と接続するウェブのうち一つと、直接に接続される。上述したように、ステント10の接続部22を使用して、二つの隣合う位置決めアーチ15b、15c、15aのそれぞれ二つの隣接するアーム15b”、15c’、15c”、15a’、15a”、15b’を接続する。
図14bに示すステント10には、その下端部2にエクストラアーチが設けられていない。むしろ、第7実施形態(図7a−c参照)に係るステント設計と同様に、第14実施形態のステント10は、ステント10の下端部2を形成する少なくとも一つの環状カラー(襟状部)40を備える。この少なくとも一つの環状カラー40は、図14bに示すステント10の追加固定手段として機能する。
図14aの切断パターンから特に理解できるように、少なくとも一つの環状カラー40は、保持アーチ16a、16b、16cのそれぞれのアーム16a’、16a”、16b’、16b”、16c’、16c”の下端部とまたはその一部と接続されてもよい。
少なくとも一つの環状カラー40は、上記ステント10の非拡張状態時にステント10の長手軸と平行に走り、横方向ウェブ42(図14a参照)により相互接続される複数の支持ウェブ41を有する。ステント10の拡張状態時には、支持ウェブ41と横方向ウェブ42とが菱形状または蛇紋状(serpentine)の環状カラー40を形成し、ステント10の移植状態時に血管壁と接触する。図14bは、拡張状態にある環状カラー40を示す。
環状カラー40は、自己拡張により発現する半径方向の力を血管壁に伝達する経路となる支持体として機能する。ステント10の比較的広い接触面積が血管壁と相互作用するので、また環状カラー40の菱形状または蛇紋状構造のために、半径方向の力が増大するにもかかわらず、動脈または組織に損傷を与える危険性を低減することができる。
移植された体内プロテーゼ1の移動を防止するためには特定量の半径方向の力が必要であることに注意するのが重要である。それゆえ、ステントの下端部のより一様な構造のために、完全に拡張した状態のステントによって与えられる半径方向の圧力をさらに一様に分布させる。その際、完全に拡張した状態のステントによって与えられる半径方向の圧力が分布され、同一の半径方向の力全体に対して、高い接触圧が軽減される。
したがって、環状カラー40を設けることによって自己拡張後のステント10の剛性を高めるだけでなく、ステント10の移植部位での固定を改善すなわち強化することができる。加えて、環状カラー40の環状の断面形状は、血管壁と弁プロテーゼが取り付けられたステントとの間の封止も改善する。
このような環状カラー40は、自己拡張可能な支持構造として有利に構成される。これは、半径方向外向きに作用する接触圧およびその設計のために、移植部位におけるステント10の固定がさらに改善されるという有利な効果を与え、その結果、弁プロテーゼが取り付けられたステント10の変位をさらに防止することができる。
図14bに示すステント10には、ステント本体の下端部に補助アーチが設けられていない。むしろ、補助アーチの代わりに、第14実施形態に係るステント10は、隣合う(隣接する)二つの保持アーチ16a、16b、16cの隣接するアームの間の領域に複数の支柱(strut)によって形成された格子セル構造70を備える。これによって、ステント10に取り付けられた心臓弁プロテーゼの継ぎ目のさらなる支持を提供する。
加えて、隣合う二つの保持アーチ16a、16b、16cの隣接するアームの間の領域に複数の支柱によって形成された格子セル構造70は、心臓弁プロテーゼが取り付けられたステント10の移植された状態での血液の漏れを最小化する、一様なステント構造を提供してもよい。
したがって、第14実施形態のステント設計によると、ステント本体の下端部に環状カラー40の下端部が設けられ、保持アーチ16a、16b、16cおよび上述した格子セル構造70を介して、環状カラー40の下端部がステント本体に接続される。しかしながら、図14bには示していないが当然なことに、第14実施形態のステント10は、図7bおよび図7cに示す実施形態を参照して上述したステント設計と同様に、補助アーチを備えてもよい。
しかしながら、図14bに示すステント10は、環状カラー40の下端部に一様に分配されたいくつかの小穴12fを備えることに注意するのが重要である。これらの小穴12fを用いて心臓弁プロテーゼ(図14bには示さず)をステント10に固定することができる。これは、ステント10に対する心臓弁プロテーゼ100の軸方向変位のリスクを軽減することができる。
図15は、さらに別の実施形態(第15実施形態)の心臓弁ステントの平面展開図である。図15に示す展開図は、本発明の第15実施形態の心臓弁ステントを、チューブの一部から、特に金属管から一体片として切り出すために使用可能である切断パターンの二次元投影図に対応する。第15実施形態に係るステントの側面図または斜視図は、図面に示されていない。
上述の要素と概ね同様である図15内の要素は、同様の要素について既に使用された参照番号と同一の参照番号を有する。
第15実施形態に係るステントは、図14aおよび図14bとともに上述した第14実施形態のステントと本質的に対応している。繰り返しを避けるために、第14実施形態の上記説明を参照する。
図15の切断パターンの二次元投影図では、それぞれの弁尖保護アーチを切り出すための対応する切断線が明瞭さのみを目的に省略されている。よって、図15の切断パターンには、明瞭さのみを目的として、対応する切断線が示されていないが、第15実施形態の設計にしたがって切り出されたステントには、対応する弁尖保護アーチが備えられていてよい。特に、第15実施形態に係るステントに全部で三つの弁尖保護アーチが設けられると、三つの弁尖保護アーチが二つの弁尖保護アームによって構成されるという利点がある。第12、第13および第14実施形態に係る上述のステント設計と同じく、第15実施形態のステントは全部で三つの弁尖保護アーチを持つ構造を有しており、三つの弁尖保護アーチのうちの一つが各位置決めアーチ15a、15b、15cに割り当てられ、各位置決めアーチ15a、15b、15cの間に設けられる。
さらに、第15実施形態のステント設計では、弁尖保護アーチのそれぞれが、ステントの下端2で閉鎖する実質的にU字形またはV字形の構造を有することが好ましい。特に、各弁尖保護アーチは、対応する弁尖保護アーチが間に配置される位置決めアーチ15a、15b、15cの形状とほぼ同様の形状を有している。さらに、各弁尖保護アーチは、対応する弁尖保護アーチが間に配置される位置決めアーチ15a、15b、15cと同じ方向に延出する。
本発明の第15実施形態に係るステント設計には、ステント本体の下端部に配置された環状カラー40が設けられる。第14実施形態に係るステント設計と同様に、この少なくとも一つの環状カラー40は、図15に示す切断パターンを用いてチューブの一部から切断されるステントの追加固定手段として機能する。
図15に示す切断パターンによると、少なくとも一つの環状カラー40は、保持アーチ16a、16b、16cのそれぞれのアーム16a’、16a”、16b’、16b”、16c’、16c”の下端部に設けられるヘッド部30と接続される。図15aの切断パターンから理解できるように、少なくとも一つの環状カラー40は、上記ステント10の非拡張状態時にステントの長手軸Lと平行に走り、横方向ウェブ42により相互接続される複数の支持ウェブ41を有する。第14実施形態に係るステント設計と同様に、ステントの拡張状態時には、支持ウェブ41と横方向ウェブ42とが菱形状または蛇紋状の環状カラー40を形成し、ステントが移植された状態のときに血管壁と接触する。
ステントの下端部2に設けられた少なくとも一つの環状カラー40によって得ることができる技術的な効果については、本発明の第14実施形態のステントと関連して既に説明した。よって、繰り返しを避けるために、上述の態様が参照される。
第15実施形態に係るステント設計は、環状カラー40のあらゆる第2支持ウェブ41の下端部に、追加締結手段として小穴12fが設けられる点で、第14実施形態に係るステント設計とは相違する。この点において、小穴12fは環状カラー40の下端部により一様に分布しており、これによって、心臓弁プロテーゼをステントにさらに一様に固定している。よって、ステントに対する心臓弁プロテーゼの軸方向変位のリスクをさらに軽減することができる。
上述の第14実施形態に係るステント設計と同様に、第15実施形態のステント設計には、隣合う(隣接する)二つの保持アーチ16a、16b、16cのアームの間の領域に複数の支柱によって形成された格子セル構造70がさらに設けられる。図15の切断パターンに示すように、格子セル構造70を形成する支柱は、保持アーチ16a、16b、16cのアームとそれぞれ接続する。その際、ステントに取り付けられた心臓弁プロテーゼの継ぎ目の追加支持が提供される。
第15実施形態に係るステント設計は、隣合う二つの保持アーチ16a、16b、16cの第1および第2アーム16a”、16b’、16b”、16c’、16c”、16a’の間に配置され、第1接続ウェブ17の下端17dからステントの下端3の方向に延出する第1追加締結部が設けられていない点で、上述のステント設計とは相違する。
むしろ、第15実施形態のステント設計によると、保持アーチ16a、16b、16cの各アーム16a’、16a”、16b’、16b”、16c’、16c”に、複数の追加締結部11cが設けられている。追加締結部はそれぞれ、弁プロテーゼの組織部分を締結するための複数の追加締結穴12aを有する。具体的には、追加締結部11cは互いに離れており、保持アーチ16a、16b、16cの各アーム16a’、16a”、16b’、16b”、16c’、16c”の全長にわたり分布している。追加締結部11cには、追加締結穴12aが直接形成されている。保持アーチ16a、16b、16cの各アーム16a’、16a”、16b’、16b”、16c’、16c”に追加締結穴12aが形成されず、小穴として構成されることも当然想定可能である。追加締結穴12aにより、弁プロテーゼの上部領域をステントにさらにしっかりと固定することが可能になる。
追加締結穴12aの大きさは、弁プロテーゼをステント10に締結するために使用される糸またはワイヤの太さに合わせてもよい。追加締結穴12aの断面形状も、弁プロテーゼの締結に使用される糸またはワイヤの断面形状に合わせてもよい。弁プロテーゼを心臓弁ステントに固定するための複数の追加締結穴12aが存在するために、心臓弁ステントに対する弁プロテーゼの締結位置を正確に定めることができる。
締結穴12aの代わりとして、ステント10の同一領域に一つまたは複数の追加切り欠きを設けてもよい。これらの切り欠きは締結穴12aと同様の機能を実行し、ステント内での人工弁のさらなる固定を助ける。
本発明の第16実施形態に係るステント10を図16bないし16gに示す。特に、図16bは、本発明の第16実施形態に係る心臓弁ステントの第1側面斜視図であり、ここでは心臓弁ステント10が拡張した状態で示されている。心臓弁ステント10が拡張した状態の第2および第3の側面図が図16cおよび図16dに示される。
他方、図16eは、拡張した状態にある本発明の第16実施形態に係る心臓弁ステント10の上端の平面図である。
第16実施形態に係るステントの平面展開図を図16aに示す。
図16fは、心臓弁の狭窄および/または心臓弁不全症を治療する体内プロテーゼの側面図である。ここでは、体内プロテーゼは、本発明の第15実施形態と同様である弁プロテーゼを保持するための心臓弁ステントを含む。詳細には、図16fは、弁プロテーゼ100のステント10への固定の仕方の一例として、ステント10に取り付けられた弁プロテーゼ100を示している。この例は、本明細書で説明した他のステント実施形態にも同様に適用することができる。
図16gは、心臓弁の狭窄および/または心臓弁不全症を治療する体内プロテーゼの側面図である。ここでは、体内プロテーゼは、本発明の第16実施形態に係る、弁プロテーゼを保持するための心臓弁ステントを含む。
上述の実施形態と同様に、第16実施形態のステント10は、チューブの一部、特に金属管から切り出された一体構造として構成される。切断パターンは、図16aに二次元投影図として示されている。
本発明の第16実施形態に係るステント設計には、ステント本体の下端部に配置される環状カラー40が設けられる。第14または第15実施形態に係るステント設計と同様に、この少なくとも一つの環状カラー40は、図15に示す切断パターンを用いてチューブの一部から切り出されるステントの追加固定手段として機能する。
ステント10の第16実施形態は、第15実施形態に関する構造および機能と同様である。したがって、繰り返しを避けるために、第15実施形態の上記説明を参照する。特に、ステント10の上部領域において半径方向に作用する接触力を増加させるために、本質的にU字形またはV字形の放射アーチ32a、32b、32cが同様に設けられる。
加えて、第16実施形態に係るステント10には、対応する保持アーチ16a、16b、16cが設けられる。一つの位置決めアーチ15a、15b、15cに対して一つの保持アーチ16a、16b、16cが割り当てられる。また、本発明のステント10の第16実施形態によると、保持アーチ16a、16b、16cの各アーム16a’、16a”、16b’、16b”、16c’、16c”に、複数の追加締結穴12aを有する複数の締結部11cが構成される。
追加締結部11cに加えて、第16実施形態に係るステント10は、弁プロテーゼの組織部分または弁プロテーゼの一部をさらに締結するための第2追加締結部11bも備える。第12実施形態について上述したのと同様に、ステントの各第1接続ウェブ17に少なくとも一つの第2追加締結部11bが設けられる。少なくとも一つの第2追加締結部11bは、追加補助締結穴12cおよび/または他の締結手段を備える部分である。この少なくとも一つの第2追加締結部11bは、第12実施形態に係るステントの長手方向Lに本質的に延出する。
この点において、第16実施形態のステント10は弁プロテーゼの材料を取り付ける複数の締結部11bを備えた構成を有する。
本発明の第13実施形態と同様に、図16b−gに示すステント10には、弁尖保護アーチが設けられてもよい。各位置決めアーチ15a、15b、15cの間に一つの弁尖保護アーチが設けられてもよい。よって、明瞭さのために図16b−gには明示されていないが、第16実施形態に係るステント設計では、第12、第13または第14実施形態を参照して上述したように、各位置決めアーチ15a、15b、15cに一つの弁尖保護アーチが割り当てられてもよい。
上述したように、第16実施形態の構造は、上述した第15実施形態の構造と極めて類似している。しかしながら、図16b−gに示すステント設計は、保持アーチ16a、16b、16cの各アーム16a’、16a”、16b’、16b”、16c’、16c”の特定の構造について、第15実施形態とは異なっている。
詳細には、第16実施形態のステント設計によると、ステント10の拡張した状態において、保持アーチ16a、16b、16cの各アーム16a’、16a”、16b’、16b”、16c’、16c”が、外科的に配置された生体弁が構成される仕方と同様に形成される。さらに、保持アーチ16a、16b、16cの各アーム16a’、16a”、16b’、16b”、16c’、16c”には、複数の追加締結部11cが設けられる。各追加締結部は、弁プロテーゼの組織部分を締結するために設けられる複数の追加締結穴12aまたは小穴を有する。これらの追加締結穴12aまたは小穴は、ステント10に取り付けられた心臓弁プロテーゼの弁尖およびスカートの良好な取り付け点を与える。
したがって、第16実施形態のステント設計によると、ステント10の拡張した状態で、保持アーチ16a、16b、16cの各アーム16a’、16a”、16b’、16b”、16c’、16c”は、ステント10に取り付けられた心臓弁プロテーゼの弁尖と実質的に一致する形状を有する。保持アーチ16a、16b、16cの各アーム16a’、16a”、16b’、16b”、16c’、16c”のこの特定の設計は、カテーテルで運ばれる弁に対して固有であり、弁の耐久性の利点がある。このように形成された、保持アーチ16a、16b、16cのアーム16a’、16a”、16b’、16b”、16c’、16c”は、位置決めアーチ15a−cの背後のギャップを横切ってステント10に取り付けられる心臓弁プロテーゼの弁尖のスカートおよび縁を支持するように機能する。例えば、図示のように、図16b−dでは、保持アーチ16a、16b、16cの各アーム16a’、16a”、16b’、16b”、16c’、16c”は、拡張した状態のステント10に取り付けられた弁プロテーゼ(図16b−dには図示せず)の弁尖の形状を辿る。さらに、保持アーチ16a、16b、16cの各アーム16a’、16a”、16b’、16b”、16c’、16c”は、位置決めアーチ15a−cの背後の場所で、保持アーチ16a、16b、16cの一つのアームから他のアームまで最小の支持されないギャップを有するように設計される。
詳細には、図16aの切断パターンに示すように、保持アーチ16a、16b、16cの各アーム16a’、16a”、16b’、16b”、16c’、16c”には、複数の曲げエッジ33が設けられる。これらの曲げエッジ33は、各アーム16a’、16a”、16b’、16b”、16c’、16c”を複数のアーム区画に分割する。保持アーチ16a、16b、16cのアーム16a’、16a”、16b’、16b”、16c’、16c”のアーム区画は相互に接続され、これによって、ステント10の非拡張状態において本質的に直線をなす保持アーチアームを構成する。この点において、保持アーチ16a、16b、16cの各アーム16a’、16a”、16b’、16b”、16c’、16c”の非曲線構造を示す、図16aの切断パターンが参照される。
ステント10の製造時、ステント構造および特に保持アーチ16a、16b、16cの構造は、保持アーチ16a、16b、16cの各アーム16a’、16a”、16b’、16b”、16c’、16c”がステント10の拡張時に曲線形状を有するようにプログラムされる。保持アーチ16a、16b、16cの各アーム16a’、16a”、16b’、16b”、16c’、16c”の形状は、ステント10に取り付けられる弁プロテーゼ100の弁尖102の形状をアームがたどるように画成される。
したがって、その上に弁プロテーゼ100が縫い付けられるまたは縫い付け可能である、ステント10の保持アーチ16a、16b、16cの各アーム16a’、16a”、16b’、16b”、16c’、16c”は、ステント10の拡張時に自身の形状を変化させる。ステント10が拡張された状態で保持アーチ16a、16b、16cは曲がっているが、ステント10が折り畳まれているときは相対的に直線である。
例えば図16b−dから分かるように、保持アーチ16a、16b、16cの各アーム16a’、16a”、16b’、16b”、16c’、16c”の湾曲は、アーム16a’、16a”、16b’、16b”、16c’、16c”の分割によって達成される。詳細には、アーム16a’、16a”、16b’、16b”、16c’、16c”は複数の曲げエッジ33を設けることによって分割される。ステント10の拡張した状態では、二つの隣合うアーム区画が互いに対して角度を持ち、これら二つの隣合うアーム区画の屈曲点が、両方の隣合うアーム区画の間に設けられた曲げエッジ33によって画成される。したがって、保持アーチ16a、16b、16cのアーム16a’、16a”、16b’、16b”、16c’、16c”に設けられる曲げエッジ33の数が多くなるほど、ステント10の拡張された状態で異なる方向に延出可能であるアーム区画の数が多くなる。この点において、保持アーチ16a、16b、16cの各アーム16a’、16a”、16b’、16b”、16c’、16c”の形状を、ステント10に取り付けられる弁プロテーゼの弁尖形状に正確に適合させることができる。
心臓弁の狭窄または心臓弁不全症を治療する体内プロテーゼ1の側面図である図16fおよび図16gを参照する。図16fおよび図16gに示す実施形態では、sてんと10は、本発明の第16実施形態に関する、弁プロテーゼ100を保持するステントに対応する。第16実施形態のステント10に弁プロテーゼ100を固定する方法についての説明は、本明細書で説明した他の実施形態に係るステント10にも同様に適用することができる。
弁プロテーゼ100は、生物材料または合成材料で作られた少なくとも一つの弁尖102(図16fまたは図16gを参照)を備える。特に、図16fおよび図16gは体内プロテーゼ1の側面図をそれぞれ示し、ここでは心臓弁ステント10が完全に拡張した状態で示されている。
ステント10が中に展開された心臓および血管の蠕動運動の間でさえも、ステント10に固定された弁プロテーゼ100のステント10に対する縦方向の変位を減少させるように、本発明の第16実施形態に係るステント10は、ステント10の長手方向Lに延びる複数の締結部11を備える。加えて、第16実施形態に係るステント10には、追加締結部11b、11cが設けられる。締結部11および追加締結部11b、11cの両方を用いて、弁プロテーゼ100の組織部分がステント10に固定される。
詳細には、弁プロテーゼ100は、締結部11および追加締結部11b、11cの締結穴12、12aをそれぞれ通して導かれる糸101または細いワイヤによってステント10に締結される。これにより、ステント10に対する予め定められた位置で、弁プロテーゼ100の組織部分をステント10に固定することができる。
図16fまたは図16gから、糸101を用いて弁プロテーゼ100をステント10に取り付ける方法をさらに理解することができる。保持アーチ16a、16b、16cの締結部11cおよび締結部11bに設けられた締結穴12f、12cに縫い付けられた心膜弁プロテーゼ100が本実施形態で用いられる。弁プロテーゼ100は、実質的に円形の断面を持つチューブ状であってもよい。ステント10の下端2では、弁プロテーゼ100はビード(bead)105状になる。体内プロテーゼ1の平面図では環状であるこのビード105は、弁プロテーゼ100を自身の上に巻き上げて弁プロテーゼ100の下端を裏返すことによって形成され、体内プロテーゼ1の流入端を画成する。
弁プロテーゼ100の下端にある環状ビード105は、蠕動運動があった場合でも、弁プロテーゼ100の周辺領域を体内プロテーゼ1の移植部位における血管に固定し、血管壁に対する封止を提供することができる。ステント10の下端部2に設けられた環状カラー40のために、弁プロテーゼ100の下端にある環状ビード105は、移植部位における生体構造に適合した丸い形状を有する。この点において、体内プロテーゼ1が挿入される、拡張し移植された状態ある体内プロテーゼ1の下端部2と血管壁との間の接触面を強化することができ、これによって体内プロテーゼ1と血管壁との間の封止が改善される。
拡張された体内プロテーゼ1の上面図におけるステント10の基本構造が三角形であるにもかかわらず、環状ビード105は弁プロテーゼ100を血管壁をしっかりと封止することができる。生体血管内に体内プロテーゼ1を移植するとき、環状ビード105の周辺領域と血管壁との間のあらゆる漏れは、自然発生する付着物、特に石灰化によって封止される。したがって、ビード形状の領域105は、特に心臓サイクルの充満期(心臓拡張期)の間、しっかりとした封止を提供する。
弁プロテーゼ100の材料、特に弁プロテーゼの弁尖102の材料は、合成物、動物の弁または心膜などの他の動物組織から作ることができる。動物の組織は、複数の種類の動物からであってもよい。好ましくは、弁プロテーゼ100の弁尖組織は、ウシまたはブタの心膜から作られるが、例えばウマ、カンガルーなどの他の動物も考慮することができる。
好適な弁設計および小径のカテーテルシステム内で折り畳まれる能力にとって、動物の心膜が好適な材料である。ウシが好適であるが、その厚さはブタよりも一般的に厚く、固定中に組織の実質的な膨張(35%)が起こり得ることが発見されている。この膨張は、小さなカテーテルサイズで折り畳むためにウシの適用を困難なものにする可能性がある。
図16eに示すように、第16実施形態に係るステント10は下端部2の連続設計を含む。この連続設計のために、ステント10が移植され拡張した状態では、ステント10の下端部2を介して、ステント10が展開される血管壁に対して一様な半径方向力が与えられる。この点において、第16実施形態に係るステント10と、ステント10に取り付けられた弁プロテーゼ100とで構成される体内プロテーゼ1は、体内プロテーゼ1の移植状態で移動に対抗してさらにしっかりと固定される。
加えて、ステント10の下端部2から血管壁に対して一様な変形方向力が加わるときに、体内プロテーゼ1と血管壁との間の封止を改善することができる。
移植され拡張された体内プロテーゼ1の位置固定をさらに改善し順行性移動を防止するために、第16実施形態に係るステント10には、下端部2に放射形状のフレア(広がり)区画またはテーパー区画が設けられる。詳細には、図16b−eに示すように、ステント10の拡張した状態で、環状カラー40の下端部は、ステント10のフレア区画またはテーパー区画を構成する。
図16b−eに示すステント10は、その下端部2に、放射形状のフレア区画またはテーパー区画を有する。しかしながら、このフレア区画またはテーパー区画がステント10の周囲に均一に配置されないことも想定される。例えば、ステント10は、位置決めアーチ15a−cの場所の近くにのみフレアを有してもよいし、継ぎ目領域、すなわち二つの隣合う位置決めアーチ15a、15b、15cの二本のアーム15a’、15a”、15b’、15b”、15c’、15c”の間の領域の近傍にはフレアを設けなくてもよい。
図示していないが、ステント10が拡張された状態のとき、ステント10がその下端部2に波形の(scalloped)流入端設計を有することが、本発明の任意の実施形態にとって特に好ましい。したがって、ステント10の流入端は、ステント10の長手方向Lと直交する平面内に完全には位置していない。むしろ、流入側にあるステントのエッジは波形形状であってもよい。加えて、波形の流入端は、全周にわたりまたは選択された場所のみでフレア状またはテーパー状であってもよい。例えば、一実施形態は、隣合う位置決めアーチの間の領域で非フレアの直線円筒形状へと遷移する位置決めアーチの場所の近傍のみで、流入端にフレアを備えてもよい。特に、各フレアおよび各直線円筒形状の場所は、弁プロテーゼの組織部分が取り付けられる各保持アーチのアームの場所によって定められてもよい。
そのような波形の流入端設計を有するステント10は、神経束を含むなどの重要な構造を有する領域に、ステント10の長手方向Lと直交する平面内に位置する流入端を有するステント10の全長を短くする。しかしながら、波形形状は生体弁環を概ねなぞり、漏れに対して封止する弁の能力を低下させることはない。
本発明は、波形流入端設計を有するステントに限定されない。むしろ、本発明に係るステント10に、ステント10の長手方向Lと直交する平面内に位置する流入端を有する非連続フレア設計またはテーパー状のフレア設計を有する流入端を設けたり、または、ステント10の長手方向Lと直交する平面内に完全には位置しないステント10の流入端向けのテーパー状構造を有するフレアを持つ設計、あるいは流入端の周りに非連続的に分配されたフレアを持つ設計を有する流入端を設けることも想定される。
本発明の第17実施形態に係るステント10を図17bから図17eに示す。特に、図17bは本発明の第17実施形態に係る心臓弁ステントの第1側面斜視図であり、ここでは心臓弁ステント10が拡張した状態で示されている。心臓弁ステント10が拡張した状態の第2および第3の側面図が図17cおよび図17dに示される。
他方、図17eは、拡張した状態にある本発明の第17実施形態に係る心臓弁ステント10の上端の平面図である。
第17実施形態に係るステント10の平面展開図を図17aに示す。
ステント10の第17実施形態は、第16実施形態と構造および機能の点で類似している。しかしながら、図17b−eに示すステント設計は、環状カラー40の特定構造に関して第16実施形態とは相違する。詳細には、第17実施形態には、環状カラー内に二列のセルを有する代わりに、一列のセルのみを有することで、長さが短縮された環状カラー40が設けられる。
本発明のステントの上述の実施形態は、弁プロテーゼ100がステント10に接続される取り付け点における高い応力集中を回避するために、心拡張中にいくらか屈曲して弁尖応力を軽減し分配させることができる特定の構造を有している。ステント10に取り付けられた心臓弁プロテーゼ100の弁尖102に柔軟性を提供し、またステント10に取り付けられたプロテーゼ100の耐久性を高めるために、ステント10は、新たな弁の継ぎ目、すなわちステント10に取り付けられる弁プロテーゼ100の継ぎ目の上部に円周周りに連続的なケージ(かご)を持たないことが好ましい。この点において、ステントの継ぎ目にはいくらかの固有の柔軟さがある。
特に、ここで説明するステント10は、ステント10の上端部3に上部カラー40’が設けられていないが、他のケージ状弁設計に対して弁継ぎ目の柔軟性という利点を与える。外科的生体人工弁は、弁の継ぎ目の上端部にいくらかの柔軟性を与えて、弁尖内の応力集中を軽減してプロテーゼの寿命(すなわち弁の耐久性)を高め、また弁尖の接合(coaptation)を改善する。
基部におけるステント直径、すなわちステント10の下端部2における直径は、目標直径の周りの環の直径の範囲に適応できることが好ましい。この範囲内では、剛性に起因して加わる力は移動を防止するのに適したものでなければならないが、環の損傷を起こすほど大きすぎてはならない。継ぎ目の上部では、たとえ環の直径が目標直径とぴったりではないときでも、弁の癒合(coaptation)または開弁の性能に与える影響を最小限にするため、直径が著しく変化しないことが望ましい。
加えて、全体のステント高さを最小にしてカテーテルの搬送部を短くするべきである。体内プロテーゼ1を収容する搬送カテーテルシステムの部分は、通常、カテーテルシステムの残りの部分と比較して堅いので、これは重要である。大腿部アプローチの場合、患者の生体構造(例えば上行大動脈)の曲線に追従するようにカテーテルシステムの柔軟性が高くなるという利点がある。
第16実施形態に関連して上述したように、基部の設計をより連続的にすると、移動に抗して弁を固定する一様な半径方向力を与えることができる。一様な半径方向力は、移植ステージにおける漏れを最小化することもできる。例えば図17bに示すように、放射形状またはより大きな直径になるわずかなテーパーを有するようにステント10の基部が広がっていることが好ましい。この点において、このステント設計は、弁の位置の固定をさらに改善し、順行性移動をさらに防止することができる。
図17eに示すように、第17実施形態に係るステント10は、その下端部2に連続的な設計を備える。この連続的な設計のため、ステント10が移植され拡張した状態では、ステント10の下端部2を介して、ステント10がその中に展開される血管の壁に一様な半径方向力が与えられる。さらに、図17b−eに示すステント10は、その下端部2に放射形状のフレア区画またはテーパー区画を有する。しかしながら、ステント10の周縁でフレア区画またはテーパー区画が一様でないものも想定可能である。
弁プロテーゼが取り付けられた、移植され拡張した状態のステントが、心臓弁輪のはるか下方で広がることができない場合、ステントと弁プロテーゼからなる移植された体内プロテーゼが神経束と接触し心臓ブロックするリスクがある。神経束は、心臓弁輪の下方約6〜10mmの場所で進入することができる。
この点において、ステントの全高を短縮して患者の体内に移植される体内プロテーゼの全高を短縮することが好ましいことがある。図17a−eに示した第17実施形態と同様に、例えば第14実施形態(図14a−b参照)のステント設計における二列のセルの代わりに、環状カラー40内に一列のセルを有することによって、これを達成することができる。
他方、波形の流入端設計も想定可能である。よって、ステント10が拡張した状態にあるとき、ステント10はその下端部2に波形の流入端設計を有してもよい。このような設計では、ステント10の流入端は、ステント10の長手方向Lと直交する平面内に位置しない。むしろ、流入側のステントのエッジは、位置決めアーチの場所および二つの隣合う位置決めアーチの間の領域内のギザギザの近くに、フレアを持つ波形形状を有してもよい。特に、各フレアおよび各ギザギザの形状および場所は、弁プロテーゼの組織部分が取り付けられる各保持アーチのアームによって決定されてもよい。
ステント10は、形状記憶材料で形成されると好ましい。ステント10が第1の形状、したがって折り畳まれた状態である図1aまたは図2aに示したステント10の状態は、形状記憶材料で作られたステント構造のいわゆる「一時的な」形状である。図1aまたは図2aに係るステント構造に過度の刺激が作用すると、形状記憶効果が始動する。こうして、封止力(encapsulating force)すなわち径方向内向きに作用してステントを折り畳まれた状態に保持する力が存在しない場合、例えば図1bまたは図2bにしたがったステント10の製造中に記憶された予め定義された恒久的形状に回復する。
上記の過度の刺激は、特定可能な切替温度であることが好ましく、形状記憶効果を発揮させ、ステント10の保存された恒久的形状を再生するために、ステント材料が切替温度よりも高い温度に暖められる。ステント10に使用される材料の適切な化学成分を選択することで、特定の切替温度を予め定義することができる。本発明の好ましい実施形態の解決法では、切替温度は約20°Cから患者の体温までの範囲である。
疲労、生体適合性を最大化し、また取り付けられる組織および縫い目への損傷または生体組織への損傷を最小にするために、ステント10の表面は滑らかであり、エッジは丸められているべきである。したがって、例えば電解研磨によって、ステントの表面が研磨されることが好ましい。ステント表面の研磨は、所望の(拡張した)ステント構造の形状が固定されるプログラムプロセスの前または後に実行することができる。
ステント10を移植する際、挿入手順の間にステント10を冷却することも考えられる。好ましくは適切な挿入カテーテルシステムを用いてステント10が所望の移植部位、すなわち生体弁Hまで一旦導かれると(図18a参照)、冷却を止めることができる。続いて、ステント10を患者の体温(37°C)まで暖めて、ステント材料の形状記憶効果を発揮させることができる。ステント10の自己拡張特性のきっかけを与えることで、ステントの個々の要素、特にステント10の位置決めアーチ15a、15b、15c、保持アーチ16a、16b、16cおよび補助アーチ18a、18b、18cに作用する半径方向の力が発生する。
ステントの移植に使用される挿入カテーテルシステムと同じく、上述のステント10は、弁プロテーゼ100が固定されたステント10を患者の体内に経動脈的に(transarterially)挿入可能となるように構成されることが好ましい。一例では、ステント10は、挿入カテーテルシステムのカテーテル先端内に収容可能であり、カテーテル先端は例えば総大腿骨(femoris communis)(鼠径動脈)の穿刺により体内に挿入される。適切なカテーテルシステムはWO 2006/076890およびPCT/EP2008/003803に記載されており、その詳細は参照により本明細書に援用される。
代替的に、本発明の特定の実施形態に係るステント10は、トランスアピカル移植にも適している。トランスアピカル移植(心尖(apex)に由来する)では、挿入カテーテルシステムのカテーテル先端を、例えば左心室を通して大動脈弁に前進させる。適切に修正されたカテーテル先端を用いて、弁プロテーゼ100を備えたステント10の類似の移植が可能になる。適切なカテーテルシステムはPCT/EP2008/003803に記載されており、その詳細は参照により本明細書に援用される。
ステント10が移植部位に経動脈的アプローチまたはトランスアピカルなアプローチのいずれによって運ばれるかにかかわらず、挿入カテーテルシステムのカテーテル先端は、血管造影法および心エコー図(超音波)による制御を用いて移植部位まで進められることが好ましい。弁プロテーゼ100が取り付けられたステント10の実際の移植がその後に続く。
図18aから図18cは、本発明の特定の実施形態に係るステント10を備える体内プロテーゼ1の経動脈的移植を図解した過程を模式的に示す。図示のように、弁プロテーゼ100が取り付けられたステント10の移植は、挿入カテーテルシステムの搬送部の適切な操作によってカテーテルシステムの搬送部内に収容されたステント10の個々の要素が順に解放されるように行われる。
上述のステント10の移植に使用されるカテーテルシステムは、カテーテルシステム内部の空洞を通してカテーテルシステムの搬送部に液体冷却剤を供給できるように構成されるのが理想的である。例えば食塩水の形態である液体冷却剤は、カテーテルシステムの搬送部の近位側Kが移植部位に向けて前進している間、カテーテルシステムの搬送部内に収容されたステント10を切替温度未満の温度に維持する。これは、ステント10の材料として形状記憶材料が使われているとき特に有利である。その理由は、過度の刺激の影響を受けたとき、ステント10は一時的な形状から恒久的な形状に変形するからである。一時的な形状は、ステント10の第1形状(ステント10がカテーテルシステムの搬送部内に収容されているときの、折り畳まれた状態)であり、恒久的な形状は、ステント10の第2形状(ステント10の拡張された状態)である。
拡張されたステント10の「恒久的形状」は、その環境における自然な形状に一致することに注意する。これにより、患者によってそれぞれ異なる移植部位における環境の形状に変化を持たせることができる。環境の自然な形状に自動的に完全に適合する拡張されたステント10の「恒久的形状」に関連する、ステント10のこの特性は、弁プロテーゼ100の最適な移植を常に保証する。
ステント10の完全に拡張した永続的な形状と、移植ステージにおけるステント10の拘束された形状との違いは、移植部位における環境に依存しており、移動を防止し良好な封止を保証するためにステント10によって血管壁に与えられる半径方向の圧力を決定する。ステント10の完全に拡張した形状は、対象とする患者の生体組織の大きさに合わせて適切な半径方向圧力を与えるように設計される。
ニッケルとチタンの等原子比(equiatomic)合金であるニチノールなどの形状記憶材料を、上述のステント10に使用することができるので、弁プロテーゼ100が固定されたステント10を移植するとき、特に優しい移植手順を実現できる。ステント10の材料としてニチノールは生体適合性が良好であるため好適である。
カテーテルシステムの搬送部が前進しつつステント材料の温度を臨界の遷移温度未満に維持する間、挿入カテーテルシステムに適切な冷却剤を流すことによって、カテーテルシステムの搬送部に収容されたステント10を冷却することができる。冷却されたステント10を有するカテーテルシステムの搬送部が移植部位に前進したら、ステント10の冷却を停止すべきであり、この結果、ステント10は患者の体温(37°C)まで暖められ、ステント材料の形状記憶効果が発揮される。
ステント10の個々の要素の自己拡張特性が始動すると、ステント10の個々の要素、特にステント10の位置決めアーチ15a、15b、15c、保持アーチ16a、16b、16c、弁尖保護アーチ50a、50b、50cおよび補助アーチ18a、18b、18cに作用する半径方向の力が発生する。ステント10のそれぞれの要素は依然としてカテーテルシステムの搬送部内に位置するので、超過した臨界切替温度により発現しステント10の個々の要素に作用する半径方向の力は、カテーテルシステムの搬送部の壁によって依然として相殺され、形状記憶効果の発生にもかかわらず、ステント10は第1の(折り畳まれた)形状を強制的に維持される。
ステント10の適切な漸進的な解放による、カテーテルシステムの搬送部の後続の操作時に、ステント10の個々の要素がカテーテルシステムの搬送部から解放される。
例えば、図18aに示すように、ステント10の位置決めアーチ15a、15b、15cは、作用する半径方向の力によって放射状に広がる。続いて、拡張した位置決めアーチ15a、15b、15cを生体心臓弁Hの嚢Tの中に配置することができる。
その後、図18bに示すように、ステント10の残りの要素がカテーテルシステムの搬送部から順に解放される。ステント10の解放された残りの要素、特に弁プロテーゼ100を備えた補助アーチ18a、18b、18cおよび保持アーチ16a、16b、16cが半径方向に展開し、締結部11に取り付けられた弁プロテーゼ100が傘のように広がる。
ステント10の保持アーチ16a、16b、16cおよび補助アーチ18a、18b、18cに作用する半径方向の力、並びにステント10の上端領域3に作用する半径方向の力は、血管壁に対してステント10を半径方向に押しつける(図18c参照)。これにより、拡張された弁プロテーゼ100を用いてステント10が移植部位にしっかりと固定される一方、ステント10の下端部2で弁プロテーゼ100が高い信頼性で封止される。
続いて、挿入カテーテルシステムの搬送部がさらに操作され、ステント10の小穴24を解放し、これによってステント10の上端領域3が拡張可能となる。その際、それぞれの位置決めアーチと保持アーチの間に生体心臓弁Hの弁尖が挟まれ、ステント10の下端部2に配置された弁プロテーゼ100を広げることができる。
ステント10と弁プロテーゼ100の移植が成功した後、患者の体からカテーテルが取り除かれる。
ステント10は、外部刺激に反応して第1(折り畳まれた)形状から第2(拡張された)形状に自己拡張する形状記憶材料で作られることに限定されない。それどころか、従来のバルーンシステムを使用して拡張されるステント10も考えられる。
上述の解決法は、添付の図面を参照して説明した特定の実施形態に限定されないことは理解されよう。それどころか、本発明は、説明した実施形態に例示された個々の特徴の組み合わせを包含する。
特に、ステント10には放射アーチ32a−cが設けられなくてもよい。むしろ、ステント10の基部構成は、複数の位置決めアーチ15a−cと複数の保持アーチ16a、16b、16cのみを備えてもよい。
本発明に係るステント10の第18実施形態について、図19a−bを参照して以下で説明する。詳細には、図19aは、本発明の第18実施形態に係る体内プロテーゼを支持し固定することが可能な心臓弁ステントの第1側面斜視図を示す。ここでは、心臓弁ステントが拡張した状態で示されている。図19bは、本発明の第18実施形態に係る体内プロテーゼを支持し固定することが可能な心臓弁ステントの第2側面斜視図を示す。ここでは、心臓弁ステントが拡張した状態で示されている。
したがって、第18実施形態に係るステント10は、患者の生体心臓弁Hの複数の嚢T内に配置され、複数の生体心臓弁尖の第1側面に配置されるように構成された複数の位置決めアーチ15a、15b、15cと、第1側面とは反対側の複数の生体心臓弁尖の第2側面に配置されるように構成された複数の保持アーチ16a、16b、16cとを備える。さらに、複数の弁尖保護アーチ50a、50b、50cが設けられる。各弁尖保護アーチは、複数の位置決めアーチ15a、15b、15cのうち一つの二本のアーム15a’、15a”、15b’、15b”、15c’、15c”の間の空間を占める。加えて、保持アーチ16a、16b、16cの各アーム16a’、16a”、16b’、16b”、16c’、16c”には、各アーム16a’、16a”、16b’、16b”、16c’、16c”を複数のアーム区画に分割するために複数の曲げエッジ33が設けられることが好ましい。ステント10の構造は、保持アーチ16a、16b、16cの各アーム16a’、16a”、16b’、16b”、16c’、16c”が、少なくともステント10の拡張状態で曲線形状を有するようにプログラムされる。特に、保持アーチ16a、16b、16cの各アーム16a’、16a”、16b’、16b”、16c’、16c”の形状は、ステント10に取り付けられる弁プロテーゼ100の弁尖102の形状をアームがなぞるように画成される(図16fおよび図16g参照)。
加えて、第18実施形態に係るステント10は、二つの隣合う保持アーチ16a、16b、16cの間を埋める少なくとも一つの補助アーチ18a、18b、18cをさらに備えてもよい。少なくとも一つの補助アーチ18a、18b、18cは、その第1端部で第1保持アーチ16a、16b、16cと接続される第1アーム18a’、18b’、18c’と、その第1端部で第2保持アーチ16a、16b、16cと接続される第2アーム18a”、18b”、18c”とを備える。少なくとも一つの補助アーチ18a、18b、18cの第1および第2アーム18a’、18b’、18c’、18a”、18b”、18c”はそれぞれ、縫い目を受け入れるように構成された少なくとも一つの締結穴を備える接合部で互いに接続される第2端部を備える
少なくとも一つの補助アーチ18a、18b、18cに加えてまたはその代わりに、本発明の第18実施形態に係るステントは、複数の位置決めアーチ15a、15b、15cのうち少なくとも一つと実質的に円周方向に位置合わせされる少なくとも一つの放射アーチ32a、32b、32cをさらに備えてもよい。
さらに、本発明の第18実施形態に係るステント10には複数のエクストラアーチ60a、60b、60cが設けられてもよい。複数のエクストラアーチ60a、60b、60cはそれぞれ、第1保持アーチ16a、16b、16cと隣接する第2保持アーチ16a、16b、16cとの間の空間を占める。
また、本発明の第18実施形態に係るステント10の下端部2および/または上端部3に、少なくとも一つの環状カラー40、40’が設けられてもよい。
さらに、ステント10が展開される血管壁にステント10の上部領域3を固定することに関して、ステント10が、例えば小穴24に配置された鉤の先端がステント10の下端部2の方向を向いた鉤状部材を備えることも想定可能である。
加えて、ステント10の外側表面の全てまたは大半を覆うために、ステント10の外側の少なくとも一部の上に、ステントの下端部近傍の位置からステントの上端部近傍の位置に広がる、典型的に繊維、高分子また心膜のシート、薄膜等である、ライナーまたはさや(sheath)を設けてもよい。ライナーは、ステント10の少なくとも一端に取り付けられるとともに、両端の間の複数位置に取り付けられて外部被覆を形成する。このような外部被覆は、ステント10と内腔壁の間の血流の漏れを阻止するための、血管内腔の内壁に対する周縁シールを提供し、これによって血流が体内プロテーゼ1をバイパスすることを防止する。
例えば、ライナーは、円周方向に間隔を空けた複数の軸線に沿ってステント10に縫い付けられるか他の方法で固定されてもよい。このような取り付けは、ステント10が半径方向に圧縮されたときに、複数の軸方向の折り目に沿ってライナーを折り畳むことを可能にする。ライナーは、フレームが広がるとき管状フレームの内腔壁に開いて一致することが可能である。代替的に、ライナーは、ステント10に熱溶接されるか超音波溶接されてもよい。ステント10に複数の個々の締結部11、11aが設けられる例示的な実施形態では、ライナーがこれらの締結部11、11aに固定されてもよい。複数の個々のアーチ(位置決めアーチ15a、15b、15c、保持アーチ16a、16b、16cおよび補助アーチ18a、18b、18cおよび/または締結アーチ19、19a、19b、19c)が設けられる第2の例示的実施形態では、ライナーが好ましくは軸線に沿ってこれらのアーチに固定されてもよい。ライナーは、少なくとも一端でステント10に対して周縁が封止されていることが好ましい。
ステント10の外表面の少なくとも一部をライナーまたはさやでカバーすることによって、露出したステント部材から生じる体内プロテーゼ1の血栓形成が大きく低減されるかまたは排除される。このような血栓形成の低減は、弁プロテーゼ100の展開および弁プロテーゼ100の適切な位置への固定に使用されるステント構造を有する利点を維持しつつ達成される。
上述したように、挿入を容易にするために、弛緩した大きな直径の構成から小さな直径の構成にステント10を圧縮することができる。当然ながら、半径方向に圧縮された構成および拡張され弛緩した構成の両方で、外側ライナーはステント10に取り付いた状態を維持する必要がある。
ライナーは、通常は織物、不織繊維、ポリマーシート、薄膜等の形態である、ポリエステル、ポリテトラフルオロエチレン(PTFE)、ポリウレタン等の心膜材料または従来の生体移植材料で構成される。好適な繊維ライナー材料は、ダクロン(登録商標)糸(デュポン、ウィルミントン、デラウェア)などの平織りのポリエステルである。
本発明に係るステント10の第19実施形態を、図20a−図20dを参照して以下で説明する。
詳細には、図20aは、ステント10が非拡張状態である、本発明の第19実施形態に係る心臓弁ステント10の平面展開図を示す。この平面展開図は、本発明の第19実施形態に従ったステント10の製造で使用可能である切断パターンの二次元投影図に対応する。これにより、チューブの一部、特に金属管から一体的なステント10を切り出すことが可能になる。一方では、本発明のステント10は、ステント10の個々の部品(位置決めアーチ、保持アーチ、補助アーチ)の間の固定本体ジョイントまたは他の類似の接続デバイスが省略されていることは明らかである。他方では、位置決めアーチ15a、15b、15cによって提供される位置決め機能と、保持アーチ16a、16b、16cの各アーム16a’、16a”、16b’、16b”、16c’、16c”内に構成された締結穴11によって提供される弁プロテーゼの締結機能とが、長手方向の広がりを最小にしてステント10に与えられている。さらに、ステント本体の下端部に配置される環状カラー40の下端部周囲に一様に配列された複数の切り欠き12eを備える追加締結手段によって、心臓弁プロテーゼの規定された締結が達成される。
図20bは、本発明の第19実施形態に係る弁プロテーゼの支持および固定が可能である心臓弁ステント10の第1斜視図である。図20cは、心臓弁ステントが拡張された状態の、本発明の第19実施形態に係る弁プロテーゼの支持および固定が可能である心臓弁ステントの第2斜視図である。
図20dは、本発明の第19実施形態に係る心臓弁ステント10の平面展開図を示す。しかし、図20aに示した平面展開図に反して、図20での平面展開図は、心臓弁ステント10の拡張された状態を示している。
このため、第19実施形態に係るステント10は、複数の位置決めアーチ15a、15b、15cと、複数の保持アーチ16a、16b、16cとを備えることが分かる。複数の位置決めアーチ15a、15b、15cはそれぞれ、患者の生体心臓弁Hの複数の嚢T内に配置され、複数の生体心臓弁尖(図18a−18cを参照)の第1側に配置されるように構成される。他方、複数の保持アーチ16a、16b、16cはそれぞれ、第1側とは反対の複数の生体心臓弁尖の第2側(同じく図18a−18cを参照)に配置されるように構成される。
さらに、複数の位置決めアーチ15a、15b、15cの一つの二本のアーム15a’、15a”、15b’、15b”、15c’、15c”の間にそれぞれ配置された、複数の弁尖保護アーチ50a、50b、50cが設けられている。加えて、保持アーチ16a、16b、16cの各アーム16a’、16a”、16b’、16b”、16c’、16c”には複数の曲げエッジ33が好ましくは設けられ、各アーム16a’、16a”、16b’、16b”、16c’、16c”を複数のアーム区画に分割している。保持アーチ16a、16b、16cの各アーム16a’、16a”、16b’、16b”、16c’、16c”が少なくともステント10の拡張時に曲線形状を有するように、ステント10の構造がプログラムされる。特に、保持アーチ16a、16b、16cの各アーム16a’、16a”、16b’、16b”、16c’、16c”の形状が、ステント10に取り付けられる弁プロテーゼ100の弁尖102の形状をアームがたどるように画成される。
詳細には、図20aの平面展開図に示されるように、保持アーチ16a、16b、16cの各アーム16a’、16a”、16b’、16b”、16c’、16c”には、複数の曲げエッジ33が設けられている。これらの曲げエッジ33は、各保持アーチアーム16a’、16a”、16b’、16b”、16c’、16c”の全長に沿って一様に分布しており、これによって各アーム16a’、16a”、16b’、16b”、16c’、16c”を複数のアーム区画に分割する。対応する保持アーチアーム16a’、16a”、16b’、16b”、16c’、16c”のアーム区画は相互に接続しており、これによってステント10の非拡張時に本質的に直線をなす保持アーチアームを構成する。この点において、保持アーチ16a、16b、16cの各アーム16a’、16a”、16b’、16b”、16c’、16c”の非曲線構造を示す、図20aの平面展開図が参照される。
ステント10の製造時、ステント構造および特に保持アーチ16a、16b、16cの構造は、各保持アーチアーム16a’、16a”、16b’、16b”、16c’、16c”がステント10の拡張時に曲線形状を有するようにプログラムされる。各保持アーチアーム16a’、16a”、16b’、16b”、16c’、16c”の形状は、ステント10に取り付けられる弁プロテーゼ100の弁尖の形状をアームがたどるように画成される(図20d参照)。
したがって、その上に弁プロテーゼ100が縫い付けられるまたは縫い付け可能である各保持アーチアーム16a’、16a”、16b’、16b”、16c’、16c”は、ステント10の拡張時に自身の形状を変化させる。すなわち、ステント10が拡張された状態では保持アーチ16a、16b、16cは曲がっているが、ステント10が折り畳まれているときは相対的に直線である。
例えば図20dから分かるように、各保持アーチアーム16a’、16a”、16b’、16b”、16c’、16c”の湾曲は、アーム16a’、16a”、16b’、16b”、16c’、16c”の分割によって達成される。詳細には、アーム16a’、16a”、16b’、16b”、16c’、16c”は複数の曲げエッジ33を設けることによって分割される。ステント10の拡張した状態では、二つの隣合うアーム区画が互いに対して角度を持ち、これら二つの隣合うアーム区画の屈曲点が、両方の隣合うアーム区画の間に設けられた曲げエッジ33によって画成される。したがって、保持アーチ16a、16b、16cのアーム16a’、16a”、16b’、16b”、16c’、16c”に設けられる曲げエッジ33の数が多くなるほど、ステント10の拡張された状態で異なる方向に延出可能であるアーム区画の数が多くなる。この点において、各保持アーチアーム16a’、16a”、16b’、16b”、16c’、16c”の形状を、ステント10に取り付けられる弁プロテーゼの弁尖形状に正確に適合させることができる。
第19実施形態のステント設計によると、保持アーチ16a、16b、16cの各アーム16a’、16a”、16b’、16b”、16c’、16c”には、例えば第18または17実施形態にあるような締結穴12aが設けられていない。代わりに、第19実施形態では、保持アーチアーム16a’、16a”、16b’、16b”、16c’、16c”に設けられた曲げエッジ33が、二本の隣合うアーム区画の屈曲点を画成するのみならず、心臓弁プロテーゼをステント10に固定するために使用可能な締結用切り欠きとしても使用される。
例えば図17aの平面展開図(第17実施形態)との比較から、第19実施形態に係るステント設計の各保持アーチアーム16a’、16a”、16b’、16b”、16c’、16c”は、締結穴12aを有する締結部が設けられた第17実施形態の各保持アーチアームと比較すると、少なくとも部分的に非常に薄いことが分かる。保持アーチアーム16a’、16a”、16b’、16b”、16c’、16c”の厚さを低減することによって、アームの柔軟性が向上し、各保持アーチアーム16a’、16a”、16b’、16b”、16c’、16c”の形状を、ステント10に取り付けられる弁プロテーゼの弁尖形状により正確に適合させることが可能になる。
さらに、心臓弁プロテーゼをステント10に固定する締結用切り欠きとして保持アーチアーム16a’、16a”、16b’、16b”、16c’、16c”に設けられた曲げエッジ33を使用することによって、締結穴12aの数と比較してより多数の取り付け点を作成することができる。この点において、単一の取り付け点における高い応力集中を効果的に回避することができる。
加えて、第19実施形態では、ステント10の保持アーチアーム16a’、16a”、16b’、16b”、16c’、16c”に心臓弁プロテーゼを固定するために使用される取り付け点(曲げエッジ33)が、各保持アーチアーム16a’、16a”、16b’、16b”、16c’、16c”に沿ってより一様に分布している。これによって、心臓弁プロテーゼがステントにより一様に固定される。したがって、ステントに対して心臓弁プロテーゼが軸方向にずれるリスクをさらに低下することができる。各保持アーチアーム16a’、16a”、16b’、16b”、16c’、16c”に設けられた個々の曲げエッジ33は、ステント10の対応する保持アーチアーム16a’、16a”、16b’、16b”、16c’、16c”に弁プロテーゼ100の組織部分を固定または縫い付けるのに用いられる糸または細いワイヤを案内する役割をする。詳細には、各保持アーチアーム16a’、16a”、16b’、16b”、16c’、16c”に弁プロテーゼの組織部分を締結するための上記手段(糸または細いワイヤ)が、締結用切り欠きとして機能する曲げエッジ33によって案内されるので、ステント10に対する弁プロテーゼの軸方向変位が実質的に最小化される。これにより、ステント10に対する弁プロテーゼの正確な位置決めも可能になる。
加えて、第19実施形態に係るステント10は、二つの隣合う保持アーチ16a、16b、16cの間を埋める少なくとも一つの補助アーチ18a、18b、18cをさらに備えてもよい。少なくとも一つの補助アーチ18a、18b、18cは、その第1端部で第1保持アーチ16a、16b、16cと接続される第1アーム18a’、18b’、18c’と、その第1端部で第2保持アーチ16a、16b、16cと接続される第2アーム18a”、18b”、18c”とを備える。少なくとも一つの補助アーチ18a、18b、18cの第1および第2アーム18a’、18b’、18c’、18a”、18b”、18c”はそれぞれ、ステント本体の下端部に配置される環状カラー40に接続された第2端部を有している。上述のステント設計(第14−第18実施形態)と同様に、この少なくとも一つのカラー40は、図20aに示す切断パターンを使用することで、チューブの一部からステントを切り出すための追加の固定手段として機能する。
詳細には、少なくとも一つの補助アーチ18a、18b、18cの第1および第2アーム18a’、18b’、18c’、18a”、18b”、18c”は、二つの隣合う補助アーチ18a、18b、18cの第1および第2アーム18a’、18b’、18c’、18a”、18b”、18c”の間に設けられる支柱(strut)またはウェブ構造の一部であり、ステント10に固定される弁プロテーゼ100を支持する(例えば、図16fおよび16gを参照)。例えば図20dから分かるように、支柱またはウェブ構造は、強化構造を形成するように相互に接続される複数の支柱または支柱状部材によって構成されてもよい。強化構造の各支柱または支柱状部材は、二つの隣合う補助アーチ18a、18b、18cの第1および第2アーム18a’、18b’、18c’、18a”、18b”、18c”の間の領域の強度または耐変形性を向上するための強化部材として機能する。これによって、強化構造はステント10を機械的に強化する。さらに、二つの隣合う補助アーチ18a、18b、18cの第1および第2アーム18a’、18b’、18c’、18a”、18b”、18c”の間の強化構造の強化部材は、ステント10に取り付けられる心臓弁プロテーゼの接合面の追加支持部を提供する。
本明細書で使用される「強度」または「耐変形性」という用語は、強化部材に関連する複数の様々な特性のうち任意のものを意味するように使用されることがある。例えば、強化部材を作成する材料の特性、例えば降伏強度、弾性係数、剛性係数、または伸び率を指すのに上記用語を使用してもよい。同様に、強化部材の硬度を指すのに上記用語を使用してもよい。硬度は、材料の硬度測定に使用される装置に関連して、材料の「デュロメータ」として特徴づけられてもよい。強化部材の厚さなどの、強化部材の幾何的な特徴を意味するのに上記用語を使用してもよい。「強度」または「耐変形性」という用語は、上記の特性の任意の組み合わせ、並びに追加の特性および/または特徴を指すのに使用されてもよい。
二つの隣合う補助アーチ18a、18b、18cの第1および第2アーム18a’、18b’、18c’、18a”、18b”、18c”の間の領域の強度または耐変形性を、様々な方法で高めることができる。図20dから分かるように、例えば、少なくとも一つの強化要素、好ましくは互いに接続された複数の強化要素(例えば支柱または支柱状部材)で形成された強化構造を設けることによって、二つの隣合う補助アーチ18a、18b、18cの第1および第2アーム18a’、18b’、18c’、18a”、18b”、18c”の間の領域の強度または耐変形性を高めることができる。
二つの隣合う補助アーチ18a、18b、18cの第1および第2アーム18a’、18b’、18c’、18a”、18b”、18c”の間の領域の強度または耐変形性を高めるために、強化ウェブを設けることも想定可能である。この強化ウェブは、互いに接続されることによって菱形パターンを形成する複数の強化要素(例えば支柱または支柱状部材)で構成されてもよい。
強化部材の厚さを増加することによって、またはステント10の設計から応力集中を高めるものを排除することによって、または強化部材の形状の他の特徴を変更することによって、二つの隣合う補助アーチ18a、18b、18cの第1および第2アーム18a’、18b’、18c’、18a”、18b”、18c”の間の領域の強度または耐変形性を高めることができる。ステント10および/または強化部材の機械的特性を変更することによっても、強度を高めることができる。例えば、それぞれ異なるレベルの硬度を有する多数の様々な材料、好ましくは形状記憶材料で強化部材を作成することができる。この点において、ステント10および/または強化部材の機械的特性をステントの各用途での特定のニーズに適合させるように、ステントおよび強化部材の形成に使用する材料の化学量論的組成を変更することも想定される。また、ステントおよび強化部材を形成するのに、例えばニチノールおよび形状記憶ポリマーなどの異なる材料を使用することも想定される。このように、ステントの各用途の特定のニーズに合わせて強化部材の選択を調整することができる。例えば、大きな外力が予想される領域では、高硬度を有する強化部材が好ましい場合がある。形状を変えた材料特性を組み合わせることによって強度を高めてもよい。
図20dから分かるように、第19実施形態に係るステント10には、二つの隣合う(隣接する)保持アーチ16a、16b、16cのアーム16a’、16a”、16b’、16b”、16c’、16c”の間の領域に複数の支柱によって形成された複数の格子セル70で構成される強化構造が設けられており、これによって、ステント10に取り付けられる心臓弁プロテーゼの接合面の追加支持部を提供している。
加えて、二つの隣合う保持アーチ16a、16b、16cの隣接アーム間の領域に複数の支柱によって形成された格子セル70のこの構造は、一様なステント構造を提供することができる。これは、心臓弁プロテーゼが取り付けられたステント10が移植された段階で血液漏出を最小化することができる。
格子セル70の構造を形成する各支柱の上端部は、保持アーチ16a、16b、16cの各アームに接続される。好ましくは、該支柱の上端部と保持アーチ16a、16b、16cのアームとの間の接続を強化するために、支柱の上端部の直径が拡大されている。
ステント本体の上端部に設けられる上述した環状カラー40は、保持アーチ16a、16b、16cを介してステント本体に接続される一方、少なくとも一つの補助アーチ18a、18b、18cの各アーム18a’、18a”、18b’、18b”、18c’、18c”の第2端部を介してステント本体に接続される。少なくとも一つの補助アーチ18a、18b、18cのこれらのアーム18a’、18a”、18b’、18b”、18c’、18c”は、格子セル70の構造の一部である。特に、本発明の第19実施形態に係るステント10には、単一列のセルのみを有することで全長が短縮された環状カラー40が設けられている。
図20aの平面展開図から分かるように、ステント本体の下端部にある環状カラー40は、ステント10の非拡張時にステント10の長手軸と平行に走り、横方向ウェブ42により相互接続される複数の支持ウェブ41を有する。しかしながら、図20cの二次元展開図から分かるように、ステント10の拡張時には、支持ウェブ41と横方向ウェブ42とが菱形状、または蛇紋状(serpentine)の環状カラー40を形成し、ステント10が移植された状態で血管壁と接触する。
移植され拡張された体内プロテーゼ1の位置固定をさらに改善し順行性移動を防止するために、第19実施形態に係るステント10には、下端部2に放射形状のフレア(広がり)区画またはテーパー区画が設けられる。詳細には、図20bおよび20cに示すように、ステント10の拡張した状態で、環状カラー40の下端部がステント10のフレア区画またはテーパー区画を構成する。
図20bおよび20cに示すステント10は、その下端部2に、放射形状のフレア区画またはテーパー区画を有する。しかしながら、このフレア区画またはテーパー区画がステント10の周囲に均一に配置されないことも想定される。例えば、ステント10は、位置決めアーチ15a、15b、15cの場所の近くにのみフレアを有してもよいし、継ぎ目領域、すなわち二つの隣合う位置決めアーチ15a、15b、15cの二本のアーム15a’、15a”、15b’、15b”、15c’、15c”の間の領域の近傍にはフレアを設けなくてもよい。
図20bおよび20cに示すように、第19実施形態に係るステント10は、その下端部2の連続設計を有する。この連続設計のために、ステント10が移植され拡張された状態では、一様な径方向の力が、ステント10の下端部2を介して、ステント10が内部に展開された血管壁に与えられる。
弁プロテーゼが取り付けられた、移植され拡張した状態のステントが、心臓弁輪のはるか下方で広がることができない場合、ステントと弁プロテーゼからなる移植された体内プロテーゼが神経束と接触し心臓ブロックするリスクがある。神経束は、心臓弁輪の下方約6〜10mmの場所で進入することができる。
ステント10の下端部2が房室結節と接触することを避けるために、第19実施形態に係るステント10には、単一列のセルのみを有することでその全長が短縮された環状カラー40が設けられている。この点において、ステント10の全高を短縮して患者の体内に移植される体内プロテーゼ1の全高が短縮される。
さらに、所望の(拡張された)ステント構造の形状が固定されるプログラミング過程において、第19実施形態のステント10が拡張された状態のときに、環状カラー40の上部のみがステント10の外周の外側で半径方向に延び、環状カラー40の下端部は、ステント10の外周の内側で半径方向に環状カラー40の上部に対して屈曲するように、環状カラー40の支持ウェブ41がプログラムされてもよい。環状カラー40の下端部は、例えば、ステント10の長手方向Lと略平行に延びるように屈曲してもよい。こうして、ステント10が内部に展開された血管の壁に対して、環状カラー40の上部によって与えられる接触力(径方向の力)が増加する一方、環状カラー40の下端部が房室結節と接触するリスクが軽減される。
第19実施形態に係るステント10が、環状カラー40の下端部周囲に一様に分配された複数の切り欠き12eを備えていることに注意することが大切である。これらの切り欠き12eを使用して、ステント10に心臓弁プロテーゼ(図20bおよび20cには示されていない)固定することができ、ステント10に対して心臓弁プロテーゼ100が軸方向に移動するリスクが軽減される。複数の切り欠き12eを追加固定手段として使用するため、環状カラー40の全支持ウェブ41の下端部を利用して、心臓弁プロテーゼをステント10にさらに締結することができる。これは、図20aの平面展開図に直接表れている。
例えば図17aの平面展開図(第17実施形態)との比較から、環状カラー40のあらゆる支持ウェブ41の下端部に小穴12fを設けるためには、各切り欠き12eを形成するのに必要な材料の量よりも多くの材料が各小穴12fについて必要であることが分かる。ステント10の全ての構造部分、特に位置決めアーチ15a、15b、15c、保持アーチ16a、16b、16c、およびその下端部に追加締結手段が画成された環状カラー40を備えるステント10が、チューブの一部、特に金属管から切り出した一体構造を呈することが想定されるので、元のチューブ部からステント10の設計を形成するための精巧な切断パターンが重要である。特に、全ての構造的なステント部分を有するステント10の構造を、元のチューブ部の限られた側面積から切り出さなければならないことを考慮に入れる必要がある。
したがって、小穴12fの代わりに、環状カラー40の下端部に追加締結手段として切り欠き12eを設けることによって、小穴12fの数よりも多数の切り欠き12eを作成することができる。詳細には、第19実施形態によると、環状カラー40の全ての支持ウェブ41の下端部に、追加締結手段として機能する対応する切り欠き12eが設けられる。対照的に、第17および第18実施形態では、環状カラー40の一つおきの支持ウェブ41の下端部のみに、追加締結手段として機能する対応する小穴12fを設けることができる。
この点において、第19実施形態に係るステント設計は、環状カラー40の全ての支持ウェブ41の下端部に追加締結手段が設けられる点で、例えば第18実施形態に係るステント設計とは異なる。これは、ステント10の第19実施形態では、追加締結手段として切り欠き12eが使用されているという事実による。
したがって、第19実施形態では、ステント10に心臓弁プロテーゼを固定するために使用される追加締結手段が、環状カラー40の下端部周囲により一様に分布している。これによって、心臓弁プロテーゼがステントにより一様に固定される。したがって、ステントに対して心臓弁プロテーゼが軸方向にずれるリスクをさらに低下することができる。環状カラー40の下端部に設けられた個々の切り欠き12eは、ステント10の環状カラー40の下端部に弁プロテーゼの組織部分を固定または縫い付けるのに用いられる糸または細いワイヤを案内する役割をする。詳細には、環状カラー40の下端部に弁プロテーゼの組織部分を締結するための上記手段(糸または細いワイヤ)が切り欠き12eによって案内されるので、ステント10に対する弁プロテーゼの軸方向変位が実質的に最小化される。これにより、ステント10に対する弁プロテーゼの正確な位置決めも可能になる。
さらに、ステント10の環状カラー40の下端部に弁プロテーゼの組織部分をしっかりと規定のかたちで固定するために対応する切り欠き12eを用いることによって、弁プロテーゼが固定されたステント10、すなわち体内プロテーゼ1を圧縮して、体内プロテーゼ1の移植に使用されるカテーテルシステム内への挿入の準備ができた折り畳み状態にするときに、組織部分をステント10に締結するのに使用される手段(糸または細いワイヤ)が押しつぶされて品質が低下することを効果的に防止する。この点において、弁プロテーゼ100の組織部分をステント10に締結するために使用される糸または細いワイヤが構造的に劣化するリスクが軽減される。
切り欠き12eの断面形状は、弁プロテーゼ100の組織部分を締結するために使用される糸または細いワイヤの断面形状に適合されてもよい。これにより、弁プロテーゼ100の組織部分を、予め定義された正確な位置でステント10に固定することが可能になる。締結穴12は、弁プロテーゼ100をステント10に締結するために使用される糸または細いワイヤの太さおよび/または断面形状に適合されているので、体内プロテーゼ1が移植されるとき、心臓の蠕動運動に起因するステント10と弁プロテーゼ100の組織部分との間の相対移動を効果的に防ぐことができる。体内プロテーゼ1が完全に拡張して移植された状態にあるとき、弁プロテーゼ100の組織部分は、弁プロテーゼの固定に使用される糸または細いワイヤの摩擦で引き起こされる摩耗が最小化されるような、最小限の遊びでステント10に締結される。
特に図20b−20dから分かるように、本発明の第19実施形態に係るステント10は、少なくとも一つの放射アーチ32a、32b、32cを備える。放射アーチは、心臓の移植部位でステント10の特にしっかりとした固定を可能にし、複数の位置決めアーチ15a、15b、15cの少なくとも一つの実質的に円周方向で位置合わせされている。放射アーチ32a、32b、32cに加えて、ステント10には、それぞれ二つの弁尖保護アームを備える全部で三つの弁尖保護アーチ50a、50b、50cが設けられている。図20aの平面展開図から分かるように、第19実施形態に係るステント構造では、各位置決めアーチ15a、15b、15cの間に弁尖保護アーチ50a、50b、50cが設けられる。したがって、第19実施形態に係るステントでは、一つの弁尖保護アーチ50a、50b、50cが各位置決めアーチ15a、15b、15cに割り当てられている。
図20aに示す平面展開図を参照すると、第19実施形態に係るステント10の放射アーチ32a、32b、32cは、弁尖保護アーチ50a、50b、50cからステント10の上端3に向けて延びる。図20aに最も明瞭に示されているように、ステント10は三つの放射アーチ32a、32b、32cを有し、各アーチ32a、32b、32cは各弁尖保護アーチ50a、50b、50cの二本のアームの間に位置している。各放射アーチ32a、32b、32cは、各位置決めアーチ15a、15b、15cとはおおよそ逆の形状を有しており、位置決めアーチ15a、15b、15cのそれぞれ一つと反対の方向に延出する。
他方、各弁尖保護アーチ50a、50b、50cは、ステントの下端2で閉鎖する実質的にU字形またはV字形の構造を有する。各弁尖保護アーチ50a、50b、50cは、対応する弁尖保護アーチ50a、50b、50cが間に配置される位置決めアーチ15a、15b、15cの形状とほぼ同様の形状を有している。さらに、各弁尖保護アーチ50a、50b、50cは位置決めアーチ15a、15b、15cと同じ方向に延出する。
第19実施形態のステント設計では、弁尖保護アーチ50a、50b、50cの各アームは、放射アーチ32a、32b、32cのアーム全長の略中点で、反対側の放射アーチ32a、32b、32cのアームと融合する。第19実施形態のステント設計によると、弁尖保護アーチ50a、50b、50cはステントの長手方向Lに突出し、ステント10の拡張中に位置決めアーチ15a、15b、15cが展開可能であり弁尖保護アーチ50a、50b、50cが展開中に干渉しないような短縮された全長を有する。
ステント10に配置された位置決めアーチ15a、15b、15cと保持アーチ16a、16b、16cは、ステントの下端部の方向に、すなわちステントの下端2に向けて、凸状でアーチ形に曲がっていてもよい。このような丸みのある形態は、動脈の損傷を軽減するとともに、自己拡大中の展開を容易にすることができる。このような設計によって、近隣の組織または血管壁を相応に傷つけることなく、生体心臓弁の嚢T内への位置決めアーチ15a、15b、15cの挿入を容易にすることができる(図18a−18cを参照)。
図20aに係る平面展開図には明示されていないが、所望の(拡張した)ステント構造の形状が固定されるプログラミング過程中、第19実施形態に係るステント10が拡張した状態にあるとき、ステント10の外周外側に径方向に延出するように弁尖保護アーチ50a、50b、50cがプログラムされていることが好ましい。こうすると、第19実施形態のステントが拡張され移植された状態のとき、生体(病変した)心臓弁の弁尖Hに対する接触力を増大することができる。これによって、その場所でステントを固定するときの安全性が増加する。
ステントが拡張され移植された状態のとき、位置決めアーチ15a、15b、15cが生体弁尖の外側に置かれる場合に、弁尖保護アーチ50a、50b、50cは、病変した弁尖H、すなわち生体心臓弁の弁尖が、ステント10に固定された弁プロテーゼ100の弁尖組織に影響を与えないようにする。加えて、弁尖保護アーチ50a、50b、50cは、移動に対抗する追加の固定および保持を提供してもよい。この特徴は、病変した弁尖を邪魔にならないように押し出す位置決めアーチが設けられていない従来のステント設計で知られるケージと比較して特有のものである。
図20aに示す展開図から分かるように、第19実施形態のステント設計によると、各放射アーチ32a、32b、32cの二つのアーム32’、32”は、丸い接続部またはヘッド部によってステント10の上端3で互いに接続される。このヘッド部は丸いだけでなく、ステント10が拡張され移植された状態のとき、血管の内壁に対して可能な限り大きな接触面積で接触するように先端が広がっている。各放射アーチ32a、32b、32cのヘッド部は、移植前および移植中にステント10をカテーテル内に保持し、および/または移植後にステントを取り戻すことのできる追加手段としても機能する。
所望の(拡張された)ステント構造の形状が固定されるプログラミング過程において、ステント10が拡張された状態のときにステント10の外周外側に径方向に放射アーチ32a、32b、32cが延出するように、放射アーチ32a、32b、32cがプログラムされる。こうすると、ステント10の上端領域によって血管壁に与えられる接触力を増大することができる。したがって、その場所でステント10を固定するときの安全性が増加し、これによってステントが移動する可能性が低下する。したがって、拡張された状態では、位置決めアーチ15a、15b、15cのクランプ効果に加えて、並びに弁尖保護アーチ50a、50b、50cにより得られる追加の固定に加えて、全てがステント10の外周から径方向外方に突出する保持アーチ16a、16b、16c、補助アーチ18a、18b、18c、放射アーチ32a、32b、32c、および環状カラー40によって及ぼされる半径方向の力によって、第19実施形態のステント10が移植の適切な位置に固定される。
カテーテル保持手段23または締結小穴24を有する締結手段が位置する平面を越えて、放射アーチ32a、32b、32cがステント10の長手方向Lに突出しないことが、図20aに平面展開図から分かる。これは、放射アーチ32a、32b、32cのヘッド部と干渉することなく、カテーテル保持手段23が適切な移植カテーテル内の対応手段と協働できることを保証している。実際、上述したように、ステント10の外植を遂行するための追加のカテーテル保持手段または追加手段として、ヘッド部自体を使用することができる。
原理上、径方向の接触力をさらに増大するために、ステント10は三つより多い数の放射アーチ32を備えてもよい。例えば、移植部位においてステント10をさらに良好に固定可能とするために、放射アーチ32a、32b、32cの一部または全てに鉤状(barb)要素を設けることも可能である。
さらに、ステント10が展開される血管壁にステント10の上部領域3を固定することに関して、ステント10が、例えば小穴24に配置される、鉤の先端がステント10の下端部2の方向を向いた鉤状部材を備えることも想定可能である。
加えて、ステント10の外側表面の全てまたは大半を覆うために、ステント10の外側の少なくとも一部の上に、ステントの下端部近傍の位置からステントの上端部近傍の位置に広がる、典型的に繊維、高分子また心膜のシート、薄膜等である、ライナーまたはさや(sheath)を設けてもよい。ライナーは、ステント10の少なくとも一端に取り付けられるとともに、両端の間の複数位置に取り付けられて外部被覆を形成してもよい。このような外部被覆は、ステント10と内腔壁の間の血流の漏れを阻止するための、血管内腔の内壁に対する周縁シールを提供し、これによって血流が体内プロテーゼ1をバイパスすることを防止する。
例えば、ライナーは、円周方向に間隔を空けた複数の軸線に沿ってステント10に縫い付けられるか他の方法で固定されてもよい。このような取り付けは、ステント10が半径方向に圧縮されたときに、複数の軸方向の折り目に沿ってライナーを折り畳むことを可能にする。ライナーは、フレームが広がるとき管状フレームの内腔壁に開いて一致することが可能である。代替的に、ライナーは、ステント10に熱溶接されるか超音波溶接されてもよい。ライナーは、好ましくは軸線に沿って、複数の個々のアーチ(位置決めアーチ15a、15b、15c、保持アーチ16a、16b、16c、補助アーチ18a、18b、18c、弁尖保護アーチ50a、50b、50c)に固定されてもよい。加えて、ライナーは、ステント10の下端部2に設けられた環状カラー40に固定されてもよい。
ステント10の外表面の少なくとも一部をライナーまたはさやでカバーすることによって、露出したステント部材から生じる体内プロテーゼ1の血栓形成が大きく低減されるかまたは排除される。このような血栓形成の低減は、弁プロテーゼ100の展開および弁プロテーゼ100の適切な位置への固定に使用されるステント構造を有する利点を維持しつつ達成される。
上述したように、挿入を容易にするために、弛緩した大きな直径の構成から小さな直径の構成にステント10を圧縮することができる。当然ながら、半径方向に圧縮された構成および拡張され弛緩した構成の両方で、外側ライナーはステント10に取り付いた状態を維持する必要がある。
ライナーは、通常は織物、不織繊維、ポリマーシート、薄膜等の形態である、ポリエステル、ポリテトラフルオロエチレン(PTFE)、ポリウレタン等の心膜材料または従来の生体移植材料で構成される。好適な繊維ライナー材料は、ダクロン(登録商標)糸(デュポン、ウィルミントン、デラウェア)などの平織りのポリエステルである。
本発明に係るステント10の第20実施形態を、図21を参照して以下で説明する。図21は、心臓弁ステント10が拡張した状態の、この実施形態の平面展開図である。
ステント10の第20実施形態は、第19実施形態と構造および機能の点で類似する。繰り返しを避けるために、第19実施形態の上記説明を参照する。特に、ステント10の下端部は、追加締結手段として機能する切り欠き12eが同様に設けられた環状カラー40によって構成されている。
加えて、第20実施形態に係るステント10には、複数の曲げエッジ33によってアーム16a’、16a”、16b’、16b”、16c’、16c”が分割されている保持アーチ16a、16b、16cが設けられている。複数の曲げエッジ33は、二本の隣合うアーム区画の屈曲点を画成するのみならず、心臓弁プロテーゼをステント10に固定するために使用可能な締結用切り欠きとしても使用される。
第20実施形態に係るステント10は、位置決めアーチ15a、15b、15cからステント10の上端3に向けて延びる放射アーチ32a、32b、32cも備える。図21に示すように、ステント10は三つの放射アーチ32a、32b、32cを有し、各アーチ32a、32b、32cは各位置決めアーチ15a、15b、15cの二本のアーム15a’、15a”、15b’、15b”、15c’、15c”の間に位置している。各放射アーチ32a、32b、32cは、各位置決めアーチ15a、15b、15cとはおおよそ逆の形状を有しており、位置決めアーチ15a、15b、15cのそれぞれ一つと反対の方向に延出する。
しかしながら、第19実施形態のステント設計とは異なり、第20実施形態のステント設計には弁尖保護アーチ50a、50b、50cが設けられていない。さらに、放射アーチ32a、32b、32cの各アームは、ステント10の全長の略中点で、反対側の位置決めアーチ15a、15b、15cのアーム15a’、15a”、15b’、15b”、15c’、15c”と融合する。
本発明に係るステント10の第21実施形態を、図22を参照して以下で説明する。詳細には、図22は、心臓弁ステント10が拡張した状態の、第21実施形態の平面展開図である。
図22を図20dと比較すると、ステント10の第21実施形態は、第19実施形態と構造および機能の点で類似する。繰り返しを避けるために、第19実施形態の上記説明を参照する。
ステント10の第21実施形態は、弁尖保護アーチ50a、50b、50cの各下端部が取り除かれている点で、第19実施形態と異なるに過ぎない。特に、放射アーチ32a、32b、32cの各アームが融合する点の間の弁尖保護アーチ50a、50b、50cの各下端部が取り除かれている。
上記の開示は例示を意図しており包括的なものではない。この説明は、当業者に対して多くの変形例および代替例を提案する。これらの変形例および代替例の全ては、「含む」の用語が「備えるが限定されない」を意味する特許請求の範囲内に含まれるように意図されている。当業者は、本明細書に記載された特定の実施形態の他の等価物も請求項によって包含されるように意図されていることを認めることができる。
さらに、従属項に提示された特定の特徴は、本発明の範囲内の他の態様と互いに組み合わせることができるので、従属項の特徴の他の任意の取り得る組み合わせを有する他の実施形態を特に指し示すものとして本発明を認識するべきである。例えば、クレームの公開を目的として、裁判管轄内で複数従属項形式が受け入れられる場合、後に続く任意の従属項は、従属項で参照される全ての先行詞を有する全ての従前の請求項に複数従属するように代替的に記載されるものとして解釈されるべきである(例えば、請求項1に直接従属する各請求項は、全ての従前の請求項に従属するものとして代替的に解釈されるべきである)。複数従属項形式が制限される裁判管轄では、以下の従属項はそれぞれ、従属項に記載の特定の請求項以外の先行詞を有する従前の請求項に従属する、単一従属項形式で代替的に記載されるものとして解釈されるべきである。