WO2024005144A1 - 体表面潰瘍治癒促進装置 - Google Patents
体表面潰瘍治癒促進装置 Download PDFInfo
- Publication number
- WO2024005144A1 WO2024005144A1 PCT/JP2023/024188 JP2023024188W WO2024005144A1 WO 2024005144 A1 WO2024005144 A1 WO 2024005144A1 JP 2023024188 W JP2023024188 W JP 2023024188W WO 2024005144 A1 WO2024005144 A1 WO 2024005144A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- body surface
- ulcer
- vibration
- glucose concentration
- healing promoting
- Prior art date
Links
- 208000025865 Ulcer Diseases 0.000 title claims abstract description 67
- 231100000397 ulcer Toxicity 0.000 title claims abstract description 67
- 230000035876 healing Effects 0.000 title claims abstract description 35
- 230000001737 promoting effect Effects 0.000 title claims abstract description 33
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 claims abstract description 50
- 239000008103 glucose Substances 0.000 claims abstract description 50
- 210000000416 exudates and transudate Anatomy 0.000 claims abstract description 25
- 230000017531 blood circulation Effects 0.000 claims description 33
- 206010012601 diabetes mellitus Diseases 0.000 claims description 23
- 239000004475 Arginine Substances 0.000 claims description 16
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 claims description 16
- 208000003790 Foot Ulcer Diseases 0.000 claims description 8
- 238000004519 manufacturing process Methods 0.000 claims description 6
- 206010040943 Skin Ulcer Diseases 0.000 claims description 3
- 241000700159 Rattus Species 0.000 description 53
- 210000001519 tissue Anatomy 0.000 description 49
- 210000004027 cell Anatomy 0.000 description 37
- 206010052428 Wound Diseases 0.000 description 30
- 208000027418 Wounds and injury Diseases 0.000 description 30
- 102000058061 Glucose Transporter Type 4 Human genes 0.000 description 20
- 108091006300 SLC2A4 Proteins 0.000 description 20
- MWUXSHHQAYIFBG-UHFFFAOYSA-N Nitric oxide Chemical compound O=[N] MWUXSHHQAYIFBG-UHFFFAOYSA-N 0.000 description 16
- 210000004369 blood Anatomy 0.000 description 15
- 239000008280 blood Substances 0.000 description 15
- 210000001789 adipocyte Anatomy 0.000 description 14
- VRYALKFFQXWPIH-PBXRRBTRSA-N (3r,4s,5r)-3,4,5,6-tetrahydroxyhexanal Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)CC=O VRYALKFFQXWPIH-PBXRRBTRSA-N 0.000 description 11
- PMMURAAUARKVCB-UHFFFAOYSA-N alpha-D-ara-dHexp Natural products OCC1OC(O)CC(O)C1O PMMURAAUARKVCB-UHFFFAOYSA-N 0.000 description 11
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 10
- 206010002091 Anaesthesia Diseases 0.000 description 9
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 9
- 230000037005 anaesthesia Effects 0.000 description 9
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 8
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 8
- 239000002953 phosphate buffered saline Substances 0.000 description 8
- 210000004204 blood vessel Anatomy 0.000 description 7
- 238000010586 diagram Methods 0.000 description 7
- 239000000463 material Substances 0.000 description 7
- 101000934372 Homo sapiens Macrosialin Proteins 0.000 description 6
- 102100025136 Macrosialin Human genes 0.000 description 6
- 210000000170 cell membrane Anatomy 0.000 description 6
- 210000000805 cytoplasm Anatomy 0.000 description 6
- 230000002757 inflammatory effect Effects 0.000 description 6
- 230000003834 intracellular effect Effects 0.000 description 6
- 230000005945 translocation Effects 0.000 description 6
- 208000001072 type 2 diabetes mellitus Diseases 0.000 description 6
- 210000003556 vascular endothelial cell Anatomy 0.000 description 6
- 102100036009 5'-AMP-activated protein kinase catalytic subunit alpha-2 Human genes 0.000 description 5
- 101000783681 Homo sapiens 5'-AMP-activated protein kinase catalytic subunit alpha-2 Proteins 0.000 description 5
- 102000004877 Insulin Human genes 0.000 description 5
- 108090001061 Insulin Proteins 0.000 description 5
- 206010022489 Insulin Resistance Diseases 0.000 description 5
- 108010021487 Nitric Oxide Synthase Proteins 0.000 description 5
- 102000008299 Nitric Oxide Synthase Human genes 0.000 description 5
- 230000015572 biosynthetic process Effects 0.000 description 5
- 230000000694 effects Effects 0.000 description 5
- 230000014509 gene expression Effects 0.000 description 5
- 201000001421 hyperglycemia Diseases 0.000 description 5
- 229940125396 insulin Drugs 0.000 description 5
- 239000003550 marker Substances 0.000 description 5
- 206010061218 Inflammation Diseases 0.000 description 4
- ACFIXJIJDZMPPO-NNYOXOHSSA-N NADPH Chemical compound C1=CCC(C(=O)N)=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](COP(O)(=O)OP(O)(=O)OC[C@@H]2[C@H]([C@@H](OP(O)(O)=O)[C@@H](O2)N2C3=NC=NC(N)=C3N=C2)O)O1 ACFIXJIJDZMPPO-NNYOXOHSSA-N 0.000 description 4
- 230000004913 activation Effects 0.000 description 4
- 238000002266 amputation Methods 0.000 description 4
- 230000002354 daily effect Effects 0.000 description 4
- 230000004054 inflammatory process Effects 0.000 description 4
- 239000003112 inhibitor Substances 0.000 description 4
- 230000037353 metabolic pathway Effects 0.000 description 4
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 4
- 229920005862 polyol Polymers 0.000 description 4
- 150000003077 polyols Chemical class 0.000 description 4
- LVTJOONKWUXEFR-FZRMHRINSA-N protoneodioscin Natural products O(C[C@@H](CC[C@]1(O)[C@H](C)[C@@H]2[C@]3(C)[C@H]([C@H]4[C@@H]([C@]5(C)C(=CC4)C[C@@H](O[C@@H]4[C@H](O[C@H]6[C@@H](O)[C@@H](O)[C@@H](O)[C@H](C)O6)[C@@H](O)[C@H](O[C@H]6[C@@H](O)[C@@H](O)[C@@H](O)[C@H](C)O6)[C@H](CO)O4)CC5)CC3)C[C@@H]2O1)C)[C@H]1[C@H](O)[C@H](O)[C@H](O)[C@@H](CO)O1 LVTJOONKWUXEFR-FZRMHRINSA-N 0.000 description 4
- 238000003786 synthesis reaction Methods 0.000 description 4
- QDLHCMPXEPAAMD-QAIWCSMKSA-N wortmannin Chemical compound C1([C@]2(C)C3=C(C4=O)OC=C3C(=O)O[C@@H]2COC)=C4[C@@H]2CCC(=O)[C@@]2(C)C[C@H]1OC(C)=O QDLHCMPXEPAAMD-QAIWCSMKSA-N 0.000 description 4
- QDLHCMPXEPAAMD-UHFFFAOYSA-N wortmannin Natural products COCC1OC(=O)C2=COC(C3=O)=C2C1(C)C1=C3C2CCC(=O)C2(C)CC1OC(C)=O QDLHCMPXEPAAMD-UHFFFAOYSA-N 0.000 description 4
- 108010001336 Horseradish Peroxidase Proteins 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- 102100028452 Nitric oxide synthase, endothelial Human genes 0.000 description 3
- 230000033115 angiogenesis Effects 0.000 description 3
- 239000000427 antigen Substances 0.000 description 3
- 108091007433 antigens Proteins 0.000 description 3
- 102000036639 antigens Human genes 0.000 description 3
- 230000007423 decrease Effects 0.000 description 3
- 230000003247 decreasing effect Effects 0.000 description 3
- 230000010339 dilation Effects 0.000 description 3
- 230000003203 everyday effect Effects 0.000 description 3
- 239000007850 fluorescent dye Substances 0.000 description 3
- 210000002540 macrophage Anatomy 0.000 description 3
- 229930027945 nicotinamide-adenine dinucleotide Natural products 0.000 description 3
- 239000012188 paraffin wax Substances 0.000 description 3
- 230000035752 proliferative phase Effects 0.000 description 3
- 230000024883 vasodilation Effects 0.000 description 3
- 102000016912 Aldehyde Reductase Human genes 0.000 description 2
- 108010053754 Aldehyde reductase Proteins 0.000 description 2
- RGHNJXZEOKUKBD-SQOUGZDYSA-N D-gluconic acid Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C(O)=O RGHNJXZEOKUKBD-SQOUGZDYSA-N 0.000 description 2
- 241000283074 Equus asinus Species 0.000 description 2
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 2
- 239000004366 Glucose oxidase Substances 0.000 description 2
- 108010015776 Glucose oxidase Proteins 0.000 description 2
- WZUVPPKBWHMQCE-UHFFFAOYSA-N Haematoxylin Chemical compound C12=CC(O)=C(O)C=C2CC2(O)C1C1=CC=C(O)C(O)=C1OC2 WZUVPPKBWHMQCE-UHFFFAOYSA-N 0.000 description 2
- 101001128156 Homo sapiens Nanos homolog 3 Proteins 0.000 description 2
- 101001124309 Homo sapiens Nitric oxide synthase, endothelial Proteins 0.000 description 2
- 101001082142 Homo sapiens Pentraxin-related protein PTX3 Proteins 0.000 description 2
- PIWKPBJCKXDKJR-UHFFFAOYSA-N Isoflurane Chemical compound FC(F)OC(Cl)C(F)(F)F PIWKPBJCKXDKJR-UHFFFAOYSA-N 0.000 description 2
- 210000004322 M2 macrophage Anatomy 0.000 description 2
- BFHAYPLBUQVNNJ-UHFFFAOYSA-N Pectenotoxin 3 Natural products OC1C(C)CCOC1(O)C1OC2C=CC(C)=CC(C)CC(C)(O3)CCC3C(O3)(O4)CCC3(C=O)CC4C(O3)C(=O)CC3(C)C(O)C(O3)CCC3(O3)CCCC3C(C)C(=O)OC2C1 BFHAYPLBUQVNNJ-UHFFFAOYSA-N 0.000 description 2
- 102100027351 Pentraxin-related protein PTX3 Human genes 0.000 description 2
- 102000003992 Peroxidases Human genes 0.000 description 2
- 102000001253 Protein Kinase Human genes 0.000 description 2
- BQCADISMDOOEFD-UHFFFAOYSA-N Silver Chemical compound [Ag] BQCADISMDOOEFD-UHFFFAOYSA-N 0.000 description 2
- 230000003213 activating effect Effects 0.000 description 2
- 210000003690 classically activated macrophage Anatomy 0.000 description 2
- 229940116332 glucose oxidase Drugs 0.000 description 2
- 235000019420 glucose oxidase Nutrition 0.000 description 2
- 238000007490 hematoxylin and eosin (H&E) staining Methods 0.000 description 2
- 230000028709 inflammatory response Effects 0.000 description 2
- 229960002725 isoflurane Drugs 0.000 description 2
- 210000003141 lower extremity Anatomy 0.000 description 2
- 239000012528 membrane Substances 0.000 description 2
- 230000004060 metabolic process Effects 0.000 description 2
- 108040007629 peroxidase activity proteins Proteins 0.000 description 2
- 229910052697 platinum Inorganic materials 0.000 description 2
- 108060006633 protein kinase Proteins 0.000 description 2
- 239000008213 purified water Substances 0.000 description 2
- 229910052709 silver Inorganic materials 0.000 description 2
- 239000004332 silver Substances 0.000 description 2
- 238000001356 surgical procedure Methods 0.000 description 2
- 230000007704 transition Effects 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- 230000010388 wound contraction Effects 0.000 description 2
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 1
- HSTOKWSFWGCZMH-UHFFFAOYSA-N 3,3'-diaminobenzidine Chemical compound C1=C(N)C(N)=CC=C1C1=CC=C(N)C(N)=C1 HSTOKWSFWGCZMH-UHFFFAOYSA-N 0.000 description 1
- FWBHETKCLVMNFS-UHFFFAOYSA-N 4',6-Diamino-2-phenylindol Chemical compound C1=CC(C(=N)N)=CC=C1C1=CC2=CC=C(C(N)=N)C=C2N1 FWBHETKCLVMNFS-UHFFFAOYSA-N 0.000 description 1
- 230000002407 ATP formation Effects 0.000 description 1
- 239000012103 Alexa Fluor 488 Substances 0.000 description 1
- 239000012110 Alexa Fluor 594 Substances 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- 108010078791 Carrier Proteins Proteins 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- RGHNJXZEOKUKBD-UHFFFAOYSA-N D-gluconic acid Natural products OCC(O)C(O)C(O)C(O)C(O)=O RGHNJXZEOKUKBD-UHFFFAOYSA-N 0.000 description 1
- 101100372758 Danio rerio vegfaa gene Proteins 0.000 description 1
- 208000008960 Diabetic foot Diseases 0.000 description 1
- 206010063560 Excessive granulation tissue Diseases 0.000 description 1
- 102000010834 Extracellular Matrix Proteins Human genes 0.000 description 1
- 108010037362 Extracellular Matrix Proteins Proteins 0.000 description 1
- 108010043121 Green Fluorescent Proteins Proteins 0.000 description 1
- 101100273739 Homo sapiens CD68 gene Proteins 0.000 description 1
- 108060003951 Immunoglobulin Proteins 0.000 description 1
- 208000005230 Leg Ulcer Diseases 0.000 description 1
- 206010028289 Muscle atrophy Diseases 0.000 description 1
- 101710090055 Nitric oxide synthase, endothelial Proteins 0.000 description 1
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 1
- 206010030113 Oedema Diseases 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 239000004372 Polyvinyl alcohol Substances 0.000 description 1
- 206010062519 Poor quality sleep Diseases 0.000 description 1
- ZSJLQEPLLKMAKR-UHFFFAOYSA-N Streptozotocin Natural products O=NN(C)C(=O)NC1C(O)OC(CO)C(O)C1O ZSJLQEPLLKMAKR-UHFFFAOYSA-N 0.000 description 1
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 1
- 102100040247 Tumor necrosis factor Human genes 0.000 description 1
- 101150030763 Vegfa gene Proteins 0.000 description 1
- 230000003698 anagen phase Effects 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 230000002238 attenuated effect Effects 0.000 description 1
- 238000009835 boiling Methods 0.000 description 1
- 229940098773 bovine serum albumin Drugs 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 229920002301 cellulose acetate Polymers 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 239000007979 citrate buffer Substances 0.000 description 1
- 239000005515 coenzyme Substances 0.000 description 1
- 230000008602 contraction Effects 0.000 description 1
- 230000001086 cytosolic effect Effects 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 210000003743 erythrocyte Anatomy 0.000 description 1
- 230000005284 excitation Effects 0.000 description 1
- 210000002744 extracellular matrix Anatomy 0.000 description 1
- 239000000835 fiber Substances 0.000 description 1
- 210000002950 fibroblast Anatomy 0.000 description 1
- 239000011888 foil Substances 0.000 description 1
- 239000000174 gluconic acid Substances 0.000 description 1
- 235000012208 gluconic acid Nutrition 0.000 description 1
- 230000004190 glucose uptake Effects 0.000 description 1
- 230000002414 glycolytic effect Effects 0.000 description 1
- 210000001126 granulation tissue Anatomy 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 239000000416 hydrocolloid Substances 0.000 description 1
- 239000000017 hydrogel Substances 0.000 description 1
- 238000003125 immunofluorescent labeling Methods 0.000 description 1
- 102000018358 immunoglobulin Human genes 0.000 description 1
- 208000028867 ischemia Diseases 0.000 description 1
- 210000001872 metatarsal bone Anatomy 0.000 description 1
- 238000000034 method Methods 0.000 description 1
- 239000012120 mounting media Substances 0.000 description 1
- 210000003205 muscle Anatomy 0.000 description 1
- 230000020763 muscle atrophy Effects 0.000 description 1
- 230000004220 muscle function Effects 0.000 description 1
- 201000000585 muscular atrophy Diseases 0.000 description 1
- 210000000440 neutrophil Anatomy 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 208000033808 peripheral neuropathy Diseases 0.000 description 1
- 229920001296 polysiloxane Polymers 0.000 description 1
- 229920002635 polyurethane Polymers 0.000 description 1
- 239000004814 polyurethane Substances 0.000 description 1
- 229920002451 polyvinyl alcohol Polymers 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- 230000000630 rising effect Effects 0.000 description 1
- 239000000243 solution Substances 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 238000001228 spectrum Methods 0.000 description 1
- ZSJLQEPLLKMAKR-GKHCUFPYSA-N streptozocin Chemical compound O=NN(C)C(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O ZSJLQEPLLKMAKR-GKHCUFPYSA-N 0.000 description 1
- 229960001052 streptozocin Drugs 0.000 description 1
- 239000013589 supplement Substances 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- 230000000472 traumatic effect Effects 0.000 description 1
- 230000004102 tricarboxylic acid cycle Effects 0.000 description 1
- 230000002792 vascular Effects 0.000 description 1
- 230000029663 wound healing Effects 0.000 description 1
- 239000008096 xylene Substances 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B10/00—Other methods or instruments for diagnosis, e.g. instruments for taking a cell sample, for biopsy, for vaccination diagnosis; Sex determination; Ovulation-period determination; Throat striking implements
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/02—Detecting, measuring or recording pulse, heart rate, blood pressure or blood flow; Combined pulse/heart-rate/blood pressure determination; Evaluating a cardiovascular condition not otherwise provided for, e.g. using combinations of techniques provided for in this group with electrocardiography or electroauscultation; Heart catheters for measuring blood pressure
- A61B5/026—Measuring blood flow
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61H—PHYSICAL THERAPY APPARATUS, e.g. DEVICES FOR LOCATING OR STIMULATING REFLEX POINTS IN THE BODY; ARTIFICIAL RESPIRATION; MASSAGE; BATHING DEVICES FOR SPECIAL THERAPEUTIC OR HYGIENIC PURPOSES OR SPECIFIC PARTS OF THE BODY
- A61H23/00—Percussion or vibration massage, e.g. using supersonic vibration; Suction-vibration massage; Massage with moving diaphragms
- A61H23/02—Percussion or vibration massage, e.g. using supersonic vibration; Suction-vibration massage; Massage with moving diaphragms with electric or magnetic drive
Definitions
- the present invention relates to treatment technology, and relates to a body surface ulcer healing promotion device.
- a method of treating foot ulcers includes local administration of platelet-derived growth factors.
- one of the objects of the present invention is to provide a device that promotes healing of ulcers on the body surface.
- a body surface ulcer healing promoting device includes a glucose concentration sensor that detects the glucose concentration in the exudate of a body surface ulcer, a vibrator that vibrates the ulcer, and a body surface ulcer based on the glucose concentration in the exudate. , and a control device that controls vibration of the vibrator.
- the ulcer may be an ulcer caused by diabetes.
- the ulcer may be a foot ulcer caused by diabetes.
- the above body surface ulcer healing promotion device may include a plurality of vibrators.
- control device may control the vibration of the vibrator so that the production of arginine in cells is promoted.
- control device may control the vibration of the vibrator so that the glucose concentration in the exudate is equal to or higher than the concentration that increases blood flow.
- control device may vibrate the vibrator until the glucose concentration in the exudate falls below a concentration at which the amount of arginine produced in the cells is equal to or higher than a threshold value.
- the above body surface ulcer healing promoting device may further include a blood flow sensor that detects blood flow near the ulcer, and the control device may control the vibration of the vibrator based on the blood flow.
- control device may control the vibration of the vibrator so that blood flow increases.
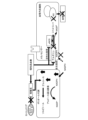
- FIG. 1 is a schematic diagram showing a body surface ulcer healing promoting device according to an embodiment.
- FIG. 2 is a schematic diagram showing the relationship between hyperglycemia and metabolism according to an embodiment.
- FIG. 2 is a schematic diagram showing the relationship between hyperglycemia and metabolism according to an embodiment.
- 2 is a graph showing the amount of 2-deoxyglucose taken up in Examples.
- 2 is a graph showing the amount of 2-deoxyglucose taken up in Examples.
- 2 is a graph showing the amount of 2-deoxyglucose taken up in Examples.
- 2 is a graph showing the amount of 2-deoxyglucose taken up in Examples.
- FIG. 2 is a schematic diagram showing GLUT4 translocation according to an example.
- FIG. 2 is a schematic diagram and a photograph showing GLUT4 translocation according to an example. It is a photograph showing the presence or absence of GLUT4 translocation according to an example. It is a graph of the ratio of the intensity of GLUT4-derived fluorescence in the cell membrane to the intensity of GLUT4-derived fluorescence in the cytoplasm according to Examples. It is a photograph of a rat according to an example. 1 is a photograph of a rat wound according to an example. 1 is a photograph of a rat wound according to an example. It is a graph of the wound area of a rat according to an example. It is a photograph of the tissue of a rat wound according to an example.
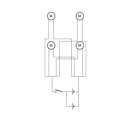
- FIG. 2 is a circuit diagram of an excitation device according to an example.
- 1 is a photograph of a rat wound according to an example. It is a graph of the wound area of a rat according to an example. It is a graph of blood volume of a rat according to an example. It is a photograph of the tissue of a rat wound according to an example. 1 is a graph of gene expression levels in rats according to Examples. 1 is a graph of gene expression levels in rats according to Examples. 1 is a graph of gene expression levels in rats according to Examples.
- 1 is a photograph of rat wound tissue stained using an anti-PTX3 antibody according to an example. It is a graph of the value obtained by dividing the number of CD68-positive cells by the number of CD163-positive cells (M1/M2 macrophage ratio) according to Examples.
- the body surface ulcer healing promoting device includes a glucose concentration sensor 11 that detects the glucose concentration in the exudate of an ulcer 2 on the body surface 1, and a vibrator 21A that vibrates the ulcer 2. , 21B, and 21C, and a control device 31 that controls the vibrations of the vibrators 21A, 21B, and 21C based on the glucose concentration in the exudate.
- the vibrators 21A, 21B, and 21C can be used as the vibrators 21A, 21B, and 21C.
- the number of vibrators 21A, 21B, and 21C included in the body surface ulcer healing promoting device according to the embodiment is not particularly limited, and may be one or more than one.
- the vibrators 21A, 21B, 21C are placed so as to surround the patient's ulcer 2.
- the vibrators 21A, 21B, and 21C generate, for example, low-frequency vibrations.
- the low frequency is, for example, 20 Hz or more and 100 Hz or less, 30 Hz or more and 90 Hz or less, 40 Hz or more and 80 Hz or less, 40 Hz or more and 70 Hz or less, or 40 Hz or more and 60 Hz or less, but is not particularly limited.
- the intensity of the vibration is, for example, 100 mVpp or more and 3000 mVpp or less, 500 mVpp or more and 2500 mVpp or less, 500 mVpp or more and 2000 mVpp or less, or 800 mVpp or more and 2000 mVpp or less, but is not particularly limited.
- the vibrators 21A, 21B, and 21C may be placed on the body surface 1 via the dressing material 41.
- materials for dressing material 41 include silicone, polyurethane, hydrophilic membrane, hydrophilic fiber, hydrocolloid, hydrogel, cellulose acetate, and polyvinyl alcohol.
- the glucose concentration sensor 11 is placed, for example, in contact with the patient's ulcer 2.
- the principle by which the glucose concentration sensor 11 detects the glucose concentration is not particularly limited.
- the glucose concentration sensor 11 includes a membrane to which glucose oxidase is immobilized, a platinum electrode, and a silver electrode.
- glucose is decomposed into gluconic acid and hydrogen peroxide by glucose oxidase
- hydrogen peroxide is oxidized with a platinum electrode and reduced with a silver electrode.
- the current produced by this at the electrode is proportional to the glucose concentration.
- the glucose concentration sensor 11 detects the glucose concentration in the exudate of the ulcer 2 and transmits the glucose concentration in the exudate of the ulcer 2 to the control device 31 .
- the control device 31 controls the vibrations of the vibrators 21A, 21B, and 21C so that the vibrations of the vibrators 21A, 21B, and 21C satisfy conditions for promoting the production of arginine in cells.
- conditions that promote arginine production in cells include vibration intensity and frequency.
- the control device 31 may store the relationship between the glucose concentration in the exudate and the amount of intracellular arginine produced, which has been obtained in advance. Further, the control device 31 may store a pre-obtained threshold value for the amount of intracellular arginine produced necessary for properly synthesizing nitric oxide. Generally, there is a negative proportional relationship between the glucose concentration in the exudate and the amount of intracellular arginine produced. Therefore, when the glucose concentration in the exudate is high, the amount of intracellular arginine produced is small, and when the glucose concentration in the exudate is low, the amount of intracellular arginine produced is large.
- the control device 31 controls the vibrations of the vibrators 21A, 21B, and 21C so that the glucose concentration in the exudate detected by the glucose concentration sensor 11 is equal to or lower than the concentration at which the amount of arginine produced in the cells is equal to or higher than a threshold value. do.
- the control device 31 continues to vibrate the vibrators 21A, 21B, and 21C until the glucose concentration in the exudate detected by the glucose concentration sensor 11 falls below a concentration at which the amount of arginine produced in cells exceeds a threshold value. good.
- the control device 31 may store the relationship between the glucose concentration in the exudate and the blood flow, which is obtained in advance. Further, the control device 31 may store an appropriate blood flow threshold obtained in advance. Generally, the glucose concentration in exudate and blood flow are in a negative proportional relationship. Therefore, if the glucose concentration in the exudate is high, there will be less blood flow, and if the glucose concentration in the exudate is low, there will be more blood flow.
- the control device 31 controls the vibrations of the vibrators 21A, 21B, and 21C so that the glucose concentration in the exudate detected by the glucose concentration sensor 11 is equal to or lower than the concentration at which the blood flow is equal to or higher than the threshold value.
- the control device 31 may vibrate the vibrators 21A, 21B, and 21C until the glucose concentration in the exudate detected by the glucose concentration sensor 11 falls below a concentration at which the blood flow is equal to or higher than a threshold value.
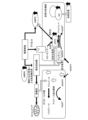
- the body surface ulcer healing promotion device may further include a blood flow sensor 12 that detects blood flow near the ulcer.
- the principle by which the blood flow sensor 12 detects blood flow is not particularly limited.
- the blood flow sensor 12 includes a light source and a light receiving element. Laser light emitted from a light source toward the human body is scattered by red blood cells in blood vessels. The blood flow sensor 12 receives scattered light with a light receiving element, and detects blood flow from the frequency spectrum of the scattered light. The blood flow sensor 12 transmits the detected blood flow to the control device 31.
- the control device 31 may control the vibrations of the vibrators 21A, 21B, and 21C based on blood flow. For example, the control device 31 may control the vibrations of the vibrators 21A, 21B, and 21C so as to satisfy conditions for increasing blood flow. Examples of conditions that increase blood flow include vibration intensity and frequency.
- the ulcer may be an ulcer caused by diabetes.
- the ulcer may be a foot ulcer.
- glucose taken into cells from blood vessels is used for the production of ATP in the glycolytic system and the citric acid cycle.
- glucose is taken up into cells due to hyperglycemia, glucose is taken into the polyol metabolic pathway.
- glucose is converted to sorbitol by aldose reductase.
- NADPH reduced nicotinamide adenine dinucleotide phosphate
- NADPH is also used in vascular endothelial cells to synthesize nitric oxide (NO) using arginine, but when NADPH is consumed in the polyol metabolic pathway, nitric oxide synthesis decreases.
- high glucose concentrations inhibit arginine production. When arginine production is inhibited, nitric oxide synthesis decreases. Decreased nitric oxide results in decreased blood flow and ischemia.
- the body surface ulcer healing promoting device according to the embodiment applies vibration to the ulcer 2, as shown in FIG. It is thought that insulin resistance in adipocytes is improved by activating protein kinase (protein kinase). Furthermore, it is thought that by improving the insulin resistance of adipocytes, the glucose concentration near the adipocytes is optimized, nitric oxide is appropriately synthesized in vascular endothelial cells, and blood flow is promoted. Note that diabetic foot ulcers tend to form in areas with poor muscle mass, such as metatarsals and heels. In addition, diabetic patients also progress to muscle atrophy due to peripheral neuropathy, resulting in poor muscle function. Therefore, the body surface ulcer healing promoting device according to the embodiment is considered to activate AMPK in fat cells near the ulcer 2.
- protein kinase protein kinase
- mechanosensors in vascular endothelial cells respond to mechanical stress caused by the body surface ulcer healing promoting device according to the embodiment, and nitric oxide synthase (NOS) in vascular endothelial cells ) is thought to promote the synthesis of Furthermore, activation of AMPK in adipocytes is thought to lead to activation of nitric oxide synthase in vascular endothelial cells. It is thought that by promoting and activating the synthesis of nitric oxide synthase, nitric oxide is appropriately synthesized in vascular endothelial cells and blood flow is promoted.
- NOS nitric oxide synthase
- the body surface ulcer healing promoting device according to the embodiment can be miniaturized, it can be fixed to the patient's body surface at all times while the patient leads an independent daily life. Also, a patient's insulin resistance is not constant and may fluctuate.
- the body surface ulcer healing promoting device according to the embodiment detects the glucose concentration in the exudate, which varies depending on insulin resistance, and controls the vibrations of the vibrators 21A, 21B, and 21C, so it does not impose unnecessary load on the patient. It is possible to suppress this.
- the stages of ulcer healing are divided into the inflammatory phase and the proliferative phase.
- the ulcer is infiltrated with neutrophils and M1 inflammatory macrophages, resulting in edema.
- fibroblasts migrate from the periphery of the ulcer to rebuild the extracellular matrix, angiogenesis occurs, and granulation tissue is formed.
- prolonged inflammation and inability to transition to the proliferative phase are the causes of intractable foot ulcers.
- the body surface ulcer healing promoting device vibrates locally near the ulcer to promote wound contraction at an early stage, thereby causing the ulcer to quickly transition to the growth phase without prolonging inflammation.
- Example 1 3T3-L1 adipocytes that had been differentiated into adipocytes for 8 days were prepared.
- the adipocytes were divided into a group with vibrations and a group without vibrations and cultured.
- the vibration groups received 50 Hz vibration at an intensity of 600 mVpp, 800 mVpp, 1000 mVpp, 1500 mVpp, or 2000 mVpp for 40 minutes every day.
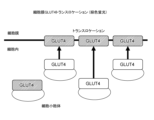
- Example 2 The protein GLUT4, which is a sugar transporter, is responsible for the intracellular uptake of blood sugar promoted by insulin and exercise. As shown in FIGS. 8 and 9, GLUT4 is normally stored in the cytoplasmic GLUT4 storage compartment. When cells are stimulated by insulin or exercise, GLUT4 is transported from the storage compartment to the cell membrane. This phenomenon, called GLUT4 translocation, is known to be inhibited by insulin resistance due to type 2 diabetes. GLUT4 translocation can be observed by immunofluorescent staining of GLUT4.
- GLUT4 was present in the cytoplasm in cells to which vibration was not applied, but in cells to which vibration was applied, GLUT4 was localized to the cell membrane.
- GLUT4 was localized at the cell membrane both in cells not given vibration and in cells given vibration.
- wortmannin GLUT4 was present in the cytoplasm in cells to which vibration was not applied, but in cells to which vibration was applied, GLUT4 was localized to the cell membrane.
- GLUT4 was present in the cytoplasm in cells to which vibration was not applied, and GLUT4 was present in the cytoplasm in cells to which vibration was applied.
- FIG. 11 shows a graph of the ratio of the fluorescence intensity in the cell membrane to the fluorescence intensity in the cytoplasm.
- Compound C In the cells to which Compound C was applied, no significant difference was observed between the cells to which vibration was not applied and the cells to which vibration was applied.
- wortmannin In the cells given wortmannin, a significant difference was observed between the cells not given vibration and the cells given vibration. This result also suggests that the effect of vibration on promoting 2-deoxyglucose uptake is due to activation of AMPK by vibration.
- Example 3 Seven-week-old male SD rats were prepared. 55 mg/kg of streptozotocin was intraperitoneally administered to rats, and rats with blood glucose levels of 300 mg/dL or higher 7 and 14 days later were selected as diabetic model rats.
- a full-thickness wound with a diameter of 2 cm was formed on the flank of a diabetic model rat under anesthesia, a dressing material (Foamlite, ConvaTec) was applied to the wound, and the trunk was fixed with gauze. . Dressings were changed daily.
- a vibrator was placed on the gauze above the wound every day for 14 days, and low-frequency vibrations were locally applied to the wound for 40 minutes while the diabetic model rat was put to sleep with isoflurane inhalation anesthesia.
- the period of vibration was 50 Hz, and the intensity of vibration was 0 mVpp, 300 mVpp, 600 mVpp, or 1000 mVpp.
- Example 4 Non-diabetic rats and diabetic model rats were anesthetized and a wound was formed in the same manner as in Example 3, and the total tissue blood volume at the time of anesthesia, the tissue total blood volume at the time of wound formation under anesthesia, and the amount from anesthesia. Total tissue blood volume after awakening was measured with a laser tissue blood oxygen monitor (OMEGAMONITOR, BOM-L1 TR SF, OMEGAWAVE, INC.). As a result, as shown in FIG. 18, in both non-diabetic rats and diabetic model rats, the total tissue blood volume was higher when awake than during anesthesia. This result suggests that changes in total tissue blood volume can be measured more accurately during wakefulness than during anesthesia.
- OMEGAMONITOR laser tissue blood oxygen monitor
- Example 5 A vibrating device having a circuit equivalent to the circuit diagram shown in FIG. 19 was manufactured using a C1034 small vibration motor (Shinsou Denki Co., Ltd.). In the same manner as in Example 3, a full-thickness wound with a diameter of 2 cm was formed on the flank of an anesthetized diabetic model rat. A vibration device was attached to the. Rats were subjected to vibrations of 50 Hz and 600 to 1000 mVpp from a vibrator for 40 minutes a day for 7 days. The rats were not anesthetized and were awake when the vibrations were applied. In the control group, a vibration device was attached to the rat, but the vibration device was not activated.
- FIG. 22 shows a graph of the blood volume of the rat, where the blood volume of the control rat on day 0 after the wound was formed is set to 1.
- the blood volume of rats exposed to vibration increased day by day. Therefore, it was shown that vibration not only temporarily dilated blood vessels, but also increased steady-state blood volume in rats.
- Example 6 In the rats subjected to vibration in Example 3, gene expression was examined on the fourth day. As shown in FIG. 24, the gene marker NOS3 of the NO synthase eNOS related to vasodilation and the angiogenesis marker Vegfa It was rising at a vibration of 1000 mVpp. Furthermore, the decrease in TNF-a suggests that inflammation is suppressed and vascular dynamics are improved.
- Example 7 A diabetic model rat was prepared in the same manner as in Example 3, a full-thickness wound with a diameter of 2 cm was formed on the flank of the diabetic model rat under anesthesia, and a dressing material (Foamlite, ConvaTec) was applied to the wound. The trunk was fixed with gauze. Dressings were changed daily. Thereafter, a vibrator was placed on the gauze above the wound every day for 14 days, and low-frequency vibrations were locally applied to the wound for 40 minutes while the diabetic model rat was put to sleep with isoflurane inhalation anesthesia. The period of vibration was 50 Hz, and the intensity of vibration was 0 mVpp or 1000 mVpp.
- a dressing material Foamlite, ConvaTec
- tissue from the wound was collected, and the collected tissue was immersed in a 10% formalin solution overnight at room temperature to fix the tissue.
- the tissues were then dehydrated using G-Nox (Genostaff), an alternative to ethanol and xylene, and then the tissues were embedded in paraffin to create paraffin blocks of the tissues. Furthermore, the paraffin-embedded tissue was sliced to a thickness of 3 ⁇ m to prepare tissue sections.
- tissue section was immersed in G-Nox for 5 minutes x 3 times to remove paraffin from the tissue section.
- tissue section was immersed in ethanol for 5 minutes x 3 times to remove G-Nox from the tissue section. Thereafter, the tissue sections were washed twice for 5 minutes with purified water. Additionally, tissue sections were incubated in 3% hydrogen peroxide diluted in methanol for 30 minutes to inactivate endogenous peroxidase in the tissue sections. Further, the tissue section was placed in 0.01 mol/L citrate buffer (pH 6.0) and autoclaved at 121° C. for 15 minutes to activate the antigen in the tissue section.
- citrate buffer pH 6.0
- tissue sections were washed with phosphate buffered saline (PBS), and anti-Pentraxin 3 (PTX3) antibody (rabbit-polyclonal, 13797-1- AP, Novus Biological) and tissue sections were reacted overnight. Thereafter, the anti-PTX3 antibody not bound to the antigen was removed from the tissue section, and the tissue section was washed 3 times for 5 minutes with PBS.
- PBS phosphate buffered saline
- PTX3 antibody rabbit-polyclonal, 13797-1- AP, Novus Biological
- tissue sections and horseradish peroxidase (HRP)-labeled anti-rabbit immunoglobulin antibody (Jackson ImmunoResearch) diluted 1000 times were incubated at room temperature for 1 hour.
- the tissue sections were mixed with 0.2 mg/mL 3,3'-diaminobenzidine [DAB] in 0.05 mol/L Tris-HCl buffer (pH 7.4) supplemented with 2% hydrogen peroxide.
- HRP was visualized, and the reaction was stopped with purified water. Thereafter, counterstaining with hematoxylin was performed. After dehydrating the tissue section with ethanol and clearing the tissue section with G-Nox, the tissue section was mounted with a mounting medium.
- the stained tissue sections were observed under a microscope (BZ-X800, Keyence). As a result, as shown in FIG. 27, it was confirmed that the inflammatory marker PTX3 was significantly reduced in the rats to which vibration was applied, compared to the rats to which no vibration was applied.
- Example 8 Tissue sections were prepared in the same manner as in Example 7. However, in this example, endogenous peroxidase in the tissue section was not inactivated. The tissue sections were washed with phosphate buffered saline (PBS), and anti-CD68 antibody (CD68/SR-D1 antibody (ED1), mouse monoclonal, diluted 100 times with bovine serum albumin/phosphate buffered saline) was added. The tissue sections were reacted with NB600-985-0.025 (Novus Biological) and anti-CD163 antibody (CD163, EPR19518, rabbit monoclonal, ab182422, Abcam) overnight.
- CD68 is a marker for M1-type macrophages that promotes inflammatory responses.
- CD163 is a marker for M2-type macrophages that suppresses inflammatory responses.
- tissue sections were washed 3 times for 5 minutes with PBS. Furthermore, tissue sections and 1000-fold diluted green fluorescent dye-labeled anti-rabbit IgG antibody (Alexa Fluor 488, registered trademark, donkey, #711-545-152, Jackson ImmunoResearch) and red fluorescent dye-labeled anti-mouse IgG antibody (Alexa Fluor 594) were used. , Donkey, #715-585-151, Jackson ImmunoResearch) was incubated for 1 hour at room temperature. Next, the tissue section was washed with PBS, the nucleus was stained with a blue fluorescent dye using DAPI, and the tissue section was mounted.
- Green fluorescent dye-labeled anti-rabbit IgG antibody Alexa Fluor 488, registered trademark, donkey, #711-545-152, Jackson ImmunoResearch
- red fluorescent dye-labeled anti-mouse IgG antibody Alexa Fluor 594
- Donkey, #715-585-151, Jackson ImmunoResearch was incubated for
- the stained tissue sections were observed under a microscope (BZ-X800, Keyence).
- Cells that emit green fluorescence are CD163-positive cells.
- Cells that emit red fluorescence are CD68 positive cells.
- the number of CD68-positive cells and the number of CD163-positive cells were measured. Furthermore, the value obtained by dividing the number of CD68-positive cells by the number of CD163-positive cells (M1/M2 macrophage ratio) was calculated. The smaller M1/M2 indicates that the inflammation is improved. As a result, as shown in FIG. 28, M1/M2 was significantly decreased in rats to which vibrations were applied, compared to rats to which no vibrations were applied.
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Surgery (AREA)
- Heart & Thoracic Surgery (AREA)
- Medical Informatics (AREA)
- Molecular Biology (AREA)
- Biomedical Technology (AREA)
- Engineering & Computer Science (AREA)
- Pathology (AREA)
- Physics & Mathematics (AREA)
- Biophysics (AREA)
- Hematology (AREA)
- Cardiology (AREA)
- Physiology (AREA)
- Epidemiology (AREA)
- Pain & Pain Management (AREA)
- Physical Education & Sports Medicine (AREA)
- Rehabilitation Therapy (AREA)
- Measuring And Recording Apparatus For Diagnosis (AREA)
Abstract
体表面1の潰瘍2の滲出液中のグルコース濃度を検出するグルコース濃度センサ11と、潰瘍2に振動を与える振動器21A、21B、21Cと、滲出液中のグルコース濃度に基づき、振動器21A、21B、21Cの振動を制御する制御装置31と、を備える体表面潰瘍治癒促進装置。
Description
本発明は治療技術に関し、体表面潰瘍治癒促進装置に関する。
糖尿病及びその合併症は、下肢切断の主な非外傷的原因である。大多数において、下肢切断の手術の前に、足潰瘍が発症する。足潰瘍が発症した段階で、高血糖を是正することは困難であることが多い。足潰瘍は3分の2しか最終的に治癒せず、残りは、何らかの形の切断手術が行われる結果になると考えられている。足潰瘍及び切断手術は、患者の生活に重大な影響を及ぼしている(例えば、特許文献1から3参照。)。足潰瘍の治療方法としては、血小板由来成長因子の局所投与がある。
体表面の潰瘍の治療方法の選択肢は少なく、患者が日常生活を送りながら、潰瘍の治癒を促進する手段が望まれている。そこで、本発明は、体表面の潰瘍の治癒を促進する装置を提供することを目的の一つとする。
本発明の態様に係る体表面潰瘍治癒促進装置は、体表面の潰瘍の滲出液中のグルコース濃度を検出するグルコース濃度センサと、潰瘍に振動を与える振動器と、滲出液中のグルコース濃度に基づき、振動器の振動を制御する制御装置と、を備える。
上記の体表面潰瘍治癒促進装置において、潰瘍が、糖尿病による潰瘍であってもよい。
上記の体表面潰瘍治癒促進装置において、潰瘍が、糖尿病による足潰瘍であってもよい。
上記の体表面潰瘍治癒促進装置が、振動器を複数備えていてもよい。
上記の体表面潰瘍治癒促進装置において、細胞におけるアルギニンの産生が促進されるように、制御装置が、振動器の振動を制御してもよい。
上記の体表面潰瘍治癒促進装置において、滲出液中のグルコース濃度が、血流を増加させる濃度以上になるように、制御装置が、振動器の振動を制御してもよい。
上記の体表面潰瘍治癒促進装置において、滲出液中のグルコース濃度が、細胞におけるアルギニンの産生量が閾値以上になる濃度以下になるまで、制御装置が、振動器を振動させてもよい。
上記の体表面潰瘍治癒促進装置が、潰瘍の近傍の血流を検出する血流センサをさらに備え、制御装置が、血流に基づき、振動器の振動を制御してもよい。
上記の体表面潰瘍治癒促進装置において、制御装置が、血流が増加するよう、振動器の振動を制御してもよい。
本発明によれば、体表面の潰瘍の治癒を促進する装置を提供可能である。
実施形態に係る体表面潰瘍治癒促進装置は、図1に示すように、体表面1の潰瘍2の滲出液中のグルコース濃度を検出するグルコース濃度センサ11と、潰瘍2に振動を与える振動器21A、21B、21Cと、滲出液中のグルコース濃度に基づき、振動器21A、21B、21Cの振動を制御する制御装置31と、を備える。
振動器21A、21B、21Cとしては、モーター、空気圧装置、トランスデューサー材料、圧電性ホイル、ボイルコイル、及び圧電性アクチュエータが使用可能である。実施形態に係る体表面潰瘍治癒促進装置が備える振動器21A、21B、21Cの数は特に限定されず、1個であってもよいし、複数個であってもよい。例えば、振動器21A、21B、21Cは、患者の潰瘍2を取り囲むように配置される。振動器21A、21B、21Cは、例えば、低周波の振動を発生する。
低周波とは、例えば、20Hz以上100Hz以下、30Hz以上90Hz以下、40Hz以上80Hz以下、40Hz以上70Hz以下、あるいは40Hz以上60Hz以下であるが、特に限定されない。振動の強度は、例えば、100mVpp以上3000mVpp以下、500mVpp以上2500mVpp以下、500mVpp以上2000mVpp以下、あるいは800mVpp以上2000mVpp以下であるが、特に限定されない。
振動器21A、21B、21Cは、ドレッシング材41を介して、体表面1上に配置されてもよい。ドレッシング材41の材料の例としては、シリコーン、ポリウレタン、親水性メンブレン、親水性ファイバー、ハイドロコロイド、ハイドロゲル、セルロースアセテート、及びポリビニルアルコールが挙げられる。
グルコース濃度センサ11は、例えば、患者の潰瘍2に接して配置される。グルコース濃度センサ11がグルコースの濃度を検出する原理は特に限定されない。例えば、グルコース濃度センサ11は、グルコース・オキシダーゼが固定された膜と、白金電極と、銀電極と、を備える。グルコースが、グルコース・オキシダーゼにより、グルコン酸と過酸化水素に分解されると、過酸化水素は白金電極で酸化され、銀電極で還元される。これにより電極で生じる電流は、グルコース濃度に比例する。グルコース濃度センサ11は、潰瘍2の滲出液中のグルコース濃度を検出し、制御装置31に潰瘍2の滲出液中のグルコース濃度を伝達する。
制御装置31は、振動器21A、21B、21Cの振動が、細胞におけるアルギニンの産生が促進される条件を満たすよう、振動器21A、21B、21Cの振動を制御する。細胞におけるアルギニンの産生が促進される条件の例としては、振動の強度及び周波数が挙げられる。
制御装置31は、予め取得された、滲出液中のグルコース濃度と、細胞内のアルギニンの産生量と、の関係を記憶していてもよい。また、制御装置31は、予め取得された、一酸化窒素が適正に合成されるために必要な細胞内のアルギニンの産生量の閾値を記憶していてもよい。一般的に、滲出液中のグルコース濃度と、細胞内のアルギニンの産生量と、は、負の比例の関係にある。したがって、滲出液中のグルコース濃度が高いと、細胞内のアルギニンの産生量は少なく、滲出液中のグルコース濃度が低いと、細胞内のアルギニンの産生量は多い。
制御装置31は、グルコース濃度センサ11で検出される滲出液中のグルコース濃度が、細胞におけるアルギニンの生成量が閾値以上になる濃度以下になるように、振動器21A、21B、21Cの振動を制御する。制御装置31は、グルコース濃度センサ11で検出される滲出液中のグルコース濃度が、細胞におけるアルギニンの生成量が閾値以上になる濃度以下になるまで、振動器21A、21B、21Cを振動させてもよい。
制御装置31は、予め取得された、滲出液中のグルコース濃度と、血流と、の関係を記憶していてもよい。また、制御装置31は、予め取得された、適切な血流の閾値を記憶していてもよい。一般的に、滲出液中のグルコース濃度と、血流と、は、負の比例の関係にある。したがって、滲出液中のグルコース濃度が高いと、血流は少なく、滲出液中のグルコース濃度が低いと、血流は多い。
制御装置31は、グルコース濃度センサ11で検出される滲出液中のグルコース濃度が、血流が閾値以上になる濃度以下になるように、振動器21A、21B、21Cの振動を制御する。制御装置31は、グルコース濃度センサ11で検出される滲出液中のグルコース濃度が、血流が閾値以上になる濃度以下になるまで、振動器21A、21B、21Cを振動させてもよい。
実施形態に係る体表面潰瘍治癒促進装置は、潰瘍の近傍の血流を検出する血流センサ12をさらに備えていてもよい。血流センサ12が血流を検出する原理は特に限定されない。例えば、血流センサ12は、光源と、受光素子と、を備える。光源から人体に向けて発せられたレーザー光は、血管内の赤血球で散乱される。血流センサ12は、受光素子で散乱光を受光し、散乱光の周波数スペクトルから、血流を検出する。血流センサ12は、制御装置31に検出した血流を伝達する。
制御装置31は、血流に基づき、振動器21A、21B、21Cの振動を制御してもよい。例えば、制御装置31は、血流が増加する条件を満たすよう、振動器21A、21B、21Cの振動を制御してもよい。血流が増加する条件の例としては、振動の強度及び周波数が挙げられる。
潰瘍は、糖尿病による潰瘍であってもよい。潰瘍は、足潰瘍であってもよい。通常、人体において、血管から細胞に取り込まれたグルコースは、解糖系及びクエン酸回路におけるATPの産生に利用される。しかし、高血糖により細胞に取り込まれるグルコースが増えると、グルコースはポリオール代謝経路に取り込まれる。
図2に示すように、ポリオール代謝経路で、グルコースは、アルドース還元酵素により、ソルビトールへ変換される。ポリオール代謝経路でアルドース還元酵素の活性が上昇すると、補酵素であるNADPH(還元型ニコチンアミドアデニンジヌクレオチド燐酸)が消費される。NADPHは、血管内皮細胞において、アルギニンを利用する一酸化窒素(NO)の合成にも利用されるが、ポリオール代謝経路でNADPHが消費されると、一酸化窒素の合成が低下する。また、グルコースの濃度が高いと、アルギニンの産生が阻害される。アルギニンの産生が阻害されると、一酸化窒素の合成が低下する。一酸化窒素の低下は、血流の低下及び虚血をもたらす。
理論に拘束されるものではないが、実施形態に係る体表面潰瘍治癒促進装置が潰瘍2に振動を与えることにより、図3に示すように、潰瘍2の近傍の脂肪細胞におけるAMPK(AMP活性化プロテインキナーゼ)が活性化され、脂肪細胞のインスリン抵抗性が改善されると考えられる。また、脂肪細胞のインスリン抵抗性が改善されることにより、脂肪細胞近傍のグルコース濃度が適正化され、血管内皮細胞で一酸化窒素が適正に合成され、血流が促進されると考えられる。なお、糖尿病足潰瘍は、中足骨や踵などの筋肉の乏しい部位に形成されやすい。また、糖尿病患者は、末梢神経障害から筋萎縮も進み、筋肉の作用が乏しい。そのため、実施形態に係る体表面潰瘍治癒促進装置は、潰瘍2の近傍の脂肪細胞におけるAMPKを活性化すると考えられる。
また、理論に拘束されるものではないが、血管内皮細胞のメカノセンサーが、実施形態に係る体表面潰瘍治癒促進装置によるメカニカルストレスに応答して、血管内皮細胞内の一酸化窒素合成酵素(NOS)の合成を促進すると考えられる。また、脂肪細胞におけるAMPKの活性化は、血管内皮細胞内の一酸化窒素合成酵素の活性化をもたらすと考えられる。一酸化窒素合成酵素の合成が促進され、活性化されることにより、血管内皮細胞で一酸化窒素が適正に合成され、血流が促進されると考えられる。
実施形態に係る体表面潰瘍治癒促進装置は、小型化が可能であるため、患者が自立した日常生活を送りながら、患者の体表面に常時固定することが可能である。また、患者のインスリン抵抗性は、一定ではなく、変動し得る。実施形態に係る体表面潰瘍治癒促進装置は、インスリン抵抗性によって変動する滲出液中のグルコース濃度を検出して、振動器21A、21B、21Cの振動を制御するため、患者に不要な負荷を与えることを抑制可能である。
潰瘍治癒の段階は、炎症期と増殖期に分けられる。炎症期においては、潰瘍に好中球及びM1炎症性マクロファージが浸潤し、浮腫が生じる。増殖期においては、線維芽細胞が潰瘍の周辺から遊走して細胞外マトリックスを再構築し、血管新生が起こり、肉芽組織が形成される。慢性高血糖の糖尿病患者では、炎症が遷延し増殖期に移行できないことが、足潰瘍が難治性となる原因となっている。実施形態に係る体表面潰瘍治癒促進装置は、潰瘍の近傍を局所的に振動して、早期に創収縮を促進することで、炎症を遷延させることなく潰瘍を増殖期に早期に移行させる。
(実施例1)
脂肪細胞に分化して8日経過した3T3-L1脂肪細胞を用意した。脂肪細胞を、振動を与える群と、振動を与えない群に分けて、それぞれ培養した。振動を与える群には、毎日40分、強度が600mVpp、800mVpp、1000mVpp、1500mVpp、又は2000mVppである、50Hzの振動を与えた。
脂肪細胞に分化して8日経過した3T3-L1脂肪細胞を用意した。脂肪細胞を、振動を与える群と、振動を与えない群に分けて、それぞれ培養した。振動を与える群には、毎日40分、強度が600mVpp、800mVpp、1000mVpp、1500mVpp、又は2000mVppである、50Hzの振動を与えた。
7日経過後、図4に示すように、振動を与えない群より、振動を与えた群の方が、脂肪細胞による2-デオキシグルコースの取り込み量が多かった。また、7日間、脂肪細胞による2-デオキシグルコースの取り込みを検査した。その結果、図5に示すように、振動を与えると、脂肪細胞による2-デオキシグルコースの取り込み量は、経時的に上昇した。
脂肪細胞に、インスリン依存性糖取り込み経路阻害剤であるウォルトマンニンを与えたところ、図6に示すように、ウォルトマンニンは、振動による2-デオキシグルコースの取り込み促進効果を、有意に阻害しなかった。一方、脂肪細胞に、AMPK阻害剤であるコンパウンドCを与えたところ、図7に示すように、コンパウンドCは、振動による2-デオキシグルコースの取り込み促進効果を、有意に阻害した。この結果は、振動による2-デオキシグルコースの取り込み促進効果は、振動によるAMPKの活性化によることを示唆している。
(実施例2)
インスリンや運動によって促進される血糖の細胞内取り込みは、糖輸送体であるタンパク質GLUT4が担っている。図8及び図9に示すように、GLUT4は、通常、細胞質内のGLUT4ストレージコンパートメントに貯蔵されている。細胞にインスリンや運動の刺激が加わると、GLUT4はストレージコンパートメントから細胞膜へと輸送される。GLUT4トランスロケーションと呼ばれるこの現象は、2型糖尿病によるインスリン抵抗性により阻害されることが知られている。GLUT4を免疫蛍光染色することにより、GLUT4トランスロケーションを観察することが可能である。
インスリンや運動によって促進される血糖の細胞内取り込みは、糖輸送体であるタンパク質GLUT4が担っている。図8及び図9に示すように、GLUT4は、通常、細胞質内のGLUT4ストレージコンパートメントに貯蔵されている。細胞にインスリンや運動の刺激が加わると、GLUT4はストレージコンパートメントから細胞膜へと輸送される。GLUT4トランスロケーションと呼ばれるこの現象は、2型糖尿病によるインスリン抵抗性により阻害されることが知られている。GLUT4を免疫蛍光染色することにより、GLUT4トランスロケーションを観察することが可能である。
50Hz、1000から1500mVpp、40分/日、5日間の振動により、3T3-L1脂肪細胞において、GLUT4トランスロケーションが生じるか、観察した。図10に示すように、インスリン及び阻害剤を与えなかった細胞においては、振動を与えなかった細胞ではGLUT4は細胞質に存在したが、振動を与えた細胞ではGLUT4は細胞膜に偏在した。インスリンを与え、阻害剤を与えなかった細胞においては、振動を与えなかった細胞及び振動を与えた細胞の両方でGLUT4は細胞膜に偏在した。ウォルトマンニンを与えた細胞では、振動を与えなかった細胞ではGLUT4は細胞質に存在したが、振動を与えた細胞ではGLUT4は細胞膜に偏在した。コンパウンドCを与えた細胞では、振動を与えなかった細胞ではGLUT4は細胞質に存在し、振動を与えた細胞でもGLUT4は細胞質に存在した。
細胞質における蛍光の強度に対する、細胞膜における蛍光の強度の比のグラフを図11に示す。コンパウンドCを与えた細胞においては、振動を与えなかった細胞と振動を与えた細胞との間に有意差は認められなかった。ウォルトマンニンを与えた細胞においては、振動を与えなかった細胞と振動を与えた細胞との間に有意差が認められた。この結果も、振動による2-デオキシグルコースの取り込み促進効果は、振動によるAMPKの活性化によることを示唆している。
(実施例3)
7週齢、オスのSDラットを用意した。ラットに55mg/kgのストレプトゾトシンを腹腔内投与し、7日後及び14日後の血糖値が300mg/dL以上のラットを、糖尿病のモデルラットとして選択した。
7週齢、オスのSDラットを用意した。ラットに55mg/kgのストレプトゾトシンを腹腔内投与し、7日後及び14日後の血糖値が300mg/dL以上のラットを、糖尿病のモデルラットとして選択した。
図12に示すように、直径2cmの全層欠損創を麻酔下の糖尿病のモデルラットの側腹部に形成し、創部にドレッシング材(Foamlite、ConvaTec)を貼り付けし、ガーゼで体幹を固定した。ドレッシング材は毎日交換した。
その後、14日間、毎日、振動器を創部上のガーゼ上に配置し、糖尿病のモデルラットにイソフルラン吸入麻酔を与えて眠らせている間、創部に局所的に低周波振動を40分与えた。振動の周期は50Hzであり、振動の強度は、0mVpp、300mVpp、600mVpp、又は1000mVppであった。
創部の外観を経時的に観察したところ、図13、図14、及び図15に示すように、振動を与えた糖尿病のモデルラットのほうが、振動を与えられなかった糖尿病のモデルラットよりも、創部の収縮が早かった。創部を形成してから7日後、図16に示すように、ヘマトキシリン・エオジン染色により、創部の組織を観察したところ、振動を与えられなかった糖尿病のモデルラットより、1000mVppの振動を与えた糖尿病のモデルラットのほうが、血管の拡張が認められた。創部を形成してから14日後においても、図17に示すように、振動を与えられなかった糖尿病のモデルラットより、1000mVppの振動を与えた糖尿病のモデルラットのほうが、血管の拡張が認められた。
(実施例4)
糖尿病でないラット、及び糖尿病のモデルラットのそれぞれについて、実施例3と同様に麻酔をして創部を形成し、麻酔時の組織全血液量、麻酔下創部形成時の組織全血液量、及び麻酔から覚醒した後の組織全血液量をレーザー組織血液酸素モニター(OMEGAMONITOR、BOM-L1 TR SF、OMEGAWAVE,INC.)で測定した。その結果、図18に示すように、糖尿病でないラット、及び糖尿病のモデルラットのいずれにおいても、覚醒時のほうが、麻酔時よりも組織全血液量が多かった。この結果は、麻酔時よりも、覚醒時のほうが、組織全血液量の変化を正確に計測できることを示唆している。
糖尿病でないラット、及び糖尿病のモデルラットのそれぞれについて、実施例3と同様に麻酔をして創部を形成し、麻酔時の組織全血液量、麻酔下創部形成時の組織全血液量、及び麻酔から覚醒した後の組織全血液量をレーザー組織血液酸素モニター(OMEGAMONITOR、BOM-L1 TR SF、OMEGAWAVE,INC.)で測定した。その結果、図18に示すように、糖尿病でないラット、及び糖尿病のモデルラットのいずれにおいても、覚醒時のほうが、麻酔時よりも組織全血液量が多かった。この結果は、麻酔時よりも、覚醒時のほうが、組織全血液量の変化を正確に計測できることを示唆している。
(実施例5)
C1034小型振動モーター(新思考電機株式会社)を用い、図19に示す回路図と等価な回路を有する加振装置を作製した。実施例3と同様に、直径2cmの全層欠損創を麻酔下の糖尿病のモデルラットの側腹部に形成し、麻酔下の糖尿病のモデルラットの創部にドレッシング材を貼り付けし、ドレッシング材の上に加振装置を貼りつけた。7日間、1日40分間、加振装置から50Hz、600から1000mVppの振動をラットに与えた。振動を与える際に、ラットを麻酔せず、ラットは覚醒状態であった。コントロール群においては、ラットに加振装置を貼りつけたものの、加振装置を作動させなかった。
C1034小型振動モーター(新思考電機株式会社)を用い、図19に示す回路図と等価な回路を有する加振装置を作製した。実施例3と同様に、直径2cmの全層欠損創を麻酔下の糖尿病のモデルラットの側腹部に形成し、麻酔下の糖尿病のモデルラットの創部にドレッシング材を貼り付けし、ドレッシング材の上に加振装置を貼りつけた。7日間、1日40分間、加振装置から50Hz、600から1000mVppの振動をラットに与えた。振動を与える際に、ラットを麻酔せず、ラットは覚醒状態であった。コントロール群においては、ラットに加振装置を貼りつけたものの、加振装置を作動させなかった。
その結果、図20及び図21に示すように、振動を与えたラットのほうが、創部の収縮が早かった。また、創部を形成して0日目のコントロールのラットの血液量を1とした場合の、ラットの血液量のグラフを図22に示す。振動を与えられたラットの血液量は、日々上昇していた。したがって、振動は血管を一時的に拡張するだけでなく、ラットの定常的な血液量を上昇させたことが示された。
また、創部を形成してから7日後、図23に示すように、ヘマトキシリン・エオジン染色により、創部の組織を観察したところ、振動を与えられなかった糖尿病のモデルラットより、振動を与えた糖尿病のモデルラットのほうが、血管の拡張が認められ、新生血管も無数に確認された。この結果は、血管の拡張と血管の新生が、ラットの定常的な血液量の増加をもたらしたことを示している。
(実施例6)
実施例3で振動を与えたラットにおいて、4日目に遺伝子発現を検査したところ、図24に示すように、血管拡張に関するNOの合成酵素eNOSの遺伝子マーカーNOS3、及び血管新生マーカーのVegfaが、1000mVppの振動で上昇していた。また、Tnf-aが減少していることから炎症が抑えられ、血管動態が改善されていることが示唆される。
実施例3で振動を与えたラットにおいて、4日目に遺伝子発現を検査したところ、図24に示すように、血管拡張に関するNOの合成酵素eNOSの遺伝子マーカーNOS3、及び血管新生マーカーのVegfaが、1000mVppの振動で上昇していた。また、Tnf-aが減少していることから炎症が抑えられ、血管動態が改善されていることが示唆される。
実施例3で振動を与えたラットにおいて、14日目においては、創傷治癒が進み、図25に示すように、振動を加えたラットでは炎症性マーカー(Tnf-a、Ptx、Ccl2)は、振動を加えなかったラットと比較して優位に減弱していた。また、300mVppから1000mVppの振動を加えたラットでは、血管拡張に関するNOS3が有意に増加していた。
実施例5で振動を与えたラットにおいて、7日目に遺伝子発現を検査したところ、図26に示すように、振動を加えなかったコントロールよりも、炎症性マーカーが減少していることが確認された。
(実施例7)
実施例3と同様に糖尿病のモデルラットを用意し、直径2cmの全層欠損創を麻酔下の糖尿病のモデルラットの側腹部に形成し、創部にドレッシング材(Foamlite、ConvaTec)を貼り付けし、ガーゼで体幹を固定した。ドレッシング材は毎日交換した。その後、14日間、毎日、振動器を創部上のガーゼ上に配置し、糖尿病のモデルラットにイソフルラン吸入麻酔を与えて眠らせている間、創部に局所的に低周波振動を40分与えた。振動の周期は50Hzであり、振動の強度は、0mVpp又は1000mVppであった。
実施例3と同様に糖尿病のモデルラットを用意し、直径2cmの全層欠損創を麻酔下の糖尿病のモデルラットの側腹部に形成し、創部にドレッシング材(Foamlite、ConvaTec)を貼り付けし、ガーゼで体幹を固定した。ドレッシング材は毎日交換した。その後、14日間、毎日、振動器を創部上のガーゼ上に配置し、糖尿病のモデルラットにイソフルラン吸入麻酔を与えて眠らせている間、創部に局所的に低周波振動を40分与えた。振動の周期は50Hzであり、振動の強度は、0mVpp又は1000mVppであった。
創部を形成してから14日後、創部の組織を採取し、採取した組織を10%ホルマリン溶液に一晩室温で浸漬し、組織を固定した。その後、エタノールとキシレンの代替品であるG-Nox(Genostaff)を使用して組織を脱水した後、組織をパラフィンに埋め込み、組織のパラフィンブロックを作成した。さらに、パラフィン包埋組織を3μmの厚さで薄切し、組織切片を作製した。
組織切片をG-Nox中に5分×3回浸漬し、組織切片からパラフィンを除去した。次に、組織切片をエタノール中に5分×3回浸漬し、組織切片からG-Noxを除去した。その後、組織切片を精製水で5分×2回洗浄した。さらに、組織切片をメタノールで希釈した3%過酸化水素に30分間インキュベートし、組織切片の内因性ペルオキシダーゼを不活化した。また、組織切片を0.01mol/Lのクエン酸緩衝液(pH6.0)に入れ、121℃、15分間のオートクレーブ処理により、組織切片の抗原を賦活化した。
次に、リン酸緩衝生理食塩水(PBS)で組織切片を洗浄し、ウシ血清アルブミン/リン酸緩衝生理食塩水にて100倍希釈した抗Pentraxin3(PTX3)抗体(rabbit-polyclonal, 13797-1-AP, Novus Biological)と組織切片とを一晩反応させた。その後、組織切片から抗原と結合していない抗PTX3抗体を除去し、組織切片をPBSで5分間×3回洗浄した。
さらに、組織切片と1000倍希釈したホースラディッシュ・ペルオキシダーゼ(HRP)標識抗ラビット免疫グロブリン抗体(Jackson ImmunoResearch)を1時間室温でインキュベートした。次に、2%過酸化水素を添加した0.05mol/Lのトリス-塩酸緩衝液(pH7.4)中で、組織切片と0.2mg/mLの3,3´-diaminobenzidine[DAB](和光純薬)を反応させ、HRPを可視化し、精製水にて反応を止めた。その後、ヘマトキシリンによる対比染色を実施した。エタノールで組織切片を脱水し、G-Noxで組織切片を透徹した後、封入剤で組織切片を封入した。
染色された組織切片を顕微鏡(BZ-X800、キーエンス)で観察した。その結果、図27に示すように、振動を加えなかったラットと比較して、振動を加えられたラットにおいては、炎症性マーカーであるPTX3が著しく減少していることが確認された。
(実施例8)
実施例7と同様に組織切片を作製した。ただし、本実施例では、組織切片の内因性ペルオキシダーゼを不活化しなかった。リン酸緩衝生理食塩水(PBS)で組織切片を洗浄し、ウシ血清アルブミン/リン酸緩衝生理食塩水にて100倍希釈した抗CD68抗体(CD68/SR-D1 antibody (ED1)、マウス-モノクローナル、NB600-985-0.025、Novus Biological)及び抗CD163抗体(CD163、EPR19518、ウサギ―モノクローナル、ab182422、Abcam)と組織切片とを一晩反応させた。CD68は、炎症反応を促進するM1型マクロファージのマーカーである。CD163は、炎症反応を抑制するM2型マクロファージのマーカーである。
実施例7と同様に組織切片を作製した。ただし、本実施例では、組織切片の内因性ペルオキシダーゼを不活化しなかった。リン酸緩衝生理食塩水(PBS)で組織切片を洗浄し、ウシ血清アルブミン/リン酸緩衝生理食塩水にて100倍希釈した抗CD68抗体(CD68/SR-D1 antibody (ED1)、マウス-モノクローナル、NB600-985-0.025、Novus Biological)及び抗CD163抗体(CD163、EPR19518、ウサギ―モノクローナル、ab182422、Abcam)と組織切片とを一晩反応させた。CD68は、炎症反応を促進するM1型マクロファージのマーカーである。CD163は、炎症反応を抑制するM2型マクロファージのマーカーである。
その後、組織切片から抗原と結合していない抗CD68抗体及び抗CD163抗体を除去し、組織切片をPBSで5分間×3回洗浄した。さらに、組織切片と1000倍希釈した緑色蛍光色素標識抗ウサギIgG抗体(Alexa Fluor 488、登録商標、donkey, #711-545-152, Jackson ImmunoResearch)及び赤色蛍光色素標識抗マウスIgG抗体(Alexa Fluor 594、登録商標、donkey、#715-585-151、Jackson ImmunoResearch)を1時間室温でインキュベートした。次に、PBSで組織切片を洗浄し、DAPIで核を青色の蛍光色素で染色し、組織切片を封入した。
染色された組織切片を顕微鏡(BZ-X800、キーエンス)で観察した。緑色の蛍光を発する細胞は、CD163陽性細胞である。赤色の蛍光を発する細胞は、CD68陽性細胞である。CD68陽性細胞数とCD163陽性細胞数を計測した。さらに、CD68陽性細胞数をCD163陽性細胞数で割った値(M1/M2マクロファージ比)を算出した。M1/M2が小さいほど、炎症が改善されていることを示している。その結果、図28に示すように、振動を加えなかったラットと比較して、振動を加えられたラットにおいては、M1/M2が著しく減少していた。
11・・・グルコース濃度センサ、12・・・血流センサ、21・・・振動器、31・・・制御装置、41・・・ドレッシング材
Claims (9)
- 体表面の潰瘍の滲出液中のグルコース濃度を検出するグルコース濃度センサと、
前記潰瘍に振動を与える振動器と、
前記滲出液中のグルコース濃度に基づき、前記振動器の振動を制御する制御装置と、
を備える、体表面潰瘍治癒促進装置。 - 前記潰瘍が、糖尿病による潰瘍である、請求項1に記載の体表面潰瘍治癒促進装置。
- 前記潰瘍が、糖尿病による足潰瘍である、請求項1に記載の体表面潰瘍治癒促進装置。
- 前記振動器を複数備える、請求項1に記載の体表面潰瘍治癒促進装置。
- 細胞におけるアルギニンの産生が促進されるように、前記制御装置が、前記振動器の振動を制御する、請求項1に記載の体表面潰瘍治癒促進装置。
- 前記グルコース濃度が、血流を増加させる濃度以上になるように、前記制御装置が、前記振動器の振動を制御する、請求項1に記載の体表面潰瘍治癒促進装置。
- 前記グルコース濃度が、細胞におけるアルギニンの産生量が閾値以上になる濃度以下になるまで、前記制御装置が、前記振動器を振動させる、請求項1に記載の体表面潰瘍治癒促進装置。
- 前記潰瘍の近傍の血流を検出する血流センサをさらに備え、
前記制御装置が、前記血流に基づき、前記振動器の振動を制御する、
請求項1に記載の体表面潰瘍治癒促進装置。 - 前記制御装置が、前記血流が増加するよう、前記振動器の振動を制御する、請求項8に記載の体表面潰瘍治癒促進装置。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2022107292 | 2022-07-01 | ||
| JP2022-107292 | 2022-07-01 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2024005144A1 true WO2024005144A1 (ja) | 2024-01-04 |
Family
ID=89382433
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/JP2023/024188 WO2024005144A1 (ja) | 2022-07-01 | 2023-06-29 | 体表面潰瘍治癒促進装置 |
Country Status (1)
| Country | Link |
|---|---|
| WO (1) | WO2024005144A1 (ja) |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2008059810A1 (fr) * | 2006-11-14 | 2008-05-22 | Kagoshima University | Dispositif d'injection de médicament |
| JP2012517324A (ja) * | 2009-02-12 | 2012-08-02 | パーフュジア メディカル インコーポレーテッド | 患者の循環系の循環を操作するための装置及び方法 |
| WO2022137756A1 (ja) * | 2020-12-23 | 2022-06-30 | 株式会社ウイルステージ | マッサージ機、および、それを用いた血糖値管理システム |
-
2023
- 2023-06-29 WO PCT/JP2023/024188 patent/WO2024005144A1/ja unknown
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2008059810A1 (fr) * | 2006-11-14 | 2008-05-22 | Kagoshima University | Dispositif d'injection de médicament |
| JP2012517324A (ja) * | 2009-02-12 | 2012-08-02 | パーフュジア メディカル インコーポレーテッド | 患者の循環系の循環を操作するための装置及び方法 |
| WO2022137756A1 (ja) * | 2020-12-23 | 2022-06-30 | 株式会社ウイルステージ | マッサージ機、および、それを用いた血糖値管理システム |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Neidert et al. | Enhanced fibrin remodeling in vitro with TGF-β1, insulin and plasmin for improved tissue-equivalents | |
| Tandara et al. | Oxygen in wound healing—more than a nutrient | |
| Ko et al. | Elevated expression of connective tissue growth factor in human atrial fibrillation and angiotensin II-treated cardiomyocytes | |
| Beckert et al. | Lactate stimulates endothelial cell migration | |
| Blair et al. | Human mast cells stimulate vascular tube formation. Tryptase is a novel, potent angiogenic factor. | |
| Xiang et al. | In situ regulation of macrophage polarization to enhance osseointegration under diabetic conditions using injectable silk/sitagliptin gel scaffolds | |
| TWI258506B (en) | Artificial dermis and method of preparation | |
| Taylor et al. | Thrombospondin‐2 influences the proportion of cartilage and bone during fracture healing | |
| Williams | Glucose-induced vascular smooth muscle dysfunction: the role of protein kinase C | |
| Chambers et al. | Role of oxygen in wound healing: a review of evidence | |
| Sengupta et al. | Hypoxia and amino acid supplementation synergistically promote the osteogenesis of human mesenchymal stem cells on silk protein scaffolds | |
| La Padula et al. | Striae distensae: in vitro study and assessment of combined treatment with sodium ascorbate and platelet-rich plasma on fibroblasts | |
| Liu et al. | Periodic vs constant high glucose in inducing pro-inflammatory cytokine expression in human coronary artery endothelial cells | |
| Cosentino et al. | Effects of blood pressure and glucose on endothelial function | |
| do Nascimento et al. | Both obesity-prone and obesity-resistant rats present delayed cutaneous wound healing | |
| Sun et al. | Effects of metformin on the osteogenesis of alveolar BMSCs from diabetic patients and implant osseointegration in rats | |
| US20110070646A1 (en) | Biomimetic Cell Scaffolds | |
| WO2024005144A1 (ja) | 体表面潰瘍治癒促進装置 | |
| Yoshizawa et al. | Ex vivo produced human conjunctiva and oral mucosa equivalents grown in a serum-free culture system | |
| Ascher et al. | Thiamine reverses hyperglycemia-induced dysfunction in cultured endothelial cells | |
| Sun et al. | Exosomes from human adipose-derived mesenchymal stromal/stem cells accelerate angiogenesis in wound healing: implication of the EGR-1/lncRNA-SENCR/DKC1/VEGF-A axis | |
| Xu et al. | Silicone rubber membrane with specific pore size enhances wound regeneration | |
| Natorska | Diabetes mellitus as a risk factor for aortic stenosis: from new mechanisms to clinical implications | |
| Qiao et al. | 4-Octyl itaconate modified demineralized bone matrix scaffold improves bone repair by regulating early inflammation | |
| Nakazawa et al. | Postnatal expression of the facilitated glucose transporter, GLUT 5, in gerbil outer hair cells |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 23831583 Country of ref document: EP Kind code of ref document: A1 |