UTILISATION DE DERIVES ORGANOMETALLIQUES DE POLYPHENOLS EHTYLENE POUR LE TRAITEM ENT D ' UN CANCER NON HORMONO-DEPENDENTUSE OF ORGANOMETALLIC DERIVATIVES OF POLYPHENOLS EHTYLENE FOR THE TREATMENT OF NON-HORMONO-DEPENDENT CANCER
5 L'invention a pour objet l'utilisation de dérivés organométalliques de polyphénol éthylène pour la préparation d'un médicament destiné à la prévention et/ou au traitement d'un cancer non hormono-dépendant. Il a également pour objet certains de ces dérivés et les compositions pharmaceutiques les comprenant.The subject of the invention is the use of organometallic derivatives of polyphenol ethylene for the preparation of a medicament for the prevention and / or treatment of non-hormonally dependent cancer. It also relates to some of these derivatives and pharmaceutical compositions comprising them.
Les cancers du sein sont classés en deux catégories principales : lesBreast cancers are classified into two main categories:
10 cancers hormo-dépendants, qui sont généralement sensibles aux traitements par les dérivés du tamoxifène ou des antiaromatases, et les traitements non hormono- dépendants, pour lesquels l'approche chimiothérapeutique n'a à ce jour pas apporté de solution satisfaisante.10 hormone-dependent cancers, which are generally sensitive to treatment with tamoxifen derivatives or anti-aromatases, and non-hormone-dependent treatments, for which the chemotherapeutic approach has not yet provided a satisfactory solution.
D'autres formes de cancer sont classées comme hormono- 15 indépendantes il s'agit notamment de certains cancer de la prostate, de l'ovaire, du colon, de l'endomètre, du rein, des mélanomes, des rétinoblastomes. Il existe à ce jour peu de traitements chimiques efficaces de ces cancers.Other forms of cancer are classified as hormone-independent, including certain cancers of the prostate, ovary, colon, endometrium, kidney, melanoma and retinoblastoma. To date, there are few effective chemical treatments for these cancers.
Des dérivés ferrocényl du diaryléthylène ont été décrits dans laFerrocenyl derivatives of diarylethylene have been described in
Demande Internationale WO 96/11935. Certains de ces dérivés, tels que lesInternational Application WO 96/11935. Some of these derivatives, such as
20 ferrocifènes 1 et les hydroxyferrocifènes 2 sont des analogues ferrocényl du tamoxifène, un médicament utilisé pour le traitement des cancers du sein hormono- dépendants.Ferrocifenes 1 and the hydroxyferrocifenes 2 are ferrocenyl analogues of tamoxifen, a drug used for the treatment of hormone-dependent breast cancers.
25
Les hydroxyferrocifènes 2 ont montré in vitro un effet antiprolifératif sur des lignées cellulaires cancéreuses hormono-dépendantes (MCF7) et non hormono- dépendantes (MDA-MB231) (TOP S. et al, Chem. Commun., 1996, 955-956 ; TOP S. et al, Chem. Eur. J., 2003, 9, 5223-5236). Toutefois, la nature métallique de ces molécules fait que l'on souhaite les utiliser à la plus faible concentration possible, afin d'éviter l'accumulation de métaux dans l'organisme. On a donc cherché à mettre au point des molécules ayant une activité antiproliférative supérieure à celle des composés de l'art antérieur, de façon à pouvoir les utiliser à des doses plus faibles par rapport aux composés de l'art antérieur. Une famille particulière de dérivés métallocéniques du diphénoléthylène a montré une activité anti-proliférative particulièrement importante sur des lignées cellulaires cancéreuses non hormono-dépendantes et permet d'envisager leur utilisation pour Ia préparation d'un médicament destiné à la prévention et/ou au traitement des cancers non hormono-dépendants. Les molécules concernées par la présente invention sont celles qui répondent à la formule (I) ci-dessous :25 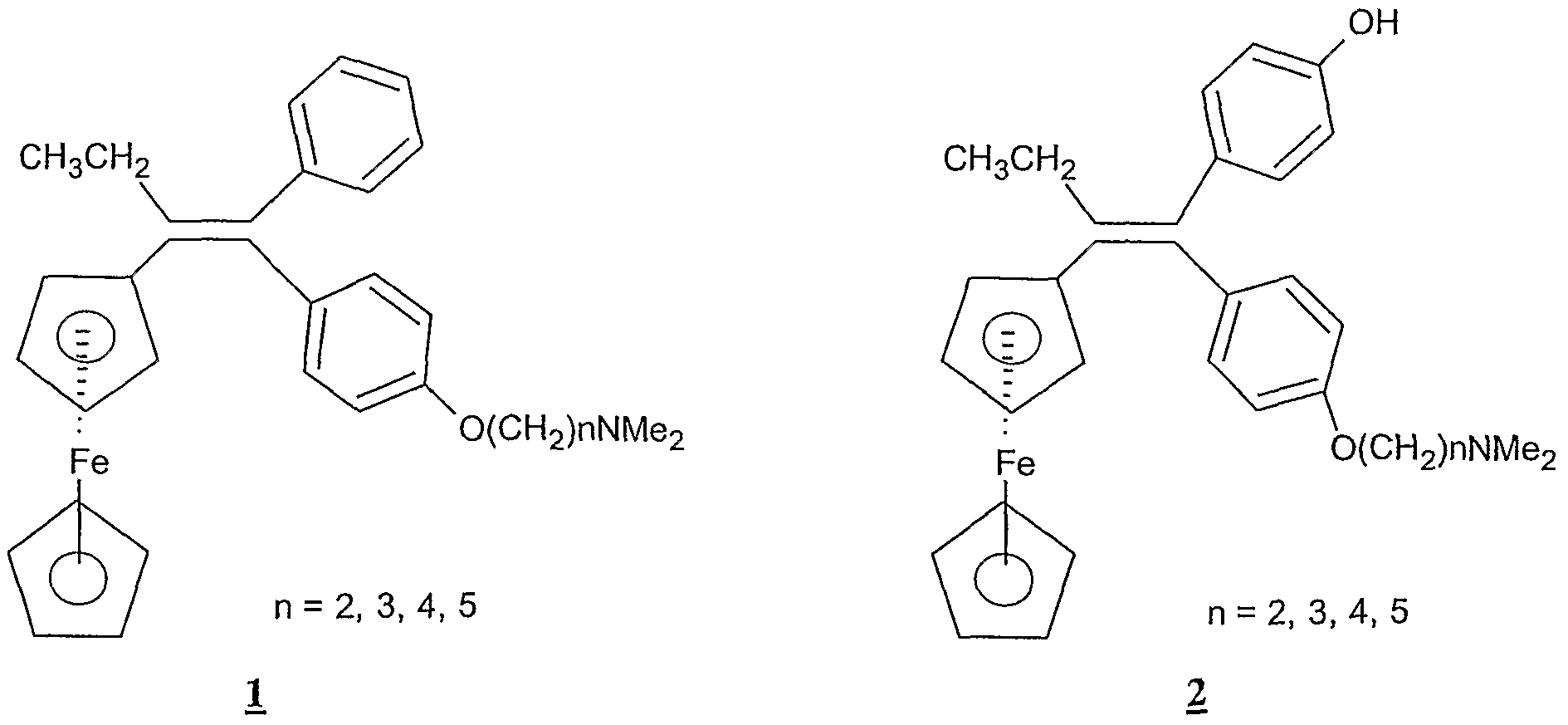
dans laquelle soit : (i) l'un de R1 et de R2 représente un groupementwherein either: (i) one of R 1 and R 2 represents a group
et l'autre représente un groupement organométallique tel qu'un métallocène,and the other represents an organometallic group such as a metallocene,
R3 représente un groupement choisi parmi : un atome d'hydrogène, un atome d'halogène, un groupement NO2, un groupement CN, un groupement halogéno alkyle en Ci-C12 ou un groupement alkyle en C1-C12, un groupement aryle,
soit :R 3 represents a group chosen from: a hydrogen atom, a halogen atom, an NO 2 group, a CN group, an alkyl halo Ci-C 12 alkyl or C 1 -C 12 alkyl, a aryl group, is :
(ii) R2 représente un groupement(ii) R 2 represents a grouping
et R] et R3 pris ensemble avec C=C forment un groupement organométallique, soit :and R 1 and R 3 taken together with C = C form an organometallic group, that is:
(iii) R2 représente un groupement(iii) R 2 represents a grouping
et -YR3C=CR1- forme un groupement organométallique,and -YR 3 C = CR 1 - forms an organometallic group,
R'i, R'2, R'3, R"i5 R'5 2, R'53, identiques ou différents représentent un groupement choisi parmi un atome d'hydrogène, un groupement hydroxyle, un groupement alkyle en Cj-C6, un atome d'halogène, un groupement halogénoalkyle en C1-C6, un groupement -OCOR4 dans lequel R4 représente un groupement alkyle en C1- Cj6 (éventuellement en C1-C6), halogéno alkyle en Cj-C16 (éventuellement en C1-C6), ou un groupement aryle. Un groupement organométallique est par définition un groupement contenant une liaison M-C entre un atome de métal (M) et un atome de carbone. Des groupements comprenant des doubles (carbène) et triples (carbyne) liaisons métal- carbone font également partie de cette définition.R'i, R '2, R' 3, R "i 5 R '5 2, R' 5 3, identical or different, represent a group selected from a hydrogen atom, a hydroxyl group, an alkyl group CJ C 6, a halogen atom, a haloalkyl group, C 1 -C 6, a -OCOR 4 group wherein R 4 represents an alkyl group C 1 - 6 -C (optionally C 1 -C 6) haloalkyl C 1 -C 16 (optionally C 1 -C 6 ), or an aryl group An organometallic group is by definition a group containing an MC bond between a metal atom (M) and a carbon atom. double (carbene) and triple (carbyne) metal-carbon bonds are also part of this definition.
De nombreux documents de l'art antérieur décrivent l'utilisation de dérivés du cisplatine ou du carboplatine dans le traitement du cancer du sein (Yuehua et al, Bioorg.& Medic. Chem. Letters, vol.5, n°19, 2217-2222 ; Séné et al, Drug Design and Discovery, 1998, vol.15, ρ.277-285 ; G. Grenier et al, Chem. Pharm. Bull., 46(9),
1480-1483 (1998). Toutefois, les molécules décrites dans ces documents sont des complexes de coordination du platine et non des composés organométalliques.Numerous prior art documents describe the use of cisplatin or carboplatin derivatives in the treatment of breast cancer (Yuehua et al., Biochem. & Medic., Chem., Letters, vol.5, No. 19, 2217- 2222, Séné et al, Drug Design and Discovery, 1998, vol.15, p.277-285, G. Grenier et al, Chem Pharm Bull., 46 (9), 1480-1483 (1998). However, the molecules described in these documents are platinum coordination complexes and not organometallic compounds.
De préférence, les molécules répondant à la formule (I) ci-dessus vérifient l'une ou plusieurs des conditions suivantes : - l'un au moins de R'l5 R'2, R'3 est un groupe -OH ou -OCOR4 ;Preferably, the molecules of formula (I) above satisfy one or more of the following conditions: - at least one of R 'l5 R' 2, R '3 is -OH or -OCOR 4 ;
- l'un au moins de R"i, R"2, R"3 est un groupe -OH Ou -OCOR4.at least one of R "i, R" 2 , R " 3 is a -OH or -OCOR 4 group .
De façon surprenante, les inventeurs ont en effet constaté que la présence d'un groupement hydroxyle (ou d'un groupement -OCOR4, qui conduit à la formation d'un hydroxyle lorsque la molécule est administrée in vivo) sur chacun des cycles phényle confère à ces molécules des propriétés antiprolifératives qui ont été observées sur des lignées cellulaires de cancer non hormono-dépendant.Surprisingly, the inventors have indeed found that the presence of a hydroxyl group (or a group -OCOR 4 , which leads to the formation of a hydroxyl when the molecule is administered in vivo) on each of the phenyl rings confers on these molecules antiproliferative properties which have been observed on non-hormonally dependent cancer cell lines.
Notamment le composé 8 (l,l-bis(4-hydroxyphényl)-2-ferrocényl- but-1-ène) ci-dessous montre une activité anti-proliférativeIn particular, the compound 8 (1,1-bis (4-hydroxyphenyl) -2-ferrocenyl-but-1-ene) below shows an anti-proliferative activity
88
très supérieure à celle du 4-hydroxy tamoxifène et des hydroxyferrocifènes 2. Le composé 8 a déjà été décrit comme intermédiaire dans la synthèse des hydroxy ferrocifènes 2 (Chem. Eur. J., 2003, 9, 5223-5226). Il a également dans ce même document été décrit pour son affinité pour le récepteur oestrogénique ERa. Toutefois, les cellules cancéreuses des cancers non hormono-dépendants n'ont pas de récepteurs ERa et rien ne permettait de supposer que les composés de l'invention, en
particulier le composé 8, auraient une activité anti-proliférative sur des cancers non hormono-dépendants, résistants au tamoxifène.much higher than that of 4-hydroxy tamoxifen and hydroxyferrocifenes 2. Compound 8 has already been described as an intermediate in the synthesis of hydroxy ferrocifenes 2 (Chem Eur, J., 2003, 9, 5223-5226). It has also been described in this document for its affinity for the estrogen receptor ERa. However, the cancer cells of the nonhormone-dependent cancers do not have ERa receptors and there is no reason to suppose that the compounds of the invention, in compound 8 would have anti-proliferative activity on non-hormonally dependent, tamoxifen-resistant cancers.
En outre, cet effet antiprolifératif peut être observé pour une molécule de formule (I) ne comportant pas de fonction hydroxyle ni de fonction -OCOR4 sur ses noyaux phényls, mais qui est transformée par oxydation lors de son administration in vivo. On peut citer en particulier la molécule :In addition, this antiproliferative effect can be observed for a molecule of formula (I) having no hydroxyl function or -OCOR 4 function on its phenyl nuclei, but which is converted by oxidation when administered in vivo. In particular, the molecule can be mentioned:
Selon la présente invention le terme alkyle en C1-C16, respectivement en C1-Ci2, désigne tout groupement alkyle linéaire ramifié ou cyclique, saturé ou insaturé comprenant de 1 à 16, respectivement de 1 à 12 atomes de carbone, comme par exemple un groupement méthyle, éthyle, n-propyle, isopropyle, n-butyle, ter-butyle, ... n-dodécyle, ...n-hexadécyle. Le terme aryle désigne un noyau aromatique éventuellement substitué par un ou plusieurs groupements alkyles en C1-C3.According to the present invention the term alkyl C 1 -C 16 or C 1 -C 2 alkyl group means a linear branched or cyclic, saturated or unsaturated containing from 1 to 16, respectively from 1 to 12 carbon atoms, such as for example a methyl, ethyl, n-propyl, isopropyl, n-butyl, tert-butyl, n-dodecyl, ... n-hexadecyl group. The term aryl designates an aromatic ring optionally substituted with one or more C 1 -C 3 alkyl groups.
L'expression halogène ou halogéno désigne un atome de chlore, de fluor, de brome ou d'iode.The term halogen or halo means a chlorine, fluorine, bromine or iodine atom.
L'expression métallocène désigne un groupement organométallique comprenant au moins un atome métallique du groupe VIII de la classification périodique des éléments chimiques, ledit atome métallique pouvant être éventuellement sous forme oxydée.The expression metallocene denotes an organometallic group comprising at least one metal atom of group VIII of the periodic classification of chemical elements, said metal atom possibly being in oxidized form.
La présente invention concerne plus particulièrement les molécules de formule (I) dans lesquelles le groupe métallocène répond à la formule (II) ci-dessous :
The present invention relates more particularly to the molecules of formula (I) in which the metallocene group corresponds to formula (II) below:
("I)( 'I)
dans laquelle M représente un atome métallique du groupe VIII de la classification périodique des éléments chimiques, ledit atome métallique pouvant être éventuellement sous forme oxydée et R représente un groupement choisi parmi H, CH3 ou CF3.in which M represents a group VIII metal atom of the periodic classification of chemical elements, said metal atom possibly being in oxidized form and R represents a group chosen from H, CH 3 or CF 3 .
Les molécules utilisables dans la présente invention peuvent être celles dans lesquelles le groupe organométallique répond à la formule générale (III)The molecules that can be used in the present invention may be those in which the organometallic group has the general formula (III)
dans laquelle M représente un atome métallique choisi par le titane, le vanadium, le nobium, le hafhium et le molybdène et X représente un atome d'halogène choisi parmi le chlore, le brome et l'iode. Selon une variante de l'invention X peut désigner tout autre ligand assurant la stabilité électronique de l'entité organométallique à 16 ou 18 électrons.wherein M represents a metal atom selected from titanium, vanadium, nobium, hafhium and molybdenum and X represents a halogen selected from chlorine, bromine and iodine. According to a variant of the invention X may designate any other ligand ensuring the electronic stability of the organometallic entity with 16 or 18 electrons.
Le groupement organométallique peut être aussi un complexe semi- sandwich ou un clusters tels que ceux représentés par les formules (IV) et (V) ci- dessous :The organometallic group may also be a semi-sandwich complex or clusters such as those represented by formulas (IV) and (V) below:
(IV) M=Mn, Tc, Re (V)
Complexe semi-sandwich cluster (IV) M = Mn, Tc, Re (V) Semi-sandwich cluster complex
A l'exception des composés pour lesquels : selon la variante définie au point (i) R1 représente le parahydroxyphényl, R2 représente le groupement ferrocényl et R3 représente le groupement éthyle, R'2 et R'3 représentent un atome d'hydrogène et R'i représente un hydroxyle en para du phényl ou R'i représente H, les composés de formule (I) sont nouveaux et constituent un autre objet de l'invention, ainsi que les compositions pharmaceutiques les comprenant.With the exception of compounds for which: according to the variant defined in (i) R 1 represents para-hydroxyphenyl, R 2 represents the ferrocenyl group and R 3 represents the ethyl group, R ' 2 and R' 3 represent an atom of hydrogen and R'i represents a hydroxyl in para of the phenyl or R'i represents H, the compounds of formula (I) are new and constitute another object of the invention, as well as the pharmaceutical compositions comprising them.
La présente invention concerne plus particulièrement les molécules répondant à la formule (Ia) ou à la formule (Ib) ci-dessous :The present invention relates more particularly to the molecules corresponding to formula (Ia) or formula (Ib) below:
dans lesquelles M, R, R3, R'j, R'2, R'3j R"i, R"2, R"3 ont la même définition que ci-dessus. Les composés (Ia) et (Ib) sont isomérisables et l'invention concerne les 2 isomères de chacune de ces formules.wherein M, R, R 3, R'j, R '2, R' 3j R "i, R" 2, R "3 have the same definition as above. The compounds (Ia) and (Ib) are isomerizable and the invention relates to the 2 isomers of each of these formulas.
Avantageusement, les molécules utilisables dans la présente invention sont celles qui vérifient une ou plusieurs des conditions ci-dessous :Advantageously, the molecules that can be used in the present invention are those that satisfy one or more of the conditions below:
- M = Fe,- M = Fe,
- R3 représente un groupement alkyle en C1-C6 ou un atome d'hydrogène,R 3 represents a C 1 -C 6 alkyl group or a hydrogen atom,
- (R',, R'2, R'3) = (OH, H, H), (OH, OH, H)- (R ', R' 2 , R ' 3 ) = (OH, H, H), (OH, OH, H)
- (R",, R"25 R"3) = (OH, H, H), (OH5 OH, H)5 - (R ",, R" 25 R "3) = (OH, H, H), (OH 5 OH, H) 5
- R représente H- R represents H
- l'un au moins des hydroxyles est placé en position para sur les noyaux phényle.
Le composé préféré pour la mise en œuvre de l'invention est le composé 8.at least one of the hydroxyls is placed in the para position on the phenyl rings. The preferred compound for the practice of the invention is compound 8.
Une autre famille de molécules préférées de l'invention est constituée de molécules répondant à la formule (I), préférentiellement à la formule (Ia) ou à la formule (Ib) dans lesquelles l'un au moins de R'i, R'2, R'3 est le groupement -OCOR4 et l'un au moins de R"l5 R"2, R"3 est le groupement -OCOR4, R4 ayant la même définition que ci-dessus.Another family of preferred molecules of the invention consists of molecules corresponding to formula (I), preferentially to formula (Ia) or formula (Ib) in which at least one of R'i, R ' 2 , R ' 3 is the group -OCOR 4 and at least one of R " 15 R" 2 , R " 3 is the group -OCOR 4 , R 4 having the same definition as above.
Le groupement -OCOR4 est avantageusement placé en position para de chacun des phényls. De préférence (R' u R'2, R'3) = (-OCOR4, H, H) ou (-The group -OCOR 4 is advantageously placed in the para position of each of the phenyls. Preferably (R ' u R' 2 , R ' 3 ) = (-OCOR 4 , H, H) or (-
OCOR4, OH, H) et (R" 1} R"2, R"3) - (-OCOR4, H, H) ou (-OCOR4, OH, H).OCOR 4 , OH, H) and (R " 1) R" 2 , R " 3 ) - (-OCOR 4 , H, H) or (-OCOR 4 , OH, H).
Les molécules de formule (I) dans lesquelles chacun des deux noyaux phényl est substitué par un groupement -OCOR4 sont nouvelles et constituent un autre objet de l'invention. De préférence chacun des noyaux phényl de la molécule de formule (I) est représenté par la formule (VI) ci-dessous :The molecules of formula (I) in which each of the two phenyl rings is substituted with a group -OCOR 4 are new and constitute another object of the invention. Preferably each of the phenyl nuclei of the molecule of formula (I) is represented by formula (VI) below:
(VI)(VI)
Selon cette variante de l'invention, les molécules préférées sont celles de formule (Ic) et (Id) sous leurs deux formes isomériques :According to this variant of the invention, the preferred molecules are those of formula (Ic) and (Id) in their two isomeric forms:
R, R3 et R4 ayant la même définition que ci-dessus.
De préférence l'une ou plusieurs des conditions ci-dessous sont vérifiées :R, R 3 and R 4 having the same definition as above. Preferably one or more of the conditions below are verified:
R3 représente H ou un groupement alkyle en C1-C6,R 3 represents H or a C 1 -C 6 alkyl group,
M représente Fe,M represents Fe,
R représente H,R is H,
R4 représente un groupement alkyle en C1-C16, éventuellement en C1- C6.R 4 represents a C 1 -C 16 alkyl group, optionally a C 1 -C 6 alkyl group.
La synthèse des composés utilisables dans la présente invention peut être faite aisément au moyen de méthodes connues de l'homme du métier et décrites dansThe synthesis of the compounds which can be used in the present invention can be easily carried out using methods known to those skilled in the art and described in
WO 96/11935, TOP S. et al, Chem. Eur. J., 2003, 9, 5223-5236. La partie expérimentale illustre la préparation de certains de ces composés.WO 96/11935, TOP S. et al., Chem. Eur. J., 2003, 9, 5223-5236. The experimental part illustrates the preparation of some of these compounds.
Selon la variante de l'invention numérotée (ii) R2 représente un groupementAccording to the variant of the invention numbered (ii) R 2 represents a grouping
et R] et R3 pris ensemble avec C=C forment un groupement organométallique. Deux exemples de composés répondant à cette formule sont illustrés ci-dessous :and R 1 and R 3 taken together with C = C form an organometallic group. Two examples of compounds corresponding to this formula are illustrated below:
et
Selon la variante de l'invention numérotée (iii) R2 représente un groupement and According to the variant of the invention numbered (iii) R 2 represents a grouping
et -YR3C=CRi- forme un groupement organométallique. Un exemple d'un composé répondant à cette formule est illustré ci-dessous :and -YR 3 C = CR-form an organometallic group. An example of a compound of this formula is shown below:
Les composés de l'invention sont destinés à être administrés de façon connue de l'homme du métier dans un véhicule pharmaceutiquement acceptable. On peut citer plus particulièrement les compositions destinées à une administration par voie entérale ou parentérale : intraveineuse, intramusculaire ou sous-cutanée, nasale, orale. On peut citer en particulier les compositions sous forme de solution, de
comprimés dragéifiés ou non, les comprimés sublinguaux, les gélules, les suppositoires les crèmes, les pommades, les gels dermiques, les préparations injectables, les suspensions buvables.The compounds of the invention are intended to be administered in a manner known to those skilled in the art in a pharmaceutically acceptable vehicle. Mention may more particularly be made of compositions intended for enteral or parenteral administration: intravenous, intramuscular or subcutaneous, nasal, oral. In particular, compositions in the form of solution, sugar-coated tablets, sublingual tablets, capsules, suppositories, creams, ointments, dermal gels, injectable preparations, oral suspensions.
La posologie peut être adaptée en fonction de la nature et de la sévérité de l'affection, la voie d'administration, l'âge et le poids du patient.The dosage may be adapted depending on the nature and severity of the condition, the route of administration, the age and weight of the patient.
L'invention a donc pour objet l'utilisation d'un composé de formule (I) pour la préparation d'un médicament destiné au traitement d'un cancer non hormono dépendant. Il a également pour objet l'utilisation d'un composé de formule (I) pour la préparation d'un médicament destiné à la prévention d'un cancer non hormono dépendant. Notamment à l'issue du traitement d'un tel cancer, les composés de formule (I) permettraient de prévenir et/ou de retarder la réapparition d'un syndrome prolifératif. Les composés de formule (I) peuvent également être utilisés pour la préparation d'un médicament destiné à la prévention et/ou au traitement de cancers de type hétérogène, c'est-à-dire comportant à la fois un aspect hormono-dépendant et un aspect non hormono-dépendant.The subject of the invention is therefore the use of a compound of formula (I) for the preparation of a medicament for the treatment of non-hormone dependent cancer. It also relates to the use of a compound of formula (I) for the preparation of a medicament for the prevention of non-hormone dependent cancer. In particular, after the treatment of such a cancer, the compounds of formula (I) would make it possible to prevent and / or to delay the reappearance of a proliferative syndrome. The compounds of formula (I) may also be used for the preparation of a medicament intended for the prevention and / or treatment of heterogeneous type of cancers, that is to say having both a hormone-dependent and a non-hormonally dependent aspect.
PARTIE EXEPRIMENTALE I- SYNTHESEEXPRESS PART I- SYNTHESIS
1. Synthèse du 1 J-bisf4-hvdroxyphényl)-2-phényl-but-l-ène (composé 6)1. Synthesis of 1β-bis (4-hydroxyphenyl) -2-phenyl-but-1-ene (compound 6)
La préparation initiale repose sur la méthode de Dodds et al, Proc. R. Soc. London Ser. B5 1939, 127, 140-167. Elle a été reprise par Lubezyk et al. Pour la synthèse du composé 6, D ; Robertson et al, J. Steroid Biochem., 1982, 16, 2-13 ; M.
R. Schneider, J. Med. Chem., 1986, 29, 1494-98 ; V. lubczyk et al, J. Med. Chem., 2002, 45, 5358-5364, la méthode requiert plusieurs étapes de réactions. La synthèse du tamoxifène a été facilitée par l'utilisation de la réaction de couplage de McMurry appliquée par Coe et Scriven, J ; Chem. Soc. Perkin Trans I, 1986, 475-477. Par contre cette réaction de couplage n'est pas encore appliquée pour la synthèse du composé 6.The initial preparation is based on the method of Dodds et al., Proc. R. Soc. London Ser. B 5 1939, 127, 140-167. It was taken over by Lubezyk et al. For the synthesis of compound 6, D; Robertson et al., J. Steroid Biochem., 1982, 16, 2-13; Mr. R. Schneider, J. Med. Chem., 1986, 29, 1494-98; V. Lubczyk et al., J. Med. Chem., 2002, 45, 5358-5364, the method requires several reaction steps. The synthesis of tamoxifen was facilitated by the use of the McMurry coupling reaction applied by Coe and Scriven, J; Chem. Soc. Perkin Trans I, 1986, 475-477. On the other hand, this coupling reaction is not yet applied for the synthesis of compound 6.
En appliquant cette réaction, la propiophénone se couple avec la dihydroxyphénone pour fournir 6 avec un rendement de 73% suivant le schéma 1 ci- dessous :Applying this reaction, propiophenone couples with dihydroxyphenone to provide 6 with a yield of 73% according to Scheme 1 below:
2. Synthèse du 1 J-bis(4-hvdroxyphényl)-2-ferrocényl-but-l-ène (composé 8)2. Synthesis of 1-bis (4-hydroxyphenyl) -2-ferrocenyl-but-1-ene (compound 8)
Le composé l,l-bis(4-hydroxyphényl)-2-ferrocényl-but-l-ène 8 a été préparé selon la réaction de couplage de McMurry, réaction utilisée pour la préparation du composé organique 6. Le propionylferrocène est mis à réagir avec la dihydroxybenzophénone en présence du réactif de McMurry TiCl4/Zn. On obtient le composé 8 avec un rendement de 52,5% .
The 1,1-bis (4-hydroxyphenyl) -2-ferrocenyl-but-1-ene compound 8 was prepared according to the McMurry coupling reaction, a reaction used for the preparation of the organic compound 6. The propionylferrocene is reacted with dihydroxybenzophenone in the presence of McMurry TiCl 4 / Zn reagent. Compound 8 is obtained with a yield of 52.5%.
3. Partie expérimentale3. Experimental part
Le THF anhydre est obtenu par distillation sur benzophénone/sodium. Les spectres RMN sont enregistrés sur les spectromètres de résonance magnétique nucléaire Bruker à 200 MHz et à 300 MHz. La chromato graphie sur colonne est réalisée avec le gel de silice Merck avec un éluant de qualité technique. Les analyses élémentaires ont été effectuées par le Service d'Analyse de l'Université de Jussieu. 1 , 1 -bis(4-hydroxyohényl)- 1 -phényl-but- 1 -ène 6 Dans un tube de Schlenk surmonté d'un réfrigérant et purgé par de l'argon, on place 2,00 g (30 mmol) de poudre de zinc et 60 mL de THF anhydre. Le mélange est refroidi à -10°C. Sous une bonne agitation, 3,11 g (1,8 mL, 16 mmol) de TiCl4 sont lentement ajoutés dans le mélange. Le milieu gris foncé obtenu est chauffé au reflux pendant 2 h. Après avoir laissé refroidir à la température ambiante, une solution de THF (20 mL) contenu le propiophénone (0.67 g, 5 mmol) et la 4,4'- dihydroxybenzophénone (1.07 g, 5 mmol) est doucement ajouté dans le milieu. Après addition complète, le mélange est chauffé au reflux pendant 2 h. Après avoir laissé refroidir à la température ambiante, le milieu réactionnel est hydrolisé par une solution de 10% K2CO3. Les produits sont extraits au dichlorométhane et séchés au MgSO4. Le brut obtenu après évaporation du solvant est chromatographié sur une colonne de gel de silice avec comme éluant CH2Cl2: acétone 95:5. Le composé 6 est finalement isolé sous forme de solide incolore (rendement 73%, p. de fusion 165°C).
1H RMN (300 MHz, CD3OH) d 7,13-7,06 (m, 5 H, C6H5) ; 7,01 et 6,76 (d, d, 2 H, J = 8,7 Hz C6H4) ; 6,65 et 6,39 (d, d, 2 H, 2 H, J = 8,7 Hz, C6H4) ; 2,47 (q, 2 H, J = 7,4 Hz, CH2) ; 0,90 (t, 3 H, J = 7,4 Hz, CH3).Anhydrous THF is obtained by distillation over benzophenone / sodium. The NMR spectra are recorded on the Bruker 200 MHz and 300 MHz nuclear magnetic resonance spectrometers. Column chromatography is performed with Merck silica gel with a technical eluent. The elementary analyzes were carried out by the Analysis Department of the University of Jussieu. In a Schlenk tube surmounted by a condenser and purged with argon, 2,00 g (30 mmol) of zinc powder and 60 mL of anhydrous THF. The mixture is cooled to -10 ° C. Under good stirring, 3.11 g (1.8 mL, 16 mmol) of TiCl 4 is slowly added to the mixture. The dark gray medium obtained is refluxed for 2 hours. After allowing to cool to room temperature, a solution of THF (20 mL) containing propiophenone (0.67 g, 5 mmol) and 4,4'-dihydroxybenzophenone (1.07 g, 5 mmol) is gently added to the medium. After complete addition, the mixture is refluxed for 2 hours. After having allowed to cool to room temperature, the reaction medium is hydrolyzed with a solution of 10% K 2 CO 3 . The products are extracted with dichloromethane and dried with MgSO 4 . The crude product obtained after evaporation of the solvent is chromatographed on a column of silica gel eluting with CH 2 Cl 2 : acetone 95: 5. Compound 6 is finally isolated as a colorless solid (73% yield, mp 165 ° C). 1 H NMR (300 MHz, CD 3 OH) d 7.13-7.06 (m, 5H, C 6 H 5 ); 7.01 and 6.76 (d, d, 2H, J = 8.7 Hz C 6 H 4 ); 6.65 and 6.39 (d, d, 2H, 2H, J = 8.7 Hz, C 6 H 4 ); 2.47 (q, 2H, J = 7.4 Hz, CH 2 ); 0.90 (t, 3H, J = 7.4 Hz, CH 3 ).
Les caractéristiques spectroscopiques sont identiques à celles du produit de la littérature qui avait été obtenu par une autre voie de synthèse (V. Lubcyk, H. Bachmann, R. Gust, J. Med. Chem., 2002, 45, 5358-5364).The spectroscopic characteristics are identical to those of the product of the literature which had been obtained by another synthetic route (V. Lubcyk, H. Bachmann, R. Gust, J. Med Chem, 2002, 45, 5358-5364). .
1 , 1 -bis(4-hydroxyphényl)-2-ferrocenyl-but- 1 -ene 81, 1-bis (4-hydroxyphenyl) -2-ferrocenyl-but-1-ene
Dans un tube de Schlenk surmonté d'un réfrigérant et purgé par de l'argon, on place 3,90 g (60 mmol) de poudre de zinc et 60 mL de THF anhydre. Le mélange est refroidi à -1O0C. Sous une bonne agitation, 5.70 g (30 mmol) de TiCl4 sont lentement ajoutés dans le mélange. Le milieu gris foncé obtenu est chauffé au reflux pendant 2 h. Après avoir laissé refroidir à la température ambiante, une solution deIn a Schlenk tube surmounted by a condenser and purged with argon, 3.90 g (60 mmol) of zinc powder and 60 ml of anhydrous THF are placed. The mixture is cooled to -1O 0 C. Under good stirring, 5.70 g (30 mmol) of TiCl 4 are slowly added to the mixture. The dark gray medium obtained is refluxed for 2 hours. After allowing to cool to room temperature, a solution of
THF (30 mL) contenu le propionylferrocène (2,42 g, 10 mmol) et la 4,4'- dihydroxybenzophénone (2.14 g, 10 mmol) est doucement ajouté dans le milieu. Après addition complète, le mélange est chauffé au reflux pendant 15 h. Après avoir laissé refroidir à la température ambiante, le milieu réactionnel est hydrolyse par une solution de 10% Na2CO3. Les produits sont extraits à l'éther éthylique et séchés au MgSO4. Le but obtenu après évaporation du solvant est chromatographié sur une colonne de gel de silice avec comme éluant éther éthyliquerpentane 1 :2. 2,23 g du composé 8 est finalement isolé sous forme de solide orange (rendement 52,5%, p. de fusion 219°C).THF (30 mL) contained propionylferrocene (2.42 g, 10 mmol) and 4,4'-dihydroxybenzophenone (2.14 g, 10 mmol) was gently added to the medium. After complete addition, the mixture is refluxed for 15 hours. After allowing to cool to room temperature, the reaction medium is hydrolyzed with a solution of 10% Na 2 CO 3 . The products are extracted with ethyl ether and dried with MgSO 4 . The purpose obtained after evaporation of the solvent is chromatographed on a column of silica gel with 1: 2 ethyl etherpentane eluent. 2.23 g of compound 8 is finally isolated as an orange solid (52.5% yield, mp 219 ° C.).
1H RMN (200 MHz, CDCl3) d 7,08 et 6,80 (d, d, 2 H, 2 H, J = 8,5 Hz, C6H4) ; 6,90 et 6,68 (d, d, 2 H, 2 H, J = 8,5 Hz, C6H4) ; 5,04 (s, 2 H, OH) ; 4,11 (s, 5 H, Cp) ; 4,07 et 3,90 (t, t, 2 H, 2 H, C5H4) ; 2,58 (q, 2 H, J = 7,5 Hz, CH2) ; 1,02 (t, 3H, J = 7,5 Hz, CH3). Analyse : cale, pour C26H24O2Fe : C, 73,44 ; H, 5,70. Trouvé : C, 73,44 ; H, 5,83. 1 H NMR (200 MHz, CDCl 3 ) d 7.08 and 6.80 (d, d, 2H, 2H, J = 8.5 Hz, C 6 H 4 ); 6.90 and 6.68 (d, d, 2H, 2H, J = 8.5 Hz, C 6 H 4 ); 5.04 (s, 2H, OH); 4.11 (s, 5H, Cp); 4.07 and 3.90 (t, t, 2H, 2H, C 5 H 4); 2.58 (q, 2H, J = 7.5 Hz, CH 2 ); 1.02 (t, 3H, J = 7.5 Hz, CH 3 ). Analysis: Calcd for C 26 H 24 O 2 Fe: C, 73.44; H, 5.70. Found: C, 73.44; H, 5.83.
II- ACTIVITE BIOLOGIQUEII- BIOLOGICAL ACTIVITY
La figure 1 est un graphique illustrant l'effet prolifératif/antiprolifératif sur des cellules MDA-MB231 (ERa négative, ERβ positive, cellules de cancer non-hormono-dépendant) de 1 nM de 17β-oestradiol (E2), lμM de 4- OH-Tamoxifène (OH-TAM), 1 et lOμM des composés 6 et 8 après 5 jours de culture. Les valeurs sont exprimées à partir du contrôle pris à 100%. Résultats d'une expérience représentative (8 points, ± limite de confiance P=O5I, T=2,35).FIG. 1 is a graph illustrating the proliferative / antiproliferative effect on MDA-MB231 cells (ERa negative, ERβ positive, non-hormonally dependent cancer cells) of 1 nM of 17β-estradiol (E2), 1 μM of 4- OH-Tamoxifen (OH-TAM), 1 and 10 μM compounds 6 and 8 after 5 days of culture. The values are expressed from the 100% control. Results of a representative experiment (8 points, ± confidence limit P = O 5 I, T = 2.35).
La figure 2 est un graphique illustrant l'effet prolifératif/antiprolifératif sur des cellules DU- 145 (cellules hormono-indépendantes de
cancer de la prostate)) de 1 nM et lμM de Testostérone (Testo) et de dihydrotestostérone (DHT) et de lμM de composé 8 après 5 jours de culture. Les valeurs sont exprimées à partir du contrôle pris à 100%. Résultats d'une expérience représentative (8 points, ± limite de confiance P=O5I, T=2,35). La figure 3 est un graphique illustrant l'effet prolifératif/antiprolifératif sur des cellules PC3 (cellules hormono-indépendantes de cancer de la prostate)) de 1 nM et lμM de Testostérone (Testo) et de dihydrotestostérone (DHT) et de lμM de composé 8 après 5 jours de culture. Les valeurs sont exprimées à partir du contrôle pris à 100%. Résultats d'une expérience représentative (8 points, ± limite de confiance P=O5I, T=2,35).FIG. 2 is a graph illustrating the proliferative / antiproliferative effect on DU-145 cells (hormone-independent cells of prostate cancer)) of 1 nM and 1 μM of testosterone (Testo) and dihydrotestosterone (DHT) and 1 μM of compound 8 after 5 days of culture. The values are expressed from the 100% control. Results of a representative experiment (8 points, ± confidence limit P = O 5 I, T = 2.35). FIG. 3 is a graph illustrating the proliferative / antiproliferative effect on PC3 cells (hormone-independent prostate cancer cells) of 1 nM and 1 μM of testosterone (Testo) and dihydrotestosterone (DHT) and 1 μM of compound 8 after 5 days of culture. The values are expressed from the 100% control. Results of a representative experiment (8 points, ± confidence limit P = O 5 I, T = 2.35).
1. Comportement biologique des composés 6 et 8 Les mesures d'ARL (Affinité Relative de Liaison) de 6 et 8 ont été déterminées sur les formes α et β du récepteur des oestrogènes. Par définition la valeur d'ARL de Poestradiol, l'hormone de référence est de 100%. Les valeurs de lipophilie logPo/w ont également été mesurées en utilisant la méthode précédemment décrite par Minick et al, J. Med. Chem., 1988, 31, 1923. Ces valeurs sont regroupées dans le tableau 1.1. Biological Behavior of Compounds 6 and 8 The ARL (Relative Relative Binding Affinity) measurements of 6 and 8 were determined on the α and β forms of the estrogen receptor. By definition the ARL value of Poestradiol, the reference hormone is 100%. LogPo / w lipophilicity values were also measured using the method previously described by Minick et al., J. Med. Chem., 1988, 31, 1923. These values are summarized in Table 1.
Tableau 1 : Affinité Relative de Liaison (ARL) pour les récepteurs des oestrogènes (ERa et ERβ*) et valeurs de logPo/wTable 1: Relative Binding Affinity (ARL) for estrogen receptors (ERa and ERβ * ) and logPo / w values
Mesures faites à partir de solutions 1x10"3M dans le DMSO avec une incubation de 3h30 à O0C.Measurements made from 1x10 " 3M solutions in DMSO with an incubation of 3h30 at 0 ° C.
Ces molécules reconnaissent donc les deux formes du récepteur des oestrogènes avec une meilleure affinité pour la forme beta. Les coefficients de partage, exprimés sous forme de logPo/w, ont été mesurés selon la méthode développé par Minick et al, J. Med. Chem., 1988, 31, 1923.These molecules therefore recognize both forms of the estrogen receptor with a better affinity for the beta form. The partition coefficients, expressed as logPo / w, were measured according to the method developed by Minick et al., J. Med. Chem., 1988, 31, 1923.
L'étude de l'effet prolifératif/antiprolifératif sur une lignée cellulaire de cancer du sein (MDA-MB231) a été effectuée. La figure 1 montre le résultat obtenu avec la lignée cellulaire MDA-The study of the proliferative / antiproliferative effect on a breast cancer cell line (MDA-MB231) was carried out. Figure 1 shows the result obtained with the cell line MDA-
MB231. Les cellules MDA-MB231, classées « Estrogen Receptor négative » ER- ne contiennent pas de récepteur ERa mais l'on sait depuis peu que la deuxième forme de récepteur ERβ y est présente (E. A. Vladusic et al, Cancer Res., 1998, 58, 210-214).MB231. The MDA-MB231 cells, classified as "Estrogen Receptor Negative ER", do not contain an ERα receptor, but it has recently been known that the second form of ERβ receptor is present (EA Vladusic et al, Cancer Res., 1998, 58 , 210-214).
Le résultat obtenu est spectaculaire. Le 17B -estradiol, le 4-OHTAM et le composé 6 n'ont pas le même effet sur cette lignée cellulaire alors que le composéThe result is spectacular. 17B-estradiol, 4-OHTAM and compound 6 do not have the same effect on this cell line whereas the compound
8 a un effet antiprolifératif très important avec une baisse de 80% observée dès la concentration de 1 μM. Cet effet est plus important que celui précédemment observé avec les hydroxyferrocifènes 5 .8 has a very important antiproliferative effect with a decrease of 80% observed at a concentration of 1 μM. This effect is greater than that previously observed with the hydroxyferrocifenes 5.
2. Effet sur des lignées cellulaires dérivées de cancer de la prostate ωU-145 et PC3)2. Effect on cell lines derived from cancerU-145 and PC3 prostate cancer
Le composé 8 a été testé sur deux lignées cellulaires de cancer hormono indépendantes dérivées de cancer de la prostate (DU- 145 et PC3) et comparé à l'effet de la testostérone et de la dihydrotestostérone (DHT). Les résultats obtenus sont représentés sur les figures 2 et 3. La testostérone et la dihydrotestostérone n'ont pas d'effet sur ces lignées hormono indépendantes ce qui est attendu. En revanche, le composé 8 montre un effet antiprolifératif très marqué sur ces deux lignées.Compound 8 was tested on two independent hormone cancer cell lines derived from prostate cancer (DU-145 and PC3) and compared to the effect of testosterone and dihydrotestosterone (DHT). The results obtained are shown in FIGS. 2 and 3. Testosterone and dihydrotestosterone have no effect on these independent hormone lines, which is expected. On the other hand, compound 8 shows a very marked antiproliferative effect on these two lines.
3. Conclusion3. Conclusion
Les tests biologiques ont montré clairement l'activité antiproliférative du composé ferrocénique 8 sur la lignée cellulaire MDA-MB231. Les traitements des
cancers du sein se heurtent à un sérieux problème de résistance aux médicaments, en particulier le tamoxifène. Le composé 8 apparaît comme un produit prometteur, il présente une activité antiproliférative contre la lignées cellulaire MDA-MB231, lignées résistante au tamoxifène mais aussi sur des lignées de cancer de la prostate hormono indépendantes.
The biological tests clearly showed the antiproliferative activity of the ferrocenic compound 8 on the MDA-MB231 cell line. Treatments Breast cancers face a serious problem of drug resistance, especially tamoxifen. Compound 8 appears as a promising product, it exhibits antiproliferative activity against the MDA-MB231 cell lines, tamoxifen-resistant lines, but also on independent hormonal prostate cancer lines.






































