RU2829797C2 - Иммунохроматографический анализ для измерения функционального ингибитора c1-эстеразы (c1-inh) в образцах плазмы - Google Patents
Иммунохроматографический анализ для измерения функционального ингибитора c1-эстеразы (c1-inh) в образцах плазмы Download PDFInfo
- Publication number
- RU2829797C2 RU2829797C2 RU2021132766A RU2021132766A RU2829797C2 RU 2829797 C2 RU2829797 C2 RU 2829797C2 RU 2021132766 A RU2021132766 A RU 2021132766A RU 2021132766 A RU2021132766 A RU 2021132766A RU 2829797 C2 RU2829797 C2 RU 2829797C2
- Authority
- RU
- Russia
- Prior art keywords
- inh
- agent
- binding agent
- zone
- sample
- Prior art date
Links
- 238000003556 assay Methods 0.000 title description 35
- 239000003112 inhibitor Substances 0.000 title description 7
- 108010028774 Complement C1 Proteins 0.000 title description 3
- 102000016917 Complement C1 Human genes 0.000 title 1
- 239000011230 binding agent Substances 0.000 claims abstract description 208
- 108700040183 Complement C1 Inhibitor Proteins 0.000 claims abstract description 202
- 102000055157 Complement C1 Inhibitor Human genes 0.000 claims abstract description 202
- 239000003795 chemical substances by application Substances 0.000 claims abstract description 185
- 238000000034 method Methods 0.000 claims abstract description 87
- 239000012528 membrane Substances 0.000 claims abstract description 66
- 238000003032 molecular docking Methods 0.000 claims abstract description 54
- 239000000872 buffer Substances 0.000 claims abstract description 50
- 239000012472 biological sample Substances 0.000 claims abstract description 17
- 229940009550 c1 esterase inhibitor Drugs 0.000 claims abstract description 15
- 238000001514 detection method Methods 0.000 claims abstract description 12
- 238000004445 quantitative analysis Methods 0.000 claims abstract 2
- 239000000523 sample Substances 0.000 claims description 121
- 206010019860 Hereditary angioedema Diseases 0.000 claims description 87
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 claims description 58
- 238000012360 testing method Methods 0.000 claims description 52
- 230000027455 binding Effects 0.000 claims description 47
- 229960002685 biotin Drugs 0.000 claims description 47
- 239000011616 biotin Substances 0.000 claims description 47
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 38
- 239000002245 particle Substances 0.000 claims description 36
- 125000006850 spacer group Chemical group 0.000 claims description 34
- 108010090804 Streptavidin Proteins 0.000 claims description 30
- 235000020958 biotin Nutrition 0.000 claims description 29
- 210000004369 blood Anatomy 0.000 claims description 27
- 239000008280 blood Substances 0.000 claims description 27
- 230000001404 mediated effect Effects 0.000 claims description 26
- 230000007812 deficiency Effects 0.000 claims description 25
- 239000002250 absorbent Substances 0.000 claims description 24
- 230000002745 absorbent Effects 0.000 claims description 24
- 108090001008 Avidin Proteins 0.000 claims description 20
- 108010080865 Factor XII Proteins 0.000 claims description 19
- 102000000429 Factor XII Human genes 0.000 claims description 19
- 229910052693 Europium Inorganic materials 0.000 claims description 18
- OGPBJKLSAFTDLK-UHFFFAOYSA-N europium atom Chemical compound [Eu] OGPBJKLSAFTDLK-UHFFFAOYSA-N 0.000 claims description 18
- 239000004816 latex Substances 0.000 claims description 14
- 229920000126 latex Polymers 0.000 claims description 14
- 208000024891 symptom Diseases 0.000 claims description 13
- 210000002966 serum Anatomy 0.000 claims description 10
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 claims description 9
- 208000005707 acquired angioedema Diseases 0.000 claims description 8
- 239000003446 ligand Substances 0.000 claims description 6
- 238000002560 therapeutic procedure Methods 0.000 claims description 6
- GNBHRKFJIUUOQI-UHFFFAOYSA-N fluorescein Chemical compound O1C(=O)C2=CC=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 GNBHRKFJIUUOQI-UHFFFAOYSA-N 0.000 claims description 5
- 239000002096 quantum dot Substances 0.000 claims description 5
- 108010043121 Green Fluorescent Proteins Proteins 0.000 claims description 4
- 102000004144 Green Fluorescent Proteins Human genes 0.000 claims description 4
- 108010004729 Phycoerythrin Proteins 0.000 claims description 4
- 239000005090 green fluorescent protein Substances 0.000 claims description 4
- 208000026278 immune system disease Diseases 0.000 claims description 4
- 238000005259 measurement Methods 0.000 claims description 4
- PYWVYCXTNDRMGF-UHFFFAOYSA-N rhodamine B Chemical compound [Cl-].C=12C=CC(=[N+](CC)CC)C=C2OC2=CC(N(CC)CC)=CC=C2C=1C1=CC=CC=C1C(O)=O PYWVYCXTNDRMGF-UHFFFAOYSA-N 0.000 claims description 4
- GUGOEEXESWIERI-UHFFFAOYSA-N Terfenadine Chemical compound C1=CC(C(C)(C)C)=CC=C1C(O)CCCN1CCC(C(O)(C=2C=CC=CC=2)C=2C=CC=CC=2)CC1 GUGOEEXESWIERI-UHFFFAOYSA-N 0.000 claims description 3
- 230000001387 anti-histamine Effects 0.000 claims description 3
- 239000000739 antihistaminic agent Substances 0.000 claims description 3
- 239000003246 corticosteroid Substances 0.000 claims description 3
- 230000000694 effects Effects 0.000 abstract description 3
- 239000000126 substance Substances 0.000 abstract description 2
- 230000001133 acceleration Effects 0.000 abstract 1
- 108010071241 Factor XIIa Proteins 0.000 description 38
- 210000002381 plasma Anatomy 0.000 description 27
- 239000012634 fragment Substances 0.000 description 25
- 108090000623 proteins and genes Proteins 0.000 description 25
- 239000000427 antigen Substances 0.000 description 24
- 108091007433 antigens Proteins 0.000 description 24
- 102000036639 antigens Human genes 0.000 description 24
- 235000018102 proteins Nutrition 0.000 description 24
- 102000004169 proteins and genes Human genes 0.000 description 24
- 201000010099 disease Diseases 0.000 description 23
- 102000004196 processed proteins & peptides Human genes 0.000 description 18
- 108090000765 processed proteins & peptides Proteins 0.000 description 18
- 108090000113 Plasma Kallikrein Proteins 0.000 description 17
- 229920001184 polypeptide Polymers 0.000 description 17
- 102000003827 Plasma Kallikrein Human genes 0.000 description 16
- 238000005516 engineering process Methods 0.000 description 11
- 230000002829 reductive effect Effects 0.000 description 11
- 208000035475 disorder Diseases 0.000 description 10
- 239000000758 substrate Substances 0.000 description 10
- 239000007853 buffer solution Substances 0.000 description 9
- -1 cyanine Chemical class 0.000 description 9
- 239000003085 diluting agent Substances 0.000 description 9
- 239000000243 solution Substances 0.000 description 9
- 239000005018 casein Substances 0.000 description 8
- BECPQYXYKAMYBN-UHFFFAOYSA-N casein, tech. Chemical compound NCCCCC(C(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(CC(C)C)N=C(O)C(CCC(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(C(C)O)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(COP(O)(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(N)CC1=CC=CC=C1 BECPQYXYKAMYBN-UHFFFAOYSA-N 0.000 description 8
- 235000021240 caseins Nutrition 0.000 description 8
- 239000003153 chemical reaction reagent Substances 0.000 description 8
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 6
- 229930006000 Sucrose Natural products 0.000 description 6
- 239000007983 Tris buffer Substances 0.000 description 6
- 239000002274 desiccant Substances 0.000 description 6
- 239000011888 foil Substances 0.000 description 6
- 230000006870 function Effects 0.000 description 6
- 229910001112 rose gold Inorganic materials 0.000 description 6
- 239000005720 sucrose Substances 0.000 description 6
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 6
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 5
- 238000002965 ELISA Methods 0.000 description 5
- 108060003951 Immunoglobulin Proteins 0.000 description 5
- 239000007987 MES buffer Substances 0.000 description 5
- 206010030113 Oedema Diseases 0.000 description 5
- 239000013068 control sample Substances 0.000 description 5
- 239000003814 drug Substances 0.000 description 5
- 102000018358 immunoglobulin Human genes 0.000 description 5
- 230000009870 specific binding Effects 0.000 description 5
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 description 4
- BTBUEUYNUDRHOZ-UHFFFAOYSA-N Borate Chemical compound [O-]B([O-])[O-] BTBUEUYNUDRHOZ-UHFFFAOYSA-N 0.000 description 4
- NTYJJOPFIAHURM-UHFFFAOYSA-N Histamine Chemical compound NCCC1=CN=CN1 NTYJJOPFIAHURM-UHFFFAOYSA-N 0.000 description 4
- 101001081555 Homo sapiens Plasma protease C1 inhibitor Proteins 0.000 description 4
- 229920001213 Polysorbate 20 Polymers 0.000 description 4
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 description 4
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 description 4
- 230000004071 biological effect Effects 0.000 description 4
- 230000015572 biosynthetic process Effects 0.000 description 4
- 238000011088 calibration curve Methods 0.000 description 4
- 239000001913 cellulose Substances 0.000 description 4
- 229920002678 cellulose Polymers 0.000 description 4
- 229940088949 cinryze Drugs 0.000 description 4
- 238000003745 diagnosis Methods 0.000 description 4
- 238000010586 diagram Methods 0.000 description 4
- 239000010931 gold Substances 0.000 description 4
- 102000044507 human SERPING1 Human genes 0.000 description 4
- 229940127121 immunoconjugate Drugs 0.000 description 4
- 238000011534 incubation Methods 0.000 description 4
- 239000002105 nanoparticle Substances 0.000 description 4
- 239000008188 pellet Substances 0.000 description 4
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 4
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 4
- 238000002360 preparation method Methods 0.000 description 4
- RPENMORRBUTCPR-UHFFFAOYSA-M sodium;1-hydroxy-2,5-dioxopyrrolidine-3-sulfonate Chemical compound [Na+].ON1C(=O)CC(S([O-])(=O)=O)C1=O RPENMORRBUTCPR-UHFFFAOYSA-M 0.000 description 4
- 230000008961 swelling Effects 0.000 description 4
- 239000011534 wash buffer Substances 0.000 description 4
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 4
- KIUMMUBSPKGMOY-UHFFFAOYSA-N 3,3'-Dithiobis(6-nitrobenzoic acid) Chemical compound C1=C([N+]([O-])=O)C(C(=O)O)=CC(SSC=2C=C(C(=CC=2)[N+]([O-])=O)C(O)=O)=C1 KIUMMUBSPKGMOY-UHFFFAOYSA-N 0.000 description 3
- 101800004538 Bradykinin Proteins 0.000 description 3
- 108010047041 Complementarity Determining Regions Proteins 0.000 description 3
- QXZGBUJJYSLZLT-UHFFFAOYSA-N H-Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg-OH Natural products NC(N)=NCCCC(N)C(=O)N1CCCC1C(=O)N1C(C(=O)NCC(=O)NC(CC=2C=CC=CC=2)C(=O)NC(CO)C(=O)N2C(CCC2)C(=O)NC(CC=2C=CC=CC=2)C(=O)NC(CCCN=C(N)N)C(O)=O)CCC1 QXZGBUJJYSLZLT-UHFFFAOYSA-N 0.000 description 3
- 108010067060 Immunoglobulin Variable Region Proteins 0.000 description 3
- 102000017727 Immunoglobulin Variable Region Human genes 0.000 description 3
- 102000001399 Kallikrein Human genes 0.000 description 3
- 108060005987 Kallikrein Proteins 0.000 description 3
- 102100035792 Kininogen-1 Human genes 0.000 description 3
- 102100027637 Plasma protease C1 inhibitor Human genes 0.000 description 3
- 239000004743 Polypropylene Substances 0.000 description 3
- 230000004913 activation Effects 0.000 description 3
- 238000004458 analytical method Methods 0.000 description 3
- 102000023732 binding proteins Human genes 0.000 description 3
- 108091008324 binding proteins Proteins 0.000 description 3
- QXZGBUJJYSLZLT-FDISYFBBSA-N bradykinin Chemical compound NC(=N)NCCC[C@H](N)C(=O)N1CCC[C@H]1C(=O)N1[C@H](C(=O)NCC(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)N[C@@H](CO)C(=O)N2[C@@H](CCC2)C(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)CCC1 QXZGBUJJYSLZLT-FDISYFBBSA-N 0.000 description 3
- 230000000295 complement effect Effects 0.000 description 3
- 230000001419 dependent effect Effects 0.000 description 3
- 238000011156 evaluation Methods 0.000 description 3
- 239000003365 glass fiber Substances 0.000 description 3
- 229910052737 gold Inorganic materials 0.000 description 3
- 230000036541 health Effects 0.000 description 3
- 238000010438 heat treatment Methods 0.000 description 3
- 238000003018 immunoassay Methods 0.000 description 3
- 230000003993 interaction Effects 0.000 description 3
- 239000000463 material Substances 0.000 description 3
- 230000035800 maturation Effects 0.000 description 3
- 238000012544 monitoring process Methods 0.000 description 3
- 230000037361 pathway Effects 0.000 description 3
- 229920001155 polypropylene Polymers 0.000 description 3
- 239000002243 precursor Substances 0.000 description 3
- 239000000047 product Substances 0.000 description 3
- 238000012216 screening Methods 0.000 description 3
- 241000894007 species Species 0.000 description 3
- 201000000596 systemic lupus erythematosus Diseases 0.000 description 3
- 229940124597 therapeutic agent Drugs 0.000 description 3
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 2
- ZOCSXAVNDGMNBV-UHFFFAOYSA-N 5-amino-1-[2,6-dichloro-4-(trifluoromethyl)phenyl]-4-[(trifluoromethyl)sulfinyl]-1H-pyrazole-3-carbonitrile Chemical compound NC1=C(S(=O)C(F)(F)F)C(C#N)=NN1C1=C(Cl)C=C(C(F)(F)F)C=C1Cl ZOCSXAVNDGMNBV-UHFFFAOYSA-N 0.000 description 2
- 208000028185 Angioedema Diseases 0.000 description 2
- BPYKTIZUTYGOLE-IFADSCNNSA-N Bilirubin Chemical compound N1C(=O)C(C)=C(C=C)\C1=C\C1=C(C)C(CCC(O)=O)=C(CC2=C(C(C)=C(\C=C/3C(=C(C=C)C(=O)N\3)C)N2)CCC(O)=O)N1 BPYKTIZUTYGOLE-IFADSCNNSA-N 0.000 description 2
- 108010073361 BioXtra Proteins 0.000 description 2
- 206010048962 Brain oedema Diseases 0.000 description 2
- 102100025406 Complement C1s subcomponent Human genes 0.000 description 2
- 208000007342 Diabetic Nephropathies Diseases 0.000 description 2
- 206010061818 Disease progression Diseases 0.000 description 2
- 102000004190 Enzymes Human genes 0.000 description 2
- 108090000790 Enzymes Proteins 0.000 description 2
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 2
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 2
- 102000013463 Immunoglobulin Light Chains Human genes 0.000 description 2
- 108010065825 Immunoglobulin Light Chains Proteins 0.000 description 2
- 239000000020 Nitrocellulose Substances 0.000 description 2
- 239000004698 Polyethylene Substances 0.000 description 2
- 239000002202 Polyethylene glycol Substances 0.000 description 2
- 102000012479 Serine Proteases Human genes 0.000 description 2
- 108010022999 Serine Proteases Proteins 0.000 description 2
- 208000006011 Stroke Diseases 0.000 description 2
- PPBRXRYQALVLMV-UHFFFAOYSA-N Styrene Chemical compound C=CC1=CC=CC=C1 PPBRXRYQALVLMV-UHFFFAOYSA-N 0.000 description 2
- 208000007536 Thrombosis Diseases 0.000 description 2
- 238000002835 absorbance Methods 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- MWPLVEDNUUSJAV-UHFFFAOYSA-N anthracene Chemical compound C1=CC=CC2=CC3=CC=CC=C3C=C21 MWPLVEDNUUSJAV-UHFFFAOYSA-N 0.000 description 2
- 239000002981 blocking agent Substances 0.000 description 2
- 208000006752 brain edema Diseases 0.000 description 2
- 230000003197 catalytic effect Effects 0.000 description 2
- 210000004027 cell Anatomy 0.000 description 2
- 230000015271 coagulation Effects 0.000 description 2
- 238000005345 coagulation Methods 0.000 description 2
- 230000002860 competitive effect Effects 0.000 description 2
- 230000004154 complement system Effects 0.000 description 2
- 150000001875 compounds Chemical class 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- 230000002596 correlated effect Effects 0.000 description 2
- 230000000875 corresponding effect Effects 0.000 description 2
- 230000003013 cytotoxicity Effects 0.000 description 2
- 231100000135 cytotoxicity Toxicity 0.000 description 2
- 208000033679 diabetic kidney disease Diseases 0.000 description 2
- 230000005750 disease progression Effects 0.000 description 2
- 229940088598 enzyme Drugs 0.000 description 2
- 239000007850 fluorescent dye Substances 0.000 description 2
- 239000000576 food coloring agent Substances 0.000 description 2
- 229960001340 histamine Drugs 0.000 description 2
- 230000005764 inhibitory process Effects 0.000 description 2
- 238000002347 injection Methods 0.000 description 2
- 239000007924 injection Substances 0.000 description 2
- 238000003475 lamination Methods 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 210000003657 middle cerebral artery Anatomy 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 229920001220 nitrocellulos Polymers 0.000 description 2
- 239000004033 plastic Substances 0.000 description 2
- 229920003023 plastic Polymers 0.000 description 2
- 239000004417 polycarbonate Substances 0.000 description 2
- 229920000515 polycarbonate Polymers 0.000 description 2
- 229920000573 polyethylene Polymers 0.000 description 2
- 229920001223 polyethylene glycol Polymers 0.000 description 2
- 238000003908 quality control method Methods 0.000 description 2
- 238000011002 quantification Methods 0.000 description 2
- 239000011541 reaction mixture Substances 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 230000004044 response Effects 0.000 description 2
- 239000012146 running buffer Substances 0.000 description 2
- 238000005070 sampling Methods 0.000 description 2
- 239000004065 semiconductor Substances 0.000 description 2
- 238000003860 storage Methods 0.000 description 2
- ANRHNWWPFJCPAZ-UHFFFAOYSA-M thionine Chemical class [Cl-].C1=CC(N)=CC2=[S+]C3=CC(N)=CC=C3N=C21 ANRHNWWPFJCPAZ-UHFFFAOYSA-M 0.000 description 2
- SLLFVLKNXABYGI-UHFFFAOYSA-N 1,2,3-benzoxadiazole Chemical compound C1=CC=C2ON=NC2=C1 SLLFVLKNXABYGI-UHFFFAOYSA-N 0.000 description 1
- NFGXHKASABOEEW-UHFFFAOYSA-N 1-methylethyl 11-methoxy-3,7,11-trimethyl-2,4-dodecadienoate Chemical compound COC(C)(C)CCCC(C)CC=CC(C)=CC(=O)OC(C)C NFGXHKASABOEEW-UHFFFAOYSA-N 0.000 description 1
- VGIRNWJSIRVFRT-UHFFFAOYSA-N 2',7'-difluorofluorescein Chemical compound OC(=O)C1=CC=CC=C1C1=C2C=C(F)C(=O)C=C2OC2=CC(O)=C(F)C=C21 VGIRNWJSIRVFRT-UHFFFAOYSA-N 0.000 description 1
- MPPQGYCZBNURDG-UHFFFAOYSA-N 2-propionyl-6-dimethylaminonaphthalene Chemical compound C1=C(N(C)C)C=CC2=CC(C(=O)CC)=CC=C21 MPPQGYCZBNURDG-UHFFFAOYSA-N 0.000 description 1
- BNBQQYFXBLBYJK-UHFFFAOYSA-N 2-pyridin-2-yl-1,3-oxazole Chemical compound C1=COC(C=2N=CC=CC=2)=N1 BNBQQYFXBLBYJK-UHFFFAOYSA-N 0.000 description 1
- UWAUSMGZOHPBJJ-UHFFFAOYSA-N 4-nitro-1,2,3-benzoxadiazole Chemical compound [O-][N+](=O)C1=CC=CC2=C1N=NO2 UWAUSMGZOHPBJJ-UHFFFAOYSA-N 0.000 description 1
- 208000004998 Abdominal Pain Diseases 0.000 description 1
- 206010001052 Acute respiratory distress syndrome Diseases 0.000 description 1
- 241001552669 Adonis annua Species 0.000 description 1
- 208000024827 Alzheimer disease Diseases 0.000 description 1
- 206010002198 Anaphylactic reaction Diseases 0.000 description 1
- 206010002388 Angina unstable Diseases 0.000 description 1
- 108010064733 Angiotensins Proteins 0.000 description 1
- 102000015427 Angiotensins Human genes 0.000 description 1
- 206010003178 Arterial thrombosis Diseases 0.000 description 1
- 206010003497 Asphyxia Diseases 0.000 description 1
- 208000023275 Autoimmune disease Diseases 0.000 description 1
- 229940123765 Bradykinin B2 receptor antagonist Drugs 0.000 description 1
- 201000006474 Brain Ischemia Diseases 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 208000024172 Cardiovascular disease Diseases 0.000 description 1
- 206010008120 Cerebral ischaemia Diseases 0.000 description 1
- 208000018380 Chemical injury Diseases 0.000 description 1
- VYZAMTAEIAYCRO-UHFFFAOYSA-N Chromium Chemical compound [Cr] VYZAMTAEIAYCRO-UHFFFAOYSA-N 0.000 description 1
- 208000006545 Chronic Obstructive Pulmonary Disease Diseases 0.000 description 1
- 208000011231 Crohn disease Diseases 0.000 description 1
- 201000003883 Cystic fibrosis Diseases 0.000 description 1
- 206010012689 Diabetic retinopathy Diseases 0.000 description 1
- 208000010201 Exanthema Diseases 0.000 description 1
- 108010008177 Fd immunoglobulins Proteins 0.000 description 1
- 102000003886 Glycoproteins Human genes 0.000 description 1
- 108090000288 Glycoproteins Proteins 0.000 description 1
- 201000005569 Gout Diseases 0.000 description 1
- 206010062506 Heparin-induced thrombocytopenia Diseases 0.000 description 1
- 102100027619 Histidine-rich glycoprotein Human genes 0.000 description 1
- 206010055171 Hypertensive nephropathy Diseases 0.000 description 1
- 206010073257 Idiopathic angioedema Diseases 0.000 description 1
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 1
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 1
- 102000006496 Immunoglobulin Heavy Chains Human genes 0.000 description 1
- 108010019476 Immunoglobulin Heavy Chains Proteins 0.000 description 1
- 208000026350 Inborn Genetic disease Diseases 0.000 description 1
- 206010061218 Inflammation Diseases 0.000 description 1
- 206010065390 Inflammatory pain Diseases 0.000 description 1
- 208000005777 Lupus Nephritis Diseases 0.000 description 1
- 206010025323 Lymphomas Diseases 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- 102100033320 Lysosomal Pro-X carboxypeptidase Human genes 0.000 description 1
- 208000001344 Macular Edema Diseases 0.000 description 1
- 206010025415 Macular oedema Diseases 0.000 description 1
- 101710136697 Modular serine protease Proteins 0.000 description 1
- 206010028813 Nausea Diseases 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 208000012902 Nervous system disease Diseases 0.000 description 1
- 208000025966 Neurological disease Diseases 0.000 description 1
- 239000004677 Nylon Substances 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 201000009859 Osteochondrosis Diseases 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 239000002033 PVDF binder Substances 0.000 description 1
- 208000002193 Pain Diseases 0.000 description 1
- 102000035195 Peptidases Human genes 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- 206010054048 Postoperative ileus Diseases 0.000 description 1
- WDVSHHCDHLJJJR-UHFFFAOYSA-N Proflavine Chemical compound C1=CC(N)=CC2=NC3=CC(N)=CC=C3C=C21 WDVSHHCDHLJJJR-UHFFFAOYSA-N 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- 229940124158 Protease/peptidase inhibitor Drugs 0.000 description 1
- 208000010378 Pulmonary Embolism Diseases 0.000 description 1
- 208000013616 Respiratory Distress Syndrome Diseases 0.000 description 1
- 206010040047 Sepsis Diseases 0.000 description 1
- 206010040070 Septic Shock Diseases 0.000 description 1
- 102000008847 Serpin Human genes 0.000 description 1
- 108050000761 Serpin Proteins 0.000 description 1
- 108010003723 Single-Domain Antibodies Proteins 0.000 description 1
- 208000001435 Thromboembolism Diseases 0.000 description 1
- 208000030886 Traumatic Brain injury Diseases 0.000 description 1
- 208000007814 Unstable Angina Diseases 0.000 description 1
- 206010047115 Vasculitis Diseases 0.000 description 1
- 206010047249 Venous thrombosis Diseases 0.000 description 1
- 206010047700 Vomiting Diseases 0.000 description 1
- ZHAFUINZIZIXFC-UHFFFAOYSA-N [9-(dimethylamino)-10-methylbenzo[a]phenoxazin-5-ylidene]azanium;chloride Chemical compound [Cl-].O1C2=CC(=[NH2+])C3=CC=CC=C3C2=NC2=C1C=C(N(C)C)C(C)=C2 ZHAFUINZIZIXFC-UHFFFAOYSA-N 0.000 description 1
- DPKHZNPWBDQZCN-UHFFFAOYSA-N acridine orange free base Chemical compound C1=CC(N(C)C)=CC2=NC3=CC(N(C)C)=CC=C3C=C21 DPKHZNPWBDQZCN-UHFFFAOYSA-N 0.000 description 1
- BGLGAKMTYHWWKW-UHFFFAOYSA-N acridine yellow Chemical compound [H+].[Cl-].CC1=C(N)C=C2N=C(C=C(C(C)=C3)N)C3=CC2=C1 BGLGAKMTYHWWKW-UHFFFAOYSA-N 0.000 description 1
- 150000001251 acridines Chemical class 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- 201000000028 adult respiratory distress syndrome Diseases 0.000 description 1
- 208000026935 allergic disease Diseases 0.000 description 1
- 230000000172 allergic effect Effects 0.000 description 1
- 150000001413 amino acids Chemical group 0.000 description 1
- 230000036783 anaphylactic response Effects 0.000 description 1
- 208000003455 anaphylaxis Diseases 0.000 description 1
- 230000033115 angiogenesis Effects 0.000 description 1
- 238000002399 angioplasty Methods 0.000 description 1
- 230000000890 antigenic effect Effects 0.000 description 1
- 229940027998 antiseptic and disinfectant acridine derivative Drugs 0.000 description 1
- 208000007474 aortic aneurysm Diseases 0.000 description 1
- 210000001367 artery Anatomy 0.000 description 1
- 239000012131 assay buffer Substances 0.000 description 1
- 230000000712 assembly Effects 0.000 description 1
- 238000000429 assembly Methods 0.000 description 1
- 208000006673 asthma Diseases 0.000 description 1
- JPIYZTWMUGTEHX-UHFFFAOYSA-N auramine O free base Chemical compound C1=CC(N(C)C)=CC=C1C(=N)C1=CC=C(N(C)C)C=C1 JPIYZTWMUGTEHX-UHFFFAOYSA-N 0.000 description 1
- 239000011324 bead Substances 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- DZBUGLKDJFMEHC-UHFFFAOYSA-N benzoquinolinylidene Natural products C1=CC=CC2=CC3=CC=CC=C3N=C21 DZBUGLKDJFMEHC-UHFFFAOYSA-N 0.000 description 1
- 230000008236 biological pathway Effects 0.000 description 1
- 230000023555 blood coagulation Effects 0.000 description 1
- 210000001772 blood platelet Anatomy 0.000 description 1
- 238000009534 blood test Methods 0.000 description 1
- 210000004204 blood vessel Anatomy 0.000 description 1
- 239000003359 bradykinin B2 receptor antagonist Substances 0.000 description 1
- 210000004899 c-terminal region Anatomy 0.000 description 1
- 210000001736 capillary Anatomy 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- CZPLANDPABRVHX-UHFFFAOYSA-N cascade blue Chemical compound C=1C2=CC=CC=C2C(NCC)=CC=1C(C=1C=CC(=CC=1)N(CC)CC)=C1C=CC(=[N+](CC)CC)C=C1 CZPLANDPABRVHX-UHFFFAOYSA-N 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 206010008118 cerebral infarction Diseases 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 238000012875 competitive assay Methods 0.000 description 1
- 230000009137 competitive binding Effects 0.000 description 1
- 108010020742 complement C1 inhibitor Ta Proteins 0.000 description 1
- 230000024203 complement activation Effects 0.000 description 1
- 238000004590 computer program Methods 0.000 description 1
- 208000029078 coronary artery disease Diseases 0.000 description 1
- 150000001893 coumarin derivatives Chemical class 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 125000001295 dansyl group Chemical group [H]C1=C([H])C(N(C([H])([H])[H])C([H])([H])[H])=C2C([H])=C([H])C([H])=C(C2=C1[H])S(*)(=O)=O 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 238000012217 deletion Methods 0.000 description 1
- 230000037430 deletion Effects 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 238000002405 diagnostic procedure Methods 0.000 description 1
- 238000010494 dissociation reaction Methods 0.000 description 1
- 230000005593 dissociations Effects 0.000 description 1
- 239000012636 effector Substances 0.000 description 1
- 210000002889 endothelial cell Anatomy 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- YQGOJNYOYNNSMM-UHFFFAOYSA-N eosin Chemical compound [Na+].OC(=O)C1=CC=CC=C1C1=C2C=C(Br)C(=O)C(Br)=C2OC2=C(Br)C(O)=C(Br)C=C21 YQGOJNYOYNNSMM-UHFFFAOYSA-N 0.000 description 1
- 210000003743 erythrocyte Anatomy 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 201000005884 exanthem Diseases 0.000 description 1
- 230000005284 excitation Effects 0.000 description 1
- 230000007717 exclusion Effects 0.000 description 1
- 238000013213 extrapolation Methods 0.000 description 1
- 208000030533 eye disease Diseases 0.000 description 1
- 239000011152 fibreglass Substances 0.000 description 1
- 230000020764 fibrinolysis Effects 0.000 description 1
- 108091006047 fluorescent proteins Proteins 0.000 description 1
- 102000034287 fluorescent proteins Human genes 0.000 description 1
- 235000015219 food category Nutrition 0.000 description 1
- 230000007274 generation of a signal involved in cell-cell signaling Effects 0.000 description 1
- 208000016361 genetic disease Diseases 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 108010044853 histidine-rich proteins Proteins 0.000 description 1
- 210000004408 hybridoma Anatomy 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 230000002779 inactivation Effects 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 208000027866 inflammatory disease Diseases 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 230000028709 inflammatory response Effects 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 201000004332 intermediate coronary syndrome Diseases 0.000 description 1
- 230000000968 intestinal effect Effects 0.000 description 1
- 208000028867 ischemia Diseases 0.000 description 1
- 229940039088 kininogenase Drugs 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 108010057284 lysosomal Pro-X carboxypeptidase Proteins 0.000 description 1
- 201000010230 macular retinal edema Diseases 0.000 description 1
- FDZZZRQASAIRJF-UHFFFAOYSA-M malachite green Chemical compound [Cl-].C1=CC(N(C)C)=CC=C1C(C=1C=CC=CC=1)=C1C=CC(=[N+](C)C)C=C1 FDZZZRQASAIRJF-UHFFFAOYSA-M 0.000 description 1
- 229940107698 malachite green Drugs 0.000 description 1
- 230000036210 malignancy Effects 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- DZVCFNFOPIZQKX-LTHRDKTGSA-M merocyanine Chemical compound [Na+].O=C1N(CCCC)C(=O)N(CCCC)C(=O)C1=C\C=C\C=C/1N(CCCS([O-])(=O)=O)C2=CC=CC=C2O\1 DZVCFNFOPIZQKX-LTHRDKTGSA-M 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 239000000203 mixture Substances 0.000 description 1
- 150000002772 monosaccharides Chemical group 0.000 description 1
- 229940126619 mouse monoclonal antibody Drugs 0.000 description 1
- 230000035772 mutation Effects 0.000 description 1
- 150000002790 naphthalenes Chemical class 0.000 description 1
- 230000008693 nausea Effects 0.000 description 1
- 208000004296 neuralgia Diseases 0.000 description 1
- 208000021722 neuropathic pain Diseases 0.000 description 1
- XJCPMUIIBDVFDM-UHFFFAOYSA-M nile blue A Chemical compound [Cl-].C1=CC=C2C3=NC4=CC=C(N(CC)CC)C=C4[O+]=C3C=C(N)C2=C1 XJCPMUIIBDVFDM-UHFFFAOYSA-M 0.000 description 1
- VOFUROIFQGPCGE-UHFFFAOYSA-N nile red Chemical compound C1=CC=C2C3=NC4=CC=C(N(CC)CC)C=C4OC3=CC(=O)C2=C1 VOFUROIFQGPCGE-UHFFFAOYSA-N 0.000 description 1
- 150000007523 nucleic acids Chemical class 0.000 description 1
- 102000039446 nucleic acids Human genes 0.000 description 1
- 108020004707 nucleic acids Proteins 0.000 description 1
- 229920001778 nylon Polymers 0.000 description 1
- 201000008482 osteoarthritis Diseases 0.000 description 1
- 150000004866 oxadiazoles Chemical class 0.000 description 1
- GHTWDWCFRFTBRB-UHFFFAOYSA-M oxazine-170 Chemical compound [O-]Cl(=O)(=O)=O.N1=C2C3=CC=CC=C3C(NCC)=CC2=[O+]C2=C1C=C(C)C(N(C)CC)=C2 GHTWDWCFRFTBRB-UHFFFAOYSA-M 0.000 description 1
- 150000004893 oxazines Chemical class 0.000 description 1
- 230000008506 pathogenesis Effects 0.000 description 1
- 239000013610 patient sample Substances 0.000 description 1
- 239000000137 peptide hydrolase inhibitor Substances 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 230000002085 persistent effect Effects 0.000 description 1
- 239000012071 phase Substances 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- IEQIEDJGQAUEQZ-UHFFFAOYSA-N phthalocyanine Chemical compound N1C(N=C2C3=CC=CC=C3C(N=C3C4=CC=CC=C4C(=N4)N3)=N2)=C(C=CC=C2)C2=C1N=C1C2=CC=CC=C2C4=N1 IEQIEDJGQAUEQZ-UHFFFAOYSA-N 0.000 description 1
- 239000000902 placebo Substances 0.000 description 1
- 229940068196 placebo Drugs 0.000 description 1
- 229920001343 polytetrafluoroethylene Polymers 0.000 description 1
- 239000004810 polytetrafluoroethylene Substances 0.000 description 1
- 239000004800 polyvinyl chloride Substances 0.000 description 1
- 229920000915 polyvinyl chloride Polymers 0.000 description 1
- 229920002981 polyvinylidene fluoride Polymers 0.000 description 1
- RKCAIXNGYQCCAL-UHFFFAOYSA-N porphin Chemical compound N1C(C=C2N=C(C=C3NC(=C4)C=C3)C=C2)=CC=C1C=C1C=CC4=N1 RKCAIXNGYQCCAL-UHFFFAOYSA-N 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 229960000286 proflavine Drugs 0.000 description 1
- 230000000770 proinflammatory effect Effects 0.000 description 1
- 230000006337 proteolytic cleavage Effects 0.000 description 1
- 208000007153 proteostasis deficiencies Diseases 0.000 description 1
- 150000003220 pyrenes Chemical class 0.000 description 1
- 206010037844 rash Diseases 0.000 description 1
- 238000010188 recombinant method Methods 0.000 description 1
- 230000000306 recurrent effect Effects 0.000 description 1
- 230000010410 reperfusion Effects 0.000 description 1
- 208000023504 respiratory system disease Diseases 0.000 description 1
- 208000037803 restenosis Diseases 0.000 description 1
- 206010039073 rheumatoid arthritis Diseases 0.000 description 1
- 206010039083 rhinitis Diseases 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 230000036303 septic shock Effects 0.000 description 1
- 239000001488 sodium phosphate Substances 0.000 description 1
- 229910000162 sodium phosphate Inorganic materials 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 208000005198 spinal stenosis Diseases 0.000 description 1
- 230000002269 spontaneous effect Effects 0.000 description 1
- 239000011550 stock solution Substances 0.000 description 1
- 208000003265 stomatitis Diseases 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- MPLHNVLQVRSVEE-UHFFFAOYSA-N texas red Chemical compound [O-]S(=O)(=O)C1=CC(S(Cl)(=O)=O)=CC=C1C(C1=CC=2CCCN3CCCC(C=23)=C1O1)=C2C1=C(CCC1)C3=[N+]1CCCC3=C2 MPLHNVLQVRSVEE-UHFFFAOYSA-N 0.000 description 1
- 210000001519 tissue Anatomy 0.000 description 1
- 208000037816 tissue injury Diseases 0.000 description 1
- 230000009529 traumatic brain injury Effects 0.000 description 1
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 1
- 210000005166 vasculature Anatomy 0.000 description 1
- 210000003462 vein Anatomy 0.000 description 1
- 230000002861 ventricular Effects 0.000 description 1
- 238000012800 visualization Methods 0.000 description 1
- 230000008673 vomiting Effects 0.000 description 1
- 125000001834 xanthenyl group Chemical class C1=CC=CC=2OC3=CC=CC=C3C(C12)* 0.000 description 1
Images
Abstract
Настоящее изобретение относится к устройствам и способам для качественной и/или количественной детекции функционального C1-INH (fC1-INH). Устройство для детекции и/или количественного анализа функционального ингибитора C1-эстеразы (fC1-INH) содержит: (i) прокладку конъюгата, содержащую первую зону и вторую зону, где первая зона содержит первое средство, и вторая зона содержит второе средство соответственно и (ii) мембрану, соединенную с прокладкой конъюгата. Где мембрана содержит третью зону, где третья зона содержит третье средство, где первое средство является средством, связывающим функциональный ингибитор C1 (fC1-INH), или средством, связывающим ингибитор C1 (C1-INH), и второе средство является fC1-INH-связывающим средством или C1-INH-связывающим средством. При этом первое средство и второе средство отличаются друг от друга. Третье средство представляет собой средство захвата, способное связываться со средством докинга. Одно из fC1-INH-связывающего средства и C1-INH-связывающего средства конъюгировано с детектируемой меткой, и одно из fC1-INH-связывающего средства и C1-INH-связывающего средства конъюгировано со средством докинга. При этом детектируемая метка и средство докинга конъюгированы с разными связывающими средствами. Прокладка конъюгата дополнительно содержит четвертую зону для размещения биологического образца и пятую зону для размещения буфера, где буфер протекает через устройство в следующем порядке: первая зона, вторая зона и третья зона. Техническим результатом является ускорение процесса. 3 н. и 52 з.п. ф-лы, 20 ил., 11 табл.
Description
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет согласно 35 U.S.C. § 119(e) по временной патентной заявке США № 62/833235, поданной 12 апреля 2019 года, и временной патентной заявке США № 62/930615, поданной 5 ноября 2019 года, содержание каждой из которых включено в настоящее описание в качестве ссылки.
УРОВЕНЬ ТЕХНИКИ
Ингибитор C1-эстеразы (также известный как C1-ингибитор или C1-INH) является ингибитором протеазы, принадлежащей к суперсемейству серпинов. Его основной функцией является ингибирование системы комплемента для предотвращения спонтанной активации. C1-INH также является эндогенным ингибитором калликреина плазмы (pKal). Аутосомно-доминантная мутация C1-INH приводит к наследственному ангионевротическому отеку (HAE), включая HAE типов I и II.
В существующих анализах, используемых для оценки функционального уровня C1-INH, измеряют ингибирование C1s из каскада комплемента под действием C1-INH, используя хромогенный анализ или комплексный способ ELISA. Хромогенный анализ, как правило, считают предпочтительным, но оба способа имеют ограничения. Хромогенный анализ чаще дает ложноположительные результаты, в то время как комплексный ELISA имеет прогностическую ценность отрицательного результата всего лишь 62%.
Представляет интерес разработка новых тестов и/или платформ для измерения функционального C1-INH, вовлеченного в патогенез заболевания HAE.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к устройствам и способам для детекции функционального C1-INH (fC1-INH) качественным и/или количественным образом, являющимся быстрым и экономически эффективным. В некоторых вариантах осуществления детекции fC1-INH достигают с использованием устройства, сконфигурированного для детекции и/или количественного анализа fC1-INH посредством иммунохроматографического анализа (LFA).
Таким образом, один из аспектов настоящего изобретения относится к устройству для детекции и/или количественного анализа функционального ингибитора C1-эстеразы (fC1-INH), устройству, содержащему (i) прокладку конъюгата, содержащую первую зону и вторую зону, на которой иммобилизованы первое средство и второе средство, соответственно, и (ii) мембрану, соединенную с прокладкой конъюгата, где мембрана содержит третью зону, на которой иммобилизовано третье средство. Первое средство может являться средством, связывающимся с функциональным C1-ингибитором (fC1-INH), или средством, связывающимся с C1-ингибитором (C1-INH). Второе средство и третье средство являются одним из средства, связывающегося с функциональным C1-ингибитором (fC1-INH), средства, связывающегося с C1-ингибитором (C1-INH), и средства захвата. Первое средство, второе средство и третье средство отличаются друг от друга. Одно из fC1-INH-связывающего средства, C1-INH-связывающего средства и средства захвата конъюгировано с детектируемой меткой, и одно из fC1-INH-связывающего средства и C1-INH-связывающего средства конъюгировано со средством докинга. Детектируемая метка и средство докинга конъюгированы с разными средствами. Прокладка конъюгата дополнительно содержит четвертую зону для размещения биологического образца, протекающего через устройство в следующем порядке: первая зона, вторая зона и третья зона. В некоторых случаях четвертая зона для размещения биологического образца может перекрываться со второй зоной, на которой может находиться fC1-INH-связывающее средство.
В некоторых вариантах осуществления первое средство, второе средство и третье средство являются C1-INH-связывающим средством, fC1-INH-связывающим средством и средством захвата, соответственно. В других вариантах осуществления первое средство, второе средство и третье средство являются fC1-INH-связывающим средством, C1-INH-связывающим средством и средством захвата, соответственно.
В некоторых примерах первое средство конъюгировано с детектируемой меткой, второе средство конъюгировано со средством докинга. В других примерах первое средство конъюгировано со средством докинга, второе средство конъюгировано с детектируемой меткой.
В некоторых вариантах осуществления fC1-INH-связывающее средство может являться активной формой фактора XII (FXIIa). Альтернативно или дополнительно, C1-INH-связывающее средство может являться антителом, связывающимся с C1-INH. Кроме того, средство докинга и средство захвата могут являться членами пары рецептор-лиганд. Например, пара рецептор-лиганд может содержать биотин и авидин (например, стрептавидин или полистрептавидин).
В некоторых вариантах осуществления детектируемая метка может представлять собой европий, коллоидное золото, фикоэритрин, флуоресцеин, родамин, зеленый флуоресцентный белок, квантовую точку и хромофор. В некоторых вариантах осуществления детектируемая метка является европием. В некоторых случаях, детектируемую метку можно присоединять к латексным частицам.
В одном из примеров первое средство является C1-INH-связывающим средством, находящимся на первой зоне, второе средство является fC1-INH-связывающим средством, находящимся на второй зоне, и третье средство является средством захвата, находящимся на третьей зоне. C1-INH-связывающее средство может являться антителом, связывающимся с C1-INH, которое можно конъюгировать с детектируемой меткой, как представлено в настоящем описании. Альтернативно или дополнительно, fC1-INH-связывающее средство может являться FXIIa, который можно конъюгировать со средством докинга (например, биотином). Кроме того, средство захвата может являться авидином, таким как стрептавидин или полистрептавидин.
В некоторых вариантах осуществления устройство дополнительно содержит прокладку абсорбента, соединенную с мембраной. Прокладку абсорбента и прокладку конъюгата можно разделять мембраной. Альтернативно или дополнительно, устройство может дополнительно содержат опорный элемент, на который устанавливают прокладку конъюгата, мембрану и/или прокладку абсорбента.
Кроме того, устройство также может содержать корпус. В некоторых вариантах осуществления корпус может содержать первое отверстие, образующее буферный порт, второе отверстие, образующее порт для образца, и третье отверстие, образующее тестовое окно. Порт для образца может находиться между буферным портом и тестовым окном. В некоторых примерах буферный порт может быть выровнен с первой зоной, на которой находится C1-INH-связывающее средство. В некоторых примерах порт для образца может быть выровнен со второй зоной, на которой находится fC1-INH-связывающее средство. В некоторых примерах тестовое окно выровнено с третьей зоной, на которой находится средство захвата.
В другом аспекте настоящее изобретение относится к способам детекции и/или количественного анализа функционального ингибитора C1-эстеразы (fC1-INH) в образце с использованием любых из устройств для LFA, представленных в настоящем описании. Такой способ может включать: (i) помещение образца в порт для образца устройства, представленного в настоящем описании, (ii) помещение буфера в буферный порт в устройстве, где буфер протекает в направлении от первой зоны к третьей зоне; (iii) изучение сигнала в тестовом окне устройства, и (iv) определение наличия или измерение уровня fC1-INH в образце с учетом наличия или интенсивности сигнала в тестовом окне. В некоторых вариантах осуществления стадию (ii) осуществляют через по меньшей мере 5 минут после стадии (i). fC1-INH-связывающее средство можно иммобилизовать на второй зоне, которая может быть выровнена с портом для образца.
Настоящее изобретение также относится к способам детекции и/или количественного анализа функционального ингибитора C1-эстеразы (fC1-INH) в образце, включающим (i) приведение образца в контакт с fC1-INH-связывающим средством, C1-INH-связывающим средством и средством захвата для образования комплекса, где одно из fC1-INH-связывающего средства и C1-INH-связывающего средства конъюгировано со средством докинга, связывающимся со средством захвата, и где одно из fC1-INH-связывающего средства, C1-INH-связывающего средства и средства захвата конъюгировано с детектируемой меткой, при этом детектируемая метка и средство докинга конъюгированы с другим средством; и (ii) детекцию сигнала, высвобождаемого из детектируемой метки в комплексе; где наличие сигнала, высвобождаемого из детектируемой метки в комплексе, свидетельствует о наличии fC1-INH в образце. Любое из fC1-INH-связывающего средства, C1-INH-связывающего средства, средства докинга, детектируемой метки и средства захвата, представленных в настоящем описании, можно использовать в способах, представленных в настоящем описании.
В некоторых вариантах осуществления стадию (i) можно осуществлять посредством (a) инкубации образца с fC1-INH-связывающим средством в течение по меньшей мере 5 минут, и (b) приведение образца в контакт с C1-INH-связывающим средством и средством захвата. В других вариантах осуществления стадию (i) осуществляют посредством (a) инкубации образца с fC1-INH-связывающим средством в течение по меньшей мере 5 минут для образования первого комплекса, (b) приведение первого комплекса в контакт с C1-INH-связывающим средством для образования второго комплекса, и (c) приведение второго комплекса в контакт со средством захвата для образования комплекса, и где средство захвата иммобилизовано на опорном элементе.
В любом из способов анализов, представленных в настоящем описании, образец, подлежащий анализу, может являться биологическим образцом, полученным из индивидуума, например, образцом сыворотки, образцом плазмы или образцом крови (например, цельной крови). В некоторых вариантах осуществления индивидуум может являться пациентом-человеком, как предполагают, имеющим опосредованное недостаточностью fC1-INH нарушение или имеющим риск его развития, включающего, в качестве неограничивающих примеров, наследственный ангионевротический отек (HAE), приобретенный ангионевротический отек (AAE) и C1-INH-связанное иммунное заболевание. В некоторых вариантах осуществления индивидуум имеет симптом HAE. В некоторых вариантах осуществления HAE является HAE типа I или HAE типа II. В других вариантах осуществления индивидуум не имеет симптомов HAE, не имеет симптомов HAE в анамнезе или не имеет HAE в анамнезе. В некоторых вариантах осуществления индивидуум резистентен к антигистаминной терапии, терапии кортикостероидами или и той, и другой.
Подробности нескольких вариантов осуществления устройств и способов, представленных в настоящем описании, приведены на сопутствующих фигурах и в подробном описании. Другие признаки, цели и преимущества устройств и способов, представленных в настоящем описании, будут очевидны из описания и формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Различные аспекты и варианты осуществления будут описаны со ссылкой на следующие фигуры. Фигуры не всегда нарисованы в масштабе.
Фиг. 1 является схемой примера устройства для иммунохроматографического анализа (LFA) 100 для детекции и/или количественного анализа функционального ингибитора C1-эстеразы (fC1-INH). Устройство для LFA 100 содержит прокладку конъюгата 200, мембрану 300 и, необязательно, прокладку абсорбента 400, и опорный элемент 500 в некоторых вариантах осуществления технологии, представленной в настоящем описании.
Фиг. 2 является схемой примера устройства для LFA 100, на которой показаны примеры размеров каждого компонента и примеры размеров перекрывания между двумя смежными компонентами в некоторых вариантах осуществления технологии, представленной в настоящем описании.
Фиг. 3A является схемой вида сверху примера устройства для LFA 100 для детекции и/или количественного анализа fC1-INH. Устройство для LFA 100 содержит прокладку конъюгата 200, содержащую первую зону 210 и вторую зону 220, и мембрану 300, содержащую третью зону 230, в некоторых вариантах осуществления технологии, представленной в настоящем описании.
Фиг. 3B является схемой вида сверху примера устройства для LFA 100 для детекции и/или количественного анализа fC1-INH. Устройство для LFA 100 содержит прокладку конъюгата 200, содержащую первую зону 210, перекрывающуюся с пятой зоной 250, для помещения образца и вторую зону 220, перекрывающуюся с четвертой зоной 240, для помещения буфера, и мембрану 300, содержащую третью зону 230, в некоторых вариантах осуществления технологии, представленной в настоящем описании.
Фиг. 4 является схемой вида сверху примера устройства для LFA 100 для детекции и/или количественного анализа fC1-INH. Устройство для LFA 100 дополнительно содержит корпус 600, образующий буферный порт 610, порт для образца 620 и тестовое окно 630, в некоторых вариантах осуществления технологии, представленной в настоящем описании. Также указаны первая зона 210, вторая зона 220, третья зона 230, прокладка конъюгата 200, мембрана 300 и прокладка абсорбента 400.
Фиг. 5 является изображением примера устройства для LFA в некоторых вариантах осуществления технологии, представленной в настоящем описании.
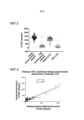
Фиг. 6 является графиком, на котором показана калибровочная кривая, полученная с помощью функционального ингибитора C1-эстеразы (fC1-INH), разведенного в C1-INH-истощенной плазме, с использованием устройства для LFA, представленного в настоящем описании.
Фиг. 7 является графиком кривой операционных характеристик (ROC) для диагностических характеристик с учетом образцов от контрольных индивидуумов и индивидуумов с наследственным ангионевротическим отеком (HAE) с использованием устройства для LFA, представленного в настоящем описании.
Фиг. 8 является графиком, на котором показан уровень функционального C1-INH у нормальных индивидуумов (норма) и индивидуумов с наследственным ангионевротическим отеком (HAE) с использованием хромогенного анализа (Chrom) или устройства для LFA (LFA), представленного в настоящем описании.
Фиг. 9 является графиком, на котором показана корреляция между уровнем функционального C1-INH у индивидуумов с наследственным ангионевротическим отеком (HAE), определяемым посредством хромогенного анализа, по сравнению с устройством для LFA, представленным в настоящем описании.
Фиг. 10A является схемой, на которой показан забор образца крови с использованием пробоотборной петли и взятия крови из пальца.
Фиг. 10B является схемой, на которой показано добавление пробоотборной петли, наполненной кровью, с фиг. 10A к бутыли SampleTainer®.
Фиг. 11A является графиком, на котором показано использование Fab против C1-INH, конъюгированного с наночастицами европия, в указанных условиях.
Фиг. 11B является графиком, на котором показано использование Fab против C1-INH, конъюгированного с наночастицами красного золота, в указанных условиях.
Фиг. 12 является графиком, на котором показаны результаты для полистрептавидина R по сравнению со стрептавидином в качестве средств захвата в тестовой линии. Значение R2 означает аппроксимацию к модельной линии (пунктирная линия).
Фиг. 13 является графиком, на котором показаны результаты использования указанных реагентов в качестве средств захвата в тестовой линии.
Фиг. 14 является графиком, на котором показаны результаты для указанного Fab против C1-INH или клонов антител в качестве детекторных средств. Для каждого антитела колонки обозначали в соответствии с концентрациями детекторного средства, слева направо, 1200 мЕд./мл, 600 мЕд./мл, 100 мЕд./мл, 0 мЕд./мл.
Фиг. 15 является графиком, на котором показаны результаты с использованием буфера, содержащего неорганическое блокирующее средство (IBA) или органическое блокирующее средство (OBA) при различном pH.
Фиг. 16 является графиком, на котором показаны результаты с использованием тестовой линии стрептавидина (0,75 мг/мл стрептавидина) и указанных концентраций C1-INH/CINRYZE®.
Фиг. 17 является схемой примеров способов, представленных в настоящем описании. Белок захвата, такой как стрептавидин, взаимодействует со своей парой (например, биотином), конъюгированной со средством захвата (например, биотинилированным FXIIa), связывающимся с функциональным C1-INH (fC1-INH, CINRYZE®). Связанный fC1-INH определяют с использованием детекторного средства, такого как антитело против C1-INH, конъюгированного с частицами золота (конъюгат антитело против C1-INH-Au).
ПОДРОБНОЕ ОПИСАНИЕ
Настоящее изобретение основано по меньшей мере частично на разработке способов и устройств для иммунохроматографического анализа (LFA) для измерения функционального ингибитора C1-эстеразы (fC1-INH). Способы и устройства для LFA созданы для специфической детекции наличия fC1-INH и/или измерения уровня fC1-INH, например, в биологическом образце. Наличие и/или уровень fC1-INH зачастую свидетельствует о статусе заболеваний, ассоциированных с биологическими путями, в которых играет роль C1-INH. В связи с этим, способы и устройства для LFA будут особенно пригодны для диагностики и прогнозирования заболеваний, опосредованных недостаточностью C1-INH, например, заболеваний, опосредованных путем калликреина плазмы (например, заболеваний, таких как наследственный ангионевротический отек), т.к. fC1-INH является ингибитором пути pKal.
В рамках изобретения термин "функциональный C1-INH" или "fC1-INH" относится к белку C1-INH в форме, способной связываться с белковым фактором, с которым связывается C1-INH в природе и проявляет свою биологическую активность. Такой белковый фактор включает, в качестве неограничивающих примеров, C1s, фактор XIIa (FXIIa) и калликреин плазмы (pKal). Детекция этой субпопуляции fC1-INH особенно полезна в оценке функциональных уровней C1-INH при заболеваниях, таких как HAE.
HAE является очень редким и потенциально угрожающим жизни генетическим заболеванием, возникающим у от приблизительно 1 на 10000 до 1 на 50000 человек. Симптомы включают отек различных частей тела, включая кисти рук, стопы, лицо и дыхательные пути (горло). Пациенты часто страдают мучительной болью в области живота, тошнотой и рвотой, вызванной отеком стенки кишечника. Отек дыхательных путей или горла является особенно опасным; он может приводить к гибели в результате удушения. Тремя специфическими анализами крови, необходимыми для подтверждения HAE типов I и II являются антиген C1INH, fC1INH и C4. Во многих диагностических тестах используют устаревшие технологии, и они не являются быстрыми, или стандартизированными, или доступными по всему миру.
Быстрые и чувствительные способы и устройства для LFA, представленные в настоящем описании, можно использовать в лаборатории врачебного кабинета для быстрой диагностики HAE (например, типа I и II) с учетом уровней fC1INH. Такие способы и устройства будут приводить к недорогим расходным материалам, возмещаемым системой страхования здоровья, высокому уровню надежности в количественных результатах, простоте интерпретации данных лечащими врачами и/или низкому уровню потребности в подтверждающих анализах. Такой быстрый анализ для диагностики HAE типа I или II во врачебном кабинете может помочь расширить скрининг HAE и быстрее идентифицировать новых пациентов с HAE. В настоящее время общая частота диагностики HAE составляет только 40%; таким образом, недиагностированные пациенты имеют высокие неудовлетворенные потребности. Быстрая доступность теста на распространенных платформах для устройств может расширить распознавание HAE. Кроме того, быстрый тест на fC1INH, представленный в настоящем описании, может способствовать мониторингу прогрессирования заболевания HAE или ответа на терапевтические средства своевременно в клинических условиях.
Способы и устройства для LFA, представленные в настоящем описании, включают первое связывающее средство, специфическое для fC1-INH (fC1-INH-связывающее средство), второе связывающее средство, специфическое для C1-INH (специфическое для функционального C1-INH, нефункционального C1-INH или и того, и другого), и средство захвата. fC1-INH-связывающее средство или C1-INH-связывающее средство можно конъюгировать со средством докинга, способным связываться со средством захвата. Одно из fC1-INH-связывающего средства, C1-INH-связывающего средства и средства захвата можно конъюгировать с детектируемой меткой. Таким образом, fC1-INH в образце (например, биологическом образце) может образовывать комплекс с fC1-INH-связывающим средством и C1-INH-связывающим средством. Такой комплекс может связываться со средством захвата посредством взаимодействия между средством захвата и средством докинга, конъюгированным с одним из C1-INH-связывающего средства и fC1-INH-связывающего средства. После детекции сигнала (например, наличия или интенсивности), высвобождаемого из детектируемой метки, наличие или уровень fC1-INH в образце можно определять и/или количественно анализировать с учетом стандартов, тестируемых вместе с ними. Например, Cinryze®, очищенный C1INH, полученный из плазмы человека, на разных уровнях можно использовать в качестве стандартов для получения стандартной кривой для экстраполяции и определения уровней fC1INH в образце, измеряемых любыми из способов, представленных в настоящем описании. Интенсивность сигнала, высвобождаемого из детектируемой метки, можно количественно анализировать в ед./мл fC1INH в образце с учетом стандартов, и она свидетельствует об уровне fC1-INH в образце.
I. Компоненты для использования в иммунохроматографическом анализе (LFA)
Способы и устройства для LFA, представленные в настоящем описании, включают (i) fC1-INH-связывающее средство, (ii) C1-INH-связывающее средство, одно из которых конъюгировано со средством докинга, и (iii) средство захвата, связывающееся со средством докинга. Одно из (i)-(iii) конъюгировано с детектируемой меткой.
(a) fC1-INH-связывающее средство
fC1-INH-связывающее средство представляет собой молекулу (например, белок или его фрагмент, связывающийся с fC1-INH), специфически связывающуюся с функциональным C1-INH. Указывают, что молекула проявляет "специфическое связывание", если она реагирует чаще, быстрее, с большей длительностью и/или большей аффинностью с конкретной мишенью (например, представленной в настоящем описании), чем с альтернативными мишенями, которые могут являться измененной формой конкретной мишени. Например, молекула, специфически связывающаяся с fC1-INH, будет реагировать чаще, быстрее, с большей длительностью и/или большей аффинностью с fC1-INH по сравнению с альтернативной мишенью, такой как нефункциональный C1-INH. Термины "специфическое связывание" или "преференциальное связывание" не обязательно требуют (хотя могут включать) исключительное связывание.
В некоторых случаях белок или полипептид, способный связываться с fC1-INH в природе, или его связывающий фрагмент можно использовать в качестве fC1-INH-связывающего средства. В некоторых примерах fC1-INH-связывающее средство является FXII, например, активной формой FXII (FXIIa). Фактор XII является гликопротеином сыворотки, участвующим в инициации свертывания крови, фибринолиза и образовании брадикинина и ангиотензина. Прекалликреин расщепляется фактором XII с образованием калликреина, который затем активирует фактор XII, что приводит к образованию фактора XIIa и фрагментов фактора XII (фактора XIIf) ("Histidine-rich glycoprotein binds factor XIIa with high affinity and inhibits contact-initiated coagulation" Macquarrie, et al.,Blood 117:4134-4141 2011). Показано, что ингибитор C1 (C1-INH) является важным плазменным ингибитором фактора XIIa и фактора XIIf ("Effect of negatively charged activating compounds on inactivation of factor XIIa by C1 inhibitor" Pixley, et al., Arch Biochem Biophys 256(2):490-8 1987).
Белки FXII, включая их формы-предшественники, зрелые формы и активные формы, хорошо известны в этой области. Например, последовательность белка-предшественника фактора XII человека и его активная форма приведены под регистрационным номером Genbank: NP_000496.2. Белки FXII других видов, например, не являющихся человеком млекопитающих, также известны в этой области. Информацию об их структуре можно найти в этой области, например, в общедоступных генетических базах данных, с использованием последовательности FXII человека в качестве последовательности запроса.
Термин "активный" или "функциональный" фактор XII относится к полипептиду фактора XII или полипептидному фрагменту фактора XII, сохраняющему биологическую активность, схожую, но могущую не быть идентичной, с природным фактором XII, включая зрелые формы. В некоторых вариантах осуществления активный или функциональный фактор XII является полипептидом фактора XII или полипептидным фрагментом фактора XII, связывающимся с fC1-INH. В некоторых вариантах осуществления активный или функциональный фактор XII является полипептидом фактора XIIa или полипептидным фрагментом фактора XIIa, связывающимся с fC1-INH. В некоторых вариантах осуществления активный или функциональный фактор XII является полипептидом фактора XIIf или полипептидным фрагментом фактора XIIf, связывающимся с fC1-INH.
В других примерах fC1-INH-связывающее средство является калликреином плазмы (pKal), например, каталитическим фрагментом природного белка pKal. Калликреин плазмы является серин-протеазным компонентом контактной системы (Sainz I.M. et al., Thromb Haemost 98, 77-83, 2007). Контактная система активируется фактором XIIa после воздействия чужеродных или отрицательно заряженных поверхностей или на поверхностях эндотелиальных клеток под действием пролилкарбоксипептидаз (Sainz I.M. et al., Thromb Haemost 98, 77-83, 2007). Активация калликреина плазмы усиливает внутренний путь свертывания посредством активации обратной связи фактора XII и усиливает воспаление посредством продукции провоспалительного нонапептида брадикинина. В качестве первичной кининогеназы в кровотоке, калликреин плазмы, главным образом, отвечает за образование брадикинина в сосудистой сети.
Белки pKal хорошо известны в этой области. Примеры последовательностей калликреина плазмы могут включать аминокислотные последовательности калликреина плазмы человека (регистрационный номер: NP_000883.2), мыши (регистрационный номер: NP_032481.1) или крысы (регистрационный номер: NP_036857.2).
Термин "активный" или "функциональный" калликреин плазмы относится к полипептиду калликреина плазмы или полипептидному фрагменту калликреина плазмы, сохраняющему биологическую активность (например, протеазную активность) схожую, но не обязательно идентичную, соответствующему природному калликреину плазмы, включая зрелые формы. В некоторых вариантах осуществления активный или функциональный калликреин плазмы является полипептидом калликреина плазмы или полипептидным фрагментом калликреина плазмы, связывающимся с fC1-INH.
В других примерах fC1-INH-связывающее средство, представленное в настоящем описании, может представлять собой C1s и C1r, или их активные/функциональные фрагменты. C1s и C1r являются активированными гомологичными сериновыми протеазами первого компонента комплемента (C1). C1s и C1r могут образовывать комплекс с C1-INH. Arlaud et al., (1993) Methods Enzymol. 223, 61-82. C1s является модульной сериновой протеазой, выполняющей каталитическую функцию комплекса C1. C1r является ферментом, активирующим C1s до его активной формой посредством протеолитического расщепления.
Белки C1s и C1r также хорошо известны в этой области. Например, последовательность белка-предшественника C1s человека приведена под регистрационным номером Genbank: NP_001725.1 и C1r человека приведен под регистрационным номером Genbank: NP_001724.4.
Термин "активный" или "функциональный" C1s и C1r относится к полипептидному фрагменту C1s и C1r, сохраняющему биологическую активность, схожую, но не обязательно идентичную, с соответствующими природными C1s и C1r, включая зрелые формы, соответственно. В некоторых вариантах осуществления активный или функциональный фрагмент C1s или C1r является частью полипептида C1s или полипептида C1s, связывающегося с fC1-INH.
Любое из fC1-INH-связывающих средств можно получать посредством рекомбинантной технологии или выделять из подходящего природного источника.
(b) C1-INH-связывающее средство
C1-INH-связывающее средство для использования в способах и устройствах для LFA, представленных в настоящем описании, может являться любой молекулой (например, белками или полипептидами), способными связываться с C1-INH. В некоторых случаях C1-INH-связывающее средство является специфическим для fC1-INH. В других случаях C1-INH-связывающее средство перекрестно реагирует с функциональным и нефункциональным C1-INH.
C1-INH-связывающее средство может являться антителом, связывающимся с C1-INH. В рамках изобретения термин "антитело" относится к белку, включающему по меньшей мере один вариабельный домен иммуноглобулина или последовательность вариабельного домена иммуноглобулина. Например, антитело может включать вариабельную область тяжелой цепи (H) (сокращенно обозначаемую в настоящем описании как VH) и вариабельную область легкой цепи (L) (сокращенно обозначаемую в настоящем описании как VL). В другом примере антитело включает две вариабельные области тяжелой цепи (H) и две вариабельные области легкой цепи (L). Термин "антитело" включает антигенсвязывающие фрагменты антител (например, одноцепочечные антитела, Fab- и sFab-фрагменты, F(ab')2, Fd-фрагменты, Fv-фрагменты, scFv и доменные антитела (dAb) (de Wildt et al., Eur J Immunol. 1996; 26(3):629-39.)), а также полные антитела. Антитело может иметь структурные признаки IgA, IgG, IgE, IgD, IgM (а также их подтипов).
Области VH и VL можно дополнительно разделять на области гипервариабельности, обозначаемые как "определяющие комплементарность области" ("CDR"), перемежающиеся с областями, являющимися более консервативными, обозначаемыми как "каркасные области" ("FR"). Протяженность каркасной области и CDR точно определена (см., Kabat, E.A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242, и Chothia, C. et al., (1987) J. Mol. Biol. 196:901-917, также см. www.hgmp.mrc.ac.uk). В настоящем описании используют определения по Kabat. Каждая VH и VL, как правило, состоит из трех CDR и четырех FR, расположенных от амино-конца к карбокси-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4.
Цепь VH или VL антитела может дополнительно включать всю или часть константной области тяжелой или легкой цепи, таким образом, образующие тяжелые или легкие цепи иммуноглобулинов, соответственно. В одном из вариантов осуществления антитело является тетрамером из двух тяжелых цепей иммуноглобулина и двух легких цепей иммуноглобулина, где тяжелая и легкая цепи иммуноглобулина соединены друг с другом, например, дисульфидными связями. В IgG константная область тяжелой цепи включает три иммуноглобулиновых домена, CH1, CH2 и CH3. Константная область легкой цепи включает домен CL. Вариабельная область тяжелой и легкой цепей содержит связывающий домен, взаимодействующий с антигеном. Константные области антител, как правило, опосредуют связывание антитела с тканями или факторами организма-хозяина, включая различные клетки иммунной системы (например, эффекторные клетки) и первый компонент (C1q) классической системы комплемента. Легкие цепи иммуноглобулина могут представлять собой каппа- или лямбда-цепь. В одном из вариантов осуществления антитело гликозилировано. Антитело может являться функциональным в отношении антителозависимой цитотоксичности и/или комплемент-опосредованной цитотоксичности.
В некоторых вариантах осуществления антитело, связывающееся с C1-INH, может специфически связываться с C1-INH, например, эпитопом fC1-INH или эпитопом, общим для fC1-INH и нефункционального C1-INH. Антитело, "специфически связывающееся" с антигеном или эпитопом, представляет собой термин, хорошо известный в этой области, и способы определения такого специфического связывания хорошо известны в этой области. Указывают, что антитело проявляется "специфическое связывание", если оно реагирует или ассоциируется чаще, быстрее, с большей длительностью и/или с большей аффинностью с конкретным антигеном-мишенью, чем с альтернативной мишенью. Антитело "специфически связывается" с целевым антигеном или эпитопом, если оно связывается с большей аффинностью, авидностью, легче и/или с большей длительностью, чем с другими веществами. Например, антитело, специфически (или преференциально) связывающееся с антигеном (например, C1-INH) или антигенным эпитопом, является антителом, связывающимся со своим антигеном-мишенью с большей аффинностью, авидность, легче и/или с большей длительностью, чем с другими антигенами или другими эпитопами на том же антигене. Также из этого определения следует понимать, что, например, антитело, специфически связывающееся с первым антигеном-мишенью, может специфически или преференциально связываться или не связываться со вторым антигеном-мишенью. В связи с этим, "специфическое связывание" или "преференциальное связывание" не обязательно требует (хотя может включать) исключительное связывание. Как правило, но не обязательно, ссылка на связывание означает преференциальное связывание. В некоторых примерах антитело, "специфически связывающееся" с антигеном-мишенью или его эпитопом, может не связываться с другими антигенами или другими эпитопами в том же антигене.
Антитело, связывающееся с C1-INH, для использования в способах и устройствах для LFA, представленных в настоящем описании, могут иметь подходящую аффинность связывания с C1-INH или его подходящим эпитопом. В рамках изобретения термин "аффинность связывания" относится к кажущейся константе ассоциации или KA. KA является обратной константе диссоциации (KD). Антитело, представленное в настоящем описании, может иметь аффинность связывания (KD) по меньшей мере 10-5, 10-6, 10-7, 10-8, 10-9, 10-10 M или менее. Повышенная аффинность связывания соответствует сниженной KD. Более высокая аффинность связывания антитела с первым антигеном относительно второго антигена может свидетельствовать о более высокой KA (или меньшем числовом значении KD) для связывания первого антигена, чем KA (или числовое значение KD) для связывания второго антигена. В таких случаях антитело имеет специфичность к первому антигену относительно второго антигена. Различия аффинности связывания (например, по специфичности или другим сравнениям) могут составлять по меньшей мере 1,5, 2, 3, 4, 5, 10, 15, 20, 30, 40, 50, 60, 70, 80, 90, 100, 500, 1000, 10000 или 105 раз. Аффинность связывания (или специфичность связывания) можно определять общепринятыми способами.
Антитело, связывающееся с C1-INH, может являться полноразмерным антителом. Альтернативно, антитело является антигенсвязывающим фрагментом полноразмерного антитела. Термин "антигенсвязывающий фрагмент" полноразмерного антитела относится к одному или более фрагментам полноразмерного антитела, сохраняющим способность специфически связываться с интересующей мишенью. Примеры связывающих фрагментов, включенных в термин "антигенсвязывающий фрагмент" полноразмерного антитела, включают (i) Fab-фрагмент, моновалентный фрагмент, состоящий из VL, VH, доменов CL и CH1; (ii) F(ab')2-фрагмент, бивалентный фрагмент, включающий два Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области; (iii) Fd-фрагмент, состоящий из доменов VH и CH1; (iv) Fv-фрагмент, состоящий из доменов VL и VH однодоменного антитела, (v) dAb-фрагмент (Ward et al., (1989) Nature 341:544-546), состоящий из домена VH; и (vi) выделенную определяющую комплементарность область (CDR), сохраняющую функциональность. Кроме того, хотя два домена Fv-фрагмента, VL и VH, кодируются разными генами, их можно соединять с использованием рекомбинантных способов, синтетического линкера, позволяющего получать их в виде единой белковой цепи, в которой области VL и VH спариваются с образованием моновалентных молекул, известных как одноцепочечные Fv (scFv). См., например, патенты США №№ 5260203, 4946778 и 4881175; Bird et al., (1988) Science 242:423-426; и Huston et al., (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883. Фрагменты антител можно получать любым подходящим способом, включая общепринятые способы, известные специалистам в этой области.
Любые из антител, связывающихся с C1-INH, как представлено в настоящем описании, могут являться моноклональными или поликлональными. Термин "моноклональное антитело" относится к гомогенной популяции антител, и термин "поликлональное антитело" относится к гетерогенной популяции антитела. Эти два термина не ограничивают источник антитела или способ его получения.
Антитело, связывающееся с C1-INH, можно получать любыми известными в этой области способами. См., например, Harlow and Lane, (1998) Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, New York. В некоторых вариантах осуществления антитела, специфические для C1-INH (например, C1-INH человека), можно получать с помощью общепринятой гибридомной технологии. В других вариантах осуществления антитела, специфические для C1-INH, можно выделять из библиотек антител, следуя общепринятой технологии скрининга библиотеки антител.
В некоторых вариантах осуществления антитело является антителом, специфически связывающимся с C1-INH человека. В некоторых вариантах осуществления антитела являются моноклональными антителами, специфически связывающимися с C1-INH человека. В некоторых вариантах осуществления антитела являются моноклональными антителами мыши, специфически связывающимися с C1-INH человека, такими как клон антитела MM06 или MM03 (также обозначаемый как 10995-MM06 и 10995-MM03, соответственно, от Sino Biological Inc.). В некоторых вариантах осуществления антитела являются поликлональными антителами, специфически связывающимися с C1-INH человека. В некоторых вариантах осуществления антитела являются поликлональными антителами кролика, специфически связывающимися с C1-INH человека, такими как клон антитела RP01 или RP02 (также обозначаемый как 10995-RP01 и 10995-RP02, соответственно, от Sino Biological Inc.). В некоторых вариантах осуществления антитело является RP02.
(c) Средства докинга-захвата
Одно из fC1-INH-связывающего средства и C1-INH-связывающего средства конъюгировано со средством докинга, способным связываться со средством захвата, также используемым в способах и устройствах для LFA, как представлено в настоящем описании. В одном из вариантов осуществления средство докинга конъюгировано с fC1-INH-связывающим средством (например, FXIIa). В других вариантах осуществления средство докинга можно конъюгировать с C1-INH (например, антитело, связывающееся с C1-INH).
Средство докинга и средство захвата являются членами пары рецептор-лиганд, которая обозначает любую пару молекул, способных связываться друг с другом с образованием комплекса. В одном из примеров средство докинга и средство захвата представляют собой биотин и авидин, соответственно, или наоборот. Например, средство докинга может являться биотином, и средство захвата может являться стрептавидином или полистрептавидином.
(d) Детектируемая метка
Одно из fC1-INH-связывающего средства, C1-INH-связывающего средства и средства захвата для использования в способах и устройствах для LFA, как представлено в настоящем описании, можно конъюгировать с детектируемой меткой. В некоторых вариантах осуществления fC1-INH-связывающее средство конъюгировано с детектируемой меткой. В других вариантах осуществления C1-INH-связывающее средство конъюгировано с детектируемой меткой. Альтернативно, средство захвата конъюгировано с детектируемой меткой.
В рамках изобретения термин "детектируемая метка" относится к любой молекуле, способной высвобождать детектируемый сигнал прямо или косвенно. В некоторых вариантах осуществления детектируемая метка может представлять собой флуорофор (например, флуоресцеин). В рамках изобретения термин "флуорофор" (также обозначаемый как "флуоресцентная метка" или "флуоресцентный краситель") относится к остаткам, абсорбирующим энергию света при определенной длине волне возбуждения и испускающим энергию света при другой длине волны.
Неограничивающие примеры флуорофоров включают производные ксантенов (например, флуоресцеин, родамин, Oregon green, эозин и Texas red), цианиновые производные (например, цианин, индокарбоцианин, оксакарбоцианин, тиакарбоцианин и мероцианин), производные нафталина (например, производные дансила и продана), производные кумарина, оксадиазоловые производные (например, пиридилоксазол, нитробензоксадиазол и бензоксадиазол), пиреновые производные (например, Cascade blue), оксазиновые производные (например, Nile red, Nile blue, крезилвиолет и оксазин 170), акридиновые производные (например, профлавин, акридиновый оранжевый и акридиновый желтый), арилметановые производные (например, аурамин, кристалл-виолет и малахитовый зеленый), тетрапирроловые производные (например, порфин, фталоцианин и билирубин) или флуоресцентные белки (например, зеленый флуоресцентный белок).
В некоторых вариантах осуществления детектируемая метка является фикоэритрином.
В некоторых вариантах осуществления детектируемая метка является хромофором (например, антраценом). В некоторых вариантах осуществления детектируемая метка является полупроводниковой частицей (например, квантовой точкой). В некоторых вариантах осуществления детектируемую метку присоединяют к полупроводниковым частицам (например, квантовым точкам). В некоторых вариантах осуществления детектируемая метка является европием. В некоторых вариантах осуществления детектируемая метка является коллоидным золотом. В некоторых вариантах осуществления детектируемая метка присоединена к частицам золота. В некоторых вариантах осуществления детектируемая метка присоединена к частицам красного золота. В некоторых вариантах осуществления детектируемая метка присоединена к латексным частицам. В некоторых вариантах осуществления C1-INH-связывающее средство является антителом RP02, конъюгированным с европием. В некоторых вариантах осуществления C1-INH-связывающее средство является антителом RP02, конъюгированным с частицами золота. В некоторых вариантах осуществления C1-INH-связывающее средство является антителом RP02, конъюгированным с частицами красного золота. В некоторых вариантах осуществления C1-INH-связывающее средство является антителом RP02, конъюгированным с латексными частицами.
II. Устройства для LFA
В некоторых аспектах настоящее изобретение относится к устройству для иммунохроматографического анализа (LFA) для измерения fC1-INH в образце, содержащем его. См. фиг. 1-4, где графически представлены различные варианты осуществления примеров устройств для LFA, представленных в настоящем описании.
Как показано на фиг. 1, устройство 100 в некоторых вариантах осуществления содержит прокладку конъюгата 200, мембрану 300 и, необязательно, прокладку абсорбента 400 и опорный элемент 500, на который устанавливают прокладку конъюгата 200, мембрану 300 и, необязательно, прокладку абсорбента 400.
Прокладку конъюгата 200 соединяют с мембраной 300 напрямую или через линкер. Если устройство содержит прокладку абсорбента 400, прокладку конъюгата 200, прокладка абсорбента 400 отделена мембраной 300, соединенной с прокладкой абсорбента 400 прямо или косвенно. В некоторых вариантах осуществления прокладка конъюгата 200 перекрывается с мембраной 300, например, на 2-6 мм, например, 3 мм, как показано на фиг. 2. Альтернативно или дополнительно, мембрана 300 перекрывается с прокладкой абсорбента 400, например, на 2-6 мм, например, 3 мм, как показано на фиг. 2.
Конкретные характеристики и размеры прокладки конъюгата 200, мембраны 300, прокладки абсорбента 400 и опорного элемента 500 можно модифицировать по мере необходимости для достижения желаемых результатов. Как показано на фиг. 2, в некоторых вариантах осуществления поддерживающая мембрана имеет длину 80 мм, представляющую собой объединенную длину прокладки конъюгата (42 мм), мембраны (25 мм) и прокладки абсорбента (19 мм), из которой вычтено перекрывание прокладки образца и прокладки абсорбента на мембране (3 мм, 3 мм).
Как показано на фиг. 3A, вид сверху устройства 100, устройство может содержать различные зоны (210, 220, 230), которые в некоторых вариантах осуществления можно использовать для иммобилизации fC1-INH-связывающего средства, C1-INH-связывающего средства и средства захвата, как представлено в настоящем описании. В некоторых вариантах осуществления устройство 100 содержит первую зону 210 и вторую зону 220, которая может находиться на прокладке конъюгата 200, и третью зону 230, которая может находиться на мембране 300.
Каждое из fC1-INH-связывающего средства, C1-INH-связывающего средства и средства захвата можно иммобилизовать на одной из зон 210, 220 и 230 (которые могут находиться в другом порядке). Любое из этих средств можно иммобилизовать любыми способами, известными в этой области. Средство можно иммобилизовать или связывать на поверхности прокладки конъюгата 200 и/или мембраны 300 прямо или косвенно. В некоторых вариантах осуществления связывающее средство иммобилизовано на поверхности посредством ковалентной связи. В некоторых вариантах осуществления связывающее средство иммобилизовано на поверхности посредством нековалентной связи. В некоторых вариантах осуществления связывающее средство иммобилизовано на поверхности через линкер. Неограничивающие примеры линкеров включают углерод-содержащие цепи, полиэтиленгликоль (PEG), нуклеиновые кислоты, моносахаридные единицы, биотин, авидин и пептиды.
В некоторых вариантах осуществления fC1-INH-связывающее средство, такое как FXIIa, иммобилизовано на первой зоне 210. fc1-INH-связывающее средство можно конъюгировать со средством докинга, таким как биотин. C1-INH-связывающее средство, такое как антитело, связывающееся с C1-INH, можно иммобилизовать на второй зоне 220. C1-INH-связывающее средство можно конъюгировать с детектируемой меткой, такой как представленные в настоящем описании. Средство захвата, такое как авидин (например, стрептавидин), можно иммобилизовать на третьей зоне 230.
В некоторых вариантах осуществления fC1-INH-связывающее средство, такое как FXIIa, иммобилизовано на первой зоне 210. fC1-INH-связывающее средство можно конъюгировать с детектируемой меткой, такой, как представленные в настоящем описании. C1-INH-связывающее средство, такое как антитело, связывающееся с C1-INH, можно иммобилизовать на второй зоне 220. C1-INH-связывающее средство можно конъюгировать со средством докинга, таким как биотин. Средство захвата, такое как авидин (например, стрептавидин), можно иммобилизовать на третьей зоне 230.
В некоторых вариантах осуществления C1-INH-связывающее средство, такое как антитело, связывающееся с C1-INH, можно иммобилизовать на первой зоне 210. C1-INH-связывающее средство можно конъюгировать со средством докинга, таким как биотин. fC1-INH-связывающее средство, такое как FXIIa, можно иммобилизовать на второй зоне 220. fC1-INH-связывающее средство можно конъюгировать с детектируемой меткой, такой как представленные в настоящем описании. Средство захвата, такое как авидин (например, стрептавидин), можно иммобилизовать на третьей зоне 230.
В некоторых вариантах осуществления C1-INH-связывающее средство, такое как антитело, связывающееся с C1-INH, можно иммобилизовать на первой зоне 210. C1-INH-связывающее средство можно конъюгировать с детектируемой меткой, такой как представленные в настоящем описании. fC1-INH-связывающее средство, такое как FXIIa, можно иммобилизовать на второй зоне 220. fC1-INH-связывающее средство можно конъюгировать со средством докинга, таким как биотин. Средство захвата, такое как авидин (например, стрептавидин), можно иммобилизовать на третьей зоне 230.
В некоторых вариантах осуществления fC1-INH-связывающее средство, такое как FXIIa, иммобилизовано на первой зоне 210. fC1-INH-связывающее средство можно конъюгировать со средством докинга, таким как биотин. Средство захвата, такое как авидин (например, стрептавидин), можно иммобилизовать на второй зоне 220. Средство захвата можно конъюгировать с детектируемой меткой, такой как представленные в настоящем описании. C1-INH-связывающее средство, такое как антитело, связывающееся с C1-INH, можно иммобилизовать на третьей зоне 230.
В некоторых вариантах осуществления fC1-INH-связывающее средство, такое как FXIIa, иммобилизовано на первой зоне 210. fC1-INH-связывающее средство можно конъюгировать с детектируемой меткой, такой как представленные в настоящем описании. Средство захвата, такое как авидин (например, стрептавидин), можно иммобилизовать на второй зоне 220. C1-INH-связывающее средство, такое как антитело, связывающееся с C1-INH, можно иммобилизовать на третьей зоне 230. C1-INH-связывающее средство можно конъюгировать со средством докинга, таким как биотин.
В некоторых вариантах осуществления C1-INH-связывающее средство, такое как антитело, связывающееся с C1-INH, можно иммобилизовать на первой зоне 210. C1-INH-связывающее средство можно конъюгировать со средством докинга, таким как биотин. Средство захвата, такое как авидин (например, стрептавидин), можно иммобилизовать на второй зоне 220. Средство захвата можно конъюгировать с детектируемой меткой, такой как представленные в настоящем описании. fC1-INH-связывающее средство, такое как FXIIa, можно иммобилизовать на третьей зоне 230.
В некоторых вариантах осуществления C1-INH-связывающее средство, такое как антитело, связывающееся с C1-INH, можно иммобилизовать на первой зоне 210. C1-INH-связывающее средство можно конъюгировать с детектируемой меткой, такой как представленные в настоящем описании. Средство захвата, такое как авидин (например, стрептавидин), можно иммобилизовать на второй зоне 220. fC1-INH-связывающее средство, такое как FXIIa, можно иммобилизовать на третьей зоне 230. fC1-INH-связывающее средство можно конъюгировать со средством докинга, таким как биотин.
Любое из устройств для LFA, представленных в настоящем описании, может дополнительно содержать 4-ую зону 240, которая может быть предназначена для размещения образца, такого как представленные в настоящем описании, и, необязательно, 5-ую зону 250, которая может быть предназначена для размещения буферного раствора.
5-ая зона 250 может находиться на одном конце устройства таким образом, что, когда буферный раствор помещают в 5-ую зону 250, буферный раствор может протекать через устройство от 1-ой зоны 210 к 3-ей зоне 230. В некоторых примерах 5-ая зона 250 может перекрываться с 1-ой зоной 210. См. фиг. 3B. В этом случае C1-INH-связывающее средство, такое как антитело, связывающееся с C1-INH, можно иммобилизовать на 1-ой зоне 210, перекрывающейся с 5-ой зоной 250. C1-INH-связывающее средство можно конъюгировать с детектируемой меткой.
Альтернативно или дополнительно, 4-ая зона 240 может находиться между 5-ой зоной 250 и 2-ой зоной 220. В некоторых случаях 4-ая зона 240 и 2-ая зона 220 могут перекрываться. См. фиг. 3B. fC1-INH-связывающее средство, такое как FXIIa, которое можно конъюгировать со средством докинга, таким как биотин, можно иммобилизовать на 2-ой зоне 220.
Как показано на фиг. 4, устройство 100 в некоторых вариантах осуществления может дополнительно содержать корпус 600, который может являться съемным. Изображение устройства, представленного в настоящем описании в корпусе, приведено на фиг. 5. Корпус 600 можно конфигурировать так, чтобы экспонировать по меньшей мере часть прокладки конъюгата 200 и мембрану 300 устройства 100. В некоторых вариантах осуществления корпус 600 содержит первое отверстие для получения буферного порта 610, который может быть выровнен с первой зоной 210. Корпус 600 может дополнительно содержать второе отверстие для получения порта для образца 620, который может быть выровнен со второй зоной 220. Кроме того, корпус 600 может содержать третье отверстие для получения тестового окна 630, которое может быть выровнено с третьей зоной 230.
В некоторых вариантах осуществления C1-INH-связывающее средство, такое как антитело, связывающееся с C1-INH, иммобилизовано на 1-ой зоне 210, выровненной с буферным портом 610. Фиг. 4. C1-INH-связывающее средство можно конъюгировать с детектируемой меткой, такой как представленные в настоящем описании. fC1-INH-связывающее средство, такое как FXIIa, можно иммобилизовать на 2-ой зоне 220, которая может быть выровнена с портом для образца 620. fC1-INH-связывающее средство можно конъюгировать со средством докинга, таким как биотин. Средство захвата, такое как авидин (например, стрептавидин), можно иммобилизовать на 3-ей зоне 230, которую можно выравнивать с тестовым окном 630.
В некоторых примерах образец можно помещать в порт для образца 620, делая возможным связывание fC1-INH в нем с конъюгатом FXIIa-биотин. Буферный раствор можно помещать в буферный порт 610, делая возможной миграцию C1-INH-связывающего средства на 1-ой зоне 210 к 2-ой зоне 220 вместе с буферным раствором. Когда C1-INH-связывающее средство контактирует с комплексом fC1-INH-FXIIa на 2-ой зоне 220, образуется комплекс C1-INH-связывающее средство/fC1-INH/FXIIa-биотин. Этот комплекс будет мигрировать к 3-ей зоне 230 вместе с буферным раствором и захватываться на 3-ей зоне 230 посредством взаимодействия между биотином и стрептавидином на 3-ей зоне 230. Можно измерять сигнал, высвобождаемый из детектируемой метки, конъюгированной с C1-INH-связывающим средством, на 3-ей зоне 230, выровненной с тестовым окном 630, который будет свидетельствовать о наличии или уровне fC1-INH в образце.
Альтернативно или дополнительно, корпус 600 может являться прозрачным для облегчения визуализации порта для образца 610, и/или буферного порта 620, и/или тестового окна 630. В некоторых вариантах осуществления часть корпуса является прозрачной. В некоторых вариантах осуществления весь корпус 600 является прозрачным.
В некоторых вариантах осуществления корпус 600 содержит метку для облегчения идентификации образца или результата. В некоторых вариантах осуществления корпус 600 содержит одну или более меток для облегчения идентификации результата в тестовом окне 630. В некоторых вариантах осуществления с помощью одной или более меток идентифицируют результат для образца.
Следует понимать, что различные варианты осуществления устройства, включая многочисленные компоненты в устройстве (например, прокладку конъюгата, мембрану, прокладку абсорбента и опорный элемент), как представлено в настоящем описании, можно получать из подходящих материалов, например, из любой подходящей прокладки конъюгата, из любой подходящей мембраны, из любой подходящей прокладки абсорбента, из любого подходящего опорного элемента, из любой подходящей связывающего средства и из любой подходящей их комбинации.
Например, мембрана 300 в устройстве для LFA, как представлено в настоящем описании, может являться любой подходящей мембраной, включая, в качестве неограничивающих примеров, нитроцеллюлозную мембрану, нейлоновую мембрану, целлюлозную мембрану, поливинилиденфторидную мембрану, поликарбонатную мембрану, полипропиленовую мембрану, полиэтиленовую мембрану, политетрафторэтиленовую мембрану и полипарафенилентерефталамидную мембрану. В некоторых вариантах осуществления мембрана является нитроцеллюлозной мембраной.
В устройстве, представленном в настоящем описании, можно использовать любой подходящий опорный элемент. В некоторых вариантах осуществления опорный элемент содержит металл. В некоторых вариантах осуществления опорный элемент содержит пластик. В некоторых вариантах осуществления опорный элемент содержит пластик, выбранный из группы, состоящей из стирола, поликарбоната, полипропилена, полиэтилена и поливинилхлорида.
В устройстве, представленном в настоящем описании, в качестве прокладки конъюгата можно использовать любую подходящую прокладку. В некоторых вариантах осуществления прокладка конъюгата содержит целлюлозу или стекловолокно. В некоторых вариантах осуществления прокладка абсорбента содержит целлюлозу или стекловолокно.
Устройство, представленное в настоящем описании, может дополнительно содержать прокладку для образца. В некоторых вариантах осуществления прокладка для образца содержит целлюлозу или стекловолокно.
Следует понимать, что различные варианты осуществления настоящего изобретения можно получать с использованием одного или более описанных выше признаков. Указанные выше аспекты и признаки изобретения можно использовать в любой подходящей комбинации, т.к. настоящее изобретение не ограничено в этом смысле. Также следует понимать, что на чертежах проиллюстрированы различные компоненты и признаки, которые можно включать в различные варианты осуществления настоящего изобретения. Для простоты, на некоторых из чертежей могут быть проиллюстрировано несколько необязательных признаков или компонентов. Однако настоящее изобретение не ограничено конкретными вариантами осуществления, изображенными на чертежах. Следует понимать, что настоящее изобретение относится к вариантам осуществления, которые могут включать только часть компонентов, проиллюстрированных на любой из фигур чертежей, и/или также могут включать варианты осуществления, в которых комбинируют проиллюстрированные компоненты на разных фигурах.
III. Измерение функционального C1-INH
Настоящее изобретение также относится к способам детекции и/или количественного анализа функционального ингибитора C1-эстеразы (fC1-INH) в образце. Способы анализа, представленные в настоящем описании, включают использование fC1-INH-связывающего средства, C1-INH-связывающего средства и средства захвата, все из которых представлены в настоящем описании. Одно из fC1-INH-связывающего средства и C1-INH-связывающего средства конъюгировано со средством докинга, связывающимся со средством захвата. Одно из fC1-INH-связывающего средства, C1-INH-связывающего средства и средства захвата конъюгировано с детектируемой меткой. Детектируемая метка и средство докинга конъюгированы с разными средствами.
Для осуществления способа анализа, представленного в настоящем описании, образец, как предполагают, содержащий fC1-INH, можно приводить в контакт с fC1-INH-связывающим средством, C1-INH-связывающим средством и средством захвата в условиях, делающих возможным образование комплекса, содержащего fC1-INH, fC1-INH-связывающее средство, C1-INH-связывающее средство и средство захвата (посредством взаимодействия со средством докинга, конъюгированным с fC1-INH-связывающим средством или C1-INH-связывающим средством). Наличие или уровень fC1-INH в образце можно определять и/или количественно анализировать посредством измерения сигнала, высвобождаемого из детектируемой метки, которая может быть конъюгирована с любым из fC1-INH-связывающего средства, C1-INH-связывающего средства и средства захвата.
В некоторых примерах образец и fC1-INH-связывающее средство (например, FXIIa) можно инкубировать сначала с течение подходящего периода (например, по меньшей мере 5 минут, например, 5-10 минут), чтобы сделать возможным образование комплекса fC1-INH/FXIIa. Затем комплекс можно инкубировать с C1-INH-связывающим средством, таким как антитело, связывающееся с C1-INH, для образования трехкомпонентного комплекса, который затем можно приводить в контакт со средством захвата, связывающимся со средством докинга, конъюгированным с fC1-INH-связывающим средством или C1-INH-связывающим средством. Сигнал, высвобождаемый из детектируемой метки, конъюгированной с одним компонентом в конечном комплексе, можно измерять для определения наличия/отсутствия и/или уровня fC1-INH в образце.
Способы детекции и/или количественного анализа fC1-INH, представленные в настоящем описании, в некоторых вариантах осуществления включают (i) приведение образца в контакт с fC1-INH-связывающим средством, C1-INH-связывающим средством и средством захвата для получения комплекса, где одно из fC1-INH-связывающего средства и C1-INH-связывающего средства конъюгировано со средством докинга, связывающимся со средством захвата, и где одно из fC1-INH-связывающего средства, C1-INH-связывающего средства и средства захвата конъюгировано с детектируемой меткой, при этом детектируемая метка и средство докинга конъюгированы с разными средствами; и (ii) детекцию сигнала, высвобождаемого из детектируемой метки в комплексе; где наличие сигнала, высвобождаемого из детектируемой метки в комплексе, свидетельствует о наличии fC1-INH в образце.
Способы, представленные в настоящем описании, включают средство захвата, иммобилизованное на любом подходящем субстрате любым подходящим образом. Неограничивающие примеры субстратов включают бусы, частицы, предметные стекла и многолуночные планшеты. В некоторых вариантах осуществления средство захвата ковалентно связано с субстратом. В некоторых вариантах осуществления средство захвата нековалентно связано с субстратом. В некоторых вариантах осуществления средство захвата связано с субстратом косвенно, например, через линкер.
В некоторых вариантах осуществления способы анализа, представленные в настоящем описании, можно осуществлять с использованием любого из устройств для LFA, представленных в настоящем описании. Например, образец можно помещать в порт для образца 620 (фиг. 4) и буферный раствор можно помещать в буферный порт 610. Порт для образца 620 можно выравнивать со 2-ой зоной 220. Буферный порт 610 можно выравнивать с 1-ой зоной 210. Буферный раствор будет протекать из, например, 1-ой зоны 210 во 2-ую зону 220 и третью зону 230 вместе с образцом и fC1-INH-связывающим средством, C1-INH-связывающим средством и/или средством захвата, иммобилизованным на 1-ой зоне 210 и 2-ой зоне 220. Это делает возможным контакт образца с fC1-INH-связывающим средством, C1-INH-связывающим средством и средством захвата, когда буферный раствор проходит через 1-ую зону 210, 2-ую зону 220 и 3-ю зону 230, таким образом, что может образовываться комплекс, содержащий fC1-INH в образце, fC1-INH-связывающее средство, C1-INH-связывающее средство и средство захвата. Наличие или уровень fC1-INH в образце можно определять посредством измерения сигнала, высвобождаемого из детектируемой метки, конъюгированной с одним компонентом в комплексе.
В одном из примеров способ детекции и/или количественного анализа fC1-INH с помощью устройства для LFA, содержащего FXIIa-биотин и антитело против C1-INH, конъюгированное с частицами европия, например, устройства, сконфигурированного, как показано на фиг. 4, описан исключительно в иллюстративных целях. В этом примере антитело против C1-INH, конъюгированное с частицами европия, функционирует в качестве C1-INH-связывающего средства, конъюгированного с детектируемой меткой, и конъюгат антитела против C1-INH иммобилизован в первой зоне 210. FXIIa, конъюгированный с биотином, функционирует в качестве fC1-INH-связывающего средства, конъюгированного со средством докинга, и FXIIa-биотин иммобилизован во второй зоне 220. Для детекции наличия fC1-INH в образце образец помещают во вторую зону 220 на прокладку конъюгата 200 через порт для образца 620. Когда образец контактирует с FXIIa-биотином во второй зоне 220, fC1-INH в образце связывается с FXIIa, таким образом, образуя комплекс FXIIa-биотин:fC1-INH.
В рамках изобретения термин "контактирует" относится к воздействию на образец одним или более связывающими средствами в течение подходящего периода времени, достаточного для образования комплекса с fC1-INH и/или C1-INH в образце, если он есть. В некоторых вариантах осуществления образец и/или буфер контактирует с одним или более связывающими средствами под действием капиллярности, где образец и/или буфер двигается по прокладке конъюгата или мембране.
Буфер можно помещать в первую зону 210 на прокладке конъюгата 200 через буферный порт 610. Буфер можно помещать в первую зону 210 на любой период времени после помещения образца во вторую зону 220, например, буфер можно помещать по меньшей мере через 5 минут после помещения образца в устройство. Буфер солюбилизирует конъюгат антитела против C1-INH и способствует его движению по прокладке конъюгата 200 от первой зоны 210 к мембране 300 под действием капиллярности. Когда буфер достигает второй зоны 220, он контактирует с комплексом FXIIa-биотин:fC1-INH, и конъюгат антитело против C1-INH в буфере связывается с fC1-INH в комплексе с FXIIa-биотином, таким образом, образуя "сэндвич". В этом примере "сэндвич" fC1-INH, таким образом, содержит FXIIa, конъюгированный с биотином, связанным с fC1-INH, который связан антителом против C1-INH, конъюгированным с частицами европия.
Буфер, содержащий "сэндвич" fC1-INH, продолжает двигаться по прокладке конъюгата 200 к мембране 300, на которой стрептавидин иммобилизован в третьей зоне 230 (например, тестовой линией). В этом примере стрептавидин функционирует как средство захвата, связывающееся со средством докинга, в частности, биотином. Когда буфер контактирует со стрептавидином в третьей зоне 230, биотин в "сэндвиче" fC1-INH связывается со стрептавидином в третьей зоне 230, таким образом, захватывая "сэндвич" fC1-INH. Затем наличие fC1-INH в образце определяют с учетом наличия сигнала от частиц европия в третьей зоне 230 через тестовое окно 630. Детекция "сэндвича" fC1-INH не ограничена детекцией с помощью частиц европия. Например, наличие fC1-INH можно определять посредством детектируемого изменения цвета или pH. Если fC1-INH отсутствует в образце, не образуется "сэндвич" fC1-INH и не определяется сигнал в третьей зоне 230.
После перемещения в третью зону 230 образец продолжает двигаться по мембране 300 в прокладку абсорбента 400, действующий в качестве фитиля для перемещения образца вверх, таким образом, удаляя любой фоновый материал из третьей зоны 230.
Способы, представленные в настоящем описании, включают детекцию и/или количественный анализ fC1-INH или его отсутствия в различных образцах. В некоторых вариантах осуществления образец является биологическим образцом, полученным из индивидуума. В некоторых вариантах осуществления биологический образец является образцом сыворотки, образцом плазмы или образцом крови. В некоторых вариантах осуществления образец получают из индивидуума, как предполагают, имеющего опосредованное недостаточностью fC1-INH нарушение (например, HAE) или имеющего риск его развития.
В некоторых вариантах осуществления биологический образец является образцом крови, например, цельной крови, полученной из индивидуума. Цельная кровь содержит эритроциты, лейкоциты, тромбоциты и плазму крови. В некоторых вариантах осуществления образец крови можно собирать из кровеносных сосудов (например, капилляров, вен и артерий). В некоторых вариантах осуществления образец крови можно получать посредством взятия крови из пальца, получая капли крови. В некоторых вариантах осуществления после получения образца крови, образцы крови держат при 2-8°C. Для получения плазмы или сыворотки, плазму или сыворотку можно получать после забора крови посредством центрифугирования. Образцы плазмы и сыворотки можно хранить при -80°C перед анализом.
В некоторых вариантах осуществления способы и/или устройства, представленные в настоящем описании, могут дополнительно содержать контрольную линию. Как будет понятно специалисту в этой области, контрольную линию можно использовать для обеспечения того, чтобы способ и/или устройство функционировали, как задумано, например, в детекции fC1-INH.
IV. Применение способов и устройств для LFA
Способы и устройства, представленные в настоящем описании, можно использовать для оценки заболевания, например, диагностики или прогнозирования заболевания. Оценка может включать идентификацию индивидуума как имеющего риск развития заболевания или имеющего заболевания, как представлено в настоящем описании, например, опосредованного недостаточностью fC1-INH нарушения. Оценка также может включать мониторинг лечения заболевания, такой как оценка эффективности лечения опосредованного недостаточностью fC1-INH нарушения. Неограничивающие примеры опосредованных недостаточностью fC1-INH нарушений включают наследственный ангионевротический отек (например, HAE типа I и/или типа II), приобретенный ангионевротический отек (например, AAE типа I и/или типа II), связанные с недостаточностью C1-INH иммунные заболевания (например, системную красную волчанку (SLE), и связанные с недостаточностью C1-INH злокачественные новообразования (например, лимфому)).
В некоторых вариантах осуществления способы и устройства, используемые в настоящем описании, используют для оценки того, имеет ли индивидуум наследственный ангионевротический отек или имеет риск его развития. В основном, существует три разных типа наследственного ангионевротического отека, демонстрирующие схожие воспалительные ответы, но отличающиеся по своей этиологии. Например, HAE типа 1 ассоциирован с функциональными, но низкими уровнями C1-INH, в то время как HAE типа II ассоциирован с нефункциональным C1-INH, присутствующим в нормальных концентрациях.
A. Диагностика
В некоторых вариантах осуществления способы и устройства, представленные в настоящем описании, используют для определения уровня fC1-INH в биологическом образце (например, образце сыворотки, или образце плазмы, или образце крови), полученном из индивидуума (например, человека-пациента, как предполагают, имеющего опосредованное недостаточностью fC1-INH нарушение, такое как HAE). Затем уровень fC1-INH сравнивают с референсным значением для определения того, имеет ли индивидуум опосредованное недостаточностью fC1-INH нарушение или имеет риск его развития. Референсное значение может представлять собой контрольный уровень fC1-INH, способного связываться с fC1-INH-связывающим средством, как представлено в настоящем описании (например, FXIIa). В некоторых вариантах осуществления контрольный уровень является уровнем fC1-INH в контрольном образце, способном связываться с fC1-INH-связывающим средством. В некоторых вариантах осуществления контрольный образец получают из здорового индивидуума или популяции здоровых индивидуумов. В рамках изобретения здоровый индивидуум является индивидуумом, очевидно неимеющим опосредованное недостаточностью fC1-INH нарушение на момент измерения уровня fC1-INH или неимеющим заболевание в анамнезе.
Контрольный уровень также может являться заранее определенным уровнем. Такой заранее определенный уровень может представлять собой уровень fC1-INH в популяции индивидуумов, не имеющих или не имеющих риск развития опосредованного недостаточностью fC1-INH нарушения. Заранее определенный уровень может принимать множество форм. Например, он может являться отдельным пороговым значением, таким как медиана или среднее значение. В некоторых вариантах осуществления такой заранее определенный уровень можно устанавливать в зависимости от сравнительных групп, например, где одна определенная группа, как известно, имеет целевое заболевание, а другая определенная группа, как известно, не имеет целевого заболевания. Альтернативно, заранее определенный уровень может являться диапазоном, например, диапазоном, представляющим уровни fC1-INH в контрольной популяции в заранее определенном процентиле.
Контрольный уровень, как представлено в настоящем описании, можно определять различными способами. В некоторых вариантах осуществления контрольный уровень можно получать, осуществляя известный способ. В некоторых вариантах осуществления контрольный уровень можно получать, осуществляя тот же анализ, который используют для определения уровня fC1-INH в образце от индивидуума. В некоторых вариантах осуществления контрольный уровень можно получать, осуществляя способ, представленный в настоящем описании. В некоторых вариантах осуществления контрольный уровень можно получать с помощью устройства, представленного в настоящем описании. В некоторых вариантах осуществления контрольный уровень можно получать из членов контрольной популяции и результаты можно анализировать с помощью, например, вычислительной программы, для получения контрольного уровня (заранее определенного уровня), представляющего собой уровень fC1-INH в контрольной популяции.
Сравнивая уровень fC1-INH, способного связываться с fC1-INH-связывающим средством в образце, полученном из индивидуума, с референсным значением, как представлено в настоящем описании, можно определять, имеет ли индивидуум опосредованное недостаточностью fC1-INH заболевание (например, HAE) или имеет риск его развития. Например, если уровень fC1-INH, связывающегося с fC1-INH-связывающим средством, у индивидуума отклоняется от референсного значения (например, снижен по сравнению с референсным значением), индивидуума-кандидата можно идентифицировать как имеющего опосредованное недостаточностью fC1-INH заболевание, например, HAE, или имеющего риск его развития. Анализ, представленный в настоящем описании, можно использовать для предварительного определения порогового значения, представляющего fC1-INH у нормальных индивидуумов. Такое пороговое значение можно использовать для определения того, имеет ли индивидуум или имеет ли он риск развития опосредованного недостаточностью fC1-INH заболевание (например, HAE). В некоторых случаях уровень fC1-INH у индивидуума ниже порогового значения может свидетельствовать о риске или возникновении заболевания.
В рамках изобретения термин "сниженный уровень или уровень ниже референсного значения" означает, что уровень fC1-INH, связывающегося с fC1-INH-связывающим средством, ниже референсного значения, такого как заранее определенное пороговое значение или уровень fC1-INH, связывающегося с fC1-INH-связывающим средством в контрольном образце.
Сниженный уровень fC1-INH, связывающегося с fC1-INH-связывающим средством, включает уровень fC1-INH, составляющий, например, на 50%, 60%, 70%, 80%, 90%, 100%, 150%, 200%, 300%, 400%, 500% или более ниже референсного значения. Сниженный уровень fC1-INH, связывающегося с fC1-INH-связывающим средством, также включает снижение явления с ненулевого состояния (например, некоторого или детектируемого fC1-INH, связывающегося с fC1-INH-связывающим средством в образце), до нулевого состояния (например, отсутствующего или недетектируемого fC1-INH, связывающегося с fC1-INH-связывающим средством в образце).
В некоторых вариантах осуществления индивидуум является человеком-пациентом, имеющим симптом опосредованного недостаточностью fC1-INH заболевания, например, представленного в настоящем описании, такого как HAE. Например, индивидуум имеет отек, где указанный отек является полностью или преимущественно периферическим; сыпь; покраснение, боль и отек в отсутствие признаков инфекции; отек, не опосредованный гистамином, рецидивирующие приступы отека, или их комбинацию. В некоторых вариантах осуществления индивидуум не имеет симптомов опосредованного недостаточностью fC1-INH заболевания на момент забора образца, не имеет симптомов опосредованного недостаточностью fC1-INH заболевания в анамнезе или не имеет опосредованное недостаточностью fC1-INH заболевание в анамнезе, такое как HAE. В некоторых вариантах осуществления индивидуум является резистентным к антигистаминной терапии, терапии кортикостероидами или и той, и другой.
Неограничивающие примеры опосредованных недостаточностью fC1-INH заболеваний включают независящий от гистамина идиопатический ангионевротический отек, ревматоидный артрит, болезнь Крона, системную красную волчанку, болезнь Альцгеймера, септический шок, ожог, ишемию головного мозга/реперфузию, отек головного мозга, диабетическую ретинопатию, диабетическую нефропатию, отек желтого пятна, васкулит, тромбоз артерий или вен, тромбоз, ассоциированный с устройством поддержки желудочков или стентами, гепарин-индуцированную тромбоцитопению с тромбозом, тромбоэмболическое заболевание и коронарное заболевание сердца с нестабильной стенокардией, отек, заболевание глаз, подагру, заболевание кишечника, мукозит слизистой оболочки полости рта, невропатическую боль, воспалительную боль, спинальный стеноз-остеохондроз, послеоперационную непроходимость кишечника, аневризму аорты, остеоартрит, наследственный ангионевротический отек, тромбоэмболию легочной артерии, инсульт, черепно-мозговую травму или периопухолевый отек головного мозга, сепсис, острую ишемию средней мозговой артерии (MCA) (инсульт), рестеноз (например, после ангиопластики), волчаночный нефрит, аутоиммунное заболевание, воспалительное заболевание, сердечно-сосудистое заболевание, неврологическое заболевание, заболевание, ассоциированное с нарушенным фолдингом белка, заболевание, ассоциированное с ангиогенезом, гипертензивную нефропатию и диабетическую нефропатию, аллергические и респираторные заболевания (например, анафилаксию, астму, хроническую обструктивную болезнь легких, острый респираторный дистресс-синдром, кистозный фиброз, персистирующий ринит) и повреждения тканей (например, ожог или химическое повреждение).
B. Оценка эффективности лечения
Способы и устройства, представленные в настоящем описании, также можно использовать для оценки эффективности лечения, опосредованного недостаточностью fC1-INH заболевания (например, HAE). Например, многочисленные биологические образцы (например, образцы сыворотки, плазмы или крови) можно получать из индивидуума, лечение которого осуществляют, до и после лечения или в течение лечения. Уровни fC1-INH можно измерять любым способом, представленным в настоящем описании. Если уровень fC1-INH повышается после лечения или в течение лечения (уровень fC1-INH в позже собранном образце по сравнению с ранее собранным образцом), остается тем же или повышается, это свидетельствует о том, что лечение является эффективным.
Если индивидуума идентифицируют как неотвечающего на лечение, в отношении идентифицированного индивидуума используют более высокую дозу и/или частоту введения терапевтического средства. В некоторых вариантах осуществления дозу или частоту введения терапевтического средства поддерживают, снижают или прекращают у индивидуума, идентифицированного как отвечающего на лечение или ненуждающегося в дальнейшем лечении. Альтернативно, можно использовать другое лечение в отношении индивидуума, который, как обнаружено, не отвечает на первое лечение.
Терапевтические средства включают в качестве неограничивающих примеров, калликреин-связывающие средства, антагонисты рецептора брадикинина B2, средства-заместители C1-INH, DX-2930 и DX88 (см., например, публикацию PCT № WO 2014/113701, включенную в настоящее описание в качестве ссылки в полном объеме).
ПРИМЕРЫ
Для более полного понимания устройств и способов, представленных в настоящем описании, приведены следующие примеры. Примеры, описанные в настоящей заявке, приведены для иллюстрирования способов и композиций, представленных в настоящем описании, и не следует истолковывать их как какое-либо ограничение объема изобретения.
Пример 1: Получение устройства для иммунохроматографического анализа (LFA) для детекции и/или количественного анализа функционального ингибитора C1-эстеразы (fC1-INH)
Линование мембран
FRONTLINE HR™ (BioDot) использовали для стриппирования мембран. Полоски FrontLine промывали 10 циклами промывочного буфер (0,05% BIO-TERGE® (Stepan Company) в diH2O) и выравнивали так, чтобы тестовая линия находилась на 11 мм от дна мембраны. Полоски FrontLine опустошали и примировали 0,5 мг/мл полистрептавидина в 10 мМ фосфата, pH 7,3, 0,5% сахарозы. Тестовые линии полистрептавидина наносили на мембраны (см., например, на третьей зоне 230 на мембране 300 на фиг. 3A). Затем мембраны метили и сушили при 40°C в течение 30 минут. Полоски FrontLine промывали 10 циклами промывочного буфера после линования. Компоненты для линования мембран приведены в таблице 1.
Таблица 1. Компоненты для линования мембран.
| Компонент | Категория | Поставщик | Номер партии | Количество на мл |
| 0,5 M фосфата натрия, pH 7,3 | N/A | DCN | 10026 | Переменный |
| Полистрептавидин | N/A | Biotez | PolyStrept R | |
| Сахароза | ACS | Sigma | S5500 | 5 мг |
| Вода (diH2O) | ≥18 МОм | Thermo | ≥18 мОм | В количестве, достаточном для конечного объема |
| 0,05% BIO-TERGE® | N/A | DCN | N/A | N/A |
| Мембрана (25 мм × 300 мм) | CN95 | Sartorius | 1UN95ER1000025NTB | N/A |
| Frontline Striper | N/A | BioDot | XYZ 3210 | N/A |
| Большой фольгированный мешок | IMPAK | 125MF518 | Большой фольгированный мешок | Большой фольгированный мешок |
| Десиканты, 0,5 г | IMPAK | 39SG03 | Десиканты, 0,5 г | Десиканты, 0,5 г |
Линование прокладок конъюгатов
FRONTLINE HR™ (BioDot) использовали для линования конъюгатами антител против C1-INH с частицами Eu и FXIIa-биотином прокладки конъюгата (Ahlstrom). Перед линованием прокладки конъюгата конъюгаты антитела против C1-INH с частицами разводили до 0,04% масс./об. в дилюенте для латексных частиц с Eu, и FXIIa-биотин разводили до 2,4 мкМ дилюентом для FXIIa-биотина. Затем полоски FrontLine промывали 10 циклами промывочного буфера (0,05% BIO-TERGE® (Stepan Company) в diH2O). Полоски FrontLine выравнивали таким образом, что конъюгат антитела против C1-INH с частицами Eu наносили линиями 15 мм от низа прокладки конъюгата, и конъюгат FXIIa-биотин наносили линиями на 8 мм от верха прокладки конъюгата со скоростью 10 и 2,5 мкл/см, соответственно. Положения конъюгата антитела против C1-INH с частицами Eu и конъюгата FXIIa-биотин выравнивают с буферным портом и портом для образца в сделанных на заказ кассетах для корпуса SLA, соответственно.
Полоски FrontLine опустошали и примировали любым конъюгатом. Конъюгаты наносили линиями на прокладки конъюгата, которые затем метили и сушили при 40°C в течение 30 минут. Прокладки конъюгата герметично закрывали и обезвоживали. Полоски FrontLine промывали 10 циклами промывочного буфера после линования. Компоненты для линования прокладок конъюгата приведены в таблице 2. Компоненты для дилюента для латексных частиц с Eu и дилюента для FXIIa-биотин приведены в таблице 3 и таблице 4, соответственно.
Таблица 2. Компоненты для линования прокладок конъюгата
| Компонент | Категория | Поставщик | Номер партии |
| Прокладка конъюгата (42 мм × 300 мм) | Стекловолокно | Ahlstrom | 8951 |
| Антитело против C1-INH с частицами Eu | N/A | DCN | Подготавливали как в NBR 715-001 |
| FXIIa-биотин | N/A | Enzyme Research Labs | HFXIIabiotin 3790 |
| Дилюент FXIIa-биотин: 10 мМ Трис, pH 8, 0,1% Tween-20, 2% казеина, 10% сахарозы, 4% трегалозы, 0,25% зеленого пищевого красителя | N/A | DCN | N/A |
| Дилюент для латексных частиц с Eu: 10 мМ Трис, pH 8, 0,1% Tween-20, 2% казеина, 10% сахарозы, 4% трегалозы | N/A | DCN | N/A |
| Frontline Striper | N/A | BioDot | XYZ 3210 |
| Большой фольгированный мешок | N/A | IMPAK | 125MF518 |
| Десиканты, 0,5 г | N/A | IMPAK | 39SG03 |
Таблица 3.Компоненты для дилюента для латексных частиц с Eu
| Компонент | Категория | Поставщик | Номер партии | Количество на мл |
| Трис-HCl | Реагент | Sigma | T3253 | N/A |
| 6% казеина в 50 мМ Трис, pH 8,5, 7-дневное созревание | N/A | DCN | Подготовлено как 21NOV21085M | N/A |
| Tween-20 | BioXtra | Sigma | P7949 | 10 мкл |
| Сахароза | ACS | Sigma | S5500 | 100 мг |
| Трегалоза | ACS | Fisher | BP2687100 | N/A |
| Вода (diH2O) | ≥18 МОм | Thermo | ≥18 МОм | В количестве, достаточном для конечного объема |
Таблица 4. Компоненты для дилюента для FXIIa-биотин
| Компонент | Категория | Поставщик | Номер партии | Количество на мл |
| Трис-HCl | Реагент | Sigma | T3253 | N/A |
| 6% казеин в 50 мМ Трис, pH 8,5, 7-дневное созревание | N/A | DCN | Подготовлено как 21NOV21085M | N/A |
| Tween-20 | BioXtra | Sigma | P7949 | 10 мкл |
| Сахароза | ACS | Sigma | S5500 | 100 мг |
| Трегалоза | ACS | Fisher | BP2687100 | N/A |
| Зеленый пищевой краситель | Пищевая категория | Vons | N/A | 2,5 мкл |
| Вода (diH2O) | ≥18 МОм | Thermo | ≥18 МОм | В количестве, достаточном для конечного объема |
Получение конъюгата антитела против C1-INH с частицами Eu
Для получения конъюгата антитела против C1-INH с частицами Eu 0,1 мг антитела против C1-INH подвергали замене буфера в 50 мМ борате, pH 8, с помощью центрифужных колонок ZEBA™ (Thermo Fisher) по инструкциям производителя. Концентрацию антитела определяли по поглощению (A280, 1 мм, 1 OD=1,4 мг/мл). Сток латексных частиц вращали в течение 10 минут, а затем обрабатывали ультразвуком в течение 10-15 секунд с использованием соникатора Microtip (настройка 25). Стоковый раствор латекса (10%) разводили до 1% в 0,1 M MES, pH 6,5, и подвергали микроцентрифугированию в течение 10 минут при 17000×g. Супернатант удаляли и ресуспендировали осадок в 0,1 M MES, pH 6,5, объемом буфера, равным начальному объему раствора латекса. Полученный раствор обрабатывали ультразвуком, подвергали микроцентрифугированию и ресуспендировали, как описано выше.
Для получения 15 мг/мл EDC в 0,1 M буфере MES, EDC позволяли достигать комнатной температуры и взвешивали. Раствор EDC получали в пределах 10 минут перед использованием в получении конъюгатов антитела против C1-INH с частицами Eu. Стоковый порошок EDC обезвоживали и замораживали при -20°C для длительного хранения.
Для получения 50 мг/мл сульфо-NHS в 0,1 M буфере MES, сульфо-NHS позволяли достигать комнатной температуры и взвешивали. Раствор сульфо-NHS получали в пределах 10 минут перед использованием в получении конъюгатов антител против C1-INH с частицами Eu. Раствор сульфо-NHS активировали посредством инкубации в течение 30 минут на шейкере при 1000 об./мин. раствор подвергали микроцентрифугированию в течение 8 минут при 17000×g. Осадок ресуспендировали в 50 мМ боратном буфере, перемешивали на центрифуге типа вортекс и обрабатывали ультразвуком. Объем буфера был равен начальному объему раствора латекса (600 мкл). Затем раствор подвергали микроцентрифугированию, ресуспендировали в боратном буфере (300 мкл), перемешивали на центрифуге типа вортекс и обрабатывали ультразвуком, как описано выше. Активированные частицы аликвотировали по 50 мкл/пробирку и добавляли подходящие количества буфера и белка (например, 20 мкг белка (т.е. антитело)) для получения массового соотношения 20:1 частиц и белка. Пробирки перемешивали на центрифуге типа вортекс непосредственно после добавления буфера и белка.
Пробирки инкубировали в течение 2 часов при комнатной температуре на шейкере при 1000 об./мин. После инкубации добавляли 1 M этаноламина в количестве 10 мкл/мл и пробирки инкубировали в течение 30 минут при комнатной температуре на шейкере при 1000 об./мин. Пробирки подвергали микроцентрифугированию в течение 10 минут при 17000×g и осадок ресуспендировали в 1% казеине, подвергнутом 7-дневному созреванию, и инкубировали в течение ночи со встряхиванием. После инкубации в течение ночи пробирки подвергали микроцентрифугированию и осадок ресуспендировали в 1% казеине, подвергнутом 7-дневному созреванию, перемешивали на центрифуге типа вортекс и обрабатывали ультразвуком. Затем конъюгаты частиц наносили линиями на прокладки конъюгата, как представлено в настоящем описании. Компоненты конъюгатов антител против C1-INH с частицами Eu приведены в таблице 5.
Таблица 5. Конъюгаты антител против C1-INH с частицами Eu
| Компонент | Категория | Поставщик | Номер партии | Количество на мл |
| Антитело против C1-INH | N/A | Shire | AbD28387.2 | 0,05 мг |
| Частицы латекса с Eu, 0,2 мкм | N/A | Thermo | 93470520010150 | 1 мг |
| Дилюент для хранения конъюгата: 10 мМ Трис, pH 8, 1% казеина | DCN | DCN | N/A | 1 мл |
| 0,1 M MES, pH 6,5 | N/A | DCN | N/A | N/A |
| 0,1 M борат, pH 8 | N/A | DCN | 10061 | N/A |
| Вода (diH2O) | ≥18 МОм | Thermo | ≥18 МОм | В количестве, достаточном для конечного объема |
| 6% казеина в 50 мМ Трис, pH 8,5, 7-дневное созревание | N/A | DCN | подготавливали как 21NOV2108SM | N/A |
| EDC | N/A | Thermo | 22980 | N/A |
| NHS | N/A | Thermo | 24500 | N/A |
| Этаноламин | N/A | TCI | A0297 | N/A |
| Исследовательская центрифуга | N/A | Thermo | Legend XTR | N/A |
| Миксер для микропланшетов | N/A | Scilogex | 82200004SX | N/A |
| Соникатор | N/A | Qsonica | Q55 | N/A |
Ламинирование компонентов на картонные подложки
Для ламинирования компонентов на картонные положки длинной 80 мм (DCN) заднюю подложку для стикера разрезали через 39 мм от низа картонной подложки с использованием резака с линейкой. Задние подложки для стикера удаляли из положения 39 мм наверху картонной подложки. Мембрану приклеивали к картонной подложке через 39 мм от низа картонной подложки. Прокладку абсорбента (Ahlstrom) приклеивали сверху картонной подложки таким образом, что прокладка на 3 мм перекрывалась с верхом мембраны. Остальные задние подложки для стикера удаляли, и прокладку конъюгата приклеивали ко дну картонной подложки таким образом, что прокладка на 3 мм перекрывалась с низом мембраны. Компоненты и порядок компонентов приведены в таблице 6 и таблице 7, соответственно.
Таблица 6. Компоненты карточки
| Компонент | Материал | Длина (мм) | Положение относительно низа полоски (мм) |
| Мембрана | Sartorius CN95 | 25 мм | 39 мм |
| Прокладка конъюгата | Ahlstrom 8951 | 42 мм | N/A |
| Проладка-фитиль (прокладка абсорбента) |
Ahlstrom 243 | 19 мм | 61 мм |
| Картонная подложка (мембрана-подложка) |
DCN P/N P12-651 | 80 мм | N/A |
| Положение на тестовой линии | 11 мм (центр) от нижнего края мембраны. Общая ширина 1 мм. | ||
| Общая ширина полоски | 5,0 мм | ||
Таблица 7. Порядок, ориентация и положения компонентов для ламинирования
| Порядок | Компонент | Ориентация | Положение относительно низа карточки | Перекрывание с мембраной |
| 1 | Линованная мембрана | Перевернутая мембрана, тестовая линия ближе всего к низу карточки | 39 мм | N/A |
| 2 | Прокладка абсорбента | Гладкой стороной вниз | 61 мм | 3 мм |
| 3 | Линованная прокладка конъюгата | Конъюгат Eu ближе всего к низу карточки | N/A | 3 мм |
Получение тест-полосок
Карточки помещали в Kinematic Cutter (Kinematic) и нарезали их на полоски шириной 5,0 мм. Полоски короче 5,0 мм или полоски, помеченные ручкой при линовании, выбрасывали. Нарезанные полоски помещали в фольгированные пакеты с десикантом. Фольгированные пакеты герметично закрывали и хранили в коробках с десикантами до использования.
Пример 2: Использование устройства для LFA для детекции функционального ингибитора C1-эстеразы (fC1-INH) в образцах плазмы от пациентов.
Для осуществления иммунохроматографического анализа (LFA) для определения концентрации fC1-INH тест-полоски, полученные, как описано в примере 1 выше, помещали в сделанную на заказ кассету для стереолитографии (SLA) (см., например, фиг. 4). Стандарты и контроли качества получали посредством добавления референсного стандарта C1-INH (лот № TCP103, Shire, Takeda Company) в C1-INH-истощенную плазму человека с K3-ЭДТА (полученную в Shire, Takeda company). Контрольные образцы, содержащие от 0 мЕд./мл до 800 мЕд./мл очищенного C1-INH, использовали для получения калибровочной кривой. Контрольные образцы разводили 1:20 в C1-INH-истощенных средах. Образец добавляли в порт для образца и инкубировали в течение 5 минут. Подвижный буфер (30 мкл) добавляли в порт для образца, что позволяет образцу попадать на мембрану и вверх в тестовое окно. Затем в буферный порт добавляли подвижный буфер (150 мкл) и кассету инкубировали еще в течение 20 минут. Тест-полоску удаляли из кассеты, и измеряли интенсивность области тестовой линии с использованием флуоресцентного ридера Axxin AX-2X (Axxin). Изображение тест-полоски в кассете приведено на фиг. 5. Строили график измеренной интенсивности области тестовой линии относительно концентрации C1-INH для получения калибровочной кривой, показанной на фиг. 6, и получали R2 0,97.
Пятьдесят образцов нормальной плазмы с K3-ЭДТА получали в коммерческих источниках и пятьдесят образцов плазмы пациентов с HAE использовали с согласия пациентов из SAHARA, рандомизированного, двойного слепого, плацебо-контроллируемого, частично перекрестного исследования фазы III с двумя периодами, тремя последовательностями, в котором оценивали эффективность и безопасность подкожного введения 2000 МЕ жидкого ингибитора C1-эстеразы [человека] для инъекций для профилактики приступов ангионевротического отека у подростков и взрослых с HAE.
Затем калибровочную кривую с фиг. 6 использовали для определения концентрации fC1-INH в образцах плазмы контрольных индивидуумов и индивидуумов, имеющих наследственный ангионевротический отек (HAE). В кратком изложении, образцы плазмы индивидуумов разводили 1:20 в C1-INH-истощенной плазме. Разведенный образец плазмы (20 мкл) добавляли в порт для образца и инкубировали в течение 5 минут. Концентрации fC1-INH, определенные с использованием тест-полосок, составляли в пределах 20% от значений концентрации, определенных посредством ELISA.
Как показано на фиг. 8, уровни C1-INH были ниже у индивидуумов с HAE по сравнению со здоровыми контролями в обоих способах. Измеренные средние концентрации C1-INH составляли 1345 и 1089 мЕд./мл у здоровых контролей и 275 и 163 мЕд./мл у индивидуумов с HAE при использовании хромогенного способа и способа LFA, соответственно (таблица 8). SEM и 95%-ные доверительные интервалы для измерений приведены в таблице 8. Данные о C1-INH для всех индивидуумов с HAE, полученные двумя способами, коррелировали друг с другом с R2 0,86, включая двух индивидуумов HAE, имевших концентрации C1-INH в диапазоне здоровых контролей (фиг. 9). Средние соотношения между fC1INH, измеренных у нормальных контролей и индивидуумов с HAE, составляли 4,9 и 6,7 при использовании хромогенного способа и способа LFA, соответственно.
Кривая операционных характеристик (ROC) для диагностических характеристик на основе образцов от контрольных индивидуумов и индивидуумов с HAE, соответствовала 0,98, что свидетельствовало о том, что концентрация C1-IHN, определенная посредством LFA, позволяла точно различать контрольных индивидуумов и индивидуумов с HAE (фиг. 7). Кривая ROC свидетельствовала о том, что пороговое значение C1-INH 496 мЕд./мл приводило к чувствительности (доле истинно положительных результатов) 94% и специфичности (доли ложноположительных результатов) 96% (фиг. 7); доли ложноотрицательных и ложноположительных результатов приведены в таблице 9.
Как показано в таблице 8 и на фиг. 8-9, результаты, полученные с использованием LFA, сравнивали с хромогенным анализом с помощью ELISA. В кратком изложении, хромогенным способом напрямую измеряют уровни fC1-INH, включая C1s, расщепляющий синтетический субстрат с образованием окрашенного соединения, где сниженная интенсивность окраски свидетельствует об ингибировании ферментативной активности C1s. Хромогенный анализ сертифицирован по прецизионности, точности, линейности и верхнему и нижнему пределам количественного определения. Белок C1-INH (2000 МЕ ингибитора C1-экстеразы [человека], жидкого, для инъекций, Shire, Takeda Company) использовали для получения трех контролей качества, а также стандартной кривой с десятью стандартными точками в диапазоне 1000-1,95 мЕд./мл. Наивысшую и низшую точки стандартной кривой использовали в качестве опорных точек. В кратком изложении, образцы плазмы с K3-ЭДТА и референсный белок предварительно инкубировали с рекомбинантным белком компонента комплемента человека C1s (R&D Systems) в течение 30 минут при комнатной температуре (RT) в полипропиленовом планшете. Образованный комплекс C1-INH и C1s разводили 1:5 в аналитическом буфере и смешивали с раствором субстрата ((синтетический субстрат с тиобензиловой сложноэфирной группой, M-1300, Bachem) и 5,5’-дитиобис(2-нитробензойной кислоты) (DTNB) # D-8000, Biosynth) и реакционной смеси позволяли инкубироваться в течение 40 минут при RT. Поглощение регистрировали при 405 нм с использованием спектрофотометра для чтения планшетов SpectraMax M5 с программным обеспечением SoftMax Pro.
Таблица 8. Результаты сравнения хромогенного анализа и LFA для определения концентрации fC1-INH
| Измерение fC1INH с использованием хромогенного анализа | Измерение fC1INH с использованием LFA | ||
| Образцы плазмы нормальных контролей | Среднее значение | 1345 мЕд./мл | 1089 мЕд./мл |
| n | 50 | 50 | |
| SEM | 36 мЕд./мл | 38 мЕд./мл | |
| 95%-ный доверительный интервал | 1272-1418 мЕд./мл | 1011-1166 мЕд./мл | |
| Образцы плазмы пациентов с HAE | Среднее значение | 275 мЕд./мл | 163 мЕд./мл |
| n | 50 | 50 | |
| SEM | 39 мЕд./мл | 32 мЕд./мл | |
| 95%-ный доверительный интервал | 196-354 мЕд./мл | 100-227 мЕд./мл |
Таблица 9. Доли ложноположительных и ложноотрицательных результатов в образцах контролей и пациентов с HAE.
| Пороговое значение fC1-INH для LFA=496мЕд./мл | ||
| Образцы пациентов с HAE | Нормальные контроли | |
| Положительные результаты на HAE при LFA | 47 | 2 |
| Отрицательные результаты на HAE при LFA | 3 | 48 |
В совокупности, эти результаты свидетельствуют о том, что схожие концентрации fC1-INH определяли в образцах плазмы пациентов с помощью LFA и ELISA (обозначаемого как хромогенный анализ). Таким образом, LFA и тест-полоски, представленные в настоящем описании, могут представлять собой эффективный инструмент для идентификации пациентов, имеющих HAE, с учетом уровня fC1-INH в образце плазмы пациента. Результаты, полученные с использованием LFA, представленного в настоящем описании, коррелировали с результатами хромогенного анализа для оценки fC1-INH.
Быстрые и чувствительные способы и устройства для LFA, представленные в настоящем описании, можно использовать в лаборатории врачебного кабинета для быстрой диагностики HAE (например, типа I и II) с учетом уровней fC1INH. Такие способы и устройства могут приводить к недорогим расходным материалам, возмещаемым системой страхования здоровья, высокому уровню надежности в количественных результатах, простоте интерпретации данных лечащими врачами и/или низкому уровню потребности в подтверждающих анализах. Такой быстрый анализ для диагностики HAE типа I или II во врачебном кабинете может помочь расширить скрининг HAE и быстрее идентифицировать новых пациентов с HAE. В настоящее время, общая частота диагностики HAE составляет только 40%; таким образом, недиагностированные пациенты имеют высокие неудовлетворенные потребности. Быстрая доступность теста на распространенных платформах для устройств может расширить распознавание HAE. Кроме того, быстрый тест на fC1INH, представленный в настоящем описании, может способствовать мониторингу прогрессирования заболевания HAE или ответа на терапевтические средства своевременно в клинических условиях.
Ссылки
1. Maurer, M. et al. (2018) The international WAO/EAACI guideline for the management ofhereditary angioedema - the 2017 revision and update. World Allergy Organization Journal
2. Aabom, A. et al. (2017) Complement factor C4 activation in patients with hereditary angioedema. Clinical Biochemistry 50 (15), 816-821.
3. Bork, K. and Davis-Lorton, M. (2013) Overview of hereditary angioedema caused by C1-inhibitor deficiency: assessment and clinical management. Eur Ann Allergy Clin Immunol 45(1), 7-16.
4. Csuka, D. et al. (2017) The role of the complement system in hereditary angioedema. Mol Immunol 89, 59-68.
5. Li, H.H. et al. (2015) Comparison of chromogenic and ELISA functional C1 inhibitor tests indiagnosing hereditary angioedema. J Allergy Clin Immunol Pract 3 (2), 200-5.
6. Campbell, R.L., Wagner, D.B., and O’Connel, J.P. (1987). Solid phase assay with visual readout. Патент США № 4703017.
7. Rosenstein, R.W. and Bloomster, T.G. (1989). Solid phase assay employing capillary flow. Патент США № 4855240.
8. May, K., Prior, M.E., and Richards, I. (1997). Capillary immunoassay and device therefore comprising mobilizable particulate labelled reagents. Патент США № 5622871.
9. O’Farrell, B. (2009). Evolution in Lateral Flow-Based Immunoassay Systems. In: Wong, R.C. and Tse, H.Y. (eds.). Lateral Flow Immunoassay. Humana Press New York (NY).
10. Zahedi R, Aulak KS, Eldering E, Davis AE 3rd (1996). Characterization of C1 inhibitor-Ta. A dysfunctional C1INH with deletion of lysine 251. J Biol Chem. 1996 Sep 27;271(39):24307-12
Пример 3: Анализы конкурентного связывания демонстрируют специфичность устройства для иммунохроматографического анализа (LFA) для детекции функционального ингибитора C1-эстеразы (fC1-INH).
Специфичность устройства для иммунохроматографического анализа (LFA), представленного в настоящем описании, для определения концентраций fC1-INH исследовали посредством осуществления анализов в присутствии разных конкурентно связывающих белков. Образцы содержали 100 мЕд./мл очищенного C1-INH. В контрольный образец не добавляли конкурентный белок. Измеряли интенсивность области тестовой линии и вычисляли процент снижения сигнала относительно контрольной реакционной смеси для каждого образца. В случае образцов с конкурентными белками интенсивность тестовой линии (TL) снижалась на 40-60% по сравнению с контрольным образцом (таблица 10). Интенсивность TL снижалась на 55% при добавлении меченого биотином BSA, что свидетельствует о том, что в анализе не определяют неродственные белки (таблица 10). Интенсивность TL снижалась на 61% и 48% в случае немеченого FXIIa и немеченого антитела, соответственно, что свидетельствует о специфичности FXIIa и антитела с C1-INH для получения сигнала (таблица 10).
Таблица 10. Результаты тестирования специфичности
| Тестовая линия | Меченый конъюгат | Биотинилированный связывающий белок | Конкурирующий белок | Сигнал от 100 мЕд./мл | % снижения сигнала TL |
| AbD28387 | Нейтравидин-Eu | 50 нМ FXIIa | Нет | 2400 | N/A |
| 3 мкМ BSA-биотин | 1080 | 55% | |||
| 200 нМ FXIIa (без биотина) | 930 | 61% | |||
| 900 нМ AbD28387 | 1240 | 48% | |||
| AbD28384 | Нейтравидин-Eu | 50 нМ FXIIa | Нет | 3700 | N/A |
| 900 нМ AbD28384 | 2150 | 42% |
Специфичность детекции дополнительно тестировали с использованием белка C1-INH, подвергнутого денатурации посредством нагревания. Интенсивность TL не снижалась при нагревании при 40°C, но нагревание при 53°C снижало интенсивность TL до уровня фонового сигнала (таблица 11).
Таблица 11. Результаты тестирования специфичности с использованием термически обработанного C1-INH
| Тестовая линия | Меченый конъюгат | Биотинилированный связывающий белок | Термическая обработка | Сигнал от 1000 мЕд./мл в плазме | Сигнал в истощенной плазме |
| AbD28387 | Нейтравидин-Eu | 50 нМ FXIIa | Нет | 5410 | 360 |
| 40°C в течение 120 мин | 7110 | 360 | |||
| 53°C в течение 120 мин | 370 | 420 |
В совокупности, эти результаты свидетельствуют о том, что LFA и тест-полоски, представленные в настоящем описании, являются специфическими для детекции fC1-INH в образцах плазмы.
Пример 4: Использование образцов крови пациентов для детекции функционального ингибитора C1-эстеразы (fC1-INH) в устройстве для LFA.
В кратком изложении, образец цельной крови получали, осуществляя взятие крови из пальца в соответствии с лабораторной практикой, очевидной специалисту в этой области. После вытирания первой капли крови на пальце образуется вторая капля крови. Пробоотборную петлю используют так, чтобы она контактировала со второй каплей крови, заполняя петлю кровью (фиг. 10A). Затем петлю помещают в контейнер, такой как бутыль SampleTainer® (фиг. 10B). Когда петля касается дна бутыли, бутыль защелкивают и закручивают так, чтобы нижняя часть стержня сломалась в бутыль. И наконец, крышку бутыли заменяют и встряхивают бутыль для смешивания. Образец цельной крови можно добавлять в любые устройства для анализа.
Пример 5: Выбор реагентов
Реагенты выбирали для использования в способах и/или с устройствами, представленными в настоящем описании. Разрабатывали два исходных детекторных средства: в одном использовали наночастицы европия, конъюгированные с Fab против fC1-INH (фиг. 11A), а в другом использовали наночастицы красного золота, конъюгированные с Fab против fC1-INH (фиг. 11B).
Наблюдали резкое снижение сигнала на нижнем конце динамического диапазона, что позволяет предполагать, что система достигла максимального сигнала. В попытке снизить угловой коэффициент зависимости, оценивали разные количества разных реагентов. Два реагента оценивали как тестовые линии: стрептавидин и полимерную версию стрептавидина (полистрептавидин R), напечатанный в концентрации 0,5 мг/мл. Обнаружили, что стрептавидин имел более высокие сигналы по сравнению с полистрептавидином, в то время как полистрептавидин имел больше линейности (фиг. 12). Конъюгаты европия доводили до 0,05% твердого вещества из 0,1%. Концентрацию FXIIa, используемую на стадии инкубации с C1-INH/CINRYZE®, снижали с 1 пмоль/мкл до 0,5 пмоль/мкл для снижения динамического диапазона анализа. Это приводило к получению анализа с сигналом в детектируемом диапазоне.
Также оценивали разные средства для тестовых линий. В кратком изложении, получали три разные тестовые линии: биотинилированный FXIIa человека (B-HFXIIa) смешивали со стрептавидином, B-HFXIIa смешивали с полистрептавидином, и HFXIIa (небиотинилированный) использовали в отдельности. Использование HFXIIa обеспечивало положительный, хоть и низкий, сигнал, в то время как B-HFXIIa и стрептавидин и B-HPFXIIa и полистрептавидин не имели какого-либо заметного положительного сигнала (фиг. 13).
Кроме того, антитела против C1-INH также оценивали для использования в способах, представленных в настоящем описании. Четыре конъюгата европия (Fab против C1-INH, а также антитела против C1-INH RP01, RP02, MM03 и MM06 от Sino Biological Inc.) оценивали в четырех концентрациях (1200 мЕд./мл, 600 мЕд./мл, 100 мЕд./мл и 9 мЕд./мл) (фиг. 14). Сигнал, полученный с использованием каждого из антител RP01, RP02, MM03 и MM06, был повышен по сравнению с конъюгатом Fab. Для дальнейшего анализа выбирали поликлональное антитело RP02.
Также оценивали буферные условия. Например, каждый из буфера с неорганическим буферным средством (IBA) или буфера с органическим буферным средством (OBA) получали с разным pH в диапазоне 7,0-9,5. Буфер с IBA действовал лучше (например, имел более высокий сигнал) на верхнем конце диапазона pH (pH 9,5), в то время как буфер с OBA действовал лучше (например, имел более высокий сигнал) при физиологических диапазонах pH (приблизительно 7-7,5) (фиг. 15).
И наконец, также оценивали детектируемое средство, конъюгированное с C1-INH-связывающим средством. В частности, антитело RP02 оценивали с использованием конъюгата европия или конъюгата красного золота и сравнивали с Fab против C1-INH. Конъюгаты Fab не приводили к положительным сигналам, в то время как антитела RP02 с конъюгатами красного золота приводили к положительному сигналу (фиг. 16).
ДРУГИЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
Все из признаков, представленных в настоящем описании, можно комбинировать в любой комбинации. Каждый признак, представленный в настоящем описании, можно заменять альтернативным признаком, служащим той же, эквивалентной или схожей цели. Таким образом, если конкретно не указано иначе, каждый описанный признак является исключительно примером общей серии эквивалентных или схожих признаков. Используя приведенное выше описание, специалист в этой области легко может определить ключевые характеристики настоящего изобретения без отклонения от его сущности и объема, может осуществлять различные изменения и модификации настоящего изобретения для его адаптации к различному применению и условиям. Таким образом, другие варианты осуществления также входят в формулу изобретения.
ЭКВИВАЛЕНТЫ И ОБЪЕМ ИЗОБРЕТЕНИЯ
Специалистам в этой области будут понятны или станут понятны при использовании не более чем рутинного экспериментирования многие эквиваленты конкретных вариантов осуществления настоящего изобретения, представленных в настоящем описании. Объем настоящего изобретения должен быть ограничен не приведенным выше описанием, а формулой изобретения.
В формуле изобретения термины в единственном числе могут означать один или более, если не указано иное или иное не очевидно из контекста. Пункты формулы изобретения или описание, включающие термин "или" между одним или более членами группы, считают удовлетворяющими, если один, несколько или все из членов группы присутствуют, использованы или иным образом связаны с указанным продуктом или способом, если не указано иное или иное не очевидно из контекста. Настоящее изобретение включает варианты осуществления, в которых конкретно один член группы присутствует, использован или иным образом связан с указанным продуктом или способом. Настоящее изобретение включает варианты осуществления, в которых несколько или все члены группы присутствуют, использованы или иным образом связаны с указанным продуктом или способом.
Кроме того, настоящее изобретение включает все варианты, комбинации и пермутации, в которых одно или более ограничений, элементов, частей формулы изобретения и описательных терминов из одного или более указанных пунктов формулы включены в другой пункт формулы. Например, любой пункт формулы, зависящий от другого пункта, можно модифицировать так, чтобы он включал одно или более ограничений, обнаруживаемых в любом другом пункте формулы, зависящем от того же базового пункта. Если элементы приведены в виде списков, например, в формате групп Маркуша, каждая подгруппа элементов также описана, и из группы можно удалять любые элементы. Следует понимать, что, в основном, если настоящее изобретение или аспекты настоящего изобретения обозначают как содержащие конкретные элементы и/или признаки, некоторые варианты осуществления настоящего изобретения или аспекты настоящего изобретения состоят или состоят, по существу, из таких элементов и/или признаков. Для простоты, эти варианты осуществления конкретно не указаны дословно в настоящем описании. Также следует отметить, что термин "содержащий" должны быть неограничивающими и допускать включение дополнительных элементов или стадий. Если приведены диапазоны, они включают конечные точки. Кроме того, если не указано иначе или иное не очевидно из контекста и знаний специалиста в этой области, значения, выраженные как диапазоны, могут принимать любое конкретное значение или поддиапазон в пределах указанных диапазонов в разных вариантах осуществления настоящего изобретения до десятой части нижнего предела диапазона, если контекст четко не указывает на иное.
В настоящей заявке ссылаются на различные выданные патенты, опубликованные патентные заявки, журнальные статьи и другие публикации, все из которых включены в настоящее описание в качестве ссылки. В случае конфликта между любой из включенных ссылок и настоящим описанием, описание должно обладать приоритетом. Кроме того, любой конкретный вариант осуществления настоящего описания, попадающий в современный уровень техники, можно однозначно исключать из любого одного или более из пунктов формулы изобретения. Т.к. такие варианты осуществления считают известными специалисту в этой области, их можно исключать, даже если исключение не указано конкретно в настоящем описании. Любой конкретный вариант осуществления настоящего изобретения можно исключать из любого пункта формулы по любой причине, связано ли это или нет с современным уровнем техники.
Специалистам в этой области будут известны или станут известны с использованием не более чем рутинного экспериментирования многие эквиваленты конкретных вариантов осуществления, представленных в настоящем описании. Объем вариантов осуществления, представленных в настоящем описании, должен быть ограничен не приведенным выше описанием, а формулой изобретения. Специалистам в этой области будет понятно, что различные изменения и модификации настоящего описания можно осуществлять без отклонения от сущности или объема настоящего изобретения, определенного в следующей формуле изобретения.
Claims (69)
1. Устройство для детекции и/или количественного анализа функционального ингибитора C1-эстеразы (fC1-INH), содержащее:
(i) прокладку конъюгата, содержащую первую зону и вторую зону, где первая зона содержит первое средство, и вторая зона содержит второе средство соответственно и
(ii) мембрану, соединенную с прокладкой конъюгата, где мембрана содержит третью зону, где третья зона содержит третье средство,
где первое средство является средством, связывающим функциональный ингибитор C1 (fC1-INH), или средством, связывающим ингибитор C1 (C1-INH), и второе средство является fC1-INH-связывающим средством или C1-INH-связывающим средством;
где первое средство и второе средство отличаются друг от друга;
где третье средство представляет собой средство захвата, способное связываться со средством докинга;
где одно из fC1-INH-связывающего средства и C1-INH-связывающего средства конъюгировано с детектируемой меткой, и одно из fC1-INH-связывающего средства и C1-INH-связывающего средства конъюгировано со средством докинга, при этом детектируемая метка и средство докинга конъюгированы с разными связывающими средствами; и
где прокладка конъюгата дополнительно содержит четвертую зону для размещения биологического образца и пятую зону для размещения буфера, где буфер протекает через устройство в следующем порядке: первая зона, вторая зона и третья зона.
2. Устройство по п.1, где первое средство, второе средство и третье средство представляют собой C1-INH-связывающее средство, fC1-INH-связывающее средство и средство захвата соответственно или где первое средство, второе средство и третье средство представляют собой fC1-INH-связывающее средство, C1-INH-связывающее средство и средство захвата соответственно.
3. Устройство по п.1 или 2, где первое средство конъюгировано с детектируемой меткой, второе средство конъюгировано со средством докинга или где первое средство конъюгировано со средством докинга, второе средство конъюгировано с детектируемой меткой.
4. Устройство по любому из пп.1-3, где fC1-INH-связывающее средство является активной формой фактора XII (FXIIa).
5. Устройство по любому из пп.1-4, где C1-INH-связывающее средство является антителом, связывающим C1-INH.
6. Устройство по любому из пп.1-5, где средство докинга и средство захвата являются членами пары рецептор-лиганд.
7. Устройство по п.6, где пара рецептор-лиганд содержит биотин и авидин.
8. Устройство по п.7, где средство докинга является биотином, и средство захвата является авидином.
9. Устройство по п.8, где авидин является стрептавидином или полистрептавидином.
10. Устройство по любому из пп.1-9, где детектируемая метка выбрана из группы, состоящей из европия, коллоидного золота, фикоэритрина, флуоресцеина, родамина, зеленого флуоресцентного белка, квантовой точки и хромофора.
11. Устройство по п.10, где детектируемая метка является европием.
12. Устройство по п.10, где детектируемая метка является коллоидным золотом.
13. Устройство по любому из пп.1-12, где детектируемая метка присоединена к частицам латекса.
14. Устройство по любому из пп.1-13, где четвертая зона перекрывается со второй зоной.
15. Устройство по любому из пп.1-14, где первое средство является C1-INH-связывающим средством, находящимся в первой зоне, второе средство является fC1-INH-связывающим средством, находящимся во второй зоне, и третье средство является средством захвата, находящимся в третьей зоне.
16. Устройство по п.15, где C1-INH-связывающее средство является антителом, связывающимся с C1-INH, конъюгированным с детектируемой меткой, fC1-INH-связывающее средство является FXIIa, конъюгированным со средством докинга, являющимся биотином, и средство захвата является авидином, необязательно, являющимся стрептавидином или полистрептавидином.
17. Устройство по п.15 или 16, где четвертая зона для размещения биологического образца перекрывается со второй зоной, на которой находится fC1-INH-связывающее средство.
18. Устройство по любому из пп.1-17, дополнительно содержащее прокладку абсорбента, соединенную с мембраной, где прокладка абсорбента и прокладка конъюгата разделены мембраной.
19. Устройство по любому из пп.1-18, дополнительно содержащее опорный элемент, на который устанавливают прокладку конъюгата, мембрану и/или прокладку абсорбента.
20. Устройство по любому из пп.1-19, дополнительно содержащее корпус.
21. Устройство по п.20, где корпус содержит первое отверстие, образующее буферный порт, второе отверстие, образующее порт для образца, и третье отверстие, образующее тестовое окно.
22. Устройство по п.21, где порт для образца находится между буферным портом и тестовым окном.
23. Устройство по п.21 или 22, где буферный порт выровнен с первой зоной, на которой находится C1-INH-связывающее средство.
24. Устройство по любому из пп.21-23, где порт для образца выровнен со второй зоной, на которой находится fC1-INH-связывающее средство.
25. Устройство по любому из пп.21-24, где тестовое окно выровнено с третьей зоной, на которой находится средство захвата.
26. Способ детекции и/или количественного анализа функционального ингибитора C1-эстеразы (fC1-INH) в образце, включающий:
(i) помещение образца в порт для образца устройства по любому из пп.21-25,
(ii) помещение буфера в буферный порт устройства, где буфер протекает в направлении от первой зоны к третьей зоне;
(iii) исследование сигнала с детектируемой метки на тестовом окне устройства, и
(iv) определение наличия или измерения уровня fC1-INH в образце с учетом наличия или интенсивности сигнала в тестовом окне.
27. Способ по п.26, где стадию (ii) осуществляют по меньшей мере через 5 минут после стадии (i), и где fC1-INH-связывающее средство иммобилизовано на второй зоне, выровненной с портом для образца.
28. Способ по п.26 или 27, где образец является биологическим образцом, полученным из индивидуума.
29. Способ по п.28, где биологический образец является образцом сыворотки, образцом плазмы или образцом крови.
30. Способ по любому из пп.26-29, где индивидуум является пациентом-человеком, как предполагают, имеющим опосредованное недостаточностью fC1-INH нарушение или имеющим риск его развития.
31. Способ по п.30, где опосредованное недостаточностью fC1-INH нарушение выбрано из группы, состоящей из наследственного ангионевротического отека (HAE), приобретенного ангионевротического отека (AAE) и C1-INH-связанного иммунного заболевания.
32. Способ по п.31, где индивидуум имеет симптом HAE.
33. Способ по п.31 или 32, где HAE является HAE типа I или HAE типа II.
34. Способ по п.31 или 33, где индивидуум не имеет симптомов HAE, не имеет симптомов HAE в анамнезе или не имеет HAE в анамнезе.
35. Способ детекции и/или количественного анализа функционального ингибитора C1-эстеразы (fC1-INH) в образце, включающий:
(i) приведение образца в контакт с fC1-INH-связывающим средством и C1-INH-связывающим средством для получения комплекса, где одно из fC1-INH-связывающего средства и C1-INH-связывающего средства конъюгировано со средством докинга, и где одно из fC1-INH-связывающего средства и C1-INH-связывающего средства конъюгировано с детектируемой меткой, при этом детектируемая метка и средство докинга конъюгированы с разными связывающими средствами;
(ii) приведения в контакт комплекса согласно (i) со средством захвата, которое связывает средство докинга; и
(iii) детекцию сигнала, высвобождаемого детектируемой меткой; где наличие сигнала, высвобождаемого детектируемой меткой, свидетельствует о наличии fC1-INH в образце.
36. Способ по п.35, где стадию (i) осуществляют посредством (a) инкубации образца с fC1-INH-связывающим средством в течение по меньшей мере 5 минут и (b) приведения образца в контакт с C1-INH-связывающим средством.
37. Способ по п.35 или 36, где fC1-INH-связывающее средство является активной формой фактора XII (FXIIa).
38. Способ по любому из пп.35-37, где средство докинга и средство захвата являются членами пары рецептор-лиганд.
39. Способ по п.38, где средство докинга является биотином, и средство захвата является авидином; или средство докинга является авидином, и средство захвата является биотином.
40. Способ по п.39, где авидин является стрептавидином или полистрептавидином.
41. Способ по любому из пп.35-40, где C1-INH-связывающее средство является антителом, связывающимся с C1-INH.
42. Способ по любому из пп.35-41, где детектируемая метка выбрана из группы, состоящей из европия, коллоидного золота, фикоэритрина, флуоресцеина, родамина, зеленого флуоресцентного белка, квантовой точки и хромофора.
43. Способ по п.42, где детектируемая метка является европием.
44. Способ по п.42, где детектируемая метка является коллоидным золотом.
45. Способ по любому из пп.35-44, где детектируемая метка присоединена к частицам латекса.
46. Способ по любому из пп.35-45, где fC1-INH-связывающее средство является активной формой фактора XII (FXIIa), конъюгированной с биотином, где C1-INH-связывающее средство является антителом, связывающимся с C1-INH, при этом антитело конъюгировано с детектируемой меткой, и где средство захвата является стрептавидином.
47. Способ по п.46, где стадию (i) осуществляют посредством (a) инкубации образца с fC1-INH-связывающим средством в течение по меньшей мере 5 минут для получения первого комплекса, (b) приведения первого комплекса в контакт с C1-INH-связывающим средством для получения второго комплекса, и где стадию (ii) осуществляют путем приведения второго комплекса в контакт со средством захвата для получения комплекса, и где средство захвата иммобилизовано на опорном элементе.
48. Способ по любому из пп.35-47, где образец является биологическим образцом, полученным из индивидуума.
49. Способ по п.48, где биологический образец является образцом сыворотки, образцом плазмы или образцом крови.
50. Способ по п.48 или 49, где индивидуум является пациентом-человеком, как предполагают, имеющим опосредованное недостаточностью fC1-INH нарушение или имеющим риск его развития.
51. Способ по п.50, где опосредованное недостаточностью fC1-INH нарушение выбрано из группы, состоящей из наследственного ангионевротического отека (HAE), приобретенного ангионевротического отека (AAE) и C1-INH-связанного иммунного заболевания.
52. Способ по п.51, где индивидуум имеет симптом HAE.
53. Способ по п.51 или 52, где HAE является HAE типа I или HAE типа II.
54. Способ по любому из пп.48-53, где индивидуум является резистентным к антигистаминной терапии, терапии кортикостероидами, или и тому, и другому.
55. Способ по п.50, где индивидуум не имеет симптомов HAE, не имеет симптомов HAE в анамнезе или не имеет HAE в анамнезе.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US62/833,235 | 2019-04-12 | ||
| US62/930,615 | 2019-11-05 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2021132766A RU2021132766A (ru) | 2023-05-12 |
| RU2829797C2 true RU2829797C2 (ru) | 2024-11-06 |
Family
ID=
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4855240A (en) * | 1987-05-13 | 1989-08-08 | Becton Dickinson And Company | Solid phase assay employing capillary flow |
| WO2008073222A2 (en) * | 2006-12-11 | 2008-06-19 | Genzyme Corporation | Indirect lateral flow sandwich assay |
| WO2014113701A1 (en) * | 2013-01-20 | 2014-07-24 | Dyax Corp. | Evaluation, assays and treatment of pkal-mediated disorders |
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4855240A (en) * | 1987-05-13 | 1989-08-08 | Becton Dickinson And Company | Solid phase assay employing capillary flow |
| WO2008073222A2 (en) * | 2006-12-11 | 2008-06-19 | Genzyme Corporation | Indirect lateral flow sandwich assay |
| WO2014113701A1 (en) * | 2013-01-20 | 2014-07-24 | Dyax Corp. | Evaluation, assays and treatment of pkal-mediated disorders |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20240103018A1 (en) | Galectin-3 immunoassay | |
| US8030097B2 (en) | Lipocalin-2 as a prognostic and diagnostic marker for heart and stroke risks | |
| CN114573692B (zh) | 用于检测嗜铬粒蛋白a的免疫测定与抗体 | |
| US12163956B2 (en) | Lateral flow immunoassay for measuring functional C1-esterase inhibitor (C1-INH) in plasma samples | |
| JP2024087052A (ja) | 血漿サンプルにおいて機能的c1-エステラーゼインヒビター(c1-inh)を測定するためのラテラルフローイムノアッセイ | |
| RU2829797C2 (ru) | Иммунохроматографический анализ для измерения функционального ингибитора c1-эстеразы (c1-inh) в образцах плазмы | |
| US20250130237A1 (en) | Point of Care Assays | |
| US20250189521A1 (en) | Lateral flow immunoassay for measuring functional c1-esterase inhibitor (c1-inh) in plasma samples | |
| HK40070435A (en) | Lateral flow immunoassay for measuring functional c1-esterase inhibitor (c1-inh) in plasma samples | |
| HK40070435B (en) | Lateral flow immunoassay for measuring functional c1-esterase inhibitor (c1-inh) in plasma samples | |
| US20250035630A1 (en) | Method for measuring elastase 1 in feces | |
| JP7651402B2 (ja) | 高血圧、心筋症、及び心房細動よりなる群から選択されるいずれか一つ疾患の罹患を測定する方法、前記疾患の罹患を測定するための検査試薬、及び前記疾患の罹患を測定するための検査キット | |
| US8841084B2 (en) | Methods for the detection and monitoring of acute myocardial infarction | |
| HK40072995A (en) | Galectin-3 immunoassay | |
| HK40109997A (en) | Method for measuring elastase 1 in feces | |
| OA19228A (en) | Point of care assays |