RU2799554C1 - New probiotic based on a consortium of spore-forming bacteria for aquaculture and animals and a method of its production - Google Patents
New probiotic based on a consortium of spore-forming bacteria for aquaculture and animals and a method of its production Download PDFInfo
- Publication number
- RU2799554C1 RU2799554C1 RU2022108049A RU2022108049A RU2799554C1 RU 2799554 C1 RU2799554 C1 RU 2799554C1 RU 2022108049 A RU2022108049 A RU 2022108049A RU 2022108049 A RU2022108049 A RU 2022108049A RU 2799554 C1 RU2799554 C1 RU 2799554C1
- Authority
- RU
- Russia
- Prior art keywords
- vkpm
- bacillus
- strains
- probiotic
- aquaculture
- Prior art date
Links
Images
Abstract
Description
Изобретение относится к микробиологии и биотехнологии, в частности, к технологии получения пробиотических препаратов для использования в аквакультуре.The invention relates to microbiology and biotechnology, in particular, to a technology for obtaining probiotic preparations for use in aquaculture.
Аквакультура - это один из самых быстрорастущих секторов производства продуктов питания в мире. Различные заболевания водных животных и ухудшение состояния окружающей среды часто приводят к серьезным экономическим потерям. В качестве борьбы и профилактики с инфекционными заболеваниями очень часто применяются антибиотики, но их использование приводит к развитию резистентности патогенных микроорганизмов и подавлению иммунитета организма. В связи с этим, а также с растущим спросом на аквакультуру, в настоящее время широкое признание получает применение пробиотиков в качестве усиливающего иммунитет средства. Пробиотики характеризуются отсутствием патогенности, беспрепятственной пролиферацией in vitro, быстрым ростом в организме [1]. В дополнение к этому, их активность не должна ингибироваться кормовыми ингредиентами и для удобства они должны легко смешиваться с кормом. В аквакультуре пробиотики также добавляют в рыбный корм или, дополнительно, в воду.Aquaculture is one of the fastest growing food production sectors in the world. Various diseases of aquatic animals and environmental degradation often lead to serious economic losses. Antibiotics are often used to fight and prevent infectious diseases, but their use leads to the development of resistance of pathogenic microorganisms and suppression of the body's immunity. Because of this, and with the growing demand for aquaculture, the use of probiotics as an immune booster is now gaining ground. Probiotics are characterized by the absence of pathogenicity, unhindered proliferation in vitro, and rapid growth in the body [1]. In addition, their activity should not be inhibited by the feed ingredients and, for convenience, they should be easy to mix with the feed. In aquaculture, probiotics are also added to fish feed or additionally to water.
К настоящему времени известно большое количество пробиотиков, получаемых с использованием различных видов и групп микроорганизмов: Bacillus subtilis, В. licheniformis, В. coagulans, В. cereus, Lactobacillus sporogenes, L. rhamnosus, L. aracasei, L. delbrueckii, L. acidophilus, L. bulgaricus, L. fermentum, Lactococcus lactis, Bifidobacterium animalis, B. bifidum, Saccharomyces boulardii, Enterococcus faecium и др. Пробиотики являются эффективным средством в борьбе с патогенными бактериями, которые вызывают заболевания, способствуют пролиферации кишечной микрофлоры, продуцируют молочную или уксусную кислоту, различные витамины, белки, ферменты и другие полезные вещества. Таким образом, оздоравливающие свойства пробиотиков заключаются в антагонистической активности против патогенных микробов и их метаболитов, в создании благоприятных условий для микрофлоры желудочно-кишечного тракта и снабжении организма животных биологически активными веществами, повышающими конвертируемость корма, улучшающими процессы жизнедеятельности и иммунный статус [2].To date, a large number of probiotics are known that are obtained using various types and groups of microorganisms: Bacillus subtilis, B. licheniformis, B. coagulans, B. cereus, Lactobacillus sporogenes, L. rhamnosus, L. aracasei, L. delbrueckii, L. acidophilus , L. bulgaricus, L. fermentum, Lactococcus lactis, Bifidobacterium animalis, B. bifidum, Saccharomyces boulardii, Enterococcus faecium, etc. Probiotics are an effective tool in the fight against pathogenic bacteria that cause diseases, promote the proliferation of intestinal microflora, produce lactic or acetic acid, various vitamins, proteins, enzymes and other useful substances. Thus, the healing properties of probiotics consist in antagonistic activity against pathogenic microbes and their metabolites, in creating favorable conditions for the microflora of the gastrointestinal tract and supplying the animal body with biologically active substances that increase feed convertibility, improve vital processes and immune status [2].
Известна кормовая добавка «Субтиспорин», с содержанием вегетативных клеток бактерий Bacillus subtilis ВКПМ В-2150 в количестве 5×109 КОЕ/мл.Known feed additive "Subtisporin", containing vegetative cells of bacteria Bacillus subtilis VKPM B-2150 in the amount of 5×10 9 CFU/ml.
Известен пробиотик «Моноспорин» как в жидком, так и сухом виде. В основе препарата - споровая форма штамма В. subtilis 945 (В-5225) с титром не менее 1×108 КОЕ/мл. В состав препарата так же входят меласса свекловичная, соевый гидролизат, вода.Known probiotic "Monosporin" both in liquid and dry form. The drug is based on the spore form of the strain B. subtilis 945 (B-5225) with a titer of at least 1×10 8 CFU/ml. The composition of the drug also includes beet molasses, soy hydrolyzate, water.
Известен пробиотический препарат для обогащения Artemia franciscana, содержащий в своем составе S. boulardii. В литературе показано, что дрожжи усиливают резистентность и устойчивость артемий к возбудителю Vibrio harveyi при внесении дрожжей в концентрации в 1×104 КОЕ/мл [3].Known probiotic preparation for the enrichment of Artemia franciscana, containing in its composition S. boulardii. It has been shown in the literature that yeast enhances the resistance and resistance of Artemia to the Vibrio harveyi pathogen when yeast is introduced at a concentration of 1×10 4 CFU/ml [3].
Было проведено исследование на обогащение пробиотиком с В. subtilis A. franciscana с последующим ее скармливанием декоративным рыбам Poecilia latipinna. Результаты показали, что культивирование артемий с добавлением В. subtilis в конецентрации 1×105 КОЕ улучшает репродуктивные параметры, кишечную микрофлору и устойчивость к патогенным бактериям у рыб [4].A probiotic enrichment study was conducted with B. subtilis A. franciscana and then fed to ornamental fish Poecilia latipinna. The results showed that the cultivation of Artemia with the addition of B. subtilis at a concentration of 1×10 5 CFU improves reproductive parameters, intestinal microflora and resistance to pathogenic bacteria in fish [4].
Известен препарат с пробиотическим штаммом L. rhamnosus IMC 501®, обладающий ингибирующим эффектом против таких патогенных микроорганизмов как Escherichia coli, Staphylococcus aureus, Candida albicans, Clostridium perfringens и Streptococcus mutans. Проведено исследование на влияние этого штамма на обогащение Artemia sp. с последующим ее скармливанием различным видам рыб. Было показано улучшение в развитии личинок рыб Amphiprion ocellaris [5]. Испанскими учеными [6] проведен эксперимент по введению пробиотика на основе L. rhamnosus в среду к A. metanauplii, чтобы проанализировать эффект от применения пробиотика в качестве средства борьбы с потенциально патогенными представителями микроорганизмов семейства Vibrionaceae. В результате ими доказано позитивное влияние на рачков L. rhamnosus и снижение уровня болезнетворных организмов на целый порядок по сравнению с контролем.Known drug with probiotic strain L. rhamnosus IMC 501®, which has an inhibitory effect against pathogens such as Escherichia coli, Staphylococcus aureus, Candida albicans, Clostridium perfringens and Streptococcus mutans. A study was carried out on the effect of this strain on the enrichment of Artemia sp. followed by feeding it to various types of fish. An improvement in the development of the larvae of the fish Amphiprion ocellaris has been shown [5]. Spanish scientists [6] conducted an experiment on the introduction of a probiotic based on L. rhamnosus into the medium of A. metanauplii in order to analyze the effect of using a probiotic as a means of combating potentially pathogenic representatives of microorganisms of the Vibrionaceae family. As a result, they proved a positive effect on L. rhamnosus crustaceans and a decrease in the level of pathogens by an order of magnitude compared with the control.
Индийскими учеными [7] проведены исследования по обогащению науплиусов А. parthenogenetica разными микроорганизмами: L. rhamnosus, В. coagulans. В ходе эксперимента изучалась нагрузка и время задерживания пробиотических добавок в кишечнике науплиусов артемий. В результате было выявлено, что науплиусы артемий, обогащенные L. rhamnosus, достигали наполненного состояния кишечника через 39±1,41 мин, а обогащенные науплиусы В. coagulans - через 39,5±0,71 мин. Нагрузка на кишечник и время задерживания в кишечнике варьировали в экспериментальных группах.Indian scientists [7] conducted studies on the enrichment of A. parthenogenetica nauplii with various microorganisms: L. rhamnosus, B. coagulans. During the experiment, the load and retention time of probiotic supplements in the intestines of Artemia nauplii were studied. As a result, it was found that Artemia nauplii enriched with L. rhamnosus reached the full state of the intestine after 39 ± 1.41 min, and enriched with B. coagulans nauplii - after 39.5 ± 0.71 min. The load on the intestine and the retention time in the intestine varied in the experimental groups.
Из вышеприведенных данных видно, что в составе пробиотических препаратов чаще всего выступают хорошо изученные микроорганизмы родов Lactobacillus и Bacillus. Однако, для устойчивого развития аквакультуры необходимо увеличить пул микроорганизмов, используемых в качестве пробиотиков для гидробионтов, а также расширить линейку препаратов, базирующихся на консорциуме микробов, а не монокультурах. Кроме того, титр микроорганизмов в большинстве пробиотиков, как правило, не превышает 5×109 КОЕ/г. При этом экспериментально установлено, что чем выше численность микроорганизмов в биопрепарате, тем он эффективнее [8].From the above data, it can be seen that well-studied microorganisms of the genera Lactobacillus and Bacillus most often act as part of probiotic preparations. However, for the sustainable development of aquaculture, it is necessary to increase the pool of microorganisms used as probiotics for aquatic organisms, as well as expand the range of drugs based on a consortium of microbes, rather than monocultures. In addition, the titer of microorganisms in most probiotics, as a rule, does not exceed 5×10 9 CFU/g. At the same time, it was experimentally established that the higher the number of microorganisms in a biological product, the more effective it is [8].
Наиболее близким, по технической сущности или аналогом, к заявляемому изобретению, является способ получения комбинированного пробиотического препарата для животноводства на основе спорообразующих бактерий Bacillus subtilis BKM-B-2998D и Bacillus licheniformis BKM-B-2999D. В качестве вспомогательных веществ или добавок - Bacillus subtilis (natto) ВКМ B-3057D, глюконат кальция, ферментный препарат «Кемзайм плюс» и наполнитель молочная сыворотка. Титр готового препарата - не менее 5×109 КОЕ/г [9].The closest, in terms of technical essence or analogue, to the claimed invention is a method for producing a combined probiotic preparation for animal husbandry based on spore-forming bacteria Bacillus subtilis BKM-B-2998D and Bacillus licheniformis BKM-B-2999D. As excipients or additives - Bacillus subtilis (natto) VKM B-3057D, calcium gluconate, enzyme preparation "Kemzaym plus" and whey filler. The titer of the finished product is not less than 5×10 9 CFU/g [9].
Задачей, стоявшей перед авторами данного изобретения, являлось создание нового комбинированного пробиотического сухого препарата с повышенной эффективностью, высоким титром живых пробиотических микроорганизмов и длительным сроком хранения на основе уникальных штаммов В. toyonensis В-13249 и В. pumilus В-13250, выделенных из ризосферы растений Helianthus annus L. и Cichorium intybus L. соответственно.The task facing the authors of this invention was to create a new combined probiotic dry preparation with increased efficiency, a high titer of live probiotic microorganisms and a long shelf life based on unique strains of B. toyonensis B-13249 and B. pumilus B-13250 isolated from the rhizosphere of plants Helianthus annus L. and Cichorium intybus L., respectively.
Технический результат, получаемый при осуществлении изобретения, заключается в возможности получения пробиотика для аквакультуры и животных, с высоким значением титра за счет включения в состав уникальных штаммов микроорганизмов, обладающих широким спектром антагонистической активности по отношению к патогенным, условно-патогенным микроорганизмам и дрожжеподобным грибкам.The technical result obtained in the implementation of the invention consists in the possibility of obtaining a probiotic for aquaculture and animals with a high titer value due to the inclusion in the composition of unique strains of microorganisms that have a wide spectrum of antagonistic activity against pathogenic, conditionally pathogenic microorganisms and yeast-like fungi.
Технический результат достигается следующим образом: пробиотический препарат для использования в аквакультуре и животных в своем составе содержит лиофильно высушенную биомассу штаммов Bacillus toyonensis ВКПМ В-13249 и Bacillus pumilus ВКПМ В-13250, и наполнитель мальтодекстрин в следующем соотношении (%) по массе: Bacillus toyonensis - 5, Bacillus pumilus - 15, мальтодекстрин - 80, и представляет собой сыпучий порошок белого цвета с коричневыми вкраплениями. Количество жизнеспособных бактерий не менее 1×1010 КОЕ/г.The technical result is achieved as follows: a probiotic preparation for use in aquaculture and animals in its composition contains freeze-dried biomass of Bacillus toyonensis VKPM B-13249 and Bacillus pumilus VKPM B-13250 strains, and maltodextrin filler in the following ratio (%) by weight: Bacillus toyonensis - 5, Bacillus pumilus - 15, maltodextrin - 80, and is a free-flowing white powder with brown patches. The number of viable bacteria is not less than 1×10 10 CFU/g.
Способ получения пробиотического препарата включает последовательное, раздельное культивирование штаммов Bacillus toyonensis ВКПМ В-13249 и Bacillus pumilus ВКПМ В-13250 на мелассно-кукурузной среде в ферментационных установках при рН 6,8-7,0, концентрирование культуральной жидкости на проточной центрифуге, сублимационную сушку концентратов, смешивание полученной сухой биомассы бактерий в соотношении 1:3 с последующей добавкой наполнителя мальто декстрина до 100% массы препарата, приводящей к получению пробиотика с содержанием жизнеспособных бактерий не менее 1×1010 КОЕ/г.The method for producing a probiotic preparation includes sequential, separate cultivation of Bacillus toyonensis VKPM B-13249 and Bacillus pumilus VKPM B-13250 strains on molasses-corn medium in fermentation units at pH 6.8-7.0, concentration of the culture liquid in a flow centrifuge, freeze-drying concentrates, mixing the resulting dry biomass of bacteria in a ratio of 1:3, followed by the addition of a filler maltodextrin to 100% of the mass of the drug, resulting in a probiotic with a viable bacteria content of at least 1×10 10 CFU/g.
1. Штаммы и питательные среды для культивирования.1. Strains and nutrient media for cultivation.
В качестве действующего компонента нового пробиотика использовался консорциум на основе штаммов Bacillus toyonensis ВКПМ В-13249 и Bacillus pumilus ВКПМ В-13250. Оба штамма бактерий были запатентованы в 2019 году [10, 11] как антагонисты по отношению к таким патогенным микроорганизмам, как Escherichia coli, Candida albicans, Staphylococcus aureus, St. epidermidis, Salmonella typhimurium, Shigella sonnei, Pseudomonas aeruginosa.A consortium based on Bacillus toyonensis VKPM B-13249 and Bacillus pumilus VKPM B-13250 strains was used as the active component of the new probiotic. Both bacterial strains were patented in 2019 [10, 11] as antagonists against such pathogenic microorganisms as Escherichia coli, Candida albicans, Staphylococcus aureus, St. epidermidis, Salmonella typhimurium, Shigella sonnei, Pseudomonas aeruginosa.
В колбах и чашках Петри штаммы культивировались на L-среде, содержащей 5 г дрожжевого экстракта, 5 г NaCl и 15 г пептона на 1 л дистиллированной воды. Для получения твердой питательной среды добавлялся агар из расчета 15 г/л.In flasks and Petri dishes, the strains were cultivated on L-medium containing 5 g of yeast extract, 5 g of NaCl, and 15 g of peptone per 1 liter of distilled water. To obtain a solid nutrient medium, agar was added at the rate of 15 g/l.
Питательная среда для ферментации имела следующий состав на 1 л водопроводной воды: 25 г мелассы, 12,5 г кукурузного экстракта, 1 г дрожжевого экстракта, 0,5 г триптона, 0,25 г MgSO4, 0,03 г MnSO4, 0,046 г CoCl2, 1 г CaCl2, 0,001 г FeSO4, 0,001 г CuSO4 и 2 мл лапрола.The nutrient medium for fermentation had the following composition per 1 l of tap water: 25 g molasses, 12.5 g corn extract, 1 g yeast extract, 0.5 g tryptone, 0.25 g MgSO 4 , 0.03 g MnSO 4 , 0.046 g CoCl 2 , 1 g CaCl 2 , 0.001 g FeSO 4 , 0.001 g CuSO 4 and 2 ml laprol.
2. Антагонистическая активность концентратов и готового биопрепарата.2. Antagonistic activity of concentrates and finished biological product.
Лиофилизированные концентраты каждого из штаммов, а также их композиции и готовый пробиотик проявляют антагонистический эффект по отношению к штаммам Е. coli. За счет явления синергизма между штаммами, выражающегося в максимальном антагонистическом эффекте, выбранное соотношение бактерий Bacillus toyonensis ВКПМ В-13249 и Bacillus pumilus ВКПМ В-13250 в готовом препарате - 1:3.Freeze-dried concentrates of each of the strains, as well as their compositions and the finished probiotic, exhibit an antagonistic effect against E. coli strains. Due to the phenomenon of synergy between strains, expressed in the maximum antagonistic effect, the selected ratio of bacteria Bacillus toyonensis VKPM B-13249 and Bacillus pumilus VKPM B-13250 in the finished product is 1:3.
3. Технологическая схема производства препарата и его готовый вид.3. Technological scheme for the production of the drug and its finished form.
Штаммы Bacillus toyonensis ВКПМ В-13249 и Bacillus pumilus ВКПМ В-13250 культивируются раздельно в ферментере с мелассно-кукурузной средой следующего состава (г/л): 25 г мелассы, 12,5 г кукурузного экстракта, 1 г дрожжевого экстракта, 0,5 г триптона, 0,25 г MgSO4, 0,03 г MnSO4, 0,046 г CoCl2, 1 г CaCl2, 0,001 г FeSO4, 0,001 г CuSO4 и 2 мл лапрола. Ферментацию проводят при рН 6,8-7,0 и температуре 37°С, расходе воздуха 100-150 л/мин, скорости перемешивания 250-500 об/мин; pO2 - 30-50% в фазе интенсивного роста культуры. Продолжительность процесса ферментации 18-24 часа. Процесс считается законченным, если концентрация клеток в споровой форме составляет 93-95%. По окончании культивирования штаммов В. toyonensis ВКПМ В-13249 и В. pumilus ВКПМ В-13250 культуральную жидкость концентрируют на высокоскоростной центрифуге с периодической выгрузкой концентрата. Центрифугирование культуральной жидкости проводят при скорости вращения ротора - 15000 об/мин. Скорость подачи культуральной жидкости 100-120 л/ч. По окончании центрифугирования концентраты штаммов В. toyonensis и В. pumilus смешивают с криопротекторной средой, замораживают при -25-40°С в морозильном шкафу и затем, подвергают лиофильной сушке. На выходе получается сыпучий порошок от светло-кремового до темно-бурого цвета, сладко-горького вкуса, с легким специфическим запахом.The strains of Bacillus toyonensis VKPM B-13249 and Bacillus pumilus VKPM B-13250 are cultivated separately in a fermenter with a molasses-corn medium of the following composition (g/l): 25 g of molasses, 12.5 g of corn extract, 1 g of yeast extract, 0.5 g tryptone, 0.25 g MgSO 4 , 0.03 g MnSO 4 , 0.046 g CoCl 2 , 1
Для получения целевого продукта с общим содержанием жизнеспособных клеток бактерий не менее 1×1010 КОЕ/г используют смеситель периодического действия по типу «Пьяная бочка» и наполнитель мальтодекстрин - углевод, представляющий собой промежуточный продукт ферментного расщепления растительного крахмала, в результате чего молекулы крахмала делятся на фрагменты - декстрины, при этом образуются молекулы глюкозы (декстрозы), мальтозы, мальтотриозы. В смеситель вносят 48 кг мальтодекстрина и 2 кг концентратов В. toyonensis и В. pumilus в соотношении 1:3. Затем, содержимое тщательно перемешивается в течение 30-60 мин. (время смешивания выбрано экспериментальным путем, т.к. за такой промежуток времени концентрат бактерий равномерно распределяется по всему объему мальтодекстрина). После перемешивания содержимое смесителя ссыпается в полиэтиленовые мешки, соблюдая точный вес на весах, отбирается средняя проба для анализа. Мешки упаковываются в трехслойные kraft-мешки, зашиваются и отправляются в складское помещение на карантин, до получения результатов анализа на чистоту и содержание микроорганизмов. Общая схема получения готового пробиотического препарата для аквакультуры представлена на блок-схеме (Фиг. 1).To obtain the target product with a total content of viable bacterial cells of at least 1 × 10 10 CFU / g, a batch mixer of the “Drunken barrel” type and a maltodextrin filler are used - a carbohydrate, which is an intermediate product of the enzymatic cleavage of vegetable starch, as a result of which starch molecules are divided into fragments - dextrins, with the formation of molecules of glucose (dextrose), maltose, maltotriose. 48 kg of maltodextrin and 2 kg of B. toyonensis and B. pumilus concentrates are added to the mixer in a ratio of 1:3. Then, the contents are thoroughly mixed for 30-60 minutes. (the mixing time was chosen experimentally, because during such a period of time the bacterial concentrate is evenly distributed throughout the entire volume of maltodextrin). After mixing, the contents of the mixer are poured into plastic bags, observing the exact weight on the scales, an average sample is taken for analysis. The bags are packed in three-layer kraft bags, sewn up and sent to the warehouse for quarantine, until the results of the analysis for purity and microorganism content are received. The general scheme for obtaining a finished probiotic preparation for aquaculture is presented in the block diagram (Fig. 1).
Весь процесс изготовления опытно-промышленных партий готового продукта происходил в лаборатории ИЦ «Промбиотех» АлтГУ на имеющимся оборудовании центра. Таким образом полученный препарат представляет из себя порошок белого цвета с коричневыми вкраплениями бактериального концентрата. Специфический запах бацилл фактически не идентифицируется.The entire process of manufacturing pilot batches of the finished product took place in the laboratory of the Research Center "Prombiotech" of the Altai State University on the existing equipment of the center. The preparation thus obtained is a white powder with brown patches of bacterial concentrate. The specific smell of bacilli is not actually identified.
4. Эффективность препарата при проращивании цист артемий и выращивании креветок.4. Efficacy of the preparation in sprouting Artemia cysts and growing shrimp.
Новый пробиотический препарат, содержащий консорциум штаммов В. toyonensis В-13249 и В. pumilus В-13250 оказывает положительный эффект на процент выклева цист и выход биомассы артемий. Рекомендуемая доза биопрепарата - 0,1 г на 2 г цист.A new probiotic preparation containing a consortium of strains B. toyonensis B-13249 and B. pumilus B-13250 has a positive effect on the percentage of cyst hatching and the yield of Artemia biomass. The recommended dose of the biological product is 0.1 g per 2 g of cysts.
Новый пробиотик на основе споровых бактерий способствует более раннему выходу из личиночной стадии креветки М. rosenbergii по сравнению с контролем (на 18-й день).A new probiotic based on spore bacteria contributes to an earlier exit from the larval stage of the M. rosenbergii shrimp compared to the control (on the 18th day).
Изобретение иллюстрируется следующими примерами:The invention is illustrated by the following examples:
Пример 1. Определение антагонистической активности концентратов штаммов Bacillus toyonensis ВКПМ В-13249 и Bacillus pumilus ВКПМ В-13250 и препарата на их основеExample 1. Determination of the antagonistic activity of concentrates of strains of Bacillus toyonensis VKPM B-13249 and Bacillus pumilus VKPM B-13250 and a preparation based on them
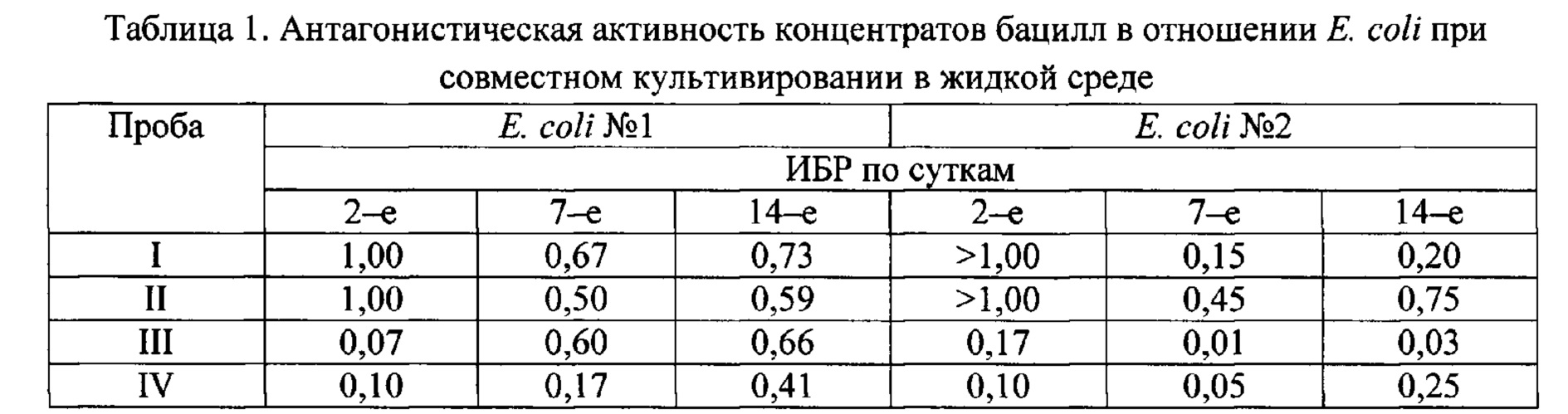
Антагонизм концентратов и бактериального препарата устанавливался по отношению к двум штаммам Е. coli из коллекции ИЦ «Промбиотех». Для этого использовали метод совместного культивирования антагонистов и тест культур в соотношении 1:1 в жидких питательных средах в течение 14-и суток при комнатной температуре. В контрольных колбах штаммы Е. coli выращивали без присутствия бацилл. На 2-е, 7-е и 14-е сутки осуществляли посев из всех колб на среду Эндо для установления индекса блокирования роста (далее ИБР). ИБР - отношение числа колониеобразующих единиц (КОЕ), выросших с контрольной колбы, к числу КОЕ, выросших с опытной колбы. Результат принимали за положительный при ИБР<1. В таблице 1 представлены результаты антагонистической активности лиофилизированных концентратов бацилл. Из них были составлены следующие комбинации: I - только штамм В. toyonensis, II - только штамм В. pumilus, III - штаммы В. toyonensis и В. pumilus в соотношении 1:1, IV - штаммы В. toyonensis и В. pumilus в соотношении 1:3.Antagonism of the concentrates and the bacterial preparation was established in relation to two E. coli strains from the collection of the Research Center "Prombiotech". To do this, we used the method of co-cultivation of antagonists and test cultures in a ratio of 1:1 in liquid nutrient media for 14 days at room temperature. In control flasks, E. coli strains were grown without the presence of bacilli. On the 2nd, 7th, and 14th days, all flasks were inoculated on Endo medium to establish the growth blocking index (hereinafter referred to as IBR). IBR is the ratio of the number of colony forming units (CFU) grown from the control flask to the number of CFU grown from the test flask. The result was taken as positive at IBR<1. Table 1 presents the results of the antagonistic activity of lyophilized concentrates of bacilli. Of these, the following combinations were made: I - only B. toyonensis strain, II - only B. pumilus strain, III - B. toyonensis and B. pumilus strains in a ratio of 1: 1, IV - B. toyonensis and B. pumilus strains in ratio 1:3.
В соответствии с полученными результатами через двое суток концентраты отдельных штаммов бацилл еще не оказывают антагонистическое действие в отношении обоих тест-культур, а пробы с бактериальными консорциумами уже снижают численность Е. coli в пределах порядка с контролем.In accordance with the results obtained, after two days, the concentrates of individual strains of bacilli still do not have an antagonistic effect on both test cultures, and samples with bacterial consortia already reduce the number of E. coli within the order of the control.
К 7-м суткам эксперимента пробы I и II начинают подавлять кишечную палочку, а консорциумы из штаммов В. toyonensis и В. pumilus и вовсе способствуют сокращению численности Е. coli №2 на целый порядок, именно на этом сроке достигается наилучший антагонистический эффект. Через две недели антагонистичекое действие бацилл снижается у всех проб, поэтому до 3-й недели эксперимент не продолжали.By the 7th day of the experiment, samples I and II begin to suppress E. coli, and consortiums of B. toyonensis and B. pumilus strains even contribute to a reduction in the number of E. coli No. 2 by an order of magnitude, it is at this time that the best antagonistic effect is achieved. After two weeks, the antagonistic effect of bacilli decreases in all samples, so the experiment was not continued until the 3rd week.
Е. coli №1 бациллы лучше подавляют, находясь в соотношении 1:3, а Е. coli №2 - в соотношении 1:1, хотя разница не столь велика. На основании выше указанных данных для создания биопрепарата целесообразно использовать консорциум В. pumilus и В. toyonensis в соотношении 3:1.
Данные по антагонистическому действию готового бактериального препарата с мальтодекстрином, установленные при длительном культивировании на жидкой питательной среде его с тест-культурами, представлены в таблице 2.Data on the antagonistic effect of the finished bacterial preparation with maltodextrin, established during long-term cultivation on a liquid nutrient medium with test cultures, are presented in Table 2.
Согласно установленным результатам пробиотик подавляет рост обоих штаммов кишечной палочки в пределах порядка уже на 2-е сутки, как и консорциумы концентратов бацилл. По штамму Е. coli №1 можно заметить, что пробиотик с каждой контрольной точкой эксперимента все сильнее действует на условно-патогенный микроорганизм. При действии биопрепарата на штамм Е. coli №2 зафиксирована особенность - снижение его антагонистической активности через неделю и достижение наилучшего значения ИБР к 14-м суткам эксперимента. Отличие в ИБР между концентратами и готовым препаратом можно объяснить тем, что численность бацилл в готовом пробиотике на порядок ниже, чем в концентрированных культурах В. toyonensis и В. pumilus.According to the established results, the probiotic inhibits the growth of both strains of Escherichia coli within the order already on the 2nd day, as well as consortia of bacilli concentrates. According to the E. coli No. 1 strain, it can be seen that with each control point of the experiment, the probiotic has an increasingly stronger effect on the opportunistic microorganism. Under the action of the biological product on the E. coli No. 2 strain, a feature was recorded - a decrease in its antagonistic activity after a week and the achievement of the best IBR value by the 14th day of the experiment. The difference in IBR between concentrates and the finished product can be explained by the fact that the number of bacilli in the finished probiotic is an order of magnitude lower than in concentrated cultures of B. toyonensis and B. pumilus.
Важно отметить, что в рамках этого опыта дополнительная доза пробиотического препарата не вносилась в питательную среду с кишечной палочкой, а антагонистическое действие бактериального препарата сохранялось на высоком уровне и даже улучшалось со временем. Это важно учитывать при промышленных испытаниях готового продукта, чтобы установить наиболее оптимальный план кормления креветок биопрепаратом и срок достижения максимального положительного эффекта от пробиотикотерапии, который может наступить после завершения профилактического курса приема пробиотической добавки.It is important to note that in the framework of this experiment, an additional dose of the probiotic preparation was not added to the nutrient medium with Escherichia coli, and the antagonistic effect of the bacterial preparation remained at a high level and even improved with time. It is important to take this into account during industrial testing of the finished product in order to establish the most optimal plan for feeding shrimp with a biological product and the period for achieving the maximum positive effect from probiotic therapy, which can occur after the completion of the prophylactic course of taking a probiotic supplement.
Пример 2. Влияние пробиотика при инкубации цист артемийExample 2. Effect of a probiotic during the incubation of Artemia cysts
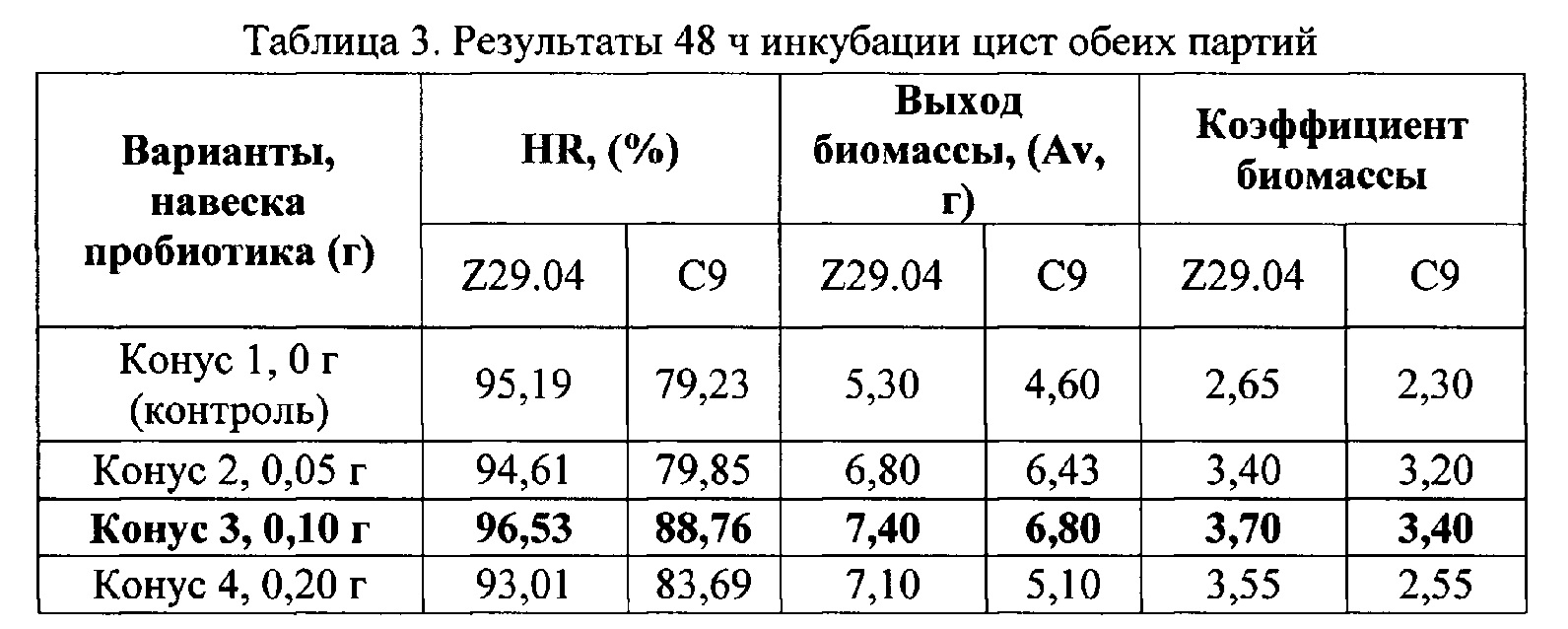
Проведены исследования по эффективности пробиотика при инкубации цист рачка артемий при содействии промышленного партнера - ООО «Ареал» (г. Яровое, Алтайский край). В эксперименте использовались цисты жаброногого рачка артемий A. franciscana двух партий: Z29.04 (озеро Большое Яровое) и С9 (озеро Кучукское) по 4 варианта для каждой из партий в 24-х повторностях. Инкубацию проводили, используя следующие дозы пробиотика (г): 0 (контроль), 0,05, 0,1, 0,2. Пробиотик непосредственно вносился в конус с инкубационным раствором одновременно с началом процесса инкубации. По истечении 48 часов инкубации в каждом конусе подсчитывали количество рачков или науплиусов (N), цист (С) и эмбрионов (U). После чего рассчитывали процент выклева (HR), применяя стандартный метод [12] и коэффициент биомассы [13]. Результаты по обеим партиям цист представлены в таблице 3.Studies on the effectiveness of probiotics in the incubation of Artemia crustacean cysts were carried out with the assistance of an industrial partner - Areal LLC (Yarovoe, Altai Territory). The experiment used cysts of the branchial crustacean Artemia A. franciscana of two lots: Z29.04 (Lake Bolshoye Yarovoe) and C9 (Lake Kuchukskoye), 4 variants for each of the parties in 24 replications. Incubation was performed using the following probiotic doses (g): 0 (control), 0.05, 0.1, 0.2. The probiotic was directly introduced into the cone with the incubation solution simultaneously with the start of the incubation process. After 48 hours of incubation, the number of crustaceans or nauplii (N), cysts (C), and embryos (U) was counted in each cone. After that, the hatching percentage (HR) was calculated using the standard method [12] and the biomass coefficient [13]. The results for both batches of cysts are presented in Table 3.
Из таблицы видно, что лучшие результаты с обеих партий получены при добавлении 0,1 г пробиотика на 2 г сухих цист. Стоит заметить, что % выклева в партии Z29.04 меняется по сравнению с контролем на 1,4%, что хоть и не значительно, но в лучшую сторону. При добавлении биопрепарата к партии С9 отмечается прирост HR на 9,5%. Положительное влияние пробиотика сказывается и на выходе биомассы относительно контроля на 2,1 и 2,2 г в партиях Z29.04 и С9 соответственно.The table shows that the best results from both batches are obtained with the addition of 0.1 g of probiotic per 2 g of dry cysts. It is worth noting that the percentage of hatching in the Z29.04 batch changes by 1.4% compared to the control, which, although not significantly, is for the better. When adding a biological product to batch C9, an increase in HR by 9.5% is noted. The positive effect of the probiotic also affects the biomass yield relative to the control by 2.1 and 2.2 g in batches Z29.04 and C9, respectively.
Пример 3. Установление эффективности биопрепарата при выращивании креветокExample 3. Establishing the effectiveness of a biological product in growing shrimp
Исследование проводилось на частной ферме в Республики Казахстан, в окрестностях г. Караганда. Объектом исследования явилась креветка Розенберга (Macrobrachium rosenbergii), разделенная на 2 группы: контрольная (в кормлении использовалась Artemia franciscana L., инкубированная без добавления пробиотика) и опытная (в кормлении использовалась артемия, инкубированная с добавлением пробиотика, т.н. «обогащенная» артемия) по 200 личинок в каждой, которые выращивались в одинаковых аквариумных системах по 600 литров каждая. Пробиотик вносили на 20 час инкубации цист артемий в количестве 1 г на 100 сухих цист при общей продолжительности инкубации 24 ч. При кормлении креветки на более поздней стадии развития (примерно 15 суток) использовались науплиусы 48 часов инкубации. Стоить отметить, что в ходе кормления на ранних стадиях развития креветки требовательны к подвижности корма. В связи с этим, при кормлении предличинок добавляли суспензию живой спирулины (5 мл на бассейн/сутки) для увеличения подвижности науплиусов. Известно, что вылупившаяся личинка креветки Розенберга проходит 11 различных личиночных стадий, чтобы достичь постличинкой. Этот процесс занимает приблизительно от 22 до 45 дней. Фиксирование линек креветок осуществляли визуально, чтобы не травмировать животных. При обнаружении в общей массе хотя бы одной креветки прошедшей линьку, считали, что вся группа прошла очередную линьку, так как начав, вся группа заканчивает линьку в течение суток. Согласно полученным результатам, в опытной группе наблюдался более ранний выход из личиночной стадии - на 18 день. В контрольной группе - на 28 день. Таким образом сказывается положительный эффект влияния пробиотика на сроки метаморфоза личинок М. rosenbergii.The study was conducted on a private farm in the Republic of Kazakhstan, near the city of Karaganda. The object of the study was the Rosenberg shrimp (Macrobrachium rosenbergii), divided into 2 groups: control (Artemia franciscana L. was used in feeding, incubated without the addition of a probiotic) and experimental (Artemia was used in feeding, incubated with the addition of a probiotic, the so-called "enriched" brine shrimp) of 200 larvae each, which were grown in the same aquarium systems of 600 liters each. The probiotic was introduced at the 20th hour of incubation of Artemia cysts in the amount of 1 g per 100 dry cysts with a total incubation duration of 24 hours. When feeding shrimp at a later stage of development (about 15 days), nauplii were used for 48 hours of incubation. It should be noted that in the course of feeding in the early stages of development, shrimp are demanding on food mobility. In this regard, when feeding the prelarvae, a suspension of live spirulina (5 ml per tank/day) was added to increase the mobility of nauplii. A hatched Rosenberg shrimp larva is known to go through 11 different larval stages to reach the postlarva. This process takes approximately 22 to 45 days. Shrimp molts were fixed visually so as not to injure the animals. If at least one molted shrimp was found in the total mass, it was believed that the whole group went through the next molt, since having started, the whole group completes the molt within a day. According to the results obtained, in the experimental group, an earlier exit from the larval stage was observed - on the 18th day. In the control group - on the 28th day. Thus, the positive effect of the influence of the probiotic on the timing of metamorphosis of the larvae of M. rosenbergii affects.
Пример 4. Установление срока годностиExample 4: Establishing an expiration date
Для установления срока годности готового препарата на протяжении времени хранения при 5°С проверяли изменение титра бацилл, а также наличие, либо отсутствие, посторонней микрофлоры (Фиг. 2).To establish the shelf life of the finished product during the storage time at 5°C, we checked the change in the titer of bacilli, as well as the presence or absence of foreign microflora (Fig. 2).
Как показывают полученные результаты, после хранения препарата на протяжении 12 месяцев, содержание живых микробных клеток остается на высоком уровне, а также отсутствует посторонняя микрофлора.As the results show, after storage of the drug for 12 months, the content of live microbial cells remains at a high level, and there is also no extraneous microflora.
ЛитератураLiterature
1. Левахин В.И., Ласыгина Ю.А., Харламов А.В., Ворошилова Л.Н. Пробиотики в животноводстве // Животноводство и кормопроизводство, 2013. - Т. 1. - №79. - С. 7-10.1. Levakhin V.I., Lasygina Yu.A., Kharlamov A.V., Voroshilova L.N. Probiotics in animal husbandry // Animal husbandry and feed production, 2013. - V. 1. - No. 79. - S. 7-10.
2. Соколенко Г.Г., Лазарев Б.П., Миньченко С.В. Пробиотики в рациональном кормлении животных // Технологии пищевой и перерабатывающей промышленности АПК - продукты здорового питания, 2015. - №1. - С.72-78.2. Sokolenko G.G., Lazarev B.P., Minchenko S.V. Probiotics in the rational feeding of animals // Technologies of the food and processing industry of the agro-industrial complex - healthy food products, 2015. - No. 1. - P.72-78.
3. Patra S.K., Mohamed K.S. Enrichment of Artemia nauplii with the probiotic yeast Saccharomyces boulardii and its resistance against a pathogenic Vibrio // Aquaculture International, 2003. - Vol. 11(5). - P. 505-514.3. Patra S.K., Mohamed K.S. Enrichment of Artemia nauplii with the probiotic yeast Saccharomyces boulardii and its resistance against a pathogenic Vibrio // Aquaculture International, 2003. - Vol. 11(5). - P. 505-514.
4. Ahmadifard N., Aminlooi R., V., Tukmechi A., Agh N. Evaluation of the Impacts of Long-Term Enriched Artemia with Bacillus subtilis on Growth Performance, Reproduction, Intestinal Microflora, and Resistance to Aeromonas hydrophila of Ornamental Fish Poecilia latipinna // Probiotics and Antimicrobial Proteins, 2019. - Vol. 11(3). - P. 957-965.4. Ahmadifard N., Aminlooi R., V., Tukmechi A., Agh N. Evaluation of the Impacts of Long-Term Enriched Artemia with Bacillus subtilis on Growth Performance, Reproduction, Intestinal Microflora, and Resistance to Aeromonas hydrophila of Ornamental Fish Poecilia latipinna // Probiotics and Antimicrobial Proteins, 2019. - Vol. 11(3). - P. 957-965.
5. Avella M.A., Olivotto I., Silvi S., Place A.R., Carnevali O. Effect of dietary probiotics on clownfish: a molecular approach to define how lactic acid bacteria modulate development in a marine fish // Am. J. Physiol. Regul. Integr. Сотр. Physiol., 2010. - Vol. 298(2). - P. 359-371.5. Avella M.A., Olivotto I., Silvi S., Place A.R., Carnevali O. Effect of dietary probiotics on clownfish: a molecular approach to define how lactic acid bacteria modulate development in a marine fish // Am. J Physiol. Regul. integration Associate Physiol., 2010. - Vol. 298(2). - P. 359-371.
6. Ofelio С, Planas M, Pintado J. Administration of the probiotic Lactobacillus rhamnosus IMC 501 as a strategy for the control of Vibrio bacteria in the brine shrimp Artemia // Lett. Appl. Microbiol., 2021. - Vol. 73(3). - P. 336-342.6. Ofelio C, Planas M, Pintado J. Administration of the probiotic Lactobacillus rhamnosus IMC 501 as a strategy for the control of Vibrio bacteria in the brine shrimp Artemia // Lett. Appl. Microbiol., 2021. - Vol. 73(3). - P. 336-342.
7. Isamma A., Divya Kan. R., Ramasubramanian V., Arunjith Th., Sureshkumar S. Standartization of the bioencapsulation of probiotics and oil emulsion in Artemia parthenogenetica // Int. J. Res. Fish. Aquae, 2014. - Vol. 4(3). - P. 122-125.7. Isamma A., Divya Kan. R., Ramasubramanian V., Arunjith Th., Sureshkumar S. Standardization of the bioencapsulation of probiotics and oil emulsion in Artemia parthenogenetica // Int. J. Res. fish. Aquae, 2014. - Vol. 4(3). - P. 122-125.
8. Amoah K., Huang, Q.C, Tan B.P., Zhang S., Chi S. Y., Yang Q. H., Dong X.H. Dietary supplementation of probiotic bacteria, Bacillus coagulans ATCC 7050, improves the growth performance, intestinal morphology, microflora, immune response, and disease confrontation of Pacific white shrimp, Litopenaeus vannamei // Fish and Shellfish Immunology, 2019. - Vol. 87. - P. 796-808.8. Amoah K., Huang, Q.C, Tan B.P., Zhang S., Chi S. Y., Yang Q. H., Dong X.H. Dietary supplementation of probiotic bacteria, Bacillus coagulans ATCC 7050, improves the growth performance, intestinal morphology, microflora, immune response, and disease confrontation of Pacific white shrimp, Litopenaeus vannamei // Fish and Shellfish Immunology, 2019. - Vol. 87.-P. 796-808.
9. Джавахия В.В., Глаголева Е.В., Воинова Т.М., Карташов М.И., Овчинников А.И. Комбинированный пробиотический препарат на основе спорообразующих бактерий рода Bacillus (варианты) для использования в животноводстве, способ его производства (варианты) и штамм Bacillus subtilis (natto), используемый в качестве добавки к препарату // Патент РФ №2675934, заявлено 10.04.2017, опубл. 25.12.2018.9. Dzhavakhia V.V., Glagoleva E.V., Voinova T.M., Kartashov M.I., Ovchinnikov A.I. Combined probiotic preparation based on spore-forming bacteria of the genus Bacillus (variants) for use in animal husbandry, method of its production (variants) and a strain of Bacillus subtilis (natto) used as an additive to the preparation // Patent of the Russian Federation No. 2675934, declared 04/10/2017, publ. . 12/25/2018.
10. Иркитова А.Н., Гребенщикова А.В. Штамм бактерий Bacillus toyonensis ВКПМ В-13249, обладающий выраженным антагонизмом по отношению к микроорганизмам Escherichia coli, Candida albicans, Staphylococcus aureus, St. epidermidis, Salmonella typhimurium, Shigella sonnei, Pseudomonas aeruginosa // Патент РФ №2693439, заявка 25.12.2018, опубл. 02.07.2019 Бюл. №19.10. Irkitova A.N., Grebenshchikova A.V. The bacterial strain Bacillus toyonensis VKPM B-13249, which has a pronounced antagonism against the microorganisms Escherichia coli, Candida albicans, Staphylococcus aureus, St. epidermidis, Salmonella typhimurium, Shigella sonnei, Pseudomonas aeruginosa // Patent of the Russian Federation No. 2693439, application 25.12.2018, publ. 02.07.2019 Bull. No. 19.
11. Иркитова А. Н., Гребенщикова А. В. Штамм бактерий Bacillus pumilus ВКПМ В-13250, обладающий выраженным антагонизмом по отношению к микроорганизмам Escherichia coli, Candida albicans, Staphylococcus aureus, St. epidermidis // Патент РФ №2694522, заявка 25.12.2018, опубл. 16.07.2019. Бюл. №20.11. Irkitova A. N., Grebenshchikova A. V. The bacterial strain Bacillus pumilus VKPM B-13250, which has a pronounced antagonism towards the microorganisms Escherichia coli, Candida albicans, Staphylococcus aureus, St. epidermidis // Patent of the Russian Federation No. 2694522, application 12/25/2018, publ. 07/16/2019. Bull. No. 20.
12. Lavens P., Sorgeloos. P. Manual on the production and use of live food for aquaculture. - Rome, FAO, 1996. - 295 p.12. Lavens P., Sorgeloos. P. Manual on the production and use of live food for aquaculture. - Rome, FAO, 1996. - 295 p.
13. Baert P., Bosteels Т., Sorgeloos P. Pond production // Manual on the production and use of live food for aquaculture, 1996. - P. 196-251.13. Baert P., Bosteels T., Sorgeloos P. Pond production // Manual on the production and use of live food for aquaculture, 1996. - P. 196-251.
Claims (2)
Publications (1)
| Publication Number | Publication Date |
|---|---|
| RU2799554C1 true RU2799554C1 (en) | 2023-07-06 |
Family
ID=
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2675934C2 (en) * | 2017-04-10 | 2018-12-25 | Общество с ограниченной ответственностью "Фермлаб" | Combined probiotic preparation based on spore-forming bacteria of bacillus genus (options) for use in animal breeding, method for production thereof (variants) and bacillus subtilis (natto) strain used as additive for preparation |
| RU2693439C1 (en) * | 2018-12-25 | 2019-07-02 | федеральное государственное бюджетное образовательное учреждение высшего образования "Алтайский государственный университет" | Bacterial strain bacillus toyonensis vkpm b-13249, having marked antagonism with respect to microorganisms escherichia coli, candida albicans, staphylococcus aureus, staphylococcus epidermidis, salmonella typhimurium, shigella sonnei, pseudomonas aeruginosa |
| RU2694522C1 (en) * | 2018-12-25 | 2019-07-16 | федеральное государственное бюджетное образовательное учреждение высшего образования "Алтайский государственный университет" | Bacterial strain bacillus pumilus rncim v-13250, having expressed antagonism towards microorganisms escherichia coli, candida albicans, staphylococcus aureus, staphylococcus epidermidis |
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2675934C2 (en) * | 2017-04-10 | 2018-12-25 | Общество с ограниченной ответственностью "Фермлаб" | Combined probiotic preparation based on spore-forming bacteria of bacillus genus (options) for use in animal breeding, method for production thereof (variants) and bacillus subtilis (natto) strain used as additive for preparation |
| RU2693439C1 (en) * | 2018-12-25 | 2019-07-02 | федеральное государственное бюджетное образовательное учреждение высшего образования "Алтайский государственный университет" | Bacterial strain bacillus toyonensis vkpm b-13249, having marked antagonism with respect to microorganisms escherichia coli, candida albicans, staphylococcus aureus, staphylococcus epidermidis, salmonella typhimurium, shigella sonnei, pseudomonas aeruginosa |
| RU2694522C1 (en) * | 2018-12-25 | 2019-07-16 | федеральное государственное бюджетное образовательное учреждение высшего образования "Алтайский государственный университет" | Bacterial strain bacillus pumilus rncim v-13250, having expressed antagonism towards microorganisms escherichia coli, candida albicans, staphylococcus aureus, staphylococcus epidermidis |
Non-Patent Citations (1)
| Title |
|---|
| ГРЕБЕНЩИКОВA A.В., Изучение антагонистической активности бактериальных консорциумов на основе штаммов Bacillus subtilis, Труды молодых ученых Aлтайского Государственного Университета. //Материалы V региональной молодежной конференции "Мой выбор - наука", XIV научной конференции студентов, магистрантов, аспирантов и учащихся лицейных классов, 1-28 апреля 2018, вып. 15, с. 6-8. ОРЛОВA Т.Н. и др., Aнтагонистическая активность Bacillus subtilis, Вестник Aлтайского государственного аграрного университета, 2018, N 5 (163), с. 141-145. * |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Nimrat et al. | Enhancement of growth performance, digestive enzyme activities and disease resistance in black tiger shrimp (Penaeus monodon) postlarvae by potential probiotics | |
| KR101536901B1 (en) | Probiotics composition for fishes containing a mixture of Bacillus subtilis and phage | |
| MXPA03008563A (en) | Delivery of disease control in aquaculture and agriculture using microbes containing bioactive proteins. | |
| KR101663570B1 (en) | Feed additive containing Pyeong wee-San sludge extract and functional feed using thereof | |
| EP3198040A1 (en) | Probiotic fermented feed additives | |
| KR101230813B1 (en) | Probiotics Agent Against Saprolegnia sp. | |
| JP2009159955A (en) | Probiotics lactic acid bacterium separated from inside of prawn intestine | |
| Liu et al. | Effects of Lactobacillus pentosus combined with Arthrospira platensis on the growth performance, immune response, and intestinal microbiota of Litopenaeus vannamei | |
| JP2010051247A (en) | Biological control agent containing bacillus amyloliquefaciens having antibacterial activity against pathogenic bacterium and fungus as active ingredient | |
| KR101068531B1 (en) | Novel bacteriocin-producing lactic acid bacteria and mixed microbial composition using it for livestocks | |
| KR101047948B1 (en) | Lactobacillus Producing Bacteriocin and Probiotic Composition Containing the Same | |
| Chemlal-Kherraz et al. | The probiotic potential of lactobacilli isolated from Nile tilapia (Oreochromis niloticus)’s intestine | |
| KR100371503B1 (en) | Probiotic preparations for aquacultured fish and its production method | |
| KR101670955B1 (en) | Feed for farming-fish and Farming-fish farmed using that | |
| RU2723411C2 (en) | Bacillus cereus strain rcam04578, a biologically active compounds producer having probiotic properties | |
| RU2799554C1 (en) | New probiotic based on a consortium of spore-forming bacteria for aquaculture and animals and a method of its production | |
| Jahari et al. | Encapsulation of Lactobacillus plantarum with mannan and sodium alginate improves its cell production | |
| RU2768281C1 (en) | Combined probiotic for aquaculture based on spore-forming bacteria of the genus bacillus and a method for production thereof | |
| KR101616530B1 (en) | Lactococcus lactis KR-W.W-2 as a novel strain with antibacterial activity and use thereof | |
| Ali et al. | The effect of oral administration of lactic acid bacteria isolated from kefir on intestinal microbiota, growth performance and survival in juvenile rainbow trout, Oncorhynchus mykiss | |
| TWI460269B (en) | A myristic yeast strain, a composition containing the strain and the use of the strain | |
| WO2016037296A1 (en) | Method for producing indigenous probiotocs with immunostimulant activity and use thereof in prophylaxis against flavobacteriosis in salmonids | |
| Das et al. | Effect of feed probiotic on the growth and their colonization performance on the intestine of rohu (Labeo rohita) | |
| KR101633909B1 (en) | Lactobacillus plantarum mz-1 strain with antimicrobial activity against harmful bacteria to hatchery fish | |
| RU2802073C1 (en) | Feed additive with probiotic activity for fish |