RU2721406C1 - Medicinal complex for treating type 2 diabetes and diabetic dyslipidemia - Google Patents
Medicinal complex for treating type 2 diabetes and diabetic dyslipidemia Download PDFInfo
- Publication number
- RU2721406C1 RU2721406C1 RU2019118301A RU2019118301A RU2721406C1 RU 2721406 C1 RU2721406 C1 RU 2721406C1 RU 2019118301 A RU2019118301 A RU 2019118301A RU 2019118301 A RU2019118301 A RU 2019118301A RU 2721406 C1 RU2721406 C1 RU 2721406C1
- Authority
- RU
- Russia
- Prior art keywords
- rosuvastatin
- hemigliptin
- group
- fdc
- baseline
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/21—Esters, e.g. nitroglycerine, selenocyanates
- A61K31/215—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids
- A61K31/22—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids of acyclic acids, e.g. pravastatin
- A61K31/225—Polycarboxylic acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/519—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
- A61P31/06—Antibacterial agents for tuberculosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
Landscapes
- Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Chemical & Material Sciences (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Epidemiology (AREA)
- Emergency Medicine (AREA)
- Diabetes (AREA)
- General Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Engineering & Computer Science (AREA)
- Communicable Diseases (AREA)
- Endocrinology (AREA)
- Oncology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Hematology (AREA)
- Obesity (AREA)
- Pulmonology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Abstract
Description
Область техники, к которой относится изобретениеFIELD OF THE INVENTION
Настоящее изобретение относится к комбинированному препарату для эффективного лечения диабета 2 типа и дислипидемии у диабетических пациентов. Более конкретно, настоящее изобретение обеспечивает комбинированный препарат, включающий гемиглиптин, который является ингибитором дипептидилпептидазы IV, или его фармацевтически приемлемую соль, и розувастатин, который является ингибитором HMG-CoA редуктазы, или его фармацевтически приемлемую соль, для эффективного контроля глюкозы в крови и снижения фактора риска сердечно-сосудистых заболеваний.The present invention relates to a combination preparation for the effective treatment of type 2 diabetes and dyslipidemia in diabetic patients. More specifically, the present invention provides a combination preparation comprising hemigliptin, which is a dipeptidyl peptidase IV inhibitor, or a pharmaceutically acceptable salt thereof, and rosuvastatin, which is an HMG-CoA reductase inhibitor, or a pharmaceutically acceptable salt thereof, for effectively controlling blood glucose and reducing factor risk of cardiovascular disease.
Предпосылки создания изобретенияBACKGROUND OF THE INVENTION
В 2011 году, по оценкам Международной диабетической федерации (IDF), 366 миллионов человек в мире страдали диабетом. Кроме того, согласно сообщениям IDF, 80% людей с диабетом живут в странах с низким и средним уровнем дохода, и около 36% людей с диабетом живут в западном тихоокеанском регионе, включая Корею. Однако, учитывая, что около 183 миллионов человек страдают диабетом, но не диагностированы, по оценкам IDF, в мире более 549 миллионов человек страдают диабетом, и сообщалось, что диабет стал причиной 4,6 миллиона смертей в 2011 году. (Международная диабетическая федерация, Один взрослый из десяти будет страдать диабетом к 2030 году, Press release, Brussels, 14 November 2011).In 2011, the International Diabetes Federation (IDF) estimates that 366 million people worldwide had diabetes. In addition, IDF reports that 80% of people with diabetes live in low- and middle-income countries, and about 36% of people with diabetes live in the Western Pacific, including Korea. However, given that about 183 million people have diabetes but are not diagnosed, IDF estimates that more than 549 million people have diabetes in the world, and diabetes has been reported to cause 4.6 million deaths in 2011. (International Diabetes Federation, One out of ten adults will have diabetes by 2030, Press release, Brussels, November 14, 2011).
Диабет представляет собой метаболическое расстройство, при котором уровень глюкозы в крови является высоким из-за дефицита секреции инсулина, дефицита действия инсулина или того и другого. Диабет 1 типа является результатом разрушения бета-клеток поджелудочной железы (β-клеток) и является серьезным заболеванием, которое может вызвать кетоз, если его не лечить. У пациентов с диабетом 1 типа уровень глюкозы в крови должен контролироваться лечением инсулином. Диабет 1 типа обычно возникает у детей или молодых людей, но может возникать у взрослых, не страдающих ожирением, и первый симптом высокого уровня глюкозы в крови проявляется с годами. Диабет 2 типа, число случаев которого увеличилось в последнее время, составляет от 90 до 95% от всех случаев диабета. Диабет 2 типа является сложным заболеванием, и его механизм до сих пор неизвестен. Это обычно происходит у взрослых, но также наблюдается у подростков. Его симптомы несерьезны и проявляются в различных формах. Эти симптомы включают в комплексе нарушение функции бета-клеток, периферическую инсулинорезистентность, аномальный метаболизм глюкозы в печени и т.п. При диабете 2 типа контроль гликемии с течением времени становится более трудным, и, таким образом, каждые три или четыре года следует вводить новое гипогликемическое средство для надлежащего контроля гликемии. Кроме того, надлежащий гликемический контроль является трудным, несмотря на комбинированную терапию и инсулинотерапию.Diabetes is a metabolic disorder in which blood glucose levels are high due to a deficiency in insulin secretion, a deficiency in insulin action, or both. Type 1 diabetes is the result of the destruction of pancreatic beta cells (β cells) and is a serious disease that can cause ketosis if left untreated. In patients with type 1 diabetes, blood glucose levels should be monitored by insulin treatment. Type 1 diabetes usually occurs in children or young people, but it can occur in adults who are not obese, and the first symptom of high blood glucose appears over the years. Type 2 diabetes, the number of cases of which has increased recently, ranges from 90 to 95% of all cases of diabetes. Type 2 diabetes is a complex disease, and its mechanism is still unknown. This usually occurs in adults, but also occurs in adolescents. Its symptoms are not serious and manifest in various forms. These symptoms include beta-cell dysfunction, peripheral insulin resistance, abnormal glucose metabolism in the liver, etc. In type 2 diabetes, glycemic control becomes more difficult over time, and therefore, a new hypoglycemic agent should be introduced every three or four years to properly control glycemia. In addition, proper glycemic control is difficult despite combination therapy and insulin therapy.
Согласно рекомендациям Американской Диабетической Ассоциации (ADA), когда уровень гемоглобина A1c (HbA1c) составляет 6,5% или более у пациентов с диабетом 2 типа, необходимо начинать лечение или вводить новое гипогликемическое средство. Кроме того, ADA было рекомендовано, чтобы уровень HbA1c контролировался как можно ближе к недиабетическому диапазону или был снижен по меньшей мере до 7% как цели лечения, и цель лечения была классифицирована в соответствии с периодом диабетической болезни или фактором риска сердечно-сосудистых заболеваний (CVD) у пациентов. (Standards of Medical Care in Diabetes. Diabetes Care. 2016; 39:S1-112).As recommended by the American Diabetes Association (ADA), when hemoglobin A1c (HbA1c) is 6.5% or more in patients with type 2 diabetes, treatment should be started or a new hypoglycemic agent should be administered. In addition, ADA recommended that the level of HbA1c be controlled as close to the non-diabetic range as possible, or be reduced to at least 7% as a treatment goal, and the treatment goal should be classified according to the period of the diabetic disease or CVD risk factor (CVD) ) in patients. (Standards of Medical Care in Diabetes. Diabetes Care. 2016; 39: S1-112).
Диабет является основным фактором риска сердечно-сосудистых заболеваний, и в то же время сердечно-сосудистые заболевания являются основной причиной смерти взрослых пациентов с диабетом. Гипертензия и дислипидемия также являются основными факторами сердечно-сосудистых заболеваний, тем самым значительно увеличивая риск возникновения сердечно-сосудистых заболеваний. Поэтому у пациентов с сахарным диабетом 2 типа рекомендуется оценивать факторы риска сердечно-сосудистых заболеваний как минимум раз в год. (Standards of Medical Care in Diabetes. Diabetes Care. 2016; 39:S1-112).Diabetes is a major risk factor for cardiovascular disease, while cardiovascular disease is a leading cause of death in adult diabetes patients. Hypertension and dyslipidemia are also major factors in cardiovascular disease, thereby significantly increasing the risk of cardiovascular disease. Therefore, in patients with type 2 diabetes mellitus, it is recommended that risk factors for cardiovascular disease be evaluated at least once a year. (Standards of Medical Care in Diabetes. Diabetes Care. 2016; 39: S1-112).
В соответствии с UKPDS, представляющим собой крупномасштабное клиническое исследование, проведенное в Соединенном Королевстве, сообщалось, что инфаркт миокарда или инсульт и стенокардия возникали примерно у 22% пациентов с диабетом 2 типа в течение 10 лет после постановки диагноза, и примерно у 30% пациентов умерли от макрососудистых осложнений. В этом исследовании, в результате анализа факторов риска возникновения сердечно-сосудистых заболеваний, HDL-C (холестерин липопротеинов низкой плотности) демонстрирует наивысшую корреляцию, а затем следуют по порядку LDL-C (холестерин липопротеинов высокой плотности), HbA1c, систолическое артериальное давление и курение (Turner RC et al., British Medical Journal, 1998, Vol. 316, pp. 823-828). В связи с этим, Steno-2 исследование впервые доказало, что эффективный контроль множества факторов риска сердечно-сосудистых заболеваний на ранних стадиях может предотвратить риск сердечно-сосудистых событий или снизить смертность среди пациентов с диабетом 2 типа (Gaede P et al., The New England Journal of Medicine, 2003, Vol 348, pp. 383-393). Это показало необходимость активного контроля других множественных факторов риска, а также строгого гликемического контроля для предотвращения сердечно-сосудистых заболеваний у пациентов с диабетом.According to UKPDS, a large-scale clinical study conducted in the United Kingdom, it was reported that myocardial infarction or stroke and angina pectoris occurred in approximately 22% of patients with type 2 diabetes within 10 years after diagnosis, and approximately 30% of patients died from macrovascular complications. In this study, as a result of the analysis of risk factors for cardiovascular diseases, HDL-C (low-density lipoprotein cholesterol) shows the highest correlation, and then LDL-C (high-density lipoprotein cholesterol), HbA1c, systolic blood pressure and smoking are in order (Turner RC et al., British Medical Journal, 1998, Vol. 316, pp. 823-828). In this regard, the Steno-2 study was the first to show that effective control of many early-stage cardiovascular risk factors can prevent the risk of cardiovascular events or reduce mortality among patients with type 2 diabetes (Gaede P et al., The New England Journal of Medicine, 2003, Vol 348, pp. 383-393). This has shown the need for active monitoring of other multiple risk factors, as well as strict glycemic control to prevent cardiovascular disease in patients with diabetes.
Когда использовали статины, был известен тот факт, что снижение уровня холестерина в крови, среди множества факторов риска сердечно-сосудистых заболеваний, может снизить уровень смертности от сердечно-сосудистых заболеваний. Согласно исследованию 4S с использованием симвастатина, в случае введения 20 мг симвастатина пациентам со стенокардией или инфарктом миокарда, смертность снижалась на около 30%. В результате, статины были признаны в качестве лекарственных средств, которые могут снизить частоту возникновения и смертность от сердечно-сосудистых заболеваний, предотвращая отрыв атеросклеротической бляшки (Pedersen TR et al., Atherosclerosis Supplements, 2004, Vol. 5, pp. 81-87). В настоящее время большинство руководств рекомендуют статины в качестве препаратов первой линии от дислипидемии с LDL-C в качестве основной мишени.When statins were used, it was known that lowering blood cholesterol, among many risk factors for cardiovascular disease, can reduce mortality from cardiovascular disease. According to a 4S study using simvastatin, when 20 mg of simvastatin was administered to patients with angina pectoris or myocardial infarction, mortality was reduced by about 30%. As a result, statins have been recognized as drugs that can reduce the incidence and mortality from cardiovascular disease by preventing the detachment of atherosclerotic plaque (Pedersen TR et al., Atherosclerosis Supplements, 2004, Vol. 5, pp. 81-87) . Most guidelines currently recommend statins as first-line drugs for dyslipidemia with LDL-C as the main target.
Известно, что, как правило, риск серьезного сосудистого события, смертности от сердечно-сосудистых заболеваний и нефатального инфаркта миокарда снижается на 20-25% при снижении LDL-C приблизительно на 1,0 ммоль/л, а у пациентов с риском сердечно-сосудистых заболеваний поддержание LDL-C≤1,8 ммоль/л или снижение на 50% по сравнению с исходным значением показывает достаточный вторичный профилактический эффект. Эти результаты не отличались у пациентов с диабетом. (Baigent C et al., Lancet, 2010, Vol. 376, pp. 1670-1681). Из результатов многих клинических испытаний и мета-анализов было подтверждено, что статины как терапевтические препараты от дислипидемии у пациентов с диабетом значительно снижают риск возникновения сердечно-сосудистых заболеваний за счет снижения концентрации LDL-C. Таким образом, статины были рекомендованы в качестве терапевтических средств от дислипидемии у пациентов с диабетом. Кроме того, даже для пациентов, имеющих более низкий риск сердечно-сосудистых заболеваний (например, пациентов без сердечно-сосудистых заболеваний и в возрасте до 40 лет), было рекомендовано поддерживать LDL-C на уровне 100 мг/дл и рассмотреть возможность применения статинов для изменения образа жизни в случае наличия нескольких факторов риска сердечно-сосудистых заболеваний. (Reiner Ž et al., European Heart Journal, 2011 Vol.32, pp. 1769-1818)It is known that, as a rule, the risk of a serious vascular event, mortality from cardiovascular diseases and non-fatal myocardial infarction is reduced by 20-25% with a decrease in LDL-C by about 1.0 mmol / L, and in patients with a risk of cardiovascular diseases, the maintenance of LDL-C≤1.8 mmol / L or a decrease of 50% compared with the initial value shows a sufficient secondary preventive effect. These results did not differ in patients with diabetes. (Baigent C et al., Lancet, 2010, Vol. 376, pp. 1670-1681). From the results of many clinical trials and meta-analyzes, it has been confirmed that statins as therapeutic agents for dyslipidemia in patients with diabetes significantly reduce the risk of cardiovascular disease by lowering the concentration of LDL-C. Thus, statins have been recommended as therapeutic agents for dyslipidemia in patients with diabetes. In addition, even for patients who have a lower risk of cardiovascular disease (for example, patients without cardiovascular disease and under the age of 40), it was recommended that LDL-C be maintained at 100 mg / dl and consider using statins for lifestyle changes if there are several risk factors for cardiovascular disease. (Reiner Ž et al., European Heart Journal, 2011 Vol. 32, pp. 1769-1818)
То есть, поскольку как гликемический контроль, так и снижение факторов риска сердечно-сосудистых заболеваний непосредственно влияют на возникновение сердечно-сосудистых заболеваний, доступ к комплексному лечению является обязательным для пациентов с диабетом 2 типа.That is, since both glycemic control and a decrease in risk factors for cardiovascular diseases directly affect the occurrence of cardiovascular diseases, access to complex treatment is mandatory for patients with type 2 diabetes.
Раскрытие изобретенияDisclosure of invention
Техническая задачаTechnical challenge
Поэтому технической задачей настоящего изобретения является обеспечение комбинированного препарата, который улучшает соблюдение режима приема препарата пациентами с диабетом 2 типа и эффективно лечит дислипидемию, являющуюся одним из основных факторов риска сердечно-сосудистых заболеваний при диабете, а также контролирует уровень глюкозы в крови.Therefore, the technical task of the present invention is the provision of a combination drug that improves adherence to the drug in patients with type 2 diabetes and effectively treats dyslipidemia, which is one of the main risk factors for cardiovascular diseases in diabetes, and also controls the level of glucose in the blood.
Решение задачиThe solution of the problem
Для решения вышеуказанной технической задачи настоящее изобретение обеспечивает комбинированный препарат, включающий гемиглиптин, который является ингибитором дипептидилпептидазы IV, или его фармацевтически приемлемую соль, и розувастатин, который является ингибитором HMG-CoA-редуктазы, или его фармацевтически приемлемую соль в качестве активных ингредиентов.To solve the above technical problem, the present invention provides a combination preparation comprising hemigliptin, which is an inhibitor of dipeptidyl peptidase IV, or a pharmaceutically acceptable salt thereof, and rosuvastatin, which is an inhibitor of HMG-CoA reductase, or a pharmaceutically acceptable salt thereof as active ingredients.
Настоящее изобретение подробно описано ниже.The present invention is described in detail below.
Гемиглиптин является сильным и селективным ингибитором дипептидилпептидазы-IV (DPP-IV), который был разработан сравнительно недавно. Ингибитор DPP-IV представляет собой лекарственное средство, предназначенное для ингибирования разложения глюкагоноподобного пептида-1 (GLP-1) под действием DPP-IV. GLP-1 представляет собой инкретин, который играет роль в стимулировании секреции инсулина бета-клетками, повышении поглощения глюкозы периферическими тканями, ингибировании секреции глюкагона альфа-клетками и снижении продукции глюкозы в печени.Hemigliptin is a potent and selective inhibitor of dipeptidyl peptidase-IV (DPP-IV), which was developed relatively recently. A DPP-IV inhibitor is a medicament for inhibiting the degradation of glucagon-like peptide-1 (GLP-1) by DPP-IV. GLP-1 is an incretin that plays a role in stimulating insulin secretion by beta cells, increasing peripheral tissue glucose uptake, inhibiting glucagon secretion by alpha cells, and decreasing liver glucose production.
Гемиглиптин можно использовать в различных формах фармацевтически приемлемой соли. В настоящем изобретении примеры фармацевтически приемлемой соли гемиглиптина включают соль хлористоводородной кислоты, бромистоводородной кислоты, фосфорной кислоты, серной кислоты, уксусной кислоты, лимонной кислоты, трифторуксусной кислоты, муравьиной кислоты, малеиновой кислоты, щавелевой кислоты, янтарной кислоты, бензойной кислоты, винной кислоты, фумаровой кислоты, миндальной кислоты, аскорбиновой кислоты, яблочной кислоты и метансульфоновой кислоты, и наиболее предпочтительно можено использовать соль винной кислоты (тартрат).Hemigliptin can be used in various forms of a pharmaceutically acceptable salt. In the present invention, examples of a pharmaceutically acceptable salt of hemigliptin include a salt of hydrochloric acid, hydrobromic acid, phosphoric acid, sulfuric acid, acetic acid, citric acid, trifluoroacetic acid, formic acid, maleic acid, oxalic acid, succinic acid, benzoic acid, tartaric acid, fumaric acid, mandelic acid, ascorbic acid, malic acid and methanesulfonic acid, and most preferably a tartaric acid salt (tartrate) can be used .
Розувастатин является статиновым препаратом, который является ингибитором 3-гидрокси-3-метилглутарил-кофермента A (HMG-CoA). Розувастатин имеет структуру, подобную HMG-CoA, таким образом, он может лечить дислипидемию, ингибируя HMG-CoA редуктазу путем конкурентного ингибирования, для задержки продукции холестерина.Rosuvastatin is a statin drug that is an inhibitor of 3-hydroxy-3-methylglutaryl coenzyme A (HMG-CoA). Rosuvastatin has a structure similar to HMG-CoA, so it can treat dyslipidemia by inhibiting HMG-CoA reductase by competitive inhibition to delay cholesterol production.
Розувастатин можно использовать в различных формах фармацевтически приемлемой соли. В настоящем изобретении примеры фармацевтически приемлемой соли розувастатина включают соль кальция, аммония, лития, цинка или магния, и наиболее предпочтительно можно использовать соль кальция.Rosuvastatin can be used in various forms of a pharmaceutically acceptable salt. In the present invention, examples of a pharmaceutically acceptable salt of rosuvastatin include a calcium, ammonium, lithium, zinc or magnesium salt, and most preferably a calcium salt can be used.
В одном варианте осуществления настоящего изобретения комбинированный препарат может представлять собой комбинацию фиксированных доз, где гемиглиптин или его фармацевтически приемлемая соль и розувастатин или его фармацевтически приемлемая соль содержатся в одной лекарственной форме. В настоящем изобретении было подтверждено, что гемиглиптин или его фармацевтически приемлемая соль и розувастатин или его фармацевтически приемлемая соль не изменяют свои скорости растворения или фармакокинетические свойства в одной лекарственной форме, не влияя друг на друга, обеспечивая, таким образом, комбинацию фиксированных доз.In one embodiment of the present invention, the combination preparation may be a fixed dose combination, where hemigliptin or a pharmaceutically acceptable salt thereof and rosuvastatin or a pharmaceutically acceptable salt thereof are contained in a single dosage form. In the present invention, it was confirmed that hemigliptin or its pharmaceutically acceptable salt and rosuvastatin or its pharmaceutically acceptable salt do not change their dissolution rates or pharmacokinetic properties in one dosage form without affecting each other, thus providing a combination of fixed doses.
В одном варианте осуществления настоящего изобретения комбинация фиксированных доз может дополнительно включать стабилизатор, связующее, разрыхлитель, смазывающее вещество, объемообразующий агент и т.п. в качестве фармацевтически приемлемого эксципиента. Примеры связующего включают, но не ограничиваются этим, поливинилацетат, винилпирролидон-винилацетатный сополимер, гидроксипропилметилцеллюлозу, поливинилпирролидон, коповидон, желатин, альгинат, кукурузный крахмал и картофельный крахмал. Примеры разрыхлителя включают, но не ограничиваются этим, натрий кроскармеллозу, кросповидон и натрий крахмалгликолят. Примеры смазывающего вещества включают, но не ограничиваются этим, коллоидный диоксид кремния, водный диоксид кремния, стеарат магния, стеарилфумарат натрия, глицерилбегенат, стеарат кальция, стеариновую кислоту и тальк. Примеры объемообразующего агента включают, но не ограничиваются этим, микрокристаллическую целлюлозу, силикатизированную микрокристаллическую целлюлозу, маннит и лактозу.In one embodiment of the present invention, a fixed dose combination may further include a stabilizer, a binder, a disintegrant, a lubricant, a bulking agent, and the like. as a pharmaceutically acceptable excipient. Examples of a binder include, but are not limited to, polyvinyl acetate, vinylpyrrolidone-vinyl acetate copolymer, hydroxypropyl methylcellulose, polyvinylpyrrolidone, copovidone, gelatin, alginate, corn starch and potato starch. Examples of the disintegrant include, but are not limited to, croscarmellose sodium, crospovidone and sodium starch glycolate. Examples of a lubricant include, but are not limited to, colloidal silica, aqueous silica, magnesium stearate, sodium stearyl fumarate, glyceryl behenate, calcium stearate, stearic acid and talc. Examples of the bulking agent include, but are not limited to, microcrystalline cellulose, silicified microcrystalline cellulose, mannitol and lactose.
В одном варианте осуществления настоящего изобретения комбинация фиксированных доз может включать гидрофосфат кальция дигидрат (торговое наименование: DI-TAB, Innophos), который играет роль стабилизатора, в качестве фармацевтически приемлемого эксципиента. Поскольку розувастатин стабилен в щелочных условиях и нестабилен кислотных условиях, в обычных лекарственных формах часто используют сильное основание в качестве эксципиента. Однако гемиглиптин нестабилен в щелочных условиях. Использование гидрофосфата кальция дигидрата может придавать стабильность обоим активным ингредиентам гемиглиптину и розувастатину.In one embodiment of the present invention, a fixed-dose combination may include calcium hydrogen phosphate dihydrate (trade name: DI-TAB, Innophos), which acts as a stabilizer, as a pharmaceutically acceptable excipient. Since rosuvastatin is stable under alkaline conditions and unstable under acidic conditions, a strong base is often used as an excipient in conventional dosage forms. However, hemigliptin is unstable under alkaline conditions. The use of calcium hydrogen phosphate dihydrate can give stability to both active ingredients hemigliptin and rosuvastatin.
В одном варианте осуществления настоящего изобретения комбинированный препарат может представлять собой двухслойную таблетку, которая включает слой, содержащий гемиглиптин или его фармацевтически приемлемую соль, и слой, содержащий розувастатин или его фармацевтически приемлемую соль. В случае обеспечения комбинированного препарата в лекарственной форме двухслойной таблетки, лекарственную форму можно получить более легко без учета различий в физико-химических свойствах между гемиглиптином и розувастатином.In one embodiment of the present invention, the combination preparation may be a two-layer tablet that includes a layer containing hemigliptin or a pharmaceutically acceptable salt thereof and a layer containing rosuvastatin or a pharmaceutically acceptable salt thereof. In the case of providing a combined preparation in the dosage form of a two-layer tablet, the dosage form can be obtained more easily without taking into account the differences in physicochemical properties between hemigliptin and rosuvastatin.
В одном варианте осуществления настоящего изобретения двухслойная таблетка может дополнительно включать стабилизатор, связующее, разрыхлитель, смазывающее вещество, объемообразующий агент и т.п. в качестве фармацевтически приемлемого эксципиента. Примеры связующего включают, но не ограничиваются этим, поливинилацетат, винилпирролидон-винилацетатный сополимер, гидроксипропилметилцеллюлозу, поливинилпирролидон, коповидон, желатин, альгинат, кукурузный крахмал и картофельный крахмал. Примеры разрыхлителя включают, но не ограничиваются этим, натрий кроскармеллозу, кросповидон и натрий крахмалгликолят. Примеры смазывающего вещества включают, но не ограничиваются этим, коллоидный диоксид кремния, водный диоксид кремния, стеарат магния, стеарилфумарат натрия, глицерилбегенат, стеарат кальция, стеариновую кислоту и тальк. Примеры наполнителя включают, но не ограничиваются этим, микрокристаллическую целлюлозу, силикатизированную микрокристаллическую целлюлозу, маннит, лактозу и моногидрат лактозы.In one embodiment of the present invention, the bilayer tablet may further include a stabilizer, a binder, a disintegrant, a lubricant, a bulking agent, and the like. as a pharmaceutically acceptable excipient. Examples of a binder include, but are not limited to, polyvinyl acetate, vinylpyrrolidone-vinyl acetate copolymer, hydroxypropyl methylcellulose, polyvinylpyrrolidone, copovidone, gelatin, alginate, corn starch and potato starch. Examples of the disintegrant include, but are not limited to, croscarmellose sodium, crospovidone and sodium starch glycolate. Examples of a lubricant include, but are not limited to, colloidal silica, aqueous silica, magnesium stearate, sodium stearyl fumarate, glyceryl behenate, calcium stearate, stearic acid and talc. Examples of filler include, but are not limited to, microcrystalline cellulose, silicified microcrystalline cellulose, mannitol, lactose and lactose monohydrate.
В одном варианте осуществления настоящего изобретения слой, включающий гемиглиптин, двухслойной таблетки может предпочтительно содержать стеарилфумарат натрия в качестве смазывающего вещества. Если стеарилфумарат натрия содержится в слое, включающем гемиглиптин, в качестве смазывающего вещества, это смазывающее вещество может придавать бóльшую стабильность гемиглиптину по сравнению с другими смазывающими веществами.In one embodiment of the present invention, the hemigliptin-containing layer of a two-layer tablet may preferably contain sodium stearyl fumarate as a lubricant. If sodium stearyl fumarate is contained in a layer comprising hemigliptin as a lubricant, this lubricant can give hemigliptin more stability compared to other lubricants.
В одном варианте осуществления настоящего изобретения слой, включающий розувастатин, двухслойной таблетки может включать гидрофосфат кальция дигидрат (торговое наименование: DI-TAB, Innophos), который играет роль стабилизатора, в качестве фармацевтически приемлемого эксципиента. Если в качестве наполнителя содержится гидрофосфат кальция дигидрат, образование примесей может быть предотвращено, поскольку он способствует стабилизации розувастатина.In one embodiment of the present invention, a layer comprising rosuvastatin of a two-layer tablet may include calcium hydrogen phosphate dihydrate (trade name: DI-TAB, Innophos), which acts as a stabilizer, as a pharmaceutically acceptable excipient. If the filler contains calcium hydrogen phosphate dihydrate, the formation of impurities can be prevented, since it helps to stabilize rosuvastatin.
В одном варианте осуществления настоящего изобретения комбинированный препарат может включать предпочтительно от 25 до 100 мг гемиглиптина или его фармацевтически приемлемой соли, и более предпочтительно от 40 до 80 мг гемиглиптина или его фармацевтически приемлемой соли.In one embodiment of the present invention, the combination preparation may preferably comprise from 25 to 100 mg of hemigliptin or a pharmaceutically acceptable salt thereof, and more preferably from 40 to 80 mg of hemigliptin or a pharmaceutically acceptable salt thereof.
В одном варианте осуществления настоящего изобретения комбинированный препарат может включать предпочтительно от 1 до 50 мг розувастатина или его фармацевтически приемлемой соли, и более предпочтительно от 3 до 40 мг розувастатина или его фармацевтически приемлемой соли.In one embodiment of the present invention, the combination preparation may preferably comprise from 1 to 50 mg of rosuvastatin or a pharmaceutically acceptable salt thereof, and more preferably from 3 to 40 mg of rosuvastatin or a pharmaceutically acceptable salt thereof.
В одном варианте осуществления настоящего изобретения комбинированный препарат может включать, например, 50 мг гемиглиптина или его фармацевтически приемлемой соли и 5 мг розувастатина или его фармацевтически приемлемой соли, 50 мг гемиглиптина или его фармацевтически приемлемой соли и 10 мг розувастатина или его фармацевтически приемлемой соли, 50 мг гемиглиптина или его фармацевтически приемлемой соли и 20 мг розувастатина или его фармацевтически приемлемой соли, или 50 мг гемиглиптина или его фармацевтически приемлемой соли и 40 мг розувастатина или его фармацевтически приемлемой соли.In one embodiment of the present invention, the combination preparation may include, for example, 50 mg of hemigliptin or its pharmaceutically acceptable salt and 5 mg of rosuvastatin or its pharmaceutically acceptable salt, 50 mg of hemigliptin or its pharmaceutically acceptable salt and 10 mg of rosuvastatin or its pharmaceutically acceptable salt, 50 mg of hemigliptin or its pharmaceutically acceptable salt and 20 mg of rosuvastatin or its pharmaceutically acceptable salt, or 50 mg of hemigliptin or its pharmaceutically acceptable salt and 40 mg of rosuvastatin or its pharmaceutically acceptable salt.
В одном варианте осуществления настоящего изобретения комбинированный препарат может иметь пленочное покрытие. Вещества, присутствующие в слое пленочного покрытия, могут включать обычные вещества, такие как гидроксипропилметилцеллюлоза, поливинилпирролидон, коповидон, серию Opadry®, серию Eudragit®, но не ограничиваются этим.In one embodiment of the present invention, the combination preparation may be film coated. Substances present in the film coating layer may include, but are not limited to, conventional substances such as hydroxypropyl methylcellulose, polyvinylpyrrolidone, copovidone, the Opadry® series, the Eudragit® series.
Эффекты изобретенияEffects of the invention
В соответствии с настоящим изобретением, обеспечивается комбинированный препарат, включающий гемиглиптин или его фармацевтически приемлемую соль и розувастатин или его фармацевтически приемлемую соль, который может улучшить соблюдение режима приема препарата пациентами, эффективно лечить дислипидемию у диабетических пациентов, а также эффективно лечить диабет 2 типа путем гликемического контроля.In accordance with the present invention, there is provided a combination preparation comprising hemigliptin or a pharmaceutically acceptable salt thereof and rosuvastatin or a pharmaceutically acceptable salt thereof which can improve patient adherence, effectively treat dyslipidemia in diabetic patients, and also effectively treat type 2 diabetes by glycemic control.
Краткое описание чертежейBrief Description of the Drawings
Фиг. 1 представляет график, показывающий изменения Hb1Ac (%) при каждом визите.FIG. 1 is a graph showing changes in Hb1Ac (%) at each visit.
Фиг. 2 представляет график, показывающий изменения LDL-C (мг/дл) при каждом визите.FIG. 2 is a graph showing changes in LDL-C (mg / dl) at each visit.
Способ осуществления изобретенияThe method of carrying out the invention
Далее настоящее изобретение объясняется более подробно при помощи следующих примеров. Однако должно быть понятно, что объем правовой охраны настоящего изобретения не ограничивается этими примерами.Further, the present invention is explained in more detail using the following examples. However, it should be understood that the scope of legal protection of the present invention is not limited to these examples.
Пример 1: Получение фиксированной дозыExample 1: Getting a fixed dose
Получали комбинации фиксированных доз 3 композиций с разным содержанием розувастатина в соответствии с соответствующей композицией Таблицы 1.Received combinations of fixed doses of 3 compositions with different contents of rosuvastatin in accordance with the corresponding composition of Table 1.
2) Prosolv SMCC 50: силикатизированная микрокристаллическая целлюлоза
3) DI-TAB: гидрофосфат кальция дигидрат
4) Коллидон VA64: винилпирролидон-винилацетатный сополимер1) Supertab 21AN: Anhydrous Lactose
2) Prosolv SMCC 50: silicate microcrystalline cellulose
3) DI-TAB: calcium hydrogen phosphate dihydrate
4) Collidone VA64: vinylpyrrolidone-vinyl acetate copolymer
Пример 2: Получение двухслойной таблеткиExample 2: Obtaining a two-layer tablet
Двухслойные таблетки 3 композиций с разным содержанием розувастатина получали в соответствии с соответствующей композицией Таблицы 2. Способ получения представлен в Таблице 3.Two-layer tablets of 3 compositions with different contents of rosuvastatin were obtained in accordance with the corresponding composition of Table 2. The production method is presented in Table 3.
2) DI-TAB: гидрофосфат кальция дигидрат
3) Коллидон VA64: винилпирролидон-винилацетатный сополимер1) Flowlac 100: Lactose Monohydrate
2) DI-TAB: calcium hydrogen phosphate dihydrate
3) Collidone VA64: vinylpyrrolidone-vinyl acetate copolymer
Пример 3: Испытание на стабильностьExample 3: Stability Test
Испытание на стабильность композиций двухслойных таблеток, полученных в Примере 2, осуществляли в условиях ускоренного испытания (40°C, 75% влажности) в течение 6 месяцев. Результаты представлены в Таблице 4.The stability test of the compositions of the two-layer tablets obtained in Example 2 was carried out under conditions of accelerated testing (40 ° C, 75% humidity) for 6 months. The results are presented in Table 4.
DP-IMP-1:DP-IMP-1:
2-[(2S)-6,6-дифтор-2,3,5,6,7,8-гексагидроимидазо[1,2-a]пиридин-2-ил]-1-[2,4-ди(трифторметил)-5,6,7,8-тетрагидропиридо[3,4-d]пиримидин-7-ил]-1-этанон2 - [(2 S ) -6,6-difluoro-2,3,5,6,7,8-hexahydroimidazo [1,2- a ] pyridin-2-yl] -1- [2,4-di ( trifluoromethyl) -5,6,7,8-tetrahydropyrido [3,4- d ] pyrimidin-7-yl] -1-ethanone
DP-IMP-2:DP-IMP-2:
2,4-ди(трифторметил)-5,6,7,8-тетрагидропиридо[3,4-d]пиримидин-8-он2,4-di (trifluoromethyl) -5,6,7,8-tetrahydropyrido [3,4- d ] pyrimidin-8-one
DP-IMP-3:DP-IMP-3:
(3S)-3-амино-4-(5,5-дифтор-2-оксопиперидино)-1-[8-гидрокси-2,4-ди(трифторметил)-5,6,7,8-тетрагидропиридо[3,4-d]пиримидин-7-ил]бутан-1-он, соль винной кислоты(3 S ) -3-amino-4- (5,5-difluoro-2-oxopiperidino) -1- [8-hydroxy-2,4-di (trifluoromethyl) -5,6,7,8-tetrahydropyrido [3 , 4- d ] pyrimidin-7-yl] butan-1-one, tartaric acid salt
5-Оксо:5-oxo:
Бис (6E)-7-[4-(4-фторфенил)-6-изопропил-2-[метил (метилсульфонил)амино]пиримидин-5-ил](3R)-3-гидрокси-5-оксогепт-6-еновая кислотаBis (6E) -7- [4- (4-fluorophenyl) -6-isopropyl-2- [methyl (methylsulfonyl) amino] pyrimidin-5-yl] (3R) -3-hydroxy-5-oxohept-6-ene acid
Лактон:Lacton:
N-(4-(4-фторфенил)-5-(1E)-2-[(2S,4R)-4-гидрокси-6-оксотетрагидро-2H-пиран-2-ил]этенил]-6-изопропилпиримидин-2-ил}-N-метилметансульфонамидN- (4- (4-fluorophenyl) -5- (1E) -2 - [(2S, 4R) -4-hydroxy-6-oxotetrahydro-2H-pyran-2-yl] ethenyl] -6-isopropylpyrimidin-2 -yl} -N-methylmethanesulfonamide
GS-IMP-1:GS-IMP-1:
1-[(S)-2-[(3R,5R,E)-7-{2-[N-Метил(метилсульфонил)амино]-4-(п-фторфенил)-6-изопропил-5-пиримидинил}-3,5-дигидрокси-6-гептеноиламино]-4-[2,4-бис(трифторметил)-1,3,7-триаза-5,6,7,8-тетрагидронафт-7-ил]-4-оксобутил]-5,5-дифтор-2-пиперидинон1 - [(S) -2 - [(3R, 5R, E) -7- {2- [N-Methyl (methylsulfonyl) amino] -4- (p-fluorophenyl) -6-isopropyl-5-pyrimidinyl} - 3,5-dihydroxy-6-heptenoylamino] -4- [2,4-bis (trifluoromethyl) -1,3,7-triase-5,6,7,8-tetrahydronaphth-7-yl] -4-oxobutyl] -5,5-difluoro-2-piperidinone
Как можно видеть из Таблицы 4, из результатов испытания стабильности можно заключить, что все композиции удовлетворяют критериям приемлемости, что касается примесей.As can be seen from Table 4, from the results of the stability test, we can conclude that all compositions meet the criteria for acceptability, with regard to impurities.
Пример 4: Клиническое исследованиеExample 4: Clinical Study
Для оценки эффективности и безопасности комбинации фиксированных доз (FDC) гемиглиптина/розувастатина у пациентов с диабетом 2 типа с сопутствующей дислипидемией, в соответствии с руководством для клинических испытаний комбинированных препаратов, эффективность и безопасность сравнивали с каждой монотерапией.To evaluate the efficacy and safety of the fixed-dose combination (FDC) of hemigliptin / rosuvastatin in patients with type 2 diabetes with concomitant dyslipidemia, in accordance with the guidelines for clinical trials of combination drugs, efficacy and safety were compared with each monotherapy.
В соответствии с руководством для клинических испытаний, изданному Министерством безопасности пищевых продуктов и лекарств Кореи, как правило, в фазе III клинических испытаний терапевтических средств для лечения диабета лекарственные средства следует вводить в течение 24 недель и более, а в фазе III клинических испытаний терапевтических средств для лечения дислипидемии лекарственные средства следует вводить в течение 12 недель и более. Таким образом, после введения лекарственных средств для клинических испытаний в течение 24 недель, что считалось достаточным для подтверждения эффективности гемиглиптина и розувастатина, осуществляли оценку эффективности.According to the guidelines for clinical trials published by the Ministry of Food and Drug Safety of Korea, usually in phase III of clinical trials of therapeutic agents for diabetes, drugs should be administered for 24 weeks or more, and in phase III of clinical trials of therapeutic agents for For the treatment of dyslipidemia, medicines should be administered for 12 weeks or more. Thus, after administration of drugs for clinical trials within 24 weeks, which was considered sufficient to confirm the effectiveness of hemigliptin and rosuvastatin, the effectiveness was evaluated.
Метформин, который предназначен для фоновой терапии, является гипогликемическим средством для перорального применения, широко используемым в качестве монотерапии первой линии для пациентов с диабетом 2 типа. Так же, как в случае других гипогликемических средств для перорального введения, поскольку трудно получить непрерывный гликемический контроль, необходима комбинация с новым гипогликемическим средством для перорального введения, которое является эффективным и обладает хорошей лекарственной устойчивостью. Поскольку эффект гемиглиптина на снижение уровня глюкозы в крови при сочетании с метформином было подтверждено в фазе III клинических испытаний, гемиглиптин можно использовать в комбинированной терапии с метформином. Поэтому в этом клиническом исследовании пациенты, которые не реагировали на метформин, были включены в исследуемую популяцию.Metformin, which is intended for background therapy, is an oral hypoglycemic agent widely used as first-line monotherapy for patients with type 2 diabetes. As with other hypoglycemic agents for oral administration, since continuous glycemic control is difficult to obtain, a combination with a new oral hypoglycemic agent is necessary, which is effective and has good drug resistance. Since the effect of hemigliptin on lowering blood glucose levels when combined with metformin was confirmed in phase III of clinical trials, hemigliptin can be used in combination therapy with metformin. Therefore, in this clinical study, patients who did not respond to metformin were included in the study population.
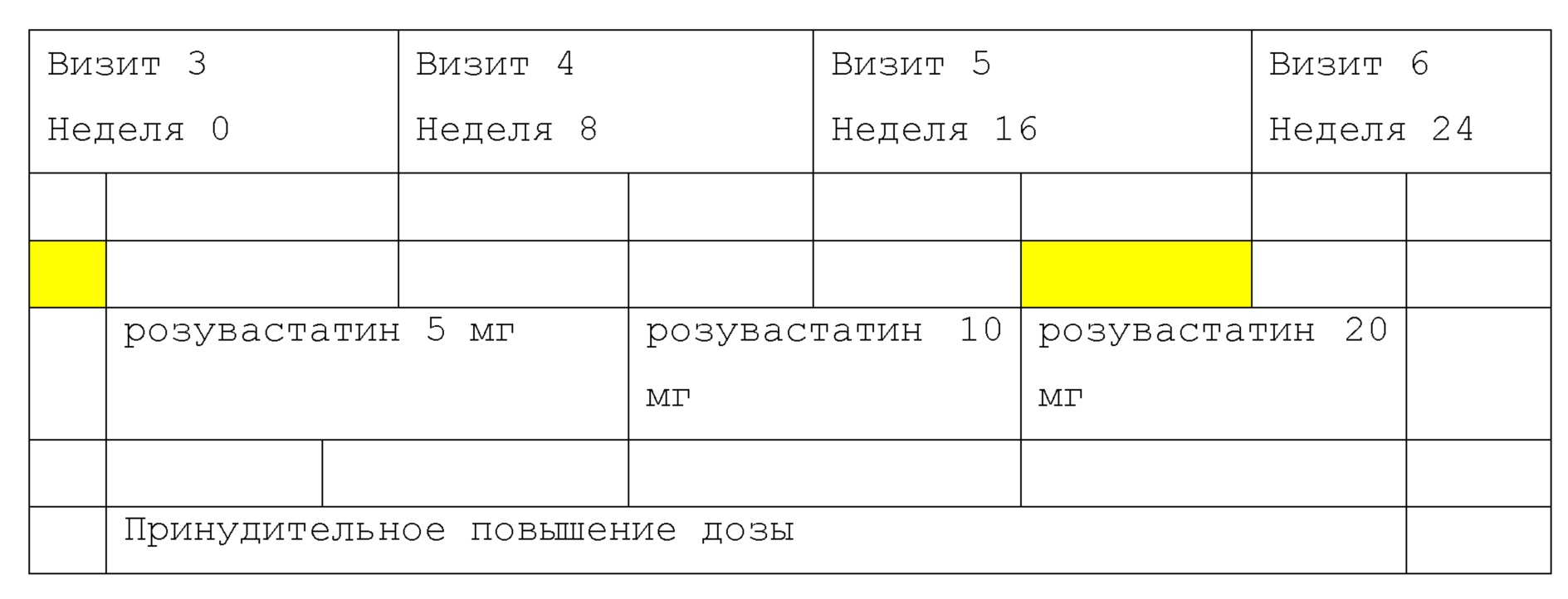
Кроме того, учитывая дозозависимое нежелательное явление и повышенное системное воздействие розувастатина у азиатских пациентов (примерно в 2 (два) раза выше среднего значения AUC и Cmax), известные по результатам различных исследований, дозу розувастатина принудительно увеличивали с восьминедельными интервалами от начальной дозы до максимальной (20 мг) и оценивали эффективность и безопасность каждые 8 недель.In addition, given the dose-dependent adverse event and increased systemic exposure to rosuvastatin in Asian patients (about 2 (two) times higher than the average AUC and Cmax), known from various studies, the dose of rosuvastatin was forcibly increased at eight-week intervals from the initial dose to the maximum ( 20 mg) and efficacy and safety were evaluated every 8 weeks.
Поскольку пациенты с диабетом 2 типа с сопутствующей дислипидемией, в случае, если это пациенты, которые не реагируют на монотерапию метформином в фиксированной дозе (≥1000 мг/день), сами или их представители дали согласие в письменной форме, был проведен скрининг-тест для определения, соответствуют ли пациенты критериям включения/исключения. Субъекты, соответствующие критериям включения/исключения, проходили период TLC (изменение терапевтического жизненного цикла) в течение 2 недель, а затем им вводили в общей сложности 3 таблетки плацебо (плацебо (гемиглиптин/розувастатин FDC), плацебо (гемиглиптин) и плацебо (розувастатин)) в течение 2-недельного вводного периода с использованием одного слепого исследования. В случае введения терапевтического средства от дислипидемии в течение 4 недель до Визита 1, после 4-недельного периода вымывания следовал 2-недельный период TLC и 2-недельный вводный период.Since patients with type 2 diabetes with concomitant dyslipidemia, in case they are patients who do not respond to fixed dose metformin monotherapy (≥1000 mg / day), themselves or their representatives gave written consent, a screening test was conducted to determining whether patients meet inclusion / exclusion criteria. Subjects meeting the inclusion / exclusion criteria underwent a TLC (change in therapeutic life cycle) period of 2 weeks, and then they were given a total of 3 placebo tablets (placebo (hemigliptin / rosuvastatin FDC), placebo (hemigliptin) and placebo (rosuvastatin) ) during a 2-week introductory period using one blind study. In the case of administration of a therapeutic agent for dyslipidemia within 4 weeks prior to Visit 1, after a 4-week washout period, a 2-week TLC period and a 2-week induction period followed.
А затем субъектов, соблюдающих режим приема каждого лекарственного средства фоновой терапии (метформин, ≥1000 мг/день) и в общей сложности 3 таблеток плацебо (плацебо (гемиглиптин/розувастатин FDC), плацебо (гемиглиптин) и плацебо (розувастатин)) в течение 2-недельного вводного периода к Визиту 3 (рандомизация; неделя 0), которые составляли 70% или более и которые соответствовали критериям включения/исключения по результатам теста, проведенного при Визите 2, случайным образом распределяли в одну из 3 групп.And then, subjects following each background drug regimen (metformin, ≥1000 mg / day) and a total of 3 placebo tablets (placebo (hemigliptin / rosuvastatin FDC), placebo (hemigliptin) and placebo (rosuvastatin)) for 2 -weekly introductory period to Visit 3 (randomization; week 0), which were 70% or more and which met inclusion / exclusion criteria according to the results of the test conducted at Visit 2, were randomly assigned to one of 3 groups.
И затем в течение 24-недельного периода введения субъектам назначали визиты через 8 недель, 16 недель и 24 недели, и общий период клинического исследования, включая период вымывания, период TLC и вводный период, составлял около 28-32 недель.And then, during the 24-week administration period, subjects were scheduled for visits after 8 weeks, 16 weeks and 24 weeks, and the total period of the clinical study, including the washout period, the TLC period and the induction period, was about 28-32 weeks.
Визит планировали на основании Визита 3 (рандомизация; неделя 0), и затем допустимый период для Визита 4 (неделя 8), Визита 5 (неделя 16) и Визита 6 (неделя 24) составлял±10 дней.The visit was planned based on Visit 3 (randomization; week 0), and then the valid period for Visit 4 (week 8), Visit 5 (week 16) and Visit 6 (week 24) was ± 10 days.
В течение всего периода клинических исследований, включая период вымывания, период TLC и вводный период, субъекты прекращали прием лекарственного средства от дислипидемии (включая дополнительное диетическое питание), которое может влиять на уровень липидов, за исключением лекарственных препаратов для клинического исследования, поддерживали фоновую терапию (метформин, ≥1000 мг/день), и разрешались регулярные физические упражнения/контроль режима питания без значительного изменения образа жизни.During the entire period of clinical trials, including the washout period, the TLC period and the introductory period, subjects stopped taking the drug for dyslipidemia (including additional dietary nutrition), which can affect lipid levels, with the exception of drugs for the clinical study, supported background therapy ( metformin, ≥1000 mg / day), and regular exercise / diet control was allowed without significant lifestyle changes.
Пример 4-1: Вводимые леченияExample 4-1: Introduced Treatment
После рандомизации в общей сложности 3 таблетки (по 1 таблетке каждого), как показано в Таблице 5, вводили раз в день в одно и то же время каждое утро в общей сложности в течение 24 недель. Однако, в некоторых случаях, субъектам разрешали принимать их во время, предписанное непосредственно перед визитом.After randomization, a total of 3 tablets (1 tablet each), as shown in Table 5, were administered once a day at the same time every morning for a total of 24 weeks. However, in some cases, subjects were allowed to receive them at the time prescribed immediately before the visit.
/розувастатина / rosuvastatin
Фоновая терапия: метформин (≥1000 мг/день) вводили в одно и то же время каждый день в соответствии с предписанным приемом дозой.Background therapy: metformin (≥1000 mg / day) was administered at the same time every day in accordance with the prescribed dose.
Для всех субъектов дозу розувастатина обязательно увеличивали в соответствии со следующим способом, независимо от уровня LDL-C. Однако, если дозу для субъекта нельзя было принудительно увеличивать по соображениям безопасности, причину соответствующем образом указывали в истории болезни и дозу розувастатина корректировали.For all subjects, the dose of rosuvastatin was necessarily increased in accordance with the following method, regardless of the level of LDL-C. However, if the dose for the subject could not be forcibly increased for safety reasons, the cause was appropriately indicated in the medical history and the dose of rosuvastatin was adjusted.
- Введение розувастатина 5 мг каждый день в течение 8 недель с Визита 3 (Неделя 0) до Визита 4 (Неделя 8).- The introduction of rosuvastatin 5 mg every day for 8 weeks from Visit 3 (Week 0) to Visit 4 (Week 8).
- Введение розувастатина 10 мг каждый день в течение 8 недель с Визита 4 (Неделя 8) до Визита 5 (Неделя 16).- The introduction of rosuvastatin 10 mg every day for 8 weeks from Visit 4 (Week 8) to Visit 5 (Week 16).
- Введение розувастатина 20 мг каждый день в течение 8 недель с Визита 5 (Неделя 16) до Визита 6 (Неделя 24).- The introduction of rosuvastatin 20 mg every day for 8 weeks from Visit 5 (Week 16) to Visit 6 (Week 24).
Пример 4-2: Способ распределения субъектов по группам леченияExample 4-2: Method for the allocation of subjects to treatment groups
В этом клиническом исследовании была составлена таблица рандомизации методом стратифицированной блочной рандомизации с двойным слепым испытанием. Для рандомизации статистики назначают достаточный размер рандомизационных номеров при рассмотрении заранее определенного размера блока и стратифицированного фактора (больше или меньше 8,5% HbA1c при Визите 2) с использованием SAS® ver. 9.2. Для рандомизации этого клинического исследования использовали интерактивную систему с доступом через интернет (IWRS). Лица, проводящие испытание, имели доступ к веб-сайту IWRS через присвоенный ID и пароль, и осуществляли рандомизацию путем ввода информации о субъектах, подлежащих рандомизации, в том порядке, в котором эти субъекты были зачислены в испытание. Номера ноборов вместе с номером рандомизации были присвоены для поддержания двойной анонимности, и рандомизационный код во время чрезвычайной ситуации также должен быть публично доступным через IWRS. Рандомизационный код не был обнародован во время этого клинического исследования.This clinical study compiled a randomization table using stratified block randomization with a double blind trial. For randomization of statistics, a sufficient size of randomization numbers is assigned when considering a predetermined block size and stratified factor (greater or less than 8.5% of HbA1c at Visit 2) using SAS® ver. 9.2. To randomize this clinical trial, an interactive Internet access system (IWRS) was used. Test persons had access to the IWRS website with the assigned ID and password and randomized by entering information about the subjects to be randomized in the order in which these subjects were enrolled in the test. Noob numbers along with a randomization number were assigned to maintain double anonymity, and the randomization code during an emergency should also be publicly available through the IWRS. The randomization code was not made public during this clinical trial.
Пример 4-3: Слепой методExample 4-3: Blind Method
Это клиническое исследование представляет собой двойное слепое испытание, в котором как лица, проводящие испытание, так и испытуемые не знали, являются ли лекарственные препараты для клинического исследования испытываемыми препаратами или плацебо, чтобы поддерживать объективность результатов испытания. Однако, поскольку во время вводного периода вводили только плацебо, этот период проходил при осуществлении простого слепого испытания.This clinical trial is a double-blind trial in which both the trial participants and the subjects did not know whether the drugs for the clinical trial are test drugs or a placebo to maintain the objectivity of the test results. However, since only a placebo was administered during the introductory period, this period passed with a simple blind trial.
Для поддержания двойной анонимности в этом исследовании использовали плацебо в такой же лекарственной форме, которую нельзя отличить от испытываемого лекарственного средства по внешнему виду, и они отличались по № набора для рандомизированного назначения. Таким образом, только лицо, отвечающее за подготовку рандомизационного кода, диспетчер кода и диспетчер IWRS знали, в какую группу были распределены субъекты, а другие участники исследования, включая лиц, проводящих испытание, и испытуемых, не знали.To maintain double anonymity, this study used a placebo in the same dosage form that could not be distinguished from the test drug in appearance, and they differed in the randomized kit number. Thus, only the person responsible for the preparation of the randomization code, the code dispatcher and the IWRS dispatcher knew which group the subjects were assigned to, and the other study participants, including the test takers and the subjects, did not know.
После того, как все результаты испытаний были внесены в базу данных и доступ к базе данных был защищен, ответственное лицо от LG Chem. Ltd. (ранее LG Life Sciences Ltd.) могло знать результаты рандомизации.After all test results have been entered into the database and access to the database has been protected, the person in charge of LG Chem. Ltd. (formerly LG Life Sciences Ltd.) could know the results of randomization.
Пример 4-4: Комплаентность к исследуемому лечениюExample 4-4: Compliance with the study treatment
Для оценки комплаентности в медицинской карте пациента регистрировали количества испытываемых препаратов/комбинированных препаратов, предоставляемых субъектам, возвращенных препаратов и препаратов, принимаемых субъектами. Соблюдение режима приема препарата рассчитывали по следующей формуле.To assess compliance, the number of test drugs / combination drugs provided to the subjects, returned drugs and drugs taken by the subjects was recorded on the patient’s medical record. Compliance with the regimen of the drug was calculated according to the following formula.
* Расчет дозировки каждого лекарственного средства* Calculation of the dosage of each drug
[FDC гемиглиптина/розувастатина и гемиглиптин 50 мг][FDC hemigliptin / rosuvastatin and hemigliptin 50 mg]
- Визит 3 (Неделя 0) - Визит 4 (Неделя 8), Визит 4 (Неделя 8) - Визит 5 (Неделя 16), Визит 5 (Неделя 16) - Визит 6 (Неделя 24): 56 таблеток (раз в день в течение 8 недель)- Visit 3 (Week 0) - Visit 4 (Week 8), Visit 4 (Week 8) - Visit 5 (Week 16), Visit 5 (Week 16) - Visit 6 (Week 24): 56 tablets (once a day within 8 weeks)
[розувастатин][rosuvastatin]
- Визит 3 (Неделя 0) - Визит 4 (Неделя 8): 5 мг * 56 дней (1 таблетка (5 мг) раз в день в течение 8 недель (единовременная доза * количество в день))- Visit 3 (Week 0) - Visit 4 (Week 8): 5 mg * 56 days (1 tablet (5 mg) once a day for 8 weeks (single dose * amount per day))
- Визит 4 (Неделя 8) - Визит 5 (Неделя 16): X мг * 56 дней (1 таблетка (X мг) раз в день в течение 8 недель (единовременная доза * количество в день))- Visit 4 (Week 8) - Visit 5 (Week 16): X mg * 56 days (1 tablet (X mg) once a day for 8 weeks (single dose * amount per day))
- Визит 5 (Неделя 16) - Визит 6 (Неделя 24): X мг * 56 дней (1 таблетка (X мг) раз в день в течение 8 недель (единовременная доза * количество в день))- Visit 5 (Week 16) - Visit 6 (Week 24): X mg * 56 days (1 tablet (X mg) once a day for 8 weeks (single dose * amount per day))
- Когда назначали снижение доз розувастатина во время Визита 3 - Визита 6, дозировку рассчитывали как X мг от непосредственно предшествующего регулярного визита до дня перед началом снижения, и рассчитывали как уменьшенную дозировку от дня начала снижения до дня перед следующим регулярным визитом.- When a dose reduction of rosuvastatin was prescribed during Visit 3 - Visit 6, the dosage was calculated as X mg from the immediately preceding regular visit to the day before the start of the decline, and was calculated as the reduced dosage from the day the decrease began to the day before the next regular visit.
- X мг: суточная доза розувастатина, принимаемая субъектами в период Визит 4 - Визит 6- X mg: daily dose of rosuvastatin taken by subjects during visit 4 - visit 6
- В случае выбывания комплаентность на период визита рассчитывали на основании количества, которое субъект должен был принять с момента непосредственно предшествующего регулярного визита, и включали в общую комплаентность.- In case of retirement, compliance for the period of the visit was calculated based on the amount that the subject should have taken from the moment of the immediately preceding regular visit, and included in the general compliance.
Пример 4-5: Оценка эффективностиExample 4-5: Performance Evaluation
Определения параметров, используемых для оценки эффективности, являются следующими:The definitions of the parameters used to evaluate effectiveness are as follows:
• Гемоглобин A1c (HbA1c)• Hemoglobin A1c (HbA1c)
Известно, что снижение уровня HbA1c связано с уменьшением риска развития микрососудистых осложнений. HbA1c является наиболее подходящим основным параметром оценки эффективности, обычно используемым для измерения длительного статуса гликемического контроля при диабете типа 1 и типа 2, и отражает средний уровень глюкозы в крови за последние 2-3 месяца. Собранную кровь анализировали с использованием стандартизированного и валидированного анализа HbA1c.It is known that a decrease in HbA1c levels is associated with a reduced risk of microvascular complications. HbA1c is the most appropriate primary measure of efficacy, commonly used to measure the long-term status of glycemic control in type 1 and type 2 diabetes, and reflects the average blood glucose level over the past 2–3 months. Collected blood was analyzed using a standardized and validated HbA1c assay.
• Холестерин липопротеинов низкой плотности (LDL-C)• Low Density Lipoprotein Cholesterol (LDL-C)
Уровень LDL-C является основным параметром оценки снижающей уровень холестерина терапии. Болезни липидного обмена в основном относятся к гиперхолестеринемии, и, в частности, существует много эпидемиологических доказательств корреляции и причинно-следственной связи между уровнем сывороточного LDL-C и риском заболеваний коронарных артерий. Кроме того, другие клинические симптомы атеросклероза связаны с уровнем LDL-C в крови. То есть, поскольку риск заболеваний коронарных артерий снижается, когда снижается уровень LDL-C, этот параметр установлен как суррогатный индикатор для предотвращения сердечно-сосудистых заболеваний и смерти, что является основной целью лечения заболеваний липидного обмена.LDL-C levels are a key parameter in evaluating cholesterol-lowering therapy. Diseases of lipid metabolism are mainly related to hypercholesterolemia, and, in particular, there is a lot of epidemiological evidence for a correlation and a causal relationship between serum LDL-C and the risk of coronary artery disease. In addition, other clinical symptoms of atherosclerosis are associated with blood LDL-C levels. That is, since the risk of coronary artery disease decreases when LDL-C is reduced, this parameter is set as a surrogate indicator to prevent cardiovascular disease and death, which is the main goal of treating lipid metabolism diseases.
• Уровень глюкозы в плазме натощак (FPG)• Fasting Plasma Glucose (FPG)
В качестве параметра оценки эффективности были исследованы изменения контроля уровня глюкозы в плазме натощак после введения лекарственных средств для клинического исследования.As a parameter for evaluating efficacy, changes in fasting plasma glucose control after administration of drugs for a clinical study were investigated.
• Инсулин в сыворотке натощак• Fasting serum insulin
В случае снижения количества инсулина в крови в соответствии с использованием перорального гипогликемического средства, можно рассматривать улучшение инсулинорезистентности наряду с рассмотрением снижения уровня HbA1c. Как таковой, этот параметр был разработан для оценки эффекта лекарственных средств, используемых в клиническом исследовании.In the case of a decrease in the amount of insulin in the blood in accordance with the use of an oral hypoglycemic agent, an improvement in insulin resistance can be considered along with consideration of a decrease in the level of HbA1c. As such, this parameter was designed to evaluate the effect of drugs used in a clinical trial.
• Проинсулин в сыворотке натощак• Proinsulin in fasting serum
При диабете 2 типа инсулин не полностью вырабатывается из-за дисфункции бета-клеток, и концентрация проинсулина увеличивается. Этот параметр был разработан для оценки эффекта лекарственных средств для клинического исследования на функцию бета-клеток путем определения отношения проинсулин/инсулин натощак).In type 2 diabetes, insulin is not completely produced due to beta cell dysfunction, and the proinsulin concentration increases. This parameter was developed to evaluate the effect of clinical trial drugs on beta cell function by determining the fasting proinsulin / insulin ratio).
• С-пептид в сыворотке натощак• C-peptide in fasting serum
С-пептид является частью, которая отделяется в процессе образования инсулина из предшественника проинсулина. Поскольку он присутствует в соотношении 1:1 с инсулином, способность бета-клеток поджелудочной железы к секреции инсулина может быть посредством этого косвенно подтверждена. Как таковой, этот параметр был разработан для оценки эффекта лекарственных средств, используемых в клиническом исследовании.The C-peptide is the part that separates during the formation of insulin from the proinsulin precursor. Since it is present in a 1: 1 ratio with insulin, the ability of pancreatic beta cells to secrete insulin can be indirectly confirmed through this. As such, this parameter was designed to evaluate the effect of drugs used in a clinical study.
• HOMA-β (оценка гомеостатической модели)• HOMA-β (evaluation of the homeostatic model)
Этот параметр был разработан для оценки эффекта лекарственных средств для клинического исследования на функцию бета-клеток и рассчитан по следующей формуле.This parameter was developed to evaluate the effect of clinical trial drugs on beta cell function and is calculated using the following formula.
• HOMA-IR (HOMA-Инсулинорезистентность)• HOMA-IR (HOMA-Insulin Resistance)
Этот параметр был разработан для оценки эффекта лекарственных средств для клинического исследования на инсулинорезистентность.This parameter was designed to evaluate the effect of drugs for clinical trials on insulin resistance.
• Масса тела и окружность талии• Body weight and waist circumference
Поскольку ожирение повышает инсулинорезистентность и сердечно-сосудистые заболевания, эти параметры были разработаны для оценки эффекта лекарственных средств для клинического исследования в этой связи.Since obesity increases insulin resistance and cardiovascular disease, these parameters were developed to evaluate the effect of drugs for clinical research in this regard.
• Параметры липидов натощак (общий холестерин, HDL-C, триглицериды)• Fasting lipid parameters (total cholesterol, HDL-C, triglycerides)
Поскольку общий холестерин (TC), триглицериды (TG) и HDL-C все чаще используются в качестве подпараметров для лечения дислипидемии, их следует оценивать как вторичные оцениваемые параметры. Гипертриглицеридемия является еще одним независимым фактором риска сердечно-сосудистых заболеваний и фактором риска панкреатита. В противоположность этому, низкий уровень HDL-C в крови является фактором риска сердечно-сосудистых заболеваний, и, в частности, он часто сопровождается гипертриглицеридемией у пациентов с диабетом 2 типа и считается таким же важным фактором, как LDL-C.Since total cholesterol (TC), triglycerides (TG), and HDL-C are increasingly used as subparameters for the treatment of dyslipidemia, they should be evaluated as secondary assessed parameters. Hypertriglyceridemia is another independent risk factor for cardiovascular disease and a risk factor for pancreatitis. In contrast, low levels of HDL-C in the blood are a risk factor for cardiovascular disease, and in particular, it is often accompanied by hypertriglyceridemia in patients with type 2 diabetes and is considered as an important factor as LDL-C.
• Отношение LDL-C/HDL-C натощак• Fasting LDL-C / HDL-C Ratio
Характеристики дистрибуции липопротеинов в крови, приводящие к артериосклерозу, включают высокий уровень LDL-C, низкий уровень HDL-C и сопутствующее повышение уровня TG. LDL-C/HDL-C отношение является более убедительным фактором, прогнозирующим риск сердечно-сосудистых заболеваний, чем один LDL-C. Сообщалось, что если отношение LDL-C/HDL-C составляет > 5 или более, вероятность развития заболевания коронарных артерий в течение 8 лет составляет 19,2%, и эта вероятность еще больше возрастает при сопутствующем повышении TG. Этот параметр был разработан для оценки эффекта лекарственных средств для клинического исследования в этой связи.Blood lipoprotein distribution characteristics leading to arteriosclerosis include high LDL-C, low HDL-C, and a concomitant increase in TG. The LDL-C / HDL-C ratio is a more convincing predictor of cardiovascular risk than LDL-C alone. It has been reported that if the ratio of LDL-C / HDL-C is> 5 or more, the likelihood of developing coronary artery disease within 8 years is 19.2%, and this probability is further increased with a concomitant increase in TG. This parameter was developed to evaluate the effect of drugs for clinical research in this regard.
• Уровень Apo A-I в сыворотке натощак, уровень Apo B в сыворотке натощак, отношение Apo B/Apo A-I в сыворотке натощак• Apo A-I level in fasting serum, fasting serum Apo B level, fasting serum Apo B / Apo A-I ratio
Apo A-1 является основным аполипопротеином, который составляет HDL-C и считается фактором риска сердечно-сосудистых заболеваний, так же как и HDL-C. Apo B является основным аполипопротеином, который составляет LDL-C и существует в соотношении 1:1 с LDL-C. Его используют эквивалентно оценке LDL-C, и известно, что высокий уровень TG является более точным показателем для оценки, чем LDL-C. Поэтому соотношение Аро В/Аро А-I является одним из факторов прогнозирования риска сердечно-сосудистых заболеваний.Apo A-1 is the main apolipoprotein that makes up HDL-C and is considered a risk factor for cardiovascular disease, as is HDL-C. Apo B is the main apolipoprotein that makes up LDL-C and exists in a 1: 1 ratio with LDL-C. It is used equivalently to LDL-C scores, and it is known that high TG is a more accurate measure for scoring than LDL-C. Therefore, the ratio of Apo B / Aro A-I is one of the factors predicting the risk of cardiovascular disease.
• Lp (a) в сыворотке натощак• Lp (a) in fasting serum
Липопротеин (а) представляет собой липопротеин низкой плотности, присоединенный к аполипопротеину (а). Высокие уровни Lp (a) ассоциируются с повышенным риском заболевания коронарных артерий и ишемического инсульта, в частности, для пациентов с высоким риском сердечно-сосудистых заболеваний рекомендуется его оценка.Lipoprotein (a) is a low density lipoprotein attached to apolipoprotein (a). High levels of Lp (a) are associated with an increased risk of coronary artery disease and ischemic stroke, in particular, for patients with a high risk of cardiovascular disease, its assessment is recommended.
(1) Результаты оценки основных параметров эффективности(1) Results of the assessment of key performance parameters
Основными параметрами оценки эффективности в этом клиническом исследовании были изменения HbA1c и LDL-C при Визите 6 (неделя 24) по сравнению с исходным уровнем при Визите 3 (рандомизация; неделя 0). Величину изменения и процентное изменение (%) использовали для HbA1c и LDL-C, соответственно.The main parameters for evaluating the efficacy in this clinical study were changes in HbA1c and LDL-C at Visit 6 (week 24) compared to baseline at Visit 3 (randomization; week 0). The magnitude of the change and percent change (%) was used for HbA1c and LDL-C, respectively.
Для HbA1c сравнивали величину изменения между группой FDC гемиглиптина/розувастатина и группой розувастатина. Для LDL-C сравнивали процентное изменение между группой FDC гемиглиптина/розувастатина и группой гемиглиптина. Каждое сравнение подтверждает превосходство группы FDC гемиглиптина/розувастатина.For HbA1c, the magnitude of the change between the hemigliptin / rosuvastatin FDC group and the rosuvastatin group was compared. For LDL-C, the percent change between the hemigliptin / rosuvastatin FDC group and the hemigliptin group was compared. Each comparison confirms the superiority of the hemigliptin / rosuvastatin FDC group.
<HbA1c><HbA1c>
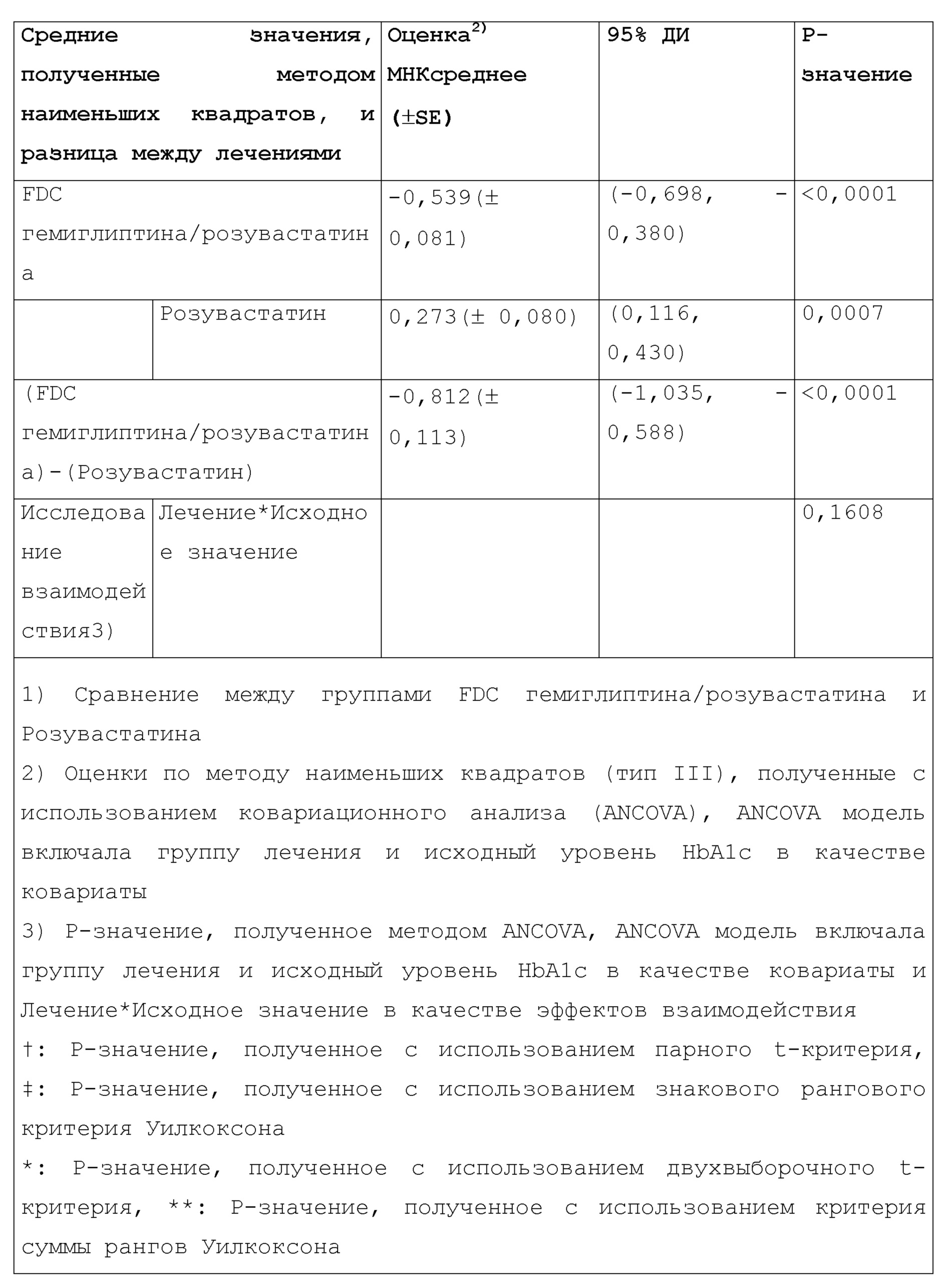
Исходный уровень HbA1c в каждой группе составлял 7,79±0,79% в группе гемиглиптина/розувастатина и 7,78±0,78% в группе розувастатина, соответственно, и между группами не было значимого различия (P=0,9537).The initial HbA1c level in each group was 7.79 ± 0.79% in the hemigliptin / rosuvastatin group and 7.78 ± 0.78% in the rosuvastatin group, respectively, and there was no significant difference between the groups (P = 0.9537).
Результаты ковариационного анализа (ANCOVA) с исходным уровнем HbA1c в качестве ковариаты представлены в таблице 6.The results of covariance analysis (ANCOVA) with baseline HbA1c as covariates are presented in table 6.
При Визите 6 (24-я неделя) МНКсреднее (средние значения, полученные методом наименьших квадратов) изменения HbA1c по сравнению с исходным уровнем составило -0,539±0,081% в группе FDC гемиглиптина/розувастатина и 0,273±0,080% в группе розувастатина. Группа FDC гемиглиптина/розувастатина показала значительное снижение по сравнению с исходным уровнем (P <0,0001), тогда как группа розувастатина напротив показала значительное увеличение по сравнению с исходным уровнем (P=0,0007).At Visit 6 (week 24), the least-squares mean (average values obtained by the least squares method) of the change in HbA1c compared to the initial level was -0.539 ± 0.081% in the hemigliptin / rosuvastatin FDC group and 0.273 ± 0.080% in the rosuvastatin group. The hemigliptin / rosuvastatin FDC group showed a significant decrease compared to the baseline (P <0.0001), while the rosuvastatin group showed a significant increase compared to the baseline (P = 0.0007).
Разница величин изменения между двумя группами составила -0,812±0,113%, а в группе FDC гемиглиптина/розувастатина уровень HbA1c значительно снижался по сравнению с группой розувастатина. Исходя из доверительного интервала(ДИ) 95% (-1,035, -0,588), где верхний предел составляет менее 0, было подтверждено превосходство группы FDC гемиглиптина/розувастатина, что касается эффективности снижения HbA1c (P <0,0001).The difference in the magnitude of the change between the two groups was -0.812 ± 0.113%, and the HbA1c level in the hemigliptin / rosuvastatin FDC group significantly decreased compared to the rosuvastatin group. Based on the 95% confidence interval (CI) (-1.035, -0.588), where the upper limit is less than 0, the superiority of the hemigliptin / rosuvastatin FDC group was confirmed in terms of the effectiveness of HbA1c reduction (P <0.0001).
<LDL-C><LDL-C>
Исходный уровень LDL-C в каждой группе составлял 133,39±25,84 мг/дл в группе FDC гемиглиптина/розувастатина и 141,99±29,58 мг/дл в группе гемиглиптина, соответственно, и была значимая разница между этими группами (P=0,0263).The initial LDL-C level in each group was 133.39 ± 25.84 mg / dl in the hemigliptin / rosuvastatin FDC group and 141.99 ± 29.58 mg / dl in the hemigliptin group, respectively, and there was a significant difference between these groups ( P = 0.0263).
Результаты ковариационного анализа (ANCOVA) с исходным уровнем LDL-C в качестве ковариаты представлены в Таблице 7.The results of covariance analysis (ANCOVA) with baseline LDL-C as covariates are presented in Table 7.
При Визите 6 (Неделя 24), МНКсреднее (средние значения, полученные методом наименьших квадратов) процентного изменения уровня LDL-C (%) по сравнению с исходным уровнем было -53,002±1,929% в группе FDC гемиглиптина/розувастатина и -1,135±1,939% в группе гемиглиптина. Группа FDC гемиглиптина/розувастатина показала существенное уменьшение по сравнению с исходным уровнем (P <0,0001), тогда как группа гемиглиптина не показала никакого значимого изменения (P=0,5587).At Visit 6 (Week 24), the least-squares least-squares mean (average values obtained by the least squares method) of the percent change in LDL-C level (%) compared with the baseline was -53.002 ± 1.929% in the FDC group of hemigliptin / rosuvastatin and -1.135 ± 1.939% in the hemigliptin group. The hemigliptin / rosuvastatin FDC group showed a significant decrease compared to the baseline ( P <0.0001), while the hemigliptin group showed no significant change (P = 0.5587).
Разница в процентном изменении между двумя группами составила -51,867±2,745%, и в группе FDC гемиглиптина/розувастатина LDL-C был значительно ниже по сравнению с группой гемиглиптина. Исходя из 95% ДИ (-57,271, -46,463), в котором верхний предел меньше 0, было подтверждено превосходство группы FDC гемиглиптина/розувастатина в эффективности снижения LDL-C (P <0,0001).The difference in the percentage change between the two groups was -51.867 ± 2.745%, and the hemigliptin / rosuvastatin LDL-C in the FDC group was significantly lower compared to the hemigliptin group. Based on 95% CI (-57.271, -46.463), in which the upper limit is less than 0, the superiority of the hemigliptin / rosuvastatin FDC group in the effectiveness of LDL-C reduction was confirmed ( P <0.0001).
/Розувастатина/ Rosuvastatin
(N=94)(N = 94)
(N=94)(N = 94)
2) Оценки по методу наименьших квадратов (тип III), полученные с использованием ковариационного анализа (ANCOVA), ANCOVA модель включала группу лечения и исходный уровень LDL-C в качестве ковариаты
3) P-значение, полученное методом ANCOVA,
ANCOVA модель включала группу лечения и исходный уровень HbA1c в качестве ковариаты и Лечение*Исходное значение в качестве эффектов взаимодействия
†: P-значение, полученное с использованием парного t-критерия, ‡: P-значение, полученное с использованием знакового рангового критерия Уилкоксона
*: P-значение, полученное с использованием двухвыборочного t-критерия, **: P-значение, полученное с использованием критерия суммы рангов Уилкоксона1) Comparison between Hemigliptin / Rosuvastatin and Hemigliptin FDC Groups
2) Least squares scores (type III) obtained using covariance analysis (ANCOVA), the ANCOVA model included a treatment group and baseline LDL-C as covariates
3) P-value obtained by the ANCOVA method,
The ANCOVA model included a treatment group and baseline HbA1c as covariates and Treatment * Baseline as interaction effects
†: P-value obtained using the paired t-test, ‡: P-value obtained using the Wilcoxon signed rank test
*: P-value obtained using the two-sample t-test **: P-value obtained using the Wilcoxon rank sum test
(2) Результаты оценки вторичных показателей эффективности(2) Secondary Performance Indicator Assessment Results
В качестве вторичных параметров оценки эффективности оценивали изменения HbA1c и LDL-C при Визите 6 (Неделя 24) по сравнению с исходным уровнем. Для HbA1c, сравнивали величину изменения в группе FDC гемиглиптина/розувастатина и группе гемиглиптина. Для LDL-C, сравнивали процентное изменение в группе FDC гемиглиптина/розувастатина и в группе розувастатина.As secondary parameters for evaluating efficacy, changes in HbA1c and LDL-C at Visit 6 (Week 24) were compared with baseline. For HbA1c, the magnitude of the change was compared in the hemigliptin / rosuvastatin FDC group and the hemigliptin group. For LDL-C, the percent change in the hemigliptin / rosuvastatin FDC group and the rosuvastatin group were compared.
<HbA1c><HbA1c>
Исходный уровень HbA1c в каждой группе составлял 7,79±0,79% в группе FDC гемиглиптина/розувастатина и 7,79±0,78% в группе гемиглиптина, соответственно, и не было никакой значимой разницы между этими группами (P=0,8923).The initial HbA1c level in each group was 7.79 ± 0.79% in the hemigliptin / rosuvastatin FDC group and 7.79 ± 0.78% in the hemigliptin group, respectively, and there was no significant difference between these groups ( P = 0, 8923).
Результаты ковариационного анализа (ANCOVA) с исходным уровнем LDL-C в качестве ковариаты представлены в Таблице 8.The results of covariance analysis (ANCOVA) with baseline LDL-C as covariates are presented in Table 8.
При Визите 6 (Неделя 24), МНКсреднее (средние значения, полученные методом наименьших квадратов) величины изменения HbA1c по сравнению с исходным уровнем составило -0,539±0,081% в группе FDC гемиглиптина/розувастатина и -1,007±0,081% в группе гемиглиптина. Обе группы показали существенное уменьшение по сравнению с исходным уровнем (P <0,0001), но группа FDC гемиглиптина/розувастатина показала меньшее снижение HbA1c, чем группа гемиглиптина, и была статистически значимая разница (P=0,0001).At Visit 6 (Week 24), the least-squares least-squares mean (average values obtained by the least squares method) of the change in HbA1c compared to the baseline was -0.539 ± 0.081% in the hemigliptin / rosuvastatin FDC group and -1.007 ± 0.081% in the hemigliptin group. Both groups showed a significant decrease compared to baseline ( P <0.0001), but the hemigliptin / rosuvastatin FDC group showed a lower decrease in HbA1c than the hemigliptin group, and there was a statistically significant difference ( P = 0.0001).
/Розувастатина/ Rosuvastatin
(N=94)(N = 94)
(N=94)(N = 94)
2) Оценки по методу наименьших квадратов (тип III), полученные с использованием ковариационного анализа (ANCOVA), ANCOVA модель включала группу лечения и исходный уровень HbA1c в качестве ковариаты
3) P-значение, полученное методом ANCOVA,
ANCOVA модель включала группу лечения и исходный уровень HbA1c в качестве ковариаты и Лечение*Исходное значение в качестве эффектов взаимодействия
†: P-значение, полученное с использованием парного t-критерия, ‡: P-значение, полученное с использованием знакового рангового критерия Уилкоксона
*: P-значение, полученное с использованием двухвыборочного t-критерия, **: P-значение, полученное с использованием критерия суммы рангов Уилкоксона1) Comparison between groups of FDC hemigliptin / rosuvastatin and hemigliptin 50mg
2) Least squares estimates (type III) obtained using covariance analysis (ANCOVA), the ANCOVA model included a treatment group and baseline HbA1c as covariates
3) P-value obtained by the ANCOVA method,
The ANCOVA model included a treatment group and baseline HbA1c as covariates and Treatment * Baseline as interaction effects
†: P-value obtained using the paired t-test, ‡: P-value obtained using the Wilcoxon signed rank test
*: P-value obtained using the two-sample t-test **: P-value obtained using the Wilcoxon rank sum test
<LDL-C><LDL-C>
Исходный уровень LDL-C в каждой группе составлял 133,39±25,84 мг/дл в группе FDC гемиглиптина/розувастатина и 133,63±27,20 мг/дл в группе розувастатина, соответственно, и не было никакой значимой разницы между этими группами (P=0,9747).The initial LDL-C level in each group was 133.39 ± 25.84 mg / dl in the hemigliptin / rosuvastatin FDC group and 133.63 ± 27.20 mg / dl in the rosuvastatin group, respectively, and there was no significant difference between these groups ( P = 0.9747).
Результаты ковариационного анализа (ANCOVA) с исходным уровнем LDL-C в качестве ковариаты представлены в Таблице 9.The results of covariance analysis (ANCOVA) with baseline LDL-C as covariates are presented in Table 9.
При Визите 6 (Неделя 24), МНКсреднее (средние значения, полученные методом наименьших квадратов) процентного изменения LDL-C (%) по сравнению с исходным уровнем составило -53,002±1,929% в группе FDC гемиглиптина/розувастатина и -54,288±1,909% в группе розувастатина. Обе группы показали существенное уменьшение по сравнению с исходным уровнем (P <0,0001), и не было никакой значимой разницы в процентном изменении LDL-C между этими двумя группами (P=0,6354).At Visit 6 (Week 24), the least-squares least-squares mean (average values obtained by the least squares method) of the percent change in LDL-C (%) compared with the baseline was -53.002 ± 1.929% in the hemigliptin / rosuvastatin FDC group and -54.288 ± 1.099% in rosuvastatin group. Both groups showed a significant decrease compared to baseline ( P <0.0001), and there was no significant difference in the percentage change in LDL-C between the two groups ( P = 0.6354).
/Розувастатина/ Rosuvastatin
(N=94)(N = 94)
(N=96)(N = 96)
2) Оценки по методу наименьших квадратов (тип III), полученные с использованием ковариационного анализа (ANCOVA), ANCOVA модель включала группу лечения и исходный уровень HbA1c в качестве ковариаты
3) P-значение, полученное методом ANCOVA,
ANCOVA модель включала группу лечения и исходный уровень HbA1c в качестве ковариаты и Лечение*Исходное значение в качестве эффектов взаимодействия
†: P-значение, полученное с использованием парного t-критерия, ‡: P-значение, полученное с использованием знакового рангового критерия Уилкоксона
*: P-значение, полученное с использованием двухвыборочного t-критерия, **: P-значение, полученное с использованием критерия суммы рангов Уилкоксона1) Comparison between groups of FDC hemigliptin / rosuvastatin and hemigliptin 50mg
2) Least squares estimates (type III) obtained using covariance analysis (ANCOVA), the ANCOVA model included a treatment group and baseline HbA1c as covariates
3) P-value obtained by the ANCOVA method,
The ANCOVA model included a treatment group and baseline HbA1c as covariates and Treatment * Baseline as interaction effects
†: P-value obtained using the paired t-test, ‡: P-value obtained using the Wilcoxon signed rank test
*: P-value obtained using the two-sample t-test **: P-value obtained using the Wilcoxon rank sum test
(3) Результаты дополнительной оценки эффективности(3) Results of an additional performance evaluation
<Изменения уровня HbAlc (%) при каждом визите><HbAlc level changes (%) at each visit>
Изменения Hb1Ac (%) у субъектов за весь период клинического исследования представлены на Фиг. 1.Changes in Hb1Ac (%) in subjects over the entire period of the clinical trial are shown in FIG. 1.
Исходный уровень HbA1c в каждой группе составлял 7,79±0,79% в группе FDC гемиглиптина/розувастатина, 7,79±0,78% в группе гемиглиптина и 7,78±0,78% в группе розувастатина, и не было никакой значимой разницы между этими группами (P=0,9900). В группе FDC гемиглиптина/розувастатина и группе гемиглиптина HbA1c был существенно ниже по сравнению с исходным уровнем при каждом визите вплоть до Визита 6 (Неделя 24) (P<0,0001), но в группе розувастатина HbA1c существенно не изменялся, а наоборот был значительно выше при Визите 6 (Неделя 24) (0,27±0,83%, P=0,0016).The initial HbA1c level in each group was 7.79 ± 0.79% in the hemigliptin / rosuvastatin FDC group, 7.79 ± 0.78% in the hemigliptin group, and 7.78 ± 0.78% in the rosuvastatin group, and there was no significant difference between these groups ( P = 0.9900). In the FDC group, hemigliptin / rosuvastatin and hemigliptin group HbA1c was significantly lower than the initial level at each visit until Visit 6 (Week 24) ( P <0.0001), but in the rosuvastatin group HbA1c did not change significantly, but on the contrary it was significantly higher at Visit 6 (Week 24) (0.27 ± 0.83%, P = 0.0016).
Результаты ковариационного анализа (ANCOVA) с исходным уровнем HbA1c в качестве ковариаты представлены в Таблице 10.The results of covariance analysis (ANCOVA) with baseline HbA1c as covariates are presented in Table 10.
Когда сравнивали МНКсреднее (средние значения, полученные методом наименьших квадратов) изменения уровня HbA1c от исходного уровня между этими группами при каждом визите, группа FDC гемиглиптина/розувастатина показывала существенное уменьшение HbA1c по сравнению с группой розувастатина при всех визитах, но показала меньшее снижение, чем группа гемиглиптина (существенно меньшее снижение HbA1c после Визита 5 (Неделя 16)).When comparing the least-squares least-squares least-squares mean changes in HbA1c from baseline between these groups at each visit, the hemigliptin / rosuvastatin FDC group showed a significant decrease in HbA1c compared to the rosuvastatin group at all visits, but showed a smaller decrease than the group hemigliptin (a significantly smaller decrease in HbA1c after Visit 5 (Week 16)).
Оценки по методу наименьших квадратов (тип III), полученные с использованием ковариационного анализа (ANCOVA), ANCOVA модель включала группу лечения и исходный уровень HbA1c в качестве ковариаты
: P-значение, полученное с использованием критерия хи-квадрат,: P-значение, полученное с использованием точного критерия Фишера
#: P-значение, полученное методом ANOVA, ##: P-значение, полученное с использованием критерия Краскела-УоллисаComparison Between Hemigliptin / Rosuvastatin and Rosuvastatin FDC Groups
Least squares scores (type III) using covariance analysis (ANCOVA), the ANCOVA model included a treatment group and baseline HbA1c as covariates
: P-value obtained using the chi-square test: P-value obtained using the exact Fisher test
#: P-value obtained by the ANOVA method, ##: P-value obtained using the Kruskal-Wallis test
<Изменения уровня LDL-C (%) при каждом визите><LDL-C level changes (%) at each visit>
Изменения уровня LDL-C у субъектов за весь период клинического исследования представлены на Фиг. 2.Changes in LDL-C levels in subjects over the entire period of the clinical study are shown in FIG. 2.
Исходный уровень LDL-C в каждой группе составлял 133,39±25,84 мг/дл в группе FDC гемиглиптина/розувастатина, 141,99±29,58 мг/дл в группе гемиглиптина и 133,63±27,20 мг/дл в группе розувастатина, и была статистически значимая разница (P=0,0267). В группе FDC гемиглиптина/розувастатина и группе розувастатина уровень LDL-C был значительно снижен по сравнению с исходным уровнем при каждом визите вплоть до Визита 6 (Неделя 24) (P<0,0001), а в группе гемиглиптина уровень LDL-C был значительно снижен по сравнению с исходным уровнем при Визите 4 (Неделя 8) и Визите 6 (Неделя 24) (P<0,05).The initial LDL-C level in each group was 133.39 ± 25.84 mg / dl in the hemigliptin / rosuvastatin FDC group, 141.99 ± 29.58 mg / dl in the hemigliptin group and 133.63 ± 27.20 mg / dl in the rosuvastatin group, and there was a statistically significant difference ( P = 0.0267). In the hemigliptin / rosuvastatin FDC group and the rosuvastatin group, the LDL-C level was significantly reduced compared to the baseline level at each visit up to Visit 6 (Week 24) ( P <0.0001), and in the hemigliptin group the LDL-C level was significantly reduced from baseline at Visit 4 (Week 8) and Visit 6 (Week 24) ( P <0.05).
Результаты ковариационного анализа (ANCOVA) с исходным уровнем LDL-C в качестве ковариаты представлены в Таблице 11.The results of covariance analysis (ANCOVA) with baseline LDL-C as covariates are presented in Table 11.
Когда сравнивали МНКсреднее (средние значения, полученные методом наименьших квадратов) изменения LDL-C от исходного уровня между этими группами при каждом визите, группа FDC гемиглиптина/розувастатина показывала существенное снижение LDL-C по сравнению с группой гемиглиптина при всех визитах, и не показывала никакой значимой разницы по сравнению с группой розувастатина при всех визитах.When comparing the least-squares least-squares least-squares average LDL-C changes between the groups at each visit, the hemigliptin / rosuvastatin FDC group showed a significant decrease in LDL-C compared to the hemigliptin group at all visits, and did not show any significant difference compared with the rosuvastatin group at all visits.
(±SE)(± SE)
Оценки по методу наименьших квадратов (тип III), полученные с использованием ковариационного анализа (ANCOVA), ANCOVA модель включала группу лечения и исходный уровень HbA1c в качестве ковариаты
: P-значение, полученное с использованием критерия хи-квадрат,: P-значение, полученное с использованием точного критерия Фишера
#: P-значение, полученное методом ANOVA, ##: P-значение, полученное с использованием критерия Краскела-УоллисаComparison Between Hemigliptin / Rosuvastatin and Rosuvastatin FDC Groups
Least squares scores (type III) using covariance analysis (ANCOVA), the ANCOVA model included a treatment group and baseline HbA1c as covariates
: P-value obtained using the chi-square test: P-value obtained using the exact Fisher test
#: P-value obtained by the ANOVA method, ##: P-value obtained using the Kruskal-Wallis test
<Изменения уровня глюкозы в плазме натощак (мг/дл) при каждом визите><Changes in fasting plasma glucose (mg / dl) at each visit>
Результаты ковариационного анализа (ANCOVA) с исходным уровнем FPG в качестве ковариаты представлены в Таблице 12.The results of covariance analysis (ANCOVA) with baseline FPG as covariates are presented in Table 12.
Когда сравнивали МНКсреднее (средние значения, полученные методом наименьших квадратов) изменения FPG от исходного уровня между этими группами при каждом визите, группа FDC гемиглиптина/розувастатина показывала существенно меньшее снижение FPG, чем группа гемиглиптина при всех визитах, но показывала существенно большее снижение FPG, чем группа розувастатина, при всех визитах.When comparing the least-squares least-squares least-squares mean changes in FPG from baseline between these groups at each visit, the hemigliptin / rosuvastatin FDC group showed a significantly lower decrease in FPG than the hemigliptin group at all visits, but showed a significantly larger decrease in FPG than rosuvastatin group, at all visits.
Оценки по методу наименьших квадратов (тип III), полученные с использованием ковариационного анализа (ANCOVA), ANCOVA модель включала группу лечения и исходный уровень HbA1c в качестве ковариаты
: P-значение, полученное с использованием критерия хи-квадрат,: P-значение, полученное с использованием точного критерия Фишера
#: P-значение, полученное методом ANOVA, ##: P-значение, полученное с использованием критерия Краскела-УоллисаComparison Between Hemigliptin / Rosuvastatin and Rosuvastatin FDC Groups
Least squares scores (type III) obtained using covariance analysis (ANCOVA), the ANCOVA model included a treatment group and baseline HbA1c as covariates
: P-value obtained using the chi-square test: P-value obtained using the exact Fisher test
#: P-value obtained by the ANOVA method, ##: P-value obtained using the Kruskal-Wallis test
<Изменения общего холестерина (мг/дл) при каждом визите><Changes in total cholesterol (mg / dl) at each visit>
Когда сравнивали МНКсреднее (средние значения, полученные методом наименьших квадратов) изменения TG от исходного уровня между группами при Визите 6 (Неделя 24), группа FDC гемиглиптина/розувастатина показала существенно большее снижение TG, чем группа гемиглиптина, и не показала никакой значимой разницы в изменении TC по сравнению с группой розувастатина (Таблица 13).When comparing the least-squares least-squares least-squares mean TG changes from baseline between groups at Visit 6 (Week 24), the hemigliptin / rosuvastatin FDC group showed a significantly larger decrease in TG than the hemigliptin group, and showed no significant difference in the change TC compared with the rosuvastatin group (table 13).
(±SE)(± SE)
Оценки по методу наименьших квадратов (тип III), полученные с использованием ковариационного анализа (ANCOVA), ANCOVA модель включала группу лечения и исходный уровень HbA1c в качестве ковариаты
: P-значение, полученное с использованием критерия хи-квадрат,: P-значение, полученное с использованием точного критерия Фишера
#: P-значение, полученное методом ANOVA, ##: P-значение, полученное с использованием критерия Краскела-УоллисаComparison Between Hemigliptin / Rosuvastatin and Rosuvastatin FDC Groups
Least squares scores (type III) using covariance analysis (ANCOVA), the ANCOVA model included a treatment group and baseline HbA1c as covariates
: P-value obtained using the chi-square test: P-value obtained using the exact Fisher test
#: P-value obtained by the ANOVA method, ##: P-value obtained using the Kruskal-Wallis test
<Изменения уровня HDL-C (мг/дл) при каждом визите><Changes in HDL-C (mg / dl) at each visit>
Когда сравнивали МНКсреднее (средние значения, полученные методом наименьших квадратов) изменения уровня HDL-C от исходного уровня между группами при Визите 6 (Неделя 24), группа FDC гемиглиптина/розувастатина не показала никакой значимой разницы в изменении HDL-C по сравнению с группой гемиглиптина, и показала существенно меньшее повышение HDL-C, чем группа розувастатина (Таблица 14).When comparing the least-squares least-squares MELs of the change in HDL-C from baseline between groups at Visit 6 (Week 24), the hemigliptin / rosuvastatin FDC group showed no significant difference in HDL-C change compared to the hemigliptin group , and showed a significantly lower increase in HDL-C than the rosuvastatin group (Table 14).
(±SE)(± SE)
Оценки по методу наименьших квадратов (тип III), полученные с использованием ковариационного анализа (ANCOVA), ANCOVA модель включала группу лечения и исходный уровень HbA1c в качестве ковариаты
: P-значение, полученное с использованием критерия хи-квадрат,: P-значение, полученное с использованием точного критерия Фишера
#: P-значение, полученное методом ANOVA, ##: P-значение, полученное с использованием критерия Краскела-УоллисаComparison Between Hemigliptin / Rosuvastatin and Rosuvastatin FDC Groups
Least squares scores (type III) using covariance analysis (ANCOVA), the ANCOVA model included a treatment group and baseline HbA1c as covariates
: P-value obtained using the chi-square test: P-value obtained using the exact Fisher test
#: P-value obtained by the ANOVA method, ##: P-value obtained using the Kruskal-Wallis test
<Изменения уровня триглицеридов (TG, мг/дл) при каждом визите><Changes in triglycerides (TG, mg / dl) at each visit>
Когда сравнивали МНКсреднее (средние значения, полученные методом наименьших квадратов) изменения уровня TG от исходного уровня между группами при Визите 6 (Неделя 24), группа FDC гемиглиптина/розувастатина показала существенное уменьшение уровня TG по сравнению с группой гемиглиптина, и не показала никакой значимой разницы в изменении TG по сравнению с группой розувастатина (Таблица 15).When comparing the least-squares least-squares least-squares mean TG changes from baseline between groups at Visit 6 (Week 24), the hemigliptin / rosuvastatin FDC group showed a significant decrease in TG level compared to the hemigliptin group, and showed no significant difference in the change in TG compared to the rosuvastatin group (table 15).
Оценки по методу наименьших квадратов (тип III), полученные с использованием ковариационного анализа (ANCOVA), ANCOVA модель включала группу лечения и исходный уровень HbA1c в качестве ковариаты
: P-значение, полученное с использованием критерия хи-квадрат,: P-значение, полученное с использованием точного критерия Фишера
#: P-значение, полученное методом ANOVA, ##: P-значение, полученное с использованием критерия Краскела-УоллисаComparison Between Hemigliptin / Rosuvastatin and Rosuvastatin FDC Groups
Least squares scores (type III) using covariance analysis (ANCOVA), the ANCOVA model included a treatment group and baseline HbA1c as covariates
: P-value obtained using the chi-square test: P-value obtained using the exact Fisher test
#: P-value obtained by the ANOVA method, ##: P-value obtained using the Kruskal-Wallis test
<Изменения отношения LDL-C/HDL-C при каждом визите><Changes in the LDL-C / HDL-C relationship at each visit>
Когда сравнивали МНКсреднее (средние значения, полученные методом наименьших квадратов) изменения отношения LDL-C/HDL-C от исходного уровня между группами при Визите 6 (Неделя 24), группа FDC гемиглиптина/розувастатина показала существенно большее снижение отношения LDL-C/HDL-C, чем группа гемиглиптина, и не показала никакой значимой разницы в LDL-C/HDL-C отношении по сравнению с группой розувастатина (Таблица 16).When comparing the least-squares least-squares least-squares average changes in the LDL-C / HDL-C ratio from baseline between groups at Visit 6 (Week 24), the hemigliptin / rosuvastatin FDC group showed a significantly larger decrease in LDL-C / HDL- C than the hemigliptin group, and showed no significant difference in the LDL-C / HDL-C ratio compared to the rosuvastatin group (Table 16).
Оценки по методу наименьших квадратов (тип III), полученные с использованием ковариационного анализа (ANCOVA), ANCOVA модель включала группу лечения и исходный уровень HbA1c в качестве ковариаты
: P-значение, полученное с использованием критерия хи-квадрат,: P-значение, полученное с использованием точного критерия Фишера
#: P-значение, полученное методом ANOVA, ##: P-значение, полученное с использованием критерия Краскела-УоллисаComparison Between Hemigliptin / Rosuvastatin and Rosuvastatin FDC Groups
Least squares scores (type III) using covariance analysis (ANCOVA), the ANCOVA model included a treatment group and baseline HbA1c as covariates
: P-value obtained using the chi-square test: P-value obtained using the exact Fisher test
#: P-value obtained by the ANOVA method, ##: P-value obtained using the Kruskal-Wallis test
<Изменения массы тела (кг) при каждом визите><Changes in body weight (kg) at each visit>
Когда сравнивали МНКсреднее (средние значения, полученные методом наименьших квадратов) изменения массы тела от исходного уровня между группами при Визите 6 (Неделя 24), группа FDC гемиглиптина/розувастатина показала существенно меньшее снижение массы тела, чем группа розувастатина, и не показала никакой значимой разницы в массе тела по сравнению с группой гемиглиптина (Таблица 17).When comparing the least-squares least-squares average of body mass changes from baseline between groups at Visit 6 (Week 24), the hemigliptin / rosuvastatin FDC group showed a significantly lower body weight decrease than the rosuvastatin group, and showed no significant difference in body weight compared to the hemigliptin group (table 17).
Оценки по методу наименьших квадратов (тип III), полученные с использованием ковариационного анализа (ANCOVA), ANCOVA модель включала группу лечения и исходный уровень HbA1c в качестве ковариаты
: P-значение, полученное с использованием критерия хи-квадрат,: P-значение, полученное с использованием точного критерия Фишера
#: P-значение, полученное методом ANOVA, ##: P-значение, полученное с использованием критерия Краскела-УоллисаComparison Between Hemigliptin / Rosuvastatin and Rosuvastatin FDC Groups
Least squares scores (type III) using covariance analysis (ANCOVA), the ANCOVA model included a treatment group and baseline HbA1c as covariates
: P-value obtained using the chi-square test: P-value obtained using the exact Fisher test
#: P-value obtained by the ANOVA method, ##: P-value obtained using the Kruskal-Wallis test
<Изменение окружности талии (см) при каждом визите><Change in waist circumference (cm) at each visit>
Когда сравнивали МНКсреднее (средние значения, полученные методом наименьших квадратов) изменения окружности талии от исходного уровня между группами при Визите 6 (Неделя 24), группа FDC гемиглиптина/розувастатина не показала никакой значимой разницы в окружности талии по сравнению с другими двумя контрольными группами (Таблица 18).When comparing the least-squares least-squares average of the waist circumference change from baseline between the groups at Visit 6 (Week 24), the hemigliptin / rosuvastatin FDC group showed no significant difference in waist circumference compared to the other two control groups (Table eighteen).
Оценки по методу наименьших квадратов (тип III), полученные с использованием ковариационного анализа (ANCOVA), ANCOVA модель включала группу лечения и исходный уровень HbA1c в качестве ковариаты
: P-значение, полученное с использованием критерия хи-квадрат,: P-значение, полученное с использованием точного критерия Фишера
#: P-значение, полученное методом ANOVA, ##: P-значение, полученное с использованием критерия Краскела-УоллисаComparison Between Hemigliptin / Rosuvastatin and Rosuvastatin FDC Groups
Least squares scores (type III) obtained using covariance analysis (ANCOVA), the ANCOVA model included a treatment group and baseline HbA1c as covariates
: P-value obtained using the chi-square test: P-value obtained using the exact Fisher test
#: P-value obtained by the ANOVA method, ##: P-value obtained using the Kruskal-Wallis test
<Изменения уровня инсулина в сыворотке натощак (мкМЕ/мл) на неделе 24><Changes in fasting serum insulin levels (μMU / ml) at
Изменения уровня инсулина в сыворотке натощак у субъектов по сравнению с исходным уровнем при Визите 6 (Неделя 24) представлены в Таблице 19.Changes in fasting serum insulin levels in subjects compared to baseline at Visit 6 (Week 24) are presented in Table 19.
Исходный уровень инсулина в сыворотке натощак в каждой группе, 9,26±4,42 мкМЕ/мл в группе FDC гемиглиптина/розувастатина, 11,02±10,59 мкМЕ/мл в группе гемиглиптина и 9,12±3,95 мкМЕ/мл в группе розувастатина, был схожим. При Визите 6 (Неделя 24) группа FDC гемиглиптина/розувастатина и группа розувастатина показали существенное повышение уровня инсулина в сыворотке натощак по сравнению с исходным уровнем, тогда как группа гемиглиптина не показала никакой значимой разницы по сравнению с исходным уровнем.The initial fasting serum insulin level in each group, 9.26 ± 4.42 μIU / ml in the hemigliptin / rosuvastatin FDC group, 11.02 ± 10.59 μI / ml in the hemigliptin group and 9.12 ± 3.95 μI / ml in the rosuvastatin group was similar. At Visit 6 (Week 24), the hemigliptin / rosuvastatin group FDC and the rosuvastatin group showed a significant increase in fasting serum insulin levels compared to baseline, while the hemigliptin group showed no significant difference compared to baseline.
Когда сравнивали МНКсреднее (средние значения, полученные методом наименьших квадратов) изменения уровня инсулина в сыворотке натощак от исходного уровня между этими группами при Визите 6 (Неделя 24) с использованием ковариационного анализа (ANCOVA), с исходным уровнем в сыворотке инсулина натощак в качестве ковариаты, группа FDC гемиглиптина/розувастатина показала повышение уровня инсулина в сыворотке натощак по сравнению с группой гемиглиптина и снижение уровня инсулина в сыворотке натощак по сравнению с группой розувастатина. Однако оба отличия не были существенно значимыми.When comparing the least-squares least-squares mean of fasting serum insulin levels from baseline between Visit Group 6 (Week 24) using covariance analysis (ANCOVA), with baseline fasting insulin serum as covariates, the hemigliptin / rosuvastatin FDC group showed an increase in fasting serum insulin compared to the fasting hemigliptin group and a decrease in fasting serum insulin compared to the rosuvastatin group. However, both differences were not significantly significant.
/Розувастатина/ Rosuvastatin
(N=94)(N = 94)
(N=94)(N = 94)
(N=96)(N = 96)
(±SE)(± SE)
(Гемиглиптин 50 мг или Розувастатин)
Оценки по методу наименьших квадратов (тип III), полученные с использованием ковариационного анализа (ANCOVA), ANCOVA модель включала группу лечения и исходный уровень HbA1c в качестве ковариаты
P-значение, полученное методом ANCOVA, ANCOVA модель включала группу лечения и исходный уровень HbA1c в качестве ковариаты и Лечение*Исходное значение в качестве эффектов взаимодействия
†: P-значение, полученное с использованием парного t-критерия, ‡: P-значение, полученное с использованием знакового рангового критерия Уилкоксона
*: P-значение, полученное с использованием двухвыборочного t-критерия, **: P-значение, полученное с использованием критерия суммы рангов УилкоксонаComparison between Combination (Hemigliptin / Rosuvastatin FDC) and Monotherapy
(
Least squares scores (type III) using covariance analysis (ANCOVA), the ANCOVA model included a treatment group and baseline HbA1c as covariates
P-value obtained by ANCOVA, ANCOVA model included treatment group and baseline HbA1c as covariates and Treatment * Baseline as interaction effects
†: P-value obtained using the paired t-test, ‡: P-value obtained using the Wilcoxon signed rank test
*: P-value obtained using the two-sample t-test **: P-value obtained using the Wilcoxon rank sum test
<Изменения уровня проинсулина в сыворотке натощак (мкМЕ/мл) на неделе 24><Changes in fasting serum proinsulin level (μMU / ml) at
Изменения уровня проинсулина в сыворотке натощак у субъектов по сравнению с исходным уровнем при Визите 6 (Неделя 24) представлены в Таблице 20.Changes in fasting serum proinsulin levels in subjects compared to baseline at Visit 6 (Week 24) are presented in Table 20.
Исходный уровень проинсулина в сыворотке натощак в каждой группе, 14,99±11,11 мкМЕ/мл в группе FDC гемиглиптина/розувастатина, 17,64±15,77 мкМЕ/мл в группе гемиглиптина и 14,77±10,52 мкМЕ/мл в группе розувастатина, был схожим. При Визите 6 (Неделя 24) группа FDC гемиглиптина/розувастатина не показала никакого существенного изменения по сравнению с исходным уровнем, группа гемиглиптина показала существенное уменьшение уровня проинсулина в сыворотке натощак по сравнению с исходным уровнем, и группа розувастатина показала существенное повышение уровня проинсулина в сыворотке натощак по сравнению с исходным уровнем.The initial fasting serum proinsulin level in each group, 14.99 ± 11.11 μI / ml in the hemigliptin / rosuvastatin FDC group, 17.64 ± 15.77 μI / ml in the hemigliptin group and 14.77 ± 10.52 μI / ml in the rosuvastatin group was similar. At Visit 6 (Week 24), the hemigliptin / rosuvastatin FDC group showed no significant change from baseline, the hemigliptin group showed a significant decrease in fasting serum proinsulin compared to the baseline, and the rosuvastatin group showed a significant increase in fasting serum proinsulin compared to baseline.
Когда сравнивали МНКсреднее (средние значения, полученные методом наименьших квадратов) изменения уровня проинсулина в сыворотке натощак от исходного уровня между этими группами при Визите 6 (Неделя 24) с использованием ковариационного анализа (ANCOVA), с исходным уровнем проинсулина в сыворотке натощак в качестве ковариаты, группа FDC гемиглиптина/розувастатина показала существенное повышение уровня проинсулина в сыворотке натощак по сравнению с группой гемиглиптина и никакой значимой разницы в величине изменения по сравнению с группой розувастатина.When comparing the least-squares least-squares average of fasting serum proinsulin changes from the baseline between these groups at Visit 6 (Week 24) using covariance analysis (ANCOVA), with the fasting serum proinsulin level as covariates, the hemigliptin / rosuvastatin FDC group showed a significant increase in fasting serum proinsulin compared with the hemigliptin group and no significant difference in the magnitude of the change compared with the ro group zuvastatin.
/Розувастатина/ Rosuvastatin
(N=94)(N = 94)
(N=94)(N = 94)
(N=96)(N = 96)
Оценки по методу наименьших квадратов (тип III), полученные с использованием ковариационного анализа (ANCOVA), ANCOVA модель включала группу лечения и исходный уровень HbA1c в качестве ковариаты
P-значение, полученное методом ANCOVA, ANCOVA модель включала группу лечения и исходный уровень HbA1c в качестве ковариаты и Лечение*Исходное значение в качестве эффектов взаимодействия
†: P-значение, полученное с использованием парного t-критерия, ‡: P-значение, полученное с использованием знакового рангового критерия Уилкоксона
*: P-значение, полученное с использованием двухвыборочного t-критерия, **: P-значение, полученное с использованием критерия суммы рангов УилкоксонаComparison between Combination (Hemigliptin / Rosuvastatin FDC) and Monotherapy (
Least squares scores (type III) obtained using covariance analysis (ANCOVA), the ANCOVA model included a treatment group and baseline HbA1c as covariates
P-value obtained by ANCOVA, ANCOVA model included treatment group and baseline HbA1c as covariates and Treatment * Baseline as interaction effects
†: P-value obtained using the paired t-test, ‡: P-value obtained using the Wilcoxon signed rank test
*: P-value obtained using the two-sample t-test **: P-value obtained using the Wilcoxon rank sum test
<Изменения уровня C-пептида в сыворотке натощак (нг/мл) на неделе 24><Changes in fasting serum C-peptide (ng / ml) at
Изменения уровня C-пептида в сыворотке натощак у субъектов по сравнению с исходным уровнем при Визите 6 (Неделя 24) представлены в Таблице 21.Changes in fasting serum C-peptide levels in subjects compared to baseline at Visit 6 (Week 24) are presented in Table 21.
Исходный уровень в C-пептида сыворотке натощак в каждой группе, 2,14±0,89 нг/мл в группе FDC гемиглиптина/розувастатина, 2,48±1,29 нг/мл в группе гемиглиптина и 2,23±0,86 нг/мл в группе розувастатина, был схожим. При Визите 6 (Неделя 24) все 3 группы не показали никакого существенного изменения по сравнению с исходным уровнем.The initial level of fasting serum C-peptide in each group, 2.14 ± 0.89 ng / ml in the hemigliptin / rosuvastatin FDC group, 2.48 ± 1.29 ng / ml in the hemigliptin group, and 2.23 ± 0.86 ng / ml in the rosuvastatin group was similar. At Visit 6 (Week 24), all 3 groups showed no significant change from baseline.
Когда сравнивали МНКсреднее (средние значения, полученные методом наименьших квадратов) изменения уровня C-пептида в сыворотке натощак от исходного уровня между этими группами при Визите 6 (Неделя 24) с использованием ковариационного анализа (ANCOVA), с исходным уровнем C-пептида в сыворотке натощак в качестве ковариаты, группа FDC гемиглиптина/розувастатина показала существенное повышение уровня C-пептида в сыворотке натощак по сравнению с группой гемиглиптина и никакой значимой разницы в величине изменения по сравнению с группой розувастатина.When we compared the least-squares least-squares average of fasting serum C-peptide changes from baseline between these groups at Visit 6 (Week 24) using covariance analysis (ANCOVA), with the fasting serum C-peptide baseline as covariates, the hemigliptin / rosuvastatin FDC group showed a significant increase in fasting serum C-peptide compared to the hemigliptin group and no significant difference in the magnitude of the change compared to the rosuvastatin group on the.
/Розувастатина/ Rosuvastatin
(N=94)(N = 94)
(N=94)(N = 94)
(N=96)(N = 96)
Оценки по методу наименьших квадратов (тип III), полученные с использованием ковариационного анализа (ANCOVA), ANCOVA модель включала группу лечения и исходный уровень HbA1c в качестве ковариаты
P-значение, полученное методом ANCOVA, ANCOVA модель включала группу лечения и исходный уровень HbA1c в качестве ковариаты и Лечение*Исходное значение в качестве эффектов взаимодействия
†: P-значение, полученное с использованием парного t-критерия, ‡: P-значение, полученное с использованием знакового рангового критерия Уилкоксона
*: P-значение, полученное с использованием двухвыборочного t-критерия, **: P-значение, полученное с использованием критерия суммы рангов УилкоксонаComparison between Combination (Hemigliptin / Rosuvastatin FDC) and Monotherapy (
Least squares scores (type III) obtained using covariance analysis (ANCOVA), the ANCOVA model included a treatment group and baseline HbA1c as covariates
P-value obtained by ANCOVA, ANCOVA model included treatment group and baseline HbA1c as covariates and Treatment * Baseline as interaction effects
†: P-value obtained using the paired t-test, ‡: P-value obtained using the Wilcoxon signed rank test
*: P-value obtained using the two-sample t-test **: P-value obtained using the Wilcoxon rank sum test
<Изменения отношения проинсулин/инсулин в сыворотке натощак на неделе 24><Changes in the ratio of proinsulin / insulin in fasting serum at
Изменения отношения проинсулин/инсулин в сыворотке натощак у субъектов по сравнению с исходным значением при Визите 6 (Неделя 24) представлены в Таблице 22.Changes in fasting serum proinsulin / insulin ratios in subjects compared to baseline at Visit 6 (Week 24) are presented in Table 22.
Исходное отношение проинсулин/инсулин в сыворотке натощак в каждой группе, 0,23±0,13 в группе FDC гемиглиптина/розувастатина, 0,24±0,13 в группе гемиглиптина и 0,23±0,13 в группе розувастатина, было схожим. При Визите 6 (Неделя 24) группа FDC гемиглиптина/розувастатина и группа розувастатина не показали никакого существенного изменения по сравнению с исходным значением, а группа гемиглиптина показала существенное уменьшение отношения проинсулин/инсулин в сыворотке натощак по сравнению с исходным уровнем.The initial fasting serum proinsulin / insulin ratio in each group, 0.23 ± 0.13 in the hemigliptin / rosuvastatin FDC group, 0.24 ± 0.13 in the hemigliptin group and 0.23 ± 0.13 in the rosuvastatin group, was similar . At Visit 6 (Week 24), the hemigliptin / rosuvastatin FDC group and the rosuvastatin group showed no significant change from the baseline, and the hemigliptin group showed a significant decrease in the fasting serum proinsulin / insulin ratio compared to the baseline.
Когда сравнивали МНКсреднее (средние значения, полученные методом наименьших квадратов) изменения отношения проинсулин/инсулин в сыворотке натощак от исходного значения между этими группами при Визите 6 (Неделя 24) с использованием ковариационного анализа (ANCOVA), с исходным отношением проинсулин/инсулин в сыворотке натощак в качестве ковариаты, группа FDC гемиглиптина/розувастатина показала повышение отношения проинсулин/инсулин в сыворотке натощак по сравнению с группой гемиглиптина, но разница не была значимой, и не показала никакой значимой разницы в величине изменения по сравнению с группой розувастатина.When comparing the least-squares least-squares average of fasting serum proinsulin / insulin ratios from the baseline value between these groups at Visit 6 (Week 24) using covariance analysis (ANCOVA), with the fasting serum proinsulin / insulin ratio as covariates, the hemigliptin / rosuvastatin FDC group showed an increase in the fasting serum proinsulin / insulin ratio compared to the hemigliptin group, but the difference was not significant, and showed no significant difference in the magnitude of the change compared to the rosuvastatin group.
/Розувастатин/ Rosuvastatin
(N=94)(N = 94)
(N=94)(N = 94)
Оценки по методу наименьших квадратов (тип III), полученные с использованием ковариационного анализа (ANCOVA), ANCOVA модель включала группу лечения и исходный уровень HbA1c в качестве ковариаты
P-значение, полученное методом ANCOVA, ANCOVA модель включала группу лечения и исходный уровень HbA1c в качестве ковариаты и Лечение*Исходное значение в качестве эффектов взаимодействия
†: P-значение, полученное с использованием парного t-критерия, ‡: P-значение, полученное с использованием знакового рангового критерия Уилкоксона
*: P-значение, полученное с использованием двухвыборочного t-критерия, **: P-значение, полученное с использованием критерия суммы рангов УилкоксонаComparison between Combination (Hemigliptin / Rosuvastatin FDC) and Monotherapy (
Least squares scores (type III) using covariance analysis (ANCOVA), the ANCOVA model included a treatment group and baseline HbA1c as covariates
P-value obtained by ANCOVA, ANCOVA model included treatment group and baseline HbA1c as covariates and Treatment * Baseline as interaction effects
†: P-value obtained using the paired t-test, ‡: P-value obtained using the Wilcoxon signed rank test
*: P-value obtained using the two-sample t-test **: P-value obtained using the Wilcoxon rank sum test
<Изменения уровня HOMA-β на неделе 24><HOMA-β Level Changes at
Изменения уровня HOMA-β у субъектов по сравнению с исходным уровнем при Визите 6 (Неделя 24) представлены в Таблице 23.Changes in HOMA-β levels in subjects compared to baseline at Visit 6 (Week 24) are presented in Table 23.
Исходный уровень HOMA-β в каждой группе, 46,86±27,22 в группе FDC гемиглиптина/розувастатина, 50,76±37,16 в группе гемиглиптина и 42,76±25,74 в группе розувастатина, был схожим. При Визите 6 (Неделя 24) группа FDC гемиглиптина/розувастатина и группа гемиглиптина показала существенное повышение HOMA-β по сравнению с исходным уровнем, но группа розувастатина не показала никакого существенного изменения уровня HOMA-β по сравнению с исходным уровнем.The baseline HOMA-β level in each group, 46.86 ± 27.22 in the FDC group of hemigliptin / rosuvastatin, 50.76 ± 37.16 in the hemigliptin group and 42.76 ± 25.74 in the rosuvastatin group, was similar. At Visit 6 (Week 24), the hemigliptin / rosuvastatin FDC group and hemigliptin group showed a significant increase in HOMA-β compared to baseline, but the rosuvastatin group showed no significant change in HOMA-β compared to baseline.
Когда сравнивали МНКсреднее (средние значения, полученные методом наименьших квадратов) изменения уровня HOMA-β от исходного уровня между этими группами при Визите 6 (Неделя 24) с использованием ковариационного анализа (ANCOVA), с исходным уровнем HOMA-β в качестве ковариаты, группа FDC гемиглиптина/розувастатина показала существенное повышение HOMA-β по сравнению с группой розувастатина и никакой значимой разницы в величине изменений по сравнению с группой гемиглиптина.When comparing the least-squares least-squares least-squares mean HOMA-β level changes from baseline between these groups at Visit 6 (Week 24) using covariance analysis (ANCOVA), with baseline HOMA-β as covariates, FDC group hemigliptin / rosuvastatin showed a significant increase in HOMA-β compared with the rosuvastatin group and no significant difference in the magnitude of the changes compared with the hemigliptin group.
/Розувастатина/ Rosuvastatin
(N=94)(N = 94)
(N=94)(N = 94)
(N=96)(N = 96)
Оценки по методу наименьших квадратов (тип III), полученные с использованием ковариационного анализа (ANCOVA), ANCOVA модель включала группу лечения и исходный уровень HbA1c в качестве ковариаты
P-значение, полученное методом ANCOVA, ANCOVA модель включала группу лечения и исходный уровень HbA1c в качестве ковариаты и
Лечение*Исходное значение в качестве эффектов взаимодействия
†: P-значение, полученное с использованием парного t-критерия, ‡: P-значение, полученное с использованием знакового рангового критерия Уилкоксона
*: P-значение, полученное с использованием двухвыборочного t-критерия, **: P-значение, полученное с использованием критерия суммы рангов УилкоксонаComparison between Combination (Hemigliptin / Rosuvastatin FDC) and Monotherapy (
Least squares scores (type III) using covariance analysis (ANCOVA), the ANCOVA model included a treatment group and baseline HbA1c as covariates
P-value obtained by ANCOVA, ANCOVA model included a treatment group and baseline HbA1c as covariates and
Treatment * Initial value as interaction effects
†: P-value obtained using the paired t-test, ‡: P-value obtained using the Wilcoxon signed rank test
*: P-value obtained using the two-sample t-test **: P-value obtained using the Wilcoxon rank sum test
<Изменения HOMA-IR на неделе 24><HOMA-IR changes in
Изменения HOMA-IR у субъектов по сравнению с исходным уровнем при Визите 6 (Неделя 24) представлены в Таблице 24.Changes in HOMA-IR in subjects compared to baseline at Visit 6 (Week 24) are presented in Table 24.
Исходное значение HOMA-IR в каждой группе, 3,23±1,67 в группе FDC гемиглиптина/розувастатина, 4,10±4,65 в группе гемиглиптина и 3,37±1,63 в группе розувастатина, было схожим. При Визите 6 (Неделя 24) группа FDC гемиглиптина/розувастатина и группа гемиглиптина не показали никакого существенного изменения HOMA-IR по сравнению с исходным значением, а группа розувастатина показала существенное повышение HOMA-IR по сравнению с исходным значением.The initial HOMA-IR value in each group, 3.23 ± 1.67 in the hemigliptin / rosuvastatin FDC group, 4.10 ± 4.65 in the hemigliptin group and 3.37 ± 1.63 in the rosuvastatin group, was similar. At Visit 6 (Week 24), the hemigliptin / rosuvastatin FDC group and the hemigliptin group showed no significant change in HOMA-IR compared to the baseline, and the rosuvastatin group showed a significant increase in HOMA-IR compared to the baseline.
Когда сравнивали МНКсреднее (средние значения, полученные методом наименьших квадратов) изменения значения HOMA-IR от исходного значения между этими группами при Визите 6 (Неделя 24) с использованием ковариационного анализа (ANCOVA), с исходным значением HOMA-IR в качестве ковариаты, группа FDC гемиглиптина/розувастатина показала существенное уменьшение HOMA-IR по сравнению с группой розувастатина и никакой значимой разницы в величине изменения по сравнению с группой гемиглиптина.When comparing the least-squares least-squares least-squares mean changes in the HOMA-IR value from the baseline between these groups at Visit 6 (Week 24) using covariance analysis (ANCOVA), with the baseline HOMA-IR as covariates, the FDC group hemigliptin / rosuvastatin showed a significant decrease in HOMA-IR compared with the rosuvastatin group and no significant difference in the magnitude of the change compared with the hemigliptin group.
/Розувастатина/ Rosuvastatin
(N=94)(N = 94)
(N=94)(N = 94)
(N=96)(N = 96)
Оценки по методу наименьших квадратов (тип III), полученные с использованием ковариационного анализа (ANCOVA), ANCOVA модель включала группу лечения и исходный уровень HbA1c в качестве ковариаты
P-значение, полученное методом ANCOVA, ANCOVA модель включала группу лечения и исходный уровень HbA1c в качестве ковариаты и
Лечение*Исходное значение в качестве эффектов взаимодействия
†: P-значение, полученное с использованием парного t-критерия, ‡: P-значение, полученное с использованием знакового рангового критерия Уилкоксона
*: P-значение, полученное с использованием двухвыборочного t-критерия, **: P-значение, полученное с использованием критерия суммы рангов УилкоксонаComparison between Combination (Hemigliptin / Rosuvastatin FDC) and Monotherapy (
Least squares scores (type III) using covariance analysis (ANCOVA), the ANCOVA model included a treatment group and baseline HbA1c as covariates
P-value obtained by ANCOVA, ANCOVA model included a treatment group and baseline HbA1c as covariates and
Treatment * Initial value as interaction effects
†: P-value obtained using the paired t-test, ‡: P-value obtained using the Wilcoxon signed rank test
*: P-value obtained using the two-sample t-test **: P-value obtained using the Wilcoxon rank sum test
<Изменения уровня Apo A-I в сыворотке (мг/дл) на неделе 24><Changes in serum Apo A-I level (mg / dl) at
Изменения уровня Apo A-I у субъектов по сравнению с исходным уровнем при Визите 6 (Неделя 24) представлены в Таблице 25.Changes in Apo A-I level in subjects compared to baseline at Visit 6 (Week 24) are presented in Table 25.
Исходный уровень Apo A-I в каждой группе, 145,24±24,51 мг/дл в группе FDC гемиглиптина/розувастатина, 144,47±22,37 мг/дл в группе гемиглиптина и 142,14±24,75 мг/дл в группе розувастатина, был схожим. При Визите 6 (Неделя 24) группа FDC гемиглиптина/розувастатина и группа гемиглиптина не показали никакого существенного изменения уровня Apo A-I по сравнению с исходным уровнем, а группа розувастатина показала существенное повышение Apo A-I по сравнению с исходным уровнем.Baseline Apo AI level in each group, 145.24 ± 24.51 mg / dl in the hemigliptin / rosuvastatin FDC group, 144.47 ± 22.37 mg / dl in the hemigliptin group and 142.14 ± 24.75 mg / dl in the rosuvastatin group was similar. At Visit 6 (Week 24), the hemigliptin / rosuvastatin FDC group and the hemigliptin group showed no significant change in Apo A-I level compared to baseline, and rosuvastatin group showed a significant increase in Apo A-I compared to baseline.
Когда сравнивали МНКсреднее (средние значения, полученные методом наименьших квадратов) изменения уровня Apo A-I от исходного уровня между этими группами при Визите 6 (Неделя 24) с использованием ковариационного анализа (ANCOVA), с исходным уровнем Apo A-I в качестве ковариаты, группа FDC гемиглиптина/розувастатина не показала никакой значимой разницы в величине изменения по сравнению с двумя контрольными группами.When the least-squares least-squares least-squares comparisons were compared, the changes in Apo AI level from baseline between these groups at Visit 6 (Week 24) using covariance analysis (ANCOVA), with baseline Apo AI as covariates, hemigliptin FDC group / rosuvastatin showed no significant difference in the magnitude of the change compared with the two control groups.
/Розувастатина/ Rosuvastatin
(N=94)(N = 94)
(N=94)(N = 94)
(N=96)(N = 96)
Оценки по методу наименьших квадратов (тип III), полученные с использованием ковариационного анализа (ANCOVA), ANCOVA модель включала группу лечения и исходный уровень HbA1c в качестве ковариаты
P-значение, полученное методом ANCOVA, ANCOVA модель включала группу лечения и исходный уровень HbA1c в качестве ковариаты и
Лечение*Исходное значение в качестве эффектов взаимодействия
†: P-значение, полученное с использованием парного t-критерия, ‡: P-значение, полученное с использованием знакового рангового критерия Уилкоксона
*: P-значение, полученное с использованием двухвыборочного t-критерия, **: P-значение, полученное с использованием критерия суммы рангов УилкоксонаComparison between Combination (Hemigliptin / Rosuvastatin FDC) and Monotherapy (Hemigliptin 50 mg or Rosuvastatin)
Least squares scores (type III) obtained using covariance analysis (ANCOVA), the ANCOVA model included a treatment group and baseline HbA1c as covariates
P-value obtained by ANCOVA, ANCOVA model included a treatment group and baseline HbA1c as covariates and
Treatment * Initial value as interaction effects
†: P-value obtained using the paired t-test, ‡: P-value obtained using the Wilcoxon signed rank test
*: P-value obtained using the two-sample t-test **: P-value obtained using the Wilcoxon rank sum test
<Изменения уровня Apo B (мг/дл) в сыворотке на неделе 24><Changes in serum Apo B (mg / dl) at
Изменения уровня Apo B у субъектов по сравнению с исходным уровнем при Визите 6 (Неделя 24) представлены в Таблице 26.Changes in Apo B level in subjects compared to baseline at Visit 6 (Week 24) are presented in Table 26.
Исходный уровень Apo B в каждой группе, 121,90±20,57 мг/дл в группе FDC гемиглиптина/розувастатина, 128,40±23,65 мг/дл в группе гемиглиптина и 119,46±22,15 мг/дл в группе розувастатина, был схожим. При Визите 6 (Неделя 24) все 3 группы показали существенное уменьшение Apo B по сравнению с исходным уровнем.The initial Apo B level in each group, 121.90 ± 20.57 mg / dl in the hemigliptin / rosuvastatin FDC group, 128.40 ± 23.65 mg / dl in the hemigliptin group and 119.46 ± 22.15 mg / dl in the rosuvastatin group was similar. At Visit 6 (Week 24), all 3 groups showed a significant decrease in Apo B compared to baseline.
Когда сравнивали МНКсреднее (средние значения, полученные методом наименьших квадратов) изменения уровня Apo B от исходного уровня между этими группами при Визите 6 (Неделя 24) с использованием ковариационного анализа (ANCOVA), с исходным уровнем Apo B в качестве ковариаты, группа FDC гемиглиптина/розувастатина показала существенное уменьшение Apo B по сравнению с группой гемиглиптина и никакой значимой разницы в величине изменения по сравнению с группой розувастатина.When the least-squares least-squares least-squares comparisons were compared, the changes in Apo B level from baseline between these groups at Visit 6 (Week 24) using covariance analysis (ANCOVA), with baseline Apo B as covariates, hemigliptin FDC group / rosuvastatin showed a significant decrease in Apo B compared with the hemigliptin group and no significant difference in the magnitude of the change compared with the rosuvastatin group.
/Розувастатина/ Rosuvastatin
(N=94)(N = 94)
(N=94)(N = 94)
(N=96)(N = 96)
Оценки по методу наименьших квадратов (тип III), полученные с использованием ковариационного анализа (ANCOVA), ANCOVA модель включала группу лечения и исходный уровень HbA1c в качестве ковариаты
P-значение, полученное методом ANCOVA, ANCOVA модель включала группу лечения и исходный уровень HbA1c в качестве ковариаты и
Лечение*Исходное значение в качестве эффектов взаимодействия †: P-значение, полученное с использованием парного t-критерия, ‡: P-значение, полученное с использованием знакового рангового критерия Уилкоксона
*: P-значение, полученное с использованием двухвыборочного t-критерия,
**: P-значение, полученное с использованием критерия суммы рангов УилкоксонаComparison between Combination (Hemigliptin / Rosuvastatin FDC) and Monotherapy (Hemigliptin 50 mg or Rosuvastatin)
Least squares scores (type III) using covariance analysis (ANCOVA), the ANCOVA model included a treatment group and baseline HbA1c as covariates
P-value obtained by ANCOVA, ANCOVA model included a treatment group and baseline HbA1c as covariates and
Treatment * Initial value as interaction effects †: P-value obtained using paired t-test, ‡: P-value obtained using Wilcoxon's signed rank test
*: P-value obtained using the two-sample t-test,
**: P-value obtained using the Wilcoxon rank sum test
<Изменения уровня Липопротеина (a) (мг/дл) на неделе 24><Changes in Lipoprotein (a) level (mg / dl) at
Изменения уровня липопротеина (a) (Lp (a)) у субъектов по сравнению с исходным уровнем при Визите 6 (Неделя 24) представлены в Таблице 27.Changes in the level of lipoprotein (a) (Lp (a)) in subjects compared to the baseline at Visit 6 (Week 24) are presented in Table 27.
Исходный уровень Lp (a) в каждой группе, 17,27±19,72 мг/дл в группе FDC гемиглиптина/розувастатина, 19,41±19,31 мг/дл в группе гемиглиптина и 16,12±14,06 мг/дл в группе розувастатина, был схожим. При Визите 6 (Неделя 24) группа FDC гемиглиптина/розувастатина и группа розувастатина показали существенное повышение Lp (a) по сравнению с исходным уровнем, а группа гемиглиптина не показала никакого существенного изменения уровня Lp (a) по сравнению с исходным уровнем.The initial level of Lp (a) in each group, 17.27 ± 19.72 mg / dl in the hemigliptin / rosuvastatin FDC group, 19.41 ± 19.31 mg / dl in the hemigliptin group and 16.12 ± 14.06 mg / dl in the rosuvastatin group was similar. At Visit 6 (Week 24), the hemigliptin / rosuvastatin FDC group and the rosuvastatin group showed a significant increase in Lp (a) compared to the baseline, and the hemigliptin group showed no significant change in Lp (a) compared to the baseline.
Когда сравнивали МНКсреднее (средние значения, полученные методом наименьших квадратов) изменения Lp (a) от исходного уровня между этими группами при Визите 6 (Неделя 24) с использованием ковариационного анализа (ANCOVA), с исходным уровнем Lp (a) в качестве ковариаты, группа FDC гемиглиптина/розувастатина показала существенное повышение Lp (a) по сравнению с группой гемиглиптина и никакой значимой разницы в величине изменения по сравнению с группой розувастатина.When comparing the least-squares least-squares least-squares mean Lp (a) changes from baseline between these groups at Visit 6 (Week 24) using covariance analysis (ANCOVA), with baseline Lp (a) as covariates, group Hemigliptin / rosuvastatin FDC showed a significant increase in Lp (a) compared to the hemigliptin group and no significant difference in the magnitude of the change compared to the rosuvastatin group.
/Розувастатина/ Rosuvastatin
(N=94)(N = 94)
(N=94)(N = 94)
(N=96)(N = 96)
Оценки по методу наименьших квадратов (тип III), полученные с использованием ковариационного анализа (ANCOVA), ANCOVA модель включала группу лечения и исходный уровень HbA1c в качестве ковариаты
P-значение, полученное методом ANCOVA, ANCOVA модель включала группу лечения и исходный уровень HbA1c в качестве ковариаты и
Лечение*Исходное значение в качестве эффектов взаимодействия
†: P-значение, полученное с использованием парного t-критерия, ‡: P-значение, полученное с использованием знакового рангового критерия Уилкоксона *: P-значение, полученное с использованием двухвыборочного t-критерия, **: P-значение, полученное с использованием критерия суммы рангов УилкоксонаComparison between Combination (Hemigliptin / Rosuvastatin FDC) and Monotherapy (Hemigliptin 50 mg or Rosuvastatin)
Least squares scores (type III) using covariance analysis (ANCOVA), the ANCOVA model included a treatment group and baseline HbA1c as covariates
P-value obtained by ANCOVA, ANCOVA model included a treatment group and baseline HbA1c as covariates and
Treatment * Initial value as interaction effects
†: P-value obtained using the paired t-test, ‡: P-value obtained using the Wilcoxon sign test *: P-value obtained using the two-sample t-test **: P-value obtained from using the Wilcoxon rank sum test
<Изменения отношения Apo A-I/Apo B на неделе 24><Apo A-I / Apo B Relationship Changes in
Изменения отношения Apo A-I/Apo B у субъектов, включенных в полную популяцию для анализа, по сравнению с исходным уровнем при Визите 6 (Неделя 24) представлены в Таблице 28.Changes in the Apo A-I / Apo B ratio in subjects included in the total population for analysis compared to the baseline at Visit 6 (Week 24) are presented in Table 28.
Исходное отношение Apo A-I/Apo B в каждой группе, 0,87±0,25 в группе FDC гемиглиптина/розувастатина, 0,91±0,23 в группе гемиглиптина и 0,86±0,21 в группе розувастатина, было схожим. При Визите 6 (Неделя 24) группа FDC гемиглиптина/розувастатина и группа розувастатина показали существенное уменьшение отношения Apo A-I/Apo B по сравнению с исходным отношением, а группа гемиглиптина не показала никакого существенного изменения отношения Apo A-I/Apo B по сравнению с исходным отношением.The initial Apo A-I / Apo B ratio in each group, 0.87 ± 0.25 in the hemigliptin / rosuvastatin FDC group, 0.91 ± 0.23 in the hemigliptin group, and 0.86 ± 0.21 in the rosuvastatin group, were similar. At Visit 6 (Week 24), the hemigliptin / rosuvastatin FDC group and the rosuvastatin group showed a significant decrease in the Apo A-I / Apo B ratio compared to the baseline ratio, and the hemigliptin group showed no significant change in the Apo A-I / Apo B ratio compared to the baseline ratio.
Когда сравнивали МНКсреднее (средние значения, полученные методом наименьших квадратов) изменения отношения Apo A-I/Apo B от исходного значения между этими группами при Визите 6 (Неделя 24) с использованием ковариационного анализа (ANCOVA), с исходным отношением Apo A-I/Apo B в качестве ковариаты, группа FDC гемиглиптина/розувастатина показала существенное уменьшение отношения Apo A-I/Apo B по сравнению с группой гемиглиптина и никакой значимой разницы в величине изменения по сравнению с группой розувастатина.When comparing the least-squares least-squares least-squares average of the change in the Apo AI / Apo B ratio from the baseline between the groups at Visit 6 (Week 24) using covariance analysis (ANCOVA), with the original Apo AI / Apo B ratio as covariates, the hemigliptin / rosuvastatin FDC group showed a significant decrease in the Apo AI / Apo B ratio compared to the hemigliptin group and no significant difference in the magnitude of the change compared to the rosuvastatin group.
/Розувастатина/ Rosuvastatin
(N=94)(N = 94)
(N=94)(N = 94)
(N=96)(N = 96)
Оценки по методу наименьших квадратов (тип III), полученные с использованием ковариационного анализа (ANCOVA), ANCOVA модель включала группу лечения и исходный уровень HbA1c в качестве ковариаты
P-значение, полученное методом ANCOVA, ANCOVA модель включала группу лечения и исходный уровень HbA1c в качестве ковариаты и
Лечение*Исходное значение в качестве эффектов взаимодействия
†: P-значение, полученное с использованием парного t-критерия, ‡: P-значение, полученное с использованием знакового рангового критерия Уилкоксона
*: P-значение, полученное с использованием двухвыборочного t-критерия, **: P-значение, полученное с использованием критерия суммы рангов УилкоксонаComparison between Combination (Hemigliptin / Rosuvastatin FDC) and Monotherapy (
Least squares scores (type III) obtained using covariance analysis (ANCOVA), the ANCOVA model included a treatment group and baseline HbA1c as covariates
P-value obtained by ANCOVA, ANCOVA model included a treatment group and baseline HbA1c as covariates and
Treatment * Initial value as interaction effects
†: P-value obtained using the paired t-test, ‡: P-value obtained using the Wilcoxon signed rank test
*: P-value obtained using the two-sample t-test **: P-value obtained using the Wilcoxon rank sum test
(3) Обобщение результатов оценки эффективности(3) Summary of performance assessment results
Для HbA1c, сравнивали величину изменений в группе FDC гемиглиптина/розувастатина и группе розувастатина. Для LDL-C, сравнивали процентное изменение в группе FDC гемиглиптина/розувастатина и группе гемиглиптина. Каждое сравнение подтверждало превосходство группы FDC гемиглиптина/розувастатина.For HbA1c, the magnitude of the changes in the hemigliptin / rosuvastatin FDC group and the rosuvastatin group were compared. For LDL-C, the percent change in the hemigliptin / rosuvastatin FDC group and the hemigliptin group were compared. Each comparison confirmed the superiority of the hemogliptin / rosuvastatin FDC group.
- При Визите 6 (Неделя 24) среднеквадратичное среднее изменения уровня HbA1c по сравнению с исходным уровнем составило -0,539±0,081% в группе FDC гемиглиптина/розувастатина и 0,273±0,080% в группе розувастатина. Исходя из 95% ДИ (-1,035, -0,588), в котором верхний предел меньше 0, было подтверждено превосходство группы FDC гемиглиптина/розувастатина в эффективности снижения HbA1c по сравнению с группой розувастатина.- At Visit 6 (Week 24), the mean square mean change in the level of HbA1c compared to the baseline was -0.539 ± 0.081% in the hemigliptin / rosuvastatin FDC group and 0.273 ± 0.080% in the rosuvastatin group. Based on 95% CI (-1.035, -0.588), in which the upper limit is less than 0, the superiority of the hemigliptin / rosuvastatin FDC group in the effectiveness of HbA1c reduction compared with the rosuvastatin group was confirmed.
- При Визите 6 (Неделя 24) среднеквадратичное среднее процентного изменения уровня LDL-C (%) по сравнению с исходным уровнем составило -53,002±1,929% в группе FDC гемиглиптина/розувастатина и -1,135±1,939% в группе гемиглиптина. Исходя из 95% ДИ (-57,271, -46,463), в котором верхний предел меньше 0, было подтверждено превосходство группы FDC гемиглиптина/розувастатина в эффективности снижения LDL-C по сравнению с группой гемиглиптина.- At Visit 6 (Week 24), the mean square percent change in LDL-C level (%) compared to baseline was -53.002 ± 1.929% in the hemigliptin / rosuvastatin FDC group and -1.135 ± 1.939% in the hemigliptin group. Based on 95% CI (-57.271, -46.463), in which the upper limit is less than 0, the superiority of the hemigliptin / rosuvastatin FDC group in the efficiency of lowering LDL-C compared with the hemigliptin group was confirmed.
Во вторую очередь, для оценки изменения уровня HbA1c и LDL-C в группе FDC гемиглиптина/розувастатина HbA1c сравнивали с группой гемиглиптина, а LDL-C сравнивали с группой розувастатина.Secondly, to assess changes in the levels of HbA1c and LDL-C in the hemogliptin / rosuvastatin FDC group, HbA1c was compared with the hemigliptin group, and LDL-C was compared with the rosuvastatin group.
- При Визите 6 (Неделя 24) среднеквадратичное среднее величины изменения HbA1c по сравнению с исходным уровнем составило -0,539±0,081% в группе FDC гемиглиптина/розувастатина и -1,007±0,081% в группе гемиглиптина. Обе группы показали существенное уменьшение по сравнению с исходным уровнем (P <0,0001), но группа FDC гемиглиптина/розувастатина показала меньшее снижение HbA1c, чем группа гемиглиптина, и была статистически значимая разница (P=0,0001).- At Visit 6 (Week 24), the mean square mean change in HbA1c compared to the baseline was -0.539 ± 0.081% in the hemigliptin / rosuvastatin FDC group and -1.007 ± 0.081% in the hemigliptin group. Both groups showed a significant decrease compared to baseline ( P <0.0001), but the hemigliptin / rosuvastatin FDC group showed a lower decrease in HbA1c than the hemigliptin group, and there was a statistically significant difference ( P = 0.0001).
- При Визите 6 (Неделя 24) среднеквадратичное среднее процентного изменения LDL-C (%) по сравнению с исходным уровнем составило -52,57±20,56% в группе FDC гемиглиптина/розувастатина и -53,89±16,64% в группе розувастатина. Обе группы показали существенное уменьшение по сравнению с исходным уровнем (P <0,0001), и не было никакой значимой разницы в процентном изменении LDL-C между обеими группами(P=0,6354).- At Visit 6 (Week 24), the mean square percent change in LDL-C (%) compared to baseline was -52.57 ± 20.56% in the FDC group of hemigliptin / rosuvastatin and -53.89 ± 16.64% in rosuvastatin group. Both groups showed a significant decrease compared to baseline ( P <0.0001), and there was no significant difference in the percentage change in LDL-C between the two groups ( P = 0.6354).
При каждом визите в течение 24 недель группа FDC гемиглиптина/розувастатина показывала существенное уменьшение HbA1c и FPG по сравнению с группой розувастатина и существенное уменьшение LDL-C по сравнению с группой гемиглиптина.At each 24-week visit, the hemigliptin / rosuvastatin FDC group showed a significant decrease in HbA1c and FPG compared to the rosuvastatin group and a significant decrease in LDL-C compared to the hemigliptin group.
- В течение 24 недель HbA1c в группе FDC гемиглиптина/розувастатина был существенно ниже по сравнению с исходным уровнем при каждом визите. Среднеквадратичное среднее изменения уровня HbA1c от исходного уровня -0,686±0,055% при Визите 4(Неделя 8) было самым большим снижением. С другой стороны, в группе розувастатина HbA1c был несколько снижен до -0,074±0,055% при Визите 4 (Неделя 8), но затем снова повышался. При каждом визите группа FDC гемиглиптина/розувастатина показывала существенное уменьшение HbA1c по сравнению с группой розувастатина, и разница в величине изменения между группами была самой большой на неделе 24 (-0,812±0,113% (P<0,0001)). В то же время, при сравнении с группой гемиглиптина, группа гемиглиптина показала существенно большее снижение HbA1c, чем группа FDC гемиглиптина/розувастатина, после Визита 5 (Неделя 16).- Within 24 weeks, the HbA1c in the FDC group of hemigliptin / rosuvastatin was significantly lower than the baseline at each visit. The mean square change in HbA1c level from baseline of -0.686 ± 0.055% at Visit 4 (Week 8) was the largest decrease. On the other hand, in the rosuvastatin group, HbA1c was slightly reduced to -0.074 ± 0.055% at Visit 4 (Week 8), but then increased again. At each visit, the hemigliptin / rosuvastatin FDC group showed a significant decrease in HbA1c compared to the rosuvastatin group, and the difference in the magnitude of the change between the groups was the largest at week 24 (-0.812 ± 0.113% ( P < 0.0001)). At the same time, when compared with the hemigliptin group, the hemigliptin group showed a significantly greater decrease in HbA1c than the hemigliptin / rosuvastatin FDC group after Visit 5 (Week 16).
- В течение 24 недель уровень FPG в группе FDC гемиглиптина/розувастатина был существенно ниже по сравнению с исходным уровнем при каждом визите. Среднеквадратичное среднее изменения уровня FPG от исходного уровня -11,962±2,801 мг/дл при Визите 4 (Неделя 8) было самым большим снижением. С другой стороны, в группе розувастатина уровень FPG был постоянно повышенным. При каждом визите группа FDC гемиглиптина/розувастатина показывала существенное уменьшение FPG по сравнению с группой розувастатина, и разница в величине изменения между группами на неделе 24 составила -20,627±4,417 мг/дл. В то же время, при сравнении с группой гемиглиптина, группа гемиглиптина показывала существенно большее снижение FPG, чем группа FDC гемиглиптина/розувастатина, при каждом визите.- Within 24 weeks, the FPG level in the hemigliptin / rosuvastatin FDC group was significantly lower compared to the baseline at each visit. The mean square change in FPG level from baseline of -11.962 ± 2.801 mg / dL at Visit 4 (Week 8) was the largest decrease. On the other hand, in the rosuvastatin group, FPG was constantly elevated. At each visit, the hemigliptin / rosuvastatin FDC group showed a significant decrease in FPG compared to the rosuvastatin group, and the difference in the magnitude of the change between the groups at
- В течение 24 недель уровень LDL-C в группе FDC гемиглиптина/розувастатина был существенно ниже по сравнению с исходным уровнем при каждом визите. Среднеквадратичное среднее изменения уровня LDL-C от исходного уровня -53,002±1,929% при Визите 6 (Неделя 24) было самым большим снижением. С другой стороны, в группе гемиглиптина уровень LDL-C существенно не изменялся от исходного уровня. При каждом визите группа FDC гемиглиптина/розувастатина показывала существенное уменьшение LDL-C по сравнению с группой гемиглиптина, и разница в процентном изменении между группами на неделе 24 составила -51,867±2,745%. В то же время, при сравнении с группой розувастатина, снижение LDL-C в группе FDC гемиглиптина/розувастатина существенно не отличалось от группы розувастатина при каждом визите.- Within 24 weeks, the LDL-C level in the hemigliptin / rosuvastatin FDC group was significantly lower compared to the baseline at each visit. The root mean square change in LDL-C from baseline of -53.002 ± 1.929% at Visit 6 (Week 24) was the largest decrease. On the other hand, in the hemigliptin group, the level of LDL-C did not significantly change from the initial level. At each visit, the hemigliptin / rosuvastatin FDC group showed a significant decrease in LDL-C compared with the hemigliptin group, and the difference in the percentage change between the groups at
Что касается других параметров оценки, указывающих на диабет, группа FDC гемиглиптина/розувастатина показала существенное улучшение HOMA-β и HOMA-IR при Визите 6 (Неделя 24).For other evaluation parameters indicating diabetes, the hemigliptin / rosuvastatin FDC group showed a significant improvement in HOMA-β and HOMA-IR at Visit 6 (Week 24).
- Группа FDC гемиглиптина/розувастатина не показала никакого существенного изменения отношения проинсулин/инсулин в сыворотке натощак по сравнению с исходным значением или каждой контрольной группой при Визите 6 (Неделя 24).- The hemigliptin / rosuvastatin FDC group showed no significant change in the fasting serum proinsulin / insulin ratio compared with the baseline value or each control group at Visit 6 (Week 24).
- Группа FDC гемиглиптина/розувастатина не показала никакого существенного изменения уровня C-пептида в сыворотке натощак по сравнению с исходным уровнем при Визите 6 (Неделя 24), никакой значимой разницы в величине изменения по сравнению с группой розувастатина, но показала статистически значимое увеличение уровня C-пептида в сыворотке натощак по сравнению с группой гемиглиптина (P=0,0488).- The hemigliptin / rosuvastatin FDC group showed no significant change in fasting serum C-peptide compared to baseline at Visit 6 (Week 24), no significant difference in the magnitude of the change compared to the rosuvastatin group, but showed a statistically significant increase in C -peptide in fasting serum compared with the hemigliptin group ( P = 0.0488).
- При Визите 6 (Неделя 24) среднеквадратичное среднее изменения HOMA-β по сравнению с исходным значением в группе FDC гемиглиптина/розувастатина составило 11,249±2,832, что было существенным увеличением по сравнению со значением (0,531±3,005) группы розувастатина (P=0,0100), и существенно не отличалось от значения (15,279±2,892) группы гемиглиптина.- At Visit 6 (Week 24), the mean square mean change in HOMA-β compared to the baseline in the hemigliptin / rosuvastatin FDC group was 11.249 ± 2.832, which was a significant increase compared to the value (0.531 ± 3.005) of the rosuvastatin group ( P = 0, 0100), and did not significantly differ from the value (15.279 ± 2.892) of the hemigliptin group.
- При Визите 6 (Неделя 24) среднеквадратичное среднее изменения HOMA-IR по сравнению с исходным значением в группе FDC гемиглиптина/розувастатина составило -0,092±0,245, что не было существенным изменением по сравнению с исходным значением, и было существенно ниже по сравнению со значением (0,670±0,258) группы розувастатина (P=0,0331) и существенно не отличалось от значения (-0,382±0,250) группы гемиглиптина.- At Visit 6 (Week 24), the root-mean-square mean change in HOMA-IR compared to the baseline value in the hemigliptin / rosuvastatin FDC group was -0.092 ± 0.245, which was not a significant change compared to the baseline value, and was significantly lower compared to the value (0.670 ± 0.258) of the rosuvastatin group ( P = 0.0331) and did not significantly differ from the value (-0.382 ± 0.250) of the hemigliptin group.
Большинство из оцениваемых параметров, связанных с дислипидемией, в группе FDC гемиглиптина/розувастатина были существенно улучшены при Визите 6 (Неделя 24).Most of the assessed parameters associated with dyslipidemia in the hemogliptin / rosuvastatin FDC group were significantly improved at Visit 6 (Week 24).
- При Визите 6 (Неделя 24) среднеквадратичное среднее величины изменения Apo B по сравнению с исходным уровнем составило -56,393±1,903 мг/дл в группе FDC гемиглиптина/розувастатина, что было существенным уменьшением по сравнению с исходным уровнем. Группа FDC гемиглиптина/розувастатина показала существенное уменьшение по сравнению с группой гемиглиптина (-4,456±1,961) (P<0,0001), и не было никакой значимой разницы по сравнению с группой розувастатина (-56,118±2,028). Эти результаты совпадают с тенденцией LDL-C.- At Visit 6 (Week 24), the mean square mean change in Apo B compared to baseline was -56.393 ± 1.903 mg / dL in the hemigliptin / rosuvastatin FDC group, which was a significant decrease from baseline. The hemigliptin / rosuvastatin FDC group showed a significant decrease compared to the hemigliptin group (-4.456 ± 1.961) ( P <0.0001), and there was no significant difference compared to the rosuvastatin group (-56.118 ± 2.028). These results are consistent with the LDL-C trend.
- В течение 24 недель общий холестерин (TC) в группе FDC гемиглиптина/розувастатина был существенно ниже по сравнению с исходным уровнем при каждом визите. Среднеквадратичное среднее изменения уровня TC от исходного уровня 78,175±2,761 мг/дл при Визите 6 (Неделя 24) было самым большим снижением. При каждом визите группа FDC гемиглиптина/розувастатина показывала существенно большее снижение TC, чем группа гемиглиптина, и разница в величине изменения между группами на неделе 24 составила -75,024±3,935 мг/дл. В то же время, при сравнении с группой розувастатина, группа FDC гемиглиптина/розувастатина не показывала никакой значимой разницы в снижение TC при каждом визите.- Within 24 weeks, the total cholesterol (TC) in the hemogliptin / rosuvastatin FDC group was significantly lower than the baseline at each visit. The root mean square change in TC level from baseline of 78.175 ± 2.761 mg / dl at Visit 6 (Week 24) was the largest decrease. At each visit, the hemigliptin / rosuvastatin FDC group showed a significantly greater decrease in TC than the hemigliptin group, and the difference in the magnitude of the change between the groups at
- В течение 24 недель уровень триглицеридов (TG) в группе FDC гемиглиптина/розувастатина был существенно ниже по сравнению с исходным уровнем при каждом визите. Среднеквадратичное среднее изменения уровня TG от исходного уровня -62,433±8,771 мг/дл при Визите 6 (Неделя 24) было самым большим снижением. При каждом визите группа FDC гемиглиптина/розувастатина показывала существенно большее снижение TG, чем группа гемиглиптина, и разница в величине изменения между группами на неделе 24 составила -55,440±12,391 мг/дл. В то же время, при сравнении с группой розувастатина, группа FDC гемиглиптина/розувастатина не показывала никакой значимой разницы в снижении TG при каждом визите.- Within 24 weeks, the level of triglycerides (TG) in the hemigliptin / rosuvastatin FDC group was significantly lower compared with the initial level at each visit. The mean square TG change from baseline of -62.433 ± 8.771 mg / dL at Visit 6 (Week 24) was the largest decrease. At each visit, the hemigliptin / rosuvastatin FDC group showed a significantly greater decrease in TG than the hemigliptin group, and the difference in the magnitude of the change between the groups at
- В течение 24 недель отношение LDL-C/HDL-C в группе FDC гемиглиптина/розувастатина было существенно ниже по сравнению с исходным уровнем при каждом визите. Среднеквадратичное среднее изменения отношения LDL-C/HDL-C от исходного уровня -1,649±0,059 при Визите 6 (Неделя 24) было самым большим снижением. При каждом визите группа FDC гемиглиптина/розувастатина показывала существенно большее снижение отношения LDL-C/HDL-C, чем группа гемиглиптина, и разница в величине изменения между группами на неделе 24 составила -1,637±0,084. В то же время, при сравнении с группой розувастатина, группа FDC гемиглиптина/розувастатина не показывала никакой значимой разницы в уменьшении отношения LDL-C/HDL-C при каждом визите.- Within 24 weeks, the ratio of LDL-C / HDL-C in the FDC group of hemigliptin / rosuvastatin was significantly lower compared with the initial level at each visit. The mean square mean change in the LDL-C / HDL-C ratio from baseline of -1.649 ± 0.059 at Visit 6 (Week 24) was the largest decrease. At each visit, the hemigliptin / rosuvastatin FDC group showed a significantly larger decrease in the LDL-C / HDL-C ratio than the hemigliptin group, and the difference in the magnitude of the change between the groups at
- При Визите 6 (Неделя 24) среднеквадратичное среднее величины изменения отношения Apo A-I/Apo B по сравнению с исходным уровнем составило -0,409±0,015 в группе FDC гемиглиптина/розувастатина, что было существенным уменьшением по сравнению с исходным уровнем. Группа FDC гемиглиптина/розувастатина показала существенное уменьшение по сравнению с группой гемиглиптина (-0,014±0,016) (P<0,0001), и никакой значимой разницы по сравнению с группой розувастатина (-0,425±0,016). Эти результаты совпадают с тенденцией отношения LDL-C/HDL-C.- At Visit 6 (Week 24), the rms average of the change in the Apo AI / Apo B ratio compared to the baseline was –0.409 ± 0.015 in the hemigliptin / rosuvastatin FDC group, which was a significant decrease compared to the baseline. The hemigliptin / rosuvastatin FDC group showed a significant decrease compared with the hemigliptin group (-0.014 ± 0.016) ( P <0.0001), and no significant difference compared with the rosuvastatin group (-0.425 ± 0.016). These results are consistent with the trend of the LDL-C / HDL-C relationship.
- При Визите 6 (Неделя 24) среднеквадратичное среднее изменения HDL-C по сравнению с исходным уровнем составило 1,452±0,804 мг/дл в группе FDC гемиглиптина/розувастатина, что не было существенным изменением по сравнению с исходным уровнем. Группа FDC гемиглиптина/розувастатина не показала никакой значимой разницы по сравнению с группой гемиглиптина (-0,594±0,804 мг/дл), но показала существенно меньшее повышение, чем группа розувастатина (4,535±0,796 мг/дл).- At Visit 6 (Week 24), the mean-square mean change in HDL-C compared to baseline was 1.452 ± 0.804 mg / dL in the hemigliptin / rosuvastatin FDC group, which was not a significant change from baseline. The hemigliptin / rosuvastatin FDC group showed no significant difference compared to the hemigliptin group (-0.594 ± 0.804 mg / dl), but showed a significantly lower increase than the rosuvastatin group (4.535 ± 0.796 mg / dl).
- При Визите 6 (Неделя 24) среднеквадратичное среднее изменения Apo A-I по сравнению с исходным уровнем составило 0,996±2,092 мг/дл в группе FDC гемиглиптина/розувастатина, что не было существенным изменением по сравнению с исходным уровнем. Группа FDC гемиглиптина/розувастатина не показала никакой значимой разницы по сравнению с группой гемиглиптина (-2,909±2,141 мг/дл) или группой розувастатина (6,755±2,221 мг/дл).- At Visit 6 (Week 24), the mean square change in Apo A-I compared to baseline was 0.996 ± 2.092 mg / dL in the hemigliptin / rosuvastatin FDC group, which was not a significant change from baseline. The hemigliptin / rosuvastatin FDC group showed no significant difference compared to the hemigliptin group (-2.909 ± 2.141 mg / dl) or the rosuvastatin group (6.755 ± 2.221 mg / dl).
- При Визите 6 (Неделя 24) среднеквадратичное среднее изменения уровня липопротеина (a) по сравнению с исходным уровнем составило 5,930±1,160 мг/дл в группе FDC гемиглиптина/розувастатина, что было существенным увеличением по сравнению с исходным уровнем. Группа FDC гемиглиптина/розувастатина показала существенное уменьшение по сравнению с группой гемиглиптина (-0,435±1,188 мг/дл), но никакой значимой разницы по сравнению с группой розувастатина (4,800±1,232 мг/дл).- At Visit 6 (Week 24), the rms mean change in lipoprotein (a) compared to baseline was 5.930 ± 1.160 mg / dL in the hemigliptin / rosuvastatin FDC group, which was a significant increase from baseline. The hemigliptin / rosuvastatin FDC group showed a significant decrease compared to the hemigliptin group (-0.435 ± 1.188 mg / dl), but no significant difference compared to the rosuvastatin group (4,800 ± 1,232 mg / dl).
В то же время, при Визите 6 (Неделя 24) не было никакого существенного изменения в окружности талии и массе тела в группе FDC гемиглиптина/розувастатина.At the same time, at Visit 6 (Week 24), there was no significant change in waist circumference and body weight in the hemogliptin / rosuvastatin FDC group.
- При Визите 6 (Неделя 24) среднеквадратичное среднее изменения окружности талии по сравнению с исходным уровнем составило -0,738±0,373 см в группе FDC гемиглиптина/розувастатина, что было существенным уменьшением по сравнению с исходным уровнем. Группа FDC гемиглиптина/розувастатина не показала никакой значимой разницы по сравнению с группой гемиглиптина (-0,144±0,372 см) или группой розувастатина (-0,150±0,369 см).- At Visit 6 (Week 24), the mean square mean change in the waist circumference compared to the baseline was -0.738 ± 0.373 cm in the hemigliptin / rosuvastatin FDC group, which was a significant decrease compared to the baseline. The hemigliptin / rosuvastatin FDC group showed no significant difference compared with the hemigliptin group (-0.144 ± 0.372 cm) or the rosuvastatin group (-0.150 ± 0.369 cm).
- При Визите 6 (Неделя 24), среднеквадратичное среднее изменения массы тела по сравнению с исходным уровнем составило -0,132±0,244 кг в группе FDC гемиглиптина/розувастатина, что не было существенным изменением по сравнению с исходным уровнем. Группа FDC гемиглиптина/розувастатина не показала никакой значимой разницы по сравнению с группой гемиглиптина (-0,407±0,0,243 кг), но показала существенно меньшее снижение, чем группа розувастатина (-0,893±0,241 кг).- At Visit 6 (Week 24), the mean square mean change in body weight compared to baseline was -0.132 ± 0.244 kg in the hemigliptin / rosuvastatin FDC group, which was not a significant change from baseline. The hemigliptin / rosuvastatin FDC group showed no significant difference compared to the hemigliptin group (-0.407 ± 0.0.243 kg), but showed a significantly smaller decrease than the rosuvastatin group (-0.893 ± 0.241 kg).
Claims (13)
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR20160152195 | 2016-11-15 | ||
| KR10-2016-0152195 | 2016-11-15 | ||
| PCT/KR2017/012941 WO2018093144A1 (en) | 2016-11-15 | 2017-11-15 | Medicinal complex for treating type 2 diabetes and diabetic dyslipidemia |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| RU2721406C1 true RU2721406C1 (en) | 2020-05-19 |
Family
ID=62146049
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2019118301A RU2721406C1 (en) | 2016-11-15 | 2017-11-15 | Medicinal complex for treating type 2 diabetes and diabetic dyslipidemia |
Country Status (9)
| Country | Link |
|---|---|
| KR (1) | KR102055894B1 (en) |
| CN (1) | CN109996545A (en) |
| BR (1) | BR112019009709A2 (en) |
| CO (1) | CO2019005207A2 (en) |
| MX (1) | MX2019005572A (en) |
| PE (1) | PE20191502A1 (en) |
| PH (1) | PH12019501028A1 (en) |
| RU (1) | RU2721406C1 (en) |
| WO (1) | WO2018093144A1 (en) |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2358737C2 (en) * | 2003-09-26 | 2009-06-20 | АстраЗенека Ю-Кей Лимитед | Therapeutic treatment |
| WO2011139256A2 (en) * | 2010-05-04 | 2011-11-10 | Bilgic Mahmut | Stable rosuvastatin formulations |
| WO2014017833A1 (en) * | 2012-07-24 | 2014-01-30 | Hanmi Pharm. Co., Ltd. | Composite formulation for oral administration comprising metformin and rosuvastatin |
| WO2014058188A1 (en) * | 2012-10-08 | 2014-04-17 | Lg Life Sciences Ltd. | Combination drug comprising gemigliptin and metformin, and method for the preparation thereof |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101277949A (en) * | 2005-04-22 | 2008-10-01 | 阿兰托斯制药控股公司 | Dipeptidyl peptidase-iv inhibitors |
| AU2010281913A1 (en) * | 2009-08-13 | 2012-04-05 | Synthon B.V. | Pharmaceutical tablet comprising rosuvastatin calcium |
| KR20240090632A (en) * | 2009-11-27 | 2024-06-21 | 베링거 인겔하임 인터내셔날 게엠베하 | Treatment of genotyped diabetic patients with dpp-iv inhibitors such as linagliptin |
| WO2014080383A1 (en) * | 2012-11-26 | 2014-05-30 | Ranbaxy Laboratories Limited | Pharmaceutical composition of dipeptidyl peptidase-iv (dpp-iv) inhibitors in combination with other antidiabetics |
| TW201513857A (en) * | 2013-07-05 | 2015-04-16 | Cadila Healthcare Ltd | Synergistic compositions |
| CN103494788B (en) * | 2013-10-10 | 2015-08-05 | 齐晓彤 | Pharmaceutical composition of rosuvastatin calcium tablets and preparation method thereof |
| CN104473929B (en) * | 2014-12-17 | 2018-05-29 | 深圳翰宇药业股份有限公司 | A kind of Xi Gelieting simvastatin slow-releases composition |
-
2017
- 2017-11-15 CN CN201780070583.7A patent/CN109996545A/en active Pending
- 2017-11-15 KR KR1020170152253A patent/KR102055894B1/en active IP Right Grant
- 2017-11-15 WO PCT/KR2017/012941 patent/WO2018093144A1/en active Application Filing
- 2017-11-15 BR BR112019009709A patent/BR112019009709A2/en not_active IP Right Cessation
- 2017-11-15 RU RU2019118301A patent/RU2721406C1/en active
- 2017-11-15 MX MX2019005572A patent/MX2019005572A/en unknown
- 2017-11-15 PE PE2019001004A patent/PE20191502A1/en unknown
-
2019
- 2019-05-09 PH PH12019501028A patent/PH12019501028A1/en unknown
- 2019-05-22 CO CONC2019/0005207A patent/CO2019005207A2/en unknown
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2358737C2 (en) * | 2003-09-26 | 2009-06-20 | АстраЗенека Ю-Кей Лимитед | Therapeutic treatment |
| WO2011139256A2 (en) * | 2010-05-04 | 2011-11-10 | Bilgic Mahmut | Stable rosuvastatin formulations |
| WO2014017833A1 (en) * | 2012-07-24 | 2014-01-30 | Hanmi Pharm. Co., Ltd. | Composite formulation for oral administration comprising metformin and rosuvastatin |
| WO2014058188A1 (en) * | 2012-10-08 | 2014-04-17 | Lg Life Sciences Ltd. | Combination drug comprising gemigliptin and metformin, and method for the preparation thereof |
Non-Patent Citations (3)
| Title |
|---|
| CHOI H.Y. et al. Evaluation of the pharmacokinetics of the DPP-4 inhibitor gemigliptin when coadministered with rosuvastatin or irbesartan to healthy subjects. Curr.Med.Res. Opin. 2015 Feb; 31(2): 229-41. [он лайн] [найдено 25.12.2019] (найдено из интернет: www.ncbi.nlm/nih.gov/pubmed/25350224). * |
| ИНСТРУКЦИЯ ПО ПРИМЕНЕНИЮ ЛЕКАРСТВЕННОГО ПРЕПАРАТА ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ РОЗАРТ, регистрационный номер ЛП - 002213 от 02.09.2013. * |
| ИНСТРУКЦИЯ ПО ПРИМЕНЕНИЮ ЛЕКАРСТВЕННОГО ПРЕПАРАТА ДЛЯ МЕДИЦИНСКОГОПРИМЕНЕНИЯ РОЗАРТ, регистрационный номер ЛП - 002213 от 02.09.2013. * |
Also Published As
| Publication number | Publication date |
|---|---|
| KR102055894B1 (en) | 2019-12-13 |
| MX2019005572A (en) | 2019-08-14 |
| CN109996545A (en) | 2019-07-09 |
| PE20191502A1 (en) | 2019-10-22 |
| WO2018093144A1 (en) | 2018-05-24 |
| CO2019005207A2 (en) | 2019-08-20 |
| PH12019501028A1 (en) | 2020-01-20 |
| BR112019009709A2 (en) | 2019-08-13 |
| KR20180054500A (en) | 2018-05-24 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP1741446B1 (en) | Combinations comprising dipeptidylpeptidase-IV inhibitors and antidiabetic agents | |
| Nauck et al. | Efficacy and safety of adding the dipeptidyl peptidase‐4 inhibitor alogliptin to metformin therapy in patients with type 2 diabetes inadequately controlled with metformin monotherapy: a multicentre, randomised, double‐blind, placebo‐controlled study | |
| Dhillon | Sitagliptin: a review of its use in the management of type 2 diabetes mellitus | |
| Taskinen et al. | Safety and efficacy of linagliptin as add‐on therapy to metformin in patients with type 2 diabetes: a randomized, double‐blind, placebo‐controlled study | |
| KR100769786B1 (en) | Pharmaceutical composition comprising a combination of metformin and glibenclamide | |
| EP3076971B1 (en) | Compositions and methods for reducing major adverse cardiovascular events | |
| US20130296345A1 (en) | Methods for treating hyperuricemia and related diseases | |
| JP7293129B2 (en) | Pharmaceutical compositions containing PDE9 inhibitors | |
| KR20170122777A (en) | Treatment with tridipitant | |
| EP4054620B1 (en) | Semaglutide in the treatment of alzheimer's dementia | |
| RU2664422C2 (en) | Combined preparation containing gemigliptin and metformin and method for its production | |
| Lee et al. | Phase IV, 8-week, multicenter, randomized, active treatment–controlled, parallel group, efficacy, and tolerability study of high-dose candesartan cilexetil combined with hydrochlorothiazide in Korean adults with stage II hypertension | |
| Chazova et al. | The efficacy and safety of valsartan and combination of valsartan and hydrochlorothiazide in the treatment of patients with mild to moderate arterial hypertension—the VICTORY trial | |
| EP4335438A1 (en) | Combination therapy with vildagliptin and metformin | |
| KR102306005B1 (en) | Complex formulation comprising valsartan and rosuvastatin calcium and method for the preparation thereof | |
| KR20230143978A (en) | Pharmaceutical formulation for preventing or treating diabetes mellitus comprising cyclo-hispro | |
| RU2721406C1 (en) | Medicinal complex for treating type 2 diabetes and diabetic dyslipidemia | |
| Patel et al. | A systematic review on effect of canagliflozin in special population | |
| KR20210025582A (en) | Composition, kit and combination therapy for treating type 2 diabetes mellitus and diabetic dyslipidemia | |
| Pote et al. | Comparative clinical pharmacokinetics and pharmacodynamics of investigational once-daily sustained-release (sr) vildagliptin 100 mg tablet formulation with conventional 50 mg twice-daily regimen in healthy Indian males | |
| CN113950328A (en) | Compositions comprising pridopidine and analogs thereof for treating huntington's disease and symptoms thereof | |
| TW201922243A (en) | Pharmaceutical composition and composite preparation including the same | |
| JP2005531558A5 (en) | ||
| Uno et al. | Effects of strict blood pressure control by a long-acting calcium channel blocker on brain natriuretic peptide and urinary albumin excretion rate in Japanese hypertensive patients | |
| KR20240021760A (en) | Treatment methods for Alzheimer's disease |