RU2639819C2 - Composition inhibiting telomerase - Google Patents
Composition inhibiting telomerase Download PDFInfo
- Publication number
- RU2639819C2 RU2639819C2 RU2014153863A RU2014153863A RU2639819C2 RU 2639819 C2 RU2639819 C2 RU 2639819C2 RU 2014153863 A RU2014153863 A RU 2014153863A RU 2014153863 A RU2014153863 A RU 2014153863A RU 2639819 C2 RU2639819 C2 RU 2639819C2
- Authority
- RU
- Russia
- Prior art keywords
- group
- substituents
- telomerase
- imidazol
- block copolymer
- Prior art date
Links
- 108010017842 Telomerase Proteins 0.000 title claims abstract description 74
- 239000000203 mixture Substances 0.000 title claims abstract description 60
- 230000002401 inhibitory effect Effects 0.000 title claims abstract description 49
- -1 polyoxyethylene Polymers 0.000 claims abstract description 99
- 150000001875 compounds Chemical class 0.000 claims abstract description 35
- 229920001400 block copolymer Polymers 0.000 claims abstract description 33
- JLXZMLLNPNOODV-UHFFFAOYSA-N imidazol-4-one Chemical class O=C1C=NC=N1 JLXZMLLNPNOODV-UHFFFAOYSA-N 0.000 claims abstract description 29
- 229920003171 Poly (ethylene oxide) Polymers 0.000 claims abstract description 25
- 229920001451 polypropylene glycol Polymers 0.000 claims abstract description 25
- 125000001424 substituent group Chemical group 0.000 claims description 17
- 125000003118 aryl group Chemical group 0.000 claims description 12
- 229910052757 nitrogen Inorganic materials 0.000 claims description 11
- 125000005842 heteroatom Chemical group 0.000 claims description 10
- 229910052760 oxygen Inorganic materials 0.000 claims description 9
- 229910052717 sulfur Inorganic materials 0.000 claims description 9
- 230000002209 hydrophobic effect Effects 0.000 claims description 6
- 239000007864 aqueous solution Substances 0.000 claims description 5
- 229920001983 poloxamer Polymers 0.000 claims description 5
- 238000004108 freeze drying Methods 0.000 claims description 4
- 229910002651 NO3 Chemical group 0.000 claims description 3
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical group [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 claims description 3
- 229910052799 carbon Inorganic materials 0.000 claims description 3
- 125000004432 carbon atom Chemical group C* 0.000 claims description 3
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 claims description 3
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 claims description 3
- 229910052736 halogen Inorganic materials 0.000 claims description 3
- 150000002367 halogens Chemical class 0.000 claims description 3
- CUJPFPXNDSIBPG-UHFFFAOYSA-N 1,3-propanediyl Chemical group [CH2]C[CH2] CUJPFPXNDSIBPG-UHFFFAOYSA-N 0.000 claims description 2
- OMIVCRYZSXDGAB-UHFFFAOYSA-N 1,4-butanediyl Chemical group [CH2]CC[CH2] OMIVCRYZSXDGAB-UHFFFAOYSA-N 0.000 claims description 2
- GVNVAWHJIKLAGL-UHFFFAOYSA-N 2-(cyclohexen-1-yl)cyclohexan-1-one Chemical compound O=C1CCCCC1C1=CCCCC1 GVNVAWHJIKLAGL-UHFFFAOYSA-N 0.000 claims description 2
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 claims description 2
- 125000004105 2-pyridyl group Chemical group N1=C([*])C([H])=C([H])C([H])=C1[H] 0.000 claims description 2
- 101150065749 Churc1 gene Proteins 0.000 claims description 2
- 102100038239 Protein Churchill Human genes 0.000 claims description 2
- 150000001805 chlorine compounds Chemical group 0.000 claims description 2
- 125000000816 ethylene group Chemical group [H]C([H])([*:1])C([H])([H])[*:2] 0.000 claims description 2
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 claims 2
- BAVYZALUXZFZLV-UHFFFAOYSA-N Methylamine Chemical compound NC BAVYZALUXZFZLV-UHFFFAOYSA-N 0.000 claims 2
- 125000001931 aliphatic group Chemical group 0.000 claims 1
- 125000004429 atom Chemical group 0.000 claims 1
- 230000000694 effects Effects 0.000 abstract description 25
- 230000005764 inhibitory process Effects 0.000 abstract description 14
- 239000000126 substance Substances 0.000 abstract 1
- 229910021591 Copper(I) chloride Inorganic materials 0.000 description 24
- OXBLHERUFWYNTN-UHFFFAOYSA-M copper(I) chloride Chemical compound [Cu]Cl OXBLHERUFWYNTN-UHFFFAOYSA-M 0.000 description 24
- 210000004027 cell Anatomy 0.000 description 23
- 108091035539 telomere Proteins 0.000 description 15
- 102000055501 telomere Human genes 0.000 description 15
- 210000003411 telomere Anatomy 0.000 description 14
- 206010028980 Neoplasm Diseases 0.000 description 10
- 239000000243 solution Substances 0.000 description 8
- 108091034117 Oligonucleotide Proteins 0.000 description 7
- 201000011510 cancer Diseases 0.000 description 7
- 239000003277 telomerase inhibitor Substances 0.000 description 7
- 239000001963 growth medium Substances 0.000 description 6
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 6
- 238000000034 method Methods 0.000 description 5
- BOLDJAUMGUJJKM-LSDHHAIUSA-N renifolin D Natural products CC(=C)[C@@H]1Cc2c(O)c(O)ccc2[C@H]1CC(=O)c3ccc(O)cc3O BOLDJAUMGUJJKM-LSDHHAIUSA-N 0.000 description 5
- 108010057210 telomerase RNA Proteins 0.000 description 5
- 102100034343 Integrase Human genes 0.000 description 4
- 108010092799 RNA-directed DNA polymerase Proteins 0.000 description 4
- 229940123582 Telomerase inhibitor Drugs 0.000 description 4
- VMGAPWLDMVPYIA-HIDZBRGKSA-N n'-amino-n-iminomethanimidamide Chemical compound N\N=C\N=N VMGAPWLDMVPYIA-HIDZBRGKSA-N 0.000 description 4
- 125000004433 nitrogen atom Chemical group N* 0.000 description 4
- 230000000717 retained effect Effects 0.000 description 4
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- 102000004190 Enzymes Human genes 0.000 description 3
- 108090000790 Enzymes Proteins 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 3
- 230000006907 apoptotic process Effects 0.000 description 3
- 230000003197 catalytic effect Effects 0.000 description 3
- 210000000349 chromosome Anatomy 0.000 description 3
- 239000003112 inhibitor Substances 0.000 description 3
- 238000009630 liquid culture Methods 0.000 description 3
- 229920002477 rna polymer Polymers 0.000 description 3
- 239000002904 solvent Substances 0.000 description 3
- 108020004414 DNA Proteins 0.000 description 2
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 2
- YXOLAZRVSSWPPT-UHFFFAOYSA-N Morin Chemical compound OC1=CC(O)=CC=C1C1=C(O)C(=O)C2=C(O)C=C(O)C=C2O1 YXOLAZRVSSWPPT-UHFFFAOYSA-N 0.000 description 2
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 2
- 208000035896 Twin-reversed arterial perfusion sequence Diseases 0.000 description 2
- 239000005557 antagonist Substances 0.000 description 2
- 230000000692 anti-sense effect Effects 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 238000004113 cell culture Methods 0.000 description 2
- 230000032823 cell division Effects 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- 239000005547 deoxyribonucleotide Substances 0.000 description 2
- 125000002637 deoxyribonucleotide group Chemical group 0.000 description 2
- 238000004090 dissolution Methods 0.000 description 2
- 239000003814 drug Substances 0.000 description 2
- LVZYXEALRXBLJZ-ISQYCPACSA-N f60ne4xb53 Chemical compound N1([C@@H]2O[C@@H]([C@H](C2)NP(O)(=S)OC[C@@H]2[C@H](C[C@@H](O2)N2C3=NC=NC(N)=C3N=C2)NP(S)(=O)OC[C@@H]2[C@H](C[C@@H](O2)N2C3=NC=NC(N)=C3N=C2)N)COP(O)(=S)N[C@H]2C[C@@H](O[C@@H]2COP(O)(=S)N[C@H]2C[C@@H](O[C@@H]2COP(O)(=S)N[C@H]2C[C@@H](O[C@@H]2COP(O)(=S)N[C@H]2C[C@@H](O[C@@H]2COP(O)(=S)N[C@H]2C[C@@H](O[C@@H]2COP(O)(=S)N[C@H]2C[C@@H](O[C@@H]2COP(O)(=S)N[C@H]2C[C@@H](O[C@@H]2COP(O)(=S)N[C@H]2C[C@@H](O[C@@H]2COP(O)(=S)N[C@H]2C[C@@H](O[C@@H]2COP(O)(=S)N[C@H]2C[C@@H](O[C@@H]2COP(O)(=S)OCC(O)CNC(=O)CCCCCCCCCCCCCCC)N2C(NC(=O)C(C)=C2)=O)N2C3=NC=NC(N)=C3N=C2)N2C3=C(C(NC(N)=N3)=O)N=C2)N2C3=C(C(NC(N)=N3)=O)N=C2)N2C3=C(C(NC(N)=N3)=O)N=C2)N2C(NC(=O)C(C)=C2)=O)N2C(NC(=O)C(C)=C2)=O)N2C3=NC=NC(N)=C3N=C2)N2C3=C(C(NC(N)=N3)=O)N=C2)N2C3=NC=NC(N)=C3N=C2)C=CC(N)=NC1=O LVZYXEALRXBLJZ-ISQYCPACSA-N 0.000 description 2
- 229950004291 imetelstat Drugs 0.000 description 2
- 239000003446 ligand Substances 0.000 description 2
- 239000000314 lubricant Substances 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- 125000000250 methylamino group Chemical group [H]N(*)C([H])([H])[H] 0.000 description 2
- UXOUKMQIEVGVLY-UHFFFAOYSA-N morin Natural products OC1=CC(O)=CC(C2=C(C(=O)C3=C(O)C=C(O)C=C3O2)O)=C1 UXOUKMQIEVGVLY-UHFFFAOYSA-N 0.000 description 2
- 235000007708 morin Nutrition 0.000 description 2
- 239000002777 nucleoside Substances 0.000 description 2
- 150000004033 porphyrin derivatives Chemical class 0.000 description 2
- 239000002244 precipitate Substances 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 102000004169 proteins and genes Human genes 0.000 description 2
- 108090000623 proteins and genes Proteins 0.000 description 2
- 239000003419 rna directed dna polymerase inhibitor Substances 0.000 description 2
- 238000004904 shortening Methods 0.000 description 2
- 238000005063 solubilization Methods 0.000 description 2
- 230000007928 solubilization Effects 0.000 description 2
- 239000004094 surface-active agent Substances 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- 210000001519 tissue Anatomy 0.000 description 2
- 210000004881 tumor cell Anatomy 0.000 description 2
- AZKSAVLVSZKNRD-UHFFFAOYSA-M 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide Chemical compound [Br-].S1C(C)=C(C)N=C1[N+]1=NC(C=2C=CC=CC=2)=NN1C1=CC=CC=C1 AZKSAVLVSZKNRD-UHFFFAOYSA-M 0.000 description 1
- RAAXEFOWVKHGBT-UHFFFAOYSA-N 3-methyl-5-(pyridin-2-ylmethylidene)imidazol-4-one Chemical compound O=C1N(C)C=NC1=CC1=CC=CC=N1 RAAXEFOWVKHGBT-UHFFFAOYSA-N 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 208000011691 Burkitt lymphomas Diseases 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- JPVYNHNXODAKFH-UHFFFAOYSA-N Cu2+ Chemical compound [Cu+2] JPVYNHNXODAKFH-UHFFFAOYSA-N 0.000 description 1
- 108091081406 G-quadruplex Proteins 0.000 description 1
- 208000032612 Glial tumor Diseases 0.000 description 1
- 206010018338 Glioma Diseases 0.000 description 1
- 239000004705 High-molecular-weight polyethylene Substances 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- VEQPNABPJHWNSG-UHFFFAOYSA-N Nickel(2+) Chemical compound [Ni+2] VEQPNABPJHWNSG-UHFFFAOYSA-N 0.000 description 1
- 206010033128 Ovarian cancer Diseases 0.000 description 1
- 206010061535 Ovarian neoplasm Diseases 0.000 description 1
- 108091093037 Peptide nucleic acid Proteins 0.000 description 1
- 206010060862 Prostate cancer Diseases 0.000 description 1
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 1
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 description 1
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 1
- PTFCDOFLOPIGGS-UHFFFAOYSA-N Zinc dication Chemical compound [Zn+2] PTFCDOFLOPIGGS-UHFFFAOYSA-N 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 125000000748 anthracen-2-yl group Chemical group [H]C1=C([H])C([H])=C2C([H])=C3C([H])=C([*])C([H])=C([H])C3=C([H])C2=C1[H] 0.000 description 1
- 230000001093 anti-cancer Effects 0.000 description 1
- 238000011319 anticancer therapy Methods 0.000 description 1
- 239000002246 antineoplastic agent Substances 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 230000022131 cell cycle Effects 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 230000005770 chromosome separation Effects 0.000 description 1
- 239000010949 copper Substances 0.000 description 1
- 201000010099 disease Diseases 0.000 description 1
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 210000003527 eukaryotic cell Anatomy 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 239000000945 filler Substances 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- 210000005260 human cell Anatomy 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- MMIPFLVOWGHZQD-UHFFFAOYSA-N manganese(3+) Chemical compound [Mn+3] MMIPFLVOWGHZQD-UHFFFAOYSA-N 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 102000039446 nucleic acids Human genes 0.000 description 1
- 108020004707 nucleic acids Proteins 0.000 description 1
- 150000007523 nucleic acids Chemical class 0.000 description 1
- 125000003835 nucleoside group Chemical group 0.000 description 1
- 239000002773 nucleotide Substances 0.000 description 1
- 125000003729 nucleotide group Chemical group 0.000 description 1
- 238000011275 oncology therapy Methods 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 239000013110 organic ligand Substances 0.000 description 1
- 230000008520 organization Effects 0.000 description 1
- 210000001672 ovary Anatomy 0.000 description 1
- 239000008194 pharmaceutical composition Substances 0.000 description 1
- 150000003016 phosphoric acids Chemical class 0.000 description 1
- HRGDZIGMBDGFTC-UHFFFAOYSA-N platinum(2+) Chemical compound [Pt+2] HRGDZIGMBDGFTC-UHFFFAOYSA-N 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 229920002503 polyoxyethylene-polyoxypropylene Polymers 0.000 description 1
- 108090000765 processed proteins & peptides Proteins 0.000 description 1
- 230000002062 proliferating effect Effects 0.000 description 1
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000002829 reductive effect Effects 0.000 description 1
- 210000005132 reproductive cell Anatomy 0.000 description 1
- 230000001850 reproductive effect Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- 235000019333 sodium laurylsulphate Nutrition 0.000 description 1
- 230000003381 solubilizing effect Effects 0.000 description 1
- 210000001082 somatic cell Anatomy 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 210000000130 stem cell Anatomy 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 235000012222 talc Nutrition 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- RYYWUUFWQRZTIU-UHFFFAOYSA-K thiophosphate Chemical compound [O-]P([O-])([O-])=S RYYWUUFWQRZTIU-UHFFFAOYSA-K 0.000 description 1
- 238000011282 treatment Methods 0.000 description 1
- 230000001960 triggered effect Effects 0.000 description 1
- 239000001226 triphosphate Substances 0.000 description 1
- 235000011178 triphosphate Nutrition 0.000 description 1
- 210000003932 urinary bladder Anatomy 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/4164—1,3-Diazoles
- A61K31/4166—1,3-Diazoles having oxo groups directly attached to the heterocyclic ring, e.g. phenytoin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/28—Compounds containing heavy metals
- A61K31/30—Copper compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/08—Solutions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/19—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles lyophilised, i.e. freeze-dried, solutions or dispersions
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F1/00—Compounds containing elements of Groups 1 or 11 of the Periodic Table
- C07F1/08—Copper compounds
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Inorganic Chemistry (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
Description
Область техникиTechnical field
Изобретение относится к области органической и медицинской химии, молекулярной биологии и касается композиции, ингибирующей теломеразу, которая может быть использована для изучения теломераз и каталитических субъединиц теломераз, обратных транскриптаз, а также для изучения и лечения опухолевых и вирусных заболеваний.The invention relates to the field of organic and medical chemistry, molecular biology, and relates to a telomerase inhibiting composition that can be used to study telomerases and catalytic subunits of telomerases, reverse transcriptases, as well as to study and treat tumor and viral diseases.
Уровень техникиState of the art
Теломераза - это фермент, необходимый для компенсации укорочения длины теломер в клетках эукариот. Теломеры состоят из характерных тандемных повторов (например, TTAGGG у человека), найденных на концах большинства эукариотических хромосом (Blackburn, "Structure and Function of Telomeres,"Nature, 350: 569-573, 1991). Количество повторов определяет длину теломер. Пролиферативный потенциал клетки связывают с длиной теломер, так как стабильность и целостность эукариотических хромосом зависят от динамической структурной организации теломер (Baird DM. "Mechanisms of telomeric instability", Cytogenet Genome Res. 2008; 122(3-4): 308-14, 2009), при их укорочении меньше критической длины стабильность нарушается, затем клетка гибнет. Теломеры играют важную роль в контроле разделения хромосом и вовлечены в регулирование клеточного цикла. С каждым клеточным делением у соматической клетки теряются приблизительно 60-100 оснований с концов хромосом. Теломеры сокращаются, клетка, в конечном счете, достигает кризиса, и в клетке запускается апоптоз. В организме существуют клетки с неограниченным потенциалом деления. Именно в них (в половых, стволовых клетках, а также в клетках опухоли) существует процесс компенсации укорочения теломер. За этот процесс отвечает фермент-теломераза. Теломераза активна в таких клетках и поддерживает длину теломер выше кризисного уровня. Теломераза - это специализированная обратная транскриптаза (для человека hTERT), работающая в комплексе с собственной рибонуклеиновой кислотой (РНК). Эта РНК называется теломеразной (для человека hTERC) и содержит участок для синтеза теломерных повторов ДНК (матричный участок). Другими словами, для приобретения способности к неограниченному делению клетка должна активировать механизм, поддерживающий длину теломер выше критического уровня, а именно теломеразу. Так, существенный уровень теломеразной активности был обнаружен в более чем 85% опухолей (Kim et al. "Specific Association of Human Telomerase Activity with Immortal Cells and Cancer", Science, 266: 2011-2015, 1994). Теломеразная активность также присутствует в стволовых сумках нормальных тканей, но на более низком уровне (Morin, "Is Telomerase a Universal Cancer Target?", J. Natl. Cancer Inst., 87: 859-861, 1995). Таким образом, присутствие активной теломеразы в опухоли обеспечивает наличие мишени, дающей потенциально хорошую селективность к опухолевым клеткам по отношению к здоровой ткани. Ингибирование теломеразы было предложено в качестве нового подхода к терапии рака (первые работы Morin, "Is Telomerase a Universal Cancer Target?", J. Natl. Cancer Inst., 87: 859-861, 1995; Parkinson, "Do Telomerase Antagonists Represent a Novel Anti-Cancer Strategy?" Brit. J. Cancer, 73: 1-4, 1996; Raymond et al. "Agents that target telomerase and telomeres," Curr Opinion Biotech., 7: 583-591, 1996, более современное состояние в обзоре Shay JW, Wright WE. Telomerase therapeutics for cancer: challenges and new directions. Nat Rev Drug Discov. 5(7): 577-84, 2006).Telomerase is an enzyme necessary to compensate for the shortening of the telomere length in eukaryotic cells. Telomeres consist of characteristic tandem repeats (eg, human TTAGGG) found at the ends of most eukaryotic chromosomes (Blackburn, "Structure and Function of Telomeres," Nature, 350: 569-573, 1991). The number of repetitions determines the length of the telomeres. The proliferative potential of cells is associated with the length of telomeres, since the stability and integrity of eukaryotic chromosomes depends on the dynamic structural organization of telomeres (Baird DM. "Mechanisms of telomeric instability", Cytogenet Genome Res. 2008; 122 (3-4): 308-14, 2009 ), when they are shortened less than the critical length, stability is violated, then the cell dies. Telomeres play an important role in controlling chromosome separation and are involved in the regulation of the cell cycle. With each cell division in a somatic cell, approximately 60-100 bases from the ends of the chromosomes are lost. The telomeres contract, the cell eventually reaches a crisis, and apoptosis is triggered in the cell. In the body there are cells with unlimited division potential. It is in them (in the reproductive and stem cells, as well as in the tumor cells) that there is a process for compensating for telomere shortening. The telomerase enzyme is responsible for this process. Telomerase is active in such cells and maintains telomere lengths above the crisis level. Telomerase is a specialized reverse transcriptase (for humans, hTERT) that works in combination with its own ribonucleic acid (RNA). This RNA is called telomerase (for humans, hTERC) and contains a site for the synthesis of telomeric DNA repeats (template site). In other words, in order to acquire the ability for unlimited division, the cell must activate a mechanism that maintains the telomere length above a critical level, namely telomerase. Thus, a significant level of telomerase activity was detected in more than 85% of tumors (Kim et al. "Specific Association of Human Telomerase Activity with Immortal Cells and Cancer", Science, 266: 2011-2015, 1994). Telomerase activity is also present in stem bags of normal tissues, but at a lower level (Morin, "Is Telomerase a Universal Cancer Target?", J. Natl. Cancer Inst., 87: 859-861, 1995). Thus, the presence of active telomerase in a tumor provides a target that provides potentially good selectivity for tumor cells in relation to healthy tissue. Telomerase inhibition has been proposed as a new approach to cancer therapy (Morin's first work, "Is Telomerase a Universal Cancer Target?", J. Natl. Cancer Inst. 87: 859-861, 1995; Parkinson, "Do Telomerase Antagonists Represent a Novel Anti-Cancer Strategy? "Brit. J. Cancer, 73: 1-4, 1996; Raymond et al." Agents that target telomerase and telomeres, "Curr Opinion Biotech., 7: 583-591, 1996, more recent in a review by Shay JW, Wright WE. Telomerase therapeutics for cancer: challenges and new directions. Nat Rev Drug Discov. 5 (7): 577-84, 2006).
Третичная структура белка каталитической субъединицы теломеразы человека остается на настоящий момент неразрешенной, но на основе анализа первичной структуры показано, что этот белок сходен с другими обратными транскриптазами (Lingner et al. "Reverse Transcriptase Motifs in the Catalytic Subunit of Telomerase," Sci., 276: 561-567, 1997), поэтому ее активность подавляется при использовании ингибиторов обратных транскриптаз, например AZT (Strahl and Blackburn, "Effects of Reverse Transcriptase Inhibitors on Telomere Length and Telomerase Activity in Two Immortalized Human Cell Lines", Mol. Cell. Biol., 16; 53-65, 1996) и других нуклеозидов (Fletcher et al., "Human Telomerase Inhibition by 7-Deaza 2'-deoxypurine Nucleoside Triphosphates", Biochem, 35: 15611-15617, 1996). Также была показана возможность ингибирования любой теломеразной активности при использовании антисмысловой последовательности к матричному участку теломеразной РНК, например нуклеиновых кислот, слитых с пептидом (Norton et al. "Inhibition of Human Telomerase Activity by Peptide Nucleic Acids", Nature Biotechnol., 14: 615-619, 1996) и фосфотиоатных олигонуклеотидов (Mata et al. "A Hexameric Phosphorothioate Oligonucleotide Telomerase Inhibitor Arrests Growth of Burkitt's Lymphoma Cells in Vitro and in Vivo", Toxicol Appl. Pharmacol., 144: 189-197, 1997). Антисмысловый дезоксирибонуклеотид, содержащий 185 нуклеотидов hTERC, был в состоянии сократить теломеры в клетках HeLa за 23-26 клеточных делений до критического уровня и вызвал апоптоз. Другой дезоксирибонуклеотид, содержащий 2'-5'-аденилат (2-5А) с тем, чтобы не только связать, но и расщепить hTERC, вызвал апоптоз в глиоме, раке простаты, раке шейки матки, мочевого пузыря и яичников в течение 4-5 дней. Чтобы увеличить сродство к hTERC-последовательности и стабильность олигонуклеотида были использованы 2'-O-метил-РНК-олигонуклеотиды. Самым эффективным оказался олигонуклеотид GRN163 (Asai et al. A novel telomerase template antagonist (GRN163) as a potential anticancer agent. Cancer Research, 63: 3931-3939, 2003). Клетки, культивируемые с этим соединением, гибли в течение 100 дней, GRN163 ингибировал теломеразную активность при очень низких, по сравнению с другими олигонуклеотидами, концентрациях, GRN163L является первым ингибитором теломеразы, который вошел в клиническую практику. Доклинические исследования показали безопасность и эффективность такого ингибирования. Безопасность и определение дозы для пациентов, невосприимчивых к другой терапии, находятся в стадии изучения. Эти исследования не закончены (США, Clinical Trials. gov, NCT00310895), однако уже показанная эффективность GRN163L - однозначное подтверждение того, что ингибирование теломеразы - это основа антираковой терапии.The tertiary structure of the protein of the catalytic subunit of human telomerase remains currently unresolved, but based on the analysis of the primary structure, this protein has been shown to be similar to other reverse transcriptases (Lingner et al. "Reverse Transcriptase Motifs in the Catalytic Subunit of Telomerase," Sci., 276 : 561-567, 1997), therefore, its activity is suppressed when using reverse transcriptase inhibitors, for example AZT (Strahl and Blackburn, "Effects of Reverse Transcriptase Inhibitors on Telomere Length and Telomerase Activity in Two Immortalized Human Cell Lines", Mol. Cell. Biol ., 16; 53-65, 1996) and other nucleosides (Fletcher et al., "Human Telomerase Inhibition by 7-De aza 2'-deoxypurine Nucleoside Triphosphates ", Biochem, 35: 15611-15617, 1996). The possibility of inhibiting any telomerase activity using an antisense sequence to the telomerase RNA template region, for example, nucleic acids fused to a peptide (Norton et al. "Inhibition of Human Telomerase Activity by Peptide Nucleic Acids", Nature Biotechnol., 14: 615-, was also shown. 619, 1996) and phosphotioate oligonucleotides (Mata et al. "A Hexameric Phosphorothioate Oligonucleotide Telomerase Inhibitor Arrests Growth of Burkitt's Lymphoma Cells in Vitro and in Vivo", Toxicol Appl. Pharmacol., 144: 189-197, 1997). An antisense deoxyribonucleotide containing 185 hTERC nucleotides was able to reduce telomeres in HeLa cells from 23-26 cell divisions to a critical level and caused apoptosis. Another deoxyribonucleotide containing 2'-5'-adenylate (2-5A) in order to not only bind but also cleave hTERC caused apoptosis in glioma, prostate cancer, cancer of the cervix, bladder and ovaries for 4-5 days. To increase the affinity for the hTERC sequence and stability of the oligonucleotide, 2'-O-methyl-RNA oligonucleotides were used. The most effective oligonucleotide was GRN163 (Asai et al. A novel telomerase template antagonist (GRN163) as a potential anticancer agent. Cancer Research, 63: 3931-3939, 2003). Cells cultured with this compound died within 100 days, GRN163 inhibited telomerase activity at very low concentrations compared to other oligonucleotides, GRN163L is the first telomerase inhibitor to enter clinical practice. Preclinical studies have shown the safety and effectiveness of such inhibition. Safety and dose determination for patients immune to other therapy are under study. These studies are not complete (USA, Clinical Trials. Gov, NCT00310895), but the already shown efficacy of GRN163L is clear evidence that telomerase inhibition is the basis of anti-cancer therapy.
Из WO 99/01560 от 14.01.1999 (RU 2000102361, дата приоритета 01.07.1998) также известны ингибиторы теломеразной активности олигонуклеотидной природы.Inhibitors of oligonucleotide nature of telomerase activity are also known from WO 99/01560 dated 01/14/1999 (RU 2000102361, priority date 01/07/1998).
Известны примеры использования координационных соединений железа (III), цинка (II), никеля (II), марганца (III) и платины (II) (Monchaud et al. "A hitchhiker's guide to G-quadruplex ligands", Org. Biomol. Chem., 6, 627, 2008). Большинство координационных соединений содержит производные порфирина или конденсированные пиридиновые системы. Ингибирование теломеразы наблюдается при значениях IC50-TRAP (IC50 - концентрация ингибитора, при которой активность фермента подавляется на 50%) от 0,12 до 30 мкМ.Examples of the use of coordination compounds of iron (III), zinc (II), nickel (II), manganese (III) and platinum (II) are known (Monchaud et al. "A hitchhiker's guide to G-quadruplex ligands", Org. Biomol. Chem ., 6, 627, 2008). Most coordination compounds contain porphyrin derivatives or fused pyridine systems. Inhibition of telomerase is observed at IC 50 -TRAP values (IC 50 is the inhibitor concentration at which enzyme activity is suppressed by 50%) from 0.12 to 30 μM.
Известен ингибитор теломеразы, который представляет собой координационное соединение меди (II), содержащее лиганд на основе производного порфирина [S.Е. Evans, М.A. Mendez, K.В. Turner, L.R. Keating, R.Т. Grimes, S. Melchoir and V.A. Szalai, J. Biol. Inorg. Chem., 2007, 12(8), 1235-1249]. Это соединение селективно взаимодействует с квадруплексом ДНК, значение IC50-TRAP в экспериментах по ингибированию теломеразы составляет 26 мкМ. К недостаткам этого ингибитора теломеразы следует отнести сложность синтеза органического лиганда и координационного соединения, а также низкое значение IC50.A known telomerase inhibitor, which is a coordination compound of copper (II) containing a ligand based on a porphyrin derivative [S.E. Evans, M.A. Mendez, K.V. Turner, LR Keating, R.T. Grimes, S. Melchoir and VA Szalai, J. Biol. Inorg. Chem., 2007, 12 (8), 1235-1249]. This compound selectively interacts with the quadruplex of DNA; the IC 50 -TRAP value in the telomerase inhibition experiments is 26 μM. The disadvantages of this telomerase inhibitor include the complexity of the synthesis of the organic ligand and coordination compound, as well as the low IC 50 value.
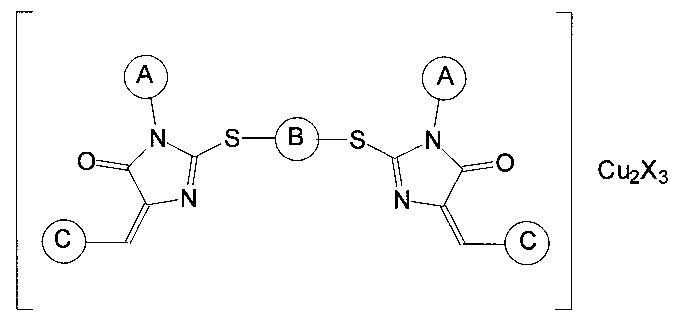
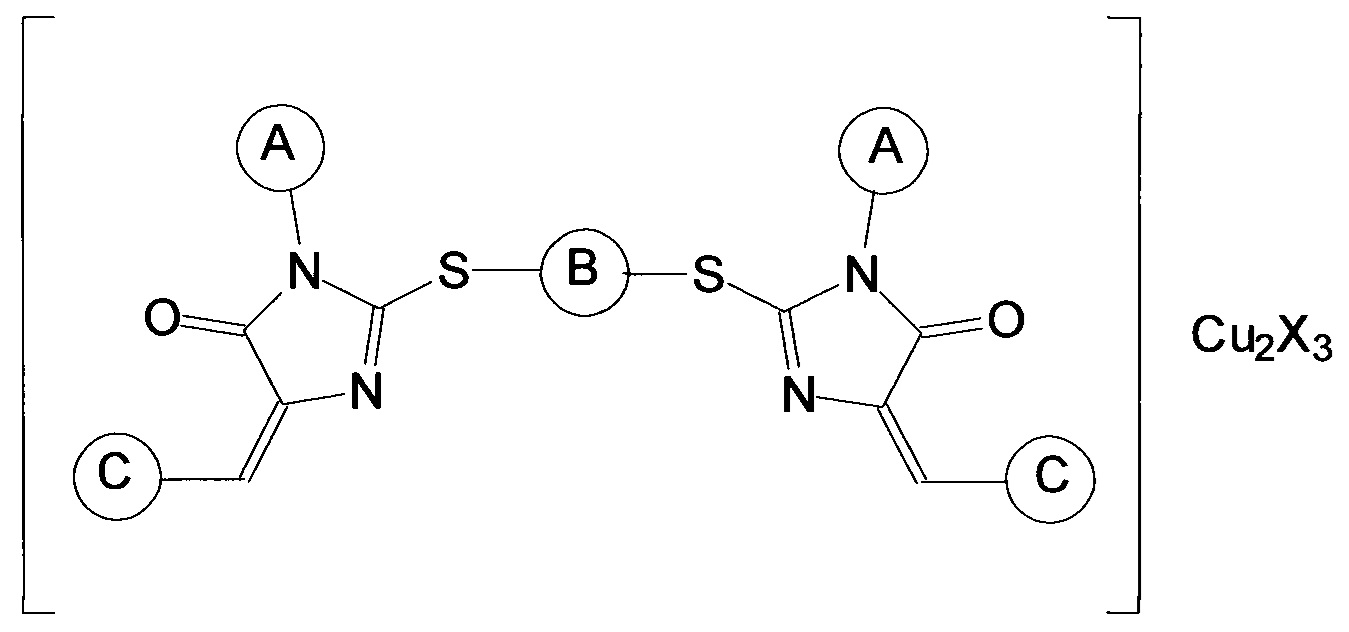
Наиболее близким аналогом изобретения является группа соединений, раскрытая в заявке на выдачу патента РФ №2010113946 от 09.04.2010, «Ингибиторы теломеразы и способ их получения», опубл. 20.10.2011 (патент №2468030), и включающая координационные соединения производных имидазол-4-она общей формулыThe closest analogue of the invention is the group of compounds disclosed in the application for the grant of a patent of the Russian Federation No.2010113946 dated 04/09/2010, "Telomerase inhibitors and the method for their preparation", publ. 10/20/2011 (patent No. 2468030), and including coordination compounds of imidazol-4-one derivatives of the general formula
где заместитель А выбран из группы, включающей арильные заместители, конденсированные арильные заместители, циклопентил, циклогексил, алифатические заместители, алифатические заместители с двойной связью, алифатические заместители с тройной связью, метиламиновый заместитель CH3NH-, карбэтокси-группу C2H5O(O)С-, пятичленные гетероциклические заместители с одним атомом азота, пятичленные гетероциклические заместители с двумя атомами азота, шестичленные гетероциклические заместители, заместитель В отсутствует или является алифатическим заместителем, заместитель С представляет собой гетероарильный заместитель, присоединяемый к производному имидазол-4-она через атом углерода и выбран из группы, включающей 5-членные ненасыщенные моноциклические гетероарильные заместители с 1, 2, 3 гетероатомами в цикле, выбранными из группы, включающей N, О и S, 6-членные ненасыщенные моноциклические гетероарильные заместители с 1, 2, 3 гетероатомами в цикле, выбранными из группы, включающей N, О и S, 8-, 9- и 10-членные ненасыщенные бициклические гетероарильные заместители с 1, 2, 3 гетероатомами в цикле, выбранными из группы, включающей N, О и S, X представляет собой хлорид Cl или нитрат NO3. Эти соединения обладают выраженным ингибирующим действием в отношении теломеразы, но их использование ограничивается низкой растворимостью в воде, что во многих случаях не позволяет достичь требуемой величины эффекта ингибирования.where Deputy A is selected from the group consisting of aryl substituents, fused aryl substituents, cyclopentyl, cyclohexyl, aliphatic substituents, double bond aliphatic substituents, triple bond aliphatic substituents, methylamine substituent CH 3 NH-, carbetoxy group C 2 H 5 O ( O) C-, five-membered heterocyclic substituents with one nitrogen atom, five-membered heterocyclic substituents with two nitrogen atoms, six-membered heterocyclic substituents, substituent B is absent or is aliphatic substituent, substituent C is a heteroaryl substituent attached to the imidazol-4-one derivative through a carbon atom and is selected from the group consisting of 5-membered unsaturated monocyclic heteroaryl substituents with 1, 2, 3 heteroatoms in the ring selected from the group consisting of N, O and S, 6-membered unsaturated monocyclic heteroaryl substituents with 1, 2, 3 heteroatoms in the ring selected from the group consisting of N, O and S, 8-, 9- and 10-membered unsaturated bicyclic heteroaryl substituents with 1, 2, 3 heteroatoms per cycle e, selected from the group consisting of N, O and S, X is a chloride or nitrate Cl 3 NO. These compounds have a pronounced inhibitory effect against telomerase, but their use is limited by low solubility in water, which in many cases does not allow to achieve the desired value of the inhibition effect.
Указанный недостаток известных ингибиторов теломеразы может быть преодолен при использовании композиции, ингибирующей теломеразу, более подробно описанной далее со ссылками на прилагаемые иллюстративные материалы.This disadvantage of known telomerase inhibitors can be overcome by using a telomerase inhibiting composition described in more detail below with reference to the accompanying illustrative materials.
Раскрытие изобретенияDisclosure of invention
Технический результат, достигаемый при использовании заявленных композиций, ингибирующих теломеразу, заключается в возможности достижения больших величин эффекта ингибирования теломеразы за счет увеличения растворимости координационных соединений производных имидазол-4-она.The technical result achieved when using the claimed compositions inhibiting telomerase, is the ability to achieve large values of the effect of inhibition of telomerase by increasing the solubility of the coordination compounds of imidazol-4-one derivatives.
Описание чертежейDescription of drawings
Фиг. 1 - структурные формулы заместителей А в производных имидазол-4-она, которые могут входить в состав заявленной композиции, ингибирующей теломеразу.FIG. 1 - structural formulas of substituents A in imidazol-4-one derivatives, which may be part of the claimed telomerase inhibiting composition.
Фиг. 2 - структурные формулы заместителей B в заявленных производных имидазол-4-она, которые могут входить в состав заявленной композиции, ингибирующей теломеразу.FIG. 2 - structural formulas of the substituents B in the claimed derivatives of imidazol-4-one, which may be part of the claimed composition, inhibiting telomerase.
Фиг. 3 - структурные формулы заместителей С в заявленных производных имидазол-4-она, которые могут входить в состав заявленной композиции, ингибирующей теломеразу.FIG. 3 - structural formulas of the substituents C in the claimed derivatives of imidazol-4-one, which may be part of the claimed composition inhibiting telomerase.
Раскрытие изобретенияDisclosure of invention
Согласно изобретению композиция, ингибирующая теломеразу (фармацевтическая композиция), включает по крайней мере один блок-сополимер полиоксиэтилена и полиоксипропилена, а также по крайней мере одно координационное соединение производного имидазол-4-она общей формулыAccording to the invention, the telomerase inhibitory composition (pharmaceutical composition) includes at least one polyoxyethylene-polyoxypropylene block copolymer as well as at least one coordination compound of an imidazole-4-one derivative of the general formula
где заместитель А выбран из группы, включающей арильные заместители, конденсированные арильные заместители, циклопентил, циклогексил, алифатические заместители, алифатические заместители с двойной связью, алифатические заместители с тройной связью, метиламиновый заместитель CH3NH-, карбэтокси-группу C2H5O(O)С-, пятичленные гетероциклические заместители с одним атомом азота, пятичленные гетероциклические заместители с двумя атомами азота, шестичленные гетероциклические заместители, заместитель В отсутствует или является алифатическим заместителем, заместитель С представляет собой гетероарильный заместитель, присоединяемый к производному имидазол-4-она через атом углерода, X представляет собой хлорид Cl или нитрат NO3.where Deputy A is selected from the group consisting of aryl substituents, fused aryl substituents, cyclopentyl, cyclohexyl, aliphatic substituents, double bond aliphatic substituents, triple bond aliphatic substituents, methylamine substituent CH 3 NH-, carbetoxy group C 2 H 5 O ( O) C-, five-membered heterocyclic substituents with one nitrogen atom, five-membered heterocyclic substituents with two nitrogen atoms, six-membered heterocyclic substituents, substituent B is absent or is aliphatic substituent, substituent C represents a heteroaryl substituent attached to the imidazol-4-one derivative through a carbon atom, X represents Cl chloride or NO 3 nitrate.
В предпочтительном варианте выполнения изобретения заместитель А является незамещенным, или монозамещенным, или дизамещенным арильным заместителем, при этом заместители R в арильной группе выбраны из группы, включающей галогены и алкильные заместители.In a preferred embodiment, substituent A is an unsubstituted or monosubstituted or disubstituted aryl substituent, wherein the R substituents in the aryl group are selected from the group consisting of halogens and alkyl substituents.
В предпочтительном варианте выполнения изобретения заместитель А является незамещенным, или монозамещенным, или дизамещенным конденсированным арильным заместителем, при этом заместители R в конденсированной арильной группе выбраны из группы, включающей галогены и алкильные заместители.In a preferred embodiment, substituent A is an unsubstituted or monosubstituted or disubstituted fused aryl substituent, wherein the R substituents in the fused aryl group are selected from the group consisting of halogens and alkyl substituents.
В предпочтительном варианте выполнения заместитель А выбран из группы, включающей фенил C6H5-, 3-хлор-4-фторфенил 3-Cl-4-F-С6Н3-, 4-карбэтоксифенил 4-C2H5O(O)СС6Н4-, метил СН3-, аллил СН2=СНСН2-, 2-антрил, пропил С3Н7- (фиг. 1).In a preferred embodiment, Deputy A is selected from the group consisting of phenyl C 6 H 5 -, 3-chloro-4-fluorophenyl 3-Cl-4-F-C 6 H 3 -, 4-carbethoxyphenyl 4-C 2 H 5 O ( O) SS 6 H 4 -, methyl CH 3 -, allyl CH 2 = CHCH 2 -, 2-anthryl, propyl C 3 H 7 - (Fig. 1).
В предпочтительном варианте выполнения заместитель В выбран из группы, включающей 1,2-этандиил -(СН2)2-, 1,3-пропандиил -(СН2)3-, 1,4-бутандиил -(СН2)4-, 1,6-гександиил -(СН2)6-, 1,10-декандиил -(СН2)10- (фиг. 2).In a preferred embodiment, Deputy B is selected from the group consisting of 1,2-ethanediyl - (CH 2 ) 2 -, 1,3-propanediyl - (CH 2 ) 3 -, 1,4-butanediyl - (CH 2 ) 4 -, 1,6-hexanediyl - (CH 2 ) 6 -, 1,10-decanediyl - (CH 2 ) 10 - (Fig. 2).
В предпочтительном варианте выполнения заместитель С выбран из группы, включающей 5-членные ненасыщенные моноциклические гетероарильные заместители с 1, 2, 3 гетероатомами в цикле, выбранными из группы, включающей N, О и S, 6-членные ненасыщенные моноциклические гетероарильные заместители с 1, 2, 3 гетероатомами в цикле, выбранными из группы, включающей N, О и S, 8-, 9- и 10-членные ненасыщенные бициклические гетероарильные заместители с 1, 2, 3 гетероатомами в цикле, выбранными из группы, включающей N, О и S.In a preferred embodiment, Deputy C is selected from the group consisting of 5-membered unsaturated monocyclic heteroaryl substituents with 1, 2, 3 heteroatoms in the ring selected from the group consisting of N, O and S, 6-membered unsaturated monocyclic
В предпочтительном варианте выполнения заместитель С выбран из группы, включающей 2-хинолил, 2-пиридил, 1-метил-2-имидазолил, 4-метил-5-имидазолил, 5-имидазолил, 2-имидазолил, 1,5-диметил-3-пиразолинил, 1,5-дифенил-3-пиразолинил (фиг. 3).In a preferred embodiment, Deputy C is selected from the group consisting of 2-quinolyl, 2-pyridyl, 1-methyl-2-imidazolyl, 4-methyl-5-imidazolyl, 5-imidazolyl, 2-imidazolyl, 1,5-dimethyl-3 -pyrazolinyl, 1,5-diphenyl-3-pyrazolinyl (Fig. 3).
В предпочтительном варианте выполнения изобретения координационное соединение производного имидазол-4-она в композиции содержится в количестве от 5 до 60 масс%., блок-сополимера - остальное.In a preferred embodiment, the coordination compound of the imidazol-4-one derivative in the composition is contained in an amount of from 5 to 60 wt.%, The rest of the block copolymer.
В предпочтительном варианте выполнения изобретения в блок-сополимере полиоксиэтилена и полиоксипропилена молярная масса гидрофобной части блок-сополимера составляет от 1500 г/моль до 36000 г/моль.In a preferred embodiment of the invention, in the block copolymer of polyoxyethylene and polyoxypropylene, the molar mass of the hydrophobic part of the block copolymer is from 1500 g / mol to 36000 g / mol.
В предпочтительном варианте выполнения изобретения в блок-сополимере полиоксиэтилена и полиоксипропилена содержание гидрофобной части блок-сополимера составляет от 50% по массе до 80% по массе.In a preferred embodiment of the invention, in the block copolymer of polyoxyethylene and polyoxypropylene, the content of the hydrophobic part of the block copolymer is from 50% by weight to 80% by weight.
В предпочтительном варианте выполнения изобретения блок-сополимер полиоксиэтилена и полиоксипропилена выбран из группы, включающей плюроники Р85, F108, F127, L101 и F68.In a preferred embodiment, the block copolymer of polyoxyethylene and polyoxypropylene is selected from the group consisting of pluronics P85, F108, F127, L101 and F68.
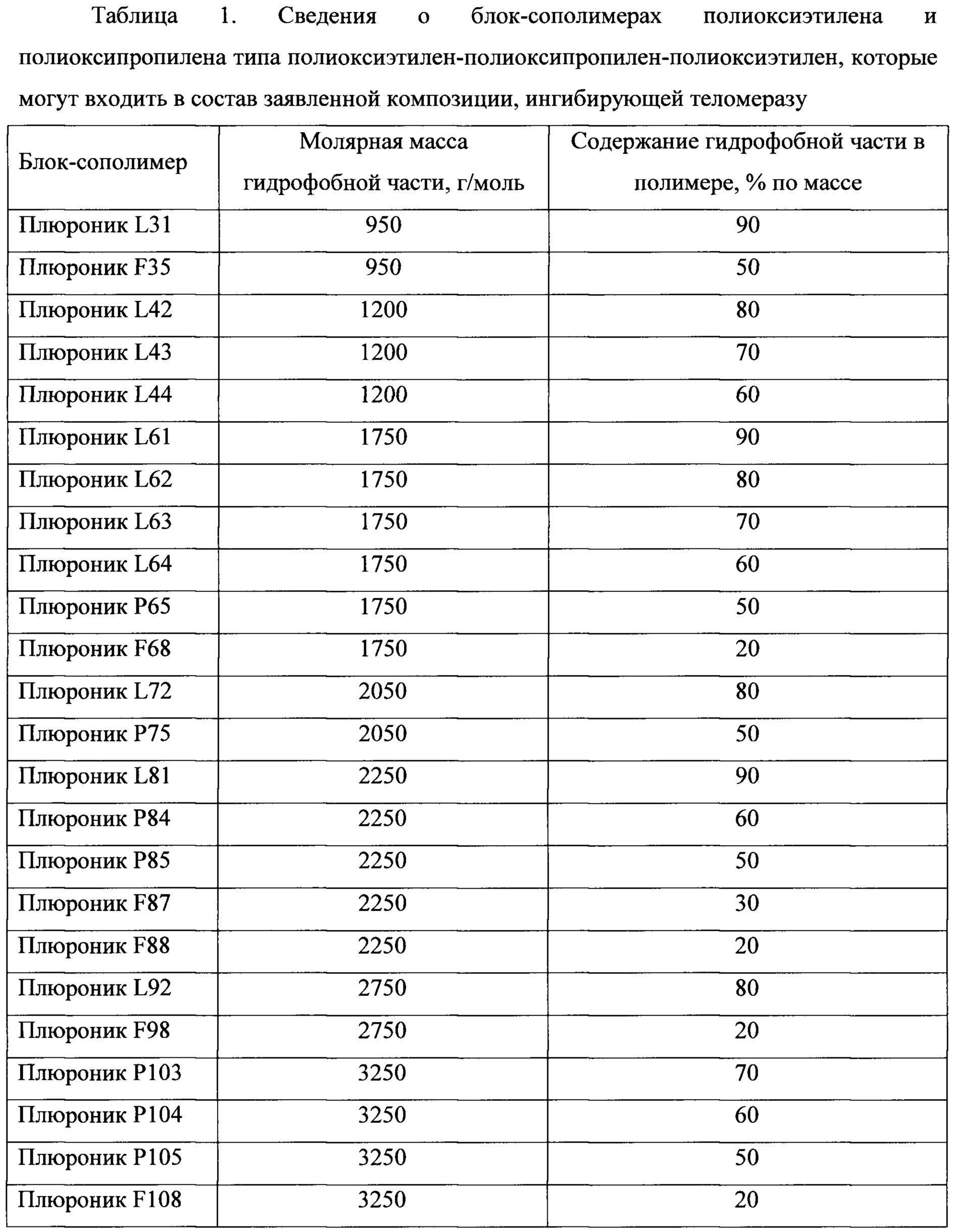
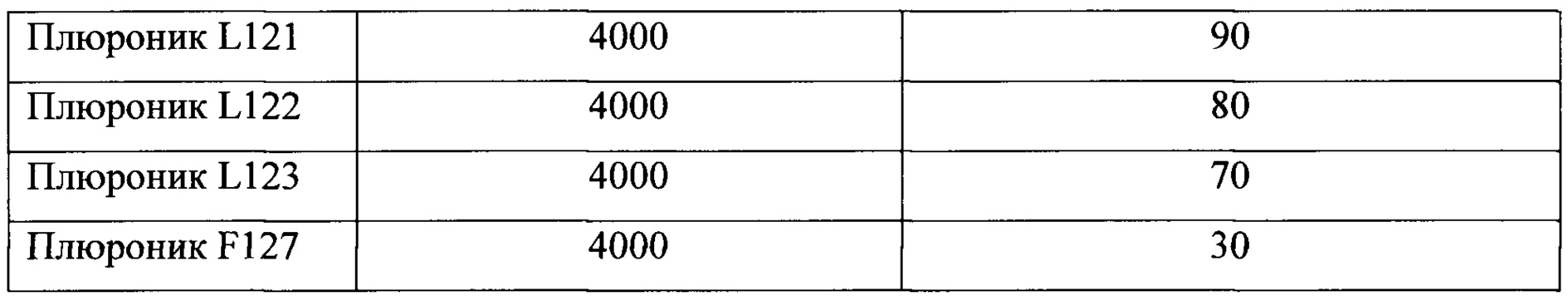
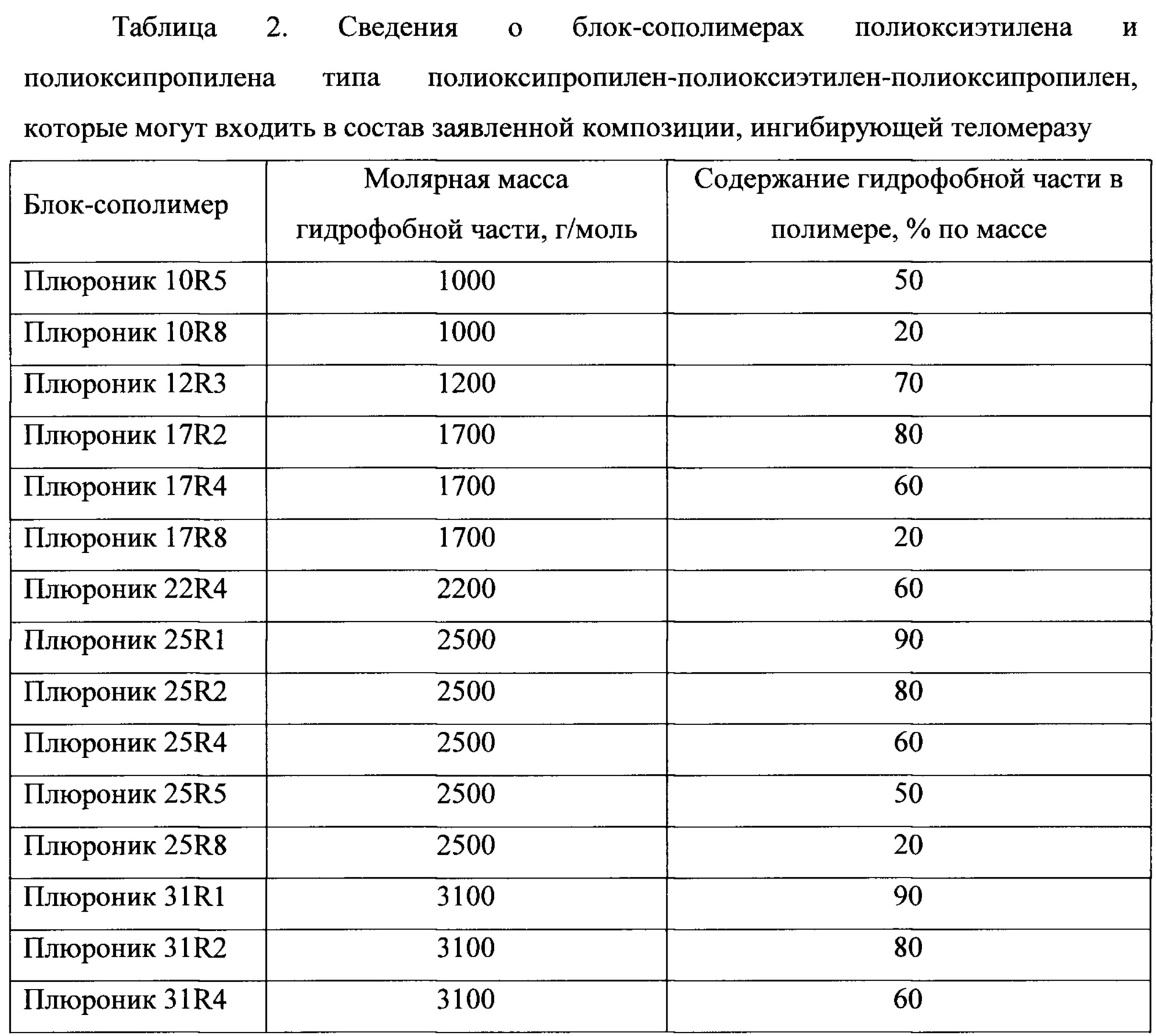
В таблице 1 и таблице 2 приведены сведения о блок-сополимерах полиоксиэтилена и полиоксипропилена, которые могут входить в состав заявленной композиции, ингибирующей теломеразу.Table 1 and table 2 provide information on block copolymers of polyoxyethylene and polyoxypropylene, which may be part of the claimed composition that inhibits telomerase.
В предпочтительном варианте выполнения изобретения композиция содержит от 2 до 50 мг/мл блок-сополимер полиоксиэтилена и полиоксипропилена.In a preferred embodiment, the composition comprises from 2 to 50 mg / ml block copolymer of polyoxyethylene and polyoxypropylene.
В предпочтительном варианте выполнения изобретения композиция содержит от 3 до 10 мг/мл координационного соединения производного имидазол-4-она.In a preferred embodiment, the composition comprises from 3 to 10 mg / ml of the coordination compound of the imidazol-4-one derivative.
В одном из вариантов выполнения изобретения композиция может быть представлена в виде водного раствора.In one embodiment of the invention, the composition may be presented in the form of an aqueous solution.
Изобретение относится также к сухой композиции, полученной из композиции, содержащей воду (водного раствора). В предпочтительном варианте выполнения изобретения сухая композиция получена методом лиофильной сушки. В предпочтительном варианте выполнения изобретения сухая композиция дополнительно содержит вспомогательные добавки, выбранные из группы, включающей наполнители, разрыхлители, смазывающие и скользящие вещества, эмульгаторы, подсластители, ароматизаторы. В предпочтительном варианте выполнения изобретения сухая композиция дополнительно содержит вспомогательные добавки, выбранные из группы, включающей лактозу, цитрат натрия, соли фосфорной кислоты, крахмал, стеарат магния, лаурилсульфат натрия, тальк, высокомолекулярный полиэтиленгликоль.The invention also relates to a dry composition obtained from a composition containing water (aqueous solution). In a preferred embodiment, the dry composition is obtained by freeze drying. In a preferred embodiment, the dry composition further comprises adjuvants selected from the group consisting of fillers, disintegrants, lubricants and lubricants, emulsifiers, sweeteners, flavorings. In a preferred embodiment of the invention, the dry composition further comprises auxiliary additives selected from the group consisting of lactose, sodium citrate, phosphoric acid salts, starch, magnesium stearate, sodium lauryl sulfate, talc, high molecular weight polyethylene glycol.
Из уровня техники известны приемы, позволяющие в ряде случаев повысить растворимость малорастворимых соединений за счет их солюбилизации в растворах поверхностно-активных веществ, например, как указано в патенте США №6227410 от 21.08.2001, блок-сополимеров полиоксиэтилена и полиоксипропилена - плюроников. Тем не менее, на основе информации, известной из уровня техники, без проведения дополнительных исследований нельзя определить, как изменится ингибирующая активность соединения при его солюбилизации.The prior art methods are known that in some cases can increase the solubility of sparingly soluble compounds due to their solubilization in solutions of surfactants, for example, as described in US patent No. 6227410 from 08.21.2001, block copolymers of polyoxyethylene and polyoxypropylene - pluronics. However, on the basis of information known from the prior art, without additional studies it is impossible to determine how the inhibitory activity of the compound will change upon solubilization.
Таким образом, влияние поверхностно-активных веществ на активность ингибиторов теломеразы, раскрытых в заявке на выдачу патента РФ №2010113946 от 09.04.2010, не является очевидным для специалиста в соответствующей области техники.Thus, the effect of surfactants on the activity of telomerase inhibitors disclosed in the application for the grant of a patent of the Russian Federation No.2010113946 dated 04/09/2010 is not obvious to a person skilled in the relevant field of technology.
При проведении экспериментальных исследований было найдено, что при солюбилизации ряда координационных соединений производных имидазол-4-она, обладающих ингибирующим действием в отношении теломеразы, в растворах блок-сополимеров полиоксиэтилена и полиоксипропилена - плюроников Р85, F108, F127, L101 и F68 - ингибирующая активность координационного соединения сохраняется, при этом за счет увеличения растворимости ингибитора становится возможным достижение больших величин эффекта ингибирования.During experimental studies, it was found that when solubilizing a number of coordination compounds of imidazol-4-one derivatives that have an inhibitory effect on telomerase in solutions of block copolymers of polyoxyethylene and polyoxypropylene - pluronics P85, F108, F127, L101 and F68 - the inhibitory activity of coordination the compound is retained, while by increasing the solubility of the inhibitor it becomes possible to achieve large values of the inhibition effect.
Изобретение иллюстрируется примерами альтернативных вариантов его выполнения.The invention is illustrated by examples of alternative embodiments.
Пример 1Example 1
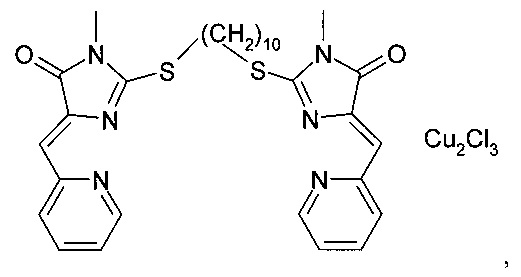
Композицию, ингибирующую теломеразу, готовили из комплекса (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-фенил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2 The telomerase inhibiting composition was prepared from the complex (5Z, 5'Z) -2,2 '- (ethane-1,2-diyldisulfanyldiyl) bis (5- (2-pyridylmethylene) -3-phenyl-3,5-dihydro 4H-imidazol-4-one) with CuCl 2
и блок-сополимера полиоксиэтилена и полиоксипропилена - плюроника Р85.and a block copolymer of polyoxyethylene and polyoxypropylene - Pluronic P85.
Получение композиции, ингибирующей теломеразу, осуществляли следующим образом.The preparation of a telomerase inhibiting composition was carried out as follows.
Раствор координационного соединения производного имидазол-4-она в ацетонитриле смешивали с раствором блок-сополимера полиоксиэтилена и полиоксипропилена в метаноле и полученную смесь упаривали, при этом получали сухую композицию, ингибирующую теломеразу. Пленку, образовавшуюся после удаления растворителя, растворяли в необходимом количестве воды с получением раствора солюбилизированного координационного соединения производного имидазол-4-она - композиции, ингибирующей теломеразу.A solution of the coordination compound of the imidazol-4-one derivative in acetonitrile was mixed with a solution of a block copolymer of polyoxyethylene and polyoxypropylene in methanol and the resulting mixture was evaporated, and a telomerase inhibitory dry composition was obtained. The film formed after removal of the solvent was dissolved in the required amount of water to obtain a solution of the solubilized coordination compound of the imidazol-4-one derivative, a telomerase inhibiting composition.
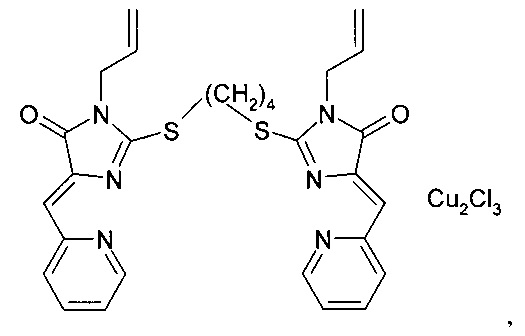
Экспериментально было определено, что в соответствии с этим способом можно получить растворы солюбилизированного комплекса (5Z, 5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-фенил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2 с содержанием координационного соединения производного имидазол-4-она 3 мг/мл при содержании блок-сополимера полиоксиэтилена и полиоксипропилена 30 мг/мл. Растворимость комплекса (5Z, 5'Z)-2,2'-(этан-1,2-диилдисульфанил-диил)бис(5-(2-пиридилметилен)-3-фенил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2 в воде составляет 0,6 мг/мл. Таким образом, введение в состав композиции, ингибирующей теломеразу, блок-сополимера полиоксиэтилена и полиоксипропилена приводит к увеличению растворимости комплекса (5Z, 5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-фенил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2 в 5 раз.It was experimentally determined that in accordance with this method it is possible to obtain solutions of the solubilized complex (5Z, 5'Z) -2,2 '- (ethane-1,2-diyldisulfanyldiyl) bis (5- (2-pyridylmethylene) -3-phenyl -3,5-dihydro-4H-imidazol-4-one) with CuCl 2 containing a coordination compound of the imidazol-4-one derivative of 3 mg / ml with a block copolymer of polyoxyethylene and polyoxypropylene 30 mg / ml. The solubility of the complex (5Z, 5'Z) -2,2 '- (ethane-1,2-diyldisulfanyl-diyl) bis (5- (2-pyridylmethylene) -3-phenyl-3,5-dihydro-4H-imidazole- 4-one) with CuCl 2 in water is 0.6 mg / ml. Thus, the introduction of a telomerase inhibiting composition, a block copolymer of polyoxyethylene and polyoxypropylene, leads to an increase in the solubility of the complex (5Z, 5'Z) -2,2 '- (ethane-1,2-diyldisulfanyldiyl) bis (5- (2 -pyridylmethylene) -3-phenyl-3,5-dihydro-4H-imidazol-4-one) with CuCl 2 5 times.
Активность композиции измеряли следующим образом.The activity of the composition was measured as follows.
Клетки (MCF-7) культивировали в течение 24 часов в жидкой культуральной среде перед определением активности композиции. Затем в культуру клеток добавляли определенное количество полученной композиции, ингибирующей теломеразу, и культивировали в течение 24 часов. Затем клетки отделяли от культуральной среды, помещали в жидкую культуральную среду, не содержащую композиции, ингибирующей теломеразу, и культивировали в течение 72 часов. Затем определяли количество живых клеток с использованием стандартной процедуры, основанной на восстановлении бромида 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия - реагента МТТ - клеточными ферментами до окрашенного нерастворимого формазана. Для этого клетки отделяли от культуральной среды, помещали в жидкую культуральную среду, содержащую реагент МТТ, и культивировали в течение 3 часов при 37°С. Затем культуральную среду отделяли от осадка формазана, осадок формазана растворяли в диметилсульфоксиде и измеряли оптическую плотность раствора при 562 нм с использованием прибора SpectraMax М5 производства «Molecular Devices». По предварительно построенному градуировочному графику определяли количество формазана в растворе, которое пропорционально количеству живых клеток. Уменьшение интенсивности размножения клеток после обработки клеточной культуры композицией, ингибирующей теломеразу, характеризует подавление активности теломеразы в клетках и, как следствие, ингибирующую активность композиции, ингибирующей теломеразу.Cells (MCF-7) were cultured for 24 hours in a liquid culture medium before determining the activity of the composition. Then, a certain amount of the obtained telomerase inhibiting composition was added to the cell culture and cultured for 24 hours. Then the cells were separated from the culture medium, placed in a liquid culture medium containing no telomerase inhibiting composition, and cultured for 72 hours. Then, the number of living cells was determined using a standard procedure based on the reduction of 3- (4,5-dimethylthiazol-2-yl) -2,5-diphenyltetrazolium bromide, MTT reagent, by cell enzymes to stained insoluble formazan. For this, the cells were separated from the culture medium, placed in a liquid culture medium containing MTT reagent, and cultured for 3 hours at 37 ° C. Then, the culture medium was separated from the formazan precipitate, the formazan precipitate was dissolved in dimethyl sulfoxide, and the optical density of the solution was measured at 562 nm using a SpectraMax M5 instrument manufactured by Molecular Devices. According to a previously constructed calibration schedule, the amount of formazan in the solution was determined, which is proportional to the number of living cells. A decrease in the intensity of cell reproduction after treatment of the cell culture with a telomerase inhibiting composition characterizes the suppression of telomerase activity in cells and, as a result, the inhibitory activity of the telomerase inhibiting composition.
Было определено, что интенсивность размножения клеток уменьшалась на 60% при обработке композицией, ингибирующей теломеразу, содержащей 3 мкг/мл комплекса (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-фенил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2. Такое же уменьшение интенсивности размножения клеток было зафиксировано при обработке клеток водным раствором комплекса (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-фенил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2 с концентрацией 3 мкг/мл, что свидетельствует о том, что присутствие блок-сополимера полиоксиэтилена и полиоксипропилена в композиции, ингибирующей теломеразу, не уменьшает ингибирующую активность координационного соединения производного имидазол-4-она.It was determined that the cell multiplication rate was reduced by 60% when treated with a telomerase inhibiting composition containing 3 μg / ml of the complex (5Z, 5'Z) -2,2 '- (ethane-1,2-diyldisulfanyldiyl) bis (5- (2-pyridylmethylene) -3-phenyl-3,5-dihydro-4H-imidazol-4-one) with CuCl 2 . The same decrease in the rate of cell multiplication was recorded when the cells were treated with an aqueous solution of the (5Z, 5'Z) -2,2 '- (ethane-1,2-diyldisulfanyldiyl) bis (5- (2-pyridylmethylene) -3-phenyl- 3,5-dihydro-4H-imidazol-4-one) with CuCl 2 at a concentration of 3 μg / ml, which indicates that the presence of a block copolymer of polyoxyethylene and polyoxypropylene in the telomerase inhibiting composition does not reduce the inhibitory activity of the coordination compound of the derivative imidazol-4-one.
Таким образом, экспериментально было показано, что при использовании заявленной композиции, ингибирующей теломеразу, ингибирующая активность координационного соединения производного имидазол-4-она сохраняется, при этом становится возможным использование композиций, ингибирующих теломеразу, с большим содержанием комплекса (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-фенил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2, что позволяет увеличить максимально достижимую величину эффекта ингибирования.Thus, it was experimentally shown that when using the claimed telomerase inhibiting composition, the inhibitory activity of the coordination compound of the imidazole-4-one derivative is retained, while it becomes possible to use telomerase inhibiting compositions with a high content of complex (5Z, 5'Z) - 2,2 '- (ethane-1,2-diyldisulfanyldiyl) bis (5- (2-pyridylmethylene) -3-phenyl-3,5-dihydro-4H-imidazol-4-one) with CuCl 2 , which allows to increase the maximum the achievable value of the inhibition effect.
Экспериментально было показано, что после удаления из композиции, ингибирующей теломеразу, растворителя методом лиофильной сушки и последующего растворения лиофилизованной композиции, ингибирующей теломеразу, в воде ингибирующая активность композиции, ингибирующей теломеразу, полностью сохраняется.It was experimentally shown that, after removal of the solvent from the telomerase inhibiting composition by freeze drying and subsequent dissolution of the lyophilized telomerase inhibiting composition, the water inhibiting activity of the telomerase inhibiting composition is completely retained.
Группа примеров 1Example Group 1
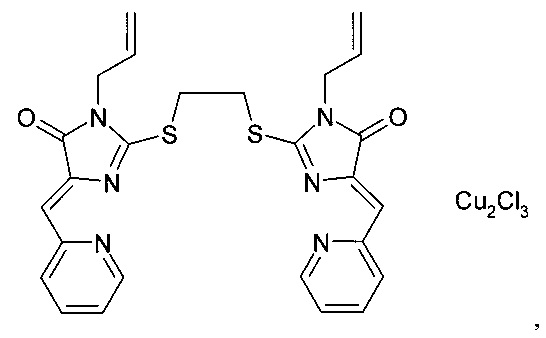
Композиции, ингибирующие теломеразу, готовили аналогично примеру 1, при этом в качестве координационных соединений производных имидазол-4-она использовали комплекс (5Z,5'Z)-2,2'-(декан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-метил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2 Compositions inhibiting telomerase were prepared analogously to Example 1, while the complex (5Z, 5'Z) -2,2 '- (decane-1,2-diyldisulfanyldiyl) bis (5- (2-pyridylmethylene) -3-methyl-3,5-dihydro-4H-imidazol-4-one) with CuCl 2
комплекс (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-аллил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2 complex (5Z, 5'Z) -2,2 '- (ethane-1,2-diyldisulfanyldiyl) bis (5- (2-pyridylmethylene) -3-allyl-3,5-dihydro-4H-imidazol-4-one ) with CuCl 2
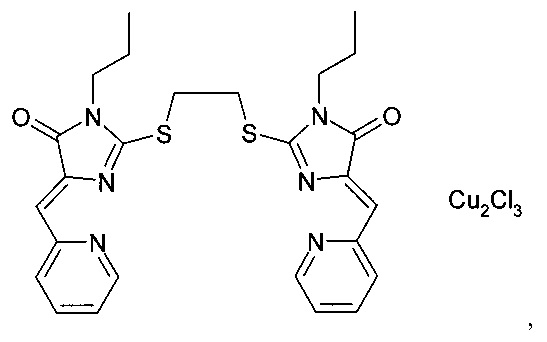
комплекс (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-пропил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2 complex (5Z, 5'Z) -2,2 '- (ethane-1,2-diyldisulfanyldiyl) bis (5- (2-pyridylmethylene) -3-propyl-3,5-dihydro-4H-imidazol-4-one ) with CuCl 2
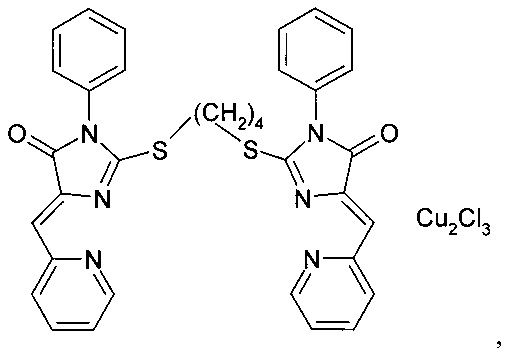
комплекс (5Z,5'Z)-2,2'-(бутан-1,4-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-фенил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2 complex (5Z, 5'Z) -2,2 '- (butane-1,4-diyldisulfanyldiyl) bis (5- (2-pyridylmethylene) -3-phenyl-3,5-dihydro-4H-imidazol-4-one ) with CuCl 2
комплекс (5Z,5'Z)-2,2'-(бутан-1,4-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-аллил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2 complex (5Z, 5'Z) -2,2 '- (butane-1,4-diyldisulfanyldiyl) bis (5- (2-pyridylmethylene) -3-allyl-3,5-dihydro-4H-imidazol-4-one ) with CuCl 2
комплекс (5Z, 5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-хинолилметилен)-3-пропил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2 complex (5Z, 5'Z) -2,2 '- (ethane-1,2-diyldisulfanyldiyl) bis (5- (2-quinolylmethylene) -3-propyl-3,5-dihydro-4H-imidazol-4-one ) with CuCl 2
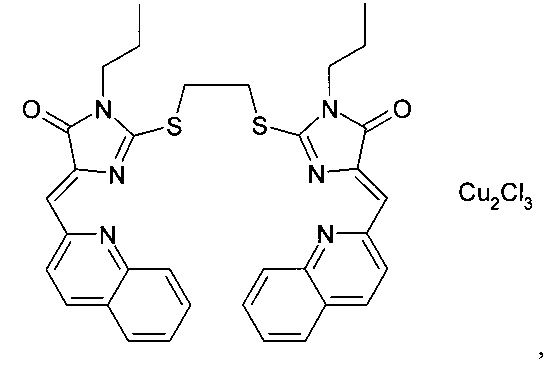
комплекс (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-метил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2, комплекс (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5 -(2-пиридилметилен)-3-циклопентил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2, комплекс (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-циклогексил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2, комплекс (5Z, 5'2)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-(бут-2-инил)-3,5-дигидро-4Н-имидазол-4-она) с CuCl2, комплекс (5Z, 5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-метиламино-3,5-дигидро-4Н-имидазол-4-она) с CuCl2, комплекс (5Z, 5'Z)-2,2'-(этан-l,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-карбэтокси-3,5-дигидро-4Н-имидазол-4-она) с CuCl2, комплекс (5Z, 5'Z)-2,2'-(этан-1,2-диилдисульфанил-диил)бис(5-(2-пиридилметилен)-3-(2-оксопирролидин-3-ил)-3,5-дигидро-4Н-имидазол-4-она) с CuCl2, комплекс (5Z, 5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-(1-метил-1Н-имидазол-2-ил)-3,5-дигидро-4Н-имидазол-4-она) с CuCl2, комплекс (5Z, 5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-(2-пиридил)-3,5-дигидро-4Н-имидазол-4-она) с CuCl2, комплекс (5Z, 5'Z)-2,2'-дисульфанилбис(5-(2-пиридилметилен)-3-метил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2, комплекс (5Z, 5'Z)-2,2'-(этан-1,2-диилдисульфанил-диил)бис(5-(1-метил-1Н-имидазол-2-илметилен)-3-метил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2, комплекс (5Z, 5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-метил-3,5-дигидро-4Н-имидазол-4-она) с Cu(NO3)2, при этом в качестве блок-сополимеров полиоксиэтилена и полиоксипропилена использовали плюроники Р85, F108, F127, L101, F68, при этом использовали такие количества блок-сополимеров полиоксиэтилена и полиоксипропилена и координационных соединений производных имидазол-4-она, чтобы в готовых композициях, ингибирующих теломеразу, содержание блок-сополимеров полиоксиэтилена и полиоксипропилена варьировалось в пределах от 2 до 50 мг/мл, а содержание координационных соединений производных имидазол-4-она варьировалось в пределах от 3 до 10 мг/мл, при этом молярная масса гидрофобной части блок-сополимера полиоксиэтилена и полиоксипропилена от 1500 г/моль до 36000 г/моль, при этом содержание гидрофобной части в блок-сополимере полиоксиэтилена и полиоксипропилена варьировалась от 50% по массе до 80% по массе.complex (5Z, 5'Z) -2,2 '- (ethane-1,2-diyldisulfanyldiyl) bis (5- (2-pyridylmethylene) -3-methyl-3,5-dihydro-4H-imidazol-4-one ) with CuCl 2 , complex (5Z, 5'Z) -2,2 '- (ethane-1,2-diyldisulfanyldiyl) bis (5 - (2-pyridylmethylene) -3-cyclopentyl-3,5-dihydro-4H- imidazol-4-one) with CuCl 2 , complex (5Z, 5'Z) -2,2 '- (ethane-1,2-diyldisulfanyldiyl) bis (5- (2-pyridylmethylene) -3-cyclohexyl-3,5 -dihydro-4H-imidazol-4-one) with CuCl 2 , complex (5Z, 5'2) -2,2 '- (ethane-1,2-diyldisulfanyldiyl) bis (5- (2-pyridylmethylene) -3- (but-2-ynyl) -3,5-dihydro-4H-imidazol-4-one) with CuCl 2 , complex (5Z, 5'Z) -2,2 '- (ethane-1,2-diyldisulfanyldiyl) bis (5- (2-pyridylmethylene) -3-methylamino-3,5-dig core-4H-imidazol-4-one), with CuCl 2 complex (5Z, 5'Z) -2,2 '- ( ethane-l, 2-diyldisulfanyldiyl) bis (5- (2-pyridylmethylene) -3-carbethoxy -3,5-dihydro-4H-imidazol-4-one) with CuCl 2 , complex (5Z, 5'Z) -2,2 '- (ethane-1,2-diyldisulfanyl-diyl) bis (5- (2 -pyridylmethylene) -3- (2-oxopyrrolidin-3-yl) -3,5-dihydro-4H-imidazol-4-one) with CuCl 2 , complex (5Z, 5'Z) -2,2 '- (ethane -1,2-diyldisulfanyldiyl) bis (5- (2-pyridylmethylene) -3- (1-methyl-1H-imidazol-2-yl) -3,5-dihydro-4H-imidazol-4-one) with CuCl 2 complex (5Z, 5'Z) -2,2 '- (ethane-1,2-diyldisulfanyldiyl) bis (5- (2-pyridylmethylene) -3- (2-pyridyl) -3,5-dihydro-4H- imidazol-4-one) with CuCl 2 , complex (5Z, 5'Z) -2,2'-disulfanylbis ( 5- (2-pyridylmethylene) -3-methyl-3,5-dihydro-4H-imidazol-4-one) with CuCl 2 , complex (5Z, 5'Z) -2,2 '- (ethane-1,2 -diyl disulfanyl-diyl) bis (5- (1-methyl-1H-imidazol-2-ylmethylene) -3-methyl-3,5-dihydro-4H-imidazol-4-one) with CuCl 2 , complex (5Z, 5 'Z) -2,2' - (ethane-1,2-diyldisulfanyldiyl) bis (5- (2-pyridylmethylene) -3-methyl-3,5-dihydro-4H-imidazol-4-one) with Cu (NO 3) 2, wherein as block copolymers of polyoxyethylene and polyoxypropylene used pluronics P85, F108, F127, L101, F68 , wherein used amount of such block copolymers of polyoxyethylene and polyoxypropylene derivatives of coordination compounds imidazol-4-one, so that in the finished telomerase-inhibiting compositions, the content of block copolymers of polyoxyethylene and polyoxypropylene varies from 2 to 50 mg / ml, and the content of coordination compounds of imidazole-4-one derivatives varies from 3 to 10 mg / ml, while the molar mass of the hydrophobic part of the block copolymer of polyoxyethylene and polyoxypropylene from 1500 g / mol to 36000 g / mol, while the content of the hydrophobic part in the block copolymer of polyoxyethylene and polyoxypropylene ranged from 50% by weight to 80% by weight .
Экспериментально было определено, что во всех случаях введение в состав композиций, ингибирующих теломеразу, блок-сополимеров полиоксиэтилена и полиоксипропилена приводит к увеличению растворимости координационных соединений производных имидазол-4-она в 3-10 раз.It was experimentally determined that in all cases, the introduction of telomerase inhibiting compositions of block copolymers of polyoxyethylene and polyoxypropylene leads to an increase in the solubility of coordination compounds of imidazole-4-one derivatives by 3-10 times.
Активность композиции измеряли аналогично примеру 1. Во всех случаях присутствие блок-сополимеров полиоксиэтилена и полиоксипропилена в композициях, ингибирующих теломеразу, не уменьшало ингибирующую активность координационных соединений производных имидазол-4-она.The activity of the composition was measured analogously to example 1. In all cases, the presence of block copolymers of polyoxyethylene and polyoxypropylene in telomerase inhibiting compositions did not reduce the inhibitory activity of the coordination compounds of imidazol-4-one derivatives.
Таким образом, экспериментально было показано, что при использовании заявленных композиций, ингибирующих теломеразу, ингибирующая активность координационных соединений производных имидазол-4-она сохраняется, при этом становится возможным использование композиций, ингибирующих теломеразу, с большим содержанием координационных соединений производных имидазол-4-она, что позволяет увеличить максимально достижимую величину эффекта ингибирования.Thus, it was experimentally shown that when using the claimed telomerase inhibiting compositions, the inhibitory activity of the coordination compounds of imidazol-4-one derivatives is retained, while it becomes possible to use telomerase inhibiting compositions with a high content of coordination compounds of imidazole-4-one derivatives, which allows to increase the maximum achievable value of the inhibition effect.
Экспериментально было показано, что после удаления из композиций, ингибирующих теломеразу, растворителя методом лиофильной сушки и последующего растворения лиофилизованных композиций, ингибирующих теломеразу, в воде ингибирующая активность композиций, ингибирующих теломеразу, полностью сохраняется.It was experimentally shown that, after removing the solvent from the telomerase inhibiting compositions by freeze drying and subsequent dissolution of the lyophilized telomerase inhibiting compositions, the inhibitory activity of the telomerase inhibiting compositions in water is completely preserved.
Таким образом, при использовании заявленных композиций, ингибирующих теломеразу, достигается технический результат, заключающийся в возможности достижения больших величин эффекта ингибирования теломеразы за счет увеличения растворимости координационных соединений производных имидазол-4-она.Thus, when using the claimed compositions inhibiting telomerase, a technical result is achieved consisting in the possibility of achieving large values of the effect of inhibition of telomerase by increasing the solubility of the coordination compounds of imidazol-4-one derivatives.
Claims (11)
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2014153863A RU2639819C2 (en) | 2014-12-30 | 2014-12-30 | Composition inhibiting telomerase |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2014153863A RU2639819C2 (en) | 2014-12-30 | 2014-12-30 | Composition inhibiting telomerase |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2014153863A RU2014153863A (en) | 2016-07-20 |
| RU2639819C2 true RU2639819C2 (en) | 2017-12-22 |
Family
ID=56413293
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2014153863A RU2639819C2 (en) | 2014-12-30 | 2014-12-30 | Composition inhibiting telomerase |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU2639819C2 (en) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2676279C1 (en) * | 2017-11-01 | 2018-12-27 | Общество с ограниченной ответственностью научно-технический центр "БиоКлиникум" (ООО НТЦ "БиоКлиникум") | Stable anti-tumor medicine, method for its preparation and application |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20040185110A1 (en) * | 2002-11-08 | 2004-09-23 | Ronald Harland | Formulations of low solubility bioactive agents and processes for making the same |
| WO2005065657A2 (en) * | 2003-12-31 | 2005-07-21 | Pfizer Products Inc. | Solid compositions of low-solubility drugs and poloxamers |
| WO2007128968A1 (en) * | 2006-04-07 | 2007-11-15 | Imperial Innovations Limited | Telomerase inhibitors |
| RU2468030C2 (en) * | 2010-04-09 | 2012-11-27 | Государственное учебно-научное учреждение Химический факультет Московского государственного университета им. М.В. Ломоносова | Telomerase inhibitors and method for production thereof |
-
2014
- 2014-12-30 RU RU2014153863A patent/RU2639819C2/en active
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20040185110A1 (en) * | 2002-11-08 | 2004-09-23 | Ronald Harland | Formulations of low solubility bioactive agents and processes for making the same |
| WO2005065657A2 (en) * | 2003-12-31 | 2005-07-21 | Pfizer Products Inc. | Solid compositions of low-solubility drugs and poloxamers |
| WO2007128968A1 (en) * | 2006-04-07 | 2007-11-15 | Imperial Innovations Limited | Telomerase inhibitors |
| RU2468030C2 (en) * | 2010-04-09 | 2012-11-27 | Государственное учебно-научное учреждение Химический факультет Московского государственного университета им. М.В. Ломоносова | Telomerase inhibitors and method for production thereof |
Non-Patent Citations (2)
| Title |
|---|
| EVANS S.E. et al. End-stacking of copper cationic porphyrins on parallel-stranded guanine quadruplexes. JBIC Journal of Biological Inorganic Chemistry, November 2007, Volume 12, Issue 8, pp/ 1235-1249, . * |
| EVANS S.E. et al. End-stacking of copper cationic porphyrins on parallel-stranded guanine quadruplexes. JBIC Journal of Biological Inorganic Chemistry, November 2007, Volume 12, Issue 8, pp/ 1235-1249, реферат. * |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2676279C1 (en) * | 2017-11-01 | 2018-12-27 | Общество с ограниченной ответственностью научно-технический центр "БиоКлиникум" (ООО НТЦ "БиоКлиникум") | Stable anti-tumor medicine, method for its preparation and application |
Also Published As
| Publication number | Publication date |
|---|---|
| RU2014153863A (en) | 2016-07-20 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Furet et al. | Discovery of NVP-BYL719 a potent and selective phosphatidylinositol-3 kinase alpha inhibitor selected for clinical evaluation | |
| CN101678107A (en) | Drug combinations for the treatment of duchenne muscular dystrophy | |
| ES2545516T3 (en) | Inhibitors of pyrimidine gyrase and topoisomerase IV | |
| ZA200404923B (en) | Substituted quinazoline derivatives as inhibitors of aurora kinases | |
| MA28429B1 (en) | Derivatives of 1H-thieno [2,3-c] pyrazole useful as kinase inhibitors | |
| JP2021517116A (en) | Combination therapy | |
| MA28064A1 (en) | Pyrrolo [3,4-c] pyrazole derivatives active as kinase inhibitors | |
| TW201443049A (en) | Heteroaromatic compounds as PI3 kinase modulators and methods of use | |
| TW202023563A (en) | Novel quinazoline egfr inhibitors | |
| AU2018309739A1 (en) | Compounds, Compositions, and Methods for Treating T-cell Acute Lymphoblastic Leukemia | |
| JP2007506787A5 (en) | ||
| US20160229857A1 (en) | Substituted pyrrolo[2,3-d]dipyrimidines for selectively targeting tumor cells with fr-alpha and fr-beta type receptors | |
| RU2639819C2 (en) | Composition inhibiting telomerase | |
| AU2019321432A1 (en) | Treatment of B cell malignancies | |
| TWI324929B (en) | Antitumor effect potentiator, antitumor preparation, and method for treating cancer | |
| ES2266497T3 (en) | CAK INHIBITORS AND USES OF THE SAME. | |
| CN108367016B (en) | A3 adenosine receptor ligands for the treatment of ectopic fat accumulation | |
| WO2003051906A2 (en) | Compounds and methods | |
| US20190255063A1 (en) | Combination of pi3k-inhibitors | |
| CN107698639A (en) | The weary oxygen activation prodrug of N formic acid esters of a kind of gemcitabine phosphate and its application | |
| JP2010254656A (en) | Scca-1 production inhibitor including carboxamide derivative and/or its salt as active ingredient | |
| WO2018215282A1 (en) | Combination of bub1 and pi3k inhibitors | |
| JP2014534227A5 (en) | ||
| RU2468030C2 (en) | Telomerase inhibitors and method for production thereof | |
| US20210220331A1 (en) | Inhibitors of ires-mediated protein synthesis |