RU2607965C1 - Liquid dosage form of fenspiride and production method thereof - Google Patents
Liquid dosage form of fenspiride and production method thereof Download PDFInfo
- Publication number
- RU2607965C1 RU2607965C1 RU2015136347A RU2015136347A RU2607965C1 RU 2607965 C1 RU2607965 C1 RU 2607965C1 RU 2015136347 A RU2015136347 A RU 2015136347A RU 2015136347 A RU2015136347 A RU 2015136347A RU 2607965 C1 RU2607965 C1 RU 2607965C1
- Authority
- RU
- Russia
- Prior art keywords
- fenspiride
- syrup
- drug
- fenspiride hydrochloride
- weighed
- Prior art date
Links
- 239000008297 liquid dosage form Substances 0.000 title claims abstract description 11
- FVNFBBAOMBJTST-UHFFFAOYSA-N 8-(2-phenylethyl)-1-oxa-3,8-diazaspiro[4.5]decan-2-one Chemical compound O1C(=O)NCC11CCN(CCC=2C=CC=CC=2)CC1 FVNFBBAOMBJTST-UHFFFAOYSA-N 0.000 title description 26
- 229960002912 fenspiride Drugs 0.000 title description 24
- 238000004519 manufacturing process Methods 0.000 title description 5
- 239000006188 syrup Substances 0.000 claims abstract description 74
- 235000020357 syrup Nutrition 0.000 claims abstract description 74
- FIKFLLIUPUVONI-UHFFFAOYSA-N 8-(2-phenylethyl)-1-oxa-3,8-diazaspiro[4.5]decan-2-one;hydrochloride Chemical compound Cl.O1C(=O)NCC11CCN(CCC=2C=CC=CC=2)CC1 FIKFLLIUPUVONI-UHFFFAOYSA-N 0.000 claims abstract description 28
- 229960000695 fenspiride hydrochloride Drugs 0.000 claims abstract description 28
- 239000000796 flavoring agent Substances 0.000 claims abstract description 23
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 claims abstract description 20
- 239000000600 sorbitol Substances 0.000 claims abstract description 20
- 235000010356 sorbitol Nutrition 0.000 claims abstract description 20
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 claims abstract description 16
- 239000000126 substance Substances 0.000 claims abstract description 16
- 239000007788 liquid Substances 0.000 claims abstract description 15
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims abstract description 15
- 239000001509 sodium citrate Substances 0.000 claims abstract description 11
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 claims abstract description 11
- YASYEJJMZJALEJ-UHFFFAOYSA-N Citric acid monohydrate Chemical compound O.OC(=O)CC(O)(C(O)=O)CC(O)=O YASYEJJMZJALEJ-UHFFFAOYSA-N 0.000 claims abstract description 10
- 229960002303 citric acid monohydrate Drugs 0.000 claims abstract description 10
- 235000012907 honey Nutrition 0.000 claims abstract description 10
- 239000008213 purified water Substances 0.000 claims abstract description 10
- CHHHXKFHOYLYRE-UHFFFAOYSA-M 2,4-Hexadienoic acid, potassium salt (1:1), (2E,4E)- Chemical compound [K+].CC=CC=CC([O-])=O CHHHXKFHOYLYRE-UHFFFAOYSA-M 0.000 claims abstract description 8
- 239000004302 potassium sorbate Substances 0.000 claims abstract description 8
- 235000010241 potassium sorbate Nutrition 0.000 claims abstract description 8
- 229940069338 potassium sorbate Drugs 0.000 claims abstract description 8
- 235000010232 propyl p-hydroxybenzoate Nutrition 0.000 claims abstract description 8
- 239000004405 propyl p-hydroxybenzoate Substances 0.000 claims abstract description 8
- QELSKZZBTMNZEB-UHFFFAOYSA-N propylparaben Chemical compound CCCOC(=O)C1=CC=C(O)C=C1 QELSKZZBTMNZEB-UHFFFAOYSA-N 0.000 claims abstract description 8
- 235000011187 glycerol Nutrition 0.000 claims abstract description 7
- 235000010270 methyl p-hydroxybenzoate Nutrition 0.000 claims abstract description 7
- 239000004292 methyl p-hydroxybenzoate Substances 0.000 claims abstract description 7
- 229960002216 methylparaben Drugs 0.000 claims abstract description 7
- CVHZOJJKTDOEJC-UHFFFAOYSA-N saccharin Chemical compound C1=CC=C2C(=O)NS(=O)(=O)C2=C1 CVHZOJJKTDOEJC-UHFFFAOYSA-N 0.000 claims abstract description 7
- 239000000901 saccharin and its Na,K and Ca salt Substances 0.000 claims abstract description 7
- LXCFILQKKLGQFO-UHFFFAOYSA-N methylparaben Chemical compound COC(=O)C1=CC=C(O)C=C1 LXCFILQKKLGQFO-UHFFFAOYSA-N 0.000 claims abstract description 6
- 239000004173 sunset yellow FCF Substances 0.000 claims abstract description 4
- 239000000203 mixture Substances 0.000 claims description 42
- 238000002360 preparation method Methods 0.000 claims description 32
- 235000019634 flavors Nutrition 0.000 claims description 13
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 9
- OIQPTROHQCGFEF-UHFFFAOYSA-L chembl1371409 Chemical compound [Na+].[Na+].OC1=CC=C2C=C(S([O-])(=O)=O)C=CC2=C1N=NC1=CC=C(S([O-])(=O)=O)C=C1 OIQPTROHQCGFEF-UHFFFAOYSA-L 0.000 claims description 7
- 239000013543 active substance Substances 0.000 claims description 5
- 238000004090 dissolution Methods 0.000 claims description 3
- 239000008369 fruit flavor Substances 0.000 claims description 3
- 239000003814 drug Substances 0.000 abstract description 68
- 229940079593 drug Drugs 0.000 abstract description 67
- 229930006000 Sucrose Natural products 0.000 abstract description 19
- 239000005720 sucrose Substances 0.000 abstract description 19
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 abstract description 16
- 235000013355 food flavoring agent Nutrition 0.000 abstract description 10
- 239000002552 dosage form Substances 0.000 abstract description 8
- 235000013399 edible fruits Nutrition 0.000 abstract description 5
- 230000007774 longterm Effects 0.000 abstract description 5
- 230000000694 effects Effects 0.000 abstract description 2
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 abstract 1
- 239000004615 ingredient Substances 0.000 abstract 1
- 238000002483 medication Methods 0.000 abstract 1
- 229960001790 sodium citrate Drugs 0.000 abstract 1
- 235000011083 sodium citrates Nutrition 0.000 abstract 1
- 239000000872 buffer Substances 0.000 description 9
- 238000011161 development Methods 0.000 description 9
- 238000003860 storage Methods 0.000 description 8
- 201000010099 disease Diseases 0.000 description 7
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 7
- 239000000243 solution Substances 0.000 description 7
- 230000001154 acute effect Effects 0.000 description 6
- 210000002345 respiratory system Anatomy 0.000 description 6
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 5
- 206010057190 Respiratory tract infections Diseases 0.000 description 5
- 230000000845 anti-microbial effect Effects 0.000 description 5
- 206010006451 bronchitis Diseases 0.000 description 5
- 230000007423 decrease Effects 0.000 description 5
- 239000003755 preservative agent Substances 0.000 description 5
- 230000001225 therapeutic effect Effects 0.000 description 5
- 239000001649 glycyrrhiza glabra l. absolute Substances 0.000 description 4
- 230000036541 health Effects 0.000 description 4
- 235000020725 licorice root extract Nutrition 0.000 description 4
- 229940051810 licorice root extract Drugs 0.000 description 4
- 238000011160 research Methods 0.000 description 4
- 239000002904 solvent Substances 0.000 description 4
- 239000003765 sweetening agent Substances 0.000 description 4
- 238000012360 testing method Methods 0.000 description 4
- 239000002562 thickening agent Substances 0.000 description 4
- 208000006545 Chronic Obstructive Pulmonary Disease Diseases 0.000 description 3
- 235000009499 Vanilla fragrans Nutrition 0.000 description 3
- 244000263375 Vanilla tahitensis Species 0.000 description 3
- 235000012036 Vanilla tahitensis Nutrition 0.000 description 3
- 238000004458 analytical method Methods 0.000 description 3
- 239000002260 anti-inflammatory agent Substances 0.000 description 3
- 229940124599 anti-inflammatory drug Drugs 0.000 description 3
- 239000008280 blood Substances 0.000 description 3
- 210000004369 blood Anatomy 0.000 description 3
- 239000006172 buffering agent Substances 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 230000000052 comparative effect Effects 0.000 description 3
- 229960001340 histamine Drugs 0.000 description 3
- 230000002906 microbiologic effect Effects 0.000 description 3
- 210000000056 organ Anatomy 0.000 description 3
- 230000001105 regulatory effect Effects 0.000 description 3
- 208000023504 respiratory system disease Diseases 0.000 description 3
- 235000019204 saccharin Nutrition 0.000 description 3
- 229940081974 saccharin Drugs 0.000 description 3
- 238000002560 therapeutic procedure Methods 0.000 description 3
- 230000009974 thixotropic effect Effects 0.000 description 3
- 229940098465 tincture Drugs 0.000 description 3
- 206010006440 Bronchial obstruction Diseases 0.000 description 2
- NTYJJOPFIAHURM-UHFFFAOYSA-N Histamine Chemical compound NCCC1=CN=CN1 NTYJJOPFIAHURM-UHFFFAOYSA-N 0.000 description 2
- 206010061218 Inflammation Diseases 0.000 description 2
- 206010046306 Upper respiratory tract infection Diseases 0.000 description 2
- 238000010521 absorption reaction Methods 0.000 description 2
- 229940125715 antihistaminic agent Drugs 0.000 description 2
- 239000000739 antihistaminic agent Substances 0.000 description 2
- 208000006673 asthma Diseases 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 2
- 230000001684 chronic effect Effects 0.000 description 2
- 239000013078 crystal Substances 0.000 description 2
- 206010012601 diabetes mellitus Diseases 0.000 description 2
- 235000003599 food sweetener Nutrition 0.000 description 2
- 239000003205 fragrance Substances 0.000 description 2
- 230000008014 freezing Effects 0.000 description 2
- 238000007710 freezing Methods 0.000 description 2
- 230000004054 inflammatory process Effects 0.000 description 2
- 208000030603 inherited susceptibility to asthma Diseases 0.000 description 2
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 2
- 235000019671 masking sweet taste Nutrition 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- 229940126601 medicinal product Drugs 0.000 description 2
- 230000003204 osmotic effect Effects 0.000 description 2
- 230000000306 recurrent effect Effects 0.000 description 2
- 208000020029 respiratory tract infectious disease Diseases 0.000 description 2
- QZAYGJVTTNCVMB-UHFFFAOYSA-N serotonin Chemical compound C1=C(O)C=C2C(CCN)=CNC2=C1 QZAYGJVTTNCVMB-UHFFFAOYSA-N 0.000 description 2
- 238000012430 stability testing Methods 0.000 description 2
- 235000021092 sugar substitutes Nutrition 0.000 description 2
- 230000009747 swallowing Effects 0.000 description 2
- 208000024891 symptom Diseases 0.000 description 2
- 230000003612 virological effect Effects 0.000 description 2
- ZIIUUSVHCHPIQD-UHFFFAOYSA-N 2,4,6-trimethyl-N-[3-(trifluoromethyl)phenyl]benzenesulfonamide Chemical compound CC1=CC(C)=CC(C)=C1S(=O)(=O)NC1=CC=CC(C(F)(F)F)=C1 ZIIUUSVHCHPIQD-UHFFFAOYSA-N 0.000 description 1
- 125000000094 2-phenylethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])([H])* 0.000 description 1
- 208000035143 Bacterial infection Diseases 0.000 description 1
- 101800004538 Bradykinin Proteins 0.000 description 1
- 208000009079 Bronchial Spasm Diseases 0.000 description 1
- 208000014181 Bronchial disease Diseases 0.000 description 1
- 206010006458 Bronchitis chronic Diseases 0.000 description 1
- 206010006482 Bronchospasm Diseases 0.000 description 1
- 208000024172 Cardiovascular disease Diseases 0.000 description 1
- 229920000298 Cellophane Polymers 0.000 description 1
- 208000014085 Chronic respiratory disease Diseases 0.000 description 1
- 206010011224 Cough Diseases 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- 208000019505 Deglutition disease Diseases 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 229920002527 Glycogen Polymers 0.000 description 1
- QXZGBUJJYSLZLT-UHFFFAOYSA-N H-Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg-OH Natural products NC(N)=NCCCC(N)C(=O)N1CCCC1C(=O)N1C(C(=O)NCC(=O)NC(CC=2C=CC=CC=2)C(=O)NC(CO)C(=O)N2C(CCC2)C(=O)NC(CC=2C=CC=CC=2)C(=O)NC(CCCN=C(N)N)C(O)=O)CCC1 QXZGBUJJYSLZLT-UHFFFAOYSA-N 0.000 description 1
- 102000000543 Histamine Receptors Human genes 0.000 description 1
- 206010020751 Hypersensitivity Diseases 0.000 description 1
- 102000004877 Insulin Human genes 0.000 description 1
- 108090001061 Insulin Proteins 0.000 description 1
- 208000022120 Jeavons syndrome Diseases 0.000 description 1
- 102100035792 Kininogen-1 Human genes 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 241000867418 Morion Species 0.000 description 1
- 229910002651 NO3 Inorganic materials 0.000 description 1
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 1
- 201000007100 Pharyngitis Diseases 0.000 description 1
- 102000015439 Phospholipases Human genes 0.000 description 1
- 108010064785 Phospholipases Proteins 0.000 description 1
- 206010035664 Pneumonia Diseases 0.000 description 1
- 206010062106 Respiratory tract infection viral Diseases 0.000 description 1
- 241001574948 Sereda Species 0.000 description 1
- 206010052428 Wound Diseases 0.000 description 1
- 208000027418 Wounds and injury Diseases 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 230000007815 allergy Effects 0.000 description 1
- 102000030619 alpha-1 Adrenergic Receptor Human genes 0.000 description 1
- 108020004102 alpha-1 Adrenergic Receptor Proteins 0.000 description 1
- 238000012443 analytical study Methods 0.000 description 1
- 230000008485 antagonism Effects 0.000 description 1
- 230000000844 anti-bacterial effect Effects 0.000 description 1
- 230000002322 anti-exudative effect Effects 0.000 description 1
- 230000003110 anti-inflammatory effect Effects 0.000 description 1
- 238000011861 anti-inflammatory therapy Methods 0.000 description 1
- 239000004599 antimicrobial Substances 0.000 description 1
- 208000022362 bacterial infectious disease Diseases 0.000 description 1
- 230000003115 biocidal effect Effects 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- QXZGBUJJYSLZLT-FDISYFBBSA-N bradykinin Chemical compound NC(=N)NCCC[C@H](N)C(=O)N1CCC[C@H]1C(=O)N1[C@H](C(=O)NCC(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)N[C@@H](CO)C(=O)N2[C@@H](CCC2)C(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)CCC1 QXZGBUJJYSLZLT-FDISYFBBSA-N 0.000 description 1
- 229940124630 bronchodilator Drugs 0.000 description 1
- 239000000168 bronchodilator agent Substances 0.000 description 1
- 230000001013 cariogenic effect Effects 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 208000007451 chronic bronchitis Diseases 0.000 description 1
- 239000007979 citrate buffer Substances 0.000 description 1
- 229960004106 citric acid Drugs 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 210000003298 dental enamel Anatomy 0.000 description 1
- 230000001066 destructive effect Effects 0.000 description 1
- 238000000502 dialysis Methods 0.000 description 1
- 229940126534 drug product Drugs 0.000 description 1
- 229940088679 drug related substance Drugs 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 239000002389 essential drug Substances 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 230000005713 exacerbation Effects 0.000 description 1
- 230000007717 exclusion Effects 0.000 description 1
- 239000003172 expectorant agent Substances 0.000 description 1
- 238000013401 experimental design Methods 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 239000007941 film coated tablet Substances 0.000 description 1
- 210000001035 gastrointestinal tract Anatomy 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 229940096919 glycogen Drugs 0.000 description 1
- 238000011194 good manufacturing practice Methods 0.000 description 1
- 238000000265 homogenisation Methods 0.000 description 1
- 201000001421 hyperglycemia Diseases 0.000 description 1
- 230000002727 hyperosmolar Effects 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 206010022000 influenza Diseases 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 229940042040 innovative drug Drugs 0.000 description 1
- 229940125396 insulin Drugs 0.000 description 1
- 230000003914 insulin secretion Effects 0.000 description 1
- 238000011835 investigation Methods 0.000 description 1
- 239000006101 laboratory sample Substances 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 210000004379 membrane Anatomy 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 238000000034 method Methods 0.000 description 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 1
- 150000004682 monohydrates Chemical class 0.000 description 1
- 230000000510 mucolytic effect Effects 0.000 description 1
- 229940066491 mucolytics Drugs 0.000 description 1
- 210000004400 mucous membrane Anatomy 0.000 description 1
- -1 mukokinetics Substances 0.000 description 1
- 239000002547 new drug Substances 0.000 description 1
- 239000006186 oral dosage form Substances 0.000 description 1
- 210000000496 pancreas Anatomy 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- 238000011170 pharmaceutical development Methods 0.000 description 1
- 229940124531 pharmaceutical excipient Drugs 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 230000000704 physical effect Effects 0.000 description 1
- 230000002335 preservative effect Effects 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 230000000241 respiratory effect Effects 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 206010039083 rhinitis Diseases 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 229940076279 serotonin Drugs 0.000 description 1
- 238000009097 single-agent therapy Methods 0.000 description 1
- 238000013112 stability test Methods 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 125000000185 sucrose group Chemical group 0.000 description 1
- 150000005846 sugar alcohols Polymers 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 230000008961 swelling Effects 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 238000010257 thawing Methods 0.000 description 1
- 210000001519 tissue Anatomy 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- UFTFJSFQGQCHQW-UHFFFAOYSA-N triformin Chemical compound O=COCC(OC=O)COC=O UFTFJSFQGQCHQW-UHFFFAOYSA-N 0.000 description 1
- 230000010415 tropism Effects 0.000 description 1
- 238000000196 viscometry Methods 0.000 description 1
- 238000005303 weighing Methods 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/12—Carboxylic acids; Salts or anhydrides thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/26—Carbohydrates, e.g. sugar alcohols, amino sugars, nucleic acids, mono-, di- or oligo-saccharides; Derivatives thereof, e.g. polysorbates, sorbitan fatty acid esters or glycyrrhizin
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Public Health (AREA)
- Epidemiology (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Engineering & Computer Science (AREA)
- General Chemical & Material Sciences (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Medicinal Preparation (AREA)
Abstract
Description
Область техникиTechnical field
Изобретение относится к области медицины, в частности к фармацевтической промышленности, и описывает жидкую пероральную лекарственную форму, выполненную в виде сиропа, включающую фенспирида гидрохлорид.The invention relates to medicine, in particular to the pharmaceutical industry, and describes a liquid oral dosage form in the form of a syrup, including fenspiride hydrochloride.
Уровень техникиState of the art
Болезни органов дыхания составляют до 80% заболеваний, диагностируемых у детей и подростков [Опыт использования препарата фенспирид гидрохлорид при лечении острых респираторных заболеваний у детей в амбулаторной практике / Ю.В. Черненков, О.И. Гуменюк, И.Ю. Попова, Е.Е. Раскина, Н.Н. Добло // Педиатрия. - 2010. - Том 89 - №1. - С. 95-98]. Наряду с высоким уровнем заболеваемости, отмечается увеличение в общей популяции числа рецидивирующих и хронических форм болезней органов дыхания, нередко приводящих к инвалидизации [Механизмы бронхиальной обструкции и терапевтическая тактика при бронхитах у детей / Е.В. Середа, О.Ф. Лукина, Л.Р. Селимзянова // Педиатрия. - 2008. - №87 (6). - С. 146-149. Здоровье детей России (состояние и проблемы). Под ред. А.А. Баранова. М.: Союз педиатров России, 1999. Белая книга: Пульмонология / Чучалин А.Г. // Пульмонология. - 2004. - №1. - С. 7-34]. Наибольшую опасность эти заболевания представляют для ребенка в первые три года жизни [Фенспирида гидрохлорид: опыт применения в терапии ОРИ у детей // Информационно-аналитическая газета «Фармацевтический вестник». 27.10.2010].Respiratory diseases account for up to 80% of diseases diagnosed in children and adolescents [Experience of using the drug fenspiride hydrochloride in the treatment of acute respiratory diseases in children in outpatient practice / Yu.V. Chernenkov, O.I. Gumenyuk, I.Yu. Popova, E.E. Raskina, N.N. Doblo // Pediatrics. - 2010. - Volume 89 - No. 1. - S. 95-98]. Along with a high incidence rate, there is an increase in the number of recurrent and chronic forms of respiratory diseases in the general population, often leading to disability [Mechanisms of bronchial obstruction and therapeutic tactics for bronchitis in children]. Sereda, O.F. Lukina, L.R. Selimzyanova // Pediatrics. - 2008. - No. 87 (6). - S. 146-149. Children's health in Russia (state and problems). Ed. A.A. Baranova. M.: Union of Pediatricians of Russia, 1999. White Paper: Pulmonology / Chuchalin A.G. // Pulmonology. - 2004. - No. 1. - S. 7-34]. These diseases pose the greatest danger to the child in the first three years of life [Fenspirida hydrochloride: experience of using ARI in children // Information and analytical newspaper Pharmaceutical Bulletin. 10/27/2010].
При этом, по статистике, 20-25% детей в России могут быть отнесены к категории часто болеющих, т.е. переносящих от 6 до 12 эпизодов инфекций верхних дыхательных путей в год. Болезни органов дыхания детей первого года жизни приводят к летальному исходу в 7,8% случаев [Рациональная антибактериальная терапия в отделениях реанимации и интенсивной терапии / М.А. Георгянц, Ю.А. Винник, В.А. Корсунов // Клиническая антибиотикотерапия. - 2003. - №2. - С. 8].At the same time, according to statistics, 20-25% of children in Russia can be classified as often sick, i.e. carrying 6 to 12 episodes of upper respiratory tract infections per year. Diseases of the respiratory organs of children of the first year of life lead to death in 7.8% of cases [Rational antibacterial therapy in the intensive care units and intensive care / M.A. Georgyants, Yu.A. Vinnik, V.A. Korsunov // Clinical antibiotic therapy. - 2003. - No. 2. - S. 8].
Высокая распространенность инфекций верхних дыхательных путей отчасти объясняется неадекватным лечением, в т.ч. одновременным назначением неоправданно большого количества лекарственных средств в основном симптоматической терапии [Фенспирида гидрохлорид: опыт применения в терапии ОРИ у детей // Информационно-аналитическая газета «Фармацевтический вестник». - 27.10.2010].The high prevalence of upper respiratory tract infections is partly due to inadequate treatment, including the simultaneous prescription of an unjustifiably large number of drugs, mainly symptomatic therapy [Fenspirida hydrochloride: experience of using ARI in children // Information and analytical newspaper Pharmaceutical Bulletin. - 10.27.2010].
В последние годы в качестве противовоспалительного препарата при острых, рецидивирующих и хронических заболеваниях органов дыхания успешно применяется фенспирида гидрохлорид (препарат Эреспал® сироп, «Лаборатории Сервье Индастри», Франция), обладающий выраженным противовоспалительным действием и тропностью к слизистой оболочке дыхательных путей [Механизмы бронхиальной обструкции и терапевтическая тактика при бронхитах у детей / Е.В. Середа, О.Ф. Лукина, Л.Р. Селимзянова // Педиатрия. - 2008. - №87 (6). - С. 146-149. Эффективность и безопасность применения фенспирида гидрохлорида (эреспала) в лечении детей и подростков в раннем реабилитационном периоде внебольничных пневмоний / Н.Д. Сорока, Е.В. Коршунова, С.П. Гомозова, Т.Г. Власова, В.Н. Котельникова // Педиатрия. - 2010. - Том 89. - №2. - С. 120 127].In recent years, fenspiride hydrochloride (Erespal ® syrup, Labs Servier Industry, France) has been successfully used as an anti-inflammatory drug in acute, recurrent and chronic respiratory diseases, which has a pronounced anti-inflammatory effect and tropism to the mucous membrane of the respiratory tract [Mechanisms of bronchial obstruction and therapeutic tactics for bronchitis in children / E.V. Sereda, O.F. Lukina, L.R. Selimzyanova // Pediatrics. - 2008. - No. 87 (6). - S. 146-149. Efficiency and safety of fenspiride hydrochloride (Erespal) in the treatment of children and adolescents in the early rehabilitation period of community-acquired pneumonia / N.D. Soroka, E.V. Korshunova, S.P. Gomozova, T.G. Vlasova, V.N. Kotelnikova // Pediatrics. - 2010. - Volume 89. - No. 2. - S. 120 127].
Феспирид гидрохлорид - 8-(2-фенилэтил)-1-окса-3,8-диазаспиро (4,5)-декан-2-ОН является противовоспалительным средством, оказывающим антиэкссудативное действие, препятствующим развитию бронхоспазма. Проявляет антагонизм с медиаторами воспаления и аллергии: серотонином, гистамином (на уровне Н1-гистаминовых рецепторов), брадикинином {Противовоспалительный препарат фенспирид / А.А. Визелъ, И.Ю. Визелъ, И.Ю. Пронина // Пульмонология. - 2007. - №2. - С. 80-88].Fespirid hydrochloride - 8- (2-phenylethyl) -1-oxa-3,8-diazaspiro (4,5) -decane-2-OH is an anti-inflammatory drug that has an antiexudative effect that prevents the development of bronchospasm. It shows antagonism with mediators of inflammation and allergies: serotonin, histamine (at the level of H1-histamine receptors), bradykinin {Anti-inflammatory drug fenspiride / A.A. Vizel, I.Yu. Vizel, I.Yu. Pronina // Pulmonology. - 2007. - No. 2. - S. 80-88].
Феспирид гидрохлорид (Эреспал сироп) хорошо себя зарекомендовал при лечении бронхиальной астмы у детей [Патогенетическое обоснование применения фенспирида (эреспала) при бронхиальной астме у детей / С.В. Лукьянов [и др.] // Пульмонология. - 2001. - №4. - С. 59-64], острой респираторной вирусной инфекции [Результаты многоцентрового исследования эффективности фенспирида гидрохлорида (эреспала) при лечении острой респираторной инфекции у детей / Г.А. Самсыгина, С.Б. Фитилев, A.M. Левин // Педиатрия. - 2003. - №2. - С. 81-85], хронического бронхита [Эффективность фенспирида у больных хроническим обструктивным бронхитом / Т.Д. Шорохова [и др.] // Клиническая медицина. - 2001. - №8. - С. 55-57], заболеваний бронхо-легочной системы и ЛОР-органов [Эреспал (фенспирид) в лечении заболеваний бронхо-легочной системы и ЛОР-органов / А.С. Соколов // Пульмонология. - 2003. - №5. - С. 122-127]. Имеются сообщения об эффективности фенспирида при хронической обструктивной болезни легких [Клинико-функциональное состояние и качество жизни больных хронической обструктивной болезнью легких до и после лечения фенспиридом в амбулаторных условиях / С.И. Буторов [и др.] // Терапевтический архив. - 2008. - Т. 80. - №3. - С. 24-28].Fespirid hydrochloride (Erespal syrup) has proven itself in the treatment of bronchial asthma in children [Pathogenetic rationale for the use of fenspiride (erespal) in bronchial asthma in children / C.V. Lukyanov [et al.] // Pulmonology. - 2001. - No. 4. - P. 59-64], acute respiratory viral infection [Results of a multicenter study of the effectiveness of fenspiride hydrochloride (erespal) in the treatment of acute respiratory infection in children / G.A. Samsygina, S.B. Fitilev, A.M. Levin // Pediatrics. - 2003. - No. 2. - S. 81-85], chronic bronchitis [The effectiveness of fenspiride in patients with chronic obstructive bronchitis / T.D. Shorokhov [et al.] // Clinical Medicine. - 2001. - No. 8. - S. 55-57], diseases of the broncho-pulmonary system and ENT organs [Erespal (fenspiride) in the treatment of diseases of the broncho-pulmonary system and ENT organs / А.S. Sokolov // Pulmonology. - 2003. - No. 5. - S. 122-127]. There are reports of the effectiveness of fenspiride in chronic obstructive pulmonary disease [Clinical and functional status and quality of life of patients with chronic obstructive pulmonary disease before and after treatment with fenspiride in an outpatient setting / S.I. Butorov [et al.] // Therapeutic Archive. - 2008. - T. 80. - No. 3. - S. 24-28].
В настоящее время высокая клиническая эффективность фенспирида гидрохлорида доказана в лечении практически всех заболеваний верхних дыхательных путей, различных клинических вариантов бронхитов, обострений хронической обструктивной болезни легких.Currently, the high clinical effectiveness of fenspiride hydrochloride has been proven in the treatment of almost all diseases of the upper respiratory tract, various clinical options for bronchitis, exacerbations of chronic obstructive pulmonary disease.
Фенспирид входит в перечень жизненно необходимых и важнейших лекарственных средств (ЖНВЛС).Fenspiride is included in the list of vital and essential medicines (Vital and Essential Drugs).
Применение фенспирида гидрохлорида в лечении острых респираторных инфекций (ОРИ) у детей первых месяцев жизни позволяет купировать основные симптомы ОРИ (ринит, фарингит, кашель). Кроме того, монототерапия фенспирида гидрохлоридом при лечении ОРИ позволяет избежать полипрагмазии (назначения больным детям нескольких препаратов одновременно - муколитиков, мукокинетиков, бронхолитиков и антигистаминных).The use of fenspiride hydrochloride in the treatment of acute respiratory infections (ARI) in children of the first months of life allows you to stop the main symptoms of ARI (rhinitis, pharyngitis, cough). In addition, monotherapy of fenspiride with hydrochloride in the treatment of ARI allows avoiding polypharmacy (prescribing sick children several drugs at the same time - mucolytics, mukokinetics, bronchodilators and antihistamines).
Наиболее высокие показатели заболеваемости гриппом и ОВРИ отмечаются у детей первых 6 лет жизни. Известно, что детский возраст, особенно ранний и дошкольный, характеризуется значительно более высокой чувствительностью организма ребенка к вирусным и вирусно-бактериальным агентам, проникающим в респираторный тракт, и, соответственно, значительно более высокой заболеваемостью ОРИ. Отсюда очевидно, что группой высокого риска по заболеваемости вирусными и вирусно-бактериальными инфекциями респираторного тракта являются дети первых лет жизни [Самсыгина Г.А. Противовоспалительная терапия острых респираторных инфекций у детей. Педиатрия - 2011. - Том 90. - №1. - С. 102-105].The highest incidence of influenza and ARVI are observed in children of the first 6 years of life. It is known that childhood, especially early and preschool, is characterized by a significantly higher sensitivity of the child's body to viral and viral-bacterial agents that penetrate the respiratory tract, and, accordingly, a significantly higher incidence of ARI. Hence it is obvious that the high risk group for the incidence of viral and viral-bacterial infections of the respiratory tract are children of the first years of life [G. Samsygina Anti-inflammatory therapy for acute respiratory infections in children. Pediatrics - 2011. -
Учитывая детский возраст пациентов, а также симптоматику ОРИ (воспаленность и отечность дыхательных путей), проблема затрудненного глотания лекарственных препаратов является актуальной. Дисфагия (затруднение глотания) широко распространена, особенно среди детей и пожилых людей, и по разным оценкам наблюдается примерно у 35% населения. В этой связи выпуск лекарственных препаратов фенспирида в жидкой форме представляется наиболее удобным и безопасным.Given the children's age of patients, as well as the symptoms of ARI (inflammation and swelling of the respiratory tract), the problem of difficulty swallowing drugs is relevant. Dysphagia (difficulty swallowing) is widespread, especially among children and the elderly, and according to various estimates, approximately 35% of the population. In this regard, the release of fenspiride drugs in liquid form seems to be the most convenient and safe.
Препараты фенспирида представлены на рынке в виде таблеток покрытых пленочной оболочкой и сиропов.Fenspiride preparations are marketed in the form of film-coated tablets and syrups.
Из предшествующего уровня техники широко известны и представлены на отечественном рынке следующие жидкие лекарственные формы фенспирида гидрохлорида:The following liquid dosage forms of fenspiride hydrochloride are widely known and presented on the domestic market from the prior art:
- «Эриспирус®» в лекарственной форме сиропа в дозировке 2 мг/мл во флаконе 150 мл, производства фирмы Сандоз д.д. (Словения), регистрационное удостоверение №ЛП-002715 от 14.11.2014 г.- "Erispirus®" in the dosage form of syrup in a dosage of 2 mg / ml in a bottle of 150 ml, manufactured by Sandoz D. (Slovenia), registration certificate No. LP-002715 dated November 14, 2014
- «Сиресп» в лекарственной форме сиропа в дозировке 2 мг/мл во флаконе 150 мл, производства Фармацевтический завод «Польфарма» АО (Польша), регистрационное удостоверение №ЛП-002683 от 29.10.2014 г.- “Syres” in the dosage form of syrup in a dosage of 2 mg / ml in a bottle of 150 ml, manufactured by Pharmaceutical Plant Polfarma AO (Poland), registration certificate No. LP-002683 dated 10.29.2014.
- «Эреспал®» в лекарственной форме сиропа в дозировке 2 мг/мл во флаконах по 150 и 250 мл, производства фирмы Лаборатории Сервье (Франция), регистрационное удостоверение №П N012547/02 от 28.06.2010 г. - “Erespal®" in the dosage form of syrup in a dosage of 2 mg / ml in bottles of 150 and 250 ml, produced by the company Servier Laboratory (France), registration certificate No. P N012547 / 02 of 06/28/2010
Указанные препараты, помимо активного действующего вещества (фенспирида гидрохлорида) также содержат: антимикробные консерванты (метилпарагидроксибензоат, пропилпарагидроксибензоат, калия сорбат), гидрофильный растворитель (глицерин), корригенты вкуса (сахарин, солодки корней экстракт), красители и ароматизаторы, воду в качестве основного растворителя. Также в составе всех вышеуказанных препаратов содержится корригент вкуса одновременно выполняющий функцию загустителя - сахароза.These preparations, in addition to the active active ingredient (fenspiride hydrochloride) also contain: antimicrobial preservatives (methyl parahydroxybenzoate, propyl parahydroxybenzoate, potassium sorbate), hydrophilic solvent (glycerin), flavoring agents (saccharin, licorice root extract), colorants and flavoring agents, water in the main solvent, water . Also, the composition of all the above preparations contains flavor flavoring simultaneously performing the function of a thickener - sucrose.
При этом, концентрация сахарозы в сиропах составляет около 60-65% или 600-650 мг/мл. Данное количество сахарозы является оптимальным т.к. сиропы с концентрацией сахара выше 66% при хранении и небольшом охлаждении засахариваются, образуя крупные трудно растворимые кристаллы сахарозы. В то же время, сиропы с концентрацией сахара ниже 60% подвергаются брожению и скисанию.At the same time, the concentration of sucrose in syrups is about 60-65% or 600-650 mg / ml. This amount of sucrose is optimal because syrups with a sugar concentration higher than 66%, when stored and slightly cooled, are sugared, forming large, hardly soluble sucrose crystals. At the same time, syrups with a sugar concentration below 60% are fermented and soured.
Вместе с тем, употребление сахарозы способствует развитию гипергликемии, усиленному выбросу инсулина в кровь, истощению инсулярного аппарата, что способствует развитию сахарного диабета. Пациентам с данным заболеванием, употребление сахарозы противопоказано либо допустимо в малых количествах с повышенной осторожностью. Увеличенное количество сахарозы, которое поступает в организм человека, не может полностью депонировать в виде гликогена и превращаться в триглицерид, что способствует развитию живой ткани, увеличению холестерина в крови и развитию на этом фоне ряда тяжелых сердечно-сосудистых заболеваний. Известно также о разрушительном влиянии сахарозы на зубную эмаль и о ее высоком кариесогенном действии.At the same time, the use of sucrose contributes to the development of hyperglycemia, increased insulin release into the bloodstream, and the depletion of the insular apparatus, which contributes to the development of diabetes mellitus. For patients with this disease, the use of sucrose is contraindicated or permissible in small quantities with increased caution. The increased amount of sucrose that enters the human body cannot be fully deposited in the form of glycogen and converted into triglyceride, which contributes to the development of living tissue, an increase in blood cholesterol and the development of a number of severe cardiovascular diseases. It is also known about the destructive effect of sucrose on tooth enamel and its high cariogenic effect.
В этой связи существует потребность в разработке качественных и доступных отечественных H1-антигистаминных средств, содержащих фенспирида гидрохлорид в виде жидких лекарственных форм, предпочтительно в виде сиропов, удобных для применения, стабильных при хранении и имеющих маскирующий сладкий вкус, и, кроме того, лишенных недостатков известных лекарственных препаратов, содержащих в своем составе сахарозу.In this regard, there is a need to develop high-quality and affordable domestic H1 antihistamines containing fenspiride hydrochloride in the form of liquid dosage forms, preferably in the form of syrups, convenient for use, stable during storage and having a masking sweet taste, and, in addition, without disadvantages known drugs containing sucrose in their composition.
Наиболее близким аналогом, принятым в качестве прототипа, является широко распространенный и известный на рынке лекарственный препарат «Эреспал®» производства фирмы Лаборатории Сервье (Франция), в лекарственной форме сиропа в дозировке 2 мг/мл во флаконах по 150 и 250 мл (регистрационное удостоверение №П N012547/02 от 28.06.2010 г.).The closest analogue adopted as a prototype is the widely distributed and well-known on the market drug Erespal® manufactured by Servier Laboratory (France), in the dosage form of syrup in a dosage of 2 mg / ml in 150 and 250 ml bottles (registration certificate No. P N012547 / 02 of 06/28/2010).
Технической задачей настоящего изобретения является расширение перечня лекарственных средств отечественного производства.The technical task of the present invention is to expand the list of domestic drugs.
Техническим результатом (целью) изобретения является создание жидкой лекарственной формы фенспирида, предпочтительно в форме сиропа, стабильной при получении и длительном хранении, фармацевтически эквивалентной прототипу, но исключающей при этом содержание сахарозы в своем составе.The technical result (goal) of the invention is the creation of a liquid dosage form of fenspiride, preferably in the form of a syrup, stable upon receipt and long-term storage, pharmaceutically equivalent to the prototype, but excluding the content of sucrose in its composition.
Для достижения указанной цели авторами настоящего изобретения была предпринята попытка разработки препарата-аналога - «Фенспирид сироп» 2 мг/мл (разрабатываемый препарат), который по эффективности, безвредности и показателям качества не уступал бы инновационному препарату «Эреспал®» сироп 2 мг/мл («Лаборатории Сервье», Франция), (референтный препарат, препарат сравнения, прототип).To achieve this goal, the authors of the present invention attempted to develop an analogue drug - “Fenspiride syrup” 2 mg / ml (the drug being developed), which would not be inferior to the innovative drug “Erespal®”
Раскрытие изобретенияDisclosure of invention
Исходя из задачи исследования, авторы настоящего изобретения, попытались разработать препарат фармацевтически эквивалентный препарату «Эреспал®» сироп 2 мг/мл, имеющий сопоставимые с ним показатели качества и свойства, включая специфические виды действия и безвредность. При этом можно будет прогнозировать, что разработанный препарат будет также терапевтически эквивалентен препарату сравнения.Based on the objectives of the study, the authors of the present invention, tried to develop a drug pharmaceutically equivalent to the drug "Erespal®"
Лекарственные препараты являются фармацевтически эквивалентными, если они содержат одно и то же количество одного и того же действующего вещества (одних и тех же действующих веществ) в одних и тех же лекарственных формах, которые соответствуют требованиям одних и тех же или сопоставимых стандартов. Терапевтически эквивалентным другому препарату, является препарат, содержащий ту же активную субстанцию или ее терапевтически активную часть и клинически проявляющий такую же эффективность и безопасность, как и препарат, эффективность и безопасность которого установлена [CPMP/EWG/QWP/1401/98. Note for guidance on the investigation of bioavailability and bioequivalence. - London: CPMP/EMEA, 26 July 2001].Medicines are pharmaceutically equivalent if they contain the same amount of the same active substance (the same active substances) in the same dosage forms that meet the requirements of the same or comparable standards. Therapeutically equivalent to another drug is a drug containing the same active substance or its therapeutically active part and clinically showing the same efficacy and safety as the drug whose efficacy and safety has been established [CPMP / EWG / QWP / 1401/98. Note for guidance on the investigation of bioavailability and bioequivalence. - London: CPMP / EMEA, July 26, 2001].
Требования к препарату в форме сиропа, содержащему фенспирида гидрохлорид, в ведущих фармакопеях не описаны. Общие требования к сиропам описаны в монографии «Liguid preparations for oral use» Европейской Фармакопеи [European Pharmacopoeia 7th Edition. - Strassbourg: European Directorate for the Quality of Medicines & Health Care (EDQM) - Council of Europe, 67075 Strasbourg Cedex, France 2010. - Vol. 1, Vol. 2. - 3536 p.], в монографии «Liguid preparations for oral use» Британской Фармакопеи [British Pharmacopoeia. - 2013, vol. III], в монографии «Pharmaceutical Dosage Forms: Solutions}) Фармакопеи США [The United States Pharmacopeia, 36 ed. (NF 31) / Rochiville: United States Pharmacopeia Convention Inc],The requirements for a syrup preparation containing fenspiride hydrochloride are not described in the leading pharmacopoeias. General requirements for syrups are described in the monograph “Liguid preparations for oral use” of the European Pharmacopoeia [European Pharmacopoeia 7th Edition. - Strassbourg: European Directorate for the Quality of Medicines & Health Care (EDQM) - Council of Europe, 67075 Strasbourg Cedex, France 2010. - Vol. 1, Vol. 2. - 3536 p.], In the monograph "Liguid preparations for oral use" of the British Pharmacopoeia [British Pharmacopoeia. - 2013, vol. III], in the monograph “Pharmaceutical Dosage Forms: Solutions}) of the United States Pharmacopeia [The United States Pharmacopeia, 36 ed. (NF 31) / Rochiville: United States Pharmacopeia Convention Inc],
Референтный препарат «Эреспал®» сироп 2 мг/мл, содержит следующие компоненты г/100 мл:Reference drug "Erespal®"
Вспомогательные вещества в составе препарата «Эреспал®» сироп 2 мг/мл выполняют следующее функциональное назначение:Excipients in the composition of the drug "Erespal ® "
- солодки корней экстракт - корригент вкуса;- licorice root extract - flavor flavoring;
- настойка ванильная, ароматизирующий состав с медовыми оттенками - ароматизаторы;- vanilla tincture, flavoring composition with honey tones - flavors;
- метилпарагидроксибензоат, пропилпарагидроксибензоат, калия сорбат - антимикробные консерванты;- methyl parahydroxybenzoate, propyl parahydroxybenzoate, potassium sorbate - antimicrobial preservatives;
- сахарин - корригент вкуса;- saccharin - flavor flavoring;
- сахароза - корригент вкуса, загуститель;- sucrose - flavor flavoring, thickener;
- глицерол - гидрофильный растворитель;- glycerol is a hydrophilic solvent;
- краситель солнечный закат желтый (Сансет желтый S) - краситель;- dye sunny sunset yellow (Sunset yellow S) - dye;
- вода очищенная - растворитель.- purified water - solvent.
План экспериментов по фармацевтической разработке препарата «Фенспирид сироп» 2 мг/мл основывался на фармакопейных и регуляторных требованиях. Предполагалась разработка препарата в форме сиропа, содержащего в качестве действующего вещества фенспирида гидрохлорида - ингибитора фосфолипазы А2 (ФЛА2), блокатора Н1-гистаминовых и α1-адренергических рецепторов.The experimental design for the pharmaceutical development of
Учитывая физико-химические свойства действующего и вспомогательных веществ, входящих в состав препарата, необходимо было выбрать их качественный и количественный состав по результатам физико-химических, микробиологических, технологических и аналитических исследований.Given the physico-chemical properties of the active and excipients that make up the drug, it was necessary to choose their qualitative and quantitative composition according to the results of physico-chemical, microbiological, technological and analytical studies.
Сложность достижения технического результата заключается в исключении (или замене) сахарозы из состава препарата с одновременным сохранением его физико-химических, органолептических, фармацевтических и терапевтических свойств, при условии, что указанная сахароза в референтном препарате является не только корригентом вкуса, но и загустителем, а учитывая ее количество в составе сиропа, по сути, наряду с водой, является его основой.The difficulty of achieving a technical result lies in the exclusion (or replacement) of sucrose from the composition of the drug while preserving its physicochemical, organoleptic, pharmaceutical and therapeutic properties, provided that the sucrose in the reference preparation is not only a flavoring agent, but also a thickener, and given its amount in the composition of the syrup, in fact, along with water, is its basis.
С целью решения данной задачи, авторам удалось разработать рациональный состав препарата «Фенспирид сироп» 2 мг/мл с учетом состава и свойств референтного препарата «Эреспал®» сироп 2 мг/мл, а также свойств фенспирида гидрохлорида и вспомогательных веществ. При этом выбрать состав препарата таким образом, чтобы изменения в нем по отношению к референтному препарату можно было классифицировать как несущественные изменения I типа [The rules governing medicinal products in the European Union. - V. 2. - Notice to Applicants. - V. 2C. - Regulatory Guidelines. - Guideline on Dossier Requirements for Type IA and IB Notifications. - EC. - July 2003. Надлежащая производственная практика лекарственных средств / Под ред. Н.А. Ляпунова, В.А. Загория, В.П. Георгиевского, Е.П. Безуглой. - К: МОРИОН, 1999. - 896 с. The rules governing medicinal products in the European Union. - V. 2. - Notice to Applicants. - V. 2C. - Regulatory Guidelines. - Guideline on the Categorisation of new Applications (NA) versus Variations Applications (V). - European Comission. - January 2002. - 11 р.]. Разработку состава необходимо осуществлять так, чтобы разрабатываемый препарат можно квалифицировать как фармацевтически эквивалентный относительно референтного препарата, а также с учетом медико-биологических требований, предъявляемых к препаратам для системного лечения органов верхних дыхательных путей, для чего:In order to solve this problem, the authors managed to develop a rational composition of the
- препарат должен содержать фенспирида гидрохлорид в концентрации, соответствующей его содержанию в референтном препарате - 2 мг/мл;- the preparation should contain fenspiride hydrochloride in a concentration corresponding to its content in the reference preparation - 2 mg / ml;
- препарат должен иметь лекарственную форму «сироп» и обеспечивать терапевтическую эквивалентность относительно референтного препарата.- the drug must have the dosage form “syrup” and provide therapeutic equivalence with respect to the reference drug.
В этой связи критическими характеристиками для разрабатываемого препарата являются:In this regard, the critical characteristics for the drug under development are:
- физическая стабильность сиропа (в т.ч. аналогичный уровень рН);- physical stability of the syrup (including a similar pH level);
- микробиологическая чистота, которая должна соответствовать фармакопейным требованиям [5.1.4. Microbiological guality non-sterile pharmaceutical preparations and substances for pharmaceutical use. - European Pharmacopoeia 8.0. - P. 559. Государственная фармакопея Российской Федерации. - М.: Издательство «Научный центр экспертизы средств медицинского применения», 2008. - 704 с.].- microbiological purity, which must comply with pharmacopoeial requirements [5.1.4. Microbiological guality non-sterile pharmaceutical preparations and substances for pharmaceutical use. - European Pharmacopoeia 8.0. - P. 559. State Pharmacopoeia of the Russian Federation. - M.: Publishing House "Scientific Center for Expertise of Medical Applications", 2008. - 704 p.].
С целью достижения вышеуказанного технического результата авторами настоящего изобретения были проведены исследования по выбору корригентов вкуса, корригентов рН (буферных веществ), ароматизаторов и антимикробных консервантов разрабатываемого состава.In order to achieve the above technical result, the authors of the present invention conducted studies on the selection of flavoring agents, pH flavoring agents (buffering substances), flavors and antimicrobial preservatives of the developed composition.
Для изготовления лабораторных образцов использовали мешалку «Polytron» фирмы «Kinematica» (Швейцария). Наработку опытных серий препарата осуществляли в вакуумном реакторе-гомогенизаторе РП 500 фирмы «Промвит» (Украина), моделирующем промышленное оборудование.For the manufacture of laboratory samples used the mixer "Polytron" company "Kinematica" (Switzerland). The experimental series of the preparation were developed in a RP 500 vacuum homogenizer reactor manufactured by Promvit (Ukraine), which models industrial equipment.
Для взвешивания использовали весы EUROPE-C500 и CRYSTAL 200 фирмы «Gibertini S.A.» (Италия).For weighing we used EUROPE-C500 and
рН сиропов определяли потенциометрически на рН-метре «744 рН Meter» фирмы «Metrohm» (Швейцария) с электродом типа «Porotrode» [European Pharmacopoeia 7th Edition. - Strassbourg: European Directorate for the Quality of Medicines & Health Care (EDQM) - Council of Europe, 67075 Strasbourg Cedex, France 2010. - Vol. 1, Vol. 2. - 3536 p.].The pH of the syrups was determined potentiometrically on a 744 pH Meter (Metrohm, Switzerland) with an electrode of the Porotrode type [European Pharmacopoeia 7th Edition. - Strassbourg: European Directorate for the Quality of Medicines & Health Care (EDQM) - Council of Europe, 67075 Strasbourg Cedex, France 2010. - Vol. 1, Vol. 2. - 3536 p.].
Определение структурной вязкости проводили методом ротационной вискозиметрии на ротационном вискозиметре с коаксиальными цилиндрами «Reolab-QC» фирмы «Anton Paar» (Австрия), при температуре (25,0±0,1)°С или при других температурах, указанных в тексте. Строили реограммы, отражающие зависимость касательного напряжения сдвига τr от градиента скорости сдвига Dr, по которым определяли тип течения системы, наличие тиксотропных свойств, нижний, верхний и экстраполированный пределы текучести. Структурную вязкость рассчитывали по формуле: η=τr/Dr [Государственная фармакопея Российской Федерации. - М.: Издательство «Научный центр экспертизы средств медицинского применения», 2008. - 704 с.].The structural viscosity was determined by rotational viscometry on a rotational viscometer with coaxial Reolab-QC cylinders from Anton Paar (Austria), at a temperature of (25.0 ± 0.1) ° С or at other temperatures indicated in the text. Rheograms were constructed reflecting the dependence of the shear stress τ r on the shear rate gradient D r , which was used to determine the type of system flow, the presence of thixotropic properties, and the lower, upper, and extrapolated yield stresses. The structural viscosity was calculated by the formula: η = τ r / D r [State Pharmacopoeia of the Russian Federation. - M.: Publishing House "Scientific Center for Expertise of Medical Applications", 2008. - 704 p.].
Размер частиц определяли с помощью микроскопа MBL-2100 («», Германия).Particle size was determined using an MBL-2100 microscope (" ", Germany).
Кинетику абсорбции воды сиропами, характеризующую их осмотическую активность, определяли в опытах in vitro методом диализа через полупроницаемую мембрану из целлофана (ГОСТ 7730-89) при температуре (25,0±0,1)°С [Работы ГНЦЛС по созданию, внедрению и стандартизации мягких лекарственных средств и суппозиториев / Н.А. Ляпунов, Е.П. Безуглая, Н.Г. Козлова и др. // Фармаком. - 1999. - №3. - С. 61-64. Lugano A.S. Etude du transport de principles actifs incorpores dans des emulsions liquides de type huile dans eau: These doct. pharm. sci. - 1793. - Zurich, 1977. - 117 s. Методические рекомендации no экспериментальному (доклиническому) изучению лекарственных препаратов для местного лечения ран / Б.М. Даценко, С.В. Бирюкова, Т.И. Тамм и др. - М., МЗ СССР, 1989. - 47 с.].The kinetics of water absorption by syrups, characterizing their osmotic activity, was determined in experiments in vitro by dialysis through a semipermeable cellophane membrane (GOST 7730-89) at a temperature of (25.0 ± 0.1) ° С [GNSSLS work on the creation, implementation and standardization soft drugs and suppositories / N.A. Lyapunov, E.P. Bezuglaya, N.G. Kozlova and others // Farmakom. - 1999. - No. 3. - S. 61-64. Lugano A.S. Etude du transport de principles actifs incorpores dans des emulsions liquides de type huile dans eau: These doct. pharm. sci. - 1793. - Zurich, 1977 .-- 117 s. Guidelines for experimental (preclinical) study of drugs for local treatment of wounds / B.M. Datsenko, S.V. Biryukova, T.I. Tamm et al. - M., Ministry of Health of the USSR, 1989. - 47 p.].
В качестве основного корригента вкуса в состав референтного препарата входит сахароза в концентрации 60,0 г/100 мл сиропа.The main flavoring agent in the composition of the reference preparation is sucrose in a concentration of 60.0 g / 100 ml of syrup.
Для приготовления сиропов может быть использована либо сахароза в концентрации не менее 45 мас.%, либо другие полиспирты или подсластители.For the preparation of syrups, either sucrose at a concentration of not less than 45 wt.%, Or other polyalcohols or sweeteners can be used.
В настоящее время в качестве подсластителя и загустителя сиропов также используется сорбитол.Currently, sorbitol is also used as a sweetener and thickener for syrups.
Сорбитол обладает маскирующим сладким вкусом, в то же время он не является токсичным, не вызывает быстрых изменений количества сахара в крови и не провоцирует дополнительной выработки инсулина поджелудочной железой. Являясь калоригенным заменителем сахара, сорбитол всасывается из желудочно-кишечного тракта, практически не влияя на содержание глюкозы в крови, что позволяет применять препарат для лечения больных сахарным диабетом (Регистр лекарственных средств России, РЛС. Энциклопедия лекарств. - 14-й вып./ред. Г.Л. Вышковский. - М.: РЛС - 2006, 2005).Sorbitol has a masking sweet taste, but at the same time it is not toxic, does not cause rapid changes in the amount of sugar in the blood and does not provoke additional production of insulin by the pancreas. Being a caloric sugar substitute, sorbitol is absorbed from the gastrointestinal tract, practically without affecting blood glucose, which allows the drug to be used to treat patients with diabetes mellitus (Russian Drug Register, Radar. Encyclopedia of drugs. - 14th issue / red G.L. Vyshkovsky. - M.: Radar - 2006, 2005).
Сорбитол, как химическое вещество - это шестиатомный спирт с эмпирической формулой C5H14O6. Он является стереоизомером маннитола. Сорбитол используется как заменитель сахара [Справочник - Видаль. Sorbitol, as a chemical substance, is a six-atom alcohol with the empirical formula C 5 H 14 O 6 . It is a stereoisomer of mannitol. Sorbitol is used as a sugar substitute [Reference - Vidal.
Лекарственные препараты в России / М.: АстраФармСервис, 2010. Handbook of Pharmaceutical Excipients: 6-th Edition / Ed. by Anley Wade and Paul J. Weller. - Washington/London: Amer. Pharm. Association/The Pharm. Press, 2009. – 888 p.].Medicines in Russia / M.: AstraPharmService, 2010. Handbook of Pharmaceutical Excipients: 6th Edition / Ed. by Anley Wade and Paul J. Weller. - Washington / London: Amer. Pharm. Association / The Pharm. Press, 2009. - 888 p.].
В качестве основного корригента вкуса в разрабатываемом препарате был выбран сорбитол жидкий некристаллизующийся.Non-crystallizing liquid sorbitol was chosen as the main flavoring agent in the developed product.
Поскольку реопараметры сиропов на основе сорбитола зависят от его концентрации, были проведены реологические исследования образцов сиропов в зависимости от концентрации сорбитола жидкого некристаллизующегося. Составы сиропов приведены в таблице 1.Since the rheoparameters of sorbitol-based syrups depend on its concentration, rheological studies of syrup samples were carried out depending on the concentration of non-crystallizing liquid sorbitol. The composition of the syrups are shown in table 1.
На Фиг. 1 представлены реограммы сиропов фенспирида гидрохлорида, содержащих сорбитол жидкий некристаллизующийся в разных концентрациях и реограмма препарата «Эреспал®» сироп 2 мг/мл. На Фиг. 2 представлен график зависимости структурной вязкости сиропов от концентрации сорбитола жидкого некристаллизующегося при градиенте скорости сдвига 41,64 с-1. В таблице 2 приведены значения структурной вязкости указанных сиропов при разных градиентах скорости сдвига в сравнении со структурной вязкостью референтного препарата.In FIG. 1 shows rheograms of fenspiride hydrochloride syrups containing non-crystalline liquid sorbitol non-crystallizing in different concentrations and a rheogram of the Erespal ® syrup 2 mg / ml. In FIG. 2 is a graph of the structural viscosity of syrups versus the concentration of liquid non-crystallizing sorbitol with a shear rate gradient of 41.64 s -1 . Table 2 shows the values of the structural viscosity of the indicated syrups at different shear rate gradients in comparison with the structural viscosity of the reference preparation.
Как видно из данных, представленных на фиг. 1, все сиропы имеют тип течения близкий к ньютоновскому, у них отсутствуют нижний предел текучести и тиксотропные свойства. Структурная вязкость сиропов увеличивается с увеличением концентрации сорбитола жидкого некристаллизующегося (фиг. 2). Наиболее близким по своим реологическим свойствам к референтному препарату является сироп, содержащий 85,2 г сорбитола жидкого некристализующегося в 100 мл (табл. 2).As can be seen from the data presented in FIG. 1, all syrups have a flow type close to Newtonian, they have no lower yield strength and thixotropic properties. The structural viscosity of syrups increases with increasing concentration of liquid non-crystallizing sorbitol (Fig. 2). The rheological closest to the reference drug is a syrup containing 85.2 g of liquid non-crystallizing sorbitol in 100 ml (Table 2).
При исследовании уровня рН референтного препарата, были установлены следующие значения рН: 5,03; 5,28 5,48; 5,50; 5,53; 5,89. Соответственно, для разрабатываемого препарата должны быть установлены пределы рН от 5,0 до 6,0.When examining the pH level of the reference drug, the following pH values were established: 5.03; 5.28 5.48; 5.50; 5.53; 5.89. Accordingly, for the developed product, pH limits from 5.0 to 6.0 should be set.
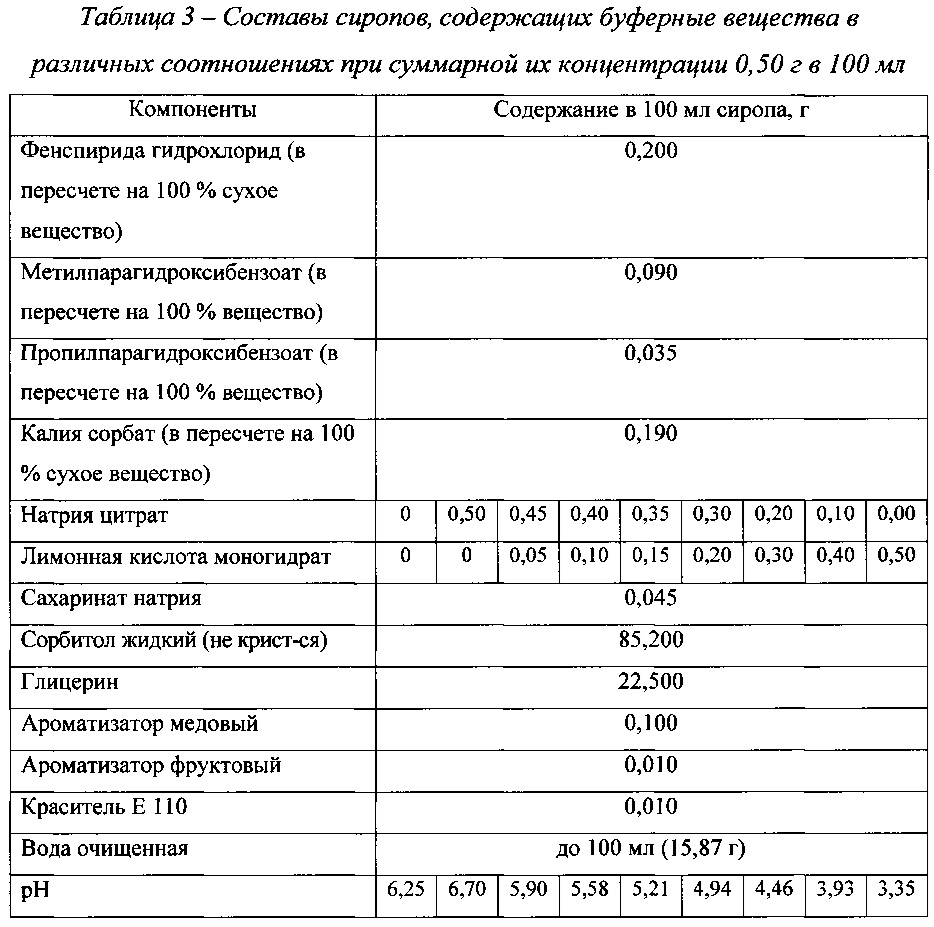
рН разрабатываемого сиропа, в состав которого не вводили корригенты рН (буферные вещества), составил 6,25. Для создания рН около 5,5 в состав сиропа были включены буферные вещества. Выбран нитратный буфер, состоящий из натрия цитрата и лимонной кислоты моногидрата.The pH of the developed syrup, which did not contain pH flavors (buffering agents), was 6.25. To create a pH of about 5.5, buffers were included in the syrup. A nitrate buffer consisting of sodium citrate and citric acid monohydrate was selected.
Были наработаны сиропы, содержащие буферные вещества в различных соотношениях при суммарной их концентрации 0,50 г в 100 мл, что соответствует 0,40 мас.% Составы этих сиропов представлены в табл. 3. На фиг. 3 представлена зависимость рН препарата от соотношения буферных веществ.Syrups containing buffering substances in various ratios were developed at a total concentration of 0.50 g per 100 ml, which corresponds to 0.40 wt.%. The compositions of these syrups are presented in table. 3. In FIG. 3 shows the dependence of the pH of the drug on the ratio of buffer substances.
Как видно из данных, представленных на фиг. 3, с увеличением концентрации лимонной кислоты моногидрата и, соответственно, с уменьшением концентрации натрия цитрата рН сиропов уменьшается. Оптимальное значение рН 5,5 достигается при содержании в 100 мл сиропа лимонной кислоты моногидрата и натрия цитрата около 0,10 г и 0,40 г соответственно.As can be seen from the data presented in FIG. 3, with an increase in the concentration of citric acid monohydrate and, accordingly, with a decrease in the concentration of sodium citrate, the pH of syrups decreases. The optimum pH value of 5.5 is achieved when the content of 100 ml of citric acid syrup monohydrate and sodium citrate is about 0.10 g and 0.40 g, respectively.
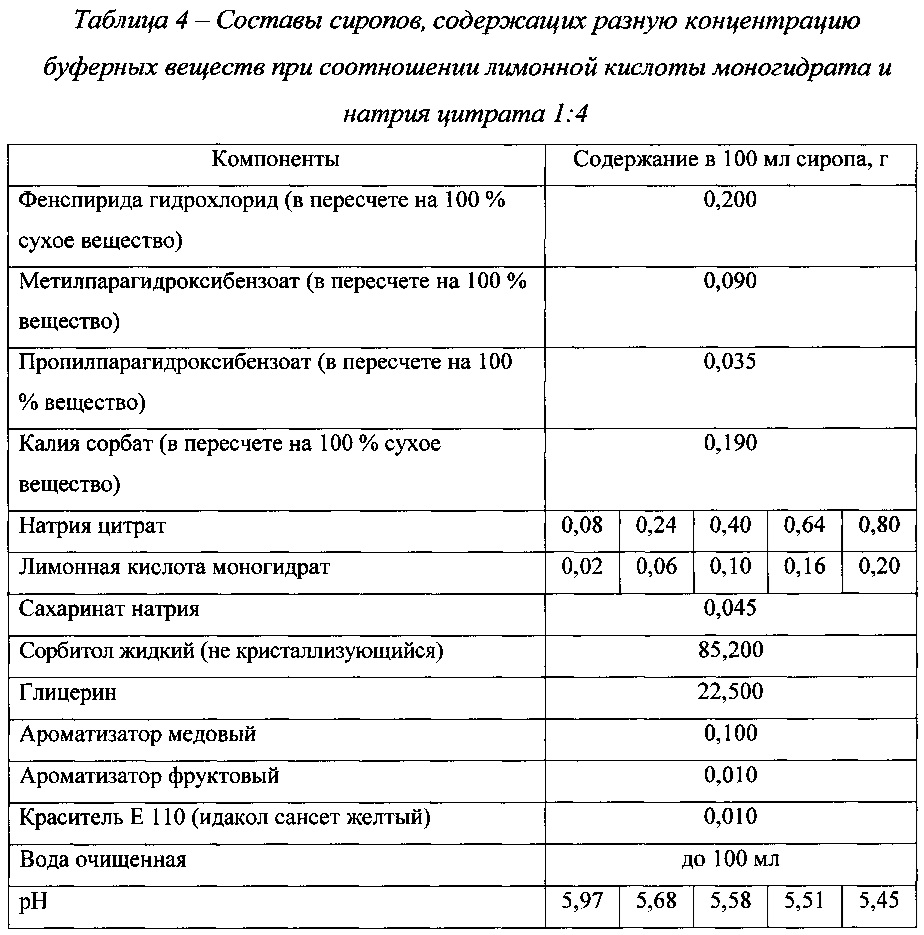
Дальнейшим этапом наших исследований было изучение зависимости рН сиропов от концентрации буферных веществ при выбранном соотношении лимонной кислоты моногидрата и натрия цитрата (1:4). В табл. 4 приведены составы исследуемых сиропов, а на фиг. 4 - результаты исследований.The next step in our research was to study the dependence of the pH of syrups on the concentration of buffer substances at a selected ratio of citric acid monohydrate and sodium citrate (1: 4). In the table. 4 shows the compositions of the studied syrups, and in FIG. 4 - research results.
Как видно из данных, представленных в табл. 4 и на фиг. 4, с увеличением концентрации буферных веществ при выбранном соотношении лимонной кислоты моногидрата и натрия цитрата рН сиропа уменьшается.As can be seen from the data presented in table. 4 and in FIG. 4, with an increase in the concentration of buffer substances at a selected ratio of citric acid monohydrate and sodium citrate, the pH of the syrup decreases.
На основании полученных данных был выбран состав буферных веществ разрабатываемого препарата: лимонной кислоты моногидрат 0,15 г в 100 мл сиропа, что соответствует 0,12 мас.% и натрия цитрата 0,60 г в 100 мл сиропа, что соответствует 0,48 мас.%.Based on the data obtained, the composition of the buffer substances of the preparation under development was selected: citric acid monohydrate 0.15 g in 100 ml of syrup, which corresponds to 0.12 wt.% And sodium citrate 0.60 g in 100 ml of syrup, which corresponds to 0.48 wt. .%.
В состав референтного препарата «Эреспал» в качестве отдушек The composition of the reference drug "Erespal" as fragrances
входят ароматизирующий состав с оттенками медового запаха, настойка ванильная и солодки корней экстракт в концентрациях 0,5 г/100 мл, 0,4 г/100 мл и 0,2 г/100 мл соответственно.includes a flavoring composition with hints of honey smell, tincture of vanilla and licorice root extract in concentrations of 0.5 g / 100 ml, 0.4 g / 100 ml and 0.2 g / 100 ml, respectively.
В состав разрабатываемого препарата в качестве отдушек были включены ароматизатор медовый и ароматизатор фруктовый. Были приготовлены сиропы, содержащие эти ароматизаторы в разных концентрациях. На добровольцах проведена органолептическая оценка каждого сиропа. Результаты представлены в таблице 5.The composition of the developed product as fragrances included honey flavoring and fruit flavoring. Syrups containing these flavors in different concentrations were prepared. Organoleptic evaluation of each syrup was performed on volunteers. The results are presented in table 5.
По результатам органолептических исследований в состав разрабатываемого препарата включены ароматизатор медовый в концентрация 0,10 г/100 мл и ароматизатор фруктовый в концентрация 0,01 г/100 мл, что соответствует 0,080 мас.% и 0,008 мас.%, соответственно.According to the results of organoleptic studies, the composition of the developed drug included honey flavoring at a concentration of 0.10 g / 100 ml and fruit flavoring at a concentration of 0.01 g / 100 ml, which corresponds to 0.080 wt.% And 0.008 wt.%, Respectively.
В результате исследований по разработке препарата «Фенспирид сироп» 2 мг/мл, авторы настоящего изобретения пришли к следующим выводам относительно состава вспомогательных веществ, входящих в его состав:As a result of research on the development of the drug "Fenspiride Syrup" 2 mg / ml, the authors of the present invention came to the following conclusions regarding the composition of excipients included in its composition:
1. Выбор корригентов вкуса. В качестве основного корригента вкуса выбран сорбитол жидкий некристаллизующийся. На основании экспериментальных данных и изучения физико-химических свойств сиропов, содержащих сорбитол жидкий некристаллизующийся в разных концентрациях (реологических свойств сиропов и их плотности) была выбрана его концентрация 85,2 г в 100 мл сиропа, что соответствует 68,16 мас.%.1. The choice of flavoring flavor. Non-crystallizing liquid sorbitol was chosen as the main flavoring agent for the taste. Based on experimental data and the study of the physicochemical properties of syrups containing non-crystalline liquid sorbitol non-crystallizing in different concentrations (rheological properties of syrups and their density), its concentration of 85.2 g in 100 ml of syrup was selected, which corresponds to 68.16 wt.%.
2. Выбор корригентов рН (буферных веществ). Замена сахарозы, входящей в состав референтного препарата, на сорбитол жидкий некристаллизующийся повлекло за собой изменение рН препарата. В связи с этим в состав препарата был введен цитратный буфер, включающий натрия цитрат и лимонную кислоту моногидрат в концентрации 0,60 г/100 мл и 0,15 г/100 мл соответственно (0,48 мас.% и 0,12 мас.% соответственно). 2. The choice of pH flavors (buffer substances). The replacement of sucrose, which is part of the reference preparation, with non-crystallizing liquid sorbitol caused a change in the pH of the preparation. In this regard, a citrate buffer was introduced into the preparation, including sodium citrate and citric acid monohydrate at a concentration of 0.60 g / 100 ml and 0.15 g / 100 ml, respectively (0.48 wt.% And 0.12 wt. % respectively).
Выбранный качественный и количественный состав буферных веществ обеспечивает рН препарата в установленных пределах от 5,0 до 6,0.The selected qualitative and quantitative composition of the buffer substances provides the pH of the drug in the established range from 5.0 to 6.0.
3. Выбор ароматизаторов. На основании результатов органолептических исследований в состав препарата были включены ароматизатор медовый в концентрации 0,1 г/100 мл и ароматизатор фруктовый в концентрации 0,01 г/100 мл, что соответствует 0,080 мас.% и 0,008 мас.%, соответственно.3. The choice of flavorings. Based on the results of organoleptic studies, the composition of the drug included honey flavoring at a concentration of 0.1 g / 100 ml and fruit flavoring at a concentration of 0.01 g / 100 ml, which corresponds to 0.080 wt.% And 0.008 wt.%, Respectively.
4. Выбор антимикробных консервантов. В состав разрабатываемого препарата были включены метилпарагидроксибензоат (0,090 г/100 мл или 0,072 мас.%), пропилпарагидроксибензоат (0,035 г/100 мл или 0,028 мас.%) и калия сорбат (0,19 г/100 мл или 0,152 мас.%). Выбранный качественный и количественный состав консервантов обеспечивает антимикробное консервирующее действие, соответствующее требованиям ЕФ 8.0 (5.1.3) к лекарственным средствам для приема внутрь и требованиям ГФ РФ XII издания (статья 34) к лекарственным средствам категории 3.4. The choice of antimicrobial preservatives. The composition of the developed product included methyl parahydroxybenzoate (0.090 g / 100 ml or 0.072 wt.%), Propyl parahydroxybenzoate (0.035 g / 100 ml or 0.028 wt.%) And potassium sorbate (0.19 g / 100 ml or 0.152 wt.%) . The selected qualitative and quantitative composition of preservatives provides an antimicrobial preservative effect that complies with the requirements of EF 8.0 (5.1.3) for drugs for oral administration and the requirements of the RF Civil Fund of the XII edition (Article 34) for
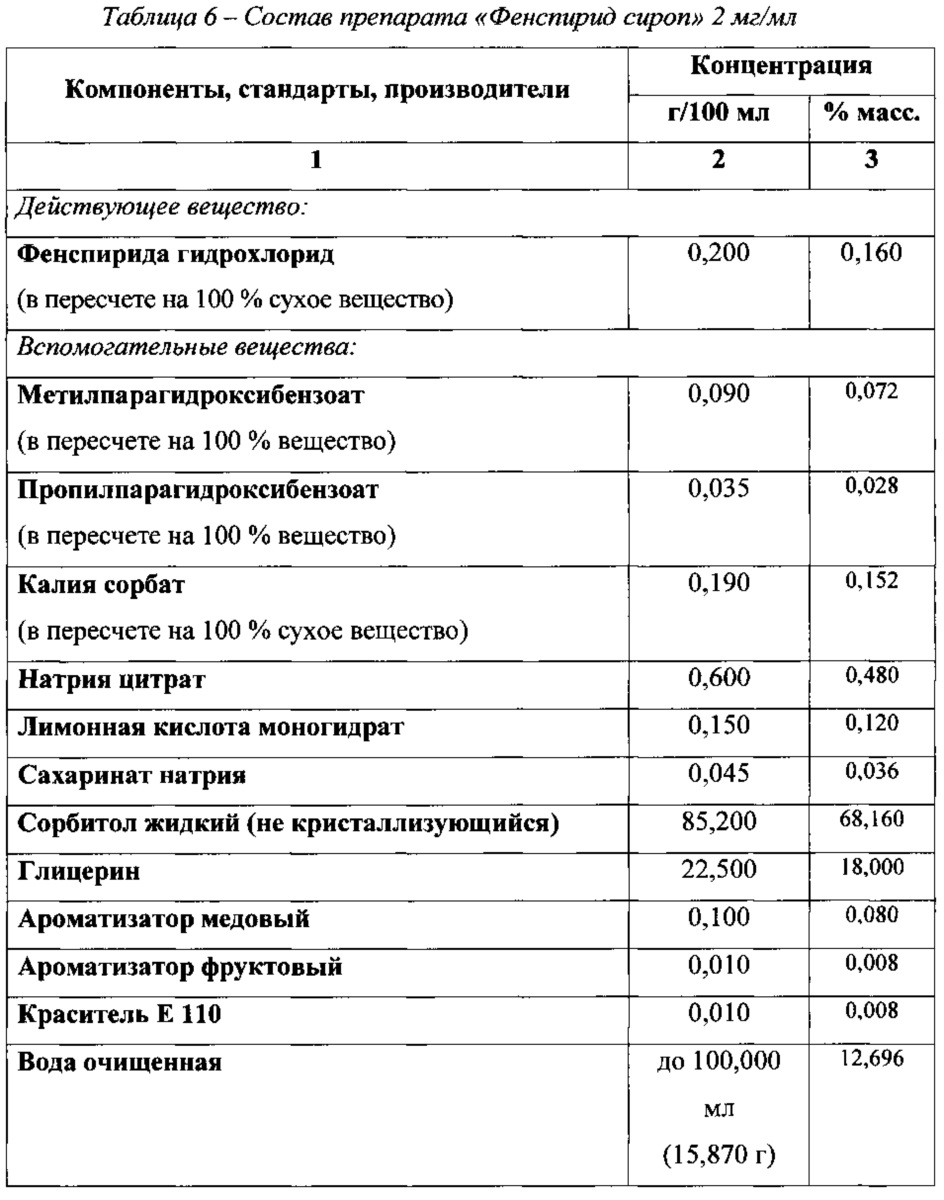
Таким образом, на основании результатов проведенных исследований был обоснован состав препарата «Фенспирид сироп» 2 мг/мл, представленный в таблице 6Thus, based on the results of the studies, the composition of the drug “Fenspiride syrup” 2 mg / ml, which is presented in table 6, was substantiated.
В результате проведенных комплексных исследований, экспериментальным путем, авторами настоящего изобретения была получена жидкая лекарственная форма фенспирида в виде сиропа, физико-химические и биологические свойства, а также показатели качества которой, подтверждают рациональность выбранного состава, для достижения цели настоящего изобретения и решения проблемы замещения сахарозы.As a result of comprehensive studies, experimentally, the authors of the present invention obtained a liquid dosage form of fenspiride in the form of a syrup, physico-chemical and biological properties, as well as quality indicators of which confirm the rationality of the selected composition, to achieve the purpose of the present invention and solve the problem of sucrose substitution .
Ниже представлены сравнительные результаты анализа разработанного препарата «Фенспирид сироп» 2 мг/мл и препарата «Эреспал®» сироп 2 мг/мл, заявленного авторами настоящего изобретения в качестве прототипа.Below are the comparative results of the analysis of the developed drug "Fenspiride syrup" 2 mg / ml and the drug "Erespal®"
Реологические свойстваRheological properties
Для определения условий хранения препарата было исследовано влияние колебаний температуры на реологические и физические свойства разрабатываемого препарата.To determine the storage conditions of the drug, the effect of temperature fluctuations on the rheological and physical properties of the drug being developed was investigated.
Препарат хранили в течение 2 мес. при температуре -8°С, после чего выдерживали при температуре 25°С до постоянной температуры препарата и снимали его реограмму, а также реограмму препарата этой же серии, хранившегося после наработки при температуре 25°С (фиг. 5). Кроме того, были сделаны фотографии указанных образцов препарата (фиг. 6).The drug was stored for 2 months. at a temperature of -8 ° C, after which it was kept at a temperature of 25 ° C to a constant temperature of the preparation and its rheogram was taken, as well as a rheogram of a preparation of the same series stored after operating time at a temperature of 25 ° C (Fig. 5). In addition, photographs were taken of these samples of the drug (Fig. 6).
Как видно по данным, представленным на фиг. 5 и 6, замораживание и последующее размораживание препарата не нарушает его физическую стабильность, все компоненты остаются в растворенном состоянии. Реограммы препаратов, подвергавшегося и не подвергавшегося замораживанию, практически совпадают, структурная вязкость при различных градиентах скорости сдвига практически не отличается.As can be seen from the data presented in FIG. 5 and 6, freezing and subsequent thawing of the drug does not violate its physical stability, all components remain in a dissolved state. The rheograms of the preparations subjected to and not subjected to freezing practically coincide, the structural viscosity at different shear rate gradients is practically the same.
На фиг. 7 представлены реограммы препарата «Фенспирид сироп» 2 мг/мл при разных температурах, а на фиг. 8 - зависимость структурной вязкости сиропа от температуры.In FIG. 7 shows rheograms of the preparation “Fenspiride syrup” 2 mg / ml at different temperatures, and in FIG. 8 - dependence of the structural viscosity of the syrup on temperature.
Как видно из реограмм, приведенных на фиг. 7, препарат в интервале температур от 15 до 45°С имеет тип течения близкий к ньютоновскому, тиксотропные свойства у препарата при всех изученных температурах отсутствуют. Что касается структурной вязкости, то она уменьшается с увеличением температуры (фиг. 8). Так, при увеличении температуры с 15 до 45°С значения структурной вязкости уменьшаются на ~80%. Изменения реопараметров с изменением температуры обратимы.As can be seen from the rheograms shown in FIG. 7, the drug in the temperature range from 15 to 45 ° C has a flow type close to Newtonian; the drug has no thixotropic properties at all temperatures studied. As for structural viscosity, it decreases with increasing temperature (Fig. 8). So, with an increase in temperature from 15 to 45 ° С, the values of structural viscosity decrease by ~ 80%. Changes in rheoparameter with temperature change are reversible.
На фиг. 9 приведены реограммы разработанного и референтного препаратов, а в таблице 7 - значения их структурной вязкости при разных градиентах напряжения сдвига.In FIG. Figure 9 shows the rheograms of the developed and reference preparations, and Table 7 shows the values of their structural viscosity at different shear stress gradients.
Как видно из данных, представленных на фиг. 9 и в табл. 7, реопараметры разработанного и референтного препаратов практически не отличаются.As can be seen from the data presented in FIG. 9 and tab. 7, the reoparameters of the developed and reference drugs are practically the same.
Гиперосмолярные свойстваHyperosmolar properties
Были проведены сравнительные исследования кинетики абсорбции воды разработанным и референтным препаратами. Результаты исследований представлены на фиг. 10. Как видно из представленных данных осмотическая активность разрабатываемого и референтного препаратов практически не отличается.Comparative studies of the kinetics of water absorption by developed and reference drugs were carried out. The research results are presented in FIG. 10. As can be seen from the data presented, the osmotic activity of the developed and reference drugs is practically the same.
СтабильностьStability
Совместимость фенспирида гидрохлорида со вспомогательными веществами и его стабильность в разработанном препарате «Фенспирид сироп» 2 мг/мл подтверждены результатами исследования его стабильности, приведенными ниже.The compatibility of fenspiride hydrochloride with excipients and its stability in the developed preparation "Fenspiride Syrup" 2 mg / ml are confirmed by the results of a study of its stability, given below.
Исследования были проведены на трех опытных сериях (011113, 021113 и 031113) препарата «Фенспирид сироп» 2 мг/мл. На хранение были заложены образцы опытных серий, изготовленные в реакторе-гомогенизаторе РП-500, моделирующем промышленное оборудование, и расфасованные во флаконы по 100 мл. Масса каждой серии нерасфасованной продукции составляла 3,75 кг (3,0 л).The studies were carried out on three experimental series (011113, 021113 and 031113) of the
Для указанных трех серий были проведены долгосрочные испытания при хранении образцов при температуре (25±1)°С и ускоренные испытания при хранении образцов при температуре (40±1)°С.For these three series, long-term tests were carried out during storage of samples at a temperature of (25 ± 1) ° C and accelerated tests during storage of samples at a temperature of (40 ± 1) ° C.
Долгосрочные и ускоренные испытания серий 011113, 021113 и 031113 были запланированы в соответствии с рекомендациями Руководства CPMP/ICH/2736/99 (ICH Topic Q1A (R2)) «Note for Guidance on Stability Testing: Stability Testing of New Drug Substances and Products)); протокол включал исходный анализ трех серий, анализ через 3 месяца в первый год хранения, через 6 месяцев во второй год хранения.Long-term and accelerated testing of the 011113, 021113 and 031113 series were planned in accordance with the recommendations of CPMP / ICH / 2736/99 (ICH Topic Q1A (R2)) (Note for Guidance on Stability Testing: Stability Testing of New Drug Substances and Products)) ; the protocol included an initial analysis of three series, analysis after 3 months in the first year of storage, after 6 months in the second year of storage.
Данные о стабильности представлены в таблицах 8 и 9 и на фиг. 11-14.Stability data are presented in tables 8 and 9 and in FIG. 11-14.
В результате долгосрочных испытаний стабильности при температуре 25°С в течение 6 месяцев (периода изучения стабильности) существенных изменений в показателях качества препарата не произошло; препарат выдерживал испытания по всем показателям спецификации.As a result of long-term stability tests at 25 ° C for 6 months (stability study period), there were no significant changes in the quality indicators of the drug; the drug passed the tests for all indicators of the specification.
Настоящее изобретение также относится к способу получения жидкой лекарственной формы фенспирида, который, учитывая свойства компонентов, входящих в его состав, включает следующие основные технологические процессы:The present invention also relates to a method for producing a liquid dosage form of fenspiride, which, given the properties of the components included in its composition, includes the following basic processes:
- приготовление раствора;- preparation of a solution;
- растворение фенспирида гидрохлорида в воде очищенной;- dissolution of fenspiride hydrochloride in purified water;
- приготовление раствора буферных веществ, сахарината натрия и красителя в воде очищенной;- preparation of a solution of buffer substances, sodium saccharinate and dye in purified water;
- введение приготовленных растворов и ароматизатора фруктового в сорбитол, гомогенизация и выгрузка нерасфасованного сиропа из реактора-гомогенизатора;- the introduction of prepared solutions and fruit flavoring in sorbitol, homogenization and unloading of bulk syrup from the homogenizing reactor;
Согласно изобретению способ получения жидкой лекарственной формы фенспирида осуществляют следующим образом:According to the invention, a method for producing a liquid dosage form of fenspiride is as follows:
В емкость №1 загружают глицерин, нагревают, затем загружают предварительно отвешенные метилпарагидроксибензоат, пропилпарагидроксибензоат, калия сорбат и ароматизатор медовый и перемешивают до полного растворения компонентов; одновременно в емкость №2 загружают предварительно отвешенные часть воды очищенной и фенспирида гидрохлорид, который перемешивают до полного растворения; в емкость №3 загружают предварительно отвешенные часть воды очищенной, натрия цитрат, лимонную кислоту моногидрат, натрия сахаринат, краситель Е 110 и перемешивают смесь до полного растворения веществ; затем в реактор-гомогенизатор загружают предварительно отвешенный сорбитол жидкий некристаллизующийся и из емкости №3 количественно переносят раствор вспомогательных веществ, после чего перемешивают смесь в течение 5-10 мин при температуре 20-25°С до получения однородной массы; далее в реактор-гомогенизатор из емкости №1 количественно переносят раствор и перемешивают смесь в течение 5-10 мин при температуре 20-25 С до получения однородной массы; также в реактор-гомогенизатор из емкости №2 количественно переносят раствор фенспирида гидрохлорида и загружают предварительно отвешенный ароматизатор фруктовый, которые перемешивают смесь в течение 5-10 мин при температуре 20-25 С до получения однородного сиропа; в промежуточных емкостях сироп нерасфасованный транспортируют в помещение для дозирования и выгружают частями в бункер дозирующий машины, после чего сироп дозируют во флаконы, укупоривают крышками и упаковывают в пачки.Glycerin is loaded into container No. 1, heated, then pre-weighed methyl parahydroxybenzoate, propyl parahydroxybenzoate, potassium sorbate and honey flavor are loaded and mixed until the components are completely dissolved; at the same time, a previously weighed portion of purified water and fenspiride hydrochloride are loaded into a container No. 2, which is stirred until complete dissolution; in container No. 3 load pre-weighed part of purified water, sodium citrate, citric acid monohydrate, sodium saccharinate, dye E 110 and mix the mixture until the substances are completely dissolved; then pre-weighed sorbitol non-crystallizing liquid is loaded into the homogenizing reactor, and a solution of excipients is quantitatively transferred from tank No. 3, after which the mixture is stirred for 5-10 minutes at a temperature of 20-25 ° C until a homogeneous mass is obtained; then, the solution is quantitatively transferred to the homogenizer from tank No. 1 and the mixture is stirred for 5-10 minutes at a temperature of 20-25 ° C until a homogeneous mass is obtained; also, the solution of fenspiride hydrochloride is quantitatively transferred from the container No. 2 to the homogenizer reactor and the pre-weighed fruit flavor is loaded, which mix the mixture for 5-10 minutes at a temperature of 20-25 ° C until a homogeneous syrup is obtained; in intermediate containers, bulk syrup is transported to the dosing room and unloaded in parts into the hopper of the dosing machine, after which the syrup is dosed into bottles, sealed with lids and packaged in packs.
Claims (3)
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2015136347A RU2607965C1 (en) | 2015-08-26 | 2015-08-26 | Liquid dosage form of fenspiride and production method thereof |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2015136347A RU2607965C1 (en) | 2015-08-26 | 2015-08-26 | Liquid dosage form of fenspiride and production method thereof |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| RU2607965C1 true RU2607965C1 (en) | 2017-01-11 |
Family
ID=58455859
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2015136347A RU2607965C1 (en) | 2015-08-26 | 2015-08-26 | Liquid dosage form of fenspiride and production method thereof |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU2607965C1 (en) |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5272137A (en) * | 1992-02-14 | 1993-12-21 | Mcneil-Pfc, Inc. | Aqueous pharmaceutical suspension for pharmaceutical actives |
| RU2169557C1 (en) * | 1999-12-22 | 2001-06-27 | Александр Афанасьевич Яремчук | Ambroxol syrup for treatment of patients with bronchopulmonal diseases |
| WO2010107404A1 (en) * | 2009-03-16 | 2010-09-23 | Mahmut Bilgic | Stable pharmaceutical combinations |
-
2015
- 2015-08-26 RU RU2015136347A patent/RU2607965C1/en active
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5272137A (en) * | 1992-02-14 | 1993-12-21 | Mcneil-Pfc, Inc. | Aqueous pharmaceutical suspension for pharmaceutical actives |
| RU2169557C1 (en) * | 1999-12-22 | 2001-06-27 | Александр Афанасьевич Яремчук | Ambroxol syrup for treatment of patients with bronchopulmonal diseases |
| WO2010107404A1 (en) * | 2009-03-16 | 2010-09-23 | Mahmut Bilgic | Stable pharmaceutical combinations |
Non-Patent Citations (1)
| Title |
|---|
| Инструкция по медицинскому применению лекарственного препарата Эреспал, дата регистрации 28.06.2010, найдно в Интернет на сайте: http://grls.rosminzdrav.ru/Grls_View_v2.aspx?idReg=141666&t=;. * |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US8541018B2 (en) | Palatable suspending vehicle for pharmaceutical ingredients | |
| JP5695029B2 (en) | Pediatric solutions containing beta-blockers | |
| US20170239217A1 (en) | Anhydrous liquid melatonin composition | |
| US10211534B2 (en) | Sildenafil solutions and methods of making and using same | |
| BRPI0822206B1 (en) | NET FORMULATION FOR DEFERIPRONE WITH A NICE FLAVOR. | |
| US4927638A (en) | Etoposide solutions | |
| TW536403B (en) | An ethanol and ethylenediaminetetraacetic acid free pharmaceutical composition comprising lamivudine and exhibiting antimicrobial preservative efficacy | |
| KR20220003541A (en) | Methods for Treating Neonatal Opioid Withdrawal Syndrome | |
| RU2607965C1 (en) | Liquid dosage form of fenspiride and production method thereof | |
| Kini et al. | Investigating the suitability of Isomalt and liquid glucose as sugar substitute in the formulation of Salbutamol sulfate hard candy lozenges | |
| US20060142254A1 (en) | Antipyretic preparation containing xylitol | |
| Klovrzová et al. | Pediatric oral solutions with propranolol hydrochloride for extemporaneous compounding: the formulation and stability study | |
| UA127658C2 (en) | A pharmaceutical composition in the form of an aqueous solution, preferably a syrup, containing inosine pranobex and zinc gluconate and a method of preparation thereof | |
| CN117883379A (en) | Oral alkaline solvent composition and preparation method and application thereof | |
| Bayor et al. | Assessment of the physico-chemical and microbial quality of selected extemporaneous paediatric oral formulations frequently prepared at Komfo Anokye Teaching Hospital in Kumasi | |
| US11351220B2 (en) | Combined herbal and pharmaceutical composition and method | |
| FR2987559A1 (en) | Composition in form of dispersible paste/aqueous suspension to treat anemia resulting from martial deficiency, comprises ferrous succinate and succinic acid that are dispersed in mixture including polyol, suspending and sweetening agents | |
| EP2873418A1 (en) | A combination of dosage units for use in the treatment of preterm labour condition | |
| CN114159387A (en) | Dextromethorphan hydrobromide oral solution | |
| RU2406494C1 (en) | Analgesic and antipyretic pharmaceutical composition and method for preparing thereof | |
| KR20250018514A (en) | Oral liquid suspension of pan-RAF kinase inhibitor | |
| AU2022491229A1 (en) | Liquid pharmaceutical composition containing flecainide and process for the preparaton thereof | |
| WO2024180567A1 (en) | Room stable hydroxyurea oral suspension | |
| RU2410088C2 (en) | Syrup pharmaceutical composition and method for producing thereof | |
| TW202015702A (en) | A galactose oral composition and application thereof |