RU2602685C1 - Application of l-carnitine as agent reducing risk of fatal arrhythmia - Google Patents
Application of l-carnitine as agent reducing risk of fatal arrhythmia Download PDFInfo
- Publication number
- RU2602685C1 RU2602685C1 RU2015142418/15A RU2015142418A RU2602685C1 RU 2602685 C1 RU2602685 C1 RU 2602685C1 RU 2015142418/15 A RU2015142418/15 A RU 2015142418/15A RU 2015142418 A RU2015142418 A RU 2015142418A RU 2602685 C1 RU2602685 C1 RU 2602685C1
- Authority
- RU
- Russia
- Prior art keywords
- carnitine
- patient
- patients
- dispersion
- myocardial infarction
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/205—Amine addition salts of organic acids; Inner quaternary ammonium salts, e.g. betaine, carnitine
Abstract
Description
Группа изобретений относится к медицине, в частности к кардиологии, и может быть использована для создания средства для снижения риска развития фатальной аритмии, в частности у пациентов с нестабильной стенокардией.The group of inventions relates to medicine, in particular to cardiology, and can be used to create a means to reduce the risk of developing fatal arrhythmias, in particular in patients with unstable angina.
УРОВЕНЬ ТЕХНИКИBACKGROUND
В основе гибели клеток при ишемии или реперфузии лежат изменения энергетического обмена кардиомиоцитов. В частности, происходит снижение запасов аденозинтрифосфорной кислоты (АТФ), так как при ишемии происходит нарушение утилизации энергетических субстратов и снижение синтеза АТФ.Cell death during ischemia or reperfusion is based on changes in the energy metabolism of cardiomyocytes. In particular, adenosine triphosphoric acid (ATP) reserves decrease, since ischemia causes a disruption in the utilization of energy substrates and a decrease in ATP synthesis.
В связи с этим постоянно существует потребность в препарате, способном восстановить энергетический потенциал кардиомиоцитов при остром ишемическом или реперфузионном повреждении, однако многие исследования закончились неудачей [1].In this regard, there is always a need for a drug that can restore the energy potential of cardiomyocytes in acute ischemic or reperfusion injury, however, many studies have failed [1].
Наиболее перспективным подходом считается попытка увеличить окисление в митохондриях клеток глюкозы, либо частично затормозить метаболизм длинноцепочечных жирных кислот (ДЦ-ЖК), которые для своего окисления требуют большие количества кислорода [2].The most promising approach is an attempt to increase the oxidation of glucose cells in the mitochondria, or partially inhibit the metabolism of long chain fatty acids (DC-FA), which require large amounts of oxygen for their oxidation [2].
В частности, одним из таких подходов может быть восстановление содержания L-карнитина, содержание которого в кардиомиоцитах при ишемии резко снижается.In particular, one of such approaches may be the restoration of the content of L-carnitine, the content of which in cardiomyocytes decreases sharply during ischemia.
Следует сказать, что карнитин играет важную роль в энергетическом обмене кардиомиоцитов. Карнитин является ключевым компонентом «карнитинового челнока», ответственного за перенос ДЦ-ЖК внутрь митохондрий кардиомиоцитов. Работа карнитинового челнока сводится к следующему: под влиянием фермента карнитин-пальмитоил трансферазы-1 (КПТ-1), локализованного на наружной мембране митохондрии (MX), происходит перенос ДЦ-ацила с КоА на карнитин, в результате чего образуется эфир ДЦ-ацил-карнитин, который транспортируется специальным переносчиком - ацил-карнитин/карнитин транслоказой (АККТ) - через внутреннюю мембрану MX в обмен на карнитин, который находится в митохондриях. Стехиометрия такого обмена составляет 1:1. Внутри митохондрий ДД-ацильный остаток с помощью фермента КПТ-2 переносится с ДЦ-ацил-карнитина на КоА митохондрий. Образовавшийся ДЦ-ацил-КоА в дальнейшем подвергается β-окислению. Когда поступление ацил-КоА превосходит его использование в цикле β-окисления, ацил-КоА вновь превращается в ацилкарнитин, который удаляется из митохондрий в цитоплазму, а затем из клеток - в кровь. Этот процесс предупреждает накопление ацил-КоА в цитоплазме и тормозит развитие липотоксического эффекта. Вследствие снижения внутримитохондриального пула L-карнитина при повышенном удалении из клеток ДЦ-ацилкарнитинов может происходить ограничение активности матриксного фермента CrAT, который предпочтительно образует эфиры короткоцепочечных ЖК с L-карнитином. Особая роль CrAT в регуляции метаболизма в MX связана со снижением отношения ацетил-КоА/свободный КоА в результате переноса ацетильных остатков на карнитин и увеличением уровня свободного КоА (регенерация КоА), который используется пируватдегидрогеназой (ПДГ), а также ферментом цикла трикарбоновых кислот (цикла Кребса) - α-кетоглютаратдегидрогеназой [3, 4, 5, 6].It should be said that carnitine plays an important role in the energy metabolism of cardiomyocytes. Carnitine is a key component of the "carnitine shuttle," responsible for the transfer of DC-LCD into the mitochondria of cardiomyocytes. The work of the carnitine shuttle boils down to the following: under the influence of the carnitine palmitoyl transferase-1 (KPT-1) enzyme localized on the outer mitochondrial membrane (MX), DC acyl is transferred from CoA to carnitine, resulting in the formation of DC acyl ester carnitine, which is transported by a special carrier - acyl-carnitine / carnitine translocase (ACCT) - through the inner MX membrane in exchange for carnitine, which is located in the mitochondria. The stoichiometry of such an exchange is 1: 1. Inside the mitochondria, the DD-acyl residue is transferred using DCT-2 enzyme from DC-acyl-carnitine to CoA of mitochondria. The resulting DC-acyl-CoA is subsequently subjected to β-oxidation. When the intake of acyl-CoA exceeds its use in the β-oxidation cycle, acyl-CoA again turns into acylcarnitine, which is removed from the mitochondria into the cytoplasm, and then from the cells into the blood. This process prevents the accumulation of acyl-CoA in the cytoplasm and inhibits the development of the lipotoxic effect. Due to the decrease in the intramitochondrial pool of L-carnitine with increased removal of DC acylcarnitines from the cells, a restriction of the activity of the matrix enzyme CrAT, which preferably forms short-chain FA esters with L-carnitine, can occur. A special role of CrAT in the regulation of metabolism in MX is associated with a decrease in the ratio of acetyl-CoA / free CoA as a result of the transfer of acetyl residues to carnitine and an increase in the level of free CoA (CoA regeneration), which is used by pyruvate dehydrogenase (PDH), as well as the tricarboxylic acid cycle enzyme (cycle Krebs) - α-ketoglutarate dehydrogenase [3, 4, 5, 6].
Следует отметить, что некоторые ферменты цикла Кребса, в частности α-кетоглютаратдегидрогеназа, используют большие количества свободного КоА, который образуется из ДЦ-ацил-КоА с участием L-карнитина. Дефицит последнего может тормозить синтез субстратов НАДН, ФАДН2, сукцината и тем самым снижать уровень образования АТФ. В то же время избыточное поступление ацетил-КоА увеличивает генерацию CO2, создавая условия для снижения внутриклеточного pHi и развития ацидоза. Перенос ацетильной группы с ацетил-КоА на карнитин приводит к образованию свободного КоА, который используется во множестве метаболических реакций, протекающих в кардиомиоцитах, включая цикл Кребса, синтез липидов и др. В связи с этим становится ясной важная роль L-карнитина в энергетическом обмене в физиологических условиях и его защитное действие при ишемии. Таким образом, очевидно, что адекватное содержание и обмен L-карнитина в организме имеет большое значение для синтеза АТФ и поддержания функциональной активности кардиомиоцитов [7, 8, 9].It should be noted that some enzymes of the Krebs cycle, in particular α-ketoglutarate dehydrogenase, use large amounts of free CoA, which is formed from DC-acyl-CoA with the participation of L-carnitine. Deficiency of the latter can inhibit the synthesis of substrates NADH, FADN2, succinate and thereby reduce the level of ATP formation. At the same time, the excess supply of acetyl-CoA increases the generation of CO 2 , creating conditions for reducing intracellular pHi and the development of acidosis. The transfer of the acetyl group from acetyl-CoA to carnitine leads to the formation of free CoA, which is used in many metabolic reactions that occur in cardiomyocytes, including the Krebs cycle, lipid synthesis, etc. In this connection, the important role of L-carnitine in energy metabolism becomes clear physiological conditions and its protective effect in ischemia. Thus, it is obvious that the adequate content and metabolism of L-carnitine in the body is of great importance for the synthesis of ATP and the maintenance of the functional activity of cardiomyocytes [7, 8, 9].
Удаление избытка ацетил-КоА из MX в цитоплазму с помощью образования ацетил-карнитина приводит к увеличению синтеза физиологического ингибитора КПТ-1 - малонил-КоА, что тормозит транспорт и окисление ДЦ-ЖК в MX в условиях недостатка кислорода и частично переключает энергетический обмен на окисление метаболита глюкозы - пирувата. Помимо этого, при ишемии L-карнитин участвует в выведении ДЦ-ЖК и их недоокисленных продуктов из MX в цитоплазму, а затем - из клеток, что предупреждает эктопическое накопление липидов в сердце и развитие липоцитотоксического эффекта.Removing excess acetyl-CoA from MX into the cytoplasm by the formation of acetyl-carnitine leads to an increase in the synthesis of the physiological inhibitor of KPT-1, malonyl-CoA, which inhibits the transport and oxidation of DC-LC in MX under conditions of oxygen deficiency and partially switches the energy exchange to oxidation glucose metabolite - pyruvate. In addition, in ischemia, L-carnitine is involved in the excretion of DC-LC and their unoxidized products from MX into the cytoplasm, and then from the cells, which prevents the ectopic accumulation of lipids in the heart and the development of a lipocytotoxic effect.
Один из подходов к улучшению энергетического обмена в кардиомиоцитах при ишемии основан на введении экзогенного L-карнитина, который ускоряет выведение из MX ацетил-КоА, способствует увеличению активности ПДГ и усиливает окисление пирувата. Кроме того, в цитоплазме из ацетил-КоА ферментативно образуется малонил-КоА, который блокирует активность КПТ-1, тормозит окисление ДЦ-ЖК и в еще большей степени усиливает окисление пирувата. Известно, что в период длительной ишемии уровень свободного и общего L-карнитина уменьшен в зоне ишемии и периишемической зоне [10, 11]. Rebuzzi AG и соавторами показано, что введение L-карнитина уменьшает распространенность инфаркта миокарда при введении в течение 8 часов после начала симптомов [12].One approach to improving energy metabolism in cardiomyocytes during ischemia is based on the introduction of exogenous L-carnitine, which accelerates the elimination of acetyl-CoA from MX, increases the activity of PDH and enhances the oxidation of pyruvate. In addition, malonyl-CoA is enzymatically formed from acetyl-CoA in the cytoplasm, which blocks the activity of CPT-1, inhibits the oxidation of DC-FA, and further enhances the oxidation of pyruvate. It is known that during prolonged ischemia, the level of free and total L-carnitine is reduced in the ischemic zone and peri-ischemic zone [10, 11]. Rebuzzi AG et al. Have shown that administration of L-carnitine decreases the incidence of myocardial infarction when administered within 8 hours after the onset of symptoms [12].
Доказательством того, что L-карнитин снижает объем пораженного миокарда при остром инфаркте миокарда, могут служить данные, полученные в нескольких клинических плацебо контролируемых рандомизированных двойных слепых исследованиях, где введение L-карнитина обеспечивало меньший уровень в крови маркеров повреждения миокарда. Так, в исследовании Singh R.B. и соавт. было показано, что в группе пациентов, получавших L-карнитин, в крови были достоверно более низкие уровни КФК (95,5±23,6 против 116,2±26,2 Ме/л на плацебо, р<0,01), ее MB фракции (58,6±16,6 против 73,3±21,5 Ме/л на плацебо, р<0,01), а также меньший индекс QRS на ЭКГ, определенный как сумма зубцов Q и R в отведениях V1-V6 (7,4±1,2 против 10,7±2,0, р<0,01). При этом в группе проходивших лечение L-карнитином отмечали меньшее число эпизодов ишемии (17,6% против 36,0%; ОШ составило -0,49 (0,98, 0,24)) и число пациентов с сердечной недостаточностью III/IV функционального класса по NYHA в сочетании с увеличением левого желудочка (23,4% против 36,0% пациентов; ОШ-0,56 (1,86, 0,17)) [13, 14].Evidence that L-carnitine reduces the volume of the affected myocardium in acute myocardial infarction can be obtained from several clinical placebo-controlled randomized double-blind trials, where the administration of L-carnitine provided a lower level of blood markers of myocardial damage. So, in a study by Singh R.B. et al. it was shown that in the group of patients receiving L-carnitine, the blood had significantly lower levels of CK (95.5 ± 23.6 versus 116.2 ± 26.2 Me / L on placebo, p <0.01), its MB fraction (58.6 ± 16.6 versus 73.3 ± 21.5 Me / L on placebo, p <0.01), as well as a lower QRS index on the ECG, defined as the sum of the Q and R waves in leads V1 -V6 (7.4 ± 1.2 vs 10.7 ± 2.0, p <0.01). Moreover, in the group treated with L-carnitine, a smaller number of episodes of ischemia was noted (17.6% versus 36.0%; OR was -0.49 (0.98, 0.24)) and the number of patients with heart failure III / IV functional class according to NYHA in combination with an increase in the left ventricle (23.4% versus 36.0% of patients; OSH-0.56 (1.86, 0.17)) [13, 14].
В двойном слепом плацебо контролируемом исследовании CEDIM (The L-Carnitine Ecocardiografia Digitalizzata Infarto Miocardico, 472 пациента с первичным передним ИМ) L-карнитин или плацебо вводили в течение 5 дней внутривенно в суточной дозе 9 г и затем в течение 12 месяцев внутрь в суточной дозе 6 г. В группе, получавшей L-карнитин, наблюдалось достоверное снижение объемов сердца, начиная с третьего месяца терапии (конечно-систолический объем 55,0±1,63 мл против 58,9±1,75 мл, р=0,03 и конечно-диастолический - 99,3±2,06 мл против 105,4±2,37 мл, р=0,01). Значимых различий в величине ФВ к 12 месяцу лечения не наблюдалось (45,8±0,57% против 45,2±0,52%, р=0,46). В другом исследовании (160 пациентов после ИМ) показано, что прием L-карнитина в течение одного года по сравнению с плацебо приводил к большему улучшению систолического АД, функции левого желудочка и уменьшению частоты приступов стенокардии [13].In a CEDIM double-blind, placebo-controlled study (The L-Carnitine Ecocardiografia Digitalizzata Infarto Miocardico, 472 patients with primary anterior MI), L-carnitine or placebo was administered intravenously for 5 days at a daily dose of 9 g and then for 12 months, orally at a daily dose 6 g. In the group receiving L-carnitine, a significant decrease in heart volumes was observed starting from the third month of therapy (end-systolic volume 55.0 ± 1.63 ml versus 58.9 ± 1.75 ml, p = 0.03 and end-diastolic - 99.3 ± 2.06 ml versus 105.4 ± 2.37 ml, p = 0.01). Significant differences in the amount of PV by the 12th month of treatment were not observed (45.8 ± 0.57% versus 45.2 ± 0.52%, p = 0.46). Another study (160 patients after myocardial infarction) showed that taking L-carnitine for one year compared with placebo led to a greater improvement in systolic blood pressure, left ventricular function and a decrease in the frequency of angina attacks [13].
Показано, что в условиях ишемии L-карнитин предотвращает накопление эфиров жирных кислот, которое может приводить к возникновению фатальных желудочковых аритмий (ЖА). В нескольких работах проводилась оценка влияния L-карнитина у пациентов с острым инфарктом миокарда. Однако данные по снижению смертности пациентов с ИМ разноречивы, что может быть обусловлено различными протоколами введения карнитина. Так, в исследовании CEDIM различий в смертности получено не было, не было различий также в комбинированной точке - частота смертельных исходов + случаи развития сердечной недостаточности (6% против 9.6% в группе плацебо, н.д.) [14, 15]. В других исследованиях отмечено значительное уменьшение смертности (1,2 против 12,5%, р<0.005). Меньшим был комбинированный показатель «смерть по сердечным причинам+нефатальный инфаркт миокарда» (15,6% против 26% в группе плацебо). Положительный эффект возможно обусловлен протективным эффектом в отношении некроза сердца и осложнений в течение первых 28 дней [13, 16]. В рандомизированном двойном слепом плацебо контролируемом исследовании CEDIM 2 (2330 пациентов с острым передним ИМ) было получено значимое снижение ранней смертности после инфаркта миокарда - на 5 сутки острого периода снижение составило 39% (ОР=0.61, 95% ДИ 0.37-0.98, р=0.04). Отчасти снижение смертности в ранние сроки инфаркта миокарда (2-е сутки) может быть обусловлено снижением у большего числа пациентов желудочковых экстрасистол высоких градаций (IVa и IVb по Lown) при введении 5 г L-карнитина, чем у пациентов, получавших плацебо (р=0.028) [17, 18]. Близкие данные получены в параллельном двойном слепом плацебо контролируемом исследовании у 56 пациентов с ИМ, которым в течение 36 часов вводили L-карнитин в дозе 100 мг/кг каждые 12 часов в период от 5 до 12 часов от начала заболевания. В группе получавших L-карнитин эпизоды нарушений ритма уменьшались на 80% и достоверно снижалось время регистрации мультиформных или парных экстрасистол [19].It has been shown that under ischemic conditions, L-carnitine prevents the accumulation of fatty acid esters, which can lead to the occurrence of fatal ventricular arrhythmias (VA). Several studies have evaluated the effects of L-carnitine in patients with acute myocardial infarction. However, the data on reducing mortality in patients with MI are contradictory, which may be due to different protocols for the administration of carnitine. Thus, in the CEDIM study, there were no differences in mortality, there were also no differences in the combined point — mortality rate + heart failure (6% versus 9.6% in the placebo group, n.d.) [14, 15]. Other studies showed a significant decrease in mortality (1.2 versus 12.5%, p <0.005). The combined indicator “death due to cardiac causes + nonfatal myocardial infarction” was lower (15.6% versus 26% in the placebo group). The positive effect is probably due to the protective effect against cardiac necrosis and complications during the first 28 days [13, 16]. In a randomized, double-blind, placebo-controlled study of CEDIM 2 (2330 patients with acute anterior MI), a significant decrease in early mortality after myocardial infarction was obtained - on the 5th day of the acute period, the decrease was 39% (RR = 0.61, 95% CI 0.37-0.98, p = 0.04). In part, a decrease in mortality in the early stages of myocardial infarction (day 2) may be due to a decrease in a greater number of patients with high grade ventricular extrasystoles (IVa and IVb according to Lown) with the introduction of 5 g of L-carnitine than in patients receiving placebo (p = 0.028) [17, 18]. Close data were obtained in a parallel double-blind, placebo-controlled study in 56 patients with MI who were injected with L-carnitine at a dose of 100 mg / kg every 12 hours for a period of 5 to 12 hours from the onset of the disease for 36 hours. In the group receiving L-carnitine, episodes of rhythm disturbances decreased by 80% and the time of registration of multiform or paired extrasystoles was significantly reduced [19].
В нескольких исследованиях оценено влияние L-карнитина при операциях коронарной реваскуляризации. Так, среди пациентов, которым в течение 24 часов после проведения чрескожной транслюминальной коронарной ангиопластики (ЧТКА) по поводу инфаркта миокарда без подъема ST, вводили L-карнитин в дозе 5 г в день болюсом за 30 минут до ЧТКА и в последующие 3 дня по 10 г в день инфузионно, меньшим (Р<0,01) был максимальный уровень креатинфосфокиназы (МВ-КФК) через 12 и 24 часа после оперативного вмешательства, и тропонина I через 8 часов. Мультивариантный анализ показал, что терапия L-карнитином была независимым предиктором меньшего уровня МВ-КФК (r=0.596, Р<0.001) и тропонина-I (r=0.633, P<0.001). Внутривенное введение пропионил-L-карнитина до операций аортокоронарного шунтирования значительно улучшало раннее послеоперационное восстановление у больных сахарным диабетом, что проявлялось увеличением сердечного индекса и снижением давления в легочной артерии. При проведении экстракорпорального кровообращения во время аорто-коронарного шунтирования (АКШ) назначение L-карнитина предупреждало развитие ишемических изменений и сохраняло в пределах нормальных значений уровень лактата, пирувата, отношения сукцинат/фумарат, отражающих гликолитический клеточный метаболизм, в отличие от группы плацебо [20, 21, 22].Several studies have evaluated the effect of L-carnitine on coronary revascularization operations. So, among patients who, within 24 hours after percutaneous transluminal coronary angioplasty (PTCA) for myocardial infarction without raising ST, L-carnitine was administered at a dose of 5 g daily by bolus 30 minutes before PTCA and in the next 3 days, 10 g per day infusion, lower (P <0.01) was the maximum level of creatine phosphokinase (MV-CPK) 12 and 24 hours after surgery, and troponin I after 8 hours. Multivariate analysis showed that L-carnitine therapy was an independent predictor of lower levels of MV-CPK (r = 0.596, P <0.001) and troponin-I (r = 0.633, P <0.001). Intravenous administration of propionyl-L-carnitine before coronary artery bypass grafting significantly improved early postoperative recovery in patients with diabetes mellitus, which was manifested by an increase in the cardiac index and a decrease in pressure in the pulmonary artery. During extracorporeal circulation during aorto-coronary artery bypass grafting (CABG), the administration of L-carnitine prevented the development of ischemic changes and kept lactate, pyruvate, and succinate / fumarate ratios reflecting glycolytic cellular metabolism within normal values, unlike the placebo group [20, 21, 22].
Весьма интересные и важные данные были получены у пациентов с кардиогенным шоком (27 человек). В открытом исследовании показано, что назначение L-карнитина в виде внутривенного болюсного введения 4 г с последующей инфузией 6 г в период шока обеспечило к 10 дню 77,8% выживаемость пациентов, что существенно превышает указываемые в литературе 25-30%. Важно, что препарат хорошо переносится, и при длительном приеме не было необходимости в его отмене из-за побочных эффектов [23].Very interesting and important data were obtained in patients with cardiogenic shock (27 people). In an open study, it was shown that the administration of L-carnitine in the form of an intravenous bolus injection of 4 g followed by infusion of 6 g during the period of shock provided 77.8% patient survival by day 10, which significantly exceeds 25-30% indicated in the literature. It is important that the drug is well tolerated, and with prolonged use there was no need to cancel it due to side effects [23].
Однако все проведенные к настоящему времени исследования касаются лечения пациентов с острым инфарктом миокарда, и нет исследований, подтверждающих успешное применение L-карнитина у пациентов с нестабильной стенокардией (НС).However, all the studies carried out to date concern the treatment of patients with acute myocardial infarction, and there are no studies confirming the successful use of L-carnitine in patients with unstable angina pectoris (NS).
В то же время ранее было показано, что другой метаболический цитопротектор - триметазидин может оказывать выраженное положительное действие у пациентов с нестабильной стенокардией. В исследовании была изучена и обоснована возможность применения триметазидина при НС. В рандомизированном плацебо-контролируемом исследовании у 50 пациентов с НС оценено влияние добавления триметазидина с модифицируемым высвобождением к стандартной терапии острого коронарного синдрома (ОКС) на динамику ангинозных приступов, суммарную депрессию сегмента ST и длительность QT. В течение 6 месяцев проводился контроль над клиническими событиями. В группе больных, лечившихся триметазидином, число приступов стенокардии в неделю было меньшим, чем в группе получавших стандартную терапию, соответственно, к 7 суткам лечения (2,7±1,06 против 7,1±0,95, р<0,05); к 30 суткам лечения (0,5±0,09 против 5,3±1,14, р<0,01); и через 6 месяцев от начала заболевания (0,7±0,12 против 2,0±0,14, р<0,01). Отмечено более быстрое достоверное уменьшение суммарной депрессии сегмента ST в грудных отведениях: через 2 часа - до 1,14±0,2 мм в группе пациентов, проходивших лечение триметазидином, и 2,60±0,3 мм в группе получавших стандартную терапию, а также на 3 сутки (1,11±0,2 мм против 2,09±0,3 мм), на 7 сутки (1,09±0,1 мм и 2,03±0,1 мм) и 30 сутки лечения (0,76±0,1 мм и до 1,95±0,1 мм, р<0,01). Длительность QT в группе пациентов, проходивших лечение триметазидином, снижалась быстрее, особенно у лиц с исходно удлиненным QT интервалом. Количество неблагоприятных сердечно-сосудистых исходов за 6 месяцев наблюдения (инфаркт миокарда, смерть, повторные госпитализации, операции реваскуляризации) также было достоверно меньшим в группе, принимавших триметазидин (8 случаев против 25 случаев, достоверность различий по методу Фишера - 0,0016). Было сделано заключение, что метаболический цитопротектор триметазидин оказывает выраженное противоишемическое действие у пациентов с нестабильной стенокардией и его включение в комплексную терапию больных целесообразно [24].At the same time, it was previously shown that another metabolic cytoprotector, trimetazidine, can have a pronounced positive effect in patients with unstable angina pectoris. The study examined and justified the possibility of using trimetazidine in NS. In a randomized, placebo-controlled study in 50 patients with NS, the effect of the addition of modifiable release trimetazidine to standard therapy for acute coronary syndrome (ACS) on the dynamics of anginal attacks, total ST segment depression, and QT duration was evaluated. Clinical events were monitored for 6 months. In the group of patients treated with trimetazidine, the number of angina attacks per week was less than in the group receiving standard therapy, respectively, by 7 days of treatment (2.7 ± 1.06 versus 7.1 ± 0.95, p <0.05 ); by 30 days of treatment (0.5 ± 0.09 versus 5.3 ± 1.14, p <0.01); and after 6 months from the onset of the disease (0.7 ± 0.12 versus 2.0 ± 0.14, p <0.01). A faster reliable decrease in total ST segment depression in the chest leads was noted: after 2 hours, to 1.14 ± 0.2 mm in the group of patients treated with trimetazidine, and 2.60 ± 0.3 mm in the group receiving standard therapy, and also on day 3 (1.11 ± 0.2 mm vs 2.09 ± 0.3 mm), on day 7 (1.09 ± 0.1 mm and 2.03 ± 0.1 mm) and 30 days of treatment (0.76 ± 0.1 mm and up to 1.95 ± 0.1 mm, p <0.01). The duration of QT in the group of patients treated with trimetazidine decreased faster, especially in individuals with an initially extended QT interval. The number of adverse cardiovascular outcomes after 6 months of observation (myocardial infarction, death, repeated hospitalizations, revascularization operations) was also significantly lower in the group taking trimetazidine (8 cases versus 25 cases, the significance of the differences according to the Fisher method was 0.0016). It was concluded that the metabolic cytoprotector trimetazidine has a pronounced anti-ischemic effect in patients with unstable angina and it is advisable to include it in the complex therapy of patients [24].
Однако существует и сложность в использовании триметазидина, обусловленная отсутствием лекарственной формы препарата для внутривенного введения, что задерживает начало действия препарата.However, there is a difficulty in using trimetazidine, due to the lack of a dosage form of the drug for intravenous administration, which delays the onset of the drug.
За ближайший аналог заявленного изобретения принят способ снижения риска развития фатальной аритмии, описанный в [24].For the closest analogue of the claimed invention adopted a method of reducing the risk of fatal arrhythmia, described in [24].
Как уже упоминалось выше, данный способ не обладает достаточной эффективностью, т.к. введение триметазидина по данному способу не может быть осуществлено внутривенно.As mentioned above, this method does not have sufficient efficiency, because the introduction of trimetazidine in this way can not be carried out intravenously.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯSUMMARY OF THE INVENTION
В связи с вышесказанным, целью настоящего изобретения является создание нового эффективного способа снижения риска развития фатальной аритмии, а также расширение области применения раствора L-карнитина для внутривенного и внутримышечного введения.In connection with the foregoing, the purpose of the present invention is to provide a new effective way to reduce the risk of developing fatal arrhythmias, as well as expanding the scope of the solution of L-carnitine for intravenous and intramuscular administration.
Техническим результатом настоящего изобретения является снижение риска развития фатальной аритмии за счет снижения оксидативного стресса в клетках MX у пациентов, страдающих острым коронарным синдромом, в частности нестабильной стенокардией или инфарктом миокарда.The technical result of the present invention is to reduce the risk of fatal arrhythmias by reducing oxidative stress in MX cells in patients suffering from acute coronary syndrome, in particular unstable angina pectoris or myocardial infarction.
Технический результат достигается за счет применения раствора L-карнитина для внутривенного и внутримышечного введения в качестве средства для снижения риска увеличения дисперсии QT у пациента.The technical result is achieved through the use of a solution of L-carnitine for intravenous and intramuscular administration as a means to reduce the risk of increasing QT dispersion in a patient.
Варианты осуществления настоящего изобретения относятся также к применению раствора L-карнитина для внутривенного и внутримышечного введения в качестве средства для снижения риска увеличения дисперсии QT у пациентов, страдающих нестабильной стенокардией, а также к способу снижения риска увеличения дисперсии QT у пациентов, в частности у пациентов, страдающих нестабильной стенокардией.Embodiments of the present invention also relate to the use of an L-carnitine solution for intravenous and intramuscular administration as a means to reduce the risk of increasing QT dispersion in patients suffering from unstable angina pectoris, and also to a method of reducing the risk of increasing QT dispersion in patients, in particular in patients suffering from unstable angina.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙBRIEF DESCRIPTION OF THE DRAWINGS
На фиг. 1 приведена диаграмма влияния L-карнитина у пациентов с нестабильной стенокардией.In FIG. 1 is a diagram of the effect of L-carnitine in patients with unstable angina pectoris.
На фиг. 2 приведена диаграмма влияния L-карнитина у пациентов с инфарктом миокарда.In FIG. Figure 2 shows a diagram of the effect of L-carnitine in patients with myocardial infarction.
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯMODES FOR CARRYING OUT THE INVENTION
Соответственно, основным аспектом осуществления настоящего изобретения является применение раствора L-карнитина для внутривенного и внутримышечного введения в качестве средства для снижения риска увеличения дисперсии QT у пациента.Accordingly, a major aspect of an embodiment of the present invention is the use of an L-carnitine solution for intravenous and intramuscular administration as a means to reduce the risk of increasing QT dispersion in a patient.
Другим аспектом осуществления настоящего изобретения является применение раствора L-карнитина для внутривенного и внутримышечного введения в качестве средства для снижения риска увеличения дисперсии QT у пациентов, страдающих нестабильной стенокардией.Another aspect of the implementation of the present invention is the use of a solution of L-carnitine for intravenous and intramuscular administration as a means to reduce the risk of an increase in QT dispersion in patients suffering from unstable angina pectoris.
Другим аспектом настоящего изобретения является способ снижения риска увеличения дисперсии QT у пациента, заключающийся в том, что 4 ампулы раствора «Элькар» (2 г L-карнитина) для внутривенного и внутримышечного введения вводят пациенту внутривенно 2 раза в сутки в течение первых 3 суток с начала лечения, после чего дозу снижают вдвое и продолжают вводить упомянутый раствор пациенту внутривенно в течение 12 суток или до достижения благоприятного эффекта.Another aspect of the present invention is a method of reducing the risk of increasing QT dispersion in a patient, which consists in the fact that 4 ampoules of the Elkar solution (2 g of L-carnitine) for intravenous and intramuscular administration are administered to the patient intravenously 2 times a day for the first 3 days the beginning of treatment, after which the dose is halved and the solution is continued to be administered to the patient intravenously for 12 days or until a favorable effect is achieved.
Другим аспектом настоящего изобретения является способ снижения риска увеличения дисперсии QT у пациента, страдающего нестабильной стенокардией, заключающийся в том, что 4 ампулы раствора «Элькар» (2 г L-карнитина) для внутривенного и внутримышечного введения вводят упомянутому пациенту 2 раза в сутки в течение первых 3 суток с начала лечения, после чего дозу снижают вдвое и продолжают вводить упомянутый раствор упомянутому пациенту внутривенно в течение 12 суток или до достижения благоприятного эффекта.Another aspect of the present invention is a method of reducing the risk of increasing QT dispersion in a patient suffering from unstable angina pectoris, comprising 4 ampoules of Elkar solution (2 g of L-carnitine) for intravenous and intramuscular administration, administered to said patient 2 times a day for the first 3 days from the start of treatment, after which the dose is reduced by half and the solution is continued to be administered to the said patient intravenously for 12 days or until a favorable effect is achieved.
Другим аспектом настоящего изобретения является фармацевтическое средство для снижения риска увеличения дисперсии QT у пациента, содержащее L-карнитин, представляющее собой раствор для внутривенного и внутримышечного введения. Более конкретно упомянутое фармацевтическое средство предназначено для пациента, страдающего острым коронарным синдромом, в частности заболеванием, выбранным из группы: нестабильная стенокардия, острый инфаркт миокарда. Более конкретно упомянутое фармацевтическое средство представляет собой лекарственный препарат для медицинского применения «Элькар» (РУ № ЛСР-006143/10), содержащий L-карнитин в количестве 0,5 г на ампулу.Another aspect of the present invention is a pharmaceutical agent for reducing the risk of increasing QT dispersion in a patient containing L-carnitine, which is a solution for intravenous and intramuscular administration. More specifically, the pharmaceutical agent is intended for a patient suffering from acute coronary syndrome, in particular a disease selected from the group: unstable angina pectoris, acute myocardial infarction. More specifically, the pharmaceutical agent mentioned is a medicinal product for medical use “Elkar” (RU No. LSR-006143/10) containing L-carnitine in an amount of 0.5 g per ampoule.
ДЕТАЛЬНОЕ РАСКРЫТИЕ ИЗОБРЕТЕНИЯDETAILED DISCLOSURE OF THE INVENTION
Раствор «Элькар» для внутривенного и внутримышечного введения (далее по тексту - Элькар, карнитин) является известным из уровня техники препаратом и его состав далее, соответственно, не описывается [25].The Elkar solution for intravenous and intramuscular administration (hereinafter referred to as Elkar, carnitine) is a well-known drug and its composition is not further described, respectively [25].
Для проверки правильности и применимости настоящего технического решения была проведена научно-исследовательская работа, направленная на изучение новой специфической фармакологической активности L-карнитина (Элькара).To verify the correctness and applicability of this technical solution, research work was carried out aimed at studying the new specific pharmacological activity of L-carnitine (Elkara).
В соответствии со ст. 11 Федерального закона «Об обращении лекарственных средств», №61-Ф3, «Доклиническое исследование лекарственного средства для медицинского применения проводится путем применения научных методов оценок в целях получения доказательств безопасности, качества и эффективности лекарственного средства».In accordance with Art. 11 of the Federal Law “On the Circulation of Medicines”, No. 61-F3, “Preclinical research of a medicinal product for medical use is carried out by applying scientific assessment methods in order to obtain evidence of the safety, quality and effectiveness of the medicinal product”.
Для этих целей было проведено проспективное двойное слепое рандомизированное плацебо-контролируемое исследование в параллельных группах.For these purposes, a prospective, double-blind, randomized, placebo-controlled study was conducted in parallel groups.
Для включения пациентов были использованы следующие критерии включения: пациенты с ОКС, не подвергавшиеся инвазивному коронарному вмешательству, старше 18 лет; наличие нестабильной стенокардии, в частности учащение или усиление типичных стенокардических болей, наличие депрессий ST, отсутствие повышения уровня тропонина; подписанное согласие пациента на проведение исследования; и не включения: боли или изменения на ЭКГ, возникшие в связи с повышением артериального давления (АД) (более 180 и 100 мм рт. ст.); кардиогенный шок; хронические заболевания печени и почек с выраженными нарушениями функции; наличие хронических интоксикаций (алкоголизм, наркомания); прием других препаратов метаболического действия.The following inclusion criteria were used to include patients: patients with ACS who did not undergo invasive coronary intervention, over 18 years of age; the presence of unstable angina, in particular, the increase or intensification of typical angina pain, the presence of ST depression, the absence of an increase in troponin level; signed consent of the patient to conduct the study; and not inclusions: pain or ECG changes that have arisen in connection with an increase in blood pressure (BP) (more than 180 and 100 mm Hg); cardiogenic shock; chronic diseases of the liver and kidneys with severe impaired function; the presence of chronic intoxication (alcoholism, drug addiction); taking other drugs with metabolic effects.
Рандомизация пациентов на группу плацебо и группу активного лечения проводилась случайным образом с помощью таблицы простых чисел.Patients were randomized to a placebo group and an active treatment group randomly using a prime table.
Элькар и плацебо назначались сразу после рандомизации пациента. Элькар назначался в следующей дозировке: в течение первых 3 суток по 2 г (по 4 ампулы) 2 раза в сутки (всего 8 ампул в сутки), с 4 суток по 15 сутки (или до достижения благоприятного эффекта, если он наступал раньше) по 2 г (по 4 ампулы) 1 раз в сутки. Продолжительность наблюдения - не менее 15 дней или до выписки из стационара.Elkar and placebo were prescribed immediately after the randomization of the patient. Elkar was prescribed in the following dosage: during the first 3 days, 2 g (4 ampoules) 2 times a day (only 8 ampoules per day), from 4 days to 15 days (or until a favorable effect is achieved if it occurred earlier) 2 g (4 ampoules) 1 time per day. Duration of observation - at least 15 days or until discharge from the hospital.
Действие препарата оценивалось следующим образом. Анализировали параметры электрокардиограммы (ЭКГ) с помощью электрокардиографа и данных эхокардиографического исследования. ЭКГ регистрировали в покое в 12 общепринятых отведениях при скорости движения бумаги 25 мм/с в день поступления и затем на 2, 3, 5, 7 и 12-15 сутки госпитализации. Оценку противоишемического действия проводили по изменению величины суммарного отклонения ST во всех 12 отведениях ЭКГ. Степень депрессии оценивали на расстоянии 0,08 мс от точки J.The effect of the drug was evaluated as follows. The parameters of the electrocardiogram (ECG) were analyzed using an electrocardiograph and data from an echocardiographic study. The ECG was recorded at rest in 12 standard leads at a paper speed of 25 mm / s on the day of receipt and then on the 2nd, 3rd, 5th, 7th and 12-15th days of hospitalization. Evaluation of the anti-ischemic effect was carried out by changing the total ST deviation in all 12 ECG leads. The degree of depression was evaluated at a distance of 0.08 ms from point J.
Интервал QT показывает время общей электрической активности желудочков, включая как деполяризацию, так и реполяризацию. Измерение интервала QT производили вручную от места перехода изоэлектрической линии сегмента P-Q (R) в зубец Q (R) до поздней точки зубца Т, которую определяли как окончание зубца Т в месте пересечения изоэлектрической линии Т-Р с касательной, проведенной по максимальному наклону нисходящей части волны Т. В отведениях, где присутствовала U волна, окончанием Т волны считалась низшая точка между двумя волнами U и Т. Измерение проводилось во II стандартном отведении. Интервал QT и предшествующий ему интервал RR измерялся не менее чем в трех последовательных циклах с расчетом средних значений. Для корректного измерения и клинической интерпретации интервала QT использовалась формула Базетта QTc = QT/√RR, где QTc - интервал QT корригированный, RR - время между соседними зубцами R на ЭКГ. Рассчитывали также дисперсию интервала QT (ΔQT), которую определяли как разницу между максимальной и минимальной длительностью QT интервала в каждом из 12 стандартных отведений поверхностной ЭКГ (ΔQT = QTmax - QTmin). Дисперсия интервала QT отражает региональную неоднородность реполяризации (то есть функционального восстановления) желудочков. Во многих работах показано повышение дисперсии реполяризации после острого инфаркта миокарда и обосновано важное прогностическое значение данного показателя как предиктора возникновения в постинфарктном периоде фатальных аритмий и внезапных сердечных смертей (ВСС) [26]. Повышенную дисперсию QT принято рассматривать как признак неблагоприятного прогноза у широкой категории людей (здоровых, больных с врожденными заболеваниями сердца, ишемической болезнью сердца, инфарктом миокарда и др.). Основанием для этого служат многочисленные исследования, свидетельствующие о том, что у пациентов, перенесших инфаркт миокарда, дисперсия QT выше, чем у лиц, не имевших в анамнезе инфаркта миокарда, и существенно выше у лиц, имеющих пароксизмы желудочковой тахикардии по сравнению с теми, у кого нарушений ритма сердца нет [27]. По мнению большинства исследователей дисперсия QT как маркер негомогенности реполяризации может быть использована для выявления групп высокого риска, в частности риска ВСС [28-30]. Известно, что дисперсия QT увеличивается при острой ишемии, вызванной физической нагрузкой или инфарктом миокарда [31, 32]. При этом так же известно, что дисперсия QT является чувствительным предиктором риска жизнеугрожающих аритмий у пациентов, перенесших инфаркт миокарда [33]. В крупных исследованиях, таких как The Strong Heart Study (1839 участников) и Роттердамское исследование (анализ более 5000 ЭКГ исследований у лиц старше 55 лет), подтверждена предсказательная значимость дисперсии QT в отношении смерти по любой причине и по причинам сердечно-сосудистых заболеваний. Аналогично и проведенный подгрупповой анализ исследования ValHeFT (Valsartan Heart Failure Trial) показал, что дисперсия QT более 70 мс ассоциируется со значимым повышением риска смерти [34-37]. Важно, что дисперсия QT служит предиктором не только краткосрочных, но и долгосрочных прогнозов у пациентов с инфарктом миокарда [38]. Причем дисперсия QT является истинным фактором риска, так как она не только увеличивается при ишемии миокарда, но, что особенно важно, устранение ишемии приводит к отчетливому уменьшению выраженности дисперсии QT. Это наблюдают при успешно проведенной тромболитической терапии и при хирургическом восстановлении коронарного кровотока (в частности, при стентировании) [39-42]. Важным моментом для дальнейшего прогноза является скорость уменьшения дисперсии QT при устранении ишемии. Так, если в ближайшие шесть часов уменьшение было маловыраженным, даже при восстановлении кровотока прогноз был неблагоприятным, при этом смертность была выше (14.6 vs 2.4%, р<0.001) [43].The QT interval shows the time of the total electrical activity of the ventricles, including both depolarization and repolarization. The QT interval was measured manually from the point of transition of the isoelectric line of the PQ (R) segment to the Q wave (R) to the late point of the T wave, which was determined as the end of the T wave at the intersection of the isoelectric line TP with the tangent drawn along the maximum inclination of the descending part T. waves in the leads where the U wave was present, the end of the T wave was considered the lowest point between the two waves U and T. The measurement was carried out in the II standard lead. The QT interval and the preceding RR interval were measured in at least three consecutive cycles with the calculation of average values. For the correct measurement and clinical interpretation of the QT interval, the Bazetta formula QTc = QT / √RR was used, where QTc is the corrected QT interval, RR is the time between adjacent R teeth on the ECG. The dispersion of the QT interval (ΔQT) was also calculated, which was determined as the difference between the maximum and minimum duration of the QT interval in each of the 12 standard leads of the surface ECG (ΔQT = QTmax - QTmin). Dispersion of the QT interval reflects the regional heterogeneity of repolarization (i.e. functional recovery) of the ventricles. Many studies have shown an increase in the dispersion of repolarization after acute myocardial infarction and substantiated the important prognostic value of this indicator as a predictor of the occurrence of fatal arrhythmias and sudden cardiac deaths (SCD) in the post-infarction period [26]. An increased dispersion of QT is considered to be a sign of an unfavorable prognosis in a wide category of people (healthy, patients with congenital heart diseases, coronary heart disease, myocardial infarction, etc.). The basis for this is the numerous studies showing that in patients who have had myocardial infarction, the QT dispersion is higher than in people who did not have a history of myocardial infarction, and significantly higher in people with paroxysms of ventricular tachycardia compared with those in there are no heart rhythm disturbances [27]. According to most researchers, QT dispersion as a marker of repolarization inhomogeneity can be used to identify high-risk groups, in particular, SCD risk [28-30]. It is known that the dispersion of QT increases with acute ischemia caused by exercise or myocardial infarction [31, 32]. It is also known that QT dispersion is a sensitive predictor of the risk of life-threatening arrhythmias in patients after myocardial infarction [33]. Large studies, such as The Strong Heart Study (1839 participants) and the Rotterdam Study (analysis of more than 5000 ECG studies in people over 55 years of age), confirmed the predictive significance of QT dispersion for death for any reason and for reasons of cardiovascular disease. Similarly, a subgroup analysis of the ValHeFT study (Valsartan Heart Failure Trial) showed that a QT dispersion of more than 70 ms is associated with a significant increase in the risk of death [34–37]. It is important that QT dispersion is a predictor of not only short-term, but also long-term prognoses in patients with myocardial infarction [38]. Moreover, the dispersion of QT is a true risk factor, since it not only increases with myocardial ischemia, but, most importantly, elimination of ischemia leads to a clear decrease in the severity of QT dispersion. This is observed with successful thrombolytic therapy and with surgical restoration of coronary blood flow (in particular, with stenting) [39-42]. An important point for further forecasting is the rate of decrease in QT dispersion while eliminating ischemia. So, if in the next six hours the decrease was not pronounced, even with the restoration of blood flow, the prognosis was unfavorable, and the mortality was higher (14.6 vs 2.4%, p <0.001) [43].
В соответствии с критериями включения и не включения в исследование вошли 19 пациентов, клиническая характеристика которых приведена в таблице 1.In accordance with the criteria for inclusion and non-inclusion in the study included 19 patients, the clinical characteristics of which are shown in table 1.
Как видно из приведенных данных, рандомизация была успешной и группы практически не отличались по своим антропометрическим, анамнестическим и клиническим характеристикам, кроме величины ЧСС.As can be seen from the above data, randomization was successful and the groups practically did not differ in their anthropometric, medical history and clinical characteristics, except for the heart rate.
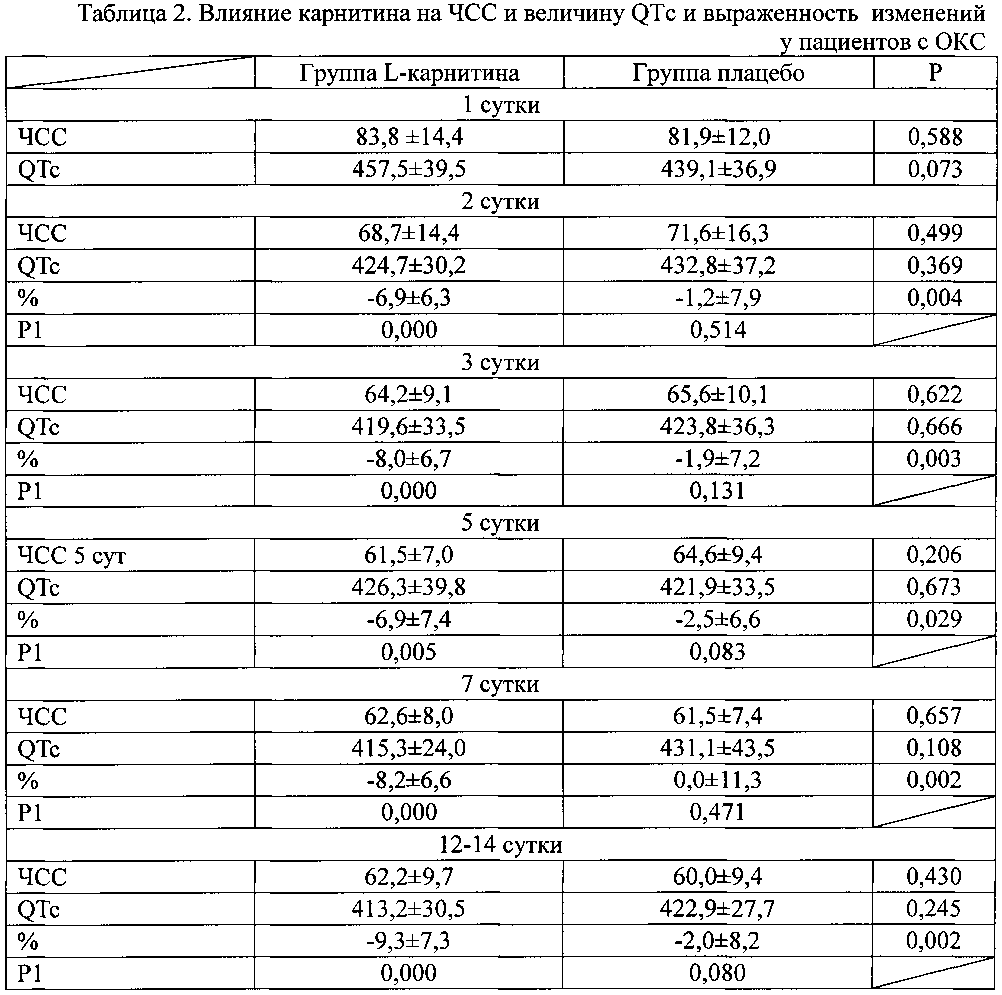
Суммарная величина депрессий сегмента ST в день поступления была одинаково выраженной в обеих группах. Как видно из данных, представленных в таблице 1, в обеих группах больных отмечалось уменьшение значений QTc. Однако в группе получавших плацебо это снижение не было достоверным. В группе, получавших L-карнитин, уменьшение продолжительности QTc был достоверным с первого дня заболевания. При оценке выраженности уменьшения продолжительности QTc установлено, что в группе L-карнитина снижение было достоверно большим.The total value of ST segment depressions on the day of admission was equally pronounced in both groups. As can be seen from the data presented in table 1, in both groups of patients a decrease in QTc values was noted. However, in the placebo group, this decrease was not significant. In the group receiving L-carnitine, a decrease in the duration of QTc was significant from the first day of the disease. When assessing the severity of the decrease in QTc duration, it was found that in the L-carnitine group the decrease was significantly greater.
Примечание к таблице 2. Данные представлены в виде М±σ; Р - достоверность различий между группами леченных карнитином и плацебо; Р1 - достоверность различий показателей по сравнению с 1 днем заболевания.Note to table 2. Data are presented as M ± σ; P - significance of differences between groups treated with carnitine and placebo; P1 - significance of differences in indicators compared with 1 day of illness.
Из проведенного анализа влияния L-карнитина на продолжительность интервала QTc в зависимости от варианта острого коронарного синдрома (таблица 3; фиг. 1, 2) видно, что продолжительность QTc снижалась и в группах с нестабильной стенокардией и в группах пациентов с инфарктом миокарда. Однако в группах с нестабильной стенокардией уменьшение QTc не носило достоверного характера. В группе пациентов с инфарктом миокарда лечение карнитином приводило к достоверному уменьшению длительности QTc начиная с первого дня заболевания и выраженность снижения достоверно отличалась от динамики QTc в группе плацебо.From the analysis of the effect of L-carnitine on the duration of the QTc interval, depending on the variant of acute coronary syndrome (table 3; Figs. 1, 2), it can be seen that the duration of QTc decreased both in groups with unstable angina and in groups of patients with myocardial infarction. However, in groups with unstable angina, the decrease in QTc was not significant. In the group of patients with myocardial infarction, treatment with carnitine led to a significant decrease in the duration of QTc from the first day of the disease and the severity of the decrease was significantly different from the dynamics of QTc in the placebo group.
Примечание к таблице 3. Данные представлены в виде М±σ; НС - нестабильная стенокардия; ИМ - инфаркт миокарда; Р - достоверность различий между группами нестабильной стенокардии и инфарктом миокарда; Р1 - достоверность различий показателей по сравнению с 1 днем заболевания; Р2 - достоверность различий между группой пациентов с нестабильной стенокардией получавших плацебо и карнитин; Р3 - достоверность различий между группой пациентов с инфарктом миокарда.Note to table 3. Data are presented as M ± σ; NS - unstable angina pectoris; IM - myocardial infarction; P - significance of differences between the groups of unstable angina and myocardial infarction; P1 - significance of differences in indicators compared with 1 day of illness; P2 - significance of differences between a group of patients with unstable angina receiving placebo and carnitine; P3 - significance of differences between a group of patients with myocardial infarction.
При анализе выраженности изменений длительности интервала QTc в зависимости от его исходной величины (таблица 4) видно, что более выраженное уменьшение происходило в группах пациентов, исходно имевших длительность QTc более 440 мс. При этом в группе карнитина у лиц, имевших большую продолжительность интервала QTc, уменьшение наблюдалось с первого дня заболевания. В группе плацебо уменьшение QTc достигло достоверности лишь к 7 дню заболевания. В группе леченных L-карнитином при исходном QTc менее 440 мс также наблюдалось уменьшение его продолжительности к 7 дню заболевания. В группе плацебо у лиц с QTc менее 440 мс достоверных изменений не наблюдалось.When analyzing the severity of changes in the duration of the QTc interval depending on its initial value (Table 4), it is seen that a more pronounced decrease occurred in groups of patients who initially had a QTc duration of more than 440 ms. Moreover, in the carnitine group in individuals who had a longer QTc interval, a decrease was observed from the first day of the disease. In the placebo group, a decrease in QTc achieved significance only by day 7 of the disease. In the group treated with L-carnitine with an initial QTc of less than 440 ms, a decrease in its duration by day 7 of the disease was also observed. In the placebo group in individuals with a QTc of less than 440 ms, no significant changes were observed.
Примечание к таблице 4. Данные представлены в виде М±σ; Р - достоверность различий между группами нестабильной стенокардии и инфарктом миокарда; Р1 - достоверность различий показателей по сравнению с 1 днем заболевания; Р2 - достоверность различий между группой пациентов с нестабильной стенокардией, получавших плацебо и карнитин; Р3 - достоверность различий между группой пациентов с инфарктом миокарда.Note to table 4. Data are presented as M ± σ; P - significance of differences between the groups of unstable angina and myocardial infarction; P1 - significance of differences in indicators compared with 1 day of illness; P2 - significance of differences between a group of patients with unstable angina who received placebo and carnitine; P3 - significance of differences between a group of patients with myocardial infarction.
При этом дисперсия QT снижалась в обеих группах (таблица 5). Однако в группе L-карнитина уменьшение ΔQTc отмечено с первого дня заболевания и выраженность снижения ΔQTc была более выраженной, чем в группе плацебо в течение всего периода наблюдения.Moreover, the dispersion of QT decreased in both groups (table 5). However, in the L-carnitine group, a decrease in ΔQTc was noted from the first day of the disease and the severity of the decrease in ΔQTc was more pronounced than in the placebo group during the entire observation period.
Примечание к таблице 5. Данные представлены в виде М±σ; Р - достоверность различий между группами леченных карнитином и плацебо; Р1 - достоверность различий показателей по сравнению с 1 днем заболевания.Note to table 5. Data are presented as M ± σ; P - significance of differences between groups treated with carnitine and placebo; P1 - significance of differences in indicators compared with 1 day of illness.
При этом было выявлено, что дисперсия QT снижалась и в группах пациентов с нестабильной стенокардией и в группах с инфарктом миокарда (таблица 6). Более того в группе, получавших L-карнитин, при обоих вариантах острого коронарного синдрома снижение дисперсии QT носило достоверный характер с первого дня заболевания, а в группе, получавших плацебо, при нестабильной стенокардии изменения не носили достоверного характера, при инфаркте миокарда - достоверность отмечена к 7 суткам заболевания. Важно, что во всех временных точках абсолютное значение ΔQTc и степень ее снижения при инфаркте миокарда в группе, получавших L-карнитин, была достоверно более выраженной.Moreover, it was found that the dispersion of QT decreased both in groups of patients with unstable angina and in groups with myocardial infarction (table 6). Moreover, in the group receiving L-carnitine, in both variants of acute coronary syndrome, the decrease in QT dispersion was reliable from the first day of the disease, and in the group receiving placebo, with unstable angina, the changes were not significant, with myocardial infarction, the reliability was noted to 7 days of illness. It is important that at all time points the absolute value of ΔQTc and the degree of its decrease during myocardial infarction in the group receiving L-carnitine were significantly more pronounced.
Примечание к таблице 6. Данные представлены в виде М±σ; НС - нестабильная стенокардия; ИМ - инфаркт миокарда; Р - достоверность различий между группами леченных карнитином и плацебо; Р1 - достоверность различий показателей по сравнению с 1 днем заболевания; Р2 - достоверность различий между группой пациентов с нестабильной стенокардией, получавших плацебо и карнитин; Р3 - достоверность различий между группой пациентов с инфарктом миокарда.Note to table 6. Data are presented as M ± σ; NS - unstable angina pectoris; IM - myocardial infarction; P - significance of differences between groups treated with carnitine and placebo; P1 - significance of differences in indicators compared with 1 day of illness; P2 - significance of differences between a group of patients with unstable angina who received placebo and carnitine; P3 - significance of differences between a group of patients with myocardial infarction.
При анализе изменения дисперсии QT в зависимости от ее исходной величины установлено (таблица 7), что в группах пациентов с большой дисперсией QT ее снижение выражено в большей степени, чем у пациентов с дисперсией менее 80 мс. Это различие прослеживается наиболее отчетливо в группе плацебо начиная с 3 суток заболевания. В группе, получавших L-карнитин, выраженность снижения дисперсии QT в меньшей степени зависела от ее исходной величины. В группе, получавших L-карнитин, уменьшение дисперсии QT было более выраженным, чем в группе плацебо, особенно у пациентов с исходно большей дисперсией, и к 12-14 суткам наблюдения достигала значимых различий.When analyzing the change in QT dispersion depending on its initial value, it was found (Table 7) that in groups of patients with large QT dispersion its decrease is more pronounced than in patients with dispersion less than 80 ms. This difference is most pronounced in the placebo group starting from 3 days of illness. In the group receiving L-carnitine, the severity of the decrease in QT dispersion was less dependent on its initial value. In the group receiving L-carnitine, the decrease in QT dispersion was more pronounced than in the placebo group, especially in patients with an initially greater dispersion, and reached significant differences by 12-14 days of observation.
Примечание к таблице 7. Данные представлены в виде М±σ; Р - достоверность различий между группами нестабильной стенокардии и инфарктом миокарда; Р1 - достоверность различий показателей по сравнению с 1 днем заболевания; Р2 - достоверность различий между группой пациентов с нестабильной стенокардией, получавших плацебо и карнитин; Р3 - достоверность различий между группой пациентов с инфарктом миокарда.Note to table 7. Data are presented as M ± σ; P - significance of differences between the groups of unstable angina and myocardial infarction; P1 - significance of differences in indicators compared with 1 day of illness; P2 - significance of differences between a group of patients with unstable angina who received placebo and carnitine; P3 - significance of differences between a group of patients with myocardial infarction.
Таким образом, лечение L-карнитином приводило к более выраженному и более раннему улучшению параметров электрической стабильности миокарда у пациентов с острым коронарным синдромом.Thus, treatment with L-carnitine led to a more pronounced and earlier improvement in the parameters of myocardial electrical stability in patients with acute coronary syndrome.
Наиболее выраженное влияние карнитин оказывал на больных, которых можно отнести к категории высокого риска.Carnitine exerted the most pronounced effect on patients, which can be classified as high risk.
Можно полагать, что положительное действие L-карнитина обусловлено его действием в качестве метаболического цитопротектора.It can be assumed that the positive effect of L-carnitine is due to its action as a metabolic cytoprotector.
В основе гибели клеток при ишемии/реперфузии лежат изменения энергетического обмена кардимиоцитов. В частности, происходит снижение запасов АТФ, так как при ишемии происходит нарушение утилизации энергетических субстратов и снижение синтеза АТФ.Cell death during ischemia / reperfusion is based on changes in the energy metabolism of cardiomyocytes. In particular, there is a decrease in ATP reserves, since ischemia causes a violation of the utilization of energy substrates and a decrease in ATP synthesis.
По результатам исследования авторами было показано, при нестабильной стенокардии в результате ишемии сердца нарушается доставка крови, энергетических субстратов (ДЦ-ЖК, глюкозы, лактата) и кислорода к кардиомиоцитам. Следствием этого является торможение синтеза АТФ, изменение взаиморегуляции потоков субстратов в митохондрии, разобщение гликолиза от окисления метаболита глюкозы - пирувата в MX, возникновение внутриклеточного ацидоза, нарушение ионного гомеостаза и сократительной активности сердца. В этих условиях в MX усиливается образование радикалов кислорода, формируется оксидативный стресс, который вместе с падением уровня АТФ, перегрузкой цитоплазмы кардиомиоцитов ионами Са2+, снижением pHi вызывает гибель кардиомиоцитов по механизму некроза или апоптоза. В кровь выделяются соединения (хемоатрактантны), по градиенту которых фагоциты (сперва нейтрофилы, затем моноциты) из крови поступают в пораженный участок, активируются и выделяют разнообразные высокоактивные агенты (катионные белки, протеолитические ферменты, провоспалительные цитокины), которые ответственны за создание условий, способствующих фагоцитозу поврежденных или разрушенных клеток. Важная роль среди таких агентов принадлежит радикалам кислорода, генерируемым в большом количестве в процессе «дыхательного взрыва», которые вместе с некоторыми соединениями (например, гипохлоритом натрия и хлораминовыми производными аминокислот) изменяют структуры белков и подавляют их ферментативную активность в миелопероксидазной реакции. Особо необходимо отметить, что радикалы кислорода, генерируемые фагоцитами крови, способны разрушать практически все виды макромолекул: белки, углеводы, РНК, ДНК, что требуется для санации пораженной области и активации процессов репарации. Однако при неадекватно большом образовании таких радикалов кислорода происходит не только разрушение погибших клеток, но и жизнеспособных клеток микроокружения, что увеличивает область поражения. Определить способность фагоцитов к адекватному или неадекватному ответу у конкретного пациента можно в опытах in vitro на образцах цельной крови при воздействии стандартных стимуляторов.According to the results of the study, the authors showed that with unstable angina as a result of cardiac ischemia, the delivery of blood, energy substrates (DC-LCD, glucose, lactate) and oxygen to cardiomyocytes is disrupted. The consequence of this is inhibition of ATP synthesis, a change in the mutual regulation of substrate flows into mitochondria, uncoupling of glycolysis from oxidation of the glucose metabolite - pyruvate in MX, the occurrence of intracellular acidosis, impaired ionic homeostasis and contractile activity of the heart. Under these conditions, the formation of oxygen radicals increases in MX, oxidative stress is formed, which, together with a decrease in ATP level, overload of the cytoplasm of cardiomyocytes with Ca2 + ions, and a decrease in pHi, causes the death of cardiomyocytes by the mechanism of necrosis or apoptosis. Compounds (chemoattractant) are released into the blood, along the gradient of which phagocytes (first neutrophils, then monocytes) enter the affected area from the blood, various highly active agents (cationic proteins, proteolytic enzymes, pro-inflammatory cytokines) are activated and are responsible for creating conditions conducive to phagocytosis of damaged or destroyed cells. An important role among such agents belongs to oxygen radicals generated in large quantities during the “breathing explosion”, which, together with some compounds (for example, sodium hypochlorite and chloramine derivatives of amino acids) change the structure of proteins and inhibit their enzymatic activity in the myeloperoxidase reaction. It is especially necessary to note that oxygen radicals generated by blood phagocytes are capable of destroying almost all types of macromolecules: proteins, carbohydrates, RNA, DNA, which is required for the rehabilitation of the affected area and activation of repair processes. However, with the inadequately large formation of such oxygen radicals, not only the destruction of dead cells, but also viable cells of the microenvironment occurs, which increases the lesion area. The ability of phagocytes to an adequate or inadequate response in a particular patient can be determined in in vitro experiments on whole blood samples when exposed to standard stimulants.
В проведенном авторами исследовании был использован такой подход для оценки силы ответной индивидуальной реакции фагоцитов пациентов с нестабильной стенокардией на воздействие стандартных агентов (определение нормы реакции) и возможности коррекции неадекватных ответов фагоцитов в образцах крови, связанных с отсутствием «транзиторности» ответа и чрезмерным образованием радикалов кислорода в условиях in vitro с помощью L-карнитина. Генерацию радикалов кислорода в образцах цельной крови определяли по хемилюминесценции люминофора - люцигенина (20 мкМ) на хемилюминометре «Биотокс-7» (Россия). В качестве стандартных стимуляторов использовали бактериальный трипептид - формил-метионил-лейцил-фенилаланин (fMLP) и форболовый эфир (форбол миристат ацетат - РМА), раствор Элькара в ампулах (Россия, ООО «ПИК-ФАРМА»). В качестве стандартных антиоксидантов использовали супероксид дисмутазу и тролакс. Периферическую кровь пациентов с нестабильной стенокардией забирали из локтевой вены, собирали в пластиковые пробирки, содержащие гепарин (30 МЕ/мл). К пробам крови (объемом 100 мкл) добавляли люцигенин (конечная концентрация 30 мкМ). Спонтанное и индуцированное стандартными стимуляторами образование радикалов кислорода регистрировали на хемилюминометре «Биотокс»-7. Измерения проводили при 25°C. Образование супероксид анионов регистрировали в непрерывном режиме и выражали в количестве импульсов в секунду, а также оценивали по интегральным значениям хемилюминесценции (светосумма за 10 сек). В результате проведенных исследований было показано, что в крови пациентов с нестабильной стенокардией фагоциты предактивированы и L-карнитин дозозависимым образом подавлял ответ на стандартные стимуляторы. Ингибиторный эффект L-карнитина наблюдался также при неадекватном ответе фагоцитов крови на стандартные агенты. Таким образом, за счет снижения оксидативного стресса в клетках MX, L-карнитин может быть применен в качестве средства снижения риска увеличения дисперсии QT у пациента, в частности у пациента с нестабильной стенокардией.In the study conducted by the authors, this approach was used to assess the strength of the individual response of the phagocytes of patients with unstable angina to the effects of standard agents (determining the reaction rate) and the possibility of correcting inadequate phagocyte responses in blood samples associated with the absence of “transient” response and excessive formation of oxygen radicals in vitro using L-carnitine. The generation of oxygen radicals in whole blood samples was determined by the chemiluminescence of the phosphor — lucigenin (20 μM) on a Biotox-7 chemiluminometer (Russia). As standard stimulants, we used a bacterial tripeptide - formyl-methionyl-leucyl-phenylalanine (fMLP) and phorbol ether (phorbol myristate acetate - RMA), Elkar solution in ampoules (Russia, PIK-PHARMA LLC). Superoxide dismutase and trolax were used as standard antioxidants. The peripheral blood of patients with unstable angina was taken from the ulnar vein, collected in plastic tubes containing heparin (30 IU / ml). To blood samples (100 μl) was added lucigenin (final concentration of 30 μm). Spontaneous and induced by standard stimulators the formation of oxygen radicals was recorded on a Biotox-7 chemiluminometer. The measurements were carried out at 25 ° C. Superoxide Anion Formation recorded in a continuous mode and expressed in the number of pulses per second, and also evaluated by the integrated values of chemiluminescence (light sum for 10 seconds). As a result of the studies, it was shown that in the blood of patients with unstable angina, phagocytes are preactivated and L-carnitine in a dose-dependent manner suppressed the response to standard stimulants. The inhibitory effect of L-carnitine was also observed with an inadequate response of blood phagocytes to standard agents. Thus, by reducing oxidative stress in MX cells, L-carnitine can be used as a means of reducing the risk of increased QT dispersion in a patient, in particular in a patient with unstable angina.
Предлагаемый способ снижения риска увеличения дисперсии QT у пациента может быть реализован, в частности, следующим образом.The proposed method of reducing the risk of increasing QT dispersion in a patient can be implemented, in particular, as follows.
При поступлении у пациента регистрируют электрокардиограмму и на фоне стандартной проводимой терапии дезагрегантами и статинами начинают терапию L-карнитином, который вводят внутривенно в течение первых 3 суток по 2 г (по 4 ампулы) 2 раза в сутки (всего 8 ампул в сутки), с 4 суток по 15 сутки (или до выписки, если она происходит раньше) - по 2 г (по 4 ампулы) 1 раз в сутки. Продолжительность терапии - не менее 15 дней или до выписки из стационара.Upon admission, an electrocardiogram is recorded in the patient and, against the background of standard therapy with disaggregants and statins, L-carnitine therapy is started, which is administered intravenously during the first 3 days, 2 g (4 ampoules) 2 times a day (8 ampoules per day), s 4 days to 15 days (or until discharge, if it occurs earlier) - 2 g (4 ampoules) 1 time per day. The duration of therapy is at least 15 days or until discharge from the hospital.
Список цитируемых источниковList of cited sources
1. Dirksen М Т., Laarman G J., Simoons М L., Duncker D J.G.M. Reperfusion injury in humans: A review of clinical trials on reperfusion injury inhibitory strategies Cardiovascular Research 2007; 74 (): 343-355.1. Dirksen M T., Laarman G J., Simoons M L., Duncker D J.G.M. Reperfusion injury in humans: A review of clinical trials on reperfusion injury inhibitory strategies Cardiovascular Research 2007; 74 (): 343-355.
2. Кардиология и сердечно-сосудистая хирургия. Е.И. Асташкин, М.Г. Глезер, №2, том 6, 2012 год.2. Cardiology and cardiovascular surgery. E.I. Astashkin, M.G. Glaser, No. 2, volume 6, 2012.
3. Noland R.C., Koves T.R., Seiler S.E., et al. Carnitine insufficiency caused by aging and overnutrition compromises mitochondrial performance and metabolic control. J.Biol.Chem. 2009; 284:34: 22840-22852. Sharma Sh, Black St.M. Carnitine homeostasis, mitochondrial function, and cardiovascular disease //DrugDiscov Today Dis Mech. 2009; 6:1-4: e31-e39.3. Noland R.C., Koves T.R., Seiler S.E., et al. Carnitine insufficiency caused by aging and overnutrition compromises mitochondrial performance and metabolic control. J. Biol. Chem. 2009; 284: 34: 22840-22852. Sharma Sh, Black St. M. Carnitine homeostasis, mitochondrial function, and cardiovascular disease // DrugDiscov Today Dis Mech. 2009; 6: 1-4: e31-e39.
4. Sharma Sh., Sud N., Wiseman D.A., et al. Altered carnitine homeostasis is associated with decreased mitochondrial function and altered nitric oxide signaling in lambs with pulmonary hypertension Am J Physiol Lung Cell MolPhysiol, 2008, 294: 1: L46-L56.4. Sharma Sh., Sud N., Wiseman D.A., et al. Altered carnitine homeostasis is associated with decreased mitochondrial function and altered nitric oxide signaling in lambs with pulmonary hypertension Am J Physiol Lung Cell MolPhysiol, 2008, 294: 1: L46-L56.
5. Indiveri C., Iacobazzi V., Tonazzi A. et al. The mitochondrial carnitine/acylcarnitine carrier: Function, structure and physiopathology. MolAspectsMed. 2011; 32 (4-6): 223-233.5. Indiveri C., Iacobazzi V., Tonazzi A. et al. The mitochondrial carnitine / acylcarnitine carrier: Function, structure and physiopathology. MolAspectsMed. 2011; 32 (4-6): 223-233.
6. Lee K., Kerner J., HoppelCh.L. Mitochondrial carnitine palmitoyltransferase 1a (CPT1a) is part of an outer membrane fatty acid transfer complex J Biol Chem. 2011; 286: 29: 25655-25662.6. Lee K., Kerner J., HoppelCh. L. Mitochondrial carnitine palmitoyltransferase 1a (CPT1a) is part of an outer membrane fatty acid transfer complex J Biol Chem. 2011; 286: 29: 25655-25662.
7. Dyck J.R., Lopaschuk G.D. Malonyl CoA control of fatty acid oxidation in the ischemic heart // J Mol Cell Cardiol., 2002; 34: 1099-1109.7. Dyck J.R., Lopaschuk G. D. Malonyl CoA control of fatty acid oxidation in the ischemic heart // J Mol Cell Cardiol., 2002; 34: 1099-1109.
8. Stanley W.C., Recchia F.A., Lopaschuk G.D. Myocardial subsrate metabolism in the normal and failing heart // Physiol Rev., 2005; 85: 1093-1129.8. Stanley W.C., Recchia F.A., Lopaschuk G. D. Myocardial subsrate metabolism in the normal and failing heart // Physiol Rev., 2005; 85: 1093-1129.
9. Folmes C.D., Lopaschuk G.D. Role of malonyl CoA in heart disease and the hypothalamic control of obesity // Cardiovasc Res., 2007; 73: 278-187.9. Folmes C.D., Lopaschuk G..D. Role of malonyl CoA in heart disease and the hypothalamic control of obesity // Cardiovasc Res., 2007; 73: 278-187.
10. Spagnoli LG, Corsi M, Villaschi S, Palmieri G, Maccari F. Myocardial carnitine deficiency in acute myocardial infarction. Lancet. 1982; 1: 8286: 1419-1420.10. Spagnoli LG, Corsi M, Villaschi S, Palmieri G, Maccari F. Myocardial carnitine deficiency in acute myocardial infarction. Lancet. 1982; 1: 8286: 1419-1420.
11. Shug Al, Thomsen Jh, Folts Jd, et al. Changes in tissue levels of carnitine and other metabolites during myocardial ischemia and anoxia. Arch BiochemBiophys l978; 187:1:25-33.11. Shug Al, Thomsen Jh, Folts Jd, et al. Changes in tissue levels of carnitine and other metabolites during myocardial ischemia and anoxia. Arch Biochem Biophys l978; 187: 1: 25-33.
12. Rebuzzi AG, Schiavoni G, Amico CM, et al. Beneficial effect of L-carnitine in the reduction of necrotic area in acute myocardial infarction. Drugs ExpClinRes. 1984; 10: 219-223.12. Rebuzzi AG, Schiavoni G, Amico CM, et al. Beneficial effect of L-carnitine in the reduction of necrotic area in acute myocardial infarction. Drugs ExpClinRes. 1984; 10: 219-223.
13. Singh RB, Niaz MA, Agarwal P, et al. A randomized, double-blind, placebo controlled trial of L-carnitine in suspected myocardial infarction. PostgradMedJ 1996; 72: 843: 45-50.13. Singh RB, Niaz MA, Agarwal P, et al. A randomized, double-blind, placebo controlled trial of L-carnitine in suspected myocardial infarction. PostgradMedJ 1996; 72: 843: 45-50.
14. Chiariello M, Nrevetti G, Policicclio A, et al. L-Camitine in acute myocardial infarction. A multicentre randomized trial. In: Borum, ed. Clinical aspects of human carnitine deficiency, New York: Pergamon Press, 1986; p. 242-243.14. Chiariello M, Nrevetti G, Policicclio A, et al. L-Camitine in acute myocardial infarction. A multicentre randomized trial. In: Borum, ed. Clinical aspects of human carnitine deficiency, New York: Pergamon Press, 1986; p. 242-243.
15. Iliceto S, Scrutinio D, Bruzzi P, et al. Effect of L-carnitine administration on left ventricular remodeling after acute anterior myocardial infarction: the L-Carnitine Ecocardiografia Digitalizzata Infarto Miocardico (CEDIM) trial. J Am Coll Cardiol. 1995; 26 (2): 380-387.15. Iliceto S, Scrutinio D, Bruzzi P, et al. Effect of L-carnitine administration on left ventricular remodeling after acute anterior myocardial infarction: the L-Carnitine Ecocardiografia Digitalizzata Infarto Miocardico (CEDIM) trial. J Am Coll Cardiol. 1995; 26 (2): 380-387.
16. Cave M.C., Hurt R.T., Frazier Т.Н., et al. Obesity, inflammation, and the potential application of pharmaconutrition Nutr. Clin. Pract, 2008; 23: 1: 16-34.16. Cave M.C., Hurt R. T., Frazier T. N., et al. Obesity, inflammation, and the potential application of pharmaconutrition Nutr. Clin. Pract, 2008; 23: 1: 16-34.
17. Tarantini G, Scrutinio D, Bruzzi P, et al. Metabolic treatment with L-carnitine in acute anterior ST segment elevation myocardial infarction. A randomized controlled trial. Cardiology. 2006; 106: 4: 215-223.17. Tarantini G, Scrutinio D, Bruzzi P, et al. Metabolic treatment with L-carnitine in acute anterior ST segment elevation myocardial infarction. A randomized controlled trial. Cardiology. 2006; 106: 4: 215-223.
18. Martina B, Zuber M, Weiss P, et al. Anti-arrhythmia treatment using L-carnitine in acute myocardial infarct. Schweiz Med Wochenschr. 1992; 122: 37: 1352-1355.18. Martina B, Zuber M, Weiss P, et al. Anti-arrhythmia treatment using L-carnitine in acute myocardial infarct. Schweiz Med Wochenschr. 1992; 122: 37: 1352-1355.
19. Rizzon P, Biasco G, Di Biase M et al. High doses of L-carnitine in acute myocardial infarction: metabolic and antiarrhythmic effects. Eur Heart J. 1989; 10: 6: 502-508.19. Rizzon P, Biasco G, Di Biase M et al. High doses of L-carnitine in acute myocardial infarction: metabolic and antiarrhythmic effects. Eur Heart J. 1989; 10: 6: 502-508.
20. Xue YZ, Wang LX, Liu HZ, Qi XW, Wang XH, Ren HZ. L-carnitine as an adjunct therapy to percutaneous coronary intervention for non-ST elevation myocardial infarction. Cardiovasc Drugs Ther. 2007; 21: 6: 445-8.20. Xue YZ, Wang LX, Liu HZ, Qi XW, Wang XH, Ren HZ. L-carnitine as an adjunct therapy to percutaneous coronary intervention for non-ST elevation myocardial infarction. Cardiovasc Drugs Ther. 2007; 21: 6: 445-8.
21. Lango R, Smolenr ski RT, Rogowski J, et al. Propionyl-L-carnitine improves hemodynamics and metabolic markers of cardiac perfusion during coronary surgery in diabetic patients. Cardiovasc Drugs Ther. 2005; 19: 4: 267-275.21. Lango R, Smolenr ski RT, Rogowski J, et al. Propionyl-L-carnitine improves hemodynamics and metabolic markers of cardiac perfusion during coronary surgery in diabetic patients. Cardiovasc Drugs Ther. 2005; 19: 4: 267-275.
22. Corbucci GG, Menichetti A, Cogliatti A, et al. Metabolic aspects of acute tissue hypoxia during extracorporeal circulation and their modification induced by L-carnitine treatment. IntJClinPharmacolRes. 1992; 12: 3: 149-157.22. Corbucci GG, Menichetti A, Cogliatti A, et al. Metabolic aspects of acute tissue hypoxia during extracorporeal circulation and their modification induced by L-carnitine treatment. IntJClinPharmacolRes. 1992; 12: 3: 149-157.
23. Corbucci GG, Loche F. L-carnitine in cardiogenic shock therapy: pharmacodynamic aspects and clinical data. Int J Clin Pharmacol Res. 1993; 13: 2: 87-91.23. Corbucci GG, Loche F. L-carnitine in cardiogenic shock therapy: pharmacodynamic aspects and clinical data. Int J Clin Pharmacol Res. 1993; 13: 2: 87-91.
24. Глезер М.Г., Васильев C.B. Антиангинальная и противоишемическая эффективность триметазидина с модифицируемым высвобождением у пациентов с нестабильной стенокардией. Кардиоваскулярная терапия и профилактика. 2009, том 8, №1, стр. 42-46.24. Glezer M.G., Vasiliev C.B. Antianginal and anti-ischemic efficacy of modifiable release trimetazidine in patients with unstable angina pectoris. Cardiovascular therapy and prevention. 2009, Volume 8, No 1, pp. 42-46.
25. Инструкция к препарату «Элькар» раствор для внутривенного и внутримышечного введения. ЛСР-002224/08 от 31.03.2008. Дата переоформления 18.12.2012 (ООО «ПИК-ФАРМА»).25. Instructions for the drug "Elkar" solution for intravenous and intramuscular administration. LSR-002224/08 dated 03/31/2008. Date of renewal December 18, 2012 (PIK-PHARMA LLC).
26. Никитин Ю.П., Кузнецов А.А. Дисперсия интервала QT (обзор). - Кардиология, 1998, 5, 58-63.26. Nikitin Yu.P., Kuznetsov A.A. QT interval variance (overview). - Cardiology, 1998, 5, 58-63.
27. Walter Т, Griessl G, Kluge Р, Neugebauer A. QT dispersion in surface ECG and QT dynamics in long-term ECG in patients with coronary heart disease in the chronic post-infarct stage with and without ventricular tachyarrhythmias-correlation with other risk parameters. Z Kardiol. 1997; 86 (3): 204-10.27. Walter T, Griessl G, Kluge P, Neugebauer A. QT dispersion in surface ECG and QT dynamics in long-term ECG in patients with coronary heart disease in the chronic post-infarct stage with and without ventricular tachyarrhythmias-correlation with other risk parameters. Z Kardiol. 1997; 86 (3): 204-10.
28. Bluzaite I, Brazdzionyte J, , Rickli H, Ammann P. QT dispersion and heart rate variability in sudden death risk stratification in patients with ischemic heart disease. Medicina (Kaunas). 2006; 42 (6): 450-4.28. Bluzaite I, Brazdzionyte J, , Rickli H, Ammann P. QT dispersion and heart rate variability in sudden death risk stratification in patients with ischemic heart disease. Medicina (Kaunas). 2006; 42 (6): 450-4.
29. Zabel M, Klingenheben T, Franz MR, Hohnloser SH. Assessment of QT dispersion for prediction of mortality or arrhythmic events after myocardial infarction: results of a prospective, long-term follow-up study. Circulation 1998, 97: 2543-2550.29. Zabel M, Klingenheben T, Franz MR, Hohnloser SH. Assessment of QT dispersion for prediction of mortality or arrhythmic events after myocardial infarction: results of a prospective, long-term follow-up study. Circulation 1998, 97: 2543-2550.
30. Day CP, McComb JM, Campbell RW. QT dispersion: an indication of arrhythmia risk in patients with long QT syndrome. Br Heart J. 1990, 63:342-344.30. Day CP, McComb JM, Campbell RW. QT dispersion: an indication of arrhythmia risk in patients with long QT syndrome. Br Heart J. 1990, 63: 342-344.
31. Roukema G, Singh JP, Meijs M, Carvalho C, Hart G. Effects of exercise-induced ischemia on QT interval dispersion. Am Heart J 1998; 135: 88-92.31. Roukema G, Singh JP, Meijs M, Carvalho C, Hart G. Effects of exercise-induced ischemia on QT interval dispersion. Am Heart J 1998; 135: 88-92.
32. Tomassoni G, Pisano E, Gardner L, Krucoff MW, Natale A. QT prolongation and dispersion in myocardial ischemia and infarction. J Electrocardiol 1998; 30S: 187-90.32. Tomassoni G, Pisano E, Gardner L, Krucoff MW, Natale A. QT prolongation and dispersion in myocardial ischemia and infarction. J Electrocardiol 1998; 30S: 187-90.
33. Perkimki J, Koistinen MJ, Yli-Myry S, Huikuru H. Measurement of QT dispersion identifies patients at risk. J Am Coll Cardiol 1995; 26: 174-9.33. Perkimki J, Koistinen MJ, Yli-Myry S, Huikuru H. Measurement of QT dispersion identifies patients at risk. J Am Coll Cardiol 1995; 26: 174-9.
34. Okin PM, Devereux RB, Howard BV, Fabsitz RR, Lee ET, Welty TK. Assessment of QT interval and QT dispersion for prediction of all-cause and cardiovascular mortality in American Indians. The Strong Heart Study. Circulation 2000; 101: 61-6.34. Okin PM, Devereux RB, Howard BV, Fabsitz RR, Lee ET, Welty TK. Assessment of QT interval and QT dispersion for prediction of all-cause and cardiovascular mortality in American Indians. The Strong Heart Study. Circulation 2000; 101: 61-6.
35. De Bruyne MC, Hoes AW, Kors JA, Hofman A, van Bemmel JH, Grobbee DE. QTc dispersion predicts cardiac mortality in the elderly. The Rotterdam Study. Circulation 1998; 97: 467.35. De Bruyne MC, Hoes AW, Kors JA, Hofman A, van Bemmel JH, Grobbee DE. QTc dispersion predicts cardiac mortality in the elderly. The Rotterdam Study. Circulation 1998; 97: 467.
36. Senft MK. QT-Dispersion bei Patienten mit Herzinsuffizienz. Subgruppenanalyse der 313 deutschen Studienteilnehmer der ValHeFT-Studie. Thesis. Available form: URL: http://tumb1.biblio.tu-muenchen.de/pub/diss/me/2001/senf.pdf36. Senft MK. QT-Dispersion bei Patienten mit Herzinsuffizienz. Subgruppenanalyse der 313 deutschen Studienteilnehmer der ValHeFT-Studie. Thesis. Available form: URL: http://tumb1.biblio.tu-muenchen.de/pub/diss/me/2001/senf.pdf
37. Stierle U, Giannitsis E, Sheikhzadeh A, , . Relation between QT dispersion and the extent of myocardial ischemia in patients with three-vessel coronary artery disease. Am J Cardiol 1998; 81: 564-8.37. Stierle U, Giannitsis E, Sheikhzadeh A, , . Relation between QT dispersion and the extent of myocardial ischemia in patients with three-vessel coronary artery disease. Am J Cardiol 1998; 81: 564-8.
38. Spargias KS, Lindsay SJ, Kawar GI, Greenwood DC, Cowan JC, Ball SG, Hall AS. QT dispersion as a predictor of long-term mortality in patients with acute myocardial infarction and clinical evidence of heart failure. Eur Heart J. 1999; 20 (16): 1158-65.38. Spargias KS, Lindsay SJ, Kawar GI, Greenwood DC, Cowan JC, Ball SG, Hall AS. QT dispersion as a predictor of long-term mortality in patients with acute myocardial infarction and clinical evidence of heart failure. Eur Heart J. 1999; 20 (16): 1158-65.
39. Ornek E, Duran M, Ornek D, , Murat S, Kurtul A, , , Kahveci K, Doger C, . The effect of thrombolytic therapy on QT dispersion in acute myocardial infarction and its role in the prediction of reperfusion arrhythmias. Niger J Clin Pract. 2014; 17(2): 183-7.39. Ornek E, Duran M, Ornek D, , Murat S, Kurtul A, , , Kahveci K, Doger C, . The effect of thrombolytic therapy on QT dispersion in acute myocardial infarction and its role in the prediction of reperfusion arrhythmias. Niger J Clin Pract. 2014; 17 (2): 183-7.
40. Moreno FL, Villanueva T, Karagounis LA, Anderson JL. Reduction in QT interval dispersion by successful thrombolytic therapy in acute myocardial infarction. TEAM-2 Study Investigators. Circulation. 1994; 90 (1): 94-100.40. Moreno FL, Villanueva T, Karagounis LA, Anderson JL. Reduction in QT interval dispersion by successful thrombolytic therapy in acute myocardial infarction. TEAM-2 Study Investigators. Circulation. 1994; 90 (1): 94-100.
41. Ueda H, Hayashi T, Tsumura K, Kaitani K, Yoshimaru K, Nakayama Y, Yoshiyama M. QT dispersion and prognosis after coronary stent placement in acute myocardial infarction. Clin Cardiol. 2007; 30 (5):229-33.41. Ueda H, Hayashi T, Tsumura K, Kaitani K, Yoshimaru K, Nakayama Y, Yoshiyama M. QT dispersion and prognosis after coronary stent placement in acute myocardial infarction. Clin Cardiol. 2007; 30 (5): 229-33.
42. Pan KL, Hsu JT, Chang ST, Chung CM, Chen MC. Prognostic value of QT dispersion change following primary percutaneous coronary intervention in acute ST elevation myocardial infarction. Int Heart J. 2011; 52 (4): 207-11.42. Pan KL, Hsu JT, Chang ST, Chung CM, Chen MC. Prognostic value of QT dispersion change following primary percutaneous coronary intervention in acute ST elevation myocardial infarction. Int Heart J. 2011; 52 (4): 207-11.
43. Zimarino M1, Corazzini A, Tatasciore A, Marazia S, Torge G, Di Iorio C, De Caterina R. Defective recovery of QT dispersion predicts late cardiac mortality after percutaneous coronary intervention. Heart. 2011; 97 (6): 466-72.43. Zimarino M1, Corazzini A, Tatasciore A, Marazia S, Torge G, Di Iorio C, De Caterina R. Defective recovery of QT dispersion predicts late cardiac mortality after percutaneous coronary intervention. Heart 2011; 97 (6): 466-72.
Claims (10)
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2015142418/15A RU2602685C1 (en) | 2014-11-25 | 2014-11-25 | Application of l-carnitine as agent reducing risk of fatal arrhythmia |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2015142418/15A RU2602685C1 (en) | 2014-11-25 | 2014-11-25 | Application of l-carnitine as agent reducing risk of fatal arrhythmia |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2014147357A Division RU2014147357A (en) | 2014-11-25 | 2014-11-25 | APPLICATION OF L-CARNITINE AS A MEANS OF REDUCING THE RISK OF DEVELOPMENT OF Fatal Arrhythmia |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| RU2602685C1 true RU2602685C1 (en) | 2016-11-20 |
Family
ID=57760200
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2015142418/15A RU2602685C1 (en) | 2014-11-25 | 2014-11-25 | Application of l-carnitine as agent reducing risk of fatal arrhythmia |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU2602685C1 (en) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN116173000A (en) * | 2023-03-29 | 2023-05-30 | 复旦大学附属中山医院 | Application of amino acid derivative in preparation of medicine for treating cardiovascular diseases |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2266130C1 (en) * | 2004-06-10 | 2005-12-20 | Быданова Софья Сергеевна | Method for treating arrhythmic syndrome in case of progressing stenocardia |
-
2014
- 2014-11-25 RU RU2015142418/15A patent/RU2602685C1/en active
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2266130C1 (en) * | 2004-06-10 | 2005-12-20 | Быданова Софья Сергеевна | Method for treating arrhythmic syndrome in case of progressing stenocardia |
Non-Patent Citations (2)
| Title |
|---|
| CUBEDDU L.X. Iatrogenic QT Abnormalities and Fatal Arrhythmias: Mechanisms and Clinical Significance// Curr Cardiol Rev. 2009 Aug;5(3):166-76. * |
| ГЛЕЗЕР М.Г. и др. "Антиангинальная и противоишемическая эффектиность триметазидина с модифицируемым высвобождением у пациентов с нестабильной стенокардией"// Кардиоваскулярная терапия и профилактика, 2009, no 8, с.42-46. * |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN116173000A (en) * | 2023-03-29 | 2023-05-30 | 复旦大学附属中山医院 | Application of amino acid derivative in preparation of medicine for treating cardiovascular diseases |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| AU2009252897B2 (en) | Use of dronedarone for the preparation of a medicament for use in the prevention of cardiovascular hospitalization or of mortality | |
| Conde et al. | Flecainide versus vernakalant for conversion of recent-onset atrial fibrillation | |
| US20130331321A1 (en) | Perhexiline for treating chronic heart failure | |
| Flint et al. | Effect of GL enzyme (a highly purified form of hyaluronidase) on mortality after myocardial infarction | |
| JP2013515719A (en) | Combination composition useful for the treatment of cardiovascular disease | |
| Serhiyenko et al. | Diabetic cardiovascular neuropathy | |
| Kinugawa et al. | A case of atrial tachycardia sensitive to increased caffeine intake | |
| RU2602685C1 (en) | Application of l-carnitine as agent reducing risk of fatal arrhythmia | |
| CA2900526C (en) | Compositions and their use to treat heart failure with preserved injection fraction (hfpef) | |
| Wu et al. | SGLT2 Inhibitors: New Hope for the Treatment of Acute Myocardial Infarction? | |
| RU2137472C1 (en) | Medicinal preparation "gistokhrom" for treatment of patients with acute myocardium infarction and heart ischemic disease | |
| WO2020201263A1 (en) | Methods and pharmaceutical compositions for the treatment and prevention of cardiac remodeling | |
| ES2364189T3 (en) | USEFUL COMPOUND FOR THE PREVENTION AND TREATMENT OF LEFT VENTRICULAR HYPERTROPHY IN DIALIZED PATIENTS. | |
| Azzarelli et al. | Coronary slow flow phenomenon: description of three cases evaluated with myocardial perfusion scintigraphy | |
| WO2004091602A1 (en) | Use of l-carnitine for the treatment of cardiovascular diseases | |
| Standl et al. | Clinical features and treatment of coronary heart disease in diabetes | |
| Shved et al. | Clinical Effectiveness of Cardiocytoprotective Therapy in Patients with Acute Coronar Syndrome (ACS)–Myocardial Infarction (MI), Who Were Performed Balloon Angioplasty and Coronary Artery Stenting | |
| Tsutsui et al. | Intracellular magnesium deficiency in acute myocardial infarction | |
| Ocak et al. | Mad honey poisoning presenting with ventricular tachycardia and acute myocardial infarction: a case report | |
| BR112015005199B1 (en) | COMPOSITION AND METHOD TO PROVIDE A BENEFIT TO AN ANIMAL IN NEED OF THE SAME | |
| Komatsu | Current strategies of antiarrhythmic drug therapy for paroxysmal atrial fibrillation | |
| Hatch et al. | Depression and Cardiovascular Risk: Epidemiology, Mechanisms, and Implications | |
| Ahmed et al. | The Efficacy of Oral Ivabradine in Acute Phase in Non ST-segment Elevation Myocardial Infarction (NSTEMI) Post PCI: A Pilot Study | |
| Mikhin et al. | Impact of omega-3 polyunsaturated fatty acids on arrhythmic activity of myocardium and characteristics of cardiac rhythm in patients with unstable angina | |
| Irina et al. | Modern Possibilities of Metabolic Therapy in Improving the Quality of Life in Patients with Postinfarction Cardiosclerosis |