RU2563679C2 - Method for immunohistochemical colouring of whole amounts of biological tissue samples (versions) - Google Patents
Method for immunohistochemical colouring of whole amounts of biological tissue samples (versions) Download PDFInfo
- Publication number
- RU2563679C2 RU2563679C2 RU2013154783/13A RU2013154783A RU2563679C2 RU 2563679 C2 RU2563679 C2 RU 2563679C2 RU 2013154783/13 A RU2013154783/13 A RU 2013154783/13A RU 2013154783 A RU2013154783 A RU 2013154783A RU 2563679 C2 RU2563679 C2 RU 2563679C2
- Authority
- RU
- Russia
- Prior art keywords
- room temperature
- hours
- samples
- methanol
- solution
- Prior art date
Links
Images
Abstract
Description
Предлагаемая группа изобретений относится к области экспериментальной биологии и медицины, где необходимо приготовление тотальных препаратов биологических тканей для оптической проекционной томографии, конфокальной, мультифотонной и светоплоскостной микроскопии с целью получения трехмерных карт гистологической и цитологической локализации антигенов (белков, пептидов, моноаминов, аминокислот, нуклеиновых кислот, полисахаридов). Изобретения могут быть использованы для предклинических испытаний фармакологических препаратов и оценки физиологических воздействий на организм, а также для работы с материалом биопсий в диагностических и исследовательских целях.The proposed group of inventions relates to the field of experimental biology and medicine, where it is necessary to prepare total preparations of biological tissues for optical projection tomography, confocal, multiphoton and light plane microscopy in order to obtain three-dimensional maps of histological and cytological localization of antigens (proteins, peptides, monoamines, amino acids, nucleic acids polysaccharides). The invention can be used for preclinical trials of pharmacological preparations and assessment of physiological effects on the body, as well as for working with biopsy material for diagnostic and research purposes.
В последние годы в связи с развитием методов трехмерной микроскопии и оптической томографии возникла потребность в новых методах детекции антигенов в исследуемых образцах биологической ткани. Однако в настоящее время во всем мире иммуногистохимические исследования проводятся на гистологических срезах, потому что образцы толщиной более 50 мкм обладают низкой проницаемостью для антител и других высокомолекулярных маркеров.In recent years, in connection with the development of methods of three-dimensional microscopy and optical tomography, a need has arisen for new methods for detecting antigens in the studied samples of biological tissue. However, immunohistochemical studies are currently being carried out all over the world on histological sections, because samples more than 50 microns thick have low permeability for antibodies and other high molecular weight markers.
Известен способ иммуногистохимического окрашивания, в котором в качестве образца ткани использовали эмбрионов шпорцевой лягушки до 26 стадии, которых фиксировали впервые описанным в этой работе фиксатором Дента (метанол: диметилсульфоксид в соотношении 4:1) в течение 2-12 ч, затем обесцвечивали в отбеливателе Дента (метанол: диметилсульфоксид (ДМСО): 30% перекись водорода в соотношении 4:1:1) в течение 48 ч. Хранили в метаноле при -20°C. После регидратации в Трис-буфере (2 раза по 5 мин) проводили иммуногистохимическую реакцию. Для этого инкубировали образцы в растворе первичных антител, приготовленном на 20% сыворотке новорожденного теленка, при 4°C в течение ночи. Затем образцы отмывали буфером пять раз не менее 1 ч каждый, после чего инкубировали в растворе вторичных антител, конъюгированных с пероксидазой хрена или щелочной фосфатазой (условия как для первичных антител). После этого производили энзиматические реакции, дегидратировали эмбрионы в метаноле 2 раза по 5-15 мин и просветляли в растворе бензил бензоат: бензиловый спирт в соотношении 2:1 [Dent J.A., Polson A.G., Klymkowsky M.W. A whole-mount immunocytochemical analysis of the expression of the intermediate filament protein vimentin in Xenopus // Development. - 1989. - V. 105. - №1. - P. 61-74].There is a known method of immunohistochemical staining, in which Spur frog embryos up to stage 26 were used as a tissue sample, which were fixed for the first time with the Dent fixative (methanol: dimethyl sulfoxide in a ratio of 4: 1) for 2-12 hours, then decolorized in Dent bleach (methanol: dimethyl sulfoxide (DMSO): 30% hydrogen peroxide in a ratio of 4: 1: 1) for 48 hours. They were stored in methanol at -20 ° C. After rehydration in Tris buffer (2 times for 5 min), an immunohistochemical reaction was performed. For this, samples were incubated in a solution of primary antibodies prepared on 20% serum of a newborn calf at 4 ° C overnight. Then, the samples were washed with buffer five times for at least 1 h each, after which they were incubated in a solution of secondary antibodies conjugated to horseradish peroxidase or alkaline phosphatase (conditions as for primary antibodies). After this, enzymatic reactions were carried out, embryos were dehydrated in methanol 2 times for 5-15 minutes and clarified in a solution of benzyl benzoate: benzyl alcohol in a ratio of 2: 1 [Dent J.A., Polson A.G., Klymkowsky M.W. A whole-mount immunocytochemical analysis of the expression of the intermediate filament protein vimentin in Xenopus // Development. - 1989. - V. 105. - No. 1. - P. 61-74].
Однако описанный в данной работе способ применялся к образцам малого размера (толщина до 100 мкм), использовались эмбрионы, а не ткани взрослых животных, в то время как использование иммуногистохимии в зрелой нервной системе, в отличие от эмбриональной ткани, сильно затруднено вследствие высокой гидрофобности миелина. Также данный способ является нефлуоресцентным, вследствие чего он не подходит для изготовления препаратов для оптической проекционной томографии, конфокальной, мультифотонной и светоплоскостной микроскопии.However, the method described in this work was applied to samples of small size (thickness up to 100 μm), embryos were used, and not tissues of adult animals, while the use of immunohistochemistry in the mature nervous system, in contrast to embryonic tissue, is very difficult due to the high hydrophobicity of myelin . Also, this method is non-fluorescent, as a result of which it is not suitable for the manufacture of preparations for optical projection tomography, confocal, multiphoton and light-plane microscopy.
Известен способ иммуногистохимического окрашивания, в котором окрашивали образцы мозга тритона - препараты спинного мозга толщиной до 400 мкм. Тритонов перфузировали сначала 1.5 мл 85% фосфатного буфера, затем 3 мл буфера, содержащего периодат-лизин и 0.5% параформальдегид, после чего постфиксировали иммерсией в течение 2 ч в растворе того же состава. Отмывали препараты в фосфатном буфере 3 раза по 30 мин, последняя отмывка в течение ночи при 4°C. Отбеливали препараты в растворе, содержащем 6% Н2О2, 3% формамида, 0.1% Triton Х-100 в фосфатном буфере в течение нескольких часов. Затем отмывали препараты в фосфатном буфере 3 раза по 30 мин, последняя отмывка в течение ночи при 4°C. Пермеабилизировали образцы инкубацией в фосфатном буфере, содержащем 0.5-2% Triton Х-100 и 20% DMSO в течение 4-12 ч, а затем инкубировали в течение 10 суток в растворе первичных антител, приготовленном на пермеабилизационном буфере и содержащем 1% бычий сывороточный альбумин и 0.1% рыбий желатин. Отмывали пермеабилизационным буфером 5 раз по 30 мин и затем инкубировали с флуоресцентными вторичными антителами, также как и с первичными антителами. Отмывали пермеабилизационным буфером 4 раза по 30 мин и один раз в TNT-буфере: 100 mM Tris-HCl, pH 7.5, 150 тМ NaCl, 0.05% Tween-20. Дегидратировали образцы последовательной проводкой в 20%, 50%, 75%, 100% метаноле по 15 мин в каждом спирте и просветляли препараты в растворе бензил бензоат: бензиловый спирт в соотношении 2:1. [Zukor К.A., Kent D.T., Odelberg S.J. Fluorescent whole-mount method for visualizing three-dimensional relationships in intact and regenerating adult newt spinal cords // Dev. Dyn. - 2010. - V. 239. - №11. - P. 3048-3057].A known method of immunohistochemical staining, in which stained samples of the brain of the newt - preparations of the spinal cord with a thickness of up to 400 microns. Tritons were first perfused with 1.5 ml of 85% phosphate buffer, then 3 ml of buffer containing periodate-lysine and 0.5% paraformaldehyde, and then post-fixed by immersion for 2 hours in a solution of the same composition. The preparations were washed in phosphate buffer 3 times for 30 minutes, the last washing overnight at 4 ° C. The preparations were bleached in a solution containing 6% H 2 O 2 , 3% formamide, 0.1% Triton X-100 in phosphate buffer for several hours. Then the preparations were washed in phosphate buffer 3 times for 30 minutes, the last washing overnight at 4 ° C. The samples were permeabilized by incubation in a phosphate buffer containing 0.5–2% Triton X-100 and 20% DMSO for 4–12 h, and then incubated for 10 days in a solution of primary antibodies prepared in a permeabilization buffer and containing 1% bovine serum albumin and 0.1% fish gelatin. Washed off with a permeabilization buffer 5 times for 30 minutes and then incubated with fluorescent secondary antibodies, as well as with primary antibodies. Washed off with a permeabilization buffer 4 times for 30 minutes and once in a TNT buffer: 100 mM Tris-HCl, pH 7.5, 150 tM NaCl, 0.05% Tween-20. Samples were dehydrated by sequential wiring in 20%, 50%, 75%, 100% methanol for 15 min in each alcohol and the preparations were clarified in a solution of benzyl benzoate: benzyl alcohol in a ratio of 2: 1. [Zukor K.A., Kent DT, Odelberg SJ Fluorescent whole-mount method for visualizing three-dimensional relationships in intact and regenerating adult newt spinal cords // Dev. Dyn. - 2010. - V. 239. - No. 11. - P. 3048-3057].
Данный способ использовался для окраски ткани мозга амфибий и не был апробирован на мозге млекопитающих, миелинизация которого сильно отличается. В способе используются детергенты высоких концентраций, которые могут разрушительно сказываться на морфологии образца. В способе отсутствует этап низкотемпературной заморозки, и, таким образом, не предусматривает длительное накопление и хранение материала до осуществления окраски, что может быть необходимым при проведении медико-биологических экспериментов и клинических испытаний. Способ требует больших временных затрат - не менее 24 суток.This method was used to stain amphibian brain tissue and was not tested on the mammalian brain, the myelination of which is very different. The method uses detergents of high concentrations, which can destructively affect the morphology of the sample. The method does not have a stage of low-temperature freezing, and, thus, does not provide for the long-term accumulation and storage of material until coloring, which may be necessary when conducting biomedical experiments and clinical trials. The method requires a lot of time - at least 24 days.
Известен способ иммуногистохимического окрашивания, в котором окрашивали блоки мозга взрослой мыши толщиной 1 мм, залитых в полиакриламидный гель, из которых предварительно электролитически вымыта липидная фракция клеточным мембранам (технология CLARITY). Мозг фиксировали перфузией 16% параформальдегида с неполимеризованным полиакриламидным гелем. Затем постфиксировали в том же составе. После осуществления процедур CLARITY изготавливали блоки толщиной 1 мм. Отмывали препараты фосфатным буфером, содержащим 0.1% Triton Х-100, 2 раза по 24 ч каждый. Инкубировали образцы с раствором первичных антител, приготовленном на 0.5 М боратном буфере, pH 8.5 с 0.1% Triton Х-100, при 37°С, в течение 2-14 сут. Отмывали препараты 0.5 М боратным буфером в течение 1-7 сут. Инкубировали образцы с флуоресцентными вторичными антителами (условия как для первичных антител). Отмывали препараты 0.5 М боратным буфером в течение 1-7 сут. Просветляли образцы с помощью FocusClear или 80% глицерин в течение 2 сут. [Chung К, Wallace J, Kim SY, Kalyanasundaram S., Andalman A.S., Davidson T.J., Mirzabekov J.J., Zalocusky K.A., Mattis J., Denisin A.K., Pak S., Bernstein H., Ramakrishnan C, Grosenick L., Gradinaru V., Deisseroth K. Structural and molecular interrogation of intact biological systems // Nature. - 2013.- V. 16. - №497(7449). - Р. 332-337].A known method of immunohistochemical staining in which stained brain blocks of an adult mouse 1 mm thick, embedded in a polyacrylamide gel, from which the lipid fraction of the cell membranes was previously electrolytically washed (CLARITY technology). The brain was fixed by perfusion of 16% paraformaldehyde with unpolymerized polyacrylamide gel. Then postfixed in the same composition. After the CLARITY procedures, blocks of 1 mm thickness were made. The preparations were washed with phosphate buffer containing 0.1% Triton X-100, 2 times for 24 hours each. Samples were incubated with a solution of primary antibodies prepared in 0.5 M borate buffer, pH 8.5 with 0.1% Triton X-100, at 37 ° С, for 2-14 days. The preparations were washed with 0.5 M borate buffer for 1–7 days. Samples were incubated with fluorescent secondary antibodies (conditions as for primary antibodies). The preparations were washed with 0.5 M borate buffer for 1–7 days. Clarified samples using FocusClear or 80% glycerin for 2 days. [Chung K, Wallace J, Kim SY, Kalyanasundaram S., Andalman AS, Davidson TJ, Mirzabekov JJ, Zalocusky KA, Mattis J., Denisin AK, Pak S., Bernstein H., Ramakrishnan C, Grosenick L., Gradinaru V ., Deisseroth K. Structural and molecular interrogation of intact biological systems // Nature. - 2013.- V. 16. - No. 497 (7449). - R. 332-337].
Описанный способ показывает наилучшие показатели иммуногистохимической окраски толстых образцов мозга, однако является технически трудновыполнимым: требует специального дорогостоящего оборудования для осуществления экстракции липидов с помощью электрофореза целого мозга и специальных навыков у персонала. Метод в коротком исполнении занимает 7 суток, однако в полном варианте продолжительность составляет до 42 суток.The described method shows the best immunohistochemical staining of thick samples of the brain, but is technically difficult: it requires special expensive equipment for the extraction of lipids using electrophoresis of the whole brain and special skills of the staff. The method in short execution takes 7 days, but in the full version, the duration is up to 42 days.
Известен способ, в котором окрашивали крупные образцы мозга - препараты целого мозжечка взрослой мыши. После глубокой анестезии мышей перфузировали раствором 4% параформальдегида и затем изолированные образцы постфиксировали в 4% растворе парформальдегида в течение 24-48 ч при 4°C. Затем постфиксировали в фиксаторе Дента в течение 12-18 ч, инкубировали в отбеливателе Дента в течение 8 ч и дегидратировали в 100% метаноле 2 раза по 30 мин. Потом проводили циклы замораживания - оттаивания (4-5 циклов заморозки до температуры -80°C и оттаивания до комнатной температуры) и оставляли на 12-18 ч в метаноле при -80°C. Для проведения иммуногистохимической реакции препараты регидратировали последовательно в 50%, 15% метаноле на 0,1 М фосфатном буфере, при комнатной температуре, 90 мин в каждом растворе, затем 0,1 М фосфатным буфером, также 90 мин при тех же условиях. Для пермеабилизации образцы инкубировали при комнатной температуре в растворе протеиназы К (10 мкг/мл), в течение 5 мин, после чего производили 3 отмывки фосфатным буфером по 10 мин каждая. Неспецифическое связывание антител блокировали инкубацией препаратов в течение 4-8 ч при комнатной температуре в фосфатном буфере, содержащем: 2% обезжиренное сухое молоко, 0,1% Triton Х-100 и 5% ДМСО. Осуществляли 2-3 смены раствора. Затем инкубировали в растворе антител, приготовленном на блокирующем буфере, в течение 48 ч, при 4°C .После этого отмывали препараты блокирующим буфером 2-3 раза по 2-3 ч каждый при 4С и осуществляли инкубацию с вторичными антителами, конъюгированными с пероксидазой хрена, при тех же условиях, что и с первичными антителами. После этого отмывали препараты 3-4 раза по 2-3 ч каждый при 4С, последнюю отмывку оставляли на ночь, затем отмывали фосфатным буфером, содержащим 0.2% бычий сывороточный альбумин, 0.1% Triton X-100, в течение ночи при 4°C или 2 ч при комнатной температуре. После этого осуществляли энзиматическую реакцию при помощи диаминобензидина и отмывали фосфатным буфером с 0,04% азидом натрия. Для оптического просветления образцы вновь дегидратировали в 30%, 50%, 80% и 100% метаноле по 30-60 мин в каждом и просветляли в растворе бензил бензоат: бензиловый спирт в соотношении 2:1 [R.V. Sillitoe, R. Hawkes. Whole-mount immunohistochemistry: a high-throughput screen for patterning defects in the mouse cerebellum // J. Histochem. Cytochem. - 2002. - V. 50. - 2. - P. 235-244.].A known method in which stained large samples of the brain - preparations of the whole cerebellum of an adult mouse. After deep anesthesia, the mice were perfused with a solution of 4% paraformaldehyde and then isolated samples were postfixed in a 4% solution of parformaldehyde for 24-48 hours at 4 ° C. Then it was postfixed in the Dent fixative for 12-18 hours, incubated in the Dent bleach for 8 hours and dehydrated in 100% methanol 2 times for 30 minutes. Then, freezing and thawing cycles were carried out (4-5 freezing cycles to a temperature of -80 ° C and thawing to room temperature) and left for 12-18 hours in methanol at -80 ° C. To carry out the immunohistochemical reaction, the preparations were rehydrated sequentially in 50%, 15% methanol in 0.1 M phosphate buffer, at room temperature, 90 min in each solution, then 0.1 M phosphate buffer, also 90 min under the same conditions. For permeabilization, the samples were incubated at room temperature in a proteinase K solution (10 μg / ml) for 5 min, after which 3 washes with phosphate buffer for 10 min each were performed. Nonspecific antibody binding was blocked by incubation of the preparations for 4-8 hours at room temperature in phosphate buffer containing: 2% skimmed milk powder, 0.1% Triton X-100 and 5% DMSO. Carried out 2-3 changes of the solution. Then they were incubated in an antibody solution prepared on blocking buffer for 48 h at 4 ° C. After that, the preparations were washed with blocking buffer 2-3 times for 2-3 h at 4 ° C and incubated with secondary antibodies conjugated to horseradish peroxidase , under the same conditions as with primary antibodies. After this, the preparations were washed 3-4 times for 2-3 hours each at 4C, the last wash was left overnight, then washed with phosphate buffer containing 0.2% bovine serum albumin, 0.1% Triton X-100, overnight at 4 ° C or 2 hours at room temperature. After this, an enzymatic reaction was carried out using diaminobenzidine and washed with phosphate buffer with 0.04% sodium azide. For optical bleaching, the samples were again dehydrated in 30%, 50%, 80%, and 100% methanol for 30-60 minutes each and were clarified in a solution of benzyl benzoate: benzyl alcohol in a ratio of 2: 1 [R.V. Sillitoe, R. Hawkes. Whole-mount immunohistochemistry: a high-throughput screen for patterning defects in the mouse cerebellum // J. Histochem. Cytochem. - 2002. - V. 50. - 2. - P. 235-244.].
Данный способ иммуногистохимического окрашивания является нефлуоресцентным, что не позволяет его использовать для изготовления препаратов для оптической проекционной томографии, конфокальной, мультифотонной и светоплоскостной микроскопии. Также для пермеабилизации использовалась обработка протеолитическим ферментом, разрушающим ряд антигенов, что сильно ограничивает области применения данного способа. Для пермеабилизации используется несколько циклов заморозки-разморозки образца, что может негативно сказываться на сохранности морфологии образца. Способ обладает относительно невысокой глубиной прокрашивания мозга - не более 300 мкм. Продолжительность процедуры окрашивания по данному способу составляет не менее 15 суток.This method of immunohistochemical staining is non-fluorescent, which does not allow it to be used for the manufacture of preparations for optical projection tomography, confocal, multiphoton and light-plane microscopy. Also, for permeabilization, treatment with a proteolytic enzyme that destroys a number of antigens was used, which greatly limits the scope of this method. For permeabilization, several cycles of freezing and thawing of the sample are used, which can adversely affect the preservation of the morphology of the sample. The method has a relatively low depth of staining of the brain - not more than 300 microns. The duration of the staining procedure for this method is at least 15 days.
Ближайшим аналогом заявляемого способа является способ, в котором окрашивали целые полушария мозга молодых (в возрасте 8 недель) мышей. После анестезии мышей перфузировали сначала 0,1 М фосфатным буфером, содержащим гепарин (10 ед/мл), затем раствором 1% параформальдегида, после чего извлекали мозг и постфиксировали его в 1% растворе параформальдегида в течение 2 ч. Затем образцы непосредственно дегидратировали в течение дня в серии спиртов до 100% метанола. Потом проводили циклы замораживания - оттаивания (4 циклов заморозки до температуры -80°C и оттаивания до комнатной температуры по 1 ч каждый), после чего препараты регидратировали последовательно в серии спиртов до 0,1 М фосфатного буфера в течение дня. Для пермеабилизации образцы инкубировали при комнатной температуре в растворе протеиназы К (10 мкг/мл), в течение 5 мин, после чего производили отмывку фосфатным буфером. Восстановление антигена производили в микроволновой печи в 0.01 М цитратном буфере, pH 6.0, в режиме: 0-90°C 11 мин, 90-98°C 3 мин, 98°C 10 мин. Затем образцы были охлаждены до комнатной температуры и отмыты. Далее все операции производили в микроволновой печи. Образцы были инкубированы при 37°C в течение 48 ч в растворе первичных антител, содержащем 5% нормальную сыворотку, 5% ДМСО и 0.01% Triton Х-100. Затем образцы были отмыты при 37°C в течение 48 ч в растворе, содержащем 5% нормальную сыворотку и 0.01% Triton Х-100, смену раствора производили спустя 24 ч инкубации. Затем образцы были инкубированы при 37°C в течение 72 ч в растворе вторичных антител, содержащем 5% нормальную сыворотку, 5% ДМСО и 0.01% Triton Х-100, после чего отмыты при 37°C в течение 48 ч в растворе, содержащем 5% нормальную сыворотку и 0.01% Triton Х-100, смену раствора производили спустя 24 ч инкубации. После этого образцы дегидратировали и просветляли в растворе бензил бензоат: бензиловый спирт в соотношении 2:1 [J.A. Gleave, J.P. Lerch, R.M. Henkelman, B.J. Nieman. A method for 3D immunostaining and optical imaging of the mouse brain demonstrated in neural progenitor cells // PLoS One. - 2013. - V. 8. - 8. - e72039].The closest analogue of the proposed method is a method in which stained whole hemispheres of the brain of young (aged 8 weeks) mice. After anesthesia, the mice were perfused first with 0.1 M phosphate buffer containing heparin (10 units / ml), then with a solution of 1% paraformaldehyde, after which the brain was removed and postfixed in a 1% solution of paraformaldehyde for 2 hours. Then, the samples were directly dehydrated for days in a series of alcohols to 100% methanol. Then, freezing and thawing cycles were carried out (4 freezing cycles to a temperature of -80 ° C and thawing to room temperature for 1 hour each), after which the preparations were rehydrated sequentially in a series of alcohols to 0.1 M phosphate buffer during the day. For permeabilization, the samples were incubated at room temperature in a proteinase K solution (10 μg / ml) for 5 min, after which they were washed with phosphate buffer. Antigen reduction was carried out in a microwave oven in 0.01 M citrate buffer, pH 6.0, in the mode: 0-90 ° C 11 min, 90-98 ° C 3 min, 98 ° C 10 min. Then the samples were cooled to room temperature and washed. Further, all operations were carried out in a microwave oven. Samples were incubated at 37 ° C for 48 h in a solution of primary antibodies containing 5% normal serum, 5% DMSO and 0.01% Triton X-100. Then, the samples were washed at 37 ° C for 48 h in a solution containing 5% normal serum and 0.01% Triton X-100; the solution was changed after 24 h of incubation. Then the samples were incubated at 37 ° C for 72 h in a solution of secondary antibodies containing 5% normal serum, 5% DMSO and 0.01% Triton X-100, and then washed at 37 ° C for 48 h in a solution containing 5 % normal serum and 0.01% Triton X-100; the solution was changed after 24 hours of incubation. After that, the samples were dehydrated and clarified in a solution of benzyl benzoate: benzyl alcohol in a ratio of 2: 1 [J.A. Gleave, J.P. Lerch, R.M. Henkelman, B.J. Nieman. A method for 3D immunostaining and optical imaging of the mouse brain demonstrated in neural progenitor cells // PLoS One. - 2013. - V. 8. - 8. - e72039].
Данный способ был апробирован только для мозга молодых животных, обладающего лучшей проницаемостью для антител, чем мозг взрослых животных. При окрашивании по этому способу для пермеабилизации используют обработку протеолитическим ферментом и инкубации при высокой температуре, разрушающими ряд антигенов, что ограничивает области применения данного способа. Для пермеабилизации также используют несколько циклов заморозки-разморозки образца, что может негативно сказываться на сохранности морфологии образца. Также образцы, окрашенные данным способом, обладают высокой аутофлуоресценцией, что может ограничивать использование его для изготовления препаратов для количественного анализа. Продолжительность процедуры окрашивания по данному способу составляет не менее 15 суток.This method was tested only for the brain of young animals, which has better permeability to antibodies than the brain of adult animals. When staining by this method for permeabilization, treatment with a proteolytic enzyme and incubation at high temperature, destroying a number of antigens, are used, which limits the scope of this method. For permeabilization, several freeze-thaw cycles of the sample are also used, which can adversely affect the preservation of the morphology of the sample. Also, samples stained by this method have high autofluorescence, which may limit its use for the manufacture of drugs for quantitative analysis. The duration of the staining procedure for this method is at least 15 days.
Техническим результатом предлагаемой группы изобретений является иммуногистохимическое окрашивание тотальных препаратов образцов биологических тканей (в частности, мозга) животных разного возраста толщиной до 1,5 мм с сохранением морфологии образцов и более широким охватом выявляемых антигенов, возможность проведения количественного анализа иммуногистохимически выявленных меток за счет высокого соотношения фон - сигнал и снижения аутофлуоресценции, уменьшение продолжительности процесса окрашивания.The technical result of the proposed group of inventions is immunohistochemical staining of total preparations of samples of biological tissues (in particular, the brain) of animals of different ages up to 1.5 mm thick, preserving the morphology of the samples and a wider coverage of detectable antigens, the possibility of quantitative analysis of immunohistochemically detected labels due to the high ratio background - signal and decrease in autofluorescence, reducing the duration of the staining process.
Указанный технический результат достигается тем, что в предлагаемом способе иммуногистохимического окрашивания тотальных препаратов образцов биологической ткани, включающем фиксацию ткани раствором параформальдегида, постфиксацию, дегидратацию в метаноле, регидратацию в растворах метанола, пермеабилизацию, отмывку фосфатным буфером, инкубацию в растворе первичных антител, отмывку в буфере, инкубацию в растворе флуоресцентных вторичных антител, отмывку в буфере, дегидратацию, просветление в смеси бензил бензоата:бензиловый спирт, взятых в соотношении 2:1, постфиксацию сначала проводят 0,5-1%-ным параформальдегидом в течение 48 ч при 4°C, а затем после трехкратной отмывки фосфатным буфером при комнатной температуре, в растворе 20%-ного диметилсульфоксида в 100%-ном метаноле в течение 1-2 ч при комнатной температуре, после этого образец ткани отбеливают в растворе, содержащем 100%-ный метанол:диметилсульфоксид: 30% Н2О2 в соотношении 4:1:1, в течение 2-4 ч на ярком свету при комнатной температуре до полного обесцвечивания, затем отмывают 3 раза по 60 мин в 100%-ном метаноле при комнатной температуре и замораживают не менее чем на 1 час при -70…-80°C , после чего регидратируют последовательно в 50, 25 и 12,5%-ных растворах метанола в фосфатном буфере по 45-60 мин в каждом при комнатной температуре, затем образцы трижды отмывают от метанола фосфатным буфером, причем два раза отмывают по 1-2 ч при комнатной температуре, а последнюю отмывку проводят в течение ночи при 4°C, последующую пермеабилизацию образца проводят в фосфатном буфере, содержащем 2%-ный Triton Х-100, 5%-ную нормальную сыворотку, 5%-ный диметилсульфоксид, в течение 2 ч при комнатной температуре, затем образец отмывают трижды в фосфатном буфере, содержащем 0,2%-ный Triton Х-100, причем два раза отмывают по 30-60 мин при комнатной температуре, а последнюю отмывку проводят в течение ночи при 4°C, после этого проводят инкубацию последовательно в растворах первичных и вторичных антител, приготовленных на буфере, состоящем из 0.05 М Tris-HCl с pH 7.5; 0.15 М NaCl; 0.2% Triton Х-100, 5% диметилсульфоксид и 2.5-5.0% нормальной сыворотки животного-хозяина вторичных антител, при 4°C в течение 2-7 суток, с отмывками после каждой инкубации в буфере, состоящем из 0.05 М Tris-HCl с pH 7.5; 0.15 М NaCl; 0.2% Triton Х-100, сначала 3 раза по 60 мин при комнатной температуре, а затем в течение ночи при 4°C, окрашенные образцы дегидратируют последовательно в 50, 96%-ных растворах этанола в фосфатном буфере по 45-60 мин в каждом при комнатной температуре, затем выдерживают сначала в 100%-ном этаноле при комнатной температуре 2-3 раза по 45-60 мин, а затем в 2-бутоксиэтаноле при 4°C в течение 12-18 ч, дегидратированные образцы просветляют при комнатной температуре в течение 3-4 ч, способ окрашивания, начиная с операции постфиксации, проводят при помешивании со скоростью 650-800 об/мин.The specified technical result is achieved by the fact that in the proposed method for immunohistochemical staining of total preparations of biological tissue samples, including tissue fixation with paraformaldehyde solution, postfixation, dehydration in methanol, rehydration in methanol solutions, permeabilization, washing with phosphate buffer, incubation in a solution of primary antibodies, washing , incubation in a solution of fluorescent secondary antibodies, washing in buffer, dehydration, enlightenment in a mixture of benzyl benzoate: benzyl alcohol, in bacilli in a ratio of 2: 1, post-fixation is first carried out with 0.5-1% paraformaldehyde for 48 hours at 4 ° C, and then after washing three times with phosphate buffer at room temperature, in a solution of 20% dimethyl sulfoxide in 100% - methanol for 1-2 hours at room temperature, after which the tissue sample is bleached in a solution containing 100% methanol: dimethyl sulfoxide: 30% H 2 O 2 in a ratio of 4: 1: 1, for 2-4 hours bright light at room temperature until completely discolored, then washed 3 times for 60 minutes in 100% methanol at room temperature temperature and freeze for at least 1 hour at -70 ... -80 ° C, and then rehydrate sequentially in 50, 25 and 12.5% solutions of methanol in phosphate buffer for 45-60 minutes each at room temperature, then the samples are washed three times from methanol with phosphate buffer, and twice washed for 1-2 hours at room temperature, and the last washing is carried out overnight at 4 ° C, subsequent permeabilization of the sample is carried out in phosphate buffer containing 2% Triton X-100 , 5% normal serum, 5% dimethyl sulfoxide, for 2 hours at room temperature temperature, then the sample is washed three times in phosphate buffer containing 0.2% Triton X-100, and twice washed for 30-60 minutes at room temperature, and the last washing is carried out overnight at 4 ° C, after which incubation sequentially in solutions of primary and secondary antibodies prepared on a buffer consisting of 0.05 M Tris-HCl with a pH of 7.5; 0.15 M NaCl; 0.2% Triton X-100, 5% dimethyl sulfoxide and 2.5-5.0% normal serum of an animal host of secondary antibodies, at 4 ° C for 2-7 days, with washes after each incubation in a buffer consisting of 0.05 M Tris-HCl with pH 7.5; 0.15 M NaCl; 0.2% Triton X-100, first 3 times for 60 minutes at room temperature, and then overnight at 4 ° C, stained samples are dehydrated sequentially in 50, 96% ethanol solutions in phosphate buffer for 45-60 minutes each at room temperature, then first kept in 100% ethanol at room temperature for 2-3 times for 45-60 minutes, and then in 2-butoxyethanol at 4 ° C for 12-18 hours, dehydrated samples are clarified at room temperature in for 3-4 hours, the staining method, starting with the post-fixation operation, is carried out with stirring at a speed of 650-8 00 rpm
Указанный технический результат достигается также тем, что ткань фиксируют методом транскардиальной перфузии 0,5-1% раствором параформальдегида, охлажденным до 4-10°C.The specified technical result is also achieved by the fact that the tissue is fixed by transcardial perfusion with a 0.5-1% paraformaldehyde solution, cooled to 4-10 ° C.
Указанный технический результат достигается также тем, что ткань фиксируют методом погружения образца в 0,5-1% раствор параформальдегида в течение 48 ч при 4°C .The specified technical result is also achieved by the fact that the fabric is fixed by immersion of the sample in a 0.5-1% solution of paraformaldehyde for 48 hours at 4 ° C.
Указанный технический результат достигается также тем, что дегидратированные образцы до окрашивания накапливают и хранят в 100% метаноле в условиях глубокой заморозки при -70…-80°C.The indicated technical result is also achieved by the fact that dehydrated samples are accumulated and stored in 100% methanol prior to staining under conditions of deep freezing at -70 ... -80 ° C.
Указанный технический результат достигается также тем, что дегидратированные образцы до окрашивания просветляют в смеси бензил бензоат: бензиловый спирт в соотношении 2:1 в течение 30 мин при комнатной температуре до состояния полной прозрачности, а затем экспонируют прозрачные образцы под ультрафиолетом в течение 1 ч, при 4-10°C, после чего препараты отмывают дважды в абсолютном метаноле в течение 30 мин при комнатной температуре, а затем регидратируют и инкубируют с антителами.The indicated technical result is also achieved by the fact that, before staining, dehydrated samples are enlightened in a mixture of benzyl benzoate: benzyl alcohol in a ratio of 2: 1 for 30 minutes at room temperature to a state of complete transparency, and then transparent samples are exposed under ultraviolet for 1 hour, at 4-10 ° C, after which the preparations are washed twice in absolute methanol for 30 min at room temperature, and then rehydrated and incubated with antibodies.
Указанный технический результат достигается также тем, что растворы первичных и/или вторичных антител дополнительно содержат 0.5-1% сапонин.The specified technical result is also achieved by the fact that solutions of primary and / or secondary antibodies additionally contain 0.5-1% saponin.
Указанный технический результат достигается также тем, что инкубационные растворы первичных и вторичных антител заменяют на свежие 2-3 раза через 36-48 ч инкубации.The specified technical result is also achieved by the fact that the incubation solutions of primary and secondary antibodies are replaced with fresh ones 2-3 times after 36-48 hours of incubation.
Указанный технический результат достигается также тем, что инкубационные растворы первичных и вторичных антител освежают добавлением новой порции антител.The specified technical result is also achieved by the fact that the incubation solutions of primary and secondary antibodies are refreshed by adding a new portion of antibodies.
Указанный технический результат достигается также тем, что образцы ткани перед просветлением хранят в 2-бутоксиэтаноле при 4°C.The specified technical result is also achieved by the fact that tissue samples are stored in 2-butoxyethanol at 4 ° C before enlightenment.
Указанный технический результат достигается тем, что в способе иммуногистохимического окрашивания тотальных препаратов образцов биологической ткани, включающем фиксацию ткани раствором параформальдегида, постфиксацию, дегидратацию в метаноле, регидратацию в растворах метанола, пермеабилизацию, отмывку фосфатным буфером, инкубацию в растворе первичных антител, отмывку в буфере, дегидратацию, просветление в смеси бензил бензоата:бензиловый спирт, взятых в соотношении 2:1, постфиксацию сначала проводят 0,5-1%-ным параформальдегидом в течение 48 ч при 4°C, а затем после трехкратной отмывки фосфатным буфером при комнатной температуре, в растворе 20%-ного диметилсульфоксида в 100%-ном метаноле в течение 1-2 ч при комнатной температуре, после этого образец ткани отбеливают в растворе, содержащем 100%-ный метанол:диметилсульфоксид: 30% Н2О2 в соотношении 4:1:1, в течение 2-4 ч на ярком свету при комнатной температуре до полного обесцвечивания, затем отмывают 3 раза по 60 мин в 100%-ном метаноле при комнатной температуре и замораживают не менее чем на 1 час при -70…-80°C, после чего регидратируют последовательно в 50, 25 и 12,5%-ных растворах метанола в фосфатном буфере по 45-60 мин в каждом при комнатной температуре, затем образцы трижды отмывают от метанола фосфатным буфером, причем два раза отмывают по 1-2 ч при комнатной температуре, а последнюю отмывку проводят в течение ночи при 4°C, последующую пермеабилизацию образца проводят в фосфатном буфере, содержащем 2%-ный Triton Х-100, 5%-ную нормальную сыворотку, 5%-ный диметилсульфоксид, в течение 2 ч при комнатной температуре, затем образец отмывают трижды в фосфатном буфере, содержащем 0,2%-ный Triton Х-100, причем два раза отмывают по 30-60 мин при комнатной температуре, а последнюю отмывку проводят в течение ночи при 4°C, после этого проводят инкубацию в растворе флуоресцентно-меченных первичных антител, приготовленных на буфере, состоящем из 0.05 М Tris-HCl с pH 7.5; 0.15 М NaCl; 0.2% Triton Х-100, 5% диметилсульфоксид и 2.5-5.0% нормальной сыворотки, при 4°C в течение 2-7 суток, после чего окрашенный образец отмывают в буфере, состоящем из 0.05 М Tris-HCl с pH 7.5; 0.15 М NaCl; 0.2% Triton Х-100, сначала 3 раза по 60 мин при комнатной температуре, а затем в течение ночи при 4°C, образцы дегидратируют последовательно в 50, 96%-ных растворах этанола в фосфатном буфере по 45-60 мин в каждом при комнатной температуре, затем выдерживают сначала в 100%-ном этаноле при комнатной температуре 2-3 раза по 45-60 мин, а затем в 2-бутоксиэтаноле при 4°C в течение 12-18 ч, дегидратированные образцы просветляют при комнатной температуре в течение 3-4 ч, способ окрашивания, начиная с операции постфиксации, проводят при помешивании со скоростью 650-800 об/мин.The specified technical result is achieved by the fact that in the method of immunohistochemical staining of total preparations of biological tissue samples, including tissue fixation with paraformaldehyde solution, postfixation, dehydration in methanol, rehydration in methanol solutions, permeabilization, washing with phosphate buffer, incubation in a solution of primary antibodies, washing in buffer, dehydration, enlightenment in a mixture of benzyl benzoate: benzyl alcohol, taken in a ratio of 2: 1, post-fixation is first carried out with 0.5-1% paraformaldehyde for 48 hours at 4 ° C, and then after washing three times with phosphate buffer at room temperature, in a solution of 20% dimethyl sulfoxide in 100% methanol for 1-2 hours at room temperature, after which the tissue sample is bleached in solution, containing 100% methanol: dimethyl sulfoxide: 30% H2O2 in a ratio of 4: 1: 1, for 2-4 hours in bright light at room temperature until completely discolored, then washed 3 times for 60 minutes in 100% methanol with room temperature and freeze for at least 1 hour at -70 ... -80 ° C, after which rehydrate the last For example, in 50, 25, and 12.5% methanol solutions in phosphate buffer for 45-60 min each at room temperature, then the samples are washed three times with methanol in phosphate buffer, and then washed twice for 1-2 hours at room temperature, and the last washing is carried out overnight at 4 ° C, the subsequent permeabilization of the sample is carried out in phosphate buffer containing 2% Triton X-100, 5% normal serum, 5% dimethyl sulfoxide, for 2 hours at room temperature , then the sample is washed three times in phosphate buffer containing 0.2% Triton X-100, at it is washed twice for 30-60 minutes at room temperature, and the last washing is carried out overnight at 4 ° C, after which they are incubated in a solution of fluorescently-labeled primary antibodies prepared on a buffer consisting of 0.05 M Tris-HCl with pH 7.5; 0.15 M NaCl; 0.2% Triton X-100, 5% dimethyl sulfoxide and 2.5-5.0% normal serum, at 4 ° C for 2-7 days, after which the stained sample is washed in a buffer consisting of 0.05 M Tris-HCl with a pH of 7.5; 0.15 M NaCl; 0.2% Triton X-100, first 3 times for 60 minutes at room temperature, and then overnight at 4 ° C, the samples are dehydrated sequentially in 50, 96% ethanol solutions in phosphate buffer for 45-60 minutes each at room temperature, then first kept in 100% ethanol at room temperature 2-3 times for 45-60 minutes, and then in 2-butoxyethanol at 4 ° C for 12-18 hours, dehydrated samples are clarified at room temperature for 3-4 hours, the staining method, starting with the post-fixation operation, is carried out with stirring at a speed of 650-800 rpm.
Указанный технический результат достигается также тем, что ткань фиксируют методом транскардиальной перфузии 0,5-1% раствором параформальдегида, охлажденным до 4-10°C .The specified technical result is also achieved by the fact that the tissue is fixed by transcardial perfusion with a 0.5-1% paraformaldehyde solution, cooled to 4-10 ° C.
Указанный технический результат достигается также тем, что ткань фиксируют методом погружения образца в 0,5-1% раствор параформальдегида в течение 48 ч при 4°C.The specified technical result is also achieved by the fact that the fabric is fixed by immersion of the sample in a 0.5-1% solution of paraformaldehyde for 48 hours at 4 ° C.
Указанный технический результат достигается также тем, что дегидратированные образцы до окрашивания накапливают и хранят в 100% метаноле в условиях глубокой заморозки при -70…-80°C.The indicated technical result is also achieved by the fact that dehydrated samples are accumulated and stored in 100% methanol prior to staining under conditions of deep freezing at -70 ... -80 ° C.
Указанный технический результат достигается также тем, что дегидратированные образцы до окрашивания просветляют в смеси бензил бензоат:бензиловый спирт в соотношении 2:1 в течение 30 мин при комнатной температуре до состояния полной прозрачности, а затем экспонируют прозрачные образцы под ультрафиолетом в течение 1 ч, при 4-10°C , после чего препараты отмывают дважды в абсолютном метаноле в течение 30 мин при комнатной температуре, а затем регидратируют и инкубируют с антителами.The indicated technical result is also achieved by the fact that, before staining, dehydrated samples are enlightened in a mixture of benzyl benzoate: benzyl alcohol in a ratio of 2: 1 for 30 minutes at room temperature to a state of complete transparency, and then transparent samples are exposed under ultraviolet for 1 hour, at 4-10 ° C, after which the preparations are washed twice in absolute methanol for 30 min at room temperature, and then rehydrated and incubated with antibodies.
Указанный технический результат достигается также тем, что раствор первичных антител дополнительно содержит 0.5-1% сапонин.The specified technical result is also achieved by the fact that the solution of primary antibodies additionally contains 0.5-1% saponin.
Указанный технический результат достигается также тем, что инкубационный раствор первичных антител заменяют на свежий 2-3 раза через 24-48 ч инкубации.The specified technical result is also achieved by the fact that the incubation solution of primary antibodies is replaced with a fresh 2-3 times after 24-48 hours of incubation.
Указанный технический результат достигается также тем, что инкубационный раствор первичных антител освежают добавлением новой порции антител.The specified technical result is also achieved by the fact that the incubation solution of primary antibodies is refreshed by adding a new portion of antibodies.
Указанный технический результат достигается также тем, что образцы ткани перед просветлением хранят в 2-бутоксиэтаноле при 4°C.The specified technical result is also achieved by the fact that tissue samples are stored in 2-butoxyethanol at 4 ° C before enlightenment.
Сущность настоящей группы изобретений поясняется иллюстративным материалом в виде графиков с показателями глубины прокраски образцов и микрофотографий, окрашенных по способу образцов биологической ткани на фиг. 1-2, где:The essence of this group of inventions is illustrated by illustrative material in the form of graphs with indicators of the depth of sample and microphotographs stained by the method of biological tissue samples in FIG. 1-2, where:
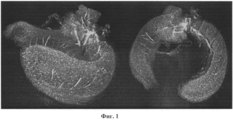
на фиг. 1 представлены трехмерные изображения цельного гиппокампа взрослой мыши с экспрессией белка c-Fos, выявленной с помощью заявленного способа иммуногистохимической окраски, визуализация осуществлена при помощи светоплоскостной микроскопии;in FIG. 1 presents three-dimensional images of the whole hippocampus of an adult mouse with expression of c-Fos protein, detected using the claimed method of immunohistochemical staining, visualization was performed using light-plane microscopy;
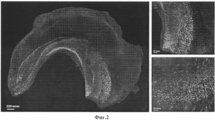
на фиг. 2 представлено трехмерное изображение гиппокампа 14-суточного мышонка линии Nestin-CFPnuc, окрашенного заявленным способом, во вставках справа представлены увеличенные фрагменты гранулярного слоя зубчатой фасции гиппокампа с экспрессией CFP в ядрах нервных стволовых клеток.in FIG. 2 presents a three-dimensional image of the hippocampus of a 14-day-old mouse of the Nestin-CFPnuc line stained by the claimed method, the insets on the right show enlarged fragments of the granular layer of the dentate fascia of the hippocampus with CFP expression in the nuclei of nerve stem cells.
Первый вариант заявленного способа иммуногистохимического окрашивания тотальных препаратов образцов биологических тканей осуществляют следующим образом. Образцы биологической ткани (мозг новорожденных, молодых, взрослых и старых мышей) фиксируют транскардиальной перфузией сначала 0.1 М фосфатным буфером при pH 7.4 (далее по тексту фосфатный буфер) в объеме 30 мл, а затем охлажденным до 4-10°C 0,5-1%-ным параформальдегидом в фосфатном буфере при pH 7.4, также в объеме 30 мл. Далее все операции проводят при помешивании со скоростью 650-800 об/мин (меньшая скорость недостаточна для равномерного прокрашивания, а большая может вызвать повреждение образца). Образцы постфиксируют сначала 0,5-1%-ным параформальдегидом в течение 48 ч при 4°C (при меньшем времени фиксации образцы могут разрушаться в процессе окраски, при более длительной фиксации появляется аутофлуоресценция в сосудах), а затем после трехкратной отмывки фосфатным буфером при комнатной температуре, в растворе 20%-ного диметилсульфоксида (ДМСО) в 100%-ном метаноле в течение 1-2 ч при комнатной температуре (при комнатной температуре происходит дополнительная делипидизация ткани). Ткань также можно фиксировать методом погружения образца в 0,5-1% раствор параформальдегида в течение 48 ч при 4°C , а затем постфиксировать в растворе 20%-ного ДМСО в 100%-ном метаноле, как описано выше. Фиксированные образцы ткани отбеливают в растворе, содержащем 100%-ный метанол: ДМСО: 30% Н2О2 в соотношении 4:1:1, в течение 2-4 ч на ярком свету при комнатной температуре до полного обесцвечивания (пока образцы не станут белыми), после чего их отмывают 3 раза по 60 мин в 100%-ном метаноле при комнатной температуре и замораживают не менее чем на 1 час при -70…-80°C. На этом этапе дегидратированные образцы можно накапливать и хранить длительное время в 100% метаноле в условиях глубокой заморозки при -70…-80°C. Для снижения аутофлуоресценции в сосудах дегидратированные образцы до окрашивания просветляют в смеси бензил бензоат:бензиловый спирт в соотношении 2:1 в течение 30 мин при комнатной температуре до состояния полной прозрачности, а затем экспонируют прозрачные образцы под ультрафиолетом в течение 1 ч, при 4-10°C (высокая температура может негативно влияет на антигенность), после чего препараты отмывают дважды в абсолютном метаноле в течение 30 мин при комнатной температуре. Данный этап является обязательным, если препараты окрашиваются с целью последующего количественного анализа. Далее дегидратированные препараты регидратируют последовательно в 50, 25 и 12,5%-ных растворах метанола в фосфатном буфере по 45-60 мин в каждом при комнатной температуре, а затем трижды отмывают от метанола фосфатным буфером, причем два раза отмывают по 1-2 ч при комнатной температуре, а последнюю отмывку проводят в течение ночи при 4°C . Регидратированные образцы пермеабилизируют в фосфатном буфере, содержащем 2%-ный Triton Х-100, 5%-ную нормальную сыворотку, 5%-ный ДМСО, в течение 2 ч при комнатной температуре, после чего образцы отмывают трижды в фосфатном буфере, содержащем 0,2%-ный Triton Х-100, причем два раза отмывают по 30-60 мин при комнатной температуре, а последнюю отмывку проводят в течение ночи при 4°C. Далее проводят инкубацию образцов в растворе первичных антител, приготовленном на буфере, состоящем из 0.05 М Tris-HCl с pH 7.5; 0.15 М NaCl; 0.2% Triton Х-100, 5% ДМСО и 2.5-5.0% нормальной сыворотки животного-хозяина вторичных антител, при 4°C в течение 2-7 суток (время зависит от (1) размера образца: крупный размер образца требует большего времени для диффузии антител вглубь образца; (2) возраста животного: образцы старых животных требуют большего времени инкубации, чем молодых, вследствие большей гидрофобности их нервной ткани, и (3) размера конкретных антител: промышленные антитела отличаются по молекулярной массе, чем крупней антитела, тем большее время инкубации требуется), заменяя инкубационный раствор на свежий 2-3 раза через 24-48 ч инкубации.The first variant of the claimed method of immunohistochemical staining of total preparations of samples of biological tissues is as follows. Samples of biological tissue (brain of newborns, young, adults and old mice) are fixed by transcardial perfusion, first with 0.1 M phosphate buffer at pH 7.4 (hereinafter referred to as phosphate buffer) in a volume of 30 ml, and then cooled to 4-10 ° C 0.5- 1% paraformaldehyde in phosphate buffer at pH 7.4, also in a volume of 30 ml. Further, all operations are carried out with stirring at a speed of 650-800 rpm (a lower speed is not sufficient for uniform staining, and a large one can cause damage to the sample). Samples are postfixed first with 0.5-1% paraformaldehyde for 48 hours at 4 ° C (with shorter fixation times, samples may break down during staining, autofluorescence in vessels appears with longer fixation), and then after washing three times with phosphate buffer at room temperature, in a solution of 20% dimethyl sulfoxide (DMSO) in 100% methanol for 1-2 hours at room temperature (additional tissue delipidization occurs at room temperature). The tissue can also be fixed by immersing the sample in a 0.5-1% paraformaldehyde solution for 48 hours at 4 ° C, and then postfixing in a solution of 20% DMSO in 100% methanol, as described above. Fixed tissue samples are bleached in a solution containing 100% methanol: DMSO: 30% H 2 O 2 in a ratio of 4: 1: 1 for 2-4 hours in bright light at room temperature until completely discolored (until the samples become discolored) white), after which they are washed 3 times for 60 minutes in 100% methanol at room temperature and frozen for at least 1 hour at -70 ... -80 ° C. At this stage, dehydrated samples can be accumulated and stored for a long time in 100% methanol under conditions of deep freezing at -70 ... -80 ° C. To reduce autofluorescence in the vessels, dehydrated samples before staining are enlightened in a mixture of benzyl benzoate: benzyl alcohol in a ratio of 2: 1 for 30 min at room temperature to a state of complete transparency, and then transparent samples are exposed under ultraviolet for 1 h, at 4-10 ° C (high temperature can negatively affect antigenicity), after which the preparations are washed twice in absolute methanol for 30 minutes at room temperature. This stage is mandatory if the preparations are stained for the purpose of subsequent quantitative analysis. Next, the dehydrated preparations are rehydrated sequentially in 50, 25 and 12.5% methanol solutions in phosphate buffer for 45-60 minutes each at room temperature, and then washed three times with methanol in phosphate buffer, whereupon they are washed twice for 1-2 hours at room temperature, and the last washing is carried out overnight at 4 ° C. Rehydrated samples are permeabilized in phosphate buffer containing 2% Triton X-100, 5% normal serum, 5% DMSO for 2 hours at room temperature, after which the samples are washed three times in phosphate buffer containing 0, 2% Triton X-100, moreover, twice washed for 30-60 minutes at room temperature, and the last washing is carried out overnight at 4 ° C. Next, the samples are incubated in a solution of primary antibodies prepared on a buffer consisting of 0.05 M Tris-HCl with a pH of 7.5; 0.15 M NaCl; 0.2% Triton X-100, 5% DMSO and 2.5-5.0% normal serum of an animal host of secondary antibodies, at 4 ° C for 2-7 days (time depends on (1) sample size: large sample size takes longer to diffusion of antibodies deep into the sample; (2) the age of the animal: samples of old animals require longer incubation times than young ones, due to the greater hydrophobicity of their nervous tissue, and (3) the size of specific antibodies: industrial antibodies differ in molecular weight, the larger the antibodies, the greater incubation time required), replacing the incubation ionic solution fresh 2-3 times after 24-48 hours of incubation.
После инкубации с антителами образцы отмывают в буфере, состоящем из 0.05 М Tris-HCl с pH 7.5; 0.15 М NaCl; 0.2% Triton Х-100, сначала 3 раза по 60 мин при комнатной температуре, а затем в течение ночи при 4°C . Затем проводят инкубацию образцов в растворе вторичных флуоресцентно меченных антител, приготовленном на буфере, состоящем из 0.05 М Tris-HCl с pH 7.5; 0.15 М NaCl; 0.2% Triton Х-100, 5% ДМСО и 2.5-5.0% нормальной сыворотки животного-хозяина вторичных антител, при 4°C в течение 2-7 суток, заменяя инкубационный раствор на свежий 2-3 раза через 24-48 ч инкубации. После инкубации с вторичными антителами образцы снова отмывают в буфере, состоящем из 0.05 М Tris-HCl с pH 7.5; 0.15 М NaCl; 0.2% Triton Х-100, сначала 3 раза по 60 мин при комнатной температуре, а затем в течение ночи при 4°C. Растворы первичных и/или вторичных антител могут дополнительно содержать 0.5-1% сапонин для повышения проницаемости образцов для антител. Инкубационные растворы первичных и вторичных антител можно освежать также добавлением новой порции антител. Окрашенные образцы дегидратируют последовательно в 50, 96%-ных растворах этанола в фосфатном буфере по 45-60 мин в каждом при комнатной температуре, затем выдерживают сначала в 100%-ном этаноле при комнатной температуре 2-3 раза по 45-60 мин, а затем в 2-бутоксиэтаноле при 4°C в течение 12-18 ч. На этом этапе окрашенные образцы ткани можно хранить в 2-бутоксиэтаноле при 4°C. Дегидратированные образцы просветляют при комнатной температуре в течение 3-4 ч в смеси бензил бензоата:бензиловый спирт, взятых в соотношении 2:1.After incubation with antibodies, the samples are washed in a buffer consisting of 0.05 M Tris-HCl with a pH of 7.5; 0.15 M NaCl; 0.2% Triton X-100, first 3 times for 60 minutes at room temperature, and then overnight at 4 ° C. Then the samples are incubated in a solution of secondary fluorescently labeled antibodies prepared on a buffer consisting of 0.05 M Tris-HCl with a pH of 7.5; 0.15 M NaCl; 0.2% Triton X-100, 5% DMSO and 2.5-5.0% normal serum of an animal host of secondary antibodies, at 4 ° C for 2-7 days, replacing the incubation solution with fresh 2-3 times after 24-48 hours of incubation. After incubation with secondary antibodies, the samples are again washed in a buffer consisting of 0.05 M Tris-HCl with a pH of 7.5; 0.15 M NaCl; 0.2% Triton X-100, first 3 times for 60 minutes at room temperature, and then overnight at 4 ° C. Solutions of primary and / or secondary antibodies may additionally contain 0.5-1% saponin to increase the permeability of samples for antibodies. Incubation solutions of primary and secondary antibodies can also be refreshed by adding a new portion of antibodies. The stained samples are dehydrated sequentially in 50, 96% ethanol solutions in phosphate buffer for 45-60 minutes each at room temperature, then they are first incubated in 100% ethanol at room temperature 2-3 times for 45-60 minutes, and then in 2-butoxyethanol at 4 ° C for 12-18 hours. At this point, stained tissue samples can be stored in 2-butoxyethanol at 4 ° C. Dehydrated samples are clarified at room temperature for 3-4 hours in a mixture of benzyl benzoate: benzyl alcohol, taken in a 2: 1 ratio.
Второй вариант заявленного способа иммуногистохимического окрашивания тотальных препаратов образцов биологических тканей осуществляют следующим образом. Образцы биологической ткани (мозг новорожденных, молодых, взрослых и старых мышей) фиксируют транскардиальной перфузией сначала 0.1 М фосфатным буфером при pH 7.4 (далее по тексту фосфатный буфер) в объеме 30 мл, а затем охлажденным до 4-10°C 0,5-1%-ным параформальдегидом в фосфатном буфере при pH 7.4, также в объеме 30 мл. Далее все операции проводят при помешивании со скоростью 650-800 об/мин (меньшая скорость недостаточна для равномерного прокрашивания, а большая может вызвать повреждение образца). Образцы постфиксируют сначала 0,5-1%-ным параформальдегидом в течение 48 ч при 4°C (при меньшем времени фиксации образцы могут разрушаться в процессе окраски, при более длительной фиксации появляется аутофлуоресценция в сосудах), а затем после трехкратной отмывки фосфатным буфером при комнатной температуре, в растворе 20%-ного ДМСО в 100%-ном метаноле в течение 1-2 ч при комнатной температуре (при комнатной температуре происходит дополнительная делипидизация ткани). Ткань также можно фиксировать методом погружения образца в 0,5-1% раствор параформальдегида в течение 48 ч при 4°C, а затем постфиксировать в растворе 20%-ного ДМСО в 100%-ном метаноле, как описано выше. Фиксированные образцы ткани отбеливают в растворе, содержащем 100%-ный метанол:ДМСО: 30% Н2О2 в соотношении 4:1:1, в течение 2-4 ч на ярком свету при комнатной температуре до полного обесцвечивания (пока образцы не станут белыми), после чего их отмывают 3 раза по 60 мин в 100%-ном метаноле при комнатной температуре и замораживают не менее чем на 1 час при -70…-80°C. На этом этапе дегидратированные образцы можно накапливать и хранить длительное время в 100% метаноле в условиях глубокой заморозки при -70…-80°C. Для снижения аутофлуоресценции в сосудах дегидратированные образцы до окрашивания просветляют в смеси бензил бензоат:бензиловый спирт в соотношении 2:1 в течение 30 мин при комнатной температуре до состояния полной прозрачности, а затем экспонируют прозрачные образцы под ультрафиолетом в течение 1 ч, при 4-10°C (высокая температура может негативно влияет на антигенность), после чего препараты отмывают дважды в абсолютном метаноле в течение 30 мин при комнатной температуре. Данный этап является обязательным, если препараты окрашиваются с целью последующего количественного анализа. Далее дегидратированные препараты регидратируют последовательно в 50, 25 и 12,5%-ных растворах метанола в фосфатном буфере по 45-60 мин в каждом при комнатной температуре, а затем трижды отмывают от метанола фосфатным буфером, причем два раза отмывают по 1-2 ч при комнатной температуре, а последнюю отмывку проводят в течение ночи при 4°C. Регидратированные образцы пермеабилизируют в фосфатном буфере, содержащем 2%-ный Triton Х-100, 5%-ную нормальную сыворотку, 5%-ный ДМСО, в течение 2 ч при комнатной температуре, после чего образцы отмывают трижды в фосфатном буфере, содержащем 0,2%-ный Triton Х-100, причем два раза отмывают по 30-60 мин при комнатной температуре, а последнюю отмывку проводят в течение ночи при 4°C . Далее проводят инкубацию образцов в растворе первичных флуоресцентно меченных антител, приготовленном на буфере, состоящем из 0.05 М Tris-HCl с pH 7.5; 0.15 М NaCl; 0.2% Triton Х-100, 5% ДМСО и 2.5-5.0% нормальной сыворотки, при 4°C в течение 2-7 суток (время зависит от (1) размера образца: крупный размер образца требует большего времени для диффузии антител вглубь образца; (2) возраста животного: образцы старых животных требуют большего времени инкубации, чем молодых, вследствие большей гидрофобности их нервной ткани, и (3) размера конкретных антител: промышленные антитела отличаются по молекулярной массе, чем крупней антитела, тем большее время инкубации требуется), заменяя инкубационный раствор на свежий 2-3 раза через 24-48 ч инкубации. После инкубации с антителами образцы отмывают в буфере, состоящем из 0.05 М Tris-HCl с pH 7.5; 0.15 М NaCl; 0.2% Triton Х-100, сначала 3 раза по 60 мин при комнатной температуре, а затем в течение ночи при 4°C. Раствор антител может дополнительно содержать 0.5-1% сапонин для повышения проницаемости образцов для антител. Инкубационный раствор первичных антител можно освежать также добавлением новой порции антител. Окрашенные образцы дегидратируют последовательно в 50, 96%-ных растворах этанола в фосфатном буфере по 45-60 мин в каждом при комнатной температуре, затем выдерживают сначала в 100%-ном этаноле при комнатной температуре 2-3 раза по 45-60 мин, а затем в 2-бутоксиэтаноле при 4°C в течение 12-18 ч. На этом этапе окрашенные образцы ткани можно хранить в 2-бутоксиэтаноле при 4°C. Дегидратированные образцы просветляют при комнатной температуре в течение 3-4 ч в смеси бензил бензоата:бензиловый спирт, взятых в соотношении 2:1.The second variant of the claimed method of immunohistochemical staining of total preparations of samples of biological tissues is as follows. Samples of biological tissue (brain of newborns, young, adults and old mice) are fixed by transcardial perfusion, first with 0.1 M phosphate buffer at pH 7.4 (hereinafter referred to as phosphate buffer) in a volume of 30 ml, and then cooled to 4-10 ° C 0.5- 1% paraformaldehyde in phosphate buffer at pH 7.4, also in a volume of 30 ml. Further, all operations are carried out with stirring at a speed of 650-800 rpm (a lower speed is not sufficient for uniform staining, and a large one can cause damage to the sample). Samples are postfixed first with 0.5-1% paraformaldehyde for 48 hours at 4 ° C (with shorter fixation times, samples may break down during staining, autofluorescence in vessels appears with longer fixation), and then after washing three times with phosphate buffer at room temperature, in a solution of 20% DMSO in 100% methanol for 1-2 hours at room temperature (additional tissue delipidization occurs at room temperature). The tissue can also be fixed by immersing the sample in a 0.5-1% paraformaldehyde solution for 48 hours at 4 ° C, and then postfixing in a solution of 20% DMSO in 100% methanol, as described above. Fixed tissue samples are bleached in a solution containing 100% methanol: DMSO: 30% H 2 O 2 in a ratio of 4: 1: 1 for 2-4 hours in bright light at room temperature until completely discolored (until the samples become discolored) white), after which they are washed 3 times for 60 minutes in 100% methanol at room temperature and frozen for at least 1 hour at -70 ... -80 ° C. At this stage, dehydrated samples can be accumulated and stored for a long time in 100% methanol under conditions of deep freezing at -70 ... -80 ° C. To reduce autofluorescence in the vessels, dehydrated samples before staining are enlightened in a mixture of benzyl benzoate: benzyl alcohol in a ratio of 2: 1 for 30 min at room temperature to a state of complete transparency, and then transparent samples are exposed under ultraviolet for 1 h, at 4-10 ° C (high temperature can negatively affect antigenicity), after which the preparations are washed twice in absolute methanol for 30 minutes at room temperature. This stage is mandatory if the preparations are stained for the purpose of subsequent quantitative analysis. Next, the dehydrated preparations are rehydrated sequentially in 50, 25 and 12.5% methanol solutions in phosphate buffer for 45-60 minutes each at room temperature, and then washed three times with methanol in phosphate buffer, whereupon they are washed twice for 1-2 hours at room temperature, and the last washing is carried out overnight at 4 ° C. Rehydrated samples are permeabilized in phosphate buffer containing 2% Triton X-100, 5% normal serum, 5% DMSO for 2 hours at room temperature, after which the samples are washed three times in phosphate buffer containing 0, 2% Triton X-100, moreover, twice washed for 30-60 minutes at room temperature, and the last washing is carried out overnight at 4 ° C. Next, the samples are incubated in a solution of primary fluorescently labeled antibodies prepared on a buffer consisting of 0.05 M Tris-HCl with a pH of 7.5; 0.15 M NaCl; 0.2% Triton X-100, 5% DMSO and 2.5-5.0% normal serum, at 4 ° C for 2-7 days (the time depends on (1) the size of the sample: the large size of the sample requires more time for diffusion of antibodies deep into the sample; (2) the age of the animal: samples of old animals require a longer incubation time than young ones, due to the greater hydrophobicity of their nervous tissue, and (3) the size of specific antibodies: industrial antibodies differ in molecular weight, the larger the antibodies, the longer the incubation time is required), replacing the incubation solution with fresh 2-3 times 24-48 h incubation. After incubation with antibodies, the samples are washed in a buffer consisting of 0.05 M Tris-HCl with a pH of 7.5; 0.15 M NaCl; 0.2% Triton X-100, first 3 times for 60 minutes at room temperature, and then overnight at 4 ° C. The antibody solution may additionally contain 0.5-1% saponin to increase the permeability of the samples for antibodies. The incubation solution of primary antibodies can also be refreshed by adding a new portion of antibodies. The stained samples are dehydrated sequentially in 50, 96% ethanol solutions in phosphate buffer for 45-60 minutes each at room temperature, then they are first incubated in 100% ethanol at room temperature 2-3 times for 45-60 minutes, and then in 2-butoxyethanol at 4 ° C for 12-18 hours. At this point, stained tissue samples can be stored in 2-butoxyethanol at 4 ° C. Dehydrated samples are clarified at room temperature for 3-4 hours in a mixture of benzyl benzoate: benzyl alcohol, taken in a 2: 1 ratio.
Ниже приведены конкретные примеры реализации заявленных способов.The following are specific examples of the implementation of the claimed methods.
Пример 1.Example 1
Окрашивали образцы изолированного гиппокампа взрослых мышей линии 129sv в возрасте около 60-и постнатальных суток. Для индукции экспрессии c-Fos мышь помещали в незнакомую экспериментальную камеру и через 2.5 мин наносили удар током 0.5 А по лапам длительностью 2 с. После этого животное выдерживали в камере еще 30 с, а затем возвращали в домашнюю клетку. Декапитацию производили на пике индуцируемой экспрессии - через 90 мин от начала эксперимента. Мозг фиксировали методом погружения образца в 1% раствор параформальдегида в течение 24 ч при 4°C . После этого из мозга извлекали гиппокамп и постфиксировали его в том же растворе дополнительно 24 ч. Далее все операции проводили при помешивании со скоростью 750 об/мин. После трехкратной отмывки фосфатным буфером при комнатной температуре, препараты гиппокампа дополнительно постфиксировали в растворе 20%-ного диметилсульфоксида (ДМСО) в 100%-ном метаноле в течение 2 ч при температуре 4°C. Фиксированные препараты отбеливали в растворе, содержащем 100%-ный метанол: ДМСО: 30% Н2О2 в соотношении 4:1:1, в течение 2 ч на ярком свету при комнатной температуре до полного обесцвечивания, после чего их отмывали 3 раза по 60 мин в 100%-ном метаноле при комнатной температуре и замораживали на 18 ч при -80°C. Далее дегидратированные препараты регидратировали последовательно в 50, 25 и 12,5%-ных растворах метанола в фосфатном буфере по 60 мин в каждом при комнатной температуре, а затем трижды отмывали от метанола фосфатным буфером, причем два раза отмывали по 1 ч при комнатной температуре, а последнюю отмывку проводили в течение ночи при 4°C. Далее проводили инкубацию образцов в растворе кроличьих первичных антител к белку c-Fos (sc-52, Santa Cruz, США, в разведении 1:500), приготовленном на буфере, состоящем из 0.05 М Tris-HCl с pH 7.5; 0.15 М NaCl; 0.2% Triton Х-100, 5% ДМСО и 2.5% нормальной козьей сыворотки, при 4°C в течение 72 ч. После инкубации с антителами образцы отмывали в буфере, состоящем из 0.05 М Tris-HCl с pH 7.5; 0.15 М NaCl; 0.2% Triton Х-100, сначала 3 раза по 60 мин при комнатной температуре, а затем в течение ночи при 4°C. Затем проводили инкубацию образцов в растворе вторичных козьих противокроличьих антител, конъюгированных с Alexa Fluor 488 (F(ab′)2-фрагменты, А-11070, Molecular Probes, США, 1:500), приготовленном на буфере, состоящем из 0.05М Tris-HCl с pH 7.5; 0.15 М NaCl; 0.2% Triton Х-100, 5% ДМСО и 2.5% нормальной сыворотки животного-хозяина вторичных антител, при 4°C в течение 24 ч. После инкубации с вторичными антителами образцы снова отмывали в буфере, состоящем из 0.05 М Tris-HCl с pH 7.5; 0.15 М NaCl; 0.2% Triton Х-100, сначала 3 раза по 60 мин при комнатной температуре, а затем в течение ночи при 4°C. Далее окрашенные образцы дегидратировали последовательно в 50, 96%-ных растворах этанола в фосфатном буфере по 60 мин в каждом при комнатной температуре, затем выдерживали сначала в 100%-ном этаноле при комнатной температуре 3 раза по 60 мин, а затем в 2-бутоксиэтаноле при 4°C в течение 18 ч. Дегидратированные образцы просветляли при комнатной температуре в течение 12 ч в смеси бензил бензоата:бензиловый спирт, взятых в соотношении 2:1 Съемку препаратов проводили на светоплоскостном микроскопе, построение трехмерных реконструкций окрашенных гиппокампов осуществляли в Imaris 6.0 (Bitplane AG, Швейцария).Stained samples of the isolated hippocampus of adult 129sv mice at the age of about 60 postnatal days. To induce c-Fos expression, the mouse was placed in an unfamiliar experimental chamber, and after 2.5 min, a shock of 0.5 A was applied to the legs for 2 s. After that, the animal was kept in the chamber for another 30 s, and then returned to the home cage. Decapitation was performed at the peak of inducible expression — 90 minutes after the start of the experiment. The brain was fixed by immersing the sample in a 1% paraformaldehyde solution for 24 hours at 4 ° C. After that, the hippocampus was removed from the brain and postfixed in the same solution for an additional 24 hours. Next, all operations were performed with stirring at a speed of 750 rpm. After washing three times with phosphate buffer at room temperature, the hippocampal preparations were additionally fixed in a solution of 20% dimethyl sulfoxide (DMSO) in 100% methanol for 2 hours at 4 ° C. The fixed preparations were bleached in a solution containing 100% methanol: DMSO: 30% Н2О2 in a ratio of 4: 1: 1, for 2 hours in bright light at room temperature until completely discolored, after which they were washed 3 times for 60 minutes each 100% methanol at room temperature and frozen for 18 hours at -80 ° C. Then, the dehydrated preparations were rehydrated successively in 50, 25, and 12.5% methanol solutions in phosphate buffer for 60 min each at room temperature, and then they were washed three times with methanol in phosphate buffer, and then washed twice for 1 h at room temperature, and the last washing was performed overnight at 4 ° C. Next, samples were incubated in a solution of rabbit primary antibodies to c-Fos protein (sc-52, Santa Cruz, USA, diluted 1: 500) prepared on a buffer consisting of 0.05 M Tris-HCl with a pH of 7.5; 0.15 M NaCl; 0.2% Triton X-100, 5% DMSO and 2.5% normal goat serum, at 4 ° C for 72 hours. After incubation with antibodies, the samples were washed in a buffer consisting of 0.05 M Tris-HCl with a pH of 7.5; 0.15 M NaCl; 0.2% Triton X-100, first 3 times for 60 minutes at room temperature, and then overnight at 4 ° C. Then, samples were incubated in a solution of secondary goat anti-rabbit antibodies conjugated with Alexa Fluor 488 (F (ab ′) 2 fragments, A-11070, Molecular Probes, USA, 1: 500), prepared on a buffer consisting of 0.05 M Tris- HCl pH 7.5; 0.15 M NaCl; 0.2% Triton X-100, 5% DMSO and 2.5% normal serum of an animal host of secondary antibodies, at 4 ° C for 24 hours. After incubation with secondary antibodies, the samples were again washed in a buffer consisting of 0.05 M Tris-HCl with pH 7.5; 0.15 M NaCl; 0.2% Triton X-100, first 3 times for 60 minutes at room temperature, and then overnight at 4 ° C. Then, the stained samples were dehydrated sequentially in 50, 96% ethanol solutions in phosphate buffer for 60 min each at room temperature, then they were first kept in 100% ethanol at room temperature for 3 times for 60 min, and then in 2-butoxyethanol at 4 ° C for 18 h. Dehydrated samples were illuminated at room temperature for 12 h in a mixture of benzyl benzoate: benzyl alcohol, taken in a 2: 1 ratio. The preparations were taken using a light-plane microscope and three-dimensional reconstructions of stained hippocampures were performed. MPa was performed in Imaris 6.0 (Bitplane AG, Switzerland).
Препараты гиппокампа, окрашенные по заявленному способу, прокрашены полностью, после просветления в растворе Мюррея не наблюдается потеря флуоресцентного сигнала, достигается клеточное разрешение по всей глубине образца, а также высокое соотношение сигнал:фон, пригодные для осуществления количественного анализа (Фиг. 1).The hippocampal preparations stained according to the claimed method are completely stained, after bleaching in a Murray solution, there is no loss of fluorescence signal, cellular resolution is achieved over the entire depth of the sample, as well as a high signal: background ratio suitable for quantitative analysis (Fig. 1).
Пример 2.Example 2
Окрашивали образцы изолированного гиппокампа взрослых мышей линии NestinCFPnuc в возрасте около 60 постнатальных суток, в геном которых встроен голубой флуоресцентный белок CFP под регулирующей последовательностью гена nestin-маркера стволовых клеток мозга. Проводили транскардиальную перфузию сначала 0.1 М фосфатным буфером при pH 7.4 в объеме 30 мл, а затем охлажденным до 10°C 1%-ным параформальдегидом в фосфатном буфере при pH 7.4, также в объеме 30 мл. После этого извлекали головной мозг и постфиксировали его 1%-ным параформальдегидом в фосфатном буфере при 4°C в течение 24 ч. После этого из мозга извлекали гиппокамп и постфиксировали его в том же растворе дополнительно 24 ч. Далее все операции проводили при помешивании со скоростью 650 об/мин. После трехкратной отмывки фосфатным буфером при комнатной температуре, образцы постфиксировали в растворе 20%-ного ДМСО в 100%-ном метаноле в течение 2 ч при температуре 4°C .Фиксированные препараты гиппокампа отбеливали в растворе, содержащем 100%-ный метанол: ДМСО: 30% Н2О2 в соотношении 4:1:1, в течение 2 ч на ярком свету при комнатной температуре до полного обесцвечивания, после чего их отмывали 3 раза по 60 мин в 100%-ном метаноле при комнатной температуре и замораживали не менее чем на 1 час при -70…-80°C. Для снижения аутофлуоресценции в сосудах дегидратированные образцы до окрашивания просветляли в смеси бензил бензоат:бензиловый спирт в соотношении 2:1 в течение 30 мин при комнатной температуре до состояния полной прозрачности, а затем экспонировали прозрачные образцы под ультрафиолетом в течение 1 ч, при 10°C , после чего препараты отмывали дважды в абсолютном метаноле в течение 30 мин при комнатной температуре. Далее дегидратированные препараты гиппокампа регидратировали последовательно в 50, 25 и 12,5%-ных растворах метанола в фосфатном буфере по 60 мин в каждом при комнатной температуре, а затем трижды отмывали от метанола фосфатным буфером, причем два раза отмывали по 1 ч при комнатной температуре, а последнюю отмывку проводили в течение ночи при 4°C. Регидратированные образцы пермеабилизировали в фосфатном буфере, содержащем 2%-ный Triton Х-100, 5%-ную нормальную козью сыворотку, 5%-ный ДМСО, в течение 2 ч при комнатной температуре, после чего гиппокампы отмывали трижды в фосфатном буфере, содержащем 0,2%-ный Triton Х-100, два раза отмывали по 30 мин при комнатной температуре, а последнюю отмывку проводили в течение ночи при 4°C. Далее препараты инкубировали в растворе кроличьих поликлональных антител к белку GFP, конъюгированных с флуорофором AlexaFluor488 (Molecular Probes, 1:500), приготовленном на буфере, состоящем из 0.05М Tris-HCl с pH 7.5; 0.15 М NaCl; 0.2% Triton Х-100, 5% ДМСО, 1% сапонин и 2.5% нормальной козьей сыворотки при 4°C в течение 72 ч, заменяя инкубационный раствор на свежий через 36 ч инкубации. После инкубации с антителами образцы отмывали в буфере, состоящем из 0.05 М Tris-HCl с pH 7.5; 0.15 М NaCl; 0.2% Triton Х-100, сначала 3 раза по 1 ч при комнатной температуре, а затем в течение ночи при 4°C. Окрашенные препараты дегидратировали последовательно в 50, 96%-ных растворах этанола в фосфатном буфере по 60 мин в каждом при комнатной температуре, затем выдерживали сначала в 100%-ном этаноле при комнатной температуре 2 раза по 60 мин, а затем в 2-бутоксиэтаноле при 4°C в течение 18 ч. На этом этапе окрашенные образцы ткани хранили в 2-бутоксиэтаноле при 4°C. Дегидратированные образцы просветляли при комнатной температуре в течение 4 ч в смеси бензил бензоата:бензиловый спирт, взятых в соотношении 2:1. Анализ и съемку образцов осуществляли с помощью конфокального лазерного сканирующего микроскопа (Olympus FluoView 1000, Япония). Послойное панорамное сшивание и построение трехмерных реконструкций окрашенных гиппокампов осуществляли в Imaris 6.0 (Bitplane AG, Швейцария).Stained samples of the isolated hippocampus of adult NestinCFPnuc mice aged about 60 postnatal days, in the genome of which a blue fluorescent CFP protein was inserted under the regulatory sequence of the brain stem cell nestin marker gene. Transcardial perfusion was carried out, first with 0.1 M phosphate buffer at pH 7.4 in a volume of 30 ml, and then with 1% paraformaldehyde cooled to 10 ° C in phosphate buffer at pH 7.4, also in a volume of 30 ml. After that, the brain was removed and postfixed with 1% paraformaldehyde in phosphate buffer at 4 ° C for 24 hours. After that, the hippocampus was removed from the brain and postfixed in the same solution for an additional 24 hours. Next, all operations were performed with stirring at a speed 650 rpm After washing three times with phosphate buffer at room temperature, the samples were fixed in a solution of 20% DMSO in 100% methanol for 2 hours at 4 ° C. Fixed hippocampal preparations were bleached in a solution containing 100% methanol: DMSO: 30% H 2 O 2 in a ratio of 4: 1: 1, for 2 hours in bright light at room temperature until completely discolored, after which they were washed 3 times for 60 minutes in 100% methanol at room temperature and frozen for at least less than 1 hour at -70 ... -80 ° C. To reduce autofluorescence in the vessels, dehydrated samples were illuminated before staining in a mixture of benzyl benzoate: benzyl alcohol in a 2: 1 ratio for 30 min at room temperature until completely transparent, and then transparent samples were exposed under ultraviolet light for 1 h at 10 ° C after which the preparations were washed twice in absolute methanol for 30 min at room temperature. Then, the dehydrated hippocampal preparations were rehydrated successively in 50, 25, and 12.5% methanol solutions in phosphate buffer for 60 min each at room temperature, and then they were washed three times with methanol in phosphate buffer, and then washed twice for 1 h at room temperature and the last washing was carried out overnight at 4 ° C. Rehydrated samples were permeabilized in phosphate buffer containing 2% Triton X-100, 5% normal goat serum, 5% DMSO for 2 hours at room temperature, after which the hippocampi were washed three times in phosphate buffer containing 0 , 2% Triton X-100, was washed twice for 30 minutes at room temperature, and the last washing was performed overnight at 4 ° C. The preparations were then incubated in a solution of rabbit polyclonal antibodies to the GFP protein conjugated with AlexaFluor488 fluorophore (Molecular Probes, 1: 500), prepared on a buffer consisting of 0.05 M Tris-HCl with pH 7.5; 0.15 M NaCl; 0.2% Triton X-100, 5% DMSO, 1% saponin and 2.5% normal goat serum at 4 ° C for 72 hours, replacing the incubation solution with fresh after 36 hours of incubation. After incubation with antibodies, the samples were washed in a buffer consisting of 0.05 M Tris-HCl with a pH of 7.5; 0.15 M NaCl; 0.2% Triton X-100, first 3 times for 1 hour at room temperature, and then overnight at 4 ° C. The colored preparations were dehydrated sequentially in 50, 96% ethanol solutions in phosphate buffer for 60 min each at room temperature, then they were first kept in 100% ethanol at room temperature 2 times for 60 min, and then in 2-butoxyethanol at 4 ° C for 18 hours. At this point, stained tissue samples were stored in 2-butoxyethanol at 4 ° C. Dehydrated samples were clarified at room temperature for 4 h in a mixture of benzyl benzoate: benzyl alcohol, taken in a 2: 1 ratio. Analysis and shooting of the samples was carried out using a confocal laser scanning microscope (Olympus FluoView 1000, Japan). Layered panoramic stitching and construction of three-dimensional reconstructions of stained hippocampi was carried out in Imaris 6.0 (Bitplane AG, Switzerland).
В препаратах гиппокампа, окрашенных по заявленному способу, отчетливо видны ядра стволовых клеток в субгранулярной зоне зубчатой фасции гиппокампа, экспрессирующие CFP (Фиг. 2). После просветления в растворе Мюррея не наблюдается потери флуоресцентного сигнала, ядерное разрешение наблюдается по всей глубине образца (Фиг. 2, справа), достигается высокое соотношение сигнал:фон, что делает принципиально возможным осуществление количественного анализа.In hippocampal preparations stained by the claimed method, the nuclei of stem cells in the subgranular zone of the dentate fascia of the hippocampus expressing CFP are clearly visible (Fig. 2). After enlightenment in a Murray solution, there is no loss of fluorescence signal, nuclear resolution is observed over the entire depth of the sample (Fig. 2, right), a high signal: background ratio is achieved, which makes it possible in principle to carry out quantitative analysis.
Предлагаемые варианты способа иммуногистохимического окрашивания тотальных препаратов образцов биологических тканей позволяют окрашивать тотальные препараты образцов биологических тканей как молодых, так и взрослых животных. Использование предлагаемых способов окрашивания позволяет сохранять морфологию образцов и расширить область применения за счет более широкого охвата выявляемых антигенов, а также сократить продолжительность процесса окрашивания препаратов до 12-15 суток по первому варианту и до 9-11 суток - по второму варианту. Препараты образцов, окрашенные предлагаемыми способами, обладают высоким соотношением сигнал:фон, что позволяет использовать их, в отличие от образцов, окрашенных ранее известными способами, для проведения количественного анализа иммуногистохимически выявленных меток.The proposed variants of the method of immunohistochemical staining of total preparations of samples of biological tissues allow staining of total preparations of samples of biological tissues of both young and adult animals. Using the proposed staining methods allows you to save the morphology of the samples and expand the scope due to the wider coverage of the detected antigens, as well as reduce the duration of the staining process of drugs to 12-15 days according to the first embodiment and to 9-11 days - according to the second embodiment. Sample preparations stained by the proposed methods have a high signal: background ratio, which makes it possible to use them, in contrast to samples stained by previously known methods, for quantitative analysis of immunohistochemically identified labels.
Claims (18)
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2013154783/13A RU2563679C2 (en) | 2013-12-11 | 2013-12-11 | Method for immunohistochemical colouring of whole amounts of biological tissue samples (versions) |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2013154783/13A RU2563679C2 (en) | 2013-12-11 | 2013-12-11 | Method for immunohistochemical colouring of whole amounts of biological tissue samples (versions) |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2013154783A RU2013154783A (en) | 2015-06-20 |
| RU2563679C2 true RU2563679C2 (en) | 2015-09-20 |
Family
ID=53433461
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2013154783/13A RU2563679C2 (en) | 2013-12-11 | 2013-12-11 | Method for immunohistochemical colouring of whole amounts of biological tissue samples (versions) |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU2563679C2 (en) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2657787C1 (en) * | 2016-12-28 | 2018-06-15 | Федеральное государственное бюджетное научное учреждение "Институт экспериментальной медицины" (ФГБНУ "ИЭМ") | Immunohistochemical method for detection of sympathetic and parasympathetic structures in histological preparations |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4857300A (en) * | 1987-07-27 | 1989-08-15 | Cytocorp, Inc. | Cytological and histological fixative formulation and methods for using same |
| RU2419798C1 (en) * | 2009-10-16 | 2011-05-27 | Лариса Афанасьевна Медведева | Method for immunohistochemical staining of cryostat tissue sections under conditions of intraoperative diagnosis |
| RU2429462C2 (en) * | 2009-10-14 | 2011-09-20 | Учреждение Российской академии медицинских наук Научно-исследовательский институт нормальной физиологии имени П.К. Анохина РАМН | Optical clarification of biological tissue specimens |
| CN102288471A (en) * | 2011-07-27 | 2011-12-21 | 上海交通大学医学院附属仁济医院 | Immunofluorescence staining method for suspension cells |
-
2013
- 2013-12-11 RU RU2013154783/13A patent/RU2563679C2/en active
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4857300A (en) * | 1987-07-27 | 1989-08-15 | Cytocorp, Inc. | Cytological and histological fixative formulation and methods for using same |
| RU2429462C2 (en) * | 2009-10-14 | 2011-09-20 | Учреждение Российской академии медицинских наук Научно-исследовательский институт нормальной физиологии имени П.К. Анохина РАМН | Optical clarification of biological tissue specimens |
| RU2419798C1 (en) * | 2009-10-16 | 2011-05-27 | Лариса Афанасьевна Медведева | Method for immunohistochemical staining of cryostat tissue sections under conditions of intraoperative diagnosis |
| CN102288471A (en) * | 2011-07-27 | 2011-12-21 | 上海交通大学医学院附属仁济医院 | Immunofluorescence staining method for suspension cells |
Non-Patent Citations (1)
| Title |
|---|
| J.A. Gleave, J.P. Lerch, R.M. Henkelman, B.J. Nieman. "A method for 3D immunostaining and optical imaging of the mouse brain demonstrated in neural progenitor cells", PLoS One. " 08.2013. - V.8. " I.8. * |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2657787C1 (en) * | 2016-12-28 | 2018-06-15 | Федеральное государственное бюджетное научное учреждение "Институт экспериментальной медицины" (ФГБНУ "ИЭМ") | Immunohistochemical method for detection of sympathetic and parasympathetic structures in histological preparations |
Also Published As
| Publication number | Publication date |
|---|---|
| RU2013154783A (en) | 2015-06-20 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20210131925A1 (en) | Method for making biological material transparent and use thereof | |
| US10883903B2 (en) | Method for rendering biological material transparent and processing kit for rendering biological material transparent | |
| Azaripour et al. | A survey of clearing techniques for 3D imaging of tissues with special reference to connective tissue | |
| Köbbert et al. | Current concepts in neuroanatomical tracing | |
| Taylor et al. | Contractile basis of ameboid movement. VII. The distribution of fluorescently labeled actin in living amebas. | |
| Baudouin et al. | Calcium release induced by interaction of angiotensin with its receptors in smooth muscle cell microsomes | |
| CN108061677A (en) | For the fining agent and its purposes of biomaterial | |
| WO2012161143A1 (en) | Clarifying reagent for biological materials and use thereof | |
| Kántor et al. | Calcium buffer proteins are specific markers of human retinal neurons | |
| Wollesen et al. | Pygmy squids and giant brains: mapping the complex cephalopod CNS by phalloidin staining of vibratome sections and whole-mount preparations | |
| Da’dara et al. | New insights into the reaction of Schistosoma mansoni cercaria to the human complement system | |
| RU2563679C2 (en) | Method for immunohistochemical colouring of whole amounts of biological tissue samples (versions) | |
| US20210190652A1 (en) | Multiplexed Expansion (MultiExM) Pathology | |
| ISHIKAWA et al. | A staining procedure for nerve fibers in whole mount preparations of the medaka and chick embryos | |
| KR20170119936A (en) | A refractive index matching composition for biological tissue | |
| Aryal et al. | Characterization of Astrocyte Morphology and Function Using a Fast and Reliable Tissue Clearing Technique | |
| RU2620559C1 (en) | Method for colouring preparations of whole biological tissues and organs by click histochemistry (variants) | |
| WO2021001348A1 (en) | Method for preparing biological material for microscopy analysis | |
| Vanický et al. | Formaldehyde–hardened albumin as a non-penetrating embedding matrix for frozen and vibratome sectioning | |
| CN104133068A (en) | Method for observing microtubule structure of cytoskeleton in liver tissue of animals | |
| CN104807788B (en) | A kind of method and kit for monitoring vascular remodeling phenomenon | |
| Mariën et al. | Aging impairs the essential contributions of non-glial progenitors to neurorepair in the dorsal telencephalon of the Killifish N. furzeri | |
| JP7296785B2 (en) | Observation method of apocrine sweat gland dynamics and evaluation method of test substance | |
| Zolbin et al. | Fetal lung tissue engineering | |
| Fowler et al. | Live tissue antibody injection: A novel method for imaging ECM in limb buds and other tissues |