RU2524629C2 - Method of identifying compound, suitable for treating inflammatory condition of oral cavity - Google Patents
Method of identifying compound, suitable for treating inflammatory condition of oral cavity Download PDFInfo
- Publication number
- RU2524629C2 RU2524629C2 RU2011144028/15A RU2011144028A RU2524629C2 RU 2524629 C2 RU2524629 C2 RU 2524629C2 RU 2011144028/15 A RU2011144028/15 A RU 2011144028/15A RU 2011144028 A RU2011144028 A RU 2011144028A RU 2524629 C2 RU2524629 C2 RU 2524629C2
- Authority
- RU
- Russia
- Prior art keywords
- mmp
- expression
- positive control
- periodontitis
- matrix metalloproteinases
- Prior art date
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/569—Immunoassay; Biospecific binding assay; Materials therefor for microorganisms, e.g. protozoa, bacteria, viruses
- G01N33/56911—Bacteria
- G01N33/56955—Bacteria involved in periodontal diseases
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/02—Stomatological preparations, e.g. drugs for caries, aphtae, periodontitis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/90—Enzymes; Proenzymes
- G01N2333/914—Hydrolases (3)
- G01N2333/948—Hydrolases (3) acting on peptide bonds (3.4)
- G01N2333/95—Proteinases, i.e. endopeptidases (3.4.21-3.4.99)
- G01N2333/964—Proteinases, i.e. endopeptidases (3.4.21-3.4.99) derived from animal tissue
- G01N2333/96425—Proteinases, i.e. endopeptidases (3.4.21-3.4.99) derived from animal tissue from mammals
- G01N2333/96427—Proteinases, i.e. endopeptidases (3.4.21-3.4.99) derived from animal tissue from mammals in general
- G01N2333/9643—Proteinases, i.e. endopeptidases (3.4.21-3.4.99) derived from animal tissue from mammals in general with EC number
- G01N2333/96486—Metalloendopeptidases (3.4.24)
Abstract
Description
УРОВЕНЬ ТЕХНИКИBACKGROUND
Периодонтит характеризуется, частично, неправильной и чрезмерной деградацией периодонтального органического матрикса. Этот матрикс включает десну, периодонтальную связку, цементное вещество зубов и альвеолярную кость. По меньшей мере, часть разрушения матрикса опосредована сверхсинтезом матриксных металлопротеиназ (MMP), семейства цинк-зависимых эндопептидаз. MMP также способствуют резорбции костной ткани, разрушая остеоидную ткань (то есть деминерализованный и недавно синтезированный костный матрикс), затем разрушая матрикс. Эти явления приводят к клиническому проявлению периодонтита, включая атрофию десен, образование патологического десневого кармана, потерю прикрепления и возможную потерю зуба.Periodontitis is characterized, in part, by abnormal and excessive degradation of the periodontal organic matrix. This matrix includes the gums, periodontal ligament, cementum of the teeth and alveolar bone. At least a portion of the destruction of the matrix is mediated by the super synthesis of matrix metalloproteinases (MMP), a family of zinc-dependent endopeptidases. MMPs also contribute to bone resorption by destroying osteoid tissue (i.e., demineralized and newly synthesized bone matrix), then destroying the matrix. These phenomena lead to the clinical manifestation of periodontitis, including gum atrophy, the formation of a pathological gingival pocket, loss of attachment and possible tooth loss.
СУЩНОСТЬ ИЗОБРЕТЕНИЯSUMMARY OF THE INVENTION
Изобретение включает способ лечения периодонтита у млекопитающего, нуждающегося в таком лечении, включающий взаимодействие клетки во рту млекопитающего с агентом, который подавляет, по меньшей мере, одну матриксную металлопротеиназу, выбранную из группы, состоящей из MMP-9 и MMP-13, в котором подавление металлопротеиназы коррелируется с сокращением, по меньшей мере, одного симптома, связанного с периодонтитом.The invention includes a method of treating periodontitis in a mammal in need of such treatment, comprising contacting a cell in the mouth of a mammal with an agent that suppresses at least one matrix metalloproteinase selected from the group consisting of MMP-9 and MMP-13, in which metalloproteinases are correlated with a reduction in at least one symptom associated with periodontitis.
Изобретение также включает способ идентификации соединения, пригодного для лечения периодонтита у млекопитающего, способ, включающий взаимодействие клетки с исследуемым соединением и определение, подавляет ли исследуемое соединение, по меньшей мере, одну матриксную металлопротеиназу, выбранную из группы, состоящей из MMP-9 и MMP-13, в котором подавление, по меньшей мере, одной матриксной металлопротеиназы является показателем, что исследуемое соединение является пригодным для лечения периодонтита.The invention also includes a method for identifying a compound suitable for treating periodontitis in a mammal, a method comprising interacting a cell with a test compound and determining whether the test compound inhibits at least one matrix metalloproteinase selected from the group consisting of MMP-9 and MMP- 13, in which the suppression of at least one matrix metalloproteinase is an indication that the test compound is suitable for the treatment of periodontitis.
Изобретение также включает способ лечения периодонтита у млекопитающего, нуждающегося в таком лечении, включающий введение в ротовую полость млекопитающего пероральной композиции, содержащей 2,4,4'-трихлор-2'-гидроксидифениловый эфир в количестве, которое является эффективным для подавления, по меньшей мере, одной матриксной металлопротеиназы в ротовой полости млекопитающего, причем матриксная металлопротеиназа выбрана из группы, состоящей из MMP-9 и MMP-13, в котором подавление матриксной металлопротеиназы приводит к лечению периодонтита у млекопитающего.The invention also includes a method of treating periodontitis in a mammal in need of such treatment, comprising administering to the oral cavity of a mammal an oral composition containing 2,4,4'-trichloro-2'-hydroxydiphenyl ether in an amount that is effective to suppress at least , one matrix metalloproteinase in the oral cavity of a mammal, the matrix metalloproteinase selected from the group consisting of MMP-9 and MMP-13, in which the suppression of matrix metalloproteinase leads to the treatment of periodontitis mammal.
Изобретение дополнительно включает способ сокращения патологического превышения активности матриксной металлопротеиназы в ротовой полости млекопитающего, нуждающегося в таком лечении, включающий введение в ротовую полость млекопитающего пероральной композиции, содержащей 2,4,4'-трихлор-2'-гидроксидифениловый эфир в количестве, которое является эффективным для уменьшения активности матриксной металлопротеиназы в ротовой полости млекопитающего, причем матриксная металлопротеиназа выбрана из группы, состоящей из MMP-9 и MMP-13, в котором ингибирование активности матриксной металлопротеиназы приводит к ингибированию чрезмерного разрушения компонентов соединительной ткани матриксного протеина.The invention further includes a method of reducing the pathological excess of the activity of matrix metalloproteinase in the oral cavity of a mammal in need of such treatment, comprising introducing into the oral cavity of a mammal an oral composition containing 2,4,4'-trichloro-2'-hydroxydiphenyl ether in an amount that is effective to reduce the activity of matrix metalloproteinase in the oral cavity of a mammal, and matrix metalloproteinase selected from the group consisting of MMP-9 and MMP-13, in which gibirovanie matrix metalloproteinase activity leads to the inhibition of excessive destruction of components of connective tissue matrix protein.
Изобретение включает способ сокращения патологического избытка матриксной металлопротеиназы в ротовой полости млекопитающего, нуждающегося в таком лечении, включающий введение в ротовую полость млекопитающего пероральной композиции, содержащей 2,4,4'-трихлор-2'-гидроксидифениловый эфир в количестве, которое является эффективным для уменьшения уровня матриксной металлопротеиназы в ротовой полости млекопитающего, в котором ингибирование уровня матриксной металлопротеиназы приводит к ингибированию чрезмерного разрушения компонентов соединительной ткани матриксного протеина и в котором матриксная металлопротеиназа выбрана из группы, состоящей из MMP-9 и MMP-13.The invention includes a method for reducing the pathological excess of matrix metalloproteinase in the oral cavity of a mammal in need of such treatment, comprising introducing into the oral cavity of a mammal an oral composition containing 2,4,4'-trichloro-2'-hydroxydiphenyl ether in an amount that is effective to reduce the level of matrix metalloproteinase in the oral cavity of a mammal, in which inhibition of the level of matrix metalloproteinase leads to inhibition of excessive destruction of components connective tissue matrix protein and in which matrix metalloproteinase is selected from the group consisting of MMP-9 and MMP-13.
В одном варианте осуществления способ включает пероральную композицию, содержащую 0-36% вес. кремнийсодержащего полирующего компонента; 0,25-0,35% вес., по существу, нерастворимого в воде некатионного антибактериального агента, выбранного из группы, состоящей из галогенированных дифениловых эфиров, галогенированных салициланилидов, бензойных эфиров, галогенированных карбанилидов и фенольных соединений; и эффективное количество 0,01-4,0% вес. агента, увеличивающего антибактериальную активность, который улучшает доставку и плотное соединение вышеуказанного антибактериального агента и удержание его на поверхности зуба и десны, в котором вышеуказанный агент, увеличивающий антибактериальную активность, представляет собой (i) сополимер малеиновой кислоты или ангидрида с другим инертным этиленненасыщенным полимеризующимся мономером или (ii) полимер поли(бета-стиролфосфоновой кислоты) или поли(альфа-стиролфосфоновой кислоты) или сополимер любой стиролфосфоновой кислоты с другим этиленненасыщенным мономером, и композицию, необязательно дополнительно содержащую источник, обеспечивающий количество фторид-ионов, достаточное для доставки от 25 ч./млн до 5000 ч./млн фторид-ионов. В одном варианте осуществления пероральная композиция содержит 0,01-36% вес. кремнийсодержащего полирующего компонента. В другом варианте осуществления пероральная композиция не содержит кремнийсодержащего полирующего компонента.In one embodiment, the method comprises an oral composition comprising 0-36% by weight. silicon polishing component; 0.25-0.35% by weight of a substantially water-insoluble non-cationic antibacterial agent selected from the group consisting of halogenated diphenyl ethers, halogenated salicylanilides, benzoic esters, halogenated carbanilides and phenolic compounds; and an effective amount of 0.01-4.0% by weight. an agent that increases antibacterial activity, which improves the delivery and tight connection of the above antibacterial agent and its retention on the surface of the tooth and gums, in which the above agent that increases the antibacterial activity is (i) a copolymer of maleic acid or anhydride with another inert ethylenically unsaturated polymerizable monomer or (ii) a polymer of poly (beta-styrenephosphonic acid) or poly (alpha-styrenephosphonic acid) or a copolymer of any styrene phosphonic acid with another m ethylenically unsaturated monomer, and a composition, optionally additionally containing a source, providing an amount of fluoride ions sufficient for delivery from 25 ppm to 5000 ppm fluoride ions. In one embodiment, the oral composition comprises 0.01-36% by weight. silicon-containing polishing component. In another embodiment, the oral composition does not contain a silicon-containing polishing component.
В одном варианте осуществления способ включает пероральную композицию, содержащую эффективное количество против зубного налета, по меньшей мере, одной растворимой в воде линейной молекулярно дегидратированной полифосфатной соли в качестве необходимого агента против зубного налета, эффективное количество против зубного камня, по существу, нерастворимого в воде некатионного антибактериального соединения в качестве необходимого агента против зубного камня, и необязательно источник, обеспечивающий количество фторид-ионов, достаточное для доставки от 25 ч./млн до 5000 ч./млн фторид-ионов. В одном аспекте 2,4,4'-трихлор-2'-гидроксидифениловый эфир присутствует в композиции в концентрации от 1 ч./млн до 100 ч./млн.In one embodiment, the method comprises an oral composition comprising an effective amount of anti-plaque of at least one linear water-soluble molecularly dehydrated polyphosphate salt as a necessary anti-plaque agent, an effective amount of anti-tartar, substantially water-insoluble non-cationic an antibacterial compound as a necessary anti-calculus agent, and optionally a source providing an amount of fluoride ions, is sufficient to deliver from 25 hr. / million to 5000 hr. / million fluoride ion. In one aspect, 2,4,4'-trichloro-2'-hydroxydiphenyl ether is present in the composition at a concentration of from 1 ppm to 100 ppm.
В одном варианте осуществления пероральная композиция представляет собой жидкость для полоскания ротовой полости или средство для полоскания ротовой полости. В одном аспекте жидкость для полоскания ротовой полости или средство для полоскания ротовой полости не содержит кремнийсодержащего полирующего агента.In one embodiment, the oral composition is an oral rinse or an oral rinse. In one aspect, the mouthwash or mouthwash does not contain a silicon-containing polishing agent.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙBRIEF DESCRIPTION OF THE DRAWINGS
Фигура 1 иллюстрирует эффект 2,4,4'-трихлор-2'-гидроксидифенилового эфира на TNFα-индуцированную MMP-9 выработку моноцитов.Figure 1 illustrates the effect of 2,4,4'-trichloro-2'-hydroxydiphenyl ether on TNFα-induced MMP-9 monocyte production.
Фигура 2 иллюстрирует эффект 2,4,4'-трихлор-2'-гидроксидифенилового эфира на ПТГ-индуцированную MMP-13 выработку остеобластов.Figure 2 illustrates the effect of 2,4,4'-trichloro-2'-hydroxydiphenyl ether on PTH-induced MMP-13 osteoblast production.
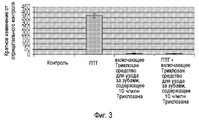
Фигура 3 иллюстрирует эффект средства для ухода за зубами настоящего изобретения на выработку MMP-13, индуцированную ПТГ, в остеобластах.Figure 3 illustrates the effect of the dentifrice of the present invention on the production of PTH induced MMP-13 in osteoblasts.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯDETAILED DESCRIPTION OF THE INVENTION
Три основные разрушительные MMP при периодонтите представляют собой MMP-8, MMP-9 и MMP-13. MMP-8 и MMP-13 представляют собой коллагеназы и MMP-9 представляет собой желатиназу. Все три фермента могут быть обнаружены в пораженной корневой оболочке и гингивальной десневой жидкости. Уровни этих ферментов положительно коррелируются с клиническими признаками периодонтита. Таким образом, повышенные или «выше нормального» уровни, по меньшей мере, одной из MMP-8, MMP-9 и MMP-13 представляют собой признак периодонтита. Измерения можно проводить, используя ферменты MMP-8, MMP-9 и MMP-13, РНК или биологической активности.The three main destructive MMPs in periodontitis are MMP-8, MMP-9, and MMP-13. MMP-8 and MMP-13 are collagenases and MMP-9 is gelatinase. All three enzymes can be found in the affected root membrane and gingival gingival fluid. The levels of these enzymes are positively correlated with the clinical signs of periodontitis. Thus, elevated or “above normal” levels of at least one of MMP-8, MMP-9, and MMP-13 are a sign of periodontitis. Measurements can be made using the enzymes MMP-8, MMP-9 and MMP-13, RNA, or biological activity.
В настоящем описании далее теперь показано, что пероральную композицию, содержащую 2,4,4'-трихлор-2'-гидроксидифениловый эфир (триклозан), можно использовать для уменьшения уровней, по меньшей мере, одной из MMP-8, MMP-9 и MMP-13 в ротовой полости млекопитающего. В одном варианте осуществления пероральная композиция представляет собой средство для ухода за зубами. В другом варианте осуществления пероральная композиция включает, например, жидкость для полоскания ротовой полости, накладку или гель. В другом аспекте антибактериальное соединение можно использовать для уменьшения уровней, по меньшей мере, одной из MMP-8, MMP-9 и MMP-13 в ротовой полости млекопитающего.In the present description, it is now further shown that an oral composition containing 2,4,4'-trichloro-2'-hydroxydiphenyl ether (triclosan) can be used to reduce levels of at least one of MMP-8, MMP-9, and MMP-13 in the oral cavity of a mammal. In one embodiment, the oral composition is a dentifrice. In another embodiment, the oral composition includes, for example, a mouthwash, patch, or gel. In another aspect, the antibacterial compound can be used to reduce levels of at least one of MMP-8, MMP-9, and MMP-13 in the oral cavity of a mammal.
Во всей заявке используется, что диапазоны применяют в качестве условного обозначения для описания всех без исключения величин, которые находятся в пределах диапазона. Любая величина в пределах диапазона может быть выбрана как конец диапазона. Кроме того, все ссылки, процитированные в настоящем описании, включены в настоящее описание в полном объеме посредством ссылки. В случае противоречия в определениях в настоящем раскрытии и определениях в процитированной ссылке, настоящее раскрытие имеет преимущественную силу.Throughout the application, it is used that ranges are used as a symbol to describe all, without exception, quantities that are within the range. Any value within the range can be selected as the end of the range. In addition, all references cited herein are hereby incorporated by reference in their entirety. In the event of a conflict in the definitions in this disclosure and the definitions in the cited reference, this disclosure shall prevail.
Используемый в настоящем описании термин «периодонтит» относится к неправильному и чрезмерному разрушению периодонтального органического матрикса, включая десну, периодонтальную связку, цементное вещество зубов и альвеолярную кость. Клиническое проявление периодонтита включает, но не ограничивается ими, атрофию десен, образование патологического десневого кармана, потерю прикрепления матрикса, потерю зуба и костной массы. Периодонтит может быть охарактеризован как начальный периодонтит, умеренный периодонтит или осложненный периодонтит. Однако периодонтит не должен быть ограничен только теми симптомами и осложнениями, изложенными в настоящем описании, как будет очевидно специалисту в данной области техники. Начальный периодонтит клинически проявляется, среди других симптомов, одним или более из: кровотечение при зондировании; присутствие карманов (3-4 мм); локализованные области рецессии мягких тканей; потеря прикрепления (3-4 мм); потеря костной массы (например, горизонтальная); и класс I инвазии зоны разделения корней многокорневых зубов. Умеренный периодонтит клинически проявляется, среди других симптомов, одним или более из: присутствие карманов (4-6 мм); присутствие потери прикрепления (4-6 мм); кровотечение при зондировании; степень I и/или степень II инвазии зоны разделения корней многокорневых зубов; класс I подвижности зуба; потеря костной массы (например, горизонтальная и/или вертикальная); и потеря 1/3 поддерживающей альвеолярной кости (то есть отношение коронки к корню 1:1). Осложненный периодонтит клинически проявляется одним или более из: кровотечение при зондировании; присутствие карманов (более чем 6 мм); потеря прикрепления (более чем 6 мм); степень II и/или степень III инвазии зоны разделения корней многокорневых зубов; класс II и/или класс III подвижности зуба; потеря костной массы (например, горизонтальная и/или вертикальная); и потеря более 1/3 поддерживающей альвеолярной кости (то есть отношение коронки к корню 2:1 или более). Периодонтит делится на формы, включая, но не ограничиваясь ими: периодонтит взрослых (например, связанный с налетом); ранний периодонтит (например, препубертатный, ювенильный, быстро развивающийся и подобные); периодонтит, связанный с системными заболеваниями; некротический язвенный периодонтит; устойчивый периодонтит; периимплантит и подобные.Used in the present description, the term "periodontitis" refers to the improper and excessive destruction of the periodontal organic matrix, including the gums, periodontal ligament, cementum of the teeth and alveolar bone. The clinical manifestations of periodontitis include, but are not limited to, gum atrophy, the formation of a pathological gingival pocket, loss of matrix attachment, loss of tooth and bone mass. Periodontitis can be characterized as initial periodontitis, moderate periodontitis or complicated periodontitis. However, periodontitis should not be limited only to those symptoms and complications set forth in the present description, as will be obvious to a person skilled in the art. Initial periodontitis is clinically manifested, among other symptoms, by one or more of: bleeding on probing; the presence of pockets (3-4 mm); localized areas of soft tissue recession; loss of attachment (3-4 mm); bone loss (e.g. horizontal); and class I infestation of the zone of separation of the roots of multi-rooted teeth. Moderate periodontitis is clinically manifested, among other symptoms, by one or more of: the presence of pockets (4-6 mm); the presence of loss of attachment (4-6 mm); sounding bleeding; degree I and / or degree II invasion of the zone of separation of the roots of multirooted teeth; class I tooth mobility; bone loss (e.g. horizontal and / or vertical); and loss of 1/3 of the supporting alveolar bone (i.e., the ratio of crown to root is 1: 1). Complicated periodontitis is clinically manifested by one or more of: bleeding on probing; the presence of pockets (more than 6 mm); loss of attachment (more than 6 mm); degree II and / or degree III invasion of the zone of separation of the roots of multirooted teeth; class II and / or class III tooth mobility; bone loss (e.g. horizontal and / or vertical); and loss of more than 1/3 of the supporting alveolar bone (i.e., the ratio of crown to root is 2: 1 or more). Periodontitis is divided into forms, including, but not limited to: periodontitis of adults (for example, associated with plaque); early periodontitis (e.g. prepubertal, juvenile, rapidly developing and the like); periodontitis associated with systemic diseases; necrotic ulcerative periodontitis; persistent periodontitis; peri-implantitis and the like.
Используемый в настоящем описании термин «лечение» относится к обнаруживаемому улучшению неблагоприятного состояния и/или сокращению симптомов состояния после взаимодействия млекопитающего с пероральной композицией изобретения и/или согласно способу изобретения.As used herein, the term “treatment” refers to a detectable improvement in an adverse condition and / or a reduction in symptoms of a condition after a mammal interacts with an oral composition of the invention and / or according to the method of the invention.
Следует понимать, что термин «лечение периодонтита» включает предотвращения периодонтита у млекопитающего, так же как ингибирование развития одного или более существующих ранее состояний, связанных с периодонтитом у млекопитающего. Используемые в настоящем описании термины «ингибировать» и «ингибирование» относятся к частичному ингибированию или полному ингибированию периодонтита по сравнению с состоянием без лечения, такому как терапевтическое лечение и/или профилактика результатов. Лечение периодонтита согласно изобретению, следовательно, включает сокращение, ингибирование, улучшение, уменьшение, снижение, прекращение или устранение одного или более симптомов и/или осложнений, изложенных в настоящем описании.It should be understood that the term "treatment of periodontitis" includes preventing periodontitis in a mammal, as well as inhibiting the development of one or more pre-existing conditions associated with periodontitis in a mammal. As used herein, the terms “inhibit” and “inhibition” refer to partial inhibition or complete inhibition of periodontitis compared to an untreated condition, such as therapeutic treatment and / or prophylaxis of results. The treatment of periodontitis according to the invention, therefore, includes the reduction, inhibition, improvement, decrease, decrease, cessation or elimination of one or more of the symptoms and / or complications described in the present description.
Используемый в настоящем описании «патологический избыток» относится к активности выше принятого нормального уровня. Например, «патологический избыток» активности матриксной металлопротеиназы представляет собой уровень активности матриксной металлопротеиназы, который является выше уровня, обычно обнаруживаемого при здоровом состоянии. Используемый в настоящем описании «патологический избыток активности матриксной металлопротеиназы» является уровнем активности матриксной металлопротеиназы, связанным с периодонтитом.As used herein, “pathological excess” refers to activity above an accepted normal level. For example, a “pathological excess” of matrix metalloproteinase activity is a level of matrix metalloproteinase activity that is higher than that normally found in a healthy state. As used herein, a “pathological excess of matrix metalloproteinase activity” is the level of matrix metalloproteinase activity associated with periodontitis.
Используемый в настоящем описании термин «подавление» относится к сокращению ферментативной активности, сокращению уровня ферментативной активности, сокращению уровня протеина и/или нуклеиновой кислоты, кодирующей такой протеин, или сокращению биохимического эффекта присутствия протеина, такого как один или более из MMP-8, MMP-9 и MMP-13.As used herein, the term “suppression” refers to a decrease in enzymatic activity, a decrease in the level of enzymatic activity, a decrease in the level of the protein and / or nucleic acid encoding such a protein, or a decrease in the biochemical effect of the presence of a protein, such as one or more of MMP-8, MMP -9 and MMP-13.
В одном аспекте изобретение обеспечивает способ сокращения патологического избытка, по меньшей мере, одной из MMP-8, MMP-9 и MMP-13 в ротовой полости млекопитающего, нуждающегося в таком лечении, включающий введение в ротовую полость млекопитающего пероральной композиции, содержащей 2,4,4'-трихлор-2'-гидроксидифениловый эфир в количестве, которое является эффективным для уменьшения уровня матриксной металлопротеиназы в ротовой полости млекопитающего, в котором ингибирование уровня матриксной металлопротеиназы приводит к ингибированию чрезмерного разрушения компонентов соединительной ткани матриксного протеина.In one aspect, the invention provides a method for reducing the pathological excess of at least one of MMP-8, MMP-9, and MMP-13 in the oral cavity of a mammal in need of such treatment, comprising administering to the oral cavity of a mammal an oral composition containing 2.4 , 4'-trichloro-2'-hydroxydiphenyl ether in an amount that is effective to reduce the level of matrix metalloproteinase in the oral cavity of a mammal, in which inhibition of the level of matrix metalloproteinase leads to inhibition of th destruction of components of connective tissue matrix protein.
В настоящем описании изложено, что MMP, такие как MMP-8, MMP-9 или MMP-13, можно уменьшить в ротовой полости с помощью одного из многочисленных путей. В одном варианте осуществления MMP можно уменьшить в ротовой полости с помощью подавления MMP на уровне нуклеиновой кислоты, как изложено в другом месте в настоящем описании. Такое сокращение может привести к сокращению одной или более нуклеиновых кислот, кодирующих MMP (например, мРНК), и фермента MMP, экспрессированного в ротовой полости. Сокращение мРНК, кодирующей MMP, например, можно производить с помощью одного или более из многочисленных способов, как будет очевидно специалисту в данной области техники при использовании раскрытия, изложенного в настоящем описании. Примеры включают сокращение транскрипции мРНК, кодирующей MMP, и разрушение/удаление мРНК, кодирующей MMP.In the present description it is stated that MMPs, such as MMP-8, MMP-9 or MMP-13, can be reduced in the oral cavity using one of many ways. In one embodiment, MMP can be reduced in the oral cavity by suppressing MMP at the nucleic acid level, as set forth elsewhere in the present description. Such a contraction may result in contraction of one or more nucleic acids encoding MMP (e.g., mRNA) and the MMP enzyme expressed in the oral cavity. Reduction of the mRNA encoding MMP, for example, can be performed using one or more of numerous methods, as will be apparent to a person skilled in the art using the disclosure set forth in the present description. Examples include the reduction of transcription of mRNA encoding MMP, and the destruction / removal of mRNA encoding MMP.
В другом варианте осуществления MMP можно уменьшить в ротовой полости, непосредственно уменьшая количество фермента MMP. Сокращение фермента MMP можно производить с помощью одного или более из многочисленных способов, как будет очевидно специалисту в данной области техники при использовании раскрытия, изложенного в настоящем описании. Примеры включают, например, ингибирование фермента с помощью низкомолекулярного ингибитора, ингибирование с помощью природной или биологически-полученной молекулы, протеолитическое разрушение фермента и основанное на сродстве очищение фермента из ротовой полости. В настоящей заявке описано, что агент, который уменьшает одну или более из MMP-8, MMP-9 или MMP-13, может быть агентом, таким как 2,4,4'-трихлор-2'-гидроксидифениловый эфир (ТРИКЛОЗАН) или он может быть другим антибактериальным агентом. В другом аспекте агент может быть отличным от антибактериального агента. Также изобретение обеспечивает способы лечения субъекта, пораженного периодонтитом.In another embodiment, MMP can be reduced in the oral cavity by directly reducing the amount of MMP enzyme. Reducing the MMP enzyme can be accomplished using one or more of numerous methods, as will be apparent to one skilled in the art using the disclosure set forth herein. Examples include, for example, inhibition of an enzyme with a small molecule inhibitor, inhibition with a natural or biologically derived molecule, proteolytic degradation of the enzyme, and affinity-based purification of the enzyme from the oral cavity. It is described herein that an agent that reduces one or more of MMP-8, MMP-9, or MMP-13 may be an agent, such as 2,4,4'-trichloro-2'-hydroxydiphenyl ether (TRICLOSAN) or it may be another antibacterial agent. In another aspect, the agent may be different from an antibacterial agent. The invention also provides methods of treating a subject affected by periodontitis.
В одном аспекте изобретения способ обеспечивает сокращение патологического избытка активности матриксной металлопротеиназы в ротовой полости млекопитающего, нуждающегося в таком лечении, включающий введение в ротовую полость млекопитающего пероральной композиции, содержащей 2,4,4'-трихлор-2'-гидроксидифениловый эфир в количестве, которое является эффективным для уменьшения активности матриксной металлопротеиназы, по меньшей мере, одной из MMP-8, MMP-9 и MMP-13 в ротовой полости млекопитающего, в котором ингибирование активности матриксной металлопротеиназы приводит к ингибированию чрезмерного разрушения компонентов соединительной ткани матриксного протеина. В другом аспекте введение в ротовую полость млекопитающего пероральной композиции, содержащей 2,4,4'-трихлор-2'-гидроксидифениловый эфир, проводят в количестве, которое является эффективным для снижения уровня, по меньшей мере, одной из MMP-8, MMP-9 и MMP-13 в ротовой полости млекопитающего, в котором снижение уровня матриксной металлопротеиназы приводит к сокращению полной ферментативной активности металлопротеиназы, приводящему к ингибированию чрезмерного разрушения компонентов соединительной ткани матриксного протеина. В одном варианте осуществления патологический избыток одной или более MMP можно уменьшить, как описано в другом месте в настоящей заявке, относительно сокращения количества MMP в ротовой полости млекопитающего. Таким образом, MMP можно уменьшить в одном или обоих уровнях нуклеиновой кислоты и протеина. Как описано в другом месте настоящей заявки, сокращение патологического избытка одного или более таких MMP может обеспечить лечение периодонтита у млекопитающего.In one aspect of the invention, the method provides a reduction in the pathological excess of matrix metalloproteinase activity in the oral cavity of a mammal in need of such treatment, comprising introducing into the oral cavity of a mammal an oral composition containing 2,4,4'-trichloro-2'-hydroxydiphenyl ether in an amount that is effective in reducing the activity of matrix metalloproteinase of at least one of MMP-8, MMP-9 and MMP-13 in the oral cavity of a mammal in which the inhibition of matrix Talloproteinases inhibit the excessive destruction of the components of the connective tissue of the matrix protein. In another aspect, the administration to the oral cavity of a mammal of an oral composition containing 2,4,4'-trichloro-2'-hydroxydiphenyl ether is carried out in an amount that is effective to reduce the level of at least one of MMP-8, MMP- 9 and MMP-13 in the oral cavity of a mammal, in which a decrease in the level of matrix metalloproteinase leads to a decrease in the complete enzymatic activity of the metalloproteinase, leading to inhibition of excessive destruction of the connective tissue components of the matrix protein. In one embodiment, a pathological excess of one or more MMPs can be reduced, as described elsewhere in this application, with respect to reducing the amount of MMPs in a mammalian oral cavity. Thus, MMP can be reduced at one or both levels of nucleic acid and protein. As described elsewhere in this application, reducing the pathological excess of one or more of these MMPs can provide a treatment for periodontitis in a mammal.
В другом аспекте изобретение обеспечивает способ сокращения активности, по меньшей мере, одной из MMP-8, MMP-9 и MMP-13 в ротовой полости млекопитающего, нуждающегося в таком лечении, включающий введение в ротовую полость млекопитающего пероральной композиции, содержащей 2,4,4'-трихлор-2'-гидроксидифениловый эфир в количестве, которое является эффективным для уменьшения уровня матриксной металлопротеиназы в ротовой полости млекопитающего, в котором ингибирование уровня матриксной металлопротеиназы приводит к ингибированию чрезмерного разрушения компонентов соединительной ткани матриксного протеина. В одном варианте осуществления активность одного или более MMP можно уменьшить, как описано в другом месте в настоящей заявке, относительно сокращения количества протеина MMP в ротовой полости млекопитающего. Таким образом, MMP можно уменьшить в одном или обоих уровнях нуклеиновой кислоты и протеина, таким образом, уменьшая активность MMP в ротовой полости, или непосредственно уменьшая активность MMP, или косвенно уменьшая уровень MMP протеина и/или нуклеиновой кислоты.In another aspect, the invention provides a method of reducing the activity of at least one of MMP-8, MMP-9, and MMP-13 in the oral cavity of a mammal in need of such treatment, comprising administering to the oral cavity of a mammal an oral composition containing 2.4, 4'-trichloro-2'-hydroxydiphenyl ether in an amount that is effective to reduce the level of matrix metalloproteinase in the oral cavity of a mammal, in which inhibition of the level of matrix metalloproteinase leads to inhibition of excessive destruction Ia components of connective tissue matrix protein. In one embodiment, the activity of one or more MMPs can be reduced, as described elsewhere in this application, with respect to reducing the amount of MMP protein in the oral cavity of a mammal. Thus, MMP can be reduced in one or both levels of nucleic acid and protein, thereby reducing the activity of MMP in the oral cavity, or directly decreasing the activity of MMP, or indirectly reducing the level of MMP protein and / or nucleic acid.
В другом аспекте изобретение обеспечивает способы лечения периодонтита у млекопитающего, нуждающегося в таком лечении, включающие взаимодействие клетки в ротовой полости млекопитающего с агентом, который подавляет одну или обе, по меньшей мере, одной из MMP-8, MMP-9 и MMP-13. Согласно изобретению подавление металлопротеиназы коррелируется с сокращением, по меньшей мере, одного симптома, связанного с периодонтитом.In another aspect, the invention provides methods of treating periodontitis in a mammal in need of such treatment, comprising contacting a cell in the oral cavity of a mammal with an agent that suppresses one or both of at least one of MMP-8, MMP-9, and MMP-13. According to the invention, the suppression of metalloproteinases is correlated with a reduction of at least one symptom associated with periodontitis.
MMP, такие как MMP-8, MMP-9 или MMP-13, можно подавлять на уровне нуклеиновой кислоты. Посредством неограничивающего примера MMP можно подавлять согласно изобретению с помощью подавления мРНК, кодирующей MMP. В одном варианте осуществления способ изобретения включает взаимодействие ротовой полости млекопитающего с агентом, который подавляет одну или более из MMP-8, MMP-9 или MMP-13. В настоящей заявке описано, что агент, который подавляет одну или более из MMP-8, MMP-9 или MMP-13, может быть агентом, таким как ТРИКЛОЗАН, или он может быть другим антибактериальным агентом. В другом аспекте агент может быть отличным от антибактериального агента. Также, изобретение обеспечивает способы лечения индивида, пораженного периодонтитом.MMPs, such as MMP-8, MMP-9 or MMP-13, can be suppressed at the nucleic acid level. By way of non-limiting example, MMP can be suppressed according to the invention by suppressing mRNA encoding MMP. In one embodiment, the method of the invention comprises contacting a mammalian oral cavity with an agent that suppresses one or more of MMP-8, MMP-9, or MMP-13. This application describes that an agent that suppresses one or more of MMP-8, MMP-9, or MMP-13 may be an agent such as TRICLOSAN, or it may be another antibacterial agent. In another aspect, the agent may be different from an antibacterial agent. The invention also provides methods of treating an individual affected by periodontitis.
В другом аспекте изобретение обеспечивает способ лечения периодонтита у млекопитающего, нуждающегося в таком лечении. В одном варианте осуществления способ лечения периодонтита у млекопитающего, нуждающегося в таком лечении, включает введение в ротовую полость млекопитающего пероральной композиции, содержащей 2,4,4'-трихлор-2'-гидроксидифениловый эфир в количестве, которое является эффективным для подавления, по меньшей мере, одной из MMP-8, MMP-9 и MMP-13, в котором подавление матриксной металлопротеиназы приводит к лечению периодонтита у млекопитающего. В другом варианте осуществления способ лечения периодонтита у млекопитающего, нуждающегося в таком лечении, включает введение в ротовую полость млекопитающего пероральной композиции, содержащей 2,4,4'-трихлор-2'-гидроксидифениловый эфир в количестве, которое является эффективным для снижения уровня, по меньшей мере, одной из MMP-8, MMP-9 и MMP-13, в котором снижение уровня матриксной металлопротеиназы приводит к лечению периодонтита у млекопитающего. В еще другом варианте осуществления способ лечения периодонтита у млекопитающего, нуждающегося в таком лечении, включает введение в ротовую полость млекопитающего пероральной композиции, содержащей 2,4,4'-трихлор-2'-гидроксидифениловый эфир в количестве, которое является эффективным для снижения уровня активности, по меньшей мере, одной из MMP-8, MMP-9 и MMP-13, в котором снижение уровня активности матриксной металлопротеиназы приводит к лечению периодонтита у млекопитающего.In another aspect, the invention provides a method of treating periodontitis in a mammal in need of such treatment. In one embodiment, a method of treating periodontitis in a mammal in need of such treatment comprises administering to the oral cavity of a mammal an oral composition containing 2,4,4'-trichloro-2'-hydroxydiphenyl ether in an amount that is effective to suppress at least one of MMP-8, MMP-9, and MMP-13, in which suppression of matrix metalloproteinase leads to treatment of periodontitis in a mammal. In another embodiment, a method of treating periodontitis in a mammal in need of such treatment comprises administering to the oral cavity of a mammal an oral composition containing 2,4,4'-trichloro-2'-hydroxydiphenyl ether in an amount that is effective to reduce the level of, at least one of MMP-8, MMP-9 and MMP-13, in which a decrease in matrix metalloproteinase leads to the treatment of periodontitis in a mammal. In yet another embodiment, a method of treating periodontitis in a mammal in need of such treatment comprises administering to the oral cavity of a mammal an oral composition containing 2,4,4'-trichloro-2'-hydroxydiphenyl ether in an amount that is effective to reduce the level of activity at least one of MMP-8, MMP-9 and MMP-13, in which a decrease in the level of matrix metalloproteinase activity leads to the treatment of periodontitis in a mammal.
В способе лечения периодонтита с помощью введения в ротовую полость млекопитающего пероральной композиции активность одной или более MMP может быть уменьшена, как описано в другом месте настоящей заявки, относительно сокращения количества MMP в ротовой полости млекопитающего. Таким образом, MMP может быть снижена при уровне одного или обоих из нуклеиновой кислоты и протеина, таким образом, уменьшая активность MMP в ротовой полости. Подобно этому, подавление MMP или сокращение уровня MMP может быть затронуто действием уровней или нуклеиновой кислоты, или протеина, как описано подробно в другом месте в настоящей заявке.In a method of treating periodontitis by administering an oral composition to the oral cavity of a mammal, the activity of one or more MMPs can be reduced, as described elsewhere in this application, with respect to reducing the amount of MMPs in the oral cavity of a mammal. Thus, MMP can be reduced at the level of one or both of the nucleic acid and protein, thus reducing the activity of MMP in the oral cavity. Similarly, the suppression of MMP or the reduction of the level of MMP can be affected by the action of the levels of either nucleic acid or protein, as described in detail elsewhere in this application.
В другом аспекте изобретение обеспечивает способ идентификации соединения, пригодного для лечения периодонтита у млекопитающего, нуждающегося в таком лечении, включающий взаимодействие клетки с исследуемым соединением и определение, подавляет ли исследуемое соединение одну или обе, по меньшей мере, из одной из MMP-8, MMP-9 и MMP-13. Подавление, по меньшей мере, одной из матриксных металлопротеиназ является показателем, что исследуемое соединение является пригодным для лечения периодонтита.In another aspect, the invention provides a method for identifying a compound suitable for the treatment of periodontitis in a mammal in need of such treatment, comprising contacting a cell with a test compound and determining whether the test compound inhibits one or both of at least one of MMP-8, MMP -9 and MMP-13. The suppression of at least one of the matrix metalloproteinases is an indication that the test compound is suitable for the treatment of periodontitis.
В одном варианте осуществления способ лечения периодонтита включает введение агента, идентифицированного с помощью анализа скрининга, описанного в настоящей заявке, или комбинации агентов, которые ингибируют один или более маркеров периодонтита, в котором, по меньшей мере, один из агентов представляет собой агент, идентифицированный с помощью анализа скрининга, описанного в настоящей заявке.In one embodiment, a method of treating periodontitis includes administering an agent identified by the screening assay described herein, or a combination of agents that inhibit one or more periodontitis markers in which at least one of the agents is an agent identified with using the screening analysis described in this application.
В одном варианте осуществления изобретение обеспечивает способ лечения периодонтита, включающий стадию введения терапевтически эффективного количества агента, которое ингибирует периодонтальное заболевание и/или периодонтальное нарушение у субъекта, нуждающегося в таком лечении. В настоящей заявке определено, что терапевтически эффективное количество агента (то есть эффективная дозировка) располагается в диапазоне от 0,001 до 30 мг/кг массы тела, предпочтительно от 0,01 до 25 мг/кг массы тела, более предпочтительно от 0,1 до 20 мг/кг массы тела и еще более предпочтительно от 1 до 10 мг/кг, от 2 до 9 мг/кг, от 3 до 8 мг/кг, от 4 до 7 мг/кг или от 5 до 6 мг/кг массы тела. Специалист в данной области техники оценит, что определенные факторы могут влиять на дозировку, необходимую для эффективного лечения субъекта, включая, но не ограничиваясь ими, тяжесть заболевания или нарушения, предыдущие методы лечения, общее состояние здоровья и/или возраст субъекта и другие присутствующие заболевания. Кроме того, лечение субъекта с помощью терапевтически эффективного количества ингибитора может включать единичный курс лечения, или предпочтительно, может включать серию курсов лечения. Следует также отметить, что эффективная дозировка, используемая для лечения, может увеличиться или уменьшиться в течение курса определенного лечения. В настоящей заявке описано, что изменения в дозировке могут следовать из результатов диагностического исследования.In one embodiment, the invention provides a method of treating periodontitis, comprising the step of administering a therapeutically effective amount of an agent that inhibits periodontal disease and / or periodontal disorder in a subject in need of such treatment. It is determined herein that a therapeutically effective amount of an agent (i.e., an effective dosage) ranges from 0.001 to 30 mg / kg body weight, preferably from 0.01 to 25 mg / kg body weight, more preferably from 0.1 to 20 mg / kg body weight and even more preferably 1 to 10 mg / kg, 2 to 9 mg / kg, 3 to 8 mg / kg, 4 to 7 mg / kg or 5 to 6 mg / kg body weight . One of ordinary skill in the art will appreciate that certain factors can influence the dosage needed to effectively treat a subject, including, but not limited to, the severity of the disease or disorder, previous treatments, general health and / or age of the subject, and other diseases present. In addition, treating a subject with a therapeutically effective amount of an inhibitor may include a single course of treatment, or preferably, may include a series of treatments. It should also be noted that the effective dosage used for treatment may increase or decrease during the course of a particular treatment. This application describes that dosage changes may result from a diagnostic study.
Специалист в данной области техники определит, как обнаружить присутствие периодонтита. Дополнительно, специалист в данной области техники определит, как идентифицировать повышенный уровень одной или более из MMP-8, MMP-9 и MMP-13. Характерный способ для детектирования присутствия или отсутствия периодонтита у млекопитающего включает получение биологического образца из ротовой полости исследуемого субъекта и взаимодействие биологического образца с соединением или агентом, способным определить один или более маркеров периодонтита (то есть MMP-8, MMP-9 или MMP-13), описанных в настоящей заявке, например, маркерная нуклеиновая кислота (например, в том числе мРНК, геномная ДНК) или маркерный пептид (например, в том числе фрагмент пептида или протеин), кодируемый маркерной нуклеиновой кислотой, так что присутствие маркерной нуклеиновой кислоты или маркерного пептида, кодируемого нуклеиновой кислотой, детектируют в биологическом образце. В одном варианте осуществления агент для детектирования маркерной мРНК или геномной ДНК представляет собой меченый зонд нуклеиновой кислоты, способный к гибридизации с маркерной мРНК или геномной ДНК. Зонд нуклеиновой кислоты может быть, например, маркерной нуклеиновой кислотой по всей длине или ее частью. Другие подходящие зонды для применения в диагностических исследованиях изобретения описаны в настоящей заявке. В другом варианте осуществления активность маркера периодонтита используют как способ детектирования маркера (то есть активность MMP-8, MMP-9 или MMP-13). Любое известное на данный момент или позже разработанное исследование для детектирования активности маркера охвачено в настоящем описании.One skilled in the art will determine how to detect the presence of periodontitis. Additionally, one skilled in the art will determine how to identify an elevated level of one or more of MMP-8, MMP-9, and MMP-13. A representative method for detecting the presence or absence of periodontitis in a mammal involves obtaining a biological sample from the oral cavity of a test subject and interacting the biological sample with a compound or agent capable of determining one or more periodontitis markers (i.e., MMP-8, MMP-9 or MMP-13) described herein, for example, a marker nucleic acid (e.g., including mRNA, genomic DNA) or a marker peptide (e.g., including a fragment of a peptide or protein) encoded by the marker well leinovoy acid, so that the presence of the marker nucleic acids or marker peptide encoded by the nucleic acid is detected in the biological sample. In one embodiment, the agent for detecting marker mRNA or genomic DNA is a labeled nucleic acid probe capable of hybridization with marker mRNA or genomic DNA. The nucleic acid probe may be, for example, a marker nucleic acid along the entire length or part thereof. Other suitable probes for use in diagnostic studies of the invention are described herein. In another embodiment, the activity of a periodontitis marker is used as a method for detecting a marker (i.e., the activity of MMP-8, MMP-9, or MMP-13). Any currently known or later developed study for detecting marker activity is encompassed herein.
В другом варианте осуществления агент для детектирования маркерного пептида представляет собой антитело, способное к связыванию с маркерным пептидом, такое как антитело с определяемой меткой. Антитела могут быть поликлональными или моноклональными. Можно использовать интактное антитело или его фрагмент (например Fab или F(ab').sub.2). Полагают, что термин «меченый» относительно зонда или антитела охватывает прямое мечение зонда или антитела с помощью связывания (то есть, физического соединения) детектируемого вещества с зондом или антителом, так же как непрямое мечение зонда или антитела с помощью взаимодействия с другим реагентом, который непосредственно метят. Примеры непрямого мечения включают детектирование первичного антитела, используя флуоресцентно меченное вторичное антитело и меченый на конце ДНК-зонд с биотином, так что он может быть детектирован флуоресцентно меченным стрептавидином.In another embodiment, the marker peptide detection agent is an antibody capable of binding to a marker peptide, such as a detectable label antibody. Antibodies can be polyclonal or monoclonal. An intact antibody or fragment thereof can be used (e.g., Fab or F (ab '). Sub.2). It is believed that the term “labeled” with respect to a probe or antibody encompasses direct labeling of the probe or antibody by binding (ie, physically connecting) the detectable substance to the probe or antibody, as well as indirect labeling of the probe or antibody by interaction with another reagent that directly tagged. Examples of indirect labeling include detecting a primary antibody using a fluorescently labeled secondary antibody and a biotin-labeled DNA probe at the end, so that it can be detected by fluorescently labeled streptavidin.
Полагают, что используемый в настоящем описании термин «биологический образец» включает ткани, клетки и биологические жидкости, выделенные из ротовой полости субъекта, так же как ткани, клетки и жидкости, находящиеся в пределах ротовой полости субъекта. Таким образом, способ детектирования изобретения можно использовать для детектирования маркерной мРНК, пептида (например, протеина) или геномной ДНК в биологическом образце in vitro так же как in vivo. Посредством неограничивающего примера методы in vitro для детектирования маркерной мРНК включают Нозерн-гибридизации и гибридизации in situ. Методы in vitro для детектирования маркерного пептида включают твердофазный иммуноферментный анализ (ELISA), вестерн-блоттинг, иммунопреципитацию и иммунофлуоресценцию. Методы in vitro для детектирования маркерной геномной ДНК включают Саузерн-гибридизацию. Методы in vivo для детектирования маркерного пептида включают введение в ротовую полость субъекта меченого антимаркерного антитела. Например, антитело может быть мечено радиоактивным маркером, присутствие которого и местоположение у субъекта можно детектировать с помощью стандартных методов воспроизведения изображения.It is believed that the term “biological sample” as used herein includes tissues, cells and body fluids isolated from the oral cavity of a subject, as well as tissues, cells and fluids within the oral cavity of a subject. Thus, the detection method of the invention can be used to detect marker mRNA, peptide (eg, protein) or genomic DNA in an in vitro biological sample as well as in vivo . By way of non-limiting example, in vitro methods for detecting marker mRNA include Northern hybridization and in situ hybridization . In vitro methods for detecting marker peptides include enzyme-linked immunosorbent assay (ELISA), Western blotting, immunoprecipitation and immunofluorescence. In vitro methods for detecting marker genomic DNA include Southern hybridization. In vivo methods for detecting a marker peptide include introducing a labeled anti-marker antibody into the oral cavity of a subject. For example, an antibody can be labeled with a radioactive marker, the presence of which and the location of the subject can be detected using standard image reproduction methods.
В одном варианте осуществления способы дополнительно включают получение контрольного биологического образца от контрольного субъекта, взаимодействие контрольного образца с соединением или агентом, способным детектировать маркерные пептиды, мРНК или геномную ДНК, так что присутствие маркерного пептида, мРНК или геномной ДНК детектируют в биологическом образце, и сравнение присутствия маркерных пептидов, мРНК или геномной ДНК в контрольном образце с присутствием маркерного пептида, мРНК или геномной ДНК в исследуемом образце. Альтернативно, присутствие маркерного пептида, мРНК или геномной ДНК в исследуемом образце можно сравнить с информацией в базе данных или на диаграмме для проведения детектирования или диагноза. В другом варианте осуществления способы дополнительно включают использование контрольного биологического образца, полученного от субъекта, имеющего периодонтит, в которых контрольный образец получали от субъекта до начала заболевания периодонтитом (то есть когда субъект был здоров или в «нормальном» состоянии без периодонтита).In one embodiment, the methods further include obtaining a control biological sample from a control subject, interacting the control sample with a compound or agent capable of detecting marker peptides, mRNA or genomic DNA, such that the presence of a marker peptide, mRNA or genomic DNA is detected in the biological sample, and comparison the presence of marker peptides, mRNA or genomic DNA in the control sample with the presence of marker peptides, mRNA or genomic DNA in the test sample. Alternatively, the presence of a marker peptide, mRNA, or genomic DNA in a test sample can be compared with information in a database or diagram for detection or diagnosis. In another embodiment, the methods further include the use of a control biological sample obtained from a subject having periodontitis, in which a control sample was obtained from the subject prior to the onset of periodontitis (that is, when the subject was healthy or in a “normal” state without periodontitis).
Посредством неограничивающего примера уровень MMP-9 можно определить in vitro с помощью взаимодействия клетки с TNFα. В одном варианте осуществления клетка представляет собой моноцит. После взаимодействия клетки с TNFα уровень MMP-9 детектируют или при уровне протеина, или нуклеиновой кислоты. В одном аспекте уровень MMP-9 также определяют in vitro с помощью взаимодействия клетки с TNFα в присутствии антибактериального агента. В одном варианте осуществления антибактериальный агент представляет собой 2,4,4'-трихлор-2'-гидроксидифениловый эфир. В другом варианте осуществления агент представляет собой доксициклин. В другом аспекте агент может быть отличным от антибактериального агента. В одном варианте осуществления агент представляет собой ингибитор MMP.By way of a non-limiting example, the level of MMP-9 can be determined in vitro by the interaction of a cell with TNFα. In one embodiment, the cell is a monocyte. After the interaction of cells with TNFα, the MMP-9 level is detected either at the protein or nucleic acid level. In one aspect, the level of MMP-9 is also determined in vitro by the interaction of a cell with TNFα in the presence of an antibacterial agent. In one embodiment, the antibacterial agent is 2,4,4'-trichloro-2'-hydroxydiphenyl ether. In another embodiment, the agent is doxycycline. In another aspect, the agent may be different from an antibacterial agent. In one embodiment, the agent is an MMP inhibitor.
В одном варианте осуществления изобретения измерение подавления MMP-9 с помощью детектирования уровня MMP-9 определяют in vitro при взаимодействии клетки с TNFα в присутствии агента, такого как антибактериальный агент, и с помощью сравнения уровня MMP-9, установленного in vitro, при взаимодействии клетки с TNFα при отсутствии антибактериального агента, в котором экспериментальные условия являются иным образом идентичными. Более низкий уровень MMP-9 протеина, нуклеиновой кислоты или ферментативной активности в присутствии антибактериального агента, чем при отсутствии антибактериального агента, является показателем, что антибактериальное соединение подавляет MMP-9. Основываясь на раскрытии, изложенном в настоящем описании, следует понимать, что одинаковые способы могут быть использованы для оценки MMP-8 и/или MMP-13.In one embodiment, the measurement of the inhibition of MMP-9 by detecting the level of MMP-9 is determined in vitro by interaction of the cell with TNFα in the presence of an agent such as an antibacterial agent, and by comparing the level of MMP-9 established in vitro by interaction of the cell with TNFα in the absence of an antibacterial agent in which the experimental conditions are otherwise identical. A lower level of MMP-9 protein, nucleic acid, or enzymatic activity in the presence of an antibacterial agent than in the absence of an antibacterial agent is an indication that the antibacterial compound inhibits MMP-9. Based on the disclosure set forth in the present description, it should be understood that the same methods can be used to evaluate MMP-8 and / or MMP-13.
Следует понимать, что in vitro измерение подавления MMP-8, MMP-9 и/или MMP-13 может коррелироваться с in vivo эффектом, наблюдением или результатом. В одном аспекте подавление металлопротеиназы, измеренное in vitro, является подтверждением наблюдения in vivo, включая, но не ограничиваясь ими, лечение периодонтита, способ сокращения патологического избытка металлопротеиназы и/или активности металлопротеиназы in vivo и способ идентификации соединения, пригодного для лечения периодонтита и/или уменьшения патологического избытка металлопротеиназы и/или активности металлопротеиназы in vivo. См., например, Golub et al., Inflamm. Res. (1997) 46:310-9, Preshaw et al., J. Clin. Periodontol. (2004) 31:697-707; Mantyla et al., J. Periodontal. Res. (2003) 38:436-439; Lorencini et al., Histol. Histopathol. (2009) 24:157-166; и Pozo et al., J. Periodontal Res. (2005) 40:199-207. В другом аспекте подавление металлопротеиназы, измеренное in vitro, является прогнозирующим параметром результата in vivo, включая, но не ограничиваясь ими, лечение периодонтита, способ сокращения патологического избытка металлопротеиназы и/или активности металлопротеиназы in vivo и способ идентификации соединения, пригодного для лечения периодонтита и/или уменьшения патологического избытка металлопротеиназы и/или активности металлопротеиназы in vivo.It should be understood that in vitro measurement of the inhibition of MMP-8, MMP-9 and / or MMP-13 may be correlated with an in vivo effect, observation, or result. In one aspect, in vitro suppression of metalloproteinase is evidence of in vivo observation, including but not limited to treatment of periodontitis, a method for reducing pathological excess metalloproteinase and / or in vivo metalloproteinase activity, and a method for identifying a compound suitable for treating periodontitis and / or reducing a pathological excess of metalloproteinase and / or in vivo metalloproteinase activity. See, for example, Golub et al., Inflamm. Res. (1997) 46: 310-9, Preshaw et al., J. Clin. Periodontol. (2004) 31: 697-707; Mantyla et al., J. Periodontal. Res. (2003) 38: 436-439; Lorencini et al., Histol. Histopathol. (2009) 24: 157-166; and Pozo et al., J. Periodontal Res. (2005) 40: 199-207. In another aspect, in vitro suppression of metalloproteinase is a predictive parameter of an in vivo outcome, including, but not limited to, treatment of periodontitis, a method for reducing pathological excess metalloproteinase and / or in vivo metalloproteinase activity, and a method for identifying a compound suitable for treating periodontitis and / or reducing a pathological excess of metalloproteinase and / or in vivo metalloproteinase activity.
Посредством другого неограничивающего примера уровень MMP-13 может быть определен in vitro при взаимодействии клетки с паратиреоидным гормоном (ПТГ). В одном варианте осуществления клетка представляет собой остеобласт. После взаимодействия клетки с ПТГ уровень MMP-13 детектируют или при уровне протеина, или нуклеиновой кислоты. В одном аспекте уровень MMP-13 также определяют in vitro с помощью взаимодействия клетки с ПТГ в присутствии антибактериального агента. В одном варианте осуществления антибактериальный агент представляет собой 2,4,4'-трихлор-2'-гидроксидифениловый эфир. Более низкий уровень MMP-13 протеина, нуклеиновой кислоты или ферментативной активности в присутствии антибактериального агента, чем при отсутствии антибактериального агента, является показателем, что антибактериальное соединение подавляет MMP-13.By another non-limiting example, the level of MMP-13 can be determined in vitro by the interaction of a cell with parathyroid hormone (PTH). In one embodiment, the cell is an osteoblast. After the interaction of cells with PTH, the level of MMP-13 is detected either at the level of protein or nucleic acid. In one aspect, the level of MMP-13 is also determined in vitro by the interaction of a cell with PTH in the presence of an antibacterial agent. In one embodiment, the antibacterial agent is 2,4,4'-trichloro-2'-hydroxydiphenyl ether. A lower level of MMP-13 protein, nucleic acid, or enzymatic activity in the presence of an antibacterial agent than in the absence of an antibacterial agent is an indication that the antibacterial compound inhibits MMP-13.
В одном аспекте способность пероральной композиции, описанной в настоящей заявке, лечить периодонтит определяют при сравнении эффекта 2,4,4'-трихлор-2'-гидроксидифенилового эфира при подавлении металлопротеиназы с эффектом пероральной композиции при подавлении металлопротеиназы. В другом аспекте способность любой пероральной композиции лечить периодонтит определяют при сравнении эффекта пероральной композиции или in vivo, или in vitro с эффектом пероральной композиции, описанной в настоящей заявке.In one aspect, the ability of an oral composition described herein to treat periodontitis is determined by comparing the effect of 2,4,4'-trichloro-2'-hydroxydiphenyl ether in inhibiting metalloproteinase with the effect of oral composition in suppressing metalloproteinase. In another aspect, the ability of any oral composition to treat periodontitis is determined by comparing the effect of the oral composition, either in vivo or in vitro, with the effect of the oral composition described herein.
Изобретение дополнительно включает пероральную композицию, такую как, например, средство для ухода за зубами, гель, накладку, жидкость для полоскания полости рта или спрей для применения в способе изобретения. В одном аспекте пероральная композиция содержит антибактериальный агент. В типичном варианте осуществления антибактериальный агент представляет собой некатионный антибактериальный агент. См., например, патент США № 5288480, который включен в настоящее описание в полном объеме посредством ссылки. Некатионный антибактериальный агент присутствует в пероральной композиции в эффективном против налета количестве 0,25-0,35% вес., предпочтительно 0,3%. Антибактериальный агент является, по существу, нерастворимым в воде, подразумевая, что его растворимость является менее чем 1% вес. в воде при 25°С и может быть даже менее чем 0,1%. Например, когда пероральная композиция представляет собой жидкость для полоскания полости рта, концентрацию антибактериального агента можно уменьшить до 10 раз по сравнению с той, которую используют в другом средстве для ухода за зубами, таком как зубная паста. В одном варианте осуществления антибактериальный агент представляет собой 2,4,4'-трихлор-2'-гидроксидифениловый эфир. В другом варианте осуществления пероральная композиция содержит два или более антибактериальных агентов.The invention further includes an oral composition, such as, for example, a dentifrice, gel, pad, mouthwash or spray for use in the method of the invention. In one aspect, the oral composition comprises an antibacterial agent. In a typical embodiment, the antibacterial agent is a non-cationic antibacterial agent. See, for example, US Pat. No. 5,288,480, which is incorporated herein by reference in its entirety. The non-cationic antibacterial agent is present in the oral composition in an effective anti-plaque amount of 0.25-0.35% by weight, preferably 0.3%. The antibacterial agent is essentially insoluble in water, implying that its solubility is less than 1% by weight. in water at 25 ° C and may even be less than 0.1%. For example, when the oral composition is an oral rinse, the concentration of the antibacterial agent can be reduced up to 10 times compared to that used in other dentifrices such as toothpaste. In one embodiment, the antibacterial agent is 2,4,4'-trichloro-2'-hydroxydiphenyl ether. In another embodiment, the oral composition comprises two or more antibacterial agents.
В одном варианте осуществления агент, усиливающий антибактериальную активность (AEA), увеличивает доставку антибактериального агента и удерживание его на поверхностях рта. В одном аспекте AEA содержит вязкий материал. См. патент США № 5288480 для описаний материалов и композиций, пригодных для материалов AEA настоящего изобретения, так же как для общих описаний пероральных композиций, таких как композиции средства для ухода за зубами, пригодные в настоящем изобретении. Посредством неограничивающего примера клейкий материал в композиции представляет собой полимер, имеющий среднечисловую молекулярную массу между 100000 и 2500000 включительно. В одном аспекте клейкий материал выбран из полимеров поливинилфосфоновой кислоты, поли(1-фосфонопропен)сульфоновой кислоты, поли(бета-стиролфосфоновой кислоты), альфа-стиролфосфоновой кислоты, синтетического анионного полимерного поликарбоксилата, малеинового ангидрида, малеиновой кислоты и метилвинилового эфира. В другом аспекте клейкая молекула представляет собой полимер метилвинилового эфира и малеинового ангидрида. Агент, усиливающий антибактериальную активность, можно использовать при уровне, который представляет собой 0,01% вес.-4,0% вес. пероральной композиции.In one embodiment, an antibacterial activity enhancing agent (AEA) enhances the delivery of the antibacterial agent and its retention on the surfaces of the mouth. In one aspect, the AEA comprises a viscous material. See US Pat. No. 5,288,480 for descriptions of materials and compositions suitable for the AEA materials of the present invention, as well as for general descriptions of oral compositions, such as dentifrice compositions useful in the present invention. By way of a non-limiting example, the adhesive material in the composition is a polymer having a number average molecular weight of between 100,000 and 2,500,000 inclusive. In one aspect, the adhesive material is selected from polymers of polyvinylphosphonic acid, poly (1-phosphonopropene) sulfonic acid, poly (beta-styrenephosphonic acid), alpha-styrenephosphonic acid, synthetic anionic polymeric polycarboxylate, maleic anhydride, maleic acid and methyl vinyl ester. In another aspect, the adhesive molecule is a polymer of methyl vinyl ether and maleic anhydride. An agent that enhances antibacterial activity can be used at a level that is 0.01% w / w-4.0% w / w. oral composition.
Используемая в настоящем описании «увеличивающая доставку группа» относится к группе, которая присоединяет или, по существу, адгезионно, когезионно или иначе связывает AEA (несущий антибактериальный агент) с ротовыми (например, зуб и десна) поверхностями, таким образом «доставляя» антибактериальный агент таким поверхностям. Органическая увеличивающая удерживание группа, обычно гидрофобная, присоединяет или иначе связывает антибактериальный агент с AEA, таким образом способствуя удерживанию антибактериального агента с AEA и косвенно на поверхностях рта. В некоторых случаях присоединение антибактериального агента происходит через его физическое удерживание с помощью AEA, особенно когда AEA представляет собой поперечно сшитый полимер, структура которого неотъемлемо обеспечивает увеличенные области для такого удерживания. Присутствие с более высокой молекулярной массой более гидрофобной поперечно сшитой части в поперечно сшитом полимере еще дополнительно обеспечивает физическое удерживание антибактериального агента к или с помощью поперечно сшитого AEA полимера.As used herein, a “delivery enhancing group” refers to a group that attaches or substantially adheres, cohesively, or otherwise binds AEA (a carrier antibacterial agent) to oral (eg, tooth and gum) surfaces, thereby “delivering” an antibacterial agent to such surfaces. An organic retention enhancing group, usually hydrophobic, binds or otherwise binds the antibacterial agent to AEA, thereby facilitating the retention of the antibacterial agent with AEA and indirectly on the surfaces of the mouth. In some cases, the attachment of the antibacterial agent occurs through its physical retention using AEA, especially when the AEA is a cross-linked polymer whose structure inherently provides increased areas for such retention. The presence with a higher molecular weight of a more hydrophobic crosslinked moiety in the crosslinked polymer still further provides physical retention of the antibacterial agent to or with the aid of the crosslinked AEA polymer.
В одном варианте осуществления агент, усиливающий антибактериальную активность, который улучшает доставку и плотное соединение вышеуказанного антибактериального агента и удержание его на поверхности зуба и десны, представляет собой (i) сополимер малеиновой кислоты или ангидрида с другим инертным этиленненасыщенным полимеризующимся мономером или (ii) полимер поли(бета-стиролфосфоновой кислоты) или поли(альфа-стиролфосфоновой кислоты) или сополимер любой стиролфосфоновой кислоты с другим этиленненасыщенным мономером. Однако специалист в данной области техники поймет, что настоящее изобретение не ограничивается используемым определенным агентом, усиливающим антибактериальную активность, и что другие агенты, усиливающие антибактериальную активность, охвачены в соответствии с настоящим изобретением.In one embodiment, an antibacterial enhancing agent that improves the delivery and tight bonding of the aforementioned antibacterial agent and its retention on the surface of the tooth and gums is (i) a copolymer of maleic acid or anhydride with another inert ethylenically unsaturated polymerizable monomer or (ii) a polymer poly (beta-styrenephosphonic acid) or poly (alpha-styrenephosphonic acid) or a copolymer of any styrenephosphonic acid with another ethylenically unsaturated monomer. However, one skilled in the art will understand that the present invention is not limited to the specific antibacterial enhancing agent used, and that other antibacterial enhancing agents are encompassed in accordance with the present invention.
В типичном средстве для ухода за зубами присутствует перорально приемлемый наполнитель, включающий водную фазу с увлажняющим веществом. Вода присутствует обычно в количестве, по меньшей мере, 3% вес., обычно 3-35% и увлажняющее вещество, предпочтительно глицерин и/или сорбит, обычно в общем количестве 6,5-75% или 80% вес. средства для ухода за зубами, более характерно 10-75%. Несмотря на то что не требуется в настоящем изобретении, в котором необязательно присутствует 0,25-0,35% нерастворимого в воде некатионного антибактериального агента, в водный увлажняющий наполнитель может быть включен дополнительный ингредиент, который помогает солюбилизации антибактериального агента в слюне. Такие необязательные солюбилизирующие агенты включают увлажняющие полиолы, такие как пропиленгликоль, дипропиленгликоль и гексиленгликоль, целлозольвы, такие как метилцеллозольв и этилцеллозольв, растительные масла и воски, содержащие, по меньшей мере, 12 углеродов в прямой цепи, такие как оливковое масло, касторовое масло и петролатум и сложные эфиры, такие как амилацетат, этилацетат и бензилбензоат. Используемый в настоящем описании «пропиленгликоль» включает 1,2-пропиленгликоль и 1,3-пропиленгликоль. Следует избегать значительных количеств полиэтиленгликоля, особенно с молекулярной массой 600 или более, так как полиэтиленгликоль эффективно ингибирует антибактериальную активность некатионного антибактериального агента. Например, полиэтиленгликоль (ПЭГ) 600, когда находится с триклозаном в весовом отношении 25 триклозан : 1 ПЭГ 600, снижает антибактериальную активность триклозана в 10-20 раз от существующей при отсутствии полиэтиленгликоля.In a typical dentifrice, an orally acceptable excipient comprising an aqueous phase with a moisturizing agent is present. Water is usually present in an amount of at least 3% by weight, usually 3-35%, and a moisturizing agent, preferably glycerin and / or sorbitol, usually in a total amount of 6.5-75% or 80% by weight. dentifrices, more typically 10-75%. Although not required in the present invention, in which 0.25-0.35% of a water-insoluble non-cationic antibacterial agent is optionally present, an additional ingredient may be included in the aqueous moisturizing excipient that helps solubilize the antibacterial agent in saliva. Such optional solubilizing agents include moisturizing polyols such as propylene glycol, dipropylene glycol and hexylene glycol, cellosolves such as methyl cellosolve and ethyl cellosolve, vegetable oils and waxes containing at least 12 straight-chain carbons such as olive oil, castor oil and petrol and esters such as amyl acetate, ethyl acetate and benzyl benzoate. As used herein, “propylene glycol” includes 1,2-propylene glycol and 1,3-propylene glycol. Significant amounts of polyethylene glycol should be avoided, especially with a molecular weight of 600 or more, since polyethylene glycol effectively inhibits the antibacterial activity of a non-cationic antibacterial agent. For example, polyethylene glycol (PEG) 600, when it is present with triclosan in a weight ratio of 25 triclosan: 1 PEG 600, reduces the antibacterial activity of triclosan 10-20 times the existing in the absence of polyethylene glycol.
рН пероральной композиции находится обычно в диапазоне от 4,5 до 10 и в другом аспекте от 6,5 до 7,5. Примечательно, что композиции изобретения можно применять перорально при рН ниже 5, по существу, без декальцинирования или иного повреждения зубной эмали. рН можно контролировать с помощью кислоты (например, лимонная кислота или бензойная кислота), или основания (например, гидроксид натрия), или буферного раствора (цитрат натрия, бензоат, карбонат или бикарбонат, натрия фосфат двузамещенный, натрия фосфат однозамещенный и подобное).The pH of the oral composition is usually in the range from 4.5 to 10 and in another aspect from 6.5 to 7.5. It is noteworthy that the compositions of the invention can be used orally at pH below 5, essentially without decalcification or other damage to tooth enamel. The pH can be controlled using an acid (e.g., citric acid or benzoic acid), or a base (e.g., sodium hydroxide), or a buffer solution (sodium citrate, benzoate, carbonate or bicarbonate, sodium phosphate disubstituted, sodium phosphate monosubstituted and the like).
Любые абразивные твердые частицы могут быть использованы и могут быть выбраны из бикарбоната натрия, фосфата кальция (например, дикальцийфосфат дигидрат), сульфата кальция, осажденного карбоната кальция, диоксида кремния (например, гидратированный диоксид кремния), оксида железа, оксида алюминия, перлита, полимерных частиц, например, полиэтилена, и их комбинаций. В частности, абразивное вещество может быть выбран из фосфата кальция (например, дикальцийфосфат дигидрат), сульфата кальция, осажденного карбоната кальция, диоксида кремния (например, гидратированный диоксид кремния), пирофосфата кальция и комбинаций. Может быть использован любой тип диоксида кремния, такой как осажденные диоксиды кремния или силикагели. Предпочтительными являются коммерчески доступные диоксиды кремния, такие как INEOS AC43, доступные от Ineos Silicas, Warrington, United Kingdom. Другие абразивные вещества можно также использовать в соответствии с настоящим изобретением. В патенте США № 4358437 изложено, что порошковые формы карбоната кальция в абразивной форме составляют один важный класс таких абразивных веществ. Примеры этих абразивных веществ представляют собой измельченный известняк или мрамор, карбонаты кальция (мелы), такие как арагонит, кальцит или их смеси и синтетически осажденные карбонаты кальция, такие как карбонат кальция системы водоснабжения. Обычно карбонат кальция должен иметь весовой медианный диаметр менее чем 40 микрон, предпочтительно менее чем 15 микрон. Второй класс абразивных веществ представляет собой порошковые диоксиды кремния, в частности, ксерогели на основе диоксида кремния, как определено в патенте США № 3538230.Any abrasive solids can be used and can be selected from sodium bicarbonate, calcium phosphate (e.g., dicalcium phosphate dihydrate), calcium sulfate, precipitated calcium carbonate, silicon dioxide (e.g. hydrated silicon dioxide), iron oxide, alumina, perlite, polymer particles, for example, polyethylene, and combinations thereof. In particular, the abrasive can be selected from calcium phosphate (e.g., dicalcium phosphate dihydrate), calcium sulfate, precipitated calcium carbonate, silicon dioxide (e.g. hydrated silicon dioxide), calcium pyrophosphate, and combinations. Any type of silica may be used, such as precipitated silica or silica gel. Preferred are commercially available silicas, such as INEOS AC43, available from Ineos Silicas, Warrington, United Kingdom. Other abrasives can also be used in accordance with the present invention. US Pat. No. 4,358,437 teaches that powdered forms of calcium carbonate in abrasive form constitute one important class of such abrasive substances. Examples of these abrasives are crushed limestone or marble, calcium carbonates (chalks) such as aragonite, calcite or mixtures thereof, and synthetically precipitated calcium carbonates such as calcium carbonate in a water supply system. Typically, calcium carbonate should have a weight median diameter of less than 40 microns, preferably less than 15 microns. A second class of abrasive substances is silica powder, in particular silica-based xerogels, as defined in US Pat. No. 3,538,230.
В одном варианте осуществления пероральная композиция содержит кремнийсодержащий полирующий агент. Полирующий агент может быть кремнийсодержащим материалом, таким как содержащий воду силикагель, ксерогель на основе диоксида кремния, или сложный аморфный алюмосиликат или цирконосиликат щелочного металла, или осажденный диоксид кремния. Коллоидные материалы диоксида кремния включают продаваемые под торговой маркой SYLOID, такие как материалы, которые были проданы как SYLOID 72 и SYLOID 74. Осажденные диоксиды кремния включают продаваемые под торговой маркой ZEODENT, такие как ZEODENT 113, и ZEODENT 115, и ZEODENT 119.In one embodiment, the oral composition comprises a silicon-containing polishing agent. The polishing agent may be a silicon-containing material, such as water-containing silica gel, silica-based xerogel, or a complex amorphous silica-alumina or alkali metal zirconosilicate, or precipitated silica. Colloidal silica materials include those sold under the SYLOID trademark, such as those sold as SYLOID 72 and SYLOID 74. Precipitated silicas include those sold under the ZEODENT trademark, such as ZEODENT 113, and ZEODENT 115, and ZEODENT 119.
Жидкость для полоскания полости рта или средство для полоскания полости рта не будут обычно содержать абразивные частицы или полирующие частицы. Накладка не будет обычно содержать абразивные частицы или полирующие частицы.An oral rinse or mouthwash will not typically contain abrasive particles or polishing particles. The pad will not typically contain abrasive particles or polishing particles.
Не будучи привязанным к теории, на основании чего достигают преимуществ этого изобретения, полагают, что даже при отсутствии специального солюбилизирующего материала для антибактериального агента (например, 2,4,4'-трихлор-2'-гидроксидифениловый эфир), когда количество агента представляет собой 0,25% вес.-0,35% вес. и присутствует поликарбоксилат, присутствует достаточный агент для эффективного лечения периодонтита посредством подавления, по меньшей мере, одной из MMP-8, MMP-9 или MMP-13. Это одинаково применимо к другим нерастворимым в воде некатионным антибактериальным агентам, описанным в настоящей заявке.Without being bound by theory, on the basis of which the advantages of this invention are achieved, it is believed that even in the absence of a special solubilizing material for an antibacterial agent (for example, 2,4,4'-trichloro-2'-hydroxydiphenyl ether), when the amount of agent is 0.25% weight.-0.35% weight. and polycarboxylate is present, a sufficient agent is present to effectively treat periodontitis by suppressing at least one of MMP-8, MMP-9 or MMP-13. This is equally applicable to the other water-insoluble non-cationic antibacterial agents described in this application.
Пероральная композиция (например, средство для ухода за зубами) может также содержать источник ионов фторида или компонент, обеспечивающий фтор, в качестве противокариесного агента, в количестве, достаточном для обеспечения от 25 ч./млн до 5000 ч./млн ионов фторида. Эти соединения могут быть слабо растворимыми в воде или могут быть полностью растворимыми в воде. Они характеризуются их способностью высвобождать ионы фторида в воде и существенным освобождением от нежелательной реакции с другими соединениями перорального лекарственного средства. К числу этих соединений относятся неорганические соли фторида, такие как растворимые соли щелочных металлов, щелочноземельных металлов или, например, фторид натрия, фторид калия, фторид аммония, фторид кальция, фторид меди, такой как фторид одновалентной меди, фторид цинка, фторид бария, фторсиликат натрия, фторсиликат аммония, фторцирконат натрия, фторцирконат аммония, монофторфосфат натрия, моно- и дифторфосфат алюминия и фторированный пирофосфат натрия-кальция. Предпочтительными являются фториды щелочного металла и олова, такие как фториды натрия и олова, монофторфосфат натрия (MFP) и их смеси. Как правило, в случае фторидов щелочных металлов этот компонент присутствует в количестве не более 2% вес., основываясь на весе лекарственного средства, и предпочтительно в диапазоне от 0,05% до 1%. В случае монофторфосфата натрия соединение может присутствовать в количестве 0,1-3% и В одном варианте осуществления 0,7-0,8%.The oral composition (for example, a dentifrice) may also contain a fluoride ion source or a fluoride providing component as an anti-caries agent in an amount sufficient to provide from 25 ppm to 5000 ppm fluoride ions. These compounds may be slightly soluble in water or may be completely soluble in water. They are characterized by their ability to release fluoride ions in water and a significant release from an undesirable reaction with other compounds of the oral drug. Among these compounds are inorganic fluoride salts, such as soluble salts of alkali metals, alkaline earth metals or, for example, sodium fluoride, potassium fluoride, ammonium fluoride, calcium fluoride, copper fluoride such as monovalent copper fluoride, zinc fluoride, barium fluoride, fluorosilicate sodium, ammonium fluorosilicate, sodium fluorozirconate, ammonium fluorozirconate, sodium monofluorophosphate, aluminum mono- and difluorophosphate and fluorinated sodium-calcium pyrophosphate. Preferred are alkali metal and tin fluorides, such as sodium and tin fluorides, sodium monofluorophosphate (MFP), and mixtures thereof. Typically, in the case of alkali metal fluorides, this component is present in an amount of not more than 2% by weight, based on the weight of the drug, and preferably in the range from 0.05% to 1%. In the case of sodium monofluorophosphate, the compound may be present in an amount of 0.1-3% and, in one embodiment, 0.7-0.8%.
В одном аспекте композиция дополнительно содержит агент, выбранный из агента ионов олова; соединения фторида; фторида натрия; хлоргексидина; алексидина; гексетидина; сангвинарина; бензалкония хлорида; салициланилида; домифена бромида; цетилпиридиния хлорида (CPC); тетрадецилпиридиния хлорида (TPC); N-тетрадецил-4-этилпиридиния хлорида (TDEPC); октенидина; делмопинола; октапинола; низина; агента ионов цинка; агента ионов меди; эфирных масел; фуранонов; бактериоцинов, этиллауроила аргината, экстрактов магнолии, источника ионов металла, аргинина, бикарбоната аргинина, гонокиола, магонола, урсоловой кислоты, урсиновой кислоты, морина, экстракта облепихи крушинной, пероксида, фермента, экстракта камелии, флавоноида, флавана, галогенированного дифенилового эфира, креатина и прополиса.In one aspect, the composition further comprises an agent selected from a tin ion agent; fluoride compounds; sodium fluoride; chlorhexidine; alexidine; hexetidine; sanguinarine; benzalkonium chloride; salicylanilide; domiphen bromide; cetylpyridinium chloride (CPC); tetradecylpyridinium chloride (TPC); N-tetradecyl-4-ethylpyridinium chloride (TDEPC); octenidine; delmopinol; octapinol; lowland; zinc ion agent; copper ion agent; essential oils; furanones; bacteriocins, ethyl lauroyl arginate, extracts of magnolia, a source of metal ions, arginine, arginine bicarbonate, gonociol, magonol, ursolic acid, ursic acid, morin, buckthorn extract, peroxide, enzyme, camellia extract, flavonoid, flavanofenine, flavanen, flavanen, flavanen, propolis.
Некоторые варианты осуществления настоящего изобретения обеспечивают способы идентификации соединения, пригодного для лечения заболевания или состояния ротовой полости, способ, включающий: получение первого гингивального образца от млекопитающего, страдающего от заболевания или состояния ротовой полости; получение второго гингивального образца из ротовой полости вышеуказанного млекопитающего; взаимодействие вышеуказанного первого образца с исследуемым соединением; взаимодействие вышеуказанного второго образца с положительным контролем, в котором вышеуказанный положительный контроль представляет собой соединение, известное для подавления экспрессии одной или более матриксных металлопротеиназ; измерение степени, с которой экспрессия одной или более из вышеуказанных матриксных металлопротеиназ подавляется с помощью вышеуказанного исследуемого соединения; измерение степени, с которой экспрессия одной или более из вышеуказанных матриксных металлопротеиназ подавляется с помощью вышеуказанного положительного контроля; и сравнение степени, с которой экспрессия одной или более из вышеуказанных матриксных металлопротеиназ подавляется с помощью вышеуказанного исследуемого соединения, со степенью, с которой экспрессия одной или более из вышеуказанных матриксных металлопротеиназ подавляется с помощью вышеуказанного положительного контроля; в котором исследуемое соединение, которое подавляет экспрессию одной или более из вышеуказанных матриксных металлопротеиназ в равной или большей степени, чем вышеуказанный положительный контроль, является соединением, пригодным для лечения заболевания или состояния ротовой полости.Some embodiments of the present invention provide methods for identifying a compound suitable for treating a disease or condition of the oral cavity, a method comprising: obtaining a first gingival sample from a mammal suffering from a disease or condition of the oral cavity; obtaining a second gingival sample from the oral cavity of the above mammal; the interaction of the above first sample with the test compound; the interaction of the above second sample with a positive control, in which the above positive control is a compound known to inhibit the expression of one or more matrix metalloproteinases; measuring the degree to which the expression of one or more of the aforementioned matrix metalloproteinases is inhibited by the aforementioned test compound; measuring the degree to which the expression of one or more of the aforementioned matrix metalloproteinases is inhibited by the above positive control; and comparing the degree to which the expression of one or more of the above matrix metalloproteinases is inhibited by the above test compound, with the degree to which the expression of one or more of the above matrix metalloproteinases is suppressed by the above positive control; in which the test compound, which inhibits the expression of one or more of the aforementioned matrix metalloproteinases to an equal or greater degree than the above positive control, is a compound suitable for treating a disease or condition of the oral cavity.
В других вариантах осуществления одну или более матриксных металлопротеиназ выбирают из группы, состоящей из: MMP-8, MMP-9 и MMP-13. В дополнительных вариантах осуществления положительный контроль подавляет экспрессию MMP-8, MMP-9 и MMP-13.In other embodiments, one or more matrix metalloproteinases is selected from the group consisting of: MMP-8, MMP-9, and MMP-13. In further embodiments, the positive control inhibits the expression of MMP-8, MMP-9, and MMP-13.
В некоторых вариантах осуществления заболевание или состояние ротовой полости представляет собой гингивит или периодонтит. В других вариантах осуществления положительный контроль представляет собой галогенированный дифениловый эфир. В еще других вариантах осуществления положительный контроль представляет собой триклозан.In some embodiments, the implementation of the disease or condition of the oral cavity is gingivitis or periodontitis. In other embodiments, the positive control is a halogenated diphenyl ether. In still other embodiments, the positive control is triclosan.
В некоторых вариантах осуществления исследуемое соединение подавляет экспрессию одной или более из вышеуказанных матриксных металлопротеиназ в большей степени, чем вышеуказанный положительный контроль. В дополнительных вариантах осуществления исследуемое соединение подавляет экспрессию MMP-9 и MMP-13 в большей степени, чем вышеуказанный положительный контроль. Еще дополнительные варианты осуществления обеспечивают способы, в которых исследуемое соединение подавляет экспрессию MMP-8, MMP-9 и MMP-13 в большей степени, чем положительный контроль.In some embodiments, a test compound inhibits the expression of one or more of the aforementioned matrix metalloproteinases to a greater extent than the aforementioned positive control. In additional embodiments, the test compound inhibits the expression of MMP-9 and MMP-13 to a greater extent than the above positive control. Still further embodiments provide methods in which the test compound inhibits the expression of MMP-8, MMP-9 and MMP-13 to a greater extent than the positive control.
В некоторых вариантах осуществления положительный контроль подавляет экспрессию MMP-8. В некоторых вариантах осуществления положительный контроль подавляет экспрессию MMP-9. В еще других вариантах осуществления положительный контроль подавляет экспрессию MMP-13.In some embodiments, the positive control inhibits the expression of MMP-8. In some embodiments, the positive control inhibits the expression of MMP-9. In still other embodiments, a positive control inhibits the expression of MMP-13.
Изобретение дополнительно описано с помощью следующих примеров. Примеры являются просто иллюстративными и никаким образом не ограничивают объем изобретения, как описано и заявлено.The invention is further described using the following examples. The examples are merely illustrative and in no way limit the scope of the invention as described and claimed.
ПРИМЕРЫEXAMPLES
Пример 1: Получение MMP-9 и характеристикаExample 1: Obtaining MMP-9 and characterization
Клетки U937 и культуральную среду RPMI 1640 получали от ATCC. Набор с MMP-9 человека для ELISA (QUANTIKINE) получали от R&D Systems. Эмбриональную бычью сыворотку (ЭБС) получали от VWR и раствор пенициллина-стрептомицина и фактор некроза опухоли α (TNFα) получали от Sigma.U937 cells and RPMI 1640 culture medium were obtained from ATCC. The human MMP-9 kit for ELISA (QUANTIKINE) was obtained from R&D Systems. Fetal bovine serum (EBS) was obtained from VWR and a solution of penicillin-streptomycin and tumor necrosis factor α (TNFα) were obtained from Sigma.
Клетки лимфомы моноцита лейкемии человека U937 культивировали в среде RPMI 1640, дополненной 10% ЭБС и 1% раствором пенициллина-стрептомицина. Клетки инкубировали при 37°C в увлажненной атмосфере, содержащей 5% CO2 и 95% воздуха. Перед обработкой клетки переносили в RPMI, содержащую 1% ЭБС, в течение ночи. Клетки помещали на 48-луночный планшет. Клеточная культуральная среда включала или TNFα (250 нг/мл), Триклозан (1 ч./млн), или оба агента вместе, или агент отсутствовал (контроль). Клетки инкубировали после обработки в течение 24 часов. Кондиционированные среды собирали и хранили при -80°C до анализа. Образцы кондиционированных сред подвергали твердофазному иммуноферментному анализу (ELISA) для MMP-9, согласно промышленному протоколу ELISA (фигура 1).U937 human leukemia monocyte lymphoma cells were cultured in RPMI 1640 medium supplemented with 10% EBL and 1% penicillin-streptomycin solution. Cells were incubated at 37 ° C in a humidified atmosphere containing 5% CO 2 and 95% air. Before treatment, cells were transferred to RPMI containing 1% EBS overnight. Cells were placed on a 48-well plate. The cell culture medium included either TNFα (250 ng / ml), Triclosan (1 ppm), or both agents together, or no agent (control). Cells were incubated after treatment for 24 hours. Conditioned media were collected and stored at -80 ° C until analysis. Samples of conditioned media were subjected to enzyme-linked immunosorbent assay (ELISA) for MMP-9, according to the industrial ELISA protocol (figure 1).
Клетки U937, стимулируемые TNFα, производили увеличение уровня MMP-9. Триклозан при 1 ч./млн значительно снижал уровень MMP-9 в клетках U937, стимулируемых TNFα.TNFα-stimulated U937 cells produced an increase in MMP-9. Triclosan at 1 ppm significantly reduced the level of MMP-9 in U937 cells stimulated by TNFα.
Данные для фигуры 1, демонстрирующие эффект триклозана на выработку MMP-9Table 1
The data for figure 1, demonstrating the effect of triclosan on the production of MMP-9
Пример 2: Получение и характеристика MMP-13Example 2: Preparation and Characterization of MMP-13
Паратиреоидный гормон (крысиный ПТГ 1-34) получали от Sigma. Клетки UMR 106-01 культивировали в минимальной поддерживающей среде Игла (EMEM), дополненной 25 мМ Hepes рН 7,4, 1% заменимыми аминокислотами, 100 ед./мл пенициллина, 100 мкг/мл стрептомицина, 5% эмбриональной бычьей сывороткой. ПЦР в режиме реального времени проводили согласно следующему способу: клетки UMR 106-01 помещали в 12-луночные планшеты и культивировали в течение 2-3 дней в клеточной культуральной среде. Когда клетки сливались, культуральную клеточную среду меняли на 1% эмбриональную бычью сыворотку в течение ночи для выращивания клеток на минимальной среде. Клетки предварительно инкубировали с триклозаном или содержащим триклозан средством для ухода за зубами (см., например, патенты США № 4894220, 5032386 и родственные патенты) в течение 15 минут и затем инкубировали с ПТГ (10-8 M) в течение 4 часов.Parathyroid hormone (rat PTH 1-34) was obtained from Sigma. UMR 106-01 cells were cultured in Eagle's Minimum Support Medium (EMEM) supplemented with 25 mM Hepes pH 7.4, 1% essential amino acids, 100 units / ml penicillin, 100 μg / ml streptomycin, 5% fetal bovine serum. Real-time PCR was performed according to the following method: UMR 106-01 cells were placed in 12-well plates and cultured for 2-3 days in a cell culture medium. When the cells fused, the cell culture medium was changed to 1% fetal bovine serum overnight to grow the cells on minimal medium. Cells were preincubated with triclosan or triclosan-containing dentifrices (see, for example, US Pat. Nos. 4,894,220, 5,032,386 and related patents) for 15 minutes and then incubated with PTH (10 -8 M) for 4 hours.
Тотальную РНК выделяли из клеток UMR 106-01, стимулируемых с или без ПТГ с реагентом TRIzol. Тотальную РНК (0,1 мкг) подвергали обратной транскрипции с кДНК, используя набор Invitrogen SUPERSCRIPT согласно инструкциям изготовителя. ПЦР проводили на кДНК, используя праймеры, последовательности которых изложены в таблице 2. Все кДНК амплифицировали с помощью добавления 2,5 мкл кДНК к смеси ПЦР (22,5 мкл), содержащей каждый праймер (0,2 мкМ) и 12,5 мкл Platinum SYBR Green qPCR SuperMix UDG (Invitrogen). Реакции предварительно инкубировали при 50°C в течение 2 минут для очистки от dU-содержащей ДНК с помощью UDG, затем при 95°C в течение 2 минут для инактивации UDG и активации Taq. Программу ПЦР продолжали 49 циклов денатурации при 95°C в течение 15 секунд, отжига и элонгации праймеров при 60°C в течение 30 секунд. Относительное количество экспрессии гена определяли при использовании способа 2-delta delta CT, где кратные изменения в экспрессии гена относятся к контрольным образцам. Все образцы нормализировали по отношению к β-актину.Total RNA was isolated from UMR 106-01 cells stimulated with or without PTH with TRIzol reagent. Total RNA (0.1 μg) was reverse transcribed with cDNA using the Invitrogen SUPERSCRIPT kit according to the manufacturer's instructions. PCR was performed on cDNA using primers whose sequences are shown in Table 2. All cDNA was amplified by adding 2.5 μl of cDNA to a PCR mixture (22.5 μl) containing each primer (0.2 μM) and 12.5 μl Platinum SYBR Green qPCR SuperMix UDG (Invitrogen). The reactions were preincubated at 50 ° C for 2 minutes to purify dU-containing DNA using UDG, then at 95 ° C for 2 minutes to inactivate UDG and activate Taq. The PCR program continued with 49 cycles of denaturation at 95 ° C for 15 seconds, annealing and elongation of primers at 60 ° C for 30 seconds. The relative amount of gene expression was determined using the 2-delta delta CT method, where multiple changes in gene expression relate to control samples. All samples were normalized with respect to β-actin.
Все результаты выражали как среднее значение ± стандартная ошибка (S.E.) тройных измерений всех экспериментов, повторяемых, по меньшей мере, три раза. Статистические исследования проводили, используя t-критерий Стьюдента.All results were expressed as mean ± standard error (S.E.) of triplicate measurements of all experiments repeated at least three times. Statistical studies were performed using t-student test.
Клетки UMR, стимулируемые ПТГ, производили увеличение экспрессии MMP-13. Триклозан при 10 ч./млн, 4 ч./млн и 1 ч./млн значительно уменьшал экспрессию MMP-13 в клетках UMR, стимулируемых ПТГ. Включающая триклозан суспензия средства для ухода за зубами, содержащая 10 ч./млн триклозана, значительно уменьшала экспрессию MMP-13 в клетках UMR, стимулируемых ПТГ.PTH stimulated UMR cells produced an increase in MMP-13 expression. Triclosan at 10 ppm, 4 ppm and 1 ppm significantly reduced the expression of MMP-13 in PTH stimulated UMR cells. The triclosan-containing suspension of a dentifrice containing 10 ppm triclosan significantly reduced the expression of MMP-13 in PTH stimulated UMR cells.
Последовательности праймераtable 2
Primer sequences
Данные для фигуры 2, демонстрирующие, что триклозан ингибирует экспрессию MMP-13Table 3
The data for figure 2, demonstrating that triclosan inhibits the expression of MMP-13
Данные для фигуры 3, демонстрирующие, что содержащее триклозан средство для ухода за зубами ингибирует экспрессию MMP-13Table 4
The data for figure 3, demonstrating that containing triclosan dentifrice inhibits the expression of MMP-13
Claims (7)
взаимодействие первого гингивального образца, полученного от млекопитающего, страдающего от гингивита, с исследуемым соединением;
взаимодействие второго гингивального образца, полученного из ротовой полости вышеуказанного млекопитающего, с положительным контролем, в котором вышеуказанный положительный контроль представляет собой соединение, известное для подавления экспрессии одной или более матриксных металлопротеиназ;
измерение степени, с которой экспрессия одной или более из вышеуказанных матриксных металлопротеиназ подавляется с помощью вышеуказанного исследуемого соединения;
измерение степени, с которой экспрессия одной или более из вышеуказанных матриксных металлопротеиназ подавляется с помощью вышеуказанного положительного контроля; и
сравнение степени, с которой экспрессия одной или более из вышеуказанных матриксных металлопротеиназ подавляется с помощью вышеуказанного исследуемого соединения, со степенью, с которой экспрессия одной или более из вышеуказанных матриксных металлопротеиназ подавляется с помощью вышеуказанного положительного контроля;
в котором исследуемое соединение, которое подавляет экспрессию одной или более из вышеуказанных матриксных металлопротеиназ в равной или большей степени, чем вышеуказанный положительный контроль, является соединением, пригодным для лечения гингивита;
где вышеуказанная одна или более матриксных металлопротеиназ, для которых измеряют экспрессию, включают, по меньшей мере, ММР-9 и ММР-13; и
где вышеуказанный положительный контроль представляет собой галогенированный дифениловый эфир.1. A method for identifying a compound suitable for the treatment of gingivitis, including:
the interaction of the first gingival sample obtained from a mammal suffering from gingivitis, with the test compound;
the interaction of the second gingival sample obtained from the oral cavity of the above mammal with a positive control, in which the above positive control is a compound known to inhibit the expression of one or more matrix metalloproteinases;
measuring the degree to which the expression of one or more of the aforementioned matrix metalloproteinases is inhibited by the aforementioned test compound;
measuring the degree to which the expression of one or more of the aforementioned matrix metalloproteinases is inhibited by the above positive control; and
comparing the degree to which the expression of one or more of the aforementioned matrix metalloproteinases is inhibited by the above test compound with the degree to which the expression of one or more of the aforementioned matrix metalloproteinases is suppressed by the above positive control;
in which the test compound, which inhibits the expression of one or more of the above matrix metalloproteinases to an equal or greater degree than the above positive control, is a compound suitable for the treatment of gingivitis;
where the above one or more matrix metalloproteinases for which expression is measured include at least MMP-9 and MMP-13; and
where the above positive control is a halogenated diphenyl ether.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US16568509P | 2009-04-01 | 2009-04-01 | |
| US61/165,685 | 2009-04-01 | ||
| PCT/US2010/029670 WO2010115031A1 (en) | 2009-04-01 | 2010-04-01 | Anti bone-loss and anti attachment-loss effects of an oral composition |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2011144028A RU2011144028A (en) | 2013-05-10 |
| RU2524629C2 true RU2524629C2 (en) | 2014-07-27 |
Family
ID=42328354
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2011144028/15A RU2524629C2 (en) | 2009-04-01 | 2010-04-01 | Method of identifying compound, suitable for treating inflammatory condition of oral cavity |
Country Status (20)
| Country | Link |
|---|---|
| US (1) | US8637266B2 (en) |
| EP (1) | EP2414838B1 (en) |
| JP (1) | JP5330596B2 (en) |
| CN (1) | CN102365550B (en) |
| AR (1) | AR076177A1 (en) |
| AU (1) | AU2010232590B2 (en) |
| BR (1) | BRPI1013185A2 (en) |
| CA (1) | CA2757317C (en) |
| CO (1) | CO6420374A2 (en) |
| DK (1) | DK2414838T3 (en) |
| ES (1) | ES2432864T3 (en) |
| HK (1) | HK1167272A1 (en) |
| MX (1) | MX2011008438A (en) |
| MY (1) | MY158406A (en) |
| PL (1) | PL2414838T3 (en) |
| RU (1) | RU2524629C2 (en) |
| SG (1) | SG173487A1 (en) |
| TW (1) | TWI405565B (en) |
| WO (1) | WO2010115031A1 (en) |
| ZA (1) | ZA201106054B (en) |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101745067B1 (en) * | 2014-12-31 | 2017-06-12 | 서울대학교산학협력단 | System and method for the prediction of periodontal disease |
| KR102098624B1 (en) * | 2019-09-20 | 2020-04-08 | 서울대학교산학협력단 | A system and method for the prediction of periodontitis using salivary mmp-9 and il-8 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6814958B1 (en) * | 1998-04-24 | 2004-11-09 | Sunstar Inc. | Food compositions, compositions for oral cavity and medicinal compositions for preventing or treating periodontosis and method for preventing or treating periodontosis |
| WO2005103071A1 (en) * | 2004-04-23 | 2005-11-03 | Ctt Cancer Targeting Technologies Oy | Peptide inhibitors of metalloproteinase activity |
Family Cites Families (38)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3538230A (en) | 1966-12-05 | 1970-11-03 | Lever Brothers Ltd | Oral compositions containing silica xerogels as cleaning and polishing agents |
| US4358437A (en) | 1978-11-29 | 1982-11-09 | Beecham Group Limited | Compositions |
| US5032386A (en) | 1988-12-29 | 1991-07-16 | Colgate-Palmolive Company | Antiplaque antibacterial oral composition |
| US5288480A (en) | 1987-01-30 | 1994-02-22 | Colgate-Palmolive Co. | Antiplaque antibacterial oral composition |
| US4894220A (en) | 1987-01-30 | 1990-01-16 | Colgate-Palmolive Company | Antibacterial antiplaque oral composition |
| GB9117140D0 (en) | 1991-08-08 | 1991-09-25 | Unilever Plc | Treatment of periodontitis |
| DE4226043A1 (en) | 1992-08-06 | 1994-02-10 | Haarmann & Reimer Gmbh | Agents with a physiological cooling effect and active compounds suitable for these agents |
| US5756361A (en) * | 1992-12-17 | 1998-05-26 | Metra Biosystems, Inc. | Screening method for periodontal disease |
| WO1995013094A1 (en) | 1993-11-10 | 1995-05-18 | Bristol-Myers Squibb Company | Treatment of bacterially-induced inflammatory diseases |
| FI98961C (en) * | 1994-08-26 | 1997-09-10 | Medix Biochemica Ab Oy | Procedure and test means for diagnosing periodontal disease activity and / or peri-implantitis and / or increased risk thereof |
| US5578295A (en) | 1995-04-28 | 1996-11-26 | The Procter & Gamble Company | Oral care compositions comprising certain substituted diphenyl ethers |
| WO1997047282A1 (en) | 1996-06-12 | 1997-12-18 | Henkel Kommanditgesellschaft Auf Aktien | Cosmetic and/or pharmaceutical preparations |
| US5998487A (en) * | 1998-04-08 | 1999-12-07 | Colgate-Palmolive Company | Anti-inflammatory and antibacterial benzyl phenol agents and their use in oral compositions |
| FR2794457B1 (en) | 1999-06-01 | 2001-08-10 | Oreal | RETINOL CARBONATE DERIVATIVES, PREPARATION METHOD AND USES |
| US6165447A (en) * | 1999-06-15 | 2000-12-26 | Colgate-Palmolive Company | Synergistic antibacterial combination |
| EP1234181A4 (en) | 1999-12-03 | 2005-01-26 | Baxter Int | Pyrogenicity test for use with automated immunoassay systems |
| GB0001704D0 (en) | 2000-01-25 | 2000-03-15 | Glaxo Group Ltd | Protein |
| US20020009740A1 (en) | 2000-04-14 | 2002-01-24 | Rima Kaddurah-Daouk | Methods for drug discovery, disease treatment, and diagnosis using metabolomics |
| US7329489B2 (en) | 2000-04-14 | 2008-02-12 | Matabolon, Inc. | Methods for drug discovery, disease treatment, and diagnosis using metabolomics |
| US6500409B1 (en) | 2000-05-10 | 2002-12-31 | Colgate Palmolive Company | Synergistic antiplaque/antigingivitis oral composition |
| DE10059584A1 (en) | 2000-11-30 | 2002-06-06 | Beiersdorf Ag | Cosmetic or dermatological soaked wipes |
| DOP2002000332A (en) * | 2001-02-14 | 2002-08-30 | Warner Lambert Co | MATRIX METALOPROTEINAS PYRIDINE INHIBITORS |
| BR0313724A (en) * | 2002-08-13 | 2005-06-28 | Warner Lambert Co | Azaisoquinoline derivatives as matrix metalloproteinase inhibitors |
| US7005225B2 (en) | 2002-11-12 | 2006-02-28 | Samsung Electronics Company | Organosol including amphipathic copolymeric binder having crystalline material, and use of the organosol to make dry tones for electrographic applications |
| EP1599212A4 (en) | 2003-02-14 | 2006-02-08 | Combinatorx Inc | Combination therapy for the treatment of immunoinflammatory disorders |
| GB2401865A (en) | 2003-05-22 | 2004-11-24 | Givaudan Sa | Antibacterial and antifungal glycerol monocarbonates |
| WO2005039504A2 (en) | 2003-10-24 | 2005-05-06 | Eisai Co., Ltd. | Compounds and methods for treating toll-like receptor 2-related diseases and conditions |
| ES2320139T3 (en) | 2003-12-03 | 2009-05-19 | Whitehead Institute For Biomedical Research | USE OF SOLUBLE T-CADHERINE FOR THE TREATMENT OF METABOLIC DISORDERS. |
| JP4662043B2 (en) * | 2004-09-09 | 2011-03-30 | 国立大学法人東京農工大学 | Periodontal disease evaluation system |
| CN101111288A (en) * | 2004-12-02 | 2008-01-23 | 高露洁-棕榄公司 | Oral care composition comprising a phenolic compound and antioxidant vitamins and vitamin derivatives |
| US20060141421A1 (en) | 2004-12-28 | 2006-06-29 | Kimberly-Clark Worldwide, Inc. | System and method for detecting substances related to oral health |
| WO2006074450A2 (en) | 2005-01-07 | 2006-07-13 | President And Fellows Of Harvard College | Methods and compositions for detecting and modulating periodontal disorders and periodontal diseases |
| JP5024506B2 (en) * | 2005-03-25 | 2012-09-12 | ライオン株式会社 | Periodontal tissue destruction inhibitor / ameliorant and oral composition |
| ES2421595T3 (en) | 2006-01-10 | 2013-09-04 | Colgate Palmolive Co | Methods to modulate cell surface receptors to prevent or reduce inflammation |
| US20080161394A1 (en) | 2006-11-23 | 2008-07-03 | Jean-Yves Fouron | Cosmetic composition comprising at least one volatile carbonic acid ester |
| WO2008093072A2 (en) | 2007-01-29 | 2008-08-07 | Paul Webb | Topical composition against contact dermatitis due to water |
| EP2207546A1 (en) | 2007-10-09 | 2010-07-21 | Humco Holding Group, Inc. | Antifungal treatment of nails |
| TWI481870B (en) * | 2009-04-01 | 2015-04-21 | Colgate Palmolive Co | Protein biomarkers for soft tissue disease diagnosis and as therapeutic targets for oral care intervention |
-
2010
- 2010-03-31 TW TW099109773A patent/TWI405565B/en not_active IP Right Cessation
- 2010-03-31 AR ARP100101094A patent/AR076177A1/en unknown
- 2010-04-01 CA CA2757317A patent/CA2757317C/en not_active Expired - Fee Related
- 2010-04-01 BR BRPI1013185A patent/BRPI1013185A2/en not_active IP Right Cessation
- 2010-04-01 ES ES10712854T patent/ES2432864T3/en active Active
- 2010-04-01 DK DK10712854.8T patent/DK2414838T3/en active
- 2010-04-01 CN CN201080015649.0A patent/CN102365550B/en not_active Expired - Fee Related
- 2010-04-01 WO PCT/US2010/029670 patent/WO2010115031A1/en active Application Filing
- 2010-04-01 US US13/262,027 patent/US8637266B2/en active Active
- 2010-04-01 EP EP10712854.8A patent/EP2414838B1/en not_active Revoked
- 2010-04-01 AU AU2010232590A patent/AU2010232590B2/en not_active Ceased
- 2010-04-01 MX MX2011008438A patent/MX2011008438A/en active IP Right Grant
- 2010-04-01 MY MYPI2011003577A patent/MY158406A/en unknown
- 2010-04-01 PL PL10712854T patent/PL2414838T3/en unknown
- 2010-04-01 SG SG2011055332A patent/SG173487A1/en unknown
- 2010-04-01 RU RU2011144028/15A patent/RU2524629C2/en not_active IP Right Cessation
- 2010-04-01 JP JP2012503715A patent/JP5330596B2/en not_active Expired - Fee Related
-
2011
- 2011-08-17 ZA ZA2011/06054A patent/ZA201106054B/en unknown
- 2011-09-06 CO CO11114807A patent/CO6420374A2/en not_active Application Discontinuation
-
2012
- 2012-08-03 HK HK12107648.7A patent/HK1167272A1/en not_active IP Right Cessation
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6814958B1 (en) * | 1998-04-24 | 2004-11-09 | Sunstar Inc. | Food compositions, compositions for oral cavity and medicinal compositions for preventing or treating periodontosis and method for preventing or treating periodontosis |
| WO2005103071A1 (en) * | 2004-04-23 | 2005-11-03 | Ctt Cancer Targeting Technologies Oy | Peptide inhibitors of metalloproteinase activity |
Non-Patent Citations (2)
| Title |
|---|
| EJEIL AL et.al. Еxpression of matrix metalloproteinases (MMPs) and tissue inhibitors of metalloproteinases (TIMPs) in healthy and diseased human gingival. // J Periodontol. 2003 Feb. V. 74(2). P.188-195 * |
| T.SADOWSKI et.al. Effects of tetracyclines on the production of matrix metalloproteinases and plasminogen activators as well as of their natural inhibitors, tissue inhibitor of metalloproteinases-1 and plasminogen activator inhibitor-1.// Inflamm Res. - 2001 Mar -V.50(3) - P.175-82. YOSHIOKA M. et.al. Effect of hydroxamic acid-based matrix metalloproteinase inhibitors on human gingival cells and Porphyromonas gingivalis. // J Periodontol. - 2003. Aug - 74(8). P.1219-1224 . MARCELA HERNANDEZ et.al. Matrix Metalloproteinase-13 is highly expressed in destructive periodontal disease activity. // J Periodontol - November. 2006. V.77. N11. P.1863-1870. Е.В.БОРОВСКИЙ и др. Терапевтическая стоматология: Учебник для студентов медицинских вузов/ Под ред. Е.В.Боровского. " М.: "Медицинское информационное агенство", 2004. 840 с. F.S.PANAGAKOS et.al. Triclosan inhibition of cytokine-stimulated MMP production by osteoblast-like cells. // 81st General Session of the International Association for Dent * |
Also Published As
| Publication number | Publication date |
|---|---|
| ES2432864T3 (en) | 2013-12-05 |
| JP2012524884A (en) | 2012-10-18 |
| AR076177A1 (en) | 2011-05-26 |
| US20120107843A1 (en) | 2012-05-03 |
| MY158406A (en) | 2016-10-14 |
| SG173487A1 (en) | 2011-09-29 |
| CO6420374A2 (en) | 2012-04-16 |
| PL2414838T3 (en) | 2014-01-31 |
| MX2011008438A (en) | 2011-09-06 |
| JP5330596B2 (en) | 2013-10-30 |
| ZA201106054B (en) | 2014-01-29 |
| CN102365550B (en) | 2014-08-13 |
| HK1167272A1 (en) | 2012-11-23 |
| CA2757317A1 (en) | 2010-10-07 |
| TW201039812A (en) | 2010-11-16 |
| TWI405565B (en) | 2013-08-21 |
| EP2414838A1 (en) | 2012-02-08 |
| CA2757317C (en) | 2014-03-11 |
| EP2414838B1 (en) | 2013-08-28 |
| CN102365550A (en) | 2012-02-29 |
| AU2010232590A1 (en) | 2011-08-18 |
| BRPI1013185A2 (en) | 2016-04-12 |
| RU2011144028A (en) | 2013-05-10 |
| WO2010115031A1 (en) | 2010-10-07 |
| AU2010232590B2 (en) | 2013-03-07 |
| US8637266B2 (en) | 2014-01-28 |
| DK2414838T3 (en) | 2013-11-04 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2523383C2 (en) | Protein biomarkers for diagnosing soft tissue diseases and as therapeutic targets for oral hygiene intervention | |
| Rangbulla et al. | Salivary IgA, interleukin-1β and MMP-8 as salivary biomarkers in chronic periodontitis patients | |
| Söder | Neutrophil elastase activity, levels of prostaglandin E2, and matrix metalloproteinase-8 in refractory periodontitis sites in smokers and non-smokers | |
| Aboyoussef et al. | Detection of Prostaglandin E 2 and Matrix Metalloproteinases in Implant Crevicular Fluid. | |
| Okuda et al. | Levels of tissue inhibitor of metalloproteinases‐1 and matrix metalloproteinases‐1 and‐8 in gingival crevicular fluid following treatment with enamel matrix derivative (EMDOGAIN®) | |
| Henskens et al. | Effect of periodontal treatment on the protein composition of whole and parotid saliva | |
| Neto et al. | Matrix metalloproteinase‐2 may be involved with increased bone loss associated with experimental periodontitis and smoking: A study in rats | |
| Vuotila et al. | The relationship between MMPs and pH in whole saliva of radiated head and neck cancer patients | |
| RU2524629C2 (en) | Method of identifying compound, suitable for treating inflammatory condition of oral cavity | |
| EP2344149A1 (en) | Use of a compound capable of reducing the uric acid level for the prevention and/or the treatment of lung inflammation and fibrosis | |
| Pietruska et al. | Assessment of aprotinin influence on periodontal clinical status and matrix metalloproteinases 1, 2 and their tissue inhibitors saliva concentrations in patients with chronic periodontitis | |
| Lee et al. | MMP-13 expression in coronal and radicular dentin according to caries progression-a pilot study | |
| AU2010232593B2 (en) | Protein biomarkers for soft tissue disease diagnosis and as therapeutic targets for oral care intervention | |
| Meydhyono et al. | Evaluation of salivary matrix metallo proteinase-13 and tissue inhibitor of metalloproteinase-1 levels in patients with chronic periodontitis | |
| Ahmed et al. | Matrix Metalloproteinase Activity in Gingival Crevicular Fluid and Periodontal Health Status in Down Syndrome Patients: A Comparative Study | |
| Pratiwi et al. | RANKL and MMP8 levels in Gingival Crevicular Fluid (GCF) as oral biomarker for periodontal condition | |
| EP2795334B1 (en) | Diagnostic methods | |
| Raulo | Matrix Metalloproteinases as Markers of Inflammation in Equine Chronic Obstructive Pulmonary Disease (COPD): With Special Reference to Gelatinases and Collagenases |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20180402 |