RU2518297C2 - TEST-SYSTEM FOR DIFFERENTIATING SPECIES AND BIOTYPES OF BACTERIA OF GENUS Yersinia - Google Patents
TEST-SYSTEM FOR DIFFERENTIATING SPECIES AND BIOTYPES OF BACTERIA OF GENUS Yersinia Download PDFInfo
- Publication number
- RU2518297C2 RU2518297C2 RU2012110981/10A RU2012110981A RU2518297C2 RU 2518297 C2 RU2518297 C2 RU 2518297C2 RU 2012110981/10 A RU2012110981/10 A RU 2012110981/10A RU 2012110981 A RU2012110981 A RU 2012110981A RU 2518297 C2 RU2518297 C2 RU 2518297C2
- Authority
- RU
- Russia
- Prior art keywords
- fermentation
- determining
- culture medium
- species
- yersinia
- Prior art date
Links
Abstract
Description
Изобретение относится к области микробиологии и может быть использовано при бактериологических исследованиях для внутриродовой и внутривидовой дифференциации бактерий рода Yersinia, а также для определения биотипа некоторых видов иерсиний.The invention relates to the field of microbiology and can be used in bacteriological studies for intrageneric and intraspecific differentiation of bacteria of the genus Yersinia, as well as for determining the biotype of some species of Yersinia.
Род Yersinia включает обширную группу грамотрицательных факультативно анаэробных микроорганизмов, относящихся к семейству Enterobacteriaceae. Среди 17 видов, входящих в род Yersinia, только три отнесены к патогенным для человека и животных - возбудитель чумы Y.pestis, возбудитель псевдотуберкулеза Y.pseudotuberculosis и отдельные представители Y.enterocolitica, являющиеся возбудителями кишечного иерсиниоза. Заболеваемость кишечным иерсиниозом регистрируется в России практически повсеместно, но наблюдается неравномерное распространение инфекции по отдельным территориям.The genus Yersinia includes an extensive group of gram-negative facultatively anaerobic microorganisms belonging to the Enterobacteriaceae family. Among the 17 species belonging to the genus Yersinia, only three are classified as pathogenic for humans and animals - the plague pathogen Y. pestis, the causative agent of pseudotuberculosis Y. pseudotuberculosis and individual representatives of Y.enterocolitica, which are the causative agents of intestinal yersiniosis. The incidence of intestinal yersiniosis is registered almost everywhere in Russia, but there is an uneven spread of infection in certain territories.
Вид Y. enterocolitica широко распространен в природе. Представители вида встречаются в желудочно-кишечном тракте (ЖКТ) различных животных, в воде, почве, могут контаминировать сырые овощи, молоко и другие продукты, хранящиеся в условиях холодильника [Bottone E.J. Yersinia enterocolitica: overview and epidemiologic correlates / J.Microb. Infect. - 1999. - №1. - P.323-333]. В соответствии с результатами биохимических реакций известно шесть биотипов Y.enterocolitica: 1А, 1В, 2, 3, 4, 5. Представители биотипов 1В, 2-5 являются патогенными и содержат хромосомные и плазмидные гены, детерминирующие адгезивность, инвазивность, термостабильные токсины и другие вирулентные свойства микроба [Thoerner P., Bin Kingombe С.I., Bogli-Stuber К., et al. PCR detection of virulence genes in Yersinia enterocolitica and Yersinia pseudotuberculosis and investigation of virulence gene distribution / J. Appl. Env. Microb. - 2003. - Vol.69, №3. - P.1810-1816]. Представители биотипа 1А отнесены к непатогенным, как неимеющие хромосомных и плазмидных генов вирулентности [Grant Т., Bennet-Wood V., Robbins-Brown R.M. Identification of virulence-associated characteristics in clinical isolates of Yersinia enterocolitica lacking classical virulence markers / Infection and Immunity. - 1998. - Vol 66. - №3. - P.1113-1120]. Однако в последние годы появились данные о наличии внутри этого биотипа патогенных вариантов, способных вызывать заболевания ЖКТ, сопровождающиеся диареей [Tennant S.M., Grant Т.Н., Robins-Browne R.M. Pathogenicity of Yersinia enterocolitica biotype 1A / FEMS Immun. Med. Microb. - 2003. - №38. - P.127-137].The species Y. enterocolitica is widespread in nature. Representatives of the species are found in the gastrointestinal tract (GIT) of various animals, in water, soil, and can contaminate raw vegetables, milk, and other products stored in a refrigerator [Bottone E.J. Yersinia enterocolitica: overview and epidemiologic correlates / J. Microb. Infect. - 1999. - No. 1. - P.323-333]. In accordance with the results of biochemical reactions, six biotypes of Y.enterocolitica are known: 1A, 1B, 2, 3, 4, 5. Representatives of biotypes 1B, 2-5 are pathogenic and contain chromosomal and plasmid genes that determine adhesiveness, invasiveness, thermostable toxins and others virulent properties of the microbe [Thoerner P., Bin Kingombe C.I., Bogli-Stuber K., et al. PCR detection of virulence genes in Yersinia enterocolitica and Yersinia pseudotuberculosis and investigation of virulence gene distribution / J. Appl. Env. Microb. - 2003. - Vol.69, No. 3. - P.1810-1816]. Representatives of biotype 1A are classified as non-pathogenic, as having no chromosomal and plasmid virulence genes [Grant T., Bennet-Wood V., Robbins-Brown R.M. Identification of virulence-associated characteristics in clinical isolates of Yersinia enterocolitica lacking classical virulence markers / Infection and Immunity. - 1998. - Vol 66. - No. 3. - P.1113-1120]. However, in recent years, there has been evidence of the presence within this biotype of pathogenic variants that can cause gastrointestinal diseases, accompanied by diarrhea [Tennant S.M., Grant T.N., Robins-Browne R.M. Pathogenicity of Yersinia enterocolitica biotype 1A / FEMS Immun. Med. Microb. - 2003. - No. 38. - P.127-137].
Остальные представители рода отнесены к непатогенным, но могут быть возбудителями оппортунистических инфекций. До недавнего времени по биохимическим свойствам их подразделяли на восемь видов: Y.aldovae, Y.bercovieri, Y.frederiksenii, Y.intermedia, Y.kristensenii, Y.mollaretii, Y.rohdei, Y.ruckeri. Развитие молекулярно-генетических методов позволило в последние годы (2006-2011 гг.) дополнить род Yersinia еще шестью представителями - Y.aleksiciae [Spraguet L.D., Neubauer Н. Yersinia aleksiciae sp.nov. / Int. J. of Syst. and Evol. Microb., 2005. - Vol.55. - P.831-835], Y. similis [Spraguet L.D., Scholz H.C., Amman S., et al. Yersinia similis sp.nov. / Int. J. of Syst. and Evol. Microb., 2008. - Vol.58. - P.952-958], Y.massiliensis [Merhej V., Adekambi Т., Pargnier I., et al. Yersinia massiliensis sp.nov., isolated from fresh water / Int. J. Syst. Evol. Microbiol, 2008. - Vol.58. - P.779-784], Y. nurmii [Murros-Kontiainen A., Fredriksson-Ahomaa M., Korkeala H., et al. Yersinia nurmii sp.nov. / Int. J. Syst. Evol. Microbiol., 2011. - Vol.61. - 2368-2372], Y.pekkanenii [Murros-Kontiainen A., Johansson P., Niskanen Т., et al. Y.pekkanenii sp.nov. / Int. J. Syst. Evol. Microbiol., 2011. - Vol.61. - P.2363-2367], Y. entomophaga [Hurst M.R.H., Becher S.A., Young S.D., et al. Yersinia entomophaga sp.nov., isolated from the New Zealand grass grub Costelytra zealandica I Int. J. Syst. Evol. Microbiol, 2011 - Vol.61. - P.844-849], а вид Y. intermedia - двумя биотипами (на данный момент насчитывается 10 биотипов Y.intermedia) [Martin L., Leclercq A., Savin C, and Carniel E. Characterization of atypical isolates of Yersinia intermedia and definition of two new biotypes / J. Clin. Microbiol., 2009. - Vol.47, №8. - P.2376-2380]. Разнообразие представителей рода и гетерогенность отдельных видов осложняет идентификацию иерсиний. Существующие коммерческие тест-системы по составу биохимических тестов ориентированы на выявление более часто встречающихся патогенных представителей семейства Enterobacteriaceae таких родов, как Enterobacter, Escherichia, Klebsiella, Proteus, Salmonella, Shigella. У клинических микробиологов, использующих такие тест-системы, часто возникают проблемы при идентификации и дифференциации некоторых видов иерсиний, особенно Y.enterocolitica биотипа 1А, Y.intermedia, Y.frederiksenii, Y.bercovieri, Y.mollaretii, вследствие недостаточного количества необходимых тестов [Hallanvuo S., Peltola J., Heiskkanen Т., Siitonen A. Simlified phenotypic scheme evaluated by 16S rRNA sequencing for differentiation between Yersinia enterocolitica and Y.enterocolitica-like species / J.Clin. Microbiol., 2006. - Vol.44, №3. - P.1077-1080]. В целом отсутствует общедоступная система внутриродовой дифференциации бактерий рода Yersinia. Все это приводит к возникновению ошибок и получению некорректных результатов, особенно при исследовании материала из окружающей среды, смывов с овощей и других продуктов питания - основных источников выделения представителей Y.enterocolitica биотипа 1А и близкородственных видов.The remaining representatives of the genus are classified as non-pathogenic, but can be causative agents of opportunistic infections. Until recently, they were subdivided into eight species according to biochemical properties: Y.aldovae, Y.bercovieri, Y.frederiksenii, Y.intermedia, Y.kristensenii, Y.mollaretii, Y.rohdei, Y.ruckeri. The development of molecular genetic methods in recent years (2006-2011) has supplemented the Yersinia genus with six more representatives - Y.aleksiciae [Spraguet L.D., Neubauer N. Yersinia aleksiciae sp.nov. / Int. J. of Syst. and Evol. Microb., 2005 .-- Vol. 55. - P.831-835], Y. similis [Spraguet L.D., Scholz H.C., Amman S., et al. Yersinia similis sp.nov. / Int. J. of Syst. and Evol. Microb., 2008 .-- Vol. 58. - P.952-958], Y.massiliensis [Merhej V., Adekambi T., Pargnier I., et al. Yersinia massiliensis sp.nov., Isolated from fresh water / Int. J. Syst. Evol. Microbiol, 2008 .-- Vol. 58. - P.779-784], Y. nurmii [Murros-Kontiainen A., Fredriksson-Ahomaa M., Korkeala H., et al. Yersinia nurmii sp.nov. / Int. J. Syst. Evol. Microbiol., 2011 .-- Vol. 61. - 2368-2372], Y.pekkanenii [Murros-Kontiainen A., Johansson P., Niskanen T., et al. Y.pekkanenii sp.nov. / Int. J. Syst. Evol. Microbiol., 2011 .-- Vol. 61. - P.2363-2367], Y. entomophaga [Hurst M.R.H., Becher S.A., Young S.D., et al. Yersinia entomophaga sp.nov., Isolated from the New Zealand grass grub Costelytra zealandica I Int. J. Syst. Evol. Microbiol, 2011 - Vol. 61. - P.844-849], and the species Y. intermedia is two biotypes (currently there are 10 Y.intermedia biotypes) [Martin L., Leclercq A., Savin C, and Carniel E. Characterization of atypical isolates of Yersinia intermedia and definition of two new biotypes / J. Clin. Microbiol., 2009. - Vol. 47, No. 8. - P.2376-2380]. The diversity of the genus and the heterogeneity of individual species complicates the identification of Yersinia. Existing commercial test systems for the composition of biochemical tests are aimed at identifying more common pathogenic representatives of the Enterobacteriaceae family of such genera as Enterobacter, Escherichia, Klebsiella, Proteus, Salmonella, Shigella. Clinical microbiologists using such test systems often have problems identifying and differentiating certain types of Yersinia, especially Y.enterocolitica biotype 1A, Y.intermedia, Y.frederiksenii, Y.bercovieri, Y.mollaretii, due to the insufficient number of necessary tests [ Hallanvuo S., Peltola J., Heiskkanen T., Siitonen A. Simlified phenotypic scheme evaluated by 16S rRNA sequencing for differentiation between Yersinia enterocolitica and Y.enterocolitica-like species / J.Clin. Microbiol., 2006. - Vol. 44, No. 3. - P.1077-1080]. In general, there is no generally accessible system of intrageneric differentiation of bacteria of the genus Yersinia. All this leads to errors and incorrect results, especially when studying material from the environment, washes from vegetables and other food products - the main sources of isolation of representatives of Y.enterocolitica biotype 1A and closely related species.
Известны способы родовой и видовой фенотипической идентификации бактерий рода Yersinia и дифференциации представителей Y.enterocolitica на биотипы, в том числе по совокупности многих биохимических признаков - по ферментации некоторых углеводов, утилизации некоторых аминокислот, образованию метаболитов.Known methods of generic and species phenotypic identification of bacteria of the genus Yersinia and differentiation of representatives of Y.enterocolitica into biotypes, including the totality of many biochemical characters — fermentation of certain carbohydrates, utilization of certain amino acids, and the formation of metabolites.
В определителе бактерий Берджи [Определитель бактерий Берджи / Под ред. Дж. Хоут [и др.], 9-е издание, Т.1. - М.: Мир, 1997 г. - 432 с., ил.] фенотипическая идентификация иерсиний производится по 56 признакам (таблицы 5.2 стр.227-229; 5.40, 5.41, 5.42, 5.43 стр.254-258), в т.ч. 22 теста для дифференциации 11 видов (подвижность, продукция индола, продукция ацетоина в реакции Фогеса-Проскауэра; утилизация цитрата; наличие уреазы, лизиндекарбоксилазы, орнитиндекарбоксилазы, желатиназы, пиразинамидазы, β-ксилозидазы, τ-глутамилтрансферазы; образование кислоты из целлобиозы, мелибиозы, α-метил-D-глюкозида, раффинозы, L-рамнозы D-сорбитола, сахарозы, муцината, L-фукозы, L-сорбозы) и 7 тестов для определения биотипов Y.enterocolitica (продукция индола; наличие дезоксирибонуклеазы, наличие липазы, восстановление нитрата, образование кислоты из сахарозы, трегалозы, D-ксилозы). Недостатками видовой дифференциации по определителю бактерий Берджи является неточность дифференциации между видами Y.frederiksenii, Y.intermedia, Y.enterocolitica 1 биотипа, а также отсутствие дифференциации биотипа 1 Y.enterocolitica на биотип 1А, представители которого считаются непатогенными, и биотип 1В, представители которого являются патогенными. Межвидовая дифференциация Y.frederiksenii и Y.intermedia осложнена гетерогенностью представителей Y.intermedia, количество биотипов которых насчитывает 10.In the determinant of the bacteria Bergie [The determinant of bacteria Bergie / Ed. J. Howth [et al.], 9th edition, Vol. 1. - M .: Mir, 1997 - 432 p., Ill.] Phenotypic identification of Yersinia is made according to 56 characters (tables 5.2 p. 227-229; 5.40, 5.41, 5.42, 5.43 p. 254-258), in t. hours 22 tests for differentiation of 11 species (mobility, indole production, acetone production in the Voges-Proscauer reaction; citrate utilization; presence of urease, lysine decarboxylase, ornithine decarboxylase, gelatinase, pyrazinamidase, β-xylosidase, τ-glutamyl transferase; formation of acid from cellobiose, m, cellulose, m -methyl-D-glucoside, raffinose, L-rhamnose, D-sorbitol, sucrose, mucinate, L-fucose, L-sorbose) and 7 tests for determination of Y.enterocolitica biotypes (production of indole; presence of deoxyribonuclease, presence of lipase, reduction of nitrate, education acids from sucrose, trehalose, D-xylose). The disadvantages of species differentiation according to the determinant of Bergey bacteria are the inaccuracy of differentiation between the species Y.frederiksenii, Y.intermedia, Y.enterocolitica 1 biotype, as well as the lack of differentiation of biotype 1 Y.enterocolitica biotype 1A, representatives of which are considered non-pathogenic, and biotype 1B, representatives of which are pathogenic. The interspecific differentiation of Y.frederiksenii and Y.intermedia is complicated by the heterogeneity of representatives of Y.intermedia, the number of biotypes of which is 10.
В руководстве по клинической микробиологии [Wagner A. Yersinia. Manual of Clinical Microbiology, editor Patrick R. Murray, 9th edition, vol. 1. - Washington, D.C.: ASM Press, 2007. - P.688-697] предложена идентификация 11 видов иерсиний по 14 фенотипическим признакам (подвижность, наличие уреазы, продукция ацетоина в реакции Фогеса-Проскауэра, наличие орнитиндекарбоксилазы, утилизация цитрата, продукция индола, ферментация углеводов: рамнозы, сахарозы, целлобиозы, сорбозы, сорбитола, мелибиозы, раффинозы, фукозы) и дифференциация биотипов Y.enterocolitica по девяти биохимическим свойствам (наличие липазы, гидролиз эскулина, продукция индола, восстановление нитрата, тест на ДНКазу, наличие пиразинамидазы, ферментация салицина, ксилозы, трегалозы). Дифференциация по указанному набору фенотипических признаков имеет аналогичные с предыдущим способом недостатки вследствие отсутствия необходимых тестов и более полных данных биохимических свойств иерсиний.Clinical Microbiology Guide [Wagner A. Yersinia. Manual of Clinical Microbiology, editor Patrick R. Murray, 9 th edition, vol. 1. - Washington, DC: ASM Press, 2007. - P.688-697] proposed the identification of 11 species of yersinia according to 14 phenotypic characteristics (mobility, the presence of urease, production of acetoin in the Voges-Proskauer reaction, the presence of ornithine decarboxylase, utilization of citrate, production of indole carbohydrate fermentation: rhamnose, sucrose, cellobiose, sorbose, sorbitol, melibiosis, raffinose, fucose) and differentiation of Y.enterocolitica biotypes by nine biochemical properties (lipase, esculin hydrolysis, indole production, nitrate reduction, DNase test, pyrazinamidase test, fer entatsiya salicin, xylose, trehalose). Differentiation according to the indicated set of phenotypic characters has drawbacks similar to the previous method due to the lack of necessary tests and more complete data on the biochemical properties of Yersinia.
В МУ 3.1.1.2438-09 [Эпидемиологический надзор и профилактика псевдотуберкулеза и кишечного иерсиниоза. МУ 3.1.1.2438-09. М.: ФГОУ «ВУНМЦ Росздрава», 2009] представлены биохимические свойства 10 видов иерсиний (вид Y.pestis не включен в таблицу) согласно определителю Берджи. Соответственно, данная таблица, также как и дифференциация видов и биотипов иерсиний по определителю Берджи, имеет ряд недостатков и не позволяет полноценно дифференцировать некоторые виды бактерий рода Yersinia.In MU 3.1.1.2438-09 [Epidemiological surveillance and prevention of pseudotuberculosis and intestinal yersiniosis. MU 3.1.1.2438-09. M .: FSEI “VUNMC Roszdrava”, 2009] presents the biochemical properties of 10 species of Yersinia (the species Y. pestis is not included in the table) according to the Bergei determinant. Accordingly, this table, as well as the differentiation of species and biotypes of Yersinia according to Bergey's determinant, has several disadvantages and does not allow to fully differentiate some species of bacteria of the genus Yersinia.
В основе реализации существующих коммерческих тест-систем лежит определение совокупности фенотипических признаков бактерий, приведенных в определителе Берджи и других общепринятых руководствах.The implementation of existing commercial test systems is based on the determination of the totality of phenotypic traits of bacteria given in the Bergey determinant and other generally accepted guidelines.
Тест-система биохимическая для идентификации и дифференциации энтеробактерий «ДС-ДИФ-ЭНТЕРО-24» (НПО Диагностические Системы, Н. Новгород) предназначена для фенотипической идентификации микроорганизмов семейства Enterobacteriaceae в течение 24 часов по 24-м биохимическим признакам. В состав набора «ДС-ДИФ-ЭНТЕРО-24» входят: планшеты полистироловые 96-луночные разборные с нанесенными на дно лунок субстратно-индикаторные питательными средами, стабилизированными поливиниловым спиртом; раствор физиологический стерильный для приготовления суспензии культур микроорганизмов; масло вазелиновое стерильное для создания анаэробных условий протекания биохимической реакции; реактив для теста «индол» (3,5% раствор парадиметиламинобензальдегида); реактив для теста «фенилаланин» (10% раствор железа хлорида (III) гексагидрата); реактив 1 для теста «АМК» (12% раствор α-нафтола), реактив 2 для теста «АМК» (40% раствор калия гидроксида). Тест-система позволяет определить следующие биохимические свойства энтеробактерий: утилизацию цитрата натрия, малоната натрия, инозита, сорбита, маннита, адонита, дульцита, глюкозы, лактозы, сахарозы, арабинозы, мальтозы, рамнозы, трегалозы, гидролиз эскулина; образование индола, сероводорода, ацетилметилкарбинола (реакция Фогеса-Проскауэра); наличие уреазы, β-галактозидазы, декарбоксилаз орнитина и лизина, дезаминазы фенилаланина, дигидролазы аргинина. Тест-система идентифицирует такие виды иерсиний, как Y.enterocolitica, Y.frederiksenii, Y.intermedia, Y.kristensenii, Y.pseudotuberculosis, но не позволяет идентифицировать другие виды иерсиний, установить биотипы Y.enterocolitica и Y.intermedia и произвести дифференциацию между представителями вида Y.frederiksenii и некоторыми биотипами Y.intermedia.The biochemical test system for identification and differentiation of enterobacteria “DS-DIF-ENTERO-24” (NPO Diagnostic Systems, N. Novgorod) is intended for phenotypic identification of microorganisms of the Enterobacteriaceae family within 24 hours according to 24th biochemical characteristics. The DS-DIF-ENTERO-24 kit includes: 96-well collapsible polystyrene plates with substrate-indicator nutrient media stabilized with polyvinyl alcohol applied to the bottom of the wells; sterile physiological solution for the preparation of a suspension of microorganism cultures; sterile vaseline oil to create anaerobic conditions for a biochemical reaction; reagent for the test "indole" (3.5% solution of paradimethylaminobenzaldehyde); reagent for the test "phenylalanine" (10% solution of iron chloride (III) hexahydrate); reagent 1 for the test "AMK" (12% solution of α-naphthol), reagent 2 for the test "AMK" (40% solution of potassium hydroxide). The test system allows you to determine the following biochemical properties of enterobacteria: utilization of sodium citrate, sodium malonate, inositol, sorbitol, mannitol, adonite, dulcite, glucose, lactose, sucrose, arabinose, maltose, ramnose, trehalose, hydrolysis of esculin; formation of indole, hydrogen sulfide, acetylmethylcarbinol (Voges-Proskauer reaction); the presence of urease, β-galactosidase, decarboxylases of ornithine and lysine, phenylalanine deaminase, arginine dihydrolase. The test system identifies Yersinia species such as Y.enterocolitica, Y.frederiksenii, Y.intermedia, Y.kristensenii, Y.pseudotuberculosis, but does not identify other Yersinia species, establish the biotypes Y.enterocolitica and Y.intermedia and differentiate between representatives of the species Y.frederiksenii and some biotypes of Y.intermedia.
Тест-система «ЭНТЕРОтест24» (и ее модификация «Энтеротест24Н») (ЭрбаЛахема, Чехия). Набор «ЭНТЕРОтест24» содержит: микротитровальные пластинки (каждая для идентификации 4 штаммов); рамку пластинки с крышкой для инкубации; полиэтиленовые пакеты для инкубации; бланки для регистрации результатов. Также необходимы реактивы, поставляемые отдельно: реактив для теста ИНДОЛ, реактив для теста ФЕНИЛАЛАНИН, реактив для теста АЦЕТОИН, парафиновое масло стерильное. Тест-система применяется для идентификации энтеробактерий по 24 признакам и включает панель из 24 биохимических субстратов. Тест-система «ЭНТЕРОтест24» включает 24 теста для определения таких биохимических свойств, как образование индола, образование сероводорода, наличие лизиндекарбоксилазы, орнитиндекарбоксилазы, уреазы, аргинидигидролазы, утилизация цитрата, утилизация малоната, наличие фенилаланиндезаминазы, β-галактозидазы, гидролиз эскулина, образование ацетоина (реакция Фогеса-Проскауэра), ферментация инозитола, адонитола, целлобиозы, сахарозы, трегалозы, маннита, сорбитола, рамнозы, мелибиозы, раффинозы, дульцита, глюкозы. Тест система «ЭНТЕРОтест24 Н» состоит из 24 тестов, в том числе 5 тестов, отличающих ее от «ЭНТЕРОтест24»: вместо определения образования индола, наличия фенилаланиндезаминазы, образования ацетоина, ферментации рамнозы и глюкозы введены тесты для определения β-глюкуронидазы, β-ксилоксидазы, ферментации салицина, лактозы, артрата. Она может быть дополнена выпускаемыми отдельно тестами на образование индола и ацетоина, которые являются необходимыми для дифференциации иерсиний. С помощью тест-системы «ЭНТЕРОтест24» («Энтеротест24Н») возможно идентифицировать такие виды иерсиний, как Y.enterocolitica, Y.frederiksenii, Y.intermedia, Y.kristensenii, Y.pestis, Y.pseudotuberculosis, но она не позволяет идентифицировать иерсиний других видов, произвести дифференциацию между Y.frederiksenii, некоторыми биотипами Y.intermedia и Y.enterocolitica биотипа 1А, а также установить биотипы Y.enterocolitica и Y.intermedia.Test system "Enterotest24" (and its modification "Enterotest24N") (ErbaLahema, Czech Republic). The “Enterotest24” kit contains: microtiter plates (each for identification of 4 strains); plate frame with a cover for incubation; plastic bags for incubation; forms for recording results. Separate reagents are also required: an INDOL test reagent, a phenylalanine test reagent, an ACETOIN test reagent, and sterile paraffin oil. The test system is used to identify enterobacteria by 24 signs and includes a panel of 24 biochemical substrates. The test system “ENTEROtest24” includes 24 tests to determine biochemical properties such as indole formation, hydrogen sulfide formation, the presence of lysine decarboxylase, ornithine decarboxylase, urease, arginine dihydrolase, citrate utilization, malonate utilization, the presence of phenylalanine deaminase, β-galactosidinase, hydrol isosidinase, hydrol isosidinase, hydrol Foges-Proskauer reaction), fermentation of inositol, adonitol, cellobiose, sucrose, trehalose, mannitol, sorbitol, ramnose, melibiosis, raffinose, dulcite, glucose. The test system "Enterotest 24 N" consists of 24 tests, including 5 tests that distinguish it from "Enterotest 24": instead of determining the formation of indole, the presence of phenylalanine deaminase, the formation of acetoin, fermentation of rhamnose and glucose, tests were introduced to determine β-glucuronidase, β-xyloxidase fermentation of salicin, lactose, arthrate. It can be supplemented by separate tests for the formation of indole and acetoin, which are necessary for the differentiation of yersinia. Using the test system "Enterotest24" ("Enterotest24N") it is possible to identify such types of Yersinia as Y.enterocolitica, Y.frederiksenii, Y.intermedia, Y.kristensenii, Y.pestis, Y.pseudotuberculosis, but it does not allow to identify Yersinia other species, to differentiate between Y.frederiksenii, some biotypes Y.intermedia and Y.enterocolitica biotype 1A, as well as establish biotypes Y.enterocolitica and Y.intermedia.
Микротестсистема для биохимической идентификации энтеробактерий («МТС-М-12Е») производства НПО «Питательные среды» (г.Махачкала). Набор «МТС-М-12Е» представляет собой контейнер, изготовленный из нейтрального прозрачного полистирола, с ячейками, на дне которых находятся субстратно-индикаторные питательные среды, стабилизированные поливиниловым спиртом. Тест-система позволяет определить следующие биохимические свойства энтеробактерий: утилизацию цитрата натрия, малоната натрия, глюкозы, лактозы, маннита, мальтозы, образование индола, сероводорода, наличие уреазы (3-галактозидазы, декарбоксилазы лизина, дезаминазы фенилаланина. Данная тест-система позволяет идентифицировать род Yersinia, но предлагаемых 12 тестов недостаточно для определения видов иерсиний и тем более биотипов.Microtest system for biochemical identification of enterobacteria ("MTS-M-12E") manufactured by NPO "Nutrient media" (Makhachkala). The MTS-M-12E kit is a container made of neutral transparent polystyrene, with cells at the bottom of which are substrate-indicator nutrient media stabilized by polyvinyl alcohol. The test system allows you to determine the following biochemical properties of enterobacteria: utilization of sodium citrate, sodium malonate, glucose, lactose, mannitol, maltose, the formation of indole, hydrogen sulfide, the presence of urease (3-galactosidase, lysine decarboxylase, phenylalanine deaminase. This test system allows you to identify the genus Yersinia, but the proposed 12 tests are not enough to determine the species of Yersinia and, moreover, biotypes.
За прототип выбрана тест-система «АР1 20Е» (bioMerieux, Франция). Набор «АР1 20Е» предназначен для идентификации бактерий семейства Enterobacteriaceae и других нетребовательных к питательным веществам грамотрицательных палочек по 20 признакам. Состав набора «АР1 20Е»: стрипы API 20Е, контейнеры для инкубации, бланки для учета результатов, инструкция. Необходимы реактивы и материалы, не включенные в набор: минеральное масло; физиологический раствор API NaCl 0,85%; реактив к стрипу API 20Е TDA для определения триптофандезаминазы; реактив к стрипу API 20Е JAMES для определения индолообразования; реактив к стрипу API 20Е VP 1 и VP 2 для определения продукции ацетоина. Стрип API 20Е состоит из 20 микролунок, содержащих дегидрированные субстраты для определения β-галактозидазы, аргининдигидролазы, лизиндекарбоксилазы, орнитиндекарбоксилазы, утилизации цитратов, продукции сероводорода, уреазы, триптофандезаминазы, продукции индола, продукции ацетоина в реакции Фогеса-Проскауэра, желатиназы, ферментации D-глюкозы, D-маннита, инозита, D-сорбита, L-рамнозы, D-сахарозы, D-мелибиозы, амигдалина, L-арабинозы. С помощью тест-системы возможно идентифицировать такие виды иерсиний, как Y.enterocolitica, Y.frederiksenii, Y.intermedia, Y.kristensenii, Y.pestis, Y.pseudotuberculosis, но данная тест-система не позволяет выявить иерсиний других видов, а также произвести дифференциацию между видами Y.frederiksenii и Y.intermedia и установить биотипы Y.enterocolitica и Y.intermedia.For the prototype, the test system "AP1 20E" (bioMerieux, France) was selected. The “AP1 20E” kit is designed to identify bacteria of the Enterobacteriaceae family and other gram-negative sticks that are undemanding for nutrients by 20 signs. The composition of the set “AP1 20E”: API 20E strips, containers for incubation, forms for recording results, instructions. Reagents and materials not included in the kit are required: mineral oil; physiological saline API NaCl 0.85%; API 20E TDA strip reagent for determination of tryptophandesaminase; reagent to strip API API 20E JAMES for the determination of indole formation; reagent for strip API 20E VP 1 and VP 2 for determining the production of acetoin. The API 20E strip consists of 20 microwells containing dehydrogenated substrates for the determination of β-galactosidase, arginine dihydrolase, lysine decarboxylase, ornithine decarboxylase, citrate utilization, hydrogen sulfide, urease, tryptophandesaminase production, indole production, glucose-enzyme D production, Glugesate-Pro-Glucose D-Progesase D-Progesase , D-mannitol, inositol, D-sorbitol, L-ramnose, D-sucrose, D-melibiosis, amygdalin, L-arabinose. Using the test system it is possible to identify such species of Yersinia as Y.enterocolitica, Y.frederiksenii, Y.intermedia, Y.kristensenii, Y.pestis, Y.pseudotuberculosis, but this test system does not allow the identification of Yersinia of other species, as well as differentiate between species Y.frederiksenii and Y.intermedia and establish biotypes Y.enterocolitica and Y.intermedia.
Из уровня техники следует, что ни одна из существующих коммерческих тест-систем не позволяет произвести полноценное определение видов и биотипов бактерий рода Yersinia. Некоторые виды иерсиний часто не внесены в спектр определяемых тест-системами микроорганизмов. Такие виды, как Y.aldovae, Y.bercovieri, Y.mollaretii, Y.rohdei и Y.aleksiciae часто определяются как Y.enterocolitica из-за отсутствия у аналогов как некоторых тестов для их идентификации, так и данных по биохимическим свойствам этих видов. В свою очередь, представителей Y.frederiksenii, Y.intermedia дифференцируют неверно или не дифференцируют вообще. Нередко возникают ошибки определения вида, особенно при необходимости дифференцировать представителей биотипа 1А Y.enterocolitica, которые широко распространены в окружающей среде и часто выделяются из смывов с овощей и других продуктов питания.From the prior art it follows that none of the existing commercial test systems allows a complete determination of the species and biotypes of bacteria of the genus Yersinia. Some types of Yersinia are often not included in the spectrum of microorganisms determined by test systems. Species such as Y.aldovae, Y.bercovieri, Y.mollaretii, Y.rohdei, and Y.aleksiciae are often identified as Y.enterocolitica due to the lack of analogues of some tests to identify them and data on the biochemical properties of these species . In turn, representatives of Y.frederiksenii, Y.intermedia differentiate incorrectly or do not differentiate at all. Often there are errors in determining the species, especially if it is necessary to differentiate representatives of the biotype 1A of Y.enterocolitica, which are widespread in the environment and often stand out from washes from vegetables and other food products.
Внутриродовая дифференциация иерсиний осложнена не только большим числом видов бактерий этого рода, но и высокой внутривидовой гетерогенностью. Имеющиеся схемы и коммерческие тест-системы для идентификации бактерий семейства Enterobacteriaceae не способны корректно и полноценно осуществить внутриродовую и внутривидовую дифференциацию иерсиний.Intrageneric differentiation of Yersinia is complicated not only by a large number of bacterial species of this genus, but also by high intraspecific heterogeneity. Existing schemes and commercial test systems for the identification of bacteria of the Enterobacteriaceae family are not able to correctly and fully implement the intrageneral and intraspecific differentiation of Yersinia.
Изобретение направлено на создание комплекса биохимических тестов, позволяющего корректно и полноценно осуществить внутриродовую и внутривидовую дифференциацию бактерий рода Yersinia.The invention is directed to the creation of a complex of biochemical tests, which allows to correctly and fully implement the intrageneral and intraspecific differentiation of bacteria of the genus Yersinia.
Технический результат от использования изобретения - повышение специфической активности при дифференциации бактерий рода Yersinia за счет расширения диапазона определяемых видов и биотипов иерсиний.The technical result from the use of the invention is to increase the specific activity in the differentiation of bacteria of the genus Yersinia by expanding the range of defined species and biotypes of Yersinia.
В результате решения поставленной задачи авторы получили комплекс необходимых тестов для внутриродовой и внутривидовой дифференциации бактерий рода Yersinia.As a result of solving this problem, the authors obtained a set of necessary tests for intrageneral and intraspecific differentiation of bacteria of the genus Yersinia.
Предложенная авторами тест-система состоит из набора питательных сред, содержащих субстраты, и реактивы для определения лизиндекарбоксилазы, орнитиндекарбоксилазы, триптофандезаминазы, уреазы, продукции ацетоина, продукции индола, ферментации мелибиозы, ферментации рамнозы, ферментации сахарозы, ферментации сорбита. Дополнительно в состав введены среды с субстратами для определения липазы, ферментации ксилозы, ферментации мальтозы, ферментации α-метил-D-глюкопиранозида, ферментации салицина, ферментации сорбозы, ферментации раффинозы при следующем количественном содержании компонентов тест-системы для одного определения, мл:The test system proposed by the authors consists of a set of nutrient media containing substrates and reagents for determining lysine decarboxylase, ornithine decarboxylase, tryptophandesaminase, urease, acetoin production, indole production, melibiosis fermentation, ramnose fermentation, sucrose fermentation, sorbitol fermentation. Additionally, media with substrates were introduced into the composition for determining lipase, xylose fermentation, maltose fermentation, α-methyl-D-glucopyranoside fermentation, salicin fermentation, sorbose fermentation, raffinose fermentation with the following quantitative content of test system components for one determination, ml:
питательная среда для определения лизиндекарбоксилазы - 0,15culture medium for the determination of lysine decarboxylase - 0.15
питательная среда для определения орнитиндекарбоксилазы - 0,15culture medium for the determination of ornithine decarboxylase - 0.15
питательная среда для определения триптофандезаминазы - 0,15culture medium for the determination of tryptophandesaminase - 0.15
реактив для определения триптофандезаминазы - 0,025…0,050reagent for the determination of tryptophandesaminase - 0,025 ... 0,050
питательная среда для определения уреазы - 0,15culture medium for the determination of urease - 0.15
питательная среда для определения продукции ацетоина - 0,15culture medium for determining the production of acetoin - 0.15
реактив для определения продукции ацетоина - 0,025…0,050reagent for determining the production of acetoin - 0,025 ... 0,050
питательная среда для определения продукции индола - 0,15nutrient medium for determining indole production - 0.15
реактив для определения продукции индола - 0,025…0,050reagent for determining indole production - 0.025 ... 0.050
питательная среда для определения ферментации мелибиозы - 0,15culture medium for determining the fermentation of melibiosis - 0.15
питательная среда для определения ферментации рамнозы - 0,15culture medium for determination of rhamnose fermentation - 0.15
питательная среда для определения ферментации сахарозы - 0,15culture medium for the determination of sucrose fermentation - 0.15
питательная среда для определения ферментации сорбита - 0,15culture medium for determining sorbitol fermentation - 0.15
питательная среда для определения - 5,00culture medium for determination - 5.00
питательная среда для определения ферментации ксилозы - 0,15culture medium for determining xylose fermentation - 0.15
питательная среда для определения ферментации мальтозы - 0,15nutrient medium for determining the fermentation of maltose - 0.15
питательная среда для определения ферментацииfermentation culture medium
α-метил-D-глюкопиранозида - 0,15α-methyl-D-glucopyranoside - 0.15
питательная среда для определения ферментации салицина - 0,15culture medium for determining salicin fermentation - 0.15
питательная среда для определения ферментации сорбозы - 0,15culture medium for determining sorbose fermentation - 0.15
питательная среда для определения ферментации раффинозы - 0,15.culture medium for determining the fermentation of raffinose - 0.15.
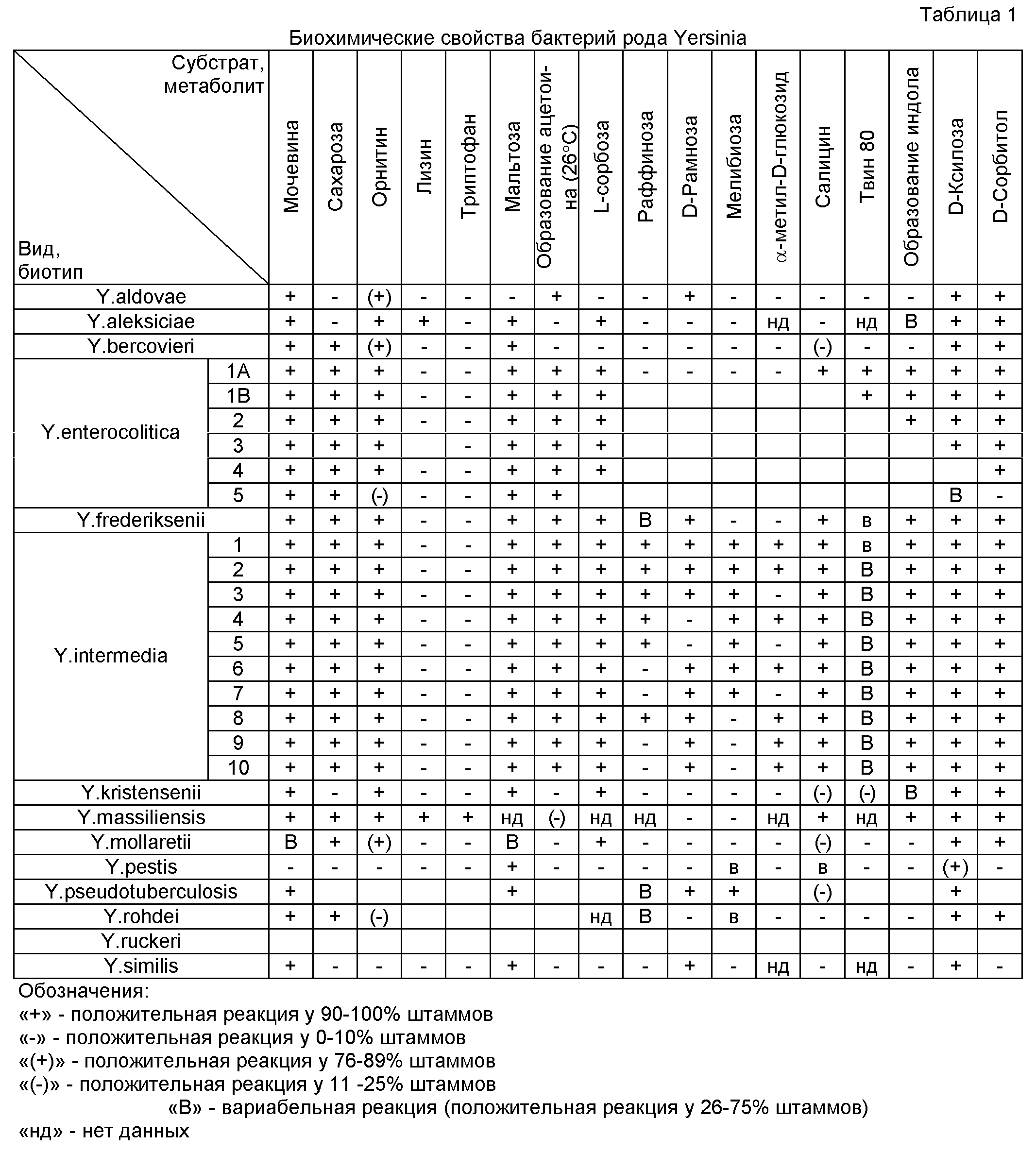
Биохимические свойства бактерий рода Yersinia в отношении субстратов, используемых для определения перечисленных признаков, представлены в таблице 1.The biochemical properties of bacteria of the genus Yersinia in relation to the substrates used to determine the listed characteristics are presented in table 1.
Выделение и изучение чистой культуры возбудителя чумы Y.pestis могут проводиться только в специализированных лабораториях противочумных учреждений Роспотребнадзора при строгом соблюдении режима работы с микроорганизмами I-II групп патогенности. Поэтому приведем биохимические свойства Y.pestis только для сравнения с остальными представителями рода Yersinia.Isolation and study of the pure culture of the plague pathogen Y. pestis can be carried out only in specialized laboratories of the anti-plague institutions of Rospotrebnadzor with strict adherence to the regime of work with microorganisms of pathogenicity I-II. Therefore, we present the biochemical properties of Y. pestis only for comparison with other representatives of the genus Yersinia.
Определение наличия фермента уреазы, осуществляющего гидролиз мочевины. Данный признак является основополагающим почти для всего рода Yersinia. Уреазой обладают такие виды, как Y.aldovae, Y.aleksiciae, Y.bercovieri, Y.enterocolitica, Y.frederiksenii, Y.intermedia, Y.kristensenii, Y.massiliensis, Y.mollaretii, Y.pseudotuberculosis, Y.rohdei и Y.similis. He обладают способностью гидролизовать мочевину Y.pestis и Y.ruckeri. Некоторые представители Y.mollaretii могут быть уреазонегативными, в этом случае их можно дифференцировать от Y.ruckeri (и Y.pestis) по результатам ферментации сахарозы.Determination of the presence of the urease enzyme carrying out hydrolysis of urea. This trait is fundamental to almost the entire genus Yersinia. Urease is possessed by species such as Y. aldovae, Y.aleksiciae, Y.bercovieri, Y.enterocolitica, Y.frederiksenii, Y.intermedia, Y.kristensenii, Y.massiliensis, Y.mollaretii, Y.pseudotuberculosis, Y.rohdei and Y.similis. He has the ability to hydrolyze urea Y. pestis and Y.ruckeri. Some representatives of Y.mollaretii may be ureazonegative, in which case they can be differentiated from Y.ruckeri (and Y. pestis) according to the results of sucrose fermentation.
Сахарозу ферментируют с образованием кислоты представители Y.bercovieri, Y.enterocolitica, Y.frederiksenii, Y.intermedia, Y.massiliensis, Y.mollaretii, Y.rohdei, не ферментируют представители Y.aldovae, Y.aleksiciae, Y.kristensenii, Y.pseudotuberculosis, Y.ruckeri, Y.similis, Y.pestis.Sucrose is fermented with acid formation by representatives of Y.bercovieri, Y.enterocolitica, Y.frederiksenii, Y.intermedia, Y.massiliensis, Y.mollaretii, Y.rohdei, and representatives of Y.aldovae, Y.aleksiciae, Y.kristensenii, Y. .pseudotuberculosis, Y.ruckeri, Y.similis, Y. pestis.
Определение наличия фермента орнитиндекарбоксилазы. Тест позволяет провести дифференциацию между видами Y.kristensenii и Y.pseudotuberculosis.Determination of the presence of the enzyme ornithine decarboxylase. The test allows differentiation between the species Y.kristensenii and Y.pseudotuberculosis.
Определение наличия фермента лизиндекарбоксилазы. Обычно не используется для дифференциации видов иерсиний. Однако только этот тест позволяет дифференцировать Y.kristensenii от Y.aleksiciae. Лизиндекарбоксилаза также определяется у Y.massiliensis и у некоторых представителей Y.ruckeri.Determination of the presence of the enzyme lysine decarboxylase. Usually not used to differentiate yersinia species. However, only this test allows us to differentiate Y.kristensenii from Y.aleksiciae. Lysine decarboxylase is also detected in Y.massiliensis and in some representatives of Y.ruckeri.
Определение наличия фермента триптофандезаминазы. У всех иерсиний, за исключением представителей Y.massiliensis, данный фермент отсутствует.Determination of the presence of the enzyme tryptophandesaminase. In all Yersinia, with the exception of representatives of Y.massiliensis, this enzyme is absent.
Ферментация мальтозы с образованием кислоты наблюдается у всех иерсиний, кроме представителей Y.aldovae и Y.rohdei, дифференциацию между которыми, в свою очередь, можно провести по ферментации сахарозы (приведено выше).Maltose fermentation with the formation of acid is observed in all Yersinia, except for representatives of Y.aldovae and Y.rohdei, the differentiation between which, in turn, can be carried out by sucrose fermentation (given above).
Важную роль при видовой дифференциации иерсиний внутри рода играет такое биохимическое свойство бактерий, как способность образования ацетилметилкарбинола (ацетоина) в реакции Фогеса-Проскауэра. При (37±1)°С у всех иерсиний ацетоин не образуется. Однако при (26±2)°С наблюдаются результаты, отличающиеся для разных видов. Так, способностью образовывать ацетоин обладают представители видов Y.aldovae, Y.enterocolitica, Y.frederiksenii, Y.intermedia; не образуют ацетоин Y.bercovieri, Y.kristensenii, Y.mollaretii, Y.pestis, Y.pseudotuberculosis, Y.rohdei. Этот тест важен для дифференциации Y.mollaretii и Y.bercovieri от Y.enterocolitica. Между собой Y.mollaretii и Y.bercovieri могут быть разделены при определении ферментации L-сорбозы.An important role in the species differentiation of yersinia within the genus is played by such a biochemical property of bacteria as the ability to form acetylmethylcarbinol (acetoin) in the Voges-Proskauer reaction. At (37 ± 1) ° С, all yersinia do not produce acetoin. However, at (26 ± 2) ° C, results are observed that differ for different species. So, representatives of the species Y.aldovae, Y.enterocolitica, Y.frederiksenii, Y.intermedia possess the ability to form acetoin; do not form acetoin Y.bercovieri, Y.kristensenii, Y.mollaretii, Y. pestis, Y. pseudotuberculosis, Y.rohdei. This test is important for differentiating Y.mollaretii and Y.bercovieri from Y.enterocolitica. Between themselves, Y.mollaretii and Y.bercovieri can be separated when determining the fermentation of L-sorbose.
Способность разложения рамнозы с образованием кислоты используется для дифференциации Y.frederiksenii от Y.enterocolitica, неспособных ферментировать рамнозу. Рамнозу также утилизируют представители отдельных биотипов Y.intermedia, а также Y.aldovae, Y.pseudotuberculosis и Y.similis.The decomposition ability of rhamnose to form acid is used to differentiate Y.frederiksenii from Y.enterocolitica, unable to ferment rhamnose. Ramnose is also utilized by representatives of individual biotypes Y. intermedia, as well as Y. aldovae, Y. pseudotuberculosis and Y.similis.
По отсутствию у представителей всех биотипов Y.enterocolitica способности ферментировать с образованием кислоты рамнозу, раффинозу и мелибиозу, их дифференцируют от Y.intermedia. Вид Y.intermedia биохимически гетерогенный и включает, по данным референс-центра Парижского института Пастера [Martin L., Leclercq A., Savin С, and Carniel Е. Characterization of atypical isolates of Yersinia intermedia and definition of two new biotypes / J.Clin. Microbiol., 2009. - Vol.47, №8. - P.2376-2380], 10 биотипов. Несмотря на то что в отличие от биотипов Y.enterocolitica биотипы Y.intermedia не имеют важного клинического значения, высокая гетерогенность биохимических свойств этого вида требует внутривидовой дифференциации для корректного определения других видов иерсиний в ходе исследования. Деление на биотипы производят по способности ферментировать мелибиозу, рамнозу, α-метил-D-глюкопиранозид (α-метилглюкозид), раффинозу и способности утилизировать цитрат натрия. Распределение по биотипам отражено в таблице 1. Видно, что представители биотипов 1-7 Y.intermedia ферментируют мелибиозу в отличие от Y.frederiksenii. Определение способности ферментировать α-метил-D-глюкопиранозид является необходимым для дифференциации «рамнозоположительных» штаммов Y.frederiksenii от представителей Y.intermedia 8-10 биотипов.Due to the absence of the ability of all the Y.enterocolitica biotypes to ferment with the formation of acid ramnose, raffinose and melibiosis, they are differentiated from Y.intermedia. The Y.intermedia species is biochemically heterogeneous and includes, according to the Pasteur Institute Paris reference center [Martin L., Leclercq A., Savin C, and Carniel E. Characterization of atypical isolates of Yersinia intermedia and definition of two new biotypes / J. Clin . Microbiol., 2009. - Vol. 47, No. 8. - P.2376-2380], 10 biotypes. Despite the fact that, unlike Y.enterocolitica biotypes, Y.intermedia biotypes do not have important clinical significance, the high heterogeneity of the biochemical properties of this species requires intraspecific differentiation for the correct determination of other Yersinia species during the study. The division into biotypes is performed by the ability to ferment melibiosis, rhamnose, α-methyl-D-glucopyranoside (α-methyl glucoside), raffinose and the ability to utilize sodium citrate. The distribution of biotypes is shown in table 1. It can be seen that representatives of biotypes 1-7 Y.intermedia ferment melibiosis in contrast to Y.frederiksenii. Determination of the ability to ferment α-methyl-D-glucopyranoside is necessary for the differentiation of "Ramopositive" Y.frederiksenii strains from representatives of Y.intermedia 8-10 biotypes.
Вид Y.enterocolitica по биохимическим свойствам разделен на шесть биотипов [Bottone E.J. Yersinia enterocolitica: overview and epidemiologic correlates / J.Microb. Infect, 1999. - №1. - P.323-333]. Установление биотипа имеет важное эпидемиологическое значение. Так, представители биотипа 1А считаются непатогенными, тогда как Y.enterocolitica биотипов 1В и 2-5 обладают набором генов вирулентности и способны вызывать заболевания человека и животных. Распределение по биотипам отражено в таблице 1. Внутривидовую дифференциацию следует проводить с использованием следующих тестов. Определение способности ферментации салицина, которая есть у представителей биотипа 1А. Определение наличия фермента липазы, который есть у представителей биотипа 1А и 1В, но отсутствует у биотипов 2-5. Этот тест позволяет дифференцировать патогенных представителей «американского» биотипа 1В от остальных патогенных Y.enterocolitica. Определение способности индолообразования позволяет дифференцировать между собой 2-й и 3-й биотипы Y.enterocolitica, индол способны образовывать представители биотипов 1А, 1В и 2, тогда как остальные индол не образуют. Дифференцировать между собой 3-й и 4-й биотипы Y.enterocolitica позволяет определение ферментации ксилозы. Представители 3-го биотипа в отличие от 4-го способны ферментировать ксилозу с образованием кислоты. По способности к ферментации сорбитола можно дифференцировать 4-й биотип от 5-го. Сорбитол ферментируют представители 4-го биотипа, тогда как штаммы Y.enterocolitica 5-го биотипа этой способностью не обладают, редкие представители этого биотипа могут не обладать орнитиндекарбоксилазой и не ферментировать сахарозу.Species Y.enterocolitica on biochemical properties is divided into six biotypes [Bottone E.J. Yersinia enterocolitica: overview and epidemiologic correlates / J. Microb. Infect, 1999. - No. 1. - P.323-333]. Establishing a biotype is of great epidemiological importance. So, representatives of biotype 1A are considered non-pathogenic, while Y.enterocolitica of biotypes 1B and 2-5 have a set of virulence genes and can cause diseases in humans and animals. The distribution of biotypes is shown in table 1. Intraspecific differentiation should be carried out using the following tests. Determination of the salicin fermentation ability that is present in representatives of biotype 1A. Determination of the presence of lipase enzyme, which is present in representatives of biotype 1A and 1B, but is absent in biotypes 2-5. This test allows us to differentiate pathogenic representatives of the "American" biotype 1B from the rest of the pathogenic Y.enterocolitica. Determination of the ability of indole formation allows us to differentiate between ourselves the 2nd and 3rd biotypes of Y.enterocolitica, indole can form representatives of biotypes 1A, 1B and 2, while the rest do not form indole. Differentiation of the 3rd and 4th biotypes of Y.enterocolitica among themselves allows the determination of xylose fermentation. Representatives of the 3rd biotype, unlike the 4th, are able to ferment xylose with the formation of acid. The ability to ferment sorbitol can differentiate the 4th biotype from the 5th. Representatives of the 4th biotype ferment sorbitol, while strains of Y.enterocolitica of the 5th biotype do not have this ability, rare representatives of this biotype may not have ornithine decarboxylase and not ferment sucrose.
Изобретение реализуется следующим образом.The invention is implemented as follows.
Все биохимические реакции проводят по общепринятым методикам. Исследуемые суточные агаровые культуры иерсиний засевают по одной петле (диаметр 2 мм) в среды, содержащие различные субстраты.All biochemical reactions are carried out according to generally accepted methods. The studied diurnal agar cultures of Yersinia are inoculated one loop (2 mm in diameter) into media containing various substrates.
Углеводные субстраты. Тест основан на способности исследуемого микроорганизма утилизировать углевод, введенный в количественном соотношении 1% в жидкую питательную среду, содержащую пептон (1%), натрия хлорид (0,5%), бромтимоловый синий или феноловый красный (0,002%), с образованием кислоты, определяемым по изменению цвета индикатора среды [Руководство по медицинской микробиологии. Общая и санитарная микробиология. Книга I /Колл. Авторов // Под ред. Лабинской А.С., Волиной Е.Г. - М.: Издательство БИНОМ, 2008. - 1080 с.: ил.]. Ферментация углеводов сопровождается изменением синего (индикатор бромтимоловый синий) или красного (индикатор феноловый красный) цвета среды на желтый.Carbohydrate substrates. The test is based on the ability of the studied microorganism to utilize carbohydrate introduced in a quantitative ratio of 1% in a liquid nutrient medium containing peptone (1%), sodium chloride (0.5%), bromothymol blue or phenol red (0.002%), with the formation of acid, determined by the color change of the environment indicator [Guide to medical microbiology. General and sanitary microbiology. Book I / Coll. Authors // Ed. Labinskaya A.S., Volina E.G. - M.: Publishing house BINOM, 2008. - 1080 p .: ill.]. Fermentation of carbohydrates is accompanied by a change in blue (indicator bromothymol blue) or red (indicator phenol red) to yellow.
Мочевина. Микроорганизмы, обладающие ферментом уреаза, способны гидролизовать мочевину, образуя в виде конечных продуктов аммиак и диоксид углерода, тем самым изменяя рН среды в щелочную сторону. Изменение визуализируется с помощью индикатора. Среда для определения уреазы содержит 100 мл 0,067 М фосфатного буфе, рН 7,0 (40 мл калия дигидрофосфата в концентрации 9,078 г/л, 60 мл двуводного натрия гидрофосфата в концентрации 11,876 г/л); 2,5 г натрия хлорида; 2,5 мл 0,4% водно-щелочного раствора фенолового красного; 10 мл 50% мочевины; конечный объем доводят до 500 мл дистиллированной водой [Методические рекомендации по микробиологической диагностике раневых инфекций в лечебно-диагностических учреждениях армии и флота / Добрынин В.М. [и др.] // утв. Нач. Главного военно-медицинского управления министерства обороны Российской Федерации. - СПб.: Савож, 1999. - 75 с]. Реакцию учитывают через один, два и 24 ч инкубации исследуемой культуры при (26±2)°С.Urea. Microorganisms with a urease enzyme are able to hydrolyze urea, forming ammonia and carbon dioxide in the form of final products, thereby changing the pH of the medium to the alkaline side. The change is visualized using an indicator. The urease determination medium contains 100 ml of 0.067 M phosphate buffer, pH 7.0 (40 ml of potassium dihydrogen phosphate at a concentration of 9.078 g / l, 60 ml of sodium hydrogen phosphate at a concentration of 11.876 g / l); 2.5 g of sodium chloride; 2.5 ml of a 0.4% aqueous alkaline solution of phenol red; 10 ml of 50% urea; the final volume is adjusted to 500 ml with distilled water [Guidelines for microbiological diagnosis of wound infections in medical and diagnostic institutions of the army and navy / Dobrynin V.M. [et al.] // approved. The beginning The main military medical department of the Ministry of Defense of the Russian Federation. - St. Petersburg: Savozh, 1999. - 75 s]. The reaction is taken into account after one, two and 24 hours of incubation of the test culture at (26 ± 2) ° С.
Аминокислоты лизин и орнитин. Тесты направлены на выявление ферментов, способных катализировать декарбоксилирование аминокислот с образованием щелочных продуктов, которое выявляется по изменению индикатора среды. Состав среды: пептон (0,5%), глюкоза (0,1%), бромтимоловый синий (0,003%), L-аминокислота (лизин, орнитин) (1%), вода дистиллированная; рН среды (6,5±5) [Руководство по медицинской микробиологии. Частная медицинская микробиология и этиологическая диагностика инфекций. Книга II /Колл. Авторов // Под ред. Лабинской А.С., Костюковой Н.Н., Ивановой С.М. - М.: Издательство БИНОМ, 2010. - 1152 с.: ил.]. При разложении субстрата желтовато-зеленый цвет среды изменяется на синий.Amino acids lysine and ornithine. Tests are aimed at identifying enzymes that can catalyze the decarboxylation of amino acids with the formation of alkaline products, which is detected by a change in the indicator of the environment. The composition of the medium: peptone (0.5%), glucose (0.1%), bromothymol blue (0.003%), L-amino acid (lysine, ornithine) (1%), distilled water; pH of the medium (6.5 ± 5) [Guide to medical microbiology. Private medical microbiology and etiological diagnosis of infections. Book II / Coll. Authors // Ed. Labinskaya A.S., Kostyukova N.N., Ivanova S.M. - M .: Publishing house BINOM, 2010. - 1152 p.: Ill.]. Upon decomposition of the substrate, the yellowish-green color of the medium changes to blue.
Триптофан. Тест основан на способности микроорганизмов при росте на питательных средах, содержащих L-триптофан (α-амино-3-индолилпропионовая кислота), вырабатывать специфические дезаминазы в отношении L-триптофана, которые подвергают его окислительному дезаминированию с образованием индол-3-пировиноградной кислоты, что может быть выявлено качественной реакцией при добавлении хлорида железа (III). Жидкая среда для определения дезаминазы содержит пептон сухой ферментативный (1%), натрия хлорид (0,5%), L-триптофан (0,5%), воду дистиллированную. Для определения в среде индол-3-пирувата используют реактив, содержащий 50 мл 10% водный раствор хлорида железа (III) (FeCl3) и 50 мл 10% раствора соляной кислоты [Методические рекомендации по микробиологической диагностике раневых инфекций в лечебно-диагностических учреждениях армии и флота / Добрынин В.М. [и др.] // утв. Нач. Главного военно-медицинского управления министерства обороны Российской Федерации. - СПб.: Савож, 1999. - 75 с]. Наличие триптофандезаминазы выявляется по появлению темно-коричневого или красно-бурого окрашивания среды через 1-2 мин после внесения 1-2 капель реактива с хлорным железом.Tryptophan. The test is based on the ability of microorganisms to grow on nutrient media containing L-tryptophan (α-amino-3-indolylpropionic acid) to produce specific deaminases with respect to L-tryptophan, which undergo oxidative deamination with the formation of indole-3-pyruvic acid, which can be detected by a qualitative reaction with the addition of iron (III) chloride. The liquid medium for the determination of deaminase contains dry enzymatic peptone (1%), sodium chloride (0.5%), L-tryptophan (0.5%), and distilled water. To determine indole-3-pyruvate in the medium, a reagent containing 50 ml of a 10% aqueous solution of iron (III) chloride (FeCl 3 ) and 50 ml of a 10% solution of hydrochloric acid is used [Methodical recommendations for the microbiological diagnosis of wound infections in medical diagnostic institutions of the army and fleet / Dobrynin V.M. [et al.] // approved. The beginning The main military medical department of the Ministry of Defense of the Russian Federation. - St. Petersburg: Savozh, 1999. - 75 s]. The presence of tryptophandesaminase is detected by the appearance of a dark brown or reddish-brown staining of the medium 1-2 minutes after making 1-2 drops of the reagent with ferric chloride.
Образование индола. Тест основан на том, что в процессе размножения в среде, содержащей триптофан, микроорганизмы образуют фермент триптофаназу, который расщепляет гетероциклическую аминокислоту L-триптофан с образованием индола и других веществ. Среда для индолообразования безуглеводная, содержит L-триптофан (0,25%) (или его источник), натрия хлорид (0,5%), калия дигидрофосфат (0,25%), воду дистиллированную; рН среды (7,3±1) [Руководство по медицинской микробиологии. Общая и санитарная микробиология. Книга I /Колл. Авторов // Под ред. Лабинской А.С., Волиной Е.Г. - М.: Издательство БИНОМ, 2008. - 1080 с.: ил.]. Содержание индола определяют добавлением бензойного альдегида (реактив Ковача или Эрлиха), реакция с которым ведет к образованию соединений розового или красного цвета. Для приготовления реактива Ковача 5 г параметиламинобензальдегида растворяют в 75 мл амилового спирта, затем добавляют 25 мл концентрированной соляной кислоты [Методические рекомендации по микробиологической диагностике раневых инфекций в лечебно-диагностических учреждениях армии и флота / Добрынин В.М. [и др.] // утв. Нач. Главного военно-медицинского управления министерства обороны Российской Федерации. - СПб.: Савож, 1999. - 75 с]. Наличие индола в среде после инкубации оценивают по появлению красного кольца на поверхности среды через 1-2 мин после внесения 1-2 капель реактива Ковача.Indole formation. The test is based on the fact that in the process of propagation in a medium containing tryptophan, microorganisms form the enzyme tryptophanase, which breaks down the heterocyclic amino acid L-tryptophan to form indole and other substances. The carbohydrate-free indole formation medium contains L-tryptophan (0.25%) (or its source), sodium chloride (0.5%), potassium dihydrogen phosphate (0.25%), distilled water; pH of the medium (7.3 ± 1) [Guide to medical microbiology. General and sanitary microbiology. Book I / Coll. Authors // Ed. Labinskaya A.S., Volina E.G. - M.: Publishing house BINOM, 2008. - 1080 p .: ill.]. Indole content is determined by the addition of benzoic aldehyde (Kovacs or Erlich reagent), the reaction with which leads to the formation of pink or red compounds. To prepare the Kovac reagent, 5 g of parametaminaminobenzaldehyde is dissolved in 75 ml of amyl alcohol, then 25 ml of concentrated hydrochloric acid is added [Methodical recommendations for the microbiological diagnosis of wound infections in medical and diagnostic institutions of the army and navy / Dobrynin V.M. [et al.] // approved. The beginning The main military medical department of the Ministry of Defense of the Russian Federation. - St. Petersburg: Savozh, 1999. - 75 s]. The presence of indole in the medium after incubation is evaluated by the appearance of a red ring on the surface of the medium 1-2 minutes after making 1-2 drops of Kovac's reagent.
Образование ацетоина. Анаэробное сбраживание глюкозы идет с преобразованием метаболита пировиноградной кислоты в ацетоин (ацетилметилкарбинол). Среда для реакции Фогеса-Проскауэра содержит пептон (0,5%), калия гидрофосфат (0,5%), глюкозу (0,5%), воду дистиллированную; рН среды (6,9±1). После инкубации при (26±2)°С образование ацетоина выявляют по окрашиванию среды за счет окисления ацетоина в присутствии α-нафтола (добавляют 1-3 капли 6% спиртового раствора α-нафтола) в щелочной среде (добавляют 1-3 капли 40%-го водного раствора калия гидроксида) до диацетила, который образует комплексы вишнево-красного цвета, вступая в реакцию с азотистыми основаниями пептона [Руководство по медицинской микробиологии. Общая и санитарная микробиология. Книга I /Колл. Авторов // Под ред. Лабинской А.С., Волиной Е.Г. - М.: Издательство БИНОМ, 2008. - 1080 с.: ил.].The formation of acetoin. Anaerobic fermentation of glucose goes with the conversion of the metabolite of pyruvic acid to acetoin (acetylmethylcarbinol). The Voges-Proskauer reaction medium contains peptone (0.5%), potassium hydrogen phosphate (0.5%), glucose (0.5%), distilled water; pH of the medium (6.9 ± 1). After incubation at (26 ± 2) ° C, the formation of acetoin is detected by staining the medium due to the oxidation of acetoin in the presence of α-naphthol (add 1-3 drops of a 6% alcohol solution of α-naphthol) in an alkaline medium (add 1-3 drops of 40% th aqueous solution of potassium hydroxide) to diacetyl, which forms complexes of a cherry-red color, reacting with nitrogenous peptone bases [Guide to medical microbiology. General and sanitary microbiology. Book I / Coll. Authors // Ed. Labinskaya A.S., Volina E.G. - M.: Publishing house BINOM, 2008. - 1080 p .: ill.].
Среды с соответствующими субстратами могут помещаться как в стандартные бактериологические пробирки с пробками в объеме 0,5-1,0 мл, так и в лунки стерильного 96-луночного полимерного планшета в объеме 100-200 мкл (микрообъемная технология исследования). Микрообъемная технология исследования биохимических свойств бактерий наиболее экономична, проста, пригодна для автоматизации и стандартизации исследований. Могут быть использованы как круглодонные, так и плоскодонные полистироловые планшеты. Первые удобны при засеве исследуемого микроорганизма в среду. В свою очередь, плоскодонные планшеты выпускаются в виде разборных на отдельные стрипы. Стриппированные планшеты позволяют проводить исследования от одной культуры. Для создания анаэробных условий и для предотвращения выхода летучих метаболитов, например, аммиака, способных изменять рН среды в соседних лунках, после инокуляции культуры на среду в лунке наносят 2-3 капли стерильного минерального масла. Перед инкубацией планшет (или стрипы) заклеивают пленкой или убирают в плотный полиэтиленовый пакет для предотвращения контаминации и высыхания среды.Media with appropriate substrates can be placed both in standard bacteriological tubes with stoppers in the volume of 0.5-1.0 ml, and in the wells of a sterile 96-well polymer plate in the volume of 100-200 μl (microvolume research technology). Microvolume technology for studying the biochemical properties of bacteria is the most economical, simple, and suitable for automation and standardization of research. Both round-bottom and flat-bottom polystyrene plates can be used. The former are convenient when inoculating the studied microorganism in the medium. In turn, flat-bottomed tablets are available as collapsible into separate strips. Stripped tablets allow studies from a single culture. To create anaerobic conditions and to prevent the release of volatile metabolites, for example, ammonia, capable of changing the pH of the medium in neighboring wells, after inoculation of the culture, 2-3 drops of sterile mineral oil are applied to the medium in the well. Before incubation, the plate (or strips) is sealed with a film or put into a dense plastic bag to prevent contamination and drying of the medium.
Твин 80 (эфир олеиновой кислоты) используется в качестве субстрата для определения наличия у микроорганизма фермента липазы. Для выявления липаз микроорганизмы культивируют на средах с липосодержащими субстратами, гидролитическое расщепление которых сопровождается визуально определяемым изменением внешнего вида среды. Использовали агаровую среду с добавлением 0,01% одноводного кальция хлорида и 1% твина 80 [Методы общей бактериологии: Пер. с англ. /Под ред. Ф.Герхардта [и др.], в трех томах, Т.3. - М.: Мир, 1984. - 264 с.: ил.]. В качестве агаровой основы использовали агар Хоттингера. Инкубация на данной среде производится в течение 24-48 часов при (26±2)°С. Положительный результат - появление мутного ореола вокруг колоний, состоящего из кристаллов кальциевого мыла. Среда для определения липазы является плотной и при приготовлении разливается в чашки Петри.Tween 80 (oleic acid ester) is used as a substrate to determine if the microorganism has a lipase enzyme. To detect lipases, microorganisms are cultured on media with liposubstrate substrates, the hydrolytic cleavage of which is accompanied by a visually detectable change in the appearance of the medium. Used agar medium with the addition of 0.01% monohydrous calcium chloride and 1% tween 80 [General bacteriology methods. from English / Ed. F. Gerhardt [et al.], In three volumes, Vol. 3. - M .: Mir, 1984. - 264 p.: Ill.]. Hottinger agar was used as the agar base. Incubation in this medium is carried out for 24-48 hours at (26 ± 2) ° С. A positive result is the appearance of a cloudy halo around the colonies, consisting of crystals of calcium soap. The lipase determination medium is dense and, when cooked, is poured into Petri dishes.
Важными условиями использования изобретения являются также возраст культуры бактерий, температурный и временной режимы. Оптимальный режим проведения исследования - инкубация суточной агаровой при (26±2)°С в течение 24 часов. Это объясняется психрофильными свойствами представителей рода Yersinia, у которых метаболизм некоторых веществ может различаться при (37±1)°С и (26±2)°С.Important conditions for the use of the invention are also the age of the bacterial culture, temperature and time conditions. The optimal study mode is incubation of daily agar at (26 ± 2) ° С for 24 hours. This is explained by the psychrophilic properties of representatives of the genus Yersinia, in which the metabolism of some substances may vary at (37 ± 1) ° С and (26 ± 2) ° С.
Отличительная особенность тест-системы - комплексное использование в одном наборе различных субстратов в питательной среде, позволяющих определять 17 биохимических свойств для полноценной дифференциации видов и биотипов бактерий рода Yersinia.A distinctive feature of the test system is the integrated use in a single set of different substrates in a nutrient medium, allowing to determine 17 biochemical properties for the full differentiation of species and biotypes of bacteria of the genus Yersinia.
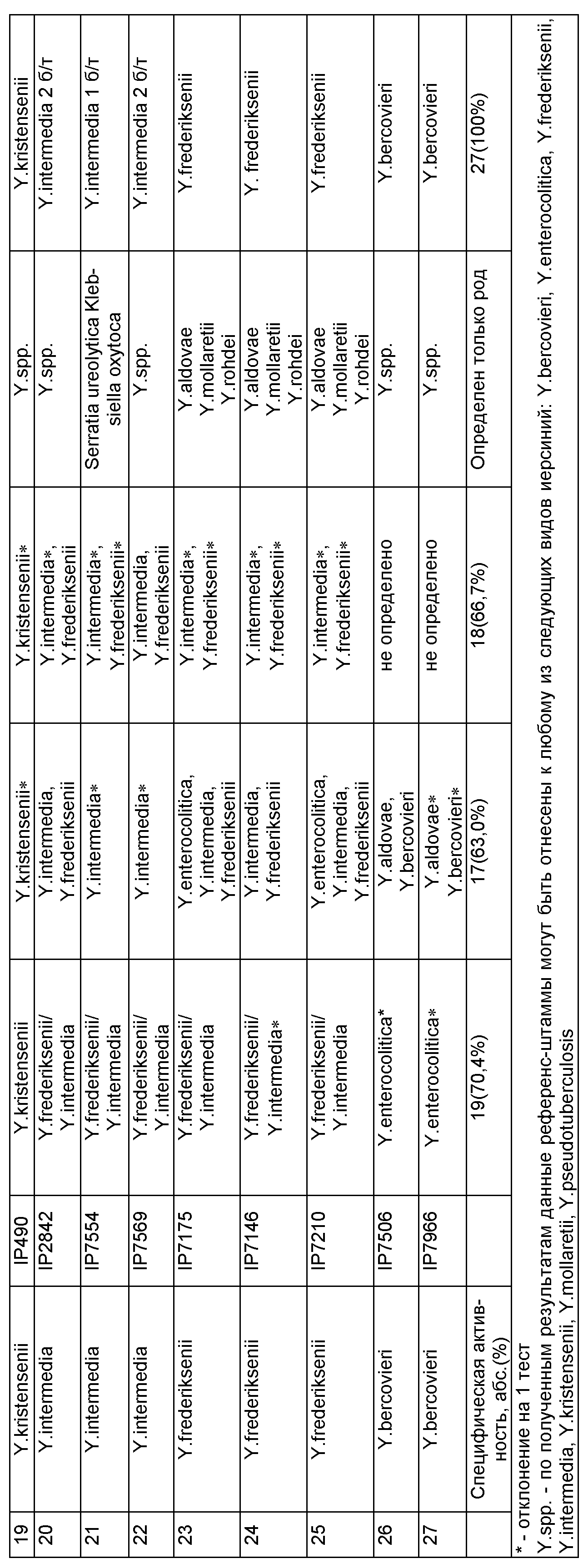
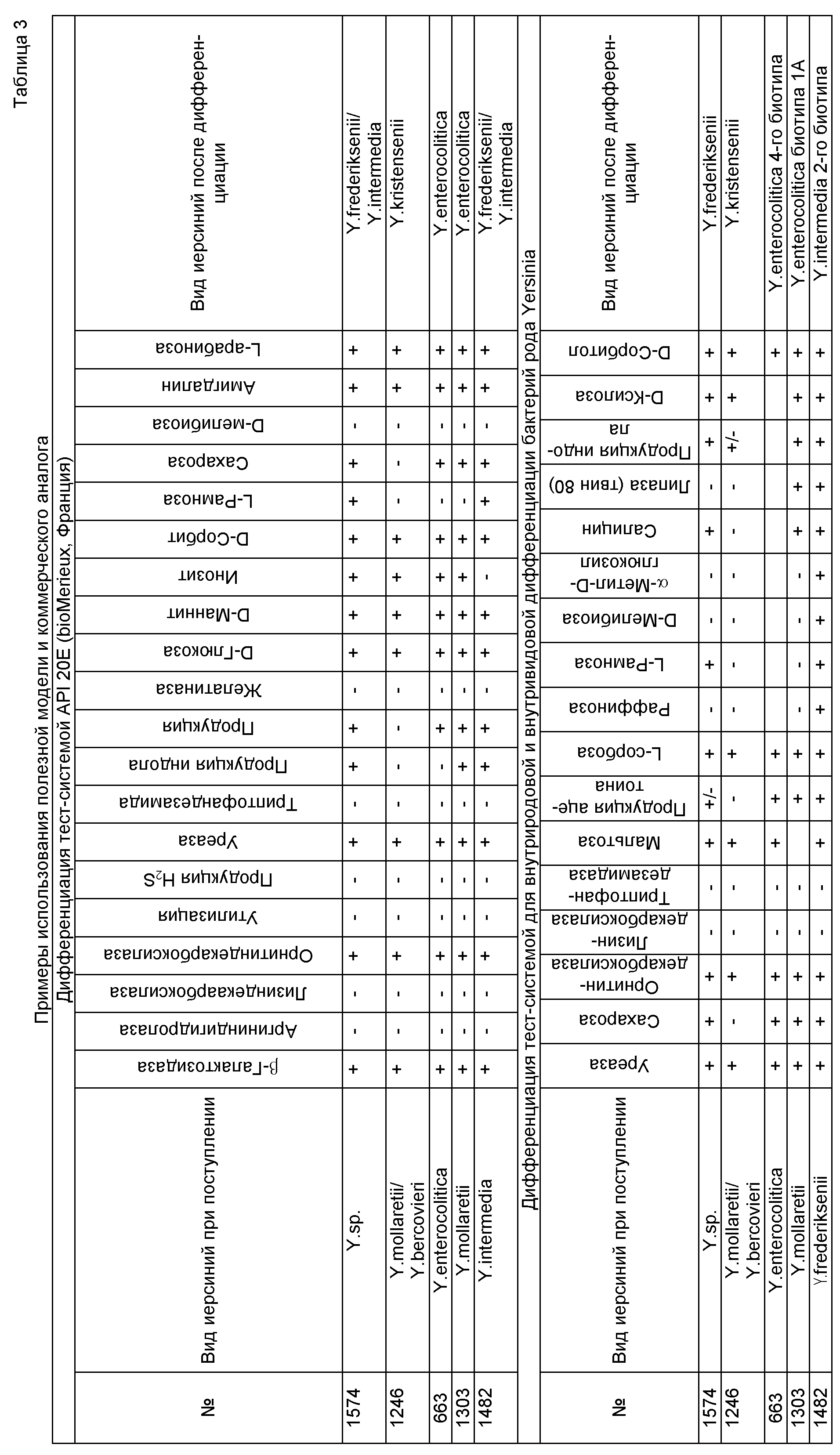
Специфическая активность тест-системы была установлена в ходе исследования 27 референс-штаммов иерсиний (26 получены из коллекции референс-центра по иерсиниям Парижского института Пастера, одна культура Y.enterocolitica КМ 174 - из Государственной коллекции патогенных бактерий «Микроб» ФКУЗ РосНИПЧИ «Микроб» Роспотребнадзора): два штамма Y.pseudotuberculosis; 14 штаммов Y.enterocolitica, в том числе четыре штамма биотипа 1В, четыре штамма биотипа 1А, два штамма биотипа 2, один штамм биотипа 3, два штамма биотипа 4 и один штамм биотипа 5; три штамма Y.frederiksenii; три штамма различных биотипов Y.intermedia; три штамма Y.kristensenii; два штамма Y.bercovieri. Результаты представлены в таблице 2.The specific activity of the test system was established during the study of 27 reference strains of Yersinia (26 were obtained from the collection of the reference center for Yersinia of the Paris Institute of Pasteur, one culture of Y.enterocolitica KM 174 was from the State collection of pathogenic bacteria "Microbe" of the Federal Microbiological Research Institute for Microbiology, Microbi) Rospotrebnadzor): two strains of Y. pseudotuberculosis; 14 strains of Y.enterocolitica, including four strains of biotype 1B, four strains of biotype 1A, two strains of biotype 2, one strain of biotype 3, two strains of biotype 4 and one strain of biotype 5; three strains of Y.frederiksenii; three strains of different biotypes of Y.intermedia; three strains of Y.kristensenii; two strains of Y.bercovieri. The results are presented in table 2.
Специфичность тест-системы оценивали при идентификации некоторых представителей семейства Enterobacteriaceae. Было исследовано восемь культур: две культуры Escherichia coli, одна культура Klebsiella oxytoca, одна культура Klebsiella pneumonia, одна культура Proteus mirabilis, одна культура Enterobacter amnigenes, одна культура Shigella sp., одна культура Salmonella enteritidis. Родовая и видовая принадлежность исследуемых культур определялась с помощью коммерческих тест-систем API 20Е (BioMerieux, Франция), ЭНТЕРОтест24 Н (Эрба Лахема, Чехия), ДС-ДИФ-Энтеро-24 (Диагностические Системы, Н. Новгород). Ни одна из исследуемых восьми культур не была идентифицирована как иерсиния тест-системой для внутриродовой и внутривидовой дифференциации бактерий рода Yersinia.The specificity of the test system was assessed by the identification of some representatives of the Enterobacteriaceae family. Eight cultures were studied: two cultures of Escherichia coli, one culture of Klebsiella oxytoca, one culture of Klebsiella pneumonia, one culture of Proteus mirabilis, one culture of Enterobacter amnigenes, one culture of Shigella sp., One culture of Salmonella enteritidis. Genus and species affiliation of the studied cultures was determined using commercial test systems API 20E (BioMerieux, France), Enterotest 24 N (Erba Lahema, Czech Republic), DS-DIF-Entero-24 (Diagnostic Systems, N. Novgorod). None of the eight cultures studied was identified as yersinia by a test system for intrageneral and intraspecific differentiation of bacteria of the genus Yersinia.
Результат от использования изобретения - повышение эффективности внутриродовой и внутривидовой дифференциации бактерий рода Yersinia за счет использования предлагаемых тестов, увеличение диапазона определяемых видов и биотипов, повышение стандартности исследования за счет устранения субъективного выбора различных тестов и методик их приготовления.The result of the use of the invention is an increase in the efficiency of the intra-genus and intraspecific differentiation of bacteria of the genus Yersinia through the use of the proposed tests, an increase in the range of species and biotypes identified, an increase in the standard of research by eliminating the subjective choice of various tests and methods for their preparation.
Приводим примеры использования тест-системы. Исследуемый материал - культуры бактерий, выделенные из смывов с овощей и из материала от человека и животных и идентифицированные как Yersinia sp. Для установления вида и биотипа использовали тест-системы для внутриродовой и внутривидовой дифференциации бактерий рода Yersinia. В лунки стерильного полистиролового планшета предварительно были разлиты 16 жидких сред с субстратами по 0,15 мл. Суточную агаровую культуру поместили петлей (диаметр 2 мм) в каждую лунку с субстратно-индикаторной средой. В лунки с мочевиной и аминокислотами внесли стерильное минеральное масло. На плотную среду в чашке Петри, содержащую твин 80, культуру засеяли штрихом. После инкубации при (26±2)°С в течение 24 часов в одну лунку с триптофаном (среда для определения индолообразования) внесли 1-2 капли реактива Ковача, в лунку со средой для определения образования ацетоина внесли поочередно 1 каплю 40% водного раствора калия гидроксида и 1 каплю 6% спиртового раствора α-нафтола. После инкубации при (26±2)°С в течение 30 минут в другую лунку с триптофаном (среда для определения триптофандезаминазы) внесли 1-2 капли реактива с хлорным железа (III) и произвели учет реакций. Для сравнения результатов использовали прототип - коммерческую тест-систему API 20Е (BioMerieux, Франция), у которой был наибольший процент верной идентификации референс-штаммов иерсиний различных видов.We give examples of the use of the test system. Test material - bacterial cultures isolated from washes from vegetables and from material from humans and animals and identified as Yersinia sp. To establish the species and biotype, test systems were used for the intrageneric and intraspecific differentiation of bacteria of the genus Yersinia. In the wells of a sterile polystyrene tablet, 16 liquid media with 0.15 ml substrates were previously spilled. The daily agar culture was placed in a loop (2 mm diameter) in each well with a substrate-indicator medium. Sterile mineral oil was added to the urea and amino acid wells. On a solid medium in a Petri dish containing tween 80, the culture was seeded with a stroke. After incubation at (26 ± 2) ° C for 24 hours, 1-2 drops of Kovac's reagent were added to one well with tryptophan (medium for determining indole formation), 1 drop of a 40% aqueous potassium solution was added to the well with medium for determining the formation of acetoin hydroxide and 1 drop of a 6% alcohol solution of α-naphthol. After incubation at (26 ± 2) ° С for 30 minutes, 1-2 drops of the reagent with ferric chloride (III) were added to another well with tryptophan (medium for the determination of tryptophandesaminase) and the reactions were counted. To compare the results, a prototype was used - a commercial test system API 20E (BioMerieux, France), which had the highest percentage of correct identification of reference strains of Yersinia of various species.
Пример 1.Example 1
Из лаборатории практического здравоохранения была получена культура №1574, выделенная от мышевидного грызуна (рыжая полевка), и по результатам фенотипической идентификации была отнесена к роду Yersinia. В ходе исследования с использованием разработанной тест-системы данную культуру отнесли к виду Y.frederiksenii. А именно, было определено наличие уреазы, орнитиндекарбоксилазы; образования индола, ацетоина; ферментации сахарозы, сорбита, ксилозы, салицина, сорбозы, рамнозы, мальтозы. Остальные тесты дали отрицательный результат. Также биохимические свойства данной культуры исследовали коммерческой тест-системой API 20Е (BioMerieux, Франция). Такие тесты, как определение наличия β-галактозидазы, орнитиндекарбоксилазы, уреазы, продукции индола, продукции ацетоина, ферментации D-глюкозы, D-маннита, D-сорбита, инозита, L-рамнозы, D-сахарозы, амигдалина, L-арабинозы были положительные, остальные - отрицательные. По результатам определения биохимических свойств культуры определили вид иерсиний. Согласно тест-системе API 20Е культура относилась либо к виду Y.frederiksenii, либо к виду Y.intermedia. Установить вид точно было возможно с использованием разработанной тест-системы. Результаты представлены в таблице 3.Culture No. 1574, isolated from a mouse-like rodent (red-headed vole), was obtained from the laboratory of practical health care, and according to the results of phenotypic identification, it was assigned to the genus Yersinia. In a study using the developed test system, this culture was assigned to the species Y.frederiksenii. Namely, the presence of urease, ornithine decarboxylase was determined; formation of indole, acetoin; fermentations of sucrose, sorbitol, xylose, salicin, sorbose, ramnose, maltose. Other tests gave a negative result. Also, the biochemical properties of this culture were investigated by a commercial test system API 20E (BioMerieux, France). Tests such as determining the presence of β-galactosidase, ornithine decarboxylase, urease, indole production, acetoin production, D-glucose, D-mannitol, D-sorbitol, inositol, L-ramnose, D-sucrose, amygdalin, L-arabinose were positive the rest are negative. According to the results of determining the biochemical properties of the culture, the species of Yersinia was determined. According to the API 20E test system, the culture was either of the species Y.frederiksenii or of the species Y.intermedia. It was precisely possible to establish the view using the developed test system. The results are presented in table 3.
Пример 2.Example 2
Из лаборатории практического здравоохранения была получена культура №1246, выделенная от мышевидного грызуна (бурозубка), и по результатам фенотипической идентификации была отнесена к роду Yersinia и видам Y.mollaretii или Y.bercovieri. В ходе исследования с использованием разработанной тест-системы данную культуру отнесли к виду Y.kristensenii. А именно, было определено наличие уреазы, орнитин декарбоксилазы; образование индола; ферментация сорбита, ксилозы, сорбозы, мальтозы. Остальные тесты дали отрицательный результат, в том числе культура не ферментировала сахарозу и не продуцировала ацетоин в реакции Фогеса-Проскауэра. Также биохимические свойства данной культуры исследовали коммерческой тест-системой API 20Е (BioMerieux, Франция). Такие тесты, как определение наличия β-галактозидазы, орнитиндекарбоксилазы, уреазы, ферментации D-глюкозы, D-маннита, D-сорбита, инозита, амигдалина, L-арабинозы были положительные, остальные - отрицательные. По полученным биохимическим свойствам культуры определили ее вид. Согласно результатам исследования как с использованием разработанной тест-системы, так и тест-системы API 20Е, исследуемый штамм относился к виду Y.kristensenii. Результаты представлены в таблице 3.A culture No. 1246 isolated from a mouse-like rodent (shrew) was obtained from the laboratory of practical health care and, according to the results of phenotypic identification, was assigned to the genus Yersinia and the species Y.mollaretii or Y.bercovieri. In a study using the developed test system, this culture was assigned to the species Y.kristensenii. Namely, the presence of urease, ornithine decarboxylase, was determined; indole formation; fermentation of sorbitol, xylose, sorbose, maltose. Other tests yielded a negative result, including the culture that did not ferment sucrose and did not produce acetoin in the Voges-Proskauer reaction. Also, the biochemical properties of this culture were investigated by a commercial test system API 20E (BioMerieux, France). Tests such as determining the presence of β-galactosidase, ornithine decarboxylase, urease, fermentation of D-glucose, D-mannitol, D-sorbitol, inositol, amygdalin, L-arabinose were positive, the rest were negative. According to the obtained biochemical properties of the culture, its type was determined. According to the results of the study using both the developed test system and the API 20E test system, the studied strain belonged to the species Y.kristensenii. The results are presented in table 3.
Пример 3.Example 3
Из лаборатории практического здравоохранения была получена культура №663, выделенная из материала от человека, и по результатам фенотипической идентификации была отнесена к роду Yersinia виду Y.enterocolitica. В ходе исследования с использованием разработанной тест-системы, был подтвержден вид, а также выявлен биотип данного штамма. Культура обладала уреазой, орнитиндекарбоксилазой; продуцировала ацетоин в реакции Фогеса-Проскауэра; ферментировала сахарозу, сорбит, сорбозу, мальтозу. Остальные тесты дали отрицательный результат, а именно, культура не образовывала индол; не обладала лизиндекарбоксилазой, триптофандезаминазой, липазой; не ферментировала ксилозу, салицин, мелибиозу, α-метил-D-глюкозид, рамнозу, раффинозу. При исследовании биохимических свойств коммерческой тест-системой API 20Е (BioMerieux, Франция), было выявлено наличие β-галактозидазы, орнитиндекарбоксилазы, уреазы; продукции ацетоина; способности ферментировать D-глюкозу, D-маннит, D-сорбит, инозит, сахарозу, амигдалин, L-арабинозу. Остальные тесты - отрицательные. Согласно тест-системе API 20Е был определен только вид исследуемого штамма - Y.enterocolitica. Результаты представлены в таблице 3.From the laboratory of practical health care, culture No. 663 was obtained, isolated from human material, and according to the results of phenotypic identification, it was assigned to the genus Yersinia in the species Y.enterocolitica. During the study using the developed test system, the species was confirmed, and the biotype of this strain was identified. The culture possessed urease, ornithine decarboxylase; produced acetoin in the Voges-Proskauer reaction; fermented sucrose, sorbitol, sorbose, maltose. Other tests gave a negative result, namely, the culture did not form indole; did not possess lysine decarboxylase, tryptophandesaminase, lipase; did not ferment xylose, salicin, melibiosis, α-methyl-D-glucoside, rhamnose, raffinose. When studying the biochemical properties of the commercial test system API 20E (BioMerieux, France), the presence of β-galactosidase, ornithine decarboxylase, urease was revealed; acetoin production; ability to ferment D-glucose, D-mannitol, D-sorbitol, inositol, sucrose, amygdalin, L-arabinose. Other tests are negative. According to the API 20E test system, only the type of test strain, Y.enterocolitica, was determined. The results are presented in table 3.
Пример 4.Example 4
Из лаборатории практического здравоохранения была получена культура №1303, выделенная из смыва с картофеля, и по результатам фенотипической идентификации была отнесенная к роду Yersinia виду Y.mollaretii. В ходе исследования с использованием разработанной тест-системы данную культуру отнесли к виду Y.enterocolitica и биотипу 1А. По результатам биохимических тестов культура обладала уреазой, орнитиндекарбоксилазой, липазой, не обладала лизиндекарбоксилазой, триптофандезаминазой; продуцировала индол и ацетоин; ферментировала сахарозу, мальтозу, сорбит, сорбозу, ксилозу и салицин; не ферментировала мелибиозу, рамнозу, раффинозу и α-метил-D-глюкозид. Также биохимические свойства данной культуры исследовали коммерческой тест-системой API 20Е (BioMerieux, Франция), с помощью которой определили наличие β-галактозидазы, орнитиндекарбоксилазы, уреазы; продукцию индола и ацетоина; ферментацию D-глюкозы, D-маннита, D-сорбита, сахарозы, инозита, амигдалина, L-арабинозы; отсутствовала ферментация рамнозы и мелибиозы; культура не обладала лизиндекарбоксилазой, триптофандезаминазой, аргининдигидролазой, желатиназой, не продуцировала сероводород, не обладала способностью утилизировать цитрат натрия. По результатам определения биохимических свойств культуры с помощью API 20Е, установили вид Y.enterocolitica, но биотип не определили. Результаты представлены в таблице 3.From the laboratory of practical health care, culture No. 1303 was obtained, isolated from flushing from potatoes, and according to the results of phenotypic identification, Y.mollaretii was assigned to the genus Yersinia. During the study using the developed test system, this culture was assigned to the species Y.enterocolitica and biotype 1A. According to the results of biochemical tests, the culture had urease, ornithine decarboxylase, lipase, did not have lysine decarboxylase, tryptophandesaminase; produced indole and acetoin; fermented sucrose, maltose, sorbitol, sorbose, xylose and salicin; did not ferment melibiosis, rhamnose, raffinose and α-methyl-D-glucoside. Also, the biochemical properties of this culture were studied using the API 20E commercial test system (BioMerieux, France), which determined the presence of β-galactosidase, ornithine decarboxylase, and urease; indole and acetoin production; fermentation of D-glucose, D-mannitol, D-sorbitol, sucrose, inositol, amygdalin, L-arabinose; there was no fermentation of rhamnose and melibiosis; the culture did not possess lysine decarboxylase, tryptophandesaminase, arginine dihydrolase, gelatinase, did not produce hydrogen sulfide, did not have the ability to utilize sodium citrate. According to the results of determining the biochemical properties of the culture using API 20E, the species Y.enterocolitica was established, but the biotype was not determined. The results are presented in table 3.
Пример 5.Example 5
Из лаборатории практического здравоохранения была получена культура №1482, выделенная из смыва с картофеля и по результатам фенотипической идентификации отнесенная к роду Yersinia виду Y.frederiksenii. В ходе исследования с использованием разработанной тест-системы было определено наличие уреазы, орнитиндекарбоксилазы; образование индола, ацетоина; ферментации сахарозы, сорбита, ксилозы, салицина, сорбозы, мальтозы, мелибиозы, рамнозы, α-метил-D-глюкозида, раффинозы. Остальные тесты дали отрицательный результат. По результатам определения биохимических свойств исследуемый штамм относился к виду Y.intermedia. Также биохимические свойства данной культуры исследовали коммерческой тест-системой API 20Е (BioMerieux, Франция). Было выявлено: наличие β-галактозидазы, орнитиндекарбоксилазы, уреазы; продукция индола, ацетоина; ферментация D-глюкозы, D-маннита, D-сорбита, L-рамнозы, D-сахарозы, амигдалина, L-арабинозы. Остальные тесты - отрицательные. Однако согласно полученным при использовании тест-системы API 20Е результатам культура относилась либо к виду Y.frederiksenii, либо к виду Y.intermedia. Установить вид точно можно было с использованием разработанной тест-системы. Результаты представлены в таблице 3.Culture No. 1482 was obtained from the laboratory of practical health care, isolated from flushing from potatoes and, according to the results of phenotypic identification, assigned to the genus Yersinia, species Y.frederiksenii. During the study, using the developed test system, the presence of urease, ornithine decarboxylase was determined; formation of indole, acetoin; fermentations of sucrose, sorbitol, xylose, salicin, sorbose, maltose, melibiosis, ramnose, α-methyl-D-glucoside, raffinose. Other tests gave a negative result. According to the results of determining the biochemical properties of the studied strain belonged to the species Y.intermedia. Also, the biochemical properties of this culture were investigated by a commercial test system API 20E (BioMerieux, France). It was revealed: the presence of β-galactosidase, ornithine decarboxylase, urease; production of indole, acetoin; fermentation of D-glucose, D-mannitol, D-sorbitol, L-ramnose, D-sucrose, amygdalin, L-arabinose. Other tests are negative. However, according to the results obtained using the API 20E test system, the culture belonged either to the species Y.frederiksenii or to the species Y.intermedia. It was possible to establish the view precisely using the developed test system. The results are presented in table 3.
Таким образом, применение разработанной тест-системы позволяет повысить специфическую активность при дифференциации бактерий рода Yersinia за счет расширения диапазона определяемых видов и биотипов иерсиний.Thus, the use of the developed test system allows to increase the specific activity in the differentiation of bacteria of the genus Yersinia by expanding the range of defined species and biotypes of Yersinia.
Claims (1)
питательная среда для определения лизиндекарбоксилазы - 0,15
питательная среда для определения орнитиндекарбоксилазы - 0,15
питательная среда для определения триптофандезаминазы - 0,15
реактив для определения триптофандезаминазы - 0,025…0,050
питательная среда для определения уреазы - 0,15
питательная среда для определения продукции ацетоина - 0,15
реактив для определения продукции ацетоина - 0,025…0,050
питательная среда для определения продукции индола - 0,15
реактив для определения продукции индола - 0,025…0,050
питательная среда для определения ферментации мелибиозы - 0,15
питательная среда для определения ферментации рамнозы - 0,15
питательная среда для определения ферментации сахарозы - 0,15
питательная среда для определения ферментации сорбита - 0,15
питательная среда для определения липазы - 5,00
питательная среда для определения ферментации ксилозы - 0,15
питательная среда для определения ферментации мальтозы - 0,15
питательная среда для определения ферментации
α-метил-D-глюкопиранозида - 0,15
питательная среда для определения ферментации салицина - 0,15
питательная среда для определения ферментации сорбозы - 0,15
питательная среда для определения ферментации раффинозы - 0,15. Test system for differentiating species and biotypes of bacteria of the Yersinia genus, consisting of a set of nutrient media containing substrates and reagents for determining the presence of lysine decarboxylase, ornithine decarboxylase, tryptophandesaminase, urease, acetoin production, indole production, melibiosis fermentation, rhamnose fermentation fermentation of sorbitol, characterized in that it further comprises a medium with substrates for determining the presence of lipase in the microorganism, xylose fermentation, maltose fermentation, rmentatsii α-methyl-D-glucopyranoside, salicin fermentation, fermentation sorbose fermentation raffinose next quantitative content of components of a test system for determining one ml:
culture medium for the determination of lysine decarboxylase - 0.15
culture medium for the determination of ornithine decarboxylase - 0.15
culture medium for the determination of tryptophandesaminase - 0.15
reagent for the determination of tryptophandesaminase - 0,025 ... 0,050
culture medium for the determination of urease - 0.15
culture medium for determining the production of acetoin - 0.15
reagent for determining the production of acetoin - 0,025 ... 0,050
nutrient medium for determining indole production - 0.15
reagent for determining indole production - 0.025 ... 0.050
culture medium for determining the fermentation of melibiosis - 0.15
culture medium for determination of rhamnose fermentation - 0.15
culture medium for the determination of sucrose fermentation - 0.15
culture medium for determining sorbitol fermentation - 0.15
nutrient medium for determining lipase - 5.00
culture medium for determining xylose fermentation - 0.15
nutrient medium for determining the fermentation of maltose - 0.15
fermentation culture medium
α-methyl-D-glucopyranoside - 0.15
culture medium for determining salicin fermentation - 0.15
culture medium for determining sorbose fermentation - 0.15
culture medium for determining the fermentation of raffinose - 0.15.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2012110981/10A RU2518297C2 (en) | 2012-03-21 | 2012-03-21 | TEST-SYSTEM FOR DIFFERENTIATING SPECIES AND BIOTYPES OF BACTERIA OF GENUS Yersinia |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2012110981/10A RU2518297C2 (en) | 2012-03-21 | 2012-03-21 | TEST-SYSTEM FOR DIFFERENTIATING SPECIES AND BIOTYPES OF BACTERIA OF GENUS Yersinia |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2012110981A RU2012110981A (en) | 2013-09-27 |
| RU2518297C2 true RU2518297C2 (en) | 2014-06-10 |
Family
ID=49253712
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2012110981/10A RU2518297C2 (en) | 2012-03-21 | 2012-03-21 | TEST-SYSTEM FOR DIFFERENTIATING SPECIES AND BIOTYPES OF BACTERIA OF GENUS Yersinia |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU2518297C2 (en) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2560570C1 (en) * | 2014-04-08 | 2015-08-20 | Государственное научное учреждение Всероссийский научно-исследовательский институт экспериментальной ветеринарии имени Я.Р. Коваленко (ВИЭВ Россельхозакадемии) | METHOD FOR DIAGNOSIS OF SALMON YERSINIOSIS, CAUSED BY Yersinia ruckeri, BY POLYMERASE CHAIN REACTION AND DIAGNOSTIC KIT THEREFOR |
| RU2684231C1 (en) * | 2018-01-22 | 2019-04-04 | Федеральное казенное учреждение здравоохранения "Российский научно-исследовательский противочумный институт "Микроб" Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека ("РосНИПЧИ "Микроб") | Method of differentiation of yersinia pestis strains of medieval biovar according to phylogenetic affiliation with pcr method with electrophoretic accounting of results |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1389242B1 (en) * | 2001-05-18 | 2007-04-18 | Biotecon Diagnostics GmbH | Detecting microorganisms of the yersinia pestis/yersinia pseudotuberculosis species and/or differentiating between yersinia pestis and yersinia pseudotuberculosis |
| RU2339952C1 (en) * | 2007-05-29 | 2008-11-27 | Тихоокеанский Институт Биоорганической Химии Дальневосточного Отделения Российской Академии Наук (Тибох Дво Ран) | Method for differential diagnostics of pseudo-tuberculosis and intestinal yersiniosis and diagnostic set for its realisation |
| RU2345365C1 (en) * | 2007-05-29 | 2009-01-27 | Тихоокеанский Институт Биоорганической Химии Дальневосточного Отделения Российской Академии Наук (Тибох Дво Ран) | Method for differential diagnostics of yersiniosis and respective diagnostic kit |
-
2012
- 2012-03-21 RU RU2012110981/10A patent/RU2518297C2/en not_active IP Right Cessation
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1389242B1 (en) * | 2001-05-18 | 2007-04-18 | Biotecon Diagnostics GmbH | Detecting microorganisms of the yersinia pestis/yersinia pseudotuberculosis species and/or differentiating between yersinia pestis and yersinia pseudotuberculosis |
| RU2339952C1 (en) * | 2007-05-29 | 2008-11-27 | Тихоокеанский Институт Биоорганической Химии Дальневосточного Отделения Российской Академии Наук (Тибох Дво Ран) | Method for differential diagnostics of pseudo-tuberculosis and intestinal yersiniosis and diagnostic set for its realisation |
| RU2345365C1 (en) * | 2007-05-29 | 2009-01-27 | Тихоокеанский Институт Биоорганической Химии Дальневосточного Отделения Российской Академии Наук (Тибох Дво Ран) | Method for differential diagnostics of yersiniosis and respective diagnostic kit |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2560570C1 (en) * | 2014-04-08 | 2015-08-20 | Государственное научное учреждение Всероссийский научно-исследовательский институт экспериментальной ветеринарии имени Я.Р. Коваленко (ВИЭВ Россельхозакадемии) | METHOD FOR DIAGNOSIS OF SALMON YERSINIOSIS, CAUSED BY Yersinia ruckeri, BY POLYMERASE CHAIN REACTION AND DIAGNOSTIC KIT THEREFOR |
| RU2684231C1 (en) * | 2018-01-22 | 2019-04-04 | Федеральное казенное учреждение здравоохранения "Российский научно-исследовательский противочумный институт "Микроб" Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека ("РосНИПЧИ "Микроб") | Method of differentiation of yersinia pestis strains of medieval biovar according to phylogenetic affiliation with pcr method with electrophoretic accounting of results |
Also Published As
| Publication number | Publication date |
|---|---|
| RU2012110981A (en) | 2013-09-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Lior | New, extended biotyping scheme for Campylobacter jejuni, Campylobacter coli, and" Campylobacter laridis" | |
| Ljungh et al. | Aeromonas hydrophila in acute diarrheal disease: detection of enterotoxin and biotyping of strains | |
| JP6192658B2 (en) | Method for detecting Salmonella microorganisms | |
| Jayne‐Williams | The application of miniaturized methods for the characterization of various organisms isolated from the animal gut | |
| Malnick et al. | Description of a medium for isolating Anaerobiospirillum spp., a possible cause of zoonotic disease, from diarrheal feces and blood of humans and use of the medium in a survey of human, canine, and feline feces | |
| Soltan-Dallal et al. | Comparison of four methods for isolation of Yersinia enterocolitica from raw and pasteurized milk from northern Iran | |
| Neilson | The occurrence of aeromonads in activated sludge: isolation of Aeromonas sobria and its possible confusion with Escherichia coli | |
| MX2014007888A (en) | Method of detecting a salmonella microorganism. | |
| US20150315627A1 (en) | Methods and compositions for the detection of functional clostridium difficile toxins | |
| RU2518297C2 (en) | TEST-SYSTEM FOR DIFFERENTIATING SPECIES AND BIOTYPES OF BACTERIA OF GENUS Yersinia | |
| CN109762871B (en) | Application of mixture of tetrazolium monosulfonate and PMS derivative in microbial detection and detection method thereof | |
| Lejbkowicz et al. | Recovery of Kingella kingae from blood and synovial fluid of two pediatric patients by using the BacT/Alert system | |
| Claeys et al. | Endocarditis of native aortic and mitral valves due to Corynebacterium accolens: report of a case and application of phenotypic and genotypic techniques for identification | |
| Jones et al. | Laboratory aspects of Salmonella. | |
| Doğan et al. | Evaluation of two commercial kits and arbitrarily primed PCR for identification and differentiation of Actinobacillus actinomycetemcomitans, Haemophilus aphrophilus, and Haemophilus paraphrophilus | |
| RU2425877C1 (en) | BACTERIOPHAGE Escherichia coli V32 STRAIN FOR IDENTIFICATION OF Escherichia coli BACTERIA SEROGROUP O157 | |
| Tebbutt | Evaluation of some methods for the laboratory identification of Haemophilus influenzae. | |
| Togo et al. | Lactimicrobium massiliense gen. nov., sp. nov.; Anaerolactibacter massiliensis gen. nov., sp. nov.; Galactobacillus timonensis gen. nov., sp. nov. and Acidipropionibacterium timonense sp. nov. isolated from breast milk from healthy breastfeeding African women | |
| RU2756980C1 (en) | Strain of escherichia coli serovar o26:h11 bacteria, producer of a shiga-like toxin, deposited in the state collection of pathogenic microorganisms and cell cultures "scpm-obolensk" under number b-8034 | |
| Dickinson et al. | Agar medium for the selective enumeration of coagulase-positive Staphylococcus from the rat alimentary tract | |
| McBee et al. | The genus Hafnia | |
| Lal et al. | Decarboxylase Broth Protocol | |
| Omeonu et al. | Phylogenetic Identification and Some Physiological Properties of Lactic Acid Bacteria Isolated from the Oral Cavities of Some Selected Students from University of Ibadan, Nigeria | |
| Gusils et al. | Identification of lactic acid bacteria and enterobacteria. A technique in microplates | |
| Shembil | Isolation of lactic acid bacteria with antimicrobial activity |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20160322 |
|
| NF4A | Reinstatement of patent |
Effective date: 20170116 |
|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20190322 |