RU2409349C2 - Pharmaceutical compositions, containing glucagon-like peptide (glp-1) - Google Patents
Pharmaceutical compositions, containing glucagon-like peptide (glp-1) Download PDFInfo
- Publication number
- RU2409349C2 RU2409349C2 RU2008144965/15A RU2008144965A RU2409349C2 RU 2409349 C2 RU2409349 C2 RU 2409349C2 RU 2008144965/15 A RU2008144965/15 A RU 2008144965/15A RU 2008144965 A RU2008144965 A RU 2008144965A RU 2409349 C2 RU2409349 C2 RU 2409349C2
- Authority
- RU
- Russia
- Prior art keywords
- glp
- fdkp
- diketopiperazine
- solution
- specified
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/007—Pulmonary tract; Aromatherapy
- A61K9/0073—Sprays or powders for inhalation; Aerolised or nebulised preparations generated by other means than thermal energy
- A61K9/0075—Sprays or powders for inhalation; Aerolised or nebulised preparations generated by other means than thermal energy for inhalation via a dry powder inhaler [DPI], e.g. comprising micronized drug mixed with lactose carrier particles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/19—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles lyophilised, i.e. freeze-dried, solutions or dispersions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/496—Non-condensed piperazines containing further heterocyclic rings, e.g. rifampin, thiothixene
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/22—Hormones
- A61K38/26—Glucagons
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/007—Pulmonary tract; Aromatherapy
- A61K9/0073—Sprays or powders for inhalation; Aerolised or nebulised preparations generated by other means than thermal energy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/08—Solutions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/141—Intimate drug-carrier mixtures characterised by the carrier, e.g. ordered mixtures, adsorbates, solid solutions, eutectica, co-dried, co-solubilised, co-kneaded, co-milled, co-ground products, co-precipitates, co-evaporates, co-extrudates, co-melts; Drug nanoparticles with adsorbed surface modifiers
- A61K9/143—Intimate drug-carrier mixtures characterised by the carrier, e.g. ordered mixtures, adsorbates, solid solutions, eutectica, co-dried, co-solubilised, co-kneaded, co-milled, co-ground products, co-precipitates, co-evaporates, co-extrudates, co-melts; Drug nanoparticles with adsorbed surface modifiers with inorganic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/141—Intimate drug-carrier mixtures characterised by the carrier, e.g. ordered mixtures, adsorbates, solid solutions, eutectica, co-dried, co-solubilised, co-kneaded, co-milled, co-ground products, co-precipitates, co-evaporates, co-extrudates, co-melts; Drug nanoparticles with adsorbed surface modifiers
- A61K9/145—Intimate drug-carrier mixtures characterised by the carrier, e.g. ordered mixtures, adsorbates, solid solutions, eutectica, co-dried, co-solubilised, co-kneaded, co-milled, co-ground products, co-precipitates, co-evaporates, co-extrudates, co-melts; Drug nanoparticles with adsorbed surface modifiers with organic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1605—Excipients; Inactive ingredients
- A61K9/1611—Inorganic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1682—Processes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/18—Drugs for disorders of the alimentary tract or the digestive system for pancreatic disorders, e.g. pancreatic enzymes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/06—Antihyperlipidemics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
Landscapes
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Diabetes (AREA)
- Immunology (AREA)
- Hematology (AREA)
- Obesity (AREA)
- Endocrinology (AREA)
- Neurology (AREA)
- Pulmonology (AREA)
- Otolaryngology (AREA)
- Biomedical Technology (AREA)
- Neurosurgery (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Gastroenterology & Hepatology (AREA)
- Zoology (AREA)
- Inorganic Chemistry (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Dermatology (AREA)
- Emergency Medicine (AREA)
- Child & Adolescent Psychology (AREA)
- Transplantation (AREA)
- Hospice & Palliative Care (AREA)
- Urology & Nephrology (AREA)
- Psychiatry (AREA)
- Vascular Medicine (AREA)
Abstract
Description
ОписаниеDescription
Перекрестная ссылка на родственные заявкиCross reference to related applications
Настоящая заявка является частичным продолжением заявки на патент США № 10/632878, поданной 22 июля 2003; и в настоящей заявке, согласно статье 35, § 119 (е) Кодекса законов США, испрашивается преимущество предварительной заявки на патент США № 60/744882, поданной 14 апреля 2006. Каждая из вышеупомянутых приоритетных заявок во всей своей полноте вводится в настоящее описание посредством ссылки.This application is a partial continuation of application for US patent No. 10/632878, filed July 22, 2003; and in this application, pursuant to
Область, к которой относится изобретениеFIELD OF THE INVENTION
Настоящее изобретение относится к области разработки фармацевтических композиций. В настоящем изобретении описаны сухие порошкообразные препараты, содержащие частицы дикетопиперазина (DKP) в комбинации с глюкагонподобным пептидом 1 (GLP-1). Настоящее изобретение относится к применению фармацевтического препарата для лечения заболеваний, таких как, но не ограничивающихся ими, диабет, рак и ожирение. Более конкретно, настоящее изобретение относится к применению фармацевтического препарата для внутрилегочной доставки.The present invention relates to the development of pharmaceutical compositions. The present invention describes dry powder formulations containing particles of diketopiperazine (DKP) in combination with glucagon-like peptide 1 (GLP-1). The present invention relates to the use of a pharmaceutical preparation for the treatment of diseases such as, but not limited to, diabetes, cancer and obesity. More specifically, the present invention relates to the use of a pharmaceutical preparation for intrapulmonary delivery.
Предшествующий уровень техникиState of the art
Глюкагонподобный пептид 1 (GLP-1), описанный в литературе, представляет собой инкретин длиной в 30 или 31 аминокислоту, высвобождаемый эндокринными L-клетками тонкого кишечника в ответ на поступление жира, углеводов и белка с пищей. Было обнаружено, что уровень секреции такого пептидного гормона снижается у индивидуума с сахарным диабетом типа 2, а поэтому указанный гормон является потенциальным кандидатом на средство для лечения этих и других родственных заболеваний.The glucagon-like peptide 1 (GLP-1) described in the literature is an incretin of 30 or 31 amino acids in length released by the endocrine L-cells of the small intestine in response to the intake of fat, carbohydrates and protein from food. It was found that the level of secretion of such a peptide hormone decreases in an individual with
В нормальном состоянии GLP-1 секретируется L-клетками тонкого кишечника в ответ на поступающие с пищей питательные вещества (в частности, сахар), которые стимулируют индуцируемое пищей высвобождение инсулина из поджелудочной железы, ингибируют высвобождения глюкагона из печени, а также оказывают другое воздействие на желудочно-кишечный тракт и головной мозг. Действие GLP-1 в поджелудочной железе зависит от глюкозы и минимизирует риск развития гипогликемии во время экзогенного введения пептида. GLP-1 также стимулирует все стадии биосинтеза инсулина и непосредственно стимулирует рост и выживаемость β-клеток, а также дифференцировку β-клеток. Комбинация этих эффектов приводит к увеличению массы β-клеток. Кроме того, рецептор GLP-1 передает сигнал, приводящий к снижению апоптоза β-клеток, что способствует увеличению массы β-клеток.In a normal state, GLP-1 is secreted by small intestine L-cells in response to nutrients (in particular sugar) that come from food, which stimulate food-induced insulin release from the pancreas, inhibit the release of glucagon from the liver, and also have other effects on the gastrointestinal tract. intestinal tract and brain. The action of GLP-1 in the pancreas is dependent on glucose and minimizes the risk of hypoglycemia during exogenous administration of the peptide. GLP-1 also stimulates all stages of insulin biosynthesis and directly stimulates the growth and survival of β-cells, as well as the differentiation of β-cells. The combination of these effects leads to an increase in the mass of β-cells. In addition, the GLP-1 receptor transmits a signal leading to a decrease in β-cell apoptosis, which contributes to an increase in β-cell mass.
В желудочно-кишечном тракте GLP-1 ингибирует перистальтику желудочно-кишечного тракта, повышает секрецию инсулина в ответ на действие глюкозы и снижает секрецию глюкагона, что способствует замедлению метаболизма глюкозы. Было показано, что введение GLP-1 в центральную нервную систему подавляет потребление пищи грызунами, что позволяет предположить, что периферическое высвобождение GLP-1 может непосредственно влиять на функцию головного мозга. Это предположение является вполне обоснованным, так как было показано, что циркулирующий GLP-1 может быть доступным для GLP-1-рецепторов в некоторых областях головного мозга, а именно в субфорникальном органе и в области самого заднего поля (posttrema). Известно, что эти области головного мозга участвуют в регуляции аппетита и энергетического гомеостаза. Интересно отметить, что растяжение желудка активирует GLP-1-содержащие нейроны в хвостатом ядре одиночного пути и, вероятно, играют определенную роль в экспрессии GLP-1 в центральной нервной системе как вещества, подавляющего аппетит. Эти гипотезы были подтверждены исследованиями, проводимыми с использованием антагониста рецептора GLP-1, экзендина (9-39), где наблюдался противоположный эффект. У человека введение GLP-1 приводило к эффекту насыщения (Verdich et al, 2001), а при непрерывном подкожном вливании в течение 6 недель у пациентов с диабетом наблюдалось снижение аппетита, что приводило к значительному снижению массы тела (Zander et al, 2002).In the gastrointestinal tract, GLP-1 inhibits gastrointestinal motility, increases insulin secretion in response to glucose, and decreases glucagon secretion, which slows down glucose metabolism. The introduction of GLP-1 into the central nervous system has been shown to inhibit rodent food intake, suggesting that peripheral release of GLP-1 can directly affect brain function. This assumption is well-founded, since it has been shown that circulating GLP-1 may be available for GLP-1 receptors in some areas of the brain, namely, in the subfornial organ and in the posterior field itself (posttrema). It is known that these areas of the brain are involved in the regulation of appetite and energy homeostasis. It is interesting to note that gastric distension activates GLP-1-containing neurons in the caudate nucleus of the single pathway and probably plays a role in the expression of GLP-1 in the central nervous system as an appetite suppressant. These hypotheses were confirmed by studies using the GLP-1 receptor antagonist, exendin (9-39), where the opposite effect was observed. In humans, administration of GLP-1 led to a satiety effect (Verdich et al, 2001), and with continuous subcutaneous infusion for 6 weeks, patients with diabetes showed a decrease in appetite, which led to a significant decrease in body weight (Zander et al, 2002).
Было также показано, что GLP-1 является эффективным у пациентов с диабетом типа 2, а именно при непрерывном внутривенном вливании он вызывает увеличение секреции инсулина и нормализует уровни глюкозы в крови натощак и после приема пищи (Nauck et al, 1993). Кроме того, было показано, что вливание GLP-1 приводит к снижению уровней глюкозы у пациентов, которые ранее подвергались лечению неинсулиновыми пероральными лекарственными средствами, и у пациентов, которым требовалось лечение инсулином после неудачной терапии с использованием сульфонилмочевины (Nauck et al, 1993). Однако, как было описано в литературе и как обсуждается ниже, действие одной подкожной инъекции GLP-1 дало разочаровывающие результаты. Хотя были достигнуты высокие уровни иммунореактивного GLP-1 в плазме, однако секреция инсулина быстро возвращалась на уровни, наблюдаемые до проведения лечения, а концентрации глюкозы в крови не нормализовались (Nauck et al, 1996). Только после повторного подкожного введения влияние на уровни глюкозы в крови натощак было сравнимо с эффектом, наблюдаемым при внутривенном введении (Nauck et al, 1996). Было показано, что непрерывное подкожное введение в течение 6 недель приводило к снижению концентраций глюкозы в крови натощак и после приема пищи и к снижению уровней HbA1c (Zander et al, 2002). Кратковременная эффективность одноразовых подкожных инъекций GLP-1 была ассоциирована с его нестабильностью в кровотоке. Было показано, что GLP-1 подвергается метаболизму в плазме in vitro и что за такое разложение ответственен фермент дипептидил-петидаза-IV (DPP-IV) (Mentlein et al., 1993).It has also been shown that GLP-1 is effective in patients with
Поскольку было продемонстрировано, что GLP-1 играет важную физиологическую роль при диабете и что экзогенный GLP-1 быстро разлагается по аминоконцу у здоровых индивидуумов и у индивидуумов с диабетом типа 2, то многие исследования были посвящены возможности повышения in vivo стабильности GLP-1, что можно рассматривать как новый подход к разработке противодиабетического средства для лечения диабета (Deacon et al, 2004). Было предложено два отдельных подхода: 1) получение аналогов, которые являются нечувствительными к ферментативному расщеплению и 2) применение селективных ингибиторов ферментов для предотвращения деградации GLP-1 in vivo и увеличение уровней интактных биологически активных пептидов. Были проведены клинические испытания аналогов GLP-1 длительного действия (например, лираглутида (Novo Nordisk, Copenhagen, Denmark); экзенатида (экзендина-4; Byetta®) (Amylin Inc., San Diego, CA) и экзенатида-LAR (Eli Lilly, Indianapolis, IN)), которые являются резистентными к расщеплению и получили название «миметики инкретина». Ингибиторы дипептидил-пептидазы IV (например, вилдаглиптин (Galvus), разработанный Novartis, Basel, Switzerland, и ситаглиптин (Januvia), разработанный Merck, Whitehouse Station, New Jersey)), которые ингибируют фермент, ответственный за разложение инсулина, также находятся на стадии исследований (Deacon et al, 2004). Так, например, очевидно, что широкий спектр действия GLP-1 (например, повышение уровня высвобождения инсулина, замедление скорости опустошения желудка и повышение насыщаемости), наряду с его низкой предрасположенностью к развитию гипогликемии, делает этот препарат более предпочтительным для применения по сравнению с имеющимися в настоящее время терапевтическими средствами.Since it was demonstrated that GLP-1 plays an important physiological role in diabetes and that exogenous GLP-1 is rapidly degraded at the amino terminus in healthy individuals and in individuals with
Однако, несмотря на имеющиеся в настоящее время методы/преимущества GLP-1-терапии, ни одно из лекарственных средств, применяемых в настоящее время для лечения диабета, не дает нужного терапевтического эффекта (снижения уровней HbA1c, снижения уровней глюкозы в крови натощак и улучшения метаболизма глюкозы), и у всех пациентов наблюдаются побочные эффекты, такие как токсикоз, гипогликемия, увеличение массы, тошнота и стресс от рвоты. Следовательно, необходимость в разработке стабильных препаратов GLP-1, обладающих длительной эффективностью и оптимальной абсорбцией при их введении в качестве фармацевтических препаратов, остается актуальной.However, despite the current methods / benefits of GLP-1 therapy, none of the drugs currently used to treat diabetes have the desired therapeutic effect (lowering HbA1c levels, lowering fasting blood glucose levels and improving metabolism glucose), and all patients experience side effects such as toxicosis, hypoglycemia, weight gain, nausea, and stress from vomiting. Therefore, the need to develop stable GLP-1 preparations with long-term effectiveness and optimal absorption when administered as pharmaceuticals remains relevant.
Описание сущности изобретенияDescription of the invention
В настоящее время не существует каких-либо стабильных и вводимых путем ингаляции препаратов, содержащих глюкагонподобный пептид 1 (GLP-1) и применяемых в качестве фармацевтических средств. Для решения этой проблемы было разработано настоящее изобретение, которое относится к препаратам, содержащим GLP-1 в комбинации с частицами дикетопиперазина (DKP) и используемым в качестве фармацевтического средства.Currently, there are no stable and inhalable preparations containing glucagon-like peptide 1 (GLP-1) and used as pharmaceuticals. To solve this problem, the present invention has been developed, which relates to preparations containing GLP-1 in combination with particles of diketopiperazine (DKP) and used as a pharmaceutical agent.
Поэтому в своих конкретных вариантах изобретения настоящее изобретение относится к сухой порошкообразной композиции, содержащей молекулу GLP-1 и дикетопиперазин или их фармацевтически приемлемую соль. В других вариантах изобретения сухая порошкообразная композиция согласно изобретению содержит молекулу GLP-1, выбранную из группы, состоящей из нативного GLP-1, метаболита GLP-1, aналога GLP-1, производного GLP-1, GLP-1, защищенного от действия дипептидил-пептидазы IV (DPP-IV), GLP-1-миметика, экзендина, аналога пептида GLP-1 или биосинтетического аналога GLP-1. В еще одном варианте настоящего изобретения сухая порошкообразная композиция содержит дикетопиперазин, имеющий формулу 2,5-дикето-3,6-ди(4-X-аминобутил)пиперазин, где X выбран из группы, состоящей из сукцинила, глутарила, малеила и фумарила. В другом варианте изобретения сухая порошкообразная композиция содержит соль дикетопиперазина. В еще одном своем варианте настоящее изобретение относится к сухой порошкообразной композиции, где указанным дикетопиперазином является 2,5-дикето-3,6-ди(4-фумарил-аминобутил)пиперазин.Therefore, in its specific embodiments of the invention, the present invention relates to a dry powder composition comprising a GLP-1 molecule and diketopiperazine or a pharmaceutically acceptable salt thereof. In other embodiments of the invention, the dry powder composition according to the invention comprises a GLP-1 molecule selected from the group consisting of native GLP-1, a metabolite of GLP-1, an analog of GLP-1, a derivative of GLP-1, GLP-1, protected from the action of dipeptidyl- peptidases IV (DPP-IV), GLP-1 mimetic, exendin, GLP-1 peptide analogue or GLP-1 biosynthetic analogue. In yet another embodiment of the present invention, the dry powder composition comprises diketopiperazine having the
Кроме того, в настоящем изобретении рассматривается сухая порошкообразная композиция, где указанной молекулой GLP-1 является нативная или амидированная молекула GLP-1, где указанной амидированной молекулой GLP-1 является амид GLP-1 (7-36).In addition, the present invention contemplates a dry powder composition, wherein said GLP-1 molecule is a native or amidated GLP-1 molecule, wherein said GLP-1 amidated molecule is GLP-1 amide (7-36).
В еще одном своем конкретном варианте настоящее изобретение относится к способу получения частиц, содержащих молекулу GLP-1 и дикетопиперазин, где указанный способ включает стадии получения раствора GLP-1, содержащего молекулу GLP-1; получения раствора дикетопиперазина, образующего частицы, или суспензии частиц дикетопиперазина; и объединения раствора GLP-1 с раствором или суспензией дикетопиперазина. В других конкретных вариантах изобретения способ получения частиц, содержащих молекулу GLP-1 и дикетопиперазин, также включает удаление растворителя из раствора или суспензии путем лиофилизации, фильтрации или сушки распылением. В еще одном варианте изобретения частицы согласно изобретению образуются при удалении растворителя или перед удалением растворителя.In yet another specific embodiment, the present invention relates to a method for producing particles containing a GLP-1 molecule and diketopiperazine, wherein said method includes the steps of producing a GLP-1 solution containing a GLP-1 molecule; obtaining a solution of diketopiperazine forming particles, or a suspension of particles of diketopiperazine; and combining the GLP-1 solution with a solution or suspension of diketopiperazine. In other specific embodiments of the invention, a method for producing particles containing a GLP-1 molecule and diketopiperazine also includes removing the solvent from the solution or suspension by lyophilization, filtration, or spray drying. In yet another embodiment of the invention, particles according to the invention are formed upon removal of the solvent or before removal of the solvent.
В одном из своих вариантов настоящее изобретение относится к способу получения частиц, содержащих молекулу GLP-1 и дикетопиперазин, где указанная молекула GLP-1 выбрана из группы, состоящей из нативного GLP-1, aналога GLP-1, производного GLP-1, GLP-1, защищенного от действия дипептидил-пептидазы IV (DPP-IV), GLP-1-миметика, экзендина, аналога пептида GLP-1 или биосинтетического аналога GLP-1. В другом варианте изобретения способ получения частиц, содержащих молекулу GLP-1 и дикетопиперазин, включает получение дикетопиперазина в виде суспензии частиц. В другом варианте изобретения дикетопиперазин получают в растворе, и такой способ включает коррекцию pH раствора для осаждения дикетопиперазина и образования частиц.In one embodiment, the present invention relates to a method for producing particles comprising a GLP-1 molecule and diketopiperazine, wherein said GLP-1 molecule is selected from the group consisting of native GLP-1, an analog of GLP-1, a derivative of GLP-1, GLP- 1, protected against the effects of dipeptidyl peptidase IV (DPP-IV), GLP-1 mimetic, exendin, GLP-1 peptide analogue or GLP-1 biosynthetic analogue. In another embodiment of the invention, a method for producing particles comprising a GLP-1 molecule and diketopiperazine comprises the preparation of diketopiperazine in the form of a suspension of particles. In another embodiment of the invention, diketopiperazine is prepared in solution, and such a method involves adjusting the pH of the solution to precipitate diketopiperazine and form particles.
В других конкретных вариантах изобретения раствор GLP-1 имеет концентрацию, составляющую примерно 1 мкг/мл - 50 мг/мл, более предпочтительно примерно 0,1 мг/мл - 10 мг/мл. В еще одном конкретном варианте изобретения раствор GLP-1 имеет концентрацию примерно 0,25 мг/мл.In other specific embodiments of the invention, the GLP-1 solution has a concentration of about 1 μg / ml to 50 mg / ml, more preferably about 0.1 mg / ml to 10 mg / ml. In yet another specific embodiment of the invention, the GLP-1 solution has a concentration of about 0.25 mg / ml.
Другой способ получения частиц, содержащих молекулу GLP-1 и дикетопиперазин, также включает добавление агента в раствор, где указанный агент выбран из солей, поверхностно-активных веществ, ионов, осмолитов, хаотропов и лиотропов, кислоты, основания и органических растворителей. Такой агент стимулирует ассоциацию частиц GLP-1 и дикетопиперазина, а также повышает стабильность и/или улучшает фармакодинамику молекулы GLP-1. В некоторых вариантах изобретения указанным агентом является соль, такая как, но не ограничивающаяся ею, хлорид натрия. Также рассматривается, что указанным агентом может быть поверхностно-активное вещество, такое как, но не ограничивающееся ими, твин, тритон, плюроновая кислота, CHAPS, цетримид и Brij, H(CH2)7SO4Na. Таким агентом может быть ион, например катион или анион. Указанным агентом может быть осмолит (стабилизатор), такой как, но не ограничивающийся ими, гексилен-гликоль (Hex-Gly), трегалоза, глицин, полиэтиленгликоль (ПЭГ), N-оксид триметиламина (TMAO), маннит и пролин. Указанным агентом может быть хаотроп или лиотроп, такой как, но не ограничивающийся ими, хлорид цезия, цитрат натрия и сульфат натрия. Указанным агентом может быть органический растворитель, например спирт, выбранный из метанола (MeOH), этанола (EtOH), трифторэтанола (TFE) и гексафторизопропанола (HFIP).Another method for preparing particles containing the GLP-1 molecule and diketopiperazine also involves adding the agent to a solution, wherein said agent is selected from salts, surfactants, ions, osmolytes, chaotropes and lyotropes, acids, bases, and organic solvents. Such an agent stimulates the association of GLP-1 particles and diketopiperazine, and also increases stability and / or improves the pharmacodynamics of the GLP-1 molecule. In some embodiments of the invention, said agent is a salt, such as, but not limited to, sodium chloride. It is also contemplated that the agent may be a surfactant such as, but not limited to, tween, triton, pluronic acid, CHAPS, cetrimide, and Brij, H (CH 2 ) 7 SO 4 Na. Such an agent may be an ion, for example a cation or anion. The specified agent may be an osmolite (stabilizer), such as, but not limited to, hexylene glycol (Hex-Gly), trehalose, glycine, polyethylene glycol (PEG), trimethylamine N-oxide (TMAO), mannitol and proline. The specified agent may be a chaotrope or lyotropic, such as, but not limited to, cesium chloride, sodium citrate and sodium sulfate. The agent may be an organic solvent, for example an alcohol selected from methanol (MeOH), ethanol (EtOH), trifluoroethanol (TFE) and hexafluoroisopropanol (HFIP).
В другом своем конкретном варианте настоящее изобретение относится к способу получения частиц, содержащих молекулу GLP-1 и дикетопиперазин, где указанный способ включает доведение pH суспензии частиц до значения, составляющего примерно 4 или более. В других своих вариантах настоящее изобретение относится к способу получения частиц, содержащих молекулу GLP-1 и дикетопиперазин, где указанная молекула GLP-1 в данных частицах имеет более высокую стабильность.In another specific embodiment, the present invention relates to a method for producing particles containing a GLP-1 molecule and diketopiperazine, wherein said method comprises adjusting the pH of the suspension of particles to a value of about 4 or more. In other embodiments, the present invention relates to a method for producing particles containing a GLP-1 molecule and diketopiperazine, wherein said GLP-1 molecule in these particles has higher stability.
В настоящем изобретении также рассматривается способ введения эффективного количества молекулы GLP-1 индивидууму, нуждающемуся в этом, где указанный способ включает введение индивидууму частиц GLP-1/дикетопиперазина. Такими способами введения могут быть, но не ограничиваются ими, внутривенное, подкожное, пероральное, интраназальное, трансбуккальное, ректальное или внутрилегочное введение. В одном из вариантов изобретения указанным способом введения является внутрилегочное введение. В другом варианте изобретения указанный способ введения осуществляют для лечения состояния или заболевания, выбранного из группы, состоящей из диабета, ишемии, реперфузионного поражения ткани, дислипидемии, диабетической кардиомиопатии, инфаркта миокарда, острого коронарного синдрома, ожирения, катаболических изменений после хирургического вмешательства, гипергликемии, синдрома раздраженного кишечника, инсульта, нейродегенеративных расстройств, расстройства памяти и нарушения познавательных способностей и состояний, связанных с имплантацией островковых клеток и регенеративной терапией.The present invention also contemplates a method for administering an effective amount of a GLP-1 molecule to an individual in need thereof, wherein said method comprises administering to the individual GLP-1 / diketopiperazine particles. Such methods of administration may include, but are not limited to, intravenous, subcutaneous, oral, intranasal, buccal, rectal or intrapulmonary administration. In one embodiment of the invention, said method of administration is intrapulmonary administration. In another embodiment of the invention, the indicated method of administration is carried out to treat a condition or disease selected from the group consisting of diabetes, ischemia, reperfusion tissue damage, dyslipidemia, diabetic cardiomyopathy, myocardial infarction, acute coronary syndrome, obesity, catabolic changes after surgery, hyperglycemia, irritable bowel syndrome, stroke, neurodegenerative disorders, memory disorders and cognitive impairment and conditions associated with and islet cell implantation and regenerative therapy.
В другом варианте изобретения способ введения композиции частиц GLP-1/дикетопиперазина позволяет улучшить фармакокинетику, увеличить время полужизни и улучшить биологическую доступность GLP-1.In another embodiment of the invention, a method of administering a composition of GLP-1 / diketopiperazine particles can improve pharmacokinetics, increase half-life, and improve bioavailability of GLP-1.
В еще одном своем конкретном варианте настоящее изобретение относится к способу получения сухой порошкообразной композиции с улучшенным фармакокинетическим профилем, где указанный способ включает стадии: получения раствора молекулы GLP-1; получения дикетопиперазина, образующего частицы; образования частиц; и объединения GLP-1 и дикетопиперазина; а затем удаления растворителя методом сушки с получением сухого порошка, где указанный сухой порошок имеет улучшенный фармакокинетический профиль. Термин «улучшенный фармакокинетический профиль» означает более длительное время полужизни GLP-1 и/или улучшенную биологическую доступность GLP-1. Такое более длительное время полужизни GLP-1 составляет 7,5 минут или более.In another specific embodiment, the present invention relates to a method for producing a dry powder composition with an improved pharmacokinetic profile, wherein said method comprises the steps of: obtaining a solution of a GLP-1 molecule; obtaining diketopiperazin, forming particles; particle formation; and combining GLP-1 and diketopiperazine; and then removing the solvent by drying to obtain a dry powder, wherein said dry powder has an improved pharmacokinetic profile. The term "improved pharmacokinetic profile" means a longer half-life of GLP-1 and / or improved bioavailability of GLP-1. Such a longer half-life of GLP-1 is 7.5 minutes or more.
В одном из своих вариантов настоящее изобретение относится к получению сухой порошкообразной композиции, содержащей молекулу GLP-1 и дикетопиперазин или их фармацевтически приемлемую соль. В другом варианте изобретения молекула GLP-1 выбрана из группы, состоящей из нативных GLP-1; метаболитов GLP-1; aналогов GLP-1; производных GLP-1; GLP-1, защищенных от действия дипептидил-пептидазы IV (DPP-IV); GLP-1-миметиков; аналогов пептида GLP-1 или биосинтетических аналогов GLP-1.In one embodiment, the present invention relates to a dry powder composition comprising a GLP-1 molecule and diketopiperazine or a pharmaceutically acceptable salt thereof. In another embodiment of the invention, the GLP-1 molecule is selected from the group consisting of native GLP-1; metabolites of GLP-1; analogs of GLP-1; GLP-1 derivatives; GLP-1 protected against the effects of dipeptidyl peptidase IV (DPP-IV); GLP-1 mimetics; GLP-1 peptide analogues or GLP-1 biosynthetic analogues.
В другом варианте изобретения указанный дикетопиперазин представляет собой дикетопиперазин, имеющий формулу 2,5-дикето-3,6-ди(4-X-аминобутил)пиперазин, где X выбран из группы, состоящей из сукцинила, глутарила, малеила и фумарила. В другом варианте изобретения указанным дикетопиперазином является соль дикетопиперазина. В другом варианте изобретения указанным дикетопиперазином является 2,5-дикето-3,6-ди-(4-фумарил-аминобутил)пиперазин.In another embodiment of the invention, said diketopiperazine is diketopiperazine having the
В одном из вариантов изобретения молекула GLP-1 представляет собой нативный GLP-1. В другом варианте изобретения молекула GLP-1 представляет собой амидированную молекулу GLP-1. В другом варианте изобретения указанной амидированной молекулой GLP-1 является амид GLP-1(7-36).In one embodiment, the GLP-1 molecule is native GLP-1. In another embodiment, the GLP-1 molecule is an amidated GLP-1 molecule. In another embodiment of the invention, said amidated GLP-1 molecule is GLP-1 amide (7-36).
В одном из своих вариантов настоящее изобретение относится к способу получения частиц, содержащих молекулу GLP-1 и дикетопиперазин, где указанный способ включает стадии: получения молекулы GLP-1; получения дикетопиперазина в форме, выбранной из дикетопиперазина, образующего частицы, дикетопиперазиновых частиц и их комбинаций; и объединения молекулы GLP-1 и дикетопиперазина в форме сораствора, где образуются частицы, содержащие молекулу GLP-1 и дикетопиперазин.In one of its variants, the present invention relates to a method for producing particles containing a GLP-1 molecule and diketopiperazine, where the specified method includes the steps of: obtaining a GLP-1 molecule; obtaining diketopiperazine in a form selected from diketopiperazine forming particles, diketopiperazine particles and combinations thereof; and combining the GLP-1 molecule and diketopiperazine in the form of a co-solution where particles containing the GLP-1 molecule and diketopiperazine are formed.
В одном из вариантов изобретения указанный способ также включает удаление растворителя из указанного сораствора путем лиофилизации, фильтрации или сушки распылением. В другом варианте изобретения частицы, содержащие указанную молекулу GLP-1 и дикетопиперазин, образуются при удалении растворителя. В другом варианте изобретения частицы, содержащие указанную молекулу GLP-1 и дикетопиперазин, образуются перед удалением растворителя.In one embodiment of the invention, said method also includes removing the solvent from said co-solution by lyophilization, filtration, or spray drying. In another embodiment of the invention, particles containing said GLP-1 molecule and diketopiperazine are formed when the solvent is removed. In another embodiment of the invention, particles containing said GLP-1 molecule and diketopiperazine are formed before solvent removal.
В другом варианте изобретения молекула GLP-1 выбрана из группы, состоящей из нативного GLP-1, aналога GLP-1, производного GLP-1, GLP-1, защищенного от действия дипептидил-пептидазы IV (DPP-IV), GLP-1-миметика, аналога пептида GLP-1 или биосинтетического аналога GLP-1. В другом варианте изобретения молекулу GLP-1 получают в виде раствора, содержащего GLP-1 в концентрации примерно 1 мкг/мл - 50 мг/мл. В другом варианте изобретения молекулу GLP-1 получают в виде раствора, содержащего GLP-1 в концентрации примерно 0,1 мг/мл - 10 мг/мл. В другом варианте изобретения молекулу GLP-1 получают в виде раствора, содержащего GLP-1 в концентрации примерно 0,25 мг/мл.In another embodiment of the invention, the GLP-1 molecule is selected from the group consisting of native GLP-1, an analog of GLP-1, a derivative of GLP-1, GLP-1, protected against the effects of dipeptidyl peptidase IV (DPP-IV), GLP-1- mimetic, GLP-1 peptide analogue or GLP-1 biosynthetic analogue. In another embodiment of the invention, the GLP-1 molecule is obtained in the form of a solution containing GLP-1 at a concentration of about 1 μg / ml - 50 mg / ml. In another embodiment of the invention, the GLP-1 molecule is obtained in the form of a solution containing GLP-1 at a concentration of about 0.1 mg / ml - 10 mg / ml. In another embodiment, the GLP-1 molecule is prepared as a solution containing GLP-1 at a concentration of about 0.25 mg / ml.
В другом варианте изобретения дикетопиперазин получают в форме суспензии дикетопиперазиновых частиц. В другом варианте изобретения дикетопиперазин получают в форме раствора, содержащего образующий частицы дикетопиперазин, где указанный способ также включает доведение рН раствора до значения, благоприятствующего образованию дикетопиперазиновых частиц. В другом варианте изобретения указанный способ также включает добавление агента в указанный раствор или суспензию, где указанный агент выбран из группы, состоящей из солей, поверхностно-активных веществ, ионов, осмолитов, хаотропов и лиотропов, кислот, оснований и органических растворителей. В другом варианте изобретения указанный агент стимулирует ассоциацию молекулы GLP-1 и дикетопиперазиновых частиц или дикетопиперазина, образующего частицы. В другом варианте изобретения указанный агент повышает стабильность или улучшает фармакодинамику молекулы GLP-1. В другом варианте изобретения указанным агентом является хлорид натрия.In another embodiment of the invention, diketopiperazine is obtained in the form of a suspension of diketopiperazine particles. In another embodiment of the invention, diketopiperazine is prepared in the form of a solution containing the particle-forming diketopiperazine, wherein said method also comprises adjusting the pH of the solution to a value favorable for the formation of diketopiperazine particles. In another embodiment of the invention, said method also includes adding an agent to said solution or suspension, wherein said agent is selected from the group consisting of salts, surfactants, ions, osmolytes, chaotropes and lyotropes, acids, bases and organic solvents. In another embodiment of the invention, said agent stimulates the association of a GLP-1 molecule and diketopiperazine particles or diketopiperazine forming particles. In another embodiment of the invention, said agent increases stability or improves the pharmacodynamics of the GLP-1 molecule. In another embodiment of the invention, said agent is sodium chloride.
В другом варианте изобретения указанный способ также включает коррекцию рН суспензии или раствора. В другом варианте изобретения указанный способ также включает доведение рН примерно до 4,0 или более. В еще одном варианте изобретения молекула GLP-1, присутствующая в частице, является более стабильной, чем нативный GLP-1.In another embodiment of the invention, said method also includes adjusting the pH of the suspension or solution. In another embodiment of the invention, said method also includes adjusting the pH to about 4.0 or more. In yet another embodiment of the invention, the GLP-1 molecule present in the particle is more stable than native GLP-1.
В другом варианте изобретения указанный сораствор содержит GLP-1 в концентрации примерно 1 мкг/мл - 50 мг/мл. В другом варианте изобретения указанный сораствор содержит GLP-1 в концентрации примерно 0,1 мг/мл - 10 мг/мл. В другом варианте изобретения указанный сораствор содержит молекулу GLP-1 в концентрации примерно 0,25 мг/мл.In another embodiment of the invention, said co-solution contains GLP-1 at a concentration of about 1 μg / ml to about 50 mg / ml. In another embodiment of the invention, said co-solution contains GLP-1 at a concentration of about 0.1 mg / ml to 10 mg / ml. In another embodiment of the invention, said co-solution comprises a GLP-1 molecule at a concentration of about 0.25 mg / ml.
В другом варианте изобретения указанный способ также включает добавление агента в сораствор, где указанный агент выбран из группы, состоящей из солей, поверхностно-активных веществ, ионов, осмолитов, хаотропов и лиотропов, кислот, оснований и органических растворителей. В другом варианте изобретения указанный агент стимулирует ассоциацию молекулы GLP-1 и дикетопиперазиновых частиц или дикетопиперазина, образующего частицы. В другом варианте изобретения указанный агент повышает стабильность или улучшает фармакодинамику молекулы GLP-1. В другом варианте изобретения указанным агентом является хлорид натрия.In another embodiment of the invention, said method also includes adding an agent to a co-solution, wherein said agent is selected from the group consisting of salts, surfactants, ions, osmolytes, chaotropes and lyotropes, acids, bases and organic solvents. In another embodiment of the invention, said agent stimulates the association of a GLP-1 molecule and diketopiperazine particles or diketopiperazine forming particles. In another embodiment of the invention, said agent increases stability or improves the pharmacodynamics of the GLP-1 molecule. In another embodiment of the invention, said agent is sodium chloride.
В другом варианте изобретения указанный способ также включает коррекцию рН сораствора. В другом варианте изобретения указанный способ также включает доведение рН примерно до 4,0 или более.In another embodiment of the invention, said method also includes adjusting the pH of the co-solution. In another embodiment of the invention, said method also includes adjusting the pH to about 4.0 or more.
В одном из своих вариантов настоящее изобретение относится к способу введения эффективного количества молекулы GLP-1 индивидууму, нуждающемуся в этом, где указанный способ включает введение указанному индивидууму частиц, содержащих GLP-1 и дикетопиперазин. В другом варианте изобретения указанный способ осуществляют путем внутривенного, подкожного, перорального, интраназального, трансбуккального, ректального или внутрилегочного введения. В другом варианте изобретения указанный способ осуществляют путем внутрилегочного введения.In one embodiment, the present invention provides a method for administering an effective amount of a GLP-1 molecule to an individual in need thereof, wherein said method comprises administering to said individual particles containing GLP-1 and diketopiperazine. In another embodiment of the invention, the method is carried out by intravenous, subcutaneous, oral, intranasal, buccal, rectal or intrapulmonary administration. In another embodiment of the invention, the method is carried out by intrapulmonary administration.
В другом варианте изобретения указанный способ осуществляют для лечения состояния или заболевания, выбранного из группы, состоящей из диабета, ишемии, реперфузионного поражения ткани, дислипидемии, диабетической кардиомиопатии, инфаркта миокарда, острого коронарного синдрома, ожирения, катаболических изменений после хирургического вмешательства, гипергликемии, синдрома раздраженного кишечника, инсульта, нейродегенеративных расстройств, расстройства памяти и нарушения познавательных способностей и состояний, связанных с имплантацией островковых клеток и регенеративной терапией.In another embodiment of the invention, the method is carried out for the treatment of a condition or disease selected from the group consisting of diabetes, ischemia, reperfusion tissue damage, dyslipidemia, diabetic cardiomyopathy, myocardial infarction, acute coronary syndrome, obesity, catabolic changes after surgery, hyperglycemia, syndrome irritable bowel, stroke, neurodegenerative disorders, memory disorders and impaired cognitive abilities and conditions associated with implantation she islet cells and regenerative therapy.
В другом варианте изобретения введение указанных частиц, по сравнению с введением нативного GLP-1, приводит к улучшению фармакокинетики, увеличению времени полужизни и улучшению биологической доступности GLP-1.In another embodiment of the invention, the introduction of these particles, compared with the introduction of native GLP-1, leads to improved pharmacokinetics, increased half-life and improved bioavailability of GLP-1.
В одном из своих вариантов настоящее изобретение относится к способу получения порошкообразной композиции с улучшенным фармакокинетическим профилем GLP-1, где указанный способ включает стадии: получения молекулы GLP-1; получения дикетопиперазина, образующего частицы в растворе; образования частиц дикетопиперазина; объединения молекулы GLP-1 и раствора с образованием сораствора; и удаления растворителя из сораствора путем сушки распылением с получением порошка, имеющего улучшенный фармакокинетический профиль GLP-1.In one of its variants, the present invention relates to a method for producing a powder composition with an improved pharmacokinetic profile of GLP-1, wherein said method includes the steps of: obtaining a GLP-1 molecule; obtaining diketopiperazine, forming particles in solution; particle formation of diketopiperazine; combining a GLP-1 molecule and a solution to form a co-solution; and removing the solvent from the co-solution by spray drying to obtain a powder having an improved pharmacokinetic profile of GLP-1.
В другом варианте изобретения указанный улучшенный фармакокинетический профиль GLP-1 включает более длительное время полужизни GLP-1. В другом варианте изобретения более длительное время полужизни GLP-1 составляет 7,5 минут или более. В другом варианте изобретения указанный улучшенный фармакокинетический профиль GLP-1 включает улучшенную биологическую доступность GLP-1 по сравнению с нативным GLP-1.In another embodiment of the invention, said improved pharmacokinetic profile of GLP-1 includes a longer half-life of GLP-1. In another embodiment of the invention, the longer half-life of GLP-1 is 7.5 minutes or more. In another embodiment of the invention, said improved GLP-1 pharmacokinetic profile includes improved bioavailability of GLP-1 compared to native GLP-1.
Краткое описание графического материалаA brief description of the graphic material
Нижеследующий графический материал составляет часть описания настоящей заявки и включает некоторые другие аспекты настоящего изобретения. Настоящее изобретение будет более понятным из нижеследующего описания со ссылками на одну или несколько иллюстраций в сочетании с подробным описанием представленных здесь конкретных вариантов осуществления изобретения.The following graphic is part of the description of this application and includes some other aspects of the present invention. The present invention will be better understood from the following description with reference to one or more illustrations in combination with the detailed description of the specific embodiments of the invention presented here.
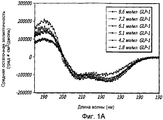
Фиг. 1A-1D. Структурный анализ GLP-1 при различных концентрациях (pH 4, 20°С). Фиг. 1A - Круговой дихроизм (КД) в далекой области УФ-излучения GLP-1 показал, что по мере увеличения концентрации вторичная структура пептида трансформируется в основном из неструктурированной конформации в спиральную конформацию. Фиг. 1B - КД в ближнем УФ показал, что степень третичной структуры увеличивается с увеличением концентрации пептида, что позволяет предположить, что GLP-1 подвергается самосборке. Фиг. 1С - Флуоресцентное излучение GLP-1 при различных концентрациях (pH 4, 20°С), возникающее в результате возбуждения триптофана на 280 нм. Фиг. 1D - Просвечивающая инфракрасная Фурье-спектроскопия (FTIR) GLP-1 при различных концентрациях (pH 4, 20°С). Полоса амида I при 1656 см-1 указывает на то, что GLP-1 имеет α-спиральную структуру при концентрациях ≥ 2 мг/мл.FIG. 1A-1D. Structural analysis of GLP-1 at various concentrations (
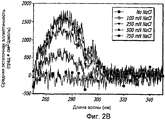
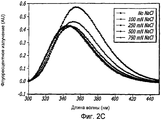
Фиг. 2A-2D. Структурный анализ GLP-1 при низких концентрациях и при варьирующейся ионной силе (pH 4, 20°С). Фиг. 2A - КД в далекой области УФ-излучения GLP-1 при 1,0 мг/мл показал, что при возрастании концентрации соли неупорядоченная структура GLP-1 превращается в более упорядоченные α-спиральные структуры. Фиг. 2B - КД в ближней области УФ-излучения пептида при 1,0 мг/мл показал, что при возрастании концентрации NaCl также наблюдалась тенденция к увеличению степени третичной структуры GLP-1. Фиг. 2C - Собственное флуоресцентное излучение GLP-1 в концентрации 1,0 мг/мл при варьирующихся концентрациях NaCl (pH 4, 20°С) после возбуждения триптофана на 280 нм. При высоких концентрациях пептида максимальное значение интенсивности снижается и сдвигается в сторону более низкой длины волны, что указывает на присутствие хорошо определенной третичной структуры. Фиг. 2D - Анализ третичной структуры GLP-1 в концентрации 10 мг/мл при варьирующейся ионной силе (pH 4, 20°С). КД в ближней области спектра УФ-излучения показал, что с увеличением ионной силы увеличивается степень третичной структуры GLP-1, подвергаемого самосборке.FIG. 2A-2D. Structural analysis of GLP-1 at low concentrations and with varying ionic strength (
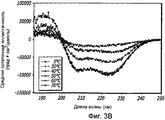
Фиг. 3A-3B. Структурный анализ 10 мг/мл GLP-1 при различных температурах (pH 4). Фиг. 3A - КД в ближнем УФ показал, что олигомеры GLP-1 диссоциируются с увеличением температуры. Фиг. 3B - Структурный анализ 10 мг/мл GLP-1 при различных температурах (pH 4). Фиг. 3C - Структурный анализ 0,05 мг/мл GLP-1 при различных температурах (pH 4). КД в далеком УФ показал, что данный пептид не чувствителен к изменению температуры.FIG. 3A-3B. Structural analysis of 10 mg / ml GLP-1 at various temperatures (pH 4). FIG. 3A - Near-UV CD showed that GLP-1 oligomers dissociate with increasing temperature. FIG. 3B - Structural analysis of 10 mg / ml GLP-1 at various temperatures (pH 4). FIG. 3C - Structural analysis of 0.05 mg / ml GLP-1 at various temperatures (pH 4). CD in the far UV showed that this peptide is not sensitive to temperature changes.
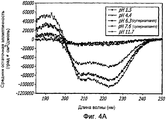
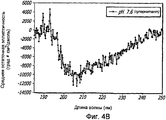
Фиг. 4A-4B. Структурный анализ GLP-1 при варьирующихся pH (20°С). Фиг. 4A - КД в далеком УФ GLP-1 в концентрации 10 мг/мл при варьирующихся pH (20°С). По мере увеличения pH GLP-1, подвергнутый самосборке, осаждается при pH 6,3-7,6, но сохраняет спиральную структуру при 1,5 и 11,7. Фиг. 4B - Уширение спектра при pH 7,6 показало, что при снижении концентрации вторичная структура GLP-1 становится неупорядоченной.FIG. 4A-4B. Structural analysis of GLP-1 at varying pH (20 ° C). FIG. 4A - CD in the far UV GLP-1 at a concentration of 10 mg / ml at varying pH (20 ° C). As the pH increases, self-assembled GLP-1 precipitates at a pH of 6.3–7.6, but retains a spiral structure at 1.5 and 11.7. FIG. 4B - Spectrum broadening at pH 7.6 showed that as the concentration decreases, the secondary structure of GLP-1 becomes disordered.
Фиг. 5. Резистентность GLP-1 в концентрации 1 мг/мл к дезамидированию и окислению была продемонстрирована с помощью ЖХВД. Условия дезамидирования были достигнуты путем инкубирования GLP-1 при pH 10,5 в течение 5 дней при 40°С. Окислительные условия были достигнуты путем инкубирования GLP-1 в 0,1 % H2O2 в течение 2 часов при комнатной температуре.FIG. 5. The resistance of GLP-1 at a concentration of 1 mg / ml to deamidation and oxidation was demonstrated by HPLC. Deamidation conditions were achieved by incubating GLP-1 at pH 10.5 for 5 days at 40 ° C. Oxidative conditions were achieved by incubating GLP-1 in 0.1% H 2 O 2 for 2 hours at room temperature.
Фиг. 6A-6B. Влияние перемешивания на третичную структуру GLP-1 при концентрациях 1,5 и 9,4 мг/мл (pH 4). КД в ближнем УФ (фиг. 6A) и флуоресцентное излучение GLP-1 (фиг. 6B) показали, что третичная структура пептида GLP-1 не подвергается каким-либо значительным изменениям при перемешивании. Образцы перемешивали в течение 30 и 90 минут при комнатной температуре и после возбуждения триптофана на 280 нм получали спектры флуоресцентного излучения.FIG. 6A-6B. The effect of mixing on the tertiary structure of GLP-1 at concentrations of 1.5 and 9.4 mg / ml (pH 4). Near-UV CDs (FIG. 6A) and GLP-1 fluorescence (FIG. 6B) showed that the tertiary structure of the GLP-1 peptide does not undergo any significant changes with stirring. The samples were mixed for 30 and 90 minutes at room temperature, and after excitation of tryptophan at 280 nm, fluorescence emission spectra were obtained.
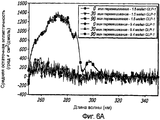
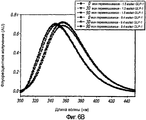
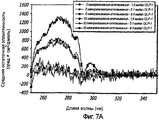
Фиг. 7A-7C. Влияние 10 циклов «замораживания - оттаивания» на третичную структуру GLP-1 при концентрациях 1,6, 5,1 и 8,4 мг/мл (pH 4). КД в ближнем УФ (фиг. 7A) и флуоресцентное излучение GLP-1 (фиг. 7B) показали, что третичная структура данного пептида не подвергается каким-либо значительным изменениям при проведении множества циклов «замораживания - оттаивания». Образцы замораживали при -20°С и размораживали при комнатной температуре. После возбуждения триптофана на 280 нм получали спектры флуоресцентного излучения. Аналогичные эксперименты по влиянию 11 циклов «замораживания - оттаивания» на вторичную структуру GLP-1 (рН4) при концентрации 10 мг/мл были проведены методом КД в далеком УФ (фиг. 7C).FIG. 7A-7C. The effect of 10 freeze-thaw cycles on the tertiary structure of GLP-1 at concentrations of 1.6, 5.1 and 8.4 mg / ml (pH 4). Near-UV CDs (FIG. 7A) and GLP-1 fluorescence (FIG. 7B) showed that the tertiary structure of this peptide does not undergo any significant changes during many freeze-thaw cycles. Samples were frozen at -20 ° C and thawed at room temperature. After excitation of tryptophan at 280 nm, fluorescence emission spectra were obtained. Similar experiments on the effect of 11 freeze-thaw cycles on the secondary structure of GLP-1 (pH4) at a concentration of 10 mg / ml were carried out by CD in far UV (Fig. 7C).
Фиг. 8A-8B. Исследование солей. Кривые загрузки GLP-1/FDKP в зависимости от pH и концентрации NaCl (фиг. 8A). Загрузку осуществляли при 5 мг/мл FDKP и 0,25 мг/мл GLP-1. Концентрации NaCl выражали в мM. Фиг. 8B - Указано количество GLP-1, обнаруженное в разведенных контрольных образцах, не содержащих FDKP, в зависимости от pH и концентрации NaCl.FIG. 8A-8B. The study of salts. GLP-1 / FDKP loading curves as a function of pH and NaCl concentration (Fig. 8A). Download was carried out at 5 mg / ml FDKP and 0.25 mg / ml GLP-1. NaCl concentrations were expressed in mM. FIG. 8B — The amount of GLP-1 detected in diluted control samples containing no FDKP is indicated, depending on pH and NaCl concentration.
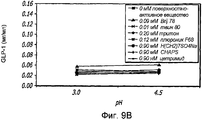
Фиг. 9A-9B. Исследование поверхностно-активных веществ. Кривые загрузки GLP-1/FDKP в зависимости от pH и поверхностно-активного вещества (фиг. 9A). Загрузку осуществляли при 5 мг/мл FDKP и 0,25 мг/мл GLP-1. Фиг. 9B - Указано количество GLP-1, обнаруженное в разведенных контрольных образцах, не содержащих FDKP, в зависимости от pH и добавленного поверхностно-активного вещества.FIG. 9A-9B. The study of surfactants. GLP-1 / FDKP loading curves versus pH and surfactant (Fig. 9A). Download was carried out at 5 mg / ml FDKP and 0.25 mg / ml GLP-1. FIG. 9B — The amount of GLP-1 detected in diluted control samples containing no FDKP is indicated, depending on pH and surfactant added.
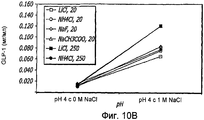
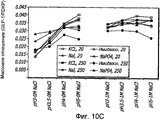
Фиг. 10A-10D. Исследование ионов. Кривые загрузки GLP-1/FDKP в зависимости от pH и ионов. Загрузку осуществляли при 5 мг/мл FDKP и 0,25 мг/мл GLP-1 (фиг.10А и 11С). Концентрации ионов указаны в надписях к графическому материалу (мМ). На кривых, расположенных справа, представлены результаты для 1 М NaCl. Фиг. 10В и 10D - Указано количество GLP-1, обнаруженное в разведенных контрольных образцах, не содержащих FDKP, в зависимости от pH, ионов и 1 М NaCl.FIG. 10A-10D. The study of ions. GLP-1 / FDKP loading curves as a function of pH and ions. Download was carried out at 5 mg / ml FDKP and 0.25 mg / ml GLP-1 (figa and 11C). Ion concentrations are indicated in the captions for the graphic material (mm). The curves on the right show the results for 1 M NaCl. FIG. 10B and 10D — The amount of GLP-1 detected in diluted control samples containing no FDKP, depending on pH, ions, and 1 M NaCl, is indicated.
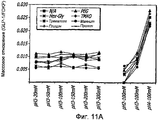
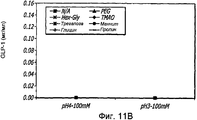
Фиг. 11-11В. Исследование осмолитов. Кривые загрузки GLP-1/FDKP в зависимости от pH и от присутствия общих стабилизаторов (осмолитов; фиг.11А). Загрузку осуществляли при 5 мг/мл FDKP и 0,25 мг/мл GLP-1. Фиг. 11В - Указано количество GLP-1, обнаруженное в разведенных контрольных образцах, не содержащих FDKP, в зависимости от pH и осмолитов. «N/A» означает отсутствие осмолитов в образце.FIG. 11-11B. The study of osmolites. GLP-1 / FDKP loading curves as a function of pH and the presence of common stabilizers (osmolytes; FIG. 11A). Download was carried out at 5 mg / ml FDKP and 0.25 mg / ml GLP-1. FIG. 11B — The amount of GLP-1 detected in diluted control samples containing no FDKP, depending on pH and osmolytes, is indicated. "N / A" means the absence of osmolytes in the sample.
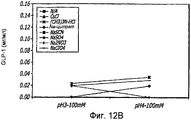
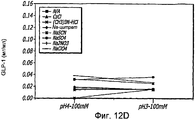
Фиг. 12A-12B. Исследование хаотропов/лиотропов. Кривые загрузки GLP-1/FDKP в зависимости от концентрации хаотропов или лиотропов при рН 3,0 (фиг.12А) и рН 4,0 (фиг. 12C). Загрузку осуществляли при 5 мг/мл FDKP и 0,25 мг/мл GLP-1. Фиг. 12В и 12D - Указано количество GLP-1, обнаруженное в разведенных контрольных образцах, не содержащих FDKP, в зависимости от pH в присутствии различных хаотропов или лиотропов. «N/A» означает отсутствие хаотропов или лиотропов в образце.FIG. 12A-12B. Study of chaotropes / lyotropes. GLP-1 / FDKP loading curves as a function of the concentration of chaotropes or lyotropes at pH 3.0 (FIG. 12A) and pH 4.0 (FIG. 12C). Download was carried out at 5 mg / ml FDKP and 0.25 mg / ml GLP-1. FIG. 12B and 12D — Indicated is the amount of GLP-1 found in diluted control samples not containing FDKP, depending on pH in the presence of various chaotropes or lyotropes. “N / A” means the absence of chaotropes or lyotropes in the sample.
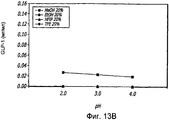
Фиг. 13A-13B. Исследование спиртов. Кривые загрузки GLP-1/FDKP в зависимости от pH и от спиртов. Загрузку осуществляли при 5 мг/мл FDKP и 0,25 мг/мл GLP-1. Были оценены четыре концентрации для каждого спирта, 5%, 10%, 15% и 20% об./об. (фиг. 13A). TFE=трифторэтанол; HFIP=гексафторизопропанол. Фиг. 13B - Указано количество GLP-1, обнаруженное в разведенных контрольных образцах, не содержащих FDKP, в зависимости от pH и спирта (20%).FIG. 13A-13B. The study of alcohols. GLP-1 / FDKP loading curves as a function of pH and alcohols. Download was carried out at 5 mg / ml FDKP and 0.25 mg / ml GLP-1. Four concentrations were evaluated for each alcohol, 5%, 10%, 15% and 20% v / v. (Fig. 13A). TFE = trifluoroethanol; HFIP = hexafluoroisopropanol. FIG. 13B — The amount of GLP-1 detected in diluted control samples containing no FDKP, depending on pH and alcohol (20%), is indicated.
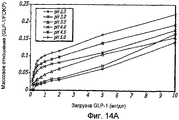
Фиг. 14A-14B. Исследование загрузки концентраций GLP-1/FDKP (фиг. 14A). Загрузку осуществляли при 5 мг/мл FDKP и анализируемую концентрацию GLP-1 откладывали по оси Х. Фиг. 14B - Изображения множества препаратов GLP-1/FDKP, полученные с помощью сканирующей электронной микроскопии (СЭМ) (при увеличении 10000x), указывают на образование скоплений сферических и палочкоподобных GLP-1/FDKP-частиц, используемых в качестве препаратов. (Панель A) - 0,5 мг/мл GLP-1 и 2,5 мг/мл FDKP; (панель B) 0,5 мг/мл GLP-1 и 10 мг/мл FDKP; (панель C) 0,5 мг/мл GLP-1 и 10 мг/мл FDKP в 20 мM хлорида натрия, 20 мM ацетата калия и 20 мM фосфата калия, pH 4,0; и (панель D) 10 мг/мл GLP-1 и 50 мг/мл FDKP в 20 мМ хлорида натрия, 20 мM ацетата калия и 20 мM фосфата калия, pH 4,0.FIG. 14A-14B. A study of loading concentrations of GLP-1 / FDKP (Fig. 14A). Loading was carried out at 5 mg / ml FDKP and the assayed concentration of GLP-1 was laid on the X axis. FIG. 14B - Images of a plurality of GLP-1 / FDKP preparations obtained by scanning electron microscopy (SEM) (at 10,000x) indicate the formation of clusters of spherical and rod-like GLP-1 / FDKP particles used as preparations. (Panel A) - 0.5 mg / ml GLP-1 and 2.5 mg / ml FDKP; (panel B) 0.5 mg / ml GLP-1 and 10 mg / ml FDKP; (panel C) 0.5 mg / ml GLP-1 and 10 mg / ml FDKP in 20 mM sodium chloride, 20 mM potassium acetate and 20 mM potassium phosphate, pH 4.0; and (panel D) 10 mg / ml GLP-1 and 50 mg / ml FDKP in 20 mM sodium chloride, 20 mM potassium acetate and 20 mM potassium phosphate, pH 4.0.
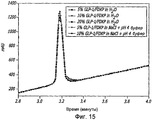
Фиг. 15. Показано влияние стресса на множество препаратов GLP-1/FDKP. Указано процентное содержание (по массе) GLP-1 по отношению к частицам FDKP и к другим компонентам, которые присутствовали в растворе до лиофилизации. Образцы инкубировали в течение 10 дней при 40°С.FIG. 15. The effect of stress on many GLP-1 / FDKP preparations is shown. The percentage (by weight) of GLP-1 is indicated with respect to the FDKP particles and to other components that were present in the solution prior to lyophilization. Samples were incubated for 10 days at 40 ° C.
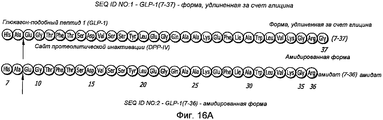
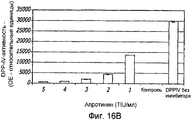
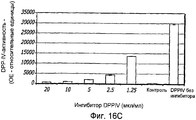
Фиг. 16A-16C. Структура GLP-1. Фиг. 16A - Показана удлиненная за счет глицина форма GLP-1 (SEQ ID NO.1) и амидированная форма (SEQ ID NO. 2). Фиг. 16B - Ингибирование DPP-IV-активности апротинином. Фиг. 16C - Ингибирование DPP-IV-активности ингибитором DPPIV.FIG. 16A-16C. GLP-1 structure. FIG. 16A — Glycine-elongated form GLP-1 (SEQ ID NO.1) and amidated form (SEQ ID NO. 2) are shown. FIG. 16B - Inhibition of DPP-IV activity by aprotinin. FIG. 16C - Inhibition of DPP-IV activity by a DPPIV inhibitor.
Фиг. 17. Обнаружение GLP-1 после инкубирования в легочном лаваже.FIG. 17. Detection of GLP-1 after incubation in pulmonary lavage.
Фиг. 18A-18B. Проиллюстрирована количественная оценка GLP-1 в плазме. На фиг. 18A проиллюстрирована количественная оценка при разведении 1:2 в плазме. На фиг. 18B проиллюстрирована количественная оценка при разведении 1:10 в плазме.FIG. 18A-18B. Plasma GLP-1 quantification is illustrated. In FIG. 18A illustrates a 1: 2 dilution in plasma. In FIG. 18B illustrates a quantitative estimate at a 1:10 dilution in plasma.
Фиг. 19A-19B. Влияние GLP-1 и аналогов GLP-1 на выживание клеток. Влияние GLP-1 на гибель эпителиальных клеток поджелудочной железы крыс (ARIP) (фиг. 19A). Окрашивание аннексином V указывало на ингибирование апоптоза в присутствии GLP-1 и стауроспорина (Stau), используемых в качестве отдельных средств и в комбинации (фиг. 19B). Концентрация GLP-1 составляет 15 нМ, а концентрация стауроспорина составляет 1 мкМ.FIG. 19A-19B. The effect of GLP-1 and GLP-1 analogues on cell survival. The effect of GLP-1 on the death of rat pancreatic epithelial cells (ARIP) (Fig. 19A). Annexin V staining indicated inhibition of apoptosis in the presence of GLP-1 and staurosporin (Stau), used as separate agents and in combination (Fig. 19B). The concentration of GLP-1 is 15 nM, and the concentration of staurosporine is 1 μM.
Фиг. 20. Влияние аналога GLP-1, экзендина-4, на жизнеспособность клеток. Клетки ARIP обрабатывали 0, 10, 20 и 40 нМ экзендина-4 в течение 16, 24 и 48 часов.FIG. 20. The effect of the GLP-1 analog, exendin-4, on cell viability. ARIP cells were treated with 0, 10, 20, and 40 nM exendin-4 for 16, 24, and 48 hours.
Фиг. 21. Влияние множества препаратов GLP-1/FDKP на индуцированную стауроспорином гибель клеток. Клетки ARIP, предварительно обработанные образцами GLP-1, подвергали воздействию 5 мкМ стауроспорина в течение 4 часов и анализировали с использованием реагента Cell Titer-GloTM на жизнеспособность клеток. Образцы помещали на 4 недели в условия стресса при 4°С и 40°С. Контрольные образцы, показанные справа (среда, GLP-1, STAU, GLP+STAU), иллюстрируют жизнеспособность клеток в среде (без GLP-1 или стауроспорина), в среде с GLP-1, в среде со стауроспорином и в среде с GLP-1 и стауроспорином (примечание: надписи на графике не относятся к контрольным образцам). Все результаты представлены как средние величины для трех экспериментов.FIG. 21. The effect of many GLP-1 / FDKP preparations on staurosporin-induced cell death. ARIP cells pretreated with GLP-1 samples were exposed to 5 μM staurosporin for 4 hours and analyzed using Cell Titer-Glo ™ reagent for cell viability. Samples were placed for 4 weeks under stress at 4 ° C and 40 ° C. The control samples shown on the right (medium, GLP-1, STAU, GLP + STAU) illustrate cell viability in the medium (without GLP-1 or staurosporine), in medium with GLP-1, in medium with staurosporine and in medium with GLP- 1 and staurosporin (note: the inscriptions on the graph do not apply to control samples). All results are presented as average values for three experiments.
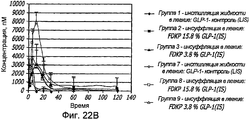
Фиг. 22A-22B. Фармакокинетические исследования, иллюстрирующие одну внутривенную инъекцию (i.v., фиг. 22A) и внутрилегочную инсуффляцию (i.s.; фиг. 22B) крысам с использованием различных концентраций препаратов GLP-1/FDKP. Указано процентное содержание (по массе) GLP-1 по отношению к частицам FDKP для анализируемых препаратов.FIG. 22A-22B. Pharmacokinetic studies illustrating single intravenous injection (i.v., FIG. 22A) and intrapulmonary insufflation (i.s .; FIG. 22B) in rats using various concentrations of GLP-1 / FDKP preparations. The percentage (by weight) of GLP-1 relative to the FDKP particles for the assayed preparations is indicated.
Фиг. 23A-23B. Снижение общего потребления пищи у крыс через 2 часа (фиг. 23A) и 6 часов (фиг. 23B) после введения им дозы препаратов GLP-1/FDKP.FIG. 23A-23B. The decrease in total food intake in rats after 2 hours (Fig. 23A) and 6 hours (Fig. 23B) after administration of a dose of GLP-1 / FDKP preparations.
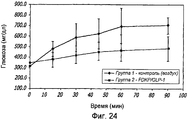
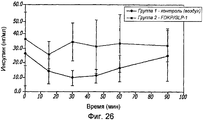
Фиг. 24. Фармакодинамические исследования GLP-1/FDKP, вводимого путем внутрилегочной инсуффляции самцам крыс, у которых было индуцировано ожирение в результате кормления их сахаром. Представлены данные измерения уровня глюкозы через 0, 15, 30, 45, 60 и 90 минут для контроля (воздух; группа 1) и для GLP-1/FDKP-обработанных животных (группа 2).FIG. 24. Pharmacodynamic studies of GLP-1 / FDKP administered by intrapulmonary insufflation in male rats that were induced obesity by feeding them sugar. Data on glucose measurements after 0, 15, 30, 45, 60 and 90 minutes for control (air; group 1) and for GLP-1 / FDKP-treated animals (group 2) are presented.
Фиг. 25. Фармакодинамические исследования GLP-1/FDKP, вводимого путем внутрилегочной инсуффляции самцам крыс, у которых было индуцировано ожирение в результате кормления их сахаром. Представлены данные измерения уровня GLP-1 через 0, 15, 30, 45, 60 и 90 минут для контроля (воздух; группа 1) и для GLP-1/FDKP-обработанных животных (группа 2).FIG. 25. Pharmacodynamic studies of GLP-1 / FDKP administered by intrapulmonary insufflation in male rats that were induced obesity by feeding them sugar. Data are presented for measuring the level of GLP-1 after 0, 15, 30, 45, 60 and 90 minutes for control (air; group 1) and for GLP-1 / FDKP-treated animals (group 2).
Фиг. 26. Фармакодинамические исследования GLP-1/FDKP, вводимого путем внутрилегочной инсуффляции самцам крыс, у которых было индуцировано ожирение в результате кормления их сахаром. Представлены данные измерения уровня инсулина через 0, 15, 30, 45, 60 и 90 минут для контроля (воздух; группа 1) и для GLP-1/FDKP-обработанных животных (группа 2).FIG. 26. Pharmacodynamic studies of GLP-1 / FDKP administered by intrapulmonary insufflation in male rats that were induced obesity by feeding them sugar. Data are presented for measuring insulin levels at 0, 15, 30, 45, 60, and 90 minutes for control (air; group 1) and for GLP-1 / FDKP-treated animals (group 2).
Фиг. 27. Фармакокинетические исследования GLP-1/FDKP различными концентрациями GLP-1, вводимыми самкам крыс путем внутрилегочной инсуффляции. Представлены данные измерения уровня GLP-1 через 0, 2, 5, 10, 20, 30, 40 и 60 минут для контроля (воздух; группа 1) и для GLP-1/FDKP-обработанных групп 2, 3 и 4, которым вводили 5%, 10% и 15% GLP-1 соответственно.FIG. 27. Pharmacokinetic studies of GLP-1 / FDKP with various concentrations of GLP-1 administered to female rats by intrapulmonary insufflation. The data of GLP-1 level measurement after 0, 2, 5, 10, 20, 30, 40 and 60 minutes are presented for control (air; group 1) and for GLP-1 / FDKP-treated
Фиг. 28. Фармакокинетические исследования GLP-1/FDKP с различными концентрациями GLP-1, вводимыми самкам крыс путем внутрилегочной инсуффляции. Данные измерения уровня FDKP через 0, 2, 5, 10, 20, 30, 40 и 60 минут для контроля (воздух; группа 1) и для GLP-1/FDKP-обработанных групп 2, 3 и 4, которым вводили 5%, 10% и 15% GLP-1 соответственно.FIG. 28. Pharmacokinetic studies of GLP-1 / FDKP with various concentrations of GLP-1 administered to female rats by intrapulmonary insufflation. FDKP level measurement data after 0, 2, 5, 10, 20, 30, 40 and 60 minutes for control (air; group 1) and for GLP-1 / FDKP-treated
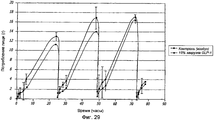
Фиг. 29. Фармакодинамические исследования GLP-1/FDKP у самок крыс, которым вводили GLP-1/FDKP, содержащий 15% GLP-1 (0,3 мг GLP-1), посредством внутрилегочной инсуффляции, проводимой один раз в день (n=10) 4 дня подряд. Полученные данные указывают на среднее потребление пищи, измеряемое перед введением дозы и через 1, 2, 4 и 6 часов после введения дозы 4 дня подряд.FIG. 29. Pharmacodynamic studies of GLP-1 / FDKP in female rats injected with GLP-1 / FDKP containing 15% GLP-1 (0.3 mg GLP-1) by intrapulmonary insufflation once daily (n = 10 ) 4 days in a row. The data obtained indicate the average food intake, measured before the dose and 1, 2, 4 and 6 hours after the dose for 4 days in a row.
Фиг. 30. Фармакодинамические исследования GLP-1/FDKP у самок крыс, которым вводили GLP-1/FDKP, содержащий 15% GLP-1 (0,3 мг GLP-1), посредством внутрилегочной инсуффляции, проводимой один раз в день (n=10) 4 дня подряд. Полученные данные указывают на среднюю массу тела, измеряемую перед введением дозы и через 1, 2, 4 и 6 часов после введения дозы 4 дня подряд.FIG. 30. Pharmacodynamic studies of GLP-1 / FDKP in female rats injected with GLP-1 / FDKP containing 15% GLP-1 (0.3 mg GLP-1) by intrapulmonary insufflation once daily (n = 10 ) 4 days in a row. The data obtained indicate the average body weight, measured before the dose and 1, 2, 4 and 6 hours after the dose for 4 consecutive days.
Фиг. 31. Токсикокинетические исследования GLP-1/FDKP у обезьян, которым ороназально вводили GLP-1/FDKP один раз в день (в течение 30 минут) 5 дней подряд. Полученные данные указывают на максимальные концентрации (Cmax) GLP-1 в плазме самцов и самок. Животным контрольной группы вводили воздух (группа 1), животным группы 2 вводили 2 мг/кг FDKP, а животным групп 3, 4 и 5 вводили 0,3, 1,0 или 2,0 мг/кг GLP-1/FDKP соответственно.FIG. 31. Toxicokinetic studies of GLP-1 / FDKP in monkeys who were oronasally administered GLP-1 / FDKP once a day (for 30 minutes) for 5 consecutive days. The data obtained indicate the maximum concentration (C max ) of GLP-1 in the plasma of males and females. The animals of the control group were injected with air (group 1), the animals of
Подробное описание предпочтительного варианта изобретенияDetailed Description of a Preferred Embodiment
В настоящее время не существует каких-либо стабильных и вводимых путем ингаляции препаратов, содержащих глюкагонподобный пептид 1 (GLP-1) и применяемых в качестве фармацевтических средств. Это обусловлено нестабильностью пептида GLP-1 in vivo. Соединения GLP-1 могут сохраняться в растворе в различных условиях, но они имеют относительно непродолжительное время полужизни in vivo при их введении в виде раствора. Кроме того, было обнаружено, что в различных биологических жидкостях, таких как легочная жидкость и кровь, присутствует дипептидил-пептидаза IV (DPP-IV), которая значительно снижает биологическое время полужизни молекул GLP-1. Так, например, было показано, что биологическое время полужизни GLP-l(7-37) составляет 3-5 минут, см. патент США No. 5118666. Было также показано, что GLP-1 быстро абсорбируется in vivo после парентерального введения. Аналогичным образом, время полужизни амида GLP-1(7-36), при его подкожном введении, составляет примерно 50 минут, см. также патент США No. 5118666.Currently, there are no stable and inhalable preparations containing glucagon-like peptide 1 (GLP-1) and used as pharmaceuticals. This is due to the instability of the GLP-1 peptide in vivo . GLP-1 compounds can remain in solution under various conditions, but they have a relatively short half-life in vivo when administered as a solution. In addition, it was found that dipeptidyl peptidase IV (DPP-IV) is present in various biological fluids, such as pulmonary fluid and blood, which significantly reduces the biological half-life of GLP-1 molecules. So, for example, it was shown that the biological half-life of GLP-l (7-37) is 3-5 minutes, see US patent No. 5118666. It was also shown that GLP-1 is rapidly absorbed in vivo after parenteral administration. Similarly, the half-life of amide GLP-1 (7-36), when administered subcutaneously, is about 50 minutes, see also U.S. Pat. 5118666.
Быстрый клиренс и непродолжительное время полужизни композиций GLP-1, как известно специалистам, представляет определенную проблему, которая может быть решена в соответствии с настоящим изобретением. Проблема, рассматриваемая в настоящем изобретении, может быть решена путем получения оптимизированной композиции, содержащей нативный GLP-1/FDKP (фумарилдикетопиперазин) и особенно подходящей для внутрилегочного введения. В одном из своих конкретных аспектов настоящее изобретение относится к препаратам нативной молекулы GLP-1, которая может вырабатывать GLP-1-ответ in vivo. Рассматривается также применение вариантов нативного GLP-1 в таких препаратах.The quick clearance and short half-life of the GLP-1 compositions, as known to those skilled in the art, present a certain problem that can be solved in accordance with the present invention. The problem discussed in the present invention can be solved by obtaining an optimized composition containing native GLP-1 / FDKP (fumaridicetopiperazine) and especially suitable for intrapulmonary administration. In one of its specific aspects, the present invention relates to preparations of a native GLP-1 molecule that can generate an GLP-1 response in vivo . The use of native GLP-1 variants in such preparations is also contemplated.
Для решения вышеуказанных проблем, с которыми сталкиваются специалисты в данной области, было разработано настоящее изобретение, относящееся к препаратам GLP-1 в комбинации с дикетопиперазиновыми (DKP) частицами. В конкретных вариантах изобретения индивидууму вводят препараты GLP-1/DKP. В других конкретных вариантах изобретения препараты GLP-1/DKP содержат, но не ограничиваются ими, фумарилдикетопиперазин (FDKP) и могут включать другие DKP (асимметрические DKP, xDKP), такие как 2,5-дикето-3,6-ди(4-сукцинил-аминобутил)пиперазин (SDKP), асимметрические дикетопиперазины, включая дикетопиперазины, замещенные только в одном положении на кольце DKP (например, аналоги FDKP «с одним плечом»), и соли DKP. В других конкретных вариантах изобретения введение препарата GLP-1/FDKP осуществляют путем внутрилегочной доставки.To solve the above problems faced by specialists in this field, the present invention was developed relating to GLP-1 preparations in combination with diketopiperazine (DKP) particles. In specific embodiments of the invention, GLP-1 / DKP preparations are administered to an individual. In other specific embodiments of the invention, GLP-1 / DKP preparations contain, but are not limited to, fumaryldiketopiperazine (FDKP) and may include other DKP (asymmetric DKP, xDKP), such as 2,5-diketo-3,6-di (4- succinyl-aminobutyl) piperazine (SDKP), asymmetric diketopiperazines, including diketopiperazines substituted at only one position on the DKP ring (for example, FDKP “one-arm” analogs), and DKP salts. In other specific embodiments of the invention, the administration of GLP-1 / FDKP is carried out by intrapulmonary delivery.
При разработке терапевтических препаратов молекул GLP-1 структурные свойства GLP-1 в растворе оценивали с применением различных биофизических и аналитических методов, которыми являются круговой дихроизм в далекой области УФ-излучения (КД в далеком УФ), круговой дихроизм в ближней области УФ-излучения (КД в ближнем УФ), собственная флуоресценция, инфракрасная Фурье-спектроскопия (FTIR), жидкостная хроматография высокого давления (ЖХВД) и масс-спектроскопия (МС). Метод кругового дихроизма (КД) представляет собой ценный инструмент, используемый для анализа структурных изменений белка в различных экспериментальных условиях и хорошо известный специалистам. Экспериментальными условиями, при которых были проведены данные анализы, являются: концентрация, ионная сила, температура, рН, оксилительный стресс, перемешивание и множество циклов «замораживания - оттаивания», влияющие на пептид GLP-1. Такие анализы были разработаны для характеризации основных путей разложения, а также для определения условий, которые влияют на структуру пептида GLP-1, в целях получения предпочтительных препаратов GLP-1/DKP, имеющих желательные фармакокинетические (ФК) и фармакодинамические (ФД) свойства.When developing therapeutic preparations of GLP-1 molecules, the structural properties of GLP-1 in solution were evaluated using various biophysical and analytical methods, which are circular dichroism in the far UV region (CD in far UV), circular dichroism in the near UV region ( Near-UV CD), intrinsic fluorescence, infrared Fourier spectroscopy (FTIR), high-pressure liquid chromatography (HPLC) and mass spectroscopy (MS). The circular dichroism (CD) method is a valuable tool used to analyze structural changes in a protein under various experimental conditions and is well known in the art. The experimental conditions under which these analyzes were carried out are: concentration, ionic strength, temperature, pH, oxidative stress, mixing and many freeze-thaw cycles that affect the GLP-1 peptide. Such assays have been developed to characterize the main degradation pathways, as well as to determine conditions that affect the structure of the GLP-1 peptide, in order to obtain preferred GLP-1 / DKP preparations having the desired pharmacokinetic (PK) and pharmacodynamic (PD) properties.
Наблюдения показали, что по мере увеличения концентрации GLP-1 вторичная структура пептида трансформируется в основном из неструктурированной конформации в более упорядоченную спиральную конформацию. Увеличение ионной силы в растворе приводит к увеличению степени указанной структуры GLP-1 до его обратимого осаждения. Присутствие NaCl повышает степень третичной структуры GLP-1, на что указывает увеличение интенсивности полос КД в ближнем УФ, как показано на фиг. 2D. Это происходит даже при низких концентрациях пептида, при которых не обнаруживается самосборка. Увеличение ионной силы способствует быстрому превращению неструктурированного GLP-1 в альфа-спиральную форму, на что указывают сдвиги минимумов при КД в далеком УФ в сторону длин волн 208 нм и 222 нм (фиг. 2A), и самоассоциирующуюся конформацию, на что указывают сдвиги излучения триптофана в направлении более коротких длин волн по мере увеличения концентрации соли и картины КД в ближнем УФ, как показано на фиг. 2B и 2D. Температура и pH различным образом влияют на конформацию GLP-1, при этом неупорядоченная структура GLP-1 не изменяется под действием любого из этих параметров. С другой стороны, было обнаружено, что самоассоциирующаяся конформация GLP-1 является чувствительной к тепловой денатурации, а его растворимость зависит от рН, как показано на фиг. 4A и 4B, где проиллюстрировано, что пептид GLP-1 подвергается обратимому осаждению при рН 6,3-7,6 и при концентрации 10 мг/мл. Было обнаружено, что различные конформации GLP-1, по существу, являются устойчивыми к перемешиванию и ко множеству циклов «замораживания - оттаивания». При этом какого-либо дезамидирования и окисления GLP-1 не наблюдалось.Observations showed that as the concentration of GLP-1 increases, the secondary structure of the peptide transforms mainly from an unstructured conformation into a more ordered spiral conformation. An increase in the ionic strength in the solution leads to an increase in the degree of the indicated structure of GLP-1 until its reversible deposition. The presence of NaCl increases the degree of tertiary structure of GLP-1, as indicated by an increase in the intensity of CD bands in near UV, as shown in FIG. 2D. This occurs even at low peptide concentrations at which self-assembly is not detected. An increase in ionic strength facilitates the rapid conversion of unstructured GLP-1 to an alpha-helical form, as indicated by shifts of minima in CDs in the far UV towards 208 nm and 222 nm (Fig. 2A), and a self-associated conformation, as indicated by radiation shifts tryptophan in the direction of shorter wavelengths with increasing salt concentration and CD pattern in near UV, as shown in FIG. 2B and 2D. Temperature and pH in various ways affect the conformation of GLP-1, while the disordered structure of GLP-1 does not change under the influence of any of these parameters. On the other hand, it was found that the self-associating conformation of GLP-1 is sensitive to thermal denaturation, and its solubility is pH dependent, as shown in FIG. 4A and 4B, where it is illustrated that the GLP-1 peptide undergoes reversible precipitation at a pH of 6.3-7.6 and at a concentration of 10 mg / ml. It has been found that the various conformations of GLP-1 are essentially resistant to mixing and to many freeze-thaw cycles. No deamidation and oxidation of GLP-1 was observed.
Адсорбция GLP-1 на частицах FDKP также наблюдалась при различных условиях, которыми являются изменение рН, изменение концентрации GLP-1 и изменение концентрации различных поверхностно-активных веществ, солей, ионов, хаотропов и лиотропов, стабилизаторов и спиртов. Было обнаружено, что адсорбция GLP-1 на частицах FDKP в значительной степени зависит от рН, а в частности связывание происходит при pH примерно 4,0 или выше. Было обнаружено, что другие наполнители оказывают ограниченное влияние на абсорбцию GLP-1 на частицах FDKP.GLP-1 adsorption on FDKP particles was also observed under various conditions, such as a change in pH, a change in the concentration of GLP-1, and a change in the concentration of various surfactants, salts, ions, chaotropes and lyotropes, stabilizers and alcohols. It has been found that the adsorption of GLP-1 on FDKP particles is highly pH dependent, and in particular, binding occurs at a pH of about 4.0 or higher. Other excipients were found to have a limited effect on the absorption of GLP-1 on FDKP particles.
При разработке препаратов GLP-1/DKP согласно изобретению был оценен ряд параметров, которые могут воздействовать или влиять на доставку и абсорбцию in vivo. Такими параметрами являются, например, структура пептида GLP-1, заряд на поверхности молекулы в некоторых условиях приготовления препарата, растворимость и стабильность при использовании такого пептида в качестве препарата, а также чувствительность к расщеплению сериновой протеазой и стабильность in vivo, где все вышеперечисленные параметры играют решающую роль в получении препарата, который может легко абсорбироваться и имеет более длительное биологическое время полужизни.In developing GLP-1 / DKP formulations according to the invention, a number of parameters have been evaluated that may affect or influence in vivo delivery and absorption. Such parameters are, for example, the structure of the GLP-1 peptide, the charge on the surface of the molecule under certain preparation conditions, the solubility and stability when using such a peptide as a preparation, as well as sensitivity to serine protease cleavage and in vivo stability, where all of the above parameters play a decisive role in obtaining a drug that can be easily absorbed and has a longer biological half-life.
Стабильность полученных GLP-1/FDKP-препаратов тестировали в различных условиях in vitro и in vivo. Стабильность GLP-1 анализировали с помощью ЖХВД-анализа и клеточных анализов. Кроме того, стабильность GLP-1 оценивали в легочном лаваже (содержащем DPP-IV). Было также обнаружено, что стабильность нативного GLP-1 зависит от его концентрации в растворе.The stability of the obtained GLP-1 / FDKP preparations was tested under various in vitro and in vivo conditions . GLP-1 stability was analyzed using HPLC analysis and cell assays. In addition, GLP-1 stability was evaluated in pulmonary lavage (containing DPP-IV). It was also found that the stability of native GLP-1 depends on its concentration in solution.
In vitro исследования биологической активности GLP-1 также включают исследования загрузки GLP-1/FDKP и определение эффекта in vivo. Эта стратегия позволяет также разработать основные методы получения GLP-1/FDKP-препаратов. Кроме того, поскольку было обнаружено, что GLP-1 играет определенную роль в увеличении массы β-клеток посредством ингибирования апоптоза, стимуляции пролиферации β-клеток и неогенеза островковых клеток, то с помощью клеточного анализа была оценена пролиферативная и антиапоптотическая активность GLP-1/FDKP-препаратов согласно разложению. In vitro studies of the biological activity of GLP-1 also include GLP-1 / FDKP loading studies and in vivo effect determination. This strategy also allows you to develop basic methods for producing GLP-1 / FDKP drugs. In addition, since it was found that GLP-1 plays a role in increasing β-cell mass by inhibiting apoptosis, stimulating β-cell proliferation, and islet cell neogenesis, the proliferative and anti-apoptotic activity of GLP-1 / FDKP was evaluated using cell analysis preparations according to the decomposition.
Таким образом, настоящее изобретение относится к оптимизированным препаратам, содержащим нативный человеческий GLP-1 в комбинации с фумарилдикетопиперазином (FDKP), который является стабильным и резистентным к разложению.Thus, the present invention relates to optimized formulations containing native human GLP-1 in combination with fumaryldiketopiperazine (FDKP), which is stable and resistant to decomposition.
II. Молекулы GLP-1II. Molecules GLP-1
В своих конкретных вариантах настоящее изобретение относится к оптимизированным препаратам, содержащим нативный человеческий глюкагонподобный пептид 1 (GLP-1) в комбинации с дикетопиперазином, таким как фумарилдикетопиперазин (FDKP). Такие GLP-1/FDKP-препараты согласно изобретению являются стабильными и резистентными к разложению.In specific embodiments, the present invention provides optimized formulations containing native human glucagon-like peptide 1 (GLP-1) in combination with diketopiperazine, such as fumaryldicetopiperazine (FDKP). Such GLP-1 / FDKP preparations according to the invention are stable and resistant to degradation.
Человеческий GLP-1 хорошо известен специалистам и происходит от полипептида препроглюкагона, синтезируемого в L-клетках дистальной подвздошной кишки, поджелудочной железы и головного мозга. GLP-1 представляет собой пептид из 30-31 аминокислоты, который существует в двух молекулярных формах, 7-36 и 7-37, причем доминирующей является форма 7-36. Процессинг препроглюкагона в амид GLP-1(7-36) и в удлиненную форму GLP-1(7-37) происходит главным образом в L-клетках. Было обнаружено, что уровни GLP-1 в плазме натощак составляют примерно 40 пг/мл. После приема пищи уровни GLP-1 в плазме быстро возрастают приблизительно до 50-165 пг/мл.Human GLP-1 is well known in the art and is derived from the preproglucagon polypeptide synthesized in the L cells of the distal ileum, pancreas, and brain. GLP-1 is a peptide of 30-31 amino acids that exists in two molecular forms, 7-36 and 7-37, with form 7-36 being the dominant one. Processing of preproglucagon into the amide GLP-1 (7-36) and into the elongated form of GLP-1 (7-37) occurs mainly in L cells. Fasting plasma levels of GLP-1 have been found to be approximately 40 pg / ml. After ingestion, plasma GLP-1 levels rapidly increase to approximately 50-165 pg / ml.
Используемый здесь термин «молекулы GLP-1» означает белки, пептиды, полипептиды, аналоги, миметики, производные, изоформы, фрагменты GLP-1 и т.п. Такими молекулами GLP-1 могут быть природные полипептиды GLP-1 (GLP-1(7-37)OH, GLP-1(7-36)NH2) и метаболиты GLP-1, такие как GLP-l(9-37). Таким образом, в конкретных вариантах изобретения молекулами GLP-1 являются: нативный GLP-1, aналог GLP-1, производное GLP-1, GLP-1, защищенный от действия дипептидил-пептидазы IV (DPP-IV), GLP-1-миметик, аналог пептида GLP-1 или биосинтетический аналог GLP-1.As used herein, the term “GLP-1 molecules” means proteins, peptides, polypeptides, analogs, mimetics, derivatives, isoforms, GLP-1 fragments, and the like. Such GLP-1 molecules can be the natural polypeptides GLP-1 (GLP-1 (7-37) OH, GLP-1 (7-36) NH 2 ) and GLP-1 metabolites, such as GLP-l (9-37) . Thus, in specific embodiments, the GLP-1 molecules are: native GLP-1, an analog of GLP-1, a derivative of GLP-1, GLP-1, protected against the effects of dipeptidyl peptidase IV (DPP-IV), GLP-1 mimetic , an analog of the GLP-1 peptide or a biosynthetic analog of GLP-1.
Используемый здесь термин «аналог» включает соединения, которые по своей структуре аналогичны другому соединению. Так, например, противовирусное соединение ацикловир представляет собой нуклеозидный аналог, который по своей структуре аналогичен нуклеозиду гуанозину, происходящему от основания гуанина. Таким образом, ацикловир имитирует действие гуанозина (является его биологическим аналогом) и препятствует синтезу ДНК благодаря замене гуанозиновых остатков (или конкурентному связыванию с ними) в вирусной нуклеиновой кислоте и предотвращает ее трансляцию/транскрипцию. Таким образом, соединения, которые по своей структуре аналогичны другому соединению (родительскому соединению) и имитируют биологическую или химическую активность родительского соединения, называются аналогами. Для количественной оценки соединения, используемого в качестве аналога, необходимо, чтобы оно не содержало минимального или максимального числа элементных или функциональных групп-заместителей, при условии, что, в некоторых релевантных случаях, такой аналог будет обладать способностью имитировать родительское соединение, то есть, по своим биологическим или химическим свойствам, будет идентичным или комплементарным этому родительскому соединению или конкурировать с ним. Аналогами могут быть, и в большинстве случаев являются, производные родительского соединения (см. ниже определение термина «производное»). Аналоги описанных здесь соединений могут обладать активностью, аналогичной активности родительских соединений, либо меньшей, или большей активностью.As used herein, the term “analogue” includes compounds that are similar in structure to another compound. So, for example, the antiviral compound acyclovir is a nucleoside analogue, which in its structure is similar to the nucleoside guanosine, originating from the base of guanine. Thus, acyclovir imitates the action of guanosine (it is its biological analogue) and interferes with DNA synthesis due to the replacement of guanosine residues (or competitive binding to them) in viral nucleic acid and prevents its translation / transcription. Thus, compounds that are similar in structure to another compound (parent compound) and mimic the biological or chemical activity of the parent compound are called analogues. To quantify the compound used as an analogue, it is necessary that it does not contain a minimum or maximum number of elementary or functional substituent groups, provided that, in some relevant cases, such an analogue will be able to mimic the parent compound, i.e., its biological or chemical properties, will be identical or complementary to this parent compound or compete with it. Derivatives of the parent compound can be, and in most cases are, analogues (see the definition of the term “derivative” below). Analogs of the compounds described herein may have an activity similar to that of the parent compounds, or less or greater activity.
Используемый здесь термин «производное» означает соединение, полученное из (или происходящее от) природного родительского соединения либо продуцированное из родительского соединения путем синтеза. Производное может представлять собой аналог (определение термина «аналог» см. выше), а поэтому может обладать аналогичной химической или биологической активностью. Однако, в отличие от аналога, производное необязательно должно имитировать биологическую или химическую активность родительского соединения. Для количественной оценки соединения, используемого в качестве производного, необходимо, чтобы оно не содержало минимального или максимального числа элементных или функциональных групп-заместителей. Так, например, хотя противовирусное соединение ганцикловир представляет собой производное ацикловира, однако ганцикловир имеет другой спектр противовирусной активности и обладает другими токсикологическими свойствами по сравнению с ацикловиром. Производные описанных здесь соединений могут обладать активностью, аналогичной активности родительских соединений, либо меньшей, или большей активностью, либо они могут вообще не обладать такой активностью.The term “derivative”, as used herein, means a compound derived from (or derived from) a natural parent compound or produced from a parent compound by synthesis. The derivative may be an analogue (for the definition of “analogue” see above), and therefore may have similar chemical or biological activity. However, unlike the analogue, the derivative does not need to mimic the biological or chemical activity of the parent compound. To quantify a compound used as a derivative, it is necessary that it does not contain a minimum or maximum number of elemental or functional substituent groups. So, for example, although the antiviral compound ganciclovir is a derivative of acyclovir, but ganciclovir has a different spectrum of antiviral activity and has different toxicological properties compared to acyclovir. Derivatives of the compounds described herein may have an activity similar to that of the parent compounds, either less or greater activity, or they may not have such activity at all.
Используемый здесь термин «метаболит» означает любое промежуточное соединение или продукт метаболизма и включает как крупные, так и небольшие молекулы. Определение используемого здесь термина, в соответствующих случаях, относится как к первичным, так и ко вторичным метаболитам. Первичный метаболит непосредственно участвует в нормальном росте, развитии и репродуцировании живых организмов. Вторичный метаболит не принимает непосредственного участия в этих процессах, но обычно несет важную экологическую функцию (например, действует как антибиотик).As used herein, the term “metabolite” means any intermediate or metabolic product and includes both large and small molecules. The definition of the term used here, as appropriate, refers to both primary and secondary metabolites. The primary metabolite is directly involved in the normal growth, development and reproduction of living organisms. The secondary metabolite does not directly participate in these processes, but usually has an important environmental function (for example, acts as an antibiotic).
Используемый здесь термин «биосинтетический» относится к любому продуцированию химического соединения живым организмом.As used herein, the term “biosynthetic” refers to any production of a chemical compound by a living organism.
Используемый здесь термин «образующий частицы» относится к химическим, биосинтетическим или биологическим молекулам или соединениям, способным образовывать твердые частицы, обычно в жидкой среде. Образование частиц обычно происходит при создании определенного(ых) условия(й), благоприятствующего(их) образованию для молекулы, частицы, такого(их) как, например, изменение pH, температуры, влажности и/или осмомолярности/осмомоляльности. Создание такого(их) условия(й) может приводить, например, к связыванию, коалесценции, отверждению и/или дегидратации и тем самым к образованию частиц. Одним из примеров процесса образования частиц является реакция осаждения.The term “particle forming” as used herein refers to chemical, biosynthetic or biological molecules or compounds capable of forming solid particles, usually in a liquid medium. Particle formation usually occurs when certain condition (s) are created conducive to their formation for the molecule, particle, such as them, for example, a change in pH, temperature, humidity and / or osmolarity / osmolality. The creation of such condition (s) may lead, for example, to binding, coalescence, curing and / or dehydration and thereby to the formation of particles. One example of a particle formation process is a precipitation reaction.
Используемый здесь термин «сораствор» означает любую среду, состоящую по меньшей мере из двух химических, биологических и/или биосинтетических молекул. Так, например, сораствор может быть получен путем объединения жидкости, содержащей по меньшей мере одну химическую, биологическую и/или биосинтетическую молекулу, с твердым веществом, содержащим химическую, биологическую и/или биосинтетическую молекулу. В другом примере сораствор может быть получен путем объединения жидкости, содержащей по меньшей мере одну химическую, биологическую и/или биосинтетическую молекулу, с другой жидкостью, содержащей химическую, биологическую и/или биосинтетическую молекулу. В другом примере сораствор может быть получен путем добавления по меньшей мере двух твердых веществ, каждое из которых содержит по меньшей мере одну химическую, биологическую и/или биосинтетическую молекулу, в один раствор.As used herein, the term "co-solution" means any medium consisting of at least two chemical, biological, and / or biosynthetic molecules. So, for example, a co-solution can be obtained by combining a liquid containing at least one chemical, biological and / or biosynthetic molecule, with a solid substance containing a chemical, biological and / or biosynthetic molecule. In another example, a co-solution can be obtained by combining a liquid containing at least one chemical, biological and / or biosynthetic molecule with another liquid containing a chemical, biological and / or biosynthetic molecule. In another example, a co-solution can be obtained by adding at least two solids, each of which contains at least one chemical, biological and / or biosynthetic molecule, in one solution.
Нативный GLP-1, рассматриваемый в настоящем изобретении, представляет собой полипептид, имеющий аминокислотную последовательность SEQ ID NO. 1 или SEQ ID NO. 2. Нативный пептид GLP-1 подвергается быстрому расщеплению и инактивации в течение нескольких минут in vivo.Native GLP-1 contemplated by the present invention is a polypeptide having the amino acid sequence of SEQ ID NO. 1 or SEQ ID NO. 2. The native GLP-1 peptide undergoes rapid cleavage and inactivation within minutes in vivo .
Аналогами GLP-1 согласно изобретению могут быть экзендины, то есть пептиды, которые, как было обнаружено, являются агонистами рецептора GLP-1, и такие аналоги могут также включать экзендины 1-4. Экзендины были обнаружены в яде змеи ядозуба и имеют примерно 53%-ную гомологию аминокислот с аминокислотами GLP-1 млекопитающего. Экзендины также обладают аналогичной аффинностью связывания с рецептором GLP-1. Сообщалось, что экзендин-3 и экзендин-4 стимулируют продуцирование cAMP в ацинарных клетках поджелудочной железы и высвобождение амилазы из этих клеток (Malhotra et al, 1992; Raufman et al, 1992; Singh et al, 1994). Ранее было предложено использовать экзендин-3 и экзендин-4 в качестве инсулинотропных средств для лечения сахарного диабета и для предупреждения гипергликемии (патент США No. 5424286).The analogs of GLP-1 according to the invention can be exendins, that is, peptides that have been found to be GLP-1 receptor agonists, and such analogs may also include exendins 1-4. The exendins were found in the venom of the Toothfish snake and have approximately 53% amino acid homology with the mammalian GLP-1 amino acids. Exendins also have a similar binding affinity for the GLP-1 receptor. Exendin-3 and exendin-4 have been reported to stimulate the production of cAMP in pancreatic acinar cells and the release of amylase from these cells (Malhotra et al, 1992; Raufman et al, 1992; Singh et al, 1994). It has previously been proposed to use exendin-3 and exendin-4 as insulinotropic drugs for the treatment of diabetes mellitus and for the prevention of hyperglycemia (US patent No. 5424286).
Сообщалось, что карбоксиконцевые фрагменты экзендина, такого как экзендин[9-39], карбоксиамидированная молекула и фрагменты 3-39 - 9-39 являются сильными и селективными антагонистами GLP-1 (Goke et al, 1993; Raufman et al, 1991; Schepp et al, 1994; Montrose-Rafizadeh et al, 1996). В литературе также было продемонстрировано, что экзендин[9-39] блокирует эндогенный GLP-1 in vivo, что приводит к снижению секреции инсулина (Wang et al, 1995; D'Alessio et al, 1996). Экзендин-4 сильно связывается с рецепторами GLP-1, присутствующими на инсулин-секретирующих β-ТС1-клетках, с диспергированными ацинарными клетками поджелудочной железы и с париетальными клетками желудка. Пептид зкзендин-4 также играет определенную роль в стимуляции высвобождения соматостатина и в ингибировании высвобождения гастрина в отдельных областях желудка (Goke et al, 1993; Schepp et al, 1994; Eissele et al, 1994). В клетках, трансфецированных клонированным рецептором GLP-1, экзендин-4 может вести себя как агонист, то есть он способствует повышению уровня cAMP, а экзендин[9-39] был идентифицирован как антагонист, то есть он блокирует стимулирующее действие экзендина-4 и GLP-1. Было также обнаружено, что экзендин является резистентным к разложению.Carboxy-terminal fragments of an exendin such as exendin [9–39], a carboxyamidated molecule, and fragments 3–39–9–39 have been reported to be potent and selective antagonists of GLP-1 (Goke et al, 1993; Raufman et al, 1991; Schepp et al, 1994; Montrose-Rafizadeh et al, 1996). It has also been demonstrated in the literature that exendin [9-39] blocks endogenous GLP-1 in vivo , resulting in decreased insulin secretion (Wang et al, 1995; D'Alessio et al, 1996). Exendin-4 binds strongly to GLP-1 receptors present on insulin-secreting β-TC1 cells, to dispersed pancreatic acinar cells, and to parietal cells of the stomach. Peptide zkzendin-4 also plays a role in stimulating the release of somatostatin and in inhibiting the release of gastrin in certain regions of the stomach (Goke et al, 1993; Schepp et al, 1994; Eissele et al, 1994). In cells transfected with the cloned GLP-1 receptor, exendin-4 can act as an agonist, that is, it promotes an increase in cAMP, and exendin [9-39] has been identified as an antagonist, that is, it blocks the stimulating effect of exendin-4 and GLP -one. It was also found that exendin is resistant to degradation.
В другом варианте настоящего изобретения рассматривается использование пептидомиметиков. Пептидомиметиками, известными специалистам, являются пептиды, которые биологически имитируют активные детерминанты на гормонах, цитокинах, субстратах ферментов, вирусах или других биомолекулах и могут подавлять, стимулировать или как-либо иначе модулировать физиологическую активность природных лигандов. Пептидомиметики являются особенно ценными при разработке лекарственных средств. См., например, Johnson et al, "Peptide Turn Mimetics" in Biotechnology and pharmacy, Pezzuto et al, Eds., Chapman and Hall, New York (1993). Главным соображением, лежащим в основе применения пептидомиметиков, является ориентация боковых цепей пептидного остова белков, которая облегчает взаимодействие молекул. Предполагается, что пептидомиметики подвергаются молекулярным взаимодействиям, аналогичным взаимодействию природных молекул.In another embodiment of the present invention, the use of peptidomimetics is contemplated. Peptidomimetics known to those skilled in the art are peptides that biologically mimic active determinants on hormones, cytokines, enzyme substrates, viruses, or other biomolecules and can inhibit, stimulate, or otherwise modulate the physiological activity of natural ligands. Peptidomimetics are especially valuable in the development of drugs. See, for example, Johnson et al, "Peptide Turn Mimetics" in Biotechnology and pharmacy, Pezzuto et al, Eds., Chapman and Hall, New York (1993). The main consideration underlying the use of peptidomimetics is the orientation of the side chains of the peptide backbone of proteins, which facilitates the interaction of molecules. It is assumed that peptidomimetics undergo molecular interactions similar to the interaction of natural molecules.
В других вариантах изобретения предусматривается, что молекулы GLP-1 согласно изобретению обладают по меньшей мере одной биологической активностью, присущей нативному GLP-1, а именно способностью связываться с рецептором GLP-1 и инициировать путь передачи сигнала, приводящий к индуцированию инсулинотропной активности. В других вариантах изобретения молекулой GLP-1 может быть пептид, полипептид, белок, аналог, миметик, производное, изоформа, фрагмент и т.п., которые сохраняют по меньшей мере одну биологическую активность природного GLP-1. Молекулами GLP-1 могут быть также фармацевтически приемлемые соли и пролекарства и соли пролекарств, полиморфы, гидраты, сольваты, биологически активные фрагменты, биологически активные варианты и стереоизомеры природного человеческого GLP-1, а также агонист, миметик и варианты антагонистов природного человеческого GLP-1, семейство экзендинов, включая экзендины 1-4 и их полипептидные гибриды. Молекулой GLP-1 согласно изобретению может быть также GLP-1, защищенный от действия дипептидил-пептидазы-IV (DPP-IV), который предотвращает или ингибирует разложение GLP-1.In other embodiments, it is contemplated that GLP-1 molecules of the invention have at least one biological activity inherent in native GLP-1, namely, the ability to bind to the GLP-1 receptor and initiate a signal transduction pathway leading to the induction of insulinotropic activity. In other embodiments, the GLP-1 molecule may be a peptide, polypeptide, protein, analog, mimetic, derivative, isoform, fragment, and the like, which retain at least one biological activity of natural GLP-1. GLP-1 molecules can also be pharmaceutically acceptable salts and prodrugs and prodrug salts, polymorphs, hydrates, solvates, biologically active fragments, biologically active variants and stereoisomers of natural human GLP-1, as well as agonist, mimetic and antagonists of natural human GLP-1 , a family of exendins, including exendins 1-4 and their polypeptide hybrids. The GLP-1 molecule of the invention may also be GLP-1 protected against the action of dipeptidyl peptidase-IV (DPP-IV), which prevents or inhibits the degradation of GLP-1.
Молекулами GLP-1 согласно изобретению являются пептиды, полипептиды, белки и их производные, которые содержат аминокислотные замены, улучшают растворимость, сообщают резистентность к окислению, повышают биологическую активность или увеличивают время полужизни в кровотоке. Таким образом, молекулы GLP-1, рассматриваемые в настоящем изобретении, содержат аминокислотные замены, делеции или добавления, где аминокислоту, предназначенную для замены, делеции или добавления, выбирают из аминокислот, хорошо известных специалистам. N- или C-концы молекулы могут быть также модифицированы, например, путем ацилирования, ацетилирования, амидирования и т.п. Таким образом, в настоящем изобретении термин «аминокислота» означает природные и неприродные аминокислоты, а также аминокислотные аналоги и миметики, функции которых аналогичны функциям природных аминокислот. Природными кодируемыми аминокислотами являются 20 незаменимых аминокислот (аланин, аргинин, аспарагин, аспарагиновая кислота, цистеин, глутамин, глутаминовая кислота, глицин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, серин, треонин, триптофан, тирозин и валин), пиролизин и селеноцистеин. Термин «аминокислотный аналог» означает соединения, имеющие такую же основную химическую структуру, как и природная аминокислота, то есть в них α-углерод связан с водородом, с карбоксильной группой, аминогруппой и с группой R, например, такие соединения, как гомосерин, норлейцин, норваоин, сульфоксид метионина, метионинметилсульфоний, цитруллин, гидроксилглутаминовая кислота, гидроксипролин и пралин. Такие аналоги имеют модифицированные группы R (такие как норлейцин), но сохраняют основную химическую структуру, присущую природной аминокислоте. Аминокислотами, рассматриваемыми в настоящем изобретении, также являются β-аминокислоты, которые аналогичны α-аминокислотам с той точки зрения, что они также имеют аминоконец и карбоксиконец. Однако в β-аминокислотах эти функциональные концы разделены двумя атомами углерода. β-аминокислоты со специфической боковой цепью могут существовать в форме R- или S-изомеров в положении альфа-углерода (C2) или бета-углерода (C3). Это приводит к образованию всего четырех возможных диастереоизомеров для любой данной боковой цепи.The GLP-1 molecules of the invention are peptides, polypeptides, proteins and their derivatives that contain amino acid substitutions, improve solubility, impart oxidation resistance, increase biological activity or increase half-life in the bloodstream. Thus, the GLP-1 molecules contemplated by the present invention contain amino acid substitutions, deletions or additions, where the amino acid to be substituted, deleted or added is selected from amino acids well known in the art. The N- or C-ends of the molecule can also be modified, for example, by acylation, acetylation, amidation, etc. Thus, in the present invention, the term "amino acid" means natural and unnatural amino acids, as well as amino acid analogues and mimetics, the functions of which are similar to those of natural amino acids. The natural encoded amino acids are 20 essential amino acids (alanine, arginine, asparagine, aspartic acid, cysteine, glutamine, glutamic acid, glycine, histidine, isoleucine, leucine, lysine, methionine, phenylalanine, proline, serine, threonine, tryptophan, tyrosine and valine , pyrolysin and selenocysteine. The term "amino acid analogue" means compounds having the same basic chemical structure as the natural amino acid, that is, in them the α-carbon is bonded to hydrogen, to a carboxyl group, an amino group and to an R group, for example, compounds such as homoserine, norleucine , norvaoin, methionine sulfoxide, methionine methylsulfonium, citrulline, hydroxylglutamic acid, hydroxyproline and pralin. Such analogues have modified R groups (such as norleucine), but retain the basic chemical structure inherent in a natural amino acid. The amino acids contemplated by the present invention are also β-amino acids, which are similar to α-amino acids in the sense that they also have an amino terminal and a carboxy terminal. However, in β-amino acids, these functional ends are separated by two carbon atoms. Specific side chain β-amino acids can exist in the form of R- or S-isomers at the position of alpha carbon (C2) or beta carbon (C3). This results in the formation of only four possible diastereoisomers for any given side chain.
Молекулами GLP-1 согласно изобретению могут быть также гибридные белки GLP-1, слитые белки, олигомеры и мультимеры, гомологи, варианты гликозилирования различных типов и их мутеины, где указанная молекула GLP-1 сохраняет по меньшей мере одну биологическую активность нативной молекулы, и, кроме того, такими молекулами, независимо от метода их синтеза или продуцирования, являются, но не ограничиваются ими, рекомбинантные молекулы (независимо от того, продуцированы ли они из кДНК, геномной ДНК, синтетической ДНК или другой формы нуклеиновой кислоты), синтетические молекулы и молекулы, полученные методами активации генов. Техника рекомбинантных ДНК хорошо известна среднему специалисту в данной области (см. Russell, D. W., et al, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor, N.Y., 2001).The GLP-1 molecules of the invention may also be GLP-1 fusion proteins, fusion proteins, oligomers and multimers, homologs, glycosylation variants of various types and their muteins, wherein said GLP-1 molecule retains at least one biological activity of the native molecule, and, in addition, such molecules, regardless of the method of their synthesis or production, are, but are not limited to, recombinant molecules (regardless of whether they are produced from cDNA, genomic DNA, synthetic DNA, or another form of nucleic acid ), synthetic molecules and molecules obtained by gene activation methods. The recombinant DNA technique is well known to one of ordinary skill in the art (see Russell, D. W., et al, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor, N.Y., 2001).
III. ДикетопиперазиныIII. Diketopiperazines
Дикетопиперазины хорошо известны специалистам по их способности образовывать микрочастицы, которые могут быть использованы для доставки и стабилизации лекарственного средства. В настоящем изобретении дикетопиперазины используются для облегчения абсорбции молекул GLP-1 и тем самым для получения стабильного препарата, резистентного к разложению.Diketopiperazines are well known to those skilled in the art for their ability to form microparticles that can be used to deliver and stabilize a drug. In the present invention, diketopiperazines are used to facilitate the absorption of GLP-1 molecules and thereby to provide a stable degradation resistant preparation.
При этом могут применяться различные методики, в которых дикетопиперазины могут быть образованы в виде частиц, включающих молекулы GLP-1, или частиц, на которых могут адсорбироваться молекулы GLP-1. Такая методика может включать смешивание растворов дикетопиперазина с растворами или суспензиями молекул GLP-1 с последующим осаждением и образованием частиц, содержащих дикетопиперазин и GLP-1. Альтернативно, дикетопиперазин может быть осажден с образованием частиц и последующим их смешиванием с раствором молекул GLP-1. Ассоциация между частицами дикетопиперазина и молекулой GLP-1 может быть инициирована удалением растворителя, либо, для стимуляции такой ассоциации, может быть осуществлена специфическая стадия, такая как коррекция рН, которая может быть проведена перед сушкой.In this case, various techniques can be applied in which diketopiperazines can be formed in the form of particles including GLP-1 molecules, or particles on which GLP-1 molecules can be adsorbed. Such a technique may include mixing diketopiperazine solutions with solutions or suspensions of GLP-1 molecules, followed by precipitation and formation of particles containing diketopiperazine and GLP-1. Alternatively, diketopiperazine can be precipitated to form particles and then mixed with a solution of GLP-1 molecules. The association between diketopiperazine particles and the GLP-1 molecule can be initiated by removal of the solvent, or, to stimulate such an association, a specific step can be carried out, such as a pH correction, which can be carried out before drying.
В предпочтительном варианте изобретения дикетопиперазинами согласно изобретению являются, но не ограничиваются ими, 3,6-ди(4-аминобутил)-2,5-дикетопиперазин, также известный как (E)-3,6-бис[4-(N-карбоксил-2-пропенил)амидобутил]-2,5-дикетопиперазин (который может также называться фумарилдикетопиперазином или FDKP).In a preferred embodiment, the diketopiperazines of the invention include, but are not limited to, 3,6-di (4-aminobutyl) -2,5-diketopiperazine, also known as (E) -3,6-bis [4- (N-carboxyl -2-propenyl) amidobutyl] -2,5-diketopiperazine (which may also be called fumaryldiketopiperazine or FDKP).
Другими дикетопиперазинами, рассматриваемыми в настоящем изобретении, являются, но не ограничиваются ими, производные 3,6-ди(4-аминобутил)-2,5-дикетопиперазин, такие как: 3,6-ди(сукцинил-4-аминобутил)-2,5-дикетопиперазин (также называемый здесь 3,6-бис(4-карбоксипропил)амидобутил-2,5-дикетопиперазином; сукцинилдикетопиперазином или SDKP); 3,6-ди(малеил-4-аминобутил)-2,5-дикетопиперазин; 3,6-ди(цитраконил-4-аминобутил)-2-5-дикетопиперазин; 3,6-ди(глутарил-4-аминобутил)-2,5-дикетопиперазин; 3,6-ди(малонил-4-аминобутил)-2,5-дикетопиперазин; 3,6-ди(оксалил-4-аминобутил)-2,5-дикетопиперазин и их производные. В других вариантах настоящего изобретения рассматривается использование солей дикетопиперазина. Такими солями могут быть, например, любые фармацевтически приемлемые соли, такие как дикетопиперазиновые соли Na, K, Li, Mg, Ca, аммония или моно-, ди- или триалкиламмония (происходящие от триэтиламина, бутиламина, диэтаноламина, триэтаноламина или пиридинов и т.п.). Такой солью может быть моно-, ди- или смешанная соль. Рассматриваются также соли дикетопиперазинов высшего порядка, в которых группы R содержат более чем одну кислотную группу. В других аспектах изобретения основная форма агента может быть смешана с дикетопиперазином с получением лекарственного средства в виде соли дикетопиперазина, где указанное лекарственное средство является противокатионом дикетопиперазина. Неограничивающим примером рассматриваемой здесь соли является динатриевая соль (diNa) FDKP. Доставка лекарственного средства с использованием солей DKP описана в заявке на патент США No 11/210710, все разделы которой, относящиеся к солям DKP, вводятся в настоящее описание посредством ссылки.Other diketopiperazines contemplated by the present invention include, but are not limited to, derivatives of 3,6-di (4-aminobutyl) -2,5-diketopiperazine, such as: 3,6-di (succinyl-4-aminobutyl) -2 5-diketopiperazine (also referred to herein as 3,6-bis (4-carboxypropyl) amidobutyl-2,5-diketopiperazine; succinyl diketopiperazine or SDKP); 3,6-di (maleyl-4-aminobutyl) -2,5-diketopiperazine; 3,6-di (citraconyl-4-aminobutyl) -2-5-diketopiperazine; 3,6-di (glutaryl-4-aminobutyl) -2,5-diketopiperazine; 3,6-di (malonyl-4-aminobutyl) -2,5-diketopiperazine; 3,6-di (oxalyl-4-aminobutyl) -2,5-diketopiperazine and their derivatives. In other embodiments, the use of diketopiperazine salts is contemplated. Such salts can be, for example, any pharmaceutically acceptable salts, such as diketopiperazine salts of Na, K, Li, Mg, Ca, ammonium or mono-, di- or trialkylammonium (derived from triethylamine, butylamine, diethanolamine, triethanolamine or pyridines, etc. P.). Such a salt may be a mono-, di- or mixed salt. Also considered are salts of higher order diketopiperazines in which the R groups contain more than one acid group. In other aspects of the invention, the main form of the agent can be mixed with diketopiperazine to form a drug in the form of a diketopiperazine salt, wherein said drug is a diketopiperazine anti-cation. A non-limiting example of the salt contemplated herein is the disodium salt (diNa) FDKP. Drug delivery using DKP salts is described in U.S. Patent Application No. 11/210710, all of which sections relating to DKP salts are incorporated herein by reference.
Как указывается в настоящем описании, также рассматривается использование новых асимметрических аналогов FDKP, xDKP, таких как (Е)-3-(4-(3,6-диоксопиперазин-2-ил)бутилкарбамоил)-акриловая кислота; (E)-3-(3-(3,6-диоксопиперазин-2-ил)пропил-карбамоил)акриловая кислота; и (E)-3-(4-(5-изопропил-3,6-диоксопиперазин-2-ил)бутилкарбамоил) акриловая кислота, и аналогов, описанных в предварительной заявке на патент США, озаглавленной «Асимметрические аналоги FDKP, используемые в качестве агентов для доставки лекарственных средств» ("Asymmetrical FDKP Analogs for Use as Drug Delivery Agents"), которая была подана одновременно с настоящей заявкой и во всей своей полноте вводится в настоящее описание (документ патентного поверенного No. 51300-00041).As indicated herein, the use of new asymmetric analogues of FDKP, xDKP, such as ( E ) -3- (4- (3,6-dioxopiperazin-2-yl) butylcarbamoyl) -acrylic acid; ( E ) -3- (3- (3,6-dioxopiperazin-2-yl) propyl carbamoyl) acrylic acid; and ( E ) -3- (4- (5-isopropyl-3,6-dioxopiperazin-2-yl) butylcarbamoyl) acrylic acid, and the analogs described in the provisional patent application US, entitled "Asymmetric FDKP analogues used as agents for drug delivery ”(" Asymmetrical FDKP Analogs for Use as Drug Delivery Agents "), which was filed simultaneously with this application and in its entirety is introduced into the present description (patent attorney No. 51300-00041).
Дикетопиперазины могут быть получены путем циклодимеризации производных сложного эфира аминокислоты, описанных Katchalski, et al. (J. Amer. Chem. Soc. 68:879-80; 1946), путем циклизации производных сложного эфира дипептида или путем тепловой дегидратации производных аминокислот в растворителях с высокой температурой кипения, рассматриваемых в работе Kopple, et al., (J. Org. Chem. 33:862-64;1968), описание которой вводится в настоящее описание.Diketopiperazines can be prepared by cyclodimerization of amino acid ester derivatives described by Katchalski, et al. ( J. Amer. Chem. Soc. 68: 879-80; 1946), by cyclization of dipeptide ester derivatives or by thermal dehydration of amino acid derivatives in high boiling point solvents considered by Kopple, et al., ( J. Org Chem. 33: 862-64; 1968), the description of which is introduced in the present description.
Методы синтеза и получения дикетопиперазинов хорошо известны среднему специалисту в данной области и описаны в патентах США №№ 5352461; 5503852; 6071497; 6331318; 6428771 и в заявке на патент США No. 20060040953. В патентах США №№ 6444226 и 6652885 описано получение и синтез микрочастиц дикетопиперазинов в водной суспензии, к которой добавляют раствор активного агента для связывания активного агента с частицами. В этих патентах также описан способ удаления жидкой среды путем лиофилизации с получением микрочастиц, содержащих активный агент, и изменения состояния растворителя в такой суспензии для стимуляции связывания активного агента с частицами, как указывается в заявках на патенты США №№ 60/717524 и 11/532063, озаглавленных «Способ получения лекарственного средства исходя из увеличения аффинности активных агентов по отношению к поверхностям кристаллических микрочастиц» ("Method of Drug Formulation Based on Increasing the Affinity of Active Agents for Crystalline Microparticle Surfaces"); и 11/532065, озаглавленной «Способ получения лекарственного средства исходя из увеличения аффинности активных агентов по отношению к поверхностям кристаллических микрочастиц» (Method of Drug Formulation Based on Increasing the Affinity of Active Agents for Crystalline Microparticle Surfaces". Cм. также патент США № 6440463 и заявку на патент США No. 11/210709, поданную 23 августа 2005, и заявку на патент США № 11/208087). В некоторых случаях предусматривается, что нагруженные частицы дикетопиперазина согласно изобретению могут быть подвергнуты сушке методом сушки распылением, как описано, например, в заявке на патент США № 11/678046, поданной 22 февраля 2006 и озаглавленной «Способ улучшения фармацевтических свойств микрочастиц, содержащих дикетопиперазин и активный агент» («Method For Improving the Pharmaceutic Properties of Microparticles Comprising Diketopiperazine and an Active Agent»). Все указанные патенты и патентные заявки во всех разделах, относящихся к дикетопиперазинам, вводятся в настоящее описание посредством ссылки.Methods for the synthesis and preparation of diketopiperazines are well known to one of ordinary skill in the art and are described in US Pat. Nos. 5352461; 5503852; 6,071,497; 6,331,318; 6428771 and U.S. Patent Application No. 20060040953. US Patent Nos. 6444226 and 6652885 describe the preparation and synthesis of diketopiperazine microparticles in an aqueous suspension to which an active agent solution is added to bind the active agent to the particles. These patents also describe a method for removing a liquid medium by lyophilization to obtain microparticles containing an active agent, and changing the state of the solvent in such a suspension to stimulate binding of the active agent to the particles, as indicated in US patent applications Nos. 60/717524 and 11/532063 entitled "Method of Drug Formulation Based on Increasing the Affinity of Active Agents for Crystalline Microparticle Surfaces"; and 11/532065, entitled “Method of Drug Formulation Based on Increasing the Affinity of Active Agents for Crystalline Microparticle Surfaces". See also US Patent No. 6440463 and U.S. Patent Application No. 11/210709, filed August 23, 2005, and U.S. Patent Application No. 11/208087). In some cases, it is contemplated that loaded particles of the diketopiperazine of the invention may be spray dried as described, for example in the application for US Patent No. 11/678046, filed February 22, 2006, entitled "Method For Improving the Pharmaceutic Properties of Microparticles Comprising Diketopiperazine and an Active Agent." All of these patents and patent applications in all sections related to diketopiperazines are incorporated herein by reference.
IV. Терапевтические препараты GLP-1/DKP-частицIV. Therapeutic drugs GLP-1 / DKP particles
Настоящее изобретение также относится к GLP-1/FDKP-препарату для его введения индивидууму, нуждающемуся в лечении. Индивидуумом, рассматриваемым в настоящем изобретении, может быть животное-компаньон или человек. В некоторых вариантах изобретения рассматривается лечение диабета типа II, ожирения, рака или любых родственных заболеваний и/или состояний. Особенно предпочтительным индивидуумом является человек.The present invention also relates to a GLP-1 / FDKP preparation for administration to an individual in need of treatment. The individual contemplated by the present invention may be a companion animal or human. In certain embodiments, the treatment of type II diabetes, obesity, cancer, or any related diseases and / or conditions is contemplated. A particularly preferred individual is a person.
Другими заболеваниями или состояниями, рассматриваемыми в настоящем изобретении, являются, но не ограничиваются ими, синдром раздраженного кишечника, инфаркт миокарда, ишемия, реперфузионное поражение ткани, дислипидемия, диабетическая кардиомиопатия, острый коронарный синдром, метаболический синдром, катаболические изменения после хирургического вмешательства, нейродегенеративные расстройства, расстройство памяти и нарушение познавательных способностей, состояния, связанные с имплантацией островковых клеток и регенеративной терапией, или инсульт. Другими заболеваниями и/или состояниями, рассматриваемыми в настоящем изобретении, являются любые заболевания и/или состояния включительно, которые ассоциируются с вышеперечисленными заболеваниями и которые могут быть подвергнуты лечению путем введения индивидууму, нуждающемуся в этом, сухого порошкообразного GLP-1/FDKP-препарата. Указанный сухой порошкообразный GLP-1/FDKP-препарат согласно изобретению может быть также использован для предотвращения индуцирования дифференцировки человеческих бета-клеток при диабете типа II и гипергликемии.Other diseases or conditions contemplated by the present invention include, but are not limited to, irritable bowel syndrome, myocardial infarction, ischemia, tissue reperfusion injury, dyslipidemia, diabetic cardiomyopathy, acute coronary syndrome, metabolic syndrome, catabolic changes after surgery, neurodegenerative disorders , memory impairment and cognitive impairment, conditions associated with islet cell implantation and regenerative apiey, or stroke. Other diseases and / or conditions contemplated by the present invention are any diseases and / or conditions inclusive that are associated with the aforementioned diseases and which can be treated by administering to an individual in need thereof a dry, powdered GLP-1 / FDKP preparation. Specified dry powdery GLP-1 / FDKP preparation according to the invention can also be used to prevent the induction of differentiation of human beta cells in type II diabetes and hyperglycemia.
В другом варианте настоящего изобретения предусматривается, что указанным индивидуумом может быть домашний питомец или животное-компаньон, включая крыс, кроликов, хомячков, морских свинок, песчанок, сурков, кошек, собак, овец, коз, свиней, коров, лошадей, обезьян и человекообразных обезьян (включая шимпанзе, гиббонов и павианов).Another embodiment of the present invention provides that the specified individual may be a pet or companion animal, including rats, rabbits, hamsters, guinea pigs, gerbils, marmots, cats, dogs, sheep, goats, pigs, cows, horses, monkeys and anthropoids monkeys (including chimpanzees, gibbons and baboons).
Кроме того, предусматривается, что препараты GLP-1/FDKP-частиц согласно изобретению могут быть введены в клинических или неклинических целях различными способами, известными среднему специалисту в данной области. GLP-1/FDKP-композиции согласно изобретению могут быть введены в любую нужную биологическую мембрану, а предпочтительно в слизистую оболочку индивидуума. Введение может быть осуществлено любым способом, включая, но не ограничиваясь ими, пероральное введение, интраназальное введение, трансбуккальное введение, системную внутривенную инъекцию, подкожное введение, региональное введение путем доставки через кровь или лимфу, введение непосредственно в пораженный участок или даже местное введение. В предпочтительных вариантах изобретения введение GLP-1/FDKP-композиции осуществляют путем внутрилегочной доставки.In addition, it is contemplated that preparations of GLP-1 / FDKP particles of the invention can be administered for clinical or non-clinical purposes in various ways known to one of ordinary skill in the art. GLP-1 / FDKP compositions according to the invention can be introduced into any desired biological membrane, and preferably into the mucous membrane of an individual. The administration can be carried out by any method, including, but not limited to, oral administration, intranasal administration, buccal administration, systemic intravenous injection, subcutaneous administration, regional administration by delivery through blood or lymph, administration directly to the affected area, or even local administration. In preferred embodiments of the invention, the administration of the GLP-1 / FDKP composition is accomplished by intrapulmonary delivery.
Другими альтернативными способами введения, которые могут быть применены в настоящем изобретении, являются чрескожное введение, внутриартериальное введение, внутрибрюшинное введение, введение в пораженный участок, внутричерепное введение, внутрисуставное введение, введение в предстательную железу, интраплевральное введение, интратрахеальное введение, введение в стекловидное тело, интравагинальное введение, ректальное введение, введение в опухоль, внутримышечное введение, интравезикулярное введение, введение в слизистую, введение в область перикарда, местное введение в бронхи с помощью аэрозольного ингалятора, путем инъекции, вливания и непрерывного вливания, прямое промывание клеток-мишеней путем локализованной перфузии с использованием катетера и лаважа, местное введение с помощью кремов, жидких композиций (например, липосом) или другим способом либо любая комбинация из вышеперечисленных методов, хорошо известных среднему специалисту в данной области (см., например, руководство Remington's Pharmaceutical Sciences, 1990, все разделы которого, относящиеся к методам доставки, вводятся в настоящее описание посредством ссылки).Other alternative routes of administration that may be used in the present invention are transdermal administration, intra-arterial administration, intraperitoneal administration, administration to the affected area, intracranial administration, articular administration, administration to the prostate gland, intrapleural administration, intratracheal administration, intravitreal administration, intravaginal administration, rectal administration, administration to the tumor, intramuscular administration, intravascular administration, administration to the mucosa, administration pericardial area, local injection into the bronchi using an aerosol inhaler, by injection, infusion and continuous infusion, direct washing of target cells by localized perfusion using a catheter and lavage, local injection using creams, liquid formulations (e.g. liposomes) or by other means or any combination of the above methods that are well known to one of ordinary skill in the art (see, for example, Remington's Pharmaceutical Sciences, 1990, all sections of which are related to delivery methods, are administered see in the present description by reference).
Как и сухой порошкообразный препарат, частицы GLP-1/DKP согласно изобретению могут быть доставлены путем ингаляции в конкретные области дыхательной системы, в зависимости от их размера. Кроме того, частицы GLP-1/DKP могут иметь достаточно малый размер, который позволяет включать их в лекарственную форму в виде суспензии для внутривенного введения. Для пероральной доставки эти частицы могут быть включены в суспензию, таблетки или капсулы. GLP-1/DKP-композиция может быть доставлена с помощью ингалятора, такого как аэрозольный ингалятор, ингалятор с дозирующим клапаном, инсуффлятор и распылитель.Like a dry powder preparation, GLP-1 / DKP particles according to the invention can be delivered by inhalation to specific areas of the respiratory system, depending on their size. In addition, the particles of GLP-1 / DKP can have a sufficiently small size, which allows you to include them in a dosage form in the form of a suspension for intravenous administration. For oral delivery, these particles may be included in a suspension, tablets or capsules. The GLP-1 / DKP composition can be delivered using an inhaler, such as an aerosol inhaler, a metering valve inhaler, an insufflator and a nebulizer.
В других вариантах изобретения рассматривается введение “эффективного количества» GLP-1/DKP-препарата пациенту, нуждающемуся в этом. Термин «эффективное количество» сухого порошкообразного GLP-1/DKP-препарата, рассматриваемого в настоящем изобретении, означает количество соединения GLP-1, его аналога, или пептидомиметика, или т.п., которое до некоторой степени ослабляет один или несколько симптомов заболевания, состояния или расстройства, подвергаемого лечению. В одном из вариантов изобретения «эффективное количество» сухого порошкообразного GLP-1/DKP-препарата может представлять собой количество молекул GLP-1, подходящее для лечения диабета посредством увеличения уровней инсулина в плазме, снижения или уменьшения уровней глюкозы в крови натощак и увеличения клеточной массы панкреатических бета-клеток по меньшей мере примерно на 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50% или более и т.п. В другом своем предпочтительном варианте настоящее изобретение относится к лечению ожирения путем введения индивидууму, нуждающемуся в таком лечении, фармацевтически эффективного количества молекулы GLP-1. В таких случаях «эффективным количеством» сухого порошкообразного GLP-1/DKP-препарата может быть количество молекул GLP-1, подходящее для лечения ожирения посредством снижения или уменьшения массы тела по меньшей мере примерно на 5, 10, 15, 20, 25, 30, 35, 40, 45, 50% или более и т.п. В настоящем изобретении также рассматривается введение «эффективного количества» сухого порошкообразного GLP-1/DKP-препарата для регуляции насыщения у индивидуума, нуждающегося в таком лечении, где указанному индивидууму вводят фармацевтически эффективное количество молекулы GLP-1. Неограничивающим примером молекулы GLP-1 может быть молекула экзендина, такая как экзендин-1 или -4. В этих случаях «эффективным количеством» сухого порошкообразного GLP-1/DKP-препарата может быть количество молекул GLP-1, которое ослабляет ощущение голода и снижает потребление пищи (как было определено, например, по измерению массы или содержанию калорий) по меньшей мере примерно на 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50% или более и т.п. «Эффективное количество» сухого порошкообразного GLP-1/DKP-препарата может быть также определено как количество, достаточное для детектируемого и обнаруживаемого ослабления, снижения, минимизации или ограничения тяжести заболевания или состояния или их симптомов. Прекращение развития, предотвращение или излечение данного заболевания или состояния может быть также осуществлено с использованием «эффективного количества» препарата согласно изобретению.In other embodiments, the invention contemplates administering an “effective amount” of a GLP-1 / DKP preparation to a patient in need thereof. The term "effective amount" of dry powdered GLP-1 / DKP preparation as contemplated by the present invention means an amount of GLP-1 compound, an analogue thereof, or a peptidomimetic, or the like, which to some extent alleviates one or more symptoms of the disease, condition or disorder being treated. In one embodiment of the invention, an “effective amount” of dry powdered GLP-1 / DKP preparation may be a number of GLP-1 molecules suitable for treating diabetes by increasing plasma insulin levels, lowering or decreasing fasting blood glucose levels, and increasing cell mass pancreatic beta cells at least about 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50% or more, etc. P. In another preferred embodiment, the present invention relates to the treatment of obesity by administering to an individual in need of such treatment a pharmaceutically effective amount of a GLP-1 molecule. In such cases, the “effective amount” of dry powdered GLP-1 / DKP preparation may be the number of GLP-1 molecules suitable for treating obesity by reducing or reducing body weight by at least about 5, 10, 15, 20, 25, 30 , 35, 40, 45, 50% or more, and the like. The present invention also contemplates administering an “effective amount” of dry powdered GLP-1 / DKP preparation to regulate saturation in an individual in need of treatment where a pharmaceutically effective amount of a GLP-1 molecule is administered to said individual. A non-limiting example of a GLP-1 molecule may be an exendin molecule, such as exendin-1 or -4. In these cases, the “effective amount” of dry powdered GLP-1 / DKP preparation may be the number of GLP-1 molecules that reduces hunger and reduces food intake (as determined, for example, by measuring weight or calorie content) at least about by 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 , 30, 35, 40, 45, 50% or more, and the like. An “effective amount” of dry powdered GLP-1 / DKP preparation can also be defined as an amount sufficient to detectably and detectably attenuate, reduce, minimize or limit the severity of the disease or condition or its symptoms. The cessation of development, prevention, or cure of a given disease or condition can also be carried out using an “effective amount” of a preparation according to the invention.
При введении GLP-1/FDKP-композиции согласно изобретению индивидууму, нуждающемуся в этом, конкретная доза данной композиции может быть определена исходя из физических и физиологических факторов, таких как масса тела, тяжесть состояния, тип заболевания, подвергаемого лечению, ранее или одновременно проводимое терапевтическое лечение, наличие идиопатических заболеваний у пациента и способ введения. Средний специалист в данной области может самостоятельно определить конкретную дозу лекарственного средства в зависимости от одного или нескольких из указанных факторов.With the introduction of the GLP-1 / FDKP composition according to the invention to an individual in need thereof, the specific dose of the composition can be determined based on physical and physiological factors, such as body weight, severity of the condition, type of disease being treated, previously or simultaneously administered therapeutic treatment, the presence of idiopathic diseases in a patient and method of administration. An average person skilled in the art can independently determine the specific dose of the drug, depending on one or more of these factors.
GLP-1/DKP-препарат согласно изобретению может быть введен один или несколько раз в зависимости от заболевания или состояния, подвергаемого лечению. Введение GLP-1/DKP-препарата индивидууму может быть осуществлено через определенные интервалы времени, а именно через несколько минут, часов, дней, недель или месяцев. В некоторых случаях продолжительность терапевтического курса лечения может зависеть от времени полужизни молекулы GLP-1 после ее введения. В других вариантах изобретения для лечения конкретных заболеваний или состояний или комплекса заболеваний или состояний, таких как рак, может, например, оказаться желательным введение GLP-1/DKP-препарата согласно изобретению в сочетании с фармацевтическим наполнителем или агентом. В этих случаях курс лечения может быть назначен в зависимости от используемого фармацевтического наполнителя или агента.The GLP-1 / DKP preparation of the invention may be administered one or more times depending on the disease or condition being treated. The administration of the GLP-1 / DKP preparation to an individual can be carried out at certain time intervals, namely after a few minutes, hours, days, weeks or months. In some cases, the duration of the therapeutic course of treatment may depend on the half-life of the GLP-1 molecule after its administration. In other embodiments of the invention, for the treatment of specific diseases or conditions or a complex of diseases or conditions, such as cancer, it may, for example, be desirable to administer the GLP-1 / DKP preparation of the invention in combination with a pharmaceutical excipient or agent. In these cases, the course of treatment may be prescribed depending on the pharmaceutical excipient or agent used.
V. ПримерыV. Examples
Нижеследующие примеры приводятся для иллюстрации некоторых вариантов изобретения. При этом следует отметить, что способы, описанные в этих примерах, являются репрезентативными способами, подходящими для осуществления настоящего изобретения. Однако следует отметить, что, исходя из данного описания, в конкретные варианты осуществления изобретения могут быть внесены различные изменения, которые дают такой же или аналогичный результат и не выходят за рамки существа и объема изобретения.The following examples are provided to illustrate certain embodiments of the invention. It should be noted that the methods described in these examples are representative methods suitable for implementing the present invention. However, it should be noted that, based on this description, various changes may be made to specific embodiments of the invention, which give the same or similar result and do not go beyond the essence and scope of the invention.
Пример 1Example 1
Анализы структуры GLP-1 с применением биофизических и аналитических методовAnalysis of the structure of GLP-1 using biophysical and analytical methods
Анализы структуры и поведения GLP-1 были проведены с применением ряда биофизических и аналитических методов. Такими методами являются круговой дихроизм в далекой области УФ-излучения (КД в далеком УФ), круговой дихроизм в ближней области УФ-излучения (КД в ближнем УФ), собственная флуоресценция, инфракрасная Фурье-спектроскопия (FTIR), жидкостная хроматография высокого давления (ЖХВД) и масс-спектроскопия (МС), хорошо известные среднему специалисту в данной области. Исследования влияния концентрации, ионной силы, температуры, рН, окислительного стресса, перемешивания и множества циклов «замораживания - оттаивания» на пептид GLP-1 проводили в экспериментальных условиях широкого ряда, более подробно описанных ниже. Такие анализы были также проведены для характеризации основных путей разложения и определения условий, при которых может быть изменена пептидная структура GLP-1 в целях получения некоторых GLP-1/DKP-препаратов.Analyzes of the structure and behavior of GLP-1 were carried out using a number of biophysical and analytical methods. Such methods are circular dichroism in the far UV region (CD in far UV), circular dichroism in the near UV region (CD in near UV), intrinsic fluorescence, infrared Fourier transform spectroscopy (FTIR), high pressure liquid chromatography (HPLC) ) and mass spectroscopy (MS), well known to those of ordinary skill in the art. Studies of the effects of concentration, ionic strength, temperature, pH, oxidative stress, mixing, and many freeze-thaw cycles on the GLP-1 peptide were carried out under a wide range of experimental conditions, described in more detail below. Such analyzes were also carried out to characterize the main pathways of decomposition and determine the conditions under which the peptide structure of GLP-1 can be changed in order to obtain some GLP-1 / DKP preparations.
Экспериментальная процедураExperimental procedure
GLP-1 закупали у American Peptide (Sunnyvale, CA) или AnaSpec (San Jose, CA), или получали в лаборатории (MannKind Corporation, Valencia, CA). Образцы водного раствора GLP-1 при различных концентрациях анализировали при pH 4,0 и 20°С (если это не оговорено особо). Перед проведением каждого эксперимента обычно получали свежие образцы и эти образцы смешивали с соответствующей добавкой (например, с солью, рН-корректирующим буфером, Н2О2 и т.п., если это необходимо). Измерение вторичной структуры GLP-1 в различных условиях проводили методами КД в далеком УФ и просвечивающей инфракрасной Фурье-спектроскопии (FTIR). Кроме того, методы КД в ближнем УФ и собственной флуоресценции применяли для анализа третичной структуры GLP-1 путем мониторинга среды, окружающей его ароматические остатки, а именно триптофан.GLP-1 was purchased from American Peptide (Sunnyvale, CA) or AnaSpec (San Jose, CA), or obtained in the laboratory (MannKind Corporation, Valencia, CA). Samples of an GLP-1 aqueous solution at various concentrations were analyzed at pH 4.0 and 20 ° C (unless otherwise specified). Before each experiment, fresh samples were usually obtained and these samples were mixed with an appropriate additive (for example, salt, pH-correction buffer, H 2 O 2 , etc., if necessary). The secondary structure of GLP-1 under various conditions was measured by CD methods in far UV and transmission infrared Fourier transform spectroscopy (FTIR). In addition, CD methods in near UV and intrinsic fluorescence were used to analyze the tertiary structure of GLP-1 by monitoring the environment surrounding its aromatic residues, namely tryptophan.
Структуры GLP-1 в зависимости от концентрацииGLP-1 structures depending on concentration
Спектр кругового дихроизма (КД) был использован для анализа α-спирали, β-складчатого слоя, β-витков и случайной спирали, которые могут характеризовать такую молекулу, как белок или пептид. В частности, метод КД в далеком УФ был применен для определения типа вторичной структуры, например, чистой α-спирали, β-складчатого слоя и т.п., в белках и пептидах. С другой стороны, КД в ближнем УФ был использован для анализа третичных структур молекулы. Так, например, для определения влияния концентрации на структуры GLP-1 были применены методы КД в далеком и ближнем УФ.The circular dichroism spectrum (CD) was used to analyze the α-helix, β-fold layer, β-turns and random spirals, which can characterize a molecule such as a protein or peptide. In particular, the CD method in the far UV was used to determine the type of secondary structure, for example, a pure α-helix, β-folded layer, etc., in proteins and peptides. On the other hand, CD in near UV was used to analyze the tertiary structures of the molecule. So, for example, to determine the effect of concentration on the structures of GLP-1, CD methods in the far and near UV were used.
КД в далеком УФ, продемонстрированный на фиг. 1A, показал, что GLP-1, используемый при концентрациях в широком диапазоне (например, 1,8; 4,2; 5,1; 6,1; 7,2 и 8,6 мг/мл), образует две отдельные структуры, включающие α-спирали и случайные спирали. При низких концентрациях (≤ 2 мг/мл) GLP-1 является в основном неструктурированным, как было определено по ярким одиночным минимумам на 205 нм. При возрастании концентрации данный пептид приобретает α-спиральную структуру, как было определено по двум минимумам на 208 нм и 224 нм (фиг. 1A).CD in the far UV shown in FIG. 1A showed that GLP-1, used at concentrations over a wide range (e.g. 1.8; 4.2; 5.1; 6.1; 7.2 and 8.6 mg / ml), forms two separate structures including α-helices and random helices. At low concentrations (≤ 2 mg / ml), GLP-1 is largely unstructured, as determined by bright single minima at 205 nm. With increasing concentration, this peptide acquires an α-helical structure, as determined by two minima at 208 nm and 224 nm (Fig. 1A).
Анализ третичной структуры позволяет предположить, что структуры GLP-1 при высоких концентрациях представляют собой самоассоциирующиеся конформации (то есть олигомеры). Данные, полученные методами КД в ближнем УФ и флуоресцентного излучения, подтвердили эту гипотезу. Позитивные полосы в области 250-300 нм при КД в ближнем УФ (фиг. 1B) показали, что GLP-1 имеет определенную третичную структуру, компоненты которой увеличиваются при более высоких концентрациях. Более конкретно, эти полосы указывают на то, что ароматические остатки данного пептида являются в высокой степени иммобилизованными и находятся в хорошо определенном окружении.Analysis of the tertiary structure suggests that the structures of GLP-1 at high concentrations are self-associating conformations (i.e., oligomers). The data obtained by CD methods in the near UV and fluorescence radiation, confirmed this hypothesis. Positive bands in the region of 250-300 nm with CD in the near UV (Fig. 1B) showed that GLP-1 has a definite tertiary structure, the components of which increase at higher concentrations. More specifically, these bands indicate that aromatic residues of a given peptide are highly immobilized and are in a well defined environment.
Аналогичным образом, флуоресцентное излучение GLP-1 при различных концентрациях (pH 4,0, 20°С) показало, что ароматический остаток триптофан (который также представлен интенсивными полосами в КД-спектре в ближнем УФ) присутствует в хорошо определенной третичной структуре, на что указывают данные по возбуждению триптофана на 280 нм (фиг. 1C). Максимум флуоресценции на 355 нм при низких концентрациях GLP-1 указывает на то, что триптофан подвержен воздействию растворителя и в данном случае GLP-1 не имеет четкой третичной структуры. При высоких концентрациях пептида интенсивность максимумов снижается, и эти максимумы смещаются в сторону более коротких длин волн, что указывает на более определенную третичную структуру.Similarly, the fluorescence emission of GLP-1 at various concentrations (pH 4.0, 20 ° C) showed that the aromatic tryptophan residue (which is also represented by intense bands in the CD spectrum in the near UV) is present in a well-defined tertiary structure, to which indicate tryptophan excitation data at 280 nm (FIG. 1C). The maximum fluorescence at 355 nm at low GLP-1 concentrations indicates that tryptophan is susceptible to solvent and in this case GLP-1 does not have a clear tertiary structure. At high peptide concentrations, the intensity of the maxima decreases, and these maxima shift toward shorter wavelengths, which indicates a more definite tertiary structure.
Для уточнения предполагаемой вторичной структуры самоассоциирующейся конформации GLP-1 был проведен FTIR-анализ при различных концентрациях (pH 4,0, 20°С). Полоса амида I при 1656 см-1 явно указывает на то, что GLP-1 имеет α-спиральную структуру при концентрациях ≥ 2 мг/мл (фиг. 1D). Следовательно, GLP-1 не образует β-складчатых структур, и более вероятно, что вместо этого данный пептид при высоких концентрациях образует спиральный пучок.To clarify the proposed secondary structure of the self-associating conformation of GLP-1, FTIR analysis was carried out at various concentrations (pH 4.0, 20 ° C). The band of amide I at 1656 cm -1 clearly indicates that GLP-1 has an α-helical structure at concentrations ≥ 2 mg / ml (Fig. 1D). Therefore, GLP-1 does not form β-folded structures, and it is more likely that, instead, this peptide forms a spiral bundle at high concentrations.
Кроме того, было экспериментально показано, что эти различные структуры GLP-1 не были генерированы путем обработки образца. После проведения сравнения разведений концентрированного маточного раствора с GLP-1, полученным путем прямого растворения пептида в буфере, были получены аналогичные спектры КД в далеком УФ, КД в ближнем УФ и флуоресцентного излучения.In addition, it was experimentally shown that these various structures of GLP-1 were not generated by processing the sample. After comparing dilutions of the concentrated mother liquor with GLP-1 obtained by direct dissolution of the peptide in the buffer, similar CD spectra in far UV, near UV and fluorescence CD were obtained.
Влияние ионной силы на GLP-1Effect of ionic strength on GLP-1
Были также проведены исследования для определения влияния ионной силы на пептид GLP-1. На фиг. 2A (КД в далеком УФ) показано, что при возрастании концентрации соли (от 100 мМ до 1000 мМ) неупорядоченная структура GLP-1 превращается в α-спиральную конформацию, как было определено по минимумам на 208 и 224 нм. После повышения концентрации NaCl до 1 М из раствора осаждалось значительное количество пептида (при 1,0 мг/мл) (фиг. 2А). Тем не менее было показано, что осадок такого типа растворялся после разбавления водой, и тем самым было установлено, что при высокой ионной силе растворителя может происходить обратимое осаждение GLP-1.Studies have also been conducted to determine the effect of ionic strength on the GLP-1 peptide. In FIG. 2A (CD in the far UV), it was shown that with an increase in salt concentration (from 100 mM to 1000 mM), the disordered structure of GLP-1 turns into an α-helical conformation, as was determined by the minima at 208 and 224 nm. After increasing the concentration of NaCl to 1 M, a significant amount of the peptide was precipitated from the solution (at 1.0 mg / ml) (Fig. 2A). Nevertheless, it was shown that a precipitate of this type was dissolved after dilution with water, and thereby it was found that at high ionic strength of the solvent, reversible precipitation of GLP-1 can occur.
Было показано, что соль также способствует образованию и улучшению третичной структуры GLP-1. Это проиллюстрировано на фиг. 2В (КД в ближнем УФ), где GLP-1 в концентрации 1,0 мг/мл не обнаруживал сигнала в отсутствие соли, но имел четкую третичную структуру, которая усиливалась с увеличением ионной силы. Эти результаты были подтверждены флуоресцентным излучением 1,0 мг/мл GLP-1 (фиг. 2C) при различных концентрациях NaCl (pH 4,0; 20°С) после возбуждения триптофана на 280 нм. Увеличение ионной силы приводило к сдвигу максимума интенсивности флуоресценции в сторону более коротких длин волн, что указывает на то, что в данном случае наблюдалось образование и усиления третичной структуры GLP-1 при концентрации 1,0 мг/мл.It has been shown that salt also contributes to the formation and improvement of the tertiary structure of GLP-1. This is illustrated in FIG. 2B (near-UV CD), where GLP-1 at a concentration of 1.0 mg / ml did not detect a signal in the absence of salt, but had a clear tertiary structure, which intensified with increasing ionic strength. These results were confirmed by fluorescence emission of 1.0 mg / ml GLP-1 (Fig. 2C) at various concentrations of NaCl (pH 4.0; 20 ° C) after excitation of tryptophan at 280 nm. An increase in ionic strength led to a shift in the maximum fluorescence intensity towards shorter wavelengths, which indicates that in this case the formation and strengthening of the tertiary structure of GLP-1 was observed at a concentration of 1.0 mg / ml.
Кроме того, анализ третичной структуры GLP-1 в концентрации 10 мг/мл при варьирующейся ионной силе (pH 4,0; 20°С), проводимый по спектру КД в ближнем УФ, показал, что с увеличением ионной силы также усиливается образование самоассоциирующейся конформации GLP-1 (фиг 2D).In addition, the analysis of the tertiary structure of GLP-1 at a concentration of 10 mg / ml with varying ionic strength (pH 4.0; 20 ° C), performed on the basis of the CD spectrum in the near UV, showed that the formation of self-associated conformation also increases with increasing ionic strength GLP-1 (FIG. 2D).
Поэтому полученные данные позволяют предположить, что ионная сила оказывает сильное влияние на структуру GLP-1, в результате чего этот белок приобретает α-спиральную конформацию и ассоциируется в олигомеры. Кроме того, увеличение ионной силы в растворе приводит к усилению олигомеризации GLP-1 до его обратимого осаждения. Это наблюдается при низких концентрациях пептида, при которых изначально отсутствовала третичная структура, а также при высоких концентрациях пептида, который уже имел достаточный уровень вторичной и третичной структуры. Таким образом, при увеличении ионной силы неструктурированный GLP-1 быстро превращается в α-спиральную и самоассоциирующуюся конформацию. Кроме того, полученные данные спектроскопии были сравнимы с полученными ранее данными анализов на влияние повышенных концентраций пептида.Therefore, the obtained data suggest that ionic strength has a strong effect on the structure of GLP-1, as a result of which this protein acquires an α-helical conformation and is associated with oligomers. In addition, an increase in ionic strength in the solution leads to increased oligomerization of GLP-1 until it is reversibly precipitated. This is observed at low concentrations of the peptide, at which the tertiary structure was initially absent, as well as at high concentrations of the peptide, which already had a sufficient level of secondary and tertiary structure. Thus, with an increase in ionic strength, unstructured GLP-1 quickly turns into an α-helical and self-associating conformation. In addition, the obtained spectroscopic data were comparable with the previously obtained analysis data on the effect of elevated peptide concentrations.
Влияние температуры и рН на GLP-1Effect of temperature and pH on GLP-1
Были также проведены исследования для того, чтобы определить, является ли самоассоциирующаяся конформация GLP-1 чувствительной к изменениям температуры или pH. На фиг. 3A (КД в ближнем УФ) показано, что третичная структура GLP-1 при концентрации 10 мг/мл в значительной степени диссоциируется по мере увеличения температуры. С другой стороны, в анализе GLP-1 при различных температурах и pH 4,0 было установлено, что температура не оказывает влияния на GLP-1 при низких концентрациях (0,05 мг/мл); см. фиг. 3B и 3C (КД в далеком УФ). КД в далеком УФ показал, что данный пептид не является нечувствительным к температуре. Поэтому увеличение подвижности молекулы значительно затрудняет самосборку GLP-1.Studies have also been conducted to determine whether the self-associating conformation of GLP-1 is sensitive to changes in temperature or pH. In FIG. 3A (near-UV CD), it is shown that the tertiary structure of GLP-1 at a concentration of 10 mg / ml dissociates substantially with increasing temperature. On the other hand, in the analysis of GLP-1 at various temperatures and pH 4.0, it was found that the temperature does not affect GLP-1 at low concentrations (0.05 mg / ml); see FIG. 3B and 3C (CD in the far UV). CD in far UV has shown that this peptide is not temperature insensitive. Therefore, increasing the mobility of the molecule greatly complicates the self-assembly of GLP-1.
И наоборот, на фиг. 4A (КД в далеком УФ) было продемонстрировано, что растворимость α-спиральной конформации GLP-1 зависит от pH. Хотя структура GLP-1 в концентрации 10 мг/мл является относительно однородной (то есть GLP-1 сохраняет спиральную структуру) при pH 4,4 и ниже, однако если рН повышается до нейтрального или близкого к нейтральному значения (pH 6,3-7,6), то некоторое осаждение все же происходит и образуется неупорядоченная структура, на что указывает спектр. Образцы, в которых наблюдалось осаждение, имели меньшую интенсивность, что обусловлено меньшей растворимостью GLP-1 в растворе. Такая неупорядоченная структура была определена по одному минимуму, наблюдаемому на 208 нм, как показано на фиг. 4А (КД в далеком УФ) и как показано на фиг. 4В (КД в ближнем УФ), что, вероятно, является результатом снижения концентрации GLP-1 в растворе после осаждения. Такое осаждение может наблюдаться в том случае, если значения рН выше значения pH 5,5 для GLP-1. Однако, по мере увеличения значения рН от близкого к нейтральному до 11,7, большая часть осадка снова растворяется, что указывает на то, что такое осаждение является обратимым. Оставшийся нерастворимый осадок GLP-1 при pH 11,7 будет снижать количество пептида в растворе и тем самым снижать интенсивность спектра КД в далеком УФ, как показано на фиг. 4А. Также наблюдалось, что GLP-1 является в высокой степени нерастворимым в случае, когда лиофилизованный порошок GLP-1 смешивали с буфером, pH 9, до получения высокой концентрации GLP-1.Conversely, in FIG. 4A (CD in far UV), it was demonstrated that the solubility of the α-helical conformation of GLP-1 is pH dependent. Although the structure of GLP-1 at a concentration of 10 mg / ml is relatively uniform (that is, GLP-1 retains a helical structure) at a pH of 4.4 or lower, however, if the pH rises to a neutral or near neutral value (pH 6.3-7 6), then some deposition nevertheless occurs and a disordered structure forms, as indicated by the spectrum. Samples in which precipitation was observed had a lower intensity, due to the lower solubility of GLP-1 in solution. Such a disordered structure was determined from a single minimum observed at 208 nm, as shown in FIG. 4A (CD in the far UV) and as shown in FIG. 4B (CD in near UV), which is probably the result of a decrease in the concentration of GLP-1 in solution after precipitation. Such precipitation can occur if the pH is higher than the pH of 5.5 for GLP-1. However, as the pH increases from close to neutral to 11.7, most of the precipitate dissolves again, indicating that this deposition is reversible. The remaining insoluble precipitate of GLP-1 at pH 11.7 will reduce the amount of peptide in solution and thereby reduce the intensity of the CD spectrum in far UV, as shown in FIG. 4A. It was also observed that GLP-1 is highly insoluble when the lyophilized GLP-1 powder was mixed with buffer,
Стабильность GLP-1Stability GLP-1
Стабильность пептида GLP-1 оценивали путем определения его резистентности к дезамидированию и окислению, а также к влиянию перемешивания и циклов «замораживания - оттаивания».The stability of the GLP-1 peptide was evaluated by determining its resistance to deamidation and oxidation, as well as to the effect of mixing and “freeze-thaw” cycles.
GLP-1 (1 мг/мл) при pH 10,5 инкубировали в течение 5 дней при 40°С, после чего проводили анализы на дезамидирование и окисление с помощью обращенно-фазовой ЖХВД и масс-спектрометрии электрораспылением (МС). Оценку окисления также проводили на образцах GLP-1 (1 мг/мл), инкубированных в течение 2 часов в присутствии 0,1% Н2О2, с помощью ЖХВД и МС.GLP-1 (1 mg / ml) at pH 10.5 was incubated for 5 days at 40 ° C, after which analyzes were performed for deamidation and oxidation using reverse phase HPLC and electrospray mass spectrometry (MS). Oxidation was also evaluated on GLP-1 samples (1 mg / ml), incubated for 2 hours in the presence of 0.1% H 2 O 2 , using HPLC and MS.
На фиг. 5 проиллюстрирована стабильность GLP-1 в условиях дезамидирования и оксиления. ЖХВД-хроматограммы показали, что GLP-1 элюируется при одном и том же времени удерживания и пики разложения, образующиеся в анализируемых условиях дестабилизации, отсутствуют. Кроме того, МС-анализы давали аналогичные массы для всех образцов, 3297 г/моль, что указывало на то, что масса не изменялась. Полученные данные также показали, что эти пептиды остаются чистыми и интактными при их инкубировании в различных условиях. Таким образом, дезамидирования GLP-1 не наблюдалось. Было показано, что GLP-1 является резистентным к окислительному стрессу, как было обнаружено в присутствии 0,1% Н2О2, где чистота и масса GLP-1 оставались неизменными, на что указывали ЖХВД и МС соответственно. Вообще говоря, каких-либо изменений времени удерживания или величин массы, а также пиков разложения не обнаруживалось, что свидетельствует о том, что пептид GLP-1 является резистентным к дезамидированию и окислению.In FIG. 5 illustrates the stability of GLP-1 under deamidation and oxidation conditions. HPLC chromatograms showed that GLP-1 elutes at the same retention time and there are no decomposition peaks formed under the analyzed conditions of destabilization. In addition, MS analyzes gave similar masses for all samples, 3297 g / mol, indicating that the mass did not change. The data obtained also showed that these peptides remain clean and intact when incubated under various conditions. Thus, GLP-1 deamidation was not observed. GLP-1 was shown to be resistant to oxidative stress, as was found in the presence of 0.1% H 2 O 2 , where the purity and mass of GLP-1 remained unchanged, as indicated by HPLC and MS, respectively. Generally speaking, no changes in retention time or mass values, as well as decomposition peaks were detected, which indicates that the GLP-1 peptide is resistant to deamidation and oxidation.
Влияние перемешивания и последующего проведения циклов «замораживания - оттаивания» на GLP-1 при различных концентрациях анализировали с помощью КД в ближнем УФ и собственной флуоресценции. Перемешивание 9,4 и 1,5 мг/мл GLP-1 не приводило к каким-либо значительным изменениям в структуре пептида, на что указывали КД в ближнем УФ (фиг. 6А) и флуоресцентное излучение (фиг. 6B). Образцы перемешивали в течение 30 и 90 минут при комнатной температуре и после возбуждения триптофана на 280 нм получали спектры флуоресцентного излучения. В независимых исследованиях по «замораживанию - оттаиванию» растворы, содержащие GLP-1 (рН 4,0) при концентрациях 1,6, 5,1 и 8,4 мг/мл, замораживали при -20°С и оттаивали при комнатной температуре. Влияние 10 циклов «замораживания - оттаивания» на GLP-1 осуществляли и анализировали с помощью КД в ближнем УФ (фиг. 7A) и флуоресцентного излучения (фиг. 7B). После возбуждения триптофана на 280 нм получали спектры флуоресцентного излучения. Оба анализа показали, что при проведении множества циклов «замораживания - оттаивания» третичная структура данного пептида не подвергается каким-либо значительным изменениям. В аналогичных экспериментах анализировали влияние 11 циклов «замораживания - оттаивания» на вторичную структуру GLP-1 при концентрации 10 мг/мл (pH 4,0) (фиг. 7C). КД в далеком УФ показал, что вторичная структура пептида не подвергалась какому-либо заметному изменению при проведении множества циклов «замораживания - оттаивания».The effect of mixing and subsequent “freeze-thaw” cycles on GLP-1 at various concentrations was analyzed using CD in near UV and intrinsic fluorescence. Mixing of 9.4 and 1.5 mg / ml GLP-1 did not lead to any significant changes in the structure of the peptide, as indicated by near-UV CD (FIG. 6A) and fluorescence (FIG. 6B). The samples were mixed for 30 and 90 minutes at room temperature, and after excitation of tryptophan at 280 nm, fluorescence emission spectra were obtained. In independent freeze-thaw studies, solutions containing GLP-1 (pH 4.0) at concentrations of 1.6, 5.1 and 8.4 mg / ml were frozen at -20 ° C and thawed at room temperature. The effect of 10 freeze-thaw cycles on GLP-1 was carried out and analyzed using near-UV CD (FIG. 7A) and fluorescence (FIG. 7B). After excitation of tryptophan at 280 nm, fluorescence emission spectra were obtained. Both analyzes showed that during many cycles of freezing and thawing, the tertiary structure of this peptide does not undergo any significant changes. In similar experiments, the effect of 11 freeze-thaw cycles on the secondary structure of GLP-1 was analyzed at a concentration of 10 mg / ml (pH 4.0) (Fig. 7C). CD in the far UV showed that the secondary structure of the peptide did not undergo any noticeable change during many cycles of freezing and thawing.
В целом результаты биофизических анализов, проводимых в вышеописанных экспериментах, показали, что на структуру пептида GLP-1 значительно влияет его концентрация в растворе. По мере увеличения концентрации GLP-1 α-спиральные структуры становятся более явно выраженными. Кроме того, увеличение ионной силы приводит к усилению структуры GLP-1, а в некоторых случаях к образованию третичных структур GLP-1.In general, the results of biophysical analyzes conducted in the above experiments showed that the concentration in the solution significantly affects the structure of the GLP-1 peptide. As the concentration of GLP-1 increases, the α-helical structures become more pronounced. In addition, an increase in ionic strength leads to an increase in the structure of GLP-1, and in some cases to the formation of tertiary structures of GLP-1.
Пример 2Example 2
Исследование адсорбции GLP-1/FDKPGLP-1 / FDKP Adsorption Assay
Взаимодействие GLP-1 с частицами дикетопиперазина (DKP) в суспензии оценивали путем проведения исследований адсорбции. Исследования по изменению адсорбции проводили в целях изучения влияния электростатических свойств, водородных связей, водной структуры, гибкости структуры белка и специфических реакций присоединения солей на взаимодействие GLP-1/DKP. Кроме того, некоторые известные стабилизаторы белков были протестированы на блокирование адсорбции GLP-1 на поверхностях DKP.The interaction of GLP-1 with particles of diketopiperazine (DKP) in suspension was evaluated by conducting adsorption studies. Studies on changes in adsorption were carried out in order to study the effect of electrostatic properties, hydrogen bonds, water structure, flexibility of the protein structure, and specific salt addition reactions on the GLP-1 / DKP interaction. In addition, some well-known protein stabilizers have been tested to block the adsorption of GLP-1 on DKP surfaces.
С использованием ранее полученных частиц DKP-суспензии (то есть FDKP) были проанализированы условия, при которых GLP-1 адсорбируется на поверхностях ранее полученных DKP-частиц. Суспензию FDKP-частиц, которая уже содержала ранее образованные частицы FDKP, объединяли с 3X pH-корректирующим буфером и 3X раствором добавки или наполнителя. Конечный раствор содержал FDKP в концентрации 5 мг/мл и GLP-1 в концентрации 0,25 мг/мл (5% масс./масс.). Несвязанный GLP-1 в супернатанте отфильтровывали из суспензии. Частицы FDKP со связанным белком GLP-1 растворяли (разводили) 100 мМ бикарбоната аммония и фильтровали для отделения любого агрегированного белка GLP-1. Количество GLP-1 в супернатанте и в разведенных фракциях количественно оценивали с помощью ЖХВД. Была проведена серия экспериментов, в которых использовали добавки, такие как соли, поверхностно-активные вещества, ионы, осмолиты, хаотропы, органические вещества и различные концентрации GLP-1. Результаты этих исследований описаны ниже.Using previously prepared particles of the DKP suspension (i.e., FDKP), conditions were analyzed under which GLP-1 is adsorbed on the surfaces of previously prepared DKP particles. A suspension of FDKP particles, which already contained previously formed FDKP particles, was combined with a 3X pH-correction buffer and a 3X additive or excipient solution. The final solution contained FDKP at a concentration of 5 mg / ml and GLP-1 at a concentration of 0.25 mg / ml (5% w / w). Unbound GLP-1 in the supernatant was filtered from the suspension. Particles of FDKP with bound GLP-1 protein were dissolved (diluted) with 100 mM ammonium bicarbonate and filtered to separate any aggregated GLP-1 protein. The amount of GLP-1 in the supernatant and in the diluted fractions was quantified using HPLC. A series of experiments was carried out in which additives such as salts, surfactants, ions, osmolytes, chaotropes, organic substances and various concentrations of GLP-1 were used. The results of these studies are described below.
Исследования соли. Влияние соли на связывание GLP-1 с частицами FDKP оценивали с помощью ЖХВД-анализа. Загрузку GLP-1/ FDKP-частиц осуществляли при 5 мг/мл FDKP и 0,25 мг/мл GLP-1 в присутствии 0, 25, 50, 100, 250, 500, 1000 и 1500 мМ NaCl (фиг. 8A). Также оценивали количество GLP-1, обнаруженное в разведенных контрольных образцах, не содержащих FDKP, в зависимости от pH и концентрации NaCl (фиг. 8В). рН в данных наборах образцов корректировали смесью 20 мМ фосфата/20 мМ ацетата. Salt research . The effect of salt on the binding of GLP-1 to FDKP particles was evaluated by HPLC analysis. Download GLP-1 / FDKP particles was carried out at 5 mg / ml FDKP and 0.25 mg / ml GLP-1 in the presence of 0, 25, 50, 100, 250, 500, 1000 and 1500 mm NaCl (Fig. 8A). The amount of GLP-1 found in diluted control samples containing no FDKP was also evaluated as a function of pH and NaCl concentration (FIG. 8B). The pH in these sets of samples was adjusted with a mixture of 20 mm phosphate / 20 mm acetate.
Как видно на фиг. 8A, оптимальное связывание (адсорбция) GLP-1 с частицами FDKP в высокой степени зависело от рН данной суспензии. При pH 4 и выше наблюдалось приблизительно 3,2% - 4% связывание GLP-1 с частицами FDKP, где отношение GLP-1/FDKP в растворе составляло 5% масс./масс. При pH 2,0 в присутствии 0 и 25 мМ NaCl адсорбции GLP-1 на частицах FDKP в основном не наблюдалось, однако при увеличении ионной силы наблюдалась явно заметная нагрузка. Осаждение GLP-1 наблюдалось в контрольных образцах, не содержащих FDKP, в присутствии ≥ 1 M NaCl (фиг. 8B). Такая заметная нагрузка при ≥ 1 M NaCl является результатом обратимого осаждения (высаливания) пептида GLP-1 при высокой ионной силе. Контрольный образец GLP-1 с высоким содержанием соли в отсутствие частиц FDKP также обнаруживал высокие уровни GLP-1 в разведенных образцах, что указывает на то, что GLP-1 удерживался на фильтрах при сборе супернатанта. При концентрации NaCl ниже 1 М какого-либо осаждения GLP-1 в отсутствие частиц FDKP не наблюдалось.As seen in FIG. 8A, the optimal binding (adsorption) of GLP-1 to FDKP particles was highly dependent on the pH of the suspension. At
Исследование поверхностно-активных веществ. Влияние поверхностно-активных веществ на связывание GLP-1 с частицами FDKP оценивали с помощью ЖХВД-анализа. Загрузку осуществляли при 5 мг/мл FDKP и 0,25 мг/мл GLP-1 в присутствии поверхностно-активного вещества (фиг. 9А). Также оценивали количество GLP-1, обнаруженное в разведенных контрольных образцах, не содержащих FDKP, в зависимости от pH и концентрации поверхностно-активного вещества (фиг.9В). pH и условия контрольных образцов были такими же, как описано выше для исследования ионной силы. В данном исследовании использовали следующие поверхностно-активные вещества: Brij 78 при 0,09 мМ, твин 80 при 0,01 мМ, тритон X при 0,2 мМ, плюроник F68 при 0,12 мМ, H(CH2)7SO4Na при 0,9 мМ, CHAPS при 0,9 мМ, цетримид при 0,9 мМ. Кривые загрузки GLP-1 в присутствии каждого поверхностно-активного вещества были построены для GLP-1/FDKP в зависимости от pH. The study of surfactants . The effect of surfactants on the binding of GLP-1 to FDKP particles was evaluated using HPLC analysis. Download was carried out at 5 mg / ml FDKP and 0.25 mg / ml GLP-1 in the presence of a surfactant (Fig. 9A). The amount of GLP-1 found in diluted control samples containing no FDKP was also evaluated as a function of pH and surfactant concentration (Fig. 9B). The pH and conditions of the control samples were the same as described above for the study of ionic strength. The following surfactants were used in this study: Brij 78 at 0.09 mm,
Полученные данные показали, что на кривые адсорбции в зависимости от рН для GLP-1/FDKP-частиц не влияет присутствие поверхностно-активных веществ при концентрации, близкой к критической мицеллярной концентрации (CMC), то есть при концентрациях в небольшом интервале, разделенном границей, ниже которой агрегаты/мицеллы фактически не обнаруживаются и выше которой фактически все другие молекулы поверхностно-активных веществ образуют агрегаты. Поэтому можно также предположить, что любое из этих поверхностно-активных веществ может быть использовано для оптимизации стабильности и/или фармакокинетики (ФК), обсуждаемой ниже. Как было показано выше в описании исследований соли, взаимодействие GLP-1 с частицами FDKP зависит от pH данной суспензии.The data obtained showed that the adsorption curves depending on pH for GLP-1 / FDKP particles are not affected by the presence of surfactants at a concentration close to the critical micellar concentration (CMC), i.e., at concentrations in a small interval separated by a boundary below which aggregates / micelles are practically not detected and above which virtually all other surfactant molecules form aggregates. Therefore, it can also be assumed that any of these surfactants may be used to optimize the stability and / or pharmacokinetics (PK), discussed below. As shown above in the description of salt studies, the interaction of GLP-1 with FDKP particles depends on the pH of the suspension.
Исследование ионов. В этом эксперименте проводили исследования двух различных ионов для определения влияния ионов на связывание GLP-1 с частицами FDKP. В обоих исследованиях Cl- представляет собой противоион для катионов, а Na+ представляет собой противоион для анионов. Загрузку GLP-1/FDKP-частиц осуществляли, как описано в предыдущих экспериментах. pH регулировали, как описано выше. Образцы получали с использованием рН-буфера = 3,0, 3,5, 4,0 или 5,0 в присутствии и в отсутствие NaCl (который был использован для более точной оценки в случае высокой ионной силы). В отдельные образцы были включены дополнительные ионы: LiCl при 20 или 250 мМ, NH4Сl при 20 или 250 мМ, NaF при 20 или 250 мМ, и NaCH3СОО при 20 или 250 мМ. The study of ions . In this experiment, two different ions were studied to determine the effect of ions on the binding of GLP-1 to FDKP particles. In both studies, Cl - is the counterion for the cations, and Na + is the counterion for the anions. Download GLP-1 / FDKP particles was carried out as described in previous experiments. The pH was adjusted as described above. Samples were prepared using pH buffer = 3.0, 3.5, 4.0, or 5.0 in the presence and absence of NaCl (which was used for a more accurate estimate in the case of high ionic strength). Additional ions were included in individual samples: LiCl at 20 or 250 mM, NH 4 Cl at 20 or 250 mM, NaF at 20 or 250 mM, and NaCH 3 COO at 20 or 250 mM.
Данные, полученные в первом исследовании ионов и приведенные на фиг. 10A, представлены в виде кривых загрузки GLP-1/FDKP в зависимости от pH и ионов. В отсутствие NaCl фторид при концентрации 20 или 250 мМ значительно влияет на адсорбцию (усиливает адсорбцию) при низком pH, а NaF при концентрации 250 мМ обнаруживает максимальное связывание независимо от рН. Такая картина наблюдается благодаря присутствию фторида, но не натрия, в данном растворе, поскольку бикарбонат натрия не дает одинаковых эффектов при 20 и 250 мМ. Кроме того, такие эффекты не являются результатом присутствия натрия в образце, поскольку соль в аналогичной концентрации, как показано на фиг.8, не дает такого эффекта. В присутствии 1 M NaCl все ионы дают достаточно «заметную» нагрузку. Такая «заметная» нагрузка для образцов с 1 M NaCl является результатом высаливания пептида GLP-1 из раствора в присутствии высокой ионной силы. Это также проиллюстрировано на фиг. 10B, где показано, что GLP-1 присутствует в разведенных контрольных образцах, не содержащих FDKP, но содержащих 1 M NaCl. Количество детектируемого GLP-1 для этих контрольных образцов возрастало по мере увеличения концентрации ионов, поскольку они были добавлены к общему количеству ионов в данных образцах.The data obtained in the first ion study and shown in FIG. 10A are presented as GLP-1 / FDKP loading curves as a function of pH and ions. In the absence of NaCl, fluoride at a concentration of 20 or 250 mM significantly affects adsorption (enhances adsorption) at low pH, and NaF at a concentration of 250 mM exhibits maximum binding regardless of pH. This pattern is observed due to the presence of fluoride, but not sodium, in this solution, since sodium bicarbonate does not give the same effects at 20 and 250 mm. In addition, such effects are not the result of the presence of sodium in the sample, since salt at a similar concentration, as shown in Fig. 8, does not produce such an effect. In the presence of 1 M NaCl, all ions give a fairly “noticeable” load. This “noticeable” load for samples with 1 M NaCl is the result of salting out of the GLP-1 peptide from the solution in the presence of high ionic strength. This is also illustrated in FIG. 10B, where it is shown that GLP-1 is present in diluted control samples not containing FDKP, but containing 1 M NaCl. The amount of detectable GLP-1 for these control samples increased with increasing ion concentration, as they were added to the total number of ions in these samples.
Во втором эксперименте по исследованию ионов (фиг. 10C) получали образцы GLP-1/FDKP в присутствии KCl при 20 или 250 мМ, имидазола при 20 или 250 мМ, NaI при 20 или 250 мМ или NaPO4 при 20 или 250 мМ. Эти данные показали, что имидазол при 250 мМ снижает нагрузку в присутствии 1 М NaCl, а фосфат при 250 мМ и иодид при 250 мМ дают достаточно заметную нагрузку (фиг. 10C). Исходя из количества GLP-1, обнаруженного в разведенных контрольных образцах, не содержащих FDKP, при концентрациях 0 M и 1 M NaCl (фиг. 10D), можно сказать, что такой эффект обусловлен влиянием ионов на сам пептид GLP-1, а не на взаимодействие пептида с частицами FDKP. Присутствие фосфата натрия и иодида натрия приводит к некоторому высаливанию GLP-1 в отсутствие NaCl. Кроме того, имидазол стимулирует солюбилизацию GLP-1 в образцах с 1 M NaCl и, таким образом, дает менее явную нагрузку. Осаждение также наблюдалось в контролях с 0 М NaCl, содержащих 250 мМ фосфата и иодида.In a second ion study (FIG. 10C), GLP-1 / FDKP samples were prepared in the presence of KCl at 20 or 250 mM, imidazole at 20 or 250 mM, NaI at 20 or 250 mM, or NaPO 4 at 20 or 250 mM. These data showed that imidazole at 250 mM reduces the load in the presence of 1 M NaCl, and phosphate at 250 mM and iodide at 250 mM give a fairly noticeable load (Fig. 10C). Based on the amount of GLP-1 found in diluted control samples not containing FDKP at concentrations of 0 M and 1 M NaCl (Fig. 10D), we can say that this effect is due to the effect of ions on the GLP-1 peptide itself, and not on peptide interaction with FDKP particles. The presence of sodium phosphate and sodium iodide leads to some salting out of GLP-1 in the absence of NaCl. In addition, imidazole stimulates the solubilization of GLP-1 in samples with 1 M NaCl and, thus, gives a less pronounced load. Precipitation was also observed in controls with 0 M NaCl containing 250 mM phosphate and iodide.
Исследование осмолитов. Влияние осмолитов на связывание GLP-1 с частицами FDKP оценивали с помощью ЖХВД-анализа. На фиг. 11А представлены кривые загрузки GLP-1/FDKP в зависимости от pH в присутствии общих стабилизаторов (осмолитов). Загрузку GLP-1/ FDKP-частиц осуществляли, как описано в предыдущем эксперименте. Аналогичным образом, рН регулировали, как описано выше. Образцы получали при рН 3,0 и в присутствии 20, 50, 100, 150, 200 или 300 мМ осмолита (стабилизатора). Осмолиты представляют собой гексиленгликоль (Hex-Gly), трегалозу, глицин, ПЭГ, TMAO, маннит или пролин; а N/A означает отсутствие осмолита. В аналогичном эксперименте концентрация осмолита (стабилизатора) в образцах была постоянной при 100 мМ, а pH варьировался от 2,0 до 4,0. The study of osmolites . The effect of osmolytes on the binding of GLP-1 to FDKP particles was evaluated using HPLC analysis. In FIG. 11A shows the loading curves of GLP-1 / FDKP versus pH in the presence of general stabilizers (osmolytes). Download GLP-1 / FDKP particles was carried out as described in the previous experiment. Similarly, the pH was adjusted as described above. Samples were obtained at pH 3.0 and in the presence of 20, 50, 100, 150, 200 or 300 mM osmolyte (stabilizer). Osmolites are hexylene glycol (Hex-Gly), trehalose, glycine, PEG, TMAO, mannitol or proline; and N / A means no osmolyte. In a similar experiment, the concentration of osmolyte (stabilizer) in the samples was constant at 100 mM, and the pH ranged from 2.0 to 4.0.
Ни один из исследуемых осмолитов (стабилизаторов) не оказывал значительного влияния на адсорбцию GLP-1 на поверхности FDKP в случае, когда pH поддерживался на уровне pH 3,0, а концентрации осмолитов варьировались (фиг. 11A; кривые слева), или когда концентрация осмолитов поддерживалась при 100 мМ, а значения pH варьировались (фиг. 11A; кривые справа). Какого-либо осаждения GLP-1 в разведенных контрольных образцах, не содержащих FDKP, не обнаруживалось (фиг. 11B). Эти осмолиты могут быть использованы для оптимизации стабильности и/или улучшения фармакокинетических свойств.None of the studied osmolytes (stabilizers) had a significant effect on the adsorption of GLP-1 on the FDKP surface in the case when the pH was maintained at pH 3.0 and the osmolyte concentration varied (Fig. 11A; curves on the left), or when the osmolyte concentration was maintained at 100 mM, and the pH values varied (Fig. 11A; curves on the right). No deposition of GLP-1 was detected in the diluted control samples not containing FDKP (Fig. 11B). These osmolytes can be used to optimize stability and / or improve pharmacokinetic properties.
Исследование хаотропов и лиотропов. Было проведено исследование ионов, которые влияют на структуру воды и белков (хаотропов и лиотропов), для определения роли этих факторов в адсорбции GLP-1 на FDKP. Загрузку GLP-1/FDKP-частиц осуществляли, как описано в предыдущих экспериментах. Аналогичным образом, рН регулировали, как описано выше. Образцы получали при рН 3,0 и в присутствии 0, 20, 50, 100, 150, 200 или 300 мМ нижеследующих хаотропов или лиотропов: NaSCN, CsCl, Na2SO4, (СН3)3N-HC1, Na2NO3, Na-цитрата и NaClO4. В аналогичном эксперименте концентрация хаотропа или лиотропа в образцах поддерживалась при 100 мМ, а pH варьировался от 2,0 до 4,0. Study of chaotropes and lyotropes . A study was carried out of ions that affect the structure of water and proteins (chaotropes and lyotropes) to determine the role of these factors in the adsorption of GLP-1 on FDKP. Download GLP-1 / FDKP particles was carried out as described in previous experiments. Similarly, the pH was adjusted as described above. Samples were obtained at pH 3.0 and in the presence of 0, 20, 50, 100, 150, 200 or 300 mM of the following chaotropes or lyotropes: NaSCN, CsCl, Na 2 SO 4 , (CH 3 ) 3 N-HC1, Na 2 NO 3 , Na-citrate and NaClO 4 . In a similar experiment, the concentration of the chaotropic or lyotropic in the samples was maintained at 100 mM, and the pH ranged from 2.0 to 4.0.
На фиг.12А представлены кривые загрузки для GLP-1/FDKP в зависимости от pH и хаотропа и/или лиотропа. При низком pH (≤ 3) для различных анализируемых хаотропов, а в частности, при более высоких концентрациях хаотропов наблюдались значительные изменения загрузки. Однако при pH 4 такие изменения не наблюдались (фиг. 12C). Таким образом, очевидно, что эти агенты стимулируют связывание GLP-1 с частицами FDKP при более низком pH, являющимся неблагоприятным для связывания, но при более высоких pH, которые являются благоприятными условиями для связывания, такое стимулирующее воздействие является незначительным. Данные, полученные для разведенных контрольных образцов, не содержащих FDKP, позволяют предположить, что изменения нагрузки, наблюдаемые при pH 3,0, частично вызваны присутствием специфических хаотропов, в различной степени влияющих на высаливание (осаждение) пептида GLP-1 (фиг. 12B и 12D). Такой эффект наблюдался для сильных хаотропов, таких как NaSCN и NaClO4.12A shows loading curves for GLP-1 / FDKP as a function of pH and chaotrope and / or lyotrope. At low pH (≤ 3), for various analyzed chaotropes, and in particular, at higher concentrations of chaotropes, significant changes in the load were observed. However, at
Исследование органических соединений. Спирты, которые, как известно, индуцируют образование спиральной конформации в неструктурированных пептидах посредством увеличения силы водородных связей, оценивали для определения роли спиральной конформации в адсорбции GLP-1 на FDKP. Загрузку GLP-1/FDKP-частиц осуществляли, как описано в предыдущих экспериментах. Аналогичным образом, рН регулировали, как описано выше. Эффекты каждого из указанных спиртов наблюдали при рН 2,0, 3,0, 4,0 и 5,0. Были использованы следующие спирты: метанол (MeOH), этанол (EtOH), трифторэтанол (TFE) или гексафторизопропанол (HFIP). Каждый из этих спиртов оценивали при концентрации 5%, 10%, 15% и 20% об./об. The study of organic compounds . Alcohols, which are known to induce the formation of helical conformation in unstructured peptides by increasing the strength of hydrogen bonds, were evaluated to determine the role of helical conformation in the adsorption of GLP-1 on FDKP. Download GLP-1 / FDKP particles was carried out as described in previous experiments. Similarly, the pH was adjusted as described above. The effects of each of these alcohols were observed at pH 2.0, 3.0, 4.0 and 5.0. The following alcohols were used: methanol (MeOH), ethanol (EtOH), trifluoroethanol (TFE) or hexafluoroisopropanol (HFIP). Each of these alcohols was evaluated at a concentration of 5%, 10%, 15%, and 20% v / v.
На фиг. 13А представлены кривые загрузки GLP-1/FDKP в зависимости от pH для каждого спирта в каждой концентрации. При pH 3,0 низкая концентрация HFIP (5%) дает высокий уровень адсорбции, на что указывает массовое отношение GLP-1 к частицам FDKP. Влиянием на адсорбцию в данных забуференных суспензиях обладали только спирты с наиболее прочными Н-связями (образующими спираль), HFIP. При более высоких концентрациях HFIP (20%) наблюдалось ингибирование адсорбции GLP-1 на FDKP. На фиг. 13B показано, что при 20% концентрации спирта какого-либо значительного осаждения GLP-1 в разведенных контрольных образцах, не содержащих FDKP, не наблюдалось.In FIG. 13A shows the loading curves of GLP-1 / FDKP versus pH for each alcohol at each concentration. At pH 3.0, a low concentration of HFIP (5%) gives a high level of adsorption, as indicated by the mass ratio of GLP-1 to FDKP particles. Only alcohols with the strongest H-bonds (forming a helix), HFIP, had an effect on adsorption in these buffered suspensions. At higher HFIP concentrations (20%), inhibition of GLP-1 adsorption on FDKP was observed. In FIG. 13B shows that at 20% alcohol concentration no significant precipitation of GLP-1 was observed in diluted control samples containing no FDKP.
Это позволяет предположить, что конформационная гибкость лекарственного средства (то есть энтропия и число контактов FDKP, которые могут образовываться) может играть определенную роль в адсорбции. Полученные данные позволяют предположить, что Н-связи могут играть определенную роль во взаимодействии GLP-1 с частицами FDKP в вышеописанных условиях. Исходя из этих данных можно также сделать предположение, что если Н-связи служат в качестве доминирующей и обобщенной силы во взаимодействиях FDKP-GLP-1, то очевидно, что должно наблюдаться большее число взаимодействий и более сильные воздействия.This suggests that the conformational flexibility of the drug (i.e., the entropy and the number of FDKP contacts that can form) may play a role in adsorption. The data obtained suggest that H bonds may play a role in the interaction of GLP-1 with FDKP particles under the above conditions. Based on these data, it can also be assumed that if H-bonds serve as the dominant and generalized force in the FDKP-GLP-1 interactions, then it is obvious that a larger number of interactions and stronger effects should be observed.
Исследование концентраций. Было проведено исследование адсорбции GLP-1 на поверхности частиц FDKP при различных концентрациях GLP-1. На фиг. 14A показаны кривые загрузки GLP-1/FDKP в зависимости от концентрации GLP-1 при различных pH. Концентрации GLP-1 составляли 0,15, 0,25, 0,4, 0,5, 0,75, 1,0, 1,5, 2,0, 5,0 или 10 мг/мл. pH образцов составлял 2,5, 3,0, 3,5, 4,0, 4,5 или 5,0. The study of concentrations . A study was conducted of the adsorption of GLP-1 on the surface of FDKP particles at various concentrations of GLP-1. In FIG. 14A shows the loading curves of GLP-1 / FDKP versus GLP-1 concentration at various pHs. GLP-1 concentrations were 0.15, 0.25, 0.4, 0.5, 0.75, 1.0, 1.5, 2.0, 5.0, or 10 mg / ml. The pH of the samples was 2.5, 3.0, 3.5, 4.0, 4.5, or 5.0.
Увеличение загрузки GLP-1 на частицы FDKP наблюдалось в случае, когда концентрация FDKP поддерживалась при 5 мг/мл, а концентрация GLP-1 увеличивалась. Примерно 20% адсорбция GLP-1 на частицах FDKP наблюдалась в случае, когда концентрация GLP-1 составляла 10 мг/мл при pH 4. При этом неожиданностью явилось то, что какого-либо насыщения адсорбции GLP-1 на частицах FDKP при высоких концентрациях GLP-1 не наблюдалось. Такое наблюдение, вероятно, можно объяснить самосборокой GLP-1 в мультислои.An increase in the loading of GLP-1 onto FDKP particles was observed when the concentration of FDKP was maintained at 5 mg / ml and the concentration of GLP-1 was increased. Approximately 20% adsorption of GLP-1 on FDKP particles was observed when the concentration of GLP-1 was 10 mg / ml at
Анализ морфологии препаратов GLP-1/FDKP с помощью сканирующей электронной микроскопии (СЭМ) показал, что GLP-1/FDKP-частицы присутствуют в виде кристаллических или пластинчатых структур, которые могут образовывать агрегаты, включающие несколько GLP-1/FDKP-частиц (фиг. 14B). Эти препараты получали путем лиофилизации раствора, содержащего: (панель A) 0,5 мг/мл GLP-1 и 2,5 мг/мл FDKP; (панель B) 0,5 мг/мл GLP-1 и 10 мг/мл FDKP; (панель C) 0,5 мг/мл GLP-1 и 10 мг/мл FDKP в 20 мМ хлорида натрия, 20 мМ ацетата калия и 20 мМ фосфата калия, pH 4,0; и (панель D) 10 мг/мл GLP-1 и 50 мг/мл FDKP в 20 мМ хлорида натрия, 20 мМ ацетата калия и 20 мМ фосфата калия при pH 4,0.Scanning electron microscopy (SEM) morphology of the GLP-1 / FDKP preparations showed that GLP-1 / FDKP particles are present in the form of crystalline or lamellar structures that can form aggregates comprising several GLP-1 / FDKP particles (FIG. . 14B). These preparations were obtained by lyophilization of a solution containing: (panel A) 0.5 mg / ml GLP-1 and 2.5 mg / ml FDKP; (panel B) 0.5 mg / ml GLP-1 and 10 mg / ml FDKP; (panel C) 0.5 mg / ml GLP-1 and 10 mg / ml FDKP in 20 mM sodium chloride, 20 mM potassium acetate and 20 mM potassium phosphate, pH 4.0; and (panel D) 10 mg / ml GLP-1 and 50 mg / ml FDKP in 20 mM sodium chloride, 20 mM potassium acetate and 20 mM potassium phosphate at pH 4.0.
Краткое описание результатовSummary of Results
В общих чертах, исследования влияния адсорбции на взаимодействие GLP-1 с частицами FDKP показали, что связывание GLP-1 с поверхностями частиц DKP зависит от pH, при этом высокий уровень адсорбции наблюдается при pH 4 или выше. Было обнаружено, что адсорбция GLP-1 на поверхностях частиц DKP главным образом зависит от pH, причем при pH 2,0 адсорбция в основном не наблюдалась, а при pH ≥ 4,0 наблюдалось значительное взаимодействие. Как было обнаружено, ионы натрия и фторида усиливали адсорбцию при низком pH. Другие добавки, такие как поверхностно-активные вещества и известные стабилизаторы, оказывали лишь незначительное влияние на адсорбцию GLP-1 на поверхностях частиц FDKP.In general, studies of the effect of adsorption on the interaction of GLP-1 with FDKP particles have shown that the binding of GLP-1 to the surfaces of DKP particles is pH dependent, with a high level of adsorption observed at
Кроме того, на результаты этих экспериментов влияют свойства самого GLP-1. Было обнаружено, что поведение GLP-1 является нетипичным, и неожиданность такого поведения состоит в наблюдаемом отсутствии насыщения адсорбции, что может объясняться самосборкой GLP-1 при высоких концентрациях. Сама сборка GLP-1 при высоких концентрациях может приводить к покрытию частиц DKP мультислоями пептида GLP-1 и тем самым к стимуляции повышения процента загрузки пептида GLP-1. Было подтверждено, что такая неожиданно обнаруженная способность GLP-1 к самосборке является благоприятной с точки зрения получения стабильных форм GLP-1, подходящих для введения. Кроме того, самоассоциирующаяся конформация GLP-1 может обеспечивать снижение степени разложения или замедление такого разложения GLP-1 в крови. Однако следует отметить, что при работе с ассоциированным GLP-1 необходимо принимать меры предосторожности, поскольку такой GLP-1 является чувствительным к изменениям температуры и к высоким рН.In addition, the properties of GLP-1 itself affect the results of these experiments. It was found that the behavior of GLP-1 is atypical, and the surprise of this behavior is the observed lack of adsorption saturation, which may be explained by self-assembly of GLP-1 at high concentrations. The assembly of GLP-1 at high concentrations can lead to the coating of DKP particles with multilayers of the GLP-1 peptide and thereby stimulate an increase in the percent loading of the GLP-1 peptide. It was confirmed that such an unexpectedly discovered ability of GLP-1 to self-assemble is favorable from the point of view of obtaining stable forms of GLP-1, suitable for administration. In addition, the self-associating conformation of GLP-1 can provide a reduction in the degree of degradation or a delay in such decomposition of GLP-1 in the blood. However, it should be noted that when working with associated GLP-1, precautions must be taken, since such GLP-1 is sensitive to temperature changes and high pH.
Пример 3Example 3
Анализ на целостность препаратов GLP-1/FDKPGLP-1 / FDKP drug integrity analysis
Исходя из результатов, описанных в экспериментах по примерам 1 и 2, для проведения анализа на жизнеспособность клеток, обсуждаемого в настоящей заявке, были отобраны серии препаратов GLP-1, обладающих свойствами, описанными в таблице 1. Большинство из таких препаратов содержало наполнители GRAS («в основном известные как безопасные»), и некоторые из них были отобраны для проведения исследований на взаимосвязь стабильности и адсорбции.Based on the results described in the experiments of Examples 1 and 2, a series of GLP-1 preparations having the properties described in Table 1 were selected for the cell viability analysis discussed in this application. Most of these preparations contained GRAS excipients (" mostly known as safe ”), and some of them were selected for studies on the relationship of stability and adsorption.
Выбранные GLP-1/FDKP-препараты для проведения анализов в фазе испытания на целостностьTable 1
Selected GLP-1 / FDKP preparations for analysis in the integrity test phase
(мМ)amount
(mm)
Кроме того, исходя из результатов, полученных, как описано в примерах 1 и 2, были также выбраны серии препаратов для проведения исследований в фазе II на целостность GLP-1/FDKP. В нижеприведенной таблице 2 представлены шесть препаратов GLP-1, отобранных для проведения исследований в фазе II на целостность. После получения порошков они были смешаны с контрольным FDKP с получением одинаковых масс пептида GLP-1 и FDKP в каждом препарате.In addition, based on the results obtained as described in examples 1 and 2, a series of preparations were also selected for studies in phase II on the integrity of GLP-1 / FDKP. Table 2 below shows six GLP-1 formulations selected for integrity studies in phase II. After receiving the powders, they were mixed with the control FDKP to obtain the same masses of the peptides GLP-1 and FDKP in each preparation.
GLP-1/FDKP-препараты, отобранные для проведения исследований в фазе II на целостность. Препарат, полученный из 10 мг/мл GLP-1 в 20 мМ NaCl и в буфере, pH 4,0, описан как препарат, содержащий сольtable 2
GLP-1 / FDKP drugs selected for phase II integrity studies. A preparation obtained from 10 mg / ml GLP-1 in 20 mM NaCl and in buffer, pH 4.0, is described as a preparation containing salt
Влияние стресса на препараты GLP-1/FDKP, описанные в таблице 2, анализировали с помощью ЖХВД (фиг. 15). Образцы, содержащие 5%, 10% или 20% GLP-1/FDKP, загруженные в Н2О, или 5% или 10% GLP-1/FDKP, загруженные в NaCl + буфер, pH 4,0, инкубировали в течение 10 дней при 40°С. ЖХВД-хроматограммы показали, что пептид GLP-1 элюируется при одном и том же времени удерживания, а пики разложения отсутствуют. Кроме того, МС-анализы давали аналогичные массы для всех образцов, 3297 г/моль, что указывало на то, что масса всех исследуемых образцов не изменялась. Полученные данные показали присутствие GLP-1 и частиц FDKP в определенном массовом отношении, а также других компонентов, имеющихся в растворе перед лиофилизацией. Было обнаружено, что GLP-1/FDKP-препараты, по существу, являются устойчивыми к стрессу.The effect of stress on GLP-1 / FDKP preparations described in Table 2 was analyzed by HPLC (Fig. 15). Samples containing 5%, 10% or 20% GLP-1 / FDKP loaded in H 2 O, or 5% or 10% GLP-1 / FDKP loaded in NaCl + buffer, pH 4.0, were incubated for 10 days at 40 ° C. HPLC chromatograms showed that the GLP-1 peptide elutes at the same retention time, and there are no decomposition peaks. In addition, MS analyzes yielded similar masses for all samples, 3297 g / mol, which indicated that the mass of all the samples studied did not change. The data obtained showed the presence of GLP-1 and FDKP particles in a certain weight ratio, as well as other components present in the solution before lyophilization. It was found that GLP-1 / FDKP drugs are essentially resistant to stress.
Пример 4Example 4
Стабильность GLP-1, инкубированного в легочном лаважеStability of GLP-1 incubated in pulmonary lavage
Принимая во внимание тот факт, что дипептидил-пептидаза IV (DPP-IV), обнаруживаемая в биологических жидкостях, расщепляет и инактивирует GLP-1, стабильность GLP-1 была проанализирована в биологических жидкостях, таких как легочная жидкость и кровь.Considering the fact that dipeptidyl peptidase IV (DPP-IV), found in biological fluids, cleaves and inactivates GLP-1, GLP-1 stability has been analyzed in biological fluids such as pulmonary fluid and blood.
Дипептидил-пептидаза IV (DPP-IV) представляет собой внеклеточную мембранно-связанную сериновую протеазу, экспрессируемую на поверхности клеток некоторых типов, а в частности на CD4+-Т-клетках. DPP-IV была также обнаружена в крови и в легочной жидкости. DPP-IV участвует в регуляции метаболизма глюкозы, поскольку ее субстратом является инсулинотропный гормон GLP-1, который инактивируется путем удаления его двух N-концевых аминокислот, см. фиг. 16A. DPP-IV расщепляет связь Ala-Glu в большинстве форм человеческого GLP-1 (GLP-1(7-36)), циркулирующих в крови, что приводит к высвобождению N-концевых двух остатков. DPP-IV участвует в негативной регуляции выведения глюкозы путем разложения GLP-1, что приводит к снижению влияния инкретина на β-клетки поджелудочной железы.Dipeptidyl peptidase IV (DPP-IV) is an extracellular membrane-bound serine protease expressed on the surface of certain types of cells, in particular CD4 + T cells. DPP-IV has also been detected in the blood and in pulmonary fluid. DPP-IV is involved in the regulation of glucose metabolism, since its substrate is the insulinotropic hormone GLP-1, which is inactivated by the removal of its two N-terminal amino acids, see FIG. 16A. DPP-IV cleaves the Ala-Glu bond in most forms of human GLP-1 (GLP-1 (7-36)) circulating in the blood, resulting in the release of the N-terminal two residues. DPP-IV is involved in the negative regulation of glucose excretion by decomposition of GLP-1, which leads to a decrease in the effect of incretin on pancreatic β-cells.
Были проведены исследования для определения уровня ингибирования разложения GLP-1 в крови и в легочной жидкости крыс в присутствии апротинина или ингибитора DPP-IV. Апротинин, природный ингибитор сериновой протеазы, который, как известно, ингибирует разложение белка, добавляли к образцам после их сбора в концентрации 1, 2, 3, 4 и 5 единиц ингибитора трипсина на мл (TIU/мл). Затем измеряли DPP-IV-активность путем детектирования расщепления люминесцентного субстрата, содержащего DPP-IV-распознаваемую последовательность Gly-Pro. Бронхиальный лаваж инкубировали с пролюминесцентным субстратом в течение 30 минут и продукт расщепления детектировали по интенсивности люминесценции.Studies have been conducted to determine the level of inhibition of GLP-1 decomposition in the blood and in the pulmonary fluid of rats in the presence of aprotinin or a DPP-IV inhibitor. Aprotinin, a naturally occurring serine protease inhibitor that is known to inhibit protein degradation, was added to the samples after collecting them at a concentration of 1, 2, 3, 4, and 5 units of trypsin inhibitor per ml (TIU / ml). Then, DPP-IV activity was measured by detecting cleavage of a luminescent substrate containing a DPP-IV-recognized Gly-Pro sequence. Bronchial lavage was incubated with a proluminescent substrate for 30 minutes and the cleavage product was detected by luminescence intensity.
Полученные данные указывали на усиление ингибирования DPP-IV-активности, как было установлено по ингибированию разложения пептида в различных биологических жидкостях (как обсуждается в настоящем описании) в присутствии возрастающих концентраций апротинина (фиг. 16B). Аналогичные результаты были получены с использованием ингибитора DPP-IV, добавленного в образцы после их сбора при 1,25, 2,5, 5, 10 и 20 мкл/мл (фиг. 16C). Добавление ингибиторов после сбора образцов позволяло проводить более точную оценку данных образцов.The data obtained indicated an increase in the inhibition of DPP-IV activity, as was shown by inhibition of peptide decomposition in various biological fluids (as discussed in the present description) in the presence of increasing concentrations of aprotinin (Fig. 16B). Similar results were obtained using a DPP-IV inhibitor added to the samples after collection at 1.25, 2.5, 5, 10, and 20 μl / ml (Fig. 16C). The addition of inhibitors after sampling allowed a more accurate assessment of these samples.
Стабильность GLP-1 также оценивали в легочном лаваже с использованием mAb для ELISA с захватом антитела, которое распознает аминокислоты 7-9 GLP-1. GLP-1 инкубировали в легочном лаваже (LLF) в течение 2, 5, 20 и 30 минут. Инкубирование проводили в следующих условиях: 1 или 10 мкг (масс./масс.) LLF и 1 или 10 мкг (масс./масс.) GLP-1, как показано на фиг. 17. GLP-1 не детектировался лишь в одном LLF. При использовании комбинации LLF и GLP-1 в различных концентрациях наблюдался высокий уровень GLP-1 по сравнению с уровнем GLP-1, используемого отдельно, что указывало на то, что GLP-1 является стабильным в легочном лаваже в течение всего периода времени (фиг. 17). Стабильность GLP-1 в неразведенном легочном лаваже была подтверждена в аналогичных исследованиях, при этом, через 20 минут, GLP-1 сохранял свою целостность на 70-72% (данные не приводятся).GLP-1 stability was also assessed in pulmonary lavage using an mAb for ELISA capture antibodies that recognize amino acids 7-9 GLP-1. GLP-1 was incubated in pulmonary lavage (LLF) for 2, 5, 20 and 30 minutes. Incubation was performed under the following conditions: 1 or 10 μg (w / w) LLF and 1 or 10 μg (w / w) GLP-1, as shown in FIG. 17. GLP-1 was not detected in only one LLF. Using a combination of LLF and GLP-1 at different concentrations, a high level of GLP-1 was observed compared to the level of GLP-1, used alone, which indicated that GLP-1 was stable in pulmonary lavage over the entire period of time (FIG. 17). The stability of GLP-1 in undiluted pulmonary lavage was confirmed in similar studies, while, after 20 minutes, GLP-1 retained its integrity by 70-72% (data not shown).
Кроме того, была оценена стабильность GLP-1 в крысиной плазме. Плазму брали у различных крыс (плазма 1 и плазма 2, как указано в надписях на данном графике) и разводили 1:2 или 1:10 (об./об.). Один микрограмм GLP-1 добавляли к 10 мкл плазмы или PBS. Образцы инкубировали при 37°С в течение 5, 10, 30 или 40 минут. Реакцию прекращали на льду и добавляли 0,1 ед. апротинина. Полученные данные показали высокую концентрацию GLP-1 в плазме при разведениях 1:2 и 1:10 в течение всех периодов времени проведения тестов (фиг. 18A и 18B). В целом полученные данные неожиданно показали, что GLP-1 является стабильным в легочном лаваже и в плазме, в которых присутствует сериновая протеаза DPP-IV.In addition, the stability of GLP-1 in rat plasma was evaluated. Plasma was taken from various rats (
Пример 5Example 5
Влияние молекул GLP-1 на апоптоз и пролиферацию клетокThe effect of GLP-1 molecules on apoptosis and cell proliferation
В целях детекции ингибирования апоптоза под действием GLP-1 был проведен скрининг-анализ для того, чтобы определить, влияет ли GLP-1 на ингибирование гибели β-клеток. Панкреатические эпителиальные клетки крыс (ARIP) (используемые в качестве модели панкреатических β-клеток и закупленные у ATCC, Manassas, VA) были предварительно обработаны GLP-1 при концентрациях 0, 2, 5, 10, 15 или 20 нМ в течение 10 минут. Затем либо эти клетки не подвергали дальнейшей обработке, либо их обрабатывали 5 мкМ стауроспорина (индуктора апоптоза) в течение 4,5 часа. Жизнеспособность клеток оценивали с использованием реагента Cell Titer-GloTM (Promega, Madison, WI). С увеличением концентрации GLP-1 до 10 нМ в клетках, обработанных стауроспорином, наблюдалось снижение процента гибели клеток (фиг. 19A).In order to detect inhibition of apoptosis by GLP-1, a screening assay was performed to determine if GLP-1 affects the inhibition of β-cell death. Rat pancreatic epithelial cells (ARIP) (used as a model of pancreatic β-cells and purchased from ATCC, Manassas, VA) were pretreated with GLP-1 at concentrations of 0, 2, 5, 10, 15, or 20 nM for 10 minutes. Then, either these cells were not subjected to further processing, or they were treated with 5 μM staurosporin (apoptosis inducer) for 4.5 hours. Cell viability was assessed using Cell Titer-Glo ™ reagent (Promega, Madison, WI). With an increase in the concentration of GLP-1 to 10 nM in cells treated with staurosporine, a decrease in the percentage of cell death was observed (Fig. 19A).
Дополнительную оценку влияния GLP-1 на апоптоз проводили с помощью FACS-анализа с окрашиванием аннексином V. Окрашивание аннексином V является ценным инструментом для детектирования апоптотических клеток и хорошо известно специалистам. Связывание аннексина V с клеточной мембраной позволяет проанализировать изменения асимметрии в фосфолипидах (ФЛ) перед проведением анализа на морфологические изменения, ассоциированные с апоптозом, и на утрату целостности мембраны. Таким образом, влияние GLP-1 на апоптоз определяли в клетках, обработанных 15 нМ GLP-1, l мкМ стауроспорина в течение 4 часов и 1 мкМ стауроспорина + 15 нМ GLP-1, или в клетках, не обработанных ни стауроспорином, ни GLP-1 (экспериментальный контроль). Полученные данные показали, что GLP-1 ингибирует индуцированный стауроспорином апоптоз примерно на 40% (фиг. 19B).An additional assessment of the effect of GLP-1 on apoptosis was performed using FACS analysis with staining with annexin V. Staining with annexin V is a valuable tool for the detection of apoptotic cells and is well known in the art. The binding of annexin V to the cell membrane allows us to analyze the changes in the asymmetry in phospholipids (PL) before analyzing the morphological changes associated with apoptosis and the loss of membrane integrity. Thus, the effect of GLP-1 on apoptosis was determined in cells treated with 15 nM GLP-1, 1 μM staurosporin for 4 hours and 1 μM staurosporin + 15 nM GLP-1, or in cells not treated with either staurosporine or GLP- 1 (experimental control). The data obtained showed that GLP-1 inhibits staurosporin-induced apoptosis by about 40% (Fig. 19B).
Аналогичные результаты анализа на ингибирование апоптоза были получены с использованием аналога GLP-1, экзендина-4, который связывается с рецептором GLP-1 так же, как и с самим GLP-1. Клетки ARIP обрабатывали 5 мкМ стауроспорина в присутствии 0, 10, 20 или 40 нМ экзендина в течение 16, 24 или 48 часов соответственно. Полученные данные (фиг. 20) показали, что при 10 нM экзендин был абсолютно неэффективным в ингибировании апоптоза, то есть наблюдалась 100% клеточная гибель. При концентрации 20 и 40 нM экзендин ингибировал апоптоз лишь до определенной степени, причем примерно 50%-ное ингибирование наблюдалось через 48 часов в присутствии 40 нМ экзендина-4.Similar results of an apoptosis inhibition assay were obtained using the GLP-1 analog, exendin-4, which binds to the GLP-1 receptor in the same way as GLP-1 itself. ARIP cells were treated with 5 μM staurosporine in the presence of 0, 10, 20 or 40 nM exendin for 16, 24 or 48 hours, respectively. The data obtained (Fig. 20) showed that at 10 nM exendin was completely ineffective in inhibiting apoptosis, i.e., 100% cell death was observed. At a concentration of 20 and 40 nM, exendin inhibited apoptosis only to a certain extent, with approximately 50% inhibition observed after 48 hours in the presence of 40 nM exendin-4.
Пример 6Example 6
Влияние GLP-1/FDKP-композиций-кандидатов на клеточную гибельThe effect of GLP-1 / FDKP candidate compositions on cell death
Для оценки способности GLP-1/FDKP-препаратов ингибировать гибель клеток были проведены клеточные анализы (как описано в примере 3, см. выше таблицу 1). Эти препараты GLP-1/FDKP-частиц использовали либо в виде суспензии, либо в лиофилизованной форме. Полученные препараты анализировали на их способность ингибировать индуцированную стауроспорином гибель клеток ARIP. Клетки ARIP, предварительно обработанные GLP-1-образцами, подвергали воздействию 5 мкМ стауроспорина в течение 4 часов и анализировали с использованием реагента Cell Titer-GloTM (Promega, Madison, WI) для определения жизнеспособности клеток.To assess the ability of GLP-1 / FDKP preparations to inhibit cell death, cell analyzes were performed (as described in example 3, see table 1 above). These formulations of GLP-1 / FDKP particles were used either in suspension or in lyophilized form. The resulting preparations were analyzed for their ability to inhibit staurosporin-induced ARIP cell death. ARIP cells pretreated with GLP-1 samples were exposed to 5 μM staurosporin for 4 hours and analyzed using Cell Titer-Glo ™ reagent (Promega, Madison, WI) to determine cell viability.
Образцы различных GLP-1/FDKP-препаратов либо не подвергали воздействию стресса, либо помещали на 4 недели в условия стресса при 4°С или 40°С. В клеточном анализе, проводимом для определения способности GLP-1/FDKP ингибировать индуцированную стауроспорином гибель клеток, каждый образец GLP-1/FDKP использовали в концентрации 45 нМ. Контрольные образцы, показанные справа, продемонстрировали жизнеспособность клеток только в одной среде, в среде лишь с одним GLP-1, в среде лишь с одним стауроспорином или в присутствии GLP-1 и стауроспорина (примечание: надписи на графике не относятся к контрольным образцам. Каждый столбик гистограммы представляет отдельный эксперимент с тремя повторностями). Все результаты представлены как среднее для экспериментов с тремя повторностями.Samples of various GLP-1 / FDKP preparations were either not exposed to stress or placed for 4 weeks under stress at 4 ° C or 40 ° C. In a cell assay conducted to determine the ability of GLP-1 / FDKP to inhibit staurosporin-induced cell death, each GLP-1 / FDKP sample was used at a concentration of 45 nM. The control samples shown on the right showed cell viability in only one medium, in an environment with only one GLP-1, in an environment with only one staurosporin, or in the presence of GLP-1 and staurosporin (note: the inscriptions on the graph do not apply to control samples. Each the bar graph represents a separate experiment with three repetitions). All results are presented as the average for experiments with three replicates.
Полученные данные показали, что все подвергнутые стрессу лиофилизованные GLP-1/FDKP-препараты ингибировали индуцированную стауроспорином гибель клеток (фиг. 21). Однако гибель клеток не ингибировалась под действием многих GLP-1/FDKP-препаратов, используемых в форме суспензий.The data showed that all stressed lyophilized GLP-1 / FDKP preparations inhibited staurosporin-induced cell death (FIG. 21). However, cell death was not inhibited by many GLP-1 / FDKP preparations used in the form of suspensions.
Пример 7Example 7
Инсуффляция GLP-1/DKP-частиц в легкиеInsufflation of GLP-1 / DKP particles into the lungs
Для анализа фармакокинетики GLP-1/FDKP проводили оценку концентраций GLP-1 в плазме самок крыс Sprague Dawley, которым вводили различные препараты GLP-1/FDKP путем внутривенных инъекций или инсуффляции в легкие. В предварительных исследованиях в препаратах GLP-1/FDKP-частиц GLP-1 присутствовал в концентрации приблизительно 4% и 16% (масс./масс.). Крыс произвольно разделяли на 12 групп, где группам 1, 4, 7 и 10 вводили раствор GLP-1 путем инстилляции жидкости в легкие или путем внутривенной (i.v.) инъекции. Группам 2, 5, 8 и 11 вводили GLP-1/FDKP-препарат в виде соли (как указано в таблице 2) путем инсуффляции в легкие или i.v.-инъекции. Группам 3, 6, 9 и 12 вводили смешанный GLP-1/FDKP-препарат в виде соли путем инсуффляции в легкие или i.v.-инъекции. GLP-1/DKP-препарат представлял собой препарат в виде соли с загрузкой приблизительно 16%. Для достижения загрузки приблизительно 4%, 16% препарат смешивали с DKP-частицами в отношении 3:1. При инсуффляции в легкие или внутривенной инъекции вводили 0,5 или 2,0 мг частиц (загрузка GLP-1 составляла 16% или 4% соответственно), где суммарная доза GLP-1 составляла 0,08 мг.To analyze the pharmacokinetics of GLP-1 / FDKP, plasma concentrations of GLP-1 were evaluated in female Sprague Dawley rats, which were administered various preparations of GLP-1 / FDKP by intravenous injection or pulmonary insufflation. In preliminary studies of GLP-1 / FDKP particle preparations, GLP-1 was present at a concentration of approximately 4% and 16% (w / w). Rats were randomly divided into 12 groups, where
Животным отдельной группы (группы 7-12) введение повторяли на день 2. Группам 1, 4, 7 и 10 вводили 80 мкг раствора GLP-1. Группам 2, 5, 8 и 11 вводили GLP-1/DKP-препарат в виде соли (загрузка GLP-1 составляла ~ 16%). Группам 3, 6, 9, 12 вводили смешанный GLP-1/DKP-препарат в виде соли (загрузка GLP-1 составляла ~ 4%).Animals of a separate group (groups 7-12) were repeated on
Эксперимент проводили два раза с использованием одних и тех же препаратов, при этом введение дозы и забор крови осуществляли два дня подряд. Пробы крови для каждой группы брали в день введения дозы, перед введением дозы (время 0) и через 2, 5, 10, 20, 30, 60 и 120 минут после введения дозы. В каждый определенный момент времени из латеральной хвостовой вены брали приблизительно 150 мкл цельной крови в криогенную пробирку, содержащую приблизительно 3 ед/мл апротинина и 0,3% EDTA, а затем пробирку переворачивали и ставили на лед. Пробы крови центрифугировали при 4000 об/мин и 40 мкл плазмы раскапывали с помощью пипетки по 96-луночным планшетам, а затем планшеты помещали на хранение при -80°С вплоть до их использования в ELISA-анализах на уровни GLP-1 в соответствии с инструкциями производителей (Linco Research, St Charles, MO). Было установлено, что оптимальными условиями являются условия, при которых аналитический буфер представляет собой GLP-1 в сочетании с одной сывороткой (5% FBS) без матрикса.The experiment was carried out twice using the same drugs, with the introduction of a dose and blood sampling was carried out for two days in a row. Blood samples for each group were taken on the day of the dose, before the dose (time 0) and 2, 5, 10, 20, 30, 60 and 120 minutes after the dose. At each particular point in time, approximately 150 μl of whole blood was taken from the lateral tail vein into a cryogenic tube containing approximately 3 u / ml aprotinin and 0.3% EDTA, and then the tube was inverted and put on ice. Blood samples were centrifuged at 4000 rpm and 40 μl of plasma was pipetted into 96-well plates, and then the plates were stored at -80 ° C until they were used in ELISA assays for GLP-1 levels in accordance with the instructions manufacturers (Linco Research, St Charles, MO). It was found that optimal conditions are those under which the assay buffer is GLP-1 in combination with serum alone (5% FBS) without matrix.
Внутривенное введение. Группам 5, 6, 10, 11 и 12 внутривенно (i.v.) вводили различные GLP-1/FDKP-препараты и раствор GLP-1 (фиг. 22A). Группам 5 и 6 вводили 15,8% GLP-1/FDKP, группам 11 и 12 вводили еще одну дозу 15,8% GLP-1/FDKP на следующий день, а группе 10 вводили раствор GLP-1 в качестве контроля. Концентрацию GLP-1/FDKP детектировали через 0, 2, 5, 10, 20, 40, 60, 80, 100 и 120 минут. У всех групп, после внутривенного введения, наблюдалось детектируемое увеличение уровней GLP-1 в плазме, при этом максимальные концентрации наблюдались через 2 минуты после обработки. Уровни активного GLP-1 у всех групп снижались до фоновых уровней через 20 минут после обработки. Какого-либо значимого различия в кинетике указанных различных препаратов GLP-1/FDKP и раствора GLP-1 при их внутривенной инъекции не наблюдалось. Было отмечено, что уровни GLP-1 в плазме снижались до фоновых уровней через 10-20 минут после введения дозы крысам, обработанным путем внутривенных инъекций, что дает основание предположить о наличии физиологической кинетики (то есть примерно 95 % GLP-1 элиминировалось через 10 минут). Intravenous administration.
Разовое введение путем инсуффляции. Из 12 групп группам 1, 2, 3, 7, 8 и 9 вводили различные GLP-1/FDKP-препараты или раствор GLP-1 путем инсуффляции в легкие (фиг. 22B). Группе 1 вводили 80 мкг контрольного GLP-1 путем инстилляции жидкости в легкие (LIS); группе 2 вводили 15,8% GLP-1/FDKP путем инсуффляции в легкие (IS); группе 3 вводили 3,8% GLP-1/FDKP путем инсуффляции в легкие (IS); группе 7 вводили 80 мкг контрольного GLP-1 путем инстилляции жидкости в легкие (LIS); группе 8 вводили 15,% GLP-1/FDKP путем инсуффляции в легкие (IS); а группе 9 вводили 3,8% GLP-1/FDKP путем инсуффляции в легкие (IS). Концентрации GLP-1/FDKP измеряли через 0, 2, 5, 10, 20, 40, 60, 80, 100 и 120 минут. Single administration by insufflation. Of the 12 groups,
У всех групп, после внутрилегочного введения, наблюдалось детектируемое увеличение концентрации GLP-1 в плазме. Максимальные концентрации GLP-1 в плазме варьировались в зависимости от используемого препарата/композиции. У групп 2 и 8, через 10-20 минут после обработки, наблюдались максимальные уровни GLP-1 в плазме, на что указывала AUC, у групп 3 и 9 через 5-10 минут наблюдались значимые уровни активного GLP-1, а у групп 1 и 7 наблюдалось более быстрое и кратковременное увеличение уровней активного GLP-1 в плазме. У групп 2, 3, 7 и 8 через 60 минут после обработки уровни активного GLP-1 в плазме снижались до фоновых уровней, а у групп 1 и 7 уровни GLP-1 достигали фоновых значений через 20 минут после обработки.In all groups, after intrapulmonary administration, a detectable increase in plasma GLP-1 concentration was observed. Maximum plasma concentrations of GLP-1 varied depending on the preparation / composition used.
GLP-1 в концентрации 8 наномоль, очевидно, является эффективным у крыс с моделью диабета; доза GLP-1 составляла 80 мкг (которая в 3000 раз превышала сообщаемую эффективную дозу); уровни GLP-1 в плазме через 30 минут после введения дозы были в 10 раз выше при внутрилегочной доставке, чем после 3-часового вливания (Chelikani et al, 2005), а биологическая доступность GLP-1/FDKP, вводимого путем инсуффляции в легкие, составляла 71%. Полученные результаты представлены ниже в таблице 4. У большинства крыс, обработанных путем внутрилегочной доставки, уровни GLP-1 в плазме снижались до фоновых уровней через 30-60 минут после введения дозы. У всех крыс, за исключением 1 крысы в группе 2, после внутривенного введения или инсуффляции в легкие различных GLP-1/FDKP-препаратов наблюдалось увеличение концентраций GLP-1 в плазме.GLP-1 at a concentration of 8 nanomoles is obviously effective in rats with a diabetes model; the dose of GLP-1 was 80 μg (which was 3,000 times the reported effective dose); plasma levels of GLP-1 30 minutes after dosing were 10 times higher after intrapulmonary delivery than after a 3-hour infusion (Chelikani et al, 2005), and the bioavailability of GLP-1 / FDKP administered by lung insufflation, accounted for 71%. The results are presented below in table 4. In most rats treated by intrapulmonary delivery, plasma levels of GLP-1 decreased to background levels 30-60 minutes after dosing. In all rats, with the exception of 1 rat in
Выводы. Фармакокинетические профили GLP-1/FDKP-препаратов отличались от фармакокинетических профилей раствора GLP-1. У крыс, обработанных путем инсуффляции GLP-1/FDKP-препаратов в легкие, по сравнению с крысами, обработанными раствором GLP-1, концентрации GLP-1 в плазме оставались неизменными в течение более длительного периода времени. У всех животных через 20-60 минут после введения дозы наблюдалось прогрессирующее снижение концентраций GLP-1 в плазме. 2 эксперимента, проводимые 2 дня подряд, дали относительно похожие результаты. Findings. The pharmacokinetic profiles of GLP-1 / FDKP preparations differed from the pharmacokinetic profiles of GLP-1 solution. In rats treated by insufflation of GLP-1 / FDKP preparations into the lungs, compared to rats treated with GLP-1 solution, plasma GLP-1 concentrations remained unchanged for a longer period of time. In all animals, a progressive decrease in plasma GLP-1 concentrations was observed 20-60 minutes after dosing. 2 experiments, conducted 2 days in a row, gave relatively similar results.
Биологическая доступность GLP-1/FDKP-препаратовTable 4
The bioavailability of GLP-1 / FDKP preparations
GLP-1 (мкг/мкМ)Dose
GLP-1 (μg / μM)
(мин)T 1/2
(min)
(мин)T max
(min)
(пМ)C max
(PM)
Пример 8Example 8
GLP-1/FDKP снижает потребление корма у крысGLP-1 / FDKP reduces feed intake in rats
Специалистам также известно, что в головном мозге GLP-1 стимулирует возникновение чувства насыщения и снижает потребление пищи. На основе такой роли GLP-1 в насыщении и снижении потребления пищи были проведены эксперименты для того, чтобы определить, являются ли GLP-1/FDKP-препараты согласно изобретению эффективными средствами для снижения потребления пищи и тем самым для предотвращения ожирения.Professionals are also aware that in the brain, GLP-1 stimulates a sense of fullness and reduces food intake. Based on this role of GLP-1 in saturating and lowering food intake, experiments were conducted to determine whether the GLP-1 / FDKP preparations of the invention are effective in reducing food intake and thereby prevent obesity.
Двум группам самок крыс Sprague Dawley были введены дозы либо контроля (воздух), либо 15,8%-ного GLP-1/FDKP-препарата в количестве 2 мг/день (0,32 мг GLP-1/дозу) путем инсуффляции в легкие. Контрольная группа состояла из пяти крыс, а тест-группа состояла из десяти крыс. Каждой крысе вводили одну дозу 5 дней подряд и через 2 и 6 часов после введения каждой дозы определяли уровень потребления пищи. Массу тела каждой крысы определяли ежедневно.Two groups of female Sprague Dawley rats were given doses of either control (air) or a 15.8% GLP-1 / FDKP preparation in an amount of 2 mg / day (0.32 mg GLP-1 / dose) by lung insufflation . The control group consisted of five rats, and the test group consisted of ten rats. Each rat was given a single dose for 5 consecutive days, and 2 and 6 hours after each dose, the level of food intake was determined. The body weight of each rat was determined daily.
Предварительные данные показали, что через 2 и 6 часов после введения дозы у крыс, которым вводили GLP-1/FDKP-препараты, наблюдалось общее снижение потребления пищи (фиг. 23A и 23B). Такое снижение было еще более явным на 4-й день через 2 часа после введения дозы (p=0,01). Через 6 часов такое снижение было более выраженным на дни 1 и 2 (p<0,02). Через 24 часа после введения дозы какого-либо воздействия на потребление пищи не наблюдалось.Preliminary data showed that 2 and 6 hours after dosing, rats given GLP-1 / FDKP preparations showed a general decrease in food intake (Figs. 23A and 23B). This decrease was even more pronounced on
Пример 9Example 9
Исследование токсичностиToxicity study
Исследования токсичности повторных доз проводили для оценки потенциальных токсических эффектов и токсикокинетического профиля GLP-1/DKP после неоднократных введений. Исследования на крысах проводили в течение 14 дней, а на обезьянах - в течение 28 дней. GLP-1/DKP вводили ежедневно путем ингаляции. В исследованиях, в которых животным вводили дозы в течение 28 дней, часть животных умерщвляли сразу после проведения курса обработки, а других животных оставляли на один месяц для восстановления, а затем умерщвляли. Всех животных оценивали на клинические признаки, различные физиологические параметры, включая уровни GLP-1, глюкозы и инсулина, массу органов, клинические патологии и гистопатологию различных органов.Repeated dose toxicity studies were performed to evaluate the potential toxic effects and toxicokinetic profile of GLP-1 / DKP after repeated administrations. Studies in rats were performed for 14 days, and in monkeys - for 28 days. GLP-1 / DKP was administered daily by inhalation. In studies in which animals were dosed for 28 days, part of the animals were killed immediately after the course of treatment, and other animals were left for one month to recover, and then were killed. All animals were evaluated for clinical signs, various physiological parameters, including GLP-1, glucose and insulin levels, organ mass, clinical pathologies and histopathology of various organs.
Была проведена серия исследований на мутагенность GLP для оценки мутагенного потенциала дикетопиперазиновых частиц. Эти исследования включали тест Эймса in vitro и анализы на хромосомные аберрации, которые хорошо известны специалистам. Кроме того, был также проведен in vivo анализ мышиных микроядер, известный специалистам. Данные генотоксичности указывали на отсутствие какой-либо мутагенной активности или генетической токсичности частиц дикетопиперазина.A series of GLP mutagenicity studies have been conducted to evaluate the mutagenic potential of diketopiperazine particles. These studies included the Ames test in vitro o and chromosome aberration tests, which are well known in the art. In addition, an in vivo assay of murine micronuclei known in the art was also performed. Genotoxicity data indicated the absence of any mutagenic activity or genetic toxicity of diketopiperazine particles.
Были также проведены исследования для оценки влияния дикетопиперазиновых частиц на репродуктивную токсичность. Эти исследования включали анализы на плодовитость, внутриутробное развитие эмбрионов и постнатальное развитие детенышей крыс и кроликов. Дикетопиперазиновые частицы, вводимые путем подкожной инъекции, не оказывали какого-либо влияния на плодовитость или на имплантацию органов у крыс, а также не наблюдалось какой-либо тератогенности у крыс или кроликов. Дикетопиперазиновые частицы не оказывали какого-либо негативного воздействия на плодовитость и раннее развитие эмбриона, на внутриутробное развитие плода или на пренатальное или постнатальное развитие.Studies have also been conducted to evaluate the effect of diketopiperazine particles on reproductive toxicity. These studies included analyzes of fertility, fetal development of embryos, and postnatal development of young rats and rabbits. The diketopiperazine particles administered by subcutaneous injection did not have any effect on fecundity or organ implantation in rats, and no teratogenicity was observed in rats or rabbits. Diketopiperazine particles did not adversely affect fertility and early embryo development, fetal development, or prenatal or postnatal development.
Принимая во внимание тот факт, что ряд фармацевтических средств был изъят из продаж на рынке фармацевтических препаратов из-за их способности индуцировать развитие LQT-синдрома (приобретенный LQTS или синдром удлинения Q-T является редким наследственным нарушением электрического сердечного ритма, которое может встречаться и у относительно здоровых людей), был проведен анализ на hERG для оценки фармакологических свойств дикетопиперазиновых частиц. Анализ на hERG проводили исходя из того факта, что фармацевтические средства широкого ряда, вызывающие приобретенный LQTS, индуцируют этот синдром путем блокирования калиевого канала, кодируемого человеческим геном ether-a-go-go* (hERG), ответственным за реполяризацию потенциала желудочка сердца. Результаты анализа на hERG показали, что для дикетопиперазиновых частиц IC50 >100 мкМ. Кроме того, результаты неклинических исследований с использованием дикетопиперазиновых частиц показали, что эти частицы не оказывают какого-либо влияния на интервал QTc (интервал QT, корригированный с учетом частоты сердечных сокращений), поскольку его удлинение не наблюдалось у собак (9-месячные исследования или фармакологические исследования на безопасность для сердечно-сосудистой системы). Причем при внутривенном введении дикетопиперазиновых частиц какого-либо их влияния на ЦНС или сердечно-сосудистую систему не наблюдалось, как было оценено с помощью эталонного набора тестов на фармакологическую безопасность.Taking into account the fact that a number of pharmaceuticals were withdrawn from the pharmaceutical market due to their ability to induce the development of LQT syndrome (acquired LQTS or QT prolongation syndrome is a rare hereditary disturbance of electric heart rhythm, which can also occur in relatively healthy humans), an hERG assay was performed to evaluate the pharmacological properties of diketopiperazine particles. The hERG assay was performed based on the fact that a wide range of pharmaceuticals that cause acquired LQTS induce this syndrome by blocking the potassium channel encoded by the human ether-a-go-go * (hERG) gene, responsible for the repolarization of the heart ventricle potential. HERG assay results showed that for diketopiperazine particles, IC 50 > 100 μM. In addition, the results of non-clinical studies using diketopiperazine particles showed that these particles did not have any effect on the QTc interval (QT interval corrected for heart rate), since its elongation was not observed in dogs (9-month studies or pharmacological studies). safety studies for the cardiovascular system). Moreover, with the intravenous administration of diketopiperazine particles, any of their effects on the central nervous system or the cardiovascular system was not observed, as was estimated using the reference set of tests for pharmacological safety.
Пример 10Example 10
Влияние GLP-1 на массу β-клетокThe effect of GLP-1 on the mass of β-cells
Известно, что GLP-1 стимулирует все стадии биосинтеза инсулина и непосредственно стимулирует рост, выживаемость, а также дифференцировку β-клеток. Совокупность этих эффектов приводит к увеличению массы β-клеток. Кроме того, передача сигнала рецептора GLP-1 приводит к подавлению апоптоза β-клеток, что также играет определенную роль в увеличении β-клеточной массы. Известно, что GLP-1 модулирует массу β-клеток по трем возможным механизмам: усилению пролиферации β-клеток; ингибированию апоптоза β-клеток и дифференцировке предполагаемых стволовых клеток в эпителии протоков.It is known that GLP-1 stimulates all stages of insulin biosynthesis and directly stimulates the growth, survival, and differentiation of β-cells. The combination of these effects leads to an increase in the mass of β-cells. In addition, GLP-1 receptor signaling inhibits β-cell apoptosis, which also plays a role in increasing β-cell mass. GLP-1 is known to modulate the mass of β-cells by three possible mechanisms: enhancing the proliferation of β-cells; inhibition of β-cell apoptosis and differentiation of putative stem cells in ductal epithelium.
Для иллюстрации влияния GLP-1 на β-клеточную массу клетки обрабатывали GLP-1/FDKP на день 1, 3 и 5 и сравнивали с необработанными клетками. Введение активного GLP-1 приводило к 2-кратному увеличению массы β-клеток, как предполагалось ранее в литературе (Sturis et al., 2003). Кроме того, анализ влияния различных агонистов GLP-1-рецептора (GLP-1R) на развитие диабета продемонстрировал, что агонисты GLP-1R способствуют предупреждению либо замедлению возникновения или прогрессирования диабета.To illustrate the effect of GLP-1 on β-cell mass, cells were treated with GLP-1 / FDKP on
Влияние GLP-1/FDKP на пролиферацию β-клеток и на уровни инсулина и глюкозы оценивали у самцов крыс с диабетическим ожирением, индуцированным сахаром/с ожирением (ZDF) (n=8/группу). Животным ежедневно 3 дня подряд вводили либо контроль (воздух), либо 2 мг GLP-1/FDKP, содержащий 15% (0,3 мг) GLP-1. Затем проводили тест на толерантность к глюкозе, вводимой внутрибрюшинно (i.р.), и брали пробы крови для проведения анализа на уровни GLP-1 и глюкозы в плазме перед введением дозы и через 15, 30, 45, 60 и 90 минут после введения дозы. Ткани поджелудочной железы брали для проведения иммуногистохимического анализа на уровни секреции инсулина, массу β-клеток и апоптоз.The effect of GLP-1 / FDKP on β-cell proliferation and on insulin and glucose levels was evaluated in male rats with diabetic obesity induced by sugar / obesity (ZDF) (n = 8 / group). The animals were injected with either control (air) or 2 mg of GLP-1 / FDKP containing 15% (0.3 mg) of GLP-1 every day for 3 consecutive days. Then, a glucose tolerance test was administered intraperitoneally (i.r.p.) and blood samples were taken to analyze plasma levels of GLP-1 and glucose before the dose and 15, 30, 45, 60 and 90 minutes after administration doses. Pancreatic tissues were taken for immunohistochemical analysis for insulin secretion levels, β-cell mass and apoptosis.
Тест на толерантность к внутрибрюшинно (i.р.) вводимой глюкозе (IPGTT, фиг. 24) проводили на 4-й день после введения дозы. На 3-й день, после голодания в течение ночи, животным вводили ударную дозу глюкозы путем внутрибрюшинной инъекции, а затем сразу вводили контроль (воздух) или GLP-1/FDKP путем инсуффляции в легкие. Кровь брали до введения глюкозы и в различные периоды времени в течение 90 минут после введения дозы. Через 30 минут после введения дозы у животных группы 1 наблюдалось 47% увеличение уровней глюкозы по сравнению с уровнями глюкозы, наблюдаемыми до введения дозы, а у животных группы 2 (GLP-1/FDKP) наблюдалось 17% увеличение уровней глюкозы по сравнению с уровнями глюкозы, наблюдаемыми до введения дозы. Во все периоды времени после проведения теста на толерантность к глюкозе уровни глюкозы у обработанных животных были значительно ниже уровней, наблюдаемых у контрольных животных (p<0,05).A test for tolerance to intraperitoneal (i.r.) administered glucose (IPGTT, Fig. 24) was performed on the 4th day after the dose. On
Уровни GLP-1 также измеряли на 3-й день после введения дозы (фиг. 25). Через 15 минут после введения дозы максимальная концентрация GLP-1 в плазме у животных группы 2 составляла 10643 пM.GLP-1 levels were also measured on
Кроме того, на 3-й день после теста на толерантность к i.р.-вводимой глюкозе одновременно измеряли уровни инсулина и глюкозы в различные интервалы времени. Через 15 минут после введения дозы у контрольной группы 1 (воздух) и у группы 2 (GLP-1/DKP) сначала наблюдалось снижение концентрации инсулина по сравнению с уровнем до введения дозы, на 46% и 30% соответственно (фиг. 26). Однако через 30 минут после введения дозы уровни инсулина у животных группы 2 снижались до фоновых, а уровни инсулина у животных группы 1 снижались на 64% по сравнению с уровнями до введения доз. У обработанных животных уровни инсулина через 45 минут, 60 минут и 90 минут были близки к уровням, наблюдаемым до введения доз с отклонениями менее чем 1,5%.In addition, on the 3rd day after the i.r.p.-glucose tolerance test, insulin and glucose levels were simultaneously measured at different time intervals. 15 minutes after dosing, control group 1 (air) and group 2 (GLP-1 / DKP) initially showed a decrease in insulin concentration compared to the level before the dose by 46% and 30%, respectively (Fig. 26). However, 30 minutes after administration of the dose, insulin levels in animals of
Для иммуноокрашивания на инсулин и оценки экспрессии инсулина под микроскопом были приготовлены предметные стекла. Количественная оценка экспрессии инсулина с помощью оптического микроскопа показала, что ассоциированное с обработкой увеличение уровней экспрессии инсулина в поджелудочной железе самцов крыс ZDF зависело от дозы, хотя оно не было статистически значимым (p=0,067), как было определено по процентному содержанию островковых β-клеток, экспрессирующих инсулин.Microscopes were prepared for immunostaining for insulin and evaluating insulin expression under a microscope. A quantitative assessment of insulin expression using an optical microscope showed that treatment-related increase in insulin expression levels in the pancreas of male ZDF rats was dose-dependent, although it was not statistically significant (p = 0.067) as determined by the percentage of islet β-cells expressing insulin.
Был также проведен анализ на апоптоз в ткани поджелудочной железы крыс ZDF. Экзокринные и эндокринные панкреатические клетки оценивали с помощью анализа TUNEL (Tornusciolo D. R. et al., 1995). Было оценено приблизительно 10000 клеток в поджелудочной железе (экзокринных и эндокринных). Большинство TUNEL-позитивных клеток были экзокринными. Какого-либо отличия в индексах мечения апоптотических клеток у обработанных животных и у контрольных животных не наблюдалось.An analysis of apoptosis in pancreatic tissue of rats ZDF was also performed. Exocrine and endocrine pancreatic cells were evaluated using the TUNEL assay (Tornusciolo D. R. et al., 1995). Approximately 10,000 cells in the pancreas (exocrine and endocrine) were evaluated. Most TUNEL-positive cells were exocrine. There was no difference in the labeling indices of apoptotic cells in the treated animals and in the control animals.
Кроме того, в поджелудочной железе крыс с диабетическим ожирением, индуцированным сахаром, пролиферацию β-клеток оценивали путем ежедневного введения дозы контроля (воздух) или дозы GLP-1/FDKP путем инсуффляции один раз в день в течение 3 дней. Для определения совместной локализации инсулина и Ki67 (маркера пролиферации), проводимого с помощью иммуногистохимического анализа, приготавливали предметные стекла. Оценку пролиферации клеток под микроскопом проводили в инсулин-позитивных островковых клетках и в экзокринных клетках поджелудочной железы у всех 17 крыс ZDF. Количественная оценка пролиферации клеток указывала на отсутствие ассоциированного с обработкой влияния на пролиферацию островковых бета-клеток или экзокринных клеток поджелудочной железы самцов крыс ZDF.In addition, in the pancreas of diabetic obese sugar-induced rats, β-cell proliferation was evaluated by daily administration of a control dose (air) or a dose of GLP-1 / FDKP by insufflation once a day for 3 days. To determine the joint localization of insulin and Ki67 (proliferation marker), carried out using immunohistochemical analysis, slides were prepared. Microscopic evaluation of cell proliferation was performed in insulin-positive islet cells and in exocrine pancreatic cells in all 17 ZDF rats. A quantitative assessment of cell proliferation indicated no treatment-related influence on proliferation of islet beta cells or exocrine pancreatic cells of male ZDF rats.
В целом эти исследования показали, что GLP-1/FDKP, вводимый в концентрации 2 мг или 0,3 мг GLP-1 путем инсуффляции в легкие, приводил к снижению уровней глюкозы в крови у крыс с диабетическим ожирением (модель диабета типа 2), как показал тест на толерантность к глюкозе, и к увеличению числа инсулин-секретирующих клеток на число островковых клеток.In general, these studies showed that GLP-1 / FDKP, administered at a concentration of 2 mg or 0.3 mg of GLP-1 by insufflation into the lungs, led to a decrease in blood glucose levels in rats with diabetic obesity (
Пример 11Example 11
Получение препаратов GLP-1/FDKP-частицPreparation of GLP-1 / FDKP Particles
Была также применена альтернативная методика получения препаратов GLP-1/FDKP-частиц. Препараты получали следующим образом: 10 масс.% маточного раствора GLP-1 получали путем добавления 1 части GLP-1 (по массе) к 9 частям деионизованной воды и добавления небольшого количества ледяной уксусной кислоты до образования прозрачного раствора. Маточную суспензию FDKP-частиц (приблизительно 10 масс.% частиц) разделяли на три части. К каждой суспензии добавляли соответствующее количество маточного раствора GLP-1 и получали нужные композиции, содержащие 5 и 15 масс.% GLP-1 в осушенном порошке. После добавления раствора белка pH суспензий составлял приблизительно 3,5. Затем рН суспензий доводили приблизительно до 4,4-4,5, после чего эти суспензии гранулировали в жидком азоте и лиофилизовали для удаления льда.An alternative technique for preparing preparations of GLP-1 / FDKP particles was also used. The preparations were prepared as follows: 10 mass% of the GLP-1 mother liquor was obtained by adding 1 part GLP-1 (by mass) to 9 parts of deionized water and adding a small amount of glacial acetic acid until a clear solution was formed. A mother suspension of FDKP particles (approximately 10% by weight of particles) was divided into three parts. An appropriate amount of GLP-1 mother liquor was added to each suspension and the desired compositions were obtained containing 5 and 15 wt.% GLP-1 in dried powder. After adding the protein solution, the pH of the suspensions was approximately 3.5. Then the pH of the suspensions was adjusted to about 4.4-4.5, after which these suspensions were granulated in liquid nitrogen and lyophilized to remove ice.
Аэродинамические свойства порошков характеризуются объемом дыхательной фракции на полный объем (ДФ на полный объем), то есть процентом (%) порошка дыхательной фракции, нормализованным по количеству порошка в картридже, который определяли следующим образом: пять картриджей вручную наполняли 5 мг порошка и этот порошок выпускали через ингалятор MannKind's MedTone® (описанный в заявке на патент США No. 10/655153).The aerodynamic properties of the powders are characterized by the volume of the respiratory fraction per full volume (DF per full volume), that is, the percentage (%) of the powder of the respiratory fraction normalized by the amount of powder in the cartridge, which was determined as follows: five cartridges were manually filled with 5 mg of powder and this powder was released via a MannKind's MedTone® inhaler (described in US patent application No. 10/655153).
Эта методика позволяла продуцировать препарат с хорошим показателем ДФ на полный объем. Порошок, содержащий 5 масс.% GLP-1, имел 48,8% ДФ/полный объем, а порошок, содержащий 15 масс.% GLP-1, имел 32,2% ДФ/полный объем.This technique allowed us to produce a drug with a good DF in full. A powder containing 5 wt.% GLP-1 had 48.8% DF / total, and a powder containing 15 wt.% GLP-1 had 32.2% DF / total.
Пример 12Example 12
Фармакокинетические свойства GLP-1/FDKP при различных концентрациях GLP-1Pharmacokinetic properties of GLP-1 / FDKP at various concentrations of GLP-1
Для оценки фармакокинетических свойств GLP-1/FDKP в различных концентрациях GLP-1 восемнадцать самок крыс Sprague Dawley весом 192,3-211,5 граммов разделяли на четыре группы обработки: контрольную группу, которой вводили GLP-1 (группа 1, n=3); и группы, которым вводили GLP-1/FDKP-препараты (группы 2-4, n=5/группу). Животным вводили один из нижеследующих тестируемых веществ: контроль (воздух) путем инстилляции в легкие; 2,42 мг GLP-1/FDKP, содержащего 5% GLP-1 (0,12 мг GLP-1); 1,85 мг GLP-1/FDKP, содержащего 10% GLP-1 (0,19 мг GLP-1), или 2,46 мг GLP-1/FDKP, содержащего 15% GLP-1 (0,37 мг GLP-1), путем инсуффляции в легкие. Затем брали пробы крови и анализировали на уровни FDKP в сыворотке и GLP-1 в плазме перед введением дозы и через различные интервалы времени (через 2, 5, 10, 20, 30, 40 и 60 минут) после введения дозы.To assess the pharmacokinetic properties of GLP-1 / FDKP at various concentrations of GLP-1, eighteen female Sprague Dawley rats weighing 192.3-211.5 grams were divided into four treatment groups: the control group, which was administered GLP-1 (
Максимальные концентрации GLP-1 в плазме (Cmax) после введения GLP-1/FDKP (5% препарат) составляли 2321 пM при Tmax через 5 минут после введения дозы; 4887 пМ при Tmax через 10 минут после введения дозы (10% препарат); и 10207 пМ при Tmax через 10 минут после введения дозы (15% препарат). Как показано на фиг. 27, значимые уровни GLP-1 наблюдались в течение 30 минут после введения дозы. Уровни GLP-1, измеренные по площади под кривой (AUC), составляли 10622, 57101, 92606, 227873 пМ·мин для групп 1-4 соответственно. Оцениваемое время полужизни GLP-1 составляло 10 минут для GLP-1/FDKP при 10% или 15% нагрузке GLP-1.The maximum plasma concentration of GLP-1 (C max ) after administration of GLP-1 / FDKP (5% preparation) was 2321 pM at
Как показано на фиг. 28, максимальные концентрации FDKP составляли 8,5 мкг/мл (группа 2), 4,8 мкг/мл (группа 3) и 7,1 мкг/мл (группа 4) для GLP-1/FDKP-препаратов при 5%, 10% и 15% GLP-1 соответственно. Время до момента наблюдения максимальных концентраций (Tmax) составляло 10 минут. Эти данные показали, что FDKP и GLP-1 обладали аналогичной кинетикой абсорбции и аналогичные количества FDKP абсорбировались независимо от загрузки GLP-1 на частицах.As shown in FIG. 28, the maximum concentrations of FDKP were 8.5 μg / ml (group 2), 4.8 μg / ml (group 3) and 7.1 μg / ml (group 4) for GLP-1 / FDKP preparations at 5%, 10% and 15% GLP-1, respectively. The time to observation of maximum concentrations (Tmax) was 10 minutes. These data showed that FDKP and GLP-1 had similar absorption kinetics and similar amounts of FDKP were absorbed regardless of the loading of GLP-1 on the particles.
В целом исследования показали, что уровни GLP-1 в плазме детектировались на значимых уровнях после введения крысам Sprague Dawley разовой дозы GLP-1/FDKP путем инсуффляции в легкие. Дозозависимое увеличение уровней GLP-1 в плазме наблюдалось при максимальных концентрациях, достигаемых приблизительно через 10 минут после введения дозы, а наблюдаемые уровни GLP-1 обнаруживались через 40 минут после введения дозы. Все животные выживали до завершения исследования.In general, studies showed that plasma GLP-1 levels were detected at significant levels after administration of a single dose of GLP-1 / FDKP to Sprague Dawley rats by lung insufflation. A dose-dependent increase in plasma GLP-1 levels was observed at maximum concentrations achieved approximately 10 minutes after the dose was administered, and observed GLP-1 levels were detected 40 minutes after the dose. All animals survived until completion of the study.
Пример 13Example 13
Фармакодинамические свойства GLP-1/FDKP, вводимого путем инсуффляции в легкиеPharmacodynamic properties of GLP-1 / FDKP administered by lung insufflation
Для оценки фармакодинамических свойств GLP-1/FDKP самок крыс Sprague Dawley разделяли на 2 группы обработки. Животным ежедневно 4 дня подряд вводили либо контроль (воздух; n=5), либо 2 мг GLP-1/FDKP, содержащего 15% GLP-1 (0,3 мг GLP-1), путем инсуффляции в легкие (n=10).To evaluate the pharmacodynamic properties of GLP-1 / FDKP, female Sprague Dawley rats were divided into 2 treatment groups. Animals were injected daily with control (air; n = 5) or 2 mg of GLP-1 / FDKP containing 15% GLP-1 (0.3 mg GLP-1) daily for 4 consecutive days by lung insufflation (n = 10) .
Потребление пищи оценивали в темное время суток перед введением дозы и через 1, 2, 4 и 6 часов после введения дозы 4 дня подряд (фиг. 29). Уровень потребления пищи снижался на дни 1, 2 и 3 после ежедневного введения разовой дозы GLP-1/FDKP путем инсуффляции в легкие животным группы обработки, по сравнению с контрольной группой (воздух) (p<0,05). Статистически значимое снижение потребления пищи у животных группы обработки, по сравнению с контролем (воздух), наблюдалось на 1-й день, через 1 час и через 6 часов после введения дозы, на 2-й день через 4 и 6 часов после введения дозы и перед введением дозы на 3-й день.Food consumption was evaluated in the dark before the dose and 1, 2, 4 and 6 hours after the dose was administered for 4 consecutive days (Fig. 29). The level of food consumption decreased on
Массы тела (фиг. 30) измеряли ежедневно в течение 4 дней подряд перед введением дозы. Массы тела непосредственно перед введением дозы составляли примерно 180-209 граммов. Хотя статистической значимости при сравнении обработанных животных и контрольных животных (воздух) не достигалось, однако обработанные животные все же имели меньшую массу тела. Все животные выживали до проведения запланированного умерщвления.Body weights (FIG. 30) were measured daily for 4 consecutive days before the dose. The body mass immediately before the dose was approximately 180-209 grams. Although statistical significance was not achieved when comparing treated animals and control animals (air), the treated animals still had less body weight. All animals survived until the planned killing.
Примеры 14-16Examples 14-16
Токсикокинетические (TK) исследованияToxicokinetic (TK) studies
В нижеприведенных примерах 14-16 описаны исследования токсичности повторных доз, проводимые на крысах и обезьянах для оценки потенциального токсического действия и токсикокинетического профиля GLP-1/FDKP-порошка, вводимого путем ингаляции. Полученные данные показали, что GLP-1/FDKP-порошок, вводимый путем ингаляции, не обладает какой-либо явной токсичностью при дозах, в несколько раз превышающих дозы, допустимые для клинического применения. Кроме того, каких-либо различий между самцами и самками животных каждого вида не наблюдалось.Examples 14-16 below describe repeated dose toxicity studies in rats and monkeys to evaluate the potential toxic effects and toxicokinetic profile of a GLP-1 / FDKP powder administered by inhalation. The data obtained showed that GLP-1 / FDKP powder, administered by inhalation, does not have any obvious toxicity at doses several times higher than the doses allowed for clinical use. In addition, no differences between males and females of animals of each species were observed.
Пример 14Example 14
Токсикокинетические свойства GLP-1/FDKP, вводимого обезьянам в течение 5 дней путем инсуффляции в легкиеToxicokinetic properties of GLP-1 / FDKP administered to monkeys for 5 days by lung insufflation
Были проведены исследования для определения токсичности и токсикокинетического профиля GLP-1/FDKP путем ороназального введения (предпочтительного для человека терапевтического способа введения) собакоподобным обезьянам (Macaca fascicularis) ежедневно (в течение 30 минут в день) 5 дней подряд. Ороназальное введение осуществляли путем надевания обезьянам маски на рот и нос и обеспечения вдыхания ими тестируемого препарата в течение 30 минут.Studies have been conducted to determine the toxicity and toxicokinetic profile of GLP-1 / FDKP by oronasal administration (human preferred therapeutic route of administration) to dog-like monkeys ( Macaca fascicularis ) daily (for 30 minutes per day) for 5 consecutive days. Oronasal administration was carried out by putting the monkeys on a mask on their mouth and nose and ensuring that they inhaled the test drug for 30 minutes.
За четырнадцать дней до начала обработки животных подвергали механической фиксации для адаптации и вводили дозы. В начале эксперимента (день 1) животные самцы имели возраст от 30 месяцев до 56 месяцев и массу от 2,3 до 4,0 кг; а животные самки имели возраст от 31 месяца до 64 месяцев и массу от 1,6 до 3,4 кг. Десять (5 самцов и 5 самок) собакоподобных обезьян, ранее не участвующих в экспериментах, разделяли на 5 групп (по 2 животных на группу), как указано ниже в таблицах 5 и 6. Обезьяны, участвующие в экспериментах, представляют собой животных, живущих колониями, которым ранее вводили тестируемые препараты. Однако такие препараты имеют непродолжительное время полужизни, а поэтому маловероятно, что эти препараты могут присутствовать в организме обезьян или оказывать какое-либо влияние на обезьян во время проведения описанных здесь экспериментов по введению доз. Животным вводили контроль (воздух), 2 мг/кг FDKP или 0,3 (0,04 мг GLP-1), 1,0 (0,13 мг GLP-1) или 2,0 (0,26 мг GLP-1) мг/кг GLP-1/FDKP.Fourteen days before the start of treatment, the animals were mechanically fixed for adaptation and doses were administered. At the beginning of the experiment (day 1), the animal males were aged from 30 months to 56 months and weight from 2.3 to 4.0 kg; and animal females were aged from 31 months to 64 months and weight from 1.6 to 3.4 kg. Ten (5 males and 5 females) dog-like monkeys not previously participating in the experiments were divided into 5 groups (2 animals per group), as shown in Tables 5 and 6 below. The monkeys participating in the experiments are animals living in colonies previously administered test drugs. However, such drugs have a short half-life, and therefore it is unlikely that these drugs may be present in the monkeys or have any effect on the monkeys during the dose-administration experiments described here. Animals were administered control (air), 2 mg / kg FDKP, or 0.3 (0.04 mg GLP-1), 1.0 (0.13 mg GLP-1), or 2.0 (0.26 mg GLP-1 ) mg / kg GLP-1 / FDKP.
Средние уровни целевой и достигаемой дозы (определяемые с помощью гравиметрического анализа*)Table 5
Average levels of target and achieved dose (determined by gravimetric analysis *)
1 Вычислено исходя из предполагаемой массы тела 2,5 кг.
2 Вычислено исходя из измеренной массы тела (среднее для самцов и самок).
3 Исходя из целевого и достигаемого уровня доз можно предположить, что содержание GLP-1 в создаваемой атмосфере составляет 13%. По оценкам, осаждение общей вдыхаемой дозы в дыхательных путях, предположительно, составляло 100%.* Gravimetric analysis was carried out by weighing filter paper in the chamber for inhalation before, during and after the dose to calculate the concentration of aerosol in the chamber and to determine the duration of the dose.
1 Calculated based on the estimated body weight of 2.5 kg.
2 Calculated based on the measured body weight (average for males and females).
3 Based on the target and achieved dose levels, it can be assumed that the content of GLP-1 in the atmosphere created is 13%. It is estimated that deposition of the total respirable dose in the respiratory tract was estimated to be 100%.
Средние целевые и достигаемые концентрации аэрозоля (определяемые с помощью гравиметрического анализа*)Table 6
Average target and achieved aerosol concentrations (determined by gravimetric analysis *)
1 Исходя из целевых и достигаемых концентраций аэрозоля можно предположить, что содержание GLP-1 в создаваемой атмосфере составляет 13%. По оценкам, осаждение общей вдыхаемой дозы в дыхательных путях, предположительно, составляло 100%.* Gravimetric analysis was carried out by weighing filter paper in the chamber for inhalation before, during and after the dose to calculate the concentration of aerosol in the chamber and to determine the duration of the dose.
1 Based on the target and achieved aerosol concentrations, it can be assumed that the content of GLP-1 in the created atmosphere is 13%. It is estimated that deposition of the total respirable dose in the respiratory tract was estimated to be 100%.
Пробы цельной крови (1,4 мл/пробу крови) брали на день 5 в нижеследующие моменты времени: перед введением дозы, через 10, 30, 45, 60, 90, 120 минут и 4 часа после введения дозы. Кровь брали из бедренной вены путем венопункции. Пробы крови разделяли на 2 аликвоты: одну брали для анализа на уровень GLP-1 в плазме (0,8 мл), а другую (0,6 мл) - для анализа на уровень FDKP в сыворотке. Для проведения анализа на уровень GLP-1 в плазме в каждый из указанных моментов времени собирали цельную кровь (0,8 мл) в 1,3-миллилитровые EDTA-пробирки (0,1% EDTA). Затем приблизительно через 5-10 секунд после забора крови в пробирки добавляли ингибитор DPP-IV (Millipore - Billerica, MA, 10 мкл/мл крови) (до достижения концентрации DPP-IV 100 мкМ). Пробирки несколько раз переворачивали и сразу помещали на влажный лед. Пробы цельной крови выдерживали на влажном льду, а затем центрифугировали (2-8°С) при 4000 об/мин приблизительно в течение 10 минут с получением плазмы. Пробы плазмы переносили в соответствующие сосуды и выдерживали на сухом льду, а затем хранили в холодильнике при -70(±10)°С. После этого определяли концентрации GLP-1 в плазме Cmax, Tmax, AUC и T1/2.Whole blood samples (1.4 ml / blood sample) were taken on
После введения GLP-1/FDKP путем ингаляции в течение четырех дней подряд во всех образцах, перед введением дозы, на 5-й день были обнаружены детектируемые уровни GLP-1. На 5-й день максимальные концентрации (Cmax) GLP-1 в плазме были достигнуты приблизительно через 10 минут после введения дозы (фиг. 31).After administration of GLP-1 / FDKP by inhalation for four consecutive days in all samples, detectable levels of GLP-1 were detected on
Увеличение Cmax и AUClast (площадь под кривой зависимости концентрации от времени в интервале времени от 0 до времени последней количественной оценки концентрации) для GLP-1 в зависимости от дозы наблюдалось у самцов и самок обезьян на 5-й день. Однако, во время исследования интервала доз, при увеличении доз как у самцов, так и у самок обезьян пропорционального увеличения величин AUClast для GLP-1 не наблюдалось, за исключением самцов при уровне дозы 1 мг/кг/день. 6,7-кратное увеличение дозы от 0,3 до 2,0 мг/кг/день приводило всего лишь к 2,9-кратному увеличению AUClast у самцов и к 1,1-кратному увеличению AUClast у самок.An increase in C max and AUC last (the area under the concentration versus time curve in the time interval from 0 to the time of the last quantitative assessment of concentration) for GLP-1 depending on the dose was observed in males and female monkeys on the 5th day. However, during the study of the dose range, with increasing doses in both males and female monkeys, a proportional increase in AUC last values for GLP-1 was not observed, except for males at a dose level of 1 mg / kg / day. A 6.7-fold increase in dose from 0.3 to 2.0 mg / kg / day resulted in only a 2.9-fold increase in AUC last in males and a 1.1-fold increase in AUC last in females.
Максимальная концентрация GLP-1 в среднем составляла 17,2, 93,1 и 214 пг/мл у самцов и 19,3, 67,9 и 82,8 пг/мл у самок при введении GLP-1/FDKP в дозах 0,3, 1,0 и 2,0 мг/кг/день соответственно. Уровни GLP-1 в плазме быстро снижались с явным сокращением интервала времени полужизни от 4 минут до 24 минут.The maximum concentration of GLP-1 averaged 17.2, 93.1 and 214 pg / ml in males and 19.3, 67.9 and 82.8 pg / ml in females with GLP-1 / FDKP at doses of 0, 3, 1.0 and 2.0 mg / kg / day, respectively. Plasma GLP-1 levels decreased rapidly with a clear reduction in half-life from 4 minutes to 24 minutes.
Величины AUC для GLP-1 составляли 21,6, 105 и 62,3 пг·ч/мл у самцов и 33,4, 23,7 и 35,4 пг·ч/мл у самок при введении GLP-1/FDKP в дозах 0,3, 1,0 и 2,0 мг/кг/день соответственно.The AUC values for GLP-1 were 21.6, 105 and 62.3 pg · h / ml in males and 33.4, 23.7 and 35.4 pg · h / ml in females with GLP-1 / FDKP doses of 0.3, 1.0 and 2.0 mg / kg / day, respectively.
Каких-либо явных отличий у животных разных полов по параметрам TK GLP-1 при самой низкой дозе не наблюдалось. Однако у самцов обезьян величины AUClast были соответственно выше, чем величины AUClast у самок обезьян при средней и высокой исследуемой дозе. В некоторых образцах, взятых у контрольных обезьян, которым вводили наполнитель, и у контрольных обезьян, которым вводили воздух, наблюдались измеримые уровни GLP-1. Это может быть обусловлено загрязнением воздуха, вдыхаемого животными, или может указывать на присутствие эндогенного GLP-1 у конкретных обезьян. При этом следует отметить, что контрольные животные подвергались обработке не в тех помещениях, в которых содержались животные, обрабатываемые GLP-1/FDKP.There were no obvious differences in animals of different sexes in terms of TK GLP-1 parameters at the lowest dose. However, in male monkeys, the AUC last values were correspondingly higher than the AUC last values in female monkeys at an average and high studied dose. Measurable levels of GLP-1 were observed in some samples taken from control monkeys injected with filler and control monkeys injected with air. This may be due to contamination of the air inhaled by animals, or may indicate the presence of endogenous GLP-1 in specific monkeys. It should be noted that the control animals were not treated in the rooms in which the animals treated with GLP-1 / FDKP were kept.
Поскольку биологическое время полужизни GLP-1 составляло менее чем 15 минут, то GLP-1 после введения GLP-1/FDKP должен быть полностью выведен через 24 часа. Поэтому эндогенные уровни GLP-1 могут служить возможным объяснением постоянству оцениваемых уровней GLP-1 в образцах на время 0, собранных на 5-й день у всех GLP-1/FDKP-обработанных животных. Вычитание величин, полученных на время 0, из величин наблюдаемых концентраций GLP-1 после введения дозы должно отражать изменение GLP-1, обусловленное введением GLP-1/FDKP.Since the biological half-life of GLP-1 was less than 15 minutes, GLP-1 after administration of GLP-1 / FDKP should be completely eliminated after 24 hours. Therefore, endogenous levels of GLP-1 can serve as a possible explanation for the constancy of the estimated levels of GLP-1 in samples at
Для анализа на FDKP в сыворотке в каждый из указанных моментов времени брали цельную кровь (0,6 мл) в пробирки, не содержащие антикоагулянта, а затем кровь оставляли при комнатной температуре минимум на 30 минут для свертывания, после чего ее разделяли путем центрифугирования с получением сыворотки. Затем проводили анализ на FDKP и определяли его концентрации в сыворотке (Cmax, Tmax, AUC и T1/2). После введения GLP-1/FDKP путем ингаляции в течение четырех дней подряд, во всех образцах, перед введением дозы, на 5-й день были обнаружены детектируемые уровни FDKP. На 5-й день максимальные концентрации (Cmax) FDKP в плазме были достигнуты приблизительно через 10-30 минут после введения дозы.For analysis on serum FDKP, at each of the indicated time points, whole blood (0.6 ml) was taken in tubes containing no anticoagulant, and then the blood was left at room temperature for at least 30 minutes to coagulate, after which it was separated by centrifugation to obtain serum. Then, an analysis was performed on FDKP and its concentration in serum was determined (C max , T max , AUC and T 1/2 ). After administration of GLP-1 / FDKP by inhalation for four consecutive days, detectable FDKP levels were detected on
Увеличение AUC∞ (площадь под кривой зависимости концентрации от времени, построенной в пределах от времени 0 и экстраполированной до бесконечности) FDKP в зависимости от дозы наблюдалось у самцов и самок обезьян на 5-й день. Однако у самок какого-либо различия в AUC∞ FDKP при дозе 0,3 и 1,0 мг/кг/день не наблюдалось, а при дозе 1-2 мг/кг/день наблюдалось дозозависимое увеличение. Во всех случаях, при которых наблюдалось увеличение, оно было все же непропорциональным. 6,7-кратное увеличение дозы от 0,3 до 2,0 мг/кг/день приводило всего лишь к 2,7-кратному увеличению AUClast у самцов и к 3,0-кратному увеличению AUC∞ у самок. Максимальные концентрации (Cmax) FDKP в среднем составляли 200, 451 и 339 нг/мл у самцов и 134, 161 и 485 нг/мл у самок при введении GLP-1/FDKP в дозах 0,3, 1,0 и 2,0 мг/кг/день соответственно. Величины AUC∞ для FDKP составляли 307, 578 и 817 нг·ч/мл у самцов и 268, 235 и 810 нг·ч/мл у самок, которым вводили GLP-1/FDKP в дозах 0,3, 1,0 и 2,0 мг/кг/день соответственно. Величины AUC∞ и Cmax у животных, которым вводили только FDKP в дозе 2,1 мг/кг/день (группа 2), имели тот же порядок, что и величины для животных, которым вводили GLP-1/FDKP в дозе 2,13 мг/кг/день, за исключением того, что через 30-45 минут после введения дозы Tmax было немного более продолжительным.An increase in AUC∞ (the area under the concentration versus time curve plotted over
В целом GLP-1/FDKP хорошо переносился животными, и при этом не наблюдалось каких-либо клинических признаков или влияния на массу тела, потребление пищи, клинические параметры патологии и на макроскопическую или микроскопическую оценку. Следует также отметить, что введение GLP-1/FDKP путем ингаляции собакоподобным обезьянам при оцениваемых достигаемых дозах до 2,13 мг/кг/день (соответствующих дозе 0,26 мг/кг/день GLP-1), вводимых в течение 30 минут в день в течение 5 дней, не ассоциировалось с какой-либо дозоограничивающей токсичностью.In general, GLP-1 / FDKP was well tolerated by animals, and there were no clinical signs or effects on body weight, food intake, clinical pathology parameters, or macroscopic or microscopic evaluation. It should also be noted that administration of GLP-1 / FDKP by inhalation to dog-like monkeys at estimated achievable doses of up to 2.13 mg / kg / day (corresponding to a dose of 0.26 mg / kg / day GLP-1), administered over 30 minutes day for 5 days was not associated with any dose-limiting toxicity.
Пример 15Example 15
Токсикокинетика GLP-1/FDKP, вводимого в течение 14 дней путем инсуффляции в легкие крысToxicokinetics of GLP-1 / FDKP, administered for 14 days by insufflation in rat lungs
В данном исследовании оценивали потенциальную токсичность GLP-1/FDKP после ежедневного введения путем инсуффляции в легкие в течение 14 дней подряд. Крысам ежедневно в течение 14 дней подряд вводили контроль (воздух), FDKP-частицы при 10 мг/кг или 1 (0,15 мг GLP-1), 3 (0,45 мг GLP-1) или 10 (1,5 мг GLP-1) мг/кг GLP-1/FDKP путем инсуффляции в легкие (n=24/пол/группу). Животных ежедневно оценивали на клинические признаки токсичности, а также регистрировали массу тела и потребление пищи.This study evaluated the potential toxicity of GLP-1 / FDKP after daily administration by insufflation into the lungs for 14 consecutive days. Rats were administered control (air) daily for 14 consecutive days, FDKP particles at 10 mg / kg or 1 (0.15 mg GLP-1), 3 (0.45 mg GLP-1) or 10 (1.5 mg GLP-1) mg / kg GLP-1 / FDKP by insufflation in the lungs (n = 24 / gender / group). Animals were evaluated daily for clinical signs of toxicity, and body weight and food intake were recorded.
На 1-й и 14-й дни Cmax GLP-1 достигалась примерно через 10-15 минут после введения дозы животным всех тест-групп. Максимальные концентрации GLP-1 при введении 10 мг/кг/день GLP-1/FDKP в среднем составляли 6714 и 6270 пг/мл на день 1 и 2979 и 5834 пг/мл на день 14 у самцов и самок соответственно. Уровни GLP-1 в плазме быстро снижались со значительным сокращением интервала времени полужизни от 0,7 часа до 4,4 часа. Средние величины AUC для GLP-1 составляли 2187 пМ·ч у самцов и 2703 пМ·ч у самок при наивысшей дозе 10 мг/кг/день GLP-1/FDKP. При этом наблюдался минимальный уровень аккумуляции GLP-1, или такой аккумуляции GLP-1 вообще не наблюдалось, а также не наблюдалось какого-либо отличия в Cmax, времени полужизни и Тmax для обоих полов. Величины AUC GLP-1 были несколько выше у самок крыс, чем у самцов при всех вводимых дозах. Каких-либо значительных побочных эффектов (NOAEL) у крыс, которым вводили 10 мг/кг/день GLP-1/FDKP (1,5 мг/кг/день GLP-1) 14 дней подряд путем инсуффляции в легкие, не наблюдалось.On
Примерно через 24 часа после введения последней дозы животных (12/пол/группу) умерщвляли и проводили оценку клинической патологии и макроскопический и микроскопический анализы. Животных, участвующих в токсикокинетических (TK) исследованиях (12/пол/группу), умерщвляли на 14-й день после введения доз и конечного забора крови. Каких-либо случаев гибели или клинической патологии, ассоциированной с GLP-1/DKP, не наблюдалось. Какого-либо отличия в массах тела и в потреблении пищи у контрольных и обработанных животных также не наблюдалось. Лишь при введении самкам 10 мг/кг GLP-1/FDKP масса печени и отношение массы печени к общей массе тела были значительно ниже по сравнению с указанными параметрами у контрольной группы (воздух).About 24 hours after the last dose, the animals (12 / gender / group) were euthanized and clinical pathology evaluated and macroscopic and microscopic analyzes were performed. Animals participating in toxicokinetic (TK) studies (12 / gender / group) were euthanized on the 14th day after dosing and final blood sampling. No deaths or clinical pathologies associated with GLP-1 / DKP were observed. There were no differences in body weights and food intake in control and treated animals either. Only when 10 mg / kg GLP-1 / FDKP was administered to females, the liver mass and the ratio of liver mass to total body weight were significantly lower compared to the indicated parameters in the control group (air).
Каких-либо явных отличий в результатах гематологических тестов, анализов на свертывание крови, химических анализов, биохимических анализов мочи или химического анализа мочи у крыс, которым вводили наполнитель и воздух (контроль), не наблюдалось. Каких-либо явных или гистопатологических изменений в тканях, которые, как было определено, обладают потенциальной токсичностью в результате введения GLP-1/FDKP, не наблюдалось.There were no obvious differences in the results of hematological tests, blood coagulation tests, chemical tests, biochemical tests of urine or chemical analysis of urine in rats that were injected with vehicle and air (control). There were no obvious or histopathological changes in the tissues that were determined to have potential toxicity as a result of GLP-1 / FDKP administration.
Пример 16Example 16
Токсикокинетика GLP-1/FDKP, вводимого обезьянам в течение 28 дней путем инсуффляции в легкиеToxicokinetics of GLP-1 / FDKP administered to monkeys for 28 days by pulmonary insufflation
В этом исследовании оценивали токсичность и токсикокинетические параметры GLP-1/FDKP, вводимого путем ингаляции ежедневно в течение по меньшей мере 4 недель. Для оценки обратимости, постоянства или замедления каких-либо эффектов животных оставляли на 4 недели для восстановления.This study evaluated the toxicity and toxicokinetic parameters of GLP-1 / FDKP administered by inhalation daily for at least 4 weeks. To assess the reversibility, constancy or deceleration of any effects, the animals were left for 4 weeks to recover.
Животных разделяли на следующие группы обработки: группа 1: контроль (воздух); группа 2: 3,67 мг/кг/день FDKP-частиц; группа 3: 0,3 мг/кг/день GLP-1/FDKP (0,045 мг/кг/день GLP-1); группа 4: 1 мг/кг/день GLP-1/FDKP (0,15 мг/кг/день GLP-1) или группа 5: 2,6 мг/кг/день GLP-1/FDKP (0,39 мг/кг/день GLP-1). Сорок две собакоподобные обезьяны разделяли на 2 группы: группы для основного исследования (n = 3/пол/группа) и группы для восстановления (n= 2/пол/группа), а именно группы 1, 2 и 5. Группа 1: контроль (воздух), группа 2: FDKP (~4 мг/кг/день); группа 3: 0,3 мг/кг/день GLP-1/FDKP (низкая доза); группа 4: 1,0 мг/кг/день GLP-1/FDKP (средняя доза); группа 5: 2,6 мг/кг/день GLP-1/FDKP (высокая доза). Обычно, в этих исследованиях, на восстановление оценивали только обезьян, получавших высокие дозы, и контроль.Animals were divided into the following treatment groups: group 1: control (air); group 2: 3.67 mg / kg / day of FDKP particles; group 3: 0.3 mg / kg / day GLP-1 / FDKP (0.045 mg / kg / day GLP-1); group 4: 1 mg / kg / day GLP-1 / FDKP (0.15 mg / kg / day GLP-1) or group 5: 2.6 mg / kg / day GLP-1 / FDKP (0.39 mg / kg / day GLP-1). Forty-two dog-like monkeys were divided into 2 groups: groups for the main study (n = 3 / gender / group) and groups for recovery (n = 2 / gender / group), namely
Мониторинг животных на смертность и заболеваемость проводили два раза в день, а мониторинг на патологии и признаки токсичности проводили, по меньшей мере, один раз в день через 30 минут после введения дозы. Массу тела регистрировали еженедельно и ежедневно проводили качественную оценку потребления пищи. Кровь брали на 1-й, 28-й и 56-й дни для проведения токсикокинетических исследований. Трех животных/пол/группу анестезировали, взвешивали, а затем у них брали кровь и подвергали аутопсии на 29-й день. Остальных животных групп 1, 2 и 5 (n=2/пол/группу) анестезировали, взвешивали, а затем у них брали кровь и подвергали аутопсии на 57-й день. После аутопсии отобранные органы взвешивали и выбранные ткани собирали и помещали на хранение. Все ткани от каждого животного исследовали под микроскопом.Animals were monitored for mortality and morbidity twice a day, and pathology and signs of toxicity were monitored at least once a
У животных всех групп иногда наблюдались отклонения в массах тела, однако какого-либо ассоциированного с обработкой влияния на массу тела не наблюдалось. Вообще говоря, во время всего исследования все животные сохраняли массу тела или слегка прибавляли в весе. При высоких дозах наблюдалась большая частота опорожнения кишечника или появления жидкого стула. Каких-либо заметных ассоциированных с обработкой изменений любых клинических биохимических параметров не наблюдалось, за исключением умеренного повышения уровня лактат-дегидрогеназы (LDH) и аспартат-аминотрансферазы (AST) при высокой дозе, вводимой самкам на 29-й день (в конце обработки), см. таблицу 7. Уровни LDH у самцов были также повышенными, но очень незначительно. Эти изменения были выявлены по окончании периода восстановления и не коррелировали с какими-либо данными микроскопического анализа печени. Изменения уровней AST у самок группы, которым вводили высокую дозу, обусловлены главным образом данными, полученными для одного из пяти животных.In animals of all groups, deviations in body masses were sometimes observed, however, no effect on body weight associated with processing was observed. Generally speaking, throughout the study, all animals retained their body weight or slightly gained weight. At high doses, a high frequency of bowel movement or loose stools was observed. No significant changes associated with the treatment of any clinical biochemical parameters were observed, with the exception of a moderate increase in the level of lactate dehydrogenase (LDH) and aspartate aminotransferase (AST) at a high dose administered to females on the 29th day (at the end of treatment), see table 7. Male LDH levels were also elevated, but very slightly. These changes were identified at the end of the recovery period and did not correlate with any data from a microscopic analysis of the liver. Changes in AST levels in females of the high-dose group were mainly due to data from one of the five animals.
Средний % изменения уровней ALT, AST и LDHTable 7
Average% change in ALT, AST and LDH levels
Каких-либо ассоциированных с обработкой макроскопических или гистологических изменений при дозах до 2,6 мг/кг/день GLP-1/FDKP не наблюдалось. GLP-1/FDKP хорошо переносился животными, и при дозах, составляющих до 2,6 мг/кг/день GLP-1/FDKP (0,39 мг/кг/день GLP-1), при этом не наблюдалось каких-либо значимых проявлений клинических признаков или влияния на изменение массы тела, потребление пищи, данные гематологического анализа, биохимического анализа мочи, анализа на инсулин, офтальмоскопические данные, данные ЭКГ и макроскопические или микроскопические анализы. Введение FDKP путем ингаляции в оцениваемой достигаемой дозе 3,67 мг/кг/день в течение 28 дней по 30 минут в день также не ассоциировалось с какой-либо токсичностью.No macroscopic or histological changes associated with the treatment were observed at doses up to 2.6 mg / kg / day GLP-1 / FDKP. GLP-1 / FDKP was well tolerated by animals, and at doses up to 2.6 mg / kg / day GLP-1 / FDKP (0.39 mg / kg / day GLP-1), there were no significant manifestations of clinical signs or effects on changes in body weight, food intake, hematological analysis data, urine biochemical analysis, insulin analysis, ophthalmoscopic data, ECG data and macroscopic or microscopic analyzes. Administration of FDKP by inhalation at an estimated attainable dose of 3.67 mg / kg / day for 28 days, 30 minutes per day, was also not associated with any toxicity.
Увеличение Сmax и AUClast для GLP-1 и FDKP в зависимости от дозы наблюдалось у самцов и самок обезьян на день 1. Во время проведения исследований, при различных интервалах доз, при увеличении доз на день 28 у самцов и самок обезьян наблюдалось непропорциональное увеличение Сmax GLP-1, но не AUClast. Максимальные концентрации GLP-1 при 2,6 мг/кг/день GLP-1/FDKP в среднем составляли 259 пг/мл у самцов и 164 пг/мл у самок. Уровни GLP-1 в плазме снижались со значительным сокращением интервала времени полужизни от 0,6 часов до 2,5 часа. Средние величины AUC для GLP-1 составляли 103 пг·ч/мл у самцов и 104 пг·ч/мл у самок при высокой дозе. При этом у самок обезьян наблюдались более высокие значения AUC и Сmax при низкой дозе по сравнению со значениями, наблюдаемыми у самцов. Максимальные концентрации FDKP при 2,6 мг/кг/день GLP-1/FDKP в среднем составляли 1800 нг/мл у самцов и 1900 пг/мл у самок.An increase in C max and AUC last for GLP-1 and FDKP depending on the dose was observed in males and female monkeys on
В заключение следует отметить, что введение GLP-1/FDKP собакоподобным обезьянам путем ингаляции в оцениваемых достигаемых дозах, составляющих до 2,6 мг/кг/день GLP-1/FDKP или 0,39 мг/кг/день GLP-1, вводимого в течение 28 дней по 30 минут в день, хорошо переносилось с клинической точки зрения. При дозе 2,6 мг/кг/день GLP-1/FDKP (0,39 мг/кг/день GLP-1) каких-либо значительных побочных эффектов (NOAEL) не наблюдалось. Как описано ниже в примере 19, максимальная доза для человека в исследованиях фазы I составляла 1,5 мг GLP-1/FDKP в день или ~0,021 мг/кг GLP-1 (на массу тела человека приблизительно 70 кг). Дополнительные исследования проводили при дозе 3,0 мг GLP-1/FDKP в день или ~0,042 мг/кг GLP-1.In conclusion, it should be noted that administration of GLP-1 / FDKP to dog-like monkeys by inhalation in estimated attainable doses of up to 2.6 mg / kg / day GLP-1 / FDKP or 0.39 mg / kg / day GLP-1 administered for 28 days, 30 minutes a day, was well tolerated from a clinical point of view. At a dose of 2.6 mg / kg / day GLP-1 / FDKP (0.39 mg / kg / day GLP-1), no significant side effects (NOAEL) were observed. As described in Example 19 below, the maximum human dose in phase I studies was 1.5 mg GLP-1 / FDKP per day or ~ 0.021 mg / kg GLP-1 (per person body weight about 70 kg). Additional studies were performed at a dose of 3.0 mg GLP-1 / FDKP per day or ~ 0.042 mg / kg GLP-1.
Пример 17Example 17
Получение препаратов экзендина/FDKPPreparation of Exendin / FDKP Preparations
Экзендин-4/FDKP получали путем объединения кислотного раствора пептида экзендина-4 (SEQ ID No. 3) с суспензией FDKP-частиц. Кислотный раствор пептида представляет собой 10% (масс./масс.) пептид, растворенный в 2% уксусной кислоте. Суспензия FDKP содержит приблизительно 10% (масс./масс.) FDKP-частиц. Кислотный раствор пептида экзендина-4 добавляли к суспензии FDKP-частиц при осторожном помешивании. Смесь экзендина-4/FDKP медленно титровали с 25% раствором аммиака до рH 4,50. Затем смесь гранулировали в жидком азоте и лиофилизовали.Exendin-4 / FDKP was obtained by combining an acid solution of the exendin-4 peptide (SEQ ID No. 3) with a suspension of FDKP particles. The peptide acid solution is a 10% (w / w) peptide dissolved in 2% acetic acid. The FDKP suspension contains approximately 10% (w / w) of FDKP particles. An acid solution of the exendin-4 peptide was added to a suspension of FDKP particles with gentle stirring. The exendin-4 / FDKP mixture was slowly titrated with 25% ammonia to pH 4.50. The mixture was then granulated in liquid nitrogen and lyophilized.
% объема дыхательной фракции на полный объем (% ДФ на полный объем), который содержит порошок, включающий 15% экзендин- 4/FDKP, составляет 36%, при этом процент опустошения картриджа составлял 99%. Порошок, включающий 15% экзендин-4/FDKP, продуцированный в таком же масштабе, имел % ДФ на полный объем 34%, где процент опустошения картриджа составлял 100%.% of the volume of the respiratory fraction per full volume (% DF per full volume), which contains a powder including 15% exendin-4 / FDKP, is 36%, while the percentage of empty cartridge was 99%. A powder comprising 15% exendin-4 / FDKP produced on the same scale had a% DF over a total volume of 34%, where the percent emptying of the cartridge was 100%.
Пример 18Example 18
Фармакокинетика экзендина/FDKP, вводимого путем инсуффляции в легкиеPharmacokinetics of exendin / FDKP administered by pulmonary insufflation
В настоящее время проводятся предварительные исследования токсичности повторных доз для оценки фармакодинамического и фармакокинетического профиля экзендина-4 (аналога GLP-1) в препарате экзендина-4/FDKP в различных концентрациях, а также оценки этого профиля после множества внутрилегочных введений.Preliminary studies of repeated dose toxicity are currently underway to evaluate the pharmacodynamic and pharmacokinetic profile of exendin-4 (GLP-1 analogue) in exendin-4 / FDKP at various concentrations, as well as evaluating this profile after many intrapulmonary injections.
Исследования проводили на крысах и обезьянах в течение двадцати восьми дней. Экзендин/FDKP вводили ежедневно путем ингаляции. В исследованиях, в которых животным вводили дозу в течение 28 дней, одну часть животных умерщвляли сразу после введения доз, а других животных оставляли на один месяц для восстановления, а затем умерщвляли. Всех животных оценивали на клинические признаки токсичности, различные физиологические параметры, включая уровни экзендина-4, глюкозы и инсулина в крови; массу органов и клиническую патологию и гистопатологию различных органов.Studies were performed on rats and monkeys for twenty-eight days. Exendin / FDKP was administered daily by inhalation. In studies in which animals were dosed for 28 days, one part of the animals was sacrificed immediately after administration of the doses, and the other animals were left for one month to recover, and then were killed. All animals were evaluated for clinical signs of toxicity, various physiological parameters, including levels of exendin-4, glucose and insulin in the blood; weight of organs and clinical pathology and histopathology of various organs.
Группы для предварительного исследования состояли из пяти животных на группу и двух контрольных групп, которым внутривенно вводили воздух и экзендин. В исследованиях участвовали шесть групп, которым путем инсуффляции в легкие вводили приблизительно 2,0 мг доз экзендина/FDKP при 5%, 10%, 15%, 20%, 25% и 30% загрузке экзендина (масс./масс.). Затем брали цельную кровь для анализа уровня глюкозы в крови и концентраций экзендина в течение периода времени, составляющего 8 часов.Groups for the preliminary study consisted of five animals per group and two control groups, which were injected intravenously with air and exendin. The study involved six groups that were injected with insufflation into the lungs approximately 2.0 mg doses of exendin / FDKP at 5%, 10%, 15%, 20%, 25% and 30% loading of exendin (wt./mass.). Then, whole blood was taken to analyze blood glucose and exendin concentrations over a period of 8 hours.
Затем получали данные (Сmax, T1/2 и Tmax), которые показали, что препараты экзендина/FDKР по своим фармакокинетическим свойствам являются сравнимыми с GLP-1/FDKP или обладают лучшими фармакокинетическими свойствами, чем GLP-1/FDKP.Then, data were obtained (C max , T 1/2 and T max ), which showed that exendin / FDKP preparations are comparable in pharmacokinetic properties with GLP-1 / FDKP or have better pharmacokinetic properties than GLP-1 / FDKP.
Пример 19Example 19
Фармакокинетика GLP-1/xDKP, вводимого крысам путем инсуффляции в легкиеPharmacokinetics of GLP-1 / xDKP administered to rats by lung insufflation
Для того чтобы определить, могут ли различные DKP влиять на фармакокинетический профиль препаратов GLP-1/FDKP, были получены различные препараты GLP-1/xDKP, описанные в предварительной заявке на патент США, озаглавленной «Асимметрические аналоги FDKP, используемые в качестве агентов для доставки лекарственных средств» ("Asymmetrical Analogs FDKP for Use as Drug Delivery Agents"), которая была подана одновременно с настоящей заявкой и во всей своей полноте вводится в настоящее описание посредством ссылки (документ патентного поверенного No. 51300-00041).In order to determine whether different DKPs can affect the pharmacokinetic profile of GLP-1 / FDKP preparations, various GLP-1 / xDKP preparations were prepared as described in US provisional patent application entitled Asymmetric FDKP Analogs Used as Delivery Agents medicines "(" Asymmetrical Analogs FDKP for Use as Drug Delivery Agents "), which was filed simultaneously with this application and in its entirety is introduced into the present description by reference (document patent attorney No. 51300-00041).
Исследования проводили на крысах, которые были разделены на 6 групп обработки, состоящих из пяти животных на группу. Контрольной группе (n=3) вводили GLP-1 путем инстилляции жидкости. В качестве второго контроля также использовали GLP-1/FDKP (0,3 мг GLP-1), вводимый путем инсуффляции в легкие. Каждой из GLP-1/xDKP-обработанных групп вводили препараты GLP-1/xDKP путем инсуффляции в легкие в дозах ~2,0 мг xDKP, содержащего 10% и 15% GLP-1. В качестве xDKP использовали (E)-3-(4-(3,6-диоксопиперазин-2-ил)бутилкарбамоил)акриловую кислоту), (3,6-бис(4-карбоксипропил)амидобутил-2,5-дикетопиперазин) и динатриевую соль (E)-3,6-бис(4-(карбокси-2-пропенил)амидобутил)-2,5-дикетопиперазина. Цельную кровь брали для оценки концентраций GLP-1 через 5, 10, 20, 30, 45, 60 и 90 минут после введения дозы.Studies were performed on rats, which were divided into 6 treatment groups consisting of five animals per group. The control group (n = 3) was administered GLP-1 by fluid instillation. GLP-1 / FDKP (0.3 mg GLP-1) administered by insufflation into the lungs was also used as a second control. Each of the GLP-1 / xDKP-treated groups was administered GLP-1 / xDKP preparations by insufflation into the lungs at doses of ~ 2.0 mg xDKP containing 10% and 15% GLP-1. As xDKP, (E) -3- (4- (3,6-dioxopiperazin-2-yl) butylcarbamoyl) acrylic acid), (3,6-bis (4-carboxypropyl) amidobutyl-2,5-diketopiperazine) and (E) -3,6-bis (4- (carboxy-2-propenyl) amidobutyl) -2,5-diketopiperazine disodium salt. Whole blood was taken to evaluate GLP-1
Пример 20Example 20
Испытания по введению порошка GLP-1/FDKP путем ингаляции взрослым здоровым мужчинам, проводимые в фазе Ia с использованием одной дозы, открытой метки, возрастающих доз, контроля на безопасность и толерантностьTests for the administration of GLP-1 / FDKP powder by inhalation to adult healthy men, conducted in phase Ia using a single dose, open label, increasing doses, safety and tolerance controls
Было показано, что GLP-1, при его внутривенном (i.v.) или подкожном (s.c.) вливании или при множестве подкожных инъекций, снижает повышенные уровни глюкозы в крови у человека. Поскольку этот гормон имеет очень короткое время полужизни, его необходимо вводить непрерывно путем подкожного вливания или множества ежедневных подкожных инъекций. На практике ни один из этих способов не является пригодным для длительного клинического применения. Эксперименты на животных показали, что при введении GLP-1 путем ингаляции могут быть достигнуты нужные терапевтические уровни.It has been shown that GLP-1, when given intravenously (i.v.) or subcutaneously (s.c.), or with multiple subcutaneous injections, reduces elevated blood glucose levels in humans. Since this hormone has a very short half-life, it must be administered continuously by subcutaneous infusion or multiple daily subcutaneous injections. In practice, none of these methods is suitable for long-term clinical use. Animal experiments have shown that administration of GLP-1 by inhalation can achieve the desired therapeutic levels.
Некоторые из функций GLP-1, включая снижение скорости опорожнения желудка, усиление чувства насыщения и подавление нерелевантной секреции глюкагона, очевидно, связаны с импульсным высвобождением GLP-1 после начала приема пищи. Благодаря такому раннему выбросу GLP-1 после ингаляции GLP-1/FDKP-порошка у животных с диабетом может вырабатываться фармакодинамический ответ. Кроме того, поздний выброс нативного GLP-1, ассоциированный с повышением секреции инсулина, может быть смоделирован путем ингаляции GLP-1/FDKP-порошка после приема пищи.Some of the functions of GLP-1, including reducing the rate of gastric emptying, enhancing satiety and suppressing irrelevant secretion of glucagon, are obviously related to the pulsed release of GLP-1 after eating. Due to this early release of GLP-1 after inhalation of the GLP-1 / FDKP powder, a pharmacodynamic response can be generated in animals with diabetes. In addition, the late release of native GLP-1 associated with increased insulin secretion can be modeled by inhalation of the GLP-1 / FDKP powder after a meal.
Клинические испытания фазы Iа GLP-1/FDKP-порошка, вводимого путем ингаляции, были впервые разработаны для проведения теста на безопасность и переносимость выбранных доз нового вводимого путем ингаляции терапевтического продукта, регулирующего уровень глюкозы в крови у человека. Такое введение предусматривает применение ранее протестированного ингалятора MedTone®. Основной целью такого клинического испытания является идентификация интервалов доз GLP-1/FDKP-порошка, вводимого путем ингаляции в легкие, которые являются безопасными, хорошо переносятся пациентом и могут быть использованы в последующих клинических испытаниях на эффективность и безопасность. Дозы, выбранные для клинического испытания фазы Ia, были определены исходя из результатов неклинических испытаний на безопасность GLP-1/FDKP-порошка, вводимого путем ингаляции, и эти результаты были описаны выше в примерах для крыс и приматов.Clinical trials of phase Ia of GLP-1 / FDKP powder administered by inhalation were first developed to test the safety and tolerability of selected doses of a new inhaled therapeutic product that controls blood glucose in humans. Such an administration involves the use of a previously tested MedTone® inhaler. The main objective of such a clinical trial is to identify dose ranges of GLP-1 / FDKP powder administered by inhalation into the lungs, which are safe, well tolerated by the patient and can be used in subsequent clinical trials for efficacy and safety. The doses selected for the clinical trial of phase Ia were determined based on the results of non-clinical safety trials of the GLP-1 / FDKP powder administered by inhalation, and these results were described above in the examples for rats and primates.
Двадцать шесть (26) индивидуумов были включены в 5 групп, где каждая из групп 1 и 2 содержала до 4 обследуемых индивидуумов, а каждая из групп 3-5 содержала до 6 обследуемых индивидуумов, которые удовлетворяли критериям приемлемости, а затем было проведено клиническое испытание. Каждый индивидуум получал одну дозу глюкагонподобного пептида-1 (GLP-1) в качестве GLP-1/FDKP-порошка для ингаляции при следующих уровнях доз: группа 1: 0,05 мг; группа 2: 0,45 мг; группа 3: 0,75 мг; группа 4: 1,05 мг и группа 5: 1,5 мг GLP-1. Других пациентов, вместо выбывших, не набирали. Дозы вводили с учетом массы тела в 70 кг. Средний специалист в данной области может самостоятельно определить и другие уровни доз, исходя из описанных выше исследований.Twenty-six (26) individuals were included in 5 groups, where each of
Целью данного испытания является определение безопасности и переносимости возрастающих доз GLP-1/FDKP-порошка, вводимого путем ингаляции здоровым взрослым мужчинам. Переносимость возрастающих доз GLP-1/FDKP-порошка для ингаляции оценивали путем мониторинга фармакологического или негативного воздействия на различные параметры, включая оценку сообщаемых ранее побочных эффектов (AE), оценку параметров жизненно важных функций, врачебное обследование, клинические лабораторные тесты и электрокардиограммы (ЭКГ).The purpose of this test is to determine the safety and tolerance of increasing doses of GLP-1 / FDKP powder administered by inhalation to healthy adult men. Tolerance of increasing doses of GLP-1 / FDKP powder for inhalation was evaluated by monitoring the pharmacological or negative effects on various parameters, including the assessment of previously reported side effects (AE), the evaluation of vital signs, medical examination, clinical laboratory tests and electrocardiograms (ECG) .
Другими второстепенными целями является дополнительная оценка безопасности и фармакокинетических параметров. Такими параметрами являются дополнительные параметры безопасности, такие как случаи заболевания легких и другие AE, а также изменения функций легких между визитом 1 (скрининг) и визитом 3 (врачебное обследование); фармакокинетические (ФК) параметры GLP-1 в плазме и фумарилдикетопиперазина (FDKP) в сыворотке после введения дозы GLP-1/FDKP-порошка путем ингаляции, как было измерено по AUC0-120(мин) GLP-1 в плазме и AUC0-480(мин) FDKP в сыворотке; и дополнительные ФК-параметры GLP-1 в плазме, включая Tmax GLP-1 в плазме; Cmax GLP-1 в плазме; и Т1/2 GLP-1 в плазме. Другими ФК-параметрами FDKP в сыворотке являются: Tmax FDKP в сыворотке; Cmax FDKP в сыворотке; и Т1/2 FDKP в сыворотке.Other secondary goals are an additional assessment of safety and pharmacokinetic parameters. These parameters are additional safety parameters, such as cases of lung disease and other AE, as well as changes in lung function between visit 1 (screening) and visit 3 (medical examination); plasma pharmacokinetic (PK) parameters of plasma GLP-1 and fumaryldiketopiperazine (FDKP) in serum after administration of a dose of GLP-1 / FDKP powder by inhalation, as measured by AUC 0-120 (min) GLP-1 in plasma and AUC 0- 480 (min) serum FDKP; and additional plasma parameters of GLP-1 in plasma, including T max GLP-1 in plasma; C max GLP-1 in plasma; and T 1/2 GLP-1 in plasma. Other FC parameters of serum FDKP are: T max FDKP in serum; C max FDKP in serum; and T 1/2 FDKP in serum.
Конечной целью испытаний является сравнение нижеследующих фармакологических параметров и параметров безопасности, определенных для группы индивидуумов, участвующих в испытаниях. Главными конечными целями являются: конечный результат испытаний на безопасность с точки зрения частоты возникновения и тяжести сообщаемых AE, включая кашель и одышку, тошноту и/или рвоту, а также изменения, выявленные в результате скрининга параметров жизненно важных функций, проведения клинических лабораторных тестов и врачебного обследования. Другими целями являются определение фармакокинетических параметров GLP-1 в плазме и FDKP в сыворотке (AUC0-120(мин) GLP-1 в плазме и AUC0-480(мин) FDKP в сыворотке); дополнительных фармакокинетических свойств GLP-1 в плазме (Tmax GLP-1 в плазме; Cmax GLP-1 в плазме и Т1/2 GLP-1 в плазме; другие ФК-параметры FDKP в сыворотке (Tmax FDKP в сыворотке и Cmax FDKP в сыворотке) и дополнительных параметров безопасности (тесты на функции легких (PFT)) и ЭКГ.The ultimate goal of the trials is to compare the following pharmacological and safety parameters determined for the group of individuals participating in the trials. The main end goals are: the end result of safety tests in terms of the incidence and severity of reported AEs, including coughing and shortness of breath, nausea and / or vomiting, as well as changes identified by screening vital signs, conducting clinical laboratory tests, and medical survey. Other goals are the determination of the pharmacokinetic parameters of GLP-1 in plasma and FDKP in serum (AUC 0-120 (min) GLP-1 in plasma and AUC 0-480 (min) FDKP in serum); additional pharmacokinetic properties of GLP-1 in plasma (T max GLP-1 in plasma; C max GLP-1 in plasma and T 1/2 GLP-1 in plasma; other FC parameters of serum FDKP (T max FDKP in serum and C max FDKP in serum) and additional safety parameters (lung function tests (PFT)) and ECG.
Испытания в фазе Ia с введением одной дозы включают стратегию, включающую использование открытой метки, схемы введения возрастающих доз, а также конструирование лекарственного средства, и указанные испытания проводят в соответствии с настоящим изобретением согласно статье 21 CFR (Свода федеральных правил) § 312 и Международных правил и принципов клинических исследований лекарственных средств (ВОЗ): Общим руководством (ICH-E6) и Руководством по общим правилам клинических исследований (ICH-E8) в целях определения безопасности и переносимости исследуемого медицинского продукта (IMP).Single dose phase Ia trials include a strategy involving the use of an open label, incremental dose regimens, and drug design, and these trials are carried out in accordance with the present invention in accordance with Article 21 CFR (Code of Federal Regulations) § 312 and International Rules and Guidelines for Clinical Trials of Medicines (WHO): General Guidelines (ICH-E6) and Guidelines for General Rules for Clinical Trials (ICH-E8) to determine safety and tolerability uemogo medicinal product (IMP).
Клиническое испытание состоит из 3 визитов в клинику: 1) одного визита - для предварительного обследования (визит 1); 2) одного визита - для проведения лечения (визит 2); и 3) одного визита - для врачебного обследования (визит 3) через 8-14 дней после визита 2. Введение разовой дозы GLP-1/FDKP-порошка путем ингаляции проводят во время визита 2.A clinical trial consists of 3 visits to the clinic: 1) one visit - for a preliminary examination (visit 1); 2) one visit - for treatment (visit 2); and 3) one visit - for a medical examination (visit 3) 8-14 days after
Целью данного клинического испытания является оценка параметров безопасности в каждой группе. Группе, которой была назначена соответствующая схема введения доз, не вводили дозу в более высокой концентрации до тех пор, пока от главного научного руководителя (PI) не поступила информация о безопасности и переносимости первой дозы или ранних вводимых доз. Для гарантии безопасности индивидуумам каждой группы дозы вводили с получасовым запаздыванием. Введение дозы может быть прекращено, если у 3 или более индивидуумов в группе наблюдается сильная тошнота и/или рвота, либо если уже была введена максимальная доза, либо по усмотрению главного научного руководителя (PI).The purpose of this clinical trial is to evaluate the safety parameters in each group. The group to which the appropriate dose schedule was assigned was not given a dose in a higher concentration until the chief scientific adviser (PI) received information about the safety and tolerability of the first dose or early doses. To ensure safety for individuals of each group, doses were administered with a half-hour delay. Dosing may be discontinued if 3 or more individuals in the group experience severe nausea and / or vomiting, or if a maximum dose has already been administered, or at the discretion of the principal supervisor (PI).
Было оценено пять доз GLP-1/FDKP-порошка для ингаляции (0,05, 0,45, 0,75, 1,05 и 1,5 мг GLP-1). Для приготовления всех доз полученный GLP-1/FDKP должен быть смешан с порошкообразным FDKP для ингаляции. Для приготовления нужной дозы GLP-1 (0,05 мг, 0,45 мг, 0,75 мг, 1,05 мг и 1,5 мг) были использованы картриджи с одноразовой дозой, содержащей 10 мг сухого порошка, состоящего из GLP-1/FDKP для ингаляции (15% масс./масс. GLP-1/FDKP), взятого отдельно или смешанного с соответствующим количеством порошкообразного FDKP для ингаляций. Первые 2 самые низкие дозы оценивали для 2 групп, каждая из которых состояла из 4 индивидуумов, а 3 самые высокие дозы оценивали для 3 групп, каждая из которых состояла из 6 индивидуумов. Каждый индивидуум получал только 1 дозу из 5 оцениваемых доз. Помимо забора крови для анализа уровней GLP-1 (активного и общего) и измерения уровней FDKP, брали также пробы крови для определения уровней глюкагона, глюкозы, инсулина и С-пептида.Five doses of GLP-1 / FDKP powder for inhalation were evaluated (0.05, 0.45, 0.75, 1.05 and 1.5 mg GLP-1). To prepare all doses, the resulting GLP-1 / FDKP must be mixed with powdered FDKP for inhalation. To prepare the desired dose of GLP-1 (0.05 mg, 0.45 mg, 0.75 mg, 1.05 mg and 1.5 mg), single dose cartridges were used containing 10 mg of dry powder consisting of GLP- 1 / FDKP for inhalation (15% w / w GLP-1 / FDKP) taken alone or mixed with an appropriate amount of powdered FDKP for inhalation. The first 2 lowest doses were evaluated for 2 groups, each of which consisted of 4 individuals, and the 3 highest doses were estimated for 3 groups, each of which consisted of 6 individuals. Each individual received only 1 dose from 5 evaluated doses. In addition to blood sampling to analyze GLP-1 levels (active and total) and measure FDKP levels, blood samples were also taken to determine glucagon, glucose, insulin and C-peptide levels.
В настоящем описании приводятся различные ссылки на патенты и публикации. Каждая из этих цитируемых работ и публикаций во всей своей полноте вводится в настоящее описание посредством ссылки.In the present description, various references are made to patents and publications. Each of these cited works and publications in its entirety is introduced into the present description by reference.
Термин «примерно», если это не оговорено особо, означает, что все числа, указывающие на количество ингредиентов, свойства, такие как молекулярная масса, условия проведения реакций и т.п., используемые в описании и в формуле изобретения, во всех случаях могут варьироваться. В соответствии с этим, если это не оговорено особо, численные параметры, представленные в данном описании и в прилагаемой формуле изобретения, являются приближенными и могут варьироваться в зависимости от свойств, которые необходимо получить при осуществлении настоящего изобретения. Без каких-либо преувеличений и попыток ограничить применение доктрины эквивалентов к заявленному объему авторы настоящего изобретения считают, что каждый численный параметр следует рассматривать по меньшей мере как ряд сообщаемых значимых величин и величин, вычисленных стандартными методами их округления. Несмотря на то что численные интервалы и параметры, представляющие широкий объем настоящего изобретения, являются приближенными, однако, как уже сообщалось, численные значения, приводящиеся в конкретных примерах, по возможности, указаны наиболее точно. При этом любые численные значения имеют присущие им погрешности, что обусловлено стандартными отклонениями, возникающими при соответствующих измерениях, проводимых в анализах.The term “about”, unless otherwise specified, means that all numbers indicating the number of ingredients, properties, such as molecular weight, reaction conditions, etc. used in the description and in the claims, in all cases, can vary. In accordance with this, unless otherwise specified, the numerical parameters presented in this description and in the attached claims are approximate and may vary depending on the properties that need to be obtained when implementing the present invention. Without any exaggeration or attempt to limit the application of the doctrine of equivalents to the claimed volume, the authors of the present invention believe that each numerical parameter should be considered at least as a series of reported significant quantities and quantities calculated by standard methods of their rounding. Despite the fact that the numerical ranges and parameters representing a wide scope of the present invention are approximate, however, as already reported, the numerical values given in the specific examples are indicated as accurately as possible. Moreover, any numerical values have inherent errors, due to standard deviations arising from the corresponding measurements carried out in the analyzes.
Для каждого специалиста очевидно, что в настоящее изобретение могут быть внесены различные варианты и модификации, не выходящие за рамки существа и объема изобретения.It will be apparent to any person skilled in the art that various variations and modifications may be made to the present invention without departing from the spirit and scope of the invention.
Артикли “а” и “аn”, используемые в формуле и/или в описании изобретения в сочетании со словом “включающий”, могут относиться к «одному» объекту, а также к «одному или нескольким» объектам, «по меньшей мере к одному объекту» и «к одному или более чем одному» объекту.The articles “a” and “an” used in the claims and / or in the description of the invention in combination with the word “including” may refer to “one” object, as well as to “one or more” objects, “to at least one object ”and“ to one or more than one ”object.
Считается, что любые описанные здесь способы или композиции могут быть использованы для осуществления любых других описанных здесь способов или для приготовления любых других описанных здесь композиций.It is believed that any of the methods or compositions described herein can be used to implement any of the other methods described herein or to prepare any other compositions described herein.
Союз “или”, используемый в формуле изобретения, означает “и/или” и, если это не оговорено особо, означает только альтернативные варианты, либо эти альтернативные варианты являются взаимоисключающими.The term “or” used in the claims means “and / or” and, unless otherwise indicated, means only alternatives, or these alternatives are mutually exclusive.
В настоящей заявке термин “примерно” используется для указания величины, которая включает стандартное отклонение ошибки для данного устройства или метода, используемых для определения этой величины.In this application, the term “about” is used to indicate a value that includes the standard error of the error for a given device or method used to determine this value.
Другие цели, отличительные признаки и преимущества настоящего изобретения будут очевидны из предшествующего описания и примеров, а также из формулы изобретения. Однако следует отметить, что подробное описание и конкретные примеры, в которых описаны конкретные варианты изобретения, приводятся лишь в целях иллюстрации и различные изменения и модификации, которые будут очевидны для специалиста в данной области исходя из подробного описания изобретения, также входят в объем и сущность настоящего изобретения.Other objectives, features and advantages of the present invention will be apparent from the foregoing description and examples, as well as from the claims. However, it should be noted that the detailed description and specific examples in which specific embodiments of the invention are described are for illustration purposes only and various changes and modifications that will be obvious to a person skilled in the art based on the detailed description of the invention are also included in the scope and essence of the present inventions.
БиблиографияBibliography
Помимо публикаций, приведенных выше, нижеследующие публикации, если они относятся к проведению репрезентативных процедур или к другим подробно описанным вариантам изобретения, вводятся в настоящее описание посредством ссылки.In addition to the publications cited above, the following publications, if they relate to representative procedures or other detailed embodiments of the invention, are incorporated herein by reference.
Chelikani PK et al., Intravenous infusion of glucagon-like peptide-1 potently inhibits food intake, sham feeding, and gastric emptying in rats. Am J Physiol. Regul. Integr. Comp. Physiol, 288(6): R1695-706, 2005.Chelikani PK et al., Intravenous infusion of glucagon-like peptide-1 potently inhibits food intake, sham feeding, and gastric emptying in rats. Am J Physiol. Regul. Integr. Comp. Physiol, 288 (6): R1695-706, 2005.
D'Alessio, et al., J. Clin. Invest., 97:133-38, 1996.D'Alessio, et al., J. Clin. Invest., 97: 133-38, 1996.
Deacon CF: Therapeutic strategies based on glucagon-like peptide 1. Diabetes. Sep; 53(9):2181-9, 2004.Deacon CF: Therapeutic strategies based on glucagon-
Eissele, et al., Life Sci, 55:629-34, 1994.Eissele, et al., Life Sci, 55: 629-34, 1994.
Goke, et al., J. Biol. Chem. 268:19650-55, 1993.Goke, et al., J. Biol. Chem. 268: 19650-55, 1993.
Johnson JD et al: RyR2 and calpain-10 delineate a novel apoptosis pathway in pancreatic islets. J Biol Chem., 279(23):24794-802, 2004.Johnson JD et al: RyR2 and calpain-10 delineate a novel apoptosis pathway in pancreatic islets. J Biol Chem., 279 (23): 24794-802, 2004.
Malhotra, R., et al., Regulatory Peptides, 41:149-56, 1992.Malhotra, R., et al., Regulatory Peptides, 41: 149-56, 1992.
Mentlein R, et al., Dipeptidyl peptidase IV hydrolyses gastric inhibitory polypeptide, glucagon-like peptide-1 (7-36) amide, peptide histidine methionine and is responsible for their degradation in human serum. Eur J Biochem., 214:829-835, 1993.Mentlein R, et al., Dipeptidyl peptidase IV hydrolyses gastric inhibitory polypeptide, glucagon-like peptide-1 (7-36) amide, peptide histidine methionine and is responsible for their degradation in human serum. Eur J Biochem., 214: 829-835, 1993.
Montrose-Rafizadeh, et al., Diabetes, 45 (Suppl. 2):152A, 1996.Montrose-Rafizadeh, et al., Diabetes, 45 (Suppl. 2): 152A, 1996.
Nauck MA, et al., Normalization of fasting hyperglycemia by exogenous GLP-I (7-36 amide) in type 2 diabetic patients. Diabetologia, 36:741-744, 1993.Nauck MA, et al., Normalization of fasting hyperglycemia by exogenous GLP-I (7-36 amide) in
Nauck MA, et al., Effects of subcutaneous glucagon-like peptide 1 (GLP-I [7-36 amide]) in patients with NIDDM. Diabetologia, 39:1546 -1553, 1996.Nauck MA, et al., Effects of subcutaneous glucagon-like peptide 1 (GLP-I [7-36 amide]) in patients with NIDDM. Diabetologia, 39: 1546-1553, 1996.
Nauck MA, et al., Effects of glucagon-like peptide 1 on counterregulatory hormone responses, cognitive functions, and insulin secretion during hyperinsulinemic, stepped hypoglycemic clamp experiments in healthy volunteers. J Clin Endocrinol Metab., 87:1239-1246, 2002.Nauck MA, et al., Effects of glucagon-
Raufman, et al., J. Biol. Chem. 267:21432-37, 1992.Raufman, et al., J. Biol. Chem. 267: 21432-37, 1992.
Raufman, et al., J. Biol. Chem. 266:2897-902, 1991.Raufman, et al., J. Biol. Chem. 266: 2897-902, 1991.
Schepp, et al., Eur. J. Pharmacol, 69:183-91, 1994.Schepp, et al., Eur. J. Pharmacol, 69: 183-91, 1994.
Singh, et al., Regul. Pept. 53:47-59, 1994.Singh, et al., Regul. Pept. 53: 47-59, 1994.
Sturis J, et al., British Journal of Pharmacology, 140, 123, 132, 2003.Sturis J, et al., British Journal of Pharmacology, 140, 123, 132, 2003.
Tornusciolo D.R. et al., Biotechniques 19(5):800-805, 1995. Simultaneous detection of TDT-mediated dUTP-biotin nick end-labeling (TUNEL)-positive cells and multiple immunohistochemical markers in single tissue sections.Tornusciolo D.R. et al., Biotechniques 19 (5): 800-805, 1995. Simultaneous detection of TDT-mediated dUTP-biotin nick end-labeling (TUNEL) -positive cells and multiple immunohistochemical markers in single tissue sections.
Verdich C, et al., A meta-analysis of the effect of glucagon-like peptide-1 (7-36) amide on ad libitum energy intake in humans. J Clin Endocrinol Metab., 86:4382-4389, 2001.Verdich C, et al., A meta-analysis of the effect of glucagon-like peptide-1 (7-36) amide on ad libitum energy intake in humans. J Clin Endocrinol Metab., 86: 4382-4389, 2001.
Wang Q, et al., Glucagon-like peptide-1 regulates proliferation and apoptosis via activation of protein kinase B in pancreatic INS-I beta cells. Diabetologia, 47:478-487, 2004.Wang Q, et al., Glucagon-like peptide-1 regulates proliferation and apoptosis via activation of protein kinase B in pancreatic INS-I beta cells. Diabetologia, 47: 478-487, 2004.
Wang, et al., J. Clin. Invest, 95:417-21, 1995.Wang, et al., J. Clin. Invest, 95: 417-21, 1995.
Zander M, et al., Effect of 6-week course of glucagon-like peptide 1 on glycaemic control, insulin sensitivity, and beta-cell function in type 2 diabetes: a parallel-group study. Lancet, 359:824-830, 2002.Zander M, et al., Effect of 6-week course of glucagon-
Claims (24)
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US74488206P | 2006-04-14 | 2006-04-14 | |
| US60/744,882 | 2006-04-14 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2010137392/15A Division RU2542500C2 (en) | 2006-04-14 | 2007-04-16 | Pharmaceutical compositions, containing glucagon-like peptide 1 (glp-1) |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2008144965A RU2008144965A (en) | 2010-05-20 |
| RU2409349C2 true RU2409349C2 (en) | 2011-01-20 |
Family
ID=38567214
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2008144965/15A RU2409349C2 (en) | 2006-04-14 | 2007-04-16 | Pharmaceutical compositions, containing glucagon-like peptide (glp-1) |
| RU2010137392/15A RU2542500C2 (en) | 2006-04-14 | 2007-04-16 | Pharmaceutical compositions, containing glucagon-like peptide 1 (glp-1) |
| RU2014152320A RU2014152320A (en) | 2006-04-14 | 2014-12-23 | PHARMACEUTICAL COMPOSITIONS CONTAINING GLUCAGON-LIKE PEPTIDE 1 (GLP-1) |
Family Applications After (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2010137392/15A RU2542500C2 (en) | 2006-04-14 | 2007-04-16 | Pharmaceutical compositions, containing glucagon-like peptide 1 (glp-1) |
| RU2014152320A RU2014152320A (en) | 2006-04-14 | 2014-12-23 | PHARMACEUTICAL COMPOSITIONS CONTAINING GLUCAGON-LIKE PEPTIDE 1 (GLP-1) |
Country Status (11)
| Country | Link |
|---|---|
| EP (1) | EP2010155A2 (en) |
| JP (3) | JP5415938B2 (en) |
| KR (3) | KR101558829B1 (en) |
| CN (2) | CN101453988A (en) |
| AU (1) | AU2007238000B2 (en) |
| BR (1) | BRPI0709964A2 (en) |
| CA (1) | CA2646400A1 (en) |
| HK (1) | HK1206241A1 (en) |
| MX (1) | MX2008013216A (en) |
| RU (3) | RU2409349C2 (en) |
| WO (1) | WO2007121411A2 (en) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9764003B2 (en) | 2012-07-01 | 2017-09-19 | Novo Nordisk A/S | Use of long-acting GLP-1 peptides |
Families Citing this family (64)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9006175B2 (en) | 1999-06-29 | 2015-04-14 | Mannkind Corporation | Potentiation of glucose elimination |
| AU779986B2 (en) | 1999-06-29 | 2005-02-24 | Mannkind Corporation | Purification and stabilization of peptide and protein pharmaceutical agents |
| ES2300568T3 (en) | 2002-03-20 | 2008-06-16 | Mannkind Corporation | INHALATION APPARATUS |
| US8921311B2 (en) | 2003-08-01 | 2014-12-30 | Mannkind Corporation | Method for treating hyperglycemia |
| US9078866B2 (en) * | 2003-08-01 | 2015-07-14 | Mannkind Corporation | Method for treating hyperglycemia with GLP-1 |
| MX2007001903A (en) | 2004-08-20 | 2007-08-02 | Mannkind Corp | Catalysis of diketopiperazine synthesis. |
| KR101306384B1 (en) | 2004-08-23 | 2013-09-09 | 맨카인드 코포레이션 | Diketopiperazine salts, diketomorpholine salts or diketodioxane salts for drug delivery |
| JP5465878B2 (en) | 2005-09-14 | 2014-04-09 | マンカインド コーポレイション | Method of drug formulation based on increasing the affinity of crystalline microparticle surfaces for active agents |
| CN104383546B (en) | 2006-02-22 | 2021-03-02 | 曼金德公司 | Method for improving the pharmaceutical properties of microparticles comprising diketopiperazines and an active agent |
| MX2008013216A (en) * | 2006-04-14 | 2008-10-27 | Mannkind Corp | Glucagon-like peptide 1(glp-1) pharmaceutical formulations. |
| MX2010004510A (en) * | 2007-10-24 | 2010-07-02 | Mannkind Corp | Method of preventing adverse effects by glp-1. |
| US8785396B2 (en) | 2007-10-24 | 2014-07-22 | Mannkind Corporation | Method and composition for treating migraines |
| AU2008316636B2 (en) * | 2007-10-24 | 2014-02-06 | Mannkind Corporation | Delivery of active agents |
| WO2009146320A1 (en) | 2008-05-27 | 2009-12-03 | Dmi Life Sciences, Inc. | Therapeutic methods and compounds |
| US8485180B2 (en) | 2008-06-13 | 2013-07-16 | Mannkind Corporation | Dry powder drug delivery system |
| CN104689432B (en) | 2008-06-13 | 2018-07-06 | 曼金德公司 | Diskus and the system for drug conveying |
| JP5479465B2 (en) | 2008-06-20 | 2014-04-23 | マンカインド コーポレイション | Interactive device and method for profiling inhalation efforts in real time |
| TWI494123B (en) | 2008-08-11 | 2015-08-01 | Mannkind Corp | Use of ultrarapid acting insulin |
| US8314106B2 (en) | 2008-12-29 | 2012-11-20 | Mannkind Corporation | Substituted diketopiperazine analogs for use as drug delivery agents |
| CA2791847C (en) * | 2009-03-04 | 2017-05-02 | Mannkind Corporation | An improved dry powder drug delivery system |
| PL2405963T3 (en) | 2009-03-11 | 2014-04-30 | Mannkind Corp | Apparatus, system and method for measuring resistance of an inhaler |
| MY172858A (en) | 2009-06-12 | 2019-12-12 | Mannkind Corp | Diketopiperazine microparticles with defined isomer contents |
| EP2440184B1 (en) | 2009-06-12 | 2023-04-05 | MannKind Corporation | Diketopiperazine microparticles with defined specific surface areas |
| WO2011017554A2 (en) * | 2009-08-07 | 2011-02-10 | Mannkind Corporation | Val (8) glp-1 composition and method for treating functional dyspepsia and/or irritable bowel syndrome |
| WO2011056889A1 (en) | 2009-11-03 | 2011-05-12 | Mannkind Corporation | An apparatus and method for simulating inhalation efforts |
| RU2571331C1 (en) | 2010-06-21 | 2015-12-20 | Маннкайнд Корпорейшн | Systems and methods for dry powder drug delivery |
| EP2613786A4 (en) | 2010-09-07 | 2013-10-23 | Dmi Acquisition Corp | Treatment of diseases |
| DK2694402T3 (en) | 2011-04-01 | 2017-07-03 | Mannkind Corp | BLISTER PACKAGE FOR PHARMACEUTICAL CYLINDER AMPULS |
| WO2012174472A1 (en) | 2011-06-17 | 2012-12-20 | Mannkind Corporation | High capacity diketopiperazine microparticles |
| MY167804A (en) | 2011-10-10 | 2018-09-26 | Ampio Pharmaceuticals Inc | Treatment of degenerative joint disease |
| EP2765968A4 (en) | 2011-10-10 | 2015-01-21 | Ampio Pharmaceuticals Inc | Implantable medical devices with increased immune tolerance, and methods for making and implanting |
| AU2012328885B2 (en) | 2011-10-24 | 2017-08-31 | Mannkind Corporation | Methods and compositions for treating pain |
| JP6231484B2 (en) | 2011-10-28 | 2017-11-15 | アンピオ ファーマシューティカルズ,インコーポレイテッド | Rhinitis treatment |
| AU2013289957B2 (en) | 2012-07-12 | 2017-02-23 | Mannkind Corporation | Dry powder drug delivery systems and methods |
| US20150231067A1 (en) * | 2012-08-29 | 2015-08-20 | Mannkind Corporation | Method and composition for treating hyperglycemia |
| UA116217C2 (en) | 2012-10-09 | 2018-02-26 | Санофі | Exendin-4 derivatives as dual glp1/glucagon agonists |
| WO2014066856A1 (en) | 2012-10-26 | 2014-05-01 | Mannkind Corporation | Inhalable influenza vaccine compositions and methods |
| WO2014096150A1 (en) | 2012-12-21 | 2014-06-26 | Sanofi | Dual glp1/gip or trigonal glp1/gip/glucagon agonists |
| EP3587404B1 (en) * | 2013-03-15 | 2022-07-13 | MannKind Corporation | Microcrystalline diketopiperazine compositions, methods for preparation and use thereof |
| CA2906864A1 (en) | 2013-03-15 | 2014-09-18 | Ampio Pharmaceuticals, Inc. | Compositions for the mobilization, homing, expansion and differentiation of stem cells and methods of using the same |
| BR112016000937A8 (en) | 2013-07-18 | 2021-06-22 | Mannkind Corp | dry powder pharmaceutical formulations, method for making a dry powder formulation and use of a dry powder pharmaceutical formulation |
| JP2016530930A (en) | 2013-08-05 | 2016-10-06 | マンカインド コーポレイション | Ventilation device and method |
| US9173924B2 (en) | 2013-08-22 | 2015-11-03 | Zp Opco, Inc. | Stable glucagon peptide formulations |
| US9782344B2 (en) | 2013-08-22 | 2017-10-10 | Zp Opco, Inc. | Stable glucagon peptide formulations |
| TW201609795A (en) | 2013-12-13 | 2016-03-16 | 賽諾菲公司 | EXENDIN-4 peptide analogues as dual GLP-1/GIP receptor agonists |
| WO2015086733A1 (en) | 2013-12-13 | 2015-06-18 | Sanofi | Dual glp-1/glucagon receptor agonists |
| WO2015086730A1 (en) | 2013-12-13 | 2015-06-18 | Sanofi | Non-acylated exendin-4 peptide analogues |
| EP3080154B1 (en) | 2013-12-13 | 2018-02-07 | Sanofi | Dual glp-1/gip receptor agonists |
| AU2015233635B2 (en) | 2014-03-18 | 2019-07-25 | Apeptico Forschung Und Entwicklung Gmbh | Dry-powder peptide medicament |
| WO2015148905A1 (en) | 2014-03-28 | 2015-10-01 | Mannkind Corporation | Use of ultrarapid acting insulin |
| TW201625668A (en) | 2014-04-07 | 2016-07-16 | 賽諾菲公司 | Exendin-4 derivatives as peptidic dual GLP-1/glucagon receptor agonists |
| TW201625669A (en) | 2014-04-07 | 2016-07-16 | 賽諾菲公司 | Peptidic dual GLP-1/glucagon receptor agonists derived from Exendin-4 |
| TW201625670A (en) | 2014-04-07 | 2016-07-16 | 賽諾菲公司 | Dual GLP-1/glucagon receptor agonists derived from EXENDIN-4 |
| US9932381B2 (en) | 2014-06-18 | 2018-04-03 | Sanofi | Exendin-4 derivatives as selective glucagon receptor agonists |
| JP6723222B2 (en) | 2014-08-18 | 2020-07-15 | アンピオ ファーマシューティカルズ,インコーポレイテッド | Treatment of joint pathology |
| US10561806B2 (en) | 2014-10-02 | 2020-02-18 | Mannkind Corporation | Mouthpiece cover for an inhaler |
| AR105319A1 (en) | 2015-06-05 | 2017-09-27 | Sanofi Sa | PROPHARMS THAT INCLUDE A DUAL AGONIST GLU-1 / GLUCAGON CONJUGATE HIALURONIC ACID CONNECTOR |
| EP3310375A4 (en) | 2015-06-22 | 2019-02-20 | Ampio Pharmaceuticals, Inc. | Use of low molecular weight fractions of human serum albumin in treating diseases |
| TW201706291A (en) | 2015-07-10 | 2017-02-16 | 賽諾菲公司 | New EXENDIN-4 derivatives as selective peptidic dual GLP-1/glucagon receptor agonists |
| CN108066762B (en) * | 2016-11-07 | 2022-04-01 | 赫兰 | Application of GLP-1 receptor agonist drugs |
| TWI705820B (en) * | 2018-06-22 | 2020-10-01 | 美商美國禮來大藥廠 | Gip/glp1 agonist compositions |
| CN109827875A (en) * | 2019-04-10 | 2019-05-31 | 上海市食品药品检验所 | A kind of device and method for measuring sucking preparation dissolution rate |
| KR20210062509A (en) | 2019-11-21 | 2021-05-31 | 대한민국(전북기계공업고등학교장) | filterless dynamic fine dust air purifier |
| CN115192554A (en) * | 2022-08-08 | 2022-10-18 | 浙江仙琚萃泽医药科技有限公司 | Propellant-free peptide-containing inhalation solution and preparation method thereof |
Family Cites Families (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5352461A (en) * | 1992-03-11 | 1994-10-04 | Pharmaceutical Discovery Corporation | Self assembling diketopiperazine drug delivery system |
| DE4242863A1 (en) * | 1992-12-18 | 1994-06-23 | Boehringer Mannheim Gmbh | Stable lyophilized pharmaceutical preparations of G-CSF |
| EP1012188B1 (en) * | 1997-09-12 | 2004-08-18 | Pharis Biotec GmbH | Composition for treating diabetes mellitus and obesity |
| AU779986B2 (en) * | 1999-06-29 | 2005-02-24 | Mannkind Corporation | Purification and stabilization of peptide and protein pharmaceutical agents |
| JP2005506956A (en) * | 2001-06-01 | 2005-03-10 | イーライ・リリー・アンド・カンパニー | Long-acting GLP-1 formulation |
| ES2614603T3 (en) * | 2002-02-20 | 2017-06-01 | Emisphere Technologies, Inc. | GLP-1 Molecule Administration Procedure |
| JP2005528351A (en) * | 2002-03-08 | 2005-09-22 | イーライ・リリー・アンド・カンパニー | Activated protein C formulation |
| CA2493478C (en) * | 2002-08-01 | 2014-11-18 | Mannkind Corporation | Cell transport compositions and uses thereof |
| US20040038865A1 (en) * | 2002-08-01 | 2004-02-26 | Mannkind Corporation | Cell transport compositions and uses thereof |
| ES2596553T3 (en) * | 2003-06-02 | 2017-01-10 | Glaxosmithkline Biologicals Sa | Immunogenic compositions based on microparticles comprising adsorbed toxoid and an antigen containing a polysaccharide |
| KR101306384B1 (en) * | 2004-08-23 | 2013-09-09 | 맨카인드 코포레이션 | Diketopiperazine salts, diketomorpholine salts or diketodioxane salts for drug delivery |
| JP5465878B2 (en) * | 2005-09-14 | 2014-04-09 | マンカインド コーポレイション | Method of drug formulation based on increasing the affinity of crystalline microparticle surfaces for active agents |
| CN104383546B (en) * | 2006-02-22 | 2021-03-02 | 曼金德公司 | Method for improving the pharmaceutical properties of microparticles comprising diketopiperazines and an active agent |
| MX2008013216A (en) * | 2006-04-14 | 2008-10-27 | Mannkind Corp | Glucagon-like peptide 1(glp-1) pharmaceutical formulations. |
-
2007
- 2007-04-16 MX MX2008013216A patent/MX2008013216A/en active IP Right Grant
- 2007-04-16 KR KR1020147011316A patent/KR101558829B1/en active IP Right Grant
- 2007-04-16 CN CNA200780013424XA patent/CN101453988A/en active Pending
- 2007-04-16 RU RU2008144965/15A patent/RU2409349C2/en not_active IP Right Cessation
- 2007-04-16 KR KR1020157008571A patent/KR20150042304A/en not_active Application Discontinuation
- 2007-04-16 KR KR1020087027774A patent/KR101438839B1/en active IP Right Grant
- 2007-04-16 AU AU2007238000A patent/AU2007238000B2/en not_active Ceased
- 2007-04-16 BR BRPI0709964-9A patent/BRPI0709964A2/en not_active IP Right Cessation
- 2007-04-16 RU RU2010137392/15A patent/RU2542500C2/en not_active IP Right Cessation
- 2007-04-16 EP EP20070760728 patent/EP2010155A2/en not_active Withdrawn
- 2007-04-16 CA CA002646400A patent/CA2646400A1/en active Pending
- 2007-04-16 CN CN201410514033.8A patent/CN104288756A/en active Pending
- 2007-04-16 WO PCT/US2007/066728 patent/WO2007121411A2/en active Application Filing
- 2007-04-16 JP JP2009505655A patent/JP5415938B2/en not_active Expired - Fee Related
-
2013
- 2013-09-17 JP JP2013191549A patent/JP5898156B2/en active Active
-
2014
- 2014-12-23 RU RU2014152320A patent/RU2014152320A/en not_active Application Discontinuation
-
2015
- 2015-07-16 HK HK15106772.4A patent/HK1206241A1/en unknown
- 2015-11-30 JP JP2015233125A patent/JP2016104736A/en active Pending
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9764003B2 (en) | 2012-07-01 | 2017-09-19 | Novo Nordisk A/S | Use of long-acting GLP-1 peptides |
| RU2657573C2 (en) * | 2012-07-01 | 2018-06-14 | Ново Нордиск А/С | Use of long-acting glp-1 peptides |
| US10335462B2 (en) | 2012-07-01 | 2019-07-02 | Novo Nordisk A/S | Use of long-acting GLP-1 peptides |
Also Published As
| Publication number | Publication date |
|---|---|
| CA2646400A1 (en) | 2007-10-25 |
| RU2010137392A (en) | 2012-03-20 |
| KR101558829B1 (en) | 2015-10-08 |
| EP2010155A2 (en) | 2009-01-07 |
| KR20140072138A (en) | 2014-06-12 |
| KR101438839B1 (en) | 2014-10-02 |
| RU2008144965A (en) | 2010-05-20 |
| WO2007121411A2 (en) | 2007-10-25 |
| BRPI0709964A2 (en) | 2011-08-02 |
| KR20150042304A (en) | 2015-04-20 |
| CN101453988A (en) | 2009-06-10 |
| JP2014043445A (en) | 2014-03-13 |
| JP2009533476A (en) | 2009-09-17 |
| MX2008013216A (en) | 2008-10-27 |
| AU2007238000B2 (en) | 2013-01-17 |
| AU2007238000A1 (en) | 2007-10-25 |
| WO2007121411A3 (en) | 2007-12-13 |
| HK1206241A1 (en) | 2016-01-08 |
| RU2542500C2 (en) | 2015-02-20 |
| KR20080111533A (en) | 2008-12-23 |
| JP5415938B2 (en) | 2014-02-12 |
| CN104288756A (en) | 2015-01-21 |
| JP2016104736A (en) | 2016-06-09 |
| RU2014152320A (en) | 2016-07-20 |
| JP5898156B2 (en) | 2016-04-06 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2409349C2 (en) | Pharmaceutical compositions, containing glucagon-like peptide (glp-1) | |
| US20080260838A1 (en) | Glucagon-like peptide 1 (glp-1) pharmaceutical formulations | |
| US8642548B2 (en) | Val (8) GLP-1 composition and method for treating functional dyspepsia and/or irritable bowel syndrome | |
| EP2934567B1 (en) | Exendin-4 derivatives as dual glp1/gip- or trigonal glp1/gip/glucagon agonists | |
| JP5918539B2 (en) | Method for treating hyperglycemia using GLP-1 | |
| EP2906595B1 (en) | Exendin-4 derivatives as dual glp1/glucagon agonists | |
| TW201609795A (en) | EXENDIN-4 peptide analogues as dual GLP-1/GIP receptor agonists | |
| KR20170073638A (en) | Co-agonists of the glucagon and glp-1 receptors | |
| TW201625669A (en) | Peptidic dual GLP-1/glucagon receptor agonists derived from Exendin-4 | |
| TW201609800A (en) | EXENDIN-4 peptide analogues as dual GLP-1/glucagon receptor agonists | |
| TW201625668A (en) | Exendin-4 derivatives as peptidic dual GLP-1/glucagon receptor agonists | |
| JP2015526523A (en) | Methods and compositions for the treatment of hyperglycemia | |
| TW201609798A (en) | EXENDIN-4 peptide analogues | |
| TW201625670A (en) | Dual GLP-1/glucagon receptor agonists derived from EXENDIN-4 | |
| AU2003208945A1 (en) | Method for administering glp-1 molecules | |
| SK1432004A3 (en) | Medicament for reducing mortality and morbidity associated with critical illnesses | |
| US11028137B2 (en) | Mutant islet amyloid polypeptides with improved solubility and methods for using the same | |
| AU2013201640A1 (en) | Glucagon-like peptide 1(GLP-1) pharmaceutical formulations |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20170417 |