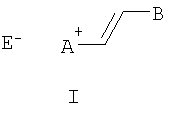RU2398800C2 - N-алкилазакраунсодержащие стириловые красители в качестве оптических молекулярных сенсоров для определения катионов щелочных и щелочноземельных металлов и способ их получения - Google Patents
N-алкилазакраунсодержащие стириловые красители в качестве оптических молекулярных сенсоров для определения катионов щелочных и щелочноземельных металлов и способ их получения Download PDFInfo
- Publication number
- RU2398800C2 RU2398800C2 RU2008141677/04A RU2008141677A RU2398800C2 RU 2398800 C2 RU2398800 C2 RU 2398800C2 RU 2008141677/04 A RU2008141677/04 A RU 2008141677/04A RU 2008141677 A RU2008141677 A RU 2008141677A RU 2398800 C2 RU2398800 C2 RU 2398800C2
- Authority
- RU
- Russia
- Prior art keywords
- formula
- alkali
- dyes
- cations
- dye
- Prior art date
Links
- 239000000975 dye Substances 0.000 title claims abstract description 61
- 150000001768 cations Chemical class 0.000 title claims abstract description 17
- 229910052784 alkaline earth metal Inorganic materials 0.000 title claims abstract description 16
- 230000003287 optical effect Effects 0.000 title claims abstract description 12
- 239000003513 alkali Substances 0.000 title claims abstract description 10
- PPBRXRYQALVLMV-UHFFFAOYSA-N Styrene Chemical compound C=CC1=CC=CC=C1 PPBRXRYQALVLMV-UHFFFAOYSA-N 0.000 title abstract 4
- 229910052783 alkali metal Inorganic materials 0.000 title abstract 2
- 238000002360 preparation method Methods 0.000 title description 3
- 238000000034 method Methods 0.000 claims abstract description 14
- 239000002131 composite material Substances 0.000 claims abstract description 9
- 125000000217 alkyl group Chemical group 0.000 claims abstract description 7
- 125000000623 heterocyclic group Chemical group 0.000 claims abstract description 7
- 239000000463 material Substances 0.000 claims abstract description 7
- 239000012634 fragment Substances 0.000 claims abstract description 6
- 230000000723 chemosensory effect Effects 0.000 claims abstract description 4
- 229910052757 nitrogen Inorganic materials 0.000 claims description 47
- 125000005504 styryl group Chemical group 0.000 claims description 20
- 125000002485 formyl group Chemical group [H]C(*)=O 0.000 claims description 12
- 150000001342 alkaline earth metals Chemical class 0.000 claims description 7
- 229920000642 polymer Polymers 0.000 claims description 7
- 239000002555 ionophore Substances 0.000 claims description 5
- 230000000236 ionophoric effect Effects 0.000 claims description 5
- 239000000203 mixture Substances 0.000 claims description 5
- 125000004433 nitrogen atom Chemical group N* 0.000 claims description 5
- 239000004014 plasticizer Substances 0.000 claims description 5
- 150000003839 salts Chemical group 0.000 claims description 5
- 239000002585 base Substances 0.000 claims description 4
- 125000000816 ethylene group Chemical group [H]C([H])([*:1])C([H])([H])[*:2] 0.000 claims description 4
- 125000002496 methyl group Chemical class [H]C([H])([H])* 0.000 claims description 4
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 4
- 229910020366 ClO 4 Inorganic materials 0.000 claims description 3
- 150000002678 macrocyclic compounds Chemical class 0.000 claims description 3
- 125000003545 alkoxy group Chemical group 0.000 claims description 2
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 2
- 239000011159 matrix material Substances 0.000 claims description 2
- 150000007530 organic bases Chemical class 0.000 claims description 2
- 125000001424 substituent group Chemical group 0.000 claims description 2
- 229910052717 sulfur Inorganic materials 0.000 claims description 2
- 125000004434 sulfur atom Chemical group 0.000 claims description 2
- 150000002148 esters Chemical class 0.000 claims 2
- 230000001747 exhibiting effect Effects 0.000 claims 1
- 230000003993 interaction Effects 0.000 claims 1
- 150000001875 compounds Chemical class 0.000 abstract description 17
- RTZKZFJDLAIYFH-UHFFFAOYSA-N ether Substances CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 abstract description 7
- 230000000694 effects Effects 0.000 abstract description 5
- 239000000126 substance Substances 0.000 abstract 1
- 229910052739 hydrogen Inorganic materials 0.000 description 62
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 39
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 23
- 239000011575 calcium Substances 0.000 description 21
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical compound C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 18
- -1 ammonium cations Chemical class 0.000 description 18
- 239000010408 film Substances 0.000 description 17
- 229910052751 metal Inorganic materials 0.000 description 13
- 239000002184 metal Substances 0.000 description 13
- 238000010521 absorption reaction Methods 0.000 description 11
- 239000000243 solution Substances 0.000 description 10
- 229910052791 calcium Inorganic materials 0.000 description 9
- 239000013078 crystal Substances 0.000 description 9
- 238000000425 proton nuclear magnetic resonance spectrum Methods 0.000 description 9
- 238000002211 ultraviolet spectrum Methods 0.000 description 9
- 239000011734 sodium Substances 0.000 description 8
- UXVMQQNJUSDDNG-UHFFFAOYSA-L Calcium chloride Chemical compound [Cl-].[Cl-].[Ca+2] UXVMQQNJUSDDNG-UHFFFAOYSA-L 0.000 description 7
- 239000001110 calcium chloride Substances 0.000 description 7
- 229910001628 calcium chloride Inorganic materials 0.000 description 7
- 150000002170 ethers Chemical class 0.000 description 7
- 150000002500 ions Chemical class 0.000 description 7
- VLTRZXGMWDSKGL-UHFFFAOYSA-N perchloric acid Chemical compound OCl(=O)(=O)=O VLTRZXGMWDSKGL-UHFFFAOYSA-N 0.000 description 7
- 239000011541 reaction mixture Substances 0.000 description 7
- 238000010992 reflux Methods 0.000 description 7
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 6
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 6
- VLTRZXGMWDSKGL-UHFFFAOYSA-M perchlorate Inorganic materials [O-]Cl(=O)(=O)=O VLTRZXGMWDSKGL-UHFFFAOYSA-M 0.000 description 6
- HIXDQWDOVZUNNA-UHFFFAOYSA-N 2-(3,4-dimethoxyphenyl)-5-hydroxy-7-methoxychromen-4-one Chemical compound C=1C(OC)=CC(O)=C(C(C=2)=O)C=1OC=2C1=CC=C(OC)C(OC)=C1 HIXDQWDOVZUNNA-UHFFFAOYSA-N 0.000 description 5
- 238000001460 carbon-13 nuclear magnetic resonance spectrum Methods 0.000 description 5
- 125000001033 ether group Chemical group 0.000 description 5
- 239000002244 precipitate Substances 0.000 description 5
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 5
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 4
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 4
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 4
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 4
- 229920006254 polymer film Polymers 0.000 description 4
- KWCYGSCAKCOSRB-UHFFFAOYSA-M sodium;dihexadecyl phosphate Chemical compound [Na+].CCCCCCCCCCCCCCCCOP([O-])(=O)OCCCCCCCCCCCCCCCC KWCYGSCAKCOSRB-UHFFFAOYSA-M 0.000 description 4
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 3
- 229910052786 argon Inorganic materials 0.000 description 3
- 230000000536 complexating effect Effects 0.000 description 3
- 238000002189 fluorescence spectrum Methods 0.000 description 3
- 230000001980 ionochromic effect Effects 0.000 description 3
- 238000004519 manufacturing process Methods 0.000 description 3
- 239000012528 membrane Substances 0.000 description 3
- 239000010453 quartz Substances 0.000 description 3
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N silicon dioxide Inorganic materials O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 3
- 238000001228 spectrum Methods 0.000 description 3
- 238000004448 titration Methods 0.000 description 3
- YOBTXORLVXZWSR-UHFFFAOYSA-M 1,4-dimethylpyridin-1-ium;iodide Chemical compound [I-].CC1=CC=[N+](C)C=C1 YOBTXORLVXZWSR-UHFFFAOYSA-M 0.000 description 2
- USKULPQBSBCXOQ-UHFFFAOYSA-M 1-ethyl-2-methylquinolin-1-ium;perchlorate Chemical compound [O-]Cl(=O)(=O)=O.C1=CC=C2[N+](CC)=C(C)C=CC2=C1 USKULPQBSBCXOQ-UHFFFAOYSA-M 0.000 description 2
- 0 CC[N+]=C(C=CC=C1)C1=CC=*C=C[C@]1C=C2OCCOCCOCCOCCOCCN(C)C2=CC1 Chemical compound CC[N+]=C(C=CC=C1)C1=CC=*C=C[C@]1C=C2OCCOCCOCCOCCOCCN(C)C2=CC1 0.000 description 2
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 2
- PHXQIAWFIIMOKG-UHFFFAOYSA-N NClO Chemical compound NClO PHXQIAWFIIMOKG-UHFFFAOYSA-N 0.000 description 2
- 238000005481 NMR spectroscopy Methods 0.000 description 2
- 238000000862 absorption spectrum Methods 0.000 description 2
- WEVYAHXRMPXWCK-FIBGUPNXSA-N acetonitrile-d3 Chemical compound [2H]C([2H])([2H])C#N WEVYAHXRMPXWCK-FIBGUPNXSA-N 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 150000007513 acids Chemical class 0.000 description 2
- 150000001450 anions Chemical class 0.000 description 2
- 239000013060 biological fluid Substances 0.000 description 2
- 238000009835 boiling Methods 0.000 description 2
- 238000010668 complexation reaction Methods 0.000 description 2
- 238000009833 condensation Methods 0.000 description 2
- 230000005494 condensation Effects 0.000 description 2
- 150000003983 crown ethers Chemical class 0.000 description 2
- 238000010908 decantation Methods 0.000 description 2
- 230000007613 environmental effect Effects 0.000 description 2
- SMWDFEZZVXVKRB-UHFFFAOYSA-O hydron;quinoline Chemical compound [NH+]1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-O 0.000 description 2
- 239000008235 industrial water Substances 0.000 description 2
- 238000001748 luminescence spectrum Methods 0.000 description 2
- 238000004020 luminiscence type Methods 0.000 description 2
- UVFOVSRWICIMNX-UHFFFAOYSA-N methyl 2-[6-methyl-2-(4-methylphenyl)imidazo[1,2-a]pyridin-3-yl]acetate Chemical compound N1=C2C=CC(C)=CN2C(CC(=O)OC)=C1C1=CC=C(C)C=C1 UVFOVSRWICIMNX-UHFFFAOYSA-N 0.000 description 2
- 238000012544 monitoring process Methods 0.000 description 2
- 239000003960 organic solvent Substances 0.000 description 2
- 210000002381 plasma Anatomy 0.000 description 2
- 229920005597 polymer membrane Polymers 0.000 description 2
- 229920000915 polyvinyl chloride Polymers 0.000 description 2
- 239000004800 polyvinyl chloride Substances 0.000 description 2
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 2
- JUJWROOIHBZHMG-UHFFFAOYSA-O pyridinium Chemical compound C1=CC=[NH+]C=C1 JUJWROOIHBZHMG-UHFFFAOYSA-O 0.000 description 2
- 238000006862 quantum yield reaction Methods 0.000 description 2
- CXMXRPHRNRROMY-UHFFFAOYSA-N sebacic acid Chemical compound OC(=O)CCCCCCCCC(O)=O CXMXRPHRNRROMY-UHFFFAOYSA-N 0.000 description 2
- 239000002904 solvent Substances 0.000 description 2
- 239000000758 substrate Substances 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- SCYULBFZEHDVBN-UHFFFAOYSA-N 1,1-Dichloroethane Chemical compound CC(Cl)Cl SCYULBFZEHDVBN-UHFFFAOYSA-N 0.000 description 1
- XZWQGXPOVCERLB-UHFFFAOYSA-M 1,4-dimethylpyridin-1-ium;perchlorate Chemical compound [O-]Cl(=O)(=O)=O.CC1=CC=[N+](C)C=C1 XZWQGXPOVCERLB-UHFFFAOYSA-M 0.000 description 1
- CPZSDJKECLMNNQ-UHFFFAOYSA-M 1,4-dimethylquinolin-1-ium;perchlorate Chemical compound [O-]Cl(=O)(=O)=O.C1=CC=C2C(C)=CC=[N+](C)C2=C1 CPZSDJKECLMNNQ-UHFFFAOYSA-M 0.000 description 1
- 238000001644 13C nuclear magnetic resonance spectroscopy Methods 0.000 description 1
- 238000005160 1H NMR spectroscopy Methods 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 229920000623 Cellulose acetate phthalate Polymers 0.000 description 1
- VYZAMTAEIAYCRO-UHFFFAOYSA-N Chromium Chemical compound [Cr] VYZAMTAEIAYCRO-UHFFFAOYSA-N 0.000 description 1
- MQIUGAXCHLFZKX-UHFFFAOYSA-N Di-n-octyl phthalate Natural products CCCCCCCCOC(=O)C1=CC=CC=C1C(=O)OCCCCCCCC MQIUGAXCHLFZKX-UHFFFAOYSA-N 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- 241001104043 Syringa Species 0.000 description 1
- 235000004338 Syringa vulgaris Nutrition 0.000 description 1
- OYYYPYWQLRODNN-UHFFFAOYSA-N [hydroxy(3-methylbut-3-enoxy)phosphoryl]methylphosphonic acid Chemical compound CC(=C)CCOP(O)(=O)CP(O)(O)=O OYYYPYWQLRODNN-UHFFFAOYSA-N 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 239000012736 aqueous medium Substances 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 150000001555 benzenes Chemical class 0.000 description 1
- 230000000035 biogenic effect Effects 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- BJQHLKABXJIVAM-UHFFFAOYSA-N bis(2-ethylhexyl) phthalate Chemical compound CCCCC(CC)COC(=O)C1=CC=CC=C1C(=O)OCC(CC)CCCC BJQHLKABXJIVAM-UHFFFAOYSA-N 0.000 description 1
- 244000309464 bull Species 0.000 description 1
- 159000000007 calcium salts Chemical class 0.000 description 1
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 1
- 125000002091 cationic group Chemical group 0.000 description 1
- 210000004027 cell Anatomy 0.000 description 1
- 229920002301 cellulose acetate Polymers 0.000 description 1
- 229940081734 cellulose acetate phthalate Drugs 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 229910052804 chromium Inorganic materials 0.000 description 1
- 239000011651 chromium Substances 0.000 description 1
- 239000013256 coordination polymer Substances 0.000 description 1
- 238000000354 decomposition reaction Methods 0.000 description 1
- MIMDHDXOBDPUQW-UHFFFAOYSA-N dioctyl decanedioate Chemical group CCCCCCCCOC(=O)CCCCCCCCC(=O)OCCCCCCCC MIMDHDXOBDPUQW-UHFFFAOYSA-N 0.000 description 1
- 238000001035 drying Methods 0.000 description 1
- 238000001941 electron spectroscopy Methods 0.000 description 1
- 238000000921 elemental analysis Methods 0.000 description 1
- 238000000295 emission spectrum Methods 0.000 description 1
- 230000005284 excitation Effects 0.000 description 1
- 238000001917 fluorescence detection Methods 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 1
- 239000003295 industrial effluent Substances 0.000 description 1
- 229910001416 lithium ion Inorganic materials 0.000 description 1
- 239000002609 medium Substances 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 229920002037 poly(vinyl butyral) polymer Polymers 0.000 description 1
- 229920002223 polystyrene Polymers 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- SUKJFIGYRHOWBL-UHFFFAOYSA-N sodium hypochlorite Chemical compound [Na+].Cl[O-] SUKJFIGYRHOWBL-UHFFFAOYSA-N 0.000 description 1
- 229910001415 sodium ion Inorganic materials 0.000 description 1
- 238000002798 spectrophotometry method Methods 0.000 description 1
- 238000004528 spin coating Methods 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 239000000979 synthetic dye Substances 0.000 description 1
- 239000012085 test solution Substances 0.000 description 1
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 1
- 239000010409 thin film Substances 0.000 description 1
- ANRHNWWPFJCPAZ-UHFFFAOYSA-M thionine Chemical compound [Cl-].C1=CC(N)=CC2=[S+]C3=CC(N)=CC=C3N=C21 ANRHNWWPFJCPAZ-UHFFFAOYSA-M 0.000 description 1
- 229920002554 vinyl polymer Polymers 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 238000005303 weighing Methods 0.000 description 1
Landscapes
- Plural Heterocyclic Compounds (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Nitrogen And Oxygen Or Sulfur-Condensed Heterocyclic Ring Systems (AREA)
- Investigating Or Analyzing Non-Biological Materials By The Use Of Chemical Means (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Nitrogen And Oxygen As The Only Ring Hetero Atoms (AREA)
Abstract
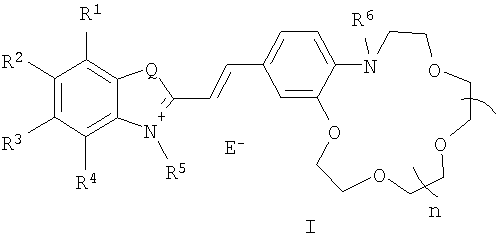
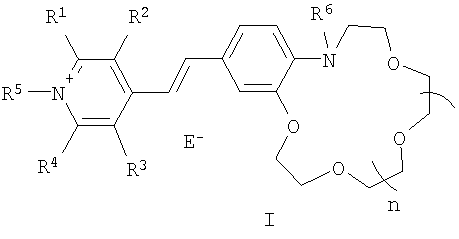
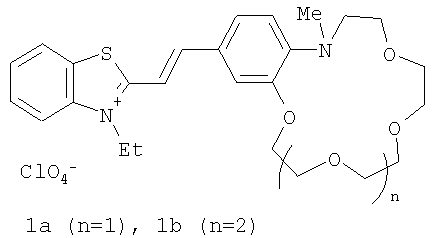
Изобретение относится к органической химии, а именно к новому типу соединений - N-алкилазакраунсодержащим стириловым красителям общей формулы I:
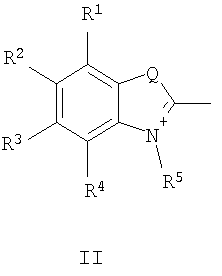
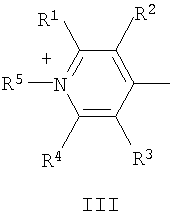
в которой А+ - гетероциклический остаток формулы (II) или (III):
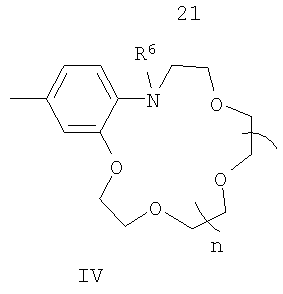
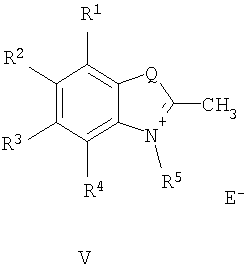
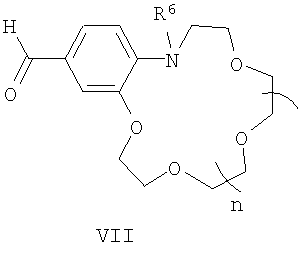
В в формуле (I) - фрагмент N-алкилбензоазакраун-эфира формулы (IV):
где R6 - низший алкил; n=0-3; к способу их получения, а также к новым композитным пленочным материалам на основе красителей (I), проявляющим эффективные оптические хемосенсорные свойства по отношению к катионам щелочных и щелочноземельных металлов. 3 н. и 1 з.п. ф-лы, 4 табл.
Description
Изобретение относится к органической химии и химии материалов, а именно к новому типу соединений общей формулы (I):
в которой А+ - гетероциклический остаток формулы (II) или (III):
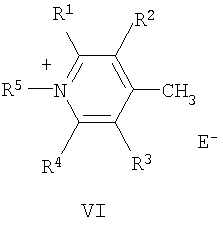
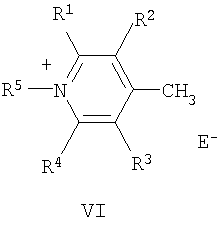
где R1-R4 - атом водорода, низший алкил, низшая алкоксильная группа, два заместителя R1 и R2 или R3 и R4 вместе составляют С4Н4-бензогруппу;
R5 - алкил;
Q - атом серы, группа СН=СН;
Е в формуле (I) = Cl, Br, I, ClO4, PF6, BF4, TsO, CH3SO3, CF3SO3, CH3OSO3;
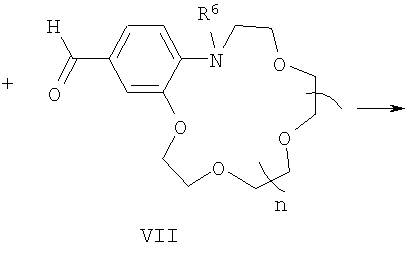
В в формуле (I) - фрагмент N-алкилбензоазакраун-эфира формулы (IV):
где R6 - низший алкил;
n=0-3;
а также к новым полимерным пленкам и мембранам на основе красителей (I).
Полученные соединения и композитные материалы на их основе могут быть использованы в составе оптических хемосенсоров для колориметрического и люминесцентного определения катионов щелочных и щелочноземельных металлов, например, в составе полимерных пленок, мембран и ультратонких пленок для определения микроколичеств указанных ионов в биологических жидкостях, в промышленных водах и стоках, для мониторинга окружающей среды. Изобретение относится также к способам получения таких соединений и материалов.
Указанный тип соединений и пленочные хемосенсорные композитные материалы на их основе, их свойства и способ получения в литературе не описаны.
Заявляемый новый тип соединений имеет структуру, не относящуюся ни к одному из известных типов структур. Предложенный класс соединений содержит неизвестное ранее сочетание фрагментов стирилового красителя и моноазакраун-эфира, конденсированных таким образом, что атом азота макрогетероцикла находится в сопряжении с бензольным циклом и в пара-положении к этиленовой группе, что и позволяет отнести эти соединения к новому типу красителей.
Известны катионные красители стирилового ряда [Berlin L., Reister О., "Methoden zur Herstellung von Cyaninen (Polymethinen)", In "Methoden der Organischen Chemie", Edn. Miller E, B. 5/1 d, Georg Thieme Verlag, Stuttgart, 1972, 227; Фикен Г.Е. Цианиновые красители. В кн. Химия синтетических красителей. Под ред. Венкатарамана К., т.4, Л.: Химия, 1975, 207; Гордон П., Грегори П. "Органическая химия красителей", М.: Мир, 1987, 344], особенностью строения которых является наличие четвертичного гетероциклического ядра, связанного посредством двойной углерод-углеродной связи с замещенным бензольным ядром. Эти красители не способны к комплексообразованию с катионами металлов и аммония, поскольку не имеют макрогетероциклического фрагмента.
В литературе описаны стириловые красители, в которых гетероциклический остаток соединен через одну двойную углерод-углеродную связь с фрагментом N-фенилазакраун-эфира [Ушаков Е.Н., Громов С.П., Федорова О.А., Алфимов М.В., Изв. АН. Сер. хим., 1997, 484]. Для них характерны наличие поглощения в области 500-550 нм и способность к комплексообразованию с катионами щелочных и щелочноземельных металлов. Однако константы устойчивости таких комплексов с катионами металлов невысоки из-за слабого участия атома азота макроцикла в координации катиона металла и из-за конформационной подвижности макроцикла N-фенилазакраун-эфира. Это не позволяет использовать стириловые красители с фрагментом N-фенилазакраун-эфира в качестве эффективных оптических молекулярных сенсоров на катионы металлов и аммония.
В литературе описаны стириловые красители, в которых гетероциклический остаток соединен через одну двойную углерод-углеродную связь с фрагментом краун-эфира или тиакраун-эфира [Громов С.П., Федорова О.А., Фомина М.В., Алфимов М.В., Патент 2012574 РФ, Бюл. изобр., 1994, №9; Громов С.П., Алфимов М.В., Изв. АН. Сер. хим., 1997, 641; Громов С.П., Федорова О.А., Ведерников А.И., Ещеулова О.В., Федоров Ю.В., Алфимов М.В., Патент 2176256 РФ, Бюл. изобр., 2001, №33; Gromov S.P., Ushakov Е.N., Fedorova O.A., Baskin I.I., Buevich A.V., Andryukhina E.N., Alfimov M.V., Johnels D., Ediund U.G., Whitesell J.K., Fox M.A., J. Org. Chem., 2003, 68, 6115]. Для них характерны наличие поглощения в видимой области спектра и выраженная способность к комплексообразованию с катионами металлов и аммония. Однако поглощение и флуоресценция таких красителей сдвинуты в коротковолновую область спектра по сравнению со стириловыми красителями на основе N-фенилазакраун-эфиров, а ионохромный эффект не превышает 56 нм. Это сильно ограничивает применение таких красителей в качестве оптических молекулярных сенсоров на катионы металлов и аммония.
Целью настоящего изобретения является новый тип соединений - N-алкильные производные азакраунсодержащих стириловых красителей, в которых атом азота, входящий в состав фрагмента моноазакраун-эфира, находится в сопряжении с бензольным циклом и в пара-положении к этиленовой группе. Задачей изобретения является также разработка способа получения целевых продуктов, доказательство их строения и изучение их комплексообразующих, ионохромных и ионофлуорохромных свойств.
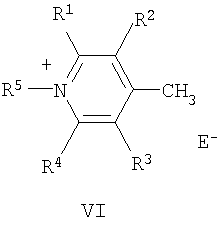
Поставленная цель достигается структурой заявляемого нового типа стириловых красителей общей формулы (I) и способом их получения, заключающимся в том, что четвертичные соли метальных производных гетероциклических оснований общих формул (V) и (VI):
где R1-R5, Q и Е имеют указанные выше значения для формулы (I), при этом Е в формуле (I) и в формулах (V), (VI) могут быть одинаковыми или разными;
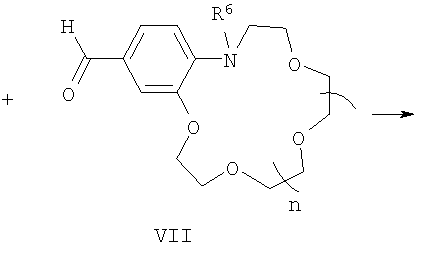
подвергают взаимодействию с формильными производными N-алкилбензоазакраун-эфиров общей формулы (VII):
где R6 и n имеют указанные выше значения для формулы (I).
Процесс проводят в среде органического растворителя, например спирта, в присутствии органических оснований, таких как пиридин, пиперидин, пирролидин, триэтиламин (или без них) при температурах 20-140°С. Реакцию можно проводить с последующей заменой анионов в (I) обработкой кислотами, солями кислот с иными противоионами (или без замены аниона).
Конденсация указанных четвертичных солей метильных производных гетероциклических оснований общих формул (V) и (VI) с формильными производными N-алкилбензоазакраун-эфиров общей формулы (VII) до настоящего времени не была известна. Согласно предлагаемому способу синтез стириловых красителей общей формулы (I) осуществляют конденсацией активированной в четвертичных солях гетероциклических оснований общих формул (V) и (VI) метильной группы с карбонильной группой формильных производных азакраун-эфиров общей формулы (VII) с образованием двойной углерод-углеродной связи.
Строение полученных соединений общей формулы (I) доказано с помощью спектроскопии ЯМР 1H и 13С, электронной спектроскопии, а также данными элементного анализа (примеры 1-9).
Пример 1. Перхлорат 3-этил-2-[(E)-2-(13-метил-2,3,5,6,8,9,12,13-октагидро-11H-1,4,7,10,13-бензотетраоксаазациклопентадецин-16-ил)этенил]-1,3-бензотиазолия-3.
В колбе емкостью 20 мл, снабженной обратным холодильником и хлоркальциевой трубкой, смешивают 27 мг (0.10 ммоля) перхлората 3-этил-2-метилбензотиазолия, 37 мг (0.12 ммоля) формильного производного N-метилбензоаза-15-краун-5-эфира, 0.03 мл пиридина и 5 мл абс. этанола. Реакционную смесь нагревают при кипении на масляной бане в течение 10 ч, охлаждают до -10°С, осадок отфильтровывают, четырежды промывают холодным абс. этанолом и высушивают на воздухе. Получают 49 мг (выход 89%) красителя в виде темно-красных кристаллов, т.пл. 194-196°С.
Спектр ЯМР 1Н (500 МГц, в ДМСО-d6, 30°С): 1.46 (т, 3 Н, MeCH2, J=7.3 Гц); 2.95 (с, 3 Н, MeN); 3.43 (т, 2 Н, CH2CH2H, J=7.3 Гц); 3.59 (с, 4 Н, 2 CH2O); 3.63 (м, 4 Н, 2 CH2O); 3.87 (м, 4 Н, CH2CH2H, CH2CH2OAr); 4.24 (м, 2 Н, CH2OAr); 4.90 (к, 2 Н, CH2N+, J=7.3 Гц); 6.91 (д, 1 Н, Н(14), J=8.6 Гц); 7.55 (д, 1 Н, Н(17), J=1.8 Гц); 7.57 (д.д, 1 Н, Н(15), J=8.6 Гц, J=1.8 Гц); 7.70 (д, 1 Н, СН=CHHet, 3Jтранс=15.4 Гц); 7.73 (м, 1 Н, Н(6)); 7.82 (м, 1 Н, Н(5)); 8.10 (д, 1 Н, CH=CHHet, 3Jтранс=15.4 Гц); 8.19 (д, 1 Н, Н(4), J=8.6 Гц); 8.35 (д, 1 Н, Н(7), J=7.7 Гц).
Спектр ЯМР 13С (125 МГц, в ДМСО-d6, 27°С): 13.88 (MeCH2); 39.84 (MeN); 43.73 (CH2N+); 54.33 (CH2CH2N); 68.23 (CH2OAr); 68.37 (CH2O); 68.56 (CH2O); 68.88 (CH2O); 68.94 (CH2O); 69.08 (CH2O); 70.06 (CH2O); 107.83 (CH=CHHet); 112.19 (C(17)); 115.61 (C(14)); 115.94 (C(4)); 124.04 (C(7)); 124.97 (C(16)); 126.59 (C(15)); 127.48 (C(8)); 127.70 (С(6)); 129.10 (С(5)); 140.77 (С(9)); 146.46 (С(13а)); 149.20 (С(17а)); 150.07 (CH=CHHet); 171.04 (C(2)).
УФ-спектр (ацетонитрил), нм: 518 (ε=42000).
Найдено, %; С 54.74; Н 5.79; N 4.81.
C26H33ClN2O8S.
Вычислено, %: С 54.88; Н 5.85; N 4.92.
Пример 2. Перхлорат 3-этил-2-[(E)-2-(16-метил-2,3,5,6,8,9,11,12,15,16-декагидро-14H-1,4,7,10,13,16-бензопентаоксаазациклооктадецин-19-ил)этенил]-1,3-бензотиазолия-3.
Получен аналогично примеру 1 из перхлората 3-этил-2-метилбензотиазолия и формильного производного N-метилбензоаза-18-краун-6-эфира с выходом 70% в виде темно-красных кристаллов, т.пл. 186-188°С.
Спектр ЯМР 1H (500 МГц, в ДМСО-d6, 30°С): 1.45 (т, 3 Н, МеСН2, J=7.3 Гц); 3.02 (с, 3 Н, MeN); 3.53 (м, 4 Н, CH2O); 3.56 (м, 4 Н, 2 CH2O); 3.59 (т, 2 Н, CH2CH2N, J=5.9 Гц); 3.62 (м, 4 Н, 2 CH2O); 3.75 (т, 2 Н, CH2CH2N, J=5.9 Гц); 3.86 (м, 2 Н, CH2CH2OAr); 4.22 (м, 2 Н, CH2OAr); 4.90 (к, 2 Н, CH2N+, J=7.3 Гц); 6.88 (д, 1 Н, Н(17), J=8.2 Гц); 7.56 (уш.с, 1 Н, Н(20)); 7.58 (д.д, 1 Н, Н(18), J=8.2 Гц, J=1.8 Гц); 7.69 (д, 1 Н, СН=CHHet, 3Jтранс=15.4 Гц); 7.72 (м, 1 Н, Н(6)); 7.82 (м, 1 Н, Н(5)); 8.10 (д, 1 Н, СH=CHHet, 3Jтранс=15.4 Гц); 8.19 (д, 1 Н, Н(4), J=8.6 Гц); 8.35 (д, 1 Н, Н(7), J=7.7 Гц).
Спектр ЯМР 13С (125 МГц, в ДМСО-d6, 30°С): 13.76 (MeCH2); 40.70 (MeN); 43.61 (CH2N+); 53.88 (CH2CH2N); 67.78 (CH2OAr); 68.72 (CH2CH2OAr); 69.16 (CH2O); 69.65 (CH2CH2N, CH2O); 69.77 (CH2O); 69.87 (CH2O); 70.11 (CH2O); 70.42 (CH2O); 107.39 (CH=CHHet); 112.57 (C(20)); 115.57 (C(17)); 115.79 (C(4)); 123.92 (C(7)); 124.54 (C(19)); 126.86 (C(18)); 127.34 (C(8)); 127.57 (C(6)); 129.00 (C(5)); 140.69 (C(9)); 146.02 (C(16a)); 148.70 (C(20a)); 150.01 (CH=CHHet); 170.89 (C(2)).
УФ-спектр (ацетонитрил), нм: 526 (ε=43000).
Найдено, %: С 54.65; Н 6.08; N 4.39.
C28H37ClN2O9S.
Вычислено, %: С 54.85; Н 6.08; N 4.57.
Пример 3. Перхлорат 1-этил-2-[(E)-2-(13-метил-2,3,5,6,8,9,12,13-октагидро-11H-1,4,7,10,13-бензотетраоксаазациклопентадецин-16-ил)этенил]хинолиния.
В колбе емкостью 20 мл, снабженной обратным холодильником и хлоркальциевой трубкой, смешивают 16 мг (0.06 ммоля) перхлората 1-этил-2-метилхинолиния, 22 мг (0.07 ммоля) формильного производного N-метилбензоаза-15-краун-5-эфира, 0.02 мл пирролидина и 3 мл абс. этанола. Реакционную смесь нагревают при кипении на масляной бане в течение 10 ч, охлаждают до -10°С, осадок отфильтровывают, четырежды промывают холодным абс. этанолом и высушивают на воздухе. Получают 19 мг (выход 57%) красителя в виде темно-сиреневых кристаллов, т.пл. 199-201°С.
Спектр ЯМР 1Н (500 МГц, в ДМСО-d6, 30°С): 1.56 (т, 3 Н, МеСН2, J=7.3 Гц); 2.91 (с, 3 Н, MeN); 3.36 (т, 2 Н, CH2CH2N J=7.3 Гц); 3.59 (с, 4 Н, 2 CH2O); 3.63 (м, 4 Н, 2 CH2O); 3.87 (м, 4 Н, CH2CH2H, CH2CH2OAr); 4.24 (м, 2 Н, CH2OAr); 5.12 (к, 2 Н, CH2N+, J=7.3 Гц); 6.91 (д, 1 Н, Н(14), J=8.6 Гц); 7.49 (уш.д, 1 Н, Н(15), J=8.6 Гц); 7.50 (уш.с, 1 Н, Н(17)); 7.57 (д, 1 Н, СН=CHHet, 3Jтранс=15.4 Гц); 7.89 и 8.14 (2 м, по 1 Н каждый, Н(6) и Н(7)); 8.25 (д, 1 Н, СР=CHHet, 3Jтранс=15.4 Гц); 8.30 и 8.50 (д.д. и д, по 1 Н каждый, Н(5) и Н(8), J=8.2 Гц, J=1.4 Гц и J=9.1 Гц); 8.54 (д, 1 Н, Н(3), J=9.1 Гц); 8.91 (д, 1 Н, Н(4), J=9.1 Гц).
УФ-спектр (ацетонитрил), нм: 507 (ε=37700).
Найдено, %: С 59.92; Н 6.31; N 4.87.
C28H35ClN2O8.
Вычислено, %: С 59.73; Н 6.27; N 4.98.
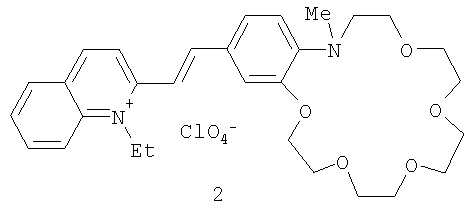
Пример 4. Перхлорат 1-этил-2-[(E)-2-(16-метил-2,3,5,6,8,9,11,12,15,16-декагидро-14H-1,4,7,10,13,16-бензопентаоксаазациклооктадецин-19-ил)этенил]хинолиния.
Получен аналогично примеру 3 из перхлората 1-этил-2-метилхинолиния и формильного производного N-метилбензоаза-18-краун-6-эфира с выходом 50% в виде темно-сиреневых кристаллов, т.пл. 184-186°С.
Спектр ЯМР 1H (500 МГц, в ДМСО-d6, 30°С): 1.56 (т, 3 Н, МеСН2, J=7.3 Гц); 2.98 (с, 3 Н, MeN); 3.53 (м, 6 Н, CH2CH2H, 2 CH2O); 3.56 (м, 4 Н, 2 CH2O); 3.63 (м, 4 Н, 2 CH2O); 3.75 (т, 2 Н, CH2CH2H, J=5.9 Гц); 3.87 (м, 2 Н, CH2CH2OAr); 4.24 (м, 2 Н, CH2OAr); 5.12 (к, 2 Н, CH2N+, J=7.3 Гц); 6.89 (д, 1 Н, Н(17), J=8.2 Гц); 7.49 (д.д, 1 Н, Н(18), J=8.2 Гц, J=1.8 Гц); 7.50 (уш.с, 1 Н, Н(20)); 7.56 (д, 1 Н, СН=CHHet, 3Jтранс=15.4 Гц); 7.89 и 8.13 (2 м, по 1 Н каждый, Н(6) и Н(7)); 8.25 (д, 1 Н, CH=CHHet, 3Jтранс=15.4 Гц); 8.29 и 8.49 (2 д, по 1 Н каждый, Н(5) и Н(8), J=8.2 Гц и J=9.1 Гц); 8.53 (д, 1 Н, Н(3), J=9.1 Гц); 8.89 (д, 1 Н, Н(4), J=9.1 Гц).
УФ-спектр (ацетонитрил), нм: 512 (ε=32000).
Найдено, %: С 59.32; Н 6.46; N 4.61.
C30H39ClN2O9.
Вычислено, %: С 59.35; Н 6.48; N 4.61.
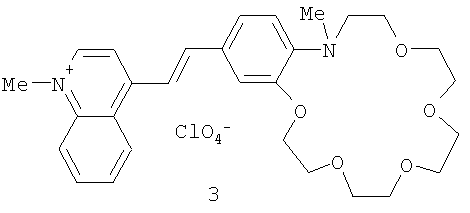
Пример 5. Перхлорат 1-метил-4-[(E)-2-(16-метил-2,3,5,6,8,9,11,12,15,16-декагидро-14H-1,4,7,10,13,16-бензопентаоксаазациклооктадецин-19-ил)этенил]хинолиния.
В двугорлой колбе емкостью 20 мл, снабженной обратным холодильником и хлоркальциевой трубкой, смешивают 19 мг (0.07 ммоля) перхлората 1,4-диметилхинолиния, 31 мг (0.09 ммоля) формильного производного N-метилбензоаза-18-краун-6-эфира, 0.02 мл пирролидина и 4 мл абс. этанола. Реакционную смесь нагревают при кипении на масляной бане в темноте в атмосфере аргона в течение 10 ч и охлаждают до -10°С. Образовавшийся осадок отфильтровывают, четырежды промывают холодным абс. этанолом и высушивают на воздухе. Получают 29 мг (выход 66%) красителя в виде темно-фиолетовых кристаллов, т.пл. 224-225°С.
Спектр ЯМР 1Н (500 МГц, в ДМСО-d6, 30°С): 2.94 (с, 3 Н, MeN); 3.46 (т, 2 Н, CH2N, J=5.9 Гц); 3.56 (м, 4 Н, 2 СН2О); 3.59 (с, 4 Н, 2 CH2O); 3.63 (м, 4 Н, 2 CH2O); 3.74 (т, 2 Н, CH2CH2N, J=5.9 Гц); 3.87 (м, 2 Н, CH2CH2OAr); 4.26 (м, 2 Н, CH2OAr); 4.48 (с, 3 Н, MeN+); 6.88 (д, 1 Н, Н(17), J=8.2 Гц); 7.40 (д.д, 1 Н, Н(18), J=8.2 Гц, J=1.4 Гц); 7.58 (уш.с, 1 Н, Н(20)); 8.03 (м, 1 Н, Н(6)); 8.12 (м, 2 Н, СН=СН); 8.24 (м, 1 Н, Н(7)); 8.38 (м, 2 Н, Н(3), Н(8)); 9.04 (д, 1 Н, Н(5), J=8.6 Гц); 9.12 (д, 1 Н, Н(2), J=6.4 Гц).
УФ-спектр (ацетонитрил), нм: 519 (ε=26000).
Найдено, %: С 58.75; Н 6.31; N 4.64.
C29H37ClN2O9.
Вычислено, %: С 58.73; Н 6.29; N 4.72.
Пример 6. Иодид 1-метил-4-[(E)-2-(13-метил-2,3,5,6,8,9,12,13-октагидро-11H-1,4,7,10,13-бензотетраоксаазациклопентадецин-16-ил)-1-этенил]пиридиния.
В колбе емкостью 20 мл, снабженной обратным холодильником и хлоркальциевой трубкой, смешивают 69 мг (0.29 ммоля) иодида 1,4-диметилпиридиния, 100 мг (0.32 ммоля) формильного производного N-метилбензоаза-15-краун-5-эфира, 0.07 мл пиперидина и 7 мл метанола. Реакционную смесь нагревают при кипении на масляной бане в течение 26 ч, затем тщательно упаривают в вакууме. Остаток четырежды экстрагируют кипящим бензолом, нерастворившееся вещество отделяют декантацией и высушивают на воздухе. Получают 137 мг (выход 89%) красителя в виде темно-красных кристаллов, т.пл. 210-212°С.
Спектр ЯМР 1H (500 МГц, в ДМСО-d6, 30°С): 2.83 (с, 3 Н, MeN); 3.23 (т, 2 Н, CH2N, J=7.2 Гц); 3.58 (с, 4 Н, 2 CH2O); 3.61 (м, 4 Н, 2 CH2O); 3.86 (м, 4 Н, CH2CH2N, CH2CH2OAr); 4.17 (м, 2 Н, CH2OAr); 4.20 (с, 3 Н, MeN+); 6.88 (д, 1 Н, Н(14), J=8.3 Гц); 7.21 (д.д, 1 Н, Н(15), J=8.3 Гц, J=1.3 Гц); 7.29 (д, 1 Н, Н(17), J=1.3 Гц); 7.32 (д, 1 Н, CH=CHPy, 3Jтранс=16.2 Гц); 7.90 (д, 1 Н, CH=CHPy, 3Jтранс=16.2 Гц); 8.08 (д, 2 Н, Н(3), Н(5), J=6.6 Гц); 8.74 (д, 2 Н, Н(2), Н(6), J=6.6 Гц).
Спектр ЯМР 13С (125 МГц, в ДМСО-d6, 30°С): 39.42 (MeN); 46.46 (MeN+); 54.54 (CH2N); 67.77 (CH2OAr); 68.19 (CH2O); 68.58 (CH2O); 68.70 (CH2O); 68.94 (2 СН2О), 70.00 (CH2O); 110.29 (С(17)); 116.15 (С(14)); 119.32 (СН=CHPy); 122.43 (С(3), С(5)); 123.17 (С(15)); 126.81 (С(16)); 141.24 (CH=CHPy); 144.31 (С(13а)); 144.44 (С(2), С(6)); 149.88 (С(17а)); 152.91 (С(4)).
УФ-спектр (ацетонитрил), нм: 456 (ε=34700).
Найдено, %: С 50.18; Н 6.29; N 4.95.
C23H31IN2O4·1.5H2O.
Вычислено, %: С 49.92; Н 6.19; N 5.06.
Пример 7. Иодид 1-метил-4-[(Е)-2-(16-метил-2,3,5,6,8,9,11,12,15,16-декагидро-14H-1,4,7,10,13,16-бензопентаоксаазациклооктадецин-19-ил)-1-этенил]пиридиния.
В колбе емкостью 20 мл, снабженной обратным холодильником и хлоркальциевой трубкой, смешивают 45 мг (0.19 ммоля) иодида 1,4-диметилпиридиния, 80 мг (0.23 ммоля) формильного производного N-метилбензоаза-18-краун-6-эфира, 0.04 мл пирролидина и 6 мл абс. этанола. Реакционную смесь нагревают при кипении на масляной бане в течение 25 ч, затем тщательно упаривают в вакууме. Остаток четырежды экстрагируют кипящим бензолом, нерастворившееся вещество отделяют декантацией и высушивают на воздухе. Получают 59 мг (выход 54%) красителя в виде темно-красных кристаллов, т.пл. 163-164°С.
Спектр ЯМР 1H (500 МГц, в ДМСО-d6, 30°С): 2.90 (с, 3 Н, MeN); 3.41 (т, 2 Н, CH2N, J=6.0 Гц); 3.54 (м, 4 Н, 2 CH2O); 3.55 (м, 4 Н, 2 CH2O); 3.62 (м, 4 Н, 2 CH2O); 3.72 (т, 2 Н, CH2CH2N, J=6.0 Гц); 3.85 (м, 2 Н, CH2CH2OAr); 4.17 (м, 2 Н, CH2OAr); 4.20 (с, 3 Н, MeN+); 6.86 (д, 1 Н, Н(17), J=8.2 Гц); 7.22 (д.д, 1 Н, Н(18), J=8.2 Гц, J=1.4 Гц); 7.30 (уш.с, 1 Н, Н(20)); 7.32 (д, 1 Н, CH=CHPy, 3Jтранс=15.9 Гц); 7.91 (д, 1 Н, CH=CHPy, 3Jтранс=15.9 Гц); 8.08 (д, 2 Н, Н(3), Н(5), J=6.6 Гц); 8.75 (д, 2 Н, Н(2), Н(6), J=6.6 Гц).
Спектр ЯМР 13С (125 МГц, в ДМСО-d6, 30°С): 40.08 (MeN); 46.42 (MeN+); 53.82 (CH2N); 67.37 (CH2OAr); 68.78 (CH2CH2OAr); 69.23 (CH2O); 69.37 (CH2CH2N); 69.61 (CH2O); 69.82 (2 CH2O); 70.10 (CH2O), 70.31 (CH2O); 110.68 (С(20)); 116.30 (С(17)); 119.16 (CH=CHPy); 122.37 (С(3), С(5)); 123.36 (С(18)); 126.54 (С(19)); 141.24 (CH=CHPy); 143.94 (С(16а)); 144.42 (С(2), С(6)); 149.48(С(20а)); 152.92 (С(4)).
УФ-спектр (ацетонитрил), нм: 456 (ε=24500).
Найдено, %: С 51.66; Н 6.02; N 4.78.
C25H35IN2O5·0.5H2O.
Вычислено, %: С 51.82; Н 6.26; N 4.83.
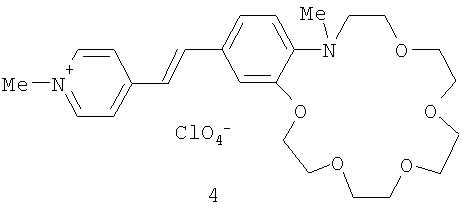
Пример 8. Перхлорат 1-метил-4-[(Е)-2-(16-метил-2,3,5,6,8,9,11,12,15,16-декагидро-14H-1,4,7,10,13,16-бензопентаоксаазациклооктадецин-19-ил)-1-этенил]пиридиния.
В колбе емкостью 20 мл, снабженной обратным холодильником и хлоркальциевой трубкой, смешивают 12 мг (0.06 ммоля) перхлората 1,4-диметилпиридиния, 24 мг (0.07 ммоль) формильного производного N-метилбензоаза-18-краун-6-эфира, 0.02 мл пирролидина и 3 мл абс. этанола. Реакционную смесь нагревают при кипении на масляной бане в темноте в атмосфере аргона в течение 11 ч и охлаждают до -10°С. Образовавшийся осадок отфильтровывают, четырежды промывают холодным абс. этанолом и высушивают на воздухе. Получают 23 мг (выход 73%) красителя в виде темно-красных кристаллов, т.пл. 191-193°С.
Спектр ЯМР 1Н (500 МГц, в ДМСО-d6, 30°С): 2.89 (с, 3 Н, MeN); 3.40 (т, 2 Н, CH2N, J=5.9 Гц); 3.53 (м, 4 Н, 2 CH2O); 3.55 (м, 4 Н, 2 CH2O); 3.62 (м, 4 Н, 2 СН2О); 3.71 (т, 2 Н, CH2CH2N, J=5.9 Гц); 3.84 (м, 2 Н, CH2CH2OAr); 4.17 (м, 2 Н, CH2OAr); 4.19 (с, 3 Н, MeN+); 6.85 (д, 1 Н, Н(17), J=8.2 Гц); 7.21 (д.д, 1 Н, Н(18), J=8.2 Гц, J=1.4 Гц); 7.29 (д, 1 Н, Н(20), J=1.4 Гц); 7.30 (д, 1 Н, CH=CHPy, 3Jтранс=16.4 Гц); 7.89 (д, 1 Н, CH=CHPy, 3Jтранс=16.4 Гц); 8.07 (д, 2 Н, Н(3), Н(5), J=6.8 Гц); 8.73 (д, 2 Н, Н(2), Н(6), J=6.8 Гц).
Спектр ЯМР 13С (125 МГц, в ДМСО-d6, 30°С): 40.08 (MeN); 46.42 (MeN+); 53.82 (CH2N); 67.37 (CH2OAr); 68.78 (CH2CH2OAr); 69.23 (CH2O); 69.37 (CH2CH2N); 69.61 (CH2O); 69.82 (2 CH2O); 70.10 (CH2O), 70.31 (CH2O); 110.68 (С(20)); 116.30 (С(17)); 119.16 (CH=CHPy); 122.37 (С(3), С(5)); 123.36 (С(18)); 126.54 (С(19)); 141.24 (CH=CHPy); 143.94 (С(16а)); 144.42 (С(2), С(6)); 149.48 (С(20а)); 152.92 (С(4)).
УФ-спектр (ацетонитрил), нм: 459 (ε=28000).
Найдено, %: С 55.39; Н 6.58; N 5.18.
C25H35CIN2O9.
Вычислено, %: С 55.30; Н 6.50; N 5.16.
Пример 9. Перхлорат 4-[(E)-2-(16-Метил-2,3,5,6,8,9,11,12,15,16-декагидро-14H-1,4,7,10,13,16-бензопентаоксаазациклооктадецин-19-ил)винил]-1-октадецилпиридиния.
В колбе емкостью 20 мл, снабженной обратным холодильником и хлоркальциевой трубкой, смешивают 26 мг (0.06 ммоля) перхлората 4-метил-1-октадецилпиридиния, 25 мг (0.07 ммоль) формильного производного N-метилбензоаза-18-краун-6-эфира, 0.02 мл пирролидина и 4 мл абс. этанола. Реакционную смесь нагревают при кипении на масляной бане в темноте в атмосфере аргона течение 25 ч и охлаждают до -10°С. Образовавшийся осадок отфильтровывают, четырежды промывают холодным абс. этанолом и высушивают на воздухе. Получают 24 мг (выход 52%) красителя в виде темно-красных кристаллов, т.пл. 92-94°С.
Спектр ЯМР 1H (500 МГц, в ДМСО-d6, 30°С): 2.89 (т, 3 Н, MeN, J=7.0 Гц); 1.22 (м, 30 Н, 15 СН2); 1.88 (м, 2 Н, MeCH2); 3.40 (т, 2 Н, CH2N, J=6.2 Гц); 3.53 (м, 4 Н, 2 CH2O); 3.54 (м, 4 Н, 2 CH2O); 3.61 (м, 4 Н, 2 CH2O); 3.71 (т, 2 Н, CH2CH2N, J=6.1 Гц); 3.84 (м, 2 Н, CH2CH2OAr); 4.16 (м, 2 Н, CH2OAr); 4.42 (т, 2 Н, CH2N+, J=7.3 Гц); 6.85 (д, 1 Н, Н(17), J=8.2 Гц); 7.22 (д.д, 1 Н, Н(18), J=8.2 Гц, J=1.4 Гц); 7.29 (уш.с, 1 Н, Н(20)); 7.31 (д, 1 Н, CH=CHPy, 3Jтранс=15.9 Гц); 7.91 (д, 1 Н, CH=CHPy, 3Jтранс=15.9 Гц); 8.09 (д, 2 Н, Н(3), Н(5), J=6.8 Гц); 8.81 (д, 2 Н, Н(2), Н(6), J=6.8 Гц).
УФ-спектр (ацетонитрил), нм: 459 (ε=26500).
Найдено, %: С 64.68; Н 8.98; N 3.69.
C42H69ClN2O9.
Вычислено, %: С 64.55; Н 8.90; N 3.58.
Остальные соединения были получены способами, аналогичными примерам 1, 3 или 5-9.
Изучены комплексообразующие, ионохромные и ионофлуорохромные свойства полученных азакраунсодержащих стириловых красителей (I) из примеров 1 (1a), 2 (1b), 4 (2), 5 (3) и 8 (4) в ацетонитрильных растворах.
Методом ЯМР 1Н-титрования измерены константы устойчивости комплексов красителей 1b и 2 с биогенными катионами Na+, K+, Mg2+ и Ca2+ в ацетонитриле-d3 (содержание воды <0.05%). В таблице 1 приведены значения констант устойчивости комплексов состава 1:1, которые указывают на очень высокую селективность связывания 1b и 2 с катионами кальция (коэффициенты селективности Ca2+/Mm+ (m=1,2)>103).
| Таблица 1 | ||||
| Константы устойчивости комплексов красителей 1b и 2 с перхлоратами металлов.а) | ||||
| Краситель | lgK | |||
| Na+ | K+ | Mg2+ | Ca2+ | |
| 1b | 3.1 | 3.5 | 0.9 | >7 |
| 2 | 3.5 | 3.8 | 1.1 | >7 |
| a) ЯМР 1Н-титрование в ацетонитриле-d3 при Т=30±1°С. Концентрация красителя (1-5)×103 моль×л-1 | ||||
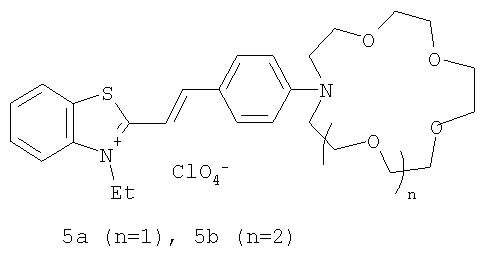
В таблице 2 приведены основные абсорбционные и люминесцентные характеристики красителей 1a,b и 2-4 и их комплексов состава 1:1 с катионами щелочных и щелочноземельных металлов. Константы устойчивости комплексов красителей 1a,b и 2, измеренные методом спектрофотометрического титрования, даны в таблице 3. Для сравнения в таблице 4 приведены основные абсорбционные характеристики и константы устойчивости комплексов с катионами металлов для стириловых красителей 5a,b, отличающихся от красителей 1a,b тем, что вместо фрагмента N-метилбензоазакраун-эфира содержат соответствующий по размеру фрагмент N-фенилазакраун-эфира [Ушаков Е.Н., Громов С.П., Федорова О.А., Алфимов М.В., Изв. АН. Сер. хим., 1997, 484; Насимова И.Р., Ушаков Е.Н., Махаева Е.Е., Федорова О.А., Громов С.П., Алфимов М.В., Хохлов А.Р., Высокомол. соединения. Сер. А, 2002, 44, 2171; Ушаков Е.Н., Дисс. док. хим. наук, ИПХФ РАН, Черноголовка, 2006].
Количественные данные, приведенные в таблицах 2-4, убедительно свидетельствуют о том, что новые хромогенные бензоазакраун-эфиры 1a,b и 2-4 значительно превосходят аналогичные хромогенные N-фенилазакраун-эфиры 5a,b как по термодинамической устойчивости комплексов с катионами щелочных и щелочноземельных металлов, так и по величине ионохромного эффекта. Краситель 1а в сравнении с ранее известными донорно-акцепторными хромоионофорами на основе краун-эфиров [Ушаков Е.Н., Алфимов М.В., Громов С.П. Успехи химии, 2008, 77, 39] демонстрирует рекордные величины ионохромного эффекта для ионов Li+ и Na+ (105 и 95 нм, соответственно). Красители 1b и 2 характеризуются очень высокими коэффициентами селективности Ca2+/Mg2+ (>105) в сочетании с большими величинами ионохромного эффекта для Ca2+ (127 и 117 нм, соответственно). Кроме того, красители 1b-4 способны действовать не только как колориметрические молекулярные сенсоры, но и как «включающиеся» люминесцентные сенсоры. Например, при комплексообразовании красителя 4 с ионом Ва2+ квантовый выход люминесценции возрастает в 60 раз.
| Таблица 2 | ||||||
| Абсорбционные и люминесцентные характеристики хромогенных бензоазакраун-эфиров 1a,b и 2-4 и их комплексов состава 1:1 с катионами металлов.а) | ||||||
| Соединение | Поглощение | Люминесценция | ||||
| λmax, б) нм |
Δλ, в) нм | εmax×10-4,г) л·моль-1·см-1 | λfl max,д) нм | S×10-3, e) см-1 | Квантовый выход | |
| 1а | 518 | 4.20 | - | - | - | |
| 1a·Li+ | 413 | 105 | 3.22 | - | - | - |
| 1a·Na+ | 423 | 95 | 3.20 | - | - | - |
| 1a·Mg2+ | 382 | 136 | 3.42 | - | - | - |
| 1a·Ca2+ | 395 | 123 | 3.47 | - | - | - |
| 1a·Sr2+ | 405 | 113 | 3.50 | - | - | - |
| 1a·Ba2+ | 410 | 108 | 3.44 | - | - | - |
| 1b | 526 | 4.30 | 643 | 3.5 | 0.0019 | |
| 1b·Li+ | 508 | 18 | 3.38 | - | - | - |
| 1b·Na+ | 443 | 83 | 3.17 | 638 | 6.9 | 0.015 |
| 1b·K+ | 441 | 85 | 3.37 | - | - | - |
| 1b·Ca2+ | 399 | 127 | 3.46 | 606 | 8.6 | 0.019 |
| 1b·Sr2+ | 401 | 125 | 3.44 | 591 | 8.0 | 0.038 |
| 1b·Ba2+ | 409 | 117 | 3.43 | 592 | 7.6 | 0.049 |
| 2 | 512 | 3.20 | - | - | <2×10-4 | |
| 2·Li+ | 498 | 14 | 2.21 | - | - | - |
| 2·Na+ | 434 | 78 | 2.74 | - | - | - |
| 2·K+ | 433 | 79 | 2.91 | - | - | - |
| 2·Ca2+ | 395 | 117 | 3.24 | 656 | 10.1 | 0.0031 |
| 2·Sr2+ | 397 | 115 | 3.23 | 628 | 9.3 | 0.0061 |
| 2·Ba2+ | 404 | 108 | 3.20 | 637 | 9.1 | 0.0063 |
| 3 | 519 | 2.60 | - | - | <2×10-4 | |
| 3·Na+ | 443 | 76 | 2.38 | - | - | - |
| 3·Ca2+ | 404 | 115 | 2.73 | 692 | 10.3 | 0.0074 |
| 3·Sr2+ | 405 | 114 | 2.76 | 672 | 9.8 | 0.014 |
| 3·Ba2+ | 413 | 106 | 2.75 | 671 | 9.3 | 0.018 |
| 4 | 459 | 2.80 | 666 | 6.8 | 0.0013 | |
| 4·Ca2+ | 367 | 92 | 3.04 | 615 | 11.0 | 0.029 |
| 4·Sr2+ | 369 | 90 | 3.08 | 598 | 10.4 | 0.056 |
| 4·Ba2+ | 376 | 83 | 3.03 | 594 | 9.8 | 0.078 |
| а) В ацетонитриле в присутствии кислорода воздуха при Т=23±2°С. | ||||||
| б} Положение максимума длинноволновой полосы поглощения. | ||||||
| в) Δλ=λmax (краситель)-λmax (комплекс). | ||||||
| г) Коэффициент молярного поглощения при λmax. | ||||||
| d) Положение максимума в исправленном спектре люминесценции. | ||||||
| е) Стоксов сдвиг спектра люминесценции. | ||||||
| Таблица 3 | |||||||
| Константы устойчивости комплексов красителей 1a,b и 2 с катионами металлов в безводном ацетонитриле (H2O<0.03%) при Т=23±2°С.а) | |||||||
| Соединение | lgK | ||||||
| Li+ | Na+ | K+ | Mg2+ | Ca2+ | Sr2+ | Ba2+ | |
| 1а | 3.12 | 2.72 | - | 5.30 | 5.24 | 4.71 | 4.24 |
| 1b | 2.30 | 3.53 | 3.78 | <2 | 7.19 | 8.03 | 7.60 |
| 2 | 2.57 | 3.87 | 4.11 | <2 | 7.67 | 8,37 | 8.08 |
| а) Константы измерены спектрофотометрическим методом при ионной силе раствора 0.01 моль·л-1 (ионную силу поддерживали с помощью Bu4NClO4 или NaClO4). | |||||||
| Таблица 4 | ||||
| Абсорбционные характеристики и константы устойчивости комплексов хромогенных N-фенилазакраун-эфиров 5a,b с катионами металлов в безводном ацетонитриле (H2O<0.03%) при 25°С.а) | ||||
| Соединение | λmax, нм | Δλ, нм | εmax×10-4, л·моль-1·см-1 | lgK |
| 5а | 522 | 6.8 | ||
| 5a·Mg2+ | 390 | 132 | 3.6 | 1.3 |
| 5а·Са2+ | 410 | 112 | 3.1 | 2.4 |
| 5a·Sr2+ | 420 | 102 | 3.1 | 1.6 |
| 5a·Ba2+ | 432 | 90 | 3.0 | 1.7 |
| 5b | 525 | 7.00 | ||
| 5b·Li+ | 516 | 9 | 6.29 | 1.8 |
| 5b·Na+ | 516 | 9 | 6.46 | 3.03 |
| 5b·K+ | 504 | 21 | 5.57 | - |
| 5b·Mg2+ | 504 | 21 | 5.95 | 2.68 |
| 5b·Ca2+ | 497 | 28 | 5.01 | 5.17 |
| 5b·Sr2+ | 402 | 123 | 3.26 | 4.94 |
| 5b·Ba2+ | 400 | 125 | 3.21 | 4.81 |
| а) Константы устойчивости измерены спектрофотометрическим методом при ионной силе раствора 0.01 моль·л-1 (ионную силу поддерживали с помощью Et4NClO4); в случае 5а для расчета lgK использовали контрольный спектр, измеренный при концентрации катиона металла, равной 0.5 моль·л-1. | ||||
Таким образом, предварительные результаты исследования красителей общей формулы (I) показали, что в апротонной среде они способны селективно и с хорошим оптическим откликом связывать катионы щелочных и щелочноземельных металлов, то есть проявляют свойства оптических молекулярных сенсоров. Эти свойства сохраняются в полимерных композитных пленках, что позволяет создать на основе полученных красителей оптические хемосенсорные материалы.
Композитные материалы, заявляемые в данном изобретении, получают методом спин-коатинга из растворов в органическом растворителе, содержащих полимер, пластификатор, ионофор и краунсодержащий краситель общей формулы (I). Способ получения пленочного материала на кварцевой подложке технологически прост и доступен как в лабораторной практике, так и в процессе производства и является оптимальным для целей, указанных в данном изобретении. Важным достоинством этого метода получения пленок является возможность получения тонких пленок (толщиной менее микрона) и то, что процесс проводится при сравнительно низкой температуре, благодаря чему возможно введение нетермостойких добавок, например красителей, определяющих дальнейшее применение пленки. Однако стириловые красители ранее не вводились в полимерные пленки или композитные материалы указанным способом.
Для получения хемосенсорных композитных материалов использовали следующие полимеры: целлюлозы ацетатфталат, целлюлозы ацетатгидрофталат, поливинилбутираль, полистирол и поливинилхлорид. В качестве пластификаторов использовали диоктиловый эфир себациновой кислоты, диоктилфталат, O-трифторметилоктиловый эфир. В качестве ионофора использовали дицетилфосфат натрия. В качестве ионофлуорофоров были взяты красители общей формулы (I) из примеров 7 и 8. Растворы полимеров, пластификаторов, ионофора и красителей готовили в следующих растворителях: хлороформе, метиленхлориде, дихлорэтане, тетрагидрофуране. Пленкообразующий раствор содержал в 1 мл растворителя (например, ТГФ) 30 мг полимера (например, поливинилхлорида), 50-60 мкл пластификатора (например, диоктилового эфира себациновой кислоты), 1 ммоль·л-1 дицетилфосфата натрия, 16 мг красителя общей формулы (I) с противоионами I- или ClO4 -. В полученных композитных пленках в присутствии катионов кальция не было обнаружено существенного влияния ионофора дицетилфосфата натрия на квантовый выход и сдвиг флуоресценции красителя. Поэтому в качестве рабочего варианта для приготовления пленок могут быть использованы растворы, не содержащие дицетилфосфата натрия.
В качестве подложки для приготовления пленок использовали кварцевые пластины размерами 20×13×1.3 мм. Пластины отмывали свежеприготовленной хромовой смесью с последующим многократным промыванием бидистиллированной водой. На подготовленную поверхность пластины, вращающейся на горизонтальном роторе центрифуги со скоростью 2000 об/мин, наносили 50 мкл пленкообразующего раствора в течение не более 0.5 с. Образовавшуюся пленку высушивали на воздухе в течение 30 мин. Дальнейшее увеличение времени высушивания не приводило к изменению параметров пленки. Толщина пленки, измеренная путем взвешивания, составляла 1-2 мкм.
Полученные пленки, содержащие заявленные красители общей формулы (I), были исследованы в качестве ион-селективных оптических материалов для определения ионов Ca2+. Определение катионов кальция проводили методами флуоресценции и спектрофотометрии. В случае флуоресцентной регистрации кварцевую пластину с нанесенной пленкой помещали в стандартную флуорометрическую кювету с длиной оптического пути 10 мм по диагонали. Кювету располагали в держателе таким образом, чтобы угол падения возбуждающего луча составлял 60 градусов с поверхностью пленки, при этом пленка находилась на стороне пластины, обращенной в направлении возбуждающего света. В кювету вводили раствор соли кальция в концентрации, соответствующей физиологической концентрации кальция в плазме крови - 2.5 ммоль·л-1 и в меньших концентрациях в диапазоне 0.25-2.5 ммоль·л-1. После добавления исследуемого раствора через определенные интервалы времени записывали спектры флуоресценции при возбуждении на длине волны 403 нм. В отсутствие катионов кальция наблюдается флуоресценция от хемосенсорной пленки с максимумом около 610 нм. В присутствии катионов кальция происходит коротковолновый сдвиг максимума флуоресценции, достигающий 60 нм при концентрации 2.5 ммоль·л-1. Выход на стационарное значение спектров флуоресценции и поглощения происходит экспоненциально с характерным временем 15 мин. При уменьшении концентрации катионов кальция спектр флуоресценции становится асимметричным вследствие того, что он состоит из двух сигналов: свободного (не связанного в комплекс) красителя и комплексов красителя с катионами кальция. Разложение этого сигнала на составляющие позволяет определить долю комплекса и тем самым концентрацию комплексов в растворе. Калибровочные зависимости величины сдвигов максимумов поглощения и флуоресценции от концентрации катионов кальция позволяют определять эти ионы в интервале концентраций 0.25-2.5 ммоль·л-1.
Таким образом, получен новый тип азакраунсодержащих стириловых красителей - N-алкилазакраунсодержащие стириловые красители, содержащие неизвестное ранее сочетание фрагментов стирилового красителя и моноазакраун-эфира, конденсированных таким образом, что атом азота макрогетероцикла находится в сопряжении с бензольным циклом и в пара-положении к этиленовой группе и обнаружена их ярко выраженная способность к селективному связыванию катионов щелочных и щелочноземельных металлов как в апротонной, так и в водной среде, в том числе в составе полимерных матриц, характеризующаяся существенными изменениями в спектрах поглощения и испускания. Эти свойства позволяют использовать заявленные соединения в составе оптических хемосенсоров для колориметрического и люминесцентного определения катионов щелочных и щелочноземельных металлов, например, в составе полимерных пленок, мембран и ультратонких пленок для определения микроколичеств указанных ионов в биологических жидкостях, в том числе в плазме крови, а также для определения микроколичеств указанных ионов в промышленных водах и стоках, в том числе для мониторинга окружающей среды. Разработан также способ получения заявленных соединений высокой степени чистоты и с хорошими выходами (до 89%).
Claims (4)
1. N-Алкилазакраунсодержащие стириловые красители общей формулы I
в которой A+ - гетероциклический остаток формулы (II) или (III):
где R1-R4 - атом водорода, низший алкил, низшая алкоксильная группа или два заместителя R1 и R2 или R3 и R4 вместе составляют С4Н4-бензогруппу;
R5 - алкил;
Q - атом серы, группа CH=CH;
Е в формуле (I) = Cl, Br, I, ClO4, PF6, BF4, TsO, CH3SO3, CF3SO3, CH3OSO3;
В в формуле (I) - фрагмент N-алкилбензоазакраунэфира формулы (IV)
где R6 - низший алкил;
n=0-3;
причем макроцикл в составе N-алкилазакраунсодержащих стириловых красителей содержит один атом азота, находящийся в сопряжении с бензольным кольцом и в пара-положении к этиленовой группе.
в которой A+ - гетероциклический остаток формулы (II) или (III):
где R1-R4 - атом водорода, низший алкил, низшая алкоксильная группа или два заместителя R1 и R2 или R3 и R4 вместе составляют С4Н4-бензогруппу;
R5 - алкил;
Q - атом серы, группа CH=CH;
Е в формуле (I) = Cl, Br, I, ClO4, PF6, BF4, TsO, CH3SO3, CF3SO3, CH3OSO3;
В в формуле (I) - фрагмент N-алкилбензоазакраунэфира формулы (IV)
где R6 - низший алкил;
n=0-3;
причем макроцикл в составе N-алкилазакраунсодержащих стириловых красителей содержит один атом азота, находящийся в сопряжении с бензольным кольцом и в пара-положении к этиленовой группе.
2. Способ получения азакраунсодержащих стириловых красителей формулы (I) по п.1, отличающийся тем, что он включает взаимодействие четвертичных солей метильных производных гетероциклических оснований формул (V) или (VI):
в которых R1-R5, Q и Е имеют указанные в п.1 значения, а Е может совпадать или не совпадать с Е в формуле (I) по п.1,
с формильными производными N-алкилбензоазакраунэфиров формулы (VII)
где R6 и n имеют указанные в п.1 значения.
в которых R1-R5, Q и Е имеют указанные в п.1 значения, а Е может совпадать или не совпадать с Е в формуле (I) по п.1,
с формильными производными N-алкилбензоазакраунэфиров формулы (VII)
где R6 и n имеют указанные в п.1 значения.
3. Способ по п.2, отличающийся тем, что процесс проводят в присутствии органического основания.
4. Композитные пленочные материалы, проявляющие оптические хемосенсорные свойства по отношению к катионам щелочных и щелочноземельных металлов, включающие полимерную матрицу, пластификатор, ионофор и азакраунсодержащий стириловый краситель, отличающиеся тем, что в качестве красителя они содержат азакраунсодержащий стириловый краситель формулы (I) по п.1.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2008141677/04A RU2398800C2 (ru) | 2008-10-23 | 2008-10-23 | N-алкилазакраунсодержащие стириловые красители в качестве оптических молекулярных сенсоров для определения катионов щелочных и щелочноземельных металлов и способ их получения |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2008141677/04A RU2398800C2 (ru) | 2008-10-23 | 2008-10-23 | N-алкилазакраунсодержащие стириловые красители в качестве оптических молекулярных сенсоров для определения катионов щелочных и щелочноземельных металлов и способ их получения |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2008141677A RU2008141677A (ru) | 2010-04-27 |
| RU2398800C2 true RU2398800C2 (ru) | 2010-09-10 |
Family
ID=42672099
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2008141677/04A RU2398800C2 (ru) | 2008-10-23 | 2008-10-23 | N-алкилазакраунсодержащие стириловые красители в качестве оптических молекулярных сенсоров для определения катионов щелочных и щелочноземельных металлов и способ их получения |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU2398800C2 (ru) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2543881C1 (ru) * | 2013-08-02 | 2015-03-10 | Федеральное государственное бюджетное учреждение науки Институт элементоорганических соединений им. А.Н. Несмеянова Российской академии наук (ИНЭОС РАН) | Хемосенсорный композитный материал для определения катионов меди (ii) и композиция для его получения |
| RU2644894C2 (ru) * | 2016-04-14 | 2018-02-14 | Федеральное государственное бюджетное учреждение науки Институт неорганической химии им. А.В. Николаева Сибирского отделения Российской академии наук | Люминесцентный детектор катионов щелочных металлов |
| RU2781790C1 (ru) * | 2021-12-09 | 2022-10-18 | Федеральное государственное учреждение "Федеральный научно-исследовательский центр "Кристаллография и фотоника" Российской академии наук" | Бис-N-метилазакраунсодержащие диеноны в качестве оптических молекулярных сенсоров для определения катионов щелочных, щелочноземельных металлов, аммония и способ их получения |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2012574C1 (ru) * | 1991-02-11 | 1994-05-15 | Громов Сергей Пантелеймонович | 18(15)-краун-6(5)-содержащие стириловые красители в качестве селективных реагентов на катионы аммония, щелочных или щелочноземельных металлов и способ их получения |
| RU2176256C1 (ru) * | 2000-04-28 | 2001-11-27 | Громов Сергей Пантелеймонович | Тиакраунсодержащие стириловые красители в качестве селективных сенсоров на катионы тяжелых или переходных металлов и способ их получения |
| RU2278134C1 (ru) * | 2005-03-10 | 2006-06-20 | Сергей Пантелеймонович Громов | Краунсодержащие стириловые красители с аммонийной группой в n-заместителе гетероциклического остатка в качестве фото- и термочувствительных соединений и способы их получения |
-
2008
- 2008-10-23 RU RU2008141677/04A patent/RU2398800C2/ru not_active IP Right Cessation
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2012574C1 (ru) * | 1991-02-11 | 1994-05-15 | Громов Сергей Пантелеймонович | 18(15)-краун-6(5)-содержащие стириловые красители в качестве селективных реагентов на катионы аммония, щелочных или щелочноземельных металлов и способ их получения |
| RU2176256C1 (ru) * | 2000-04-28 | 2001-11-27 | Громов Сергей Пантелеймонович | Тиакраунсодержащие стириловые красители в качестве селективных сенсоров на катионы тяжелых или переходных металлов и способ их получения |
| RU2278134C1 (ru) * | 2005-03-10 | 2006-06-20 | Сергей Пантелеймонович Громов | Краунсодержащие стириловые красители с аммонийной группой в n-заместителе гетероциклического остатка в качестве фото- и термочувствительных соединений и способы их получения |
Non-Patent Citations (1)
| Title |
|---|
| GROMOV S.P. et al. J. Org. Chem., 2003, 68, p.6115. YAMADA S. et al. J. Am. Chem. Soc., 2007, 129, p.12100. * |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2543881C1 (ru) * | 2013-08-02 | 2015-03-10 | Федеральное государственное бюджетное учреждение науки Институт элементоорганических соединений им. А.Н. Несмеянова Российской академии наук (ИНЭОС РАН) | Хемосенсорный композитный материал для определения катионов меди (ii) и композиция для его получения |
| RU2644894C2 (ru) * | 2016-04-14 | 2018-02-14 | Федеральное государственное бюджетное учреждение науки Институт неорганической химии им. А.В. Николаева Сибирского отделения Российской академии наук | Люминесцентный детектор катионов щелочных металлов |
| RU2781790C1 (ru) * | 2021-12-09 | 2022-10-18 | Федеральное государственное учреждение "Федеральный научно-исследовательский центр "Кристаллография и фотоника" Российской академии наук" | Бис-N-метилазакраунсодержащие диеноны в качестве оптических молекулярных сенсоров для определения катионов щелочных, щелочноземельных металлов, аммония и способ их получения |
Also Published As
| Publication number | Publication date |
|---|---|
| RU2008141677A (ru) | 2010-04-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Huang et al. | A bright water-compatible sugar-rhodamine fluorescence sensor for selective detection of Hg 2+ in natural water and living cells | |
| Chen et al. | Highly sensitive detection of low-level water content in organic solvents and cyanide in aqueous media using novel solvatochromic AIEE fluorophores | |
| Kandemir et al. | Novel fluorescent coumarin-thiazole based sensors for selective determination of cyanide in aqueous media | |
| Yao et al. | A smart two-photon fluorescent platform based on desulfurization–cyclization: a phthalimide–rhodamine chemodosimeter for Hg 2+ NIR emission at 746 nm and through-bond energy transfer | |
| Meng et al. | A new fluorescent chemosensor for highly selective and sensitive detection of inorganic phosphate (Pi) in aqueous solution and living cells | |
| Lv et al. | A novel coumarin-benzopyrylium based near-infrared fluorescent probe for Hg2+ and its practical applications | |
| CN107417671B (zh) | 一种含喹啉取代的香豆素衍生物及其制备方法和在比率型pH荧光探针上的应用 | |
| EP0623599A1 (de) | Optischer Sensor zur Bestimmung von Kationen | |
| Čipor et al. | Structure-dependent mitochondria or lysosome-targeting styryl fluorophores bearing remarkable Stokes shift | |
| CN113200988B (zh) | 同时检测羟基自由基和粘度的双功能荧光探针的合成与应用 | |
| RU2398800C2 (ru) | N-алкилазакраунсодержащие стириловые красители в качестве оптических молекулярных сенсоров для определения катионов щелочных и щелочноземельных металлов и способ их получения | |
| CN112194614B (zh) | 一种特异性识别Fe3+的三联吡啶荧光探针及其合成方法和应用 | |
| Wang et al. | An Hg 2+-selective chemosensor based on the self-assembly of a novel amphiphilic block copolymer bearing rhodamine 6G derivative moieties in purely aqueous media | |
| CN103232466A (zh) | 4-羟基取代苯基亚胺型罗丹明6g荧光分子探针的制备方法与用途 | |
| CN1087744C (zh) | 一种钌(ⅱ)多吡啶配合物及其制备方法 | |
| Liepouri et al. | Iminocoumarin-based low affinity fluorescent Ca2+ indicators excited with visible light | |
| Wang et al. | 1, 4-Dihydroxyanthraquinone–Cu 2+ ensemble probe for selective detection of sulfide anion in aqueous solution | |
| RU2389745C2 (ru) | Хемосенсорные оптоматериалы для определения катионов металлов большого ионного радиуса и ионов диаммония на основе краунсодержащих бисстириловых красителей, иммобилизованных в полимерные пленки, и способы их получения | |
| RU2012574C1 (ru) | 18(15)-краун-6(5)-содержащие стириловые красители в качестве селективных реагентов на катионы аммония, щелочных или щелочноземельных металлов и способ их получения | |
| RU2176256C1 (ru) | Тиакраунсодержащие стириловые красители в качестве селективных сенсоров на катионы тяжелых или переходных металлов и способ их получения | |
| Xu et al. | Highly selective and sensitive optical probe for Fe 3+ based on a water-soluble squarylium dye | |
| Erk et al. | The synthesis of novel crown ethers. Part IV. Coumarin derivatives of [18] crown-6 and cation binding from fluorescence spectra | |
| RU2292368C1 (ru) | Оптические сенсорные материалы на катионы тяжелых и переходных металлов на основе дитиакраунсодержащих бутадиенильных красителей и способы их получения | |
| CN113004206B (zh) | 一种萘衍生物类荧光探针及其制备方法和应用 | |
| Panchenko et al. | Hybrid sensor materials based on tin (IV) oxide and crown-containing 4-amino-1, 8-naphthalimides |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20141024 |