RU2353622C2 - Novel fusidic acid derivatives - Google Patents
Novel fusidic acid derivatives Download PDFInfo
- Publication number
- RU2353622C2 RU2353622C2 RU2006104712/04A RU2006104712A RU2353622C2 RU 2353622 C2 RU2353622 C2 RU 2353622C2 RU 2006104712/04 A RU2006104712/04 A RU 2006104712/04A RU 2006104712 A RU2006104712 A RU 2006104712A RU 2353622 C2 RU2353622 C2 RU 2353622C2
- Authority
- RU
- Russia
- Prior art keywords
- compound
- acid
- fusidic acid
- bromo
- deacetoxy
- Prior art date
Links
Abstract
Description
Область техники, к которой относится изобретениеFIELD OF THE INVENTION
Настоящее изобретение относится к новым производным фузидовой кислоты, фармацевтическим композициям, содержащим указанные производные, а также их применению в терапии.The present invention relates to new derivatives of fusidic acid, pharmaceutical compositions containing these derivatives, as well as their use in therapy.
Уровень техникиState of the art
Фузидовая кислота относится к фузиданам, которые представляют собой небольшое семейство природных антибиотиков.Fusidic acid refers to fusidans, which are a small family of natural antibiotics.
Фузиданы объединяет наличие тетрациклиновой кольцевой системы с уникальной конформацией по типу «кресло-лодка-кресло», которая отличает их от стероидов. В этой связи, несмотря на некоторое структурное сходство со стероидами, а именно: наличие тетрациклической системы, фузиданы не проявляют какой-либо гормональной активности. Кроме того, фузиданы имеют одинаковую боковую цепь, содержащую карбоновую кислоту, которая присоединена к кольцевой системе в положении С-17 за счет двойной связи, и ацетатную группу, присоединенную в положении С-16. Фузидовая кислота в качестве продукта ферментации Fusidium coccineum представляет собой наиболее мощный антибиотик среди фузидановых соединений и является единственным фузиданом, который нашел клиническое применение при лечении инфекционных заболеваний. Фузидовая кислота (Фуцидин® (Fucidin®)) используется в клинической практике при лечении тяжелых стафилококковых инфекций, в частности, инфекции костей и суставов как в случае острой, так и трудноизлечимой формы заболевания (The Use of Antibiotics, 5th Ed., A. Kucers and N. Mck. Bennett (Eds.), Butterworth 1997, p. 580-587; и содержащиеся в работе ссылки). Несмотря на то, что фузидовая кислота представляет собой чаще всего используемый препарат против стафилококков, она также используется как средство борьбы с некоторыми другими грамположительными видами микроорганизмов. Клиническая значимость фузидовой кислоты также определяется ее эффективным распределением в различных тканях, низким уровнем токсичности и аллергических реакций, а также отсутствием перекрестной резистентности с другими клинически используемыми антибиотиками. Фузидовая кислота широко используется в местной терапии различных кожных и глазных инфекций, вызванных стафилококками. В основном, ее применяют в сочетании с традиционными антибиотиками, такими как пенициллины, эритромицины или клиндамицин. Она также используется как альтернатива ванкомицину для контроля Clostridium difficile.Fusidans combines the presence of a tetracycline ring system with a unique “chair-boat-chair” conformation, which distinguishes them from steroids. In this regard, despite some structural similarities with steroids, namely: the presence of a tetracyclic system, fusidans do not show any hormonal activity. In addition, fusidans have the same side chain containing carboxylic acid, which is attached to the ring system in position C-17 due to a double bond, and an acetate group attached in position C-16. Fusidic acid as a fermentation product of Fusidium coccineum is the most powerful antibiotic among fusidan compounds and is the only fusidan that has found clinical use in the treatment of infectious diseases. Fusidic acid (Fucidin® (Fucidin®)) is used in clinical practice in the treatment of severe staphylococcal infections, in particular, infections of bones and joints in both acute and intractable forms of the disease ( The Use of Antibiotics , 5 th Ed., A. Kucers and N. Mck. Bennett (Eds.), Butterworth 1997, p. 580-587; and references cited therein). Despite the fact that fusidic acid is the most commonly used drug against staphylococci, it is also used as a means of combating some other gram-positive microorganisms. The clinical significance of fusidic acid is also determined by its effective distribution in various tissues, a low level of toxicity and allergic reactions, as well as the absence of cross-resistance with other clinically used antibiotics. Fusidic acid is widely used in local therapy of various skin and eye infections caused by staphylococci. It is mainly used in combination with traditional antibiotics such as penicillins, erythromycins or clindamycin. It is also used as an alternative to vancomycin to control C lostridium difficile .
В сравнении со стафилококками некоторые другие грамположительные кокки зачастую проявляют меньшую чувствительность к фузидовой кислоте. Например, можно отметить, что разные виды стерптококков в целом до 100 раз менее чувствительны к фузидовой кислоте, чем стафилококки [Kuchers et al., supra]. Другие чувствительные бактерии включают грамположительные анаэробные кокки, такие как Peptococcus и Peptostreptococcus spp, аэробные или анаэробные грамположительные бактерии, такие как Corynebacterium diphtheriae, Clostridium tetani, Clostridium difficile и Clostridium perfringens. Грамотрицательные бактерии характеризуются резистентностью, за исключением Neisseria spp. и Legionella pneumophila. Данный лекарственный препарат обладает особой эффективностью как против внутриклеточных, так и внеклеточных M.leprae. Взаимосвязь структуры и активности (SAR) для фузидовой кислоты очень широко исследовалась и получено множество аналогов. Однако лишь несколько из указанных аналогов обладают активностью, сравнимой с активностью фузидовой кислоты. Несмотря на интенсивные и широкомасштабные исследования SAR, возможность модификаций боковой цепи изучалась не столь широко.Compared to staphylococci, some other gram-positive cocci often show less sensitivity to fusidic acid. For example, it can be noted that different types of sterptococci are generally up to 100 times less sensitive to fusidic acid than staphylococci [Kuchers et al., Supra ]. Other sensitive bacteria include gram-positive anaerobic cocci, such as Peptococcus and Peptostreptococcus spp, aerobic or anaerobic gram-positive bacteria, such as Corynebacterium diphtheriae, Clostridium tetani, Clostridium difficile and Clostridium perfringens . Gram-negative bacteria are resistant, with the exception of Neisseria spp. and Legionella pneumophila . This drug is particularly effective against both intracellular and extracellular M.leprae. The relationship between structure and activity (SAR) for fusidic acid has been extensively studied and many analogues have been obtained. However, only a few of these analogues have activity comparable to that of fusidic acid. Despite intensive and widespread SAR studies, the possibility of side chain modifications has not been studied extensively.
В сравнении с другими антибиотиками применение фузидовой кислоты не приводит к развитию серьезных клинических проблем, связанных с резистентностью к лекарственным препаратам [Turnidge, Int. J. Antimicro. Agents, 12, S35-S44, 1999]. Однако, как указывалось выше, это вещество само по себе обладает достаточно ограниченным спектром антибиотической активности, и, в этой связи, было бы желательно разработать новые аналоги фузидовой кислоты, которые бы обладали антибиотической активностью в отношении более широкого спектра патогенных микроорганизмов и, в частности, стрептококков.Compared to other antibiotics, the use of fusidic acid does not lead to the development of serious clinical problems associated with drug resistance [Turnidge, Int. J. Antimicro. Agents , 12, S35-S44, 1999]. However, as mentioned above, this substance itself has a rather limited spectrum of antibiotic activity, and, in this regard, it would be desirable to develop new analogues of fusidic acid that would have antibiotic activity against a wider range of pathogenic microorganisms and, in particular, streptococcus.
Ранее предпринимались попытки улучшить терапевтические свойства фузидана за счет изменения структуры боковой цепи. Так, в документе WO 02/070537 описываются производные фузидовой кислоты, в которых двойная связь С17-С20 была преобразована в циклопропановый фрагмент за счет введения метиленовой группы.Previously, attempts were made to improve the therapeutic properties of fusidan by changing the structure of the side chain. Thus, document WO 02/070537 describes derivatives of fusidic acid in which the C17-C20 double bond was converted to a cyclopropane fragment by introducing a methylene group.
В документе WO 01/29061 описываются производные фузидовой кислоты с насыщенной двойной связью С17-С20.WO 01/29061 describes fusidic acid derivatives with a saturated C17-C20 double bond.
Краткое описание сущности изобретенияSUMMARY OF THE INVENTION
Авторы настоящего изобретения неожиданно обнаружили, что производные фузидовой кислоты, в которых положение С-24 замещено, сохраняют активность против стафилококков и существенно повышают активность в отношении стрептококков. Таким образом, настоящее изобретение относится к соединениям общей формулы I:The authors of the present invention unexpectedly found that derivatives of fusidic acid, in which the position of C-24 is substituted, retain activity against staphylococci and significantly increase activity against streptococci. Thus, the present invention relates to compounds of the general formula I:
где Х обозначает галоген, трифторметил, циано, азидо, алкил, алкенил или арил, где указанные алкил, алкенил или арил необязательно замещены одним или более, одинаковыми или различными, заместителями, выбранными из группы, состоящей из алкила, алкенила, арила, алкокси, нитро, алкилтио, галогена, азидо, трифторметила и циано;where X is halogen, trifluoromethyl, cyano, azido, alkyl, alkenyl or aryl, wherein said alkyl, alkenyl or aryl are optionally substituted with one or more, same or different, substituents selected from the group consisting of alkyl, alkenyl, aryl, alkoxy, nitro, alkylthio, halogen, azido, trifluoromethyl and cyano;
Y и Z, оба, обозначают водород или вместе со связью С-17/С-20 образуют двойную связь между С-17 и С-20 или вместе представляют собой метилен и образуют циклопропановое кольцо в сочетании с С-17 и С-20;Y and Z both represent hydrogen or together with the C-17 / C-20 bond form a double bond between C-17 and C-20 or together represent methylene and form a cyclopropane ring in combination with C-17 and C-20;
А обозначает связь, O, S или S(O);A is a bond, O, S or S (O);
B обозначает C1-6алкил, C2-6алкенил, C1-6ацил, C3-7циклоалкилкарбонил или бензоил, где все указанные группы необязательно замещены одним или более заместителями, выбранными из группы, состоящей из галогена, гидрокси, алкокси, арила, гетероарила и азидо, или, если А обозначает связь, то В может также обозначать водород;B is C 1-6 alkyl, C 2-6 alkenyl, C 1-6 acyl, C 3-7 cycloalkylcarbonyl or benzoyl, where all these groups are optionally substituted with one or more substituents selected from the group consisting of halogen, hydroxy, alkoxy , aryl, heteroaryl and azido, or, if A is a bond, then B can also be hydrogen;
Q1 и Q2 независимо обозначают -CH2-, -C(O)-, -(CHOH)-,Q 1 and Q 2 are independently —CH 2 -, —C (O) -, - (CHOH) -,
-(CHOR)-, -(CHSH)-, -(NH)-, -(CHNH2)- или -(CHW)-, где R обозначает C1-6 алкил и W обозначает галоген, циано, азидо или трифторметил;- (CHOR) -, - (CHSH) -, - (NH) -, - (CHNH 2 ) - or - (CHW) -, where R is C 1-6 alkyl and W is halogen, cyano, azido or trifluoromethyl;
Q3 обозначает -CH2-, -C(O)- или -CHOH-;Q 3 is —CH 2 -, —C (O) - or —CHOH—;
G обозначает водород, OH или O-CO-CH3;G is hydrogen, OH or O — CO — CH 3 ;
две связи в пентациклическом кольце, показанные сплошными и прерывистыми линиями, указывают на то, что любая из этих двух связей может представлять собой двойную связь, и в этом случае Y отсутствует, а Z обозначает водород;two bonds in the pentacyclic ring, shown by solid and broken lines, indicate that either of these two bonds can be a double bond, in which case Y is absent and Z is hydrogen;
связь между С-1 и С-2 может представлять собой одинарную или двойную связь;the bond between C-1 and C-2 may be a single or double bond;
и к фармацевтически приемлемым солям и легко гидролизуемым сложным эфирам указанных соединений.and pharmaceutically acceptable salts and readily hydrolyzable esters of these compounds.
В другом аспекте настоящее изобретение относится к соединениям общей формулы I, применяемым в терапии, и, конкретно, к фармацевтической композиции, включающей соединение формулы I вместе с фармацевтически приемлемым эксципиентом или носителем.In another aspect, the present invention relates to compounds of general formula I used in therapy, and more particularly, to a pharmaceutical composition comprising a compound of formula I together with a pharmaceutically acceptable excipient or carrier.
В другом аспекте настоящее изобретение относится к способу лечения, предотвращения или ослабления инфекции, где указанный способ включает введение эффективного количества соединений формулы I пациенту при необходимости такого введения.In another aspect, the present invention relates to a method for treating, preventing or ameliorating infection, wherein said method comprises administering an effective amount of compounds of formula I to a patient, if necessary.
В еще одном аспекте настоящее изобретение относится к применению соединения формулы I для производства лекарственного средства для предотвращения, лечения, ослабления или профилактики инфекций.In another aspect, the present invention relates to the use of a compound of formula I for the manufacture of a medicament for the prevention, treatment, amelioration, or prevention of infections.
В еще одном аспекте настоящее изобретение относится к применению соединения формулы I для регулирования микробного роста и для предотвращения или профилактики бактериальных инфекций при разведении животных.In another aspect, the present invention relates to the use of a compound of formula I for regulating microbial growth and for preventing or preventing bacterial infections in breeding animals.
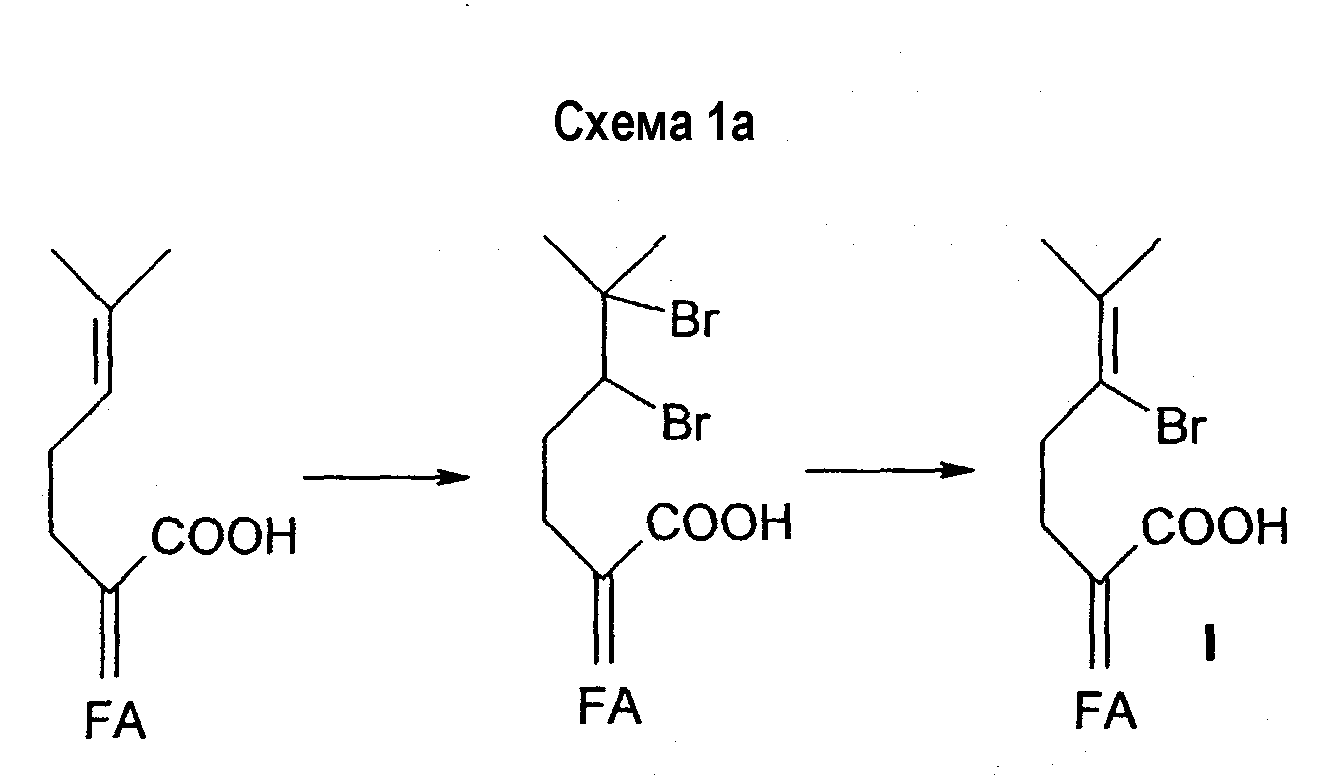
В еще одном аспекте настоящее изобретение относится к способу получения соединения формулы IaIn another aspect, the present invention relates to a method for producing a compound of formula Ia
где Х обозначает бром, Y и Z, оба, обозначают водород или вместе со связью С-17/С-20 образуют двойную связь между С-17 и С-20 или вместе представляют собой метилен и образуют циклопропановое кольцо в сочетании с С-17 и С-20; А обозначает связь, O, S или S(O); B обозначает C1-6алкил, C2-6алкенил, C1-6ацил, C3-7циклоалкилкарбонил или бензоил, где все указанные группы могут быть необязательно замещены одним или более заместителями, выбранными из группы, состоящей из галогена, гидрокси, C1-6алкокси, арила, гетероциклила или азидо, или, если А обозначает связь, то В может также обозначать водород; Q1 и Q2 независимо обозначают -C(O)-, -(CHOH)-, -(CHSH)- или -(CHW)-, где W обозначает галоген, циано, азидо и трифторметил, включающему:where X is bromo, Y and Z are both hydrogen or, together with the C-17 / C-20 bond, form a double bond between C-17 and C-20 or together represent methylene and form a cyclopropane ring in combination with C-17 and C-20; A is a bond, O, S or S (O); B is C 1-6 alkyl, C 2-6 alkenyl, C 1-6 acyl, C 3-7 cycloalkylcarbonyl or benzoyl, where all these groups may optionally be substituted with one or more substituents selected from the group consisting of halogen, hydroxy , C 1-6 alkoxy, aryl, heterocyclyl or azido, or, if A is a bond, then B can also be hydrogen; Q 1 and Q 2 independently represent —C (O) -, - (CHOH) -, - (CHSH) - or - (CHW) -, where W is halogen, cyano, azido and trifluoromethyl, including:
(а) растворение фузидовой кислоты или подходящего аналога фузидовой кислоты в соответствующем органическом растворителе с последующей обработкой бромом с получением 24,25-дибромного промежуточного соединения общей структуры Ib:(a) dissolving fusidic acid or a suitable fusidic acid analogue in an appropriate organic solvent, followed by bromine treatment to give a 24.25-dibromic intermediate of general structure Ib:
где Х и Х' обозначают бром, R обозначает водород, связь между С-24 и С-25 представляет собой одинарную связь и Y, Z, A, B, Q1 и Q2 определены выше;where X and X 'are bromo, R is hydrogen, the bond between C-24 and C-25 is a single bond and Y, Z, A, B, Q 1 and Q 2 are as defined above;
(b) обработку раствора 24,25-дибромного промежуточного соединения в подходящем растворителе в присутствии подходящего основания с получением дегидробромированного соединения формулы Ia в виде соли и(b) treating a solution of the 24.25-dibromic intermediate in a suitable solvent in the presence of a suitable base to give a dehydrobrominated compound of formula Ia as a salt; and
(с) контактирование соли, образованной на стадии (b), с кислотой с получением соединения формулы Ia в виде свободной кислоты.(c) contacting the salt formed in step (b) with an acid to give a compound of formula Ia as a free acid.
В еще одном аспекте настоящее изобретение относится к соединению общей структуры Ib:In another aspect, the present invention relates to a compound of general structure Ib:
где Х и Х' обозначают бром, R обозначает водород, связь между С-24 и С-25 представляет собой одинарную связь, Y и Z, оба, обозначают водород или вместе со связью С-17/С-20 образуют двойную связь между С-17 и С-20 или вместе представляют собой метилен и образуют циклопропановое кольцо в сочетании с С-17 и С-20; А обозначает связь, O, S или S(O); B обозначает C1-6алкил, C2-6алкенил, C1-6ацил, C3-7циклоалкилкарбонил или бензоил, где все указанные группы необязательно замещены одним или более заместителями, выбранными из группы, состоящей из галогена, гидрокси, C1-6алкокси, арила, гетероциклила и азидо, или, если А обозначает связь, то В может также обозначать водород; Q1 и Q2 независимо обозначают -C(O)-, -(CHOH)-, -(CHSH)- или -(CHW)-, где W обозначает галоген, циано, азидо или трифторметил.where X and X 'are bromo, R is hydrogen, the bond between C-24 and C-25 is a single bond, Y and Z are both hydrogen or together with C-17 / C-20 form a double bond between C -17 and C-20 or together represent methylene and form a cyclopropane ring in combination with C-17 and C-20; A is a bond, O, S or S (O); B is C 1-6 alkyl, C 2-6 alkenyl, C 1-6 acyl, C 3-7 cycloalkylcarbonyl or benzoyl, where all these groups are optionally substituted with one or more substituents selected from the group consisting of halogen, hydroxy, C 1-6 alkoxy, aryl, heterocyclyl and azido, or, if A is a bond, then B may also be hydrogen; Q 1 and Q 2 are independently —C (O) -, - (CHOH) -, - (CHSH) - or - (CHW) -, where W is halogen, cyano, azido or trifluoromethyl.
Подробное описание изобретенияDETAILED DESCRIPTION OF THE INVENTION
ОпределенияDefinitions
В контексте настоящего описания термин "алкил" обозначает одновалентный радикал, полученный из алкана при удалении атома водорода от любого атома углерода, и охватывает подклассы первичных, вторичных и третичных алкильных групп, включая, например, С1-С12 алкил, такой как C1-С8 алкил, такой как С1-С6 алкил, такой как С1-С4 алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, нонил, додеканил, циклопропил, циклопропилметил, циклобутил, циклопентил и циклогексил. Алкан относится к ациклическому или циклическому, разветвленному или неразветвленному насыщенному углеводороду и, в этой связи, полностью состоит из атомов водорода и атомов углерода.In the context of the present description, the term "alkyl" means a monovalent radical derived from alkane by removing a hydrogen atom from any carbon atom, and encompasses subclasses of primary, secondary and tertiary alkyl groups, including, for example, C 1 -C 12 alkyl, such as C 1 - C 8 alkyl, such as C 1 -C 6 alkyl, such as C 1 -C 4 alkyl, methyl, ethyl, n-propyl, isopropyl, n-butyl, isobutyl, sec-butyl, tert-butyl, pentyl, hexyl , nonyl, dodecanyl, cyclopropyl, cyclopropylmethyl, cyclobutyl, cyclopentyl and cyclohexyl. Alkane refers to an acyclic or cyclic, branched or unbranched saturated hydrocarbon and, in this regard, is completely composed of hydrogen atoms and carbon atoms.
Термин "алкенил" в контексте настоящего описания обозначает линейный или разветвленный ациклический углеводород, содержащий одну или несколько двойных углерод-углеродных связей в стереохимии Е или Z, что приемлемо. Данный термин включает, например, С2-С12алкенил, С2-С8алкенил, С2-С6алкенил, винил, аллил, 1-бутенил, 2-бутенил и 2-метил-2-пропенил.The term "alkenyl" in the context of the present description refers to a linear or branched acyclic hydrocarbon containing one or more carbon-carbon double bonds in the stereochemistry of E or Z, which is acceptable. The term includes, for example, C 2 -C 12 alkenyl, C 2 -C 8 alkenyl, C 2 -C 6 alkenyl, vinyl, allyl, 1-butenyl, 2-butenyl and 2-methyl-2-propenyl.
Термин "ацил" в контексте настоящего описания обозначает радикал формулы -CO-R, где R обозначает алкил, определенный выше, например, С1-С6ацил, такой как ацил, пропионил, бутирил или пивалоил.The term “acyl” as used herein refers to a radical of the formula —CO — R, where R is alkyl as defined above, for example, C 1 -C 6 acyl such as acyl, propionyl, butyryl or pivaloyl.
Термин "алкокси" в контексте настоящего описания обозначает радикал формулы -O-R, где R обозначает алкил, определенный выше, например, С1-С5алкокси, С1-С3алкокси, метокси, н-пропокси, трет-бутокси и т.п.The term “alkoxy” as used herein means a radical of the formula —OR, where R is alkyl as defined above, for example, C 1 -C 5 alkoxy, C 1 -C 3 alkoxy, methoxy, n-propoxy, tert-butoxy, etc. P.
Термин "галоген" обозначает представителя седьмой основной группы периодической системы элементов, например, фтор, хлор, бром и йод.The term "halogen" means a representative of the seventh main group of the periodic system of elements, for example, fluorine, chlorine, bromine and iodine.
Термин "циклоалкилкарбонил" в контексте настоящего описания обозначает радикал формулы -C(O)-R', где R' обозначает циклический радикал, определенный выше.The term “cycloalkylcarbonyl” as used herein refers to a radical of the formula —C (O) —R ′, where R ′ is a cyclic radical as defined above.
Термин "арил" в контексте настоящего описания обозначает циклический радикал, необязательно конденсированный бициклический радикал, в котором все атомы кольца представляют углерод и в котором кольцо является ароматическим, или в случае конденсированной кольцевой системы по меньшей мере одно кольцо является ароматическим. Примеры арила включают фенил, нафтил и тетралинил.The term “aryl” as used herein refers to a cyclic radical, an optionally fused bicyclic radical in which all ring atoms are carbon and in which the ring is aromatic, or in the case of a fused ring system, at least one ring is aromatic. Examples of aryl include phenyl, naphthyl and tetralinyl.
Термин "алкилтио" в контексте настоящего описания обозначает радикал формулы -S-R', где R' обозначает алкил, определенный выше.The term “alkylthio,” as used herein, refers to a radical of the formula —S — R ′, where R ′ is alkyl as defined above.
Термин "гетероарил" в контексте настоящего описания включает радикалы, представляющие собой гетероциклические ароматические кольца, которые включают 1-6 гетероатомов (выбранные из O, S и N) и 1-20 атомов углерода, такие как кольца, включающие 1-5 гетероатомов и 1-10 атомов углерода, такие как кольца, включающие 1-5 гетероатомов и 1-6 атомов углерода, такие как кольца, включающие 1-5 гетероатомов и 1-3 атомов углерода, в частности, 5- или 6-членные кольца с 1-4 гетероатомами, выбранными из O, S и N, или необязательно конденсированные бициклические кольца с 1-4 гетероатомами, где по меньшей мере одно кольцо является ароматическим, например, фуранил, пиридил, хинолил, изохинолил, индолил, тетразолил, тиазолил, имидазолил, пиразолил, оксазолил, изоксазолил, тиенил, пиразинил, изотиазолил, бензимидазолил и бензофуранил.The term “heteroaryl” as used herein includes heterocyclic aromatic ring radicals that include 1-6 heteroatoms (selected from O, S, and N) and 1-20 carbon atoms, such as rings containing 1-5 heteroatoms and 1 -10 carbon atoms, such as rings containing 1-5 heteroatoms and 1-6 carbon atoms, such as rings containing 1-5 heteroatoms and 1-3 carbon atoms, in particular 5- or 6-membered rings with 1- 4 heteroatoms selected from O, S and N, or optionally fused bicyclic rings with 1-4 get roatomami, wherein at least one ring is aromatic, for example, furanyl, pyridyl, quinolyl, isoquinolyl, indolyl, tetrazolyl, thiazolyl, imidazolyl, pyrazolyl, oxazolyl, isoxazolyl, thienyl, pyrazinyl, isothiazolyl, benzimidazolyl and benzofuranyl.
Выражение «легко гидролизуемые сложные эфиры» в контексте настоящего описания обозначает алканоилоксиалкильные, аралканоилоксиалкильные, ароилоксиалкильные, например, ацетоксиметильные, пивалоилоксиметильные, бензоилоксиметильные сложные эфиры и их соответствующие 1'-оксиэтильные производные, или алкоксикарбоноилоксиалкильные сложные эфиры, например, метоксикарбонилоксиметильные сложные эфиры и этоксикарбонилоксиметильные сложные эфиры и их соответствующие 1'-оксиэтильные производные, или лактонильные сложные эфиры, например, фталидильные сложные эфиры или диалкиламиноалкильные сложные эфиры, например, диэтиламиноэтильные сложные эфиры. Выражение «легко гидролизуемые сложные эфиры» включает гидролизуемые in vivo сложные эфиры соединений по настоящему изобретению. Такие сложные эфиры могут быть получены с использованием способов, известных специалистам в данной области, см. патент GB No. 1 490 852, включенный в описание в качестве ссылки.The term “readily hydrolyzable esters” as used herein refers to alkanoyloxyalkyl, aralkanoyloxyalkyl, aroyloxyalkyl, for example, acetoxymethyl, pivaloyloxymethyl, benzoyloxymethyl esters and their corresponding 1'-hydroxyethyl derivatives, and alkoxycarbonyloxyalkyl ethers, for example and their corresponding 1'-hydroxyethyl derivatives, or lactonyl esters, for example, phthalidyl esters or dialkylaminoalkyl esters, for example diethylaminoethyl esters. The expression "readily hydrolyzable esters" includes in vivo hydrolyzable esters of the compounds of the present invention. Such esters can be prepared using methods known to those skilled in the art, see GB Patent No. 1,490,852, incorporated herein by reference.
Предпочтительные варианты соединений формулы IPreferred Variants of Compounds of Formula I
В предпочтительном варианте настоящее изобретение относится к соединениям общей формулы IaIn a preferred embodiment, the present invention relates to compounds of General formula Ia
где X обозначает галоген, трифторметил, циано, азидо, C1-7алкил, C2-9алкенил или арил, где указанные C1-6алкил, C2-9алкенил или арил необязательно замещены одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из C1-7алкила, C2-9алкенила, арила, C1-6алкокси, нитро, алкилтио, галогена, азидо, трифторметила или циано;where X is halogen, trifluoromethyl, cyano, azido, C 1-7 alkyl, C 2-9 alkenyl or aryl, wherein said C 1-6 alkyl, C 2-9 alkenyl or aryl are optionally substituted with one or more identical or different substituents, selected from the group consisting of C 1-7 alkyl, C 2-9 alkenyl, aryl, C 1-6 alkoxy, nitro, alkylthio, halogen, azido, trifluoromethyl or cyano;
Y и Z, оба, обозначают водород или вместе со связью С-17/С-20 образуют двойную связь между С-17 и С-20 или вместе представляют собой метилен и образуют циклопропановое кольцо в сочетании с С-17 и С-20;Y and Z both represent hydrogen or together with the C-17 / C-20 bond form a double bond between C-17 and C-20 or together represent methylene and form a cyclopropane ring in combination with C-17 and C-20;
А обозначает связь, O, S или S(O);A is a bond, O, S or S (O);
B обозначает C1-6алкил, C2-6алкенил, C1-6ацил, C3-7циклоалкилкарбонил или бензоил, где все указанные группы необязательно замещены одним или более заместителями, выбранными из группы, состоящей из галогена, гидрокси, C1-6алкокси, арила, гетероарила или азидо, или, если А обозначает связь, то В может также обозначать водород;B is C 1-6 alkyl, C 2-6 alkenyl, C 1-6 acyl, C 3-7 cycloalkylcarbonyl or benzoyl, where all these groups are optionally substituted with one or more substituents selected from the group consisting of halogen, hydroxy, C 1-6 alkoxy, aryl, heteroaryl or azido, or, if A is a bond, then B can also be hydrogen;
Q1 и Q2 независимо обозначают -C(O)-, -(CHOH)-, -(CHSH)- или -(CHW)-, где W обозначает галоген, циано, азидо или трифторметил;Q 1 and Q 2 are independently —C (O) -, - (CHOH) -, - (CHSH) - or - (CHW) -, where W is halogen, cyano, azido or trifluoromethyl;
и к их фармацевтически приемлемым солям или легко гидролизуемым сложным эфирам.and their pharmaceutically acceptable salts or readily hydrolyzable esters.
В предпочтительном варианте соединений формулы I, Ia или Ib Y и Z, оба, обозначают водород и имеют стереохимическую конфигурацию S как при C-17, так и при C-20.In a preferred embodiment of the compounds of formula I, Ia or Ib, Y and Z are both hydrogen and have a stereochemical configuration S both at C-17 and at C-20.
В другом предпочтительном варианте соединений формулы I, Ia или Ib Y и Z вместе представляют собой метилен и образуют циклопропановое кольцо в сочетании с C-17 и C-20, имея стереохимическую конфигурацию S как при C-17, так и при C-20.In another preferred embodiment of the compounds of formula I, Ia or Ib, Y and Z together represent methylene and form a cyclopropane ring in combination with C-17 and C-20, having a stereochemical configuration S both at C-17 and at C-20.
В другом предпочтительном варианте соединений формулы I, Ia или Ib Y и Z вместе со связью С-17/С-20 образуют двойную связь между С-17 и С-20. Наиболее предпочтительная конфигурация двойной связи между С-17 и С-20 такая же, как и в фузидовой кислоте.In another preferred embodiment of the compounds of formula I, Ia or Ib, Y and Z together with the C-17 / C-20 bond form a double bond between C-17 and C-20. The most preferred double bond configuration between C-17 and C-20 is the same as in fusidic acid.
В еще одном предпочтительном варианте Х обозначает хлор, бром, йод, фтор, метил, этил, пропил, фенил, винил, пропенил, бутенил, пентенил, гексенил, гептенил, ноненил, бифенил или нафтил, где указанные метил, этил, пропил, фенил, винил, пропенил, бутенил, пентенил, гексенил, гептенил, ноненил, бифенил или нафтил необязательно замещены одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из фтора, хлора, брома, фенила, винила, циано, метокси, трифторметила, нитро, метилтио, бутила, метила, этила, пропила, бутила, пентила, гексила и гептила.In another preferred embodiment, X is chloro, bromo, iodo, fluoro, methyl, ethyl, propyl, phenyl, vinyl, propenyl, butenyl, pentenyl, hexenyl, heptenyl, nonenyl, biphenyl or naphthyl, wherein said methyl, ethyl, propyl, phenyl , vinyl, propenyl, butenyl, pentenyl, hexenyl, heptenyl, nonenyl, biphenyl or naphthyl are optionally substituted with one or more identical or different substituents selected from the group consisting of fluoro, chloro, bromo, phenyl, vinyl, cyano, methoxy, trifluoromethyl, nitro, methylthio, butyl, methyl, ethyl, propyl, butyl, foam tyla, hexyl and heptyl.
В конкретном предпочтительном варианте Х обозначает фтор, хлор, бром, йод, трифторметил, фенил, 4-бромфенил, 4-хлорфенил, 3,5-дифторфенил, транс-1-гексен-1-ил, транс-1-бутен-3,3-диметил-1-ил, транс-1-нонен-1-ил, транс-5-хлор-1-пентен-1-ил, транс-2-фенил-1-винил, 2-фенил-1-этил, 4-н-пропилфенил, 4-винилфенил, 4-трет-бутилфенил, 4-цианофенил, 3-бифенил, 4-(трифторметил)фенил, 4-метоксифенил, 3-цианофенил, 2-метоксифенил, 3-нитрофенил, 3-бромфенил, 4-(метилтио)фенил, 2-нафтил, 3,5-бис-(трифторметил)фенил, 3,4-диметоксифенил или 3,5-дибромфенил.In a particular preferred embodiment, X is fluoro, chloro, bromo, iodo, trifluoromethyl, phenyl, 4-bromophenyl, 4-chlorophenyl, 3,5-difluorophenyl, trans -1-hexen-1-yl, trans -1-butene-3, 3-dimethyl-1-yl, trans -1-nonen-1-yl, trans- 5-chloro-1-penten-1-yl, trans -2-phenyl-1-vinyl, 2-phenyl-1-ethyl, 4-n-propylphenyl, 4-vinylphenyl, 4- tert- butylphenyl, 4-cyanophenyl, 3-biphenyl, 4- (trifluoromethyl) phenyl, 4-methoxyphenyl, 3-cyanophenyl, 2-methoxyphenyl, 3-nitrophenyl, 3-bromophenyl , 4- (methylthio) phenyl, 2-naphthyl, 3,5- bis - (trifluoromethyl) phenyl, 3,4-dimethoxyphenyl or 3,5-dibromophenyl.
Q1 и Q2 могут быть с успехом выбраны из группы, состоящей из -(CO)- и -(CHOH)-. Q1 может также с успехом представлять собой CHF, CHCl, CHBr, CHI, CHN3.Q 1 and Q 2 can be successfully selected from the group consisting of - (CO) - and - (CHOH) -. Q 1 can also successfully be CHF, CHCl, CHBr, CHI, CHN 3 .
Еще один вариант осуществления настоящего изобретения относится к соединениям формулы Ia, где Q1 и Q2, оба, обозначаютAnother embodiment of the present invention relates to compounds of formula Ia, wherein Q 1 and Q 2 are both
-(CHOH)-группу или один из Q1 и Q2 обозначает -(CO)-, или Q1 обозначает CHF, CHCl, CHBr, CHI или CHN3;- a (CHOH) group or one of Q 1 and Q 2 is - (CO) -, or Q 1 is CHF, CHCl, CHBr, CHI or CHN 3 ;
Х обозначает хлор, бром, йод, трифторметил, азидо или циано;X is chloro, bromo, iodo, trifluoromethyl, azido or cyano;
Z и Y вместе со связью С-17/С-20 образуют двойную связь между С-17 и С-20;Z and Y together with the C-17 / C-20 bond form a double bond between C-17 and C-20;
А обозначает O, S или S(O);A is O, S or S (O);
B обозначает C1-4алкильную группу, необязательно замещенную одним или более заместителями, выбранными из группы, состоящей из азидо, гидрокси, фтора, хлора и брома, или В обозначает С1-4ацильную группу или бензоильную группу, где обе указанные группы необязательно замещены одним или более атомами галогена, такими как, например, фтор и хлор.B is a C 1-4 alkyl group optionally substituted with one or more substituents selected from the group consisting of azido, hydroxy, fluoro, chloro and bromo; or B is a C 1-4 acyl group or a benzoyl group, where both of these groups are optional substituted with one or more halogen atoms, such as, for example, fluorine and chlorine.
Конкретно, в предпочтительном варианте А обозначает O или S(O).Specifically, in a preferred embodiment, A is O or S (O).
В еще одном предпочтительном варианте В обозначает ацил, метил, этил, пропил, бутил, пентил, пропенил или циклопентил, где все указанные группы необязательно замещены одним или более заместителями, выбранными из ряда, состоящего из метила, этила, пропила, бутила, фтора, винила, гидрокси, фенила, фурфурила и метокси.In yet another preferred embodiment, B is acyl, methyl, ethyl, propyl, butyl, pentyl, propenyl or cyclopentyl, where all of these groups are optionally substituted with one or more substituents selected from the group consisting of methyl, ethyl, propyl, butyl, fluorine, vinyl, hydroxy, phenyl, furfuryl and methoxy.
В конкретном предпочтительном варианте В обозначает ацетил, изопропил, этил, 2,2,2-трифторэтил, винил, 1-пентил, 2-метил-1-бутил, 3-метил-1-бутил, циклопентил, 2-гидроксиэтил, бензил, фурфурил, фенил, 2-фторэтил, 2-метоксиэтил, 2,2,2-трихлорэтил, 2-азидоэтил, 2-гидроксиэтил, пропил, трет-бутил, 1,3-дифтор-изопропил, пропионил, хлорацетил или трифторацетил.In a particular preferred embodiment, B is acetyl, isopropyl, ethyl, 2,2,2-trifluoroethyl, vinyl, 1-pentyl, 2-methyl-1-butyl, 3-methyl-1-butyl, cyclopentyl, 2-hydroxyethyl, benzyl, furfuryl, phenyl, 2-fluoroethyl, 2-methoxyethyl, 2,2,2-trichloroethyl, 2-azidoethyl, 2-hydroxyethyl, propyl, tert -butyl, 1,3-difluoro-isopropyl, propionyl, chloroacetyl or trifluoroacetyl.
В конкретном предпочтительном варианте Q1 или Q2 или оба, и Q1 и Q2, обозначают -(COH)-.In a particular preferred embodiment, Q 1 or Q 2, or both, and Q 1 and Q 2 are - (COH) -.
Когда Q1 и/или Q2 в формулах I, Ia или Ib обозначаютWhen Q 1 and / or Q 2 in the formulas I, Ia or Ib denote
-(COH)-, то стереохимическая конфигурация представляет собой предпочтительно 3α и 11α, соответственно.- (COH) -, then the stereochemical configuration is preferably 3α and 11α, respectively.
Конкретные примеры соединений по настоящему изобретению включают приведенные ниже соединения:Specific examples of the compounds of the present invention include the following compounds:
Натриевая соль 24-трифторметилфузидовой кислоты (соединение 101),24-trifluoromethylfusidic acid sodium salt (compound 101),
Пивалоилоксиметиловый сложный эфир 24-трифторметилфузидовой кислоты (соединение 102),24-trifluoromethylfusidic acid pivaloyloxymethyl ester (compound 102),
24-хлорфузидовая кислота (соединение 103),24-chlorofusidic acid (compound 103),
Пивалоилоксиметиловый сложный эфир 24-хлорфузидовой кислоты (соединение 104),24-chlorofusidic acid pivaloyloxymethyl ester (compound 104),
Натриевая соль 24-хлорфузидовой кислоты (соединение 105),24-chlorofusidic acid sodium salt (compound 105),
24-трифторметилфузидовая кислота (соединение 106),24-trifluoromethylfusidic acid (compound 106),
Ацетоксиметиловый сложный эфир 24-бромфузидовой кислоты (соединение 107),Acetoxymethyl ester of 24-bromofusidic acid (compound 107),
24-бромфузидовая кислота (соединение 108),24-bromofusidic acid (compound 108),
Натриевая соль 24-бромфузидовой кислоты (соединение 109),24-bromfusidic acid sodium salt (compound 109),
Пивалоилоксиметиловый сложный эфир 24-бромфузидовой кислоты (соединение 110),24-bromofusidic acid pivaloyloxymethyl ester (compound 110),
Ацетоксиметиловый сложный эфир 24-бром-16-деацетокси-16β-тиоацетилфузидовой кислоты (соединение 111),24-Bromo-16-deacetoxy-16β-thioacetylfusidic acid acetoxymethyl ester (compound 111),
24-бром-16-деацетокси-16β-изопропилтиофузидовая кислота (соединение 112),24-bromo-16-deacetoxy-16β-isopropylthiofusidic acid (compound 112),
24-бром-16-деацетокси-16β-изопропилсульфинилфузидовая кислота (соединение 113),24-bromo-16-deacetoxy-16β-isopropylsulfinylfusidic acid (compound 113),
24-бром-16-деацетокси-16β-тиоацетилфузидовая кислота (соединение 114),24-bromo-16-deacetoxy-16β-thioacetylfusidic acid (compound 114),
24-бром-17S,20S-дигидрофузидовая кислота (соединение 115),24-bromo-17S, 20S-dihydrofusidic acid (compound 115),
24-бром-16-деацетокси-16β-этоксифузидовая кислота (соединение 116),24-bromo-16-deacetoxy-16β-ethoxyfusidic acid (compound 116),
Ацетоксиметиловый сложный эфир 24-бром-16-деацетокси-16β-этоксифузидовой кислоты (соединение 117),24-Bromo-16-deacetoxy-16β-ethoxyfusidic acid acetoxymethyl ester (compound 117),
Ацетоксиметиловый сложный эфир 24-бром-16-деацетокси-16β-(2',2',2'-трифторэтокси)фузидовой кислоты (соединение 118),Acetoxymethyl ester 24-bromo-16-deacetoxy-16β- (2 ', 2', 2'-trifluoroethoxy) fusidic acid (compound 118),
24-бром-16-деацетокси-16β-(2',2',2'-трифторэтокси)фузидовая кислота (соединение 119),24-bromo-16-deacetoxy-16β- (2 ', 2', 2'-trifluoroethoxy) fusidic acid (compound 119),
Ацетоксиметиловый сложный эфир 24-бром-17S,20S-фузидовой кислоты (соединение 120),Acetoxymethyl ester 24-bromo-17S, 20S-fusidic acid (compound 120),
Ацетоксиметиловый сложный эфир 24-бром-17S,20S-метиленфузидовой кислоты (соединение 121),Acetoxymethyl ester 24-bromo-17S, 20S-methylenefusidic acid (compound 121),
24-бром-17S,20S-метиленфузидовая кислота (соединение 122),24-bromo-17S, 20S-methylenefusidic acid (compound 122),
3-дезокси-3β,24-дибромфузидовая кислота (соединение 123),3-deoxy-3β, 24-dibromofusidic acid (compound 123),
3α-азидо-24-бром-3-дезоксифузидовая кислота (соединение 124),3α-azido-24-bromo-3-deoxyfusidic acid (compound 124),
24-йодфузидовая кислота (соединение 125),24-iodofusidic acid (compound 125),
Ацетоксиметиловый сложный эфир 24-йодфузидовой кислоты (соединение 126),Acetoxymethyl ester of 24-iodofusidic acid (compound 126),
Пивалоилоксиметиловый сложный эфир 24-йодфузидовой кислоты (соединение 127),24-iodofusidic acid pivaloyloxymethyl ester (compound 127),
Пивалоилоксиметиловый сложный эфир 24-фенилфузидовой кислоты (соединение 136),24-phenylfusidic acid pivaloyloxymethyl ester (compound 136),
24-фенилфузидовая кислота (соединение 137),24-phenylfusidic acid (compound 137),
Пивалоилоксиметиловый сложный эфир 24-(4-бромфенил)фузидовой кислоты (соединение 138),24- (4-bromophenyl) fusidic acid pivaloyloxymethyl ester (compound 138),
24-(4-бромфенил)фузидовая кислота (соединение 139),24- (4-bromophenyl) fusidic acid (compound 139),
Пивалоилоксиметиловый сложный эфир 24-(4-хлорфенил)фузидовой кислоты (соединение 140),24- (4-chlorophenyl) fusidic acid pivaloyloxymethyl ester (compound 140),
24-(4-хлорфенил)фузидовая кислота (соединение 141),24- (4-chlorophenyl) fusidic acid (compound 141),
Пивалоилоксиметиловый сложный эфир 24-(3,5-дифторфенил)фузидовой кислоты (соединение 142),24- (3,5-difluorophenyl) fusidic acid pivaloyloxymethyl ester (compound 142),
24-(3,5-дифторфенил)фузидовая кислота (соединение 143),24- (3,5-difluorophenyl) fusidic acid (compound 143),
Ацетоксиметиловый сложный эфир 3-дезокси-3β,24-дибромфузидовой кислоты (соединение 144),3-Deoxy-3β, 24-dibromofusidic acid acetoxymethyl ester (compound 144),
24-бром-16-деацетокси-16β-этилтиофузидовая кислота (соединение 146),24-bromo-16-deacetoxy-16β-ethylthiofusidic acid (compound 146),
24-бром-16-деацетокси-16β-этилсульфинилфузидовая кислота (соединение 147),24-bromo-16-deacetoxy-16β-ethylsulfinylfusidic acid (compound 147),
24-бром-16-деацетокси-16β-аллиллтиофузидовая кислота (соединение 148),24-bromo-16-deacetoxy-16β-allyllthiofusidic acid (compound 148),
24-бром-16-деацетокси-16β-(1-пентилтио)фузидовая кислота (соединение 149),24-bromo-16-deacetoxy-16β- (1-pentylthio) fusidic acid (compound 149),
24-бром-16-деацетокси-16β-(1-пентилсульфинил)фузидовая кислота (соединение 150),24-bromo-16-deacetoxy-16β- (1-pentylsulfinyl) fusidic acid (compound 150),
24-бром-16-деацетокси-16β-(2-метил-1-бутилтио)фузидовая кислота (соединение 151),24-bromo-16-deacetoxy-16β- (2-methyl-1-butylthio) fusidic acid (compound 151),
24-бром-16-деацетокси-16β-(2-метил-1-бутилсульфинил)фузидовая кислота (соединение 152),24-bromo-16-deacetoxy-16β- (2-methyl-1-butylsulfinyl) fusidic acid (compound 152),
24-бром-16-деацетокси-16β-(3-метил-1-бутилтио)фузидовая кислота (соединение 153),24-bromo-16-deacetoxy-16β- (3-methyl-1-butylthio) fusidic acid (compound 153),
24-бром-16-деацетокси-16β-(3-метил-1-бутилсульфинил)фузидовая кислота (соединение 154),24-bromo-16-deacetoxy-16β- (3-methyl-1-butylsulfinyl) fusidic acid (compound 154),
24-бром-16-деацетокси-16β-циклопентилтиофузидовая кислота (соединение 155),24-bromo-16-deacetoxy-16β-cyclopentylthiofusidic acid (compound 155),
24-бром-16-деацетокси-16β-(2,2,2-тритфорэтилтио)фузидовая кислота (соединение 156),24-bromo-16-deacetoxy-16β- (2,2,2-tritfortoethylthio) fusidic acid (compound 156),
24-бром-16-деацетокси-16β-(2-гидрокиэтилтио)фузидовая кислота (соединение 157),24-bromo-16-deacetoxy-16β- (2-hydroxyethylthio) fusidic acid (compound 157),
24-бром-16-деацетокси-16β-бензилтиофузидовая кислота (соединение 158),24-bromo-16-deacetoxy-16β-benzylthiofusidic acid (compound 158),
24-бром-16-деацетокси-16β-бензилсульфинилфузидовая кислота (соединение 159),24-bromo-16-deacetoxy-16β-benzylsulfinylfusidic acid (compound 159),
24-бром-16-деацетокси-16β-(2-фурилметилтио)фузидовая кислота (соединение 160),24-bromo-16-deacetoxy-16β- (2-furylmethylthio) fusidic acid (compound 160),
24-бром-16-деацетокси-16β-фенилтиофузидовая кислота (соединение 161),24-bromo-16-deacetoxy-16β-phenylthiofusidic acid (compound 161),
24-бром-16-деацетокси-16β-бензоилтиофузидовая кислота (соединение 162),24-bromo-16-deacetoxy-16β-benzoylthiofusidic acid (compound 162),
24-бром-16-деацетокси-16β-изопропоксифузидовая кислота (соединение 163),24-bromo-16-deacetoxy-16β-isopropoxyfusidic acid (compound 163),
24-бром-16-деацетокси-16β-(2-фторэтокси)фузидовая кислота (соединение 164),24-bromo-16-deacetoxy-16β- (2-fluoroethoxy) fusidic acid (compound 164),
24-бром-16-деацетокси-16β-(2-метоксиэтокси)фузидовая кислота (соединение 165),24-bromo-16-deacetoxy-16β- (2-methoxyethoxy) fusidic acid (compound 165),
24-(транс-1-гексен-1-ил)фузидовая кислота (соединение 166),24- ( trans -1-hexen-1-yl) fusidic acid (compound 166),
24-(транс-1-бутен-3,3-диметил-1-ил)фузидовая кислота (соединение 167),24- ( trans -1-butene-3,3-dimethyl-1-yl) fusidic acid (compound 167),
24-(транс-1-нонен-1-ил)фузидовая кислота (соединение 168),24- ( trans -1-nonen-1-yl) fusidic acid (compound 168),
24-(транс-5-хлор-1-пентен-1-ил)фузидовая кислота (соединение 169),24- ( trans -5-chloro-1-penten-1-yl) fusidic acid (compound 169),
24-(транс-2-фенил-1-винил)фузидовая кислота (соединение 170),24- ( trans -2-phenyl-1-vinyl) fusidic acid (compound 170),
24-(2-фенил-1-этил)фузидовая кислота (соединение 171),24- (2-phenyl-1-ethyl) fusidic acid (compound 171),
24-(4-н-пропилфенил)фузидовая кислота (соединение 172),24- (4-n-propylphenyl) fusidic acid (compound 172),
24-(4-винилфенил)фузидовая кислота (соединение 173),24- (4-vinylphenyl) fusidic acid (compound 173),
24-(4-трет-бутилфенил)фузидовая кислота (соединение 174),24- (4- tert- butylphenyl) fusidic acid (compound 174),
24-(4-цианофенил)фузидовая кислота (соединение 175),24- (4-cyanophenyl) fusidic acid (compound 175),
24-(3-бифенил)фузидовая кислота (соединение 176),24- (3-biphenyl) fusidic acid (compound 176),
24-(4-(трифторметил)фенил)фузидовая кислота (соединение 177),24- (4- (trifluoromethyl) phenyl) fusidic acid (compound 177),
24-(4-метоксифенил)фузидовая кислота (соединение 178),24- (4-methoxyphenyl) fusidic acid (compound 178),
24-(3-цианофенил)фузидовая кислота (соединение 179),24- (3-cyanophenyl) fusidic acid (compound 179),
24-(2-метоксифенил)фузидовая кислота (соединение 180),24- (2-methoxyphenyl) fusidic acid (compound 180),
24-(3-нитрофенил)фузидовая кислота (соединение 181),24- (3-nitrophenyl) fusidic acid (compound 181),
24-(3-бромфенил)фузидовая кислота (соединение 182),24- (3-bromophenyl) fusidic acid (compound 182),
24-(4-(метилтио)фенил)фузидовая кислота (соединение 183),24- (4- (methylthio) phenyl) fusidic acid (compound 183),
24-(2-нафтил)фузидовая кислота (соединение 184),24- (2-naphthyl) fusidic acid (compound 184),
24-(3,5-бис-(трифторметил)фенил)фузидовая кислота (соединение 185),24- (3,5- bis - (trifluoromethyl) phenyl) fusidic acid (compound 185),
24-(3,4-диметоксифенил)фузидовая кислота (соединение 186),24- (3,4-dimethoxyphenyl) fusidic acid (compound 186),
24-(3,5-дибромфенил)фузидовая кислота (соединение 187),24- (3,5-dibromophenyl) fusidic acid (compound 187),
Холиновая соль 24-бромфузидовой кислоты (соединение 188),Choline salt of 24-bromofusidic acid (compound 188),
L-аргининовая соль 24-бромфузидовой кислоты (соединение 189),L-arginine salt of 24-bromofusidic acid (compound 189),
2-(диметиламино)этанольная соль 24-бромфузидовой кислоты (соединение 190),2- (dimethylamino) ethanol salt of 24-bromofusidic acid (compound 190),
4-(2-гидроксиэтил)морфолиновая соль 24-бромфузидовой кислоты (соединение 191),4- (2-hydroxyethyl) morpholine salt of 24-bromofusidic acid (compound 191),
L-лизиновая соль 24-бромфузидовой кислоты (соединение 192),L-lysine salt of 24-bromofusidic acid (compound 192),
N-(2-гидроксиэтил)пирролидиновая соль 24-бромфузидовой кислоты (соединение 193),N- (2-hydroxyethyl) pyrrolidine salt of 24-bromofusidic acid (compound 193),
Этаноламиновая соль 24-бромфузидовой кислоты (соединение 194),Ethanolamine salt of 24-bromofusidic acid (compound 194),
Калиевая соль 24-бромфузидовой кислоты (соединение 195),Potassium salt of 24-bromofusidic acid (compound 195),
Тетрабутиламмониевая соль 24-бромфузидовой кислоты (соединение 196),Tetrabutylammonium salt of 24-bromofusidic acid (compound 196),
Бензилтриметиламмониевая соль 24-бромфузидовой кислоты (соединение 197),Benzyltrimethylammonium salt of 24-bromofusidic acid (compound 197),
Цетилтриметиламмониевая соль 24-бромфузидовой кислоты (соединение 198),Cetyltrimethylammonium salt of 24-bromofusidic acid (compound 198),
Тетраметиламмониевая соль 24-бромфузидовой кислоты (соединение 199),Tetramethylammonium salt of 24-bromofusidic acid (compound 199),
Тетрапропиламмониевая соль 24-бромфузидовой кислоты (соединение 300),Tetrapropylammonium salt of 24-bromofusidic acid (compound 300),
Трис(гидроксиметил)аминометановая соль 24-бромфузидовой кислоты (соединение 301),Tris (hydroxymethyl) aminomethane salt of 24-bromofusidic acid (compound 301),
N-метил-D-глюкаминовая соль 24-бромфузидовой кислоты (соединение 302),N-methyl-D-glucamine salt of 24-bromofusidic acid (compound 302),
Серебряная соль 24-бромфузидовой кислоты (соединение 303),Silver salt of 24-bromofusidic acid (compound 303),
Бензетониевая соль 24-бромфузидовой кислоты (соединение 304),Benzetonium salt of 24-bromofusidic acid (compound 304),
Триэтаноламиновая соль 24-бромфузидовой кислоты (соединение 305),Triethanolamine salt of 24-bromofusidic acid (compound 305),
Пивалоилоксиметиловый сложный эфир 24-(транс-1-гексен-1-ил)фузидовой кислоты (соединение 306),24- ( trans -1-hexen-1-yl) fusidic acid pivaloyloxymethyl ester (compound 306),
Пивалоилоксиметиловый сложный эфир 24-(транс-1-бутен-3,3-диметил-1-ил)фузидовой кислоты (соединение 307),24- ( trans -1-butene-3,3-dimethyl-1-yl) fusidic acid pivaloyloxymethyl ester (compound 307),
Пивалоилоксиметиловый сложный эфир 24-(транс-1-нонен-1-ил)фузидовой кислоты (соединение 308),24- ( trans -1-nonen-1-yl) fusidic acid pivaloyloxymethyl ester (compound 308),
Пивалоилоксиметиловый сложный эфир 24-(транс-5-хлор-1-пентен-1-ил)фузидовой кислоты (соединение 309),24- ( trans- 5-chloro-1-penten-1-yl) fusidic acid pivaloyloxymethyl ester (compound 309),
Пивалоилоксиметиловый сложный эфир 24-(транс-2-фенил-1-винил)фузидовой кислоты (соединение 310),24- ( trans- 2-phenyl-1-vinyl) fusidic acid pivaloyloxymethyl ester (compound 310),
Пивалоилоксиметиловый сложный эфир 24-(2-фенил-1-этил)фузидовой кислоты (соединение 311),24- (2-phenyl-1-ethyl) fusidic acid pivaloyloxymethyl ester (compound 311),
Пивалоилоксиметиловый сложный эфир 24-(4-н-пропилфенил)фузидовой кислоты (соединение 312),24- (4-n-propylphenyl) fusidic acid pivaloyloxymethyl ester (compound 312),
Пивалоилоксиметиловый сложный эфир 24-(4-винилфенил)фузидовой кислоты (соединение 313),24- (4-vinylphenyl) fusidic acid pivaloyloxymethyl ester (compound 313),
Пивалоилоксиметиловый сложный эфир 24-(4-трет-бутилфенил)фузидовой кислоты (соединение 314),24- (4- tert- butylphenyl) fusidic acid pivaloyloxymethyl ester (compound 314),
Пивалоилоксиметиловый сложный эфир 24-(4-цианофенил)фузидовой кислоты (соединение 315),24- (4-cyanophenyl) fusidic acid pivaloyloxymethyl ester (compound 315),
Пивалоилоксиметиловый сложный эфир 24-(3-бифенил)фузидовой кислоты (соединение 316),24- (3-biphenyl) fusidic acid pivaloyloxymethyl ester (compound 316),
Пивалоилоксиметиловый сложный эфир 24-(4-(трифторметил)фенил)фузидовой кислоты (соединение 317),24- (4- (trifluoromethyl) phenyl) fusidic acid pivaloyloxymethyl ester (compound 317),
Пивалоилоксиметиловый сложный эфир 24-(4-метоксифенил)фузидовой кислоты (соединение 318),24- (4-methoxyphenyl) fusidic acid pivaloyloxymethyl ester (compound 318),
Пивалоилоксиметиловый сложный эфир 24-(3-цианофенил)фузидовой кислоты (соединение 319),24- (3-cyanophenyl) fusidic acid pivaloyloxymethyl ester (compound 319),
Пивалоилоксиметиловый сложный эфир 24-(2-метоксифенил)фузидовой кислоты (соединение 320),24- (2-methoxyphenyl) fusidic acid pivaloyloxymethyl ester (compound 320),
Пивалоилоксиметиловый сложный эфир 24-(3-нитрофенил)фузидовой кислоты (соединение 321),24- (3-nitrophenyl) fusidic acid pivaloyloxymethyl ester (compound 321),
Пивалоилоксиметиловый сложный эфир 24-(3-бромфенил)фузидовой кислоты (соединение 322),24- (3-Bromophenyl) fusidic acid pivaloyloxymethyl ester (compound 322),
Пивалоилоксиметиловый сложный эфир 24-(4-(метилтио)фенил)фузидовой кислоты (соединение 323),24- (4- (Methylthio) phenyl) fusidic acid pivaloyloxymethyl ester (compound 323),
Пивалоилоксиметиловый сложный эфир 24-(2-нафтил)фузидовой кислоты (соединение 324),24- (2-Naphthyl) fusidic acid pivaloyloxymethyl ester (compound 324),
Пивалоилоксиметиловый сложный эфир 24-(3,5-бис-(трифторметил)фенил)фузидовой кислоты (соединение 325),24- (3,5- bis - (trifluoromethyl) phenyl) fusidic acid pivaloyloxymethyl ester (compound 325),
Пивалоилоксиметиловый сложный эфир 24-(3,4-диметоксифенил)фузидовой кислоты (соединение 326),24- (3,4-Dimethoxyphenyl) fusidic acid pivaloyloxymethyl ester (compound 326),
Пивалоилоксиметиловый сложный эфир 24-(3,5-дибромфенил)фузидовой кислоты (соединение 327).24- (3,5-Dibromophenyl) fusidic acid pivaloyloxymethyl ester (compound 327).
Соединения по настоящему изобретению могут использоваться как таковые или в форме солей или легко гидролизуемых сложных эфиров (определенных выше). В частности, соли соединений по настоящему изобретению представляют собой фармацевтически приемлемые соли, такие как соли щелочных металлов и соли щелочноземельных металлов, например, соли натрия, калия, магния или кальция, а также соли серебра и соли, полученные с использованием оснований, такие как аммониевые соли или соли подходящих нетоксичных аминов, таких как низшие алкиламины, например, триэтиламин, гидрокси-низших алкиламинов, например, 2-гидроксиэтиламин, бис-(2-гидроксиэтил)амин, циклоалкиламинов, например, дициклогексиламин, или бензиламинов, например, N,N'-дибензилэтилендиамин и дибензиламин. Соли серебра по настоящему изобретению могут быть особенно полезны для использования при местном лечении.The compounds of the present invention can be used as such either in the form of salts or readily hydrolyzable esters (as defined above). In particular, the salts of the compounds of the present invention are pharmaceutically acceptable salts, such as alkali metal salts and alkaline earth metal salts, for example, sodium, potassium, magnesium or calcium salts, as well as silver and base salts, such as ammonium salts or salts of suitable non-toxic amines, such as lower alkyl amines, for example triethylamine, hydroxy lower alkyl amines, for example 2-hydroxyethylamine, bis- (2-hydroxyethyl) amine, cycloalkylamines, for example dicyclohexylamine, il benzylamines, e.g., N, N'-dibenzylethylenediamine, and dibenzylamine. The silver salts of the present invention may be particularly useful for use in topical treatment.
В предпочтительном варианте фармацевтически приемлемые соли соединения общей формулы I или Ia выбирают из группы, состоящей из натриевых солей, холиновых солей, L-аргининовых солей, 2-(диметиламино)этанольных солей, 4-(2-гидроксиэтил)морфолиновых солей, L-лизиновых солей, N-(2-гидроксиэтил)пирролидиновых солей, этаноламиновых солей, калиевых солей, тетрабутиламмониевых солей, бензилтриметиламмониевых солей, цетилтриметиламмониевых солей, тетраметиламмониевых солей, тетрапропиламмониевых солей, трис(гидроксиметил)аминометановых солей, N-метил-D-глюкаминовых солей, солей серебра, бензетониевых солей и триэтаноламиновых солей.In a preferred embodiment, the pharmaceutically acceptable salts of the compounds of general formula I or Ia are selected from the group consisting of sodium salts, choline salts, L-arginine salts, 2- (dimethylamino) ethanol salts, 4- (2-hydroxyethyl) morpholine salts, L-lysine salts, N- (2-hydroxyethyl) pyrrolidine salts, ethanolamine salts, potassium salts, tetrabutylammonium salts, benzyltrimethylammonium salts, cetyltrimethylammonium salts, tetramethylammonium salts, tetrapropylammonium salts of methyltrimethanes, Nomethanes (Tris) il-D-glucamine salts, silver salts, benzethonium salts and triethanolamine salts.
В предпочтительном варианте получения соединения формулы Ia растворитель, используемый на стадии (а) для растворения фузидовой кислоты, представляет собой уксусную кислоту или С1-3 алкиловый сложный эфир С1-4 карбоновой кислоты и является, в частности, этилацетатом.In a preferred embodiment of the preparation of a compound of formula Ia, the solvent used in step (a) for dissolving fusidic acid is acetic acid or a C 1-3 alkyl ester of C 1-4 carboxylic acid and is, in particular, ethyl acetate.
В предпочтительном варианте получения соединения формулы Ia растворитель, используемый на стадии (b) для растворения 24,25-дибромного промежуточного соединения, представляет собой С1-6 спирт, такой как метанол, этанол, н-пропанол, изопропанол или бутанол, или воду, или смесь указанных растворителей.In a preferred embodiment of the preparation of a compound of formula Ia, the solvent used in step (b) for dissolving the 24.25-dibromic intermediate is a C 1-6 alcohol, such as methanol, ethanol, n-propanol, isopropanol or butanol, or water, or a mixture of these solvents.
В предпочтительном варианте получения соединения формулы Ia основание, используемое на стадии (b) для дегидробромирования 24,25-дибромного промежуточного соединения, представляет собой соль щелочного металла или шелочноземельного металла и слабой кислоты, такой как карбоновая, фосфорная или борная кислота, например, карбонат калия или натрия, или основания, такого как аммиак или С1-8 замещенный аммиак, например, этиламин, диэтиламин, триэтиламин или пиперидин, или гидроксид щелочного или щелочноземельного металла, такой как разбавленный гидроксид натрия, гидроксид кальция или разбавленный гидроксид калия.In a preferred embodiment of the preparation of a compound of formula Ia, the base used in step (b) for dehydrobromination of the 24.25-dibromic intermediate is an alkali metal or alkaline earth metal salt and a weak acid such as carboxylic, phosphoric or boric acid, for example, potassium carbonate or sodium or a base, such as ammonia or a C 1-8 substituted ammonia, for example, ethylamine, diethylamine, triethylamine or piperidine, or an alkali hydroxide or alkaline earth metal such as dilute w roksid sodium hydroxide, calcium hydroxide or dilute potassium hydroxide.
Соединения по настоящему изобретению могут включать хиральный(ые) атом(ы) углерода и двойную(ые) углерод-углеродную(ые) связь(и), которые определяют возможность появления стереоизомерных форм. Настоящее изобретение относится ко всем таким изомерам как в чистом виде, так и в виде их смесей. Чистые стереоизомерные формы соединения по настоящему изобретению могут быть получены с использованием известных в данной области методов. Диастереомеры могут быть разделены с использованием методов физического разделения, таких как селективная кристаллизация и хроматография, например, жидкостная хроматография с использованием хиральных стационарных фаз. Указанные чистые стереоизомерные формы могут быть также получены из соответствующих чистых стереоизомерных форм соответствующих исходных материалов при условии, что реакция осуществляется стереоселективно или стереоспецифично. Предпочтительно, если желателен конкретный стереоизомер указанного соединения, чтобы синтез осуществлялся с использованием стереоселективных или стереоспецифических методов получения.The compounds of the present invention may include chiral carbon atom (s) and carbon-carbon double (s) bond (s), which determine the possibility of the appearance of stereoisomeric forms. The present invention relates to all such isomers, both in pure form and in the form of mixtures thereof. Pure stereoisomeric forms of the compounds of the present invention can be obtained using methods known in the art. Diastereomers can be separated using physical separation methods, such as selective crystallization and chromatography, for example, liquid chromatography using chiral stationary phases. Said pure stereoisomeric forms can also be obtained from the corresponding pure stereoisomeric forms of the corresponding starting materials, provided that the reaction is stereoselective or stereospecific. Preferably, if a particular stereoisomer of said compound is desired, the synthesis is carried out using stereoselective or stereospecific methods of preparation.
Соединения по настоящему изобретению полезны для лечения, предупреждения или ослабления инфекций у пациентов, включая млекопитающих и, в частности, человека. Более конкретно, животные, в отношении которых может быть проведено лечение с использованием соединения по настоящему изобретению, включают домашних животных, таких как лошади, коровы, свиньи, овцы, домашняя птица, рыбы, кошки, собаки и животные зоопарка. Соединения по настоящему изобретению могут быть, в частности, полезны при лечении бактериальных инфекций, таких как кожные инфекции или вторичные кожные инфекции, или глазные инфекции. Кроме того, соединения по настоящему изобретению могут использоваться при лечении простых абсцессов, импетиго, фурункулов или целлюлита. Соединения по настоящему изобретению, в частности, могут использоваться при лечении, например, при местном лечении контагиозных поверхностных инфекций кожи, таких как небуллезное импетиго (или контагиозное импетиго) или буллезное импетиго. В этой связи настоящее изобретение относится к способу лечения, предупреждения или ослабления бактериальных инфекций, где данный способ включает введение пациенту эффективного количества соединения формулы I, необязательно вместе с другим терапевтически активным соединением. Примеры таких других терапевтически активных соединений включают антибиотики, такие как β-лактамы, такие как пенициллины (феноксиметилпенициллин, бензилпенициллин, диклоксациллин, ампициллин, амоксициллин, пивампициллин, флуклоксациллин, пиперациллин и мецеллинам), цефалоспорины (цефалексин, цефалотин, цефепим, цефотаксим, цефтазидим, цефтриазон и цефуроксим), монобактамы (азтреонам) и карбапенемы (меропенем); макролиды (азитромицин, кларитромицин, эритромицин и рокситромицин); полимиксины (колистин); тетрациклины (тетрациклин, доксициклин, окситетрациклин и лимециклин); аминогликозиды (стрептомицин, гентамицин, тобрамицин и нетилмицин); флуорохинолоны (норфлоксацин, офлоксацин, ципрофлоксацин и моксифлоксацин); клиндамицин, линкомицин, тейкопланин, ванкомицин, оксазолидоны (линезолид), рифамицин, метронидазол и фузидовая кислота. Другие соединения, которые могут быть успешно объединены с соединением по настоящему изобретению, особенно для целей местного применения, включают, например, кортикостероиды, такие как гидрокортизон, бетаметазон-17-валерат и триамцинолона ацетонид. Соединения могут вводиться как одновременно, так и в последовательном режиме.The compounds of the present invention are useful for the treatment, prevention or amelioration of infections in patients, including mammals, and in particular humans. More specifically, animals that can be treated using the compounds of the present invention include domestic animals such as horses, cows, pigs, sheep, poultry, fish, cats, dogs and zoo animals. The compounds of the present invention may be particularly useful in the treatment of bacterial infections, such as skin infections or secondary skin infections, or eye infections. In addition, the compounds of the present invention can be used in the treatment of simple abscesses, impetigo, boils, or cellulite. The compounds of the present invention, in particular, can be used in the treatment of, for example, topical treatment of contagious superficial skin infections, such as non-bullous impetigo (or contagious impetigo) or bullous impetigo. In this regard, the present invention relates to a method for treating, preventing or ameliorating bacterial infections, wherein the method comprises administering to a patient an effective amount of a compound of formula I, optionally together with another therapeutically active compound. Examples of such other therapeutically active compounds include antibiotics such as β-lactams, such as penicillins (phenoxymethylpenicillin, benzylpenicillin, dicloxacillin, ampicillin, amoxicillin, pivampicillin, fluxloxacillin, pipecephalipin, cefefilefin, cefefalipin, cefefalpecin, cefefalipin, cefefalipin, cephalphefalin, cephalphefalin, cefefalipin, cefefalipin, cefefalipin, cefefalipin, cephalphellin, cephalphellin, cephalphellin, cephalphefinol ceftriazone and cefuroxime), monobactams (aztreonam) and carbapenems (meropenem); macrolides (azithromycin, clarithromycin, erythromycin and roxithromycin); polymyxins (colistin); tetracyclines (tetracycline, doxycycline, oxytetracycline and limycycline); aminoglycosides (streptomycin, gentamicin, tobramycin and netilmicin); fluoroquinolones (norfloxacin, ofloxacin, ciprofloxacin and moxifloxacin); clindamycin, lincomycin, teicoplanin, vancomycin, oxazolidones (linezolid), rifamycin, metronidazole and fusidic acid. Other compounds that can be successfully combined with the compound of the present invention, especially for topical use, include, for example, corticosteroids such as hydrocortisone, betamethasone-17-valerate and triamcinolone acetonide. Compounds can be administered both simultaneously and in sequential mode.
Соединения по настоящему изобретению могут также использоваться для предупреждения или профилактики бактериальных инфекций у животных и, в этой связи, могут использоваться при разведении домашних животных, таких как млекопитающие, например, лошади, коровы, свиньи, овцы, домашняя птица, рыба, кошки, собаки, животные зоопарка.The compounds of the present invention can also be used to prevent or prevent bacterial infections in animals and, in this regard, can be used in breeding domestic animals such as mammals, for example horses, cows, pigs, sheep, poultry, fish, cats, dogs , animals of the zoo.
В целях терапевтического применения соединения по настоящему изобретению берут в виде фармацевтической композиции. В этой связи настоящее изобретение относится к фармацевтической композиции, включающей соединения формулы I или Ia, необязательно в сочетании с другими фармацевтически активными соединениями, а также вместе с фармацевтически приемлемым эксципиентом или носителем. Эксципиент должен быть «приемлемым» в том смысле, что он должен совмещаться с другими ингредиентами композиции и не должен оказывать вредного воздействия на реципиента.For therapeutic use, the compounds of the present invention are taken in the form of a pharmaceutical composition. In this regard, the present invention relates to a pharmaceutical composition comprising compounds of formula I or Ia, optionally in combination with other pharmaceutically active compounds, as well as together with a pharmaceutically acceptable excipient or carrier. The excipient must be “acceptable” in the sense that it must be combined with the other ingredients of the composition and must not adversely affect the recipient.
Обычно активный ингредиент включает от 0,05 до 99,9 мас.% от веса всей композиции.Typically, the active ingredient comprises from 0.05 to 99.9% by weight of the total composition.
В виде стандартной дозированной формы соединение может вводиться один или несколько раз в день с соответствующими интервалами и всегда в зависимости от состояния пациента, в соответствии с предписаниями лечащего врача. Обычно стандартная дозированная единица композиции содержит от 50 мг до 5000 мг, предпочтительно от 200 мг до 1000 мг соединения формулы I или Ia.In the form of a standard dosage form, the compound can be administered once or several times a day at appropriate intervals and always depending on the condition of the patient, in accordance with the instructions of the attending physician. Typically, a unit dosage composition contains from 50 mg to 5000 mg, preferably from 200 mg to 1000 mg, of a compound of formula I or Ia.
В контексте применения при местном лечении больше подходит выражение «используемая единица», которое обозначает однократную дозу, которую можно вводить пациенту, с которой легко манипулировать и которая после упаковки сохраняется в виде физически и химически стабильной стандартной дозы, включающей активный материал как таковой или смесь его с твердыми или жидкими фармацевтическими разбавителями или носителями.In the context of topical application, the phrase “unit used” is more appropriate, which refers to a single dose that can be administered to a patient that is easy to manipulate and which, after packaging, is stored in the form of a physically and chemically stable unit dose, including the active material as such or a mixture of it with solid or liquid pharmaceutical diluents or carriers.
Термин «используемая единица» в контексте местного применения обозначает единичную, то есть однократную дозу, которую можно вводить в местном режиме пациенту путем нанесения на квадратный сантиметр пораженной поверхности от 0,1 мг до 10 мг и предпочтительно от 0,2 мг до 1 мг рассматриваемого активного ингредиента.The term "unit used" in the context of topical application refers to a single, that is, a single dose that can be administered locally to a patient by applying from a dose of 0.1 mg to 10 mg per square centimeter of the affected surface, and preferably from 0.2 mg to 1 mg of the subject active ingredient.
Предусматривается также, что в некоторых режимах лечения лучше проводить введение с более длительными интервалами, например, через день, каждую неделю или с еще более длинными интервалами.It is also envisaged that in some treatment regimens, it is better to administer at longer intervals, for example, every other day, every week or at even longer intervals.
Если режим лечения включает введение другого терапевтически активного соединения, рекомендуется свериться с рекомендациями, приведенными в руководстве Гудмана и Гилмана (Goodman & Gilman's The Pharmacological Basis of Therapeutics, 9th Ed., J.G. Hardman and L.E. Limbird (Eds.), McGraw-Hill 1995), в котором приведены используемые дозы данных соединений.If the treatment regimen involves administering another therapeutically active compound, it is recommended that you consult the recommendations in the Goodman &Gilman's Pharmacological Basis of Therapeutics , 9 th Ed., JG Hardman and LE Limbird (Eds.), McGraw-Hill 1995 ), which shows the used doses of these compounds.
Рассматриваемые композиции включают, в частности, такие композиции, которые имеют форму, приемлемую для перорального введения (включая длительное или задержанное высвобождение), ректального введения, парентерального введения (включая подкожное, внутрибрюшинное, внутримышечное, внутрисуставное и внутривенное введение), чрескожного, офтальмологического, местного, назального или трансбуккального введения.Contemplated compositions include, but are not limited to, those compositions which are in a form suitable for oral administration (including sustained or delayed release), rectal administration, parenteral administration (including subcutaneous, intraperitoneal, intramuscular, intraarticular and intravenous administration), transdermal, ophthalmic, local nasal or buccal administration.
В удобном варианте композиции могут быть представлены в дозированной форме и могут быть изготовлены с использованием любых известных в фармации способов, таких, например, которые описаны в руководстве Ремингтона (Remington, The Science and Practice of Pharmacy, 20 th ed., 2000). Все такие способы включают стадию приведения в контакт активного ингредиента с носителем, который представляет собой один или несколько вспомогательных ингредиентов. В целом, композиции получают путем осуществления однородного и тщательного контакта активного ингредиента с жидким носителем, или тонкоизмельченным твердым носителем, или с ними обоими и затем, при необходимости, путем придания продукту формы желаемой композиции.In a convenient embodiment, the compositions can be presented in dosage form and can be manufactured using any methods known in pharmacy, such as those described in the Remington manual (Remington, The Science and Practice of Pharmacy , 20 th ed., 2000). All such methods include the step of contacting the active ingredient with a carrier, which is one or more accessory ingredients. In general, compositions are prepared by uniformly and thoroughly contacting the active ingredient with a liquid carrier or a finely divided solid carrier, or both, and then, if necessary, shaping the product to the desired composition.
Композиции по настоящему изобретению, подходящие для перорального введения, могут иметь вид дискретных единиц, таких как капсулы, пакетики, таблетки или пастилки, каждая из которых содержит заданное количество активного ингредиента, могут также иметь вид порошка или гранул, вид раствора или суспензии в водной жидкости или в неводной жидкости, такой как этанол или глицерин; или могут иметь вид эмульсии типа «масло-в-воде» или эмульсии типа «вода-в-масле». Такие масла могут представлять собой пищевые масла, такие как, например, хлопковое масло, кунжутное масло, кокосовое масло или арахисовое масло. Подходящие диспергирующие средства или средства, способствующие суспендированию, в случае применения их в водных суспензиях, включают синтетические или натуральные камеди, такие как трагакант, альгинат, аравийская камедь, декстран, натрий-карбоксиметилцеллюлоза, желатин, метилцеллюлоза, гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза, карбомеры и поливинилпирролидон. Активные ингредиенты могут быть также введены в виде болюса, электуария или пасты.Compositions of the present invention suitable for oral administration may be in the form of discrete units, such as capsules, sachets, tablets or lozenges, each of which contains a predetermined amount of the active ingredient, may also be in the form of powder or granules, in the form of a solution or suspension in an aqueous liquid or in a non-aqueous liquid such as ethanol or glycerin; or may be in the form of an oil-in-water emulsion or a water-in-oil emulsion. Such oils may be edible oils, such as, for example, cottonseed oil, sesame oil, coconut oil or peanut oil. Suitable dispersing agents or suspending agents, if used in aqueous suspensions, include synthetic or natural gums such as tragacanth, alginate, gum arabic, dextran, sodium carboxymethyl cellulose, gelatin, methyl cellulose, hydroxypropyl methyl cellulose, hydroxypropyl cellulose, hydroxypropyl cellulose and polycarbyl cellulose. The active ingredients may also be administered as a bolus, electuary or paste.
Таблетки могут быть изготовлены путем прессования или формования активного ингредиента необязательно при наличии одного или нескольких вспомогательных ингредиентов. Таблетки могут быть получены путем прессования в соответствующем аппарате, где активный(ые) ингредиент(ы) находится(ятся) в свободно текучей форме, такой как порошок или гранулы, необязательно при смешивании со связующим веществом, таким как, например, лактоза, глюкоза, крахмал, желатин, аравийская камедь, трагакант, альгинат натрия, карбоксиметилцеллюлоза, метилцеллюлоза, гидроксипропилметилцеллюлоза, полиэтиленгликоль, воски или т.п.; с замасливателем, таким как, например, олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия или т.п.; со средством, способствующим разложению, таким как, например, крахмал, метилцеллюлоза, агар, бентонит, натрий-кроскармеллоза, натрий-крахмалгликоллят, кросповидон или т.п.; или средством, способствующим диспергированию, таким как полисорбат 80. Формованные таблетки могут быть получены при формовании в соответствующей машине смеси порошкового активного ингредиента и подходящего носителя, увлажненного инертным жидким разбавителем.Tablets may be made by compression or molding of the active ingredient, optionally with one or more accessory ingredients. Tablets can be prepared by compression in an appropriate apparatus where the active ingredient (s) are in free flowing form, such as powder or granules, optionally when mixed with a binder, such as, for example, lactose, glucose, starch, gelatin, gum arabic, tragacanth, sodium alginate, carboxymethyl cellulose, methyl cellulose, hydroxypropyl methyl cellulose, polyethylene glycol, waxes or the like; with a sizing agent such as, for example, sodium oleate, sodium stearate, magnesium stearate, sodium benzoate, sodium acetate, sodium chloride or the like; with a decomposition aid such as, for example, starch, methylcellulose, agar, bentonite, croscarmellose sodium, starch glycolate, crospovidone or the like; or a dispersion aid, such as Polysorbate 80. Molded tablets may be prepared by molding in a suitable machine a mixture of the powdered active ingredient and a suitable carrier moistened with an inert liquid diluent.
Композиции для ректального введения могут иметь вид суппозитория, в котором соединение по настоящему изобретению смешано с низкоплавкими водорастворимыми или водонерастворимыми твердыми веществами, такими как какао-масло, гидрогенизированные растительные масла, полиэтиленгликоль или сложные эфиры жирных кислот и полиэтиленгликолей, при этом эликсиры могут быть получены при использовании миристилпальмитата.Formulations for rectal administration may be in the form of a suppository in which the compound of the present invention is mixed with low melting water-soluble or water-insoluble solids, such as cocoa butter, hydrogenated vegetable oils, polyethylene glycol or esters of fatty acids and polyethylene glycols, wherein elixirs can be prepared by the use of myristyl palmitate.
Композиции, подходящие для парентерального введения, в удобном варианте включают стерильный масляный или водный препарат активных ингредиентов, который предпочтительно является изотоническим для крови реципиента, на основе, например, изотонического солевого раствора, изотонического раствора глюкозы или буферного раствора. Композиция может быть соответствующим образом простерилизована, например, фильтрованием через бактериальный фильтр, при добавлении стерилизующего агента к композиции, путем облучения или нагревания композиции. Липосомальные композиции, описанные, например, в Энциклопедии фармацевтической технологии (Encyclopedia of Pharmaceutical Technology, vol. 9, 1994), также приемлемы для парентерального введения.Compositions suitable for parenteral administration conveniently comprise a sterile oily or aqueous preparation of the active ingredients, which is preferably isotonic for the blood of the recipient, based on, for example, isotonic saline, isotonic glucose or buffer solution. The composition can be suitably sterilized, for example, by filtration through a bacterial filter, by adding a sterilizing agent to the composition, by irradiating or heating the composition. Liposomal compositions described, for example, in the Encyclopedia of Pharmaceutical Technology (Encyclopedia of Pharmaceutical Technology, vol. 9, 1994) are also suitable for parenteral administration.
Альтернативно, соединение формулы I может быть представлено в виде стерильного твердого препарата, например, лиофильно высушенного порошка, который легко растворяется в стерильном растворителе непосредственно перед употреблением.Alternatively, the compound of formula I can be presented in the form of a sterile solid preparation, for example, freeze-dried powder, which is readily soluble in a sterile solvent immediately before use.
Чрескожные композиции могут иметь вид пластыря или иного вида небольших налагаемых участков соответствующего материала.Transdermal compositions may take the form of a patch or other form of small overlay areas of the respective material.
Композиции, пригодные для офтальмологического введения, представлены в виде стерильного водного препарата активных ингредиентов, которые могут иметь форму микрокристаллического продукта, например, форму водной микрокристаллической суспензии. Липосомальные композиции или биодеградируемые полимерные системы, описанные, например, в Энциклопедии фармацевтической технологии (Encyclopedia of Pharmaceutical Technology, vol. 2, 1989), также могут использоваться с данными активными ингредиентами при офтальмологическом введении.Compositions suitable for ophthalmic administration are presented as a sterile aqueous preparation of the active ingredients, which may be in the form of a microcrystalline product, for example, in the form of an aqueous microcrystalline suspension. Liposomal compositions or biodegradable polymer systems described, for example, in the Encyclopedia of Pharmaceutical Technology (Encyclopedia of Pharmaceutical Technology, vol. 2, 1989) can also be used with these active ingredients for ophthalmic administration.
Композиции, пригодные для местного или офтальмологического введения, включают жидкие или полужидкие препараты, такие как линименты, лосьоны, гели, аппликации, эмульсии типа «масло-в-воде» или «вода-в-масле», такие как кремы, мази или пасты; или растворы или суспензии, такие как капли.Compositions suitable for topical or ophthalmic administration include liquid or semi-liquid preparations, such as liniment, lotions, gels, applications, oil-in-water or water-in-oil emulsions, such as creams, ointments or pastes ; or solutions or suspensions, such as drops.
Композиции, пригодные для назального или трансбуккального введения, включают порошковые, самораспыляющиеся и распыляемые композиции, такие как аэрозоли и атомайзеры. Такого рода композиции достаточно детально описаны в литературе (Modern Pharmaceutics, 2nd ed., G.S. Banker and C.T. Rhodes (Eds.), p. 427-432, Marcel Dekker, New York; Modern Pharmaceutics, 3th ed., G.S. Banker and C.T. Rhodes (Eds.), p. 618-619 и 718-721, Marcel Dekker, New York and Encyclopedia of Pharmaceutical Technology, vol. 10, Swarbrick and J.C. Boylan (Eds.), p. 191-221, Marcel Dekker, New York).Compositions suitable for nasal or buccal administration include powder, self-spraying and nebulizing compositions, such as aerosols and atomizers. Such compositions are described in sufficient detail in the literature (Modern Pharmaceutics, 2 nd ed., GS Banker and CT Rhodes (Eds.), P. 427-432, Marcel Dekker, New York; Modern Pharmaceutics, 3 th ed., GS Banker and CT Rhodes (Eds.), P. 618-619 and 718-721, Marcel Dekker, New York and Encyclopedia of Pharmaceutical Technology, vol. 10, Swarbrick and JC Boylan (Eds.), P. 191-221, Marcel Dekker, New York).
Кроме указанных выше ингредиентов, композиции соединения по настоящему изобретению формулы I или Ia могут включать один или несколько дополнительных ингредиентов, таких как разбавители, буферы, вкусовые вещества, красители, поверхностно-активные вещества, загустители, консерванты, например, метилгидроксибензоат (включая антиоксиданты), эмульгаторы и т.п.In addition to the above ingredients, the compositions of the compounds of the present invention of formula I or Ia may include one or more additional ingredients, such as diluents, buffers, flavors, colorants, surfactants, thickeners, preservatives, for example methyl hydroxybenzoate (including antioxidants), emulsifiers and the like
Парентеральные композиции полезны, в частности, для лечения состояний, при которых желателен быстрый ответ организма на лечение. В случае лечения в непрерывном режиме пациентов, страдающих инфекционными заболеваниями, используемые таблетки или капсулы могут иметь вид фармацевтического препарата, оказывающего пролонгированный эффект, достигаемый при пероральном введении лекарственного средства, в частности, это могут быть таблетки с длительным высвобождением. В том случае, когда активный ингредиент вводится в форме солей фармацевтически приемлемых нетоксичных кислот или оснований, предпочтительные соли представляют собой, например, легко растворимые в воде или слаборастворимые в воде соли, подобранные для целей достижения определенной, соответствующей состоянию степени абсорбции.Parenteral compositions are useful, in particular, for treating conditions in which a quick response of the body to treatment is desired. In the case of continuous treatment of patients suffering from infectious diseases, the tablets or capsules used may be in the form of a pharmaceutical preparation having a prolonged effect achieved by the oral administration of the drug, in particular, these may be sustained-release tablets. When the active ingredient is administered in the form of salts of pharmaceutically acceptable non-toxic acids or bases, preferred salts are, for example, readily soluble in water or slightly soluble in water, selected for the purpose of achieving a certain state of absorption.
Как отмечалось выше, композиция может содержать другие терапевтически активные компоненты, которые могут быть соответствующим образом введены в сочетании с соединениями по настоящему изобретению при лечении инфекционных заболеваний, такие как другие подходящие антибиотики, в частности, такие антибиотики, которые могут повышать активность и/или препятствовать развитию резистентности. Могут также с успехом использоваться кортикостероиды, включаемые в композиции по настоящему изобретению. В частности, указанный другой активный компонент может включать β-лактамы, такие как пенициллины (феноксиметилпенициллин, бензилпенициллин, диклоксациллин, ампициллин, амоксициллин, пивампициллин, флуклоксациллин, пиперациллин и мецеллинам), цефалоспорины (цефалексин, цефалотин, цефепим, цефатоксим, цефтазидим, цефтриазон и цефуроксим), монобактамы (азтреонам) и карбапенемы (меропенем); макролиды (азитромицин, кларитромицин, эритромицин и рокситромицин); полимиксины (колистин); тетрациклины (тетрациклин, доксициклин, окситетрациклин и лимециклин); аминогликозиды (стрептомицин, гентамицин, тобрамицин и нетилмицин); флуорохинолоны (норфлоксацин, офлоксацин, ципрофлоксацин и моксифлоксацин); клиндамицин, линкомицин, тейкопланин, ванкомицин, оксазолидоны (линезолид), рифамицин, метронидазол и фузидовая кислота. Другие соединения, которые могут быть успешно объединены с соединениями по настоящему изобретению, особенно для целей местного применения, включают, например, кортикостероиды, такие как гидрокортизон, бетаметазон-17-валерат и триамцинолона ацетонид.As noted above, the composition may contain other therapeutically active components that can be appropriately administered in combination with the compounds of the present invention in the treatment of infectious diseases, such as other suitable antibiotics, in particular antibiotics that can increase activity and / or inhibit development of resistance. Corticosteroids included in the compositions of the present invention may also be successfully used. In particular, the indicated other active component may include β-lactams, such as penicillins (phenoxymethylpenicillin, benzylpenicillin, dicloxacillin, ampicillin, amoxicillin, pivampicillin, fluxloxacillin, piperacillin and metsellinam), cephalefincetin, cefalefincetimonetz cefalefincetin cefalefinzimonetz cefalefincetin cefalefincetin cefalefincetin cefalefincetin cefalefinzimetin cefalefincetin cefalefinzimetin cefalefinzimetin cefalefinzimetin cefalefinzimetin cefalefin cytin cefatecimetin cefalefin tezimincetin cefalefincetin cefalefincetin cefalefincetim cefuroxime), monobactams (aztreonam) and carbapenems (meropenem); macrolides (azithromycin, clarithromycin, erythromycin and roxithromycin); polymyxins (colistin); tetracyclines (tetracycline, doxycycline, oxytetracycline and limycycline); aminoglycosides (streptomycin, gentamicin, tobramycin and netilmicin); fluoroquinolones (norfloxacin, ofloxacin, ciprofloxacin and moxifloxacin); clindamycin, lincomycin, teicoplanin, vancomycin, oxazolidones (linezolid), rifamycin, metronidazole and fusidic acid. Other compounds that can be successfully combined with the compounds of the present invention, especially for topical use, include, for example, corticosteroids such as hydrocortisone, betamethasone-17-valerate and triamcinolone acetonide.
Другое терапевтически активное соединение может находиться в том же или в отдельном контейнере в составе препарата, адаптированного для проведения одновременного или последовательного введения указанных терапевтически активных соединений.Another therapeutically active compound may be in the same or in a separate container in the composition of the drug, adapted for the simultaneous or sequential administration of these therapeutically active compounds.
Лечение инфекционных заболеваний часто включает определение перед началом лечения, является ли данное заболевание устойчивым или трудно поддающимся данному лечению. В качестве примера можно отметить, что от пациента могут быть взяты образцы, содержащие инфекционный микроорганизм, например образцы крови или мочи, после чего данный образец культивируют и подвергают воздействию применяемого для лечения соединения с целью определения, отвечает ли данный инфицирующий организм на предполагаемое лечение. Соответственно, настоящее изобретение также относится к способу идентификации соединений, эффективных против микроорганизма, где данный способ включает введение соединения формулы I или Ia, необязательно в сочетании с другими фармацевтически активными агентами, в микроорганизм и определение, оказывает ли данное соединение или смесь соединений токсический или статический эффект на данный микроорганизм.Treatment for infectious diseases often involves determining before treatment whether the disease is persistent or difficult to treat. As an example, it can be noted that samples containing an infectious microorganism can be taken from a patient, for example, blood or urine samples, after which this sample is cultured and exposed to the compound used for treatment in order to determine whether this infectious organism responds to the intended treatment. Accordingly, the present invention also relates to a method for identifying compounds effective against a microorganism, wherein the method comprises administering a compound of formula I or Ia, optionally in combination with other pharmaceutically active agents, into the microorganism and determining whether the compound or mixture of compounds is toxic or static effect on a given microorganism.
Композиции по настоящему изобретению не ограничиваются фармацевтическими препаратами, но могут использоваться в области не терапевтического применения для регулирования микробного роста. Например, композиции или соединения по настоящему изобретению могут быть полезны в качестве добавок, которые ингибируют микробный рост, применяемых, например, в ферментационных процессах. В качестве примера можно отметить, что присущая данным антимикробным агентам селективность полезна для усиления роста определенных микроорганизмов за счет других микроорганизмов в культуре, включающей множество видов микроорганизмов.The compositions of the present invention are not limited to pharmaceutical preparations, but can be used in the field of non-therapeutic use for regulating microbial growth. For example, the compositions or compounds of the present invention may be useful as additives that inhibit microbial growth, used, for example, in fermentation processes. As an example, it can be noted that the selectivity inherent in these antimicrobial agents is useful for enhancing the growth of certain microorganisms due to other microorganisms in a culture that includes many types of microorganisms.
Биологическая активностьBiological activity
Исследования in vitro продемонстрировали высокую эффективность соединений по настоящему изобретению в отношении штаммов как стафилококков, так и стрептококков, которые входят в число наиболее частых патогенных бактерий, вызывающих различные кожные и глазные инфекции. Биологические тесты показали такую же или в некоторых случаях несколько повышенную антибактериальную активность против стафилококков соединений по настоящему изобретению в сравнении с фузидовой кислотой и, что более важно, существенно более высокую антибактериальную активность против стрептококков, как это видно из таблицы 1, в которой приведены значения МИК выбранных соединений формулы Ia в отношении и стафилококков, и стрептококков. In vitro studies have demonstrated the high efficiency of the compounds of the present invention in relation to strains of both staphylococci and streptococci, which are among the most common pathogenic bacteria that cause various skin and eye infections. Biological tests showed the same or, in some cases, slightly increased antibacterial activity against staphylococci of the compounds of the present invention compared to fusidic acid and, more importantly, significantly higher antibacterial activity against streptococci, as can be seen from table 1, which shows the MIC values selected compounds of formula Ia in relation to both staphylococci and streptococci.
СоединенияConnections
Аналоги фузидовой кислоты по настоящему изобретению и эталонные соединения 201 (фузидовая кислота (в виде натриевой соли)), 207, 205, 203 и 206 (см. примечания к таблице А) хранят в порошковой форме при температуре +4°С. Для применения в данных тестах их растворяют в 95% EtOH (3,84 мг/мл) и хранят максимум в течение одного месяца при температуре -20°С перед отбором.The fusidic acid analogs of the present invention and reference compounds 201 (fusidic acid (as sodium salt)), 207, 205, 203 and 206 (see notes to table A) are stored in powder form at a temperature of + 4 ° C. For use in these tests, they are dissolved in 95% EtOH (3.84 mg / ml) and stored for a maximum of one month at a temperature of -20 ° C before selection.
СредыWednesday
LB среды (на 1000 мл ddH2O: 10 г бактотриптона, 5 г дрожжевого экстракта, 10 г NaCl). THB бульон Тодда-Хьюитта (Todd-Hewitt) (SIGMA), номер продукта: Т1438 (на 1000 мл ddH2O: 50 г инфузии из сердца быка, 20 г казеинового пептона, 2 г декстрозы, 2 г NaHCO3, 2,5 г NaCl, 0,4 г Na2HPO4). Чашки готовят с использованием агара в концентрации 1,5%. Чашки Петри с кровяным агаром содержат дополнительно 5 об. % дефибринизированной крови лошади, получаемой от компании SLU (Swedish Agricultural University, Uppsala).LB medium (per 1000 ml of ddH 2 O: 10 g of bactotryptone, 5 g of yeast extract, 10 g of NaCl). THD Todd-Hewitt broth (SIGMA), product number: T1438 (per 1000 ml ddH 2 O: 50 g infusion from the heart of a bull, 20 g casein peptone, 2 g dextrose, 2 g NaHCO 3 , 2.5 g of NaCl; 0.4 g of Na 2 HPO 4 ). Cups are prepared using agar at a concentration of 1.5%. Blood agar Petri dishes contain an additional 5 vol. % defibrinated horse blood obtained from SLU (Swedish Agricultural University, Uppsala).
Определение МИК (минимальной ингибирующей концентрации)Determination of MIC (minimum inhibitory concentration)
Тест для определения МИК соединений проводят в 96-луночных микротитрационных планшетах (Thermo Labsystems). Бактерии в количестве 4Ч105 инокулируют в 0,4 мл ростовых сред (S. aureus - LB бульон, S. pyogenes - TH бульон), содержащих серийные разбавления исследуемых соединений, начиная от 128 мкг/мл (коэффициент разведения 2, например, 128 мкг/мл, 64 мкг/мл, …, 0,016 мкг/мл). Критерием чувствительности является отсутствие видимого роста через 24 часа в условиях аэробной инкубации при температуре 37°С. Каждое соединение тестируют по меньшей мере два раза и во всех случаях в испытание включают фузидовую кислоту в качестве экспериментального контроля.The test for the determination of MIC compounds is carried out in 96-well microtiter plates (Thermo Labsystems). Bacteria in an amount of 4 × 10 5 are inoculated in 0.4 ml of growth media ( S. aureus - LB broth, S. pyogenes - TH broth) containing serial dilutions of the studied compounds, starting from 128 μg / ml (dilution factor 2, for example, 128 μg / ml, 64 μg / ml, ..., 0.016 μg / ml). The sensitivity criterion is the absence of visible growth after 24 hours under aerobic incubation conditions at a temperature of 37 ° C. Each compound was tested at least twice and in all cases, fusidic acid was included as an experimental control in the test.
Антибактериальная активность,
определенная для выбранных соединений по настоящему изобретению. МИК/мкг мл-1
Table a:
Antibacterial activity,
specific to selected compounds of the present invention. MIC / μg ml -1
DA7121DA7121
DA7864DA7864
Этал. соед. 201 (фузидовая кислота)108
Etal. conn. 201 (fusidic acid)
0,110.05
0.11
0.030,03
0.03
0,03n.i.
0,03
3,50.8
3,5
3,50.8
3,5
Этал. соед. 207113
Etal. conn. 207
0,220.22
0.22
0,050.11
0.05
н.и.n.i.
n.i.
1,60.4
1,6
1,60.4
1,6
Этал. соед. 205115
Etal. conn. 205
0,440.88
0.44
0,060.06
0.06
0,110.11
0.11
141.8
fourteen
281.8
28
Этал. соед. 203116
Etal. conn. 203
0,220.44
0.22
0,060.06
0.06
0,220.11
0.22
77
7
147
fourteen
Этал. соед. 206122
Etal. conn. 206
0,220.88
0.22
0,060.22
0.06
0,110.88
0.11
>327
> 32
287
28
Концентрация клеток в момент времени t=0 соответствует ~106/мл. Бактерии растут в бульоне в аэробных условиях при 37°С.
н.и. = не исследовались
Этал. соед. - эталонное соединениеNotes to table A:
The concentration of cells at time t = 0 corresponds to ~ 10 6 / ml. Bacteria grow in the broth under aerobic conditions at 37 ° C.
n.i. = not investigated
Etal. conn. - reference connection
Эталонными соединениями в таблице А являются известные производные фузидовой кислоты. Каждое эталонное соединение относится к соединению по настоящему изобретению, указанному выше в той же самой колонке. Эталонные соединения не замещены С-24 и имеют двойную связь между С-24 и С-25. Все другие структурные характеристики эталонных соединений идентичны соответствующим соединениям по настоящему изобретению, указанным выше в той же колонке:The reference compounds in Table A are known fusidic acid derivatives. Each reference compound refers to the compound of the present invention indicated above in the same column. The reference compounds are not substituted with C-24 and have a double bond between C-24 and C-25. All other structural characteristics of the reference compounds are identical to the corresponding compounds of the present invention, indicated above in the same column:
201 - Фузидовая кислота201 - Fusidic acid
207 - 16-дезокси-16β-изопропилсульфинилфузидовая кислота (von Daehne, W. et al., Adv. Appl. Microbiol., 1979. vol. 25, p. 95-146)207 - 16-deoxy-16β-isopropylsulfinylfusidic acid (von Daehne, W. et al., Adv. Appl. Microbiol ., 1979. vol. 25, p. 95-146)
205 - 17S,20S-дигидрофузидовая кислота (Duvold, T. et al., J. Med. Chem., 2001, Vol 44, p. 3125-3131)205-17S, 20S-dihydrofusidic acid (Duvold, T. et al., J. Med. Chem. , 2001, Vol 44, p. 3125-3131)
203 - 16-дезацетокси-16β-этоксифузидовая кислота (von Daehne, W. et al., Adv. Appl. Microbiol., 1979. vol. 25, p. 95-146)203 - 16-deacetoxy-16β-ethoxyfusidic acid (von Daehne, W. et al., Adv. Appl. Microbiol. , 1979. vol. 25, p. 95-146)
206 - 17S,20S-метиленфузидовая кислота (Duvold, T., et al., Bioorg. Med. Chem. Lett., 2002, Vol. 12, p. 3569-3572)206-17S, 20S-methylenefusidic acid (Duvold, T., et al., Bioorg. Med. Chem. Lett ., 2002, Vol. 12, p. 3569-3572)
Приведенные выше данные четко показывают, что замещение фузидовой кислоты в положении 24 приводит к значительному повышению активности соединения против стрептококков (в 2-15 раз), тогда как активность против стафилококков сохраняется по существу на том же уровне.The above data clearly show that the substitution of fusidic acid at position 24 leads to a significant increase in the activity of the compound against streptococci (2-15 times), while the activity against staphylococci remains essentially at the same level.
СокращенияAbbreviations
Ниже даны определения стандартных сокращений, используемых в данной заявке:The following are definitions of standard abbreviations used in this application:
AcOH = уксусная кислотаAcOH = acetic acid
Ac2O = уксусный ангидридAc 2 O = Acetic Anhydride
Ac = ацетилAc = Acetyl
aq. (водн.) = водныйaq. (aq) = water
Bu = н-бутилBu = n-butyl
tBu, tBu = трет-бутил t Bu, tBu = tert-butyl
Comp. = соединениеComp. = connection
DBU = 1,8-диазабицикло[5.4.0]ундец-7-енDBU = 1,8-diazabicyclo [5.4.0] undec-7-ene
DMF (ДМФ) = диметилформамидDMF (DMF) = dimethylformamide
eq. (эквив.) = эквивалентeq. (equiv.) = equivalent
Et = этилEt = ethyl
Ether = диэтиловый эфирEther = diethyl ether
EtOAc = этилацетатEtOAc = ethyl acetate
EtOH = этанолEtOH = Ethanol
Ex. (прим.) = примерEx. (approx.) = example
FA = фузидовая кислота или аналог по кольцевым подструктурам A,B,C,DFA = fusidic acid or an analogue of the ring substructures A, B, C, D
FCC = колоночная флэш-хроматографияFCC = flash column chromatography
Fu = кольцевые подструктуры A,B,C,D в фузидовой кислотеFu = ring substructures A, B, C, D in fusidic acid
HMPA = триамид гексаметилфосфорной кислотыHMPA = hexamethylphosphoric triamide
HPLC (ВЭЖХ)= высокоэффективная жидкостная хроматографияHPLC (HPLC) = high performance liquid chromatography
iPr = изопропилiPr = Isopropyl
Me = метилMe = methyl
MeOH = метанолMeOH = methanol
m.p. (Т.пл.) = точка плавленияm.p. (Mp.) = Melting point
MRSA = метициллин-резистентный Staphylococcus aureusMRSA = methicillin-resistant Staphylococcus aureus
Pet.ether = петролейный эфирPet.ether = petroleum ether
Ph = фенилPh = phenyl
Phenac = фенацилPhenac = phenacyl
Piv = пивалоилPiv = pivaloyl
Prep. (преп.) = препаратPrep. (prep.) = drug
THF (ТГФ)= тетрагидрофуранTHF (THF) = tetrahydrofuran
TLC (ТСХ) = тонкослойная хроматографияTLC (TLC) = thin layer chromatography
rt (к.т.)= комнатная температураrt (rt) = room temperature
sat. (насыщ.) NaCl = насыщенный водный раствор хлорида натрияsat. (sat.) NaCl = saturated aqueous solution of sodium chloride
TMS (ТМС) = триметилсилилTMS (TMS) = trimethylsilyl
v = объемv = volume
Получение соединений по настоящему изобретениюObtaining compounds of the present invention
Соединения формулы I могут быть синтезированы из известных исходных материалов с использованием различных схем синтеза, в зависимости от потребностей, определяемых каждым конкретным соединением I, таких как доступность исходных материалов, необходимость временной защиты чувствительных заместителей, уровень чистоты и выхода на стадиях синтеза и выбор предпочтительного порядка следования данных стадий реакции.The compounds of formula I can be synthesized from known starting materials using various synthesis schemes, depending on the needs determined by each specific compound I, such as the availability of starting materials, the need for temporary protection of sensitive substituents, the level of purity and yield in the synthesis steps, and the selection of the preferred order following these reaction steps.
Ниже приведены иллюстративные, но не ограничивающие способы и примеры синтеза различных соединений формулы I или Ia. Различные способы синтеза могут быть объединены друг с другом, как это сочтет нужным специалист в данной области, для получения нужных соединений формулы I или Ia с желаемым замещением в кольце A, C и D, в 24 положении боковой цепи, и с учетом того, что касается их формы: свободных кислот, солей или легко гидролизуемых сложных эфиров.The following are illustrative, but not limiting methods and examples of the synthesis of various compounds of formula I or Ia. Various synthesis methods can be combined with each other, as it is deemed necessary by a person skilled in the art, to obtain the desired compounds of formula I or Ia with the desired substitution in ring A, C and D, at the 24 position of the side chain, and taking into account concerns their form: free acids, salts or easily hydrolyzable esters.
Основной способ синтеза 24-бромсоединений общей формулы I с кольцевыми субструктурами A,B,C,D в FA (фузидовая кислота/аналог фузидовой кислоты) из исходных материалов 201-206 (с теми же кольцевыми подструктурами A,B,C,D) показан на схеме 1:The basic method for the synthesis of 24-bromo compounds of general formula I with ring substructures A, B, C, D in FA (fusidic acid / fusidic acid analog) from starting materials 201-206 (with the same ring substructures A, B, C, D) is shown in diagram 1:
Примеры кольцевых подструктур A,B,C,D фузидовой кислоты и аналогов фузидовой кислоты, FA:Examples of ring substructures A, B, C, D of fusidic acid and analogues of fusidic acid, FA :
Условия: (a) ClCH2O(CO)R', Et3N, ДМФ (R' = Me или C(CH3)3), к.т.; (b) Br2, CCl4, 0°C; (c) DBU, CCl4 или CH3CN, к.т.; (d) DBU/водн. MeOH или K2CO3/MeOH, к.т.Conditions: (a) ClCH 2 O (CO) R ', Et 3 N, DMF (R' = Me or C (CH 3 ) 3 ), qt .; (b) Br 2 , CCl 4 , 0 ° C; (c) DBU, CCl 4 or CH 3 CN, qt .; (d) DBU / aq. MeOH or K 2 CO 3 / MeOH, k.t.
Фузидовая кислота или аналог фузидовой кислоты могут быть этерифицированы, например, хлорметилацетатом или хлорметилпивалатом, с использованием соответствующего растворителя, такого как диметилформамид, в присутствии подходящего основания, такого как триэтиламин. Сложный эфир может быть затем подвергнут бромированию с использованием брома в подходящем растворителе, таком как тетрахлорид углерода или ацетонитрил. Полученный дибромид (который обычно представляет собой смесь 24-диастереоизомеров) может быть подвергнут дегидробромированию путем обработки соответствующим основанием, таким как DBU, в соответствующем растворителе, таком как тетрахлорид углерода или ацетонитрил, с образованием преимущественно 24-бромфузидовой кислоты или сложноэфирного аналога фузидовой кислоты. При желании, сложный эфир может использоваться в качестве пролекарства соответствующей свободной кислоты I, например, в случае наличия легко гидролизуемой сложноэфирной группы. Альтернативно, сложный эфир может быть гидролизован с использованием подходящего основания, такого как DBU или K2CO3, в подходящем растворителе, таком как вода, содержащая метанол или этанол, с получением желаемых соединений общей структуры I (где Х = бром) в виде свободных кислот или солей. В другом варианте осуществления настоящего изобретения дибромид подвергают на одной стадии дегидробромированию и гидролизу с получением желаемого соединения I в виде свободной кислоты или в виде солей, например, при использовании описанных выше способов. В другом предпочтительном варианте фузидовую кислоту или аналог фузидовой кислоты подвергают непосредственному бромированию в соответствии со способами, описанными выше, с получением соответствующей дибромкислоты (которая обычно представляет смесь 24-диастереоизомеров). Далее дибромкислоту подвергают дегидробромированию, например, в соответствии со способами, описанными выше, с получением желаемых соединений общей структуры I (где Х = бром) в виде свободных кислот и необязательно в виде солей.Fusidic acid or an analogue of fusidic acid may be esterified, for example, with chloromethyl acetate or chloromethyl pivalate, using an appropriate solvent, such as dimethylformamide, in the presence of a suitable base such as triethylamine. The ester can then be brominated using bromine in a suitable solvent, such as carbon tetrachloride or acetonitrile. The resulting dibromide (which is usually a mixture of 24-diastereoisomers) can be dehydrobrominated by treatment with an appropriate base, such as DBU, in an appropriate solvent, such as carbon tetrachloride or acetonitrile, to form a predominantly 24-bromfusidic acid or ester analogue of fusidic acid. If desired, the ester can be used as a prodrug of the corresponding free acid I, for example, in the case of the presence of an easily hydrolyzable ester group. Alternatively, the ester can be hydrolyzed using a suitable base, such as DBU or K 2 CO 3 , in a suitable solvent, such as water containing methanol or ethanol, to give the desired compounds of general structure I (where X = bromo) as free acids or salts. In another embodiment of the present invention, the dibromide is subjected in one step to dehydrobromination and hydrolysis to obtain the desired compound I as a free acid or as salts, for example, using the methods described above. In another preferred embodiment, fusidic acid or an analogue of fusidic acid is directly brominated in accordance with the methods described above to give the corresponding dibromo acid (which is usually a mixture of 24-diastereoisomers). The dibromo acid is then subjected to dehydrobromination, for example, in accordance with the methods described above, to obtain the desired compounds of general structure I (where X = bromo) in the form of free acids and optionally in the form of salts.
Распространенный в настоящее время способ получения соединений формулы Ia, где Q1, Q2, A и В указаны выше, Y и Z вместе со связью С-17/C-20 образуют двойную связь между C-17 и C-20, или вместе представляют метилен, или оба обозначают водород, и X обозначает бром, проиллюстрирован на схеме 1a соответствующей реакцией (где FA обозначает кольцевые подструктуры A,B,C,D-фузидовой кислоты или аналога фузидовой кислоты, как показано на схеме 1):The currently common method for preparing compounds of formula Ia, wherein Q 1 , Q 2 , A and B are indicated above, Y and Z together with the C-17 / C-20 bond form a double bond between C-17 and C-20, or together are methylene, or both are hydrogen, and X is bromo, illustrated in Scheme 1a by the corresponding reaction (where FA is ring substructures A, B, C, D-fusidic acid or fusidic acid analogue, as shown in scheme 1):
Фузидовую кислоту или аналог фузидовой кислоты растворяют в подходящем растворителе, таком как уксусная кислота или С1-4алкиовый сложный эфир С1-4карбоновой кислоты, например этилацетат, изопропилацетат, трет-бутилацетат, и обрабатывают бромом, предпочтительно растворенным в том же растворителе, при температуре -10°C-20°С, предпочтительно при температуре 0°С-10°С, такой как 5°С, с получением 24,25-дибромированного промежуточного соединения. 24,25-дибромированное промежуточное соединение может быть выделено, необязательно, после добавления водного основания и/или восстановителя, такого как Na2SO3, и проводят разделение фаз путем выпаривания органического растворителя. Затем 24,25-дибромированное промежуточное соединение (необязательно без осуществления стадий выделения или очистки) подвергают дегидробромированию с получением соединения формулы Ia при взаимодействии раствора 24,25-дибромированного промежуточного соединения в подходящем растворителе, таком как С1-6спирт, например, метанол, этанол, 1-пропанол, изопропанол или бутанол, или вода, или смесь указанных растворителей, с подходящим основанием, например, при температуре кипения с обратным холодильником, или, например, при температуре от 50°С до 120°С, такой как в диапазоне 60°С-90°С, такой как в диапазоне 70°С-80°С, с получением дегидробромированного соединения формулы Ia в виде соли. Основание, используемое для получения дегидробромированных соединений формулы Ia, может быть соответствующим образом выбрано из солей щелочного металла или щелочноземельного металла на основе слабой кислоты, такой как угольная, фосфорная или борная кислота, например, это может быть карбонат калия или натрия, или может быть выбрано из оснований, таких как аммиак или С1-8замещенный аммиак, например, этиламин, диэтиламин, триэтиламин или пиперидин, или гидроксидов щелочного металла или щелочноземельного металла, таких как гидроксид натрия, гидроксид кальция или разбавленный гидроксид калия. Соединение формулы Ia в виде свободной кислоты может быть далее получено из соли путем подкисления соответствующей кислотой, такой как водный раствор фосфорной кислоты или уксусной кислоты. Соединение формулы Ia далее может быть подвергнуто очистке и рекристаллизации, например, как описано ниже в примерах 8 и 45, с получением чистого соединения Ia или преобразованию в легко гидролизуемый сложный эфир, например, в рамках процедуры, описанной в способе получения 1 и 2, или может быть превращено в подходящую соль, такую как натриевая соль, например, как описано ниже в примере 9.Fusidic acid or a fusidic acid analogue is dissolved in a suitable solvent such as acetic acid or a C 1-4 ester alkiovy C 1-4 carboxylic acid such as ethyl acetate, isopropyl acetate, tert-butyl acetate, and treated with bromine is preferably dissolved in the same solvent, at a temperature of −10 ° C. to 20 ° C., preferably at a temperature of 0 ° C. to 10 ° C., such as 5 ° C., to obtain a 24.25-dibromated intermediate. The 24.25-dibrominated intermediate may optionally be isolated after addition of an aqueous base and / or a reducing agent, such as Na 2 SO 3 , and the phases are separated by evaporation of the organic solvent. Then, the 24.25-dibrominated intermediate (optionally without performing isolation or purification steps) is subjected to dehydrobromination to give a compound of formula Ia by reacting a solution of the 24.25-dibromated intermediate in a suitable solvent, such as C 1-6 alcohol, for example methanol, ethanol, 1-propanol, isopropanol or butanol, or water, or a mixture of these solvents, with a suitable base, for example, at reflux temperature, or, for example, at a temperature of from 50 ° C to 120 ° C, such as in the range of 60 ° C-90 ° C, such as in the range of 70 ° C-80 ° C, to obtain the dehydrobrominated compound of formula Ia as a salt. The base used to prepare the dehydrobrominated compounds of formula Ia may be suitably selected from alkali metal or alkaline earth metal salts of a weak acid, such as carbonic, phosphoric or boric acid, for example, it may be potassium or sodium carbonate, or may be selected from bases such as ammonia or C 1-8 substituted ammonia, for example ethylamine, diethylamine, triethylamine or piperidine, or alkali metal or alkaline earth metal hydroxides such as sodium hydroxide, calcium hydroxide or diluted potassium hydroxide. The compound of formula Ia in the form of a free acid can be further obtained from the salt by acidification with an appropriate acid, such as an aqueous solution of phosphoric acid or acetic acid. The compound of formula Ia can then be subjected to purification and recrystallization, for example, as described below in examples 8 and 45, to obtain pure compound Ia or conversion to an easily hydrolyzable ester, for example, as part of the procedure described in production method 1 and 2, or can be converted into a suitable salt, such as a sodium salt, for example, as described below in example 9.
Основной способ, используемый для преобразования бромного заместителя в 24-ом положении соединения общей формулы I (Х = бром), в 24-замещенные соединения общей формулы I (Х = бром) показан на примере преобразования соединения 108 на схеме 2:The basic method used to convert the bromine substituent at the 24th position of the compound of general formula I (X = bromo) into 24-substituted compounds of general formula I (X = bromo) is shown by the example of the conversion of compound 108 in scheme 2:
Условия: (a) ClCH2O(CO)R', Et3N, ДМФ (R' = Me или C(CH3)3), к.т.; (d) DBU/водн. MeOH или K2CO3/MeOH, к.т.; (e) CuI, KI, HMPA, 120°C; (f) (R'= -CH2COPh) BrCH2COPh, KF, ДМФ, к.т.; (g) CuI, CiCl, HMPA, 120°C; (h) CF3Cu, HMPA, к.т.; (i) ArB(OR”)2*, Pd(PPh3)4, K2CO3, EtOH+толуол, 90°С.Conditions: (a) ClCH 2 O (CO) R ', Et 3 N, DMF (R' = Me or C (CH 3 ) 3 ), qt .; (d) DBU / aq. MeOH or K 2 CO 3 / MeOH, rt .; (e) CuI, KI, HMPA, 120 ° C; (f) (R ′ = —CH 2 COPh) BrCH 2 COPh, KF, DMF, qt .; (g) CuI, CiCl, HMPA, 120 ° C; (h) CF 3 Cu, HMPA, qt .; (i) ArB (OR ") 2 *, Pd (PPh 3 ) 4 , K 2 CO 3 , EtOH + toluene, 90 ° C.
(Fu = кольцевые подструктуры A,B,C,D-фузидовой кислоты)(Fu = ring substructures A, B, C, D-fusidic acid)
*см. примеры 36-43, иллюстрирующие процедуры с включением Ar и ArB(OR”)2 *cm. examples 36-43 illustrating procedures involving Ar and ArB (OR ”) 2
Ацетоксиметиловые сложные эфиры или пивалоилоксиметиловые сложные эфиры 24-бромфузидовой кислоты или аналога 24-бромфузидовой кислоты или могут быть гидролизованы до соответствующих свободных кислот, например, путем обработки метанолом и водным основанием. Бромкислоты далее нагревают с иодидом меди (I) и иодидом калия в HMPA при температуре 120°C с получением соответствующей 24-йодкислоты формулы I. Кислоты могут быть далее этерифицированы до соответствующих фенациловых сложных эфиров при обработке фенацилбромидом и фторидом калия в ДМФ. Фенациловые сложные эфиры дают соответствующие 24-трифторметиловые сложные эфиры, например, при взаимодействии с раствором трифторметилмеди в HMPA. В итоге, сложные эфиры могут быть преобразованы в свободные 24-трифторметилфузидовые кислоты (или аналоги фузидовой кислоты) формулы I при проведении гидролиза, например, щелочного гидролиза.Acetoxymethyl esters or pivaloyloxymethyl esters of 24-bromofusidic acid or an analogue of 24-bromofusidic acid or can be hydrolyzed to the corresponding free acids, for example, by treatment with methanol and an aqueous base. The bromic acids are further heated with copper (I) iodide and potassium iodide in HMPA at a temperature of 120 ° C. to give the corresponding 24-iodide acid of formula I. The acids can be further esterified to the corresponding phenacyl esters by treatment with phenacyl bromide and potassium fluoride in DMF. Phenacyl esters give the corresponding 24-trifluoromethyl esters, for example, by reaction with a solution of trifluoromethyl copper in HMPA. As a result, esters can be converted to the free 24-trifluoromethylfusidic acids (or fusidic acid analogues) of formula I by hydrolysis, for example, alkaline hydrolysis.
Альтернативно, 24-иодкислоты могут быть подвергнуты этерификации до своих ацетоксиметиловых сложных эфиров или пивалоилоксиметиловых сложных эфиров, как описано выше, после чего преобразованы в соответствующие 24-арильные или алкенильные сложные эфиры и т.п., в ходе соответствующих реакций сочетания, например, в рамках реакции сочетания типа Судзуки с арилбороновой кислотой или сложным эфиром, или замещены арилбороновой кислотой или сложным эфиром, как показано на схеме 2. В итоге соответствующие свободные кислоты соединений общей формулы I могут быть получены при проведении гидролиза сложного эфира, такого как щелочной гидролиз.Alternatively, 24-iodoacids can be esterified to their acetoxymethyl esters or pivaloyloxymethyl esters as described above, and then converted to the corresponding 24-aryl or alkenyl esters and the like, during corresponding coupling reactions, for example, to in the framework of a coupling reaction of the Suzuki type with an arylboronic acid or ester, or substituted with an arylboronic acid or ester, as shown in Scheme 2. As a result, the corresponding free acids of the compounds are of the general form s I can be prepared by carrying out ester hydrolysis such as alkaline hydrolysis.
В другом варианте ацетоксиметиловые сложные эфиры или пивалоилоксиметиловые сложные эфиры 24-бромфузидовой кислоты или аналога 24-бромфузидовой кислоты нагревают с иодидом меди (I) и хлоридом лития в HMPA с получением соответствующего 24-хлорсодержащего сложного эфира. Этот эфир дает свободные 24-хлоркислоты соединений общей формулы I после гидролиза, такого как щелочной гидролиз.In another embodiment, acetoxymethyl esters or pivaloyloxymethyl esters of 24-bromofusidic acid or a 24-bromofusidic acid analogue are heated with copper (I) iodide and lithium chloride in HMPA to give the corresponding 24-chlorine ester. This ester gives free 24-chloroacids of the compounds of general formula I after hydrolysis, such as alkaline hydrolysis.
Основной способ синтеза соединений I, включающий модификацию в кольце А в ходе реакций синтеза, проиллюстрирован применительно к синтезу соединений 123, 124 и 144 на схеме 3:The main method for the synthesis of compounds I, including the modification in ring A during synthesis reactions, is illustrated in relation to the synthesis of compounds 123, 124 and 144 in scheme 3:
Условия: (j) PhP3P, CBr4, бензол, к.т.; (k) K2CO3, MeOH, к.т.; (l) LiN3, ДМФ, к.т.Conditions: (j) PhP 3 P, CBr 4 , benzene, qt .; (k) K 2 CO 3 , MeOH, qt .; (l) LiN 3 , DMF, qt
Не ограничивающий пример модификации по типу замещения в одном из колец кольцевых подструктур A,B,C,D фузидовой кислоты, например, после введения 24-заместителя, показан на схеме 3 применительно к модификации в кольце А: например, ацетоксиметиловый сложный эфир или пивалоилоксиметиловый сложный эфир 24-бромфузидовой кислоты или аналога 24-бромфузидовой кислоты может быть подвергнут бромированию трифенилфосфином и тетрабромметаном с образованием инверсной конфигурации, соответствующего 3-β-бромсодержащего сложного эфира. Сложный эфир может быть необязательно подвергнут гидролизу до свободной кислоты формулы I. Указанная кислота может быть далее подвергнута модификации, например, как было показано, путем обработки азидом лития с образованием другой инверсной конфигурации, соответствующего 3-α-азидоэфира формулы I.A non-limiting example of a substitution modification in one of the rings of the ring substructures A, B, C, D of fusidic acid, for example, after the introduction of a 24-substituent, is shown in Scheme 3 as applied to the modification in ring A: for example, acetoxymethyl ester or pivaloyloxymethyl complex an ester of 24-bromofusidic acid or a 24-bromofusidic acid analogue may be brominated with triphenylphosphine and tetrabromomethane to form an inverse configuration corresponding to a 3-β-bromo-containing ester. The ester may optionally be hydrolyzed to the free acid of formula I. This acid may be further modified, for example, as shown by treatment with lithium azide to form another inverse configuration corresponding to the 3-α-azido ester of formula I.
Основной способ синтеза соединения I, включающий модификацию в кольце А и в кольце D в ходе реакций синтеза, проиллюстрирован применительно к синтезу соединений 112 и 113 на схеме 4:The main method for the synthesis of compound I, including the modification in ring A and ring D during synthesis reactions, is illustrated in relation to the synthesis of compounds 112 and 113 in scheme 4:
Условия: (m) Ac2O, пиридин, к.т.; (n) 1. 1 экв. водн. NaOH, МеОН, к.т., 2. водн. NaHCO3, 100°C; (o) 1. 1 экв. водн. NaOH, MeOH, к.т., 2. ClCH2(CO)C(CH3)3, ДМФ, к.т.; (p) Cl(CO)OPh, NaBr, DMF, 0°C; (q) Br2, CCl4, к.т.; (r) DBU, CH3CN, температура кипения с обратным холодильником; (s) 1. iPrSH, NaOH, ДМФ, к.т., 2. водн. NaOH, 60°C; (t) 1. 1 экв. водн. NaOH, MeOH, к.т.; 2. NaIO4, MeOH, к.т.Conditions: (m) Ac 2 O, pyridine, qt .; (n) 1. 1 equiv. aq. NaOH, Meon, KT, 2. aq. NaHCO 3 , 100 ° C; (o) 1. 1 equiv. aq. NaOH, MeOH, rt., 2. ClCH 2 (CO) C (CH 3 ) 3 , DMF, rt .; (p) Cl (CO) OPh, NaBr, DMF, 0 ° C; (q) Br 2 , CCl 4 , qt .; (r) DBU, CH 3 CN, reflux temperature; (s) 1. iPrSH, NaOH, DMF, qt, 2. aq. NaOH, 60 ° C; (t) 1.1 eq. aq. NaOH, MeOH, c .; 2. NaIO 4 , MeOH, KT
Синтез соединений 112 и 113 из фузидовой кислоты иллюстрирует приведенная неограничивающая процедура, в рамках которой 16-заместитель в кольце D может быть в ходе синтеза соединений общей формулы I изменен до алкилтио или алкилсульфинильной группы с 16-β-стереохимией. Временная защита 3-гидроксигруппы и карбоксигруппы может быть полезной для данной реакции, а бром в положение 24 может быть введен на соответствующей стадии синтеза: фузидовая кислота (201) может быть ацетилирована в положении С3 при использовании уксусного ангидрида и пиридина с образованием соединения (4). Соответствующую натриевую соль соединения (4) далее нагревают с водным раствором гидрокарбоната натрия с получением 16-α-гидроксисоединения (5) (с инверсией конфигурации в положении С16). Натриевая соль соединения (5) далее может быть, например, подвергнута этерификации хлорметилпивалатом с образованием соединения (6). Соединение (6) далее может быть обработано фенилхлорформиатом, диметилформамидом и бромидом натрия с образованием 16-α-бромсоединения (11) (при сохранении конфигурации в положении С16). Соединение (11) может быть подвергнуто бромированию с образованием 24,25-дибромного соединения (12), которое может быть подвергнуто дегидробромированию, например, с использованием DBU до 24-бромсоединения (13). Алкилирование изопропилтиолята натрия соединением (13) дает 16-β-изопропилтио промежуточное соединение (с инверсией конфигурации в положении С16), которое может быть подвергнуто гидролизу, например, водным основанием, с образованием 24-бром-3-α-гидрокси-16-β-изопропилтиокарбоновой кислоты (112) формулы I. Если желательно, соединение (112) может быть окислено (например, периодатом натрия) до соответствующего сульфоксида (113).The synthesis of compounds 112 and 113 from fusidic acid is illustrated by the following non-limiting procedure, in which the 16-substituent in ring D can be changed to an alkylthio or alkylsulfinyl group with 16-β-stereochemistry during the synthesis of compounds of general formula I. Temporary protection of the 3-hydroxy group and the carboxy group can be useful for this reaction, and the bromine at position 24 can be introduced at the corresponding synthesis stage: fusidic acid (201) can be acetylated at position C3 using acetic anhydride and pyridine to form compound (4) . The corresponding sodium salt of compound (4) is then heated with an aqueous solution of sodium bicarbonate to obtain the 16-α-hydroxy compound (5) (with the configuration inverted at position C16). The sodium salt of compound (5) can then be, for example, esterified with chloromethyl pivalate to form compound (6). Compound (6) can then be treated with phenylchloroformate, dimethylformamide and sodium bromide to form 16-α-bromo compound (11) (while maintaining the configuration at position C16). Compound (11) can be brominated to form 24.25-dibromic compound (12), which can be subjected to dehydrobromination, for example, using DBU to 24-bromo compound (13). Alkylation of sodium isopropylthiolate with compound (13) gives a 16-β-isopropylthio intermediate (with an inversion of configuration at position C16), which can be hydrolyzed, for example, with an aqueous base, to form 24-bromo-3-α-hydroxy-16-β isopropylthiocarboxylic acid (112) of the formula I. If desired, the compound (112) can be oxidized (for example, sodium periodate) to the corresponding sulfoxide (113).
СПОСОБЫ ПОЛУЧЕНИЯ И ПРИМЕРЫMETHODS FOR PRODUCING AND EXAMPLES
Основные сведенияBasic information
Все значения точек плавления приведены в некорректированном виде.All melting points are given in uncorrected form.
Значения химического сдвига в спектрах ядерно-магнитного резонанса (ЯМР) для 1Н (300 МГц) и 13С (75,6 МГц) (δ) (в м.д.) относятся, если особо не указано иное, к растворам дейтерохлороформа относительно внутреннего стандарта тетраметилсилана (δ=0,00) или дейтерохлороформа (δ=76,81 для 13С ЯМР). Значение мультиплета, либо определенного ((дуплет (д.), триплет (т), квартет (к)), либо неопределенного (м), в соответствующей средней точке дается, если не указан диапазон (с = синглет, ш. - широкий синглет). Реакционные смеси обычно обрабатывают следующим образом: проводят экстракцию органическим растворителем (что указывается), который встряхивают с водой и/или водными растворами солей или кислот (что также указывается); органические растворы обычно сушат над сульфатом натрия или магния и концентрируют при пониженном давлении на роторном испарителе. Хроматографию проводят на силикагеле, обычно с использованием этилацетата и петролейного эфира с низкой точкой кипения в качестве элюента. Используемое соотношение растворителей указывается в объемных соотношениях/процентах (объем:объем). Соответствующие фракции объединяют и концентрируют, проводя в некоторых случаях кристаллизацию или лиофильную сушку. Растворители включают: безводные растворители, которые обычно готовят с использованием хранящихся растворителей аналитической чистоты после просеивания их через молекулярные сита 4Е в течение нескольких дней перед использованием.The values of the chemical shift in the spectra of nuclear magnetic resonance (NMR) for 1 N (300 MHz) and 13 C (75.6 MHz) (δ) (ppm) relate, unless otherwise indicated, to solutions of deuterochloroform relative to internal standard tetramethylsilane (δ = 0.00) or deuterochloroform (δ = 76.81 for 13 C NMR). The value of the multiplet, either specific ((doublet (d), triplet (t), quartet (k)), or indefinite (m), is given at the corresponding midpoint if the range is not specified (c = singlet, w. - wide singlet The reaction mixtures are usually treated as follows: they are extracted with an organic solvent (as indicated), which is shaken with water and / or aqueous solutions of salts or acids (which is also indicated); organic solutions are usually dried over sodium or magnesium sulfate and concentrated under reduced pressure rotary ispa The chromatography is carried out on silica gel, usually using ethyl acetate and petroleum ether with a low boiling point as an eluent. The solvent ratio used is indicated in volumetric ratios / percent (volume: volume). The appropriate fractions are combined and concentrated, in some cases crystallizing or lyophilic drying. Solvents include: anhydrous solvents, which are usually prepared using stored solvents of analytical purity after sieving them through molecular sieve 4E for several days before use.
Получение промежуточных соединений для синтеза соединений IObtaining intermediate compounds for the synthesis of compounds I
Промежуточные соединения общей формулы Ib перечислены в таблице 1:Intermediates of general formula Ib are listed in table 1:
Примечания к формуле Ib и таблице 1: Преп. = Препарат; Преп. = процедура используется при получении других препаратов и в других примерах; Соед. - Соединение; Q2 = CH-OH(α);Notes to Formula Ib and Table 1: Prep. = Drug; Rev. = the procedure is used to obtain other drugs and in other examples; Connection - Connection; Q 2 = CH-OH (α);
-CH2- = [Y,Z]-C17-C20 образуют циклопропановое кольцо со стереохимией 17S, 20S-.H, H = 17S-H, 20S-H, that is, C17 and C20 are connected by a single bond;
-CH 2 - = [Y, Z] -C17-C20 form a cyclopropane ring with the stereochemistry 17S, 20S-.
Способы полученияProduction methods
Способ получения 1: Ацетоксиметиловый сложный эфир фузидовой кислоты (2а) Production Method 1 : Acetoxymethyl ester of fusidic acid (2a)
К раствору фузидовой кислоты (201) (128,6 г, 250 ммоль) в ДМФ (375 мл) добавляют Et3N (45 мл, 33 г, 320 ммоль) и смесь перемешивают в течение 30 минут при комнатной температуре. После этого добавляют хлорметилацетат (49 мл, 55 г, 500 ммоль) и реакционную смесь перемешивают в течение ночи при комнатной температуре, после чего промывают (EtOAc, вода) с получением неочищенного продукта. Неочищенный сложный эфир (2а) рекристаллизуют из изопропилового эфира с получением чистого соединения в виде бесцветного порошка, Т.пл. 103-105°С.To a solution of fusidic acid (201) (128.6 g, 250 mmol) in DMF (375 ml) was added Et 3 N (45 ml, 33 g, 320 mmol) and the mixture was stirred for 30 minutes at room temperature. After this, chloromethyl acetate (49 ml, 55 g, 500 mmol) was added and the reaction mixture was stirred overnight at room temperature and then washed (EtOAc, water) to obtain a crude product. The crude ester (2a) is recrystallized from isopropyl ether to give the pure compound as a colorless powder, mp. 103-105 ° C.
13C ЯМР (CDCl3): 170,4, 169,6, 168,4, 150,6, 132,7, 129,3, 122,9, 79,4, 74,4, 71,4, 68,2, 49,2, 48,7, 44,3, 39,5, 39,0, 37,1, 36,2, 36,2, 35,5, 32,4, 30,3, 30,0, 28,8, 28,3, 25,7, 24,2, 22,8, 20,9, 20,8, 20,7, 17,9, 17,7,15,9. 13 C NMR (CDCl 3 ): 170.4, 169.6, 168.4, 150.6, 132.7, 129.3, 122.9, 79.4, 74.4, 71.4, 68, 2, 49.2, 48.7, 44.3, 39.5, 39.0, 37.1, 36.2, 36.2, 35.5, 32.4, 30.3, 30.0, 28.8, 28.3, 25.7, 24.2, 22.8, 20.9, 20.8, 20.7, 17.9, 17.7.15.
Способ получения 2: Пивалоилоксиметиловый сложный эфир фузидовой кислоты (2b) Production Method 2 : Pivaloyloxymethyl ester of fusidic acid (2b)
По процедуре, приведенной для способа получения 1, при замещении хлорметилацетата хлорметилпавалатом, проводя реакцию при температуре 50°С в течение ночи, получают пивалоилоксиметиловый сложный эфир фузидовой кислоты (2b) в виде бесцветного аморфного вещества.According to the procedure described for Production Method 1, by replacing chloromethyl acetate with chloromethyl pavalate, reacting at a temperature of 50 ° C. overnight, pivaloyloxymethyl ester of fusidic acid (2b) is obtained in the form of a colorless amorphous substance.
13C ЯМР (CDCl3): 177,0, 170,2, 168,1, 150,9, 132,6, 129,3, 123,0, 79,8, 74,3, 71,4, 68,2, 49,3, 48,8, 44,3, 39,5, 39,0, 38,8, 37,0, 36,3, 36,1, 35,6, 32,3, 30,2, 30,0, 28,8, 28,3, 26,9, 25,7, 24,1, 22,9, 20,8, 17,9, 17,8, 15,9. 13 C NMR (CDCl 3 ): 177.0, 170.2, 168.1, 150.9, 132.6, 129.3, 123.0, 79.8, 74.3, 71.4, 68, 2, 49.3, 48.8, 44.3, 39.5, 39.0, 38.8, 37.0, 36.3, 36.1, 35.6, 32.3, 30.2, 30.0, 28.8, 28.3, 26.9, 25.7, 24.1, 22.9, 20.8, 17.9, 17.8, 15.9.
Способ получения 3: Ацетоксиметиловый сложный эфир 24R,S,25-дибромфузидовой кислоты (3а) Production Method 3 : Acetoxymethyl ester 24R, S, 25-dibromofusidic acid (3a)
Ацетоксиметиловый сложный эфир фузидовой кислоты (2а) (6 г, 10 ммоль) растворяют в CCl4 (40 мл) и добавляют раствор брома (0,56 мл, 1,76 г, 11 ммоль) в CCl4 (40 мл) в течение одного часа при постоянном перемешивании и охлаждении на ледяной бане. Полученный слегка желтый раствор используют на следующей стадии без дальнейшей очистки.Fusidic acid acetoxymethyl ester (2a) (6 g, 10 mmol) was dissolved in CCl 4 (40 ml) and a solution of bromine (0.56 ml, 1.76 g, 11 mmol) in CCl 4 (40 ml) was added over a period of one hour with constant stirring and cooling in an ice bath. The resulting slightly yellow solution was used in the next step without further purification.
1H ЯМР (CDCl3): 5,91 (м, 1H), 5,78 (ш.с., 2H), 4,36 (ш.с., 1H), 4,20 (м, 1H), 3,75 (ш.с., 1H), 3,16 (м, 1H), 2,80-1,00 (м, 20H), 2,10 (с, 3H), 1,97 (ш.с, 6H), 1,80 (с, 3H), 1,38 (с, 3H), 0,96 (с, 3H), 0,95 (с, 3H), 0,91 (д, 3H). 1 H NMR (CDCl 3 ): 5.91 (m, 1H), 5.78 (br s, 2H), 4.36 (br s, 1H), 4.20 (m, 1H), 3.75 (br s, 1H), 3.16 (m, 1H), 2.80-1.00 (m, 20H), 2.10 (s, 3H), 1.97 (br s 6H), 1.80 (s, 3H), 1.38 (s, 3H), 0.96 (s, 3H), 0.95 (s, 3H), 0.91 (d, 3H).
Способ получения 4: Пивалоилоксиметиловый сложный эфир 24R,S,25-дибромфузидовой кислоты (3b) Production Method 4 : Pivaloyloxymethyl ester 24R, S, 25-dibromofusidic acid (3b)
По процедуре, приведенной для способа получения 3, при замещении ацетоксиметилового сложного эфира фузидовой кислоты (2а) пивалоилоксиметиловым сложным эфиром фузидовой кислоты (2b), после концентрирования реакционной смеси и очистки продукта методом колоночной флэш-хроматографии (гексан:EtOAc 50:50, в качестве элюента) получают указанное в заголовке соединение 3b в виде бесцветной пены.According to the procedure described for production method 3, when substituting fusidic acid acetoxymethyl ester (2a) with fusidic acid pivaloyloxymethyl ester (2b), after concentrating the reaction mixture and purifying the product by flash column chromatography (hexane: EtOAc 50:50, as eluent) give the title compound 3b as a colorless foam.
13C ЯМР (CDCl3): 177,0, 170,2, 170,2, 167,7, 167,6, 153,0, 153,0, 127,7, 80,1, 80,0, 74,3, 71,4, 68,5, 68,4, 68,2, 68,1, 66,2, 65,8, 60,4, 49,3, 49,2, 48,9, 48,9 44,5 39,5, 39,0 38,8, 37,0, 36,3, 36,1, 35,8, 35,2, 35,1, 32,3, 31,6, 30,2, 30,0, 28,5, 28,2, 28,2, 27,7, 26,9, 24,1, 24,1, 22,8, 22,7, 20,8, 20,8, 18,1, 18,0, 16,0, 14,2. 13 C NMR (CDCl 3 ): 177.0, 170.2, 170.2, 167.7, 167.6, 153.0, 153.0, 127.7, 80.1, 80.0, 74, 3, 71.4, 68.5, 68.4, 68.2, 68.1, 66.2, 65.8, 60.4, 49.3, 49.2, 48.9, 48.9 44 5 39.5, 39.0 38.8, 37.0, 36.3, 36.1, 35.8, 35.2, 35.1, 32.3, 31.6, 30.2, 30 , 0, 28.5, 28.2, 28.2, 27.7, 26.9, 24.1, 24.1, 22.8, 22.7, 20.8, 20.8, 18.1 , 18.0, 16.0, 14.2.
Способ получения 5: 3-ацетилфузидовая кислота (4) The method of obtaining 5 : 3-acetylfusidic acid (4)
Фузидовую кислоту (201) (74,3 г, 0,144 моль) растворяют в пиридине (75 мл, 74 г, 0,93 моль) и уксусном ангидриде (75 мл, 81 г, 0,79 моль) и полученную реакционную смесь перемешивают при комнатной температуре в течение трех часов, после чего реакция завершается. Ацетилированный продукт осаждают при добавлении льда и воды. Рекристаллизация из смеси метанол/вода дает чистое соединение (4).Fusidic acid (201) (74.3 g, 0.144 mol) was dissolved in pyridine (75 ml, 74 g, 0.93 mol) and acetic anhydride (75 ml, 81 g, 0.79 mol) and the resulting reaction mixture was stirred at room temperature for three hours, after which the reaction is complete. The acetylated product is precipitated by the addition of ice and water. Recrystallization from methanol / water gives the pure compound (4).
13C ЯМР (CDCl3): 174,5, 171,0, 170,6, 151,1, 132,7, 129,7, 123,0, 74,4, 74,2, 68,3, 49,1, 48,8, 44,3, 39,4, 39,0, 37,8, 37,0, 35,8, 34,8, 32,7, 31,1, 28,7, 28,4, 27,4, 25,7, 24,4, 22,6, 21,3, 20,6, 20,6, 18,1, 17,8, 15,5. 13 C NMR (CDCl 3 ): 174.5, 171.0, 170.6, 151.1, 132.7, 129.7, 123.0, 74.4, 74.2, 68.3, 49, 1, 48.8, 44.3, 39.4, 39.0, 37.8, 37.0, 35.8, 34.8, 32.7, 31.1, 28.7, 28.4, 27.4, 25.7, 24.4, 22.6, 21.3, 20.6, 20.6, 18.1, 17.8, 15.5.
Способ получения 6: 3-ацетил-16-деацетокси-16α-гидроксифузидовая кислота (5) The method of obtaining 6 : 3-acetyl-16-deacetoxy-16α-hydroxyfusidic acid (5)
3-ацетоксифузидовую кислоту (4) (9,95 г, 17,8 ммоль) растворяют в MeOH (250 мл) и нейтрализуют эквивалентным количеством водного NaOH (примерно 9 мл, 2М). Растворители выпаривают и к остатку добавляют воду (150 мл). Смесь нагревают до температуры кипения с обратным холодильником и добавляют в течение 30 минут 20 мл насыщенного водного раствора NaHCO3 (примерно 1 M). Полученный прозрачный раствор нагревают до температуры 100°С в течение восьми часов, после чего образуется нерастворимый побочный продукт (соответствующий лактон). Лактон удаляют фильтрованием и фильтрат подкисляют с помощью HCl (20 мл, 4М) и экстрагируют EtOAc. Органическую фазу промывают водой, сушат с использованием MgSO4 и концентрируют при пониженном давлении с получением указанного в заголовке соединения (5), которое используют на следующей стадии без дальнейшей очистки.3-acetoxyfusidic acid (4) (9.95 g, 17.8 mmol) was dissolved in MeOH (250 ml) and neutralized with an equivalent amount of aqueous NaOH (about 9 ml, 2M). The solvents were evaporated and water (150 ml) was added to the residue. The mixture was heated to reflux and 20 ml of saturated aqueous NaHCO 3 solution (about 1 M) was added over 30 minutes. The resulting clear solution is heated to a temperature of 100 ° C for eight hours, after which an insoluble by-product (corresponding lactone) is formed. The lactone was removed by filtration and the filtrate was acidified with HCl (20 ml, 4M) and extracted with EtOAc. The organic phase is washed with water, dried using MgSO 4 and concentrated under reduced pressure to obtain the title compound (5), which is used in the next step without further purification.
13C ЯМР (CDCl3): 174,2, 171,2, 164,7, 132,5, 127,6, 123,2, 74,2, 72,2, 68,4, 49,1, 47,4, 43,9, 39,5, 39,2, 37,7, 36,9, 35,9, 34,9, 32,6, 31,0, 29,1, 28,4, 27,3, 25,7, 24,5, 22,7, 21,4, 20,7, 18,4, 17,9, 15,5. 13 C NMR (CDCl 3 ): 174.2, 171.2, 164.7, 132.5, 127.6, 123.2, 74.2, 72.2, 68.4, 49.1, 47, 4, 43.9, 39.5, 39.2, 37.7, 36.9, 35.9, 34.9, 32.6, 31.0, 29.1, 28.4, 27.3, 25.7, 24.5, 22.7, 21.4, 20.7, 18.4, 17.9, 15.5.
Способ получения 7: Пивалоилоксиметиловый сложный эфир 3-ацетил-16-деацетокси-16α-гидроксифузидовой кислоты (6) Production Method 7 : 3-Acetyl-16-deacetoxy-16α-hydroxyfusidic acid pivaloyloxymethyl ester (6)
3-ацетил-16-деацетокси-16α-гидроксифузидовую кислоту (5) (39,7 г, 77 ммоль) растворяют в MeOH (250 мл) и нейтрализуют 1 экв. водного NaOH. Растворитель выпаривают и остаток перерастворяют в ДМФ (450 мл). Добавляют хлорметилпивалат (13,4 мл, 13,9 г, 92 ммоль) в течение 30 минут при постоянном перемешивании и охлаждении льдом. Полученную смесь перемешивают в течение ночи при комнатной температуре, после чего ее промывают (EtOAc, водн. CaCl2, вода, насыщенный NaCl), сушат с использованием MgSO4 и концентрируют при пониженном давлении с получением указанного в заголовке соединения (6) в виде масла, которое используют на следующей стадии без дальнейшей очистки (способ получения 11).3-Acetyl-16-deacetoxy-16α-hydroxyfusidic acid (5) (39.7 g, 77 mmol) was dissolved in MeOH (250 ml) and neutralized with 1 equivalent. aqueous NaOH. The solvent was evaporated and the residue was redissolved in DMF (450 ml). Chloromethyl pivalate (13.4 ml, 13.9 g, 92 mmol) was added over 30 minutes with constant stirring and cooling with ice. The resulting mixture was stirred overnight at room temperature, after which it was washed (EtOAc, aq. CaCl 2 , water, saturated with NaCl), dried using MgSO 4 and concentrated under reduced pressure to obtain the title compound (6) as an oil which is used in the next step without further purification (production method 11).
13C ЯМР (CDCl3): 177,2, 171,0, 168,6, 164,6, 132,6, 127,2, 123,1, 80,0, 74,1, 72,1, 68,4, 49,1, 47,4, 43,7, 39,5, 39,4, 38,8, 37,7, 36,9, 36,0, 34,9, 32,6, 31,0, 28,9, 28,0, 27,4, 26,9, 25,7, 24,5, 22,6, 21,3, 20,7, 18,4, 17,8, 15,5. 13 C NMR (CDCl 3 ): 177.2, 171.0, 168.6, 164.6, 132.6, 127.2, 123.1, 80.0, 74.1, 72.1, 68, 4, 49.1, 47.4, 43.7, 39.5, 39.4, 38.8, 37.7, 36.9, 36.0, 34.9, 32.6, 31.0, 28.9, 28.0, 27.4, 26.9, 25.7, 24.5, 22.6, 21.3, 20.7, 18.4, 17.8, 15.5.
Способ получения 8: Ацетоксиметиловый сложный эфир 16-деацетокси-16β-тиоацетилфузидовой кислоты (8) Production Method 8 : Acetoxymethyl ester of 16-deacetoxy-16β-thioacetylfusidic acid (8)
По процедуре, приведенной для способа получения 1, при замене фузидовой кислоты 16-деацетокси-16β-тиоацетилфузидовой кислотой (202) (von Daehne, W. et al., Adv. Appl. Microbiol., 1979, vol. 25, p. 95-146) и с использованием по 10 экв. каждого из Et3N и хлорметилацетата, при дальнейшей очистке неочищенного продукта колоночной флэш-хроматографией с использованием в качестве элюента смеси петролейный эфир:EtOAc (1:1) получают указанное в заголовке соединение (8).According to the procedure described for production method 1, when replacing fusidic acid with 16-deacetoxy-16β-thioacetylfusidic acid (202) (von Daehne, W. et al., Adv. Appl. Microbiol. , 1979, vol. 25, p. 95 -146) and using 10 equiv. each of Et 3 N and chloromethyl acetate, upon further purification of the crude product by flash column chromatography using petroleum ether: EtOAc (1: 1) as the eluent, the title compound (8) is obtained.
13C ЯМР (CDCl3): 194,9, 169,5, 168,4, 151,3, 132,7, 129,5, 122,9, 80,0, 71,4, 68,3, 49,2, 49,0, 45,7, 43,7, 41,4, 39,7, 37,2, 36,3, 35,9, 35,7, 32,7, 30,4, 30,0, 29,9, 29,3, 28,3, 25,7, 24,4, 22,4, 20,7, 20,6, 18,6, 17,7, 16,0. 13 C NMR (CDCl 3 ): 194.9, 169.5, 168.4, 151.3, 132.7, 129.5, 122.9, 80.0, 71.4, 68.3, 49, 2, 49.0, 45.7, 43.7, 41.4, 39.7, 37.2, 36.3, 35.9, 35.7, 32.7, 30.4, 30.0, 29.9, 29.3, 28.3, 25.7, 24.4, 22.4, 20.7, 20.6, 18.6, 17.7, 16.0.
Способ получения 9: Ацетоксиметиловый сложный эфир 16-деацетокси-16β-этоксифузидовой кислоты (9) Production Method 9 : Acetoxymethyl ester of 16-deacetoxy-16β-ethoxyfusidic acid (9)
По процедуре, приведенной для способа получения 1, при замене фузидовой кислоты калиевой солью 16-деацетокси-16β-этоксифузидовой кислотой (203) (von Daehne, W. et al., Adv. Appl. Microbiol., 1979, vol.25, p. 95-146), без Et3N, но с использованием 10 экв. хлорметилацетата, при дальнейшей очистке неочищенного продукта колоночной флэш-хроматографией с использованием в качестве элюента смеси петролейный эфир:EtOAc (1:1) получают указанное в заголовке соединение (9).According to the procedure described for production method 1, when fusidic acid is replaced with potassium salt of 16-deacetoxy-16β-ethoxyfusidic acid (203) (von Daehne, W. et al., Adv. Appl. Microbiol. , 1979, vol. 25, p . 95-146), without Et 3 N, but using 10 equiv. chloromethyl acetate, upon further purification of the crude product by flash column chromatography using petroleum ether: EtOAc (1: 1) as the eluent, the title compound (9) is obtained.
13C ЯМР (CDCl3): 169,7, 169,6, 151,2, 132,4, 128,6, 123,2, 79,6, 78,8, 71,4, 68,4, 65,2, 49,2, 49,0, 43,3, 39,5, 37,0, 36,3, 36,2, 35,8, 35,5, 32,5, 30,2, 30,0, 28,8, 28,2, 25,7, 24,1, 22,8, 20,9, 20,8, 17,8, 17,7, 16,0, 15,3. 13 C NMR (CDCl 3 ): 169.7, 169.6, 151.2, 132.4, 128.6, 123.2, 79.6, 78.8, 71.4, 68.4, 65, 2, 49.2, 49.0, 43.3, 39.5, 37.0, 36.3, 36.2, 35.8, 35.5, 32.5, 30.2, 30.0, 28.8, 28.2, 25.7, 24.1, 22.8, 20.9, 20.8, 17.8, 17.7, 16.0, 15.3.
Способ получения 10: Ацетоксиметиловый сложный эфир 16-деацетокси-16β-(2',2',2'-трифторэтокси)фузидовой кислоты (10) Production Method 10 : Acetoxymethyl ester of 16-deacetoxy-16β- (2 ', 2', 2'-trifluoroethoxy) fusidic acid (10)
По процедуре, приведенной для способа получения (1), при замене фузидовой кислоты 16-деацетокси-16β-(2',2',2'-трифторэтокси)фузидовой кислотой (204) (von Daehne, W. et al., Adv. Appl. Microbiol., 1979, vol.25, p. 95-146) и с использованием по 10 экв. каждого из Et3N и хлорметилацетата, при дальнейшей очистке неочищенного продукта колоночной флэш-хроматографией с использованием в качестве элюента смеси петролейный эфир:EtOAc (1:1) получают указанное в заголовке соединение (10).According to the procedure described for the production method (1), when replacing fusidic acid with 16-deacetoxy-16β- (2 ', 2', 2'-trifluoroethoxy) fusidic acid (204) (von Daehne, W. et al., Adv. Appl. Microbiol ., 1979, vol. 25, p. 95-146) and using 10 eq. each of Et 3 N and chloromethyl acetate, upon further purification of the crude product by flash column chromatography using petroleum ether: EtOAc (1: 1) as the eluent, the title compound (10) is obtained.
13C ЯМР (CDCl3): 169,7, 169,1, 151,0, 132,6, 129,9, 123,7, 123,0, 80,1, 79,5, 71,4, 68,3, 67,8, 49,1, 49,0, 43,8, 39,5, 37,1, 36,3, 36,2, 35,8, 35,5, 32,6, 30,3, 30,0, 28,6, 28,2, 25,7, 24,3, 22,7, 20,8, 20,7, 17,7, 17,6, 15,9. 13 C NMR (CDCl 3 ): 169.7, 169.1, 151.0, 132.6, 129.9, 123.7, 123.0, 80.1, 79.5, 71.4, 68, 3, 67.8, 49.1, 49.0, 43.8, 39.5, 37.1, 36.3, 36.2, 35.8, 35.5, 32.6, 30.3, 30.0, 28.6, 28.2, 25.7, 24.3, 22.7, 20.8, 20.7, 17.7, 17.6, 15.9.
Способ получения 11: Пивалоилоксиметиловый сложный эфир 3-ацетил-16α-бром-16-деацетоксифузидовой кислоты (11) Production Method 11 : 3-Acetyl-16α-bromo-16-deacetoxyfusidic acid pivaloyloxymethyl ester (11)
Пивалоилоксиметиловый сложный эфир 3-ацетил-16-деацетокси-16α-гидроксифузидовой кислоты (6) (22,8 г, 36,1 ммоль) растворяют в ДМФ (200 мл) и охлаждают на ледяной бане в атмосфере аргона при постоянном перемешивании. К раствору добавляют бромид натрия (18,6 г, 181 ммоль) и полученную смесь перемешивают в течение одного часа. Добавляют фенилхлорформиат (22,8 мл, 28,3 г, 181 ммоль) в течение одного часа при температуре 0°С и затем перемешивают в течение 18 часов при комнатной температуре. Реакционную смесь промывают (EtOAc, водн. CaCl2, вода, насыщ. NaCl), сушат с использованием MgSO4 и концентрируют при пониженном давлении с получением неочищенного продукта. Неочищенный продукт очищают колоночной флэш-хроматографией (10%-30% EtOAc в петролейном эфире, в качестве элюента) с получением указанного в заголовке соединения (11) в виде масла.3-Acetyl-16-deacetoxy-16α-hydroxyfusidic acid pivaloyloxymethyl ester (6) (22.8 g, 36.1 mmol) was dissolved in DMF (200 ml) and cooled in an ice bath under argon atmosphere with constant stirring. Sodium bromide (18.6 g, 181 mmol) was added to the solution, and the resulting mixture was stirred for one hour. Phenylchloroformate (22.8 ml, 28.3 g, 181 mmol) is added over one hour at 0 ° C. and then stirred for 18 hours at room temperature. The reaction mixture was washed (EtOAc, aq. CaCl 2 , water, sat. NaCl), dried using MgSO 4 and concentrated under reduced pressure to obtain a crude product. The crude product was purified by flash column chromatography (10% -30% EtOAc in petroleum ether as eluent) to give the title compound (11) as an oil.
13C ЯМР (CDCl3): 177,3, 171,0, 167,5, 154,8, 132,6, 129,5, 123,0, 79,8, 74,1, 68,2, 50,6, 49,3, 48,8, 43,5, 42,0, 39,5, 38,9, 37,6, 36,9, 35,8, 35,0, 32,5, 30,9, 28,6, 28,3, 27,3, 27,0, 25,7, 24,3, 22,8, 21,3, 20,7, 17,8, 17,4, 15,5. 13 C NMR (CDCl 3 ): 177.3, 171.0, 167.5, 154.8, 132.6, 129.5, 123.0, 79.8, 74.1, 68.2, 50, 6, 49.3, 48.8, 43.5, 42.0, 39.5, 38.9, 37.6, 36.9, 35.8, 35.0, 32.5, 30.9, 28.6, 28.3, 27.3, 27.0, 25.7, 24.3, 22.8, 21.3, 20.7, 17.8, 17.4, 15.5.
Способ получения 12: Пивалоилоксиметиловый сложный эфир 3-ацетил-16-деацетокси-16α-24,25-трибромфузидовой кислоты (12) Production Method 12 : 3-Acetyl-16-deacetoxy-16α-24,25-tribromofusidic acid pivaloyloxymethyl ester (12)
По процедуре, приведенной для способа получения (3), при замещении ацетоксиметилового сложного эфира фузидовой кислоты (2а) пивалоилоксиметиловым сложным эфиром 3-ацетил-16α-бром-16-деацетоксифузидовой кислотой (11) получают указанное в заголовке соединение (12) в виде бесцветной пены.According to the procedure described for production method (3), when substituting fusidic acid ester of acetoxymethyl ester (2a) with 3-acetyl-16α-bromo-16-deacetoxyfusidic acid pivaloyloxymethyl ester (11), the title compound (12) is obtained as a colorless foam.
13H ЯМР (CDCl3): 5,87 (м, 2H), 5,64 (ш.т., 1H), 4,93 (ш.с., 1H), 4,35 (ш.с., 1H), 4,14 (дд, 1H), 3,46 (ш.д., 1H), 2,80-1,00 (м, 20H), 2,07 (с, 3H), 1,97 (с, 3H), 1,84 (с, 3H), 1,49 (с, 3H), 1,22 (с, 9H), 0,98 (с, 3H), 0,83 (д, 3H), 0,78 (с, 3H). 13 H NMR (CDCl 3 ): 5.87 (m, 2H), 5.64 (br, 1H), 4.93 (br, 1H), 4.35 (br, 1H), 4.14 (dd, 1H), 3.46 (bd, 1H), 2.80-1.00 (m, 20H), 2.07 (s, 3H), 1.97 ( s, 3H), 1.84 (s, 3H), 1.49 (s, 3H), 1.22 (s, 9H), 0.98 (s, 3H), 0.83 (d, 3H), 0.78 (s, 3H).
Способ получения 13: Пивалоилоксиметиловый сложный эфир 3-ацетил-16-деацетокси-16α,24-дибромфузидовой кислоты (13) Production Method 13 : 3-Acetyl-16-deacetoxy-16α, 24-dibromofusidic acid pivaloyloxymethyl ester (13)
Пивалоилоксиметиловый сложный эфир 3-ацетил-16-деацетокси-16α-24,25-трибромфузидовой кислоты (12) (14,4 г, 16,4 ммоль) и DBU (7,4 мл, 7,6 г, 49 ммоль) растворяют в ацетонитриле (200 мл) и полученный раствор нагревают в течение пяти часов при температуре 50°С в атмосфере аргона при постоянном перемешивании. Реакционную смесь концентрируют при пониженном давлении и промывают (EtOAc, вода, насыщ. NaCl). Неочищенный продукт очищают колоночной флэш-хроматографией (10%-15% EtOAc в петролейном эфире, в качестве элюента) с получением указанного в заголовке соединения (13) в виде кристаллического продукта.3-Acetyl-16-deacetoxy-16α-24.25-tribromofusidic acid pivaloyloxymethyl ester (12) (14.4 g, 16.4 mmol) and DBU (7.4 ml, 7.6 g, 49 mmol) are dissolved in acetonitrile (200 ml) and the resulting solution is heated for five hours at a temperature of 50 ° C in argon atmosphere with constant stirring. The reaction mixture was concentrated under reduced pressure and washed (EtOAc, water, sat. NaCl). The crude product was purified by flash column chromatography (10% -15% EtOAc in petroleum ether as eluent) to give the title compound (13) as a crystalline product.
1H ЯМР (CDCl3) 5,87 (д, 1H) 5,84 (д, 1H), 5,64 (ш.т. 1H), 4,94 (ш.с., 1H), 4,36 (ш.с, 1H), 3,45 (ш.д., 1H), 2,75-2,50 (м, 5H), 2,30-1,00 (м, 15H), 2,07 (с, 3H), 1,85 (с, 3H), 1,78 (с., 3H), 1,46 (с, 3H), 1,23 (с, 9H), 0,98 (с, 3H), 0,83 (дд, 3H), 0,77 (с, 3H). 1 H NMR (CDCl 3 ) 5.87 (d, 1H) 5.84 (d, 1H), 5.64 (bt, 1H), 4.94 (bt, 1H), 4.36 (br.s, 1H), 3.45 (br, 1H), 2.75-2.50 (m, 5H), 2.30-1.00 (m, 15H), 2.07 ( s, 3H), 1.85 (s, 3H), 1.78 (s, 3H), 1.46 (s, 3H), 1.23 (s, 9H), 0.98 (s, 3H) 0.83 (dd, 3H); 0.77 (s, 3H).
Способ получения 14: Ацетоксиметиловый сложный эфир 17S,20S-дигидрофузидовой кислоты (14) Production Method 14 : Acetoxymethyl ester 17S, 20S-dihydrofusidic acid (14)
По процедуре, приведенной для способа получения (1), при замене фузидовой кислоты 17S,20S-дигидрофузидовой кислотой (205) (von Duvold, T. et al., J. Med. Chem., 2001, vol. 44, p. 3125-3131), с использованием по 10 экв. каждого из Et3N и хлорметилацетата, при дальнейшей очистке неочищенного продукта колоночной флэш-хроматографией с использованием в качестве элюента смеси петролейный эфир:EtOAc (1:1) получают указанное в заголовке соединение (14).According to the procedure described for the production method (1), when replacing fusidic acid 17S, 20S-dihydrofusidic acid (205) (von Duvold, T. et al., J. Med. Chem. , 2001, vol. 44, p. 3125 -3131) using 10 eq. each of Et 3 N and chloromethyl acetate, upon further purification of the crude product by flash column chromatography using petroleum ether: EtOAc (1: 1) as the eluent, the title compound (14) is obtained.
13C ЯМР (CDCl3): 173,8, 170,0, 169,8, 132,4, 123,3, 78,7, 76,5, 71,4, 68,8, 49,3, 45,7, 44,1, 40,6, 38,3, 37,1, 36,3, 34,3, 32,7, 32,5, 30,3, 30,0, 25,7, 25,2, 23,7, 22,8, 21,0, 20,9, 20,7, 17,7, 17,2, 16,0. 13 C NMR (CDCl 3 ): 173.8, 170.0, 169.8, 132.4, 123.3, 78.7, 76.5, 71.4, 68.8, 49.3, 45, 7, 44.1, 40.6, 38.3, 37.1, 36.3, 34.3, 32.7, 32.5, 30.3, 30.0, 25.7, 25.2, 23.7, 22.8, 21.0, 20.9, 20.7, 17.7, 17.2, 16.0.
Способ получения 15: Ацетоксиметиловый сложный эфир 17S,20S-метиленфузидовой кислоты (15) Production Method 15 : Acetoxymethyl ester 17S, 20S-methylenefusidic acid (15)
По процедуре, приведенной для способа получения (1), при замене фузидовой кислоты 17S,20S-метиленфузидовой кислотой (206) (Duvold, T. et al., Bioorg. Med. Chem.Lett., 2002, vol. 12, p. 3569-3572), с использованием по 10 экв. каждого из Et3N и хлорметилацетата, при дальнейшей очистке неочищенного продукта колоночной флэш-хроматографией с использованием в качестве элюента смеси петролейный эфир:EtOAc (1:1) получают указанное в заголовке соединение (15).According to the procedure described for the production method (1), when replacing fusidic acid 17S, 20S-methylenefusidic acid (206) (Duvold, T. et al., Bioorg. Med. Chem. Lett. , 2002, vol. 12, p. 3569-3572) using 10 eq. each of Et 3 N and chloromethyl acetate, upon further purification of the crude product by flash column chromatography using petroleum ether: EtOAc (1: 1) as the eluent, the title compound (15) is obtained.
13C ЯМР (CDCl3): 171,5, 170,1, 169,6, 132,2, 123,6, 79,1, 78,8, 71,4, 68,3, 49,7, 48,5, 42,6, 40,1, 39,9, 38,6, 37,1, 36,4, 36,3, 36,1, 34,6, 32,3, 31,8, 30,3, 29,9, 26,0, 25,7, 24,1, 22,9, 20,7, 20,7, 18,9, 18,0, 17,6, 16,0. 13 C NMR (CDCl 3 ): 171.5, 170.1, 169.6, 132.2, 123.6, 79.1, 78.8, 71.4, 68.3, 49.7, 48, 5, 42.6, 40.1, 39.9, 38.6, 37.1, 36.4, 36.3, 36.1, 34.6, 32.3, 31.8, 30.3, 29.9, 26.0, 25.7, 24.1, 22.9, 20.7, 20.7, 18.9, 18.0, 17.6, 16.0.
Способ получения 16: Фенациловый сложный эфир 24-иодфузидовой кислоты (7) Production Method 16 : 24-Iodfusidic Acid Phenacyl Ester (7)
Смесь фенацилбромида (0,42 г, 2,1 ммоль), фторида калия (0,27 г, 4,6 ммоль) и ДМФ (10 мл) перемешивают в течение пяти минут при температуре 90°С в атмосфере аргона. Добавляют 24-иодфузидовую кислоту (125I) (1,35 г, 2,1 ммоль) и полученную смесь перемешивают в течение одного часа при температуре 90°С. Реакционную смесь обрабатывают (диэтиловый эфир, вода, насыщ. NaCl, MgSO4) и концентрируют при пониженном давлении, получая указанное в заголовке соединение (7) в виде аморфного порошка.A mixture of phenacyl bromide (0.42 g, 2.1 mmol), potassium fluoride (0.27 g, 4.6 mmol) and DMF (10 ml) was stirred for five minutes at a temperature of 90 ° C in an argon atmosphere. 24-Iodfusidic acid ( 125 I) (1.35 g, 2.1 mmol) was added and the resulting mixture was stirred for one hour at a temperature of 90 ° C. The reaction mixture was treated (diethyl ether, water, sat. NaCl, MgSO 4 ) and concentrated under reduced pressure to obtain the title compound (7) as an amorphous powder.
13C ЯМР (CDCl3): 171,1, 170,5, 168,6, 152,3, 137,4, 134,3, 133,8, 128,9, 128,2, 127,8, 100,3, 74,4, 71,4, 68,2, 65,8, 60,4, 49,3, 48,9, 44,7, 41,6, 39,5, 39,1, 37,0, 36,4, 36,1, 36,0, 32,2, 31,7, 30,2, 30,0, 28,9, 24,0, 22,9, 21,0, 20,9, 19,4, 18,0, 16,0, 14,2. 13 C NMR (CDCl 3 ): 171.1, 170.5, 168.6, 152.3, 137.4, 134.3, 133.8, 128.9, 128.2, 127.8, 100, 3, 74.4, 71.4, 68.2, 65.8, 60.4, 49.3, 48.9, 44.7, 41.6, 39.5, 39.1, 37.0, 36.4, 36.1, 36.0, 32.2, 31.7, 30.2, 30.0, 28.9, 24.0, 22.9, 21.0, 20.9, 19, 4, 18.0, 16.0, 14.2.
Способ получения 17: Фенациловый сложный эфир 24-трифторметилфузидовой кислоты (16) Production Method 17 : 24-Trifluoromethylfusidic Acid Phenacyl Ester (16)
Раствор комплексного соединения трифторметилмеди в HMPA (Kobayashi, Y. et al., Tetrahedron. Lett., 1979, Vol. 42, p. 4071-4072), полученного из трифторметилиодида (0,43 г, 2,2 ммоль) и порошка меди (0,32 г, 5 мг At) в HMPA (1,5 мл), добавляют к фенациловому сложному эфиру 24-иодфузидовой кислоты (7) (190 мг, 0,25 ммоль). Полученную смесь перемешивают в закрытом флаконе в течение 3 дней при комнатной температуре в атмосфере аргона, после чего обрабатывают EtOAc, водой и насыщенным раствором NaCl, сушат и концентрируют при пониженном давлении. Неочищенный продукт очищают колоночной флэш-хроматографией (20-40% EtOAc в петролейном эфире, в качестве элюента) и затем проводят препаративную ВЭЖХ (Lichrospher®-100 RP18, в градиенте 50%-0% 0,01 М водн. NH4 +HCOO-, смешанного с 0,01 М NH4 +HCOO-, в смеси ацетонитрил:вода (9:1) в качестве элюента). Соответствующие фракции объединяют, концентрируют при пониженном давлении, экстрагируют EtOAc; концентрирование раствора EtOAc при пониженном давлении дает указанное в заголовке соединение (16) в виде масла.A solution of a complex compound of trifluoromethyl copper in HMPA (Kobayashi, Y. et al., Tetrahedron. Lett ., 1979, Vol. 42, p. 4071-4072) obtained from trifluoromethyl iodide (0.43 g, 2.2 mmol) and copper powder (0.32 g, 5 mg At) in HMPA (1.5 ml) was added to the 24-iodofusidic acid phenacyl ester (7) (190 mg, 0.25 mmol). The resulting mixture was stirred in a closed bottle for 3 days at room temperature in an argon atmosphere, then treated with EtOAc, water and a saturated solution of NaCl, dried and concentrated under reduced pressure. The crude product is purified by flash column chromatography (20-40% EtOAc in petroleum ether as eluent) and then preparative HPLC (Lichrospher®-100 RP18, in a gradient of 50% -0% 0.01 M aq. NH 4 + HCOO - , mixed with 0.01 M NH 4 + HCOO - , in a mixture of acetonitrile: water (9: 1) as eluent). The appropriate fractions were combined, concentrated under reduced pressure, extracted with EtOAc; concentration of the EtOAc solution under reduced pressure afforded the title compound (16) as an oil.
1H ЯМР (CDCl3): 7,88 (дд, 2H), 7,58 (т, 1H), 7,48 (т, 2H), 5,98 (д, 1H), 5,48 (д, 1H), 5,11 (д, 1H), 4,36 (с, 1H), 3,75 (ш.с., 1H), 3,10 (ш.д., 1H), 2,75-1,00 (м, 21H), 2,01 (с, 3H), 1,88 (, 3H), 1,83 (, 3H), 1,38 (с, 3H), 0,98 (с, 3H), 0,93 (с, 3H), 0,92 (д, 3H). 1 H NMR (CDCl 3 ): 7.88 (dd, 2H), 7.58 (t, 1H), 7.48 (t, 2H), 5.98 (d, 1H), 5.48 (d, 1H), 5.11 (d, 1H), 4.36 (s, 1H), 3.75 (br s, 1H), 3.10 (bd, 1H), 2.75-1 00 (m, 21H), 2.01 (s, 3H), 1.88 (, 3H), 1.83 (, 3H), 1.38 (s, 3H), 0.98 (s, 3H) 0.93 (s, 3H); 0.92 (d, 3H).
Способ получения 18: 24,25-дибромфузидовая кислота (17) The method of obtaining 18 : 24,25-dibromofusidic acid (17)
Раствор брома (16,0 г, 2,1 моль) в этилацетате (100 мл) добавляют к перемешанному раствору фузидовой кислоты (51,6 г, 0,1 моль) в этилацетате (1000 мл) в течение 75 минут. Температуру поддерживают на уровне 5°С, охлаждая смесь на ледяной бане. Добавляют KH2PO4 (100 мл, 1М водн.) и Na2S2O3 (50 мл, 1М водн.) в течение нескольких минут. Фазу EtOAc отделяют и экстрагируют KH2PO4 (200 мл, 0,5М водн.) и водой (100 мл), после чего концентрируют при пониженном давлении с получением твердого остатка соединения (17), которое используют на следующей стадии без дальнейшей очистки (пример 45).A solution of bromine (16.0 g, 2.1 mol) in ethyl acetate (100 ml) was added to a mixed solution of fusidic acid (51.6 g, 0.1 mol) in ethyl acetate (1000 ml) over 75 minutes. The temperature is maintained at 5 ° C, cooling the mixture in an ice bath. KH 2 PO 4 (100 ml, 1M aq) and Na 2 S 2 O 3 (50 ml, 1M aq) were added over several minutes. The EtOAc phase was separated and extracted with KH 2 PO 4 (200 ml, 0.5M aq) and water (100 ml), and then concentrated under reduced pressure to obtain a solid residue of compound (17), which was used in the next step without further purification ( Example 45).
1H ЯМР (CDCl3): 5,81 (д, 1H), 4,32 (м, 1H), 4,26 (т, 1H), 3,66 (м, 1H),3,09 (м, 1H), 3,0-1,0 (м, 19H), 1,82 (с, 3H), 1,81 (с, 3H), 1,39 (с, 3H), 1,00 (с, 3H), 0,99 (с, 3H), 0,94 (с, 3H), 0,89 (д, 3H). 1 H NMR (CDCl 3 ): 5.81 (d, 1H), 4.32 (m, 1H), 4.26 (t, 1H), 3.66 (m, 1H), 3.09 (m, 1H), 3.0-1.0 (m, 19H), 1.82 (s, 3H), 1.81 (s, 3H), 1.39 (s, 3H), 1.00 (s, 3H ), 0.99 (s, 3H), 0.94 (s, 3H), 0.89 (d, 3H).
Соединения I по настоящему изобретениюCompounds I of the present invention
В таблице 2 перечислены примеры соединений общей формулы I (соединения общей формулы Ia, где Q2 = CH-OH (α)):Table 2 lists examples of compounds of general formula I (compounds of general formula Ia, where Q 2 = CH-OH (α)):
Примечание к таблице 2: Символы в таблице 2, которые являются общими для символов таблицы 1, имеют те же самые значения. Ex.= пример; Ex. = процедура, используемая в других примерах.Note to table 2: The symbols in table 2, which are common to the symbols of table 1, have the same meanings. Ex. = Example; Ex. = procedure used in other examples.
Примеры легко гидролизуемых сложных эфиров соединений общей формулы I приведены в таблице 3а (для ацетоксиметиловых сложных эфиров) и в таблице 3b (для пивалоилоксиметиловых сложных эфиров) (для сложных эфиров соединений общей формулы Ia (Q2=CH-OH (α)):Examples of readily hydrolyzable esters of compounds of general formula I are shown in table 3a (for acetoxymethyl esters) and table 3b (for pivaloyloxymethyl esters) (for esters of compounds of general formula Ia (Q 2 = CH-OH (α)):
Примечание к таблицам 3а b 3b: Символы в таблицах 3a и 3b, которые являются общими для символов таблицы 1, имеют те же самые значения. Ex.= пример; Ex. = процедура, используемая в других примерах.Note to tables 3a b 3b: The symbols in tables 3a and 3b, which are common to the symbols of table 1, have the same meanings. Ex. = Example; Ex. = procedure used in other examples.
Примеры солей соединений общей формулы I перечислены в таблице 4 (для солей общей формулы Ic (Q2 = CH-OH (α)):Examples of salts of the compounds of general formula I are listed in table 4 (for salts of the general formula Ic (Q 2 = CH-OH (α)):
Примечание к таблице 4: Символы в таблицах 3a и 3b, которые являются общими для символов таблицы 1, имеют те же самые значения. Ex.= пример; Ex. = процедура, используемая в других примерах.Note to table 4: The symbols in tables 3a and 3b, which are common to the symbols of table 1, have the same meanings. Ex. = Example; Ex. = procedure used in other examples.
ПРИМЕРЫEXAMPLES
Пример 1: Натриевая соль 24-трифторметилфузидовой кислоты (соединение 101) Example 1 : Sodium salt of 24-trifluoromethylfusidic acid (compound 101)
Указанное в заголовке соединение (101) может быть получено по процедуре примера 9 при замене 24-бромфузидовой кислоты (108) 24-трифторметилфузидовой кислотой (106).The title compound (101) can be obtained by the procedure of Example 9 by substituting 24-bromofusidic acid (108) for 24-trifluoromethylfusidic acid (106).
Пример 2: Пивалоилоксиметиловый сложный эфир 24-трифторметилфузидовой кислоты (соединение 102) Example 2 : Pivaloyloxymethyl ester of 24-trifluoromethylfusidic acid (compound 102)
Указанное в заголовке соединение (102) может быть получено по процедуре, описанной в способе получения 2, при замене фузидовой кислоты 24-трифторметилфузидовой кислотой (106) с последующей лиофильной сушкой продукта.The title compound (102) can be obtained by the procedure described in Production Method 2 by replacing fusidic acid with 24-trifluoromethylfusidic acid (106) followed by freeze drying of the product.
Пример 3: 24-хлорфузидовая кислота (соединение 103) Example 3 : 24-chlorofusidic acid (compound 103)
Пивалоилоксиметиловый сложный эфир 24-хлорфузидовой кислоты (104) (140 мг, 0,21 ммоль) и K2CO3 (60 мг, 0,43 ммоль) перемешивают в MeOH (2 мл) в течение 3 часов при комнатной температуре. После проведения колоночной флэш-хроматографии концентрированной реакционной смеси (петролейный эфир:EtOAc:HCOOH, 90:10:1-10:90:1, в качестве элюента) получают указанное в заголовке соединение 103.24-chlorofusidic acid pivaloyloxymethyl ester (104) (140 mg, 0.21 mmol) and K 2 CO 3 (60 mg, 0.43 mmol) were stirred in MeOH (2 ml) for 3 hours at room temperature. After flash column chromatography of the concentrated reaction mixture (petroleum ether: EtOAc: HCOOH, 90: 10: 1-10: 90: 1, as an eluent), the title compound 103 was obtained.
13C ЯМР (CDCl3): 174,0, 170,6, 152,5, 128,5, 126,8, 74,5, 71,5, 68,2, 49,3, 48,8, 44,6, 39,5, 39,0, 37,0, 36,3, 36,0, 35,6, 32,2, 30,2, 29,9, 27,3, 24,0, 22,9, 21,9, 20,8, 20,6, 20,3, 17,9, 15,9. 13 C NMR (CDCl 3 ): 174.0, 170.6, 152.5, 128.5, 126.8, 74.5, 71.5, 68.2, 49.3, 48.8, 44, 6, 39.5, 39.0, 37.0, 36.3, 36.0, 35.6, 32.2, 30.2, 29.9, 27.3, 24.0, 22.9, 21.9, 20.8, 20.6, 20.3, 17.9, 15.9.
Пример 4: Пивалоилоксиметиловый сложный эфир 24-хлорфузидовой кислоты (соединение 104) Example 4 : Pivaloyloxymethyl ester of 24-chlorofusidic acid (compound 104)
Пивалоилоксиметиловый сложный эфир 24-бромфузидовой кислоты (10) (283 мг, 0,40 ммоль), CuI (240 мг, 1,26 ммоль), LiCl (30 мг, 0,7 ммоль) и HMPA (1,2 мл) встряхивают в закрытом флаконе в течение 3 часов при температуре 120°С. Реакционную смесь промывают (EtOAc и насыщ. NaCl) с получением неочищенного продукта. Далее этот продукт очищают колоночной флэш-хроматографией с использованием смеси петролейный эфир:EtOAc (90:10-10:90) в качестве элюента и получают чистое, указанное в заголовке соединение 104.24-Bromofusidic acid pivaloyloxymethyl ester (10) (283 mg, 0.40 mmol), CuI (240 mg, 1.26 mmol), LiCl (30 mg, 0.7 mmol) and HMPA (1.2 ml) are shaken in a closed bottle for 3 hours at a temperature of 120 ° C. The reaction mixture was washed (EtOAc and sat. NaCl) to give a crude product. This product was then purified by flash column chromatography using petroleum ether: EtOAc (90: 10-10: 90) as an eluent to give the pure title compound 104.
13C ЯМР (CDCl3): 177,0, 170,2, 167,8, 152,8, 128,5, 128,0, 126,7, 80,0, 74,4, 71,4, 68,2, 49,3, 48,8, 44,6, 39,5, 39,0, 38,8, 37,0, 36,4, 36,0, 35,5, 35,4, 32,2, 30,2, 29,9, 27,2, 26,9, 24,0, 22,9, 21,9, 20,8, 20,4, 17,9, 16,0, 14,2. 13 C NMR (CDCl 3 ): 177.0, 170.2, 167.8, 152.8, 128.5, 128.0, 126.7, 80.0, 74.4, 71.4, 68, 2, 49.3, 48.8, 44.6, 39.5, 39.0, 38.8, 37.0, 36.4, 36.0, 35.5, 35.4, 32.2, 30.2, 29.9, 27.2, 26.9, 24.0, 22.9, 21.9, 20.8, 20.4, 17.9, 16.0, 14.2.
Пример 5: Натриевая соль 24-хлорфузидовой кислоты (соединение 105) Example 5 : Sodium salt of 24-chlorofusidic acid (compound 105)
По процедуре, приведенной в примере 9, при замене 24-бромфузидовой кислоты (108) 24-хлорфузидовой кислотой (103) с последующей лиофильной сушкой продукта получают указанное в заголовке соединение (105).According to the procedure described in Example 9, by replacing 24-bromofusidic acid (108) with 24-chlorofusidic acid (103) followed by freeze drying of the product, the title compound (105) is obtained.
Пример 6: 24-трифторметилфузидовая кислота (соединение 106) Example 6 : 24-trifluoromethylfusidic acid (compound 106)
Фенациловый сложный эфир 24-трифторметилфузидовой кислоты (17) (15 мг, 0,021 ммоль) и тиофенолат натрия (20 мг, 0,15 ммоль) в сухом ДМФ (0,5 мл) перемешивают в атмосфере аргона при температуре 100°С в течение пяти часов. Добавляют EtOAc (15 мл) и органический раствор экстрагируют с использованием: 3М водн. CaCl2 (10 мл) + 1 М водн. H3PO4 (0,25 мл) и затем (по 10 мл каждого) 3М водн. CaCl2, воды и насыщ. NaCl. После сушки и концентрирования неочищенный продукт очищают колоночной флэш-хроматографией с использованием в качестве элюента смеси петролейный эфир:EtOAc:HCOOH (60:40:1/2) и получают после лиофильной сушки указанное в заголовке соединение 106 в виде аморфного порошка.24-trifluoromethylfusidic acid phenacyl ester (17) (15 mg, 0.021 mmol) and sodium thiophenolate (20 mg, 0.15 mmol) in dry DMF (0.5 ml) are stirred under argon at 100 ° C for five hours. EtOAc (15 ml) was added and the organic solution was extracted using: 3M aq. CaCl 2 (10 ml) + 1 M aq. H 3 PO 4 (0.25 ml) and then (10 ml each) 3M aq. CaCl 2 , water and sat. NaCl. After drying and concentration, the crude product is purified by flash column chromatography using petroleum ether: EtOAc: HCOOH (60: 40: 1/2) as eluent to give the title compound 106 as an amorphous powder after freeze drying.
1H ЯМР (CDCl3): 5,87 (д, 1H), 4,34 (с, 1H), 3,75 (с, 1H), 3,06 (ш.д., 1H), 2,70-0,80 (м, 22H), 1,98 (с, 3H), 1,85 (кв., 3H), 1,83 (кв., 3H), 1,37 (м, 3H), 0,97 (с, 3H), 0,91 (с, 3H), 0,90 (д, 3H). 1 H NMR (CDCl 3 ): 5.87 (d, 1H), 4.34 (s, 1H), 3.75 (s, 1H), 3.06 (bd, 1H), 2.70 -0.80 (m, 22H), 1.98 (s, 3H), 1.85 (q, 3H), 1.83 (q, 3H), 1.37 (m, 3H), 0, 97 (s, 3H), 0.91 (s, 3H), 0.90 (d, 3H).
Пример 7: Ацетоксиметиловый сложный эфир 24-бромфузидовой кислоты (соединение 107) Example 7: Acetoxymethyl ester of 24-bromofusidic acid (compound 107)
Ацетоксиметиловый сложный эфир 24-R,S,25-дибромфузидовой кислоты (3а) (полученный из 22,3 ммоль ацетоксиметилового сложного эфира фузидовой кислоты) в CCl4 (280 мл) и DBU (6,64 мл, 6,77 г, 44,5 ммоль) кипятят с обратным холодильником в течение 16 часов. Реакционную смесь в виде глиноподобного осадка фильтруют через хлопчатобумажный фильтр и промывают фильтр смесью петролейного эфира и EtOAc. Объединенный фильтрат и промывные воды концентрируют с получением указанного в заголовке соединения 107 в виде неочищенного продукта (примерно 70% чистоты, по данным ЯМР), который может быть использован без дальнейшей очистки при получении соединения 108 (пример 8). Чистый образец получают с использованием колоночной флэш-хроматографии (30-50% EtOAc в петролейном эфире, в качестве элюента).Acetoxymethyl ester 24-R, S, 25-dibromofusidic acid (3a) (obtained from 22.3 mmol of acetoxymethyl ester of fusidic acid) in CCl 4 (280 ml) and DBU (6.64 ml, 6.77 g, 44 , 5 mmol) is refluxed for 16 hours. The reaction mixture in the form of a clay-like precipitate is filtered through a cotton filter and the filter is washed with a mixture of petroleum ether and EtOAc. The combined filtrate and washings were concentrated to afford the title compound 107 as a crude product (about 70% pure, according to NMR), which could be used without further purification to give compound 108 (Example 8). A pure sample was obtained using flash column chromatography (30-50% EtOAc in petroleum ether as eluent).
13C ЯМР (CDCl3): 170,3, 169,6, 167,3, 152,6, 131,6, 127,9, 120,0, 79,5, 74,4, 71,4, 68,2, 49,3, 48,8, 44,6, 39,5, 39,0, 37,8, 37,0, 36,3, 36,0, 35,6, 32,2, 30,2, 29,9, 27,8, 25,3, 24,0, 22,9, 20,8, 20,7, 20,4, 18,0, 16,0. 13 C NMR (CDCl 3 ): 170.3, 169.6, 167.3, 152.6, 131.6, 127.9, 120.0, 79.5, 74.4, 71.4, 68, 2, 49.3, 48.8, 44.6, 39.5, 39.0, 37.8, 37.0, 36.3, 36.0, 35.6, 32.2, 30.2, 29.9, 27.8, 25.3, 24.0, 22.9, 20.8, 20.7, 20.4, 18.0, 16.0.
Пример 8: 24-бромфузидовая кислота (108) Example 8 : 24-bromfusidic acid (108)
Неочищенный ацетоксиметиловый сложный эфир 24-бромфузидовой кислоты (соединение 107) или ее пивалоилоксиметиловый сложный эфир (110) (полученный из 44,4 ммоль ацетоксиметилового сложного эфира (2а) или пивалоилоксиметилового сложного эфира (2b)) растворяют в MeOH (250 мл) и добавляют DBU (3 мл) для поддержания щелочной реакции. При комнатной температуре в течение двух часов добавляют смесь MeOH/вода (1:1) (300 мл) при перемешивании, которое продолжат еще в течение двух часов. Добавляют 1М раствор KH2PO4 (100 мл) и при необходимости также фосфорную кислоту с достижением pH примерно 4-5; осадок, который образуется, растворяют при двукратной экстракции EtOAc. Органическую фазу экстрагируют водой и насыщ. NaCl, сушат с использованием MgSO4 и концентрируют с получением неочищенного продукта. Данный продукт очищают колоночной флэш-хроматографией (50% EtOAc в петролейном эфире + 0,5% HCOOH, в качестве элюента) и затем проводят рекристаллизацию из смеси EtOAc + толуол (с частичным выпариванием) с получением чистого указанного в заголовке соединения (108).The crude 24-bromofusidic acid acetoxymethyl ester (compound 107) or its pivaloyloxymethyl ester (110) (obtained from 44.4 mmol of acetoxymethyl ester (2a) or pivaloyloxymethyl ester (2b)) was dissolved in MeOH (250 ml) and added DBU (3 ml) to maintain an alkaline reaction. At room temperature, MeOH / water (1: 1) (300 ml) was added over two hours with stirring, which was continued for another two hours. A 1M solution of KH 2 PO 4 (100 ml) and, if necessary, also phosphoric acid are added to achieve a pH of about 4-5; the precipitate that forms is dissolved by double extraction with EtOAc. The organic phase is extracted with water and sat. NaCl, dried using MgSO 4 and concentrated to obtain a crude product. This product was purified by flash column chromatography (50% EtOAc in petroleum ether + 0.5% HCOOH as eluent) and then recrystallized from EtOAc + toluene (partially evaporated) to give the pure title compound (108).
13C ЯМР (CDCl3): 173,0, 170,5, 152,6, 131,5, 128,1, 120,1, 74,5, 71,4, 68,2, 49,2, 48,8, 44,6, 39,5, 39,0, 37,8, 37,1, 36,2, 36,2, 35,7, 32,4, 30,2, 29,9, 28,0, 25,3, 24,1, 22,8, 20,8, 20,7, 20,4, 18,0, 15,9. 13 C NMR (CDCl 3 ): 173.0, 170.5, 152.6, 131.5, 128.1, 120.1, 74.5, 71.4, 68.2, 49.2, 48, 8, 44.6, 39.5, 39.0, 37.8, 37.1, 36.2, 36.2, 35.7, 32.4, 30.2, 29.9, 28.0, 25.3, 24.1, 22.8, 20.8, 20.7, 20.4, 18.0, 15.9.
Пример 9: Натриевая соль 24-бромфузидовой кислоты (соединение 109) Example 9 : Sodium salt of 24-bromofusidic acid (compound 109)
24-бромфузидовую кислоту (108) (2,38 г, 4,00 ммоль) растворяют в MeOH (30 мл). Добавляют постепенно эквивалентное количество 1N раствора NaOH (4 мл) до достижения pH примерно 8,5 при измерении pH-метром. Полученный раствор концентрируют и остаток растворяют в EtOH (15 мл). Добавляют EtOAc (25 мл), но кристаллизация не происходит до выпаривания растворителей, добавляют EtOH и EtOAc и растворители снова выпаривают. При этом остаток кристаллизуют из EtOH+EtOAc с образованием указанного в заголовке соединения (109) в виде бесцветных кристаллов.24-bromofusidic acid (108) (2.38 g, 4.00 mmol) was dissolved in MeOH (30 ml). An equivalent amount of a 1N NaOH solution (4 ml) is gradually added until a pH of about 8.5 is reached when measured with a pH meter. The resulting solution was concentrated and the residue was dissolved in EtOH (15 ml). EtOAc (25 ml) was added, but crystallization did not occur until the solvents were evaporated, EtOH and EtOAc were added, and the solvents were again evaporated. The residue is crystallized from EtOH + EtOAc to give the title compound (109) as colorless crystals.
13C ЯМР (CDCl3): 179,1, 173,5, 138,8, 138,2, 131,3, 122,6, 76,0, 72,5, 68,9, 50,8, 50,0, 43,8, 40,7, 40,3, 38,5, 38,3, 37,8, 37,5, 36,9, 33,0, 31,1, 31,0, 30,2, 25,4, 23,8, 23,8, 22,5, 21,1, 20,5, 17,9, 16,5. 13 C NMR (CDCl 3 ): 179.1, 173.5, 138.8, 138.2, 131.3, 122.6, 76.0, 72.5, 68.9, 50.8, 50, 0, 43.8, 40.7, 40.3, 38.5, 38.3, 37.8, 37.5, 36.9, 33.0, 31.1, 31.0, 30.2, 25.4, 23.8, 23.8, 22.5, 21.1, 20.5, 17.9, 16.5.
Пример 10: Пивалоилоксиметиловый сложный эфир 24-бромфузидовой кислоты (соединение 110) Example 10 : Pivaloyloxymethyl ester of 24-bromofusidic acid (compound 110)
При проведении процедуры, описанной в примере 7, с заменой ацетоксиметилового сложного эфира 24R,S,25-дибромфузидовой кислоты пивалоилоксиметиловым сложным эфиром 24R,S,25-дибромфузидовой кислоты (3b) получают неочищенное, указанное в заголовке соединение (110). Это соединение может быть подвергнуто гидролизу без дальнейшей очистки с получением соединения 108. Колоночная флэш-хроматография образца неочищенного продукта, проводимая с использованием в качестве элюента 30%-50% EtOAc в петролейном эфире, дает чистое, указанное в заголовке соединение (110) в виде слегка желтой аморфной пены.When the procedure described in Example 7 was carried out with the substitution of 24R, S, 25-dibromofusidic acid acetoxymethyl ester with pivaloyloxymethyl ester 24R, S, 25-dibromofusidic acid (3b), the crude title compound (110) was obtained. This compound can be hydrolyzed without further purification to give compound 108. Flash column chromatography of a crude product sample using 30% -50% EtOAc in petroleum ether as eluent gives the pure title compound (110) as slightly yellow amorphous foam.
13C ЯМР (CDCl3): 177,0, 170,2, 167,8, 152,8, 131,5, 127,9, 120,1, 80,0, 74,4, 71,4, 68,2, 49,3, 48,8, 44,6, 39,5, 39,0, 38,8, 37,7, 37,0, 36,3, 36,0, 35,7, 32,3, 30,2, 30,0, 27,8, 26,9, 25,3, 24,0, 22,9, 20,8, 20,4, 18,0, 16,0. 13 C NMR (CDCl 3 ): 177.0, 170.2, 167.8, 152.8, 131.5, 127.9, 120.1, 80.0, 74.4, 71.4, 68, 2, 49.3, 48.8, 44.6, 39.5, 39.0, 38.8, 37.7, 37.0, 36.3, 36.0, 35.7, 32.3, 30.2, 30.0, 27.8, 26.9, 25.3, 24.0, 22.9, 20.8, 20.4, 18.0, 16.0.
Пример 11: Ацетоксиметиловый сложный эфир 24-бром-16-деацетокси-16β-тиоацетилфузидовой кислоты (соединение 111) Example 11 : Acetoxymethyl ester of 24-bromo-16-deacetoxy-16β-thioacetylfusidic acid (compound 111)
Раствор брома (45 мкл, 140 мг, 0,88 ммоль) в CCl4 (5 мл) добавляют к раствору ацетоксиметилового сложного эфира 16-деацетокси-16β-тиоацетилфузидовой кислоты (8) (0,48 г, 0,8 ммоль) в CCl4 (10 мл), осуществляя добавление в течение двух часов в атмосфере аргона при перемешивании и охлаждении на ледяной бане. Перемешивание продолжают в течение 15 минут на ледяной бане и в течение еще 15 минут при комнатной температуре. Добавляют DBU (0,66 мл, 0,67 г, 4,4 ммоль) и смесь кипятят с обратным холодильником в течение 12 часов. Реакционную смесь фильтруют через фильтрующее устройство и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией с использованием в качестве элюента 0%-70% EtOAc в петролейном эфире, получая указанное в заголовке соединение (111).A solution of bromine (45 μl, 140 mg, 0.88 mmol) in CCl 4 (5 ml) was added to a solution of 16-deacetoxy-16β-thioacetylfusidic acid acetoxymethyl ester (8) (0.48 g, 0.8 mmol) in CCl 4 (10 ml), adding over two hours in an argon atmosphere with stirring and cooling in an ice bath. Stirring is continued for 15 minutes in an ice bath and for another 15 minutes at room temperature. DBU (0.66 ml, 0.67 g, 4.4 mmol) was added and the mixture was refluxed for 12 hours. The reaction mixture was filtered through a filter device and concentrated in vacuo . The residue was purified by flash column chromatography using 0% -70% EtOAc in petroleum ether as the eluent to give the title compound (111).
13C ЯМР (CDCl3): 194,8, 169,5, 168,0, 153,0, 131,7, 128,1, 120,0, 79,9, 71,4, 68,2, 49,3, 49,0, 45,9, 43,8, 41,4, 39,7, 37,6, 37,2, 36,4, 35,9, 35,8, 32,8, 30,4, 30,1, 29,9, 28,3, 25,3, 24,5, 22,4, 20,7, 20,6, 20,4, 18,8, 16,0. 13 C NMR (CDCl 3 ): 194.8, 169.5, 168.0, 153.0, 131.7, 128.1, 120.0, 79.9, 71.4, 68.2, 49, 3, 49.0, 45.9, 43.8, 41.4, 39.7, 37.6, 37.2, 36.4, 35.9, 35.8, 32.8, 30.4, 30.1, 29.9, 28.3, 25.3, 24.5, 22.4, 20.7, 20.6, 20.4, 18.8, 16.0.
Пример 12: 24-бром-16-деацетокси-16β-изопропилтиофузидовая кислота (соединение 112) Example 12 : 24-bromo-16-deacetoxy-16β-isopropylthiofusidic acid (compound 112)
2-пропантиол (1,4 мл, 1,13 г, 15 ммоль) растворяют в сухом ДМФ (12,5 мл) и добавляют гидрид натрия (60% дисперсия в масле, 0,6 г, примерно 15 ммоль) и затем пивалоилоксиметиловый сложный эфир 3-ацетил-16-деацетокси-16α-24-дибромфузидовой кислоты (13) (0,45 г, 0,6 ммоль), перемешивая при комнатной температуре в атмосфере аргона. Перемешивание продолжают в течение двух часов, после чего реакционную смесь обрабатывают (EtOAc, вода, водн. HCl (до примерно pH 4), вода, насыщ. NaCl) и концентрируют с получением масла. Указанное масло растворяют в EtOH (20 мл), добавляют 2N водн. NaOH (10 мл) и нагревают смесь до температуры 60°С в течение двух часов. Гидролизную смесь обрабатывают, как описано выше, и неочищенный продукт подвергают очистке колоночной флэш-хроматографией (10-20% EtOAc в петролейном эфире + 1% AcOH, в качестве элюента) с получением указанного в заголовке соединения (112).2-propanethiol (1.4 ml, 1.13 g, 15 mmol) was dissolved in dry DMF (12.5 ml) and sodium hydride (60% dispersion in oil, 0.6 g, about 15 mmol) was added and then pivaloyloxymethyl 3-acetyl-16-deacetoxy-16α-24-dibromofusidic acid ester (13) (0.45 g, 0.6 mmol), stirring at room temperature in an argon atmosphere. Stirring was continued for two hours, after which the reaction mixture was treated (EtOAc, water, aq. HCl (to about pH 4), water, sat. NaCl) and concentrated to give an oil. The specified oil was dissolved in EtOH (20 ml), 2N aq. NaOH (10 ml) and heat the mixture to a temperature of 60 ° C for two hours. The hydrolysis mixture is treated as described above, and the crude product is purified by flash column chromatography (10-20% EtOAc in petroleum ether + 1% AcOH as eluent) to give the title compound (112).
1H ЯМР (CDCl3): 4,30 (м, 1H), 4,15 (м, 1H), 3,75 (м, 1H), 3,10 (м, 1H), 1,82 (с, 3H), 1,75 (с, 3H), 1,35 (с, 3H), 1,24 (д, 3H, J=6 Гц), 1,18 (д, 3H, J=6 Гц), 0,99 (с, 3H), 0,98 (с, 3H), 0,88 (д, 3H, J=6 Гц), 2,9-1,0 (м, 23H). 1 H NMR (CDCl 3 ): 4.30 (m, 1H), 4.15 (m, 1H), 3.75 (m, 1H), 3.10 (m, 1H), 1.82 (s, 3H), 1.75 (s, 3H), 1.35 (s, 3H), 1.24 (d, 3H, J = 6 Hz), 1.18 (d, 3H, J = 6 Hz), 0 99 (s, 3H), 0.98 (s, 3H), 0.88 (d, 3H, J = 6 Hz), 2.9-1.0 (m, 23H).
Пример 13: 24-бром-16-деацетокси-16β-изопропилсульфинилфузидовая кислота (соединение 113) Example 13 : 24-bromo-16-deacetoxy-16β-isopropylsulfinylfusidic acid (compound 113)
К раствору 24-бром-16-деацетокси-16β-изопропилтиофузидовой кислоты (112) (0,29 г, 0,47 ммоль) в MeOH (10 мл) добавляют 2N водн. NaOH (0,5 мл) и периодат натрия (0,23 г, 1,1 ммоль) в воде (40 мл). Смесь перемешивают в течение одного часа при комнатной температуре и подкисляют водн. HCl для осаждения кислоты. Продукт далее отфильтровывают, промывают водой и рекристаллизуют из EtOAc с получением указанного в заголовке соединения (113) в виде кристаллов, Т.пл. 166-168°С.To a solution of 24-bromo-16-deacetoxy-16β-isopropylthiofusidic acid (112) (0.29 g, 0.47 mmol) in MeOH (10 ml) was added 2N aq. NaOH (0.5 ml) and sodium periodate (0.23 g, 1.1 mmol) in water (40 ml). The mixture was stirred for one hour at room temperature and acidified with aq. HCl for precipitation of acid. The product is then filtered off, washed with water and recrystallized from EtOAc to give the title compound (113) as crystals, mp. 166-168 ° C.
13C ЯМР (CDCl3): 173,7, 159,6, 131,3, 125,8, 120,2, 71,5, 68,3, 60,2, 51,8, 49,5, 48,2, 47,5, 39,7, 38,2, 37^2, 36,3, 36,1, 35,6, 32,6, 30,4, 30,6, 28,0, 26,6, 25,3, 24,6, 22,7, 20,7, 20,4, 18,3, 17,8, 16,0, 13,5. 13 C NMR (CDCl 3 ): 173.7, 159.6, 131.3, 125.8, 120.2, 71.5, 68.3, 60.2, 51.8, 49.5, 48, 2, 47.5, 39.7, 38.2, 37 ^ 2, 36.3, 36.1, 35.6, 32.6, 30.4, 30.6, 28.0, 26.6, 25.3, 24.6, 22.7, 20.7, 20.4, 18.3, 17.8, 16.0, 13.5.
Пример 14: 24-бром-16-деацетокси-16β-тиоацетилфузидовая кислота (114) Example 14 : 24-bromo-16-deacetoxy-16β-thioacetylfusidic acid (114)
Ацетоксиметиловый сложный эфир 24-бром-16-деацетокси-16β-тиоацетилфузидовой кислоты (111) (40 мг, 0,059 ммоль) растворяют в MeOH (2,5 мл), добавляют карбонат калия (17 мг, 0,12 ммоль) и смесь перемешивают в течение трех часов (при доступе влаги из воздуха). Добавляют воду (10 мл) и смесь подкисляют примерно до pH 4 с использованием водн. HCl, что приводит к осаждению кислоты. Смесь обрабатывают EtOAc, водой, насыщ. NaCl, сушат с использованием Na2SO4 и концентрируют с получением неочищенного продукта. Данный продукт очищают колоночной флэш-хроматографией (0%-10% MeOH в дихлорметане, в качестве элюента) с получением указанного в заголовке соединения (114).24-Bromo-16-deacetoxy-16β-thioacetylfusidic acid (111) acetoxymethyl ester (40 mg, 0.059 mmol) was dissolved in MeOH (2.5 ml), potassium carbonate (17 mg, 0.12 mmol) was added and the mixture was stirred within three hours (with the access of moisture from the air). Water (10 ml) was added and the mixture was acidified to approximately pH 4 using aq. HCl, which leads to the precipitation of acid. The mixture is treated with EtOAc, water, sat. NaCl, dried using Na 2 SO 4 and concentrated to give a crude product. This product was purified by flash column chromatography (0% -10% MeOH in dichloromethane as eluent) to give the title compound (114).
13C ЯМР (CDCl3): 202,7, 175,6, 133,0, 131,6, 120,4, 71,4, 68,0, 54,5, 50,4, 48,5, 40,8, 40,6, 37,1, 37,0, 36,7, 36,0, 35,2, 32,7, 31,7, 30,2, 29,9, 25,3, 23,4, 23,3, 21,0, 20,4, 19,5, 16,0. 13 C NMR (CDCl 3 ): 202.7, 175.6, 133.0, 131.6, 120.4, 71.4, 68.0, 54.5, 50.4, 48.5, 40, 8, 40.6, 37.1, 37.0, 36.7, 36.0, 35.2, 32.7, 31.7, 30.2, 29.9, 25.3, 23.4, 23.3, 21.0, 20.4, 19.5, 16.0.
Пример 15: 24-бром-17S,20S-дигидрофузидовая кислота (115) Example 15 : 24-bromo-17S, 20S-dihydrofusidic acid (115)
По процедуре, приведенной в примере 14, при замене ацетоксиметилового сложного эфира 24-бром-16-деацетокси-16β-тиоацетилфузидовой кислоты (111) ацетоксиметиловым сложным эфиром 24-бром-17S,20S-дигидрофузидовой кислоты (120) получают указанное в заголовке соединение (115).According to the procedure described in Example 14, when replacing the 24-bromo-16-deacetoxy-16β-thioacetylfusidic acid (111) acetoxymethyl ester with 24-bromo-17S, 20S-dihydrofusidic acid (120) acetoxymethyl ester (120), the title compound ( 115).
13C ЯМР (CDCl3): 180,7, 170,1, 130,9, 120,5, 76,3, 71,5, 68,8, 49,4, 49,4, 44,9, 44,2, 40,6, 38,3, 37,2, 36,4, 36,2, 35,1, 34,3, 32,5, 31,3, 30,3, 29,9, 25,4, 23,8, 22,8, 21,0, 20,8, 20,3, 17,2, 15,9. 13 C NMR (CDCl 3 ): 180.7, 170.1, 130.9, 120.5, 76.3, 71.5, 68.8, 49.4, 49.4, 44.9, 44, 2, 40.6, 38.3, 37.2, 36.4, 36.2, 35.1, 34.3, 32.5, 31.3, 30.3, 29.9, 25.4, 23.8, 22.8, 21.0, 20.8, 20.3, 17.2, 15.9.
Пример 16: 24-бром-16-деацетокси-16β-этоксифузидовая кислота (116) Example 16 : 24-bromo-16-deacetoxy-16β-ethoxyfusidic acid (116)
По процедуре, приведенной в примере 14, при замене ацетоксиметилового сложного эфира 24-бром-16-деацетокси-16β-тиоацетилфузидовой кислоты (111) ацетоксиметиловым сложным эфиром 24-бром-16-деацетокси-16β-этоксифузидовой кислоты (117) получают указанное в заголовке соединение (116).According to the procedure described in Example 14, when the 24-bromo-16-deacetoxy-16β-thioacetylfusidic acid (111) acetoxymethyl ester is replaced with the 24-bromo-16-deacetoxy-16β-ethoxyfusidic acid ester (117), the title compound is obtained compound (116).
13C ЯМР (CDCl3): 171,0, 151,7, 132,6, 131,6, 120,2, 80,9, 71,5, 68,4, 64,8, 49,5, 49,0, 44,2, 39,8, 37,6, 37,2, 36,5, 35,9, 35,9, 35,1, 32,8, 30,4, 30,1, 28,9, 25,3, 24,4, 22,3, 20,6, 20,5, 18,6, 16,0, 14,7. 13 C NMR (CDCl 3 ): 171.0, 151.7, 132.6, 131.6, 120.2, 80.9, 71.5, 68.4, 64.8, 49.5, 49, 0, 44.2, 39.8, 37.6, 37.2, 36.5, 35.9, 35.9, 35.1, 32.8, 30.4, 30.1, 28.9, 25.3, 24.4, 22.3, 20.6, 20.5, 18.6, 16.0, 14.7.
Пример 17: Ацетоксиметиловый сложный эфир 24-бром-16-деацетокси-16β-этоксифузидовой кислоты (117) Example 17 : Acetoxymethyl ester of 24-bromo-16-deacetoxy-16β-ethoxyfusidic acid (117)
По процедуре, приведенной в примере 11, при замене ацетоксиметилового сложного эфира 16-деацетокси-16β-тиоацетилфузидовой кислоты (8) ацетоксиметиловым сложным эфиром 16-деацетокси-16β-этоксифузидовой кислоты (9) получают указанное в заголовке соединение (117).By the procedure described in Example 11, when replacing the acetoxymethyl ester with 16-deacetoxy-16β-thioacetylfusidic acid (8) with acetoxymethyl ester of 16-deacetoxy-16β-ethoxyfusidic acid (9), the title compound (117) is obtained.
13C ЯМР (CDCl3): 169,7, 152,8, 131,2, 127,3, 120,4, 79,6, 78,8, 71,4, 68,4, 65,3, 49,2, 49,1, 43,4, 39,5, 37,7, 37,1, 36,3, 36,3, 35,8, 35,5, 32,5, 30,3, 30,0, 27,8, 25,3, 24,2, 22,8, 20,8, 20,9, 20,3, 17,9, 16,0, 15,3. 13 C NMR (CDCl 3 ): 169.7, 152.8, 131.2, 127.3, 120.4, 79.6, 78.8, 71.4, 68.4, 65.3, 49, 2, 49.1, 43.4, 39.5, 37.7, 37.1, 36.3, 36.3, 35.8, 35.5, 32.5, 30.3, 30.0, 27.8, 25.3, 24.2, 22.8, 20.8, 20.9, 20.3, 17.9, 16.0, 15.3.
Пример 18: Ацетоксиметиловый сложный эфир 24-бром-16-деацетокси-16β-(2',2',2'-трифторэтокси) фузидовой кислоты (соединение 118) Example 18 : Acetoxymethyl ester 24-bromo-16-deacetoxy-16β- (2 ', 2', 2'-trifluoroethoxy) fusidic acid (compound 118)
По процедуре, приведенной в примере 11, при замене ацетоксиметилового сложного эфира 16-деацетокси-16β-тиоацетилфузидовой кислоты (8) ацетоксиметиловым сложным эфиром 16-деацетокси-16β-(2',2',2'-трифторэтокси)фузидовой кислоты (10) получают указанное в заголовке соединение (118).According to the procedure described in example 11, when replacing the acetoxymethyl ester with 16-deacetoxy-16β-thioacetylfusidic acid (8) with acetoxymethyl ester of 16-deacetoxy-16β- (2 ', 2', 2'-trifluoroethoxy) fusidic acid (10) the title compound (118) is obtained.
13C ЯМР (CDCl3): 169,6, 168,7, 152,6, 131,4, 128,5, 123,8, 120,2, 80,1, 79,4, 71,4, 68,2, 67,8, 67,6, 49,1, 49,1, 44,0, 39,5, 37,6, 37,1, 36,2, 35,8, 35,6, 32,5, 30,3, 30,0, 27,6, 25,3, 24,2, 22,8, 20,7, 20,8, 20,3, 17,7, 16,0. 13 C NMR (CDCl 3 ): 169.6, 168.7, 152.6, 131.4, 128.5, 123.8, 120.2, 80.1, 79.4, 71.4, 68, 2, 67.8, 67.6, 49.1, 49.1, 44.0, 39.5, 37.6, 37.1, 36.2, 35.8, 35.6, 32.5, 30.3, 30.0, 27.6, 25.3, 24.2, 22.8, 20.7, 20.8, 20.3, 17.7, 16.0.
Пример 19: 24-бром-16-деацетокси-16β-(2',2',2'-трифторэтокси)фузидовая кислота Example 19 : 24-bromo-16-deacetoxy-16β- (2 ', 2', 2'-trifluoroethoxy) fusidic acid
По процедуре, приведенной в примере 14, при замене ацетоксиметилового сложного эфира 24-бром-16-деацетокси-16β-тиоацетилфузидовой кислоты (111) ацетоксиметиловым сложным эфиром 24-бром-16-деацетокси-16β-(2',2',2'-трифторэтокси)фузидовой кислоты (118) получают указанное в заголовке соединение (119).According to the procedure described in example 14, when replacing the acetoxymethyl ester of 24-bromo-16-deacetoxy-16β-thioacetylfusidic acid (111) with the acetoxymethyl ester of 24-bromo-16-deacetoxy-16β- (2 ', 2', 2 ' trifluoroethoxy) fusidic acid (118) affords the title compound (119).
13C ЯМР (CDCl3): 175,3, 151,9, 131,4, 129,0, 123,6, 120,2, 80,5, 77,2, 71,5, 68,3, 67,8, 49,1, 49,0, 43,9, 39,6, 37,7, 37,1, 36,2, 35,8, 35,6, 32,5, 30,3, 30,0, 28,0, 25,3, 24,2, 22,8, 20,2, 17,7, 16,0. 13 C NMR (CDCl 3 ): 175.3, 151.9, 131.4, 129.0, 123.6, 120.2, 80.5, 77.2, 71.5, 68.3, 67, 8, 49.1, 49.0, 43.9, 39.6, 37.7, 37.1, 36.2, 35.8, 35.6, 32.5, 30.3, 30.0, 28.0, 25.3, 24.2, 22.8, 20.2, 17.7, 16.0.
Пример 20: Ацетоксиметиловый сложный эфир 24-бром-17S,20S-дигидрофузидовой кислоты (120) Example 20 : Acetoxymethyl ester 24-bromo-17S, 20S-dihydrofusidic acid (120)
По процедуре, приведенной в примере 11, при замене ацетоксиметилового сложного эфира 16-деацетокси-16β-тиоацетилфузидовой кислоты (8) ацетоксиметиловым сложным эфиром 17S,20S-дигидрофузидовой кислоты (14) получают указанное в заголовке соединение (120).By the procedure described in Example 11, when replacing the acetoxymethyl ester with 16-deacetoxy-16β-thioacetylfusidic acid (8) with acetoxymethyl ester 17S, 20S-dihydrofusidic acid (14), the title compound (120) is obtained.
13C ЯМР (CDCl3): 173,6, 169,9, 169,7, 130,8, 120,4, 78,8, 76,5, 71,4, 68,8, 49,4, 49,3, 45,4, 43,9, 40,6, 40,6, 38,3, 37,2, 36,4, 36,2, 35,0, 34,2, 32,6, 31,2, 30,4, 30,0, 25,3, 23,8, 22,7, 20,9, 20,9, 20,7, 20,3, 17,2, 16,0. 13 C NMR (CDCl 3 ): 173.6, 169.9, 169.7, 130.8, 120.4, 78.8, 76.5, 71.4, 68.8, 49.4, 49, 3, 45.4, 43.9, 40.6, 40.6, 38.3, 37.2, 36.4, 36.2, 35.0, 34.2, 32.6, 31.2, 30.4, 30.0, 25.3, 23.8, 22.7, 20.9, 20.9, 20.7, 20.3, 17.2, 16.0.
Пример 21: Ацетоксиметиловый сложный эфир 24-бром-17S,20S-метиленфузидовой кислоты (соединение 121) Example 21 : Acetoxymethyl ester 24-bromo-17S, 20S-methylenefusidic acid (compound 121)
По процедуре, приведенной в примере 11, при замене ацетоксиметилового сложного эфира 16-деацетокси-16β-тиоацетилфузидовой кислоты (8) ацетоксиметиловым сложным эфиром 17S,20S-метиленфузидовой кислоты (15) получают указанное в заголовке соединение (121).By the procedure described in Example 11, when replacing the acetoxymethyl ester with 16-deacetoxy-16β-thioacetylfusidic acid (8) with acetoxymethyl ester 17S, 20S-methylenefusidic acid (15), the title compound (121) is obtained.
13C ЯМР (CDCl3): 171,5, 169,9, 169,6, 130,9, 120,9, 79,2, 79,0, 71,4, 68,3, 49,6, 48,5, 43,3, 40,4, 39,9, 39,2, 37,1, 36,3, 36,2, 35,9, 35,7, 34,6, 32,4, 30,3, 30,0, 29,5, 25,4, 24,2, 22,8, 21,1, 20,9, 20,7, 20,2, 19,4, 17,9, 15,9. 13 C NMR (CDCl 3 ): 171.5, 169.9, 169.6, 130.9, 120.9, 79.2, 79.0, 71.4, 68.3, 49.6, 48, 5, 43.3, 40.4, 39.9, 39.2, 37.1, 36.3, 36.2, 35.9, 35.7, 34.6, 32.4, 30.3, 30.0, 29.5, 25.4, 24.2, 22.8, 21.1, 20.9, 20.7, 20.2, 19.4, 17.9, 15.9.
Пример 22: 24-бром-17S,20S-метиленфузидовая кислота (соединение 122) Example 22 : 24-bromo-17S, 20S-methylenefusidic acid (compound 122)
По процедуре, приведенной в примере 14, при замене ацетоксиметилового сложного эфира 24-бром-16-деацетокси-16β-тиоацетилфузидовой кислоты (111) ацетоксиметиловым сложным эфиром 24-бром-17S,20S-метиленфузидовой кислоты (соединение 121) получают указанное в заголовке соединение (122). (Элюент для колоночной флэш-хроматографии представляет собой 50% EtOAc в петролейном эфире + 1% HCOOH).Following the procedure in Example 14, when the 24-bromo-16-deacetoxy-16β-thioacetylfusidic acid (111) acetoxymethyl ester is replaced with the 24-bromo-17S, 20S-methylenefusidic acid ester (compound 121), the title compound is obtained (122). (Flash column chromatography eluent was 50% EtOAc in petroleum ether + 1% HCOOH).
13C ЯМР (CDCl3): 178,3, 170,0, 130,8, 120,9, 79,6, 71,5, 68,3, 49,3, 48,6, 44,5, 40,8, 40,3, 39,8, 37,1, 36,2, 36,1, 35,9, 34,7, 32,5, 30,3, 29,9, 29,0, 25,3, 24,4, 22,7, 21,4, 20,8, 20,4, 20,2, 17,6, 15,9. 13 C NMR (CDCl 3 ): 178.3, 170.0, 130.8, 120.9, 79.6, 71.5, 68.3, 49.3, 48.6, 44.5, 40, 8, 40.3, 39.8, 37.1, 36.2, 36.1, 35.9, 34.7, 32.5, 30.3, 29.9, 29.0, 25.3, 24.4, 22.7, 21.4, 20.8, 20.4, 20.2, 17.6, 15.9.
Пример 23: 3-дезокси-3β,24-дибромфузидовая кислота (123) Example 23 : 3-deoxy-3β, 24-dibromofusidic acid (123)
По процедуре, приведенной в примере 14, при замене ацетоксиметилового сложного эфира 24-бром-16-деацетокси-16β-тиоацетилфузидовой кислоты (111) ацетоксиметиловым сложным эфиром 3-дезокси-3β,24-дибромфузидовой кислоты (144) получают указанное в заголовке соединение (123). (Элюент для колоночной флэш-хроматографии представляет собой 10% EtOAc в петролейном эфире + 1% HCOOH).According to the procedure described in Example 14, by replacing the 24-bromo-16-deacetoxy-16β-thioacetylfusidic acid (111) acetoxymethyl ester with 3-deoxy-3β, 24-dibromfusidic acid (144) acetoxymethyl ester, the title compound ( 123). (Flash column chromatography eluent is 10% EtOAc in petroleum ether + 1% HCOOH).
13C ЯМР (CDCl3): 173,8, 170,4, 153,0, 131,7, 128,2, 120,0, 74,4, 68,2, 62,7, 49,0, 48,8, 45,5, 44,5, 41,3, 39,4, 39,0, 37,7, 37,2, 36,8, 36,1, 35,1, 32,5, 27,9, 25,4, 23,9, 23,8, 22,0, 20,6, 20,4, 18,9, 17,9. 13 C NMR (CDCl 3 ): 173.8, 170.4, 153.0, 131.7, 128.2, 120.0, 74.4, 68.2, 62.7, 49.0, 48, 8, 45.5, 44.5, 41.3, 39.4, 39.0, 37.7, 37.2, 36.8, 36.1, 35.1, 32.5, 27.9, 25.4, 23.9, 23.8, 22.0, 20.6, 20.4, 18.9, 17.9.
Пример 24: 3α-азидо-24-бром-3-дезоксифузидовая кислота (соединение 124) Example 24 : 3α-azido-24-bromo-3-deoxyfusidic acid (compound 124)
3-дезокси-3β,24-дибромфузидовую кислоту (123) (100 мг, 0,15 ммоль) растворяют в ДМФ (2,5 мл) и добавляют азид лития (30 мг, 0,6 ммоль). Смесь перемешивают при комнатной температуре в атмосфере аргона в течение 11 дней. Добавляют EtOAc и воду (по 5 мл каждого) и вместе с AcOH создают слегка кислый pH. Дальнейшая обработка (EtOAc, вода, насыщ. NaCl), сушка с использованием Na2SO4 и концентрирование дают неочищенный продукт, который очищают колоночной флэш-хроматографией (элюент: 0-50% EtOAc в петролейном эфире + 1% HCOOH) с получением указанного в заголовке соединения (124).3-deoxy-3β, 24-dibromofusidic acid (123) (100 mg, 0.15 mmol) was dissolved in DMF (2.5 ml) and lithium azide (30 mg, 0.6 mmol) was added. The mixture was stirred at room temperature under argon for 11 days. EtOAc and water (5 ml each) are added and a slightly acidic pH is created with AcOH. Further processing (EtOAc, water, sat. NaCl), drying using Na 2 SO 4 and concentration gave the crude product, which was purified by flash column chromatography (eluent: 0-50% EtOAc in petroleum ether + 1% HCOOH) to give the indicated in the title compound (124).
13C ЯМР (CDCl3): 174,1, 170,5, 153,1, 131,6, 128,2, 120,0, 74,5, 68,1, 65,4, 49,1, 48,8, 44,6, 39,4, 39,0, 37,8, 37,4, 36,9, 35,9, 35,5, 32,4, 30,8, 27,9, 26,9, 25,4, 24,2, 23,0, 20,6, 20,5, 20,4, 18,1, 16,7. 13 C NMR (CDCl 3 ): 174.1, 170.5, 153.1, 131.6, 128.2, 120.0, 74.5, 68.1, 65.4, 49.1, 48, 8, 44.6, 39.4, 39.0, 37.8, 37.4, 36.9, 35.9, 35.5, 32.4, 30.8, 27.9, 26.9, 25.4, 24.2, 23.0, 20.6, 20.5, 20.4, 18.1, 16.7.
Пример 25: 24-иодфузидовая кислота (соединение 125) Example 25 : 24-iodofusidic acid (compound 125)
24-бромфузидовую кислоту (108) (17,0 г, 28,5 ммоль), CuI (27,2 г, 143 ммоль), KI (43,4 г, 285 ммоль) и HMPA (100 мл) нагревают на масляной бане в течение 20 часов в атмосфере аргона при температуре 120°С, при перемешивании и кипячении с обратным холодильником с использованием парциального конденсатора горячего орошения. Добавляют воду (400 мл) и полученную вязкую смесь экстрагируют четыре раза EtOAc (всего 400 мл). Органическую фазу фильтруют через фильтрующее устройство, которое промывают EtOAc. Объединенную органическую фазу экстрагируют 20% водным раствором Na2S2O5, два раза водой и насыщ. NaCl. После сушки с использованием MgSO4 растворитель выпаривают и остаток перемешивают с толуолом (300 мл) в течение трех часов. Осадок отделяют фильтрованием, промывают толуолом и петролейным эфиром и далее сушат с получением практически чистого указанного в заголовке соединения 125 в виде окрашенных в бежевый цвет кристаллов.24-bromfusidic acid (108) (17.0 g, 28.5 mmol), CuI (27.2 g, 143 mmol), KI (43.4 g, 285 mmol) and HMPA (100 ml) are heated in an oil bath for 20 hours in an argon atmosphere at a temperature of 120 ° C, with stirring and boiling under reflux using a partial condenser of hot irrigation. Water (400 ml) was added and the resulting viscous mixture was extracted four times with EtOAc (400 ml total). The organic phase is filtered through a filter device, which is washed with EtOAc. The combined organic phase is extracted with a 20% aqueous solution of Na 2 S 2 O 5 , twice with water and sat. NaCl. After drying using MgSO 4, the solvent was evaporated and the residue was stirred with toluene (300 ml) for three hours. The precipitate was separated by filtration, washed with toluene and petroleum ether, and then dried to obtain substantially pure title compound 125 as beige colored crystals.
13C ЯМР (CDCl3) 173,8, 170,6, 152,3, 137,4, 128,0, 99,9, 74,5, 71,5, 68,2, 60,4, 49,3, 48,8, 44,5, 41,7, 39,5, 39,0, 37,0, 36,4, 36,0, 32,1, 31,6, 30,2, 29,9, 24,0, 23,0, 20,9, 20,7, 19,5, 17,9, 15,9, 14,2. 13 C NMR (CDCl 3 ) 173.8, 170.6, 152.3, 137.4, 128.0, 99.9, 74.5, 71.5, 68.2, 60.4, 49.3 , 48.8, 44.5, 41.7, 39.5, 39.0, 37.0, 36.4, 36.0, 32.1, 31.6, 30.2, 29.9, 24 , 0, 23.0, 20.9, 20.7, 19.5, 17.9, 15.9, 14.2.
Пример 26: Ацетоксиметиловый сложный эфир 24-иодфузидовой кислоты (соединение 126) Example 26 : Acetoxymethyl ester of 24-iodofusidic acid (compound 126)
По процедуре, приведенной в примере 25, при замене соединения 108 ацетоксиметиловым сложным эфиром 24-бромфузидовой кислоты (107) получают неочищенное соединение 126. Указанный продукт очищают колоночной флэш-хроматографией, используя в качестве элюента 40% EtOAc в петролейном эфире, и получают указанное в заголовке соединение (126) в виде аморфного вещества.According to the procedure described in Example 25, when compound 108 was replaced with 24-bromofusidic acid acetoxymethyl ester (107), crude compound 126 was obtained. The product was purified by flash column chromatography using 40% EtOAc in petroleum ether as the eluent to give the title compound the title compound (126) as an amorphous substance.
13C ЯМР (CDCl3): 170,3, 169,6, 168,0, 152,5, 137,5, 127,6, 99,8, 79,5, 74,4, 71,4, 68,1, 49,4, 48,8, 44,6, 41,7, 39,5, 39,0, 36,9, 36,5, 35,8, 32,0, 31,6, 30,1, 29,9, 28,6, 23,9, 23,1, 20,9, 20,8, 20,8, 19,4, 17,9, 16,0, 14,2. 13 C NMR (CDCl 3 ): 170.3, 169.6, 168.0, 152.5, 137.5, 127.6, 99.8, 79.5, 74.4, 71.4, 68, 1, 49.4, 48.8, 44.6, 41.7, 39.5, 39.0, 36.9, 36.5, 35.8, 32.0, 31.6, 30.1, 29.9, 28.6, 23.9, 23.1, 20.9, 20.8, 20.8, 19.4, 17.9, 16.0, 14.2.
Пример 27: Пивалоилоксиметиловый сложный эфир 24-иодфузидовой кислоты (соединение 127) Example 27 : Pivaloyloxymethyl ester of 24-iodofusidic acid (compound 127)
24-иодфузидовую кислоту (125) (0,84 г, 1,31 ммоль) и триэтиламин (0,19 мл, 0,14 г, 1,35 ммоль) растворяют в ДМФ (5 мл) и перемешивают в течение 20 минут при комнатной температуре. Добавляют хлорметилпивалат (0,30 мл, 0,32 г, 2,1 ммоль) и смесь перемешивают в течение ночи при комнатной температуре. Реакционную смесь экстрагируют 3М водн. CaCl2, водой и насыщ. NaCl, сушат с использованием MgSO4 и концентрируют. Остаток очищают колоночной флэш-хроматографией, используя в качестве элюента 40% EtOAc в петролейном эфире, с получением указанного в заголовке соединения (127) в виде аморфного вещества.24-iodo-fusidic acid (125) (0.84 g, 1.31 mmol) and triethylamine (0.19 ml, 0.14 g, 1.35 mmol) are dissolved in DMF (5 ml) and stirred for 20 minutes at room temperature. Chloromethyl pivalate (0.30 ml, 0.32 g, 2.1 mmol) was added and the mixture was stirred overnight at room temperature. The reaction mixture was extracted with 3M aq. CaCl 2 , water and sat. NaCl, dried using MgSO 4 and concentrated. The residue was purified by flash column chromatography using 40% EtOAc in petroleum ether as eluent to afford the title compound (127) as an amorphous substance.
13C ЯМР (CDCl3): 177,0, 170,2, 167,8, 152,8, 137,5, 127,7, 99,7, 80,1, 74,4, 71,4, 68,2, 60,4, 49,3, 48,8, 44,6, 41,6, 39,5, 39,0, 38,8, 37,1, 36,3, 36,1, 36,0, 32,3, 31,6, 30,2, 30,0, 28,6, 26,9, 24,1, 22,8, 20,8, 20,8, 19,5, 18,0, 16,0, 14,2. 13 C NMR (CDCl 3 ): 177.0, 170.2, 167.8, 152.8, 137.5, 127.7, 99.7, 80.1, 74.4, 71.4, 68, 2, 60.4, 49.3, 48.8, 44.6, 41.6, 39.5, 39.0, 38.8, 37.1, 36.3, 36.1, 36.0, 32.3, 31.6, 30.2, 30.0, 28.6, 26.9, 24.1, 22.8, 20.8, 20.8, 19.5, 18.0, 16, 0, 14.2.
Пример 28: Крем Example 28 : Cream
Нагревают вазелин, парафин, спермацет, монопальмитат сорбитана, монопальмитат полиоксиэтиленсорбитана до температуры 70°С и медленно добавляют воду при постоянном перемешивании. Продолжают перемешивание до охлаждения крема. Растирают натриевую соль 24-бромфузидовой кислоты до получения кремовой основы, которую гомогенизируют в роликовой мельнице. Заполняют кремом алюминиевые мягкие тубы.Vaseline, paraffin, spermaceti, sorbitan monopalmitate, polyoxyethylene sorbitan monopalmitate are heated to a temperature of 70 ° C and water is slowly added with constant stirring. Stirring is continued until the cream cools. Rub the sodium salt of 24-bromofusidic acid to obtain a cream base, which is homogenized in a roller mill. Fill the cream with aluminum soft tubes.
Пример 29: Мазь Example 29 : Ointment
Расплавляют парафин, цетанол, ланолин и вазелин при температуре 70°С. После охлаждения до температуры ниже 40°С растирают натриевую соль 24-бромфузидовой кислоты. Заполняют мазью лакированные алюминиевые мягкие тубы.Paraffin, cetanol, lanolin and petrolatum are melted at a temperature of 70 ° C. After cooling to a temperature below 40 ° C, the sodium salt of 24-bromofusidic acid is triturated. Fill ointment with varnished aluminum soft tubes.
Пример 30: Капсулы Example 30 : Capsules
Пропускают ингредиенты через сито 60 меш и перемешивают всю массу в течение 10 минут. Заполняют смесью твердые желатиновые капсулы с введением в капсулы количеств, равных 400 мг.Pass the ingredients through a 60 mesh sieve and mix the whole mass for 10 minutes. Hard gelatin capsules are filled with a mixture of 400 mg in capsules.
Пример 31: Таблетки Example 31 : Tablets
Натриевую соль 16-деацетокси-16β-(2',2',2'-трифторэтокси)-17S,20S-метансульфоновой кислоты, АвицельТМ (AvicelTM) и STA-Rx смешивают, просеивают через сито с размером пор 0,7 мм и затем смешивают со стеаратом магния. Смесь прессуют в таблетки, каждая из которых содержит по 500 мг.The sodium salt of 16-Deacetoxy-16β- (2 ', 2', 2'-trifluoroethoxy) -17S, 20S-methanesulfonic acid Avicel TM (Avicel TM) and STA-Rx are mixed, sieved through a sieve with a pore size of 0.7 mm and then mixed with magnesium stearate. The mixture is compressed into tablets, each containing 500 mg.
Пример 32: Суспензия Example 32 : Suspension
Кристаллы микронизируют и суспенируют в растворе лимонной кислоты, моногидрофосфата натрия, сахарозы, сорбата калия и ТвинТМ 80 в 10 мл воды, при необходимости проводя слабое нагревание. Натрий-карбоксиметилцеллюлозу растворяют в 4 мл кипящей воды. После охлаждения ее добавляют к другим ингредиентам. Суспензию гомогенизируют в смесителе и в конце процедуры добавляют воду до конечного объема 100 мл.The crystals are micronized and suspended in a solution of citric acid, sodium monohydrogen phosphate, sucrose, potassium sorbate, and Tween TM 80 in 10 ml of water, if necessary, conducting mild heating. Sodium carboxymethyl cellulose is dissolved in 4 ml of boiling water. After cooling, it is added to other ingredients. The suspension is homogenized in a mixer and water is added at the end of the procedure to a final volume of 100 ml.
Пример 33: Мазь Example 33 : Ointment
16β-(2',2',2'-трифторэтокси)фузидовой кислотыA: Sodium salt of 24-bromo-16-deacetoxy-
16β- (2 ', 2', 2'-trifluoroethoxy) fusidic acid
триамцинолон или флуоцинолонB: One of the compounds: hydrocortisone,
triamcinolone or fluocinolone
Расплавляют парафин, цетанол, ланолин и вазелин при температуре 70°С. После охлаждения до температуры ниже 40°С растирают A и B. Заполняют мазью лакированные алюминиевые мягкие тубы.Paraffin, cetanol, lanolin and petrolatum are melted at a temperature of 70 ° C. After cooling to a temperature below 40 ° C, rub A and B. Fill the varnished aluminum soft tubes with ointment.
Пример 34: Мазь Example 34 : Ointment
Расплавляют парафин, цетанол, ланолин и вазелин при температуре 70°С. После охлаждения до температуры ниже 40°С растирают A и B. Заполняют мазью лакированные алюминиевые мягкие тубы.Paraffin, cetanol, lanolin and petrolatum are melted at a temperature of 70 ° C. After cooling to a temperature below 40 ° C, rub A and B. Fill the varnished aluminum soft tubes with ointment.
Пример 35: Глазной гель Example 35 : Eye Gel
Растворяют эдетат динатрия и маннит в воде для инъекций в сосуде из нержавеющей стали, снабженном устройством для перемешивания и встроенным гомогенизатором. Добавляют Карбомер 934Р, отбирают сосуд и автоклавируют дисперсию при медленном перемешивании и гомогенизации с высокой скоростью. Охлаждают до температуры 70°С, останавливают перемешивание и гомогенизацию. Добавляют микронизированную стерильную натриевую соль 24-бром-16-деацетокси-16β-(2',2',2'-трифторэтокси)фузидовой кислоты, отбирают сосуд и дают 24-бром-16-деацетокси-16β-(2',2',2'-трифторэтокси)фузидовой кислоте осесть при медленном перемешивании. Гомогенизируют с высокой скоростью в течение 10 минут при 70°С. Охлаждают до температуры ниже 30°С при перемешивании и гомогенизации с низкой скоростью. Добавляют стерильный раствор бензалкония хлорида в воде для инъекций при медленном перемешивании. Нейтрализуют Карбомер 934Р при добавлении стерильного раствора гидроксида натрия (1,050 кг) в воде для инъекций. Перемешивают и гомогенизируют с низкой скоростью в течение 5 минут. Корректируют, при необходимости, значение pH до 5,4-5,8. Переносят глазной гель в резервуары для хранения под давлением азота с использованием низкоскоростной переносной системы для гомогенизации. Хранят при комнатной температуре до заполнения. Глазной гель вводят в асептических условиях в стерильные тубы, используя для заполнения продукт в количестве 3,5 г.Disodium edetate and mannitol are dissolved in water for injection in a stainless steel vessel equipped with a stirrer and an integrated homogenizer. Carbomer 934P is added, a vessel is taken and the dispersion is autoclaved with slow stirring and homogenization at high speed. Cool to a temperature of 70 ° C, stop mixing and homogenization. Micronized sterile 24-bromo-16-deacetoxy-16β- (2 ′, 2 ′, 2′-trifluoroethoxy) fusidic acid sodium salt was added, a vessel was selected and 24-bromo-16-deacetoxy-16β- (2 ′, 2 ′) was taken , 2'-trifluoroethoxy) fusidic acid precipitate with slow stirring. Homogenize at high speed for 10 minutes at 70 ° C. Cool to a temperature below 30 ° C with stirring and homogenization at a low speed. A sterile solution of benzalkonium chloride in water for injection is added with slow stirring. Neutralize Carbomer 934P by adding a sterile solution of sodium hydroxide (1,050 kg) in water for injection. Mix and homogenize at low speed for 5 minutes. Correct, if necessary, the pH value to 5.4-5.8. The ophthalmic gel is transferred to storage tanks under nitrogen pressure using a low-speed portable system for homogenization. Store at room temperature until filled. Eye gel is administered under aseptic conditions into sterile tubes, using 3.5 g of product to fill it.
Пример 36: Пивалоилоксиметиловый сложный эфир 24-фенилфузидовой кислоты (соединение 136) Example 36 : Pivaloyloxymethyl ester of 24-phenylfusidic acid (compound 136)
Фенилбороновую кислоту (50 мг, 0,4 ммоль) и EtOAc (0,25 мл) добавляют к раствору пивалоилоксиметилового сложного эфира 24-иодфузидовой кислоты (127) (150 мг, 0,2 ммоль) в толуоле (1,5 мл) и барботируют смесь аргоном в течение 2 минут. Добавляют K2CO3 (2М водн. раствор, 0,3 мл) и Pd(PPh3)4 (11,5 мг, 0,01 ммоль), после чего смесь встряхивают при 90°С в течение 20 часов в атмосфере аргона. Реакционную смесь обрабатывают EtOAc, водой и насыщ. NaCl, сушат и концентрируют. Полученный неочищенный продукт очищают колоночной флэш-хроматографией (20% EtOAc в петролейном эфире, в качестве элюента) с получением чистого указанного в заголовке соединения 136.Phenylboronic acid (50 mg, 0.4 mmol) and EtOAc (0.25 ml) are added to a solution of pivaloyloxymethyl ester of 24-iodofusidic acid (127) (150 mg, 0.2 mmol) in toluene (1.5 ml) and bubble the mixture with argon for 2 minutes. K 2 CO 3 (2M aq. Solution, 0.3 ml) and Pd (PPh 3 ) 4 (11.5 mg, 0.01 mmol) were added, after which the mixture was shaken at 90 ° C for 20 hours under argon atmosphere . The reaction mixture was treated with EtOAc, water and sat. NaCl, dried and concentrated. The resulting crude product was purified by flash column chromatography (20% EtOAc in petroleum ether as eluent) to give the pure title compound 136.
13C ЯМР (CDCl3): 177,0, 170,2, 167,7, 152,3, 144,1, 133,9, 129,6, 128,9, 128,4, 127,9, 125,9, 80,0, 74,3, 71,4, 67,9, 48,9, 48,7, 44,4, 39,4, 39,0, 38,8, 36,9, 36,3, 36,1, 35,4, 35,0, 32,2, 30,0, 27,4, 26,9, 23,9, 22,7, 22,0, 20,8, 20,0, 17,9, 15,9. 13 C NMR (CDCl 3 ): 177.0, 170.2, 167.7, 152.3, 144.1, 133.9, 129.6, 128.9, 128.4, 127.9, 125, 9, 80.0, 74.3, 71.4, 67.9, 48.9, 48.7, 44.4, 39.4, 39.0, 38.8, 36.9, 36.3, 36.1, 35.4, 35.0, 32.2, 30.0, 27.4, 26.9, 23.9, 22.7, 22.0, 20.8, 20.0, 17, 9, 15.9.
Пример 37: 24-фенилфузидовая кислота (соединение 137) Example 37 : 24-phenylfusidic acid (compound 137)
По процедуре, описанной в примере 3, при замене пивалоилоксиметилового сложного эфира 24-хлорфузидовой кислоты (104) пивалоилоксиметиловым сложным эфиром 24-фенилфузидовой кислоты (136) и при проведении перед колоночной флэш-хроматографией водной обработки (EtOAc, вода + водн. HCl до pH примерно 2 и насыщ. NaCl) получают чистое, указанное в заголовке соединение (137).According to the procedure described in example 3, when replacing pivaloyloxymethyl ester of 24-chlorofusidic acid (104) with pivaloyloxymethyl ester of 24-phenylfusidic acid (136) and when carrying out aqueous treatment before flash column chromatography (EtOAc, water + aq. HCl to pH about 2 and sat. NaCl) give the pure title compound (137).
13C ЯМР (CDCl3): 173,9, 170,6, 151,7, 144,1, 134,0, 129,6, 129,5, 128,4, 127,9, 125,9, 74,4, 71,5, 67,9, 48,9, 48,6, 44,3, 39,4, 39,0, 36,8, 36,3, 36,1, 35,4, 35,0, 32,2, 30,0, 30,0, 27,4, 23,8, 22,8, 22,0, 20,8, 20,7, 20,0, 17,9, 15,9. 13 C NMR (CDCl 3 ): 173.9, 170.6, 151.7, 144.1, 134.0, 129.6, 129.5, 128.4, 127.9, 125.9, 74, 4, 71.5, 67.9, 48.9, 48.6, 44.3, 39.4, 39.0, 36.8, 36.3, 36.1, 35.4, 35.0, 32.2, 30.0, 30.0, 27.4, 23.8, 22.8, 22.0, 20.8, 20.7, 20.0, 17.9, 15.9.
Пример 38: Пивалоилоксиметиловый сложный эфир 24-(4-бромфенил)фузидовой кислоты (соединение 138) Example 38 : 24- (4-Bromophenyl) fusidic acid pivaloyloxymethyl ester (compound 138)
По процедуре, приведенной в примере 36, при замене фенилбороновой кислоты [2-(4-бромфенил)-5,5-диметил-1,3,2-диоксаборинан]ом получают указанное в заголовке соединения (138).According to the procedure described in Example 36, when the phenylboronic acid is replaced with [2- (4-bromophenyl) -5,5-dimethyl-1,3,2-dioxaborinan] ohm, the title compound (138) is obtained.
13C ЯМР (CDCl3): 177,0, 170,2, 167,7, 152,5, 142,9, 132,9, 131,3, 131,1, 129,0, 128,6, 119,9, 80,0, 74,3, 71,4, 68,0, 49,0, 48,6, 44,5, 39,4, 39,0, 38,8, 37,0, 36,2, 35,1, 35,0, 32,4, 30,1, 30,0, 27,4, 26,9, 24,1, 22,7, 22,0, 20,8, 20,7, 20,0, 18,0, 15,9. 13 C NMR (CDCl 3 ): 177.0, 170.2, 167.7, 152.5, 142.9, 132.9, 131.3, 131.1, 129.0, 128.6, 119, 9, 80.0, 74.3, 71.4, 68.0, 49.0, 48.6, 44.5, 39.4, 39.0, 38.8, 37.0, 36.2, 35.1, 35.0, 32.4, 30.1, 30.0, 27.4, 26.9, 24.1, 22.7, 22.0, 20.8, 20.7, 20, 0, 18.0, 15.9.
Пример 39: 24-(4-бромфенил)фузидовая кислота (соединение 139) Example 39 : 24- (4-bromophenyl) fusidic acid (compound 139)
По процедуре, описанной в примере 3, при замене пивалоилоксиметилового сложного эфира 24-хлорфузидовой кислоты (104) пивалоилоксиметиловым сложным эфиром 24-(4-бромфенил)фузидовой кислоты (138) и при проведении перед колоночной флэш-хроматографией водной обработки (EtOAc, вода + водн. HCl до pH примерно 2 и насыщ. NaCl) получают чистое, указанное в заголовке соединение (139).According to the procedure described in example 3, when replacing pivaloyloxymethyl ester of 24-chlorofusidic acid (104) with pivaloyloxymethyl ester of 24- (4-bromophenyl) fusidic acid (138) and when carrying out aqueous treatment before flash column chromatography (EtOAc, water + aq HCl to a pH of about 2 and sat. NaCl) give the pure title compound (139).
13C ЯМР (CDCl3): 174,0, 170,6, 152,1, 142,9, 133,0, 131,3, 131,1, 129,1, 128,4, 119,8, 74,3, 71,5, 68,0, 49,0, 48,6, 44,4, 39,4, 39,0, 37,0, 36,2, 35,1, 35,0, 32,3, 30,1, 30,0, 27,4, 24,0, 22,7, 22,1, 20,8, 20,6, 20,0, 17,9, 15,9. 13 C NMR (CDCl 3 ): 174.0, 170.6, 152.1, 142.9, 133.0, 131.3, 131.1, 129.1, 128.4, 119.8, 74, 3, 71.5, 68.0, 49.0, 48.6, 44.4, 39.4, 39.0, 37.0, 36.2, 35.1, 35.0, 32.3, 30.1, 30.0, 27.4, 24.0, 22.7, 22.1, 20.8, 20.6, 20.0, 17.9, 15.9.
Пример 40: Пивалоилоксиметиловый сложный эфир 24-(4-хлорфенил)фузидовой кислоты (соединение 140) Example 40 : Pivaloyloxymethyl ester of 24- (4-chlorophenyl) fusidic acid (compound 140)
По процедуре, приведенной в примере 36, при замене фенилбороновой кислоты [2-(4-хлорфенил)-5,5-диметил-1,3,2-диоксаборинан]ом получают указанное в заголовке соединение (140).Following the procedure in Example 36, when the phenylboronic acid [2- (4-chlorophenyl) -5,5-dimethyl-1,3,2-dioxaborinan] ohm is replaced, the title compound (140) is obtained.
13C ЯМР (CDCl3): 177,0, 170,2, 167,8, 152,3, 142,4, 132,9, 131,8, 130,9, 129,1, 128,7, 128,2, 80,0, 74,2, 71,4, 68,0, 49,0, 48,6, 44,5, 39,4, 39,0, 37,0, 36,2, 36,1, 35,1, 35,0, 32,3, 30,1, 30,0, 27,4, 26,9, 24,0, 22,7, 22,0, 21,3, 20,8, 20,8, 20,0, 17,9, 15,9. 13 C NMR (CDCl 3 ): 177.0, 170.2, 167.8, 152.3, 142.4, 132.9, 131.8, 130.9, 129.1, 128.7, 128, 2, 80.0, 74.2, 71.4, 68.0, 49.0, 48.6, 44.5, 39.4, 39.0, 37.0, 36.2, 36.1, 35.1, 35.0, 32.3, 30.1, 30.0, 27.4, 26.9, 24.0, 22.7, 22.0, 21.3, 20.8, 20, 8, 20.0, 17.9, 15.9.
Пример 41: 24-(4-хлорфенил)фузидовая кислота (соединение 141) Example 41 : 24- (4-chlorophenyl) fusidic acid (compound 141)
По процедуре, приведенной в примере 3, при замене пивалоилоксиметилового сложного эфира 24-хлорфузидовой кислоты (104) пивалоилоксиметиловым сложным эфиром 24-(4-хлорфенил)фузидовой кислоты (140) и при проведении перед колоночной флэш-хроматографией водной обработки (EtOAc, вода + водн. HCl до pH примерно 2 и насыщ. NaCl) получают чистое, указанное в заголовке соединение (141).According to the procedure described in example 3, when replacing pivaloyloxymethyl ester of 24-chlorofusidic acid (104) with pivaloyloxymethyl ester of 24- (4-chlorophenyl) fusidic acid (140) and when water treatment (EtOAc, water +) is carried out before flash column chromatography aq HCl to a pH of about 2 and sat. NaCl) give the pure title compound (141).
13C ЯМР (CDCl3): 173,9, 170,6, 151,9, 142,4, 133,0, 131,8, 130,9, 129,2, 129,1, 128,1, 74,3, 71,6, 71,5, 68,0, 49,0, 48,6, 44,4, 39,4, 39,0, 37,0, 36,2, 36,1, 35,0, 32,3, 30,0, 27,4, 24,0, 22,7, 22,1, 21,3, 20,8, 20,6, 20,0, 17,9, 15,9. 13 C NMR (CDCl 3 ): 173.9, 170.6, 151.9, 142.4, 133.0, 131.8, 130.9, 129.2, 129.1, 128.1, 74, 3, 71.6, 71.5, 68.0, 49.0, 48.6, 44.4, 39.4, 39.0, 37.0, 36.2, 36.1, 35.0, 32.3, 30.0, 27.4, 24.0, 22.7, 22.1, 21.3, 20.8, 20.6, 20.0, 17.9, 15.9.
Пример 42: Пивалоилоксиметиловый сложный эфир 24-(3,5-дифторфенил)фузидовой кислоты (соединение 142) Example 42 : Pivaloyloxymethyl ester of 24- (3,5-difluorophenyl) fusidic acid (compound 142)
По процедуре, приведенной в примере 36, при замене фенилбороновой кислоты [2-(3,5-дифторфенил)-5,5-диметил-1,3,2-диоксаборинан]ом получают указанное в заголовке соединение (142).According to the procedure described in Example 36, when phenylboronic acid is replaced with [2- (3,5-difluorophenyl) -5,5-dimethyl-1,3,2-dioxaborinan] ohm, the title compound (142) is obtained.
13C ЯМР (CDCl3): 177,0, 170,2, 167,8, 162,9, 162,7, 152,2, 147,2, 132,3, 130,1, 128,5, 112,2, 112,0, 101,4, 80,1, 74,2, 71,4, 68,1, 49,1, 48,6, 44,5, 39,4, 39,0, 38,8, 37,0, 36,2, 35,3, 34,4, 32,4, 30,2, 30,0, 27,6, 26,9, 24,2, 22,6, 22,1, 20,8, 20,7, 20,2, 18,0, 15,9. 13 C NMR (CDCl 3 ): 177.0, 170.2, 167.8, 162.9, 162.7, 152.2, 147.2, 132.3, 130.1, 128.5, 112, 2, 112.0, 101.4, 80.1, 74.2, 71.4, 68.1, 49.1, 48.6, 44.5, 39.4, 39.0, 38.8, 37.0, 36.2, 35.3, 34.4, 32.4, 30.2, 30.0, 27.6, 26.9, 24.2, 22.6, 22.1, 20, 8, 20.7, 20.2, 18.0, 15.9.
Пример 43: 24-(3,5-дифторфенил)фузидовая кислота (соединение 143) Example 43 : 24- (3,5-difluorophenyl) fusidic acid (compound 143)
По процедуре, приведенной в примере 3, при замене пивалоилоксиметилового сложного эфира 24-хлорфузидовой кислоты (104) пивалоилоксиметиловым сложным эфиром 24-(3,5-дифторфенил)фузидовой кислоты (142) и при проведении перед колоночной флэш-хроматографией водной обработки (EtOAc, вода + водн. HCl до pH примерно 2 и насыщ. NaCl) получают чистое, указанное в заголовке соединение (143).According to the procedure described in example 3, when replacing pivaloyloxymethyl ester of 24-chlorofusidic acid (104) with pivaloyloxymethyl ester of 24- (3,5-difluorophenyl) fusidic acid (142) and when water treatment (EtOAc, water + aq HCl to a pH of about 2 and sat. NaCl) give the pure title compound (143).
13C ЯМР (CDCl3): 174,1, 170,6, 162,8, 162,7, 152,0, 147,2, 132,3, 130,2, 129,0, 112,2, 101,4, 74,3, 71,5, 68,1, 49,1, 48,6, 44,4, 39,4, 39,0, 37,0, 36,2, 36,2, 35,3, 34,5, 32,4, 30,2, 29,9, 27,5, 24,1, 22,7, 22,1, 20,7, 20,6, 20,1, 17,9, 15,9. 13 C NMR (CDCl 3 ): 174.1, 170.6, 162.8, 162.7, 152.0, 147.2, 132.3, 130.2, 129.0, 112.2, 101, 4, 74.3, 71.5, 68.1, 49.1, 48.6, 44.4, 39.4, 39.0, 37.0, 36.2, 36.2, 35.3, 34.5, 32.4, 30.2, 29.9, 27.5, 24.1, 22.7, 22.1, 20.7, 20.6, 20.1, 17.9, 15, 9.
Пример 44: Ацетоксиметиловый сложный эфир 3-дезокси-3β,24-дибромфузидовой кислоты (соединение 144) Example 44 : Acetoxymethyl 3-deoxy-3β, 24-dibromofusidic acid ester (compound 144)
Ацетоксиметиловый сложный эфир 24-бромфузидовой кислоты (107) (0,45 г, 0,67 ммоль) растворяют в сухом бензоле (10 мл) и перемешивают в атмосфере аргона. Добавляют трифенилфосфин (0,7 г, 2,7 ммоль) и тетрабромметан (1,1 г, 3,3 ммоль) и смесь перемешивают при комнатной температуре в течение одного часа. Добавляют диэтиловый эфир (50 мл) и осажденный материал удаляют фильтрованием. Фильтрат концентрируют, а остаток очищают колоночной флэш-хроматографией (элюент: 0%-50% EtOAc в петролейном эфире), получая указанное в заголовке соединение (144).Acetoxymethyl ester of 24-bromofusidic acid (107) (0.45 g, 0.67 mmol) was dissolved in dry benzene (10 ml) and stirred under argon. Triphenylphosphine (0.7 g, 2.7 mmol) and tetrabromomethane (1.1 g, 3.3 mmol) were added and the mixture was stirred at room temperature for one hour. Diethyl ether (50 ml) was added and the precipitated material was removed by filtration. The filtrate was concentrated, and the residue was purified by flash column chromatography (eluent: 0% -50% EtOAc in petroleum ether) to give the title compound (144).
13C ЯМР (CDCl3): 170,3, 169,6, 167,8, 152,3, 131,8, 128,1, 119,9, 79,5,74,3, 68,1, 62,7, 49,0, 48,8, 45,5, 44,4, 41,3, 39,4, 39,0, 37,7, 37,2, 36,8, 36,1, 35,1, 32,5, 27,8, 25,3, 23,9, 23,9, 22,0, 20,8, 20,7, 20,4, 18,9, 17,9. 13 C NMR (CDCl 3 ): 170.3, 169.6, 167.8, 152.3, 131.8, 128.1, 119.9, 79.5.74.3, 68.1, 62, 7, 49.0, 48.8, 45.5, 44.4, 41.3, 39.4, 39.0, 37.7, 37.2, 36.8, 36.1, 35.1 , 32.5, 27.8, 25.3, 23.9, 23.9, 22.0, 20.8, 20.7, 20.4, 18.9, 17.9.
Пример 45: 24-бромфузидовая кислота (соединение 108) Example 45 : 24-bromofusidic acid (compound 108)
24,25-дибромфузидовую кислоту (17) (неочищенный продукт, полученный из 0,1 моль фузидовой кислоты) растворяют в EtOH (900 мл) и воде (25 мл) и добавляют K2CO3 (30 г, 0,22 моль). Смесь кипятят с обратным холодильником при непрерывном перемешивании в течение 30 минут, охлаждают до комнатной температуры и выливают в воду (4 литра). Щелочной раствор калиевой соли (108) подкисляют путем добавления водн. H3PO4 (350 мл, 1М) при непрерывном перемешивании до pH 4,0, при этом образуется осадок. Продукт собирают фильтрованием, промывают водой и сушат с получением неочищенного продукта (108). Указанное неочищенное соединение 108 может быть затем очищено и кристаллизовано, например, по процедуре, описанной в примере 8, с получением чистого соединения 108, или может быть преобразовано в легко гидролизуемый сложный эфир, например, по процедуре, описанной в способах получения 1 и 2, или может быть преобразовано в подходящую соль, такую как натриевая соль, как описано в примере 9. Преимуществом натриевой соли соединения 108 8 является то, что при этом сразу удается получить очень чистую кристаллическую натриевую соль, так что отпадает потребность в хроматографической очистке. При высвобождении свободной кислоты из данной натриевой соли (например, как описано выше применительно к калиевой соли) получают продукт, который может быть непосредственно подвергнут кристаллизации (например, из этилацетата и толуола) с образованием чистого кристаллического соединения 108.24,25-dibromofusidic acid (17) (crude product obtained from 0.1 mol of fusidic acid) was dissolved in EtOH (900 ml) and water (25 ml) and K 2 CO 3 (30 g, 0.22 mol) was added. . The mixture was refluxed with continuous stirring for 30 minutes, cooled to room temperature and poured into water (4 liters). The alkaline potassium salt solution (108) is acidified by the addition of aq. H 3 PO 4 (350 ml, 1M) with continuous stirring to pH 4.0, a precipitate forms. The product was collected by filtration, washed with water and dried to obtain a crude product (108). The specified crude compound 108 can then be purified and crystallized, for example, according to the procedure described in example 8, to obtain pure compound 108, or can be converted into an easily hydrolyzable ester, for example, according to the procedure described in methods 1 and 2, or can be converted to a suitable salt, such as the sodium salt, as described in Example 9. The advantage of the sodium salt of compound 108 8 is that it is immediately possible to obtain a very pure crystalline sodium salt, so that there is no need to NOSTA to chromatographic purification. When free acid is released from a given sodium salt (for example, as described above with respect to the potassium salt), a product is obtained which can be directly crystallized (for example, from ethyl acetate and toluene) to give pure crystalline compound 108.
Пример 46: 24-бром-16-деацетокси-16β-этилтиофузидовая кислота (соединение 146) Example 46 : 24-bromo-16-deacetoxy-16β-ethylthiofusidic acid (compound 146)
По процедуре, приведенной в примере 12, при замене 2-пропантиола этантиолом получают указанное в заголовке соединение (146).According to the procedure described in Example 12, when replacing 2-propanethiol with ethanethiol, the title compound (146) was obtained.
13C ЯМР (CDCl3): 176,3, 154,8, 131,3, 128,3, 120,4, 71,5, 68,4, 49,4, 48,9, 46,1, 45,6, 41,0, 39,7, 37,9, 37,1, 36,4, 36,0, 35,8, 32,7, 30,4, 30,0, 29,6, 28,6, 25,3, 24,4, 22,5, 20,7, 20,4, 18,8, 16,0, 14,7. 13 C NMR (CDCl 3 ): 176.3, 154.8, 131.3, 128.3, 120.4, 71.5, 68.4, 49.4, 48.9, 46.1, 45, 6, 41.0, 39.7, 37.9, 37.1, 36.4, 36.0, 35.8, 32.7, 30.4, 30.0, 29.6, 28.6, 25.3, 24.4, 22.5, 20.7, 20.4, 18.8, 16.0, 14.7.
Пример 47: 24-бром-16-деацетокси-16β-этилсульфинилфузидовая кислота (соединение 147) Example 47 : 24-bromo-16-deacetoxy-16β-ethylsulfinylfusidic acid (compound 147)
По процедуре, приведенной в примере 13, при замене 24-бром-16-деацетокси-16β-изопропилтиофузидовой кислоты (112) 24-бром-16-деацетокси-16β-этилтиофузидовой кислотой (соединение 146) получают указанное в заголовке соединение (147).Following the procedure in Example 13, by replacing 24-bromo-16-deacetoxy-16β-isopropylthiofusidic acid (112) with 24-bromo-16-deacetoxy-16β-ethylthiofusidic acid (compound 146), the title compound (147) was obtained.
1H ЯМР (CDCl): 4,40 (д, 1H), 4,37 (м, 1H), 3,76 (м, 1H), 3,18 (д, 1H), 2,90-2,40 (м, 5H), 2,25-1,0 (м, 19H), 1,84 (ш.с., 3H), 1,77 (ш.с., 3H), 1,45 (с, 3H), 1,25 (т, 3H), 0,97 (с, 3H), 0,93 (д, 3H), 0,79 (с, 3H). 1 H NMR (CDCl 3): 4.40 (d, 1H), 4.37 (m, 1H), 3.76 (m, 1H), 3.18 (d, 1H), 2.90-2.40 (m, 5H), 2.25-1.0 (m, 19H), 1.84 (br.s, 3H), 1.77 (br.s, 3H), 1.45 (s, 3H) ), 1.25 (t, 3H), 0.97 (s, 3H), 0.93 (d, 3H), 0.79 (s, 3H).
Пример 48: 24-бром-16-деацетокси-16β-аллилтиофузидовая кислота (соединение 148) Example 48 : 24-bromo-16-deacetoxy-16β-allylthiofusidic acid (compound 148)
По процедуре, приведенной в примере 12, при замене 2-пропантиола аллилмеркаптаном получают указанное в заголовке соединение (148).According to the procedure described in Example 12, when replacing 2-propanethiol with allyl mercaptan, the title compound (148) was obtained.
13C ЯМР (CDCl3): 175,5, 154,7, 134,4, 131,3, 128,4, 120,4, 117,0, 71,5, 68,4, 49,4, 48,9, 45,6, 39,7, 37,9, 37,1, 36,4, 36,0, 34,7, 32,7, 30,9, 30,3, 30,0, 29,7, 29,0, 28,6, 25,4, 24,4, 22,5, 20,7, 20,4, 18,9, 16,0. 13 C NMR (CDCl 3 ): 175.5, 154.7, 134.4, 131.3, 128.4, 120.4, 117.0, 71.5, 68.4, 49.4, 48, 9, 45.6, 39.7, 37.9, 37.1, 36.4, 36.0, 34.7, 32.7, 30.9, 30.3, 30.0, 29.7, 29.0, 28.6, 25.4, 24.4, 22.5, 20.7, 20.4, 18.9, 16.0.
Пример 49: 24-бром-16-деацетокси-16β-(1-пентилтио)фузидовая кислота (соединение 149) Example 49 : 24-bromo-16-deacetoxy-16β- (1-pentylthio) fusidic acid (compound 149)
По процедуре, приведенной в примере 12, при замене 2-пропантиола 1-пентантиолом получают указанное в заголовке соединение (149).According to the procedure described in Example 12, when replacing 2-propanethiol with 1-pentanethiol, the title compound (149) was obtained.
13C ЯМР (CDCl3): 176,0, 155,0, 131,3, 128,3, 120,4, 71,5, 68,4, 49,4, 48,9, 46,6, 45,6, 41,0, 39,7, 38,0, 37,1, 36,3, 36,0, 35,9, 35,9, 32,7, 31,4, 30,3, 30,0, 29,4, 28,7, 25,3, 24,3, 22,5, 22,3, 20,7, 20,4, 18,8, 16,0, 14,0. 13 C NMR (CDCl 3 ): 176.0, 155.0, 131.3, 128.3, 120.4, 71.5, 68.4, 49.4, 48.9, 46.6, 45, 6, 41.0, 39.7, 38.0, 37.1, 36.3, 36.0, 35.9, 35.9, 32.7, 31.4, 30.3, 30.0, 29.4, 28.7, 25.3, 24.3, 22.5, 22.3, 20.7, 20.4, 18.8, 16.0, 14.0.
Пример 50: 24-бром-16-деацетокси-16β-(1-пентилсуфльфинил)фузидовая кислота (соединение 150) Example 50 : 24-bromo-16-deacetoxy-16β- (1-pentylsulfonyl) fusidic acid (compound 150)
По процедуре, приведенной в примере 13, при замене 24-бром-16-деацетокси-16β-изопропилтиофузидовой кислоты (112) 24-бром-16-деацетокси-16β-(1-пентилтио)фузидовой кислотой (соединение 149) получают указанное в заголовке соединение (150).Following the procedure in Example 13, by replacing 24-bromo-16-deacetoxy-16β-isopropylthiofusidic acid (112) with 24-bromo-16-deacetoxy-16β- (1-pentylthio) fusidic acid (compound 149), the title was obtained compound (150).
13C ЯМР (CDCl3): 173,6, 159,2, 131,3, 125,9, 120,2, 71,5, 68,3, 49,5, 48,2, 47,6, 39,8, 38,1, 37,1, 36,2, 35,5, 32,5, 31,0, 30,3, 29,9, 27,9, 25,8, 25,3, 24,5, 22,8, 22,7, 22,4, 20,7, 20,4, 17,8, 16,0, 14,0. 13 C NMR (CDCl 3 ): 173.6, 159.2, 131.3, 125.9, 120.2, 71.5, 68.3, 49.5, 48.2, 47.6, 39, 8, 38.1, 37.1, 36.2, 35.5, 32.5, 31.0, 30.3, 29.9, 27.9, 25.8, 25.3, 24.5, 22.8, 22.7, 22.4, 20.7, 20.4, 17.8, 16.0, 14.0.
Пример 51: 24-бром-16-деацетокси-16β-(2-метил-1-бутилтио)фузидовая кислота (соединение 151) Example 51 : 24-bromo-16-deacetoxy-16β- (2-methyl-1-butylthio) fusidic acid (compound 151)
По процедуре, приведенной в примере 12, при замене 2-пропантиола 2-метил-1-бутантиолом получают указанное в заголовке соединение (151).Following the procedure described in Example 12, substituting 2-propanethiol with 2-methyl-1-butanethiol affords the title compound (151).
13C ЯМР (CDCl3): 175,8, 155,0, 131,3, 128,3, 120,4, 71,6, 68,4, 49,4, 48,9, 47,2, 46,8, 45,7, 45,6, 43,4, 42,9, 40,8, 40,4, 39,7, 38,0, 37,1, 36,4, 36,0, 35,9, 34,9, 34,6, 32,8, 30,4, 30,0, 29,3, 28,7, 25,3, 24,4, 22,5, 20,7, 20,4, 19,3, 19,0, 18,9, 16,0, 11,3. 13 C NMR (CDCl 3 ): 175.8, 155.0, 131.3, 128.3, 120.4, 71.6, 68.4, 49.4, 48.9, 47.2, 46, 8, 45.7, 45.6, 43.4, 42.9, 40.8, 40.4, 39.7, 38.0, 37.1, 36.4, 36.0, 35.9, 34.9, 34.6, 32.8, 30.4, 30.0, 29.3, 28.7, 25.3, 24.4, 22.5, 20.7, 20.4, 19, 3, 19.0, 18.9, 16.0, 11.3.
Пример 52: 24-бром-16-деацетокси-16β-(2-метил-1-бутилсульфинил)фузидовая кислота (соединение 152) Example 52 : 24-bromo-16-deacetoxy-16β- (2-methyl-1-butylsulfinyl) fusidic acid (compound 152)
По процедуре, приведенной в примере 13, при замене 24-бром-16-деацетокси-16β-изопропилтиофузидовой кислоты (112) 24-бром-16-деацетокси-16β-(2-метил-1-бутилтио)фузидовой кислотой (соединение 151) получают указанное в заголовке соединение (152).According to the procedure described in example 13, when replacing 24-bromo-16-deacetoxy-16β-isopropylthiofusidic acid (112) with 24-bromo-16-deacetoxy-16β- (2-methyl-1-butylthio) fusidic acid (compound 151) the title compound (152) is obtained.
13C ЯМР (CDCl3): 173,9, 131,3, 126,0, 120,2, 71,5, 68,3, 49,6, 48,3, 47,8, 39,8, 38,2, 37,1, 36,2, 36,1, 35,5, 32,4, 30,3, 29,9, 28,0, 27,9, 25,3, 24,5, 22,8, 20,8, 20,4, 19,5, 17,9, 16,0, 11,2. 13 C NMR (CDCl 3 ): 173.9, 131.3, 126.0, 120.2, 71.5, 68.3, 49.6, 48.3, 47.8, 39.8, 38, 2, 37.1, 36.2, 36.1, 35.5, 32.4, 30.3, 29.9, 28.0, 27.9, 25.3, 24.5, 22.8, 20.8, 20.4, 19.5, 17.9, 16.0, 11.2.
Пример 53: 24-бром-16-деацетокси-16β-(3-метил-1-бутилтио)фузидовая кислота (соединение 153) Example 53 : 24-bromo-16-deacetoxy-16β- (3-methyl-1-butylthio) fusidic acid (compound 153)
По процедуре, приведенной в примере 12, при замене 2-пропантиола 3-метил-1-бутантиолом получают указанное в заголовке соединение (153).Following the procedure described in Example 12, substituting 2-propanethiol with 3-methyl-1-butanethiol affords the title compound (153).
13C ЯМР (CDCl3): 176,0, 155,0, 131,2, 128,3, 120,5, 71,6, 68,4, 49,4, 48,9, 46,6, 45,7, 40,9, 39,7, 38,5, 38,0, 37,1, 36,3, 36,1, 35,9, 33,9, 32,6, 30,3, 30,0, 28,7, 27,7, 25,3, 24,3, 22,6, 22,4, 22,3, 20,8, 20,4, 18,8, 16,0. 13 C NMR (CDCl 3 ): 176.0, 155.0, 131.2, 128.3, 120.5, 71.6, 68.4, 49.4, 48.9, 46.6, 45, 7, 40.9, 39.7, 38.5, 38.0, 37.1, 36.3, 36.1, 35.9, 33.9, 32.6, 30.3, 30.0, 28.7, 27.7, 25.3, 24.3, 22.6, 22.4, 22.3, 20.8, 20.4, 18.8, 16.0.
Пример 54: 24-бром-16-деацетокси-16β-(3-метил-1-бутилсульфинил)фузидовая кислота (соединение 154) Example 54 : 24-bromo-16-deacetoxy-16β- (3-methyl-1-butylsulfinyl) fusidic acid (compound 154)
По процедуре, приведенной в примере 13, при замене 24-бром-16-деацетокси-16β-изопропилтиофузидовой кислоты (112) 24-бром-16-деацетокси-16β-(3-метил-1-бутилтио)фузидовой кислотой (соединение 153) получают указанное в заголовке соединение (154).According to the procedure described in example 13, when replacing 24-bromo-16-deacetoxy-16β-isopropylthiofusidic acid (112) with 24-bromo-16-deacetoxy-16β- (3-methyl-1-butylthio) fusidic acid (compound 153) the title compound (154) is obtained.
13C ЯМР (CDCl3): 173,6, 131,3, 120,2, 71,5, 68,3, 49,5, 48,2, 39,8, 38,1, 37,1, 36,2, 35,6, 32,5, 31,5, 30,3, 29,9, 27,8, 25,3, 24,5, 22,8, 22,6, 2,3, 20,8, 20,4, 17,8, 16,0. 13 C NMR (CDCl 3 ): 173.6, 131.3, 120.2, 71.5, 68.3, 49.5, 48.2, 39.8, 38.1, 37.1, 36, 2, 35.6, 32.5, 31.5, 30.3, 29.9, 27.8, 25.3, 24.5, 22.8, 22.6, 2.3, 20.8, 20.4, 17.8, 16.0.
Пример 55: 24-бром-16-деацетокси-16β-циклопентилтиофузидовая кислота (соединение 155) Example 55 : 24-bromo-16-deacetoxy-16β-cyclopentylthiofusidic acid (compound 155)
Раствор брома (12,0 мг, 0,150 моль) в этилацетате (0,6 мл) добавляют к раствору 16-деацетокси-16β-циклопентилтиофузидовой кислоты (von Daehne, W. et. al., Adv. Appl. Microbiol., 1979, vol 25, p. 95-146) (76,0 мг, 0,136 ммоль) в этилацетате (4 мл) в течение 2 минут при перемешивании и охлаждении на ледяной бане. Далее добавляют 1М водн. KH2PO4 (0,2 мл) и 1М водн. Na2S2O3 (0,1 мл), при перемешивании в течение 5 минут. EtOAc-фазу отделяют, экстрагируют 0,5М водн. KH2PO4 (0,5 мл) и водой (0,5 мл) и концентрируют с получением промежуточного соединения - аналога 24,25-дибромфузидовой кислоты в виде масла, которую используют без дальнейшей очистки в реакции дегидробромирования. Промежуточный продукт - аналог 24,25-дибромфузидовой кислоты растворяют в этаноле (3 мл), добавляют воду (0,06 мл) и K2CO3 (40 мг, 0,3 ммоль) и смесь кипятят с обратным холодильником при перемешивании в течение Ѕ часа; охлаждают до комнатной температуры и выливают в воду (15 мл). Щелочной раствор (155) подкисляют путем добавления 1М водн. H3PO4 при перемешивании до pH 4,0 и обрабатывают (EtOAc, насыщ. NaCl) с получением неочищенного продукта. Далее указанный неочищенный продукт очищают колоночной флэш-хроматографией (10-50% EtOAc в петролейном эфире + 1% AcOH, в качестве элюента) с получением чистого, указанного в заголовке соединения (155).A solution of bromine (12.0 mg, 0.150 mol) in ethyl acetate (0.6 ml) was added to a solution of 16-deacetoxy-16β-cyclopentylthiofusidic acid (von Daehne, W. et. Al., Adv. Appl. Microbiol ., 1979, vol 25, p. 95-146) (76.0 mg, 0.136 mmol) in ethyl acetate (4 ml) for 2 minutes with stirring and cooling in an ice bath. Then add 1M aq. KH 2 PO 4 (0.2 ml) and 1M aq. Na 2 S 2 O 3 (0.1 ml), with stirring for 5 minutes. The EtOAc phase was separated, extracted with 0.5M aq. KH 2 PO 4 (0.5 ml) and water (0.5 ml) and concentrated to obtain an intermediate compound - analogue of 24.25-dibromofusidic acid in the form of an oil, which is used without further purification in the dehydrobromination reaction. An intermediate product, an analogue of 24.25-dibromofusidic acid, was dissolved in ethanol (3 ml), water (0.06 ml) and K 2 CO 3 (40 mg, 0.3 mmol) were added and the mixture was refluxed with stirring for Ѕ hours; cooled to room temperature and poured into water (15 ml). The alkaline solution (155) is acidified by adding 1M aq. H 3 PO 4 with stirring to pH 4.0 and treated (EtOAc, sat. NaCl) to obtain a crude product. Next, the crude product was purified by flash column chromatography (10-50% EtOAc in petroleum ether + 1% AcOH as eluent) to give the pure title compound (155).
13C ЯМР (CDCl3): 175,3, 155,0, 131,3, 128,2, 120,4, 71,5, 68,4, 49,4, 48,8, 47,7, 46,2, 45,6, 41,1, 39,7, 38,0, 37,2, 36,5, 35,9, 34,6, 32,9, 32,5, 30,4, 30,1, 28,8, 25,3, 24,8, 24,6, 24,5, 22,3, 20,7, 20,4, 19,0, 16,0. 13 C NMR (CDCl 3 ): 175.3, 155.0, 131.3, 128.2, 120.4, 71.5, 68.4, 49.4, 48.8, 47.7, 46, 2, 45.6, 41.1, 39.7, 38.0, 37.2, 36.5, 35.9, 34.6, 32.9, 32.5, 30.4, 30.1, 28.8, 25.3, 24.8, 24.6, 24.5, 22.3, 20.7, 20.4, 19.0, 16.0.
Пример 56: 24-бром-16-деацетокси-16β-(2',2',2'-трифторэтилтио) фузидовая кислота (соединение 156) Example 56 : 24-bromo-16-deacetoxy-16β- (2 ', 2', 2'-trifluoroethylthio) fusidic acid (compound 156)
По процедуре, приведенной в примере 12, при замене 2-пропантиола 2,2,2-трифторэтантиолом получают указанное в заголовке соединение (156).According to the procedure described in Example 12, substituting 2-propanethiol with 2,2,2-trifluoroethanethiol afforded the title compound (156).
13C ЯМР (CDCl3): 175,6, 155,6, 131,5, 128,9, 120,2, 71,5, 68,3, 49,1, 48,9, 45,9, 41,2, 39,6, 38,9, 37,8, 37,1, 36,3, 36,0, 35,8, 32,7, 30,4, 30,0, 28,5, 25,3, 24,4, 22,5, 21,1, 20,6, 20,4, 18,9, 16,0. 13 C NMR (CDCl 3 ): 175.6, 155.6, 131.5, 128.9, 120.2, 71.5, 68.3, 49.1, 48.9, 45.9, 41, 2, 39.6, 38.9, 37.8, 37.1, 36.3, 36.0, 35.8, 32.7, 30.4, 30.0, 28.5, 25.3, 24.4, 22.5, 21.1, 20.6, 20.4, 18.9, 16.0.
Пример 57: 24-бром-16-деацетокси-16β-(2-гидроксиэтитио)фузидовая кислота (соединение 157) Example 57 : 24-bromo-16-deacetoxy-16β- (2-hydroxyethithio) fusidic acid (compound 157)
По процедуре, приведенной в примере 55, при замене 16-деацетокси-16β-циклопентилтиофузидовой кислоты 16-деацетокси-16β-(2-гидроксиэтилтио)фузидовой кислотой (von Daehne, W. et. al., Adv. Appl. Microbiol., 1979, vol 25, p. 95-146) получают указанное в заголовке соединение (157).According to the procedure described in example 55, when replacing 16-deacetoxy-16β-cyclopentylthiofusidic acid with 16-deacetoxy-16β- (2-hydroxyethylthio) fusidic acid (von Daehne, W. et. Al., Adv. Appl. Microbiol. , 1979 vol 25, p. 95-146), the title compound (157) is obtained.
13C ЯМР (CDCl3): 174,4, 153,3, 131,3, 129,0, 120,5, 71,6, 68,3, 59,0, 49,4, 48,9, 45,7, 43,9, 39,9, 39,8, 37,9, 37,1, 36,7, 36,3, 36,1, 35,8, 32,6, 30,3, 30,0, 28,5, 25,4, 24,3, 22,6, 20,7, 20,4, 18,9, 16,0. 13 C NMR (CDCl 3 ): 174.4, 153.3, 131.3, 129.0, 120.5, 71.6, 68.3, 59.0, 49.4, 48.9, 45, 7, 43.9, 39.9, 39.8, 37.9, 37.1, 36.7, 36.3, 36.1, 35.8, 32.6, 30.3, 30.0, 28.5, 25.4, 24.3, 22.6, 20.7, 20.4, 18.9, 16.0.
Пример 58: 24-бром-16-деацетокси-16β-бензилтиофузидовая кислота (соединение 158) Example 58 : 24-bromo-16-deacetoxy-16β-benzylthiofusidic acid (compound 158)
По процедуре, приведенной в примере 12, при замене 2-пропантиола бензилмеркаптаном получают указанное в заголовке соединение (158).Following the procedure described in Example 12, when 2-propanethiol was replaced with benzyl mercaptan, the title compound (158) was obtained.
13C ЯМР (CDCl3): 175,9, 155,0, 138,4, 131,3, 129,0, 128,4, 128,3, 126,8, 120,4, 71,6, 68,4, 49,3, 48,9, 46,0, 45,7, 40,1, 39,9, 39,7, 38,0, 37,1, 36,3, 36,0, 35,8, 32,5, 30,3, 30,0, 28,7, 25,3, 24,2, 22,5, 20,7, 20,4, 18,9, 16,0. 13 C NMR (CDCl 3 ): 175.9, 155.0, 138.4, 131.3, 129.0, 128.4, 128.3, 126.8, 120.4, 71.6, 68, 4, 49.3, 48.9, 46.0, 45.7, 40.1, 39.9, 39.7, 38.0, 37.1, 36.3, 36.0, 35.8, 32.5, 30.3, 30.0, 28.7, 25.3, 24.2, 22.5, 20.7, 20.4, 18.9, 16.0.
Пример 59: 24-бром-16-деацетокси-16β-бензилсульфинилфузидовая кислота (соединение 159) Example 59 : 24-bromo-16-deacetoxy-16β-benzylsulfinylfusidic acid (compound 159)
По процедуре, приведенной в примере 13, при замене 24-бром-16-деацетокси-16β-изопропилтиофузидовой кислоты (112) 24-бром-16-деацетокси-16β-бензилтиофузидовой кислотой (158) получают указанное в заголовке соединение (159).Following the procedure in Example 13, by replacing 24-bromo-16-deacetoxy-16β-isopropylthiofusidic acid (112) with 24-bromo-16-deacetoxy-16β-benzylthiofusidic acid (158), the title compound (159) is obtained.
1H ЯМР (CDCl3): 7,30 (м, 5H), 4,54 (д, 1H), 4,35 (ш.с., 1H), 4,04 (д, 1H), 3,76 (м, 1H), 3,l5 (ш.д., 1H), 2,80-2,4 (м, 4H), 2,20-1,0 (м, 18H), 1,84 (ш.с., 3H), 1,76 (ш.с., 3H), 1,38 (с, 3H), 0,96 (с, 3H), 0,92 (д, 3H), 0,75 (с, 3H). 1 H NMR (CDCl 3 ): 7.30 (m, 5H), 4.54 (d, 1H), 4.35 (br s, 1H), 4.04 (d, 1H), 3.76 (m, 1H), 3, l5 (bd, 1H), 2.80-2.4 (m, 4H), 2.20-1.0 (m, 18H), 1.84 (b. s, 3H), 1.76 (bs, 3H), 1.38 (s, 3H), 0.96 (s, 3H), 0.92 (d, 3H), 0.75 (s , 3H).
Пример 60: 24-бром-16-деацетокси-16β-(2-фурилметилтио)фузидовая кислота (соединение 160) Example 60 : 24-bromo-16-deacetoxy-16β- (2-furylmethylthio) fusidic acid (compound 160)
По процедуре, приведенной в примере 12, при замене 2-пропантиола фурфурилмеркаптаном получают указанное в заголовке соединение (160).Following the procedure described in Example 12, when 2-propanethiol was replaced with furfuryl mercaptan, the title compound (160) was obtained.
13C ЯМР (CDCl3): 175,6, 154,8, 151,9, 141,9, 131,3, 128,4, 120,4, 110,5, 107,5, 71,6, 68,4, 60,4, 49,3, 48,9, 46,6, 45,6, 40,4, 39,7, 37,9, 37,0, 36,2, 36,1, 35,8, 32,4, 32,2, 30,3, 30,0, 25,3, 24,2, 22,6, 21,0, 20,7, 20,4, 18,7, 16,0. 13 C NMR (CDCl 3 ): 175.6, 154.8, 151.9, 141.9, 131.3, 128.4, 120.4, 110.5, 107.5, 71.6, 68, 4, 60.4, 49.3, 48.9, 46.6, 45.6, 40.4, 39.7, 37.9, 37.0, 36.2, 36.1, 35.8, 32.4, 32.2, 30.3, 30.0, 25.3, 24.2, 22.6, 21.0, 20.7, 20.4, 18.7, 16.0.
Пример 61: 24-бром-16-деацетокси-16β-фенилтиофузидовая кислота (соединение 161) Example 61 : 24-bromo-16-deacetoxy-16β-phenylthiofusidic acid (compound 161)
По процедуре, приведенной в примере 12, при замене 2-пропантиола тиофенолом получают указанное в заголовке соединение (161).According to the procedure described in Example 12, when 2-propanethiol was replaced with thiophenol, the title compound (161) was obtained.
13C ЯМР (CDCl3): 176,6, 175,2, 153,1, 138,3, 131,5, 129,1, 129,0, 128,8, 126,0, 120,2, 71,6, 68,4, 49,5, 48,8, 48,5, 45,8, 39,8, 37,9, 37,1, 36,4, 35,9, 35,8, 32,8, 30,3, 30,0, 28,6, 25,3, 24,4, 22,4, 20,7, 20,4, 19,3, 16,0. 13 C NMR (CDCl 3 ): 176.6, 175.2, 153.1, 138.3, 131.5, 129.1, 129.0, 128.8, 126.0, 120.2, 71, 6, 68.4, 49.5, 48.8, 48.5, 45.8, 39.8, 37.9, 37.1, 36.4, 35.9, 35.8, 32.8, 30.3, 30.0, 28.6, 25.3, 24.4, 22.4, 20.7, 20.4, 19.3, 16.0.
Пример 62: 24-бром-16-деацетокси-16β-бензоилтиофузидовая кислота (соединение 162) Example 62 : 24-bromo-16-deacetoxy-16β-benzoylthiofusidic acid (compound 162)
По процедуре, приведенной в примере 55, при замене 16-деацетокси-16β-циклопентилтиофузидовой кислоты 16-деацетокси-16β-бензоилтиофузидовой кислотой (von Daehne, W. et. al., Adv. Appl. Microbiol., 1979, vol 25, p. 95-146) получают указанное в заголовке соединение (162).According to the procedure described in Example 55, when replacing 16-deacetoxy-16β-cyclopentylthiofusidic acid with 16-deacetoxy-16β-benzoylthiofusidic acid (von Daehne, W. et. Al., Adv. Appl. Microbiol. , 1979, vol 25, p . 95-146), the title compound (162) is obtained.
13C ЯМР (CDCl3): 191,4, 173,6, 154,1, 137,0, 133,0, 131,5, 128,5, 128,3, 127,3, 120,2, 71,5, 68,3, 49,3, 49,0, 46,1, 43,9, 41,5, 39,7, 37,8, 37,2, 36,4, 35,9, 32,7, 30,4, 30,0, 28,4, 25,3, 24,5, 22,4, 20,6, 20,4, 19,0, 16,0. 13 C NMR (CDCl 3 ): 191.4, 173.6, 154.1, 137.0, 133.0, 131.5, 128.5, 128.3, 127.3, 120.2, 71, 5, 68.3, 49.3, 49.0, 46.1, 43.9, 41.5, 39.7, 37.8, 37.2, 36.4, 35.9, 32.7, 30.4, 30.0, 28.4, 25.3, 24.5, 22.4, 20.6, 20.4, 19.0, 16.0.
Пример 63: 24-бром-16-деацетокси-16β-изопропоксифузидовая кислота (соединение 163) Example 63 : 24-bromo-16-deacetoxy-16β-isopropoxyfusidic acid (compound 163)
По процедуре, приведенной в примере 55, при замене 16-деацетокси-16β-циклопентилтиофузидовой кислоты 16-деацетокси-16β-изопропоксифузидовой кислотой (von Daehne, W. et. al., Adv. Appl. Microbiol., 1979, vol 25, p. 95-146) получают указанное в заголовке соединение (163).According to the procedure described in Example 55, when replacing 16-deacetoxy-16β-cyclopentylthiofusidic acid with 16-deacetoxy-16β-isopropoxyfusidic acid (von Daehne, W. et. Al., Adv. Appl. Microbiol. , 1979, vol 25, p . 95-146), the title compound (163) is obtained.
13C ЯМР (CDCl3): 171,6, 151,7, 131,9, 131,5, 120,2, 71,5, 70,1, 68,4, 49,3, 49,0, 44,2, 39,7, 37,6, 37,2, 36,4, 35,9, 35,3, 32,8, 30,3, 30,1, 28,9, 25,3, 24,3, 23,2, 22,4, 20,7, 20,5, 20,0, 18,4, 16,0. 13 C NMR (CDCl 3 ): 171.6, 151.7, 131.9, 131.5, 120.2, 71.5, 70.1, 68.4, 49.3, 49.0, 44, 2, 39.7, 37.6, 37.2, 36.4, 35.9, 35.3, 32.8, 30.3, 30.1, 28.9, 25.3, 24.3, 23.2, 22.4, 20.7, 20.5, 20.0, 18.4, 16.0.
Пример 64: 24-бром-16-деацетокси-16β-(2-фторэтокси)фузидовая кислота (соединение 164) Example 64 : 24-bromo-16-deacetoxy-16β- (2-fluoroethoxy) fusidic acid (compound 164)
По процедуре, приведенной в примере 55, при замене 16-деацетокси-16β-циклопентилтиофузидовой кислоты 16-деацетокси-16β-(2-фторэтокси)фузидовой кислотой (von Daehne, W. et. al., Adv. Appl. Microbiol., 1979, vol 25, p. 95-146) получают указанное в заголовке соединение (164).According to the procedure described in example 55, when replacing 16-deacetoxy-16β-cyclopentylthiofusidic acid with 16-deacetoxy-16β- (2-fluoroethoxy) fusidic acid (von Daehne, W. et. Al., Adv. Appl. Microbiol. , 1979 vol 25, p. 95-146), the title compound (164) is obtained.
13C ЯМР (CDCl3): 174,0, 151,8, 131,4, 129,6, 120,3, 82,5, 80,1, 71,5, 69,1, 68,4, 49,2, 49,1, 43,8, 39,6, 37,7, 37,1, 36,3, 36,1, 35,7, 32,6, 30,3, 30,0, 28,3, 25,3, 24,3, 22,6, 20,8, 20,4, 18,0, 16,0. 13 C NMR (CDCl 3 ): 174.0, 151.8, 131.4, 129.6, 120.3, 82.5, 80.1, 71.5, 69.1, 68.4, 49, 2, 49.1, 43.8, 39.6, 37.7, 37.1, 36.3, 36.1, 35.7, 32.6, 30.3, 30.0, 28.3, 25.3, 24.3, 22.6, 20.8, 20.4, 18.0, 16.0.
Пример 65: 24-бром-деацетокси-16β-(2-метоксиэтокси)фузидовая кислота (соединение 165) Example 65 : 24-bromo-deacetoxy-16β- (2-methoxyethoxy) fusidic acid (compound 165)
По процедуре, приведенной в примере 55, при замене 16-деацетокси-16β-циклопентилтиофузидовой кислоты 16-деацетокси-16β-(2-метоксиэтокси)фузидовой кислотой (von Daehne, W. et. al., Adv. Appl. Microbiol., 1979, vol 25, p. 95-146) получают указанное в заголовке соединение (165).According to the procedure described in Example 55, when replacing 16-deacetoxy-16β-cyclopentylthiofusidic acid with 16-deacetoxy-16β- (2-methoxyethoxy) fusidic acid (von Daehne, W. et. Al., Adv. Appl. Microbiol. , 1979 vol 25, p. 95-146) give the title compound (165).
13C ЯМР (CDCl3): 172,1, 151,3, 131,4, 131,0, 120,3, 80,7, 71,6, 71,5, 68,8, 68,4, 59,0, 49,4, 49,1, 43,9, 39,7, 37,6, 37,1, 36,3, 36,1, 35,8, 35,3, 32,6, 30,3, 30,1, 28,6, 25,3, 24,2, 22,6, 20,8, 20,4, 18,2, 16,0. 13 C NMR (CDCl 3 ): 172.1, 151.3, 131.4, 131.0, 120.3, 80.7, 71.6, 71.5, 68.8, 68.4, 59, 0, 49.4, 49.1, 43.9, 39.7, 37.6, 37.1, 36.3, 36.1, 35.8, 35.3, 32.6, 30.3, 30.1, 28.6, 25.3, 24.2, 22.6, 20.8, 20.4, 18.2, 16.0.
Пример 66: 24-(транс-1-гексен-1-ил)фузидовая кислота (соединение 166) Example 66 : 24- ( trans -1-hexen-1-yl) fusidic acid (compound 166)
Суспензию пивалоилоксиметилового сложного эфира 24-(транс-1-гексен-1-ил)фузидовой кислоты (306) (50 мг, 0,070 ммоль) в MEOH (1 мл) охлаждают на ледяной бане и добавляют K2CO3 (20 мг, 0,14 ммоль). Смесь перемешивают при комнатной температуре в течение 3 часов и затем подвергают обработке (EtOAc, вода + водн. HCl до pH примерно 2 и насыщ. NaCl) с получением неочищенного продукта. После колоночной флэш-хроматографии неочищенного продукта (петролейный эфир:EtOAc:HCOOH (90:10:0-0:99:1, в качестве элюента) получают чистое, указанное в заголовке соединение (166).A suspension of pivaloyloxymethyl ester of 24- ( trans -1-hexen-1-yl) fusidic acid (306) (50 mg, 0.070 mmol) in MEOH (1 ml) was cooled in an ice bath and K 2 CO 3 (20 mg, 0 , 14 mmol). The mixture was stirred at room temperature for 3 hours and then treated (EtOAc, water + aq. HCl to a pH of about 2 and sat. NaCl) to give a crude product. Flash column chromatography of the crude product (petroleum ether: EtOAc: HCOOH (90: 10: 0-0: 99: 1, as eluent) gave the pure title compound (166).
13C ЯМР (CDCl3): 174,1, 170,6, 149,9r 129,9, 129,8, 129,7, 128,5, 127,9, 74,5, 71,5, 68,2, 49,2, 48,7, 44,2, 39,5, 39,0, 37,0, 36,2, 36,2, 35,7, 33,2, 32,4, 32,1, 30,3, 29,9, 28,0, 27,8, 24,2, 22,8, 22,3, 21,5, 20,8, 20,6, 20,4, 17,8, 15,9, 14,0. 13 C NMR (CDCl 3): 174.1, 170.6, 149.9 r 129.9, 129.8, 129.7, 128.5, 127.9, 74.5, 71.5, 68, 2, 49.2, 48.7, 44.2, 39.5, 39.0, 37.0, 36.2, 36.2, 35.7, 33.2, 32.4, 32.1, 30.3, 29.9, 28.0, 27.8, 24.2, 22.8, 22.3, 21.5, 20.8, 20.6, 20.4, 17.8, 15, 9, 14.0.
Пример 67: 24-(транс-бутен-3,3-диметил-1-ил)фузидовая кислота (соединение 167) Example 67 : 24- ( trans- butene-3,3-dimethyl-1-yl) fusidic acid (compound 167)
По процедуре, приведенной в примере 66, при замене пивалоилоксиметилового сложного эфира 24-(транс-1-гексен-1-ил)фузидовой кислоты (306) пивалоилоксиметиловым сложным эфиром 24-(транс-1-бутен-3,3-диметил-1-ил) фузидовой кислоты (307) получают указанное в заголовке соединение (167).According to the procedure described in example 66, when replacing pivaloyloxymethyl ester of 24- ( trans -1-hexen-1-yl) fusidic acid (306) with pivaloyloxymethyl ester of 24- ( trans -1-butene-3,3-dimethyl-1 -yl) fusidic acid (307), the title compound (167) is obtained.
13C ЯМР (CDCl3): 171,1, 139,2, 130,0, 129,9, 122,5, 74,5, 71,5, 68,2, 49,2, 48,7, 44,1, 39,4, 39,0, 37,0, 36,3, 36,2, 35,7, 33,4, 32,4, 30,2, 30,0, 27,9, 24,2, 22,8, 21,6, 20,8, 20,5, 17,8 15,9. 13 C NMR (CDCl 3 ): 171.1, 139.2, 130.0, 129.9, 122.5, 74.5, 71.5, 68.2, 49.2, 48.7, 44, 1, 39.4, 39.0, 37.0, 36.3, 36.2, 35.7, 33.4, 32.4, 30.2, 30.0, 27.9, 24.2, 22.8, 21.6, 20.8, 20.5, 17.8 15.9.
Пример 68: 24-(транс-1-нонен-1-ил)фузидовая кислота (соединение 168) Example 68: 24- ( trans -1-nonen-1-yl) fusidic acid (compound 168)
По процедуре, приведенной в примере 66, при замене пивалоилоксиметилового сложного эфира 24-(транс-1-гексен-1-ил)фузидовой кислоты (306) пивалоилоксиметиловым сложным эфиром 24-(транс-1-нонен-1-ил) фузидовой кислоты (308) получают указанное в заголовке соединение (168).According to the procedure described in example 66, when replacing pivaloyloxymethyl ester of 24- ( trans -1-hexen-1-yl) fusidic acid (306) with pivaloyloxymethyl ester of 24- ( trans -1-nonen-1-yl) fusidic acid ( 308), the title compound (168) is obtained.
13C ЯМР (CDCl3): 173,8, 170,6, 149,9, 129,9, 129,8, 129,7, 128,5, 127,9, 74,5, 71,4, 68,3, 49,2, 48,7, 44,2, 39,5, 39,0, 37,1, 36,2, 35,7, 33,6, 32,4, 31,9, 30,3, 30,0, 29,9, 29,3, 28,0, 27,8, 24,2, 22,7, 21,5, 20,8, 20,6, 20,4, 17,8, 15,9, 14,1. 13 C NMR (CDCl 3 ): 173.8, 170.6, 149.9, 129.9, 129.8, 129.7, 128.5, 127.9, 74.5, 71.4, 68, 3, 49.2, 48.7, 44.2, 39.5, 39.0, 37.1, 36.2, 35.7, 33.6, 32.4, 31.9, 30.3, 30.0, 29.9, 29.3, 28.0, 27.8, 24.2, 22.7, 21.5, 20.8, 20.6, 20.4, 17.8, 15, 9, 14.1.
Пример 69: 24-(транс-5-хлор-1-пентен-1-ил)фузидовая кислота (соединение 169) Example 69 : 24- ( trans- 5-chloro-1-penten-1-yl) fusidic acid (compound 169)
По процедуре, приведенной в примере 66, при замене пивалоилоксиметилового сложного эфира 24-(транс-1-гексен-1-ил)фузидовой кислоты (306) пивалоилоксиметиловым сложным эфиром 24-(транс-5-хлор-1-пентен-1-ил)фузидовой кислоты (309) получают указанное в заголовке соединение (169).According to the procedure described in example 66, when replacing pivaloyloxymethyl ester of 24- ( trans- 1-hexen-1-yl) fusidic acid (306) with pivaloyloxymethyl ester of 24- ( trans- 5-chloro-1-penten-1-yl ) fusidic acid (309), the title compound (169) is obtained.
13C ЯМР (CDCl3): 174,1, 170,6, 150,2, 130,6, 129,6, 129,3, 125,9, 74,5, 71,5, 68,2, 49,2, 48,7, 44,6, 44,3, 39,5, 39,0, 37,1, 36,2, 35,7, 32,6, 32,4, 30,5, 30,3, 29,9, 27,9, 27,8, 24,2, 22,8, 21,5, 20,8, 20,6, 20,4, 17,8, 15,9. 13 C NMR (CDCl 3 ): 174.1, 170.6, 150.2, 130.6, 129.6, 129.3, 125.9, 74.5, 71.5, 68.2, 49, 2, 48.7, 44.6, 44.3, 39.5, 39.0, 37.1, 36.2, 35.7, 32.6, 32.4, 30.5, 30.3, 29.9, 27.9, 27.8, 24.2, 22.8, 21.5, 20.8, 20.6, 20.4, 17.8, 15.9.
Пример 70: 24-(транс-2-фенил-1-винил)фузидовая кислота (соединение 170) Example 70 : 24- ( trans -2-phenyl-1-vinyl) fusidic acid (compound 170)
По процедуре, приведенной в примере 66, при замене пивалоилоксиметилового сложного эфира 24-(транс-1-гексен-1-ил)фузидовой кислоты (306) пивалоилоксиметиловым сложным эфиром 24-(транс-2-фенил-1-винил)фузидовой кислоты (310) получают указанное в заголовке соединение (170).According to the procedure described in example 66, when replacing pivaloyloxymethyl ester of 24- ( trans- 1-hexen-1-yl) fusidic acid (306) with pivaloyloxymethyl ester of 24- ( trans- 2-phenyl-1-vinyl) fusidic acid ( 310) receive the title compound (170).
13C ЯМР (CDCl3): 174,4, 170,6, 150,6, 138,5, 133,6, 130,4, 129,5, 128,6, 127,2, 126,9, 126,3, 126,1, 74,5, 71,5, 68,1, 49,2, 48,7, 44,3, 39,4, 39,0, 37,0, 36,3, 36,1, 35,9, 32,3, 30,1, 29,9, 27,9, 24,0, 22,8, 21,9, 20,8, 20,7, 20,6, 17,8, 15,9. 13 C NMR (CDCl 3 ): 174.4, 170.6, 150.6, 138.5, 133.6, 130.4, 129.5, 128.6, 127.2, 126.9, 126, 3, 126.1, 74.5, 71.5, 68.1, 49.2, 48.7, 44.3, 39.4, 39.0, 37.0, 36.3, 36.1, 35.9, 32.3, 30.1, 29.9, 27.9, 24.0, 22.8, 21.9, 20.8, 20.7, 20.6, 17.8, 15, 9.
Пример 71: 24-(2-фенил-1-этил)фузидовая кислота (соединение 171) Example 71 : 24- (2-phenyl-1-ethyl) fusidic acid (compound 171)
По процедуре, приведенной в примере 66, при замене пивалоилоксиметилового сложного эфира 24-(транс-1-гексен-1-ил)фузидовой кислоты (306) пивалоилоксиметиловым сложным эфиром 24-(2-фенил-1-этил)фузидовой кислоты (311) получают указанное в заголовке соединение (171).According to the procedure described in Example 66, when replacing pivaloyloxymethyl ester of 24- ( trans- 1-hexen-1-yl) fusidic acid (306) with pivaloyloxymethyl ester of 24- (2-phenyl-1-ethyl) fusidic acid (311) the title compound (171) is obtained.
13C ЯМР (CD3OD): 174,5, 172,6, 147,8, 144,2, 144,1, 132,8, 129,4, 129,4, 129,3, 126,6, 75,7, 72,4, 68,5, 50,7, 44,8, 44,3, 40,7, 40,0, 38,2, 37,8, 37,4, 37,3, 36,7, 35,0, 34,8, 33,7, 33,3, 32,8, 31,6, 31,6, 31,0, 30,9, 30,3, 30,2, 28,1, 23,9, 23,8, 22,4, 20,7, 19,7, 19,7, 19,5, 19,4, 18,0, 16,5. 13 C NMR (CD 3 OD): 174.5, 172.6, 147.8, 144.2, 144.1, 132.8, 129.4, 129.4, 129.3, 126.6, 75 7, 72.4, 68.5, 50.7, 44.8, 44.3, 40.7, 40.0, 38.2, 37.8, 37.4, 37.3, 36.7 , 35.0, 34.8, 33.7, 33.3, 32.8, 31.6, 31.6, 31.0, 30.9, 30.3, 30.2, 28.1, 23 , 9, 23.8, 22.4, 20.7, 19.7, 19.7, 19.5, 19.4, 18.0, 16.5.
Пример 72: 24-(4-н-пропилфенил)фузидовая кислота (соединение 172) Example 72 : 24- (4-n-propylphenyl) fusidic acid (compound 172)
По процедуре, приведенной в примере 66, при замене пивалоилоксиметилового сложного эфира 24-(транс-1-гексен-1-ил)фузидовой кислоты (306) пивалоилоксиметиловым сложным эфиром 24-(4-н-пропилфенил)фузидовой кислоты (312) получают указанное в заголовке соединение (172).According to the procedure described in example 66, when replacing pivaloyloxymethyl ester of 24- ( trans- 1-hexen-1-yl) fusidic acid (306) with pivaloyloxymethyl ester of 24- (4-n-propylphenyl) fusidic acid (312), the indicated in the title compound (172).
13C ЯМР (CDCl3): 173,3, 170,6, 152,0, 141,4, 140,5, 133,9, 129,4, 128,2, 127,8, 74,5, 71,5, 67,9, 48,9, 48,7, 44,3, 39,4, 39,0, 37,7, 36,9, 36,3, 36,1, 35,5, 35,0, 32,2, 30,1, 30,0, 27,5, 24,7, 23,8, 22,7, 22,1, 20,8, 20,7, 19,9, 18,0, 15,9, 14,0. 13 C NMR (CDCl 3 ): 173.3, 170.6, 152.0, 141.4, 140.5, 133.9, 129.4, 128.2, 127.8, 74.5, 71, 5, 67.9, 48.9, 48.7, 44.3, 39.4, 39.0, 37.7, 36.9, 36.3, 36.1, 35.5, 35.0, 32.2, 30.1, 30.0, 27.5, 24.7, 23.8, 22.7, 22.1, 20.8, 20.7, 19.9, 18.0, 15, 9, 14.0.
Пример 73: 24-(4-винилфенил)фузидовая кислота (соединение 173) Example 73 : 24- (4-vinylphenyl) fusidic acid (compound 173)
По процедуре, приведенной в примере 66, при замене пивалоилоксиметилового сложного эфира 24-(транс-1-гексен-1-ил)фузидовой кислоты (306) пивалоилоксиметиловым сложным эфиром 24-(4-винилфенил)фузидовой кислоты (313) получают указанное в заголовке соединение (173).According to the procedure described in example 66, when replacing pivaloyloxymethyl ester of 24- ( trans- 1-hexen-1-yl) fusidic acid (306) with pivaloyloxymethyl ester of 24- (4-vinylphenyl) fusidic acid (313), the title is obtained compound (173).
13C ЯМР (CDCl3): 173,5, 170,5, 152,5, 143,8, 136,4, 135,4, 133,7, 129,9, 129,0, 128,5, 125,8, 113,5, 74,4, 71,5, 67,8, 48,9, 48,6, 44,4, 39,4, 39,0, 36,9, 36,3, 36,0, 35,3, 35,1, 32,1, 30,0, 27,4, 23,8, 22,7, 22,1, 20,8, 20,7, 19,9, 17,9, 15,9. 13 C NMR (CDCl 3 ): 173.5, 170.5, 152.5, 143.8, 136.4, 135.4, 133.7, 129.9, 129.0, 128.5, 125, 8, 113.5, 74.4, 71.5, 67.8, 48.9, 48.6, 44.4, 39.4, 39.0, 36.9, 36.3, 36.0, 35.3, 35.1, 32.1, 30.0, 27.4, 23.8, 22.7, 22.1, 20.8, 20.7, 19.9, 17.9, 15, 9.
Пример 74: 24-(4-трет-бутилфенил)фузидовая кислота (соединение 174) Example 74 : 24- (4- tert- butylphenyl) fusidic acid (compound 174)
По процедуре, приведенной в примере 66, при замене пивалоилоксиметилового сложного эфира 24-(транс-1-гексен-1-ил)фузидовой кислоты (306) пивалоилоксиметиловым сложным эфиром 24-(4-трет-бутилфенил)фузидовой кислоты (314) получают указанное в заголовке соединение (174).According to the procedure described in example 66, when replacing pivaloyloxymethyl ester of 24- ( trans- 1-hexen-1-yl) fusidic acid (306) with pivaloyloxymethyl ester of 24- (4- tert- butylphenyl) fusidic acid (314), the indicated in the title compound (174).
13C ЯМР (CDCl3): 173,6, 170,6, 151,8, 149,0, 141,0, 133,8, 129,6, 129,1, 128,3, 124,6, 74,5, 71,5, 67,9, 48,9, 48,8, 44,2, 39,4, 39,0, 36,9, 36,2, 36,1, 35,5, 34,9, 34,5, 32,3, 31,5, 30,3, 29,9, 27,6, 23,9, 22,7, 22,1, 20,8, 20,7, 19,9, 18,0, 15,9. 13 C NMR (CDCl 3 ): 173.6, 170.6, 151.8, 149.0, 141.0, 133.8, 129.6, 129.1, 128.3, 124.6, 74, 5, 71.5, 67.9, 48.9, 48.8, 44.2, 39.4, 39.0, 36.9, 36.2, 36.1, 35.5, 34.9, 34.5, 32.3, 31.5, 30.3, 29.9, 27.6, 23.9, 22.7, 22.1, 20.8, 20.7, 19.9, 18, 0, 15.9.
Пример 75: 24-(4-цианофенил)фузидовая кислота (соединение 175) Example 75 : 24- (4-cyanophenyl) fusidic acid (compound 175)
По процедуре, приведенной в примере 66, при замене пивалоилоксиметилового сложного эфира 24-(транс-1-гексен-1-ил)фузидовой кислоты (306) пивалоилоксиметиловым сложным эфиром 24-(4-цианолфенил)фузидовой кислоты (315) получают указанное в заголовке соединение (175).According to the procedure described in Example 66, when replacing pivaloyloxymethyl ester of 24- ( trans- 1-hexen-1-yl) fusidic acid (306) with pivaloyloxymethyl ester of 24- (4-cyanophenyl) fusidic acid (315), the title is obtained compound (175).
13C ЯМР (CDCl3): 173,4, 170,6, 151,6, 148,9, 132,9, 131,9, 130,4, 130,2, 129,2, 119,0, 109,8, 74,3, 71,4, 68,2, 49,1, 48,7, 44,4, 39,4, 39,0, 37,1, 36,3, 36,1, 35,0, 34,4, 32,6, 30,3, 30,0, 27,6, 24,3, 22,6, 22,2, 20,7, 20,2, 18,0, 15,9. 13 C NMR (CDCl 3 ): 173.4, 170.6, 151.6, 148.9, 132.9, 131.9, 130.4, 130.2, 129.2, 119.0, 109, 8, 74.3, 71.4, 68.2, 49.1, 48.7, 44.4, 39.4, 39.0, 37.1, 36.3, 36.1, 35.0, 34.4, 32.6, 30.3, 30.0, 27.6, 24.3, 22.6, 22.2, 20.7, 20.2, 18.0, 15.9.
Пример 76: 24-(3-бифенил)фузидовая кислота (соединение 176) Example 76 : 24- (3-biphenyl) fusidic acid (compound 176)
По процедуре, приведенной в примере 66, при замене пивалоилоксиметилового сложного эфира 24-(транс-1-гексен-1-ил)фузидовой кислоты (306) пивалоилоксиметиловым сложным эфиром 24-(3-бифенил)фузидовой кислоты (316) получают указанное в заголовке соединение (176).According to the procedure described in Example 66, when replacing pivaloyloxymethyl ester of 24- ( trans- 1-hexen-1-yl) fusidic acid (306) with pivaloyloxymethyl ester of 24- (3-biphenyl) fusidic acid (316), the title is obtained compound (176).
13C ЯМР (CDCl3): 173,8, 170,5, 152,2, 144,4, 140,9, 140,7, 134,0, 129,1, 128,9, 128,7, 128,6, 128,5, 128,0, 127,4, 126,9, 124,5, 74,4, 71,5, 67,9, 48,8, 48,6, 44,4, 39,3, 39,0, 36,8, 36,2, 36,0, 35,5, 34,9, 32,2, 29,9, 27,6, 23,9, 22,6, 22,2, 20,8, 20,6, 20,0, 17,9, 15,9. 13 C NMR (CDCl 3 ): 173.8, 170.5, 152.2, 144.4, 140.9, 140.7, 134.0, 129.1, 128.9, 128.7, 128, 6, 128.5, 128.0, 127.4, 126.9, 124.5, 74.4, 71.5, 67.9, 48.8, 48.6, 44.4, 39.3, 39.0, 36.8, 36.2, 36.0, 35.5, 34.9, 32.2, 29.9, 27.6, 23.9, 22.6, 22.2, 20, 8, 20.6, 20.0, 17.9, 15.9.
Пример 77: 24-(4-трифторметил)фенил)фузидовая кислота (соединение 177) Example 77 : 24- (4-trifluoromethyl) phenyl) fusidic acid (compound 177)
По процедуре, приведенной в примере 66, при замене пивалоилоксиметилового сложного эфира 24-(транс-1-гексен-1-ил)фузидовой кислоты (306) пивалоилоксиметиловым сложным эфиром 24-(4-(трифторметил)фенил)фузидовой кислоты (317) получают указанное в заголовке соединение (177).According to the procedure described in example 66, when replacing pivaloyloxymethyl ester of 24- ( trans -1-hexen-1-yl) fusidic acid (306) with pivaloyloxymethyl ester of 24- (4- (trifluoromethyl) phenyl) fusidic acid (317), the title compound (177).
13C ЯМР (CDCl3): 173,5, 170,6, 152,3, 147,8, 133,0, 129,8, 129,7, 129,0, 125,0, 74,3, 71,4, 67,9, 49,0, 48,6, 44,4, 39,4, 39,0, 37,0, 36,2, 36,1, 35,0, 34,9, 32,5, 30,0, 27,5, 24,2, 22,5, 22,1, 20,6, 20,0, 18,0, 15,9. 13 C NMR (CDCl 3 ): 173.5, 170.6, 152.3, 147.8, 133.0, 129.8, 129.7, 129.0, 125.0, 74.3, 71, 4, 67.9, 49.0, 48.6, 44.4, 39.4, 39.0, 37.0, 36.2, 36.1, 35.0, 34.9, 32.5, 30.0, 27.5, 24.2, 22.5, 22.1, 20.6, 20.0, 18.0, 15.9.
Пример 78: 24-(4-метоксифенил)фузидовая кислота (соединение 178) Example 78 : 24- (4-methoxyphenyl) fusidic acid (compound 178)
По процедуре, приведенной в примере 66, при замене пивалоилоксиметилового сложного эфира 24-(транс-1-гексен-1-ил)фузидовой кислоты (306) пивалоилоксиметиловым сложным эфиром 24-(4-метоксифенил)фузидовой кислоты (318) получают указанное в заголовке соединение (178).According to the procedure described in Example 66, when replacing pivaloyloxymethyl ester of 24- ( trans- 1-hexen-1-yl) fusidic acid (306) with pivaloyloxymethyl ester of 24- (4-methoxyphenyl) fusidic acid (318), the title is obtained compound (178).
13C ЯМР (CDCl3): 173,6, 170,7, 157,9, 151,3, 136,4, 133,5, 130,6, 129,7, 128,2, 113,2, 74,4, 71,5, 68,0, 55,2, 49,0, 48,6, 44,2, 39,4, 39,0, 36,9, 36,3, 36,0, 35,3, 35,1, 32,1, 30,0, 27,4, 23,8, 22,8, 22,1, 20,8, 20,7, 20,0, 17,9, 15,9. 13 C NMR (CDCl 3 ): 173.6, 170.7, 157.9, 151.3, 136.4, 133.5, 130.6, 129.7, 128.2, 113.2, 74, 4, 71.5, 68.0, 55.2, 49.0, 48.6, 44.2, 39.4, 39.0, 36.9, 36.3, 36.0, 35.3, 35.1, 32.1, 30.0, 27.4, 23.8, 22.8, 22.1, 20.8, 20.7, 20.0, 17.9, 15.9.
Пример 79: 24-(3-цианофенил)фузидовая кислота (соединение 179) Example 79 : 24- (3-cyanophenyl) fusidic acid (compound 179)
По процедуре, приведенной в примере 66, при замене пивалоилоксиметилового сложного эфира 24-(транс-1-гексен-1-ил)фузидовой кислоты (306) пивалоилоксиметиловым сложным эфиром 24-(3-цианофенил)фузидовой кислоты (319) получают указанное в заголовке соединение (179).According to the procedure described in example 66, when replacing pivaloyloxymethyl ester of 24- ( trans- 1-hexen-1-yl) fusidic acid (306) with pivaloyloxymethyl ester of 24- (3-cyanophenyl) fusidic acid (319), the title is obtained compound (179).
13C ЯМР (CDCl3): 173,2, 170,5, 152,3, 144,9, 134,0, 132,9, 132,2, 130,6, 129,7, 128,9, 128,8, 119,0, 112,1, 74,3, 71,4, 68,1, 49,1, 48,7, 44,5, 39,4, 39,0, 37,1, 36,3, 36,1, 35,2, 34,4, 32,5, 30,3, 30,0, 27,5, 24,3, 22,6, 22,1, 20,7, 20,2, 18,0, 15,9. 13 C NMR (CDCl 3 ): 173.2, 170.5, 152.3, 144.9, 134.0, 132.9, 132.2, 130.6, 129.7, 128.9, 128, 8, 119.0, 112.1, 74.3, 71.4, 68.1, 49.1, 48.7, 44.5, 39.4, 39.0, 37.1, 36.3, 36.1, 35.2, 34.4, 32.5, 30.3, 30.0, 27.5, 24.3, 22.6, 22.1, 20.7, 20.2, 18, 0, 15.9.
Пример 80: 24-(2-метоксифенил)фузидовая кислота (соединение 180) Example 80 : 24- (2-methoxyphenyl) fusidic acid (compound 180)
По процедуре, приведенной в примере 66, при замене пивалоилоксиметилового сложного эфира 24-(транс-1-гексен-1-ил)фузидовой кислоты (306) пивалоилоксиметиловым сложным эфиром 24-(2-метоксифенил)фузидовой кислоты (320) получают указанное в заголовке соединение (180).According to the procedure described in Example 66, when replacing pivaloyloxymethyl ester of 24- ( trans- 1-hexen-1-yl) fusidic acid (306) with pivaloyloxymethyl ester of 24- (2-methoxyphenyl) fusidic acid (320), the title is obtained compound (180).
1H ЯМР (CDCl3): 7,23 (м, 1H), 6,95 (м, 3H), 5,83 (д, 1H), 3,81 (ш.с., 1H), 3,79 (с, 3H), 3,74 (ш.с., 1H), 2,81 (дд, 1H), 2,65-0,95 (м, 22H), 1,95 (с, 3H), 1,84 (ш.с., 3H), 1,50 (ш.с., 3H), 1,27 (с, 3H), 0,92 (ш.с., 3H), 0,92 (д, 3H), 0,81 (ш.с., 3H). 1 H NMR (CDCl 3 ): 7.23 (m, 1H), 6.95 (m, 3H), 5.83 (d, 1H), 3.81 (br s, 1H), 3.79 (s, 3H), 3.74 (br s, 1H), 2.81 (dd, 1H), 2.65-0.95 (m, 22H), 1.95 (s, 3H), 1 84 (br.s., 3H), 1.50 (br.s, 3H), 1.27 (s, 3H), 0.92 (br.s, 3H), 0.92 (d, 3H), 0.81 (br s, 3H).
Пример 81: 24-(3-нитрофенил)фузидовая кислота (соединение 181) Example 81 : 24- (3-nitrophenyl) fusidic acid (compound 181)
По процедуре, приведенной в примере 66, при замене пивалоилоксиметилового сложного эфира 24-(транс-1-гексен-1-ил)фузидовой кислоты (306) пивалоилоксиметиловым сложным эфиром 24-(3-нитрофенил)фузидовой кислоты (321) получают указанное в заголовке соединение (181).According to the procedure described in Example 66, when replacing pivaloyloxymethyl ester of 24- ( trans- 1-hexen-1-yl) fusidic acid (306) with pivaloyloxymethyl ester of 24- (3-nitrophenyl) fusidic acid (321), the title is obtained compound (181).
13C ЯМР (CDCl3): 173,1, 170,5, 152,5, 148,2, 145,3, 135,8, 132,1, 130,9, 128,9, 128,6, 124,1, 121,1, 74,3, 71,4, 68,1, 49,1, 48,6, 44,5, 39,4, 38,9, 37,0, 36,2, 36,1, 35,2, 34,4, 32,5, 30,2, 30,0, 27,5, 24,2, 22,6, 22,2, 20,6, 20,3, 18,0, 15,9. 13 C NMR (CDCl 3 ): 173.1, 170.5, 152.5, 148.2, 145.3, 135.8, 132.1, 130.9, 128.9, 128.6, 124, 1, 121.1, 74.3, 71.4, 68.1, 49.1, 48.6, 44.5, 39.4, 38.9, 37.0, 36.2, 36.1, 35.2, 34.4, 32.5, 30.2, 30.0, 27.5, 24.2, 22.6, 22.2, 20.6, 20.3, 18.0, 15, 9.
Пример 82: 24-(3-бромфенил)фузидовая кислота (соединение 182) Example 82 : 24- (3-bromophenyl) fusidic acid (compound 182)
По процедуре, приведенной в примере 66, при замене пивалоилоксиметилового сложного эфира 24-(транс-1-гексен-1-ил)фузидовой кислоты (306) пивалоилоксиметиловым сложным эфиром 24-(3-бромфенил)фузидовой кислоты (322) получают указанное в заголовке соединение (182).According to the procedure described in example 66, when replacing pivaloyloxymethyl ester of 24- ( trans- 1-hexen-1-yl) fusidic acid (306) with pivaloyloxymethyl ester of 24- (3-bromophenyl) fusidic acid (322), the title is obtained compound (182).
13C ЯМР (CDCl3): 173,8, 170,7, 151,7, 146,1, 132,9, 132,2, 129,6, 129,5, 129,3, 129,0, 128,4, 122,0, 74,3, 71,5, 68,1, 49,0, 48,6, 44,4, 39,4, 39,0, 36,9, 36,3, 36,1, 35,5, 34,8, 32,2, 30,0, 27,6, 24,0, 22,8, 22,1, 20,8, 20,7, 20,0, 17,9, 15,9. 13 C NMR (CDCl 3 ): 173.8, 170.7, 151.7, 146.1, 132.9, 132.2, 129.6, 129.5, 129.3, 129.0, 128, 4, 122.0, 74.3, 71.5, 68.1, 49.0, 48.6, 44.4, 39.4, 39.0, 36.9, 36.3, 36.1, 35.5, 34.8, 32.2, 30.0, 27.6, 24.0, 22.8, 22.1, 20.8, 20.7, 20.0, 17.9, 15, 9.
Пример 83: 24-(4-(метилтио)фенил)фузидовая кислота (соединение 183) Example 83 : 24- (4- (methylthio) phenyl) fusidic acid (compound 183)
По процедуре, приведенной в примере 66, при замене пивалоилоксиметилового сложного эфира 24-(транс-1-гексен-1-ил)фузидовой кислоты (306) пивалоилоксиметиловым сложным эфиром 24-(4-(метилтио)фенил)фузидовой кислоты (323) получают указанное в заголовке соединение (183).According to the procedure described in example 66, when replacing pivaloyloxymethyl ester of 24- ( trans- 1-hexen-1-yl) fusidic acid (306) with pivaloyloxymethyl ester of 24- (4- (methylthio) phenyl) fusidic acid (323), the title compound (183).
13C ЯМР (CDCl3): 173,6, 170,7, 151,5, 140,9, 135,9, 133,5, 130,1, 129,5, 128,5, 126,0, 74,4, 71,5, 68,0, 49,0, 48,6, 44,3, 39,4, 39,0, 36,9, 36,3, 36,1, 35,3, 35,0, 32,2, 30,0, 27,4, 23,9, 22,8, 22,1, 20,8, 20,7, 19,9, 17,9, 15,9, 15,7. 13 C NMR (CDCl 3 ): 173.6, 170.7, 151.5, 140.9, 135.9, 133.5, 130.1, 129.5, 128.5, 126.0, 74, 4, 71.5, 68.0, 49.0, 48.6, 44.3, 39.4, 39.0, 36.9, 36.3, 36.1, 35.3, 35.0, 32.2, 30.0, 27.4, 23.9, 22.8, 22.1, 20.8, 20.7, 19.9, 17.9, 15.9, 15.7.
Пример 84: 24-(2-нафтил)фузидовая кислота (соединение 184) Example 84 : 24- (2-naphthyl) fusidic acid (compound 184)
По процедуре, приведенной в примере 66, при замене пивалоилоксиметилового сложного эфира 24-(транс-1-гексен-1-ил)фузидовой кислоты (306) пивалоилоксиметиловым сложным эфиром 24-(2-нафтил)фузидовой кислоты (324) получают указанное в заголовке соединение (184).According to the procedure described in Example 66, when replacing pivaloyloxymethyl ester of 24- ( trans- 1-hexen-1-yl) fusidic acid (306) with pivaloyloxymethyl ester of 24- (2-naphthyl) fusidic acid (324), the title is obtained compound (184).
13C ЯМР (CDCl3): 174,4, 170,8, 151,6, 141,7, 134,0, 133,4, 131,9, 129,6, 128,7, 128,6, 127,8, 127,6, 127,4, 126,2, 125,6, 74,3, 71,5, 67,5, 48,7, 48,4, 44,2, 39,3, 38,9, 36,6, 36,3, 35,8, 35,2, 35,1, 31,9, 29,9, 29,7, 27,4, 23,6, 22,7, 22,2, 20,8, 20,6, 19,9, 17,8, 15,9. 13 C NMR (CDCl 3 ): 174.4, 170.8, 151.6, 141.7, 134.0, 133.4, 131.9, 129.6, 128.7, 128.6, 127, 8, 127.6, 127.4, 126.2, 125.6, 74.3, 71.5, 67.5, 48.7, 48.4, 44.2, 39.3, 38.9, 36.6, 36.3, 35.8, 35.2, 35.1, 31.9, 29.9, 29.7, 27.4, 23.6, 22.7, 22.2, 20, 8, 20.6, 19.9, 17.8, 15.9.
Пример 85: 24-(3,5-бис-(трифторметил)фенил)фузидовая кислота (соединение 185) Example 85 : 24- (3,5- bis - (trifluoromethyl) phenyl) fusidic acid (compound 185)
По процедуре, приведенной в примере 66, при замене пивалоилоксиметилового сложного эфира 24-(транс-1-гексен-1-ил)фузидовой кислоты (306) пивалоилоксиметиловым сложным эфиром 24-(3,5-бис-(трифторметил)фенил)фузидовой кислоты (325) получают указанное в заголовке соединение (185).According to the procedure described in Example 66, when replacing pivaloyloxymethyl ester of 24- ( trans- 1-hexen-1-yl) fusidic acid (306) with pivaloyloxymethyl ester of 24- (3,5- bis - (trifluoromethyl) phenyl) fusidic acid (325) receive the title compound (185).
13C ЯМР (CDCl3): 173,1, 170,5, 152,9, 145,9, 131,7, 131,4, 129,5, 128,4, 125,3, 121,7, 120,0, 74,3, 71,4, 67,9, 49,0, 48,6, 44,6, 39,4, 38,9, 37,0, 36,2, 36,1, 35,3, 34,6, 32,5, 30,2, 30,0, 27,6, 24,2, 22,4, 22,1, 20,6, 20,2, 18,0, 15,9. 13 C NMR (CDCl 3 ): 173.1, 170.5, 152.9, 145.9, 131.7, 131.4, 129.5, 128.4, 125.3, 121.7, 120, 0, 74.3, 71.4, 67.9, 49.0, 48.6, 44.6, 39.4, 38.9, 37.0, 36.2, 36.1, 35.3, 34.6, 32.5, 30.2, 30.0, 27.6, 24.2, 22.4, 22.1, 20.6, 20.2, 18.0, 15.9.
Пример 86: 24-(3,4-диметоксифенил)фузидовая кислота (соединение 186) Example 86 : 24- (3,4-dimethoxyphenyl) fusidic acid (compound 186)
По процедуре, приведенной в примере 66, при замене пивалоилоксиметилового сложного эфира 24-(транс-1-гексен-1-ил)фузидовой кислоты (306) пивалоилоксиметиловым сложным эфиром 24-(3,4-диметоксифенил)фузидовой кислоты (326) получают указанное в заголовке соединение (186).According to the procedure described in example 66, when replacing pivaloyloxymethyl ester of 24- ( trans- 1-hexen-1-yl) fusidic acid (306) with pivaloyloxymethyl ester of 24- (3,4-dimethoxyphenyl) fusidic acid (326), the above in the title compound (186).
13C ЯМР (CDCl3): 173,4, 170,5, 152,2, 148,5, 147,3, 136,6, 133,7, 129,1, 128,2, 121,7, 113,1, 110,6, 74,4, 71,5, 68,0, 56,1, 55,9, 49,0, 48,6, 44,4, 39,4, 39,0, 36,9, 36,3, 36,1, 35,2, 35,0, 32,2, 30,0, 27,5, 23,9, 22,7, 22,2, 20,8, 20,6, 20,0, 17,9, 15,9. 13 C NMR (CDCl 3 ): 173.4, 170.5, 152.2, 148.5, 147.3, 136.6, 133.7, 129.1, 128.2, 121.7, 113, 1, 110.6, 74.4, 71.5, 68.0, 56.1, 55.9, 49.0, 48.6, 44.4, 39.4, 39.0, 36.9, 36.3, 36.1, 35.2, 35.0, 32.2, 30.0, 27.5, 23.9, 22.7, 22.2, 20.8, 20.6, 20, 0, 17.9, 15.9.
Пример 87: 24-(3,5-дибромфенил)фузидовая кислота (соединение 187) Example 87 : 24- (3,5-dibromophenyl) fusidic acid (compound 187)
По процедуре, приведенной в примере 66, при замене пивалоилоксиметилового сложного эфира 24-(транс-1-гексен-1-ил)фузидовой кислоты (306) пивалоилоксиметиловым сложным эфиром 24-(3,5-дибромфенил)фузидовой кислоты (327) получают указанное в заголовке соединение (187).According to the procedure described in example 66, when replacing pivaloyloxymethyl ester of 24- ( trans -1-hexen-1-yl) fusidic acid (306) with pivaloyloxymethyl ester of 24- (3,5-dibromophenyl) fusidic acid (327), the above in the title compound (187).
13C ЯМР (CDCl3): 173,3, 170,5, 152,9, 147,4, 131,8, 131,5, 131,2, 130,7, 128,5, 122,4, 74,4, 71,5, 68,1, 49,1, 48,6, 44,6, 39,4, 39,0, 37,0, 36,2, 36,1, 35,6, 34,6, 32,3, 30,2, 30,0, 27,6, 24,1, 22,8, 22,2, 20,8, 20,7, 20,1, 18,0, 15,9. 13 C NMR (CDCl 3 ): 173.3, 170.5, 152.9, 147.4, 131.8, 131.5, 131.2, 130.7, 128.5, 122.4, 74, 4, 71.5, 68.1, 49.1, 48.6, 44.6, 39.4, 39.0, 37.0, 36.2, 36.1, 35.6, 34.6, 32.3, 30.2, 30.0, 27.6, 24.1, 22.8, 22.2, 20.8, 20.7, 20.1, 18.0, 15.9.
Пример 88: Холиновая соль 24-бромфузидовой кислоты (соединение 188) Example 88 : Choline salt of 24-bromofusidic acid (compound 188)
Раствор гидроксида холина в метаноле (45%, 0,4 мл, 0,18 г, 1,5 ммоль) постепенно добавляют при перемешивании, к раствору 24-бромфузидовой кислоты (108) (893 мг, 1,5 ммоль) в этаноле (10 мл). Полученный раствор концентрируют при пониженном давлении и остаток кристаллизуют из диэтилового эфира. Указанное в заголовке соединение (188) собирают фильтрованием.A solution of choline hydroxide in methanol (45%, 0.4 ml, 0.18 g, 1.5 mmol) is gradually added with stirring to a solution of 24-bromofusidic acid (108) (893 mg, 1.5 mmol) in ethanol ( 10 ml). The resulting solution was concentrated under reduced pressure, and the residue was crystallized from diethyl ether. The title compound (188) was collected by filtration.
13C ЯМР (CD3OD): 179,1, 173,3, 138,5, 138,3, 131,3, 122,6, 76,0, 72,5, 69,1, 68,9, 57,1, 54,7, 50,8, 50,0, 43,7, 40,7, 40,3, 38,5, 38,3, 37,8, 37,5, 36,9, 33,0, 31,1, 31,0, 30,3, 25,4, 23,8, 22,5, 21,1, 20,5, 17,9, 16,5. 13 C NMR (CD 3 OD): 179.1, 173.3, 138.5, 138.3, 131.3, 122.6, 76.0, 72.5, 69.1, 68.9, 57 , 1, 54.7, 50.8, 50.0, 43.7, 40.7, 40.3, 38.5, 38.3, 37.8, 37.5, 36.9, 33.0 , 31.1, 31.0, 30.3, 25.4, 23.8, 22.5, 21.1, 20.5, 17.9, 16.5.
Пример 89: L-аргининовая соль 24-бромфузидовой кислоты (соединение 189) Example 89 : L-arginine salt of 24-bromofusidic acid (compound 189)
По процедуре, приведенной в примере 88, при замене гидроксида холина L-аргинином (261 мг, 1,5 ммоль, в воде (10 мл)) получают указанное в заголовке соединение (189) (из этилацетата) в виде аморфного порошка.Following the procedure in Example 88, when choline hydroxide was replaced with L-arginine (261 mg, 1.5 mmol, in water (10 ml)), the title compound (189) (from ethyl acetate) was obtained as an amorphous powder.
13C ЯМР (CD3OD): 179,2, 174,7, 173,3, 158,9, 139,9, 137,6, 131,5, 122,4, 75,9, 72,5, 68,8, 55,6, 50,8, 50,0, 43,9, 41,9, 40,7, 40,2, 38,6, 38,3, 37,9, 37,5, 36,9, 33,0, 31,1, 31,0, 30,1, 29,5, 25,8, 25,4, 23,8, 22,5, 21,1, 20,5, 17,9, 16,5. 13 C NMR (CD 3 OD): 179.2, 174.7, 173.3, 158.9, 139.9, 137.6, 131.5, 122.4, 75.9, 72.5, 68 , 8, 55.6, 50.8, 50.0, 43.9, 41.9, 40.7, 40.2, 38.6, 38.3, 37.9, 37.5, 36.9 , 33.0, 31.1, 31.0, 30.1, 29.5, 25.8, 25.4, 23.8, 22.5, 21.1, 20.5, 17.9, 16 ,5.
Пример 90: 2-(диметиламино)этанольная соль 24-бромфузидовой кислоты (соединение 190) Example 90 : 2- (dimethylamino) ethanol salt of 24-bromofusidic acid (compound 190)
По процедуре, приведенной в примере 88, при замене гидроксида холина 2-(диметиламино)этанолом (151 мкл, 134 мг, 1,5 ммоль) получают указанное в заголовке соединение (190) (из диэтилового эфира) в виде кристаллов.Following the procedure in Example 88, when choline hydroxide was replaced with 2- (dimethylamino) ethanol (151 μl, 134 mg, 1.5 mmol), the title compound (190) (from diethyl ether) was obtained in the form of crystals.
13C ЯМР (CD3OD): 178,1, 173,1, 141,6, 136,4, 131,6, 122,3, 75,9, 72,5, 68,8, 66,9, 60,9, 57,5, 50,8, 50,0, 44,1, 40,7, 40,2, 38,7, 38,3, 37,9, 37,5, 36,9, 33,0, 31,1, 31,0, 30,0, 25,4, 23,8, 22,5, 21,1, 20,5, 17,9, 16,5, 15,5. 13 C NMR (CD 3 OD): 178.1, 173.1, 141.6, 136.4, 131.6, 122.3, 75.9, 72.5, 68.8, 66.9, 60 , 9, 57.5, 50.8, 50.0, 44.1, 40.7, 40.2, 38.7, 38.3, 37.9, 37.5, 36.9, 33.0 , 31.1, 31.0, 30.0, 25.4, 23.8, 22.5, 21.1, 20.5, 17.9, 16.5, 15.5.
Пример 91: 4-(2-гидроксиэтил)морфолиновая соль 24-бромфузидовой кислоты (соединение 191) Example 91 : 4- (2-hydroxyethyl) morpholine salt of 24-bromofusidic acid (compound 191)
По процедуре, приведенной в примере 88, при замене гидроксида холина 4-(2-гидроксиэтил)морфолином (184 мкл, 197 мг, 1,5 ммоль) получают указанное в заголовке соединение (191) (из диизопропилового эфира) в виде аморфного порошка.Following the procedure in Example 88, when choline hydroxide was replaced with 4- (2-hydroxyethyl) morpholine (184 μl, 197 mg, 1.5 mmol), the title compound (191) (from diisopropyl ether) was obtained as an amorphous powder.
13C ЯМР (CD3OD): 175,0, 172,7, 147,7, 132,4, 132,2, 121,7, 75,8, 72,5, 68,6, 66,9, 61,3, 58,7, 54,6, 50,7, 49,9, 44,9, 40,7, 40,1, 38,8, 38,2, 37,8, 37,4, 36,8, 32,9, 31,1, 31,0, 29,3, 25,5, 23,9, 23,1, 22,4, 20,8, 20,6, 18,0, 16,5. 13 C NMR (CD 3 OD): 175.0, 172.7, 147.7, 132.4, 132.2, 121.7, 75.8, 72.5, 68.6, 66.9, 61 , 3, 58.7, 54.6, 50.7, 49.9, 44.9, 40.7, 40.1, 38.8, 38.2, 37.8, 37.4, 36.8 , 32.9, 31.1, 31.0, 29.3, 25.5, 23.9, 23.1, 22.4, 20.8, 20.6, 18.0, 16.5.
Пример 92: L-лизиновая соль 24-бромфузидовой кислоты (соединение 192) Example 92 : L-lysine salt of 24-bromofusidic acid (compound 192)
По процедуре, приведенной в примере 88, при замене гидроксида холина L-лизином (219 мг, 1,5 ммоль, в воде (5 мл)) получают указанное в заголовке соединение (192) (из этилацетата) в виде кристаллов.Following the procedure in Example 88, when choline hydroxide was replaced with L-lysine (219 mg, 1.5 mmol, in water (5 ml)), the title compound (192) (from ethyl acetate) was obtained as crystals.
13C ЯМР (CD3OD): 179,1, 175,1, 173,2, 139,4, 137,9, 131,4, 122,5, 75,9, 72,5, 68,8, 55,9, 50,8, 50,0, 43,9, 40,7, 40,4, 40,3, 38,6, 38,3, 37,9, 37,5, 36,9, 33,0, 32,0, 31,1, 31,0, 30,2, 28,5, 25,4, 23,8, 23,2, 22,5, 21,2, 20,6, 17,9, 16,5. 13 C NMR (CD 3 OD): 179.1, 175.1, 173.2, 139.4, 137.9, 131.4, 122.5, 75.9, 72.5, 68.8, 55 , 9, 50.8, 50.0, 43.9, 40.7, 40.4, 40.3, 38.6, 38.3, 37.9, 37.5, 36.9, 33.0 , 32.0, 31.1, 31.0, 30.2, 28.5, 25.4, 23.8, 23.2, 22.5, 21.2, 20.6, 17.9, 16 ,5.
Пример 93: N-(2-гидроксиэтил)пирролидиновая соль 24-бромфузидовой кислоты (соединение 193) Example 93 : N- (2-hydroxyethyl) pyrrolidine salt of 24-bromofusidic acid (compound 193)
По процедуре, приведенной в примере 88, при замене гидроксида холина N-(2-гидроксиэтил)пирролидином (177 мкл, 173 мг, 1,5 ммоль) получают указанное в заголовке соединение (193) (из диизопропилового эфира) в виде кристаллов.Following the procedure in Example 88, by replacing the choline hydroxide with N- (2-hydroxyethyl) pyrrolidine (177 μl, 173 mg, 1.5 mmol), the title compound (193) (from diisopropyl ether) was obtained as crystals.
13C ЯМР (CD3OD): 178,5, 173,1, 140,7, 137,0, 131,5, 122,4, 75,9, 72,5, 70,1, 68,8, 58,3, 55,2, 50,8, 50,0, 44,0, 40,7, 40,2, 38,6, 38,3, 37,8, 37,5, 36,9, 33,0, 31,1, 31,0, 30,1, 25,4, 24,0, 23,8, 23,1, 22,5, 21,1, 20,5, 17,9, 16,5. 13 C NMR (CD 3 OD): 178.5, 173.1, 140.7, 137.0, 131.5, 122.4, 75.9, 72.5, 70.1, 68.8, 58 , 3, 55.2, 50.8, 50.0, 44.0, 40.7, 40.2, 38.6, 38.3, 37.8, 37.5, 36.9, 33.0 , 31.1, 31.0, 30.1, 25.4, 24.0, 23.8, 23.1, 22.5, 21.1, 20.5, 17.9, 16.5.
Пример 94: Этаноламиновая соль 24-бромфузидовой кислоты (соединение 194) Example 94 : Ethanolamine salt of 24-bromofusidic acid (compound 194)
По процедуре, приведенной в примере 88, при замене гидроксида холина этаноламином (90 мкл, 92 мг, 1,5 ммоль) получают указанное в заголовке соединение (194) (из диэтилового эфира) в виде аморфного порошка.Following the procedure in Example 88, when replacing choline hydroxide with ethanolamine (90 μl, 92 mg, 1.5 mmol), the title compound (194) (from diethyl ether) was obtained as an amorphous powder.
13C ЯМР (CD3OD): 178,9, 173,3, 139,7, 137,6, 131,4, 122,5, 75,9, 72,5, 68,8, 59,4, 50,8, 50,0, 43,9, 43,0, 40,7, 40,2, 38,6, 38,3, 37,8, 37,5, 36,9, 33,0, 31,1, 31,0, 30,1, 25,4, 23,8, 22,5, 21,1, 20,5, 17,9, 16,5. 13 C NMR (CD 3 OD): 178.9, 173.3, 139.7, 137.6, 131.4, 122.5, 75.9, 72.5, 68.8, 59.4, 50 , 8, 50.0, 43.9, 43.0, 40.7, 40.2, 38.6, 38.3, 37.8, 37.5, 36.9, 33.0, 31.1 , 31.0, 30.1, 25.4, 23.8, 22.5, 21.1, 20.5, 17.9, 16.5.
Пример 95: Калиевая соль 24-бромфузидовой кислоты (соединение 195) Example 95 : Potassium salt of 24-bromofusidic acid (compound 195)
Водный раствор гидроксида калия (0,82 М, 1,8 мл, 1,5 ммоль) добавляют постепенно к раствору 24-бромфузидовой кислоты (108) (893 мг, 1,5 ммоль) в этаноле (10 мл) и воде (2,5 мл). pH раствора отслеживают с помощью pH-метра. Добавляют еще некоторое количество воды (7,5 мл) до pH примерно 7. Полученный раствор (с конечным pH 10) концентрируют при пониженном давлении и остаток кристаллизуют из ацетона. Указанное в заголовке соединение (195) собирают фильтрованием.An aqueous solution of potassium hydroxide (0.82 M, 1.8 ml, 1.5 mmol) is added gradually to a solution of 24-bromofusidic acid (108) (893 mg, 1.5 mmol) in ethanol (10 ml) and water (2 5 ml). The pH of the solution is monitored using a pH meter. Some more water (7.5 ml) was added to a pH of about 7. The resulting solution (with a final pH of 10) was concentrated under reduced pressure and the residue was crystallized from acetone. The title compound (195) was collected by filtration.
13C ЯМР (CD3OD): 179,2, 173,4, 138,6, 138,4, 131,3, 122,6, 75,9, 72,5, 68,9, 50,8, 50,0, 43,7, 40,7, 40,3, 38,5, 38,3, 37,8, 37,5, 36,9, 33,0, 31,1, 31,0, 30,3, 25,4, 23,8, 22,5, 21,2, 20,5, 17,9, 16,5, 8,1. 13 C NMR (CD 3 OD): 179.2, 173.4, 138.6, 138.4, 131.3, 122.6, 75.9, 72.5, 68.9, 50.8, 50 , 0, 43.7, 40.7, 40.3, 38.5, 38.3, 37.8, 37.5, 36.9, 33.0, 31.1, 31.0, 30.3 , 25.4, 23.8, 22.5, 21.2, 20.5, 17.9, 16.5, 8.1.
Пример 96: Тетрабутиламмониевая соль 24-бромфузидовой кислоты (соединение 196) Example 96 : Tetrabutylammonium salt of 24-bromofusidic acid (compound 196)
По процедуре, приведенной в примере 95, при замене гидроксида калия водн. гидроксидом тетрабутиламмония (примерно 25%, 1,8 мл, 1,5 ммоль, конечный pH 9) получают указанное в заголовке соединение (196) (из диэтилового эфира) в виде кристаллов.According to the procedure described in example 95, when replacing potassium hydroxide aq. tetrabutylammonium hydroxide (about 25%, 1.8 ml, 1.5 mmol, final pH 9) gave the title compound (196) (from diethyl ether) as crystals.
13C ЯМР, (CD3OD): 178,3, 173,2, 140,3, 137,1, 131,4, 122,5, 76,0, 72,5, 68,8, 59,5, 50,8, 50,0, 43,9, 40,7, 40,2, 38,6, 38,3, 37:8, 37,5, 36,8, 32,9, 31,1, 31,0, 30,0, 25,4, 24,8, 23,8, 22,5, 21,1, 20,7, 20,5, 17,9, 16,5, 14,0. 13 C NMR, (CD 3 OD): 178.3, 173.2, 140.3, 137.1, 131.4, 122.5, 76.0, 72.5, 68.8, 59.5, 50.8, 50.0, 43.9, 40.7, 40.2, 38.6, 38.3, 37: 8, 37.5, 36.8, 32.9, 31.1, 31, 0, 30.0, 25.4, 24.8, 23.8, 22.5, 21.1, 20.7, 20.5, 17.9, 16.5, 14.0.
Пример 97: Бензилтриметиламмониевая соль 24-бромфузидовой кислоты (соединение 197) Example 97 : Benzyltrimethylammonium salt of 24-bromofusidic acid (compound 197)
По процедуре, приведенной в примере 95, при замене гидроксида калия гидроксидом бензилтриметиламмония (примерно 40% в метаноле, с конечным pH 9) получают указанное в заголовке соединение (197) (из ацетона) в виде кристаллов.According to the procedure described in Example 95, when replacing potassium hydroxide with benzyltrimethylammonium hydroxide (about 40% in methanol, with a final pH of 9), the title compound (197) (from acetone) was obtained in the form of crystals.
1H ЯМР (CD3OD): 7,55 (м, 5H) 5,74 (д, 1H), 4,53 (с, 2H), 4,30 (ш.с., 1H), 3,64 (ш.с., 1H), 3,10 (с, 9H), 3,00 (д, 1H), 2,8-2,0 (м, 8H), 1,99 (с, 3H), 1,91-1,40 (м, 7H), 1,83 (с, 3H), 1,80 (с, 3H), 1,38 (с, 3H), 1,2-1,0 (м, 3H), 0,99 (с, 3H), 0,95 (с, 3H), 0,89 (д, 3H). 1 H NMR (CD 3 OD): 7.55 (m, 5H) 5.74 (d, 1H), 4.53 (s, 2H), 4.30 (br s, 1H), 3.64 (br.s., 1H), 3.10 (s, 9H), 3.00 (d, 1H), 2.8-2.0 (m, 8H), 1.99 (s, 3H), 1 91-1.40 (m, 7H), 1.83 (s, 3H), 1.80 (s, 3H), 1.38 (s, 3H), 1.2-1.0 (m, 3H) ), 0.99 (s, 3H), 0.95 (s, 3H), 0.89 (d, 3H).
Пример 98: Цетилтриметиламмониевая соль 24-бромфузидовой кислоты (соединение 198) Example 98 : Cetyltrimethylammonium salt of 24-bromofusidic acid (compound 198)
По процедуре, приведенной в примере 95, при замене гидроксида калия гидроксидом цетилтриметиламмония (примерно 10% в воде, с конечным pH 10) получают указанное в заголовке соединение (198) (из метилэтилкетона) в виде кристаллов.According to the procedure described in Example 95, when replacing potassium hydroxide with cetyltrimethylammonium hydroxide (about 10% in water, with a final pH of 10), the title compound (198) (from methyl ethyl ketone) was obtained in the form of crystals.
13C ЯМР (CD3OD): 179,2, 173,3, 138,4, 138,3, 131,2, 122,6, 76,0, 72,5, 68,9, 67,9, 53,5, 50,8, 50,0, 43,7, 40,7, 40,3, 38,5, 38,3, 37,8, 37,5, 36,8, 33,1, 32,9, 31,1, 31,0, 30,8, 30,7, 30,6, 30,5, 30,3, 27,4, 25,4, 24,0, 23,9, 23,8, 22,5, 21,1, 20,5, 17,9, 16,5, 14,5. 13 C NMR (CD 3 OD): 179.2, 173.3, 138.4, 138.3, 131.2, 122.6, 76.0, 72.5, 68.9, 67.9, 53 5, 50.8, 50.0, 43.7, 40.7, 40.3, 38.5, 38.3, 37.8, 37.5, 36.8, 33.1, 32.9 , 31.1, 31.0, 30.8, 30.7, 30.6, 30.5, 30.3, 27.4, 25.4, 24.0, 23.9, 23.8, 22 5, 21.1, 20.5, 17.9, 16.5, 14.5.
Пример 99: Тетраметиламмониевая соль 24-бромфузидовой кислоты (соединение 199) Example 99 : Tetramethylammonium salt of 24-bromofusidic acid (compound 199)
По процедуре, приведенной в примере 95, при замене гидроксида калия гидроксидом тетраметиламмония (примерно 10% в воде, с конечным pH 10) получают указанное в заголовке соединение (199) (из ацетона/диэтилового эфира) в виде кристаллов.According to the procedure described in Example 95, when replacing potassium hydroxide with tetramethylammonium hydroxide (approximately 10% in water, with a final pH of 10), the title compound (199) (from acetone / diethyl ether) was obtained in the form of crystals.
13C ЯМР (CD3OD): 179,2, 173,3, 138,4, 138,3, 131,2, 122,6, 76,0, 72,5, 68,9, 55,9, 50,8, 50,0, 43,7, 40,7, 40,-3, 38,5, 38,3, 37,8, 37,5, 36,8, 32,9, 31,1, 31,0, 30,3, 25,4, 23,8, 23,8, 22,5, 21,1, 20,5, 17,9, 16,5. 13 C NMR (CD 3 OD): 179.2, 173.3, 138.4, 138.3, 131.2, 122.6, 76.0, 72.5, 68.9, 55.9, 50 , 8, 50.0, 43.7, 40.7, 40, -3, 38.5, 38.3, 37.8, 37.5, 36.8, 32.9, 31.1, 31, 0, 30.3, 25.4, 23.8, 23.8, 22.5, 21.1, 20.5, 17.9, 16.5.
Пример 100: Тетрапропиламмониевая соль 24-бромфузидовой кислоты (соединение 300) Example 100 : Tetrapropylammonium salt of 24-bromofusidic acid (compound 300)
По процедуре, приведенной в примере 95, при замене гидроксида калия гидроксидом тетрапропиламмония (примерно 10% в воде, с конечным pH 9,5) получают указанное в заголовке соединение (300) (из ацетона/диэтилового эфира) в виде кристаллов.Following the procedure in Example 95, when the potassium hydroxide was replaced with tetrapropylammonium hydroxide (about 10% in water, with a final pH of 9.5), the title compound (300) (from acetone / diethyl ether) was obtained in the form of crystals.
13C ЯМР (CD3OD): 179,2, 173,3, 138,4, 138,3, 131,2, 122,7, 76,0, 72,5, 68,9, 61,3, 50,8, 50,0, 43,7, 40,7, 40,3, 38,5, 38,3, 37,8, 37,5, 36,9, 33,0, 31,1, 31,0, 30,3, 25,4, 23,8, 23,8, 22,5, 21,1, 20,5, 17,9, 16,5, 16,4, 10,9. 13 C NMR (CD 3 OD): 179.2, 173.3, 138.4, 138.3, 131.2, 122.7, 76.0, 72.5, 68.9, 61.3, 50 , 8, 50.0, 43.7, 40.7, 40.3, 38.5, 38.3, 37.8, 37.5, 36.9, 33.0, 31.1, 31.0 , 30.3, 25.4, 23.8, 23.8, 22.5, 21.1, 20.5, 17.9, 16.5, 16.4, 10.9.
Пример 101: Трис(гидроксиметил)аминометановая соль 24-бромфузидовой кислоты (соединение 301) Example 101 : Tris (hydroxymethyl) aminomethane salt of 24-bromofusidic acid (compound 301)
По процедуре, приведенной в примере 88, при замене гидроксида калия трис(гидроксиметил)аминометаном (82 мг, 1,5 ммоль), растворенным в этаноле (12 мл) и воде (8 мл), получают указанное в заголовке соединение (301) (из диэтилового эфира) в виде аморфного порошка.By the procedure of Example 88, by replacing potassium hydroxide with tris (hydroxymethyl) aminomethane (82 mg, 1.5 mmol) dissolved in ethanol (12 ml) and water (8 ml), the title compound (301) ( from diethyl ether) as an amorphous powder.
13C ЯМР (CD3OD): 178,8, 173,3, 140,1, 137,4, 131,4, 122,4, 76,0, 72,5, 70,1, 68,8, 61,8, 50,8, 50,0, 43,9, 40,7, 40,2, 38,6, 38,3, 37,8, 37,5, 36,9, 32,9, 31,1, 31,0, 30,1, 25,4, 23,8, 23,1, 22,5, 21,1, 20,5, 17,9, 16,5. 13 C NMR (CD 3 OD): 178.8, 173.3, 140.1, 137.4, 131.4, 122.4, 76.0, 72.5, 70.1, 68.8, 61 , 8, 50.8, 50.0, 43.9, 40.7, 40.2, 38.6, 38.3, 37.8, 37.5, 36.9, 32.9, 31.1 , 31.0, 30.1, 25.4, 23.8, 23.1, 22.5, 21.1, 20.5, 17.9, 16.5.
Пример 102: N-метил-D-глюкаминовая соль 24-бромфузидовой кислоты (соединение 302) Example 102 : N-methyl-D-glucamine salt of 24-bromofusidic acid (compound 302)
По процедуре, приведенной в примере 88, при замене гидроксида калия N-метил-D-глюкамином (293 мг, 1,5 ммоль), растворенным в этаноле (5 мл) и воде (5 мл), получают указанное в заголовке соединение (302) (из диэтилового эфира) в виде аморфного порошка.Following the procedure in Example 88, by replacing potassium hydroxide with N-methyl-D-glucamine (293 mg, 1.5 mmol) dissolved in ethanol (5 ml) and water (5 ml), the title compound (302) was obtained. ) (from diethyl ether) as an amorphous powder.
13C ЯМР (CD3OD): 179,2, 173,3, 139,5, 137,8, 131,4, 122,5, 75,9, 73,0, 72,5, 72,2, 70,1, 68,8, 64,8, 61,6, 53,0, 50,8, 50,0, 43,9, 40,7, 40,3, 38,6, 38,3, 37,8, 37,5, 36,9, 34,2, 33,0, 31,0, 30,2, 25,4, 23,8, 22,5, 21,2, 20,9, 20,6, 17,9, 16,5, 14,5. 13 C NMR (CD 3 OD): 179.2, 173.3, 139.5, 137.8, 131.4, 122.5, 75.9, 73.0, 72.5, 72.2, 70 , 1, 68.8, 64.8, 61.6, 53.0, 50.8, 50.0, 43.9, 40.7, 40.3, 38.6, 38.3, 37.8 , 37.5, 36.9, 34.2, 33.0, 31.0, 30.2, 25.4, 23.8, 22.5, 21.2, 20.9, 20.6, 17 9, 16.5, 14.5.
Пример 103: Серебряная соль 24-бромфузидовой кислоты (соединение 303) Example 103 : Silver salt of 24-bromofusidic acid (compound 303)
Раствор натриевой соли 24-бромфузидовой кислоты (109) (926 мг, 1,5 ммоль) в воде (10 мл) добавляют к раствору ацетата серебра (250 мг, 1,5 ммоль) в воде (30 мл). Добавляют этанол (25 мл) и через один час тонкодисперсный осадок собирают фильтрованием (через мелкопористый стеклянный фильтр), промывают водой и сушат в вакууме над силикагелем в темноте в течение нескольких дней. Серебряная соль (303) представляет собой слегка серый аморфный порошок.A solution of 24-bromfusidic acid sodium salt (109) (926 mg, 1.5 mmol) in water (10 ml) is added to a solution of silver acetate (250 mg, 1.5 mmol) in water (30 ml). Ethanol (25 ml) was added and after one hour a fine precipitate was collected by filtration (through a fine-pore glass filter), washed with water and dried in vacuum over silica gel in the dark for several days. Silver salt (303) is a slightly gray amorphous powder.
1H ЯМР (DMSO): 5,68 (д, 1H), 4,14 (ш.,1H), 4,00 (м, 2H), 3,51 (ш., 1H), 2,9-0,93 (м, 20H), 1,90 (с, 3H), 1,79 (с, 3H), 1,78 (с, 3H), 1,27 (с, 3H), 0,89 (с, 3H), 0,82 (с, 3H), 0,79 (д, 3H). 1 H NMR (DMSO): 5.68 (d, 1H), 4.14 (br, 1H), 4.00 (m, 2H), 3.51 (br, 1H), 2.9-0 93 (m, 20H), 1.90 (s, 3H), 1.79 (s, 3H), 1.78 (s, 3H), 1.27 (s, 3H), 0.89 (s, 3H), 0.82 (s, 3H), 0.79 (d, 3H).
Пример 104: Бензетониевая соль 24-бромфузидовой кислоты (соединение 304) Example 104 : Benzetonium salt of 24-bromofusidic acid (compound 304)
Раствор хлорида бензетония (672 мг, 1,5 ммоль) в воде (5 мл) добавляют к раствору натриевой соли 24-бромфузидовой кислоты (109) (926 мг, 1,5 ммоль) в воде (10 мл), при этом образуется липкий осадок бензетониевой соли. Водную фазу декантируют и осадок промывают водой с декантацией. Осадок растворяют в ацетоне, концентрируют и выпаривают с использованием этилацетата (3 раза) для удаления воды. После обработки диэтиловым эфиром остается соль в виде липкой массы, которую отфильтровывают и оставляют на ночь, получая указанное в заголовке соединение (304) в виде ломкого аморфного порошка.A solution of benzethonium chloride (672 mg, 1.5 mmol) in water (5 ml) is added to a solution of 24-bromofusidic acid sodium salt (109) (926 mg, 1.5 mmol) in water (10 ml), and a sticky precipitate of benzethonium salt. The aqueous phase is decanted and the precipitate is washed with water with decantation. The precipitate was dissolved in acetone, concentrated and evaporated using ethyl acetate (3 times) to remove water. After treatment with diethyl ether, the salt remains as a sticky mass, which is filtered off and left overnight to afford the title compound (304) as a brittle amorphous powder.
13C ЯМР (CD3OD): 179,0, 173,3, 157,8, 143,6, 138,7, 138,2, 134,4, 132,0, 131,3, 130,4, 128,9, 128,4, 122,6, 114,8, 76,0, 72,5, 71,0, 70,4, 68,9, 68,3, 66,9, 65,9, 64,7, 58,0, 51,4, 50,8, 50,0, 43,7, 40,7, 40,3, 38,9, 38,5, 38,3, 37,8, 37,5, 36,8, 33,1, 32,9, 32,4, 32,3, 31,1, 31,0, 30,3, 25,4, 23,8, 23,8, 22,5, 21,1, 20,5, 17,9, 16,5, 15,5. 13 C NMR (CD 3 OD): 179.0, 173.3, 157.8, 143.6, 138.7, 138.2, 134.4, 132.0, 131.3, 130.4, 128 9, 128.4, 122.6, 114.8, 76.0, 72.5, 71.0, 70.4, 68.9, 68.3, 66.9, 65.9, 64.7 , 58.0, 51.4, 50.8, 50.0, 43.7, 40.7, 40.3, 38.9, 38.5, 38.3, 37.8, 37.5, 36 , 8, 33.1, 32.9, 32.4, 32.3, 31.1, 31.0, 30.3, 25.4, 23.8, 23.8, 22.5, 21.1 , 20.5, 17.9, 16.5, 15.5.
Пример 105: Триэтаноламиновая соль 24-бромфузидовой кислоты (соединение 305) Example 105 : Triethanolamine salt of 24-bromofusidic acid (compound 305)
По процедуре, приведенной в примере 88, при замене гидроксида холина триэтаноламином (209 мкл, 234 мг, 1,5 ммоль, чистое вещество) получают указанное в заголовке соединение (305) (из этанола/диэтилового эфира) в виде кристаллического порошка.Following the procedure in Example 88, when replacing choline hydroxide with triethanolamine (209 μl, 234 mg, 1.5 mmol, pure), the title compound (305) (from ethanol / diethyl ether) was obtained as a crystalline powder.
13C ЯМР (CD3OD): 176,4, 172,9, 144,7, 134,3, 131,9, 122,0, 75,8, 72,5, 68,7, 58,7, 57,6, 50,8, 50,0, 44,5, 40,7, 40,1, 38,7, 38,2, 37,8, 37,5, 36,8, 32,9, 31,0, 29,6, 25,5, 23,8, 22,4, 20,9, 20,5, 18,0, 16,5. 13 C NMR (CD 3 OD): 176.4, 172.9, 144.7, 134.3, 131.9, 122.0, 75.8, 72.5, 68.7, 58.7, 57 , 6, 50.8, 50.0, 44.5, 40.7, 40.1, 38.7, 38.2, 37.8, 37.5, 36.8, 32.9, 31.0 , 29.6, 25.5, 23.8, 22.4, 20.9, 20.5, 18.0, 16.5.
Пример 106: Пивалоилоксиметиловый сложный эфир 24-(транс-1-гексен-1-ил)фузидовой кислоты (соединение 306) Example 106 : Pivaloyloxymethyl ester 24- ( trans -1-hexen-1-yl) fusidic acid (compound 306)
По процедуре, приведенной в примере 36, при замене фенилбороновой кислоты транс-1-гексен-1-илбороной кислотой получают указанное в заголовке соединение (306).Following the procedure in Example 36, by replacing phenylboronic acid with trans -1-hexen-1-ylboronic acid, the title compound (306) was obtained.
13C ЯМР (CDCl3): 177,0, 170,3, 168,4, 149,9, 129,8, 129,7, 129,6, 128,4, 127,8, 80,0, 74,4, 71,4, 68,2, 49,2, 48,7, 44,2, 39,4, 39,0, 38,8, 37,1, 36,2, 36,2, 35,7, 33,2, 32,5, 32,1, 30,3, 30,0, 27,8, 27,6, 26,9, 24,3, 22,7, 22,4, 21,5, 20,8, 20,7, 20,4, 17,9, 15,9, 14,0. 13 C NMR (CDCl 3 ): 177.0, 170.3, 168.4, 149.9, 129.8, 129.7, 129.6, 128.4, 127.8, 80.0, 74, 4, 71.4, 68.2, 49.2, 48.7, 44.2, 39.4, 39.0, 38.8, 37.1, 36.2, 36.2, 35.7, 33.2, 32.5, 32.1, 30.3, 30.0, 27.8, 27.6, 26.9, 24.3, 22.7, 22.4, 21.5, 20, 8, 20.7, 20.4, 17.9, 15.9, 14.0.
Пример 107: Пивалоилоксиметиловый сложный эфир 24-(транс-1-бутен-3,3-диметил-1-ил)фузидовой кислоты (соединение 307) Example 107 : Pivaloyloxymethyl ester 24- ( trans -1-butene-3,3-dimethyl-1-yl) fusidic acid (compound 307)
По процедуре, приведенной в примере 36, при замене фенилбороновой кислоты транс-1-бутен-3,3-диметил-1-илбороновой кислотой получают указанное в заголовке соединение (307).Following the procedure in Example 36, when substituting phenylboronic acid for trans -1-butene-3,3-dimethyl-1-ylboronic acid, the title compound (307) is obtained.
13C ЯМР (CDCl3): 177,0, 170,3, 168,5, 149,9, 139,2, 130,1, 129,7, 129,5, 122,5, 80,0, 74,4, 71,4, 68,2, 49,2, 48,7, 44,2, 39,4, 39,0, 38,8, 37,1, 36,2, 36,2, 35,6, 33,4, 32,5, 30,3, 30,0, 29,0, 27,8, 27,7, 26,9, 24,3, 22,7, 21,6, 20,8, 20,7, 20,4, 17,8, 15,9. 13 C NMR (CDCl 3 ): 177.0, 170.3, 168.5, 149.9, 139.2, 130.1, 129.7, 129.5, 122.5, 80.0, 74, 4, 71.4, 68.2, 49.2, 48.7, 44.2, 39.4, 39.0, 38.8, 37.1, 36.2, 36.2, 35.6, 33.4, 32.5, 30.3, 30.0, 29.0, 27.8, 27.7, 26.9, 24.3, 22.7, 21.6, 20.8, 20, 7, 20.4, 17.8, 15.9.
Пример 108: Пивалоилоксиметиловый сложный эфир 24-(транс-1-нонен-1-ил)фузидовой кислоты (соединение 308) Example 108 : Pivaloyloxymethyl ester 24- ( trans -1-nonen-1-yl) fusidic acid (compound 308)
По процедуре, приведенной в примере 36, при замене фенилбороновой кислоты транс-1-нонен-1-илбороновой кислотой получают указанное в заголовке соединение (308).Following the procedure in Example 36, when phenylboronic acid is replaced with trans -1-nonen-1-ylboronic acid, the title compound (308) is obtained.
13C ЯМР (CDCl3): 177,0, 170,3, 168,4, 149,9, 129,8, 129,7, 129,6, 128,5, 127,8, 80,0, 74,4, 71,4, 68,2, 49,2, 48,7, 44,2, 39,4, 39,0, 38,8, 37,1, 36,3, 36,1, 35,7, 33,6, 32,5, 31,9, 30,3, 30,0, 30,0, 29,4, 29,3, 27,8, 27,6, 26,9, 24,3, 22,7, 22,7, 21,5, 20,8, 20,7, 20,4, 17,9, 15,9, 14,1. 13 C NMR (CDCl 3 ): 177.0, 170.3, 168.4, 149.9, 129.8, 129.7, 129.6, 128.5, 127.8, 80.0, 74, 4, 71.4, 68.2, 49.2, 48.7, 44.2, 39.4, 39.0, 38.8, 37.1, 36.3, 36.1, 35.7, 33.6, 32.5, 31.9, 30.3, 30.0, 30.0, 29.4, 29.3, 27.8, 27.6, 26.9, 24.3, 22, 7, 22.7, 21.5, 20.8, 20.7, 20.4, 17.9, 15.9, 14.1.
Пример 109: Пивалоилоксиметиловый сложный эфир 24-(транс-5-хлор-1-пентен-1-ил)фузидовой кислоты (соединение 309) Example 109 : 24- ( trans- 5-chloro-1-penten-1-yl) fusidic acid pivaloyloxymethyl ester (compound 309)
По процедуре, приведенной в примере 36, при замене фенилбороновой кислоты транс-5-хлор-1-пентен-1-илбороновой кислотой получают указанное в заголовке соединение (309).Following the procedure in Example 36, when replacing phenylboronic acid with trans- 5-chloro-1-penten-1-ylboronic acid, the title compound (309) is obtained.
13C ЯМР (CDCl3): 177,0, 170,2, 168,4, 149,9, 130,7, 129,6, 129,5, 129,3, 125,9, 80,0, 74,4, 71,4, 68,2, 49,2, 48,7, 44,6, 44,2, 39,4, 39,0, 38,8, 37,1, 36,3, 36,1, 35,7, 32,6, 30,5, 30,3, 30,0, 27,8, 27,6, 26,9, 24,3, 22,6, 21,5, 20,8, 20,7, 20,4, 17,9, 15,9. 13 C NMR (CDCl 3 ): 177.0, 170.2, 168.4, 149.9, 130.7, 129.6, 129.5, 129.3, 125.9, 80.0, 74, 4, 71.4, 68.2, 49.2, 48.7, 44.6, 44.2, 39.4, 39.0, 38.8, 37.1, 36.3, 36.1, 35.7, 32.6, 30.5, 30.3, 30.0, 27.8, 27.6, 26.9, 24.3, 22.6, 21.5, 20.8, 20, 7, 20.4, 17.9, 15.9.
Пример 110: Пивалоилоксиметиловый сложный эфир 24-(транс-2-фенил-1-винил-1-ил)фузидовой кислоты (соединение 310) Example 110 : Pivaloyloxymethyl ester 24- ( trans -2-phenyl-1-vinyl-1-yl) fusidic acid (compound 310)
По процедуре, приведенной в примере 36, при замене фенилбороновой кислоты транс-2-фенил-1-винилбороновой кислотой получают указанное в заголовке соединение (310).According to the procedure described in Example 36, when replacing phenylboronic acid with trans -2-phenyl-1-vinylboronic acid, the title compound (310) is obtained.
13C ЯМР (CDCl3): 177,0, 170,2, 168,4, 150,4, 138,4, 133,6, 130,3, 129,3, 128,6, 127,1, 126,9, 126,3, 126,1, 80,1, 74,4, 71,4, 68,1, 49,2, 48,7, 44,3, 39,4, 39,0, 38,8, 37,0, 36,2, 36,1, 35,9, 32,4, 30,2, 29,9, 27,9, 27,6, 26,9, 24,1, 22,7, 21,9, 20,8, 20,8, 20,7, 17,8, 15,9. 13 C NMR (CDCl 3 ): 177.0, 170.2, 168.4, 150.4, 138.4, 133.6, 130.3, 129.3, 128.6, 127.1, 126, 9, 126.3, 126.1, 80.1, 74.4, 71.4, 68.1, 49.2, 48.7, 44.3, 39.4, 39.0, 38.8, 37.0, 36.2, 36.1, 35.9, 32.4, 30.2, 29.9, 27.9, 27.6, 26.9, 24.1, 22.7, 21, 9, 20.8, 20.8, 20.7, 17.8, 15.9.
Пример 111: Пивалоилоксиметиловый сложный эфир 24-(2-фенил-1-этил)фузидовой кислоты (соединение 311) Example 111 : 24- (2-Phenyl-1-ethyl) fusidic acid pivaloyloxymethyl ester (compound 311)
Пивалоилоксиметиловый сложный эфир 24-(транс-2-фенил-1-винил)фузидовой кислоты (310) (230 мг, 0,3 ммоль) растворяют в этаноле (5 мл) и добавляют палладий на угле (25 мг, 5%). Колбу отбирают, присоединяют к ней баллон, содержащий газ водород, и перемешивают в течение ночи на магнитной мешалке. Катализатор отфильтровывают через фильтровальное устройство и фильтрат концентрируют. Неочищенный продукт очищают колоночной флэш-хроматографией (элюент: петролейный эфир:EtOAc, 90:10-50:50) с получением чистого указанного в заголовке соединения (311).24- ( trans -2-phenyl-1-vinyl) fusidic acid pivaloyloxymethyl ester (310) (230 mg, 0.3 mmol) was dissolved in ethanol (5 ml) and palladium on charcoal (25 mg, 5%) was added. The flask was removed, a cylinder containing hydrogen gas was attached to it, and stirred overnight on a magnetic stirrer. The catalyst was filtered through a filter device and the filtrate was concentrated. The crude product was purified by flash column chromatography (eluent: petroleum ether: EtOAc, 90: 10-50: 50) to give the pure title compound (311).
13C ЯМР (CD3OD): 178,2, 172,1, 169,7, 152,1, 152,1, 144,1, 143,9, 130,9, 130,8, 129,4, 129,3, 126,6, 81,0, 75,6, 72,3, 68,4, 50,6, 45,5, 44,8, 44,4, 40,6, 40,0, 39,7, 38,1, 37,8, 37,4, 37,3, 36,7, 35,0, 34,8, 33,6, 33,3, 32,8, 31,9, 31,0, 30,2, 28,2, 27,3, 23,9, 23,0, 22,3, 20,9, 19,6, 19,5, 18,2, 16,5. 13 C NMR (CD 3 OD): 178.2, 172.1, 169.7, 152.1, 152.1, 144.1, 143.9, 130.9, 130.8, 129.4, 129 , 3, 126.6, 81.0, 75.6, 72.3, 68.4, 50.6, 45.5, 44.8, 44.4, 40.6, 40.0, 39.7 , 38.1, 37.8, 37.4, 37.3, 36.7, 35.0, 34.8, 33.6, 33.3, 32.8, 31.9, 31.0, 30 , 2, 28.2, 27.3, 23.9, 23.0, 22.3, 20.9, 19.6, 19.5, 18.2, 16.5.
Пример 112: Пивалоилоксиметиловый сложный эфир 24-(4-н-пропилфенил)фузидовой кислоты (соединение 312) Example 112 : 24- (4-n-propylphenyl) fusidic acid pivaloyloxymethyl ester (compound 312)
По процедуре, приведенной в примере 36, при замене фенилбороновой кислоты 4-н-пропилфенилбороновой кислотой получают указанное в заголовке соединение (312).Following the procedure in Example 36, when the phenylboronic acid is replaced with 4-n-propylphenylboronic acid, the title compound (312) is obtained.
13C ЯМР (CDCl3): 177,0, 170,2, 167,6, 152,5, 141,4, 140,5, 133,8, 129,5, 129,0, 128,2, 127,8, 80,0, 74,4, 71,4, 67,9, 48,9, 48,7, 44,4, 39,4, 39,0, 38,8, 37,7, 36,9, 36,3, 36,1, 35,5, 35,0, 32,2, 30,1, 30,0, 27,4, 26,9, 24,7, 23,8, 22,7, 22,1, 20,9, 20,8, 19,9, 18,0, 15,9, 14,0. 13 C NMR (CDCl 3 ): 177.0, 170.2, 167.6, 152.5, 141.4, 140.5, 133.8, 129.5, 129.0, 128.2, 127, 8, 80.0, 74.4, 71.4, 67.9, 48.9, 48.7, 44.4, 39.4, 39.0, 38.8, 37.7, 36.9, 36.3, 36.1, 35.5, 35.0, 32.2, 30.1, 30.0, 27.4, 26.9, 24.7, 23.8, 22.7, 22, 1, 20.9, 20.8, 19.9, 18.0, 15.9, 14.0.
Пример 113: Пивалоилоксиметиловый сложный эфир 24-(4-винилфенил)фузидовой кислоты (соединение 313) Example 113 : Pivaloyloxymethyl ester of 24- (4-vinylphenyl) fusidic acid (compound 313)
По процедуре, приведенной в примере 36, при замене фенилбороновой кислоты 4-винилфенилобороновой кислотой получают указанное в заголовке соединение (313).Following the procedure in Example 36, when the phenylboronic acid is replaced with 4-vinylphenylboronic acid, the title compound (313) is obtained.
13C ЯМР (CDCl3): 177,0, 170,2, 167,7, 152,6, 143,8, 136,4, 135,4, 133,7, 129,9, 128,8, 128,5, 125,8, 113,6, 80,0, 74,3, 71,4, 67,8, 48,9, 48,6, 44,4, 39,4, 39,0, 38,8, 36,9, 36,3, 36,0, 35,3, 35,0, 32,2, 30,0, 27,3, 26,9, 23,9, 22,7, 22,1, 20,8, 20,8, 19,9, 17,9, 15,9. 13 C NMR (CDCl 3 ): 177.0, 170.2, 167.7, 152.6, 143.8, 136.4, 135.4, 133.7, 129.9, 128.8, 128, 5, 125.8, 113.6, 80.0, 74.3, 71.4, 67.8, 48.9, 48.6, 44.4, 39.4, 39.0, 38.8, 36.9, 36.3, 36.0, 35.3, 35.0, 32.2, 30.0, 27.3, 26.9, 23.9, 22.7, 22.1, 20, 8, 20.8, 19.9, 17.9, 15.9.
Пример 114: Пивалоилоксиметиловый сложный эфир 24-(4-трет-бутилфенил)фузидовой кислоты (соединение 314) Example 114 : Pivaloyloxymethyl ester of 24- (4- tert- butylphenyl) fusidic acid (compound 314)
По процедуре, приведенной в примере 36, при замене фенилбороновой кислоты 4-трет-бутилфенилбороновой кислотой получают указанное в заголовке соединение (314).By the procedure of Example 36, when the phenylboronic acid is replaced with 4- tert- butylphenylboronic acid, the title compound (314) is obtained.
13C ЯМР (CDCl3) 177,0, 170,2, 167,6, 152,5, 149,0, 140,9, 133,7, 129,1, 129,0, 128,3, 124,6, 80,0, 74,4, 71,4, 67,9, 48,9, 48,8, 44,3, 39,4, 39,0, 38,8, 36,9, 36,2, 36,1, 35,5, 34,8, 34,5, 32,3, 31,5, 30,3, 30,0, 27,5, 26,9, 23,9, 22,6, 22,1, 20,9, 20,7, 20,0, 18,1, 15,9. 13 C NMR (CDCl 3 ) 177.0, 170.2, 167.6, 152.5, 149.0, 140.9, 133.7, 129.1, 129.0, 128.3, 124.6 , 80.0, 74.4, 71.4, 67.9, 48.9, 48.8, 44.3, 39.4, 39.0, 38.8, 36.9, 36.2, 36 , 1, 35.5, 34.8, 34.5, 32.3, 31.5, 30.3, 30.0, 27.5, 26.9, 23.9, 22.6, 22.1 , 20.9, 20.7, 20.0, 18.1, 15.9.
Пример 115: Пивалоилоксиметиловый сложный эфир 24-(4-цианофенил)фузидовой кислоты (соединение 315) Example 115 : Pivaloyloxymethyl ester of 24- (4-cyanophenyl) fusidic acid (compound 315)
По процедуре, приведенной в примере 36, при замене фенилбороновой кислоты 4-цианофенилобороновой кислотой получают указанное в заголовке соединение (315).Following the procedure in Example 36, when the phenylboronic acid is replaced with 4-cyanophenyl boronic acid, the title compound (315) is obtained.
13C ЯМР (CDCl3): 177,0, 170,1, 167,7, 152,2, 148,9, 132,8, 131,9, 130,5, 130,2, 128,5, 119,0, 109,9, 80,0, 74,2, 71,3, 68,1, 49,1, 48,6, 44,5, 39,4, 39,0, 38,8, 37,1, 36,3, 36,0, 34,9, 34,4, 32,6, 30,3, 30,0, 27,5, 26,9, 24,3, 22,6, 22,2, 20,8, 20,6, 20,2, 18,0, 15,9. 13 C NMR (CDCl 3 ): 177.0, 170.1, 167.7, 152.2, 148.9, 132.8, 131.9, 130.5, 130.2, 128.5, 119, 0, 109.9, 80.0, 74.2, 71.3, 68.1, 49.1, 48.6, 44.5, 39.4, 39.0, 38.8, 37.1, 36.3, 36.0, 34.9, 34.4, 32.6, 30.3, 30.0, 27.5, 26.9, 24.3, 22.6, 22.2, 20, 8, 20.6, 20.2, 18.0, 15.9.
Пример 116: Пивалоилоксиметиловый сложный эфир 24-(3-бифенил)фузидовой кислоты (соединение 316) Example 116 : 24- (3-Biphenyl) fusidic acid pivaloyloxymethyl ester (compound 316)
По процедуре, приведенной в примере 36, при замене фенилбороновой кислоты 3-бифенилбороновой кислотой получают указанное в заголовке соединение (316).Following the procedure in Example 36, when the phenylboronic acid is replaced with 3-biphenylboronic acid, the title compound (316) is obtained.
13C ЯМР (CDCl3): 177,0, 170,2, 167,8, 152,3, 144,4, 140,9, 140,7, 133,9, 128,9, 128,8, 128,6, 128,6, 128,5, 128,0, 127,5, 126,9, 124,5, 80,0, 74,3, 71,4, 67,8, 48,8, 48,6, 44,4, 39,3, 39,0, 38,8, 36,8, 36,2, 36,1, 35,5, 34,8, 32,2, 30,0, 27,6, 26,9, 23,9, 22,5, 22,2, 20,8, 20,7, 20,0, 18,0, 15,9. 13 C NMR (CDCl 3 ): 177.0, 170.2, 167.8, 152.3, 144.4, 140.9, 140.7, 133.9, 128.9, 128.8, 128, 6, 128.6, 128.5, 128.0, 127.5, 126.9, 124.5, 80.0, 74.3, 71.4, 67.8, 48.8, 48.6, 44.4, 39.3, 39.0, 38.8, 36.8, 36.2, 36.1, 35.5, 34.8, 32.2, 30.0, 27.6, 26, 9, 23.9, 22.5, 22.2, 20.8, 20.7, 20.0, 18.0, 15.9.
Пример 117: Пивалоилоксиметиловый сложный эфир 24-(4-(трифторметил)фенил)фузидовой кислоты (соединение 317) Example 117 : Pivaloyloxymethyl ester 24- (4- (trifluoromethyl) phenyl) fusidic acid (compound 317)
По процедуре, приведенной в примере 36, при замене фенилбороновой кислоты 4-(трифторметил)фенилбороновой кислотой получают указанное в заголовке соединение (317).Following the procedure in Example 36, when the phenylboronic acid is replaced with 4- (trifluoromethyl) phenylboronic acid, the title compound (317) is obtained.
13C ЯМР (CDCl3): 177,0, 170,2, 167,7, 152,6, 147,8, 133,0, 129,8, 129,7, 128,5, 125,0, 124,9, 80,0, 74,2, 71,4, 67,9, 49,0, 48,6, 44,5, 39,3, 39,0, 3878, 37,0, 36,2, 36,1, 34,9, 34,8, 32,5, 30,0, 27,4, 26,9, 24,2, 22,4, 22,1, 20,8, 20,6, 20,0, 18,0, 15,9. 13 C NMR (CDCl 3 ): 177.0, 170.2, 167.7, 152.6, 147.8, 133.0, 129.8, 129.7, 128.5, 125.0, 124, 9, 80.0, 74.2, 71.4, 67.9, 49.0, 48.6, 44.5, 39.3, 39.0, 3878, 37.0, 36.2, 36, 1, 34.9, 34.8, 32.5, 30.0, 27.4, 26.9, 24.2, 22.4, 22.1, 20.8, 20.6, 20.0, 18.0, 15.9.
Пример 118: Пивалоилоксиметиловый сложный эфир 24-(4-метоксифенил)фузидовой кислоты (соединение 318) Example 118 : Pivaloyloxymethyl ester of 24- (4-methoxyphenyl) fusidic acid (compound 318)
По процедуре, приведенной в примере 36, при замене фенилбороновой кислоты 4-метоксифенилбороновой кислотой получают указанное в заголовке соединение (318).Following the procedure in Example 36, when the phenylboronic acid is replaced with 4-methoxyphenylboronic acid, the title compound (318) is obtained.
13C ЯМР (CDCl3): 177,0, 170,2, 167,7, 157,9, 152,2, 136,3, 133,4, 130,6, 129,0, 128,2, 113,2, 80,0, 74,3, 71,4, 67,9, 55,2, 49,0, 48,6, 44,4, 39,4, 39,0, 38,8, 36,9, 36,3, 36,0, 35,3, 35,1, 32,1, 30,0, 27,3, 26,9, 23,8, 22,8, 22,0, 20,8, 20,0, 17,9, 15,9. 13 C NMR (CDCl 3 ): 177.0, 170.2, 167.7, 157.9, 152.2, 136.3, 133.4, 130.6, 129.0, 128.2, 113, 2, 80.0, 74.3, 71.4, 67.9, 55.2, 49.0, 48.6, 44.4, 39.4, 39.0, 38.8, 36.9, 36.3, 36.0, 35.3, 35.1, 32.1, 30.0, 27.3, 26.9, 23.8, 22.8, 22.0, 20.8, 20, 0, 17.9, 15.9.
Пример 119: Пивалоилоксиметиловый сложный эфир 24-(3-цианофенил)фузидовой кислоты (соединение 319) Example 119 : Pivaloyloxymethyl ester 24- (3-cyanophenyl) fusidic acid (compound 319)
По процедуре, приведенной в примере 36, при замене фенилбороновой кислоты 3-цианофенилбороновой кислотой получают указанное в заголовке соединение (319).Following the procedure in Example 36, when the phenylboronic acid is replaced with 3-cyanophenylboronic acid, the title compound (319) is obtained.
13C ЯМР (CDCl3): 177,0, 170,2, 167,7, 152,3, 144,9, 134,0, 132,9, 132,2, 130,6, 129,7, 128,9, 128,5, 119,0, 112,2, 80,0, 74,2, 71,3, 68,1, 49,1, 48,7, 44,5, 39,4, 39,0, 38,8, 37,1, 36,3, 36,1, 35,2, 34,4, 32,6, 30,3, 30,0, 27,5, 26,9, 24,3, 22,5, 22,1, 20,8, 20,6, 20,2, 18,0, 15,9. 13 C NMR (CDCl 3 ): 177.0, 170.2, 167.7, 152.3, 144.9, 134.0, 132.9, 132.2, 130.6, 129.7, 128, 9, 128.5, 119.0, 112.2, 80.0, 74.2, 71.3, 68.1, 49.1, 48.7, 44.5, 39.4, 39.0, 38.8, 37.1, 36.3, 36.1, 35.2, 34.4, 32.6, 30.3, 30.0, 27.5, 26.9, 24.3, 22, 5, 22.1, 20.8, 20.6, 20.2, 18.0, 15.9.
Пример 120: Пивалоилоксиметиловый сложный эфир 24-(2-метоксифенил)фузидовой кислоты (соединение 320) Example 120 : Pivaloyloxymethyl ester of 24- (2-methoxyphenyl) fusidic acid (compound 320)
По процедуре, приведенной в примере 36, при замене фенилбороновой кислоты 2-метоксифенилбороновой кислотой получают указанное в заголовке соединение (320).According to the procedure described in Example 36, when the phenylboronic acid is replaced with 2-methoxyphenylboronic acid, the title compound (320) is obtained.
13C ЯМР (CDCl3): 177,0, 170,2, 167,8, 157,2, 152,2, 132,7, 131,9, 130,9, 130,3, 129,1, 127,5, 120,3, 111,0, 79,9, 74,4, 71,5, 68,0, 55,9, 55,4, 48,9, 48,7, 44,4, 39,4, 39,0, 38,8, 36,8, 36,4, 36,0, 35,4, 34,4, 33,2, 32,1, 30,0, 27,2, 26,9, 23,8, 22,8, 22,0, 20,9, 19,7, 17,9, 15,9. 13 C NMR (CDCl 3 ): 177.0, 170.2, 167.8, 157.2, 152.2, 132.7, 131.9, 130.9, 130.3, 129.1, 127, 5, 120.3, 111.0, 79.9, 74.4, 71.5, 68.0, 55.9, 55.4, 48.9, 48.7, 44.4, 39.4, 39.0, 38.8, 36.8, 36.4, 36.0, 35.4, 34.4, 33.2, 32.1, 30.0, 27.2, 26.9, 23, 8, 22.8, 22.0, 20.9, 19.7, 17.9, 15.9.
Пример 121: Пивалоилоксиметиловый сложный эфир 24-(3-нитрофенил)фузидовой кислоты (соединение 321) Example 121 : Pivaloyloxymethyl ester of 24- (3-nitrophenyl) fusidic acid (compound 321)
По процедуре, приведенной в примере 36, при замене фенилбороновой кислоты 3-нитрофенилбороновой кислотой получают указанное в заголовке соединение (321).According to the procedure described in Example 36, when replacing phenylboronic acid with 3-nitrophenylboronic acid, the title compound (321) was obtained.
13C ЯМР (CDCl3): 177,0, 170,2, 167,7, 152,3, 148,3, 145,3, 135,7, 132,1, 130,9, 129,0, 128,4, 124,1, 121,l, 80,0, 74,2, 71,3, 68,1, 49,0, 48,6, 44,5, 39,4, 39,0, 38,8, 37,0, 36,3, 36,1, 35,2, 34,3, 32,6, 30,3, 30,0, 27,6, 26,9, 24,3, 22,5, 22,2, 20,8, 20,6, 20,3, 18,0, 15,9. 13 C NMR (CDCl 3 ): 177.0, 170.2, 167.7, 152.3, 148.3, 145.3, 135.7, 132.1, 130.9, 129.0, 128, 4, 124.1, 121, l, 80.0, 74.2, 71.3, 68.1, 49.0, 48.6, 44.5, 39.4, 39.0, 38.8, 37.0, 36.3, 36.1, 35.2, 34.3, 32.6, 30.3, 30.0, 27.6, 26.9, 24.3, 22.5, 22, 2, 20.8, 20.6, 20.3, 18.0, 15.9.
Пример 122: Пивалоилоксиметиловый сложный эфир 24-(3-бромфенил)фузидовой кислоты (соединение 322) Example 122 : Pivaloyloxymethyl ester 24- (3-bromophenyl) fusidic acid (compound 322)
По процедуре, приведенной в примере 36, при замене фенилбороновой кислоты 3-бромфенилбороновой кислотой получают указанное в заголовке соединение (322).According to the procedure described in Example 36, when replacing phenylboronic acid with 3-bromophenylboronic acid, the title compound (322) was obtained.
13C ЯМР (CDCl3): 177,0, 170,2, 167,7, 152,5, 146,1, 132,8, 132,2, 129,6, 129,5, 129,0, 128,5, 128,4, 122,0, 80,0, 74,3, 71,4, 68,0, 49,0, 48,6, 44,5, 39,4, 39,0, 38,8, 36,9, 36,3, 36,1, 35,5, 34,8, 32,2, 30,1, 30,0, 27,5, 26,9, 24,0, 22,7. 13 C NMR (CDCl 3 ): 177.0, 170.2, 167.7, 152.5, 146.1, 132.8, 132.2, 129.6, 129.5, 129.0, 128, 5, 128.4, 122.0, 80.0, 74.3, 71.4, 68.0, 49.0, 48.6, 44.5, 39.4, 39.0, 38.8, 36.9, 36.3, 36.1, 35.5, 34.8, 32.2, 30.1, 30.0, 27.5, 26.9, 24.0, 22.7.
Пример 123: Пивалоилоксиметиловый сложный эфир 24-(4-(метилтио)фенил)фузидовой кислоты (соединение 323) Example 123 : 24- (4- (Methylthio) phenyl) fusidic acid pivaloyloxymethyl ester (compound 323)
По процедуре, приведенной в примере 36, при замене фенилбороновой кислоты 4-(метилтио)фенилбороновой кислотой получают указанное в заголовке соединение (323).Following the procedure in Example 36, when the phenylboronic acid is replaced with 4- (methylthio) phenylboronic acid, the title compound (323) is obtained.
13C ЯМР (CDCl3): 177,0, 170,2, 167,7, 152,5, 140,8, 135,9, 133,3, 130,1, 128,7, 128,5, 125,9, 79,9, 74,3, 71,4, 67,9, 48,9, 48,6, 44,4, 39,4, 39,0, 38,8, 36,9, 36,3, 36,0, 35,2, 35,0, 32,1, 30,0, 29,9, 27,3, 26,9, 23,9, 22,8, 22,0, 20,8, 20,8, 19,9, 17,9, 15,9, 15,6. 13 C NMR (CDCl 3 ): 177.0, 170.2, 167.7, 152.5, 140.8, 135.9, 133.3, 130.1, 128.7, 128.5, 125, 9, 79.9, 74.3, 71.4, 67.9, 48.9, 48.6, 44.4, 39.4, 39.0, 38.8, 36.9, 36.3, 36.0, 35.2, 35.0, 32.1, 30.0, 29.9, 27.3, 26.9, 23.9, 22.8, 22.0, 20.8, 20, 8, 19.9, 17.9, 15.9, 15.6.
Пример 124: Пивалоилоксиметиловый сложный эфир 24-(2-нафтил)фузидовой кислоты (соединение 324) Example 124 : Pivaloyloxymethyl ester of 24- (2-naphthyl) fusidic acid (compound 324)
По процедуре, приведенной в примере 36, при замене фенилбороновой кислоты 2-нафтилбороновой кислотой получают указанное в заголовке соединение (324).According to the procedure described in Example 36, when replacing phenylboronic acid with 2-naphthylboronic acid, the title compound (324) was obtained.
13C ЯМР (CDCl3): 177,0, 170,2, 167,7, 152,7, 141,7, 133,9, 133,3, 131,9, 128,7, 128,6, 128,6, 127,8, 127,6, 127,4, 126,2, 125,6, 80,0, 74,3, 71,4, 67,4, 48,6, 48,4, 44,4, 39,3, 39,0, 38,8, 36,6, 36,3, 35,8, 35,2, 35,1, 32,0, 29,9, 29,6, 27,4, 26,9, 23,7, 22,6, 22,2, 20,8, 20,8, 19,9, 17,8, 15,9. 13 C NMR (CDCl 3 ): 177.0, 170.2, 167.7, 152.7, 141.7, 133.9, 133.3, 131.9, 128.7, 128.6, 128, 6, 127.8, 127.6, 127.4, 126.2, 125.6, 80.0, 74.3, 71.4, 67.4, 48.6, 48.4, 44.4, 39.3, 39.0, 38.8, 36.6, 36.3, 35.8, 35.2, 35.1, 32.0, 29.9, 29.6, 27.4, 26, 9, 23.7, 22.6, 22.2, 20.8, 20.8, 19.9, 17.8, 15.9.
Пример 125: Пивалоилоксиметиловый сложный эфир 24-(3,5-бис-(трифторметил)фенил)фузидовой кислоты (соединение 325) Example 125 : Pivaloyloxymethyl ester 24- (3,5- bis - (trifluoromethyl) phenyl) fusidic acid (compound 325)
По процедуре, приведенной в примере 36, при замене фенилбороновой кислоты 3,5-бис-(трифторметил)фенилбороновой кислотой получают указанное в заголовке соединение (325).By the procedure described in Example 36, when replacing phenylboronic acid with 3,5- bis - (trifluoromethyl) phenylboronic acid, the title compound (325) is obtained.
13C ЯМР (CDCl3): 176,9, 170,2, 167,6, 152,7, 145,9, 131,7, 131,7, 131,4, 129,4, 128,2, 123,5, 120,0, 80,1, 74,2, 71,3, 67,9, 60,4, 49,0, 48,6, 44,6, 39,4, 39,0, 38,8, 37,0, 36,2, 36,1, 35,3, 34,6, 32,5, 30,2, 30,0, 27,6, 26,9, 24,3, 22,4, 22,1, 20,8, 20,6, 20,2, 18,0, 15,9, 14,2. 13 C NMR (CDCl 3 ): 176.9, 170.2, 167.6, 152.7, 145.9, 131.7, 131.7, 131.4, 129.4, 128.2, 123, 5, 120.0, 80.1, 74.2, 71.3, 67.9, 60.4, 49.0, 48.6, 44.6, 39.4, 39.0, 38.8, 37.0, 36.2, 36.1, 35.3, 34.6, 32.5, 30.2, 30.0, 27.6, 26.9, 24.3, 22.4, 22, 1, 20.8, 20.6, 20.2, 18.0, 15.9, 14.2.
Пример 126: Пивалоилоксиметиловый сложный эфир 24-(3,4-диметоксифенил)фузидовой кислоты (соединение 326) Example 126 : Pivaloyloxymethyl ester of 24- (3,4-dimethoxyphenyl) fusidic acid (compound 326)
По процедуре, приведенной в примере 36, при замене фенилбороновой кислоты 3,4-диметоксифенилбороновой кислотой получают указанное в заголовке соединение (326).Following the procedure in Example 36, when the phenylboronic acid is replaced with 3,4-dimethoxyphenylboronic acid, the title compound (326) is obtained.
13C ЯМР (CDCl3): 177,0, 170,2, 167,8, 152,1, 148,5, 147,3, 136,6, 133,7, 128,9, 128,2, 121,7, 113,1, 110,6, 80,0, 74,3, 71,4, 67,9, 56,1, 55,8, 49,0, 48,6, 44,4, 39,4, 39,0, 38,8, 36,9, 36,3, 36,0, 35,2, 35,0, 32,2, 30,0, 27,5, 26,9, 23,9, 22,7, 22,1, 20,8, 20,8, 20,0, 17,9, 15,9, 14,2. 13 C NMR (CDCl 3 ): 177.0, 170.2, 167.8, 152.1, 148.5, 147.3, 136.6, 133.7, 128.9, 128.2, 121, 7, 113.1, 110.6, 80.0, 74.3, 71.4, 67.9, 56.1, 55.8, 49.0, 48.6, 44.4, 39.4, 39.0, 38.8, 36.9, 36.3, 36.0, 35.2, 35.0, 32.2, 30.0, 27.5, 26.9, 23.9, 22, 7, 22.1, 20.8, 20.8, 20.0, 17.9, 15.9, 14.2.
Пример 127: Пивалоилоксиметиловый сложный эфир 24-(3,5-дибромфенил)фузидовой кислоты (соединение 327) Example 127 : Pivaloyloxymethyl ester of 24- (3,5-dibromophenyl) fusidic acid (compound 327)
По процедуре, приведенной в примере 36, при замене фенилбороновой кислоты 3,5-дибромфенилбороновой кислотой получают указанное в заголовке соединение (327).According to the procedure described in Example 36, when replacing phenylboronic acid with 3,5-dibromophenylboronic acid, the title compound (327) was obtained.
13C ЯМР (CDCl3): 177,0, 170,2, 167,7, 152,7, 147,4, 131,8, 131,5, 131,2, 130,7, 128,3, 122,5, 80,0, 74,2, 71,4, 68,1, 49,1, 48,6, 44,6, 39,4, 39,0, 38,8, 36,9, 36,3, 36,1, 35,6, 34,6, 32,3, 30,2, 30,0, 27,5, 26,9, 24,1, 22,7, 22,2, 20,8, 20,8, 20,1, 18,0, 15,9. 13 C NMR (CDCl 3 ): 177.0, 170.2, 167.7, 152.7, 147.4, 131.8, 131.5, 131.2, 130.7, 128.3, 122, 5, 80.0, 74.2, 71.4, 68.1, 49.1, 48.6, 44.6, 39.4, 39.0, 38.8, 36.9, 36.3, 36.1, 35.6, 34.6, 32.3, 30.2, 30.0, 27.5, 26.9, 24.1, 22.7, 22.2, 20.8, 20, 8, 20.1, 18.0, 15.9.
Claims (31)
где X обозначает галоген, трифторметил, С1-С7алкил, замещенный фенилом, С2-С9алкенил, необязательно замещенный С1-С7алкилом, галогеном или фенилом, фенил, необязательно замещенный одним или двумя одинаковыми или различными заместителями, выбранными из группы, состоящей из галогена, С1-С7алкила, С2-С9алкенила, фенила, С1-С6алкокси, нитро, С1-С6алкилтио, трифторметила и циано; или X представляет собой нафтил;
Y и Z, оба, обозначают водород или вместе со связью С-17/С-20 образуют двойную связь между С-17 и С-20 или вместе представляют собой метилен и образуют циклопропановое кольцо в сочетании с С-17 и С-20;
А обозначает О, S или S(O);
В обозначает С1-6алкил, С2-6алкенил, С1-6ацил, фенил или бензоил, где С1-6 необязательно замещен одним или более галогенами, гидрокси, С2-6алкенилом, фенилом, С1-4гетероарилом или С1-6алкокси;
Q1 обозначает -(СНОН)-, или -(CHW)-, где W обозначает галоген или азидо;
Q2 обозначает -(СНОН)-;
и его фармацевтически приемлемые соли и легкогидролизуемые сложные эфиры.1. Derivatives of fusidic acid of General formula I
wherein X is halogen, trifluoromethyl, C 1- C 7 alkyl substituted by phenyl, C 2 -C 9 alkenyl, optionally substituted C 1 -C 7 alkyl, halogen or phenyl, phenyl optionally substituted with one or two identical or different substituents selected from the group consisting of halogen, C 1 -C 7 alkyl, C 2 -C 9 alkenyl, phenyl, C 1 -C 6 alkoxy, nitro, C 1 -C 6 alkylthio, trifluoromethyl and cyano; or X is naphthyl;
Y and Z are both hydrogen or, together with the C-17 / C-20 bond, form a double bond between C-17 and C-20 or together represent methylene and form a cyclopropane ring in combination with C-17 and C-20;
A is O, S or S (O);
B is C 1-6 alkyl, C 2-6 alkenyl, C 1-6 acyl, phenyl or benzoyl, where C 1-6 is optionally substituted with one or more halogens, hydroxy, C 2-6 alkenyl, phenyl, C 1-4 heteroaryl or C 1-6 alkoxy;
Q 1 is - (CHOH) -, or - (CHW) -, where W is halogen or azido;
Q 2 is - (CHOH) -;
and its pharmaceutically acceptable salts and hydrolyzable esters.
X обозначает хлор, бром, йод, трифторметил;
Z и Y вместе со связью С-17/С-20 образуют двойную связь между С-17 и С-20;
А обозначает О, S или S(O);
В обозначает С1-4алкильную группу, необязательно замещенную одним или более заместителями, выбранными из ряда, состоящего из гидрокси, или фтора, или В обозначает С1-4ацильную группу или бензоильную группу.10. The compound according to claim 1, in which Q 1 and Q 2 both denote a - (CHOH) group or Q 1 denotes CHBr, or CHN 3 ,
X is chloro, bromo, iodo, trifluoromethyl;
Z and Y together with the C-17 / C-20 bond form a double bond between C-17 and C-20;
A is O, S or S (O);
B is a C 1-4 alkyl group optionally substituted with one or more substituents selected from the range consisting of hydroxy or fluorine, or B is a C 1-4 acyl group or benzoyl group.
натриевая соль 24-трифторметилфузидовой кислоты (соединение 101),
пивалоилоксиметиловый сложный эфир 24-трифторметилфузидовой кислоты (соединение 102),
24-хлорфузидовая кислота (соединение 103),
пивалоилоксиметиловый сложный эфир 24-хлорфузидовой кислоты (соединение 104),
натриевая соль 24-хлорфузидовой кислоты (соединение 105), 24-трифторметилфузидовая кислота (соединение 106),
ацетоксиметиловый сложный эфир 24-бромфузидовой кислоты (соединение 107),
24-бромфузидовая кислота (соединение 108),
натриевая соль 24-бромфузидовой кислоты (соединение 109),
пивалоилоксиметиловый сложный эфир 24-бромфузидовой кислоты (соединение 110),
ацетоксиметиловый сложный эфир 24-бром-16-деацетокси-16β тиоацетилфузидовой кислоты (соединение 111),
24-бром-16-деацетокси-16β-изопропилтиофузидовая кислота (соединение 112),
24-бром-16-деацетокси-16β-изопропилсульфинилфузидовая кислота (соединение 113),
24-бром-16-деацетокси-16β-тиоацетилфузидовая кислота (соединение 114),
24-бром-17S,20S-дигидрофузидовая кислота (соединение 115), 24-бром-16-деацетокси-16β-этоксифузидовая кислота (соединение 116),
ацетоксиметиловый сложный эфир 24-бром-16-деацетокси-16β-этоксифузидовой кислоты (соединение 117),
ацетоксиметиловый сложный эфир 24-бром-16-деацетокси-16β-(2',2',2'-трифторэтокси)фузидовой кислоты (соединение 118),
24-бром-16-деацетокси-16β-(2',2',2'-трифторэтокси)фузидовая кислота (соединение 119),
ацетоксиметиловый сложный эфир 24-бром-17S,20S-фузидовой кислоты (соединение 120),
ацетоксиметиловый сложный эфир 24-бром-17S,20S-метиленфузидовой кислоты (соединение 121),
24-бром-17S,20S-метиленфузидовая кислота (соединение 122),
3-дезокси-3β,24-дибромфузидовая кислота (соединение 123),
3α-азидо-24-бром-3-дезоксифузидовая кислота (соединение 124),
24-йодфузидовая кислота (соединение 125),
ацетоксиметиловый сложный эфир 24-йодфузидовой кислоты (соединение 126),
пивалоилоксиметиловый сложный эфир 24-йодфузидовой кислоты (соединение 127),
пивалоилоксиметиловый сложный эфир 24-фенилфузидовой кислоты (соединение 136),
24-фенилфузидовая кислота (соединение 137),
пивалоилоксиметиловый сложный эфир 24-(4-бромфенил)фузидовой кислоты (соединение 138),
24-(4-бромфенил)фузидовая кислота (соединение 139),
пивалоилоксиметиловый сложный эфир 24-(4-хлорфенил)фузидовой кислоты (соединение 140),
24-(4-хлорфенил)фузидовая кислота (соединение 141),
пивалоилоксиметиловый сложный эфир 24-(3,5-дифторфенил)фузидовой кислоты (соединение 142),
24-(3,5-дифторфенил)фузидовая кислота (соединение 143),
ацетоксиметиловый сложный эфир 3-дезокси-3β,24-дибромфузидовой кислоты (соединение 144),
24-бром-16-деацетокси-16β-этилтиофузидовая кислота (соединение 146),
24-бром-16-деацетокси-16β-этилсульфинилфузидовая кислота (соединение 147),
24-бром-16-деацетокси-16β-аллиллтиофузидовая кислота (соединение 148),
24-бром-16-деацетокси-16β-(1-пентилтио)фузидовая кислота (соединение 149),
24-бром-16-деацетокси-16β-(1-пентилсульфинил)фузидовая кислота (соединение 150),
24-бром-16-деацетокси-16β-(2-метил-1-бутилтио)фузидовая кислота (соединение 151),
24-бром-16-деацетокси-16β-(2-метил-1-бутилсульфинил)фузидовая кислота (соединение 152),
24-бром-16-деацетокси-16β-(3-метил-1-бутилтио)фузидовая кислота (соединение 153),
24-бром-16-деацетокси-16β-(3-метил-1-бутилсульфинил)фузидовая кислота (соединение 154),
24-бром-16-деацетокси-16β-циклопентилтиофузидовая кислота (соединение 155),
24-бром-16-деацетокси-16β-(2,2,2-тритфорэтилтио)фузидовая кислота (соединение 156),
24-бром-16-деацетокси-16β-(2-гидрокиэтилтио)фузидовая кислота (соединение 157),
24-бром-16-деацетокси-16β-бензилтиофузидовая кислота (соединение 158),
24-бром-16-деацетокси-16β-бензилсульфинилфузидовая кислота (соединение 159),
24-бром-16-деацетокси-16β-(2-фурилметилтио)фузидовая кислота (соединение 160),
24-бром-16-деацетокси-16β-фенилтиофузидовая кислота (соединение 161),
24-бром-16-деацетокси-16β-бензоилтиофузидовая кислота (соединение 162),
24-бром-16-деацетокси-16β-изопропоксифузидовая кислота (соединение 163),
24-бром-16-деацетокси-16β-(2-фторэтокси)фузидовая кислота (соединение 164),
24-бром-16-деацетокси-16β-(2-метоксиэтокси)фузидовая кислота (соединение 165),
24-(транс-1-гексен-1-ил)фузидовая кислота (соединение 166),
24-(транс-1-бутен-3,3-диметил-1-ил)фузидовая кислота (соединение 167),
24-(транс-1-нонен-1-ил)фузидовая кислота (соединение 168),
24-(транс-5-хлор-1-пентен-1-ил)фузидовая кислота (соединение 169),
24-(транс-2-фенил-1-винил)фузидовая кислота (соединение 170),
24-(2-фенил-1-этил)фузидовая кислота (соединение 171),
24-(4-н-пропилфенил)фузидовая кислота (соединение 172),
24-(4-винилфенил)фузидовая кислота (соединение 173),
24-(4-трет-бутилфенил)фузидовая кислота (соединение 174),
24-(4-цианофенил)фузидовая кислота (соединение 175),
24-(3-бифенил)фузидовая кислота (соединение 176),
24-(4-(трифторметил)фенил)фузидовая кислота (соединение 177),
24-(4-метоксифенил)фузидовая кислота (соединение 178),
24-(3-цианофенил)фузидовая кислота (соединение 179),
24-(2-метоксифенил)фузидовая кислота (соединение 180),
24-(3-нитрофенил)фузидовая кислота (соединение 181),
24-(3-бромфенил)фузидовая кислота (соединение 182),
24-(4-(метилтио)фенил)фузидовая кислота (соединение 183),
24-(2-нафтил)фузидовая кислота (соединение 184),
24-(3,5-бис-(трифторметил)фенил)фузидовая кислота (соединение 185),
24-(3,4-диметоксифенил)фузидовая кислота (соединение 186),
24-(3,5-дибромфенил)фузидовая кислота (соединение 187),
холиновая соль 24-бромфузидовой кислоты (соединение 188),
L-аргининовая соль 24-бромфузидовой кислоты (соединение 189),
2-(диметиламино)этанольная соль 24-бромфузидовой кислоты (соединение 190),
4-(2-гидроксиэтил)морфолиновая соль 24-бромфузидовой кислоты (соединение 191),
L-лизиновая соль 24-бромфузидовой кислоты (соединение 192),
N-(2-гидроксиэтил)пирролидиновая соль 24-бромфузидовой кислоты (соединение 193),
этаноламиновая соль 24-бромфузидовой кислоты (соединение 194),
калиевая соль 24-бромфузидовой кислоты (соединение 195),
тетрабутиламмониевая соль 24-бромфузидовой кислоты (соединение 196),
бензилтриметиламмониевая соль 24-бромфузидовой кислоты (соединение 197),
цетилтриметиламмониевая соль 24-бромфузидовой кислоты (соединение 198),
тетраметиламмониевая соль 24-бромфузидовой кислоты (соединение 199),
тетрапропиламмониевая соль 24-бромфузидовой кислоты (соединение 300),
трис(гидроксиметил)аминометановая соль 24-бромфузидовой кислоты (соединение 301),
N-метил-D-глюкаминовая соль 24-бромфузидовой кислоты (соединение 302),
серебряная соль 24-бромфузидовой кислоты (соединение 303),
бензетониевая соль 24-бромфузидовой кислоты (соединение 304),
триэтаноламиновая соль 24-бромфузидовой кислоты (соединение 305),
пивалоилоксиметиловый сложный эфир 24-(транс-1-гексен-1-ил)фузидовой кислоты (соединение 306),
пивалоилоксиметиловый сложный эфир 24-(транс-1-бутен-3,3-диметил-1-ил)фузидовой кислоты (соединение 307),
пивалоилоксиметиловый сложный эфир 24-(транс-1-нонен-1-ил)фузидовой кислоты (соединение 308),
пивалоилоксиметиловый сложный эфир 24-(транс-5-хлор-1-пентен-1-ил)фузидовой кислоты (соединение 309),
пивалоилоксиметиловый сложный эфир 24-(транс-2-фенил-1-винил)фузидовой кислоты (соединение 310),
пивалоилоксиметиловый сложный эфир 24-(2-фенил-1-этил)фузидовой кислоты (соединение 311),
пивалоилоксиметиловый сложный эфир 24-(4-н-пропилфенил)фузидовой кислоты (соединение 312),
пивалоилоксиметиловый сложный эфир 24-(4-винилфенил)фузидовой кислоты (соединение 313),
пивалоилоксиметиловый сложный эфир 24-(4-трет-бутилфенил)фузидовой кислоты (соединение 314),
пивалоилоксиметиловый сложный эфир 24-(4-цианофенил)фузидовой кислоты (соединение 315),
пивалоилоксиметиловый сложный эфир 24-(3-бифенил)фузидовой кислоты (соединение 316),
пивалоилоксиметиловый сложный эфир 24-(4-(трифторметил)фенил)фузидовой кислоты (соединение 317),
пивалоилоксиметиловый сложный эфир 24-(4-метоксифенил)фузидовой кислоты (соединение 318),
пивалоилоксиметиловый сложный эфир 24-(3-цианофенил)фузидовой кислоты (соединение 319),
пивалоилоксиметиловый сложный эфир 24-(2-метоксифенил)фузидовой кислоты (соединение 320),
пивалоилоксиметиловый сложный эфир 24-(3-нитрофенил)фузидовой кислоты (соединение 321),
пивалоилоксиметиловый сложный эфир 24-(3-бромфенил)фузидовой кислоты (соединение 322),
пивалоилоксиметиловый сложный эфир 24-(4-(метилтио)фенил)фузидовой кислоты (соединение 323),
пивалоилоксиметиловый сложный эфир 24-(2-нафтил)фузидовой кислоты (соединение 324),
пивалоилоксиметиловый сложный эфир 24-(3,5-бис-(трифторметил)фенил)фузидовой кислоты (соединение 325),
пивалоилоксиметиловый сложный эфир 24-(3,4-диметоксифенил)фузидовой кислоты (соединение 326) и
пивалоилоксиметиловый сложный эфир 24-(3,5-дибромфенил)фузидовой кислоты (соединение 327).17. The compound according to claim 1, which is selected from the group consisting of such compounds as
24-trifluoromethylfusidic acid sodium salt (compound 101),
pivaloyloxymethyl ester of 24-trifluoromethylfusidic acid (compound 102),
24-chlorofusidic acid (compound 103),
pivaloyloxymethyl ester of 24-chlorofusidic acid (compound 104),
24-chlorofusidic acid sodium salt (compound 105), 24-trifluoromethylfusidic acid (compound 106),
acetoxymethyl ester of 24-bromofusidic acid (compound 107),
24-bromofusidic acid (compound 108),
24-bromofusidic acid sodium salt (compound 109),
pivaloyloxymethyl ester of 24-bromofusidic acid (compound 110),
24-bromo-16-deacetoxy-16β thioacetylfusidic acid acetoxymethyl ester (compound 111),
24-bromo-16-deacetoxy-16β-isopropylthiofusidic acid (compound 112),
24-bromo-16-deacetoxy-16β-isopropylsulfinylfusidic acid (compound 113),
24-bromo-16-deacetoxy-16β-thioacetylfusidic acid (compound 114),
24-bromo-17S, 20S-dihydrofusidic acid (compound 115), 24-bromo-16-deacetoxy-16β-ethoxyfusidic acid (compound 116),
24-bromo-16-deacetoxy-16β-ethoxyfusidic acid acetoxymethyl ester (compound 117),
24-bromo-16-deacetoxy-16β- (2 ', 2', 2'-trifluoroethoxy) fusidic acid acetoxymethyl ester (compound 118),
24-bromo-16-deacetoxy-16β- (2 ', 2', 2'-trifluoroethoxy) fusidic acid (compound 119),
acetoxymethyl ester 24-bromo-17S, 20S-fusidic acid (compound 120),
acetoxymethyl ester 24-bromo-17S, 20S-methylenefusidic acid (compound 121),
24-bromo-17S, 20S-methylenefusidic acid (compound 122),
3-deoxy-3β, 24-dibromofusidic acid (compound 123),
3α-azido-24-bromo-3-deoxyfusidic acid (compound 124),
24-iodofusidic acid (compound 125),
24-iodofusidic acid acetoxymethyl ester (compound 126),
pivaloyloxymethyl ester of 24-iodofusidic acid (compound 127),
pivaloyloxymethyl ester of 24-phenylfusidic acid (compound 136),
24-phenylfusidic acid (compound 137),
pivaloyloxymethyl ester 24- (4-bromophenyl) fusidic acid (compound 138),
24- (4-bromophenyl) fusidic acid (compound 139),
24- (4-chlorophenyl) fusidic acid pivaloyloxymethyl ester (compound 140),
24- (4-chlorophenyl) fusidic acid (compound 141),
24- (3,5-difluorophenyl) fusidic acid pivaloyloxymethyl ester (compound 142),
24- (3,5-difluorophenyl) fusidic acid (compound 143),
3-deoxy-3β, 24-dibromofusidic acid acetoxymethyl ester (compound 144),
24-bromo-16-deacetoxy-16β-ethylthiofusidic acid (compound 146),
24-bromo-16-deacetoxy-16β-ethylsulfinylfusidic acid (compound 147),
24-bromo-16-deacetoxy-16β-allyllthiofusidic acid (compound 148),
24-bromo-16-deacetoxy-16β- (1-pentylthio) fusidic acid (compound 149),
24-bromo-16-deacetoxy-16β- (1-pentylsulfinyl) fusidic acid (compound 150),
24-bromo-16-deacetoxy-16β- (2-methyl-1-butylthio) fusidic acid (compound 151),
24-bromo-16-deacetoxy-16β- (2-methyl-1-butylsulfinyl) fusidic acid (compound 152),
24-bromo-16-deacetoxy-16β- (3-methyl-1-butylthio) fusidic acid (compound 153),
24-bromo-16-deacetoxy-16β- (3-methyl-1-butylsulfinyl) fusidic acid (compound 154),
24-bromo-16-deacetoxy-16β-cyclopentylthiofusidic acid (compound 155),
24-bromo-16-deacetoxy-16β- (2,2,2-tritfortoethylthio) fusidic acid (compound 156),
24-bromo-16-deacetoxy-16β- (2-hydroxyethylthio) fusidic acid (compound 157),
24-bromo-16-deacetoxy-16β-benzylthiofusidic acid (compound 158),
24-bromo-16-deacetoxy-16β-benzylsulfinylfusidic acid (compound 159),
24-bromo-16-deacetoxy-16β- (2-furylmethylthio) fusidic acid (compound 160),
24-bromo-16-deacetoxy-16β-phenylthiofusidic acid (compound 161),
24-bromo-16-deacetoxy-16β-benzoylthiofusidic acid (compound 162),
24-bromo-16-deacetoxy-16β-isopropoxyfusidic acid (compound 163),
24-bromo-16-deacetoxy-16β- (2-fluoroethoxy) fusidic acid (compound 164),
24-bromo-16-deacetoxy-16β- (2-methoxyethoxy) fusidic acid (compound 165),
24- (trans-1-hexen-1-yl) fusidic acid (compound 166),
24- (trans-1-butene-3,3-dimethyl-1-yl) fusidic acid (compound 167),
24- (trans-1-nonen-1-yl) fusidic acid (compound 168),
24- (trans-5-chloro-1-penten-1-yl) fusidic acid (compound 169),
24- (trans-2-phenyl-1-vinyl) fusidic acid (compound 170),
24- (2-phenyl-1-ethyl) fusidic acid (compound 171),
24- (4-n-propylphenyl) fusidic acid (compound 172),
24- (4-vinylphenyl) fusidic acid (compound 173),
24- (4-tert-butylphenyl) fusidic acid (compound 174),
24- (4-cyanophenyl) fusidic acid (compound 175),
24- (3-biphenyl) fusidic acid (compound 176),
24- (4- (trifluoromethyl) phenyl) fusidic acid (compound 177),
24- (4-methoxyphenyl) fusidic acid (compound 178),
24- (3-cyanophenyl) fusidic acid (compound 179),
24- (2-methoxyphenyl) fusidic acid (compound 180),
24- (3-nitrophenyl) fusidic acid (compound 181),
24- (3-bromophenyl) fusidic acid (compound 182),
24- (4- (methylthio) phenyl) fusidic acid (compound 183),
24- (2-naphthyl) fusidic acid (compound 184),
24- (3,5-bis- (trifluoromethyl) phenyl) fusidic acid (compound 185),
24- (3,4-dimethoxyphenyl) fusidic acid (compound 186),
24- (3,5-dibromophenyl) fusidic acid (compound 187),
24-bromofusidic acid choline salt (compound 188),
L-arginine salt of 24-bromofusidic acid (compound 189),
2- (dimethylamino) ethanol salt of 24-bromofusidic acid (compound 190),
4- (2-hydroxyethyl) morpholine salt of 24-bromofusidic acid (compound 191),
L-lysine salt of 24-bromofusidic acid (compound 192),
N- (2-hydroxyethyl) pyrrolidine salt of 24-bromofusidic acid (compound 193),
ethanolamine salt of 24-bromofusidic acid (compound 194),
potassium salt of 24-bromofusidic acid (compound 195),
tetrabutylammonium salt of 24-bromofusidic acid (compound 196),
benzyltrimethylammonium salt of 24-bromofusidic acid (compound 197),
cetyltrimethylammonium salt of 24-bromofusidic acid (compound 198),
tetramethylammonium salt of 24-bromofusidic acid (compound 199),
tetrapropylammonium salt of 24-bromofusidic acid (compound 300),
tris (hydroxymethyl) aminomethane salt of 24-bromofusidic acid (compound 301),
N-methyl-D-glucamine salt of 24-bromofusidic acid (compound 302),
silver salt of 24-bromofusidic acid (compound 303),
benzethonium salt of 24-bromofusidic acid (compound 304),
triethanolamine salt of 24-bromofusidic acid (compound 305),
pivaloyloxymethyl ester 24- (trans-1-hexen-1-yl) fusidic acid (compound 306),
24- (trans-1-buten-3,3-dimethyl-1-yl) fusidic acid pivaloyloxymethyl ester (compound 307),
pivaloyloxymethyl ester 24- (trans-1-nonen-1-yl) fusidic acid (compound 308),
24- (trans-5-chloro-1-penten-1-yl) fusidic acid pivaloyloxymethyl ester (compound 309),
pivaloyloxymethyl ester 24- (trans-2-phenyl-1-vinyl) fusidic acid (compound 310),
pivaloyloxymethyl ester of 24- (2-phenyl-1-ethyl) fusidic acid (compound 311),
24- (4-n-propylphenyl) fusidic acid pivaloyloxymethyl ester (compound 312),
24- (4-vinylphenyl) fusidic acid pivaloyloxymethyl ester (compound 313),
24- (4-tert-butylphenyl) fusidic acid pivaloyloxymethyl ester (compound 314),
24- (4-cyanophenyl) fusidic acid pivaloyloxymethyl ester (compound 315),
pivaloyloxymethyl ester 24- (3-biphenyl) fusidic acid (compound 316),
24- (4- (trifluoromethyl) phenyl) fusidic acid pivaloyloxymethyl ester (compound 317),
24- (4-methoxyphenyl) fusidic acid pivaloyloxymethyl ester (compound 318),
24- (3-cyanophenyl) fusidic acid pivaloyloxymethyl ester (compound 319),
24- (2-methoxyphenyl) fusidic acid pivaloyloxymethyl ester (compound 320),
pivaloyloxymethyl ester 24- (3-nitrophenyl) fusidic acid (compound 321),
pivaloyloxymethyl ester 24- (3-bromophenyl) fusidic acid (compound 322),
24- (4- (methylthio) phenyl) fusidic acid pivaloyloxymethyl ester (compound 323),
pivaloyloxymethyl ester of 24- (2-naphthyl) fusidic acid (compound 324),
24- (3,5-bis- (trifluoromethyl) phenyl) fusidic acid pivaloyloxymethyl ester (compound 325),
24- (3,4-dimethoxyphenyl) fusidic acid pivaloyloxymethyl ester (compound 326) and
pivaloyloxymethyl ester of 24- (3,5-dibromophenyl) fusidic acid (compound 327).
где X обозначает бром, Y и Z, оба, обозначают водород или вместе со связью С-17/С-20 образуют двойную связь между С-17 и С-20 или вместе представляют собой метилен и образуют циклопропановое кольцо в сочетании с С-17 и С-20; А обозначает О, S или S(O);
В обозначает С1-6алкил, необязательно замещенный одним или более галогенами или гидрокси, С2-6алкенилом, фенилом, С1-С4гетероарилом или C1-6алкокси, С2-6алкенил, С1-6ацил, фенил или бензоил;
Q1 обозначает -(СНОН)-, или -(CHW)-, где W обозначает галоген или азидо;
Q2 обозначает -(СНОН)-;
включающий:
(а) растворение фузидовой кислоты или подходящего аналога фузидовой кислоты в подходящем органическом растворителе с последующей обработкой бромом с получением 24,25-дибромного промежуточного соединения общей структуры Ib:
где X и X' обозначают бром, R обозначает водород, связь между С-24 и С-25 представляет собой одинарную связь и Y, Z, А, В, Q1 и Q2 определены выше;
(b) обработку раствора 24,25-дибромного промежуточного соединения в подходящем растворителе в присутствии подходящего основания с получением дегидробромированного соединения формулы Ia в виде соли; и
(c) контактирование соли, образованной на стадии (b), с кислотой с получением соединения формулы Ia в виде свободной кислоты.30. A method of obtaining a compound of formula Ia
where X is bromo, Y and Z are both hydrogen or, together with the C-17 / C-20 bond, form a double bond between C-17 and C-20 or together represent methylene and form a cyclopropane ring in combination with C-17 and C-20; A is O, S or S (O);
B is C 1-6 alkyl optionally substituted with one or more halogens or hydroxy, C 2-6 alkenyl, phenyl, C 1 -C 4 heteroaryl or C 1-6 alkoxy, C 2-6 alkenyl, C 1-6 acyl, phenyl or benzoyl;
Q 1 is - (CHOH) -, or - (CHW) -, where W is halogen or azido;
Q 2 is - (CHOH) -;
including:
(a) dissolving fusidic acid or a suitable fusidic acid analog in a suitable organic solvent, followed by bromine treatment to give a 24.25-dibromic intermediate of general structure Ib:
where X and X 'are bromo, R is hydrogen, the bond between C-24 and C-25 is a single bond and Y, Z, A, B, Q 1 and Q 2 are as defined above;
(b) treating a solution of the 24.25-dibromo intermediate in a suitable solvent in the presence of a suitable base to give a dehydrobrominated compound of formula Ia as a salt; and
(c) contacting the salt formed in step (b) with an acid to give a compound of formula Ia as a free acid.
где X и X' обозначают бром, R обозначает водород, связь между С-24 и С-25 представляет собой одинарную связь, Y и Z вместе со связью С-17/С-20 образуют двойную связь между С-17 и С-20; А обозначает О; В обозначает С1-6ацил; Q1 и Q2 независимо обозначают -(СНОН)-. 31. The compound of General structure Ib;
where X and X 'are bromo, R is hydrogen, the bond between C-24 and C-25 is a single bond, Y and Z together with the C-17 / C-20 bond form a double bond between C-17 and C-20 ; A is O; B is C 1-6 acyl; Q 1 and Q 2 independently represent - (CHOH) -.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DKPA200301080 | 2003-07-16 | ||
| DKPA200301080 | 2003-07-16 | ||
| US48760903P | 2003-07-17 | 2003-07-17 | |
| US60/487,609 | 2003-07-17 | ||
| DKPA200301486 | 2003-10-09 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2006104712A RU2006104712A (en) | 2006-06-27 |
| RU2353622C2 true RU2353622C2 (en) | 2009-04-27 |
Family
ID=36714580
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2006104712/04A RU2353622C2 (en) | 2003-07-16 | 2004-07-09 | Novel fusidic acid derivatives |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU2353622C2 (en) |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2477316C1 (en) * | 2011-12-29 | 2013-03-10 | Учреждение Российской академии наук Институт экологии и генетики микроорганизмов Уральского отделения РАН | Biocatalytic method to produce (r)-phenylmethyl sulfoxide |
| RU2726122C1 (en) * | 2019-04-01 | 2020-07-09 | Федеральное государственное бюджетное научное учреждение Уфимский федеральный исследовательский центр Российской академии наук | (2z)-2-[(4α, 5α, 8α, 9β, 13α, 14β, 16β)-16-(acetyloxy)-3(z),11(e)-bis (hydroxyimino)-4,8,10,14-tetramethylgonane-17-ylidene]-6-methylhept-5-enoic acid, method of producing and antimicrobial properties |
| RU2726196C1 (en) * | 2019-10-08 | 2020-07-09 | Федеральное государственное бюджетное научное учреждение Уфимский федеральный исследовательский центр Российской академии наук | N,n'-bis(3-aminopropyl)butane-1,4-diamino derivatives of fusidic acid, having a wide spectrum of antimicrobial activity |
| RU2746947C2 (en) * | 2019-10-08 | 2021-04-22 | Федеральное государственное бюджетное научное учреждение Уфимский федеральный исследовательский центр Российской академии наук | New naphtho[2,1-b]carbazol derivatives of fusidic acid, method of synthesis and anti-microbial properties |
-
2004
- 2004-07-09 RU RU2006104712/04A patent/RU2353622C2/en not_active IP Right Cessation
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2477316C1 (en) * | 2011-12-29 | 2013-03-10 | Учреждение Российской академии наук Институт экологии и генетики микроорганизмов Уральского отделения РАН | Biocatalytic method to produce (r)-phenylmethyl sulfoxide |
| RU2726122C1 (en) * | 2019-04-01 | 2020-07-09 | Федеральное государственное бюджетное научное учреждение Уфимский федеральный исследовательский центр Российской академии наук | (2z)-2-[(4α, 5α, 8α, 9β, 13α, 14β, 16β)-16-(acetyloxy)-3(z),11(e)-bis (hydroxyimino)-4,8,10,14-tetramethylgonane-17-ylidene]-6-methylhept-5-enoic acid, method of producing and antimicrobial properties |
| RU2726196C1 (en) * | 2019-10-08 | 2020-07-09 | Федеральное государственное бюджетное научное учреждение Уфимский федеральный исследовательский центр Российской академии наук | N,n'-bis(3-aminopropyl)butane-1,4-diamino derivatives of fusidic acid, having a wide spectrum of antimicrobial activity |
| RU2746947C2 (en) * | 2019-10-08 | 2021-04-22 | Федеральное государственное бюджетное научное учреждение Уфимский федеральный исследовательский центр Российской академии наук | New naphtho[2,1-b]carbazol derivatives of fusidic acid, method of synthesis and anti-microbial properties |
Also Published As
| Publication number | Publication date |
|---|---|
| RU2006104712A (en) | 2006-06-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP3334980B2 (en) | Novel erythromycin derivatives, their production method and their use as drugs | |
| US5583239A (en) | Antimicrobial sterol conjugates | |
| JP2001515915A (en) | 6,9-bridged erythromycin derivatives | |
| US4100276A (en) | Fusidic acid derivatives | |
| RU2353622C2 (en) | Novel fusidic acid derivatives | |
| AU2004256886B2 (en) | Novel fusidic acid derivatives | |
| US5834453A (en) | Methods for the manufacture and use of antimicrobial sterol conjugates | |
| UA81825C2 (en) | Derivatives of fusidic acid | |
| AU777352B2 (en) | Novel fusidic acid derivatives | |
| JPS6238360B2 (en) | ||
| US6673783B2 (en) | Fusidic acid derivatives | |
| KR20060091290A (en) | Novel fusidic acid derivatives | |
| US4162259A (en) | Fusidic acid derivatives | |
| AU2003226917B2 (en) | Branched polyamine steroid derivatives | |
| TW457245B (en) | Cyclic phosphites and phosphates | |
| JP2003501439A (en) | 6-O-carbamate ketolide derivative | |
| US20030087887A1 (en) | Novel fusidic acid derivatives | |
| JPS5931796A (en) | C-23-modified derivative of dmt | |
| JPS63307894A (en) | Ring-reduced macrolide antibiotic | |
| JP2004075599A (en) | Antimicrobial agent consisting essentially of steroid derivative | |
| MXPA00002335A (en) | 6,9-bridged erythromycin derivatives |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20100710 |