KR20220109443A - 면역요법 동안 가용성 cd28 수준 - Google Patents
면역요법 동안 가용성 cd28 수준 Download PDFInfo
- Publication number
- KR20220109443A KR20220109443A KR1020227022534A KR20227022534A KR20220109443A KR 20220109443 A KR20220109443 A KR 20220109443A KR 1020227022534 A KR1020227022534 A KR 1020227022534A KR 20227022534 A KR20227022534 A KR 20227022534A KR 20220109443 A KR20220109443 A KR 20220109443A
- Authority
- KR
- South Korea
- Prior art keywords
- subject
- immunotherapy
- cancer
- scd28
- time point
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
- G01N33/57484—Immunoassay; Biospecific binding assay; Materials therefor for cancer involving compounds serving as markers for tumor, cancer, neoplasia, e.g. cellular determinants, receptors, heat shock/stress proteins, A-protein, oligosaccharides, metabolites
- G01N33/57488—Immunoassay; Biospecific binding assay; Materials therefor for cancer involving compounds serving as markers for tumor, cancer, neoplasia, e.g. cellular determinants, receptors, heat shock/stress proteins, A-protein, oligosaccharides, metabolites involving compounds identifable in body fluids
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/705—Assays involving receptors, cell surface antigens or cell surface determinants
- G01N2333/70503—Immunoglobulin superfamily, e.g. VCAMs, PECAM, LFA-3
- G01N2333/70521—CD28, CD152
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/52—Predicting or monitoring the response to treatment, e.g. for selection of therapy based on assay results in personalised medicine; Prognosis
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/54—Determining the risk of relapse
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Immunology (AREA)
- Engineering & Computer Science (AREA)
- Molecular Biology (AREA)
- Cell Biology (AREA)
- Chemical & Material Sciences (AREA)
- Biomedical Technology (AREA)
- Urology & Nephrology (AREA)
- Hematology (AREA)
- Food Science & Technology (AREA)
- General Health & Medical Sciences (AREA)
- Biotechnology (AREA)
- Oncology (AREA)
- Hospice & Palliative Care (AREA)
- Medicinal Chemistry (AREA)
- Physics & Mathematics (AREA)
- Analytical Chemistry (AREA)
- Biochemistry (AREA)
- Microbiology (AREA)
- General Physics & Mathematics (AREA)
- Pathology (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Investigating Or Analysing Biological Materials (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
Abstract
대상체에서 가용성 CD28 수준을 측정하는 것을 포함하는 암 재발을 진단하고 예측하는 방법이 제공되며, 여기서 가용성 CD28의 증가는 암 재발 또는 임박한 암 재발을 나타낸다. 감소가 반응을 나타내고, 증가는 반응의 결핍을 나타내는 적어도 2개의 시점에서 PD-1/PD-L1 기반 면역요법을 받고 있는 대상체에서 sCD28 수준을 측정하는 것을 포함하는, 면역요법에 대한 반응 결정을 필요로 하는 대상체에서 PD-1/PD-L1 기반 면역요법에 대한 반응을 결정하는 방법이 또한 제공된다.
Description
관련 출원에 대한 교차 참조
본 출원은 2019년 12월 2일자로 출원된 미국 가특허 출원 번호 62/942,276의 우선권의 이익을 주장하며, 그 내용은 모두 그 전체가 참고로 본 명세서에 통합된다.
발명의 분야
본 발명은 면역 조절 및 면역요법의 분야에 있다.
일부 공동-자극 분자는 여러 생리학적 형태를 갖는 것으로 알려져 있다. 막-결합 형태와 함께 순수 면역 세포에서 발현되어, T 세포 생물학의 복잡성을 증가시키는 가용성 형태가 기술되었다. CD28의 가용성 형태(sCD28)는 암에 대한 면역 반응을 억제하는 것과 관련되어 있다. 더욱이, sCD28은 PD-1 및 PD-L1 기반 면역요법의 효과를 억제하는 것으로 입증되었다. sCD28의 존재가 면역요법에 대한 반응의 이질성에 기여하는 요인일 수 있다는 가설이 세워졌다.
그러나, 면역요법의 과정 동안 sCD28의 상태 및 재발에서 그 가능한 역할은 조사되지 않았다. 더욱이, sCD28 수준이 면역치료적 처리에 불응하는 환자에서 가질 수 있는 역할은 알려져 있지 않다.
발명의 요약
본 발명은 대상체에서 암 재발을 진단하고 대상체에서 임박한 암 재발을 예측하는 방법을 제공한다. 방법은 대상체에서 가용성 CD28(sCD28) 수준을 측정하는 것을 포함하며, 여기서 sCD28 수준의 증가는 대상체가 재발 중에 있거나 재발이 임박했음을 나타낸다. 감소가 반응을 나타내고, 증가는 반응의 결핍을 나타내는 적어도 2개의 시점에서 PD-1/PD-L1 기반 면역요법을 받고 있는 대상체에서 sCD28 수준을 측정하는 것을 포함하는, PD-1/PD-L1 기반 면역요법에 대한 반응 결정을 필요로 하는 대상체에서 PD-1/PD-L1 기반 면역요법에 대한 반응을 결정하는 방법이 또한 제공된다.
제1 양태에 따르면, 암을 앓고 있는 대상체에서 PD-1/PD-L1 기반 면역요법에 대한 반응을 결정하는 방법이 제공되며, 상기 방법은 적어도 2개의 시점에서 대상체에서 sCD28 수준을 측정하는 것을 포함하며 여기서 이들 시점 중 적어도 하나는 PD-1/PD-L1 기반 면역요법의 개시 후이고, 여기서 PD-1/PD-L1 기반 면역요법의 개시 후 제1 시점부터 제2 시점까지 sCD28 수준의 증가는 대상체가 면역요법에 대한 반응자가 아님을 나타내고 PD-1/PD-L1 기반 면역요법의 개시 후 제1 시점부터 제2 시점까지 sCD28 수준의 감소 또는 무 변화는 대상체가 면역요법에 대한 반응자임을 나타내며, 이에 의해 대상체에서 PD-1/PD-L1 기반 면역요법에 대한 반응을 결정한다.
일부 실시형태에 따르면, 제1 시점은 면역요법의 개시 전 또는 개시 시점이다.
일부 실시형태에 따르면, 제1 시점은 면역요법의 개시 후이다.
일부 실시형태에 따르면, 제2 시점은 제1 시점 후 적어도 6주이다.
일부 실시형태에 따르면, 제2 시점은 제1 시점 후 최대 7주이다.
일부 실시예에 따르면,
a. 제1 시점은 면역요법의 개시 시 또는 그 전이고, 제2 시점은 면역요법의 개시 후 7주 또는 13주이거나; 또는
b. 제1 시점은 면역요법의 개시 후 7주이고 제2 시점은 면역요법의 개시 후 13주이다.
일부 실시형태에 따르면, PD-1/PD-L1 기반 면역요법의 개시 후 제1 시점부터 제2 시점까지 sCD28 수준의 감소는 대상체가 면역요법에 대한 반응자임을 나타낸다.
일부 실시형태에 따르면, 감소는 적어도 1ng/ml sCD28의 감소이다.
또 다른 양태에 따르면, 암 재발 진단을 필요로 하는 대상체에서 암 재발을 진단하는 방법이 제공되며, 상기 방법은 대상체에서 가용성 CD28(sCD28) 수준을 측정하는 것을 포함하며, 여기서 대상체에서 sCD28 수준의 증가는 암 재발을 나타내며, 이에 의해 대상체에서 암 재발을 진단한다.
일부 실시형태에 따르면, 본 발명의 방법은 다음 중 적어도 하나를 추가로 포함한다:
a. 반응자가 아닌 대상체에 대해 면역요법 중단;
b. 비-반응자인 대상체에 대해 상이한 면역요법 투여;
c. 반응자인 대상체에 대해 상기 PD-1/PD-L1 기반 면역요법의 계속 투여; 및
d. 반응자인 대상체에 대해 투여되는 PD-1/PD-L1 기반 면역요법의 용량 증가.
또 다른 양태에 따르면, 암 재발 예측을 필요로 하는 대상체에서 암 재발을 예측하는 방법이 제공되며, 상기 방법은 대상체에서 가용성 CD28(sCD28) 수준을 측정하는 것을 포함하며, 여기서 대상체에서 sCD28 수준의 증가는 임박한 암 재발을 나타내며, 이에 의해 대상체에서 암 재발을 예측한다.
일부 실시형태에 따르면, 대상체는 암을 앓고 있고 암은 관해 상태에 있다.
일부 실시형태에 따르면, 대상체는 이전에 암을 앓았고 현재 암이 없다.
일부 실시형태에 따르면, 대상체는 면역요법을 받았거나 받고 있다.
일부 실시형태에 따르면, 면역요법은 PD-1, PD-L1 및/또는 CD80 기반 면역요법이다.
일부 실시형태에 따르면, 증가는 재발 전 대상체에서의 sCD28 수준과 비교된다.
일부 실시형태에 따르면, 증가는 미리결정된 역치와 비교된다.
일부 실시형태에 따르면, 증가는 적어도 50%의 증가이다.
일부 실시형태에 따르면, 증가는 적어도 6ng/mL sCD28로의 증가이다.
일부 실시형태에 따르면, 증가는 적어도 1ng/ml sCD28 증가이다.
일부 실시형태에 따르면, 측정은 대상체로부터 샘플을 수득하고 샘플에서 sCD28 수준을 측정하는 것을 포함한다.
일부 실시형태에 따르면, 샘플은 혈액 샘플이다.
일부 실시형태에 따르면, 측정은 복수의(a plurality of) 시점에 측정하는 것을 포함하며, 여기서 적어도 하나의 시점은 대상체가 관해 또는 암이 없는 것으로 공지된 시점이고, 여기서 적어도 하나의 시점은 대상체가 재발할 위험이 있는 시점이다.
일부 실시형태에 따르면, 관해는 요법에 대한 부분 반응 및 완전 반응을 포함한다.
일부 실시형태에 따르면, 대상체가 관해 또는 암이 없는 것으로 알려진 시점에서 sCD28 수준은 5ng/mL 미만이다.
일부 실시형태에 따르면, 방법을 수행하기 전의 대상체는 6ng/mL 미만의 혈액 sCD28 수준을 갖는다.
일부 실시형태에 따르면, 암은 피부암, 요로상피암, 폐암 및 신장암으로부터 선택된다.
일부 실시형태에 따르면, 암은 흑색종 및 요로상피암종으로부터 선택된다.
일부 실시형태에 따르면, 임박(imminent)은 다음(next) 20주 이내이다.
일부 실시형태에 따르면, 발명의 방법은 암 재발로 진단되거나 예측된 대상체에게 또 다른 면역요법을 투여하는 것을 추가로 포함한다.
일부 실시형태에 따르면, 발명의 방법은 상기 면역요법에 대해 비-반응자인 것으로 결정된 대상에게 또 다른 면역요법을 투여하는 것을 추가로 포함한다.
일부 실시형태에 따르면, 면역요법은 하기로부터 선택된다:
a. 체크포인트 억제제;
b. 키메라 항원 수용체(CAR) 기반 요법; 및
c. 암 백신.
일부 실시형태에 따르면, 체크포인트 억제제는 PD-1 및/또는 PD-L1 기반 면역요법이다.
본 발명의 추가 실시형태 및 적용가능성의 전체 범주는 이하에 주어진 상세한 설명으로부터 명백해질 것이다. 그러나, 발명의 사상 및 범주 내의 다양한 변경 및 변형이 이 상세한 설명으로부터 당업자에게 명백해질 것이기 때문에, 상세한 설명 및 특정 실시예는 발명의 바람직한 실시예를 나타내면서 단지 예시의 목적으로 제공되는 것으로 이해되어야 한다.
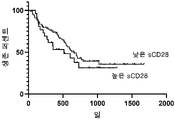
도 1. 항-PD1 요법을 받고 있는 흑색종 환자의 생존 차트. 치료의 개시 전 sCD28의 낮은 수치를 갖는 환자는 sCD28의 높은 수치를 갖는 환자보다 평균 생존 기간이 더 길었다.
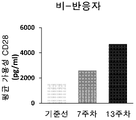
도 2a-2d. (2a) 면역요법의 몇 주의 경과에 걸쳐 17명의 환자(9명의 반응자 및 8명의 비-반응자)에서 sCD28 수준의 선 그래프. (2b-2c) 3개의 시점에서 면역요법에 대한 (2b) 비-반응자 및 (2c) 반응자에서 평균 sCD28 수준의 막대 그래프. (2d) 면역요법의 개시 전의 초기 판독값에서부터 개시 후 2개의 시점까지 sCD28 발현에서 절대 변화의 막대 그래프. *는 Pval=0.06이고, **는 Signed Rank 테스트에 따른 Pval<0.05이다.
도 3 면역요법에 반응하고 그 다음에 암이 재발한 2명의 환자로부터의 sCD28 수준의 선 그래프. CR은 완전 반응이고; PR은 부분 반응이고; PD는 진행성 질환이고; SD는 안정한 질환이다.
도 2a-2d. (2a) 면역요법의 몇 주의 경과에 걸쳐 17명의 환자(9명의 반응자 및 8명의 비-반응자)에서 sCD28 수준의 선 그래프. (2b-2c) 3개의 시점에서 면역요법에 대한 (2b) 비-반응자 및 (2c) 반응자에서 평균 sCD28 수준의 막대 그래프. (2d) 면역요법의 개시 전의 초기 판독값에서부터 개시 후 2개의 시점까지 sCD28 발현에서 절대 변화의 막대 그래프. *는 Pval=0.06이고, **는 Signed Rank 테스트에 따른 Pval<0.05이다.
도 3 면역요법에 반응하고 그 다음에 암이 재발한 2명의 환자로부터의 sCD28 수준의 선 그래프. CR은 완전 반응이고; PR은 부분 반응이고; PD는 진행성 질환이고; SD는 안정한 질환이다.
일부 실시형태에서, 본 발명은 대상체에서 가용성 CD28(sCD28 수준)을 측정하는 것을 포함하는, 암에 걸렸거나 여전히 앓고 있는 대상체에서 암 재발을 진단 및 예측하는 방법을 제공하며, 여기서 sCD28의 증가는 암 재발 또는 임박한 암 재발을 나타낸다. 본 발명은 면역요법으로 치료하는 과정 동안 sCD28 수준에서의 변화를 측정함에 의해 PD-1/PD-L1 기반 면역요법에 대한 반응을 결정하는 방법을 추가로 제공한다. 발명은 면역요법에 반응했던 대상체에서 sCD28 수준에서의 스파이크가 개시되었거나 개시하려는 재발의 마커로 작용한다는 놀라운 발견에 기초한다. 이는 추가로 sCD28 수준이 면역요법에 반응하지 않는 대상체의 증가하고 반응하는 대상체에서 변화하지 않거나 또는 감소한다는 놀라운 발견에 기초한다.
제1 양태에 의해, 암 재발 진단을 필요로 하는 대상체에서 암 재발을 진단하는 방법이 제공되며, 상기 방법은 대상체에서 가용성 CD28(sCD28) 수준을 측정하는 것을 포함하며, 여기서 대상체에서 sCD28 수준의 증가는 암 재발을 나타내고, 이에 의해 암 재발을 진단한다.
또 다른 양태에 의해, 암 재발 예측을 필요로 하는 대상체에서 암 재발을 예측하는 방법이 제공되며, 상기 방법은 대상체에서 sCD28 수준을 측정하는 것을 포함하며, 여기서 대상체에서 sCD28 수준의 증가는 암 재발이 도래한다는 것을 나타낸다.
또 다른 양태에 의해, PD-1/PD-L1 기반 면역요법에 대한 반응 결정을 필요로 하는 대상체에서 PD-1/PD-L1 기반 면역요법에 대한 반응을 결정하는 방법이 제공되며, 상기 방법은 적어도 2개의 시점에서 대상체에서 sCD28 수준을 측정하는 것을 포함하며, 여기서 sCD28 수준의 증가는 대상체가 면역요법에 반응하지 않거나 반응자가 아님을 나타내고 sCD28 수준의 감소 또는 무 변화는 대상체가 면역요법에 반응하거나 반응자임을 나타내며, 이에 의해 PD-1/PD-L1 기반 면역요법에 대한 반응을 결정한다.
일부 실시형태에서, CD28은 포유동물 CD28이다. 일부 실시형태에서 CD28은 인간 CD28이다. 일부 실시형태에서, 인간 CD28은 아미노산 서열: MLRLLLALNLFPSIQVTGNKILVKQSPMLVAYDNAVNLSCKYSYNLFSREFRASLHKGLDSAVEVCVVYGNYSQQLQVYSKTGFNCDGKLGNESVTFYLQNLYVNQTDIYFCKIEVMYPPPYLDNEKSNGTIIHVKGKHLCPSPLFPGPSKPFWVLVVVGGVLACYSLLVTVAFIIFWVRSKRSRLLHSDYMNMTPRRPGPTRKHYQPYAPPRDFAAYRS (서열번호: 1)을 포함하거나 이로 이루어진다. 일부 실시형태에서, 성숙한 CD28은 신호 펩티드를 결하고 서열: NKILVKQSPMLVAYDNAVNLSCKYSYNLFSREFRASLHKGLDSAVEVCVVYGNYSQQLQVYSKTGFNCDGKLGNESVTFYLQNLYVNQTDIYFCKIEVMYPPPYLDNEKSNGTIIHVKGKHLCPSPLFPGPSKPFWVLVVVGGVLACYSLLVTVAFIIFWVRSKRSRLLHSDYMNMTPRRPGPTRKHYQPYAPPRDFAAYRS (서열번호: 2)을 포함한다.
일부 실시형태에서, 전장 인간 CD28을 코딩하는 DNA 코딩 서열은 서열: ATGCTCAGGCTGCTCTTGGCTCTCAACTTATTCCCTTCAATTCAAGTAACAGGAAACAAGATTTTGGTGAAGCAGTCGCCCATGCTTGTAGCGTACGACAATGCGGTCAACCTTAGCTGCAAGTATTCCTACAATCTCTTCTCAAGGGAGTTCCGGGCATCCCTTCACAAAGGACTGGATAGTGCTGTGGAAGTCTGTGTTGTATATGGGAATTACTCCCAGCAGCTTCAGGTTTACTCAAAAACGGGGTTCAACTGTGATGGGAAATTGGGCAATGAATCAGTGACATTCTACCTCCAGAATTTGTATGTTAACCAAACAGATATTTACTTCTGCAAAATTGAAGTTATGTATCCTCCTCCTTACCTAGACAATGAGAAGAGCAATGGAACCATTATCCATGTGAAAGGGAAACACCTTTGTCCAAGTCCCCTATTTCCCGGACCTTCTAAGCCCTTTTGGGTGCTGGTGGTGGTTGGTGGAGTCCTGGCTTGCTATAGCTTGCTAGTAACAGTGGCCTTTATTATTTTCTGGGTGAGGAGTAAGAGGAGCAGGCTCCTGCACAGTGACTACATGAACATGACTCCCCGCCGCCCCGGGCCCACCCGCAAGCATTACCAGCCCTATGCCCCACCACGCGACTTCGCAGCCTATCGCTCCTGA (서열번호: 3)을 포함한다.
본 명세서에 사용된 sCD28은 막횡단 도메인을 포함하지 않고 따라서 막에 통합될 수 없는 임의의 CD28 단편 또는 변이체를 지칭한다. 일부 실시형태에서, CD28 막횡단 도메인은 아미노산 서열 FWVLVVVGGVLACYSLLVTVAFIIFWV(서열번호: 4)를 포함한다. 일부 실시형태에서, sCD28은 막 결합되지 않는다. 일부 실시형태에서, sCD28은 용액 상태이다. 일부 실시형태에서, sCD28은 혈액 내 CD28이다. 일부 실시형태에서, sCD28은 TME 내 CD28이다. 일부 실시형태에서, sCD28은 체액 내 CD28이다. 일부 실시형태에서, sCD28은 막 CD28(mCD28)로부터의 절단 생성물이다. 일부 실시형태에서, sCD28은 절단된 CD28이다. 일부 실시형태에서, sCD28은 전장 CD28의 세포질 도메인을 결한다. 일부 실시형태에서, sCD28은 이량체 sCD28이다. 일부 실시형태에서, sCD28은 단량체 sCD28이다. 일부 실시형태에서, sCD28은 CD28의 대안적 스플라이싱으로부터 발생하는 스플라이스 변이체가 아니다. 일부 실시형태에서, sCD28은 아미노산 서열: MLRLLLALNLFPSIQVTGNKILVKQSPMLVAYDNAVNLSCKYSYNLFSREFRASLHKGLDSAVEVCVVYGNYSQQLQVYSKTGFNCDGKLGNESVTFYLQNLYVNQTDIYFCKIEVMYPPPYLDNEKSNGTIIHVKGKHLCPSP (서열번호: 5)을 포함한다. 일부 실시형태에서, sCD28은 신호 펩티드를 결하고 서열: NKILVKQSPMLVAYDNAVNLSCKYSYNLFSREFRASLHKGLDSAVEVCVVYGNYSQQLQVYSKTGFNCDGKLGNESVTFYLQNLYVNQTDIYFCKIEVMYPPPYLDNEKSNGTIIHVKGKHLCPSP (서열번호: 6)을 포함한다.
일부 실시형태에서, 대상체는 이전에 암이 있었다. 일부 실시형태에서, 대상체는 여전히 암이 있다. 일부 실시형태에서, 대상체는 암을 앓고 있다. 일부 실시형태에서, 대상체는 암이 있었고 현재 암이 없다. 일부 실시형태에서, 대상체는 관해 중인 암이 있다. 일부 실시형태에서, 대상체는 부분 관해 중인 암이 있다. 일부 실시형태에서, 관해는 완전한 관해 및 부분 관해를 포함한다. 일부 실시형태에서 관해는 부분 반응 및 완전 반응을 포함한다. 일부 실시형태에서, 관해는 완전한 관해를 포함한다. 일부 실시형태에서, 관해는 부분 관해를 포함한다. 일부 실시형태에서, 대상체는 암에 대한 요법을 받았다. 일부 실시형태에서, 대상체는 암에 대한 요법을 받고 있다. 일부 실시형태에서, 요법은 면역요법이다. 일부 실시형태에서, 대상체는 요법에 대한 반응자이다. 일부 실시형태에서, 대상체는 요법에 대한 비-반응자이다. 일부 실시형태에서, 대상체는 PD-1/PD-L1 기반 면역요법을 받았다. 일부 실시형태에서, 대상체는 PD-1/PD-L1 기반 면역요법을 받고 있다.
일부 실시형태에서, 반응자는 요법에 반응하는 대상체이다. 일부 실시형태에서, 반응자는 반응하는 사람이다. 일부 실시형태에서, 반응하는 사람은 반응자이다. 일부 실시형태에서, 반응자는 요법에 대해 호의적인 반응을 갖는 대상체이다. 본 명세서에 사용된, 암 환자의 "호의적인 반응"은 요법에 의한 치료에 대한 암 환자의 "반응성"을 나타내며, 즉 면역요법에 의한 반응성 암 환자의 치료는 원하는 임상 결과 예컨대 종양 퇴행, 종양 수축 또는 종양 괴사; 면역계에 의한 항-종양 반응; 종양 재발, 종양 성장 또는 종양 전이의 예방 또는 지연을 초래할 것이다. 일부 실시형태에서, 반응은 완전 반응(CR)이다. 일부 실시형태에서, 반응은 부분 반응(PR)이다. 일부 실시형태에서, 반응은 암 퇴행이다. 일부 실시형태에서, 퇴행은 안정한 질환으로부터의 것이다. 일부 실시형태에서, 퇴행은 진행성 질환으로부터의 것이다. 일부 실시형태에서, 비-반응자는 요법에 반응하지 않는 대상체이다. 일부 실시형태에서, 비-반응자는 반응하지 않는 사람이다. 일부 실시형태에서, 반응하지 않는 사람은 비-반응자이다. 일부 실시형태에서, 비-반응자는 요법에 대해 비-호의적인 반응을 갖는 대상체이다. 본 명세서에 사용된 암 환자의 "비-호의적 반응"은 요법에 의한 치료에 대한 암 환자의 "비-반응성"을 나타내고, 따라서 요법에 의한 비-반응성 암 환자의 치료는 원하는 임상 결과 및 잠재적으로 종양 확장, 재발 및 전이와 같은 바람직하지 않은 결과로 이어지지 않을 것이다. 일부 실시형태에서, 바람직하지 않은 결과는 암 재발이다. 일부 실시형태에서, 바람직하지 않은 반응은 안정한 질환의 전개이다. 일부 실시형태에서, 바람직하지 않은 반응은 진행성 질환의 전개이다.
본 명세서에 사용된 용어 "완전 반응", "부분 반응", "안정 질환" 및 "진행성 질환"은 모두 암 및 특히 고형 병변을 평가하기 위한 평가 기준이다. 평가 중 병변을 측정하여 치료 중 비교 및 평가를 위한 근거를 제공한다. 일부 실시형태에서, 완전 반응은 치료의 과정 동안 사라진 모든 병변을 지칭한다. 일부 실시형태에서, 완전 반응은 치료의 과정 동안 사라진 모든 표적 병변을 지칭한다. 일부 실시형태에서, 부분 반응은 병변 또는 병변들의 크기의 감소를 지칭한다. 일부 실시형태에서, 감소는 가장 큰 병변의 크기이다. 일부 실시형태에서, 감소는 모든 병변의 크기의 합에서의 것이다. 일부 실시형태에서, 감소는 병변의 평균 크기에서의 것이다. 일부 실시형태에서, 크기의 감소는 적어도 10, 20, 30, 40, 또는 50%의 감소이다. 각 가능성은 발명의 별도의 실시형태를 나타낸다. 일부 실시형태에서, 크기 감소는 적어도 30%의 감소이다. 일부 실시형태에서, 감소는 병변 직경의 감소이다. 일부 실시형태에서, 안정한 질환은 병변 또는 병변들의 크기에서 유의한 감소 또는 증가가 없음을 지칭한다. 일부 실시형태에서, 진행성 질환은 병변 또는 병변들의 크기의 증가를 지칭한다. 일부 실시형태에서, 증가는 가장 큰 병변에서의 것이다. 일부 실시형태에서, 증가는 모든 병변의 크기의 합에서의 것이다. 일부 실시형태에서, 증가는 병변의 평균 크기에서의 것이다. 일부 실시형태에서, 크기의 증가는 적어도 10, 20, 30, 40, 또는 50%의 증가이다. 각 가능성은 본 발명의 별도의 실시형태를 나타낸다. 일부 실시형태에서, 크기의 증가는 적어도 20%의 증가이다.
일부 실시형태에서, 면역요법은 PD-1 및/또는 PD-L1 기반 면역요법이다. 일부 실시형태에서, 면역요법은 PD-1 기반 면역요법이다. 일부 실시형태에서, 면역요법은 PD-L1 기반 면역요법이다. 일부 실시형태에서, PD-1/PD-L1 기반 면역요법은 항-PD1 또는 항-PD-L1 항체를 투여하는 것을 포함한다. 일부 실시형태에서, 요법은 PD-1 체크포인트의 차단을 포함한다. 일부 실시형태에서, 면역요법은 대상체에게 동종이계, 동계 또는 자가 면역 세포를 투여하는 것을 포함한다. 일부 실시형태에서, 면역 세포는 T 세포이다. 일부 실시형태에서, 면역요법이 필요한 대상체는 암을 앓고 있다. 일부 실시형태에서, PD-1 기반 면역요법은 PD-L2 기반 면역요법을 포함한다. 일부 실시형태에서, PD-L1 기반 면역요법은 PD-L2 기반 면역요법을 포함한다.
일부 실시형태에서, 면역요법은 CD80 기반 면역요법이다. 일부 실시형태에서, 면역요법은 CD86 기반 면역요법이다. CD80 및 CD86 면역요법은 당업계에 잘 알려져 있고 면역 반응을 자극하기 위해 CD80/CD86 및/또는 이의 모의체, 유도체 또는 모방체를 투여하는 것을 포함한다. CD80-Fc는 현재 비-제한적인 예로 항암 면역치료제로서 임상 시험 중에 있다.
일부 실시형태에서, 면역요법은 CTLA-4 기반 면역요법이다. 일부 실시형태에서, CTLA-4 면역요법은 CTLA-4 차단을 포함한다. 일부 실시형태에서, CTLA-4 면역요법은 CTLA-4 억제제를 투여하는 것을 포함한다. 일부 실시형태에서, CTLA-4 면역요법은 항-CTLA-4 항체를 투여하는 것을 포함한다. 일부 실시형태에서, 요법은 CTLA-4 체크포인트의 차단을 포함한다. 일부 실시형태에서, 면역요법은 본 명세서에 기재된 면역요법 중 임의의 것의 조합 요법이다.
일부 실시형태에서, 대상체는 암을 앓고 있다. 일부 실시형태에서, 암은 면역요법으로 치료될 수 있는 암이다. 일부 실시형태에서, 암은 PD-1/PD-L1 요법으로 치료될 수 있는 암이다. 일부 실시형태에서, 대상체는 PD-1/PD-L1 요법을 받았다. 일부 실시형태에서, 대상체는 PD-1/PD-L1 요법에 대한 비-반응자이다. 일부 실시형태에서, 대상체는 PD-1/PD-L1 요법에 대해 순수하다. 일부 실시형태에서, 발명의 방법은 PD-1/PD-L1 요법과 함께 수행된다. 일부 실시형태에서, 발명의 방법은 PD-1/PD-L1 요법 전에 수행된다.
일부 실시형태에서, 암은 상승된 sCD28 수준을 갖는 암이다. 일부 실시형태에서, 암은 높은 sCD28 수준을 포함한다. 일부 실시형태에서, 상승된 및/또는 높은 sCD28 수준은 5, 6, 7, 8, 9, 10, 12, 14, 15, 17, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90 또는 100ng/mL인 수준 및/또는 그 초과의 수준이다. 각 가능성은 발명의 별도의 실시형태를 나타낸다. 일부 실시형태에서, 암은 높은 sCD28 수준을 포함한다. 일부 실시형태에서, 상승된 및/또는 높은 sCD28 수준은 건강한 대상체에서의 수준의 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 150, 200, 300, 400, 500, 600, 700, 800, 900, 또는 1000%인 수준 및/또는 그 초과의 수준이다. 각 가능성은 발명의 별도의 실시형태를 나타낸다. 일부 실시형태에서, 암은 유방암이 아니다. 일부 실시형태에서, 암은 흑색종, 요로상피암종, 두경부암, 비-소세포 폐암, 난소암, 신장암, 위암 및 결장직장암으로부터 선택된다. 일부 실시형태에서, 암은 흑색종, 요로상피암종, 두경부암, 비-소세포 폐암, 난소암 및 결장직장암으로부터 선택된다. 일부 실시형태에서, 암은 흑색종, 요로상피암종, 두경부암, 비-소세포폐암, 난소암, 신장암, 위암 또는 결장직장암이다. 각 가능성은 발명의 별도의 실시형태를 나타낸다. 일부 실시형태에서, 암은 흑색종 및 요로상피암종으로부터 선택된다. 일부 실시형태에서, 암은 피부암, 요로상피암, 폐암 및 신장암으로부터 선택된다. 일부 실시형태에서, 암은 피부암 및 요로상피암으로부터 선택된다.
일부 실시형태에서, sCD28은 적어도 1, 2, 3, 4, 5, 6, 7, 8, 9 또는 10개의 시점에서 측정된다. 각 가능성은 발명의 별도의 실시형태를 나타낸다. 일부 실시형태에서, sCD28은 적어도 2개의 시점에서 측정된다. 일부 실시형태에서, 적어도 2개의 시점은 제1 시점 및 제2 시점을 포함한다. 일부 실시형태에서, 하나의 시점부터 제2 시점으로의 증가가 있다. 일부 실시형태에서, 하나의 시점부터 제2 시점으로의 감소가 있다. 일부 실시형태에서, 하나의 시점부터 제2 시점으로의 변화가 없다. 일부 실시형태에서, sCD28 동역학에서의 추세가 있다. 일부 실시형태에서, 추세는 증가 또는 감소이다. 일부 실시형태에서, 증가 추세는 대상체가 요법에 반응하지 않는다는 것을 나타낸다. 일부 실시형태에서, 증가 추세는 암 재발을 나타낸다. 일부 실시형태에서, 증가 추세는 임박한 암 재발을 나타낸다.
일부 실시형태에서, 요법에 반응하는 대상체는 반응자이다. 일부 실시형태에서, 요법에 반응하지 않는 대상체는 비-반응자이다. 치료에 대한 반응은 완전 반응일 필요는 없으나 부분 반응이거나 적어도 하나의 증상의 개선에 대한 반응일 수 있다. 일부 실시형태에서, 비-반응자는 요법에 대해 양성 반응을 갖지 않는다.
일부 실시형태에서, 증가는 건강한 대상체에서 sCD28 수준과 비교된다. 일부 실시형태에서, 증가는 재발 전 대상체에서의 sCD28 수준과 비교된다. 일부 실시형태에서, 증가는 면역요법의 개시 후 대상체에서의 sCD28 수준과 비교된다. 일부 실시형태에서, 증가는 질환의 관해 후 sCD28 수준과 비교된다. 일부 실시형태에서, 증가는 미리결정된 역치와 비교된다. 일부 실시형태에서, 증가는 면역요법 개시 전의 수준과 비교된다.
일부 실시형태에서, 증가는 한 시점부터 다른 시점까지의 것이다. 일부 실시형태에서, 증가는 제1 시점부터 제2 시점까지의 것이다. 일부 실시형태에서, 증가는 대상체가 요법에 비-반응자임을 나타낸다. 일부 실시형태에서, 증가는 대상체가 요법에 반응하지 않는다는 것을 나타낸다. 일부 실시형태에서, 방법은 무 반응 환자에 대한 요법을 중단하는 것을 추가로 포함한다. 일부 실시형태에서, 방법은 무 반응 환자에 대한 용량을 증가시키는 것을 추가로 포함한다. 일부 실시형태에서, 증가는 통계적으로 유의한 증가이다.
일부 실시형태에서, 적어도 하나의 시점은 치료의 개시 시 또는 그 전이다. 일부 실시형태에서, 적어도 하나의 시점은 치료의 개시 후이다. 일부 실시형태에서, 제1 시점은 요법 전이다. 일부 실시형태에서, 제1 시점은 요법의 개시시이다. 일부 실시형태에서, 제1 시점은 관해 동안이다. 일부 실시형태에서, 제1 시점은 대상체가 암이 없는 때이다. 일부 실시형태에서, 제1 시점은 면역요법의 개시 전이다. 일부 실시형태에서, 제1 시점은 면역요법의 개시시이다. 일부 실시형태에서, 제1 시점은 면역요법 동안이다. 일부 실시형태에서, 제2 시점은 현행 측정이다. 일부 실시형태에서, 제2 시점은 시험 시점이다. 일부 실시형태에서, 제2 시점은 대상체가 재발의 위험이 있는 시점이다. 일부 실시형태에서, 제2 시점은 면역요법의 개시 후이다. 일부 실시형태에서, 제2 시점은 면역요법 동안이다. 일부 실시형태에서, 제1 시점은 면역요법의 개시 전이고 제2 시점은 면역요법의 개시 후이다. 일부 실시형태에서, 제1 및 제2 시점은 면역요법의 개시 후이다.
일부 실시형태에서, 제1 및 제2 시점은 적어도 1, 2, 3, 4, 5, 6, 또는 7주만큼 분리된다. 각 가능성은 발명의 별도의 실시형태를 나타낸다. 일부 실시형태에서, 제1 및 제2 시점은 적어도 6주만큼 분리된다. 일부 실시형태에서, 제1 및 제2 시점은 적어도 7주만큼 분리된다. 일부 실시형태에서, 제1 및 제2 시점은 최대 1, 2, 3, 4, 5, 6, 또는 7주만큼 분리된다. 각 가능성은 발명의 별도의 실시형태를 나타낸다. 일부 실시형태에서, 제1 및 제2 시점은 최대 6주만큼 분리된다. 일부 실시형태에서, 제1 및 제2 시점은 최대 7주만큼 분리된다. 일부 실시형태에서, 제1 및 제2 시점은 약 6주만큼 분리된다. 일부 실시형태에서, 제1 및 제2 시점은 약 7주만큼 분리된다. 일부 실시형태에서, 제1 및 제2 시점은 약 6-7주만큼 분리된다. 일부 실시형태에서, 제1 및 제2 시점은 6-7주만큼 분리된다. 일부 실시형태에서, 제2 시점은 면역요법의 개시 후 7주이다. 일부 실시형태에서, 제1 시점은 면역요법의 개시시이다. 일부 실시형태에서, 제1 시점은 면역요법의 개시 후 7주이다. 일부 실시형태에서, 제2 시점은 면역요법의 개시 후 13주이다. 일부 실시형태에서, 제2 시점은 면역요법의 개시 후 7주 또는 13주이다.
일부 실시형태에서, 증가는 적어도 10, 20, 25, 30, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250, 300, 350, 400, 450, 500, 600, 700, 800, 900 또는 1000% 증가이다. 각 가능성은 발명의 별도의 실시형태를 나타낸다. 일부 실시형태에서, 증가는 sCD28의 무 발현으로부터 발현까지의 증가이다. 일부 실시형태에서, 증가는 sCD28의 부재로부터 sCD28의 존재까지이다. 일부 실시형태에서, 증가는 적어도 1, 2, 3, 4, 5, 6, 7, 8, 9 또는 10ng/mL sCD28이다. 각 가능성은 발명의 별도의 실시형태를 나타낸다. 일부 실시형태에서, 증가는 적어도 1ng/mL sCD28이다. 일부 실시형태에서, 증가는 적어도 2ng/mL sCD28이다. 일부 실시형태에서, 증가는 적어도 5ng/mL sCD28이다. 일부 실시형태에서, 증가는 적어도 6ng/mL sCD28이다. 일부 실시형태에서, 증가는 적어도 1, 2, 3, 4, 5, 6, 7, 8, 9 또는 10ng/mL sCD28의 증가이다. 각 가능성은 발명의 별도의 실시형태를 나타낸다. 일부 실시형태에서, 증가는 적어도 1ng/mL sCD28의 증가이다. 일부 실시형태에서, 증가는 적어도 2ng/mL sCD28의 증가이다.
일부 실시형태에서, 제1 시점부터 제2 시점까지의 sCD28 수준의 감소는 대상체가 면역요법에 대한 반응자임을 나타낸다. 일부 실시형태에서, 제1 시점부터 제2 시점까지의 sCD28 수준에서 무 변화는 대상체가 면역요법에 대한 반응자임을 나타낸다. 일부 실시형태에서, 제1 시점부터 제2 시점까지의 sCD28 수준의 증가는 대상체가 면역요법에 대해 비-반응자임을 나타낸다. 일부 실시형태에서, 감소는 한 시점부터 다른 시점까지이다. 일부 실시형태에서, 감소는 제1 시점부터 제2 시점까지이다. 일부 실시형태에서, 감소는 대상체가 요법에 대한 반응자임을 나타낸다. 일부 실시형태에서, 감소는 대상체가 요법에 반응하고 있음을 나타낸다. 일부 실시형태에서, 방법은 반응하는 환자에 대한 요법을 계속하는 것을 추가로 포함한다. 일부 실시형태에서, 방법은 반응하는 환자에 대한 요법을 증가시키는 것을 추가로 포함한다. 일부 실시형태에서, 감소는 통계적으로 유의한 감소이다. 일부 실시형태에서, 방법은 비-반응하는 환자에 대한 요법을 중단하는 것을 포함한다. 일부 실시형태에서, 방법은 비-반응하는 환자에게 상이한 요법을 투여하는 것을 포함한다. 일부 실시형태에서, 상이한 요법은 또 다른 요법이다.
일부 실시형태에서, 무 변화는 한 시점부터 다른 시점까지이다. 일부 실시형태에서, 무 변화는 제1 시점부터 제2 시점까지이다. 일부 실시형태에서, 무 변화는 대상체가 요법에 대한 반응자임을 나타낸다. 일부 실시형태에서, 무 변화는 대상체가 요법에 반응하고 있음을 나타낸다. 일부 실시형태에서, 무 변화는 통계적으로 무의미한 변화를 포함한다. 일부 실시형태에서, 감소는 적어도 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 97, 99 또는 100% 감소이다. 각 가능성은 발명의 별도의 실시형태를 나타낸다. 일부 실시형태에서, 감소는 sCD28의 무 발현으로의 감소이다. 일부 실시형태에서, 감소는 sCD28의 실질적으로 무 발현으로의 감소이다. 일부 실시형태에서, 감소는 1, 2, 3, 4, 5, 6, 7, 8, 9 또는 10ng/mL 미만의 sCD28이다. 각 가능성은 발명의 별도의 실시형태를 나타낸다. 일부 실시형태에서, 감소는 2ng/mL 미만의 sCD28이다. 일부 실시형태에서, 감소는 5ng/mL 미만의 sCD28이다. 일부 실시형태에서, 감소는 6ng/mL 미만의 sCD28이다. 일부 실시형태에서, 감소는 적어도 1, 2, 3, 4, 또는 5ng/mL sCD28의 감소이다. 각 가능성은 발명의 별도의 실시형태를 나타낸다. 일부 실시형태에서, 감소는 적어도 1ng/mL sCD28의 감소이다. 일부 실시형태에서, 감소는 적어도 2ng/mL sCD28의 감소이다.
일부 실시형태에서, 대상체의 혈액은 상승된 수준의 sCD28을 포함한다. 일부 실시형태에서, 증가는 상승된 수준이다. 일부 실시형태에서, 수준은 건강한 대상체의 수준 초과로 상승된다. 일부 실시형태에서, 대상체의 sCD28 수준은 건강한 대상체 수준보다 적어도 5%, 10%, 15%, 20%, 25%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 150%, 200%, 250%, 300%, 350%, 400%, 500%, 600%, 700%, 800%, 900%, 또는 1000%까지 상승된다. 각 가능성은 발명의 별도의 실시형태를 나타낸다. 일부 실시형태에서, 수준은 혈액 중 5, 6, 7, 8, 9, 10, 12, 14, 15, 16, 18, 20, 25, 30, 35, 40, 45 또는 50ng/mL 초과로 상승된다. 각 가능성은 발명의 별도의 실시형태를 나타낸다. 일부 실시형태에서, 수준은 5ng/mL 초과로 상승된다. 일부 실시형태에서, 수준은 10ng/mL 이상으로 상승된다. 일부 실시형태에서, 수준은 20ng/mL 초과로 상승된다. 일부 실시형태에서, 대상체의 혈액은 혈액의 mL당 적어도 5, 6, 7, 8, 9, 10, 12, 14, 15, 16, 18, 20, 25, 30, 35, 40, 45 또는 50ng sCD28을 포함한다. 각 가능성은 발명의 별도의 실시형태를 나타낸다. 일부 실시형태에서, 대상체의 혈액은 적어도 5ng/mL sCD28을 포함한다. 일부 실시형태에서, 대상체의 혈액은 적어도 10ng/mL sCD28을 포함한다. 일부 실시형태에서, 대상체의 혈액은 적어도 20ng/mL sCD28을 포함한다.
일부 실시형태에서, 대상체의 혈액은 재발 전 건강한 수준의 sCD28을 포함한다. 일부 실시형태에서, 대상체의 것은 재발 전에 비-상승된 수준의 sCD28을 포함한다. 일부 실시형태에서, 대상체의 혈액은 재발 전 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 14, 15, 16, 18, 20, 25, 30, 35, 40, 45 또는 50ng/mL 미만의 sCD28을 포함한다. 일부 실시형태에서, 대상체의 혈액은 재발 전 5ng/mL 미만의 sCD28을 포함한다. 일부 실시형태에서, 대상체의 혈액은 재발 전 6ng/mL 미만의 sCD28을 포함한다. 각 가능성은 발명의 별도의 실시형태를 나타낸다. 일부 실시형태에서, 대상체의 혈액은 발명의 방법을 수행하기 전의 대상체의 혈액이다.
일부 실시형태에서, 측정은 대상체로부터 샘플을 수득하는 것을 포함한다. 일부 실시형태에서, 측정은 샘플에서 sCD28 수준을 측정하는 것이다. 일부 실시형태에서, 샘플은 생검이다. 일부 실시형태에서, 샘플은 체액이다. 일부 실시형태에서, 샘플은 혈액이다. 일부 실시형태에서, 샘플은 대상체로부터의 것이다. 일부 실시형태에서, 샘플은 체액을 포함한다. 일부 실시형태에서, 샘플은 조직을 포함한다. 일부 실시형태에서, 샘플은 세포를 포함한다. 일부 실시형태에서, 검출은 2차 항체에 의한 것이다. 일부 실시형태에서, 검출은 sCD28에 결합하는 태깅된 분자로의 것이다. 일부 실시형태에서, 검출은 ELISA에 의한 것이다. 일부 실시형태에서, 검출은 면역조직화학에 의한 것이다. 일부 실시형태에서, 검출은 면역블롯에 의한 것이다. sCD28을 검출하기 위한 작용제는 그 전문이 본 명세서에 참고로 포함되는 국제 특허 출원 WO2019/175885에 기재되어 있다.
일부 실시형태에서, 측정은 복수의 시점에서 측정하는 것을 포함한다. 일부 실시형태에서, 복수의 시점은 적어도 2, 3, 4, 5, 6, 7, 8, 9, 또는 10개의 시점이다. 각 가능성은 발명의 별도의 실시형태를 나타낸다. 일부 실시형태에서, 복수의 시점은 2개의 시점이다. 일부 실시형태에서, 복수의 시점은 적어도 2개의 시점이다. 일부 실시형태에서, 복수의 시점은 제1 및 제2 시점을 포함한다. 일부 실시형태에서, 적어도 하나의 시점은 대상체가 관해 상태이거나 암이 없는 시점이다. 일부 실시형태에서, 적어도 하나의 시점은 대상체가 관해 상태이거나 암이 없는 것으로 공지된 시점이다. 일부 실시형태에서, 대상체가 관해 상태이거나 암이 없는 또는 관해 상태이거나 암이 없는 것으로 공지된 시점은 대상체가 1, 2, 3, 4, 5, 6, 7, 8, 9 또는 10ng/mL sCD28이거나 또는 그 미만의 sCD28 수준을 갖는 시점이다. 각 가능성은 발명의 별도의 실시형태를 나타낸다. 일부 실시형태에서, 시점은 대상체가 2ng/mL 이하의 sCD28 수준을 갖는 때이다. 일부 실시형태에서, 시점은 대상체가 5ng/mL 이하의 sCD28 수준을 갖는 때이다. 일부 실시형태에서, 시점은 대상체가 6ng/mL 이하의 sCD28 수준을 갖는 때이다. 일부 실시형태에서, 적어도 하나의 시점은 요법의 개시 후이다.
일부 실시형태에서, 적어도 하나의 시점은 대상체가 재발의 위험이 있는 시점이다. 일부 실시형태에서, 적어도 하나의 시점은 대상체가 재발이 의심되는 시점이다. 일부 실시형태에서, 적어도 하나의 시점은 요법의 개시 후 적어도 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55 또는 60주이다. 각 가능성은 발명의 별도의 실시형태를 나타낸다. 일부 실시형태에서, 적어도 하나의 시점은 요법의 개시 후 적어도 35주이다. 일부 실시형태에서, 적어도 하나의 시점은 요법의 개시 후 적어도 40주이다. 일부 실시형태에서, 적어도 하나의 시점은 요법의 개시 후 적어도 45주이다. 일부 실시형태에서, 적어도 하나의 시점은 요법의 개시 후 적어도 46주이다.
일부 실시형태에서, 다가올 재발은 긴박한(impending) 재발이다. 일부 실시형태에서, 긴박한 재발은 임박한 재발이다. 일부 실시형태에서, 긴박한 것은 다음 10, 15, 20, 25, 30, 35, 또는 40주 이내이다. 각 가능성은 발명의 별도의 실시형태를 나타낸다. 일부 실시형태에서, 다가올 재발은 미래의 임의의 시점에서의 재발이다. 일부 실시형태에서, 임박한 재발은 다음 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15 또는 20주 이내이다. 각 가능성은 발명의 별도의 실시형태를 나타낸다.
일부 실시형태에서, 방법은 대상체에게 또 다른 요법을 투여하는 것을 추가로 포함한다. 일부 실시형태에서, 또 다른 요법은 상이한 요법이다. 일부 실시형태에서, 또 다른 요법은 암을 치료하는 요법이다. 일부 실시형태에서, 방법은 암 재발로 진단되거나 예측된 대상체에게 또 다른 요법을 투여하는 것을 추가로 포함한다. 일부 실시형태에서, 방법은 암 재발로 진단된 대상체에게 또 다른 요법을 투여하는 것을 추가로 포함한다. 일부 실시형태에서, 방법은 암 재발이 예측된 대상체에게 또 다른 요법을 투여하는 것을 추가로 포함한다. 일부 실시형태에서, 방법은 비-반응자로 결정된 대상체에게 또 다른 요법을 투여하는 것을 추가로 포함한다. 일부 실시형태에서, 방법은 면역요법에 대해 비-반응자로 결정된 대상체에게 또 다른 요법을 투여하는 것을 추가로 포함한다. 일부 실시형태에서, 다른 요법은 관해를 야기한 요법이 아니다. 일부 실시형태에서, 다른 요법은 암을 치료하기 위해 초기에 사용된 요법과 상이한 요법이다. 일부 실시형태에서, 다른 요법은 PD-1/PD-L1 기반 면역요법이 아니다. 일부 실시형태에서, 다른 요법은 면역요법이 아니다. 일부 실시형태에서, 다른 요법은 대상체가 비-반응자인 요법이 아니다.
일부 실시형태에서, 또 다른 요법은 면역요법이다. 일부 실시형태에서, 또 다른 요법은 암을 치료하는 요법이다. 일부 실시형태에서, 또 다른 요법은 PD-1 및/또는 PD-L1 기반 면역요법이다. 일부 실시형태에서, 또 다른 면역요법은 체크포인트 억제제이다. 일부 실시형태에서, 체크포인트 억제제는 PD-1 및/또는 PD-L1 억제제이다. 일부 실시형태에서, 체크포인트 억제제는 CTLA-4 억제제이다. 일부 실시형태에서, 또 다른 면역요법은 키메라 항원 수용체(CAR) 기반 면역요법이다. 일부 실시형태에서, CAR은 CAR-T이다. 일부 실시형태에서, CAR은 CAR-NK이다. 일부 실시형태에서, 또 다른 면역요법은 암 백신이다.
본 명세서에 사용된 용어 "투여하는", "투여" 및 유사한 용어는 건전한 의료 관행에서 치료적 효과를 제공하는 방식으로 활성 작용제를 함유하는 조성물을 대상체에게 전달하는 임의의 방법을 지칭한다. 본 주제의 일 양태는 치료를 필요로 하는 환자에게 치료적으로 유효한 양의 발명의 작용제의 경구 투여를 제공한다. 다른 적절한 투여의 경로는 비경구, 피하, 정맥내, 근육내 또는 복강내를 포함할 수 있다.
본 명세서에 사용된 용어 "CAR-T 세포" 및 "CAR-NK 세포"는 적어도 하나의 관심있는 단백질(예를 들어, 후성유전학적 변형 작용제로 처리한 후 증가된 발현을 갖는 면역원성 단백질)에 대해 특이성을 갖고 면역 이펙터 세포(T 세포 또는 NK 세포) 상에 그라프팅된 조작된 수용체를 지칭한다. 일부 실시형태에서, CAR-T 세포는 T-세포 상에 그라프팅된 모노클로날 항체의 특이성을 갖는다. 일부 실시형태에서, CAR-NK 세포는 NK-세포 상에 그라프팅된 모노클로날 항체의 특이성을 갖는다. 일부 실시형태에서, T 세포는 세포독성 T 림프구 및 조절 T 세포로부터 선택된다.
CAR-T 및 CAR-NK 세포 및 이의 벡터는 당업계에 잘 알려져 있다. 이러한 세포는 수용체가 결합하는 단백질을 표적으로 하고 이에 대해 세포독성이다. 일부 실시형태에서, CAR-T 또는 CAR-NK 세포는 적어도 하나의 바이러스 단백질을 표적화한다. 일부 실시형태에서, CAR-T 또는 CAR-NK 세포는 복수의 바이러스 단백질을 표적화한다. 일부 실시형태에서, CAR-T 또는 CAR-NK 세포는 후성유전학적 변형 작용제와의 접촉으로 인해 증가된 발현을 갖는 바이러스 단백질을 표적화한다.
CAR-T 세포의 구축은 당업계에 잘 알려져 있다. 하나의 비-제한적인 예에서, 바이러스 단백질에 대한 모노클로날 항체가 만들어질 수 있고, 그 다음 항체를 코딩하는 벡터가 작제될 것이다. 벡터는 또한 공동자극 신호 영역을 포함할 것이다. 일부 실시형태에서, 공동자극 신호 영역은 공지된 T 세포 또는 NK 세포 자극 분자의 세포내 도메인을 포함한다. 일부 실시형태에서, 세포내 도메인은 다음 중 적어도 하나로부터 선택된다: CD3Z, CD27, CD28, 4-1BB, OX40, CD30, CD40, PD-1, ICOS, 림프구 기능-연관된 항원-1(LFA-1), CD2, CD 7, LIGHT, NKG2C, B7-H3, 및 CD83과 특이적으로 결합하는 리간드. 일부 실시형태에서, 벡터는 또한 CD3Z 시그널링 도메인을 포함한다. 그런 다음 이 벡터는, 예를 들어, 렌티바이러스 감염에 의해 T-세포 안으로 형질감염된다.
본 명세서에 사용된 용어, 질환, 장애 또는 병태의 "치료" 또는 "치료하는"은 이의 적어도 하나의 증상의 완화, 이의 중증도의 감소, 또는 이의 진행의 억제를 포괄한다. 치료가 질환, 장애 또는 병태가 완전히 치유되었음을 의미할 필요는 없다. 효과적인 치료가 되기 위해, 본 명세서에서 유용한 조성물은 질환, 장애 또는 병태의 중증도를 감소시키거나, 이와 연관된 증상의 중증도를 감소시키거나, 환자 또는 대상체의 삶의 질에 개선을 제공하기만 하면 된다.
본 명세서에 사용된 용어 "재발"은 개선의 기간 후에 암이 악화되는 것을 지칭한다. 재발은 암이 치료 전 수준으로 돌아왔음을 의미할 필요는 없으며, 단지 관해가 있었던 시점부터 어떤 식으로든 악화되었다는 의미일 뿐이다. 일부 실시형태에서, 재발은 대상체가 암이 없어진 후 암의 복귀를 포함한다. 일부 실시형태에서, 재발은 암의 지속적인 성장을 포함한다. 일부 실시형태에서, 재발은 성장의 정지 후 암의 성장을 포함한다. 일부 실시형태에서, 재발은 암의 성장 속도의 증가를 포함한다. 일부 실시형태에서, 재발은 중단되었던 암의 증상의 복귀를 포함한다. 일부 실시형태에서, 재발은 개선되었던 암의 증상의 악화를 포함한다. 재발은 암의 중증도 또는 암과 연관된 증상의 중증도의 증가만을 요한다.
일부 실시형태에서, 재발은 재발된 암이다. 일부 실시형태에서, 재발은 관해를 야기한 요법에 대한 굴절성이다. 일부 실시형태에서, 재발은 관해를 야기한 요법에 대해 비-반응성이다.
일부 실시형태에서, 방법은 생체내에서 수행된다. 일부 실시형태에서, 방법은 생체외에서 수행된다. 일부 실시형태에서, 방법은 시험관내에서 수행된다. 일부 실시형태에서, 측정은 생체내에서 수행된다. 일부 실시형태에서, 측정은 생체외에서 수행된다. 일부 실시형태에서, 측정은 시험관내에서 수행된다. 일부 실시형태에서, 샘플은 시험관내 샘플이다. 일부 실시형태에서, 샘플은 생체외 샘플이다.
본 명세서에 사용된 용어 "약"은 값과 조합될 때 기준 값의 플러스 및 마이너스 10%를 지칭한다. 예를 들어, 약 1000나노미터(nm)의 길이는 1000nm+-100nm의 길이를 지칭한다.
본 명세서 및 첨부된 청구범위에서 사용된 바와 같이, 단수 형태 "a", "an" 및 "the"는 문맥이 명백하게 달리 지시하지 않는 한 복수 지시 대상을 포함한다는 것에 유의한다. 따라서, 예를 들어, "폴리뉴클레오티드"에 대한 언급은 다수의 이러한 폴리뉴클레오티드를 포함하고 "폴리펩티드"에 대한 언급은 당업자에게 공지된 하나 이상의 폴리펩티드 및 그의 등가물 등에 대한 언급을 포함한다. 청구범위는 임의의 선택적 요소를 제외하도록 작성될 수 있음을 추가로 유의한다. 따라서, 이 진술은 청구항 요소의 인용 또는 "부정적" 제한의 사용과 관련하여 "단독", "오직" 등의 배타적 용어의 사용에 대한 선행 근거로 작용하는 것으로 의도된다.
"A, B, C 등 중 적어도 하나"와 유사한 관습이 사용된 이들 경우에, 일반적으로 이러한 구성은 당업계에서 숙련자가 관례를 이해할 수 있는 의미에서 의도된다(예를 들어, "A, B 및 C 중 적어도 하나를 갖는 시스템"은 A 단독, B 단독, C 단독, A와 B 함께, A와 C 함께, B와 C 함께, 및/또는 A, B, C 함께 등을 갖는 시스템을 포함하지만 이에 제한되지 않는다). 상세한 설명, 청구범위, 또는 도면에 있든지 간에 둘 이상의 대안적인 용어를 제시하는 실질적으로 임의의 분리 단어 및/또는 구는 용어 중 하나, 용어 중 어느 하나 또는 용어 둘 모두를 포함하는 가능성을 고려하는 것으로 이해되어야 한다는 것이 기술 내에서 추가로 이해될 것이다. 예를 들어, 문구 "A 또는 B"는 "A" 또는 "B" 또는 "A 및 B"의 가능성을 포함하는 것으로 이해될 것이다.
명료함을 위해 별도의 실시형태의 맥락에서 설명된 발명의 특정 특징은 단일 실시형태에서 조합하여 제공될 수도 있음을 이해해야 한다. 반대로, 간결함을 위해 단일 실시형태의 맥락에서 설명된 발명의 다양한 특징은 개별적으로 또는 임의의 적절한 하위-조합으로 제공될 수도 있다. 발명에 속하는 실시형태의 모든 조합은 본 발명에 의해 구체적으로 포괄되고, 마치 각각 및 모든 조합이 개별적으로 명시적으로 개시된 것처럼 본 명세서에 개시된다. 부가하여, 다양한 실시형태의 모든 하위-조합 및 그 요소도 본 발명에 의해 구체적으로 포괄되고, 마치 각각 및 모든 이러한 하위-조합이 개별적으로 그리고 명시적으로 본 명세서에 개시되어 있는 것처럼 본 명세서에 개시된다.
본 발명의 추가적인 목적, 이점, 및 신규 특징은 제한하고자 하는 것이 아닌 하기 실시예를 검토함으로써 당업자에게 명백해질 것이다. 부가적으로, 상기에서 기술되고 하기 청구범위 섹션에서 청구된 바와 같은 본 발명의 다양한 실시형태 및 양태 각각은 다음 실시예에서 실험적 지지를 발견한다.
상기에서 기술되고 하기 청구범위 섹션에서 청구된 바와 같은 본 발명의 다양한 실시형태 및 양태는 다음 실시예에서 실험적 지지를 발견한다.
실시예
일반적으로, 본 명세서에 사용된 명명법 및 본 발명에 이용된 실험실 절차는 분자, 생화학적, 미생물학적 및 재조합 DNA 기술을 포함한다. 이러한 기술은 문헌에 자세히 설명되어 있다. 예를 들어, "Molecular Cloning: A laboratory Manual" Sambrook et al., (1989); "Current Protocols in Molecular Biology" Volumes I-III Ausubel, R. M., ed. (1994); Ausubel et al., "Current Protocols in Molecular Biology", John Wiley and Sons, Baltimore, Maryland (1989); Perbal, "A Practical Guide to Molecular Cloning", John Wiley & Sons, New York (1988); Watson et al., "Recombinant DNA", Scientific American Books, New York; Birren et al. (eds) "Genome Analysis: A Laboratory Manual Series", Vols. 1-4, Cold Spring Harbor Laboratory Press, New York (1998); 미국 특허 번호 4,666,828; 4,683,202; 4,801,531; 5,192,659 및 5,272,057에 제시된 바와 같은 방법론; "Cell Biology: A Laboratory Handbook", Volumes I-III Cellis, J. E., ed. (1994); "Culture of Animal Cells - A Manual of Basic Technique" by Freshney, Wiley-Liss, N. Y. (1994), Third Edition; "Current Protocols in Immunology" Volumes I-III Coligan J. E., ed. (1994); Stites et al. (eds), "Basic and Clinical Immunology" (8th Edition), Appleton & Lange, Norwalk, CT (1994); Mishell and Shiigi (eds), "Strategies for Protein Purification and Characterization - A Laboratory Course Manual" CSHL Press (1996)를 참고하며; 이들 모두는 참조로 포함된다. 기타 일반 참조는 이 문헌 전체에 제공된다.
재료 및 방법
암 환자의 혈장에서 가용성 인간 CD28의 검출 - 항PD1 요법을 받은 상이한 적응증의 암 환자 혈장 샘플을 1:10으로 희석하고 기능적 ELISA에 의해 가용성 인간 CD28에 대해 분석했다. 높은 sCD28을 갖는 샘플을 적절한 희석액에서 다시 분석했다. 샘플은 치료에 대한 반응에 대해 임상 관찰이 이용가능한 경우에만 조사되었다. 실시예는 치료 동안에만 sCD28의 양에서 >0.5-배 변화의 기준에 의해 선택되었다.
실시예 1: 면역요법 전 sCD28 수준은 반응을 예측한다
sCD28의 면역억제 효과는 이미 확립되어 있다(그 전체로 본 명세서에 참고로 포함된, 국제 특허 출원 WO2019/175885). 더욱이, sCD28은 면역요법의 강력한 억제제이고 sCD28의 수준은 다수의 암에서 상승된다는 것이 발견되었다. 항-PD1/항-PD-L1 및 CD80 기반 면역요법은 모두 sCD28에 의해 부정적으로 영향을 받는 것으로 나타났다.
면역요법 동안 암 진행에 대한 sCD28 수준의 영향을 더 이해하기 위해, 항-PD1 요법(니볼루맙, NCT01176461)의 개시 이전에 흑색종 환자로부터 100개 초과의 혈청 샘플을 ELISA에 의한 sCD28 수준에 대해 시험했다. 생존은 요법 전반에 걸쳐 모니터링되었고 생존 함수는 요법 전 높은 수준과 낮은 수준의 sCD28을 가진 대상체를 비교하여 플롯팅되었다(도 1). 낮은 수준의 sCD28(2ng/mL 미만)을 가진 대상체는 높은 수준을 가진 것들보다 더 긴 중앙 생존(659일 대 514일)을 갖는 것으로 밝혀졌다.
실시예 2: 면역요법 동안 sCD28 수준
면역요법(항-PD-1, 예를 들어 니볼루맙 및 펨브롤리주맙, 항-PD-L1, 예를 들어 아테졸리주맙 및 항-CTLA-4, 예를 들어 이필리무맙)을 받고있는 166명의 개별 환자(흑색종, 신세포 암종, 폐 편평 세포 암종 및 요로상피 암종 환자)로부터 혈청을 그의 sCD28 수준에 대해 조사했다. 이들 166명 중 154명 개체가 요법의 과정 동안 다중 샘플을 제공했다. 이들 대상체 중 37명이 측정된 최소 한 시점 동안 sCD28에 대해 양성(>2ng/mL)인 것으로 간주되었다. 이들 37명 중 19명은 요법 동안 sCD28 발생의 동역학을 변경하는 것으로 나타났다(sCD28 수준에서 50%보다 큰 변화). 흥미롭게도, 변화의 방향(음성 동역학의 양성)은 항상 일관되었다: 반응자는 sCD28 수준의 감소를 가졌고 비-반응자는 sCD28 수준의 증가를 보였다(도 2a).
이들 166명의 환자로부터, 92명의 개별 환자가 니볼루맙(NCT01176461)으로 항-PD-1 요법을 받고 있었다. 모든 환자는 면역요법의 과정 전반에 걸쳐 3개의 시점(기준선, 7주차 및 13주차)에서 샘플을 제공했다. 환자는 시험의 종료 시 종양 크기에 의해 측정된, 암 관해에 기반하여 반응자과 비-반응자로 계층화되었다. sCD28 수준에서의 추세가 반응자 및 비-반응자 모집단 전체에서 검사되었을 때, 예후 마커로서의 sCD28의 의미는 쉽게 명백하다. 비-반응자는 기준선(요법 전)으로부터 7주차까지 그리고 13주차 전반에 걸쳐 sCD28 수준이 증가하는 것으로 나타났다(도 2b). 대조적으로, 반응자는 sCD28의 증가하는 수준을 나타내지 않았을 뿐만 아니라 실제로 평균 sCD28 수준은 기준선으로부터 7주차까지 그리고 13주차 전반에 걸쳐 감소했다(도 2c). sCD28 발현에서의 절대 변화가 7주차와 13주차에 정량화될 때 비-반응자 모집단에서 관찰된 증가는 통계적으로 유의했다(도 2d).
실시예 3: 재발 동안 sCD28 수준
sCD28의 동역학에 변화를 보인 모니터링된 환자 중 2명은 예상치 못한 결과를 나타냈다. 두 환자 모두 면역요법에 반응했으며, 첫 번째(요로상피암종)는 완전 반응(CR)을 나타내고 기타(흑색종)는 부분 반응(PR)을 나타냈다. 두 환자 모두 평균적으로 요법에 대한 그의 반응 동안, 즉 관해의 기간 동안 sCD28에 대해 음성이었다(도 3). 그러나 두 환자 모두 암 재발의 개시 직전 또는 개시시에 sCD28 수준에서 현저한 증가를 나타났다. 완전 반응을 가진 환자는 진행성 질환(PD)의 단계에 들어갔고 sCD28 수준은 46주차부터 증가하기 시작했다(도 3, 상단 패널). 부분 반응을 가진 환자는 안정한 질환(SD)의 단계에 들어갔고 sCD28 수준은 35주차에 증가하기 시작했다(도 3, 하단 패널). 이것은 증가된 및/또는 증가하는 sCD28 수준이 면역요법 후 암 재발에 대한 마커로 작용할 수 있고 이 증가가 임박한 재발에 대한 예측 마커가 될 수 있음을 입증한다.
발명이 그의 특정한 실시형태와 관련하여 기술되었지만, 많은 대안, 변형 및 변화가 당업자에게 자명할 것임이 명백하다. 따라서, 첨부된 청구범위의 사상과 넓은 범주에 속하는 모든 그러한 대안, 변형 및 변화를 포용하도록 의도된다.
<110> Biond Biologics LTD.
<120> SOLUBLE CD28 LEVELS DURING IMMUNOTHERAPY
<130> BDB-P-010-USP
<150> US 62/942,276
<151> 2019-12-02
<160> 6
<170> PatentIn version 3.5
<210> 1
<211> 220
<212> PRT
<213> Homo sapiens
<400> 1
Met Leu Arg Leu Leu Leu Ala Leu Asn Leu Phe Pro Ser Ile Gln Val
1 5 10 15
Thr Gly Asn Lys Ile Leu Val Lys Gln Ser Pro Met Leu Val Ala Tyr
20 25 30
Asp Asn Ala Val Asn Leu Ser Cys Lys Tyr Ser Tyr Asn Leu Phe Ser
35 40 45
Arg Glu Phe Arg Ala Ser Leu His Lys Gly Leu Asp Ser Ala Val Glu
50 55 60
Val Cys Val Val Tyr Gly Asn Tyr Ser Gln Gln Leu Gln Val Tyr Ser
65 70 75 80
Lys Thr Gly Phe Asn Cys Asp Gly Lys Leu Gly Asn Glu Ser Val Thr
85 90 95
Phe Tyr Leu Gln Asn Leu Tyr Val Asn Gln Thr Asp Ile Tyr Phe Cys
100 105 110
Lys Ile Glu Val Met Tyr Pro Pro Pro Tyr Leu Asp Asn Glu Lys Ser
115 120 125
Asn Gly Thr Ile Ile His Val Lys Gly Lys His Leu Cys Pro Ser Pro
130 135 140
Leu Phe Pro Gly Pro Ser Lys Pro Phe Trp Val Leu Val Val Val Gly
145 150 155 160
Gly Val Leu Ala Cys Tyr Ser Leu Leu Val Thr Val Ala Phe Ile Ile
165 170 175
Phe Trp Val Arg Ser Lys Arg Ser Arg Leu Leu His Ser Asp Tyr Met
180 185 190
Asn Met Thr Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro
195 200 205
Tyr Ala Pro Pro Arg Asp Phe Ala Ala Tyr Arg Ser
210 215 220
<210> 2
<211> 202
<212> PRT
<213> Homo sapiens
<400> 2
Asn Lys Ile Leu Val Lys Gln Ser Pro Met Leu Val Ala Tyr Asp Asn
1 5 10 15
Ala Val Asn Leu Ser Cys Lys Tyr Ser Tyr Asn Leu Phe Ser Arg Glu
20 25 30
Phe Arg Ala Ser Leu His Lys Gly Leu Asp Ser Ala Val Glu Val Cys
35 40 45
Val Val Tyr Gly Asn Tyr Ser Gln Gln Leu Gln Val Tyr Ser Lys Thr
50 55 60
Gly Phe Asn Cys Asp Gly Lys Leu Gly Asn Glu Ser Val Thr Phe Tyr
65 70 75 80
Leu Gln Asn Leu Tyr Val Asn Gln Thr Asp Ile Tyr Phe Cys Lys Ile
85 90 95
Glu Val Met Tyr Pro Pro Pro Tyr Leu Asp Asn Glu Lys Ser Asn Gly
100 105 110
Thr Ile Ile His Val Lys Gly Lys His Leu Cys Pro Ser Pro Leu Phe
115 120 125
Pro Gly Pro Ser Lys Pro Phe Trp Val Leu Val Val Val Gly Gly Val
130 135 140
Leu Ala Cys Tyr Ser Leu Leu Val Thr Val Ala Phe Ile Ile Phe Trp
145 150 155 160
Val Arg Ser Lys Arg Ser Arg Leu Leu His Ser Asp Tyr Met Asn Met
165 170 175
Thr Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala
180 185 190
Pro Pro Arg Asp Phe Ala Ala Tyr Arg Ser
195 200
<210> 3
<211> 663
<212> DNA
<213> Homo sapiens
<400> 3
atgctcaggc tgctcttggc tctcaactta ttcccttcaa ttcaagtaac aggaaacaag 60
attttggtga agcagtcgcc catgcttgta gcgtacgaca atgcggtcaa ccttagctgc 120
aagtattcct acaatctctt ctcaagggag ttccgggcat cccttcacaa aggactggat 180
agtgctgtgg aagtctgtgt tgtatatggg aattactccc agcagcttca ggtttactca 240
aaaacggggt tcaactgtga tgggaaattg ggcaatgaat cagtgacatt ctacctccag 300
aatttgtatg ttaaccaaac agatatttac ttctgcaaaa ttgaagttat gtatcctcct 360
ccttacctag acaatgagaa gagcaatgga accattatcc atgtgaaagg gaaacacctt 420
tgtccaagtc ccctatttcc cggaccttct aagccctttt gggtgctggt ggtggttggt 480
ggagtcctgg cttgctatag cttgctagta acagtggcct ttattatttt ctgggtgagg 540
agtaagagga gcaggctcct gcacagtgac tacatgaaca tgactccccg ccgccccggg 600
cccacccgca agcattacca gccctatgcc ccaccacgcg acttcgcagc ctatcgctcc 660
tga 663
<210> 4
<211> 27
<212> PRT
<213> Homo sapiens
<400> 4
Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu
1 5 10 15
Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val
20 25
<210> 5
<211> 144
<212> PRT
<213> Homo sapiens
<400> 5
Met Leu Arg Leu Leu Leu Ala Leu Asn Leu Phe Pro Ser Ile Gln Val
1 5 10 15
Thr Gly Asn Lys Ile Leu Val Lys Gln Ser Pro Met Leu Val Ala Tyr
20 25 30
Asp Asn Ala Val Asn Leu Ser Cys Lys Tyr Ser Tyr Asn Leu Phe Ser
35 40 45
Arg Glu Phe Arg Ala Ser Leu His Lys Gly Leu Asp Ser Ala Val Glu
50 55 60
Val Cys Val Val Tyr Gly Asn Tyr Ser Gln Gln Leu Gln Val Tyr Ser
65 70 75 80
Lys Thr Gly Phe Asn Cys Asp Gly Lys Leu Gly Asn Glu Ser Val Thr
85 90 95
Phe Tyr Leu Gln Asn Leu Tyr Val Asn Gln Thr Asp Ile Tyr Phe Cys
100 105 110
Lys Ile Glu Val Met Tyr Pro Pro Pro Tyr Leu Asp Asn Glu Lys Ser
115 120 125
Asn Gly Thr Ile Ile His Val Lys Gly Lys His Leu Cys Pro Ser Pro
130 135 140
<210> 6
<211> 126
<212> PRT
<213> Homo sapiens
<400> 6
Asn Lys Ile Leu Val Lys Gln Ser Pro Met Leu Val Ala Tyr Asp Asn
1 5 10 15
Ala Val Asn Leu Ser Cys Lys Tyr Ser Tyr Asn Leu Phe Ser Arg Glu
20 25 30
Phe Arg Ala Ser Leu His Lys Gly Leu Asp Ser Ala Val Glu Val Cys
35 40 45
Val Val Tyr Gly Asn Tyr Ser Gln Gln Leu Gln Val Tyr Ser Lys Thr
50 55 60
Gly Phe Asn Cys Asp Gly Lys Leu Gly Asn Glu Ser Val Thr Phe Tyr
65 70 75 80
Leu Gln Asn Leu Tyr Val Asn Gln Thr Asp Ile Tyr Phe Cys Lys Ile
85 90 95
Glu Val Met Tyr Pro Pro Pro Tyr Leu Asp Asn Glu Lys Ser Asn Gly
100 105 110
Thr Ile Ile His Val Lys Gly Lys His Leu Cys Pro Ser Pro
115 120 125
Claims (32)
- 암을 앓고 있는 대상체에서 PD-1/PD-L1 기반 면역요법에 대한 반응을 결정하는 방법으로서, 상기 방법은 상기 대상체에서 sCD28 수준을 적어도 2개의 시점에서 측정하는 것을 포함하고, 여기서 이들 시점 중 적어도 하나는 상기 PD-1/PD-L1 기반 면역요법의 개시 후이고, 여기서 상기 PD-1/PD-L1 기반 면역요법의 개시 후 제1 시점부터 제2 시점까지 sCD28 수준의 증가는 상기 대상체가 상기 면역요법에 대한 반응자가 아님을 나타내고 상기 PD-1/PD-L1 기반 면역요법의 개시 후 상기 제1 시점부터 상기 제2 시점까지 sCD28 수준의 감소 또는 무 변화는 상기 대상체가 상기 면역요법에 대한 반응자임을 나타내며, 이에 의해 대상체에서 PD-1/PD-L1 기반 면역요법에 대한 반응을 결정하는, 방법.
- 제1항에 있어서, 상기 제1 시점은 상기 면역요법의 개시 전 또는 개시시(at the time of initiation)인, 방법.
- 제1항에 있어서, 상기 제1 시점은 상기 면역요법의 개시 후인, 방법.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 상기 제2 시점은 상기 제1 시점 후 적어도 6주인, 방법.
- 제1항 내지 제4항 중 어느 한 항에 있어서, 상기 제2 시점은 상기 제1 시점 후 최대 7주인, 방법.
- 제1항 내지 제5항 중 어느 한 항에 있어서,
a. 상기 제1 시점은 상기 면역요법의 개시시 또는 개시 전이고, 상기 제2 시점은 상기 면역요법의 개시 후 7주 또는 13주이거나; 또는
b. 상기 제1 시점은 상기 면역요법의 개시 후 7주이고, 상기 제2 시점은 상기 면역요법의 개시 후 13주인, 방법. - 제1항 내지 제6항 중 어느 한 항에 있어서, 상기 PD-1/PD-L1 기반 면역요법의 개시 후 상기 제1 시점부터 상기 제2 시점까지 sCD28 수준의 감소는 상기 대상체가 상기 면역요법에 대한 반응자임을 나타내는, 방법.
- 제1항 내지 제7항 중 어느 한 항에 있어서, 감소는 적어도 1ng/ml sCD28의 감소인, 방법.
- 제1항 내지 제8항 중 어느 한 항에 있어서, 다음 중 적어도 하나를 더 포함하는, 방법:
a. 반응자가 아닌 대상체에 대해 상기 면역요법의 중단;
b. 비-반응자인 대상체에 대해 상이한 면역요법의 투여;
c. 반응자인 대상체에 대해 상기 PD-1/PD-L1 기반 면역요법의 계속 투여; 및
d. 반응자인 대상체에게 투여되는 상기 PD-1/PD-L1 기반 면역요법 용량의 증가. - 암 재발 진단을 필요로 하는 대상체에서 암 재발을 진단하는 방법으로서, 상기 방법은 상기 대상체에서 가용성 CD28(sCD28) 수준의 측정을 포함하며, 여기서 상기 대상체에서 sCD28 수준의 증가는 암 재발을 나타내며, 이에 의해 상기 대상체에서 암 재발을 진단하는, 방법.
- 암 재발 예측을 필요로 하는 대상체에서 암 재발을 예측하는 방법으로서, 상기 방법은 상기 대상체에서 가용성 CD28(sCD28) 수준의 측정을 포함하며, 여기서 상기 대상체에서 sCD28 수준의 증가는 임박한 암 재발을 나타내며, 이에 의해 상기 대상체에서 암 재발을 예측하는, 방법.
- 제10항 또는 제11항에 있어서, 상기 대상체는 암을 앓고 있고 상기 암은 관해 상태에 있는, 방법.
- 제10항 또는 제11항에 있어서, 상기 대상체는 이전에 암에 걸렸고 현재는 암이 없는, 방법.
- 제10항 내지 제13항 중 어느 한 항에 있어서, 상기 대상체는 면역요법을 받았거나 받고 있는, 방법.
- 제14항에 있어서, 상기 면역요법은 PD-1, PD-L1 및/또는 CD80 기반 면역요법인, 방법.
- 제10항 내지 제15항 중 어느 한 항에 있어서, 상기 증가는 재발 전 상기 대상체에서의 sCD28 수준과 비교되는 것인, 방법.
- 제1항 내지 제16항 중 어느 한 항에 있어서, 상기 증가는 사전결정된 역치와 비교되는 것인, 방법.
- 제1항 내지 제17항 중 어느 한 항에 있어서, 상기 증가는 적어도 50%의 증가인, 방법.
- 제1항 내지 제18항 중 어느 한 항에 있어서, 상기 증가는 적어도 6ng/mL sCD28로의 증가인, 방법.
- 제1항 내지 제19항 중 어느 한 항에 있어서, 상기 증가는 적어도 1ng/ml sCD28의 증가인, 방법.
- 제1항 내지 제20항 중 어느 한 항에 있어서, 상기 측정은 상기 대상체로부터 샘플 수득 및 상기 샘플에서 sCD28 수준 측정을 포함하는, 방법.
- 제21항에 있어서, 상기 샘플은 혈액 샘플인, 방법.
- 제10항 내지 제22항 중 어느 한 항에 있어서, 상기 측정은 복수의 시점에서 측정을 포함하며, 여기서 적어도 하나의 시점은 상기 대상체가 관해이거나 암이 없는 것으로 공지된 시점이고, 적어도 하나의 시점은 대상체가 재발의 위험에 있는 시점인, 방법.
- 제23항에 있어서, 관해는 요법에 대한 부분 반응 및 완전 반응을 포함하는, 방법.
- 제23항 또는 제24항에 있어서, 상기 대상체가 관해이거나 암이 없는 것으로 공지된 상기 시점에서 sCD28 수준은 5ng/mL 미만인, 방법.
- 제10항 내지 제25항 중 어느 한 항에 있어서, 상기 방법의 수행 전의 상기 대상체는 6ng/mL 미만의 혈액 sCD28 수준을 갖는, 방법.
- 제1항 내지 제26항 중 어느 한 항에 있어서, 상기 암은 피부암, 요로상피암, 폐암 및 신장암으로부터 선택되는, 방법.
- 제27항에 있어서, 상기 암은 흑색종 및 요로상피암으로부터 선택되는, 방법.
- 제10항 내지 제28항 중 어느 한 항에 있어서, 임박은 다음(next) 20주 이내인, 방법.
- 제1항 내지 제29항 중 어느 한 항에 있어서, 암 재발로 진단되거나 예측되거나 상기 면역요법에 비-반응자인 것으로 결정된 대상체에게 또 다른 면역요법을 투여하는 것을 추가로 포함하는, 방법.
- 제30항에 있어서, 상기 면역요법은
a. 체크포인트 억제제;
b. 키메라 항원 수용체(CAR) 기반 요법; 및
c. 암 백신
으로부터 선택되는, 방법. - 제31항에 있어서, 상기 체크포인트 억제제는 PD-1 및/또는 PD-L1 기반 면역요법인, 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201962942276P | 2019-12-02 | 2019-12-02 | |
| US62/942,276 | 2019-12-02 | ||
| PCT/IL2020/051244 WO2021111442A1 (en) | 2019-12-02 | 2020-12-02 | Soluble cd28 levels during immunotherapy |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20220109443A true KR20220109443A (ko) | 2022-08-04 |
Family
ID=76222602
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020227022534A Withdrawn KR20220109443A (ko) | 2019-12-02 | 2020-12-02 | 면역요법 동안 가용성 cd28 수준 |
Country Status (10)
| Country | Link |
|---|---|
| US (1) | US20230035730A1 (ko) |
| EP (1) | EP4070099A4 (ko) |
| JP (2) | JP2023510427A (ko) |
| KR (1) | KR20220109443A (ko) |
| CN (1) | CN114902046A (ko) |
| AU (1) | AU2020394907A1 (ko) |
| BR (1) | BR112022010832A2 (ko) |
| CA (1) | CA3160220A1 (ko) |
| IL (1) | IL293557A (ko) |
| WO (1) | WO2021111442A1 (ko) |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20240099157A (ko) | 2021-09-06 | 2024-06-28 | 비온드 바이오로직스 엘티디 | Cd28 셰딩 차단제 |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4666828A (en) | 1984-08-15 | 1987-05-19 | The General Hospital Corporation | Test for Huntington's disease |
| US4683202A (en) | 1985-03-28 | 1987-07-28 | Cetus Corporation | Process for amplifying nucleic acid sequences |
| US4801531A (en) | 1985-04-17 | 1989-01-31 | Biotechnology Research Partners, Ltd. | Apo AI/CIII genomic polymorphisms predictive of atherosclerosis |
| US5272057A (en) | 1988-10-14 | 1993-12-21 | Georgetown University | Method of detecting a predisposition to cancer by the use of restriction fragment length polymorphism of the gene for human poly (ADP-ribose) polymerase |
| US5192659A (en) | 1989-08-25 | 1993-03-09 | Genetype Ag | Intron sequence analysis method for detection of adjacent and remote locus alleles as haplotypes |
| CN102735841B (zh) * | 2011-04-13 | 2014-11-05 | 苏州卫生职业技术学院 | 一种测定Graves病患者血液中可溶性CD28含量的方法 |
| CN112074539B (zh) * | 2018-03-15 | 2025-01-24 | 比昂生物制剂公司 | 降低可溶性免疫受体cd28的方法和组合物 |
-
2020
- 2020-12-02 KR KR1020227022534A patent/KR20220109443A/ko not_active Withdrawn
- 2020-12-02 BR BR112022010832A patent/BR112022010832A2/pt not_active Application Discontinuation
- 2020-12-02 JP JP2022545912A patent/JP2023510427A/ja active Pending
- 2020-12-02 AU AU2020394907A patent/AU2020394907A1/en not_active Abandoned
- 2020-12-02 CA CA3160220A patent/CA3160220A1/en active Pending
- 2020-12-02 CN CN202080090920.0A patent/CN114902046A/zh active Pending
- 2020-12-02 US US17/781,966 patent/US20230035730A1/en active Pending
- 2020-12-02 IL IL293557A patent/IL293557A/en unknown
- 2020-12-02 WO PCT/IL2020/051244 patent/WO2021111442A1/en not_active Ceased
- 2020-12-02 EP EP20894967.7A patent/EP4070099A4/en active Pending
-
2025
- 2025-02-14 JP JP2025022896A patent/JP2025076498A/ja active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| WO2021111442A1 (en) | 2021-06-10 |
| EP4070099A1 (en) | 2022-10-12 |
| JP2023510427A (ja) | 2023-03-13 |
| US20230035730A1 (en) | 2023-02-02 |
| BR112022010832A2 (pt) | 2022-08-23 |
| CA3160220A1 (en) | 2021-06-10 |
| CN114902046A (zh) | 2022-08-12 |
| JP2025076498A (ja) | 2025-05-15 |
| IL293557A (en) | 2022-08-01 |
| EP4070099A4 (en) | 2024-03-20 |
| AU2020394907A1 (en) | 2022-06-23 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP4327878A2 (en) | Combination of a cell therapy and an immunomodulatory compound | |
| CN113573719A (zh) | 治疗和t细胞调节的方法和组合 | |
| CN116003575A (zh) | 获得肿瘤特异性t细胞受体的方法 | |
| HK1225396A1 (zh) | 用於治疗癌症和病毒感染的免疫受体调节 | |
| CN113166972A (zh) | 新型免疫检查点抑制剂 | |
| EP3362074A2 (en) | Regulatory t cell pd-1 modulation for regulating t cell effector immune responses | |
| WO2019222188A1 (en) | Methods of treating cancer | |
| JP2023014162A (ja) | 抗cd47及び抗pd-l1による卵巣癌の処置 | |
| EP3215844A1 (en) | Methods for predicting and monitoring cancer patients' response to treatment by measuring myeloid derived suppressor cells (mdscs) | |
| KR102408161B1 (ko) | 대상체가 췌관 선암을 앓을 위험을 평가하기 위한 초기 및 비 침습적 방법 및 이러한 질환의 치료 방법 | |
| WO2016141312A1 (en) | Beta-catenin inhibitors in cancer immunotherapy | |
| US20230037966A1 (en) | Source specific exosomes for determining avoidance of cancer treatment and avoidance of checkpoint inhibitor therapies | |
| JP2025076498A (ja) | 免疫療法中の可溶性cd28レベル | |
| EP3762105A1 (en) | Inhibitor of setdb1 histone methyltransferase for use in cancer combination therapy | |
| WO2014167529A1 (en) | Methods and compositions for preventing and treating atherosclerosis | |
| US20180244750A1 (en) | Methods for treatment of cancer | |
| US20180038865A1 (en) | Cd9 as a therapeutic target for hematologic malignancies | |
| Gu et al. | EGFR: new insights on its activation and mutation in tumor and tumor immunotherapy | |
| WO2023170170A9 (en) | New chimeric antigen receptor (car) cells and medical uses thereof | |
| WO2019164870A1 (en) | Expression of signature mrnas for identifying patients responsive to anti-pd-l1 antibody therapy | |
| NL2019156B1 (en) | Treatment of haematological malignancies | |
| WO2024249366A1 (en) | Treatment of cancer with drq polypeptides | |
| Liu et al. | Inhibitory Effects of Circulating Natural Autoantibodies to CD47-derived Peptides on Oral Squamous Cell Carcinoma Cells | |
| WO2024040681A1 (zh) | Car-t细胞及其在非小细胞肺癌治疗中的应用 | |
| WO2023019129A1 (en) | Biomarkers for cd40 agonist therapy |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PA0105 | International application |
St.27 status event code: A-0-1-A10-A15-nap-PA0105 |
|
| PG1501 | Laying open of application |
St.27 status event code: A-1-1-Q10-Q12-nap-PG1501 |
|
| PC1203 | Withdrawal of no request for examination |
St.27 status event code: N-1-6-B10-B12-nap-PC1203 |
|
| R18-X000 | Changes to party contact information recorded |
St.27 status event code: A-3-3-R10-R18-oth-X000 |