KR20200032162A - 항-bst-1 항체 및 시티딘 유사체를 포함하는 약학적 조합물 - Google Patents
항-bst-1 항체 및 시티딘 유사체를 포함하는 약학적 조합물 Download PDFInfo
- Publication number
- KR20200032162A KR20200032162A KR1020207005030A KR20207005030A KR20200032162A KR 20200032162 A KR20200032162 A KR 20200032162A KR 1020207005030 A KR1020207005030 A KR 1020207005030A KR 20207005030 A KR20207005030 A KR 20207005030A KR 20200032162 A KR20200032162 A KR 20200032162A
- Authority
- KR
- South Korea
- Prior art keywords
- antibody
- bst1
- cancer
- antibodies
- seq
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2896—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against molecules with a "CD"-designation, not provided for elsewhere
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7042—Compounds having saccharide radicals and heterocyclic rings
- A61K31/7052—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides
- A61K31/706—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2809—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against the T-cell receptor (TcR)-CD3 complex
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/31—Immunoglobulins specific features characterized by aspects of specificity or valency multispecific
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/40—Immunoglobulins specific features characterized by post-translational modification
- C07K2317/41—Glycosylation, sialylation, or fucosylation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
- C07K2317/732—Antibody-dependent cellular cytotoxicity [ADCC]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/77—Internalization into the cell
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Immunology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Organic Chemistry (AREA)
- Epidemiology (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Mycology (AREA)
- Endocrinology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Microbiology (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Peptides Or Proteins (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Saccharide Compounds (AREA)
Abstract
본 발명은 BST1 (ADP-리보실 사이클라제 2)에 대한 항체를 시티딘 유사체 또는 이의 약제학적으로 허용가능한 염과 함께 포함하는 약학적 조합물, 및 BST1 (ADP-리보실 사이클라제 2) 발현/활성에 의해 매개되거나 및/또는 BST1의 비정상적인 발현/활성과 관련있는 암과 같은 질환의 치료 방법에 관한 것이다.
Description
본원은 면역학 및 분자 생물학 분야에 관한 것이다. 보다 상세하게는, 본 발명은 BST1 (ADP-리보실 사이클라제 2)에 대한 항체 및 시티딘 유사체 또는 이의 약제학적으로 허용가능한 염을 포함하는 약학적 조합물, 및 BST1 (ADP-리보실 사이클라제 2) 발현/활성에 의해 매개되거나 및/또는 BST1의 비정상적인 발현/활성과 관련있는 암과 같은 질환의 치료 방법을 제공한다.
백혈병 및 림프종은 혈액, 골수 및 림프계에 발병하는 광범위한 종양 군에 속하며, 조혈 및 림프 조직 종양으로도 알려져 있다.
림프종은 림프구에서 발병하는 일 군의 혈액 세포 종양이다. 징후 및 증상으로는 림프절 비대, 열, 과도한 발한, 의도하지 않은 체중 감소, 가려움 및 지속적인 피로감 등이 있을 수 있다. 림프종에는 여러가지 서브타입들이 존재한다: 림프종의 주요 범주 2가지는 호지킨 림프종 (HL)과 비-호지킨 림프종 (NHL)이다. 세계보건기구 (WHO)에서는 림프종의 유형으로서 또 다른 2가지 범주, 다발성 골수종 및 면역증식성 질환을 포함한다. 림프종의 약 90%가 비-호지킨 림프종이다.
백혈병은 일반적으로 골수에서 시작해, 많은 수의 비정상적인 백혈구를 만드는 일 군의 암이다. 그 증상으로는 출혈 및 타박상 현상, 피로감, 열 및 감염 위험성 증가 등이 있을 수 있다. 이러한 증상들은 정상적인 혈액 세포의 부족으로 인해 발생한다. 진단은 전형적으로 혈액 검사 또는 골수 생검에 의해 이루어진다. 백혈병의 주된 4가지 타입으로는 급성 림프모구성 백혈병 (ALL), 급성 골수성 백혈병 (AML), 만성 림프성 백혈병 (CLL) 및 만성 골수성 백혈병 (CML)이 있으며, 또한 몇가지 드문 타입도 존재한다.
백혈병 및 림프종의 치료는 화학요법, 방사선 치료, 표적 치료 및 수술 (백혈병의 경우, 골수 이식) 중 한가지 이상을 수반할 수 있다. 백혈병 치료의 성공은 백혈병의 타입과 개체의 나이에 좌우된다. 림프종 치료 성과는 서브타입에 따라 달라지며, 일부는 치유가능하지만, 대부분 생존 연장 치료이다.
백혈병을 치료하기 위해 프레드니손 (prednisone), 빈크리스틴 (vincristine), 안트라사이클린 (anthracycline), L-아스파라기나제, 사이클로포스파미드 (cyclophosphamide), 메토트렉세이트 (methotrexate), 6-머캅토퓨린, 플루다라빈 (fludarabine), 펜토스타틴 (pentostatin) 및 클라드리빈 (cladribine) 등의 다수 화학치료 물질들이 기존에 사용되어 왔다. 림프종을 치료하기 위한 화학치료 물질로는 사이클로포스파미드 (cyclophosphamide), 하이드록시다우노루비신 (daunorubicin) (독소루비신 또는 아드리아마이신 (adriamycin)이라고도 알려짐), 온코빈 (oncovin) (빈크리스틴), 프레드니손, 프레드니솔론 (prednisolone), 블레오마이신 (bleomycin), 다카르바진 (dacarbazine), 에토포시드 (etoposide) 및 프로카바진 (procarbazine) 등이 있다.
병용 화학요법 (combination chemotherapy)은 서로 다른 약물 2종 이상을 동시에 사용해 환자를 치료하는 것을 포함한다. 약물은 기전 및 부작용 측면에서 서로 다를 수 있다. 이의 가장 큰 장점은 어떤 한가지 제제에 대한 내성 발생 가능성을 최소화한다는 것이다. 아울러, 약물을 대개 저 용량으로 사용할 수 있어, 독성을 줄일 수 있다. 호지킨 질환을 치료하기 위한 병용 요법은 MOPP (무스틴 (mustine), 빈크리스틴, 프로카바진, 프레드니솔론 및 ABVD (독소루비신 (doxorubicin), 블레오마이신 (bleomycin), 빈블라스틴, 다카르바진)을 포함한다. 비-호지킨 림프종을 치료하기 위한 병용 요법은 CHOP (사이클로포스파미드 (cyclophosphamide), 독소루비신, 빈크리스틴, 프레드니솔론)을 포함한다. 백혈병 및 림프종 치료용으로 알려진 약물의 수를 감안하면, 가능한 약물 치료의 치환 및 조합들이 매우 많다. 아울러, 전술한 병용 요법은 항체를 포함하지 않는다.
하지만, 백혈병 및 림프종에 대한 새로운 치료학적 물질, 특히 효과적인 병용 요법이 여전히 필요한 실정이다.
골수 기질 항원 1 (Bone marrow stromal antigen 1, BST1)은 ADP-리보실 사이클라제 2 또는 CD157으로도 알려져 있으며, 리보뉴클레오티드 고리화 및 가수분해를 촉매하는 지질-고정된, 2 기능성 엑토자임 (ectoenzyme)이다. 이것은, 칼슘 방출 및 단백질 인산화를 활성화할 수 있는 뉴클레오티드 2차 메신저 사이클릭 ADP-리보스 및 ADP-리보스를 생성한다 (FEBS Lett. 1994, 356(2-3):244-8). 또한, 이것은, 잠재적으로는 NAD+ 대사산물의 생성을 통해, 파라크린 방식으로 pre-B 세포의 증식을 뒷받침할 수 있다 (Proc. Natl. Acad. Sci. USA 1994, 91:5325-5329; J. Biol. Chem. 2005, 280:5343-5349).
ADP-리보실 사이클라제 2 및 그 유사체, 즉 CD38은, 수용체로 작용하여, 리아노딘 수용체를 통해 세포내 Ca2 + 방출을 유도하는 제2 메신저 대사산물을 만드는 것으로 보인다 (Biochem. Biophys. Res. Commun. 1996, 228(3):838-45). 또한, 이는 CD11b 인테그린을 통해 작용하여, PI-3 키나제 경로를 경유하여 Ca2 + 방출에 작용할 수 있다 (J. Biol. Regul. Homeost. Agents. 2007;21(1-2):5-11).
WO2013/003625에는 항-BST1 항체 및 다양한 암 치료에서의 이의 용도가 개시되어 있다.
5-아자-시티딘 및 5-아자-2'-데옥시시티딘은 골수이형성 증후군 치료에 현재 사용되고 있는 시티딘 유사체이다.
본원에서는, (i) 특정 항-BST1 항체와 5-아자-시티딘의 조합, 및 (ii) 특정 항-BST1 항체와 5-아자-2'-데옥시시티딘의 조합이 백혈병 및 BST1의 발현과 관련된 기타 암을 치료하는데 상승적으로 작용한다는 것을, 알게 되었다.
본원은 (A) BST1에 대한 항체 및 (B) 시티딘 유사체 또는 이의 약제학적으로 허용가능한 염을 포함하는 약학적 조합물, 및 BST1 매개 장애와 같은 질환, 예를 들어, 이하 '본 발명의 질환'으로 지칭되는, 급성 골수성 백혈병 (AML), B 세포 만성 림프성 백혈병, 유방암, 결장직장암, 신장암, 두경부암, 폐암, 난소암, 췌장암 등의 인간 암의 치료 방법을 제공한다.
일 구현예에서, 약학적 조합물은,
(A)
서열번호 2에 나타낸 아미노산 서열을 포함하는 중쇄 가변 영역 및 서열번호 4에 나타낸 아미노산 서열을 포함하는 경쇄 가변 영역을 포함하는 항체와, BST1 결합에 대해 경쟁하는, 항-BST1 항체, 또는 이의 항원-결합 영역;
또는
a) i) 서열번호 10과 80% 이상 동일한 서열을 포함하는 제1 CDR;
ii) 서열번호 12 또는 서열번호 51과 80% 이상 동일한 서열을 포함하는 제2 CDR;
iii) 서열번호 14와 80% 이상 동일한 서열을 포함하는 제3 CDR
을 포함하는 중쇄 가변 영역; 및
b) i) 서열번호 16과 80% 이상 동일한 서열을 포함하는 제1 CDR;
ii) 서열번호 18과 80% 이상 동일한 서열을 포함하는 제2 CDR;
iii) 서열번호 20과 80% 이상 동일한 서열을 포함하는 제3 CDR
을 포함하는 경쇄 가변 영역
을 포함하며, 선택적으로, 상기 서열번호들 중 임의의 하나 이상이 독립적으로 1, 2, 3, 4 또는 5개의 아미노산 치환, 부가 또는 결손을 포함하는,
단리된 항-BST1 항체, 또는 이의 항원-결합 영역;
및
(B) 시티딘 유사체 또는 이의 약제학적으로 허용가능한 염을 포함하며,
약학적 조합물은, 바람직하게는, 암 치료시 동시적인, 개별적으로 또는 순차적으로 사용하기 위한 조합 제제 (combined preparation) 형태이다.
바람직하게는, 시티딘 유사체는 5-아자-시티딘 또는 5-아자-2'-데옥시시티딘이다. 5-아자-시티딘은, DNA 및 RNA 형태의 뉴클레오시드로서 시티딘의 화학적 유사체이다. 이것은 하기 구조를 가진다:
5-아자-시티딘은 또한 상품명 비다자 (Vidaza) 및 아자딘 (Azadine)으로도 알려져 있다.
5-아자-2'-데옥시시티딘은 또한 시티딘의 화학적 유사체이다. 이것은 하기의 구조를 가진다:
5-아자-2'-데옥시시티딘은 데시타빈 (Decitabine) 및 상품명 다코젠 (Dacogen)으로도 알려져 있다.
본 발명의 항체에 의해 인지되는 에피토프(들)는 서열번호 44의 폴리펩타이드 서열 내에 존재한다.
추가적인 구현예에서, 단리된 항-BST1 항체는 서열번호 2로 표시되는 중쇄 가변 영역 서열과 서열번호 4로 표시되는 경쇄 가변 영역 서열을 가진다.
다른 구현예에서, 단리된 항-BST1 항체는 서열번호 46으로 표시되는 중쇄 가변 영역 서열과 서열번호 49로 표시되는 경쇄 가변 영역 서열을 가진다.
일 구현예에서, 임의의 전술한 항체는 Fc 도메인을 가진다. 일부 구현예에서, Fc 도메인은 인간 유래이다. 다른 구현예들에서, Fc 도메인의 가변성 인간 Fc 도메인이다.
다른 구현예에서, 임의의 전술한 항체는 단일클론 항체이다.
일 구현예에서, 임의의 전술한 항체는 접합 물질 (conjugated agent)을 추가로 포함한다. 일부 구현예에서, 접합 물질은 세포독성 물질이다. 다른 구현예들에서, 접합 물질은 폴리머이다. 다른 구현예에서, 폴리머는 폴리에틸렌 글리콜 (PEG)이다. 다른 구현예에서, PEG는 PEG 유도체이다.
일 구현예에서, 단리된 항체는 BST1에의 결합에 대해 BST1_A2와 경쟁하는 항체이다.
임의의 전술한 항-BST1 항체는 약학적 조성물에 제공될 수 있다.
다른 구현예에서, 본 발명은, 본 발명의 약학적 조합물의 구성성분 (A) 및 (B)를 치료학적 유효량으로 필요한 개체에 동시, 개별 또는 순차적으로 투여하는 것을 포함하는, BST1과 관련된 질환 또는 BST1을 발현하는 타겟 세포와 관련된 질환, 바람직하게는 암, 더 바람직하게, 인간 암을 치료 또는 예방하는 방법을 제공한다.
일부 구현예에서, 항체는 IgG1, IgG2, IgG3, 또는 IgG4 이소형의 전장 항체이다.
일부 구현예에서, 항체는 전체 항체, 항체 단편, 인간화 항체, 단쇄 항체, 면역접합체, 탈푸코시화 항체 (defucosylated antibody) 및 2중 특이성 항체로 이루어진 군으로부터 선택된다. 항체 단편은 UniBody, 도메인 항체 및 나노바디로 이루어진 군으로부터 선택될 수 있다. 일부 구현예에서, 본 발명의 면역접합체는 치료학적 물질을 포함한다. 본 발명의 다른 측면에서, 치료학적 물질은 세포독소 또는 방사성 동위원소이다.
일부 구현예에서, 항체는 Affibody, DARPin, Anticalin, Avimer, Versabody 및 Duocalin으로 이루어진 군으로부터 선택된다.
대안적인 구현예에서, 본 발명의 약학적 조합물은 항체 또는 이의 항원-결합 영역 및 약제학적으로 허용가능한 담체를 포함한다.
일부 구현예에서, 본 발명은, 인간 BST1의 에피토프에 결합하는 항체 또는 이의 항원-결합 영역의 중쇄 및/또는 경쇄를 코딩하는 단리된 핵산을 포함하는 하나 이상의 발현 벡터, 및 시티딘 유사체, 바람직하게는 5-아자-시티딘 또는 5-아자-2'-데옥시시티딘 또는 이의 약제학적으로 허용가능한 염을 포함하는 키트를 포함한다.
다른 구현예들에서, 본 발명은 BST1을 발현하는 타겟 세포와 관련된 질환을 치료 또는 예방하는데 사용하기 위한 본 발명의 약학적 조합물에 관한 것이다. 일부 측면에서, 치료 또는 예방되는 질환은 암, 바람직하게는 인간 암이다. 일부 구현예에서, 본 발명의 항체에 의해 치료 또는 예방되는 질환은 본 발명의 질환이다.
다른 구현예들에서, 본 발명은 BST1을 발현하는 타겟 세포와 관련된 질환의 치료 또는 예방을 위해 동시, 개별 또는 순차적으로 사용하기 위한 약학적 조합물의 제조에 있어, 본 발명의 약학적 조합물의 구성성분 (A) 및 (B)의 용도에 관한 것이다. 일부 측면에서, 치료 또는 예방되는 질환은 암, 바람직하게는 인간 암이다.
바람직한 구현예에서, 본 발명의 약학적 조합물은 급성 골수성 백혈병 (AML), B 세포 만성 림프성 백혈병, 유방암, 결장직장암, 신장암, 두경부암, 폐암, 난소암 및/또는 췌장암, 바람직하게는 급성 골수성 백혈병 (AML)을 치료 또는 예방하는데 사용될 수 있다.
본 발명의 일부 측면에서, 항체 또는 이의 항원-결합 영역은, 서열번호 2에 기재된 아미노산 서열을 포함하는 중쇄 가변 영역과 서열번호 4에 기재된 아미노산 서열을 포함하는 경쇄 가변 영역을 포함하는 항체에 의해 인지되는, 서열번호 44의 아미노산 서열을 가진, BST1 폴리펩타이드 상의 에피토프에 결합한다.
본 발명의 다른 측면들과 이점은 아래 상세한 설명 및 실시예에서 명확해질 것이나, 이들로 제한되는 것으로 해석되어서는 안된다. 본 출원 전체에서 인용된 모든 참조문헌, 유전자은행 엔트리, 특허 및 공개된 특허 출원들의 내용은 원용에 의해 본 명세서에 명확하게 포함된다.
도 1a는 A1의 중쇄 CDR1 영역의 뉴클레오티드 서열 (서열번호 21)과 마우스 생식세포계열 VH 1-80 뉴클레오티드 서열의 뉴클레오티드 138392-138424 (서열번호 33)의 정렬; A2의 중쇄 CDR1 영역의 뉴클레오티드 서열 (서열번호 22)과 마우스 생식세포계열 VH 1-39 뉴클레오티드 서열의 뉴클레오티드 153362-153394 (서열번호 35)의 정렬을 도시한 것이다.
도 1b는 A1의 중쇄 CDR2 영역의 뉴클레오티드 서열 (서열번호 23)과 마우스 생식세포계열 VH 1-80 뉴클레오티드 서열의 뉴클레오티드 138461-138511 (서열번호 34)의 정렬; A2의 중쇄 CDR2 영역의 뉴클레오티드 서열 (서열번호 24)과 마우스 생식세포계열 VH 1-39 뉴클레오티드 서열의 뉴클레오티드 153431-153481 (서열번호 36)의 정렬을 도시한 것이다.
도 2a는 A1의 경쇄 CDR1 영역의 뉴클레오티드 서열 (서열번호 27)과 마우스 생식세포계열 VK 4-74 뉴클레오티드 서열의 뉴클레오티드 496-531 (서열번호 37)의 정렬; A2의 경쇄 CDR1 영역의 뉴클레오티드 서열 (서열번호 28)과 마우스 생식세포계열 VK 4-55 뉴클레오티드 서열의 뉴클레오티드 523-552 (서열번호 40)의 정렬을 도시한 것이다.
도 2b는 A1의 경쇄 CDR2 영역의 뉴클레오티드 서열 (서열번호 29)과 마우스 생식세포계열 VK 4-74 뉴클레오티드 서열의 뉴클레오티드 577-597 (서열번호 38)의 정렬; A2의 경쇄 CDR2 영역의 뉴클레오티드 서열 (서열번호 30)과 마우스 생식세포계열 VK 4-55 뉴클레오티드 서열의 뉴클레오티드 598-618 (서열번호 41)의 정렬을 도시한 것이다.
도 2c는 A1의 경쇄 CDR3 영역의 뉴클레오티드 서열 (서열번호 31)과 마우스 생식세포계열 VK 4-74 뉴클레오티드 서열의 뉴클레오티드 691-718 (서열번호 39)의 정렬; A2의 경쇄 CDR3 영역의 뉴클레오티드 서열 (서열번호 32)과 마우스 생식세포계열 VK 4-55 뉴클레오티드 서열의 뉴클레오티드 715-739 (서열번호 42)의 정렬을 도시한 것이다.
도 3a 및 3b는 A549 및 H226 세포에서의 BST1 유세포 분석 결과를 나타낸 것이다.
도 4a 및 4b는 MabZAP 분석을 이용한 A549 및 H226 세포에 의한 항-BST1 단일클론 항체의 내재화를 나타낸 것이다.
도 5는 서열번호 2의 잔기 21-137 (서열번호 45)을, 인간 생식세포계열 BF238102 VH에 대응되는 위치에서 전위된 서열번호 2의 CDR 영역 (진하게 강조 표시됨)을 가진 인간화 VH 쇄 (서열번호 46) 및 인간 생식세포계열 BF238102 VH (서열번호 47)와 정렬한 것이다. 잔기들은 대응되는 인간 잔기에 대해 치환된 CDR 영역들과 유의한 접촉을 나타낸다. 이러한 치환 (밑줄 표시됨)은 30, 48, 67, 71 및 100번 위치에서 이루어졌다.
도 6은 서열번호 4의 잔기 22-128 (서열번호 48), 인간 생식세포계열 X72441 VL에 대응되는 위치로 전위된 서열번호 4의 CDR 영역 (진하게 강조 표시됨)을 가진 인간화 VL 쇄 (서열번호 49) 및 인간 생식세포계열 X72441 VL (서열번호 50)을 정렬한 것이다. 잔기들은 대응되는 인간 잔기에 대해 치환된 CDR 영역들과 유의한 접촉을 나타낸다. 이러한 치환 (밑줄 표시됨)은 71번 위치에서 이루어졌다.
도 7은 A2 중쇄의 CDR2 영역 (서열번호 12)을 항원-결합 친화성의 소실 없이 가능한 아미노산 치환 (서열번호 51)과 정렬한 것이다.
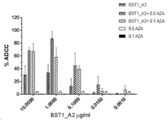
도 8은 BST1_A2 및 BST1_A2_NF가 작동자 세포의 존재 하에 항체 의존적인 세포 세포독성 (ADCC) 반응을 유발함을 나타낸 것이다.
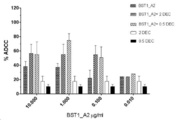
도 9는 K052 세포에서 BST1_A2 + 5-아자시티딘에 의해 유도된 ADCC 수준을 나타낸 것이다.
도 10은 SKNO1 세포에서 BST1_A2 + 5-아자시티딘에 의해 유도된 ADCC 수준을 나타낸 것이다.
도 11은 SKNO1 세포에서 BST1_A2 + 데시타빈에 의해 유도된 ADCC 수준을 나타낸 것이다.
도 12는 HL60 세포에서 BST1_A2 + 데시타빈에 의해 유도된 ADCC 수준을 나타낸 것이다.
도 1b는 A1의 중쇄 CDR2 영역의 뉴클레오티드 서열 (서열번호 23)과 마우스 생식세포계열 VH 1-80 뉴클레오티드 서열의 뉴클레오티드 138461-138511 (서열번호 34)의 정렬; A2의 중쇄 CDR2 영역의 뉴클레오티드 서열 (서열번호 24)과 마우스 생식세포계열 VH 1-39 뉴클레오티드 서열의 뉴클레오티드 153431-153481 (서열번호 36)의 정렬을 도시한 것이다.
도 2a는 A1의 경쇄 CDR1 영역의 뉴클레오티드 서열 (서열번호 27)과 마우스 생식세포계열 VK 4-74 뉴클레오티드 서열의 뉴클레오티드 496-531 (서열번호 37)의 정렬; A2의 경쇄 CDR1 영역의 뉴클레오티드 서열 (서열번호 28)과 마우스 생식세포계열 VK 4-55 뉴클레오티드 서열의 뉴클레오티드 523-552 (서열번호 40)의 정렬을 도시한 것이다.
도 2b는 A1의 경쇄 CDR2 영역의 뉴클레오티드 서열 (서열번호 29)과 마우스 생식세포계열 VK 4-74 뉴클레오티드 서열의 뉴클레오티드 577-597 (서열번호 38)의 정렬; A2의 경쇄 CDR2 영역의 뉴클레오티드 서열 (서열번호 30)과 마우스 생식세포계열 VK 4-55 뉴클레오티드 서열의 뉴클레오티드 598-618 (서열번호 41)의 정렬을 도시한 것이다.
도 2c는 A1의 경쇄 CDR3 영역의 뉴클레오티드 서열 (서열번호 31)과 마우스 생식세포계열 VK 4-74 뉴클레오티드 서열의 뉴클레오티드 691-718 (서열번호 39)의 정렬; A2의 경쇄 CDR3 영역의 뉴클레오티드 서열 (서열번호 32)과 마우스 생식세포계열 VK 4-55 뉴클레오티드 서열의 뉴클레오티드 715-739 (서열번호 42)의 정렬을 도시한 것이다.
도 3a 및 3b는 A549 및 H226 세포에서의 BST1 유세포 분석 결과를 나타낸 것이다.
도 4a 및 4b는 MabZAP 분석을 이용한 A549 및 H226 세포에 의한 항-BST1 단일클론 항체의 내재화를 나타낸 것이다.
도 5는 서열번호 2의 잔기 21-137 (서열번호 45)을, 인간 생식세포계열 BF238102 VH에 대응되는 위치에서 전위된 서열번호 2의 CDR 영역 (진하게 강조 표시됨)을 가진 인간화 VH 쇄 (서열번호 46) 및 인간 생식세포계열 BF238102 VH (서열번호 47)와 정렬한 것이다. 잔기들은 대응되는 인간 잔기에 대해 치환된 CDR 영역들과 유의한 접촉을 나타낸다. 이러한 치환 (밑줄 표시됨)은 30, 48, 67, 71 및 100번 위치에서 이루어졌다.
도 6은 서열번호 4의 잔기 22-128 (서열번호 48), 인간 생식세포계열 X72441 VL에 대응되는 위치로 전위된 서열번호 4의 CDR 영역 (진하게 강조 표시됨)을 가진 인간화 VL 쇄 (서열번호 49) 및 인간 생식세포계열 X72441 VL (서열번호 50)을 정렬한 것이다. 잔기들은 대응되는 인간 잔기에 대해 치환된 CDR 영역들과 유의한 접촉을 나타낸다. 이러한 치환 (밑줄 표시됨)은 71번 위치에서 이루어졌다.
도 7은 A2 중쇄의 CDR2 영역 (서열번호 12)을 항원-결합 친화성의 소실 없이 가능한 아미노산 치환 (서열번호 51)과 정렬한 것이다.
도 8은 BST1_A2 및 BST1_A2_NF가 작동자 세포의 존재 하에 항체 의존적인 세포 세포독성 (ADCC) 반응을 유발함을 나타낸 것이다.
도 9는 K052 세포에서 BST1_A2 + 5-아자시티딘에 의해 유도된 ADCC 수준을 나타낸 것이다.
도 10은 SKNO1 세포에서 BST1_A2 + 5-아자시티딘에 의해 유도된 ADCC 수준을 나타낸 것이다.
도 11은 SKNO1 세포에서 BST1_A2 + 데시타빈에 의해 유도된 ADCC 수준을 나타낸 것이다.
도 12는 HL60 세포에서 BST1_A2 + 데시타빈에 의해 유도된 ADCC 수준을 나타낸 것이다.
본 발명을 보다 용이하게 이해할 수 있도록 먼저 특정 용어들을 정의한다. 추가적인 정의는 상세한 설명 전반에 걸쳐 기술된다.
본원에 기술된 인간화 및 뮤라인 항체는, 특정 경우에, 인간 이외의 다른 종으로부터 유래된 BST1과 교차-반응할 수 있다. 특정 구현예에서, 항체는 하나 이상의 인간 BST1에 대해 완전히 특이적일 수 있으며, 인간 이외의 종 또는 다른 타입에 대해 교차-반응성을 나타내지 않을 수 있다.
용어 "면역 반응"은 병원체가 침입한 인간 신체, 병원체로 감염된 세포 또는 조직, 암성 세포, 또는 자가면역 또는 병리학적 염증의 경우 정상 인간 세포 또는 조직에 대한 선택적인 손상, 파괴 또는 소거를 야기하는, 예를 들어 림프구, 항원 제시 세포, 식세포, 과립구 및 이들 세포 또는 간에 의해 생산된 가용성 거대분자 (항체, 사이토카인 및 보체 등)의 작용을 의미한다.
"신호 전달 경로"는 신호를 세포의 한 영역에서 세포의 또 다른 영역으로 전달하는데 소정의 역할을 수행하는 다양한 신호 전달 분자들간의 생화학적 관계를 지칭한다. 본원에서, 표현 "세포 표면 수용체"는 예를 들어 신호를 수신하여 그 신호를 세포의 원형질 막을 통과해 전달할 수 있는 분자 및 분자 복합체를 포함한다. "세포 표면 수용체"의 예는 BST1이다.
본원에서 언급되는 용어 "항체"는 적어도 면역글로불린의 항원 결합 단편 (즉, "항원-결합 영역")을 포함한다.
"항체"의 정의는 각각 전장 항체, 항체 단편, 단쇄 항체, 이중 특이성 항체, 미니바디, 도메인 항체, 합성 항체 (본원에서 때때로 "항체 모방체"로 지칭됨), 키메라 항체, 인간화 항체, 항체 융합체 (때때로 "항체 접합체"로 지칭됨), 및 이들 각각의 단편 및/또는 유도체를 포함하나, 이들로 제한되는 것은 아니다. 일반적으로, 전장 항체 (본원에서 때때로 "전체 항체"로 지칭됨)는 이황화 결합에 의해 상호-연결된 적어도 2개의 중쇄 (H) 및 2개의 경쇄 (L)를 포함할 수 있는 당단백질을 지칭한다. 각각의 중쇄는 중쇄 가변 영역 (이하, VH로 약칭함)과 중쇄 불변 영역으로 구성된다. 중쇄 불변 영역은 3개의 도메인 CH1, CH2 및 CH3로 구성된다. 각각의 경쇄는 경쇄 가변 영역 (이하, VL 또는 VK로 약칭함)과 경쇄 불변 영역으로 구성된다. 경쇄 불변 영역은 1개의 도메인 CL로 구성된다. VH 및 VL / VK 영역은 프레임워크 영역 (FR)으로 지칭되는 보존적인 영역이 사이에 배치된, 상보성 결정 영역 (CDR)으로 지칭되는 과가변성 영역으로 보다 세분될 수 있다. 각각의 VH 및 VL / VK는 아미노-말단에서 카르복시-말단으로 방향으로 다음과 같은 순서로 배열된 3개의 CDR과 4개의 FR로 구성된다: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. 중쇄 및 경쇄의 가변 영역은 항원과 상호작용하는 결합 도메인을 포함한다. 항체의 불변 영역은 숙주 조직 또는 인자, 예를 들어 면역계의 다양한 세포 (예, 작동자 세포) 및 고전적 보체 시스템의 제1 성분 (Clq)에 대한 면역글로불린의 결합을 매개할 수 있다.
일 구현예에서, 항체는 항체 단편이다. 특정 항체 단편은, (i) VL, VH, CL 및 CH1 도메인으로 이루어진 Fab 단편, (ii) VH 및 CH1 도메인으로 이루어진 Fd 단편, (iii) 단일 항체의 VL 및 VH 도메인으로 이루어진 Fv 단편, (iv) 단일 가변성 도메인으로 이루어진 dAb 단편, (v) 단리된 CDR 영역, (vi) F(ab')2 단편, 즉 연결된 2개의 Fab 단편을 포함하는 2가 단편, (vii) 2개의 도메인을 결합시켜 항원 결합부가 형성하는 펩타이드 링커에 의해 VH 도메인과 VL 도메인이 연결된, 단쇄 Fv 분자 (scFv), (viii) 2중 특이성 단쇄 Fv 이량체, 및 (ix) 유전자 융합에 의해 구축된 다가 또는 다중특이성 단편인 "디아바디" 또는 "트리아바디"를 포함하지만, 이들로 제한되는 것은 아니다. 항체 단편은 변형될 수 있다. 예를 들어, 분자는 VH 및 VL 도메인을 연결하는 이황화 결합을 통해 안정될 수 있다. 항체 포맷 및 구조의 예는 Holliger & Hudson (2006) Nature Biotechnology 23(9):1126-1136, 및 Carter (2006) Nature Reviews Immunology 6:343-357과, 이들에 인용된 참고문헌에 기술되어 있으며, 이들 문헌들 모두 명확하게 원용에 의해 본 명세서에 포함된다.
본원은 항체 유사체를 제공한다. 이러한 유사체는, 비-제한적으로, 각각 전장 항체, 항체 단편, 2중 특이성 항체, 미니바디, 도메인 항체, 합성 항체 (본원에서 때때로 "항체 모방체"로 지칭됨), 항체 융합체, 항체 접합체 및 이들 각각의 단편 등의, 다양한 구조체를 포함할 수 있다.
일 구현예에서, 면역글로불린은 항체 단편을 포함한다. 특이적인 항체 단편은, 비-제한적으로, (i) VL, VH, CL 및 CH1 도메인으로 이루어진 Fab 단편, (ii) VH 및 CH1 도메인으로 이루어진 Fd 단편, (iii) 단일 항체의 VL 및 VH 도메인으로 이루어진 Fv 단편, (iv) 단일 가변 도메인으로 이루어진 dAb 단편, (v) 단리된 CDR 영역, (vi) F(ab')2 단편, 즉 연결된 2개의 Fab 단편을 포함하는 2가 단편, (vii) 2개의 도메인을 결합시켜 항원 결합 부위를 형성시키는 펩타이드 링커에 의해 VH 도메인과 VL 도메인이 연결된, 단쇄 Fv 분자 (scFv), (viii) 2중 특이성 단쇄 Fv 다이머, 및 (ix) "디아바디" 또는 "트리아바디", 즉 유전자 융합에 의해 구축된 다가 또는 다중 특이성 단편을 포함한다. 항체 단편은 변형될 수 있다. 예를 들어, 분자는 VH 및 VL 도메인을 연결하는 이황화 결합에 의해 안정될 수 있다. 항체 포맷 및 구조의 예는 문헌 Holliger & Hudson, 2006, Nature Biotechnology 23(9):1126-1136, 및 Carter 2006, Nature Reviews Immunology 6:343-357과, 여기에 인용된 참고문헌에 기술되어 있으며, 이들 문헌들 모두 명확하게 원용에 의해 본 명세서에 포함된다.
예를 들어, 인간에서 인지되는 면역글로불린 유전자는, 다수의 가변 영역 유전자 및 IgM, IgD, IgG (IgG1, IgG2, IgG3 및 IgG4), IgE 및 IgA (IgA1 및 IgA2) 이소형 각각을 각각 코딩하는 불변부 유전자 뮤 (υ), 델타 (δ), 감마 (γ), 시그마 (σ) 및 알파 (α)를 함께 포함하는, 카파 (κ), 람다 (λ) 및 중쇄 유전자좌를 포함한다. 본원에서, 항체는 전장 항체 및 항체 단편을 포함하는 것으로 의도되며, 임의의 유기체로부터의 천연 항체, 조작된 항체, 또는 실험적, 치료적 또는 다른 목적으로 재조합에 의해 생성된 항체를 지칭할 수 있다.
일 구현예에서, 본원에 개시된 항체는 다중 특이성 항체, 특히 때때로 "디아바디"로 지칭되는 2중 특이성 항체일 수 있다. 이들은 2개 (또는 더 많은 수)의 서로 다른 항원에 결합하는 항체이다. 디아바디는 당업계에 공지된 다양한 방식으로 제조될 수 있고, 예를 들어 화학적으로 또는 하이브리드 하이브리도마로부터 제조될 수 있다. 일 구현예에서, 항체는 미니바디이다. 미니바디는 CH3 도메인에 연결된 scFv를 포함하는 최소한의 항체-유사 단백질이다. 일부 경우에, scFv는 Fc 영역과 연결될 수 있고, 힌지 영역의 일부 또는 전체를 포함할 수 있다. 다중 특이성 항체에 대한 설명은 Holliger and Hudson (2006) Nature Biotechnology 23(9):1126-1136과 이 문헌에 인용된 참고문헌을 참조하며, 이들 문헌은 원용에 의해 본 명세서에 명확하게 포함된다.
본원에서, "CDR"은 항체 가변성 도메인의 "상보성 결정 영역"을 의미한다. CDR에 포함된 잔기에 대한 체계적인 식별은 카바트 (Kabat et al. (1991) Sequences of Proteins of Immunological Interest, 5th Ed., United States Public Health Service, National Institutes of Health, Bethesda), 그리고 대안적으로 코티아 (Chothia and Lesk (1987) J. Mol. Biol. 196: 901-917; Chothia et al. (1989) Nature 342: 877-883; Al-Lazikani et al. (1997) J. Mol. Biol. 273: 927-948)에 의해 개발되어 있다. 본 발명의 목적으로, CDR은 코티아에 의해 정의된 CDR보다 약간 더 작은 잔기 세트로 정의된다. VL CDR은 본원에서 27-32 (CDR1), 50-56 (CDR2) 및 91-97 (CDR3)번 위치의 잔기를 포함하는 것으로 정의되며, 이때 넘버링은 코티아에 따른다. 코티아 및 카바트에 의해 정의되는 VL CDR은 동일하기 때문에, 이들 VL CDR 위치의 넘버링은 또한 카바트에 따른다. VH CDR은 본원에서 27-33 (CDR1), 52-56 (CDR2) 및 95-102 (CDR3)번 위치의 잔기를 포함하는 것으로 정의되며, 이때 넘버링은 코티아에 따른다. 이들 VH CDR 위치는 카바트에 따른 27-35 (CDR1), 52-56 (CDR2) 및 95-102 (CDR3)번 위치에 해당된다.
당업자가 인지하는 바와 같이, 본원에 기술된 CDR은 또한 예를 들어 본원에 개시된 CDR을 다양한 프레임워크 영역에 역돌연변이 (backmutating)하는 경우, 변이체를 포함할 수 있다. 일반적으로, 각각의 CDR 변이체들 간의 아미노산 동일성은 본원에 표시된 서열에 대해 적어도 80%이고, 보다 전형적으로 바람직하게는 적어도 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 및 거의 100%로 동일성은 증가한다. 유사한 방식으로, 본원에서 식별되는 결합 단백질의 핵산 서열에 대한 "핵산 서열 동일성 퍼센트 (%)"는 항원 결합 단백질의 코딩 서열 내 뉴클레오티드 잔기와 동일한 후보 서열 내 뉴클레오티드 잔기의 백분율로 정의된다. 구체적인 방법은 중첩 스팬 (overlap span) 및 중첩 분율 (overlap fraction)이 각각 1 및 0.125인, 디폴트 파라미터로 설정된 WU-BLAST-2의 BLASTN 모듈을 사용하고, 필터는 선택하지 않는다.
일반적으로, 개별 변이체 CDR을 코딩하는 뉴클레오티드 서열과 본원에 표시된 뉴클레오티드 서열 간의 핵산 서열 동일성은 적어도 80%이고, 보다 전형적으로 바람직하게는 적어도 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% 또는 99%, 및 거의 100%로 동일성은 증가한다.
따라서, "CDR 변이체"는 본 발명의 parent CDR에 대해 지정된 상동성, 유사성 또는 동일성을 가진 것으로, 비-제한적으로, parent CDR의 특이성 및/또는 활성에 대해 적어도 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% 또는 99% 등의 생물학적 기능성을 공유한다.
아미노산 서열 변형을 도입하기 위한 부위 또는 영역은 미리 결정되지만, 돌연변이 그 자체가 미리 결정되어야 하는 것은 아니다. 예를 들어, 소정의 부위에서 돌연변이를 최적화하기 위해, 무작위적인 돌연변이 유발을 표적 코돈 또는 영역에서 수행할 수 있으며, 발현된 항원 결합 단백질 CDR 변이체를 대상으로 바람직한 활성의 최적의 조합을 스크리닝할 수 있다. 서열이 공지된 DNA 내 미리 결정된 부위에서 치환 돌연변이를 만들기 위한 기법, 예를 들어 M13 프라이머 돌연변이 유발 및 PCR 돌연변이 유발 방법은 널리 공지되어 있다. 돌연변이의 스크리닝은 본원에 기술된 바와 같이 항원 결합 단백질 활성 분석을 이용해 수행한다.
아미노산 치환은 전형적으로 단일 잔기의 치환이고; 상당히 더 큰 삽입도 허용될 수 있지만, 삽입은 통상적으로 아미노산 잔기 약 1 내지 약 20개일 것이다. 일부 경우에 결손이 더 높은 수준으로 이루어질 수도 있지만, 결손 범위는 아미노산 잔기 약 1 내지 약 20개이다.
치환, 결손, 삽입 또는 이들의 임의 조합을 이용해, 최종 유도체 또는 변이체를 달성할 수 있다. 일반적으로, 이들 변형은 분자의 변이, 특히 항원 결합 단백질의 면역원성 및 특이성의 변이를 최소화하도록 수개의 아미노산 수준에서 이루어진다. 그러나, 특수 경우에는 더 큰 변화도 허용될 수 있다.
본원에서, "Fab" 또는 "Fab 영역"은 VH, CH1, VL 및 CL 면역글로불린 도메인을 포함하는 폴리펩타이드를 의미한다. Fab는 단리된 형태의 Fab 또는 전장 항체, 항체 단편 또는 Fab 융합 단백질 형태에서의 Fab를 지칭할 수 있으며, 또는 본원에 개략적으로 기술된 임의의 다른 항체 구현예를 참조할 수 있다.
본원에서, "Fv" 또는 "Fv 단편" 또는 "Fv 영역"은 단일 항체의 VL 및 VH 도메인을 포함하는 폴리펩타이드를 의미한다.
본원에서, "프레임워크"는 항체 가변 도메인에서 CDR로서 정의된 영역을 제외한 영역을 지칭한다. 각각의 항체 가변 도메인의 프레임워크는 CDR들에 의해 이격된 근접 영역으로 추가로 세분될 수 있다 (FR1, FR2, FR3 및 FR4).
본원에서, 용어 항체의 "항원-결합 영역" (또는 간단히 "항체 영역")은 항체에서 항원 (예를 들어, BST1)에 특이적으로 결합하는 능력을 가진 하나 이상의 단편을 지칭한다. 항체의 항원-결합 기능은 전장 항체의 단편에 의해 수행될 수 있는 것으로 밝혀져 있다. 용어 항체의 "항원-결합 영역"에 포함되는 결합 단편의 예는 (i) Fab 단편, VL / VK, VH, CL 및 CH1 도메인으로 이루어진 1가 단편; (ii) F(ab')2 단편, 힌지부에서 이황화 결합으로 연결된 2개의 Fab 단편을 포함하는 2가 단편; (iii) 기본적으로 힌지부 파트를 가진 Fab인 Fab' 단편 (FUNDAMENTAL IMMUNOLOGY (Paul ed., 3.sup.rd ed. 1993 참조); (iv) VH 및 CH1 도메인으로 이루어진 Fd 단편; (v) 항체의 단일 아암 (arm)의 VL 및 VH 도메인으로 이루어진 Fv 단편; (vi) VH 도메인으로 이루어진 dAb 단편 (Ward et al. (1989) Nature 341:544-546); (vii) 단리된 상보성 결정 영역 (CDR); 및 (viii) 나노바디, 단일 가변 도메인 및 2개의 불변 도메인을 포함하는 중쇄 가변 영역을 포함한다. 추가적으로, Fv 단편, VL / VK 및 VH의 2개의 도메인은 개별 유전자들에 의해 코딩되지만, 이들은 재조합 방법에 의해 단일 단백질 쇄로 만들 수 있는 합성 링커를 통해 연결될 수 있으며, 이때 VL / VK 및 VH 영역이 쌍을 형성해 1가 분자를 형성한다 (단쇄 Fv (scFv)로 공지됨; 예를 들어, Bird et al. (1988) Science 242:423-426; 및 Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883 참조). 이러한 단쇄 항체 역시 항체의 "항원-결합 영역"이라는 용어에 포함되는 것으로 의도된다. 이들 항체 단편은 당업자에게 공지된 통상의 기술을 이용하여 수득되며, 단편은 무손상 항체와 동일한 방식으로 유용성에 대해 스크리닝한다.
본원에서, "단리된 항체"는 서로 다른 항원 특이성을 가진 다른 항체가 실질적으로 존재하지 않는 항체를 지칭하도록 의도된다 (예를 들어, BST1에 특이적으로 결합하는 단리된 항체에는 BST1 이외의 항원에 특이적으로 결합하는 항체가 실질적으로 없음). 그러나 BST1에 특이적으로 결합하는 단리된 항체는 다른 항원, 예를 들어 다른 종으로부터 유래된 BST1에 교차-반응성을 가질 수 있다. 추가적으로 및/또는 대안적으로, 단리된 항체에는 자연에서 통상적으로 발견되지 않는 형태의 다른 세포 물질 및/또는 화학물질이 실질적으로 존재하지 않을 수 있다.
일부 구현예에서, 본 발명의 항체는 재조합 단백질, 단리된 단백질 또는 실질적으로 순수한 단백질이다. "단리된" 단백질은 이의 천연 상태에서 통상적으로 결합된 물질을 적어도 일부 수반되지 않으며, 예를 들어 소정의 샘플에서 총 단백질의 적어도 약 5 중량%, 또는 적어도 약 50 중량%를 차지한다. 단리된 단백질은 상황에 따라 총 단백질 함량의 5 내지 99.9 중량%를 차지할 수 있을 것으로 이해된다. 예를 들어, 단백질은 단백질이 증가된 농도 수준으로 만들어지도록 유도성 프로모터 또는 고발현 프로모터를 사용함으로써 유의하게 높은 농도로 만들어질 수 있다. 재조합 단백질의 경우, 그 정의는 자연적으로 생산되지 않는, 당업계에 공지된 매우 다양한 유기체 및/또는 숙주 세포에서의 항체의 생산을 포함한다.
본원에서, 용어 "단일클론 항체" 또는 "단일클론 항체 조성물"은 단일 분자 조성물인 항체 분자 제제를 지칭한다. 단일클론 항체 조성물은 특정 에피토프에 대해 단일 결합 특이성 및 친화성을 나타낸다. 본원에서, "다클론 항체"는 전체 동물에서의 경우와 같이 B-림프구의 여러가지 클론에 의해 생산되는 항체를 지칭한다.
본원에서, "이소형"은 중쇄 불변 영역 유전자에 의해 코딩되는 항체 클래스 (예, IgM 또는 IgG1)를 지칭한다.
본원에서, "항원을 인식하는 항체" 및 "항원에 특이적인 항체"라는 표현은 "항원에 특이적으로 결합하는 항체"라는 용어와 상호 호환적으로 사용된다.
용어 "항체 유도체"는 항체의 임의의 변형된 형태, 예를 들어 항체와 다른 물질 또는 (일반적으로 화학적으로 연결된) 항체와의 접합체를 지칭한다. 예를 들어, 본 발명의 항체는, 아래에서 보다 상세히 기술한 바와 같이, 비-제한적으로, 폴리머 (예, PEG), 독소, 표지물질 등의 물질에 접합될 수 있다. 본 발명의 항체는 비-인간, 키메라, 인간화 또는 완전 인간 항체일 수 있다. 키메라 및 인간화 항체 개념에 대한 설명은 Clark et al. (2000) 및 인용된 참고문헌 (Clark, 2000, Immunol Today 21:397-402)을 참조한다. 키메라 항체는 인간 항체의 불변 영역에 작동가능하게 연결된, 비-인간 항체의 가변 영역, 예를 들어 마우스 또는 랫 기원의 VH 및 VL 도메인을 포함한다 (예, 미국 특허 4,816,567 참조). 바람직한 구현예에서, 본 발명의 항체는 인간화된다. 본원에서, "인간화" 항체는 인간 프레임워크 영역 (FR)과, 비-인간 (통상적으로 마우스 또는 랫) 항체로부터 유래된 하나 이상의 상보성 결정 영역 (CDR)을 포함하는 항체를 의미한다. CDR을 제공하는 비-인간 항체는 "공여자"로 지칭되고, 프레임워크를 제공하는 인간 면역글로불린은 "수용자"로 지칭된다. 인간화는 주로 공여자 CDR이 수용자 (인간) VL 및 VH 프레임워크에 그래프팅됨으로써 이루어진다 (미국 특허 5,225,539). 이러한 전략을 "CDR 그래프팅"이라 한다. 선택된 수용자 프레임워크 잔기를 대응되는 공여자 잔기로 "역돌연변이"하는 경우도 종종 처음 그래프팅된 구조체에서 소실된 친화성을 회복하기 위해 필요하다 (US 5,530,101; US 5,585,089; US 5,693,761; US 5,693,762; US 6,180,370; US 5,859,205; US 5,821,337; US 6,054,297; US 6,407,213). 인간화 항체는 최적으로는 또한 면역글로불린 불변 영역 중 적어도 일부, 전형적으로 인간 면역글로불린 불변 중 적어도 일부를 포함할 것이며, 따라서 전형적으로 인간 Fc 영역을 포함할 것이다. 비-인간 항체의 인간화 방법은 당업계에 널리 공지되어 있으며, 기본적으로 윈터 및 동료에 따른 방법 [Jones et al. (1986) Nature 321:522-525; Riechmann et al. (1988) Nature 332:323-329; Verhoeyen et al. (1988) Science, 239:1534-1536]으로 수행할 수 있다. 인간화 뮤라인 단일클론 항체에 대한 추가의 예들 역시 당업계에 공지되어 있으며, 예를 들어 항체 결합 인간 단백질 C [O'Connor et al., 1998, Protein Eng 11:321-8], 인터루킨 2 수용체 [Queen et al. (1989) Proc Natl Acad Sci, USA 86:10029-33] 및 인간 상피 성장 인자 수용체 2 [Carter et al. (1992) Proc Natl Acad Sci USA 89:4285-9]가 있다. 대안적인 구현예에서, 본 발명의 항체는 완전 인간 항체일 수 있으며, 즉 항체의 서열이 완전히 또는 실질적으로 인간 서열이다. 형질전환 마우스 [Bruggemann et al. (1997) Curr Opin Biotechnol 8:455-458] 또는 선택된 방법과 연계된 인간 항체 라이브러리 [Griffiths et al. (1998) Curr Opin Biotechnol 9:102-108]의 사용을 비롯하여, 완전한 인간 항체를 제조하기 위한 다수의 방법이 당업계에 공지되어 있다.
용어 "인간화 항체"는 마우스와 같은 다른 포유류 종의 생식세포계열로부터 유래되는 CDR 서열이 인간 프레임워크 서열에 그래프팅된 항체를 포함하는 것으로 의도된다. 추가적인 프레임워크 영역의 변형은 본원에 기술된 바와 같이 Fc 도메인 아미노산 변형 등의 인간 프레임워크 서열에서 이루어질 수 있다.
용어 "키메라 항체"는 가변 영역 서열이 하나의 종에서 유래되고 불변 영역 서열은 또 다른 종으로부터 유래된 항체, 예컨대 가변 영역 서열은 마우스 항체로부터 유래되고 불변 영역 서열은 인간 항체로부터 유래된 항체를 의미하는 것으로 의도된다.
용어 "특이적으로 결합한다" (또는 "면역특이적으로 결합한다")는, 다수의 구현예에서는 사실일지라도, 즉 항체가 그의 표적에 "특이적으로 결합하며" 샘플, 세포 또는 환자의 다른 성분에 검출하가능하게 또는 실질적으로 결합하지 않더라도, 항체가 그 의도된 표적에만 결합하는 것을 의미하고자 하는 것은 아니다. 그러나, 일부 구현예에서, 항체가 그 의도된 표적에 대한 친화성이 비-표적 분자에 대한 친화성과 비교시에 약 5배를 초과한다면, 항체는 "특이적으로 결합하"는 것이다. 적합하게는, 원치않는 물질, 특히 건강한 사람 또는 동물의 자연 생성 단백질 또는 조직과 유의한 교차-반응 또는 교차-결합은 존재하지 않는다. 항체의 친화성은, 비-표적 분자와 비교해, 표적 분자에 대해, 예를 들어 적어도 약 5배, 예컨대 10배, 예컨대 25배, 특히 50배, 및 특히 100배 이상 더 높을 것이다. 일부 구현예에서, 항체 또는 다른 결합제와 항원 간의 특이적인 결합은 적어도 106 M-1의 결합 친화성을 나타낸다. 항체는 예를 들어 적어도 약 107 M-1, 예컨대 약 108 M-1 내지 약 109 M-1, 약 109 M-1 내지 약 1010 M-1, 또는 약 1010 M-1 내지 약 1011 M-1의 친화성으로 결합할 수 있다. 항체는 예를 들어 50 nM 이하, 10 nM 이하, 1 nM 이하, 100 pM 이하, 또는 보다 바람직하게는 10 pM 이하의 EC50으로 결합할 수 있다.
본원에서, 용어 단백질 또는 세포"에 실질적으로 결합하지 않는"은 단백질 또는 세포에 결합하지 않거나, 고 친화성으로 결합하지 않는다는, 즉 단백질 또는 세포에 1 x 10-6 M 이상, 보다 바람직하게는 1 x 10-5 M 이상, 보다 바람직하게는 1 x 10-4 M 이상, 보다 바람직하게는 1 x 10-3 M 이상, 보다 더 바람직하게는 1 x 10-2 M 이상의 KD로 결합하지 않는다는 것을 의미한다.
본원에서, 용어 "EC50"은 50%의 최대 반응/효과를 유발하는 농도를 정량함으로써, 화합물의 효력을 나타내기 위해 의도된다. EC50은 스캐차드 (Scratchard) 또는 FACS에 의해 결정할 수 있다.
본원에서, 용어 "Kassoc" 또는 "Ka"는 특정 항체-항원 상호작용의 결합율 (association rate)을 나타내는 것이고, 본원에서, 용어 "Kdis" 또는 "Kd"는 특정 항체-항원 상호작용의 해리율 (dissociation rate)을 나타내는 것으로 의도된다. 본원에서, 용어 "KD"는 Kd 대 Ka의 비 (즉, Kd/Ka)로 구하며, 몰 농도 (M)로서 표현되는 친화성 상수를 나타내는 것으로 의도된다. 항체의 KD 값은 당업계에 널리 확립된 방법을 이용하여 결정할 수 있다. 항체의 KD를 결정하기 위한 바람직한 방법은 표면 플라즈몬 공명, 바람직하게는 Biacore® 시스템과 같은 바이오센서 시스템을 이용하는 방법에 의한 것이다.
본원에서, IgG 항체에 대한 용어 "고 친화성"은 표적 항원에 대해 1 x 10-7 M 이하, 보다 바람직하게는 5 x 10-8 M 이하, 보다 더 바람직하게는 1x10-8 M 이하, 보다 더 바람직하게는 5 x 10-9 M 이하, 및 보다 더 바람직하게는 1 x 10-9 M 이하의 KD를 가진 항체를 지칭한다. 그러나, "고 친화성" 결합은 다른 항체 이소형에 대해서는 달라질 수 있다. 예를 들어, IgM 이소형에 대한 "고 친화성" 결합은 항체의 KD 값이 10-6 M 이하, 보다 바람직하게는 10-7 M 이하, 보다 더 바람직하게는 10-8 M 이하인 경우를 지칭한다.
용어 "에피토프" 또는 "항원 결정기"는 면역글로불린 또는 항체가 특이적으로 결합하는 항원 상의 부위를 지칭한다. 에피토프는 단백질의 3차 폴딩에 의해 나란치 놓인 인접 또는 비-인접 아미노산으로부터 형성될 수 있다. 인접 아미노산들로부터 형성된 에피토프는 전형적으로 변성 용매에 노출시 유지되지만, 3차 폴딩에 의해 형성된 에피토프는 전형적으로 변성 용매 처리시 소실된다. 에피토프는 전형적으로 아미노산 적어도 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 또는 15개를 고유한 공간 입체형태로 포함한다. 에피토프의 공간 입체형태를 확인하는 방법은 당업계의 방법 및 본원에 기술된 기법, 예를 들어 x선 결정학 및 2차원 핵 자기 공명을 포함한다 [예, Epitope Mapping Protocols in Methods in Molecular Biology, Vol. 66, G. E. Morris, Ed. (1996) 참조].
따라서, 또한 본 발명은 BST1_A2와 동일한 에피토프에 결합 (즉, 인지)하는항체를 포함하는 약학적 조합물을 포함한다. 동일한 에피토프에 결합하는 항체는 표적 항원에 대한 참조 항체와 통계적으로 유의한 방식으로 교차-경쟁 (즉, 결합을 경쟁적으로 저해)하는 능력을 통해 식별할 수 있다. 경쟁적 저해는, 예를 들어, 항체가 동일하거나 또는 구조적으로 유사한 에피토프에 결합하는 경우 (예, 에피토프 중첩), 또는 결합시 항체들 간에 입체 장애를 일으키는 공간적으로 근접한 에피토프들에 결합하는 경우에, 발생할 수 있다.
경쟁적 저해는, 시험 면역글로불린이 공통 항원에 대한 참조 항체의 특이적인 결합을 저해하는, 통상적인 분석을 통해 확인할 수 있다. 많은 유형의 경쟁적인 결합 분석들이 공지되어 있으며, 예를 들어 고상 직접 또는 간접 방사성 면역 분석 (RIA), 고상 직접 또는 간접 효소 면역분석 (EIA), 샌드위치 경쟁 분석 [Stahl et al. (1983) Methods in Enzymology 9:242]; 고상 직접 비오틴-아비딘 EIA [Kirkland et al. (1986) J. Immunol. 137:3614 참조]; 고상 직접 표지 분석, 고상 직접 표지 샌드위치 분석 [Harlow and Lane (1988) Antibodies: A Laboratory Manual, Cold Spring Harbor Press]; I-125 표지물질을 이용한 고상 직접 표지 RIA [Morel et al. (1988) Mol. Immunol. 25(1):7)]; 고상 직접 비오틴-아비딘 EIA [Cheung et al. (1990) Virology 176:546]; 및 직접 표지된 RIA [Moldenhauer et al. (1990) Scand. J. Immunol. 32:77]가 있다. 전형적으로, 이러한 분석은 비-표지된 시험 면역글로불린과 표지된 참조 면역글로불린 중 어느 하나를 가진 고체 표면 또는 세포에 결합된 정제된 항원의 사용을 포함한다. 경쟁적 저해는 시험 면역글로불린의 존재 하에 고체 표면 또는 세포에 결합된 표지물질의 양을 결정함으로써, 측정한다. 통상적으로, 시험 면역글로불린은 과량으로 제공된다. 통상적으로, 경쟁 항체가 과량으로 존재하는 경우, 이는 공통 항원에 대한 참조 항체의 특이적인 결합을 적어도 50-55%, 55-60%, 60-65%, 65-70%, 70-75% 또는 그 보다 높은 수준으로 저해할 것이다.
다른 기법으로는, 예를 들어 에피토프의 원자 해상도를 제공하는 항원:항체 복합체 결정의 x선 분석과 같은, 에피토프 맵핑 방법이 있다. 또 다른 방법은 항원 단편 또는 항원의 돌연변이 변이체에 대한 항체의 결합을 모니터링하는 방법으로, 이때 항원 서열 내의 아미노산 잔기의 변형으로 인한 결합 감소는 흔히 에피토프 성분임을 나타내는 것으로 간주된다. 또한, 에피토프 맵핑에 대한 전산 조합 방법 (computational combinatorial method)도 이용할 수 있다. 이러한 방법은 조합 파지 디스플레이 펩타이드 라이브러리로부터 특이적인 짧은 펩타이드를 친화성 분리하는 대상 항체의 능력을 토대로 한다. 이후, 펩타이드는 펩타이드 라이브러리를 스크리닝하는데 사용되는 항체에 대응되는 에피토프를 정의하기 위한 리드 (lead)로서 간주된다. 에피토프 맵핑과 관련하여, 입체형태적으로 불연속적인 에피토프를 맵핑하는 것으로 알려진 전산 알고리즘이 역시 개발되어 있다.
본원에서, 용어 "개체"는 임의의 인간 또는 비-인간 동물을 포함한다. 용어 "비-인간 동물"은 모든 척추동물, 예를 들어 포유류 및 비-포유류, 예로 비-인간 영장류, 양, 개, 고양이, 말, 소, 닭, 양서류, 파충류 등을 포함한다.
본원의 다양한 측면들은 후술한 세부 항목들에서 보다 상세히 설명된다.
본 발명은, 동시, 개별 또는 순차적 용도의 조합 제제 (combined preparation) 형태의, 본원에 정의되는 구성성분 (A) 및 (B)를 포함하는 약학적 조합물에 관한 것이다. 구성성분 (A)는 본원에 정의된 항-BST1에 관한 것이다. 구성성분 (B)는 시티딘 유사체 또는 이의 약제학적으로 허용가능한 염에 관한 것이다.
항-
BST1
항체
본 발명의 약학적 조합물의 항체는 항체의 특정 기능성 특징 또는 특성에 의해 특정된다. 예를 들어, 항체는 인간 BST1에 특이적으로 결합한다. 바람직하게는, 본 발명의 항체는 BST1에 고 친화성으로, 예를 들어, KD 8 x 10-7 M 이하, 보다 더 전형적으로 1 x 10-8 M 이하로 결합한다. 항-BST1 항체는 바람직하게는 다음과 같은 특징들 중 하나 이상을 나타내며, 항체는 나타낸 구체적인 용도 둘다를 나타낸다:
인간 BST1에 EC50 50 nM 이하, 10 nM 이하, 1 nM 이하, 100 pM 이하, 더 바람직하게 10 pM 이하로 결합함;
BST1을 발현하는 인간 세포에 결합함.
일 구현예에서, 항체 바람직하게는 BST1에 존재하나 다른 단백질에 존재하지 않는 항원성 에피토프에 결합한다. 바람직하게는, 항체는 관련 단백질에는 결합하지 않으며, 예를 들어, 항체는 다른 세포 부착 분자에 실질적으로 결합하지 않는다. 일 구현예에서, 항체는 BST1을 발현하는 세포 내에 내재화될 수 있다. 예를 들어, MabZap 또는 HumZap 내재화 분석을 비롯하여, 항체 내재화를 평가하기 위한 표준 분석들이 당업계에 공지되어 있다.
예를 들어, ELISA, 웨스턴 블롯, RIA, BIAcore® 분석 및 유세포 측정을 비롯한, BST1에 대한 항체의 결합 능력을 평가하기 위한 표준 분석들이 단백질 또는 세포 수준에서 수행될 수 있으며, 당업계에 공지되어 있다. 적합한 분석은 실시예에서 상세히 언급된다. 또한, 항체의 결합 동역학 (예, 결합 친화성)을 당업계에 공지된 표준 분석, 예컨대 Biacore® 시스템 분석으로 평가할 수 있다. Raji 또는 Daudi B 세포 종양 세포에서 결합을 평가하기 위해, Raji (ATCC 기탁 번호 CCL-86) 또는 Daudi (ATCC 기탁 번호 CCL-213) 세포를 공개적으로 이용가능한 공급원, 예를 들어 아메리칸 타입 컬쳐 콜렉션 (American Type Culture Collection)로부터 입수할 수 있으며, 유세포 분석과 같은 표준 분석에 이용할 수 있다.
단일클론 항체
본 발명의 약학적 조합물의 바람직한 항체는 실시예 1-4에 기술된 바와 같이 단리되고 구조적으로 특정화된, 단일클론 항체 BST1_A2 및 이의 변이체이다. BST1_A2의 VH 아미노산 서열은 서열번호 2로 나타낸다. BST1_A2의 VK 아미노산 서열은 서열번호 4로 나타낸다.
이 항체가 BST1에 결합할 수 있다는 것을 감안하여, VH 및 VK 서열을 변형시켜 다른 항-BST1 결합 분자를 구축할 수 있다. 이러한 변이체 항체의 BST1 결합은 전술한 결합 분석 및 실시예에 기술된 결합 분석 (예, ELISA)을 사용해 검사할 수 있다.
이에, 일 측면에서, 약학적 조합물은 서열번호 2로 기재된 아미노산 서열을 포함하는 중쇄 가변 영역과 서열번호 4로 기재된 아미노산 서열을 포함하는 경쇄 가변 영역을 포함하는 항체를 포함하며, 항체는 BST1, 바람직하게는 인간 BST1에 특이적으로 결합한다.
본원에 개시된 항체의 CDR 영역은 카바트 시스템을 이용해 기술된다 [Kabat, E. A. et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, US Department of Health and Human Services, NIH Publication No. 91-3242].
항체가 BST1에 결합하는 능력은 전술한 결합 분석 및 실시예에 기술된 결합 분석 (예, ELISA, Biacore® 분석)을 사용해 검사할 수 있다.
다른 바람직한 구현예에서, 항체는 하기를 포함한다:
서열번호 10을 포함하는 중쇄 가변 영역 CDR1;
서열번호 12 또는 서열번호 51을 포함하는 중쇄 가변 영역 CDR2;
서열번호 14를 포함하는 중쇄 가변 영역 CDR3;
서열번호 16을 포함하는 경쇄 가변 영역 CDR1;
서열번호 18을 포함하는 경쇄 가변 영역 CDR2; 및
서열번호 20을 포함하는 경쇄 가변 영역 CDR3.
CDR3 도메인은, CDR1 및/또는 CDR2 도메인(들)과는 독립적으로, 단독으로 동족 항원에 대한 항체의 결합 특이성을 결정할 수 있으며, 공통 CDR3 서열에 기초하여 동일한 결합 특이성을 갖는 여러가지 항체들을 예측가능하게 만들 수 있다는 것이 당업계에 널리 공지되어 있다. 예를 들어, Klimka et al. (2000) British J. of Cancer 83(2):252-260 (뮤라인 항-CD30 항체 Ki-4의 중쇄 가변 도메인 CDR3 만을 이용한 인간화 항-CD30 항체의 생산 기술); Beiboer et al. (2000) J. Mol. Biol. 296:833-849] (모 뮤라인 MOC-31 항-EGP-2 항체의 중쇄 CDR3 서열 만을 사용하는 재조합 상피 당단백질-2 (EGP-2) 항체 기술); Rader et al. (1998) Proc. Natl. Acad. Sci. USA. 95:8910-8915 (뮤라인 항-인테그린 αvβ3 항체 LM609의 중쇄 및 경쇄 가변 CDR3 도메인을 이용한 인간화 항-인테그린 αvβ3 항체 패널 기술, 각 구성원 항체는 CDR3 도메인 바깥에 특유의 서열을 포함하며, 부모 뮤라인 항체만큼 높거나 더 높은 친화성으로 부모 뮤라인 항체와 동일한 에피토프에 결합할 수 있음); Barbas et al. (1994) J. Am. Chem. Soc. 116:2161-2162 (CDR3 도메인이 항원 결합에 가장 중요하게 기여함을 개시); Barbas et al. (1995) Proc. Natl. Acad. Sci. USA. 92:2529-2533 (인간 태반 DNA에 대한 3종의 Fab (SI-1, SI-40 및 SI-32)의 중쇄 CDR3 서열을 항-파상풍 톡소이드 Fab의 중쇄에 그래프팅하여, 기존 중쇄 CDR3를 대체를 기재하며, CDR3 도메인이 단독으로 결합 특이성을 부여함을 기술); 및 Ditzel et al. (1996) J. Immunol. 157:739-749 (모 다중 특이성 Fab LNA3의 중쇄 CDR3 만 단일 특이성 IgG 파상풍 톡소이드-결합성 Fab p313 항체에 전위하는 것이 부모 Fab의 결합 특이성을 유지하는데 충분하다는 그래프팅 실험 기술)을 참조한다. 이들 문헌들은 그 전체가 원용에 의해 본 명세서에 포함된다.
따라서, 본 발명은 인간 또는 비-인간 동물로부터 유래된 항체로부터의 하나 이상의 중쇄 및/또는 경쇄 CDR3 도메인을 포함하는 단일클론 항체를 포함하며, 단일클론 항체가 BST1에 특이적으로 결합할 수 있는, 약학적 조합물을 제공한다. 특정 측면에서, BST1에 특이적으로 결합할 수 있는 단일클론 항체는, 마우스 또는 랫과 같은 비-인간 항체로부터의 하나 이상의 중쇄 및/또는 경쇄 CDR3 도메인을 포함한다. 일부 구현예에서, 비-인간 항체로부터의 하나 이상의 중쇄 및/또는 경쇄 CDR3 도메인을 포함하는 이러한 본 발명의 항체는, 대응되는 부모 비-인간 항체와 (a) 결합에 대해 경쟁할 수 있거나; (b) 그 기능적 특성을 보유하거나; (c) 동일한 에피토프에 결합하거나; 및/또는 (d) 유사한 결합 친화성을 가진다.
다른 측면에서, 본 발명은 BST1에 특이적으로 결합할 수 있는 인간 항체, 예컨대 비-인간 동물로부터 수득한 인간 항체로부터의 하나 이상의 중쇄 및/또는 경쇄 CDR3 도메인을 포함하는 단일클론 항체를 포함하는 약학적 조합물을 제공한다. 다른 측면에서, 단일클론 항체는 예를 들어 비-인간 동물로부터 수득되는 인간 항체와 같은 제1 인간 항체로부터의 하나 이상의 중쇄 및/또는 경쇄 CDR3 도메인을 포함하되, 제1 인간 항체는 BST1에 특이적으로 결합할 수 있으며, 제1 인간 항체로부터의 CDR3 도메인은 BST1에 대한 결합 특이성이 결핍된 인간 항체에서 CDR3 도메인을 대체하여, BST1에 특이적으로 결합할 수 있는 제2 인간 항체를 형성한다. 일부 구현예에서, 제1 인간 항체로부터의 하나 이상의 중쇄 및/또는 경쇄 CDR3 도메인을 포함하는 본 발명의 항체는, 대응되는 부모 제1 인간 항체와 (a) 결합에 대해 경쟁할 수 있거나; (b) 그 기능적 특성을 보유하거나; (c) 동일한 에피토프에 결합하거나; 및/또는 (d) 유사한 결합 친화성을 가진다.
특정 생식세포계열 서열을 가진 항체
본 발명의 특정 구현예에서, 항체는 특정 생식세포계열 중쇄 면역글로불린 유전자로부터의 중쇄 가변 영역 및/또는 특정 생식세포계열 경쇄 면역글로불린 유전자로부터의 경쇄 가변 영역을 포함한다.
예를 들어, 바람직한 구현예에서, 본 발명은 뮤라인 VH 1-39 유전자, 뮤라인 VH 1-80 유전자 또는 뮤라인 VH 69-1 유전자의 산물이거나 또는 이로부터 유래된 중쇄 가변 영역을 포함하는, 단리된 단일클론 항체 또는 이의 항원-결합 영역을 포함하되, 항체가 BST1에 특이적으로 결합하는, 약학적 조합물을 제공한다. 또 다른 바람직한 구현예에서, 본 발명은 뮤라인 VK 4-55 유전자, 뮤라인 VK 4-74 유전자 또는 뮤라인 VK 44-1 유전자의 산물이거나 또는 이로부터 유래된 경쇄 가변 영역을 포함하는, 단리된 단일클론 항체 또는 이의 항원-결합 영역을 포함하되, 항체가 BST1에 특이적으로 결합하는, 약학적 조합물을 제공한다.
또 다른 바람직한 구현예에서, 본 발명은 단리된 단일클론 항체 또는 이의 항원-결합 영역을 포함하는 약학적 조합물을 제공하되, 항체는
뮤라인 VH 1-39 유전자 (유전자는 서열번호 35 및 36에 기재된 뉴클레오티드 서열을 포함함)의 산물이거나 또는 이로부터 유래된 중쇄 가변 영역을 포함하고; 뮤라인 VK 4-55 유전자 (유전자는 서열번호 40, 41 및 42에 기재된 뉴클레오티드 서열을 포함함)의 산물이거나 또는 이로부터 유래된 경쇄 가변 영역을 포함하고; BST1, 바람직하게는 인간 BST1에 특이적으로 결합한다. 상기한 서열의 VH 1-39 및 VK 4-55 유전자를 가진 항체의 예는 BST1_A2이다.
또 다른 바람직한 구현예에서, 본 발명은 단리된 단일클론 항체 또는 이의 항원-결합 영역을 포함하는 약학적 조합물을 제공하되, 항체는
뮤라인 VH 1-80 유전자 (유전자는 서열번호 33 및 34에 기재된 뉴클레오티드 서열을 포함함)의 산물이거나 또는 이로부터 유래된 중쇄 가변 영역을 포함하고;
뮤라인 VK 4-74 유전자 (유전자는 서열번호 37, 38 및 39에 기재된 뉴클레오티드 서열을 포함함)의 산물이거나 또는 이로부터 유래된 경쇄 가변 영역을 포함하고; BST1, 바람직하게는 인간 BST1에 특이적으로 결합한다. 상기한 서열의 VH 1-80 및 VK 4-74 유전자를 가진 항체의 예는 BST1_A1이다.
또 다른 바람직한 구현예에서, 본 발명은 단리된 단일클론 항체 또는 이의 항원-결합 영역을 포함하는 약학적 조합물을 제공하되, 항체는
뮤라인 VH 69-1 유전자 (유전자는 서열번호 68 및 69에 기재된 뉴클레오티드 서열을 포함함)의 산물이거나 또는 이로부터 유래된 중쇄 가변 영역을 포함하고;
뮤라인 VK 44-1 유전자 (유전자는 서열번호 70, 71 및 72에 기재된 뉴클레오티드 서열을 포함함)의 산물이거나 또는 이로부터 유래된 경쇄 가변 영역을 포함하며; BST1, 바람직하게는 인간 BST1에 특이적으로 결합한다. 상기한 서열의 VH 및 VK 유전자를 가진 항체의 예는 BST1_A3이다.
본원에서, 항체의 가변 영역이 뮤라인 생식세포계열 면역글로불린 유전자를 이용하는 시스템으로부터 수득되는 경우, 이 항체는 특정 생식세포계열 서열의 "산물"이거나 또는 "이로부터 유래된" 중쇄 또는 경쇄 가변 영역을 포함한다. 이러한 시스템은 파지 상에 디스플레이된 뮤라인 면역글로불린 유전자 라이브러리에서 대상 항원으로 스크리닝하는 것을 포함한다. 뮤라인 생식세포계열 면역글로불린 서열의 "산물"이거나 또는 "이로부터 유래된" 항체는, 예를 들어 항체의 뉴클레오티드 또는 아미노산 서열을 뮤라인 생식세포계열 면역글로불린의 뉴클레오티드 또는 아미노산 서열과 비교하고, 항체의 서열과 가장 가까운 서열을 갖는 (즉, 최대 동일성 %) 뮤라인 생식세포계열 면역글로불린 서열을 선택함으로써 식별할 수 있다. 특정 뮤라인 생식세포계열 면역글로불린 서열의 "산물"이거나 또는 "이로부터 유래된" 항체는, 예를 들어 자연 생성 체세포 돌연변이, 또는 부위-특이적인 돌연변이의 의도적 도입으로 인해, 생식세포계열 서열과 비교하여 아미노산 차이를 포함할 수 있다. 그러나, 선택된 항체는 전형적으로 뮤라인 생식세포계열 면역글로불린 유전자에 의해 코딩된 아미노산 서열에 대한 아미노산 서열 동일성이 적어도 90%이고, 다른 종의 생식세포계열 면역글로불린 아미노산 서열 (예, 인간 생식세포계열 서열)과 비교할 경우 항체를 뮤라인 으로 식별하는 아미노산 잔기를 포함한다. 임의 경우에, 항체는 생식세포계열 면역글로불린 유전자에 의해 코딩되는 아미노산 서열과의 아미노산 서열 동일성이 적어도 95%, 또는 심지어 적어도 96%, 97%, 98% 또는 99%일 수 있다. 전형적으로, 특정 뮤라인 생식세포계열 서열로부터 유래되는 항체는 뮤라인 생식세포계열 면역글로불린 유전자에 의해 코딩되는 아미노산 서열과 10개 이하의 아미노산 차이를 나타낼 것이다. 일부 경우에, 항체는 생식세포계열 면역글로불린 유전자에 의해 코딩되는 아미노산 서열과 5개 이하, 또는 심지어는 4, 3, 2 또는 1개 이하의 아미노산 차이를 나타낼 수 있다.
상동 항체 (Homologous Antibody)
또 다른 구현예에서, 본 발명의 항체는 본원에 기술된 바람직한 항체의 아미노산 서열과 상동적인 아미노산 서열을 포함하는 중쇄 및 경쇄 가변 영역을 포함하며, 항체는 모 항-BST1 항체의 원하는 기능적 특성을 유지한다.
예를 들어, 본 발명은 중쇄 가변 영역 및 경쇄 가변 영역을 포함하는, 단리된 단일클론 항체 또는 이의 항원 결합 영역을 포함하되, 중쇄 가변 영역이 서열번호 2의 아미노산 서열과 적어도 80% 동일한 아미노산 서열을 포함하고; 경쇄 가변 영역이 서열번호 4의 아미노산 서열과 적어도 80% 동일한 아미노산 서열을 포함하고; 항체가 인간 BST1에 결합하는, 약학적 조합물을 제공한다. 이러한 항체는 50 nM 이하, 10 nM 이하, 1 nM 이하, 100 pM 이하 또는 더 바람직하게는 10 pM 이하의 EC50으로 인간 BST1에 결합할 수 있다.
항체는 또한 인간 BST1로 형질감염된 CHO 세포에 결합할 수 있다.
다양한 구현예에서, 항체는 예를 들어 인간 항체, 인간화 항체 또는 키메라 항체일 수 있다.
다른 구현예에서, VH 및/또는 VK 아미노산 서열은 전술한 서열과 85%, 90%, 95%, 96%, 97%, 98% 또는 99% 상동성을 가질 수 있다. 상기한 서열의 VH 및 VK 영역과 높은 (즉, 80% 이상의) 동일성의 VH 및 VK 영역을 가진 항체는 서열번호 6 및 8을 코딩하는 핵산 분자의 돌연변이 유발 (예, 부위-특이적인 또는 PCR-매개 돌연변이 유발) 후, 본원에 기술된 기능적 분석을 이용한 코딩된 변형 항체의 보유 기능을 검사함으로써, 수득할 수 있다.
서열 2개 간의 동일성 퍼센트는, 서열 2개를 최적으로 정렬하기 위해 도입하여야 하는 갭의 수 및 각 갭의 길이를 고려해, 서열들에 공유된 동일한 위치의 개수에 대한 함수 (즉, % 상동성 = 동일한 위치의 #/위치의 총 # x 100)이다. 2개의 서열 간의 서열 비교 및 동일성 퍼센트의 결정은 아래 비-제한적인 실시예에 기술된 바와 같은 수학적 알고리즘을 사용해 달성할 수 있다.
2개의 아미노산 서열 간의 동일성 퍼센트는 PAM120 가중 잔기 표, 갭 길이 패널티 12 및 갭 패널티 4를 적용한 ALIGN 프로그램 (버전 2.0)에 포함된 E. Meyers and W. Miller [Comput . Appl . Biosci. (1988) 4:11-17]의 알고리즘을 사용해 결정할 수 있다. 또한, 2개의 아미노산 서열 간의 동일성 퍼센트는 Blossum 62 매트릭스 또는 PAM250 매트릭스, 및 갭 가중치 16, 14, 12, 10, 8, 6, 또는 4 및 길이 가중치 1, 2, 3, 4, 5 또는 6을 적용하고, GCG 소프트웨어 패키지의 GAP 프로그램 (http://www.gcg.com에서 이용가능함)에 포함된 Needleman and Wunsch [J. Mol. Biol. (1970) 48:444-453] 알고리즘을 이용하여 결정할 수 있다.
추가적으로 또는 대안적으로, 본 발명의 단백질 서열은 예를 들어 관련 서열을 동정하기 위해 공공 데이터베이스에서 검색시 "질의 서열"로서 추가로 사용할 수 있다. 이러한 검색은 Altschul, et al. (1990) J. Mol. Biol. 215:403-10의 XBLAST 프로그램 (버전 2.0)을 이용하여 수행할 수 있다. BLAST 단백질 검색은 XBLAST 프로그램 (스코어 = 50, 단어 길이 = 3)으로 수행하여, 본 발명의 항체 분자에 대한 상동적인 아미노산 서열을 수득할 수 있다. 비교를 위해 갭이 도입된 정렬을 입수하기 위해서, Altschul et al., (1997) Nucleic Acids Res. 25(17):3389-3402]에 기술된 바와 같이, Gapped BLAST를 사용할 수 있다. BLAST 및 Gapped BLAST 프로그램을 사용할 경우, 해당 프로그램 (예, XBLAST 및 NBLAST)의 디폴트 파라미터를 이용할 수 있다. www.ncbi.nlm.nih.gov를 참조한다.
보존적인 변형을 가진 항체
특정 구현예에서, 본 발명의 항체는 CDR1, CDR2 및 CDR3 서열을 포함하는 중쇄 가변 영역 및 CDR1, CDR2 및 CDR3 서열을 포함하는 경쇄 가변 영역을 포함하되, 이들 CDR 서열들 중 하나 이상은 본원에서 개시된 바람직한 항체 (예, BST1_A2)에 기초하여 정의되는 아미노산 서열 또는 이의 보존적인 변형을 포함하며, 상기 항체는 항-BST1 항체의 원하는 기능적인 특성을 유지한다. 이에, 본 발명은 CDR1, CDR2 및 CDR3 서열을 포함하는 중쇄 가변 영역 및 CDR1, CDR2 및 CDR3 서열을 포함하는 경쇄 가변 영역을 포함하는 단리된 단일클론 항체 또는 이의 항원 결합 영역을 포함하되, 중쇄 가변 영역 CDR3 서열이 서열번호 14의 아미노산 서열 및 이의 보존적인 변형을 포함하고; 경쇄 가변 영역 CDR3 서열이 서열번호 20의 아미노산 서열 및 이의 보존적인 변형을 포함하며; 항체가 50 nM 이하, 10 nM 이하, 1 nM 이하, 100 pM 이하 또는 보다 바람직하게는 10 pM 이하의 EC50으로 인간 BST1에 결합하는, 약학적 조합물을 제공한다.
항체는 또한 인간 BST1로 형질감염된 CHO 세포에 결합할 수 있다.
바람직한 구현예에서, 중쇄 가변 영역 CDR2 서열은 서열번호 12 또는 51의 아미노산 서열 및 이의 보존적인 변형을 포함하며; 경쇄 가변 영역 CDR2 서열은 서열번호 18의 아미노산 서열 및 이의 보존적인 변형을 포함한다. 또 다른 바람직한 구현예에서, 중쇄 가변 영역 CDR1 서열은 서열번호 10의 아미노산 서열 및 이의 보존적인 변형을 포함하고; 경쇄 가변 영역 CDR1 서열은 서열번호 16의 아미노산 서열 및 이의 보존적인 변형을 포함한다. 또 다른 바람직한 구현예에서, 중쇄 가변 영역 CDR3 서열은 서열번호 14의 아미노산 서열 및 이의 보존적인 변형을 포함하고; 경쇄 가변 영역 CDR3 서열은 서열번호 20의 아미노산 서열 및 이의 보존적인 변형을 포함한다.
다양한 구현예들에서, 항체는 예를 들어 인간 항체, 인간화 항체 또는 키메라 항체일 수 있다.
본원에서, 용어 "보존적인 서열 변형"은 아미노산 서열을 포함하는 항체의 결합 특성에 유의한 영향을 미치지 않거나 또는 유의하게 이를 변형시키지 않는 아미노산 변형을 지칭하는 것으로 의도된다. 이러한 보존적인 변형은 아미노산 치환, 부가 및 결손을 포함한다. 변형은 당업계에 공지된 표준 기술, 예를 들어 부위-특이적인 돌연변이 유발 및 PCR-매개 돌연변이 유발에 의해 본 발명의 항체에 도입할 수 있다. 보존적인 아미노산 치환은 아미노산 잔기를 비슷한 측쇄를 가진 아미노산 잔기로 대체하는 것이다. 유사한 측쇄를 가진 아미노산 잔기 패밀리는 당업계에 규정되어 있다. 이러한 패밀리는 염기성 측쇄를 가진 아미노산 (예, 라이신, 아르기닌, 히스티딘), 산성 측쇄를 가진 아미노산 (예, 아스파르트산, 글루탐산), 비-하전된 극성 측쇄를 가진 아미노산 (예, 글리신, 아스파라긴, 글루타민, 세린, 트레오닌, 티로신, 시스테인, 트립토판), 비-극성 측쇄를 가진 아미노산 (예, 알라닌, 발린, 루신, 이소루신, 프롤린, 페닐알라닌, 메티오닌), 베타-분지형 측쇄를 가진 아미노산 (예, 트레오닌, 발린, 이소루신) 및 방향족 측쇄를 가진 아미노산 (예, 티로신, 페닐알라닌, 트립토판, 히스티딘)을 포함한다. 따라서, 본 발명의 항체의 CDR 영역 내 하나 이상의 아미노산 잔기는 동일한 측쇄 패밀리에 속하는 다른 아미노산 잔기로 치환할 수 있으며, 변형된 항체는 본원에 기술된 기능성 분석을 이용하여 보유 기능에 대해 검사할 수 있다.
서열번호 10의 중쇄 CDR1 서열은 하나 이상의 보존적인 서열 변형, 예컨대 1, 2, 3, 4 또는 5개 이상의 아미노산 치환, 부가 또는 결손을 포함할 수 있거나; 서열번호 16의 경쇄 CDR1 서열은 하나 이상의 보존적인 서열 변형, 예컨대 1, 2, 3, 4 또는 5개 이상의 아미노산 치환, 부가 또는 결손을 포함할 수 있거나; 서열번호 12 또는 51로 나타낸 중쇄 CDR2 서열은 하나 이상의 보존적인 서열 변형, 예컨대 1, 2, 3, 4 또는 5개 이상의 아미노산 치환, 부가 또는 결손을 포함할 수 있거나; 서열번호 18로 나타낸 경쇄 CDR2 서열은 하나 이상의 보존적인 서열 변형, 예컨대 1, 2, 3, 4 또는 5개 이상의 아미노산 치환, 부가 또는 결손을 포함할 수 있거나; 서열번호 14로 나타낸 중쇄 CDR3 서열은 하나 이상의 보존적인 서열 변형, 예컨대 1, 2, 3, 4 또는 5개 이상의 아미노산 치환, 부가 또는 결손을 포함할 수 있거나; 및/또는 서열번호 20으로 나타낸 경쇄 CDR3 서열은 하나 이상의 보존적인 서열 변형, 예컨대 1, 2, 3, 4 또는 5개 이상과의 아미노산 치환, 부가 또는 결손을 포함할 수 있다.
본 발명의 항-
BST1
항체와 동일한
에피토프에
결합하는 항체
다른 구현예에서, 본 발명은 BST1_A2와 같이 인간 BST1의 동일한 에피토프에 결합하는 항체 (즉, BST1 결합에 대해 BST1-A2와 교차-경쟁하는 능력을 가진 항체)를 포함하는 약학적 조합물을 제공한다.
이러한 교차-경쟁하는 항체는 표준 BST1 결합 분석에서 BST1_A2와 교차-경쟁하는 능력을 토대로 식별할 수 있다. 예를 들어, BIAcore 분석, ELISA 분석 또는 유세포 측정을 이용해, BST1-A2 교차-경쟁성을 입증할 수 있다. 시험 항체가 인간 BST1에 대한 BST1_A2의 결합을 저해하는 능력은, 시험 항체가 인간 BST1에 결합하는 것에 대해 BST1_A2와 경쟁하여 인간 BST1_A2 상의 동일한 에피토프에 결합할 수 있음을, 의미한다.
조작 및 변형된 항체
본 발명의 항체는 변형된 항체를 조작하기 위한 출발 물질로서 사용될 수 있는 본원에 개시된 하나 이상의 VH 및/또는 VL 서열을 가진 항체를 사용하여 제조할 수 있으며, 변형된 항체는 출발 항체와 비교해 변이된 특성을 가질 수 있다. 항체는 가변 영역 하나 또는 둘 다 (즉, VH 및/또는 VL), 예를 들어 하나 이상의 CDR 영역 및/또는 하나 이상의 프레임워크 영역 내에 존재하는 하나 이상의 아미노산 잔기를 변형함을써, 조작할 수 있다. 추가적으로 또는 대안적으로, 항체는 불변 영역(들) 내 잔기를 변형시켜 조작하여, 예를 들어 항체의 작동자 기능(들)을 변형시킬 수 있다.
특정 구현예에서, 항체의 가변 영역을 조작하기 위해 CDR 그래프팅을 이용할 수 있다. 항체는 주로 6개의 중쇄 및 경쇄 상보성 결정 영역 (CDR) 내에 위치한 아미노산 잔기들을 통해 표적 항원과 상호작용한다. 이러한 이유로, CDR 내의 아미노산 서열은 CDR 외부의 서열보다 개별 항체들 간에 다양성이 더 높다. CDR 서열들이 대부분의 항체-항원 상호작용을 담당하므로, 특이적인 천연 형성 항체로부터의 CDR 서열이 다른 특성을 가진 다른 항체로부터 유래된 프레임워크 서열에 그래프팅된 발현 벡터를 구축함으로써, 특이적인 천연 형성 항체의 특성을 모방하는 재조합 항체를 발현시킬 수 있다 (예, Riechmann, L. et al. (1998) Nature 332:323-327; Jones, P. et al. (1986) Nature 321:522-525; Queen, C. et al. (1989) Proc. Natl. Acad. See. USA. 86:10029-10033; 미국 특허 5,225,539 (Winter), 및 미국 특허 5,530,101; 5,585,089; 5,693,762 및 6,180,370 (Queen et al.) 참조).
이에, 항체는 단일클론 항체 BST1_A2의 VH 및 VK CDR 서열을 포함하지만, 이러한 항체와는 다른 프레임워크 서열을 포함할 수 있다.
이러한 프레임워크 서열은 생식세포계열 항체 유전자 서열을 포함하는 공공 DNA 데이터베이스 또는 간행된 참고문헌으로부터 수득할 수 있다. 예를 들어, 뮤라인 중쇄 및 경쇄 가변 영역 유전자에 대한 생식세포계열 DNA 서열은 IMGT (international ImMunoGeneTics) 뮤라인 생식세포계열 서열 데이터베이스 (hypertext transfer protocol//www.imgt.cines.fr/?에서 이용가능함)뿐 아니라 Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, US Department of Health and Human Services, NIH Publication No. 91-3242에서 찾아볼 수 있으며, 이들 문헌은 원용에 의해 본 명세서에 포함된다. 또 다른 예에서, 뮤라인 중쇄 및 경쇄 가변 영역 유전자에 대한 생식세포계열 DNA 서열은 유전자은행 데이터베이스에서 찾아볼 수 있다.
항체 단백질 서열은 당해 기술 분야의 당업자에게 널리 공지된 Gapped BLAST [Altschul et al. (1997) Nucleic Acids Research 25:3389-3402]로 지칭되는 서열 유사성 검색 방법들 중 한가지를 이용하여 컴파일링된 단백질 서열 데이터베이스에서 비교한다. BLAST는 항체 서열과 데이터베이스 서열 간에 통계적으로 유의한 정렬로 정렬된 워드의 높은-스코어링 세그먼트 쌍 (high-scoring segment pairs, HSP)을 포함할 가능성이 높다는 점에서 발견적 (heuristic) 알고리즘이다. 스코어가 연장 또는 트리밍 (trimming)에 의해 개선될 수 없는 세그먼트 쌍을 히트 (hit)라 한다. 간략하게는, 데이터베이스의 뉴클레오티드 서열을 번역하고, FR1에서 FR3 프레임워크 영역을 포함하는 이들 사이의 영역은 유지시킨다. 데이터베이스 서열은 평균 길이가 잔기 98개이다. 단백질 전체 길이에 걸쳐 정확히 매치되는 중복 서열은 제거한다. BLAST는 디폴트, 작동 중지된 저 복잡성 필터를 제외한 표준 파라미터, 및 BLOSUM62의 치환 매트릭스, 서열 매치를 산출하는 상위 5개의 히트에 대한 필터를 수반한 프로그램 blastp를 이용하여 단백질을 검색한다. 뉴클레오티드 서열을 6개의 프레임 모두에서 번역하고, 데이터베이스 서열의 매치 절편 내 정지 코돈을 전혀 수반하지 않은 프레임을 잠재적 히트로 간주한다. 이는 다시 BLAST 프로그램 tblastx를 이용하여 확인하는데, 이 프로그램은 항체 서열을 6개 모든 프레임에서 번역하고, 이러한 번역 산물을, 6개의 모든 프레임에서 다이나믹하게 번역된 데이터베이스의 뉴클레오티드 서열과 비교한다.
동일성은 서열 전체 길이에 걸쳐 항체 서열과 단백질 데이터베이스 간에 정확하게 매치되는 아미노산이다. 파지티브 (동일성 + 치환 매치)는 동일한 것은 아니지만 BLOSUM62 치환 매트릭스에 의해 파생된 아미노산 치환이다. 항체 서열이 동일한 동일성으로 데이터베이스 서열들 중 2종과 매칭되는 경우에, 가장 파지티브 값이 높은 히트를 매칭 서열 히트로 결정한다.
본원에 개시된 항체에 사용하기에 바람직한 프레임워크 서열은 본 발명의 선택된 항체에 사용되는 프레임워크 서열과 구조적으로 유사한 서열, 예를 들어 본 발명의 바람직한 단일클론 항체에 사용되는 VH 1-80 프레임워크 서열, VH 1-39 프레임워크 서열, VK 4-74 프레임워크 서열 및/또는 VK 4-55 프레임워크 서열과 유사한 서열이다. VH CDR1, CDR2 및 CDR3 서열, 및 VK CDR1, CDR2 및 CDR3 서열은 프레임워크 서열이 유래된 생식세포계열 면역글로불린 유전자에서 발견되는 것과 동일한 서열을 가진 프레임워크 영역에 그래프팅되거나, 또는 CDR 서열은 생식세포계열 서열과 비교해 하나 이상의 돌연변이를 포함하는 프레임워크 영역에 그래프팅될 수 있다. 예를 들어, 특정 경우에 프레임워크 영역 내 잔기에 돌연변이를 유발하여, 항체의 항원 결합 능력을 유지 또는 증진하는 것이 유익한 것으로 밝혀진 바 있다 (예, 미국 특허 5,530,101; 5,585,089; 5,693,762 및 6,180,370 (Queen et al.) 참조).
또 다른 유형의 가변 영역 변형은 VH 및/또는 VK CDR1, CDR2 및/또는 CDR3 영역 내 아미노산 잔기에 돌연변이를 유발하여, 대상 항체의 하나 이상의 결합 특성 (예, 친화성)을 개선하는 것이다. 부위-특이적인 돌연변이 유발 또는 PCR-매개 돌연변이 유발을 수행하여 돌연변이(들)를 도입할 수 있으며, 항체 결합에 대한 효과 또는 관심을 갖는 다른 기능적 특성을, 본원에 기술된 바와 같이, 그리고 실시예에서 제시된 바와 같이, 시험관내 또는 생체내 분석으로 평가할 수 있다. 일부 구현예에서, (상기에서 논의한 바와 같은) 보존적인 변형이 도입된다. 대안적으로, 비-보존적인 변형이 달성될 수 있다. 돌연변이는 아미노산 치환, 부가 또는 결손일 수 있지만, 바람직하게는 치환이다. 또한, 다른 구역 (예, 프레임워크 영역)에서의 변형이 더 많을 수 있음을 당업자는 알 것이지만, 전형적으로는 CDR 영역 내 1, 2, 3, 4 또는 5개 이하로 잔기가 변형된다.
본원의 조작된 항체는 VH 및/또는 VK 내 프레임워크 잔기를 변형시켜, 예를 들어 항체의 특성을 개선하는 것을 포함한다. 전형적으로, 이러한 프레임워크 변형은 항체의 면역원성을 감소시키기 위해 이루어진다. 예를 들어, 한가지 접근법은 하나 이상의 프레임워크 잔기를 대응되는 생식세포계열 서열로 "역돌연변이"화하는 것이다. 보다 구체적으로는, 체세포 돌연변이가 발생한 항체는 그 항체가 유래된 생식세포계열 서열과 다른 프레임워크 잔기를 함유할 수 있다. 그러한 잔기는 항체 프레임워크 서열을 항체가 유래된 생식세포계열 서열과 비교함으로써 확인할 수 있다.
또 다른 유형의 프레임워크 변형은 프레임워크 영역 내 또는 심지어 하나 이상의 CDR 영역 내에서 하나 이상의 잔기에 돌연변이를 유발하여 T 세포 에피토프를 제거함으로써, 항체의 잠재적인 면역원성을 감소시키는 것을 포함한다. 이러한 접근법은 또한 "탈면역화"라고도 하며, 이는 미국 특허 공개 번호 2003/0153043에 더욱 상세히 기술되어 있다.
프레임워크 또는 CDR 영역 내에서 이루어진 변형에 추가적으로 또는 이러한 변형에 대안으로서, 항체는, 전형적으로 항체의 하나 이상의 기능적 특성, 예컨대 혈청 반감기, 보체 고정 (complement fixation), Fc 수용체 결합, 및/또는 항원-의존적인 세포성 세포독성에 변화를 유발하는 변형이 Fc 영역에 포함되도록, 조작할 수 있다. 추가로, 항체를 화학적으로 변형시킬 수 있거나 (예, 하나 이상의 화학적 모이어티를 항체에 부착시킬 수 있음), 당화를 변형시켜 항체의 하나 이상의 기능적 특성이 달라지도록 변형시킬 수 있다. 각각의 이러한 구현예는 하기에서 더욱 상세히 기술된다. Fc 영역 내 잔기의 넘버링은 카바트의 EU 인덱스 넘버링이다.
일 구현예에서, CH1의 힌지 영역은, 힌지 영역 내 시스테인 잔기의 수가 달라지도록, 예를 들어 증가 또는 감소되도록 변형된다. 이러한 접근법은 추가적으로 미국 특허 5,677,425에 기술되어 있다. CH1의 힌지 영역 내 시스테인 잔기의 수는, 예를 들어 경쇄 및 중쇄의 어셈블리를 용이하게 하거나 또는 항체의 안정성을 높이거나 또는 낮추기 위해 변형된다.
또 다른 구현예에서, 항체의 Fc 힌지 영역은 항체의 생물학적 반감기를 낮추도록 돌연변이될 수 있다. 보다 구체적으로, Fc-힌지 단편의 CH2-CH3 도메인 계면 영역에 하나 이상의 아미노산 돌연변이를 도입하여, 항체가 천연 Fc-힌지 도메인 스타필로코쿠스 단백질 A (SpA) 결합에 비해, SpA 결합성이 감소되게 한다. 이러한 접근법은 미국 특허 6,165,745에 더욱 상세히 기술되어 있다.
또 다른 구현예에서, 항체는 생물학적 반감기가 증가되도록 변형된다. 다양한 접근법이 가능하다. 예를 들어, 미국 특허 6,277,375에 기재된 바와 같이, 다음과 같은 돌연변이들 중 하나 이상이 도입될 수 있다: T252L, T254S, T256F. 대안적으로, 생물학적 반감기를 늘리기 위해, 미국 특허 5,869,046 및 6,121,022에 기재된 바와 같이, IgG의 Fc 영역의 CH2 도메인의 2개의 루프로부터 취해진 샐비지 (salvage) 수용체 결합 에피토프이 포함되도록 항체를 CH1 또는 CL 영역 내에서 변형시킬 수 있다.
또 다른 구현예에서, 항체는 WO2007/059782에 기재된 바와 같이 UniBody로서 제조되며, 상기 문헌은 그 전체가 원용에 의해 본 명세서에 포함된다.
또 다른 구현예에서, 하나 이상의 아미노산 잔기를 다른 아미노산 잔기로 대체함으로써 항체의 작동자 기능(들)이 변형되도록 Fc 영역을 변형한다. 예를 들어, 작동자 리간드에 대한 친화성은 변형되지만 부모 항체의 항원-결합 능력은 유지하도록, 항체에서 아미노산 잔기 234, 235, 236, 237, 297, 318, 320 및 322로부터 선택되는 하나 이상의 아미노산이 다른 아미노산 잔기로 치환될 수 있다. 친화성이 변형된 작동자 리간드는, 예를 들어 Fc 수용체 또는 보체의 C1 성분일 수 있다. 이러한 접근법은 미국 특허 5,624,821 및 5,648,260에 더욱 상세히 기술되어 있다.
또 다른 예로, 항체에서 C1q 결합이 변형되거나 및/또는 보체 의존적인 세포독성 (CDC)이 저하 또는 소실되도록, 아미노산 잔기 329, 331 및 322로부터 선택되는 하나 이상의 아미노산이 상이한 아미노산 잔기로 치환될 수 있다. 이러한 접근법은 미국 특허 6,194,551에 더욱 상세히 기술되어 있다.
또 다른 예로, 아미노산 위치 231 및 239 내 하나 이상의 아미노산 잔기를 변형하여, 항체의 보체 고정 능력을 변형시킨다. 이러한 접근법은 PCT 공개 WO 94/29351에 추가적으로 기술되어 있다.
또 다른 구현예에서, 다음과 위치에서 하나 이상의 아미노산을 변형함으로써, 항체의 항체 의존적인 세포 세포독성 (ADCC) 능력을 높이거나 및/또는 Fcγ 수용체에 대한 항체의 친화성을 높이도록, Fc 영역을 변형시킨다: 238, 239, 248, 249, 252, 254, 255, 256, 258, 265, 267, 268, 269, 270, 272, 276, 278, 280, 283, 285, 286, 289, 290, 292, 293, 294, 295, 296, 298, 301, 303, 305, 307, 309, 312, 315, 320, 322, 324, 326, 327, 329, 330, 331, 333, 334, 335, 337, 338, 340, 360, 373, 376, 378, 382, 388, 389, 398, 414, 416, 419, 430, 434, 435, 437, 438 또는 439. 이러한 접근법은 PCT 공개 WO 00/42072 (Presta)에 추가적으로 기술되어 있다. 또한, FcγR1, FcγRII, FcγRIII 및 FcRn에 대한 인간 IgG1 상의 결합 부위가 맵핑 되었으며, 결합성이 개선된 변이체가 개시되어 있다 [Shields, R.L. et al. (2001) J. Biol. Chem. 276:6591-6604 참조). 위치 256, 290, 298, 333, 334 및 339에서의 특이적 돌연변이가 FcγRIII에 대한 결합성을 개선하는 것으로 밝혀졌다. 추가로, 다음과 같은 조합 돌연변이가 개선된 FcγRIII 결합성을 나타내는 것으로 밝혀졌다: T256A/S298A, S298A/E333A, S298A/K224A 및 S298A/E333A/K334A. 추가적인 ADCC 변이체들은 예를 들어 WO2006/019447에 기술되어 있다.
또 다른 예로, Fc 영역은, 예를 들어, PCT/US2008/088053, US 7,371,826, US 7,670,600 및 WO 97/34631에 기재된 바와 같이, 일반적으로 FcRn 수용체에 대한 결합성을 증가시킴으로써 항체 반감기가 증가되도록 변형된다. 또 다른 구현예에서, 항체는 그의 생물학적 반감기가 증가되도록 변형된다. 다양한 접근법이 가능하다. 예를 들어, 미국 특허 6,277,375 (Ward)에 기재된 바와 같은, 하기 돌연변이들 중의 하나 이상이 도입될 수 있다: T252L, T254S, T256F. 대안적으로, 생물학적 반감기를 늘리기 위해, 미국 특허 5,869,046 및 6,121,022에 기재된 바와 같이, IgG의 Fc 영역의 CH2 도메인의 2개의 루프로부터 유래된 샐비지 수용체 결합 에피토프가 포함되도록 항체를 CH1 또는 CL 영역 내에서 변형시킬 수 있다.
또 다른 구현예에서, 항체의 당화를 변형한다. 예를 들어, 비-당화 항체를 제조할 수 있다 (즉, 항체에 당화가 결핍됨). 당화는 예를 들어 항원에 대한 항체 친화성을 높이도록 변형될 수 있다. 이러한 탄수화물 변형은 예를 들어 항체 서열에서 하나 이상의 당화 부위를 변형시킴으로써 달성할 수 있다. 예를 들어, 하나 이상의 가변 영역 프레임워크의 당화 부위를 제거함으로써, 그 부위에서 당화를 없애는, 하나 이상의 아미노산 치환을 달성할 수 있다. 이러한 비-당화는 항원에 대한 항체의 친화성을 높일 수 있다. 이러한 접근법은 미국 특허 5,714,350 및 6,350,861 (Co et al.)에 보다 상세히 기술되어 있으며, 297번 아스파라긴을 제거함으로써 달성할 수 있다.
추가적으로 또는 대안적으로, 당화 타입이 변형된 항체, 예를 들어 푸코실 잔기가 수적으로 감소된 저푸코실화 (hypofucosylated) 항체 또는 바이섹팅 (bisecting) GlcNac 구조가 증가된 항체를 만들 수 있다. 이는 때때로 당업계에서 "조작된 당형태 (engineered glycoform)"로 지칭된다. 이러한 변형된 당화 패턴이 항체의 ADCC 능력을 높이는 것으로 입증된 바 있다. 이러한 탄수화물 변형은 일반적으로 2가지 방식으로 달성될 수 있으며, 예를 들어 일부 구현예에서, 항체를 변형된 당화 기전 (altered glycosylation machinery)을 가진 숙주 세포에서 발현시킨다. 당화 기전이 변형된 세포는 당업계에 개시되어 있으며, 본 발명의 재조합 항체를 발현하여 당화 변형된 항체를 생산하는 숙주 세포로서 사용할 수 있다. POTELLIGENT® 기법을 참조한다. 예를 들어, 세포주 Ms704, Ms705 및 Ms709에는 푸코실트랜스퍼라제 유전자인 FUT8 (알파 (1,6)푸코실트랜스퍼라제)이 결핍되어 있어, Ms704, Ms705 및 Ms709 세포주에서 발현된 항체는 탄수화물에 푸코스가 결핍되어 있다. Ms704, Ms705 및 Ms709 FUT8-/- 세포주는 CHO/DG44 세포의 FUT8 유전자를 2종의 치환 벡터를 사용해 표적 파괴함으로써 구축되었다 (미국 특허 공개 번호 2004/0110704, 미국 특허 7,517,670 및 Yamane-Ohnuki et al. (2004) Biotechnol. Bioeng. 87:614-22 참조). 또 다른 예로서, EP 1,176,195 (Hanai et al.)에는, 푸코실 트랜스퍼라제를 코딩하는 기능적으로 파괴된 FUT8 유전자를 가진 세포주가 개시되어 있는데, 이 세포주에서 발현된 항체는 알파 1,6 결합-관련 효소의 감소 또는 제거에 의해 저푸코실화를 나타낸다. Hanai 등은 또한, 항체의 Fc 영역과 결합하거나 또는 효소 활성이 없는 N-아세틸글루코사민에 푸코스를 부가하는 저-활성형 효소를 가진 세포주, 예를 들어 랫 골수종 세포주 YB2/0 (ATCC CRL 1662)를 개시하였다. 다른 예로, 조작된 당형태, 특히 비-푸코시화 (afucosylation)는 당화 경로 효소에 대한 소분자 억제제를 사용하여 달성될 수 있다 (예를 들어, Rothman et al. (1989) Mol. Immunol. 26(12):113-1123; Elbein (1991) FASEB J. 5:3055; PCT/US2009/042610 및 미국 특허 7,700,321 참조). PCT 공개 WO 03/035835는 푸코스를 Asn(297)-연결된 탄수화물에 부착시키는 능력이 저하되고, 또한 이로 인해 해당 숙주 세포에서 발현된 항체가 저푸코실화된, 변이체 CHO 세포주, Lec13 세포를 개시하였다 (또한, Shields, R.L. et al. (2002) J. Biol. Chem. 277:26733-26740 참조). PCT 공개 WO99/54342는 당단백질-변형된 글리코실 트랜스퍼라제 (예, 베타(1,4)-N-아세틸글루코사미닐트랜스퍼라제 III (GnTIII))를 발현하도록 조작된 세포주를 개시하고 있으며, 이와 같이 조작된 세포주에서 발현된 항체에는 바이섹팅 GlcNac 구조가 증가되어 항체의 ADCC 활성이 강화된다 (또한, Umana et al. (1999) Nat. Biotech. 17:176-180 참조).
다른 예로, 항체의 푸코스 잔기를 푸코시다제 효소를 사용해 절단할 수 있다. 예를 들어, 푸코시다제 알파-L-푸코시다제가 항체에서 푸코실 잔기를 제거한다 [Tarentino, A.L. et al. (1975) Biochem. 14:5516-23].
본 발명에서 고려되는 본원의 항체에 대한 또 다른 변형은 페길화 (pegylation)이다. 예를 들어, 항체의 생물학적 (예, 혈청) 반감기를 늘리기 위해, 항체를 페길화할 수 있다. 항체를 페길화하기 위해, 전형적으로 1개 이상의 폴리에틸렌 글리콜 (PEG) 기가 항체 또는 항체 단편에 부착되는 조건 하에, PEG, 예를 들어 PEG의 반응성 에스테르 또는 알데히드 유도체를 항체 또는 그의 단편와 반응시킨다. 바람직하게는, 페길화는 반응성 PEG 분자 (또는 유사한 반응성 수용성 중합체)와의 아실화 반응 또는 알킬화 반응을 통해 이루어진다. 본원에서, 용어 "폴리에틸렌 글리콜"은 다른 단백질을 유도체화하기 위해 사용되는 임의의 형태의 PEG, 예컨대 모노 (C1-C10) 알콕시- 또는 아릴옥시-폴리에틸렌 글리콜 또는 폴리에틸렌 글리콜-말레이미드를 포괄하는 것으로 의도된다. 특정 구현예에서, 페길되는 항체는 비-당화 항체이다. 단백질의 페길화 방법은 당업계에 공지되어 있으며, 본 발명의 항체에 적용될 수 있다. 예를 들어, EP 0154316 및 EP 0401384를 참조한다.
추가적인 구현예에서, 항체는 표지물질을 포함할 수 있다. 본원에서 "표지된"은 하나 이상의 성분, 동위원소 또는 화학적 화합물이 부착된 것을 의미한다. 일반적으로, 표지물질은 3가지 부류: a) 방사성 또는 헤비 동위원소일 수 있는 동위원소 표지물질; b) 자기성, 전기적, 열적; 및 c) 착색 또는 발광 염료로 분류되나, 표지물질은 또한 효소 및 입자, 예컨대 자기 입자를 포함한다. 바람직한 표지물질로는, 형광 란타나이드 복합체 (유로퓸 및 테르븀의 것 포함), 및 형광 표지물질 (양자 점, 플루오레세인, 로다민, 테트라메틸로다민, 에오신, 에리트로신, 쿠마린, 메틸-쿠마린, 피렌, 말라카이트 그린, 스틸벤, 루시퍼 옐로우, 캐스케이드 블루, 텍사스 레드, 알렉사 염료, Cy 염료 및 Molecular Probes Handbook by Richard P. Haugland의 제6판에 기재된 기타 물질 등이 있으나, 이들로 제한되는 것은 아니며, 상기 문헌은 원용에 의해 본 명세서에 명백하게 포함된다.
링커
본 발명은 항체가 화학적 링커를 통해 파트너에 연결된 항체-파트너 접합체를 포함하는 약학적 조합물을 제공한다. 일부 구현예에서, 링커는 펩티딜 링커이고; 그외 링커로는 하이드라진 및 다이설파이드 링커를 포함한다. 본원은 또한 본질적으로 파트너에 부착될 링커뿐 아니라, 임의의 분자 종에 부착하기에 적절한 절단가능한 링커 아암을 제공한다. 본 발명의 링커 아암은 치료 모이어티에 대한 그의 부착을 언급함으로써 본원에 예시된다. 그러나, 링커가 진단제, 분석제, 생체분자, 표적화제, 검출가능한 표지 등을 포함하나, 이들로 제한되지는 않는 다양한 종에 부착될 수 있음은, 당업자라면 쉽게 자명할 것이다.
항체-파트너 접합체에서의 펩티딜 및 다른 링커의 사용이 미국 특허 가출원 번호 60/295,196; 60/295,259; 60/295342; 60/304,908; 60/572,667; 60/661,174; 60/669,871; 60/720,499; 60/730,804; 및 60/735,657 및 미국 특허 출원 번호 10/160,972; 10/161,234; 11/134,685; 11/134,826; 및 11/398,854 및 미국 특허 6,989,452 및 PCT 특허 출원 PCT/US2006/37793 (이들 모두 본원에 원용에 의해 포함됨)에 기재되어 있다. 추가의 링커로는 미국 특허 6,214,345, 미국 특허 출원 2003/0096743 및 미국 특허 출원 2003/0130189, 문헌 de Groot et al., J. Med. Chem. 42, 5277 (1999); de Groot et al. J. Org. Chem. 43, 3093 (2000); de Groot et al., J. Med. Chem. 66, 8815, (2001); WO 02/083180; Carl et al., J. Med. Chem. Lett. 24, 479, (1981); Dubowchik et al., Bioorg & Med. Chem. Lett. 8, 3347 (1998); 및 미국 특허 가출원 번호 60/891,028에 기재되어 있다.
일 측면에서, 본원은 치료학적 물질 및 마커에 표적화 기를 부착시키는데 유용한 링커에 관한 것이다. 또 다른 측면에서, 본원은 화합물에 안정성을 부여하거나, 이들의 생체내 독성을 감소시키거나, 또는 다르게는 그의 약동학, 생체이용률 및/또는 약력학에 유리한 영향을 미치는 링커를 제공한다. 일반적으로, 이러한 구현예에서, 약물이 그 작용 부위로 전달되면, 링커는 절단되어 활성 약물을 방출시키는 것이 바람직하다. 따라서, 일 구현예에서, 링커는 흔적이 남지않아, 일단 치료학적 물질 또는 마커로부터 (예, 활성화 동안) 제거되면 링커가 존재한다는 흔적은 남지 않는다. 또 다른 구현예에서, 링커는 치료학적 물질의 작용 부위 또는 마커의 활성 부위와 같은 표적 세포 내 부위 또는 근처에서 절단될 수 있는 능력을 특징으로 한다. 이러한 절단은 사실상 효소적일 수 있다. 이러한 특징은 치료학적 물질 또는 마커의 전신 활성화를 감소시켜, 독성 및 전신 부작용을 낮추는데 도움이 된다. 효소적 절단을 위한 바람직한 절단가능한 기는 펩타이드 결합, 에스테르 연결 및 이황화 연결을 포함한다. 다른 구현예에서, 링커는 pH에 대해 민감하고, pH 변화에 의해 절단된다.
본원의 일 측면은 링커가 절단되는 속도를 제어하는 능력이다. 종종, 신속하게 절단되는 링커가 요망된다. 하지만, 일부 구현예에서는 보다 서서히 절단되는 링커가 바람직할 수 있다. 예를 들어, 지속 방출 제형, 또는 빠른 방출 성분 및 느린 방출 성분을 둘 다 갖는 제형에서, 보다 서서히 절단되는 링커를 제공하는 것이 유용할 수 있다. WO 02/096910은 하이드라진 링커를 갖는 여러 특정한 리간드-약물 복합체를 제공한다. 그러나, 요구되는 고리화의 속도에 따라 링커 조성물을 "조정하는" 방법은 없으며, 언급된 특정 화합물은 다수의 약물-링커 접합체에서 바람직한 것보다 느린 속도로 약물로부터 리간드를 절단한다. 대조적으로, 하이드라진 링커는 매우 빠른 것부터 매우 느린 것까지 소정 범위의 고리화 속도를 제공할 수 있으며, 이에 의해 고리화의 바람직한 속도에 기초한 특정 하이드라진 링커의 선택이 허용된다.
예를 들어, 매우 빠른 고리화는 절단시 단일 5원성 고리를 형성하는 하이드라진 링커에 의해 달성될 수 있다. 세포독성제의 세포 표적화된 전달에 바람직한 고리화 속도는 절단시 같은자리 위치 (geminal position)에 2개의 메틸을 갖는 링커로부터 생기는 5원성 고리 2개 또는 6원성 고리 하나를 형성하는 하이드라진 링커를 사용하여 달성된다. 같은자리-다이메틸 효과는, 같은자리 위치에서 2개의 메틸이 없는 단일 6원성 고리와 비교하여, 고리화 반응의 속도를 가속시키는 것으로 밝혀졌다. 이는 고리에서 방출되는 가닥 (strain)으로부터 기원한다. 그러나, 때때로 치환기는 반응을 보다 빠르게 하기 보다는 반응을 느리게 할 수 있다. 종종 지연의 원인은 입체 장애로 추정될 있다. 예를 들어, 같은자리 다이메틸 치환은 같은자리 탄소가 CH2인 경우와 비교해 더 빠른 고리화 반응이 일어나도록 한다.
그러나, 일부 구현예에서는 보다 서서히 절단되는 링커가 바람직할 수 있다는 것에 주목하는 것이 중요하다. 예를 들어, 지속 방출 제형 또는 빠른 방출 성분 및 느린 방출되는 성분을 둘 다 갖는 제형에서는, 보다 서서히 절단되는 링커를 제공하는 것이 유용할 수 있다. 특정 구현예에서, 고리화의 느린 속도는 절단시 같은자리-다이메틸 치환 없이 단일 6원성 고리를 형성하거나 또는 단일 7원성 고리를 형성하는 하이드라진 링커를 사용하여 달성된다. 링커는 또한 순환되는 동안 치료학적 물질 또는 마커를 분해로부터 안정시키는 작용을 한다. 이러한 특징은 이러한 안정화가 부착된 치료학적 물질 또는 마커의 순환 반감기를 연장시키기 때문에 유의한 이점을 제공한다. 링커는 또한 부착된 치료학적 물질 또는 마커의 활성을 감쇠시키는 작용을 하여 접합체가 순환되는 동안 비교적 유리하고, 원하는 작용 부위에서 활성화된 후 원하는 효과, 예를 들어 독성을 갖게 된다. 치료학적 물질 접합체의 경우, 이러한 링커의 특성은 치료학적 물질의 치료 지수 (therapeutic index)를 개선하는 작용을 한다.
안정화 기는 바람직하게는 혈액 또는 비-표적 조직에 존재할 수 있는 효소에 의한 치료학적 물질 또는 마커의 제거 및 대사를 제한하도록 선택되고, 세포 내로의 치료학적 물질 또는 마커의 수송을 제한하도록 추가적으로 선택된다. 안정화 기는 치료학적 물질 또는 마커의 분해를 차단하는 작용을 하고, 또한 치료학적 물질 또는 마커의 다른 물리적 특성을 제공하는데 작용할 수 있다. 안정화 기는 또한 제형화된 또는 비-제형화된 형태로 저장시 치료학적 물질 또는 마커의 안정성을 개선할 수 있다.
이상적으로, 안정화 기가, 인간 혈액내 작용제 또는 마커의 2시간 동안 37℃에서 저장 검사시, 치료학적 물질 또는 마커를 분해로부터 보호하는 작용을 한다면 치료학적 물질 또는 마커를 안정화시키는데 유용하고, 주어진 분석 조건 하에 인간 혈액에 존재하는 효소에 의한 절단은 치료학적 물질 또는 마커의 20% 미만, 바람직하게는 10% 미만, 보다 바람직하게는 5% 미만 및 보다 더 바람직하게는 2% 미만이다. 본 발명은 또한 이러한 링커를 함유하는 접합체에 관한 것이다. 보다 구체적으로, 본 발명은 질환의 치료, 특히 암 화학요법을 위해 사용될 수 있는 전구약물 (prodrug)의 사용에 관한 것이다. 구체적으로, 본원에 기술된 링커의 사용은 유사한 구조의 전구약물에 비해 혈액에서 작용의 높은 특이성, 감소된 독성 및 개선된 안정성을 나타내는 전구약물을 제공한다. 본원에 기술된 바와 같은 본원의 링커는 파트너 분자 내 다양한 위치에 존재할 수 있다.
따라서, 링커 쇄의 일부로서의 임의의 다양한 기가 결핍된 구축물에 비해 증진된 속도로 생체내, 예를 들어, 혈류에서 절단되는 상기한 기를 함유할 수 있는 링커가 제공된다. 링커 아암의 치료학적 물질 및 진단제와의 접합체가 또한 제공된다. 링커는 치료학적 물질의 전구약물 유사체의 형성 및 치료학적 물질 또는 진단제의 표적화제, 검출가능한 표지 또는 고체 지지체로의 가역적인 연결에 유용하다. 링커는 세포독소를 포함하는 복합체에 혼입될 수 있다.
항체에 전구약물의 부착은 세포독성 약물의 종래의 항체 접합체에 비해 추가적인 안전성 이점을 제공할 수 있다. 전구약물의 활성화는 혈장을 비롯하여, 종양 세포 및 여러 정상 조직 둘 다 내에서 에스테라제에 의해 달성될 수 있다. 인간의 적절한 에스테라제 활성의 수준은 마우스에서 관찰되는 것보다는 낮더라도, 랫 및 비-인간 영장류에서 관찰된 것과 매우 유사한 것으로 밝혀졌다. 전구약물의 활성화는 또한 글루쿠로니다제에 의한 절단에 의해 달성될 수 있다. 절단가능한 펩타이드, 하이드라진, 또는 이황화 기 뿐만 아니라, 하나 이상의 자기-희생 링커 (self-immolative linker) 기는 임의로 세포독소와 표적화제 사이에 도입된다. 이러한 링커 기는 스페이서 기로서 기재될 수 있고, 2개 이상의 반응성 관능기를 함유할 수도 있다. 전형적으로, 스페이서 기의 하나의 화학적 관능기는 치료학적 물질, 예를 들어 세포독소의 화학적 관능기에 결합하는 반면, 스페이서 기의 다른 화학적 관능기는 표적화제 또는 절단가능한 링커의 화학적 관능기에 결합하는데 사용된다. 스페이서 기의 화학적 관능기의 예로는 하이드록시, 메르캅토, 카르보닐, 카르복시, 아미노, 케톤 및 메르캅토 기를 포함한다.
자기-희생 링커는 일반적으로 치환되거나 또는 치환되지 않은 알킬, 치환되거나 또는 치환되지 않은 아릴, 치환되거나 또는 치환되지 않은 헤테로아릴, 또는 치환되거나 또는 치환되지 않은 헤테로알킬 기이다. 일 구현예에서, 알킬 또는 아릴 기는 1 내지 20개의 탄소 원자를 포함할 수 있다. 이들은 또한 폴리에틸렌 글리콜 모이어티를 포함할 수 있다.
예시적인 스페이서 기로는, 예를 들어 6-아미노헥산올, 6-메르캅토헥산올, 10-히드록시데칸산, 글리신 및 다른 아미노산, 1,6-헥산디올, β-알라닌, 2-아미노에탄올, 시스테아민 (2-아미노에탄티올), 5-아미노펜탄산, 6-아미노헥산산, 3-말레이미도벤조산, 프탈리드, α-치환된 프탈리드, 카르보닐 기, 아미날 에스테르, 핵산, 펩타이드 등을 포함한다.
스페이서는 추가의 분자 질량 및 화학적 관능기를 세포독소-표적화제 복합체내로 도입시키는 작용을 할 수 있다. 일반적으로, 추가의 질량 및 관능성은 혈청 반감기 및 다른 복합체 특성에 영향을 미칠 것이다. 따라서, 스페이서 기를 신중하게 선택함으로써, 소정 범위의 혈청 반감기를 갖는 복합체를 생성할 수 있다.
다중 스페이서가 존재하는 경우에, 또한 동일하거나 또는 상이한 스페이서가 사용될 수 있다.
바람직하게는 모이어티를 함유하는 링커를 사용하여 접합체에 증가된 용해성 또는 감소된 응집 특성을 부여하거나, 또는 접합체의 가수분해율을 변형시키는 추가의 링커 모이어티가 사용될 수 있으며, 이러한 링커는 자기 희생적일 필요는 없다. 일 구현예에서, 링커 모이어티는 치환된 알킬, 치환되지 않은 알킬, 치환된 아릴, 치환되지 않은 아릴, 치환된 헤테로알킬, 또는 치환되지 않은 헤테로알킬 (이들 모두는 직쇄형, 분지형 또는 사이클릭일 수 있음)이다. 치환기는 예를 들어 저급 (C1-C6) 알킬, 알콕시, 알킬티오, 알킬아미노 또는 다이알킬아미노일 수 있다. 특정 구현예에서, 링커는 비-사이클릭 모이어티를 포함한다. 또 다른 구현예에서, 링커는 임의의 양전하 또는 음전하로 하전된 아미노산 중합체, 예를 들어, 폴리리신 또는 폴리아르기닌을 포함한다. 링커는 폴리에틸렌 글리콜 모이어티와 같은 중합체를 포함할 수 있다. 추가적인 링커는 예를 들어 폴리머 성분 및 소형 화학적 모이어티를 둘 다 포함할 수 있다. 바람직한 구현예에서, 이러한 링커는 폴리에틸렌 글리콜 (PEG) 모이어티를 포함한다.
PEG 부분은 길이가 1 내지 50개의 단위일 수 있다. 바람직하게, PEG는 1-12개의 반복 단위, 보다 바람직하게는 3-12개의 반복 단위, 보다 바람직하게는 2-6개의 반복 단위, 보다 더 바람직하게는 3-5개의 반복 단위, 가장 바람직하게는 4개의 반복 단위를 가질 것이다. 링커는 PEG 모이어티로만 이루어질 수 있거나, 또는 치환 또는 비-치환된 추가적인 알킬 또는 헤테로알킬을 포함할 수도 있다. 복합체의 수 용해성을 높이기 위해 모이어티의 일부로서 PEG와 조합되는 것도 유용하다. 추가적으로, PEG 모이어티는 약물을 항체와 접합시키는 동안 발생할 수도 있는 응집 정도를 감소시킨다.
세포독소의 유형, 링커 및 항체에 치료학적 물질를 접합시키는 방법에 대한 추가적인 논의는, 또한 PCT 공개 WO 2007/059404 (Gangwar et al., 표제 "Cytotoxic Compounds And Conjugates"), Saito, G. et al. (2003) Adv. Drug Deliv. Rev. 55:199-215; Trail, P.A. et al. (2003) Cancer Immunol. Immunother. 52:328-337; Payne, G. (2003) Cancer Cell 3:207-212; Allen, T.M. (2002) Nat. Rev. Cancer 2:750-763; Pastan, I. and Kreitman, R. J. (2002) Curr. Opin. Investig. Drugs 3:1089-1091; Senter, P.D. and Springer, CJ. (2001) Adv. Drag Deliv. Rev. 53:247-264 (이들 문헌은 각각 전체 내용이 원용에 의해 본 명세서에 포함됨)을 참조한다.
파트너 분자
약학적 조합물은 파트너 분자, 예를 들어 세포독소, 약물 (예, 면역억제제) 또는 방사성독소에 접합된 항체를 포함한다. 이러한 접합체는 또한 본원에서 "면역접합체"로 지칭된다. 하나 이상의 세포독소를 포함하는 면역접합체는 "면역독소"로 지칭된다. 세포독소 또는 세포독성제는 세포에게 해로운 (예, 사멸시키는) 임의의 물질을 포함한다.
본원의 파트너 분자의 예로는 탁솔, 시토칼라신 B, 그라미시딘 D, 브로민화에티듐, 에메틴, 미토마이신, 에토포시드, 테노포시드, 빈크리스틴, 빈블라스틴, 콜키신, 독소루비신, 다우노루비신, 다이하이드록시 안트라신 디온, 미톡산트론, 미트라마이신, 악티노마이신 D, 1-데히드로테스토스테론, 글루코코르티코이드, 프로카인, 테트라카인, 리도카인, 프로프라놀롤, 및 퓨로마이신 및 이들의 유사체 또는 상동체를 포함한다. 파트너 분자의 예로는, 또한, 예를 들어 항-대사산물 (예, 메토트렉세이트, 6-메르캅토퓨린, 6-티오구아닌, 시타라빈, 5-플루오로우라실 데카르바진), 알킬화제 (예, 메클로레타민, 티오에파 클로람부실, 멜팔란, 카르무스틴 (BSNU) 및 로무스틴 (CCNU), 사이클로포스파미드, 부술판, 디브로모만니톨, 스트렙토조토신, 미토마이신 C, 및 시스-디클로로디아민 백금 (II) (DDP) 시스플라틴), 안트라시클린 (예, 다우노루비신 (이전에 다우노마이신) 및 독소루비신), 항생제 (예, 닥티노마이신 (종래에 악티노마이신), 블레오마이신, 미트라마이신, 안트라마이신 (AMC)), 및 항-유사분열제 (예, 빈크리스틴 및 빈블라스틴)를 포함하지만, 이들로 한정되는 것은 아니다.
바람직한 항체에 접합될 수 있는 파트너 분자에 대한 다른 바람직한 예로는 두오카르마이신, 칼리케아미신, 메이탄신 및 아우리스타틴, 및 이들의 유도체 등이 있다. 칼리케아미신 항체 접합체의 예들은 상업적으로 입수가능하다 (밀로타르그(Mylotarg)®; American Home Products).
파트너 분자에 대한 바람직한 예는 CC-1065 및 두오카르마이신이다. CC-1065는 업존 캄파니(Upjohn Company)에 의해 1981년에 스트렙토미세스 젤렌시스 (Streptomyces zelensis)로부터 최초로 단리되었으며 [Hanka et al., J. Antibiot. 31: 1211 (1978); Martin et al., J. Antibiot. 33: 902 (1980); Martin et al., J. Antibiot. 34: 1119 (1981)], 시험관내 및 실험 동물 모두에서 강력한 항종양 및 항미생물 활성을 갖는 것으로 밝혀졌다 [Li et al., Cancer Res. 42: 999 (1982)]. CC-1065는 5'-d(A/GNTTA)-3' 및 5'-d(AAAAA)-3'의 서열 선호도로 마이너 그루브 내 이중-가닥 B-DNA에 결합하고 [Swenson et al., Cancer Res. 42: 2821 (1982)], 분자에 존재하는 CPI 좌측 유닛에 의해 3'-아데닌의 N3 위치를 알킬화한다 [Hurley et al., Science 226: 843 (1984)].
CC-1065는, 강력하고 광범위한 항종양 활성에도 불구하고, 실험 동물에서 지연된 사망을 일으킨 바, 인간에 사용될 수 없다. CC-1065 및 두오카르마이신의 많은 유사체 및 유도체들이 당업계에 공지되어 있다. 이들 많은 화합물의 구조, 합성 및 특성에 관한 조사가 검토되었다. 예를 들어, Boger et al., Angew. Chem. Int. Ed. Engl. 35: 1438 (1996); 및 Boger et al., Chem. Rev. 97: 787 (1997)을 참조한다. Kyowa Hakko Kogya Co., Ltd. 사의 그룹에서 다양한 CC-1065 유도체들을 제조하였다. 예를 들어, 미국 특허 5,101,038; 5,641,780; 5,187,186; 5,070,092; 5,703,080; 5,070,092; 5,641,780; 5,101,038; 및 5,084,468; 및 공개된 PCT 출원, WO 96/10405 및 공개된 유럽 출원 0 537 575 A1을 참조한다. Upjohn Company (Pharmacia Upjohn) 또한 CC-1065의 유도체를 제조하는 활동을 하고 있다. 예를 들어, 미국 특허 5,739,350; 4,978,757, 5,332,837 및 4,912,227을 참조한다.
항체 물성
본원에 개시된 항체는 항-BST1 항체의 다양한 물리적 특성에 의해 추가로 특정화될 수 있다. 다양한 분석을 이용하여 이들 물리적 특성에 기초하여 다양한 부류의 항체를 검출 및/또는 구별할 수 있다.
일부 구현예에서, 본원에 개시된 항체는 경쇄 또는 중쇄 가변 영역에 1개 이상의 당화 부위를 함유할 수 있다. 가변 영역 내 1개 이상의 당화 부위의 존재는 변경된 항원 결합으로 인하여, 항체의 증가된 면역원성 또는 항체의 pK의 변경을 일으킬 수 있다 [Marshall et al. (1972) Annu Rev Biochem 41:673-702; Gala FA and Morrison SL (2004) J Immunol 172:5489-94; Wallick et al. (1988) J Exp Med 168:1099-109; Spiro RG (2002) Glycobiology 12:43R-56R; Parekh et al. (1985) Nature 316:452-7; Mimura et al. (2000) Mol Immunol 37:697-706]. 당화는 N-X-S/T 서열을 함유하는 모티프에서 발생하는 것으로 공지되어 있다. 항체를 절단시켜 Fab를 만든 다음, 퍼아이오데이트 산화와 쉬프( Schiff) 염기 형성을 측정하는 분석을 이용하여 당화에 관하여 시험하는 글리코블롯 (glycoblot) 분석을 이용하여 가변 영역 당화를 시험할 수 있다. 대안적으로, Fab로부터 사카라이드를 절단시켜 모노사카라이드를 수득하고, 개별 사카라이드 함량을 분석하는 디오넥스 (Dionex) 광 크로마토그래피 (디오넥스-LC)를 이용하여 가변 영역 당화를 시험할 수 있다. 일부 경우에, 가변 영역 당화를 함유하지 않는 항-BST1 항체를 갖는 것이 바람직하다. 이는 가변 영역 내에 당화 모티프를 함유하지 않는 항체를 선택함으로써, 또는 당업계에 널리 공지된 표준 기술을 이용하여, 당화 모티프 내 잔기를 돌연변이시킴으로써 달성될 수 있다.
바람직한 구현예에서, 본원에 개시된 항체는 아스파라긴 이성질화 (isomerism) 부위를 함유하지 않는다. 탈아미드화 또는 이소아스파르트산 효과는 각각, N-G 또는 D-G 서열 상에서 나타날 수 있다. 탈아미드화 또는 이소아스파르트산 효과는 주쇄 보다는 측쇄 카르복시 말단 외부에 꼬임 구조를 만들어 항체의 안정성을 감소시키는 이소아스파르트산의 발생을 일으킨다. 이소아스파르트산의 생성은 이소-정량적 분석을 이용하여 측정될 수 있는데, 이는 역상 HPLC를 이용하여 이소아스파르트산을 시험한다.
각각의 항체는 고유의 등전점 (pI)을 가질 것이나, 일반적으로 항체는 6 내지 9.5의 pH 범위일 것이다. IgG1 항체의 pI는 전형적으로 7-9.5의 pH 범위에 해당하고, IgG4 항체에 대한 pI는 전형적으로 6-8의 pH 범위에 해당한다. 항체는 이러한 범위를 벗어나는 pI를 가질 수 있다. 이들 효과가 전반적으로 공지되어 있지는 않지만, 정상 범위를 벗어나는 pI를 갖는 항체는 생체내 조건 하에 상당한 언폴딩 및 불안정성을 가질 것으로 추측된다. 등전점은 pH 구배를 발생시키는 모세관 등전점 포커싱 분석을 이용하여 시험될 수 있으며, 증가된 정확도를 위해 레이저 포커싱을 이용할 수 있다 [Janini et al. (2002) Electrophoresis 23:1605-11; Ma et al. (2001) Chromatographia 53:S75-89; Hunt et al. (1998) J Chromatogr A 800:355-67]. 일부 경우에, 정상 범위에 들어가는 pI 값을 가진 항-BST1 항체가 바람직하다. 이는 정상 범위의 pI를 갖는 항체를 선택함으로써, 또는 당업계에 널리 공지된 표준 기술을 이용하여 하전 표면 잔기를 돌연변이시킴으로써 달성될 수 있다.
각각의 항체는 열 안정성을 나타내는 용융 온도를 가질 것이다 [Krishnamurthy R and Manning MC (2002) Curr Pharm Biotechnol 3:361-71]. 보다 높은 열 안정성은 생체내 보다 높은 전체 항체 안정성을 나타낸다. 항체의 융점은 시차 주사 열량측정법과 같은 기술을 이용하여 측정할 수 있다 [Chen et al. (2003) Pharm Res 20:1952-60; Ghirlando et al. (1999) Immunol Lett 68:47-52]. TM1은 항체의 초기 언폴딩 온도를 나타낸다. TM2는 항체의 완전한 언폴딩 온도를 나타낸다. 일반적으로, 본원에 개시된 항체의 TM1이 60℃ 초과, 바람직하게는 65℃ 초과, 보다 더 바람직하게는 70℃를 초과하는 것이 바람직하다. 대안적으로, 항체의 열 안정성은 원편광 이색성을 이용하여 측정할 수 있다 [Murray et al. (2002) J. Chromatogr Sci 40:343-9].
바람직한 구현예에서, 신속하게 분해되지 않는 항체가 선택된다. 항-BST1 항체의 단편화는 당업계에서 널리 이해되는 바와 같이, 모세관 전기영동 (CE) 및 MALDI-MS를 이용하여 측정할 수 있다 [Alexander AJ and Hughes DE (1995) Anal. Chem. 67:3626-32].
또 다른 바람직한 구현예에서, 최소 응집 효과를 갖는 항체가 선택된다. 응집은 원치 않는 면역 반응의 촉발 및/또는 변경된 또는 바람직하지 않은 약동학적 특성의 촉발로 이어질 수 있다. 일반적으로, 응집이 25% 이하, 바람직하게는 20% 이하, 보다 더 바람직하게는 15% 이하, 보다 더 바람직하게는 10% 이하, 보다 더 바람직하게는 5% 이하인 항체가 허용된다. 응집은 크기-배제 컬럼 (SEC), 고성능 액체 크로마토그래피 (HPLC), 및 단량체, 이량체, 삼량체 또는 다량체를 확인하기 위한 광 산란을 비롯한, 당업계에 널리 공지된 여러 기술에 의해 측정될 수 있다.
항체 조작법
전술한 바와 같이, 본원에 개시된 VH 및 VK 서열을 갖는 항-BST1 항체는 VH 및/또는 VK 서열, 또는 이들에 부착된 불변 영역(들)을 변형함으로써 신규한 항-BST1 항체를 제작하는데 사용될 수 있다. 따라서, 바람직한 항-BST1 항체, 예를 들어 BST1_A2의 구조적 특징은 바람직한 항체의 하나 이상의 기능적 특성, 예컨대 인간 BST1에 대한 결합을 보유하는 구조적으로 관련된 항-BST1 항체를 생성하는데 사용된다. 예를 들어, BST1_A2의 하나 이상의 CDR 영역 또는 그의 돌연변이는 공지의 프레임워크 영역 및/또는 다른 CDR과 재조합에 의해 조합되어, 전술한 바와 같이 추가의 재조합-조작된 항-BST1 항체를 생성할 수 있다. 다른 유형의 변형은 이전 섹션에 기재된 것들을 포함한다. 조작 방법을 위한 출발 물질은 본원에 제공된 VH 및/또는 VK 서열 중 하나 이상, 또는 그의 하나 이상의 CDR 영역이다. 조작된 항체를 생성하기 위해, 본원에서 제공되는 하나 이상의 VH 및/또는 VK 서열 또는 그의 하나 이상의 CDR 영역을 갖는 항체를 실제로 제조할 (즉, 단백질로서 발현시킬) 필요는 없다. 오히려, 이들 서열(들) 내에 함유된 정보를 출발 물질로서 사용하여 본래의 서열(들)로부터 유래된 "제2 세대" 서열(들)을 제작한 다음, 이러한 "제2 세대" 서열(들)을 단백질로서 제조 및 발현시킨다.
표준 분자 생물학 기술을 이용하여, 변경된 항체 서열을 제조하고 발현시킬 수 있다.
바람직하게는, 변경된 항체 서열(들)에 의해 코딩되는 항체는 본원에 기술된 항-BST1 항체의 하나, 일부 또는 모든 기능적 특성을 보유하는 것이며, 상기 기능적 특성은 (a) 1x10-7 M 이하의 KD로 인간 BST1에 결합하는 것; (b) BST1로 형질감염된 인간 CHO 세포에 결합하는 것을 포함하지만, 이들로 한정되는 것은 아니다.
변경된 항체의 기능적 특성은 당업계에서 이용가능하고/거나 본원에 기술된 표준 분석, 예를 들어 실시예에 기재된 것 (예, 유세포 측정, 결합 분석)을 이용하여 평가할 수 있다.
돌연변이는 항-BST1 항체 코딩 서열의 전체 또는 일부에서 무작위적으로 또는 선택적으로 도입될 수 있으며, 수득되는 변형된 항-BST1 항체는 결합 활성 및/또는 본원에 기술된 바와 같은 다른 기능적 특성에 대해 스크리닝할 수 있다. 돌연변이 방법은 당업계에 개시되어 있다. 예를 들어, PCT 공개 WO 02/092780은 포화 돌연변이 유발, 합성 라이게이션 어셈블리, 또는 이들의 조합을 이용하여 항체 돌연변이를 제작하고 스크리닝하는 방법이 개시되어 있다. 대안적으로, PCT 공개 WO 03/074679는 항체의 생리화학적 특성을 최적화하는 전산 스크리닝 방법을 이용하는 방법을 개시하고 있다.
항체를 코딩하는 핵산 분자
또한, 본원은 본원에 개시된 항체를 코딩하는 핵산 분자에 관한 것이다. 핵산은 전체 세포 (whole cell) 내에, 세포 용해물 내에, 또는 부분적으로 정제되거나 실질적으로 순수한 형태로 존재할 수 있다. 핵산은 표준 기술, 예를 들어 알칼리성/SDS 처리, CsCl 밴딩, 컬럼 크로마토그래피, 아가로스 겔 전기영동 및 당업계에 공지된 기타 기법에 의해 다른 세포 성분 또는 다른 오염물, 예를 들어 다른 세포성 핵산 또는 단백질로부터 정제된 경우에 "단리"되거나 "실질적으로 순수한" 상태이다. F. Ausubel, et al., ed. (1987) Current Protocols in Molecular Biology, Greene Publishing and Wiley Interscience, N. Y를 참조한다. 이들 핵산은 예를 들어 DNA 또는 RNA일 수 있으며, 인트론 서열을 포함하거나 그렇지 않을 수 있다. 바람직한 구현예에서, 핵산은 cDNA 분자이다.
본원에 개시된 항체를 코딩하는 핵산은 표준 분자 생물학 기술을 이용하여 수득할 수 있다. 하이브리도마에 의해 발현되는 항체의 경우에, 하이브리도마에 의해 제조된 항체의 경쇄 및 중쇄를 코딩하는 cDNA는 표준 PCR 증폭 또는 cDNA 클로닝 기술에 의해 수득할 수 있다. 면역글로불린 유전자 라이브러리로부터 수득한 항체의 경우에 (예, 파지 디스플레이 기술을 이용하는 경우), 이러한 항체를 코딩하는 핵산은 상기 라이브러리로부터 회수할 수 있다.
바람직한 핵산 분자는 BST1_A2 단일클론 항체의 VH 및 VK 서열을 코딩하는 것이다. BST1_A2의 VH 서열을 코딩하는 DNA 서열은 서열번호 6으로 나타낸다. BST1_A2의 VK 서열을 코딩하는 DNA 서열은 서열번호 8로 나타낸다.
다른 바람직한 핵산은 서열번호 6 및 8로 나타낸 서열 중 하나와 적어도 80% 서열 동일성, 예컨대 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98% 또는 적어도 99% 서열 동일성을 갖는 핵산으로, 이들 핵산은 바람직한 항체 또는 이의 항원-결합 영역을 코딩한다.
2개의 핵산 서열 사이의 동일성 퍼센트는 이들 2개의 서열의 최적 정렬을 위해 도입되는 갭의 수와 각 갭의 길이를 고려하여, 서열 내에서 뉴클레오티드가 동일한 위치의 수이다. 서열의 비교와 2개의 서열 사이에 동일성 퍼센트의 결정은 수학적 알고리즘, 예컨대 마이어스 및 밀러의 알고리즘 또는 전술한 알츠슐(Altschul)의 XBLAST 프로그램을 이용하여 달성될 수 있다.
더 나아가, 본 발명의 바람직한 핵산은 서열번호 6 및 8로 나타낸 핵산 서열의 하나 이상의 CDR-코딩 부분을 포함한다. 이 구현예에서, 핵산은 BST1_A2의 중쇄 및 경쇄 CDR1, CDR2 및/또는 CDR3 서열을 코딩할 수 있다.
서열번호 6 및 8의 이러한 CDR-코딩 부분 (VH 및 VK 서열)과 적어도 80%, 예컨대 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98% 또는 적어도 99%의 서열 동일성을 갖는 핵산 역시 본 발명의 바람직한 핵산이다. 이러한 핵산은 비-CDR 코딩 영역 및/또는 CDR-코딩 영역 내에서 서열번호 6 및 8의 대응되는 부분과 상이할 수 있다. 이러한 차이가 CDR-코딩 영역 내에 존재하는 경우에, 핵산에 의해 코딩된 핵산 CDR 영역은 전형적으로 BST1_A2의 상응하는 CDR 서열과 비교하여 본원에 정의된 바와 같은 하나 이상의 보존적인 서열 변형을 포함한다.
일단 VH 및 VK 절편을 코딩하는 DNA 단편이 수득되면, 이들 DNA 단편을 표준 재조합 DNA 기술에 의해 추가로 조작하여, 예를 들어 가변 영역 유전자를 전장 항체 쇄 유전자, Fab 단편 유전자 또는 scFv 유전자로 전환시킬 수 있다. 이러한 조작에서, VK- 또는 VH-코딩 DNA 단편은 또 다른 단백질, 예컨대 항체 불변 영역 또는 가요성 링커를 코딩하는 또 다른 DNA 단편에 작동가능하게 연결된다. 이와 관련하여 사용된 용어 "작동가능하게 연결된"은 2개의 DNA 단편에 의해 코딩된 아미노산 서열이 인-프레임으로 유지되도록 이들 2개의 DNA 단편을 연결하는 것을 의미하는 것으로 의도된다.
VH 영역을 코딩하는 단리된 DNA는 VH-코딩 DNA를 중쇄 불변 영역 (CH1, CH2 및 CH3)을 코딩하는 또 다른 DNA 분자에 작동가능하게 연결시킴으로써 전장 중쇄 유전자로 전환시킬 수 있다. 뮤라인 중쇄 불변 영역 유전자의 서열은 당업계에 공지되어 있으며 (예, Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, US Department of Health and Human Services, NIH Publication No. 91-3242 참조), 이들 영역을 포괄하는 DNA 단편은 표준 PCR 증폭에 의해 수득될 수 있다. 중쇄 불변 영역은 IgG1, IgG2, IgG3, IgG4, IgA, IgE, IgM 또는 IgD 불변 영역일 수 있지만, 가장 바람직하게는 IgG1 또는 IgG4 불변 영역이다. Fab 단편 중쇄 유전자의 경우에, VH-코딩 DNA는 중쇄 CH1 불변 영역만을 코딩하는 또 다른 DNA 분자에 작동가능하게 연결될 수 있다.
VL / VK 영역을 코딩하는 단리된 DNA는 VL-코딩 DNA를 경쇄 불변 영역 CL을 코딩하는 또 다른 DNA 분자에 작동가능하게 연결시킴으로써 전장 경쇄 유전자 (뿐만 아니라 Fab 경쇄 유전자)로 전환시킬 수 있다. 뮤라인 경쇄 불변 영역 유전자의 서열은 당업계에 공지되어 있으며 (예, Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, US Department of Health and Human Services, NIH Publication No. 91-3242 참조), 이들 영역을 포괄하는 DNA 단편은 표준 PCR 증폭에 의해 수득될 수 있다. 바람직한 구현예에서, 경쇄 불변 영역은 카파 또는 람다 불변 영역일 수 있다.
scFv 유전자를 생성하기 위해, VH- 및 VL / VK-코딩 DNA 단편은 가요성 링커를 코딩하는, 예를 들어 아미노산 서열 (Gly4-Ser)3을 코딩하는 또 다른 단편에 작동가능하게 연결되어, VH 및 VL / VK 서열이 인접한 단일-쇄 단백질로서 발현될 수 있도록 하고, 여기서 VL / VK 및 VH 영역은 가요성 링커에 의해 연결된다 (예, Bird et al. (1988) Science 242:423-426; Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883; McCafferty et al., (1990) Nature 348:552-554 참조).
단일클론 항체의 생산
BST1 또는 그의 단편 또는 유도체는 이러한 면역원에 면역특이적으로 결합하는 항체를 생성하기 위해 면역원으로 사용될 수 있다. 이러한 면역원은 임의의 편리한 수단에 의해 단리될 수 있다. 당업자는 다수의 절차가 항체의 생성에 이용가능하다는 것을 알 것이다 (예, Antibodies, A Laboratory Manual, Ed Harlow and David Lane, Cold Spring Harbor Laboratory (1988), Cold Spring Harbor, N.Y에 언급됨). 당업자는 또한 항체를 모방하는 결합 단편 또는 Fab 단편이 다양한 절차에 의해 유전자 정보로부터 제조될 수 있다는 것을 알 것이다 [Antibody Engineering: A Practical Approach (Borrebaeck, C., ed.), 1995, Oxford University Press, Oxford; J. Immunol. 149, 3914-3920 (1992)].
BST1의 특정 도메인에 대한 항체를 생산할 수 있다. BST1의 친수성 단편을 항체 생산을 위한 면역원으로 사용할 수 있다.
항체 생산에서, 바람직한 항체에 대한 스크리닝은 당업계에 공지된 기술, 예를 들어 ELISA (효소-연결 면역흡착 분석)에 의해 수행할 수 있다. 예를 들어, BST1의 특정 도메인을 인식하는 항체를 선택하기 위해, 이러한 도메인을 함유하는 BST1 단편에 결합하는 생성물에 대해 생성된 하이브리도마를 분석할 수 있다. 제1 BST1 상동체에 특이적으로 결합하지만, 제2 BST1 상동체에 특이적으로 결합하지 않는 (또는 보다 약하게 결합하는) 항체를 선택하기 위해, 제1 BST1 상동체에 대한 양성 결합 및 제2 BST1 상동체에 대한 결합의 결핍 (또는 감소된 결합)에 기초하여 선택할 수 있다. 유사하게는, BST1에 특이적으로 결합하지만, 동일한 단백질의 상이한 이소형 (예, BST1과 동일한 코어 펩타이드를 갖는 상이한 당형태)에 특이적으로 결합하지 않는 (또는 약하게 결합하는) 항체를 선별하기 위해, BST1에 대한 양성 결합 및 상이한 이소형 (예, 상이한 당형태)에 대한 결합의 결핍 (또는 감소된 결합)에 기초하여 선별할 수 있다.
따라서, BST1의 상이한 이소형 또는 이소형들 (예, 당형태)에 비해 BST1에 대해 더 큰 친화성 (예를 들어, 적어도 2배, 예컨대 적어도 5배, 특히 적어도 10배 더 큰 친화성)로 결합하는 항체 (예, 단일클론 항체)를 개시한다.
본원에서 사용될 수 있는 다클론 항체는 면역화된 동물의 혈청으로부터 유래된 항체 분자의 혼성 집단이다. 분획화되지 않은 면역 혈청이 또한 사용될 수 있다. 당업계에 공지된 다양한 절차가 BST1, BST1의 단편, BST1-관련 폴리펩타이드, 또는 BST1-관련 폴리펩타이드의 단편에 대한 다클론 항체의 생성에 사용될 수 있다. 예를 들어, 한가지 방식은 대상 폴리펩타이드를 정제하는 방법 또는 예를 들어 당업계에 널리 공지된 고상 펩타이드 합성 방법을 이용하여 대상 폴리펩타이드를 합성하는 방법이다. 예를 들어, Guide to Protein Purification, Murray P. Deutcher, ed., Meth. Enzymol. Vol 182 (1990); Solid Phase Peptide Synthesis, Greg B. Fields ed., Meth. Enzymol. Vol 289 (1997); Kiso et al., Chem. Pharm. Bull. (Tokyo) 38: 1192-99, 1990; Mostafavi et al., Biomed. Pept. Proteins Nucleic Acids 1: 255-60, 1995; Fujiwara et al., Chem. Pharm. Bull. (Tokyo) 44: 1326-31, 1996을 참조한다. 이어서, 선택된 폴리펩타이드를 사용하여 다양한 숙주 동물 (토끼, 마우스, 랫 등을 포함하나 이들로 제한되지는 않음)을 주사에 의해 면역화시킴으로써 다클론 또는 단일클론 항체를 생성할 수 있다. 완전 또는 불완전 프로인트 보강제, 미네랄 겔, 예, 수산화알루미늄, 표면 활성 물질, 예컨대 리소레시틴, 플루로닉 폴리올, 다가음이온, 펩타이드, 오일 에멀젼, 키홀 림펫 헤모시아닌, 디니트로페놀, 및 보강제, 예컨대 BCG (바실 칼메트-게랑 (bacille Calmette-Guerin)) 또는 코리네박테리움 파르붐 (Corynebacterium parvum)을 포함하나 이에 제한되지는 않는 다양한 보강제 (즉, 면역자극제)를 사용하여 숙주 종에 따라 면역 반응을 향상시킬 수 있다. 추가의 보강제가 또한 당업계에 널리 공지되어 있다.
BST1에 대해 지정된 단일클론 항체 (mAb)를 제조하기 위해, 배양물에서 연속 세포주에 의한 항체 분자의 생성을 제공하는 임의의 기술을 이용할 수 있다. 예를 들어, Kohler 및 Milstein [1975, Nature 256:495-497]에 의해 처음 개발된 하이브리도마 기술뿐만 아니라 트리오마 기술, 인간 B-세포 하이브리도마 기술 [Kozbor et al. (1983) Immunology Today 4:72] 및 인간 단일클론 항체를 생산하기 위한 EBV-하이브리도마 기술 [Cole et al. (1985) in Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, Inc., pp. 77-96]이 있다. 이러한 항체는 IgG, IgM, IgE, IgA, IgD 및 그의 임의의 하위부류를 포함하는 임의의 면역글로불린 부류일 수 있다. 단일클론 항체를 생산하는 하이브리도마를 시험관내에서 또는 생체내에서 배양할 수 있다. 단일클론 항체는 공지된 기술을 이용하여 배-무함유 (germ-free) 동물에서 생산될 수 있다 (PCT/US90/02545, 원용에 의해 본 명세서에 포함됨).
하이브리도마를 제조하는데 바람직한 동물 시스템은 뮤라인 시스템이다. 마우스에서 하이브리도마 생산은 매우 널리 확립된 절차이다. 면역화 프로토콜, 및 융합을 위해 면역화된 비장세포를 단리하는 기술은 당업계에 공지되어 있다. 융합 파트너 (예, 뮤라인 골수종 세포) 및 융합 절차 또한 공지되어 있다.
단일클론 항체는 인간 단일클론 항체 및 키메라 단일클론 항체 (예, 인간-마우스 키메라)를 포함하지만, 이들로 한정되는 것은 아니다.
키메라 또는 인간화 항체는 전술한 바와 같이 제조된 비-인간 단일클론 항체의 서열에 기초하여 제조될 수 있다. 표준 분자 생물학 기술을 이용하여, 중쇄 및 경쇄 면역글로불린을 코딩하는 DNA를 관심 비-인간 하이브리도마로부터 수득하고 이를 조작하여 비-뮤라인 (예, 인간) 면역글로불린 서열을 함유하게 할 수 있다. 예를 들어, 키메라 항체를 제작하기 위해, 뮤라인 가변 영역을 당해 분야에 공지된 방법을 이용하여 인간 불변 영역에 연결시킬 수 있다 (예를 들어, 미국 특허 4,816,567 (Cabilly et al.) 참조). 인간화 항체를 생성하기 위해, 뮤라인 CDR 영역을 당업계에 공지된 방법을 이용하여 인간 프레임워크 내에 삽입할 수 있다 (예를 들어, 미국 특허 5,225,539 (Winter), 및 미국 특허 5,530,101; 5,585,089; 5,693,762 및 6,180,370 (Queen et al.) 참조).
완전 인간 항체는 내인성 면역글로불린 중쇄 및 경쇄 유전자를 발현시킬 순 없지만 인간 중쇄 및 경쇄 유전자를 발현시킬 수 있는 트랜스제닉 또는 트랜스크로모소믹 (transchromosomic) 마우스를 사용하여 생산할 수 있다. 트랜스제닉 마우스는 선택된 항원, 예를 들어 BST1의 전부 또는 일부로 정상적 방식으로 면역화된다. 항원에 대해 지정된 단일클론 항체는 통상의 하이브리도마 기술을 이용하여 수득할 수 있다. 트랜스제닉 마우스에 의해 확립된 인간 면역글로불린 트랜스진은 B 세포 분화 동안 재배열되고, 연속해서 부류 전환과 체세포 돌연변이를 진행한다. 따라서, 이러한 기술을 이용하여 치료상 유용한 IgG, IgA, IgM 및 IgE 항체를 생산하는 것이 가능하다. 이들 트랜스제닉 및 트랜스크로모소믹 마우스는 HuMAb 마우스® (Medarex®, Inc.) 및 KM 마우스® 계통의 마우스를 포함한다. HuMAb 마우스® 계통 (Medarex®, Inc.)은 Lonberg and Huszar (1995, Int. Rev. Immunol. 13:65-93)에 기재되어 있다. 인간 항체 및 인간 단일클론 항체의 생산을 위한 상기 기술 및 이러한 항체를 생산하기 위한 프로토콜에 대한 상세 내용은, 예를 들어 미국 특허 5,625,126; 미국 특허 5,633,425; 미국 특허 5,569,825; 미국 특허 5,661,016; 및 미국 특허 5,545,806을 참조한다. KM 마우스® 주는 인간 중쇄 트랜스진 및 인간 경쇄 트랜스크로모솜을 보유하는 마우스를 나타내고, PCT 공개 WO 02/43478 (Ishida et al.)에 상세하게 기재되어 있다.
또한, 추가적으로, 인간 면역글로불린 유전자를 발현하는 대안적인 트랜스제닉 동물 시스템도 당업계에서 이용가능하며, 본 발명의 항-BST1 항체를 생산하기 위해 사용될 수 있다. 예를 들어, 제노마우스 (Amgen, Inc.)로 지칭되는 대안적인 트랜스제닉 시스템을 이용할 수 있으며; 이러한 마우스는 예를 들어 미국 특허 5,939,598; 6,075,181; 6,114,598; 6,150,584 및 6,162,963 (Kucherlapati et al.)에 기재되어 있다.
선택된 에피토프를 인식하는 완전 인간 항체는 "가이드 선택"으로 지칭되는 기술을 이용하여 생산될 수 있다. 이러한 접근법에서, 선택된 비-인간 단일클론 항체, 예를 들어 마우스 항체를 사용하여 동일한 에피토프를 인식하는 완전 인간 항체의 선택을 안내할 수 있다 [Jespers et al. (1994) Biotechnology 12:899-903].
또한, 인간 면역글로불린 유전자를 발현하는 대안적인 트랜스크로모소믹 동물 시스템이 당업계에서 이용가능하며, 항-BST1 항체를 생산하기 위해 사용할 수 있다. 예를 들어, "TC 마우스"라고 지칭되는, 인간 중쇄 트랜스크로모솜 및 인간 경쇄 트랜스크로모솜 둘 다를 보유하는 마우스를 사용할 수 있으며, 이러한 마우스는 Tomizuka et al. (2000) Proc. Natl. Acad. Sci. USA 97:722-727에 기재되어 있다. 추가로, 인간 중쇄 및 경쇄 트랜스크로모솜을 보유하는 소 역시 당업계 [Kuroiwa et al. (2002) Nature Biotechnology 20:889-894] 및 PCT 공개 번호 WO2002/092812에 개시되어 있으며, 항-BST1 항체를 생산하기 위해 이용할 수 있다.
본 발명의 인간 단일클론 항체는 면역화시 인간 항체 반응을 발생시킬 수 있도록 인간 면역 세포가 재구성된 SCID 마우스를 이용해 제조할 수 있다. 이러한 마우스는 예를 들어 미국 특허 5,476,994 및 3,698,767에 기술되어 있다.
본원에 개시된 항체는 선택 표적에의 결합에 대해 폴리펩타이드의 라이브러리 제조 및 스크리닝용 파지 디스플레이 기술을 이용하여 생산할 수 있다 (예, Cwirla et al., Proc. Natl. Acad. Sci. USA 87, 6378-82, 1990; Devlin et al., Science 249, 404-6, 1990, Scott and Smith, Science 249, 386-88, 1990; 및 미국 특허 5,571,698 (Ladner et al.) 참조). 파지 디스플레이 방법의 기본 개념은 스크리닝할 폴리펩타이드를 코딩하는 DNA와 폴리펩타이드 간의 물리적 회합의 확립이다. 이 물리적 회합은 파지 입자에 의해 제공되며, 이는 폴리펩타이드를 코딩하는 파지 게놈을 둘러싸는 캡시드의 일부로서 폴리펩타이드를 디스플레이한다. 폴리펩타이드와 그의 유전자 물질 사이의 물리적 회합의 확립은 여러가지 폴리펩타이드를 가진 매우 많은 수의 파지들을 동시에 대규모 스크리닝 가능하게 한다. 표적에 대해 친화성을 가진 폴리펩타이드를 디스플레이하는 파지는 표적과 결합하고, 이들 파지는 표적에 대한 친화성 스크리닝에 의해 농화된다. 이러한 파지로부터 디스플레이된 폴리펩타이드의 동일성은 이들의 각각의 게놈으로부터 결정될 수 있다. 이어서, 이러한 방법을 이용하여 원하는 표적에 대해 결합 친화성을 갖는 것으로 확인된 폴리펩타이드를 통상적인 수단에 의해 대량 합성할 수 있다. 예를 들어, 미국 특허 6,057,098 (모든 표, 도면 및 특허청구범위를 포함한 전체 내용이 원용에 의해 본 명세서에 포함됨)을 참조한다. 특히, 이러한 파지를 이용하여 레퍼토리 또는 조합 항체 라이브러리 (예, 인간 또는 뮤라인 )로부터 발현된 항원 결합 도메인을 디스플레이할 수 있다. 대상 항원에 결합하는 항원 결합 도메인을 발현하는 파지를 항원으로, 예를 들어 표지된 항원 또는 고체 표면 또는 비드에 결합 또는 포획된 항원을 사용하여 선택 또는 확인할 수 있다. 이러한 방법에서 사용되는 파지는 전형적으로 파지 유전자 III 또는 유전자 VIII 단백질에 재조합적으로 융합된, Fab, Fv 또는 이황화 안정화된 Fv 항체 도메인을 함유한 파지로부터 발현된 fd 및 M13 결합 도메인을 포함하는 필라멘트형 파지이다. 본 발명의 항체의 제조에 이용될 수 있는 파지 디스플레이 방법은 Brinkman et al. (1995) J. Immunol. Methods 182:41-50; Ames et al. (1995) J. Immunol. Methods 184:177-186; Kettleborough et al., Eur. J. Immunol. 24:952-958 (1994); Persic et al. (1997) Gene 187 9-18; Burton et al. (1994) Advances in Immunology 57:191-280]; PCT 출원 번호 PCT/GB91/01134; PCT 공개 WO 90/02809; WO 91/10737; WO 92/01047; WO 92/18619; WO 93/11236; WO 95/15982; WO 95/20401; 및 미국 특허 5,698,426; 5,223,409; 5,403,484; 5,580,717; 5,427,908; 5,750,753; 5,821,047; 5,571,698; 5,427,908; 5,516,637; 5,780,225; 5,658,727; 5,733,743 및 5,969,108 (이들 문헌 각각 그 전체 내용이 원용에 의해 본 명세서에 포함됨)에 개시된 방법을 포함한다.
상기 참고문헌에 기재된 바와 같이, 파지 선택 후에, 파지로부터의 항체 코딩 영역을 단리하고, 이를 인간 항체를 비롯한 전체 항체 또는 임의의 다른 바람직한 항원 결합 단편을 생성하는데 사용하고, 포유류 세포, 곤충 세포, 식물 세포, 효모 및 박테리아를 비롯한 임의의 바람직한 숙주에서 발현시킬 수 있다 (예를 들어, 아래에 상세하게 기재되어 있음). 예를 들어, Fab, Fab' 및 F(ab')2 단편을 재조합에 의해 생산하기 위한 기술은 또한 당업계에 공지된 방법, 예컨대 PCT 공개 WO 92/22324; Mullinax et al. (1992) BioTechniques 12(6):864-869; 및 Sawai et al. (1995) AJRI 34:26-34; 및 Better et al. (1988) Science 240:1041-1043 ((이들 문헌은 그 전체 내용이 원용에 의해 본 명세서에 포함됨)에 개시된 방법을 이용하여 이용될 수 있다.
단일-쇄 Fv 및 항체를 생산하는데 이용될 수 있는 기술의 예는 미국 특허 4,946,778 및 5,258,498; Huston et al. (1991), Methods in Enzymology 203:46-88; Shu et al. (1993) PNAS 90:7995-7999; 및 Skerra et al. (1988) Science 240:1038-1040에 기재된 것을 포함한다.
본 발명은 항-BST1 면역글로불린 분자의 기능적 활성 단편, 유도체 또는 유사체를 제공한다. 기능적 활성은 단편, 유도체 또는 유사체는, 단편, 유도체 또는 유사체가 유래되는 항체에 의해 인식되는 동일한 항원을 인식하는 항-항-이디오타입 항체 (즉, 3차 항체)를 유도할 수 있다는 것을 의미한다. 특히, 특정 구현예에서, 면역글로불린 분자의 이디오타입의 항원성은 항원을 프레임워크 및 특이적으로 인식하는 CDR 서열에 대해 C-말단인 CDR 서열의 결손에 의해 강화될 수 있다. 어느 CDR 서열이 항원에 결합하는지를 결정하기 위해, CDR 서열을 함유하는 합성 펩타이드를 당업계에 공지된 임의의 결합 분석 방법에 의해 항원을 사용하는 결합 분석에 사용할 수 있다.
또한, 본 발명은 항체 단편, 예컨대 F(ab')2 단편 및 Fab 단편 (이에 제한되지는 않음)을 개시한다. 특이적인 에피토프를 인식하는 항체 단편은 공지된 기술에 의해 생산할 수 있다. F(ab')2 단편은 가변 영역, 경쇄 불변 영역 및 중쇄의 CH1 도메인으로 이루어지고, 항체 분자의 펩신 분해에 의해 생성된다. Fab 단편은 F(ab')2 단편의 이황화 가교를 환원시킴으로써 생성된다. 본 발명은 또한 본원에 개시된 항체의 중쇄 및 경쇄 이량체, 또는 임의의 그의 최소 단편, 예컨대 Fv 또는 단쇄 항체 (SCA) (예를 들어, 미국 특허 4,946,778; Bird, (1988) Science 242:423-42; Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883; 및 Ward et al. (1989) Nature 334:544-5에 기재된 바와 같음), 또는 본 발명의 항체와 동일한 특이성을 갖는 임의의 다른 분자를 개시한다. 단쇄 항체는 아미노산 가교를 통해 Fv 영역의 중쇄 및 경쇄 단편을 연결하여 단쇄 폴리펩타이드를 제조함으로써 생산된다. E. coli에서의 기능적 Fv 단편의 어셈블리를 위한 기술이 사용될 수도 있다 [Skerra et al. (1988) Science 242:1038-1041].
본원에 개시된 면역글로불린의 융합 단백질 (또는 그의 기능적 활성 단편)을 개시하며, 여기서 예를 들어 면역글로불린은 면역글로불린이 아닌 또 다른 단백질의 아미노산 서열 (또는 그의 부분, 바람직하게는 단백질의 적어도 10, 20 또는 50개 아미노산 부분)에 N-말단 또는 C-말단에서의 공유 결합 (예를 들어, 펩타이드 결합)을 통해 융합된다. 바람직하게는, 면역글로불린 또는 그의 단편은 불변 도메인의 N-말단에서 다른 단백질에 공유 결합에 의해 연결된다. 상기에 언급된 바와 같이, 이러한 융합 단백질은 정제를 용이하게 하고, 생체내 반감기를 증가시키고, 상피 장벽을 통한 면역계로의 항원 전달을 향상시킬 수 있다.
본원에 개시된 면역글로불린은 공유 부착이 면역특이적 결합을 손상시키지 않는 한, 즉 임의의 유형의 분자의 이러한 공유 부착에 의해 변형된 유사체 및 유도체를 포함한다. 예를 들어, 면역글로불린의 유도체 및 유사체는 예를 들어 당화, 아세틸화, PEG화, 인산화, 아미드화, 공지된 보호기/차단기에 의한 유도체화, 단백질분해 절단, 세포 리간드 또는 다른 단백질에 대한 연결 등에 의해 추가로 변형된 것들을 포함하지만, 이들로 한정되는 것은 아니다. 임의의 다수의 화학적 변형은 특이적인 화학적 절단, 아세틸화, 포르밀화 등을 포함하나 이들로 제한되는 것은 아닌 공지된 기술에 의해 수행될 수 있다. 추가적으로, 유사체 또는 유도체는 하나 이상의 비-고전적 아미노산을 함유할 수 있다.
마우스의 면역화
마우스는 BST1 항원 및/또는 재조합 BST1의 정제된 또는 농화된 제제, 또는 BST1을 발현하는 세포로 면역화될 수 있다. 바람직하게는, 마우스는 1차 주입시 6-16주령일 것이다. 예를 들어, BST1 항원의 정제된 또는 재조합 제제 (100 ㎍)를 사용하여 마우스를 복강내 면역화할 수 있다.
다양한 항원을 사용한 누적된 경험으로, 완전 프로인트 보강제 내 항원으로 복강내 (IP) 면역화하는 경우 마우스가 반응하다는 것이 확인되었다. 그러나, 프로인트 이외의 보강제도 효과적인 것으로 밝혀졌다. 또한, 보강제 부재 하의 전체 세포도 고도로 면역원성인 것으로 밝혀졌다. 면역 반응은 후안와동 채혈에 의해 수득한 혈장 샘플을 사용해 면역화 프로토콜 과정 내내 모니터링될 수 있다. 혈장은 만족스러운 역가를 시험하기 위해 ELISA (하기 기재된 바와 같음)으로 스크리닝할 수 있다. 마우스를 항원으로 3일 연속 정맥내 부스팅하고, 5일 후에 안락사시켜 비장을 분리할 수 있다. 일 구현예에서, A/J 마우스 계통 (Jackson Laboratories, 메인주 바 하버)이 사용될 수 있다.
단일클론 항체를 생산하는
트랜스펙토마의
구축
본원에 개시된 항체는 예를 들어, 당업계에 널리 공지된 재조합 DNA 기술 및 유전자 형질감염 방법의 조합을 이용해 숙주 세포 트랜스펙토마에서 생산할 수 있다 [예, Morrison, S. (1985) Science 229:1202].
예를 들어, 항체 또는 그 항체 단편을 발현시키기 위해, 부분 또는 전장 경쇄 및 중쇄를 코딩하는 DNA를 표준 분자 생물학 기술 (예를 들어, 관심 항체를 발현하는 하이브리도마를 사용하는 cDNA 클로닝 또는 PCR 증폭)에 의해 수득할 수 있고, 유전자가 전사 및 번역 제어 서열에 작동가능하게 연결되도록 DNA를 발현 벡터에 삽입할 수 있다. 이와 관련하여, 용어 "작동가능하게 연결된"은 벡터 내의 전사 및 번역 제어 서열이 항체 유전자의 전사 및 번역을 조절하는 이들의 의도된 기능을 수행하도록, 항체 유전자가 벡터 내로 라이게이션되는 것을 의미하도록 의도된다. 발현 벡터 및 발현 제어 서열은 사용된 발현 숙주 세포와 상용가능한 것을 선택한다.
숙주 세포를 2가지 발현 벡터로 공동-형질감염시킬 수 있는데, 제1 벡터는 중쇄 유래된 폴리펩타이드를 코딩하고; 제2 벡터는 경쇄 유래된 폴리펩타이드를 코딩한다. 이들 2가지 벡터는 중쇄 및 경쇄 폴리펩타이드를 등가로 발현시켜 줄 수 있는 동일한 선택성 마커를 함유할 수 있다. 대안적으로, 중쇄 폴리펩타이드 및 경쇄 폴리펩타이드 둘 다를 코딩하는 단일 벡터를 사용할 수 있다. 이러한 경우, 경쇄를 중쇄 앞에 위치시켜 무-독성 중쇄의 과다 발현을 피해야 한다 [Proudfoot (1986) Nature 322:52; Kohler (1980) Proc. Natl. Acad. Sci. USA 77:2197]. 중쇄 및 경쇄에 대한 코딩 서열은 cDNA 또는 게놈 DNA를 포함할 수 있다.
항체 유전자를 표준 방법 (예를 들어, 항체 유전자 단편 및 벡터 상의 상보적 제한 부위의 라이게이션, 또는 제한 부위가 존재하지 않는 경우에 평활 말단 라이게이션)에 의해 발현 벡터에 삽입할 수 있다. 본원에 기술된 항체의 경쇄 및 중쇄 가변 영역은, VH 절편이 벡터에 CH 절편(들)과 작동가능하게 연결되고 VK 절편이 벡터 내에서 CL 절편과 작동가능하게 연결되도록 이들을 이미 원하는 이소형의 중쇄 불변 영역 및 경쇄 불변 영역을 코딩하는 발현 벡터 내로 삽입함으로써 임의의 항체 이소형의 전장 항체 유전자를 제작하기 위해 사용될 수 있다. 추가적으로 또는 대안적으로, 재조합 발현 벡터는 숙주 세포로부터의 항체 쇄 분비를 용이하게 하는 신호 펩타이드를 코딩할 수 있다. 항체 쇄 유전자를 벡터 내로 클로닝하여 신호 펩타이드가 항체 쇄 유전자의 아미노 말단에 인-프레임으로 연결되도록 할 수 있다. 신호 펩타이드는 면역글로불린 신호 펩타이드 또는 이종 신호 펩타이드 (즉, 비-면역글로불린 단백질로부터의 신호 펩타이드)일 수 있다.
항체 쇄 유전자 뿐만 아니라, 본원에 개시된 재조합 발현 벡터는 숙주 세포에서의 항체 쇄 유전자의 발현을 제어하는 조절 서열을 가진다. 용어 "조절 서열"은 항체 쇄 유전자의 전사 또는 번역을 제어하는 프로모터, 인핸서 및 기타 발현 제어 요소 (예를 들어, 폴리아데닐화 신호)를 포함하는 것으로 의도된다. 이러한 조절 서열은 예를 들어 Goeddel (Gene Expression Technology, Methods in Enzymology 185, Academic Press, San Diego, CA (1990)에 기재되어 있다. 당업자는 조절 서열의 선택을 비롯한 발현 벡터의 설계가 형질전환시킬 숙주 세포의 선택, 원하는 단백질의 발현 수준 등과 같은 요인에 따라 달라질 수 있음을 인지할 것이다. 포유류 숙주 세포 발현을 위한 조절 서열은 포유류 세포 내 높은 수준의 단백질 발현을 지시하는 바이러스 성분, 예컨대 시토메갈로바이러스 (CMV), 원숭이 바이러스 40 (SV40), 아데노바이러스 (예를 들어, 아데노바이러스 주요 후기 프로모터 (AdMLP)) 및 폴리오마로부터 유래된 프로모터 및/또는 인핸서를 포함한다. 대안적으로, 비-바이러스 조절 서열, 예컨대 유비퀴틴 프로모터 또는 β-글로빈 프로모터를 사용할 수 있다. 추가적으로, 조절 요소는 SV40 초기 프로모터 및 인간 T 세포 백혈병 바이러스 유형 1의 긴 말단 반복부 유래 서열을 포함하는 SRα 프로모터 시스템과 같은 여러가지 공급원 유래 서열들로 구성된다 [Takebe, Y. et al. (1988) Mol. Cell. Biol. 8:466-472].
항체 쇄 유전자 및 조절 서열에 더하여, 본원에 개시된 재조합 발현 벡터는 추가의 서열, 예컨대 숙주 세포에서 벡터의 복제를 조절하는 서열 (예를 들어, 복제 기점) 및 선택가능한 마커 유전자를 가질 수 있다. 선택가능한 마커 유전자는 벡터가 도입된 숙주 세포의 선별을 용이하게 한다 (예를 들어, 미국 특허 4,399,216, 4,634,665 및 5,179,017 (모두 Axel et al.) 참조). 예를 들어, 전형적으로, 선택가능한 마커 유전자는 벡터가 도입된 숙주 세포에 G418, 히그로마이신 또는 메토트렉세이트와 같은 약물 내성을 부여한다. 바람직한 선택가능한 마커 유전자는 다이하이드로폴레이트 리덕타제 (DHFR) 유전자 (메토트렉세이트 선택/증폭과 함께 dhfr- 숙주 세포에서 사용하기 위한 것) 및 neo 유전자 (G418 선별)를 포함한다.
경쇄 및 중쇄의 발현을 위해, 중쇄 및 경쇄를 코딩하는 발현 벡터(들)를 표준 기술에 의해 숙주 세포로 형질감염시킨다. 다양한 형태의 용어 "형질감염"은 외인성 DNA를 원핵 또는 진핵 숙주 세포에 도입하는데 일반적으로 이용되는 광범위하게 다양한 기술, 예를 들어 전기천공, 칼슘-포스페이트 침전, DEAE-덱스트란 형질감염 등을 포괄하는 것으로 의도된다. 본원에 개시된 항체를 원핵 또는 진핵 숙주 세포에서 발현시키는 것이 이론상 가능하긴 하지만, 항체를 진핵 세포, 가장 바람직하게는 포유류 숙주 세포에서 발현시키는 것이 가장 바람직한데, 이는 이러한 진핵 세포, 특히 포유류 세포가 적절하게 폴딩되고 면역학적으로 활성인 항체를 어셈블리 및 분비하는데 있어 원핵 세포보다 더 적합하기 때문이다. 항체 유전자의 원핵세포 발현은 활성 항체의 고수율 생산에는 비효과적인 것으로 보고된 바 있다 [Boss, M. A. and Wood, C. R. (1985) Immunology Today 6:12-13].
본원에 개시된 재조합 항체를 발현하기에 바람직한 포유류 숙주 세포는 중국 햄스터 난소 세포 (CHO) (벡터, 예컨대 인간 시토메갈로바이러스로부터의 주요 중간 초기 유전자 프로모터 성분과 함께 사용됨 [Foecking et al., 1986, Gene 45:101; Cockett et al. (1990) BioTechnology 8:2], dhfr-CHO 세포 [Urlaub and Chasin (1980) Proc. Natl. Acad. Sci. USA 77:4216-4220]에 기재됨, DHFR 선택가능한 마커와 함께 사용됨 (예, R. J. Kaufman and P. A. Sharp (1982) J. Mol. Biol. 159:601-621]에 기재된 바와 같음)), NSO 골수종 세포, COS 세포 및 SP2 세포를 포함한다. 특히, NSO 골수종 세포를 사용하는 경우, 또 다른 바람직한 발현 시스템은 WO 87/04462 (Wilson), WO 89/01036 (Bebbington) 및 EP 338,841 (Bebbington)에 개시된 GS 유전자 발현 시스템이다.
다양한 숙주 발현 벡터 시스템을 활용하여 본원에 개시된 항체 분자를 발현시킬 수 있다. 이러한 숙주-발현 시스템은 대상 코딩 서열을 생산한 다음 정제할 수 있는 비히클뿐 아니라 적절한 뉴클레오티드 코딩 서열로 형질전환 또는 형질감염시킨 경우에, 인 시추로 본원에 개시된 항체 분자를 발현할 수 있는 세포이다. 이러한 것으로는, 미생물, 예컨대 항체 코딩 서열을 함유하는 재조합 박테리오파지 DNA, 플라스미드 DNA 또는 코스미드 DNA 발현 벡터로 형질전환된 박테리아 (예, E. coli, 바실러스 서브틸리스(B. subtilis)); 항체 코딩 서열을 함유하는 재조합 효모 발현 벡터로 형질전환된 효모 (예, 사카로미세스(Saccharomyces), 피키아(Pichia)); 항체 코딩 서열을 함유하는 재조합 바이러스 발현 벡터 (예, 베큘로바이러스)로 감염된 곤충 세포 시스템; 항체 코딩 서열을 함유하는 재조합 바이러스 발현 벡터 (예를 들어, 콜리플라워 모자이크 바이러스(cauliflower mosaic virus, CaMV); 담배 모자이크 바이러스, TMV)로 감염되거나 또는 재조합 플라스미드 발현 벡터 (예를 들어, Ti 플라스미드)로 형질전환된 식물 세포 시스템; 또는 포유류 세포의 게놈으로부터 유래된 프로모터 (예를 들어, 메탈로티오네인 프로모터) 또는 포유류 바이러스로부터 유래된 프로모터 (예를 들어, 아데노바이러스 후기 프로모터; 백시니아 바이러스 7.5K 프로모터)를 함유하는 재조합 발현 구축물을 보유하는 포유류 세포 시스템 (예를 들어, COS, CHO, BHK, 293, 3T3 세포) 등이 있으나, 이들로 한정되는 것은 아니다.
박테리아 시스템에서, 발현될 항체 분자의 의도한 용도에 따라 다수의 발현 벡터가 유리하게 선택될 수 있다. 예를 들어, 이러한 단백질을 다량 생산하여야 하는 경우, 예를 들어 항체 분자를 포함하는 약학적 조합물의 제조를 위해, 쉽게 정제되는 융합 단백질 생성물의 높은 발현을 지시하는 벡터가 바람직할 수 있다. 이러한 벡터는 E. coli 발현 벡터 pUR278 [Ruther et al. (1983) EMBO J. 2:1791] (여기서, 항체 코딩 서열은 융합 단백질이 생산되도록 lac Z 코딩 영역을 갖는 벡터로 인 프레임으로 개별적으로 라이게이션될 수 있음); pIN 벡터 [Inouye & Inouye (1985) Nucleic Acids Res. 13:3101-3109; Van Heeke & Schuster (1989) J. Biol. Chem. 24:5503-5509]를 포함하나, 이들로 제한되는 것은 아니며, 유사한 pGEX 벡터가 또한 글루타티온 S-트랜스퍼라제 (GST)와의 융합 단백질로서 외래 폴리펩타이드를 발현시키는데 사용될 수 있다. 일반적으로, 이러한 융합 단백질은 용해성이며, 매트릭스 글루타티온-아가로스 비드에의 흡착 및 결합 후 유리 글루타티온의 존재 하의 용리에 의해 용해된 세포로부터 용이하게 정제될 수 있다. pGEX 벡터는 클로닝된 표적 유전자 산물이 GST 모이어티로부터 방출될 수 있도록 트롬빈 또는 인자 Xa 프로테아제 절단 부위를 포함하도록 설계된다.
곤충 시스템에서는, 아우토그라파 칼리포르니카 (Autographa californica) 핵 다면증 바이러스 (AcNPV)가 외래 유전자를 발현시키기 위한 벡터로서 사용된다. 이 바이러스는 스포도프테라 프루기페르다 (Spodoptera frugiperda) 세포에서 증식한다. 항체 코딩 서열을 바이러스의 비-필수 영역 (예를 들어, 폴리헤드린 유전자) 내에 개별적으로 클로닝시키고, AcNPV 프로모터 (예를 들어, 폴리헤드린 프로모터)의 제어 하에 배치할 수 있다. 포유류 숙주 세포의 경우, 다수의 바이러스-기반 발현 시스템 (예를 들어, 아데노바이러스 발현 시스템)을 이용할 수 있다.
전술한 바와 같이, 삽입된 서열의 발현을 조절하거나 또는 유전자 산물을 원하는 특이적인 방식으로 변형 및 프로세싱하는 숙주 세포 균주를 선택할 수 있다. 이러한 단백질 생성물의 변형 (예를 들어, 당화) 및 프로세싱 (예를 들어, 절단)이 단백질의 기능에 중요할 수 있다.
재조합 항체를 장기간 고 수율로 생산하기 위해서는 안정한 발현이 바람직하다. 예를 들어, 대상 항체를 안정하게 발현하는 세포주는 항체의 뉴클레오티드 서열 및 선택가능한 마커 (예를 들어, 네오마이신 또는 히그로마이신) 뉴클레오티드 서열을 포함하는 발현 벡터로 세포를 형질감염시키고, 선택가능한 마커의 발현으로 선택함으로써 생산할 수 있다. 이러한 조작된 세포주는 특히 항체 분자와 직접적으로 또는 간접적으로 상호작용하는 화합물의 스크리닝 및 평가에 유용할 수 있다.
항체 분자의 발현 수준은 벡터 증폭에 의해 증가시킬 수 있다 (리뷰는 Bebbington and Hentschel, The use of vectors based on gene amplification for the expression of cloned genes in mammalian cells in DNA cloning, Vol.3. (Academic Press, New York, 1987)을 참조함). 항체를 발현하는 벡터 시스템 내 마커가 증폭가능한 경우에, 숙주 세포 배양물에 존재하는 억제제의 수준 증가가 마커 유전자의 카피 수를 증가시킬 것이다. 증폭된 영역은 항체 유전자와 연관되어있으므로, 항체의 생산 또한 증가할 것이다 [Crouse et al., 1983, Mol. Cell. Biol. 3:257].
항체 유전자를 코딩하는 재조합 발현 벡터를 포유류 숙주 세포 내 도입할 때, 항체는 숙주 세포에서 항체의 발현을 허용하기 위해, 또는 보다 바람직하게는 숙주 세포를 성장시키는 배양 배지 내로 항체의 분비를 허용하기 위해, 충분한 시간 동안 숙주 세포를 배양함으로써 생산한다. 항체 분자가 재조합에 의해 발현되면, 이는 당업계에 공지된 임의의 항체 분자 정제 방법, 예를 들어 크로마토그래피 (예를 들어, 이온 교환 크로마토그래피, 친화성 크로마토그래피, 예컨대 단백질 A 또는 특이적 항원에 대한 친화성 크로마토그래피, 및 크기결정 컬럼 크로마토그래피), 원심분리, 시차 용해도, 또는 단백질의 정제를 위한 임의의 다른 표준 기술에 의해 정제될 수 있다.
대안적으로, 임의의 융합 단백질은 발현되는 융합 단백질에 대해 특이적인 항체를 사용함으로써 쉽게 정제될 수 있다. 예를 들어, Janknecht 등의 문헌에 기술된 시스템은 인간 세포주에서 발현되는 비-변성 융합 단백질의 용이한 정제를 허용한다 [Janknecht et al., 1991, Proc. Natl. Acad. Sci. USA 88:8972-897]. 이 시스템에서는, 대상 유전자를 백시니아 재조합 플라스미드에 서브클로닝하여 유전자의 오픈 리딩 프레임이 6개의 히스티딘 잔기로 이루어진 아미노-말단 태그에 번역물로 융합시킨다. 태그는 융합 단백질에 대한 매트릭스 결합 도메인의 역할을 한다. 재조합 백시니아 바이러스로 감염된 세포로부터의 추출물을 Ni2 + 니트릴로아세트산-아가로스 컬럼에 로딩하고, 히스티딘-태그 부착된 단백질을 이미다졸-함유 완충제로 선택적으로 용리한다.
항원에 대한 항체 결합 특징
상기한 방법에 의해 생산된 항체는 우선 친화성 및 특이성으로 정제된 대상 폴리펩타이드를 스크리닝하고, 필요한 경우에 결합에서 배제되는 것이 바람직한 폴리펩타이드를 가진 항체의 친화성 및 특이성 결과와 비교함으로써, 선택할 수 있다. 항체는 예를 들어 표준 ELISA에 의해 BST1에 대한 결합을 검사할 수 있다. 스크리닝 절차는 마이크로타이터 플레이트의 각 웰에 정제된 폴리펩타이드를 고정하는 것을 포함할 수 있다. 이어서, 잠재적 항체 또는 항체의 군을 함유하는 용액을 각각의 마이크로타이터 웰에 배치하고, 약 30분 내지 2시간 동안 인큐베이션한다. 이어서, 마이크로타이터 웰을 세척하고, 표지된 2차 항체 (예, 상승된 항체가 마우스 항체인 경우에 알칼리성 포스파타제에 접합된 항-마우스 항체)를 웰에 첨가하고, 약 30분 동안 인큐베이션한 후에 세척한다. 기질을 웰에 첨가하고, 고정된 폴리펩타이드(들)에 대한 항체가 존재할 경우 색 반응이 나타난다.
이와 같이 확인된 항체는, 이어 선택된 분석 설계에서 친화성 및 특이성에 대해 추가로 분석될 수 있다. 표적 단백질에 대한 면역분석 개발에서, 정제된 표적 단백질은 선택된 항체를 사용하는 면역분석의 감수성 및 특이성을 판단하기 위한 표준으로서의 역할을 한다. 다양한 항체의 결합 친화성이 상이할 수 있기 때문에; 특정 항체 쌍 (예를 들어, 샌드위치 분석에서)은 서로 입체적 등으로 인해 방해할 수 있고, 항체의 분석 성능은 항체의 절대 친화성 및 특이성보다 더 중요한 척도일 수 있다.
당업자는 다수의 접근법이 항체 또는 결합 단편을 생산하고, 다양한 폴리펩타이드에 대한 친화성 및 특이성에 대해 스크리닝하고 선택하기 위해 취해질 수 있다는 것을 인지할 것이나, 이들 접근법이 본 발명의 범위를 변경하는 것은 아니다.
선택된 항-BST1 단일클론 항체가 특유의 에피토프에 결합하는지 여부를 결정하기 위해, 각각의 항체를 상업적으로 입수가능한 시약 (Pierce, 일리노이주 록포드)을 사용하여 비오티닐화할 수 있다. 비표지 단일클론 항체 및 비오티닐화 단일클론 항체를 사용하는 경쟁 실험은 BST1 코팅된-ELISA 플레이트를 사용하여 수행할 수 있다. 비오티닐화 mAb 결합은 스트렙타비딘-알칼리성 포스파타제 프로브로 검출할 수 있다.
정제된 항체의 이소형을 결정하기 위해, 특정한 이소형의 항체에 특이적인 시약을 사용하여 이소형 ELISA를 수행할 수 있다.
항-BST1 항체는 웨스턴 블롯팅에 의해 BST1 항원과의 반응성에 대해 추가로 조사할 수 있다. 간략하게는, BST1을 제조하고, 나트륨 도데실 설페이트 폴리아크릴아미드 겔 전기영동을 실시할 수 있다. 전기영동 후에, 분리된 항원을 니트로셀룰로스 막으로 옮기고, 10% 태아 소 혈청으로 차단한 다음 시험 단일클론 항체를 프로브로 탐침한다.
본원에 개시된 항체의 결합 특이성은 또한, 예를 들어 유세포 측정에 의해 BST1을 발현하는 세포에 대한 항체의 결합을 모니터링함으로써 확인할 수 있다. 전형적으로, 세포주, 예컨대 CHO 세포주를 BST1을 코딩하는 발현 벡터로 형질감염시킬 수 있다. 형질감염된 단백질은, 태그 항체를 사용해 검출하기 위해, 바람직하게는 N-말단에 태그, 예컨대 myc-태그를 포함할 수 있다. BST1에 대한 항체의 결합은 형질감염된 세포를 항체와 인큐베이션하고, 결합된 항체를 검출함으로써 확인할 수 있다. 형질감염된 단백질 상의 태그에 대한 항체의 결합을 양성 대조군으로서 사용할 수 있다.
BST1에 대한 항체의 특이성은 BST1에 대한 결합을 확인하는 동일한 방법을 사용해 항체가 다른 단백질, 예컨대 Eph 부류의 다른 구성원에 결합하는지 여부를 확인함으로써 추가로 조사할 수 있다.
면역접합체
약학적 조합물은 치료 모이어티, 예컨대 세포독소, 약물 (예를 들어 면역억제제) 또는 방사성독소가 접합된 항-BST1 항체, 또는 그 단편을 특징으로 한다. 상기 접합체는 본원에서 "면역접합체"로 지칭된다. 하나 이상의 세포독소를 포함하는 면역접합체는 "면역독소"로 지칭된다. 세포독소 또는 세포독성제는 세포에게 해로운 (예를 들어, 사멸시키는) 임의의 물질을 포함한다. 예는 탁솔, 시토칼라신 B, 그라미시딘 D, 브로민화에티듐, 에메틴, 미토마이신, 에토포시드, 테노포시드, 빈크리스틴, 빈블라스틴, 콜키신, 독소루비신, 다우노루비신, 디히드록시 안트라신 디온, 미톡산트론, 미트라마이신, 악티노마이신 D, 1-데히드로테스토스테론, 글루코코르티코이드, 프로카인, 테트라카인, 리도카인, 프로프라놀롤, 및 퓨로마이신 및 그의 유사체 또는 상동체를 포함한다. 치료학적 물질로는, 예를 들어 항-대사산물 (예를 들어, 메토트렉세이트, 6-메르캅토퓨린, 6-티오구아닌, 시타라빈, 5-플루오로우라실 데카르바진), 알킬화제 (예를 들어, 메클로레타민, 티오에파 클로람부실, 멜팔란, 카르무스틴 (BSNU) 및 로무스틴 (CCNU), 사이클로포스파미드, 부술판, 디브로모만니톨, 스트렙토조토신, 미토마이신 C, 및 시스-디클로로디아민 백금 (II) (DDP) 시스플라틴), 안트라시클린 (예를 들어, 다우노루비신 (이전에 다우노마이신) 및 독소루비신), 항생제 (예를 들어, 닥티노마이신 (이전에 악티노마이신), 블레오마이신, 미트라마이신, 및 안트라마이신 (AMC)), 및 항유사분열제 (예를 들어, 빈크리스틴 및 빈블라스틴)를 또한 포함한다.
약학적 조합물의 항체에 접합될 수 있는 치료학적 세포독소에 대한 다른 바람직한 예로는 두오카르마이신, 칼리케아미신, 메이탄신 및 아우리스타틴, 및 그의 유도체를 포함한다. 칼리케아미신 항체 접합체의 예는 상업적으로 입수가능하다 (Mylotarg®; American Home Products).
세포독소는 당업계에서 이용가능한 링커 기술을 이용하여 항체에 접합시킬 수 있다. 세포독소를 항체에 접합시키는데 사용되는 링커 유형의 예로는 하이드라존, 티오에테르, 에스테르, 이황화 및 펩타이드-함유 링커를 포함하나, 이들로 제한되는 것은 아니다. 예를 들어, 리소좀 구획 내 낮은 pH에 의한 절단에 취약하거나 또는 프로테아제, 예컨대 종양 조직에서 우세하게 발현되는 프로테아제, 예컨대 카텝신 (예를 들어, 카텝신 B, C, D)에 의한 절단에 취약한 링커가 선택될 수 있다.
세포독소의 예는 예를 들어 미국 특허 6,989,452, 7,087,600, 및 7,129,261, 및 PCT 출원 번호 PCT/US2002/17210, PCT/US2005/017804, PCT/US2006/37793, PCT/US2006/060050, PCT/US2006/060711, WO2006/110476, 및 미국 특허 출원 번호 60/891,028 (이들 문헌들 모두 전체 내용이 원용에 의해 본 명세서에 포함됨)에 기재되어 있다. 세포독소의 유형, 링커 및 항체에 치료학적 물질을 접합하는 방법에대한 추가적인 내용은, 또한 Saito, G. et al. (2003) Adv. Drug Deliv. Rev. 55:199-215; Trail, P.A. et al. (2003) Cancer Immunol. Immunother. 52:328-337; Payne, G. (2003) Cancer Cell 3:207-212; Allen, T.M. (2002) Nat. Rev. Cancer 2:750-763; Pastan, I. and Kreitman, R. J. (2002) Curr. Opin. Investig. Drugs 3:1089-1091; Senter, P.D. 및 Springer, C.J. (2001) Adv. Drug Deliv. Rev. 53:247-264을 참조한다.
항체는 또한 방사성 면역접합체로도 지칭되는 세포독성 방사성의약품 (radiopharmaceuticals)을 제조하기 위해 방사성 동위원소와 접합될 수 있다. 진단 또는 치료 목적으로 이용하기 위해 항체에 접합될 수 있는 방사성 동위원소의 예로는 아이오딘131, 인듐111, 이트륨90 및 루테튬177을 포함하지만, 이들로 한정되는 것은 아니다. 방사성 면역접합체를 제조하는 방법은 당업계에 확립되어 있다. 제발린(Zevalin)® (아이덱 파마슈티칼스(IDEC Pharmaceuticals)) 및 벡사르(Bexxar)® (코릭사 파마슈티칼스(Corixa Pharmaceuticals))를 비롯한 방사성면역접합체의 예들이 상업적으로 입수가능하며, 본원에 개시된 항체를 사용하여 방사성면역접합체를 제조하는데 유사한 방법이 이용될 수 있다.
본원에 개시된 항체 접합체는 소정의 생물학적 반응을 변형시키는데 이용될 수 있으며, 약물 모이어티는 고전적 화학 치료학적 물질로 제한적으로 해석되어서는 안된다. 예를 들어, 약물 모이어티는 원하는 생물학적 활성을 갖는 단백질 또는 폴리펩타이드일 수 있다. 이러한 단백질은, 예를 들어 효소적으로 활성인 독소, 또는 그의 활성 단편, 예컨대 아브린, 리신 A, 슈도모나스 외독소, 또는 디프테리아 독소; 단백질, 예컨대 종양 괴사 인자 또는 인터페론-γ; 또는 생물학적 반응 변형제, 예를 들어 림포카인, 인터루킨-1 ("IL-1"), 인터루킨-2 ("IL-2"), 인터루킨-6 ("IL-6"), 과립구 대식세포 콜로니 자극 인자 ("GM-CSF"), 과립구 콜로니 자극 인자 ("G-CSF"), 또는 다른 성장 인자를 포함할 수 있다.
이러한 치료 모이어티를 항체에 접합하는 기법은 널리 공지되어 있다 (예, Arnon et al., "Monoclonal Antibodies For Immunotargeting Of Drugs In Cancer Therapy," Monoclonal Antibodies And Cancer Therapy, Reisfeld et al. (eds.), pp. 243-56 (Alan R. Liss, Inc. 1985); Hellstrom et al., "Antibodies For Drug Delivery," Controlled Drug Delivery (2nd Ed.), Robinson et al. (eds.), pp. 623-53 (Marcel Dekker, Inc. 1987); Thorpe, "Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review," Monoclonal Antibodies '84: Biological And Clinical Applications, Pinchera et al. (eds.), pp. 475-506 (1985); "Analysis, Results, And Future Prospective Of The Therapeutic Use Of Radiolabeled Antibody In Cancer Therapy," Monoclonal Antibodies For Cancer Detection And Therapy, Baldwin et al. (eds.), pp. 303-16 (Academic Press 1985), 및 Thorpe et al., Immunol. Rev., 62:119-58 (1982) 참조).
2중
특이성 분자
또 다른 측면에서, 항-BST1 항체 또는 그 단편을 포함하는 2중 특이성 분자가 사용될 수 있다. 항체 또는 이의 항원-결합 영역은 유도체화되거나 또 다른 기능적 분자, 예를 들어 또 다른 펩타이드 또는 단백질 (예를 들어, 수용체에 대한 또 다른 항체 또는 리간드)에 연결되어, 적어도 2개의 상이한 결합 부위 또는 표적 분자에 결합하는 2중 특이성 분자를 만들 수 있다. 본원에 개시된 항체는 실제로, 유도체화되거나 또는 1개를 초과하는 다른 기능적 분자에 연결되어, 2개를 초과하는 상이한 결합 부위 및/또는 표적 분자에 결합하는 다중 특이성 분자를 제조할 수 있으며; 이러한 다중 특이성 분자 역시 본원에서 용어 "2중 특이성 분자"에 포함되는 것으로 의도된다. 2중 특이성 분자를 제조하기 위해, 항체를 하나 이상의 다른 결합 분자, 예컨대 또 다른 항체, 항체 단편, 펩타이드 또는 결합 모방체에 기능적으로 연결 (예를 들어, 화학적 커플링, 유전자 융합, 비공유 회합 등에 의함)시켜 2중 특이성 분자를 제조할 수 있다.
따라서, 본 발명은 제1 표적 에피토프 (즉, BST1)에 대한 하나 이상의 제1 결합 특이성 및 제2 표적 에피토프에 대한 제2 결합 특이성을 포함하는 2중 특이성 분자를 포함한다. 제2 표적 에피토프는 제1 결합 특이성으로 결합되는 단백질과 동일한 표적 단백질 상에 제시될 수 있거나; 또는 제2 표적 에피토프는 제1 단백질에 의해 제1 결합 특이성으로 결합되는 것과는 다른 표적 단백질에 제시될 수 있다. 제2 표적 에피토프는 제1 표적 에피토프 (즉, BST1)와 동일한 세포 상에 제시될 수 있거나; 또는 제2 표적 에피토프는 제1 표적 에피토프를 제시 세포에 의해 제시되지 않은 표적 상에 제시될 수 있다. 본원에서, 용어 '결합 특이성'은 하나 이상의 항체 가변 도메인을 포함하는 모이어티를 지칭한다.
본 발명의 일 구현예에서, 제2 표적 에피토프는 Fc 수용체, 예를 들어 인간 FcγRI (CD64) 또는 인간 Fcα 수용체(CD89)이다. 따라서, 본 발명은 FcγR 또는 FcαR 발현 작동자 세포 (예를 들어, 단핵구, 대식세포 또는 다형핵 세포 (PMN)) 및 BST1을 발현하는 표적 세포 둘 다에 결합할 수 있는 2중 특이성 분자를 포함한다. 이러한 2중 특이성 분자는 BST1 발현 세포를 작동자 세포로 표적화하고, Fc 수용체-매개 작동자 세포 활성, 예컨대 BST1 발현 세포의 식세포작용, 항체 의존성 세포-매개 세포독성 (ADCC), 사이토카인 방출, 또는 슈퍼옥시드 음이온 생성을 촉발한다.
본 발명의 또 다른 구현예에서, 제2 표적 에피토프는 CD3 또는 CD5이다. 따라서, 본 발명은 CD3 또는 CD5 발현 작동자 세포 (예를 들어, CD3 또는 CD5 발현 세포독성 T 세포) 둘 다, 및 BST1을 발현하는 표적 세포에 결합할 수 있는 2중 특이성 분자를 포함한다. 이러한 2중 특이성 분자는 BST1 발현 세포를 작동자 세포에 대해 표적화하고, CD3 또는 CD5-매개 작동자 세포 활성, 예컨대 T 세포 클론 증식 및 T 세포 세포독성을 촉발한다. 이러한 구현예에서, 2중 특이성 항체는 총 2 또는 3개의 항체 가변 도메인을 가질 수 있으며, 여기서 2중 특이성 항체의 제1 부분은 인간 면역 작동자 세포 상에 위치하는 작동자 항원에 대한 특이적인 결합에 의해 인간 면역 작동자 세포의 활성을 동원할 수 있으되, 작동자 항원은 인간 CD3 또는 CD5 항원이고, 제1 부분은 하나의 항체 가변 도메인으로 이루어지며, 2중 특이성 항체의 제2 부분은 작동자 항원, 예를 들어 BST1 이외의 표적 항원에 특이적으로 결합할 수 있으되, 상기 표적 항원은 상기 인간 면역 작동자 세포 이외의 표적 상에 존재하고, 상기 제2 부분은 1 또는 2개의 항체 가변 도메인을 포함한다.
2중 특이성 분자가 다중 특이성 분자인 본 발명의 일 구현예에서, 분자는 항-Fc 결합 특이성 또는 항-CD3 또는 CD5 결합 특이성 및 항-BST1 결합 특이성 뿐만 아니라 제3 결합 특이성을 추가로 포함할 수 있다. 일 구현예에서, 제3 결합 특이성은 항-증진 인자 (enhancement factor, EF) 부분, 예를 들어 세포독성 활성에 관여하는 표면 단백질과 결합함으로써 표적 세포에 대한 면역 반응을 증가시키는 분자이다. "항-증진 인자 부분"은 주어진 분자, 예를 들어 항원 또는 수용체에 결합하여, Fc 수용체 또는 표적 세포 항원에 대한 결합 결정기의 효과를 강화하는 항체, 기능적 항체 단편 또는 리간드일 수 있다. "항-증진 인자 부분"은 Fc 수용체 또는 표적 세포 항원에 결합할 수 있다. 대안적으로, 항-증진 인자 부분은 제1 및 제2 결합 특이체 부분이 결합하는 엔터티와 상이한 엔터티에 결합할 수 있다. 예를 들어, 항-증진 인자 부분은 세포독성 T-세포와 결합할 수 있다 (예를 들어, CD2, CD3, CD8, CD28, CD4, CD40, ICAM-1, 또는 표적 세포에 대한 면역 반응을 증가시키는 다른 면역 세포를 통함).
일 구현예에서, 2중 특이성 분자는 결합 특이성으로서 하나 이상의 항체 또는 그의 항체 단편, 예를 들어 Fab, Fab', F(ab')2, Fv, Fd, dAb 또는 단쇄 Fv를 포함한다. 항체는 또한 경쇄 또는 중쇄 이량체 또는 그의 임의의 최소 단편, 예컨대 미국 특허 4,946,778 (문헌의 내용이 명백하게 원용에 의해 본 명세서에 포함됨)에 기재된 바와 같은 Fv 또는 단쇄 구조체일 수 있다.
일 구현예에서, Fcγ 수용체에 대한 결합 특이성은 단일클론 항체에 의해 제공되는데, 그 결합은 인간 면역글로불린 G (IgG)에 의해 차단되지 않는다. 본원에서, 용어 "IgG 수용체"는 1번 염색체에 위치하는 임의의 8개의 γ-쇄 유전자를 지칭한다. 이러한 유전자는 3종의 Fcγ 수용체 부류: FcγRI (CD64), FcγRII (CD32) 및 FcγRIII (CD16)으로 분류되는 총 12종의 막횡단 또는 용해성 수용체 이소형을 코딩한다. 하나의 바람직한 구현예에서, Fcγ 수용체는 인간 고 친화성 FcγRI이다. 인간 FcγRI는 단량체 IgG에 대해 고 친화성 (108-109 M- 1)를 나타내는 72 kDa 분자이다.
바람직한 특정 항-Fcγ 단일클론 항체의 생산 및 특정화는 PCT 공개 WO 88/00052 및 미국 특허 4,954,617에 기술되어 있으며, 이의 교시 내용들 모두 원용에 의해 본 명세서에 포함된다. 이러한 항체는 수용체의 Fcγ 결합 부위와 구분되는 부위에서 FcγRI, FcγRII 또는 FcγRIII의 에피토프와 결합하므로, 이들 결합이 IgG의 생리학적 수준에 의해 실질적으로 차단되지 않는다. 본 발명에 유용한 구체적인 항-FcγRI 항체는 mAb 22, mAb 32, mAb 44, mAb 62 및 mAb 197이다. mAb 32를 생산하는 하이브리도마는 아메리칸 타입 컬쳐 콜렉션 (ATCC 등록 번호 HB9469)으로부터 입수가능하다. 다른 구현예에서, 항-Fcγ 수용체 항체는 단일클론 항체 22의 인간화 형태 (H22)이다. H22 항체의 생산 및 특정화는 Graziano, R.F. et al. (1995) J. Immunol 155 (10): 4996-5002 및 PCT 공개 WO 94/10332에 기술되어 있다. H22 항체 생산 세포주는 아메리칸 타입 컬쳐 콜렉션에 명칭 HA022CL1으로 기탁되었고, 기탁 번호는 CRL 11177이다.
또 다른 바람직한 구현예에서, Fc 수용체에 대한 결합 특이성은 인간 IgA 수용체, 예를 들어 Fc-알파 수용체 (FcαRI (CD89))와 결합하는 항체에 의해 제공되는데, 그 결합은 바람직하게는 인간 면역글로불린 A (IgA)에 의해 차단되지 않는다. 용어 "IgA 수용체"는 19번 염색체에 위치하는 하나의 α-유전자 (FcαRI)의 유전자 산물을 포함하도록 의도된다. 이러한 유전자는 55 내지 110 kDa의 여러가지로 다르게 스플라이싱된 막횡단 이소형을 코딩하는 것으로 공지되어 있다. FcαRI (CD89)는 단핵구/대식세포, 호산구성 및 호중구성 과립구 상에서 구성적으로 발현되지만, 비-작동자 세포 집단에서는 그렇지 않다. FcαRI는 IgA1 및 IgA2 둘 다에 대해 중간 정도의 친화성 (5 x 107 M- 1)를 갖고, 이는 G-CSF 또는 GM-CSF와 같은 사이토카인에 대한 노출시 증가된다 [Morton, H.C. et al. (1996) Critical Reviews in Immunology 16:423-440]. IgA 리간드 결합 도메인 외부에서 FcαRI에 결합하는, A3, A59, A62 및 A77로 확인된 4종의 FcαRI-특이적 단일클론 항체가 개시되어 있다 [Monteiro, R.C. et al. (1992) J. Immunol. 148:1764].
FcαRI 및 FcγRI는 본 발명의 2중 특이성 분자에서 사용하기에 바람직한 촉발 수용체인데, 그 이유는 이들 수용체가 (1) 면역 작동자 세포, 예를 들어 단핵구, PMN, 대식세포 및 수지상 세포에서 일차적으로 발현되고; (2) 높은 수준 (예를 들어, 세포당 5,000-100,000개)으로 발현되고; (3) 세포독성 활성 (예를 들어, ADCC, 식세포작용)의 매개자이고; (4) 이를 표적화하는, 자기-항원을 비롯한 항원의 증진된 항원 제시를 매개하기 때문이다.
2중 특이성 분자에 사용될 수 있는 항체는 뮤라인 , 인간, 키메라 및 인간화 단일클론 항체이다.
본원의 2중 특이성 분자는 당업계에 공지된 방법을 이용하여, 구성성분 결합 특이성, 예를 들어 항-FcR, 항-CD3, 항-CD5 및 항-BST1 결합 특이성을 접합시켜 제조할 수 있다. 예를 들어, 2중 특이성 분자의 각각의 결합 특이성을 개별적으로 합성한 후 서로 접합시킬 수 있다. 결합 특이성이 단백질 또는 펩타이드인 경우에, 공유 접합을 위해 다양한 커플링제 또는 가교제를 사용할 수 있다. 가교제의 예는 단백질 A, 카르보디이미드, N-숙신이미딜-S-아세틸-티오아세테이트 (SATA), 5,5'-디티오비스(2-니트로벤조산) (DTNB), o-페닐렌디말레이미드 (oPDM), N-숙신이미딜-3-(2-피리딜디티오)프로피오네이트 (SPDP) 및 술포숙신이미딜 4-(N-말레이미도메틸) 시클로헥산-1-카르복실레이트 (술포-SMCC)를 포함한다 (예, Karpovsky et al. (1984) J. Exp. Med. 160:1686; Liu, MA et al. (1985) Proc. Natl. Acad. Sci. USA 82:8648 참조). 다른 방법으로는 Paulus (1985) Behring Ins. Mitt. No. 78, 118-132; Brennan et al. (1985) Science 229:81-83, 및 Glennie et al. (1987) J. Immunol. 139: 2367-2375에 기재된 것들을 포함한다. 바람직한 접합제는 SATA 및 술포-SMCC이며, 이들 둘 다 피어스 케미칼 캄파니(Pierce Chemical Co.) (일리노이주 록포드)로부터 입수가능하다.
추가의 2가 작업은 이중 결합을 전장 항체-유사 포맷으로 설계함으로써 이중특이성 물질에 대해 수행되었다 [Wu et al., 2007, Nature Biotechnology 25[11]: 1290-1297; USSN12/477,711; Michaelson et al., 2009, mAbs 1[2]:128-141; PCT/US2008/074693; Zuo et al., 2000, Protein Engineering 13[5]:361-367; USSN09/865,198; Shen et al., 2006, J Biol Chem 281[16]: 10706-10714; Lu et al., 2005, J Biol Chem 280[20]: 19665-19672]; PCT/US2005/025472; 명백하게 원용에 의해 본 명세서에 포함됨).
결합 특이성 물질이 항체일 경우, 2개의 중쇄의 C-말단 힌지 영역을 설프하이드릴 결합을 통해 접합시킬 수 있다. 특히 바람직한 구현예에서, 힌지 영역은 접합 전에 설프하이드릴 잔기를 홀수개로, 바람직하게는 1개 포함하도록 변형된다.
대안적으로, 2개의 결합 특이성 물질을 모두 동일한 벡터에서 코딩하여, 동일한 숙주 세포에서 발현 및 조립할 수 있다. 이 방법은 2중 특이성 분자가 mAb x mAb, mAb x Fab, Fab x F(ab')2 또는 리간드 x Fab 융합 단백질일 경우, 특히 유용하다. 2중 특이성 분자는 하나의 단쇄 항체 및 결합 결정기를 포함하는 단쇄 분자, 또는 2개의 결합 결정기를 포함하는 단쇄 2중 특이성 분자일 수 있다. 2중 특이성 분자는 적어도 2개의 단쇄 분자를 포함할 수 있다. 2중 특이성 분자를 제조하는 방법은 예를 들어 미국 특허 5,260,203; 5,455,030; 4,881,175; 5,132,405; 5,091,513; 5,476,786; 5,013,653; 5,258,498; 및 5,482,858에 기술되어 있으며, 문헌 모두 명백하게 원용에 의해 본 명세서에 포함된다.
그의 특이적인 표적에 대한 2중 특이성 분자의 결합은, 예를 들어 효소-연결된 면역흡착 분석 (ELISA), 방사성면역분석 (RIA), FACS 분석, 생물분석 (예를 들어 증식 억제) 또는 웨스턴 블롯 분석에 의해 확인할 수 있다. 이들 분석 각각은 일반적으로 특별히 관심있는 단백질-항체 복합체에 특이적인 표지된 시약 (예를 들어 항체)을 사용함으로써 상기 복합체의 존재를 검출한다. 예를 들어, FcR-항체 복합체는 예를 들어 항체-FcR 복합체를 인지하여 이와 특이적으로 결합하는 효소-연결된 항체 또는 항체 단편을 사용하여 검출할 수 있다. 대안적으로, 복합체는 임의의 다양한 다른 면역분석을 이용하여 검출할 수 있다. 예를 들어, 항체를 방사성 표지시킬 수 있고, 방사성면역분석 (RIA)에 사용할 수 있다 (예를 들어, 원용에 의해 본 명세서에 포함되는 문헌 [Weintraub, B., Principles of Radioimmunoassays, Seventh Training Course on Radioligand Assay Techniques, The Endocrine Society, March, 1986 참조). γ 카운터 또는 신틸레이션 카운터를 사용하는 등과 같은 수단에 의해, 또는 자가방사법에 의해 방사성 동위원소를 검출할 수 있다.
항체 단편 및 항체
모방체
본 발명의 약학적 조합물은 기존 항체로 제한되지 않으며, 항체 단편 및 항체 모방체를 사용하는 것을 통해 실시될 수 있다. 하기 상세하게 설명된 바와 같이, 매우 다양한 항체 단편 및 항체 모방 기술이 현재 개발되어 있고, 당업계에 널리 공지되어 있다. 다수의 이러한 기술, 예컨대 도메인 항체, 나노바디, 및 UniBody가 전통적인 항체 구조의 단편 또는 기타 변형을 이용하는 것이지만, 아피바디, DARPin, 안티칼린스, 아비머 및 베르사바디와 같은 대안적 기술도 또한 존재하며, 이는 전통적인 항체 결합을 모방하는 것이기는 하지만, 개별 기전으로 구축 및 기능하는 결합 구조를 이용한다.
도메인 항체 (dAb)는 인간 항체의 중쇄 (VH) 또는 경쇄 (VL) 중 어느 하나의 가변 영역에 대응되는 항체의 가장 작은 기능성 결합 단위이다. 도메인 항체는 대략 13 kDa의 분자량을 갖는다. 도만티스(Domantis)는 일련의 대형 및 매우 기능적인 완전 인간 VH 및 VL dAb 라이브러리 (각 라이브러리 내에는 100 억 초과의 상이한 서열)를 개발하였고, 이들 라이브러리는 치료 표적에 대해 특이적인 dAb를 선택하는데 사용된다. 많은 기존 항체와 대조적으로, 도메인 항체는 박테리아, 효모, 및 포유류 세포 시스템에서 잘 발현된다. 도메인 항체 및 그의 생산 방법에 대한 추가의 상세 내용은 미국 특허 6,291,158; 6,582,915; 6,593,081; 6,172,197; 6,696,245; 미국 공개 번호 2004/0110941; 유럽 특허 출원 번호 1433846 및 유럽 특허 0368684 & 0616640; WO05/035572, WO04/101790, WO04/081026, WO04/058821, WO04/003019 및 WO03/002609를 참조하여 입수할 수 있으며, 이들 각각은 그 전문이 원용에 의해 본 명세서에 포함된다.
나노바디는 자연적으로 생기는 중쇄 항체의 독특한 구조적 및 기능적 특성을 가진 항체-유래 치료 단백질이다. 이들 중쇄 항체는 가변 도메인 1개 (VHH)와 불변 도메인 2개(CH2 및 CH3)를 포함한다. 중요하게는, 클로닝 및 단리된 VHH 도메인은 본래의 중쇄 항체의 완전한 항원-결합 능력을 보유하고 있는 완벽하게 안정한 폴리펩타이드이다. 나노바디는 인간 항체의 VH 도메인과의 상동성이 높고, 어떠한 활성 소실없이 추가로 인간화될 수 있다. 중요하게는, 나노바디는 낮은 면역원성 잠재력을 가지며, 이는 나노바디 유도 화합물을 사용한 영장류 실험에서 확인되었다.
나노바디는 기존 항체의 이점과 소분자 약물의 중요한 특성을 조합한 것이다. 종래의 항체와 마찬가지로, 나노바디는 높은 표적 특이성, 표적에 대한 고 친화성, 및 본질적으로 낮은 독성을 나타낸다. 그러나, 소분자 약물과 같이 이것은 효소를 억제할 수 있으며, 수용체 클래프트에 용이하게 접근할 수 있다. 추가적으로, 나노바디는 극히 안정적이며, 주사 이외의 수단에 의해 투여가능하고 (예를 들어, 본원에 그 전문이 원용에 의해 포함되는 WO 04/041867 참조), 제조가 용이하다. 나노바디의 다른 이점은 크기가 작기 때문에 흔하지 않거나 또는 숨겨진 에피토프를 인지한다는 검, 단백질 표적의 캐비티 또는 활성 부위에 고 친화성으로 결합한다는 점, 독특한 3-차원적, 약물 포맷 융통성으로 인한 선택성, 반감기 조정 및 약물 발견의 용이성 및 신속성을 포함한다.
나노바디는 단일 유전자에 의해 코딩되며, 거의 모든 원핵 및 진핵 숙주, 예를 들어 E. coli (예를 들어, 본원에 그 전문이 원용에 의해 포함되는 US 6,765,087 참조), 곰팡이 (예를 들어, 아스페르길루스(Aspergillus) 또는 트리코더마(Trichoderma)) 및 효모 (예를 들어, 사카로미세스, 클루이베로미세스(Kluyveromyces), 한세눌라(Hansenula) 또는 피키아) (예를 들어, 본원에 그 전문이 원용에 의해 포함되는 US 6,838,254 참조)에서 효율적으로 생산된다. 생산 방법은 확장가능하며, 수 킬로그램 수준으로 나노바디를 생산할 수 있다. 나노바디가 기존 항체에 비해 우수한 안정성을 나타내기 때문에, 이는 긴 반감기의 즉시 사용가능한 용액으로서 제형화될 수 있다.
나노클론 방법 (예를 들어, 본원에 그 전문이 원용에 의해 포함되는 WO 06/079372 참조)은 B-세포의 자동화된 고-성능 선별 (automated high-throughout selection)을 기초로 원하는 표적에 대한 나노바디를 생산하기 위한 독점적인 방법으로, 본 발명의 맥락에서 사용될 수 있다.
UniBody는 또 다른 항체 단편 기술이지만; 이는 IgG4 항체의 힌지 영역의 제거를 기초로 하는 것이다. 힌지 영역의 제거로 크기가 기존 IgG4 항체 크기의 본질적으로 절반인 분자가 제조되며, IgG4 항체의 2가 결합 영역이 아닌 1가 결합 영역을 가진다. 또한 IgG4 항체는 불활성이며, 따라서 면역계와 상호작용하지 않아 면역 반응이 바람직하지 않은 질환을 치료하는데 유익할 수 있으며, 이러한 이점은 UniBody에 해당한다는 사실은 널리 공지되어 있다. 예를 들어, UniBody는 그것이 결합하는 세포를 억제 또는 침묵시키기만, 사멸시키지는 않도록 기능할 수 있다. 추가적으로, 암 세포에 결합하는 UniBody는 세포가 증식하도록 자극하지 않는다. 또한, UniBody는 기존 IgG4 항체 크기의 약 절반이기 때문에, 이는 잠재적으로 유익한 효능으로 보다 큰 고형 종양에 대해 보다 양호한 분포를 나타낼 수 있다. UniBody는 전체 IgG4 항체와 유사한 속도로 신체에서 제거되며, 전체 항체와 유사한 친화성으로 항원에 결합할 수 있다. UniBody에 대한 추가적인 상세 내용은 본원에 그 전문이 원용에 의해 포함되는 특허 WO2007/059782를 참조하여 입수할 수 있다.
아피바디 분자는 스타필로코쿠스 단백질 A의 IgG-결합 도메인 중 하나로부터 유래된 58-아미노산 잔기 단백질 도메인에 기초한 친화성 단백질의 새로운 부류이다. 이의 3중 나선 다발 도메인은 조합 파지미드 라이브러리의 구축을 위한 스캐폴드로서 이용되며, 이로부터 파지 디스플레이 기술을 이용하여 원하는 분자를 표적화하는 아피바디 변이체를 선별할 수 있다 [Nord K, Gunneriusson E, Ringdahl J, Stahl S, Uhlen M, Nygren PA (1997) 'Binding proteins selected from combinatorial libraries of an α-helical bacterial receptor domain' Nat Biotechnol 15:772-7. Ronmark J, Gronlund H, Uhlen M, Nygren PA (2002) 'Human immunoglobulin A (IgA)-specific ligands from combinatorial engineering of protein A' Eur J Biochem. 269:2647-55]. 아피바디 분자의 단순하고 견고한 구조는 이의 저분자량 (6 kDa)과 더불어 이를 매우 다양한 적용분야에 적합하게 만들며, 예를 들어 검출 시약 [Ronmark J. et al. (2002) 'Construction and characterization of affibody-Fc chimeras produced in Escherichia coli' J Immunol Methods 261:199-211]으로서, 및 수용체 상호작용을 억제하는데 [Sandstorm K, Xu Z, Forsberg G, Nygren PA (2003) 'Inhibition of the CD28-CD80 co-stimulation signal by a CD28-binding Affibody ligand developed by combinatorial protein engineering' Protein Eng 16:691-7] 적합하다. 아피바디 및 그의 제조 방법에 대한 추가적인 상세 내용은 그 전문이 원용에 의해 본 명세서에 포함되는 미국 특허 5831012를 참조하여 입수할 수 있다.
표지된 아피바디는 또한 이소형의 존재율을 확인하기 위한 영상화 용도에 유용할 수 있다.
DARPin (Designed Ankyrin Repeat Proteins)은 비-항체 폴리펩타이드의 결합 능력을 활용하기 위해 개발된 항체 모방체 DRP (Designed Repeat Proteins) 기술의 일 예이다. 안키린 또는 류신 풍부 반복 단백질과 같은 반복 단백질은, 항체와 달리, 세포내 및 세포외에 존재하는 편재성 결합 분자이다. 이들의 고유한 모듈화 구조는 반복 구조 단위 (반복부)를 특징으로 하며, 이들 반복 구조는 겹겹이 쌓여, 가변적 및 모듈화 표적-결합 표면을 디스플레이하는 신장된 반복 도메인을 형성한다. 이러한 모듈성에 기초하여, 고도로 다양화된 결합 특이성을 갖는 폴리펩타이드의 조합 라이브러리를 제조할 수 있다. 이러한 전략은 반복 도메인 내 무작위 어셈블리 및 가변성 표면 잔기를 디스플레이하는 자가-상용성 반복체의 컨센서스 설계를 포함한다.
DARPin은 박테리아 발현 시스템에서 매우 높은 수율로 생산될 수 있으며, 공지된 가장 안정한 단백질에 속한다. 인간 수용체, 사이토카인, 키나제, 인간 프로테아제, 바이러스 및 막 단백질을 비롯한 넓은 범위의 표적 단백질에 매우 특이적이고 고 친화성인 DARPin이 선별된 바 있다. 한 자릿수의 나노몰 내지 피코몰 범위의 친화성을 갖는 DARPin을 수득할 수 있다.
DARPin은 ELISA, 샌드위치 ELISA, 유세포 측정 분석 (FACS), 면역조직화학 (IHC), 칩 분야, 친화성 정제 또는 웨스턴 블롯팅을 비롯한 다양한 범위의 분야에서 사용되어 왔다. DARPin은 또한 세포내 구획에서, 예를 들어 녹색 형광 단백질 (GFP)에 융합된 세포내 마커 단백질로서 활성이 높은 것으로 입증되었다. DARPin은 추가로 pM 범위의 IC50으로 바이러스 진입을 억제하는데에도 사용되었다. DARPin은 단백질-단백질 상호작용을 차단하는데 뿐만 아니라, 효소를 억제하는데에도 이상적이다. 가장 빈번하게는 알로스테릭 억제 모드로 프로테아제, 키나제 및 수송체가 성공적으로 억제되었다. 종양에서의 매우 신속하고 특이적인 농화 및 매우 바람직한 종양 대 혈액 비는 DARPin을 생체내 진단 또는 치료적 접근법에 매우 적합하게 만든다.
DARPin 및 다른 DRP 기술에 대한 추가적인 정보는 미국 특허 출원 공개 번호 2004/0132028, 및 국제 특허 출원 공개 번호 WO 02/20565에서 찾아볼 수 있으며, 이들 둘 다 그 전문이 원용에 의해 본 명세서에 포함된다.
안티칼린은 추가적인 항체 모방체 기술이다. 이러한 경우, 결합 특이성은 자연적으로 인간 조직 및 체액에서 다량 발현되는 저분자량 단백질 패밀리인 리포칼린으로부터 유래된다. 리포칼린은 화학적으로 감수성이거나 불용성인 화합물의 생리적 수송 및 저장과 연관된 일정 범위의 생체내 기능을 수행하도록 진화되어 왔다. 리포칼린은 해당 단백질의 하나의 말단에 4개의 루프를 뒷받침하는 고도로 보존된 β-배럴을 포함하는 견고한 고유한 구조를 가지고 있다. 이들 루프는 결합 포켓에 대한 입구를 형성하고, 이러한 분자 일부에서의 입체형태적 차이는 개별 리포칼린 간의 결합 특이성 차이를 나타낸다.
보존된 β-시트 프레임워크에 의해 지지되는 초가변 루프의 전체 구조가 면역글로불린을 연상시키긴 하지만, 리포칼린은 160-180개의 아미노산의 단일 폴리펩타이드 쇄로 구성되어, 크기 측면에서 항체와 상당히 다르며, 이는 단일 면역글로불린 도메인보다 약간 더 크다.
리포칼린을 클로닝하고, 그 루프를 조작하여 안티칼린으로 제작할 수 있다. 구조적으로 다양한 안티칼린의 라이브러리가 구축되었으며, 안티칼린 디스플레이는 결합 기능의 선택 및 스크리닝에 이어 원핵 또는 진핵 시스템에서의 추가 분석을 위한 가용성 단백질의 발현 및 생산을 가능하게 한다. 연구 결과, 실질적으로 임의의 인간 표적 단백질에 특이적인 안티칼린을 개발 및 단리할 수 있었으며, 나노몰 이상의 범위의 결합 친화성을 수득할 수 있는 것으로 성공적으로 입증되었다.
안티칼린은 또한 이중 표적화 단백질, 소위 듀오칼린으로 포맷될 수 있다. 듀오칼린은 2개의 결합 도메인의 구조적 배향에 관계없이 표적 특이성 및 친화성을 보유하면서 표준 제조 방법을 이용하여 용이하게 생산되는 단량체 단백질 형태로서 2개의 개별 치료 표적에 결합한다.
단일 분자를 통한 다중 표적의 조절은 원인 인자가 2 이상인 것으로 공지된 질환에 있어서 특히 유익하다. 또한, 듀오칼린과 같은 2가 또는 다가 결합 포맷은 질환에서 세포 표면 분자를 표적화하거나, 신호 전달 경로에 대해 작용제 효과를 매개하거나, 또는 세포 표면 수용체의 결합 및 클러스터링을 통한 증가된 내재화 효과를 유도하는데 있어 상당한 잠재력을 갖는다. 또한, 듀오칼린의 높은 고유의 안정성은 단량체 안티칼린과 유사하여, 듀오칼린에 융통성있는 제제화 및 전달 잠재성을 부여한다.
안티칼린에 관한 추가적인 정보는 미국 특허 7,250,297 및 국제 특허 출원 공개 번호 WO 99/16873에서 찾아볼 수 있으며, 이들은 둘 다 그 전문이 원용에 의해 본 명세서에 포함된다.
본 발명과 관련하여 유용한 또 다른 항체 모방 기술은 아비머이다. 아비머는 시험관내 엑손 셔플링 및 파지 디스플레이에 의해 인간 세포외 수용체 도메인 거대 패밀리로부터 진화된 것으로, 결합 및 억제 특성을 갖는 멀티도메인 단백질이 제조된다. 다수의 독립적인 결합 도메인을 연결하는 것이 항원-항체 결합성을 구축하고, 통상적인 단일-에피토프 결합 단백질과 비교해서 친화성 및 특이성을 개선하는 것으로 밝혀졌다. 다른 잠재적 이점은 에스케리키아 콜라이(Escherichia coli) 내에서의 다중 표적-특이성 분자의 단순하고 효율적인 생산, 개선된 열안정성 및 프로테아제에 대한 내성을 포함한다. 다양한 표적에 대해 친화성이 나노몰 이하인 아비머가 수득되어 있다.
아비머에 관한 추가적인 정보는 미국 특허 출원 공개 번호 2006/0286603, 2006/0234299, 2006/0223114, 2006/0177831, 2006/0008844, 2005/0221384, 2005/0164301, 2005/0089932, 2005/0053973, 2005/0048512, 2004/0175756 (모두 그의 전문이 원용에 의해 본 명세서에 포함됨)에서 찾아볼 수 있다.
베르사바디는 본 발명과 관련하여 이용될 수 있는 또 다른 항체 모방체 기술이다. 베르사바디는 전형적인 단백질이 갖고 있는 소수성 코어를 대체하는 높은 이황화 밀도 스캐폴드를 형성하는, 시스테인 >15%인 3-5 kDa의 소형 단백질이다. 소수성 코어를 포함하는 다수의 소수성 아미노산을 소수의 다이설파이드로 대체함으로써, 더 작고, 보다 친수성이며 (덜 응집되고, 비-특이적 결합임), 프로테아제 및 열에 대한 내성이 더 높고, 보다 낮은 밀도의 T-세포 에피토프를 갖는 단백질이 생성되는데, 이는 MHC 제시에 기여하는 대부분 잔기가 소수성이기 때문이다. 4가지 특성들 모두 면역원성에 영향을 미치는 것으로 널리 공지되어 있으며, 이들 특성은 함께 상당한 면역원성 저하를 유발할 것으로 예상된다.
베르사바디에 대한 영감은 뜻밖의 낮은 면역원성을 나타내는 것으로 공지되어 있는 거머리, 뱀, 거미, 전갈, 달팽이, 및 아네모네에 의해 생산되는 천연 주사가능한 생물제약으로부터 유래되었다. 선택된 천연 단백질 패밀리로부터 시작해, 설계 및 스크리닝하여, 크기, 소수성, 단백질분해 항원 처리, 및 에피토프 밀도가 천연 주사가능한 단백질의 평균보다 훨씬 낮은 수준으로 최소화되어 있다.
베르사바디의 구조를 고려해볼 때, 이들 항체 모방체는 다가, 다중-특이성, 반감기 메카니즘의 다양성, 조직 표적화 모듈 및 항체 Fc 영역의 부재를 포함하는 다양한 포맷을 제공한다. 추가적으로, 베르사바디는 E. coli에서 고수율로 제조되고, 친수성이며 크기가 작기 때문에, 베르사바디는 고도로 용해성이며, 고농도로 제제화할 수 있다. 베르사바디는 유난히 열 안정성이고 (비등이 가능함) 연장된 저장 수명을 제공한다.
베르사바디에 관한 추가적인 정보는 미국 특허 출원 공개 번호 2007/0191272에서 찾아볼 수 있으며, 이는 그 전문이 원용에 의해 본 명세서에 포함된다.
상기 제공된 항체 단편 및 항체 모방체 기술에 대한 상세한 설명이 본 명세서와 관련하여 이용될 수 있는 모든 기술에 대한 종합 목록으로서 의도하고자 하는 것은 아니다. 예를 들어, 및 비-제한적으로, 대안적 폴리펩타이드-기반 기술, 예컨대 Qui et al. (2007) Nature Biotechnology 25(8):921-929 (이는 그 전문이 원용에 의해 본 명세서에 포함됨)에 개략적으로 기술된 바와 같은 상보성 결정 영역의 융합, 뿐 아니라 핵산-기반 기술, 예컨대 미국 특허 5,789,157, 5,864,026, 5,712,375, 5,763,566, 6,013,443, 6,376,474, 6,613,526, 6,114,120, 6,261,774, 및 6,387,620 (이들은 모두 그 전문이 원용에 의해 본 명세서에 포함됨)에 기재된 RNA 앱타머 기술을 비롯한 다양한 추가의 기술을 본 발명과 관련하여 이용할 수 있다.
약학적 조성물
본 발명의 약학적 조합물은 동시, 개별 또는 순차적 용도를 위한 조합 제제 형태이다. 마찬가지로, 본 발명의 방법에서, 약학적 조합물의 구성성분 (A) 및 (B)는 환자에게 동시에, 분리하여 또는 순차적으로 투여될 수 있다.
용어 "조합 제제"는 고정 조합 (fixed combination) 및 비-고정 조합 (non-fixed combination) 둘다를 포함한다. 용어 "고정 조합"은 활성 성분들 (예, 구성성분 (A) 및 (B))이 단일한 엔터티 (single entity) 또는 도세지 (dosage) 형태인 것을 의미한다. 다시 말해, 활성 성분들은 단일한 조성물 또는 제형에 존재한다. 용어 "비-고정 조합"은 활성 성분들 (예, 구성성분 (A) 및 (B))이 여러가지 엔터티 또는 도세지 (예, 각각의 조성물 또는 제형)로, 예를 들어 부품 키트 (kit of parts)로서 존재하는 것을 의미한다. 독립적인 구성성분 (A) 및 (B) (원하는 조성물 또는 제형 형태로)는 동일한 시점에 또는 서로 다른 시점에, 개별적으로 또는 순차적으로 투여될 수 있다.
투여가 순차적인 경우, 제2 성분의 투여시 지연은 조합물의 사용으로 생기는 효과 이점이 없어지지 않는 수준이어야 한다. 즉, 일 구현예에서, 순차적인 치료는 조합물의 각 구성성분들이 11일 기간 이내에 투여되는 것을 포함한다. 다른 구현예에서, 이 기간은 10일이다. 다른 구현예에서, 이 기간은 9일이다. 다른 구현예에서, 이 기간은 8일이다. 다른 구현예에서, 이 기간은 7일이다. 다른 구현예에서, 이 기간은 6일이다. 다른 구현예에서, 이 기간은 5일이다. 다른 구현예에서, 이 기간은 4일이다. 다른 구현예에서, 이 기간은 3일이다. 다른 구현예에서, 이 기간은 24시간이다. 다른 구현예에서, 이 기간은 24시간이다.
구성성분 (A) 및 (B)는 임의 순서로, 예를 들어, 구성성분 (A)를 먼저 투여한 다음 (B)를, 또는 구성성분 (B)를 먼저 투여한 다음 (A)를 투여하는 것과 같이, 임의 순서로 투여될 수 있다.
약학적 조합물로 투여되는 구성성분 (A) : (B)의 총 함량의 비율은, 예를 들어, 치료할 환자 서브 집단의 필요성 또는 한명의 환자의 필요성에 대응하기 위해, 달라질 수 있으며, 이때 서로 다른 필요성은 환자의 연령, 성별, 체중 등이 이유일 수 있다.
구성성분 (A) 및 (B)는, 단일 조성물로 또는 개별 조성물들로 제공되든, 독립적으로 하나 이상의 약제학적으로 허용가능한 담체와 함께 제형화될 수 있다. 본 발명의 약학적 조합물은 또한 하나 이상의 다른 항-종양제 또는 항-염증제 또는 면역억제제를 포함할 수 있다. 병용 요법에 사용될 수 있는 치료학적 물질들의 예는 본원에 개시된 항체의 사용에 대한 후술한 좀더 상세한 설명에 기술되어 있다.
이러한 조합물은 본원에 개시된 (예, 2개 이상의 상이한) 항체 또는 2중 특이성 분자들 중 하나 또는 이들의 조합을 포함할 수 있다. 예를 들어, 본 발명의 약학적 조합물은, 표적 항원 상의 서로 다른 에피토프에 결합하거나 또는 상보적 활성을 가진, 항체 (또는 이중 특이성)의 조합을 포함할 수 있다.
본 발명의 약학적 조합물은 또한 병용 요법으로, 즉 다른 물질과 조합되어 투여될 수 있다. 예를 들어, 이러한 병용 요법은 하나 이상의 다른 항-종양제, 또는 항-염증제 또는 면역억제제와 조합된 본 발명의 항- 항체를 포함할 수 있다. 병용 요법에 사용할 수 있는 치료학적 물질의 예는 본 발명의 항체의 용도에 대한 하기 섹션에서 보다 상세하게 설명한다.
본원에서, "약제학적으로 허용되는 담체"는 생리학적으로 상용성인 임의의 모든 용매, 분산 매질, 코팅제, 항박테리아제 및 항진균제, 등장화제 및 흡수 지연제 등을 포함한다. 바람직하게는, 담체는 정맥내, 근육내, 피하, 비경구, 척수 또는 표피 투여 (예를 들어, 주사 또는 주입에 의함)에 적합하다. 투여 경로에 따라, 활성 화합물, 즉 항체, 면역접합체 또는 2중 특이성 분자는 산의 작용으로부터 및 화합물을 불활성화할 수 있는 등의 다른 천연 조건으로부터 화합물을 보호하기 위해 물질에 코팅될 수 있다.
구성성분 (A) 및 (B)는 하나 이상의 약제학적으로 허용되는 염을 포함할 수 있다. "약제학적으로 허용되는 염"은 모 화합물의 원하는 생물학적 활성을 보유하고 바람직하지 않은 어떠한 독성학적 효과도 제공하지 않는 염을 의미한다 (예, Berge, S.M., et al. (1977) J. Pharm. Sci. 66:1-19 참조). 이러한 염의 예는 산 부가염 및 염기 부가염을 포함한다. 산 부가염은 무독성 무기 산, 예컨대 염산, 질산, 인산, 황산, 브로민화수소산, 아이오딘화수소산, 아인산 등, 뿐만 아니라 비독성 유기 산, 예컨대 지방족 모노- 및 디카르복실산, 페닐-치환된 알칸산, 히드록시 알칸산, 방향족 산, 지방족 및 방향족 술폰산 등으로부터 유래된 것을 포함한다. 염기 부가염은 알칼리 토금속, 예컨대 나트륨, 칼륨, 마그네슘, 칼슘 등 뿐만 아니라 무독성 유기 아민, 예컨대 N,N'-디벤질에틸렌디아민, N-메틸글루카민, 클로로프로카인, 콜린, 디에탄올아민, 에틸렌디아민, 프로카인 등으로부터 유래된 것을 포함한다.
본 발명의 약학적 조합물은 또한 구성성분 (A) 및/또는 (B) 내에 약제학적으로 허용되는 항산화제를 포함할 수 있다. 약제학적으로 허용되는 항산화제의 예는 다음을 포함한다: (1) 수용성 항산화제, 예컨대 아스코르브산, 시스테인 히드로클로라이드, 중황산나트륨, 메타중아황산나트륨, 아황산나트륨 등; (2) 오일-용해성 항산화제, 예컨대 아스코르빌 팔미테이트, 부틸화 히드록시아니솔 (BHA), 부틸화 히드록시톨루엔 (BHT), 레시틴, 프로필 갈레이트, 알파-토코페롤 등; 및 (3) 금속 킬레이트화제, 예컨대 시트르산, 에틸렌디아민 테트라아세트산 (EDTA), 소르비톨, 타르타르산, 인산 등.
본 발명의 약학적 조성물 (구성성분 (A) 및/또는 (B))에 사용될 수 있는 적합한 수성 및 비수성 담체의 예는 물, 에탄올, 폴리올 (예컨대, 글리세롤, 프로필렌 글리콜, 폴리에틸렌 글리콜 등), 및 그의 적합한 혼합물, 식물성 오일, 예컨대 올리브 오일, 및 주사가능한 유기 에스테르, 예컨대 에틸 올레에이트를 포함한다. 적절한 유동성은 예를 들어 코팅 물질, 예컨대 레시틴의 사용, 분산액의 경우에 필요한 입자 크기의 유지, 및 계면활성제의 사용으로 유지할 수 있다.
이들 조합물 (구성성분 (A) 및/또는 (B))은 또한 보강제, 예컨대 보존제, 습윤제, 유화제 및 분산제를 함유할 수 있다. 미생물 존재의 방지는 전술한 멸균 절차, 및 다양한 항박테리아제 및 항진균제, 예를 들어 파라벤, 클로로부탄올, 페놀 소르브산 등의 도입 둘 다에 의해 보장될 수 있다. 또한, 등장화제, 예컨대 당, 염화나트륨 등을 조성물 내에 포함하는 것이 바람직할 수 있다. 추가로, 흡수를 지연시키는 작용제, 예컨대 알루미늄 모노스테아레이트 및 젤라틴을 포함시킴으로써 주사가능한 제약 형태의 흡수를 연장할 수 있다.
약제학적으로 허용되는 담체는 멸균 주사액 또는 분산액의 즉석 제조를 위한 멸균 수용액 또는 분산액 및 멸균 분말을 포함한다. 약제학적으로 활성 물질을 위한 이러한 매질 및 작용제의 사용은 당업계에 공지되어 있다. 임의의 통상적인 매질 또는 작용제가 활성 화합물과 비-상용성인 경우를 제외하고는, 본 발명의 약학적 조합물에서 이들을 사용하는 것이 고려된다. 보충 활성 화합물이 역시 조성물에 혼입될 수 있다.
치료학적 조합물은 전형적으로 제조 및 저장 조건에서 무균성이고, 안정적이어야 한다. 조합물 (구성성분 (A) 및/또는 (B))은 용액, 마이크로에멀젼, 리포솜, 또는 높은 약물 농도에 적합한 다른 정렬된 구조로서 제제화될 수 있다. 담체는, 예를 들어 물, 에탄올, 폴리올 (예를 들어, 글리세롤, 프로필렌 글리콜 및 액체 폴리에틸렌 글리콜 등), 및 그의 적합한 혼합물을 함유하는 용매 또는 분산 매질일 수 있다. 적절한 유동성은 예를 들어 코팅제, 예컨대 레시틴의 사용, 분산액의 경우에 필요한 입자 크기의 유지, 및 계면활성제의 사용으로 유지할 수 있다. 다수의 경우, 등장화제, 예를 들어 당, 폴리알콜, 예컨대 만니톨, 소르비톨, 또는 염화나트륨을 조성물 내에 포함시키는 것이 바람직할 것이다. 조성물에 흡수를 지연시키는 작용제, 예를 들어 모노스테아레이트 염 및 젤라틴을 포함시킴으로써 주사가능한 조성물의 흡수를 연장할 수 있다.
멸균 주사액은 필요량의 활성 화합물을 필요에 따라 상기 기재된 성분들 중 하나 또는 그 조합물과 함께 적절한 용매 중에 혼합한 후에 멸균 마이크로여과를 수행하여 제조될 수 있다. 일반적으로, 분산물은, 활성 화합물을 기본 분산 매질 및 상기 기재된 것 중의 요구되는 다른 성분을 함유하는 멸균 비히클 내에 투입함으로써 제조한다. 멸균 주사액을 제조하기 위한 멸균 분말의 경우에, 바람직한 제조 방법은 진공 건조 및 냉동 건조 (동결건조)인데, 이로써 미리 멸균-여과된 용액으로부터의 활성 성분 + 임의의 부가적인 바람직한 성분의 분말이 획득된다.
담체 물질과 조합하여 단일 투여 형태를 형성할 수 있는 활성 성분의 양은 치료받는 개체 및 구체적인 투여 방식에 따라 달라질 것이다. 담체 물질과 조합되어 단일 투여 형태를 형성할 수 있는 활성 성분의 양은 일반적으로 치료 효과를 나타내는 조성물의 양일 것이다. 일반적으로 100 퍼센트 중, 그 양은 약제학적으로 허용되는 담체와 조합되는 활성 성분의 약 0.01 퍼센트 내지 약 99 퍼센트, 바람직하게는 약 0.1 퍼센트 내지 약 70 퍼센트, 가장 바람직하게는 약 1 퍼센트 내지 약 30 퍼센트 범위일 것이다.
(구성성분 (A) 및/또는 (B)의) 투여 요법은 원하는 최적의 반응 (예, 상승적인 조합, 치료 반응)을 제공하도록 조정된다. 예를 들어, 단일 볼루스로 투여되거나, 여러 분할 용량으로 시간 경과에 따라 투여되거나, 또는 용량이 치료 상황의 긴급성에 따라 정해지는 바에 비례하여 감소 또는 증가될 수 있다. 비경구 조성물은, 투여의 용이성 및 투여량의 균일성을 위해 투여 단위 형태로 제제화하는 것이 특히 유익하다. 본원에서, 투여 단위 형태는 치료할 개체에 대한 단일 투여량으로서 적합한 물리적 이산 단위를 지칭하는 것으로; 각 단위는 요구되는 약제학적 담체와 함께 원하는 치료 효과를 제공하도록 계산된 예정량의 활성 화합물을 함유한다. 본 발명의 투여 단위 형태에 관한 상세 사항은 (a) 활성 화합물의 구체적인 특징 및 달성하고자 하는 구체적인 치료 효과, 및 (b) 개체에서 감수성 치료를 위해 상기 활성 화합물을 배합하는 분야에 존재하는 제한 사항에 의해 지시되고 이에 직접적으로 좌우된다.
바람직하게는, 구성성분 (A) 및 (B)의 조합은 상승적인 조합이다. 당해 기술 분야의 당업자라면, 상승적인 조합이, 조합의 효과가 개별 성분의 효과를 합한 것 보다 큰 조합임을 이해할 것이다. 상승작용은 Chou-Talalay 조합 인덱스를 사용해 정량할 수 있다 (combination index, CI) ("Evaluation of combination chemotherapy: integration of nonlinear regression, curve shift, isobologram, and combination index analyses", Zhao L, et al. Clin Cancer Res. (2004) Dec 1;10(23):7994-8004; 및 "Computerized quantitation of synergism and antagonism of taxol, topotecan, and cisplatin against human teratocarcinoma cell growth: a rational approach to clinical protocol design", Chou TC, Motzer RJ, Tong Y, Bosl GJ., J. Natl. Cancer Inst. (1994) Oct 19;86(20):1517-24 참조). 이 조합 인덱스 (CI) 방법은 질량-작용 법칙의 중앙값-효과 (median-effect) 원리로부터 파생된 다중 약물 효과 등식을 토대로 한다. 이는 강한 상승작용 (CI < 0.3), 상승작용 (CI = 0.3-0.9), 상가 효과 (additive effect) (CI = 0.9-1.1) 또는 길항/효과 없음 (CI > 1.1)에 대한 정량적인 정의를 제시하며, 약물 조합물에 대한 자동 시뮬레이션 컴퓨터 소프트웨어 알고리즘을 제공해준다. 이는 각 약물 단독 및 약물 조합의 효력 (D(m) 값)과 약물-효과 곡선 (m 값)의 형태를 고려한다. Chou-Talalay 조합 인덱스 (CI)는 Synergy R package ("Preclinical versus Clinical Drugs Combination Studies", Chou TC. Leuk. Lymphoma. (2008);49(11):2059-2080 및 이 문헌의 참조문헌, 문헌들 모두 원용에 의해 본 명세서에 포함됨)를 사용해 추정할 수 있다. 조합물의 CI는 적합한 세포주, 예를 들어 K052 세포에서, 예를 들어 실시예 9에서 사용된 조건 하에 검사할 수 있다.
바람직하게는, 본 발명의 약학적 조합물은 Chou-Talalay 조합 인덱스 (CI) 0.9 미만, 0.8 미만, 0.7 미만, 0.6 미만, 0.5 미만, 0.4 미만, 0.3 미만 또는 0.2 미만의 상승적인 조합이다. 바람직하게는, CI는 0.1-0.5, 0.1-0.3 또는 0.1-0.2이다.
특히, 본 발명은 본 발명의 약학적 조합물의 구성성분 (A) 및 (B)를 치료학적으로 유효한 상승적인 함량으로 필요한 환자에게 동시, 개별 또는 순차적으로 투여하는 것을 포함하는, 환자에서의 암 치료 방법을 제공한다. 또한, 구성성분 (A) 및 (B)의 상승적인 함량이 암 치료를 위해 환자에게 동시적으로, 각각 또는 순차적으로 투여되는, 암 치료에 사용하기 위한 본 발명의 약학적 조합물을 제공한다. 바람직하게는, 구성성분 (A) 및 (B)의 함량은 전술한 혈장 농도를 제공하도록 환자에게 투여된다.
또한, 본 발명은 암 치료를 위해 동시, 개별 또는 순차적으로 사용되는 약학적 조합물의 제조에 있어 본 발명의 약학적 조합물의 구성성분 (A) 및 (B)의 상승적인 함량의 용도를 제공한다. 또한, 약제로서 사용하기 위한 또는 테라피에 사용하기 위한 본 발명의 상승적인 약학적 조합물을 제공한다.
항체 투여와 관련하여, 투여량은 숙주 체중의 약 0.0001 내지 100 mg/kg, 보다 통상적으로는 0.01 내지 5 mg/kg 범위이다. 예를 들어, 투여량은 0.3 mg/kg 체중, 1 mg/kg 체중, 3 mg/kg 체중, 5 mg/kg 체중 또는 10 mg/kg 체중일 수 있거나, 또는 1-10 mg/kg의 범위 이내일 수 있다. 예시적인 치료 요법은 1주 당 1회 투여, 2주 당 1회 투여, 3주 당 1회 투여, 4주 당 1회 투여, 1개월 당 1회 투여, 3개월 당 1회 투여, 또는 3개월 내지 6개월 당 1회 투여를 포함한다. 본 발명의 항-BST1 항체에 대한 바람직한 투여 요법은 정맥내 투여를 통해 1 mg/kg 체중 또는 3 mg/kg 체중으로 투여하는 것을 포함하고, 여기서 항체는 다음 투여 스케줄 중 하나를 이용하여 제공된다: (i) 4주마다 6회 투여후 3개월 간격; (ii) 3주 간격; (iii) 3 mg/kg 체중으로 1회 후 3주 간격으로 1 mg/kg(체중) 투여.
일부 구현예에서, 항-BST1 항체 (예, BST1_A2)의 투여량은 0.005 내지 50 ㎍/ml, 예를 들어 0.01 내지 10 ㎍/ml의 혈장 내 항체 농도가 달성되도록 조정된다. 바람직하게는, 항-BST1 항체 (예, BST1_A2)의 투여량은 0.01 내지 0.1 ㎍/ml, 0.1 내지 1.0 ㎍/ml 또는 1.0 내지 10 ㎍/ml의 혈장내 항체 농도가 달성되도록 조정된다.
일부 구현예에서, 시티딘 유사체 (예, 5-아자시티딘) 투여량은 0.05 내지 5 μM, 예를 들어 0.1 내지 2 μM의 혈장내 농도가 달성되도록 조정된다. 바람직하게는, 시티딘 유사체 투여량은 0.1 내지 0.5 μM, 0.5 내지 1.0 μM 또는 1.0 내지 2.0 μM의 혈장내 농도가 달성되도록 조정된다.
일부 구현예에서, 시티딘 유사체 (예, 데시타빈) 투여량은 0.05 내지 5 μM, 예를 들어 0.1 내지 2 μM의 혈장내 농도가 달성되도록 조정된다. 바람직하게는, 시티딘 유사체 투여량은 0.1 내지 0.5 μM, 0.5 내지 1.0 μM 또는 1.0 내지 2.0 μM의 혈장내 농도가 달성되도록 조정된다.
시티딘 유사체 (예, 5-아자시티딘 또는 데시타빈) 또는 이의 약제학적으로 허용가능한 염은 사이클로포스파미드 (cyclophosphamide), 하이드록시다우노루비신 (hydroxydaunorubicin), 온코빈 (oncovin) 및 프레드니손 (predisone) 또는 프레드니솔론 (prednisolone) 중 하나 이상과 함께 (즉, CHOP 테라피) 투여될 수 있다.
일부 방법에서, 결합 특이성이 상이한 2 이상의 단일클론 항체가 동시에 투여되고, 이 경우에 투여되는 각각의 항체의 투여량은 지시된 범위 내에 속한다. 항체는 일반적으로 여러 번 투여된다. 단일 투여 간격은, 예를 들어 매주, 매달, 3개월마다 또는 매년일 수 있다. 또한, 환자에서 표적 항원에 대한 항체의 혈액 수준을 측정함으로써 결정되는 바와 같이 간격은 불규칙적일 수 있다. 일부 방법에서, 투여량은 약 1-1000 ㎍/ml, 일부 방법에서는 약 25-300 ㎍/ml의 혈장 항체 농도가 달성되도록 조정된다.
대안적으로, 덜 빈번한 투여가 요구되는 경우에, 각 성분을 지속 방출 제제로서 투여할 수 있다. 투여량 및 빈도는 환자의 항체 반감기에 따라 달라진다. 일반적으로, 인간 항체가 가장 긴 반감기를 나타내고, 그 다음으로 인간화 항체, 키메라 항체 및 비-인간 항체 순이다. 투여량 및 투여 빈도는 치료가 예방적인지 치료적인지의 여부에 따라 달라질 수 있다. 예방 용도에서, 비교적 낮은 투여량이 비교적 빈번하지 않은 간격으로 장기간에 걸쳐 투여된다. 일부 환자는 남은 일생 동안 계속 치료를 받는다. 치료 용도에서, 때때로 질환의 진행이 경감되거나 또는 종료될 때까지, 바람직하게는 환자가 질환 증상의 부분적 또는 완전한 개선을 보일 때까지 상대적으로 짧은 간격의 상대적으로 높은 투여량이 요구된다. 그 후, 환자에게 예방 요법을 투여할 수 있다.
본 발명의 약학적 조합물 중 활성 성분의 실제 투여량 수준은 환자에게 독성이 없으면서 특정 환자, 조성물 및 투여 방식에 대해 원하는 치료 반응을 달성하는데 효과적인 활성 성분의 양이 달성되도록 달라질 수 있다. 선택된 투여량 수준은 사용되는 본 발명의 특정 조합물 또는 그의 에스테르, 염 또는 아미드의 활성, 투여 경로, 투여 시간, 사용되는 특정한 화합물의 배출 속도, 치료 지속기간, 사용되는 특정 조성물과 조합 사용되는 다른 약물, 화합물 및/또는 물질, 치료받는 환자의 연령, 성별, 체중, 상태, 일반적인 건강 및 이전의 의학적 병력 및 의학 분야에 널리 공지된 유사 요인을 포함한, 다양한 약동학적 요인에 따라 달라질 것이다.
항-BST1 항체의 "치료학적 유효량"은 바람직하게는 질환 증상의 중증도를 낮추거나, 질환 증상이 없는 기간의 빈도 및 지속 기간을 늘리거나, 또는 질환 통증으로 인한 장애 또는 무능력을 방지한다. 예를 들어, BST1 매개 종양의 치료의 경우, "치료학적 유효 투여량"은 세포 증식 또는 종양 증식을 비-치료 개체에 비해 바람직하게는 적어도 약 20%, 보다 바람직하게는 적어도 약 40%, 보다 더 바람직하게는 적어도 약 60%, 보다 더 바람직하게는 적어도 약 80% 억제한다. 종양 증식을 억제하는 화합물의 능력은 인간 종양에서의 효능을 예측하는 동물 모델 시스템에서 평가할 수 있다. 대안적으로, 조성물의 이러한 특성은 세포 증식을 억제하는 화합물의 능력을 조사함으로써 평가할 수 있으며, 이러한 억제는 숙련된 진료의가 공지된 분석에 의해 시험관내에서 측정할 수 있다. 치료 화합물의 치료학적 유효량은 개체에게서 종양 크기를 줄이거나 또는 증상을 달리 완화할 수 있다. 당업자는 개체의 신체 크기, 개체의 증상의 중증도, 및 선택된 특정 조성물 또는 투여 경로와 같은 인자에 기초하여 치료학적 유효량을 결정할 수 있을 것이다.
본 발명의 구성성분 (A) 및 (B)는 당업계에 공지된 다양한 방법들 중 하나 이상을 이용하여 하나 이상의 투여 경로를 통해 투여할 수 있으며; 구성성분 (A) 및 (B)의 투여 경로는 동일하거나 또는 상이할 수 있다. 당업자가 인지하는 바와 같이, 투여 경로 및/또는 투여 방식은 원하는 결과에 따라 달라질 것이다. 항체에 대해 바람직한 투여 경로는 정맥내, 근육내, 피내, 복강내, 피하, 척수 또는 다른 비경구 투여 경로, 예를 들어 주사 또는 주입 경로를 포함한다. 바람직하게는, 약학적 조합물은 정맥내로 투여된다.
본원에서, 표현 "비경구 투여"는 대체로 주사에 의한, 경장 및 국소 투여 이외의 투여 방식을 의미하고, 비-제한적으로 정맥내, 근육내, 동맥내, 척수강내, 피막내, 안와내, 심장내, 피내, 복강내, 경기관, 피하, 표피하, 관절내, 피막하, 지주막하, 척수내, 경막외 및 흉골내 주사 및 주입을 포함한다.
대안적으로, 구성성분 (A) 및 (B)는 비-비경구 경로 (non-parenteral route), 예컨대 국소, 표피 또는 점막 투여 경로를 통해, 예를 들어 비강내로, 경구로, 질로, 직장으로, 설하로 또는 국소로 투여될 수 있다.
구성성분 (A) 및 (B)는 제어 방출 제제, 예컨대 이식물, 경피 패치, 및 미세캡슐화 전달 시스템과 같이 급속 방출로부터 화합물을 보호하는 담체와 함께 제형화될 수 있다. 생분해성, 생체적합성 중합체, 예컨대 에틸렌 비닐 아세테이트, 폴리무수물, 폴리글리콜산, 콜라겐, 폴리오르토에스테르 및 폴리락트산이 사용될 수 있다. 이러한 제제를 제조하기 다수 방법들이 특허 등록되었거나 일반적으로 당업자에게 공지되어 있다 (예를 들어, Sustained and Controlled Release Drug Delivery Systems (1978) J.R. Robinson, ed., Marcel Dekker, Inc., N.Y 참조).
약학적 조합물은 당업계에 공지된 의료 장치를 이용하여 함께 또는 분리하여 투여될 수 있다. 예를 들어, 바람직한 구현예에서, 본 발명의 약학적 조합물은 무바늘 피하 주사 장치, 예컨대 미국 특허 5,399,163; 5,383,851; 5,312,335; 5,064,413; 4,941,880; 4,790,824; 또는 4,596,556에 개시된 장치를 사용해 투여할 수 있다. 본 발명에 유용한 널리 공지된 이식물 및 모듈의 예로는 미국 특허 4,487,603에 개시된, 제어된 속도로 의약제를 분배하기 위한 이식가능 마이크로-주입 펌프; 미국 특허 4,486,194에 개시된, 피부를 통해 의약제를 투여하기 위한 치료 장치; 미국 특허 4,447,233에 개시된, 정확한 주입 속도로 의약제를 전달하기 위한 의약제 주입 펌프; 미국 특허 4,447,224에 개시된, 연속 약물 전달을 위한 가변 유동 이식가능 주입 기구; 미국 특허 4,439,196에 개시된, 다중-챔버 구획을 보유하는 삼투성 약물 전달 시스템; 및 미국 특허 4,475,196에 개시된, 삼투성 약물 전달 시스템을 포함한다. 이들 특허는 원용에 의해 본 명세서에 포함된다. 그외 다수의 이식물, 전달 시스템 및 모듈이 당업자에게 공지되어 있다.
특정 구현예에서, 본원에 개시된 단일클론 항체는 생체내 적절한 분포가 보장되도록 제제화될 수 있다. 예를 들어, 혈액-뇌 장벽 (BBB)은 고도로 친수성인 다수 화합물을 배제한다. 치료 화합물이 (원하는 경우에) BBB를 확실히 통과하도록 하기 위해서는, 이들을 예를 들어 리포솜 내에 제제화할 수 있다. 리포솜의 제조 방법에 대해서는 예를 들어 미국 특허 4,522,811; 5,374,548; 및 5,399,331을 참조한다. 리포솜은 하나 이상의 모이어티를 포함할 수 있으며, 이는 특이적 세포 또는 기관 내로 선택적으로 수송되어 표적화 약물 전달을 강화한다 (예, V.V. Ranade (1989) J. Clin. Pharmacol. 29:685 참조). 예시적인 표적화 모이어티로는 폴레이트 또는 비오틴 (예를 들어, 미국 특허 5,416,016 참조); 만노시드 [Umezawa et al. (1988) Biochem. Biophys. Res. Commun. 153:1038]; 항체 [P.G. Bloeman et al. (1995) FEBS Lett. 357:140; M. Owais et al. (1995) Antimicrob. Agents Chemother. 39:180]; 계면활성제 단백질 A 수용체 [Briscoe et al. (1995) Am. J. Physiol. 1233:134)]; p120 [Schreier et al. (1994) J. Biol. Chem. 269:9090]을 포함하며, 또한 K. Keinanen; M.L. Laukkanen (1994) FEBS Lett. 346:123; J.J. Killion; I.J. Fidler (1994) Immunomethods 4:273을 참조한다.
용도 및 방법
본원에 개시된 약학적 조합물 및 방법은 BST1-매개 장애의 치료를 포함하는 다수 치료학적 유용성을 가진다.
일부 구현예에서, 이들 조합물을 개체에, 예를 들어 생체내 투여하여 다양한 장애를 치료할 수 있다. 본원에서, 용어 "개체"는 인간 및 비-인간 동물을 포함하는 것으로 의도된다. 비-인간 동물은 모든 척추동물, 예를 들어 포유류 및 비-포유류, 예컨대 비-인간 영장류, 양, 개, 고양이, 소, 말, 닭, 양서류 및 파충류를 포함한다. 바람직한 개체는 BST1 활성에 의해 매개되는 장애를 가진 인간 환자를 포함한다. 방법은 비정상적인 BST1 발현과 연관된 장애를 가진 인간 환자를 치료하는데 특히 적합하다. BST1에 대한 항체를 또 다른 작용제와 함께 투여하는 경우에, 이들 둘은 어떠한 순서로든 또는 동시에 투여될 수 있다.
또한, 종양 세포 상에서 BST1의 발현을 고려해, 본 발명의 약학적 조합물은 종양발생 장애, 예를 들어 BST1을 발현하는 종양 세포의 존재를 특징으로 하는 장애 (예, 급성 골수성 백혈병 (AML), B-세포 만성 림프구성 백혈병, 유방암, 결장직장암, 신장암, 두경부암, 폐암, 난소암 및 췌장암 포함)를 가진 개체를 치료하는데 사용할 수 있다. BST1은 하기 실시예 5에 설명된 바와 같이 항체 결합시 내재화되는 것으로 입증되었으며, 따라서 본 발명의 항체는 임의의 페이로드 작용 메카니즘, 예를 들어 ADC 접근법, 방사성면역접합체 또는 ADEPT 접근법에 사용할 수 있다.
일 구현예에서, 조합물은 BST1 기능을 억제 또는 차단하는데 사용할 수 있으며, 이로써 BST1이 특정 질환 증상의 방지 또는 완화와 연계될 수 있어 질환의 매개자임을 확인시켜줄 수 있다. 이는, 샘플 및 대조군 샘플을 항-BST1 항체와, 항체 및 BST1 간에 복합체가 형성되도록 하는 조건 하에 접촉시킴으로써, 달성할 수 있다. 항체 및 BST1 간에 형성된 임의의 복합체를 검출하고, 샘플과 대조군을 비교한다.
또 다른 구현예에서, 본원에 개시된 항체 (예, 단일클론 항체, 다중 특이성 및 2중 특이성 분자 및 조성물)를 포함하는 조합물은 처음에 시험관내에서 치료 용도와 관련된 결합 활성에 대해 실험할 수 있다. 예를 들어, 본 발명의 약학적 조합물은 하기 실시예에 기재된 유세포 측정 분석을 이용하여 실험할 수 있다.
본원에 개시된 항체 (예, 단일클론 항체, 다중 특이성 및 2중 특이성 분자, 면역접합체 및 조성물)를 포함하는 조합물은 BST1 관련 질환의 요법에서 추가적인 유용성을 갖는다. 예를 들어, 단일클론 항체, 다중 특이성 또는 2중 특이성 분자 및 면역접합체를 포함하는 조합물은 생체내 또는 시험관내에서 하기 생물학적 활성들 중 하나 이상을 유도하는데 사용될 수 있다: BST1을 발현하는 세포의 증식을 억제하거나 및/또는 이러한 세포의 사멸; 인간 작동자 세포의 존재 하에 BST1을 발현하는 세포의 식세포작용 또는 ADCC 매개, 또는 BST1에 대한 BST1 리간드의 결합 차단.
특정 구현예에서, 항체 (예, 단일클론 항체, 다중 특이성 및 2중 특이성 분자 및 조성물)를 포함하는 조합물은 다양한 BST1-관련 질환을 치료하기 위해 생체내에서 사용된다. BST1-관련 질환의 예는 특히 급성 골수성 백혈병 (AML), B-세포 만성 림프구성 백혈병, 유방암, 결장직장암, 신장암, 두경부암, 폐암, 난소암 및 췌장암을 나타내는 인간 암 조직을 포함한다.
본 발명의 약학적 조합물의 구성성분 (A) 및 (B) (예를 들어, 단일클론 항체, 다중 특이성 및 2중 특이성 분자 또는 면역접합체)를 생체내 투여하는 적합한 경로는 당업계에 널리 공지되어 있으며, 당업자가 선택할 수 있다. 예를 들어, 약학적 조합물은 주사 (예, 정맥내 또는 피하)에 의해 투여할 수 있다. 사용 분자의 적합한 투여량은 개체의 연령 및 체중 및 항체 및 시티딘 유사체 조성물의 농도 및/또는 제형에 따라 달라질 것이다.
본 발명의 약학적 조합물은 하나 이상의 다른 치료학적 물질, 예를 들어 세포독성 물질, 방사성 독성 물질 또는 면역억제 물질과 공동-투여할 수 있다. 항체는 이러한 물질과 연결될 수 있거나 (면역복합체로서), 물질과 개별 투여될 수 있다. 후자의 경우에 (개별 투여), 항체는 물질의 투여 전, 투여 후 또는 이와 동시에 투여하거나, 또는 다른 공지된 요법, 예를 들어 항암 요법, 예를 들어 방사선 조사와 함께 공동-투여할 수 있다. 이러한 치료학적 물질은 특히 그 자체로는 환자에게 독성 또는 준독성인 수준에서만 효과적인 항신생물제, 예컨대 독소루비신 (아드리아마이신), 시스플라틴 블레오마이신 술페이트, 카르무스틴, 클로람부실, 및 사이클로포스파미드 히드록시우레아를 포함한다. 시스플라틴은 100 mg/kg 용량을 4주마다 1회씩 정맥내로 투여하고, 아드리아마이신은 60-75 mg/ml 용량을 21일마다 1회씩 정맥내로 투여한다.
본 발명의 약학적 조합물과 공동-투여하기 적합한 다른 물질로는 암, 예를 들어 급성 골수성 백혈병 (AML), B-세포 만성 림프구성 백혈병, 유방암, 결장직장암, 신장암, 두경부암, 폐암, 난소암 또는 췌장암의 치료에 사용되는 기타 물질, 예컨대 아바스틴(Avastin)®, 5FU 및 겜시타빈을 포함한다.
본원에 개시된 항-BST1 항체 또는 이의 항원 결합 단편과 화학요법제 (예, 시티딘 유사체)의 공동-투여는, 인간 종양 세포에 세포독성 효과를 발휘하는 서로 다른 기전을 통해 작용하는 2종의 항암제를 제공해준다. 이러한 공동-투여는 항체에 대해 비-반응성으로 만드는 약물 내성의 발생 또는 종양 세포의 항원성 변경으로 인한 문제를 해결할 수 있다.
표적-특이적인 작동자 세포, 예를 들어 (예, 단일클론 항체, 다중 특이성 및 2중 특이성 분자를 포함하는) 본원에 개시된 조합물과 연결된 작동자 세포가, 또한 치료학적 물질로서 사용될 수 있다. 표적화를 위한 작동자 세포는 인간 백혈구, 예를 들어 대식세포, 호중구 또는 단핵구일 수 있다. 다른 세포는 호산구, 자연 살상 세포 및 다른 IgG- 또는 IgA-수용체 보유 세포를 포함한다. 원하는 경우에, 작동자 세포는 치료 대상 개체로부터 수득할 수 있다. 표적-특이적인 작동자 세포는 생리학적으로 허용되는 용액 중의 세포 현탁액으로서 투여될 수 있다. 투여되는 세포의 수는 약 108-109개일 수 있지만, 치료 목적에 따라 달라질 것이다. 일반적으로, 이러한 양은 표적 세포, 예를 들어 BST1을 발현하는 종양 세포에 국지화하여, 예를 들어 식세포작용에 의한 세포 사멸에 영향을 미치는데 충분할 것이다. 투여 경로는 또한 달라질 수 있다.
표적-특이적인 작동자 세포를 사용하는 요법은 표적화 세포의 제거를 위한 다른 기술과 함께 수행될 수 있다. 예를 들어, (예, 단일클론 항체, 다중 특이성 또는 2중 특이성 분자를 포함하는) 본 발명의 약학적 조합물 및/또는 이들 조합물로 보강된 작동자 세포를 사용하는 항종양 요법은, 화학요법과 함께 사용될 수 있다. 추가로, 종양 세포 거부반응에 대해 2가지 개별 세포독성 작동자 집단에 대한 조합 면역요법을 사용할 수 있다. 예를 들어, 항-Fc-감마 RI 또는 항-CD3가 연결된 항-BST1 항체를, IgG- 또는 IgA-수용체 특이적 결합제와 함께 사용할 수 있다.
본원에 개시된 2중 특이성 및 다중 특이성 분자는 또한 예를 들어, 세포 표면 상의 수용체를 캡핑 및 제거함으로써 작동자 세포에 대한 FcγR 또는 FcγR 수준을 조절하기 위해 사용될 수 있다. 항-Fc 수용체의 혼합물이 또한 상기 목적으로 사용될 수 있다.
보체 결합 부위, 예컨대 보체에 결합하는 IgG1, -2, 또는 -3 또는 IgM으로부터 유래된 부분을 갖는 (예, 단일클론 항체, 다중 특이성 또는 2중 특이성 분자 및 면역접합체를 포함하는) 본 발명의 약학적 조합물은, 또한, 보체의 존재 하에 사용될 수 있다. 일 구현예에서, 표적 세포를 포함하는 세포 집단을 본원에 개시된 결합제 및 적절한 작동자 세포를 사용하여 생체외 처리하는 것은 보체 또는 보체 함유 혈청을 부가함으로써 보완할 수 있다. 본 발명의 결합제로 코팅되는 표적 세포의 식세포작용을 보체 단백질의 결합에 의해 개선할 수 있다. 또 다른 구현예에서, 본원에 개시된 조성물 (예를 들어, 단일클론 항체, 다중 특이성 및 2중 특이성 분자)로 코팅된 표적 세포를 또한 보체에 의해 용해시킬 수 있다. 또 다른 구현예에서, 본 발명의 조합물은 보체를 활성화하지 않는다.
(예, 단일클론 항체, 다중 특이성 또는 2중 특이성 분자 및 면역접합체를 포함하는) 본 발명의 약학적 조합물은 또한, 보체와 함께 투여할 수 있다. 특정 구현예에서, 본 발명의 개시내용은 항체, 다중 특이성 또는 2중 특이성 분자 및 혈청 또는 보체를 포함하는 약학적 조합물을 제공한다. 이들 조성물은 보체가 항체, 다중 특이성 또는 2중 특이성 분자에 아주 근접하여 위치하는 경우에 유익할 수 있다. 대안적으로, 본원에 개시된 항체, 다중 특이성 또는 2중 특이성 분자 및 보체 또는 혈청은 개별적으로 투여할 수 있다.
(예, 단일클론 항체, 2중 특이성 또는 다중 특이성 분자, 또는 면역접합체를 포함하는) 본 발명의 약학적 조합물 및 사용 지침서를 포함하는 키트 역시 본 발명의 범위에 포함된다. 이러한 키트는 하나 이상의 추가적인 시약, 예컨대 면역억제제, 세포독성제 또는 방사성독성제, 또는 본원에 개시된 하나 이상의 추가적인 항체 (예, 제1 항체와 구별되는 BST1 항원의 에피토프에 결합하는 상보성을 가진 항체)를 추가로 함유할 수 있다.
따라서, 본 발명의 약학적 조합물로 치료받는 환자에게, (시티딘 유사체 외에도) 항체의 치료 효과를 강화 또는 높이는 또 다른 치료학적 물질, 예컨대 세포독성제 또는 방사성독성제가 부가적으로 (본원에 개시된 항체의 투여 이전에, 투여와 동시에, 또는 투여 이후에) 투여될 수 있다.
다른 구현예에서, Fcγ 또는 Fcγ 수용체의 발현 또는 활성을 조절하는, 예를 들어 강화 또는 억제하는 작용제를 사용하여, 예를 들어 개체를 사이토카인으로 치료함으로써 개체를 추가로 치료할 수 있다. 다중 특이성 분자를 사용하여 치료하는 동안에 투여하기 바람직한 사이토카인은 과립구 콜로니 자극 인자 (G-CSF), 과립구-대식세포 콜로니 자극 인자 (GM-CSF), 인터페론-γ (IFN-γ), 및 종양 괴사 인자 (TNF)를 포함한다.
또한, (예, 항체, 다중 특이성 또는 2중 특이성 분자를 포함하는) 본 발명의 약학적 조합물은 FcγR 또는 BST1을 발현하는 세포를 표적하기 위해, 예를 들어 이러한 세포를 표지하기 위해 사용될 수 있다. 이와 같이 사용하기 위해서는, 검출될 수 있는 분자에 결합제를 연결시킬 수 있다. 따라서, 본 발명은 Fc 수용체, 예컨대 FcγR, 또는 BST1을 발현하는 세포를 생체외 또는 시험관내에 국지화하는 방법을 제공한다. 검출가능한 표지물질은, 예를 들어 방사성 동위원소, 형광 화합물, 효소, 또는 효소 조인자일 수 있다.
다른 구현예에서, 본 발명은 개체에서 BST1 매개 장애, 예를 들어 본 발명의 질환을 포함하여 인간 암 및 인간 염증성 질환을 치료하는 방법을 제공한다.
또 다른 구현예에서, 본원에 개시된 면역접합체를 포함하는 본 발명의 약학적 조합물 (예를 들어, 치료학적 물질, 표지, 세포독소, 방사성독소, 면역억제제 등)을 항체에 연결함으로써, BST1 세포 표면 수용체를 갖는 세포로 이들 화합물을 표적화하는데 이용될 수 있다. 예를 들어, 항-BST1 항체는 미국 특허 6,281,354 및 6,548,530, 미국 특허 출원 번호 2003/0050331, 2003/0064984, 2003/0073852, 및 2004/0087497에 기술되거나, 또는 WO 03/022806에 공개된 임의의 독소 화합물과 접합시킬 수 있다. 따라서, 본 발명은 또한 BST1을 발현하는 세포를 (예, 검출가능한 표지물질, 예컨대 방사성동위원소, 형광 화합물, 효소, 또는 효소 조인자와) 생체외 또는 생체내에서 국지화하는 방법을 제공한다. 대안적으로, 면역접합체는 세포독소 또는 방사성독소를 BST1로 표적화함으로써 BST1 세포 표면 수용체를 가진 세포를 사멸시키는데 사용할 수 있다.
모든 논문, 공개, 특허, 특허 출원, 발표문, 문서, 보고문, 원고, 소책자, 책, 인터넷 게시물, 학술지 논문, 정기 간행물, 제품 정보지 등 (이에 제한되지는 않음)을 비롯한 본 명세서에 언급된 모든 참고문헌은 그 전문이 본 명세서에 원용에 의해 포함된다. 본원에서 참고문헌의 논의는 단지 저자의 주장을 요약하기 위한 것으로, 어떠한 참고문헌도 선행 기술을 구성하는 것으로 인정되지 않으며, 출원인은 언급된 참고문헌의 정확성 및 타당성에 이의를 제기할 권리를 갖는다.
상기 본 발명이 명확한 이해를 목적으로 설명되고 실시예에서 상세하게 기술되었지만, 본 발명의 교시 내용에 비추어 종속항의 취지 또는 범위를 벗어나지 않는 임의 변화 및 변형이 가해질 수 있음은 당업자에게 자명할 것이다.
본 발명은 하기 실시예에 의해 추가로 설명되며, 이는 추가적인 제한으로 해석되어서는 안된다.
실시예
1: 파지-디스플레이 라이브러리의 구축
BST1의 아미노산 29-292 (서열번호 44)로 구성된 재조합 단백질을 표준 재조합 방법에 의해 진핵세포에서 합성하고, 면역화를 위한 항원으로 사용하였다.
면역화 및
mRNA
단리
BST1-결합 분자를 동정하기 위한 파지 디스플레이 라이브러리를 하기와 같이 구축하였다. A/J 마우스 (잭슨 래보러토리즈, 메인주 바 하버)를 0일에 프로인트 완전 보강제 중 100 μg 단백질을 사용하여 재조합 BST1 항원 (세포외 도메인)으로, 그리고 28일에 100 μg 항원으로 복강내 면역화하였다. 마우스의 검사 혈액을 후안와동 천자를 통해 수득하였다. 역가 실험에 의해, 이들이 뉴트라비딘 (리액티-바인드(Reacti-Bind™) 뉴트라비딘(TM)-코팅된 폴리스티렌 플레이트, 피어스(Pierce), 일리노이주 록포드)를 경유해 고정된 비오티닐화 BST1 항원을 이용한 ELISA에서 높은 것으로 간주되면, 마우스를 단백질 100 μg으로 70일, 71일 및 72일에 부스팅 투여하고, 이어서 77일에 희생시켜 비장절제술을 수행하였다. 항체의 역가가 만족스러운 것으로 간주되지 않는다면, 마우스를 항원 100 μg으로 56일에 부스팅 투여하고, 검사 혈액을 63일에 채취하였다. 만족스러운 역가가 얻어진다면, 동물을 항원 100 μg으로 98일, 99일 및 100일에 부스팅 접종하고, 비장을 105일에 회수하였다.
비장에서 지방 및 결합 조직은 잘라내고, 층류 후드에서 회수하여 페트리 디쉬로 옮겼다. 비장을 1.0 ml의 용액 D (25.0 g 구아니딘 티오시아네이트 (Boehringer Mannheim), 인디애나주 인디애나폴리스), 29.3 ml 멸균수, 1.76 ml 0.75 M 시트르산나트륨 pH 7.0, 2.64 ml 10% 사르코실 (피셔 사이언티픽(Fisher Scientific), 펜실베니아주 피츠버그), 0.36 ml 2-메르캅토에탄올 (피셔 사이언티픽, 펜실베니아주 피츠버그))의 존재 하에, 멸균 5 cc 시린지로부터 플런저를 사용해 침연하였다. 이 비장 현탁액을 세포가 용해될 때까지 18 게이지 바늘을 통해 뽑아내, 점성 용액을 마이크로원심분리 튜브로 옮겼다. 페트리 디쉬를 100 ㎕의 용액 D로 세척하여 임의의 남아있는 비장을 회수하였다. 이어서, 이 현탁액을 22 게이지 바늘을 통해 추가로 5-10회 뽑아내었다.
샘플을 2개의 마이크로원심분리 튜브에 균등하게 분할하고, 하기 순서대로 첨가하며, 각각의 첨가 후에 뒤집어 혼합하였다: 50 ㎕ 2 M 아세트산나트륨 pH 4.0, 0.5 ml 수-포화 페놀 (피셔 사이언티픽, 펜실베니아주 피츠버그), 100 ㎕ 클로로포름/이소아밀 알콜 49:1 (피셔 사이언티픽, 펜실베니아주 피츠버그). 용액을 10초 동안 볼텍싱하고, 얼음 상에서 15분 동안 인큐베이션하였다. 14 krpm으로 20분 동안 2-8℃에서 원심분리한 후에, 수성 상을 새로운 튜브로 옮겼다. 동일 부피의 수 포화 페놀:클로로포름:이소아밀 알콜 (50:49:1)을 첨가하고, 튜브를 10초 동안 볼텍싱하였다. 얼음 상에서 15분 인큐베이션 후에, 샘플을 20분 동안 2-8℃에서 원심분리하고, 수성 상을 새로운 튜브로 옮기고, -20℃에서 최소 30분 동안 동일 부피의 이소프로판올로 침전시켰다. 14 krpm에서 20분 동안 4℃에서 원심분리한 후에, 상청액을 흡인 제거하고, 튜브를 잠시 회전시키고, 모든 미량의 액체를 RNA 펠릿으로부터 제거하였다.
RNA 펠릿을 각각 300 ㎕의 용액 D에 용해시키고, 합한 후, -20℃에서 최소 30분 동안 동일 부피의 이소프로판올로 침전시켰다. 샘플을 14 krpm에서 20분 동안 4℃에서 원심분리하고, 상청액을 상기와 같이 흡인하고, 샘플을 100 ㎕의 빙냉한 70% 에탄올로 헹구었다. 샘플을 다시 14 krpm에서 20분 동안 4℃에서 원심분리하고, 70% 에탄올 용액을 흡인하고, RNA 펠릿을 진공 건조하였다. 펠릿을 100 ㎕의 멸균 다이에틸 피로카르보네이트-처리된 물에 재현탁하였다. 40 μg/ml의 농도에 대해 1.0의 흡광도를 적용해 농도를 A260에 의해 결정하였다. RNA를 -80℃에 보관하였다.
상보적인 DNA (cDNA) 제조
상기 기재된 바와 같이 마우스 비장으로부터 정제한 전체 RNA를 cDNA 제조를 위한 주형으로 바로 사용하였다. RNA (50 μg)를 멸균수로 100 ㎕로 희석하고, 10 ㎕의 130 ng/㎕ 올리고 dT12 (어플라이드 바이오시스템즈(Applied Biosystems) 모델 392 DNA 합성기에서 합성)를 첨가하였다. 샘플을 10분 동안 70℃에서 가열한 후에, 얼음 상에서 냉각시켰다. 얼음 위에서, 40 ㎕ 5x 제1 가닥 완충제 (깁코(Gibco)/BRL, 메릴랜드주 게이더스버그)를, 20 ㎕ 0.1 M 디티오트레이톨 (깁코/BRL, 메릴랜드주 게이더스버그), 10 ㎕ 20 mM 데옥시뉴클레오시드 트리포스페이트 (dNTP, 베링거 만하임, 인디애나주 인디애나폴리스) 및 10 ㎕ 물과 함께 첨가하였다. 이어서, 샘플을 37℃에서 2분 동안 인큐베이션하였다. 10 ㎕ 역전사효소 (슈퍼스크립트(Superscript)™ II, 깁코/BRL, 메릴랜드주 게이더스버그)를 첨가하고, 37℃에서 1시간 동안 계속 인큐베이션하였다. cDNA 생성물을 중합효소 연쇄 반응 (PCR)에 바로 사용하였다.
PCR에
의한 항체 유전자 증폭
PCR을 이용해 실질적으로 모든 H 및 L 쇄 유전자를 증폭시키기 위해, 실질적으로 모든 공개된 서열에 상응하는 프라이머를 선택하였다. H 및 L의 아미노 말단의 뉴클레오티드 서열이 상당한 다양성을 함유하기 때문에, 33개 올리고뉴클레오티드를 합성하여 H 쇄에 대한 5' 프라이머로 제공하고, 29개 올리고뉴클레오티드를 합성하여 카파 L 쇄에 대한 5' 프라이머로 제공하였다 (US 6,555,310에 기재된 바와 같음). 각각의 쇄에 대한 불변 영역 뉴클레오티드 서열은 H 쇄에 대해 오직 1개의 3' 프라이머 및 카파 L 쇄에 대해 1개의 3' 프라이머만 필요하였다.
각각의 프라이머 쌍에 대해 50 μmol의 5' 프라이머, 50 μmol의 3' 프라이머, 0.25 ㎕ Taq DNA 중합효소 (5 유닛/㎕, 베링거 만하임, 인디애나주 인디애나폴리스), 3 ㎕ cDNA (기재된 바와 같이 제조함), 5 ㎕ 2 mM dNTP, MgCl2을 함유하는 5 ㎕ 10x Taq DNA 중합효소 완충제 (베링거 만하임, 인디애나주 인디애나폴리스), 및 H2O (50 ㎕의 잔량)를 사용하여 50 ㎕ 반응을 수행하였다. 진앰프(GeneAmp)(R) 9600 열 순환기 (퍼킨 엘머(Perkin Elmer), 캘리포니아주 포스터 시티)를 이용하여 하기 열순환 프로그램으로 증폭을 수행하였다: 1분 동안 94℃; 30회 사이클로, 20초 동안 94℃, 30초 동안 55℃, 및 30초 동안 72℃, 6분 동안 72℃; 4℃.
이어서, PCR 과정의 dsDNA 생성물에 대해 오직 3' 프라이머만 사용하는 비대칭 PCR을 수행하여 실질적으로 표적 유전자의 안티센스 가닥만 제조하였다. 각각의 dsDNA 생성물에 대해 200 μmol의 3' 프라이머, 2 ㎕의 dsDNA 생성물, 0.5 ㎕ Taq DNA 중합효소, 10 ㎕ 2 mM dNTP, MgCl2를 함유하는 10 ㎕ 10x Taq DNA 중합효소 완충제 (베링거 만하임, 미국 인디애나주 인디애나폴리스) 및 H2O (100 ㎕의 잔량)를 사용하여 100 ㎕ 반응을 수행하였다. 상기 기재된 바와 동일한 PCR 프로그램을 이용하여 단일-가닥 (ss)-DNA를 증폭시켰다.
고성능 액체 크로마토그래피에 의한 단일-가닥 DNA의 정제 및 단일-가닥 DNA의 키나제 처리
H 쇄 ss-PCR 생성물 및 L 쇄 단일-가닥 PCR 생성물에, 2.5 부피의 에탄올 및 0.2 부피의 7.5M 아세트산암모늄을 첨가하고, -20℃에서 30분 이상 인큐베이션함으로써 에탄올 침전시켰다. DNA를 에펜도르프(Eppendorf) 원심분리로 14 krpm에서 10분 동안 2-8℃에서 원심분리하여 펠릿화하였다. 상청액을 조심스럽게 흡인하고, 튜브에서 2차로 잠시 회전시켰다. 상청액의 마지막 방울을 피펫으로 제거하였다. DNA를 중간 열로 10분 동안 진공에서 건조시켰다. H 쇄 생성물을 210 ㎕ 물에 모으고, L 쇄 생성물을 개별적으로 210 ㎕ 물에 모았다. 단일-가닥 DNA를 휴렛 팩커드(Hewlett Packard) 1090 HPLC 및 Gen-Pak™ FAX 음이온 교환 컬럼 (밀리포어 코포레이션(Millipore Corp.), 매사추세츠주 밀포드)을 사용하는 고성능 액체 크로마토그래피 (HPLC)에 의해 정제하였다. 단일-가닥 DNA를 정제하는데 사용된 구배를 표 1에 나타내었으며, 오븐 온도는 60℃였다. 흡광도를 260 nm에서 모니터링하였다. HPLC로부터 용리된 단일-가닥 DNA를 0.5분 분획으로 수집하였다. 단일-가닥 DNA를 함유하는 분획을 에탄올 침전시키고, 펠릿화한 후 상기와 같이 건조시켰다. 건조된 DNA 펠릿을 200 ㎕ 멸균수에 모았다.
단일-가닥 DNA를 돌연변이 유발의 제조에서 5'-인산화하였다. 24 ㎕ 10x 키나제 완충제 (유나이티드 스테이츠 바이오케미칼(United States Biochemical), 오하이오주 클리블랜드), 10.4 ㎕ 10 mM 아데노신-5'-트리포스페이트 (베링거 만하임, 인디애나주 인디애나폴리스), 및 2 ㎕ 폴리뉴클레오티드 키나제 (30 유닛/㎕, 유나이티드 스테이츠 바이오케미칼, 오하이오주 클리블랜드)를 각각의 샘플에 첨가하고, 튜브를 37℃에서 1시간 동안 인큐베이션하였다. 70℃에서 10분 동안 튜브를 인큐베이션하여 반응을 중지시켰다. 트리스 평형화 페놀 (pH>8.0, 유나이티드 스테이츠 바이오케미칼, 오하이오주 클리블랜드):클로로포름:이소아밀 알콜 (50:49:1)로 1회 추출하고, 클로로포름:이소아밀 알콜 (49:1)로 1회 추출하여 DNA를 정제하였다. 추출 후, DNA를 에탄올 침전시키고, 상기 기재된 바와 같이 펠릿화하였다. DNA 펠릿을 건조한 후, 50 ㎕ 멸균수에 용해하였다. 1.0의 흡광도에 대해 33 μg/ml를 사용해 260 nm에서 DNA 분취액의 흡광도를 측정함으로써 농도를 결정하였다. 샘플을 -20℃에 보관하였다.
비장 항체 파지 라이브러리의 구축에 사용된 우라실 주형 제조
250 ml 배플 진탕 플라스크에서, 1 ml의 E. coli CJ236 (바이오라드(BioRAD), 캘리포니아 허큘레스)의 밤샘 배양물을 50 ml 2x YT에 첨가하였다. 배양물을 37℃에서 OD600=0.6으로 증식시킨 후 BS45 벡터 파지 원액 1/100 희석액 10 ㎕를 접종하여 (US 6,555,310에 기재됨), 6시간 동안 계속 배양하였다. 대략 40 ml의 배양물을 12 krpm에서 15분 동안 4℃에서 원심분리하였다. 상청액 (30 ml)을 새로운 원심분리 튜브로 옮기고, 15 ㎕의 10 mg/ml RNaseA (베링거 만하임, 인디애나주 인디애나폴리스)를 첨가한 후에 15분 동안 실온에서 인큐베이션하였다. 7.5 ml의 20% 폴리에틸렌 글리콜 8000 (피셔 사이언티픽, 펜실베니아주 피츠버그)/3.5M 아세트산암모늄 (시그마 케미칼 캄파니(Sigma Chemical Co.), 미주리주 세인트 루이스)을 첨가하여 파지를 침전시키고, 얼음 상에서 30분 동안 인큐베이션하였다. 샘플을 12 krpm에서 15분 동안 2-8℃에서 원심분리하였다. 상청액을 조심스럽게 버리고, 튜브를 잠시 회전시켜 모든 미량의 상청액을 제거하였다. 펠릿을 400 ㎕의 고염도 완충제 (300 mM NaCl, 100 mM 트리스 pH 8.0, 1 mM EDTA)에 재현탁하고, 1.5 ml 튜브로 옮겼다.
파지 원액을 어떠한 백색 인터페이스의 흔적도 보이지 않을 때까지 동일 부피의 평형화된 페놀:클로로포름:이소아밀 알콜 (50:49:1)로 반복적으로 추출한 후에, 동일 부피의 클로로포름:이소아밀 알콜 (49:1)로 추출하였다. DNA를 2.5 부피의 에탄올 및 1/5 부피 7.5 M 아세트산암모늄으로 침전시키고, 30분 동안 -20℃에서 인큐베이션하였다. DNA를 14 krpm에서 10분 동안 4℃에서 원심분리하고, 펠릿을 차가운 70% 에탄올로 1회 세척한 후 진공에서 건조시켰다. 우라실 주형 DNA를 30 ㎕ 멸균수에 용해시키고, 농도를 40 μg/ml의 농도에 대해 1.0의 흡광도를 적용하여 A260에 의해 결정하였다. 주형을 멸균수로 250 ng/㎕로 희석하고, 분취하여 -20℃에 보관하였다.
항체 파지 라이브러리의 구축을 위한 ss-DNA로의 우라실 주형의 돌연변이 유발 및 E. coli로의 전기천공
단일-가닥 중쇄 및 경쇄 유전자를 파지 디스플레이 벡터 우라실 주형에 동시에 도입시켜 항체 파지 디스플레이 라이브러리를 구축하였다. 전형적인 돌연변이 유발은, 2 μg 규모로 하기를 0.2 ml PCR 반응 튜브에서 혼합함으로써 수행하였다: 8 ㎕ (250 ng/㎕)의 우라실 주형, 8 ㎕의 10x 어닐링 완충제 (200 mM 트리스 pH 7.0, 20 mM MgCl2, 500 mM NaCl), 3.33 ㎕의 키나제 처리된 단일-가닥 중쇄 삽입물 (100 ng/㎕), 3.1 ㎕의 키나제 처리된 단일-가닥 경쇄 삽입물 (100 ng/㎕), 및 멸균수 (80 ㎕의 잔량). DNA를 진앰프(R) 9600 열 순환기에서 하기 열 프로파일로 어닐링시켰다: 94℃에서 20초, 60초 동안 85℃, 30분에 걸친 85℃ -> 55℃ 구배, 55℃에서 15분 동안 유지. 프로그램 종료 후, DNA를 얼음으로 옮겼다. 연장/라이게이션을 8 ㎕의 10x 합성 완충제 (5 mM 각각의 dNTP, 10 mM ATP, 100 mM 트리스 pH 7.4, 50 mM MgCl2, 20 mM DTT), 8 ㎕ T4 DNA 리가제 (1 U/㎕, 베링거 만하임, 인디애나주 인디애나폴리스), 8 ㎕ 희석된 T7 DNA 중합효소 (1 U/㎕, 뉴 잉글랜드 바이오랩스(New England BioLabs), 매사추세츠주 비벌리)를 첨가함으로써 수행하고, 37℃에서 30분 동안 인큐베이션하였다. 300 ㎕의 돌연변이 유발 정지 완충제 (10 mM 트리스 pH 8.0, 10 mM EDTA)를 첨가하여 반응을 중지시켰다. 돌연변이 유발 DNA를 평형화된 페놀 (pH>8):클로로포름:이소아밀 알콜 (50:49:1)로 1회, 클로로포름:이소아밀 알콜 (49:1)로 1회 추출하고, DNA를 -20℃에서 30분 이상 동안 에탄올 침전시켰다. DNA를 펠릿화하고, 상청액을 상기 기재된 바와 같이 조심스럽게 제거하였다. 샘플을 다시 잠시 회전시키고, 모든 미량의 에탄올을 피펫맨으로 제거하였다. 펠릿을 진공에서 건조시켰다. DNA를 4 ㎕의 멸균수에 재현탁하였다.
1 ㎕의 돌연변이 유발 DNA (500 ng)를 전기천공을 이용하여 40 ㎕ 전기적격 (electrocompetent) E. coli DH12S (깁코/BRL, 메릴랜드주 게이더스버그)로 전달하였다. 형질전환된 세포를 대략 1.0 ml의 밤샘 배양한 XL-1 세포 (2x YT 브로스를 사용하여 60% 본래 부피로 희석됨)와 혼합하였다. 이어서, 이 혼합물을 15-ml 멸균 배양 튜브로 옮기고, 9 ml의 탑 아가를 플레이팅을 위해 150-mm LB 아가 플레이트 위에 첨가하였다. 플레이트를 4시간 동안 37℃에서 인큐베이션한 후에, 20℃로 옮겨 밤새 두었다. 이들 플레이트에서 10 ml의 2x YT 내 파지를 용리하고, 용해물을 회전시키고, 상청액을 취함으로써 제1 라운드 항체 파지를 제조하였다. 이들 샘플이 BST1에 대한 항체를 선택하는데 사용된 항체 파지 디스플레이 라이브러리이다. LB 아가 플레이트에 현탁 세포의 10-4 희석액 10 ㎕를 접종한 후 플레이트를 밤새 37℃에서 인큐베이션함으로써 전기천공의 효율을 측정하였다. 효율은 10-4 희석액 플레이트 상의 플라크의 수에 106을 곱하여 계산하였다. 라이브러리 전기천공 효율은 전형적으로 이러한 조건에서 파지 개수 > 1x107이다.
전기천공에 의한 E. coli
의
형질전환
전기적격 E. coli 세포를 얼음 상에서 해동시켰다. 기포가 들어가지 않도록 주의하여 세포를 2-3회 상하로 서서히 피펫팅함으로써 DNA를 이들 세포 40 L와 혼합하였다. 세포를 다시 전달시 기포가 들어가지 않도록 주의하여 얼음 상에서 냉각시킨 진 펄서(Gene Pulser) 큐벳 (0.2 cm 갭, 바이오라드, 캘리포니아주 허큘레스)으로 옮겼다. 큐벳을 E. coli 펄서 (바이오라드, 캘리포니아 허큘레스)에 넣고, 제조업체의 권고에 따라 1.88 kV에서의 전압 설정에서 전기천공을 수행하였다. 형질전환된 샘플을 즉시 2x YT 브로스 1 ml 또는 400 ㎕ 2x YT/600 ㎕ 밤샘 XL-1 세포 혼합물 1 ml에 재현탁하고, 지시된 절차에 따라 처리하였다.
항체 파지-디스플레이 벡터 돌연변이 유발 반응으로 형질전환된 M13 파지 또는 세포의
플레이팅
파지 샘플을 100 mm LB 아가 플레이트 상에 플레이팅하는 경우에 200 ㎕의 E. coli XL1-블루의 밤샘 배양물에 또는 멸균 15 ml 배양 튜브 중에서 150 mm 플레이트 상에 플레이팅하는 경우에 600 ㎕의 하룻밤 배양 세포에 첨가하였다. LB 탑 아가 (100 mm 플레이트의 경우에 3 ml 또는 150 mm 플레이트의 경우에 9 ml, 55℃에 보관된 탑 아가 (상기 Sambrook et al., 문헌 부록 A1 참조)을 첨가한 후에, 혼합물을 미리 데운 (37℃-55℃) LB 아가 플레이트 상에 균등하게 배분하여 아가 표면 상의 임의의 잉여 수분을 제거하였다. 플레이트를 탑 아가가 굳을 될 때까지 실온에서 냉각시켰다. 플레이트를 뒤집어, 지정된 바와 같이 37℃에서 인큐베이션하였다.
비오티닐화
ADP-
리보실
사이클라제 2 및
비오티닐화
항체의 제조
농축된 재조합 BST1 항원 (전장 세포외 도메인)을 충분히 BBS (20 mM 보레이트, 150 mM NaCl, 0.1% NaN3, pH 8.0)로 투석하였다. 투석 후, 1 mg의 BST1 (BBS 중 1 mg/ml)을 15배 몰 과량의 비오틴-XX-NHS 에스테르 (몰레큘라 프로브스(Molecular Probes), 오레곤주 유진, 원액 용액, DMSO 중 40 mM)와 반응시켰다. 반응물을 실온에서 90분 동안 인큐베이션한 후에, 20 mM의 최종 농도에서 타우린 (시그마 케미칼 캄파니, 미주리주 세인트 루이스)으로 퀀칭하였다. 이어서, 비오티닐화 반응 혼합물을 BBS에서 2-8℃에서 투석하였다. 투석 후, 비오티닐화 BST1을 패닝 완충제 (40 mM 트리스, 150 mM NaCl, 20 mg/ml BSA, 0.1% 트윈 20, pH 7.5)으로 희석하고, 분취하여 필요시까지 -80℃에 두었다.
항체를 중쇄의 카르복시 말단에 위치한 유리 시스테인을 사용하여 3-(N-말레이미딜프로피오닐)비오시틴 (몰레큘라 프로브스, 오레곤주 유진)과 반응시켰다. DTT를 1 mM의 최종 농도로 30분 동안 실온에서 첨가함으로써 항체를 환원시켰다. 환원된 항체를 50 mM 인산칼륨, 10 mM 붕산, 150 mM NaCl, pH 7.0으로 평형화된 세파덱스(Sephadex) G50 탈염 컬럼에 주입하여 통과시켰다. 3-(N-말레이미딜프로피오닐)-비오시틴을 최종 농도 1 mM로 첨가하고, 반응을 실온에서 60분 동안 진행시켰다. 이어서, 샘플을 BBS에 대해 충분히 투석하고, 2-8℃에 저장하였다.
아비딘
자기성
라텍스의 제조
자기성 라텍스 (에스타포르(Estapor), 10% 고체, 방스 래보러토리즈(Bangs Laboratories), 인디애나주 피셔스)를 완전히 재현탁하고, 2 ml를 15 ml 원추형 튜브로 분취하였다. 자기성 라텍스를 12 ml 증류수에 현탁하고, 자석 (퍼셉티브 바이오시스템즈(PerSeptive Biosystems), 매사추세츠주 프라밍햄)을 사용해 10분 동안 용액으로부터 분리하였다. 자석으로의 자기성 라텍스의 분리를 유지하면서, 10 ml 멸균 피펫을 사용하여 액체를 조심스럽게 제거하였다. 이 세척 과정을 추가로 3회 반복하였다. 최종 세척 후에, 라텍스를 증류수 2 ml에 재현탁하였다. 각각의 50 ml 원추형 튜브에서, 10 mg의 아비딘-HS (뉴트라비딘(NeutrAvidin), 피어스, 일리노이주 록포드)를 18 ml의 40 mM 트리스, 0.15 M 염화나트륨, pH 7.5 (TBS)에 용해하였다. 볼텍싱하면서, 2 ml의 세척된 자기성 라텍스를 희석된 아비딘-HS에 첨가하고, 혼합물을 추가로 30초 동안 혼합하였다. 이 혼합물을 30분마다 진탕하면서 45℃에서 2시간 동안 인큐베이션하였다. 아비딘 자기성 라텍스를 자석을 사용하여 용액으로부터 분리하고, 상기 기재된 바와 같이 20 ml BBS로 3회 세척하였다. 최종 세척 후에, 라텍스를 10 ml BBS에 재현탁하고, 4℃에 보관하였다.
사용 직전에, 아비딘 자기성 라텍스를 패닝 완충제 (40 mM 트리스, 150 mM NaCl, 20 mg/ml BSA, 0.1% 트윈 20, pH 7.5)로 평형화하였다. 패닝 실험에 필요한 아비딘 자기성 라텍스 (200 ㎕/샘플)를 멸균 15 ml 원심분리 튜브에 넣고, 패닝 완충제를 첨가하여 10 ml로 만들었다. 튜브를 10분 동안 자석 위에 두어 라텍스를 분리하였다. 용액을 상기 기재된 바와 같이 10 ml 멸균 피펫으로 조심스럽게 제거하였다. 자기성 라텍스를 10 ml의 패닝 완충제에 재현탁하여 제2 세척을 시작하였다. 자기성 라텍스를 패닝 완충제로 총 3회 세척하였다. 최종 세척 후에, 라텍스를 패닝 완충제에 출발 부피로 재현탁하였다.
실시예
2:
BST1
항원에 대한 재조합
폴리클로날
항체 선별
BST1에 특이적으로 결합하는 결합 물질을 실시예 1에 기재된 바와 같이 과면역화된 마우스로부터 구축된 파지 디스플레이 라이브러리로부터 선별하였다.
패닝
제1 라운드 항체 파지는 BS45 우라실 주형을 사용하여 실시예 1에 기재된 바와 같이 제조하였다. 돌연변이 유발 DNA의 전기천공을 수행하여 여러가지 면역화된 마우스로부터 유래된 파지 샘플을 수득하였다. 재조합 폴리클로날 라이브러리에서 더 많은 다양성을 발생시키기 위해, 각각의 파지 샘플을 별도로 패닝하였다.
비오티닐화 BST1 항원으로의 제1 라운드 기능적 패닝 수행 전, 항체 파지 라이브러리를 표면 상에 중쇄 및 경쇄 둘 다를 디스플레이하는 파지에 대해 7F11-자기성 라텍스 (US 6,555,310의 실시예 21 및 22에 기재된 바와 같음)로 패닝하여 선별하였다. 이들 농화된 라이브러리의 기능성 패닝은 원칙적으로 US 6,555,310의 실시예 16에 기재된 바와 같이 수행하였다. 구체적으로, 10 ㎕의 1x10-6 M 비오티닐화 BST1 항원을 파지 샘플 (대략 1x10-8 M BST1 최종 농도)에 첨가하고, 혼합물을 밤새 2-8℃에서 평형화하였다.
평형에 도달한 후에, 샘플을 아비딘 자기성 라텍스로 패닝하여 BST1에 결합된 항체 파지를 포획하였다. 평형화된 아비딘 자기성 라텍스 (실시예 1) (샘플당 200 ㎕ 라텍스)를 파지와 10분 동안 실온에서 인큐베이션하였다. 10분 후, 대략 9 ml의 패닝 완충제를 각각의 파지 샘플에 첨가하고, 자기성 라텍스를 자석을 사용하여 용액으로부터 분리하였다. 10분 분리 후에, 결합되지 않은 파지를 10 ml 멸균 피펫을 사용하여 조심스럽게 제거하였다. 이어서, 자기성 라텍스를 10 ml의 패닝 완충제에 재현탁하여 2차 세척을 시작하였다. 라텍스를 상기 기재된 바와 같이 총 3회 세척하였다. 각각의 세척을 위해, 튜브를 10분 동안 자석과 접촉시켜 자기성 라텍스로부터 결합되지 않은 파지를 제거하였다. 3차 세척 후, 자기성 라텍스를 1 ml의 패닝 완충제에 재현탁하고, 1.5 mL 튜브로 옮겼다. 이어서, 각각의 샘플에 대해 자기성 라텍스의 전체 부피를 수집하고, 200 ㎕ 2x YT에 재현탁하고, 실시예 1에 기재된 바와 같이 150 mm LB 플레이트 상에 플레이팅하여 결합된 파지를 증폭시켰다. 플레이트를 37℃에서 4시간 동안 인큐베이션한 후, 밤새 20℃에서 인큐베이션하였다.
결합된 파지를 증폭시키는데 사용한 150 mm 플레이트를 사용하여 다음 라운드의 항체 파지를 생산하였다. 밤새 인큐베이션한 후, 150 mm 플레이트로부터 10 mL의 2x YT 배지를 론(lawn)으로 피펫팅하고 플레이트를 실온에서 20분 동안 부드럽게 진탕함으로써 제2 라운드 항체 파지를 용리시켰다. 이어서, 파지 샘플을 플러그 밀봉 캡이 있는 15 ml 일회용 멸균 원심분리 튜브로 옮기고, 튜브를 15분 동안 3500 rpm에서 원심분리함으로써 LB 플레이트로부터의 용해물을 펠릿화하였다. 이어서, 제2 라운드 항체 파지를 함유하는 상청액을 새로운 튜브로 옮겼다.
기능적 패닝의 제2 라운드는 100 ㎕씩 각각의 파지 원액을 15 ml 일회용 멸균 원심분리 튜브에서 900 ㎕의 패닝 완충제로 희석하는 것으로 설정하였다. 이어서, 비오티닐화 BST1 항원을 패닝의 제1 라운드에서 기재된 바와 같이 각각의 샘플에 첨가하고, 파지 샘플을 1시간 동안 실온에서 인큐베이션하였다. 이어서, 파지 샘플을 상기 기재된 바와 같이 아비딘 자기성 라텍스로 패닝하였다. 패닝의 진행을 이 지점에서 각각의 라텍스 샘플의 분취액을 100 mm LB 아가 플레이트 상에 플레이팅하여 카파 양성의 백분율을 결정함으로써 모니터링하였다. 각각의 패닝으로부터의 대다수의 라텍스 (99%)를 150 mm LB 아가 플레이트 상에 플레이팅하여 라텍스에 결합된 파지를 증폭시켰다. 100 mm LB 아가 플레이트를 37℃에서 6-7시간 동안 인큐베이션한 후에, 플레이트를 실온으로 옮기고, 니트로셀룰로스 필터 (기공 크기 0.45 mm, BA85 프로트란(Protran), 슐라이허 앤드 슈엘(Schleicher and Schuell), 뉴햄프셔주 킨)를 플라그 위에 배치하였다.
니트로셀룰로스 필터가 배치된 플레이트를 밤새 실온에서 인큐베이션한 후, 염소 항-마우스 카파 알칼리성 포스파타제 접합체로 발색시켜 하기 기재된 바와 같이 카파 양성의 백분율을 결정하였다. 집단에서 카파 양성의 백분율이 보다 낮은 (<70%) 파지 샘플에 대해 7F11-자기성 라텍스로의 패닝의 라운드를 수행한 후에 대략 2x10-9 M에서 비오티닐화 BST1 항원을 사용하여 밤새 2-8℃에서 패닝의 제3 기능적 라운드를 수행하였다. 이 패닝의 라운드에서 또한 카파 양성을 모니터링하였다. 카파 양성 백분율이 80%를 초과하는 개별 파지 샘플을 모으고, 이에 대해 5x10-9 M에서 밤새 2-8℃에서 패닝의 최종 라운드를 수행하였다. 이 기능적 패닝의 제4 라운드로부터 용리된 파지 내에 함유된 BST1 항체 유전자를 발현 벡터, pBRncoH3에 서브클로닝하였다.
서브클로닝 과정은 일반적으로 US 6,555,310의 실시예 18에 기재된 바와 같이 수행하였다. 서브클로닝 후, 발현 벡터를 DH10B 세포에 전기천공으로 도입하고, 혼합물을 밤새 1% 글리세롤 및 10 μg/ml 테트라시클린을 함유하는 2x YT에서 배양하였다. 제2차 테트라시클린에서의 증식 및 선별 후, 세포의 분취액을 BST1 폴리클로날 항체 생산을 위한 공급원으로서 -80℃에서 냉동시켰다. 이들 폴리클로날 혼합물로부터 혼합물 샘플을 10 μg/ml 테트라시클린을 함유하는 LB 아가 플레이트 상에 플레이팅하고, BST1을 인식하는 항체에 대해 스크리닝함으로써 단일클론 항체를 선별하였다.
ADP-
리보실
사이클라
제
2에 대한 재조합 항체의 발현 및 정제
-70℃ 세포 은행으로부터 입수하여, 37℃, 300rpm로 설정된 이노바(Innova) 4330 인큐베이터 진탕기 (뉴 브런즈윅 사이언티픽(New Brunswick Scientific), 뉴저지주 에디슨)에서 밤새 증식시켜 진탕 플라스크 접종물을 제조하였다. 접종물을, 3 g/L L-류신, 3 g/L L-이소류신, 12 g/L 카세인 다이제스트(디프코(Difco), 미국 미시간주 디트로이트), 12.5 g/L 글리세롤 및 10 μg/ml 테트라시클린이 보충된 지정된 배양 배지 (문헌 [Pack et al. (1993) Bio/Technology 11: 1271-1277])를 함유하는 20 L 발효조 (애플리콘(Applikon), 미국 캘리포니아주 포스터 시티)에 접종하였다. 발효조 내 온도, pH 및 용존 산소는 각각 26℃, 6.0-6.8 및 25% 포화도로 조절하였다. 폴리프로필렌 글리콜 (다우(Dow), 미시간주 미들랜드)을 첨가하여 발포를 제어하였다. 글리세롤을 공급-배치 방식으로 발효조에 첨가하였다. L(+)-아라비노스 (시그마, 미주리주 세인트 루이스)를 후기 지수 성장기 동안 2 g/L로 첨가하여 Fab 발현을 유도하였다. UV-1201 분광광도계 (시마즈(Shimadzu), 메릴랜드주 컬럼비아)에서 600 nm 광학 밀도에 의해 세포 밀도를 측정하였다. 진행 종료 및 6.0로의 pH의 조정 후, 배양물을 17,000 psi에서 M-210B-EH 마이크로플루이다이저 (마이크로플루이딕스(Microfluidics), 매사추세츠주 뉴턴)를 통해 2회 통과시켰다. 세포의 고압 균질화로 Fab를 배양 상청액으로 방출시켰다.
정제의 제1 단계는 확장층 고정된 금속 친화성 크로마토그래피 (EB-IMAC)이다. 스트림라인(Streamline)™ 킬레이팅 수지 (파마시아(Pharmacia), 뉴저지주 피스카타웨이)를 0.1 M NiCl2와 함께 충전한 후, 상향 방향으로 흐르는 50 mM 아세테이트, 200 mM NaCl, 10 mM 이미다졸, 0.01% NaN3, pH 6.0 완충제 내에서 확대 및 평형화하였다. 원액 용액을 사용해 배양 균질물을 10 mM 이미다졸로 만들고, 이후에 평형 완충제로 2배 이상 희석하여 습윤 고체 함량 (wet solids content)을 5 중량% 미만으로 낮추었다. 이어, 이를 300 cm/시의 공탑 속도에서 상향 방향의 유선형 컬럼 흐름 상에 로딩하였다. 세포 용해물은 방해받지 않고 통과하였으나, Fab는 Fab 중쇄 상에서 니켈과 헥사히스티딘 태그 사이의 고 친화성 상호작용에 의해 포획되었다. 세척 후에, 확장층을 충전층으로 전환시키고, Fab를 하향 방향의 20 mM 보레이트, 150 mM NaCl, 200 mM 이미다졸, 0.01% NaN3, pH 8.0 완충제 흐름으로 용리시켰다.
정제의 제2 단계는 이온-교환 크로마토그래피 (IEC)를 이용하였다. Q 세파로스 패스트플로우(Sepharose FastFlow) 수지 (파마시아, 뉴저지주 피스카타웨이)를 20 mM 보레이트, 37.5 mM NaCl, 0.01% NaN3, pH 8.0에서 평형화하였다. EB-IMAC 단계로부터의 Fab 용리액 풀을 20 mM 보레이트, 0.01% NaN3, pH 8.0으로 4배 희석하고, IEC 컬럼에 로딩하였다. 세척 후, Fab를 37.5-200 mM NaCl 염 구배로 용리하였다. 용리액 분획을 풀링 전에 엑스셀 II(Xcell II)™ SDS-PAGE 시스템 (노벡스(Novex), 캘리포니아주 샌디에고)을 이용해 순도를 분석하였다. 최종적으로, Fab 풀을 농축시키고, 저장을 위해 20 mM 보레이트, 150 mM NaCl, 0.01% NaN3, pH 8.0 완충제로 정용여과하였다. 이는 10,000 MWCO 카세트가 장착된 사르토콘 슬라이스(Sartocon Slice)™ 시스템 (사르토리우스(Sartorius), 뉴욕주 보헤미아)에서 달성하였다. 최종 정제 수율은 전형적으로 50%였다. 정제된 Fab의 농도는 280 nm에서 UV 흡광도에 의해 측정하였으며, 1 mg/ml 용액에 대해 1.6의 흡광도를 가정하였다.
실시예
3:
유세포
측정 분석에 의해 결정된
BST1에
대한 단일클론 항체의 특이성
실시예 2에서 선별된 BST1 항체의 특이성을 유세포 측정으로 시험하였다. 세포 표면 BST1 단백질에 결합하는 항체의 능력을 시험하기 위해, 항체는 각각 인간 폐 선암종 및 인간 폐 편평세포 암종 유래 BST1-발현 세포인, A549 및 H226과 인큐베이션하였다. 세포를 FACS 완충제 (DPBS, 2% FBS)로 세척하고, 원심분리한 다음, 100 ㎕의 희석된 1차 BST1 항체 (또한 FACS 완충제에서 희석됨)에 재현탁하였다. 항체-A549 복합체를 얼음 상에서 60분 동안 인큐베이션한 후에 상기와 같이 FACS 완충제로 2회 세척하였다. 세포-항체 펠릿을 100 ㎕의 희석된 2차 항체 (또한 FACS 완충제에서 희석됨)에 재현탁하고, 얼음 상에서 60분 동안 인큐베이션하였다. 펠릿을 이전과 같이 세척하고, 200 ㎕ FACS 완충제에 재현탁하였다. 샘플을 BD FACScanto II 유세포 측정기에 로딩하고, 데이터를 BD FACSdiva 소프트웨어를 이용하여 분석하였다.
결과
유세포 측정 분석의 결과는 BST1_A1, BST1_A2 및 BST_A3로 지칭되는 4개의 단일클론 항체가 세포-표면 인간 BST1에 효과적으로 결합한다는 것을 입증해주었다. 도 3a는 각각 A549 및 H226 세포 상에서 BST1에 대한 BST1_A1 및 BST1_A2 둘 다의 결합 특이성을 보여준다. 도 3b는 A549 및 H226 세포 상에서 BST1에 대한 BST1_A3의 결합 특이성을 보여준다. 결과는 A549 및 H226 상에서 BST1에 대한 이러한 항체의 강한 결합성을 보여준다.
실시예
4:
BST1에
대한 단일클론 항체의 구조적 특징 규명
BST1_A2 및 BST1_A1 단일클론 항체의 중쇄 및 경쇄 가변 영역을 코딩하는 cDNA 서열을 표준 PCR 기술을 이용하여 수득하고, 표준 DNA 서열분석 기술을 이용하여 서열분석하였다.
항체 서열에 돌연변이를 유발하여 하나 이상의 잔기에서 생식세포계열 잔기로 되돌릴 수 있다.
BST1_A2의 중쇄 가변 영역의 뉴클레오티드 및 아미노산 서열은 각각 서열번호 6 및 2이다.
BST1_A2의 경쇄 가변 영역의 뉴클레오티드 및 아미노산 서열은 각각 서열번호 8 및 4이다.
BST_A2의 중쇄의 뉴클레오티드 및 아미노산 서열은 각각 서열번호 73 및 74이다. BST_A2의 경쇄의 뉴클레오티드 및 아미노산 서열은 각각 서열번호 75 및 76이다.
공지된 뮤라인 생식세포계열 면역글로불린 중쇄 서열에 대한 BST1_A2 중쇄 면역글로불린 서열의 비교는 BST1_A2 중쇄가 뮤라인 생식세포계열 VH 1-39로부터의 VH 절편을 사용함을 입증하였다. CDR 영역 결정의 카바트 시스템을 이용한 BST1_A2 VH 서열에 대한 추가의 분석에서 각각 서열번호 10, 12 및 14에 나타낸 바와 같이, 중쇄 CDR1, CDR2 및 CDR3 영역이 확인된다. 생식세포계열 VH 1-39 서열에 대한 BST1_A2 CDR1 및 CDR2 VH 서열의 정렬은 도 1a 및 1b에 나타낸다.
공지된 뮤라인 생식세포계열 면역글로불린 경쇄 서열에 대한 BST1_A2 경쇄 면역글로불린 서열의 비교는 BST1_A2 경쇄가 뮤라인 생식세포계열 VK 4-55로부터의 VK 절편을 사용한다는 것을 입증해준다. CDR 영역 결정의 카바트 시스템을 이용하는 BST1_A2 VK 서열에 대한 추가의 분석에서 각각 서열번호 16, 18 및 20에 나타낸 바와 같은 경쇄 CDR1, CDR2 및 CDR3 영역이 확인된다. 생식세포계열 VK 4-55 서열에 대한 BST1_A2 CDR1, CDR2 및 CDR3 VK 서열의 정렬은 도 2a, 2b 및 2c에 나타낸다.
BST1_A1의 중쇄 가변 영역의 뉴클레오티드 및 아미노산 서열은 각각 서열번호 5 및 1이다.
BST1_A1의 경쇄 가변 영역의 뉴클레오티드 및 아미노산 서열은 각각 서열번호 7 및 3이다.
공지된 뮤라인 생식세포계열 면역글로불린 중쇄 서열에 대한 BST1_A1 중쇄 면역글로불린 서열의 비교는 BST1_A1 중쇄가 뮤라인 생식세포계열 VH 1-80으로부터의 VH 절편을 사용함을 입증해준다. CDR 영역 결정의 서열 카바트 시스템을 이용하는 BST1_A1 VH 서열의 추가의 분석에서 각각 서열번호 9, 11 및 13에 나타낸 바와 같은 중쇄 CDR1, CDR2 및 CDR3 영역이 확인된다. 생식세포계열 VH 1-80 서열에 대한 BST1_A1 CDR1 및 CDR2 VH 서열의 정렬은 도 1a 및 1b에 나타낸다.
공지된 뮤라인 생식세포계열 면역글로불린 경쇄 서열에 대한 BST1_A1 경쇄 면역글로불린 서열의 비교는 BST1_A1 경쇄가 뮤라인 생식세포계열 VK 4-74로부터의 VK 절편을 사용한다는 것을 입증해준다. CDR 영역 결정의 카바트 시스템을 이용하는 BST1_A1 VK 서열의 추가의 분석에서 각각 서열번호 15, 17 및 19에 나타낸 바와 같은 경쇄 CDR1, CDR2 및 CDR3 영역이 확인된다. 생식세포계열 VK 4-74 서열에 대한 BST1_A1 CDR1, CDR2 및 CDR3 VK 서열의 정렬은 도 2a, 2b 및 2c에 나타낸다.
BST1_A3의 중쇄 가변 영역의 뉴클레오티드 및 아미노산 서열은 각각 서열번호 54 및 52이다.
BST1_A3의 경쇄 가변 영역의 뉴클레오티드 및 아미노산 서열은 각각 서열번호 55 및 53이다.
공지된 뮤라인 생식세포계열 면역글로불린 중쇄 서열에 대한 BST1_A3 중쇄 면역글로불린 서열의 비교는 BST1_A3 중쇄가 뮤라인 VH 생식세포계열 69-1로부터의 VH 절편을 사용한다는 것을 입증해준다. CDR 영역 결정의 카바트 시스템을 이용하는 BST1_A3 VH 서열의 추가의 분석에서 각각 서열번호 56, 57 및 58에 나타낸 바와 같은 중쇄 CDR1, CDR2 및 CDR3 영역이 확인된다. 뮤라인 VH 생식세포계열 69-1 서열에 대한 BST1_A3 CDR1 및 CDR2 VH 서열의 정렬은 도 1a 및 1b에 나타낸다.
공지된 뮤라인 생식세포계열 면역글로불린 경쇄 서열에 대한 BST1_A3 경쇄 면역글로불린 서열의 비교는 BST1_A3 경쇄가 뮤라인 VK 생식세포계열 44-1로부터의 VK 절편을 사용한다는 것을 입증해준다. CDR 영역 결정의 카바트 시스템을 이용하는 BST1_A3 VK 서열의 추가의 분석에서 각각 서열번호 59, 60 및 61로 나타낸 경쇄 CDR1, CDR2 및 CDR3 영역이 도시된다. 뮤라인 VK 생식세포계열 44-1 서열에 대한 BST1_A3 CDR1, CDR2 및 CDR3 VK 서열의정렬은 도 2a, 2b 및 2c에 나타낸다.
실시예
5: A549 및 H226 세포에서
BST1
_A1 및
BST1
_A2의 내재화 및
MabZAP
.
H226 및 A549에 의한 BST1_A1 및 BST1_A2의 내재화는 MabZap 분석을 이용하여 실험하였다. MabZAP 분석은 독소 사포린에 접합된 항-인간 IgG 2차 항체의 결합을 통한 항-BST1 단일클론 항체의 내재화를 보여주었다. (어드밴스드 타겟팅 시스템(Advanced Targeting System), 캘리포니아주 샌디에고, IT-22-100). 우선, BST1 Fab를 세포의 표면에 결합시켰다. 이어서, MabZAP 항체를 1차 항체에 결합시켰다. 다음으로, MabZAP 복합체를 세포에 의해 내재화시켰다. 세포에 사포린이 도입되어 단백질 합성이 억제되었으며, 궁극적으로는 세포가 사멸하였다.
MabZAP 분석은 다음과 같이 수행하였다. 각각의 세포를 웰 당 5x103개의 세포 밀도로 접종하였다. 항-BST1 단일클론 항체 또는 이소형 대조군 인간 IgG를 연속 희석한 후 세포에 첨가하고, 15분 동안 25℃에서 인큐베이션하였다. 이어서, MabZAP를 첨가하고, 72시간 동안 37℃에서 인큐베이션하였다. 플레이트에서의 세포 생존율을 셀타이터-글로(CellTiter-Glo)® 발광 세포 생존율 검정 키트 (프로메가(Promega), G7571)에 의해 검출하고, 플레이트를 판독하고, 프로메가 글로맥스(Glomax)를 이용하여 분석하였다. 세포 사멸은 항-BST1 단일클론 항체의 농도에 비례하였다. 도 4a 및 4b는 항-BST1 단일클론 항체, BST1_A1 및 BST1_A2가 항-인간 IgG 이소형 대조군 항체와 비교하여 H226 및 A549 세포에 의해 효율적으로 내재화되었다는 것을 보여준다.
실시예
6:
BST1
_A2의 인간화
BST1_A2 VH 및 VL의 인간화 서열을 설계하기 위해, CDR 구조 형성에 중요한 프레임워크 아미노산을 3차원 모델을 이용하여 확인하였다. BST1_A2와 높은 상동성을 갖는 인간 VH 및 VL 서열을 또한 유전자은행 데이터베이스로부터 선정하였다. CDR 서열을 확인된 프레임워크 아미노산 잔기와 함께 BST1_A2로부터 인간 프레임워크 서열로 그래프팅하였다 (도 5-7).
실시예
7: 항-
BST1
mAb에
의해
매개되는
항체-의존성 세포성 세포독성
우선 10nm/L 내지 0.1nm/L 농도 범위의 25㎕의 모 항체 및 비-푸코실화 항-BST1 항체 (BST1_A2 및 BST1_A2_NF)를 v자형 바닥 96 웰 플레이트의 각 웰에 50 ㎕의 BST1-발현 A549 및 U937 세포와 함께 첨가하였다. 이어서, 25 ㎕의 작동자 세포를 10:1 및 25:1의 최종 작동자: 표적 (E: T) 비가 되도록 웰에 첨가하였다. 이어서, 플레이트를 1000 rpm에서 2분 동안 부드럽게 회전시키고, 그 후에 이를 4시간 동안 37℃, 5% CO2 인큐베이터에서 인큐베이션하였다. 인큐베이션 3시간 후, 최대 LDH 방출을 측정하기 위해 BST1-발현 세포를 단독으로 함유하는 각각의 웰에 10 ㎕의 세포용해 용액을 첨가하고, 부피 보정 제어를 위해 배지를 단독으로 함유하는 1개 세트의 웰에도 첨가하였다.
인큐베이션 후, 세포를 1000 rpm에서 2분 동안 부드럽게 회전시키고, 그 후에 50 ㎕의 상청액을 편평 바닥 96 웰 플레이트로 옮겼다. 프로메가 (카탈로그 #: G1780)로부터 구입한 시토톡스 96(CytoTox 96)® 비-방사성 세포독성 분석을 이용하여, 키트 성분을 제조업체의 지시에 따라 재구성하고, 이어서 50 ㎕의 기질 혼합물을 각각의 웰에 첨가하였다. 이어서, 플레이트를 덮고, 광을 차단하여 25℃에서 30분 동안 인큐베이션하였다. 이에 따라, 50 ㎕의 정지 용액을 각각의 웰에 첨가하고, 흡광도를 배리오스칸(varioskan) 플레이트 판독기를 이용하여 490nm에서 판독하였다.
양성 대조군으로서의 ADCC 및 음성 대조군으로서의 인간 IgG1 이소형 대조군을 통해 세포-사멸을 자극하는 것으로 알려진 항체를 사용한 바, 결과는 BST1_A2 및 BST1_A2_NF가 BST1-발현 A549 및 U937 세포 상에서 ADCC를 도출할 수 있다는 것을 보여준다. BST1-발현 A549 세포 상에서, BST1_A2_NF는 10nmol/L에서 대략 45% 사멸을 나타내었다 (도 8a). BST1-발현 U937 세포 상에서, BST1_A2는 1nmol/L에서 대략 20% 사멸을 나타내었고, BST1_A2_NF는 1nmol/L에서 대략 45% 사멸을 나타내었다 (도 8b).
실시예
8:
AML
환자에서
유세포
측정 분석에 의해 결정된
BST1에
대한 단일클론 항체의 특이성
AML을 앓고 있는 환자로부터의 림프모구에 결합하는 BST_A2의 능력을 유세포 측정 분석에 의해 실험하였다. 혈액을 20명의 AML 환자에서 채취하였다. 실시예 3에 기재된 바와 같은 절차를 이용하여, BST_A2는 AML 환자의 대략 80%의 AML 아세포에 결합하는 것으로 밝혀졌다.
실시예
9: 5
-
아자시티딘
(
AZA
)을 이용한
BST1
_A2 항체에 의해 유도된
ADCC
K052 세포 (AML 세포주 Fab M2) 및 PBMC를 0.5 또는 0.1 μM 5-아자시티딘 (AZA)으로 각각 48시간 및 24시간 전처리한 다음 BST1_A2 항체 (10 - 0.01 ㎍/ml) 10배 희석물과 함께 4시간 동안 인큐베이션하였다. 세포용해를 검출하기 위해 LDH 방출을 측정하였다 (Promega kit). 그 결과는 도 9에 나타낸다. 그래프는 BST1_A2 항체 단독 또는 AZA와의 조합 존재시 ADCC %를 보여준다.
SKNO1 세포 (AML 세포주 Fab M2) 및 PBMC를 2 또는 0.5 μM 5-아자시티딘 (AZA)으로 각각 48시간 및 24시간 전처리한 다음 BST1_A2 항체 (10 - 0.01 ㎍/ml) 10배 희석물과 함께 4시간 동안 인큐베이션하였다. 세포용해를 검출하기 위해 LDH 방출을 측정하였다 (Promega kit). 그 결과는 도 10에 나타낸다. 그래프는 BST1_A2 항체 단독 또는 AZA와의 조합 존재시 ADCC %를 보여준다.
아래 표는 Chou 및 Talalay 방법 (Calcusyn software)으로 계산한 BST1_A2 항체 및 5-아자시티딘 간의 여러가지 조합 비율에 따른 조합 인덱스를 나타낸다.
(CI<1: 상승작용; CI = 1: 상가 효과; CI>1: 길항작용). 높은 수준의 상승작용이 확인된다.
| 약물 | 조합 인덱스 (CI) | |||
| SKNO-1 세포 | K052 세포 | |||
| BST1_A2 (㎍/ml) |
BST1_A2 +2 μM AZA |
BST1_A2 + 0.5 μM AZA |
BST1_A2 + 0.5 μM AZA |
BST1_A2 + 0.1 μM AZA |
| 10 | 0.975 | 0.062 | 0.197 | 0.130 |
| 1 | 0.334 | 0.035 | 0.003 | 0.036 |
| 0.1 | 0.196 | 0.080 | 0.064 | 0.036 |
| 0.01 | 0.182 | 0.438 | 0.740 | 0.643 |
실시예
10:
데시타빈
(DEC)을 이용한
BST1
_A2 항체에 의해 유도된
ADCC
SKNO1 세포 (AML 세포주 Fab M2) 및 PBMC를 0.5 또는 0.1 μM 데시타빈 (DEC)으로 각각 48시간 및 24시간 전처리한 다음 BST1_A2 항체 (10 - 0.01 ㎍/ml) 10배 희석물과 함께 4시간 동안 인큐베이션하였다. 세포용해를 검출하기 위해 LDH 방출을 측정하였다 (Promega kit). 그 결과는 도 11에 나타낸다. 그래프는 BST1_A2 항체 단독 또는 DEC와의 조합 존재시 ADCC %를 보여준다.
HL-60 세포 (AML 세포주 Fab M2/M3) 및 PBMC를 2 또는 0.5 μM 데시타빈 (DEC)으로 각각 48시간 및 24시간 처리한 다음 BST1_A2 항체 (10 - 0.01 ㎍/ml) 10배 희석물과 함께 4시간 동안 인큐베이션하였다. 세포용해를 검출하기 위해 LDH 방출을 측정하였다 (Promega kit). 그 결과는 도 12에 나타낸다. 그래프는 BST1_A2 항체 단독 또는 DEC와의 조합 존재시 ADCC %를 보여준다.
아래 표는 Chou 및 Talalay 방법 (Calcusyn software)으로 계산한 BST1_A2 항체 및 데시타빈의 여러가지 조합 비율에 따른 조합 인덱스를 나타낸다.
(CI<1: 상승작용; CI = 1: 상가 효과; CI>1: 길항작용). 높은 수준의 상승작용이 확인된다.
| 약물 | 조합 인덱스 (CI) | |||
| SKNO-1 세포 | HL60 세포 | |||
| BST1_A2 (㎍/ml) |
BST1_A2 +2 μM DEC |
BST1_A2 + 0.5 μM DEC |
BST1_A2 + 0.5 μM DEC |
BST1_A2 + 0.1 μM DEC |
| 10 | <0.001 | <0.001 | <0.001 | <0.001 |
| 1 | <0.001 | <0.001 | <0.001 | <0.001 |
| 0.1 | na | na | <0.001 | <0.001 |
| 0.01 | <0.001 | na | na | 0.1 |
서열
| 서열번호 | 설명 | 서열 |
| 1 | aa VH_A1 | MKQSTIALALLPLLFTPVAKAQVKLQQSGAELVRPGSSVKISCKASGYAFSNSWINWVKQRPGQGLEWIGQIYPGDYDTNYNGKFKGKATLTADYSSSTAYMQLNSLTSEDSAVYFCARGGSIYYGNLGFFDVWGAGTTVTVSSAKTTPPSVYPLAPGSAAQTNSMVTLGCLVKGYFPEPVTVTWNSGSLSSGVHTFPAVLQSDLYTLSSSVTVPSSTWPSETVTCNVAHPASSTKVDKKIVPRDCHHHHHHH |
| 2 | aa VH_A2 | MKQSTIALALLPLLFTPVAKAQAYLQQSGPELVKAGASVKMSCKASGYSFIEYTINWVKQSHGKSLEWIGNIDPYYGTTYYNQMFTGKATLTVDQSSNTAYMQLKSLTSEDSAVYFCARGSAWFPYWGQGTLVTVSAAKTTPPSVYPLAPGSAAQTNSMVTLGCLVKGYFPEPVTVTWNSGSLSSGVHTFPAVLQSDLYTLSSSVTVPSSTWPSETVTCNVAHPASSTKVDKKIVPRDCHHHHHHH |
| 3 | aa VK_A1 | MKYLLPTAAAGLLLLAAQPAMAEMVLTQSPAIMSTSLGERVTMTCTASSRVSSSYLHWYQQKPGSSPKLWIYSTSNLASGVPARFSGSGSGTSYSLTISSMEAEDAATYYCHQYHRSPYTFGGGTKLEIKRADAAPTVSIFPPSSEQLTSGGASVVCFLNNFYPKDINVKWKIDGSERQNGVLNSWTDQDSKDSTYSMSSTLTLTKDEYERHNSYTCEATHKTSTSPIVKSFNRNES |
| 4 | aa VK_A2 | MKYLLPTAAAGLLLLAAQPAMADIVMSQSPAIMSASPGEKVTMTCSASSSVTYMYWYQQKPGSSPRLLIYDTSNLASGVPVRFSGSGSGTSYSLTISRMEAEDTATYYCQQWSNYPLTFGAGTKLELKRADAAPTVSIFPPSSEQLTSGGASVVCFLNNFYPKDINVKWKIDGSERQNGVLNSWTDQDSKDSTYSMSSTLTLTKDEYERHNSYTCEATHKTSTSPIVKSFNRNES |
| 5 | nt VH_A1 | acgctttgtacatggagaaaataaagtgaaacaaagcactattgcactggcactcttaccgctcttatttacccctgtggcaaaagcccaggtgaagcttcagcagtccggggctgagctggtgaggcctgggtcctcagtgaagatttcctgcaaggcttctggctacgcattcagtaactcctggataaactgggtgaagcagaggcctggacagggtcttgagtggattggacagatttatcctggagattatgatactaactacaatggaaaattcaagggtaaagccacactgactgcagactactcctccagcacagcctacatgcagctcaacagcctaacatctgaggactctgcggtctatttctgtgcaagggggggatcgatctactatggtaacctcgggttcttcgatgtctggggcgcagggaccacggtcaccgtctcctcagccaaaacgacacccccatctgtctatccactggcccctggatctgctgcccaaactaactccatggtgaccctgggatgcctggtcaagggctatttccctgagccagtgacagtgacctggaactctggatccctgtccagcggtgtgcacaccttcccagctgtcctgcagtctgacctctacactctgagcagctcagtgactgtcccctccagcacctggcccagcgagaccgtcacctgcaacgttgcccacccggccagcagcaccaaggtggacaagaaaattgtgcccagggattgtcatcatcaccatcaccatcactaattgacagcttatcatcgatangct |
| 6 | nt VH_A2 | aaaaccctggcgttacccacgctttgtacatggagaaaataaagtgaaacaaagcactattgcactggcactcttaccgctcttatttacccctgtggcaaaagcccaggcttatctacagcagtctggacctgagctggtgaaggctggcgcttcagtgaagatgtcctgcaaggcttctggttactcattcattgagtacaccataaactgggtgaaacagagccatggaaagagccttgagtggattggaaatattgatccttattatggaaccacttattacaatcagatgttcacgggcaaggccacattgactgtagaccaatcttccaacactgcctacatgcagctcaagagcctgacatctgaggactctgcagtctatttctgtgcaagaggctccgcctggtttccttactggggccaggggactctagtcactgtctctgcagccaaaacgacacccccatctgtctatccactggcccctggatctgctgcccaaactaactccatggtgaccctgggatgcctggtcaagggctatttccctgagccagtgacagtgacctggaactctggatccctgtccagcggtgtgcacaccttcccagctgtcctgcagtctgacctctacactctgagcagctcagtgactgtcccctccagcacctggcccagcgagaccgtcacctgcaacgttgcccacccggccagcagcaccaaggtggacaagaaaattgtgcccagggattgtcatcatcaccatcaccatcactaattgacagcttatcatcgat |
| 7 | nt VK_A1 | gtttttttggatggagtgaaacgatgaaatacctattgcctacggcagccgctggattgttattactcgctgcccaaccagccatggccgaaatggttctcacccagtctccagcaatcatgtctacatctctaggggaacgggtcaccatgacctgcactgccagctcacgtgtaagttccagttacttgcactggtaccagcagaagccaggatcctcccccaaactctggatttatagtacatccaacctggcttctggagtcccagctcgcttcagtggcagtgggtctgggacctcttactctctcacaatcagcagcatggaggctgaagatgctgccacttattactgccaccagtatcatcgttccccgtacacgttcggaggggggaccaagctggaaataaaacgggctgatgctgcaccaactgtatccatcttcccaccatccagtgagcagttaacatctggaggtgcctcagtcgtgtgcttcttgaacaacttctaccccaaagacatcaatgtcaagtggaagattgatggcagtgaacgacaaaatggcgtcctgaacagttggactgatcaggacagcaaagacagcacctacagcatgagcagcaccctcacgttgaccaaggacgagtatgaacgacataacagctatacctgtgaggccactcacaagacatcaacttcacccattgtcaagagcttcaacaggaatgagtcttaagtgattagctaattctagaacg |
| 8 | nt VK_A2 | actctctactgtttctccatacccgtttttttggatggagtgaaacgatgaaatacctattgcctacggcagccgctggattgttattactcgctgcccaaccagccatggccgacatcgttatgtctcagtctccagcaatcatgtctgcatctccaggggagaaggtcaccatgacctgcagtgccagctcaagtgtaacttacatgtactggtaccagcagaagccaggatcctcccccagactcctgatttatgacacatccaacctggcttctggagtccctgttcgcttcagtggcagtgggtctgggacctcttactctctcacaatcagccgaatggaggctgaagatactgccacttattactgccagcagtggagtaattacccactcacgttcggtgctgggaccaagctggagctgaaacgggctgatgctgcaccaactgtatccatcttcccaccatccagtgagcagttaacatctggaggtgcctcagtcgtgtgcttcttgaacaacttctaccccaaagacatcaatgtcaagtggaagattgatggcagtgaacgacaaaatggcgtcctgaacagttggactgatcaggacagcaaagacagcacctacagcatgagcagcaccctcacgttgaccaaggacgagtatgaacgacataacagctatacctgtgaggccactcacaagacatcaacttcacccattgtcaagagcttcaacaggaatgagtcttaagtgattagctaattctagaacgcgtcacttggcactggccgtcgtttta |
| 9 | aa VH_CDR1_A1 | GYAFSNSWINW |
| 10 | aa VH_CDR1_A2 | GYSFIEYTINW |
| 11 | aa VH_CDR2_A1 | GQIYPGDYDTNYNGKFK |
| 12 | aa VH_CDR2_A2 | GNIDPYYGTTYYNQMFT |
| 13 | aa VH_CDR3_A1 | ARGGSIYYGNLGFFDV |
| 14 | aa VH_CDR3_A2 | ARGSAWFPY |
| 15 | aa VK_CDR1_A1 | TASSRVSSSYLH |
| 16 | aa VK_CDR1_A2 | SASSSVTYMY |
| 17 | aa VK_CDR2_A1 | STSNLAS |
| 18 | aa VK_CDR2_A2 | DTSNLAS |
| 19 | aa VK_CDR3_A1 | HQYHRSPYT |
| 20 | aa VK_CDR3_A2 | QQWSNYPLT |
| 21 | nt VH_CDR1_A1 | ggctacgcattcagtaactcctggataaactgg |
| 22 | nt VH_CDR1_A2 | ggttactcattcattgagtacaccataaactgg |
| 23 | nt VH_CDR2_A1 | ggacagatttatcctggagattatgatactaactacaatggaaaattcaag |
| 24 | nt VH_CDR2_A2 | ggaaatattgatccttattatggaaccacttattacaatcagatgttcacg |
| 25 | nt VH_CDR3_A1 | gcaagggggggatcgatctactatggtaacctcgggttcttcgatgtc |
| 26 | nt VH_CDR3_A2 | gcaagaggctccgcctggtttccttac |
| 27 | nt VK_CDR1_A1 | actgccagctcacgtgtaagttccagttacttgcac |
| 28 | nt VK_CDR1_A2 | agtgccagctcaagtgtaacttacatgtac |
| 29 | nt VK_CDR2_A1 | agtacatccaacctggcttct |
| 30 | nt VK_CDR2_A2 | gacacatccaacctggcttct |
| 31 | nt VK_CDR3_A1 | caccagtatcatcgttccccgtacacg |
| 32 | nt VK_CDR3_A2 | cagcagtggagtaattacccactcacg |
| 33 | IGHV1-80*01 (Genebank: AC160990 Musmus) nt 138392-138424 | ggctacgcattcagtagctactggatgaactgg |
| 34 | IGHV1-80*01 (Genebank: AC160990 Musmus) nt 138461-138511 | ggacagatttatcctggagatggtgatactaactacaacggaaagttcaag |
| 35 | IGHV1-39*01 (Genebank: AC079181 Musmus) nt 153362-153394 | ggttactcattcactgactacaacatgaactgg |
| 36 | IGHV1-39*01 (Genebank: AC079181 Musmus) nt 153431-153481 | ggagtaattaatcctaactatggtactactagctacaatcagaagttcaag |
| 37 | IGKV4-74*01 (Genebank: AJ231217 Musmus) nt 496-531 | actgccagctcaagtgtaagttccagttacttgcac |
| 38 | IGKV4-74*01 (Genebank: AJ231217 Musmus) nt 577-597 | agcacatccaacctggcttct |
| 39 | IGKV4-74*01 (Genebank: AJ231217 Musmus) nt 691-718 | caccagtatcatcgttccccaccca |
| 40 | IGKV4-55*01 (Genebank: AJ231225 Musmus) nt 523-552 | agtgccagctcaagtgtaagttacatgtac |
| 41 | IGKV4-55*01 (Genebank: AJ231225 Musmus) nt 598-618 | gacacatccaacctggcttct |
| 42 | IGKV4-55*01 (Genebank: AJ231225 Musmus) nt 715-739 | cagcagtggagtagttacccaccca |
| 43 | ADP-리보실 사이클라제 2 (CD157; BST1) | MAAQGCAASRLLQLLLQLLLLLLLLAAGGARARWRGEGTSAHLRDIFLGRCAEYRALLSPEQRNKNCTAIWEAFKVALDKDPCSVLPSDYDLFINLSRHSIPRDKSLFWENSHLLVNSFADNTRRFMPLSDVLYGRVADFLSWCRQKNDSGLDYQSCPTSEDCENNPVDSFWKRASIQYSKDSSGVIHVMLNGSEPTGAYPIKGFFADYEIPNLQKEKITRIEIWVMHEIGGPNVESCGEGSMKVLEKRLKDMGFQYSCINDYRPVKLLQCVDHSTHPDCALKSAAAATQRKAPSLYTEQRAGLIIPLFLVLASRTQL |
| 44 | ADP-리보실 사이클라제 2의 aa 29 - 292 (CD157; BST1) | GARARWRGEGTSAHLRDIFLGRCAEYRALLSPEQRNKNCTAIWEAFKVALDKDPCSVLPSDYDLFINLSRHSIPRDKSLFWENSHLLVNSFADNTRRFMPLSDVLYGRVADFLSWCRQKNDSGLDYQSCPTSEDCENNPVDSFWKRASIQYSKDSSGVIHVMLNGSEPTGAYPIKGFFADYEIPNLQKEKITRIEIWVMHEIGGPNVESCGEGSMKVLEKRLKDMGFQYSCINDYRPVKLLQCVDHSTHPDCALKSAAAATQRK |
| 45 | A2 VH (아미노산 21-137 서열번호 2) | QAYLQQSGPELVKAGASVKMSCKASGYSFIEYTINWVKQSHGKSLEWIGNIDPYYGTTYYNQMFTGKATLTVDQSSNTAYMQLKSLTSEDSAVYFCARGSAWFPYWGQGTLVTVSA |
| 46 | VH1 - 인간화 VH_A2 | QVQLVQSGA EVKKPGASVK VSCKASGYSF IEYTINWVRQ APGQGLEWIGNIDPYYGTTYY NQMFTGRATL TVDTSISTAY MELSRLRSDDTAVYYCARGSAWF PYWGQGTLV TVSS |
| 47 | BF238102 VH | QVQLVQSGA EVKKPGASVK VSCKASGYSF TXXXXXWVRQ APGQGLEWMG XXXXXXXXXXX XXXXXXRVTL TRDTSISTAY MELSRLRSDDTAVYYCARXXXXX XXXWGQGTLV PVSS |
| 48 | A2 VL (아미노산 22-128 서열번호 4) | DIVMSQSPA IMSASPGEKV TMTCSAS-SS VTYMYWYQQKPGSSPRLLIY DTSNLASGVP VRFSGSGSGT SYSLTISRMEAEDTATYYCQ QWSNYPLTFG AGTKLELK |
| 49 | VL1 - 인간화 VK_A2 | DIQMTQSPS SLSASVGDRV TITCSAS-SS VTYMYWYQQKPGKAPKLLIY DTSNLASGVP SRFSGSGSGT DYTLTISSLQPEDFATYYCQ QWSNYPLTFG QGTKVEIK |
| 50 | X72441 VL | DIQMTQSPS SLSASVGDRV TITCXXXXXX XXXXXWYQQKPGKAPKLLIY XXXXXXXGVP SRFSGSGSGT DFTLTISSLQPEDFATYYCX XXXXXXXXFG QGTKVEIK |
| 51 | VH1_CDR2 | NIDPYYGTTYYNQMFQ |
| 52 | aa VH_A3 | MKQSTIALALLPLLFTPVAKAQVQLQQSRAELVMPGASVKMSCKTSGYTFSDYWVHWVRQRPGQGLEWIGAIDGSDTFNDYSQKFKGRATLTVDESSSTVYMQLSSLTSEDSAVYYCARGGLLQYWGQGTTLTVSSAKTTPPSVYPLAPGSAAQTNSMVTLGCLVKGYFPEPVTVTWNSGSLSSGVHTFPAVLQSDLYTLSSSVTVPSSTWPSETVTCNVAHPASSTKVDKKIVPRDCHHHHHHH |
| 53 | aa VK_A3 | MKYLLPTAAAGLLLLAAQPAMADIQLTQSPASLSASVGETVTITCRASENIYSYLAWYQQKQGKSPQLLVYNTKTLGEGVPSRFSGSGSGTQFSLKINSLQPEDFGSYYCQHHYGTPFTFGSGTKLEIKRADAAPTVSIFPPSSEQLTSGGASVVCFLNNFYPKDINVKWKIDGSERQNGVLNSWTDQDSKDSTYSMSSTLTLTKDEYERHNSYTCEATHKTSTSPIVKSFNRNES |
| 54 | nt VH_A3 | gtgaaacaaagcactattgcactggcactcttaccgctcttatttacccctgtggcaaaagcccaggtccagctgcagcagtctagggctgaacttgtgatgcctggggcttcagtgaagatgtcctgcaagacttctggctacacattctctgactactgggtacactgggtgaggcagaggcctggacaaggccttgagtggatcggagcgattgatggttctgatacttttaatgactacagtcagaagtttaagggcagggccacattgactgtagacgaatcctccagcacagtctacatgcaactcagcagcctgacatctgaggactctgcggtctattactgtgcaagggggggccttcttcagtactggggccaaggcaccactctcacagtctcctcagccaaaacgacacccccatctgtctatccactggcccctggatctgctgcccaaactaactccatggtgaccctgggatgcctggtcaagggctatttccctgagccagtgacagtgacctggaactctggatccctgtccagcggtgtgcacaccttcccagctgtcctgcagtctgacctctacactctgagcagctcagtgactgtcccctccagcacctggcccagcgagaccgtcacctgcaacgttgcccacccggccagcagcaccaaggtggacaagaaaattgtgcccagggattgtcatcatcaccatcaccatcactaa |
| 55 | nt VK_A3 | atgaaatacctattgcctacggcagccgctggattgttattactcgctgcccaaccagccatggccgacattcagctgacccagtctccagcctccctatctgcatctgtgggagaaactgtcaccatcacatgtcgagcaagtgaaaacatttacagttatttagcatggtatcagcagaaacagggaaaatctcctcagctcctggtctataatacaaaaaccttaggagaaggtgtgccatcaaggttcagtggcagtggatcgggcacacaattttctctgaagatcaacagcctgcagcctgaagattttgggagttattactgtcaacatcattatggtactccattcacgttcggctcggggacaaagttggaaataaaacgggctgatgctgcaccaactgtatccatcttcccaccatccagtgagcagttaacatctggaggtgcctcagtcgtgtgcttcttgaacaacttctaccccaaagacatcaatgtcaagtggaagattgatggcagtgaacgacaaaatggcgtcctgaacagttggactgatcaggacagcaaagacagcacctacagcatgagcagcaccctcacgttgaccaaggacgagtatgaacgacataacagctatacctgtgaggccactcacaagacatcaacttcacccattgtcaagagcttcaacaggaatgagtcttaa |
| 56 | aa VH_CDR1_A3 | GYTFSDYWVHW |
| 57 | aa VH_CDR2_A3 | GAIDGSDTFNDYSQKFK |
| 58 | aa VH_CDR3_A3 | ARGGLLQY |
| 59 | aa VK_CDR1_A3 | RASENIYSYLA |
| 60 | aa VK_CDR2_A3 | NTKTLGE |
| 61 | aa VK_CDR3_A3 | QHHYGTPFT |
| 62 | nt VH_CDR1_A3 | ggctacacattctctgactactgggtacactgg |
| 63 | nt VH_CDR2_A3 | ggagcgattgatggttctgatacttttaatgactacagtcagaagtttaag |
| 64 | nt VH_CDR3_A3 | gcaagggggggccttcttcagtac |
| 65 | nt VK_CDR1_A3 | cgagcaagtgaaaacatttacagttatttagca |
| 66 | nt VK_CDR2_A3 | aatacaaaaaccttaggagaa |
| 67 | nt VK_CDR3_A3 | caacatcattatggtactccattcacg |
| 68 | IGHV1-69*01 (AC073939) | ggctacaccttcaccagctactggatgcactgg |
| 69 | IGHV1-69*01 (AC073939) | ggagagattgatccttctgatagttatactaactacaatcaaaagttcaag |
| 70 | IGKV12-44*01 (AJ235955) | cgagcaagtgagaatatttacagttatttagca |
| 71 | IGKV12-44*01 (AJ235955) | aatgcaaaaaccttagcagaa |
| 72 | IGKV12-44*01 (AJ235955) | caacatcattatggtactcctcc |
| 73 | nt H_A2 | CAAGTCCAACTGGTTCAATCTGGTGCTGAGGTTAAGAAGCCTGGTGCCTCTGTGAAGGTGTCATGTAAAGCATCTGGGTACAGCTTCATCGAGTACACCATTAATTGGGTCCGCCAAGCTCCTGGCCAGGGACTGGAGTGGATCGGCAATATCGATCCCTACTACGGGACCACATACTACAATCAAATGTTCACTGGCAGAGCCACCCTGACCGTCGACACAAGCATATCTACAGCCTATATGGAGCTCAGCCGCCTGCGGTCTGACGACACCGCTGTGTATTACTGCGCTCGGGGAAGTGCTTGGTTCCCATATTGGGGTCAGGGAACCCTCGTTACAGTCTCCTCAGCTTCAACCAAAGGCCCCAGTGTCTTCCCTCTGGCCCCTTCCAGTAAGTCTACCAGCGGCGGCACTGCCGCCCTGGGCTGTCTCGTCAAAGACTACTTCCCTGAACCCGTGACAGTGTCTTGGAACAGCGGCGCACTGACAAGCGGGGTGCACACATTTCCCGCCGTCCTGCAATCCTCCGGACTGTACAGCCTCTCAAGTGTGGTGACTGTCCCATCCTCCTCCCTCGGGACCCAGACATATATATGCAATGTGAACCATAAGCCCAGCAACACCAAGGTCGATAAGAAGGTGGAACCTAAAAGTTGCGATAAGACTCATACATGTCCTCCATGCCCTGCCCCTGAACTGCTGGGAGGACCTTCTGTCTTCCTGTTCCCTCCCAAGCCCAAAGATACCCTGATGATATCCCGCACACCAGAAGTGACATGTGTTGTTGTCGATGTCTCTCACGAGGACCCTGAAGTGAAGTTTAATTGGTATGTGGACGGGGTGGAAGTGCACAACGCCAAGACCAAACCTCGCGAAGAGCAGTACAACTCCACATACCGCGTGGTGAGTGTGCTCACCGTTCTCCATCAGGACTGGCTGAATGGCAAGGAGTATAAGTGTAAGGTGAGCAACAAAGCTCTGCCAGCACCCATAGAGAAAACTATTAGCAAAGCTAAGGGCCAGCCTCGCGAGCCACAGGTGTATACCCTCCCTCCTAGTCGCGAGGAAATGACTAAGAACCAGGTTTCCCTGACATGCCTCGTCAAGGGATTCTATCCTAGCGATATTGCCGTCGAATGGGAGTCCAATGGCCAGCCCGAGAACAACTACAAGACCACACCTCCTGTCCTCGACTCTGACGGATCCTTCTTTCTCTATAGCAAGCTGACCGTTGACAAAAGCAGGTGGCAACAGGGTAACGTGTTTTCATGCTCTGTGATGCACGAAGCCCTGCACAATCACTACACACAGAAGTCCCTGAGCCTGTCCCCTGGCAAA |
| 74 | aa H_A2 | QVQLVQSGAEVKKPGASVKVSCKASGYSFIEYTINWVRQAPGQGLEWIGNIDPYYGTTYYNQMFTGRATLTVDTSISTAYMELSRLRSDDTAVYYCARGSAWFPYWGQGTLVTVSS ASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK |
| 75 | nt L_A2 | GACATTCAGATGACCCAATCACCAAGCAGTCTGTCAGCCAGTGTTGGGGATCGCGTGACCATAACATGCTCTGCATCCTCTAGTGTGACTTACATGTACTGGTACCAACAGAAGCCCGGGAAAGCCCCAAAGCTCCTGATCTATGACACTAGCAACCTGGCTAGTGGAGTCCCCAGCCGGTTTTCCGGTTCAGGCTCAGGGACTGACTATACTCTCACTATTTCATCTCTGCAGCCTGAGGACTTTGCCACTTATTATTGTCAGCAATGGAGCAATTACCCACTGACCTTTGGGCAGGGCACCAAGGTGGAAATCAAGAGAACTGTTGCTGCTCCCTCCGTGTTCATCTTCCCACCAAGCGATGAGCAGCTGAAATCCGGGACAGCCTCTGTGGTGTGTCTCCTGAACAACTTCTATCCTCGGGAGGCAAAGGTCCAGTGGAAAGTCGATAATGCCCTCCAGAGTGGCAACTCACAAGAAAGCGTGACTGAACAGGACTCCAAAGATAGTACATATAGCCTCAGCAGTACACTGACCCTGAGCAAAGCCGATTATGAGAAACATAAGGTGTACGCTTGCGAGGTCACCCACCAGGGCCTGTCCAGTCCAGTGACTAAGAGCTTTAATAGAGGTGAGTGT |
| 76 | aa L_A2 | DIQMTQSPSSLSASVGDRVTITCSASSSVTYMYWYQQKPGKAPKLLIYDTSNLASGVPSRFSGSGSGTDYTLTISSLQPEDFATYYCQQWSNYPLTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC |
SEQUENCE LISTING
<110> Berlin-Chemie AG
<120> PHARMACEUTICAL COMBINATIONS
<130> 489.412.133779/05
<160> 76
<170> PatentIn version 3.5
<210> 1
<211> 253
<212> PRT
<213> Mus musculus
<400> 1
Met Lys Gln Ser Thr Ile Ala Leu Ala Leu Leu Pro Leu Leu Phe Thr
1 5 10 15
Pro Val Ala Lys Ala Gln Val Lys Leu Gln Gln Ser Gly Ala Glu Leu
20 25 30
Val Arg Pro Gly Ser Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Ala Phe Ser Asn Ser Trp Ile Asn Trp Val Lys Gln Arg Pro Gly Gln
50 55 60
Gly Leu Glu Trp Ile Gly Gln Ile Tyr Pro Gly Asp Tyr Asp Thr Asn
65 70 75 80
Tyr Asn Gly Lys Phe Lys Gly Lys Ala Thr Leu Thr Ala Asp Tyr Ser
85 90 95
Ser Ser Thr Ala Tyr Met Gln Leu Asn Ser Leu Thr Ser Glu Asp Ser
100 105 110
Ala Val Tyr Phe Cys Ala Arg Gly Gly Ser Ile Tyr Tyr Gly Asn Leu
115 120 125
Gly Phe Phe Asp Val Trp Gly Ala Gly Thr Thr Val Thr Val Ser Ser
130 135 140
Ala Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala
145 150 155 160
Ala Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr
165 170 175
Phe Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser
180 185 190
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu
195 200 205
Ser Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr Val
210 215 220
Thr Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys
225 230 235 240
Ile Val Pro Arg Asp Cys His His His His His His His
245 250
<210> 2
<211> 246
<212> PRT
<213> Mus musculus
<400> 2
Met Lys Gln Ser Thr Ile Ala Leu Ala Leu Leu Pro Leu Leu Phe Thr
1 5 10 15
Pro Val Ala Lys Ala Gln Ala Tyr Leu Gln Gln Ser Gly Pro Glu Leu
20 25 30
Val Lys Ala Gly Ala Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Ser Phe Ile Glu Tyr Thr Ile Asn Trp Val Lys Gln Ser His Gly Lys
50 55 60
Ser Leu Glu Trp Ile Gly Asn Ile Asp Pro Tyr Tyr Gly Thr Thr Tyr
65 70 75 80
Tyr Asn Gln Met Phe Thr Gly Lys Ala Thr Leu Thr Val Asp Gln Ser
85 90 95
Ser Asn Thr Ala Tyr Met Gln Leu Lys Ser Leu Thr Ser Glu Asp Ser
100 105 110
Ala Val Tyr Phe Cys Ala Arg Gly Ser Ala Trp Phe Pro Tyr Trp Gly
115 120 125
Gln Gly Thr Leu Val Thr Val Ser Ala Ala Lys Thr Thr Pro Pro Ser
130 135 140
Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val
145 150 155 160
Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val
165 170 175
Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala
180 185 190
Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro
195 200 205
Ser Ser Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro
210 215 220
Ala Ser Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys His
225 230 235 240
His His His His His His
245
<210> 3
<211> 237
<212> PRT
<213> Mus musculus
<400> 3
Met Lys Tyr Leu Leu Pro Thr Ala Ala Ala Gly Leu Leu Leu Leu Ala
1 5 10 15
Ala Gln Pro Ala Met Ala Glu Met Val Leu Thr Gln Ser Pro Ala Ile
20 25 30
Met Ser Thr Ser Leu Gly Glu Arg Val Thr Met Thr Cys Thr Ala Ser
35 40 45
Ser Arg Val Ser Ser Ser Tyr Leu His Trp Tyr Gln Gln Lys Pro Gly
50 55 60
Ser Ser Pro Lys Leu Trp Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly
65 70 75 80
Val Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu
85 90 95
Thr Ile Ser Ser Met Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys His
100 105 110
Gln Tyr His Arg Ser Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu
115 120 125
Ile Lys Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Ser
130 135 140
Ser Glu Gln Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu Asn
145 150 155 160
Asn Phe Tyr Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp Gly Ser
165 170 175
Glu Arg Gln Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp Ser Lys
180 185 190
Asp Ser Thr Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys Asp Glu
195 200 205
Tyr Glu Arg His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys Thr Ser
210 215 220
Thr Ser Pro Ile Val Lys Ser Phe Asn Arg Asn Glu Ser
225 230 235
<210> 4
<211> 235
<212> PRT
<213> Mus musculus
<400> 4
Met Lys Tyr Leu Leu Pro Thr Ala Ala Ala Gly Leu Leu Leu Leu Ala
1 5 10 15
Ala Gln Pro Ala Met Ala Asp Ile Val Met Ser Gln Ser Pro Ala Ile
20 25 30
Met Ser Ala Ser Pro Gly Glu Lys Val Thr Met Thr Cys Ser Ala Ser
35 40 45
Ser Ser Val Thr Tyr Met Tyr Trp Tyr Gln Gln Lys Pro Gly Ser Ser
50 55 60
Pro Arg Leu Leu Ile Tyr Asp Thr Ser Asn Leu Ala Ser Gly Val Pro
65 70 75 80
Val Arg Phe Ser Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile
85 90 95
Ser Arg Met Glu Ala Glu Asp Thr Ala Thr Tyr Tyr Cys Gln Gln Trp
100 105 110
Ser Asn Tyr Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
115 120 125
Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu
130 135 140
Gln Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe
145 150 155 160
Tyr Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg
165 170 175
Gln Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser
180 185 190
Thr Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu
195 200 205
Arg His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser
210 215 220
Pro Ile Val Lys Ser Phe Asn Arg Asn Glu Ser
225 230 235
<210> 5
<211> 811
<212> DNA
<213> Mus musculus
<220>
<221> misc_feature
<222> (808)..(808)
<223> n is a, c, g, or t
<400> 5
acgctttgta catggagaaa ataaagtgaa acaaagcact attgcactgg cactcttacc 60
gctcttattt acccctgtgg caaaagccca ggtgaagctt cagcagtccg gggctgagct 120
ggtgaggcct gggtcctcag tgaagatttc ctgcaaggct tctggctacg cattcagtaa 180
ctcctggata aactgggtga agcagaggcc tggacagggt cttgagtgga ttggacagat 240
ttatcctgga gattatgata ctaactacaa tggaaaattc aagggtaaag ccacactgac 300
tgcagactac tcctccagca cagcctacat gcagctcaac agcctaacat ctgaggactc 360
tgcggtctat ttctgtgcaa gggggggatc gatctactat ggtaacctcg ggttcttcga 420
tgtctggggc gcagggacca cggtcaccgt ctcctcagcc aaaacgacac ccccatctgt 480
ctatccactg gcccctggat ctgctgccca aactaactcc atggtgaccc tgggatgcct 540
ggtcaagggc tatttccctg agccagtgac agtgacctgg aactctggat ccctgtccag 600
cggtgtgcac accttcccag ctgtcctgca gtctgacctc tacactctga gcagctcagt 660
gactgtcccc tccagcacct ggcccagcga gaccgtcacc tgcaacgttg cccacccggc 720
cagcagcacc aaggtggaca agaaaattgt gcccagggat tgtcatcatc accatcacca 780
tcactaattg acagcttatc atcgatangc t 811
<210> 6
<211> 803
<212> DNA
<213> Mus musculus
<400> 6
aaaaccctgg cgttacccac gctttgtaca tggagaaaat aaagtgaaac aaagcactat 60
tgcactggca ctcttaccgc tcttatttac ccctgtggca aaagcccagg cttatctaca 120
gcagtctgga cctgagctgg tgaaggctgg cgcttcagtg aagatgtcct gcaaggcttc 180
tggttactca ttcattgagt acaccataaa ctgggtgaaa cagagccatg gaaagagcct 240
tgagtggatt ggaaatattg atccttatta tggaaccact tattacaatc agatgttcac 300
gggcaaggcc acattgactg tagaccaatc ttccaacact gcctacatgc agctcaagag 360
cctgacatct gaggactctg cagtctattt ctgtgcaaga ggctccgcct ggtttcctta 420
ctggggccag gggactctag tcactgtctc tgcagccaaa acgacacccc catctgtcta 480
tccactggcc cctggatctg ctgcccaaac taactccatg gtgaccctgg gatgcctggt 540
caagggctat ttccctgagc cagtgacagt gacctggaac tctggatccc tgtccagcgg 600
tgtgcacacc ttcccagctg tcctgcagtc tgacctctac actctgagca gctcagtgac 660
tgtcccctcc agcacctggc ccagcgagac cgtcacctgc aacgttgccc acccggccag 720
cagcaccaag gtggacaaga aaattgtgcc cagggattgt catcatcacc atcaccatca 780
ctaattgaca gcttatcatc gat 803
<210> 7
<211> 759
<212> DNA
<213> Mus musculus
<400> 7
gtttttttgg atggagtgaa acgatgaaat acctattgcc tacggcagcc gctggattgt 60
tattactcgc tgcccaacca gccatggccg aaatggttct cacccagtct ccagcaatca 120
tgtctacatc tctaggggaa cgggtcacca tgacctgcac tgccagctca cgtgtaagtt 180
ccagttactt gcactggtac cagcagaagc caggatcctc ccccaaactc tggatttata 240
gtacatccaa cctggcttct ggagtcccag ctcgcttcag tggcagtggg tctgggacct 300
cttactctct cacaatcagc agcatggagg ctgaagatgc tgccacttat tactgccacc 360
agtatcatcg ttccccgtac acgttcggag gggggaccaa gctggaaata aaacgggctg 420
atgctgcacc aactgtatcc atcttcccac catccagtga gcagttaaca tctggaggtg 480
cctcagtcgt gtgcttcttg aacaacttct accccaaaga catcaatgtc aagtggaaga 540
ttgatggcag tgaacgacaa aatggcgtcc tgaacagttg gactgatcag gacagcaaag 600
acagcaccta cagcatgagc agcaccctca cgttgaccaa ggacgagtat gaacgacata 660
acagctatac ctgtgaggcc actcacaaga catcaacttc acccattgtc aagagcttca 720
acaggaatga gtcttaagtg attagctaat tctagaacg 759
<210> 8
<211> 804
<212> DNA
<213> Mus musculus
<400> 8
actctctact gtttctccat acccgttttt ttggatggag tgaaacgatg aaatacctat 60
tgcctacggc agccgctgga ttgttattac tcgctgccca accagccatg gccgacatcg 120
ttatgtctca gtctccagca atcatgtctg catctccagg ggagaaggtc accatgacct 180
gcagtgccag ctcaagtgta acttacatgt actggtacca gcagaagcca ggatcctccc 240
ccagactcct gatttatgac acatccaacc tggcttctgg agtccctgtt cgcttcagtg 300
gcagtgggtc tgggacctct tactctctca caatcagccg aatggaggct gaagatactg 360
ccacttatta ctgccagcag tggagtaatt acccactcac gttcggtgct gggaccaagc 420
tggagctgaa acgggctgat gctgcaccaa ctgtatccat cttcccacca tccagtgagc 480
agttaacatc tggaggtgcc tcagtcgtgt gcttcttgaa caacttctac cccaaagaca 540
tcaatgtcaa gtggaagatt gatggcagtg aacgacaaaa tggcgtcctg aacagttgga 600
ctgatcagga cagcaaagac agcacctaca gcatgagcag caccctcacg ttgaccaagg 660
acgagtatga acgacataac agctatacct gtgaggccac tcacaagaca tcaacttcac 720
ccattgtcaa gagcttcaac aggaatgagt cttaagtgat tagctaattc tagaacgcgt 780
cacttggcac tggccgtcgt ttta 804
<210> 9
<211> 11
<212> PRT
<213> Mus musculus
<400> 9
Gly Tyr Ala Phe Ser Asn Ser Trp Ile Asn Trp
1 5 10
<210> 10
<211> 11
<212> PRT
<213> Mus musculus
<400> 10
Gly Tyr Ser Phe Ile Glu Tyr Thr Ile Asn Trp
1 5 10
<210> 11
<211> 17
<212> PRT
<213> Mus musculus
<400> 11
Gly Gln Ile Tyr Pro Gly Asp Tyr Asp Thr Asn Tyr Asn Gly Lys Phe
1 5 10 15
Lys
<210> 12
<211> 17
<212> PRT
<213> Mus musculus
<400> 12
Gly Asn Ile Asp Pro Tyr Tyr Gly Thr Thr Tyr Tyr Asn Gln Met Phe
1 5 10 15
Thr
<210> 13
<211> 16
<212> PRT
<213> Mus musculus
<400> 13
Ala Arg Gly Gly Ser Ile Tyr Tyr Gly Asn Leu Gly Phe Phe Asp Val
1 5 10 15
<210> 14
<211> 9
<212> PRT
<213> Mus musculus
<400> 14
Ala Arg Gly Ser Ala Trp Phe Pro Tyr
1 5
<210> 15
<211> 12
<212> PRT
<213> Mus musculus
<400> 15
Thr Ala Ser Ser Arg Val Ser Ser Ser Tyr Leu His
1 5 10
<210> 16
<211> 10
<212> PRT
<213> Mus musculus
<400> 16
Ser Ala Ser Ser Ser Val Thr Tyr Met Tyr
1 5 10
<210> 17
<211> 7
<212> PRT
<213> Mus musculus
<400> 17
Ser Thr Ser Asn Leu Ala Ser
1 5
<210> 18
<211> 7
<212> PRT
<213> Mus musculus
<400> 18
Asp Thr Ser Asn Leu Ala Ser
1 5
<210> 19
<211> 9
<212> PRT
<213> Mus musculus
<400> 19
His Gln Tyr His Arg Ser Pro Tyr Thr
1 5
<210> 20
<211> 9
<212> PRT
<213> Mus musculus
<400> 20
Gln Gln Trp Ser Asn Tyr Pro Leu Thr
1 5
<210> 21
<211> 33
<212> DNA
<213> Mus musculus
<400> 21
ggctacgcat tcagtaactc ctggataaac tgg 33
<210> 22
<211> 33
<212> DNA
<213> Mus musculus
<400> 22
ggttactcat tcattgagta caccataaac tgg 33
<210> 23
<211> 51
<212> DNA
<213> Mus musculus
<400> 23
ggacagattt atcctggaga ttatgatact aactacaatg gaaaattcaa g 51
<210> 24
<211> 51
<212> DNA
<213> Mus musculus
<400> 24
ggaaatattg atccttatta tggaaccact tattacaatc agatgttcac g 51
<210> 25
<211> 48
<212> DNA
<213> Mus musculus
<400> 25
gcaagggggg gatcgatcta ctatggtaac ctcgggttct tcgatgtc 48
<210> 26
<211> 27
<212> DNA
<213> Mus musculus
<400> 26
gcaagaggct ccgcctggtt tccttac 27
<210> 27
<211> 36
<212> DNA
<213> Mus musculus
<400> 27
actgccagct cacgtgtaag ttccagttac ttgcac 36
<210> 28
<211> 30
<212> DNA
<213> Mus musculus
<400> 28
agtgccagct caagtgtaac ttacatgtac 30
<210> 29
<211> 21
<212> DNA
<213> Mus musculus
<400> 29
agtacatcca acctggcttc t 21
<210> 30
<211> 21
<212> DNA
<213> Mus musculus
<400> 30
gacacatcca acctggcttc t 21
<210> 31
<211> 27
<212> DNA
<213> Mus musculus
<400> 31
caccagtatc atcgttcccc gtacacg 27
<210> 32
<211> 27
<212> DNA
<213> Mus musculus
<400> 32
cagcagtgga gtaattaccc actcacg 27
<210> 33
<211> 33
<212> DNA
<213> Mus musculus
<400> 33
ggctacgcat tcagtagcta ctggatgaac tgg 33
<210> 34
<211> 51
<212> DNA
<213> Mus musculus
<400> 34
ggacagattt atcctggaga tggtgatact aactacaacg gaaagttcaa g 51
<210> 35
<211> 33
<212> DNA
<213> Mus musculus
<400> 35
ggttactcat tcactgacta caacatgaac tgg 33
<210> 36
<211> 51
<212> DNA
<213> Mus musculus
<400> 36
ggagtaatta atcctaacta tggtactact agctacaatc agaagttcaa g 51
<210> 37
<211> 36
<212> DNA
<213> Mus musculus
<400> 37
actgccagct caagtgtaag ttccagttac ttgcac 36
<210> 38
<211> 21
<212> DNA
<213> Mus musculus
<400> 38
agcacatcca acctggcttc t 21
<210> 39
<211> 25
<212> DNA
<213> Mus musculus
<400> 39
caccagtatc atcgttcccc accca 25
<210> 40
<211> 30
<212> DNA
<213> Mus musculus
<400> 40
agtgccagct caagtgtaag ttacatgtac 30
<210> 41
<211> 21
<212> DNA
<213> Mus musculus
<400> 41
gacacatcca acctggcttc t 21
<210> 42
<211> 25
<212> DNA
<213> Mus musculus
<400> 42
cagcagtgga gtagttaccc accca 25
<210> 43
<211> 318
<212> PRT
<213> Homo sapiens
<400> 43
Met Ala Ala Gln Gly Cys Ala Ala Ser Arg Leu Leu Gln Leu Leu Leu
1 5 10 15
Gln Leu Leu Leu Leu Leu Leu Leu Leu Ala Ala Gly Gly Ala Arg Ala
20 25 30
Arg Trp Arg Gly Glu Gly Thr Ser Ala His Leu Arg Asp Ile Phe Leu
35 40 45
Gly Arg Cys Ala Glu Tyr Arg Ala Leu Leu Ser Pro Glu Gln Arg Asn
50 55 60
Lys Asn Cys Thr Ala Ile Trp Glu Ala Phe Lys Val Ala Leu Asp Lys
65 70 75 80
Asp Pro Cys Ser Val Leu Pro Ser Asp Tyr Asp Leu Phe Ile Asn Leu
85 90 95
Ser Arg His Ser Ile Pro Arg Asp Lys Ser Leu Phe Trp Glu Asn Ser
100 105 110
His Leu Leu Val Asn Ser Phe Ala Asp Asn Thr Arg Arg Phe Met Pro
115 120 125
Leu Ser Asp Val Leu Tyr Gly Arg Val Ala Asp Phe Leu Ser Trp Cys
130 135 140
Arg Gln Lys Asn Asp Ser Gly Leu Asp Tyr Gln Ser Cys Pro Thr Ser
145 150 155 160
Glu Asp Cys Glu Asn Asn Pro Val Asp Ser Phe Trp Lys Arg Ala Ser
165 170 175
Ile Gln Tyr Ser Lys Asp Ser Ser Gly Val Ile His Val Met Leu Asn
180 185 190
Gly Ser Glu Pro Thr Gly Ala Tyr Pro Ile Lys Gly Phe Phe Ala Asp
195 200 205
Tyr Glu Ile Pro Asn Leu Gln Lys Glu Lys Ile Thr Arg Ile Glu Ile
210 215 220
Trp Val Met His Glu Ile Gly Gly Pro Asn Val Glu Ser Cys Gly Glu
225 230 235 240
Gly Ser Met Lys Val Leu Glu Lys Arg Leu Lys Asp Met Gly Phe Gln
245 250 255
Tyr Ser Cys Ile Asn Asp Tyr Arg Pro Val Lys Leu Leu Gln Cys Val
260 265 270
Asp His Ser Thr His Pro Asp Cys Ala Leu Lys Ser Ala Ala Ala Ala
275 280 285
Thr Gln Arg Lys Ala Pro Ser Leu Tyr Thr Glu Gln Arg Ala Gly Leu
290 295 300
Ile Ile Pro Leu Phe Leu Val Leu Ala Ser Arg Thr Gln Leu
305 310 315
<210> 44
<211> 264
<212> PRT
<213> Homo sapiens
<400> 44
Gly Ala Arg Ala Arg Trp Arg Gly Glu Gly Thr Ser Ala His Leu Arg
1 5 10 15
Asp Ile Phe Leu Gly Arg Cys Ala Glu Tyr Arg Ala Leu Leu Ser Pro
20 25 30
Glu Gln Arg Asn Lys Asn Cys Thr Ala Ile Trp Glu Ala Phe Lys Val
35 40 45
Ala Leu Asp Lys Asp Pro Cys Ser Val Leu Pro Ser Asp Tyr Asp Leu
50 55 60
Phe Ile Asn Leu Ser Arg His Ser Ile Pro Arg Asp Lys Ser Leu Phe
65 70 75 80
Trp Glu Asn Ser His Leu Leu Val Asn Ser Phe Ala Asp Asn Thr Arg
85 90 95
Arg Phe Met Pro Leu Ser Asp Val Leu Tyr Gly Arg Val Ala Asp Phe
100 105 110
Leu Ser Trp Cys Arg Gln Lys Asn Asp Ser Gly Leu Asp Tyr Gln Ser
115 120 125
Cys Pro Thr Ser Glu Asp Cys Glu Asn Asn Pro Val Asp Ser Phe Trp
130 135 140
Lys Arg Ala Ser Ile Gln Tyr Ser Lys Asp Ser Ser Gly Val Ile His
145 150 155 160
Val Met Leu Asn Gly Ser Glu Pro Thr Gly Ala Tyr Pro Ile Lys Gly
165 170 175
Phe Phe Ala Asp Tyr Glu Ile Pro Asn Leu Gln Lys Glu Lys Ile Thr
180 185 190
Arg Ile Glu Ile Trp Val Met His Glu Ile Gly Gly Pro Asn Val Glu
195 200 205
Ser Cys Gly Glu Gly Ser Met Lys Val Leu Glu Lys Arg Leu Lys Asp
210 215 220
Met Gly Phe Gln Tyr Ser Cys Ile Asn Asp Tyr Arg Pro Val Lys Leu
225 230 235 240
Leu Gln Cys Val Asp His Ser Thr His Pro Asp Cys Ala Leu Lys Ser
245 250 255
Ala Ala Ala Ala Thr Gln Arg Lys
260
<210> 45
<211> 116
<212> PRT
<213> Mus musculus
<400> 45
Gln Ala Tyr Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Ala Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Ser Phe Ile Glu Tyr
20 25 30
Thr Ile Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Asn Ile Asp Pro Tyr Tyr Gly Thr Thr Tyr Tyr Asn Gln Met Phe
50 55 60
Thr Gly Lys Ala Thr Leu Thr Val Asp Gln Ser Ser Asn Thr Ala Tyr
65 70 75 80
Met Gln Leu Lys Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Gly Ser Ala Trp Phe Pro Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ala
115
<210> 46
<211> 116
<212> PRT
<213> Homo sapiens
<400> 46
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ser Phe Ile Glu Tyr
20 25 30
Thr Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Asp Pro Tyr Tyr Gly Thr Thr Tyr Tyr Asn Gln Met Phe
50 55 60
Thr Gly Arg Ala Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Ser Ala Trp Phe Pro Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 47
<211> 117
<212> PRT
<213> Homo sapiens
<220>
<221> misc_feature
<222> (31)..(35)
<223> Xaa can be any naturally occurring amino acid
<220>
<221> misc_feature
<222> (50)..(66)
<223> Xaa can be any naturally occurring amino acid
<220>
<221> misc_feature
<222> (99)..(106)
<223> Xaa can be any naturally occurring amino acid
<400> 47
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Xaa Xaa
20 25 30
Xaa Xaa Xaa Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
50 55 60
Xaa Xaa Arg Val Thr Leu Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Trp Gly Gln Gly Thr Leu
100 105 110
Val Pro Val Ser Ser
115
<210> 48
<211> 106
<212> PRT
<213> Mus musculus
<400> 48
Asp Ile Val Met Ser Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser Val Thr Tyr Met
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Arg Leu Leu Ile Tyr
35 40 45
Asp Thr Ser Asn Leu Ala Ser Gly Val Pro Val Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Met Glu Ala Glu
65 70 75 80
Asp Thr Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Asn Tyr Pro Leu Thr
85 90 95
Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 49
<211> 106
<212> PRT
<213> Homo sapiens
<400> 49
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Thr Tyr Met
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr
35 40 45
Asp Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Asn Tyr Pro Leu Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 50
<211> 107
<212> PRT
<213> Homo sapiens
<220>
<221> misc_feature
<222> (24)..(34)
<223> Xaa can be any naturally occurring amino acid
<220>
<221> misc_feature
<222> (50)..(56)
<223> Xaa can be any naturally occurring amino acid
<220>
<221> misc_feature
<222> (89)..(97)
<223> Xaa can be any naturally occurring amino acid
<400> 50
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
20 25 30
Xaa Xaa Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Xaa Xaa Xaa Xaa Xaa Xaa Xaa Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
85 90 95
Xaa Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 51
<211> 16
<212> PRT
<213> Homo sapiens
<400> 51
Asn Ile Asp Pro Tyr Tyr Gly Thr Thr Tyr Tyr Asn Gln Met Phe Gln
1 5 10 15
<210> 52
<211> 245
<212> PRT
<213> Mus musculus
<400> 52
Met Lys Gln Ser Thr Ile Ala Leu Ala Leu Leu Pro Leu Leu Phe Thr
1 5 10 15
Pro Val Ala Lys Ala Gln Val Gln Leu Gln Gln Ser Arg Ala Glu Leu
20 25 30
Val Met Pro Gly Ala Ser Val Lys Met Ser Cys Lys Thr Ser Gly Tyr
35 40 45
Thr Phe Ser Asp Tyr Trp Val His Trp Val Arg Gln Arg Pro Gly Gln
50 55 60
Gly Leu Glu Trp Ile Gly Ala Ile Asp Gly Ser Asp Thr Phe Asn Asp
65 70 75 80
Tyr Ser Gln Lys Phe Lys Gly Arg Ala Thr Leu Thr Val Asp Glu Ser
85 90 95
Ser Ser Thr Val Tyr Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Gly Leu Leu Gln Tyr Trp Gly Gln
115 120 125
Gly Thr Thr Leu Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val
130 135 140
Tyr Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr
145 150 155 160
Leu Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr
165 170 175
Trp Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val
180 185 190
Leu Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser
195 200 205
Ser Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala
210 215 220
Ser Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys His His
225 230 235 240
His His His His His
245
<210> 53
<211> 236
<212> PRT
<213> Mus musculus
<400> 53
Met Lys Tyr Leu Leu Pro Thr Ala Ala Ala Gly Leu Leu Leu Leu Ala
1 5 10 15
Ala Gln Pro Ala Met Ala Asp Ile Gln Leu Thr Gln Ser Pro Ala Ser
20 25 30
Leu Ser Ala Ser Val Gly Glu Thr Val Thr Ile Thr Cys Arg Ala Ser
35 40 45
Glu Asn Ile Tyr Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Gln Gly Lys
50 55 60
Ser Pro Gln Leu Leu Val Tyr Asn Thr Lys Thr Leu Gly Glu Gly Val
65 70 75 80
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Gln Phe Ser Leu Lys
85 90 95
Ile Asn Ser Leu Gln Pro Glu Asp Phe Gly Ser Tyr Tyr Cys Gln His
100 105 110
His Tyr Gly Thr Pro Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile
115 120 125
Lys Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Ser Ser
130 135 140
Glu Gln Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu Asn Asn
145 150 155 160
Phe Tyr Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp Gly Ser Glu
165 170 175
Arg Gln Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr
195 200 205
Glu Arg His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys Thr Ser Thr
210 215 220
Ser Pro Ile Val Lys Ser Phe Asn Arg Asn Glu Ser
225 230 235
<210> 54
<211> 738
<212> DNA
<213> Mus musculus
<400> 54
gtgaaacaaa gcactattgc actggcactc ttaccgctct tatttacccc tgtggcaaaa 60
gcccaggtcc agctgcagca gtctagggct gaacttgtga tgcctggggc ttcagtgaag 120
atgtcctgca agacttctgg ctacacattc tctgactact gggtacactg ggtgaggcag 180
aggcctggac aaggccttga gtggatcgga gcgattgatg gttctgatac ttttaatgac 240
tacagtcaga agtttaaggg cagggccaca ttgactgtag acgaatcctc cagcacagtc 300
tacatgcaac tcagcagcct gacatctgag gactctgcgg tctattactg tgcaaggggg 360
ggccttcttc agtactgggg ccaaggcacc actctcacag tctcctcagc caaaacgaca 420
cccccatctg tctatccact ggcccctgga tctgctgccc aaactaactc catggtgacc 480
ctgggatgcc tggtcaaggg ctatttccct gagccagtga cagtgacctg gaactctgga 540
tccctgtcca gcggtgtgca caccttccca gctgtcctgc agtctgacct ctacactctg 600
agcagctcag tgactgtccc ctccagcacc tggcccagcg agaccgtcac ctgcaacgtt 660
gcccacccgg ccagcagcac caaggtggac aagaaaattg tgcccaggga ttgtcatcat 720
caccatcacc atcactaa 738
<210> 55
<211> 711
<212> DNA
<213> Mus musculus
<400> 55
atgaaatacc tattgcctac ggcagccgct ggattgttat tactcgctgc ccaaccagcc 60
atggccgaca ttcagctgac ccagtctcca gcctccctat ctgcatctgt gggagaaact 120
gtcaccatca catgtcgagc aagtgaaaac atttacagtt atttagcatg gtatcagcag 180
aaacagggaa aatctcctca gctcctggtc tataatacaa aaaccttagg agaaggtgtg 240
ccatcaaggt tcagtggcag tggatcgggc acacaatttt ctctgaagat caacagcctg 300
cagcctgaag attttgggag ttattactgt caacatcatt atggtactcc attcacgttc 360
ggctcgggga caaagttgga aataaaacgg gctgatgctg caccaactgt atccatcttc 420
ccaccatcca gtgagcagtt aacatctgga ggtgcctcag tcgtgtgctt cttgaacaac 480
ttctacccca aagacatcaa tgtcaagtgg aagattgatg gcagtgaacg acaaaatggc 540
gtcctgaaca gttggactga tcaggacagc aaagacagca cctacagcat gagcagcacc 600
ctcacgttga ccaaggacga gtatgaacga cataacagct atacctgtga ggccactcac 660
aagacatcaa cttcacccat tgtcaagagc ttcaacagga atgagtctta a 711
<210> 56
<211> 11
<212> PRT
<213> Mus musculus
<400> 56
Gly Tyr Thr Phe Ser Asp Tyr Trp Val His Trp
1 5 10
<210> 57
<211> 17
<212> PRT
<213> Mus musculus
<400> 57
Gly Ala Ile Asp Gly Ser Asp Thr Phe Asn Asp Tyr Ser Gln Lys Phe
1 5 10 15
Lys
<210> 58
<211> 8
<212> PRT
<213> Mus musculus
<400> 58
Ala Arg Gly Gly Leu Leu Gln Tyr
1 5
<210> 59
<211> 11
<212> PRT
<213> Mus musculus
<400> 59
Arg Ala Ser Glu Asn Ile Tyr Ser Tyr Leu Ala
1 5 10
<210> 60
<211> 7
<212> PRT
<213> Mus musculus
<400> 60
Asn Thr Lys Thr Leu Gly Glu
1 5
<210> 61
<211> 9
<212> PRT
<213> Mus musculus
<400> 61
Gln His His Tyr Gly Thr Pro Phe Thr
1 5
<210> 62
<211> 33
<212> DNA
<213> Mus musculus
<400> 62
ggctacacat tctctgacta ctgggtacac tgg 33
<210> 63
<211> 51
<212> DNA
<213> Mus musculus
<400> 63
ggagcgattg atggttctga tacttttaat gactacagtc agaagtttaa g 51
<210> 64
<211> 24
<212> DNA
<213> Mus musculus
<400> 64
gcaagggggg gccttcttca gtac 24
<210> 65
<211> 33
<212> DNA
<213> Mus musculus
<400> 65
cgagcaagtg aaaacattta cagttattta gca 33
<210> 66
<211> 21
<212> DNA
<213> Mus musculus
<400> 66
aatacaaaaa ccttaggaga a 21
<210> 67
<211> 27
<212> DNA
<213> Mus musculus
<400> 67
caacatcatt atggtactcc attcacg 27
<210> 68
<211> 33
<212> DNA
<213> Mus musculus
<400> 68
ggctacacct tcaccagcta ctggatgcac tgg 33
<210> 69
<211> 51
<212> DNA
<213> Mus musculus
<400> 69
ggagagattg atccttctga tagttatact aactacaatc aaaagttcaa g 51
<210> 70
<211> 33
<212> DNA
<213> Mus musculus
<400> 70
cgagcaagtg agaatattta cagttattta gca 33
<210> 71
<211> 21
<212> DNA
<213> Mus musculus
<400> 71
aatgcaaaaa ccttagcaga a 21
<210> 72
<211> 23
<212> DNA
<213> Mus musculus
<400> 72
caacatcatt atggtactcc tcc 23
<210> 73
<211> 1338
<212> DNA
<213> Artificial Sequence
<220>
<223> Humanized heavy chain
<400> 73
caagtccaac tggttcaatc tggtgctgag gttaagaagc ctggtgcctc tgtgaaggtg 60
tcatgtaaag catctgggta cagcttcatc gagtacacca ttaattgggt ccgccaagct 120
cctggccagg gactggagtg gatcggcaat atcgatccct actacgggac cacatactac 180
aatcaaatgt tcactggcag agccaccctg accgtcgaca caagcatatc tacagcctat 240
atggagctca gccgcctgcg gtctgacgac accgctgtgt attactgcgc tcggggaagt 300
gcttggttcc catattgggg tcagggaacc ctcgttacag tctcctcagc ttcaaccaaa 360
ggccccagtg tcttccctct ggccccttcc agtaagtcta ccagcggcgg cactgccgcc 420
ctgggctgtc tcgtcaaaga ctacttccct gaacccgtga cagtgtcttg gaacagcggc 480
gcactgacaa gcggggtgca cacatttccc gccgtcctgc aatcctccgg actgtacagc 540
ctctcaagtg tggtgactgt cccatcctcc tccctcggga cccagacata tatatgcaat 600
gtgaaccata agcccagcaa caccaaggtc gataagaagg tggaacctaa aagttgcgat 660
aagactcata catgtcctcc atgccctgcc cctgaactgc tgggaggacc ttctgtcttc 720
ctgttccctc ccaagcccaa agataccctg atgatatccc gcacaccaga agtgacatgt 780
gttgttgtcg atgtctctca cgaggaccct gaagtgaagt ttaattggta tgtggacggg 840
gtggaagtgc acaacgccaa gaccaaacct cgcgaagagc agtacaactc cacataccgc 900
gtggtgagtg tgctcaccgt tctccatcag gactggctga atggcaagga gtataagtgt 960
aaggtgagca acaaagctct gccagcaccc atagagaaaa ctattagcaa agctaagggc 1020
cagcctcgcg agccacaggt gtataccctc cctcctagtc gcgaggaaat gactaagaac 1080
caggtttccc tgacatgcct cgtcaaggga ttctatccta gcgatattgc cgtcgaatgg 1140
gagtccaatg gccagcccga gaacaactac aagaccacac ctcctgtcct cgactctgac 1200
ggatccttct ttctctatag caagctgacc gttgacaaaa gcaggtggca acagggtaac 1260
gtgttttcat gctctgtgat gcacgaagcc ctgcacaatc actacacaca gaagtccctg 1320
agcctgtccc ctggcaaa 1338
<210> 74
<211> 446
<212> PRT
<213> Artificial Sequence
<220>
<223> Humanized heavy chain
<400> 74
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ser Phe Ile Glu Tyr
20 25 30
Thr Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Asp Pro Tyr Tyr Gly Thr Thr Tyr Tyr Asn Gln Met Phe
50 55 60
Thr Gly Arg Ala Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Ser Ala Trp Phe Pro Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
260 265 270
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 75
<211> 639
<212> DNA
<213> Artificial Sequence
<220>
<223> Humanized light chain
<400> 75
gacattcaga tgacccaatc accaagcagt ctgtcagcca gtgttgggga tcgcgtgacc 60
ataacatgct ctgcatcctc tagtgtgact tacatgtact ggtaccaaca gaagcccggg 120
aaagccccaa agctcctgat ctatgacact agcaacctgg ctagtggagt ccccagccgg 180
ttttccggtt caggctcagg gactgactat actctcacta tttcatctct gcagcctgag 240
gactttgcca cttattattg tcagcaatgg agcaattacc cactgacctt tgggcagggc 300
accaaggtgg aaatcaagag aactgttgct gctccctccg tgttcatctt cccaccaagc 360
gatgagcagc tgaaatccgg gacagcctct gtggtgtgtc tcctgaacaa cttctatcct 420
cgggaggcaa aggtccagtg gaaagtcgat aatgccctcc agagtggcaa ctcacaagaa 480
agcgtgactg aacaggactc caaagatagt acatatagcc tcagcagtac actgaccctg 540
agcaaagccg attatgagaa acataaggtg tacgcttgcg aggtcaccca ccagggcctg 600
tccagtccag tgactaagag ctttaataga ggtgagtgt 639
<210> 76
<211> 213
<212> PRT
<213> Artificial Sequence
<220>
<223> Humanized light chain
<400> 76
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Thr Tyr Met
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr
35 40 45
Asp Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Asn Tyr Pro Leu Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala Pro
100 105 110
Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr
115 120 125
Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys
130 135 140
Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu
145 150 155 160
Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser
165 170 175
Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala
180 185 190
Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe
195 200 205
Asn Arg Gly Glu Cys
210
Claims (25)
- 약학적 조합물 (pharmaceutical combination)로서,
(A) 서열번호 2에 나타낸 아미노산 서열을 포함하는 중쇄 가변 영역 및 서열번호 4에 나타낸 아미노산 서열을 포함하는 경쇄 가변 영역을 포함하는 항체와, BST1에의 결합에 대해 경쟁하는, 항-BST1 항체 또는 이의 항원-결합 영역;
또는
a) i) 서열번호 10을 포함하는 제1 vhCDR;
ii) 서열번호 12 및 서열번호 51로부터 선택되는 서열을 포함하는 제2 vhCDR;
iii) 서열번호 14를 포함하는 제3 vhCDR
을 포함하는 중쇄 가변 영역; 및
b) i) 서열번호 16을 포함하는 제1 vlCDR;
ii) 서열번호 18을 포함하는 제2 vlCDR;
iii) 서열번호 20을 포함하는 제3 vlCDR
을 포함하는 경쇄 가변 영역
을 포함하며, 선택적으로, 상기 서열번호들 중 하나 이상이 독립적으로 1, 2, 3, 4 또는 5개의 아미노산 치환, 부가 또는 결손을 포함하는, 항-BST1 항체, 또는 이의 항원-결합 영역;
및
(B) 시티딘 유사체, 또는 이의 약제학적으로 허용가능한 염을 포함하며,
상기 약학적 조합물이 동시 사용, 개별 사용 또는 순차적인 사용을 위한 조합된 제제 (combined preparation) 형태인, 약학적 조합물. - 제1항에 있어서,
암 치료에 사용하기 위한 것인, 약학적 조합물. - 제1항 또는 제2항에 있어서,
상기 시티딘 유사체가 5-아자-시티딘 또는 5-아자-2'-데옥시시티딘인, 약학적 조합물. - 제1항 내지 제3항 중 어느 한 항에 있어서,
상기 서열번호 10, 12, 51, 14, 16, 18 또는 20 중 하나 이상이 독립적으로 1, 2, 3, 4 또는 5개의 보존적인 아미노산 치환을 포함하는, 약학적 조합물. - 제4항에 있어서,
상기 서열번호 10, 12, 51, 14, 16, 18 또는 20 중 하나 이상이 독립적으로 1 또는 2개의 보존적인 아미노산 치환을 포함하는, 약학적 조합물. - 제1항 내지 제5항 중 어느 한 항에 있어서,
상기 항-BST1 항체 또는 이의 항원-결합 영역이
(a) 서열번호 2 또는 서열번호 46과 적어도 80%, 85%, 90%, 95%, 99% 또는 100%의 아미노산 서열 동일성을 가진, 중쇄 가변 영역, 및
(b) 서열번호 4 또는 서열번호 49와 적어도 80%, 85%, 90%, 95%, 99% 또는 100%의 아미노산 서열 동일성을 가진, 경쇄 가변 영역
을 포함하는, 약학적 조합물. - 제1항 내지 제6항 중 어느 한 항에 있어서,
상기 항-BST1 항체가
(a) 서열번호 74와 적어도 80%, 85%, 90%, 95%, 99% 또는 100%의 아미노산 서열 동일성을 가진, 중쇄 가변 영역, 및
(b) 서열번호 76과 적어도 80%, 85%, 90%, 95%, 99% 또는 100%의 아미노산 서열 동일성을 가진, 경쇄 가변 영역
을 포함하는, 약학적 조합물. - 제1항 내지 제7항 중 어느 한 항에 있어서,
상기 항-BST1 항체가 인간 IgG1 단일클론 항체인, 약학적 조합물. - 제1항 내지 제8항 중 어느 한 항에 있어서,
상기 항-BST1 항체가 항체-의존적인 세포-매개 세포독성 (ADCC), 보체-의존적인 세포독성 (CDC) 및/또는 T 세포성 세포독성, 바람직하게는 ADCC를 유발하는, 약학적 조합물. - 제9항에 있어서,
상기 항-BST1 항체가 FC 수용체에 대한 결합성이 증가되거나 및/또는 ADCC에대한 효과가 증가된 조작된 항체이고, 바람직하게는 상기 항체가 비-푸코시화 (afucsoylation) 또는 탈푸코시화 (defucosylation)된 항체인, 약학적 조합물. - 제1항 내지 제10항 중 어느 한 항에 있어서,
상기 항체가, BST1을 포함하는 제1 항원; 및 CD3 항원 및 CD5 항원으로 이루어진 군으로부터 선택되는 제2 항원에 특이적으로 결합하는, 2중 특이성 항체 또는 다중 특이성 항체인, 약학적 조합물. - 제1항 내지 제11항 중 어느 한 항에 있어서,
상기 (A) 및/또는 (B)가 하나 이상의 약제학적으로 허용가능한 희석제, 부형제 또는 담체를 더 포함하는, 약학적 조합물. - 제1항 내지 제12항 중 어느 한 항에 있어서,
상기 약학적 조합물이, 급성 골수성 백혈병 (AML), B 세포 만성 림프성 백혈병, 유방암, 결장직장암, 신장암, 두경부암, 폐암, 난소암 및 췌장암, 바람직하게는 급성 골수성 백혈병 (AML)을 치료하기 위해, 동시, 개별 또는 순차적으로 사용하기 위한 조합 제제 형태인, 약학적 조합물. - 제1항 내지 제13항 중 어느 한 항에 있어서,
상기 (A) 및 (B)를 환자에게 투여함으로써 치료가 필요한 환자에서 암을 치료하기 위한 지침서를 더 포함하는, 약학적 조합물. - 키트로서,
(i) 제1항 또는 제4항 내지 제7항 중 어느 한 항에 따라 정의되는 항-BST1 항체 또는 이의 항원-결합 영역; 및
(ii) 시티딘 유사체, 바람직하게는 5-아자-시티딘 또는 5-아자-2'-데옥시시티딘, 또는 이의 약제학적으로 허용가능한 염
을 포함하는, 키트. - 제1항 내지 제13항 중 어느 한 항에 따라 정의되는 약학적 조합물의 구성성분 (A) 및 (B)를 치료학적 유효량으로 필요한 환자에게 동시, 개별 또는 순차적으로 투여하는 것을 포함하는, 환자에서 암 치료 방법.
- 제16항에 있어서,
상기 항-BST1 항체 또는 이의 항원-결합 영역이 비-푸코시화 (afucsoylation) 또는 탈푸코시화 (defucosylation)된, 방법. - 제16항 또는 제17항에 있어서,
상기 암이 급성 골수성 백혈병 (AML), B 세포 만성 림프성 백혈병, 유방암, 결장직장암, 신장암, 두경부암, 폐암, 난소암 및 췌장암, 바람직하게는 급성 골수성 백혈병 (AML)인, 방법. - 제1항 내지 제13항 중 어느 한 항에 있어서,
구성성분 (A) 및 (B)가 암 치료를 위해 환자에게 동시, 개별 또는 순차적으로 투여되는, 암 치료에 사용하기 위한 것인, 약학적 조합물. - 제19항에 있어서,
상기 항-BST1 항체 또는 이의 항원-결합 영역이 비-푸코시화 (afucsoylation) 또는 탈푸코시화 (defucosylation)된, 약학적 조합물. - 제19항 또는 제20항에 있어서,
상기 암이 급성 골수성 백혈병 (AML), B 세포 만성 림프성 백혈병, 유방암, 결장직장암, 신장암, 두경부암, 폐암, 난소암 및 췌장암, 바람직하게는 급성 골수성 백혈병 (AML)인, 약학적 조합물. - 암 치료를 위해 동시, 개별 또는 순차적으로 사용하기 위한 약학적 조합물의 제조에 있어, 제1항 내지 제13항 중 어느 한 항에 따라 정의되는 약학적 조합물의 구성성분 (A) 및 (B)의 용도.
- 제22항에 있어서,
상기 항-BST1 항체 또는 이의 항원-결합 영역이 비-푸코시화 (afucsoylation) 또는 탈푸코시화 (defucosylation)된, 용도. - 제22항 또는 제23항에 있어서,
상기 암이 급성 골수성 백혈병 (AML), B 세포 만성 림프성 백혈병, 유방암, 결장직장암, 신장암, 두경부암, 폐암, 난소암 및 췌장암, 바람직하게는 급성 골수성 백혈병 (AML)인, 용도. - 제1항 내지 제13항 중 어느 한 항에 따라 있어서,
테라피 (therapy)에 또는 약제로서 사용하기 위한 것인, 약학적 조합물.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GBGB1711785.4A GB201711785D0 (en) | 2017-07-21 | 2017-07-21 | Antibodies |
| GB1711785.4 | 2017-07-21 | ||
| PCT/EP2018/069768 WO2019016371A1 (en) | 2017-07-21 | 2018-07-20 | PHARMACEUTICAL ASSOCIATIONS COMPRISING ANTI-BST-1 ANTIBODY AND A CYTIDINE ANALOG |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20200032162A true KR20200032162A (ko) | 2020-03-25 |
Family
ID=59771583
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020207005030A KR20200032162A (ko) | 2017-07-21 | 2018-07-20 | 항-bst-1 항체 및 시티딘 유사체를 포함하는 약학적 조합물 |
Country Status (22)
| Country | Link |
|---|---|
| US (1) | US20200231694A1 (ko) |
| EP (1) | EP3655033A1 (ko) |
| JP (1) | JP2020527594A (ko) |
| KR (1) | KR20200032162A (ko) |
| CN (1) | CN111132697A (ko) |
| AR (1) | AR112460A1 (ko) |
| AU (1) | AU2018303241A1 (ko) |
| BR (1) | BR112020001320A2 (ko) |
| CA (1) | CA3070264A1 (ko) |
| CL (1) | CL2020000175A1 (ko) |
| CO (1) | CO2020001792A2 (ko) |
| EA (1) | EA202090333A1 (ko) |
| GB (1) | GB201711785D0 (ko) |
| IL (1) | IL272096A (ko) |
| MA (1) | MA49627A (ko) |
| MX (1) | MX2020000752A (ko) |
| PH (1) | PH12020550024A1 (ko) |
| SG (1) | SG11202000390TA (ko) |
| TW (1) | TW201907952A (ko) |
| UY (1) | UY37815A (ko) |
| WO (1) | WO2019016371A1 (ko) |
| ZA (1) | ZA202000881B (ko) |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB201809746D0 (en) * | 2018-06-14 | 2018-08-01 | Berlin Chemie Ag | Pharmaceutical combinations |
Family Cites Families (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE102004063494A1 (de) * | 2004-12-23 | 2006-07-13 | Tegenero Ag | Antikörper |
| PL2726508T3 (pl) * | 2011-06-28 | 2017-12-29 | Oxford Biotherapeutics Ltd | Przeciwciała przeciwko cyklazie ADP-rybozylowej 2 |
| GB201806084D0 (en) * | 2018-04-13 | 2018-05-30 | Berlin Chemie Ag | Antibodies |
| KR20220085796A (ko) * | 2019-10-18 | 2022-06-22 | 포티 세븐, 인코포레이티드 | 골수이형성 증후군 및 급성 골수성 백혈병을 치료하기 위한 조합 치료 |
-
2017
- 2017-07-21 GB GBGB1711785.4A patent/GB201711785D0/en not_active Ceased
-
2018
- 2018-07-20 MA MA049627A patent/MA49627A/fr unknown
- 2018-07-20 SG SG11202000390TA patent/SG11202000390TA/en unknown
- 2018-07-20 MX MX2020000752A patent/MX2020000752A/es unknown
- 2018-07-20 BR BR112020001320-0A patent/BR112020001320A2/pt not_active IP Right Cessation
- 2018-07-20 AU AU2018303241A patent/AU2018303241A1/en not_active Abandoned
- 2018-07-20 TW TW107125058A patent/TW201907952A/zh unknown
- 2018-07-20 AR ARP180102042 patent/AR112460A1/es unknown
- 2018-07-20 CA CA3070264A patent/CA3070264A1/en active Pending
- 2018-07-20 WO PCT/EP2018/069768 patent/WO2019016371A1/en unknown
- 2018-07-20 UY UY0001037815A patent/UY37815A/es not_active Application Discontinuation
- 2018-07-20 KR KR1020207005030A patent/KR20200032162A/ko active Search and Examination
- 2018-07-20 EA EA202090333A patent/EA202090333A1/ru unknown
- 2018-07-20 EP EP18746656.0A patent/EP3655033A1/en not_active Withdrawn
- 2018-07-20 CN CN201880060959.0A patent/CN111132697A/zh active Pending
- 2018-07-20 JP JP2020503018A patent/JP2020527594A/ja not_active Withdrawn
- 2018-07-20 US US16/632,195 patent/US20200231694A1/en not_active Abandoned
-
2020
- 2020-01-16 IL IL272096A patent/IL272096A/en unknown
- 2020-01-16 PH PH12020550024A patent/PH12020550024A1/en unknown
- 2020-01-20 CL CL2020000175A patent/CL2020000175A1/es unknown
- 2020-02-11 ZA ZA2020/00881A patent/ZA202000881B/en unknown
- 2020-02-18 CO CONC2020/0001792A patent/CO2020001792A2/es unknown
Also Published As
| Publication number | Publication date |
|---|---|
| MA49627A (fr) | 2020-05-27 |
| UY37815A (es) | 2019-02-28 |
| JP2020527594A (ja) | 2020-09-10 |
| CL2020000175A1 (es) | 2020-06-12 |
| IL272096A (en) | 2020-03-31 |
| AR112460A1 (es) | 2019-10-30 |
| TW201907952A (zh) | 2019-03-01 |
| US20200231694A1 (en) | 2020-07-23 |
| SG11202000390TA (en) | 2020-02-27 |
| AU2018303241A1 (en) | 2020-02-20 |
| CN111132697A (zh) | 2020-05-08 |
| ZA202000881B (en) | 2021-08-25 |
| WO2019016371A1 (en) | 2019-01-24 |
| MX2020000752A (es) | 2020-08-17 |
| GB201711785D0 (en) | 2017-09-06 |
| PH12020550024A1 (en) | 2021-02-15 |
| EA202090333A1 (ru) | 2020-05-06 |
| CA3070264A1 (en) | 2019-01-24 |
| CO2020001792A2 (es) | 2020-07-31 |
| EP3655033A1 (en) | 2020-05-27 |
| BR112020001320A2 (pt) | 2020-08-11 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| AU2014203781B2 (en) | Antibodies specific to Cadherin-17 | |
| US10982005B2 (en) | Antibodies to bone marrow stromal antigen 1 | |
| KR20130138802A (ko) | 항체 | |
| KR102058185B1 (ko) | Adp-리보실 시클라제 2에 대한 항체 | |
| US20210032360A1 (en) | Antibodies against bst1 for preventing or treating myelodysplastic syndrome | |
| KR20200032162A (ko) | 항-bst-1 항체 및 시티딘 유사체를 포함하는 약학적 조합물 | |
| US20120231004A1 (en) | Antibodies | |
| OA16799A (en) | Antibodies to ADP-ribosyl cyclase 2. |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination |