KR20180130544A - 위장관의 염증성 질환의 치료용 칸나비노이드 및 칸나비스-계 조성물 및 방법 - Google Patents
위장관의 염증성 질환의 치료용 칸나비노이드 및 칸나비스-계 조성물 및 방법 Download PDFInfo
- Publication number
- KR20180130544A KR20180130544A KR1020187031360A KR20187031360A KR20180130544A KR 20180130544 A KR20180130544 A KR 20180130544A KR 1020187031360 A KR1020187031360 A KR 1020187031360A KR 20187031360 A KR20187031360 A KR 20187031360A KR 20180130544 A KR20180130544 A KR 20180130544A
- Authority
- KR
- South Korea
- Prior art keywords
- composition
- thc
- cbd
- cannabis
- derived
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/35—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom
- A61K31/352—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom condensed with carbocyclic rings, e.g. methantheline
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/01—Hydrocarbons
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/045—Hydroxy compounds, e.g. alcohols; Salts thereof, e.g. alcoholates
- A61K31/05—Phenols
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K36/00—Medicinal preparations of undetermined constitution containing material from algae, lichens, fungi or plants, or derivatives thereof, e.g. traditional herbal medicines
- A61K36/18—Magnoliophyta (angiosperms)
- A61K36/185—Magnoliopsida (dicotyledons)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0053—Mouth and digestive tract, i.e. intraoral and peroral administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Natural Medicines & Medicinal Plants (AREA)
- Engineering & Computer Science (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Microbiology (AREA)
- Alternative & Traditional Medicine (AREA)
- Mycology (AREA)
- Medical Informatics (AREA)
- Botany (AREA)
- Biotechnology (AREA)
- Nutrition Science (AREA)
- Physiology (AREA)
- Immunology (AREA)
- Pain & Pain Management (AREA)
- Rheumatology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines Containing Plant Substances (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Medicinal Preparation (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
본 발명은 위장관(GI tract)의 염증성 질환, 구체적으로는 염증성 장 질환 (IBD)과 관련된 질환의 치료용 조성물 및 방법을 제공한다. 칸나비노이드의 특정 함량으로 인해 본 발명에 따른 조성물 및 이의 특정 투여 방식을 포함하는 방법은 특히 2개의 주요 IDBs인 크론병 및 대장염의 치료에 적용 가능하다.
Description
본 발명은 칸나비노이드 및 칸나비스-계 제형을 포함하는 약학 조성물, 및 이를 이용한 위장관(GI tract)의 염증성 질환, 구체적으로는 크론병 및 궤양성 대장염을 포함하는 염증성 장 질환 (IBD)의 치료 방법에 관한 것이다.
칸나비스의 약용 가치는 문헌에 잘 기록되어 있다. 칸나비스의 활성 성분인 칸나비노이드는 암컷 칸나비스 식물의 수지-생성 암꽃차례(pistillate inflorescence)에서 발견된다. 다양한 유형의 칸나비스, 예를 들어 칸나비스 사티바(Cannabis Sativa) 및 칸나비스 인디카(Cannabis Indica)는 60 내지 80 가지의 다른 종류의 칸나비노이드를 함유할 수 있으며, 그 중 대표적인 예는 테트라히드로칸나비놀(tetrahydrocannabinol; THC) 및 칸나비디올(cannabidiol; CBD)이다. 이 2 종류의 칸나비노이드는 다양한 정상 및 비정상 세포 및 조직에서 진통, 항구토 (antiemetic), 항산화, 신경보호 및 항염증성 활성을 포함하여, 많은 별개의 약리 효과와 관련되어 있다. 뇌 및 말초 조직에서 특정 수용체 및 리간드가 있는 내인성 칸나비노이드 시스템의 발견은 엔도칸나비노이드 시스템이 사전에 인식되지 않는 편재하는 항상성 네트워크(ubiquitous homeostatic network)를 나타낸다는 것을 이해하게 되었다. 적어도 2개의 분자 수용체 단백질 (CB1 및 CB2) 및 2개의 내인성 칸나비노이드 (아난다미드(anandamide) 및 2-아실글리세롤)는 신경계 및 면역계를 포함하여 수많은 신체 조직에서 확인되었다. 현재 엔도칸나비노이드 시스템은 우리의 종과 함께 진화하여 정상적인 인간 생리학, 특히 운동 조절, 통증, 식욕, 기억력, 면역 및 염증과 복잡하게 관련되어 있는 것처럼 보인다. 이것은 다양한 인간 질병의 치료를 위한 외인성 칸나비노이드 및 칸나비스-계 의약품의 엄청난 잠재력을 설명한다.
칸나비노이드의 많은 경구 제형은 오늘날 특정 임상 징후에 대한 처방에 의해 시판되고 있다. 참기름에서 합성 △9-THC인 드로나비놀(dronabinol)을 함유한 마리놀(Marinol) 캡슐은 암 화학 요법을 받는 환자의 항구토제로, 및 소모증후군 (wasting syndrome)을 앓고 있는 에이즈 환자의 식욕 자극제로 여러 나라에서 승인받았다. 합성 THC 유사체인 나빌론(nabilone)을 포함하는 세사메트(Cesamet) 캡슐은 최근에 마리놀 대체제로 승인받았다. 순수한 THC를 함유하는 나미솔(Namisol) 정제, CBD를 함유하는 아르비솔(Arvisol) 정제, 및 THC 및 CBD를 함유하는 구강 스프레이인 사티벡스(Sativex) (나빅시몰스(nabiximols))는 알츠하이머병, 만성 신경 통증 및 다발성 경화증을 포함하여 여러 징후에 대해 승인된 보다 최근의 칸나비스-계 제형이다.
본 발명은 위장관에 영향을 미치고 자가 면역으로 인해 나타날 가능성이 높은, 총칭하여 염증성 장 질환 (IBD)이라고 하는 염증성 질환 군에 적용된다. 2개의 주요 유형의 IBD는 궤양성 대장염 및 크론병이다. 궤양성 대장염은 주로 결장 또는 대장과 관련이 있으며, 크론병은 위장관의 일부, 가장 일반적으로 소장 또는 대장, 또는 둘 모두와 관련이 있다. 궤양성 대장염 및 크론병의 주요 증상은 통증, 부기(swelling) 또는 경련(cramping), 재발하거나 또는 혈성 설사(recurring or bloody diarrhea), 체중 감소 및 극도의 피로를 포함하며, 유사하다. IBD는 일반적으로 10대 후반 또는 20대 초반의 사람에게서 진단되나, 모든 연령대의 사람에게 영향을 미칠 수 있다. CDC에 따르면, 미국에서만 약 1,000 내지 1,300만 명의 사람이 IBD로 고통받고 있다. 크론병의 유병률은 성인 100,000명 당 200명으로 추정되며, 궤양성 대장염은 성인 100,000명 당 230명으로 추정된다.
현재 IBD에 대한 확실한 치료법은 없으며, 대다수의 치료법은 완화 치료를 나타낸다. IBD에 대한 전통적인 약리학적 치료는 염증을 감소시키는 아미노살리실레이트 또는 코르티코스테로이드, 및 면역계의 활성을 감소시키는 면역억제제를 포함한다. 궤양성 대장염의 중증 증상을 갖는 환자의 약 20%는 비-반응군(non-responders)이며, 일반적으로 염증 부위의 외과적 절제술을 받았다. 크론병에서는 약 60-75%의 환자가 수술을 받을 수 있다.
본 발명자들은 이전에 칸나비스의 특정 추출물이 IBD, 특히 크론병에 효과적일 수 있으며 [1, 2], 특정 품종이 비-GI 기원의 염증 동물 모델에서 항-염증 효과 및 침해수용(nociceptive) 효과를 가질 수 있다는 점에 주목하였다 [3]. 그럼에도 불구하고, 칸나비스를 이용한 이들 및 다른 인간 연구는 투약 및 투여 방식을 매우 개별화된 상태로 유지하면서 시행 착오에 크게 의존하였다.
흡연을 통해 투여된 칸나비스는 효과의 빠른 개시 및 용이한 용량 적정의 이점을 가진다. 그러나, 그을리거나 또는 증발된 칸나비스의 정확한 투여에 대한 지침은 아직 확립되지 않았다. 칸나비스는 쿠키와 같은 구운 제품으로 먹거나, 또는 차 또는 달인 차(infusions)로 마실 수 있다. 반대로, 이러한 제품의 흡수는 느리고 불규칙적이며, 효과의 개시는 흡연에 비해 훨씬 더 오래 지속된다. 유사하게, 다른 제형, 예를 들어, 버터, 오일, 크림 및 연고의 경우, 투여 정보는 현재 이용 가능하지 않고 정보의 대부분은 사실상 입증되지 않았다. 칸나비스의 알려진 화학 및 약리학에 기초하여 개발된 투여 계획은 여전히 상당한 논란으로 고통받고 있다.
그러나, 하나의 일반적인 개념은 투여 경로가 칸나비스의 다양한 칸나비노이드의 약물 동태학, 특히 흡수 및 대사의 중요한 결정 인자라는 것이다.
칸나비스가 안전하고 치사량의 칸나비스가 지금까지 보고된 적이 없다는 일반적인 믿음에도 불구하고, 칸나비스는 여전히 위험한 약물로 간주된다. 칸나비스의 부작용으로는 인지 및 기억 장애, 기분 변화, 변경된 지각(altered perception), 특히 청소년기에 충동 조절 감소, 직업 재해(occupational hazards), 혈압 변동, 실신(syncope) 또는 심계 항진(tachycardia), 특히 그을린 칸나비스에 의한 호흡 부전, 간 또는 신장 질환 환자에서 지방증의 중증도 증가, 여성의 임신 합병증, 및 남성의 불임 경계선을 포함한다. 또한, 중요한 약물-약물 상호작용이 있으며, 수면 진정제(sedative-hypnotics) 및 알콜이 가장 두드러진다. 칸나비스에 대한 사전 경험이 없는 환자는 일반적으로 매우 낮은 용량에서 시작하여 용납할 수 없거나 또는 바람직하지 않은 부작용이 발생하면 치료를 중단하도록 주의를 받는다. 따라서, 약용 칸나비스의 위험/이익 및 상업용으로 정제된 경구 제형의 관리는 여전히 어렵다.
따라서, 칸나비노이드 약리학의 복잡성, 칸나비노이드 수용체 분포의 개체간 차이, 밀도 및 기능, 칸나비노이드 대사 및 생체이용률, 및 다양한 칸나비스 식물의 칸나비노이드 함량의 이질성(heterogeneity)을 고려하여 더욱 중요한, 특정 임상 징후에 대해 약용 칸나비스의 사용의 이익을 극대화하고 위험을 최소화하는 표준이 절실히 필요하다. 본 발명은 특히 IBD의 맥락에서 이러한 문제점을 해결하기 위한 것이다.
1. Naftali T et al., 'Treatment of Crohn's Disease with Cannabis: An Observational Study', Israeli Medical Association Journal (IMAJ) 2011;13:455-458, described a retrospective study based on self-reporting of 20 patients suffering from Crohn's disease that were granted a license for medical Cannabis treatment.
2. Naftali T et al., 'Cannabis Induces a Clinical Response in Patients With Crohn's Disease: A Prospective Placebo-Controlled Study', Clinical Gastroenterology and Hepatology 2013;11:1276-1280, described study of 21 patients granted a license for medical cannabis for the treatment of Crohn's disease. The primary end point of the study was not achieved.
3. Gallily R et al., 'Overcoming the Bell Sjaped Dose-Response of Cannobidiol by using Cannabis Extract enriched in Cannabidiol', Pharmacology & Pharmacy 2015;6:75-85, described a specific strain of Cannabis particularly enriched in CBD as being capable of certain anti-inflammatory and nociceptive effects in animal models.
본 발명은 약용 칸나비스의 신규한 품종의 배양 및 이를 이용한 특정 임상 징후의 조절 방법의 개발과 함께 발명자의 축적된 경험에 기인한다. 특정 실시예와 관련하여, 본 발명은 3개의 칸나비스 품종 또는 3개의 별개의 칸나비스 식물 군에 관한 것이며, 그 중 특정 구성원은 일반적으로 형태학적 특징 및 배양 조건의 관점에서 기재되었다 (아래 참조). 추가 구성원을 포함한 이들 품종은 이제 IBD의 맥락에서 놀라운 임상적 특성 및 임상적 용도와 관련하여 기재된다. 이들 3개의 품종의 구성원은 이 문서 전반에 걸쳐 상표명으로 언급된다. 참조된 미국 식물 특허 출원은 이로부터 유래된 출원, 즉 계속 출원 또는 일부 계속 출원을 포함하여 본 명세서에 참조로 포함된다.
따라서, 특정 측면에서, 본 발명은 하기에 관한 것이다:
i. 특히 암컷 식물의 수지-생성 꽃에서 상대적으로 낮은 CBD와 함께 16 내지 24 중량% (w/w)의 양으로 THC가 농축된 칸나비스 품종으로부터 얻어진 파이토 (phyto)-유래 물질. 본 명세서에서 에레즈(Erez)라고 하는 이 군의 예시적인 구성원은 미국 식물 특허 출원 제 2014/0245494호에 일반적으로 기재되었다.
ii. 각각, 15 내지 16.5% (w/w)의 양으로 CBD가 농축되고 0.8 내지 3.75% (w/w)의 양으로 특히 낮은 THC가 있는 칸나비스 품종으로부터 얻어진 파이토-유래 물질. 본 명세서에서 아비데켈(Avidekel)이라고 하는 이 군의 예시적인 구성원은 미국 식물 특허 출원 제 2014/0259228호에 일반적으로 기재되었다.
iii. 각각, 10 내지 13% (w/w) 및 0.8 내지 12.5% (w/w)의 양으로 실질적으로 동일한 비의 THC:CBD를 갖는 칸나비스 품종으로부터 얻어진 파이토-유래 물질. 본 명세서에서 미드나이트(Midnight)라고 하는 이 군의 예시적인 구성원은 미국 식물 특허 출원 제 2014/0245495호에 일반적으로 기재되었다.
상기 품종의 예시적인 구성원으로부터 제조된 제제는 부작용의 감소 및 일반적인 삶의 질의 개선을 수반한, 혈액에 따른 염증 지수인 질환 활성 지수 (Disease Activity Index; DAI) 점수의 현저한 개선 및 장 질환 특이적 마커에 의해 밝혀진, IBD, 즉, 크론병 및 대장염 환자에서 특이적 치료 효과를 갖는다는 것이 현재 입증되었다.
특히, 본 발명에 따르면 상기 치료 효과는 단일 요법 및 병용 요법의 형태로 투여 요법의 특정 투여량을 적용함으로써 향상되고 지속될 수 있다.
현재의 연구들은 CBD가 농축된 파이토-유래 물질, 예를 들어 아비데켈 또는 이 군의 다른 구성원들로부터 유래된 물질의 오일-계 추출물이, 놀랍게도 IBD의 지속적인 치료 및 관리에 효과적임을 나타내었다. 이러한 CBD 농축 물질은 특히 크론병의 치료에 효과적이다. 아비데켈 및 이 군의 다른 구성원을 기반으로 한 조성물은 향정신성 효과(psychotropic effects)의 희소성 및 그에 따른 일일 투여의 적합성으로 인해 특히 흥미롭다.
연구는 THC가 농축된 파이토-유래 물질, 예를 들어 담배 형태의 에레즈 또는 이 군의 다른 구성원으로부터 유래된 물질이 IBD, 특히 하나 이상의 IBD 증상의 즉각적인 완화에도 효과적이라는 것을 더 입증하였다. 이러한 THC 농축 물질은 궤양성 대장염 환자에게 특히 유익하였다. 에레즈-계 조성물 등은, 이들의 높은 THC 함량 때문에, 야간 투여에 특히 적합하다.
본 연구에서 밝혀진 대체 치료법은, 예를 들어 담배 형태의 미드나이트로부터 유래된 물질에 의해 예시된, 동일하거나 또는 실질적으로 동일한 양의 THC 및 CBD를 함유한 파이토-유래 물질을 포함하고 있다. 이러한 종류의 제제는 특히 THC의 향정신성 효과를 순응하지 않는 환자에서 THC-농축 물질 (예를 들어, 에레즈)의 효과적인 대체제로 판명되었다. 이들의 THC:CBD 함량으로 인해, 미드나이트-계 조성물 등은 주간 및 야간 투여에 모두 적합하다.
특히, 약 300명의 IBD 환자 중 절반이 6개월 이상 치료받은 IBD 환자의 현재 기재된 연구는, 대다수의 환자에서 아비데켈, 에레즈 및/또는 미드나이트로부터 유래된 제제의 조합이 즉각적이고 지속적인 완화 및 치료, 및 IBD의 장기간 관리에 가장 효과적인 것으로 판명되었다.
이러한 결과는 여러 수준에서 적용된다:
첫째, IBD 및 IBD 관련 질병의 치료에 적용되는 특정 비율의 THC 및 CBD를 포함하는 특정 칸나비노이드 조성물의 관점에서;
둘째, IBD의 즉각적인 완화 및 장기간 관리를 제공하기 위한 특정 제형, 용량 및 투여 경로에 사용되는 특정 칸나비스-계 조성물의 관점에서;
셋째, 크론병 또는 대장염에 대한 특정 치료법으로 적용되는 특정 칸나비노이드 조성물의 관점에서.
후자의 요점은 이러한 질병의 감별 진단(differential diagnosis)이 어렵다는 점에서 특히 놀랍다.
상기 내용은 본 발명의 하기의 기재를 위한 기초를 제공한다. 본 명세서에 기재된 임의의 실시예 및 측면은, 다르게 표시되거나 또는 문맥으로부터 명백하지 않는 한, 서로 관련하여 사용될 수 있다는 것을 유의해야 한다. 다른 실시예들은 다음의 설명의 검토로부터 당업자에게 명백해질 것이다.
본 발명을 기재하기 전에, 본 명세서에서 기재된 방법 및 실험 조건뿐만 아니라 특정 실시예를 기재하기 위해 본 명세서에서 사용된 용어가 제한하려는 의도가 아니라는 점에 유의해야 한다. 달리 정의되지 않는 한, 본 명세서에서 사용된 모든 과학 기술 용어는 본 발명이 속하는 기술분야의 당업자에 의해 일반적으로 이해되는 의미를 갖는다. 본 명세서에 기재된 것과 유사한 또는 동등한 임의의 방법 및 물질이 본 발명의 실시 또는 시험에 사용될 수 있지만, 특정 방법 및 물질이 이제 기재된다.
본 발명은 일반적으로 IBD 및 IBD 관련 질병, 또는 IBD와 관련된 적어도 하나의 증상을 치료, 완화 또는 감소시키는 방법에 사용하기 위한 특정 비의 THC:CBD를 포함하는 조성물에 관한 것이다. 이러한 조성물은 담체, 완충제, 부형제를 더 포함할 수 있다.
즉, 본 발명은 구강, 식도, 위, 소장 및/또는 대장을 포함하는 위장관의 지속적인 국한성 장염(regional enteritis)을 특징으로 하는, '염증성 장 질환 (IBD)' 또는 질병으로 통칭되는 장 질환의 군에 관한 것이다. 이 군의 중요한 구성원은 크론병 및 궤양성 대장염, 및 과민성 대장 증후군(Irritable Bowel Syndrome; IBS)과 같은 관련 질병이다. 현재 기재된 조성물 및 방법으로부터 이익을 얻을 수 있는 환자의 감별 진단은 신체 검사; 병력(anamnesis); 및 분변 및 혈액 검사, 조직 검사(biopsy) 및 X 선, 유연한 결장 내시경(flexible sigmoidoscopy), 대장 내시경, 캡슐 내시경, CT 또는 MRI를 이용한 의료 영상을 포함하는 하나 이상의 진단 검사에 기초하여 치료 의사에 의해 이루어진다.
크론병은 일반적으로 정상 점막의 건너뛴 곳(skipped areas)을 갖는 것과 인접하지 않는다. 크론병의 궤양은 선형인 경향이 있으며, 종종 전형적인 자갈 모양 (cobblestone appearance)의 점막을 야기한다. 육아종(Granulomas)은 크론병의 60%에서 나타나며, 궤양성 대장염에서는 거의 나타나지 않는다. 크론병의 염증은 경벽성(transmural)일 수 있지만, 궤양성 대장염에서는 점막 및 점막하층에 국한된다. 크론병은 전체 위장관을 포함할 수 있지만, 궤양성 대장염은 대장만을 포함한다. 크론병 환자의 약 90%는 말단 회장(terminal ileum) 및/또는 우측 대장의 침범이 있다. 아주 어린 아이들은 종종 순전히 대장 질환으로 나타나지만, 소아 환자는 소장에 한정된 질환으로 나타날 가능성이 더 높다. 다양한 장 및 장외 증상 (intestinal and extraintestinal manifestations)은 크론병 또는 대장염과 함께 관찰될 수 있다. 이러한 2가지 형태의 IBDs를 구별하는 특징은 표 1에 요약되어 있다.
| 궤양성 대장염 | 크론병 |
| 대장만 관련됨 | 전체 장(Panintestinal) |
| 직장(rectum)에서 근위로 연장되는 연속적인 염증 | 정상 점막 사이에 있는 건너뛴-병변 |
| 점막 및 점막하층에서만 염증 | 경벽성 염증 |
| 육아종 없음 | 비치즈 육아종 (Noncaseating granulomas) |
| pANCA(Perinuclear ANCA) 양성 | ASCA 양성 |
| 출혈 (흔한) | 출혈 (드문) |
| 누공(Fistulae) (희귀) | 누공 (흔한) |
| 체중 감소 (흔한) | 체중 감소 (드문) |
| 폐색 (흔한) | 폐색 (흔한) |
특정 실시예에서, 본 발명의 조성물 및 방법은 다른 유형의 대장염, 예를 들어 특발성 대장염 (예를 들어, 림프구성 대장염, 콜라겐성 대장염, 화학적 대장염), 허혈성 대장염 및 감염성 대장염 (예를 들어, 클로스트리디움 디피실레 (Clostridium difficile), 시겔라 디센테리애(Shigella dysenteriae)), 및 확인할 수 없는 유형 또는 비정형 대장염에 적용할 수 있다.
또 다른 실시예에서, 본 발명은 IBD 관련 질병에 적용할 수 있다. 이 군의 일반적인 질병 중 하나는 설사형 (D-IBS), 변비형 (C-IBS), 및 혼합형 (M-IBS)을 포함하여, 만성 복통 및/또는 배변 습관의 불편함 및 변경을 특징으로 하는 질병의 스펙트럼인 과민성 대장 증후군 (IBS)이다.
가장 넓은 의미에서, 본 발명은 본 발명의 치료 방법을 이용하여 IBD의 치료에 적용할 수 있는 칸나비노이드 조성물을 제공한다. 용어 '칸나비노이드'는 본 명세서에서 엔도칸나비노이드, 파이토칸나비노이드 또는 합성 칸나비노이드를 포함한다. 특정 칸나비노이드는 THC, CBD 등을 포함할 뿐만 아니라, 합성, 반-합성 및 천연 칸나비노이드 (즉, 칸나비스 식물로부터 정제되거나 또는 추출됨)를 포함한다.
주요 측면에서, 본 발명은 테트라히드로칸나비놀-유형 (THC), 칸나비디올-유형 (CBD) 및 칸나비놀-유형 (CBN) 칸나비노이드에 관한 것이다.
'테트라히드로칸나비놀 (THC)'은 본 명세서에서 CB1 및 CB2 수용체에 대해 높은 친화도, 분자식 C21H30O2, 약 314.46 Da의 평균 질량 및 화학식 I의 일반 구조를 특징으로 하는 향정신성 칸나비노이드의 종류를 나타낸다.
[화학식 I]
'칸나비디올 (CBD)'은 본 명세서에서 CB1 및 CB2 수용체에 대해 낮은 친화도, 분자식 C21H30O2, 약 314.46 Da의 평균 질량 및 화학식 II의 일반 구조를 갖는 비-향정신성 칸나비노이드의 종류를 나타낸다.
[화학식 II]
'칸나비놀 (CBN)'은 분자식 C21H26O2, 310.19 Da의 평균 질량 및 화학식 III의 일반 구조를 갖는, CB1 수용체 및 CB2 수용체에서 THC의 부분 작용제로 작용하는 약한 향정신성 칸나비노이드의 종류를 나타낸다.
[화학식 III]
본 명세서에서 용어 'THC', 'CBD', 'CBN'는 이성질체, 유도체 또는 전구체, 예를 들어 (-)-트랜스-△9-테트라히드로칸나비놀 (△9-THC), △8-THC 및 △9-CBD, 및 각각의 2-카복실산 (2-COOH)인 THC-A 및 CBD-A로부터 유래된 THC 및 CBD를 포함한다.
다수의 조성물에서, 본 발명은 칸나비노이드 식물의 사용으로부터 유래되거나 또는 이를 기반으로 한 조성물을 제공하므로, '파이토-유래 조성물' 또는 파이토-유래 물질로 간주될 수 있다. 이 용어는 생약 제제(herbal preparations), 농축 추출물 및 정제된 생성물을 포함한다. 추출물에 관하여는, 여과, 얼음물 추출, 부탄 추출 또는 CO2 추출 공정, 용매 증발에 의해 제조된 오일 추출물과 같은 농축된 칸나비스-유래 물질을 제조하는 다수의 방법이 있다. 칸나비노이드의 주요 공급원 중 하나는 암컷 칸나비스 식물의 수지-생성 암꽃차례이다.
이와 관련하여, 현재 예시된 오일 내 아비데켈 제제는 활성 성분, 예를 들어, THC 및 CBD의 비율에 의해 원래 식물과 본질적으로 구별된다 점에 유의해야 한다 (표 3 및 4 참조).
이와 관련하여, 파이토-유래 물질 및 이의 추출물은 현재 확인된 활성 성분 THC, CBD 및 CBN 외에도, 추가의 칸나비노이드 및 식물 기원의 다른 성분 (예를 들어, 테르펜)을 포함하여, 치료적 영향 및 적용에서 이의 독특한 특성에 기여한다는 점에 더 유의해야 한다 (표 3 및 실시예 2 및 3 참조).
따라서, 많은 다른 측면에서, 본 발명은 IBD의 적어도 하나의 증상을 치료, 완화 또는 감소시키는 방법에 사용하기 위한 적어도 하나의 칸나비노이드 및 적어도 하나의 테르펜을 포함하는 파이토-유래 조성물을 제공하며, 여기서
(a) 상기 조성물은 THC가 농축된 칸나비스 식물, CBD가 농축된 칸나비스 식물, THC 및 CBD의 양이 실질적으로 동일한 칸나비스 식물 중 적어도 하나로부터 유래되고,
(b) 적어도 하나의 칸나비노이드는 THC, CBD 및 CBN으로부터 선택되며,
(c) 상기 적어도 하나의 테르펜은 모노테르펜 및 세스퀴테르펜으로부터 선택된다.
일 실시예에서, 본 발명의 조성물은 오일 추출물 또는 건조 물질의 제형으로 암컷 칸나비스 식물로부터 유래되며, 이들 모두는 현재 예시되어 있다.
언급한 바와 같이, 본 발명의 조성물은 식물 기원의 추가 칸나비노이드를 포함할 수 있다. 천연 칸나비노이드의 주요 종류는 아래 표 2에 열거되어 있다.
즉, 다수의 실시예에서, 본 발명의 조성물은 테트라히드로칸나비놀-유형 및 칸나비놀-유형 (THC, CBN), 칸나비디올-유형 (CBD), 칸나비게롤(cannabigerol)-유형 (CBG), 칸나비크로멘(cannabichromene)-유형 (CBC), 칸나비엘소인 (cannabielsoin)-유형 (CBE), 이소-테트라히드로칸나비놀-유형 (iso-THC), 칸나비시클롤(cannabicyclol)-유형 (CBL), 칸나비시트란-유형 (CBT), 유도체, 전구체, 또는 이들의 조합을 포함할 수 있다.
모든 종류는 칸나비게롤-유형 화합물로부터 유도되며, 전구체가 고리화되는 방법이 주로 상이하다. 전형적인 칸나비노이드는 탈카복실화 (열, 빛 또는 알칼리 조건에 의해 촉매화됨)에 의해 각각의 2-카복실산 (2-COOH, -A로도 표시됨)으로부터 유도된다. 테트라히드로칸나비놀 및 칸나비디올 산 전구체인, THC-A 및 CBD-A도 본 발명과 관련이 있다. 다수의 관련 파이토칸나비노이드는 아래에 열거된다:
- THC (테트라히드로칸나비놀, 2개의 동형 △9-THC, △8-THC 및 산형 THC-A 포함)
- CBD (칸나비디올 및 산형 CBD-A)
- CBN (칸나비놀)
- CBG (칸나비게롤)
- CBC (칸나비크로멘)
- CBL (칸나비시클롤)
- CBV (칸나비바린(Cannabivarin))
- THCV (테트라히드로칸나비바린)
- CBDV (칸나비디바린)
- CBCV (칸나비크로메바린(Cannabichromevarin))
- CBGV (칸나비게로바린(Cannabigerovarin))
- CBGM (칸나비게롤 모노에틸 에테르(Cannabigerol Monomethyl Ether))
테트라히드로칸나비바린 (THCV)은 칸나비스의 특정 중앙 아시아 및 남부 아프리카 품종에서 발견된다.
칸나비디바린 (CBDV)은 히말라야 북서쪽의 야생(feral) 칸나비스 식물, 및 네팔의 해시시(hashish)에서 발견된다.
칸나비크로멘 (CBC)은 열대 칸나비스 품종에서 더 흔하다.
따라서, 다수의 실시예에서, 본 발명의 조성물은 THC, CBD 및 CBN 외에도, THCA, CBDA, CBG, CBC, CBL, CBV, THCV, CBDV, CBCV, CBGV, CBGM, 유도체, 전구체 또는 이들의 조합을 포함할 수도 있다.
본 발명과 더 관련이 있는 것은 식물 기원의 또 다른 군의 활성 성분, 즉 테르펜 (또한 테르페노이드)이다. 테르펜은 기본 탄화수소이며, 테르페노이드는 화학 원소의 범위로 구성될 수 있는 여분의 작용기를 함유한다. 테르페노이드는 일반적으로 미국 식품의약국 및 기타 규제 기관에 의해 안전하다고 인정되는 향료 및 향료 성분이다. 테르페노이드는 대기(ambient air)에서 흡입되면 한자릿수(single digits) ng·mL-1의 혈청 수준에서 동물 및 인간의 행동에 영향을 미치는 강력한 작동체(potent effectors)로 간주된다. 이들은 이들의 치료 지수를 증가시키기 위해 칸나비노이드-계 약용 추출물에 기여할 수 있는 독특한 치료 효과를 낼 수 있다. 파이토칸나비노이드-테르페노이드 상호 작용의 본질은 아직 알려지지 않았지만, 통증, 염증, 우울증, 불안, 중독, 간질, 암, 곰팡이 및 세균 감염의 치료를 포함한 많은 사례에 의해 상승작용 (측근 효과(entourage effect)라고도 함)으로 인정되었다.
일 실시예에서, 테르펜 및 테르페노이드는 리모넨, 미르센, α-피넨, 리날로올(linalool), β-카리오필렌(caryophyllene), 카리오필렌 옥사이드, 네로리돌 (nerolidol) 및 파이톨(phytol)로부터 선택된다.
테르페노이드는 파이토칸나비노이드와 전구체를 공유한다. 본 발명의 목적을 위해, 이러한 유형의 분자는 본 명세서에서 종류의 관점에서 개별적으로 언급된다. 테르펜의 분류는 분자 내 이소프렌 단위의 수를 기준으로 한다. 모노테르펜은 2개의 이소프렌 단위로 이루어지며, 분자식 C10H16을 가진다. 모노테르펜의 관련 예는 리모넨, 미르센, 리날로올 또는 피넨을 포함한다. 세스퀴테르펜은 3개의 이소프렌 단위로 이루어지며, 분자식 C15H24을 가진다. 세스퀴테르펜의 예는 후물렌 (humulene), 파네센(farnesenes) 및 파네졸(farnesol)을 포함한다.
본 발명의 파이토-유래 물질에서 이들 군으로부터의 테르페노이드의 다양한 분포 및 비율은 현재 예시되어 있다 (표 3 및 부록 A 참조).
또한 이와 관련하여, 본 발명은 다른 유형의 칸나비스 품종으로부터 얻어진 상이한 유형의 파이토-유래 물질 또는 조성물에 관한 것이다. 용어 '품종 (cultivar)'은 일반적으로 번식하는 동안 유지되는 바람직한 특성을 위해 선택된 식물의 집합(assemblage)을 나타낸다. 현재 예시된 칸나비스 품종은 C. 사티바 및 C. 인디카의 혼성 품종으로, 더 나은 생존, 풍미, 색 및 냄새의 증진, 또는 약효와 같은 구체적인 특성을 강화하기 위해 개발되었다.
용어 '품종'은 일반적으로 여러 품종을 포함한다는 점에 유의해야 한다.
따라서, 일 실시예에서, 본 발명은 칸나비노이드 및 테르펜 함량 및 분포, 및 IBD 및 IBD 하위-유형에 대한 특이적 임상 효과에 기초하여 현재 특징화되고 구별되는 3개의 다른 유형의 칸나비스 품종에 관한 것이다. 구체적으로는, 본 발명은 하기에 관한 것이다:
i. 16-24% (w/w)의 범위 내의 THC가 농축되고 CBD가 상대적으로 낮거나 또는 거의 없는 칸나비스 품종으로부터 얻어진 파이토-유래 조성물, 이의 예는 에레즈임.
ii. 15-16.5% (w/w)의 범위 내의 CBD가 농축되고 0.8-3.75% (w/w)로 특히 낮은 THC가 있는 칸나비스 품종으로부터 얻어진 파이토-유래 조성물, 아비데켈로 예시됨.
iii. 각각 6-13% (w/w)의 범위 내의 실질적으로 동일한 비의 THC:CBD를 갖는 칸나비스 품종으로부터 얻어진 파이토-유래 물질, 본 명세서에서 미드나이트로 예시됨.
이들 품종 (또는 군)의 추가 품종 예는 표 3에 나타내었다.
따라서, 특정 실시예에서, 본 발명은 약 16 내지 24%의 THC 및 약 3% 이하의 CBD (w/w)를 포함하는, 군 (i)에 속하는 파이토-유래 조성물로서 표현될 수 있다.
보다 구체적으로, 이러한 조성물의 THC 함량은 적어도 약 10 내지 30%, 11 내지 29%, 12 내지 28%, 13 내지 27%, 14 내지 26%, 15 내지 25%, 16 내지 24%, 17 내지 23%, 18 내지 22% 또는 약 20% (w/w) 이하의 범위일 수 있다. 이러한 조성물은 적어도 약 0.1 내지 1%, 1 내지 2%, 2 내지 3% 또는 4 내지 5% CBD (w/w)의 범위 내의 낮은 CBD 함량을 포함할 수 있음을 유의해야 한다. 다수의 실시예에서, 조성물은 1% 미만의 CBD를 포함한다 (표 3 참조).
일 실시예에서, 조성물은 최대 1% (w/w) 또는 임의로 적어도 약 0.01 내지 1%, 0.1 내지 0.9%, 0.2 내지 0.8%, 0.3 내지 0.7%, 0.4 내지 0.6% 또는 약 0.5% (w/w)의 범위의 CBN 함량으로 더 특징지워진다 (실시예 1 및 표 4 참조).
일 실시예에서, 조성물은 파이토-유래 THC 농축 조성물로서 더 특징지워질 수 있으며, 여기서 CBD는 THC에 비해 최대 약 20%를 구성하고 CBN은 THC (w/w)에 비해 최대 약 7%를 구성하거나, 또는 CBD는 THC에 비해 적어도 약 1 내지 5%, 5 내지 10%, 10 내지 15%, 15 내지 20%의 범위 내이고; CBN은 THC (w/w)에 비해 적어도 약 10 내지 8%, 8 내지 6%, 6 내지 4%, 4 내지 2% 또는 2 내지 1%의 범위 내이다.
일 실시예에서, 본 발명의 파이토-유래 THC 농축 조성물에서, CBD는 최대 4 내지 6% THC 및 THC (w/w)에 비해 5% 미만의 양의 CBN을 구성한다.
다른 실시예에서, 본 발명은 약 14 내지 24% CBD 및 THC (w/w)에 대해 약 4% 이하를 포함하는, 상기 군 (ii)에 속하는 파이토-유래 조성물을 제공한다.
조성물의 CBD 함량은 적어도 약 10 내지 30%, 10 내지 20%, 11 내지 19%, 12 내지 18%, 12.5 내지 17.5%, 13 내지 17%, 13.5 내지 16.5%, 14 내지 16%, 14.5 내지 15.5%, 또는 약 15% 이하 (w/w)의 범위일 수 있다. 조성물은 THC (w/w)에 대해 적어도 약 0.1 내지 1%, 1 내지 2%, 2 내지 3% 또는 4 내지 5%의 범위 내의 낮은 THC를 더 포함할 수 있다. 다수의 실시예에서, 이러한 조성물은 THC에 대해 약 1 내지 2%를 포함한다 (표 3 참조).
조성물은 최대 1% (w/w), 또는 적어도 약 0.01 내지 1%, 0.1 내지 0.9%, 0.2 내지 0.8%, 0.3 내지 0.7%, 0.4 내지 0.6% 또는 약 0.5% (w/w)의 범위 내의 CBN 농도로 더 특징지워질 수 있다.
이들 조성물은 파이토-유래 CBD 농축 조성물로서 더 표현될 수 있으며, 여기서 CBD는 THC에 비해 최대 약 600%를 구성하고 CBN은 THC (w/w)에 비해 최대 약 25%를 구성하거나, 또는 CBD는 THC에 비해 적어도 약 100 내지 200%, 200 내지 300%, 300 내지 400%, 400 내지 500%, 500 내지 600%, 600 내지 700%, 700 내지 800%, 또는 최대 1,000% 이상의 범위 내이고, CBN은 THC (w/w)에 비해 적어도 약 1 내지 5%, 5 내지 10%, 10 내지 15%, 15 내지 20%, 20 내지 25%, 25 내지 30%, 및 최대 50% 이상의 범위 내이다.
일 실시예에서, 본 발명의 파이토-유래 CBD 농축 조성물에서, CBD는 THC에 비해 최대 600%를 구성할 수 있고 CBN은 THC (w/w)에 비해 최대 50%를 구성할 수 있다.
또 다른 실시예에서, 본 발명은 각각 적어도 약 6 내지 14% 및 6 내지 16% (w/w)의 범위 내의, 대략 동일한 양 (또는 농도)의 THC 및 CBD를 포함하는, 상기 군 (iii)에 속하는 파이토-유래 조성물을 제공한다.
이러한 조성물에서 CBD 또는 THC 함량은 적어도 약 1 내지 20%, 2.5 내지 17.5%, 5 내지 15%, 7.5 내지 10% 또는 적어도 약 12 내지 13% (w/w)의 범위 내일 수 있다. 조성물은 최대 1% (w/w), 또는 적어도 약 0.01 내지 1%, 0.1 내지 0.9%, 0.2 내지 0.8%, 0.3 내지 0.7%, 0.4 내지 0.6% 또는 약 0.5% (w/w)의 범위의 CBN 함량으로 더 특징지워진다.
이들 조성물은 THC 및 CBD의 양이 실질적으로 동일하고, CBN이 THC (w/w)에 비해 최대 약 17%, 또는 THC (w/w)에 비해 적어도 약 1 내지 5%, 5 내지 10%, 10 내지 15%, 15 내지 20%의 범위로 구성되는, 파이토-유래 조성물로서 더 표현될 수 있다.
일 실시예에서, 실질적으로 동일한 양의 THC 및 CBD를 포함하는 파이토-유래 조성물에서, CBN은 THC (w/w)에 비해 최대 약 7 내지 10%를 구성한다.
감별 치료 효과(differential therapeutic effects)의 관점에서, 상기 조성물의 군에서 THC 및 CBD의 역할은 이전에 논의되었다. CBN의 역할은 CBN이 CB1 수용체 및 CB2 수용체에서 THC의 부분 작용제로서 작용한다는 사실에 비추어 인지되어야 한다. 따라서, 이들 군에서 THC, CBD 및 CBN의 다양한 비율은 실시예 2-7에 반영된 이들의 치료 특성에 직접적인 관련이 있어야 한다.
여전히 다른 관점에서, 군 (iii)의 조성물은 THC:CBD 비가 약 1:1, 또는 실질적으로 1:1 (w/w), 또는 구체적으로는 적어도 약 1.5:1 내지 1:1.5 (w/w)의 범위의 비인 조성물로 기재될 수 있으며, 군 (i) 및 (ii)의 조성물은 상기 비가 상기 이외의 것인 조성물이다.
본 명세서에서 THC가 농축된 조성물은 각각 적어도 약 1.5:1 내지 2:1, 또는 2:1 내지 3:1, 또는 3:1 내지 5:1, 또는 5:1 내지 10:1, 또는 10:1 내지 50:1, 또는 50:1 내지 100:1 (w/w), 또는 그 이상의 범위 내의 THC:CBD의 비를 포함할 수 있음을 의미한다.
일 실시예에서, 이러한 조성물은 실질적으로 CBD를 포함하지 않는 것으로 언급된다. 본 명세서에서 용어 '실질적으로'는 각각 적어도 약 100:1 내지 250:1, 또는 250:1 내지 500:1, 또는 500:1 내지 750:1, 또는 750:1 내지 1000:1 (w/w), 또는 그 이상의 범위 내의 THC:CBD의 비를 나타내거나, 또는 측정가능한 CBD를 포함하지 않는 것으로 나타낸다.
CBD가 농축된 본 발명의 조성물은 각각 적어도 약 1:1.5 - 1:2, 또는 1:2 - 1:3, 또는 1:3 - 1:4, 또는 1:4 - 1:5, 또는 추가로 적어도 약 1:5 - 1:10, 또는 1:10 - 1:20, 1:20 - 1:30, 1:30 - 1:40, 1:40 - 1:50, 1:50 - 1:100 (w/w), 또는 그 이하의 범위 내의 THC:CBD의 비를 포함할 수 있다.
특정 실시예에서, 이러한 조성물은 실질적으로 CBD만을 포함하는 것으로, 즉 각각 적어도 약 1:100 내지 1:250, 또는 1:250 내지 1:500, 또는 1:500 내지 1:750, 또는 1:750 내지 1:1,000 (w/w), 또는 그 이하의 범위 내의 THC:CBD의 비를 포함하는 것으로 나타내거나, 또는 측정가능한 THC를 포함하지 않는 것으로 나타낸다.
이와 관련하여, 본 발명에서 혼용되는 용어 '약', '대략', '실질적으로'는 구체적으로 언급된 매개변수의 값, 예를 들어, 칸나비노이드 함량 또는 분포 (w/w)로부터 적어도 ±10%의 편차를 나타낸다.
본 명세서에서 수치 범위가 표시될 때마다, 표시된 범위 내에서 임의의 인용된 숫자 (분수 또는 정수)를 포함하는 것을 의미한다. 제 1 표시 숫자 및 제 2 표시 숫자 '사이의 범위(ranging/ranges between)' 및 제 1 표시 숫자 '내지(to)' 제 2 표시 숫자 '의 범위 내(in the range of)'는 본 명세서에서 혼용되며, 제 1 및 2 표시 숫자 및 그 사이의 모든 분수 및 정수 숫자를 포함하는 것을 의미한다.
다양한 실시예가 지정된 범위를 이용하여 기재되는 경우, 범위는 단지 편의상 및 간결함을 위해 제공되며, 본 발명의 범위를 제한하는 것으로 해석되어서는 안된다는 점에 유의해야 한다. 따라서, 범위의 기재는 가능한 모든 하위-범위 및 그 범위 내의 개별 수치 값을 구체적으로 개시한 것으로 간주되어야 한다.
일 실시예에서 언급된 바와 같이, 본 발명의 파이토-유래 조성물은 미르센, 리모넨 및 피넨으로부터 선택된 적어도 하나의 모노테르펜 및 카리오필렌, 구아이올(guaiol) 및 파네센으로부터 선택된 적어도 하나의 세스퀴테르펜을 더 포함할 수 있다. 다른 품종의 다양한 분포 특성을 갖는 본 발명의 조성물에서 이들 성분의 존재가 현재 예시되어 있다 (표 3 참조).
다수의 실시예에서, 본 발명의 조성물은 경구 투여 또는 흡연, 흡입 및 증발에 의한 투여에 적합한 제형으로 제공된다는 것을 더 이해해야 한다.
본 명세서에서 용어 '조성물'은 제약업에서 잘 알려진 기술을 이용하여 단위 제형으로 제시될 수 있는 약학 조성물을 포함한다. 동일한 방식으로, 본 명세서에서 용어 '담체', '완충제', '부형제'는 당업자에게 잘-알려진 '약학적으로 허용가능한 담체', 예를 들어, 비히클, 보조제, 부형제 또는 희석제를 포함한다. 약학적으로 허용가능한 담체는 일반적으로 화학적으로 불활성이며 해로운 부작용 또는 독성을 갖지 않는다.
경구 제형, 예를 들어 아비데켈로부터 유래된 조성물에 의해 본 명세서에 예시된 오일 추출물과 관련하여, 다수의 실시예에서, 이러한 조성물은 IBD와 관련된 적어도 하나의 약물 또는 치료제를 더 포함할 수 있다. 대안적으로, 다수의 실시예에서, 본 발명의 조성물을 이용한 치료 방법은 IBD와 관련된 적어도 하나의 약물의 동시 투여 단계를 포함할 수 있다.
일 실시예에서, 치료제 또는 약물은 항-염증제, 항-침해수용제, 항생제, 항구토제, 항-설사제 또는 이들의 임의의 조합의 군에 속한다.
IBD 관련 치료제의 대표적인 예는 하기의 것을 포함하나 이에 한정되지 않는다:
- 항-염증제, 주로 메살라진 (INN, BAN) (메살라민 (USAN) 또는 5-아미노살리실산 (5-ASA)으로도 알려짐), 여러 경구 제형으로 이용 가능 (상표명 Asacol, Delzicol, Asacol HD, Pentasa, Dipentum, Colazal, Apriso, 및 Lialda);
- 코르티코스테로이드 약물 (코르티손, 히드로코르티손, 프레드니손 및 부데소니드 포함), 특히 경구 제형 및 주사제로 이용 가능;
- 생물학적 약물, 주로 단일클론 항체 (인플릭시맙(infliximab) (INN; 상표명 Remicade, Remsima, Inflectra) 및 아달리무맙(adalimumab) (INN; 상표명 Humira 및 Exemptia), 표적 종양 괴사 인자 알파 (TNF-α) 포함);
- 면역억제 항대사물질(Immunosuppressive antimetabolites) (아자티오프린 (azathioprine) (INN; 상표명 Imuran), 메토트렉세이트(methotrexate) (INN; 상표명 Rheumatrex, Trexall, Otrexup, Rasuvo) 및 시클로스포린(cyclosporine) (INN; 상표명 Sandimmune) 포함), 경구 제형으로 이용 가능.
일 실시예에서, 본 발명의 조성물, 그 자체(per se), 또는 다른 약물과의 조합은, 혈액 및/또는 분변 시료에서 염증성 마커의 수준인 질환 활성 지수 (DAI)에 따른 점수 및/또는 크론병에 대한 단순 내시경 점수(Endoscopic Score for Crohn's Disease; SES-CD) 중 적어도 하나의 감소, 및/또는 체중, 통증에 대한 자가-보고, 장운동 및 삶의 질 중 적어도 하나의 개선을 측정함으로써 밝혀진, IBD 또는 IBD의 적어도 하나의 증상을 치료, 완화 또는 감소시키기는 것에 관한 것이다 (실시예 2-7 참조).
본 명세서에서 입증된 바와 같이, 상기 개선의 측정을 이용한, 본 발명의 특정 조성물은 크론병의 하나 이상의 증상을 치료, 감소 및 완화시킬 수 있다. 일 실시예에서, 이러한 조성물은 CBD 농축 조성물이라고 한다 (실시예 2 참조).
추가로 입증된 바와 같이, 본 발명의 특정의 다른 조성물은 대장염의 적어도 하나의 증상을 치료, 감소 및 완화시킬 수 있다. 일 실시예에서, 이러한 조성물은 THC 농축 조성물이라고 한다 (실시예 3 참조).
본 발명의 THC 농축 조성물의 특정 예가 현재 입증되었다. 이들은 본 명세서에서 에레즈, 알라스카(Alaska), 에란-알모그(Eran-Almog), 도리트(Dorit), 오메르 (Omer), 시라(Shira), 오르(Or), 조하르(Zohar), 바락(Barak), 탈(Tal) 또는 자스민(Jasmine)으로 명명된 적어도 하나의 칸나비스 품종으로부터 유래된 조성물을 포함하나, 이에 한정되지 않는다.
CBD 농축 조성물의 예는 본 명세서에서 아비데켈 또는 레파엘(Rephael)로 명명된 적어도 하나의 칸나비스 품종으로부터 유래된 조성물을 포함하나, 이에 한정되지 않는다.
THC 및 CBD가 대략 동일한 본 발명의 조성물의 예는, 미드나이트, 엘나 (Elna) 또는 망고(Mango)로 명명된 적어도 하나의 칸나비스 품종으로부터 유래된 조성물을 포함하나, 이에 한정되지 않는다.
특정 실시예의 목적을 위해, THC 및 CBD가 동일한 THC 농축 품종 또는 품종들로부터 유래된 조성물은, 흡연, 흡입 또는 증발에 적합한 건조 식물 물질의 제형으로 제공된다. 다른 실시예의 목적을 위해, CBD 농축 품종으로부터 유래된 조성물은 경구 제형, 예를 들어 오일 추출물로 제공된다.
본 발명의 조성물은 장기간 안정화, 고체 제형의 벌크업(bulking up)의 목적을 위해, 또는 약물 흡수 촉진, 점도 감소 또는 용해도 향상과 같은 최종 제형 내 활성 성분에 대한 치료 향상을 부여하기 위해, 활성 성분과 함께 제형화된 천연 또는 합성 물질인 다양한 첨가제를 더 포함할 수 있음을 이해해야 한다. 첨가제의 유형은 항-부착제 (예를 들어, 마그네슘 스테아레이트), 결합제 (예를 들어, 당류, 젤라틴, 합성 고분자), 코팅제 (예를 들어, 셀룰로오스 에테르), 착색제 (예를 들어, 산화 티탄), 붕해제 (예를 들어, 가교 고분자), 향료, 활택제 또는 윤활제 (예를 들어, 토크(talk), 식물성 스테아린), 방부제 (예를 들어, 항산화제), 흡수제 (sorbents) (예를 들어: 건조제), 감미료, 비히클 (예를 들어, 바셀린(petrolatum) 및 오일)을 포함한다.
일 실시예에서, 상기 기재된 경구 제형인, 본 발명의 칸나비스-계 조성물은 천연 오일, 예를 들어 올리브 오일을 포함한다.
본 발명의 조성물은 다른 파이토-유래 화합물, 즉, 질소 함유(nitrogenous) 화합물, 아미노산, 단백질, 효소, 당단백질(glycoprotein), 탄화수소, 알콜, 알데히드, 케톤, 지방산, 에스터 및 락톤, 스테로이드, 테르펜, 비-칸나비노이드 페놀, 플라보노이드, 비타민 및 안료를 더 포함할 수 있으며, 이들의 상대 빈도(relative abundance)는 칸나비스 품종 간에 다르다. 일부 화합물 (예를 들어, 테르펜, 플라보노이드)은 항-산화제, 항-불안제, 항-염증제, 항-박테리아제, 항-종양제(anti-neoplastic agents)로서의 역할도 한다.
본 발명의 또 다른 측면은 치료를 필요로 하는 환자에서 IBD의 적어도 하나의 증상을 치료, 완화 또는 감소시키는 방법을 제공하는 것이고, 상기 방법은 적어도 하나의 칸나비노이드 및 적어도 하나의 테르펜을 포함하는 적어도 하나의 파이토-유래 조성물을 환자에게 투여하는 단계를 포함하며, 여기서
(a) 상기 조성물은 THC가 농축된 칸나비스 식물, CBD가 농축된 칸나비스 식물, THC 및 CBD의 양이 실질적으로 동일한 칸나비스 식물 중 적어도 하나로부터 유래되고,
(b) 적어도 하나의 칸나비노이드는 THC, CBD 및 CBN으로부터 선택되며,
(c) 상기 적어도 하나의 테르펜은 모노테르펜 및 세스퀴테르펜으로부터 선택된다.
이와 관련하여, 본 발명의 방법은 또한 본 명세서에서 '적어도 하나의 증상'으로 지칭되는, IBD의 부분 증상을 치료, 완화 또는 감소시키기 위한 것임을 유의해야 한다.
일 실시예에서, 본 발명의 방법의 치료 효과는 혈액 및/또는 분변 시료에서 염증성 마커의 수준인 질환 활성 지수 (DAI)에 따른 점수 및/또는 크론병에 대한 단순 내시경 점수 (SES-CD) 중 적어도 하나의 감소, 및/또는 체중, 통증에 대한 자가-보고, 장운동 및 삶의 질 중 적어도 하나의 개선을 측정함으로써 명백해진다. 이러한 측정 및 시험의 적용 가능성은 현재 예시되어 있다. (실시예 2-7 및 도 1A-1I 및 3A-3I 참조).
일 실시예에서, 본 발명의 방법은 크론병 또는 대장염을 앓고 있는 환자에게 적용한다.
일 실시예에서, 상기 방법은 IBD에 관련된 하나 이상의 추가 약물의 동시 투여 단계를 더 포함한다. 용어 '동시' 투여 또는 공동-투여는 동시에 (동시) 및 연속하여 투여하는 것을 포함한다. 연속 투여는 본 명세서에서 특정 기간 내, 예를 들어 72시간, 48시간, 24시간, 12시간, 6시간, 3시간, 2시간, 1시간 또는 1시간 미만의 기간에 또는 동시에 본 발명의 하나 이상의 조성물, 또는 본 발명의 하나 이상의 조성물 및 최신의(state-of-the-art) 약학 조성물의 투여를 나타낸다. IBD 및 관련 질병에 관련된 약물은 상기에 기재되었다.
본 발명의 조성물 및 방법은 모든 연령 및 성별의 다양한 환자에게 적용 가능하다는 것을 이해해야 한다. IBD는 모든 연령 군에서 보고되었으나, 15세에서 35세 사이의 청소년 및 젊은 성인이 가장 감염되기 쉬운 것으로 간주되며, 앓는 사람의 10%는 18세 미만이다. IBD 발병의 또 다른 피크는 50세 이후이다. IBD는 남성보다 여성에서 더 만연한 것으로 여겨진다. 본 발명의 방법은 비-침습적인 모든 연령 군에 적용 가능하다. 다수의 실시예에서, 파이토-유래 조성물은 경구로 또는 흡입, 증발 또는 이들의 조합에 의해 투여됨으로써, 어린이 또는 노인 환자 모두에게 적용할 수 있다. 특정 실시예에서, 본 발명의 방법은 단독으로 또는 상기와 병용하여 흡연에 의해 투여하는 단계를 포함한다.
일 실시예에서, 본 발명의 조성물 및 방법은 종래의 요법, 예를 들어 아달리무맙 (휴미라 (Humira))에 대해 비-반응군으로 간주되는 환자에게 적용할 수 있다.
본 명세서에서 혼용할 수 있는 용어 '치료 용량' 또는 '치료적 유효량'은 상기와 같이 측정된 IBD의 적어도 하나의 증상의 개선을 생성하는 임의의 제형의 본 발명의 조성물의 용량에 관한 것이다. 이러한 의미에서, 치료 효과는 또한 약력학적(pharmacodynamic) 효과이다.
특정 실시예에서, 상기 IBD의 개선은 적어도 5%, 10%, 15%, 20% 개선, 또는 적어도 25%, 또는 적어도 50%, 또는 적어도 75%, 또는 적어도 100% 개선이다. 개선은 중증도, 빈도 또는 재발 및 약제의 동시 사용 등의 관점에서 하나 이상의 증상의 개선을 포함할 수 있다.
치료적 유효량 (또는 약리학적 또는 약학적 또는 생리학적 유효량)은 본 명세서에서 혈류 또는 예상되는 생리적 반응을 제공하기 위한 표적 장기(target organ)에서 원하는 수준의 활성제를 제공하는데 필요한 약학 조성물 내 활성제 (본 발명의 파이토-유래 조성물)의 양을 의미한다. 정확한 양은 다양한 요인, 예를 들어, 당업자에 의해 쉽게 결정될 수 있는, 제제의 유형, 조성물의 활성, 의도된 환자 사용 (예를 들어, 1일 복용 횟수), 환자 고려 사항 등에 따라 달라질 것이다. 제제의 유효량은 총 유효량, 바람직하게는 24시간 이내의 양을 한번 투여 또는 여러번 투여를 통해 투여될 수 있다. 적당한 투여량 및 투여 시기를 결정하기 위해 표준 임상 절차를 이용하여 결정할 수 있다. 유효량은 치료 건강 관리 전문가 및/또는 개인의 경험적 및/또는 개별적 (사례별) 결정의 결과일 수 있음을 이해한다.
이와 관련하여, 본 발명의 특정 파이토-유래 조성물, 구체적으로는 아비데켈 유래의 CBD 농축 오일 추출물의 약동학적 프로파일이 현재 입증되었다 (실시예 2 및 도 2A-2D 참조).
본 발명의 다른 특징은 IBD의 완전 또는 부분 증상의 즉각적이고 및/또는 지속적인 완화, 감소 또는 치료를 위한 조성물 및 방법을 제공하는 것이다. 본 명세서에서 용어 '즉각적인' 및 '지속적인'은 이전의 상세한 측정 및 특정 질환 지수에 따라 상기 증상(들)의 개선에 의해 정의된 본 발명의 조성물의 치료 효과의 개시 및 지속 기간을 나타낸다.
용어 '즉각적인'은 본 발명의 조성물을 투여한 후 약 1 내지 30분 이내, 또는 적어도 약 1 내지 30분, 1 내지 20분, 1 내지 15분, 1 내지 10분, 1 내지 5분, 또는 그 이하의 범위 내에, 적어도 약 1 내지 30분, 1 내지 40분, 1 내지 50분, 1 내지 60분, 및 최대 2시간, 또는 그 이상의 지속 기간을 갖는 치료 효과의 개시를 의미하며, 지속 기간은 투여 용량 및 투여 경로에 더 의존한다.
일 실시예에서, 본 발명의 방법 및 조성물은 IBD 증상, 구체적으로는 THC가 농축된 또는 THC 및 CBD 양이 실질적으로 동일한 파이토-유래 조성물의 투여에 수반되는 증상의 즉각적인 완화에 적용한다. 이러한 조성물의 즉각적인 효과는 현재 입증되었다 (실시예 3 참조).
특정 실시예에서, 방법은 약 16-24% THC 및 약 3% 이하의 CBD 또는 약 6-14% THC 및 6-16% CBD (w/w)를 포함하는 조성물을 투여하는 단계를 포함한다. 다른 실시예에서, 방법은 최대 약 1% CBN (w/w)을 더 포함하는 조성물을 투여하는 단계를 포함한다.
다른 실시예에서, 조성물에 포함된 CBD는 THC에 비해 최대 약 20%를 구성하고 CBN은 THC (w/w)에 비해 최대 약 7%를 구성하거나, 또는 THC 및 CBD가 실질적으로 동일한 양인 조성물의 경우, CBN은 THC (w/w)에 비해 최대 약 17%를 구성한다.
일 실시예에서, 방법은 흡연, 흡입, 증발 또는 이들의 조합에 의해 본 발명의 조성물을 투여하는 단계를 포함한다.
특정 실시예에서, 이러한 방법은 본 명세서에서 에레즈, 알라스카, 에란-알모그, 도리트, 오메르, 시라, 오르, 조하르, 바락, 탈, 자스민, 미드나이트, 엘나 또는 망고로 명명된 적어도 하나의 칸나비스 품종으로부터 유래된 적어도 하나의 조성물을 투여하는 단계를 포함한다.
본 발명의 또 다른 특징은 흡연, 흡입, 증발 또는 이들의 조합에 의해 투여되는, 본 명세서에서 에레즈로 명명된 칸나비스 품종으로부터 유래된 THC-농축 조성물을 투여함으로써 대장염을 치료하는 방법을 제공하는 것이다.
다른 실시예에서, 본 발명의 방법 및 조성물은 IBD 증상, 구체적으로는 CBD가 농축된 파이토-유래 조성물의 투여에 수반되는 증상의 지속적인 완화에 적용한다. 용어 '지속적인'은 본 발명의 조성물을 투여한 후 30분 이상, 또는 적어도 약 30 내지 40분, 30 내지 50분, 30 내지 60분, 30 내지 120분, 또는 그 이상의 범위 내에, 적어도 약 1 내지 2시간, 1 내지 3시간, 1 내지 4시간, 1 내지 5시간, 1 내지 6시간, 1 내지 10시간, 1 내지 20시간, 1 내지 30시간, 또는 그 이상의 지속 기간을 갖는 치료 효과의 개시를 의미하며, 지속 기간은 투여 용량 및 투여 경로에 더 의존한다.
일 실시예에서, 이러한 방법은 약 14-24% CBD 및 약 4% 이하의 THC (w/w)를 포함하는 조성물을 투여하는 단계를 포함한다. 일 실시예에서, 방법은 최대 약 1% CBN (w/w)을 더 포함하는 조성물을 투여하는 단계를 포함한다. 다른 실시예에서, 이들 조성물에 포함된 CBD는 THC (w/w)에 비해 최대 약 600%를 구성하고, CBN은 THC (w/w)에 비해 최대 약 50%를 구성한다.
일 실시예에서, 상기 방법은 조성물의 경구 투여를 포함한다. 특정 실시예에서, 이러한 방법은 본 명세서에서 아비데켈 또는 레파엘로 명명된 적어도 하나의 칸나비스 품종을 투여하는 단계를 포함한다.
본 발명의 또 다른 구체적인 특징은 본 명세서에서 아비데켈로 명명된 칸나비스 품종으로부터 유래된 CBD-농축 조성물을 경구 투여함으로써 크론병을 치료하는 방법을 제공하는 것이다.
본 발명의 또 다른 중요한 측면은 IBD 및 관련 질병의 장기간 치료 및 관리 방법을 제공하는 것이다. 구체적으로는, 이러한 방법은 IBD 환자에게
(i) THC가 농축된 칸나비스 식물 또는 THC 및 CBD의 양이 실질적으로 동일한 칸나비스 식물로부터 유래된 적어도 하나의 조성물, 및
(ii) CBD가 농축된 칸나비스 식물로부터 유래된 적어도 하나의 조성물
을 투여하는 단계를 포함하는 병용 요법을 포함한다.
일 실시예에서, 투여 (i) 및 (ii)는 연속하여 일일 요법으로 수행된다.
다른 실시예에서, 투여 (i)는 자기 전에 수행되고, 투여 (ii)는 깨어있는 시간 동안 수행된다.
특정 실시예에서, 단계 (i)에서 투여된 조성물은 약 16 내지 24% THC 및 약 3% 이하 CBD, 또는 약 6 내지 14% THC 및 6 내지 16% CBD (w/w)를 포함하며, 단계 (ii)에서 투여된 조성물은 약 14 내지 24% CBD 및 약 4% 이하 THC (w/w)를 포함한다.
다른 실시예에서, 병용 요법은 약 1% CBN (w/w)을 더 포함하는 조성물을 투여하는 단계를 포함한다.
또 다른 실시예에서, 단계 (i)에서 이용된 조성물에 포함된 CBD는 THC에 비해 최대 약 20%를 구성하고 CBN은 THC (w/w)에 비해 최대 약 7%를 구성하거나, 또는 THC 및 CBD가 실질적으로 동일한 양인 조성물의 경우 CBN은 THC (w/w)에 비해 최대 약 17%를 구성하고, 단계 (ii)의 조성물의 경우 CBD는 THC (w/w)에 비해 최대 약 600%를 구성하고, CBN은 THC (w/w)에 비해 최대 약 50%를 구성한다.
특정 실시예에서, 방법은 단계 (i)에서 본 명세서에서 에레즈, 알라스카, 에란-알모그, 도리트, 오메르, 시라, 오르, 조하르, 바락, 탈, 자스민, 미드나이트, 엘나 또는 망고로 명명된 적어도 하나의 칸나비스 품종으로부터 유래된 조성물 및 단계 (ii)에서 본 명세서에서 아비데켈 또는 레파엘로 명명된 적어도 하나의 칸나비스 품종으로부터 유래된 조성물을 투여하는 단계를 포함한다.
다른 실시예에서, 단계 (i)에서 투여된 조성물은 흡연, 흡입, 증발 또는 이들의 조합에 의해 투여되고, 단계 (ii)에서 투여된 조성물은 경구로 투여된다.
병용 요법은 실시예 7에서 상세히 연구되었다. 연속하여 THC 농축 및 CBD 농축 조성물을 이용한 병용 요법의 놀라운 효과는 THC 농축 또는 CBD 농축 조성물을 이용한 단일 요법에 비해 질환 지수의 유의한 개선, 현저히 낮은 횟수 및 중증도의 부작용, 및 일반적인 삶의 질의 개선으로 입증되었다.
가장 놀랍게도, 이러한 병용 요법은 동일한 조성물 (즉, 미드나이트)로 투여될 때, THC 및 CBD의 조합을 이용한 단일 요법보다 더 유익한 것으로 입증되었다.
또한, 병용 요법은 THC 농축 조성물이 지금까지 보다 효과적이라고 여겨졌던 통증 관리에서 더 효과적인 것으로 판명되었다.
현재 예시된 제형과 관련하여, 담배 형태의 본 발명의 THC 농축 조성물 또는 동일한 THC 및 CBD를 포함하는 조성물은 IBD 증상 및/또는 대장염의 즉각적인 경감을 위한 것이다. 연기에서 전달된 THC의 절대량은 다양하며 20-70%로 추정되고, 나머지는 연소 또는 부류연(side-stream smoke)을 통해 손실된다. 담배 형태의 THC의 허용가능한 용량은 하루에 최대 60 내지 70mg에 도달할 수 있다.
일일 용량의 관점에서, 특정 실시예에서, 이러한 담배는 매일, 바람직하게는 자기 전에, 또는 증상(들)이 나타나면 하루에 1개 또는 2개의 담배 또는 그 이상으로, 때때로, 주기적인 또는 연속적인 치료로서 소비된다. 경구 제형, 특히 CBD가 농축된 오일 추출물의 관점에서, 이들은 IBD 및/또는 크론병의 증상(들)의 지속적인 완화를 위한 것이다. 이러한 유형의 조성물은 방울(drops)의 형태로 소비된다. 아비데켈 오일의 한 방울, 예를 들어, 0.04 ml의 부피는 약 6 mg CBD 및 약 1.5 mg THC를 갖는 것으로 추정되었다.
일 실시예에서, 단일 경구 제형은 적어도 약 10-100 mg, 10-80 mg, 10-70 mg, 10-60 mg, 또는 10-50 mg CBD, 또는 15-45 mg, 20-40 mg, 25-35 mg, 또는 약 30 mg CBD, 및 5-8 mg, 5.5-7.5 mg, 6-7 mg, 또는 약 6.5 mg THC의 범위 내의 투여 당 평균 CBD/THC 함량과 함께, 약 최대 14-15 방울, 또는 1-2, 2-4, 4-6, 6-8, 8-10, 10-12, 12-14 방울 또는 그 이상의 범위 내로 포함한다.
특정 실시예에서, 단일 경구 제형은 투여 당 평균 5 mg 미만의 THC 함량을 포함하는 것으로 이해해야 한다.
일일 용량의 관점에서, 지속적인 효과를 얻기 위해, 상기 경구 제형은 적어도 약 50-100 mg, 100-150 mg, 150-200 mg, 200-250 mg CBD, 또는 그 이상의 범위 내의 평균 일일 용량과 함께, 하루에 최대 적어도 약 300-500 mg CBD, 및 15-25, 16-24, 17-23, 18-22, 19-20 mg THC, 또는 그 이하의 최대 일일 용량과 함께, 적어도 하루에 1회, 하루에 2회 또는 하루에 3회 또는 그 이상 투여된다.
또한, 특정 실시예에서, 지속적이고 지속 가능한 효과를 얻기 위해, 상기 CBD 농축 경구 제형은 적어도 약 최대 4, 5, 6, 7, 8, 9, 10, 11, 12주, 수개월 및 수년 동안, 또는 증상(들)의 전체 지속 기간 동안 연속적으로 투여된다.
일일 요법의 관점에서, 이러한 경구 제형은 주기적인 또는 연속적인 치료로서 하루 동안 복용된다.
이의 또 다른 측면 중 하나에서, 본 발명은 IBD의 적어도 하나의 증상의 치료 또는 완화 또는 감소를 위한 약제의 제조를 위해 본 발명의 파이토-유래 조성물의 용도를 제공한다.
달리 정의되지 않는 한, 본 명세서에서 사용된 모든 과학 기술 용어는 본 발명이 속하는 기술 분야의 당업자에 의해 일반적으로 이해되는 것과 동일한 의미를 갖는다. 본 명세서에 기재된 것과 유사한 또는 동등한 임의의 방법 및 물질이 본 발명의 실시 또는 시험에 사용될 수도 있지만, 바람직한 방법 및 물질은 이제 기재된다.
본 발명을 읽으면 당업자에게 명백한 바와 같이, 본 명세서에 기재된 개별적인 실시예 각각은, 본 발명의 범위 또는 정신으로부터 벗어나지 않고 다른 몇몇 실시예의 임의의 특징으로부터 쉽게 분리되거나 또는 결합될 수 있는 별개의 성분 및 특징을 갖는다. 임의의 언급된 방법은 열거된 결과의 순서로 또는 논리적으로 가능한 다른 순서로 수행될 수 있다.
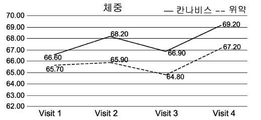
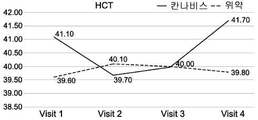
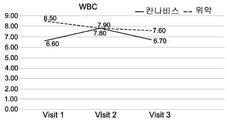
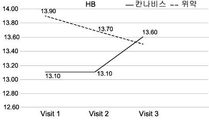
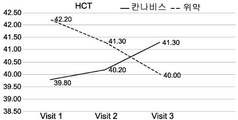
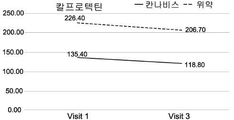
도 1A-1I는 크론병의 치료와 관련된 본 발명의 특정 실시예를 예시한다. 도면은 경구로 투여되는, THC 4% 및 CBD 16% (비 1:4) (N=18)를 포함하는 아비데켈-유래 오일 추출물 또는 위약 (N=21)으로 처리한 환자를 포함하여, 활성 크론병 환자의 전향적 연구(prospective study)의 임상 결과를 기재한다. 도면은 치료군 (검은색 실선) 대 위약군 (점선)에서 8주 추적 및 2주 휴식기(wash out period) 동안 관찰된 일반적인 경향을 나타낸다. 도 1A는 크론병 활성 지수 (CDAI)의 평가에 관한 것이다; 도 1B는 삶의 질 (SF-36) 설문지에 따른 정신 건강 상태 및 부작용에 대한 보고에 관한 것이다; 도 1C-1F는 일반적인 임상 매개변수, 즉, 환자의 체중, 백혈구 (WBC), 헤모글로빈 (HB) 및 적혈구용적률 (hematocrit; HCT)의 수준에 관한 것이다; 도 1G-1I는 크론병에 특이적인 임상 매개변수, 즉, 혈액에서의 C-반응성 단백질 (CRP)의 수준 (염증의 마커); 분변 칼프로텍틴(fecal Calprotectin) (장 염증의 마커); 및 SES 대장 내시경 점수에 관한 것이다.
도 2A-2D는 2개의 주요 칸나비노이드인 THC (△9-THC) 및 CBD, 및 2개의 대사산물인 11-히드록시 △9-THC (활성 대사산물) 및 △9 카복시 THC (불활성 대사산물)를 포함하여, 아비데켈-유래 오일 추출물의 약동학적 프로파일과 관련하여 본 발명의 다른 실시예를 예시한다. 도 1A-1I에 기재된 연구로부터의 환자의 하위-군(sub-group)에서 약동학적 연구를 수행하였다. 구체적으로는: 도 2A는 LC-MS/MS (N=7)에 의해 측정된, 15, 30, 45, 60 및 90분, 및 2, 3, 4, 5 및 6시간의 시점에서 THC (△9-THC) (ng/mL)의 평균 혈청 수준을 나타낸다; 도 2C-2D는 동일한 군에서 각각 CBD (ng/mL), 11-히드록시 △9-THC 및 △9 카복시 THC에 관하여 유사한 프로파일을 나타낸다.
도 3A-3I는 대장염의 치료와 관련된 본 발명의 다른 실시예를 예시한다. 도면은 흡연으로 투여되는, THC (23%) (N=14)가 농축된 에레즈-유래 물질 또는 위약 담배 (N=13)로 처리한 궤양성 대장염 환자의 임상 결과를 기재한다. 도면은 유사한 도 1A-1I 후에 치료군 (검은색 실선) 대 위약군 (점선)에서 관찰된 일반적인 경향을 나타낸다.
도 2A-2D는 2개의 주요 칸나비노이드인 THC (△9-THC) 및 CBD, 및 2개의 대사산물인 11-히드록시 △9-THC (활성 대사산물) 및 △9 카복시 THC (불활성 대사산물)를 포함하여, 아비데켈-유래 오일 추출물의 약동학적 프로파일과 관련하여 본 발명의 다른 실시예를 예시한다. 도 1A-1I에 기재된 연구로부터의 환자의 하위-군(sub-group)에서 약동학적 연구를 수행하였다. 구체적으로는: 도 2A는 LC-MS/MS (N=7)에 의해 측정된, 15, 30, 45, 60 및 90분, 및 2, 3, 4, 5 및 6시간의 시점에서 THC (△9-THC) (ng/mL)의 평균 혈청 수준을 나타낸다; 도 2C-2D는 동일한 군에서 각각 CBD (ng/mL), 11-히드록시 △9-THC 및 △9 카복시 THC에 관하여 유사한 프로파일을 나타낸다.
도 3A-3I는 대장염의 치료와 관련된 본 발명의 다른 실시예를 예시한다. 도면은 흡연으로 투여되는, THC (23%) (N=14)가 농축된 에레즈-유래 물질 또는 위약 담배 (N=13)로 처리한 궤양성 대장염 환자의 임상 결과를 기재한다. 도면은 유사한 도 1A-1I 후에 치료군 (검은색 실선) 대 위약군 (점선)에서 관찰된 일반적인 경향을 나타낸다.
실시예는 본 발명의 측면의 수행에서 발명자에 의해 사용된 기술을 대표한다. 이들 기술은 본 발명의 실행을 위한 바람직한 실시예의 예시이지만, 본 발명의 관점에서, 당업자는 본 발명의 정신 및 의도된 범위로부터 벗어나지 않고 많은 변형이 이루어질 수 있다는 것을 인식할 것임을 이해해야 한다.
실시예
물질 및 방법
1. 본 발명의 파이토-유래 조성물의 생화학적 분석
기체 크로마토그래피-질량 분광법 (GC-MS) 분석을 위한 표준 절차를 이용하여 칸나비노이드 및 테르펜의 함량을 측정하였다. 간단히 말하면, 건조 식물-유래 물질을 분말화하고, 유기 용매 (n-헥산)로 추출한 다음, 여과하고, 시료 (1 μL)를 GC-MS (전자 이온화 검출기가 있는 HP-5971 기체 크로마토그래프를 갖는 Hewlett Packard G 1800B GCD 시스템)에 로딩하였다. 관심있는 화합물은 표준, 보유 시간, Kovats 지수 및 이용가능한 라이브러리 (소프트웨어 GCD Plus Chemstation)를 비교하여 확인하였다. 특정 칸나비노이드 (THC, CBD)의 비는 총 칸나비노이드 함량에 대해 결정하였고, 특정 테르펜의 비는 주요 테르펜 (100%)에 대해 결정하였다.
2. 꽃-유래 물질로부터 오일 추출물의 제조
오일 추출물은 이전에 기재된 절차, 즉, CO2 추출 공정 또는 에탄올을 이용한 용매 증발을 이용하여 올리브 오일의 존재 하에 아비데켈 품종으로부터 제조하였다. 오일 제제의 칸나비노이드 함량은 표준 절차에 의하여 LC-MS 또는 HPLC를 이용하여 측정하였다. 오일 추출물의 배치는 ISO9001 및 HACCP 품질 관리 기준에 따라 관찰되었다.
3. 임상 시험에서의 용량 적정
임상 연구에 참여한 각 환자는 개별 용량의 적정을 받았다. 적정 기간은 약 3주였으며, 초기 용량 및/또는 용량 요법 (1일 투여 횟수)을 점차적으로 증가시켜 (정신 상태, 치매의 행동 및 심리적 증상 (BPSD), 운동 기능 및 안정성의 감소, 혈압, 당 수치, 호흡수, 맥박의 유의한 변화에 따라 평가된) 부작용을 최소화하면서 최대 임상 효과를 달성하였다. 일일 용량은 400 mg 활성 칸나비노이드인, CBD 및 THC를 초과하지 않았다.
4. 크론병 환자의 전향적 임상 연구
THC 4% 및 CBD 16% (THC:CBD 비 1:4)를 포함하는 아비데켈 오일 추출물 또는 엽록소가 있는 올리브 오일을 포함하는 위약을 투여받을 환자를 무작위로 할당하였다. 환자와 연구자 모두 할당 절차를 알지 못하였다. 환자들은 8주 치료의 추적 기간 및 추가의 2주 휴식기를 받았다. 기준선 및 2주, 8주 및 10주에서의 추적 자료는 임상 면담, 신체 검사, 질환 활성 평가 (CDAI), 및 혈액 검사 (완전 혈구 계수, 간 및 신장 기능, 염증에 대한 C-반응성 단백질 (CRP) 마커), SES 대장 내시경 검사, 직접 장 염증에 대한 칼프로텍틴 검사, 표준화된 삶의 질 (SF-36) 설문지를 이용한 부작용에 대해 이용하고 보고한 신체적 및 정신적 건강 상태의 측정을 포함하였다.
6. 크론병 환자의 약동학적 연구
전향적 임상 시험에 참여한 크론병 환자 (N=7). 아비데켈 오일 추출물을 설하에 4 방울 투여한 후, 혈액 시료를 시간 0에서 회수하였다. 혈액 시료를 15, 30, 45, 60 및 90분, 및 2, 3, 4, 5 및 6시간의 간격으로 회수하였으며, LC-MS/MS를 이용하여 NMS Labs에서 분석할 때까지 -70℃에서 보관하였다. 분석은 THC (△9-THC), CBD, 11-히드록시 △9-THC (활성 대사산물) 및 △9 카복시 THC (불활성 대사산물)를 포함하여, 2개의 주요 칸나비노이드 및 2개의 대사산물과 관련이 있다.
6. 궤양성 대장염 환자의 임상적 연구
THC 23%를 포함하는 1 gr 꽃-유래 물질을 함유한 담배 형태의 에레즈 또는 위약 담배를 투여받을 환자를 무작위로 할당하였다. 환자들은 8주 치료의 추적 기간 및 추가의 2주 휴식기를 받았다. 기준선 및 2주, 8주 및 10주에서의 추적 자료는 임상 면담, 신체 검사, 질환 활성 평가 (CDAI), 및 혈액 검사 (완전 혈구 계수, 간 및 신장 기능, 염증에 대한 C-반응성 단백질 (CRP) 마커), SES 대장 내시경 검사, 직접 장 염증에 대한 칼프로텍틴 검사, 표준화된 삶의 질 (SF-36) 설문지를 이용한 부작용에 대해 이용하고 보고한 신체적 및 정신적 건강 상태의 측정을 포함하였다.
7. 단일 요법 또는 병용 요법을 받는 환자의 후향적(Retrospective) 연구
환자의 자료는 인구 통계학적 및 임상적 자료를 포함하여 회사 데이터베이스에서 검색되었으며, 특정 요법 하에 본 발명의 파이토-유래 칸나비노이드 조성물을 투여받은 다양한 임상 질병을 가진 1,800명 이상의 환자에 대하여 임상적 추적 조사를 수행하였다. 본 연구를 위해, IBD, 크론병 및 대장염의 임상 진단을 받은 환자에 대한 자료를 선별하였다 (N=291). 자료는 DAI 임상 중증도 점수, 혈액 염증 지수에 대한 생화학적 검사, 분변 칼프로텍틴, 및 MAYO 및 CD-SES 점수를 이용한 대장 내시경 검사에 관련된 임상 병력, 신체 검사 및 IBD의 임상 평가를 포함하였다. QOL (SF-36) 설문지로부터 환자의 생활 방식, 삶의 질, 개인적 선호 등의 지수와 관련된 추가 평가를 검색하였다. 추가 자료는 적어도 3회 추적 방문 동안, 첫 달 및 첫 해 동안 연구 의사에 의해 부작용의 존재에 대한 보고서와 관련 있다. 환자군은 본 발명의 파이토-유래 조성물과 함께 6개월 이상의 경험을 가졌다 (N=142). 자료는 유익한 치료 결과와의 연관성을 밝히기 위해 관련 분산 분석 (예를 들어, T-test ANOVA, Mann-Whitney)을 받았다 (p <0.05는 통계적으로 유의하다고 간주되었다).
실시예 1
1a. 본 발명의 조성물에서 칸나비노이드 및 테르펜 프로파일
표 3은 2개의 주요 칸나비노이드 (THC 및 CBD 비) 및 모노테르펜 (미르센, 리모넨, β-피넨) 및 세스퀴테르펜 (β-카리오필렌, 구아이올, β-파네센) 종류의 다수의 테르펜을 포함하여, 본 발명의 파이토-유래 조성물의 칸나비노이드 및 테르펜의 상대 함량을 나타낸다. 완전한 테르펜 자료는 부록 A에 제공된다.
파이토-유래 물질에서 칸나비노이드의 상대 함량에 관한 추가 자료는 하기에 제시된다:
● 아비데켈은 꽃-유래 물질 (w/w)에서 CBD-농축 함량, 즉, 14-22% CBD, 0-2% THC 및 0-1% CBN (w/w)으로 확인되었다;
● 레파엘은, 아비데켈과 유사하게, 동일한 것에 대하여 16-24% CBD, 0-2% THC 및 0-1% CBN (w/w)으로 확인되었다;
● 에레즈는 THC-농축 함량, 즉, 16-24% THC, 0-2.5% CBD 및 0-1% CBN (w/w)으로 확인되었다;
● 알라스카, 에란-알모그, 도리트, 오메르, 시라, 오르 (그리고 더 최근의 품종 조하르)는 유사한 프로파일을 나타내었다;
● 대조적으로, 미드나이트는 동일하거나 또는 거의 동일한 THC 및 CBD, 즉, 8-16% CBD, 6-14% THC, 0-1% CBN (w/w)으로 확인되었다.
● 망고도 6-9% (w/w) 범위 내의 동일한 THC 및 CBD로 확인되었다.
이 자료는 특정 품종의 파이토-유래 물질이 칸나비노이드 및 테르펜의 특정 상대 함량 (비)으로 확인되었음을 나타내었다. 구체적으로는, THC 및 CBD의 상대 함량과 관련하여, 본 발명의 파이토-유래 물질은 3개의 주요 범주로 분류된다:
i - 에레즈, 알라스카, 에란-알모그로부터 유래된 THC 농축 물질;
ii - 아비데켈, 레파엘로부터 유래된 CBD 농축 물질;
iii - THC 및 CBD 함량이 대략 동일한 품종으로부터 유래된 물질, 예를 들어, 미드나이트.
테르펜에 관하여, 특정 품종의 파이토-유래 물질은 모노테르펜 및 세스퀴테르펜의 특정 상대 함량 및 이들 종류의 특정 테르펜으로 확인되었다. 미르센, 리모넨 (모노테르펜), 예를 들어, 도리트 및 아비데켈, 및 β-카리오필렌, 구아이올, 예를 들어, 미드나이트 및 자스민의 상대 함량에서 유의한 차이가 관찰되었다.
본 발명의 파이토-유래 조성물의 이러한 생화학적 특성은 IBD의 부분 증상에 대한 감별 효과 및 IBD 질병의 전반적인 완화와 더 관련이 있다.
1b. 아비데켈의 오일 추출물에서 주요 칸나비노이드의 상대 함량
표 4는 HPLC를 이용한 2개의 독립적인 실험에서 측정된 바와 같이, CBD 농축 물질인 아비데켈의 오일 추출물에서의 주요 칸나비노이드 프로파일을 나타낸다.
하기에 기재된 크론병 환자의 전향적 임상 연구에서 아비데켈 오일 추출물을 사용하였다. 연구 제품은 16.35% CBD, 4.01% THC (또한 △9-THC), 0.8% CBC, 0.74% CBG, 0.12% CBN 및 0.08% CBDV, 및 특정 비율의 테르펜, 플라보노이드, 왁스 및 엽록소를 함유하였다.
상대적인 칸나비노이드 함량의 관점에서, 연구 제품은 1:4의 THC:CBD 비를 함유하였다.
총 칸나비노이드 함량의 관점에서, 약 0.04 ml로 추정되는 아비데켈 오일의 한 방울은 약 1.6 mg THC 및 6.54 mg CBD를 함유하였다.
칸나비노이드 치료 용량인 투여량의 관점에서, 환자는 하루에 3회, 설하에, 투여 당 4-5 방울을 투여받았다. 대조군은 올리브 오일 및 엽록소를 함유하는 위약을 투여받았다.
후술된 후향적 연구에서, IBD 환자는 상기 기재된 용량 요법으로 아비데켈 제품을 이용하여 단독으로, 또는 다른 THC 농축 제품과 병용하여 흡연 또는 흡입에 의해 투여받았다. 많은 환자들이 THC:CBD가 동일한 비율인 제품으로 아비데켈 제품을 사용하고 있었다. 특정 환자는 아비데켈 제품을 개인적 선호에 따라 흡연 또는 흡입에 의해 투여된 레파엘과 같은 유사한 CBD 농축 제품으로 대체하였다.
실시예 2
고 CBD 조성물 (아비데켈)은 크론병의 치료에 효과적이다
크론병의 감별 진단을 받은 환자는 아비데켈 오일 (N=18) 또는 위약 (N=21)을 8주 동안, 하루에 3회, 4-5 방울로 설하 투여받았다. 모든 환자는 추가로 면역억제제, 예를 들어 아자티오프린 (이무란(Imuran)), 머캅토퓨린 (퓨리네톨 (Purinethol)), 메토트렉세이트 (류마트렉스(Rheumatrex)), 시클로스포린 (네오랄 (Neoral)); 생물학적 약물, 예를 들어, TNF 저해 항체 아달리무맙 (휴미라 (Humira)), 인플릭시맙 (레미케이드(Remicade)); 코르티코스테로이드, 예를 들어, 프레드니손 (제네릭); 항-염증성 5-아미노살리실산 (5-ASA), 화합물 (델지콜 (Delzicol), 아사콜(Asacol), 펜타사(Pentasa)), 또는 이들의 조합의 군으로부터의 적어도 하나의 약물과 함께 전형적인 항-염증 요법을 받았다. 표 5는 치료군 및 대조군에서 환자의 임상적 특성을 나타낸다.
연구에 사용된 아비데켈 오일은 약 1:4 (w/w)의 THC:CBD 비로 구성되었다. 투여량의 관점에서, 아비데켈 오일 방울 (0.04 ml 부피)은 약 3.7% THC 및 15% CBD (w/w)로 구성되었고, 함량의 관점에서는 약 1.5 mg THC 및 6 mg CBD로 구성되었다.
투여 당 활성 약물 용량의 관점에서, 평균 약물 용량은 약 6-7.5 mg THC 및 24-30 mg CBD의 범위 내였다. 용량은 투여 당 최대 15 방울 (24 mg의 THC 및 98.1 mg의 CBD)을 초과하지 않았다.
최적의 치료 용량을 달성하기 위하여, 각 환자에게 3주의 적정 기간을 주었고, 투여 당 방울의 수 및/또는 하루 (아침, 낮, 밤)에 투여 횟수를 점차적으로 증가시켰다. 최적의 치료 용량은 유의한 부작용 없이 질환의 임상 지수에 최대 영향을 미치는 일일 용량으로 평가되었다.
일일 용량의 관점에서, 평균 투여 용량은 약 18-23 mg THC 및 72-90 mg CBD의 범위 내였다. 일일 용량은 400 mg 활성 물질 CBD 및 THC을 초과하지 않았다.
본 연구의 결과는, 환자 및 의사에 의해 보고된 바와 같이, 아비데켈 오일로 처리된 환자군에서 크론병의 임상 지수, 일반적인 삶의 질 및 치료 순응도가 위약군에 비해 유의한 개선을 나타내었다. 도 1A-1I는 본 연구에서, 아비데켈 치료군 (검은색 실선) 및 위약군 (점선)에서 관찰된 일반적인 경향을 나타낸다.
구체적으로는, CDAI 및 QOL (SF-36) 점수에서 가장 유의한 유익한 효과가 관찰되었다. 2-8주의 시점에서, 이들 점수가 상대적으로 변하지 않은, 즉, 각각 CDAI가 286.7±112.0 내지 212.6±102.4이고 QOL이 72.6±13.8 내지 79.9±16.2인 위약군에 비해, 아비데켈 치료군에서 CDAI 점수는 284.6±74.6에서 118.6±71.5로 감소하였고 QOL 점수는 74.0±19.8에서 96.3±17.6으로 증가하였다.
이 결과를 토대로, 더 많은 환자군의 연구에서 모든 연구 매개변수의 유의 한 개선이 관찰될 수 있음을 시사한다. 이러한 연구는 현재 진행 중이다. 비교 연구는 현재 THC:CBD 비 1:6 및 사티벡스(Sativex) (비 1:1)를 갖는 오일 추출물을 포함하여, 크론병 환자에서 수행된다. 아비데켈 오일 (THC:CBD 비 1:4) 및 드로나비놀(dronabinol) (마리놀, 참기름에서 합성 THC)의 상업용 제제를 포함한 예비 연구는 마리놀이 질환의 임상 지수 및 일반적인 삶의 질에 유의한 효과가 없음을 나타내었다, 따라서 상대적 부작용 및 좋지 않은 환자의 순응도로 인해 종료되었다.
2개의 주요 칸나비노이드인 THC (△9-THC) 및 CBD, 및 2개의 대사산물인 11-히드록시 △9-THC (활성 대사산물) 및 △9 카복시 THC (불활성 대사산물)와 관련하여, 상기 시험의 환자군 (N=7)에서 약동학적 연구를 수행하였다. 도 2A-2D는 단일 용량의 아비데켈 오일 (6.4 mg △9-THC 및 26 mg CBD)을 투여한 후 평균 칸나비노이드 혈액 수준을 나타낸다.
구체적으로는, 2.3±2.2 ng/mL의 최대 평균 △9-THC 값은 90분 내지 120분에서 관찰되었고, 투여 후 6시간까지 연속적으로 떨어져, △9-THC 수준은 24시간의 칸나비스 휴식 후의 전형적인 수준이었다. CBD 약동학의 경우, 90분 내지 120분에서 6.2±5.9 ng/mL의 최대 평균 CBD 값을 갖고, 투여 후 6시간까지 연속적으로 떨어지는, 유사한 프로파일이 관찰되었다. 2개의 대사산물에 관하여는, 11-히드록시 △9-THC 최대 평균 수준이 90분 내지 120분에서 4.5±4.2 ng/mL에 도달하였고, 1.9±1.1 ng/mL로 떨어졌다. △9 카복시 THC의 경우는, 대조적으로, 90분 이후에 평균 수준이 34.5±47.7 ng/mL에 도달하였으나, 6시간 동안 계속 상승하여 최대 75.5±77.0 ng/mL에 도달하였다. 이러한 자료는 향후 연구에서 검증되어야 한다. 비교 약동학적 연구는 현재 THC:CBD 비 1:6 및 사티벡스 (비 1:1)를 포함하는 오일 추출물을 포함하여, 크론병 환자에서 수행된다.
실시예 3
고 THC 조성물 (에레즈)은 대장염의 치료에 효과적이다
궤양성 대장염의 감별 진단을 받은 환자는 에레즈 담배 (N=14) 또는 위약 담배 (N=13)를 투여받았으며, 에레즈 담배 (담배 당 1g 건조 중량, 약 23% w/w의 THC 함량 및 CBD는 거의 없음) 또는 위약 담배는 적어도 8주 동안, 하루에 2개의 담배의 일일 용량으로 투여되었다. 모든 환자는 추가로 면역억제제, 생물학적 약물, 코르티코스테로이드, 항-염증성 5-ASA 또는 이들의 조합의 군으로부터 적어도 하나의 약물과 함께 전형적인 항-염증 요법을 받았다. 표 6은 치료군 및 대조군에서 환자의 임상적 특성을 나타낸다.
연구에 사용된 에레즈 담배는 미량의 CBD가 거의 없는 23% THC (w/w)로 구성되었고, 함량의 관점에서는 약 0.23 gr. THC로 구성되었다.
투여 당 활성 약물 용량의 관점에서, 에레즈는 흡연 또는 흡입에 의해 소비되었기 때문에, 이는 투여된 약물 용량 또는 일일 용량의 추정을 매우 부정확하게 하고 개인적인 용도에 크게 의존하게 만든다. 일일 용량은 하루에 최대 2개의 담배 를 초과하지 않았다.
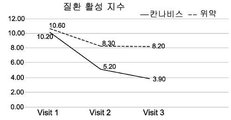
본 연구의 결과는, 환자 및 의사에 의해 보고된 바와 같이, 에레즈로 처리된 환자군에서 대장염의 임상 지수, 일반적인 삶의 질 및 치료 순응도가 위약군에 비해 유의한 개선을 나타내었다. 도 3A-3I는 본 연구에서, 에레즈 치료군 (검은색 실선) 및 위약군 (점선)에서 관찰된 일반적인 경향을 나타낸다.
구체적으로는, DAI 및 QOL (SF-36) 점수에서 가장 유의한 유익한 효과가 관찰되었다. 에레즈 군에서의 DAI 점수는, 위약군에서의 10.6±2.8 내지 8.2±2.1에 비해, 기준선에서의 10.2±3.3에서 8주 치료 후에 3.9±3.3으로 감소하였다 (p<0.01). 유사하게, 에레즈 군에서의 QOL 점수는, 위약군에서의 71.6±13.7 내지 80.8±14.0에 비해, 76.0±21.0에서 99.6±19.2로 증가하였다 (p<0.01).
이 결과를 토대로, 더 많은 환자군의 연구에서 모든 연구 매개변수의 유의 한 개선이 관찰될 수 있음을 시사한다. 이러한 연구는 현재 진행 중이다.
추가의 비교 연구는 현재 다른 시판되는 칸나비노이드 조성물과는 대조적으로 다양한 THC:CBD:테르펜 함량 (비)을 갖는 본 발명의 조성물로 처리한 다양한 유형의 IBD 환자에서 수행된다.
실시예 4
아비데켈 오일-추출물은 IBD의 지속적인 관리 및 치료에 효과적이다
IBD로 진단받은 환자 (N=50)는 아비데켈의 오일-계 추출물 또는 위약 오일을 투여받았고, 상기 제제는 8주 동안, 하루에 3회, 4-5 방울로 경구 투여되었다. 약물 요법 및 질환 상태의 관찰은 실시예 2와 유사하였다.
적어도 8주 동안 관찰한 후, 환자 및 의사는 IBD의 모든 임상 지수 및 일반적인 삶의 질과 치료 순응도의 지수에 관하여 유의한 개선을 보고하였다. 환자는 깨어있는 시간 동안 투여되는 아비데켈 오일을 순응하였다.
실시예 5
에레즈 담배는 IBD의 즉각적인 완화에 효과적이다
IBD로 진단받은 환자 (N=30)는 적어도 8주 동안 하루에 2개의 담배로 소비된 에레즈 담배 (담배 당 0.5-1g. 건조 중량) 또는 위약 담배를 투여받았다. 약물 요법 및 질환 상태의 관찰은 실시예 3과 유사하였다.
관찰 기간 동안 및 2주 후에, 환자 및 의사는 통증을 포함하여 IBD 증상의 즉각적인 완화에 관하여 유의한 개선을 보고하였다. 환자는 자기 전에 에레즈 담배의 투여를 더 잘 순응하였다.
실시예 6
미드나이트는 순응하지 않는(non-compliant) 환자에서 에레즈의 효과적인 대체제이다.
향정신성 효과 (약 20%)로 인해 에레즈를 순응하지 않는 IBD 환자는, THC:CBD 함량이 대략 동일하고 낮 동안 및/또는 자기 전에 적어도 8주 동안 하루에 2개의 담배로 투여되는 담배 형태의 미드나이트를 투여받았다. 미드나이트는, 특히 에레즈에 대한 이전의 경험과 비교하여 부작용의 현저한 감소가 있거나 또는 없을 때, 통증, 식욕 증가 및 일반적인 삶의 질의 개선을 포함하여, IBD 증상의 즉각적인 완화에 대해 보고하는 환자 및 의사를 고려할 때, 에레즈의 효과적인 대체제로 판명되었다.
실시예 7
IBD의 장기간 치료 및 관리를 위한 병용 요법의 놀라운 유익한 효과
본 연구를 위해, IBD, 크론병 및 대장염의 임상 진단을 받은 환자의 자료를 선별하였다. 자료는 DAI 임상 중증도 점수, 염증 지수에 대한 생화학적 및 혈액 검사, 칼프로텍틴, 표준 점수를 이용한 대장 내시경 검사에 관련된 임상 병력, 신체 검사 및 IBD의 임상 평가를 포함하였고, 또한 QOL (SF-36) 설문지로부터 환자의 생활 방식, 삶의 질, 개인적 선호의 평가를 검색하였다. 추가 자료는 첫 달 및 첫 해 동안 부작용의 보고를 포함하였다.
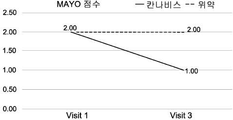
IBD 군 (N=291)은 6개월 이상 본 발명의 파이토-유래 조성물을 경험한 142명의 환자 (49%)와 함께, 평균 연령 39.8세 (SD=16.9)인 169명의 남성 (58%)을 포함하였다. 대다수의 환자는 주관적인 중증도 척도 (0-10)에서 다양한 정도의 통증 (94%)을 보고하였다. 추적 설문지를 완료한 142명의 환자의 군 내에서, 65명의 환자 (46%)는 CBD 농축 조성물 - 바람직하게는 낮 동안, 및 THC 농축 조성물 - 바람직하게는 자기 전, 연속하여 투여된 CBD 농축 및 THC 농축 조성물을 포함하는 병용 요법을 선호한다고 보고하였고; 77명의 환자 (54%)는 단일 요법 - 바람직하게는 THC 농축 조성물의 선호를 보고하였으며; 8명의 환자 (6%)는 대략 동일한 THC:CBD 함량을 포함하는 미드나이트를 선호한다고 보고하였다.
병용 요법을 받는 환자 대 단일 요법을 받는 환자의 자료 분석은, 단일 요법 군에 비해 병용 요법 군에서 질환 지수의 유의한 개선을 나타내었다 (p<0.001). 특히, (연속하여) CBD-농축 및 THC-농축 조성물로 병용 요법을 받는 환자는 동일한 양의 THC 및 CBD를 포함하는 조성물 (미드나이트)로 처리한 환자보다 더 잘 수행하였다.
병용 요법을 받는 추가의 환자는 단일 요법 군에 비해 유의하게 낮은 횟수 및 중등도의 부작용 (메스꺼움, 현기증, 건성안 증후군, 향정신성 증상, 졸음, 전반적인 허약)을 보고하였다 (p<0.001). 또한 이 분석에서, 연속하여 CBD-농축 및 THC-농축 병용 요법으로 처리한 환자는 미드나이트 (THC:CBD 동일)로 처리한 환자보다 더 잘 수행하였다.
또한, 통증 감소의 분석에서, 미드나이트를 포함하여 CBD-농축 및 THC-농축 병용 요법을 받은 환자는 단독 요법 환자보다 통증의 발생 횟수, 중증도 점수 및 경시적 관리(longitudinal management)의 관점에서, 더 유의한 통증 완화에 대해 보고하였다 (p<0.001). 이러한 결과는 THC-농축 품종 및 칸나비노이드 조성물이 지금까지 통증 치료에 보다 효과적이라고 여겨졌기 때문에, 더욱 놀랍다.
이러한 결과는 본 발명의 CBD-농축 및 THC-농축 조성물을 포함하는 병용 요법이 단일 요법, 심지어 THC 및 CBD를 포함하는 단일 요법보다 IBD의 장기간 치료 및 관리에 보다 효과적이라는 것을 시사한다. 이러한 효과는 특정 용량 요법 및 맞춤형 방법에 의해 더 향상될 수 있다. 다양한 파이토-유래 물질, 추출 방법 및 용량 요법을 이용한 병용 요법의 유리한 효과에 대한 연구는 현재 진행 중이다.
발명의 특정 실시예
일 측면에서, 본 발명은 염증성 장 질환 (IBD)과 관련된 질병의 적어도 하나의 증상을 치료, 완화 또는 감소시키는 방법에 사용하기 위한 미리-정의된 비의 테트라히드로칸나비놀 (THC) : 칸나비디올 (CBD)을 포함하는 조성물에 관한 것이고, 상기 조성물은 임의로 담체, 완충제, 부형제 중 적어도 하나를 더 포함한다.
다수의 실시예에서, 본 발명의 조성물은 암컷 칸나비스 식물 (칸나비스 꽃)의 건조 수지-생성 암꽃차례 또는 이의 추출물로부터 유래되며, 상기 수지 또는 추출물은 미리-정의된 비의 THC:CBD를 포함한다.
다른 실시예에서, 조성물은 THC, CBD 중 적어도 하나를 포함할 수 있으며, 합성, 반-합성 또는 칸나비스 식물로부터 정제된다.
특정 실시예에서, 조성물은 중량 (w/w) 당 적어도 약 1:1, 또는 실질적으로 1:1에 가까운 THC:CBD의 비를 포함할 수 있다.
또 다른 실시예태에서, 본 발명의 조성물은 THC 또는 CBD가 농축되거나 또는 1:1 (w/w) 이외의 THC:CBD의 비를 포함한다.
특정 실시예에서, 조성물은 각각 적어도 약 1.5:1-2:1, 2:1- 3:1, 3:1-5:1, 5:1-10:1, 10:1-50:1, 50:1-100:1, 100:1-500:1, 100:1-1000:1 (w/w), 또는 그 이상의 범위 내의 THC:CBD의 비를 포함할 수 있다.
다른 실시예에서, 조성물은 실질적으로 CBD를 포함할 수 없다.
다수의 실시예에서, 본 발명의 조성물은 각각 적어도 약 1:1.5-1:2, 1:2-1:3, 1:3-1:4, 1:4-1:5, 1:5-1:10, 1:10-1:20, 1:20-1:30, 1:30-1:40, 1:40-1:50, 1:50-1:100, 1:100-1:500, 1:500-1:1000 (w/w), 또는 그 이하의 범위 내의 THC:CBD의 비를 포함할 수 있다.
다른 실시예에서, 조성물은 실질적으로 CBD만을 포함할 수 있다.
특정 실시예에서, 본 발명의 조성물은 적어도 약 10-30%, 12-28%, 13-27%, 14-26%, 15-25%, 16-24%, 17-23%, 18-22%의 범위 내, 또는 대략 20% (w/w)의 THC 함량을 포함하는 파이토-유래 물질을 포함하는 담배의 제형이다.
다른 실시예에서, 이러한 조성물은 '에레즈'로 명명된 C. 인디카 품종으로부터 유래된 물질을 포함한다.
특정 실시예에서, 본 발명의 조성물은 적어도 약 10-30%, 10-20%, 11-19%, 12-18%, 12.5-17.5%, 13-17%, 13.5-16.5%, 14-16%, 14.5-15.5%의 범위 내, 또는 대략 15% (w/w)의 CBD 함량을 포함하는 파이토-유래 오일 추출물의 경구 제형이다.
다른 실시예에서, 상기 오일 추출물은 적어도 약 0.1-7.5%, 0.5-7%, 0.5-6%, 0.5-5%, 0.5-4%, 0.5-3%, 0.5-2%, 또는 0.5-1% (w/w)의 범위 내의 THC 함량을 더 포함할 수 있다.
또 다른 실시예에서, 이러한 조성물은 '아비데켈'로 명명된 C. 인디카 품종으로부터 유래된 물질을 포함한다.
다수의 실시예에서, 본 발명의 조성물은 적어도 약 5-30%, 5-20%, 6-19%, 7-18%, 8-17%, 9-16%, 10-15%, 10-14%, 10-13%, 10-12%, 또는 10-11% (w/w)의 범위 내의 실질적으로 동일한 THC 및 CBD 함량을 포함하는 파이토-유래 물질을 포함하는 담배의 제형이다.
특정 실시예에서, 상기 조성물은 '미드나이트'로 명명된 C. 사티바 L. 품종으로부터 유래된 물질을 포함한다.
특정 실시예에서, 본 발명의 조성물은 흡입 및/또는 증발에 적합하다.
다수의 실시예에서, 본 발명의 조성물은 IBD와 관련된 질병의 적어도 하나의 증상을 치료, 완화 또는 감소시키는 방법에 사용하기 위한 것이며, 상기 증상의 완화 또는 감소는 즉각적이다.
또 다른 실시예에서, 조성물은 IBD와 관련된 질병의 적어도 하나의 증상을 치료, 완화 또는 감소시키는 방법에 사용하기 위한 것이며, 상기 증상의 완화 또는 감소는 지속적이다.
특정 실시예에서, 조성물은 궤양성 대장염의 적어도 하나의 증상을 치료, 완화 또는 감소시키는 방법에 사용하기 위한 것이다.
또 다른 실시예에서, 조성물은 크론병의 적어도 하나의 증상을 치료, 완화 또는 감소시키는 방법에 사용하기 위한 것이다.
본 발명의 또 다른 측면은 IBD와 관련된 질병의 적어도 하나의 증상을 지속적인 치료, 완화 또는 감소시키는 방법에 사용하기 위한 CBD가 농축된 칸나비스-계 경구 조성물을 제공하는 것이다.
특정 실시예에서, 이러한 조성물은 크론병의 적어도 하나의 증상의 지속적인 치료, 완화 또는 감소에 적용 가능하다.
본 발명의 또 다른 측면은 IBD와 관련된 질병의 적어도 하나의 증상을 즉각적인 치료, 완화 또는 감소시키는 방법에 사용하기 위한 THC가 농축된 칸나비스-계 조성물을 제공하는 것이다.
특정 실시예에서, 조성물은 흡연, 흡입, 증발 중 적어도 하나에 적합하다.
특정 실시예에서, 이러한 조성물은 궤양성 대장염의 즉각적인 치료, 완화 또는 감소에 적용 가능하다.
다수의 실시예에서, 본 발명의 조성물은 적어도 하나의 추가 치료제를 더 포함할 수 있다.
특정 실시예에서, 치료제는 항-염증제, 항-침해수용제, 항생제, 항구토제, 항-설사제 중 적어도 하나이다.
본 발명의 또 다른 측면은 치료를 필요로 하는 피험자에서 IBD와 관련된 질병의 적어도 하나의 증상을 치료, 완화 또는 감소시키는 방법을 제공하는 것이고, 상기 방법은 미리-정의된 비의 THC:CBD를 포함하는 적어도 하나의 조성물의 치료적 유효량을 상기 피험자에게 투여하는 단계를 포함한다.
다수의 실시예에서, 상기 증상의 치료, 완화 또는 감소는 즉각적 및/또는 지속적이다.
특정 실시예에서, 상기 방법에서 투여된 조성물은 THC, CBD 중 적어도 하나를 포함하며, 합성, 반-합성 또는 칸나비스 식물로부터 정제되거나, 또는 칸나비스 식물 유래 물질 (칸나비스 꽃 유래 물질) 또는 이의 추출물, 또는 이들의 임의의 조합의 형태이다.
특정 실시예에서, 본 발명의 방법은 하나 이상의 조성물을 피험자에게 투여하는 단계를 포함할 수 있으며, 각 조성물은 별개의 미리-정의된 비의 THC:CBD를 포함하고, 투여는 연속적이다.
다수의 실시예에서, 본 발명의 방법은 피험자에게
(i) 적어도 약 1:1 w/w, 또는 실질적으로 1:1에 가까운 THC:CBD의 비를 포함하는 조성물,
(ii) THC가 농축되거나 또는 실질적으로 CBD를 포함하지 않는 조성물,
(iii)
CBD가 농축되거나 또는 실질적으로 CBD만을 포함하는 조성물
중 적어도 하나를 투여하는 단계,
또는 이들의 조합의 연속 투여 단계를 포함한다.
또 다른 실시예에서, 방법은 피험자에게
(i) 적어도 약 10-30%, 12-28%, 13-27%, 14-26%, 15-25%, 16-24%, 17-23%, 18-22%의 범위 내, 또는 약 20% (w/w)의 THC 함량을 포함하는 파이토-유래 물질을 포함하는 적어도 하나의 담배,
(ii) 적어도 약 10-30%, 10-20%, 11-19%, 12-18%, 12.5-17.5%, 13-17%, 13.5-16.5%, 14-16%, 14.5-15.5%의 범위 내, 또는 약 15% (w/w)의 CBD 함량을 포함하고, 임의로 적어도 약 0.1-7.5%, 0.5-7%, 0.5-6%, 0.5-5%, 0.5-4%, 0.5-3%, 0.5-2%, 0.5-1% (w/w)의 범위 내의 THC 함량을 더 포함하는 파이토-유래 오일 추출물의 적어도 하나의 경구 제형,
(iii) 적어도 약 5-30%, 5-20%, 6-19%, 7-18%, 8-17%, 9-16%, 10-15,% 10-14%, 10-13%, 10-12%, 10-11% (w/w)의 범위 내의 THC 및 CBD의 실질적으로 동일한 함량을 포함하는 파이토-유래 물질을 포함하는 적어도 하나의 담배
중 적어도 하나를 투여하는 단계,
또는 이들의 조합의 연속 투여 단계를 포함할 수 있다.
특정 실시예에서, 본 발명의 방법은 피험자에게
(i) 에레즈의 파이토-유래 물질을 포함하는 적어도 하나의 담배,
(ii) 아비데켈의 파이토-유래 오일 추출물의 적어도 하나의 경구 제형,
(iii) 미드나이트의 파이토-유래 물질을 포함하는 적어도 하나의 담배
중 적어도 하나를 투여하는 단계,
또는 이들의 조합의 연속 투여 단계를 포함한다.
또 다른 실시예에서, 상기 방법에서 에레즈 및/또는 미드나이트 유래 물질은 흡입 및/또는 증발에 적합한 형태이다.
다수의 실시예에서, 본 발명의 방법은 적어도 하나의 추가 치료제의 연속 또는 동시 투여 단계를 더 포함할 수 있다.
특정 실시예에서, 추가 치료제는 항-염증제, 항-침해수용제, 항생제, 항구토제, 항-설사제 중 적어도 하나이다.
또 다른 측면에서, 본 발명은 치료를 필요로 하는 피험자에서 IBD와 관련된 질병의 적어도 하나의 증상을 치료, 완화 또는 감소시키는 방법을 제공하며,
이러한 방법은 피험자에게
(i) 적어도 약 10-30%, 12-28%, 13-27%, 14-26%, 15-25%, 16-24%, 17-23%, 18-22%의 범위 내, 또는 약 20% (w/w)의 THC 함량을 포함하는 파이토-유래 물질을 포함하는 적어도 하나의 담배,
(ii) 적어도 약 5-30%, 5-20%, 6-19%, 7-18%, 8-17%, 9-16%, 10-15,% 10-14%, 10-13%, 10-12%, 10-11% (w/w)의 범위 내의 THC 및 CBD의 실질적으로 동일한 함량을 포함하는 파이토-유래 물질을 포함하는 적어도 하나의 담배
중 적어도 하나를 투여하는 단계를 포함한다.
또 다른 측면에서, 본 발명은 치료를 필요로 하는 피험자에서 IBD와 관련된 질병의 적어도 하나의 증상을 지속적인 치료, 완화 또는 감소시키는 방법을 제공하며, 이러한 방법은 피험자에게 적어도 약 10-30%, 10-20%, 11-19%, 12-18%, 12.5-17.5%, 13-17%, 13.5-16.5%, 14-16%, 14.5-15.5%의 범위 내, 또는 약 15% (w/w)의 CBD 함량을 포함하고, 임의로 적어도 약 0.1-7.5%, 0.5-7%, 0.5-6%, 0.5-5%, 0.5-4%, 0.5-3%, 0.5-2%, 0.5-1% (w/w)의 범위 내의 THC 함량을 더 포함하는 파이토-유래 물질의 오일 추출물의 적어도 하나의 경구 제형을 투여하는 단계를 포함한다.
특정 실시예에서, 상기 방법은 피험자에게
(i) 에레즈의 파이토-유래 물질을 포함하는 적어도 하나의 담배,
(ii) 미드나이트의 파이토-유래 물질을 포함하는 적어도 하나의 담배
중 적어도 하나를 투여하는 단계를 포함한다.
다른 실시예에서, 상기에 따른 방법은 피험자에게 아비데켈의 파이토-유래 물질의 오일 추출물의 적어도 하나의 경구 제형을 투여하는 단계를 더 포함할 수 있다.
또 다른 측면에서, 본 발명은 치료를 필요로 하는 피험자에서 크론병의 적어도 하나의 증상을 치료, 완화 또는 감소시키는 방법을 제공하며, 이러한 방법은 피험자에게 적어도 약 10-30%, 10-20%, 11-19%, 12-18%, 12.5-17.5%, 13-17%, 13.5-16.5%, 14-16%, 14.5-15.5%의 범위 내, 또는 약 15% (w/w)의 CBD 함량을 포함하고, 임의로 적어도 약 0.1-7.5%, 0.5-7%, 0.5-6%, 0.5-5%, 0.5-4%, 0.5-3%, 0.5-2%, 0.5-1% (w/w)의 범위 내의 THC 함량을 더 포함하는 파이토-유래 물질의 오일 추출물의 적어도 하나의 경구 제형을 투여하는 단계를 포함한다.
특정 실시예에서, 상기에 따른 방법은 피험자에게 아비데켈의 파이토-유래 물질의 오일 추출물의 적어도 하나의 경구 제형을 투여하는 단계를 포함한다.
또 다른 측면에서, 본 발명은 치료를 필요로 하는 피험자에서 궤양성 대장염의 적어도 하나의 증상을 치료, 완화 또는 감소시키는 방법을 제공하며, 이러한 방법은 피험자에게 적어도 약 10-30%, 12-28%, 13-27%, 14-26%, 15-25%, 16-24%, 17-23%, 18-22%의 범위 내, 또는 약 20% (w/w)의 THC 함량을 포함하는 파이토-유래 물질을 포함하는 적어도 하나의 담배를 투여하는 단계를 포함한다.
특정 실시예에서, 상기에 따른 방법은 피험자에게 에레즈의 파이토-유래 물질을 포함하는 적어도 하나의 담배를 투여하는 단계를 포함한다.
본 발명의 다른 측면은 IBD와 관련된 질병의 적어도 하나의 증상을 치료, 완화 또는 감소시키기 위한 약제의 제조/제제용 조성물의 용도를 제공하는 것이고, 상기 조성물은 미리-정의된 비의 THC:CBD를 포함하고, 임의로 담체, 완충제, 부형제 중 적어도 하나를 더 포함한다.
부록 A
본 발명의 칸나비스 품종의 테르펜 분석
Claims (48)
- 염증성 장 질환 (IBD)의 적어도 하나의 증상을 치료, 완화 또는 감소시키는 방법에 사용하기 위한 적어도 하나의 칸나비노이드 및 적어도 하나의 테르펜을 포함하는 파이토-유래 조성물로서, 상기 조성물은
- 테트라히드로칸나비놀 (THC)이 농축된 칸나비스 식물,
- 칸나비디올 (CBD)이 농축된 칸나비스 식물, 및
- THC 및 CBD의 양이 실질적으로 동일한 칸나비스 식물
중 적어도 하나로부터 유래되고,
상기 적어도 하나의 칸나비노이드는 THC, CBD 및 칸나비놀 (CBN)로부터 선택되며,
상기 적어도 하나의 테르펜은 모노테르펜 및 세스퀴테르펜으로부터 선택되는 것을 특징으로 하는, 조성물. - 제 1항에 있어서, 조성물은 오일 추출물 또는 건조 물질의 제형인 것을 특징으로 하는, 조성물.
- 제 1항 또는 제 2항에 있어서, 조성물은 16-24% THC 및 3% 이하의 CBD (w/w)를 포함하는 것을 특징으로 하는, 조성물.
- 제 1항 또는 제 2항에 있어서, 조성물은 14-24% CBD 및 4% 이하의 THC (w/w)를 포함하는 것을 특징으로 하는, 조성물.
- 제 1항 또는 제 2항에 있어서, 조성물은 6-14% THC 및 6-16% CBD (w/w)를 포함하는 것을 특징으로 하는, 조성물.
- 제 3항 내지 제 5항 중 어느 한 항에 있어서, 조성물은 최대 1% CBN (w/w)을 더 포함하는 것을 특징으로 하는, 조성물.
- 제 3항 또는 제 6항에 있어서, CBD는 THC에 비해 최대 20%를 구성하고 CBN은 THC (w/w)에 비해 최대 7%를 구성하는 것을 특징으로 하는, 조성물.
- 제 4항 또는 제 6항에 있어서, CBD는 THC (w/w)에 비해 최대 600%를 구성하고 CBN은 THC (w/w)에 비해 최대 50%를 구성하는 것을 특징으로 하는, 조성물.
- 제 5항 또는 제 6항에 있어서, THC 및 CBD는 실질적으로 동일한 양이며, CBN은 THC (w/w)에 비해 최대 17%를 구성하는 것을 특징으로 하는, 조성물.
- 제 1항 또는 제 2항에 있어서, 조성물은 미르센, 리모넨 및 피넨으로부터 선택된 적어도 하나의 모노테르펜 및 카리오필렌, 구아이올(guaiol) 및 파네센으로부터 선택된 적어도 하나의 세스퀴테르펜을 포함하는 것을 특징으로 하는, 조성물.
- 제 1항 내지 제 10항 중 어느 한 항에 있어서, 조성물은 경구 투여, 흡연, 흡입, 또는 증발에 적합한 제형인 것을 특징으로 하는, 조성물.
- 제 11항에 있어서, 조성물은 적어도 하나의 약물을 더 포함하는 경구 제형인 것을 특징으로 하는, 조성물.
- 제 1항에 있어서, 상기 방법은 추가 약물의 동시 투여 단계를 포함하는 것을 특징으로 하는, 조성물.
- 제 1항에 있어서, 상기 IBD의 적어도 하나의 증상의 치료, 완화 또는 감소는 혈액 및/또는 분변 시료에서 염증성 마커의 수준인 질환 활성 지수 (DAI)에 따른 점수 및/또는 크론병에 대한 단순 내시경 점수 (Endoscopic Score for Crohn's Disease; SES-CD) 중 적어도 하나의 감소, 및/또는 체중, 통증에 대한 자가-보고, 장운동 및 삶의 질 중 적어도 하나의 개선을 측정하는 것을 포함하는 것을 특징으로 하는, 조성물.
- 제 1항 또는 제 14항에 있어서, 상기 IBD는 크론병 또는 대장염인 것을 특징으로 하는, 조성물.
- 제 3항 또는 제 7항에 있어서, 조성물은 에레즈, 알라스카(Alaska), 에란-알모그(Eran-Almog), 도리트(Dorit), 오메르(Omer), 시라(Shira), 오르(Or), 조하르 (Zohar), 바락(Barak), 탈(Tal) 또는 자스민(Jasmine)으로 명명된 적어도 하나의 칸나비스 품종으로부터 유래되는 것을 특징으로 하는, 조성물.
- 제 4항 또는 제 8항에 있어서, 조성물은 아비데켈 또는 레파엘(Rephael)로 명명된 적어도 하나의 칸나비스 품종으로부터 유래되는 것을 특징으로 하는, 조성물.
- 제 5항 또는 제 9항에 있어서, 조성물은 미드나이트, 엘나(Elna) 또는 망고 (Mango)로 명명된 적어도 하나의 칸나비스 품종으로부터 유래되는 것을 특징으로 하는, 조성물.
- 제 16항 또는 제 18항에 있어서, 조성물은 흡연, 흡입 또는 증발에 적합한 제형인 것을 특징으로 하는, 조성물.
- 제 19항에 있어서, 조성물은 대장염의 적어도 하나의 증상을 치료, 완화 또는 감소시키는 방법에 사용하기 위한 것임을 특징으로 하는, 조성물.
- 제 17항에 있어서, 조성물은 경구 투여용 오일 추출물의 제형인 것을 특징으로 하는, 조성물.
- 제 21항에 있어서, 조성물은 크론병의 적어도 하나의 증상을 치료, 완화 또는 감소시키는 방법에 사용하기 위한 것임을 특징으로 하는, 조성물.
- 치료를 필요로 하는 피험자에서 IBD의 적어도 하나의 증상을 치료, 완화 또는 감소시키는 방법으로서, 상기 방법은 피험자에게 적어도 하나의 칸나비노이드 및 적어도 하나의 테르펜을 포함하는 적어도 하나의 파이토-유래 조성물을 투여하는 단계를 포함하며,
상기 조성물은
- THC가 농축된 칸나비스 식물,
- CBD가 농축된 칸나비스 식물, 및
- THC 및 CBD의 양이 실질적으로 동일한 칸나비스 식물
중 적어도 하나로부터 유래되고,
적어도 하나의 칸나비노이드는 THC, CBD 및 CBN으로부터 선택되며,
상기 적어도 하나의 테르펜은 모노테르펜 및 세스퀴테르펜으로부터 선택되는 것을 특징으로 하는, 방법. - 제 23항에 있어서, 상기 피험자에서 IBD의 적어도 하나의 증상의 치료, 완화 또는 감소는 혈액 및/또는 분변 시료에서 염증성 마커의 수준인 질환 활성 지수 (DAI)에 따른 점수 및/또는 크론병에 대한 단순 내시경 점수 (SES-CD) 중 적어도 하나의 감소, 및/또는 체중, 통증에 대한 자가-보고, 장운동 및 삶의 질 중 적어도 하나의 개선을 측정하는 것을 포함하는 것을 특징으로 하는, 방법.
- 제 23항 또는 제 24항에 있어서, 환자는 크론병 또는 대장염을 앓고 있는 것을 특징으로 하는, 방법.
- 제 23항 내지 제 25항 중 어느 한 항에 있어서, 상기 방법은 적어도 하나의 약물의 동시 투여 단계를 더 포함하는 것을 특징으로 하는, 방법.
- 제 23항 내지 제 26항 중 어느 한 항에 있어서, 상기 적어도 하나의 파이토-유래 조성물은 경구, 흡연, 흡입, 증발 또는 이들의 조합에 의해 투여되는 것을 특징으로 하는, 방법.
- 제 23항 내지 제 27항 중 어느 한 항에 있어서, 조성물은 THC가 농축된 적어도 하나의 칸나비스 식물 또는 THC 및 CBD의 양이 실질적으로 동일한 칸나비스 식물로부터 유래되고; 상기 IBD의 적어도 하나의 증상의 치료, 완화 또는 감소는 즉각적인 것을 특징으로 하는, 방법.
- 제 28항에 있어서, 조성물은 16-24% THC 및 3% 이하의 CBD 또는 6-14% THC 및 6-16% CBD (w/w)를 포함하는 것을 특징으로 하는, 방법.
- 제 29항에 있어서, 조성물은 최대 1% CBN (w/w)을 포함하는 것을 특징으로 하는, 방법.
- 제 30항에 있어서, 조성물에 포함된 CBD는 THC에 비해 최대 20%를 구성하고 CBN은 THC (w/w)에 비해 최대 7%를 구성하거나, 또는 조성물에 포함된 THC 및 CBD가 실질적으로 동일한 양이고 CBN은 THC (w/w)에 비해 최대 17%를 구성하는 것을 특징으로 하는, 방법.
- 제 28항 내지 제 31항 중 어느 한 항에 있어서, 조성물은 흡연, 흡입, 증발 또는 이들의 조합에 의해 투여되는 것을 특징으로 하는, 방법.
- 제 28항 내지 제 32항 중 어느 한 항에 있어서, 상기 적어도 하나의 조성물은 에레즈, 알라스카, 에란-알모그, 도리트, 오메르, 시라, 오르, 조하르, 바락, 탈, 자스민, 미드나이트, 엘나 또는 망고로 명명된 적어도 하나의 칸나비스 품종으로부터 유래되는 것을 특징으로 하는, 방법.
- 제 23항 또는 제24항에서, 환자는 대장염을 앓고 있고, 조성물은 흡연, 흡입, 증발 또는 이들의 조합에 의해 투여되는 에레즈로 명명된 칸나비스 품종으로부터 유래되는 것을 특징으로 하는, 방법.
- 제 23항 내지 제 27항 중 어느 한 항에 있어서, 조성물은 CBD가 농축된 적어도 하나의 칸나비스 식물로부터 유래되는 것을 특징으로 하는, 방법.
- 제 35항에 있어서, 조성물은 14-24% CBD 및 4% 이하의 THC (w/w)를 포함하는 것을 특징으로 하는, 방법.
- 제 36항에 있어서, 조성물은 최대 1% CBN (w/w)을 포함하는 것을 특징으로 하는, 방법.
- 제 36항에 있어서, CBD는 THC (w/w)에 비해 최대 600%를 구성하고 CBN은 THC (w/w)에 비해 최대 50%를 구성하는 것을 특징으로 하는, 방법.
- 제 35항 내지 제 38항 중 어느 한 항에 있어서, 조성물은 경구로 투여되는 것을 특징으로 하는, 방법.
- 제 35항 내지 제 39항 중 어느 한 항에 있어서, 조성물은 아비데켈 또는 레파엘로 명명된 적어도 하나의 칸나비스 품종으로부터 유래되는 것을 특징으로 하는, 방법.
- 제 23항 또는 제24항에서, 환자는 크론병을 앓고 있고, 조성물은 경구로 투여된 아비데켈로 명명된 칸나비스 품종으로부터 유래되는 것을 특징으로 하는, 방법.
- 제 23항 또는 제24항에서, 방법은 환자에게
(i) THC가 농축된 칸나비스 식물 또는 THC 및 CBD의 양이 실질적으로 동일한 칸나비스 식물로부터의 적어도 하나의 파이토-유래 조성물, 및
(ii) CBD가 농축된 칸나비스 식물로부터의 적어도 하나의 파이토-유래 조성물을 투여하는 단계를 포함하며,
단계 (i)의 조성물 및 단계 (ii)의 조성물은 별도로 연속하여 투여되는 것을 특징으로 하는, 방법. - 제 42항에 있어서, 단계 (i)의 조성물은 16-24% THC 및 3% 이하의 CBD, 또는 6-14% THC 및 6-16% CBD (w/w)를 포함하고, 단계 (ii)의 조성물은 14-24% CBD 및 4% 이하의 THC (w/w)를 포함하는 것을 특징으로 하는, 방법.
- 제 43항에 있어서, 단계 (i) 및 (ii)의 조성물은 최대 1% CBN (w/w)을 더 포함하는 것을 특징으로 하는, 방법.
- 제 44항에 있어서, 단계 (i)의 조성물에 포함된 CBD는 THC에 비해 최대 20%를 구성하고 CBN은 THC (w/w)에 비해 최대 7%를 구성하거나, 또는 THC 및 CBD가 실질적으로 동일하고 CBN은 THC (w/w)에 비해 최대 17%를 구성하며,
단계 (ii)의 조성물에 포함된 CBD는 THC (w/w)에 비해 최대 600%를 구성하고 CBN은 THC (w/w)에 비해 최대 50%를 구성하는 것을 특징으로 하는, 방법. - 제 42항 내지 제 45항 중 어느 한 항에 있어서, 단계 (i) 및 (ii)의 조성물은 연속하여 일일 요법으로 투여되는 것을 특징으로 하는, 방법.
- 제 42항 내지 제 46항 중 어느 한 항에 있어서, 단계 (i)의 조성물은 에레즈, 알라스카, 에란-알모그, 도리트, 오메르, 시라, 오르, 조하르, 바락, 탈, 자스민, 미드나이트, 엘나 또는 망고로 명명된 적어도 하나의 칸나비스 품종으로부터 유래되고, 단계 (ii)의 조성물은 아비데켈 또는 레파엘로 명명된 적어도 하나의 칸나비스 품종으로부터 유래되는 것을 특징으로 하는, 방법.
- 제 42항 내지 제 47항 중 어느 한 항에 있어서, 단계 (i)의 조성물은 흡연, 흡입, 증발 또는 이들의 조합에 의해 투여되고, 단계 (ii)의 조성물은 경구로 투여되는 것을 특징으로 하는, 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662313882P | 2016-03-28 | 2016-03-28 | |
| US62/313,882 | 2016-03-28 | ||
| PCT/IL2017/050388 WO2017168422A1 (en) | 2016-03-28 | 2017-03-28 | Cannabionid and cannabis-based compositions and methods for the treatment of inflammatory conditions of the gastrointestinal tract |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20180130544A true KR20180130544A (ko) | 2018-12-07 |
Family
ID=58579244
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020187031360A KR20180130544A (ko) | 2016-03-28 | 2017-03-28 | 위장관의 염증성 질환의 치료용 칸나비노이드 및 칸나비스-계 조성물 및 방법 |
Country Status (11)
| Country | Link |
|---|---|
| US (2) | US20190091198A1 (ko) |
| EP (1) | EP3436001A1 (ko) |
| JP (1) | JP2019510060A (ko) |
| KR (1) | KR20180130544A (ko) |
| AU (1) | AU2017242161A1 (ko) |
| BR (1) | BR112018069860A2 (ko) |
| CA (1) | CA3018951A1 (ko) |
| IL (1) | IL261799A (ko) |
| MX (1) | MX2018011392A (ko) |
| WO (1) | WO2017168422A1 (ko) |
| ZA (1) | ZA201807098B (ko) |
Families Citing this family (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2019130215A1 (en) * | 2017-12-27 | 2019-07-04 | To Pharmaceuticals Llc | Cannabis compositions for the treatment of inflammatory skin disorders |
| WO2019159185A1 (en) * | 2018-02-19 | 2019-08-22 | To Pharmaceuticals Llc | Compositions and methods for the treatment of protein energy wasting |
| US20210393572A1 (en) * | 2018-09-28 | 2021-12-23 | Visceral Therapeutics Inc. | Pharmaceutically active cannabis-based compositions and methods of use for treating gastrointestinal conditions |
| WO2020123383A1 (en) * | 2018-12-10 | 2020-06-18 | Natural Extraction Systems, LLC | Compositions with novel cannabinoid and terpene profiles |
| CA3137559A1 (en) * | 2019-04-26 | 2020-10-29 | Natural Extraction Systems, LLC | Compositions comprising non-crystalline forms of cannabidiol |
| AU2020323503B2 (en) * | 2019-07-29 | 2024-02-08 | Brightseed, Inc. | Method for improving digestive health |
| WO2021113261A1 (en) * | 2019-12-02 | 2021-06-10 | Natural Extraction Systems, LLC | Compositions comprising novel cannabinoid and terpene profiles |
| GB202101732D0 (en) * | 2021-02-08 | 2021-03-24 | Tts Pharma Ltd | A cannabinoid mixture |
| CA3227884A1 (en) * | 2021-08-04 | 2023-02-09 | John Crawford | Cannabinoid derivatives and their use |
| WO2023060323A1 (en) * | 2021-10-15 | 2023-04-20 | Bod Science Limited | Terpene-containing formulations and use thereof |
| US11977085B1 (en) | 2023-09-05 | 2024-05-07 | Elan Ehrlich | Date rape drug detection device and method of using same |
Family Cites Families (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB2450741A (en) * | 2007-07-05 | 2009-01-07 | Gw Pharma Ltd | Cannabinoid containing plant extracts in the treatment of inflammatory bowel disease |
| US20140245494A1 (en) | 2013-02-25 | 2014-08-28 | Ytzchak Cohen | Cannabis plant named erez |
| US20140259228A1 (en) | 2013-02-25 | 2014-09-11 | Ytzchak Cohen | Cannabis plant named 'avidekel' |
| US20140245495A1 (en) | 2013-02-25 | 2014-08-28 | Ytzchak Cohen | Cannabis plant named midnight |
-
2017
- 2017-03-28 US US16/086,338 patent/US20190091198A1/en not_active Abandoned
- 2017-03-28 AU AU2017242161A patent/AU2017242161A1/en not_active Abandoned
- 2017-03-28 MX MX2018011392A patent/MX2018011392A/es unknown
- 2017-03-28 KR KR1020187031360A patent/KR20180130544A/ko not_active Application Discontinuation
- 2017-03-28 WO PCT/IL2017/050388 patent/WO2017168422A1/en active Application Filing
- 2017-03-28 CA CA3018951A patent/CA3018951A1/en not_active Abandoned
- 2017-03-28 JP JP2018551299A patent/JP2019510060A/ja active Pending
- 2017-03-28 EP EP17718623.6A patent/EP3436001A1/en not_active Withdrawn
- 2017-03-28 BR BR112018069860-1A patent/BR112018069860A2/pt not_active Application Discontinuation
-
2018
- 2018-09-16 IL IL261799A patent/IL261799A/en unknown
- 2018-10-24 ZA ZA2018/07098A patent/ZA201807098B/en unknown
-
2020
- 2020-01-28 US US16/774,270 patent/US20200397743A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| JP2019510060A (ja) | 2019-04-11 |
| MX2018011392A (es) | 2019-07-08 |
| ZA201807098B (en) | 2020-01-29 |
| US20200397743A1 (en) | 2020-12-24 |
| WO2017168422A1 (en) | 2017-10-05 |
| CA3018951A1 (en) | 2017-10-05 |
| IL261799A (en) | 2018-10-31 |
| US20190091198A1 (en) | 2019-03-28 |
| AU2017242161A1 (en) | 2018-11-01 |
| BR112018069860A2 (pt) | 2020-11-03 |
| EP3436001A1 (en) | 2019-02-06 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20180130544A (ko) | 위장관의 염증성 질환의 치료용 칸나비노이드 및 칸나비스-계 조성물 및 방법 | |
| US11529320B2 (en) | Pharmaceutical compositions comprising cannabidiol and beta-caryophyllene and methods for their use | |
| CA3065563C (en) | Sleep disorder compositions and treatments thereof | |
| GB2479153A (en) | Use of the phytocannabinoid cannabidivarin (CBDV) in the treatment of epilepsy | |
| KR20220147636A (ko) | 칸나비디올 및 에버롤리무스에 의한 복합 결절성 경화증 치료 방법 | |
| JP2021500312A (ja) | 自閉症の治療のための組成物および方法 | |
| WO2020188551A1 (en) | Methods and compositions for treating autism spectrum disorder and associated disorders | |
| AU2017381587A1 (en) | Novel cannabinoid compositions and methods of treating pediatric epilepsy | |
| JP5956868B2 (ja) | ロキソプロフェン及びペパーミント抽出物を含有する頻尿治療用組成物 | |
| WO2020183456A1 (en) | Cannabinoid combinations for treating chronic pain in dialysis patients | |
| US11285178B2 (en) | Fertilized egg isolate and uses thereof | |
| US20240016875A1 (en) | Shan-zha for the treatment of depression and anxiety disorders | |
| WO2021077108A1 (en) | Method of treating autism | |
| KR20230069080A (ko) | 만성 통증을 치료하기 위한 조성물 및 방법 | |
| US20230226131A1 (en) | Therapeutic herbal compositions for improving liver health | |
| WO2020188569A1 (en) | Methods and compositions for preventing or treating weight gain caused by psychiatric drugs | |
| NZ789786A (en) | Sleep Disorder Compositions and Treatments Thereof | |
| Ahmed et al. | people ages 15 to 64 years reported cannabis use in 2009. | |
| WO2023072621A1 (en) | Composition from aronia melanocarpa | |
| KR101693069B1 (ko) | 신증후군의 예방 또는 치료 활성을 갖는 항산화제의 용도 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| N231 | Notification of change of applicant | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |