KR20180105243A - TIMPS encapsulating Japanese cedar pollen epitope - Google Patents
TIMPS encapsulating Japanese cedar pollen epitope Download PDFInfo
- Publication number
- KR20180105243A KR20180105243A KR1020187025977A KR20187025977A KR20180105243A KR 20180105243 A KR20180105243 A KR 20180105243A KR 1020187025977 A KR1020187025977 A KR 1020187025977A KR 20187025977 A KR20187025977 A KR 20187025977A KR 20180105243 A KR20180105243 A KR 20180105243A
- Authority
- KR
- South Korea
- Prior art keywords
- composition
- particles
- antigen
- biodegradable particles
- cathepsin
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/51—Nanocapsules; Nanoparticles
- A61K9/5107—Excipients; Inactive ingredients
- A61K9/513—Organic macromolecular compounds; Dendrimers
- A61K9/5146—Organic macromolecular compounds; Dendrimers obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyethylene glycol, polyamines, polyanhydrides
- A61K9/5153—Polyesters, e.g. poly(lactide-co-glycolide)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/385—Haptens or antigens, bound to carriers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/35—Allergens
- A61K39/36—Allergens from pollen
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/34—Macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyesters, polyamino acids, polysiloxanes, polyphosphazines, copolymers of polyalkylene glycol or poloxamers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55555—Liposomes; Vesicles, e.g. nanoparticles; Spheres, e.g. nanospheres; Polymers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/57—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2
- A61K2039/577—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2 tolerising response
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/58—Medicinal preparations containing antigens or antibodies raising an immune response against a target which is not the antigen used for immunisation
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/60—Medicinal preparations containing antigens or antibodies characteristics by the carrier linked to the antigen
- A61K2039/6093—Synthetic polymers, e.g. polyethyleneglycol [PEG], Polymers or copolymers of (D) glutamate and (D) lysine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/62—Medicinal preparations containing antigens or antibodies characterised by the link between antigen and carrier
Abstract
본 발명은 일본 삼나무 꽃가루와 관련된 하나 이상의 에피토프를 캡슐화하는 음성 제타 전위를 갖는 입자를 포함하는 조성물을 제공한다. 상기 입자를 투여하여 일본 삼나무 꽃가루에 대한 면역학적 관용을 유도하는 방법이 또한 제공된다.The present invention provides a composition comprising particles having negative zeta potential encapsulating at least one epitope associated with Japanese cedar pollen. A method of inducing immunological tolerance to Japanese cedar pollen by administering the particles is also provided.
Description
관련 출원에 대한 교차 참조Cross-reference to related application
본 출원은 2016년 2월 9일에 출원된 미국 가출원 제62/293,261호에 우선권을 청구하며, 그의 전체 내용이 본 명세서에 참고로 편입되어 l있다.This application claims priority from U.S. Provisional Application No. 62 / 293,261, filed Feb. 9, 2016, the entire contents of which are incorporated herein by reference.
전자 제출된 텍스트 파일에 대한 설명Description of the electronic submission text file
본 명세서에 전자적으로 제출된 텍스트 파일의 내용은 그 전체가 참고로 본 명세서에 편입된다: 서열 목록의 컴퓨터 판독가능한 포맷 복사본(파일명: COUR_014_02WO_SeqList_ST25.txt, 기록일: 2017년 2월 9일, 파일 크기: 12kb).The contents of an electronically submitted text file are incorporated herein by reference in their entirety: a computer-readable formatted copy of the sequence listing (filename: COUR_014_02WO_SeqList_ST25.txt, Record Date: Feb. 9, 2017, File Size : 12kb).
일본 삼나무 꽃가루 과민증은 일본 삼나무(크립토메리아 야포니카(Cryptomeria japonica))의 꽃가루를 흡입함으로써 야기되는 일본의 일반적인 알러지성 질환이다. 일본의 삼나무 꽃가루 과민증의 유병률은 학교, 공장 및 지역 사회의 개인이 아닌 무작위화된 모집단에서 30%까지 높을 수 있으며, 최대 2천만명이 이 질병에 걸릴 수 있을 것으로 추산된다. 따라서, 이 질병은 증상의 중증도, 높은 유병률, 자발적인 회복률 저하 및 질병 통제와 관련된 높은 의료 비용 때문에 부분적으로 일본의 주요 공중 보건 문제이다.Japanese cedar pollen hypersensitivity is a common allergic diseases in Japan, which is caused by inhaling the pollen of Japanese cedar (crypto-Almeria artillery NIKA (Cryptomeria japonica)). The prevalence of Japanese cedar pollen hypersensitivity can be up to 30% in randomized populations, not individuals in schools, factories and communities, and up to 20 million people are estimated to be infected with this disease. Thus, the disease is a major public health problem in Japan in part because of the high severity of symptoms, high prevalence, reduced spontaneous recovery and high medical costs associated with disease control.
일본 삼나무 꽃가루 과민증은 심각한 I형 알러지성 질환이다. I형 알러지성 질환은 알러지항원-특이적 면역글로불린 E(IgE)의 전신 수준 상승, 비만 세포 탈과립화 및 히스타민 및 알러지의 다른 화학적 매개체의 방출을 특징으로 하는 무해한 환경적 항원(예를 들어, 일본 삼나무 꽃가루)에 대한 비정상적인 Th2-극성화된 면역 반응에 의해 매개된다. 알러지성 질환의 치료에 대한 주요 임상 접근법은 일반적으로 항히스타민제, 류코트리엔 억제제 또는 광범위한-작용성 글루코코르티코이드와 같은 약물로 급성 효과기 분자를 표적화함으로써 항원(Ag) 회피(예를 들어, 알러지항원 회피) 및 증상 제어로 구성된다. 그러나 이러한 치료법은 알러지성 염증을 일으키는 근본적인 비정상적인 Th2-편향된 면역 반응의 발달을 다루지 못한다. 점막 또는 피하로 전달되는 가용성 Ag의 서서히 증가하는 용량에 환자가 노출되는 특정 면역 요법(SIT)과 같은 대안적인 접근법도 또한 임상적으로 사용된다. SIT는 Th2 반응을 억제하는 조절 및 Th1 반응을 모두 유도한다. 이와 같이, SIT는 환경 알러지항원에 대한 면역 반응의 편차가 병리적, Th2-편향된 반응을 벗어나 보호성 또는 조절성 Th1/T 조절 반응쪽으로 향하는 결과를 초래할 수 있다. 그러나 민감화된 환자에게 가용성 Ag를 투여할 경우 부작용의 위험이 상당하므로, 오말리주맙(omalizumab)과 같은 과민증을 최소화하는 추가 약물과 항원의 병용 투여 또는 느린 용량 단계적 확대가 필요하다.Japanese cedar pollen hypersensitivity is a severe type I allergic disease. Type I allergic diseases are harmless environmental antigens characterized by elevated systemic levels of allergen-specific immunoglobulin E (IgE), mast cell degranulation and release of other chemical mediators of histamine and allergy Cedar pollen) by the abnormal Th2-polarized immune response. The major clinical approaches to the treatment of allergic diseases generally include antigen (Ag) avoidance (e. G., Allergy antigen avoidance) by targeting acute effector molecules to drugs such as antihistamines, leukotriene inhibitors or broad-acting glucocorticoids Symptom control. However, these therapies do not address the development of underlying abnormal Th2-biased immune responses that cause allergic inflammation. Alternative approaches such as specific immunotherapy (SIT) in which patients are exposed to a slowly increasing dose of soluble Ag delivered mucosally or subcutaneously are also used clinically. SIT induces both Th1 responses and regulatory inhibition of Th2 responses. Thus, SIT may result in deviations in the immune response to environmental allergens from a pathological, Th2-deflected response toward a protective or regulated Th1 / T regulatory response. However, the administration of soluble Ag to sensitized patients is associated with a high risk of side effects, and concomitant use of antipsychotic drugs or slow dose escalation of additional drugs to minimize hypersensitivity such as omalizumab is needed.
따라서, Ag-특이적 내성을 안전하고 효과적으로 유도하는 개선된 방법은 사전-민감화된 대상체에서 알러지성 질환의 치료를 위한 임상 도구로 남아있다. 알러지항원성 펩타이드를 캡슐화하는 나노입자는 생체내 모델에서 알러지항원-유도된 Th2 반응을 감소시키는 것으로 이미 실증되었다(미국 공보 제2015-0209293호 참조, 그 전문이 본 명세서에 참고로 편입됨). 따라서, 다양한 환경 공급원에서 유래된 꽃가루를 일본 삼나무 꽃가루 과민증과 같은 알러지성 질환을 치료하는데 사용하기 위한 나노입자로 캡슐화하는 것이 가능하다. 또한, 일본 삼나무 꽃가루 항원 CRYJ1은 산 삼나무의 Jun a 1 항원, 일본 사이프러스(cypress)의 Cha o 1 항원 및 큐프레서스 아리조니카(Cupressus arizonica)의 Cup a 1 항원에 대하여 고도의 유사성을 나타내며, 이는 일본 삼나무 꽃가루에서 추출한 특정 항원이 여러 침엽수 꽃가루에 걸쳐 교차-반응성인 알러지성 항체 반응을 매개할 수 있음을 시사한다.Thus, an improved method of safely and effectively inducing Ag-specific resistance remains a clinical tool for the treatment of allergic diseases in pre-sensitized subjects. Nanoparticles encapsulating allergenic peptide have already been demonstrated to reduce allergen-induced Th2 responses in vivo models (see US Publication No. 2015-0209293, which is incorporated herein by reference in its entirety). Thus, it is possible to encapsulate pollen derived from various environmental sources into nanoparticles for use in treating allergic diseases such as Japanese cedar pollen hypersensitivity. In addition, Japanese cedar pollen antigen CRYJ1 represents a mountain cedar Jun a 1 antigen, Cha o Japanese cypress (cypress) 1 antigen and cue presentation suspension ahrijo NIKA high similarity with respect to the Cup a 1 antigen (Cupressus arizonica), which Suggesting that certain antigens extracted from Japanese cedar pollen may mediate cross-reactive allergic antibody responses across multiple conifer pollen.
그러나, 일본 삼나무 꽃가루를 알러지성 질환의 치료에 적합한 입자로 캡슐화하려는 시도는 부분적으로만 성공적이었다. 이는 일본 삼나무 꽃가루가 저농도에서도 매우 점성이 높기 때문일 수 있다. 따라서, 삼나무 꽃가루 과민증을 위한 SIT 치료 방법은 제한적이다. 특히 침엽수 꽃가루 사이의 항체 교차-반응성의 가능성뿐만 아니라 일본 및 인접국에서의 질병의 실질적인 유병률을 감안할 때, 일본 삼나무 꽃가루 과민증을 앓고 있는 대상체 또는 일본 삼나무 꽃가루 과민증 발병 위험이 있는 대상체에서 삼나무 꽃가루 항원(예를 들어, CRYJ1 및 CRYJ2)에 대한 내성을 유도하는 안전하고 효과적인 수단에 대한 필요성이 있다.However, attempts to encapsulate Japanese cedar pollen as particles suitable for the treatment of allergic diseases were only partially successful. This may be because Japanese cedar pollen is very viscous at low concentrations. Therefore, the treatment of SIT for cedar pollen hypersensitivity is limited. In particular, considering the possibility of antibody cross-reactivity between conifer pollen, as well as the actual prevalence of the disease in Japan and neighboring countries, there is a possibility that cedar pollen antigen (eg, For example, there is a need for safe and effective means of inducing tolerance to CRYJ1 and CRYJ2.
발명의 요약SUMMARY OF THE INVENTION
일부 구현예에서, 본 발명은 일본 삼나무 꽃가루로부터의 하나 이상의 에피토프를 삽입하거나 부착된 캐리어 입자(예를 들어, PLG 입자)를 포함하는 (예를 들어, 항원-특이적 내성의 유도를 위한) 조성물을 제공한다. 특정 구현예에서, 캐리어 입자는 음성 제타 전위를 갖는 폴리(락타이드-코-글라이콜라이드)(PLG) 입자이다.In some embodiments, the invention provides compositions (e. G., For induction of antigen-specific resistance) that comprise one or more epitopes from Japanese cedar pollen or that contain carrier particles (e. G., PLG particles) . In certain embodiments, the carrier particle is a poly (lactide-co-glycolipid) (PLG) particle having a negative zeta potential.
본 발명의 특정 구현예는 일본 삼나무 꽃가루로부터의 하나 이상의 캡슐화된 항원성 에피토프를 포함하는 생분해성 입자를 포함하는 조성물로서, 상기 생분해성 입자가 음성 제타 전위를 갖는, 조성물에 관한 것이다. 특정 구현예에서, 생분해성 입자는 폴리(락타이드-코-글라이콜라이드)(PLG)를 포함한다. 일부 구현예에서, 생분해성 입자는 폴리락트산:폴리글라이콜산의 코폴리머 비가 약 50:50인 PLG를 포함한다. 특정 구현예에서, 생분해성 입자의 표면은 카복실화된다. 일부 구현예에서, 카복실화는 폴리(에틸렌-말레산 무수물)(PEMA) 또는 폴리(아크릴산)(PAA)를 사용하여 달성된다.Certain embodiments of the invention are compositions comprising biodegradable particles comprising at least one encapsulated antigenic epitope from Japanese cedar pollen, wherein the biodegradable particles have a negative zeta potential. In certain embodiments, the biodegradable particles comprise poly (lactide-co-glycolide) (PLG). In some embodiments, the biodegradable particles comprise PLG having a copolymer ratio of polylactic acid: polyglycolic acid of about 50:50. In certain embodiments, the surface of the biodegradable particles is carboxylated. In some embodiments, the carboxylation is accomplished using poly (ethylene-maleic anhydride) (PEMA) or poly (acrylic acid) (PAA).
특정 구현예에서, 생분해성 입자는 약 -100 mV 내지 약 0 mV의 제타 전위를 갖는다. 특정 구현예에서, 생분해성 입자는 약 -50 mV 내지 약 -40 mV의 제타 전위를 갖는다. 일부 구현예에서, 생분해성 입자는 약 -75 mV 내지 약 -50 mV의 제타 전위를 갖는다. 특정 구현예에서, 생분해성 입자는 약 -50 mV의 제타 전위를 갖는다.In certain embodiments, the biodegradable particles have a zeta potential of about -100 mV to about 0 mV. In certain embodiments, the biodegradable particles have a zeta potential of about -50 mV to about -40 mV. In some embodiments, the biodegradable particles have a zeta potential of about -75 mV to about -50 mV. In certain embodiments, the biodegradable particles have a zeta potential of about -50 mV.
특정 구현예에서, 생분해성 입자는 약 0.1 ㎛ 내지 약 10 ㎛의 직경을 갖는다. 일부 구현예에서, 생분해성 입자는 약 0.3 ㎛ 내지 약 5 ㎛의 직경을 갖는다. 특정 구현예에서, 생분해성 입자는 약 0.5 ㎛ 내지 약 3 ㎛의 직경을 갖는다. 특정 구현예에서, 생분해성 입자는 약 0.5 ㎛ 내지 약 1 ㎛의 직경을 갖는다. 일부 구현예에서, 생분해성 입자는 약 0.2 ㎛ 내지 약 0.7 ㎛의 직경을 갖는다. 특정 구현예에서, 생분해성 입자는 약 0.5 ㎛의 직경을 갖는다.In certain embodiments, the biodegradable particles have a diameter of from about 0.1 microns to about 10 microns. In some embodiments, the biodegradable particles have a diameter of about 0.3 microns to about 5 microns. In certain embodiments, the biodegradable particles have a diameter of about 0.5 [mu] m to about 3 [mu] m. In certain embodiments, the biodegradable particles have a diameter of about 0.5 [mu] m to about 1 [mu] m. In some embodiments, the biodegradable particles have a diameter of about 0.2 [mu] m to about 0.7 [mu] m. In certain embodiments, the biodegradable particles have a diameter of about 0.5 占 퐉.
본 발명의 특정 구현예는 일본 삼나무 꽃가루로부터의 하나 이상의 캡슐화된 항원성 에피토프를 포함하는 음성 제타 전위를 갖는 생분해성 입자를 포함하는 조성물에 관한 것이다. 일부 구현예에서, 일본 삼나무 꽃가루로부터의 하나 이상의 캡슐화된 항원성 에피토프는 Cry j 1, Cry j 2, Cry j 3, Cry j 4, Cry j IFR, Cry j 키티나제(Chitinase), Cry j Asp, Cry j LTP 및/또는 Cry j CPA9를 포함한다. 특정 구현예에서, 일본 삼나무 꽃가루로부터의 하나 이상의 캡슐화된 항원성 에피토프는 CRYJ1 또는 그의 단편 또는 변이체를 포함한다. 일부 구현예에 있어서, CRYJ1은Certain embodiments of the invention are directed to compositions comprising biodegradable particles having negative zeta potential comprising one or more encapsulated antigenic epitopes from Japanese cedar pollen. In some embodiments, the at least one encapsulated antigenic epitope from Japanese cedar pollen is selected from the group consisting of Cry j 1, Cry j 2, Cry j 3, Cry j 4, Cry j IFR, Cry j chitinase, Cry j Asp, Cry j LTP and / or Cry j CPA9. In certain embodiments, the at least one encapsulated antigenic epitope from Japanese cedar pollen comprises CRYJ1 or a fragment or variant thereof. In some embodiments, CRYJ1 is
의 아미노산 서열을 갖는다.Lt; / RTI >
일부 구현예에서, CRYJ1의 단편은 SEQ ID NO: 1과 적어도 90%의 서열 동일성을 갖는 적어도 10, 적어도 20, 적어도 30, 적어도 40, 또는 적어도 50개의 연속적인 아미노산을 포함한다. 특정 구현예에서, CRYJ1의 변이체는 SEQ ID NO: 1과 적어도 70%, 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 또는 적어도 99%의 서열 동일성을 갖는 아미노산 서열을 갖는다. 일부 구현예에서, CRYJ1의 단편은 p16-30, p81-95, p106-120, p111-125, p211-225 및 p301-315로 구성된 그룹으로부터 선택된다.In some embodiments, the fragment of CRYJ1 comprises at least 10, at least 20, at least 30, at least 40, or at least 50 consecutive amino acids having at least 90% sequence identity with SEQ ID NO: 1. In certain embodiments, a variant of CRYJ1 has at least 70%, at least 75%, at least 80%, at least 85%, at least 90%, at least 95%, at least 98%, or at least 99% sequence identity to SEQ ID NO: ≪ / RTI > In some embodiments, the fragment of CRYJ1 is selected from the group consisting of p16-30, p81-95, p106-120, p111-125, p211-225, and p301-315.
특정 구현예에서, 일본 삼나무 꽃가루로부터의 하나 이상의 캡슐화된 항원성 에피토프는 CRYJ2 또는 그의 단편 또는 변이체를 포함한다. 일부 구현예에서, CRYJ2는 In certain embodiments, the at least one encapsulated antigenic epitope from Japanese cedar pollen comprises CRYJ2 or a fragment or variant thereof. In some embodiments, CRYJ2 is
의 아미노산 서열을 갖는다.Lt; / RTI >
일부 구현예에 있어서, CRYJ2의 단편은 SEQ ID NO: 2와 적어도 90%의 서열 동일성을 갖는 적어도 10, 적어도 20, 적어도 30, 적어도 40, 또는 적어도 50개의 연속적인 아미노산을 포함한다. 특정 구현예에서, CRYJ2의 변이체는 SEQ ID NO: 2와 적어도 70%, 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 또는 적어도 99%의 서열 동일성을 갖는 아미노산 서열을 갖는다. 일부 구현예에서, CRYJ2의 단편은 p66-80, p81-95, p141-155, p186-200, p236-250, p346-360, p351-365 및 p336-350으로 구성된 그룹으로부터 선택된다.In some embodiments, the fragment of CRYJ2 comprises at least 10, at least 20, at least 30, at least 40, or at least 50 consecutive amino acids having at least 90% sequence identity with SEQ ID NO: 2. In certain embodiments, a variant of CRYJ2 has at least 70%, at least 75%, at least 80%, at least 85%, at least 90%, at least 95%, at least 98%, or at least 99% sequence identity to SEQ ID NO: ≪ / RTI > In some embodiments, the fragment of CRYJ2 is selected from the group consisting of p66-80, p81-95, p141-155, p186-200, p236-250, p346-360, p351-365 and p336-350.
특정 구현예에서, 본원에 기술된 생분해성 입자는 일본 삼나무 꽃가루 단백질로부터의 2종 이상의 캡슐화된 항원성 에피토프를 포함한다. 일부 구현예에서, 2종 이상의 캡슐화된 에피토프는 융합 단백질에 함유되며, 여기서 융합 단백질 내의 2종 이상의 캡슐화된 에피토프는 절단가능한 링커에 의해 분리된다. 특정 구현예에서, 절단가능한 링커의 아미노산 서열은 세포의 파고리소좀에 위치한 프로테아제 및/또는 세포의 사이토졸에 위치한 프로테아제에 의해 절단가능하다. 일부 구현예에서, 절단가능한 링커의 아미노산 서열은 세포의 파고리소좀에 위치한 프로테아제 및 세포의 사이토졸에 위치한 프로테아제에 의해 절단가능하다. 특정 구현예에서, 절단가능한 링커는 퓨린 감수성 링커 또는 카텝신 감수성 링커이다. 특정 구현예에서, 절단가능한 링커는 퓨린 감수성 링커이다. 일부 구현예에서, 절단가능한 링커는 카텝신 감수성 링커이다. 특정 구현예에서, 카텝신 감수성 링커는 카텝신 A, 카텝신 B, 카텝신 C, 카텝신 D, 카텝신 E, 카텝신 F, 카텝신 G, 카텝신 H, 카텝신 K, 카텝신 L, 카텝신 O, 카텝신 W, 및/또는 카텝신 Z 중 하나 이상에 의한 절단에 민감하다. 일부 구현예에서, 링커의 아미노산 서열은 Gly-Ala-Val-Val-Arg-Gly-Ala(SEQ ID NO: 3)이다.In certain embodiments, the biodegradable particles described herein comprise two or more encapsulated antigenic epitopes from Japanese cedar pollen protein. In some embodiments, two or more encapsulated epitopes are contained in the fusion protein, wherein the two or more encapsulated epitopes in the fusion protein are separated by a cleavable linker. In certain embodiments, the amino acid sequence of the cleavable linker is cleavable by a protease located in the phagocytic lysosome of the cell and / or in the cytosol of the cell. In some embodiments, the amino acid sequence of the cleavable linker is cleavable by a protease located in the phagocytic lysosome of the cell and a cytosol in the cytosol of the cell. In certain embodiments, the cleavable linker is a purine susceptible linker or a cathepsin susceptible linker. In certain embodiments, the cleavable linker is a purine susceptible linker. In some embodiments, the cleavable linker is a cathepsin-sensitive linker. In certain embodiments, the cathepsin-sensitive linker is selected from the group consisting of cathepsin A, cathepsin B, cathepsin C, cathepsin D, cathepsin E, cathepsin F, cathepsin G, cathepsin H, cathepsin K, cathepsin L, It is sensitive to cleavage by one or more of cathepsin O, cathepsin W, and / or cathepsin Z. In some embodiments, the amino acid sequence of the linker is Gly-Ala-Val-Val-Arg-Gly-Ala (SEQ ID NO: 3).
특정 구현예에서, 일본 삼나무 꽃가루로부터의 하나 이상의 캡슐화된 항원성 에피토프는 생분해성 입자에 공유결합된다. 특정 구현예에서, 일본 삼나무 꽃가루로부터의 하나 이상의 캡슐화된 항원성 에피토프는 콘주게이트 분자에 의해 생분해성 입자에 공유결합된다. 일부 구현예에서, 콘주게이트 분자는 카보디이미드 화합물을 포함한다. 특정 구현예에서, 카보디이미드 화합물은 1-에틸-3-(3-디메틸아미노프로필)카보디이미드(EDC)를 포함한다.In certain embodiments, one or more encapsulated antigenic epitopes from Japanese cedar pollen are covalently bound to biodegradable particles. In certain embodiments, one or more encapsulated antigenic epitopes from Japanese cedar pollen are covalently bound to biodegradable particles by conjugated molecules. In some embodiments, the conjugate molecule comprises a carbodiimide compound. In certain embodiments, the carbodiimide compound comprises 1-ethyl-3- (3-dimethylaminopropyl) carbodiimide (EDC).
특정 구현예는 본원에 기재된 생분해성 입자를 포함하는 약제학적 조성물에 관한 것이다. 일부 구현예에서, 약제학적 조성물은 약제학적으로 허용가능한 캐리어를 추가로 포함한다. 특정 구현예에서, 약제학적 조성물은 약제학적으로 허용가능한 부형제를 추가로 포함한다. 특정 구현예는 본원에 기술된 생분해성 입자를 포함하는 동결건조된 조성물에 관한 것이다.Certain embodiments relate to pharmaceutical compositions comprising the biodegradable particles described herein. In some embodiments, the pharmaceutical composition further comprises a pharmaceutically acceptable carrier. In certain embodiments, the pharmaceutical composition further comprises a pharmaceutically acceptable excipient. Certain embodiments relate to lyophilized compositions comprising the biodegradable particles described herein.
특정 구현예는 본 명세서에 기술된 유효량의 약제학적 조성물을 대상체에게 투여하는 단계를 포함하는, 대상체에서 일본 삼나무 꽃가루에 대한 항원-특이적 내성을 유도하는 방법에 관한 것이다. 특정 구현예는 본 명세서에 기술된 약제학적 조성물을 투여하는 단계를 포함하는, 치료를 필요로 하는 대상체에서 일본 삼나무 꽃가루 알러지를 치료하는 방법에 관한 것이다. 일부 구현예는 본 명세서에 기술된 약제학적 조성물을 투여하는 단계를 포함하는, 치료를 필요로 하는 대상체에서 일본 삼나무 꽃가루 알러지를 예방하는 방법에 관한 것이다.Certain embodiments relate to methods of inducing antigen-specific tolerance to Japanese cedar pollen in a subject, comprising administering to the subject an effective amount of the pharmaceutical composition described herein. A particular embodiment relates to a method of treating Japanese cedar pollen allergy in a subject in need of treatment comprising administering a pharmaceutical composition as described herein. Some embodiments relate to a method of preventing Japanese cedar pollen allergy in a subject in need of treatment comprising administering a pharmaceutical composition as described herein.
특정 구현예는 본원에 기술된 동결건조된 입자를 재구성하여 재구성된 약제학적 조성물을 수득하는 단계 및 상기 재구성된 약제학적 조성물을 대상체에게 투여하는 단계를 포함하는, 대상체에서 일본 삼나무 꽃가루에 대한 항원-특이적 내성을 유도하는 방법에 관한 것이다. 특정 구현예는 본 명세서에 기술된 동결건조된 입자를 재구성하여 재구성된 약제학적 조성물을 수득하는 단계 및 상기 재구성된 약제학적 조성물을 대상체에게 투여하는 단계를 포함하는, 치료를 필요로 하는 대상체에서 일본 삼나무 꽃가루 알러지를 치료하는 방법에 관한 것이다. 일부 구현예는 본 명세서에 기술된 동결건조된 입자를 재구성하여 재구성된 약제학적 조성물을 수득하는 단계 및 상기 재구성된 약제학적 조성물을 대상체에게 투여하는 단계를 포함하는, 치료를 필요로 하는 대상체에서 일본 삼나무 꽃가루 알러지를 예방하는 방법에 관한 것이다.Certain embodiments are directed to a method of inhibiting antigen-antibody interaction in Japanese cedar pollen from a subject, comprising reconstituting the lyophilized particles described herein to obtain a reconstituted pharmaceutical composition, and administering the reconstituted pharmaceutical composition to the subject. Lt; RTI ID = 0.0 > resistance. ≪ / RTI > Certain embodiments relate to a method of treating a subject in need of treatment comprising administering to a subject in need of treatment a therapeutically effective amount of a compound of formula The present invention relates to a method for treating cedar pollen allergy. Some embodiments relate to a method of treating a subject in need of treatment, comprising reconstituting the lyophilized particles described herein to obtain a reconstituted pharmaceutical composition and administering the reconstituted pharmaceutical composition to a subject, This invention relates to a method for preventing allergy to cedar pollen.
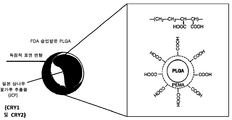
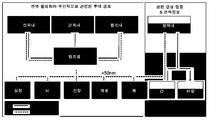
도 1은 일본 삼나무 꽃가루로부터의 항원성 에피토프를 캡슐화하는 음성 제타 전위를 갖는 생분해성 입자의 투여가 일본 삼나무 꽃가루 알러지의 효과적인 치료를 제공하는 방법의 모델을 도시한다.
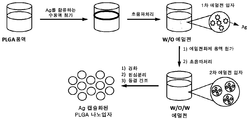
도 2는 JCP 추출물의 점도(도 2a), 일본 삼나무 꽃가루의 항원성 에피토프를 캡슐화하는 음성 제타 전위를 갖는 생분해성 입자(TIMP-JCP)의 예시적인 도시(도 2b), 및 이중-에멀젼 공정의 개략도(도 2c)를 나타낸다.
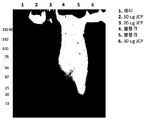
도 3은 JCP 추출물 및 재조합 JCP 단백질의 SDS-PAGE 분석 결과를 나타낸다.
도 4는 TIMP 캡슐화 JCP 추출물에 대한 입자 특징을 보여준다.
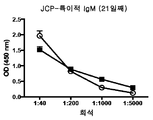
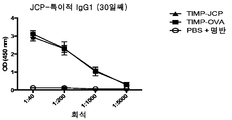
도 5는 급성 염증성 마우스 모델의 개략도(도 5a) 및 민감화 후 21일째의 항체 반응(도 5b-5d)을 도시한다.
도 6은 JCP 민감화, TIMP 처리 및 JCP 챌린지 후의 체온 변화를 나타낸다.
도 7은 JCP 민감화, TIMP 처리 및 JCP 챌린지 후의 긁기, 재채기 및 기침 점수를 나타낸다.
도 8은 TIMP-JCP 또는 TIMP-OVA로 처리된 JCP 민감화된 및 챌린지된 마우스로부터의 비장 세포로부터의 사이토카인 생성을 나타낸다.
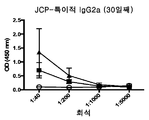
도 9는 JCP에 의한 민감화 후 30일째의 항체 반응을 나타낸다.
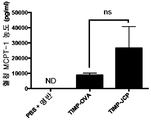
도 10은 히스타민(도 10a) 및 MCPT-1(도 10b)의 혈청 수준을 나타낸다.
도 11은 수득한 면역 반응에 대한 투여 경로의 효과를 설명한다.Figure 1 shows a model of how the administration of biodegradable particles with negative zeta potential to encapsulate an antigenic epitope from Japanese cedar pollen provides effective treatment of Japanese cedar pollen allergy.
Figure 2 shows the viscosity of the JCP extract (Figure 2a), an illustrative illustration of biodegradable particles (TIMP-JCP) with negative zeta potential encapsulating the antigenic epitope of Japanese cedar pollen (Figure 2b), and the dual- (Fig. 2C).
Figure 3 shows the results of SDS-PAGE analysis of JCP extract and recombinant JCP protein.
Figure 4 shows particle characteristics for the TIMP encapsulated JCP extract.
Figure 5 shows a schematic (Figure 5a) of an acute inflammatory mouse model and an antibody response (Figures 5b-5d) on
Figure 6 shows body temperature changes after JCP sensitization, TIMP treatment and JCP challenge.
Figure 7 shows scratching, sneezing and cough scores after JCP sensitization, TIMP treatment and JCP challenge.
Figure 8 shows cytokine production from spleen cells from JCP sensitized and challenged mice treated with TIMP-JCP or TIMP-OVA.
Figure 9 shows the antibody response on
Figure 10 shows serum levels of histamine (Figure 10a) and MCPT-1 (Figure 10b).
Figure 11 illustrates the effect of the route of administration on the obtained immune response.
본 발명자들은 항원이 포매된 나노입자가 자가면역 질병에 대한 내성을 유도할 수 있고 면역 반응을 감소시킬 수 있음을 발견하였다. 따라서, 이들 입자는 일본 삼나무 꽃가루에 대한 알러지와 같은 과도한 염증성 면역 반응을 특징으로 하는 임의의 질병 또는 질환의 치료에 유용할 수 있다.The present inventors have found that antigen-embedded nanoparticles can induce tolerance to autoimmune diseases and reduce the immune response. Thus, these particles may be useful in the treatment of any disease or disorder characterized by an excessive inflammatory immune response, such as allergy to Japanese cedar pollen.
본원에서 사용된 바와 같이, "입자"는 물질의 임의의 비-조직 유래된 조성물을 지칭하며, 구형체 또는 구형체-유사 독립체, 비드 또는 리포좀일 수 있다. 용어 "입자", 용어 "면역 변형 입자", 용어 "캐리어 입자" 및 용어 "비드"는 문맥에 따라 상호교환적으로 사용될 수 있다. 또한, "입자"라는 용어는 비드와 구형체를 포함하여 사용될 수 있다.As used herein, "particle" refers to any non-tissue-derived composition of matter and may be spherical or spheroid-like independent, bead or liposome. The term " particle ", the term "immunostimulatory particle ", the term" carrier particle "and the term" bead "may be used interchangeably depending on the context. In addition, the term "particle" may be used including beads and spheres.
본원에서 사용된 바와 같이, "음으로 하전된 입자"는 0보다 작은 순 표면 전하를 갖도록 변형된 입자를 지칭한다.As used herein, "negatively charged particle" refers to a modified particle having a net surface charge of less than zero.
"카복실화된 입자" 또는 "카복실화된 비드" 또는 "카복실화된 구형체"는 그의 표면 상에 카복실기를 함유하도록 변형된 임의의 입자를 포함한다. 일부 구현예에서, 카복실기의 첨가는 예를 들어 MARCO와 같은 포착제 수용체와의 상호작용을 통한 순환으로부터의 입자의 식균세포/단핵구 흡수를 향상시킨다. 입자의 카복실화는 폴리(에틸렌-알트-말레산 무수물)(PEMA)을 포함하지만, 이에 한정되지 않는 카복실기를 첨가하거나 혼입하는 임의의 화합물을 사용하여 달성될 수 있다."Carboxylated particle" or "carboxylated bead" or "carboxylated spheroid" includes any particle modified to contain a carboxyl group on its surface. In some embodiments, the addition of a carboxyl group improves the phagocyte / mononuclear absorption of the particle from the circulation through interaction with, for example, capture agent receptors such as MARCO. Carboxylation of the particles can be accomplished using any compound that adds or incorporates a carboxyl group, including, but not limited to, poly (ethylene-alt-maleic anhydride) (PEMA).
본원에서 사용된 바와 같이, "항원성 모이어티"는 임의의 모이어티, 예를 들어 숙주의 면역계에 의해 인식되는 펩타이드를 지칭한다. 항원성 모이어티의 예로는 자가항원, 효소 및/또는 박테리아 또는 바이러스성 단백질, 펩타이드, 약물 또는 성분이 포함되지만, 이에 한정되는 것은 아니다. 이론에 구속됨이 없이, 카복실화된 비드 자체가 면역계에 의해 인식될 수 있지만, 그에 아무것도 부착되어 있지 않는 카복실화된 비드는 본 발명의 목적 상 "항원성 모이어티"로 간주되지 않는다.As used herein, "antigenic moiety" refers to any moiety, e. G., A peptide that is recognized by the immune system of the host. Examples of antigenic moieties include, but are not limited to, autoantigens, enzymes and / or bacterial or viral proteins, peptides, drugs or components. Without being bound by theory, the carboxylated bead itself can be recognized by the immune system, but the carboxylated bead to which nothing is attached is not considered an "antigenic moiety" for purposes of the present invention.
본원에서 사용된 바와 같이, "네이키드(naked) 비드" 또는 "네이키드 입자" 또는 "네이키드 구형체"는 카복실화되지 않은 비드, 입자 또는 구형체를 지칭한다.As used herein, "naked beads" or "naked particles" or "naked spheres" refers to non-carboxylated beads, particles or spheres.
본원에서 사용된 바와 같이, "전-염증 매개체" 또는 "전-염증 폴리펩타이드"는 대상체에서 염증을 유도, 유지 또는 연장시키는 폴리펩타이드 또는 이의 단편을 지칭한다. 전-염증 매개체의 예는 사이토카인 및 케모카인을 포함하지만, 이에 한정되지 않는다.As used herein, a "pre-inflammatory mediator" or "pre-inflammatory polypeptide" refers to a polypeptide or fragment thereof that induces, maintains or prolongs inflammation in a subject. Examples of pre-inflammatory mediators include, but are not limited to, cytokines and chemokines.
본원에서 사용된 바와 같이, 용어 "염증성 단핵구"는 CD14/CD26 및 CCR2의 임의의 조합을 발현하는 임의의 골수 세포를 지칭한다.As used herein, the term "inflammatory mononuclear" refers to any bone marrow cell expressing any combination of CD14 / CD26 and CCR2.
본원에서 사용된 바와 같이, 용어 "억제성 중성구"는 억제 세포를 유도하는 중성구 및/또는 단핵구를 지칭한다.As used herein, the term "inhibitory neutrophil" refers to neutrophils and / or monocytes that induce inhibitory cells.
본원에서 사용된 바와 같이, 용어 "Th 세포" 또는 "헬퍼 T 세포"는 CD4+ 세포를 지칭한다. CD4+ T 세포는 B 세포의 형질 세포 및 메모리 B 세포로의 성숙, 및 세포독성 T 세포 및 대식세포의 활성화를 포함하는, 면역적 과정을 통해 다른 백혈구를 돕는다. T 세포는 항원-제시 세포(APCs)의 표면 상에 발현되는 MHC 부류 II 분자에 의해 펩타이드 항원에 의해 제시될 때 활성화된다.As used herein, the term "Th cell" or "helper T cell" refers to a CD4 + cell. CD4 + T cells help other leukocytes through immune processes, including maturation of B cells into plasma cells and memory B cells, and activation of cytotoxic T cells and macrophages. T cells are activated when presented by peptide antigens by MHC class II molecules expressed on the surface of antigen-presenting cells (APCs).
본원에 사용된 바와 같이, 용어 "Th1 세포"는 전-염증 매개체를 생성하는 Th 세포의 서브셋을 지칭한다. Th1 세포는 면역 반응을 촉진시키는 사이토카인을 분비하고, 감염된 조직에 대한 중성구 및 대식세포의 동원을 중재함으로써 부분적으로 병원체에 대한 숙주 방어에 역할을 한다. Th1 세포는 IFN-γ, IL-2, IL-10 및 TNFα/β를 비롯한 사이토카인을 분비하여, 바이러스 및 일부 박테리아와 같은 세포 내 병원체에 대한 방어를 조정한다.As used herein, the term "Th1 cell" refers to a subset of Th cells that produce a pre-inflammatory mediator. Th1 cells partly play a role in host defense against pathogens by secreting cytokines that stimulate the immune response and mediating the mobilization of neutrophils and macrophages to infected tissues. Th1 cells secrete cytokines including IFN-y, IL-2, IL-10 and TNFa / beta to modulate defense against intracellular pathogens such as viruses and some bacteria.
본원에서 사용된 바와 같이, 용어 "Th2 세포"는 세포외 기생충, 박테리아, 알러지항원 및 독소에 대한 항체-매개된 면역 반응의 활성화 및 유지를 매개하는 Th 세포의 서브셋을 지칭한다. Th2 세포는 IL-4, IL-5, IL-6, IL-9, IL-13 및 IL-17E(IL-25)와 같은 다양한 사이토카인을 생산함으로써 항체 생산, 호산구 활성화, 및 여러 가지 대식세포 기능의 억제가 가능하도록 상기 기능을 매개하여 식균세포-독립적인 보호성 반응을 제공한다.As used herein, the term "Th2 cell " refers to a subset of Th cells that mediate the activation and maintenance of an antibody-mediated immune response to extracellular parasites, bacteria, allergenic antigens and toxins. Th2 cells produce various cytokines such as IL-4, IL-5, IL-6, IL-9, IL-13 and IL-17E Thereby providing a phagocyte-independent, protective response mediated by the function so that inhibition of function is possible.
본원에서 사용된 바와 같이, 용어 "Th17 세포"는 Th 세포의 서브셋을 지칭한다. Th17 세포는 면역 반응을 촉진하기 위해 사이토카인을 분비하고, 감염된 조직에 중성구 및 대식세포의 동원을 중재함으로써 병원체에 대한 숙주 방어에 역할을 한다. TH17 세포는 진균 및 박테리아를 포함한 세포외 병원체에 대한 방어를 조정하기 위해 IL-17, IL-21, IL-22, IL-24, IL-26 및 TNFα와 같은 사이토카인을 분비한다.As used herein, the term "Th17 cell" refers to a subset of Th cells. Th17 cells play a role in host defense against pathogens by secreting cytokines to stimulate the immune response and mediating mobilization of neutrophils and macrophages into infected tissues. TH17 cells secrete cytokines such as IL-17, IL-21, IL-22, IL-24, IL-26 and TNFα to regulate defense against extracellular pathogens including fungi and bacteria.
본원에서 사용된 바와 같이, "커플링된"은 입자 외부에 고정되거나 입자 내에 캡슐화된 항원을 지칭한다. 따라서, 입자에 커플링된 항원은 입자내 캡슐화뿐만 아니라 표면 커플링을 모두 포함한다.As used herein, "coupled" refers to an antigen immobilized outside the particle or encapsulated within the particle. Thus, the antigen coupled to the particle includes both intra-particle encapsulation as well as surface coupling.
본원에서 사용된 바와 같이, 용어 "IMP"는 항원에 커플링되지 않은 면역-변형 입자를 지칭한다. 본원에서 사용된 바와 같이, 용어 "TIMP"는 항원에 커플링된 면역 변형된 입자를 용인하는 것을 지칭한다. 일부 구현예에서, 항원은 TIMP의 표면에 부착된다. 다른 구현예에서, 항원은 TIMP 내에 캡슐화된다.As used herein, the term "IMP " refers to immunostimulatory particles that are not coupled to an antigen. As used herein, the term "TIMP" refers to tolerating immunostimulatory particles coupled to an antigen. In some embodiments, the antigen is attached to the surface of the TIMP. In another embodiment, the antigen is encapsulated within a TIMP.
입자는 임의의 입자 형상 또는 형태를 가질 수 있다. 그러나, 일부 구현예에서, 생체내에서 덜 응집하는 입자를 사용하는 것이 바람직하다. 이들 구현예의 입자의 예는 구형 형상을 갖는 입자이다.The particles may have any particle shape or shape. However, in some embodiments, it is desirable to use less agglomerated particles in vivo. Examples of particles of these embodiments are particles having a spherical shape.
본 발명의 또 다른 양태는 음성 제타 전위를 갖고 항원성 모이어티가 없는 면역 변형된 입자를 포함하는 조성물에 관한 것이다. 추가의 구현예에서, 본 발명은 항원에 커플링된 음성 제타 전위를 갖는 면역 변형된 입자를 포함하는 조성물을 제공한다. 추가의 구현예에서, 항원은 입자의 외부에 커플링된다. 바람직한 구현예에서, 항원은 입자 내에 캡슐화된다.Another aspect of the invention relates to a composition comprising an immunostimulatory particle having a negative zeta potential and no antigenic moiety. In a further embodiment, the invention provides a composition comprising an immunostimulatory particle having a negative zeta potential coupled to an antigen. In a further embodiment, the antigen is coupled to the outside of the particle. In a preferred embodiment, the antigen is encapsulated in a particle.
본 발명의 또 다른 양태는 음성 제타 전위를 갖고 항원성 모이어티가 없는 면역 변형된 입자의 제조 방법에 관한 것이다. 이 방법은 음성 제타 전위를 갖는 면역 변형된 입자를 형성시키는데 효과적인 조건하에 면역 변형된 입자 전구체를 완충액과 접촉시키는 단계를 포함한다. 본 발명의 일부 구현예에서, 면역 변형된 입자 전구체는 공중합을 통해 형성된다. 입자 미세구조는 공중합의 방법에 의존할 수 있다.Another aspect of the present invention relates to a method for producing an immunostimulated particle having a negative zeta potential and no antigenic moiety. The method comprises contacting the immunostimulated particle precursor with a buffer under conditions effective to form an immunostimulated particle having a negative zeta potential. In some embodiments of the invention, the immunostimulated particle precursor is formed through copolymerization. The particle microstructure can depend on the method of copolymerization.
일부 구현예에서, 항원성 펩타이드 분자는 콘쥬게이트 분자 및/또는 링커 그룹에 의해 캐리어 입자(예를 들어, 면역 변형된 입자)에 커플링된다. 일부 구현예에서, 항원성 펩타이드 및/또는 세포자멸적 신호전달 분자를 캐리어(예를 들어, PLG 입자)에 커플링시키는 단계는 하나 이상의 공유 및/또는 비-공유 상호작용을 포함한다. 일부 구현예에서, 항원성 펩타이드는 음성 제타 전위를 갖는 캐리어 입자의 표면에 부착된다. 일부 구현예에서, 항원성 펩타이드는 음성 제타 전위를 갖는 캐리어 입자 내에 캡슐화된다.In some embodiments, the antigenic peptide molecule is coupled to a carrier particle (e. G., An immunostimulated particle) by a conjugate molecule and / or a linker group. In some embodiments, the step of coupling the antigenic peptide and / or the apoptotic signaling molecule to a carrier (e. G., A PLG particle) comprises one or more covalent and / or non-covalent interactions. In some embodiments, the antigenic peptide is attached to the surface of the carrier particle having a negative zeta potential. In some embodiments, the antigenic peptide is encapsulated within a carrier particle having a negative zeta potential.
일 구현예에서, 면역 변형된 입자와 접촉하는 완충액은 염기성 pH를 가질 수 있다. 염기성 용액에 적합한 염기성 pH는 7.1, 7.5, 8.0, 8.5, 9.5, 10.0 10.5, 11.0, 11.5, 12.0, 12.5, 13.0 및 13.5를 포함한다. 완충액은 또한 임의의 적합한 염기 및 그의 콘쥬게이트로 제조될 수 있다. 본 발명의 일부 구현예에서, 완충액은 중탄산 나트륨, 중탄산 칼륨, 중탄산 리튬, 인산이수소 칼륨, 인산이수소 나트륨 또는 인산이수소 리튬 및 이의 콘쥬게이트를 포함하지만, 이에 한정되지는 않는다.In one embodiment, the buffer in contact with the immunostimulated particles may have an alkaline pH. Suitable basic pHs for basic solutions include 7.1, 7.5, 8.0, 8.5, 9.5, 10.0 10.5, 11.0, 11.5, 12.0, 12.5, 13.0 and 13.5. Buffers can also be prepared with any suitable base and its conjugates. In some embodiments of the invention, the buffer solution includes, but is not limited to, sodium bicarbonate, potassium bicarbonate, lithium bicarbonate, potassium dihydrogenphosphate, sodium dihydrogenphosphate or lithium dihydrogenphosphate and conjugates thereof.
본 발명의 일 구현예에서, 면역 변형된 입자는 코폴리머를 함유한다. 이들 코폴리머는 다양한 몰비를 가질 수 있다. 본 발명의 면역 변형된 입자의 적절한 코폴리머 비는 25:75, 30:70, 35:65, 40:60, 45:55, 50:50, 55:45, 60:40, 65:35, 70:30, 75:25, 80:20, 81:19, 82:18, 83:17, 84:16, 85:15, 86:14, 87:13, 88:12, 89:11, 90:10, 91:9, 92:8, 93:7, 94:6, 95:5, 96:4, 97:3, 98:2, 99:1, 또는 100:0일 수 있다. 또 다른 구현예에서, 코폴리머는 기간적, 통계적, 선형, 분지형(스타, 브러시 또는 콤(comb) 코폴리머 포함) 코폴리머일 수 있다. 일부 구현예에서, 코폴리머 비는 폴리스티렌:폴리(비닐 카복실레이트)/80:20, 폴리스티렌:폴리(비닐 카복실레이트)/90:10, 폴리(비닐 카복실레이트):폴리스티렌/80:20, 폴리(비닐 카복실레이트):폴리스티렌/90:10, 폴리락트산:폴리글라이콜산/50:50, 폴리락트산:폴리글라이콜산/80:20, 또는 폴리락트산:폴리글라이콜산/90:10일 수 있지만, 이에 한정되지는 않는다.In one embodiment of the invention, the immunostimulated particles contain a copolymer. These copolymers can have various molar ratios. Suitable copolymer ratios of the immunostimulated particles of the present invention are 25:75, 30:70, 35:65, 40:60, 45:55, 50:50, 55:45, 60:40, 65:35, 70 : 30, 75:25, 80:20, 81:19, 82:18, 83:17, 84:16, 85:15, 86:14, 87:13, 88:12, 89:11, 90:10 , 91: 9, 92: 8, 93: 7, 94: 6, 95: 5, 96: 4, 97: 3, 98: 2, 99: 1, or 100: In another embodiment, the copolymer may be a periodic, statistical, linear, branched (including star, brush or comb copolymer) copolymer. In some embodiments, the copolymer ratio is selected from the group consisting of polystyrene: poly (vinylcarboxylate) / 80:20, polystyrene: poly (vinylcarboxylate) / 90:10, poly (vinylcarboxylate): polystyrene / Vinyl carboxylate): polystyrene / 90:10, polylactic acid: polyglycolic acid / 50: 50, polylactic acid: polyglycolic acid / 80: 20, or polylactic acid: polyglycolic acid / 90: , But is not limited thereto.
일 구현예에서, 본 발명의 입자는 폴리(에틸렌-말레산 무수물)(PEMA)의 용액에 폴리머(예를 들어, PLGA)를 포함하는 조성물을 첨가함으로써 제조된다. 용액 중의 PEMA의 농도는 약 0.1% 내지 약 10%일 수 있다. 일 구현예에서, 용액내 PEMA의 농도는 약 0.2% 내지 약 5%이다. 또 다른 구현예에서, 용액내 PEMA의 농도는 약 0.1% 내지 4%이다. 또 다른 구현예에서, 용액내 PEMA의 농도는 약 0.1% 내지 2%이다. 또 다른 구현예에서, 용액내 PEMA의 농도는 약 0.5% 내지 1%이다. 일 구현예에서, 용액내 PEMA의 백분율은 0.1%, 0.2%, 0.3%, 0.4%, 0.5%, 0.6% 0.7%, 0.8%, 0.9%, 1%, 1.5%, 2%, 2.5%, 3%, 3.5%, 4%, 4.5%, 5%, 6%, 6.5%, 7%, 7.5%, 8%, 8.5%, 9%, 9.5% 또는 10%이다. 일 구현예에서, 용액내 PEMA의 백분율은 약 0.5%이다. 또 다른 구현예에서, 용액내 PEMA의 백분율은 약 1.0%이다. 사용될 수 있는 다른 화합물은 폴리(에틸렌-alt-말레산 무수물), 폴리(이소부틸렌-co-말레산), 폴리(메틸 비닐 에테르-alt-말레산), 폴리(메틸 비닐 에테르-alt-말레산 모노에틸 에스테르), 폴리(메틸 비닐 에테르-alt-말레산 무수물), 1,9-데카디엔 분말과 가교결합된 폴리(메틸 비닐 에테르-alt-말레산 무수물), 폴리(스티렌-alt-말레산) 나트륨 염, 폴리(비닐 알코올), 폴리(아크릴산) 및/또는 나트륨 데옥시콜레이트를 포함하지만, 이에 한정되지는 않는다.In one embodiment, the particles of the present invention are prepared by adding a composition comprising a polymer (e. G., PLGA) to a solution of poly (ethylene-maleic anhydride) (PEMA). The concentration of PEMA in the solution may be from about 0.1% to about 10%. In one embodiment, the concentration of PEMA in solution is from about 0.2% to about 5%. In another embodiment, the concentration of PEMA in solution is from about 0.1% to 4%. In another embodiment, the concentration of PEMA in solution is from about 0.1% to 2%. In another embodiment, the concentration of PEMA in solution is from about 0.5% to 1%. In one embodiment, the percentage of PEMA in solution is 0.1%, 0.2%, 0.3%, 0.4%, 0.5%, 0.6% 0.7%, 0.8%, 0.9%, 1%, 1.5%, 2% %, 3.5%, 4%, 4.5%, 5%, 6%, 6.5%, 7%, 7.5%, 8%, 8.5%, 9%, 9.5% or 10%. In one embodiment, the percentage of PEMA in solution is about 0.5%. In another embodiment, the percentage of PEMA in solution is about 1.0%. Other compounds which may be used are poly (ethylene - alt - maleic anhydride), poly (isobutylene - co - maleic acid), poly (methyl vinyl ether - alt - maleic acid), poly (methyl vinyl ether - alt - maleic acid diethyl ester), poly (methyl vinyl ether - alt - maleic anhydride), 1,9-decadiene powder and crosslinked poly (methyl vinyl ether - alt - maleic anhydride), poly (styrene - alt - maleic But are not limited to, sodium salt, poly (vinyl alcohol), poly (acrylic acid), and / or sodium deoxycholate.
일 구현예에서, 입자는 리포좀이다. 추가의 구현예에서, 입자는 30:30:40 포스파티딜콜린:포스파티딜글리세롤:콜레스테롤과 같은 몰비의 하기 지질로 구성된 리포좀이다. 또 다른 구현예에서, 입자는 리포좀 내에 캡슐화된다.In one embodiment, the particle is a liposome. In a further embodiment, the particles are liposomes composed of the following lipids in the molar ratio: 30:30:40 phosphatidylcholine: phosphatidylglycerol: cholesterol. In another embodiment, the particles are encapsulated within a liposome.
입자는 일반적으로 비장 또는 간에서 격리하기에 충분한 크기이어야 하지만, 각각의 입자는 크기가 균일해야할 필요는 없고, 내피 세포 또는 다른 MPS 세포를 포함하는 항원 제시 세포에 의한 수용체 또는 비-수용체 매개된 기전을 통한 식균작용 또는 흡수를 유발한다. 바람직하게는, 입자는 용해도를 향상시키고, 생체내 응집에 의해 야기될 수 있는 합병증을 회피하고, 음세포작용(pinocytosis)을 용이하게하기 위해 현미경적 또는 나노범위 크기이다. 입자 크기는 틈새 공간으로부터 림프구 성숙 영역으로의 흡수에 대한 인자일 수 있다. 약 0.1 ㎛ 내지 약 10 ㎛의 직경을 갖는 입자는 식균작용을 유발할 수 있다. 따라서, 일 구현예에서, 입자는 이러한 제한 범위 내의 직경을 갖는다. 또 다른 구현예에서, 입자는 약 0.3 μm 내지 약 5 μm의 평균 직경을 갖는다. 또 다른 구현예에서, 입자는 약 0.5 ㎛ 내지 약 3 ㎛의 평균 직경을 갖는다. 또 다른 구현예에서, 입자는 약 0.2㎛ 내지 약 2㎛의 평균 직경을 갖는다. 추가의 구현예에서, 입자는 약 0.1 ㎛, 또는 약 0.2 ㎛ 또는 약 0.3 ㎛ 또는 약 0.4 ㎛ 또는 약 0.5 ㎛ 또는 약 1.0 ㎛ 또는 약 1.5 ㎛ 또는 약 2.0 ㎛ 또는 약 2.5 μm 또는 약 3.0 또는 약 3.5 ㎛ 또는 약 4.0 ㎛ 또는 약 4.5 ㎛ 또는 약 5.0 ㎛의 평균 크기를 갖는다. 특정 구현예에서, 입자는 약 0.5 ㎛의 평균 크기를 갖는다. 일부 구현예에서, 입자는 약 0.5 ㎛ 내지 약 0.95 ㎛의 평균 직경을 갖는다. 예를 들어, 이러한 구현예에서, 입자는 약 0.5 μm, 0.55 μm, 0.6 μm, 0.65 μm, 0.7 μm, 0.75 μm, 0.8 μm, 0.85 μm, 0.9 μm 또는 약 0.95 μm의 평균 직경을 갖는다. 특정 구현예에서, 입자는 약 0.7㎛의 평균 직경을 갖는다. 일부 구현예에서, 입자의 전체 중량은 적어도 약 1000 kDa이다. 일부 구현예에서, 입자의 전체 중량은 약 1000 kDa, 1100 kDa, 1200 kDa, 1300 kDa, 1400 kDa, 1500 kDa, 1600 kDa, 1700 kDa, 1800 kDa, 1900 kDa, 2000 kDa, 2500 kDa, 3000 kDa, 3500 kDa, 4000 kDa, 4500 kDa, 5000 kDa, 또는 그 이상이다.The particles should generally be large enough to isolate from the spleen or liver, but each particle need not be uniform in size, and may be a receptor or non-receptor mediated mechanism by antigen presenting cells, including endothelial cells or other MPS cells Lt; RTI ID = 0.0 > and / or < / RTI > Preferably, the particles are of microscopic or nano-range size to enhance solubility, avoid complications that may be caused by in vivo aggregation, and facilitate pinocytosis. Particle size may be a factor for absorption from the interstitial space into the lymphocyte maturation region. Particles having diameters of from about 0.1 [mu] m to about 10 [mu] m can cause phagocytosis. Thus, in one embodiment, the particle has a diameter within this limiting range. In yet another embodiment, the particles have an average diameter of about 0.3 [mu] m to about 5 [mu] m. In yet another embodiment, the particles have an average diameter of about 0.5 [mu] m to about 3 [mu] m. In yet another embodiment, the particles have an average diameter of about 0.2 [mu] m to about 2 [mu] m. In further embodiments, the particles have a particle size of about 0.1 microns, or about 0.2 microns, or about 0.3 microns, or about 0.4 microns, or about 0.5 microns, or about 1.0 microns, or about 1.5 microns, or about 2.0 microns, or about 2.5 microns, Mu m or about 4.0 mu m or about 4.5 mu m or about 5.0 mu m. In certain embodiments, the particles have an average size of about 0.5 [mu] m. In some embodiments, the particles have an average diameter of about 0.5 [mu] m to about 0.95 [mu] m. For example, in this embodiment, the particles have an average diameter of about 0.5 μm, 0.55 μm, 0.6 μm, 0.65 μm, 0.7 μm, 0.75 μm, 0.8 μm, 0.85 μm, 0.9 μm, or about 0.95 μm. In certain embodiments, the particles have an average diameter of about 0.7 mu m. In some embodiments, the total weight of the particles is at least about 1000 kDa. In some embodiments, the total weight of the particles is about 1000 kDa, 1100 kDa, 1200 kDa, 1300 kDa, 1400 kDa, 1500 kDa, 1600 kDa, 1700 kDa, 1800 kDa, 1900 kDa, 2000 kDa, 2500 kDa, 3000 kDa, 3500 kDa, 4000 kDa, 4500 kDa, 5000 kDa, or more.
일부 구현예에서, 입자의 전체 중량은 약 10,000 kDa 미만, 약 5,000 kDa 미만, 또는 약 1,000 kDa, 500 kDa, 400 kDa, 300 kDa, 200 kDa, 100 kDa, 50 kDa, 20 kDa, 10 kDa 미만이다. 조성물 내의 입자는 균일한 지경을 가질 필요는 없다. 예를 들어, 약제학적 제형은 다수의 입자를 함유할 수 있지만, 그중 일부는 약 0.5㎛의 직경을 갖고, 다른 입자들은 약 1.0㎛의 직경을 갖는다. 추가적인 예로서, 약제학적 제형은 다수의 입자를 함유할 수 있는데, 그중 일부는 약 0.7 ㎛의 직경을 갖는 반면, 다른 입자들은 약 0.5 ㎛ 내지 약 0.95 ㎛의 직경을 갖는다. 이들 주어진 범위 내의 임의의 입자 크기의 혼합물이 유용할 것이다.In some embodiments, the total weight of the particles is less than about 10,000 kDa, less than about 5,000 kDa, or less than about 1,000 kDa, 500 kDa, 400 kDa, 300 kDa, 200 kDa, 100 kDa, 50 kDa, 20 kDa, 10 kDa . The particles in the composition need not have a uniform diameter. For example, the pharmaceutical formulation may contain multiple particles, some of which have a diameter of about 0.5 占 퐉, and other particles have a diameter of about 1.0 占 퐉. As a further example, the pharmaceutical formulation may contain a plurality of particles, some of which have a diameter of about 0.7 microns, while others have diameters of about 0.5 microns to about 0.95 microns. Mixtures of any particle size within these given ranges will be useful.
본 발명의 입자는 특정 제타 전위를 가질 수 있다. 특정 구현예에서, 제타 전위는 음성이다. 일 구현예에서, 제타 전위는 약 -100 mV 미만이다(예를 들어, 보다 음수). 일 구현예에서, 제타 전위는 약 -50 mV 미만이다(예를 들어, 보다 음수). 특정 구현예에서, 입자는 -100 mV 내지 0 mV의 제타 전위를 갖는다. 추가의 구현예에서, 입자는 -75 mV 내지 0 mV의 제타 전위를 갖는다. 추가의 구현예에서, 입자는 -60 mV 내지 0 mV의 제타 전위를 갖는다. 추가의 구현예에서, 입자는 -50 mV 내지 0 mV의 제타 전위를 갖는다. 또 다른 구현예에서, 입자는 -40 mV 내지 0 mV의 제타 전위를 갖는다. 추가의 구현예에서, 입자는 -30 mV 내지 0 mV의 제타 전위를 갖는다. 추가의 구현예에서, 입자는 -20 mV 내지 +0 mV의 제타 전위를 갖는다. 추가의 구현예에서, 입자는 -10 mV 내지 -0 mV의 제타 전위를 갖는다. 추가의 구현예에서, 입자는 -100mV 내지 -50mV의 제타 전위를 갖는다. 또 다른 특정 구현예에서, 입자는 -75mV 내지 -50mV의 제타 전위를 갖는다. 특정 구현예에서, 입자는 -50 mV 내지 -40 mV의 제타 전위를 갖는다. 또 다른 특정 구현예에서, 입자는 약 -40mV 미만(예를 들어, 보다 음수)의 제타 전위를 갖는다. 또 다른 특정 구현예에서, 입자는 적어도 약 -30 mV의 제타 전위를 갖는다. 또 다른 특정 구현예에서, 입자는 약 -30mV 미만(예를 들어, 보다 음수)의 제타 전위를 갖는다.The particles of the present invention may have a specific zeta potential. In certain embodiments, the zeta potential is negative. In one embodiment, the zeta potential is less than about -100 mV (e. G., More negative). In one embodiment, the zeta potential is less than about -50 mV (e. G., More negative). In certain embodiments, the particles have a zeta potential between -100 mV and 0 mV. In a further embodiment, the particle has a zeta potential of -75 mV to 0 mV. In a further embodiment, the particles have a zeta potential between -60 mV and 0 mV. In a further embodiment, the particles have a zeta potential between -50 mV and 0 mV. In yet another embodiment, the particle has a zeta potential of -40 mV to 0 mV. In a further embodiment, the particle has a zeta potential of -30 mV to 0 mV. In a further embodiment, the particles have a zeta potential of -20 mV to +0 mV. In a further embodiment, the particles have a zeta potential of -10 mV to -0 mV. In a further embodiment, the particles have a zeta potential of -100 mV to -50 mV. In another particular embodiment, the particle has a zeta potential of -75 mV to -50 mV. In certain embodiments, the particles have a zeta potential of -50 mV to -40 mV. In another particular embodiment, the particles have a zeta potential of less than about -40 mV (e.g., more negative). In yet another particular embodiment, the particle has a zeta potential of at least about -30 mV. In another particular embodiment, the particles have a zeta potential of less than about-30 mV (e.g., more negative).
본 발명의 입자는 폴리머에 대한 항원의 비율(예를 들어, 항원 μg/폴리머 mg)을 가질 수 있다. 일부 구현예에서, 폴리머에 대한 항원의 비율은 약 1 ㎍/mg 내지 적어도 약 5 ㎍/mg이다. 예를 들어, 일부 구현예에서, 폴리머에 대한 항원의 비율은 약 1 μg/mg, 1.5 μg/mg, 2 μg/mg, 2.5 μg/mg, 3.0 μg/mg, 3.5 μg/mg, 4 μg/mg, 4.5 ㎍/㎎, 또는 약 5 ㎍/㎎이다. 일부 구현예에서, 폴리머에 대한 항원의 비율은 적어도 약 5 ㎍/mg이다. 예를 들어, 일부 구현예에서, 폴리머에 대한 항원의 비율은 적어도 약 5 μg/mg, 5.5 μg/mg, 6 μg/mg, 6.5 μg/mg, 7 μg/mg, 7.5 μg/mg, 8 μg/mg, 8.5 μg/mg, 9.0 μg/mg, 9.5 μg/mg, 10 μg/mg, 10.5 μg/mg, 11 μg/mg, 11.5 μg/mg, 12 μg/mg, 12.5 μg/mg, 13 μg/mg, 13.5 μg/mg, 14 μg/mg, 14.5 μg/mg 또는 약 15 μg/mg이다.The particles of the present invention may have a ratio of antigen to polymer (e.g., mg of antigen / mg of polymer). In some embodiments, the ratio of antigen to polymer is from about 1 [mu] g / mg to at least about 5 [mu] g / mg. For example, in some embodiments, the ratio of antigen to polymer is about 1 μg / mg, about 1.5 μg / mg, about 2 μg / mg, about 2.5 μg / mg, about 3.0 μg / mg, 4.5 / / mg, or about 5 / / mg. In some embodiments, the ratio of antigen to polymer is at least about 5 [mu] g / mg. For example, in some embodiments, the ratio of antigen to polymer is at least about 5 μg / mg, 5.5 μg / mg, 6 μg / mg, 6.5 μg / mg / mg, 8.5 μg / mg, 9.5 μg / mg, 10 μg / mg, 10.5 μg / mg, 11 μg / mg, 11.5 μg / / mg, 13.5 μg / mg, 14 μg / mg, 14.5 μg / mg, or about 15 μg / mg.
일부 구현예에서, 캐리어의 전하(예를 들어, 양성, 음성, 중성)는 적용-특이적 이점(예를 들어, 생리적 혼용성, 유익한 표면-펩타이드 상호작용 등)을 부여하도록 선택된다. 일부 구현예에서, 캐리어는 (예를 들어, 일반적으로 순 음전하를 띠는 세포 표면에 대한 비특이적 결합을 감소시키기 위해) 순 중성 또는 음전하를 갖는다. 특정 구현예에서, 캐리어는 내성이 요구되는 항원(본원에서 항원-특이적 펩타이드, 항원성 펩타이드, 자가항원, 유도 항원 또는 내성 항원으로 지칭됨)에 직접 또는 간접적으로 콘주게이트될 수 있다. 일부 사례에서, 캐리어는 표면 상에 노출된 항원-특이적 펩타이드 또는 다수의 상이한 펩타이드의 다중 복제를 갖기 위해, (예를 들어, 내성 반응의 가능성을 증가시키기 위해), (예를 들어, 2, 3, 4, 5, 6, 7, 8, 9, 10... 20... 50... 100 이상의) 다중 결합 부위를 보유한다. 일부 구현예에서, 캐리어는 단일 유형의 항원성 펩타이드를 나타낸다. 일부 구현예에서, 캐리어는 표면 상에 다수의 상이한 항원성 펩타이드를 나타낸다. 일부 구현예에서, 캐리어 표면은 선택된 모이어티(예를 들어, 항원성 펩타이드)의 공유부착을 위한 작용기를 나타낸다. 일부 구현예에서, 캐리어 표면 작용기는 선택된 모이어티(예를 들어, 항원성 펩타이드)와의 비-공유 상호작용을 위한 부위를 제공한다. 일부 구현예에서, 캐리어는 화학 결합 형성없이 콘주게이팅 모이어티가 흡착될 수 있는 표면을 갖는다.In some embodiments, the charge (e.g., positive, negative, neutral) of the carrier is selected to confer application-specific advantages (e.g., physiological compatibility, beneficial surface-peptide interaction, etc.). In some embodiments, the carrier has a net neutrality or negative charge (e.g., to reduce nonspecific binding to a cell surface that generally has a net negative charge). In certain embodiments, the carrier can be conjugated directly or indirectly to an antigen (herein referred to as an antigen-specific peptide, an antigenic peptide, an autoantigen, an inducible antigen or a resistant antigen) for which resistance is desired. In some instances, the carrier can have multiple copies of an antigen-specific peptide or a number of different peptides exposed on the surface, (e.g., to increase the probability of an immune response), (e.g., 3, 4, 5, 6, 7, 8, 9, 10 ... 20 ... 50 ... 100). In some embodiments, the carrier represents a single type of antigenic peptide. In some embodiments, the carrier exhibits a number of different antigenic peptides on the surface. In some embodiments, the carrier surface represents a functional group for the covalent attachment of a selected moiety (e. G., An antigenic peptide). In some embodiments, the carrier surface functional group provides sites for non-covalent interactions with a selected moiety (e. G., An antigenic peptide). In some embodiments, the carrier has a surface on which the conjugating moiety can be adsorbed without chemical bond formation.
입자의 크기 및 전하는 내성 유도에 중요하다. 입자는 그 안에 캡슐화된 항원에 기초하여 크기 및 전하가 상이할 것이지만, 일반적으로 본 발명의 입자는 약 100 나노미터 내지 약 1500 나노미터이고, 0 내지 약 -70mV의 전하를 가질 때 내성을 유도하는데 효과적이며, 400 내지 800 나노미터이고, 약 -25mV 내지 -70mV의 전하를 가질 때 내성을 유도하는데 가장 효과적이다. 또한, 동결건조 공정에서 부분적으로, 입자의 농도 및 수크로스 및 D-만니톨의 존재로 인해, 입자의 평균 입자 크기 및 전하가 동결건조 공정에서 약간 변경될 수 있다. 본원에 사용된 바와 같이, 용어 "후-합성 크기" 및 "합성 후 전하"는 동결건조 전의 입자의 크기 및 전하를 지칭한다. 용어 "후 동결건조 크기" 및 "후 동결건조 전하"는 동결건조 후 입자의 크기 및 전하를 지칭한다.Particle size and charge are important in inducing tolerance. The particle will vary in size and charge based on the antigen encapsulated therein, but in general the particles of the present invention are from about 100 nanometers to about 1500 nanometers and have a charge of from 0 to about -70 mV to induce tolerance Effective, and most effective in inducing resistance when having a charge of about 400 mV to about 800 mV and a charge of about -25 mV to -70 mV. Also, in part in the freeze-drying process, due to the concentration of the particles and the presence of sucrose and D-mannitol, the average particle size and charge of the particles may be slightly changed in the lyophilization process. As used herein, the terms "post-synthesis size" and "post-synthesis charge" refer to particle size and charge prior to lyophilization. The terms "post-lyophilization size" and "post-lyophilized charge" refer to particle size and charge after lyophilization.
일부 구현예에서, 입자는 비-금속이다. 이들 구현예에서, 입자는 폴리머로부터 형성될 수 있다. 바람직한 구현예에서, 입자는 개체에서 생분해성이다. 이 구현예에서, 입자는 개체 내에 입자가 축적되는 일없이 다중 용량에 걸쳐 개체에 제공될 수 있다. 적합한 입자의 예는 폴리스티렌 입자, PLGA 입자, PLURIONICS 안정화된 폴리프로필렌 설파이드 입자 및 다이아몬드 입자를 포함한다. 바람직하게는, 입자 표면은 비-특이적이거나 원하지 않는 생물학적 상호작용을 최소화하는 물질로 구성된다. 입자 표면과 간질 사이의 상호작용은 림프 흡수에 중요한 역할을 하는 요소일 수 있다. 입자 표면은 비-특이적 상호작용을 방지하거나 감소시키는 물질로 코팅될 수 있다. 친수성 층, 예컨대 폴리(에틸렌 글리콜)(PEG) 및 그의 코폴리머, 예컨대 PLURONICS®(폴리(에틸렌 글리콜)-블록-폴리(프로필렌 글리콜)-블록-폴리(에틸렌 글리콜)의 코폴리머를 포함)에 의해 입자를 코팅함에 의한 입체 안정화는 피하 주사 후 개선된 림프 흡수에 의해 입증된 바와 같이 간질의 단백질과의 비-특이적 상호작용을 감소시킬 수 있다. 이러한 모든 사실은 림프 흡수와 관련하여 입자의 물리적 특성의 유의성을 지적한다. 생분해성 폴리머는 폴리머 및/또는 입자 및/또는 층의 전부 또는 일부를 생성하는데 사용될 수 있다. 생분해성 폴리머는 예를 들어, 용액내 물과 반응하는 작용기의 결과에 의해 분해될 수 있다. 본원에서 사용된 용어 "분해"는 분자량의 감소 또는 소수성 기의 친수성 기로의 전환에 의해 가용성이 되는 것을 지칭한다. 에스테르기를 갖는 폴리머는 일반적으로 자발적인 가수분해, 예를 들어, 폴리락타이드 및 폴리글라이콜라이드에 적용된다.In some embodiments, the particles are non-metals. In these embodiments, the particles may be formed from a polymer. In a preferred embodiment, the particles are biodegradable in the individual. In this embodiment, the particles may be provided to the subject over multiple doses without the particles accumulating within the subject. Examples of suitable particles include polystyrene particles, PLGA particles, PLURIONICS stabilized polypropylene sulfide particles, and diamond particles. Preferably, the particle surface is composed of a material that minimizes non-specific or unwanted biological interactions. The interaction between particle surface and epilepsy may be an important factor in lymphatic absorption. The particle surface can be coated with a material that prevents or reduces non-specific interactions. Hydrophilic layers such as poly (ethylene glycol) (PEG) and copolymers thereof such as PLURONICS® (including copolymers of poly (ethylene glycol) -block-poly (propylene glycol) -block-poly (ethylene glycol) Stability stabilization by coating the particles can reduce non-specific interactions of epilepsy with proteins as evidenced by improved lymphatic absorption after subcutaneous injection. All these facts point to the significance of the physical properties of the particles in relation to lymphatic absorption. The biodegradable polymer may be used to produce all or part of the polymer and / or particles and / or layers. The biodegradable polymer can be degraded, for example, by the result of functional groups that react with water in the solution. As used herein, the term "degradation " refers to a decrease in molecular weight or availability of a hydrophobic group by conversion to a hydrophilic group. The polymer having an ester group is generally applied to spontaneous hydrolysis, for example, polylactide and polyglycolide.
본 발명의 입자는 또한 추가의 성분을 함유할 수 있다. 예를 들어, 캐리어는 캐리어에 편입되거나 콘주게이트된 조영제를 가질 수 있다. 현재 상업적으로 입수가능한 조영제를 갖는 캐리어 나노구형체의 예는 코닥(Kodak) X-사이트 나노구형체이다. 양자점(quantum dot, QDs)으로 알려진 무기 양자-국한된 발광성 나노결정은 FRET 응용 분야에서 이상적인 공여체로 부각되었으며: 높은 양자 수율과 가변 크기-의존성 스톡스 시프트(Stockes Shift)는 단일 자외선 파장에서 여기되면 청색에서 적외선으로 방출되는 크기가 서로 다르다.(Bruchez, et al., Science, 1998, 281, 2013; Niemeyer, C. M Angew. Chem. Int. Ed. 2003, 42, 5796; Waggoner, A. Methods Enzymol. 1995, 246, 362; Brus, L. E. J. Chem. Phys. 1993, 79, 5566). 덴드리머로 알려진 폴리머 부류에 기반한 하이브리드 유기/무기 양자점과 같은 양자점은 생물학적 라벨링, 이미지형성 및 광학 바이오감지 시스템에 사용될 수 있다. (Lemon, 등, J. Am. Chem. Soc. 2000, 122, 12886). 무기 양자점의 전통적인 합성과 달리, 이러한 하이브리드 양자점 나노입자의 합성은 고온 또는 매우 독성이 강한 불안정한 시약을 필요로 하지 않는다. (Etienne, et al., Appl. Phys. Lett. 87, 181913, 2005).The particles of the present invention may also contain additional components. For example, the carrier may have a contrast agent incorporated or conjugated to the carrier. An example of a carrier nanocrystal with a currently commercially available contrast agent is the Kodak X-site nanosphere. Inorganic quantum-limited luminescent nanocrystals, known as quantum dots (QDs), have emerged as ideal donors in FRET applications: high quantum yields and variable size-dependent Stokes shifts are observed in blue (Bruchez, et al., Science, 1998, 281, 2013; Niemeyer, C.M. Angew. Chem. Int. Ed., 2003, 42, 5796; Waggoner, A. Methods Enzymol. 1995, 246, 362; Brus, LEJ Chem. Quantum dots, such as hybrid organic / inorganic quantum dots based on polymer classes known as dendrimers, can be used in biological labeling, imaging and optical biosensor systems. (Lemon, et al., J. Am. Chem. Soc. 2000, 122, 12886). Unlike the traditional synthesis of inorganic quantum dots, the synthesis of these hybrid quantum dot nanoparticles does not require high temperature or highly toxic labile reagents. (Etienne, et al., Appl. Phys. Lett., 87, 181913, 2005).
입자는 광범위한 물질로부터 형성될 수 있다. 입자는 생물학적 이용에 적합한 물질로 구성되는 것이 바람직하다. 예를 들어, 입자는 유리, 실리카, 하이드록시 카복실산의 폴리에스테르, 디카복실산의 폴리무수물, 또는 하이드록시 카복실산과 디카복실산의 코폴리머로 이루어질 수 있다. 보다 일반적으로, 캐리어 입자는 직쇄 또는 분지형, 치환된 또는 치환되지 않은, 포화 또는 불포화된, 선형 또는 가교결합된 알카닐, 할로알킬, 티오알킬, 아미노알킬, 아릴, 아랄킬, 알케닐, 아르알케닐, 헤테로아릴 또는 알콕시 하이드록시 산의 폴리에스테르, 또는 직쇄 또는 분지형, 치환된 또는 치환되지 않은, 포화 또는 불포화된, 선형 또는 가교결합된 알카닐, 할로알킬, 티오알킬, 아미노알킬, 아릴, 아랄킬, 알케닐, 아르알케닐, 헤테로아릴 또는 알콕시 디카복실산의 폴리무수물로 조성될 수 있다. 또한, 캐리어 입자는 양자점일 수 있거나, 또는 양자점 폴리스티렌 입자와 같은 양자점으로 구성될 수 있다(Joumaa et al. (2006); Langmuir 22: 1810-6). 에스테르 및 무수물 결합의 혼합물을 포함하는 캐리어 입자(예를 들어, 글라이콜산 및 세박산의 코폴리머)가 또한 사용될 수 있다. 예를 들어, 캐리어 입자는 폴리글라이콜산 폴리머(PGA), 폴리락트산 폴리머(PLA), 폴리세박산 폴리머(PSA), 폴리(락트-co-글라이콜)산 코폴리머(PLGA 또는 PLG; 이 용어들은 상호교환가능함), [ρ]올리(락트-코-세박)산 코폴리머(PLSA), 폴리(글라이콜-co-세박)산 코폴리머(PGSA), 폴리프로필렌 설파이드 폴리머, 폴리(카프로락톤), 키토산 등을 포함하는 물질을 포함할 수 있다. 본 발명에서 유용한 기타 생체적합성, 생분해성 폴리머는 카프로락톤, 카보네이트, 아미드, 아미노산, 오르토에스테르, 아세탈, 시아노아크릴레이트 및 분해성 우레탄의 폴리머 또는 코폴리머뿐만 아니라 직쇄 또는 분지형, 치환 또는 치환되지않은 알카닐, 할로알킬, 티오알킬, 아미노알킬, 알케닐 또는 방향족 하이드록시- 또는 디-카복실산과의 코폴리머를 포함한다. 또한, 라이신, 아르기닌, 아스파르트산, 글루탐산, 세린, 트레오닌, 티로신 및 시스테인과 같은 반응성 측쇄 기를 갖는 생물학적으로 중요한 아미노산 또는 그의 거울상 이성질체는 항원성 펩타이드 및 단백질 또는 콘주게이팅 모이어티에 콘주게이트시키기 위한 반응성기를 제공하기 위해, 상기 언급된 물질 중 임의의 것과의 코폴리머에 포함될 수 있다. 본 발명에 적합한 생분해성 물질은 다이아몬드, PLA, PGA, 폴리프로필렌 설파이드 및 PLGA 폴리머를 포함한다. 생체적합성이지만 비-생분해성 물질도 본 발명의 캐리어 입자에 사용될 수 있다. 예를 들어, 아크릴레이트들의 비-생분해성 폴리머, 에틸렌-비닐 아세테이트, 아실 치환된 셀룰로스 아세테이트, 비-분해성 우레탄, 스티렌, 비닐 클로라이드, 비닐 플루오라이드, 비닐 이미다졸, 클로로설포네이트 올레핀, 에틸렌 옥사이드, 비닐 알콜, TEFLON®(DuPont, Wilmington, Del) 및 나일론이 사용될 수 있다.The particles can be formed from a wide range of materials. The particles are preferably composed of a material suitable for biological use. For example, the particles may comprise glass, silica, a polyester of a hydroxycarboxylic acid, a polyanhydride of a dicarboxylic acid, or a copolymer of a hydroxycarboxylic acid and a dicarboxylic acid. More generally, the carrier particles may be linear or branched, substituted or unsubstituted, saturated or unsaturated, linear or bridged alkanyl, haloalkyl, thioalkyl, aminoalkyl, aryl, aralkyl, alkenyl, Substituted or unsubstituted, saturated or unsaturated, linear or crosslinked alkanyl, haloalkyl, thioalkyl, aminoalkyl, aryl, alkenyl, alkynyl, alkenyl, , Aralkyl, alkenyl, aralkenyl, heteroaryl or alkoxydicarboxylic acid. Further, the carrier particles can be quantum dots, or they can be composed of quantum dots such as quantum dot polystyrene particles (Joumaa et al. (2006); Langmuir 22: 1810-6). Carrier particles comprising a mixture of ester and anhydride linkages (e.g., copolymers of glycolic acid and sebacic acid) may also be used. For example, the carrier particles can be selected from the group consisting of a polyglycolic acid polymer (PGA), a polylactic acid polymer (PLA), a polysaccharide polymer (PSA), a poly (lacto-co-glycol) (PGSA), polypropylene sulfide polymers, poly (capro) copolymers (PLSA), poly (lactone-co-succinate) acid copolymers Lactones), chitosan, and the like. Other biocompatible biodegradable polymers useful in the present invention include polymers or copolymers of caprolactone, carbonate, amide, amino acid, orthoester, acetal, cyanoacrylate and degradable urethane as well as straight or branched, substituted or unsubstituted Alkenyl, haloalkyl, thioalkyl, aminoalkyl, alkenyl, or aromatic hydroxy- or di-carboxylic acid. In addition, biologically important amino acids or their enantiomers with reactive side chains such as lysine, arginine, aspartic acid, glutamic acid, serine, threonine, tyrosine and cysteine provide reactive groups for conjugating to antigenic peptides and proteins or conjugating moieties , May be included in the copolymer with any of the above-mentioned materials. Biodegradable materials suitable for the present invention include diamond, PLA, PGA, polypropylene sulfide and PLGA polymers. Biocompatible but non-biodegradable materials may also be used in the carrier particles of the present invention. For example, non-biodegradable polymers of acrylates, ethylene-vinyl acetate, acyl-substituted cellulose acetate, non-degradable urethane, styrene, vinyl chloride, vinyl fluoride, vinyl imidazole, chlorosulfonate olefin, the vinyl alcohol, TEFLON ® (DuPont, Wilmington, Del) and nylon can be used.
본 발명의 입자는 당 업계에 통상적으로 알려진 임의의 수단에 의해 제조될 수 있다. 입자를 제조하는 예시적인 방법은 마이크로에멀젼 중합, 계면 중합, 침전 중합, 에멀젼 증발, 에멀젼 확산, 용매 변위 및 염석(salting out)을 포함하지만, 이에 한정되지는 않는다(Astete and Sabliov, J. Biomater. Sci. Polymer Edn., 17:247-289(2006)). PLGA 입자에 대한 제조 공정의 조작은 입자 특성(예를 들어, 크기, 크기 분포, 제타 전위, 형태, 소수성/친수성, 폴리펩타이드 포획 등)을 조절할 수 있다. 입자의 크기는 PLGA의 농도, 입자의 제조에 사용된 용매, 유기상의 성질, 제조에 사용된 계면활성제, 연속 및 불연속상의 점도, 사용된 용매의 성질, 사용된 물의 온도, 초음파처리, 증발 속도, 첨가제, 전단 응력, 멸균 및 임의의 캡슐화된 항원 또는 폴리펩타이드의 성질을 포함하지만, 이에 한정되지는 않는 다수의 인자에 의해 영향을 받는다.The particles of the present invention can be prepared by any means commonly known in the art. Exemplary methods of preparing the particles include, but are not limited to, microemulsion polymerization, interfacial polymerization, precipitation polymerization, emulsion evaporation, emulsion diffusion, solvent displacement and salting out (Astete and Sabliov, J. Biomater. Sci. Polymer Edn., 17: 247-289 (2006)). The manipulation of the manufacturing process for PLGA particles can modulate particle properties (e.g., size, size distribution, zeta potential, shape, hydrophobicity / hydrophilicity, polypeptide capture, etc.). The particle size depends on the concentration of PLGA, the solvent used in the preparation of the particles, the nature of the organic phase, the surfactant used in the preparation, the viscosity of the continuous and discontinuous phase, the nature of the solvent used, the temperature of the water used, But are not limited to, a variety of factors including, but not limited to, the nature of the additive, shear stress, sterilization, and any encapsulated antigen or polypeptide.
입자 크기는 폴리머 농도에 의해 영향을 받으며; 더 높은 입자는 보다 높은 폴리머 농도로부터 형성된다. 예를 들어, PLGA 농도가 1%에서 4%(w/v)로 증가하면 용매 프로필렌 카보네이트가 사용될 때 평균 입자 크기가 약 205nm에서 약 290nm로 증가할 수 있다. 대안적으로, 에틸 아세테이트 및 5% 플루로닉(Pluronic) F-127에서 PLGA 농도를 1%에서 5%(w/v)로 증가시키면 평균 입자 크기가 120nm에서 230nm로 증가한다.Particle size is affected by the polymer concentration; Higher particles are formed from higher polymer concentrations. For example, if the PLGA concentration is increased from 1% to 4% (w / v), the average particle size may increase from about 205 nm to about 290 nm when solvent propylene carbonate is used. Alternatively, increasing the PLGA concentration from 1% to 5% (w / v) in ethyl acetate and 5% Pluronic F-127 increases the average particle size from 120 nm to 230 nm.
연속 및 불연속상의 점도는 확산 공정에 영향을 미치는 중요한 파라미터이며, 이는 보다 작은 입자를 형성하는 주요 단계이다. 입자의 크기는 분산상의 점도가 증가함에 따라 증가하는 반면, 입자의 크기는 보다 점성이 강한 연속 상으로 감소한다. 일반적으로, 수성 용매에 대한 유기 용매의 상 비율이 낮을수록 입자 크기는 더 작아진다.The viscosity of continuous and discontinuous phases is an important parameter affecting the diffusion process, which is a major step in forming smaller particles. The size of the particles increases as the viscosity of the dispersed phase increases, while the size of the particles decreases to a more viscous continuous phase. Generally, the lower the phase ratio of the organic solvent to the aqueous solvent, the smaller the particle size.
균질기 속도 및 교반은 또한 입자 크기에 영향을 미치며; 일반적으로 속도가 높아지고 교반되면 입자 크기가 줄어들지만 속도와 교반이 추가로 증가해도 입자 크기가 줄어들지 않는 지점이 존재한다. 에멀젼이 단지 높은 교반과 비교하여, 고압 균질기로 균질화될 때 크기 감소에 양호한 영향이 있다. 예를 들어, 5% PVA에서 20%의 상 비율에서, 교반시 평균 입자 크기는 288nm이고 균질화(300bar의 고압)에 의한 평균 입자 크기는 231nm이다.Homogenizer speed and agitation also affect particle size; Generally, there is a point where the particle size decreases when the speed is increased and stirred, but the particle size does not decrease even when the speed and the stirring further increase. There is a good effect on the size reduction when the emulsion is homogenized with a high pressure homogenizer, compared to only high agitation. For example, at 20% phase ratio at 5% PVA, the average particle size upon agitation is 288 nm and the average particle size by homogenization (high pressure of 300 bar) is 231 nm.
입자의 중요한 크기 감소는 용매의 확산을 개선시키기 위해 첨가되는 물의 온도를 변화시킴으로써 달성될 수 있다. 평균 입자 크기는 수온의 증가에 따라 감소한다.The significant size reduction of the particles can be achieved by varying the temperature of the water added to improve the diffusion of the solvent. The average particle size decreases with increasing water temperature.
입자 내에 캡슐화된 폴리펩타이드의 성질은 또한 입자 크기에 영향을 미친다. 일반적으로, 소수성 폴리펩타이드의 캡슐화는 보다 친수성인 폴리펩타이드의 캡슐화에 비해 더 작은 입자의 형성을 유발시킨다. 이중 에멀젼 공정에서, 보다 친수성인 폴리펩타이드의 포획은 고 분자량 PLGA 및 보다 높은 내부 상 점도를 야기하는 제1 계면활성제의 고 분자량을 사용함으로써 개선된다. 용매, 폴리머 및 폴리펩타이드 사이의 상호작용은 폴리펩타이드를 입자에 혼입시키는 효율에 영향을 미친다.The nature of the polypeptide encapsulated within the particle also affects the particle size. In general, encapsulation of hydrophobic polypeptides leads to the formation of smaller particles as compared to encapsulation of polypeptides that are more hydrophilic. In double emulsion processes, the capture of more hydrophilic polypeptides is improved by using high molecular weight PLGA and higher molecular weight of the first surfactant resulting in a higher internal phase viscosity. The interaction between the solvent, the polymer and the polypeptide affects the efficiency of incorporating the polypeptide into the particle.
PLGA 분자량은 최종 평균 입자 크기에 영향을 미친다. 일반적으로 분자량이 높을수록 평균 입자 크기가 커진다. 예를 들어, PLGA의 조성과 분자량이 다양하기 때문에(예를 들어, 50:50 PLGA의 경우 12 내지 48 kDa; 75:25 PLGA의 경우 12 내지 98 kDa), 평균 입자 크기는 다양하다(약 102 nm - 154 nm, 약 132 nm 내지 152 nm). 입자가 동일한 분자량일지라도, 그 조성은 평균 입자 크기에 영향을 줄 수 있으며; 예를 들어, 50:50 비율의 입자는 일반적으로 75:25 비율의 입자보다 작은 입자를 형성한다. 폴리머상의 말단 기는 또한 입자 크기에 영향을 미친다. 예를 들어, 에스테르 말단 기로 제조된 입자는 산 PLGA 말단 기의 평균 크기가 240nm(PI = 0.225)인 것과 비교하여, 평균 크기가 740nm(PI = 0.394)인 입자를 형성한다.The PLGA molecular weight affects the final average particle size. Generally, the higher the molecular weight, the larger the average particle size. For example, because of the variety of PLGA composition and molecular weight (e.g., 12-48 kDa for 50:50 PLGA; 12-128 kDa for 75:25 PLGA), the average particle size varies (about 102 nm - 154 nm, about 132 nm to 152 nm). Although the particles have the same molecular weight, their composition can affect the average particle size; For example, a 50:50 ratio of particles generally forms particles smaller than a 75:25 ratio. The end groups on the polymer also affect the particle size. For example, particles made with ester end groups form particles with an average size of 740 nm (PI = 0.394) compared to an average size of acid PLGA end groups of 240 nm (PI = 0.225).
사용된 용매는 또한 입자 크기에 영향을 줄 수 있으며; 용액의 표면 장력을 감소시키는 용매는 또한 입자 크기를 감소시킨다.The solvent used may also affect particle size; Solvents that reduce the surface tension of the solution also reduce particle size.
폴리머 및 폴리펩타이드 손상을 피하고 최종 입자 크기 감소를 촉진시키기 위해 진공에서 증발시켜 유기 용매가 제거된다. 진공 하에서 유기 용매를 증발시키는 것이 보다 작은 입자를 형성하는데 보다 효율적이다. 예를 들어, 진공에서의 증발은 정상적인 증발 속도 하에서 생성된 평균 입자 크기보다 약 30% 더 작은 평균 입자 크기를 생성한다.The organic solvent is removed by evaporation in vacuo to avoid polymer and polypeptide damage and to reduce final particle size. The evaporation of the organic solvent under vacuum is more efficient in forming smaller particles. For example, evaporation in a vacuum produces an average particle size that is about 30% smaller than the average particle size produced under normal evaporation rates.
초음파처리 파장의 진폭 또한 입자 특징에 영향을 미친다. 파장의 진폭은 액적 크기가 더 이상 변하지 않는 세이블 미니(sable mini) 에멀젼을 형성하기 위해 600 내지 800초의 초음파처리로 20% 이상이어야 한다. 그러나, 초음파처리의 주된 단점은 형성된 에멀젼의 단분산성의 부족이다.The amplitude of the ultrasound wavelength also affects particle characteristics. The amplitude of the wavelength should be greater than 20% by ultrasonic treatment for 600 to 800 seconds to form a sable mini emulsion in which the droplet size no longer changes. However, the main disadvantage of ultrasonic treatment is the lack of monodispersibility of the formed emulsion.
본 발명의 입자의 제조에 사용될 수 있는 유기상은 에틸 아세테이트, 메틸 에틸 케톤, 프로필렌 카보네이트 및 벤질 알콜을 포함하지만, 이에 한정되지는 않는다. 사용될 수 있는 연속상은 계면활성제 폴록사머 188을 포함하지만, 이에 한정되지 않는다.Organic phases that can be used in the preparation of the particles of the present invention include, but are not limited to, ethyl acetate, methyl ethyl ketone, propylene carbonate and benzyl alcohol. The continuous phase that may be used includes, but is not limited to, the surfactant poloxamer 188.
다양한 계면활성제가 본 발명의 입자의 제조에 사용될 수 있다. 계면활성제는 음이온성, 양이온성 또는 비이온성일 수 있다. 폴록사머 및 폴록사민 계열의 계면활성제는 통상적으로 입자 합성에 사용된다. 사용될 수 있는 계면활성제는 PEG, Tween-80, 젤라틴, 덱스트란, 플루로닉 L-63, PVA, 메틸셀룰로스, 레시틴 및 DMAB를 포함하지만, 이에 한정되지는 않는다. 또한, 비타민 E TPGS(D-α-토코페릴 폴리에틸렌 글라이콜 1000 석시네이트)를 포함하지만, 이에 한정되지 않는 생분해성 및 생체적합성 계면활성제. 특정 구현예에서, 2개의 계면활성제가 필요하다(예를 들어 이중 에멀젼 증발 방법에서). 이들 두 계면활성제는 제1 에멀젼을 위한 소수성 계면활성제 및 제2 에멀젼을 위한 소수성 계면활성제를 포함할 수 있다.A variety of surfactants can be used in the preparation of the particles of the present invention. The surfactant may be anionic, cationic or nonionic. Poloxamer and poloxamine surfactants are typically used in particle synthesis. Surfactants that may be used include, but are not limited to, PEG, Tween-80, gelatin, dextran, pluronic L-63, PVA, methylcellulose, lecithin and DMAB. Also biodegradable and biocompatible surfactants, including, but not limited to, vitamin E TPGS (D-alpha-
본 발명의 입자의 제조에 사용될 수 있는 용매는 아세톤, 테트라하이드로푸란(THF), 클로로포름 및 염소산염 계열의 구성원인 메틸 염화물을 포함하지만, 이에 한정되지 않는다. 유기 용매의 선택에는 두 가지 선택 기준이 필요하다: 즉, 폴리머는 이 용매에 가용성이어야 하며, 용매는 수성상과 완전히 불혼화성이어야 한다.Solvents that may be used in the preparation of the particles of the present invention include, but are not limited to, acetone, tetrahydrofuran (THF), chloroform, and methyl chloride, which is a member of the chlorate series. The choice of organic solvent requires two selection criteria: the polymer must be soluble in this solvent and the solvent must be completely immiscible with the aqueous phase.
본 발명의 입자의 제조에 사용될 수 있는 염은 염화 마그네슘 헥사히드레이트, 마그네슘 아세테이트 테트라히드레이트를 포함하지만, 이에 한정되지 않는다.Salts that may be used in the preparation of the particles of the present invention include, but are not limited to, magnesium chloride hexahydrate, magnesium acetate tetrahydrate.
통상적인 염석제는 전해질(예를 들어, 염화나트륨, 아세트산 마그네슘, 염화 마그네슘), 또는 비-전해질(예를 들어, 수크로스)을 포함하지만, 이에 한정되지 않는다.Typical salting agents include, but are not limited to, electrolytes (e.g., sodium chloride, magnesium acetate, magnesium chloride), or non-electrolytes (e.g., sucrose).
본 발명의 입자의 안정성 및 크기는 지방산 또는 탄소의 짧은 사슬을 포함하지만, 이에 한정되지 않는 화합물의 첨가에 의해 개선될 수 있다. 라우르산의 더 긴 탄소 사슬의 첨가는 입자 특징의 개선과 관련된다. 또한, 소수성 첨가제의 첨가는 입자 크기, 입자 내 폴리펩타이드의 편입 및 방출 프로파일을 개선시킬 수 있다. 동결건조로 입자의 준비가 안정화될 수 있다. 트레할로스와 같은 동결보호제의 첨가는 동결건조시 입자의 응집을 감소시킬 수 있다.The stability and size of the particles of the present invention can be improved by the addition of compounds including, but not limited to, short chains of fatty acids or carbons. The addition of longer carbon chains of lauric acid is associated with an improvement in particle characteristics. In addition, the addition of hydrophobic additives can improve particle size, incorporation and release profiles of polypeptides within the particles. The preparation of the particles by freeze-drying can be stabilized. Addition of a cryoprotectant such as trehalose may reduce particle agglomeration during lyophilization.
현재 상업적으로 이용가능한 적합한 비드는 FluoSpheres(Molecular Probes, Eugene, Oreg.)와 같은 폴리스티렌 비드를 포함한다.Suitable commercially available beads include polystyrene beads such as FluoSpheres (Molecular Probes, Eugene, Oreg.).
일부 구현예에서, 본 발명은 (a) 화학적 및/또는 생물학적 제제를 대상체에게 전달하도록 구성된 전달 스캐폴드; 및 (b) 항원-특이적 내성의 유도를 위한 항원-커플링된 폴리(락타이드-코-글라이콜라이드) 입자를 포함하는 시스템을 제공한다. 일부 구현예에서, 상기 전달 스캐폴드의 적어도 일부는 미세다공성이다. 일부 구현예에서, 항원-커플링된 폴리(락타이드-코-글라이콜라이드) 입자는 상기 스캐폴드 내에 캡슐화된다. 일부 구현예에서, 화학적 및/또는 생물학적 제제는: 단백질, 펩타이드, 소분자, 핵산, 세포 및 입자로 구성된 그룹으로부터 선택된다. 일부 구현예에서, 화학적 및/또는 생물학적 제제는 세포를 포함하고, 상기 세포는 췌장 소도세포를 포함한다.In some embodiments, the invention provides a method of treating a subject comprising: (a) a delivery scaffold configured to deliver a chemical and / or biological agent to a subject; And (b) antigen-coupled poly (lactide-co-glycolipid) particles for induction of antigen-specific resistance. In some embodiments, at least a portion of the transfer scaffold is microporous. In some embodiments, the antigen-coupled poly (lactide-co-glycolipid) particles are encapsulated within the scaffold. In some embodiments, the chemical and / or biological agent is selected from the group consisting of: proteins, peptides, small molecules, nucleic acids, cells and particles. In some embodiments, the chemical and / or biological agent comprises a cell, wherein the cell comprises pancreatic islet cells.
물리적 특성은 또한 미성숙 림프구를 갖는 영역에서의 흡수 및 유지 후의 나노입자의 유용성과 관련이 있다. 여기에는 강성 또는 고무성(rubberiness)과 같은 기계적 특성이 포함된다. 일부 구현예는 PEG에서와 같이, 전신(그러나, 표적화된 또는 면역은 아님) 전달을 위해 최근 개발되고 특성규명된 PPS-PEG 시스템에서와 같이, 고무질 코어, 예를 들어 오버레이어, 예를 들어 친수성 오버레이어를 갖는 폴리(프로필렌 설파이드)(PPS) 코어에 기초한다. 고무질 코어는 폴리스티렌 또는 금속 나노입자 시스템에서와 같이 실질적으로 강성인 코어와는 대조적이다. 고무라는 용어는 천연 또는 합성 고무 이외의 특정 회복력있는 물질을 지칭하며, 고무는 폴리머 기술 분야의 사람들에게 친숙한 용어이다. 예를 들어, 가교결합된 PPS는 소수성 고무질 코어를 형성하는데 사용될 수 있다. PPS는 산화적 조건 하에 폴리설폭사이드, 마지막으로 폴리설폰으로 분해되어 소수성 고무로부터 친수성, 수용성 폴리머로 전이되는 폴리머이다. 다른 설파이드 폴리머가 사용하기에 적합할 수 있으며, 설파이드 폴리머라는 용어는 머(mer)의 골격에 황을 갖는 폴리머를 지칭한다. 사용될 수 있는 다른 고무질 폴리머는 약 37℃ 미만의 수화된 조건 하에서 유리전이 온도를 갖는 폴리에스테르이다. 코어 및 오버레이어가 섞이지 않는 경향이 있기 때문에 소수성 코어는 친수성 오버레이어와 함께 유리하게 사용될 수 있어서, 오버레이어는 코어로부터 입체적으로 팽창하는 경향이 있다. 코어는 층이 그 위에 있는 입자를 지칭한다. 층은 코어의 적어도 일부분을 덮는 물질을 지칭한다. 층은 흡착되거나 공유결합될 수 있다. 입자 또는 코어는 단단하거나 중공일 수 있다. 고무질 소수성 코어는 결정성 또는 유리질(예를 들어, 폴리스티렌의 경우) 코어와 같이 단단한 소수성 코어보다 유리하며, 소수성 약물의 고부하가 고무질 소수성 코어를 갖는 입자에 의해 전달될 수 있다는 점에서 유리하다.Physical properties are also related to the availability of nanoparticles after absorption and maintenance in areas with immature lymphocytes. This includes mechanical properties such as stiffness or rubberiness. Some embodiments include a gum core, such as an overlay, such as a hydrophilic core, such as a hydrophilic core, such as in a recently developed and characterized PPS-PEG system for systemic (but not targeted or immune) delivery, (Propylene sulfide) (PPS) core with an overlay layer. Gum cores are in contrast to cores that are substantially rigid, such as in polystyrene or metal nanoparticle systems. The term rubber refers to certain resilient materials other than natural or synthetic rubber, and rubber is a term familiar to people in the polymer arts. For example, cross-linked PPS can be used to form hydrophobic gum cores. PPS is a polymer that is decomposed to polysulfoxide under oxidative conditions and finally polysulfone, and then transferred from the hydrophobic rubber to a hydrophilic, water-soluble polymer. Other sulfide polymers may be suitable for use, and the term sulfide polymer refers to a polymer having sulfur at the skeleton of the mer. Other rubbery polymers that may be used are polyesters having a glass transition temperature under hydrated conditions below about < RTI ID = 0.0 > 37 C. < / RTI > Because the core and overlay tend not to mix, hydrophobic cores can be advantageously used with hydrophilic overlayers, so that the overlayers tend to expand in three dimensions from the core. The core refers to a particle having a layer thereon. The layer refers to a material that covers at least a portion of the core. The layer can be adsorbed or covalently bonded. The particles or cores may be rigid or hollow. A gummy hydrophobic core is advantageous over a rigid hydrophobic core such as crystalline or glassy (e.g., in the case of polystyrene) cores and is advantageous in that a high load of hydrophobic drug can be delivered by particles having a gummy hydrophobic core.
또 다른 물리적 특성은 표면의 친수성이다. 친수성 물질은 그것이 가교되지 않을 때 물에서 적어도 1 g/L의 수 용해도를 가질 수 있다. 친수성 폴리머로 입자를 입체 안정화시키면 비-특이적 상호작용을 감소시킴으로써 간질로부터의 흡수를 개선시킬 수 있지만; 입자의 증가된 스텔스(stealth) 성질은 또한, 미성숙 림프구가 있는 부위의 식균세포에 의한 내재화를 감소시킬 수 있다. 그러나 이러한 경쟁 기능의 균형을 맞추는 문제는 충족되었으며, 본 명세서는 림프절의 DC 및 기타 APC에 효과적인 림프 전달을 위한 나노입자 생성을 문서화한다. 일부 구현예는 친수성 성분, 예를 들어 친수성 물질의 층을 포함한다. 적합한 친수성 물질의 예는 폴리알킬렌 옥사이드, 폴리에틸렌 옥사이드, 다당류, 폴리아크릴산 및 폴리에테르 중 하나 이상이다. 층에서 폴리머의 분자량은 생체내 유용한 정도의 입체 장애, 예를 들어, 약 1,000 내지 약 100,000 또는 그 이상을 제공하도록 조절될 수 있으며; 당업자는 명시적으로 언급된 범위, 예를 들어 10,000 내지 50,000 내의 모든 범위 및 값이 고려되는 것을 즉시 인식할 것이다.Another physical property is the hydrophilicity of the surface. The hydrophilic material may have a water solubility in water of at least 1 g / L when it is not crosslinked. Stabilization of particles with hydrophilic polymers can improve absorption from the epilepsy by reducing non-specific interactions; The increased stealth properties of the particles can also reduce the internalization by the phagocyte cells at sites with immature lymphocytes. However, the problem of balancing these competing functions has been met and this document documents the production of nanoparticles for lymphatic delivery that is effective on DC and other APCs of the lymph nodes. Some embodiments include a layer of a hydrophilic component, for example a hydrophilic material. Examples of suitable hydrophilic materials are one or more of polyalkylene oxide, polyethylene oxide, polysaccharide, polyacrylic acid and polyether. The molecular weight of the polymer in the layer can be adjusted to provide a useful degree of steric hindrance in vivo, for example, from about 1,000 to about 100,000 or more; Those skilled in the art will readily recognize that all ranges and values within the explicitly stated ranges, e.g., 10,000 to 50,000, are contemplated.
나노입자는 추가 반응을 위한 작용기를 혼입시킬 수 있다. 추가 반응을 위한 작용기는 친전자체 또는 친핵체를 포함하며; 이들은 다른 분자와 반응하는데 편리하다. 친핵체의 예는 1차 아민, 티올 및 하이드록실이다. 친전자체의 예는 석신이미딜 에스테르, 알데하이드, 이소시아네이트 및 말레이미드이다.Nanoparticles can incorporate functional groups for further reaction. The functional group for the further reaction comprises an electrophile or a nucleophile; They are convenient for reacting with other molecules. Examples of nucleophiles are primary amines, thiols and hydroxyls. Examples of electrophiles include succinimidyl esters, aldehydes, isocyanates and maleimides.
당 업계에 널리 공지된 많은 수단이 항원성 펩타이드 및 단백질을 캐리어에 콘주게이트시키는데 사용될 수 있다. 이러한 방법은 항원성 펩타이드 및 단백질의 생물학적 활성을 파괴시키지 않거나 심각하게 제한하지 않고, 항원성 펩타이드 또는 단백질의 동족 T 세포 수용체와의 상호작용을 허용하는 배향으로 충분한 수의 항원성 펩타이드 및 단백질이 캐리어에 콘주게이트되도록 하는 임의의 표준 화학을 포함한다. 일반적으로, 항원성 펩타이드 또는 단백질의 C-말단 영역, 또는 항원성 펩타이드 또는 단백질 융합 단백질의 C-말단 영역을 어너(earner)에 콘주게이트시키는 방법이 바람직하다. 정확한 화학은 물론, 어너 물질의 성질, 항원성 펩타이드 또는 단백질에 대한 C-말단 융합의 존재 또는 부재, 및/또는 콘주게이트하는 모이어티의 존재 또는 부재에 의존할 것이다.Many means well known in the art can be used to conjugate antigenic peptides and proteins to carriers. This method does not disrupt or severely limit the biological activity of the antigenic peptides and proteins, and it is contemplated that a sufficient number of antigenic peptides and proteins will be delivered to the carrier in an orientation that allows interaction of the antigenic peptides or proteins with the corresponding T- Lt; RTI ID = 0.0 > chemistry < / RTI > Generally, a method of conjugating the C-terminal region of an antigenic peptide or protein, or the C-terminal region of an antigenic peptide or protein fusion protein, to an earner is preferred. Will depend on the precise chemistry as well as the nature of the parent material, the presence or absence of C-terminal fusion to the antigenic peptide or protein, and / or the presence or absence of the conjugating moiety.
작용기는 필요에 따라 이용가능성을 위해 입자 상에 위치할 수 있다. 하나의 위치는 코어 또는 폴리머 상의 층, 또는 그렇지 않으면 입자에 결박된 코어 폴리머 또는 폴리머들 상의 측면 기 또는 말단으로 있을 수 있다. 예를 들어, 특정 세포 표적화 또는 단백질 및 펩타이드 약물 전달을 위해 용이하게 기능화될 수 있는 나노입자를 안정화시키는 PEG를 기술하는 예가 여기에 포함된다.The functional groups may be located on the particles for availability as needed. One location may be a layer on the core or polymer, or else a side group or end on the core polymer or polymers bound to the particles. This includes, for example, describing PEGs that stabilize nanoparticles that can be readily functionalized for specific cell targeting or protein and peptide drug delivery.
펩타이드 또는 단백질을 캐리어 표면에 고착시키기 위해, 콘주게이트, 예컨대 에틸렌 카보디이미드(ECDI), 헥사메틸렌 디이소시아네이트, 2개의 에폭시 잔기를 함유하는 프로필렌글리콜 디-글리시딜에테르 및 에피클로로히드린이 사용될 수 있다. 이론에 구속됨이 없이 ECDI는 내성의 유도를 위한 두 가지 주요 기능을 수행하는 것으로 의심된다: (a) 유리 아미노와 유리 카복실 기 사이의 펩타이드 결합 형성의 촉매 작용을 통해 단백질/펩타이드를 세포 표면에 화학적으로 커플링시키고; 및 (b) 항체가 세포자멸적 세포사를 모방하도록 유도하여 비장내 숙주 항원 제시 세포(내피 세포를 포함할 수 있음)에 의해 포획되어 내성을 유도하게 된다. 자가반응성 세포에서 아네르기(anergy)를 직접 유도하는 비-면역원성 방식으로 숙주 T-세포에 대한 제시이다. 또한, ECDI는 특정 조절 T 세포의 유도에 대한 강력한 자극제 역할을 한다.In order to fix the peptide or protein to the carrier surface, a conjugate such as ethylene carbodiimide (ECDI), hexamethylene diisocyanate, propylene glycol di-glycidyl ether containing two epoxy moieties and epichlorohydrin are used . Without being bound by theory, it is suspected that ECDI performs two major functions for the induction of resistance: (a) catalyzes the formation of peptide bonds between free amino and free carboxyl groups to form proteins / peptides on the cell surface Chemically coupled; And (b) the antibody is induced to mimic cell apoptotic cell death and is captured by a splenic host antigen presenting cell (which may include endothelial cells) to induce tolerance. Is an indication of host T-cells in a non-immunogenic manner that directly induces anergy in autoreactive cells. In addition, ECDI acts as a powerful stimulant for the induction of specific regulatory T cells.
일련의 구현예에서, 항원성 펩타이드 및 단백질은 공유 화학 결합을 통해 캐리어에 결합된다. 예를 들어, 항원의 C-말단 근처의 반응성 기 또는 모이어티(예를 들어, C-말단 카복실기 또는 아미노산 측쇄의 하이드록실, 티올 또는 아민 기)는 직접적인 화학 반응에 의해 캐리어의 표면 상의 반응성 기 또는 모이어티(예를 들어, PLA 또는 PGA 폴리머의 하이드록실 또는 카복실 기, 덴드리머의 말단 아민 또는 카복실 기, 또는 인지질의 하이드록실, 카복실 또는 포스페이트 기)에 직접 콘주게이트될 수 있다. 대안적으로, 항원성 펩타이드와 단백질 및 캐리어 모두에 공유결합하는 접합 모이어티가 있을 수 있으며, 이에 의해 그들을 연결한다.In a series of embodiments, antigenic peptides and proteins are bound to the carrier via covalent chemical bonds. For example, a reactive group or moiety near the C-terminus of the antigen (e.g., a hydroxyl, thiol, or amine group of a C-terminal carboxyl group or an amino acid side chain) is reacted with a reactive group on the surface of the carrier Or may be directly conjugated to a moiety (e.g., a hydroxyl or carboxyl group of a PLA or PGA polymer, a terminal amine or carboxyl group of a dendrimer, or a hydroxyl, carboxyl or phosphate group of a phospholipid). Alternatively, there may be conjugation moieties covalently linked to both antigenic peptides, proteins and carriers, thereby linking them.
캐리어 표면상의 반응성 카복실기는 항원성 펩타이드 또는 단백질 상의 유리 아민(예를 들어, Lys 잔기로부터)을, 예를 들어 1-에틸-3-[3,9-디메틸 아미노프로필]카보디이미드 하이드로클로라이드(EDC) 또는 N-하이드록시석신이미드 에스테르(NHS)와 반응시킴으로써 유리 아민에 연결될 수 있다. 유사하게, 항원성 펩타이드 또는 단백질상의 유리 카복실(예를 들어, C-말단으로부터 또는 Asp 또는 Glu 잔기로부터)을 갖는 캐리어의 표면 상의 유리 아민을 콘주게이트하는데 동일한 화학 작용이 사용될 수 있다. 대안적으로, 캐리어의 표면상의 유리 아민 기는 본질적으로 Arano et al. (1991) Chem. 2:71-6에 의해 기재된 바와 같이 설포-SIAB 화학을 사용하여 항원성 펩타이드 및 단백질, 또는 항원성 펩타이드 또는 단백질 융합 단백질에 공유결합될 수 있다.The reactive carboxyl group on the carrier surface can be reacted with a free amine on the antigenic peptide or protein (e. G., From the Lys residue), for example 1-ethyl-3- [3,9-dimethylaminopropyl] carbodiimide hydrochloride ) Or N-hydroxysuccinimide ester (NHS). Similarly, the same chemistry can be used to conjugate the free amines on the surface of the carrier with the free carboxyl (e.g., from the C-terminus or from the Asp or GIu residue) on the antigenic peptide or protein. Alternatively, the free amine groups on the surface of the carrier are essentially as described in Arano et al. (1991) Chem. Can be covalently linked to antigenic peptides and proteins, or antigenic peptide or protein fusion proteins, using sulfo-SIBA chemistry, as described by Wang et al.
또 다른 구현예에서, 항원성 펩타이드 또는 단백질에 결합된 리간드와 캐리어에 부착된 항-리간드 사이의 비-공유결합이 항원을 캐리어에 콘주게이트시킬 수 있다. 예를 들어, 바이오틴 리가제 인식 서열 태그는 항원성 펩타이드 또는 단백질의 C-말단에 연결될 수 있으며, 이 태그는 바이오틴 리가제로 바이오티닐화될 수 있다. 이어서, 바이오틴은 항원성 펩타이드 또는 단백질을 항-리간드로서 캐리어의 표면에 흡착 또는, 그렇지 않으면 결합된 아비딘 또는 스트렙타비딘에 비-공유적으로 콘주게이트하는 리간드로서 작용할 수 있다. 대안적으로, 항원성 펩타이드 및 단백질이 상기 기재된 바와 같이 Fc 영역을 갖는 면역글로불린 도메인에 융합되는 경우, Fc 도메인은 리간드로서 작용할 수 있고, 캐리어의 표면에 공유결합 또는 비-공유결합된 단백질 A는, 항원성 펩타이드 또는 단백질을 캐리어에 비-공유결합시키는 항-리간드로서 작용할 수 있다. 다른 방법은 당 업계에 공지되어 있으며, 항원성 펩타이드 및 단백질을 캐리어에 비-공유적으로 콘주게이트시키는데 사용될 수 있으며, 금속 이온 킬레이트화 기술(예를 들어, 항원성 펩타이드 또는 단백질, 또는 항원성 펩타이드 또는 단백질 융합 단백질의 C-말단에서의 폴리-His 태그, 및 Ni+-코팅된 캐리어를 사용)를 포함할 수 있으며, 이들 방법은 본원에서 기술된 것들로 대체될 수 있다.In another embodiment, a non-covalent bond between a ligand bound to an antigenic peptide or protein and an anti-ligand attached to the carrier can conjugate the antigen to the carrier. For example, a biotinylated sequence tag may be linked to the C-terminus of an antigenic peptide or protein, which tag may be biotinylated with biotinylated. Biotin can then act as a ligand that non-covalently conjugates the antigenic peptide or protein as an anti-ligand to the surface of the carrier, or to an otherwise conjugated avidin or streptavidin. Alternatively, when an antigenic peptide and protein are fused to an immunoglobulin domain having an Fc region as described above, the Fc domain may act as a ligand and the protein A that is covalently or non-covalently bound to the surface of the carrier , An antigenic peptide, or an anti-ligand that non-covalently binds the protein to the carrier. Other methods are well known in the art and can be used to non-covalently conjugate antigenic peptides and proteins to carriers, and include metal ion chelation techniques (e. G., Antigenic peptides or proteins, or antigenic peptides Or a poly-His tag at the C-terminus of a protein fusion protein, and a Ni + -coated carrier), and these methods can be replaced by those described herein.
플랫폼 분자에 대한 핵산 모이어티의 콘주게이션은 핵산 모이어티 및 플랫폼 분자상의 하나 이상의 가교결합제 및 작용기를 전형적으로 포함하는 임의의 여러 방식으로 영향을 받을 수 있다. 연결 기는 표준 합성 화학 기술을 사용하여 플랫폼에 추가된다. 연결기는 표준 합성 기술을 사용하여 핵산 모이어티에 첨가될 수 있다. 종사자는 본 발명의 조합에 사용되는 항원에 대해 수많은 선택을 갖는다. 조합에 존재하는 유도 항원은 유도된 면역원성 반응의 특이성에 기여한다. 원하지 않는 면역학적 반응의 표적 및 내성이 요구되는 표적이 되고 치료될 대상체에 존재하거나 배치되는 항원인 표적 항원과 동일하거나 동일하지 않을 수 있다.Conjugation of the nucleic acid moiety to the platform molecule may be effected in any number of ways, typically including one or more cross-linking agents and functional groups on the nucleic acid moiety and the platform molecule. Connectors are added to the platform using standard synthetic chemistry. The linker may be added to the nucleic acid moiety using standard synthetic techniques. The practitioner has numerous options for the antigens used in the combinations of the present invention. Induced antigens present in the combination contribute to the specificity of the induced immunogenic response. The target and immunity of the unwanted immunological response may be the desired target and may or may not be the same as the target antigen that is an antigen present or located in the subject to be treated.
본 발명의 유도 항원은 폴리펩타이드, 폴리뉴클레오타이드, 탄수화물, 당지질 또는 생물학적 공급원으로부터 단리된 다른 분자일 수 있거나, 또는 화학적으로 합성된 소분자, 폴리머 또는 생물학적 물질의 유도체일 수 있으며, 점막 결합 성분과 결합될 때 이 설명에 따른 내성을 유도하는 능력을 갖는다.The inducing antigen of the present invention may be a polypeptide, polynucleotide, carbohydrate, glycolipid, or other molecule isolated from a biological source, or may be a chemically synthesized small molecule, polymer or derivative of a biological material, And have the ability to induce tolerance according to this description.
일부 구현예에서, 본 발명은 하나 이상의 펩타이드, 폴리펩타이드 및/또는 단백질에 커플링된 캐리어(예를 들어, 면역 변형 입자)를 제공한다. 일부 구현예에서, 본원에 기재된 것들과 같은 캐리어(예를 들어, PLG 캐리어)는 항원-특이적 내성을 유도하고, 및/또는 면역 관련 질환(예컨대, 마우스 모델에서 EAE)의 개시를 예방하고, 및/또는 기존의 면역 관련 질환의 중증도를 줄이는데 효과적이다. 일부 구현예에서, 본 발명의 조성물 및 방법은 T-세포가 T-세포 활성화와 관련된 초기 사건을 수행하게 할 수 있지만, T-세포가 효과기 기능을 획득하는 것을 허용하지 않는다. 예를 들어, 본 발명의 조성물의 투여는 CD69 및/또는 CD44 상향 조절과 같은 준-활성화된 표현형을 갖는 T-세포를 유도할 수 있지만, IFN-γ의 결핍 또는 IL-17 합성에 의해 지시되는 것과 같은 효과기 기능을 나타내지 않는다. 일부 구현예에서, 본 발명의 조성물의 투여는 순수한(naive) 항원-특이적 T-세포를 CD25+/Foxp3+ 표현형을 갖는 것과 같은 조절 표현형으로 전환시키지 않고 준-활성화된 표현형을 갖는 T-세포를 유도한다.In some embodiments, the invention provides carriers (e. G., Immunostimulatory particles) coupled to one or more peptides, polypeptides, and / or proteins. In some embodiments, a carrier (e. G., A PLG carrier) such as those described herein is capable of inducing antigen-specific resistance and / or preventing the onset of an immune-related disorder (e. And / or to reduce the severity of existing immune-related diseases. In some embodiments, the compositions and methods of the invention may allow T-cells to perform initial events associated with T-cell activation, but do not allow T-cells to acquire effector function. For example, administration of a composition of the present invention can induce T-cells with quasi-activated phenotypes such as CD69 and / or CD44 upregulation, but may be induced by a deficiency of IFN-gamma or by IL-17 synthesis And does not exhibit the effector functions such as. In some embodiments, the administration of the compositions of the present invention does not convert naive antigen-specific T-cells into a regulated phenotype such as having a CD25 + / Foxp3 + phenotype, but T-cells with a quasi-activated phenotype .
일부 구현예에서, 캐리어(예를 들어, 입자)의 표면은 항원성 펩타이드 및/또는 다른 기능성 요소를 캐리어에 부착(예를 들어, 공유적으로, 비-공유적으로)시킬 수 있는 화학적 모이어티 및/또는 작용기를 포함한다. 일부 구현예에서, 캐리어(예를 들어, 입자)상의 화학적 모이어티 및/또는 작용기의 수, 배향, 간격 등은 캐리어 화학, 원하는 적용 등에 따라 다양하다.In some embodiments, the surface of a carrier (e.g., a particle) is a chemical moiety capable of attaching (e.g., covalently, non-covalently) an antigenic peptide and / And / or functional groups. In some embodiments, the number, orientation, spacing, etc. of chemical moieties and / or functional groups on a carrier (e.g., a particle) varies with carrier chemistry, desired application, and the like.
일부 구현예에서, 캐리어는 캐리어에 부착되거나, 흡착되거나, 캐리어내에 캡슐화되고/되거나 캐리어 전체에 함유되는 하나 이상의 생물학적 또는 화학적 제제를 포함한다. 일부 구현예에서, 화학적 또는 생물학적 제제가 입자 전체에 캡슐화되고, 및/또는 입자 전체에 걸쳐 함유된다. 본 발명은 화학적 또는 생물학적 제제의 특성에 의해 제한되지 않는다. 이러한 제제는 단백질, 핵산 분자, 소분자 약물, 지질, 탄수화물, 세포, 세포 성분 등을 포함하지만, 이에 한정되지 않는다. 일부 구현예에서, 2종 이상의(예를 들어, 3, 4, 5 등) 상이한 화학적 또는 생물학적 제제가 캐리어 상에 또는 캐리어 내에 포함된다. 일부 구현예에서, 제제는 특정 방출 속도로 구성된다. 일부 구현예에서, 다수의 상이한 제제가 상이한 방출 속도로 구성된다. 예를 들어, 제1 제제는 제2 제제가 보다 긴 기간(예를 들어, 일, 주, 개월 등)에 걸쳐 방출하는 동안 몇 시간에 걸쳐 방출할 수 있다. 일부 구현예에서, 캐리어 또는 그의 일부는 생물학적 또는 화학적 제제의 서방형 방출을 위해 구성된다. 일부 구현예에서, 서방형 방출은 적어도 30일(예를 들어, 40일, 50일, 60일, 70일, 80일, 90일, 100일, 180일 등)의 기간에 걸쳐 제제의 생물학적 활성 양의 방출을 제공한다. 일부 구현예에서, 캐리어 또는 그의 일부분은 공극으로 세포가 내부로 들어가도록 충분히 다공성이도록 구성된다. 공극의 크기는 관심있는 특별한 세포 유형 및/또는 원하는 내재화 양을 위해 선택될 수 있다. 일부 구현예에서, 입자는 약물 또는 면역조절물질과 같은 다른 비-펩타이드 활성제없이 관심있는 항원을 포함한다. 또한, 일부 구현예에서, 본 발명의 입자는 관심 항원 이외에 면역자극성 또는 면역억제성 펩타이드를 함유하지 않는다. 또한, 일부 구현예에서, 입자는 표면 상에 또는 입자 내에 캡슐화된 다른 단백질 또는 펩타이드(예를 들어, 공동자극 분자, MHC 분자, 면역자극성 펩타이드 또는 면역억제성 펩타이드)를 함유하지 않는다.In some embodiments, the carrier comprises one or more biological or chemical agents that are attached to, adhered to, encapsulated within, and / or contained throughout the carrier. In some embodiments, a chemical or biological agent is encapsulated throughout the particle and / or is contained throughout the particle. The invention is not limited by the nature of the chemical or biological agent. Such agents include, but are not limited to, proteins, nucleic acid molecules, small molecule drugs, lipids, carbohydrates, cells, cellular components, and the like. In some embodiments, two or more (e.g., three, four, five, etc.) different chemical or biological agents are included on or in the carrier. In some embodiments, the formulation is configured with a specific release rate. In some embodiments, a number of different agents are configured at different release rates. For example, the first agent can release over a period of time while the second agent is released over a longer period of time (e.g., days, weeks, months, etc.). In some embodiments, the carrier or a portion thereof is configured for sustained release of a biological or chemical agent. In some embodiments, the sustained release is a biological activity of the agent over a period of at least 30 days (e.g., 40 days, 50 days, 60 days, 70 days, 80 days, 90 days, 100 days, 180 days, etc.) Provides positive release. In some embodiments, the carrier or a portion thereof is configured to be porous enough to allow cells to enter the interior with voids. The size of the pores may be selected for the particular cell type of interest and / or the desired amount of internalization. In some embodiments, the particle comprises an antigen of interest without a drug or other non-peptide activator such as an immunomodulatory agent. Further, in some embodiments, the particles of the present invention do not contain immunostimulatory or immunosuppressive peptides other than the antigen of interest. Further, in some embodiments, the particles do not contain other proteins or peptides (e.g., co-stimulatory molecules, MHC molecules, immunostimulatory peptides, or immunosuppressive peptides) encapsulated on or in the surface.
본 발명의 입자에서의 항원, 생물학적 및/또는 화학적 제제의 캡슐화는 놀랍게도 면역학적 관용을 유도하는 것으로 밝혀졌으며, 몇 가지 이점이 있다. 첫째, 캡슐화된 입자는 보다 느린 사이토카인 반응을 갖는다. 둘째로, 여러 항원, 생물학적 및/또는 화학적 제제를 사용하는 경우, 캡슐화는 제제가 입자 표면에 부착된 경우 발생할 수 있는 다양한 분자 간의 경쟁을 제거한다. 셋째, 캡슐화는 보다 많은 항원, 생물학적 및/또는 화학적 제제가 입자와 함께 편입되도록 한다. 넷째, 캡슐화는 복합 단백질 항원 또는 장기 균질물(예를 들어, 1형 당뇨병의 경우 췌장 균질물 또는 땅콩 알러지의 땅콩 추출물)의 보다 용이한 사용을 허용한다. 마지막으로, 입자의 표면에 콘주게이션 대신에 입자 내에 항원, 생물학적 및/또는 화학적 제제를 캡슐화하여 입자의 표면 상에 순 음전하를 유지시킨다. 본 발명의 입자내 항원, 생물학적 및/또는 화학적 제제의 캡슐화는 당 업계에 공지된 임의의 방법으로 수행될 수 있다. 일 구현예에서, 폴리펩타이드 항원은 이중-에멀젼 공정에 의해 입자 내에 캡슐화된다. 추가의 구현예에서, 폴리펩타이드 항원은 수용성이다.The encapsulation of antigenic, biological and / or chemical agents in the particles of the invention has surprisingly been found to induce immunological tolerance and has several advantages. First, the encapsulated particles have a slower cytokine response. Second, when multiple antigens, biological and / or chemical agents are used, encapsulation eliminates the competition between the various molecules that can occur when the agent is attached to the particle surface. Third, encapsulation allows more antigen, biological and / or chemical agents to be incorporated with the particles. Fourth, encapsulation allows for easier use of complex protein antigens or long-term homogenates (eg, pancreatic homogenate in the case of
또 다른 구현예에서, 폴리펩타이드 항원은 단일-에멀젼 공정에 의해 입자 내에 캡슐화된다. 추가의 구현예에서, 폴리펩타이드 항원은 보다 소수성이다. 때때로, 이중 에멀젼 공정은 큰 입자의 형성을 유도하여, 친수성 활성 성분의 누출 및 낮은 포착 효율을 초래할 수 있다. 유착 및 Ostwald 숙성은 이중-에멀전 액적을 불안정하게할 수 있는 두 가지 기전이며, 친수성 활성 성분의 유기상을 통한 확산은 포획된 활성 성분의 낮은 수준을 초래하는 주요 기전이다. 일부 구현예에서, 나노입자 크기를 감소시키는 것이 유익할 수 있다. 이것을 달성하기 위한 하나의 전략은 두 번째 강한 전단율을 적용하는 것이다. 누출 효과는 높은 폴리머 농도 및 높은 폴리머 분자량을 사용하여 내부 수성 상의 점도 증가 및 계면활성제 분자량의 증가를 수반함으로써 감소될 수 있다.In another embodiment, the polypeptide antigen is encapsulated within the particle by a single-emulsion process. In a further embodiment, the polypeptide antigen is more hydrophobic. Occasionally, dual emulsion processes can lead to formation of large particles, resulting in leakage of hydrophilic active ingredients and low capture efficiency. Adhesion and Ostwald aging are two mechanisms by which dual-emulsion droplets can be destabilized, and diffusion through the organic phase of the hydrophilic active ingredient is a major mechanism leading to low levels of entrapped active ingredients. In some embodiments, it may be beneficial to reduce the nanoparticle size. One strategy to achieve this is to apply a second strong shear rate. Leakage effects can be reduced by increasing the viscosity of the internal aqueous phase and increasing the surfactant molecular weight using higher polymer concentrations and higher polymer molecular weights.
특정 구현예에서, 본 발명은 세포 또는 다른 생물학적 또는 화학적 제제를 그 안에(또는 그 위에) 갖는 캐리어를 제공한다. 세포가 사용되는 경우, 캐리어는 특별한 유형의 세포로 제한되지 않는다. 일부 구현예에서, 캐리어는 그 위에 췌장 소도세포를 갖는다. 일부 구현예에서, 미세다공성 캐리어는 ECM 단백질 및/또는 엑센딘-4를 추가로 갖는다. 캐리어는 특별한 유형으로 제한되지 않는다. 일부 구현예에서, 캐리어는 다양한 다공성의 영역(예를 들어, 변화하는 공극 크기, 공극 깊이 및/또는 공극 밀도)을 갖는다. 일부 구현예에서, 캐리어는 약제, DNA, RNA, 세포외 기질 단백질, 엑센딘-4 등을 그 위에(또는 그 안에) 갖는다. 특정 구현예에서, 본 발명은 췌장 소도세포를 상기 캐리어로 이식하는 방법을 제공한다. 본 발명의 특정 구현예에서, 유도 항원은 단일의 단리된 또는 재조합적으로 생산된 분자이다. 표적 항원이 숙주의 다양한 위치에 전파되는 병태를 치료하기 위해, 일반적으로 유도 항원이 표적 항원과 동일하거나 면역학적으로 관련될 필요가 있다. 그러한 항원의 예로는 대부분의 폴리뉴클레오타이드 항원과 일부 탄수화물 항원(예컨대, 혈액형 항원)이 있다.In certain embodiments, the invention provides a carrier having (in or on) a cell or other biological or chemical agent. When a cell is used, the carrier is not limited to a particular type of cell. In some embodiments, the carrier has pancreatic islet cells thereon. In some embodiments, the microporous carrier further has an ECM protein and / or exendin-4. Carriers are not limited to any particular type. In some embodiments, the carrier has various areas of porosity (e.g., varying pore size, pore depth and / or pore density). In some embodiments, the carrier has (on or in) a drug, DNA, RNA, extracellular matrix protein, exendin-4, and the like. In certain embodiments, the invention provides a method of transplanting pancreatic islet cells into the carrier. In certain embodiments of the invention, the inducing antigen is a single isolated or recombinantly produced molecule. In order to treat a condition in which the target antigen is spread to various locations in the host, it is generally necessary that the inducing antigen be identical or immunologically related to the target antigen. Examples of such antigens are most polynucleotide antigens and some carbohydrate antigens (e. G., Blood group antigens).
임의의 적합한 항원이 본 발명의 범위 내에서 사용될 수 있다. 일부 구현예에서, 유도 항원은 유도된 면역원성 반응의 특이성에 기여한다. 유도 항원은 원하지 않는 면역학적 반응을 위한 표적이고 내성이 요구되는, 치료될 대상체에 존재하거나 배치되는 항원인 표적 항원과 동일하거나 같지 않을 수 있다.Any suitable antigen may be used within the scope of the present invention. In some embodiments, the inducing antigen contributes to the specificity of the induced immunogenic response. An induced antigen may be the same or different from a target antigen that is a target for an unwanted immune response and is an antigen that is present or placed on the subject to be treated that requires resistance.
본 발명의 특정 구현예에서, 유도 항원은 꽃가루에서 발견되는 것, 일본 삼나무 꽃가루로부터의 폴리펩타이드와 동일한 형태가 아니지만, 그의 단편 또는 유도체이다. 본 발명의 유도 항원은 적절한 특이성의 분자에 기반을 두지만 단편화, 잔기 치환, 라벨링, 콘주게이션 및/또는 다른 기능적 특성을 갖는 펩타이드와의 융합에 의해 적응된 펩타이드를 포함한다. 적응은 독성 또는 면역원성과 같은 임의의 바람직하지 않은 특성의 제거; 또는 점막 결합, 점막 침투 또는 면역 반응의 면역원성 아암의 자극과 같은 임의의 바람직한 특성 개선을 포함하지만, 이에 한정되지 않는 임의의 바람직한 목적을 위해 수행될 수 있다. 본원에 사용된 CRYJ1 또는 CRYJ2와 같은 용어는 유사체인 각각의 분자의 적어도 10개 및 바람직하게는 20개의 연속적인 아미노산에 대하여 온전한 하위단위뿐만 아니라 상동성(아미노산 수준이 바람직하게는 70% 동일한, 보다 바람직하게는 80% 동일하고, 더욱더 바람직하게는 90% 동일함) 영역을 함유하는 동종형 및 합성 변이체, 단편, 융합 펩타이드, 콘주게이트 및 기타 유도체를 지칭하며, 상기 유도체의 상동성 영역은 표적 항원에 대한 내성을 유도하는 능력을 각각의 모체 분자와 공유한다.In certain embodiments of the invention, the inducing antigen is not the same form found in pollen, the polypeptide from Japanese cedar pollen, but is a fragment or derivative thereof. The inducing antigens of the present invention include peptides that are based on molecules of appropriate specificity but are adapted by fusion with peptides with fragmentation, residue substitution, labeling, conjugation, and / or other functional properties. Adaptation may include the removal of any undesirable properties such as toxicity or immunogenicity; Or any desired property improvement, such as, but not limited to, mucosal binding, mucosal penetration, or stimulation of an immunogenic arm of an immune response. As used herein, terms such as CRYJ1 or CRYJ2 refer to homologous subunits for homologous subunits for at least 10 and preferably 20 consecutive amino acids of each molecule of similarity, homology (amino acid level preferably 70% identical, Refers to homologous and synthetic variants, fragments, fusion peptides, conjugates and other derivatives containing a region that is at least 80% identical, preferably at least 90% identical, and even more preferably 90% identical, Lt; RTI ID = 0.0 > resistance < / RTI > to each parent molecule.
유도 항원의 면역원성 영역은 종종 항체 반응의 자극을 위한 면역우성 에피토프와 상이하다는 것이 인식된다. 면역원성 영역은 일반적으로 T 세포를 포함하는 특정 세포 상호작용에서 나타날 수 있는 영역이다. 면역원성 영역은 존재할 수 있고, 온전한 항원의 제시시 내성을 유도할 수 있다. 일부 항원은 원상태 항원의 처리 및 제시가 정상적으로 내성을 유발하지 않는다는 점에서 잠적 면역원성 영역을 함유한다. 잠적 항원의 정교화 및 그의 동정은 국제 특허 공보 WO 94/27634에서 발견된다.It is recognized that the immunogenic region of an induced antigen is often different from an immunogenic epitope for stimulation of an antibody response. Immunogenic regions are regions that may appear in certain cell interactions, including T cells in general. Immunogenic regions may be present and induce tolerance in the presentation of intact antigens. Some antigens contain a latent immunogenic region in that the treatment and presentation of the virion antigens do not normally result in resistance. Elucidation of the latent antigen and its identification are found in International Patent Publication WO 94/27634.
본 발명의 특정 구현예에서, 2개, 3개 또는 그 이상의 복수의 유도 항원이 사용된다. 복수의 표적 항원이 존재할 때 이들 구현예를 실시하거나, 또는 표적에 대해 복수의 방관자를 제공하는 것이 바람직할 수 있다. 또한 가능한 여러 가지 다른 표적을 다루기 위해 항원 칵테일을 제공하는 것이 바람직할 수 있다. 예를 들어, CRYJ1 및 CRYJ2 단편의 칵테일 뿐만 아니라 일본 삼나무 꽃가루에서 유래된 다른 에피토프를 사용하여 대상체를 관용화시킬 수 있었다. 또 다른 예에서, 알러지항원의 혼합물은 아토피 치료를 위한 항원을 유도하는 역할을 할 수 있다.In certain embodiments of the invention, two, three, or more inducible antigens are used. It may be desirable to perform these embodiments when a plurality of target antigens are present, or to provide a plurality of bystanders for the target. It may also be desirable to provide an antigenic cocktail to handle as many different possible targets as possible. For example, the subject could be tolerated using cocktails of CRYJ1 and CRYJ2 fragments as well as other epitopes derived from Japanese cedar pollen. In another example, a mixture of allergic antigens may serve to induce an antigen for atopic treatment.
유도 항원은 분자의 성질에 따라 당 업계에 공지된 다수의 기술에 의해 제조될 수 있다. 폴리뉴클레오타이드, 폴리펩타이드 및 탄수화물 항원은 풍부한 처리 대상 종의 세포로부터 단리될 수 있다. 짧은 펩타이드는 아미노산 합성에 의해 편리하게 제조된다. 공지된 서열의 더 긴 단백질은 인코딩 서열을 합성하거나, 천연 공급원 또는 벡터로부터의 인코딩 서열을 PCR-증폭시킨 다음, 적절한 박테리아 또는 진핵 숙주 세포에서 인코딩 서열을 발현시킴으로써 제조될 수 있다.Inducible antigens can be produced by a number of techniques known in the art depending on the nature of the molecule. Polynucleotides, polypeptides and carbohydrate antigens can be isolated from cells of an abundant target species. Short peptides are conveniently prepared by amino acid synthesis. The longer protein of known sequence may be prepared by synthesizing an encoding sequence, PCR-amplifying the encoding sequence from a natural source or vector, and then expressing the encoding sequence in a suitable bacterial or eukaryotic host cell.
본 발명의 특정 구현예에서, 조합물은 꽃가루 입자로부터 수득된 항원의 복합 혼합물을 포함하며, 이들 중 하나 또는 그 이상은 항원을 유도하는 역할을 한다. 항원은 온전하거나, 포름알데하이드, 글루타르알데하이드 또는 알코올과 같은 고정액으로 처리되는 전체 세포의 형태일 수 있다. 항원은 세포 또는 조직의 제제 가용화 또는 기계적 파열에 의해 생성된 후 정화된 용해물의 형태일 수 있다. 항원은 또한 세포하 분별화, 특히 차별적인 원심분리와 같은 기술에 의한 원형질막의 농축, 임의로 제제 가용화 및 투석에 의해 수득될 수 있다. 가용화된 막 단백질의 친화성 또는 이온 교환 크로마토그래피와 같은 다른 분리 기술도 적합하다.In certain embodiments of the invention, the combination comprises a complex mixture of the antigens obtained from the pollen particles, one or more of which serves to induce the antigen. The antigen may be intact or in the form of whole cells treated with a fixative such as formaldehyde, glutaraldehyde or alcohol. The antigen may be in the form of a purified lysate after it has been produced by formulation or mechanical rupture of a cell or tissue formulation. Antigens may also be obtained by enrichment of the plasma membrane by techniques such as subcellular fractionation, particularly differential centrifugation, optionally by formulation solubilization and dialysis. Other separation techniques such as affinity of solubilized membrane proteins or ion exchange chromatography are also suitable.
알러지항원은 이에 대한 면역 반응의 면역원성이 또한 바람직한 다른 항원이다. 일 구현예에서, 항원은 일본 삼나무 꽃가루와 관련된 폴리펩타이드이다. 일부 구현예에서, 항원은 CRYJ1이다. 특정 구현예에서, 항원은 CRYJ2이다.Allergy antigens are other antigens that are also desirable for their immunogenicity. In one embodiment, the antigen is a polypeptide associated with Japanese cedar pollen. In some embodiments, the antigen is CRYJ1. In certain embodiments, the antigen is CRYJ2.
일 구현예에서, 본 발명의 입자는 알러지, 자가면역 질환 및/또는 염증성 질환 또는 장애와 관련된 하나 이상의 에피토프를 포함하는 항원에 커플링된다. 항원은 하나 이상의 에피토프의 복제본을 포함할 수 있다. 일 구현예에서, 항원은 하나의 질환 또는 장애와 관련된 단일 에피토프를 포함한다. 추가의 구현예에서, 항원은 동일한 질환 또는 장애와 관련된 하나 초과의 에피토프를 포함한다. 또 다른 구현예에서, 항원은 상이한 질환 또는 장애와 관련된 하나 초과의 에피토프를 포함한다. 추가의 구현예에서, 항원은 하나 이상의 알러지와 관련된 하나 이상의 에피토프를 포함한다.In one embodiment, the particles of the invention are coupled to an antigen comprising at least one epitope associated with an allergy, an autoimmune disease, and / or an inflammatory disease or disorder. An antigen may comprise a replica of one or more epitopes. In one embodiment, the antigen comprises a single epitope associated with a disease or disorder. In further embodiments, the antigen comprises more than one epitope associated with the same disease or disorder. In another embodiment, the antigen comprises more than one epitope associated with a different disease or disorder. In a further embodiment, the antigen comprises one or more epitopes associated with one or more allergies.
일본 삼나무 꽃가루에 대한 알러지와 관련된 에피토프의 추가의 비-한정적인 예는 표 1에 개시되어 있다.Additional non-limiting examples of allergy-related epitopes for Japanese cedar pollen are shown in Table 1.
알러지와 관련된 임의의 적합한 항원이 본 발명의 범위 내에서 사용될 수 있다. 일부 구현예에서, 본원에 기재된 입자는 알러지와 관련된 하나 이상의 항원 또는 에피토프로 캡슐화된다. 특정 구현예에서, 항원 또는 에피토프는 분진, 애완동물 알러지항원, 수목 꽃가루, 풀 꽃가루, 곰팡이, 식물성 알러지항원, 열매 알러지항원, 너트 알러지항원, 종자 알러지항원, 향신료 알러지항원, 곡물 알러지항원, 해산물 알러지항원, 육류 알러지항원, 선충 알러지항원, 라텍스 알러지항원 및/또는 독 알러지항원과 관련되어 있다.Any suitable antigen associated with allergy can be used within the scope of the present invention. In some embodiments, the particles described herein are encapsulated in one or more antigens or epitopes associated with allergy. In certain embodiments, the antigen or epitope is selected from the group consisting of dust, pet allergenic antigen, plant pollen, grass pollen, fungus, plant allergen, fruit allergen, nut allergen, seed allergen, cereal allergen, Antigens, allergenic antigens, nematode allergens, latex allergens, and / or allergic antigens.
일부 구현예에서, 일본 삼나무 꽃가루로부터의 항원성 에피토프는 Cry j 1, Cry j 2, Cry j 3, Cry j 4, Cry j IFR, Cry j 키티나제(Chitinase), Cry j Asp, Cry j LTP, 및/또는 Cry j CPA9, 또는 그의 단편 또는 변이체를 포함한다. 특정 구현예에서, 일본 삼나무 꽃가루로부터의 항원성 에피토프는 CRYJ1 폴리펩타이드 또는 그의 단편 또는 변이체를 포함한다. 일부 구현예에서, CRYJ1 폴리펩타이드는 SEQ ID NO: 1의 아미노산 서열을 포함한다. 특정 구현예에서, 일본 삼나무 꽃가루로부터의 항원성 에피토프는 CRYJ1의 단편이다. 일부 구현예에서, CRYJ1의 단편은 SEQ ID NO: 1에 대해 적어도 90%, 적어도 95%, 적어도 99% 또는 100% 서열 동일성을 갖는, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 적어도 20, 적어도 25, 적어도 30, 적어도 35, 적어도 40, 적어도 45, 또는 적어도 50개의 연속적인 아미노산을 포함한다. 특정 구현예에서, 항원성 에피토프는 CRYJ1의 변이체이다. 특정 구현예에서, 변이체는 SEQ ID NO: 1에 대해 적어도 약 60%, 65%, 70%, 75%, 80%, 85%, 86%, 87%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 또는 99% 초과의 서열 동일성을 갖는 아미노산 서열을 포함한다.In some embodiments, the antigenic epitopes from Japanese cedar pollen are
일부 구현예에서, 일본 삼나무 꽃가루로부터의 항원성 에피토프는 p16-30, p81-95, p106-120, p111-125, p211-225, 및 p301-315로 구성된 그룹으로부터 선택된 CRYJ1의 단편이며, 이는 Sone 등, J. Immunol, vol. 161(1) 448-457 (1998)에 기재되어 있으며; 그 전문이 본원에 참고로 편입되어있다.In some embodiments, the antigenic epitope from Japanese cedar pollen is a fragment of CRYJ1 selected from the group consisting of p16-30, p81-95, p106-120, p111-125, p211-225, and p301-315, Et al., J. Immunol, vol. 161 (1) 448-457 (1998); Which is incorporated herein by reference.
일부 구현예에서, 일본 삼나무 꽃가루로부터의 항원성 에피토프는 CRYJ2 폴리펩타이드 또는 그의 단편 또는 변이체를 포함한다. 일부 구현예에서, CRYJ2 폴리펩타이드는 SEQ ID NO: 2의 아미노산 서열을 포함한다. 특정 구현예에서, 일본 삼나무 꽃가루로부터의 항원성 에피토프는 CRYJ2의 단편이다. 일부 구현예에서, CRYJ2의 단편은 SEQ ID NO: 2에 대해 적어도 90%, 적어도 95%, 적어도 99% 또는 100% 서열 동일성을 갖는, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 적어도 20, 적어도 25, 적어도 30, 적어도 35, 적어도 40, 적어도 45, 또는 적어도 50개의 연속적인 아미노산을 포함한다. 특정 구현예에서, 항원성 에피토프는 CRYJ2의 변이체이다. 특정 구현예에서, 변이체는 SEQ ID NO: 2에 대해 적어도 약 60%, 65%, 70%, 75%, 80%, 85%, 86%, 87%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 또는 99% 초과의 서열 동일성을 갖는 아미노산 서열을 포함한다.In some embodiments, the antigenic epitope from Japanese cedar pollen comprises a CRYJ2 polypeptide or a fragment or variant thereof. In some embodiments, the CRYJ2 polypeptide comprises the amino acid sequence of SEQ ID NO: 2. In certain embodiments, the antigenic epitope from Japanese cedar pollen is a fragment of CRYJ2. In some embodiments, the fragment of CRYJ2 has a sequence identity of at least 90%, at least 95%, at least 99%, or 100% sequence identity to SEQ ID NO: 2, such as 10,11,12,13,14,15,16,17 , 18, 19, 20, at least 20, at least 25, at least 30, at least 35, at least 40, at least 45, or at least 50 contiguous amino acids. In certain embodiments, the antigenic epitope is a variant of CRYJ2. In certain embodiments, the variants comprise at least about 60%, 65%, 70%, 75%, 80%, 85%, 86%, 87%, 89%, 90% , 93%, 94%, 95%, 96%, 97%, 98%, 99% or 99% sequence identity.
일부 구현예에서, 일본 삼나무 꽃가루로부터의 항원성 에피토프는 p66-80, p81-95, p141-155, p186-200, p236-250, p346-360, p351-365, 및 p336-350으로 구성된 그룹으로부터 선택된 CRYJ2의 단편이며, 이들은 Sone et al(1998)에 기술되어있다.In some embodiments, the antigenic epitope from Japanese cedar pollen is from a group consisting of p66-80, p81-95, p141-155, p186-200, p236-250, p346-360, p351-365, and p336-350 Fragments of the selected CRYJ2, which are described in Sone et al (1998).
특정 구현예에서, 본원에 기재된 입자는 2개 이상, 3개 이상, 4개 이상, 5개 이상, 6개 이상, 7개 이상, 8개 이상, 9개 이상, 10개 이상, 15개 이상, 또는 20개 또는 그 이상의 일본 삼나무 꽃가루로부터의 항원성 에피토프를 캡슐화한다. 특정 구현예에서, 2개 이상의 항원성 에피토프는 융합 단백질에 함유된다. 일부 구현예에서, 융합 단백질에 함유된 항원성 에피토프는 절단가능한 링커에 의해 연결된다. 본원에서 사용되는 절단가능한 링커는 특정 절단 부위를 함유하는 아미노산 서열을 지칭한다.In certain embodiments, the particles described herein may comprise at least two, at least three, at least four, at least five, at least six, at least seven, at least eight, at least nine, at least ten, at least fifteen, Or encapsulate an antigenic epitope from 20 or more Japanese cedar pollen. In certain embodiments, two or more antigenic epitopes are contained in the fusion protein. In some embodiments, the antigenic epitope contained in the fusion protein is linked by a cleavable linker. As used herein, a cleavable linker refers to an amino acid sequence containing a specific cleavage site.
일부 구현예에서, 절단가능한 링커는 길이가 5, 6, 7, 8, 9, 10, 10 초과, 15 초과, 20 초과, 25 초과의 아미노산이다. 일부 구현예에서, 절단가능한 링커는 특정 부위의 프로테아제에 의해 절단된다. 특정 구현예에서, 절단가능한 링커는 프로테아제에 의해 절단되는 하나 이상의 특정 부위를 함유한다. 일부 구현예에서, 절단가능한 링커는 하나 이상의 특정 부위를 함유하며, 여기서 특정 부위는 상이한 프로테아제에 의해 절단된다. 일부 구현예에서, 절단가능한 링커는 하나 이상의 특정 부위를 함유하며, 여기서 특정 부위는 동일한 프로테아제에 의해 절단된다.In some embodiments, cleavable linkers are 5, 6, 7, 8, 9, 10, more than 10, more than 15, more than 20, more than 25 amino acids in length. In some embodiments, cleavable linkers are cleaved by proteases at specific sites. In certain embodiments, cleavable linkers contain one or more specific sites that are cleaved by a protease. In some embodiments, the cleavable linker contains one or more specific sites, wherein the specific site is cleaved by a different protease. In some embodiments, the cleavable linker contains one or more specific sites, wherein the specific sites are cleaved by the same protease.
일부 구현예에서, 절단가능한 링커는 퓨린 감수성 링커 및/또는 카텝신 감수성 링커이다. 특정 구현예에서, 절단가능한 링커는 링커 상의 특정 부위에서 퓨린, 카텝신 A, 카텝신 B, 카텝신 C, 카텝신 D, 카텝신 E, 카텝신 F, 카텝신 G, 카텝신 H, 카텝신 K, 카텝신 L, 카텝신 O, 카텝신 W 및/또는 카텝신 Z 중 하나 이상에 의해 절단된다. 일부 구현예에서, 절단가능한 링커는 SEQ ID NO: 3의 아미노산 서열을 포함한다.In some embodiments, the cleavable linker is a purine susceptible linker and / or a cathepsin susceptible linker. In certain embodiments, the cleavable linker is selected from the group consisting of purine, cathepsin A, cathepsin B, cathepsin C, cathepsin D, cathepsin E, cathepsin F, cathepsin G, cathepsin H, K, cathepsin L, cathepsin O, cathepsin W, and / or cathepsin Z. In some embodiments, the cleavable linker comprises the amino acid sequence of SEQ ID NO: 3.
일부 구현예에서, 융합 단백질은 동일한 단백질로부터의 2종 이상의 에피토프를 함유한다. 특정 구현예에서, 융합 단백질은 상이한 단백질로부터의 2종 이상의 에피토프를 함유한다. 특정 구현예에서, 융합 단백질은 CRYJ1의 2종 이상의 에피토프를 포함한다. 특정 구현예에서, 융합 단백질은 CRYJ2로부터의 2종 이상의 에피토프를 포함한다. 일부 구현예에서, 융합 단백질은 CRYJ1 및 CRYJ2로부터의 에피토프를 포함한다.In some embodiments, the fusion protein contains two or more epitopes from the same protein. In certain embodiments, the fusion protein contains two or more epitopes from different proteins. In certain embodiments, the fusion protein comprises two or more epitopes of CRYJ1. In certain embodiments, the fusion protein comprises two or more epitopes from CRYJ2. In some embodiments, the fusion protein comprises an epitope from CRYJ1 and CRYJ2.
항원 및/또는 에피토프의 조합은 단리된 세포 또는 동물 모델로 실험을 수행함으로써 면역원성을 증진시키는 능력에 대해 시험될 수 있다.The combination of antigen and / or epitope can be tested for its ability to enhance immunogenicity by performing experiments with isolated cells or animal models.
일부 구현예에서, 본 발명의 면역원성 유도 조성물은 (예를 들어, 항원성 펩타이드 또는 다른 항원성 분자에 추가하여) 세포자멸적 신호전달 분자를 함유한다. 일부 구현예에서, 세포자멸적 신호전달 분자는 캐리어의 표면과 커플링 및/또는 연합된다. 일부 구현예에서, 세포자멸적 신호전달 분자는 숙주의 항원 제시 세포, 예를 들어 숙주 세망내피 시스템의 세포에 의해 캐리어가 세포자멸체로 감지되도록 하며; 이것은 면역원성-유도 방식으로 상기 연합된 펩타이드 에피토프의 제시를 허용한다. 이론에 구속됨이 없이, 이것은 MHC 부류 I/II 및 공동 자극 분자와 같은 면역 세포 자극에 관여하는 분자의 상향 조절을 방지하는 것으로 추정된다. 이러한 세포자멸적 신호전달 분자는 또한 식균세포 마커로서 작용할 수 있다. 예를 들어, 본 발명에 적합한 세포자멸적 신호전달 분자는 미국 특허 출원 제20050113297호에 기재되어 있으며, 상기 특허는 본원에서 참고로 편입된다. 본 발명에 적합한 분자는 대식세포, 수지상 세포, 단핵구, 과립구 및 중성구를 포함하는 식균세포를 표적으로 하는 분자를 포함한다.In some embodiments, an immunogenic inducing composition of the invention (including, for example, in addition to an antigenic peptide or other antigenic molecule) contains apoptotic signaling molecules. In some embodiments, the apoptotic signaling molecule is coupled and / or associated with the surface of the carrier. In some embodiments, the apoptotic signaling molecule causes the carrier to be detected as an apoptotic cell by an antigen presenting cell of the host, e. G., Cells of the host retinal endothelial system; This allows the presentation of the associated peptide epitope in an immunogenicity-inducible manner. Without being bound by theory, it is believed that this prevents the upregulation of molecules involved in immune cell stimulation, such as MHC class I / II and co-stimulatory molecules. Such apoptotic signaling molecules may also act as host cell markers. For example, apoptotic signaling molecules suitable for the present invention are described in U.S. Patent Application No. 20050113297, which is incorporated herein by reference. Molecules suitable for the present invention include molecules targeting macrophage cells, including macrophages, dendritic cells, monocytes, granulocytes and neutrophils.
일부 구현예에서, 세포자멸적 신호전달 분자로서 적합한 분자는 상기 연합된 펩타이드의 면역원성을 향상시키는 작용을 한다. 또한, 세포자멸적 신호전달 분자에 결합된 캐리어는 세포자멸적 세포 인식에서 Clq에 의해 결합될 수 있다(Paidassi 등, (2008) J. Immunol. 180:2329-2338; 그 전체가 본 명세서에 참고로 포함됨). 예를 들어, 세포자멸적 신호전달 분자로서 유용할 수 있는 분자는 포스파티딜 세린, 아넥신-1, 아넥신-5, 유지방 구상체-EGF 인자 8(MFG-E8) 또는 트롬보스폰틴 계열(예를 들어, 트롬보스폰틴-1(TSP-1))을 포함한다. 본 발명에 의해 세포자멸적 신호전달 분자로서 사용하기에 적합한 다양한 분자가 예를 들어, 미국 특허 공보 제2012/0076831호에 논의되어 있으며; 그 전체가 참고문헌으로 본 명세서에 포함된다).In some embodiments, molecules suitable as apoptotic signaling molecules serve to enhance the immunogenicity of the associated peptides. In addition, carriers bound to apoptotic signaling molecules can be bound by Clq in apoptotic cell recognition (Paidassi et al., (2008) J. Immunol. 180: 2329-2338; ≪ / RTI > For example, molecules that may be useful as apoptotic signaling molecules include, but are not limited to, phosphatidylserine, annexin-1, annexin-5, endosperm globulomer-EGF factor 8 (MFG-E8), or thrombospondin family For example, thrombospondin-1 (TSP-1). Various molecules suitable for use as apoptotic signaling molecules by the present invention are discussed, for example, in U.S. Patent Publication No. 2012/0076831; The entirety of which is incorporated herein by reference).
일부 구현예에서, 세포자멸적 신호전달 분자는 항원-특이적 펩타이드에 콘주게이트될 수 있다. 일부 사례에서, 세포자멸적 신호전달 분자 및 항원-특이적 펩타이드는 융합 단백질의 생성에 의해 콘주게이트된다. 예를 들어, 융합 단백질은 세포자멸적 신호전달 분자 (또는 그의 단편 또는 변이체)의 적어도 하나의 분자에 커플링된 적어도 하나의 항원-특이적 펩타이드(또는 이의 단편 또는 변이체)를 포함할 수 있다. 융합 단백질의 생성을 위해, "융합 단백질", "융합 펩타이드", "융합 폴리펩타이드" 및 "키메라 펩타이드"라는 용어는 상호교환적으로 사용된다. 항원-특이적 펩타이드의 적합한 단편은 본 발명의 원하는 항원-특이적 면역원성 기능을 생성시키는 기능을 보유하는 전장 펩타이드의 임의 단편을 포함한다. 융합 단백질은 당 업계에서 이해되는 다양한 수단(예를 들어, 유전적 융합, 화학적 콘주게이션 등)에 의해 생성될 수 있다. 두 단백질은 직접 또는 아미노산 링커를 통해 융합될 수 있다. 융합 단백질을 형성하는 폴리펩타이드는 C-말단을 C-말단에, N-말단을 N-말단에, 또는 N-말단을 C-말단에 연결할 수 있지만, 일반적으로 C-말단을 N-말단에 연결한다. 융합 단백질의 폴리펩타이드는 임의의 순서로 존재할 수 있다. 펩타이드 링커 서열은 각각의 폴리펩타이드가 그의 2차 및 3차 구조로 폴드되는 것을 보장하기에 충분한 거리만큼 제1 및 제2 폴리펩타이드 성분을 분리하는데 사용될 수 있다. 링커로서 유용하게 사용될 수 있는 아미노산 서열은 Maratea 등, Gene 40:39-46 (1985); Murphy 등, Proc. Natl. Acad. Sci. USA 83:8258-8262 (1986); 미국 특허 제4,935,233호 및 미국 특허 제4,751,180호에 기재된 것들을 포함하며; 그 전체 내용이 본 명세서에 참고 문헌으로 포함된다. 링커 서열은 일반적으로 길이가 1 내지 약 50개의 아미노산일 수 있다. 일부 구현예에서, 예를 들어, 제1 및 제2 폴리펩타이드가 기능적 도메인을 분리하고 입체 간섭을 방지하는데 사용될 수 있는 비-필수적 N-말단 아미노산 영역을 가질 때, 링커 서열은 요구되지 않고 및/또는 이용되지 않는다.In some embodiments, the apoptotic signaling molecule may be conjugated to an antigen-specific peptide. In some instances, apoptotic signaling molecules and antigen-specific peptides are conjugated by the production of fusion proteins. For example, the fusion protein may comprise at least one antigen-specific peptide (or fragment or variant thereof) coupled to at least one molecule of a cell apoptotic signaling molecule (or fragment or variant thereof). For the production of a fusion protein, the terms "fusion protein", "fusion peptide", "fusion polypeptide" and "chimeric peptide" are used interchangeably. Suitable fragments of an antigen-specific peptide include any fragment of a full length peptide that retains the ability to produce the desired antigen-specific immunogenic function of the present invention. Fusion proteins can be produced by a variety of means as understood in the art (e. G., Genetic fusion, chemical conjugation, etc.). Both proteins can be fused directly or via an amino acid linker. Polypeptides that form fusion proteins can link the C-terminus to the C-terminus, the N-terminus to the N-terminus, or the N-terminus to the C-terminus, but generally the C- do. The polypeptides of the fusion protein may be present in any order. The peptide linker sequence may be used to separate the first and second polypeptide components by a distance sufficient to ensure that each polypeptide is folded into its secondary and tertiary structure. Amino acid sequences that may be usefully employed as linkers are described in Maratea et al., Gene 40: 39-46 (1985); Murphy et al., Proc. Natl. Acad. Sci. USA 83: 8258-8262 (1986); U.S. Patent No. 4,935,233 and U.S. Patent No. 4,751,180; The entire contents of which are incorporated herein by reference. Linker sequences can generally be from 1 to about 50 amino acids in length. In some embodiments, for example, when the first and second polypeptides have a non-essential N-terminal amino acid region that can be used to separate functional domains and prevent steric interference, the linker sequence is not required and / Or not used.
면역원성 활성을 위한 프록시는 표적 부위에서 적절한 사이토카인의 생산을 자극하기 위해 온전한 항원 또는 단편의 능력이다. 표적 부위에서 T 억제 세포에 의해 방출되는 면역조절 사이토카인은 TGF-β로 생각된다(Miller 등, Proc. Natl. Acad. Sci. USA 89:421, 1992). 관용 기간 동안 생성될 수 있는 다른 인자는 사이토카인 IL4 및 IL-10 및 매개체 PGE이다. 대조적으로, 활성 면역 파괴를 겪고있는 조직의 림프구는 IL-1, IL-2, IL-6 및 IFN-γ와 같은 사이토카인을 분비한다. 따라서, 항원을 유도하는 후보 물질의 효능은 적절한 유형의 사이토카인을 자극하는 능력을 측정함으로써 평가될 수 있다.Proxies for immunogenic activity are the ability of intact antigens or fragments to stimulate the production of appropriate cytokines at the target site. The immunomodulatory cytokine released by T suppressor cells at the target site is thought to be TGF-beta (Miller et al., Proc. Natl. Acad Sci USA 89: 421, 1992). Other factors that may be generated during the tolerance period are cytokines IL4 and IL-10 and the mediator PGE. In contrast, lymphocytes in tissues undergoing active immunodeficiency secrete cytokines such as IL-1, IL-2, IL-6 and IFN-y. Thus, the efficacy of a candidate agent to induce an antigen can be assessed by measuring its ability to stimulate an appropriate type of cytokine.
이러한 점을 염두에 두고, 유도 항원의 면역원성 에피토프, 효과적인 점막 결합 성분, 효과적인 조합, 또는 점막 투여의 효과적인 방식 및 스케줄에 대한 신속한 선별 시험은 동계의 동물을 시험관내 세포 검정을 위한 공여체로서 사용하여 수행할 수 있다. 동물을 시험 조성물로 점막 표면에서 처리하고, 때때로 완전한 프로인트 아쥬반트에서 표적 항원의 비경구 투여를 시도한다. 비장 세포를 단리하고, 약 50㎍/mL의 농도로 표적 항원 존재 하에서 시험관내에서 배양한다. 면역원성 에피토프의 위치를 매핑하기 위해 표적 항원을 후보 단백질 또는 하위-단편으로 대체할 수 있다. 매체로의 사이토카인 분비는 표준 면역검정으로 정량화될 수 있다.With this in mind, a rapid screening test for an effective method and schedule of an immunogenic epitope of an inducible antigen, an effective mucosal binding component, an effective combination, or mucosal administration can be made using a winter animal as a donor for in vitro cell assays Can be performed. Animals are treated with the test composition at the mucosal surface and sometimes parenteral administration of the target antigen is attempted in complete Freund's adjuvant. Splenocytes are isolated and cultured in vitro in the presence of the target antigen at a concentration of about 50 μg / mL. The target antigen may be replaced with a candidate protein or sub-fragment to map the location of the immunogenic epitope. The secretion of cytokines to the medium can be quantified by standard immunoassays.
세포가 다른 세포의 활성을 억제하는 능력은 표적 항원으로 면역화된 동물로부터 단리된 세포를 사용하거나 표적 항원에 반응하는 세포주를 생성함으로써 결정될 수 있다(Ben-Nun 등, Eur. J. Immunol. 11 : 195, 1981, 그 전체가 본원에 참고로 포함됨). 이 실험의 한 변형예에서, 증식을 방지하기 위해 억제제 세포 모집단을 약하게 조사하고(약 1000 내지 1250 rads), 억제제를 반응군 세포와 공동 배양한 다음, 삼중체화된 티미딘 도입(또는 MTT)을 사용하여 반응군의 증식성 활성을 정량화한다. 또 다른 변형예에서, 억제제 세포 모집단 및 반응군 세포 모집단을 이중 챔버 트랜스웰 배양 시스템(Costar, Cambridge Mass.)의 상부 및 하부 수준에서 배양하여, 모집단을 서로 1mm 내에서 동시화시키고, 폴리카보네이트 막에 의해 분리시킨다(WO 93/16724). 이 접근법에서, 억제제 세포 모집단의 조사는 반응군의 증식성 활성이 별도로 측정될 수 있기 때문에 불필요하다.The ability of a cell to inhibit the activity of other cells can be determined by using isolated cells from an animal immunized with the target antigen or by generating a cell line that responds to the target antigen (Ben-Nun et al., Eur. J. Immunol. 11: 195, 1981, which is incorporated herein by reference in its entirety). In one variation of this experiment, the inhibitor cell population is lightly irradiated (about 1000-1250 rads) to prevent proliferation, the inhibitor co-cultured with the response group cells, and then the tritiated thymidine incorporation (or MTT) To quantify the proliferative activity of the reaction group. In another variation, inhibitor cell populations and reaction group cell populations are cultured at the upper and lower levels of a dual chamber transwell culture system (Costar, Cambridge Mass.), Population is synchronized within 1 mm of each other, and the polycarbonate membrane (WO 93/16724). In this approach, irradiation of the inhibitor cell population is unnecessary since the proliferative activity of the response group can be measured separately.
표적 항원이 개체 내에 이미 존재하는 본 발명의 구현예에서, 항원을 단리하거나 점막 결합 성분과 미리 조합할 필요가 없다. 예를 들어, 항원은 병리 상태(예를 들어, 염증성 장 질환 또는 소아지방변증)의 결과로서 또는 음식 알러지항원의 소화를 통해 특정 방식으로 개체에서 발현될 수 있다. 시험은 점막 결합 성분을 하나 이상의 용량 또는 제형으로 제공하고 인시츄로 항원에 대한 관용화를 촉진시키는 능력을 측정함으로써 수행된다.In embodiments of the invention where the target antigen is already present in the subject, it is not necessary to isolate the antigen or combine it with the mucosal binding component in advance. For example, the antigen may be expressed in a subject in a particular manner, either as a result of pathological conditions (e.g., inflammatory bowel disease or pediatric adiposity) or through digestion of a food allergy antigen. The test is carried out by providing the mucosal binding component in one or more doses or formulations and measuring the ability to promote tolerance to the in situ antigen.
특정 질환의 치료를 위한 조성물 및 투여 방식의 유효성은 상응하는 동물 질환 모델에서 또한 정교화될 수 있다. 질병의 징후를 감소시키거나 지연시키는 치료의 능력은 질환의 생화학적 및 면역적 특징, 감염된 조직의 면역조직학 및 사용되는 모델에 적합한 총 임상 특징의 순환 수준에서 모니터링된다. 테스트에 사용할 수 있는 동물 모델의 비-제한적인 예가 다음 섹션에 포함되어 있다. 본 발명은 TH1 반응, TH2 반응, TH17 반응 또는 이들 반응의 조합을 조절함으로써 면역원성의 조절을 고려한다. TH1 반응의 조절은 예를 들어, 인터페론-감마의 발현을 변경시키는 것을 포함한다. TH2 반응을 조절하는 것은 예를 들어, IL-4, IL-5, IL-10 및 IL-13의 임의의 조합의 발현을 변경시키는 것을 포함한다. 전형적으로 TH2 반응의 증가(감소)는 IL-4, IL-5, IL-10 또는 IL-13 중 적어도 하나의 발현의 증가(감소)를 포함할 것이며; 더욱 전형적으로 TH2 반응의 증가(감소)는 IL-4, IL-5, IL-10 및 IL-13 중 적어도 2종의 발현의 증가를 포함할 것이고, 가장 전형적으로 TH2 반응의 증가(감소)는 IL-4, IL-5, IL-10 또는 IL-13 중 적어도 3종의 발현의 증가를 포함할 것이고, 반면 이상적으로 TH2 반응의 증가(감소)는 IL-4, IL-5, IL-10 또는 IL-13 모두의 발현의 증가(감소)를 포함할 것이다. TH17의 조절은 예를 들어 TGF-베타, IL-6, IL-21 및 IL23의 발현 변화 및 IL-17, IL-21 및 IL-22의 수준의 영향을 포함한다. 일부 구현예에서, 본 발명은 한 유형의 면역 반응을 다른 유형(예를 들어, 면역-스위칭 또는 면역 편차) 이상으로 촉진함으로써 내성의 조절을 고려한다. 이러한 구현예에서, 한 표현형의 확립된 면역 반응은 억제되거나 감소되고, 상이한 표현형의 면역 반응이 증가되거나 증진된다. 예를 들어, 알러지 면역 반응의 맥락에서 Th2 반응에서 Th1 반응으로 면역-스위칭하면 IgG2a 항체 반응의 생성과 IFNγ 및/또는 IL-12의 생산이 촉진되어 알러지항원-특정 IgE 반응의 감소 및 Th2 세포에 대한 T 세포 분극화의 감소를 유도한다. 본 발명의 조성물 및 방법의 유효성을 평가하기 위한 다른 적합한 방법은 예를 들어, 미국 특허 공보 제2012/0076831호(본 명세서에서 그 전체가 참고로 편입됨)에서 논의된 바와 같이 당 업계에 이해되어있다.The efficacy of compositions and modes of administration for the treatment of certain diseases can also be elaborated in corresponding animal disease models. The ability of the treatment to reduce or delay the manifestation of disease is monitored at the level of circulation of the total clinical characteristics appropriate to the biochemical and immunological characteristics of the disease, the immunohistology of the infected tissue and the model used. Non-limiting examples of animal models that can be used for testing are included in the next section. The present invention contemplates modulation of immunogenicity by modulating TH1, TH2, TH17 or combinations of these reactions. Control of the TH1 response includes, for example, altering the expression of interferon-gamma. Modulating the TH2 response includes, for example, altering the expression of any combination of IL-4, IL-5, IL-10 and IL-13. Typically, an increase (decrease) in the TH2 response will involve an increase (decrease) in the expression of at least one of IL-4, IL-5, IL-10 or IL-13; More typically, the increase (decrease) in the TH2 response will involve an increase in expression of at least two of IL-4, IL-5, IL-10 and IL-13 and most typically the increase IL-5, IL-10, IL-4, IL-5, IL-10 or IL-13, while ideally the increase (decrease) Or increase (decrease) in expression of both IL-13. Modulation of TH17 includes, for example, changes in the expression of TGF-beta, IL-6, IL-21 and IL23 and the effects of IL-17, IL-21 and IL-22 levels. In some embodiments, the invention contemplates modulation of resistance by promoting one type of immune response to another type (e.g., immuno-switching or immune deviation). In such embodiments, the established immune response of one phenotype is suppressed or reduced, and the immune response of the different phenotype is increased or enhanced. For example, in the context of an allergic immune response, immune-switching from a Th1 response to a Th1 response stimulates the production of an IgG2a antibody response and the production of IFNγ and / or IL-12 leading to a reduction of allergen- Leading to a decrease in T-cell polarization. Other suitable methods for evaluating the effectiveness of the compositions and methods of the present invention are described in, for example, U.S. Patent Publication No. 2012/0076831, which is incorporated herein by reference in its entirety, have.
본 발명의 특정 구현예는 치료 중재에 의해 이전에 관용되지 않은 개체에서의 면역 관용의 프라이밍(priming)에 관한 것이다. 이들 구현예는 일반적으로 항원 및 점막 결합 성분의 조합을 복수 투여하는 것을 포함한다. 치료의 초기에 대상체가 관용의 징후를 나타낼 수 있지만, 전형적으로 오래 지속되는 결과를 얻기 위해 프라이밍동안 적어도 3회 투여, 빈번하게 적어도 4회 투여, 때로는 적어도 6회 투여가 수행된다. 대부분의 경우, 각각의 용량은 볼러스(bolus) 투여로 주어지지만, 점막 방출이 가능한 지속된 제형 또한 적합하다. 다중 투여가 수행되는 경우, 투여 시간간격은 일반적으로 1일 내지 3주, 전형적으로 약 3일 내지 2주이다. 일반적으로, 동일한 항원 및 점막 결합 성분이 동일한 농도로 존재하고, 투여는 동일한 점막 표면에 주어지지만, 치료 과정 동안 이들 변수 중 임의의 변화가 수용될 수 있다. 본 발명의 다른 구현예는 이전에 확립된 면역 관용의 지속성을 증가시키거나 연장시키는 것에 관한 것이다. 이들 구현예는 일반적으로 확립된 면역원성이 감소하거나 감소할 위험이 있는 시점에서, 한 번의 투여 또는 단기간의 치료 과정을 포함한다. 부스팅은 일반적으로 1개월에서 1년 사이에 수행되며, 전형적으로 프라이밍 또는 이전의 부스트 후 2개월 내지 6개월 사이에 수행된다. 또한, 본 발명은 주2회, 주1회, 격주 또는 임의의 다른 규칙적 스케쥴에 따라 행해지는 투여 스케쥴에 대한 면역원성의 규칙적인 유지를 포함하는 구현예를 포함한다.Certain embodiments of the invention relate to priming of immune tolerance in an individual not previously tolerated by treatment intervention. These embodiments generally involve multiple administrations of a combination of antigen and mucosal binding components. At the beginning of treatment, the subject may exhibit indications of tolerance, but typically at least 3 doses, often at least 4 doses, sometimes at least 6 doses, are performed during priming to obtain long lasting results. In most cases, each dose is given in bolus doses, but sustained formulations capable of mucosal release are also suitable. When multiple administrations are performed, the administration time interval is generally from 1 day to 3 weeks, typically from about 3 days to 2 weeks. Generally, although the same antigen and mucosal binding components are present at the same concentration and administration is given to the same mucosal surface, any change in these parameters can be accommodated during the course of treatment. Another embodiment of the present invention relates to increasing or extending the persistence of previously established immunity tolerance. These embodiments generally involve a single administration or short term treatment, at a time when the established immunogenicity is at risk of diminishing or decreasing. Boosting is generally performed between one month and one year, and is typically performed between two months and six months after priming or previous boost. The invention also encompasses embodiments that include the regular maintenance of immunogenicity to the dosing schedules being made in accordance with twice weekly, weekly, biweekly or any other regular schedule.
본 발명의 입자는 이를 필요로 하는 대상체에서 염증성 면역 반응을 약화시키거나, 또는 이를 필요로 하는 대상체에서 박테리아 또는 바이러스성 감염을 치료하는데 효과적인 임의의 용량으로 제공될 수 있다. 특정 구현예에서, 약 102 내지 약 1020개의 입자가 개체에게 제공된다. 추가의 구현예에서, 약 103 내지 약 1015개의 입자가 제공된다. 또 다른 구현예에서, 약 106 내지 약 1012개의 입자가 제공된다. 또 다른 구현예에서, 약 108 내지 약 1010개의 입자가 제공된다. 바람직한 구현예에서, 바람직한 용량은 0.1% 고형물/ml이다. 따라서, 0.5 ㎛ 비드에 대해, 바람직한 용량은 0.05 μm 비드에 대해 약 4 × 109개의 비드이고, 바람직한 용량은 3 μm 비드에 대해 약 4 × 1012개의 비드이고, 바람직한 용량은 2 × 107개의 비드이다. 그러나, 치료될 특정 상태의 치료에 효과적인 임의의 용량이 본 발명에 포함된다.The particles of the present invention may be provided in any volume effective to attenuate an inflammatory immune response in a subject in need thereof, or to treat a bacterial or viral infection in a subject in need thereof. In certain embodiments, about 10 2 to about 10 20 particles are provided to an individual. In a further embodiment, about 10 3 to about 10 15 particles are provided. In another embodiment, from about 10 6 to about 10 12 particles are provided. In yet another embodiment, about 10 8 to about 10 10 particles are provided. In a preferred embodiment, the preferred dose is 0.1% solids / ml. Thus, for a 0.5 탆 bead, a preferred volume is about 4 x 10 9 beads for a 0.05 μm bead, and a preferred volume is about 4 × 10 12 beads for a 3 μm bead, with a preferred volume being 2 × 10 7 Beads. However, any dose effective for the treatment of the particular condition being treated is included in the present invention.
본 발명은 자가면역 질환, 이식 거부, 효소 결핍 및 알러지성 반응과 같은 면역 관련된 장애의 치료에 유용하다. 면역 관용을 유도하기 위한 합성 생체적합성 입자 시스템의 치환은 제조의 용이성, 치료제의 광범위한 이용가능성, 샘플 간의 균일성 증가, 잠재적 치료 부위의 수 증가 및 캐리어 세포에 대한 알러지성 반응의 가능성의 극적 감소를 유도할 수 있었다.The present invention is useful for the treatment of immune related disorders such as autoimmune diseases, graft rejection, enzyme deficiency and allergic reactions. Substitution of synthetic biocompatible particle systems to induce immunotolerance has led to a dramatic reduction in the ease of manufacture, widespread availability of therapeutic agents, increased uniformity between samples, increased number of potential therapeutic sites, and potential for allergic reactions to carrier cells .
본원에 사용된 바와 같이, 용어 "면역 반응"은 T 세포 매개된 및/또는 B 세포 매개된 면역 반응을 포함한다. 예시적인 면역 반응은 T 세포 반응, 예를 들어, 사이토카인 생산 및 세포독성을 포함한다. 또한, 용어 면역 반응은 T 세포 활성화, 예를 들어 항체 생성(체액성 반응) 및 사이토카인 반응성 세포화, 예를 들어, 대식세포의 활성화에 의해 간접적으로 영향을 받는 면역 반응을 포함한다. 면역 반응과 관련된 면역 세포는 B 세포 및 T 세포(CD4+, CD8+, Th1 및 Th2 세포)와 같은 림프구; 항원 제시 세포(예를 들어, 전문 항원 제시 세포, 예컨대 수지상 세포, 대식 세포, B 림프구, 랑게르한스 세포, 및 비전문 항원 제시 세포, 예컨대 케라틴생성 세포, 내피 세포, 성상 세포, 섬유아세포, 희소돌기 아교 세포); 천연 살해 세포; 골수 세포, 예컨대 대식세포, 호산구, 비만 세포, 호염기구 및 과립구를 포함한다. 일부 구현예에서, 본 발명의 변형된 입자는 염증 부위로의 염증 세포 이동조절을 감소시키는데 효과적이다.As used herein, the term "immune response" includes T cell mediated and / or B cell mediated immune responses. Exemplary immune responses include T cell responses, such as cytokine production and cytotoxicity. In addition, the term immune response includes immune responses that are indirectly affected by T cell activation, such as antibody production (humoral responses) and cytokine reactive cellularization, e.g., activation of macrophages. Immune cells associated with the immune response include lymphocytes such as B cells and T cells (CD4 + , CD8 + , Th1 and Th2 cells); The antigen presenting cells (e. G., Specialized antigen presenting cells such as dendritic cells, macrophages, B lymphocytes, Langerhans cells and non-progenitor antigen presenting cells such as keratinocytes, endothelial cells, astrocytes, fibroblasts, ); Natural killer cells; Bone marrow cells such as macrophages, eosinophils, mast cells, basophils and granulocytes. In some embodiments, the modified particles of the present invention are effective in reducing inflammatory cell migration regulation to the site of inflammation.
본원에 사용된 바와 같이, 용어 "아네르기", "내성" 또는 "항원-특이적 내성"은 T 세포 수용체-매개된 자극에 대한 T 세포의 무감각을 지칭한다. 이러한 무감각은 일반적으로 항원-특이적이며, 항원성 펩타이드에의 노출이 중단된 후에도 지속된다. 예를 들어, T 세포에서의 아네르기는 사이토킨, 예를 들어, IL-2 생산의 결핍을 특징으로 한다. T-세포 아네르기는 T 세포가 항원에 노출되고, 제2 신호(공동자극 신호)가 부재시에 제1 신호(T 세포 수용체 또는 CD-3 매개된 신호)를 수신할 때 발생한다. 이러한 조건 하에서, (심지어 재-노출이 공동자극 분자의 존재 하에서 발생하더라도) 동일한 항원에 세포를 다시 노출시키면 사이토카인을 생산하지 못하고 결과적으로 증식에 실패하게 된다. 따라서, 사이토카인 생산에 실패하면 증식을 예방할 수 있다. 그러나, 아네르기 T 세포는 사이토카인(예를 들어, IL-2)과 함께 배양되면 증식될 수 있다. 예를 들어, T 세포 아네르기는 또한, ELISA 또는 지표 세포주를 사용한 증식 검정으로 측정한 T 림프구에 의한 IL-2 생성의 결핍으로도 관찰될 수 있다. 대안적으로, 리포터 유전자 작제물이 사용될 수 있다. 예를 들어, 아네르기 T 세포는 5' IL-2 유전자 인핸서의 조절하에 이종성 프로모터에 의해 또는 이 인핸서 내에서 발견될 수 있는 API 서열의 다량체에 의해 유도된 DL-2 유전자 전사를 개시하지 못한다(Kang et al. 1992 Science. 257:1134).As used herein, the term "anergy", "resistance" or "antigen-specific resistance" refers to the T cell insensitivity to T cell receptor-mediated stimulation. This anesthesia is generally antigen-specific and persists after exposure to the antigenic peptide has ceased. For example, anergy in T cells is characterized by a deficiency of cytokines, such as IL-2 production. T-cell anergy occurs when a T cell is exposed to an antigen and a second signal (a co-stimulatory signal) receives a first signal (T cell receptor or CD-3 mediated signal) in the absence. Under these conditions, re-exposure of the cells to the same antigen (even if re-exposure occurs in the presence of co-stimulatory molecules) fails to produce cytokines and consequently fails to proliferate. Thus, if cytokine production fails, proliferation can be prevented. However, anergen T cells can be proliferated when cultured with a cytokine (e.g., IL-2). For example, T cell anergy can also be observed as a deficiency of IL-2 production by T lymphocytes as measured by proliferation assays using ELISA or indicator cell lines. Alternatively, reporter gene constructs may be used. For example, anergen T cells do not initiate DL-2 gene transcription induced by heterologous promoters under the control of the 5 ' IL-2 gene enhancer or by oligomers of the API sequences that can be found in this enhancer (Kang et al., 1992 Science 257: 1134).
본원에서 사용된 바와 같이, 용어 "면역학적 관용"은 하기의 경우, 치료되지 않은 대상체와 비교하여 치료된 대상체의 비율에 대해 수행되는 방법을 지칭한다: a) 특정 면역학적 반응의 감소된 수준(적어도 부분적으로 항원-특이적으로 효과기 T 림프구, B 림프구, 항체 또는 이들의 동등물); 특정 면역학적 반응의 개시 또는 진행 지연; 또는 c) 특정 면역학적 반응의 개시 또는 진행의 위험 감소. "특정" 면역학적 관용은 다른 면역계와 비교하여 특정 항원에 대해 면역학적 관용이 우선적으로 발동될 때 발생한다. "비-특이적" 면역학적 관용은 염증성 면역 반응을 일으키는 항원에 대해 면역학적 관용이 무차별적으로 유발될 때 발생한다. "준-특정" 면역학적 관용은 면역학적 관용이 병원성 면역 반응을 유도하는 항원에 대해 반-차별적으로 발생되지만, 보호성 면역 반응을 유도하는 다른 항원에는 반대로는 발생하지 않는다.As used herein, the term "immunological tolerance " refers to a method performed on a proportion of a treated subject as compared to an untreated subject, such as: a) a reduced level of a particular immunological response At least in part, antigen-specifically, effector T lymphocytes, B lymphocytes, antibodies, or equivalents thereof); Delaying the onset or progression of a particular immunological response; Or c) reducing the risk of initiation or progression of a particular immunological response. "Specific" immunological tolerance occurs when immunological tolerance is preferentially triggered for a particular antigen compared to other immune systems. "Non-specific" immunological tolerance occurs when immunological tolerance is induced indiscriminately against an antigen causing an inflammatory immune response. "Semi-specific" immunological tolerance occurs when immunological tolerance occurs semi-differentially for antigens that induce a pathogenic immune response, but not against other antigens that induce a protective immune response.
자가항원 및 자가면역 질환에 대한 내성은 흉선내 자가-반응성 T 세포의 음성 선택 및 흉선 결실을 피하고 주변에서 발견되는 자가반응성 T 세포에 대한 주변 내성의 기전을 포함하는 다양한 기전에 의해 달성된다. 주변 T 세포 내성을 제공하는 기전의 예로는 자기-항원의 "무지", 자가항원에 대한 아네르기 또는 무 반응성, 사이토카인 면역 편차 및 자기-반응성 T 세포의 활성화 유도된 세포사 등이 있다. 또한, 조절 T 세포는 말초 내성을 매개하는데 관여하는 것으로 나타났다. 예를 들어, Walker et al. (2002) Nat. Rev. Immunol. 2: 11 -19; Shevach et al. (2001) Immunol. Rev. 182:58-67을 참조한다. 일부 상황에서, 자가항원에 대한 주변 내성이 없어지고(또는 파손됨), 자가면역 반응이 일어난다. 예를 들어, EAE 동물 모델에서, TLR 선천성 면역 수용체를 통한 항원 제시 세포(APCs)의 활성화는 자기-내성을 파괴하여 EAE의 유도를 초래하는 것으로 나타났다(Waldner et al. (2004) J. Clin. Invest. 113 :990-997 참조).Resistance to autoantigens and autoimmune diseases is achieved by a variety of mechanisms, including negative selection of thymic autoreactive T cells, and avoidance of thymic deletions and the establishment of peripheral tolerance to autoreactive T cells found around. Examples of mechanisms that provide for peripheral T cell resistance include "ignorance" of self-antigen, anergy or non-reactivity to autoantigens, cytokine immunity deviations, and activation-induced cell death of self-reactive T cells. In addition, regulatory T cells are involved in mediating peripheral resistance. For example, Walker et al. (2002) Nat. Rev. Immunol. 2: 11-19; Shevach et al. (2001) Immunol. Rev. 182: 58-67. In some situations, the peripheral immunity to autoantigens is lost (or destroyed), resulting in autoimmune reactions. For example, in the EAE animal model, activation of antigen presenting cells (APCs) via the TLR congenital immunoreceptor has been shown to destroy self-resistance and lead to induction of EAE (Waldner et al. (2004) J. Clin. Invest. 113: 990-997).
따라서, 일부 구현예에서, 본 발명은 TLR7/8, TLR9 및/또는 TLR 7/8/9 의존적 세포 자극을 억제 또는 감소시키면서 항원 전달을 증가시키는 방법을 제공한다. 본원에 기재된 바와 같이, 특정 변형된 입자의 투여는 면역자극성 폴리뉴클레오타이드와 관련된 TLR 7/8, TLR9 및/또는 TLR7/8/9 의존적 세포 반응을 억제하면서 DC 또는 APC에 의한 항원 전달을 초래한다. 이러한 억제는 하나 이상의 TLR-관련 사이토카인의 감소된 수준을 포함할 수 있다.Thus, in some embodiments, the invention provides methods of increasing antigen delivery while inhibiting or reducing TLR7 / 8, TLR9, and / or
상기 논의된 바와 같이, 본 발명은 Mac-1 및 LFA-1 매개된 장애의 치료에 유용한 생물학적 특성을 갖는 신규한 화합물을 제공한다.As discussed above, the present invention provides novel compounds having biological properties useful in the treatment of Mac-1 and LFA-I mediated disorders.
따라서, 본 발명의 다른 양태에서, 면역 변형 입자를 포함하고 선택적으로 약제학적으로 허용가능한 캐리어를 포함하는 약제학적 조성물이 제공된다. 특정 구현예에서, 이들 조성물은 선택적으로 하나 이상의 추가의 치료제를 추가로 포함한다. 대안적으로, 본 발명의 변형된 입자는 하나 이상의 다른 치료제의 투여와 조합하여 이를 필요로 하는 환자에게 투여될 수 있다. 예를 들어, 본 발명의 화합물과 함께 약제학적 조성물에 합동 투여 또는 포함시키기 위한 추가의 치료제는 승인된 항-염증제일 수 있거나, 조절되지 않는 염증성 면역 반응 또는 박테리아 또는 바이러스성 감염을 특징으로 하는 임의의 장애의 치료에 대한 승인을 최종적으로 얻는, 식품 의약품 안전청(Food and Drug Administration)의 승인을 받고있는 다수의 약제 중 임의의 하나일 수 있다. 또한, 본 발명의 변형된 입자의 특정은 치료를 위해 유리 형태 또는 적절한 경우 약제학적으로 허용가능한 그것의 유도체로서 존재할 수 있음을 이해할 것이다.Thus, in another aspect of the present invention, there is provided a pharmaceutical composition comprising an immunostimulatory particle and optionally a pharmaceutically acceptable carrier. In certain embodiments, these compositions optionally further comprise one or more additional therapeutic agents. Alternatively, the modified particles of the present invention may be administered to a patient in need thereof in combination with administration of one or more other therapeutic agents. For example, additional therapeutic agents for co-administration or inclusion in a pharmaceutical composition with a compound of the present invention may be an approved anti-inflammatory agent, or may be an unregulated inflammatory immune response or an infection characterized by a bacterial or viral infection May be any one of a number of drugs approved by the Food and Drug Administration which ultimately obtain approval for the treatment of the disorder of the present invention. It is also to be understood that the specification of the modified particles of the present invention may exist in free form or, where appropriate, as a pharmaceutically acceptable derivative thereof for treatment.
본 발명의 약제학적 조성물은 약제학적으로 허용가능한 캐리어를 추가로 포함하며, 본원에서 사용되는 바와 같이, 원하는 특정한 투약 형태에 적합하게 임의의 및 모든 용매, 희석제 또는 다른 액체 비히클, 분산제 또는 현탁 보조제, 계면활성제, 등장제, 증점제 또는 유화제, 보존제, 고체 결합제, 윤활제 등을 포함한다. Remington's Pharmaceutical Sciences, Sixteenth Edition, E. W. Martin (Mack Publishing Co., Easton, Pa., 1980)은 약제학적 조성물을 제제화하는데 사용되는 다양한 캐리어 및 그의 제조를 위한 공지된 기술을 개시한다. 임의의 통상적인 캐리어 매질이 임의의 바람직하지 않은 생물학적 효과를 생성시키거나 달리 약제학적 조성물의 임의의 다른 성분(들)과 유해한 방식으로 상호작용함으로써 본 발명의 화합물과 양립할 수 없다면, 그의 용도는 본 발명의 범위내에 있는 것으로 고려된다. 약제학적으로 허용가능한 캐리어로 작용할 수 있는 물질의 일부 예로는 당류, 예컨대 락토스, 글루코스 및 수크로스; 전분, 예컨대 옥수수 전분 및 감자 전분; 셀룰로스 및 그의 유도체, 예를 들어 나트륨 카복시메틸 셀룰로스, 에틸 셀룰로스 및 셀룰로스 아세테이트; 분말화된 트라가칸쓰; 맥아; 젤라틴; 탈크; 부형제, 예컨대 코코아 버터 및 좌제 왁스; 오일, 예컨대 땅콩 오일, 면실유; 잇꽃 오일, 참기름; 올리브유; 옥수수 기름 및 콩기름; 글라이콜; 예컨대 프로필렌 글라이콜; 에스테르, 예컨대 에틸 올레이트 및 에틸 라우레이트; 한천; 완충제, 예컨대 수산화 마그네슘 및 수산화 알루미늄; 알긴산; 발열원없는 물; 등장성 염수; 링거액; 에틸 알콜 및 포스페이트 완충액뿐만 아니라 다른 무독성 양립가능한 윤활제, 예컨대 소듐 라우릴 설페이트 및 마그네슘 스테아르산마그네슘, 뿐만 아니라 착색제, 이형제, 코팅제, 감미료, 향료 및 방향제, 방부제 및 산화 방지제를 포함하지만, 이에 한정되지 않으며, 조제자의 판단에 따라 조성물에 존재할 수 있다.The pharmaceutical composition of the present invention may further comprise a pharmaceutically acceptable carrier and may be any and all solvents, diluents or other liquid vehicles, dispersants or suspending aids, as appropriate for the particular dosage form desired, Surfactants, isotonic agents, thickeners or emulsifiers, preservatives, solid binders, lubricants, and the like. Remington's Pharmaceutical Sciences, Sixteenth Edition, E. W. Martin (Mack Publishing Co., Easton, Pa., 1980) discloses various carriers used in formulating pharmaceutical compositions and known techniques for their preparation. If any conventional carrier media is incompatible with the compounds of the present invention by creating any undesirable biological effects or otherwise interacting in a deleterious manner with any other component (s) of the pharmaceutical composition, Are considered to be within the scope of the present invention. Some examples of materials that can act as pharmaceutically acceptable carriers include sugars such as lactose, glucose and sucrose; Starches such as corn starch and potato starch; Cellulose and its derivatives such as sodium carboxymethylcellulose, ethylcellulose and cellulose acetate; Powdered tragacanth; malt; gelatin; Talc; Excipients such as cocoa butter and suppository wax; Oils such as peanut oil, cottonseed oil; Safflower oil, sesame oil; olive oil; Corn oil and soybean oil; Glycols; Propylene glycol; Esters such as ethyl oleate and ethyl laurate; Agar; Buffers such as magnesium hydroxide and aluminum hydroxide; Alginic acid; Water without heat source; Isotonic saline; Ringer's solution; Ethyl alcohol and phosphate buffers as well as other non-toxic compatible lubricants such as sodium lauryl sulfate and magnesium stearate, as well as colorants, release agents, coatings, sweeteners, flavoring and fragrances, preservatives and antioxidants , And may be present in the composition according to the judgment of the preparer.
경구 투여를 위한 액체 투약 형태는 약제학적으로 허용가능한 에멀젼, 마이크로에멀젼, 용액, 현탁액, 시럽 및 엘릭시르를 포함하지만, 이에 한정되는 것은 아니다. 활성 화합물 이외에, 액체 투약 형태는 당 분야에서 통상적으로 사용되는 불활성 희석제, 예를 들어 물 또는 다른 용매, 가용화제 및 유화제, 예컨대 에틸 알콜, 이소프로필 알콜, 에틸 카보네이트, 에틸 아세테이트, 벤질 알콜, 벤질 벤조에이트, 프로필렌 글라이콜, 1,3-부틸렌 글라이콜, 디메틸포름아미드, 오일(특히 목화씨, 땅콩, 옥수수, 세균, 올리브, 피마자 및 참기름), 글리세롤, 테트라하이드로푸르푸릴 알코올, 폴리에틸렌 글라이콜 및 소르비탄의 지방산 에스테르 및 이들의 혼합물을 함유할 수 있다. 불활성 희석제 외에도, 경구 조성물은 아쥬반트, 예컨대 습윤제, 유화제 및 현탁제, 감미제, 풍미제 및 방향제를 포함할 수 있다.Liquid dosage forms for oral administration include, but are not limited to, pharmaceutically acceptable emulsions, microemulsions, solutions, suspensions, syrups and elixirs. In addition to the active compound, the liquid dosage forms may also contain inert diluents commonly used in the art, such as water or other solvents, solubilizing agents and emulsifiers such as ethyl alcohol, isopropyl alcohol, ethyl carbonate, ethyl acetate, benzyl alcohol, (Especially cotton seed, peanut, corn, germ, olive, castor and sesame oil), glycerol, tetrahydrofurfuryl alcohol, polyethylene glycol Cole and fatty acid esters of sorbitan, and mixtures thereof. In addition to inert diluents, the oral compositions can include adjuvants such as wetting agents, emulsifying and suspending agents, sweetening, flavoring and perfuming agents.
본 발명의 입자는 경구, 비강, 정맥 내, 근육 내, 안구 내, 경피 내, 복강 내 또는 피하로 투여될 수 있다. 일 구현예에서, 본 발명의 입자는 정맥 내 투여된다.The particles of the present invention may be administered orally, nasally, intravenously, intramuscularly, intraocularly, transdermally, intraperitoneally, or subcutaneously. In one embodiment, the particles of the present invention are administered intravenously.
면역 반응의 조절을 위한 본 발명의 유효량 및 투여 방법은 개체, 치료하고자하는 상태 및 당업자에게 명백한 다른 요인에 따라 기초하여 다양할 수 있다. 고려해야 할 인자는 투여 경로와 투여될 용량의 수를 포함한다. 이러한 요인은 당 업계에 공지되어 있으며, 과도한 실험없이 이러한 결정을 내리는 것은 당업자의 기술 범위 내에 있다. 적합한 투여량 범위는 면역의 원하는 조절을 제공하는 범위이다. 전달되는 캐리어의 양으로 주어진 캐리어의 유용한 투여량 범위는 예를 들어 하기 중 약 임의의 범위이다: 약 0.5 내지 10 mg/kg, 1 내지 9 mg/kg, 2 내지 8 mg/kg, 3 내지 7 mg/kg, 4 내지 6 mg/kg, 5 mg/kg, 1 내지 10 mg/kg, 5 내지 10 mg/kg. 대안적으로, 투여량은 입자의 수를 기준으로 투여될 수 있다. 예를 들어, 전달된 캐리어의 양으로 주어진 캐리어의 유용한 투여량은, 예를 들어, 투여량 당 약 106, 107, 108, 109, 1010 또는 그보다 많은 수의 입자일 수 있다. 각 환자에게 주어진 절대량은 생체이용률, 청소율 및 투여 경로와 같은 약리적 특성에 좌우된다. 약제학적으로 허용가능한 캐리어, 희석제 및 부형제의 세부사항 및 약제학적 조성물 및 제형의 제조 방법은 Remmingtons Pharmaceutical Sciences 18th Edition, 1990, Mack Publishing Co., Easton, Pa., USA에 제공되며, 이들은 그 전문이 본 명세서에 참고로 편입되어 있다.The effective amount and method of administration of the invention for the modulation of the immune response may vary based on the subject, the condition being treated, and other factors evident to those skilled in the art. Factors to consider include the route of administration and the number of doses to be administered. These factors are well known in the art and it is within the skill of the art to make such determinations without undue experimentation. Suitable dosage ranges are those that provide the desired modulation of immunity. A useful dosage range of the carrier given by the amount of carrier delivered is, for example, about any of the following ranges: about 0.5 to 10 mg / kg, 1 to 9 mg / kg, 2 to 8 mg / kg, mg / kg, 4 to 6 mg / kg, 5 mg / kg, 1 to 10 mg / kg, 5 to 10 mg / kg. Alternatively, the dosage can be administered based on the number of particles. For example, a useful dose of the carrier given by the amount of carrier delivered may be, for example, about 10 6 , 10 7 , 10 8 , 10 9 , 10 10 or more particles per dose. The absolute amount given to each patient depends on the pharmacological properties such as bioavailability, clearance rate and route of administration. The pharmaceutically acceptable carrier available, details of excipients, diluents, and details and methods of preparing pharmaceutical compositions and formulations. Remmingtons Pharmaceutical Sciences 18 th Edition, 1990, Mack Publishing Co., Easton, Pa, is provided in the USA, which in its entirety Are incorporated herein by reference.
특정 캐리어 제형의 유효량 및 투여 방법은 개별 환자, 원하는 결과 및/또는 장애 유형, 질환의 단계 및 당업자에게 자명한 다른 인자에 따라 달라질 수 있다. 특정 응용에서 유용한 투여 경로(들)은 당업자에게 명백하다. 투여 경로는 국소, 진피, 경피, 경점막, 표피, 비경구, 위장 및 비-인두 및, 폐(경기관지(transbronchial) 및 경폐포(transalveolar)를 포함하지만 이에 한정되지 않음)를 포함하지만, 이에 한정되지 않는다. 적합한 투여량 범위는 혈중 농도에 의해 측정된 약 1-50μM의 조직 농도를 달성하기에 충분한 IRP-함유 조성물을 제공하는 투여량 범위이다. 각 환자에게 주어진 절대량은 생체이용률, 청소율 및 투여 경로와 같은 약리적 특성에 좌우된다.The effective amount and mode of administration of the particular carrier formulation will depend on the particular patient, the desired outcome and / or type of disorder, the stage of the disease, and other factors evident to those skilled in the art. The route (s) of administration useful in certain applications will be apparent to those skilled in the art. Routes of administration include but are not limited to topical, dermal, transdermal, transmucosal, epidermal, parenteral, gastrointestinal and non-pharyngeal, and lungs (including, but not limited to, transbronchial and transalveolar) It is not limited. A suitable dosage range is a dosage range that provides an IRP-containing composition sufficient to achieve a tissue concentration of about 1-50 [mu] M as measured by blood concentration. The absolute amount given to each patient depends on the pharmacological properties such as bioavailability, clearance rate and route of administration.
본 발명은 생리적으로 허용가능한 임플란트, 연고, 크림, 린스 및 겔을 포함하지만, 이에 한정되지 않는 국소 적용에 적합한 캐리어 제제를 제공한다. 진피 투여의 예시적인 경로는 경피 전달, 표피 투여 및 피하 주사와 같은 침습성이 가장 적은 경로이다.The present invention provides a carrier formulation suitable for topical application, including, but not limited to, physiologically acceptable implants, ointments, creams, rinses, and gels. Exemplary routes of dermal administration are the least invasive pathways such as transdermal, epidermal, and subcutaneous injection.
경피 투여는 캐리어가 피부를 관통하여 혈류로 들어가게 할 수 있는 크림, 린스(rinse), 겔 등의 도포에 의해 달성된다. 경피 투여에 적합한 조성물은 피부에 직접 도포되거나 경피 장치(소위 "패치")와 같은 보호성 캐리어에 편입된 약제학적으로 허용가능한 현탁액, 오일, 크림 및 연고를 포함하지만, 이에 한정되는 것은 아니다. 적합한 크림, 연고 등의 예는 Physician's Desk Reference에서 찾을 수 있다. 경피 전달은 또한 이온침투요법(iontophoresis)에 의해 달성될 수 있는데, 예를 들어 며칠 또는 그 이상의 기간 동안 손상되지 않은 피부를 통해 지속적으로 그것의 생성물을 전달하는 상업적으로 입수가능한 패치를 사용한다. 이 방법을 사용함으로써 비교적 큰 농도의 약제학적 조성물의 제어된 전달이 가능하게 되고, 복합 약물의 주입을 가능하게 하고 흡수 촉진제의 동시 사용을 허용한다.Percutaneous administration is achieved by the application of creams, rinses, gels, etc., which allow the carrier to penetrate through the skin into the blood stream. Compositions suitable for transdermal administration include, but are not limited to, pharmaceutically acceptable suspensions, oils, creams and ointments, either directly applied to the skin or incorporated into a protective carrier such as a transdermal device (so-called "patch"). Examples of suitable creams, ointments, and the like can be found in the Physician's Desk Reference. Percutaneous delivery can also be accomplished by iontophoresis, for example using commercially available patches that continuously deliver its product through undamaged skin for days or longer. By using this method, controlled delivery of relatively large concentrations of the pharmaceutical composition is made possible, permitting the infusion of compound drugs and allowing simultaneous use of absorption promoters.
비경구 투여 경로는 전기(이온침투요법) 또는 중심 정맥 라인으로의 직접 주사, 정맥내, 근육내, 복강내, 진피내 또는 피하 주사와 같은 직접적인 주사를 포함하지만, 이에 한정되지는 않는다. 비경구 투여에 적합한 캐리어의 제형은 일반적으로 주사용 USP 물 또는 물에 제형화되고, pH 완충제, 염 증량제, 보존제 및 기타 약제학적으로 허용가능한 부형제를 추가로 포함할 수 있다. 비경구 주사용 면역조절 폴리뉴클레오타이드는 주사를 위한 약제학적으로 허용가능한 멸균된 등장액, 예컨대 식염수 및 인산 완충 식염수에 제형화될 수 있다.Parenteral routes of administration include, but are not limited to, direct injection, such as by electrical (iontophoretics) or direct injection into the central venous line, intravenous, intramuscular, intraperitoneal, intradermal or subcutaneous injection. Formulations of carriers suitable for parenteral administration are generally formulated in USP water or water for injection and may additionally comprise a pH buffering agent, a salt extender, a preservative and other pharmaceutically acceptable excipients. Parenteral injectable immunoregulatory polynucleotides may be formulated into pharmaceutically acceptable sterile isotonic solutions for injection, such as saline and phosphate buffered saline.
위장 투여 경로는 섭취 및 직장 경로를 포함하지만, 이에 한정되는 것은 아니며, 예를 들어 섭취를 위한 약제학적으로 허용가능한 분말, 환제 또는 액체 및 직장 투여를 위한 좌약의 사용을 포함할 수 있다.The route of gastrointestinal administration may include, but is not limited to, ingestion and rectal routes, for example, the use of pharmaceutically acceptable powders, pills or liquids for ingestion, and suppositories for rectal administration.
비-인두 및 폐 투여는 흡입에 의해 달성되며, 비강내, 경기관지(transbronchial) 및 경폐포(transalveolar) 경로와 같은 전달 경로를 포함한다. 본 발명은 에어로졸을 형성하기 위한 액체 현탁액뿐만 아니라 건조 분말 흡입 전달 시스템을 위한 분말 형태를 포함하지만, 이에 한정되지 않는, 흡입에 의한 투여에 적합한 캐리어의 제형을 포함한다. 캐리어 제형의 흡입에 의한 투여에 적합한 장치는 아토마이저, 증발기, 분무기 및 건조 분말 흡입 전달 장치를 포함하지만, 이에 한정되는 것은 아니다.Non-pharyngeal and pulmonary administration is achieved by inhalation and includes delivery routes such as intranasal, transbronchial, and transalveolar routes. The present invention includes formulations of carriers suitable for administration by inhalation, including, but not limited to, powder forms for dry powder inhalation delivery systems as well as liquid suspensions for forming aerosols. Suitable devices for administration by inhalation of carrier formulations include, but are not limited to, an atomizer, an evaporator, a sprayer, and a dry powder inhalation delivery device.
주사가능한 제제, 예를 들어 멸균된 주사가능한 수성 또는 유성 현탁액은 적합한 분산제 또는 습윤제 및 현탁화제를 사용하여 공지된 기술에 따라 제형화될 수 있다. 멸균 주사가능한 제제는 또한 비독성 비경구적으로 허용가능한 희석제 또는 용매 중 멸균된 주사가능 용액, 현탁액 또는 에멀젼, 예를 들어 1,3-부탄디올 중의 용액일 수 있다. 사용될 수 있는 허용가능한 비히클 및 용매는 물, 링거액, U.S.P. 및 등장성 염화나트륨 용액이다. 또한, 멸균된 고정유가 용매 또는 분산매로서 통상적으로 사용된다. 이 목적을 위해 합성 모노- 또는 디-글리세라이드를 포함하여 임의의 무자극 고정유가 사용될 수 있다. 또한, 올레산과 같은 지방산이 주사제의 제조에 사용된다.Injectable preparations, such as sterile injectable aqueous or oleaginous suspensions may be formulated according to the known art using suitable dispersing or wetting agents and suspending agents. Sterile injectable preparations may also be solutions in sterile injectable solutions, suspensions or emulsions, for example, 1,3-butanediol in a non-toxic parenterally acceptable diluent or solvent. Acceptable vehicles and solvents that may be used include water, Ringer's solution, U.S.P. And isotonic sodium chloride solution. In addition, sterilized fixed oils are conventionally employed as a solvent or dispersion medium. For this purpose, any unstiffened stationary oil may be used including synthetic mono- or di-glycerides. In addition, fatty acids such as oleic acid are used in the preparation of injectables.
주사가능한 제형은 예를 들어, 박테리아-고정 필터를 통한 여과에 의해, 또는 멸균수 또는 사용전에 다른 멸균 주사가능한 매체에 용해 또는 분산될 수 있는 멸균된 고체 조성물의 형태로 살균제를 혼입시킴으로써 멸균될 수 있다.The injectable formulations can be sterilized, for example, by filtration through a bacterial-fixed filter, or by incorporating the sterilizing agent in the form of a sterile solid composition that can be dissolved or dispersed in sterile water or other sterile injectable medium prior to use have.
약물의 효과를 연장시키기 위해, 종종 피하 또는 근육내 주사로부터 약물의 흡수를 늦추는 것이 바람직하다. 이는 물에 대한 용해도가 낮은 액체 현탁액 또는 결정성 또는 비정질 물질의 사용에 의해 달성될 수 있다. 약물의 흡수율은 용해 속도에 의존하며, 이어서 이는 결정 크기 및 결정 형태에 의존할 수 있다. 대안적으로, 비경구 투여된 약물 형태의 지연된 흡수는 약물을 오일 비히클에 용해 또는 현탁시킴으로써 달성된다. 주사가능 데포(depot) 형태는 폴리락타이드-폴리글라이콜라이드와 같은 생분해성 폴리머에서 약물의 마이크로캡슐 매트릭스를 형성함으로써 제조된다. 약물 대 폴리머의 비율 및 사용된 특정 폴리머의 성질에 따라, 약물 방출 속도가 제어될 수 있다. 다른 생분해성 폴리머의 예는 폴리(오르토에스테르) 및 폴리(무수물)을 포함한다. 데포 주사가능한 제형은 또한 신체 조직과 양립할 수 있는 리포좀 또는 마이크로에멀젼에 약물을 포획함으로써 제조된다.To prolong the effect of the drug, it is often desirable to slow the absorption of the drug from subcutaneous or intramuscular injection. This can be achieved by the use of liquid suspensions or crystalline or amorphous materials with low solubility in water. The rate of absorption of the drug depends on the dissolution rate, which in turn can depend on the crystal size and on the crystal form. Alternatively, delayed uptake of the parenterally administered drug form is achieved by dissolving or suspending the drug in an oil vehicle. Injectable depot forms are prepared by forming microcapsule matrices of the drug in biodegradable polymers such as polylactide-polyglycolide. Depending on the ratio of drug to polymer and the nature of the particular polymer used, the rate of drug release can be controlled. Examples of other biodegradable polymers include poly (orthoesters) and poly (anhydrides). Depot injectable formulations are also prepared by entrapping the drug in liposomes or microemulsions that are compatible with body tissues.
일부 구현예에서, 본 발명의 합성 생분해성 입자는 제조의 용이성, 치료제의 광범위한 이용가능성 및 증가된 치료 부위를 제공한다. 특정 구현예에서, 계면활성제 폴리(에틸렌-α-말레산 무수물)을 사용하여 합성된, 표면 카복실레이트 기의 고밀도를 갖는 표면-작용화된 생분해성 폴리(락타이드-코-글라이콜라이드) 입자는 다른 캐리어 입자 및/또는 표면에 비해 많은 이점을 제공하는 캐리어를 제공한다. 본 발명의 구현예를 개발하는 동안 수행된 실험은 펩타이드(예를 들어, PLP139-151 펩타이드)와 이들 입자의 콘주게이션을 실증했다. 이러한 펩타이드-커플링된 입자는 질환 진전의 예방 및 면역학적 관용의 유도(예를 들어, 다발성 경화증의 SJL/J PLP139-151/CFA-유도된 R-EAE 뮤린 모델에서)에 효과적이라는 것을 보여 주었다. 본 발명의 펩타이드에 커플링된 캐리어는 다른 내성 유도 구조에 비해 많은 이점을 제공한다. 일부 구현예에서, 입자는 생분해성이며, 따라서, 장시간 동안 신체에 잔류하지 않을 것이다. 완전한 분해 시간이 제어될 수 있다. 일부 구현예에서, 입자는 세포 활성화(예를 들어, 포스파티딜세린이 PLG 마이크로스피어에 장입됨)없이 내재화를 촉진하기 위해 작용화된다. 일부 구현예에서, 입자는 특정 세포 모집단에 대한 표적 리간드를 포함한다. 일부 구현예에서, IL-10 및 TGF-β와 같은 항-염증성 사이토카인은 입자를 내재화시키는 세포 유형의 활성화를 제한하고 에너지 및/또는 결실을 통한 내성의 유도 및 조절 T 세포의 활성화를 촉진시키기 위해 입자 상에 또는 입자 내에 포함된다. 입자의 조성은 입자가 체내에서 지속되는 시간의 길이에 영향을 미치는 것으로 밝혀졌으며, 내성은 신속한 입자 흡수 및 청소능/분해를 필요로 한다. 50:50을 초과하는 비율의 락타이드:글라이콜라이드가 분해 속도를 늦추므로, 본 발명의 입자는 약 50:50 이하의 락타이드:글라이콜라이드 비를 갖는다. 일 구현예에서, 본 발명의 입자는 약 50:50 D,L-락타이드:글라이콜라이드 비를 갖는다.In some embodiments, the synthetic biodegradable particles of the present invention provide ease of manufacture, broad availability of therapeutic agents, and increased site of treatment. In certain embodiments, surface-functionalized biodegradable poly (lactide-co-glycolide) particles with high density of surface carboxylate groups, synthesized using a surfactant poly (ethylene- alpha -maleic anhydride) Provides a carrier that provides many advantages over other carrier particles and / or surfaces. Experiments performed during the development of an embodiment of the present invention demonstrated conjugation of these particles with peptides (e. G. , PLP 139-151 peptides). These peptide-coupled particles have been shown to be effective in the prevention of disease progression and induction of immunological tolerance (e.g., in the SJL / J PLP 139-151 / CFA-induced R-EAE murine model of multiple sclerosis) gave. Carriers coupled to the peptides of the invention provide many advantages over other resistance inducing structures. In some embodiments, the particles are biodegradable and therefore will not remain in the body for an extended period of time. The complete decomposition time can be controlled. In some embodiments, the particles are functionalized to facilitate internalization without cellular activation (e.g., phosphatidylserine charged to PLG microspheres). In some embodiments, the particle comprises a target ligand for a particular cell population. In some embodiments, anti-inflammatory cytokines such as IL-10 and TGF- [beta] inhibit the activation of cell types that internalize particles and induce tolerance through energy and / or deletion and promote activation of regulatory T cells Is contained on or in the particle. The composition of the particles has been shown to affect the length of time the particles last in the body, and resistance requires rapid particle absorption and cleavage / degradation. Since the lactide: glycolide slows down the rate of degradation in excess of 50:50, the particles of the present invention have a lactide: glycolide ratio of about 50:50 or less. In one embodiment, the particles of the present invention have a ratio of about 50:50 D, L-lactide: glycolide.
경구 투여용 고체 투약 형태는 캡슐, 정제, 환제, 분말 및 과립을 포함한다. 이러한 고체 투약 형태에서, 변형된 입자는 적어도 하나의 불활성, 약제학적으로 허용가능한 부형제 또는 캐리어, 예컨대 시트르산 나트륨 또는 인산이칼슘 및/또는 a) 충전제 또는 증량제, 예컨대 전분, 락토스, 수크로스, 글루코스, 만니톨 및 규산, b) 결합제, 예컨대 카복시메틸셀룰로스, 알기네이트, 젤라틴, 폴리비닐피롤리디논, 수크로스 및 아카시아, c) 습윤제, 예컨대 글리세롤, d) 붕해제, 예컨대 한천, 탄산 칼슘, 감자 또는 타피오카 전분, 알긴산, 특정 규산염 및 탄산나트륨, e) 용액 지연제, 예컨대 파라핀, f) 흡수 촉진제, 예컨대 4차 암모늄 화합물, g) 습윤제, 예컨대 예를 들어, 세틸 알코올 및 글리세롤 모노스테아레이트, h) 흡수제, 예컨대, 카올린 및 벤토나이트 점토, 및 ⅰ) 윤활제, 예컨대 탈크, 칼슘 스테아레이트, 마그네슘 스테아레이트, 고체 폴리에틸렌 글라이콜, 소듐 라우릴 설페이트 및 이들의 혼합물이다. 캡슐, 정제 및 환제의 경우, 투약 형태는 또한 완충제를 포함할 수 있다.Solid dosage forms for oral administration include capsules, tablets, pills, powders, and granules. In such solid dosage forms, the modified particles may contain at least one inert, pharmaceutically acceptable excipient or carrier, such as sodium citrate or dicalcium phosphate, and / or a) fillers or extenders such as starch, lactose, sucrose, glucose, Mannitol and silicic acid, b) binders such as carboxymethylcellulose, alginate, gelatin, polyvinylpyrrolidinone, sucrose and acacia, c) wetting agents such as glycerol, d) disintegrants such as agar, calcium carbonate, potato or tapioca G) wetting agents such as, for example, cetyl alcohol and glycerol monostearate, h) sorbents, such as sorbitan monolaurate, sorbitan monolaurate, sorbitan monolaurate, sorbitan monolaurate, Kaolin and bentonite clay, and i) lubricants such as talc, calcium stearate, magnesium stearate, Body polyethylene glycol, a sodium lauryl sulfate, and mixtures thereof. In the case of capsules, tablets and pills, the dosage form may also comprise buffering agents.
유사한 유형의 고체 조성물은 또한 락토스 또는 유당뿐만 아니라 고분자량 폴리에틸렌 글라이콜 등과 같은 부형제를 사용하여 연질 및 경질-충전된 젤라틴 캡슐 내의 충전제로서 사용될 수 있다. 정제, 당의정, 캡슐, 환제 및 과립의 고형 투약 형태는 약제학적 제형 기술에 널리 공지된 장용 코팅물 및 기타 코팅물과 같은 코팅물 및 쉘로 제조될 수 있다. 이들은 선택적으로 불투명화제를 함유할 수 있으며, 선택적으로, 지연된 방식으로 활성 성분(들)만을 또는 우선적으로 장의 특정 부분에서 방출하는 조성물일 수 있다. 사용될 수 있는 포매 조성물의 예는 폴리머 물질 및 왁스를 포함한다. 유사한 유형의 고체 조성물은 또한 락토스 또는 유당뿐만 아니라 고분자량 폴리에틸렌 글라이콜 등과 같은 부형제를 사용하여 연질 및 경질-충전된 젤라틴 캡슐에 충전제로서 사용될 수 있다.Solid compositions of a similar type may also be used as fillers in soft and hard-filled gelatin capsules using excipients such as lactose or lactose as well as high molecular weight polyethylene glycols and the like. Solid dosage forms of tablets, dragees, capsules, pills, and granules may be prepared with coatings and shells such as enteric coatings and other coatings well known in the pharmaceutical formulation arts. They may optionally contain opacifying agents and may optionally be a composition which releases only the active ingredient (s) in a delayed manner or preferentially in certain parts of the intestine. Examples of embedding compositions that may be used include polymeric materials and waxes. Solid compositions of a similar type may also be used as fillers in soft and hard-filled gelatin capsules using excipients such as lactose or lactose as well as high molecular weight polyethylene glycols and the like.
변형된 입자는 또한 전술한 바와 같은 하나 이상의 부형제와 함께 마이크로-캡슐화된 형태일 수 있다. 정제, 당의정, 캡슐, 환제 및 과립의 고형 투약 형태는 장용성 코팅물, 방출 제어 코팅 및 약제학적 제형 기술 분야에 잘 공지된 다른 코팅과 같은 코팅 및 외피로 제조될 수 있다. 이러한 고체 투여 형태에서, 활성 화합물은 수크로스, 락토스 및 전분과 같은 적어도 하나의 불활성 희석제와 혼합될 수 있다. 이러한 투약 형태는 또한 통상적인 실시에서와 같이 불활성 희석제 이외의 추가의 물질, 예를 들어 정제화 윤활제 및 기타 정제화 보조제, 예컨대 마그네슘 스테아레이트 및 미세결정성 셀룰로스를 포함할 수 있다. 캡슐, 정제 및 환제의 경우, 투약 형태는 또한 완충제를 포함할 수 있다. 이들은 선택적으로 불투명화제를 함유할 수 있고, 임의로 지연된 방식으로 변형된 입자만을 또는 바람직하게는 장의 특정 부분에서 방출하는 조성물일 수 있다. 사용될 수 있는 포매 조성물의 예는 폴리머 물질 및 왁스를 포함한다.The modified particles may also be in micro-encapsulated form with one or more excipients as described above. Solid dosage forms of tablets, dragees, capsules, pills, and granules may be prepared with coatings and shells such as enteric coatings, release-controlled coatings and other coatings well known in the pharmaceutical formulating arts. In such solid dosage forms, the active compound may be mixed with at least one inert diluent such as sucrose, lactose and starch. Such dosage forms may also include additional substances other than inert diluents, such as tabletting lubricants and other tableting aids such as magnesium stearate and microcrystalline cellulose, as in conventional practice. In the case of capsules, tablets and pills, the dosage form may also comprise buffering agents. They may optionally contain opacifying agents, and may be a composition that releases only the modified particles, optionally in a delayed manner, or preferably in certain areas of the intestine. Examples of embedding compositions that may be used include polymeric materials and waxes.
본 발명은 본 발명의 변형된 입자의 약제학적으로 허용가능한 국소 제형을 포함한다. 본원에 사용된 바와 같이, 용어 "약제학적으로 허용가능한 국소 제형"은 제형을 표피에 도포하여 본 발명의 변형된 극미립자의 진피내 투여에 약제학적으로 허용가능한 임의의 제형을 의미한다. 본 발명의 특정 구현예에서, 국소 제형은 캐리어 시스템을 포함한다. 약제학적으로 효과적인 캐리어는 용매(예를 들어, 알콜, 폴리알콜, 물), 크림, 로션, 연고, 오일, 플라스터, 리포좀, 분말, 에멀젼, 마이크로에멀젼 및 완충 용액(예를 들어, 저삼투압 또는 완충 식염수) 또는 약제를 국소 투여하기 위해 당 업계에 공지된 임의의 다른 캐리어를 포함하지만, 이에 한정되지 않는다. 당 분야에 공지된 캐리어의 보다 완전한 목록은 당해 분야에서 표준인 참고 텍스트, 예를 들어 Remington's Pharmaceutical Sciences, 16th Edition, 1980 and 17th Edition, 1985, both published by Mack Publishing Company, Easton, Pa.에 제공되며, 이의 전문은 이후에 본 명세서에 참고로 편입된다. 특정 다른 구현예에서, 본 발명의 국소 제형은 부형제를 포함할 수 있다. 당 업계에 공지된 임의의 약제학적으로 허용가능한 부형제를 사용하여 본 발명의 약제학적으로 허용가능한 국소 제형을 제조할 수 있다. 본 발명의 국소 제형에 포함될 수 있는 부형제의 예는 보존제, 산화방지제, 보습제, 완화제, 완충제, 가용화제, 다른 침투제, 피부 보호제, 계면활성제 및 추진제 및/또는 변형된 입자에 조합하여 사용되는 추가의 치료제를 포함하지만, 이에 한정되지는 않는다. 적합한 보존제는 알콜, 4차 아민, 유기산, 파라벤 및 페놀을 포함하지만, 이에 한정되지는 않는다. 적합한 산화방지제는 아스코르브 산 및 그의 에스테르, 아황산수소나트륨, 부틸화된 하이드록시 톨루엔, 부틸화된 하이드록시아니솔, 토코페롤 및 EDTA 및 시트르산과 같은 킬레이트제를 포함하지만, 이에 한정되지는 않는다. 적합한 보습제는 글리세린, 소르비톨, 폴리에틸렌 글라이콜, 우레아 및 프로필렌 글라이콜을 포함하지만, 이에 한정되지는 않는다. 본 발명에서 사용하기에 적합한 완충제는 시트르산, 염산 및 락트산 완충액을 포함하지만, 이에 한정되지 않는다. 적합한 가용화제는 4차 암모늄 염화물, 사이클로덱스트린, 벤질 벤조에이트, 레시틴 및 폴리소르베이트를 포함 하지만, 이에 한정되지 않는다. 본 발명의 국소 제형에 사용될 수 있는 적합한 피부 보호제는 비타민 E 오일, 알라토인(allatoin), 디메티콘, 글리세린, 바셀린 및 산화 아연을 포함하지만, 이에 한정되지 않는다.The present invention includes pharmaceutically acceptable topical formulations of the modified particles of the present invention. As used herein, the term "pharmaceutically acceptable topical formulation" means any formulation that is pharmaceutically acceptable for intradermal administration of the modified microparticles of the present invention by applying the formulation to the epidermis. In certain embodiments of the invention, topical formulations comprise a carrier system. Pharmaceutically effective carriers include, but are not limited to, solvents (e.g., alcohols, polyalcohols, water), creams, lotions, ointments, oils, plasters, liposomes, powders, emulsions, microemulsions, Saline solution) or any other carrier known in the art for topical administration of the medicament. A more complete list of carriers known in the art is provided in reference texts standard in the art, such as Remington's Pharmaceutical Sciences, 16th Edition, 1980 and 17th Edition, 1985, both published by Mack Publishing Company, Easton, Pa. , The disclosure of which is incorporated herein by reference in its entirety. In certain other embodiments, topical formulations of the present invention may include excipients. Any pharmaceutically acceptable excipient known in the art may be used to prepare the pharmaceutically acceptable topical formulations of the present invention. Examples of excipients which may be included in topical formulations of the invention include, but are not limited to, preservatives, antioxidants, moisturizers, emollients, buffers, solubilizers, other penetrants, skin protectants, surfactants and propellants and / But are not limited to, therapeutic agents. Suitable preservatives include, but are not limited to, alcohols, quaternary amines, organic acids, parabens and phenols. Suitable antioxidants include, but are not limited to, ascorbic acid and its esters, sodium hydrogen sulfite, butylated hydroxytoluene, butylated hydroxyanisole, tocopherol and chelating agents such as EDTA and citric acid. Suitable moisturizing agents include, but are not limited to, glycerin, sorbitol, polyethylene glycol, urea and propylene glycol. Suitable buffers for use in the present invention include, but are not limited to, citric acid, hydrochloric acid and lactic acid buffers. Suitable solubilizing agents include, but are not limited to, quaternary ammonium chloride, cyclodextrin, benzyl benzoate, lecithin and polysorbate. Suitable skin protectants that may be used in the topical formulations of the present invention include, but are not limited to, vitamin E oil, allatoin, dimethicone, glycerin, vaseline and zinc oxide.
특정 구현예에서, 본 발명의 약제학적으로 허용가능한 국소 제형은 적어도 본 발명의 변형된 입자 및 침투 향상제를 포함한다. 국소 제형의 선택은 치료될 병태, 본 발명의 화합물 및 다른 부형제의 물리화학적 특성, 제형내 안정성, 이용가능한 제조설비 및 비용 제약을 포함하는 몇개의 인자에 좌우될 것이다. 본원에서 사용된 바와 같이, "침투 향성제"라는 용어는 바람직하게는 전신 흡수가 거의 없거나 전혀없는, 각질층 및 표피 또는 진피로 약리학적으로 활성인 화합물을 수송할 수 있는 제제를 의미한다. 다양한 화합물이 피부를 통한 약물의 침투 속도를 향상시키는데 있어 효과가 있는지 평가되었다. 예를 들어 다양한 피부 침투 향상제의 사용 및 시험을 조사한, 경피 피부 향상제, Maibach H. I. and Smith H. E. (eds.), CRC Press, Inc., Boca Raton, Fla. (1995) 및 Buyuktimkin et al., Buyuktimkin et al., 경피 및 국소 약물 전달 시스템의 경피 약물 침투 개선의 화학적 수단, Gosh T. K., Pfister W. R., Yum S. I. (Eds.), Interpharm Press Inc., Buffalo Grove, 111. (1997)를 참조한다. 특정 예시적인 구현예에서, 본 발명에서 사용하기 위한 침투제는 트리글리세라이드(예를 들어, 대두유), 알로에 조성물(예를 들어, 알로에-베라 겔), 에틸 알콜, 이소프로필 알콜, 옥톨리(octoly)페닐폴리에틸렌 글라이콜, 올레산, 폴리에틸렌 글라이콜 400, 프로필렌 글라이콜, N-데실메틸설폭사이드, 지방산 에스테르(예를 들어, 이소프로필 미리스테이트, 메틸 라우레이트, 글리세롤 모노올레에이트 및 프로필렌 글라이콜 모노올레에이트) 및 N-메틸피롤리돈을 포함하지만, 이에 한정되지 않는다.In certain embodiments, the pharmaceutically acceptable topical formulations of the present invention comprise at least the modified particles of the present invention and penetration enhancers. The choice of topical formulation will depend on several factors including the condition to be treated, the physicochemical properties of the compounds of the present invention and other excipients, stability within the formulation, available manufacturing facilities and cost constraints. As used herein, the term " penetration enhancer "preferably means an agent capable of transporting a pharmacologically active compound to the epidermis or dermis, with little or no systemic absorption. Various compounds were evaluated for their efficacy in enhancing the rate of drug penetration through the skin. For example, transdermal skin enhancers, investigated for use and testing of various skin penetration enhancers, Maibach H. I. and Smith H. E. (eds.), CRC Press, Inc., Boca Raton, Fla. (1995) and Buyuktimkin et al., Buyuktimkin et al., Chemical means of improving transdermal drug penetration of transdermal and topical drug delivery systems, Gosh TK, Pfister WR, Yum SI (Eds.), Interpharm Press Inc., Buffalo Grove, 111 (1997). In certain exemplary embodiments, the penetrants for use in the present invention are selected from the group consisting of triglycerides (e.g., soybean oil), aloe compositions (e.g., Aloe-Vera gel), ethyl alcohol, isopropyl alcohol, octoly, Propylene glycol, N-decyl methyl sulfoxide, fatty acid esters (for example, isopropyl myristate, methyl laurate, glycerol monooleate, and propylene glycol ≪ / RTI > colomooleate) and N-methylpyrrolidone.
특정 구현예에서, 조성물은 연고, 페이스트, 크림, 로션, 겔, 분말, 용액, 스프레이, 흡입제 또는 패치의 형태일 수 있다. 특정 예시적인 구현예에서, 본 발명에 따른 조성물의 제형은 크림이며, 특히 바람직한 포화 또는 불포화 지방산, 예를 들어 스테아르산, 팔미트산, 올레산, 팔미토-올레산, 세틸 또는 올레일 알코올, 스테아르산을 추가로 함유할 수 있다. 본 발명의 크림은 또한 비-이온성 계면활성제, 예를 들어 폴리옥시-40-스테아레이트를 함유할 수 있다. 특정 구현예에서, 활성 성분은 약제학적으로 허용가능한 캐리어 및, 요구될 수 있는 임의의 필요한 보존제 또는 완충제와 함께 멸균 조건 하에서 혼합된다. 안과 제형, 귀약 및 안약 또한 본 발명의 범위 내에 속하는 것으로 고려된다. 또한, 본 발명은 경피 패치의 사용을 고려하며, 경피 패치는 신체에 대한 화합물의 제어된 전달을 제공한다는 추가적인 이점을 갖는다. 이러한 투여 형태는 화합물을 적절한 매질에 용해 또는 분배하여 제조된다. 상기 논의된 바와 같이, 침투 향상제는 또한 피부를 가로지르는 화합물의 플럭스를 증가시키는데 사용될 수 있다. 속도는 속도 조절 막을 제공하거나 폴리머 매트릭스 또는 겔에 화합물을 분산시킴으로써 제어될 수 있다.In certain embodiments, the composition may be in the form of ointments, pastes, creams, lotions, gels, powders, solutions, sprays, inhalants or patches. In certain exemplary embodiments, the formulation of the composition according to the present invention is a cream, and particularly preferred are saturated or unsaturated fatty acids, such as stearic acid, palmitic acid, oleic acid, palmito-oleic acid, cetyl or oleyl alcohol, May be further contained. The cream of the present invention may also contain a non-ionic surfactant, such as polyoxy-40-stearate. In certain embodiments, the active ingredient is mixed under sterile conditions with a pharmaceutically acceptable carrier and any necessary preservatives or buffers that may be required. Ophthalmic formulations, drops and eye drops are also contemplated as falling within the scope of the present invention. The present invention also contemplates the use of transdermal patches and the transdermal patch has the additional advantage of providing controlled delivery of the compound to the body. Such dosage forms are prepared by dissolving or dispensing the compound in a suitable medium. As discussed above, penetration enhancers can also be used to increase the flux of a compound across the skin. The rate can be controlled by providing a rate controlling membrane or by dispersing the compound in a polymer matrix or gel.
변형된 입자는 에어로졸에 의해 투여될 수 있다. 이는 수성 에어로졸, 리포좀 제제 또는 변형된 입자를 함유하는 고체 입자를 제조함으로써 달성된다. 비 수성(예를 들어, 플루오로카본 추진체) 현탁액이 사용될 수 있다.The modified particles may be administered by an aerosol. This is achieved by preparing solid particles containing an aqueous aerosol, a liposome preparation or modified particles. Non-aqueous (e. G., Fluorocarbon propellants) suspensions may be used.
통상적으로, 수성 에어로졸은 종래의 약제학적으로 허용가능한 캐리어 및 안정화제와 함께 약제의 수용액 또는 현탁액을 제형화하여 제조된다. 캐리어 및 안정화제는 특정 화합물의 요건에 따라 다르지만, 일반적으로 비이온성 계면활성제(Tweens, Pluronics® 또는 폴리에틸렌 글라이콜), 혈청 알부민, 소르비탄 에스테르, 올레산, 레시틴과 같은 무해한 단백질, 글리신과 같은 아미노산, 완충액 , 염류, 당류 또는 당 알코올을 포함한다. 에어로졸은 일반적으로 등장성 용액으로부터 제조된다.Typically, aqueous aerosols are prepared by formulating aqueous solutions or suspensions of the agents together with conventional pharmaceutically acceptable carriers and stabilizers. Carriers and stabilizers will vary depending on the requirements of the particular compound but will generally include non-ionic surfactants (Tweens, Pluronics® or polyethylene glycol), harmless proteins such as serum albumin, sorbitan esters, oleic acid, lecithin, amino acids such as glycine , Buffers, salts, saccharides or sugar alcohols. Aerosols are generally prepared from isotonic solutions.
또한, 본 발명의 변형된 입자 및 약제학적 조성물이 조합 요법으로 제형화 및 사용될 수 있으며, 즉, 화합물 및 약제학적 조성물은 하나 이상의 다른 원하는 치료제 또는 의학적 처치와 동시에, 이전에, 또는 이후에, 제형화 또는 투여될 수 있다. 조합 요법에 사용하기 위한 치료법(치료제 또는 절차)의 특별한 조합은 원하는 치료제 및/또는 절차의 혼용성 및 달성될 원하는 치료 효과를 고려할 것이다. 사용된 치료법이 동일한 질환(예를 들어, 본 발명의 화합물이 다른 항-염증제와 동시에 투여될 수 있음)에 대해 원하는 효과를 달성할 수 있거나, 또는 상이한 효과(예를 들어, 임의의 역효과 제어)를 달성할 수 있다는 것이 인정될 것이다.In addition, the modified particles and pharmaceutical compositions of the present invention may be formulated and used in combination therapy, i.e., the compound and pharmaceutical composition may be administered prior to, or subsequent to, one or more other desired therapeutic or medical treatments, Or administered. The particular combination of therapies (therapeutic agents or procedures) for use in combination therapies will allow for the interchangeability of the desired therapeutic agents and / or procedures and the desired therapeutic effect to be achieved. It is contemplated that the treatment employed may achieve the desired effect for the same disorder (e.g., the compound of the invention may be administered concurrently with other anti-inflammatory agents), or it may achieve a different effect (e. It will be appreciated.
특정 구현예에서, 본 발명의 변형된 입자를 함유하는 약제학적 조성물은 하나 이상의 추가의 치료적 활성 성분(예를 들어, 항염증제 및/또는 완화제)을 추가로 포함한다. 본 발명의 목적을 위해, "완화성(palliative)"이란 용어는 질병의 증상 완화 및/또는 치료 요법의 부작용에 집중된 치료법이지만 치유적이 아닌 치료를 지칭한다. 예를 들어, 완화 치료에는 진통제, 항 메스꺼움 약물 및 항-정신병 약물이 포함된다.In certain embodiments, the pharmaceutical composition containing modified particles of the invention further comprises one or more additional therapeutically active ingredients (e.g., anti-inflammatory and / or emollient). For the purposes of the present invention, the term "palliative " refers to a treatment that is focused on the relief of the symptoms of the disease and / or the side effects of therapeutic regimens, but which is not curable. For example, palliative care includes analgesics, anti-nausea drugs and anti-psychotic drugs.
본 발명은 개체, 바람직하게는 포유동물, 보다 바람직하게는 인간에서 면역 반응을 조절하는 방법으로서, 본원에 기재된 변형된 입자를 개체에 투여하는 단계를 포함하는 방법을 제공한다. 본 발명에 의해 제공되는 면역조절 방법은 면역자극성 폴리펩타이드 또는 바이러스성 또는 박테리아 성분에 의해 자극되는 면역 반응을 포함하지만, 이에 한정되지 않는 선천적 면역 반응 또는 적응 면역 반응을 억제 및/또는 저해하는 단계를 포함한다.The invention provides a method comprising administering to a subject a modified particle described herein as a method for modulating an immune response in a subject, preferably a mammal, more preferably a human. The immunomodulatory methods provided by the present invention include the steps of inhibiting and / or inhibiting the innate or adaptive immune response, including, but not limited to, immunostimulatory polypeptides or immune responses that are stimulated by viral or bacterial components .
변형된 입자는 면역 반응을 조절하기에 충분한 양으로 투여된다. 본원에 기재된 바와 같이, 면역 반응의 조절은 체액성 및/또는 세포성일 수 있으며, 본원에 기재된 바와 같은 당해 기술 분야의 표준 기술을 이용하여 측정된다.The modified particles are administered in an amount sufficient to modulate the immune response. As described herein, modulation of the immune response may be humoral and / or cellular and is measured using standard techniques in the art as described herein.
일부 구현예에서, 본원에 기재된 조성물은 임플란트(예를 들어, 장치) 및/또는 이식(예를 들어, 조직, 세포, 장기)과 함께 (예를 들어, 병용하여, 병용하기 전에, 또는 병용 후) 투여되며, 이와 관련된 면역 반응을 매개, 무효화, 조절 및/또는 감소시킨다.In some embodiments, the compositions described herein may be administered in conjunction with an implant (e.g., a device) and / or with an implant (e.g., a tissue, a cell, a organ) ), Mediates, nullifies, modulates and / or reduces the immune response associated therewith.
특정 구현예에서, 개체는 알러지성 질환 또는 병태, 알러지 및 천식과 같은 원하지 않는 면역 활성화와 관련된 장애를 앓고있다. 알러지성 질환 또는 천식을 가진 개체는 현존하는 알러지성 질환 또는 천식의 인식가능한 증상을 가진 개체이다. 예를 들어 알러지성 반응을 유도하는 흡입 물질(예를 들어, 일본 삼나무 꽃가루 단백질)과 복합체를 형성한 입자에 의해 그러한 개체에서 면역원성이 유도될 수 있다.In certain embodiments, the subject suffers from a disorder associated with unwanted immune activation such as allergic diseases or conditions, allergies and asthma. An individual with an allergic disease or asthma is an individual with an existing allergic disease or a recognizable symptom of asthma. For example, immunogenicity may be induced in such an individual by particles that form complexes with an inhaling substance that induces an allergic response (e. G., Japanese cedar pollen protein).
일부 구현예에서, 본 발명은 알러지, 예를 들어 일본 삼나무 꽃가루에 대한 알러지 반응의 발병 전에 본 발명의 조성물의 용도에 관한 것이다. 특정 구현예에서, 본 발명은 진행중인 또는 현존하는 알러지를 억제하기 위한 본 발명의 조성물의 용도에 관한 것이다. 일부 구현예에서, 본 발명은 대상체에서 알러지 반응 또는 알러지성 반응을 완화시키는 것에 관한 것이다. 완화는 대상체의 알러지 반응 또는 알러지성 반응을 치료, 예방 또는 억제하는 것을 의미한다.In some embodiments, the invention relates to the use of the composition of the present invention prior to the onset of an allergic reaction, for example, an allergic reaction to Japanese cedar pollen. In certain embodiments, the present invention relates to the use of a composition of the present invention to inhibit ongoing or existing allergies. In some embodiments, the invention relates to alleviating an allergic or allergic response in a subject. Mitigation means treating, preventing or inhibiting the allergic or allergic response of a subject.
일부 구현예에서, 본 발명의 조성물(예를 들어, 일본 삼나무 꽃가루 알러지와 관련된 항원성 분자에 커플링된 PLG 캐리어)은 하나 이상의 스캐폴드, 매트릭스 및/또는 전달 시스템과 함께 사용된다(예를 들어, 미국 특허 공보 제2009/0238879호, 미국 특허 제7,846,466호, 제7,427,602호; 제7,029,697호; 제6,890,556호; 제6,797,738호; 및 제6,281,256호 참조; 본 명세서에 참고로 편입됨). 일부 구현예에서, 입자(예를 들어, 항원-커플링된 PLG 입자)는 (예를 들어, 화학/생물학적 물질, 세포, 조직 및/또는 장기를 대상체에 전달하기 위한) 스캐폴드, 매트릭스 및/또는 전달 시스템과 결합된, 흡착된, 포매된, 컨쥬게이팅된다. 일부 구현예에서, (예를 들어, 화학/생물학적 물질, 세포, 조직 및/또는 장기를 대상체에 전달하기 위한) 스캐폴드, 매트릭스 및/또는 전달 시스템은 본원에 기재된 물질(예를 들어, 하나 이상의 항원성 펩타이드에 접합된 PLG)을 포함하고/하거나 이로부터 제조된다.In some embodiments, a composition of the invention (e.g., a PLG carrier coupled to an antigenic molecule associated with Japanese cedar pollen allergy) is used in conjunction with one or more scaffolds, matrices, and / or delivery systems , U.S. Patent Nos. 2009/0238879, 7,846,466, 7,427,602, 7,029,697, 6,890,556, 6,797,738, and 6,281,256, incorporated herein by reference). In some embodiments, the particles (e. G., Antigen-coupled PLG particles) may be conjugated to a scaffold, a matrix, and / or a substrate (e. G., To deliver a chemical / biological material, Or conjugated, adsorbed, embedded, conjugated with a delivery system. In some embodiments, a scaffold, matrix and / or delivery system (e.g., for delivering a chemical / biological material, cells, tissue and / or organ to a subject) PLG conjugated to an antigenic peptide) and / or are prepared therefrom.
일부 구현예에서, (예를 들어, 생물학적 물질(예를 들어, 세포, 조직 등)을 대상체로 이식하기 위한) 미세다공성 스캐폴드가 제공된다. 일부 구현예에서, 제제(예를 들어, 세포외 기질 단백질, 엑센딘-4) 및 생물학적 물질(예를 들어, 췌장 소도세포)을 그위에 갖는 미세다공성 스캐폴드가 제공된다. 일부 구현예에서, 스캐폴드는 질환(예를 들어, 제1형 당뇨병)의 치료 및 관련 방법(예를 들어, 진단 방법, 연구 방법, 약물 스크리닝)에 사용된다. 일부 구현예에서, 스캐폴드는 스캐폴드 상에 및/또는 스캐폴드 내에 본원에 기재된 항원-접합된 캐리어를 갖는다. 일부 구현예에서, 스캐폴드는 항원 접합된 물질(예를 들어, 항원 접합된 PLG)로부터 생산된다.In some embodiments, a microporous scaffold is provided (e.g., for implanting a biological material (e.g., a cell, tissue, etc.) into a subject). In some embodiments, a microporous scaffold is provided having a formulation (e.g., extracellular matrix protein, exendin-4) and a biological material (e.g., pancreatic islet cells) thereon. In some embodiments, the scaffold is used for the treatment of diseases (e. G.,
일부 구현예에서, 스캐폴드 및/또는 전달 시스템은 하나 이상의 층을 포함하고/하거나, 하나 이상의 화학적 및/또는 생물학적 독립체/제제(예를 들어, 단백질, 펩타이드-접합된 입자, 소분자, 세포, 조직, 등)를 가지며, 예를 들어, 미국 특허 공보 제2009/0238879호를 참조하며; 그 전체가 참고 문헌으로 편입된다. 일부 구현예에서, 항원-커플링된 입자는 스캐폴드 전달 시스템과 함께 투여되어, 스캐폴드 및 관련 물질에 대한 면역학적 관용의 유도를 유도한다. 일부 구현예에서, 미세다공성 스캐폴드는 본원에 기재된 입자와 함께, 스캐폴드 상에 또는 스캐폴드 내에 투여된다. 일부 구현예에서, 항원-커플링된 입자는 스캐폴드 전달 시스템에 커플링된다. 일부 구현예에서, 스캐폴드 전달 시스템은 항원-커플링된 입자를 포함한다.In some embodiments, the scaffold and / or delivery system comprises one or more layers and / or one or more chemical and / or biological entities / agents (e.g., proteins, peptide-conjugated particles, small molecules, Tissue, etc.), see, for example, U.S. Patent Publication No. 2009/0238879; The entirety of which is incorporated by reference. In some embodiments, the antigen-coupled particles are administered with a scaffold delivery system to induce induction of immunological tolerance to the scaffold and related materials. In some embodiments, the microporous scaffold is administered on a scaffold or in a scaffold, along with the particles described herein. In some embodiments, the antigen-coupled particles are coupled to a scaffold delivery system. In some embodiments, the scaffold delivery system comprises antigen-coupled particles.
기재된 특징 및 구현예의 다양한 변형, 재조합 및 변형은 본 발명의 범위 및 사상을 벗어나지 않으면서 당업자에게 분명할 것이다. 특정 구현예가 기재되었지만, 청구된 본 발명이 그러한 특정 구현예에 지나치게 제한되어서는 안된다는 것을 이해해야 한다. 실제로, 관련 분야의 숙련자에게 명백한 설명된 상기 모드 및 구현예의 다양한 변형은 다음의 청구범위의 범위 내에 있는 것으로 의도된다. 예를 들어, 미국 특허 출원 제62/221,504호, PCT 출원 번호 PCT/US2016/068423 및 PCT/US2017/012173(이들 각각은 그 전체가 본원에 참고로 편입됨); 미국 특허 공개 번호 제2012/0076831호, 제2002/0045672호, 제2005/0090008호, 제2006/0002978호, 제2009/0238879호, 제2012/0076831호, 제2015/0209293호, 제2015/0283218호(이들 각각은 그 전체가 본원에 참고로 편입됨); 및 미국 특허 제7,846,466호; 제7,427,602호; 제7,029,697호; 제6,890,556호; 제6,797,738호; 및 제6,281,256호(이들 각각은 본 명세서에 그 전체가 참고로 편입됨)은 본원에 기재된 다양한 구현예에서 사용되는 세부사항, 변형 및 변화를 제공한다.Various modifications, rearrangements and modifications of the described features and embodiments will be apparent to those skilled in the art without departing from the scope and spirit of the invention. While specific embodiments have been described, it should be understood that the claimed invention should not be unduly limited to such specific embodiments. Indeed, various modifications of the modes and embodiments, which will be apparent to those skilled in the relevant art, are intended to be within the scope of the following claims. See, for example, U.S. Patent Application 62 / 221,504, PCT Application Nos. PCT / US2016 / 068423 and PCT / US2017 / 012173, each of which is incorporated herein by reference in its entirety; U.S. Patent Application Publication Nos. 2012/0076831, 2002/0045672, 2005/0090008, 2006/0002978, 2009/0238879, 2012/0076831, 2015/0209293, 2015/0283218 (Each of which is incorporated herein by reference in its entirety); And U.S. Patent No. 7,846,466; 7,427,602; 7,029,697; 6,890,556; 6,797,738; And 6,281,256, each of which is incorporated herein by reference in its entirety, provide details, modifications and variations that may be used in the various embodiments described herein.
본 출원 및/또는 하기에 언급된 모든 공보 및 특허는 그 전체가 본원에 참고로 편입된다.All publications and patents cited herein and / or hereinafter are incorporated herein by reference in their entirety.
실시예Example
하기 실시예는 본 발명의 이점 및 특징을 추가로 설명하기 위해 제공되지만, 본 발명의 범위를 제한하려는 것은 아니다.The following examples are provided to further illustrate the advantages and features of the present invention, but are not intended to limit the scope of the invention.
실시예 1: 재조합 일본 삼나무 꽃가루 단백질의 TIMPs로의 캡슐화Example 1: Encapsulation of recombinant Japanese cedar pollen protein with TIMPs
상술한 바와 같이, 삼나무 꽃가루 과민증의 치료에서 일본 삼나무 꽃가루(JCP) 추출물을 캡슐화하는 입자의 사용은 저농도에서도 용액에서 매우 점성을 유지하는 JCP를 캡슐화하는 문제점 때문에 제한적이다. 이중 에멀젼-용매 증발 방법을 사용하여 JCP를 캡슐화한 TIMP 입자(TIMP-JCPP)를 제조하기 위한 실험을 수행하였다(도 2c). 간단히, 시험된 JCP 추출물의 배치(batch)에 따라, 200 μL의 5 mg/mL JCP 용액을 DCM 내 20% w/v PLGA 0.5 mL에 첨가하거나, 400 ㎕의 5 mg/mL JCP 용액을 DCM 내 20% w/v PLGA 1.0 mL에 첨가하였다. 각 용액을 초음파처리에 의해 에멀젼화시켜 1차 에멀젼을 생성시켰다. PEMA 용액(10 mL 1% w/v 수성 PEMA)을 에멀젼에 첨가하고 초음파처리에 의해 재-에멀젼화시켜 2차 에멀젼을 생성시켰다. 에멀젼을 교반하에 200 mL의 0.5% w/v 수성 PEMA에 부었다. 입자를 정제하고, 동결건조시키고, -20도에서 미래의 사용을 위해 저장하였다. CBQCA 분석 전에 입자를 DMSO에 용해시킴으로써 이전에 기술된 바와 같이 입자의 항원 용량을 결정하였다. 물의 나노입자 크기 및 제타-전위는 Zetasizer Nano ZSP (Malvern Instruments, Westborough, MA)에서 동적 광산란을 사용하여 측정되었다. 로트-방출(Lot-release) 기준은 TIMP-JCPP 직경이 700nm ± 250nm이고, 적어도 -30mV의 전하를 필요로 하며, 적어도 5㎍ 항원/mg PLGA를 함유해야 한다. 입자 제조를 위한 조건 및 JCP 캡슐화의 결과를 도 4에 나타낸다.As mentioned above, the use of particles to encapsulate Japanese cedar pollen (JCP) extracts in the treatment of cedar pollen hypersensitivity is limited due to the problem of encapsulating JCPs which remain very viscous in solution at low concentrations. Experiments were conducted to prepare TIMP particles (TIMP-JCP P ) encapsulating JCP using the dual emulsion-solvent evaporation method (FIG. 2C). Briefly, according to a batch of the tested JCP extract, 200 μL of a 5 mg / mL JCP solution was added to 0.5 mL of 20% w / v PLGA in DCM, or 400 μL of a 5 mg / mL JCP solution was added to DCM Was added to 1.0 mL of 20% w / v PLGA. Each solution was emulsified by ultrasonic treatment to produce a primary emulsion. PEMA solution (10
달성된 최대 항원 부하가 약 1μg 단백질/mg TIMP 또는 그 이하이기 때문에 총 JCP 추출물을 TIMP로 캡슐화하기 위한 초기의 시도는 부분적으로만 성공적이었다(도 4). 이는 잠재적으로 저농도에서도 JCP의 높은 점도에 기인하였다(도 2a). 따라서, 재조합 JCP 단백질(CRYJ1 및 CRY2, Lifeome)을 TIMP(TIMP-JCPR, 도 2b에 도시된 개략도)로 캡슐화하기 위한 최적 조건을 결정하기 위한 실험을 수행하였다.Early attempts to encapsulate total JCP extracts into TIMPs were only partially successful (Figure 4), since the maximum antigen load achieved was about 1 [mu] g protein / mg TIMP or less. This was due to the high viscosity of JCP even at potentially low concentrations (Figure 2a). Therefore, the optimal conditions for encapsulating the recombinant protein JCP (CRYJ1 and CRY2, Lifeome) a TIMP (TIMP-JCP R, the schematic diagram shown in Figure 2b) experiments were performed to determine.
저 분자량 PLGA(0.17 dL/g), Sugi 염기성 단백질(CRYJ1, 55,180 Da) 및 폴리갈락투로나제(CRYJ2, 59,070 Da)를 사용하여 TIMP-JCPR 입자를 생성하였다. 재조합 단백질의 순도를 SDS-PAGE(도 3c)에 의해 평가하고, 이전에 결정된 결과와 비교하였다(Y. Mitobe et al., 조절 독성학 및 약리학: RTP 2015 71). TIMP-JCPR 입자 제조 조건은 표 2에 나타나 있다.TIMP-JCP R particles were produced using low molecular weight PLGA (0.17 dL / g), Sugi basic protein (CRYJ1, 55,180 Da) and polygalacturonase (CRYJ2, 59,070 Da). The purity of the recombinant protein was assessed by SDS-PAGE (Fig. 3c) and compared with previously determined results (Y. Mitobe et al., Regulatory Toxicology and Pharmacology : RTP 2015 71). The conditions for preparing the TIMP-JCP R particles are shown in Table 2.
입자 제형(도 2c에 도시된 개략도)을 위한, 및 상기 기술된 이중-에멀젼 프로토콜을 사용하여 CRYJ1 또는 CRYJ2를 캡슐화하였다. 단백질 농도 및 버스트 방출은 CBQCA에 의해 각각의 샘플에 대해 결정되었다. 이들 분석의 결과를 하기 표 3에 나타내었다. 크기 및 입자 전하를 Malvern Zetasizer Nano ZS 또는 ZSP를 사용하는 동적 광산란(DLS)에 의해 측정하였고, 결과를 하기 표 4에 나타내었다.CRYJ1 or CRYJ2 was encapsulated using the dual-emulsion protocol described above for the particle formulation (schematic diagram shown in Figure 2C). Protein concentration and burst release were determined for each sample by CBQCA. The results of these analyzes are shown in Table 3 below. Size and particle charge were measured by dynamic light scattering (DLS) using Malvern Zetasizer Nano ZS or ZSP and the results are shown in Table 4 below.
실시예 2: JCP 알러지의 뮤린 모델Example 2: Murine model of JCP allergy
흡입된 알러지항원에 대한 급성 알러지 반응의 마우스 모델은 천식에서의 면역적 및 염증 반응의 기전을 밝히고, 알러지성 염증을 제어하기 위한 신규한 표적의 동정 및 조사에 널리 사용되어왔다.A mouse model of an acute allergic response to inhaled allergens has been widely used to identify the mechanism of immunological and inflammatory responses in asthma and to identify and investigate novel targets to control allergic inflammation.
급성 염증성 모델의 특성은 마우스 균주, 알러지항원 및 민감화 및 챌린지 프로토콜의 선택에 의해 영향을 받을 수 있다(도 5a). 간단히, 삼나무 꽃가루 추출물(Cedar pollen extract-Cj; LSL-LG5280, Lo# 153101, Cosmo Bio USA)을 1 mg/mL의 MilliQ 물에 재현탁했다. JCP 용액을 명반(alum)의 최종 농도가 20 mg/mL가 되도록 Imject 명반(Thermo Scientific, Cat. # 77161)에서 1:1 희석시켰다. 0일째, Balb/c 마우스에게 100 μL JCP + 명반 용액(즉, 2 mg/mL의 명반에 흡착된 JCP 50 μg, n=10)을 복강내 주사하였다. 대조군 마우스에는 PBS(n=10)로 희석한 명반을 주사하였다. 제2 균등 용량을 14일째에 마우스에게 투여하였다. 21일째에 마우스를 복강 내피 세포에서 채혈하여 항체 분석을 위해 혈청을 수집하였다(도 5b-5d). 22일째에, 꼬리 정맥을 통해 정맥내 투여된 TIMP-OVA(n=5) 또는 TIMP-JCP(n=4)의 단일 2.5mg 용량으로 각 그룹으로부터의 마우스의 일부를 관용시켰다. 또한, 마우스는 JCP로 민감화하기 전에 TIMP-OVA 또는 TIMP-JCP로 관용된다.The characteristics of the acute inflammatory model can be influenced by the selection of mouse strains, allergenic antigens and sensitization and challenge protocols (Fig. 5A). Briefly, cedar pollen extract-Cj (LSL-LG5280, Lo # 153101, Cosmo Bio USA) was resuspended in 1 mg / mL MilliQ water. JCP solution was diluted 1: 1 in Imject alum (Thermo Scientific, Cat. # 77161) to a final concentration of alum of 20 mg / mL. On
28일 및 29일째에, 마우스에게 20 μL MilliQ 물 내 100μg의 JCP 추출물을 비강내로 투여하였다. 투여한지 29일 후, 1시간동안 마우스를 긁기(도 7) 및 체온 변화(도 6)에 대하여 모니터링하였다. 1시간 후, 혈액을 수집하여 MCPT-1(도 10b) 및 히스타민(도 10a)의 혈청 수준을 평가하기 위해 혈액을 수집하였다.On
30일째에, 마우스를 다시 혈청 내의 항체 분석을 위해 출혈시켰다(도 9a-9c). 이어서 마우스를 희생시키고, 각 마우스로부터의 비장을 수집하고, 생체외 사이토카인 분석 및 증식을 위해 균질화시켰다(도 8). 비장을 수확하고, 적혈구-없는 단일 세포 현탁액으로 가공하고, 및 37℃에서 48시간동안 1, 25 또는 50 μg/mL JCP 완전한 RPMI 배양 배지와 함께 배양하였다. 50 ㎕의 상등액을 사이토카인 분석을 위해 제거하고, 세포를 배양 마지막 24시간 동안 1 μCi/웰 [3H]TdR로 펄스 처리하였다. 증식은 탑카운트 마이크로플레이트 신틸레이션 계수기(Topcount Microplate Scintillation Counter)(PerkinElmer, Waltham, MA)에 의해 검출된 [3H]TdR 혼입에 의해 측정하였다.On
상기 데이터는 JCP 민감화 후 JCP-TIMP로 치료한 것이 생체외 분석에서 IFNγ, IL-17 및 IL-5 생성을 충분히 감소시킨다는 것을 나타낸다. JCP의 고용량 투여로 비장 세포를 자극한 경우 IL-4, IL-10 및 IL-13 수준에서도 유사한 결과가 관찰되었다. TIMP 치료 후 항체 수치는 변하지 않았다.The data show that treatment with JCP-TIMP after JCP sensitization significantly reduces IFNγ, IL-17 and IL-5 production in in vitro assays. Similar effects were also observed at IL-4, IL-10 and IL-13 levels when stimulated with splenocytes by high dose of JCP. Antibody levels did not change after treatment with TIMP.
실시예 3; JCP 알러지의 뮤린 모델 및 CRYJ1 및 CRYJ2 TIMPs에 의한 치료Example 3: Murine model of JCP allergy and treatment with CRYJ1 and CRYJ2 TIMPs
알러지 기도 염증 모델Allergy airway inflammation model
마우스를 10 μg CRYJ1과 CRYJ2의 2회 용량, 명반(3 mg)내 주요 일본 삼나무 꽃가루 알러지항원 또는 명반과 PBS만으로 복강 내(i.p.)로 면역화하였다. 그후, 마우스를 조직 수확 전에 3일 연속, 에어로졸화한 CRYJ1 및 CRYJ2(10 mg/ml)로 20분간 투여하였다.Mice were immunized intraperitoneally (i.p.) with PBS alone with the major Japanese cedar pollen allergen or alum in the aliquot of 10 μg CRYJ1 and CRYJ2, alum (3 mg). Mice were then dosed for 20 minutes with CRYJ1 and CRYJ2 (10 mg / ml) aerosolized for three consecutive days prior to tissue harvest.
기관지폐포 세척 호산구의 분석Analysis of bronchoalveolar lavage eosinophils
폐를 1 mL의 기관지폐포 세척액(BALF; 1 mM EDTA 및 PBS 내 10% FBS)으로 플러싱한다. 총 세포 수를 측정하고, 샘플을 차등 세포 수에 대해 염색한 슬라이드 및 DiffQuik(Siemens, Newark, DE)상에 사이토스펀(cytospun)한다.The lungs are flushed with 1 mL of bronchoalveolar lavage (BALF; 1 mM EDTA and 10% FBS in PBS). Total cell counts are determined, samples are stained for differential cell counts and cytospun on DiffQuik (Siemens, Newark, Del.).
기도 조직학Airway histology
폐를 수집하여, 포르말린에 고정시키고 파라핀으로 가공한다. 파라핀 절편은 헤마톡실린 및 에오신(H&E) 또는 과요오드산-쉬프(PAS)로 염색한다.The lungs are collected, fixed in formalin and processed into paraffin. Paraffin sections are stained with hematoxylin and eosin (H & E) or periodic acid-Schiff (PAS).
JCP-특이적 IgEJCP-specific IgE
희생시 마우스로부터 혈청을 수집하고, CRYJ1/2-특이적 IgE를 샌드위치 ELISA에 의해 정량화한다. 항-마우스 IgE(BD Biosciences)를 포획 항체로 사용하고, 바이오티닐화된 CRYJ1/2(Pierce[Rockford, Rock]의 EZ-Link 설포-NHS-LC-바이오틴 키트를 사용하여 준비됨)를 2차 시약으로 사용한다. CRYJ1/2-IgE의 양은 정제된 마우스 CRYJ1/2-IgE를 사용하여 생성된 표준 곡선에 의해 측정되어야 한다.Serum is collected from the mice at sacrifice and the CRYJ1 / 2-specific IgE is quantitated by sandwich ELISA. (Prepared using EZ-Link sulfo-NHS-LC-biotin kit of Pierce [Rockford, Rock]) with anti-mouse IgE (BD Biosciences) as capture antibody and biotinylated CRYJ1 / It is used as a reagent. The amount of CRYJ1 / 2-IgE should be measured by a standard curve generated using the purified mouse CRYJ1 / 2-IgE.
사이토카인 정량화Quantification of cytokines
리콜 반응 배양액으로부터의 BAL 유체 및 상등액(48시간에 수확됨)을 자기 Milliplex MAP 멀티플렉스 분석(Millipore, Billerica, MA)에 의해 IL-4, IL-5, IL-13, IL-10, IL-17 및 IFNγ에 대하여 분석하였다.BAL fluids and supernatants (harvested at 48 hours) from recalled reaction media were analyzed by magnetic Milliplex MAP multiplex assay (Millipore, Billerica, MA) for IL-4, IL-5, IL- 17 and IFN [gamma].
삼나무 꽃가루 항원의 생산 및/또는 공급Production and / or supply of cedar pollen antigen
정제된 삼나무 꽃가루 추출물은 일본 기상학회로부터 유래한다. 또한 재조합 일본 삼나무 꽃가루 항원은 이전에 기술한 바와 같이 제조해야 한다(Fujimura T, Int. Arch. Allergy Immunol. 2015;168(1):32-43). JCP에서 면역우성 에피토프에 대한 아미노산 서열은 CRYJ1(수탁 번호 AB081309; SEQ ID NO: 1) 및 CRYJ2(수탁 번호 AB211810; SEQ ID NO: 2)이다.The purified cedar pollen extract is derived from the Japan Meteorological Society. Also, recombinant Japanese cedar pollen antigen should be prepared as previously described (Fujimura T, Int. Arch. Allergy Immunol. 2015; 168 (1): 32-43). The amino acid sequence for the immunoprivileged epitope in JCP is CRYJ1 (Accession No. AB081309; SEQ ID NO: 1) and CRYJ2 (Accession No. AB211810; SEQ ID NO: 2).
TIMP-JCP의 연구 배치 생산Research batch production of TIMP-JCP
재조합 JCP 항원은 상기 기재된 바와 같이 TIMP로 캡슐화된다. 200 mg의 TIMP-CRYJ1 및/또는 CRYJ2(TIMP-JCPR) 및 200 mg TIMP-OVA 대조군은 JCP 알러지의 마우스 모델에서 효능 시험을 위해 사용될 것이다. 5-10 마리의 마우스의 6개의 그룹을 TIMP-OVA 또는 TIMP-JCPR로 1회 용량(그룹 1-3) 또는 2회 용량(그룹 3-6) 요법으로 처리할 것이다. 동물은 JCP 항원에 민감화된다(TIMP 처리 전후). 28일 및 29일에 기도 감염이 수행될 것이며, 치료의 효능은 아래에 기재된 1차 판독 및 성공 측정을 사용하여 결정된다. 그룹 7은 OVA에 민감해야하며, JCP 대신에 OVA로 항원 투여가 가능하므로 양성 알러지 대조군으로 사용된다.Recombinant JCP antigens are encapsulated in TIMP as described above. 200 mg of TIMP-CRYJ1 and / or CRYJ2 (TIMP-JCP R) and 200 mg TIMP-OVA control group will be used to test the efficacy in a mouse model of allergic JCP. Six groups of 5-10 mice will be treated with either TIMP-OVA or TIMP-JCP R once dose (group 1-3) or twice dose (group 3-6). Animals are sensitized to JCP antigens (before and after TIMP treatment). On
동물 POC: 민감화 이전의 TIMP-JCP 치료Animal POC: Pre-sensitized TIMP-JCP treatment
5-10 마리의 마우스의 6개의 그룹을 TIMP-OVA 또는 TIMP-JCPR로 1회 용량(그룹 1-3) 또는 2회 용량(그룹 3-6) 요법으로 표 5에 제시된 바와 같이 처리한다. 동물은 JCP 항원에 민감화될 것이다. 28일 및 29일에 기도 감염이 수행될 것이며, 치료의 효능은 아래에 기재된 1차 판독 및 성공 측정을 사용하여 결정된다. 그룹 7은 OVA에 민감해야하며, JCP 대신에 OVA로 항원 투여가 가능하므로 양성 알러지 대조군으로 사용된다.Six groups of 5-10 mice are treated with either TIMP-OVA or TIMP-JCP R in a single dose (Group 1-3) or two doses (Group 3-6) regimen as shown in Table 5. Animals will be sensitized to JCP antigens. On
동물 POC - 민감화후 TIMP-JCP 치료TIMP-JCP treatment after animal POC-sensitization
6개의 마우스 그룹을 JCP에 대한 민감화 후에 TIMP-JCPR 또는 TIMP-OVA로 하기 표 6에 나타낸 바와 같이 처리한다. 2회 용량 요법이 시험된다. 여기에는 1 회 TIMP 용량 요법(그룹 1-3)과 2회 용량 요법(그룹 4-6)을 포함하며, 7일 간격으로 나눈다. 28일 및 29일에 공기 챌린지(challenge)가 수행되고, 치료의 효능은 아래에 기술된 1차 판독 및 성공 측정을 사용하여 결정된다.Six mouse groups were sensitized to JCP and treated as TIMP-JCP R or TIMP-OVA as shown in Table 6 below. Two dosing regimens are tested. These include one TIMP dose regimen (group 1-3) and two dosing regimens (group 4-6), divided by 7 day intervals. On
동물 모델의 1차 판독 및 성공 측정Primary reading of animal model and measurement of success
1차 판독 및 성공 측정은 민감화 전에 TIMP-JCPR 처리를 받는 마우스에서 측정된다. TIMP-JCPR 처리된 마우스는 공기 챌린지 후 기준선 온도에 비해 온도 변화가 없다. TIMP-JCPR 처리된 마우스의 기준치와 비교된 혈액 호산구 수 및 비만 세포 수에는 변화가 없다. TIMP-JCPR 처리된 마우스는 JCP에 민감화된 TIMP-OVA 처리된 마우스에 비해 JCP-특이적 IgE를 유의하게 감소시켰다. TIMP-JCPR 처리된 마우스는 또한 JCP에 민감화된 TIMP-OVA 처리된 마우스와 비교하여 전신 IL-4, IL-5 및 IL-13을 유의하게 감소시켰다. TIMP-JCPR은 TIMP-OVA 처리된 마우스와 비교하였다.Primary readings and success measurements are measured in mice receiving TIMP-JCP R treatment prior to sensitization. The TIMP-JCP R treated mice had no temperature change relative to baseline temperature after air challenge. There is no change in the number of blood eosinophils and the number of mast cells compared with the reference value of TIMP-JCP R treated mice. TIMP-JCP R treated mice significantly reduced JCP-specific IgE compared to JCP-sensitized TIMP-OVA treated mice. TIMP-JCP R treated mice also significantly reduced systemic IL-4, IL-5, and IL-13 compared to JCP-sensitized TIMP-OVA treated mice. TIMP-JCP R was compared with TIMP-OVA treated mice.
1차 판독 및 성공 측정은 민감화 후 TIMP-JCPR 치료를 받은 마우스에서 측정된다. TIMP-JCPR 처리된 마우스는 공기 챌린지 후 기준선 온도에 비해 온도 변화가 없다. TIMP-JCPR 처리된 마우스의 기준치와 비교하여 혈액 호산구 수 및 비만 세포 수에는 변화가 없다. TIMP-JCPR 처리된 마우스는 JCP에 민감화된 TIMP-OVA 처리된 마우스에 비해 JCP-특이적 IgE를 유의하게 감소시켰다. 또한 TIMP-JCPR 처리된 마우스는 JCP에 민감화된 TIMP-OVA 처리된 마우스와 비교하여 JCP-특이적 전신 IL-4, IL-5 및 IL-13을 유의하게 감소시켰다. 또한 TIMP-JCPR 처리된 마우스는 TIMP-OVA 처리된 마우스에 비해 특정 항원 생성을 감소시켰다.Primary readings and success measurements were measured in mice that received TIMP-JCP R treatment after sensitization. The TIMP-JCP R treated mice had no temperature change relative to baseline temperature after air challenge. There is no change in the number of blood eosinophils and the number of mast cells compared with the reference value of TIMP-JCP R treated mice. TIMP-JCP R treated mice significantly reduced JCP-specific IgE compared to JCP-sensitized TIMP-OVA treated mice. In addition, TIMP-JCP R treated mice significantly reduced JCP-specific systemic IL-4, IL-5 and IL-13 compared to JCP-sensitized TIMP-OVA treated mice. In addition, TIMP-JCP R treated mice reduced specific antigen production compared to TIMP-OVA treated mice.
실시예 4; TIMP-JCP에 대한 임상 연구Example 4; Clinical study on TIMP-JCP
정량적 고밀도 일본 삼나무 꽃가루에 노출된 일본 계절성 알러지 비염(SAR) 환자에서 단일-중심, 비-블라인딩된, 위약 대조된 연구에서 TIMP-JCP의 효능 및 안전성을 평가하기 위해, 임상 연구를 수행한다.Clinical studies are performed to assess the efficacy and safety of TIMP-JCP in single-center, non-blind, placebo-controlled studies in Japanese seasonal allergic rhinitis (SAR) patients exposed to quantitative high density Japanese cedar pollen .
임상 연구의 1차 목표는 일본 삼나무 꽃가루에 대한 고밀도 노출 동안 경구 TIMP-JCP로 치료된 일본 SAR 환자에서 총 비강 울혈 스코어(TNSS)의 변화를 분석하고 평가하는 것이다.The primary goal of clinical studies is to analyze and evaluate changes in total nasal congestion scores (TNSS) in Japanese SAR patients treated with oral TIMP-JCP during high-density exposure to Japanese cedar pollen.
2차 목표는 알러지성 비염 환자에 대한 총 증상 점수(Total Symptom Score, TSS), 증상 점수, 비강 분비물 양, 재채기 수 및 환자의 인상의 변화를 분석하고 평가하고, 순수한 일본 삼나무 꽃가루에 고밀도 노출을 받은 환자의 정맥 내 경로로 투여된 TIMP-JCP의 안전성을 평가하는 것이다.The second goal was to analyze and evaluate the changes in total symptom score (TSS), symptom score, nasal discharge, sneeze number and patient's impression for allergic rhinitis patients, and high density exposure to pure Japanese cedar pollen And to assess the safety of TIMP-JCP administered via the intravenous route of the recipient.
일반적인 연구 설계.General research design.
환경적 노출 단위를 사용하여 일본 삼나무 꽃가루에 알러지 반응을 보이는 환자에서 TIMP-JCP의 안전성 및 효능을 측정한다. 그러나, 환경적 노출 단위(EEU)가 많이 존재하지만, 본 연구는 와카야마 현의 일본 보건 지원 네트워크 부서와 협력하여 수행된다. 기존 접근법의 많은 한계점이 없으므로, EEU를 통해 정밀하고 통제된 연구를 설계하고 실행할 수 있다(유사한 연구 설계는 Enomoto, 등, 2009에 기재되어 있음). 이하 다이어그램은 투약 및 이벤트 스케쥴을 요약한 것이다.Measure the safety and efficacy of TIMP-JCP in patients with allergic reactions to Japanese cedar pollen using environmental exposure units. However, although there are many environmental exposure units (EEU), this study is carried out in cooperation with the Wakayama prefectural Japanese health support network department. Because there are not many limitations of the existing approach, it is possible to design and implement a precise and controlled study through EEU (a similar study design is described in Enomoto, et al., 2009). The diagram below summarizes medication and event schedules.
대상체Object
임상 연구에는 총 25명의 대상체가 있다. 5명의 대상체는 위약으로 치료한다. 20명의 대상체는 TIMP-JCP로 치료한다.There are a total of 25 subjects in clinical studies. Five subjects are treated with placebo. Twenty subjects are treated with TIMP-JCP.
진단 및 포함 기준Diagnosis and inclusion criteria
포함 기준:Include by:
ㆍ 일본 SAR 환자.ㆍ Japanese SAR patients.
ㆍ 적어도 2년동안 일본 삼나무 꽃가루 과민증상의 병력이 있는 환자.ㆍ Patients with a history of Japanese cedar pollen hypersensitivity for at least two years.
ㆍ (일본 삼나무 꽃가루 항원에 대한) 양성 IgE: 스크리닝 노출 시험일 이전 1.5년 이내에 형광-효소 면역검정(FEIA) 또는 화학발광 효소 면역검정(CLEIA)에 의해 결정됨.Positive IgE for Japanese cedar pollen antigen: Screening is determined by fluorescence-enzyme immunoassay (FEIA) or chemiluminescent enzyme immunoassay (CLEIA) within 1.5 years prior to exposure test day.
ㆍ 스크리닝 노출 시험(TNSS) 시작후, TNSS가 8 이상이고 비강 울혈 점수가 2(보통) 이상인 환자.(스크리닝 노출 시작 후 90 내지 150분의 적어도 하나의 평가 점수 및 비강 울혈 스코어는 기준을 충족하는 경우 임의의 다른 평가 점수가 될 수 있음)Patients with a TNSS greater than 8 and a nasal congestion score greater than or equal to 2 (normal) after the start of screening exposure test (TNSS). (At least one score and nasal congestion score of 90 to 150 minutes after screening exposure has met the criteria If it is, it can be any other evaluation score)
ㆍ 20세 이상 65세 이하(성 선호 없음).20 years old or older and 65 years old or younger (no sexual preference).
ㆍ 고지에 의한 동의에 서명한 환자.Patients who signed the agreement by notice.
제외 기준:By exclusion:
ㆍ 비계절성 알러지성 비염의 증상이 있는 환자.Patients with symptoms of non-seasonal allergic rhinitis.
ㆍ 심한 천식, 기관지확장증, 중증 간, 신장 또는 심장 기능이상, 혈액, 내분비 질환 및 기타 심각한 합병증이 있는 환자.Patients with severe asthma, bronchiectasis, severe liver, kidney or heart function abnormalities, blood, endocrine disorders and other serious complications.
ㆍ 비강 질환(비대성 비염, 부비동염, 비강 용종, 비강 격막의 이탈 등) 또는 TIMP-JCP의 유효성 판단을 방해할 수 있는 안구 질환이 있는 환자• Patients with ocular disease that may interfere with the validity of TIMP-JCP or nasal disease (hypertrophic rhinitis, sinusitis, nasal polyposis, nasal septal deviation, etc.)
ㆍ 치료 노출일에 상부 및/또는 하부 기도 염증(급성 비염, 만성 비염, 울혈성 비염, 위축성 비염, 화농성 비강 분비물, 냉증과 같은 부비동염 등)의 증거가 있는 환자.Patients with evidence of upper and / or lower respiratory tract inflammation (acute rhinitis, chronic rhinitis, congestive rhinitis, atrophic rhinitis, purulent nasal discharge, sinusitis such as poor circulation, etc.) on the day of treatment exposure.
ㆍ TIMP-JCP의 평가에 영향을 줄 수 있는 임의의 하기 약물을 복용한 환자(항-참가물질 및 면역 조절제 포함).• Patients taking any of the following medications that may affect the evaluation of TIMP-JCP, including anti-participation agents and immunomodulators.
추가 제외 기준:Additional exclusion criteria:
제1 투여일 이전 2주 이내에:Within 2 weeks prior to the first administration day:
ㆍ 항-알러지 약물, 항히스타민제(H1 및 H2 차단제: 경구 투여, 점비약, 안약, 주사제 및 국소 사용), 항콜린성 제제, 혈관수축제 점비약, 항히스타민제-함유 감기약, 항알러지성/항히스타민제 효과를 갖는 것으로 예상될 수 있는 제제(한약 및 글리사이르히진 포함) 및 알러지 증상(재채기, 비루, 비강 울혈, 눈 가려움증 등)에 대해 표시되는 기타 제제.Anti-allergic drugs, antihistamines (H1 and H2 blockers: oral administration, spot drugs, eye drops, injections and topical use), anticholinergic agents, vasoconstrictor agents, antihistamine-containing cold medicines, antiallergic / antihistamines Other preparations that may be expected to have effects (including herbal medicines and glysirhizin) and allergic symptoms (sneezing, rash, nasal congestion, eye pruritus, etc.).
ㆍ 스테로이드(경구, 흡입, 점비약, 안약 또는 국소 사용), 면역억제제(경구, 국소 사용 또는 주사제), 아졸 살진균제 및 감마글로불린 제제를 함유한 히스타민.Histamine containing steroids (oral, inhalation, dentifrice, eye drops or topical use), immunosuppressants (oral, topical or injectable), azole fungicides and gamma globulin preparations.
ㆍ 아졸 살진균제, 매크롤라이드 항생제 및 수산화 알루미늄/수산화 마그네슘을 함유하는 제제.Formulations containing an azole fungicide, a macrolide antibiotic, and an aluminum hydroxide / magnesium hydroxide.
스크리닝 노출 시험일 이전 4주 이내에:Within 4 weeks of screening exposure test day:
ㆍ 데포 스테로이드 제제.ㆍ Defoosteroid preparation.
스크리닝 노출 시험일 이전 6개월 이내에: 스테로이드 주사.Screening Within six months of exposure test day: Steroid injection.
ㆍ 스테로이드 주사ㆍ Steroid injection
스크리닝 노출 시험일 이전 1년 이내에:Within 1 year before screening exposure test day:
ㆍ 특정 저-민감화를 위한 유지 요법 또는 비특이적 대체 요법을 받는 환자.Patients undergoing maintenance or nonspecific alternative therapies for specific low-sensitization.
ㆍ 다른 연구에 참여중이거나 고지에 의한 동의가 있기 전의 6개월 이내에 다른 연구에 이전에 참여한 환자.Patients who are participating in other studies or who have previously participated in other studies within 6 months prior to the informed consent.
ㆍ 조사자/하위-조사자가 임의의 다른 기준을 위한 연구에 등록하기에 부적합하다고 생각되는 환자.The investigator / sub-investigator is deemed unsuitable for enrolling in studies for any other criteria.
ㆍ 항히스타민제 또는 항히스타민성 제제(펙소페나딘 HCl 포함) 및 슈도에페드린 하이드로클로라이드에 과민증 이력이 있는 환자.Patients with hypersensitivity to antihistamines or antihistamine preparations (including fexofenadine HCl) and pseudoephedrine hydrochloride.
ㆍ 다른 연구에 참여 중이거나 스크리닝 노출 시험일 이전 6개월 이내에 다른 연구에 이전에 참여한 환자.Patients participating in other studies or participating in other studies within 6 months prior to screening exposure.
ㆍ 임신 중이거나 임신가능성이 있거나, 현재 모유-수유중인 여성.Women who are pregnant, have a chance of becoming pregnant, or are currently breastfeeding.
안전 및 중지 기준Safety and Stopping Criteria
다음 파라미터들 중 하나가 충족되면, 연구는 데이터 안전성 모니터링 보드의 재량에 따라 보류될 수 있다:If one of the following parameters is met, the study can be suspended at the discretion of the data safety monitoring board:
a) 하나 이상의 예상치 못한 약물 관련된 심각한 유해 사례(SAE)가 데이터 안전성 모니터링 보드에 보고되는 경우.a) one or more unexpected drug-related serious adverse events (SAEs) are reported to the data safety monitoring board.
b) 연구 약물과 명확하게 관련이 없는 과도한 및/또는 예상치 못한 유해 사례.b) Excessive and / or unexpected harmful events not clearly associated with the study drug.
c) 예기치 않은 환자 사망c) Unexpected patient death
투약량, 지속기간 및 투여 방식:Dosage, duration and mode of administration:
약물: TIMP-JCP, 폴리(락트산-코-글라이콜 산) 면역원성 면역 변형성 Drug: TIMP-JCP, poly (lactic acid-co-glycolic acid) immunogenic immunodeficiency
용량 및 형태: TIMP-JCP는 바이알 내에서 멸균된 동결건조된 백색 분말로서 제공된다. 각 바이알에는 TIMP-JCP 500mg이 함유되어 있다. TIMP-JCP는 [1단계 당 결과 조정-초기 가정은 10mg/kg임]의 용량으로 제공된다. Dosage and Form: TIMP-JCP is provided as a lyophilized white powder sterilized in vials. Each vial contains 500 mg of TIMP-JCP. TIMP-JCP is provided at a dose of [10 mg / kg initially adjusted for outcome per step].
치료/연구의 지속기간: 환자 스크리닝 및 고지에 의한 동의 후에 환자 등록이 발생한다. 연구에 동원되면 투약이 시작된다. 0일째에 투약이 제공되고, 14일째에 1회 이상 제공될 것이다. 첫번째 고밀도 일본 삼나무 꽃가루 노출은 18 내지 21일에 발생한다(환자는 환경 노출 단위로 5시간 동안 JCP의 8,000 알갱이/m3에 노출된다). 두번째 고밀도 일본 삼나무 꽃가루 노출은 32 내지 35일에 발생한다(환자는 환경 노출 단위로 5시간 동안 JCP의 8,000 알갱이/m3에 노출된다). 후속 조치 방문은 42, 49, 및 56일째에 이루어진다. 최종 후속 조치 방문은 두 번째 노출 후 4주가 지난 63일에 발생한다. Duration of therapy / study: Patient registration occurs after patient screening and notification by notice. When the study is mobilized, dosing begins. Dosage will be provided on
투여 모드: 재구성된 TIMP-JCP는 30분에 걸쳐 느린 IV 주입에 의해 정상 식염수(NS; 0.9% 염화나트륨, NaCl)로 희석되어야 한다. 조사자가 대체 요법을 시행해야 한다고 결정하면 TIMP-JCP는 언제든지 중단될 수 있다. Dosage Modes: The reconstituted TIMP-JCP should be diluted with normal saline (NS; 0.9% NaCl, NaCl) by slow IV infusion over 30 minutes. The TIMP-JCP may be discontinued at any time if the investigator determines that alternative therapies should be instituted.
평가 기준Evaluation standard
안전성:safety:
ㆍ AE의 발병률 및 중증도, 플러스 AE의 특수성(과민증 및 면역-매개된 반응에 대한 표준보고 기준 포함).The incidence and severity of AE, plus the specificity of plus AE, including standard reporting criteria for hypersensitivity and immune-mediated responses.
ㆍ 바이탈 징후(겨드랑이 온도, 앉은 자세의 혈압, 착석 위치의 맥박수)ㆍ Vital signs (armpit temperature, blood pressure in a sitting position, pulse rate in sitting position)
ㆍ 표준 실험실 평가ㆍ Standard laboratory evaluation
ㆍ 12-리드(lead) ECG 실험실 검사(혈액학, 생화학 및 소변 검사)ㆍ 12-lead ECG laboratory test (hematology, biochemistry and urinalysis)
ㆍ 일본 삼나무 꽃가루에 대한 단자(prick) 테스트ㆍ Prick test for Japanese cedar pollen
ㆍ 항체 및 히스타민 방출 시험에 의해 개발된 파라미터.Parameters developed by antibody and histamine release tests.
1차 종점:Primary endpoint:
TNSS: 재채기, 비루, 비강 울혈 및 가려운 코의 총 점수. 각 증상은 다음 5가지 범주의 환자에 의해 평가된다. 1 = 없음(증상 없음); 2 = 경증(증상은 있으나 쉽게 용인됨); 3 = 중등도(증상에 대한 인식; 불편함, 그러나 용납될 수 있음); 4 = 중증(증상의 확실한 인식; 용납하기가 어렵지만 일상 생활 활동을 방해하지 않음), 5 = 중증(용납하기 어렵고 일상 생활 활동을 방해한다)TNSS: Total score of sneezing, rash, nasal congestion and itchy nose. Each symptom is assessed by the following five categories of patients: 1 = none (no symptoms); 2 = mild (symptomatic but easily tolerated); 3 = moderate (awareness of symptoms; inconvenience, but tolerable); 4 = Severe (a clear recognition of symptoms; difficult to tolerate but not interfering with activities of daily living); 5 = severe (difficult to tolerate and interfering with daily activities)
2차 효능 종점:Secondary efficacy endpoint:
면역 모니터링:Immunity monitoring:
ㆍ 항체: IgG 항체, 특정 IgG 항체(항-JCP, 항-CRYJ1 및 항-CRYJ2), 특정 IgG4 항체(항-JCP), IgE 항체, 특정 IgE 항체(항-JCP)(Anti-JCP, anti-CRYJ1 and anti-CRYJ2), specific IgG4 antibody (anti-JCP), IgE antibody, specific IgE antibody (anti-JCP)
ㆍ 사이토카인(IFN-감마, IL-4, IL-5, IL-10, IL-12 및 IL-13)(IL-4, IL-5, IL-10, IL-12 and IL-13)
ㆍ 면역 세포 표현형검사(Tregs, 효과기 T 세포 및 단핵구)Immunocytochemistry (Tregs, effector T cells and monocytes)
ㆍ 일본 삼나무 꽃가루에 대한 주변 B 및 T 세포 반응.Peripheral B and T cell responses to Japanese cedar pollen.
ㆍ TSS의 변화, 각 증상 점수의 변화, 비강 분비물 양, 재채기 횟수 및 환자의 인상.Changes in TSS, changes in each symptom score, amount of nasal discharge, number of sneezes, and patient's impression.
ㆍ 비강 분비물 양: 환자의 코를 풀은 후 티슈 페이퍼의 중량을 1시간마다 측정한다. 코를 풀기 전의 중량과의 차이는 비강 분비물 양으로 계산된다.ㆍ Amount of nasal secretion: Measure the weight of tissue paper after rinsing patient's nose every hour. The difference from the weight before uncoiling is calculated as the amount of nasal secretion.
ㆍ 재채기 횟수: 환자는 1시간마다 스스로 재채기 횟수를 기록한다.Number of sneezes: The patient records the number of sneezes themselves every hour.
약동학(PK):Pharmacokinetics (PK):
ㆍ 연구 약물 투여 중에 희소 샘플링 디자인에서 매일 측정한 TIMP-JCP의 혈청 농도.Serum concentrations of TIMP-JCP measured daily in rare sample designs during study drug administration.
결론:conclusion:
TIMP-JCP로 치료된 대상체는 일본 삼나무 꽃가루 노출에 대한 알러지성 반응의 발생 및 중증도가 덜 나타났다. 이는 TIMP-JCP로 치료받은 대상체의 TNSS가 위약으로 치료된 대상체에 비해 감소된 것으로 나타났다. JCP로 치료받은 대상체는 또한 감소된 수준의 특정 IgG 항체(항-JCP, 항-CRYJ1 및 항-CRYJ2), 특이 IgG4 항체(항-JCP), IgE 항체, 특정 IgE 항체(항-JCP); 일본 삼나무 꽃가루에 대한 감소된 주변 B 및 T 세포 반응; 위약 그룹에 비해 낮은 TSS 점수, 증상 점수, 비강 분비물 양 및 재채기 횟수를 갖는다.Subjects treated with TIMP-JCP showed less occurrence and severity of allergic reactions to Japanese cedar pollen exposure. This indicates that TNSS of subjects treated with TIMP-JCP was reduced compared to subjects treated with placebo. JCP-treated subjects also exhibit reduced levels of specific IgG antibodies (anti-JCP, anti-CRYJ1 and anti-CRYJ2), specific IgG4 antibodies (anti-JCP), IgE antibodies, specific IgE antibodies (anti-JCP); Reduced peripheral B and T cell responses to Japanese cedar pollen; Have a lower TSS score, symptom score, nasal discharge and sneeze frequency compared to placebo groups.
본 발명의 특정 구현예가 기재되고 예시되었지만, 상기 구현예는 단지 본 발명의 예시로서 간주되어야하고, 첨부된 청구범위에 따라 해석되는 본 발명을 제한하는 것으로 간주되어서는 안된다.Although specific embodiments of the invention have been described and illustrated, it should be understood that these embodiments are to be considered merely exemplary of the invention and are not to be construed as limiting the invention as interpreted in accordance with the appended claims.
본원에 인용된 모든 특허, 출원 및 다른 참고문헌은 그 전체가 참고문헌으로 편입된다.All patents, applications and other references cited herein are incorporated by reference in their entirety.
SEQUENCE LISTING <110> Cour Pharmaceuticals Development Company Getts, Daniel R. <120> TIMPs Encapsulating Japanese Cedar Pollen Epitopes <130> COUR-014/02WO <150> US 62/293,261 <151> 2016-02-09 <160> 3 <170> PatentIn version 3.5 <210> 1 <211> 329 <212> PRT <213> Cryptomeria japonica <400> 1 Met Asp Asn Pro Ile Asp Ser Ser Trp Arg Gly Asp Ser Asn Trp Ala 1 5 10 15 Gln Asn Arg Met Lys Leu Ala Asp Ser Ala Val Gly Phe Gly Ser Ser 20 25 30 Thr Met Gly Gly Lys Gly Gly Asp Leu Tyr Thr Val Thr Asn Ser Asp 35 40 45 Asp Asp Pro Val Asn Pro Ala Pro Gly Thr Leu Arg Tyr Gly Ala Thr 50 55 60 Arg Asp Arg Pro Leu Trp Ile Ile Phe Ser Gly Asn Met Asn Ile Lys 65 70 75 80 Leu Lys Met Pro Met Tyr Ile Ala Gly Tyr Lys Thr Phe Asp Gly Arg 85 90 95 Gly Ala Gln Val Tyr Ile Gly Asn Gly Gly Pro Ser Val Phe Ile Lys 100 105 110 Arg Val Ser Asn Val Ile Ile His Gly Leu His Leu Tyr Gly Ser Ser 115 120 125 Thr Ser Val Leu Gly Asn Val Leu Ile Asn Glu Ser Phe Gly Val Glu 130 135 140 Pro Val His Pro Gln Asp Gly Asp Ala Leu Thr Leu Arg Thr Ala Thr 145 150 155 160 Asn Ile Trp Ile Asp His Asn Ser Phe Ser Asn Ser Ser Asp Gly Leu 165 170 175 Val Asp Val Thr Leu Ser Ser Thr Gly Val Thr Ile Ser Asn Asn Leu 180 185 190 Phe Phe Asn His His Lys Val Met Leu Leu Gly His Asp Asp Ala Tyr 195 200 205 Ser Asp Asp Lys Ser Met Lys Val Thr Val Ala Phe Asn Gln Phe Gly 210 215 220 Pro Asn Ser Gly Gln Arg Met Pro Arg Ala Arg Tyr Gly Leu Val His 225 230 235 240 Val Ala Asn Asn Asn Tyr Asp Pro Trp Thr Ile Tyr Ala Ile Gly Gly 245 250 255 Ser Ser Asn Pro Thr Ile Leu Ser Glu Gly Asn Ser Phe Thr Ala Pro 260 265 270 Asn Glu Ser Tyr Lys Lys Gln Val Thr Ile Arg Ile Gly Ser Lys Thr 275 280 285 Ser Ser Ser Ser Ser Asn Trp Val Trp Gln Ser Thr Gln Asp Val Phe 290 295 300 Tyr Asn Gly Ala Tyr Phe Val Ser Ser Gly Lys Tyr Glu Gly Gly Asn 305 310 315 320 Ile Tyr Thr Lys Lys Glu Ala Phe Asn 325 <210> 2 <211> 391 <212> PRT <213> Cryptomeria japonica <400> 2 Val Glu Asn Gly Asn Ala Thr Pro Gln Leu Thr Lys Asn Ala Gly Val 1 5 10 15 Leu Thr Ser Ser Leu Ser Lys Arg Cys Arg Lys Val Glu His Ser Arg 20 25 30 His Asp Ala Ile Asn Ile Phe Asn Val Glu Lys Tyr Gly Ala Val Gly 35 40 45 Asp Gly Lys His Asp Ser Thr Glu Ala Phe Ser Thr Ala Trp Gln Ala 50 55 60 Ala Ser Lys Lys Pro Ser Ala Met Leu Leu Val Pro Gly Asn Lys Lys 65 70 75 80 Phe Val Val Asn Asn Leu Phe Phe Asn Gly Pro Ser Gln Pro His Phe 85 90 95 Thr Phe Lys Val Asp Gly Ile Ile Ala Ala Tyr Gln Asn Pro Ala Ser 100 105 110 Trp Lys Asn Asn Arg Ile Trp Leu Gln Phe Ala Lys Leu Thr Gly Phe 115 120 125 Thr Leu Met Gly Lys Gly Val Ile Asp Gly Gln Gly Lys Gln Trp Trp 130 135 140 Ala Gly Gln Ser Lys Trp Val Asn Gly Arg Glu Ile Ser Asn Asp Arg 145 150 155 160 Asp Arg Pro Thr Ala Ile Lys Phe Asp Phe Ser Thr Gly Leu Ile Ile 165 170 175 Gln Gly Leu Lys Leu Met Asn Ser Pro Glu Phe His Leu Val Phe Gly 180 185 190 Asn Ser Glu Gly Val Lys Ile Ile Gly Ile Ser Ile Thr Ala Pro Arg 195 200 205 Asp Ser Pro Asn Thr Asp Gly Ile Asp Ile Phe Ala Ser Lys Asn Phe 210 215 220 His Leu Gln Lys Asn Thr Ile Gly Thr Gly Asp Asp Ser Val Ala Ile 225 230 235 240 Gly Thr Gly Ser Ser Asn Ile Val Ile Glu Asp Leu Ile Ser Gly Pro 245 250 255 Gly His Gly Ile Ser Ile Gly Ser Leu Gly Arg Glu Asn Ser Arg Ala 260 265 270 Glu Val Ser Tyr Val His Val Asn Gly Ala Lys Phe Ile Asp Thr Gln 275 280 285 Asn Gly Leu Arg Ile Lys Thr Trp Gln Gly Gly Ser Gly Met Ala Ser 290 295 300 His Ile Ile Tyr Glu Asn Val Glu Met Ile Asn Ser Glu Asn Pro Ile 305 310 315 320 Leu Ile Asn Gln Phe Tyr Ser Thr Ser Ala Ser Ala Ser Gln Asn Gln 325 330 335 Arg Ser Ala Val Gln Ile Gln Asp Val Thr Tyr Lys Asn Ile Arg Gly 340 345 350 Thr Ser Ala Thr Ala Ala Ala Ile Gln Leu Lys Ser Ser Asp Ser Met 355 360 365 Pro Ser Lys Asp Ile Lys Leu Ser Asp Ile Ser Leu Lys Leu Thr Ser 370 375 380 Gly Lys Ile Ala Ser Ser Leu 385 390 <210> 3 <211> 7 <212> PRT <213> Artificial Sequence <220> <223> Synthesized peptide linker <400> 3 Gly Ala Val Val Arg Gly Ala 1 5 SEQUENCE LISTING <110> Cour Pharmaceuticals Development Company Getts, Daniel R. <120> TIMPs Encapsulating Japanese Cedar Pollen Epitopes <130> COUR-014 / 02WO <150> US 62 / 293,261 <151> 2016-02-09 <160> 3 <170> PatentIn version 3.5 <210> 1 <211> 329 <212> PRT <213> Cryptomeria japonica <400> 1 Met Asp Asn Pro Ile Asp Ser Ser Trp Arg Gly Asp Ser Asn Trp Ala 1 5 10 15 Gln Asn Arg Met Lys Leu Ala Asp Ser Ala Val Gly Phe Gly Ser Ser 20 25 30 Thr Met Gly Gly Lys Gly Gly Asp Leu Tyr Thr Val Thr Asn Ser Asp 35 40 45 Asp Asp Pro Val Asn Pro Ala Pro Gly Thr Leu Arg Tyr Gly Ala Thr 50 55 60 Arg Asp Arg Pro Leu Trp Ile Ile Phe Ser Gly Asn Met Asn Ile Lys 65 70 75 80 Leu Lys Met Pro Met Tyr Ile Ala Gly Tyr Lys Thr Phe Asp Gly Arg 85 90 95 Gly Ala Gln Val Tyr Ile Gly Asn Gly Gly Pro Ser Val Phe Ile Lys 100 105 110 Arg Val Ser Asn Val Ile Ile His Gly Leu His Leu Tyr Gly Ser Ser 115 120 125 Thr Ser Val Leu Gly Asn Val Leu Ile Asn Glu Ser Phe Gly Val Glu 130 135 140 Pro Val His Pro Gln Asp Gly Asp Ala Leu Thr Leu Arg Thr Ala Thr 145 150 155 160 Asn Ile Trp Ile Asp His Asn Ser Phe Ser Asn Ser Ser Asp Gly Leu 165 170 175 Val Asp Val Thr Leu Ser Ser Thr Gly Val Thr Ile Ser Asn Asn Leu 180 185 190 Phe Phe Asn His His Lys Val Met Leu Leu Gly His Asp Asp Ala Tyr 195 200 205 Ser Asp Lys Ser Met Lys Val Thr Val Ala Phe Asn Gln Phe Gly 210 215 220 Pro Asn Ser Gly Gln Arg Met Met Arg Ala Arg Tyr Gly Leu Val His 225 230 235 240 Val Ala Asn Asn Asn Tyr Asp Pro Trp Thr Ile Tyr Ala Ile Gly Gly 245 250 255 Ser Ser Asn Pro Thr Ile Leu Ser Glu Gly Asn Ser Phe Thr Ala Pro 260 265 270 Asn Glu Ser Tyr Lys Lys Gln Val Thr Ile Arg Ile Gly Ser Lys Thr 275 280 285 Ser Ser Ser Ser Asn Trp Val Trp Gln Ser Thr Gln Asp Val Phe 290 295 300 Tyr Asn Gly Ala Tyr Phe Val Ser Ser Gly Lys Tyr Glu Gly Gly Asn 305 310 315 320 Ile Tyr Thr Lys Lys Glu Ala Phe Asn 325 <210> 2 <211> 391 <212> PRT <213> Cryptomeria japonica <400> 2 Val Glu Asn Gly Asn Ala Thr Pro Gln Leu Thr Lys Asn Ala Gly Val 1 5 10 15 Leu Thr Ser Ser Leu Ser Lys Arg Cys Arg Lys Val Glu His Ser Arg 20 25 30 His Asp Ala Ile Asn Ile Phe Asn Val Glu Lys Tyr Gly Ala Val Gly 35 40 45 Asp Gly Lys His Asp Ser Thr Glu Ala Phe Ser Thr Ala Trp Gln Ala 50 55 60 Ala Ser Lys Lys Pro Ser Ala Met Leu Leu Val Pro Gly Asn Lys Lys 65 70 75 80 Phe Val Val Asn Asn Leu Phe Phe Asn Gly Pro Ser Gln Pro His Phe 85 90 95 Thr Phe Lys Val Asp Gly Ile Ile Ala Ala Tyr Gln Asn Pro Ala Ser 100 105 110 Trp Lys Asn Asn Arg Ile Trp Leu Gln Phe Ala Lys Leu Thr Gly Phe 115 120 125 Thr Leu Met Gly Lys Gly Val Ile Asp Gly Gln Gly Lys Gln Trp Trp 130 135 140 Ala Gly Gln Ser Lys Trp Val Asn Gly Arg Glu Ile Ser Asn Asp Arg 145 150 155 160 Asp Arg Pro Thr Ala Ile Lys Phe Asp Phe Ser Thr Gly Leu Ile Ile 165 170 175 Gln Gly Leu Lys Leu Met Asn Ser Pro Glu Phe His Leu Val Phe Gly 180 185 190 Asn Ser Glu Gly Val Lys Ile Ile Gly Ile Ser Ile Thr Ala Pro Arg 195 200 205 Asp Ser Pro Asn Thr Asp Gly Ile Asp Ile Phe Ala Ser Lys Asn Phe 210 215 220 His Leu Gln Lys Asn Thr Ile Gly Thr Gly Asp Asp Ser Val Ala Ile 225 230 235 240 Gly Thr Gly Ser Ser Asn Ile Val Ile Glu Asp Leu Ile Ser Gly Pro 245 250 255 Gly His Gly Ile Ser Ile Gly Ser Leu Gly Arg Glu Asn Ser Arg Ala 260 265 270 Glu Val Ser Tyr Val His Val Asn Gly Ala Lys Phe Ile Asp Thr Gln 275 280 285 Asn Gly Leu Arg Ile Lys Thr Trp Gln Gly Gly Ser Gly Met Ala Ser 290 295 300 His Ile Ile Tyr Glu Asn Val Glu Met Ile Asn Ser Glu Asn Pro Ile 305 310 315 320 Leu Ile Asn Gln Phe Tyr Ser Thr Ser Ala Ser Ala Ser Gln Asn Gln 325 330 335 Arg Ser Ala Val Gln Ile Gln Asp Val Thr Tyr Lys Asn Ile Arg Gly 340 345 350 Thr Ser Ala Thr Ala Ala Ile Gln Leu Lys Ser Ser Asp Ser Met 355 360 365 Pro Ser Lys Asp Ile Lys Leu Ser Asp Ile Ser Leu Lys Leu Thr Ser 370 375 380 Gly Lys Ile Ala Ser Ser Leu 385 390 <210> 3 <211> 7 <212> PRT <213> Artificial Sequence <220> <223> Synthesized peptide linker <400> 3 Gly Ala Val Val Gly Ala 1 5
Claims (55)
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662293261P | 2016-02-09 | 2016-02-09 | |
| US62/293,261 | 2016-02-09 | ||
| PCT/US2017/017248 WO2017139498A1 (en) | 2016-02-09 | 2017-02-09 | Timps encapsulating japanese cedar pollen epitopes |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20180105243A true KR20180105243A (en) | 2018-09-27 |
Family
ID=59563413
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020187025977A KR20180105243A (en) | 2016-02-09 | 2017-02-09 | TIMPS encapsulating Japanese cedar pollen epitope |
Country Status (3)
| Country | Link |
|---|---|
| JP (2) | JP2019504895A (en) |
| KR (1) | KR20180105243A (en) |
| WO (1) | WO2017139498A1 (en) |
Families Citing this family (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9850296B2 (en) | 2010-08-10 | 2017-12-26 | Ecole Polytechnique Federale De Lausanne (Epfl) | Erythrocyte-binding therapeutics |
| US9517257B2 (en) | 2010-08-10 | 2016-12-13 | Ecole Polytechnique Federale De Lausanne (Epfl) | Erythrocyte-binding therapeutics |
| AU2011289579B2 (en) | 2010-08-10 | 2016-11-17 | Ecole Polytechnique Federale De Lausanne | Erythrocyte-binding therapeutics |
| US9597385B2 (en) | 2012-04-23 | 2017-03-21 | Allertein Therapeutics, Llc | Nanoparticles for treatment of allergy |
| AU2014248090B2 (en) | 2013-04-03 | 2018-08-02 | N-Fold Llc | Novel nanoparticle compositions |
| US10046056B2 (en) | 2014-02-21 | 2018-08-14 | École Polytechnique Fédérale De Lausanne (Epfl) | Glycotargeting therapeutics |
| BR112016019274A2 (en) | 2014-02-21 | 2017-10-10 | Anokion Sa | glyco-oriented therapeutic agents |
| US10946079B2 (en) | 2014-02-21 | 2021-03-16 | Ecole Polytechnique Federale De Lausanne | Glycotargeting therapeutics |
| US10953101B2 (en) | 2014-02-21 | 2021-03-23 | École Polytechnique Fédérale De Lausanne (Epfl) | Glycotargeting therapeutics |
| JP6904959B2 (en) * | 2016-01-04 | 2021-07-21 | クール ファーマシューティカルズ ディベロップメント カンパニー インコーポレイテッド | Particles encapsulating a fusion protein containing a binding epitope |
| EP3638296A1 (en) | 2017-06-16 | 2020-04-22 | The University Of Chicago | Compositions and methods for inducing immune tolerance |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPWO2007024026A1 (en) * | 2005-08-25 | 2009-03-05 | 明石 満 | Biodegradable nanoparticles having T cell recognition epitope peptide immobilized or encapsulated therein |
| ES2762187T3 (en) * | 2013-08-13 | 2020-05-22 | Univ Northwestern | Peptide-conjugated particles |
-
2017
- 2017-02-09 WO PCT/US2017/017248 patent/WO2017139498A1/en active Application Filing
- 2017-02-09 JP JP2018560744A patent/JP2019504895A/en active Pending
- 2017-02-09 KR KR1020187025977A patent/KR20180105243A/en unknown
-
2022
- 2022-03-31 JP JP2022059997A patent/JP2022101576A/en active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| WO2017139498A1 (en) | 2017-08-17 |
| JP2019504895A (en) | 2019-02-21 |
| JP2022101576A (en) | 2022-07-06 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11389517B2 (en) | Peptide conjugated particles | |
| KR20180105243A (en) | TIMPS encapsulating Japanese cedar pollen epitope | |
| AU2016379413B2 (en) | Covalent polymer-antigen conjugated particles | |
| KR102283760B1 (en) | Peptide conjugated particles |