KR20140053865A - 항-erbb3제를 포함하는 조합 요법 - Google Patents
항-erbb3제를 포함하는 조합 요법 Download PDFInfo
- Publication number
- KR20140053865A KR20140053865A KR1020137025188A KR20137025188A KR20140053865A KR 20140053865 A KR20140053865 A KR 20140053865A KR 1020137025188 A KR1020137025188 A KR 1020137025188A KR 20137025188 A KR20137025188 A KR 20137025188A KR 20140053865 A KR20140053865 A KR 20140053865A
- Authority
- KR
- South Korea
- Prior art keywords
- erbb2
- hsa
- lapatinib
- cell
- combination
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K33/00—Medicinal preparations containing inorganic active ingredients
- A61K33/24—Heavy metals; Compounds thereof
- A61K33/243—Platinum; Compounds thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/135—Amines having aromatic rings, e.g. ketamine, nortriptyline
- A61K31/138—Aryloxyalkylamines, e.g. propranolol, tamoxifen, phenoxybenzamine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/337—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having four-membered rings, e.g. taxol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/4196—1,2,4-Triazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/517—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with carbocyclic ring systems, e.g. quinazoline, perimidine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/56—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids
- A61K31/565—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids not substituted in position 17 beta by a carbon atom, e.g. estrane, estradiol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7042—Compounds having saccharide radicals and heterocyclic rings
- A61K31/7052—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides
- A61K31/706—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom
- A61K31/7064—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom containing condensed or non-condensed pyrimidines
- A61K31/7068—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom containing condensed or non-condensed pyrimidines having oxo groups directly attached to the pyrimidine ring, e.g. cytidine, cytidylic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/39558—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against tumor tissues, cells, antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/32—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against translation products of oncogenes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P21/00—Preparation of peptides or proteins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
- A61K2039/507—Comprising a combination of two or more separate antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/622—Single chain antibody (scFv)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/31—Fusion polypeptide fusions, other than Fc, for prolonged plasma life, e.g. albumin
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Immunology (AREA)
- Molecular Biology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Microbiology (AREA)
- Mycology (AREA)
- Oncology (AREA)
- Genetics & Genomics (AREA)
- Biochemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Biophysics (AREA)
- Inorganic Chemistry (AREA)
- Zoology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Biomedical Technology (AREA)
- Wood Science & Technology (AREA)
- Endocrinology (AREA)
- Biotechnology (AREA)
- General Engineering & Computer Science (AREA)
- Cell Biology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Peptides Or Proteins (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Abstract
객체내에서 종양(예컨대 악성 종양)의 성장을 억제하기 위한 방법 및 조성물이 개시된다. 특히, ⅰ) 항-에스트로겐제의 유효량 또는 ⅱ) 수용체 티로신 키나아제 억제제의 유효량 및 이중특이성 항-ErbB2/항-ErbB3 항체의 유효량 및 선택적으로 트라스투주맙의 유효량을 공동 투여함에 의한 객체내에서 종양을 치료하기 조합 요법이 개시된다. 또한, i) 항-에스트로겐제 또는 ⅱ) 수용체 티로신 키나아제 억제제 및 트라스투주맙의 선택적 사용과 조합한 이중특이성 항-ErbB2/항-ErbB3 항체의 종양 치료에서의 용도를 개시한다.
Description
본 명세서에 개시된 본 발명의 다양한 양태는 암의 치료를 위한 방법 및 조성물에 관한 것이다.
유방암의 약 75%는 에스트로겐 수용체(estrogen receptor, ER) 양성이다. 다른 암들도 역시 ER 양성(ER+)이다. 에스트로겐 수용체는 세포분열의 빈도를 증가시킬 수 있고 종양의 성장을 촉진할 수 있는 세포내 신호전달을 매개한다. 타목시펜(tamoxifen), 풀베스트란트(fulvestrant), 및 레트로졸(letrozole)과 같은 항-내분비치료(anti-endorine therapy)가 ER+ 유방암 환자의 치료에 있어서 상당한 효과를 나타낸다는 점이 입증되었으나, 이러한 치료에 대한 내인성 또는 후천성 내성은 이들 치료의 성공에 있어서 제한 요인이다. 유방암 및 다른 암에 있어서 인간상피세포 성장인자 수용체 2(HER2 또는 ErbB2)의 증폭이 자주 발생함에 따라 ErbB2를 치료 타겟으로 한 약물에 대한 연구 및 개발이 이루어져 왔다.
항-ErbB2 단클론항체 트라스투주맙(trastuzumab) 및 ErbB1/ErbB2 이중 수용체 티로신 키나아제 억제제 라파티닙(lapatinib) 모두가 임상에서의 성공적 치료에 부합하지만, 다수의 환자들이 이러한 약물의 혜택을 받지 못하고 있다. 또한, 초기에 약물에 반응하던 대부분의 환자들이 이러한 치료를 사용한 연장된 치료 후에 결과적으로 재발하게 될 것이다.
ErbB2/ErbB3 헤테로다이머는 상호작용의 강도, 수용체 티로신 인산화에 대한 영향, 및 마이토겐 활성화 단백질 키나아제 및 포스포이노시티드-3 키나아제 경로를 통한 다운스트림 신호전달에 미치는 영향의 관점에서 가장 강력한 ErbB 수용체쌍이다.
헤레굴린(Heregulin)은 ErbB3에 대한 1차 리간드이고, ErbB2/ErbB3 헤테로다이머에 의한 신호전달을 활성화시킨다. 현재 ErbB2-타겟 치료는 헤레굴린 활성화 신호전달을 효과적으로 억제하지 않는다. MM-111은 ErbB2의 생물학적 활성에 특별히 영향을 미치지 않으면서 헤레굴린의 ErbB2/ErbB3에의 결합을 해제하여 헤레굴린에 의한 ErbB2/ErbB3의 활성화를 억제하는 이중특이성 항-ErbB2/항-ErbB3 항체이다. HER-2+ 위암, 유방암, 자궁경부암 및 폐암의 전임상 모델에서 MM-111는 ErbB3 인산화, 세포주기 진행 및 종양성장을 억제한다.
따라서, 에스트로겐 수용체 신호전달 활성 또는 ErB1 및 ErbB2 수용체 신호전달 활성의 향상된 억제를 제공하는 치료제 및 치료 전략 뿐만 아니라, ErbB3 활성화(예를 들어, 리간드-유도 활성화)의 향상된 억제를 제공하는 치료제 및 치료 전략에 대한 요구가 존재한다.
암의 치료에서, 다수의 항암 약물 공동 투여(조합 요법)은 종종 단일 요법에 비해 더 좋은 결과를 제공한다. 이러한 결과는 저가산적, 가산적, 또는 상가적 효과일 수 있다. 즉, 각각이 정량화할 수 있는 정도의 혜택를 제공하는 2가지 항암 약물의 조합된 효과는 각 약물의 혜택을 합한 것보다 적거나, 합한 것과 동등하거나 혹은 합한 것보다 더 클 수 있다. 예를 들어, 치사 암을 치료하는데 각각 단독으로 사용하는 경우 무진행 생존을 평균 1년 연장시키는 2가지의 약물을 함께 사용하는 경우, 24개월 연장 보다 작거나(예를 들어 18개월 연장), 약 24개월의 연장이거나, 혹은 24개월 연장 보다 긴 무진행 생존의 연장 효과를 제공하게 된다. 일반적으로는 암 치료를 위한 조합 치료는 상당한 저가산적 효과를 초래한다. 조합 치료의 결과가 가산적 효과에 근접하거나, 가산적이거나 혹은 상가적 효과인 경우가 가장 바람직하지만 이러한 효과들은 매우 드물게 나타난다. 또한, 두가지의 약물을 함께 투여하는 경우에 많은 약물들은 생물학적 이용가능성을 변경시키거나, 혹은 다른 약물의 안전성 프로파일에 영향을 미치게 된다. 새로운 약물들은 최초로 조합 치료에서 사용되기 때문에, 환자에게서 약물-약물 상호작용에 의해 매개되는 독성을 유발하는 뜻밖의 위험한 약물-약물간 상호작용이 관찰될 수도 있다.
암 치료를 위한 ErbB2/ErbB3 헤테로다이머-타겟된 약제를 투여하는 것을 포함하는 조합 요법을 안전하게 투여하며, 특히 가산적 효과에 근접하거나, 가산적이거나 혹은 상가적 효과를 발휘할 수 있는 조합 요법에 대한 접근방법이 요구되고 있다.
본 발명은 ErbB3 활성화의 억제 및 에스트로겐 수용체 활성화의 억제에 효과적인 방법 및 조성물을 제공한다. 또한, 본 발명은 ErbB3 활성화의 억제 및 ErB1 및/또는 ErbB2 활성화의 억제에 효과적인 방법 및 조성물을 제공한다. 이러한 방법 및 조성물은 종양, 예를 들어 악성 종양 뿐만 아니라 다른 암의 치료에 유용하다.
제1의 구현예에서, 본 발명은 악성 종양을 갖는 객체(subject)를 치료하는 방법을 제공하며, 상기 종양은 ErbB2 발현 또는 ErbB2 과발현 종양(예를 들어, HER++ 또는 HER+++ 종양)일 수 있으며, 상기 종양은 흑색종, 투명세포육종, 두경부종양, 자궁내막종양, 전립선종양, 유방종양, 난소종양, 위종양, 대장종양, 대장직장종양, 폐종양, 방광종양, 췌장종양, 침샘종양, 간종양, 피부종양, 뇌종양 또는 신장종양일 수 있다. 상기 방법은 항-ErbB3제, 예를 들어 이중 특이성 항-ErbB2/항-ErbB3 항체(예를 들어, 서열번호 1에 개시된 아미노산 서열을 포함하는 항체)의 유효량 및 선택적으로 트라스투주맙의 유효량과 조합하여, 항-에스트로겐제의 유효량 또는 수용체 티로신 키나아제 억제제의 유효량을 객체에 공동 투여하는 단계를 포함한다.
본 발명의 일 양태에서, 이중 특이성 항-ErbB2/항-ErbB3 항체 및 항-에스트로겐제의 유효량 또는 수용체 티로신 키나아제 억제제의 유효량 및 선택적으로 트라스투주맙의 유효량과의 조합은 다음과 같은 특징을 갖는다: 제1의 농도에서의 이중 특이성 항-ErbB2/항-ErbB3 항체(예를 들어, 서열번호 1의 아미노산 서열을 포함하는 항체) 및 제2의 농도에서의 항-에스트로겐제 또는 제3의 농도에서의 수용체 티로신 키나아제 억제제(예를 들어, 라파티닙)(단, 상기 각 농도는 다른 농도와 서로 동일하거나 상이하다)를 포함하는 제1의 조직배양배지를 제조하고, 상기 배지는 세포배양내의 세포주의 암세포와 접촉되고, 세포성장 또는 세포증식 또는 세포내의 pErbB3의 생산 또는 pAKT의 생산이 저해되거나 또는 배양내에서의 세포사멸성(apoptotic) 세포의 백분율이 증가한다. 특정의 양태에서, 세포성장 또는 세포증식 또는 세포내의 pErbB3의 생산 또는 pAKT의 생산이 저해되거나, 또는 배양내에서의 세포사멸성 세포의 백분율이 세포성장 또는 세포증식 또는 세포내의 pErbB3의 생산 또는 pAKT의 생산 보다 더 큰 정도로 증가하거나, 또는 배양내에서의 세포사멸성 세포의 백분율이, 세포배양내의 세포주의 암세포를 이중특이성 항-ErbB2/항-ErbB3 항체를 포함하지 않는 것을 제외하고 제1의 배지와 필수적으로 동일한 제2의 배지 및 어떠한 항-에스트로겐제를 포함하지 않고 어떠한 수용체 티로신 키나아제 억제제를 포함하지 않는 것을 제외하고 제1의 배지와 필수적으로 동일한 제3의 배지 각각과 접촉시키는 때 보다 더 낮은 정도로 증가한다.
본 발명의 다른 양태에서, 모든 유효량은 마우스 유효량 또는 인간 유효량이다. 본 발명의 다른 양태에서, 모든 유효량은 마우스 유효량이고, 이중특이성 항-ErbB2/항-ErbB3 항체(선택적으로 서열번호 1에 개시된 아미노산 서열을 포함하는 항체) 및 항-에스트로겐제의 유효량 또는 수용체 티로신 키나아제 억제제의 유효량과의 조합은 다음과 같은 특징을 갖는다: 측정된 부피의 종양을 갖는 BT474-M3 이종이식 종양을 포함하는 마우스에 공동 투여하는 때에, 상기 조합은 공동 투여의 32일 후에 종양 부피 증가의 억제에 있어서 항-에스트로겐제의 유효량 또는 수용체 티로신 키나아제 억제제의 유효량과의 공동 투여가 없는 이중 특이성 항-ErbB2/항-ErbB3 항체의 마우스 유효량의 투여 보다 더 효과적이다. 다른 양태에서, 트라스투주맙의 마우스 유효량은 이중특이성 항-ErbB2/항-ErbB3 항체와 공동 투여된다.
제2의 구현예에서, 이중특이성 항-ErbB2/항-ErbB3 항체(선택적으로 서열번호 1을 포함하는 항체)의 암(선택적으로 흑색종, 투명세포육종, 두경부종양, 자궁내막종양, 전립선종양, 유방종양, 난소종양, 위종양, 대장종양, 대장직장종양, 폐종양, 방광종양, 췌장종양, 침샘종양, 간종양, 피부종양, 뇌종양 또는 신장종양)치료에 대한 조합 요법이 제공되며, 상기 조합 요법은 항-에스트로겐제 또는 수용체 티로신 키나아제 억제제의 수반적인 사용 및 선택적으로 트라스투주맙의 수반적인 사용을 포함한다.
제3의 구현예에서, 제1의 농도에서의 이중 특이성 항-ErbB2/항-ErbB3 항체(선택적으로 서열번호 1에 개시된 아미노산 서열을 포함하는 항체) 및 제2의 농도에서의 항-에스트로겐제 또는 제3의 농도에서의 수용체 티로신 키나아제 억제제를 포함하는 수용액을 제공한다. 특정의 양태에서, 제1의 농도에서의 이중특이성 항-ErbB2/항-ErbB3 항체, 및 제2의 농도에서의 항-에스트로겐제 또는 제3의 농도에서의 수용체 티로신 키나아제 억제제를 포함하는 제1의 조직배양배지가 제조되고, 상기 배지를 세포배양내에서 세포주의 암세포와 접촉하는 때에, 세포성장 또는 세포증식 또는 세포내에서의 pErbB3 생산 또는 pAKT 생산이 억제되거나 또는 배양내에서 세포사멸성 세포의 백분율이 증가한다. 특정의 양태에서, 세포성장 또는 세포증식 또는 세포내의 pErbB3의 생산 또는 pAKT의 생산이 억제되거나, 또는 배양내에서의 세포사멸성 세포의 백분율이 세포성장 또는 세포증식 또는 세포내의 pErbB3의 생산 또는 pAKT의 생산 보다 더 큰 정도로 증가하거나, 또는 배양내에서의 세포사멸성 세포의 백분율이, 세포배양내의 세포주의 세포를 어떠한 항-에스트로겐제를 포함하지 않고 어떠한 수용체 티로신 키나아제 억제제를 포함하지 않는 것을 제외하고 제1의 배지와 필수적으로 동일한 제2의 조직배양배지와 접촉시키는 때 보다 더 낮은 정도로 증가한다. 다른 양태에서, 세포성장 또는 세포증식 또는 세포내의 pErbB3의 생산 또는 pAKT의 생산이 저해되거나, 또는 배양내에서의 세포사멸성 세포의 백분율이, 세포배양내의 세포주의 세포를 어떠한 이중특이성 항-ErbB2/항-ErbB3 항체를 포함하지 않는 것을 제외하고 제1의 배지와 필수적으로 동일한 제3의 조직배양배지와 접촉시키는 때 보다 더 낮은 정도로 증가한다.
다른 양태에서, 상기 수용액은 객체에서의 혈장이고, 상기 객체는 객체에게 투여되고 있는 치료에서의 변화가 요구되기에 충분한 독성을 경험하지 않으며, 상기 독성은 객체에서 이중특이성 항-ErbB2/항-ErbB3 항체 및 항-에스트로겐제 또는 수용체 티로신 키나아제 억제제간의 약물-약물 상호작용에 의해 매개된다.
다른 양태에서, 상기 수용액은 제4의 농도에서의 트라스투주맙을 더욱 포함하고, 상기 배지도 제4의 농도에서의 트라스투주맙을 포함한다. 다른 양태에서, 상기 방법, 조합 요법, 또는 수용액은 아로마타제(aromatase) 억제제 또는 에스트로겐 수용체 길항제(antagonist)를 포함하지 않는다. 다른 양태에서, 상가 방법, 조합 요법 또는 수용액은 nap-파클리탁셀(nab-paclitaxel)을 포함한다. 상기 각 구현예 및 양태에서, 항-에스트로겐제는 에스트로겐 수용체 길항제(예를 들어, 풀베스트란트 또는 타목시펜) 또는 아로마타제 억제제(예를 들어, 아로마타제 억제제는 레트로졸, 엑세메스탄(exemestane), 아나스트로졸(anastrozole), 아미노글루테티미드(aminoglutethimide), 테스토락톤(testolactone), 보로졸(vorozole), 포르메스탄(formestane), 또는 파드로졸(fadrozole) 이다). 바람직하게는 상기 아로마타제 억제제는 레트로졸이다. 또한 상기 각 구현예 및 양태에서, 수용체 티로신 키나아제 억제제는 엘로티닙(erlotinib), 아파티닙(afatinib), 다사티닙(dasatinib), 제피티닙(gefitinib), 이마티닙(imatinib), 파조피닙(pazopinib), 라파티닙(lapatinib), 수니티닙(sunitinib), 니로티닙(nilotinib) 또는 소라페닙(sorafenib) 이다. 바람직하게는 상기 수용체 티로신 키나아제 억제제는 라파티닙이다. 또한, 상기 각 구현예 및 양태에서, 이중특이성 항-ErbB2/항-ErbB3 항체는 A5-HSA-ML3.9, ML3.9-HSA-A5, A5-HSA-B1D2, B1D2-HSA-A5, B12-HSA-B1D2, B1D2-HSA-B12, A5-HSA-F5B6H2, F5B6H2-HSA-A5, H3-HSA-F5B6H2, F5B6H2-HSA-H3, F4-HSA-F5B6H2, F5B6H2-HSA-F4, B1D2-HSA-H3, H3-HSA-B1D2, 또는 서열번호 1에 개시된 아미노산 서열을 포함하는 항체이다. 상기 각 구현예 및 양태에서, 카페시타빈(capecitabine) 및/또는 시스플라틴(cisplatin)의 사용을 포함한다.
상기 각 구현예 및 양태에서, a) 내지 x) 하나 이상이 선택적으로 적용될 수 있다: a) 상기 세포주는 BT474-M3이다; b) 상기 배양은 스페로이드 배양(spheroid culture)이다; c) 선택적으로 제조자의 지시서에 따라, 파클리탁셀 또는 또 다른 탁산(taxane) 또는 또 다른 화학요법약물이 공동 투여된다; d) 항-에스트로겐제는 제조자의 지시에 따라 투여된다; e) 수용체 티로신 키나아제 억제제는 제조자의 지시에 따라 투여된다; f) 트라스투주맙은 제조자의 지시에 따라 투여된다; g) 이중특이성 항-ErbB2/항-ErbB3 항체와 항-에스트로겐제의 공동 투여는 가산적 또는 상가적 효과를 생성한다; h) 이중특이성 항-ErbB2/항-ErbB3 항체와 수용체 티로신 키나아제 억제제(라파티닙)와의 공동 투여는 약 실질적으로 가산적 또는 상가적 효과를 생성한다; i) 이중특이성 항-ErbB2/항-ErbB3 항체는 서열번호 1를 포함하는 항체이고, 아래 실시예 12 및 13에서 기재된 투여 요법(regimen)(예를 들어, 모드, 투여량, 투여 간격, 부하 용량(loading dose), 유지 용량(maintenance doase) 및 투여 계획)중의 어느 하나에 따라 투여된다; j) 상기 라파티닙은 아래 실시예 16에서 기재된 투여 요법(예를 들어, 모드, 투여량, 투여 간격, 부하 용량, 유지 용량 및 투여 계획)중의 어느 하나에 따라 투여된다.
본 발명에서 제공되는 바와 같이, 이중특이성 항-ErbB2/항-ErbB3 항체 (예를 들어 MM-111)는 암을 갖는 인간 환자의 효과적인 치료를 제공하기 위해 하나 이상의 추가 치료제(예를 들어 아로마타제 억제제 또는 티로신 키나아제 억제제)와 함께 공동 투여된다.
용어 “항-ErbB3제”는 ErbB3에 결합하거나, ErbB3 특이적 리간드에 결합하거나, 또는 ErbB3의 발현을 억제함으로써 ErbB3에 의해 매개되는 세포 신호전달의 활성을 억제하는 임의의 치료제를 지칭한다. 항-ErbB3제의 형태의 비제한적예는 항체, 이중특이성 항체, 리간드 유사체, ErbB3의 가용성 형태 또는 ErbB3 엑토도메인, ErbB3 특이적 RNAi 분자, 및 유사한 생물학적 약제를 포함한다.
용어 “항체”는 특정 항원, 예를 들어 ErbB3에 특이적으로 결합하는 적어도 하나의 항체-유래 항원 결합 자리[예를 들어, VH/VL 영역 또는 Fv, 또는 CDR(complementarity determining region)]를 포함하는 폴리펩티드를 지칭한다.
“항체”는 전체 항원 및 항원 결합 단편, 예를 들어 Fab 또는 Fv 또는 단일쇄단편 (예를 들어 scFv) 뿐만 아니라 이중특이성 항체 및 유사한 가공된 변이체, 인간 항체, 인간화 항체, 키메릭 항체들 Fabs, Fab’2s, ScFvs, SMIPs, 아피바디(Affibodies), 나노바디(nanobodies), 또는 도메인 항체, 및 하기 임의의 이소타입: IgG1, IgG2, IgG3, IgG4, IgM, IgA1, IgA2, IgAsec, IgD, 및 IgE을 포함한다. 상기 항체는 천연 항체이거나 또는 변형(예를 들어, 돌연변이, 결실, 치환, 비-항체 부분에 컨쥬게이션)된 항체일 수 있다. 예를 들어, 항체는 항체의 특성(예를 들어 기능적 특성)을 변화시키는 하나 이상의 (천연의 항체와 비교하여) 변이된 아미노산을 포함할 수 있다. 예를 들어, 환자에서 예를 들어 반감기, 이펙터(effector) 기능, 및/또는 항체에 대한 면역반응에 영향을 미치는 상기와 같은 다양한 변이는 당업계에 공지되어 있다. 따라서 용어 “항체”는 전체 항체 및 이들이 항체의 결합 특이성을 유지하고 있다는 조건하에 임의의 항원 결합 단편(즉, “항원-결합 부분”, 예컨대 Fabs) 또는 이들의 단일쇄 뿐만 아니라 이중특이성 항체 및 유사한 가공된 변이체를 포함한다.
“항-ErbB3 항체”는 ErbB3의 엑토도메인(ectodomain)에 면역특이적으로 결합하는 항체이고, “항-ErbB2 항체”는 ErbB2의 엑토도메인에 면역특이적으로 결합하는 항체이다. 항체는 단리된 항체일 수 있다. 그러한 ErbB3 또는 ErbB2에의 결합은 표면 플라즈몬 공명 분석법 또는 세포 결합 분석법에 의해 측정하여 50 nM 보다 크지 않은 Kd 값을 나타낸다. 예시적 항-ErbB3 항체는 EGF-유사 리간드 매개된 ErbB3의 인산화를 억제하며, 예컨대, 헤레굴린의 ErbB2/ErbB3 헤테로다이머로의 결합을 저해하는 항-ErbB2 항체. EGF-유사 리간드는 일반적으로 ErbB1에 결합하여 ErbB1과 ErbB3의 헤테로다이머화를 유도하는, EGF, TGFα, 베타셀룰린(betacellulin), 헤파린결합성 상피세포 성장인자, 비레굴린(biregulin), 에피겐(epigen), 에피레굴린(epiregulin), 및 암피레굴린(amphiregulin)을 포함한다.
본 명세서에서 사용된 용어 “이중 특이성 항체”는 제1의 항원 또는 에피토프에 면역특이적 결합을 나타내는 제1의 결합자리 및 제1의 항원과 구별되는 제2의 항원 또는 에피토프에 면역특이적 결합을 나타내는 제2의 결합자리로서 2개의 항원 결합 자리를 포함하는 단백질을 의미한다. “항-ErbB2/항-ErbB3 이중특이성 항체”는 ErbB3의 엑토도메인에 면역특이적으로 결합하는 하나의 결합자리 및 ErbB2의 엑토도메인에 면역특이적으로 결합하는 다른 하나의 결합자리인 2개의 결합자리를 포함하는 항체이다. 바람직하게는 이중특이성 ErbB3, ErbB2 항체는 서열번호 1을 포함하는 항체이다.
본 명세서에서 사용되는 “항-에스트로겐제”는 에스트로겐의 생성을 방지하거나 감소시키는 또는 에스트로겐 수용체에 의해 매개되는 신호전달을 방지하거나 감소시키는 약제를 의미한다. 항-에스트로겐제는 에스트로겐 수용체 길항제 및 아로마타제 억제제를 포함하나 이에 한정되지 않는다. 에스트로겐 수용체 길항제는 라록시펜(raloxifene), 풀베스트란트(fulvestrant), 타목시펜(tamoxifen), 아피목시펜[afimoxifene, 4-hydoroxytamoxifen), 아르족시펜(arzoxifene), 토레미펜(toremifene), 및 라소폭손(lasofoxone)을 포함하나 이에 한정되지 않는다. 바람직하게는, 에스트로겐 수용체 길항제는 타목시펜 또는 풀베스트란트이다. 아로마타제 억제제는 동물(예컨대 마우스 또는 인간)에서 에스트로겐의 합성을 차단함으로써 작용한다. 이는 동물에서 에스트로겐 수준을 감소시키고, 이를 통해 에스트로겐 유발성 암의 성장을 저해한다. 아로마타제의 예로는 엑세메스탄(exemestane), 아나스트로졸(anastrozole), 레트로졸(letrozole), 아미노글루테티미드(aminoglutethimide), 테스토락톤(testolactone), 보로졸(vorozole), 포르메스탄(formestane), 및 파드로졸(fadrozole)을 포함하나 이에 한정되지 않는다. 바람직하게는 상기 아로마타제 억제제는 엑세메스탄 또는 레트로졸이다.
“암”은 비정상적이고, 조절되지 않으며 악성인 임의의 세포의 성장 상태를 의미한다.
“악성 종양”은 종양의 형태를 취하는 임의의 암을 의미한다.
용어 “유효량”은 원하는 효과, 예컨대 객체내에서 질병을 개선하는 효과를 달성하기에 효과적인 약물의 양을 지칭한다.
질병이 암인 경우, 약물의 유효량은 다음의 특징 중의 하나 이상을 억제(예컨대 어느 정도 늦추거나, 억제하거나 또는 중지) 할 수 있다: 암세포 성장, 암세포 증식, 암세포 이동성, 암세포의 주변 기관안으로의 침투, 종양 전이 및 종양 성장. 질병이 암인 경우, 약물의 유효량은 객체에게 투여되는 때에 다음의 특징 중의 하나 이상을 변경할 수 있다: 종양 성장의 지연 또는 중지, 종양 크기의 감소(예컨대 부피 또는 질량); 암과 관련된 증상들 중의 하나 이상을 어느 정도로 완화, 무진행 생존의 연장, (부분 반응 또는 완전 반응을 포함) 객관적 반응 결과, 및 전체 생존시간의 증가. 약물이 존재하는 암세포의 성장을 억제하거나 암세포를 사멸시키는 정도인 경우 이는 세포증식억제성 및/또는 세포독성이다.
“마우스 유효량”은 객체가 마우스인 경우에서의 원하는 효과를 달성하는 데 효과적인 약물의 양을 의미한다.
“인간 유효량”은 객체가 인간인 경우에서의 원하는 효과를 달성하는 데 효과적인 약물의 양을 의미한다.
용어들 “조합 요법(combination therapy)”, “조합 사용”, “공동 투여”, “공동 투여하는 것”, “공통 투여되는 것” 등은 적어도 2가지의 치료제를 객체에 동시에 투여하거나 또는 늦게 투여되는 치료제를 투여하는 때에는 먼저 투여되는 치료제의 효과가 객체내에서 여전히 작동하고 있는 시간의 기간 내에 투여하는 것을 의미한다.
본 명세서에서 사용된 “수용체 티로신 키나아제 억제제”는 수용체 티로신 키나아제를 특이적으로 저해함으로써 다양한 신호전달경로의 활성화를 감소시키거나 차단하는 약물 군의 하나의 일원을 의미한다.
본 명세서에 개시된 바와 같이 암의 치료에 유용한 수용체 티로신 키나아제 억제제는 소분자 저해제인 엘로티닙(erlotinib), 아파티닙(afatinib), 다사티닙(dasatinib), 제피티닙(gefitinib), 이마티닙(imatinib), 파조피닙(pazopinib), 라파티닙(lapatinib), 수니티닙(sunitinib), 니로티닙(nilotinib) 및 소라페닙(sorafenib)을 포함하나 이에 한정되지 않는다. 또한, 수용체 티로신 키나아제는 세툭시맙(cetuximab), 패니투무맙(panitumumab), 잘루투무맙(zalutumumab), 니모투주맙(nimotuzumab), 및 마투주맙(matuzumab)과 같은 항체 기반 치료제도 포함한다. 바람직하게는 상기 수용체 티로신 키나아제 억제제는 라파티닙이다.
“투여량” 또는 “투여 요법(dosing regimen)”은 단위 시간당(예컨대, 시간당, 일당, 주당, 월당 등) 규정된 양으로 환자에게 약물을 투여하기 위한 파라미터를 지칭한다. 그러한 파라미터는 예를 들어 각 투여량의 크기를 포함한다. 상기 파라미터는 또한 예를 들어 단일 투여로 섭취되거나 하나 또는 그 이상의 유닛으로서, 예를 들어 경구(예컨대 하나, 둘, 셋 또는 그 이상의 정제, 캡슐 등) 또는 주사[예컨대, 볼루스(bolus)]로서 투여될 수 있는 것과 같은 각 투여량의 배열 형태도 포함한다. 투여량 크기는(예컨대 수분 또는 수시간의 기간에 걸친 정맥내 주입) 연속적으로 투여되는 투여량과 관련될 수 있다. 그러한 파라미터는 별개의 투여량의 투여의 빈도로서, 시간에 걸쳐 변화될 수 있는 빈도를 추가적으로 포함한다. “투여 사이클” 또는 “투여 간격”은 투여 요법을 위한 치료의 한 사이클(예컨대 21일 또는 28일)을 포함하는 시간의 기간이다. “투여량”은 단일의 투여에서 주어지는 약물의 양을 의미한다.
세포주의 바람직한 암세포는 ErbB2 과발현 세포주와 같은 ErbB2 발현 세포주이며, 예컨대, BT474-M3 (ATCC# CRL- HTB-20™, 유관 암세포로부터 유래된 세포), BT474-M3-Aro (인간 아로마타제를 안정하게 발현하는 BT474-M3 세포), ZR75-30 (ATCC# CRL-1504™, 유관 암세포로부터 유래된 세포), SKOV-3 (ATCC# HTB-77™, 전이성 난소선암세포로부터 유래한 세포), MCF7 (ATCC# HTB-22™) clone 18, MDA-MB-453 (ATCC# HTB-131™, 유방암세포로부터 유래한 세포), SK-BR-3 (ATCC# HTB-30™, 유방 선암세포로부터 유래한 세포), 및 NCI-N87 (ATCC# CRL-5822™, 위암 세포로부터 유래한 세포)를 포함한다. 암은 예를 들어 육종(예컨대, 투명세포육종)과 같은 고형암, 암종(예컨대, 신장암), 및 림프종; 유방종양, 대장종양, 직장종양, 폐종양, 인두종양, 하인두종양, 식도종양, 위종양, 췌장종양, 간종양, 담낭종양, 담도종양, 소장종양, 비뇨기계 종양(신장, 방광, 및 요로 상피에서의 종양을 포함), 여성 생식기계 종양(자궁경부종양, 자궁종양, 난소종양, 융모종, 임신성 융모종를 포함), 남성 생식기계 종양(전립선, 정낭, 및 고환에서의 종양을 포함), 내분비선종양(갑상선, 부신, 및 뇌하수체에서의 종양을 포함), 피부종양(혈관종, 흑색종, 뼈 혹은 연조직으로부터 유래한 육종, 및 카포시 육종을 포함), 뇌 및 수막 종양(성상세포종, 신경절교종, 해면교아종, 망막아세포종, 신경종, 신경아세포종, 신경초종, 및 신경아세포종을 포함), 신경 종양 및 눈에서의 종양을 포함한다. 암은 에스트로겐 수용체 양성(ER+) 암일 수 있다. 그러한 암은 항-에스트로겐제를 포함하는 치료 요법을 위한 후보물질을 전형적으로 예시한다. 그러한 암은 일정의 유방암, 난소암, 자궁암, 자궁내막암, 폐암, 뼈암, 뇌암, 방광암, 간암 및 비뇨 생식기암을 포함하나 이에 한정되지 않는다.
암은 ErbB2 유전자 증폭된 암 및/또는 ErbB2-발현 또는 ErbB2-과발현 암일 수 있다. HER2 또는 Neu으로도 알려진 ErbB2는 이의 세포내 티로신 키나아제 활성을 통해 세포내 신호(예컨대 리간드 활성화에 의해)를 발생시킬 수 있는 세포 표면의 막통과 수용체 단백질이다. 과도한 경우, 그러한 신호는 예컨대 세포 분열을 촉발함으로써 종양생성을 촉진할 수 있다. ErbB2 유전자는 비제한적 예로서 유방암, 난소암, 자궁내막암, 췌장암, 직장암, 전립선암, 침샘암, 신장암 및 폐암을 포함하는 많은 형태의 인간 악성종양에서 증폭 및/또는 과발현된다. ErbB2 과발현 암은 ErbB2 과발현 수준에 따라 HER2+++ 또는 HER2++으로 표시되며, HER2+++는 가장 높은 수준의 HER2 발현을 지시한다. HER2+++ 및 HER2++ 상태는 일반적으로 면역조직화학과 같은 면역분석법, 예를 들어 Herceptest에 의해 측정된다. ErbB2 유전자 증폭은 예컨대 FISH (fluorescence in situ hybridization)에 의해 측정될 수 있으며, HER2-증폭된 암세포는 HER2-증폭되는 둘 이상의 HER2 유전자 카피를 가지며, HER2-증폭된 세포 및/또는 종양은 FISH 양성”으로 지칭된다. scFv HSA 컨쥬게이트인 다수의 이중특이성 항-ErbB2, 항-ErbB3 항체는 미국공개특허 No. 2011-0059076, 및 PCT 공개특허 Nos. WO2009/126920 및 WO 2010/059315에 기재되어 있으며, 이들 각각은 이의 전체로 참조로서 본 명세서에 삽입되며, 이들 각각은 MM-111 (B2B3-1으로도 지칭됨) 및 scFv HSA 컨쥬게이트이고 본 명세서에서 제공된 방법 및 조성물에서의 사용에 적합한, A5-HSA-ML3.9, ML3.9-HSA-A5, A5-HSA-B1D2, B1D2-HSA-A5, B12-HSA-B1D2, B1D2-HSA-B12, A5-HSA-F5B6H2, F5B6H2-HSA-A5, H3-HSA-F5B6H2, F5B6H2-HSA-H3, F4-HSA-F5B6H2, F5B6H2-HSA-F4, B1D2-HSA-H3, 및 H3-HSA-B1D2의 구성성분을 포함한 다른 이중 특이성 항-ErbB2/항-ErbB3 항체를 공개한다. 다른 적합한 이중 특이성 항-ErbB2/항-ErbB3 항체는 미국특허 7,332,580 및 7,332,585에 공개되고 특허청구되어 있으며, 이들 문헌은 참조로서 본 명세서에 삽입된다. MM-111는 현재 진행된 난치성 HER2 양성 암 환자에서의 오픈 라벨 단계 1/2 및 MM-111의 약물학적 연구, 진행된 HER2 양성 유방암 환자에서 트라스투주맙(Herceptin)과 조합한 MM-111의 오픈 라벨 단계 1/2 시험, 및 다음의 세가지의 상이한 치료와 조합한 MM-111의 오픈 라벨 단계 1/2 및 약물학적 연구: 시스플라틴, 카페시타빈 및 트라스투주맙과 조합된 MM-111, 라파티닙 및 트라스투주맙과 조합된 MM-111, 및 파클리탁셀 및 트라스투주맙과 조합된 MM-111를 포함하여 임상시험중에 있다.
이중 특이성 항-ErbB2/항-ErbB3 항체 (예컨대 MM-111)는, 악성 종양에 대한 방사선 치료 또는 악성 종양을 제거하기 위한 외과적 중재의 이전에(예컨대 신보조 항암요법), 동시에, 또는 이후에(예컨대 수술후 보조요법), 다른 치료제(예컨대 항-에스트로겐 수용체제 또는 수용체 티로신 키나아제 억제제)와 함께 공동 투여될 수 있다. 항-ErbB2/항-ErbB3 항체와의 조합에 적합한 추가 치료제는 추가적으로 다음을 포함한다: 1) 단클론 항체 EGFR 억제제[예컨대, 세툭시맙(cetuximab), 패니투무맙(panitumumab), 잘루투무맙(zalutumumab), 니모투주맙(nimotuzumab), 및 마투주맙(matuzumab)], PKI-166, PD-158780, EKB-569, Tyrphostin AG 1478, 및 pan-HER 키나아제 억제제[예컨대 CI-1033 (PD 183805), AC480, HM781-36B, AZD8931 및 PF299804]과 같은 추가적인 소분자 티로신 키나아제 억제제; 2) 미세소관 안정화제[예컨대, 라우리말리드(laulimalide), 에포티론 A(epothilone A), 에포티론 B(epothilone B), 디스코더모리드(discodermolide), 엘레우터로빈(eleutherobin), 사르코딕틴 A(sarcodictyin A), 사르코딕틴 B, 파클리탁셀, nab-파클리탁셀 또는 도세탁셀]; 5-플루오로우라실(5-FU) 및 카페시타빈과 같은 대사길항물질; 및 옥살리플라틴(oxaliplatin), 카르보플라틴(carboplatin) 및 시스플라틴과 같은 백금 기반 치료제. 항-ErbB2/항-ErbB3 항체와의 조합에 적합한 치료제의 추가 예는 하기 표 7 및 부록(appendix)에서 찾을 수 있다.
MM-111는 대량생산 및 전신치료 모두에 적합하다. MM-111는 ErbB2/ErbB3 헤테로다이머에 결합하고, ErbB2 및 ErbB3와 트라이머 복합체를 형성하여 ErbB3 신호전달을 효과적으로 억제한다. MM-111의 항종양 활성은 ErbB2 및 ErbB3 모두의 존재가 요구되지만, 특히 ErbB2 발현에 의존적이다. 이의 ErbB2 항원 결합자리의 친화도는 이의 ErbB3 항원 결합 자리의 친화도보다 약 30배 높지만, ErbB2 항원 결합 자리는 ErbB2에 결합할때에 그 자체로서 ErbB2 활성을 억제하지 않는다.
MM-111이 ErbB2에 강하게 결합하는 경우 ErbB3 항원 결합 자리는 결합된 ErbB2/ErbB3 헤테로다이머에 매우 근접한 위치에 있게 되어, 결과적으로 ErbB3 항원 결합 자리가 헤테로다이머 ErbB3에의 결합을 더욱 강력하게 하는 결합효과를 초래하여, 이에 의해 생물학적 효과가 생성된다. MM-111는 인간 객체(환자)에게 측정된 일(day)의 간격에서 적어도 20 mg/kg의 MM-111의 단일 부하 용량(loading dose)으로서 적어도 7일 간격(예컨대 매 2주마다)으로, MM-111의 단일 유지 용량(maintenance dose)의 적어도 하나의 투여에 의해 투여되며, 상기 유지 용량은 일반적으로 상기 부하 용량 보다 작으며, 예컨대 부하 용량 보다 적어도 5 mg/kg이 작다.
객체내에서 종양(예컨대 악성 종양)의 성장을 억제하기 위한 방법 및 조성물이 개시된다. 특히, ⅰ) 항-에스트로겐제의 유효량 또는 ⅱ) 수용체 티로신 키나아제 억제제의 유효량 및 이중특이성 항-ErbB2/항-ErbB3 항체의 유효량 및 선택적으로 트라스투주맙의 유효량을 공동 투여함에 의한 객체내에서 종양을 치료하기 조합 요법이 개시된다. 또한, i) 항-에스트로겐제 또는 ⅱ) 수용체 티로신 키나아제 억제제 및 트라스투주맙의 선택적 사용과 조합한 이중특이성 항-ErbB2/항-ErbB3 항체의 종양 치료에서의 용도를 개시한다.
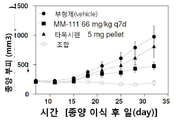
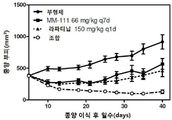
도 1은 MM-111 및 타목시펜의 조합이 MM-111 또는 타목시펜의 단독 투여 보다 인 비보 종양 성장의 억제가 더욱 우수한 것을 보여주는 그래프이다. x-축은 종양 이식 후의 시간을 일(day)로 나타내었으며, y-축은 종양 부피를 mm3의 단위로 나타내었다. 마우스는 BT474-M3 세포 이식 후 7일부터 억제제로 처리하였다.
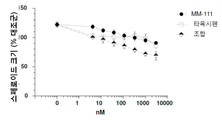
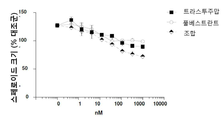
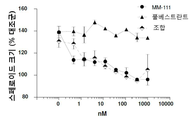
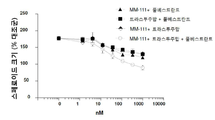
도 2는 인 비트로에서 에스트로겐 자극된 스페로이드 성장을 억제하는데 있어서 MM-111가 항-에스트로겐 약물과 양성적으로 조합되는 결과를 보여주는 7개의 그래프이다. 도 2a는 MM-111, 타목시펜(4-히드록시타목시펜, 4OHT), 또는 MM-111 및 타목시펜이 인 비트로 스페로이드 성장에 미치는 효과를 보여준다. 도 2b는 트라스투주맙, 타목시펜, 또는 트라스투주맙 및 타목시펜의 효과를 보여준다. 도 2c는 MM-111, 풀베스트란트(FVT), 또는 MM-111 및 풀베스트란트의 효과를 보여준다. 도 2d는 트라스투주맙, 풀베스트란트, 또는 트라스투주맙 및 풀베스트란트의 효과를 보여준다. 도 2e는 MM-111, 트라스투주맙, 또는 MM-111 및 트라스투주맙의 효과를 보여준다. 도 2f는 MM-111, 트라스투주맙, 및 타목시펜의 조합의 효과를 이들 약물 중의 2가지 약물의 조합의 효과와 비교하여 보여준다. 도 2g는 MM-111, 트라스투주맙, 및 풀베스트란트의 조합의 효과를 이들 약물 중의 2가지 약물의 조합의 효과와 비교하여 보여준다. x-축은 각 실험조건에서 각 약물 농도를 로그(log) 스케일로서 nM 단위로 표시하였고, y-축은 스페로이드의 크기를 대조군 스페로이드 크기에 대한 %로서 표시하였다.
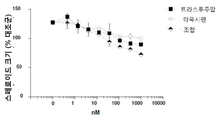
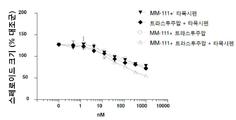
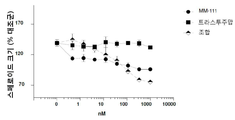
도 3은 인 비트로에서 헤레굴린(heregulin, HRG)-자극된 스페로이드 성장에 대해 MM-111이 항-에스트로겐 약물과 양성적으로 조합되는 결과를 보여주는 7개의 그래프이다. 도 3a는 MM-111, 타목시펜(4-히드록시타목시펜, 4OHT), 또는 MM-111 및 타목시펜의 효과를 보여준다. 도 3b는 트라스투주맙, 타목시펜, 또는 트라스투주맙 및 타목시펜의 효과를 보여준다. 도 3c는 MM-111, 풀베스트란트(FVT), 또는 MM-111 및 풀베스트란트의 효과를 보여준다. 도 3d는 트라스투주맙, 풀베스트란트, 또는 트라스투주맙 및 풀베스트란트의 효과를 보여준다. 도 3e는 MM-111, 트라스투주맙, 또는 MM-111 및 트라스투주맙의 효과를 보여준다. 도 3f는 MM-111, 트라스투주맙 및 타목시펜의 조합의 효과를 이들 약물중의 2가지 약물의 조합의 효과와 비교하여 보여준다. 도 3g는 MM-111, 트라스투주맙, 및 풀베스트란트의 조합의 효과를 이들 약물 중의 2가지 약물의 조합의 효과와 비교하여 보여준다. x-축은 각 실험조건에서 nM 단위의 각 약물 농도를 로그(log) 스케일로 표시하였고, y-축은 스페로이드의 크기를 대조군 스페로이드 크기에 대한 %로서 표시하였다.
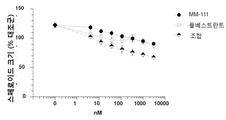
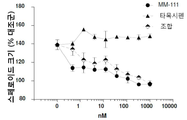
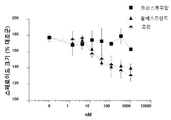
도 4는 인 비트로에서 이중 리간드(에스트로겐 및 헤레굴린)-자극된 스페로이드 성장에 대해 MM-111이 항-에스트로겐 약물과 양성적으로 조합되는 결과를 보여주는 7개의 그래프이다. 도 4a는 MM-111, 타목시펜, 또는 MM-111 및 타목시펜의 효과를 보여준다. 도 4b는 트라스투주맙, 타목시펜, 또는 트라스투주맙 및 타목시펜의 효과를 보여준다. 도 4c는 MM-111, 풀베스트란트(FVT), 또는 MM-111 및 풀베스트란트의 효과를 보여준다. 도 4d는 트라스투주맙, 풀베스트란트, 또는 트라스투주맙 및 풀베스트란트의 효과를 보여준다. 도 4e는 MM-111, 트라스투주맙, 또는 MM-111 및 트라스투주맙의 효과를 보여준다. 도 4f는 MM-111, 트라스투주맙, 및 타목시펜의 조합의 효과를 이들 약물 중의 2가지 약물의 조합의 효과와 비교하여 보여준다. 도 4g는 MM-111, 트라스투주맙, 및 풀베스트란트의 조합의 효과를 이들 약물중의 2가지 약물의 조합의 효과와 비교하여 보여준다. x-축은 각 실험조건에서 nM 단위로의 각 약물 농도를 로그(log) 스케일로 표시하였고, y-축은 스페로이드의 크기를 대조군 스페로이드 크기에 대한 %로서 표시하였다.
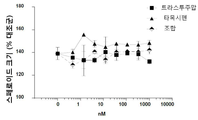
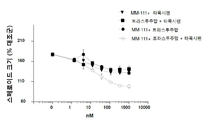
도 5는 인 비트로에서 단일 리간드(에스트로겐 또는 헤레굴린) 또는 이중 리간드(에스트로겐 및 헤레굴린) 자극된 스페로이드 성장을 억제하는 효과에 있어서, MM-111, 트라스투주맙, 및 타목시펜의 조합의 효과를 이들 약물중의 2가지 약물의 조합의 효과와 비교한 결과 또는 MM-111, 트라스투주맙, 및 풀베스트란트의 조합의 효과를 이들 약물중의 2가지 약물의 조합의 효과와 비교한 결과를 요약하여 보여주는 그래프이다. y-축은 자극된 대조군에 대해 정규화(normalize)한 스페로이드 크기의 % 억제를 표시한다.
도 6은 MM-111 및 라파티닙의 조합이 인 비보에서 종양 성장을 억제하는 결과를 보여주는 그래프이다. x-축은 종양이식 후의 시간을 일(day)로 표시하였고, y-축은 종양의 부피를 mm3으로 표시하였다. 마우스는 종양이식 후 7일에 억제제로 처리하였다.
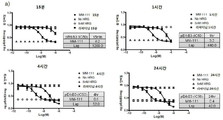
도 7은 헤레굴린-자극된 세포에서의 ErbB3 및 AKT의 활성화를 억제하는 라파티닙의 능력을 평가한 것이다. 도 7a는 컴퓨터에 의해 생성된 용량-반응 곡선(dose-response curve)을 헤레굴린-자극된 BT474-M3 세포에서의 실험 결과와 비교한 그래프이다. 도 7b는 헤레굴린-자극된 세포 및 자극 없는 세포에서 억제제와 함께 1시간 인큐베이션 한 후에 ErbB3 및 AKT 활성화를 억제하는 라파티닙의 효과(IC50)를 보여주는 그래프이다.
도 8은 헤레굴린-자극된 세포를 억제제와 함께 15분, 1시간, 4시간, 및 24시간 동안 인큐베이션한 후의 ErbB3(도 8a) 또는 AKT(도 8b)의 활성화를 억제하는 MM-111 또는 라파티닙의 효과를 보여주는 연속 그래프이다. 도 8c는 BT474M3 세포 및 ZR75-30 세포에 대해 1시간 및 24시간에서 MM-111 및 라파티닙의 IC50 값을 비교하여 보여준다.
도 9는 헤레굴린-자극된 BT474-M3 세포에서 AKT 활성화에 대한 MM-111 및 라파티닙의 조합의 효과를 보여주는 그래프이다.
도 10은 자극되지 않은 BT474-M3 세포 및 헤레굴린-자극된 BT474-M3 세포에 대해 세포증식을 측정한 세포 생존능에 대해 미치는 라파티닙의 효과를 보여주는 그래프이다.
도 11은 MM-111, 라파티닙, 또는 이들의 조합이 BT474-M3 세포의 세포사멸(apoptosis)에 미치는 효과를 보여주는 그래프이다. 사멸된 세포, 세포사멸 후기에 있는 세포, 세포사멸 초기에 있는 세포 및 생존한 세포의 수를 각각 정량하였다.
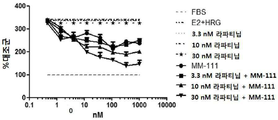
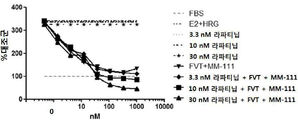
도 12는 인 비트로에서 이중 리간드[에스트로겐(E2) 및 헤레굴린(HRG)] 자극된 스페로이드의 성장을 억제하는데 있어서, MM-111이 항-에스트로겐 약물 및 라파티닙과 양성적으로 조합되는 것을 보여주는 3개의 그래프이다. 도 12a는 라파티닙 단독 또는 라파티닙 및 풀베스트란트(FVT)의 조합의 효과를 보여준다. 도 12b는 라파티닙 단독 또는 라파티닙 및 MM-111의 조합의 효과를 보여준다. 도 12c는 라파티닙 단독, MM-111 및 풀베스트란트의 조합, 또는 M-111, FVT 및 라파티닙의 3중 조합의 효과를 보여준다. 라파티닙은 3.3 nM, 10 nM, 또는 30 nM의 투여량으로 주어졌다. x-축은 nM 단위의 MM-111 및/또는 FVT 농도 각각을 로그(log) 스케일로 표시하였다. y-축은 대조군(FBS 단독) 스페로이드 크기에 대한 %로서의 스페로이드 크기로 표시하였다.
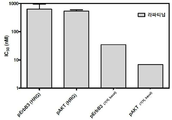
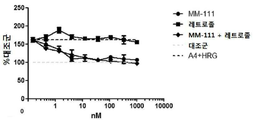
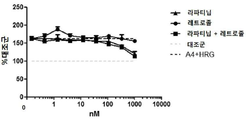
도 13은 안드로스텐다이온을 에스트로겐으로 전환하는 인간 아로마타제를 안정하게 발현하는 헤레굴린(HRG) 및 안드로스텐다이온(A4)-자극된 BT474-M3-Aro 세포에서, 아로마타제 억제제 레트로졸 및 티로신 키나아제 억제제 라파티닙과 양성적으로 조합되는 MM-111을 보여주는 4개의 그래프이다. 도 13a는 레트로졸, MM-111 또는 레트로졸 및 MM-111의 조합의 효과를 보여준다. 도 13b는 라파티닙, MM-111, 또는 라파티닙 및 MM-111의 조합의 효과를 보여준다. 도 13c는 라파티닙, 레트로졸, 또는 라파티닙 및 레트로졸의 조합의 효과를 보여준다. 도 13d는 MM-111 및 레트로졸, MM-111 및 라파티닙, 라파티닙 및 레트로졸의 이중 조합, 및 MM-111, 라파티닙 및 레트로졸의 3중 조합의 효과를 보여준다. x-축은 nM 단위의 MM-111 농도를 로그(log) 스케일로 표시하였다. 약물 농도는 MM-111:레트로졸:라파티닙이 10:20:1의 비율이다. y-축은 대조군 스페로이드 크기에 대한 %로서의 스페로이드 크기로 표시하였다.
도 2는 인 비트로에서 에스트로겐 자극된 스페로이드 성장을 억제하는데 있어서 MM-111가 항-에스트로겐 약물과 양성적으로 조합되는 결과를 보여주는 7개의 그래프이다. 도 2a는 MM-111, 타목시펜(4-히드록시타목시펜, 4OHT), 또는 MM-111 및 타목시펜이 인 비트로 스페로이드 성장에 미치는 효과를 보여준다. 도 2b는 트라스투주맙, 타목시펜, 또는 트라스투주맙 및 타목시펜의 효과를 보여준다. 도 2c는 MM-111, 풀베스트란트(FVT), 또는 MM-111 및 풀베스트란트의 효과를 보여준다. 도 2d는 트라스투주맙, 풀베스트란트, 또는 트라스투주맙 및 풀베스트란트의 효과를 보여준다. 도 2e는 MM-111, 트라스투주맙, 또는 MM-111 및 트라스투주맙의 효과를 보여준다. 도 2f는 MM-111, 트라스투주맙, 및 타목시펜의 조합의 효과를 이들 약물 중의 2가지 약물의 조합의 효과와 비교하여 보여준다. 도 2g는 MM-111, 트라스투주맙, 및 풀베스트란트의 조합의 효과를 이들 약물 중의 2가지 약물의 조합의 효과와 비교하여 보여준다. x-축은 각 실험조건에서 각 약물 농도를 로그(log) 스케일로서 nM 단위로 표시하였고, y-축은 스페로이드의 크기를 대조군 스페로이드 크기에 대한 %로서 표시하였다.
도 3은 인 비트로에서 헤레굴린(heregulin, HRG)-자극된 스페로이드 성장에 대해 MM-111이 항-에스트로겐 약물과 양성적으로 조합되는 결과를 보여주는 7개의 그래프이다. 도 3a는 MM-111, 타목시펜(4-히드록시타목시펜, 4OHT), 또는 MM-111 및 타목시펜의 효과를 보여준다. 도 3b는 트라스투주맙, 타목시펜, 또는 트라스투주맙 및 타목시펜의 효과를 보여준다. 도 3c는 MM-111, 풀베스트란트(FVT), 또는 MM-111 및 풀베스트란트의 효과를 보여준다. 도 3d는 트라스투주맙, 풀베스트란트, 또는 트라스투주맙 및 풀베스트란트의 효과를 보여준다. 도 3e는 MM-111, 트라스투주맙, 또는 MM-111 및 트라스투주맙의 효과를 보여준다. 도 3f는 MM-111, 트라스투주맙 및 타목시펜의 조합의 효과를 이들 약물중의 2가지 약물의 조합의 효과와 비교하여 보여준다. 도 3g는 MM-111, 트라스투주맙, 및 풀베스트란트의 조합의 효과를 이들 약물 중의 2가지 약물의 조합의 효과와 비교하여 보여준다. x-축은 각 실험조건에서 nM 단위의 각 약물 농도를 로그(log) 스케일로 표시하였고, y-축은 스페로이드의 크기를 대조군 스페로이드 크기에 대한 %로서 표시하였다.
도 4는 인 비트로에서 이중 리간드(에스트로겐 및 헤레굴린)-자극된 스페로이드 성장에 대해 MM-111이 항-에스트로겐 약물과 양성적으로 조합되는 결과를 보여주는 7개의 그래프이다. 도 4a는 MM-111, 타목시펜, 또는 MM-111 및 타목시펜의 효과를 보여준다. 도 4b는 트라스투주맙, 타목시펜, 또는 트라스투주맙 및 타목시펜의 효과를 보여준다. 도 4c는 MM-111, 풀베스트란트(FVT), 또는 MM-111 및 풀베스트란트의 효과를 보여준다. 도 4d는 트라스투주맙, 풀베스트란트, 또는 트라스투주맙 및 풀베스트란트의 효과를 보여준다. 도 4e는 MM-111, 트라스투주맙, 또는 MM-111 및 트라스투주맙의 효과를 보여준다. 도 4f는 MM-111, 트라스투주맙, 및 타목시펜의 조합의 효과를 이들 약물 중의 2가지 약물의 조합의 효과와 비교하여 보여준다. 도 4g는 MM-111, 트라스투주맙, 및 풀베스트란트의 조합의 효과를 이들 약물중의 2가지 약물의 조합의 효과와 비교하여 보여준다. x-축은 각 실험조건에서 nM 단위로의 각 약물 농도를 로그(log) 스케일로 표시하였고, y-축은 스페로이드의 크기를 대조군 스페로이드 크기에 대한 %로서 표시하였다.
도 5는 인 비트로에서 단일 리간드(에스트로겐 또는 헤레굴린) 또는 이중 리간드(에스트로겐 및 헤레굴린) 자극된 스페로이드 성장을 억제하는 효과에 있어서, MM-111, 트라스투주맙, 및 타목시펜의 조합의 효과를 이들 약물중의 2가지 약물의 조합의 효과와 비교한 결과 또는 MM-111, 트라스투주맙, 및 풀베스트란트의 조합의 효과를 이들 약물중의 2가지 약물의 조합의 효과와 비교한 결과를 요약하여 보여주는 그래프이다. y-축은 자극된 대조군에 대해 정규화(normalize)한 스페로이드 크기의 % 억제를 표시한다.
도 6은 MM-111 및 라파티닙의 조합이 인 비보에서 종양 성장을 억제하는 결과를 보여주는 그래프이다. x-축은 종양이식 후의 시간을 일(day)로 표시하였고, y-축은 종양의 부피를 mm3으로 표시하였다. 마우스는 종양이식 후 7일에 억제제로 처리하였다.
도 7은 헤레굴린-자극된 세포에서의 ErbB3 및 AKT의 활성화를 억제하는 라파티닙의 능력을 평가한 것이다. 도 7a는 컴퓨터에 의해 생성된 용량-반응 곡선(dose-response curve)을 헤레굴린-자극된 BT474-M3 세포에서의 실험 결과와 비교한 그래프이다. 도 7b는 헤레굴린-자극된 세포 및 자극 없는 세포에서 억제제와 함께 1시간 인큐베이션 한 후에 ErbB3 및 AKT 활성화를 억제하는 라파티닙의 효과(IC50)를 보여주는 그래프이다.
도 8은 헤레굴린-자극된 세포를 억제제와 함께 15분, 1시간, 4시간, 및 24시간 동안 인큐베이션한 후의 ErbB3(도 8a) 또는 AKT(도 8b)의 활성화를 억제하는 MM-111 또는 라파티닙의 효과를 보여주는 연속 그래프이다. 도 8c는 BT474M3 세포 및 ZR75-30 세포에 대해 1시간 및 24시간에서 MM-111 및 라파티닙의 IC50 값을 비교하여 보여준다.
도 9는 헤레굴린-자극된 BT474-M3 세포에서 AKT 활성화에 대한 MM-111 및 라파티닙의 조합의 효과를 보여주는 그래프이다.
도 10은 자극되지 않은 BT474-M3 세포 및 헤레굴린-자극된 BT474-M3 세포에 대해 세포증식을 측정한 세포 생존능에 대해 미치는 라파티닙의 효과를 보여주는 그래프이다.
도 11은 MM-111, 라파티닙, 또는 이들의 조합이 BT474-M3 세포의 세포사멸(apoptosis)에 미치는 효과를 보여주는 그래프이다. 사멸된 세포, 세포사멸 후기에 있는 세포, 세포사멸 초기에 있는 세포 및 생존한 세포의 수를 각각 정량하였다.
도 12는 인 비트로에서 이중 리간드[에스트로겐(E2) 및 헤레굴린(HRG)] 자극된 스페로이드의 성장을 억제하는데 있어서, MM-111이 항-에스트로겐 약물 및 라파티닙과 양성적으로 조합되는 것을 보여주는 3개의 그래프이다. 도 12a는 라파티닙 단독 또는 라파티닙 및 풀베스트란트(FVT)의 조합의 효과를 보여준다. 도 12b는 라파티닙 단독 또는 라파티닙 및 MM-111의 조합의 효과를 보여준다. 도 12c는 라파티닙 단독, MM-111 및 풀베스트란트의 조합, 또는 M-111, FVT 및 라파티닙의 3중 조합의 효과를 보여준다. 라파티닙은 3.3 nM, 10 nM, 또는 30 nM의 투여량으로 주어졌다. x-축은 nM 단위의 MM-111 및/또는 FVT 농도 각각을 로그(log) 스케일로 표시하였다. y-축은 대조군(FBS 단독) 스페로이드 크기에 대한 %로서의 스페로이드 크기로 표시하였다.
도 13은 안드로스텐다이온을 에스트로겐으로 전환하는 인간 아로마타제를 안정하게 발현하는 헤레굴린(HRG) 및 안드로스텐다이온(A4)-자극된 BT474-M3-Aro 세포에서, 아로마타제 억제제 레트로졸 및 티로신 키나아제 억제제 라파티닙과 양성적으로 조합되는 MM-111을 보여주는 4개의 그래프이다. 도 13a는 레트로졸, MM-111 또는 레트로졸 및 MM-111의 조합의 효과를 보여준다. 도 13b는 라파티닙, MM-111, 또는 라파티닙 및 MM-111의 조합의 효과를 보여준다. 도 13c는 라파티닙, 레트로졸, 또는 라파티닙 및 레트로졸의 조합의 효과를 보여준다. 도 13d는 MM-111 및 레트로졸, MM-111 및 라파티닙, 라파티닙 및 레트로졸의 이중 조합, 및 MM-111, 라파티닙 및 레트로졸의 3중 조합의 효과를 보여준다. x-축은 nM 단위의 MM-111 농도를 로그(log) 스케일로 표시하였다. 약물 농도는 MM-111:레트로졸:라파티닙이 10:20:1의 비율이다. y-축은 대조군 스페로이드 크기에 대한 %로서의 스페로이드 크기로 표시하였다.
하기 실시예들은 단지 본 발명을 예시하기 위한 것이므로, 본 발명의 범위가 이들 실시예에 의해 제한되지 않는다. 본 출원에서 기술은 다양한 비-중요성 파라미터들을 기꺼이 인지할 것이며, 동일하거나 유사한 결과를 필수적으로 산출하기 위해 변경 또는 변형 될 수 있다.
항-에스트로겐 치료제와 MM-111의 조합
방법:
종양구(spheroid, 스페로이드) 인 비트로 종양 모델 어세이
BT474-M3 야생형 세포(2,000 세포/웰)를 울트라 로우 클러스터 96-웰 플레이트(Costar)에 플레이팅하였다. 하룻밤 배양한 후, 지시하는 바와 같이 플레이트에 처리하였다. 세포는 6일간 계속 배양하였다. 종양구(스페로이드)는 Nikon 현미경으로 검사한 다음, MetaMorph Image Analysis Software (Molecular Devices)를 이용하여 분석하였다. 10% FBS를 포함하는 배지에서 배양한 세포의 종양구 사이즈를 대조군으로 사용하였다.
이종이식(Xenograft) 모델
BT474-M3 세포(마우스 당 2×107 세포)를 Nu/Nu 면역결핍 마우스에 피하주사하였으며, 마우스에는 실험 하루 전 에스트로겐 펠렛(0.72 mg; 60일 방출)을 이식하였다. 종양은 7일 후 측정하였으며, 마우스는 무작위적으로 4개군으로 분류하였다: 각각 플라시보 처리군, MM-111(60 mg/kg. Q7D) 처리군, 4-OHT(hydroxytamoxifen)(5 mg; 60일 방출 펠렛) 처리군 및 MM-111 및 4-OHT 조합 처리군. 종양은 3일마다 측정하였으며, 실험은 32일째에 종료하였다.
실시예 1: MM-111 및 타목시펜 조합은
인 비보
에서 종양의 성장을 억제한다.
인 비보에서 종양 성장에 대한 MM-111 및 타목시펜 조합 치료법의 효과를 비교하기 위해, 상술한 방법 또는 그것의 변형된 방법을 이용하여 이종이식 모델로서 에스트로겐 자극 마우스를 준비하였다. 마우스에 종양 형성 BT474-M3 세포를 접종하고, 7일 째에 플라시보(부형제 대조군), MM-111, 타목시펜 또는 MM-111 및 타목시펜 조합을 처리한 다음, 종양 성장을 측정하였다. 도 1과 같이, 인 비보 BT474-M3 이종이식 모델은 타목시펜 처리에 대해 저항성을 나타냈으며, 반면에 MM-111 및 타목시펜 조합을 처리한 경우 종양 성장은 보다 현저하게 억제되었다.
MM-111 및 타목시펜 조합 처리군의 통계학적 유의성(p<0.05)은 부형제 대조군과 비교하였을 때 28일째부터, MM-111 처리군과 비교하였을 때 21일째부터, 타목시펜 처리군과 비교하였을 때 25일째부터 계속 확인되었다.
실시예 2: MM-111은 항-에스트로겐 약물과 결합하여 에스트로겐-자극 종양구 성장을 억제한다.
다세포 종양구는 인 비트로에서 종양의 성장 및 미세환경 조건을 자극시키는데 이용된다. 항-에스트로겐 약물과 조합하였을 때 MM-111이 세포 성장 억제 능력을 갖는지 여부를 조사하기 위해, 상술한 방법 또는 그것의 변형된 방법을 이용하여 BT474-M3 세포의 종양구를 준비하고 ErbB2-바인딩 치료제 및/또는 항-에스트로겐 치료제를 처리하였다. 에스트로겐-자극 세포의 종양구에 MM-111, 타목시펜 또는 MM-111 및 타목시펜 조합을 용량별로 투여하였다(도 2a); 트라스투주맙, 타목시펜 또는 트라스투주맙 및 타목시펜의 조합(도 2b); MM-111, 풀베스트란트 또는 MM-111 및 풀베스트란트 조합(도 2c); 트라스투주맙, 풀베스트란트 또는 트라스투주맙 및 풀베스트란트 조합(도 2d); 또는 MM-111, 트라스투주맙 또는 MM-111 및 트라스투주맙 조합(도 2e). MM-111, 트라수투주맙, 풀베스트란트 및 타목시펜을 단일 제제로서 사용했을 때, 에스트로겐-자극 BT474-M3 종양구 어세이에서 종양구 성장 억제효과를 나타냈다. MM-111과 타목시펜 또는 풀베스트란트의 조합(도 2a 및 2c, 각각) 또는 트라스투주맙과 타목시펜 또는 풀베스트란트의 조합(도 2b 및 2d, 각각)은 성장 억제 정도를 증가시키며, MM-111 및 트라스투주맙의 조합도 성장 억제 정도를 증가시켰다(도 2e). 억제 효과는 MM-111, 트라스투주맙 및 타목시펜의 3개 조합(도 2f) 또는 MM-111, 트라스투주맙 및 풀베스트란트의 3개 조합(도 2g)을 에스트로겐-자극 종양구에 처리한 경우, 2개 조합을 처리한 경우와 비교하여 더욱 증가하였다.
실시예 3: MM-111은 항-에스트로겐 약물과 결합하여 HRG-자극 종양구 성장을 억제한다.
항-에스트로겐 약물과 조합하였을 때 MM-111이 세포 성장 억제 능력을 갖는지 여부를 조사하기 위해, 상술한 방법 또는 그것의 변형된 방법을 이용하여 HRG(heregulin)-자극 BT474-M3 세포의 종양구를 준비하고 MM-111, 타목시펜 또는 MM-111 및 타목시펜 조합을 용량별로 투여하였다(도 3a); 트라스투주맙, 타목시펜 또는 트라스투주맙 및 타목시펜의 조합(도 3b); MM-111, 풀베스트란트 또는 MM-111 및 풀베스트란트 조합(도 3c); 트라스투주맙, 풀베스트란트 또는 트라스투주맙 및 풀베스트란트 조합(도 3d); 또는 MM-111, 트라스투주맙 또는 MM-111 및 트라스투주맙 조합(도 3e). MM-111은 HRG-유도 종양구 성장을 억제하였으나, 타목시펜(도 3a), 트라스투주맙(도 3b) 및 풀베스트란트(도 3c)는 HRG에 의해 자극된 종양국의 성장을 억제하지 못했다. MM-111 및 타목시펜(도 3a) 또는 MM-111 및 풀베스트란트(도 3c)에서 조합에 따른 현저한 효과는 확인되지 않았다. 트라스투주맙과 타목시펜(도 3b) 또는 풀베스트란트(도 3d)의 조합은 단일 약물과 비교하여 현저한 억제 효과를 나타내지 않았다. 도 3e에서 보는 바와 같이, MM-111과 달리 트라스투주맙은 HRG-자극 종양구 성장에서 억제 효과를 나타냈다. MM-111 및 트라스투주맙의 조합은 개선된 억제 효과를 나타냈다.
MM-111 또는 트라스투주맙과 타목시펜 또는 풀베스트란트의 2개 조합과 MM-111, 트라스투주맙 및 타목시펜(도 3f)의 3개 조합 또는 MM-111, 트라스투주맙 및 풀베스트란트(도 3g)의 3개 조합의 효과를 비교한 결과, 상기 3개 조합은 MM-111 및 트라스투주맙의 조합(도 3e)과 HRG-자극 종양구 성장에 있어서 비슷한 억제 효과를 나타냈다.
실시예 4: MM-111은 항-에스트로겐 약물과 결합하여 이중 리간드(에스트로겐 및 HRG)-자극 종양구 성장을 억제한다.
이중 리간드(에스트로겐 및 HRG) 자극 종양구에 타목시펜, MM-111 또는 타목시펜 및 MM-111의 조합(도 4a) 또는 트라스투주맙, 타목시펜 또는 트라스투주맙 및 타목시펜의 조합(도 4b)을 용량별로 처리하였다. MM-111 및 트라스투주맙은 각각 종양구 성장을 억제하였으나(도 4a), MM-111 및 타목시펜의 조합은 각각의 약물보다 현저히 증가된 억제 효과를 나타냈다. 반면, 트라스트주맙은 단일 물질로서 억제 효과를 나타내지 않았으나 트라스투주맙 및 타목시펜의 조합은 타목시펜 단일 물질과 비슷한 효과를 나타냈다.
이중 리간드 자극 종양구에 풀베스트란트, MM-111 또는 풀베스트란트 및 MM-111의 조합(도 4c) 또는 풀베스트란트, 트라스트주맙 또는 풀베스트란트 및 트라스트주맙의 조합(도 4d)을 용량별로 처리하였다. MM-111 및 풀베스트란트는 각각 종양구의 성장을 억제하였으나, MM-111 및 풀베스트란트 조합은 단일 물질과 비교하여 보다 현저한 억제 효과를 나타냈다(도 4c). 트라스투주맙은 단일 물질로서 현저한 억제 효과를 나타내지 않았으며, 트라스투주맙 및 풀베스트란트 조합은 타목시펜 단일 물질과 비슷한 효과를 나타냈다(도 4d).
이중 리간드 자극 종양구에 MM-111, 트라스트주맙 또는 MM-111 및 트라스트주맙 조합을 처리하였다. MM-111은 이중 리간드 자극 종양구 성장에 있어서 트라스트주맙 보다 큰 억제 효과를 나타냈다. MM-111 및 트라스트주맙의 조합은 향상된 억제 효과를 갖는다(도 4e).
MM-111 또는 트라스투주맙과 타목시펜 또는 풀베스트란트의 2개 조합과 MM-111, 트라스투주맙 및 타목시펜(도 4f)의 3개 조합 또는 MM-111, 트라스투주맙 및 풀베스트란트(도 4g)의 3개 조합의 효과를 비교한 결과, 상기 3개 조합은 MM-111 및 트라스투주맙의 조합(도 4e)과 에스트로겐 및 HRG(이중 리간드) 자극 종양구 성장에 있어서 비슷한 억제 효과를 나타냈다.
앞선 실시예의 데이터에서 입증된 바와 같이, MM-11 및 항-에스트로겐 치료제를 포함하는 조합 치료법은 이들의 단일 치료보다 더욱 효과적이다. 에스트로겐 또는 HRG 자극 하에서 각 치료제에 의해 유도된 종양구 성장 억제율은 도 5 및 표 1에 요약되어 있다. MM-111은 HRG에 의해 자극된 종양구의 억제를 위해 요구된다. 각 자극 조건에서 3개 조합은 가장 큰 종양구 성장 억제 효과를 나타냈으며, 억제율은 약 70-90%였다.
| 타목시펜 조합 | ||||
| MM-111 + 트라스투주맙 | MM-111 + 항-에스트로겐 | 트라스투주맙 + 항-에스트로겐 | 3개 조합 | |
| E2 | 54% | 49% | 55% | 73% |
| HRG | 65% | 43% | 0% | 71% |
| E2 + HRG | 46% | 43% | 36% | 79% |
| 풀베스트란트 조합 | ||||
| E2 | 54% | 49% | 55% | 77% |
| HRG | 64% | 34% | 4% | 71% |
| E2 + HRG | 46% | 57% | 47% | 88% |
종양구 성장 억제율(미처리군, 자극 대조군에 표준화시킴)은 억제제를 1 M 투여하여 결정함.
MM-111 및 타목시펜 조합은 인 비보에서 종양 성장을 억제시킨다. 이러한 결과들을 조합하면, MM-111 및 항-에스트로겐 치료제의 조합은 인 비트로 및 인 비보에서 항-종양 효과를 갖는다는 것을 의미한다.
MM-111과 라파티닙의 조합
방법
계산 모델
라파티닙 모델 뿐 만 아니라, HRG-유도 인산-ErbB3 신호전달의 계산 모델은 종래에 알려진 것을 이용하였다(Schoeberl, et al 2009).
세포 신호전달 어세이
혈청 고갈(serum-starved) 상태의 세포에 MM-111, 라파티닙 또는 이들의 조합은 용량별로 단계 희석하여 기재된 시간 동안 처리한 다음, 5 nM 헤레굴린 1-β(R&D Systems, Minneapolis, MN)을 10분간 처리하여 자극시켰다. 세포 용해물은 pErbB3(phospho-ErbB3) 및 pAKT(phospho-AKT)과 반응시켜 ELISA로 분석하였다(Schoeberl et al., 2009). 억제제의 IC50 값은 4-파라미터 시그모이드 곡선에 용량 반응 데이터를 맞춤으로써 계산하였다(GraphPad Prism, GraphPad Software, Inc., La Jolla, CA).
세포 증식 어세이
세포(8,000 세포/웰)는 96-웰 플레이트에 분주한 다음 하룻밤 동안 배양하였다. 억제제를 기재된 용량으로 첨가하여 24시간 동안 처리하였다. 리간드 자극 실험을 위해, 억제제 첨가에 앞서 혈청 고갈 상태로 하룻밤 동안 세포를 배양한 다음, 2 nM 헤레굴린 1-D(R&D Systems, Minneapolis, MN)를 5% FBS를 포함하는 배지에 첨가하여 세포에 1시간 동안 처리하였다. 생존 세포의 수는 CellTiter-Glo Luminescent Cell Viability Assay (Promega, Madison, WI)를 이용하여 측정하였다.
세포사멸(apoptosis) 어세이
BT474-M3 세포(2,000 세포/웰)를 울트라 로우 클러스터 96-웰 플레이트(Costar, Corning, NY)에 분주하였다. 하룻밤 동안 배양한 다음, 72시간 동안 기재된 농도의 억제제를 종양구에 처리하였다. 종양구는 트립신 처리한 다음, 부유 세포와 결합시켰다. 세포를 차가운 PBS로 2회 세척하고, 바인딩 버퍼(0.01 M HEPES, pH 7.4; 0.14 M NaCl; 2.5 mM CaCl2)로 부유하였다. FITC-결합 어넥신 V 및 PI로 세포를 염색한 다음, 자연사 세포를 FACSCaliburTM FACS 기계로 정량화하였다.
이종이식 효과 연구
종양 이종이식은 5-6 주령 자성 무흉선(athymic) 누드 마우스(nu/nu; Charles River Labs, Wilmington, MA)의 옆구리에 BT474-M3 세포를 피하주사함으로써 구축하였다. 세포를 주사하기 24시간 전에, 마우스의 반대편 옆구리에 완효성(slow-release) 에스트로겐(0.72 mg 펠렛; Innovation Research of America, Sarasota, FL)을 이식하고, 60일간 피하로 에스트로겐을 받아들이도록 하였다. 종양 사이즈는 150-300 mm3가 되도록 하였으며, 마우스는 무작위적으로 선별하여 그룹당 8마리 또는 10마리씩 배치하였고, 3일에 한번 씩 복강 내로 부형제(vehicle), MM-111 또는 라파티닙을 투여하였다. 라파티닙 조합 연구를 위해, MM-111은 7일에 한번씩 투여하였으며, 라파티닙은 매일 위관 영양(gavage)을 통해 기재된 용량만큼 투여하였다.
아로마타제(Aromatase)-과발현 BT474-M3 세포 및 증식 어세이
BT474-M3 세포는 인간 아로마타제(gene accession No: NM_000103.2)를 포함하는 PS 100010 벡터로 형질감염시켰다. 아로마타제를 안정 발현하는 세포(BT474-M3-Aro)는 400 μg/ml 제네티신을 이용하여 선별한 후, 수득하였다. 세포 증식 어세이를 수행하기 위해, BT474-M3-Aro 세포(5,000 세포/웰)를 5% 차콜-분리 FBS를 포함하는 페놀 레드-프리 RPMI-1640 배지에 혼합하여 96-웰 플레이트에 분주하였다. 하룻밤 배양한 후, 안드로스텐디온(androstenedione)(A-4; 200 nM) 및 헤레굴린(HRG; 2 nM)을 처리하였다. 3일간 처리한 후, 세포 생존력을 WST-1(Roche; Cat. # 11 644 807 001)을 이용하여 제조사의 지시에 따라 측정하였다. 5% 차콜-분리 FBS 조건에서의 세포 생존력을 대조군으로 설정하였다(100%).
실시예 5:
인 비보
에서 MM-111 및 라파티닙의 조합은 종양 성장을 억제한다.
상술한 방법 또는 그것의 변형된 방법을 이용하여 BT474-M3 유방암 이종이식 모델을 준비하고 MM-111 및 라파티닙의 조합의 인 비보에서의 효과를 조사하였다. MM-111 및 라파티닙은 각각 최적의 효과를 나타내는 용량을 매주 또는 매일 투여하였다. MM-111 및 라파티닙의 조합은 개별 약물과 비교하여 더 큰 효과를 나타내며, 13일 째에 MM-111(p = 3.9×10-4) 및 라파티닙(p = 5.1×10-3)에 대하여 통계학적 유의성을 나타낸다(도 6). 40일부터 7일(접종)까지 종양 부피의 변화는 각 그룹별로 계산하였다(도 6b). 종양 퇴행을 반영하여 라파티닙이 종양 부피를 -11%(약 10%), MM-111이 종양 부피를 14%(약 15%) 변화시킨 것과 비교하여, MM-111 및 라파티닙의 조합은 종양 부피를 -69%(약 70%)로 감소시켰다.
실시예 6: 라파티닙은 헤레굴린-유도 pErbB3 및 pAKT의 억제에 있어서 차선의 활성을 갖는다.
pErbB3 활성화의 라파티닙 억제 투여 범위는 상술한 계산 모델을 이용하여 예측하였다. 라파티닙의 투여 범위를 BT474-M3 세포에 적용한 다음, 5 nM 헤레굴린을 10분간 처리하여 자극하였다. pErbB3의 양은 상술한 방법 또는 그것의 변형된 방법을 이용한 ELISA를 통해 측정하였다. 모델-생성 용량 반응 곡선은 실험 데이터와 오버레이된다(도 7a). 헤레굴린-자극 또는 무자극(기저) 세포에서 라파티닙의 억제 활성의 비교는 헤레굴린 신호전달이 라파티닙의 활성을 동요시키는 것을 설명하기 위해 수행하였다. 무처리(untreated) 및 헤레굴린-자극 세포에 pErbB3 및 pAKT를 반응시키고, IC50 값을 계산하였다(도 7b). 이러한 결과들은 라파티닙이 헤레굴린-활성 신호전달에 효과적인 억제제가 아니라는 것을 나타낸다.
실시예 7: MM-111은 라파티닙 보다 FTRG-유도 ErbB3 및 AKT 인산화에 있어서 보다 강력한 억제제이다.
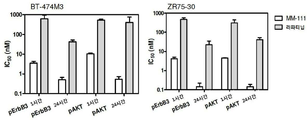
헤레굴린-유도 ErbB3 활성화를 억제하는 MM-111 및 라파티닙의 능력을 비교하기 위해 BT474-M3 또는 ErbB2 과발현 유방암 세포주인 ZR75-30(ATCC # CRL-1504TM) 세포에 단계 희석한 각 억제제를 15분, 1시간, 4시간 및 24시간 처리한 다음, 5 nM 헤레굴린을 10분간 처리하여 자극하였다. pAKT 및 pErbB3의 양은 ELISA를 이용하여 측정하였다. MM-111은 BT474-M3(IC50 =3 nM) 세포(도 8a) 및 ZR75-30 세포(IC50 = 5 nM)(도 8c)에서 pErbB3 레벨을 강력하게 감소시켰다(ErbB3 인산화를 억제시킴). MM-111에 의한 pAKT 레벨 감소(AKT 인산화 억제)는 BT474-M3(IC50 = 10)(도 8b) 및 ZR75-30 세포(IC50 = 4 nM)(도 8d)에서도 관찰되었다. MM-111의 헤레굴린-유도 ErbB3 활성화(인산화) 억제 능력은 라파티닙보다 우수하며, 각 억제제의 상대적 IC50(도 8c)는 억제제 배양 24시간 까지 일정하였으며, 처리시간은 억제제의 효능에 큰 효과를 미치지 않았다.
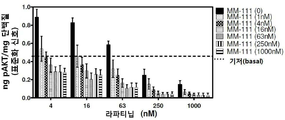
실시예 8: MM-111 및 라파티닙의 조합은 pAKT를 강력하게 억제한다.
pAKT 억제(pAKT 레벨의 감소)에 대한 MM-111 및 라파티닙 조합의 효과를 평가하기 위해 헤레굴린-자극 BT474-M3 세포를 이용하였다. 세포에 MM-111, 라파티닙 또는 그들의 조합을 용량 범위 처리하여 2시간 배양하고, ELISA를 이용하여 pAKT를 측정하였다. 헤레굴린의 존재 하에서, MM-111 및 라파티닙의 조합은 굉장히 효과적으로 작용하여 치료학적으로 유의미한 농도에서 기저 상태 이하로 pAKT를 억제시켰다(도 9). MM-111(1 μM) 또는 라파티닙(1 μM) 단독 투여는 비슷한 수준으로 pAKT를 억제시켰으며(도 8b), MM-111 및 라파티닙의 조합은 pAKT를 약 20% 이상 억제시켰다.
실시예 9: 세포 증식을 억제하는 라파티닙의 능력은 헤레쿨린-자극 조건 하에서 동요된다.
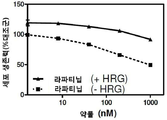
세포 증식에 있어서 라파티닙의 효과는 무자극 및 헤레굴린-자극 BT474-M3 세포에서 측정하였다. 혈청 또는 혈청 + 헤레굴린 조건에서 배양한 세포에 용량 범위의 라파티닙을 24시간 처리하였다. 라파티닙 처리는 무자극 세포의 증식을 약 50% 억제시켰으나, 헤레굴린-자극 BT474-M3 세포에서는 증식을 약 23% 억제하는 효과를 나타냈다(도 10).
실시예 10: MM-111 및 라파티닙 조합의 처리는 세포사멸를 증가시킨다.
세포사멸에 있어서 MM-111 및 라파티닙 조합의 효과는 BT474-M3 종양구 모델에서 측정하였다. 상술한 방법 또는 그것의 변형된 방법을 이용하여 종양구를 준비하고, 준비된 종양구에 MM-111(100 nM), 라파티닙(33 nM) 또는 MM-111(100 nM) 및 라파티닙(33 nM)의 조합을 처리하였다. 세포를 어넥신 V 및 프로피디움 요오드화물(propidium iodide, PI)로 염색한 다음, FACS를 이용하여 정량화하였다(도 11, 도 2). 어넥신 V 및 PI에 양성으로 염색된 세포군은 후기 세포사멸(세포괴사)로 정량하였고, 어넥신 V에 양성으로 염색되고, PI에 염색되지 않는 세포군은 초기 세포사멸로 정량하였으며, PI에 양성으로 염색되고 어넥신 V에 염색되지 않은 세포군은 죽은 세포로 정량하였다. 어넥신 V 또는 PI에 염색되지 않은 세포군은 살아있는 세포 및 세포사멸에 있지 않은 세포로 판단하였다(표 2).
라파티닙(약 31%) 또는 MM-111(약 20%)을 단독으로 처리한 경우와 비교하여, MM-111 및 라파티닙 조합을 처리한 종양구는 총 세포사멸 세포의 수가 높았다(약 46%)(도 10).
| 생존 세포 | 조기 세포사멸 | 늦은 세포사멸 | 죽은 세포 | |
| 대조군 | 75.2 | 17.3 | 7.2 | 0.42 |
| MM-111 | 78.9 | 12.9 | 7.5 | 0.74 |
| 라파티닙 | 67.9 | 16.8 | 14.5 | 0.73 |
| 조합 | 52.1 | 30.3 | 16.2 | 1.74 |
실시예 11: MM-111과 항-에스트로겐 약물 및 라파티닙의 조합은 이중 리간드(에스트로겐 및 헤레굴린)-자극 종양구의 성장을 억제시킨다.
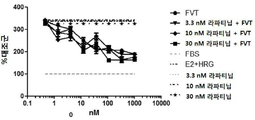
MM-111과 항-에스트로겐 약물 및 타이로신 인산화효소 억제제의 조합이 세포 성장을 억제하는지 여부를 조사하기 위해, 상술한 방법 또는 그것의 변형된 방법을 이용하여 에스트로겐의 종양구 및 헤레굴린-자극 BT474-M3 세포를 준비하고, 3.3 nM, 10 nM 또는 30 nM 라파티닙 또는 라파티닙과 용량 범위의 풀베스트란트(FVT) 조합을 처리(도 12a); 3.3 nM, 10 nM 또는 30 nM 라파티닙 또는 라파티닙과 용량 범위의 MM-111 조합을 처리(도 12b); 또는 3.3 nM, 10 nM 또는 30 nM 라파티닙 또는 라파티닙 및 용량 범위의 MM-111 및 풀베스트란트 조합을 처리(도 12c)하였다. 이중 리간드 자극 하에서 라파티닙 및 FVT의 조합은 라파티닙을 단독 처리한 경우보다 종양구 성장 억제를 크게 증가시키지는 않았다(도 12a). 반면, MM-111의 첨가는 라파티닙 처리에서 종양구의 민감성을 크게 증가시켰고(도 12b), 라파티닙, FVT 및 MM-111의 3개 조합은 라파티닙 단독 처리보다 종양구 성장 억제를 크게 증가시켰다.
실시예 12: MM-111과 항-에스트로겐 약물의 조합은 인간 안드로스텐디온 과발현 BT474-M3 세포에서 종양구의 성장을 억제시킨다.
안드로스텐디온은 스테로이드 호르몬으로 아로마타제에 의해 에스트로겐으로 전환된다. MM-111이 종양구 성장 억제 능력을 갖는지를 평가하기 위해, 안드로스텐디온(A4) 및 헤레굴린(P1RG)이 있는 조건 하에서 아로마타제-발현 세포에 MM-111, 레트로졸 또는 MM-111 및 레트로졸의 조합(도 13a); MM-111, 라파티닙 또는 MM-111 및 라파티닙의 조합(도 13b); 라파티닙, 레트로졸 또는 라파티닙 및 레트로졸의 조합(도 13c); 및 상기 2개 조합과 MM-111, 라파티닙 및 레트로졸의 3개 조합(도 13d)을 처리하였다. A4 및 HRG를 처리한 세포에서 레트로졸 처리는 대조군(미처리) 세포와 비교하여 종양구 세포의 성장 억제를 현저하게 유도하지 않았으나, MM-111을 단독 처리하거나, MM-111 및 레트로졸 조합을 처리한 경우에는 세포 증식이 비슷한 수준으로 억제되었다(도 13a).
라파티닙 처리는 고농도를 제외하고 세포 성장 억제를 유도하지 않았으나, MM-111 단독 처리 또는 MM-111 및 라파티닙 조합은 고농도를 제외하고 비슷한 수준으로 세포 성장 억제를 유도하였으며, MM-111 및 라파티닙 조합을 처리한 경우, 단일 처리 보다 세포 성장 억제를 증가시켰다(도 13b). 라파티닙 단독 처리, 레트로졸 단독 처리 또는 라파티닙 및 레트로졸 조합을 처리한 경우, 고농도를 제외하고 세포 성장 억제를 유도하지 않았다(도 13c). 유사하게, 도 13d를 살펴보면 라파티닙 및 레트로졸의 조합은 고농도에서만 세포 성장 억제를 유도하였다. 반면, MM-111 및 레트로졸 또는 MM-111 및 라파티닙의 조합은 대조군과 비교하여 세포 성장 억제를 증가시켰으며, MM-111, 라파티닙 및 레트로졸의 3개 조합은 상기 2개 조합 보다 세포 성장을 더욱 억제시켰다.
실시예 13: MM-111의 아미노산 서열(SEQ ID NO: 1 )
QVQLQESGGGLVKPGGSLRLSCAASGFTFSSYWMSWVRQAPGKGLEWVAN1NRDGSASYYVD SVKGRFTISRDDAKNSLYLQMNSLRAEDTAVYYCARDRGVGYFDLWGRGTLVTVSSASTGGGG SGGGGSGGGGSQSALTQPASVSGSPGQSITISCTGTSSDVGGYNFVSWYQQHPGKAPKLMIYDVS DRPSGVSDRFSGSKSGNTASLIISGLQADDEADYYCSSYGSSSTHVIFGGGTKVTVLGAASDAHK SEVAHRFKDLGEENFKALVLIAFAQYLQQSPFEDHVKLVNEVTEFAKTCVADESAENCDKSLHT LFGDKLCTVATLRETYGEMADCCAKQEPERNECFLQHKDDNPNLPRLVRPEVDVMCTAFHDNEETFLKKYLYEI ARRHPYFYAPELLFFAKRYKAAFTECCQAADKAACLLPKLDELRDEGKASSAK QRLKCASEQKFGERAFKAWAVARLSQRFPKAEFAEVSKLVTDLTKVHTECCHGDLLECADDRADLA YICENQDSISSKLKECCEKPLLEKSHCIAEVENDEMPADLPSLAADFVESKDVCKNYAEAK DVFLGMFLYEYARRHPDYSVVLLLRLAKTYETTLEKCCAAADPHECYAKVFDEFKPLVEEPQNL I QNCELFEQLGEYKFQNALLVRYTKKVPQVSTPTLVEVSRNLGKVGSKCCKHPEAKRMPCAED YLSVVLNQLCVLHEKTPVSDRVTKCCTESLVNRRPCFSALEVDETYVPKEFQAETFTFHADICTL SEKERQIKKQTALVELVKIIKPKATKEQLKAVMDDFAAFVEKCCKADDKETCFAEEGKKLVAAS QAALGLAAALQVQLVQSGAEVKKPGESLKISCKGSGYSFTSYWIAWVRQMPGKGLEYMGLIYP GDSDTKYSPSFQGQVTISVDKSVSTAYLQWSSLKPSDSAVYFCARHDVGYCTDRTCAKWPEWL GVWGQGTLVTVSSGGGGSSGGGSGGGGSQSVLTQPPSVSAAPGQKVTISCSGSSSNIGNNYVSW YQQLPGTAPKLLIYDHTNRPAGVPDRFSGSKSGTSASLAISGFRSEDEADYYCASWDYTLSGWV FGGGTKLTVLG
하나 또는 그 이상의 치료제 추가 조합에서 MM-111의 용량 및 투여
실시예 14: MM-111의 투여 방법
20 mM L-히스티딘 하이드로클로라이드, 150 mM 소듐 클로라이드로 구성되며 2-8℃에 보관된 살균된 수용액(pH 6.5)에 25 mg/ml MM-111을 포함하도록 하는 제제를 준비한다. MM-111은 투여 전에 반드시 상온에 정치하도록 한다. MM-111의 용기(예컨대, 바이얼)는 절대 흔들지 않는다. MM-111의 적정량을 용기로부터 덜어내어 0.9% 생리식염수 250 mL에 희석하고 저단백 바인딩 인-라인 필터를 이용하여 투입(infusion)하는 방법으로 투여한다(예컨대, 0.22 마이크로미터 필터).
MM-111은 첫 투여 시 약 90분 이상 투여한다. 투입 반응이 없는 상태에서 다음 용량은 약 60분 이상 투여한다.
전체 사이클에 사용되는 용량을 계산하기 위해 투여 사이클 초반 환자 몸무게를 이용한다. 환자의 몸무게가 10% 이상 변하는 경우, 이 변화를 반영하여 총 용량을 다시 계산해야한다.
실시예 15: MM-111의 투여 및 용량
투여 과정 중 MM-111의 바람직한 혈장 농도는 적어도 106 mg/L이다. MM-111의 용량 빈도(dose frequency)의 특정한 조합을 확인하였으며, 용량은 투여 과정 동안 적어도 환자의 혈장에 절반, 바람직하게는 60%, 70% 또는 80% 유지될 것이다.
특정 구현예에 따르면, 높은 초기 용량(부하용량; loading dose, LD)이 주어지고, 하나의 유지용량(maintenance dose, MD)의 지정된 간격에 따라 투여한다. 투여 일의 간격은 일반적으로 Q×D로 기재되고, 상기 ×는 정수를 나타내며 7의 Q×D는 매 7일 마다 투여하는 것을 나타낸다. 표 3, 표 4 및 표 5는 본 발명의 용량 및 투여 간격을 나타낸 것으로 초기 용량은 바람직하게는 부하용량(LD)으로 기재되나, 유지용량(MD)이 될 수 있다(예컨대, 의사의 지시에 따라). 표 3는 부하용량 및 유지용량의 투여 간격의 예를 나타낸다. 표 4는 표 3에서 +/- 3 mg/mL 까지의 용량 가변성(“약”으로 기재함)을 허용하는 변형을 나타낸다. 표 5는 부하용량 및 유지용량의 투여 간격의 더욱 확장된 예를 나타낸다. 표 3, 표 4 및 표 5의 각 칸에서 상부 숫자는 간격 Q×D에서 정수 ×이고(예컨대, 칸에서 상부 숫자로서 18은 Q18D 또는 매 18일의 투여 간격을 나타낸다), 가운데 숫자는 mg/kg에서 (선택적) 부하용량을 의미하며, 하부 숫자는 mg/kg에서 유지 용량을 나타낸다. 따라서, 표 3에서 상부 칸은 매 7일에 한 번의 투여 간격(Q×D), 환자 몸무게 kg당 25 mg의 부하용량(선택적) 및 환자 몸무게 kg당 20 mg의 유지용량을 나타내는 반면, 표 5의 상부 열에서 가장 오른 쪽에 있는 칸은 매 7일에 한 번의 투여 간격(Q×D), 환자 몸무게 kg당 30 mg의 부하용량(선택적) 및 환자 몸무게 kg당 15 mg의 유지용량을 나타낸다.
| 7 25 20 |
| 7 40 30 |
| 14 60 45 |
| 14 90 75 |
| 21 120 105 |
| 7 약 25 약 20 |
| 7 약 40 약 30 |
| 14 약 60 약 44 |
| 14 약 90 약 75 |
| 21 약 120 약 105 |
실시예 16: MM-111과 라파티닙 및 트라스투맙의 용량 및 투여
트라스투맙-난치(refractory)-HER2-과발현 유방암 환자의 치료는 유방 종양학 분야에서 만족되지 못하는 부분으로 치료에 대한 새로운 접근 방식이 요구된다. 선택적 타이로신 인산화효소 억제제(tyrosine kinase inhibitors, TKIs)가 특정 타이로신 인산화효소 종양유전자-유래 암 치료에 굉장히 효과적인 치료법이지만, 이들의 HER2-유래 유방암에 대한 임상학적 항-종양 효능은 적절한 체내 분포(biodistribution) 및 분명한 타겟 억제에도 불구하고 실망스러운 수준이다. 가장 유망한 치료제인 HER2 TKI, 라파티닙에 대한 임상 2상 결과, 트라스투맙-난치-HER2-과발현 유방암 환자에서 단 4-8%의 반응율(response rate)이 보고되었다. HER2+ 유방암에 대한 효과적인 치료법은 더욱 복잡하며 생각보다 회복력이 있는 것으로 현재 알려져 있다. 최근의 연구결과는 가장 강력한 티로신 키나아제 억제제(TKIs)로도 치료 인덱스를 벗어나게 하는, HER3의 역할 및 HER2 촉매 활성의 2 로그 억제에 대해 보호하는 HER2-HER3 종양 드라이버(tumor driver)에 내재된 강한 신호 완충 능력에 대해 강조하였다. 일반적으로 라파티닙은 1,000-1,500 mg 용량의 250 mg 타블렛을 하루 한번 투여한다. 라파티닙은 때때로 다른 암 치료제인 카페시타빈(capecitabine)과의 조합으로 일주일의 간격을 두고 14일간 투여하는 방식으로 이용된다.
HER2-HER2 드라이버의 완전 불활성화가 간헐적인 투여 스케줄에서 높은 TKI를 투여하는 것에 의해 달성될 수 있는지를 평가한 결과, 연속적인 투여보다 간헐적인 투여가 더욱 효과적이라는 것을 확인하였다. 수정된 투여 스케줄에 따라 증가된 라파티닙 용량을 14일 주기로 1-5일 째에 투여하였고, 상기 증가된 용량은 1,000-1,500 mg/일의 표준 용량보다 증가된 것이다. 일 구현예에 따르면, 높은 라파티닙 용량은 2,000 및 9,000 mg/일 사이이다. 예컨대, 높은 라파티닙 용량은 2,000, 2,250, 3,375, 3,000, 3,250, 3,500, 3,750, 4,000, 4,250, 4,500, 4,750, 5,000, 5,250, 5,500, 5,750, 6,000, 6,250, 6,500, 6,750, 7,000, 7,250, 7,500, 7,750, 8,000, 8,250, 8,500, 8,750 또는 9,000 mg/일 및 기타 등등 일 수 있다.
특정 구현예에 따르면, 부하용량은 14일 주기의 1일째에 투여되며 이는 그 다음날부터 투여되는 유지용량보다 높은 용량이다. 예를 들면, 14일 주기의 1일째에 투여되는 부하용량은 7,000 mg/일, 이후에 투여되는 유지용량은 3,000 mg/일 일 수 있다. 부하용량 및 유지용량 조합은 표 6에 기재된 실시예에 의해 제한되지 않는다.
MM-111은 실시예 15에 기재된 바와 같이 투여한다. 일 구현예에 따르면, 치료법은 트라스투주맙을 추가적으로 포함한다. 트라스투주맙은 일반적으로 초기 부하용량을 투여한 다음, 유지용량을 투여한다. 예를 들면, 트라스투주맙은 8 mg/kg의 부하용량을 투여한 다음, 매 3주마다 6 mg/kg의 유지 용량을 투여할 수 있다.
실시예 17: MM-111과 시스플라틴, 카페시타빈 및 트라스트주맙의 용량 및 투여
MM-111과 시스플라틴, 카페시타빈 및 트라스트주맙의 투여는 예를 들어 하기 방법 또는 그것의 변형된 방법을 이용하여 실시한다.
환자에게 21일 치료 주기로 투여한다. 시스플라틴은 21일 주기의 1일째에 정맥 투입(intravenous infusion)으로 80 mg/m2의 용량을 2시간 이상 투여한다. 카페시타빈은 매일 2회 1,000 mg/m2의 용량으로 구강투여한다. 시스플라틴의 21일 주기 까지 카페시타빈을 투여한다. 트라스투주맙은 부하용량 8 mg/kg으로 1일째 정맥으로 90분 이상 투여한 다음, 21일간 매일 6 mg/kg의 유지용량으로 30-90분 이상 투여한다. MM-111은 상술한 실시예와 같이 투여한다. 예를 들면, MM-111은 초기 용량은 90분 이상 투여하고, 그 다음 주마다 60분 이상 투여한다.
실시예 18: MM-111과 라파티닙 및 트라스트주맙의 용량 및 투여
MM-111과 라파티닙 및 트라스트주맙의 투여는 예를 들어 하기 방법 또는 그것의 변형된 방법을 이용하여 실시한다. 트라스투주맙은 부하용량 4 mg/kg으로 1일째 정맥으로 90분 이상 투여한 다음, 매주 2 mg/kg의 유지용량으로 투여한다. 라파티닙은 실시예 13에 기재된 투여 요법의 하나 또는 매일 1,000 mg 용량으로 구강 투여한다. MM-111은 상술한 실시예와 같이 투여한다. 예를 들면, MM-111은 초기 용량은 90분 이상 투여하고, 그 다음 주마다 60분 이상 투여한다.
실시예 19: MM-111과 파클리탁셀 및 트라스트주맙의 용량 및 투여
MM-111과 파클리탁셀 및 트라스트주맙의 투여는 예를 들어 하기 방법 또는 그것의 변형된 방법을 이용하여 실시한다. 환자에게 28일 치료 주기로 투여한다. 파클리탁셀은 주기 1의 1일째에 투여를 시작한다. 파클리탁셀은 매주 80 mg/m2의 용량을 정맥으로 90분 이상 투여하고, 그 다음 2 mg/kg의 유지용량을 매주 투여한다. MM-111은 상술한 실시예와 같이 투여한다. 예를 들면, MM-111은 초기 용량은 90분 이상 투여하고, 그 다음 주마다 60분 이상 투여한다.
후주(endnotes)
본 발명은 그의 특정 구현예와 연결하여 개시되어 있고, 더 변형가능한 것으로 이해되어야 하며 이러한 적용은 임의의 변경, 사용 또는 적용에 이어, 본 발명이 속하는 기술분야에서 공지의 또는 전통적인 사용에 따른 본 발명의 상세한 설명에서 벗어나는 것을 포함하여 본 명세서에 속하고 필수적인 특징을 적용하는 일반적으로 본 발명의 원리을 포함하는 것으로 간주된다.
본 명세서에 언급된 모든 공개 및 등록특허는 각 독립적인 공개 또는 등록특허가 그들 전체로서 참조로서 편입되는 것으로 특별하고 개별적으로 지시한 것처럼 동일한 내용으로 본 명세서에 참조로서 편입된다.
부록
항암제
항-에스트로겐 수용체 제제 또는 수용체 타이로신 인산화 억제제와 이중특이성 항-ErbB2/항-ErbB3 항체와 공동 투여는 아래에서 선택되는 항종양성 제제를 세 번째 제제로서 추가적으로 공통 투여할 수 있다.
| 치료학적 분류 | 예(제네릭/상품명) | 권장 투여량 |
| 유사분열 억제제 | 파클리탁셀(TAXOL; ABRAZANE) | 175 mg/m2 |
| 도세탁셀(TAXOTERE) | 60-100 mg/m2 | |
| 토포이소머라아제 억제제 | 캠토테신 | |
| 토포테칸 하이드로클로라이드(HYCAMTIN) | ||
| 에토포시드(EPOSIN) | ||
| 알킬화제 | 사이클로포스파미드(CYTOXAN) | 600 mg/m2 |
| 백금-기반 제제 | 시스플라틴 | 20-100 mg/m2 |
| 카르보플라틴(PARAPLATIN) | 300 mg/m2 | |
| 네다플라틴(AQUPLA) | ||
| 옥사리플라틴(ELOXATIN) | 65-85 mg/m2 | |
| 사트라플라틴(SPERA) | ||
| 트리플라틴 테트라니트레이트 | ||
| 선택적 에스트로겐 조절자(SERM) | 타목시펜(NOLVADEX) | 20-40 mg/일 |
| 랄로시펜(EVISTA) | 60 mg/일 | |
| 토레미펜(FARESTON) | ||
| 항대사성물질 | 메토트렉사트 | 40 mg/m2 |
| 플루오르우라실(5-FU) | 500 mg/m2 | |
| 랄티트렉세드 | ||
| 항종양항생물질 | 독소루비신(ADRIAMYCIN) | 40-75 mg/m2 |
| 에피루비신(ELLENCE) | 60-120 mg/m2 | |
| 아로마타제(aromatase) 억제제 | 아미노글루테티미드(CYTADREN) | 250-2,000 mg/일 |
| 아나스트로졸(ARIMIDEX) | 1 mg/일 | |
| 레트로졸(FEMARA) | 2.5 mg/일 | |
| 보로졸 | ||
| 엑세메스탄(AROMASIN) | 25-50 mg/일 | |
| 테스토락톤 | ||
| 패드로졸(AFEMA) | ||
| 항-VEGF 제제 | 베바시주맙(AVASTIN) | 10 mg/kg |
| 항-ErbB2(HER2/neu) 제제 | 트라스트주맙(HERCEPTIN) | 2-8 mg/kg |
| 퍼투주맙(OMNITARG) | ||
| 항-ErbB3(HER3) 제제 | U3-1287(AMG 888) |
부록
| 이중특이성을 갖는 항-ErbB2/항-ErbB3 항체와의 조합을 위한 다른 항암제 | 상표명 | 제조사/소유주 |
| 항-IGF1R 항체 | ||
| AMG 479(완전 인간화 mAb) | Amgen | |
| IMCA12(완전 인간화 mAb) | ImClone | |
| NSC-742460 | Dyax | |
| 19D12(완전 인간화 mAb) | ||
| CP751-871(완전 인간화 mAb) | Pfizer | |
| H7C10(완전 인간화 mAb) | ||
| 알파IR3(마우스) | ||
| scFV/FC(마우스/인간 키메라) | ||
| EM/164(마우스) | ||
| MK-0646, F50035 | Pierre Fabre Medicament, Merck | |
| 소분자 타겟팅 IGF1R | ||
| NVP-AEW541 | Novartis | |
| BMS-536, 924(1H-벤조이미다졸-2-일)-1H-피리딘-2-원) | Bristol-Myers Squibb | |
| BMS-554,417 | Bristol-Myers Squibb | |
| Cycloligan | ||
| TAE226 | ||
| PQ401 | ||
| 항-EGFR 단일클론항체 | ||
| INCB7839 | Incyte | |
| 베바시주맙 | Avastin | Genentech |
| 세툭시맙 | Erbitux | IMCLONE |
| mAb 806 | ||
| 마투주맙(EMD72000) | ||
| 니모투주맙(TheraClM) | ||
| 파니투무맙 | Vectibix | Amgen |
| 항-ErbB3 치료제 | ||
| U3-1287 / AMG888 | U3 Pharma/Amgen | |
| MM-121 | Merrimack Phamaceuticals | |
| 항-ErbB2 치료제 | ||
| 트라스트주맙 | Herceptin | Genentech |
| HKI-272 - 네라티닙 | Wyeth | |
| KOS-953 - 타네스피마이신 | Kosan Biosciences | |
| Her/ErbB 이합체화 억제제 | ||
| 2C4, R1273 - 퍼투주맙 | Omnitarg | Genentech, Roche |
| 소분자 타겟팅 EGFR | ||
| CI-1033(PD 183805) | Pfizer, Inc. | |
| EKB-569 | ||
| 제피티닙 | IRESSATM | AstraZeneca |
| 라파티닙 (GW572016) | GlaxoSmithKline | |
| 라파티닙 이토실레이트 | Tykerb | SmithKline Beecham |
| 엘로티닙 HCL (OSI-774) | Tarceva | OSI Pharms |
| PD158780 | ||
| PKI-166 | Novartis | |
| 티포스틴 AG 1478(4-(3-클로로아닐리노)-6,7-디메톡시퀴나졸린) | ||
| 항-cmet 항체 치료제 | ||
| AVEO(AV299) | AVEO | |
| AMG102 | Amgen | |
| 5D5(OA-5D5) | Genetech | |
| 소분자 타겟팅 cmet | ||
| PHA665752 | ||
| ARQ-650RP | ArQule | |
| ARQ 197 | ArQule | |
| 알킬화제 | ||
| BCNU → 1,3-bis(2-클로로에틸)-니트로수레아 | ||
| 벤다무스틴 | ||
| 부술판 | Myleran | GlaxoSmithKline |
| 카르보플라틴 | Paraplatin | Bristol-Myers Squibb |
| 카르보큐원 | ||
| 카르무스틴 | ||
| CCNU → 1,-(2-클로로에틸)-3-시클로헥실-1-니트로수레아(메틸 CCNU) | ||
| 클로람부실 | Leukeran | Smithkline Beecham |
| 클로메틴 | ||
| 시스플라틴(시스플라티눔, CDDP) | Platinol | Bristol-Myers |
| 시클로포스파미드 | Cytoxan | Bristol-Myers Squibb |
| Neosar | Teva Parenteral | |
| 아카바진(DTIC) | ||
| 포테무스틴 | ||
| 학사메틸멜라민(알트레타민, HMM) | Hexalen | MGI Pharma, Inc. |
| 이포스파미드 | Mitoxana | ASTA Medica |
| 로무스틴 | ||
| 만노술판 | ||
| 멜팔란 | Alkeran | GlaxoSmithKline |
| 네다플라틴 | ||
| 니무스틴 | ||
| 옥사리플라틴 | Eloxatin | Sanofi-Aventis US |
| 프레드니무느틴 | ||
| 프로카르바진 HCL | Matulane | Sigma-Tau Pharmaceuticals, Inc. |
| 리보뉴클레오티드 환원효소 억제제 | ||
| 라니무스틴 | ||
| 사트라플라틴 | ||
| 세무스틴 | ||
| 스트렙토조신 | ||
| 테모졸로미드 | ||
| 트레오술판 | ||
| 트리아지큐원 | ||
| 트리틸렌 멜라민 | ||
| 티오TEPA | Bedford, Abraxis, Teva | |
| 틀리플라틴 테트라니트레이트 | ||
| 트로포스파미드 | ||
| 우라무스틴 | ||
| 항대사성물질 | ||
| 5-아자시티딘 | ||
| 플루오르우라실(5-FU)/카페시타빈 | ||
| 6-머캅토퓨린(머캅토퓨린, 6-MP) | ||
| 6-티오구아닌(6-TG) | Purinethol | Teva |
| 시토신 아라비노시드(시타라빈, Ara-C) | Thioguanine | GlaxoSmithKline |
| 아자티오프린 | Azasan | AAIPHARMA LLC |
| 카페시타빈 | XELODA | HLR(Roche) |
| 클라드리빈(2-CdA, 2-클로로디옥시아데노신) | Leustatin | Ortho Biotech |
| 5-트리플루오르메틸-2‘-디옥시우리딘 | ||
| 플루다라빈 포스페이트 | Fludara | Bayer Health Care |
| 플록스우리딘(5-플루오르-2) | FUDR | Hospira, Inc. |
| 메토트렉세이트 소듐 | Trexall | Barr |
| 페메트렉세드 | Alimta | Lilly |
| 펜토스타틴 | Nipent | Hospira, Inc. |
| 랄티트렉세드 | Tomudex | AstraZeneca |
| 테가푸르 | ||
| 아로마타제 억제제 | ||
| 케토코나졸 | ||
| 글루코코르티코이드 | ||
| 덱사메타손 | Decadron Dexasone, Diodex, Hexadrol, Maxidex | Wyeth, Inc. |
| 프레드니솔론 | ||
| 프레드니손 | Deltasone, Orasone, Liquid Pred, Sterapred | |
| 면역치료제 | ||
| 알파 인터페론 | ||
| 혈관형성 억제제 | Avastin | Genentech |
| IL-12 → 인터루킨 12 | ||
| IL-2 → 인터루킨 2(알데스루킨) | Proleukin | Chiron |
| 수용체 타이로신 인산화효소 억제제 | ||
| AMG 386 | Amgen | |
| 악시티닙(AG-013736) | Pfizer, Inc | |
| 보수티닙(SKI-606) | Wyeth | |
| 브리바닙 알라리네이트(BMS-582664) | BMS | |
| 세디라닙(AZD2171) | Recentin | AstraVeneca |
| 다사티닙(BMS-354825) | Sprycel | Bristol-Myers Squibb |
| 이마티닙 메실레이트 | Gleevec | Novartis |
| 레스타우르티닙(CEP-701) | Cephalon | |
| 모테사닙 디포스페이트(AMG-706) | Amgen/Takeda | |
| 니로티닙 하이드로클로라이드 모노하이드레이트 | Tasigna | Novartis |
| 파조파닙 HCL(GW786034) | Armala | GSK |
| 세막사닙(SU5416) | Pharmacia, | |
| 소라페닙 토실레이트 | Nexavar | Bayer |
| 수니티닙 말레이트 | Sutent | Pfizer, Inc. |
| 반데타닙(AZD647) | Zactima | AstraZeneca |
| 바타라닙; PTK-787 | Novartis; Bayer Schering Pharma | |
| XL184, NSC718781 | Exelixis, GSK | |
| 미세소관-타겟팅 제제 | ||
| 콜히친 | ||
| 도세탁셀 | Taxotere | Sanofi-Aventis US |
| 익사베필론 | IXEMPRATM | Bristol-Myers Squibb |
| 라로탁셀 | Sanofi-aventis | |
| 오르타탁셀 | Spectrum Phamaceuticals | |
| 나노파티클 파클리탁셀(ABI-007) | Abraxane | Abraxis BioScience, Inc. |
| 파클리탁셀 | Taxol | Bistol-Myers Squibb |
| 테세탁셀 | Genta | |
| 빈블라스틴 설페이트 | Velban | Lilly |
| 빈크리스틴 | Oncovin | Lilly |
| 빈데신 설페이트 | Eldisine | Lilly |
| 빈플루닌 | Pierre Fabre | |
| 비노렐빈 타르트레이트 | Navelbine | Pierre Fabre |
| mTOR 억제제 | ||
| 데포로리머스(AP23573, MK 8669) | ARIAD Pharmaceuticals, Inc | |
| 에베로리머스(RAD001, RAD001C) | Certican, Afinitor | Novartis |
| 시로리머스(라파마이신) | Rapamune | Wyeth Pharama |
| 템시로리머스(CCI-779) | Torisel | Wyeth Pharama |
| 단백질 합성 억제제 | ||
| L-아스파라기나아제 | Elspar | Merck & Co. |
| 소마토스타틴 유사체 | ||
| 옥트레오티드 아세테이트 | Sandostatin | Novartis |
| 토포이소머라아제 억제제 | ||
| 액티노마이신 D | ||
| 캠토테킨(CPT) | ||
| 벨로테칸 | ||
| 다우노루비신 시트레이트 | Daunoxome | Gilead |
| 독소루비신 하이드로클로라이드 | Doxil | Alza |
| Vepesid | Bristol-Myers Squibb | |
| 에토포시드 | Etopophos | Hospira, Bedford, Teva Parenteral, Etc. |
| 이리노테칸 HCL(CPT-11) | Camptosar | Pharmacia & Upjohn |
| 미톡산트론 HCL | Novantrone | EMD Serono |
| 루비테칸 | ||
| 테니포시드(VM-26) | Vumon | Bristol-Myers Squibb |
| 토포테칸 HCL | Hycamtin | GlaxoSmithKline |
| 화학요법제 | ||
| 아드리아마이신, 5-플루오르우라실, 시토신, 블레오마이신, 미토마이신 C, 다우노마이신, 카르미노마이신, 아미노테린, 닥티노마이신, 미토마이신, 에스페라마이신, 플로파라빈, 머캅토퓨린, 펜토스타틴, 티오구아닌, 시타라빈, 데시타빈, 플록스우리딘, 젬시타빈(Gemzar), 엔도시타빈, 사파시타빈 | ||
| 호르몬 치료제 | ||
| 아바렐릭스 | PlenaxisTM | Amgen |
| 아비라테론 아세테이트 | CB7630 | BTG ple |
| 아피목시펜 | TamoGel | Ascend Therapeutics, Inc. |
| 아나스트라졸 | Arimidex | AstraZeneca |
| 아로마타제 억제제 | Atamestane plus toremifene | Intarcia Therapeutics, Inc. |
| Arzoxifene | Eli Lilly & Co. | |
| 아센타; DN-101 | Novartis; Oregon Health & Science Univ. | |
| 비칼루타미드 | Casodex | AstraZeneca |
| 부세렐린 | Suprefact | Sanofi Aventis |
| 세트로리릭스 | Cetrotide | EMD Serono |
| 엑세메스탄 | Aromasin | Pfizer |
| 엑세메스탄 | Xtane | Natco Pharma, Ltd. |
| 파드로졸(CGS 16949A) | ||
| 플루타미드 | Eulexin | Schering |
| 플루타미드 | Prostacur | Laboratorios Alimirall, S.A. |
| 풀베스트란트 | Faslodex | AstraZeneca |
| 고세렐린 아세테이트 | Zoladex | AstraZeneca |
| 레트로졸 | Femara | Novartis |
| 레트로졸(CGS20267) | Femara | Chugai Pharmaceutical Co., Ltd. |
| 레트로졸 | Estrochek | Jagsonpal Pharmaceuticals, Ltd. |
| 레트로졸 | Letrozole | Indchemie Health Specialities |
| 루프롤리드 아세테이트 | Eligard | Sanofi Aventis |
| 루프롤리드 아세테이트 | Leopril | VHB Life Sciences, Inc. |
| 루프롤리드 아세테이트 | Lupron/Lupron Depot | TAP Pharma |
| 루프롤리드 아세테이트 | Viador | Bayer AG |
| 메게스트롤 아세테이트 | Megace | Bristol-Myers Squibb |
| 메게스트롤 아세테이트 | Estradio valerate(Delestrogen) | Jagsonpal Pharmaceuticals, Ltd. |
| 메드록시프로게스테론 아세테이트 | Veraplex | Combiphar |
| MT206 | Medisyn Technologies, Inc. | |
| 나파렐린 | ||
| 난드롤론 디카노에이트 | Zestabolin | Mankind Pharma, Ltd. |
| 니루타미드 | Nilandron | Aventis Pharmaceuticals |
| 라록시펜 HCL | Evista | Lilly |
| 타목시펜 | Taxifen | Yung Shin Pharmaceutical |
| 타목시펜 | Tomifen | Alkem Laboratories, Ltd. |
| 타목시펜 시트레이트 | Nolvadex | AstraZeneca |
| 타목시펜 시트레이트 | Soltamox | EUSA Pharma, Inc. |
| 타목시펜 시트레이트 | Tamoxifen citrate SOPHARMA | Sopharma JSCo. |
| 토레미펜 시트레이트 | Fareston | GTX, Inc. |
| 트리프토렐린 파모에이트 | Trelstar | Watson Labs |
| 트리프토렐린 파모에이트 | Trelstar Depot | Paladin Labs, Inc. |
| 단백질 인산화 효소 B 억제제 | ||
| Akt 억제제 ASTEX | Astex Therapeutics | |
| Akt 억제제 NERVIANO | Nerviano Medical Sciences | |
| AKT 인산화효소 억제제 TELIK | Telik, Inc. | |
| AKT DECIPHERA | Deciphera Pharmaceuticals, LLC | |
| 페리포신(KRX0401, D-21266) | Keryx Biopharmaceuticals, Inc., AEterna Zentaris, Inc. | |
| 도세탁셀과 페리포신 | Keryx Biopharmaceuticals, Inc., AEterna Zentaris, Inc. | |
| 젬시타빈과 페리포신 | AEterna Zentaris, Inc. | |
| 파클리탁셀과 페리포신 | Keryx Biopharmaceuticals, Inc., AEterna Zentaris, Inc. | |
| 단백질 인산화효소-B 억제제 DEVELOGEN | DeveloGen AG | |
| PX316 | Oncothyreon, Inc. | |
| RX0183 | Rexahn Pharmaceuticals, Inc. | |
| RX0201 | Rexahn Pharmaceuticals, Inc. | |
| VQD002 | VioQuest Pharmaceuticals, Inc. | |
| XL418 | Exelixis, Inc. | |
| ZEN027 | AEterna Zentaris, Inc. | |
| 포스파티딜이노시톨 3-인산화효소 억제제 | ||
| BEZ235 | Novartis AG | |
| BGT226 | Novartis AG | |
| CAL101 | Calistoga Pharmaceuticals, Inc. | |
| CHR4432 | Chroma Therapeutics, Ltd. | |
| Erk/PI3K 억제제 ETERNA | AEterna Zentaris, Inc. | |
| GDC0941 | Genentech Inc./Piramed Limited/Roche Holdings, Ltd. | |
| Enzastaurin HCL(LY317615) | Enzastaurin | Eli LIlly |
| LY294002/Wortmannin | ||
| PI3K 억제제 SEMAFORE | Semafore Pharmaceuticals | |
| PX866 | Oncothyreon, Inc. | |
| SF1126 | Semafore Pharmaceuticals | |
| VMD-8000 | VM Discovery, Inc. | |
| XL147 | Exelixis, Inc. | |
| XL147과 XL647 | Exelixis, Inc. | |
| XL765 | Exelixis, Inc. | |
| PI-103 | Roche/Piramed | |
| 사이클린-의존적 인산화효소 억제제 | ||
| CYC200, r-로스코비틴 | Seliciclib | Cyclacel Pharma |
| NSC-649890, L86-8275, HMR-J275 | Alvocidib | NCI |
| TLr9, CD289 | ||
| IMOxine | Merck KGaA | |
| HYB2055 | Idera | |
| IMO-2055 | Isis Pharma | |
| 1018ISS | Dynavax Technologies/UCSF | |
| PF-3512676 | Pfizer | |
| 효소 억제제 | ||
| 로나파르닙(SCH66336) | Sarasar | SuperGen, U Arizona |
| 항-TRAIL | ||
| AMG-655 | Aeterna Zentaris, Keryx Biopharma | |
| Apo2L/TRAIL, AMG951 | Genentech, Amgen | |
| 아포맙(완전 인간화 mAb) | Genenteck | |
| 기타 | ||
| 임프라임 PGG | Biothera | |
| CHR-2797 | AminopeptidaseM1 | Chroma Therapeutics |
| E7820, NSC 719239 | Integrin-alpha2 | Eisai |
| INCB007839 | ADAM 17, TACE | Incyte |
| CNF2024, BIIB021 | Hsp90 | Biogen Idec |
| MP470, HPK-56 | Kit/Met/Ret | Shering-Plough |
| SNDX-275/MS-275 | HDAC | Syndax |
| 자르네스트라, 티피파르닙, R115777 | Ras | Janssen Pharma |
| 볼로식시맙; Eos200-4, M200 | alpha581 integrin | Biogen Idec; Eli Lilly/UCSF/PDL BioPharma |
| 아프리콕십(TP2001) | COX-2 inhibitor | Daiichi Sankyo; Tragara Pharma |
SEQUENCE LISTING
<110> Merrimack Pharmaceuticals, Inc.
<120> COMBINATION THERAPIES COMPRISING ANTI-ERBB3 AGENTS
<130> 06727/033WO3
<140> PCT/US2012/026602
<141> 2012-02-24
<150> US 61/470,848
<151> 2011-04-01
<150> US 61/446,326
<151> 2011-02-24
<160> 1
<170> PatentIn version 3.5
<210> 1
<211> 1095
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 1
Gln Val Gln Leu Gln Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asn Ile Asn Arg Asp Gly Ser Ala Ser Tyr Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Gly Val Gly Tyr Phe Asp Leu Trp Gly Arg Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Gly Gly Gly Gly Ser Gly Gly
115 120 125
Gly Gly Ser Gly Gly Gly Gly Ser Gln Ser Ala Leu Thr Gln Pro Ala
130 135 140
Ser Val Ser Gly Ser Pro Gly Gln Ser Ile Thr Ile Ser Cys Thr Gly
145 150 155 160
Thr Ser Ser Asp Val Gly Gly Tyr Asn Phe Val Ser Trp Tyr Gln Gln
165 170 175
His Pro Gly Lys Ala Pro Lys Leu Met Ile Tyr Asp Val Ser Asp Arg
180 185 190
Pro Ser Gly Val Ser Asp Arg Phe Ser Gly Ser Lys Ser Gly Asn Thr
195 200 205
Ala Ser Leu Ile Ile Ser Gly Leu Gln Ala Asp Asp Glu Ala Asp Tyr
210 215 220
Tyr Cys Ser Ser Tyr Gly Ser Ser Ser Thr His Val Ile Phe Gly Gly
225 230 235 240
Gly Thr Lys Val Thr Val Leu Gly Ala Ala Ser Asp Ala His Lys Ser
245 250 255
Glu Val Ala His Arg Phe Lys Asp Leu Gly Glu Glu Asn Phe Lys Ala
260 265 270
Leu Val Leu Ile Ala Phe Ala Gln Tyr Leu Gln Gln Ser Pro Phe Glu
275 280 285
Asp His Val Lys Leu Val Asn Glu Val Thr Glu Phe Ala Lys Thr Cys
290 295 300
Val Ala Asp Glu Ser Ala Glu Asn Cys Asp Lys Ser Leu His Thr Leu
305 310 315 320
Phe Gly Asp Lys Leu Cys Thr Val Ala Thr Leu Arg Glu Thr Tyr Gly
325 330 335
Glu Met Ala Asp Cys Cys Ala Lys Gln Glu Pro Glu Arg Asn Glu Cys
340 345 350
Phe Leu Gln His Lys Asp Asp Asn Pro Asn Leu Pro Arg Leu Val Arg
355 360 365
Pro Glu Val Asp Val Met Cys Thr Ala Phe His Asp Asn Glu Glu Thr
370 375 380
Phe Leu Lys Lys Tyr Leu Tyr Glu Ile Ala Arg Arg His Pro Tyr Phe
385 390 395 400
Tyr Ala Pro Glu Leu Leu Phe Phe Ala Lys Arg Tyr Lys Ala Ala Phe
405 410 415
Thr Glu Cys Cys Gln Ala Ala Asp Lys Ala Ala Cys Leu Leu Pro Lys
420 425 430
Leu Asp Glu Leu Arg Asp Glu Gly Lys Ala Ser Ser Ala Lys Gln Arg
435 440 445
Leu Lys Cys Ala Ser Leu Gln Lys Phe Gly Glu Arg Ala Phe Lys Ala
450 455 460
Trp Ala Val Ala Arg Leu Ser Gln Arg Phe Pro Lys Ala Glu Phe Ala
465 470 475 480
Glu Val Ser Lys Leu Val Thr Asp Leu Thr Lys Val His Thr Glu Cys
485 490 495
Cys His Gly Asp Leu Leu Glu Cys Ala Asp Asp Arg Ala Asp Leu Ala
500 505 510
Lys Tyr Ile Cys Glu Asn Gln Asp Ser Ile Ser Ser Lys Leu Lys Glu
515 520 525
Cys Cys Glu Lys Pro Leu Leu Glu Lys Ser His Cys Ile Ala Glu Val
530 535 540
Glu Asn Asp Glu Met Pro Ala Asp Leu Pro Ser Leu Ala Ala Asp Phe
545 550 555 560
Val Glu Ser Lys Asp Val Cys Lys Asn Tyr Ala Glu Ala Lys Asp Val
565 570 575
Phe Leu Gly Met Phe Leu Tyr Glu Tyr Ala Arg Arg His Pro Asp Tyr
580 585 590
Ser Val Val Leu Leu Leu Arg Leu Ala Lys Thr Tyr Glu Thr Thr Leu
595 600 605
Glu Lys Cys Cys Ala Ala Ala Asp Pro His Glu Cys Tyr Ala Lys Val
610 615 620
Phe Asp Glu Phe Lys Pro Leu Val Glu Glu Pro Gln Asn Leu Ile Lys
625 630 635 640
Gln Asn Cys Glu Leu Phe Glu Gln Leu Gly Glu Tyr Lys Phe Gln Asn
645 650 655
Ala Leu Leu Val Arg Tyr Thr Lys Lys Val Pro Gln Val Ser Thr Pro
660 665 670
Thr Leu Val Glu Val Ser Arg Asn Leu Gly Lys Val Gly Ser Lys Cys
675 680 685
Cys Lys His Pro Glu Ala Lys Arg Met Pro Cys Ala Glu Asp Tyr Leu
690 695 700
Ser Val Val Leu Asn Gln Leu Cys Val Leu His Glu Lys Thr Pro Val
705 710 715 720
Ser Asp Arg Val Thr Lys Cys Cys Thr Glu Ser Leu Val Asn Arg Arg
725 730 735
Pro Cys Phe Ser Ala Leu Glu Val Asp Glu Thr Tyr Val Pro Lys Glu
740 745 750
Phe Gln Ala Glu Thr Phe Thr Phe His Ala Asp Ile Cys Thr Leu Ser
755 760 765
Glu Lys Glu Arg Gln Ile Lys Lys Gln Thr Ala Leu Val Glu Leu Val
770 775 780
Lys His Lys Pro Lys Ala Thr Lys Glu Gln Leu Lys Ala Val Met Asp
785 790 795 800
Asp Phe Ala Ala Phe Val Glu Lys Cys Cys Lys Ala Asp Asp Lys Glu
805 810 815
Thr Cys Phe Ala Glu Glu Gly Lys Lys Leu Val Ala Ala Ser Gln Ala
820 825 830
Ala Leu Gly Leu Ala Ala Ala Leu Gln Val Gln Leu Val Gln Ser Gly
835 840 845
Ala Glu Val Lys Lys Pro Gly Glu Ser Leu Lys Ile Ser Cys Lys Gly
850 855 860
Ser Gly Tyr Ser Phe Thr Ser Tyr Trp Ile Ala Trp Val Arg Gln Met
865 870 875 880
Pro Gly Lys Gly Leu Glu Tyr Met Gly Leu Ile Tyr Pro Gly Asp Ser
885 890 895
Asp Thr Lys Tyr Ser Pro Ser Phe Gln Gly Gln Val Thr Ile Ser Val
900 905 910
Asp Lys Ser Val Ser Thr Ala Tyr Leu Gln Trp Ser Ser Leu Lys Pro
915 920 925
Ser Asp Ser Ala Val Tyr Phe Cys Ala Arg His Asp Val Gly Tyr Cys
930 935 940
Thr Asp Arg Thr Cys Ala Lys Trp Pro Glu Trp Leu Gly Val Trp Gly
945 950 955 960
Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Ser Gly
965 970 975
Gly Gly Ser Gly Gly Gly Gly Ser Gln Ser Val Leu Thr Gln Pro Pro
980 985 990
Ser Val Ser Ala Ala Pro Gly Gln Lys Val Thr Ile Ser Cys Ser Gly
995 1000 1005
Ser Ser Ser Asn Ile Gly Asn Asn Tyr Val Ser Trp Tyr Gln Gln
1010 1015 1020
Leu Pro Gly Thr Ala Pro Lys Leu Leu Ile Tyr Asp His Thr Asn
1025 1030 1035
Arg Pro Ala Gly Val Pro Asp Arg Phe Ser Gly Ser Lys Ser Gly
1040 1045 1050
Thr Ser Ala Ser Leu Ala Ile Ser Gly Phe Arg Ser Glu Asp Glu
1055 1060 1065
Ala Asp Tyr Tyr Cys Ala Ser Trp Asp Tyr Thr Leu Ser Gly Trp
1070 1075 1080
Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
1085 1090 1095
Claims (65)
- 악성 종양을 가진 객체(subject)를 치료하는 방법으로서, 상기 방법은 객체에 i) 항-에스트로겐제의 유효량 또는 ⅱ) 수용체 티로신 키나아제 억제제의 유효량 및 이중 특이성 항-ErbB2/항-ErbB3 항체의 유효량 및 선택적으로 트라스투주맙의 유효량을 공동 투여하는 단계를 포함하는 것을 특징으로 하는 방법.
- 제 1 항에 있어서, 상기 이중 특이성 항-ErbB2/항-ErbB3 항체 및 상기 ⅰ) 또는 ⅱ) 및 선택적으로 트라스투주맙의 유효량과의 조합은 다음과 같은 특징을 갖는 것을 특징으로 하는 방법: (제1의 농도에서의) 이중 특이성 항-ErbB2/항-ErbB3 항체 및 (제2의 농도에서의) 항-에스트로겐제 또는 (제3의 농도에서의) 수용체 티로신 키나아제 억제제를 포함하는 제1의 조직배양배지를 제조하고, 상기 배지는 세포배양내의 세포주의 암세포와 접촉되고, 세포성장 또는 세포증식 또는 세포내의 pErbB3의 생산 또는 pAKT의 생산이 저해되거나 또는 배양내에서의 세포사멸성 세포의 백분율이 증가한다.
- 제 2 항에 있어서, 세포성장 또는 세포증식 또는 세포내의 pErbB3의 생산 또는 pAKT의 생산이 저해되거나, 또는 배양내에서의 세포사멸성 세포의 백분율이 세포성장 또는 세포증식 또는 세포내의 pErbB3의 생산 또는 pAKT의 생산 보다 더 큰 정도로 증가하거나, 또는 배양내에서의 세포사멸성 세포의 백분율이, 세포배양내의 세포주의 암세포를 a) 이중 특이성 항-ErbB2/항-ErbB3 항체를 포함하지 않는 것을 제외하고는 청구항 2 기재의 배지와 필수적으로 동일한 제2의 배지 및 b) 어떠한 항-에스트로겐제를 포함하지 않고 어떠한 수용체 티로신 키나아제 억제제를 포함하지 않는 것을 제외하고는 청구항 2 기재의 배지와 필수적으로 동일한 제3의 배지 각각과 접촉시키는 때에 증가하는 것을 특징으로 하는 방법.
- 제 2 항 또는 제 3 항에 있어서, 상기 세포주는 BT474-M3인 것을 특징으로 하는 방법.
- 제 2 항 내지 제 4 항 중 어느 한 항에 있어서, 상기 배양은 스페로이드 배양(spheroid culture)인 것을 특징으로 하는 방법.
- 제 1 항에 있어서, 상기 유효량은 마우스 유효량 또는 인간 유효량인 것을 특징으로 하는 방법.
- 제 6 항에 있어서, 상기 유효량은 마우스 유효량이고, 상기 ⅰ) 또는 ⅱ) 및 이중 특이성 항-ErbB2/항-ErbB3 항체와의 조합은 다음의 특징을 갖는 것을 특징으로 하는 방법: 측정된 부피의 종양을 갖는 BT474-M3 이종이식 종양을 포함하는 마우스에 공동 투여하는 때에, 상기 조합은 공동 투여의 32일 후에 종양 부피 증가의 억제에 있어서 상기 ⅰ) 또는 ⅱ)와의 공동 투여가 없는 이중 특이성 항-ErbB2/항-ErbB3 항체의 마우스 유효량의 투여 보다 더욱 효과적이다.
- 제 7 항에 있어서, 상기 트라스투주맙의 마우스 유효량을 이중 특이성 항-ErbB2/항-ErbB3 항체와 공동 투여하는 것을 특징으로 하는 방법.
- 제 1 항 내지 제 8 항 중 어느 한 항에 있어서, 상기 객체에의 공동 투여는 객체에서 약물-약물 상호작용 매개된 독성을 생성하지 않는 것을 특징으로 하는 방법.
- 제 1 항에 있어서, 상기 객체에의 공동 투여는 실질적으로 가산적(additive) 또는 상가적(superadditive) 효과를 생성하는 것을 특징으로 하는 방법.
- 제 1 항 내지 제 10 항 중 어느 한 항에 있어서, 상기 항-에스트로겐제는 에스트로겐 수용체 길항제 또는 아로마타제 억제제인 것을 특징으로 하는 방법.
- 제 11 항에 있어서, 상기 에스트로겐 수용체 길항제는 풀베스트란트 또는 타목시펜인 것을 특징으로 하는 방법.
- 제 11 항에 있어서, 상기 아로마타제 억제제는 레트로졸, 엑세메스탄, 아나스트로졸, 아미노글루테티미드, 테스토락톤, 보로졸, 포르메스탄, 또는 파드로졸인 것을 특징으로 하는 방법.
- 제 13 항에 있어서, 상기 아로마타제 억제제는 레트로졸인 것을 특징으로 하는 방법.
- 제 1 항 내지 제 14 항 중 어느 한 항에 있어서, 상기 이중 특이성 항-ErbB2/항-ErbB3 항체는 서열번호 1에 개시된 아미노산 서열을 포함하는 것을 특징으로 하는 방법.
- 제 1 항 내지 제 15 항 중 어느 한 항에 있어서, 상기 이중 특이성 항-ErbB2/항-ErbB3 항체는 A5-HSA-ML3.9, ML3.9-HSA-A5, A5-HSA-B1D2, B1D2-HSA-A5, B12-HSA-B1D2, B1D2-HSA-B12, A5-HSA-F5B6H2, F5B6H2-HSA-A5, H3-HSA-F5B6H2, F5B6H2-HSA-H3, F4-HSA-F5B6H2, F5B6H2-HSA-F4, B1D2-HSA-H3, 및 H3-HSA-B1D2으로 이루어지는 군으로부터 선택되는 것을 특징으로 하는 방법.
- 제 1 항 내지 제 16 항 중 어느 한 항에 있어서, 상기 수용체 티로신 키나아제 억제제는 엘로티닙(erlotinib), 아파티닙(afatinib), 다사티닙(dasatinib), 제피티닙(gefitinib), 이마티닙(imatinib), 파조피닙(pazopinib), 라파티닙(lapatinib), 수니티닙(sunitinib), 니로티닙(nilotinib), 또는 소라페닙(sorafenib)인 것을 특징으로 하는 방법.
- 제 1 항 내지 제 17 항 중 어느 한 항에 있어서, 상기 수용체 티로신 키나아제 억제제는 라파티닙인 것을 특징으로 하는 방법.
- 제 18 항에 있어서, 상기 라파티닙은 14일 투여 스케줄을 포함하는 투여 요법을 통해 투여되며, 상기 라파티닙은 간헐적으로 투여되는 것을 특징으로 하는 방법.
- 제 19 항에 있어서, 상기 라파티닙은 14일 투여 스케줄의 1 내지 3일, 1 내지 4일, 1 내지 5일, 1 내지 6일, 또는 1 내지 7일에 투여되는 것을 특징으로 하는 방법.
- 제 20 항에 있어서, 상기 라파티닙은 14일 투여 스케줄의 1 내지 5일에 투여되는 것을 특징으로 하는 방법.
- 제 19 항 내지 제 21 항 중 어느 한 항에 있어서, 상기 라파티닙은 2000 내지 9000 mg/d의 용량으로 투여되는 것을 특징으로 하는 방법.
- 제 22 항에 있어서, 상기 용량은 3000 mg/day인 것을 특징으로 하는 방법.
- 제 19 항 내지 제 23 항 중 어느 한 항에 있어서, 상기 14일 투여 사이클의 1일에 투여되는 라파티닙의 투여는 부하 용량(loading dose)을 포함하는 것을 특징으로 하는 방법.
- 제 1 항 내지 제 24 항 중 어느 한 항에 있어서, 카페시타빈 및/또는 시스플라틴의 유효량을 더욱 포함하는 것을 특징으로 하는 방법.
- 이중특이성 항-ErbB2/항-ErbB3 항체를 사용한 악성 종양의 조합 치료에 있어서, 상기 조합 치료는 i) 항-에스트로겐제 또는 ⅱ) 수용체 티로신 키나아제 억제제의 수반적 사용 및 선택적으로 트라스투주맙의 사용을 포함하는 것을 특징으로 하는 조합 치료.
- 제 26 항에 있어서, 상기 항-에스트로겐제는 에스트로겐 수용체 길항제 또는 아로마타제 억제제인 것을 특징으로 하는 조합 치료.
- 제 26 항 또는 제 27 항에 있어서, 상기 에스토로겐 수용체 길항제는 풀베스트란트 또는 타목시펜인 것을 특징으로 하는 조합 치료.
- 제 26 항 또는 제 27 항에 있어서, 상기 항-에스트로겐제는 레트로졸, 엑세메스탄, 아나스트로졸, 아미노글루테티미드, 테스토락톤, 보로졸, 포르메스탄, 및 파드로졸로 이루어지는 군으로부터 선택된 아로마타제 억제제인 것을 특징으로 하는 조합 치료.
- 제 26 항, 제 27항 및 제 29 항 중 어느 한 항에 있어서, 상기 아로마타제 억제제는 레트로졸인 것을 특징으로 하는 조합 치료.
- 제 26 항 내지 제 30 항 중 어느 한 항에 있어서, 상기 이중특이성 항-ErbB2/항-ErbB3 항체는 서열번호 1에 개시된 아미노산 서열을 포함하는 것을 특징으로 하는 조합 치료.
- 제 26 항 내지 제 31 항 중 어느 한 항에 있어서, 상기 항-ErbB2/항-ErbB3 항체는 A5-HSA-ML3.9, ML3.9-HSA-A5, A5-HSA-B1D2, B1D2-HSA-A5, B12-HSA-B1D2, B1D2-HSA-B12, A5-HSA-F5B6H2, F5B6H2-HSA-A5, H3-HSA-F5B6H2, F5B6H2-HSA-H3, F4-HSA-F5B6H2, F5B6H2-HSA-F4, B1D2-HSA-H3, 및 H3-HSA-B1D2으로 이루어지는 군으로부터 선택되는 것을 특징으로 하는 조합 치료.
- 제 26 항 내지 제 32 항 중 어느 한 항에 있어서, 상기 수용체 티로신 키나아제 억제제는 엘로티닙(erlotinib), 아파티닙(afatinib), 다사티닙(dasatinib), 제피티닙(gefitinib), 이마티닙(imatinib), 파조피닙(pazopinib), 라파티닙(lapatinib), 수니티닙(sunitinib), 니로티닙(nilotinib), 및 소라페닙(sorafenib)으로 이루어지는 군으로부터 선택되는 것을 특징으로 하는 조합 치료.
- 제 26 항 내지 제 33 항 중 어느 한 항에 있어서, 상기 수용체 티로신 키나아제 억제제는 라파티닙인 것을 특징으로 하는 조합 치료.
- 제 26 항 내지 제 34 항 중 어느 한 항에 있어서, 카페시타빈 및/또는 시스플라틴의 수반적 사용을 더욱 포함하는 것을 특징으로 하는 조합 치료.
- 제1의 농도에서의 이중 특이성 항-ErbB2/항-ErbB3 항체 및 ⅰ) 제2의 농도에서의 항-에스트로겐제 또는 ⅱ) 제3의 농도에서의 수용체 티로신 키나아제 억제제를 포함하는 수용액으로서, 제1의 농도에서의 이중 특이성 항-ErbB2/항-ErbB3 항체, 및 제2의 농도에서의 항-에스트로겐제 또는 제3의 농도에서의 수용체 티로신 키나아제 억제제를 포함하는 제1의 조직배양배지가 제조되고, 상기 배지를 세포배양내에서 세포주의 암세포와 접촉하는 때에, 세포성장 또는 세포증식 또는 세포내에서의 pErbB3 생산 또는 pAKT 생산이 억제되거나 또는 배양내에서 세포사멸성 세포의 백분율이 증가하는 것을 특징으로 하는 수용액.
- 제 36 항에 있어서, 세포성장 또는 세포증식 또는 세포내의 pErbB3의 생산 또는 pAKT의 생산이 억제되거나, 또는 배양내에서의 세포사멸성 세포의 백분율이 세포배양내의 세포주의 세포를 어떠한 항-에스트로겐제를 포함하지 않고 어떠한 수용체 티로신 키나아제 억제제를 포함하지 않는 것을 제외하고 상기 제 15 항의 배지와 필수적으로 동일한 제2의 조직배양배지와 접촉시키는 때 보다 더 낮은 정도로 증가하는 것을 특징으로 하는 수용액.
- 제 36 항에 있어서, 세포성장 또는 세포증식 또는 세포내의 pErbB3의 생산 또는 pAKT의 생산이 저해되거나, 또는 배양내에서의 세포사멸성 세포의 백분율이 세포배양내의 세포주의 세포를 어떠한 이중 특이성 항-ErbB2/항-ErbB3 항체를 포함하지 않는 것을 제외하고 상기 제 15 항의 배지와 필수적으로 동일한 제3의 조직배양배지와 접촉시키는 때 보다 더 낮은 정도로 증가하는 것을 특징으로 하는 수용액.
- 제 36 항 내지 제 38 항 중 어느 한 항에 있어서, 제4의 농도에서의 트라스투주맙을 더욱 포함하고, 상기 배지가 제4의 농도에서의 트라스투주맙을 더욱 포함하는 것을 특징으로 하는 수용액.
- 제 36 항 내지 제 39 항 중 어느 한 항에 있어서, 상기 세포주는 BT474-M3인 것을 특징으로 하는 수용액.
- 제 36 항 내지 제 40 항 중 어느 한 항에 있어서, 상기 배양은 스페로이드 배양인 것을 특징으로 하는 수용액.
- 제1의 농도에서의 이중 특이성 항-ErbB2/항-ErbB3 항체 및 ⅰ) 제2의 농도에서의 항-에스트로겐제 또는 ⅱ) 제3의 농도에서의 수용체 티로신 키나아제 억제제를 포함하는 수용액으로서, 상기 각 농도는 유효 농도이고, 상기 수용액이 객체(선택적으로 인간 환자)에서의 혈장인 경우, 상기 객체는 객체에게 투여되고 있는 치료에서의 변화가 요구되기에 충분한 독성을 경험하지 않으며, 상기 독성은 객체에서 이중 특이성 항-ErbB2/항-ErbB3 항체 및 항-에스트로겐제 또는 수용체 티로신 키나아제 억제제간의 약물-약물 상호작용에 의해 매개되는 것을 특징으로 하는 수용액.
- 제 36 항 내지 제 42 항 중 어느 한 항에 있어서, 상기 항-에스트로겐제는 풀베스트란트 또는 타목시펜인 것을 특징으로 하는 수용액.
- 제 36 항, 제 37 항 및 제 39 항 내지 제 43 항 중 어느 한 항에 있어서, 상기 이중 특이성 항-ErbB2/항-ErbB3 항체는 서열번호 1의 아미노산 서열을 포함하는 것을 특징으로 하는 수용액.
- 제 36 항, 제 37 항 및 제 39 항 내지 제 44 항 중 어느 한 항에 있어서, 상기 이중 특이성 항-ErbB2/항-ErbB3 항체는 A5-HSA-ML3.9, ML3.9-HSA-A5, A5-HSA-B1D2, B1D2-HSA-A5, B12-HSA-B1D2, B1D2-HSA-B12, A5-HSA-F5B6H2, F5B6H2-HSA-A5, H3-HSA-F5B6H2, F5B6H2-HSA-H3, F4-HSA-F5B6H2, F5B6H2-HSA-F4, B1D2-HSA-H3, 및 H3-HSA-B1D2으로 이루어지는 군으로부터 선택되는 것을 특징으로 하는 수용액.
- 제 36 항 및 제 38 항 내지 제 45 항 중 어느 한 항에 있어서, 상기 수용체 티로신 키나아제 억제제는 엘로티닙(erlotinib), 아파티닙(afatinib), 다사티닙(dasatinib), 제피티닙(gefitinib), 이마티닙(imatinib), 파조피닙(pazopinib), 라파티닙(lapatinib), 수니티닙(sunitinib), 니로티닙(nilotinib), 및 소라페닙(sorafenib)으로 이루어지는 군으로부터 선택되는 것을 특징으로 하는 수용액.
- 제 36 항 및 제 38 항 내지 제 46 항 중 어느 한 항에 있어서, 상기 수용체 티로신 키나아제 억제제는 라파티닙인 것을 특징으로 하는 수용액.
- 종양세포를 포함하는 악성 종양의 성장을 억제하는 방법으로서, 상기 방법은 종양세포를 제 36 항 내지 제 47 항 중 어느 한 항의 수용액과 접촉시키는 단계를 포함하는 것을 특징으로 하는 방법.
- 제 1 항에 있어서, 에스트로겐 수용체 길항제는 풀베스트란트 또는 타목시펜인 것을 특징으로 하는 방법.
- 제 1 항에 있어서, 상기 아로마타제 억제제는 레트로졸인 것을 특징으로 하는 방법.
- 제 1 항에 있어서, 상기 이중특이성 항-ErbB2/항-ErbB3 항체는 서열번호 1에 개시된 아미노산 서열을 포함하는 것을 특징으로 하는 방법.
- 제 1 항에 있어서, 상기 수용체 티로신 키나아제 억제제는 라파티닙(lapatinib)인 것을 특징으로 하는 방법.
- 제 1 항에 있어서, 카페시타빈 및/또는 시스플라틴의 유효량을 더욱 포함하는 것을 특징으로 하는 방법.
- 제 26 항에 있어서, 상기 항-에스트로겐제는 풀베스트란트 또는 타목시펜인 것을 특징으로 하는 조합 치료.
- 제 26 항에 있어서, 상기 이중특이성 항-ErbB2/항-ErbB3 항체는 서열번호 1에 개시된 아미노산 서열을 포함하는 것을 특징으로 하는 조합 치료.
- 제 26 항에 있어서, 상기 아로마타제 억제제는 레트로졸인 것을 특징으로 하는 조합 치료.
- 제 26 항에 있어서, 상기 수용체 티로신 키나아제 억제제는 라파티닙인 것을 특징으로 하는 조합 치료.
- 제 26 항에 있어서, 카페시타빈 및/또는 시스플라틴의 수반적 사용을 더욱 포함하는 것을 특징으로 하는 조합 치료.
- 제 36 항에 있어서, 상기 항-에스트로겐제는 풀베스트란트 또는 타목시펜인 것을 특징으로 하는 수용액.
- 제 36 항에 있어서, 상기 이중특이성 항-ErbB2/항-ErbB3 항체는 서열번호 1에 개시된 아미노산 서열을 포함하는 것을 특징으로 하는 수용액.
- 제 36 항에 있어서, 상기 아로마타제 억제제는 레트로졸인 것을 특징으로 하는 수용액.
- 제 36 항에 있어서, 상기 수용체 티로신 키나아제 억제제는 라파티닙인 것을 특징으로 하는 수용액.
- 제 26 항에 있어서, 카페시타빈 및/또는 시스플라틴의 수반적 사용을 더욱 포함하는 것을 특징으로 하는 수용액.
- 악성 종양을 가진 객체를 치료하는 방법으로서, 상기 방법은 1) 이중특이성 항-ErbB2/항-ErbB3 항체의 유효량, 2) 트라스투주맙의 유효량, 3) 시스플라틴의 유효량 및 4) 카페시타빈의 유효량을 상기 객체에 공동 투여하는 단계를 포함하는 것을 특징으로 하는 방법.
- 악성 종양을 가진 객체를 치료하는 방법으로서, 상기 방법은 1) 이중특이성 항-ErbB2/항-ErbB3 항체의 유효량, 2) 트라스투주맙의 유효량, 및 3) nab-파클리탁셀의 유효량을 상기 객체에 공동 투여하는 단계를 포함하는 것을 특징으로 하는 방법.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161446326P | 2011-02-24 | 2011-02-24 | |
| US61/446,326 | 2011-02-24 | ||
| US201161470848P | 2011-04-01 | 2011-04-01 | |
| US61/470,848 | 2011-04-01 | ||
| PCT/US2012/026602 WO2012116317A2 (en) | 2011-02-24 | 2012-02-24 | Combination therapies comprising anti-erbb3 agents |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20140053865A true KR20140053865A (ko) | 2014-05-08 |
Family
ID=46721477
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020137025188A KR20140053865A (ko) | 2011-02-24 | 2012-02-24 | 항-erbb3제를 포함하는 조합 요법 |
Country Status (11)
| Country | Link |
|---|---|
| US (1) | US20140056898A1 (ko) |
| EP (1) | EP2678359A4 (ko) |
| JP (1) | JP2014511383A (ko) |
| KR (1) | KR20140053865A (ko) |
| CN (1) | CN103547598A (ko) |
| AU (1) | AU2012222094A1 (ko) |
| BR (1) | BR112013021660A2 (ko) |
| CA (1) | CA2828099A1 (ko) |
| IL (1) | IL228095A0 (ko) |
| MX (1) | MX2013009732A (ko) |
| WO (1) | WO2012116317A2 (ko) |
Families Citing this family (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| PT2716301T (pt) | 2007-02-16 | 2017-07-04 | Merrimack Pharmaceuticals Inc | Anticorpos contra erbb3 e suas utilizações |
| US8895001B2 (en) | 2010-03-11 | 2014-11-25 | Merrimack Pharmaceuticals, Inc. | Use of ErbB3 inhibitors in the treatment of triple negative and basal-like breast cancers |
| JP2014509593A (ja) * | 2011-03-15 | 2014-04-21 | メリマック ファーマシューティカルズ インコーポレーティッド | ErbB経路阻害剤に対する耐性の克服 |
| CN104755497A (zh) * | 2012-05-11 | 2015-07-01 | 梅里麦克制药股份有限公司 | 结合抗癌治疗剂的双特异性scfv轭合物的剂量和给药 |
| WO2015100459A2 (en) | 2013-12-27 | 2015-07-02 | Merrimack Pharmaceuticals, Inc. | Biomarker profiles for predicting outcomes of cancer therapy with erbb3 inhibitors and/or chemotherapies |
| CA2941030A1 (en) | 2014-02-28 | 2015-09-03 | Merus N.V. | Antibodies that bind egfr and erbb3 |
| US10184006B2 (en) | 2015-06-04 | 2019-01-22 | Merrimack Pharmaceuticals, Inc. | Biomarkers for predicting outcomes of cancer therapy with ErbB3 inhibitors |
| HUE055222T2 (hu) | 2015-10-23 | 2021-11-29 | Merus Nv | Megkötõ molekulák, amelyek gátolják a rák növekedését |
| US11560597B2 (en) * | 2016-12-01 | 2023-01-24 | Oxford BioDynamics, PLC | Application of epigenetic chromosomal interactions in cancer diagnostics |
| MX2019011660A (es) | 2017-03-31 | 2019-11-18 | Merus Nv | Anticuerpos biespecificos que se unen al receptor 2 del factor de crecimiento humano (erbb-2) y receptor 3 del factor de crecimiento humano (erbb3) para usarse en el tratamiento de celulas que tienen un gen de fusion de neuregulina-1 (nrg1). |
| ES2951864T3 (es) * | 2017-05-17 | 2023-10-25 | Merus Nv | Combinación de un anticuerpo biespecífico ERBB-2/ERBB-3 con terapia endocrina para el cáncer de mama |
| CN111094351A (zh) | 2017-08-09 | 2020-05-01 | 美勒斯公司 | 结合EGFR和cMET的抗体 |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| BRPI0921586A2 (pt) * | 2008-11-18 | 2019-09-24 | Merrimack Pharmaceuticals Inc | articuladores de albumina de soro humana e conjugados destes |
| AU2011341337A1 (en) * | 2010-12-10 | 2013-06-13 | Merrimack Pharmaceuticals, Inc. | Dosage and administration of bispecific scFv conjugates |
-
2012
- 2012-02-24 BR BR112013021660A patent/BR112013021660A2/pt not_active IP Right Cessation
- 2012-02-24 KR KR1020137025188A patent/KR20140053865A/ko not_active Application Discontinuation
- 2012-02-24 US US14/001,448 patent/US20140056898A1/en not_active Abandoned
- 2012-02-24 CN CN201280019977.7A patent/CN103547598A/zh active Pending
- 2012-02-24 JP JP2013555616A patent/JP2014511383A/ja active Pending
- 2012-02-24 MX MX2013009732A patent/MX2013009732A/es not_active Application Discontinuation
- 2012-02-24 WO PCT/US2012/026602 patent/WO2012116317A2/en active Application Filing
- 2012-02-24 AU AU2012222094A patent/AU2012222094A1/en not_active Abandoned
- 2012-02-24 EP EP12749889.7A patent/EP2678359A4/en not_active Withdrawn
- 2012-02-24 CA CA2828099A patent/CA2828099A1/en not_active Abandoned
-
2013
- 2013-08-22 IL IL228095A patent/IL228095A0/en unknown
Also Published As
| Publication number | Publication date |
|---|---|
| AU2012222094A1 (en) | 2013-10-10 |
| EP2678359A4 (en) | 2015-01-28 |
| EP2678359A2 (en) | 2014-01-01 |
| IL228095A0 (en) | 2013-09-30 |
| WO2012116317A2 (en) | 2012-08-30 |
| US20140056898A1 (en) | 2014-02-27 |
| JP2014511383A (ja) | 2014-05-15 |
| WO2012116317A3 (en) | 2013-11-14 |
| CN103547598A (zh) | 2014-01-29 |
| CA2828099A1 (en) | 2012-08-30 |
| BR112013021660A2 (pt) | 2018-06-12 |
| MX2013009732A (es) | 2013-12-06 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20140053865A (ko) | 항-erbb3제를 포함하는 조합 요법 | |
| JP6282296B2 (ja) | Egfrを標的とする癌の組み合わせ治療方法 | |
| EP2729172B1 (en) | Antibodies against epidermal growth factor receptor (egfr) and uses thereof | |
| US20190119401A1 (en) | Use of erbb3 inhibitors in the treatment of triple negative and basal-like breast cancers | |
| Schaefer et al. | A two-in-one antibody against HER3 and EGFR has superior inhibitory activity compared with monospecific antibodies | |
| US9345766B2 (en) | Combination therapies comprising anti-ERBB3 agents | |
| US20150231238A1 (en) | Overcoming resistance to erbb pathway inhibitors | |
| WO2011140254A1 (en) | Antibodies against epidermal growth factor receptor (egfr) and uses thereof |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |