KR20120023633A - 허혈 및 당뇨병 상처 치유를 촉진하기 위한 조성물, 키트 및 방법 - Google Patents
허혈 및 당뇨병 상처 치유를 촉진하기 위한 조성물, 키트 및 방법 Download PDFInfo
- Publication number
- KR20120023633A KR20120023633A KR1020117026193A KR20117026193A KR20120023633A KR 20120023633 A KR20120023633 A KR 20120023633A KR 1020117026193 A KR1020117026193 A KR 1020117026193A KR 20117026193 A KR20117026193 A KR 20117026193A KR 20120023633 A KR20120023633 A KR 20120023633A
- Authority
- KR
- South Korea
- Prior art keywords
- selectin
- wound
- sdf
- protein
- composition
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/7056—Lectin superfamily, e.g. CD23, CD72
- C07K14/70564—Selectins, e.g. CD62
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/19—Cytokines; Lymphokines; Interferons
- A61K38/195—Chemokines, e.g. RANTES
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0053—Mouth and digestive tract, i.e. intraoral and peroral administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/02—Drugs for dermatological disorders for treating wounds, ulcers, burns, scars, keloids, or the like
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2121/00—Preparations for use in therapy
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Immunology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Epidemiology (AREA)
- Gastroenterology & Hepatology (AREA)
- Zoology (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Biochemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Diabetes (AREA)
- Biophysics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Cell Biology (AREA)
- Toxicology (AREA)
- Dermatology (AREA)
- Endocrinology (AREA)
- Hematology (AREA)
- Emergency Medicine (AREA)
- Obesity (AREA)
- Nutrition Science (AREA)
- Physiology (AREA)
- Biotechnology (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
Abstract
당뇨병 상처 치유를 촉진하기 위한 조성물, 키트 및 방법은 SDF-1α가 성숙 내피 세포 (EC)에서 E-셀렉틴의 발현을 특이적으로 상향조절하여 EC-내피 전구 세포 (EPC) 부착 및 EPC 회귀의 증가를 유발한다는 발견에 기초된다. 당뇨병 개체에서 상처의 치유를 촉진하기 위한 방법은 E-셀렉틴 단백질 또는 E-셀렉틴 단백질을 인코딩하는 핵산을 포함하는 조성물의 치료 효과량, 그리고 선택적으로, E-셀렉틴 발현을 특이적으로 상향조절하는 작용제 (가령, SDF-1α)를 제공하는 단계를 포함한다. 이들 방법은 또한, 개체에 고압 산소 치료를 제공하는 단계를 포함할 수 있다. 조성물을 개체에 투여하면 골수-유래된 전구 세포의 상처로의 이동, 가속화된 상처 치유, 그리고 개체 내에서 E-셀렉틴 발현의 상향조절이 유발된다.
Description
본 발명의 기술분야
본 발명은 전반적으로, 의학 및 유전자 요법 분야에 관계한다. 더욱 구체적으로, 본 발명은 당뇨병 개체에서 상처 치유를 촉진하기 위한 조성물, 키트 및 방법에 관계한다.
배경기술
부전된 상처 치유는 당뇨병 환자에서 중요한 임상적 문제점이고, 그리고 하지 절단 (lower extremity amputation)의 주요 원인이다. 현재의 요법은 성공률이 제한적이고, 그리고 당뇨병 환자에서 나타나는 미세혈관 병리 (microvascular pathology)를 해결하는데 미흡하다. 당뇨병 상처의 불량한 치유는 부전된 혈관신생 (angiogenesis)과 혈관형성 (vasculogenesis)으로 특징된다. 혈관형성은 BM-유래된 전구 세포로부터 신혈관 (neovessel)의 성장을 필요로 하고, 그리고 출생후 신혈관신생 (neovascularization) 및 상처 치유의 과정에 기여한다. 골수 (bone marrow, BM)-유래된 내피 전구 세포 (EPC)는 혈관형성에 관여하는 핵심 세포이고 허혈 (ischemia)에 응하여 말초 조직으로 회귀 (homing)한다. EPC 동원 (mobilization)과 보충 (recruitment)을 위한 일차적인 생리학적 자극 (즉, 허혈)이 당뇨병 호스트의 상처에서 치료적 EPC-매개된 신혈관신생과 치유를 유도하는데 실패하는 이유는 아직 확인되지 않고 있다.
따라서 당뇨병 상처 치유를 증진시키기 위한 치료제와 방법이 요구된다.
요약
본 명세서에서는 SDF-1α가 성숙 내피 세포 (EC)에서 E-셀렉틴의 발현을 특이적으로 상향조절하여 EC-내피 전구 세포 (EPC) 부착 및 EPC 회귀의 증가를 유발한다는 발견에 기초하여, 허혈 (가령, 당뇨병) 상처 치유를 촉진하기 위한 조성물, 키트 및 방법이 기술된다. EPC의 표적 조직으로의 회귀 기전은 골수 적소 (niche)로부터 이탈, 혈관 내로 동원 및 순환 내에서 이동, 회귀 신호 감지, 모세관의 내피 세포 (EC) 단층으로 롤링 (rolling)과 부착, 그리고 EPC-EC 직접적인 상호작용이 요구되는 차후 경내피 이동을 포함하는 일련의 순차적 사건을 수반한다.
본 명세서에서 기술된 실험에서는 표적 조직으로 EPC 회귀를 달성하기 위하여 모세관에 정렬된 EC 및 순환 EPC 사이에 직접적인 세포-세포 상호작용이 요구되는 지의 여부, 그리고 EPC 회귀에 대한 SDF-1α의 효과가 EC 단층 상에서 특정 부착 분자(들)를 조절함으로써 적어도 부분적으로 매개되는 지를 조사하였다. EPC의 SDF-1α-유도된 회귀를 매개하는 부착 분자(들), E-셀렉틴이 확인되었다. 본 명세서에서 기술된 이들 실험의 결과는 SDF-1α가 뮤린 및 인간 성숙 EC 단층에서 E-셀렉틴의 발현을 특이적으로 상향조절하고, E-셀렉틴이 EC 단층에 EPC의 부착 및 그들의 경내피 이동을 증진시킴으로써 EPC 회귀에 대한 SDF-1α의 효과를 매개하는데 주도적인 역할을 하고, 그리고 이들 효과가 상처 신혈관신생 및 상처 치유 (신혈관신생)의 현저한 증진을 유발한다는 것을 증명한다. 이들 새로운 발견은 EPC 회귀에 대한 SDF-1α의 생물학적 효과의 기초가 되는 분자 기전 (신호)에 대한 통찰력을 제공할 뿐만 아니라, 허혈 (가령, 당뇨병) 상처 치유에서 치료적 적용을 위한 새로운 표적으로서 E-셀렉틴을 밝혀낸다.
달리 정의되지 않으면, 본 명세서에서 이용된 모든 기술 용어는 본 발명이 속하는 당해 분야의 당업자에 의해 통상적으로 이해되는 바와 동일한 의미를 갖는다.
본 명세서에서, "핵산" 또는 "핵산 분자"는 2개 또는 그 이상의 뉴클레오티드, 예를 들면, RNA (리보핵산) 및 DNA (데옥시리보핵산), 그리고 화학적으로 변형된 뉴클레오티드의 사슬을 의미한다. "정제된" 핵산 분자는 이러한 핵산이 자연적으로 존재하는 세포 또는 생물체 내에 다른 핵산 서열로부터 실질적으로 분리된 것이다 (가령, 오염물질은 30, 40, 50, 60, 70, 80, 90, 95, 96, 97, 98, 99, 100% 없다). 이들 용어에는 예로써, 벡터, 플라스미드, 바이러스, 또는 원핵생물 또는 진핵생물의 게놈으로 함입 (incorporation)된 재조합 핵산 분자가 포함된다. 정제된 핵산의 실례에는 cDNA, 게놈 핵산의 단편, 중합효소 연쇄 반응 (PCR)에 의해 산출된 핵산, 게놈 핵산의 제한 효소 처리에 의해 형성된 핵산, 재조합 핵산, 그리고 화학적으로 합성된 핵산 분자가 포함된다. "재조합" 핵산 분자는 예로써, 화학적 합성에 의해, 또는 유전자 조작 기술에 의한 핵산의 단리된 분절의 조작에 의해 서열의 그렇지 않으면 분리된 2개의 분절 (segment)의 인공 조합 (artificial combination)에 의해 만들어진 것이다.
용어 "유전자"는 특정 단백질, 또는 일정한 경우에, 기능성 또는 구조성 RNA 분자를 코딩하는 핵산 분자를 의미한다.
용어 "E- 셀렉틴 유전자", "E- 셀렉틴 폴리뉴클레오티드", 또는 "E- 셀렉틴 핵산"은 고유 인간 E- 셀렉틴 또는 E-셀렉틴-인코딩 핵산 서열, 예를 들면, 고유 인간 E- 셀렉틴 유전자 (수탁 번호 NM_000450), E- 셀렉틴 cDNA가 전사될 수 있는 서열을 갖는 핵산; 및/또는 이들의 대립형질 변이체 및 동족체를 의미한다. 상기 용어는 이중-가닥 DNA, 단일-가닥 DNA, 그리고 RNA를 포괄한다.
용어 "SDF -1α 유전자", "SDF -1α 폴리뉴클레오티드", 또는 "SDF -1α 핵산" 은 고유 인간 SDF -1α 또는 SDF-1α-인코딩 핵산 서열, 예를 들면, 고유 인간 SDF -1α 유전자 (수탁 번호 NM_199168, NM_000609, NM_001033886), SDF -1α cDNA가 전사될 수 있는 서열을 갖는 핵산; 및/또는 이들의 대립형질 변이체 및 동족체를 의미한다. 상기 용어는 이중-가닥 DNA, 단일-가닥 DNA, 그리고 RNA를 포괄한다.
핵산 분자 내에서 돌연연이를 지칭할 때, "침묵" 변화는 뉴클레오티드 서열 내에서 하나 또는 그 이상의 염기쌍이 치환되지만 상기 서열에 의해 인코딩되는 폴리펩티드의 아미노산 서열은 변하지 않는 것들이다. "보존성" 변화는 핵산 서열에 의해 인코딩된 폴리펩티드의 적어도 하나의 아미노산이 유사한 특징을 갖는 다른 아미노산으로 치환되도록 상기 핵산의 단백질-코딩 영역 내에서 적어도 하나의 코돈이 변화되는 것들이다.
펩티드, 올리고펩티드 또는 단백질 내에서 아미노산 잔기를 지칭할 때, 용어 "아미노산 잔기", "아미노산" 및 "잔기"는 동의어로서 이용되고, 그리고 본 명세서에서, 아미드 결합 또는 아미드 결합 모방체를 통하여 적어도 하나의 다른 아미노산 또는 아미노산 모방체에 공유 결합된 아미노산 또는 아미노산 모방체를 의미한다.
본 명세서에서, "단백질" 및 "폴리펩티드"는 길이에 상관없이 또는 번역후 변형, 예를 들면, 당화 (glycosylation) 또는 인산화 (phosphorylation)에 상관없이, 아미노산의 임의의 펩티드-연결된 사슬을 의미하는 동의어로서 이용된다.
용어 "E-셀렉틴 단백질" 또는 "E-셀렉틴"은 E- 셀렉틴 유전자, 예를 들면, 고유 인간 E-셀렉틴 단백질 (수탁 번호 AAQ67702, NP_000441.2)의 발현 산물, 또는 상기와 적어도 65% (바람직하게는 75, 80, 85, 90, 95, 96, 97, 98, 또는 99%) 아미노산 서열 동일성을 공유하고 고유 E-셀렉틴 단백질의 기능적 활성을 나타내는 단백질을 의미한다. 단백질의 "기능적 활성"은 상기 단백질의 생리학적 기능과 연관된 임의의 활성이다. 가령, 고유 E-셀렉틴 단백질의 기능적 활성에는 EC-EPC 부착의 매개, 그리고 혈관 내층 (vascular lining)에 세포의 부착을 매개함으로써 염증 부위에서 혈중 백혈구 (blood leukocyte) 축적의 촉진이 포함될 수 있다.
용어 "SDF-1α 단백질" 또는 " SDF-1α"는 SDF -1α 유전자, 예를 들면, 고유 인간 SDF-1α 단백질 (수탁 번호 CAG29279.1)의 발현 산물, 또는 상기와 적어도 65% (바람직하게는 75, 80, 85, 90, 95, 96, 97, 98, 또는 99%) 아미노산 서열 동일성을 공유하고 고유 SDF-1α 단백질의 기능적 활성을 나타내는 단백질을 의미한다. 단백질의 "기능적 활성"은 상기 단백질의 생리학적 기능과 연관된 임의의 활성이다. 가령, 고유 SDF-1α 단백질의 기능적 활성에는 예로써, 세포 성장 또는 혈관신생의 자극이 포함될 수 있다. SDF-1α는 EPC에 대한 강력한 회귀 신호로서 기능하는 케모킨 (chemokine)이다 (참조: Lapidot et al., Ann NY Acad Sci 938:83-95, 2001; PCT/US2008/003760).
핵산 분자, 폴리펩티드, 또는 감염성 병원체를 지칭할 때, 용어 "고유"는 자연 발생 (가령, 야생형 (WT)) 핵산, 폴리펩티드, 또는 감염성 병원체를 지칭한다.
"혈관신생"은 현존하는 혈관으로부터 기원하는 새로운 혈관의 성장을 의미한다. 혈관신생은 비-분지화 혈관 분절의 숫자 (단위 구역당 분절의 숫자), 기능성 혈관 밀도 (vascular density) (단위 구역당 관류된 혈관의 총 길이), 혈관 직경, 또는 혈관 부피 밀도 (vessel volume density) (단위 구역당 각 분절의 길이와 직영에 기초된 계산된 혈관 부피의 총계)를 측정함으로써 평가될 수 있다.
용어 "특이적인 결합" 및 "특이적으로 결합한다"는 효소/기질, 수용체/작동약, 항체/항원 등과 같은 쌍을 이루는 종 사이에 나타나고, 그리고 공유 또는 비-공유 상호작용, 또는 공유와 비-공유 상호작용의 조합에 의해 매개될 수 있는 결합을 지칭한다. 이들 두 종의 상호작용이 비-공유 결합된 복합체를 산출할 때, 나타나는 결합은 전형적으로, 정전기적 결합, 수소 결합, 또는 친유성 상호작용의 결과이다. 따라서 "특이적인 결합"은 쌍을 이루는 종 사이에 나타나고, 여기서 항체/항원 또는 효소/기질 상호작용의 특징을 갖는 결합된 복합체를 산출하는 이들 두 사이에 상호작용이 존재한다. 특히, 특이적인 결합은 한 쌍에서 한쪽 구성원이 특정 종에 결합하지만 결합 구성원의 상응하는 구성원이 속하는 화합물 집단 내에 다른 종에 결합하지 않는 것으로 특징된다.
본 명세서에서, 구(句) "서열 동일성"은 두 서열 (가령, 핵산 서열, 아미노산 서열)이 아단위 정합 (subunit matching)이 극대화되도록, 다시 말하면, 갭 (gap)과 삽입을 고려하여 정렬될 때, 이들 두 서열 내에 상응하는 위치에서 동일한 아단위의 백분율을 의미한다. 서열 동일성은 서열 분석 소프트웨어 (가령, Sequence Analysis Software Package, Accelrys CGC, San Diego, CA)를 이용하여 측정될 수 있다.
구(句) "단리된" 또는 생물학적으로 순수한"은 고유 상태에서 관찰될 때 통상적으로 동반되는 성분이 실질적으로 또는 본질적으로 없는 물질을 지칭한다.
용어 "항체"는 다중클론 항체, 단일클론 항체 (mAbs), 키메라 항체, 인간화 항체, 가용성 또는 결합된 형태로 표지될 수 있는 항체에 대한 항-이디오타입 (항-Id) 항체, 그리고 예로써, 효소 절단, 펩티드 합성 또는 재조합 기술이 포함되지만 이들에 국한되지 않는 임의의 공지된 기술에 의해 제공되는 이들의 단편, 영역 또는 유도체를 포함하는 것으로 의도된다.
본 명세서에서, 용어 "만성 상처" 및 "문제 상처" 및 "당뇨병 상처"는 지속된 해부학적 및 기능적 결과를 달성하지 못하고, 그리고 괴사성 잔해와 감염의 제거, 염증의 사그라짐, 연결 조직 매트릭스의 수복, 혈관신생, 그리고 표면치환 (resurfacing)의 정상적인 상처 치유 과정에 따라 치유되지 못하는 상처를 지칭한다. 가령, 저산소증이 병리학적으로 증가될 때, 상처 치유가 부전되고, 그리고 상처 감염 비율이 증가한다. 정상적인 치유의 본질적인 부분은 과립화 조직 형성으로 지칭되는 임시 상처 매트릭스 내에서 새로운 혈관의 형성이다.
용어 "혈관신생"은 한 구체예에서, 상처의 인접한 성숙 혈관 네트워크의 내재성 내피 세포가 증식하고, 그리고 다른 구체예에서 성숙 기질 세포 (stromal cell), 예를 들면, 섬유아세포에 의해 보조된 초기 무혈관 상처 조직 내로 성장하는 신혈관 내로 이동하고 리모델링 (remodeling)되는 과정을 지칭한다. 다른 구체예에서, 용어 "혈관형성"은 상처에 보충된 EPC가 내피 세포로 분화하고 대체 혈관 네트워크를 발생시키는 de novo 과정을 지칭한다.
용어 "전구 세포", 또는 "내피 전구 세포", 또는 "EPC"는 분화 및 증식에 의해 완전히 분화된 기능성 자손을 산출하는 능력을 갖는 임의의 체세포를 의미한다. 다른 구체예에서, 전구 세포에는 혈액, 신경, 근육, 피부, 장, 골, 신장, 간, 췌장, 흉선 등이 포함되지만 이들에 국한되지 않는 임의의 조직 또는 장기 시스템으로부터 전구 세포가 포함된다. 전구 세포는 "분화된 세포"로부터 구별되고, 이들은 다른 구체예에서, 증식하는, 다시 말하면, 자기-복제하는 능력을 갖거나 갖지 않지만 정상적인 생리학적 조건 하에 상이한 세포 유형으로의 더욱 분화가 진행될 수 없는 세포로서 정의된다. 한 구체예에서, 전구 세포는 비정상적인 세포, 예를 들면, 암 세포, 특히 백혈병 세포로부터 더욱 구별되는데, 이들은 증식 (자기-복제)하지만 미성숙 또는 미분화된 것으로 보임에도 불구하고 일반적으로 더욱 분화하지 않는다.
본 명세서에서, 용어 "전능성 (totipotent)"은 모든 유형의 성숙 세포를 생산하는데 필요하고 충분한 비수임된 전구 세포, 예를 들면, 배아 줄기 세포를 의미한다. 모든 췌장 세포 계통을 생산하는 능력을 유지하지만 자기-신생할 수 없는 전구 세포는 "다능성 (pluripotent)"으로 불린다. 다른 구체예에서, 전부가 아닌 일부 내피 계통을 생산할 수 있고 자기-신생할 수 없는 세포는 "중복성 (multipotent)"으로 불린다.
본 명세서에서, 구(句) "골수-유래된 전구 세포" 및 "BM-유래된 전구 세포"는 골수 줄기 세포 계통으로부터 유래되는 전구 세포를 의미한다. 골수-유래된 전구 세포의 실례에는 골수-유래된 중간엽 줄기 세포 (MSC) 및 EPC가 포함된다.
용어 "회귀"는 치유에 관여하는 세포가 손상 부위로 이동하고 수복을 보조하도록 유인하고 자극하는 신호를 지칭한다.
구(句) "치료 효과량" 및 "효과 용량"은 치료적으로 (가령, 임상적으로) 바람직한 결과를 산출하는데 충분한 양을 의미한다; 결과의 정확한 특징은 치료되는 질환의 성격에 따라 변할 것이다. 가령, 치료되는 질환이 비-치유성 당뇨병 상처인 경우에, 결과는 상처의 치유일 수 있다 (성숙 EC에서 E-셀렉틴 발현을 특이적으로 상향조절하여 증가된 EC-EPC 부착, EPC 회귀 및 증가된 상처 신혈관신생을 유발함으로써). 본 명세서에서 기술된 조성물 및 백신은 하루 1회 또는 그 이상 내지 주 1회 또는 그 이상 투여될 수 있다. 당업자는 질환 또는 장애의 심각도, 이전 치료, 개체의 전반적인 건강 및/또는 연령, 그리고 존재하는 다른 질환이 포함되지만 이들에 국한되지 않는 일정한 인자가 개체를 효과적으로 치료하는데 요구되는 용량 및 시간 조정에 영향을 줄 수 있다는 것을 인지할 것이다. 게다가, 본 발명의 조성물 또는 백신의 치료 효과량으로 개체의 치료는 단일 치료 또는 일련의 치료를 포함할 수 있다.
본 명세서에서, 용어 "치료"는 질환, 질환의 증상, 또는 질환에 대한 소인 (predisposition)을 치료하거나, 치유하거나, 경감시키거나, 완화시키거나, 변경하거나, 교정하거나, 개선하거나, 향상시키거나, 또는 이들에 영향을 주는 목적으로, 본 명세서에서 기술된, 또는 본 명세서에서 기술된 방법에 의해 확인된 치료제의 환자에 대한 적용 또는 투여, 또는 환자로부터 단리된 조직 또는 세포주에 상기 치료제의 적용 또는 투여로서 정의되고, 상기 환자는 질환, 질환의 증상, 또는 질환에 대한 소인을 나타낸다.
용어 "환자", "피험자" 및 "개체"는 본 명세서에서 동의어로서 이용되고, 그리고 치료되는 포유동물 개체, 바람직하게는 인간 환자를 의미한다. 일부 경우에, 본 발명의 방법은 실험 동물에서, 수의학적 적용에서, 그리고 생쥐, 쥐 및 햄스터를 비롯한 설치류, 그리고 비-인간 영장류가 포함되지만 이들에 국한되지 않는 질환에 대한 동물 모형의 개발에서 이용될 수 있다.
따라서 본 명세서에서는 당뇨병 개체에서 당뇨병 상처의 치유를 촉진하는 방법이 기술된다. 상기 방법은 아래의 단계를 포함한다: 제약학적으로 허용되는 담체, 그리고 E-셀렉틴 단백질, E-셀렉틴 단백질을 인코딩하는 핵산 및 E-셀렉틴 발현을 특이적으로 상향조절하는 작용제로 구성된 군에서 선택되는 적어도 하나의 치료제를 포함하는 조성물의 치료 효과량을 제공하는 단계; 그리고 골수-유래된 전구 세포 (가령, EPC)의 상처로의 이동이 개체 내에서 증가되도록 하는 조건 하에 상기 조성물을 개체에 투여하는 단계. 조성물은 예로써, 경구, 국소, 정맥내, 상처 또는 상처에 인접한 부위에 직접적으로, 또는 혈관내 카테터 (endovascular catheter)에 의해 투여될 수 있다. 개체에 조성물의 투여는 가속화된 상처 치유를 유발한다. 한 구체예에서, 조성물은 E-셀렉틴 단백질 또는 E-셀렉틴 단백질을 인코딩하는 핵산, 그리고 E-셀렉틴 발현을 특이적으로 상향조절하는 작용제를 포함하고, 여기서 E-셀렉틴 발현을 특이적으로 상향조절하는 작용제는 SDF-1α 단백질 또는 SDF-1α 단백질을 인코딩하는 핵산이다. 상기 방법은 개체에 고압 산소 치료를 제공하는 단계를 더욱 포함할 수 있다.
게다가, 본 명세서에서는 당뇨병 상처를 앓는 당뇨병 개체에서 E-셀렉틴 발현을 상향조절하는 방법이 기술된다. 상기 방법은 E-셀렉틴을 인코딩하는 폴리뉴클레오티드를 포함하는 적어도 하나의 rAAV 비리온 (virion)을 포함하는 조성물을 당뇨병 개체에 투여하는 단계를 포함하고, 상기 폴리뉴클레오티드는 첫 번째 AAV 반전 말단 반복부 (inverted terminal repeat) 및 두 번째 AAV 반전 말단 반복부 사이에 끼워지고, 상기 조성물은 E-셀렉틴 발현을 상향조절하고, 골수-유래된 전구 세포 (가령, EPC)의 상처로의 이동을 유도하고, 그리고 개체 내에서 상처의 치유를 가속화시키는데 효과적인 양으로 존재한다. 적어도 하나의 rAAV 비리온은 혈청형 2 캡시드 단백질을 포함할 수 있다. 조성물은 예로써, 상처 또는 상처에 인접한 부위에 직접적으로 투여될 수 있다. 상기 방법은 SDF-1α 단백질 또는 SDF-1α 단백질을 인코딩하는 핵산을 개체에 투여하는 단계 및/또는 개체에 고압 산소 치료를 제공하는 단계를 더욱 포함할 수 있다.
또한, 본 명세서에서는 포유동물 개체에서 적어도 하나의 당뇨병 상처를 치료하기 위한 키트가 기술된다. 키트는 제약학적으로 허용되는 담체, 그리고 E-셀렉틴 단백질, E-셀렉틴 단백질을 인코딩하는 핵산 및 E-셀렉틴 발현을 특이적으로 상향조절하는 작용제로 구성된 군에서 선택되는 적어도 하나의 치료제를 포함하는 조성물의 치료 효과량; 그리고 사용설명서를 포함한다. 한 구체예에서, 조성물은 E-셀렉틴 단백질 또는 E-셀렉틴 단백질을 인코딩하는 핵산, 그리고 E-셀렉틴 발현을 특이적으로 상향조절하는 작용제를 포함하고, 여기서 E-셀렉틴 발현을 특이적으로 상향조절하는 작용제는 SDF-1α 단백질 또는 SDF-1α 단백질을 인코딩하는 핵산이다. 한 구체예에서, 사용설명서는 고압 산소 치료를 개체에 제공하기 위한 사용설명서를 포함한다.
또한, 본 명세서에서는 당뇨병 개체에서 당뇨병 상처의 치유를 촉진하는 방법이 기술된다. 상기 방법은 아래의 단계를 포함한다: 제약학적으로 허용되는 담체, 그리고 복수의 골수-유래된 전구 세포를 포함하는 조성물을 제공하는 단계, 여기서 골수-유래된 전구 세포는 E-셀렉틴을 인코딩하는 폴리뉴클레오티드를 포함하고; 그리고 개체 내에서 골수-유래된 전구 세포 (가령, EPC)의 상처로의 이동을 증가시키고 상처의 치유를 가속화시키는데 효과적인 양으로 상기 조성물을 개체에 투여하는 단계. E-셀렉틴을 인코딩하는 폴리뉴클레오티드는 바이러스 벡터, 예를 들면, 바이러스 입자에 내포된 바이러스 벡터 (가령, AAV 입자 내에 rAAV 벡터) 내에 존재할 수 있다. 조성물은 SDF-1α 단백질 또는 SDF-1α 단백질을 인코딩하는 핵산을 더욱 포함할 수 있고, 그리고 상처 또는 상처에 인접한 부위에 직접적으로 투여될 수 있다. 한 구체예에서, 상기 방법은 개체에 고압 산소 치료를 제공하는 단계를 더욱 포함한다.
본 명세서에서 기술된 조성물, 키트 및 방법과 유사하거나 동등한 것들이 본 발명의 실시 또는 시험에 이용될 수 있긴 하지만, 적절한 조성물, 키트 및 방법이 하기에 기술된다. 본 명세서에서 언급된 모든 간행물, 특허 출원, 그리고 특허는 본 발명에 순전히 참조로서 편입된다. 불일치의 경우에, 정의를 비롯한 본 명세서가 우선할 것이다. 하기에 논의된 특정 구체예는 단지 예시에 불과하고 본 발명을 한정하는 것으로 의도되지 않는다.
상세한 설명
본 명세서에서 기술된 조성물, 방법 및 키트는 EC 및 순환 EPC에 의해 성숙 SDF-1α-매개된 EPC 회귀를 조정하는 신호의 발견에 기초된다. 하기에 기술된 실험에서, 세포-기초된 요법에 의한 상처에서 SDF-1α의 증가하는 수준은 당뇨병 생쥐에서 치유를 촉진하는 것으로 밝혀졌다 (3일 (day 3)까지 치유율의 ~20% 증가, P=O.006). SDF-1α는 EC-EPC 부착을 증가시키고 인간 미세혈관 EC에서 E-셀렉틴 발현을 특이적으로 상향조절하였다 (4.6-배 증가, P<0.01). 이러한 효과는 실험 생쥐의 혈관에서도 유의하였고 증가된 상처 신혈관신생을 유발하였다. EC-EPC 부착 및 EPC 회귀에 대한 SDF-1α의 조절 효과는 E-셀렉틴에 의해 특이적으로 매개되었는데, 그 이유는 E-셀렉틴 길항약의 적용이 SDF-1α-유도된 EC-EPC 부착, EPC 회귀, 상처 신혈관신생, 그리고 상처 치유를 유의하게 저해하였다. SDF-1α-유도된 상처 치유의 매개에서 E-셀렉틴의 요구는 E-sel-/- 생쥐 모형에서 증명된다. SDF-1α-조작된 세포-기초된 요법은 성숙 EC에서 E-셀렉틴 발현을 특이적으로 상향조절하여 증가된 EC-EPC 부착 및 EPC 회귀, 그리고 증가된 상처 신혈관신생을 유발함으로써 생쥐에서 당뇨병 상처 치유를 촉진한다. 이들 조사 결과는 허혈 (가령, 당뇨병) 상처 치유에서 EPC 회귀에서 SDF-1α의 생물학적 효과의 기초가 되는 신호에 대한 새로운 통찰력을 제공하고 그리고 EPC 수송 (traffic)의 치료적 조작을 위한 새로운 잠재적 표적으로서 E-셀렉틴을 지적한다.
하기에 기술된 바람직한 구체예는 이들 조성물, 백신, 키트 및 방법의 개작을 예시한다. 그럼에도 불구하고, 이들 구체예의 설명으로부터, 본 발명의 다른 측면이 하기에 제공된 설명에 기초하여 수행 및/또는 실행될 수 있다.
생물학적 방법
전통적인 분자 생물학 기술을 비롯한 방법이 본 명세서에서 기술된다. 이런 기술은 일반적으로, 당분야에 공지되어 있고 Molecular Cloning: A Laboratory Manual, 3rd ed., vol. 1-3, ed. Sambrook et al., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 2001; 그리고 Current Protocols in Molecular Biology, ed. Ausubel et al., Greene Publishing and Wiley-Interscience, New York, 1992 (주기적 업데이트)와 같은 방법 협정에서 상세하게 기술된다. 면역학 기술은 일반적으로, 당분야에 공지되어 있고 Advances in Immunology, volume 93, ed. Frederick W. Alt, Academic Press, Burlington, MA, 2007; Making and Using Antibodies: A Practical Handbook, eds. Gary C. Howard and Matthew R. Kaser, CRC Press, Boca Raton, Fl, 2006; Medical Immunology, 6thed., edited by Gabriel Virella, Informa Healthcare Press, London, England, 2007; and Harlow and Lane ANTIBODIES: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1988과 같은 방법 협정에서 상세하게 기술된다. 유전자 전달의 전통적인 방법 및 유전자 요법 역시 본 발명에서 이용을 위하여 적합될 수 있다. 예로써, Gene Therapy: Principles and Applications, ed. T. Blackenstein, Springer Verlag, 1999; and Gene Therapy Protocols (Methods in Molecular Medicine), ed. P. D. Robbins, Humana Press, 1997을 참조한다.
허혈 상처 치유를 촉진하는 조성물
당뇨병 개체에서 허혈 (가령, 당뇨병) 상처의 치유를 촉진하기 위한 조성물이 본 명세서에서 기술된다. 본 명세서에서 기술된 조성물은 임의의 유형의 허혈 상처, 예를 들면, 당뇨병 상처의 치유를 촉진하는데 이용될 수 있다. 이런 조성물은 일반적으로, 제약학적으로 허용되는 담체, 그리고 적어도 하나의 치료제, 예를 들면, E-셀렉틴 단백질 또는 E-셀렉틴 단백질을 인코딩하는 핵산을 포함하는 조성물의 치료 효과량을 포함한다. 조성물은 E-셀렉틴 발현을 특이적으로 상향조절하는 작용제를 더 포함할 수 있다. 이러한 구체예에서, E-셀렉틴 발현을 특이적으로 상향조절하는 임의의 적절한 작용제가 이용될 수 있다. 가령, SDF-1α가 이용될 수 있다. 추가의 실례에는 IL-1, TNF-알파 및 리포다당류 (LPS)가 포함된다. 이러한 구체예에서, 조성물은 E-셀렉틴 단백질 또는 E-셀렉틴 단백질을 인코딩하는 핵산, 그리고 SDF-1α 단백질 또는 SDF-1α 단백질을 인코딩하는 핵산을 포함한다. 개체에 조성물의 투여는 개체 내에서 골수-유래된 전구 세포의 상처로의 증가된 이동 및 가속화된 상처 치유를 유발한다. 상처 치유는 상처의 재상피화 (re-epithelization)로 특징된다.
E-셀렉틴 단백질은 임의의 적절한 프로토콜 (가령, 단백질 A 및 단백질 G 비드-기초된 항-E-셀렉틴 항체 포획 기술 (Invitrogen))을 이용하여 단리되거나 합성된다. E-셀렉틴 단백질을 투여하는 전형적인 구체예에서, E-셀렉틴 단백질은 세균 세포 (가령, 대장균 (E. Coli))를 형질전환시킴으로써, 또는 포유동물 세포를 형질감염시키고, 이후 이들 세포로부터 E-셀렉틴을 정제함으로써 제조된다/합성된다. SDF-1α 단백질 역시 투여되는 구체예에서, SDF-1α 단백질은 유사하게 제조된다.
다른 구체예에서, E-셀렉틴을 인코딩하는 핵산이 당뇨병 상처(들)를 치료하기 위하여 개체에 투여될 수 있다. E-셀렉틴을 인코딩하는 코딩 서열은 수탁 번호 NM_000450의 뉴클레오티드 서열에 동일하거나, 또는 이는 유전자 코드 (genetic code)의 중복성 (redundancy) 또는 축중성 (degeneracy)의 결과로써, 수탁 번호 NM_000450의 폴리뉴클레오티드와 동일한 폴리펩티드를 인코딩하는 상이한 코딩 서열일 수도 있다. 본 명세서에서 기술된 다른 핵산 분자에는 고유 E- 셀렉틴 유전자의 변이체, 예를 들면, 고유 E-셀렉틴 단백질의 단편, 유사체 및 유도체를 인코딩하는 것들이 포함된다. 이런 변이체는 예로써, 고유 E- 셀렉틴 유전자의 자연 발생 대립형질 변이체, 고유 E- 셀렉틴 유전자의 동족체, 또는 고유 E- 셀렉틴 유전자의 비-자연 발생 변이체일 수 있다. 이들 변이체는 하나 또는 그 이상의 염기에서 고유 E- 셀렉틴 유전자와 상이한 뉴클레오티드 서열을 가질 수 있다. 가령, 이런 변이체의 뉴클레오티드 서열은 고유 E- 셀렉틴 유전자의 하나 또는 그 이상의 뉴클레오티드의 결실, 부가, 또는 치환을 특징으로 할 수 있다.
다른 구체예에서, 구조에서 실질적인 변화를 보이는 변이체 E-셀렉틴 단백질은 인코딩된 폴리펩티드에서 보존성이 아닌 변화를 유발하는 뉴클레오티드 치환을 만듦으로써 산출될 수 있다. 이런 뉴클레오티드 치환의 실례는 (a) 폴리펩티드 중추의 구조; (b) 폴리펩티드의 전하 또는 소수성; 또는 (c) 아미노산 측쇄의 크기에서 변화를 유발하는 것들이다. 단백질 특성에서 최대 변화를 유발할 것으로 일반적으로 예상되는 뉴클레오티드 치환은 코돈에서 비-보존성 변화를 유발하는 것들이다. 단백질 구조에서 주요한 변화를 유발할 가능성이 높은 코돈 변화의 실례는 (a) 소수성 잔기, 예를 들면, 류신, 이소류신, 페닐알라닌, 발린 또는 알라닌에 대한 (또는 의한) 친수성 잔기, 예를 들면, 세린 또는 트레오닌; (b) 임의의 다른 잔기에 대한 (또는 의한) 시스테인 또는 프롤린; (c) 음전기 잔기, 예를 들면, 글루타민 또는 아스파라진에 대한 (또는 의한) 양전기 측쇄를 보유하는 잔기, 예를 들면, 리신, 아르기닌, 또는 히스티딘; 또는 (d) 측쇄를 보유하지 않는 잔기, 예를 들면, 글리신에 대한 (또는 의한) 거대 측쇄를 보유하는 잔기, 예를 들면, 페닐알라닌의 치환을 유발하는 것들이다.
본 명세서에서 기술된 바와 같은 고유 E- 셀렉틴 유전자 또는 고유 E- 셀렉틴 mRNA의 자연 발생 대립형질 변이체는 고유 E- 셀렉틴 유전자 또는 고유 E- 셀렉틴 mRNA와 적어도 75% (가령, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 그리고 99%) 서열 동일성을 갖고, 그리고 고유 E-셀렉틴 단백질에 구조적 유사성을 갖는 폴리펩티드를 인코딩하는 인간 조직으로부터 단리된 핵산이다. 본 명세서에서 기술된 바와 같은 고유 E- 셀렉틴 유전자 또는 고유 E- 셀렉틴 mRNA의 동족체는 고유 인간 E- 셀렉틴 유전자 또는 고유 인간 E- 셀렉틴 mRNA와 적어도 75% (가령, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 그리고 99%) 서열 동일성을 갖고, 그리고 고유 인간 E-셀렉틴 단백질에 구조적 유사성을 갖는 폴리펩티드를 인코딩하는 다른 종으로부터 단리된 핵산이다. 고유 E- 셀렉틴 유전자 또는 고유 E- 셀렉틴 mRNA에 높은 퍼센트 (가령, 70, 80, 90% 또는 그 이상) 서열 동일성을 갖는 다른 핵산 분자를 확인하기 위하여, 공개 및/또는 독점 핵산 데이터베이스가 검색될 수 있다.
비-자연 발생 E- 셀렉틴 유전자 또는 mRNA 변이체는 자연에서 발생하지 않고 (가령, 인간에 의해 수동으로 만들어지고), 고유 인간 E- 셀렉틴 유전자 또는 고유 인간 E- 셀렉틴 mRNA와 적어도 75% (가령, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 그리고 99%) 서열 동일성을 갖고, 그리고 고유 인간 E-셀렉틴 단백질에 구조적 유사성을 갖는 폴리펩티드를 인코딩하는 핵산이다. 비-자연 발생 E- 셀렉틴 유전자 변이체의 실례는 E-셀렉틴 단백질의 단편을 인코딩하는 것들, 엄격한 조건 하에 고유 E- 셀렉틴 유전자 또는 고유 E- 셀렉틴 유전자의 보체에 혼성화되는 것들, 고유 E- 셀렉틴 유전자 또는 이의 보체와 적어도 65% 서열 동일성을 공유하는 것들, 그리고 E-셀렉틴 융합 단백질을 인코딩하는 것들이다.
본 명세서에서 기술된 바와 같은 고유 E-셀렉틴 단백질의 단편을 인코딩하는 핵산은 예로써, 고유 E-셀렉틴 단백질의 2, 5, 10, 25, 50, 100, 150, 200개 또는 그 이상의 아미노산 잔기를 인코딩하는 것들이다. 고유 E-셀렉틴 단백질의 단편을 인코딩하거나, 또는 이들을 인코딩하는 핵산과 혼성화되는 더욱 짧은 올리고뉴클레오티드 (가령, 6개, 7개, 8개, 9개, 10개, 11개, 12개, 13개, 14개, 15개, 16개, 17개, 18개, 19개, 20개, 30개, 50개 염기쌍 길이의 것들)는 프로브, 프라이머, 또는 안티센스 분자로서 이용될 수 있다. 고유 E-셀렉틴 단백질의 단편을 인코딩하는 핵산은 전장 고유 E- 셀렉틴 유전자, E- 셀렉틴 mRNA 또는 cDNA, 또는 이들의 변이체의 효소적 절단 (가령, 제한 효소를 이용) 또는 화학적 분해에 의해 만들어질 수 있다. 이전에 보고된 고유 인간 E- 셀렉틴 유전자의 뉴클레오티드 서열 및 고유 E-셀렉틴 단백질의 아미노산 서열을 이용하여, 당업자는 예로써, 표준 핵산 돌연변이유발 기술에 의해, 또는 화학적 합성에 의해 그들의 뉴클레오티드 서열에서 중요하지 않은 변이를 갖는 핵산 분자를 산출할 수 있다. 변이체 E- 셀렉틴 핵산 분자는 발현되면, 변이체 E-셀렉틴 단백질을 생산할 수 있다.
당뇨병 상처 치유를 촉진하는 방법
당뇨병 개체에서 당뇨병 상처의 치유를 촉진하는 방법의 한 가지 구체예는 제약학적으로 허용되는 담체, 그리고 적어도 하나의 치료제, 예를 들면, E-셀렉틴 단백질, E-셀렉틴 단백질을 인코딩하는 핵산 및 E-셀렉틴 발현을 특이적으로 상향조절하는 작용제를 포함하는 조성물의 치료 효과량을 제공하는 단계; 그리고 골수-유래된 전구 세포 (가령, EPC)의 상처로의 이동이 개체 내에서 증가되도록 하는 조건 하에 상기 조성물을 개체에 투여하는 단계를 포함한다. 가령, 조성물은 E-셀렉틴 단백질 또는 E-셀렉틴 단백질을 인코딩하는 핵산, 그리고 E-셀렉틴 발현을 특이적으로 상향조절하는 작용제, 예를 들면, SDF-1α 단백질 또는 SDF-1α 단백질을 인코딩하는 핵산을 포함할 수 있다. 이러한 방법에서, 조성물은 임의의 적절한 경로에 의해, 예를 들면, 경구, 국소, 정맥내, 또는 상처 또는 상처에 인접한 부위에 직접적으로 투여될 수 있다. 개체에 조성물의 투여는 가속화된 상처 치유를 유발한다.
당뇨병 개체에서 당뇨병 상처를 치료하는 방법은 개체에 고압 산소 치료를 제공하는 단계를 더욱 포함할 수 있다. 본 명세서에서 기술된 방법에서, 고압 산소 요법 (HBO2)은 전형적으로, 미세혈관계 (microvasculature)가 약화되는 상황에서 상처 치유를 자극하는데 이용되는 보조 요법이다. HBO2로 당뇨병 개체를 치료하는 방법은 예로써, 본 발명에 참조로서 편입되는 PCT/US2008/003760에서 기술된다. 당뇨병 개체 (환자)에서 상처 치유를 촉진하는 방법의 한 가지 실례에서, 환자는 일일 1회 또는 2회, 대략 2.0 내지 대략 3.2 절대 기압 (ATA)에서 가압된 챔버 내에서 100% O2 호흡 치료를 20회 또는 그 이상 받는다. 치료 시간 범위는 일반적으로, 대략 10분 내지 대략 240분 (가령, 대략 10분, 15분, 30분, 60분, 90분, 120분, 150분, 180분, 210분, 240분 등)이다.
다른 구체예에서, 당뇨병 상처를 앓는 당뇨병 개체에서 E-셀렉틴 발현을 상향조절하는 방법은 E-셀렉틴을 인코딩하는 폴리뉴클레오티드를 포함하는 적어도 하나의 rAAV 비리온 (virion)을 포함하는 조성물을 당뇨병 개체에 투여하는 단계를 포함하고, 상기 폴리뉴클레오티드는 첫 번째 AAV 반전 말단 반복부 (inverted terminal repeat) 및 두 번째 AAV 반전 말단 반복부 사이에 끼워진다. 이러한 구체예에서, 상기 조성물은 E-셀렉틴 발현을 상향조절하고, 골수-유래된 전구 세포 (가령, EPC)의 상처로의 이동을 유도하고, 그리고 개체 내에서 상처의 치유를 가속화시키는데 효과적인 양으로 존재한다. 이러한 방법에서, 적어도 하나의 rAAV 비리온은 혈청형 2 캡시드 단백질을 포함할 수 있다. 본 명세서에서 기술된 다른 구체예에서처럼, 조성물은 임의의 적절한 경로에 의해, 예를 들면, 경구, 국소, 정맥내, 또는 상처 또는 상처에 인접한 부위에 직접적으로 투여될 수 있다. 상기 방법은 SDF-1α 단백질 또는 SDF-1α 단백질을 인코딩하는 핵산을 개체에 투여하는 단계 및/또는 개체에 고압 산소 치료를 제공하는 단계를 더욱 포함할 수 있다.
또 다른 구체예에서, 당뇨병 개체에서 당뇨병 상처의 치유를 촉진하는 방법은 아래의 단계를 포함한다: 제약학적으로 허용되는 담체, 그리고 복수의 골수-유래된 전구 세포를 포함하는 조성물을 제공하는 단계; 그리고 개체 내에서 골수-유래된 전구 세포 (가령, EPC)의 상처로의 이동을 증가시키고 상처의 치유를 가속화시키는데 효과적인 양으로 상기 조성물을 개체에 투여하는 단계. 이러한 구체예에서, 골수-유래된 전구 세포는 E-셀렉틴을 인코딩하는 폴리뉴클레오티드를 포함한다. E-셀렉틴을 인코딩하는 폴리뉴클레오티드는 바이러스 벡터, 예를 들면, rAAV 벡터 내에 포함될 수 있다. 전형적으로, rAAV 벡터는 rAAV 바이러스 (입자) 내에 존재한다. 이러한 구체예에서, 조성물은 SDF-1α 단백질 또는 SDF-1α 단백질을 인코딩하는 핵산을 더욱 포함할 수 있다. 조성물이 SDF-1α를 인코딩하는 핵산을 포함하면, 상기 핵산은 rAAV 벡터 내에, 두 번째 rAAV 벡터 내에, 또는 rAAV 이외의 바이러스 벡터 내에 존재할 수 있다. 이들 조성물(들)은 임의의 적절한 경로에 의해, 예를 들면, 경구, 국소, 정맥내, 또는 상처 또는 상처에 인접한 부위에 직접적으로 투여될 수 있다. 상기 방법은 개체에 고압 산소 치료를 제공하는 단계를 더욱 포함할 수 있다.
본 명세서에서 기술된 방법은 다수의 상이한 유형의 상처를 치료하는데 이용될 수 있다. 당뇨병 상처의 한 가지 실례는 망상피반 (livedo reticularis) 및 작은 위축반 (atrophie blanche)과 연관된 고통스러운 궤양화 (ulceration)로 특징되는 질환인 울혈반모양 혈관병증 (livedoid vasculopathy)이다. 당뇨병 상처의 다른 실례는 당뇨병 궤양, 예를 들면, 말초 동맥 질환 궤양, 정맥 울혈 (venous stasis) 궤양, 만성 비-치유 궤양, 피부 궤양, 욕창성 궤양, 만성 족부 궤양 등이다. 상처는 또한, 앞서 열거된 상처 중에서 하나 또는 그 이상의 조합일 수 있다. 당뇨병 개체는 치료되는 단일 또는 복수의 상처를 보유할 수 있다. 개체에는 임의의 포유동물, 예를 들면, 인간, 쥐, 생쥐, 고양이, 개, 염소, 양, 말, 원숭이, 유인원, 토끼, 소 등이 포함된다. 개체 (가령, 포유동물)는 성년, 그리고 청소년을 비롯한 임의의 발달 단계에 있을 수 있다. 표적 조직은 개체 내에 임의의 조직, 예를 들면, 망막, 간, 신장, 심장 폐, 위장관의 구성요소, 췌장, 담낭, 방광, 뇌를 비롯한 중추신경계, 피부, 골 등일 수 있다.
E-셀렉틴을 인코딩하는 핵산 (및 선택적으로, SDF-1α 또는 EPC 회귀를 조정하기 위한 다른 작용제를 인코딩하는 핵산)이 당뇨병 개체에 투여되는 방법에서, 본 명세서에서 기술된 바와 같은 핵산은 E-셀렉틴을 인코딩하는 핵산 (및 선택적으로, SDF-1α 또는 EPC 회귀를 조정하기 위한 다른 작용제를 인코딩하는 핵산)에 작동가능하게 연결된 하나 또는 그 이상의 발현 제어 서열 역시 포함할 수 있다. 다수의 이런 서열은 공지되어 있다. 포함되는 것들은 다른 적용에서 그들의 공지된 기능에 기초하여 선택될 수 있다. 발현 제어 서열의 실례에는 프로모터, 격리자 (insulator), 침묵자 (silencer), 반응 요소 (response element), 인트론 (intron), 인핸서 (enhancer), 개시 부위, 종결 신호, 그리고 pA 꼬리가 포함된다.
적절한 수준의 E-셀렉틴 (및 선택적으로 SDF-1α)을 달성하기 위하여, 표적 세포에서 이용하기 적합한 다수의 프로모터가 이용될 수 있다. 가령, 상이한 길이의 구조성 프로모터가 이용될 수 있다. 본 명세서에서 기술된 바와 같은 발현 벡터 및 플라스미드는 전사를 촉진하는데 일반적으로 활동적인 하나 또는 그 이상의 구조성 프로모터, 예를 들면, 바이러스 프로모터 또는 포유동물 유전자로부터 프로모터를 포함할 수 있다. 구조성 바이러스 프로모터의 실례에는 단순 포진 바이러스 (HSV), 티미딘 키나아제 (TK), 라우스 육종 바이러스 (RSV), 유인원 바이러스 40 (SV40), 생쥐 유방암 바이러스 (MMTV), Ad E1A 및 거대세포바이러스 (CMV) 프로모터가 포함된다. 구조성 포유동물 프로모터의 실례에는 β-악틴 프로모터에 의해 예시되는 바와 같은 다양한 관리 유전자 (housekeeping gene) 프로모터가 포함된다.
유도성 프로모터 및/또는 조절 요소 역시 본 명세서에서 기술된 조성물과 방법에서 이용이 계획될 수 있다. 적절한 유도성 프로모터의 실례에는 시토크롬 P450 유전자, 열 쇼크 단백질 유전자, 메탈로치오닌 (metallothionein) 유전자, 그리고 호르몬-유도성 유전자, 예를 들면, 에스트로겐 유전자 프로모터와 같은 유전자로부터 프로모터가 포함된다. 유도성 프로모터의 다른 실례는 테트라사이클린 (tetracycline)에 반응하는 tetVP16 프로모터이다.
조직-특이적 프로모터 및/또는 조절 요소는 본 명세서에서 기술된 조성물과 방법의 일정한 구체예에서 유용하다. 본 명세서에서 기술된 바와 같은 발현 벡터와 함께 이용될 수 있는 이런 프로모터의 실례에는 Tie-2 또는 KDR_프로모터가 포함된다.
본 명세서에서 기술된 바와 같은 조성물 (가령, E-셀렉틴을 인코딩하는 바이러스 벡터를 포함하는 조성물)은 임의의 적절한 기술에 의해 포유동물 개체에 투여될 수 있다. E- 셀렉틴 유전자를 세포 내로 도입하기 위하여 바이러스 벡터를 이용하는 다양한 기술이 본 명세서에서 기술된 조성물과 방법에 따라서 제공된다. 바이러스는 그들의 유전자를 숙주 세포 내로 효과적으로 전달하고, 따라서 치료적 유전자의 전달을 위한 바람직한 벡터 시스템인 자연적으로 진화된 운반제이다. 바람직한 바이러스 벡터는 숙주 세포에 대한 낮은 독성을 나타내고 치료량의 E-셀렉틴 단백질을 생산한다 (가령, 조직-특이적 방식으로). 바이러스 벡터 방법 및 프로토콜은 Kay et al. Nature Medicine 7:33-40, 2001에서 재검토된다.
비록 하기에 기술된 실험이 rAAV 및 렌티바이러스에 관련되긴 하지만, 임의의 적절한 바이러스 벡터가 이용될 수 있다. 유전자를 포유동물 개체에 전달하기 위한 많은 바이러스 벡터가 당분야에 공지되어 있고, 그리고 무제한적인 실례가 하기에 제시된다. 유전자 요법 벡터로서 재조합 아데노바이러스의 이용 방법은 예로써, W.C. Russell, Journal of General Virology 81:2573-2604, 2000, 그리고 Bramson et al., Curr. Opin. Biotechnol. 6:590-595, 1995에서 논의된다. 단순 포진 바이러스 벡터의 이용 방법은 예로써, Cotter and Robertson, Curr. Opin. MoI. Ther. 1:633-644, 1999에서 논의된다. HIV를 비롯한 복제-결함성 렌티바이러스 벡터 역시 이용될 수 있다. 렌티바이러스 벡터의 이용 방법은 예로써, Vigna and Naldini, J. Gene Med. 5:308-316, 2000 및 Miyoshi et al., J. Virol. 72:8150-8157, 1998에서 논의된다. 뮤린 백혈병 바이러스-기초된 벡터를 포함하는 레트로바이러스 벡터 역시 이용될 수 있다. 레트로바이러스-기초된 벡터의 이용 방법은 예로써, Hu and Pathak, Pharmacol. Rev. 52:493-511, 2000 및 Fong et al., Crit. Rev. Ther. Drug Carrier Syst. 17:1-60, 2000에서 논의된다. 이용될 수 있는 기타 바이러스 벡터에는 셈리키 삼림열 (Semliki Forest) 바이러스 및 신드비스 (Sindbis) 바이러스를 비롯한 알파바이러스가 포함된다. E-셀 렉 틴 유전자를 표적 조직 (가령, 당뇨병 상처)으로 전달하기 위하여 하이브리드 바이러스 벡터가 이용될 수 있다. 하이브리드 벡터의 작제를 위한 표준 기술은 당업자에게 널리 공지되어 있다. 이런 기술은 예로써, Sambrook, et al., In Molecular Cloning: A laboratory manual. Cold Spring Harbor, NY or any number of laboratory manuals that discuss recombinant DNA technology에서 찾아볼 수 있다.
일부 구체예에서, 본 명세서에서 기술된 조성물과 방법의 핵산은 세포 내로 도입을 용이하게 하기 위하여 rAAV 벡터 및/또는 비리온 내로 함입된다. 유용한 rAAV 벡터는 (1) 발현되는 이종기원성 서열 (가령, E-셀렉틴 단백질을 인코딩하는 폴리뉴클레오티드) 및 (2) 이종기원성 유전자의 통합과 발현을 조장하는 바이러스 서열을 포함하는 재조합 핵산 구조체이다. 이들 바이러스 서열은 DNA의 복제 및 DNA의 비리온 내로 포장을 위하여 cis로 요구되는 AAV의 서열 (가령, 기능성 ITR)을 포함할 수 있다. 전형적인 적용에서, 이들 이종기원성 유전자는 당뇨병 개체에서 상처로 골수-유래된 전구 세포 이동을 증가시키고 상처 치유를 촉진하는데 유용한 E-셀렉틴을 인코딩한다. 이런 rAAV 벡터는 또한, 마커 또는 리포터 유전자를 포함할 수 있다. 유용한 rAAV 벡터는 하나 또는 그 이상의 AAV WT 유전자가 완전히 또는 부분적으로 결실되지만, 기능성 측면 ITR 서열을 유지한다. 이들 AAV ITR은 특정한 적용에 적합한 임의의 혈청형을 가질 수 있다 (가령, 혈청형 2로부터 유래된다). rAAV 벡터를 이용하는 방법은 예로써, TaI, J., J. Biomed. Sci. 7:279-291, 2000 및 Monahan and Samulski, Gene delivery 7:24-30, 2000에서 논의된다.
본 발명의 핵산과 벡터는 이러한 핵산 또는 벡터의 세포 내로의 도입을 용이하게 하기 위하여 rAAV 비리온 내로 함입될 수 있다. AAV의 캡시드 단백질은 비리온의 외부, 비-핵산 부분을 구성하고 AAV 캡 (cap) 유전자에 의해 인코딩된다. 상기 캡 유전자는 3가지 바이러스 외피 단백질, VP1, VP2 및 VP3을 인코딩하고, 이들은 비리온 조립 (virion assembly)에 요구된다. rAAV 비리온의 작제는 이미 보고되었다. 예로써, U.S. Pat. No. 5,173,414, 5,139,941, 5,863,541, 5,869,305, 6,057,152, 6,376,237; Rabinowitz et al., J. Virol. 76:791-801, 2002; 그리고 Bowles et al., J. Virol. 77:423-432, 2003을 참조한다.
본 발명에 유용한 rAAV 비리온에는 1, 2, 3, 4, 5, 6, 7, 8 및 9를 비롯한 다수의 AAV 혈청형으로부터 유래된 것들이 포함된다. 상이한 혈청형의 AAV 벡터 및 AAV 단백질의 작제와 이용은 Chao et al., MoI. Ther. 2:619-623, 2000; Davidson et al., PNAS 97:3428-3432, 2000; Xiao et al., J. Virol. 72:2224-2232, 1998; Halbert et al., J. Virol. 74:1524-1532, 2000; Halbert et al., J. Virol. 75:6615-6624, 2001; 그리고 Auricchio et al., Hum. Molec. Genet. 10:3075-3081, 2001에서 논의된다.
또한, 본 명세서에서 기술된 조성물, 키트 및 방법에서 가성형태 rAAV가 유용하다. 가성형태 벡터에는 소정의 혈청형 이외의 혈청형으로부터 유래된 캡시드 유전자로 가성형태화 (pseudotyping)된 소정의 혈청형의 AAV 벡터가 포함된다. 가성형태 rAAV 비리온의 작제와 이용에 관련된 기술은 당분야에 공지되어 있고 Duan et al., J. Virol, 75:7662-7671, 2001; Halbert et al., J. Virol, 74:1524-1532, 2000; Zolotukhin et al, Methods, 28: 158-167, 2002; and Auricchio et al, Hum. Molec. Genet. 10:3075-3081, 2001에서 기술된다.
비리온 캡시드 내에 돌연변이를 보유하는 AAV 비리온은 비-돌연변이된 캡시드 비리온보다 더욱 효과적으로 특정 세포 유형을 감염시키는데 이용될 수 있다. 가령, 적절한 AAV 돌연변이체는 AAV의 특정 세포 유형으로의 표적화를 용이하게 하기 위하여 리간드 삽입 돌연연이를 보유할 수 있다. 삽입 돌연변이체, 알라닌 스크리닝 돌연변이체, 그리고 에피토프 태그 돌연변이체를 비롯한 AAV 캡시드 돌연변이체의 작제 및 특성화는 Wu et al, J. Virol. 74:8635-45, 2000에서 기술된다. 본 명세서에서 기술된 바와 같은 방법과 조성물에 이용될 수 있는 다른 rAAV 비리온에는 바이러스의 분자 육종 (molecular breeding) 및 엑손 셔플링 (exon shuffling)에 의해 산출되는 캡시드 하이브리드가 포함된다. Soong et al, Nat. Genet. 25:436-439, 2000; 그리고 Kolman and Stemmer Nat. Biotechnol 19:423-428, 2001을 참조한다.
주사에 의한 바이러스 벡터 또는 바이러스 입자의 비경구 투여는 예로써, 일시 주사 (bolus injection) 또는 연속 주입 (continuous infusion)에 의해 실행될 수 있다. 주사용 제제는 보존제가 첨가된 단위 약형 (unit dosage form)으로, 예를 들면, 앰풀 (ampoule) 또는 다중-투약 용기에 담겨 제공될 수 있다. 조성물은 유성 또는 수성 운반제에서 현탁액, 용액 또는 에멀젼과 같은 형태를 취할 수 있고, 그리고 조제 작용제 (formulatory agent), 예를 들면, 현탁제, 안정화제 및/또는 분산제를 포함할 수 있다. 대안으로, 벡터 또는 바이러스 입자는 이용에 앞서, 적절한 운반제, 예를 들면, 무균 발열원-없는 물로 구성을 위한 분말 형태 (가령, 냉동 건조된)로 존재할 수 있다.
바이러스 벡터에 더하여, 적어도 하나의 당뇨병 상처를 앓는 당뇨병 개체로 E-셀렉틴을 인코딩하는 핵산을 도입하기 위한 임의의 적절한 운반제 또는 벡터가 이용될 수 있다. 가령, 초음파-기초된 유전자 전달 기술이 이용될 수 있다. 추가의 실례에는 입자 폭발 (particle bombardment) 및 세포 전자투과화 (cell electropermeabilization)가 포함된다. 플라스미드 DNA와 다중세포 집합체 (multicellular aggregate)를 형성하는 합성 유전자 전이 분자 역시 유용하다. 이런 분자에는 중합성 DNA-결합 양이온 (Guy et al., MoI. Biotechnol. 3:237-248, 1995), 양이온성 친양쪽체 (리포폴리아민 (lipopolyamine) 및 양이온성 지질, Feigner et al., Ann. NY Acad. Sci. 772:126-139, 1995), 그리고 양이온성 리포좀 (Fominaya et al., J. Gene Med. 2:455-464, 2000)이 포함된다.
일부 구체예에서, 하나 또는 그 이상의 당뇨병 상처를 치료하기 위하여 EPC 포함 rAAV-E-셀렉틴 벡터 또는 바이러스가 당뇨병 개체에 투여된다. 카테터-매개된 전달 I.V. (가령, 혈관내 카테터), 또는 표적 부위, 예를 들면, 당뇨병 상처 내로 직접적인 주사를 비롯하여, 개체 내로 EPC의 도입을 위하여 여러 접근법이 이용될 수 있다. 공여자 줄기 세포의 단리 및 이런 단리된 세포의 이식을 위한 기술은 당분야에 공지되어 있다. rAAV 비리온으로 형질도입된 세포의 탈체(ex vivo) 전달 역시 본 명세서에서 기술된 방법에 포함된다. 탈체 유전자 전달은 예로써, rAAV-형질도입된 숙주 세포 (가령, EPC)를 숙주 내로 되돌려 이식하는데 이용될 수 있다. 적절한 탈체 프로토콜은 여러 단계를 포함할 수 있다. 표적 조직 (가령, BM-유래된 EPC)의 분절은 숙주로부터 수확되고, 그리고 rAAV 비리온은 개체 (즉, 숙주) 세포 내로 E-셀렉틴-인코딩 핵산을 형질도입하는데 이용될 수 있다. 이들 유전자 조작된 세포는 이후, 개체 내로 되돌려 이식될 수 있다. 정맥내 주사, 복막내 주사, 또는 표적 조직 내로 in situ 주사를 비롯하여, 개체 내로 세포의 재도입을 위하여 여러 접근법이 이용될 수 있다. 탈체에서 변형된 rAAV로 형질도입되거나 감염된 세포의 미세캡슐화 (microencapsulation)는 이용될 수 있는 다른 기술이다. 자가조직 및 동종이계 세포 이식이 본 발명에 따라 이용될 수 있다.
BM-유래된 전구 세포의 BM으로부터 비-BM 구획 (가령, 표적 조직)으로의 보충을 증가시키기 위하여, 본 명세서에서 기술된 바와 같은 상처 치유를 촉진하기 위한 조성물은 E-셀렉틴 및 SDF-1α 이외에, BM-유래된 전구 세포의 보충을 촉진할 수 있는 임의의 다른 작용제를 포함할 수 있다. 다수의 이런 작용제가 공지되어 있다. 예로써, International Application WO 00/50048에서 기술된 것들; 인테그린 (가령, α4, α5), 부착 분자의 셀렉틴 집단, VCAM-1, 그리고 콜로니 자극 인자 (colony stimulating factor)를 참조한다.
본 명세서에서 기술된 치료 방법은 일반적으로, 포유동물, 특히 인간을 비롯한 이를 필요로 하는 개체 (가령, 동물, 인간)에 본 명세서에서 기술된 조성물의 치료 효과량의 투여를 포함한다. 이런 치료는 적절하게는, 질환, 장애, 또는 이들의 증상을 앓고 있거나, 이들에 취약하거나, 또는 이들의 발병 위험이 있는 개체, 특히 인간에 투여될 것이다. “위험이 있는”개체의 결정은 개체 또는 건강 관리 제공자의 진단 검사 또는 소견에 의한 임의의 객관적 또는 주관적 결정에 의해 이루어질 수 있다. 본 발명의 방법과 조성물은 E-셀렉틴 신호전달, 발현, 또는 활성의 하향조절이 관련되는 임의의 다른 질환의 치료에도 이용될 수 있다.
한 구체예에서, 당뇨병 개체에서 당뇨병 상처의 치유를 촉진하는 방법은 치료 진행을 모니터링하는 것을 포함한다. 개체에서 치료 진행의 모니터링은 일반적으로 개체에서 상처 치유를 촉진시키는데 충분한 양 본 명세서에서 기술된 바와 같은 조성물의 치료 유효량을 투여하기 전, 당뇨병 상처(들)를 앓는 개체에게 상처 크기 또는 다른 진단학적 측정을 결정하는 것을 포함한다. 그 다음, 본 명세서에서 기술된 바와 같은 조성물의 치료 유효량을 투여받은 개체에게 하나 이상의 시점에서 상처 크기의 두 번째 측정을 하고, 상처 크기의 제 1 측정과 비교한다. 제 1 측정과 후속 측정을 비교함으로써, 상처 치유 과정 (가령, 상처 크기의 감소) 및요법의 효과를 모니터한다.
키트
포유동물 개체에서 적어도 하나의 당뇨병 상처를 치료하기 위한 키트를 본 명세서에서 기술한다. 전형적인 키트는 제약학적으로 허용되는 담체, 그리고 적어도 하나의 치료제 가령, E-셀렉틴 단백질, E-셀렉틴 단백질을 인코딩하는 핵산, 또는 E-셀렉틴 발현을 특이적으로 상향조절하는 작용제를 포함하는 조성물의 치료 효과량, 그리고 사용설명서를 포함한다. 한 구체예에서, 키트는 E-셀렉틴 단백질 또는 E-셀렉틴 단백질을 인코딩하는 핵산의 치료 효과량을 포함하는 치료 조성물, 그리고 E-셀렉틴 발현을 특이적으로 상향조절하는 작용제 및 사용설명서를 포함한다. 예를 들면, 포유동물 개체에서 적어도 하나의 당뇨병 상처를 치료하기 위한 키트는 단위 약형내에 E-셀렉틴 단백질 또는 E-셀렉틴을 인코딩하는 핵산 (가령, rAAV-E-셀렉틴)의 치료 효과량과 상처 치유를 촉진하기 위한 SDF-1α의 치료 효과량, 그리고 제약학적으로 허용되는 담체를 포함하는 치료 조성물을 포함한다. 일반적으로, 본 명세서에서 기술된 바와 같은 키트는 포장 및 사용설명서를 포함한다. 일부 구체예에서, 키트는 치료적 또는 예방 조성물을 담고 있는 멸균 용기를 포함하는데; 이러한 용기는 상자, 엠플, 병, 바이알, 튜브, 백, 파우치, 블리스터-팩 또는 당업계에 공지된 기타 적절한 용기 형태일 수 있다. 이러한 용기들은 플라스틱, 유리, 적층 페이퍼(laminated paper), 금속 포일 또는 약물을 담을 수 있는 적절한 기타 물질로 만들 수 있다. 본 명세서에서 기술된 바와 같은 치료 조성물에 부가하여 치료를 받은 개체에 고압 산소 치료를 제공하는 한 구체예에서, 사용설명서는 일반적으로 개체에게 고압 산소 치료를 제공하기 위한 사용설명서를 포함할 것이다.
EPC (가령, rAAV-E-셀렉틴을 포함하는 EPC)가 당뇨병 개체에게 투여되는 구체예에서, 본 명세서에서 기술된 바와 같은 키트는 EPC의 치료량과 함께 하나 또는 그 이상의 당뇨병 상처를 가진 개체에게 세포를 투여하는 지침을 포함한다. 이 세포들은 세포의 운반 및 저장을 위한 임의의 적절한 수단에 의해 포장될 수 있고; 이러한 방법은 당업계에 잘 공지되어 있다. 사용설명서는 일반적으로 다음중 하나 또는 그 이상을 포함한다: 세포에 대한 설명; 당뇨병 상처의 치료를 위한 투약 일정 및 투여; 예방조치; 경고; 징후; 반대-징후; 과도복용 정보; 부작용; 동물 약리학; 임상 연구; 및/또는 참조문. 사용설명서는 용기(용기가 있을 때)에 직접 인쇄하거나 또는 용기에 붙이는 라벨, 또는 별지, 팜플렛, 카드 또는 용기안 또는 용기에 제공되는 폴더로 제공될 수 있다.
조성물의 투여
본 발명의 조성물은 임의의 적절한 제형으로 포유동물(가령, 설치 동물, 인간)에 투여할 수 있다. 예를 들면, 본 명세서에서 기술된 바와 같은 상처 치유를 촉진하기 위한 조성물(가령, E-셀렉틴, E-셀렉틴을 인코딩하는 핵산, SDF-1α)은 제약학적으로 허용되는 담체 또는 생리학적 염수 또는 완충된 염 용액으로 조제될 수 있다. 적절한 담체 및 희석제는 투여 방식 및 경로, 그리고 표준 약제 실시에 근거하여 선택할 수 있다. 예시적인 제약학적으로 허용되는 담체 및 희석제, 그리고 약제 조제물에 대한 기술 사항은 이 분야에 교과서인 Remington's Pharmaceutical Sciences, 그리고 USP/NF에서 확인할 수 있다. 조성물을 안정화 및/또는 보존하기 위하여 기타 물질들을 조성물에 추가할 수 있다.
본 발명의 조성물은 임의의 통상적인 기술을 이용하여 포유동물에 투여할 수 있다. 일반적으로 이러한 투여는 국소 투여(가령, 에어로졸, 크림, 포말, 겔, 액체, 연고, 페이스트, 분말, 샴푸, 스프레이, 패치, 디스크 또는 드레싱) 또는 경구 투여일 것이다.
한 구체예에서 조성물이 경구 투여용으로 조제될 때, 활성 화합물은 부형제와 혼합되어, 복용가능한 테블릿, 볼 테이블(buccal tables), 트로키, 캡슐, 엘르시르, 현탁액, 시럽, 오블라토, 그리고 이와 유사한 형태로 이용된다. 테블릿, 트로키, 알약, 캡슐 및 이와 유사한 형태는 또한 다음을 포함할 수 있다: 검 트라가탄, 아카시아, 옥수수전분 또는 젤라틴과 같은 결합제; 인산이칼슘과 같은 부형제; 옥수수 전분, 감자 전분, 알긴산 및 이와 유사한 것과 같은 붕해제; 스테아레이트 마그네슘과 같은 윤활제; 그리고 슈크로즈, 락토즈 또는 사카린과 같은 감미제가 추가될 수 있거나 또는 페퍼민트, 노루발풀 오일 또는 체리 맛과 같은 풍미제를 추가할 수 있다. 단위 약형이 캡슐일 때, 상기 유형의 물질에 추가하여 액체 담체를 포함할 수 있다. 다양한 기타 물질들은 코팅으로 제공되거나 또는 단위 약형의 물리적 형태를 변형시키기 위하여 제공될 수 있다. 예를 들면, 태블릿, 알약 또는 캡슐은 셀락, 슈가 또는 이둘 모두에 의해 피복될 수 있다. 엘르시르 시럽은 감미제로 활성 화합물 슈크로즈, 보존제로 메틸 및 프로필파라벤, 체리 또는 오렌지향과 같은 염료 및 풍미제를 포함할 수 있다. 또한, 활성 화합물은 지속-방출(sustained-release), 펄스형 방출(pulsed release), 제어된 방출(controlled release) 또는 지연된 방출(postponed release) 조제물 및 제형에 혼합될 수 있다.
대안으로, 투여는 비경구 (가령, 정맥, 피하, 종양내, 근육내, 복막내, 또는 수막강내) 투여일 수 있다. 조성물은 경피내 패취를 통하여 여기에서 제공될 수 있는데, 가령, 패치를 치료할 피부 부위에 인접하여 제공한다. 여기에서 사용된 바와 같이, "패취(patch)"는 패취를 치료할 부위 위에 둘 수 있도록 최소한 본 발명의 조성물과 덮개 층을 포함한다. 패취는 본 발명의 조성물이 피부 각질층을 통하여 표피 또는 진피로 최대한 전달되고, 지체 시간을 줄이고, 균일한 흡수를 촉진시키고, 물리적으로 문질러서 떨어져 나가는 것을 줄이도록 고안될 것이다.
조성물은 예를 들면, 내부 또는 외부 표적 부위로 외과적인 수단에 의해, 또는 혈관이 근접한 부위로 카테터 (가령, 혈관내 카테터)를 통하여 표적 부위에 바로 투여할 수 있다. 당뇨병 상처를 앓는 개체를 치료할 때, 조성물은 개체의 정맥내 투여하거나, 상처, 또는 상처 표면에 바로 투여할 수 있다. 조성물은 전량 투여(single bolus), 다중 주사(multiple injections), 또는 연속 주입(가령, 정맥내로 복막 투성, 펌프 주입)으로 투여할 수 있다. 비경구 투여를 위하여, 조성물은 멸균된 발열원 없는 형태로 조제하는 것이 바람직하다.
본 명세서에서 기술된 바와 같은 약제학적 조성물은 투여 즉시 또는 투여후 임의의 예정된 시간 또는 시간적 기간안에 치료제(가령, E-셀렉틴 단백질, E-셀렉틴을 인코딩하는 핵산, E-셀렉틴 발현을 특이적으로 상향조절하는 작용제) 를 방출하도록 조제할 수 있다. 후자의 조성물 유형은 일반적으로 조절된 방출 제형으로 알려져 있다. 연장된 시간에 걸쳐 신체내 약물의 실질적으로 일정한 농도를 야기하는 제형을 이용할 수 있다. 다른 구체예에서, 예정된 지체 시간 후, 연장된 시간에 걸쳐 신체내 약물의 실질적으로 일정한 농도를 야기하는 제형을 이용할 수 있다. 또다른 예로써, 활성 물질의 혈장 수준에 변동과 연관된 바람직하지 못한 효과를 동시에 최소화시키면서 체내 상대적으로 일정한 효과 수준을 유지시킴으로써 예정된 시간 동안 작용을 지속하는 제형을 이용할 수 있다. 또한 본 명세서에서 기술된 조성물의 발견된 용도는 예를 들면, 매주 또는 2주에 한번 투여하는 편리한 투여를 허용하는 제형, 그리고 특정 세포 유형 (가령, 내피 세포)으로 치료제를 전달하기 위한 예를 들면, 삼투 펌프 또는 초음과-기반 유전자 전달 기술을 이용하여 당뇨병 상처를 표적으로 하는 제형이다.
방출 속도가 운반되는 치료제의 대사 속도를 능가하는, 조절된 방출을 얻는 여러 가지 전략이 있다. 한 예에서, 예를 들면, 다양한 유형의 조절된 방출 조성물 및 코팅을 포함한 다양한 제형 변수들 및 성분들의 적절한 선택에 의해 조절된 방출을 이룰 수 있다. 치료제는 적합한 부형제와 함께 약제학적 조성물로 조제하여, 조성물을 투여할 때 치료제를 조절된 방식으로 방출한다. 예로는 단일 또는 다중 단위 테블릿 또는 캡슐 조성물, 오일 용액, 현탁액, 에멀젼, 미소캡슐, 미소구, 분자 복합체, 나노입자, 패취, 그리고 리포좀을 포함한다.
유효량(
Effective
Doses
)
상기에서 설명하고 있는 조성물은 치료된 포유동물에서 바람직한 결과(가령, 성숙 EC에서 특이적으로 E-셀렉틴 발현을 상향조절함으로써 당뇨병 상처 치유를 촉진하여, EC-EPC 부착, EPC 회귀의 증가 및 증가된 상처 신혈관신생을 유도한다)를 초래할 수 있는 양이 되는 효과량으로 포유동물(가령, 인간)에게 투여하는 것이 바람직하다. 이러한 치료 효과량은 하기에서 설명하는 것과 같이 결정할 수 있다.
본 발의 방법에 이용된 조성물의 독성 및 치료 효과는 LD50 (집단의 50%를 죽이는 1회분량)을 결정하기 위하여 배양물내 세포 또는 실험 동물을 이용하여 표준 약제 과정을 통하여 결정할 수 있다. 독성 및 치료 효과 사이의 1회분량(dose) 비율이 치료 지표이며, 이 치료 지표는 LD50/ED50의 비율로 나타낼 수 있다. 치료 지표가 큰 조성물이 바람직하다. 독성 효과를 나타내는 조성물을 이용할 수 있지만, 이러한 부작용의 잠재적 손상을 최소화하는 전달 시스템을 기획하기 위하여 주의를 해야만 한다. 바람직한 조성물의 1회 투여량은 독성이 없거나 거의 없는 ED50을 포함하는 범위내에 있는 것이 바람직하다. 1회 투여량은 이용되는 투약형 및 이용되는 투여 경로에 따라 이 범위내에서 가변적일 수 있다.
의학 및 수의학 분야에 공지된 것과 같이, 임의의 개체에 대한 1회 투여량은 개체의 크기, 신체 표면적, 나이, 투여되는 특정 조성물, 투여 시간 및 경로, 전반적인 건강 그리고 동시 투여되는 기타 약물들을 포함하는 많은 인자들에 따라 달라진다. 입자의 정맥 투여를 위한 적합한 1회 투여량은 예를 들면, 상처당 약 109 바이러스 입자의 범위내 있을 것으로 예상하며, 그리고 예를 들면, 재조합 단백질 (가령, SDF-1α, E-셀렉틴)의 적합한 투여량은 25 μg/kg이다.
도 1은 SDF-1α 조작된 BMDF가 신혈관신생 및 당뇨병 상처 치유를 촉진한다는 것을 증명하는 일련의 세포 현미경사진 및 그래프이다. (A) 왼쪽: 상처 치유율은 회복%로서 표시되었다. NOD 생쥐의 2개 군은 상처를 입고 mSDF-1α/BMDF 대(對) GFP/BMDF로 치료되었다. 최초 상처 부위의 분율 (fraction)은 상처가 치유될 때까지 디지털 사진촬영 및 ImageJ 분석에 의해 매일 측정되었다. mSDF-1α/BMDF로 치료된 당뇨병 생쥐는 GFP/BMDF 치료된 대조와 비교할 때 3일부터 현저하게 향상된 상처 봉합률 (closure rate)을 보였다. 오른쪽: 상이한 일자에서 대표적인 상처가 각 군에 대하여 도시된다. (B) Dil 염료로 상처 혈관 관류. 위쪽: 5일에 레이저 주사 공초점 현미경 (laser scanning confocal microscopy)에 의해 측정된 Dil-염색된 상처 혈관의 대표적인 이미지가 각 군에 대하여 도시된다. 아래쪽: 상처 내에서 혈관 밀도의 정량. 역치 부위 (threshold area)의 백분율은 전체 상처 부위의 퍼센트로서 검출된 모든 혈관을 커버한다. mSDF-1α/BMDF 치료된 상처는 대조와 비교하여 훨씬 혈관 밀도를 보였다. 데이터는 각 군에서 4개 상처의 평균 ± SD로서 표시된다. (C) mSDF-1α의 검출을 위하여 mSDF-1α/BMDF 대(對) GFP/BMDF가 주사된 상처 조직의 IHC. 더욱 강한 mSDF-1α 발현 (갈색)이 GFP/BMDF 치료된 상처와 비교하여 mSDF-1α/BMDF-치료된 상처에서 관찰되었다 (40X).
도 2는 시험관내에서 SDF-1α 자극된 EC 단층에 EPC의 부착 증가를 증명하는 EC 단층의 사진 및 그래프이다. Dil-Ac-LDL-표지된 EPC는 SDF-1α 또는 BSA로 자극된 EC 단층에 첨가되었다. 30분후, 결합되지 않은 EPC는 세척되었다. 결합된 EPC는 형광 주사 (fluorescence scanning)에 의해 정량되었다. (A): 대표적인 이미지. (B): 정량적 데이터. 데이터는 3가지 독립된 분석평가의 평균 ± SD로서 표시되고, 여기서 샘플은 이중으로 만들어졌다.
도 3은 NOD 생쥐 상처의 그래프, 전기영동 겔의 사진, 일련의 현미경사진, 그리고 SDF-1α 자극이 EC 단층에서 E-셀렉틴의 발현을 상향 조절한다는 것을 증명하는 상처 조직의 현미경사진이다. (A) HMVEC는 4시간 동안 SDF-1α 또는 BSA로 자극되고, 그리고 전체 RNA가 추출되었다. 세포외 매트릭스와 부착 분자의 발현은 RT2 PCR Array를 이용하여 분석되었다. E- 셀렉틴의 발현은 SDF-1α 자극에 의해 상향조절되었다. BSA-치료된 EC에서 mRNA의 수준은 "1"로 설정되고 SDF-1α 치료된 EC에서 수준과 비교되었다. (B): E-셀렉틴의 발현은 웨스턴 블롯 분석에 의해 실증되었다. HMVEC는 SDF-1α 또는 BSA로 자극되고, 그리고 세포는 다양한 시점에서 수확되었다. β-악틴은 적하 대조(loading control)로서 이용되었다. (C) LacZ/AAV가 주사된 것과 비교하여 mSDF-1α/AAV가 주사된 NOD 생쥐 상처에서 E-셀렉틴의 증가된 혈관 발현. 혈관 내에서 KDR (적색) 및 E-셀렉틴 (녹색)의 공동-발현 (황색)은 면역염색 (immunostaining)에 의해 검출되었다. (D) mSDF-1α/AAV가 주사된 상처 조직 내에서 SDF-1α의 증가된 발현은 IHC에 의해 검출되었다.
도 4는 EC 단층에서 SDF-1α 유도된 E-셀렉틴이 EPC 부착 및 경내피 이동을 증가시킨다는 것을 증명하는 한 쌍의 그래프 및 일련의 EC 현미경사진이다. (A) 더욱 많은 EPC가 BSA-치료된 EC 단층보다 SDF-1α-자극된 EC 단층에 부착하였다. E-셀렉틴을 억제하는 차단 Ab의 첨가는 이러한 세포-세포 부착 분석평가에서 SDF-1α-자극된 EC와 EPC의 상호작용을 저해하였다. 데이터는 3가지 독립된 분석평가의 평균 ± SD로서 표시되고, 여기서 샘플은 이중으로 만들어졌다. (B, 위쪽 패널) 증가된 숫자의 Dil-Ac-LDL 표지된 EPC가 BSA-치료된 EC 단층보다 SDF-1α-자극된 EC 단층을 보유하는 트랜스웰 (transwell)의 아래쪽 챔버로 이주하는 것으로 관찰되었다. E-셀렉틴을 억제하는 차단 Ab는 이러한 EPC 경내피 이동을 저해하였다. (B, 아래쪽 패널) 상기 트랜스웰의 아래쪽 챔버에서 Dil-EPC는 형광 스캐너에 의해 정량되었다. E-셀렉틴을 억제하는 차단 Ab는 SDF-1α-자극된 EC와 EPC의 상호작용을 저해하였다. 데이터는 3가지 독립된 분석평가의 평균 ± SD로서 표시되고, 여기서 샘플은 이중으로 만들어졌다.
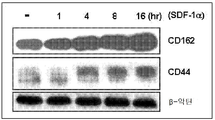
도 5는 SDF-1α가 EPC에서 E-셀렉틴 리간드의 발현을 유도한다는 것을 증명하는 웨스턴 블롯의 사진이다. EPC는 SDF-1α에 의해 자극되고, 그리고 세포는 다양한 시점에서 수확되었다. E-셀렉틴 리간드, CD162 및 CD44의 발현은 웨스턴 블롯팅 분석평가에 의해 조사되었다. β-악틴은 적하 대조 (loading control)로서 이용되었다. 실험은 2회 반복되었다.
도 6은 뒷다리 허혈 + 피부 상처의 뮤린 모형에서 SDF-1α-유도된 EPC 회귀, 신혈관신생 및 상처 치유에서 E-셀렉틴의 관여를 증명하는 일련의 사진 및 그래프이다. (A) 위쪽: E-sel-/- 대(對) WT 생쥐에서 대퇴 동맥 묶기/절제 이후에 허혈 뒷다리 내로 혈류의 자발적 수복을 보여주는 비침해성 LDI 측정의 대표적인 이미지. 아래쪽: LDI 측정의 정량적 데이터. 다양한 시점에서 2개의 생쥐 군 간에 허혈 대(對) 정상 뒷다리의 비율. 데이터는 각 군 (n=6/군)으로부터 평균 ± SD로서 표시된다. (B) E-sel-/- 대(對) WT에서 상처 봉합률. 위쪽: E-sel-/- 및 WT 생쥐에서 상처 치유의 대표적인 이미지. E-셀렉틴의 고갈은 상처 치유를 지연시켰다. 아래쪽: E-sel-/- 대(對) WT 생쥐에서 정량적 상처 봉합률. 데이터는 각 군 (n=6/군)으로부터 상처 봉합 (수복) 백분율, 평균 ± SD로서 표시된다. (C) Dil 염료로 상처 혈관 관류. 위쪽: 7일에 레이저 주사 공초점 사진촬영에 의해 검출된 Dil-염색된 상처 혈관의 대표적인 이미지가 각 군에 대하여 도시된다. 아래쪽: 형광%로서, 7일에 잔여 상처의 전체 부위에서 혈관 밀도의 소프트웨어-지원된 정량. WT 생쥐로부터 상처는 E-sel-/- 생쥐로부터 상처와 비교하여 훨씬 높은 혈관 밀도를 보였다. 데이터는 각 군에서 3가지 상처의 평균 ± SD로서 표시된다. (D) E-sel은 상처 병소에 EPC 회귀를 위하여 필수적이다. ROSA26 (LacZ+) 생쥐로부터 1 x 107개 골수 세포가 각각, E-sel-/- 및 WT 생쥐에 이식되었다. 허혈 뒷다리 상처가 만들어지고, 그리고 SDF-1α가 상처 내로 주사되었다. 세포 이식후 7일 시점에, 상처는 수확되고, 그리고 동결된 샘플은 X-gal (청색) 및 항-KDR (갈색) 염색에 종속되었다. 위쪽: 이중 염색의 대표적인 이미지. 아래쪽: 이중 양성 세포의 숫자는 상처 샘플에서 5개의 무작위로 선별된 필드로부터 계산되었다. 데이터는 각 군 (n=3개 상처/군)으로부터 평균 ± SD의 백분율이다.
도 2는 시험관내에서 SDF-1α 자극된 EC 단층에 EPC의 부착 증가를 증명하는 EC 단층의 사진 및 그래프이다. Dil-Ac-LDL-표지된 EPC는 SDF-1α 또는 BSA로 자극된 EC 단층에 첨가되었다. 30분후, 결합되지 않은 EPC는 세척되었다. 결합된 EPC는 형광 주사 (fluorescence scanning)에 의해 정량되었다. (A): 대표적인 이미지. (B): 정량적 데이터. 데이터는 3가지 독립된 분석평가의 평균 ± SD로서 표시되고, 여기서 샘플은 이중으로 만들어졌다.
도 3은 NOD 생쥐 상처의 그래프, 전기영동 겔의 사진, 일련의 현미경사진, 그리고 SDF-1α 자극이 EC 단층에서 E-셀렉틴의 발현을 상향 조절한다는 것을 증명하는 상처 조직의 현미경사진이다. (A) HMVEC는 4시간 동안 SDF-1α 또는 BSA로 자극되고, 그리고 전체 RNA가 추출되었다. 세포외 매트릭스와 부착 분자의 발현은 RT2 PCR Array를 이용하여 분석되었다. E- 셀렉틴의 발현은 SDF-1α 자극에 의해 상향조절되었다. BSA-치료된 EC에서 mRNA의 수준은 "1"로 설정되고 SDF-1α 치료된 EC에서 수준과 비교되었다. (B): E-셀렉틴의 발현은 웨스턴 블롯 분석에 의해 실증되었다. HMVEC는 SDF-1α 또는 BSA로 자극되고, 그리고 세포는 다양한 시점에서 수확되었다. β-악틴은 적하 대조(loading control)로서 이용되었다. (C) LacZ/AAV가 주사된 것과 비교하여 mSDF-1α/AAV가 주사된 NOD 생쥐 상처에서 E-셀렉틴의 증가된 혈관 발현. 혈관 내에서 KDR (적색) 및 E-셀렉틴 (녹색)의 공동-발현 (황색)은 면역염색 (immunostaining)에 의해 검출되었다. (D) mSDF-1α/AAV가 주사된 상처 조직 내에서 SDF-1α의 증가된 발현은 IHC에 의해 검출되었다.
도 4는 EC 단층에서 SDF-1α 유도된 E-셀렉틴이 EPC 부착 및 경내피 이동을 증가시킨다는 것을 증명하는 한 쌍의 그래프 및 일련의 EC 현미경사진이다. (A) 더욱 많은 EPC가 BSA-치료된 EC 단층보다 SDF-1α-자극된 EC 단층에 부착하였다. E-셀렉틴을 억제하는 차단 Ab의 첨가는 이러한 세포-세포 부착 분석평가에서 SDF-1α-자극된 EC와 EPC의 상호작용을 저해하였다. 데이터는 3가지 독립된 분석평가의 평균 ± SD로서 표시되고, 여기서 샘플은 이중으로 만들어졌다. (B, 위쪽 패널) 증가된 숫자의 Dil-Ac-LDL 표지된 EPC가 BSA-치료된 EC 단층보다 SDF-1α-자극된 EC 단층을 보유하는 트랜스웰 (transwell)의 아래쪽 챔버로 이주하는 것으로 관찰되었다. E-셀렉틴을 억제하는 차단 Ab는 이러한 EPC 경내피 이동을 저해하였다. (B, 아래쪽 패널) 상기 트랜스웰의 아래쪽 챔버에서 Dil-EPC는 형광 스캐너에 의해 정량되었다. E-셀렉틴을 억제하는 차단 Ab는 SDF-1α-자극된 EC와 EPC의 상호작용을 저해하였다. 데이터는 3가지 독립된 분석평가의 평균 ± SD로서 표시되고, 여기서 샘플은 이중으로 만들어졌다.
도 5는 SDF-1α가 EPC에서 E-셀렉틴 리간드의 발현을 유도한다는 것을 증명하는 웨스턴 블롯의 사진이다. EPC는 SDF-1α에 의해 자극되고, 그리고 세포는 다양한 시점에서 수확되었다. E-셀렉틴 리간드, CD162 및 CD44의 발현은 웨스턴 블롯팅 분석평가에 의해 조사되었다. β-악틴은 적하 대조 (loading control)로서 이용되었다. 실험은 2회 반복되었다.
도 6은 뒷다리 허혈 + 피부 상처의 뮤린 모형에서 SDF-1α-유도된 EPC 회귀, 신혈관신생 및 상처 치유에서 E-셀렉틴의 관여를 증명하는 일련의 사진 및 그래프이다. (A) 위쪽: E-sel-/- 대(對) WT 생쥐에서 대퇴 동맥 묶기/절제 이후에 허혈 뒷다리 내로 혈류의 자발적 수복을 보여주는 비침해성 LDI 측정의 대표적인 이미지. 아래쪽: LDI 측정의 정량적 데이터. 다양한 시점에서 2개의 생쥐 군 간에 허혈 대(對) 정상 뒷다리의 비율. 데이터는 각 군 (n=6/군)으로부터 평균 ± SD로서 표시된다. (B) E-sel-/- 대(對) WT에서 상처 봉합률. 위쪽: E-sel-/- 및 WT 생쥐에서 상처 치유의 대표적인 이미지. E-셀렉틴의 고갈은 상처 치유를 지연시켰다. 아래쪽: E-sel-/- 대(對) WT 생쥐에서 정량적 상처 봉합률. 데이터는 각 군 (n=6/군)으로부터 상처 봉합 (수복) 백분율, 평균 ± SD로서 표시된다. (C) Dil 염료로 상처 혈관 관류. 위쪽: 7일에 레이저 주사 공초점 사진촬영에 의해 검출된 Dil-염색된 상처 혈관의 대표적인 이미지가 각 군에 대하여 도시된다. 아래쪽: 형광%로서, 7일에 잔여 상처의 전체 부위에서 혈관 밀도의 소프트웨어-지원된 정량. WT 생쥐로부터 상처는 E-sel-/- 생쥐로부터 상처와 비교하여 훨씬 높은 혈관 밀도를 보였다. 데이터는 각 군에서 3가지 상처의 평균 ± SD로서 표시된다. (D) E-sel은 상처 병소에 EPC 회귀를 위하여 필수적이다. ROSA26 (LacZ+) 생쥐로부터 1 x 107개 골수 세포가 각각, E-sel-/- 및 WT 생쥐에 이식되었다. 허혈 뒷다리 상처가 만들어지고, 그리고 SDF-1α가 상처 내로 주사되었다. 세포 이식후 7일 시점에, 상처는 수확되고, 그리고 동결된 샘플은 X-gal (청색) 및 항-KDR (갈색) 염색에 종속되었다. 위쪽: 이중 염색의 대표적인 이미지. 아래쪽: 이중 양성 세포의 숫자는 상처 샘플에서 5개의 무작위로 선별된 필드로부터 계산되었다. 데이터는 각 군 (n=3개 상처/군)으로부터 평균 ± SD의 백분율이다.
실시예
본 발명은 다음의 특정 예를 통하여 추가 설명한다. 이들 예는 설명을 목적으로만 제공된 것이며, 본 발명의 범위를 어떠한 방식으로던 제한시키는 것으로 간주해서는 안된다.
실시예 1 - E-셀렉틴은 SDF-1α에 반응하여 내피 전구 세포 회귀를 중재하고, 정상 사지의 재맥관화 및 상처 치류율을 중재한다: 비-치유 당뇨병-관련 미세혈관 병증 및 비-치유 상처를 위한 잠재적 임상 용도
SDF-1α는 신혈관신생이 필요할 때 골수로부터 말초 부위로 EPC의 보충을 위한 회귀 신호 작용을 하지만(Gallagher et al., SDF-1α as a critically important factor, deficient in Diabetes-associated non-healing cutaneous wounds: J Clin Invest 2007, 117:1249-1259), SDF-1α가 표적 조직으로 순환 EPC를 회귀시키는 기전은 지금까지 발견되지 않았다. 표적 조직으로 EPC를 회귀시키기 위하여 모세관 안에 이어져 있는 성숙 EC와 순환 EPC 사이에 직접적인 세포-세포 상호작용이 요구되며, 이러한 상호작용은 사지 재혈관화 및 피부 상처 치유에 영향을 준다고 가정하였다. EPC 회귀 과정을 중재하는 성숙 EC 상의 SDF-1α에 의해 조절되는 특이적 부착 분자의 동정이 본 명세서에 기술되며; 생쥐 및 인간 세포의 연구에서 이러한 새로운 데이터는 이 분자를 E-셀렉틴으로 확인하였다. 추가 데이터에서 사지 재혈관화 및 상처 치유는 조직-수준 E-셀렉틴 발현에 의해 유리하게 영향받는다. 미세 혈관 병증(당뇨병 환자에서 비-치유 상처와 같은)을 앓는 비-치유 상처로 국소적으로 전달된 E-셀렉틴은 새로운 상처-치유 기술로 유용성을 가질 것이라고 가정하였다. 허혈 및 당뇨병 상처에서 테스트할 수 있는 AAV 벡터 인코딩 E-셀렉틴은 개발중에 있다.
RT2 Profiler PCR Arrays를 이용하여, 세포외 매트릭스 및 SDF-1α에 의해 유도된 부착 분자는 배양된 인간 성숙 ECs에서 연구하였다. 상기 어레이에 의해 현저하게 증가된 유전자 발현을 가진 것으로 밝혀진 분자(들)은 웨스턴 블롯팅 및 면역조직화학으로 확인하였다. EC에 대해 인간 EPC 사이에 직접적인 세포-세포 상호작용에 대한 SDF-1α 효과는 세포 부착 및 트란스내피 이동 분석평가를 이용하여 조사하였다. SDF-1α-유도된 EC-EPC 상호작용, EPC 회귀, 사지 재혈관화, 그리고 상처 치유를 중재함에 있어서 확인된 부착 분자(들)의 특이적 역할은 길항약 시험관내 및 생체내 길항약을 이용하여 연구하였다. 골수 이식 실험(Rasa26 생쥐의 골수 세포를 E-sel+/+ 대 E-sel-/- 생쥐로 이식하였다)은 상처로 EPC의 보충 및 상처 치유율과 E-셀렉틴의 조직 수준 발현 유무를 연구하기 위하여 실행하였다. 데이터는 ANOVA로 분석하였다.
SDF-1α는 시험관내에서 EC-EPC 부착 및 트란스-내피 이동을 현저하게 증가시켰고, 그리고 생체내에서 EPC 회귀를 강화시켰다. SDF-1α는 E-셀렉틴의 발현을 특이적으로 상향 조절하였지만, 배양된 인간 성숙 미세혈관 ECs 및 실험실 생쥐의 혈관에서 P-셀렉틴 및 L-셀렉틴의 발현은 상향조절하지 않았다. EC-EPC 부착 및 EPC 회귀에 SDF-1α의 조절 효과는 E-셀렉틴에 의해 특이적으로 중재되었는데, E-셀렉틴 길항약을 사용하면 SDF-1α -유도된 EC-EPC 부착, 트란스-이동 및 EPC 회귀를 현저하게 억제하였기 때문이다. E-셀렉틴의 조직 수준 발현은 생체내에서 정상적인 상처 치유 및 신혈관신생에 필요하며, 정상 치유 및 당뇨병-연관된 비-치유 상처에 주요한 이러한 두 가지 생물학적 사건에 유리하게 영향을 준다.
결론적으로, SDF-1α는 성숙 ECs에서 E-셀렉틴의 발현을 특이적으로 상향조절하여, EC-EPC 부착, EPC 회귀, 사지 재혈관화 및 상처 치유를 증가시킨다. 이러한 새로운 발견들은 당뇨병-관련된 미세혈관 병증 및 비-치유 피부 상처에서 EPC 수송, 신혈관신생, 그리고 상처 치유의 치료를 위한 새로운 표적으로 E-셀렉틴을 결론적으로 직접 지적함으로써 EPC 회귀 및 당뇨병 상처 치유에서 SDF-1α의 생물학적 효과 뒤에 있는 분자 기전에 대한 심층 식견을 제공한다.
실시예
2 -
출생후
신혈관신생의
조절을 위한 신규 표적으로 E-
셀렉틴의
확인: 당뇨병 상처 치유에 연관
신혈관신생 부위로 EPC를 모이게 하는 회귀 신호인 SDF-1α는 당뇨병 상처에서 하향-조절된다는 것은 이미 보고된 바있다 (Gallagher et al., J Clin Invest 2007, 117:1249-1259). 하기에서 설명하는 실험들에서, 성숙 EC 및 순환 EPC가 SDF-1α-매개된 EPC 회귀를 얻는 신호들을 조사하였다. 당뇨병 상처에서 SDF-1α는 SDF-1α 조작된 골수-유래된 섬유아세포를 주사함으로써 대조군 세포와 비교하여 치료에 의해 증가되었다(N= 48 (20, NOD), (28, STZ-C57)). PCR-어레이 유전자 발현 차이를 웨스턴 블롯팅 및 면역조직화학으로 확인하였다. SDF-1α-유도된 EPC 회귀 및 상처 치유를 조절함에 있어서 부착 분자(들)의 역할은 시험관 및 생체내에서 길항약을 이용하여 추가 연구하였다. 세포-기반 요법을 통하여 상처 SDF-1α를 증가시키면 당뇨병 생쥐에서 치유가 촉진되었다 (3일째 치유율이 ~20% 증가, p=0.006). SDF-1α는 EC-EPC 부착을 증가시켰고, 인간 미세혈관 EC에서 E-셀렉틴 발현을 특이적으로 상향 조절하였다 (2.3-배 증가, p<0.01). 이러한 효과는 또한 실험 생쥐의 혈관에 중요하였고, 상처 신혈관신생을 증가시켰다. EC-EPC 부착 및 EPC 회귀에서 SDF-1α의 조절 효과는 E-셀렉틴에 의해 특이적으로 중재되었는데, 그 이유는 E-셀렉틴 길항약을 사용하면 SDF-1α-유도된 EC-EPC 부착, EPC 회귀, 상처 신혈관신생, 그리고 상처 치유가 현저하게 억제되었기 때문이다. SDF-1α 조작된 세포-기초된 요법은 성숙 EC에서 E-셀렉틴 발현을 특이적으로 상향조절하여, EC-EPC 부착, EPC 회귀를 증가시키고, 상처 신혈관신생을 증가시킴으로써, 생쥐에서 당뇨병 상처 치유를 촉진시킨다. 이러한 발견들은 EPC 회귀에 있어서 SDF-1α의 생물학적 효과의 기초를 이루는 신호에 대한 새로운 식견을 제공하고, 그리고 당뇨병 상처 치유에서 EPC 수송의 치료 조절을 위한 새로운 표적으로 E-셀렉틴을 겨냥한다.
물질과 방법
HMVECs를 정상적인 인간 진피로부터 단리시켜, 1% 젤라틴이 피복된 평판에 배양하였다. 인간 EPC는 NDRI, Philadelphia, PA에서 구입하였고, 그리고 보충물 및 5% 태아 송아지 혈청(FBS)를 포함하는 완전 EGM2 배지에서 배양하였다(Cambrex Bioscience, Walkersville, MD). 293, 293T 및 NIH/3T3 세포는 10% FBS가 보충된 DMEM (Invitrogen, Carsbad, CA)에서 배양하였다. 모든 세포는 5% CO2를 포함하는 98% 가습 공기에서, 370C에서 항온처리하였다. 세포 부착 및 경내피 이동 분석평가를 위하여, EPC를 370C에서 4시간 동안 Dil-Ac-LDL (BT-902, Biomedical Technologies, Stoughton, MA)으로 라벨시키고, 인산염-완충된 염수(PBS)로 세척하였다. 준합류 HMVEC 또는 EPC는 실험에서 표시된 것과 같은 다양한 시간 동안 재조합 인간 SDF-1α (100 ng/ml)으로 자극을 주었고, 대조군으로 이용하였다.
8-12주령의 야생형 (WT) 암컷 C57 BL6 생쥐는 Charles River (Wilmington, MA)으로부터 구입하였다. 10-12주령의 NOD (NOD/shilTJ), 8주령의 E-seF-/- (B6.129S4-seletmiDmil /J) 생쥐 및 10-12 주령의 Rosa26 (lacZ+) (B6.129S7-GT (ROSA)26sor/J) 생쥐는 Jackson Laboratory (Bar Harbor, ME)으로부터 구입하였다. 모든 외과적 과정을 위하여, 생쥐는 80 mg/kg의 케타민과 20 mg/kg 크실라진(xylazine)을 i.p. 주사로 마취시켰다. 골수 이식 실험을 위하여 Rosa26 마우스의 1 x 107 골수 세포를 100 μl의 PBS에 현탁시키고, 꼬리 정맥 주사를 통하여 E-sel-/- 또는 WT 생쥐 (C57 BL6)로 이식하였다.
스트렙토코신(STZ, Sigma-Aldrich) 당뇨병을 이미 설명된 것과 같이 유도하였고, 모니터하였다(Gallagher et al, J Clin Invest 2007, 117:1249-1259). NOD 생쥐는 14-20주 이내에 통상 당뇨병이 발생하였다. 총 48마리의 당뇨병 생쥐 (N=28, STZ-C57; N=20, NOD)를 연구하였다. 혈당측정기를 이용하여 마우스의 꼬리로부터 혈청 포도당을 측정하였다. 일단 혈청 포도당이 250 mg/dl에 도달하면, 실험에 생쥐를 이용하기 전 3일간 매일 측정하였다. 당뇨병 생쥐의 평균 혈청 포도당 수준은 356-512 mg/dl 범위내 446 mg/dl가 되고, 비-당뇨병 대조군 생쥐의 평균 혈청 포도당 수준은 96-137 mg/dl 범위내 122 mg/dl이다. 6-mm 펀치 생검을 이용하여 마우스의 등의 복부 표면에 상처를 유도하였다. 전체-두께의 피부를 제거하였고, 아래 근육을 노출시켰다.
최적 바이러스 형질도입을 설명하는 기존 연구와 계획된 잠재적 임상 관련성에 근거하여, SDF-1α 수준을 조절하는 도구로서 시험관 연구를 위하여 렌티바이러스 벡터를 선택하였고, 생체 실험을 위하여 아데노-연합된 바이러스 벡터를 선택하였는다. 인간 SDF-1cc/lenti는 인간 또는 뮤린 SDF-1α 유전자를 pHX 벡터(Balint et al., J Clin Invest 2005, 115:3166-3176)로 삽입하여 만들었다. 기준 벡터, GFP/lenti는 이미 설명된 것과 같이 만들었다(Liu et al., Cancer Res 2006, 66:4182-4190). 이미 설명된 것과 같이 293 T 세포에 3개 플라스미드를 공동-형질감염시켜 가성형태 렌티바이러스를 만들었다(Liu et al., FASEB J 2006, 20:1009-1011). 형질감염후 48시간에 수거한 렌티바이러스는 NIH/3T3 세포에서 약 107형질변환 단위/㎖의 역가를 나타내었다. 렌티바이러스로 표적 세포를 감염시키기 위하여, 4 μg/ml 폴르브렌(Sigma-Aldrich) 존재하에서 다중감염도(MOI=multiplicity of infection)가 5인 바이러스에 세포를 6시간 노출시켰다. 그 다음 세포를 세척하였고, 추가 2일 동안 정규적인 완전 배지로 배양시키고, ELISA을 이용하여 단백질 발현에 대해 분석하였고, 또는 개별 실험에서 나타낸 것과 같이 후속 분석을 위하여 모았다. 뮤린 SDF-1α/AAV 및 기준 벡터, LacZ/AAV는 뮤린 SDF-1 α 또는 LacZ 유전자를 AAV2 벡터에 삽입하여 만들었다(Gao et al., Curr Gene Ther 2005, 5:285-297). 293 세포에 3개 플라스미드를 형질감염시켜 AAV를 생산하였고, 헤파린 크로마토그래피 방법으로 AAV를 정제하였고, 적정하였다. 재조합 AAV의 국소 상처 주입을 위하여, PBS중 1012 바이러스 단위/㎖에서 100 μl의 AAV를 상처 베이스로 주사하였다. 세포-기초된 요법을 위하여, 10% FBS가 보충된 DMEM 배지가 있는 플라스틱 접시에서 2주간 매 3일마다 배지를 교환시키면서 뮤린 골수 세포를 배양함으로써, 골수-유래된 섬유아세포 (BMDFs)를 만들었다. 흡착 세포는 방추형 모양을 나타내었고, 근섬유아세포 표현형과 일치하는 α 평활근 악틴+ (CcSMC+)이었다. BMDFs는 SDF-1α 또는 GFP (기준으로)을 인코드하는 렌티바이러스 벡터로 형질도입시켰다. BMDFs에서 외생성 mSDF-1α의 발현은 ELISA (데이타는 제공하지 않음)로 확인하였다. 6-mm 펀치 생검 피부 상처를 만들었고, 100㎕ PBS에 현탁된 1 x 107 mSDF-1α/BMDF 대(對) GFP/BMDF를 상처로 주사하였다.
인간 부착 분자 및 ECM RT 2 Profiler™ PCR Array는 부착 분자 및 BCM (# PA - O11, SABioseienees, Frederick, MD)의 84개 유전자를 정량적으로 프로파일하였다. 총 RNA는 TrizoF (Invitrogen)을 이용하여 세포로부터 추출하였고, cDNA는 RT 2 First Strand Kits (SABiosciences)를 이용하여 분석하였다. 제조업자의 프로토콜에 따라 PCR 어레이를 실행하였다. 임계 사이클(Ct) 값을 이용하여 표준 곡선을 플롯하였다. 모든 샘플은 β-악틴의 상대적인 수준에 대해 표준화시켰고, 결과는 상대적 수준에서 형광 강도로 표현하였다.
세포 배양물 상청액에서 SDF-1α의 농도는 제조업자의 프로토콜에 근거하여 Quantikine?SDF-1α ELISA 키트 (DY460, R&D Systems)를 이용하여 측정하였다.
HMVEC의 EC-단층은 24-웰 플레이트에서 거의 합류되도록 배양시켰고, 100 ng/ml의 재조합 인간 SDF-1α 또는 BSA로 8시간 동안 자극하였다. 후속적으로, 배양 배지를 SDF-1α-없는 EGM2 배지로 대체하였다. 미리 라벨시키고, 16시간 동안 현탁액으로 2% 아가로즈-피복된 평판에서 배양시킨, 1 x 105 Dil-Ac-LDL-라벨된 EPC를 웰에 첨가하고, 370C에서 1시간 동안 HMVEC 단층과 공동 배양하였다. 결합되지 않은 EPC는 PBS로 2회 세척하였고, 그리고 부착성 Dil-Ac-LDL-표지된 EPC는 형광 스캐너 (GE Typhoon Trio, Piscataway, NJ)로 측정하였고, 사진을 찍었다.
HMVEC의 1 x 104 세포/웰은 피브로넥틴(5 μg/ml)-피복된 24-트랜스웰 인서트(8.0-μM 구멍; Falcon 353097, Becton Dickinson Bedford, MA)의 위쪽 쳄버에서 배양하였다. 각 실험 전, 단층 합류(confluency)는 역전된 형광 현미경으로 확인하였다. HMVEC 단층은 100 ng/ml의 재조합 인간 SDF-1α 또는 BSA으로 8시간 동안 자극하였다. 상기에서 설명한 것과 같이 사전 라벨된 1 x 104 Dil-Ac-LDL-표지된 EPC는 0.3 mL 기저 EGM2 배지중 위쪽 챔버에 추가하였다. 0.6 mL의 완전 EGM2 배지를 트랜스웰의 아래쪽 챔버에 추가하였다. 세포는 37℃에서 12시간 동안 배양하였고, 트랜스웰의 위쪽에서 아래쪽 챔버로 넘어간 EPC의 양을 정량화하였다.
면역블랏팅은 Liu et al., Mol Cell Biol 2003, 23:14-25에서 설명한 것과 같이 실행하였다. 막은 E-셀렉틴 (ab-18981) 또는 β-악틴 (AC-15, Abeam, Cambridge, MA)에 대한 항체(Ab)로 프로브시켰다. 그 다음 HRP-콘쥬게이트된 2차 Ab (Santa Cruz, Santa Cruz, CA)로 프로브시키고, ECL (Amersham Biosciences, Piscataway, NJ)를 하였다. 막을 벗겨내고, 개별 실험에서 요구하는 바와 같이 재-블랏팅시켰다.
면역 착색 및 면역조직화학(IHC)를 위하여, 5-μm 파라핀 또는 냉동 단편으로 가공하고, FITC-항-E-셀렉틴 (R&D Systems), PE-항-KDR (Cell Signaling Technology, Danvers, MA) 또는 항-SDF-1α (sc28876, Santa Cruz) 으로 4℃에서 하룻밤 동안 항온처리하고, 그 다음 HRP-콘쥬게이트된 2차 항체로 항온처리하였다. 면역반응성은 DAB 키트 (Dako, Carpinteria, CA)를 이용하여 탐지하였다. 핵은 DAPI (Vector Labs, Burlingame, CA) 또는 헤마토옥실린(IHC)으로 반대염색하였다. 1차 항체를 동일한 제조업자의 비-면역원, 이소타입 일치하는 Abs로 대체하여 모든 항체에 대한 네가티브 기준을 만들었다.
다리 허혈을 유도하기 위하여, 우측 대퇴 동맥/정맥 혈관 다발의 전장(약 3-4㎜)을 결찰시키고, 절제하였다(2 집단의 생쥐를 연구하였다: E-sel-/- 생쥐 (n=6) 그리고 WT 생쥐 (n=6)). 피부는 5-0 나일론(Ethicon)으로 봉하였다(Ethicon). 다리 허혈은 Laser Doppler 관류 영상으로 확인하였다. 허혈 뒷다리 상처는 4mm 펀치 생검을 이용하여 마우스의 넓적다리 아래 표면에 유도하였다. 피부의 전체 두께 부분을 제거하여, 아래 근육 말단을 대퇴 폴드 수준까지 노출시켰다. 재조합 뮤린 SDF-1α 단백질 (R&D Systems)은 PBS에서 재구성하여, 외과술후 우측 상처 부분에 주사하였다(25μg/kg).
Olympus 디지털 카메라를 이용하여 매일 상처를 디지털 사진으로 연속적으로 촬영하였다. 측정 구경을 위하여 모든 사진에 자를 포함시켰다. ImageJ 소프트웨어(Imaging Processing and Analysis in Java, National Institutes of Health, MD)를 이용하여 영상을 분석하였다. 상처 부위는 매일 측정하였고, 상처의 회복율은 다음과 같이 나타내었다: [(원래 상처 부위 - 매일 상처 부위)/(원래 상처 부위)] X 100.
마우스 혈관은 Dil (D-282, Invitrogen/Molecular Probes)를 포함하는 특별히 조제된 수용액(7㎖/마우스)를 이용하여 살아있는 관류에 의해 마취된 생쥐에게서 생체내로 바로 라벨하였고, 이 수용액은 접촉시에 내피 세포 막에 통합되고, 그리고 동물을 희생시키기 전 직접적인 심장내 주사를 통하여 투여하였다. Dil 관류 후, 7㎖ 고정제(4% 파라포름알데히드)를 주사하였고, 전체 상처 조직을 수확하였다. 레이져 스캐닝 공촛점 현미경(Vibratome (VTlOOOS, Leica Microsystems)을 이용하여 20㎛의 두께 또는 깊이로 전체 상처 조직을 스캐닝하여 혈관 네트워크를 볼 수 있었다. ImageJ 소프트웨어를 이용하여 전체 스캔된 상처부위에 대해 표준화된 적색 Dil-라벨된 혈관의 수를 평가하여 혈관 밀도를 정량화하였다.
사지 관류는 Laser Doppler Perfusion Imaging ( LDI ) (Periscan PIM II, Perimed AB, Sweden)을 이용하여 매일 평가하였다. 사지는 마우스의 대퇴 폴드로부터 떨어진 모든 영상화된 조직으로 정의하였다. LDI는 온도 변동 및 진정 수준으로 인하여 인공물을 최소화시키기 위하여 중량 기반 진정작용이 있는 온도 조절된 설비에서 실행하였다. 상대적인 관류 데이터는 정상(좌측) 사지 혈류에 대한 허혈(우측)의 비율로 나타내었다.
허혈 뒷다리 상처 (우측)를 낸 직후, 10~12주령의 Rosa26 (LacZ+) 생쥐로부터 1× 1O7 골수 세포를 꼬리 정맥 주사를 통하여 E-sel-/- 생쥐 (n=6) 및 WT 생쥐 (n=6)에게 접목시켰다. 상처 조직으로 보충된 LacZ+ EPC의 수와 조직 단편에서 혈관으로 통합된 수는 β-갈락토시다제 분석평가에 의해 정량화하였다. 수확된 상처 조직을 냉동시키고, 조직 단편은 X-gal (Fermentas, Canada) 및 항-KDR (ab-2349, Abeam)으로 실온에서 2시간 동안 항온처리하였다. 단편들은 뉴클리어 패스트 레드[nuclear fast red (Vector Labs)]로 반대착색하였다. 적어도 3개의 연속 단편에서 단편당 5가지 무작위 고출력 장(HPF, 40X)에서 수술후 7일 시점(n=3)에서 절제된 상처아래 상처 과립화 조직의 일련의 단편내 KDR+ 혈관내 β-갈락토시다제+ 세포를 헤아려 EPC의 수를 정량화하였다.
ANOVA 및 2-tail Student's t-test를 이용하여 차이의 통계학적 분석을 실시하였다. Microsoft Excel (Microsoft Corp, Redmond, WA)을 이용하여 데이터를 분석하였다. 데이터는 평균 ± 표준 오차로 나타낸다. p<0.05일 때 값은 통계학적으로 유의적인 것으로 간주한다.
결과
SDF-1α-조작된 세포-기초된 요법은 피부 상처 신혈관신생 및 당뇨병 상처 치유를 촉진한다. 피부 상처의 과립화 조직내 미세혈관계(microvasculature)는 내재성 섬유아세포에 의해 만들어진 결합 조직 요소들에 의해 물리적으로 지탱된다. 이들 섬유아세포는 혈관의 신형성을 촉진하고, 그리고 새로 형성되는 혈관을 유지하는 독특한 미세환경을 제공한다. 섬유아세포 및 이들의 활성화된 반대부분, 근섬유아세포는 세포외 매트릭스(ECM)의 합성 및 다양한 가용성 인자들의 분비에 의한 상처 치유 과정에서 신혈관신생을 조절함에 있어서 중추적인 역할을 한다(Tomasek et al., Nat Rev Mol Cell Biol 2002, 3:349-363; Kalluri and Zeisberg, Nat Rev Cancer 2006, 6:392-401; Hinz et al., Am J Pathol 2007, 170:1807-1816). 당뇨병 뮤린 상처에서 SDF-1α의 조직 수준은 근섬유아세포에서 이의 하향-조절로 인하여 부분적으로 현저하게 감소되었다고 이미 보고된 바 있다. 근섬유아세포는 국소, 내재성 섬유아세포로부터 발생되거나 또는 순환 간엽 전구세포/줄기 세포로부터 발생될 수 있다(De Wever and Mareel, J Pathol 2003, 200:429-447; Direkze et al., Cancer Res 2004, 64:8492-8495).
당뇨병 상처 치유에 대한 SDF-1α-조작된 세포-기초된 요법의 효과를 테스트하였다. 목적은 유전적(NOD) 당뇨병 뮤린 모형에서 당뇨성 상처 치유에 섬유아세포-유래된 SDF-1α의 사전-치유 효과를 테스트하는 것이었다. 당뇨병 관련된 상처를 가진 환자의 성숙 내재성 피부 섬유아세포는 부전된 것으로 알려져 있고, 따라서 잠재적 치료적 운반제로서 임상적 관련성을 거의 가지지 않기 때문에 BMDFs를 선택하였다. 100㎕ PBS에 현탁된 1 x 107 mSDF-1α/BMDF 대(對) GFP/BMDF를 상처로 주사하였다. 종결될 때까지 매일 상처를 사진찍었다. mSDF-1α/BMDF로 치료된 당뇨병 상처는 GFP/BMDF로 주사된 것보다 상당히 더 빨리 완벽하게 치유되었다(도 1A). 피부 상처를 가진 STZ-C57 당뇨병 생쥐에서 유사한 사전-치유 결과를 관찰하였다. 상처의 네이키드 벡터 치료는 사전-치유 반응을 보였지만, 세포-기초된 방법과 같이 명확하지는 않았다. 가장 현저한 차이는 4일과 5일 시점에 관찰되었다. 상응하게, Dil 염료로 혈관 관류 후 상처를 공촛점 레이져 스캐닝 현미경에 의해 설명되는 것과 같이(도 1B), 기준 상처와 비교하였을 때, mSDF-1α/BMDF로 치료된 상처에서 더 현저하게 활발한 신혈관신생이 발달하였다. 상처를 수거하고, IHC 분석을 하였다. GFP/BMDF와 비교하여 mSDF-1α/BMDF를 주사한 상처에서 SDF-1α의 발현이 더 강력하다는 것을 IHC으로 확인하였다(도 1C). 이러한 결과는 당뇨병 뮤린 모형에서 SDF-1α의 사전-치유 및 사전-맥관형성 효과를 확인시켰고, 그리고 SDF-1α-조작된 세포-기초된 요법은 당뇨병 상처의 치료를 위한 새로운 도구로 작용할 수 있다는 사전 임상 증거를 제공하였다.
시험관내에서 SDF-1α-자극된 EC 단층에 인간 EPC의 강화된 부착. 성숙 내피 세포상에서 부착 분자(들)을 조절함으로써 EPC 회귀에서 SDF-1α의 효과가 조절된다는 가설을 테스트하기 위하여, SDF-1α 자극이 시험관내에서 세포-세포 부착 분석평가에서 EPC 부착을 더 잘 지원하도록 EC 단층을 만들 수 있는지를 검사하였다. 24-웰 평판에서 배양된 준합류 HMVEC는 재조합 인간 SDF-1α 또는 BSA로 자극되었다. Dil-Ac-LDL-표지된 EPC를 웰에 첨가하였고, 1시간 동안 EC-단층과 함께 공동-배양하였다. 결합되지 않은 EPC는 PBS로 2회 세척하여 씻어내었고, 그리고 접착 Dil-Ac-LDL-표지된 EPC는 형광 스캐너로 측정하였다(도 2A). BSA-치료된 대조과 비교하여, SDF-1α-자극된 EC 단층에 접착된 EPC 의 수는 약 8배 증가하였다(도 2B). 이러한 데이터는 SDF-1α 자극이 직접적인 EPC-EC 부착을 촉진시키고, EC 상에서 특정 부착 분자(들)의 발현은 SDF-1α에 의해 특이적으로 조절될 수 있다는 것을 말한다.
SDF-1α 자극은 EC 단층(시험관내에서) 및 생쥐의 상처 모세관 내피(생체내)에서 E-셀렉틴의 발현을 상향-조절한다. EC 단층에서 SDF-1α에 의해 상향 조절되는 부착 분자(들)을 확인하기 위하여, RT2 Profiler™ PCR 어레이를 실행하였다. 준합류 HMVEC는 4시간 동안 재조합 인간 SDF-1α 단백질 대(對) BSA로 자극을 받았다. 세포를 수확하였고, 총 RNA를 추출하였고, RT2 Profiler™ PCR 어레이를 하였다. 어레이에서 테스트된 84개 유전자중 13개는 상향 조절되었고(> 1.5-배), 20개는 하향-조절되었고(<1.5-배) 그리고 51개는 변화가 없었다(표 1). 특히, E- 셀렉틴 유전자의 발현은 SDF-1α 자극에 의해 약 2.3배 증가되었다(도 3A). E-셀렉틴의 mRNA의 관찰된 상향-조절을 확인하기 위하여, 면역블랏팅 분석을 실행하였으며, BSA-치료된 EC 단층과 비교하여 SDF-1α-자극된 단층에서 E-셀렉틴의 단백질 발현이 상향-조절되었음을 확인하였다(도 3B). 생체내 성숙 내피 세포에서 SDF-1α에 의한 E-셀렉틴의 상향 조절을 추가 확인하기 위하여, mSDF-1α/AAV 대(對) lacZ/AAV가 주사된 당뇨병 NOD 생쥐 상처내 혈관을 면역 착색으로 검사하였다. E-셀렉틴은 FITC-콘쥬게이트된 항-E-셀렉틴 Ab 및 EC와 PE-콘쥬게이트된 항-KDR Ab로 염색하였다. mSDF-1α/AAV을 주사한 당뇨병 뮤린 상처내 혈관의 EC는 LacZ/AAV를 주사한 것과 비교하여 더 강한 E-셀렉틴을 발현하였다(노란색)(도 3C). mSDF-1α/AAV에서 증가된 조직 수준은 IHC에 의해 설명되었다(도 3D). 이러한 실험들은 혈관 EC에서 SDF-1α의 하류 표적으로써 상향-조절된 하나의 주요 부착 분자로 E-셀렉틴을 확인하였다.
표 1
HMVECs에서 SDF-1α 자극시에 4시간내에 상향-조절된 그리고 하향-조절된 유전자
상향조절된 유전자 mRNA 변화 배수
CO11A1/COLL6 2.14
CD49D/IA4 1.87
CD49f/ITGA6B 2.14
CD51/DKFZp686A08142 2.3
LAM B2 2
CLG1/HNC 3.73
CD62E/ELAM 2.3
CD62/CD62P 2.3
DYT11/ESG 1.74
BNSP/BSPI 2.14
THBS/TSP 1.74
CLGI/EPA 1.74
CD106/DKFZp779G2333 2.14
하향-조절된 유전자
CSPG2/DKFZp686K061 10 -2.14
CCN2/HCS24 -3.03
CTNNB/DKFZp686D02253 -2.00
CAS/CTNND -3.73
CIG/DKFZp686F10164 -3.48
BB2/CD54 -2.82
CD49a/VLA1 -4.90
BR/CD49B -3.03
CD49e/FNRA -5.30
CD29/FNRB -2.30
CD61/GP3A -2.30
FLJ26658 -8.57
LAMM -2.82
CLM -2.82
LAMNB1 -5.28
MMP-X2/MT-MMP2 -6.06
CLG4/CLG4A -4.28
ON -2.63
CAR/CMAR -4.00
TSP3 -2.46
상향-조절된 E-셀렉틴은 SDF-1α-강화된 EC-EPC 상호작용 및 EPC 경내피 이동의 중재를 담당한다. 상향-조절된 E-셀렉틴이 SDF-1α-강화된 EC-EPC 부착의 중재를 담당하는지를 연구하기 위하여, SDF-1α-자극된 EC 단층에 EC 부착에 대한 E-셀렉틴 길항약의 효과를 테스트하였다. 24-웰 평판에서 배양된 준합류 HMVEC는 8시간 동안 100 ng/ml의 재조합 인간 SDF-1 α 또는 BSA로 자극받았고, 배양배지는 E-셀렉틴 중화 Ab 또는 이소타입-일치된 기준 Ab (2 μg/ml)를 포함하는 SDF-1α-없는 EGM2 배지로 대체하였고, EPC를 추가하기 전, 37℃에서 15분간 항온처리하였다. 후속적으로, 상기에서 설명한 것과 같이 사전-라벨된 1 x 105 Dil-Ac-LD L-표지된 EPC를 웰에 첨가하고, 1시간 동안 37℃에서 EC-단층과 공동-배양하였다. 결합되지 않은 EPC는 PBS로 2차례 세척에 의해 씻어내고, 접착성 Dil-Ac-LDL-표지된 EPC는 형광 스캐너로 측정하였다. E-셀렉틴 중화 Ab의 추가는 SDF-1α-자극된 EC 단층에 접착되는 EPC의 수를 현저하게 억제시키는 반면, 기준 Ab는 유의적인 효과가 없었다(도 4A). EPC와 EC 단층 사이의 특이적 상호작용의 중재에 있어서 E-셀렉틴의 생물학적 기능을 추가 조사하기 위하여, EPC 와 EC 단층 사이에 증가된 부착이 EC 단층을 통한 더 많은 이동을 야기시키는 지를 검사하였고, 그리고 만일 그렇다면, 이러한 이동 효과가 셀렉틴-의존성인지를 검사하였다. EPC 경내피 이동은 시험관내에서 트랜스웰 시스템에서 테스트하였다. HMVEC 단층은 γhSDF-1α 또는 BSA 존재하에 트랜스웰 인서트의 위쪽 챔버에서 배양하였다. EPC를 인서트에 추가 15분전에, 아래쪽 챔버내 EGM2 배지를 각각 γhSDF-1α 또는 BSA을 포함하는 새로운 배지로 대체하였다. 상기에서 설명하는 것과 같이 준비된 1 x 105 Dil-Ac-LDL-표지된 EPC 현탁액을 인서트에 추가하였고, 37℃에서 하룻밤동안 배양하였다. BSA-치료된 EC 단층과 비교하여, SDF-1α-자극된 EC 단층은 아래쪽 트랜스웰 챔버의 위쪽에서 아래쪽으로 EPC 이동이 현저하게 증가되었음을 보여주었다(도 4B). 중요한 것은, 이러한 효과는 적어도 부분적으로 E-셀렉틴-의존성인데, 그 이유는 트란스웰에 중화 Ab (2 μg/ml)를 추가하여 E-셀렉틴을 차단시키면 EPC 경내피 이동을 현저하게 억제시킬 수 있었기 때문이다(도 4B). 전체적으로, 이러한 결과들은 상향-조절된 E-셀렉틴이 SDF-1α-강화된 EC-EPC 부착 및 EPC 경내피 이동의 중재를 담당한다는 것을 설명하였다.
SDF-1α 자극은 EPC에서 E-셀렉틴 리간드의 발현을 상향-조절한다. 궁극적으로, 상처 모세관안에 이어져 있는 EC와 순환 EPC 사이의 직접적인 상호작용은 두 기지 세포 유형의 표면상에 부착 분자의 상호 관련 대응부에 의존할 것이다. SDF-1α가 EC 및 EPC 모두에서 관련 부착 분자(들)의 발현을 유도할 것이라고 가정하였다. EC 상의 SDF-1α-유도된 E-셀렉틴이 직접적인 EC-EPC 상호작용을 중재한다는 상기에서 상술한 결과에 근거하여, SDF-1α 자극에 반응하여 EPC에서 두 가지 E-셀렉틴 리간드, CD44 및 CD162 (PSGP-I)의 발현을 검사하였다. 준합류 인간 EPC는 다양한 시간 동안 각각 γhSDF-1α 또는 BSA로 자극받았다. 세포를 수확하였고, 면역블랏팅 분석을 받게하였다. 자극안된 EPC는 강력한 기저 수준의 CD162와 낮은 수준의 CD44를 발현하였다. SDF-1α 자극은 EPC에서 CD 162 및 CD44 모두의 발현을 상향-조절하였다(도 5). CD162 및 CD44의 유도는 SDF-1α 자극시 4시간 이내에 처음 관찰되었고, 16시간 까지 계속 증가하였다. 이들 실험은 EPC가 기저 수준의 E-셀렉틴 리간드를 발현시킨다는 것을 확인하였고, SDF-1α는 EPC에서 이들 E-셀렉틴 리간드의 발현을 상향 조절할 수 있다는 것을 보여주었는데, 이것은 가용성 인자, SDF-1α는 이들 두 가지 주요 세포 유형, 성숙 내피 세포 및 EPC 상에서 부착 분자들의 프로파일을 특이적으로 조절함으로써 EPC 회귀 효과를 중재한다는 전반적인 가설과 일치한다.
E-셀렉틴은 뮤린 허혈 뒷다리 및 피부 상처 모델에서 EPC 회귀, 신혈관신생 및 상처 치유에서 SDF-1α의 효과 중재에 요구된다. EPC 회귀, 신혈관신생, 그리고 피부 상처 치유에서 SDF-1α-유도된 E-셀렉틴의 특이적 생물학적 중요성을 연구하기 위하여, 골수 이식과 복합하여 기능상실 방법을 이용하였다. 대퇴부 묶기/절제 그리고 후속적으로 양측 4-mm 피부 절제 상처를 통하여 일측 뒷다리 허혈의 뮤린 모형을 E-sel-/- 대(對) WT 생쥐에서 만들었다. 재조합 뮤린 SDF-1α를 상처에 바로 주사하여 상처로 투여하였다. 신혈관신생 및 상처 치유에 EPC 회귀의 기여를 정량화(부분적으로)하기 위하여 꼬리 정맥을 통하여 생쥐로 Rosa26(LacZ+) 생쥐의 1× 1O7 골수 세포를 주사하여 추가 치료를 제공하였다. LDI를 이용하여 수술 후 다리 허혈을 확인하고, 그리고 시간을 두고 측정한 평균 관류를 통하여 뒷다리 혈류의 자발적 회복을 모니터하고 정량화하였다. 매일 상처 부위 측정은 디지털 사진촬영을 통하여 이루어졌다. 상처 조직내 신혈관신생은 7일 시점에서 실험 생쥐의 절반에서 수확된 상처 조직의 혈관 Dil 관류 및 후속적으로 레이져 스캐닝 공촛점 현미경으로 평가하였다. 나머지 생쥐에서, 상처를 수거하고, IHC를 하였다. 상처 조직에 보충되고, 혈관으로 통합된 EPC는 β-gal (blue) 및 항-KDR의 이중 염색에 의해 탐지하였다. WT 생쥐와 비교하였을 때, E-sel-/- 생쥐의 허혈 뒷다리는 현저하게 더 낮은 평균 유동 측정으로 나타난 바와 같이, 시간이 경과함에 따라 관류에서 지연된 개선을 나타내었다(도 6A). 일관되게, E-sel-/- 생쥐의 허혈 상처는 WT 생쥐에서보다 현저하게 더 낮은 봉합율을 가졌다(도 6B). 추가로, E-sel-/-생쥐의 허혈 상처는 WT 생쥐의 것과 비교하여 훨씬 더 약하게 혈관화되었다(도 6C). E-sel-/- 생쥐의 허혈 상처내 빈약한 신혈관신생은 EPC 회귀가 훨씬 더 적은 것과 적어도 부분적으로 관련있는데, WT 생쥐와 비교하였을 때, E-sel-/- 생쥐의 허혈 상처에서 현저하게 적은 LacZ+ 세포를 탐지하였기 때문이다(도 6D). 이들 생체내 실험은 SDF-1α- 유도된 EPC 회귀, 신혈관신생 그리고 상처 치유의 중재에 E-셀렉틴이 요구된다는 것을 설명하였다.
본 명세서에서 기술된 실험들은 SDF-1α가 EPC 상에 성숙 EC 및 E-셀렉틴 리간드에서 E-셀렉틴의 발현을 특이적으로 상향조절하여, EC-EPC 부착 및 EPC 회귀를 중재한다는 것을 설명하였다. 이러한 발견들은 EPC 회귀에 있어서 SDF-1α 의 생물학적 효과의 분자 기전에 대한 심층적 그리고 새로운 식견을 제공하고, 당뇨병 관련된 미세혈관병증 및 지연된 상처 치유 (그리고 기타 허혈 상처)에서 EPC 회귀의 치료적 조작을 위한 새로운 표적으로써 E-셀렉틴을 지정한다. EC 및 EPC에서 E-셀렉틴 및 이의 리간드의 조정은 EPC-관련된 직접적인 혈관생성 반응을 조절하고, 뿐만 아니라 당뇨병 관련된 지연된 피부 상처 치유의 해결되지 못한 임상 문제와 근원적으로 관련된 상처 치료에서 관련 직간접 효과를 조절하는 기회를 제공한다.
기타
구체예들
조성물, 키트, 그리고 방법 단계의 일부 또는 모두에 임의의 개선이 있을 수 있다. 여기에서 언급된 공개, 특허 출원 및 특허를 포함한 모든 참고문헌은 참고자료에 통합된다. 여기에서 제공하는 임의의 그리고 모든 실시예, 또는 예시적인 용어(가령, "~와 같은")는 본 발명을 설명하기 위한 의도이며, 다른 것이 청구되지 않는 한, 본 발명의 범위를 한정시키지 않는다. 예를 들면, 본 명세서에서 기술된 실시예가 당뇨병 상처, 조성물, 키트에 관계하지만, 본 명세서에서 기술된 방법은 임의의 허혈 상처를 포함하는 다수의 기타 치료 및 예방에도 용도를 찾을 수 있다. 본 발명의 특징 또는 이익 또는 구체예의 특징 및 이익에 대한 여기에서 언급되는 임의의 진술은 제한하고자 하는 의도는 아니며, 첨부된 청구범위는 이러한 진술에 의해 제한되어서는 안된다. 좀더 일반적으로, 명세서에서 본 발명을 실시하는데 필수적인 것으로 간주되는 임의의 비-청구된 요소를 지칭하는 것으로 간주되는 용어는 없다. 본 발명은 적용되는 법이 허용하는 한 여기에서 언급된 주제의 모든 변형 및 등가물을 포함한다. 더욱이, 이의 모든 가능한 변이에서 상기 설명된 요소들의 임의의 조합도 다른 언급이 없는 또는 내용에서 명시적으로 반대되지 않는 한 본 발명의 범위에 포함된다.
Claims (24)
- 당뇨병 개체에서 당뇨병 상처의 치유를 촉진하는 방법에 있어서, 아래의 단계를 포함하는 것을 특징으로 하는 방법:
제약학적으로 허용되는 담체, 그리고 E-셀렉틴 단백질, E-셀렉틴 단백질을 인코딩하는 핵산 및 E-셀렉틴 발현을 특이적으로 상향조절하는 작용제로 구성된 군에서 선택되는 적어도 하나의 치료제를 포함하는 조성물의 치료 효과량을 제공하는 단계; 그리고
골수-유래된 전구 세포 (가령, EPC)의 상처로의 이동이 개체 내에서 증가되도록 하는 조건 하에 상기 조성물을 개체에 투여하는 단계. - 청구항 1에 있어서, 조성물은 경구, 국소, 또는 정맥내 투여되는 것을 특징으로 하는 방법.
- 청구항 1에 있어서, 조성물은 상처 또는 상처에 인접한 부위에 직접적으로 투여되는 것을 특징으로 하는 방법.
- 청구항 1에 있어서, 골수-유래된 전구 세포는 내피 전구 세포 (EPC)를 포함하는 것을 특징으로 하는 방법.
- 청구항 1에 있어서, 개체에 조성물의 투여는 가속화된 상처 치유를 유발하는 것을 특징으로 하는 방법.
- 청구항 1에 있어서, 조성물은 E-셀렉틴 단백질 또는 E-셀렉틴 단백질을 인코딩하는 핵산, 그리고 E-셀렉틴 발현을 특이적으로 상향조절하는 작용제를 포함하고, 여기서 E-셀렉틴 발현을 특이적으로 상향조절하는 작용제는 SDF-1α 단백질 또는 SDF-1α 단백질을 인코딩하는 핵산인 것을 특징으로 하는 방법.
- 청구항 1에 있어서, 개체에 고압 산소 치료를 제공하는 단계를 더욱 포함하는 것을 특징으로 하는 방법.
- 당뇨병 상처를 앓는 당뇨병 개체에서 E-셀렉틴 발현을 상향조절하는 방법에 있어서, 상기 방법은 E-셀렉틴을 인코딩하는 폴리뉴클레오티드를 포함하는 적어도 하나의 rAAV 비리온 (virion)을 포함하는 조성물을 당뇨병 개체에 투여하는 단계를 포함하고, 상기 폴리뉴클레오티드는 첫 번째 AAV 반전 말단 반복부 (inverted terminal repeat) 및 두 번째 AAV 반전 말단 반복부 사이에 끼워지고, 상기 조성물은 E-셀렉틴 발현을 상향조절하고, 골수-유래된 전구 세포 (가령, EPC)의 상처로의 이동을 유도하고, 그리고 개체 내에서 상처의 치유를 가속화시키는데 효과적인 양으로 존재하는 것을 특징으로 하는 방법.
- 청구항 8에 있어서, 적어도 하나의 rAAV 비리온은 혈청형 2 캡시드 단백질을 포함하는 것을 특징으로 하는 방법.
- 청구항 8에 있어서, 조성물은 상처 또는 상처에 인접한 부위에 직접적으로 투여되는 것을 특징으로 하는 방법.
- 청구항 8에 있어서, 골수-유래된 전구 세포는 EPC를 포함하는 것을 특징으로 하는 방법.
- 청구항 8에 있어서, SDF-1α 단백질 또는 SDF-1α 단백질을 인코딩하는 핵산을 개체에 투여하는 단계를 더욱 포함하는 것을 특징으로 하는 방법.
- 청구항 8에 있어서, 개체에 고압 산소 치료를 제공하는 단계를 더욱 포함하는 것을 특징으로 하는 방법.
- 당뇨병 개체에서 당뇨병 상처의 치유를 촉진하는 방법에 있어서, 아래의 단계를 포함하는 것을 특징으로 하는 방법:
제약학적으로 허용되는 담체, 그리고 복수의 골수-유래된 전구 세포를 포함하는 조성물을 제공하는 단계, 여기서 골수-유래된 전구 세포는 E-셀렉틴을 인코딩하는 폴리뉴클레오티드를 포함하고; 그리고
개체 내에서 골수-유래된 전구 세포의 상처로의 이동을 증가시키고 상처의 치유를 가속화시키는데 효과적인 양으로 상기 조성물을 개체에 투여하는 단계. - 청구항 14에 있어서, E-셀렉틴을 인코딩하는 폴리뉴클레오티드는 바이러스 벡터 내에 포함되는 것을 특징으로 하는 방법.
- 청구항 15에 있어서, 바이러스 벡터는 바이러스 입자 내에 포함되는 것을 특징으로 하는 방법.
- 청구항 16에 있어서, 바이러스 벡터는 rAAV 벡터이고, 그리고 바이러스 입자는 AAV 입자인 것을 특징으로 하는 방법.
- 청구항 14에 있어서, 조성물은 SDF-1α 단백질 또는 SDF-1α 단백질을 인코딩하는 핵산을 더욱 포함하는 것을 특징으로 하는 방법.
- 청구항 14에 있어서, 조성물은 상처 또는 상처에 인접한 부위에 직접적으로 투여되는 것을 특징으로 하는 방법.
- 청구항 14에 있어서, 골수-유래된 전구 세포는 EPC를 포함하는 것을 특징으로 하는 방법.
- 청구항 14에 있어서, 개체에 고압 산소 치료를 제공하는 단계를 더욱 포함하는 것을 특징으로 하는 방법.
- 포유동물 개체에서 적어도 하나의 당뇨병 상처를 치료하기 위한 키트에 있어서,
(a) 제약학적으로 허용되는 담체, 그리고 E-셀렉틴 단백질, E-셀렉틴 단백질을 인코딩하는 핵산 및 E-셀렉틴 발현을 특이적으로 상향조절하는 작용제로 구성된 군에서 선택되는 적어도 하나의 치료제를 포함하는 조성물의 치료 효과량; 그리고
(b) 사용설명서를 포함하는 것을 특징으로 하는 키트. - 청구항 1에 있어서, 조성물은 E-셀렉틴 단백질 또는 E-셀렉틴 단백질을 인코딩하는 핵산, 그리고 E-셀렉틴 발현을 특이적으로 상향조절하는 작용제를 포함하고, 여기서 E-셀렉틴 발현을 특이적으로 상향조절하는 작용제는 SDF-1α 단백질 또는 SDF-1α 단백질을 인코딩하는 핵산인 것을 특징으로 하는 키트.
- 청구항 1에 있어서, 사용설명서는 고압 산소 치료를 개체에 제공하기 위한 사용설명서를 포함하는 것을 특징으로 하는 키트.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US17127109P | 2009-04-21 | 2009-04-21 | |
| US61/171,271 | 2009-04-21 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20120023633A true KR20120023633A (ko) | 2012-03-13 |
Family
ID=43011688
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020117026193A KR20120023633A (ko) | 2009-04-21 | 2010-04-09 | 허혈 및 당뇨병 상처 치유를 촉진하기 위한 조성물, 키트 및 방법 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US20120058086A1 (ko) |
| EP (1) | EP2421967A4 (ko) |
| JP (1) | JP2012524781A (ko) |
| KR (1) | KR20120023633A (ko) |
| CN (1) | CN102421894A (ko) |
| WO (1) | WO2010123699A2 (ko) |
Families Citing this family (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN105263507A (zh) * | 2013-03-15 | 2016-01-20 | 尤文塔斯医疗公司 | 使用sdf-1减轻瘢痕形成 |
| CA2971520C (en) * | 2014-12-23 | 2024-04-09 | Ilya Pharma Ab | Methods for wound healing |
| WO2016149632A1 (en) * | 2015-03-18 | 2016-09-22 | Bio1 Systems, Llc | Digital wound assessment device and method |
| CN106581068A (zh) * | 2016-11-08 | 2017-04-26 | 广州医科大学附属第三医院 | 一种可以快速恢复皮肤创面的生物膜及其制备方法 |
| EP3618852A4 (en) * | 2017-05-02 | 2021-01-06 | University of Miami | METHOD OF TREATMENT OF ISCHEMIC TISSUE |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20070244043A1 (en) * | 2005-03-10 | 2007-10-18 | Novavax, Inc. | Recombinant E-selectin made in insect cells |
| US8440617B2 (en) * | 2007-03-22 | 2013-05-14 | The Trustees Of The University Of Pennsylvania | Hyperbaric treatment in wound healing |
-
2010
- 2010-04-09 US US13/138,889 patent/US20120058086A1/en not_active Abandoned
- 2010-04-09 EP EP10767514A patent/EP2421967A4/en not_active Withdrawn
- 2010-04-09 JP JP2012507248A patent/JP2012524781A/ja active Pending
- 2010-04-09 CN CN201080019437XA patent/CN102421894A/zh active Pending
- 2010-04-09 KR KR1020117026193A patent/KR20120023633A/ko active IP Right Grant
- 2010-04-09 WO PCT/US2010/030471 patent/WO2010123699A2/en active Application Filing
Also Published As
| Publication number | Publication date |
|---|---|
| CN102421894A (zh) | 2012-04-18 |
| EP2421967A2 (en) | 2012-02-29 |
| JP2012524781A (ja) | 2012-10-18 |
| US20120058086A1 (en) | 2012-03-08 |
| WO2010123699A2 (en) | 2010-10-28 |
| EP2421967A4 (en) | 2013-01-02 |
| WO2010123699A3 (en) | 2011-01-06 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CA2504019C (en) | Stromal cell-derived factor-1 mediates stem cell homing and tissue regeneration in ischemic cardiomyopathy | |
| Gharaibeh et al. | Biological approaches to improve skeletal muscle healing after injury and disease | |
| US20040161412A1 (en) | Cell-based VEGF delivery | |
| US9226978B2 (en) | Method of treating ischemic disorders | |
| US20130236433A1 (en) | Methods, compositions, cells, and kits for treating ischemic injury | |
| US20040131601A1 (en) | Injection of bone marrow-derived cells and medium for angiogenesis | |
| KR20120023633A (ko) | 허혈 및 당뇨병 상처 치유를 촉진하기 위한 조성물, 키트 및 방법 | |
| US20220280607A1 (en) | Treatment of Heart Defects and Conditions in Pediatric Patients | |
| Li et al. | CD31+ cell transplantation promotes recovery from peripheral neuropathy | |
| US8580739B2 (en) | Methods of reducing myocardial injury following myocardial infarction | |
| JP7450244B2 (ja) | 虚血組織を治療するための方法 | |
| WO2023283404A1 (en) | Myocardial wound healing post ischemic injury | |
| AU2010241483B2 (en) | Stromal cell-derived factor-1 mediates stem cell homing and tissue regeneration | |
| Merentie | Cardiological studies in mice: special emphasis on gene therapy, imaging and ECG findings | |
| JP2006519873A (ja) | 血管形成を促進するための腫瘍内皮マーカー1、9、および17の使用 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right |