KR20110020903A - 키메라 나트륨이뇨성 폴리펩티드 및 심장 리모델링 억제 방법 - Google Patents
키메라 나트륨이뇨성 폴리펩티드 및 심장 리모델링 억제 방법 Download PDFInfo
- Publication number
- KR20110020903A KR20110020903A KR1020117000303A KR20117000303A KR20110020903A KR 20110020903 A KR20110020903 A KR 20110020903A KR 1020117000303 A KR1020117000303 A KR 1020117000303A KR 20117000303 A KR20117000303 A KR 20117000303A KR 20110020903 A KR20110020903 A KR 20110020903A
- Authority
- KR
- South Korea
- Prior art keywords
- polypeptide
- composition
- amino acid
- natriuretic
- seq
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/22—Hormones
- A61K38/2242—Atrial natriuretic factor complex: Atriopeptins, atrial natriuretic protein [ANP]; Cardionatrin, Cardiodilatin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
- A61K38/12—Cyclic peptides, e.g. bacitracins; Polymyxins; Gramicidins S, C; Tyrocidins A, B or C
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Chemical & Material Sciences (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Immunology (AREA)
- Gastroenterology & Hepatology (AREA)
- Epidemiology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Molecular Biology (AREA)
- Endocrinology (AREA)
- Zoology (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Urology & Nephrology (AREA)
- Vascular Medicine (AREA)
- Peptides Or Proteins (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
재료 및 방법은 CNP의 아미노산 서열과, DNP의 C-말단 서열을 포함하는 키메라 폴리펩티드에 관한 것이다. BNP와 비교할 때 본 폴리펩티드는 나트륨이뇨성 및 이뇨성, GFR 향상, 심장 부하 경감, 레닌 억제, 및 더 낮은 저혈압성 특성을 갖는다. 또한 본 폴리펩티드는 심장 섬유아세포 증식을 억제한다.
Description
[관련 출원에 대한 상호 참조]
본 출원은 2008년 6월 6일 출원된 미국 가출원 제61/059,576호로부터 우선권의 이익을 주장한다.
[연방 정부 지원 연구에 관한 진술]
본 발명은 미국 국립 보건원(National Institutes of Health)에서 수여하는 보조금 번호 HL76611-03 및 HL36634-20 하의 정부 지원으로 이루어졌다. 미정부는 본 발명에 대한 일정 권리를 갖는다.
[기술분야]
본 명세서는 나트륨이뇨성 폴리펩티드를 포함하는 조성물 뿐만 아니라, 심장 리모델링을 예방, 감소, 및/또는 억제하기 위해서, 및 심근경색(MI: myocardial infarction) 이후의 허혈 손상을 예방, 감소, 및/또는 억제하기 위해서 나트륨이뇨성 펩티드를 사용하는 방법에 관한 것이다.
나트륨이뇨성 펩티드 패밀리로는 심장 호르몬 심방 나트륨이뇨성 펩티드(ANP: atrial natriuretic peptide), B형 나트륨이뇨성 펩티드(BNP: B-type natriuretic peptide), C형 나트륨이뇨성 펩티드(CNP: C-type natriuretic peptide), 및 덴드로아스피스 나트륨이뇨성 펩티드(DNP: Dendroaspis natriuretic peptide)를 포함하는데, 이들 모두는 특징 규명이 잘 되어 있는 미립자 구아닐릴 사이클라제 수용체(즉, ANP 및 BNP의 경우에는 NPR-A; CNP의 경우에는 NPR-B)와 2차 메신저 사이클릭 3'5' 구아노신 모노포스페이트(cGMP: cyclic 3'5' guanosine monophosphate)를 통해 작용을 한다(문헌 ([Kuhn (2003) Circ Res 93:700-709]; [Tawaragi et al. (1991) Biochem Biophys Res Commun 175:645-651]; 및 [Komatsu et al. (1991) Endocrinology 129:1104-1106])). CNP는 혈관 및 항증식성이라는 유리한 특성을 가진다. CNP에는 신장 작용이 결여되어 있고 동시에 CNP의 저혈압성은 ANP 및 BNP의 것보다 더 낮지만, 정맥 확장에 기인하여 심장 부하를 경감한다. DNP는 현저한 저혈압성을 갖는, 유효한 나트륨이뇨성 및 이뇨성 펩티드이다. CNP 및 DNP는 별개의 구아닐릴 사이클라제 수용체를 통해 작용을 한다.
본 명세서는 부분적으로는 키메라 펩티드 조성물의 확인, 및 2가지의 다른 나트륨이뇨성 펩티드가 가지는 유익한 특성을 조합하는 방법을 토대로 한다. 본원에서 기술하는 바와 같이, CNP(GLSKGCFGLKLDRIGSMSGLGC; 서열 번호 1)와 DNP의 15-AA 선형 C-말단(PSLRDPRPNAPSTSA; 서열 번호 2)을 융합시키면 생체내에서 나트륨이뇨성 및 이뇨성, GFR 향상, 심장 부하 경감, 레닌 억제, 및 최소의 저혈압성 특성을 갖는 합성 키메라 펩티드(CD-NP)가 생성된다. 또한, 심장 섬유아세포(CF: cardiac fibroblast)에서의 시험관내 연구에 의해 입증된 바와 같이, CD-NP는 cGMP 활성화 및 항증식성 특성을 가진다. 추가로, 기타 다른 나트륨이뇨성 폴리펩티드 및 키메라 폴리펩티드도 본 개시에 따라 사용될 수 있다. 본원에 개시된 연구 결과를 통해 나트륨이뇨성 펩티드 약물 발견과 개발에서의 혁신적인 디자인 전략법이 진보됨으로써 천연 나트륨이뇨성 펩티드와 관련된 것에 바람직할 수 있으며, 심신 질환 상태, 예로서, 급성 심부전(AHF: acute heart failure), 급성 심근경색(AMI: acute myocardial infarction), 재관류 손상, 허혈 손상, 및 심장 리모델링을 치료하는 데 있어서 잠재적으로 유익한 효능과 안전성이 있는 특성을 갖는 치료학적 펩티드가 생성되었다.
하나의 측면에서, 본 명세서는 약제학적으로 허용되는 담체, 및 피험체에서 뇨 및 혈장 cGMP 수치를 증가시킬 수 있는 폴리펩티드를 포함하는 조성물을 피험체에게 투여하는 단계를 포함하며, 상기 조성물은, 심장 리모델링에 관한 하나 이상의 파라미터 수치를, 상기 조성물을 투여하기 이전의 하나 이상의 파라미터 수치와 비교할 때 10% 이상 변경하는 데 유효한 양으로 투여되고, 상기 하나 이상의 파라미터는 심장 부하 경감, 사구체 여과율 증가, 알도스테론 수치 감소, 혈장 레닌 활성 감소, 안지오텐신 II 수치 감소, 심장 섬유아세포 증식 감소, 좌심실 질량 감소, 좌심실 비대 감소, 심실 섬유증 감소, 박출률 증가, 좌심실 수축기말 직경 감소, 폐 모세혈관 쐐기압 감소, 우심방압 감소 및 평균 동맥압 감소로 구성된 군으로부터 선택되는 것인, 심장 리모델링 감소가 필요한 것으로 확인된 피험체에서 심장 리모델링을 감소시키는 방법을 특징으로 한다.
폴리펩티드는 나트륨이뇨성 폴리펩티드일 수 있다. 나트륨이뇨성 폴리펩티드는 (a) 제1 나트륨이뇨성 폴리펩티드의 환 구조, 또는 상기 제1 나트륨이뇨성 폴리펩티드의 환 구조의 변이체, 및 (b) 제2 나트륨이뇨성 폴리펩티드로부터의 아미노산 서열, 또는 상기 제2 나트륨이뇨성 폴리펩티드로부터의 아미노산 서열의 변이체를 포함하는 키메라 나트륨이뇨성 폴리펩티드일 수 있다. 나트륨이뇨성 폴리펩티드는 서열 번호 3에 기재된 아미노산 서열을 포함할 수 있지만, 서열 번호 3에 기재된 서열과 비교하여 1개, 2개, 3개, 4개, 또는 5개의 아미노산 치환을 가질 수 있다. 폴리펩티드는 NPR-B 수용체 및 NRP-A 수용체에 결합할 수 있다. 폴리펩티드는 피험체에게 투여된 후 15분 이상의 제거 반감기를 가질 수 있다.
본 방법은 (예를 들면, 1 내지 7일 동안) 지속적 정맥내 주입액으로서 본 조성물을 투여하는 것을 포함할 수 있다. 본 방법은 1 내지 7일 동안 지속적 정맥내 주입액으로서 본 조성물을 투여하고, 그 후 5 내지 30일 동안 본 조성물을 피하 투여하는 것을 포함할 수 있다. 본 방법은 본 조성물을 약 0.1 ng 폴리펩티드/kg(체질량)/분 내지 약 30 ng 폴리펩티드/kg(체질량)/분의 투여량으로 지속적 정맥내 주입액으로서 투여하고, 그 후, 본 조성물을 약 10 ng 폴리펩티드/kg(체질량)/일 내지 약 30 ng 폴리펩티드/kg(체질량)/일의 투여량으로 피하 투여하는 것을 포함할 수 있다. 본 방법은 약 3시간 내지 약 7일 동안 본 조성물을 약 0.1 ng 폴리펩티드/kg(체질량)/분 내지 약 30 ng 폴리펩티드/kg(체질량)/분의 투여량으로 지속적 정맥내 주입액으로서 투여하고, 그 후, 약 5 내지 약 30일 동안 본 조성물을 약 10 ng 폴리펩티드/kg(체질량)/일 내지 약 30 ng 폴리펩티드/kg(체질량)/일의 투여량으로 피하 투여하는 것을 포함할 수 있다.
본 피험체는 급성 심부전 또는 급성 심근경색을 앓는 것으로 확인될 수 있다. 본 방법은 재관류 시점 또는 대략 재관류 시점으로부터, 또는 재관류 개시 후 약 3시간 경과시부터 지속적 정맥내 주입액을 투여하는 것을 포함할 수 있다. 본 조성물은 재관류 후 약 3시간 내지 약 12시간이 경과했을 때 투여될 수 있다. 본 방법은 본 조성물을 약 1 ng 폴리펩티드/kg(체질량)/분 내지 약 30 ng 폴리펩티드/kg(체질량)/분(예를 들면, 약 10 ng 폴리펩티드/kg(체질량)/분, 약 12.5 ng 폴리펩티드/kg(체질량)/분, 약 15 ng 폴리펩티드/kg(체질량)/분, 약 17.5 ng 폴리펩티드/kg(체질량)/분, 또는 약 20 ng 폴리펩티드/kg(체질량)/분)의 투여량으로 투여하는 것을 포함할 수 있다. 본 방법은 추가로 심장 리모델링에 관한 하나 이상의 파라미터의 수치에 대하여 피험체를 모니터링하는 것을 포함할 수 있다.
또다른 측면에서, 본 명세서는 약제학적으로 허용되는 담체 및 폴리펩티드를 포함하는 조성물을 특징으로 하며, 상기 폴리펩티드는 피험체에서 뇨 및 혈장 cGMP 수치를 증가시킬 수 있고, 본 조성물은 이를 필요로 하는 것으로 확인된 피험체에게 투여될 때 심장 리모델링을 감소시키며, 심장 리모델링의 감소 또는 억제는 심장 부하 경감, 사구체 여과율 증가, 알도스테론 수치 감소, 혈장 레닌 활성 감소, 안지오텐신 II 수치 감소, 심장 섬유아세포 증식 감소, 좌심실 질량 감소, 좌심실 비대 감소, 심실 섬유증 감소, 박출률 증가, 좌심실 수축기말 직경 감소, 폐 모세혈관 쐐기압 감소, 우심방압 감소 및 평균 동맥압 감소로 구성된 군으로부터 선택되는 하나 이상의 파라미터의 수치 변경에 의해 나타나고, 하나 이상의 파라미터의 수치는 투여 이전의 하나 이상의 파라미터 수치와 비교할 때 10% 이상 변경되는 것을 특징으로 하는 것이다.
폴리펩티드는 나트륨이뇨성 폴리펩티드일 수 있다. 나트륨이뇨성 폴리펩티드는 (a) 제1 나트륨이뇨성 폴리펩티드의 환 구조, 또는 제1 나트륨이뇨성 폴리펩티드의 환 구조의 변이체, 및 (b) 제2 나트륨이뇨성 폴리펩티드로부터의 아미노산 서열, 또는 제2 나트륨이뇨성 폴리펩티드로부터의 아미노산 서열의 변이체를 포함하는 키메라 나트륨이뇨성 폴리펩티드일 수 있다. 나트륨이뇨성 폴리펩티드는 서열 번호 3에 기재된 아미노산 서열을 포함할 수 있지만, 서열 번호 3에 기재된 서열과 비교하여 1개, 2개, 3개, 4개, 또는 5개의 아미노산 치환을 가질 수 있다. 폴리펩티드는 NPR-B 수용체 및 NRP-A 수용체에 결합할 수 있다. 폴리펩티드는 피험체에게 투여된 후 15분 이상의 제거 반감기를 가질 수 있다. 나트륨이뇨성 폴리펩티드는 서열 번호 3에 기재된 아미노산 서열과 91 내지 98% 동일한 아미노산 서열을 포함할 수 있지만, 서열 번호 3에 기재된 서열과 비교하여 1개, 2개, 3개, 4개, 또는 5개의 아미노산 치환을 가질 수 있다. 피험체는 급성 심부전 또는 급성 심근경색을 앓는 것으로 확인될 수 있다. 약제학적 담체는 일반 생리식염수 또는 덱스트로스 및 물일 수 있다.
달리 정의되지 않는 한, 본원에서 사용하는 모든 기술 및 과학 용어는 본 발명이 속하는 분야의 숙련인이 통상적으로 이해하는 것과 동일한 의미를 가진다. 본 발명을 실시하는 데에는 본원에서 기술한 것과 유사하거나 등가인 방법 및 물질이 사용될 수 있지만, 적합한 방법 및 물질은 하기에 기술한 것이다. 본원에서 언급한 모든 공개 문헌, 특허출원, 특허 및 기타 다른 참조문헌은 그의 전문이 본원에서 참고로 인용된다. 의견이 대립되는 경우에는, 정의를 포함한 본 명세서가 조정할 것이다. 또한, 재료, 방법 및 실시예는 설명을 위해 예시한 것이며, 이를 한정하고자 하는 것은 아니다.
본 발명의 하나 이상의 실시태양에 대한 상세한 설명은 첨부된 도면 및 하기 설명에 기술하였다. 본 발명의 기타 다른 특징, 목적 및 이점은 설명 및 도면, 및 특허청구범위를 통해 자명해질 것이다.
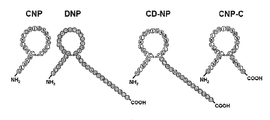
도 1은 CNP(서열 번호 1), DNP(서열 번호 17), 37-AA 키메라 나트륨이뇨성 펩티드, CD-NP(서열 번호 3), 및 CNP-C로 지칭되는, 27-AA "형질전환된" CNP-C(서열 번호 4)의 아미노산 서열 및 구조를 보여주는 다이어그램이다.
도 2는 정상적인 개(n=6)에서 DNP의 C-말단이 뇨 나트륨 배설량(UNaV: urinary excretion of sodium; 도 2A) 및 뇨량(UV: urine flow; 도 2B)에 미치는 효과에 대한 일례를 보여주는 한 쌍의 그래프이다. 데이타는 평균 ± SE로 나타내었다. C-말단은, C-말단을 42 ng/kg/분으로 정맥내 주입한 것을 나타낸다. *P<0.05 vs. 기준선.
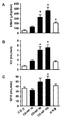
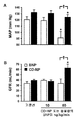
도 3은 정상적인 개(n=6)에서 CD-NP가 평균 동맥압(MAP: mean arterial pressure; 도 3A), 우심방압(RAP: right atrial pressure; 도 3B) 및 폐 모세혈관압(PCWP; 도 3C)에 미치는 효과에 대한 일례를 보여주는 일련의 그래프이다. 데이타는 평균 ± SE로 나타내었다. CD-NP 10은 CD-NP의 투여량이 10 ng/kg/분이고; CD-NP 50은 CD-NP의 투여량이 50 ng/kg/분이며; CD-NP 100은 CD-NP의 투여량이 100 ng/kg/분인 것을 나타낸다. *P<0.05 vs. 기준선.
도 4는 정상적인 개(n=6)에서 CD-NP가 뇨 나트륨 배설량(UNaV; 도 4A), 뇨량(UV; 도 4B) 및 사구체 여과율(GFR; 도 4C)에 미치는 효과에 대한 일례를 보여주는 일련의 그래프이다. 데이타는 평균 ± SE로 나타내었다. CD-NP 10은 CD-NP의 투여량이 10 ng/kg/분이고; CD-NP 50은 CD-NP의 투여량이 50 ng/kg/분이며; CD-NP 100은 CD-NP의 투여량이 100 ng/kg/분인 것을 나타낸다. *P<0.05 vs. 기준선.
도 5는 정상적인 개(n=6)에서 CD-NP가 근위 분획성 나트륨 재흡수(PFRNa: proximal fractional reabsorption of sodium; 도 5A) 및 원위 분획성 나트륨 재흡수(DFRNa: distal fractional reabsorption of sodium; 도 5B)에 미치는 효과에 대한 일례를 보여주는 한 쌍의 그래프이다. 데이타는 평균 ± SE로 나타내었다. CD-NP 10은 CD-NP의 투여량이 10 ng/kg/분이고; CD-NP 50은 CD-NP의 투여량이 50 ng/kg/분이며; CD-NP 100은 CD-NP의 투여량이 100 ng/kg/분인 것을 나타낸다. *P<0.05 vs. 기준선.
도 6은 정상적인 개로 이루어진 2개의 군(각 군당 n=6)에서 2가지 투여량의 CD-NP와 동몰량인 투여량의 인간 BNP가 미치는 효과에 대한 일례를 보여주는 한 쌍의 그래프이다. 도 6A는 CD-NP가 평균 동맥압(MAP)에 미치는 효과를 도시한 것이고, 도 6B는 CD-NP가 사구체 여과율(GFR)에 미치는 효과를 도시한 것이다. 검은색 막대(Filled bar)는 CD-NP를; 흰색 막대(empty bar)는 BNP를 나타낸다. 데이타는 평균 ± SE로 나타내었다. CD-NP 10은 CD-NP의 투여량이 10 ng/kg/분이거나, 다른 군에서는 동몰량인 투여량의 BNP를 나타내고; CD-NP 50은 CD-NP의 투여량이 50 ng/kg/분이거나, 다른 군에서는 동몰량인 투여량의 BNP를 나타낸다. *P<0.05 vs. 기준선. 군들 간의 †P<0.05.
도 7은 인간 CF에서 CD-NP가 미치는 효과에 대한 일례를 보여주는 한 쌍의 그래프이다. 도 7A는 인간 CF에서 CD-NP가 cGMP 생성에 미치는 효과를 도시한 것이다. 데이타는 평균 ± SE로 나타내었다. *P<0.05 vs. 비처리군; **P<0.05 vs. CP-NP 10-11 M; +P<0.05 vs. CD-NP 10-8 M. 도 7B는 인간 CF에서 CD-NP의 항증식성 작용의 일례를 보여주는 것으로서, 비색법에 의해 측정된 BrdU 흡수량(광학 밀도 단위)에 의해 플롯팅된 것이다. 대조군은 비처리된 인간 심장 섬유아세포를 나타내고; 카디오트로핀-1은 카디오트로핀-1에 의한 섬유아세포의 증식을 나타내며; 카디오트로핀-1 + CD-NP는 카디오트로핀-1에 첨가된 CD-NP로 자극을 받은 섬유아세포를 나타낸다. 데이타는 평균 ± SE로 나타내었다. *P<0.05 vs. 대조군.
도 8은 하나의 실시태양에서 심근경색(MI) 이후 3주가 경과시, 래트에서의 좌심실(LV) 질량을 보여주는 그래프이다. MI는 비처리군을 나타내고; MI + CDNP는 MI 후 2주동안 1.7 x 10-7 g/kg/분 CD-NP로 처리된 것을 나타낸다.
도 9a는 명시된 바와 같이 CD-NP 또는 CNP로 처리된 개에서 혈장 cGMP 수치(좌측 패널), 뇨 cGMP 배설(중간 패널), 및 cGMP에 대한 신장의 순 생성(우측 패널)을 보여주는 일련의 그래프이다. 값은 평균 ± SEM(CD-NP의 경우, n=9-10; CNP의 경우, n=7-9)이다. 군 vs. 주입 이전(평균 ± SEM, P < 0.05*, P < 0.01†) 및 군들 간(P < 0.001")의 비교를 수행하였다. 시간은 중간 제거시의 시간을 나타낸다. 도 9b는 명시된 바와 같이 CD-NP 또는 CNP로 처리된 개에서 뇨량(좌측 패널) 및 뇨 나트륨 배설(우측 패널)을 보여주는 한쌍의 그래프이다. 값은 평균 ± SEM이다. 군 vs. 주입 이전(평균 ± SEM, P < 0.05*, P < 0.01†) 및 군들 간(P < 0.05‡, P < 0.001")의 비교를 수행하였다(CD-NP의 경우, n=10; CNP의 경우, n=7). 시간은 중간 제거시의 시간을 나타낸다.
도 10a-10d는 명시된 바와 같이 CD-NP 또는 위약으로 처리된 인간에서의 혈장 cGMP(도 10a), 뇨 cGMP 배설(도 10b), 나트륨이뇨성 반응(도 10c), 및 혈압 반응(도 10d)을 보여주는 그래프이다. 군 vs. 주입 이전(평균 ± SEM, P < 0.05*, P < 0.01‡) 및 군들 간(P = 0.01")의 비교를 수행하였다. 도 10e는 단리된 개의 사구체염 중 NPR-A 길항제(1 μM)의 부재 또는 존재하에서의 CD-NP에 대한 cGMP의 반응을 보여주는 그래프이다. *P < 0.05 vs. 블랭크, †P < 0.0001 vs. 블랭크.
도 2는 정상적인 개(n=6)에서 DNP의 C-말단이 뇨 나트륨 배설량(UNaV: urinary excretion of sodium; 도 2A) 및 뇨량(UV: urine flow; 도 2B)에 미치는 효과에 대한 일례를 보여주는 한 쌍의 그래프이다. 데이타는 평균 ± SE로 나타내었다. C-말단은, C-말단을 42 ng/kg/분으로 정맥내 주입한 것을 나타낸다. *P<0.05 vs. 기준선.
도 3은 정상적인 개(n=6)에서 CD-NP가 평균 동맥압(MAP: mean arterial pressure; 도 3A), 우심방압(RAP: right atrial pressure; 도 3B) 및 폐 모세혈관압(PCWP; 도 3C)에 미치는 효과에 대한 일례를 보여주는 일련의 그래프이다. 데이타는 평균 ± SE로 나타내었다. CD-NP 10은 CD-NP의 투여량이 10 ng/kg/분이고; CD-NP 50은 CD-NP의 투여량이 50 ng/kg/분이며; CD-NP 100은 CD-NP의 투여량이 100 ng/kg/분인 것을 나타낸다. *P<0.05 vs. 기준선.
도 4는 정상적인 개(n=6)에서 CD-NP가 뇨 나트륨 배설량(UNaV; 도 4A), 뇨량(UV; 도 4B) 및 사구체 여과율(GFR; 도 4C)에 미치는 효과에 대한 일례를 보여주는 일련의 그래프이다. 데이타는 평균 ± SE로 나타내었다. CD-NP 10은 CD-NP의 투여량이 10 ng/kg/분이고; CD-NP 50은 CD-NP의 투여량이 50 ng/kg/분이며; CD-NP 100은 CD-NP의 투여량이 100 ng/kg/분인 것을 나타낸다. *P<0.05 vs. 기준선.
도 5는 정상적인 개(n=6)에서 CD-NP가 근위 분획성 나트륨 재흡수(PFRNa: proximal fractional reabsorption of sodium; 도 5A) 및 원위 분획성 나트륨 재흡수(DFRNa: distal fractional reabsorption of sodium; 도 5B)에 미치는 효과에 대한 일례를 보여주는 한 쌍의 그래프이다. 데이타는 평균 ± SE로 나타내었다. CD-NP 10은 CD-NP의 투여량이 10 ng/kg/분이고; CD-NP 50은 CD-NP의 투여량이 50 ng/kg/분이며; CD-NP 100은 CD-NP의 투여량이 100 ng/kg/분인 것을 나타낸다. *P<0.05 vs. 기준선.
도 6은 정상적인 개로 이루어진 2개의 군(각 군당 n=6)에서 2가지 투여량의 CD-NP와 동몰량인 투여량의 인간 BNP가 미치는 효과에 대한 일례를 보여주는 한 쌍의 그래프이다. 도 6A는 CD-NP가 평균 동맥압(MAP)에 미치는 효과를 도시한 것이고, 도 6B는 CD-NP가 사구체 여과율(GFR)에 미치는 효과를 도시한 것이다. 검은색 막대(Filled bar)는 CD-NP를; 흰색 막대(empty bar)는 BNP를 나타낸다. 데이타는 평균 ± SE로 나타내었다. CD-NP 10은 CD-NP의 투여량이 10 ng/kg/분이거나, 다른 군에서는 동몰량인 투여량의 BNP를 나타내고; CD-NP 50은 CD-NP의 투여량이 50 ng/kg/분이거나, 다른 군에서는 동몰량인 투여량의 BNP를 나타낸다. *P<0.05 vs. 기준선. 군들 간의 †P<0.05.
도 7은 인간 CF에서 CD-NP가 미치는 효과에 대한 일례를 보여주는 한 쌍의 그래프이다. 도 7A는 인간 CF에서 CD-NP가 cGMP 생성에 미치는 효과를 도시한 것이다. 데이타는 평균 ± SE로 나타내었다. *P<0.05 vs. 비처리군; **P<0.05 vs. CP-NP 10-11 M; +P<0.05 vs. CD-NP 10-8 M. 도 7B는 인간 CF에서 CD-NP의 항증식성 작용의 일례를 보여주는 것으로서, 비색법에 의해 측정된 BrdU 흡수량(광학 밀도 단위)에 의해 플롯팅된 것이다. 대조군은 비처리된 인간 심장 섬유아세포를 나타내고; 카디오트로핀-1은 카디오트로핀-1에 의한 섬유아세포의 증식을 나타내며; 카디오트로핀-1 + CD-NP는 카디오트로핀-1에 첨가된 CD-NP로 자극을 받은 섬유아세포를 나타낸다. 데이타는 평균 ± SE로 나타내었다. *P<0.05 vs. 대조군.
도 8은 하나의 실시태양에서 심근경색(MI) 이후 3주가 경과시, 래트에서의 좌심실(LV) 질량을 보여주는 그래프이다. MI는 비처리군을 나타내고; MI + CDNP는 MI 후 2주동안 1.7 x 10-7 g/kg/분 CD-NP로 처리된 것을 나타낸다.
도 9a는 명시된 바와 같이 CD-NP 또는 CNP로 처리된 개에서 혈장 cGMP 수치(좌측 패널), 뇨 cGMP 배설(중간 패널), 및 cGMP에 대한 신장의 순 생성(우측 패널)을 보여주는 일련의 그래프이다. 값은 평균 ± SEM(CD-NP의 경우, n=9-10; CNP의 경우, n=7-9)이다. 군 vs. 주입 이전(평균 ± SEM, P < 0.05*, P < 0.01†) 및 군들 간(P < 0.001")의 비교를 수행하였다. 시간은 중간 제거시의 시간을 나타낸다. 도 9b는 명시된 바와 같이 CD-NP 또는 CNP로 처리된 개에서 뇨량(좌측 패널) 및 뇨 나트륨 배설(우측 패널)을 보여주는 한쌍의 그래프이다. 값은 평균 ± SEM이다. 군 vs. 주입 이전(평균 ± SEM, P < 0.05*, P < 0.01†) 및 군들 간(P < 0.05‡, P < 0.001")의 비교를 수행하였다(CD-NP의 경우, n=10; CNP의 경우, n=7). 시간은 중간 제거시의 시간을 나타낸다.
도 10a-10d는 명시된 바와 같이 CD-NP 또는 위약으로 처리된 인간에서의 혈장 cGMP(도 10a), 뇨 cGMP 배설(도 10b), 나트륨이뇨성 반응(도 10c), 및 혈압 반응(도 10d)을 보여주는 그래프이다. 군 vs. 주입 이전(평균 ± SEM, P < 0.05*, P < 0.01‡) 및 군들 간(P = 0.01")의 비교를 수행하였다. 도 10e는 단리된 개의 사구체염 중 NPR-A 길항제(1 μM)의 부재 또는 존재하에서의 CD-NP에 대한 cGMP의 반응을 보여주는 그래프이다. *P < 0.05 vs. 블랭크, †P < 0.0001 vs. 블랭크.
화합물
본 명세서는 그를 필요로 하는 피험체에서 cGMP 수치를 증가시키고, 심장 리모델링을 감소시키는 데 사용될 수 있는 나트륨이뇨성 화합물 및 조성물을 제공한다. 본원에서 기술하는 바와 같이, 본 화합물은 NPR-A 수용체 및/또는 NPR-B 수용체에 결합할 수 있고, 몇몇 경우에는 NPR-C 수용체에도 결합할 수 있다. 또한, 본 화합물은 피험체에게 투여된 후에 천연 NP보다 더욱 장기간의 제거 반감기를 가질 수 있다. 몇몇 실시태양에서, 본원에서 제공하는 본 화합물은 폴리펩티드일 수 있다.
예를 들면, 본 명세서는 AHF, AMI, 재관류 손상, 허혈 손상, 및 심장 리모델링을 억제하거나 감소시킬 수 있는 일례의 단리된 나트륨이뇨성 폴리펩티드를 기술한다. 몇몇 실시태양에서, 나트륨이뇨성 펩티드는 특히, AMI 및/또는 AHF 이후의 심장 리모델링 및 허혈 손상을 치료, 억제, 및/또는 예방하는 데 사용될 수 있다. 본원에서 사용되는 바, "나트륨이뇨성 폴리펩티드" 또는 "NP"라는 용어는 천연(천연적으로 발생된 것, 야생형) NP(예를 들면, ANP, BNP, CNP, DNP, 및 유로딜라틴), 천연 NP 중 하나 이상의 일부분, 천연 NP의 변이체, 또는 천연 NP의 키메라, 천연 NP의 일부분, 또는 천연 NP의 변이체, 또는 천연 NP의 일부분을 포함한다. 몇몇 실시태양에서, NP는 오직 천연 NP의 성숙한 형태의 일부분만을 포함한다. 비록 기타 다른 천연 및 키메라 NP가 본원에서 주시되고는 있지만, CNP 및 DNP로부터 유래된 아미노산 서열을 포함하는 NP가 특히 유용할 수 있다.
CNP는 ANP 및 BNP와 구조적인 상동성을 공유하고 있지만, 유전적으로는 상이한 22-아미노산 펩티드이다. 또한 ANP 또는 BNP와는 달리, CNP에는 C-말단 아미노산 확장부가 존재하지 않으며, 이것이 부분적으로는 CNP에 나트륨이뇨성 특성이 없다는 것을 설명할 수 있다(문헌 ([Clavell et al. (1993) Am Heart J 1104-1106]; 및 [Hunt et al. (1994) J Clin Endocrinol Metab 78:1428-1435])). CNP는 대개 내피 세포로부터 유래된 펩티드이다(문헌 ([Stingo et al. (1992) Am Heart J H1318-1321]; Ogawa et al. (1992) Hypertension 19:809-813]; [Doi et al. (2001) Arterioscler Thromb Vase Biol 21:930-936]; [Naruko et al. (2005) Atherosclerosis 181:241-250]; [Horio et al. (2003) Endocrinology 144:2279-2284]; [Langenickel et al. (2006) Proc Natl Acad Sd USA 103:4735-4740]; 및[Scotland et al. (2005) Proc Natl Acad Sci USA 102:14452-14457])). 단리된 정맥 및 동맥 고리에서 CNP는 정맥 중의 NPR-B 수용체를 활성화하는 반면, ANP 및 BNP는 동맥과 정맥, 둘 모두에 있는 NPR-A 수용체에 결합한다. 이는 CNP가 ANP 및 BNP와 비교할 때 저혈압성 작용이 더 낮다는 것과 일치하는 것이다(문헌 ([Wei et al. (1993) Am J Physiol 264:H71-73]; [Igaki et al. (1998) Hypertens Res 21:7-13]; 및 [La Villa et al. (1998) Clin Sci (Lond) 95:595-602])).
정맥 확장성 특성 이외에도, CNP는 ANP 및 BNP과 비교할 때 CF에서 더욱 유효한 항증식성 및 콜라겐 억제 특성을 가진다(문헌 [Horio et al., 상기 동일 문헌]). 예를 들면, AMI를 앓는 설치동물에서 CNP를 14일 동안 연속 주입한 결과 심실 확장, 심장 섬유증, 및 심근세포 비대가 현저하게 약화되었다는 연구 결과가 나왔다(문헌 [Soeki et al. (2005) J Am Coll Cardiol 45:608-616]). CNP를 만성적으로 주입한 경우에는 저혈압성 작용은 일어나지 않았다.
ANP 및 BNP와는 대조적으로 CNP는 인간에게 주입되었을 때에 유의적인 나트륨이뇨성 및 이뇨성 작용을 갖고 있지 않다. 이는 NP가 관심의 대상이 될 정도의 확장성과 항섬유증 특성을 갖고 있음에도 나트륨 및 물 보유 증후군, 예로서, AHF에 대해서는 유용성이 부족하다는 것을 설명할 수 있다(문헌 ([Igaki et al, 상기 동일 문헌]; 및 [La Villa et al, 상기 동일 문헌])).
DNP는 원래 그린 맘바로부터 단리되었다. DNP는 잠재적으로 생체내 나트륨이뇨성 및 이뇨성을 나타내고, 유의적인 저혈압성 특성과 함께 심장 부하 경감 작용을 가지고 있다(문헌 [Schweitz et al. (1992) J Biol Chem 267:13928-13932]; [Lisy et al. (1999) Kidney Int 56:502-508]; 및 [Lisy et al. (2001) Hypertension 37:1089-1094]). ANP로 포화되면 배양된 인간 세포에서 DNP의 cGMP 활성화 작용은 약화되는 바, ANP 및 BNP와 같이 DNP도 NPR-A 수용체를 통해 작용을 한다. 실제로, 나트륨 배설 증가 및 저혈압성을 포함하는, DNP의 생체내 작용은 NPR-A 활성화와 일치하는데, 그러한 효과는 CNP가 아닌 ANP 및 BNP의 특성을 매우 근접하게 모사하고 있다. 사실상, DNP는 ANP 및 BNP와 비교하여 인간 심근에서 NPR-A 수용체에 대하여 더욱 더 높은 친화성을 갖는 것으로 나타났다(문헌 [Singh et al. (2006) Circ Res 99:183-190]).
DNP는 공지된 나트륨이뇨성 펩티드들 중 가장 긴 C-말단을 갖는데, 이는 ANP의 경우에는 5-AA, BNP의 경우에는 6-AA, 및 CNP의 경우에는 AA가 존재하지 않는 것과 비교하여 15-AA로 구성되어 있다. DNP의 긴 C-말단을 통해 중성 엔도펩티다제(NEP: neutral endopeptidase)에 의한 분해에 대하여 고도의 저항성을 띨 수 있고, 이는 DNP의 유효한 나트륨이뇨성 및 이뇨성 작용에 기여하게 된다(문헌 [Chen et al. (2002) J Am Coll Cardiol 40:1186-1191]). 추가로, CNP의 경우 C-말단이 존재하지 않는다는 것이 3가지 공지된 내인성 나트륨이뇨성 펩티드 중 하나인 CNP가 NEP 분해에 대하여 가장 큰 감수성을 갖는다는 관찰 결과를 설명할 수 있다. NEP가 신장에서 가장 고도로 발현되는 바, C-말단이 존재하지 않는다는 것은 또한 CNP의 신장 작용을 설명할 수 있다(문헌 [Kenny and Stephenson (1988) FEBS Lett 232:1-8]).
유로딜라틴은 유효한 나트륨이뇨성 및 이뇨성 활성을 갖는, NPR-A 수용체의 ANP 유사 작용제이다. 유로딜라틴은 신장에 위치하고, ANP와 동일한 전구체로부터 차별적으로 프로세싱되며, 뇨 내로 분비된다. 유로딜라틴을 구성하는 32개의 아미노산 서열은 그의 N-말단에 존재하는 4개의 아미노산 확장부와 함께, ANP를 구성하는 전체 28개의 아미노산 서열을 포함한다.
"심장 리모델링"이라는 용어는 MI, AHF, 또는 기타 다른 병태와 함께 발생할 수 있는 심장에 미치는 효과를 지칭한다. 이러한 것으로는 예를 들면, 심장 확장, 근육 세포 비대, 및 심장섬유증(즉, 간질 섬유아세포 증식)을 포함한다. 본원에서 제공하는 NP가 AMI 또는 AHF와 함께 발생하는 심장 리모델링을 억제하거나 예방할 수 있다. 몇몇 실시태양에서, 심장 리모델링의 감소를 나타내는 파라미터로는 하기들 중 하나 이상을 포함할 수 있다: 심장 부하 경감(즉, 심장압 감소), 사구체 여과율(GFR) 증가, 혈장 레닌 활성(PRA: plasma renin activity) 감소, 안지오텐신 II 수치 감소, 심장 섬유아세포 증식 감소, 좌심실(LV) 비대 감소, (섬유증 및 비대 감소를 나타내는 것인) LV 질량 감소, 폐 모세혈관 쐐기압(PWCP: pulmonary wedge capillary pressure; 좌심방압에 대한 간접적인 측정치) 감소, 우심방압 감소, 평균 동맥압 감소, (항섬유증 효과를 나타내는 것인) 알도스테론 수치 감소, 심실 섬유증 감소, 박출률 증가, 및 LV 수축기말 직경 감소. NP가 심장 리모델링을 억제하거나 예방할 수 있는지 여부를 측정하기 위하여, 예를 들면, 당업계에 공지되어 있고/거나 본원에 기술되어 있는 방법을 사용하여 (예를 들면, NP로 처리하기 이전 및 이후에) 이들 파라미터들 중 하나 이상을 평가할 수 있다.
병태, 예로서, AMI 및 AHF는 심장 손상 뿐만 아니라, 신장 손상 또한 일으킬 수 있다. 몇몇 실시태양에서, 본원에서 제공하는 NP는 또한 AMI 및 AHF 이후의 손상으로부터 신장을 보호할 수 있다. 신장 보호를 나타내는 파라미터로는 예를 들면, 근위 분획성 나트륨 재흡수(PFRNa) 감소, 원위 분획성 나트륨 재흡수(DFRNa) 감소, 뇨 나트륨 배설량(UNaV) 증가 및 뇨량(UV) 증가를 포함한다. 이들 파라미터들 중 임의의 하나 이상을 (예를 들면, NP 투여 이전 및 이후에) 평가함으로써 NP가 신장 보호 효능을 갖고 있는지 여부를 측정할 수 있다. 이들 파라미터를 평가하는 방법은 당업계에 공지되어 있고, 본원에도 역시 기술되어 있다.
"단리된 폴리펩티드"라는 용어는 (1) 자연계에서 발견되는 단백질과 회합되지 않은 상태이거나, (2) 동일의 공급원으로부터 유래된 기타 다른 단백질이 존재하지 않거나(예를 들면, 인간 단백질이 존재하지 않거나), (3) 다른 종으로부터의 세포에 의해 발현되거나, (4) 자연계에 존재하지 않는 폴리펩티드를 지칭한다. 본원에서 제공하는 단리된 폴리펩티드는 전형적으로 10개 이상(예를 들면, 12개 이상, 15개 이상, 또는 20개 이상)의 아미노산 잔기를 포함한다. 단리된 폴리펩티드는 예를 들면, 합성 DNA 또는 RNA를 비롯한 합성 DNA 또는 RNA, 또는 그의 몇몇 조합물에 의해 코딩될 수 있다.
키메라 NP는 2개 이상의 개별 NP로부터의 아미노산 서열을 포함할 수 있다. 몇몇 실시태양에서, 키메라 폴리펩티드는 CNP 및 DNP로부터의 아미노산 서열을 포함할 수 있다. 또한, 몇몇의 경우, 키메라 NP는 또다른 NP로부터의 하나 이상의 아미노산 세그먼트와 함께 조합된 환 구조 및 시스테인 결합(예를 들면, ANP, BNP, CNP, 또는 DNP의 환 구조 및 시스테인 결합)을 포함할 수 있다. 예를 들면, 키메라 CD-NP는 CNP의 전체 22-AA 서열(GLSKGCFGLKLDRIGSMSGLGC; 서열 번호 1)과 DNP의 15-AA C-말단(PSLRDPRPNAPSTSA; 서열 번호 2)을 포함할 수 있고, 이로써 서열 번호 3(GLSKGCFGLKLDRIGSMSGLGCPSLRDP RPNAPSTSA)에 기재된 아미노산 서열을 가질 수 있다. 몇몇 실시태양에서, 키메라 NP는 CNP 및 유로딜라틴으로부터의 아미노산 서열을 포함할 수 있다. 예를 들면, 키메라 CU-NP는 유로딜라틴의 10개의 아미노산 N-말단(TAPRSLRRSS; 서열 번호 6) 및 5개의 아미노산 C-말단(NSFRY; 서열 번호 7)과 함께 조합된 CNP의 환 구조 및 디설피드 결합(CFGLKLDRIGSMSGLGC; 서열 번호 5)을 포함할 수 있고, 이로써, 서열 TAPRSLRRSSCFGLKLDRIGSMSGLGCNSFRY(서열 번호 8)을 가질 수 있다.
몇몇 경우에서, 키메라 NP는 서열 번호 3 또는 서열 번호 8과 관련하여 하나 이상의 위치(예를 들면, 1, 2, 3, 4, 5, 6, 7, 8, 9, 또는 10개의 위치)에서 변이(예를 들면, 치환, 부가, 또는 결실)를 포함할 수 있다. 변이체 NP, 예를 들면, 천연 NP 아미노산 서열과 비교하여 하나 이상의 아미노산 치환을 갖는 것인 변이체 NP는 본원에서 기술하는 바와 같이 제조되고 변형될 수 있다. 몇몇 경우에서, (a) 치환 영역 중의 펩티드 골격 구조, (b) 표적 부위에 있는 분자의 전하 또는 소수성, 또는 (c) 측쇄의 벌크는 유지시켜 주면서 아미노산 효과에는 어떤 유의적인 차이도 없는 치환을 선택함으로써 아미노산을 치환할 수 있다. 예를 들면, 천연적으로 발생된 잔기는 측쇄의 특성에 기초하여 여러 군으로 분류될 수 있다: (1) 소수성 아미노산(노르루신, 메티오닌, 알라닌, 발린, 루신, 및 이소루신); (2) 중성 친수성 아미노산(시스테인, 세린, 및 트레오닌); (3) 산성 아미노산(아스파르트산 및 글루탐산); (4) 염기성 아미노산(아스파라긴, 글루타민, 히스티딘, 리신, 및 아르기닌); (5) 쇄 배향에 영향을 주는 아미노산(글리신 및 프롤린); 및 (6) 방향족 아미노산(트립토판, 티로신, 및 페닐알라닌). 이러한 군들 내에서 이루어지는 치환은 보존적 치환으로 간주될 수 있다. 유용한 치환에 대한 비제한적인 일례로는 제한없이 알라닌→발린, 아르기닌→리신, 아스파라긴→글루타민, 아스파르트산→글루탐산, 시스테인→세린, 글루타민→아스파라긴, 글루탐산→아스파르트산, 글리신→프롤린, 히스티딘→아르기닌, 이소루신→루신, 루신→이소루신, 리신→아르기닌, 메티오닌→루신, 페닐알라닌→루신, 프롤린→글리신, 세린→트레오닌, 트레오닌→세린, 트립토판→티로신, 티로신→페닐알라닌, 및/또는 발린→루신 치환을 포함한다.
변이체 CD-NP의 비제한적인 일례로는 하기를 포함한다:
CD-NP 내의 임의의 위치에서 이루어질 수 있는 보존적 치환의 추가의 일례는 표 1에 기재되어 있다.
몇몇 실시태양에서, NP는 하나 이상의 비보존적 치환을 포함할 수 있다. 비보존적 치환은 전형적으로 상기 기술된 부류들 중 하나의 구성원을 또다른 부류의 구성원으로 교체하는 것을 수반한다. 이러한 생산 방법은 상기 화합물에 대한 대량의 또는 대체 실시태양을 제공하는 데 바람직할 수 있다. 아미노산 교체를 통해 작용성 폴리펩티드가 생성되는지 여부는 펩티드 변이체의 특이적인 활성을 분석함으로써 쉽게 측정될 수 있다.
(예를 들면, 서열 번호 3과 관련된) 보존적 및/또는 비보존적 치환을 갖는 변이체 NP 뿐만 아니라, 서열 번호 3의 단편, 서열 번호 3의 변이체의 단편, 및 서열 번호 3, 서열 번호 3의 변이체 또는 단편, 또는 서열 번호 3의 변이체의 단편을 포함하는 폴리펩티드는 본원에 기술되어 있는 것을 비롯한 임의의 적합한 분석법을 통해 생물학적 활성에 대해 스크리닝될 수 있다. 예를 들면, 본원에서 기술하는 바와 같은 NP의 활성은 본원 실시예 1 및 3에 기술되어 있는 바와 같이, CF에 의해 생성된 cGMP 수치에 대하여 NP가 미치는 효과를 측정하거나, CF의 증식을 억제할 수 있는 NP의 능력을 시험함으로써 평가될 수 있다. NP의 활성은 또한 유도성 MI 이후 일어나는 동물에서의 인자들, 예로서, 폐 모세혈관 쐐기압, 우심방압, 평균 동맥압, 뇨 나트륨 배설, 뇨량, 근위 및 원위 분획성 나트륨 재흡수, 혈장 레닌 활성, 혈장 및 뇨 cGMP 수치, 사구체 여과율, 및 좌심실 질량에 대해 NP가 미치는 효과를 시험함으로써 생체내에서도 평가될 수 있다. 그러한 분석법은 예를 들면, 본원 실시예 1, 2, 및 4에 기재되어 있다.
몇몇 실시태양에서, 본원에서 제공하는 NP는 시스테인 잔기(즉, 예를 들면, 도 1에 도시한 CD-NP 구조) 사이의 디설피드 결합에 기인하여 사이클릭일 수 있다. 몇몇 실시태양에서, 시스테인 잔기 상의 설프하이드릴기는 대체기(예를 들면, -CH2CH2-)로 대체될 수 있다. 설프하이드릴기를 -CH2- 기로 대체시키기 위해서 예를 들면, 시스테인 잔기는 알파-아미노부티르산에 의해 대체될 수 있다. 그러한 사이클릭 유사체 폴리펩티드는 예를 들면, 문헌 [Lebl and Hruby (Tetrahedron Lett., 1984, 25:2067)]의 방법에 따라서, 또는 미국 특허 번호 제4,161,521호에 개시된 방법을 사용함으로써 생성될 수 있다.
또한, 세린 또는 트레오닌의 OH를 아스파르트산 또는 글루탐산의 카복실기와 함께 반응시켜 구조식 -CH2CO2CH2-를 갖는 브릿지를 수득함으로써 에스테르 또는 아미드 브릿지를 형성할 수 있다. 유사하게, 리신의 측쇄를 아스파르트산 또는 글루탐산과 반응시켜 구조식 -CH2C(O)NH(CH)4-를 갖는 브릿지를 수득함으로써 아미드를 수득할 수 있다. 이러한 브릿지를 합성하는 방법은 당업계에 공지되어 있다(예를 들면, 문헌 ([Schiller et al. (1985) Biochem . Biophy . Res . Comm. 127:558], 및 [Schiller et al. (1985) Int . J. Peptide Protein Res . 25:171])을 참조할 수 있다). 기타 다른 브릿지 형성 아미노산 잔기 및 반응은 예를 들면, 미국 특허 번호 제4,935,492호에서 제공받을 수 있다. 아미노산 잔기를 연결하는 비펩티딜 결합을 포함하는 펩티드 유사체의 제조 방법 또한 당업계에 공지되어 있다. 예를 들면, 문헌 ([Spatola et al. (1986) Life Sci. 38:1243]; [Spatola (1983) Vega Data 1(3)]; [Morley (1980) Trends Pharm . Sci. 463-468]; [Hudson et al. (1979) Int. J. Pept . Prot . Res . 14:177]; [Spatola, in Chemistry and Biochemistry of Amino Acid Peptides and Proteins. B. Weinstein, ed., Marcel Dekker, New York, p. 267 (1983)]; [Hann (1982) J. Chem . Soc . Perkin Trans. 1:307]; [Almquist et al. (1980) J. Med . Chem. 23:1392]; [Jennings-White et al. (1982) Tetrahedron Lett. 23:2533]; 유럽 특허 출원 EP 45665; [Holladay et al. (1983) Tetrahedron Lett. 24:4401]; 및 [Hruby (1982) Life Sci. 31 :189])를 참조할 수 있다.
몇몇 실시태양에서, NP는 서열 번호 3에 기재된 아미노산 서열을 포함할 수 있지만, 특정 개수의 아미노산 치환도 포함할 수 있다. 예를 들면, NP는 1개, 2개, 3개, 4개, 또는 5개의 아미노산 치환을 포함하는, 서열 번호 3의 아미노산 서열을 가질 수 있다. 그러한 아미노산 서열의 예로는 제한없이 서열 번호 9-16에 기재된 아미노산 서열을 포함한다.
몇몇 실시태양에서, 본원에서 제공하는 NP는 기준 NP 서열(예를 들면, 서열 번호 1, 서열 번호 2, 또는 서열 번호 3)의 부위와 적어도 85%(예를 들면, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 97.5%, 98%, 98.5%, 99.0%, 99.5%, 99.6%, 99.7%, 99.8%, 99.9%, 또는 100%)의 서열 동일성을 갖는 아미노산 서열을 가질 수 있다. 서열 동일성(%)은 정렬된 아미노산 서열 중 매칭되는 위치의 개수를 측정하고, 매칭되는 위치의 개수를 정렬된 아미노산의 총 개수로 나눈 다음 100을 곱하여 계산한다. 매칭되는 위치란 정렬된 아미노산 서열 중 동일한 아미노산이 동일 위치에 존재하고 있는 것인 위치를 지칭한다. 서열 동일성(%)은 또한 임의의 핵산 서열에 대해서도 측정될 수 있다.
서열 동일성(%)은 BLASTN 버전 2.0.14 및 BLASTP 버전 2.0.14를 포함하는 독립형 BLASTZ 버전의 BLAST 2 시퀀스(Sequences)(Bl2seq) 프로그램을 이용하여 표적 핵산 또는 아미노산 서열을 동정된 핵산 또는 아미노산 서열과 비교함으로써 측정된다. 이러한 독립형 BLASTZ 버전은 피쉬 앤 리처드슨(Fish & Richardson) 웹 사이트(fr.com/blast) 또는 미국 국립 생물공학 정보 센터(U.S. government's National Center for Biotechnology Information)의 웹 사이트(ncbi.nlm.nih.gov)로부터의 월드 와이드 웹 상에서 입수할 수 있다. Bl2seq 프로그램의 사용 방법을 설명하는 설명서는 BLASTZ에 첨부된 readme 파일에서 찾아볼 수 있다.
Bl2seq는 BLASTN 또는 BLASTP 알고리즘을 이용하여 두 서열 간의 비교를 수행한다. 핵산 서열 비교에는 BLASTN이 사용되는 반면, 아미노산 서열 비교에는 BLASTP가 사용된다. 2종의 핵산 서열을 비교하기 위한 옵션은 하기와 같이 설정한다: -i는 비교할 제1 핵산 서열을 포함하는 파일로 설정하고(예를 들면, C:\seq1.txt); -j는 비교할 제2 핵산 서열을 포함하는 파일로 설정하고(예를 들면, C:\seq2.txt); -p는 blastn으로 설정하고; -o는 임의의 원하는 파일명으로 설정하고(예를 들면, C:\output.txt); -q는 -1로 설정하고; -r은 2로 설정하고; 기타 다른 옵션들은 모두 디폴트 세팅으로 둔다. 두 아미노산 서열의 비교를 포함하는 출력 파일을 생성하기 위하여 예를 들어 다음 명령을 사용할 수 있다: C:\Bl2seq -i c:\seq1.txt -j c:\seq2.txt -p blastn -o c:\output.txt -q -1 -r 2. 표적 서열이 동정된 서열 중의 임의의 일부분과 상동성을 함께 공유한다면, 이때 지정된 출력 파일은 상기 상동성 부위를 정렬된 서열로서 제시하게 될 것이다. 표적 서열이 동정된 서열 중의 임의의 일부분과 상동성을 함께 공유하지 않는다면, 이때 지정된 출력 파일은 정렬된 서열을 제시하지 않을 것이다.
일단 정렬되면, 임의의 매칭되는 위치에서 출발하여 임의의 다른 매칭되는 위치에서 끝이 나며, 동정된 서열로부터의 서열과 함께 정렬하였을 때 존재하는 표적 서열로부터의 연속적인 뉴클레오티드의 개수를 카운팅하여 그 길이를 측정한다. 매칭되는 위치는 동일한 뉴클레오티드가 표적 서열 및 동정된 서열, 두 서열 모두에 존재하는 임의의 위치이다. 갭은 뉴클레오티드가 아닌 바, 표적 서열에 존재하는 갭은 카운팅되지 않는다. 유사하게, 동정된 서열로부터의 뉴클레오티드가 카운팅되는 것이 아니고, 표적 서열 뉴클레오티드가 카운팅되는 것이기 때문에 동정된 서열 중에 존재하는 갭은 카운팅되지 않는다.
특정 길이 상의 동일성(%)은 특정 길이 상의 매칭되는 위치의 개수를 카운팅하고, 상기 개수를 상기 길이로 나눈 다음 그 결과 값에 100을 곱함으로써 결정된다. 예를 들어, (1) 길이가 30개의 아미노산으로 이루어진 표적 서열을 서열 번호 3에 기재된 서열과 비교할 경우, (2) Bl2seq 프로그램은, 27개의 아미노산 부위 중 첫번째 및 마지막 아미노산이 매칭되는 서열 번호 3에 기재된 서열 부위와 함께 정렬된 표적 서열로부터 27개의 아미노산을 제시하고, (3) 상기 27개의 정렬된 아미노산에 걸쳐 매칭되는 것의 개수가 25개라면, 이때 30개의 아미노산으로 이루어진 표적 서열은 27개로 이루어진 길이를 갖고, 상기 길이에 있어서 92.6의 동일성(%)(즉, 25÷27 x 100=92.6)을 갖는다.
동정된 서열과 정렬되는, 단일 아미노산 또는 핵산 표적 서열 내의 다른 부위들은 각각 그들 자신의 고유한 동일성(%)을 가질 수 있다는 것을 이해할 것이다. 동일성(%) 값은 소수점 아래 둘째 자리에서 반올림하여 첫째 자리까지의 근사값을 구한다는 것에 주의하여야 한다. 예를 들면, 78.11, 78.12, 78.13, 및 78.14는 반올림하여 78.1이 되는 반면, 78.15, 78.16, 78.17, 78.18, 및 78.19는 반올림하여 78.2가 된다. 또한, 길이 값은 항상 정수가 된다는 것에 주의하여야 한다.
단리된 폴리펩티드는 고체상 합성을 비롯한, 임의의 적합한 방법을 사용함으로써 생산될 수 있고, 수동 기법 또는 자동화 기법(예를 들면, 어플라이드 바이오시스템즈(Applied BioSystems)(캘리포니아주 포스터 시티 소재) 펩티드 합성기 또는 바이오서치 인크.(Biosearch Inc.)(캘리포니아주 샌 라파엘 소재) 자동 펩티드 합성기를 사용한 기법)을 이용함으로써 생성될 수 있다. 예를 들면, 미국 특허 번호 제4,757,048호에서 교시된 바와 같이, KCN을 사용하여 선형 폴리펩티드를 약하게 산화시킴으로써 시스테인 잔기 사이에 디설피드 결합을 도입할 수 있다. 하기 기술하는 바와 같이, NP는 또한 재조합적으로 생산될 수 있다.
펩티드를 원하는 염기, 예를 들면, 금속 수산화물 염기(예를 들면, 수산화나트륨), 금속 탄산염 또는 중탄산염 염기(예를 들면, 탄산나트륨 또는 중탄산나트륨), 또는 아민 염기(예를 들면, 트리에틸아민, 트리에탄올아민 등)의 하나 이상의 등가물과 접촉시킴으로써 폴리펩티드의 카복실기의 염을 제조할 수 있다. 폴리펩티드를 무기산 또는 유기산(예를 들면, 염산)의 하나 이상의 등가물과 접촉시킴으로써 폴리펩티드의 산 부가염을 제조할 수 있다.
카복실산 또는 전구체를 에스테르로 전환시키는 임의의 적합한 수단(예를 들면, 당업계에 공지되어 있는 수단)을 사용함으로써 폴리펩티드의 카복실기의 에스테르를 제조할 수 있다. 예를 들면, 메리필드(Merrifield) 합성 기법을 사용할 경우, 본 폴리펩티드의 에스테르를 제조하는 한가지 방법은 수지에 따라 다르게, 염기성 또는 산성 조건하에 원하는 알코올의 존재하에서 완전한 폴리펩티드를 수지로부터 절단하는 것이다. 이어서, 수지로부터 유리되었을 때, 유리산을 단리시키지 않고서 직접 폴리펩티드의 C-말단 종단부를 에스테르화할 수 있다.
카복실산기 또는 전구체를 아미드로 전환시키는 기법(예를 들면, 당업계에 공지되어 있는 기법)을 사용함으로써 폴리펩티드의 아미드를 제조할 수 있다. C-말단의 카복실기에서 아미드를 형성하는 한가지 방법은 적절한 아민을 사용하여 고체 지지체로부터 폴리펩티드를 절단시키거나, 알코올의 존재하에서 절단하여 에스테르를 수득한 후, 원하는 아민을 사용하여 아미노분해시키는 것을 포함한다.
최종의 축합을 위해 N-아실 보호된 아미노산을 사용하거나, 보호된 또는 보호되지 않은 펩티드를 아실화함으로써 폴리펩티드의 아미노기의 N-아실 유도체를 제조할 수 있다. O-아실 유도체는 예를 들면, 유리 하이드록시 펩티드 또는 펩티드 수지의 아실화에 의해 제조될 수 있다. 표준 아실화 시약, 예로서, 아실 할라이드, 안하이드라이드, 아실 이미다졸 등을 사용함으로써 어느 아실화든지 수행할 수 있다. N- 및 O-아실화, 둘 모두는 원한다면, 함께 수행될 수 있다.
몇몇 실시태양에서, 본원에서 제공하는 NP는 천연 NP의 반감기와 비교하여 증가된 반감기를 가질 수 있다. 예를 들면, CNP의 반감기는 짧은 반면(약 1분 30초), 포유동물에게 투여된 이후 CD-NP의 제거 반감기는 약 18.5분이다(예를 들면, 문헌 ([Lee et al. BMC Pharmacol. (2007) 7(Suppl. 1):P38]; 및 [Lee et al. J. Cardiac Failure (2007) 13(6 Suppl.):S144])를 참조할 수 있다). 따라서, 본원에서 제공하는 NP는 천연 NP, 예로서, CNP와 비교할 때, 적어도 2배(예를 들면, 적어도 2배, 적어도 3 배, 적어도 4배, 적어도 5 배, 적어도 6배, 적어도 7배, 적어도 8배, 적어도 9배, 또는 적어도 10배) 증가된 반감기를 가질 수 있다. 몇몇 실시태양에서, NP는 적어도 약 10분(예를 들면, 적어도 약 10분, 적어도 약 12분, 적어도 약 15분, 적어도 약 17분, 적어도 약 18분, 또는 적어도 약 20분)의 제거 반감기를 가질 수 있다.
천연 NP의 작용이 구아닐릴 사이클라제 수용체를 통해 이루어지는 것과 같이, 본원에서 제공하는 NP는 하나 이상의 구아닐릴 사이클라제 수용체를 통해 작용할 수 있다. 예를 들면, 몇몇 실시태양에서, ANP 및 BNP의 작용이 NPR-A 수용체를 통해 이루어지는 것과 같이, 본원에서 제공하는 NP는 NPR-A 수용체에 결합하고, 그를 통해 작용할 수 있다. 몇몇 경우에서, NP는 ANP 및 BNP과 같이, NPR-A 수용체에 결합하고, 그를 통해 작용할 수 있다. 몇몇 경우에서, CNP의 작용이 NPR-B 수용체를 통해 이루어지는 것과 같이, 본원에서 제공하는 NP는 NPR-B 수용체를 통해 작용할 수 있다. 몇몇 경우에서, 본원에서 제공하는 NP는 NPR-C 수용체에 결합하고, 그를 통해 작용할 수 있다. 추가로, 몇몇 경우에서, 본원에서 제공하는 NP(예를 들면, 키메라 NP, 예로서, CD-NP)는 예를 들면, NPR-A 및 NPR-B를 비롯한, 1 초과의 구아닐릴 사이클라제 수용체에 결합하고, 그를 통해 작용할 수 있다. 어떤 수용체가 특정 NP의 작용에 관여하는지를 평가하는 방법은 당업계에 공지되어 있고, 이는 본원 실시예 5에 기술되어 있는 것을 포함한다.
본원에서 제공하는 본 화합물(예를 들면, 단리된 NP)은 예를 들면, AMI 또는 AHF 이후에 발현하는 심장 리모델링을 억제하거나 감소시킬 수 있다. 심장 리모델링을 억제할 수 있는 화합물은 하기 기술하는 바와 같이, 심장 리모델링이 억제되었거나 감소되었음을 나타내는 것인 하나 이상의 파라미터를 10% 이상 변경할 수 있는 것이다. 특정 화합물이 상기와 같은 특성들을 갖고 있는지 여부를 측정하기 위해, 본원에 기술된 분석법을 비롯한, 당업계에 주지되어 있는 분석법을 수행할 수 있다. 변이체 NP인 화합물은 전형적으로 상응하는 야생형 NP, 또는 해당 NP가 키메라 NP(예를 들면, CD-NP)인 경우에는, 그 중에 포함되어 있는 NP 성분 중 야생형 서열을 포함하는 상응하는 키메라 NP의 생물학적 활성의 적어도 약 10%(예를 들면, 적어도 약 10%, 15%, 20%, 25%, 33%, 40%, 50%, 60%, 67%, 75%, 80%, 85%, 90%, 95%, 100%, 또는 100% 초과)를 가진다.
핵산, 벡터, 및 숙주 세포
본 명세서는 또한 폴리펩티드(예를 들면, NP)를 코딩하는 예시적인 핵산 뿐만 아니라, 상기 핵산을 포함하는 발현 벡터, 및 상기 핵산 및/또는 발현 벡터를 포함하는 숙주 세포를 기술한다. 본원에서 사용되는 바, "핵산"이라는 용어는 cDNA, 게놈 DNA, 및 합성(예를 들면, 화학적으로 합성된) DNA를 비롯한, RNA 및 DNA, 둘 모두를 지칭한다. 핵산 분자는 이중 가닥이거나, 단일 가닥(즉, 센스 또는 안티센스 단일 가닥)일 수 있다. 핵산은 예를 들면, 본원에서 제공하는 NP, 변이체 NP, 및 키메라 NP를 코딩하는 cDNA를 포함한다.
"단리된 핵산"이란 척추동물 게놈에 존재하는 기타 다른 핵산 분자(보통은 척추동물 게놈 중 본 핵산의 한쪽 또는 양쪽 측면에 존재하는 핵산을 포함)로부터 분리된 핵산이다. 핵산과 관련하여 본원에서 사용되는 바, "단리된"이라는 용어는 또한 비천연적으로 발생된 서열은 자연계에서는 발견되지 않고, 천연적으로 발생된 게놈 중의 바로 옆의 인접한 서열을 갖고 있지 않기 때문에, 임의의 비천연적으로 발생된 핵산 서열을 포함한다.
단리된 핵산은 예를 들면, DNA 분자일 수 있는데, 단, 보통은, 천연적으로 발생된 게놈 중 상기 DNA 분자 바로 옆의 측면에서 발견되는 핵산 서열 중 하나는 제거되어 있거나 존재하지 않는 것을 조건으로 한다. 따라서, 단리된 핵산은 제한없이, 기타 다른 서열과는 독립적으로 별개의 분자(예를 들면, 화학적으로 합성된 핵산, 또는 PCR 또는 제한 엔도뉴클레아제 처리로 생산된 cDNA 또는 게놈 DNA 단편)로서 존재하는 DNA 분자 뿐만 아니라, 벡터, 자가 복제 플라스미드, 바이러스(예를 들면, 레트로바이러스, 렌티바이러스, 아데노바이러스 또는 헤르페스 바이러스) 내로, 또는 원핵생물 또는 진핵생물의 게놈 DNA 내로 도입된 DNA를 포함한다. 또한, 단리된 핵산은 공학처리된 핵산, 예로서, 하이브리드 또는 융합 핵산의 일부인 DNA 분자를 포함할 수 있다. 예를 들면, cDNA 라이브러리 또는 게놈 라이브러리, 또는 게놈 DNA 제한 분해를 포함하는 겔 슬라이스 내의, 수백 개 내지 수백만 개의 기타 다른 핵산 중에 존재하는 핵산은 단리된 핵산으로 간주되지 않는다. 예를 들면, "단리된 CD-NP 핵산"은 적어도 CD-NP의 일부를 코딩하는 9개 이상(예를 들면, 15개 이상, 21개 이상, 36개 이상, 또는 45개 이상) 연속된 뉴클레오티드를 포함하는 RNA 또는 DNA 분자, 또는 그에 상보적인 RNA 또는 DNA일 수 있다.
엄격한 하이브리드화 조건하에서 NP를 코딩하는 핵산 분자(예를 들면, 서열 번호 1, 서열 번호 2, 및 서열 번호 3에 기재된 아미노산 서열을 갖는 폴리펩티드를 코딩하는 핵산 분자)에 선택적으로 하이브리드화할 수 있는 핵산 분자 또한 본원에서 제공한다. "선택적으로 하이브리드화"라는 용어는 검출가능한 비특이적인 핵산에의 결합을 식별가능한 정도의 양으로 최소화하는 하이브리드화 및 세척 조건하에서 검출가능하게 특이적으로 결합한다는 것을 의미한다. 예를 들면, 고도로 엄격한 조건을 사용하여 선택적인 하이브리드화 조건을 달성할 수 있다. 중간 정도 및 엄격한 하이브리드화 조건으로는 당업계에 주지되어 있는 것을 포함한다. 예를 들면, 문헌 [sections 9.47-9.51 of Sambrook et al. (1989)]을 참조할 수 있다. 본원에서 사용되는 바, 엄격한 조건은 (1) 세척을 위해 낮은 이온 강도와 고온을 사용하는 것, 예로서, 50℃에서 0.1% 라우릴 황산나트륨(SDS)과 함께 0.015 M NaCl/0.0015 M 시트르산나트륨(SSC)을 사용하는 것, 또는 (2) 변성제를 사용하는 것, 예로서, 하이브리드화하는 동안 포름아미드를 사용하는 것, 예로서, 42℃에서 0.1% 우혈청 알부민/0.1% 피콜(Ficoll)/0.1% 폴리비닐피롤리돈/50 mM 인산나트륨 완충액(pH 6.5)(750 mM NaCl, 75 mM 시트르산나트륨 포함)과 함께 50% 포름아미드를 사용하는 것이다. 별법으로, 42℃에서 50% 포름아미드, 5xSSC (0.75 M NaCl, 0.075 M 시트르산나트륨), 50 mM 인산나트륨(pH 6.8), 0.1% 인산나트륨, 5x덴하르트 용액(Denhardt's solution), 초음파처리된 연어 정자 DNA(50 ㎍/ml), 0.1% 도데실황산나트륨(SDS), 및 10% 덱스트란황산을 사용할 수 있고, 42℃하에 0.2xSSC 및 0.1% SDS 중에서 세척할 수 있다.
단리된 핵산 분자는 제한없이, 통상의 분자 클로닝 및 화학적 핵산 합성 기법을 비롯한 표준 기법을 사용함으로써 생산될 수 있다. 예를 들면, 폴리머라제 연쇄 반응(PCR: polymerase chain reaction) 기법을 사용하여 본원에서 제공하는 NP(예를 들면, CD-NP, 또는 변이체 CD-NP)를 코딩하는 뉴클레오티드 서열을 포함하는 단리된 서열을 수득할 수 있다. PCR이란 이를 통해 표적 핵산이 효소적으로 증폭되는 방법 또는 기법을 지칭한다. 전형적으로는 관심의 대상이 되는 부위 또는 그 이상의 부위의 말단으로부터 얻은 서열 정보를 사용하여 증폭시키고자 하는 주형의 반대쪽 가닥과 서열이 동일한 올리고뉴클레오티드 프라이머를 디자인한다. PCR을 사용함으로써 전체 게놈 DNA 또는 전체 세포성 RNA로부터의 서열을 비롯한, DNA 뿐만 아니라, RNA로부터 특이적인 서열을 증폭시킬 수 있다. 전형적으로 프라이머 길이는 14 내지 40개의 뉴클레오티드이지만, 그 길이 범위는 10개의 뉴클레오티드 내지 수백 개의 뉴클레오티드일 수 있다. 일반 PCR 기법은 예를 들면, 문헌 [PCR Primer: A Laboratory Manual , ed. by Dieffenbach and Dveksler, Cold Spring Harbor Laboratory Press, 1995]에 기재되어 있다. 주형의 공급원으로서 RNA를 사용할 경우, 상보성 DNA(cDNA) 가닥을 합성하는 데 역전사 효소가 사용될 수 있다. 리가제 연쇄 반응 방법, 가닥 치환 증폭 방법, 자기 서열 복제 방법, 또는 핵산 서열 기초 증폭 방법을 사용하여 단리된 핵산을 수득할 수 있다. 예를 들면, 문헌 ([Lewis (1992) Genetic Engineering News 12:1]; [Guatelli et al. (1990) Proc . Natl . Acad . Sci . USA 87:1874-1878]; 및 [Weiss (1991) Science 254:1292])을 참조할 수 있다.
단리된 핵산은 또한 (예를 들면, 포스포르아미다이트 기술을 사용하여 3'→5' 방향으로 진행되는 자동화된 DNA 합성을 사용하여) 단일 핵산 분자로서, 또는 일련의 올리고뉴클레오티드로서 화학적으로 합성될 수 있다. 예를 들면, 원하는 서열을 포함하는 하나 이상의 장쇄 올리고뉴클레오티드(예를 들면, >100 뉴클레오티드) 쌍이 합성될 수 있는데, 이들 각각의 쌍은 상보성인 단쇄의 세그먼트(예를 들면, 약 15개의 뉴클레오티드)를 포함함으로써 올리고뉴클레오티드 쌍이 어닐링될 때 이중쇄가 형성된다. DNA 폴리머라제를 사용하여 올리고뉴클레오티드를 확장시킬 수 있고, 이를 통해 올리고뉴클레오티드 쌍 하나당 단일 가닥, 이중 가닥 핵산 분자가 형성이 되며, 이후 이들은 벡터 내로 결찰될 수 있다.
단리된 핵산(예를 들면, 변이체 NP를 코딩하는 핵산) 또한 돌연변이유발법에 의해 수득될 수 있다. 예를 들면, PCR을 통한 부위 지정 돌연변이유발법 및 올리고뉴클레오티드 지정 돌연변이유발법을 비롯한, 표준 기법을 사용하여 기준 서열을 돌연변이화시킬 수 있다. 문헌 [Short Protocols in Molecular Biology, Chapter 8, Green Publishing Associates and John Wiley & Sons, edited by Ausubel et al., 1992]를 참조할 수 있다. 변이체 NP의 비제한적인 일례를 본원에서 제공한다.
본 명세서는 또한 ANP, BNP, CNP, DNP 이외의 NP를 코딩하는 예시적인 핵산 분자, 또는 그의 키메라 또는 변이체를 기술한다. 그로부터 유래되어, NP를 코딩하는 핵산 분자, 또는 그의 핵산 보체가 수득될 수 있는 것인 뉴클레오티드 서열의 공급원으로는 당업계에 공지된 방법에 의해 그로부터 cDNA가 유래될 수 있는 것인 파충류(예를 들면, 뱀) 또는 포유동물(예를 들면, 인간, 쥐, 마우스, 개, 소, 말, 양, 염소, 또는 고양이) 세포 공급원을 비롯한, 임의의 진핵생물 공급원으로부터 유래된 전체 또는 폴리A+ RNA를 포함한다. 본원에서 제공하는 핵산 분자의 기타 다른 공급원으로는 상기 예시한 바와 같은 포유동물 공급원을 비롯한, 임의의 진핵생물 공급원으로부터 유래된 게놈 라이브러리를 포함한다.
천연 NP를 코딩하는 핵산 분자는 예를 들면, 문헌 [Sambrook et al., Molecular Cloning : A Laboratory Manual, Cold Spring Harbor Laboratory Press, NY (1989)]에 기재된 바와 같은 표준 방법을 사용하여 동정될 수 있고 단리될 수 있다. 예를 들면, 역전사 효소 PCR(RT-PCR: reverse-transcriptase PCR)을 사용하여 관심의 대상이 되는 RNA 서열을 포함하는 단리된 RNA(예를 들면, 인간 조직으로부터 단리된 전체 RNA)로부터 NP cDNA를 단리시키고 클로닝할 수 있다. NP cDNA를 동정하고, 단리시키고, 클로닝하는 기타 다른 접근법으로는 예를 들면, cDNA 라이브러리를 스크리닝하는 것을 포함한다.
예로서, 본원에서 기술하는 것과 같은 핵산을 포함하는 벡터 또한 제공한다. "벡터"는 또다른 DNA 세그먼트가 삽입되어 삽입된 세그먼트의 복제가 일어날 수 있는 레플리콘, 예로서, 플라스미드, 파지 또는 코스미드이다. "발현 벡터"는 하나 이상의 발현 제어 서열을 포함하는 벡터이고, "발현 제어 서열"은 또다른 DNA 서열의 전사 및/또는 번역을 제어하고 조절하는 DNA 서열이다.
본원에서 제공하는 발현 벡터에서, 핵산(예를 들면, NP, 예로서, CD-NP를 코딩하는 핵산)은 하나 이상의 발현 제어 서열에 작동 가능하게 연결될 수 있다. 본원에서 사용되는 바, "작동 가능하게 연결된"이라는 것은 발현 제어 서열이 관심의 대상이 되는 코딩 서열의 발현을 효과적으로 제어할 수 있도록 유전자 구성체에 도입된 것을 의미한다. 발현 제어 서열의 예는 프로모터, 인핸서 및 전사 종결 부위를 포함한다. 프로모터는 전형적으로 전사가 개시되는 지점의 상류쪽으로 100 내지 500개의 뉴클레오티드만큼의 거리 이내에(일반적으로 RNA 폴리머라제 II에 대한 개시 부위 근처에), DNA 분자 부위로 구성된 발현 제어 서열이다. 코딩 서열을 프로모터 제어 하에 위치시키기 위해서, 폴리펩티드의 번역 리딩 프레임의 번역 개시 부위를 프로모터 하류쪽으로 1 내지 약 50개의 뉴클레오티드만큼의 거리 사이에 위치시키는 것이 필수적일 수 있다. 인핸서는 시점, 위치 및 수준 등의 관점에서 발현 특이성을 제공한다. 프로모터와 달리, 인핸서는 전사 부위로부터 다양한 간격으로 위치할 때 작용을 할 수 있다. 인핸서는 또한 전사 개시 부위의 하류에 위치할 수 있다. 코딩 서열은 RNA 폴리머라제가 코딩 서열을 mRNA로 전사시키고, 이어서 코딩 서열에 의해 코딩되는 단백질로 번역될 수 있는 경우에 세포내 발현 제어 서열에 "작동 가능하게 연결"되어 그의 "제어하"에 있는 것이다. 따라서, 발현 벡터는 항체 뿐만 아니라, 기타 다른 다가 분자를 생산하는 데 유용할 수 있다.
적합한 발현 벡터는 제한없이, 예를 들면, 박테리오파지, 배큘로바이러스, 담배 모자이크 바이러스, 헤르페스 바이러스, 사이토메갈로바이러스, 레트로바이러스, 백시니아 바이러스, 아데노바이러스 및 아데노 관련 바이러스로부터 유래된 바이러스 벡터 및 플라스미드를 포함한다. 다수의 벡터 및 발현 시스템은 노바겐(Novagen)(위스콘신주 매디슨 소재), 클론테크(Clontech)(캘리포니아주 팔로알토 소재), 스트라타진(Stratagene)(캘리포니아주 라호야 소재) 및 인비트로겐/라이프 테크놀러지스(캘리포니아주 칼즈배드 소재)와 같은 회사로부터 상업적으로 이용가능하다.
발현 벡터는 발현된 핵산 서열의 후속 조작(예를 들어, 정제 또는 위치화) 이 용이하도록 디자인된 태그 서열을 포함할 수 있다. 태그 서열, 예로서, 녹색 형광 단백질(GFP: green fluorescent protein), 글루타티온 S-트랜스퍼라제(GST: glutathione S-transferase), 폴리히스티딘, c-myc, 해마글루티닌 또는 플래그(Flag)™ 태그(코네티컷주 뉴헤이븐 소재의 Kodak) 서열은 전형적으로 코딩된 폴리펩티드와의 융합체로서 발현된다. 이러한 태그는 카복실 또는 아미노 말단을 포함하여 폴리펩티드내 임의 위치에 삽입될 수 있다.
벡터를 포함하는 숙주 세포 또한 제공한다. "숙주 세포"라는 용어는 재조합 발현 벡터가 도입될 수 있는 원핵생물 세포 및 진핵생물 세포를 포함하는 것으로 한다. 본원에서 사용되는 바, "형질전환된" 및 "형질감염된"이란 다수의 기법들 중 하나에 의해 핵산 분자(예를 들면, 벡터)가 세포 내로 도입된 것을 포함한다. 특정 기법으로 제한하는 것은 아니지만, 이들 기법들 중 다수가 당업계에 잘 확립되어 있다. 원핵생물 세포는 예를 들면, 전기천공 또는 염화칼슘 매개 형질전환에 의해 핵산으로 형질전환될 수 있다. 예를 들면, 인산칼슘 공침전법, DEAE-덱스트란 매개 형질감염, 리포펙션, 전기천공 또는 미세주입을 비롯한 기법에 의해 핵산은 포유동물 세포 내로 형질감염될 수 있다. 숙주 세포를 형질전환시키고 형질감염시키는 방법은 문헌 [Sambrook et al., Molecular Cloning: A Laboratory Manual (2nd edition), Cold Spring Harbor Laboratory, New York (1989)]에서 찾아볼 수 있으며, 형질전환 및/또는 형질감염용의 시약은 상업적으로 이용가능하다(예를 들면, 리포펙틴(LIPOFECTIN)®(Invitrogen); 퓨진(FUGENE)®(인디애나주 인디애나폴리스 소재의 Roche); 및 서퍼펙트(SUPERFECT)®(캘리포니아주 발렌시아 소재의 Qiagen)).
조성물
본원에 기술된 본 화합물(예를 들면, 키메라 및 변이체 NP, 예로서, CD- NP), 또는 본원에 기술된 폴리펩티드를 코딩하는 핵산은 피험체(예를 들면, AMI 또는 AHF을 앓고 있거나, AMI 또는 AHF에 걸릴 위험에 있는 피험체)에게 투여하기 위한 조성물로 혼입될 수 있다. 치료학적 조성물을 제조한 후, 이를 투여하는 방법은 당업자에게 주지되어 있다. 투여량은 전형적으로 수일 내지 수개월 동안, 또는 적합한 반응이 나타날 때까지 치료 과정을 지속시키면서, 본 화합물에 대하여 나타나는 피험체의 반응에 따라 달라진다. 당업계의 숙련인은 통상적으로 최적의 투여량, 투여 방법 및 반복률을 결정할 수 있다. 최적의 투여량은 항체의 상대적인 효능에 따라 달라질 수 있고, 일반적으로는 시험관내, 및/또는 생체내 동물 모델에서 유효성을 나타내는 EC50에 기초하여 평가될 수 있다. 본원에서 제공하는 본 화합물(예를 들면, NP) 및 핵산을 포함하는 조성물은 매일, 매주, 매달 1회이상, 또는 그보다는 덜 빈번하게 투여될 수 있거나, 일정 기간(예를 들면, 수시간, 수일, 또는 수주) 동안 연속하여 투여될 수 있다. 본원에서 기술하는 바와 같이, 예를 들면, NP 또는 NP를 포함하는 조성물은 재관류 시점 또는 대략 재관류 시점에 적어도 약 0.01 ng NP/kg(체질량) 내지 약 100 mg NP/kg(체질량)이 투여량으로 투여될 수 있거나, 재관류 시점 또는 대략 재관류 시점으로부터 주입액으로서 연속적으로 투여된 후, 1 내지 7일 동안 (예를 들면, 약 0.01 ng NP/kg/분 내지 약 0.5 ㎍ NP/kg/분의 투여량으로) 지속될 수 있다.
NP 및 핵산은 흡수, 분포, 및/또는 흡착에 도움을 주기 위해 기타 다른 분자, 분자 구조, 또는 화합물의 혼합물, 예로서, 리포좀, 수용체, 또는 세포 표적화된 분자, 또는 경구용, 국소용, 또는 기타 다른 제제와 혼합, 그로 캡슐화, 그에 컨쥬게이트화되거나, 다르게는 회합될 수 있다.
몇몇 실시태양에서, 조성물은 약제학적으로 허용되는 담체와 함께 본원에서 제공하는 NP를 포함할 수 있다. 약제학적으로 허용되는 담체로는 항체를 예를 들면, 약제학적으로 허용되는 용매, 현탁제, 또는 피험체에게 전달하기 위한 임의의 기타 다른 약물학적으로 불활성인 비히클을 포함한다. 약제학적으로 허용되는 담체는 액체 또는 고체일 수 있고, 계획된 투여 방식은 염두해 둔 상태에서, 하나 이상의 치료학적 화합물 및 제공되는 약제학적 조성물의 임의의 기타 다른 성분과 함께 조합되었을 때에 원하는 벌크, 점조도, 및 기타 다른 적절한 수송 및 화학적 특성을 제공할 수 있도록 선택될 수 있다. 전형적인 약제학적으로 허용되는 담체로는 제한없이, 물; 염수액; 결합제(예를 들면, 폴리비닐피롤리돈 또는 하이드록시프로필 메틸셀룰로스); 충진제(예를 들면, 락토스 또는 덱스트로스 및 기타 다른 당, 젤라틴, 또는 황산칼슘); 활택제(예를 들면, 전분, 폴리에틸렌 글리콜, 또는 아세트산 나트륨); 붕해제(예를 들면, 전분 또는 전분 글리콜산나트륨); 및 습윤제(예를 들면, 라우릴 황산나트륨)를 포함한다.
본원에 기술된 분자를 포함하는 약제학적 조성물은 국소 또는 전신 치료를 원하는지에 따라서 다수의 방법으로 투여될 수 있다. 투여는 예를 들면, 비경구(예를 들면, 피하, 경막내, 심실내, 근육내, 또는 복강내 주사에 의해, 또는 정맥내(i.v.) 점적에 의해); 경구; 국소(예를 들면, 경피적, 설하, 눈, 또는 비내); 또는 폐(예를 들면, 분제 또는 에어로졸의 흡입 또는 통기에 의해) 투여일 수 있거나, 상기 방법의 조합으로 이루어질 수 있다. 투여는 (예를 들면, 주사에 의해) 빠르게 진행될 수 있거나, (예를 들면, 지효성 제제를 저속으로 주입하거나 투여함으로써) 일정 기간 동안에 걸쳐 이루어질 수 있다.
비경구, 경막내 또는 심실내 투여용의 조성물 및 제제는 멸균 수용액(예를 들면, 멸균 생리학적 염수)을 포함하는데, 상기 수용액은 또한 완충제, 희석제, 및 기타 다른 적합한 첨가제(예를 들면, 투과 증진제, 담체 화합물 및 기타 다른 약제학적으로 허용되는 담체)를 포함할 수 있다.
경구 투여용의 조성물 및 제제로는 예를 들면, 분제 또는 과립제, 물 또는 비수성 매질 중의 현탁화제 또는 액제, 캡슐제, 사셰, 또는 정제를 포함한다. 상기 조성물은 또한 증점제, 향미제, 희석제, 유화제, 분산 보조제 또는 결합제를 포함할 수 있다.
국소 투여용의 제제는 예를 들면, 멸균 및 비멸균 액제, 통상의 용매, 예로서, 알코올 중의 비수성 액제, 또는 액체 또는 고체 오일성 염기 중의 액제를 포함한다. 상기와 같은 액제는 또한 완충제, 희석제, 및 기타 다른 적합한 첨가제를 포함할 수 있다. 국소 투여용의 약제학적 조성물 및 제제는 경피용 패취, 연고, 로션, 크림, 겔, 점적제, 좌제, 스프레이, 액제, 및 분제를 포함할 수 있다. 통상의 약제학적 담체, 수성, 분말성 또는 오일성 베이스, 증점제 등이 유용할 수 있다.
약제학적 조성물은 약제, 유제, 수성 현탁제, 및 리포좀 함유 제제를 포함하지만, 이에 한정되지 않는다. 이러한 조성물은 예를 들면, 기성형 액제, 자가 유화 고체, 및 자가 유화 반고체를 포함하는 다양한 성분들로부터 생성될 수 있다. 유화 제제는 그의 제법의 용이함과, 가용화, 흡착 및 생체이용성의 유효성에 기인하여 치료학적 조성물의 경구적인 전달에 특히 유용하다. 리포좀은 특히 약물 전달이라는 관점에서 제공되는 그의 특이성 및 작용 지속 기간에 기인하여 특히 유용할 수 있다.
본원에서 제공하는 조성물은 관련 화합물(예를 들면, NP)에 대한 임의의 약제학적으로 허용되는 염, 에스테르, 또는 상기 에스테르의 염, 또는 피험체에게 투여될 때 (직접 또는 간접적으로) 생물학적으로 활성인 대사 산물을 제공할 수 있는 임의의 기타 다른 화합물, 또는 그의 잔기를 포함할 수 있다. 따라서, 예를 들면, 본 명세서는 NP의 약제학적으로 허용되는 염, 프로드럭 및 상기 프로드럭의 약제학적으로 허용되는 염, 및 기타 다른 생체등가물을 기술한다. 프로드럭은 불활성 형태로 제조된 후, 내인성 효소 또는 기타 다른 화학 물질 및/또는 조건의 작용에 의해서 체내에서 또는 그의 세포내에서 활성인 형태(즉, 약물)로 전환되는 치료학적 제제이다. "약제학적으로 허용되는 염"이라는 용어는 본원에서 제공하는 방법에서 유용한, NP의 생리학적 및 약제학적으로 허용되는 염(즉, 원치않는 독성 효과를 부가하지 않으면서 모체 NP의 바람직한 생물학적 활성을 유지하는 염)을 지칭한다. 약제학적으로 허용되는 염의 예로는 양이온(예를 들면, 나트륨, 칼륨, 칼슘, 또는 폴리아민, 예로서, 스퍼민)과의 것으로 형성된 염; 무기산(예를 들면, 염산, 브롬산, 황산, 인산, 또는 질산)과의 것으로 형성된 산 부가염; 유기산(예를 들면, 아세트산, 시트르산, 옥살산, 팔미트산, 또는 푸마르산)과의 것으로 형성된 염; 및 원소 음이온(예를 들면, 브롬, 요오드, 또는 염소)과의 것으로 형성된 염을 포함하나, 이에 한정되지 않는다.
조성물은 추가로 통상적으로 약제학적 조성물 중에서 발견되는 기타 다른 보조 성분을 포함할 수 있다. 따라서, 본 조성물은 또한 화합성이고, 약제학적으로 활성을 띠는 물질, 예로서, 항가려움제, 수렴제, 국소 마취제 또는 소염제, 또는 본 조성물을 다양한 투약 형태로 물리적으로 제조하는 데 유용한 추가 물질, 예로서, 염료, 향미제, 방부제, 항산화제, 유백제, 증점제 및 안정화제를 포함할 수 있다. 추가로, 본 조성물은 보조제, 예를 들면, 활택제, 방부제, 안정화제, 습윤제, 유화제, 삼투압에 영향을 주기 위한 염, 완충제, 착미제, 향미제, 투과 증진제, 및 방향족 물질과 함께 혼합될 수 있다. 그러한, 그러한 물질은 첨가되었을 때에 본 조성물 내에 존재하는 기타 다른 성분들의 생물학적 활성을 과도하게 방해하지 않아야 한다.
편리하게는 단위 투여 형태로 제시될 수 있는, 본원에 개시된 약제학적 제제는 약제학적 산업 분야에 주지되어 있는 통상의 기법에 따라 제조될 수 있다. 그러한 기법은 활성 성분(즉, 항체)을 원하는 약제학적 담체(들)와 회합시키는 단계를 포함한다. 전형적으로는 활성 성분을 액체 담체 또는 미분된 고체 담체 또는 양자 모두와 함께 균일하고 밀접하게 회합시킨 후, 필요하다면, 제품을 성형함으로써 제제를 제조할 수 있다. 바람직하다면, 제제를 멸균 처리할 수 있지만, 단, 그러한 멸균 방법이 본 제제에 포함되어 있는 분자(들)의 유효성을 방해하지 않아야 한다.
심장 리모델링을 감소시키거나 억제하는 방법
본 명세서는 또한 예를 들면, AHF 및 AMI의 치료를 위한, 및 심장 리모델링을 억제하거나 감소시키기 위한 본원에 개시된 화합물(예를 들면, NP)의 용도를 제공한다. 따라서, 본원에서 제공하는 본 화합물 및 핵산 분자는 예를 들면, MI 이후에 발생할 수 있는 심장 리모델링을 감소시키거나 억제하기 위해 포유동물(예를 들면, 인간, 또는 인간을 제외한 포유동물)에게 투여될 수 있다. 몇몇 실시태양에서, 본원에서 사용되는 바, "투여"라는 용어는 심장 리모델링을 감소시키거나 억제하기 위해 포유동물이 사용하게 될 화합물 또는 조성물을 처방하는 것을 포함한다. 몇몇 실시태양에서, 예를 들면, 본원에서 제공하는 NP 또는 조성물은 AMI를 앓는 것으로 진단받은 포유동물에테 투여될 수 있다. 본 조성물 또는 NP는 제한없이, 선택된 제제, 질환, 및 예방하고자 하는지 또는 치료하고자 하는지 여부를 비롯한, 다양한 인자에 따라 임의의 적합한 투여량으로 투여될 수 있다. 투여는 국소 또는 전신 투여일 수 있다.
몇몇 실시태양에서, NP 또는 NP를 포함하는 조성물은, 기타 다른 투여량 또한 유익한 결과를 제공할 수는 있지만, 적어도 약 0.01 ng NP/kg 내지 약 100 mg NP/kg(체질량)(예를 들면, 약 10 ng NP/kg(체질량) 내지 약 50 mg NP/kg(체질량), 약 20 ng NP/kg(체질량) 내지 약 10 mg NP/kg(체질량), 약 0.1 ng NP/kg(체질량) 내지 약 20 ng NP/kg(체질량), 약 3 ng NP/kg(체질량) 내지 약 10 ng NP/kg(체질량), 또는 약 50 ng NP/kg(체질량) 내지 약 100 ㎍/kg(체질량))의 투여량으로 투여될 수 있다. 몇몇 경우에서, NP, 예로서, CD-NP 또는 그의 변이체를 포함하는 조성물은 재관류 시점(즉, 폐쇄된 동맥이 다시 개방되는 시점) 또는 대략 그 시점을 시작으로 지속적 정맥내 주입액으로서 투여된 후, 1 내지 7일(예를 들면, 1, 2, 3, 4, 5, 6 또는 7일) 동안 지속될 수 있다. 상기 조성물은 예를 들면, 약 0.1 ng NP/kg/분 내지 약 500 ng NP/kg/분(예를 들면, 약 0.5 ng NP/kg/분, 약 1 ng NP/kg/분, 약 2 ng NP/kg/분, 약 3 ng NP/kg/분, 약 5 ng NP/kg/분, 약 7.5 ng NP/kg/분, 약 10 ng NP/kg/분, 약 12.5 ng NP/kg/분, 약 15 ng NP/kg/분, 약 20 ng NP/kg/분, 약 25 ng NP/kg/분, 약 30 ng NP/kg/분, 약 50 ng NP/kg/분, 약 100 ng NP/kg/분, 또는 약 300 ng NP/kg/분)의 투여량으로 투여될 수 있다. 몇몇 경우에서, NP를 포함하는 조성물은 재관류 이전에(예를 들면, 재관류하기 약 1시간 전에) 재관류하기 약 1시간 전을 시작으로 하나 이상의 개별 투여량으로서 또는 연속 주입액으로서 투여될 수 있다. 예를 들면, 조성물은 재관류하기 약 1시간, 약 45분, 약 30분, 또는 약 15분 전을 시작으로 투여될 수 있다. 몇몇 경우에서, 본원에서 제공하는 NP를 포함하는 조성물은 재관류 이후(예를 들면, 재관류 후 약 10시간 이내에) 투여될 수 있고, 재관류 후 약 10시간 이내를 시작으로 하나 이상의 개별 투여량으로서 또는 연속 주입액으로서 투여될 수 있다. 예를 들면, 조성물은 재관류 후 약 1시간, 약 2시간, 약 3시간, 약 4시간, 약 5시간, 약 6시간, 약 7시간, 약 8시간, 약 9시간, 또는 약 10시간이 경과하였을 때 투여될 수 있다.
몇몇 실시태양에서, NP 또는 NP를 포함하는 조성물은 제1 기간 동안 제1 경로(예를 들면, 정맥내)를 통해 투여된 후, 제2 기간 동안 또다른 경로(예를 들면, 피하로)를 통해 투여될 수 있다. 예를 들면, NP를 포함하는 조성물은 1 내지 7일(예를 들면, 1, 2, 3, 4, 5, 6 또는 7일) 동안 약 0.1 ng NP/kg/분 내지 약 300 ng NP/kg/분(예를 들면, 약 1 ng NP/kg/분 내지 약 15 ng NP/kg/분, 약 3 ng NP/kg/분 내지 약 10 ng NP/kg/분, 또는 약 10 ng NP/kg/분 내지 약 30 ng NP/kg/분)의 투여량으로 포유동물(예를 들면, 인간)에게 정맥내로 투여된 후, 5 내지 30일(예를 들면, 7, 10, 14, 18, 21, 24, 또는 27일) 동안 약 10 ng NP/kg/일 내지 약 100 ng NP/kg/일 (예를 들면, 약 10 ng NP/kg/일, 약 20 ng NP/kg/일, 약 25 ng NP/kg/일, 약 30 ng NP/kg/일, 약 50 ng NP/kg/일, 또는 약 100 ng NP/kg/일)의 투여량으로 포유동물에게 피하 투여될 수 있다.
본원에서 제공하는 본 방법은 NP(예를 들면, 키메라 또는 변이체 NP), 또는 NP를 코딩하는 핵산을 유효량으로, 또는 상기 분자를 포함하는 조성물을 유효량으로 포유동물에게 투여하는 것을 포함한다. 본원에서 사용되는 바, "유효량(유효한 양)"이라는 용어는 포유동물 수혜자에서 심장 리모델링 및/또는 신장 보호가 적어도 10%(예를 들면, 10%, 15%, 20%, 25%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 99%, 또는 100%) 감소되었음을 나타내는 하나 이상의(예를 들면, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10개) 파라미터를 변경하기에 충분한 분자 또는 조성물의 양이다. 예를 들면, 본원에서 제공하는 NP의 유효량은 박출률, GFR, UNaV, 또는 UV를 10% 이상 증가시킬 수 있고/거나, PRA, LV 질량, CF 증식, PWCP, RAP, MAP, 알도스테론 수치, LV 비대, 심실 섬유증, LV 수축기말 직경, PFRNa, 또는 DFRNa를 10% 이상 감소시킬 수 있고/거나, 심장 부하 경감을 일으킬 수 있는 양이다. 몇몇 실시태양에서, 본 방법은 심장 리모델링 및/또는 신장 보호가 50% 이상 감소되었음을 나타내는 하나 이상의 파라미터를 변경하기에 충분한 양으로 NP 또는 조성물을 포유동물에게 투여하는 것을 포함할 수 있다.
몇몇 실시태양에서, 예를 들면, 본원에서 제공하는 NP의 "유효량"은 NP 투여 이전 또는 NP를 투여받지 않는 포유동물의 파라미터 수치(예를 들면, 이전의 MI 에피소드에서 관찰되는 파라미터 수치)와 비교하여 처리된 포유동물에서 10% 이상 PRA 및 MAP를 감소시키고, GFR 및 UV를 증가시킬 수 있는 양일 수 있다. 그러한 파라미터는 예를 들면, 하기 실시예에 기술하는 방법을 사용하여 측정할 수 있다.
본 발명은 하기 실시예에서 추가로 설명되지만, 하기 실시예가 특허청구범위에서 기술하는 본 발명의 범위를 제한하는 것은 아니다.
[실시예]
실시예
1 - 재료 및 방법
폴리펩티드 합성: DNP 및 CNP의 공지된 서열에 기초하여 2개의 펩티드를 합성하였다. 먼저, DNP의 선형 15-AA C-말단 서열(PSLRDPRPNAPSTSA; 서열 번호 2; 도 1)을 합성하였다. 이 펩티드를 "C-말단"으로 명명하였다. 이어서, CNP(서열 번호 1; 도 1)와 DNP의 C-말단의 키메라(GLSKGCFGLKLDRIGSMSGLGCPSLRDPRPNAPS TSA; 서열 번호 3)를 합성하였다. 37-AA 키메라 펩티드를 "CD-NP"로 명명하였다. N-Fmoc-L-아미노산(캘리포니아주 더블린 소재의 SynPep)이 미리 로딩된 왕 수지(Wang resin) 상에서 ABI 431A 펩티드 합성기(캘리포니아주 포스터 시티 소재의 PE Biosystems)를 통해 메이요 프로테인 코어 시설(Mayo Protein Core Facility)이 고체상 방법을 사용함으로써 2개의 펩티드의 합성이 이루어졌다. 40분 동안 1-메틸-2-피롤리디논(NMP) 중에서 각 아미노산을 수지 유사 펩티드에 커플링시켰다. 30분 동안 NMP 중 HOBT/DCC 용액 중에서 각 Fmoc 아미노산을 활성화하였다. 다음의 활성화된 아미노산을 커플링시키기 전에 20분 동안 NMP 중 20% 피페리딘을 사용하여 Fmoc 보호기를 탈보호하였다. 이어서, 실온에서 2시간 동안 82.5% 트리플루오로아세트산(TFA)/5% 물/5% 티오아니솔/2.5% 에탄디티올/5% 페놀 혼합물로 처리하여 펩티드를 탈보호화하고 수지로부터 제거하였다. 3 x 50 ml의 냉 메틸 t-부틸 에테르 중에 침전시켜 각각의 펩티드를 세척시키고, 50분 동안 10-70% B 구배로 0.1% TFA/물 중 주피터(Jupiter) C18 칼럼(캘리포니아주 토런스 소재의 Phenomenex) 상에서 역상 HPLC에 의해 정제하였다.
퍼킨/엘머 사이억스 API 165(Perkin/Elmer Sciex API 165) 질량 분석계(캘리포니아주 포스터 시티 소재의 PE Biosystems) 상에서 전자분무 이온화(ESI: electrospray ionization) 질량 분석에 의해 각 펩티드의 실체를 확인하였다. 50 mM 중탄산암모늄(pH 8.5) 완충액 중 밤새도록 대기 산화시켜 CD-NP 중 디설피드 브릿지를 형성시켰다.
정상적인 개에서의 C-말단 및 CD - NP 의 통합된 생체내 생물학적 작용: 마취된 정상적인 개들로 구성된 별개의 5개 군에서 실험을 실시하였다. 모든 연구는 미국 생리 학회(American Physiological Society)의 가이드라인에 따라 진행되었고, 메이요 임상 실험 동물 운영 위원회(Mayo Clinic Animal Care and Use Committee)로부터 승인을 받은 것이었다.
분절성 신세뇨관의 작용을 평가하기 위해 실험 전날 저녁에 300 mg의 탄산리튬을 경구 투여하고, 동물을 밤새도록 금식시켰다. 급성 실험 당일, 펜토바비탈 나트륨을 정맥내로 투여하여(30 mg/kg) 개 모두를 마취시켰다. 4 L/분으로 산소를 보충하여 개를 기계적으로 정화시켰다(하버드 호흡기((Harvard respirator)(매사추세츠주 밀리스 소재의 Harvard Apparatus)). 좌측 측면 옆구리를 절개하여 좌측 신장을 노출시켰다. 지정 시간에 뇨 수집을 하기 위해서 요관에 캐뉼러를 꽂고, 눈금이 있는 전자기 유량 프로브를 좌측 신장 동맥 주변에 배치시키고, 신장 혈류량(RBF: renal blood flow)을 모니터링하기 위해 유량계(모델 FM 5010(노스캐롤라이나 소재의 King)에 연결하였다. 마지막으로, 2개의 폴리에틸렌 카테터(PE-240)(하나는 이눌린 주입용이고, 다른 하나는 C-말단 주입용)를 사용하여 우측 대퇴 정맥에 캐뉼러를 꽂았다. 직접 동맥혈압을 측정하고 동맥혈을 샘플링하기 위해 우측 대퇴 동맥에 캐뉼러를 꽂았다. CD-NP 또는 BNP를 투여받은 군에서의 심장 충만압을 측정하기 위해, 및 심장 박출량을 측정하기 위해, 스완-간즈(Swan-Ganz) 카테터(캘리포니아주 마운틴 뷰 소재의 Edwards)를 우측 내경 정맥 내로 삽입하였다.
수술 준비를 마친 후, 초회량의 이눌린(오하이오주 클리블랜드 소재의 ICN Biomedicals)을 주사한 후, 1 ml/분으로 계속하여 주입하였다. 개입하지 않고 60분 동안 개에서 평형이 이루어지도록 하였다. 평형 기간 후, 30분간의 기준선에서의 제거(기준선)를 실시하였다. 이어서, 15분간의 도입기가 이어졌는데, 상기 기간 동안 제1군(n=6)에서 42 ng/kg/분으로 C-말단을 정맥내로 주입하는 것을 시작하였고, 이 기간 이후 제2의 30분간의 제거(C-말단) 기간을 실시하였다. CD-NP군에 대한 대조군으로부터 작용할 수 있도록 1 ml/분으로 정맥내 염수를 사용하여 시간 대조군(n=6)을 실시하였다. 각각의 제거 기간 동안 신장 혈류역학적 성질 및 배설 반응을 기록하였다. 제3군에서는 CD-NP를 3개의 농도(10, 50 및 100 ng/kg/분)로 30분 동안 주입한 후, 각 투여량에 대하여 15분간의 도입기가 진행되었다. 4군(n=6) 및 5군(n=6)은 각각 10 및 50 ng/kg/분으로 같은 몰 농도의 CD-NP 또는 BNP를 투여받았다.
혈장 및 뇨 전해질(리튬 포함)을 불꽃 방출 분광광도계(IL943, 불꽃 광도계(매사추세츠주 렉싱턴 소재의 Instrumentation Laboratory))에 의해 측정하였다. 혈장 및 뇨 이눌린 농도는 안트론 방법에 의해 측정하고, GFR은 이눌린 제거에 의해 측정하였다. 리튬 제거 기법을 사용하여 PFRNa 및 DFRNa를 추정하였다. PFRNa는 하기 식을 통해 계산하였다: [1-(리튬 제거량/GFR)] x 100. DFRNa는 하기 식을 통해 계산하였다: [(리튬 제거-나트륨 제거)/리튬 제거] x 100. 혈장 및 뇨 cGMP 및 혈장 레닌 활성(PRA)은 앞서 기술된 바와 같이 상업적으로 이용가능한 방사선 면역 측정법을 사용하여 측정하였다.
인간 심장 섬유아세포에서 CD - NP cGMP 생성 및 세포 증식 억제에 대한 시험 관내 연구: 앞서 기술된 방법(문헌 [Tsuruda et al. (2002) Circ Res 91:1127-1134))에 따라 인간 CF(캘리포니아주 샌디에고 소재의 ScienCell)에서 연구를 수행하였다. 실험에는 오직 세포 계대접종 1부터 4까지의 것과 사용하였다. 세포를 15분 동안 CD-NP(10-11 내지 10-6 M)에 노출시켜 cGMP 활성화를 측정하였다. 경쟁적 RIA cGMP 키트(매사추세츠주 보스톤 소재의 Perkin-Elmer)를 사용하여 샘플을 분석하였다. 간략하면, 샘플 및 표준물을 항인간 cGMP 다클론 항체 및 I125-항원과 함께 18시간 동안 인큐베이션하였다. 사이클릭 GMP 분석용 완충액을 샘플에 첨가하고, 2500 rpm에서 20분 동안 원심분리하였다. 유리 분획은 흡입하여 제거하고, 결합된 분획은 카운팅하고, 그 농도를 측정하였다. 값은 pmol/ml로 표시하였다. ANP, BNP, CNP, 또는 ET와의 교차 반응성은 없었고, cAMP, GMP, GDP, ATP, GTP와는 <0.001%의 교차 반응성을 나타내었다.
CF 증식 연구를 위해 1-4차 계대 세포에서 70-80% 포화된 세포를 24시간 동안 10-8 M 카디오트로핀-1로 처리하여 세포 증식을 유도하였다. 카디오트로핀-1로 자극을 받은 CF에 10-8 M 농도의 CD-NP를 첨가하여 그의 세포 증식에 대한 효과를 측정하였다. 비처리 섬유아세포는 대조군으로부터 프로세싱하였다. 지시된 대로 비색계 브로모데옥시유리딘(BrdU) 세포 증식 ELISA(인디애나주 인디애나폴리스 소재의 Roche)를 실시하였다. 간략하면, CO2 37℃ 인큐베이터에서 2시간 동안 CF를 BrdU로 표지하였다. 항BrdU를 첨가하고 실온에서 30분 동안 반응이 이루어지도록 하였다. 항BrdU를 제거하고, 세척액을 사용하여 CF를 3회에 걸쳐 세척하였다. 비색계 기질 용액을 첨가하고, 30분 동안 색상이 발생될 수 있도록 하였다. 스펙트라 맥스(SpectraMax) 분광광도계(캘리포니아주 서니베일 소재의 Molecular Devices) 상에서 370 nm에서의 흡광도를 측정하였다.
통계학적 분석: 정량 연구 결과는 평균 ± 표준 오차로 표시하였다. 2개의 제거를 비교할 때에는 스튜던츠 t 검정법(Student's t test)을 사용하여 한 그룹 내의 통계학적 비교를 실시하고, 다중의 제거를 비교할 때에는 반복 측정 ANOVA에 이어 사후 던네트 검정법(post hoc Dunnett's test)을 사용하였다. 군들 간의 통계학적 비교를 실시할 때에는 2원 ANOVA에 이어 본페로니(Bonferroni) 사후 검정법을 사용하였다. 통계학적 유의성으로 P값 < 0.05를 수용하였다.
실시예
2 -
DNP
의 C-말단 및
CD
-
NP
의
생체내
작용
DNP의 코어 환 구조가 없는 DNP의 C-말단은 나트륨이뇨성 및 이뇨성을 띠었다(도 2). 근위 분획성 나트륨 재흡수(PFRNa)의 감소가 관찰되었는 바, 나트륨이뇨성 작용은 신장 네프론의 근위 분절로 국소화되었고, 이는 네프론의 상기 부분이 상기 소형 펩티드의 신장 작용에 기여한다는 것을 시사한다(표 2). 사구체 여과율(GFR), 신장 혈류량(RBF) 또는 뇨 cGMP 배설량에는 뚜렷한 변화가 없었다. C-말단기에서와 같이 1 ml/분으로 염수 또한 투여받은 시간 대조군에서는 신장 작용의 파라미터에서도 변화가 일어나지 않았다는 점이 중요하다.
도 3은 CD-NP 주입에 대한 생체내 반응을 보고한다. 3개의 투여량으로 시험된 CD-NP 모두 폐 모세혈관 쐐기압(PCWP)을 감소시킨 반면, 2개의 투여량이 우심방압(RAP)을 감소시켰다. 이러한 심장 부하 경감 반응은 심지어 고투여량의 CD-NP를 주입하는 동안에도 평균 동맥압(MAP)을 최소한으로 감소시키는 것과도 연관이 있었다. CD-NP를 사용하였을 때의 유효한 나트륨이뇨성 및 이뇨성 반응은 또한 정상적인 개에서도 관찰되었다(도 4). 특히, 중간 정도의 투여량과 고투여량의 CD-NP, 둘 모두가 뇨 나트륨 배설량(UNaV) 및 뇨량(UV)를 증가시켰다(도 4). 고투여량의 CD-NP를 주입하는 동안 MAP가 미세하게 감소하기는 하였지만, GFR은 증가하였다.
중간 정도의 투여량으로 CD-NP를 주입하는 동안에는 PFRNa가 감소하기 때문에 나트륨 배설 증가 및 이뇨는 근위 세뇨관의 나트륨 재흡수의 감소를 포함하였다. 또한, 중간 정도의 투여량과 고투여량으로 CD-NP를 주입하는 동안 원위 분획성 나트륨 재흡수(DFRNa)의 감소가 관찰되었는 바, 이는 CD-NP가 또한 말단 네프론에서의 활성에도 관여한다는 것을 시사한다(도 5). 이러한 신장 파라미터는 CD-NP 주입을 중단한 후에는 기준선 수치로 돌아왔다. 이러한 작용은 또한 저투여량 및 중간 정도의 투여량으로 CD-NP를 주입하는 동안 혈장 레닌 활성(PRA)이 억제되는 것과도 연관이 있었다(표 3). PRA는 주입을 중단한 후 기준선 수치로 돌아왔다. 중간 정도의 투여량과 고투여량의 CD-NP는 혈장 및 뇨 cGMP(표 3)을 증가시켰다.
CD-NP는 50 ng/kg/분에서 GFR을 유의적으로 증가시킨 것과는 대조적으로, 동몰량의 투여량으로 BNP를 투여받은 군에서는 GFR의 증가가 충분히 일어나지는 않았다(도 6). 중요하게도, 상기 투여량의 CD-NP가 BNP보다는 더 작은 저혈압성 작용과 연관이 있었다.
실시예
3 -
CD
-
NP
는 심장 섬유아세포에서의
cGMP
생성 및 증식 억제를 매개함
배양된 인간 CF에서 수행된 시험관내 연구를 통해 CD-NP가 투여량에 의존하는 방식으로 cGMP를 활성화하였다는 것을 입증하였다(도 7A). 추가로, CNP, BNP 및 DNP와 비교할 때, 10-6 M의 CD-NP를 통해 생성이 된 cGMP는 CNP를 통해 생성된 것과는 유사하였고, DNP 및 BNP를 통해 생성된 것보다는 유의적으로 더 컸다(p<0.05). CD-NP가 항증식성 작용을 갖고 있는지 여부를 측정하기 위해 전섬유증성 및 비대성 사이토카인인 카디오트로핀-1을 사용하여 실험을 수행하였다. 상기 사이토카인은 CF에 대해 현저히 강력하게 작용하는 활성제이고, 예로서, AMI 및 심부전증과 같은 상태에서 활성화된다(문헌 ([Jougasaki et al. (2000) Circulation 101:14-17]; [Talwar et al. (2002) Clin Sci (Lond) 102 :9-14]; 및 [suruda et al. (2002) Circ Res 90: 128-134]). DNA 합성 및 세포 증식의 척도로서 BrdU 흡수량을 평가한 바, CD-NP는 인간 CF에서 카디오트로핀-1에 의해 유도된 세포 증식을 억제하였다(도 7B).
실시예
4 -
래트에서
MI
이후
CD
-
NP
가
LV
질량에 미치는 효과를 평가하는
생체내
연구
위스타 래트(150-250 g)의 좌전 하방 관상 동맥을 결찰시켜 심근경색(MI)을 유발시키고, 삼투압 미니 펌프(Alzet Osmotic 펌프 모델 2ML2)를 각 래트의 등쪽 피하 공간에 삽입하였다. 2주 동안 1.7 x 10-7 g/kg/분의 투여량으로 CD-NP를 피하 투여하였다. 급성 실험 이전, 및 MI 이후 3주가 경과하였을 때 심장초음파에 의해 LV 질량을 평가하였다. 대조군 MI-비처리군과의 비교 결과, CD-NP로 처리하였을 때에는 MI 이후 3주 경과시 LV 질량이 감소하였다(도 8). 특히, MI 군에서 LV 질량은 1.351 ± 0.03764(N=10)인 반면, MI + CD-NP 군에서의 LV 질량은 1.150 ± 0.03651(N=6; p=0.0031)이었다.
실시예
5 -
CD
-
NP
및
CNP
-C의
생체내
작용
미국 국립 보건원의 실험 동물의 관리 및 사용 지침(National Institutes of Health Guide for the Care and Use of Laboratory Animals)에 따라 수컷 잡종개(n=25)에서 동물 연구를 수행하였다. 실험 전날 저녁, 각각의 개를 금식시키고 임의로 물은 이용할 수 있게 하고, 그 다음날 신세뇨관의 작용을 평가하기 위해 300 mg의 탄산리튬을 경구 투여하였다. 펜토바비탈 나트륨(유도시 6-20 mg/kg i.v., 유지시 5-15 mg/kg/h i.v.) 및 펜타닐(0.04-0.12 mg/kg i.v., 유지시 0.04-0.18 mg/kg/h)을 사용하여 개를 마취시키고, 관을 삽입하고, 5 L/분으로 O2(일호흡량 15 mL/kg, 12 사이클/분)를 사용하여 개를 기계적으로 정화시켰다(매사추세츠주 홀리스톤 소재의 Harvard Apparatus). 혈압을 모니터링하고 혈액을 샘플링하기 위해 대퇴 동맥에 캐뉼러를 꽂고, 이눌린 및 일반 생리식염수 주입을 위해 대퇴 정맥에 캐뉼러를 꽂았다. 펩티드 주입을 위해 복재 정맥에 캐뉼러를 꽂았다. 측면 옆구리를 절개하여 좌측 신장을 노출시키고, 지정 시간에 뇨 수집을 하기 위해서 요관에 캐뉼러를 꽂고, 혈류역학적 성질을 모니터링하기 위해 풍선이 끝에 달려있는 열희석용 카테터(캘리포니아주 얼바인 소재의 Edwards Lifesciences)를 사용하였다. 신장 혈류량을 측정하기 위해 전자기 유량 프로브를 신장 동맥에 배치시켰다(문헌 [Burnett et al. (1984) Am J Physiol 247:F863-866]). 이눌린 제거에 의해 GFR을 측정하기 위하여 이눌린을 중량이 조절된 볼루스 형태로 투여한 후, 주입하여(1 ml/분) 혈장 수치가 40 내지 60 mg/dL에 도달하도록 하였다(문헌 ([Burnett et al. (1984) 상기 동일 문헌]; [Chen et al. (2005) Am J Physiol Regul Integr Comp Physiol 288:R1093-1097]; 및 [Margulies et al. (1991) J Clin Invest 88:1636-1642])).
60분간의 평형 기간 후, 30분간의 주입 이전 제거가 이루어지도록 하였다. 이어서, 75분 동안 연속하여 CD-NP(50 ng/kg/분)를 주입(i.v.(n=10))하거나, 또는 동몰량 농도의 CNP(n=9)를 주입하였다. 연속 주입 기간은 15분간의 도입기와 230분간의 제거에 이어서, 30분간의 세척 및 주입 이후 제거로 구성되었다. 3마리의 추가의 개에서는 75분 동안의 연속 i.v. 주입을 위해 디코이 단백질인 CNP-C(50 ng/kg/분)을 시험하였다. 3가지의 30분간의 제거(주입 이전, 주입 30분째, 및 주입 60분째)에 대하여 데이타를 기록하였다.
방사선 면역 측정법(RIA: radioimmunoassay; 문헌 [Steiner et al. (1972) J Biol Chem 247: 1106-1113])에 의해 혈장 및 뇨 cGMP 수치를 측정하였다. 혈장 레닌 활성(문헌 [Haber et al. (1969) J Clin Endocrinol Metab 29: 1349-1355]), 안지오텐신 II(문헌 [Luchner et al. (1996) Hypertension 28:472-477]), 및 알도스테론(문헌 [Sancho and Haber (1978) J Clin Endocrinol Metab 47:391-396])을 정량하였다. 세뇨관의 나트륨 처치에 대해 평가하기 위해 불꽃 방출 분광광도계(모델 357, 매사추세츠주 윌밍턴 소재의 Instrumentation Laboratory)에 의해 혈장 및 뇨 리튬 수치를 측정하였다(문헌 [Steiner et al., 상기 동일 문헌]).
단리된 사구체염에서의 cGMP 활성화를 평가하기 위해서 펜토바비탈 나트륨을 사용하여 개(n=3)를 안락사시키고, 앞서 기술된 바와 같은(문헌 [Supaporn et al. (1996) Kidney Int 50:1718-1725])(상기 문헌에 기술된 방법은 문헌 [Chaumet-Riffaud et al. ((1981) Am J Physiol 241:F517-524]의 방법을 토대로 한 것이다) 방법을 최소한도로 변형시킨 방법을 사용하여 즉시 신장을 수거하고, 사구체염을 단리시켰다. 연구용 펩티드에 대한 cGMP 반응을 정량하기 위해, 분취량의 사구체염(300 ㎕, 크레프스(Krebs) 완충액) 중에 현탁)을 최종 부피 500 ㎕로 이소부틸메틸 크산틴(0.3 mM)의 존재하에 (처음 10분간의 사전 인큐베이션 기간 이후에) 37℃에서 10분 동안 CD-NP 또는 CNP(최종 농도 10-5 M)와 함께 인큐베이션하였다. 대조군은 같은 조성물로 구성되었는데, 단, 예외적으로 크레프스 완충액 중에 현탁된 사구체염 대신 크레프스 완충액을 사용하였다. 300 ㎕의 빙냉 트리클로로아세트산(TCA, 최종 농도 6.6%)을 첨가하여 반응을 종결시키고, 인큐베이트를 원심분리시켰다. cGMP 분석을 위해 에테르를 사용하여 800 ㎕의 상등액 분취물을 추출하고(문헌 ([Steiner et al., 상기 동일 문헌]; 및 [Supaporn et al., 상기 동일 문헌])), 및 남은 상등액은 1 N NaOH로 중화시키고, 단백질 분석법(BCA 단백질 분석법(일리노이주 록퍼드 소재의 Pierce Biotechnology))으로 분석을 하였다). NPR-A 길항제인 A71915 10(최종 농도 1 μM)으로 전처리된 단리된 사구체염을 사용하여 상기 방법을 반복하였다. 결과를 단백질 수치에 대해서 보정하고, 이를 fmol/㎍로 표시하였다.
CD-NP(스위스 라우펠피넌(Laufelfingen) 소재의 Clinalfa) 및 CNP(Phoenix Pharmaceuticals, Inc.)(미국 캘리포니아주 벨모트 소재)(도 1)를 일반 생리식염수 중에 재구성하였다. 75분간 연속 주입함에 따라 동몰량의 투여량으로 투여된 CNP(29.3 ng/kg/분)에 대하여 정맥내로 투여된 CD-NP(50.0 ng/kg/분; 또는 13.35 pmol/kg/분)를 시험하였다. 디코인 단백질인 CNP-C는 주문 맞춤형으로 합성하였다(도 1).
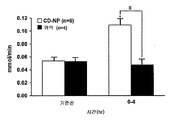
신장 그 자체에 의해 이루어진 2차 메신저 cGMP에 대한 신장의 순 생성 뿐만 아니라, 혈장 및 뇨 배설(상기 둘은 CNP에 대하여 뚜렷히 다르게 나타난 반응이었다)에서의 보다 큰 증가를 통해 밝혀진 바와 같이, CD-NP에 의한 나트륨이뇨성 펩티드 2차 메신저 cGMP의 뚜렷한 활성화가 상기 생체내 연구를 통해 입증되었다. CNP가 아닌 CD-NP를 사용하였을 때에 근위 및 원위 분획성 나트륨 재흡수 감소로 입증되는 바와 같이, 근위 및 원위 세뇨관, 둘 모두로 국소화되는 보다 큰 나트륨 배설 증가(표 4)와, GFR 증가가 관찰되었다(도 9b). 어느 군에서도 평균 동맥압에서의 유의적인 변화는 검출되지 않았다(표 5). CNP가 아닌 CD-NP에 의해서 우심방압 및 폐 모세혈관 쐐기압이 감소하였다(표 5). CD-NP는 PRA 및 안지오텐신 II(ANG II) 수치를 유의적으로 억제한 반면, CNP 군에서의 변화는 통계학적 유의성에 도달하지는 못하였다(표 6). 따라서, DNP의 C-말단을 성숙한 CNP에 융합시켰을 때 CNP는 동맥압을 감소시키지 않으면서 레닌-안지오텐신(RAN: renin-angiotensin system)을 억제하는 신장 작용성의 심장 부하 경감 펩티드로 형질전환되었다.
DNP의 C-말단이 생체 신장 및 RAS 조절 작용을 위한 엄격한 요건이 되는지 여부를 측정하기 위하여, CNP의 N-말단의 아미노산 서열을 CNP의 비어있는 C-말단 위치 내로 융합시키는 것을 포함하도록 형질전환된 CNP를 디자인하였다. CNP-C로 지칭되는 상기 폴리펩티드는 전장의 22-아미노산 CNP와, CNP C-말단에 융합된 N-말단의 5개의 아미노산으로 이루어진 복제물로 구성되었다(GLSKGCFGLKLDRIGSMSGLGCGKSLG; 서열 번호 4). 상기 폴리펩티드를 주입하였을 때에는 혈장 cGMP, 뇨 cGMP 배설, 이뇨, 나트륨 배설 증가, GFR, PRA, 또는 ANG II에서 어떠한 유의적인 변화도 일어나지 않았다. 폐 모세혈관 쐐기압(4.3 ± 0.8→3.4 ± 0.8 mmHg) 및 평균 동맥압(132 ± 6→128 ± 5 mmHg)이 주입 60분째에 기준선과 비교할 때 최소한으로 감소하였다(P<0.05). 따라서, CNP-C가 신장 작용을 증강시키지 못했고, 또한 RAS를 억제하지 못했기 때문에, DNP의 C-말단은 CNP를 신장 작용성 및 RAS 조절성 펩티드로 형질전환시키는 데 특이성을 띤다. 이러한 데이타는 CNP와 비-CNP 펩티드 서열과의 융합을 포함할 수 있는 추후의 가능한 CNP 형질전환에 대한 통찰력을 부여하다.
NPR-B 수용체가 신장에 존재하기는 하지만, 이는 사구체 여과율 또는 나트륨 배설을 매개하는 작용과는 연관이 없다. 오히려, 나트륨이뇨성 펩티드과 연관이 있는 상기와 같은 신장 작용은 NPR-A 수용체와 관련이 있다. 개로부터 사구체염을 단리시키고, CNP에 융합된 DNP의 N-말단은 사구체염에서 cGMP를 유일하게 활성화할 수 있으며, 이는 NPR-A 길항제와의 약물학적 길항작용에 의해서 소거될 수 있다는 사실을 고려하면서, CD-NP의 신장 작용이, ANP, BNP, 및 DNP에 대한 수용체인 NPR-A에 관여하는지 여부를 측정하였다. 단리된 개의 사구체염에서 CD-NP(10-5 M)는 대조군 위약보다 더욱 큰 정도로 cGMP를 활성화하였다. 동몰량의 농도(10-5 M)에서 CD-NP는 CNP보다 더욱 큰 정도로 cGMP를 활성화하였다(도 10e). NPR-A 길항제(1 μM)로 전처리한 경우(문헌 [Sancho and Haber, 상기 동일 문헌])(1 μM) cGMP 반응은 약화되었는데, 이는 신장에서 CD-NP가 또한 NPR-A 활성화에도 관여한다는 것을 입증한다.
실시예
6 - 인간 임상 시험 결과
CD-NP의 안전성을 확인하는 독성 연구를 개와 설치동물에서 실시한 후, 정상적인 인간 지원자에서의 제1 인간 임상 시험에 착수하였다.
연구 프로토콜: 헬싱키 선언(Declaration of Helsinki)과 그 수정안, 미국 식약청 의약품 임상 시험 관리 기준(U.S. Food and Drug Administration Principles of Good Clinical Practice) 및 해당되는 국제 임상 시험 관리 기준(International Conference on Harmonization guideline)에 따라 CD-NP에 대한 인간 임상 시험을 수행하였다. 임상 시험은 2단계로 구성된다: 개방형의 순차적인 용량의 단계적 확대 연구(1단계) 및 무작위 이중 맹검, 위약(PLB)-대조군 연구(2단계). 1단계를 위해, 각각 4명의 피험체로 구성된 3개의 코호트가 용량의 단계적 확대 연구(4시간 동안 10, 17.5, 또는 25 ng/kg/분 i.v.)에 등록하였다. 2단계를 위해, 4시간 동안 CD-NP vs. 위약, PLB i.v.의 최대 내성 용량(MTD: maximum tolerated dose, 단계 1에서 측정되는 바와 같음)을 평가하는 이중 맹검 연구에서 10명의 피험체를 무작위로 임의 추출하였다(CD-NP vs. PLB에 대해 6:4)
주요 포함 기준으로는 하기를 포함하였다: 1) 건강한 남성, 폐경후 여성, 또는 불임 수술을 받은 18세 내지 60세의 여성; 2) 18 내지 34 kg/㎡ 범위의 BMI; 3) 의사소통을 무리없이 잘할 수 있는 능력; 4) 유의적인 질환 또는 비정상적인 실험실의 부재; 5) 정상적인 12 유도 심전도; 6) 지난 6개월간 담배를 핀 이력이 없는 것으로 정의되는 비흡연자; 및 7) 연구에 성질과 위험성에 대한 적절한 공지 및 연구용 약물 처치 이전의 사전 동의서 제출.
주요 제외 기준으로는 하기를 포함하였다: 1) CD-NP 또는 그의 성분들, 네시리티드, 기타 다른 나트륨이뇨성 펩티드, 또는 관련 화합물에 대해 과민성이거나 알레르기 반응이 있는 것으로 알려져 있는 경우; 2) 임신 중이거나 모유 수유 중에 있는 여성; 3) 연구원 의견에 따르면 혈액계, 심혈관계, 허파계, 신장계, 위장계, 간계, 또는 중추 신경계를 위협할 수 있다고 판단되어지는 임의의 질환 또는 (의학적 또는 외과적) 병태; 또는 연구용 약물의 흡수, 분배, 대사, 배설을 방해할 수 있거나, 피험체를 증가된 위험 상태에 놓이게 할 수 있는 기타 다른 병태가 있는 경우; 4) 임상적으로 유의적인 것으로 간주되어지는 비정상적인 실험실상의 값이 존재하는 경우; 5) B형 간염에 대한 양성 스크린(HbsAg, B형 간염 표면 항원), C형 간염에 대한 양성 스크린(항 HCV, C형 간염 항체), 또는 HIV에 대한 양성 스크린(항HVI 1/2)이 있는 경우; 6) 본 연구에 등록하기 전 30일 이내에 연구용 약물을 투여받은 적인 있는 경우; 6) 연구와 관련된 임의의 치료법을 구성하는 제1 투여량을 투여 받기 1주전, 또는 5 반감기 이내에 임의의 약물 요법을 받은 적인 있는 경우(간 약물 대사를 유도하거나 억제하는 것으로 알려져 있는 임의의 약물에 대해서는 상기 제외 기준을 4주로 확장시켰다. 연구와 관련된 임의의 치료법을 구성하는 제1 투여량을 투여 받기 적어도 5 반감기 동안에는 비스테로이드성 소염제 약물, 설폰아미드, 프로베네시드 또는 신장 또는 세뇨관 기능을 변경하는 것으로 알려져 있는 기타 다른 약물을 사용하는 것은 특별히 금지시켰다); 7) 투여량을 투여받기 48시간 이내에 또는 환자 상태로 있는 임의의 기간 동안 알코올을 섭취한 경우; 8) 에탄올, 코카인, 테트라하이드로칸나비놀(THC), 바비튜레이트, 암페타민, 벤조디아제핀, 및 아편류를 비롯한, 양성 뇨 약물 스크린이 있는 경우; 9) 알코올 남용, 불법 약물 사용, 중증의 정신 질환, 아편유사제에 대한 신체적인 의존을 하는 이력이 (과거 2년 이내에) 있는 경우, 또는 약물 남용 또는 중독에 대한 임의의 이력이 있는 경우; 10) 헌혈에 어려움이 있는 이력이 있는 경우; 및 11) 등록하기 45일 이내에 수혈 또는 혈액 제제를 받은 경우.
데이타 분석: 신장, 신경호르몬, 및 혈류역학적 성질 데이타를 평균 ± SEM으로 나타내었다. 펩티드 주입 개시 후 16-45분 및 46-75분으로부터의 제거는 각각 "30분" 및 "60"분으로 나타내었다. 각 군내에서 반복 측정 1원 분산분석(ANOVA: analysis of variance) 이후, 해당된다면, 사후 던네트 다중 비교 검정법(post-hoc Dunnett's multiple comparison test)에 의해(문헌 ([Chen et al, 상기 동일 문헌]; 및 [Cataliotti et al. (2004) Circulation 109:1680-1685]) 펩티드 주입 30분 및 60분째, 및 주입 이후의 파라미터를 주입 이전의 값과 비교하였다. 2원 ANOVA에 이어 본페로니 사후 검정법(문헌 ([Chen et al., 상기 동일 문헌]; 및 [Cataliotti et al., 상기 동일 문헌])에 의해 군들 간의 비교를 수행하였다. 통계학적 유의성은 P<0.05로 정의되었다. 개에서 얻은 데이타에 대한 통계학적 분석을 위해 그래프패드 프리즘 4(GraphPad Prism 4)(캘리포니아주 샌디에고 소재의 GraphPad Software)를 사용하였다. 통계학적 분석 소프트웨어(버전 9)를 사용하여 제1 인간 임상 시험에 대한 통계학적 분석을 수행하였다. 임상 시험을 구성하는 무작위 이중 맹검 단계에서 CD-NP 군 및 위약(PLB) 군에 대한 신장, 혈류역학 성질, 및 신경호르몬 데이타를 분석하였다. 표 7에 제시된 바와 같이, 파라미터 및 비파라미터 시험을 사용하여 군 내에서의 비교(주입 종결시 vs. 기준선 비교), 및 군들 간의 비교(기준선에서의 비교 및 주입 종결시에서의 비교), 이 둘 모두를 실시하였다.
결과: 최대 내성 용량을 측정한 후, CD-NP(17.5 ng/kg/분)를 4시간 동안 투여하고, 위약과 비교하였다. CD-NP는 혈장 cGMP, 뇨 cGMP 배설, 및 뇨 나트륨 배설 을 증가시켰다(도 10a-10c 및 표 7). 뇨량은 CD-NP 군 대 기준선에서 증가하였다(1.1 ± 0.2 → 2.3 ± 0.4 mL/분; PLB 1.3 ± 0.2 → 1.6 ± 0.4 mL/분). 평균 동맥압(도 10d) 및 GFR은 군들 간에 차이를 나타내지 않았다. CD-NP는 21.9 ± 2.7 → 9.5 ± 3.2 ng/dL(P<0.001)로 혈장 알도스테론을 억제하였다.
이러한 데이트는 정맥 확장제 CNP가 혈압에는 최소한의 영향을 미치는, 신장 증진용, RAS 억제용 및 심장 부하 경감용의 펩티드로 형질전환될 수 있음을 입증하는 것으로서, 이를 통해 정맥 확장제 CNP는 AHF에서 유용한 것으로 입증될 수 있는 것으로서, 관심의 대상이 되는 신세대 치료제가 될 수 있다. (1) DNP의 C-말단 이외의(즉, CNP의 N-말단) 아미노산 서열의 융합에는 효과가 없기 때문에 C-말단 아미노산 서열을 CNP의 비어 있는 C-말단에 첨가하는 것이 확실하게 특이적일 것이며; (2) 폴리펩티드는 신장에서 NPR-A를 활성화한 바, DNP의 C-말단을 첨가하면 CNP가 효능이 더욱 큰 NPR-B의 활성 인자로 형질전환된다는 두가지 원리가 이들 연구에서 입증되었다. 추가로, 이러한 데이타는 동물 및 생체내 연구 결과를 제1 인간 연구로 확장시키며, 이를 통해 내인성 천연 펩티드 CNP와 비교할 때 CD-NP는 혈압에는 최소한의 영향을 미치면서 cGMP 경로를 활성화하고, 나트륨 배설을 증진시키며, 알도스테론을 억제한다라는 개념이 확립되었다.
이러한 연구는 또한 CNP가, CNP와는 다르게는 나트륨이뇨성 및 알도스테론 억제성을 띠고, CNP와 유사하게는 심장 부하를 경감하면서 최소한의 저혈압성을 갖는 잠재적인 치료제 펩티드로 형질전환될 수 있다는 것을 시사한다. CNP의 N-말단을 갖는 데코이의 사용을 통해 추후 키메라 디자인에 대해 파악할 수 있고, 신장에서 NPR-A가 작용할 수 있게 하는 CNP의 C-말단을 증강시키는 특이성이 강조된다. 요약하면, DNP의 C-말단을 전장의 22-AA 펩티드 CNP에 융합시키면 CNP는 심신 질환 증후군의 치료제와 관련이 있는 것으로서, 심장 부하를 경감하고, 레닌을 억제하며, 신장을 증진시키는 디자이너 펩티드로 형질전환된다.
[기타 다른 실시태양]
본 발명을 그 상세한 설명과 함께 관련하여 기술하였지만, 상기의 설명은 본 발명의 범위를 예시하고자 하는 것이지, 제한하고자 하는 것은 아니며, 상기의 본 발명의 범위는 첨부하는 특허청구범위에 의해서 정의되는 것임을 이해하여야 한다. 기타 다른 측면, 이점, 및 변형이 하기 특허청구범위 내에 포함된다.
SEQUENCE LISTING
<110> Mayo Foundation for Medical Education and Research
<120> CHIMERIC NATRIURETIC POLYPEPTIDES AND
METHODS FOR INHIBITING CARDIAC REMODELING
<130> 07039/0853WO1
<140> PCT/US2009/046095
<141> 2009-06-03
<150> 61/059,576
<151> 2008-06-06
<160> 17
<170> FastSEQ for Windows Version 4.0
<210> 1
<211> 22
<212> PRT
<213> Homo sapiens
<400> 1
Gly Leu Ser Lys Gly Cys Phe Gly Leu Lys Leu Asp Arg Ile Gly Ser
1 5 10 15
Met Ser Gly Leu Gly Cys
20
<210> 2
<211> 15
<212> PRT
<213> Dendroaspis angusticeps
<400> 2
Pro Ser Leu Arg Asp Pro Arg Pro Asn Ala Pro Ser Thr Ser Ala
1 5 10 15
<210> 3
<211> 37
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 3
Gly Leu Ser Lys Gly Cys Phe Gly Leu Lys Leu Asp Arg Ile Gly Ser
1 5 10 15
Met Ser Gly Leu Gly Cys Pro Ser Leu Arg Asp Pro Arg Pro Asn Ala
20 25 30
Pro Ser Thr Ser Ala
35
<210> 4
<211> 27
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 4
Gly Leu Ser Lys Gly Cys Phe Gly Leu Lys Leu Asp Arg Ile Gly Ser
1 5 10 15
Met Ser Gly Leu Gly Cys Gly Lys Ser Leu Gly
20 25
<210> 5
<211> 17
<212> PRT
<213> Homo sapiens
<400> 5
Cys Phe Gly Leu Lys Leu Asp Arg Ile Gly Ser Met Ser Gly Leu Gly
1 5 10 15
Cys
<210> 6
<211> 10
<212> PRT
<213> Homo sapiens
<400> 6
Thr Ala Pro Arg Ser Leu Arg Arg Ser Ser
1 5 10
<210> 7
<211> 5
<212> PRT
<213> Homo sapiens
<400> 7
Asn Ser Phe Arg Tyr
1 5
<210> 8
<211> 32
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 8
Thr Ala Pro Arg Ser Leu Arg Arg Ser Ser Cys Phe Gly Leu Lys Leu
1 5 10 15
Asp Arg Ile Gly Ser Met Ser Gly Leu Gly Cys Asn Ser Phe Arg Tyr
20 25 30
<210> 9
<211> 37
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 9
Pro Leu Ser Lys Gly Cys Phe Gly Leu Lys Leu Asp Arg Ile Gly Ser
1 5 10 15
Met Ser Gly Leu Gly Cys Pro Ser Leu Arg Asp Pro Arg Pro Asn Ala
20 25 30
Pro Ser Thr Ser Ala
35
<210> 10
<211> 37
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 10
Gly Ile Ser Lys Gly Cys Phe Gly Leu Lys Leu Asp Arg Ile Gly Ser
1 5 10 15
Met Ser Gly Leu Gly Cys Pro Ser Leu Arg Asp Pro Arg Pro Asn Ala
20 25 30
Pro Ser Thr Ser Ala
35
<210> 11
<211> 37
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 11
Gly Leu Ser Lys Gly Cys Phe Gly Leu Lys Leu Asp Arg Ile Gly Ser
1 5 10 15
Met Ser Gly Leu Gly Cys Pro Ser Leu Arg Asp Pro Arg Pro Asn Ala
20 25 30
Pro Ser Thr Thr Ala
35
<210> 12
<211> 37
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 12
Gly Leu Ser Lys Gly Cys Phe Gly Leu Lys Leu Asp Arg Ile Gly Ser
1 5 10 15
Met Ser Gly Leu Gly Cys Pro Ser Leu Arg Asp Pro Arg Pro Asn Ala
20 25 30
Pro Ser Thr Ser Val
35
<210> 13
<211> 37
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 13
Gly Leu Thr Lys Gly Cys Phe Gly Leu Lys Leu Asp Arg Ile Gly Ser
1 5 10 15
Met Ser Gly Leu Gly Cys Pro Ser Leu Arg Asp Pro Arg Pro Asn Ala
20 25 30
Pro Ser Thr Ser Ala
35
<210> 14
<211> 37
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 14
Gly Leu Ser Arg Gly Cys Phe Gly Leu Lys Leu Asp Arg Ile Gly Ser
1 5 10 15
Met Ser Gly Leu Gly Cys Pro Ser Leu Arg Asp Pro Arg Pro Asn Ala
20 25 30
Pro Ser Thr Ser Ala
35
<210> 15
<211> 37
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 15
Gly Leu Ser Lys Gly Cys Phe Gly Leu Lys Leu Asp Arg Ile Gly Ser
1 5 10 15
Met Ser Gly Leu Gly Cys Pro Ser Leu Arg Asp Pro Arg Pro Asn Ala
20 25 30
Pro Ser Ser Ser Ala
35
<210> 16
<211> 37
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 16
Gly Leu Ser Lys Gly Cys Phe Gly Leu Lys Leu Asp Arg Ile Gly Ser
1 5 10 15
Met Ser Gly Leu Gly Cys Pro Ser Leu Arg Asp Pro Arg Pro Asn Ala
20 25 30
Pro Thr Thr Ser Ala
35
<210> 17
<211> 38
<212> PRT
<213> Dendroaspis angusticeps
<400> 17
Glu Val Lys Tyr Asp Pro Cys Phe Gly His Lys Ile Asp Arg Ile Asn
1 5 10 15
His Val Ser Asn Leu Gly Cys Pro Ser Leu Arg Asp Pro Arg Pro Asn
20 25 30
Ala Pro Ser Thr Ser Ala
35
Claims (27)
- 심장 리모델링 감소가 필요한 것으로 확인된 피험체에서 심장 리모델링을 감소시키는 방법으로서, 약제학적으로 허용되는 담체, 및 상기 피험체에서 뇨 및 혈장 사이클릭 3'5' 구아노신 모노포스페이트(cGMP) 수치를 증가시킬 수 있는 폴리펩티드를 포함하는 조성물을 상기 피험체에게 투여하는 단계를 포함하며, 상기 조성물은, 심장 리모델링에 관한 하나 이상의 파라미터 수치를, 상기 조성물을 투여하기 이전의 상기 하나 이상의 파라미터 수치와 비교할 때 10% 이상 변경하는 데 유효한 양으로 투여되고, 상기 하나 이상의 파라미터는 심장 부하 경감, 사구체 여과율 증가, 알도스테론 수치 감소, 혈장 레닌 활성 감소, 안지오텐신 II 수치 감소, 심장 섬유아세포 증식 감소, 좌심실 질량 감소, 좌심실 비대 감소, 심실 섬유증 감소, 박출률 증가, 좌심실 수축기말 직경 감소, 폐 모세혈관 쐐기압 감소, 우심방압 감소 및 평균 동맥압 감소로 구성된 군으로부터 선택되는 것인 방법.
- 제1항에 있어서, 상기 폴리펩티드가 나트륨이뇨성 폴리펩티드인 방법.
- 제2항에 있어서, 상기 나트륨이뇨성 폴리펩티드가 (a) 제1 나트륨이뇨성 폴리펩티드의 환 구조, 또는 상기 제1 나트륨이뇨성 폴리펩티드의 환 구조의 변이체, 및 (b) 제2 나트륨이뇨성 폴리펩티드로부터의 아미노산 서열, 또는 상기 제2 나트륨이뇨성 폴리펩티드로부터의 상기 아미노산 서열의 변이체를 포함하는 키메라 나트륨이뇨성 폴리펩티드인 방법.
- 제2항에 있어서, 상기 나트륨이뇨성 폴리펩티드가 서열 번호 3에 기재된 아미노산 서열을 포함하지만, 서열 번호 3에 기재된 서열과 비교하여 1개, 2개, 3개, 4개, 또는 5개의 아미노산 치환을 갖는 것인 방법.
- 제1항에 있어서, 상기 폴리펩티드가 NPR-B 수용체 및 NRP-A 수용체에 결합할 수 있는 것인 방법.
- 제1항에 있어서, 상기 폴리펩티드가 상기 피험체에게 투여된 후 15분 이상의 제거 반감기를 갖는 것인 방법.
- 제1항에 있어서, 상기 조성물을 지속적 정맥내 주입액으로서 투여하는 것을 포함하는 것인 방법.
- 제7항에 있어서, 상기 지속적 정맥내 주입액을 1 내지 7일 동안 투여하는 것을 포함하는 것인 방법.
- 제1항에 있어서, 상기 조성물을 1 내지 7일 동안 지속적 정맥내 주입액으로서 투여하고, 그 후 상기 조성물을 5 내지 30일 동안 피하 투여하는 것을 포함하는 것인 방법.
- 제1항에 있어서, 상기 조성물을 약 0.1 ng 폴리펩티드/kg(체질량)/분 내지 약 30 ng 폴리펩티드/kg(체질량)/분의 투여량으로 지속적 정맥내 주입액으로서 투여하고, 그 후, 상기 조성물을 약 10 ng 폴리펩티드/kg(체질량)/일 내지 약 30 ng 폴리펩티드/kg(체질량)/일의 투여량으로 피하 투여하는 것을 포함하는 것인 방법.
- 제1항에 있어서, 상기 조성물을 약 3시간 내지 약 7일 동안 약 0.1 ng 폴리펩티드/kg(체질량)/분 내지 약 30 ng 폴리펩티드/kg(체질량)/분의 투여량으로 지속적 정맥내 주입액으로서 투여하고, 그 후, 상기 조성물을 약 5 내지 약 30일 동안 약 10 ng 폴리펩티드/kg(체질량)/일 내지 약 30 ng 폴리펩티드/kg(체질량)/일의 투여량으로 피하 투여하는 것을 포함하는 것인 방법.
- 제1항에 있어서, 상기 피험체가 급성 심부전 또는 급성 심근경색을 앓는 것으로 확인된 것인 방법.
- 제12항에 있어서, 재관류 시점 또는 대략 재관류 시점으로부터 상기 지속적 정맥내 주입액을 투여하는 것을 포함하는 것인 방법.
- 제12항에 있어서, 상기 조성물을 재관류 개시 후 약 3시간 경과시부터 투여하는 것인 방법.
- 제12항에 있어서, 상기 조성물을 재관류 후 약 3시간 내지 약 12시간 경과시부터 투여하는 것인 방법.
- 제1항에 있어서, 상기 조성물을 약 1 ng 폴리펩티드/kg(체질량)/분 내지 약 30 ng 폴리펩티드/kg(체질량)/분의 투여량으로 투여하는 것을 포함하는 것인 방법.
- 제1항에 있어서, 심장 리모델링에 관한 상기 하나 이상의 파라미터의 수치에 대하여 상기 피험체를 모니터링하는 것을 추가로 포함하는 것인 방법.
- 약제학적으로 허용되는 담체 및 폴리펩티드를 포함하는 조성물로서, 상기 폴리펩티드는 피험체에서 뇨 및 혈장 cGMP 수치를 증가시킬 수 있고, 상기 조성물은 이를 필요로 하는 것으로 확인된 피험체에게 투여될 때 심장 리모델링을 감소시키며, 상기 심장 리모델링의 감소 또는 억제는 심장 부하 경감, 사구체 여과율 증가, 알도스테론 수치 감소, 혈장 레닌 활성 감소, 안지오텐신 II 수치 감소, 심장 섬유아세포 증식 감소, 좌심실 질량 감소, 좌심실 비대 감소, 심실 섬유증 감소, 박출률 증가, 좌심실 수축기말 직경 감소, 폐 모세혈관 쐐기압 감소, 우심방압 감소 및 평균 동맥압 감소로 구성된 군으로부터 선택되는 하나 이상의 파라미터의 수치 변경에 의해 나타나고, 상기 하나 이상의 파라미터의 수치는 상기 투여 이전의 상기 하나 이상의 파라미터 수치와 비교할 때 10% 이상 변경되는 것인 조성물.
- 제18항에 있어서, 상기 폴리펩티드가 나트륨이뇨성 폴리펩티드인 조성물.
- 제19항에 있어서, 상기 나트륨이뇨성 폴리펩티드가 (a) 제1 나트륨이뇨성 폴리펩티드의 환 구조, 또는 상기 제1 나트륨이뇨성 폴리펩티드의 환 구조의 변이체, 및 (b) 제2 나트륨이뇨성 폴리펩티드로부터의 아미노산 서열, 또는 상기 제2 나트륨이뇨성 폴리펩티드로부터의 상기 아미노산 서열의 변이체를 포함하는 키메라 나트륨이뇨성 폴리펩티드인 조성물.
- 제19항에 있어서, 상기 나트륨이뇨성 폴리펩티드가 서열 번호 3에 기재된 아미노산 서열을 포함하지만, 서열 번호 3에 기재된 서열과 비교하여 1개, 2개, 3개, 4개, 또는 5개의 아미노산 치환을 갖는 것인 조성물.
- 제18항에 있어서, 상기 폴리펩티드가 NPR-B 수용체 및 NRP-A 수용체에 결합할 수 있는 것인 조성물.
- 제18항에 있어서, 상기 폴리펩티드가 상기 피험체에게 투여된 후 15분 이상의 제거 반감기를 갖는 것인 조성물.
- 제18항에 있어서, 상기 나트륨이뇨성 폴리펩티드가 서열 번호 3에 기재된 아미노산 서열과 91 내지 98% 동일한 아미노산 서열을 포함하는 것인 조성물.
- 제18항에 있어서, 상기 나트륨이뇨성 폴리펩티드가 서열 번호 3의 아미노산 서열을 포함하지만, 서열 번호 3에 기재된 서열과 비교하여 1개, 2개, 3개, 4개, 또는 5개의 아미노산 치환을 갖는 것인 조성물.
- 제18항에 있어서, 상기 피험체가 급성 심부전 또는 급성 심근경색을 앓는 것으로 확인된 것인 조성물.
- 제18항에 있어서, 상기 약제학적 담체가 일반 생리식염수 또는 덱스트로스 및 물인 조성물.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US5957608P | 2008-06-06 | 2008-06-06 | |
| US61/059,576 | 2008-06-06 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20110020903A true KR20110020903A (ko) | 2011-03-03 |
Family
ID=41398834
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020117000303A KR20110020903A (ko) | 2008-06-06 | 2009-06-03 | 키메라 나트륨이뇨성 폴리펩티드 및 심장 리모델링 억제 방법 |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US20110152194A1 (ko) |
| EP (1) | EP2303305A4 (ko) |
| JP (1) | JP2011522824A (ko) |
| KR (1) | KR20110020903A (ko) |
| CN (1) | CN102143757A (ko) |
| AU (1) | AU2009256222A1 (ko) |
| CA (1) | CA2727085A1 (ko) |
| WO (1) | WO2009149161A2 (ko) |
Families Citing this family (25)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| PL1759001T3 (pl) | 2004-04-21 | 2011-09-30 | Alexion Pharma Inc | Koniugaty dostarczane do kości i sposób ich zastosowania do nakierowywania białek do kości |
| US8455438B2 (en) | 2008-12-29 | 2013-06-04 | Mayo Foundation For Medical Education And Research | Natriuretic polypeptides for reducing or preventing restenosis |
| WO2011005939A2 (en) | 2009-07-09 | 2011-01-13 | Mayo Foundation For Medical Education And Research | Long acting atrial natriuretic peptide (la-anp) and methods for use thereof |
| WO2012088608A1 (en) | 2010-12-27 | 2012-07-05 | Enobia Canada Limited Partnership | Compositions comprising natriuretic peptides and methods of use thereof |
| US20120220528A1 (en) * | 2011-02-25 | 2012-08-30 | Medtronic, Inc. | Systems and methods for therapy of kidney disease and/or heart failure using chimeric natriuretic peptides |
| US20120277155A1 (en) * | 2011-02-25 | 2012-11-01 | Medtronic, Inc. | Therapy for kidney disease and/or heart failure |
| CN107090028A (zh) | 2011-08-30 | 2017-08-25 | 梅约医学教育与研究基金会 | 利钠多肽 |
| US20130244937A1 (en) | 2011-09-02 | 2013-09-19 | Nile Therapeutics, Inc. | Chimeric natriuretic peptide compositions and methods of preparation |
| WO2013103896A1 (en) | 2012-01-06 | 2013-07-11 | Mayo Foundation For Medical Education And Research | Treating cardiovascular or renal diseases |
| US10052366B2 (en) | 2012-05-21 | 2018-08-21 | Alexion Pharmaceuticsl, Inc. | Compositions comprising alkaline phosphatase and/or natriuretic peptide and methods of use thereof |
| WO2016007873A1 (en) | 2014-07-11 | 2016-01-14 | The Regents Of The University Of Michigan | Compositions and methods for treating craniosynostosis |
| AU2015357551B2 (en) | 2014-12-05 | 2021-02-25 | Alexion Pharmaceuticals, Inc. | Treating seizure with recombinant alkaline phosphatase |
| AU2016211447B2 (en) | 2015-01-28 | 2021-09-23 | Alexion Pharmaceuticals, Inc. | Methods of treating a subject with an alkaline phosphatase deficiency |
| WO2017031114A1 (en) | 2015-08-17 | 2017-02-23 | Alexion Pharmaceuticals, Inc. | Manufacturing of alkaline phosphatases |
| US11229686B2 (en) | 2015-09-28 | 2022-01-25 | Alexion Pharmaceuticals, Inc. | Reduced frequency dosage regimens for tissue non-specific alkaline phosphatase (TNSALP)-enzyme replacement therapy of hypophosphatasia |
| US11400140B2 (en) | 2015-10-30 | 2022-08-02 | Alexion Pharmaceuticals, Inc. | Methods for treating craniosynostosis in a patient |
| US11065306B2 (en) | 2016-03-08 | 2021-07-20 | Alexion Pharmaceuticals, Inc. | Methods for treating hypophosphatasia in children |
| WO2017173413A1 (en) | 2016-04-01 | 2017-10-05 | Alexion Pharmaceuticals, Inc. | Treating muscle weakness with alkaline phosphatases |
| WO2017173395A1 (en) | 2016-04-01 | 2017-10-05 | Alexion Pharmaceuticals, Inc. | Methods for treating hypophosphatasia in adolescents and adults |
| US10988744B2 (en) | 2016-06-06 | 2021-04-27 | Alexion Pharmaceuticals, Inc. | Method of producing alkaline phosphatase |
| EP3500289A4 (en) | 2016-08-18 | 2020-05-06 | Alexion Pharmaceuticals, Inc. | METHODS OF TREATING TRACHEOBRONCHOMALACIA |
| SG11201901226RA (en) * | 2016-08-18 | 2019-03-28 | Nat Univ Singapore | Peptides with vasodilatory and/or diuretic functions |
| KR20190129058A (ko) | 2017-03-31 | 2019-11-19 | 알렉시온 파마슈티칼스, 인코포레이티드 | 성인 및 청소년에서 저포스파타제증 (hpp)을 치료하는 방법 |
| JP2021519590A (ja) | 2018-03-30 | 2021-08-12 | アレクシオン ファーマシューティカルズ, インコーポレイテッド | 糖タンパク質の製造 |
| WO2021183928A1 (en) * | 2020-03-13 | 2021-09-16 | Mayo Foundation For Medical Education And Research | Assessing and treating acute decompensated heart failure |
Family Cites Families (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4161521A (en) * | 1975-08-08 | 1979-07-17 | Merck & Co., Inc. | Somatostatin analogs |
| US4757048A (en) * | 1985-11-05 | 1988-07-12 | Biotechnology Research Associates J.V. | Synthetic analogs of atrial natriuretic peptides |
| US4935492A (en) * | 1987-12-24 | 1990-06-19 | California Biotechnology Inc. | Cyclic analogs of atrial natriuretic peptides |
| WO2000071576A2 (en) * | 1999-05-24 | 2000-11-30 | Mayo Foundation For Medical Education And Research | Adenovirus vectors encoding brain natriuretic peptide |
| US6407211B1 (en) * | 1999-12-17 | 2002-06-18 | Mayo Foundation For Medical Education And Research | Chimeric natriuretic peptides |
| EP1720562A4 (en) * | 2004-01-15 | 2009-10-28 | Scios Inc | METHOD FOR TREATING CARDIAL REMODELING AFTER MYOCARDIAL DAMAGE |
| US20070042957A1 (en) * | 2005-08-19 | 2007-02-22 | Mayo Foundation For Medical Education And Research | Type v phosphodiesterase inhibitors and natriuretic polypeptides |
| US7803901B2 (en) * | 2005-09-16 | 2010-09-28 | Mayo Foundation For Medical Education And Research | Polypeptides with natriuresis activity |
| CA2660294C (en) * | 2006-08-08 | 2017-08-29 | Mayo Foundation For Medical Education And Research | Diuretic and natriuretic polypeptides |
| WO2008031045A2 (en) * | 2006-09-08 | 2008-03-13 | Mayo Foundation For Medical Education And Research | Aquaretic and natriuretic polypeptides lacking vasodilatory activity |
| DK2765139T3 (en) * | 2007-07-20 | 2017-07-31 | Mayo Foundation | NATURURETIC POLYPEPTIDES |
| WO2010002583A2 (en) * | 2008-07-02 | 2010-01-07 | Mayo Foundation For Medical Education And Research | Natriuretic polypeptides with unique pharmacologic profiles |
| WO2010048308A2 (en) * | 2008-10-24 | 2010-04-29 | Deborah Dickey | Natriuretic polypeptides |
| US8455438B2 (en) * | 2008-12-29 | 2013-06-04 | Mayo Foundation For Medical Education And Research | Natriuretic polypeptides for reducing or preventing restenosis |
| WO2010129655A2 (en) * | 2009-05-05 | 2010-11-11 | Mayo Foundation For Medical Education And Research | Natriuretic polypeptides having mutations within their disulfide rings |
| WO2011005939A2 (en) * | 2009-07-09 | 2011-01-13 | Mayo Foundation For Medical Education And Research | Long acting atrial natriuretic peptide (la-anp) and methods for use thereof |
-
2009
- 2009-06-03 US US12/996,500 patent/US20110152194A1/en not_active Abandoned
- 2009-06-03 EP EP09759320A patent/EP2303305A4/en not_active Withdrawn
- 2009-06-03 WO PCT/US2009/046095 patent/WO2009149161A2/en active Application Filing
- 2009-06-03 CN CN2009801289321A patent/CN102143757A/zh active Pending
- 2009-06-03 CA CA2727085A patent/CA2727085A1/en not_active Abandoned
- 2009-06-03 KR KR1020117000303A patent/KR20110020903A/ko not_active Application Discontinuation
- 2009-06-03 AU AU2009256222A patent/AU2009256222A1/en not_active Abandoned
- 2009-06-03 JP JP2011512608A patent/JP2011522824A/ja active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| EP2303305A4 (en) | 2012-07-04 |
| CN102143757A (zh) | 2011-08-03 |
| WO2009149161A3 (en) | 2010-06-10 |
| JP2011522824A (ja) | 2011-08-04 |
| WO2009149161A9 (en) | 2010-04-08 |
| US20110152194A1 (en) | 2011-06-23 |
| AU2009256222A1 (en) | 2009-12-10 |
| CA2727085A1 (en) | 2009-12-10 |
| EP2303305A2 (en) | 2011-04-06 |
| WO2009149161A2 (en) | 2009-12-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20110020903A (ko) | 키메라 나트륨이뇨성 폴리펩티드 및 심장 리모델링 억제 방법 | |
| US9079973B2 (en) | Natriuretic polypeptides for reducing restenosis | |
| US20120053123A1 (en) | Natriuretic polypeptides having mutations within their disulfide rings | |
| RU2589255C2 (ru) | Модифицированные вазоактивные интестинальные пептиды | |
| US10344068B2 (en) | Natriuretic polypeptides | |
| JP2011530509A (ja) | N末端において修飾されたグルコース依存性インスリン分泌刺激ポリペプチド(gip)のアナログ | |
| JP2007531714A (ja) | 治療的介入のためのy2/y4選択性レセプターアゴニスト | |
| US11572399B2 (en) | Long-acting GIP peptide analogues | |
| US11897931B2 (en) | MANP analogues | |
| US20140274901A1 (en) | Proanp compositions and methods for treating acute heart failure | |
| US10336803B2 (en) | Insulin secreting polypeptides | |
| US20170333530A1 (en) | Methods and materials for reducing cysts and kidney weight in mammals with polycystic kidney disease |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |