JP7033397B2 - Light emitting element - Google Patents
Light emitting element Download PDFInfo
- Publication number
- JP7033397B2 JP7033397B2 JP2017060617A JP2017060617A JP7033397B2 JP 7033397 B2 JP7033397 B2 JP 7033397B2 JP 2017060617 A JP2017060617 A JP 2017060617A JP 2017060617 A JP2017060617 A JP 2017060617A JP 7033397 B2 JP7033397 B2 JP 7033397B2
- Authority
- JP
- Japan
- Prior art keywords
- group
- ring
- formula
- light emitting
- organic layer
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 0 CC(C(*)=C(*)C1N)=C(*)C1c(c(*)c(*)c(*)c1*)c1NC Chemical compound CC(C(*)=C(*)C1N)=C(*)C1c(c(*)c(*)c(*)c1*)c1NC 0.000 description 21
- IKLNOINQWYDQGM-UHFFFAOYSA-N C1CC[IH]CC1 Chemical compound C1CC[IH]CC1 IKLNOINQWYDQGM-UHFFFAOYSA-N 0.000 description 1
- ISKHQVGFVRAJAR-UHFFFAOYSA-N CC1(C)c(cc(cc2)-c(c3c4c-5ccc3)ccc4-c3c-5c(-c4ccccc4)c(cccc4)c4c3-c3ccccc3)c2-c2ccccc12 Chemical compound CC1(C)c(cc(cc2)-c(c3c4c-5ccc3)ccc4-c3c-5c(-c4ccccc4)c(cccc4)c4c3-c3ccccc3)c2-c2ccccc12 ISKHQVGFVRAJAR-UHFFFAOYSA-N 0.000 description 1
- JVTVNLXBXQPSBB-UMSFTDKQSA-N CCC(CC)c1cc(-c2c([C@@H]3C(C=C4C5=CCC=CC=C55)=C3)c4c5c3ccccc23)ccc1C1=CC=CCC1 Chemical compound CCC(CC)c1cc(-c2c([C@@H]3C(C=C4C5=CCC=CC=C55)=C3)c4c5c3ccccc23)ccc1C1=CC=CCC1 JVTVNLXBXQPSBB-UMSFTDKQSA-N 0.000 description 1
- MMUUIWJDXPNYLN-LLVKDONJSA-N CCCCC(C[C@H]1C)=CC=C1C=C Chemical compound CCCCC(C[C@H]1C)=CC=C1C=C MMUUIWJDXPNYLN-LLVKDONJSA-N 0.000 description 1
- WFUDPIRTQOTTOL-KRJFXVTLSA-N CC[C@@](C1)(C1C1)C(C)(C)/C1=C/C(C(C)(C)C)=C Chemical compound CC[C@@](C1)(C1C1)C(C)(C)/C1=C/C(C(C)(C)C)=C WFUDPIRTQOTTOL-KRJFXVTLSA-N 0.000 description 1
Description
本発明は、発光素子に関する。 The present invention relates to a light emitting device.
有機エレクトロルミネッセンス素子(以下、「発光素子」ともいう。)は、ディスプレイ及び照明の用途に好適に使用することが可能であり、近年、寿命が長く、高発光効率な有機エレクトロルミネッセンス素子の研究開発が行われている。 Organic electroluminescence devices (hereinafter, also referred to as "light emitting devices") can be suitably used for display and lighting applications, and in recent years, research and development of organic electroluminescence devices having a long life and high light emission efficiency. Is being done.
例えば、特許文献1には、陰極と陽極間に少なくとも発光層を含む有機薄膜層が挟持されている有機エレクトロルミネッセンス素子において、前記発光層がフルオランテン構造を有する化合物と縮合環含有化合物を含有する有機エレクトロルミネッセンス素子が記載されている(請求項1)。フルオランテン構造を有する化合物の具体例には、下記式で表される化合物(2-29)及び(2-21)等が記載されている(第0110段落)。 For example, Patent Document 1 describes an organic electroluminescence device in which an organic thin film layer including at least a light emitting layer is sandwiched between a cathode and an anode, wherein the light emitting layer contains a compound having a fluorentene structure and a fused ring-containing compound. An electroluminescence element is described (claim 1). Specific examples of the compound having a fluoranthene structure include compounds (2-29) and (2-21) represented by the following formulas (paragraph 0110).
特許文献1の実施例13において、発光層に化合物(2-29)を含む有機エレクトロルミネッセンス素子が記載されている。実施例13の有機エレクトロルミネッセンス素子では、発光層は、化合物(2-29)及び縮合環含有化合物を正孔輸送層の上に同時蒸着することで形成された蒸着層である。正孔輸送層は、N,N,N’N’-テトラ(4-ビフェニリル)ベンジジンを正孔注入層の上に蒸着することで形成された蒸着層である(第0171段落)。 In Example 13 of Patent Document 1, an organic electroluminescence device containing a compound (2-29) in a light emitting layer is described. In the organic electroluminescence element of Example 13, the light emitting layer is a thin-film deposition layer formed by simultaneously vapor-depositing the compound (2-29) and the condensed ring-containing compound on the hole transport layer. The hole transport layer is a thin-film deposition layer formed by depositing N, N, N'N'-tetra (4-biphenylyl) benzidine on a hole-injection layer (paragraph 0171).
また、特許文献1の実施例21において、発光層に化合物(2-21)を含む有機エレクトロルミネッセンス素子が記載されている。実施例21の有機エレクトロルミネッセンス素子では、発光層は、化合物(2-21)及び縮合環含有化合物のトルエン溶液を正孔輸送層の上にスピンコートすることで成膜された塗布層である。正孔輸送層は、下記式で表されるポリマー1のトルエン溶液を正孔注入層の上にスピンコートすることで成膜された塗布層である(第0177段落)。 Further, in Example 21 of Patent Document 1, an organic electroluminescence device containing a compound (2-21) in a light emitting layer is described. In the organic electroluminescence element of Example 21, the light emitting layer is a coating layer formed by spin-coating a toluene solution of the compound (2-21) and the fused ring-containing compound onto the hole transport layer. The hole transport layer is a coating layer formed by spin-coating a toluene solution of polymer 1 represented by the following formula on a hole injection layer (paragraph 0177).
しかし、上述した従来の発光素子は、発光効率が必ずしも十分ではなく、さらに向上させる必要がある。
そこで、本発明は、発光効率に優れる発光素子を提供することを目的とする。
However, the above-mentioned conventional light emitting element does not always have sufficient luminous efficiency, and needs to be further improved.
Therefore, an object of the present invention is to provide a light emitting element having excellent luminous efficiency.
本発明は、以下の[1]~[12]を提供する。 The present invention provides the following [1] to [12].
[1]陽極と、陰極と、陽極及び陰極の間に設けられた第1の有機層及び第2の有機層と、を有する発光素子であり、第1の有機層が、式(1)で表される化合物を含有する層であり、第2の有機層が、架橋材料の架橋体を含有する層である、発光素子。 [1] A light emitting device having an anode, a cathode, a first organic layer and a second organic layer provided between the anode and the cathode, and the first organic layer is represented by the formula (1). A light emitting device which is a layer containing the represented compound, and the second organic layer is a layer containing a crosslinked body of a crosslinking material.
環R1A、環R2A及び環R3Aは、それぞれ独立に、芳香族炭化水素環を表し、該環は置換基を有していてもよい。該置換基が複数存在する場合、それらは同一でも異なっていてもよく、互いに結合して、それぞれが結合する炭素原子とともに環を形成していてもよい。
但し、環R1A、環R2A及び環R3Aのうちの少なくとも一つは、式(1-S)で表される基を有する。]
Ring R 1A , ring R 2A , and ring R 3A each independently represent an aromatic hydrocarbon ring, and the ring may have a substituent. When a plurality of the substituents are present, they may be the same or different, or they may be bonded to each other to form a ring together with the carbon atom to which each is bonded.
However, at least one of ring R 1A , ring R 2A and ring R 3A has a group represented by the formula (1-S). ]
[2]前記架橋材料が、架橋基A群から選ばれる少なくとも1種の架橋基を有する低分子化合物、又は、架橋基A群から選ばれる少なくとも1種の架橋基を有する架橋構成単位を含む高分子化合物である、[1]に記載の発光素子。
(架橋基A群)
[2] The cross-linking material contains a low molecular weight compound having at least one cross-linking group selected from the cross-linking group A group or a cross-linking structural unit having at least one cross-linking group selected from the cross-linking group A group. The light emitting element according to [1], which is a molecular compound.
(Crosslinking group A group)
[3]前記架橋材料が、架橋基A群から選ばれる少なくとも1種の架橋基を有する架橋構成単位を含む高分子化合物である、[2]に記載の発光素子。 [3] The light emitting element according to [2], wherein the cross-linking material is a polymer compound containing a cross-linking structural unit having at least one cross-linking group selected from the cross-linking group A group.
[4]前記架橋構成単位が、式(2)で表される構成単位又は式(2’)で表される構成単位である、[3]に記載の発光素子。 [4] The light emitting device according to [3], wherein the crosslinked structural unit is a structural unit represented by the formula (2) or a structural unit represented by the formula (2').
nAは0~5の整数を表し、nは1又は2を表す。nAが複数存在する場合、それらは同一でも異なっていてもよい。
Ar3は、芳香族炭化水素基又は複素環基を表し、これらの基は置換基を有していてもよい。
LAは、アルキレン基、シクロアルキレン基、アリーレン基、2価の複素環基、-NR’-で表される基、酸素原子又は硫黄原子を表し、これらの基は置換基を有していてもよい。R’は、水素原子、アルキル基、シクロアルキル基、アリール基又は1価の複素環基を表し、これらの基は置換基を有していてもよい。LAが複数存在する場合、それらは同一でも異なっていてもよい。
Xは、架橋基A群から選ばれる架橋基を表す。Xが複数存在する場合、それらは同一でも異なっていてもよい。]
nA represents an integer of 0 to 5, and n represents 1 or 2. When there are a plurality of nA, they may be the same or different.
Ar 3 represents an aromatic hydrocarbon group or a heterocyclic group, and these groups may have a substituent.
LA represents an alkylene group, a cycloalkylene group, an arylene group, a divalent heterocyclic group, a group represented by -NR'-, an oxygen atom or a sulfur atom, and these groups have a substituent. May be good. R'represents a hydrogen atom, an alkyl group, a cycloalkyl group, an aryl group or a monovalent heterocyclic group, and these groups may have a substituent. If there are multiple LAs , they may be the same or different.
X represents a cross-linking group selected from the group A of cross-linking groups. If there are multiple X's, they may be the same or different. ]
mAは0~5の整数を表し、mは1~4の整数を表し、cは0又は1の整数を表す。mAが複数存在する場合、それらは同一でも異なっていてもよい。
Ar5は、芳香族炭化水素基、複素環基、又は、少なくとも1種の芳香族炭化水素環と少なくとも1種の複素環とが直接結合した基を表し、これらの基は置換基を有していてもよい。
Ar4及びAr6は、それぞれ独立に、アリーレン基又は2価の複素環基を表し、これらの基は置換基を有していてもよい。
Ar4、Ar5及びAr6はそれぞれ、当該基が結合している窒素原子に結合している当該基以外の基と、直接又は酸素原子もしくは硫黄原子を介して結合して、環を形成していてもよい。
KAは、アルキレン基、シクロアルキレン基、アリーレン基、2価の複素環基、-NR’-で表される基、酸素原子又は硫黄原子を表し、これらの基は置換基を有していてもよい。R’は、水素原子、アルキル基、シクロアルキル基、アリール基又は1価の複素環基を表し、これらの基は置換基を有していてもよい。KAが複数存在する場合、それらは同一でも異なっていてもよい。
X’は、架橋基A群から選ばれる架橋基、水素原子、アルキル基、シクロアルキル基、アリール基又は1価の複素環基を表し、これらの基は置換基を有していてもよい。X’が複数存在する場合、それらは同一でも異なっていてもよい。但し、少なくとも1つのX’は、架橋基A群から選ばれる架橋基である。]
mA represents an integer of 0 to 5, m represents an integer of 1 to 4, and c represents an integer of 0 or 1. If there are multiple mAs, they may be the same or different.
Ar 5 represents an aromatic hydrocarbon group, a heterocyclic group, or a group in which at least one aromatic hydrocarbon ring and at least one heterocycle are directly bonded, and these groups have a substituent. May be.
Ar 4 and Ar 6 each independently represent an arylene group or a divalent heterocyclic group, and these groups may have a substituent.
Ar 4 , Ar 5 and Ar 6 each form a ring by directly or via an oxygen atom or a sulfur atom with a group other than the group bonded to the nitrogen atom to which the group is bonded. May be.
KA represents an alkylene group, a cycloalkylene group, an arylene group, a divalent heterocyclic group, a group represented by -NR'-, an oxygen atom or a sulfur atom, and these groups have a substituent. May be good. R'represents a hydrogen atom, an alkyl group, a cycloalkyl group, an aryl group or a monovalent heterocyclic group, and these groups may have a substituent. If there are multiple KAs , they may be the same or different.
X'represents a cross-linking group, a hydrogen atom, an alkyl group, a cycloalkyl group, an aryl group or a monovalent heterocyclic group selected from the cross-linking group A group, and these groups may have a substituent. If there are multiple X's, they may be the same or different. However, at least one X'is a cross-linking group selected from the group A of cross-linking groups. ]
前記架橋材料が、式(3)で表される低分子化合物である、[1]に記載の発光素子。 The light emitting device according to [1], wherein the crosslinked material is a small molecule compound represented by the formula (3).
mB1、mB2及びmB3は、それぞれ独立に、0以上の整数を表す。複数存在するmB1は、同一でも異なっていてもよい。mB3が複数存在する場合、それらは同一でも異なっていてもよい。
Ar7は、芳香族炭化水素基、複素環基、又は、少なくとも1種の芳香族炭化水素環と少なくとも1種の複素環とが直接結合した基を表し、これらの基は置換基を有していてもよい。Ar7が複数存在する場合、それらは同一でも異なっていてもよい。
LB1は、アルキレン基、シクロアルキレン基、アリーレン基、2価の複素環基、-N(R’’’)-で表される基、酸素原子又は硫黄原子を表し、これらの基は置換基を有していてもよい。R’’’は、水素原子、アルキル基、シクロアルキル基、アリール基又は1価の複素環基を表し、これらの基は置換基を有していてもよい。LB1が複数存在する場合、それらは同一でも異なっていてもよい。
X’’は、架橋基、水素原子、アルキル基、シクロアルキル基、アリール基又は1価の複素環基を表し、これらの基は置換基を有していてもよい。複数存在するX’’は、同一でも異なっていてもよい。但し、複数存在するX’’のうち、少なくとも1つは、架橋基である。]
m B1 , m B2 , and m B3 independently represent integers of 0 or more. A plurality of m B1s may be the same or different. If there are multiple m B3s , they may be the same or different.
Ar 7 represents an aromatic hydrocarbon group, a heterocyclic group, or a group in which at least one aromatic hydrocarbon ring and at least one heterocycle are directly bonded, and these groups have a substituent. May be. If there are multiple Ar 7s , they may be the same or different.
LB1 represents an alkylene group, a cycloalkylene group, an arylene group, a divalent heterocyclic group, a group represented by -N (R''')-, an oxygen atom or a sulfur atom, and these groups are substituents. May have. R'''represents a hydrogen atom, an alkyl group, a cycloalkyl group, an aryl group or a monovalent heterocyclic group, and these groups may have a substituent. If there are multiple LB1 , they may be the same or different.
X'' represents a bridging group, a hydrogen atom, an alkyl group, a cycloalkyl group, an aryl group or a monovalent heterocyclic group, and these groups may have a substituent. A plurality of X''s may be the same or different. However, at least one of the plurality of X''s present is a cross-linking group. ]
[6]前記環R1A、前記環R2A及び前記環R3Aが、ベンゼン環、ナフタレン環、アントラセン環、フェナントレン環、トリフェニレン環、ジヒドロフェナントレン環、ナフタセン環、フルオレン環、スピロビフルオレン環、ピレン環、ペリレン環、クリセン環、インデン環、フルオランテン環又はベンゾフルオランテン環(これらの環は置換基を有していてもよい)である、[1]~[5]のいずれかに記載の発光素子。 [6] The ring R 1A , the ring R 2A , and the ring R 3A are a benzene ring, a naphthalene ring, an anthracene ring, a phenanthrene ring, a triphenylene ring, a dihydrophenanthrene ring, a naphthacene ring, a fluorene ring, a spirobifluorene ring, and a pyrene. The ring, a perylene ring, a chrysene ring, an inden ring, a fluoranthene ring or a benzofluoranthene ring (these rings may have a substituent), according to any one of [1] to [5]. Light emitting element.
[7]前記式(1)で表される化合物が、式(1-A)で表される化合物又は式(1-B)で表される化合物である、[1]~[6]のいずれかに記載の発光素子。 [7] Any of [1] to [6], wherein the compound represented by the formula (1) is a compound represented by the formula (1-A) or a compound represented by the formula (1-B). The light emitting element described in Crab.
R11A、R12A、R13A、R14A、R21A、R22A、R23A、R31A、R32A及びR33Aは、水素原子、アルキル基、シクロアルキル基、アルコキシ基、シクロアルコキシ基、アリール基、アリールオキシ基、1価の複素環基、置換アミノ基又はハロゲン原子を表し、これらの基は置換基を有していてもよい。
但し、R11A、R12A、R13A、R14A、R21A、R22A、R23A、R31A、R32A及びR33Aのうちの少なくとも一つは、前記式(1-S)で表される基を有する。
R11AとR12A、R12AとR13A、R13AとR14A、R14AとR31A、R31AとR32A、R32AとR33A、R33AとR23A、R23AとR22A、R22AとR21A、及び、R21AとR11Aは、それぞれ結合して、それぞれが結合する炭素原子とともに環を形成していてもよい。]
R 11A , R 12A , R 13A , R 14A , R 21A , R 22A , R 23A , R 31A , R 32A and R 33A are hydrogen atom, alkyl group, cycloalkyl group, alkoxy group, cycloalkoxy group, aryl group. , Aryloxy group, monovalent heterocyclic group, substituted amino group or halogen atom, and these groups may have a substituent.
However, at least one of R 11A , R 12A , R 13A , R 14A , R 21A , R 22A , R 23A , R 31A , R 32A and R 33A is represented by the above formula (1-S). Has a group.
R 11A and R 12A , R 12A and R 13A , R 13A and R 14A , R 14A and R 31A , R 31A and R 32A , R 32A and R 33A , R 33A and R 23A , R 23A and R 22A , R 22A . And R 21A , and R 21A and R 11A may be bonded to each other to form a ring together with the carbon atom to which each is bonded. ]
R11B、R14B、R15B、R16B、R17B、R18B、R21B、R22B、R23B、R31B、R32B及びR33Bは、水素原子、アルキル基、シクロアルキル基、アルコキシ基、シクロアルコキシ基、アリール基、アリールオキシ基、1価の複素環基、置換アミノ基又はハロゲン原子を表し、これらの基は置換基を有していてもよい。
但し、R11B、R14B、R15B、R16B、R17B、R18B、R21B、R22B、R23B、R31B、R32B及びR33Bのうちの少なくとも一つは、前記式(1-S)で表される基を有する。
R11BとR15B、R15BとR16B、R16BとR17B、R17BとR18B、R18BとR14B、R14BとR31B、R31BとR32B、R32BとR33B、R33BとR23B、R23BとR22B、R22BとR21B、及び、R21BとR11Bは、それぞれ結合して、それぞれが結合する炭素原子とともに環を形成していてもよい。]
R 11B , R 14B , R 15B , R 16B , R 17B , R 18B , R 21B , R 22B , R 23B , R 31B , R 32B and R 33B are hydrogen atoms, alkyl groups, cycloalkyl groups, alkoxy groups, It represents a cycloalkoxy group, an aryl group, an aryloxy group, a monovalent heterocyclic group, a substituted amino group or a halogen atom, and these groups may have a substituent.
However, at least one of R 11B , R 14B , R 15B , R 16B , R 17B , R 18B , R 21B , R 22B , R 23B , R 31B , R 32B and R 33B is the above-mentioned formula (1-). It has a group represented by S).
R 11B and R 15B , R 15B and R 16B , R 16B and R 17B , R 17B and R 18B , R 18B and R 14B , R 14B and R 31B , R 31B and R 32B , R 32B and R 33B , R 33B . And R 23B , R 23B and R 22B , R 22B and R 21B , and R 21B and R 11B , respectively, may be bonded to form a ring together with the carbon atom to which each is bonded. ]
[8]前記Ar1Sが、ナフタレン環、アントラセン環、フェナントレン環、ジヒドロフェナントレン環、トリフェニレン環、ナフタセン環、フルオレン環、スピロビフルオレン環、ピレン環、ペリレン環、クリセン環、インデン環、フルオランテン環又はベンゾフルオランテン環から、環を構成する炭素原子に直接結合する水素原子1個を除いてなる基(該基は置換基を有していてもよい)である、[1]~[7]のいずれかに記載の発光素子。 [8] The Ar 1S is a naphthalene ring, anthracene ring, phenanthrene ring, dihydrophenanthrene ring, triphenylene ring, naphthacene ring, fluorene ring, spirobifluorene ring, pyrene ring, perylene ring, chrysene ring, inden ring, fluoranthene ring or A group consisting of a benzofluoranthene ring excluding one hydrogen atom directly bonded to a carbon atom constituting the ring (the group may have a substituent), [1] to [7]. The light emitting element according to any one of.
[9]前記式(1)で表される化合物の発光スペクトルの最大ピーク波長が380nm以上570nm以下である、[1]~[8]のいずれか一項に記載の発光素子。 [9] The light emitting device according to any one of [1] to [8], wherein the maximum peak wavelength of the emission spectrum of the compound represented by the formula (1) is 380 nm or more and 570 nm or less.
[10]前記第1の有機層が、正孔輸送材料、正孔注入材料、電子輸送材料、電子注入材料、酸化防止剤及び発光材料からなる群より選ばれる少なくとも1種の材料を更に含有する、[1]~[9]のいずれかに記載の発光素子。 [10] The first organic layer further contains at least one material selected from the group consisting of a hole transport material, a hole injection material, an electron transport material, an electron injection material, an antioxidant and a light emitting material. , [1] to any one of [9].
[11]前記第1の有機層と、前記第2の有機層とが、隣接している、[1]~[10]のいずれかに記載の発光素子。 [11] The light emitting device according to any one of [1] to [10], wherein the first organic layer and the second organic layer are adjacent to each other.
[12]前記第2の有機層が、前記陽極及び前記第1の有機層との間に設けられた層である、[1]~[11]のいずれかに記載の発光素子。 [12] The light emitting device according to any one of [1] to [11], wherein the second organic layer is a layer provided between the anode and the first organic layer.
[13]陽極と、陰極と、陽極及び陰極の間に設けられた、第1の有機層及び第2の有機層とを、有する発光素子の製造方法であって、
第1の有機層が、式(1)で表される化合物を含有する層であり、
第2の有機層が、架橋材料の架橋体を含有する層であり、
第2の有機層を形成するための架橋材料を湿式法により成膜する工程、
成膜した第2の有機層を架橋させる工程、及び
架橋した第2の有機層の上に湿式法により有機層を成膜する工程を包含する、発光素子の製造方法。
[13] A method for manufacturing a light emitting device having an anode, a cathode, and a first organic layer and a second organic layer provided between the anode and the cathode.
The first organic layer is a layer containing a compound represented by the formula (1).
The second organic layer is a layer containing a crosslinked body of a crosslinking material.
A step of forming a crosslinked material for forming a second organic layer by a wet method,
A method for manufacturing a light emitting device, comprising a step of cross-linking the formed second organic layer and a step of forming an organic layer on the cross-linked second organic layer by a wet method.
[14]架橋した第2の有機層の上に湿式法により成膜される有機層が第1の有機層である、[13]に記載の発光素子の製造方法。 [14] The method for manufacturing a light emitting device according to [13], wherein the organic layer formed on the crosslinked second organic layer by a wet method is the first organic layer.
本発明によれば、発光効率に優れる発光素子を提供することができる。 According to the present invention, it is possible to provide a light emitting element having excellent luminous efficiency.
以下、本発明の好適な実施形態について詳細に説明する。 Hereinafter, preferred embodiments of the present invention will be described in detail.
<共通する用語の説明>
本明細書で共通して用いられる用語は、特記しない限り、以下の意味である。
<Explanation of common terms>
Unless otherwise specified, the terms commonly used in the present specification have the following meanings.
Meはメチル基、Etはエチル基、Buはブチル基、i-Prはイソプロピル基、t-Buはtert-ブチル基を表す。 Me is a methyl group, Et is an ethyl group, Bu is a butyl group, i-Pr is an isopropyl group, and t-Bu is a tert-butyl group.
水素原子は、重水素原子であっても、軽水素原子であってもよい。 The hydrogen atom may be a deuterium atom or a light hydrogen atom.
金属錯体を表す式中、中心金属との結合を表す実線は、共有結合又は配位結合を意味する。 In the formula representing the metal complex, the solid line representing the bond with the central metal means a covalent bond or a coordinate bond.
「高分子化合物」とは、分子量分布を有し、ポリスチレン換算の数平均分子量が1×103~1×108である重合体を意味する。 The “polymer compound” means a polymer having a molecular weight distribution and having a polystyrene-equivalent number average molecular weight of 1 × 10 3 to 1 × 10 8 .
「低分子化合物」とは、分子量分布を有さず、分子量が1×104以下の化合物を意味する。 "Small molecule compound" means a compound having no molecular weight distribution and having a molecular weight of 1 × 10 4 or less.
「構成単位」とは、高分子化合物中に1個以上存在する単位を意味する。 The “constituent unit” means a unit existing in one or more in a polymer compound.
「アルキル基」は、直鎖及び分岐のいずれでもよい。直鎖のアルキル基の炭素原子数は、置換基の炭素原子数を含めないで、通常1~50であり、好ましくは3~30であり、より好ましくは4~20である。分岐のアルキル基の炭素原子数は、置換基の炭素原子数を含めないで、通常3~50であり、好ましくは3~30であり、より好ましくは4~20である。
アルキル基は、置換基を有していてもよく、例えば、メチル基、エチル基、プロピル基、イソプロピル基、ブチル基、2-ブチル基、イソブチル基、tert-ブチル基、ペンチル基、イソアミル基、2-エチルブチル基、ヘキシル基、ヘプチル基、オクチル基、2-エチルヘキシル基、3-プロピルヘプチル基、デシル基、3,7-ジメチルオクチル基、2-エチルオクチル基、2-ヘキシルデシル基、ドデシル基、及び、これらの基における水素原子が、シクロアルキル基、アルコキシ基、シクロアルコキシ基、アリール基、フッ素原子等で置換された基が挙げられ、例えば、トリフルオロメチル基、ペンタフルオロエチル基、パーフルオロブチル基、パーフルオロヘキシル基、パーフルオロオクチル基、3-フェニルプロピル基、3-(4-メチルフェニル)プロピル基、3-(3,5-ジ-ヘキシルフェニル)プロピル基、6-エチルオキシヘキシル基が挙げられる。
「シクロアルキル基」の炭素原子数は、置換基の炭素原子数を含めないで、通常3~50であり、好ましくは3~30であり、より好ましくは4~20である。
シクロアルキル基は、置換基を有していてもよく、例えば、シクロヘキシル基、シクロヘキシルメチル基、シクロヘキシルエチル基が挙げられる。
The "alkyl group" may be either linear or branched. The number of carbon atoms of the linear alkyl group is usually 1 to 50, preferably 3 to 30, and more preferably 4 to 20, not including the number of carbon atoms of the substituent. The number of carbon atoms of the branched alkyl group is usually 3 to 50, preferably 3 to 30, and more preferably 4 to 20, not including the number of carbon atoms of the substituent.
The alkyl group may have a substituent, for example, a methyl group, an ethyl group, a propyl group, an isopropyl group, a butyl group, a 2-butyl group, an isobutyl group, a tert-butyl group, a pentyl group, an isoamyl group, and the like. 2-Ethylbutyl group, hexyl group, heptyl group, octyl group, 2-ethylhexyl group, 3-propylheptyl group, decyl group, 3,7-dimethyloctyl group, 2-ethyloctyl group, 2-hexyldecyl group, dodecyl group. , And a group in which the hydrogen atom in these groups is substituted with a cycloalkyl group, an alkoxy group, a cycloalkoxy group, an aryl group, a fluorine atom or the like, and examples thereof include a trifluoromethyl group, a pentafluoroethyl group and a per. Fluorobutyl group, perfluorohexyl group, perfluorooctyl group, 3-phenylpropyl group, 3- (4-methylphenyl) propyl group, 3- (3,5-di-hexylphenyl) propyl group, 6-ethyloxy A hexyl group can be mentioned.
The number of carbon atoms of the "cycloalkyl group" is usually 3 to 50, preferably 3 to 30, and more preferably 4 to 20 without including the number of carbon atoms of the substituent.
The cycloalkyl group may have a substituent, and examples thereof include a cyclohexyl group, a cyclohexylmethyl group, and a cyclohexylethyl group.
「アリール基」は、芳香族炭化水素から環を構成する炭素原子に直接結合する水素原子1個を除いた残りの原子団を意味する。アリール基の炭素原子数は、置換基の炭素原子数を含めないで、通常6~60であり、好ましくは6~20であり、より好ましくは6~10である。
アリール基は、置換基を有していてもよく、例えば、フェニル基、1-ナフチル基、2-ナフチル基、1-アントラセニル基、2-アントラセニル基、9-アントラセニル基、1-ピレニル基、2-ピレニル基、4-ピレニル基、2-フルオレニル基、3-フルオレニル基、4-フルオレニル基、2-フェニルフェニル基、3-フェニルフェニル基、4-フェニルフェニル基、及び、これらの基における水素原子が、アルキル基、シクロアルキル基、アルコキシ基、シクロアルコキシ基、アリール基、フッ素原子等で置換された基が挙げられる。
"Aryl group" means the remaining atomic group excluding one hydrogen atom directly bonded to a carbon atom constituting a ring from an aromatic hydrocarbon. The number of carbon atoms of the aryl group is usually 6 to 60, preferably 6 to 20, and more preferably 6 to 10, not including the number of carbon atoms of the substituent.
The aryl group may have a substituent, for example, a phenyl group, a 1-naphthyl group, a 2-naphthyl group, a 1-anthrasenyl group, a 2-anthrasenyl group, a 9-anthrasenyl group, a 1-pyrenyl group, 2 -Pyrenyl group, 4-pyrenyl group, 2-fluorenyl group, 3-fluorenyl group, 4-fluorenyl group, 2-phenylphenyl group, 3-phenylphenyl group, 4-phenylphenyl group, and hydrogen atoms in these groups. However, examples thereof include a group substituted with an alkyl group, a cycloalkyl group, an alkoxy group, a cycloalkoxy group, an aryl group, a fluorine atom and the like.
「アルコキシ基」は、直鎖及び分岐のいずれでもよい。直鎖のアルコキシ基の炭素原子数は、置換基の炭素原子数を含めないで、通常1~40であり、好ましくは4~10である。
分岐のアルコキシ基の炭素原子数は、置換基の炭素原子数を含めないで、通常3~40であり、好ましくは4~10である。
アルコキシ基は、置換基を有していてもよく、例えば、メトキシ基、エトキシ基、プロピルオキシ基、イソプロピルオキシ基、ブチルオキシ基、イソブチルオキシ基、tert-ブチルオキシ基、ペンチルオキシ基、ヘキシルオキシ基、ヘプチルオキシ基、オクチルオキシ基、2-エチルヘキシルオキシ基、ノニルオキシ基、デシルオキシ基、3,7-ジメチルオクチルオキシ基、ラウリルオキシ基、及び、これらの基における水素原子が、シクロアルキル基、アルコキシ基、シクロアルコキシ基、アリール基、フッ素原子等で置換された基が挙げられる。
「シクロアルコキシ基」の炭素原子数は、置換基の炭素原子数を含めないで、通常3~40であり、好ましくは4~10である。
シクロアルコキシ基は、置換基を有していてもよく、例えば、シクロヘキシルオキシ基が挙げられる。
The "alkoxy group" may be either linear or branched. The number of carbon atoms of the linear alkoxy group is usually 1 to 40, preferably 4 to 10, not including the number of carbon atoms of the substituent.
The number of carbon atoms of the branched alkoxy group is usually 3 to 40, preferably 4 to 10, not including the number of carbon atoms of the substituent.
The alkoxy group may have a substituent, for example, a methoxy group, an ethoxy group, a propyloxy group, an isopropyloxy group, a butyloxy group, an isobutyloxy group, a tert-butyloxy group, a pentyloxy group, a hexyloxy group, and the like. Heptyloxy group, octyloxy group, 2-ethylhexyloxy group, nonyloxy group, decyloxy group, 3,7-dimethyloctyloxy group, lauryloxy group, and the hydrogen atom in these groups is cycloalkyl group, alkoxy group, Examples thereof include a cycloalkoxy group, an aryl group, a group substituted with a fluorine atom and the like.
The number of carbon atoms of the "cycloalkoxy group" is usually 3 to 40, preferably 4 to 10, not including the number of carbon atoms of the substituent.
The cycloalkoxy group may have a substituent, and examples thereof include a cyclohexyloxy group.
「アリールオキシ基」の炭素原子数は、置換基の炭素原子数を含めないで、通常6~60であり、好ましくは6~48である。
アリールオキシ基は、置換基を有していてもよく、例えば、フェノキシ基、1-ナフチルオキシ基、2-ナフチルオキシ基、1-アントラセニルオキシ基、9-アントラセニルオキシ基、1-ピレニルオキシ基、及び、これらの基における水素原子が、アルキル基、シクロアルキル基、アルコキシ基、シクロアルコキシ基、フッ素原子等で置換された基が挙げられる。
The number of carbon atoms of the "aryloxy group" is usually 6 to 60, preferably 6 to 48, not including the number of carbon atoms of the substituent.
The aryloxy group may have a substituent, for example, a phenoxy group, a 1-naphthyloxy group, a 2-naphthyloxy group, a 1-anthrasenyloxy group, a 9-anthrasenyloxy group, 1-. Examples thereof include a pyrenyloxy group and a group in which the hydrogen atom in these groups is substituted with an alkyl group, a cycloalkyl group, an alkoxy group, a cycloalkoxy group, a fluorine atom or the like.
「p価の複素環基」(pは、1以上の整数を表す。)とは、複素環式化合物から、環を構成する炭素原子又はヘテロ原子に直接結合している水素原子のうちp個の水素原子を除いた残りの原子団を意味する。p価の複素環基の中でも、芳香族複素環式化合物から、環を構成する炭素原子又はヘテロ原子に直接結合している水素原子のうちp個の水素原子を除いた残りの原子団である「p価の芳香族複素環基」が好ましい。
「芳香族複素環式化合物」は、オキサジアゾール、チアジアゾール、チアゾール、オキサゾール、チオフェン、ピロール、ホスホール、フラン、ピリジン、ピラジン、ピリミジン、トリアジン、ピリダジン、キノリン、イソキノリン、カルバゾール、ジベンゾホスホール等の複素環自体が芳香族性を示す化合物、及び、フェノキサジン、フェノチアジン、ジベンゾボロール、ジベンゾシロール、ベンゾピラン等の複素環自体は芳香族性を示さなくとも、複素環に芳香環が縮合されている化合物を意味する。
A "p-valent heterocyclic group" (p represents an integer of 1 or more) is p of hydrogen atoms directly bonded to a carbon atom or a hetero atom constituting a ring from a heterocyclic compound. It means the remaining atomic group excluding the hydrogen atom of. Among the p-valent heterocyclic groups, it is the remaining atomic group obtained by removing p hydrogen atoms from the hydrogen atoms directly bonded to the carbon atoms or heteroatoms constituting the ring from the aromatic heterocyclic compound. A "p-valent aromatic heterocyclic group" is preferred.
The "aromatic heterocyclic compound" is a complex such as oxadiazole, thiadiazole, thiazole, oxazole, thiophene, pyrrole, phosphor, furan, pyridine, pyrazine, pyrimidine, triazine, pyridazine, quinoline, isoquinolin, carbazole, dibenzophosphol and the like. A compound in which the ring itself exhibits aromaticity, and a compound in which an aromatic ring is condensed into the heterocycle even if the heterocycle itself such as phenoxazine, phenothiazine, dibenzoborol, dibenzosilol, and benzopyran does not exhibit aromaticity. Means.
1価の複素環基の炭素原子数は、置換基の炭素原子数を含めないで、通常、2~60であり、好ましくは4~20である。
1価の複素環基は、置換基を有していてもよく、例えば、チエニル基、ピロリル基、フリル基、ピリジル基、ピペリジニル基、キノリニル基、イソキノリニル基、ピリミジニル基、トリアジニル基、及び、これらの基における水素原子が、アルキル基、シクロアルキル基、アルコキシ基、シクロアルコキシ基等で置換された基が挙げられる。
The number of carbon atoms of the monovalent heterocyclic group does not include the number of carbon atoms of the substituent and is usually 2 to 60, preferably 4 to 20.
The monovalent heterocyclic group may have a substituent, for example, a thienyl group, a pyrrolyl group, a fryl group, a pyridyl group, a piperidinyl group, a quinolinyl group, an isoquinolinyl group, a pyrimidinyl group, a triazinyl group, and these. Examples thereof include a group in which the hydrogen atom in the group is substituted with an alkyl group, a cycloalkyl group, an alkoxy group, a cycloalkoxy group or the like.
「ハロゲン原子」とは、フッ素原子、塩素原子、臭素原子又はヨウ素原子を示す。 The "halogen atom" refers to a fluorine atom, a chlorine atom, a bromine atom or an iodine atom.
「アミノ基」は、置換基を有していてもよく、置換アミノ基が好ましい。アミノ基が有する置換基としては、アルキル基、シクロアルキル基、アリール基又は1価の複素環基が好ましい。
置換アミノ基としては、例えば、ジアルキルアミノ基、ジシクロアルキルアミノ基及びジアリールアミノ基が挙げられる。
アミノ基としては、例えば、ジメチルアミノ基、ジエチルアミノ基、ジフェニルアミノ基、ビス(4-メチルフェニル)アミノ基、ビス(4-tert-ブチルフェニル)アミノ基、ビス(3,5-ジ-tert-ブチルフェニル)アミノ基が挙げられる。
The "amino group" may have a substituent, and a substituted amino group is preferable. As the substituent contained in the amino group, an alkyl group, a cycloalkyl group, an aryl group or a monovalent heterocyclic group is preferable.
Examples of the substituted amino group include a dialkylamino group, a dicycloalkylamino group and a diarylamino group.
Examples of the amino group include a dimethylamino group, a diethylamino group, a diphenylamino group, a bis (4-methylphenyl) amino group, a bis (4-tert-butylphenyl) amino group, and a bis (3,5-di-tert-). Butylphenyl) amino groups can be mentioned.
「アルケニル基」は、直鎖及び分岐のいずれでもよい。直鎖のアルケニル基の炭素原子数は、置換基の炭素原子数を含めないで、通常2~30であり、好ましくは3~20である。
分岐のアルケニル基の炭素原子数は、置換基の炭素原子数を含めないで、通常3~30であり、好ましくは4~20である。
「シクロアルケニル基」の炭素原子数は、置換基の炭素原子数を含めないで、通常3~30であり、好ましくは4~20である。
アルケニル基及びシクロアルケニル基は、置換基を有していてもよく、例えば、ビニル基、1-プロペニル基、2-プロペニル基、2-ブテニル基、3-ブテニル基、3-ペンテニル基、4-ペンテニル基、1-ヘキセニル基、5-ヘキセニル基、7-オクテニル基、及び、これらの基が置換基を有する基が挙げられる。
The "alkenyl group" may be either linear or branched. The number of carbon atoms of the linear alkenyl group is usually 2 to 30, preferably 3 to 20, not including the number of carbon atoms of the substituent.
The number of carbon atoms of the branched alkenyl group is usually 3 to 30, preferably 4 to 20, not including the number of carbon atoms of the substituent.
The number of carbon atoms of the "cycloalkenyl group" is usually 3 to 30, preferably 4 to 20, not including the number of carbon atoms of the substituent.
The alkenyl group and the cycloalkenyl group may have a substituent, for example, a vinyl group, a 1-propenyl group, a 2-propenyl group, a 2-butenyl group, a 3-butenyl group, a 3-pentenyl group, a 4- Examples thereof include a pentenyl group, a 1-hexenyl group, a 5-hexenyl group, a 7-octenyl group, and a group in which these groups have a substituent.
「アルキニル基」は、直鎖及び分岐のいずれでもよい。アルキニル基の炭素原子数は、置換基の炭素原子を含めないで、通常2~20であり、好ましくは3~20である。分岐のアルキニル基の炭素原子数は、置換基の炭素原子を含めないで、通常4~30であり、好ましくは4~20である。
「シクロアルキニル基」の炭素原子数は、置換基の炭素原子を含めないで、通常4~30であり、好ましくは4~20である。
アルキニル基及びシクロアルキニル基は、置換基を有していてもよく、例えば、エチニル基、1-プロピニル基、2-プロピニル基、2-ブチニル基、3-ブチニル基、3-ペンチニル基、4-ペンチニル基、1-ヘキシニル基、5-ヘキシニル基、及び、これらの基が置換基を有する基が挙げられる。
The "alkynyl group" may be either linear or branched. The number of carbon atoms of the alkynyl group is usually 2 to 20, preferably 3 to 20, without including the carbon atom of the substituent. The number of carbon atoms of the branched alkynyl group is usually 4 to 30, preferably 4 to 20, without including the carbon atom of the substituent.
The number of carbon atoms of the "cycloalkynyl group" is usually 4 to 30, preferably 4 to 20, without including the carbon atom of the substituent.
The alkynyl group and the cycloalkynyl group may have a substituent, for example, an ethynyl group, a 1-propynyl group, a 2-propynyl group, a 2-butynyl group, a 3-butynyl group, a 3-pentynyl group, a 4-. Examples thereof include a pentynyl group, a 1-hexynyl group, a 5-hexynyl group, and a group in which these groups have a substituent.
「アリーレン基」は、芳香族炭化水素から環を構成する炭素原子に直接結合する水素原子2個を除いた残りの原子団を意味する。アリーレン基の炭素原子数は、置換基の炭素原子数を含めないで、通常、6~60であり、好ましくは6~30であり、より好ましくは6~18である。
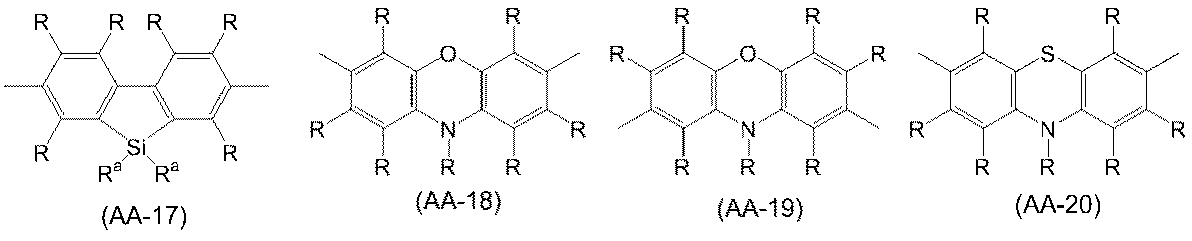
アリーレン基は、置換基を有していてもよく、例えば、フェニレン基、ナフタレンジイル基、アントラセンジイル基、フェナントレンジイル基、ジヒドロフェナントレンジイル基、ナフタセンジイル基、フルオレンジイル基、ピレンジイル基、ペリレンジイル基、クリセンジイル基、及び、これらの基が置換基を有する基が挙げられ、好ましくは、式(A-1)~式(A-20)で表される基である。アリーレン基は、これらの基が複数結合した基を含む。
The "arylene group" means the remaining atomic group excluding the two hydrogen atoms directly bonded to the carbon atoms constituting the ring from the aromatic hydrocarbon. The number of carbon atoms of the arylene group is usually 6 to 60, preferably 6 to 30, and more preferably 6 to 18, not including the number of carbon atoms of the substituent.
The arylene group may have a substituent, for example, a phenylene group, a naphthalenediyl group, an anthrasendiyl group, a phenantrenidyl group, a dihydrophenantrenidyl group, a naphthacendyl group, a full orangeyl group, a pyrenylyl group, a perylenediyl group, and the like. Examples thereof include a chrysendiyl group and a group in which these groups have a substituent, and the groups represented by the formulas (A-1) to (A-20) are preferable. The arylene group includes a group in which a plurality of these groups are bonded.
2価の複素環基の炭素原子数は、置換基の炭素原子数を含めないで、通常、2~60であり、好ましくは、3~20であり、より好ましくは、4~15である。
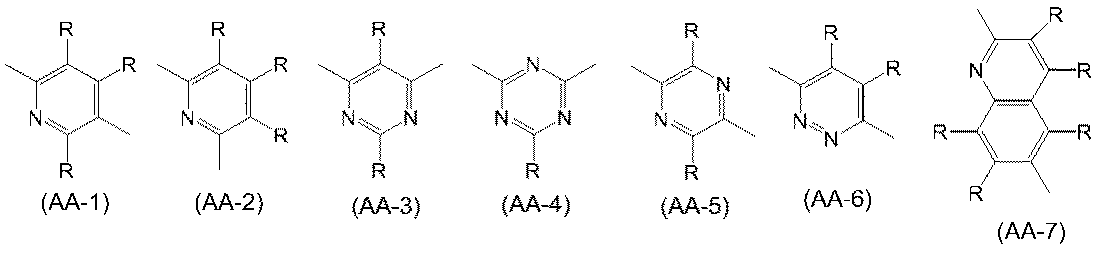
2価の複素環基は、置換基を有していてもよく、例えば、ピリジン、ジアザベンゼン、トリアジン、アザナフタレン、ジアザナフタレン、カルバゾール、ジベンゾフラン、ジベンゾチオフェン、ジベンゾシロール、フェノキサジン、フェノチアジン、アクリジン、ジヒドロアクリジン、フラン、チオフェン、アゾール、ジアゾール、トリアゾールから、環を構成する炭素原子又はヘテロ原子に直接結合している水素原子のうち2個の水素原子を除いた2価の基が挙げられ、好ましくは、式(AA-1)~式(AA-34)で表される基である。2価の複素環基は、これらの基が複数結合した基を含む。
The number of carbon atoms of the divalent heterocyclic group does not include the number of carbon atoms of the substituent and is usually 2 to 60, preferably 3 to 20, and more preferably 4 to 15.
The divalent heterocyclic group may have a substituent, for example, pyridine, diazabenzene, triazine, azanaphthalene, diazanaphthalene, carbazole, dibenzofuran, dibenzothiophene, dibenzosilol, phenoxazine, phenothiazine, acrydin, Examples thereof include divalent groups obtained by removing two hydrogen atoms from dihydroaclydin, furan, thiophene, azole, diazole, and triazole from the hydrogen atoms directly bonded to the carbon atom or hetero atom constituting the ring. Is a group represented by the formulas (AA-1) to (AA-34). A divalent heterocyclic group includes a group in which a plurality of these groups are bonded.
「架橋基」とは、加熱、紫外線照射、近紫外線照射、可視光照射、赤外線照射、ラジカル反応等に供することにより、新たな結合を生成することが可能な基であり、好ましくは、架橋基A群の式(XL-1)~(XL-17)で表される架橋基である。 The "crosslinking group" is a group capable of forming a new bond by being subjected to heating, ultraviolet irradiation, near-ultraviolet irradiation, visible light irradiation, infrared irradiation, radical reaction, etc., and is preferably a crosslinking group. It is a cross-linking group represented by the formulas (XL-1) to (XL-17) of group A.
「置換基」とは、ハロゲン原子、シアノ基、アルキル基、シクロアルキル基、アリール基、1価の複素環基、アルコキシ基、シクロアルコキシ基、アリールオキシ基、アミノ基、置換アミノ基、アルケニル基、シクロアルケニル基、アルキニル基又はシクロアルキニル基を表す。置換基は架橋基であってもよい。 The "substituted group" is a halogen atom, a cyano group, an alkyl group, a cycloalkyl group, an aryl group, a monovalent heterocyclic group, an alkoxy group, a cycloalkoxy group, an aryloxy group, an amino group, a substituted amino group and an alkenyl group. , Cycloalkenyl group, alkynyl group or cycloalkynyl group. The substituent may be a cross-linking group.
<発光素子>
次に、本発明の発光素子について説明する。
<Light emitting element>
Next, the light emitting device of the present invention will be described.
本発明の発光素子は、陽極と、陰極と、陽極及び陰極の間に設けられた第1の有機層及び第2の有機層と、を有する発光素子であり、第1の有機層が式(1)で表される化合物を含有する層であり、第2の有機層が架橋材料の架橋体を含有する層である、発光素子である。 The light emitting device of the present invention is a light emitting device having an anode, a cathode, and a first organic layer and a second organic layer provided between the anode and the cathode, and the first organic layer is of the formula (1). It is a light emitting device which is a layer containing the compound represented by 1), and the second organic layer is a layer containing a crosslinked body of a crosslinking material.
第1の有機層及び第2の有機層の形成方法としては、例えば、真空蒸着法等の乾式法、並びに、スピンコート法及びインクジェット印刷法等の湿式法が挙げられ、湿式法が好ましい。 Examples of the method for forming the first organic layer and the second organic layer include a dry method such as a vacuum vapor deposition method and a wet method such as a spin coating method and an inkjet printing method, and the wet method is preferable.
第1の有機層を湿式法により形成する場合、後述する第1のインクを用いることが好ましい。 When the first organic layer is formed by a wet method, it is preferable to use the first ink described later.
第2の有機層を湿式法により形成する場合、後述する第2のインクを用いることが好ましい。第2の有機層を形成後、加熱又は光照射することで、第2の有機層に含有される架橋材料を架橋させることができ、加熱することで、第2の有機層に含有される架橋材料を架橋させることが好ましい。架橋材料が架橋した状態(架橋材料の架橋体)で、第2の有機層に含有されている場合、第2の有機層は溶媒に対して実質的に不溶化されている。そのため、第2の有機層は、発光素子の積層化に好適に使用することができる。 When the second organic layer is formed by the wet method, it is preferable to use the second ink described later. After forming the second organic layer, the cross-linking material contained in the second organic layer can be cross-linked by heating or irradiating with light, and by heating, the cross-linking contained in the second organic layer can be cross-linked. It is preferable to crosslink the material. When the crosslinked material is contained in the second organic layer in a state of being crosslinked (crosslinked body of the crosslinked material), the second organic layer is substantially insoluble in the solvent. Therefore, the second organic layer can be suitably used for laminating light emitting elements.
架橋させるための加熱の温度は、通常、25℃~300℃であり、好ましくは50℃~250℃であり、より好ましくは150℃~200℃であり、更に好ましくは170℃~190℃である。
架橋させるための加熱の時間は、通常、0.1分~1000分であり、好ましくは0.5分~500分であり、より好ましくは1分~120分であり、更に好ましくは30分~90分である。
The heating temperature for crosslinking is usually 25 ° C. to 300 ° C., preferably 50 ° C. to 250 ° C., more preferably 150 ° C. to 200 ° C., and even more preferably 170 ° C. to 190 ° C. ..
The heating time for crosslinking is usually 0.1 to 1000 minutes, preferably 0.5 to 500 minutes, more preferably 1 to 120 minutes, still more preferably 30 to 90 minutes. ..
光照射に用いられる光の種類は、例えば、紫外光、近紫外光、可視光である。 The types of light used for light irradiation are, for example, ultraviolet light, near-ultraviolet light, and visible light.
第1の有機層又は第2の有機層に含有される成分の分析方法としては、例えば、抽出等の化学的分離分析法、赤外分光法(IR)、核磁気共鳴分光法(NMR)、質量分析法(MS)等の機器分析法、並びに、化学的分離分析法及び機器分析法を組み合わせた分析法が挙げられる。 Examples of the method for analyzing the components contained in the first organic layer or the second organic layer include a chemical separation analysis method such as extraction, infrared spectroscopy (IR), nuclear magnetic resonance spectroscopy (NMR), and the like. Instrumental analysis methods such as mass spectrometry (MS), and analysis methods that combine chemical separation analysis methods and instrumental analysis methods can be mentioned.
第1の有機層又は第2の有機層に対して、トルエン、キシレン、クロロホルム、テトラヒドロフラン等の有機溶媒を用いた固液抽出を行うことで、有機溶媒に対して実質的に不溶な成分(不溶成分)と、有機溶媒に対して溶解する成分(溶解成分)とに分離することが可能である。不溶成分は赤外分光法又は核磁気共鳴分光法により分析することが可能であり、溶解成分は核磁気共鳴分光法又は質量分析法により分析することが可能である。 By performing solid-liquid extraction of the first organic layer or the second organic layer using an organic solvent such as toluene, xylene, chloroform, or tetrahydrofuran, a component (insoluble) that is substantially insoluble in the organic solvent (insoluble). It is possible to separate a component) and a component (dissolving component) that dissolves in an organic solvent. The insoluble component can be analyzed by infrared spectroscopy or nuclear magnetic resonance spectroscopy, and the dissolved component can be analyzed by nuclear magnetic resonance spectroscopy or mass analysis.
<第1の有機層>
次に、本発明の発光素子が有する第1の有機層について説明する。
第1の有機層は、式(1)で表される化合物を含有する層である。
<First organic layer>
Next, the first organic layer included in the light emitting device of the present invention will be described.
The first organic layer is a layer containing a compound represented by the formula (1).
<式(1)で表される化合物>
次に、式(1)で表される化合物について、説明する。式(1)で表される化合物は発光材料である。第1の有機層には、式(1)で表される化合物が1種単独で含有されていてもよく、2種以上含有されていてもよい。
<Compound represented by the formula (1)>
Next, the compound represented by the formula (1) will be described. The compound represented by the formula (1) is a light emitting material. The first organic layer may contain one compound represented by the formula (1) alone, or may contain two or more compounds.
式(1)で表される化合物の発光スペクトルの最大ピーク波長は、好ましくは380nm以上570nm以下であり、より好ましくは390nm以上520nm以下であり、更に好ましくは400nm以上500nm以下であり、特に好ましくは420nm以上480nm以下である。 The maximum peak wavelength of the emission spectrum of the compound represented by the formula (1) is preferably 380 nm or more and 570 nm or less, more preferably 390 nm or more and 520 nm or less, still more preferably 400 nm or more and 500 nm or less, and particularly preferably. It is 420 nm or more and 480 nm or less.
式(1)で表される化合物の発光スペクトルの最大ピーク波長は、式(1)で表される化合物を、キシレン、トルエン、クロロホルム、テトラヒドロフラン等の有機溶媒に溶解させ、希薄溶液を調製し(1×10-6~1×10-3wt%程度)、該希薄溶液のPLスペクトルを室温で測定することで評価することができる。式(1)で表される化合物を溶解させる有機溶媒としては、トルエンが好ましい。 For the maximum peak wavelength of the emission spectrum of the compound represented by the formula (1), the compound represented by the formula (1) is dissolved in an organic solvent such as xylene, toluene, chloroform, or tetrahydrofuran to prepare a dilute solution (dilute solution). It can be evaluated by measuring the PL spectrum of the dilute solution at room temperature (about 1 × 10 -6 to 1 × 10 -3 wt%). Toluene is preferable as the organic solvent for dissolving the compound represented by the formula (1).
環R1A、環R2A及び環R3Aにおける芳香族炭化水素環の炭素原子数は、置換基の炭素原子数を含めないで、通常6~60であり、好ましくは6~30であり、より好ましくは6~20である。 The number of carbon atoms of the aromatic hydrocarbon ring in rings R 1A , ring R 2A and ring R 3A is usually 6 to 60, preferably 6 to 30, not including the number of carbon atoms of the substituent, and more. It is preferably 6 to 20.
環R1A、環R2A及び環R3Aとしては、ベンゼン環、ナフタレン環、アントラセン環、フェナントレン環、トリフェニレン環、ジヒドロフェナントレン環、ナフタセン環、フルオレン環、スピロビフルオレン環、ピレン環、ペリレン環、クリセン環、インデン環、フルオランテン環及びベンゾフルオランテン環が挙げられ、本発明の発光素子の発光効率が優れるので、ベンゼン環、ナフタレン環、アントラセン環、フェナントレン環、フルオレン環、スピロビフルオレン環又はピレン環が好ましく、ベンゼン環、ナフタレン環、アントラセン環又はフェナントレン環がより好ましく、ベンゼン環又はナフタレン環が更に好ましく、これらの環は置換基を有していてもよい。 Rings R 1A , ring R 2A and ring R 3A include a benzene ring, a naphthalene ring, an anthracene ring, a phenanthrene ring, a triphenylene ring, a dihydrophenanthrene ring, a naphthacene ring, a fluorene ring, a spirobifluorene ring, a pyrene ring and a perylene ring. Examples thereof include a chrysen ring, an inden ring, a fluoranthene ring and a benzofluorentene ring, and since the light emitting element of the present invention has excellent light emission efficiency, a benzene ring, a naphthalene ring, an anthracene ring, a phenanthrene ring, a fluorene ring, a spirobifluorene ring or A pyrene ring is preferable, a benzene ring, a naphthalene ring, an anthracene ring or a phenanthrene ring is more preferable, a benzene ring or a phenanthrene ring is more preferable, and these rings may have a substituent.
環R1Aは、本発明の発光素子の発光効率がより優れるので、置換基を有していてもよいナフタレン環が好ましい。 Ring R 1A is preferably a naphthalene ring which may have a substituent because the luminous efficiency of the light emitting device of the present invention is more excellent.
環R2A及び環R3Aは、本発明の発光素子の発光効率がより優れるので、置換基を有していてもよいベンゼン環が好ましい。 Since the ring R 2A and the ring R 3A have higher luminous efficiency of the light emitting element of the present invention, a benzene ring which may have a substituent is preferable.
環R1A、環R2A及び環R3Aが有していてもよい置換基としては、好ましくは、アルキル基、シクロアルキル基、アリール基、1価の複素環基、アルコキシ基、シクロアルコキシ基、アリールオキシ基、置換アミノ基又はハロゲン原子であり、より好ましくは、アルキル基、シクロアルキル基、アルコキシ基、シクロアルコキシ基、アリール基、1価の複素環基又は置換アミノ基であり、更に好ましくは、アルキル基、シクロアルキル基、アリール基又は1価の複素環基であり、特に好ましくは、アルキル基、シクロアルキル基又はアリール基であり、とりわけ好ましくは、アリール基であり、これらの基は更に置換基を有していてもよい。 The substituents that the ring R 1A , the ring R 2A and the ring R 3A may have are preferably an alkyl group, a cycloalkyl group, an aryl group, a monovalent heterocyclic group, an alkoxy group, a cycloalkoxy group, and the like. It is an aryloxy group, a substituted amino group or a halogen atom, more preferably an alkyl group, a cycloalkyl group, an alkoxy group, a cycloalkoxy group, an aryl group, a monovalent heterocyclic group or a substituted amino group, and further preferably. , An alkyl group, a cycloalkyl group, an aryl group or a monovalent heterocyclic group, particularly preferably an alkyl group, a cycloalkyl group or an aryl group, particularly preferably an aryl group, and these groups are further preferred. It may have a substituent.
環R1A、環R2A及び環R3Aが有していてもよい置換基におけるアリール基の炭素原子数は、置換基の炭素原子数を含めないで、通常6~60であり、好ましくは6~30であり、より好ましくは6~20である。 The number of carbon atoms of the aryl group in the substituents that the ring R 1A , the ring R 2A and the ring R 3A may have is usually 6 to 60, preferably 6 without including the number of carbon atoms of the substituent. It is ~ 30, more preferably 6-20.
環R1A、環R2A及び環R3Aが有していてもよい置換基におけるアリール基としては、ベンゼン環、ナフタレン環、アントラセン環、フェナントレン環、トリフェニレン環、ジヒドロフェナントレン環、ナフタセン環、フルオレン環、スピロビフルオレン環、ピレン環、ペリレン環、クリセン環、インデン環、フルオランテン環及びベンゾフルオランテン環から、環を構成する炭素原子に直接結合する水素原子1個を除いてなる基が挙げられ、好ましくは、ベンゼン環、ナフタレン環、アントラセン環、フェナントレン環、ジヒドロフェナントレン環、フルオレン環、スピロビフルオレン環、ピレン環、フルオランテン環又はベンゾフルオランテン環から、環を構成する炭素原子に直接結合する水素原子1個を除いてなる基であり、より好ましくは、ベンゼン環、ナフタレン環、アントラセン環、フルオレン環、スピロビフルオレン環、フルオランテン環又はベンゾフルオランテン環から、環を構成する炭素原子に直接結合する水素原子1個を除いてなる基であり、更に好ましくは、更に好ましくは、ベンゼン環、ナフタレン環、フルオレン環又はスピロビフルオレン環から、環を構成する炭素原子に直接結合する水素原子1個を除いてなる基であり、特に好ましくは、フェニル基、ナフチル基又はフルオレニル基であり、とりわけ好ましくは、フェニル基であり、これらの基は更に置換基を有していてもよい。 Examples of the aryl group in the substituents that the ring R 1A , the ring R 2A and the ring R 3A may have include a benzene ring, a naphthalene ring, an anthracene ring, a phenanthrene ring, a triphenylene ring, a dihydrophenanthrene ring, a naphthalene ring and a fluorene ring. , Spirovifluorene ring, pyrene ring, perylene ring, chrysen ring, inden ring, fluoranthrene ring and benzofluoranthrene ring, except for one hydrogen atom directly bonded to the carbon atom constituting the ring. , Preferably from a benzene ring, a naphthalene ring, an anthracene ring, a phenanthrene ring, a dihydrophenanthrene ring, a fluorene ring, a spirobifluorene ring, a pyrene ring, a fluoranthene ring or a benzofluorentene ring, directly bonded to a carbon atom constituting the ring. It is a group consisting of a group excluding one hydrogen atom, and more preferably a carbon atom constituting a ring from a benzene ring, a naphthalene ring, an anthracene ring, a fluorene ring, a spirobifluorene ring, a fluoranthrene ring or a benzofluoranthrene ring. It is a group except for one hydrogen atom directly bonded to, and more preferably, hydrogen directly bonded to a carbon atom constituting the ring from a benzene ring, a naphthalene ring, a fluorene ring or a spirobifluorene ring. It is a group excluding one atom, particularly preferably a phenyl group, a naphthyl group or a fluorenyl group, and particularly preferably a phenyl group, and these groups may further have a substituent.
環R1A、環R2A及び環R3Aが有していてもよい置換基における1価の複素環基の炭素原子数は、置換基の炭素原子数を含めないで、通常2~60であり、好ましくは3~30であり、より好ましくは3~20である。 The number of carbon atoms of the monovalent heterocyclic group in the substituents that the ring R 1A , the ring R 2A and the ring R 3A may have is usually 2 to 60, not including the number of carbon atoms of the substituent. , It is preferably 3 to 30, and more preferably 3 to 20.
環R1A、環R2A及び環R3Aが有していてもよい置換基における1価の複素環基としては、例えば、ピロール環、ジアゾール環、トリアゾール環、ピリジン環、ジアザベンゼン環、トリアジン環、アザナフタレン環、ジアザナフタレン環、トリアザナフタレン環、インドール環、カルバゾール環、アザカルバゾール環、ジアザカルバゾール環、ジベンゾフラン環、ジベンゾチオフェン環、フェノキサジン環、フェノチアジン環、アクリジン環、9,10-ジヒドロアクリジン環、アクリドン環、フェナジン環及び5,10-ジヒドロフェナジン環から、環を構成する炭素原子又はヘテロ原子に直接結合する水素原子1個を除いてなる基が挙げられ、好ましくは、ピリジン環、ジアザベンゼン環、トリアジン環、アザナフタレン環、ジアザナフタレン環、カルバゾール環、アザカルバゾール環、ジアザカルバゾール環、ジベンゾフラン環、ジベンゾチオフェン環、フェノキサジン環、フェノチアジン環、9,10-ジヒドロアクリジン環又は5,10-ジヒドロフェナジン環から、環を構成する炭素原子又はヘテロ原子に直接結合する水素原子1個を除いてなる基であり、より好ましくは、ピリジン環、ジアザベンゼン環、トリアジン環、アザナフタレン環、ジアザナフタレン環、カルバゾール環、ジベンゾフラン環又はジベンゾチオフェン環から、環を構成する炭素原子又はヘテロ原子に直接結合する水素原子1個を除いてなる基であり、これらの基は更に置換基を有していてもよい。 Examples of the monovalent heterocyclic group in the substituent that the ring R 1A , the ring R 2A and the ring R 3A may have include a pyrrole ring, a diazole ring, a triazole ring, a pyridine ring, a diazabenzene ring and a triazine ring. Azanaphthalene ring, diazanaphthalene ring, triazanaphthalene ring, indole ring, carbazole ring, azacarbazole ring, diazacarbazole ring, dibenzofuran ring, dibenzothiophene ring, phenoxazine ring, phenothiazine ring, aclydin ring, 9,10- Examples thereof include a group consisting of a dihydroacridin ring, an acridone ring, a phenazine ring and a 5,10-dihydrophenazine ring excluding one hydrogen atom directly bonded to a carbon atom or a heteroatom constituting the ring, and a pyridine ring is preferable. , Diazabenzene ring, triazine ring, azanaphthalene ring, diazanaphthalene ring, carbazole ring, azacarbazole ring, diazacarbazole ring, dibenzofuran ring, dibenzothiophene ring, phenoxazine ring, phenothiazine ring, 9,10-dihydroacridine ring or It is a group consisting of a 5,10-dihydrophenazine ring excluding one hydrogen atom directly bonded to a carbon atom or a heteroatom constituting the ring, and more preferably a pyridine ring, a diazabenzene ring, a triazine ring, or an azanaphthalene ring. , A diazanaphthalene ring, a carbazole ring, a dibenzofuran ring or a dibenzothiophene ring, except for one hydrogen atom directly bonded to a carbon atom or a heteroatom constituting the ring, and these groups further contain a substituent. You may have.
環R1A、環R2A及び環R3Aが有していてもよい置換基における置換アミノ基において、アミノ基が有する置換基としては、アリール基または1価の複素環基が好ましく、アリール基がより好ましく、これらの基は更に置換基を有していてもよい。アミノ基が有する置換基におけるアリール基の例及び好ましい範囲は、環R1A、環R2A及び環R3Aが有していてもよい置換基におけるアリール基の例及び好ましい範囲と同じである。アミノ基が有する置換基における1価の複素環基の例及び好ましい範囲は、環R1A、環R2A及び環R3Aが有していてもよい置換基における1価の複素環基の例及び好ましい範囲と同じである。 Among the substituted amino groups in the substituents that the ring R 1A , the ring R 2A and the ring R 3A may have, the substituent of the amino group is preferably an aryl group or a monovalent heterocyclic group, and the aryl group is preferable. More preferably, these groups may further have substituents. The examples and preferred ranges of aryl groups in the substituents of the amino group are the same as the examples and preferred ranges of aryl groups in the substituents that ring R 1A , ring R 2A and ring R 3A may have. Examples and preferred ranges of monovalent heterocyclic groups in the substituents of the amino group include examples of monovalent heterocyclic groups in the substituents that ring R 1A , ring R 2A and ring R 3A may have. Same as the preferred range.
環R1A、環R2A及び環R3Aが有していてもよい置換基が更に有していてもよい置換基としては、好ましくは、アルキル基、シクロアルキル基、アリール基、1価の複素環基、アルコキシ基、シクロアルコキシ基、アリールオキシ基、置換アミノ基又はハロゲン原子であり、より好ましくは、アルキル基、シクロアルキル基、アルコキシ基、シクロアルコキシ基、アリール基、1価の複素環基又は置換アミノ基であり、更に好ましくは、アルキル基、シクロアルキル基、アリール基又は1価の複素環基であり、特に好ましくは、アルキル基、シクロアルキル基又はアリール基であり、とりわけ好ましくは、アルキル基又はシクロアルキル基であり、これらの基は更に置換基を有していてもよい。 Substituents that may be further possessed by the substituents that the rings R 1A , the ring R 2A and the ring R 3A may have are preferably an alkyl group, a cycloalkyl group, an aryl group, and a monovalent complex. It is a ring group, an alkoxy group, a cycloalkoxy group, an aryloxy group, a substituted amino group or a halogen atom, and more preferably an alkyl group, a cycloalkyl group, an alkoxy group, a cycloalkoxy group, an aryl group or a monovalent heterocyclic group. Alternatively, it is a substituted amino group, more preferably an alkyl group, a cycloalkyl group, an aryl group or a monovalent heterocyclic group, particularly preferably an alkyl group, a cycloalkyl group or an aryl group, and particularly preferably. It is an alkyl group or a cycloalkyl group, and these groups may further have a substituent.
環R1A、環R2A及び環R3Aが有していてもよい置換基が更に有していてもよい置換基におけるアリール基、1価の複素環基及び置換アミノ基の例及び好ましい範囲は、それぞれ、環R1A、環R2A及び環R3Aが有していてもよい置換基におけるアリール基、1価の複素環基及び置換アミノ基の例及び好ましい範囲と同じである。 Examples and preferred ranges of aryl groups, monovalent heterocyclic groups and substituted amino groups in the substituents that the substituents that the rings R 1A , R 2A and R 3A may have may further have. , The examples and preferred ranges of aryl groups, monovalent heterocyclic groups and substituted amino groups in the substituents that ring R 1A , ring R 2A and ring R 3A may have, respectively.
環R1A、環R2A及び環R3Aが有していてもよい置換基が複数存在する場合、それらは同一でも異なっていてもよく、互いに結合して、それぞれが結合する炭素原子とともに環を形成していてもよいが、式(1)で表される化合物の発光スペクトルの最大ピーク波長が短波長になるため、環を形成しないことが好ましい。 If there are multiple substituents that ring R 1A , ring R 2A and ring R 3A may have, they may be the same or different and may be bonded together to form a ring with the carbon atoms to which they are bonded. Although it may be formed, it is preferable not to form a ring because the maximum peak wavelength of the emission spectrum of the compound represented by the formula (1) is a short wavelength.
「環R1A、環R2A及び環R3Aのうちの少なくとも一つは、式(1-S)で表される基を有する」とは、環R1A、環R2A及び環R3Aのうち、少なくとも1つの環を構成する炭素原子に直接結合する水素原子の一部又は全部が、式(1-S)で表される基で置換されていることを意味する。 "At least one of ring R 1A , ring R 2A and ring R 3A has a group represented by the formula (1-S)" means that of ring R 1A , ring R 2A and ring R 3A . It means that a part or all of the hydrogen atom directly bonded to the carbon atom constituting at least one ring is substituted with the group represented by the formula (1-S).
本発明の発光素子の発光効率が優れるので、環R1A及び環R2Aのうちの少なくとも一つが式(1-S)で表される基を有することが好ましく、環R2Aが式(1-S)で表される基を有することがより好ましい。 Since the luminous efficiency of the light emitting device of the present invention is excellent, it is preferable that at least one of the ring R 1A and the ring R 2A has a group represented by the formula (1-S), and the ring R 2A has the formula (1-S). It is more preferable to have a group represented by S).
環R1A、環R2A及び環R3Aのうちの少なくとも一つの環が有する式(1-S)で表される基の個数は、通常1~10であり、合成が容易なため、好ましくは1~5であり、より好ましくは1~3であり、更に好ましくは1又は2であり、特に好ましくは1である。 The number of groups represented by the formula (1-S) contained in at least one of the rings R 1A , the ring R 2A and the ring R 3A is usually 1 to 10, and is preferable because it is easy to synthesize. It is 1 to 5, more preferably 1 to 3, still more preferably 1 or 2, and particularly preferably 1.
式(1)で表される化合物が有する式(1-S)で表される基の個数は、通常1~15であり、本発明の発光素子の発光効率が優れ、且つ、合成が容易なため、好ましくは1~10であり、より好ましくは1~5であり、更に好ましくは1~3であり、特に好ましくは1又は2であり、好ましくは1である。 The number of groups represented by the formula (1-S) contained in the compound represented by the formula (1) is usually 1 to 15, the luminous efficiency of the light emitting device of the present invention is excellent, and the synthesis is easy. Therefore, it is preferably 1 to 10, more preferably 1 to 5, still more preferably 1 to 3, particularly preferably 1 or 2, and preferably 1.
式(1)で表される化合物が式(1-S)で表される基を複数有する場合、それらは同一でも異なっていてもよい。 When the compound represented by the formula (1) has a plurality of groups represented by the formula (1-S), they may be the same or different.
[式(1-S)で表される基]
Ar1Sにおける縮合環のアリール基の炭素原子数は、置換基の炭素原子数を含めないで、通常7~60であり、好ましくは9~30であり、より好ましくは10~18である。
[Group represented by formula (1-S)]
The number of carbon atoms of the aryl group of the fused ring in Ar 1S is usually 7 to 60, preferably 9 to 30, and more preferably 10 to 18, not including the number of carbon atoms of the substituent.
Ar1Sとしては、例えば、ナフタレン環、アントラセン環、フェナントレン環、ジヒドロフェナントレン環、トリフェニレン環、ナフタセン環、フルオレン環、スピロビフルオレン環、ピレン環、ペリレン環、クリセン環、インデン環、フルオランテン環又はベンゾフルオランテン環から、環を構成する炭素原子に直接結合する水素原子1個を除いてなる基が挙げられ、好ましくは、ナフタレン環、アントラセン環、フェナントレン環、ジヒドロフェナントレン環、フルオレン環、スピロビフルオレン環、ピレン環、フルオランテン環又はベンゾフルオランテン環から、環を構成する炭素原子に直接結合する水素原子1個を除いてなる基であり、より好ましくは、ナフタレン環、アントラセン環、フルオレン環、スピロビフルオレン環、フルオランテン環又はベンゾフルオランテン環から、環を構成する炭素原子に直接結合する水素原子1個を除いてなる基であり、更に好ましくは、ナフタレン環、フルオレン環又はスピロビフルオレン環から、環を構成する炭素原子に直接結合する水素原子1個を除いてなる基であり、特に好ましくは、ナフチル基又はフルオレニル基であり、これらの基は置換基を有していてもよい。 Examples of Ar 1S include naphthalene ring, anthracene ring, phenanthrene ring, dihydrophenanthrene ring, triphenylene ring, naphthalene ring, fluorene ring, spirobifluorene ring, pyrene ring, perylene ring, chrysen ring, inden ring, fluorene ring or benzo. Examples thereof include a group consisting of a fluorene ring excluding one hydrogen atom directly bonded to a carbon atom constituting the ring, preferably a naphthalene ring, an anthracene ring, a phenanthrene ring, a dihydrophenanthrene ring, a fluorene ring, and a spirobi. It is a group consisting of a fluorene ring, a pyrene ring, a fluorene ring or a benzofluorene ring excluding one hydrogen atom directly bonded to a carbon atom constituting the ring, and more preferably a naphthalene ring, an anthracene ring or a fluorene ring. , A group consisting of a spirobifluorene ring, a fluorene ring or a benzofluorene ring excluding one hydrogen atom directly bonded to a carbon atom constituting the ring, more preferably a naphthalene ring, a fluorene ring or a spirobi. A group consisting of a fluorene ring excluding one hydrogen atom directly bonded to a carbon atom constituting the ring, particularly preferably a naphthyl group or a fluoreneyl group, even if these groups have a substituent. good.
Ar1Sが有していてもよい置換基の例及び好ましい範囲は、環R1A、環R2A及び環R3Aが有していてもよい置換基の例及び好ましい範囲と同じである。 The examples and preferred ranges of substituents that Ar 1S may have are the same as the examples and preferred ranges of substituents that ring R 1A , ring R 2A and ring R 3A may have.
Ar1Sが有していてもよい置換基におけるアリール基、1価の複素環基及び置換アミノ基の例及び好ましい範囲は、それぞれ、環R1A、環R2A及び環R3Aが有していてもよい置換基におけるアリール基、1価の複素環基及び置換アミノ基の例及び好ましい範囲と同じである。 Examples and preferred ranges of aryl groups, monovalent heterocyclic groups and substituted amino groups in the substituents that Ar 1S may have are included in Ring R 1A , Ring R 2A and Ring R 3A , respectively. It is the same as the examples and preferred ranges of aryl groups, monovalent heterocyclic groups and substituted amino groups in the preferred substituents.
Ar1Sが有していてもよい置換基が更に有していてもよい置換基の例及び好ましい範囲は、環R1A、環R2A及び環R3が有していてもよい置換基が更に有していてもよい置換基の例及び好ましい範囲と同じである。 Examples and preferred ranges of substituents that Ar 1S may have may further include substituents that ring R 1A , ring R 2A and ring R 3 may have. It is the same as the example and preferable range of substituents which may be possessed.
環R1A、環R2A及び環R3Aが有していてもよい置換基が更に有していてもよい置換基におけるアリール基、1価の複素環基及び置換アミノ基の例及び好ましい範囲は、それぞれ、環R1A、環R2A及び環R3Aが有していてもよい置換基におけるアリール基、1価の複素環基及び置換アミノ基の例及び好ましい範囲と同じである。 Examples and preferred ranges of aryl groups, monovalent heterocyclic groups and substituted amino groups in the substituents that the substituents that the rings R 1A , R 2A and R 3A may have may further have. , The examples and preferred ranges of aryl groups, monovalent heterocyclic groups and substituted amino groups in the substituents that ring R 1A , ring R 2A and ring R 3A may have, respectively.
式(1-S)で表される基は、本発明の発光素子の発光効率がより優れるので、好ましくは、式(1-S1)~式(1-S17)で表される基であり、より好ましくは、式(1-S1)~式(1-S8)又は式(1-S14)~式(1-S17)で表される基であり、更に好ましくは、式(1-S1)、式(1-S2)又は式(1-S5)~式(1-S8)で表される基であり、特に好ましくは、式(1-S1)、式(1-S2)、式(1-S5)又は式(1-S6)で表される基であり、とりわけ好ましくは式(1-S1)又は式(1-S2)で表される基である。 The group represented by the formula (1-S) is preferably a group represented by the formulas (1-S1) to (1-S17) because the luminous efficiency of the light emitting element of the present invention is more excellent. More preferably, it is a group represented by the formula (1-S1) to the formula (1-S8) or the formula (1-S14) to the formula (1-S17), and more preferably, the formula (1-S1), It is a group represented by the formula (1-S2) or the formula (1-S5) to the formula (1-S8), and is particularly preferably the formula (1-S1), the formula (1-S2), and the formula (1-S8). It is a group represented by S5) or the formula (1-S6), and more preferably a group represented by the formula (1-S1) or the formula (1-S2).
RS1は、好ましくは、水素原子、アルキル基、シクロアルキル基、アルコキシ基、シクロアルコキシ基、アリール基、1価の複素環基又は置換アミノ基であり、より好ましくは、水素原子、アルキル基、シクロアルキル基、アルコキシ基、シクロアルコキシ基、アリール基又は1価の複素環基であり、更に好ましくは、水素原子、アルキル基、シクロアルキル基、アリール基又は1価の複素環基であり、特に好ましくは、水素原子、アルキル基、シクロアルキル基又はアリール基であり、とりわけ好ましくは、水素原子又はアリール基であり、これらの基は置換基を有していてもよい。 RS1 is preferably a hydrogen atom, an alkyl group, a cycloalkyl group, an alkoxy group, a cycloalkoxy group, an aryl group, a monovalent heterocyclic group or a substituted amino group, and more preferably a hydrogen atom, an alkyl group, and the like. It is a cycloalkyl group, an alkoxy group, a cycloalkoxy group, an aryl group or a monovalent heterocyclic group, more preferably a hydrogen atom, an alkyl group, a cycloalkyl group, an aryl group or a monovalent heterocyclic group, in particular. A hydrogen atom, an alkyl group, a cycloalkyl group or an aryl group is preferable, and a hydrogen atom or an aryl group is particularly preferable, and these groups may have a substituent.
RS2は、好ましくは、水素原子、アルキル基、シクロアルキル基、アルコキシ基、シクロアルコキシ基、アリール基、1価の複素環基又は置換アミノ基であり、より好ましくは、アルキル基、シクロアルキル基、アルコキシ基、シクロアルコキシ基、アリール基又は1価の複素環基であり、更に好ましくは、アルキル基、シクロアルキル基、アリール基又は1価の複素環基であり、特に好ましくは、アルキル基、シクロアルキル基又はアリール基であり、とりわけ好ましくは、アリール基であり、これらの基は置換基を有していてもよい。 RS2 is preferably a hydrogen atom, an alkyl group, a cycloalkyl group, an alkoxy group, a cycloalkoxy group, an aryl group, a monovalent heterocyclic group or a substituted amino group, and more preferably an alkyl group or a cycloalkyl group. , An alkoxy group, a cycloalkoxy group, an aryl group or a monovalent heterocyclic group, more preferably an alkyl group, a cycloalkyl group, an aryl group or a monovalent heterocyclic group, and particularly preferably an alkyl group. It may be a cycloalkyl group or an aryl group, particularly preferably an aryl group, and these groups may have a substituent.
RS1及びRS2におけるアリール基、1価の複素環基及び置換アミノ基の例及び好ましい範囲は、それぞれ、環R1A、環R2A及び環R3Aが有していてもよい置換基におけるアリール基、1価の複素環基及び置換アミノ基の例及び好ましい範囲と同じである。 Examples and preferred ranges of aryl groups, monovalent heterocyclic groups and substituted amino groups in RS1 and RS2 are aryls in substituents that ring R1A , ring R2A and ring R3A may have, respectively. The same is true for the examples and preferred ranges of groups, monovalent heterocyclic groups and substituted amino groups.
RS1及びRS2が有していてもよい置換基の例及び好ましい範囲は、環R1A、環R2A及び環R3が有していてもよい置換基が更に有していてもよい置換基の例及び好ましい範囲と同じである。 Examples and preferred ranges of substituents that RS1 and RS2 may have include substitutions that may be further possessed by the substituents that ring R1A , ring R2A and ring R3 may have. Same as the group example and preferred range.
RS1及びRS2が有していてもよい置換基におけるアリール基、1価の複素環基及び置換アミノ基の例及び好ましい範囲は、それぞれ、環R1A、環R2A及び環R3Aが有していてもよい置換基におけるアリール基、1価の複素環基及び置換アミノ基の例及び好ましい範囲と同じである。 Examples and preferred ranges of aryl groups, monovalent heterocyclic groups and substituted amino groups in the substituents that RS1 and RS2 may have include ring R 1A , ring R 2A and ring R 3A , respectively. It is the same as the example and preferable range of the aryl group, the monovalent heterocyclic group and the substituted amino group in the substituent which may be used.
式(1)で表される化合物は、発光素子の発光効率がより優れるので、好ましくは、式(1-A)で表される化合物又は式(1-B)で表される化合物であり、より好ましくは、式(1-B)で表される化合物である。 The compound represented by the formula (1) is preferably a compound represented by the formula (1-A) or a compound represented by the formula (1-B) because the luminous efficiency of the light emitting device is more excellent. More preferably, it is a compound represented by the formula (1-B).
<式(1-A)で表される化合物>
R11A、R12A、R13A、R14A、R21A、R22A、R23A、R31A、R32A及びR33Aの例及び好ましい範囲は、それぞれ、RS1の例及び好ましい範囲と同じである。
<Compound represented by the formula (1-A)>
The examples and preferred ranges of R 11A , R 12A , R 13A , R 14A , R 21A , R 22A , R 23A , R 31A , R 32A and R 33A are the same as those of RS 1 and preferred ranges, respectively.
R11A、R12A、R13A、R14A、R21A、R22A、R23A、R31A、R32A及びR33Aにおけるアリール基、1価の複素環基及び置換アミノ基の例及び好ましい範囲は、それぞれ、環R1A、環R2A及び環R3Aが有していてもよい置換基におけるアリール基、1価の複素環基及び置換アミノ基の例及び好ましい範囲と同じである。 Examples and preferred ranges of aryl groups, monovalent heterocyclic groups and substituted amino groups in R 11A , R 12A , R 13A , R 14A , R 21A , R 22A , R 23A , R 31A , R 32A and R 33A are: It is the same as the example and preferable range of the aryl group, the monovalent heterocyclic group and the substituted amino group in the substituent which the ring R 1A , the ring R 2A and the ring R 3A may have, respectively.
R11A、R12A、R13A、R14A、R21A、R22A、R23A、R31A、R32A及びR33Aが有していてもよい置換基の例及び好ましい範囲は、環R1A、環R2A及び環R3Aが有していてもよい置換基の例及び好ましい範囲と同じである。 Examples and preferred ranges of substituents that R 11A , R 12A , R 13A , R 14A , R 21A , R 22A , R 23A , R 31A , R 32A and R 33A may have are Ring R 1A , Ring. It is the same as the example and preferable range of substituents that R 2A and ring R 3A may have.
R11A、R12A、R13A、R14A、R21A、R22A、R23A、R31A、R32A及びR33Aが有していてもよい置換基におけるアリール基、1価の複素環基及び置換アミノ基の例及び好ましい範囲は、それぞれ、環R1A、環R2A及び環R3Aが有していてもよい置換基におけるアリール基、1価の複素環基及び置換アミノ基の例及び好ましい範囲と同じである。 Aryl groups, monovalent heterocyclic groups and substitutions in the substituents that R 11A , R 12A , R 13A , R 14A , R 21A , R 22A , R 23A , R 31A , R 32A and R 33A may have. Examples of amino groups and preferred ranges are examples and preferred ranges of aryl groups, monovalent heterocyclic groups and substituted amino groups in the substituents that ring R 1A , ring R 2A and ring R 3A may have, respectively. Is the same as.
R11A、R12A、R13A、R14A、R21A、R22A、R23A、R31A、R32A及びR33Aが有していてもよい置換基が更に有していてもよい置換基の例及び好ましい範囲は、環R1A、環R2A及び環R3が有していてもよい置換基が更に有していてもよい置換基の例及び好ましい範囲と同じである。 Examples of substituents that may be further possessed by the substituents that may be possessed by R 11A , R 12A , R 13A , R 14A , R 21A , R 22A , R 23A , R 31A , R 32A and R 33A . And the preferred range is the same as the examples and preferred ranges of substituents that may be further possessed by the substituents that ring R 1A , ring R 2A and ring R 3 may have.
R11A、R12A、R13A、R14A、R21A、R22A、R23A、R31A、R32A及びR33Aが有していてもよい置換基が更に有していてもよい置換基におけるアリール基、1価の複素環基及び置換アミノ基の例及び好ましい範囲は、それぞれ、環R1A、環R2A及び環R3Aが有していてもよい置換基におけるアリール基、1価の複素環基及び置換アミノ基の例及び好ましい範囲と同じである。 The aryl in the substituents that the substituents that R 11A , R 12A , R 13A , R 14A , R 21A , R 22A , R 23A , R 31A , R 32A and R 33A may have may further have. Examples and preferred ranges of groups, monovalent heterocyclic groups and substituted amino groups are aryl groups and monovalent heterocycles in the substituents that ring R 1A , ring R 2A and ring R 3A may have, respectively. Same as for examples and preferred ranges of groups and substituted amino groups.
本発明の発光素子の発光効率がより優れるので、R11A、R12A、R13A、R14A、R22A、R23A、R32A及びR33Aのうちの少なくとも一つが、式(1-S)で表される基であることが好ましく、R12A、R13A、R22A、R23A、R32A及びR33Aのうちの少なくとも一つが、式(1-S)で表される基であることがより好ましく、R12A、R23A及びR33Aのうちの少なくとも一つが、式(1-S)で表される基であることが更に好ましく、R23A及びR33Aのうちの少なくとも一つが、式(1-S)で表される基であることが特に好ましい。 Since the luminous efficiency of the light emitting device of the present invention is more excellent, at least one of R 11A , R 12A , R 13A , R 14A , R 22A , R 23A , R 32A and R 33A is represented by the formula (1-S). It is preferable that the group is represented by a group, and at least one of R 12A , R 13A , R 22A , R 23A , R 32A and R 33A is a group represented by the formula (1-S). Preferably, at least one of R 12A , R 23A and R 33A is more preferably a group represented by the formula (1-S), and at least one of R 23A and R 33A is of the formula (1). It is particularly preferable that the group is represented by —S).
R11A及びR14Aは、本発明の発光素子の発光効率が更に優れるので、好ましくは、水素原子、アリール基又は式(1-S)で表される基であり、より好ましくは、水素原子又はアリール基であり、更に好ましくは、アリール基である。 R 11A and R 14A are preferably a hydrogen atom, an aryl group or a group represented by the formula (1-S), and more preferably a hydrogen atom or a group because the light emitting efficiency of the light emitting element of the present invention is further excellent. It is an aryl group, more preferably an aryl group.
R12A、R13A、R21A、R22A、R31A及びR32Aは、合成が容易なため、好ましくは、水素原子、アリール基又は式(1-S)で表される基であり、より好ましくは、水素原子又はアリール基であり、更に好ましくは、水素原子である。 R 12A , R 13A , R 21A , R 22A , R 31A and R 32A are preferably hydrogen atoms, aryl groups or groups represented by the formula (1-S) because they are easy to synthesize, and more preferably. Is a hydrogen atom or an aryl group, more preferably a hydrogen atom.
R23A及びR33Aは、本発明の発光素子の発光効率が更に優れるので、好ましくは、水素原子、アリール基又は式(1-S)で表される基であり、より好ましくは、水素原子又は式(1-S)で表される基である。 Since R 23A and R 33A are more excellent in luminous efficiency of the light emitting element of the present invention, they are preferably a hydrogen atom, an aryl group or a group represented by the formula (1-S), and more preferably a hydrogen atom or a group represented by the formula (1-S). It is a group represented by the formula (1-S).
R11AとR12A、R12AとR13A、R13AとR14A、R14AとR31A、R31AとR32A、R32AとR33A、R33AとR23A、R23AとR22A、R22AとR21A、及び、R21AとR11Aは、式(1-A)で表される化合物の発光スペクトルの最大ピーク波長が短波長になるため、それぞれ結合して、それぞれが結合する炭素原子とともに環を形成しないことが好ましい。 R 11A and R 12A , R 12A and R 13A , R 13A and R 14A , R 14A and R 31A , R 31A and R 32A , R 32A and R 33A , R 33A and R 23A , R 23A and R 22A , R 22A . And R 21A , and R 21A and R 11A have short wavelengths at the maximum peak wavelength of the emission spectrum of the compound represented by the formula (1-A). It is preferable not to form a ring.
<式(1-B)で表される化合物>
R11B、R14B、R15B、R16B、R17B、R18B、R21B、R22B、R23B、R31B、R32B及びR33Bの例及び好ましい範囲は、それぞれ、RS1の例及び好ましい範囲と同じである。
<Compound represented by formula (1-B)>
Examples and preferred ranges of R 11B , R 14B , R 15B , R 16B , R 17B , R 18B , R 21B , R 22B , R 23B , R 31B , R 32B and R 33B are examples of R S1 and preferred, respectively. Same as range.
R11B、R14B、R15B、R16B、R17B、R18B、R21B、R22B、R23B、R31B、R32B及びR33Bで表されるアリール基、1価の複素環基及び置換アミノ基の例及び好ましい範囲は、それぞれ、環R1A、環R2A及び環R3Aが有していてもよい置換基におけるアリール基、1価の複素環基及び置換アミノ基の例及び好ましい範囲と同じである。 Aryl groups represented by R 11B , R 14B , R 15B , R 16B , R 17B , R 18B , R 21B , R 22B , R 23B , R 31B , R 32B and R 33B , and monovalent heterocyclic groups and substitutions. Examples of amino groups and preferred ranges are examples and preferred ranges of aryl groups, monovalent heterocyclic groups and substituted amino groups in the substituents that ring R 1A , ring R 2A and ring R 3A may have, respectively. Is the same as.
R11B、R14B、R15B、R16B、R17B、R18B、R21B、R22B、R23B、R31B、R32B及びR33Bが有していてもよい置換基の例及び好ましい範囲は、環R1A、環R2A及び環R3Aが有していてもよい置換基の例及び好ましい範囲と同じである。 Examples and preferred ranges of substituents that R 11B , R 14B , R 15B , R 16B , R 17B , R 18B , R 21B , R 22B , R 23B , R 31B , R 32B and R 33B may have are: , Ring R 1A , Ring R 2A and Ring R 3A may have the same examples and preferred ranges of substituents.
R11B、R14B、R15B、R16B、R17B、R18B、R21B、R22B、R23B、R31B、R32B及びR33Bが有していてもよい置換基におけるアリール基、1価の複素環基及び置換アミノ基の例及び好ましい範囲は、それぞれ、環R1A、環R2A及び環R3Aが有していてもよい置換基におけるアリール基、1価の複素環基及び置換アミノ基の例及び好ましい範囲と同じである。 Aryl groups and monovalents in the substituents that R 11B , R 14B , R 15B , R 16B , R 17B , R 18B , R 21B , R 22B , R 23B , R 31B , R 32B and R 33B may have. Examples and preferred ranges of the heterocyclic group and the substituted amino group of the above are the aryl group in the substituent which the ring R 1A , the ring R 2A and the ring R 3A may have, respectively, the monovalent heterocyclic group and the substituted amino. Same as the group example and preferred range.
R11B、R14B、R15B、R16B、R17B、R18B、R21B、R22B、R23B、R31B、R32B及びR33Bが有していてもよい置換基が更に有していてもよい置換基の例及び好ましい範囲は、環R1A、環R2A及び環R3が有していてもよい置換基が更に有していてもよい置換基の例及び好ましい範囲と同じである。 There are further substituents that R 11B , R 14B , R 15B , R 16B , R 17B , R 18B , R 21B , R 22B , R 23B , R 31B , R 32B and R 33B may have. The examples and preferred ranges of the preferred substituents are the same as the examples and preferred ranges of the substituents which the rings R 1A , R 2A and Ring R 3 may have may further have. ..
R11B、R14B、R15B、R16B、R17B、R18B、R21B、R22B、R23B、R31B、R32B及びR33Bが有していてもよい置換基が更に有していてもよい置換基におけるアリール基、1価の複素環基及び置換アミノ基の例及び好ましい範囲は、それぞれ、環R1A、環R2A及び環R3Aが有していてもよい置換基におけるアリール基、1価の複素環基及び置換アミノ基の例及び好ましい範囲と同じである。 There are further substituents that R 11B , R 14B , R 15B , R 16B , R 17B , R 18B , R 21B , R 22B , R 23B , R 31B , R 32B and R 33B may have. Examples and preferred ranges of aryl groups, monovalent heterocyclic groups and substituted amino groups in the preferred substituents are the aryl groups in the substituents that ring R 1A , ring R 2A and ring R 3A may have, respectively. Same as for examples and preferred ranges of monovalent heterocyclic groups and substituted amino groups.
本発明の発光素子の発光効率がより優れるので、R11B、R14B、R16B、R17B、R22B、R23B、R32B及びR33Bのうちの少なくとも一つが、式(1-S)で表される基であることが好ましく、R16B、R17B、R22B、R23B、R32B及びR33Bのうちの少なくとも一つが、式(1-S)で表される基であることがより好ましく、R16B、R17BR23B及びR33Bのうちの少なくとも一つが、式(1-S)で表される基であることが更に好ましく、R16B及びR23Bのうちの少なくとも一つが、式(1-S)で表される基であることが特に好ましい。 Since the luminous efficiency of the light emitting device of the present invention is more excellent, at least one of R 11B , R 14B , R 16B , R 17B , R 22B , R 23B , R 32B and R 33B is represented by the formula (1-S). It is preferable that the group is represented by a group, and at least one of R 16B , R 17B , R 22B , R 23B , R 32B and R 33B is a group represented by the formula (1-S). Preferably, at least one of R 16B , R 17B , R 23B and R 33B is more preferably a group represented by the formula (1-S), and at least one of R 16B and R 23B is of the formula (1-S). It is particularly preferable that the group is represented by (1-S).
R11B及びR14Bは、本発明の発光素子の発光効率が更に優れるので、好ましくは、水素原子、アリール基又は式(1-S)で表される基であり、より好ましくは、水素原子又はアリール基であり、更に好ましくは、アリール基である。 R 11B and R 14B are preferably a hydrogen atom, an aryl group or a group represented by the formula (1-S), and more preferably a hydrogen atom or a group because the light emitting efficiency of the light emitting element of the present invention is further excellent. It is an aryl group, more preferably an aryl group.
R15B、R18B、R21B、R22B、R31B及びR32Bは、合成が容易なため、好ましくは、水素原子、アリール基又は式(1-S)で表される基であり、より好ましくは、水素原子又はアリール基であり、更に好ましくは、水素原子である。 R 15B , R 18B , R 21B , R 22B , R 31B and R 32B are preferably hydrogen atoms, aryl groups or groups represented by the formula (1-S) because they are easy to synthesize, and more preferably. Is a hydrogen atom or an aryl group, more preferably a hydrogen atom.
R16B、R17B、R23B及びR33Bは、本発明の発光素子の発光効率が更に優れるので、好ましくは、水素原子、アリール基又は式(1-S)で表される基であり、より好ましくは、水素原子又は式(1-S)で表される基である。 R 16B , R 17B , R 23B and R 33B are preferably hydrogen atoms, aryl groups or groups represented by the formula (1-S) because the luminous efficiency of the light emitting element of the present invention is further excellent. It is preferably a hydrogen atom or a group represented by the formula (1-S).
R11BとR15B、R15BとR16B、R16BとR17B、R17BとR18B、R18BとR14B、R14BとR31B、R31BとR32B、R32BとR33B、R33BとR23B、R23BとR22B、R22BとR21B、及び、R21BとR11Bは、式(1-B)で表される化合物の発光スペクトルの最大ピーク波長が短波長になるため、それぞれ結合して、それぞれが結合する炭素原子とともに環を形成しないことが好ましい。 R 11B and R 15B , R 15B and R 16B , R 16B and R 17B , R 17B and R 18B , R 18B and R 14B , R 14B and R 31B , R 31B and R 32B , R 32B and R 33B , R 33B . And R 23B , R 23B and R 22B , R 22B and R 21B , and R 21B and R 11B have short wavelengths at the maximum peak wavelength of the emission spectrum of the compound represented by the formula (1-B). It is preferable that they are bonded to each other and do not form a ring together with the carbon atom to which they are bonded.
式(1)で表される化合物の具体例としては、下記式で表される化合物が挙げられる。 Specific examples of the compound represented by the formula (1) include compounds represented by the following formula.
式(1)で表される化合物は、Aldrich、Luminescence Technology Corp.、AK Scientific等から入手可能である。その他には、例えば、国際公開第2007/100010号、国際公開第2008/059713号、特開2007-291061号公報、特開2007-314506号公報、特開2007-314510号公報、特開2008-308485号公報、特開2010-121036号公報、特開2010-123917号公報、特開2011-037744号公報、特開2011-174059号公報に記載されている方法に従って合成することができる。 The compound represented by the formula (1) is described in Aldrich, Lumisense Technology Corp. , AK Scientific and the like. In addition, for example, International Publication No. 2007/100010, International Publication No. 2008/059713, JP-A-2007-291061, JP-A-2007-314506, JP-A-2007-314510, JP-A-2008- It can be synthesized according to the methods described in JP-A-308485, JP-A-2010-120136, JP-A-2010-123917, JP-A-2011-037744, and JP-A-2011-174059.
[ホスト材料]
本発明の発光素子の発光効率がより優れるため、第1の有機層は、式(1)で表される化合物と、正孔注入性、正孔輸送性、電子注入性および電子輸送性からなる群から選ばれる少なくとも1つの機能を有するホスト材料とを含有する層であることが好ましい。第1の有機層が、式(1)で表される化合物とホスト材料とを含有する層である場合、ホスト材料は、1種単独で含有されていても、2種以上含有されていてもよい。
[Host material]
Since the luminous efficiency of the light emitting element of the present invention is more excellent, the first organic layer is composed of the compound represented by the formula (1) and the hole injecting property, the hole transporting property, the electron injecting property and the electron transporting property. It is preferable that the layer contains a host material having at least one function selected from the group. When the first organic layer is a layer containing the compound represented by the formula (1) and the host material, the host material may be contained alone or in combination of two or more. good.
第1の有機層が、式(1)で表される化合物とホスト材料とを含有する層である場合、式(1)で表される化合物の含有量は、式(1)で表される化合物とホスト材料との合計を100重量部とした場合、通常、0.05~80重量部であり、好ましくは0.1~50重量部であり、より好ましくは1~30重量部であり、更に好ましくは5~15重量部である。 When the first organic layer is a layer containing the compound represented by the formula (1) and the host material, the content of the compound represented by the formula (1) is represented by the formula (1). When the total of the compound and the host material is 100 parts by weight, it is usually 0.05 to 80 parts by weight, preferably 0.1 to 50 parts by weight, more preferably 1 to 30 parts by weight, and further preferably 5 parts. ~ 15 parts by weight.
第1の有機層が、式(1)で表される化合物とホスト材料とを含有する層である場合、ホスト材料の有する最低励起一重項状態(S1)は、本発明の発光素子の発光効率が優れるので、式(1)で表される化合物の有するS1と同等のエネルギー準位、又は、より高いエネルギー準位であることが好ましい。 When the first organic layer is a layer containing the compound represented by the formula (1) and the host material, the lowest excited singlet state (S 1 ) of the host material is the light emission of the light emitting element of the present invention. Since the efficiency is excellent, it is preferable that the energy level is equivalent to or higher than that of S 1 of the compound represented by the formula (1).
ホスト材料としては、本発明の発光素子を溶液塗布プロセスで作製できるので、第1の有機層に含有される式(1)で表される化合物を溶解することが可能な溶媒に対して溶解性を示すものであることが好ましい。 As the host material, since the light emitting element of the present invention can be produced by a solution coating process, it is soluble in a solvent capable of dissolving the compound represented by the formula (1) contained in the first organic layer. It is preferable that it indicates.
ホスト材料は、低分子化合物と高分子化合物とに分類される。ホスト材料としては、例えば、後述の正孔輸送材料、及び、後述の電子輸送材料が挙げられる。 Host materials are classified into low molecular weight compounds and high molecular weight compounds. Examples of the host material include a hole transport material described later and an electron transport material described later.
[低分子ホスト]
ホスト材料として好ましい低分子化合物(以下、「低分子ホスト」と言う。)に関して説明する。
[Small molecule host]
A small molecule compound (hereinafter referred to as "small molecule host") preferable as a host material will be described.
低分子ホストは、好ましくは、式(FH-1)で表される化合物である。 The small molecule host is preferably a compound represented by the formula (FH-1).
ArH1及びArH2は、それぞれ独立に、アリール基、1価の複素環基又は置換アミノ基を表し、これらの基は置換基を有していてもよい。
nH1は、0以上15以下の整数を表す。
LH1は、アリーレン基、2価の複素環基、又は、-[C(RH11)2]nH11-で表される基を表し、これらの基は置換基を有していてもよい。LH1が複数存在する場合、それらは同一でも異なっていてもよい。nH11は、1以上10以下の整数を表す。RH11は、水素原子、アルキル基、シクロアルキル基、アルコキシ基、シクロアルコキシ基、アリール基又は1価の複素環基を表し、これらの基は置換基を有していてもよい。複数存在するRH11は、同一でも異なっていてもよく、互いに結合して、それぞれが結合する炭素原子とともに環を形成していてもよい。]
Ar H1 and Ar H2 each independently represent an aryl group, a monovalent heterocyclic group or a substituted amino group, and these groups may have a substituent.
n H1 represents an integer of 0 or more and 15 or less.
L H1 represents an arylene group, a divalent heterocyclic group, or a group represented by − [C ( RH11 ) 2 ] n H11 −, and these groups may have a substituent. When there are a plurality of L H1 , they may be the same or different. n H11 represents an integer of 1 or more and 10 or less. R H11 represents a hydrogen atom, an alkyl group, a cycloalkyl group, an alkoxy group, a cycloalkoxy group, an aryl group or a monovalent heterocyclic group, and these groups may have a substituent. The plurality of R H11s present may be the same or different, or may be bonded to each other to form a ring together with the carbon atom to which each is bonded. ]
ArH1及びArH2は、好ましくはアリール基又は1価の複素環基であり、より好ましくはアリール基である。発光効率の観点から更に好ましくは、ArH1及びArH2の少なくとも一方は、縮合環のアリール基である。これらの基は置換基を有していてもよい。 Ar H1 and Ar H2 are preferably an aryl group or a monovalent heterocyclic group, and more preferably an aryl group. More preferably, from the viewpoint of luminous efficiency, at least one of Ar H1 and Ar H2 is an aryl group of the fused ring. These groups may have substituents.
ArH1及びArH2におけるアリール基の炭素原子数は、置換基の炭素原子数を含めないで、通常6~60であり、好ましくは6~30であり、より好ましくは6~20である。 The number of carbon atoms of the aryl group in Ar H1 and Ar H2 is usually 6 to 60, preferably 6 to 30, and more preferably 6 to 20, excluding the number of carbon atoms of the substituent.
ArH1及びArH2におけるアリール基としては、ベンゼン環、ナフタレン環、アントラセン環、フェナントレン環、トリフェニレン環、ジヒドロフェナントレン環、ナフタセン環、フルオレン環、スピロビフルオレン環、ピレン環、ペリレン環、クリセン環、インデン環、フルオランテン環又はベンゾフルオランテン環から、環を構成する炭素原子に直接結合する水素原子1個を除いてなる基が挙げられ、好ましくは、ベンゼン環、ナフタレン環、アントラセン環、フェナントレン環、ジヒドロフェナントレン環、フルオレン環、スピロビフルオレン環、ピレン環又はクリセン環から、環を構成する炭素原子に直接結合する水素原子1個を除いてなる基であり、より好ましくは、ベンゼン環、ナフタレン環、アントラセン環、ピレン環、フルオレン環又はスピロビフルオレン環から、環を構成する炭素原子に直接結合する水素原子1個を除いてなる基であり、更に好ましくは、更に好ましくは、フェニル基、ナフチル基又はアントラセニル基であり、特に好ましくは、フェニル基又はナフチル基であり、これらの基は更に置換基を有していてもよい。 Examples of the aryl group in Ar H1 and Ar H2 include a benzene ring, a naphthalene ring, an anthracene ring, a phenanthrene ring, a triphenylene ring, a dihydrophenanthrene ring, a naphthalene ring, a fluorene ring, a spirobifluorene ring, a pyrene ring, a perylene ring and a chrysen ring. Examples thereof include a group consisting of an inden ring, a fluoranthene ring or a benzofluorentene ring excluding one hydrogen atom directly bonded to a carbon atom constituting the ring, preferably a benzene ring, a naphthalene ring, an anthracene ring or a phenanthrene ring. , Dihydrophenanthrene ring, fluorene ring, spirobifluorene ring, pyrene ring or chrysen ring, excluding one hydrogen atom directly bonded to a carbon atom constituting the ring, more preferably a benzene ring or naphthalene. A group consisting of a ring, an anthracene ring, a pyrene ring, a fluorene ring, or a spirobifluorene ring excluding one hydrogen atom directly bonded to a carbon atom constituting the ring, more preferably a phenyl group, and further preferably a phenyl group. It may be a naphthyl group or an anthrasenyl group, particularly preferably a phenyl group or a naphthyl group, and these groups may further have a substituent.
ArH1及びArH2における縮合環のアリール基の定義、例及び好ましい範囲は、Ar1Sにおける縮合環のアリール基の定義、例及び好ましい範囲と同じである。 The definitions, examples and preferred ranges of aryl groups of fused rings in Ar H1 and Ar H2 are the same as the definitions, examples and preferred ranges of aryl groups of fused rings in Ar 1S .
ArH1及びArH2における1価の複素環基の炭素原子数は、置換基の炭素原子数を含めないで、通常2~60であり、好ましくは3~30であり、より好ましくは3~20である。 The number of carbon atoms of the monovalent heterocyclic group in Ar H1 and Ar H2 is usually 2 to 60, preferably 3 to 30, and more preferably 3 to 20 without including the number of carbon atoms of the substituent. Is.
ArH1及びArH2における1価の複素環基としては、例えば、ピロール環、ジアゾール環、トリアゾール環、ピリジン環、ジアザベンゼン環、トリアジン環、アザナフタレン環、ジアザナフタレン環、トリアザナフタレン環、インドール環、ベンゾジアゾール環、ベンゾトリアゾール環、カルバゾール環、アザカルバゾール環、ジアザカルバゾール環、ジベンゾフラン環、ジベンゾチオフェン環、フェノキサジン環、フェノチアジン環、アクリジン環、9,10-ジヒドロアクリジン環、アクリドン環、フェナジン環及び5,10-ジヒドロフェナジン環から、環を構成する炭素原子又はヘテロ原子に直接結合する水素原子1個を除いてなる基が挙げられ、好ましくは、ジアゾール環、トリアゾール環、ピリジン環、ジアザベンゼン環、トリアジン環、インドール環、ベンゾジアゾール環、ベンゾトリアゾール環、カルバゾール環、ジベンゾフラン環、ジベンゾチオフェン環、フェノキサジン環、フェノチアジン環、9,10-ジヒドロアクリジン環又は5,10-ジヒドロフェナジン環から、環を構成する炭素原子又はヘテロ原子に直接結合する水素原子1個を除いてなる基であり、より好ましくは、ジアゾール環、トリアゾール環、ピリジン環、ジアザベンゼン環、トリアジン環、ベンゾジアゾール環、ベンゾトリアゾール環、カルバゾール環、ジベンゾフラン環又はジベンゾチオフェン環から、環を構成する炭素原子又はヘテロ原子に直接結合する水素原子1個を除いてなる基であり、これらの基は更に置換基を有していてもよい。 Examples of the monovalent heterocyclic group in Ar H1 and Ar H2 include a pyrrole ring, a diazole ring, a triazole ring, a pyridine ring, a diazabenzene ring, a triazine ring, an azanaphthalene ring, a diazanaphthalene ring, a triazanaphthalene ring, and an indol. Ring, benzodiazole ring, benzotriazole ring, carbazole ring, azacarbazole ring, diazacarbazole ring, dibenzofuran ring, dibenzothiophene ring, phenoxazine ring, phenothiazine ring, acridin ring, 9,10-dihydroacridine ring, acridone ring , Phenazine ring and 5,10-dihydrophenazine ring, except for one hydrogen atom directly bonded to a carbon atom or a heteroatom constituting the ring, preferably a diazole ring, a triazole ring, or a pyridine ring. , Diazabenzene ring, triazine ring, indole ring, benzodiazole ring, benzotriazole ring, carbazole ring, dibenzofuran ring, dibenzothiophene ring, phenoxazine ring, phenothiazine ring, 9,10-dihydroacridine ring or 5,10-dihydrophenazine It is a group consisting of a ring excluding one hydrogen atom directly bonded to a carbon atom or a heteroatom constituting the ring, and more preferably a diazole ring, a triazole ring, a pyridine ring, a diazabenzene ring, a triazine ring, or a benzodiazole. It is a group consisting of a ring, a benzotriazole ring, a carbazole ring, a dibenzofuran ring or a dibenzothiophene ring except for one hydrogen atom directly bonded to a carbon atom or a heteroatom constituting the ring, and these groups further contain a substituent. You may have.
ArH1及びArH2における置換アミノ基において、アミノ基が有する置換基としては、アリール基または1価の複素環基が好ましく、アリール基がより好ましく、これらの基は更に置換基を有していてもよい。アミノ基が有する置換基におけるアリール基の例及び好ましい範囲は、ArH1及びArH2におけるアリール基の例及び好ましい範囲と同じである。
アミノ基が有する置換基における1価の複素環基の例及び好ましい範囲は、ArH1及びArH2における1価の複素環基の例及び好ましい範囲と同じである。
Among the substituted amino groups in Ar H1 and Ar H2 , the substituent having the amino group is preferably an aryl group or a monovalent heterocyclic group, more preferably an aryl group, and these groups further have a substituent. May be good. The examples and preferred ranges of aryl groups in the substituents of the amino groups are the same as the examples and preferred ranges of aryl groups in Ar H1 and Ar H2 .
The example and preferred range of the monovalent heterocyclic group in the substituent of the amino group is the same as the example and preferred range of the monovalent heterocyclic group in Ar H1 and Ar H2 .
ArH1及びArH2が有していてもよい置換基としては、好ましくは、アルキル基、シクロアルキル基、アリール基、1価の複素環基、アルコキシ基、シクロアルコキシ基、アリールオキシ基、置換アミノ基又はハロゲン原子であり、より好ましくは、アルキル基、シクロアルキル基、アルコキシ基、シクロアルコキシ基、アリール基、1価の複素環基又は置換アミノ基であり、更に好ましくは、アルキル基、シクロアルキル基、アリール基又は1価の複素環基であり、特に好ましくは、アルキル基、シクロアルキル基又はアリール基であり、これらの基は更に置換基を有していてもよい。 The substituents that Ar H1 and Ar H2 may have are preferably an alkyl group, a cycloalkyl group, an aryl group, a monovalent heterocyclic group, an alkoxy group, a cycloalkoxy group, an aryloxy group, and a substituted amino. It is a group or a halogen atom, more preferably an alkyl group, a cycloalkyl group, an alkoxy group, a cycloalkoxy group, an aryl group, a monovalent heterocyclic group or a substituted amino group, and more preferably an alkyl group or a cycloalkyl group. It is a group, an aryl group or a monovalent heterocyclic group, particularly preferably an alkyl group, a cycloalkyl group or an aryl group, and these groups may further have a substituent.
ArH1及びArH2が有していてもよい置換基におけるアリール基、1価の複素環基及び置換アミノ基の例及び好ましい範囲は、それぞれ、ArH1及びArH2におけるアリール基、1価の複素環基及び置換アミノ基の例及び好ましい範囲と同じである。 Examples and preferred ranges of aryl groups, monovalent heterocyclic groups and substituted amino groups in the substituents that Ar H1 and Ar H2 may have are the aryl groups and monovalent complex in Ar H1 and Ar H2 , respectively. It is the same as the example and preferable range of a ring group and a substituted amino group.
ArH1及びArH2が有していてもよい置換基が更に有していてもよい置換基としては、好ましくは、アルキル基、シクロアルキル基、アリール基、1価の複素環基、アルコキシ基、シクロアルコキシ基、アリールオキシ基、置換アミノ基又はハロゲン原子であり、より好ましくは、アルキル基、シクロアルキル基、アルコキシ基、シクロアルコキシ基、アリール基、1価の複素環基又は置換アミノ基であり、更に好ましくは、アルキル基、シクロアルキル基、アリール基又は1価の複素環基であり、特に好ましくは、アルキル基又はシクロアルキル基であり、これらの基は更に置換基を有していてもよい。 The substituents that the substituents that Ar H1 and Ar H2 may have may further include, preferably, an alkyl group, a cycloalkyl group, an aryl group, a monovalent heterocyclic group, an alkoxy group, and the like. It is a cycloalkoxy group, an aryloxy group, a substituted amino group or a halogen atom, more preferably an alkyl group, a cycloalkyl group, an alkoxy group, a cycloalkoxy group, an aryl group, a monovalent heterocyclic group or a substituted amino group. More preferably, it is an alkyl group, a cycloalkyl group, an aryl group or a monovalent heterocyclic group, and particularly preferably an alkyl group or a cycloalkyl group, even if these groups further have a substituent. good.
ArH1及びArH2が有していてもよい置換基が更に有していてもよい置換基におけるアリール基、1価の複素環基及び置換アミノ基の例及び好ましい範囲は、それぞれ、ArH1及びArH2におけるアリール基、1価の複素環基及び置換アミノ基の例及び好ましい範囲と同じである。 Examples and preferred ranges of aryl groups, monovalent heterocyclic groups and substituted amino groups in the substituents that the substituents Ar H1 and Ar H2 may have may further include Ar H1 and Ar H2, respectively. It is the same as the example and preferable range of the aryl group, the monovalent heterocyclic group and the substituted amino group in Ar H2 .
nH1は、好ましくは0以上10以下の整数であり、より好ましくは1以上5以下の整数であり、更に好ましくは1以上3以下の整数である。 n H1 is preferably an integer of 0 or more and 10 or less, more preferably an integer of 1 or more and 5 or less, and further preferably an integer of 1 or more and 3 or less.
LH1は、好ましくは、アリーレン基または2価の複素環基であり、より好ましくはアリーレン基である。 L H1 is preferably an arylene group or a divalent heterocyclic group, and more preferably an arylene group.
LH1が有していてもよい置換基の例及び好ましい範囲は、ArH1及びArH2が有していてもよい置換基の例及び好ましい範囲と同じである。 The examples and preferred ranges of substituents that L H1 may have are the same as the examples and preferred ranges of substituents that Ar H1 and Ar H2 may have.
LH1におけるアリーレン基は、好ましくは、式(A-1)~式(A-14)又は式(A-17)~式(A-20)で表される基であり、より好ましくは、式(A-1)~式(A-9)、式(A-11)~式(A-14)、式(A-19)又は式(A-20)で表される基であり、更に好ましくは、式(A-1)~式(A-7)、式(A-9)、式(A-11)~式(A-14)又は式(A-19)で表される基であり、特に好ましくは、式(A-1)~式(A-6)、式(A-11)又は式(A-12)である。 The arylene group in L H1 is preferably a group represented by the formula (A-1) to the formula (A-14) or the formula (A-17) to the formula (A-20), and more preferably the formula. It is a group represented by the formula (A-1) to the formula (A-9), the formula (A-11) to the formula (A-14), the formula (A-19) or the formula (A-20), and more preferably. Is a group represented by the formulas (A-1) to (A-7), formula (A-9), formulas (A-11) to formulas (A-14) or formulas (A-19). Particularly preferably, it is a formula (A-1) to a formula (A-6), a formula (A-11) or a formula (A-12).
LH1における2価の複素環基は、好ましくは、式(AA-1)~式(AA-6)、式(AA-10)~式(AA-22)又は式(AA-24)~式(AA-34)で表される基であり、より好ましくは、式(AA-1)~式(AA-4)、式(AA-10)~式(AA-15)又は式(AA-18)~式(AA-21)又は式(AA-27)~式(AA-34)で表される基であり、更に好ましくは、式(AA-1)~式(AA-4)、式(AA-10)~式(AA-15)又は式(AA-27)~式(AA-32)で表される基である。 The divalent heterocyclic group in L H1 is preferably the formula (AA-1) to the formula (AA-6), the formula (AA-10) to the formula (AA-22) or the formula (AA-24) to the formula. It is a group represented by (AA-34), and more preferably, the formula (AA-1) to the formula (AA-4), the formula (AA-10) to the formula (AA-15) or the formula (AA-18). )-Formula (AA-21) or formula (AA-27) -formula (AA-34), more preferably formulas (AA-1) to formula (AA-4), formula (AA-4). AA-10) to a group represented by the formula (AA-15) or the formula (AA-27) to the formula (AA-32).
nH11は、好ましくは1以上5以下の整数であり、より好ましく1以上3以下の整数であり、更に好ましく1である。 n H11 is preferably an integer of 1 or more and 5 or less, more preferably an integer of 1 or more and 3 or less, and further preferably 1.
RH11は、水素原子、アルキル基、シクロアルキル基、アリール基または1価の複素環基であることが好ましく、水素原子、アルキル基またはシクロアルキル基であることがより好ましく、水素原子またはアルキル基であることが更に好ましく、これらの基は置換基を有していてもよい。 RH11 is preferably a hydrogen atom, an alkyl group, a cycloalkyl group, an aryl group or a monovalent heterocyclic group, more preferably a hydrogen atom, an alkyl group or a cycloalkyl group, and a hydrogen atom or an alkyl group. More preferably, these groups may have a substituent.
RH11が有していてもよい置換基の例及び好ましい範囲は、ArH1及びArH2が有していてもよい置換基の例及び好ましい範囲と同じである。 The examples and preferred ranges of substituents that RH11 may have are the same as the examples and preferred ranges of substituents that Ar H1 and Ar H2 may have.
式(FH-1)で表される化合物としては、例えば、下記式で表される化合物が挙げられる。 Examples of the compound represented by the formula (FH-1) include compounds represented by the following formula.
[高分子ホスト]
ホスト材料として好ましい高分子化合物(以下、「高分子ホスト」と言う。)に関して説明する。
[Polymer host]
A polymer compound preferable as a host material (hereinafter referred to as “polymer host”) will be described.
高分子ホストは、好ましくは、式(Y)で表される構成単位を含む高分子化合物である。 The polymer host is preferably a polymer compound containing a structural unit represented by the formula (Y).
ArY1で表されるアリーレン基は、より好ましくは式(A-1)、式(A-6)、式(A-7)、式(A-9)~式(A-11)、式(A-13)又は式(A-19)で表される基であり、更に好ましくは式(A-1)、式(A-7)、式(A-9) 式(A-11)又は式(A-19)で表される基であり、これらの基は置換基を有していてもよい。 The arylene group represented by Ar Y1 is more preferably the formula (A-1), the formula (A-6), the formula (A-7), the formula (A-9) to the formula (A-11), the formula ( A group represented by A-13) or formula (A-19), more preferably formula (A-1), formula (A-7), formula (A-9), formula (A-11) or formula. It is a group represented by (A-19), and these groups may have a substituent.
ArY1で表される2価の複素環基は、より好ましくは式(AA-4)、式(AA-10)、式(AA-13)、式(AA-15)、式(AA-18)又は式(AA-20)で表される基であり、とりわけ好ましくは式(AA-4)、式(AA-10)、式(AA-18)又は式(AA-20)で表される基であり、これらの基は置換基を有していてもよい。 The divalent heterocyclic group represented by Ar Y1 is more preferably the formula (AA-4), the formula (AA-10), the formula (AA-13), the formula (AA-15), the formula (AA-18). ) Or a group represented by the formula (AA-20), and particularly preferably represented by the formula (AA-4), the formula (AA-10), the formula (AA-18) or the formula (AA-20). It is a group, and these groups may have a substituent.
ArY1で表される少なくとも1種のアリーレン基と少なくとも1種の2価の複素環基とが直接結合した2価の基における、アリーレン基及び2価の複素環基のより好ましい範囲、更に好ましい範囲は、それぞれ、前述のArY1で表されるアリーレン基及び2価の複素環基のより好ましい範囲、更に好ましい範囲と同様である。 A more preferable range of the arylene group and the divalent heterocyclic group in the divalent group in which at least one arylene group represented by Ar Y1 and at least one divalent heterocyclic group are directly bonded, further preferable. The range is the same as the more preferable range and the more preferable range of the arylene group and the divalent heterocyclic group represented by Ar Y1 described above, respectively.
ArY1で表される少なくとも1種のアリーレン基と少なくとも1種の2価の複素環基とが直接結合した2価の基としては、式(X)のArX2及びArX4で表される少なくとも1種のアリーレン基と少なくとも1種の2価の複素環基とが直接結合した2価の基と同様のものが挙げられる。 As a divalent group in which at least one arylene group represented by Ar Y1 and at least one divalent heterocyclic group are directly bonded, at least Ar X 2 and Ar X 4 represented by the formula (X) are represented. Examples thereof include those similar to a divalent group in which one arylene group and at least one divalent heterocyclic group are directly bonded.
ArY1で表される基が有してもよい置換基は、好ましくはアルキル基、シクロアルキル基又はアリール基であり、これらの基は更に置換基を有していてもよい。 The substituent that the group represented by Ar Y1 may have is preferably an alkyl group, a cycloalkyl group or an aryl group, and these groups may further have a substituent.
式(Y)で表される構成単位としては、例えば、式(Y-1)~式(Y-8)で表される構成単位が挙げられ、本発明の発光素子の発光効率の観点からは、好ましくは式(Y-1)、式(Y-2)又は式(Y-8)で表される構成単位であり、高分子ホストの電子輸送性の観点からは、好ましくは式(Y-3)又は式(Y-4)で表される構成単位であり、高分子ホストの正孔輸送性の観点からは、好ましくは式(Y-5)~式(Y-7)で表される構成単位である。 Examples of the structural unit represented by the formula (Y) include the structural units represented by the formulas (Y-1) to (Y-8), and from the viewpoint of the luminous efficiency of the light emitting element of the present invention. , Preferably a structural unit represented by the formula (Y-1), the formula (Y-2) or the formula (Y-8), and is preferably the formula (Y-) from the viewpoint of electron transportability of the polymer host. It is a structural unit represented by 3) or the formula (Y-4), and is preferably represented by the formulas (Y-5) to (Y-7) from the viewpoint of hole transportability of the polymer host. It is a structural unit.
高分子ホストは、本発明の発光素子の発光効率がより優れるため、好ましくは、式(Y-2)及び/又は式(Y-8)で表される構成単位を含む高分子化合物であり、より好ましくは式(Y-2)及び式(Y-8)で表される構成単位を含む高分子化合物である。 The polymer host is preferably a polymer compound containing a structural unit represented by the formula (Y-2) and / or the formula (Y-8) because the luminous efficiency of the light emitting element of the present invention is more excellent. More preferably, it is a polymer compound containing a structural unit represented by the formula (Y-2) and the formula (Y-8).
RY1は、好ましくは水素原子、アルキル基、シクロアルキル基又はアリール基であり、これらの基は置換基を有していてもよい。 RY1 is preferably a hydrogen atom, an alkyl group, a cycloalkyl group or an aryl group, and these groups may have a substituent.
式(Y-1)で表される構成単位は、好ましくは、式(Y-1')で表される構成単位である。 The structural unit represented by the equation (Y-1) is preferably the structural unit represented by the equation (Y-1').
RY11は、好ましくは、アルキル基、シクロアルキル基又はアリール基であり、より好ましくは、アルキル基又はシクロアルキル基であり、これらの基は置換基を有していてもよい。 RY11 is preferably an alkyl group, a cycloalkyl group or an aryl group, more preferably an alkyl group or a cycloalkyl group, and these groups may have a substituent.
RY1は前記と同じ意味を表す。
XY1は、-C(RY2)2-、-C(RY2)=C(RY2)-又は-C(RY2)2-C(RY2)2-で表される基を表す。RY2は、水素原子、アルキル基、シクロアルキル基、アルコキシ基、シクロアルコキシ基、アリール基又は1価の複素環基を表し、これらの基は置換基を有していてもよい。複数存在するRY2は、同一でも異なっていてもよく、RY2同士は互いに結合して、それぞれが結合する炭素原子と共に環を形成していてもよい。]
RY1 has the same meaning as described above.
X Y1 represents a group represented by -C ( RY2 ) 2- , -C ( RY2 ) = C ( RY2 )-or -C ( RY2 ) 2 -C ( RY2 ) 2- . RY2 represents a hydrogen atom, an alkyl group, a cycloalkyl group, an alkoxy group, a cycloalkoxy group, an aryl group or a monovalent heterocyclic group, and these groups may have a substituent. A plurality of RY2s existing may be the same or different, and the RY2s may be bonded to each other to form a ring together with the carbon atoms to which they are bonded. ]
RY2は、好ましくはアルキル基、シクロアルキル基、アリール基又は1価の複素環基であり、より好ましくはアルキル基、シクロアルキル基又はアリール基であり、これらの基は置換基を有していてもよい。 RY2 is preferably an alkyl group, a cycloalkyl group, an aryl group or a monovalent heterocyclic group, more preferably an alkyl group, a cycloalkyl group or an aryl group, and these groups have a substituent. May be.
XY1において、-C(RY2)2-で表される基中の2個のRY2の組み合わせは、好ましくは双方がアルキル基若しくはシクロアルキル基、双方がアリール基、双方が1価の複素環基、又は、一方がアルキル基若しくはシクロアルキル基で他方がアリール基若しくは1価の複素環基であり、より好ましくは一方がアルキル基若しくはシクロアルキル基で他方がアリール基であり、これらの基は置換基を有していてもよい。2個存在するRY2は互いに結合して、それぞれが結合する原子と共に環を形成していてもよく、RY2が環を形成する場合、-C(RY2)2-で表される基としては、好ましくは式(Y-A1)~式(Y-A5)で表される基であり、より好ましくは式(Y-A4)で表される基であり、これらの基は置換基を有していてもよい。 In XY1 , the combination of two RY2s in the group represented by −C ( RY2 ) 2− is preferably a complex having both an alkyl group or a cycloalkyl group, both having an aryl group, and both having a monovalent value. A ring group, or one of which is an alkyl or cycloalkyl group and the other of which is an aryl or monovalent heterocyclic group, more preferably one of which is an alkyl or cycloalkyl group and the other of which is an aryl group. May have a substituent. The two existing RY2s may be bonded to each other to form a ring with the atoms to which they are bonded, and when RY2 forms a ring, it is represented by -C ( RY2 ) 2- . Is preferably a group represented by the formulas (Y-A1) to (Y-A5), more preferably a group represented by the formula (Y-A4), and these groups have a substituent. You may be doing it.
XY1において、-C(RY2)=C(RY2)-で表される基中の2個のRY2の組み合わせは、好ましくは双方がアルキル基若しくはシクロアルキル基、又は、一方がアルキル基若しくはシクロアルキル基で他方がアリール基であり、これらの基は置換基を有していてもよい。 In XY1 , the combination of two RY2s in the group represented by −C ( RY2 ) = C ( RY2 ) − is preferably both an alkyl group or a cycloalkyl group, or one is an alkyl group. Alternatively, it may be a cycloalkyl group and the other is an aryl group, and these groups may have a substituent.
XY1において、-C(RY2)2-C(RY2)2-で表される基中の4個のRY2は、好ましくは置換基を有していてもよいアルキル基又は置換基を有していてもよいシクロアルキル基である。複数あるRY2は互いに結合して、それぞれが結合する原子と共に環を形成していてもよく、RY2が環を形成する場合、-C(RY2)2-C(RY2)2-で表される基は、好ましくは式(Y-B1)~式(Y-B5)で表される基であり、より好ましくは式(Y-B3)で表される基であり、これらの基は置換基を有していてもよい。 In XY1 , the four RY2s among the groups represented by −C ( RY2 ) 2 −C ( RY2 ) 2− preferably contain an alkyl group or a substituent which may have a substituent. It is a cycloalkyl group that may have. Multiple RY2s may be bonded to each other to form a ring with the atoms to which they are bonded. If RY2 forms a ring, then -C ( RY2 ) 2 -C ( RY2 ) 2- The groups represented are preferably groups represented by the formulas (Y-B1) to (Y-B5), more preferably groups represented by the formula (Y-B3), and these groups are represented by the formulas (Y-B3). It may have a substituent.
式(Y-2)で表される構成単位は、式(Y-2')で表される構成単位であることが好ましい。 The structural unit represented by the equation (Y-2) is preferably the structural unit represented by the equation (Y-2').
RY1は前記と同じ意味を表す。
RY3は、水素原子、アルキル基、シクロアルキル基、アルコキシ基、シクロアルコキシ基、アリール基又は1価の複素環基を表し、これらの基は置換基を有していてもよい。]
RY1 has the same meaning as described above.
RY3 represents a hydrogen atom, an alkyl group, a cycloalkyl group, an alkoxy group, a cycloalkoxy group, an aryl group or a monovalent heterocyclic group, and these groups may have a substituent. ]
RY3は、好ましくはアルキル基、シクロアルキル基、アルコキシ基、シクロアルコキシ基、アリール基又は1価の複素環基であり、より好ましくはアリール基であり、これらの基は置換基を有していてもよい。 RY3 is preferably an alkyl group, a cycloalkyl group, an alkoxy group, a cycloalkoxy group, an aryl group or a monovalent heterocyclic group, more preferably an aryl group, and these groups have a substituent. May be.
RY1は前記を同じ意味を表す。
RY4は、水素原子、アルキル基、シクロアルキル基、アルコキシ基、シクロアルコキシ基、アリール基又は1価の複素環基を表し、これらの基は置換基を有していてもよい。]
RY1 has the same meaning as above.
RY4 represents a hydrogen atom, an alkyl group, a cycloalkyl group, an alkoxy group, a cycloalkoxy group, an aryl group or a monovalent heterocyclic group, and these groups may have a substituent. ]
RY4は、好ましくはアルキル基、シクロアルキル基、アルコキシ基、シクロアルコキシ基、アリール基又は1価の複素環基であり、より好ましくはアリール基であり、これらの基は置換基を有していてもよい。 RY4 is preferably an alkyl group, a cycloalkyl group, an alkoxy group, a cycloalkoxy group, an aryl group or a monovalent heterocyclic group, more preferably an aryl group, and these groups have a substituent. May be.
式(Y)で表される構成単位としては、例えば、式(Y-11)~式(Y-56)で表される構成単位が挙げられ、好ましくは、式(Y-11)~式(Y-55)で表される構成単位である。 Examples of the structural unit represented by the formula (Y) include the structural units represented by the formulas (Y-11) to the formula (Y-56), and the structural units represented by the formulas (Y-11) to the formula (Y-11) are preferable. It is a structural unit represented by Y-55).
式(Y)で表される構成単位であって、ArY1がアリーレン基である構成単位は、本発明の発光素子の発光効率がより優れるので、高分子ホストに含まれる構成単位の合計量に対して、好ましくは10~100モル%であり、より好ましくは50~100モル%である。 The structural unit represented by the formula (Y) in which Ar Y1 is an arylene group has a higher luminous efficiency of the light emitting element of the present invention, and therefore is included in the total amount of the structural units contained in the polymer host. On the other hand, it is preferably 10 to 100 mol%, and more preferably 50 to 100 mol%.
式(Y)で表される構成単位であって、ArY1が2価の複素環基、又は、少なくとも1種のアリーレン基と少なくとも1種の2価の複素環基とが直接結合した2価の基である構成単位は、高分子ホストの電荷輸送性が優れるので、高分子ホストに含まれる構成単位の合計量に対して、好ましくは0.5~40モル%であり、より好ましくは3~30モル%である。 It is a structural unit represented by the formula (Y), and Ar Y1 is a divalent heterocyclic group, or a divalent group in which at least one arylene group and at least one divalent heterocyclic group are directly bonded. Since the structural unit which is the basis of the above is excellent in charge transportability of the polymer host, it is preferably 0.5 to 40 mol%, more preferably 3 to 30% with respect to the total amount of the structural units contained in the polymer host. Mol%.
式(Y)で表される構成単位は、高分子ホスト中に、1種のみ含まれていてもよく、2種以上含まれていてもよい。 The structural unit represented by the formula (Y) may be contained in only one kind or two or more kinds in the polymer host.
高分子ホストは、正孔輸送性が優れるので、更に、式(X)で表される構成単位を含むことが好ましい。 Since the polymer host has excellent hole transportability, it is preferable that the polymer host further contains a structural unit represented by the formula (X).
aX1及びaX2は、それぞれ独立に、0以上の整数を表す。
ArX1及びArX3は、それぞれ独立に、アリーレン基又は2価の複素環基を表し、これらの基は置換基を有していてもよい。
ArX2及びArX4は、それぞれ独立に、アリーレン基、2価の複素環基、又は、少なくとも1種のアリーレン基と少なくとも1種の2価の複素環基とが直接結合した2価の基を表し、これらの基は置換基を有していてもよい。ArX2及びArX4が複数存在する場合、それらは同一でも異なっていてもよい。
RX1、RX2及びRX3は、それぞれ独立に、水素原子、アルキル基、シクロアルキル基、アリール基又は1価の複素環基を表し、これらの基は置換基を有していてもよい。RX2及びRX3が複数存在する場合、それらは同一でも異なっていてもよい。]
a X1 and a X2 each independently represent an integer of 0 or more.
Ar X1 and Ar X3 each independently represent an arylene group or a divalent heterocyclic group, and these groups may have a substituent.
Ar X2 and Ar X4 each independently form an arylene group, a divalent heterocyclic group, or a divalent group in which at least one arylene group and at least one divalent heterocyclic group are directly bonded. Representing, these groups may have substituents. If there are multiple Ar X2 and Ar X4 , they may be the same or different.
R X1 , R X 2 and R X 3 each independently represent a hydrogen atom, an alkyl group, a cycloalkyl group, an aryl group or a monovalent heterocyclic group, and these groups may have a substituent. If there are multiple R X2 and R X 3 , they may be the same or different. ]
aX1は、本発明の発光素子の発光効率がより優れるので、好ましくは2以下の整数であり、より好ましくは1である。 Since the luminous efficiency of the light emitting device of the present invention is more excellent, a X1 is preferably an integer of 2 or less, and more preferably 1.
aX2は、本発明の発光素子の発光効率がより優れるので、好ましくは2以下の整数であり、より好ましくは0である。 Since a X2 has a higher luminous efficiency of the light emitting device of the present invention, it is preferably an integer of 2 or less, and more preferably 0.
RX1、RX2及びRX3は、好ましくはアルキル基、シクロアルキル基、アリール基又は1価の複素環基であり、より好ましくはアリール基であり、これらの基は置換基を有していてもよい。 R X1 , R X 2 and R X 3 are preferably an alkyl group, a cycloalkyl group, an aryl group or a monovalent heterocyclic group, more preferably an aryl group, and these groups have a substituent. May be good.
ArX1及びArX3で表されるアリーレン基は、より好ましくは式(A-1)又は式(A-9)で表される基であり、更に好ましくは式(A-1)で表される基であり、これらの基は置換基を有していてもよい。 The arylene group represented by Ar X1 and Ar X3 is more preferably a group represented by the formula (A-1) or the formula (A-9), and further preferably represented by the formula (A-1). It is a group, and these groups may have a substituent.
ArX1及びArX3で表される2価の複素環基は、より好ましくは式(AA-1)、式(AA-2)又は式(AA-7)~式(AA-26)で表される基であり、これらの基は置換基を有していてもよい。 The divalent heterocyclic group represented by Ar X1 and Ar X3 is more preferably represented by the formula (AA-1), the formula (AA-2) or the formulas (AA-7) to the formula (AA-26). These groups may have substituents.
ArX1及びArX3は、好ましくは置換基を有していてもよいアリーレン基である。 Ar X1 and Ar X3 are preferably arylene groups which may have a substituent.
ArX2及びArX4で表されるアリーレン基は、より好ましくは式(A-1)、式(A-6)、式(A-7)、式(A-9)~式(A-11)又は式(A-19)で表される基であり、これらの基は置換基を有していてもよい。 The arylene group represented by Ar X2 and Ar X4 is more preferably the formula (A-1), the formula (A-6), the formula (A-7), the formula (A-9) to the formula (A-11). Alternatively, it is a group represented by the formula (A-19), and these groups may have a substituent.
ArX2及びArX4で表される2価の複素環基のより好ましい範囲は、ArX1及びArX3で表される2価の複素環基のより好ましい範囲と同じである。 The more preferred range of the divalent heterocyclic groups represented by Ar X2 and Ar X4 is the same as the more preferred range of the divalent heterocyclic groups represented by Ar X1 and Ar X3 .
ArX2及びArX4で表される少なくとも1種のアリーレン基と少なくとも1種の2価の複素環基とが直接結合した2価の基における、アリーレン基及び2価の複素環基のより好ましい範囲、更に好ましい範囲は、それぞれ、ArX1及びArX3で表されるアリーレン基及び2価の複素環基のより好ましい範囲、更に好ましい範囲と同じである。 A more preferable range of an arylene group and a divalent heterocyclic group in a divalent group in which at least one arylene group represented by Ar X2 and Ar X4 and at least one divalent heterocyclic group are directly bonded. The more preferable range is the same as the more preferable range and the further preferable range of the arylene group represented by Ar X1 and Ar X3 and the divalent heterocyclic group, respectively.
ArX2及びArX4で表される少なくとも1種のアリーレン基と少なくとも1種の2価の複素環基とが直接結合した2価の基としては、例えば、下記式で表される基が挙げられ、これらは置換基を有していてもよい。 Examples of the divalent group in which at least one arylene group represented by Ar X2 and Ar X4 and at least one divalent heterocyclic group are directly bonded include a group represented by the following formula. , These may have substituents.
RXXは、好ましくはアルキル基、シクロアルキル基又はアリール基であり、これらの基は置換基を有していてもよい。 R XX is preferably an alkyl group, a cycloalkyl group or an aryl group, and these groups may have a substituent.
ArX2及びArX4は、好ましくは置換基を有していてもよいアリーレン基である。 Ar X2 and Ar X4 are preferably arylene groups which may have a substituent.
ArX1~ArX4及びRX1~RX3で表される基が有してもよい置換基としては、好ましくはアルキル基、シクロアルキル基又はアリール基であり、これらの基は更に置換基を有していてもよい。 The substituents that the groups represented by Ar X1 to Ar X4 and R X1 to R X3 may have are preferably an alkyl group, a cycloalkyl group or an aryl group, and these groups further have a substituent. You may be doing it.
式(X)で表される構成単位としては、好ましくは式(X-1)~式(X-7)で表される構成単位であり、より好ましくは式(X-3)~式(X-7)で表される構成単位であり、更に好ましくは式(X-3)~式(X-6)で表される構成単位である。 The structural unit represented by the formula (X) is preferably a structural unit represented by the formulas (X-1) to (X-7), and more preferably the formulas (X-3) to (X). It is a structural unit represented by -7), and more preferably a structural unit represented by equations (X-3) to (X-6).
式(X)で表される構成単位は、正孔輸送性が優れるので、高分子ホストに含まれる構成単位の合計量に対して、好ましくは0.1~50モル%であり、より好ましくは1~40モル%であり、更に好ましくは5~30モル%である。 Since the structural unit represented by the formula (X) has excellent hole transportability, it is preferably 0.1 to 50 mol%, more preferably 1 to 1 to the total amount of the structural units contained in the polymer host. It is 40 mol%, more preferably 5 to 30 mol%.
式(X)で表される構成単位としては、例えば、式(X1-1)~式(X1-19)で表される構成単位が挙げられ、好ましくは式(X1-6)~式(X1-14)で表される構成単位である。 Examples of the structural unit represented by the formula (X) include the structural units represented by the formulas (X1-1) to (X1-19), preferably the formulas (X1-6) to (X1). It is a structural unit represented by -14).
高分子ホストにおいて、式(X)で表される構成単位は、1種のみ含まれていても、2種以上含まれていてもよい。 In the polymer host, the structural unit represented by the formula (X) may contain only one kind or two or more kinds.
高分子ホストとしては、例えば、高分子化合物(P-1)~(P-6)が挙げられる。ここで、「その他」の構成単位とは、式(Y)で表される構成単位、式(X)で表される構成単位以外の構成単位を意味する。 Examples of the polymer host include polymer compounds (P-1) to (P-6). Here, the “other” structural unit means a structural unit other than the structural unit represented by the formula (Y) and the structural unit represented by the formula (X).
高分子化合物(P-1)~(P-6)における、式(X)及び式(Y)で表される構成単位の例及び好ましい範囲は、上述のとおりである。 Examples and preferable ranges of the structural units represented by the formulas (X) and (Y) in the polymer compounds (P-1) to (P-6) are as described above.
高分子ホストは、ブロック共重合体、ランダム共重合体、交互共重合体、グラフト共重合体のいずれであってもよいし、その他の態様であってもよいが、複数種の原料モノマーを共重合してなる共重合体であることが好ましい。 The polymer host may be any of a block copolymer, a random copolymer, an alternating copolymer, a graft copolymer, and other embodiments, but a plurality of kinds of raw material monomers are used together. It is preferably a copolymer obtained by polymerizing.
高分子ホストのポリスチレン換算の数平均分子量は、好ましくは5×103~1×106であり、より好ましくは1×104~5×105であり、より好ましくは1.5×104~2×105である。 The polystyrene-equivalent number average molecular weight of the polymer host is preferably 5 × 10 3 to 1 × 10 6 , more preferably 1 × 10 4 to 5 × 10 5 , and more preferably 1.5 × 10 4 to 2. It is × 10 5 .
[高分子ホストの製造方法]
高分子ホストは、ケミカルレビュー(Chem. Rev.),第109巻,897-1091頁(2009年)等に記載の公知の重合方法を用いて製造することができ、Suzuki反応、Yamamoto反応、Buchwald反応、Stille反応、Negishi反応及びKumada反応等の遷移金属触媒を用いるカップリング反応により重合させる方法が例示される。
[Manufacturing method of polymer host]
The polymer host can be produced using a known polymerization method described in Chemical Review (Chem. Rev.), Vol. 109, pp. 897-1091 (2009), etc., and can be produced by Suzuki reaction, Yamamoto reaction, Buchwald, etc. Examples thereof include a method of polymerizing by a coupling reaction using a transition metal catalyst such as a reaction, a Stille reaction, a Negishi reaction and a Kumada reaction.
前記重合方法において、単量体を仕込む方法としては、単量体全量を反応系に一括して仕込む方法、単量体の一部を仕込んで反応させた後、残りの単量体を一括、連続又は分割して仕込む方法、単量体を連続又は分割して仕込む方法等が挙げられる。 In the above-mentioned polymerization method, as a method of charging the monomers, a method of charging the entire amount of the monomers in a batch, a method of charging a part of the monomers and reacting them, and then collectively charging the remaining monomers. Examples thereof include a method of continuously or separately charging, a method of continuously or separately charging a monomer, and the like.
遷移金属触媒としては、パラジウム触媒、ニッケル触媒等が挙げられる。 Examples of the transition metal catalyst include a palladium catalyst, a nickel catalyst and the like.
重合反応の後処理は、公知の方法、例えば、分液により水溶性不純物を除去する方法、メタノール等の低級アルコールに重合反応後の反応液を加えて、析出させた沈殿を濾過した後、乾燥させる方法等を単独又は組み合わせて行う。高分子ホストの純度が低い場合、例えば、晶析、再沈殿、ソックスレー抽出器による連続抽出、カラムクロマトグラフィー等の通常の方法にて精製することができる。 The post-treatment of the polymerization reaction is carried out by a known method, for example, a method of removing water-soluble impurities by separating liquids, a reaction liquid after the polymerization reaction is added to a lower alcohol such as methanol, the precipitated precipitate is filtered, and then dried. The method of making the mixture is used alone or in combination. When the purity of the polymer host is low, it can be purified by a usual method such as crystallization, reprecipitation, continuous extraction with a Soxhlet extractor, column chromatography and the like.
[第1の組成物]
第1の有機層は、式(1)で表される化合物と、前述のホスト材料、正孔輸送材料、正孔注入材料、電子輸送材料、電子注入材料、発光材料(式(1)で表される化合物とは異なる。)及び酸化防止剤からなる群から選ばれる少なくとも1種の材料とを含む組成物(以下、「第1の組成物」ともいう。)を含有する層であってもよい。
[First composition]
The first organic layer includes a compound represented by the formula (1), and the above-mentioned host material, hole transport material, hole injection material, electron transport material, electron injection material, and light emitting material (represented by the formula (1)). Even a layer containing a composition (hereinafter, also referred to as "first composition") containing at least one material selected from the group consisting of an antioxidant (hereinafter, also referred to as "first composition"). good.
[正孔輸送材料]
正孔輸送材料は、低分子化合物と高分子化合物とに分類され、好ましくは高分子化合物である。正孔輸送材料は、架橋基を有していてもよい。
[Hole transport material]
The hole transport material is classified into a low molecular weight compound and a high molecular weight compound, and is preferably a high molecular weight compound. The hole transport material may have a cross-linking group.
高分子化合物としては、例えば、ポリビニルカルバゾール及びその誘導体;側鎖又は主鎖に芳香族アミン構造を有するポリアリーレン及びその誘導体が挙げられる。高分子化合物は、電子受容性部位が結合された化合物でもよい。電子受容性部位としては、例えば、フラーレン、テトラフルオロテトラシアノキノジメタン、テトラシアノエチレン、トリニトロフルオレノン等が挙げられ、好ましくはフラーレンである。 Examples of the polymer compound include polyvinylcarbazole and its derivatives; polyarylene having an aromatic amine structure in its side chain or main chain and its derivatives. The polymer compound may be a compound to which an electron accepting site is bound. Examples of the electron-accepting site include fullerene, tetrafluorotetracyanoquinodimethane, tetracyanoethylene, trinitrofluorenone and the like, and fullerene is preferable.
第1の組成物において、正孔輸送材料の配合量は、式(1)で表される化合物を100重量部とした場合、通常、1~400重量部であり、好ましくは5~150重量部である。 In the first composition, the blending amount of the hole transporting material is usually 1 to 400 parts by weight, preferably 5 to 150 parts by weight, when the compound represented by the formula (1) is 100 parts by weight. Is.
正孔輸送材料は、一種単独で用いても二種以上を併用してもよい。 The hole transport material may be used alone or in combination of two or more.
[電子輸送材料]
電子輸送材料は、低分子化合物と高分子化合物とに分類される。電子輸送材料は、架橋基を有していてもよい。
[Electron transport material]
Electron transport materials are classified into low molecular weight compounds and high molecular weight compounds. The electron transport material may have a cross-linking group.
低分子化合物としては、例えば、8-ヒドロキシキノリンを配位子とする燐光発光性化合物、オキサジアゾール、アントラキノジメタン、ベンゾキノン、ナフトキノン、アントラキノン、テトラシアノアントラキノジメタン、フルオレノン、ジフェニルジシアノエチレン及びジフェノキノン、並びに、これらの誘導体が挙げられる。 Examples of the low molecular weight compound include a phosphorescent compound having 8-hydroxyquinoline as a ligand, oxadiazole, anthraquinonedimethane, benzoquinone, naphthoquinone, anthraquinone, tetracyanoanthraquinonedimethane, fluorenone, and diphenyldicyanoethylene. And diphenoquinone, as well as derivatives thereof.
高分子化合物としては、例えば、ポリフェニレン、ポリフルオレン、及び、これらの誘導体が挙げられる。高分子化合物は、金属でドープされていてもよい。 Examples of the polymer compound include polyphenylene, polyfluorene, and derivatives thereof. The polymer compound may be doped with a metal.
第1の組成物において、電子輸送材料の配合量は、式(1)で表される化合物を100重量部とした場合、通常、1~400重量部であり、好ましくは5~150重量部である。 In the first composition, the blending amount of the electron transporting material is usually 1 to 400 parts by weight, preferably 5 to 150 parts by weight, when the compound represented by the formula (1) is 100 parts by weight. be.
電子輸送材料は、一種単独で用いても二種以上を併用してもよい。 The electron transport material may be used alone or in combination of two or more.
[正孔注入材料及び電子注入材料]
正孔注入材料及び電子注入材料は、各々、低分子化合物と高分子化合物とに分類される。正孔注入材料及び電子注入材料は、架橋基を有していてもよい。
[Hole injection material and electron injection material]
Hole injection materials and electron injection materials are classified into low molecular weight compounds and high molecular weight compounds, respectively. The hole injection material and the electron injection material may have a cross-linking group.
低分子化合物としては、例えば、銅フタロシアニン等の金属フタロシアニン;カーボン;モリブデン、タングステン等の金属酸化物;フッ化リチウム、フッ化ナトリウム、フッ化セシウム、フッ化カリウム等の金属フッ化物が挙げられる。 Examples of the low molecular weight compound include metal phthalocyanines such as copper phthalocyanine; carbon; metal oxides such as molybdenum and tungsten; and metal fluorides such as lithium fluoride, sodium fluoride, cesium fluoride and potassium fluoride.
高分子化合物としては、例えば、ポリアニリン、ポリチオフェン、ポリピロール、ポリフェニレンビニレン、ポリチエニレンビニレン、ポリキノリン及びポリキノキサリン、並びに、これらの誘導体;芳香族アミン構造を主鎖又は側鎖に含む重合体等の導電性高分子が挙げられる。 Examples of the polymer compound include polyaniline, polythiophene, polypyrrole, polyphenylene vinylene, polythienylene vinylene, polyquinoline and polyquinoxaline, and derivatives thereof; conductivity of polymers having an aromatic amine structure in the main chain or side chain. Examples include sex polymers.
第1の組成物において、正孔注入材料及び電子注入材料の配合量は、各々、式(1)で表される化合物を100重量部とした場合、通常、1~400重量部であり、好ましくは5~150重量部である。 In the first composition, the blending amount of the hole injection material and the electron injection material is usually 1 to 400 parts by weight, preferably 1 to 400 parts by weight, respectively, when the compound represented by the formula (1) is 100 parts by weight. Is 5 to 150 parts by weight.
電子注入材料及び正孔注入材料は、各々、一種単独で用いても二種以上を併用してもよい。 The electron injection material and the hole injection material may be used alone or in combination of two or more.
[イオンドープ]
正孔注入材料又は電子注入材料が導電性高分子を含む場合、導電性高分子の電気伝導度は、好ましくは、1×10-5S/cm~1×103S/cmである。導電性高分子の電気伝導度をかかる範囲とするために、導電性高分子に適量のイオンをドープすることができる。
[Ion dope]
When the hole injection material or the electron injection material contains a conductive polymer, the electric conductivity of the conductive polymer is preferably 1 × 10 -5 S / cm to 1 × 10 3 S / cm. In order to keep the electric conductivity of the conductive polymer within such a range, an appropriate amount of ions can be doped into the conductive polymer.
ドープするイオンの種類は、正孔注入材料であればアニオン、電子注入材料であればカチオンである。アニオンとしては、例えば、ポリスチレンスルホン酸イオン、アルキルベンゼンスルホン酸イオン、樟脳スルホン酸イオンが挙げられる。カチオンとしては、例えば、リチウムイオン、ナトリウムイオン、カリウムイオン、テトラブチルアンモニウムイオンが挙げられる。 The type of ion to be doped is an anion in the case of a hole injection material and a cation in the case of an electron injection material. Examples of the anion include polystyrene sulfonic acid ion, alkylbenzene sulfonic acid ion, and cerebral sulfonic acid ion. Examples of the cation include lithium ion, sodium ion, potassium ion and tetrabutylammonium ion.
ドープするイオンは、一種単独で用いても二種以上を併用してもよい。 The type of ion to be doped may be used alone or in combination of two or more.
[発光材料]
発光材料は、低分子化合物と高分子化合物とに分類される。発光材料は、架橋基を有していてもよい。
[Luminescent material]
Luminescent materials are classified into low molecular weight compounds and high molecular weight compounds. The light emitting material may have a cross-linking group.
低分子化合物としては、例えば、ナフタレン及びその誘導体、アントラセン及びその誘導体、ペリレン及びその誘導体、並びに、イリジウム、白金又はユーロピウムを中心金属とする三重項発光錯体が挙げられる。 Examples of the low molecular weight compound include naphthalene and its derivatives, anthracene and its derivatives, perylene and its derivatives, and triple-term luminescent complexes having iridium, platinum or europium as a central metal.
高分子化合物としては、例えば、フェニレン基、ナフタレンジイル基、フルオレンジイル基、フェナントレンジイル基、ジヒドロフェナントレンジイル基、式(X)で表される基、カルバゾールジイル基、フェノキサジンジイル基、フェノチアジンジイル基、アントラセンジイル基、ピレンジイル基等を含む高分子化合物が挙げられる。 Examples of the polymer compound include a phenylene group, a naphthalenediyl group, a fluorinatedyl group, a phenantrenicyl group, a dihydrophenanthrendyl group, a group represented by the formula (X), a carbazolediyl group, a phenoxazinediyl group, and a phenothiazinediyl. Examples thereof include high molecular compounds containing a group, an anthracene diyl group, pyrienyl group and the like.
発光材料は、好ましくは、三重項発光錯体及び/又は高分子化合物を含む。 The luminescent material preferably comprises a triplet luminescent complex and / or a polymeric compound.
三重項発光錯体としては、例えば、以下に示す金属錯体が挙げられる。 Examples of the triplet luminescent complex include the following metal complexes.
第1の組成物において、発光材料の配合量は、式(1)で表される化合物を100重量部とした場合、通常、1~400重量部であり、好ましくは5~150重量部である。 In the first composition, the blending amount of the light emitting material is usually 1 to 400 parts by weight, preferably 5 to 150 parts by weight, when the compound represented by the formula (1) is 100 parts by weight. ..
発光材料は、一種単独で用いても二種以上を併用してもよい。 The luminescent material may be used alone or in combination of two or more.
[酸化防止剤]
酸化防止剤は、式(1)で表される化合物と同じ溶媒に可溶であり、発光及び電荷輸送を阻害しない化合物であればよく、例えば、フェノール系酸化防止剤、リン系酸化防止剤が挙げられる。
[Antioxidant]
The antioxidant may be a compound that is soluble in the same solvent as the compound represented by the formula (1) and does not inhibit light emission and charge transport. For example, a phenolic antioxidant and a phosphorus-based antioxidant may be used. Can be mentioned.
第1の組成物において、酸化防止剤の配合量は、式(1)で表される化合物を100重量部とした場合、通常、0.001~10重量部である。 In the first composition, the blending amount of the antioxidant is usually 0.001 to 10 parts by weight when the compound represented by the formula (1) is 100 parts by weight.
酸化防止剤は、一種単独で用いても二種以上を併用してもよい。 The antioxidant may be used alone or in combination of two or more.
[第1のインク]
式(1)で表される化合物と、溶媒とを含有する組成物(以下、「第1のインク」ともいう。)は、スピンコート法、キャスティング法、マイクログラビアコート法、グラビアコート法、バーコート法、ロールコート法、ワイヤーバーコート法、ディップコート法、スプレーコート法、スクリーン印刷法、フレキソ印刷法、オフセット印刷法、インクジェット印刷法、キャピラリ-コート法、ノズルコート法等の湿式法に好適に使用することができる。
[First ink]
The composition containing the compound represented by the formula (1) and the solvent (hereinafter, also referred to as “first ink”) includes a spin coating method, a casting method, a microgravia coating method, a gravure coating method, and a bar. Suitable for wet methods such as coating method, roll coating method, wire bar coating method, dip coating method, spray coating method, screen printing method, flexo printing method, offset printing method, inkjet printing method, capillary coating method, nozzle coating method, etc. Can be used for.
第1のインクの粘度は、湿式法の種類によって調整すればよいが、インクジェット印刷法等の溶液が吐出装置を経由する印刷法に適用する場合には、吐出時の目づまりと飛行曲がりが起こりづらいので、好ましくは25℃において1~20mPa・sである。 The viscosity of the first ink may be adjusted according to the type of the wet method, but when the solution such as the inkjet printing method is applied to the printing method via the ejection device, clogging and flight bending occur during ejection. Since it is difficult, it is preferably 1 to 20 mPa · s at 25 ° C.
第1のインクに含有される溶媒は、好ましくは、インク中の固形分を溶解又は均一に分散できる溶媒である。溶媒としては、例えば、1,2-ジクロロエタン、1,1,2-トリクロロエタン、クロロベンゼン、o-ジクロロベンゼン等の塩素系溶媒;THF、ジオキサン、アニソール、4-メチルアニソール等のエーテル系溶媒;トルエン、キシレン、メシチレン、エチルベンゼン、n-ヘキシルベンゼン、シクロヘキシルベンゼン等の芳香族炭化水素系溶媒;シクロヘキサン、メチルシクロヘキサン、n-ペンタン、n-ヘキサン、n-へプタン、n-オクタン、n-ノナン、n-デカン、n-ドデカン、ビシクロヘキシル等の脂肪族炭化水素系溶媒;アセトン、メチルエチルケトン、シクロヘキサノン、アセトフェノン等のケトン系溶媒;酢酸エチル、酢酸ブチル、エチルセルソルブアセテート、安息香酸メチル、酢酸フェニル等のエステル系溶媒;エチレングリコール、グリセリン、1,2-ヘキサンジオール等の多価アルコール系溶媒;イソプロピルアルコール、シクロヘキサノール等のアルコール系溶媒;ジメチルスルホキシド等のスルホキシド系溶媒;N-メチル-2-ピロリドン、N,N-ジメチルホルムアミド等のアミド系溶媒が挙げられる。溶媒は、一種単独で用いても二種以上を併用してもよい。 The solvent contained in the first ink is preferably a solvent capable of dissolving or uniformly dispersing the solid content in the ink. Examples of the solvent include chlorine-based solvents such as 1,2-dichloroethane, 1,1,2-trichloroethane, chlorobenzene and o-dichlorobenzene; ether solvents such as THF, dioxane, anisole and 4-methylanisol; toluene, Aromatic hydrocarbon solvents such as xylene, mesitylene, ethylbenzene, n-hexylbenzene, cyclohexylbenzene; cyclohexane, methylcyclohexane, n-pentane, n-hexane, n-heptane, n-octane, n-nonan, n- Aliphatic hydrocarbon solvents such as decane, n-dodecane and bicyclohexyl; ketone solvents such as acetone, methyl ethyl ketone, cyclohexanone and acetophenone; esters such as ethyl acetate, butyl acetate, ethyl cellsolve acetate, methyl benzoate and phenyl acetate System solvent; Polyhydric alcohol solvent such as ethylene glycol, glycerin, 1,2-hexanediol; Alcohol solvent such as isopropyl alcohol and cyclohexanol; Sulfoxide solvent such as dimethyl sulfoxide; N-methyl-2-pyrrolidone, N , N-Dimethylformamide and other amide-based solvents can be mentioned. The solvent may be used alone or in combination of two or more.
第1のインクにおいて、溶媒の配合量は、式(1)で表される化合物を100重量部とした場合、通常、1000~100000重量部であり、好ましくは2000~20000重量部である。 In the first ink, the blending amount of the solvent is usually 1000 to 100,000 parts by weight, preferably 2000 to 20000 parts by weight, when the compound represented by the formula (1) is 100 parts by weight.
<第2の有機層>
第2の有機層は、架橋材料の架橋体を含有する層である。架橋材料が架橋した状態で第2の有機層に含有されていることで、第2の有機層は溶媒に対して実質的に不溶化されている。そのため、第2の有機層の上に有機層を湿式法により成膜する場合に、第2の有機層が溶媒に浸食され難く、その本来の機能が十分に発揮される。また、第2の有機層の上に形成される有機層の成膜性が向上し、厚みの均一性に優れ、表面平滑性に優れた有機層が形成される。
<Second organic layer>
The second organic layer is a layer containing a crosslinked body of a crosslinking material. Since the crosslinked material is contained in the second organic layer in a crosslinked state, the second organic layer is substantially insoluble in the solvent. Therefore, when the organic layer is formed on the second organic layer by a wet method, the second organic layer is less likely to be eroded by the solvent, and its original function is fully exhibited. Further, the film forming property of the organic layer formed on the second organic layer is improved, and the organic layer having excellent thickness uniformity and surface smoothness is formed.
[架橋材料]
架橋材料の架橋体は、架橋材料を上述した方法及び条件等により架橋した状態にすることで得られる。
[Crosslinking material]
The crosslinked body of the crosslinked material is obtained by making the crosslinked material in a crosslinked state by the above-mentioned method, conditions and the like.
架橋材料は、低分子化合物であっても高分子化合物であってもよいが、本発明の発光素子の発光効率がより優れるので、架橋基A群から選ばれる少なくとも1種の架橋基を有する低分子化合物(以下、「第2の有機層の低分子化合物」ともいう。)、又は、架橋基A群から選ばれる少なくとも1種の架橋基を有する架橋構成単位を含む高分子化合物(以下、「第2の有機層の高分子化合物」ともいう。)であることが好ましく、架橋基A群から選ばれる少なくとも1種の架橋基を有する架橋構成単位を含む高分子化合物であることがより好ましい。 The cross-linking material may be a low molecular weight compound or a high molecular weight compound, but since the light emitting efficiency of the light emitting element of the present invention is more excellent, the cross-linking material has at least one cross-linking group selected from the cross-linking group A group. A molecular compound (hereinafter, also referred to as "low molecular weight compound of the second organic layer") or a polymer compound containing a cross-linking structural unit having at least one cross-linking group selected from the cross-linking group A group (hereinafter, "" It is also referred to as a "polymer compound of the second organic layer"), and more preferably a polymer compound containing a cross-linking structural unit having at least one cross-linking group selected from the cross-linking group A group.
架橋基A群から選ばれる架橋基としては、本発明の発光素子の発光効率がより優れるので、好ましくは、式(XL-1)~式(XL-4)、式(XL-7)~式(XL-10)又は式(XL-14)~式(XL-17)で表される架橋基であり、より好ましくは、式(XL-1)、式(XL-3)、式(XL-9)、式(XL-10)、式(XL-16)又は式(XL-17)で表される架橋基であり、更に好ましくは、式(XL-1)、式(XL-16)又は式(XL-17)で表される架橋基であり、特に好ましくは、式(XL-1)又は式(XL-17)で表される架橋基であり、とりわけ好ましくは、式(XL-17)で表される架橋基である。 As the cross-linking group selected from the cross-linking group A group, the light emitting element of the present invention has more excellent light emitting efficiency, and therefore, the formulas (XL-1) to (XL-4) and the formulas (XL-7) to formulas (XL-7) to the formulas are preferable. (XL-10) or a cross-linking group represented by the formulas (XL-14) to (XL-17), more preferably the formula (XL-1), the formula (XL-3), the formula (XL-). 9), a cross-linking group represented by the formula (XL-10), the formula (XL-16) or the formula (XL-17), more preferably the formula (XL-1), the formula (XL-16) or the like. It is a cross-linking group represented by the formula (XL-17), particularly preferably a cross-linking group represented by the formula (XL-1) or the formula (XL-17), and particularly preferably a cross-linking group represented by the formula (XL-17). ) Is a cross-linking group.
[第2の有機層の高分子化合物]
第2の有機層の高分子化合物に含まれる、架橋基A群から選ばれる少なくとも一種の架橋基を有する構成単位は、後述する式(2)で表される構成単位又は式(2')で表される構成単位であることが好ましいが、下記で表される構成単位であってもよい。
[Polymer compound of the second organic layer]
The structural unit having at least one cross-linking group selected from the group A of the cross-linking group contained in the polymer compound of the second organic layer is a structural unit represented by the formula (2) described later or the formula (2'). It is preferably a structural unit represented, but it may be a structural unit represented below.
[式(2)で表される構成単位]
nAは、本発明の発光素子の発光効率がより優れるので、好ましくは0~3の整数であり、より好ましくは0~2の整数であり、更に好ましくは1又は2である。
[Constituent unit represented by equation (2)]
nA is preferably an integer of 0 to 3, more preferably an integer of 0 to 2, and even more preferably 1 or 2, because the luminous efficiency of the light emitting element of the present invention is more excellent.
nは、本発明の発光素子の発光効率がより優れるので、好ましくは2である。 n is preferably 2 because the luminous efficiency of the light emitting element of the present invention is more excellent.
Ar3は、本発明の発光素子の発光効率がより優れるので、好ましくは置換基を有していてもよい芳香族炭化水素基である。 Ar 3 is an aromatic hydrocarbon group which may have a substituent because the luminous efficiency of the light emitting element of the present invention is more excellent.
Ar3で表される芳香族炭化水素基の炭素原子数は、置換基の炭素原子数を含めないで、通常6~60であり、好ましくは6~30であり、より好ましくは6~18である。
Ar3で表される芳香族炭化水素基のn個の置換基を除いたアリーレン基部分としては、好ましくは、式(A-1)~式(A-20)で表される基であり、より好ましくは、式(A-1)、式(A-2)、式(A-6)~式(A-10)、式(A-19)又は式(A-20)で表される基であり、さらに好ましくは、式(A-1)、式(A-2)、式(A-7)、式(A-9)又は式(A-19)で表される基であり、これらの基は置換基を有していてもよい。
The number of carbon atoms of the aromatic hydrocarbon group represented by Ar 3 is usually 6 to 60, preferably 6 to 30, and more preferably 6 to 18, not including the number of carbon atoms of the substituent. be.
The arylene group moiety excluding the n substituents of the aromatic hydrocarbon group represented by Ar 3 is preferably a group represented by the formulas (A-1) to (A-20). More preferably, a group represented by the formula (A-1), the formula (A-2), the formula (A-6) to the formula (A-10), the formula (A-19) or the formula (A-20). More preferably, it is a group represented by the formula (A-1), the formula (A-2), the formula (A-7), the formula (A-9) or the formula (A-19), and these are the groups. The group of may have a substituent.
Ar3で表される複素環基の炭素原子数は、置換基の炭素原子数を含めないで、通常2~60であり、好ましくは3~30であり、より好ましくは4~18である。
Ar3で表される複素環基のn個の置換基を除いた2価の複素環基部分としては、好ましくは、式(AA-1)~式(AA-34)で表される基である。
The number of carbon atoms of the heterocyclic group represented by Ar 3 is usually 2 to 60, preferably 3 to 30, and more preferably 4 to 18, not including the number of carbon atoms of the substituent.
The divalent heterocyclic group moiety excluding the n substituents of the heterocyclic group represented by Ar 3 is preferably a group represented by the formulas (AA-1) to (AA-34). be.
Ar3で表される芳香族炭化水素基及び複素環基は置換基を有していてもよく、置換基としては、アルキル基、シクロアルキル基、アルコキシ基、シクロアルコキシ基、アリール基、アリールオキシ基、ハロゲン原子、1価の複素環基及びシアノ基が好ましい。 The aromatic hydrocarbon group and the heterocyclic group represented by Ar 3 may have a substituent, and the substituents include an alkyl group, a cycloalkyl group, an alkoxy group, a cycloalkoxy group, an aryl group and an aryloxy group. Groups, halogen atoms, monovalent heterocyclic groups and cyano groups are preferred.
LAで表されるアルキレン基は、置換基の炭素原子数を含めないで、通常1~20であり、好ましくは1~15であり、より好ましくは1~10である。LAで表されるシクロアルキレン基は、置換基の炭素原子数を含めないで、通常3~20である。
アルキレン基及びシクロアルキレン基は、置換基を有していてもよく、例えば、メチレン基、エチレン基、プロピレン基、ブチレン基、ヘキシレン基、シクロヘキシレン基、オクチレン基が挙げられる。
The alkylene group represented by LA is usually 1 to 20, preferably 1 to 15, and more preferably 1 to 10 without including the number of carbon atoms of the substituent. The cycloalkylene group represented by LA is usually 3 to 20 without including the number of carbon atoms of the substituent.
The alkylene group and the cycloalkylene group may have a substituent, and examples thereof include a methylene group, an ethylene group, a propylene group, a butylene group, a hexylene group, a cyclohexylene group and an octylene group.
LAで表されるアルキレン基及びシクロアルキレン基は、置換基を有していてもよい。
アルキレン基及びシクロアルキレン基が有していてもよい置換基としては、アルキル基、シクロアルキル基、アルコキシ基、シクロアルコキシ基、ハロゲン原子又はシアノ基が好ましく、これらの基は更に置換基を有していてもよい。
The alkylene group and the cycloalkylene group represented by LA may have a substituent.
As the substituent which the alkylene group and the cycloalkylene group may have, an alkyl group, a cycloalkyl group, an alkoxy group, a cycloalkoxy group, a halogen atom or a cyano group are preferable, and these groups further have a substituent. May be.
LAで表されるアリーレン基は、置換基を有していてもよい。アリーレン基としては、フェニレン基又はフルオレンジイル基が好ましく、m-フェニレン基、p-フェニレン基、フルオレン-2,7-ジイル基、フルオレン-9,9-ジイル基がより好ましい。アリーレン基が有してもよい置換基としては、アルキル基、シクロアルキル基、アルコキシ基、シクロアルコキシ基、アリール基、アリールオキシ基、1価の複素環基、ハロゲン原子、シアノ基又は架橋基A群から選ばれる架橋基が好ましく、これらの基は更に置換基を有していてもよい。 The arylene group represented by LA may have a substituent. As the arylene group, a phenylene group or a fluoreneyl group is preferable, and an m-phenylene group, a p-phenylene group, a fluorene-2,7-diyl group, and a fluorene-9,9-diyl group are more preferable. The substituent that the arylene group may have includes an alkyl group, a cycloalkyl group, an alkoxy group, a cycloalkoxy group, an aryl group, an aryloxy group, a monovalent heterocyclic group, a halogen atom, a cyano group or a bridging group A. Bridging groups selected from the group are preferred, and these groups may further have substituents.
LAで表される2価の複素環基としては、好ましくは式(AA-1)~式(AA-34)で表される基である。 The divalent heterocyclic group represented by LA is preferably a group represented by the formulas ( AA -1) to (AA-34).
LAは、第2の有機層の高分子化合物の製造が容易になるため、好ましくは、アリーレン基又はアルキレン基であり、より好ましくは、フェニレン基、フルオレンジイル基又はアルキレン基であり、これらの基は置換基を有していてもよい。 LA is preferably an arylene group or an alkylene group, and more preferably a phenylene group, a fluorinatedyl group or an alkylene group because it facilitates the production of the polymer compound of the second organic layer. The group of may have a substituent.
Xで表される架橋基としては、本発明の発光素子の発光効率がより優れるので、好ましくは、式(XL-1)~式(XL-4)、式(XL-7)~式(XL-10)又は式(XL-14)~式(XL-17)で表される架橋基であり、より好ましくは、式(XL-1)、式(XL-3)、式(XL-9)、式(XL-10)、式(XL-16)又は式(XL-17)で表される架橋基であり、更に好ましくは、式(XL-1)、式(XL-16)又は式(XL-17)で表される架橋基であり、特に好ましくは、式(XL-1)又は式(XL-17)で表される架橋基であり、とりわけ好ましくは、式(XL-17)で表される架橋基である。 As the cross-linking group represented by X, since the light emitting efficiency of the light emitting element of the present invention is more excellent, the formulas (XL-1) to (XL-4) and the formulas (XL-7) to (XL) are preferable. -10) or a cross-linking group represented by the formulas (XL-14) to (XL-17), more preferably the formula (XL-1), the formula (XL-3), the formula (XL-9). , XL-10, formula (XL-16) or formula (XL-17), more preferably formula (XL-1), formula (XL-16) or formula (XL-1). It is a cross-linking group represented by the formula (XL-17), particularly preferably a cross-linking group represented by the formula (XL-1) or the formula (XL-17), and particularly preferably the cross-linking group represented by the formula (XL-17). It is a crosslinked group represented.
式(2)で表される構成単位は、第2の有機層の高分子化合物の安定性及び架橋性が優れるので、第2の有機層の高分子化合物に含まれる構成単位の合計量に対して、好ましくは0.5~90モル%であり、より好ましくは3~75モル%であり、更に好ましくは5~60モル%である。 Since the structural unit represented by the formula (2) is excellent in stability and crosslinkability of the polymer compound of the second organic layer, it is relative to the total amount of the structural units contained in the polymer compound of the second organic layer. It is preferably 0.5 to 90 mol%, more preferably 3 to 75 mol%, and further preferably 5 to 60 mol%.
式(2)で表される構成単位は、第2の有機層の高分子化合物中に、1種のみ含まれていてもよく、2種以上含まれていてもよい。 The structural unit represented by the formula (2) may be contained in only one kind or two or more kinds in the polymer compound of the second organic layer.
[式(2')で表される構成単位]
mAは、本発明の発光素子の発光効率がより優れるので、好ましくは0~3の整数であり、より好ましくは0~2の整数であり、更に好ましくは0又は1であり、特に好ましくは0である。
[Constituent unit represented by equation (2')]
mA is preferably an integer of 0 to 3, more preferably an integer of 0 to 2, still more preferably 0 or 1, and particularly preferably 0, because the luminous efficiency of the light emitting element of the present invention is more excellent. Is.
mは、本発明の発光素子の発光効率がより優れるので、好ましくは1又は2であり、より好ましくは2である。 m is preferably 1 or 2, and more preferably 2 because the luminous efficiency of the light emitting device of the present invention is more excellent.
cは、第2の有機層の高分子化合物の製造が容易になり、且つ、本発明の発光素子の発光効率がより優れるので、好ましくは0である。 c is preferably 0 because it facilitates the production of the polymer compound of the second organic layer and the luminous efficiency of the light emitting element of the present invention is more excellent.
Ar5は、本発明の発光素子の発光効率がより優れるので、好ましくは置換基を有していてもよい芳香族炭化水素基である。 Ar 5 is an aromatic hydrocarbon group which may have a substituent because the luminous efficiency of the light emitting element of the present invention is more excellent.
Ar5で表される芳香族炭化水素基のm個の置換基を除いたアリーレン基部分の定義や例は、後述する式(X)におけるArX2で表されるアリーレン基の定義や例と同じである。 The definition and example of the arylene group portion excluding the m substituents of the aromatic hydrocarbon group represented by Ar 5 are the same as the definition and example of the arylene group represented by Ar X 2 in the formula (X) described later. Is.
Ar5で表される複素環基のm個の置換基を除いた2価の複素環基部分の定義や例は、後述する式(X)におけるArX2で表される2価の複素環基部分の定義や例と同じである。 The definition and example of the divalent heterocyclic group portion excluding the m substituents of the heterocyclic group represented by Ar 5 are the divalent heterocyclic group represented by Ar X 2 in the formula (X) described later. It is the same as the definition and example of the part.
Ar5で表される少なくとも1種の芳香族炭化水素環と少なくとも1種の複素環が直接結合した基のm個の置換基を除いた2価の基の定義や例は、後述する式(X)におけるArX2で表される少なくとも1種のアリーレン基と少なくとも1種の2価の複素環基とが直接結合した2価の基の定義や例と同じである。 Definitions and examples of divalent groups excluding the m substituents of the group in which at least one aromatic hydrocarbon ring represented by Ar 5 and at least one heterocyclic ring are directly bonded are described in the formula described later ( It is the same as the definition and the example of the divalent group in which at least one arylene group represented by Ar X2 and at least one divalent heterocyclic group are directly bonded in X).
Ar4及びAr6は、本発明の発光素子の発光効率がより優れるので、好ましくは置換基を有していてもよいアリーレン基である。 Ar 4 and Ar 6 are arylene groups which may have a substituent because the luminous efficiency of the light emitting device of the present invention is more excellent.
Ar4及びAr6で表されるアリーレン基の定義や例は、後述する式(X)におけるArX1及びArX3で表されるアリーレン基の定義や例と同じである。 The definitions and examples of the arylene groups represented by Ar 4 and Ar 6 are the same as the definitions and examples of the arylene groups represented by Ar X 1 and Ar X 3 in the formula (X) described later.
Ar4及びAr6で表される2価の複素環基の定義や例は、後述する式(X)におけるArX1及びArX3で表される2価の複素環基の定義や例と同じである。 The definitions and examples of the divalent heterocyclic groups represented by Ar 4 and Ar 6 are the same as the definitions and examples of the divalent heterocyclic groups represented by Ar X 1 and Ar X 3 in the formula (X) described later. be.
Ar4、Ar5及びAr6で表される基は置換基を有していてもよく、置換基としては、アルキル基、シクロアルキル基、アルコキシ基、シクロアルコキシ基、アリール基、アリールオキシ基、ハロゲン原子、1価の複素環基及びシアノ基が好ましい。 The groups represented by Ar 4 , Ar 5 and Ar 6 may have a substituent, and the substituents include an alkyl group, a cycloalkyl group, an alkoxy group, a cycloalkoxy group, an aryl group and an aryloxy group. Halogen atoms, monovalent heterocyclic groups and cyano groups are preferred.
KAで表されるアルキレン基、シクロアルキレン基、アリーレン基、2価の複素環基の定義や例は、それぞれ、LAで表されるアルキレン基、シクロアルキレン基、アリーレン基、2価の複素環基の定義や例と同じである。 The definitions and examples of the alkylene group, cycloalkylene group, arylene group and divalent heterocyclic group represented by KA are the alkylene group, cycloalkylene group, arylene group and divalent complex represented by LA , respectively. It is the same as the definition and example of the ring group.
KAは、第2の有機層の高分子化合物の製造が容易になるので、フェニレン基又はメチレン基であることが好ましい。 KA is preferably a phenylene group or a methylene group because it facilitates the production of the polymer compound of the second organic layer.
X’で表される架橋基の定義や例は、前述のXで表される架橋基の定義や例と同じである。 The definition and example of the cross-linking group represented by X'are the same as the definition and example of the cross-linking group represented by X described above.
式(2')で表される構成単位は、第2の有機層の高分子化合物の安定性が優れ、且つ、第2の有機層の高分子化合物の架橋性が優れるので、第2の有機層の高分子化合物に含まれる構成単位の合計量に対して、好ましくは0.5~50モル%であり、より好ましくは3~30モル%であり、更に好ましくは5~20モル%である。 The structural unit represented by the formula (2') has excellent stability of the polymer compound of the second organic layer and excellent cross-linking property of the polymer compound of the second organic layer, so that the second organic It is preferably 0.5 to 50 mol%, more preferably 3 to 30 mol%, still more preferably 5 to 20 mol%, based on the total amount of the constituent units contained in the polymer compound of the layer.
式(2')で表される構成単位は、第2の有機層の高分子化合物中に、1種のみ含まれていてもよく、2種以上含まれていてもよい。 The structural unit represented by the formula (2') may be contained in only one kind or two or more kinds in the polymer compound of the second organic layer.
[式(2)又は(2')で表される構成単位の好ましい態様]
式(2)で表される構成単位としては、例えば、式(2-1)~式(2-30)で表される構成単位が挙げられ、式(2')で表される構成単位としては、例えば、式(2'-1)~式(2'-9)で表される構成単位が挙げられる。これらの中でも、第2の有機層の高分子化合物の架橋性が優れるので、好ましくは式(2-1)~式(2-30)で表される構成単位であり、より好ましくは式(2-1)~式(2-15)、式(2-19)、式(2-20)、式(2-23)、式(2-25)又は式(2-30)で表される構成単位であり、更に好ましくは式(2-1)~式(2-9) 、式(2-20)、式(2-22)又は式(2-30)で表される構成単位である。
[Preferable embodiment of the structural unit represented by the formula (2) or (2')]
Examples of the structural unit represented by the formula (2) include the structural units represented by the formulas (2-1) to (2-30), and the structural units represented by the formula (2') include. For example, the structural units represented by the equations (2'-1) to (2'-9) can be mentioned. Among these, since the polymer compound of the second organic layer has excellent crosslinkability, it is preferably a structural unit represented by the formulas (2-1) to (2-30), and more preferably the formula (2). -1) -Structure represented by Eq. (2-15), Eq. (2-19), Eq. (2-20), Eq. (2-23), Eq. (2-25) or Eq. (2-30) It is a unit, and more preferably a structural unit represented by Eq. (2-1) to Eq. (2-9), Eq. (2-20), Eq. (2-22) or Eq. (2-30).
第2の有機層の高分子化合物は、正孔輸送性が優れるので、更に、式(X)で表される構成単位を含むことが好ましい。また、第2の有機層の高分子化合物は、本発明の発光素子の発光効率がより優れるので、更に、式(Y)で表される構成単位を含むことが好ましい。
Since the polymer compound of the second organic layer has excellent hole transportability, it is preferable that the polymer compound further contains a structural unit represented by the formula (X). Further, since the polymer compound of the second organic layer has more excellent luminous efficiency of the light emitting device of the present invention, it is preferable that the polymer compound further contains a structural unit represented by the formula (Y).
第2の有機層の高分子化合物は、正孔輸送性が優れ、且つ、本発明の発光素子の発光効率がより優れるので、更に、式(X)で表される構成単位及び式(Y)で表される構成単位を含むことが好ましい。 Since the polymer compound of the second organic layer has excellent hole transportability and the luminous efficiency of the light emitting device of the present invention is more excellent, the structural unit represented by the formula (X) and the formula (Y) are further excellent. It is preferable to include a structural unit represented by.
第2の有機層の高分子化合物が含んでいてもよい式(X)で表される構成単位及び式(Y)で表される構成単位の定義、例及び好ましい範囲は、それぞれ、前述の高分子ホストが含んでいてもよい式(X)で表される構成単位及び(Y)で表される構成単位の定義、例及び好ましい範囲と同じである。 The definitions, examples and preferable ranges of the structural unit represented by the formula (X) and the structural unit represented by the formula (Y) which may be contained in the polymer compound of the second organic layer are, respectively, the above-mentioned high. It is the same as the definition, example and preferable range of the structural unit represented by the formula (X) and the structural unit represented by (Y) which the molecular host may include.
第2の有機層の高分子化合物において、式(X)で表される構成単位及び式(Y)で表される構成単位は、それぞれ、1種のみ含まれていても、2種以上含まれていてもよい。 In the polymer compound of the second organic layer, the structural unit represented by the formula (X) and the structural unit represented by the formula (Y) are contained in two or more types even if only one type is contained. May be.
式(X)で表される構成単位は、正孔輸送性が優れるので、第2の有機層の高分子化合物に含まれる構成単位の合計量に対して、好ましくは0.1~90モル%であり、より好ましくは1~70モル%であり、更に好ましくは10~50モル%である。 Since the structural unit represented by the formula (X) has excellent hole transportability, it is preferably 0.1 to 90 mol% with respect to the total amount of the structural units contained in the polymer compound of the second organic layer. , More preferably 1 to 70 mol%, still more preferably 10 to 50 mol%.
式(Y)で表される構成単位であって、ArY1がアリーレン基である構成単位は、本発明の発光素子の発光効率がより優れるので、第2の有機層の高分子化合物に含まれる構成単位の合計量に対して、好ましくは0.5~80モル%であり、より好ましくは30~60モル%である。 The structural unit represented by the formula (Y) in which Ar Y1 is an arylene group is included in the polymer compound of the second organic layer because the luminous efficiency of the light emitting element of the present invention is more excellent. It is preferably 0.5 to 80 mol%, more preferably 30 to 60 mol%, based on the total amount of the constituent units.
式(Y)で表される構成単位であって、ArY1が2価の複素環基、又は、少なくとも1種のアリーレン基と少なくとも1種の2価の複素環基とが直接結合した2価の基である構成単位は、第2の有機層の高分子化合物の電荷輸送性が優れるので、第2の有機層の高分子化合物に含まれる構成単位の合計量に対して、好ましくは0.5~40モル%であり、より好ましくは3~30モル%である。 It is a structural unit represented by the formula (Y), and Ar Y1 is a divalent heterocyclic group, or a divalent group in which at least one arylene group and at least one divalent heterocyclic group are directly bonded. Since the structural unit which is the basis of the above is excellent in charge transportability of the polymer compound of the second organic layer, it is preferably 0.5 to 0.5 with respect to the total amount of the structural units contained in the polymer compound of the second organic layer. It is 40 mol%, more preferably 3 to 30 mol%.
第2の有機層の高分子化合物としては、例えば、表1に示す高分子化合物P-7~P-14が挙げられる。ここで、「その他の構成単位」とは、式(2)、式(2')、式(X)及び式(Y)で表される構成単位以外の構成単位を意味する。 Examples of the polymer compound of the second organic layer include the polymer compounds P-7 to P-14 shown in Table 1. Here, the “other structural unit” means a structural unit other than the structural unit represented by the equation (2), the equation (2'), the equation (X), and the equation (Y).
高分子化合物P-7~P-14における、式(2)、式(2')、式(X)及び式(Y)で表される構成単位の例及び好ましい範囲は、上述のとおりである。 Examples and preferable ranges of the structural units represented by the formulas (2), (2'), formulas (X) and formulas (Y) in the polymer compounds P-7 to P-14 are as described above. ..
第2の有機層の高分子化合物は、ブロック共重合体、ランダム共重合体、交互共重合体、グラフト共重合体のいずれであってもよいし、その他の態様であってもよいが、複数種の原料モノマーを共重合してなる共重合体であることが好ましい。 The polymer compound of the second organic layer may be any of a block copolymer, a random copolymer, an alternating copolymer, and a graft copolymer, or may be another embodiment, but may be plural. It is preferably a copolymer obtained by copolymerizing a seed raw material monomer.
第2の有機層の高分子化合物のポリスチレン換算の数平均分子量は、好ましくは5×103~1×106であり、より好ましくは1×104~5×105であり、より好ましくは1.5×104~1×105である。 The polystyrene-equivalent number average molecular weight of the polymer compound of the second organic layer is preferably 5 × 10 3 to 1 × 10 6 , more preferably 1 × 10 4 to 5 × 10 5 , and more preferably. It is 1.5 × 10 4 to 1 × 10 5 .
[第2の有機層の高分子化合物の製造方法]
第2の有機層の高分子化合物は、前述の高分子ホストの製造方法と同様の方法で製造することができる。
[Method for producing polymer compound of second organic layer]
The polymer compound of the second organic layer can be produced by the same method as the above-mentioned method for producing a polymer host.
[第2の有機層の低分子化合物]
第2の有機層の低分子化合物は、式(3)で表される低分子化合物が好ましい。
[Small molecule compound in the second organic layer]
The small molecule compound of the second organic layer is preferably a small molecule compound represented by the formula (3).
mB1は、通常、0~10の整数であり、架橋材料の合成が容易になるため、好ましくは0~5の整数であり、より好ましくは0~2の整数であり、更に好ましくは0又は1であり、特に好ましくは0である。 m B1 is usually an integer of 0 to 10, and is preferably an integer of 0 to 5, more preferably an integer of 0 to 2, and even more preferably 0 or, because it facilitates the synthesis of the cross-linking material. It is 1, and particularly preferably 0.
mB2は、通常、0~10の整数であり、架橋材料の合成が容易となり、且つ、本発明の発光素子の発光効率がより優れるので、好ましくは0~5の整数であり、より好ましくは0~3の整数であり、更に好ましくは1又は2であり、特に好ましくは1である。 m B2 is usually an integer of 0 to 10, which facilitates the synthesis of the crosslinked material and has more excellent luminous efficiency of the light emitting element of the present invention. Therefore, it is preferably an integer of 0 to 5, more preferably. It is an integer of 0 to 3, more preferably 1 or 2, and particularly preferably 1.
mB3は、通常、0~5の整数であり、架橋材料の合成が容易になるため、好ましくは0~4の整数であり、より好ましくは0~2の整数であり、更に好ましくは0である。 m B3 is usually an integer of 0 to 5, and is preferably an integer of 0 to 4, more preferably an integer of 0 to 2, and even more preferably 0, because it facilitates the synthesis of the cross-linking material. be.
Ar7で表される芳香族炭化水素基のmB3個の置換基を除いたアリーレン基部分の定義や例は、前述の式(X)におけるArX2で表されるアリーレン基の定義や例と同じである。 The definition and example of the arylene group portion excluding the mb3 substituent of the aromatic hydrocarbon group represented by Ar 7 are the definition and example of the arylene group represented by Ar X 2 in the above formula (X). It is the same.
Ar7で表される複素環基のmB3個の置換基を除いた2価の複素環基部分の定義や例は、前述の式(X)におけるArX2で表される2価の複素環基部分の定義や例と同じである。 The definition and example of the divalent heterocyclic group portion excluding the mb3 substituents of the heterocyclic group represented by Ar 7 are the divalent heterocyclic ring represented by Ar X 2 in the above formula (X). It is the same as the definition and example of the base part.
Ar7で表される少なくとも1種の芳香族炭化水素環と少なくとも1種の複素環が直接結合した基のmB3個の置換基を除いた2価の基の定義や例は、前述の式(X)におけるArX2で表される少なくとも1種のアリーレン基と少なくとも1種の2価の複素環基とが直接結合した2価の基の定義や例と同じである。 The definition and example of a divalent group excluding the mb3 substituent of the group in which at least one aromatic hydrocarbon ring represented by Ar 7 and at least one heterocyclic ring are directly bonded are described in the above formula. It is the same as the definition and the example of the divalent group in which at least one arylene group represented by Ar X2 and at least one divalent heterocyclic group are directly bonded in (X).
Ar7で表される基が有してもよい置換基の定義や例は、前述の式(X)におけるArX2で表される基が有してもよい置換基の定義や例と同じである。 The definitions and examples of the substituents that the group represented by Ar 7 may have are the same as the definitions and examples of the substituents that the group represented by Ar X 2 may have in the above formula (X). be.
Ar7は、本発明の発光素子の発光効率がより優れるので、好ましくは芳香族炭化水素基であり、この芳香族炭化水素基は置換基を有していてもよい。 Ar 7 is preferably an aromatic hydrocarbon group because the luminous efficiency of the light emitting element of the present invention is more excellent, and this aromatic hydrocarbon group may have a substituent.
LB1で表されるアルキレン基、シクロアルキレン基、アリーレン基、2価の複素環基の定義や例は、それぞれ、前述のLAで表されるアルキレン基、シクロアルキレン基、アリーレン基、2価の複素環基の定義や例と同じである。 The definitions and examples of the alkylene group, cycloalkylene group, arylene group and divalent heterocyclic group represented by LB1 are as described above, respectively, of the alkylene group, cycloalkylene group, arylene group and divalent represented by LA . It is the same as the definition and example of the heterocyclic group of.
LB1は、架橋材料の合成が容易になるため、好ましくは、アルキレン基、アリーレン基又は酸素原子であり、より好ましくはアルキレン基又はアリーレン基であり、更に好ましくはフェニレン基、フルオレンジイル基又はアルキレン基であり、特に好ましくはフェニレン基又はアルキレン基であり、これらの基は置換基を有していてもよい。 Since LB1 facilitates the synthesis of the cross-linking material, it is preferably an alkylene group, an arylene group or an oxygen atom, more preferably an alkylene group or an arylene group, and further preferably a phenylene group, a fluoreneyl group or It is an alkylene group, particularly preferably a phenylene group or an alkylene group, and these groups may have a substituent.
X’’は、好ましくは、式(XL-1)~式(XL-17)のいずれかで表される架橋基、アリール基又は1価の複素環基であり、より好ましくは、式(XL-1)、式(XL-3)、式(XL-7)~式(XL-10)、式(XL-16)又は式(XL-17)で表される架橋基、或いは、アリール基であり、更に好ましくは、式(XL-1)、式(XL-16)若しくは式(XL-17)で表される架橋基、フェニル基、ナフチル基又はフルオレニル基であり、特に好ましくは、式(XL-16)若しくは式(XL-17)で表される架橋基、フェニル基又はナフチル基であり、とりわけ好ましくは、式(XL-16)で表される架橋基、又は、ナフチル基であり、これらの基は置換基を有していてもよい。 X'' is preferably a bridging group, an aryl group or a monovalent heterocyclic group represented by any of the formulas (XL-1) to (XL-17), and more preferably the formula (XL). -1), formula (XL-3), formula (XL-7) to formula (XL-10), formula (XL-16) or a bridging group represented by formula (XL-17), or an aryl group. Yes, more preferably a cross-linking group represented by the formula (XL-1), the formula (XL-16) or the formula (XL-17), a phenyl group, a naphthyl group or a fluorenyl group, and particularly preferably the formula ( It is a cross-linking group represented by XL-16) or formula (XL-17), a phenyl group or a naphthyl group, and particularly preferably a cross-linking group represented by formula (XL-16) or a naphthyl group. These groups may have substituents.
架橋材料としては、例えば、式(3-1)~式(3-16)で表される低分子化合物が挙げられ、好ましくは式(3-1)~式(3-10)で表される低分子化合物であり、より好ましくは式(3-5)~式(3-9)で表される低分子化合物である。 Examples of the cross-linking material include small molecule compounds represented by the formulas (3-1) to (3-16), preferably represented by the formulas (3-1) to (3-10). It is a small molecule compound, and more preferably a small molecule compound represented by the formulas (3-5) to (3-9).
第2の有機層の低分子化合物は、Aldrich、Luminescence Technology Corp.、American Dye Source等から入手可能である。その他には、例えば、国際公開第1997/033193号、国際公開第2005/035221号、国際公開第2005/049548号に記載されている方法に従って合成することができる。 The small molecule compound of the second organic layer is Aldrich, Luminesis Technology Corp. , American Dye Source, etc. In addition, for example, it can be synthesized according to the methods described in International Publication No. 1997/033193, International Publication No. 2005/0352221, and International Publication No. 2005/049548.
第2の有機層において、架橋材料の架橋体は、1種単独で含有されていても、2種以上含有されていてもよい。 In the second organic layer, the crosslinked body of the crosslinking material may be contained alone or in combination of two or more.
[第2の組成物]
第2の有機層は、架橋材料の架橋体と、正孔輸送材料、正孔注入材料、電子輸送材料、電子注入材料、発光材料及び酸化防止剤からなる群から選ばれる少なくとも1種の材料とを含む組成物(以下、「第2の組成物」ともいう。)を含有する層であってもよい。
[Second composition]
The second organic layer comprises a crosslinked body of a crosslinked material and at least one material selected from the group consisting of a hole transporting material, a hole injecting material, an electron transporting material, an electron injecting material, a light emitting material and an antioxidant. It may be a layer containing a composition containing (hereinafter, also referred to as “second composition”).
第2の組成物に含有される正孔輸送材料、電子輸送材料、正孔注入材料、電子注入材料及び発光材料の例及び好ましい範囲は、第1の組成物に含有される正孔輸送材料、電子輸送材料、正孔注入材料、電子注入材料及び発光材料の例及び好ましい範囲と同じである。第2の組成物において、正孔輸送材料、電子輸送材料、正孔注入材料、電子注入材料及び発光材料の配合量は、各々、架橋材料の架橋体を100重量部とした場合、通常、1~400重量部であり、好ましくは5~150重量部である。 Examples and preferred ranges of the hole transporting material, the electron transporting material, the hole injecting material, the electron injecting material and the light emitting material contained in the second composition are the hole transporting material contained in the first composition. Same as examples and preferred ranges of electron transport material, hole injection material, electron injection material and luminescent material. In the second composition, the blending amount of the hole transport material, the electron transport material, the hole injection material, the electron injection material and the light emitting material is usually 1 when the crosslinked body of the crosslinked material is 100 parts by weight. It is up to 400 parts by weight, preferably 5 to 150 parts by weight.
第2の組成物に含有される酸化防止剤の例及び好ましい範囲は、第1の組成物に含有される酸化防止剤の例及び好ましい範囲と同じである。第2の組成物において、酸化防止剤の配合量は、架橋材料の架橋体を100重量部とした場合、通常、0.001~10重量部である。 The examples and preferred ranges of the antioxidant contained in the second composition are the same as the examples and preferred ranges of the antioxidant contained in the first composition. In the second composition, the blending amount of the antioxidant is usually 0.001 to 10 parts by weight when the crosslinked body of the crosslinked material is 100 parts by weight.
[第2のインク]
架橋材料と、溶媒とを含有する第2の組成物(以下、「第2のインク」ともいう。)は、第1のインクの項で説明した湿式法に好適に使用することができる。 第2のインクの粘度の好ましい範囲は、第1のインクの粘度の好ましい範囲と同じである。第2のインクに含有される溶媒の例及び好ましい範囲は、第1のインクに含有される溶媒の例及び好ましい範囲と同じである。
[Second ink]
The second composition containing the cross-linking material and the solvent (hereinafter, also referred to as “second ink”) can be suitably used for the wet method described in the section of the first ink. The preferred range of the viscosity of the second ink is the same as the preferred range of the viscosity of the first ink. The examples and preferred ranges of the solvent contained in the second ink are the same as the examples and preferred ranges of the solvent contained in the first ink.
第2のインクにおいて、溶媒の配合量は、架橋材料を100重量部とした場合、通常、1000~100000重量部であり、好ましくは2000~20000重量部である。 In the second ink, the blending amount of the solvent is usually 1000 to 100,000 parts by weight, preferably 2000 to 20000 parts by weight, when the crosslinked material is 100 parts by weight.
<発光素子の層構成>
本発明の発光素子は、陽極、陰極、第1の有機層及び第2の有機層以外の層を有していてもよい。
<Layer structure of light emitting element>
The light emitting device of the present invention may have a layer other than the anode, the cathode, the first organic layer and the second organic layer.
本発明の発光素子において、第1の有機層は、通常、発光層(以下、「第1の発光層」と言う。)である。
本発明の発光素子において、第2の有機層は、通常、正孔輸送層、第2の発光層又は電子輸送層であり、好ましくは正孔輸送層又は第2の発光層であり、より好ましくは正孔輸送層である。
In the light emitting device of the present invention, the first organic layer is usually a light emitting layer (hereinafter referred to as "first light emitting layer").
In the light emitting device of the present invention, the second organic layer is usually a hole transport layer, a second light emitting layer or an electron transport layer, preferably a hole transport layer or a second light emitting layer, and more preferably. Is a hole transport layer.
本発明の発光素子において、第1の有機層と第2の有機層とは、本発明の発光素子の発光効率がより優れるので、隣接していることが好ましい。本発明の発光素子において、第2の有機層は、本発明の発光素子の発光効率がより優れるので、陽極及び第1の有機層の間に設けられた層であることが好ましく、陽極及び第1の有機層の間に設けられた正孔輸送層又は第2の発光層であることがより好ましく、陽極及び第1の有機層の間に設けられた正孔輸送層であることが更に好ましい。 In the light emitting device of the present invention, the first organic layer and the second organic layer are preferably adjacent to each other because the light emitting efficiency of the light emitting device of the present invention is more excellent. In the light emitting device of the present invention, the second organic layer is preferably a layer provided between the anode and the first organic layer because the luminous efficiency of the light emitting device of the present invention is more excellent, and the anode and the first organic layer are preferable. A hole transport layer or a second light emitting layer provided between the organic layers 1 is more preferable, and a hole transport layer provided between the anode and the first organic layer is further preferable. ..
本発明の発光素子において、第2の有機層が陽極及び第1の有機層の間に設けられた正孔輸送層である場合、本発明の発光素子の発光効率がより優れるので、陽極と第2の有機層との間に、正孔注入層を更に有することが好ましい。また、第2の有機層が陽極及び第1の有機層の間に設けられた正孔輸送層である場合、本発明の発光素子の発光効率がより優れるので、陰極と第1の有機層との間に、電子注入層及び電子輸送層のうちの少なくとも1つの層を更に有することが好ましい。 In the light emitting device of the present invention, when the second organic layer is a hole transport layer provided between the anode and the first organic layer, the luminous efficiency of the light emitting device of the present invention is more excellent, so that the anode and the first It is preferable to further have a hole injection layer between the two organic layers. Further, when the second organic layer is a hole transport layer provided between the anode and the first organic layer, the luminous efficiency of the light emitting device of the present invention is more excellent, so that the cathode and the first organic layer are used. It is preferable to further have at least one layer of an electron injecting layer and an electron transporting layer between the two.
本発明の発光素子において、第2の有機層が陽極及び第1の有機層の間に設けられた第2の発光層である場合、本発明の発光素子の発光効率がより優れるので、陽極と第2の有機層との間に、正孔注入層及び正孔輸送層のうちの少なくとも1つの層を更に有することが好ましい。また、第2の有機層が陽極及び第1の有機層の間に設けられた第2の発光層である場合、本発明の発光素子の発光効率がより優れるので、陰極と第1の有機層との間に、電子注入層及び電子輸送層のうちの少なくとも1つの層を更に有することが好ましい。 In the light emitting element of the present invention, when the second organic layer is the second light emitting layer provided between the anode and the first organic layer, the luminous efficiency of the light emitting element of the present invention is more excellent, so that the anode and the light emitting element It is preferable to further have at least one layer of a hole injection layer and a hole transport layer between the second organic layer. Further, when the second organic layer is a second light emitting layer provided between the anode and the first organic layer, the luminous efficiency of the light emitting device of the present invention is more excellent, so that the cathode and the first organic layer It is preferable to further have at least one layer of an electron injecting layer and an electron transporting layer between the two.
本発明の発光素子において、第2の有機層が陰極及び第1の有機層の間に設けられた第2の発光層である場合、本発明の発光素子の発光効率がより優れるので、陽極と第1の有機層との間に、正孔注入層及び正孔輸送層のうちの少なくとも1つの層を更に有することが好ましい。また、第2の有機層が陰極及び第1の有機層の間に設けられた第2の発光層である場合、本発明の発光素子の発光効率がより優れるので、陰極と第2の有機層との間に、電子注入層及び電子輸送層のうちの少なくとも1つの層を更に有することが好ましい。 In the light emitting device of the present invention, when the second organic layer is the second light emitting layer provided between the cathode and the first organic layer, the luminous efficiency of the light emitting device of the present invention is more excellent, so that the anode and the anode. It is preferable to further have at least one layer of a hole injection layer and a hole transport layer between the first organic layer. Further, when the second organic layer is a second light emitting layer provided between the cathode and the first organic layer, the luminous efficiency of the light emitting device of the present invention is more excellent, so that the cathode and the second organic layer are more excellent. It is preferable to further have at least one layer of an electron injecting layer and an electron transporting layer between the two.
本発明の発光素子において、第2の有機層が陰極及び第1の有機層の間に設けられた電子輸送層である場合、本発明の発光素子の発光効率がより優れるので、陽極と第1の有機層との間に、正孔注入層及び正孔輸送層のうちの少なくとも1つの層を更に有することが好ましい。また、第2の有機層が陰極及び第1の有機層の間に設けられた電子輸送層である場合、本発明の発光素子の発光効率がより優れるので、陰極と第2の有機層との間に、電子注入層を更に有することが好ましい。 In the light emitting device of the present invention, when the second organic layer is an electron transport layer provided between the cathode and the first organic layer, the luminous efficiency of the light emitting device of the present invention is more excellent, so that the anode and the first It is preferable to further have at least one layer of a hole injection layer and a hole transport layer between the organic layer and the hole transport layer. Further, when the second organic layer is an electron transport layer provided between the cathode and the first organic layer, the luminous efficiency of the light emitting device of the present invention is more excellent, so that the cathode and the second organic layer are combined. It is preferable to have an electron injection layer in between.
本発明の発光素子の具体的な層構成としては、例えば、下記の(D1)~(D15)で表される層構成が挙げられる。本発明の発光素子は、通常、基板を有するが、基板上に陽極から積層されていてもよく、基板上に陰極から積層されていてもよい。 Specific layer configurations of the light emitting device of the present invention include, for example, the layer configurations represented by the following (D1) to (D15). The light emitting device of the present invention usually has a substrate, but may be laminated on the substrate from the anode or may be laminated on the substrate from the cathode.
(D1)陽極/第2の発光層(第2の有機層)/第1の発光層(第1の有機層)/陰極
(D2)陽極/正孔輸送層(第2の有機層)/第1の発光層(第1の有機層)/陰極
(D3)陽極/正孔注入層/第2の発光層(第2の有機層)/第1の発光層(第1の有機層)/陰極
(D4)陽極/正孔注入層/第2の発光層(第2の有機層)/第1の発光層(第1の有機層)/電子輸送層/陰極
(D5)陽極/正孔注入層/第2の発光層(第2の有機層)/第1の発光層(第1の有機層)/電子注入層/陰極
(D6)陽極/正孔注入層/第2の発光層(第2の有機層)/第1の発光層(第1の有機層)/電子輸送層/電子注入層/陰極
(D7)陽極/正孔注入層/正孔輸送層(第2の有機層)/第1の発光層(第1の有機層)/陰極
(D8)陽極/正孔注入層/正孔輸送層(第2の有機層)/第1の発光層(第1の有機層)/電子輸送層/陰極
(D9)陽極/正孔注入層/正孔輸送層(第2の有機層)/第1の発光層(第1の有機層)/電子注入層/陰極
(D10)陽極/正孔注入層/正孔輸送層(第2の有機層)/第1の発光層(第1の有機層)/電子輸送層/電子注入層/陰極
(D11)陽極/正孔注入層/正孔輸送層/第2の発光層(第2の有機層)/第1の発光層(第1の有機層)/電子輸送層/電子注入層/陰極
(D12)陽極/正孔注入層/正孔輸送層(第2の有機層)/第1の発光層(第1の有機層)/第2の発光層/電子輸送層/電子注入層/陰極
(D13)陽極/正孔注入層/正孔輸送層/第1の発光層(第1の有機層)/第2の発光層(第2の有機層)/電子輸送層/電子注入層/陰極
(D14)陽極/正孔注入層/正孔輸送層/第1の発光層(第1の有機層)/電子輸送層(第2の有機層)/電子注入層/陰極
(D15)陽極/正孔注入層/正孔輸送層(第2の有機層)/第2の発光層/第1の発光層(第1の有機層)/電子輸送層/電子注入層/陰極
(D1) anode / second light emitting layer (second organic layer) / first light emitting layer (first organic layer) / cathode (D2) anode / hole transport layer (second organic layer) / second 1 light emitting layer (first organic layer) / cathode (D3) anode / hole injection layer / second light emitting layer (second organic layer) / first light emitting layer (first organic layer) / cathode (D4) anode / hole injection layer / second light emitting layer (second organic layer) / first light emitting layer (first organic layer) / electron transport layer / cathode (D5) anode / hole injection layer / Second light emitting layer (second organic layer) / first light emitting layer (first organic layer) / electron injection layer / cathode (D6) anode / hole injection layer / second light emitting layer (second (Organic layer) / first light emitting layer (first organic layer) / electron transport layer / electron injection layer / cathode (D7) anode / hole injection layer / hole transport layer (second organic layer) / second 1 light emitting layer (first organic layer) / cathode (D8) anode / hole injection layer / hole transport layer (second organic layer) / first light emitting layer (first organic layer) / electron transport Layer / cathode (D9) anode / hole injection layer / hole transport layer (second organic layer) / first light emitting layer (first organic layer) / electron injection layer / cathode (D10) anode / hole Injection layer / hole transport layer (second organic layer) / first light emitting layer (first organic layer) / electron transport layer / electron injection layer / cathode (D11) anode / hole injection layer / hole transport Layer / second light emitting layer (second organic layer) / first light emitting layer (first organic layer) / electron transport layer / electron injection layer / cathode (D12) anode / hole injection layer / hole transport Layer (second organic layer) / first light emitting layer (first organic layer) / second light emitting layer / electron transport layer / electron injection layer / cathode (D13) anode / hole injection layer / hole transport Layer / first light emitting layer (first organic layer) / second light emitting layer (second organic layer) / electron transport layer / electron injection layer / cathode (D14) anode / hole injection layer / hole transport Layer / first light emitting layer (first organic layer) / electron transport layer (second organic layer) / electron injection layer / cathode (D15) anode / hole injection layer / hole transport layer (second organic) Layer) / second light emitting layer / first light emitting layer (first organic layer) / electron transport layer / electron injection layer / cathode
上記の(D1)~(D15)中、「/」は、その前後の層が隣接して積層していることを意味する。具体的には、「第2の発光層(第2の有機層)/第1の発光層(第1の有機層)」とは、第2の発光層(第2の有機層)と第1の発光層(第1の有機層)とが隣接して積層していることを意味する。 In the above (D1) to (D15), "/" means that the layers before and after the layer are adjacent to each other. Specifically, the "second light emitting layer (second organic layer) / first light emitting layer (first organic layer)" means the second light emitting layer (second organic layer) and the first. It means that the light emitting layer (first organic layer) of the above is adjacently laminated.
本発明の発光素子の発光効率がより優れるので、(D3)~(D12)で表される層構成が好ましく、(D7)~(D10)で表される層構成がより好ましい。 Since the luminous efficiency of the light emitting device of the present invention is more excellent, the layer structure represented by (D3) to (D12) is preferable, and the layer structure represented by (D7) to (D10) is more preferable.
本発明の発光素子において、陽極、正孔注入層、正孔輸送層、第2の発光層、電子輸送層、電子注入層及び陰極は、それぞれ、必要に応じて、2層以上設けられていてもよい。
陽極、正孔注入層、正孔輸送層、第2の発光層、電子輸送層、電子注入層及び陰極が複数存在する場合、それらはそれぞれ同一でも異なっていてもよい。
In the light emitting device of the present invention, the anode, the hole injection layer, the hole transport layer, the second light emitting layer, the electron transport layer, the electron injection layer and the cathode are each provided with two or more layers as needed. May be good.
When a plurality of anodes, hole injection layers, hole transport layers, second light emitting layers, electron transport layers, electron injection layers and cathodes are present, they may be the same or different from each other.
陽極、正孔注入層、正孔輸送層、第1の発光層、第2の発光層、電子輸送層、電子注入層及び陰極の厚さは、通常、1nm~1μmであり、好ましくは2nm~500nmであり、更に好ましくは5nm~150nmである。 The thickness of the anode, the hole injection layer, the hole transport layer, the first light emitting layer, the second light emitting layer, the electron transport layer, the electron injection layer and the cathode is usually 1 nm to 1 μm, preferably 2 nm to 2 nm. It is 500 nm, more preferably 5 nm to 150 nm.
本発明の発光素子において、積層する層の順番、数、及び厚さは、発光素子の発光効率及び素子寿命を勘案して調整すればよい。 In the light emitting device of the present invention, the order, number, and thickness of the layers to be laminated may be adjusted in consideration of the luminous efficiency of the light emitting device and the device life.
[第2の発光層]
第2の発光層は、通常、第2の有機層又は発光材料を含有する層である。第2の発光層が発光材料を含有する層である場合、第2の発光層に含有される発光材料としては、例えば、前述の第1の組成物が含有していてもよい発光材料が挙げられる。第2の発光層に含有される発光材料は、1種単独で含有されていても、2種以上が含有されていてもよい。
[Second light emitting layer]
The second light emitting layer is usually a second organic layer or a layer containing a light emitting material. When the second light emitting layer is a layer containing a light emitting material, examples of the light emitting material contained in the second light emitting layer include a light emitting material that may be contained in the above-mentioned first composition. Be done. The light emitting material contained in the second light emitting layer may be contained alone or in combination of two or more.
本発明の発光素子が第2の発光層を有し、且つ、後述の正孔輸送層及び後述の電子輸送層が第2の有機層ではない場合、第2の発光層は第2の有機層であることが好ましい。 When the light emitting device of the present invention has a second light emitting layer, and the hole transport layer and the electron transport layer described later are not the second organic layer, the second light emitting layer is the second organic layer. Is preferable.
[正孔輸送層]
正孔輸送層は、通常、第2の有機層又は正孔輸送材料を含有する層である。正孔輸送層が正孔輸送材料を含有する層である場合、正孔輸送材料としては、例えば、前述の第1の組成物が含有していてもよい正孔輸送材料が挙げられる。正孔輸送層に含有される正孔輸送材料は、1種単独で含有されていても、2種以上が含有されていてもよい。
[Hole transport layer]
The hole transport layer is usually a second organic layer or a layer containing a hole transport material. When the hole transporting layer is a layer containing a hole transporting material, examples of the hole transporting material include a hole transporting material that may be contained in the above-mentioned first composition. The hole transport material contained in the hole transport layer may be contained alone or in combination of two or more.
本発明の発光素子が正孔輸送層を有し、且つ、前述の第2の発光層及び後述の電子輸送層が第2の有機層ではない場合、正孔輸送層は第2の有機層であることが好ましい。 When the light emitting device of the present invention has a hole transport layer and the above-mentioned second light emitting layer and the later electron transport layer are not the second organic layer, the hole transport layer is the second organic layer. It is preferable to have.
[電子輸送層]
電子輸送層は、通常、第2の有機層であるか、又は、電子輸送材料を含有する層であり、好ましくは、電子輸送材料を含有する層である。電子輸送層が電子輸送材料を含有する層である場合、電子輸送層に含有される電子輸送材料としては、例えば、前述の第1の組成物が含有していてもよい電子輸送材料が挙げられる。電子輸送層に含有される電子輸送材料は、1種単独で含有されていても、2種以上が含有されていてもよい。
[Electron transport layer]
The electron transport layer is usually a second organic layer or a layer containing an electron transport material, preferably a layer containing an electron transport material. When the electron transport layer is a layer containing an electron transport material, examples of the electron transport material contained in the electron transport layer include an electron transport material that may contain the above-mentioned first composition. .. The electron transport material contained in the electron transport layer may be contained alone or in combination of two or more.
[正孔注入層及び電子注入層]
正孔注入層は、正孔注入材料を含有する層である。正孔注入層に含有される正孔注入材料としては、例えば、前述の第1の組成物が含有していてもよい正孔注入材料が挙げられる。正孔注入層に含有される正孔注入材料は、1種単独で含有されていても、2種以上が含有されていてもよい。
[Hole injection layer and electron injection layer]
The hole injection layer is a layer containing a hole injection material. Examples of the hole injection material contained in the hole injection layer include the hole injection material that may be contained in the above-mentioned first composition. The hole injection material contained in the hole injection layer may be contained alone or in combination of two or more.
電子注入層は、電子注入材料を含有する層である。電子注入層に含有される電子注入材料としては、例えば、前述の第1の組成物が含有していてもよい電子注入材料が挙げられる。電子注入層に含有される電子注入材料は、1種単独で含有されていても、2種以上が含有されていてもよい。 The electron injection layer is a layer containing an electron injection material. Examples of the electron-injecting material contained in the electron-injecting layer include an electron-injecting material that may be contained in the above-mentioned first composition. The electron injection material contained in the electron injection layer may be contained alone or in combination of two or more.
[基板/電極]
発光素子における基板は、電極を形成することができ、且つ、有機層を形成する際に化学的に変化しない基板であればよく、例えば、ガラス、プラスチック、シリコン等の材料からなる基板である。不透明な基板を使用する場合には、基板から最も遠くにある電極が透明又は半透明であることが好ましい。
[Substrate / Electrode]
The substrate in the light emitting element may be a substrate that can form an electrode and does not chemically change when an organic layer is formed, and is, for example, a substrate made of a material such as glass, plastic, or silicon. When using an opaque substrate, it is preferable that the electrode farthest from the substrate is transparent or translucent.
陽極の材料としては、例えば、導電性の金属酸化物、半透明の金属が挙げられ、好ましくは、酸化インジウム、酸化亜鉛、酸化スズ;インジウム・スズ・オキサイド(ITO)、インジウム・亜鉛・オキサイド等の導電性化合物;銀とパラジウムと銅との複合体(APC);NESA、金、白金、銀、銅である。 Examples of the material of the anode include conductive metal oxides and translucent metals, preferably indium oxide, zinc oxide, tin oxide; indium tin oxide (ITO), indium zinc oxide and the like. Conductive compound; composite of silver, palladium and copper (APC); NESA, gold, platinum, silver, copper.
陰極の材料としては、例えば、リチウム、ナトリウム、カリウム、ルビジウム、セシウム、ベリリウム、マグネシウム、カルシウム、ストロンチウム、バリウム、アルミニウム、亜鉛、インジウム等の金属;それらのうち2種以上の合金;それらのうち1種以上と、銀、銅、マンガン、チタン、コバルト、ニッケル、タングステン、錫のうち1種以上との合金;並びに、グラファイト及びグラファイト層間化合物が挙げられる。合金としては、例えば、マグネシウム-銀合金、マグネシウム-インジウム合金、マグネシウム-アルミニウム合金、インジウム-銀合金、リチウム-アルミニウム合金、リチウム-マグネシウム合金、リチウム-インジウム合金、カルシウム-アルミニウム合金が挙げられる。 Materials for the cathode include, for example, metals such as lithium, sodium, potassium, rubidium, cesium, beryllium, magnesium, calcium, strontium, barium, aluminum, zinc, indium; two or more alloys thereof; one of them. Alloys of more than one species with one or more of silver, copper, manganese, titanium, cobalt, nickel, tungsten, tin; as well as graphite and graphite intercalation compounds. Examples of the alloy include magnesium-silver alloy, magnesium-indium alloy, magnesium-aluminum alloy, indium-silver alloy, lithium-aluminum alloy, lithium-magnesium alloy, lithium-indium alloy, and calcium-aluminum alloy.
本発明の発光素子において、陽極及び陰極の少なくとも一方は、通常、透明又は半透明であるが、陽極が透明又は半透明であることが好ましい。 In the light emitting element of the present invention, at least one of the anode and the cathode is usually transparent or translucent, but it is preferable that the anode is transparent or translucent.
陽極及び陰極の形成方法としては、例えば、真空蒸着法、スパッタリング法、イオンプレーティング法、メッキ法及びラミネート法が挙げられる。 Examples of the method for forming the anode and the cathode include a vacuum vapor deposition method, a sputtering method, an ion plating method, a plating method and a laminating method.
[発光素子の製造方法]
本発明の発光素子において、第1の発光層、第2の発光層、正孔輸送層、電子輸送層、正孔注入層、電子注入層等の各層の形成方法としては、低分子化合物を用いる場合、例えば、粉末からの真空蒸着法、溶液又は溶融状態からの成膜による方法が挙げられ、高分子化合物を用いる場合、例えば、溶液又は溶融状態からの成膜による方法が挙げられる。
[Manufacturing method of light emitting element]
In the light emitting element of the present invention, a low molecular weight compound is used as a method for forming each layer such as a first light emitting layer, a second light emitting layer, a hole transport layer, an electron transport layer, a hole injection layer, and an electron injection layer. In the case, for example, a vacuum vapor deposition method from a powder, a method by forming a film from a solution or a molten state can be mentioned, and when a polymer compound is used, for example, a method by forming a film from a solution or a molten state can be mentioned.
第1の発光層、第2の発光層、正孔輸送層、電子輸送層、正孔注入層及び電子注入層は、第1のインク、第2のインク、並びに、上述した発光材料、正孔輸送材料、電子輸送材料、正孔注入材料及び電子注入材料をそれぞれ含有するインクを用いて、スピンコート法、インクジェット印刷法等の湿式法により形成することができる。 The first light emitting layer, the second light emitting layer, the hole transport layer, the electron transport layer, the hole injection layer and the electron injection layer are the first ink, the second ink, and the above-mentioned light emitting material and holes. It can be formed by a wet method such as a spin coat method or an inkjet printing method using an ink containing a transport material, an electron transport material, a hole injection material, and an electron injection material, respectively.
好ましい一実施形態において、本発明の発光素子の製造方法は、陽極と陰極の間に、湿式法により第2の有機層を成膜する工程、成膜した第2の有機層を架橋させる工程、架橋した第2の有機層の上に湿式法により有機層を成膜する工程を包含する。第2の有機層は、例えば、陽極、又は正孔輸送層及び正孔注入層等の有機層の上に成膜される。第2の有機層の上に成膜される有機層は第1の有機層であってよく、電子輸送層、正孔注入層及び第2の発光層等の有機層であってもよい。 In a preferred embodiment, the method for manufacturing a light emitting element of the present invention includes a step of forming a second organic layer between an anode and a cathode by a wet method, and a step of cross-linking the formed second organic layer. It includes a step of forming an organic layer on a crosslinked second organic layer by a wet method. The second organic layer is formed on, for example, an anode or an organic layer such as a hole transport layer and a hole injection layer. The organic layer formed on the second organic layer may be the first organic layer, or may be an organic layer such as an electron transport layer, a hole injection layer, and a second light emitting layer.
[発光素子の用途]
発光素子を用いて面状の発光を得るためには、面状の陽極と陰極が重なり合うように配置すればよい。パターン状の発光を得るためには、面状の発光素子の表面にパターン状の窓を設けたマスクを設置する方法、非発光部にしたい層を極端に厚く形成し実質的に非発光とする方法、陽極若しくは陰極、又は両方の電極をパターン状に形成する方法がある。
これらのいずれかの方法でパターンを形成し、いくつかの電極を独立にON/OFFできるように配置することにより、数字、文字等を表示できるセグメントタイプの表示装置が得られる。ドットマトリックス表示装置とするためには、陽極と陰極を共にストライプ状に形成して直交するように配置すればよい。複数の種類の発光色の異なる高分子化合物を塗り分ける方法、カラーフィルター又は蛍光変換フィルターを用いる方法により、部分カラー表示、マルチカラー表示が可能となる。ドットマトリックス表示装置は、パッシブ駆動も可能であるし、TFT等と組み合わせてアクティブ駆動も可能である。これらの表示装置は、コンピュータ、テレビ、携帯端末等のディスプレイに用いることができる。面状の発光素子は、液晶表示装置のバックライト用の面状光源、又は、面状の照明用光源として好適に用いることができる。フレキシブルな基板を用いれば、曲面状の光源及び表示装置としても使用できる。
[Use of light emitting element]
In order to obtain planar light emission using a light emitting element, the planar anode and cathode may be arranged so as to overlap each other. In order to obtain patterned light emission, a method of installing a mask having a patterned window on the surface of the planar light emitting element, or forming an extremely thick layer to be a non-light emitting part to make it substantially non-light emitting. There is a method, a method of forming an anode or a cathode, or both electrodes in a pattern.
By forming a pattern by any of these methods and arranging several electrodes so that they can be turned ON / OFF independently, a segment type display device capable of displaying numbers, characters, etc. can be obtained. In order to use the dot matrix display device, both the anode and the cathode may be formed in a striped shape and arranged so as to be orthogonal to each other. Partial color display and multi-color display are possible by a method of applying a plurality of types of polymer compounds having different emission colors separately, or a method of using a color filter or a fluorescence conversion filter. The dot matrix display device can be passively driven or can be actively driven in combination with a TFT or the like. These display devices can be used for displays such as computers, televisions, and mobile terminals. The planar light emitting element can be suitably used as a planar light source for a backlight of a liquid crystal display device or a planar illumination light source. If a flexible substrate is used, it can also be used as a curved light source and a display device.
以下、実施例によって本発明を更に詳細に説明するが、本発明はこれらの実施例に限定されるものではない。但し、実施例D1、D3、D4、D5、D7、D8、D10及びD11は参考例である。
Hereinafter, the present invention will be described in more detail by way of examples, but the present invention is not limited to these examples. However, Examples D1, D3, D4, D5, D7, D8, D10 and D11 are reference examples.
実施例において、高分子化合物のポリスチレン換算の数平均分子量(Mn)およびポリスチレン換算の重量平均分子量(Mw)は、移動相にテトラヒドロフランを用い、下記のサイズエクスクルージョンクロマトグラフィー(SEC)のいずれかにより求めた。なお、SECの各測定条件は、次のとおりである。 In the examples, the polystyrene-equivalent number average molecular weight (Mn) and the polystyrene-equivalent weight average molecular weight (Mw) of the polymer compound are one of the following size exclusion chromatography (SEC) using tetrahydrofuran as the mobile phase. Asked by. The measurement conditions of SEC are as follows.
測定する高分子化合物を約0.05重量%の濃度でテトラヒドロフランに溶解させ、SECに10μL注入した。移動相は、2.0mL/分の流量で流した。カラムとして、PLgel MIXED-B(ポリマーラボラトリーズ製)を用いた。検出器にはUV-VIS検出器(島津製作所製、商品名:SPD-10Avp)を用いた。 The polymer compound to be measured was dissolved in tetrahydrofuran at a concentration of about 0.05% by weight, and 10 μL was injected into SEC. The mobile phase was run at a flow rate of 2.0 mL / min. PLgel MIXED-B (manufactured by Polymer Laboratories) was used as a column. A UV-VIS detector (manufactured by Shimadzu Corporation, trade name: SPD-10Avp) was used as the detector.
LC-MSは、下記の方法で測定した。
測定試料を約2mg/mLの濃度になるようにクロロホルムまたはテトラヒドロフランに溶解させ、LC-MS(Agilent製、商品名:1100LCMSD)に約1μL注入した。LC-MSの移動相には、アセトニトリルおよびテトラヒドロフランの比率を変化させながら用い、0.2mL/分の流量で流した。カラムは、L-column 2 ODS(3μm)(化学物質評価研究機構製、内径:2.1mm、長さ:100mm、粒径3μm)を用いた。
LC-MS was measured by the following method.
The measurement sample was dissolved in chloroform or tetrahydrofuran to a concentration of about 2 mg / mL, and about 1 μL was injected into LC-MS (manufactured by Agilent, trade name: 1100LCMSD). For the mobile phase of LC-MS, the ratio of acetonitrile and tetrahydrofuran was changed, and the flow rate was 0.2 mL / min. As a column, L-volume 2 ODS (3 μm) (manufactured by Chemicals Evaluation and Research Institute, inner diameter: 2.1 mm, length: 100 mm, particle size 3 μm) was used.
TLC-MSは、下記の方法で測定した。
測定試料をトルエン、テトラヒドロフランまたはクロロホルムのいずれかの溶媒に任意の濃度で溶解させ、DART用TLCプレート(テクノアプリケーションズ社製、商品名:YSK5-100)上に塗布し、TLC-MS(日本電子社製、商品名:JMS-T100TD(The AccuTOF TLC))を用いて測定した。測定時のヘリウムガス温度は、200~400℃の範囲で調節した。
TLC-MS was measured by the following method.
The measurement sample is dissolved in a solvent of toluene, tetrahydrofuran or chloroform at an arbitrary concentration, coated on a TLC plate for DART (manufactured by Techno Applications, trade name: YSK5-100), and coated on TLC-MS (JEOL Ltd.). Manufactured by, trade name: JMS-T100TD (The AccuTOF TLC) was used for measurement. The helium gas temperature at the time of measurement was adjusted in the range of 200 to 400 ° C.
NMRは、下記の方法で測定した。
5~10mgの測定試料を約0.5mLの重クロロホルム(CDCl3)、重テトラヒドロフラン、重ジメチルスルホキシド、重アセトン、重N,N-ジメチルホルムアミド、重トルエン、重メタノール、重エタノール、重2-プロパノールまたは重塩化メチレンに溶解させ、NMR装置(Agilent製、商品名:INOVA300またはMERCURY 400VX)を用いて測定した。
NMR was measured by the following method.
About 0.5 mL of deuterated chloroform (CDCl 3 ), deuterated tetrahydrofuran, deuterated dimethylsulfoxide, deuterated acetone, deuterated N, N-dimethylformamide, deuterated toluene, deuterated methanol, deuterated ethanol, deuterated 2-propanol Alternatively, it was dissolved in deuterated methylene chloride and measured using an NMR apparatus (manufactured by Agent, trade name: INOVA300 or MERCURY 400VX).
化合物の純度の指標として、高速液体クロマトグラフィー(HPLC)面積百分率の値を用いた。この値は、特に記載がない限り、HPLC(島津製作所製、商品名:LC-20A)でのUV=254nmにおける値とする。この際、測定する化合物は、0.01~0.2重量%の濃度になるようにテトラヒドロフランまたはクロロホルムに溶解させ、濃度に応じてHPLCに1~10μL注入した。HPLCの移動相には、アセトニトリル/テトラヒドロフランの比率を100/0~0/100(容積比)まで変化させながら用い、1.0mL/分の流量で流した。カラムは、Kaseisorb LC ODS 2000(東京化成工業製)または同等の性能を有するODSカラムを用いた。検出器には、フォトダイオードアレイ検出器(島津製作所製、商品名:SPD-M20A)を用いた。 The value of high performance liquid chromatography (HPLC) area percentage was used as an index of the purity of the compound. Unless otherwise specified, this value is a value at UV = 254 nm by HPLC (manufactured by Shimadzu Corporation, trade name: LC-20A). At this time, the compound to be measured was dissolved in tetrahydrofuran or chloroform so as to have a concentration of 0.01 to 0.2% by weight, and 1 to 10 μL was injected into HPLC depending on the concentration. For the mobile phase of HPLC, the ratio of acetonitrile / tetrahydrofuran was changed from 100/0 to 0/100 (volume ratio), and the flow was carried out at a flow rate of 1.0 mL / min. As the column, Kaseisorb LC ODS 2000 (manufactured by Tokyo Chemical Industry Co., Ltd.) or an ODS column having equivalent performance was used. A photodiode array detector (manufactured by Shimadzu Corporation, trade name: SPD-M20A) was used as the detector.
本実施例において、化合物の発光スペクトルの最大ピーク波長は、分光光度計(日本分光株式会社製、FP-6500)により室温にて測定した。化合物をトルエンに、約0.8×10-4重量%の濃度で溶解させたトルエン溶液を試料として用いた。励起光としては、波長325nmのUV光を用いた。 In this example, the maximum peak wavelength of the emission spectrum of the compound was measured at room temperature by a spectrophotometer (manufactured by JASCO Corporation, FP-6500). A toluene solution in which the compound was dissolved in toluene at a concentration of about 0.8 × 10 -4 wt% was used as a sample. As the excitation light, UV light having a wavelength of 325 nm was used.
<合成例HM1> 化合物HM-1及びHM-2の合成、入手
化合物HM-1は、特開2011-174059号公報に記載の方法に準じて合成した。
化合物HM-2は、AK Scientific社より購入した。
<Synthesis Example HM1> Synthesis of Compounds HM-1 and HM-2, Obtained Compound HM-1 was synthesized according to the method described in JP-A-2011-174059.
Compound HM-2 was purchased from AK Scientific.
<合成例EM1> 化合物EM-1、EM-2及びEM-3の合成
化合物EM-1は、特開2011-176304号公報に記載の方法に従って合成した。
化合物EM-2は、国際公開第2008/059713号に記載の方法に準じて合成した。
化合物EM-3は、特開2009-290091号公報及び特開2011-176304号公報に記載の方法に準じて合成した。
<Synthesis Example EM1> The synthetic compound EM-1 of the compounds EM-1, EM-2 and EM-3 was synthesized according to the method described in JP-A-2011-176304.
Compound EM-2 was synthesized according to the method described in International Publication No. 2008/059713.
Compound EM-3 was synthesized according to the methods described in JP-A-2009-2900091 and JP-A-2011-176304.
<合成例EM4> 化合物EM-4の合成
反応容器内を窒素雰囲気とした後、国際公開第2009/075203号に記載の方法に準じて合成した化合物EM-4a(3.50g)、特開2015-110751号公報に記載の方法に従って合成した化合物EM-4b(9.00g)、テトラキス(トリフェニルホスフィン)パラジウム(0)(0.294g)、20重量%テトラブチルアンモニウムヒドロキシド水溶液(18.9g)及びトルエン(52mL)を加え、80℃で6時間撹拌した。得られた反応混合物を室温まで冷却した後、ヘキサンを加え、析出した固体をろ取した。得られた固体をトルエンに溶解させ、イオン交換水で洗浄した後、水層を除去した。得られた有機層を、シリカゲルを敷いたろ過器でろ過し、得られたろ液を減圧濃縮した。得られた濃縮物を、トルエン及びアセトニトリルの混合溶媒を用いて晶析を行い、減圧乾燥させることにより、化合物EM-9(3.5g)を得た。化合物EM-9のHPLC面積百分率値は99.5%以上であった。
<Synthesis Example EM4> Synthesis of compound EM-4 Compound EM-4a (3.50 g) synthesized according to the method described in International Publication No. 2009/075203 after setting the inside of the reaction vessel to a nitrogen atmosphere, JP-A-2015. Compound EM-4b (9.00 g), tetrakis (triphenylphosphine) palladium (0) (0.294 g), and 20 wt% tetrabutylammonium hydroxide aqueous solution (18.9 g) synthesized according to the method described in JP-A-101751. ) And toluene (52 mL) were added, and the mixture was stirred at 80 ° C. for 6 hours. The obtained reaction mixture was cooled to room temperature, hexane was added, and the precipitated solid was collected by filtration. The obtained solid was dissolved in toluene, washed with ion-exchanged water, and then the aqueous layer was removed. The obtained organic layer was filtered through a filter covered with silica gel, and the obtained filtrate was concentrated under reduced pressure. The obtained concentrate was crystallized using a mixed solvent of toluene and acetonitrile and dried under reduced pressure to obtain compound EM-9 (3.5 g). The HPLC area percentage value of compound EM-9 was 99.5% or more.
LC-MS(ESI,positive):m/z=2043[M]+ LC-MS (ESI, positive): m / z = 2043 [M] +
<合成例EM5> 化合物EM-5の合成
化合物EM-5は、国際公開第2008/059713号に記載の方法に準じて合成した。
<Synthesis Example EM5> Synthetic compound EM-5 of compound EM-5 was synthesized according to the method described in International Publication No. 2008/059713.
化合物EM-1の発光スペクトルの最大ピーク波長は439nmであった。
化合物EM-2の発光スペクトルの最大ピーク波長は441nmであった。
化合物EM-3の発光スペクトルの最大ピーク波長は460nmであった。
化合物EM-4の発光スペクトルの最大ピーク波長は440nmであった。
化合物EM-5の発光スペクトルの最大ピーク波長は432nmであった。
The maximum peak wavelength of the emission spectrum of compound EM-1 was 439 nm.
The maximum peak wavelength of the emission spectrum of compound EM-2 was 441 nm.
The maximum peak wavelength of the emission spectrum of compound EM-3 was 460 nm.
The maximum peak wavelength of the emission spectrum of compound EM-4 was 440 nm.
The maximum peak wavelength of the emission spectrum of compound EM-5 was 432 nm.
<合成例M1> 化合物M1~M11の合成、入手
化合物M1は、特開2012-144721号公報に記載の方法に従って合成した。
化合物M2は、市販品を用いた。
化合物M3は、国際公開第2015/145871号に記載の方法に従って合成した。
化合物M4は、国際公開第2013/146806号に記載の方法に従って合成した。
化合物M5は、国際公開第2005/049546号に記載の方法に従って合成した。
化合物M6及びM7は、国際公開第2002/045184号に記載の方法に従って合成した。
化合物M8は、国際公開第2011/049241号に記載の方法に従って合成した。
化合物M9は、特開2010-189630号公報に記載の方法に従って合成した。
化合物M10は、国際公開第2002/045184号に記載の方法に従って合成した。
化合物M11は、特開2012-144721号公報に記載の方法に従って合成した。
<Synthesis Example M1> Synthesis and Acquisition of Compounds M1 to M11 Compound M1 was synthesized according to the method described in JP2012-144721.
As the compound M2, a commercially available product was used.
Compound M3 was synthesized according to the method described in WO 2015/145871.
Compound M4 was synthesized according to the method described in WO 2013/146806.
Compound M5 was synthesized according to the method described in WO 2005/049546.
Compounds M6 and M7 were synthesized according to the method described in International Publication No. 2002/045184.
Compound M8 was synthesized according to the method described in International Publication No. 2011/049241.
Compound M9 was synthesized according to the method described in JP-A-2010-189630.
Compound M10 was synthesized according to the method described in International Publication No. 2002/045184.
Compound M11 was synthesized according to the method described in JP-A-2012-144721.
<合成例HP1> 高分子化合物HP-1の合成
(工程1)反応容器内を不活性ガス雰囲気とした後、化合物M1(1.73g)、化合物M2(0.843g),ジクロロビス〔トリス(2-メトキシフェニル)ホスフィン〕パラジウム(2.2mg)及びトルエン(40ml)を加え、105℃に加熱した。
(工程2) 得られた反応液に、20重量%水酸化テトラエチルアンモニウム水溶液(8.7g)を滴下し、3時間還流させた。
(工程3) その後、そこに、9-ブロモアントラセン(64.1mg)、20重量%水酸化テトラエチルアンモニウム水溶液(8.8g)及びジクロロビス〔トリス(2-メトキシフェニル)ホスフィン〕パラジウム(2.2mg)を加え、16時間還流させた。
(工程4) その後、そこに、ジエチルジチアカルバミン酸ナトリウム水溶液を加え、80℃で2時間撹拌した。得られた反応液を冷却後、水で2回、3重量%酢酸水溶液で2回、水で2回洗浄し、得られた溶液をメタノールに滴下したところ、沈殿が生じた。沈殿物をトルエンに溶解させ、アルミナカラム、シリカゲルカラムの順番で通液することにより精製した。得られた溶液をメタノールに滴下し、撹拌したところ、沈殿が生じた。沈殿物をろ取し、乾燥させることにより、高分子化合物HP-1を0.91g得た。高分子化合物HP-1のポリスチレン換算の数平均分子量及び重量平均分子量は、それぞれ、Mn=1.2×105及びMw=4.8×105であった。
<Synthesis Example HP1> Synthesis of Polymer Compound HP-1
(Step 1) After the inside of the reaction vessel is made into an inert gas atmosphere, compound M1 (1.73 g), compound M2 (0.843 g), dichlorobis [tris (2-methoxyphenyl) phosphine] palladium (2.2 mg) and toluene (40 ml). ) Was added and heated to 105 ° C.
(Step 2) A 20 wt% tetraethylammonium hydroxide aqueous solution (8.7 g) was added dropwise to the obtained reaction solution, and the mixture was refluxed for 3 hours.
(Step 3) Then, 9-bromoanthracene (64.1 mg), a 20 wt% tetraethylammonium hydroxide aqueous solution (8.8 g) and dichlorobis [tris (2-methoxyphenyl) phosphine] palladium (2.2 mg) are added thereto. It was refluxed for 16 hours.
(Step 4) Then, an aqueous sodium diethyldithiacarbamate solution was added thereto, and the mixture was stirred at 80 ° C. for 2 hours. After cooling the obtained reaction solution, the mixture was washed twice with water, twice with a 3 wt% acetic acid aqueous solution, and twice with water, and the obtained solution was added dropwise to methanol to cause precipitation. The precipitate was dissolved in toluene and purified by passing the solution in the order of an alumina column and a silica gel column. When the obtained solution was added dropwise to methanol and stirred, precipitation occurred. The precipitate was collected by filtration and dried to obtain 0.91 g of the polymer compound HP-1. The polystyrene-equivalent number average molecular weight and weight average molecular weight of the polymer compound HP-1 were Mn = 1.2 × 10 5 and Mw = 4.8 × 10 5 , respectively.
高分子化合物HP-1は、仕込み原料の量から求めた理論値では、化合物M1から誘導される構成単位と、化合物M2から誘導される構成単位とが、50:50のモル比で構成されてなる共重合体である。 According to the theoretical value obtained from the amount of the charged raw material, the polymer compound HP-1 is composed of the structural unit derived from the compound M1 and the structural unit derived from the compound M2 in a molar ratio of 50:50. Is a copolymer.
<合成例HP2> 高分子化合物HP-2の合成
高分子化合物HP-2は、化合物M7、M10及び化合物M11を用いて、特開2011-176304号公報に記載の方法に準じて合成した。
<Synthesis Example HP2> Synthesis of Polymer Compound HP-2 The polymer compound HP-2 was synthesized using the compounds M7, M10 and the compound M11 according to the method described in JP-A-2011-176304.
高分子化合物HP-2のポリスチレン換算の数平均分子量及び重量平均分子量は、それぞれ、Mn=3.9×104及びMw=1.0×105であった。 The polystyrene-equivalent number average molecular weight and weight average molecular weight of the polymer compound HP-2 were Mn = 3.9 × 10 4 and Mw = 1.0 × 105, respectively.
高分子化合物HP-2は、仕込み原料の量から求めた理論値では、化合物M10から誘導される構成単位と、化合物M11から誘導される構成単位と、化合物M7から誘導される構成単位が、50:45:5のモル比で構成されてなる共重合体である。 According to the theoretical value obtained from the amount of the charged raw material, the polymer compound HP-2 has 50 constituent units derived from the compound M10, the constituent units derived from the compound M11, and the constituent units derived from the compound M7. It is a copolymer composed of a molar ratio of: 45: 5.
<合成例HTL1> 高分子化合物HTL-1の合成
高分子化合物HTL-1は、化合物M6及び化合物M7を用いて、特開2012-36381号公報に記載の方法に従って合成した。
<Synthesis Example HTL1> Synthesis of Polymer Compound HTL-1 Polymer compound HTL-1 was synthesized by using Compound M6 and Compound M7 according to the method described in JP2012-36381.
高分子化合物HTL-1のポリスチレン換算の数平均分子量及び重量平均分子量は、それぞれ、Mn=8.1×104及びMw=3.4×105であった。 The polystyrene-equivalent number average molecular weight and weight average molecular weight of the polymer compound HTL-1 were Mn = 8.1 × 10 4 and Mw = 3.4 × 105, respectively.
高分子化合物HTL-1は、仕込み原料の量から求めた理論値では、化合物M6から誘導される構成単位と、化合物M7から誘導される構成単位とが、50:50のモル比で構成されてなる共重合体である。 According to the theoretical value obtained from the amount of the charged raw material, the polymer compound HTL-1 is composed of the structural unit derived from the compound M6 and the structural unit derived from the compound M7 in a molar ratio of 50:50. Is a copolymer.
<合成例HTL2> 高分子化合物HTL-2の合成
高分子化合物HTL-2は、化合物M5及び化合物M9を用いて、国際公開第2015/194448号に記載の方法に従って合成した。
<Synthesis Example HTL2> Synthesis of Polymer Compound HTL-2 Polymer compound HTL-2 was synthesized using Compound M5 and Compound M9 according to the method described in International Publication No. 2015/194448.
高分子化合物HTL-2のポリスチレン換算の数平均分子量及び重量平均分子量は、それぞれ、Mn=4.5×104及びMw=1.5×105であった。 The polystyrene-equivalent number average molecular weight and weight average molecular weight of the polymer compound HTL-2 were Mn = 4.5 × 10 4 and Mw = 1.5 × 105, respectively.
高分子化合物HTL-2は、仕込み原料の量から求めた理論値では、化合物M5から誘導される構成単位と、化合物M9から誘導される構成単位とが、50:50のモル比で構成されてなる共重合体である。 According to the theoretical value obtained from the amount of the charged raw material, the polymer compound HTL-2 is composed of the structural unit derived from the compound M5 and the structural unit derived from the compound M9 in a molar ratio of 50:50. Is a copolymer.
<合成例HTL3> 高分子化合物HTL-3の合成
高分子化合物HTL-3は、化合物M6、化合物M7及び化合物M8を用いて、国際公開第2011/049241号に記載の方法に従って合成した。
<Synthesis Example HTL3> Synthesis of Polymer Compound HTL-3 The polymer compound HTL-3 was synthesized using the compound M6, the compound M7 and the compound M8 according to the method described in International Publication No. 2011/049241.
高分子化合物HTL-3のポリスチレン換算の数平均分子量及び重量平均分子量は、それぞれ、Mn=8.9×104及びMw=4.2×105であった。 The polystyrene-equivalent number average molecular weight and weight average molecular weight of the polymer compound HTL- 3 were Mn = 8.9 × 10 4 and Mw = 4.2 × 105, respectively.
高分子化合物HTL-3は、仕込み原料の量から求めた理論値では、化合物M6から誘導される構成単位と、化合物M7から誘導される構成単位と、化合物M8から誘導される構成単位とが、50:42.5:7.5のモル比で構成されてなる共重合体である。 In the theoretical value obtained from the amount of the charged raw material, the polymer compound HTL-3 has a structural unit derived from the compound M6, a structural unit derived from the compound M7, and a structural unit derived from the compound M8. It is a copolymer composed of a molar ratio of 50: 42.5: 7.5.
<合成例HTL4> 高分子化合物HTL-4の合成
高分子化合物2は、化合物M3、化合物M4及び化合物M5を用いて、国際公開第2015/145871号に記載の方法に従って合成した。
<Synthesis Example HTL4> Synthesis of Polymer Compound HTL-4 Polymer Compound 2 was synthesized using Compound M3, Compound M4 and Compound M5 according to the method described in International Publication No. 2015/145871.
高分子化合物HTL-4のポリスチレン換算の数平均分子量及び重量平均分子量は、それぞれ、Mn=2.3×104及びMw=1.2×105であった。 The polystyrene-equivalent number average molecular weight and weight average molecular weight of the polymer compound HTL-4 were Mn = 2.3 × 10 4 and Mw = 1.2 × 105, respectively.
高分子化合物HTL-4は、仕込み原料の量から求めた理論値では、化合物M3から誘導される構成単位と、化合物M4から誘導される構成単位と、化合物M5から誘導される構成単位とが、45:5:50のモル比で構成されてなる共重合体である。 In the theoretical value obtained from the amount of the charged raw material, the polymer compound HTL-4 has a structural unit derived from the compound M3, a structural unit derived from the compound M4, and a structural unit derived from the compound M5. It is a copolymer composed of a molar ratio of 45: 5: 50.
<低分子化合物HTL-5の入手>
低分子化合物HTL-5は、Luminescense Technology社より購入した。
<Obtaining the small molecule compound HTL-5>
The small molecule compound HTL-5 was purchased from Luminesecense Technology.
<実施例D1> 発光素子D1の作製と評価
(陽極および正孔注入層の形成)
ガラス基板にスパッタ法により45nmの厚みでITO膜を付けることにより陽極を形成した。該陽極上に、正孔注入材料であるND-3202(日産化学工業製)をスピンコート法により35nmの厚さで成膜した。大気雰囲気下において、50℃、3分間加熱し、更に230℃、15分間加熱することにより正孔注入層を形成した。
<Example D1> Fabrication and evaluation of light emitting device D1 (formation of anode and hole injection layer)
An anode was formed by attaching an ITO film to a glass substrate with a thickness of 45 nm by a sputtering method. ND-3202 (manufactured by Nissan Chemical Industries, Ltd.), which is a hole injection material, was formed on the anode to a thickness of 35 nm by a spin coating method. The hole injection layer was formed by heating at 50 ° C. for 3 minutes and further heating at 230 ° C. for 15 minutes in an air atmosphere.
(第2の有機層の形成)
キシレンに、高分子化合物HTL-4を0.6重量%の濃度で溶解させた。得られたキシレン溶液を用いて、正孔注入層の上にスピンコート法により20nmの厚さで成膜し、窒素ガス雰囲気下において、ホットプレート上で180℃、60分間加熱することにより第2の有機層を形成した。この加熱により、高分子化合物HTL-4は、架橋体となった。
(Formation of second organic layer)
The polymer compound HTL-4 was dissolved in xylene at a concentration of 0.6% by weight. Using the obtained xylene solution, a film was formed on the hole injection layer to a thickness of 20 nm by a spin coating method, and heated on a hot plate at 180 ° C. for 60 minutes in a nitrogen gas atmosphere to obtain a second film. Formed an organic layer of. By this heating, the polymer compound HTL-4 became a crosslinked product.
(第1の有機層の形成)
トルエンに、化合物HM-2及び化合物EM-2(化合物HM-2/化合物EM-2=91.5重量%/8.5重量%)を2重量%の濃度で溶解させた。得られたトルエン溶液を用いて、第2の有機層の上にスピンコート法により60nmの厚さで成膜し、窒素ガス雰囲気下において、ホットプレート上で150℃、10分加熱することにより第1の有機層を形成した。
(Formation of the first organic layer)
Compound HM-2 and compound EM-2 (Compound HM-2 / Compound EM-2 = 91.5% by weight / 8.5% by weight) were dissolved in toluene at a concentration of 2% by weight. Using the obtained toluene solution, a film was formed on the second organic layer by a spin coating method to a thickness of 60 nm, and heated on a hot plate at 150 ° C. for 10 minutes in a nitrogen gas atmosphere. 1 organic layer was formed.
(陰極の形成)
第1の有機層を形成した基板を蒸着機内において、1×10-4Pa以下にまで減圧した後、陰極として、第1の有機層の上に、フッ化ナトリウムを約4nm、次いで、フッ化ナトリウム層の上に、アルミニウムを約80nm蒸着した。蒸着後、ガラス基板を用いて封止することにより、発光素子D1を作製した。
(Cathode formation)
After reducing the pressure of the substrate on which the first organic layer was formed to 1 × 10 -4 Pa or less in the vapor deposition machine, sodium fluoride was placed on the first organic layer as a cathode by about 4 nm, and then fluoride. Aluminum was deposited on the sodium layer at about 80 nm. After the vapor deposition, the light emitting element D1 was manufactured by sealing with a glass substrate.
(発光素子の評価)
発光素子D1に電圧を印加することによりEL発光が観測された。50cd/m2における発光効率は4.13cd/Aであり、CIE色度座標(x,y)は(0.16, 0.24)であった。200cd/m2における発光効率は4.11cd/Aであり、CIE色度座標(x,y)は(0.16, 0.23)であった。
(Evaluation of light emitting element)
EL light emission was observed by applying a voltage to the light emitting element D1. The luminous efficiency at 50 cd / m 2 was 4.13 cd / A, and the CIE chromaticity coordinates (x, y) were (0.16, 0.24). The luminous efficiency at 200 cd / m 2 was 4.11 cd / A, and the CIE chromaticity coordinates (x, y) were (0.16, 0.23).
<実施例D2> 発光素子D2の作製と評価
実施例D1における化合物HM-2に代えて、高分子化合物HP-1を用いた以外は、実施例D1と同様にして、発光素子D2を作製した。
<Example D2> Preparation and evaluation of light emitting element D2 A light emitting element D2 was produced in the same manner as in Example D1 except that the polymer compound HP-1 was used instead of the compound HM-2 in Example D1. ..
発光素子D2に電圧を印加することによりEL発光が観測された。50cd/m2における発光効率は5.44cd/Aであり、CIE色度座標(x,y)は(0.16, 0.16)であった。200cd/m2における発光効率は5.49cd/Aであり、CIE色度座標(x,y)は(0.16, 0.16)であった。 EL light emission was observed by applying a voltage to the light emitting element D2. The luminous efficiency at 50 cd / m 2 was 5.44 cd / A, and the CIE chromaticity coordinates (x, y) were (0.16, 0.16). The luminous efficiency at 200 cd / m 2 was 5.49 cd / A, and the CIE chromaticity coordinates (x, y) were (0.16, 0.16).
<実施例D3> 発光素子D3の作製と評価
実施例D1における化合物EM-2に代えて、化合物EM-3を用いた以外は、実施例D1と同様にして、発光素子D3を作製した。
<Example D3> Fabrication and evaluation of light emitting device D3 A light emitting device D3 was manufactured in the same manner as in Example D1 except that compound EM-3 was used instead of compound EM-2 in Example D1.
発光素子D3に電圧を印加することによりEL発光が観測された。50cd/m2における発光効率は3.08cd/Aであり、CIE色度座標(x,y)は(0.16, 0.20)であった。200cd/m2における発光効率は2.66cd/Aであり、CIE色度座標(x,y)は(0.16, 0.18)であった。 EL light emission was observed by applying a voltage to the light emitting element D3. The luminous efficiency at 50 cd / m 2 was 3.08 cd / A, and the CIE chromaticity coordinates (x, y) were (0.16, 0.20). The luminous efficiency at 200 cd / m 2 was 2.66 cd / A, and the CIE chromaticity coordinates (x, y) were (0.16, 0.18).
<実施例D4> 発光素子D4の作製と評価
実施例D1における化合物EM-2に代えて、化合物EM-4を用いた以外は、実施例D1と同様にして、発光素子D4を作製した。
<Example D4> Fabrication and evaluation of light emitting device D4 A light emitting device D4 was manufactured in the same manner as in Example D1 except that compound EM-4 was used instead of compound EM-2 in Example D1.
発光素子D4に電圧を印加することによりEL発光が観測された。50cd/m2における発光効率は2.21cd/Aであり、CIE色度座標(x,y)は(0.16, 0.17)であった。200cd/m2における発光効率は2.01cd/Aであり、CIE色度座標(x,y)は(0.16, 0.17)であった。 EL light emission was observed by applying a voltage to the light emitting element D4. The luminous efficiency at 50 cd / m 2 was 2.21 cd / A, and the CIE chromaticity coordinates (x, y) were (0.16, 0.17). The luminous efficiency at 200 cd / m 2 was 2.01 cd / A, and the CIE chromaticity coordinates (x, y) were (0.16, 0.17).
<実施例D5> 発光素子D5の作製と評価
実施例D1における高分子化合物HTL-4に代えて、高分子化合物HTL-3を用いた以外は、実施例D1と同様にして、発光素子D5を作製した。
<Example D5> Fabrication and evaluation of light emitting element D5 The light emitting element D5 is used in the same manner as in Example D1 except that the polymer compound HTL-3 is used instead of the polymer compound HTL-4 in Example D1. Made.
発光素子D5に電圧を印加することによりEL発光が観測された。50cd/m2における発光効率は2.19cd/Aであり、CIE色度座標(x,y)は(0.15, 0.16)であった。200cd/m2における発光効率は2.30cd/Aであり、CIE色度座標(x,y)は(0.15, 0.18)であった。 EL light emission was observed by applying a voltage to the light emitting element D5. The luminous efficiency at 50 cd / m 2 was 2.19 cd / A, and the CIE chromaticity coordinates (x, y) were (0.15, 0.16). The luminous efficiency at 200 cd / m 2 was 2.30 cd / A, and the CIE chromaticity coordinates (x, y) were (0.15, 0.18).
<実施例D6> 発光素子D6の作製と評価
実施例D2における高分子化合物HTL-4に代えて、高分子化合物HTL-3を用いた以外は、実施例D2と同様にして、発光素子D6を作製した。
<Example D6> Fabrication and evaluation of light emitting element D6 The light emitting element D6 is used in the same manner as in Example D2 except that the polymer compound HTL-3 is used instead of the polymer compound HTL-4 in Example D2. Made.
発光素子D6に電圧を印加することによりEL発光が観測された。50cd/m2における発光効率は3.03cd/Aであり、CIE色度座標(x,y)は(0.15, 0.15)であった。200cd/m2における発光効率は3.70cd/Aであり、CIE色度座標(x,y)は(0.15, 0.15)であった。 EL light emission was observed by applying a voltage to the light emitting element D6. The luminous efficiency at 50 cd / m 2 was 3.03 cd / A, and the CIE chromaticity coordinates (x, y) were (0.15, 0.15). The luminous efficiency at 200 cd / m 2 was 3.70 cd / A, and the CIE chromaticity coordinates (x, y) were (0.15, 0.15).
<実施例D7> 発光素子D7の作製と評価
実施例D3における高分子化合物HTL-4に代えて、高分子化合物HTL-3を用いた以外は、実施例D3と同様にして、発光素子D7を作製した。
<Example D7> Fabrication and evaluation of light emitting device D7 The light emitting device D7 is used in the same manner as in Example D3 except that the polymer compound HTL-3 is used instead of the polymer compound HTL-4 in Example D3. Made.
発光素子D7に電圧を印加することによりEL発光が観測された。50cd/m2における発光効率は0.99cd/Aであり、CIE色度座標(x,y)は(0.15, 0.12)であった。200cd/m2における発光効率は1.10cd/Aであり、CIE色度座標(x,y)は(0.15, 0.12)であった。 EL light emission was observed by applying a voltage to the light emitting element D7. The luminous efficiency at 50 cd / m 2 was 0.99 cd / A, and the CIE chromaticity coordinates (x, y) were (0.15, 0.12). The luminous efficiency at 200 cd / m 2 was 1.10 cd / A, and the CIE chromaticity coordinates (x, y) were (0.15, 0.12).
<実施例D8> 発光素子D8の作製と評価
実施例D1の(第2の有機層の形成)における、「キシレンに、高分子化合物HTL-4を0.6重量%の濃度で溶解させた。」に代えて、「クロロベンゼンに、低分子化合物HTL-5を0.9重量%の濃度で溶解させた。」とする以外は、実施例D1と同様にして、発光素子D8を作製した。
<Example D8> Fabrication and evaluation of light emitting element D8 In Example D1 (formation of a second organic layer), "the polymer compound HTL-4 was dissolved in xylene at a concentration of 0.6% by weight". Instead, the light emitting element D8 was produced in the same manner as in Example D1 except that "the low molecular weight compound HTL-5 was dissolved in chlorobenzene at a concentration of 0.9% by weight."
発光素子D8に電圧を印加することによりEL発光が観測された。50cd/m2における発光効率は2.56cd/Aであり、CIE色度座標(x,y)は(0.16, 0.17)であった。200cd/m2における発光効率は3.26cd/Aであり、CIE色度座標(x,y)は(0.15, 0.16)であった。 EL light emission was observed by applying a voltage to the light emitting element D8. The luminous efficiency at 50 cd / m 2 was 2.56 cd / A, and the CIE chromaticity coordinates (x, y) were (0.16, 0.17). The luminous efficiency at 200 cd / m 2 was 3.26 cd / A, and the CIE chromaticity coordinates (x, y) were (0.15, 0.16).
<実施例D9> 発光素子D9の作製と評価
実施例D2の(第2の有機層の形成)における、「キシレンに、高分子化合物HTL-4を0.6重量%の濃度で溶解させた。」に代えて、「クロロベンゼンに、低分子化合物HTL-5を0.9重量%の濃度で溶解させた。」とする以外は、実施例D2と同様にして、発光素子D9を作製した。
<Example D9> Fabrication and evaluation of light emitting element D9 In Example D2 (formation of a second organic layer), "the polymer compound HTL-4 was dissolved in xylene at a concentration of 0.6% by weight". Instead, the light emitting element D9 was produced in the same manner as in Example D2, except that "the low molecular weight compound HTL-5 was dissolved in chlorobenzene at a concentration of 0.9% by weight."
発光素子D9に電圧を印加することによりEL発光が観測された。50cd/m2における発光効率は3.59cd/Aであり、CIE色度座標(x,y)は(0.17, 0.20)であった。200cd/m2における発光効率は4.16cd/Aであり、CIE色度座標(x,y)は(0.16, 0.19)であった。 EL light emission was observed by applying a voltage to the light emitting element D9. The luminous efficiency at 50 cd / m 2 was 3.59 cd / A, and the CIE chromaticity coordinates (x, y) were (0.17, 0.20). The luminous efficiency at 200 cd / m 2 was 4.16 cd / A, and the CIE chromaticity coordinates (x, y) were (0.16, 0.19).
<実施例D10> 発光素子D10の作製と評価
実施例D3の(第2の有機層の形成)における、「キシレンに、高分子化合物HTL-4を0.6重量%の濃度で溶解させた。」に代えて、「クロロベンゼンに、低分子化合物HTL-5を0.9重量%の濃度で溶解させた。」とする以外は、実施例D3と同様にして、発光素子D10を作製した。
<Example D10> Fabrication and evaluation of light emitting element D10 In Example D3 (formation of a second organic layer), "the polymer compound HTL-4 was dissolved in xylene at a concentration of 0.6% by weight". Instead, the light emitting element D10 was produced in the same manner as in Example D3, except that "the low molecular weight compound HTL-5 was dissolved in chlorobenzene at a concentration of 0.9% by weight."
発光素子D10に電圧を印加することによりEL発光が観測された。50cd/m2における発光効率は1.83cd/Aであり、CIE色度座標(x,y)は(0.16, 0.14)であった。200cd/m2における発光効率は2.12cd/Aであり、CIE色度座標(x,y)は(0.16, 0.13)であった。 EL light emission was observed by applying a voltage to the light emitting element D10. The luminous efficiency at 50 cd / m 2 was 1.83 cd / A, and the CIE chromaticity coordinates (x, y) were (0.16, 0.14). The luminous efficiency at 200 cd / m 2 was 2.12 cd / A, and the CIE chromaticity coordinates (x, y) were (0.16, 0.13).
<実施例D11> 発光素子D11の作製と評価
実施例D4の(第2の有機層の形成)における、「キシレンに、高分子化合物HTL-4を0.6重量%の濃度で溶解させた。」に代えて、「クロロベンゼンに、低分子化合物HTL-5を0.9重量%の濃度で溶解させた。」とする以外は、実施例D4と同様にして、発光素子D11を作製した。
<Example D11> Fabrication and evaluation of light emitting element D11 In Example D4 (formation of a second organic layer), "the polymer compound HTL-4 was dissolved in xylene at a concentration of 0.6% by weight". Instead, the light emitting element D11 was produced in the same manner as in Example D4, except that "the low molecular weight compound HTL-5 was dissolved in chlorobenzene at a concentration of 0.9% by weight."
発光素子D11に電圧を印加することによりEL発光が観測された。50cd/m2における発光効率は2.13cd/Aであり、CIE色度座標(x,y)は(0.16, 0.17)であった。200cd/m2における発光効率は2.61cd/Aであり、CIE色度座標(x,y)は(0.16, 0.16)であった。 EL light emission was observed by applying a voltage to the light emitting element D11. The luminous efficiency at 50 cd / m 2 was 2.13 cd / A, and the CIE chromaticity coordinates (x, y) were (0.16, 0.17). The luminous efficiency at 200 cd / m 2 was 2.61 cd / A, and the CIE chromaticity coordinates (x, y) were (0.16, 0.16).
<比較例CD1> 発光素子CD1の作製と評価
実施例D1における高分子化合物HTL-4に代えて、高分子化合物HTL-2を用いた以外は、実施例D1と同様にして、発光素子CD1を作製した。
<Comparative Example CD1> Fabrication and Evaluation of Light Emitting Element CD1 A light emitting element CD1 is used in the same manner as in Example D1 except that the polymer compound HTL-2 is used instead of the polymer compound HTL-4 in Example D1. Made.
発光素子CD1に電圧を印加することによりEL発光が観測された。50cd/m2における発光効率は0.48cd/Aであり、CIE色度座標(x,y)は(0.16, 0.19)であった。200cd/m2における発光効率は0.62cd/Aであり、CIE色度座標(x,y)は(0.16, 0.19)であった。 EL light emission was observed by applying a voltage to the light emitting element CD1. The luminous efficiency at 50 cd / m 2 was 0.48 cd / A, and the CIE chromaticity coordinates (x, y) were (0.16, 0.19). The luminous efficiency at 200 cd / m 2 was 0.62 cd / A, and the CIE chromaticity coordinates (x, y) were (0.16, 0.19).
<比較例CD2> 発光素子CD2の作製と評価
実施例D1における高分子化合物HTL-4に代えて、高分子化合物HTL-1を用いた以外は、実施例D1と同様にして、発光素子CD2を作製した。
<Comparative Example CD2> Preparation and evaluation of the light emitting element CD2 The light emitting element CD2 is used in the same manner as in Example D1 except that the polymer compound HTL-1 is used instead of the polymer compound HTL-4 in Example D1. Made.
発光素子CD2に電圧を印加することによりEL発光が観測された。50cd/m2における発光効率は0.37cd/Aであり、CIE色度座標(x,y)は(0.14, 0.14)であった。200cd/m2における発光効率は0.54cd/Aであり、CIE色度座標(x,y)は(0.14, 0.14)であった。 EL light emission was observed by applying a voltage to the light emitting element CD2. The luminous efficiency at 50 cd / m 2 was 0.37 cd / A, and the CIE chromaticity coordinates (x, y) were (0.14, 0.14). The luminous efficiency at 200 cd / m 2 was 0.54 cd / A, and the CIE chromaticity coordinates (x, y) were (0.14, 0.14).
<比較例CD3> 発光素子CD3の作製と評価
実施例D6における化合物HM-2に代えて、化合物HM-1を用いた。また、化合物EM-3に代えて、化合物EM-1を用いた。それ以外は、実施例D6と同様にして、発光素子CD3を作製した。
<Comparative Example CD3> Fabrication and evaluation of light emitting device CD3 Compound HM-1 was used instead of compound HM-2 in Example D6. Further, the compound EM-1 was used instead of the compound EM-3. Other than that, the light emitting device CD3 was produced in the same manner as in Example D6.
発光素子CD3に電圧を印加することによりEL発光が観測された。50cd/m2における発光効率は0.07cd/Aであり、CIE色度座標(x,y)は(0.19, 0.17)であった。また、電圧を12Vまで印加したが、200cd/m2には至らなかった。 EL light emission was observed by applying a voltage to the light emitting element CD3. The luminous efficiency at 50 cd / m 2 was 0.07 cd / A, and the CIE chromaticity coordinates (x, y) were (0.19, 0.17). Moreover, although the voltage was applied up to 12V, it did not reach 200cd / m 2 .
<比較例CD4> 発光素子CD4の作製と評価
実施例D5における化合物EM-2に代えて、化合物EM-5を用いた以外は、実施例D5と同様にして、発光素子CD4を作製した。
<Comparative Example CD4> Preparation and Evaluation of Light Emitting Element CD4 A light emitting device CD4 was produced in the same manner as in Example D5 except that compound EM-5 was used instead of compound EM-2 in Example D5.
発光素子CD4に電圧を印加することによりEL発光が観測された。50cd/m2における発光効率は0.15cd/Aであり、CIE色度座標(x,y)は(0.17, 0.20)であった。200cd/m2における発光効率は0.20cd/Aであり、CIE色度座標(x,y)は(0.17, 0.19)であった。 EL light emission was observed by applying a voltage to the light emitting element CD4. The luminous efficiency at 50 cd / m 2 was 0.15 cd / A, and the CIE chromaticity coordinates (x, y) were (0.17, 0.20). The luminous efficiency at 200 cd / m 2 was 0.20 cd / A, and the CIE chromaticity coordinates (x, y) were (0.17, 0.19).
<実施例D12> 発光素子D12の作製と評価
実施例D5における化合物HM-2に代えて、高分子化合物HP-2を用いた以外は、実施例D5と同様にして、発光素子D12を作製した。
<Example D12> Fabrication and evaluation of light emitting device D12 A light emitting device D12 was manufactured in the same manner as in Example D5 except that the polymer compound HP-2 was used instead of the compound HM-2 in Example D5. ..
発光素子D12に電圧を印加することによりEL発光が観測された。100cd/m2における発光効率は2.19cd/Aであり、CIE色度座標(x,y)は(0.16, 0.22)であった。 EL light emission was observed by applying a voltage to the light emitting element D12. The luminous efficiency at 100 cd / m 2 was 2.19 cd / A, and the CIE chromaticity coordinates (x, y) were (0.16, 0.22).
<比較例CD5> 発光素子CD5の作製と評価
実施例D12における高分子化合物HTL-3に代えて、高分子化合物HTL-1を用いた以外は、実施例D12と同様にして、発光素子CD5を作製した。
<Comparative Example CD5> Fabrication and Evaluation of Light Emitting Element CD5 A light emitting device CD5 is used in the same manner as in Example D12 except that the polymer compound HTL-1 is used instead of the polymer compound HTL-3 in Example D12. Made.
発光素子CD5に電圧を印加することによりEL発光が観測された。100cd/m2における発光効率は0.99cd/Aであり、CIE色度座標(x,y)は(0.15, 0.15)であった。 EL light emission was observed by applying a voltage to the light emitting element CD5. The luminous efficiency at 100 cd / m 2 was 0.99 cd / A, and the CIE chromaticity coordinates (x, y) were (0.15, 0.15).
<比較例CD6> 発光素子CD6の作製と評価
実施例D12における化合物EM-2に代えて、化合物EM-5を用いた以外は、実施例D12と同様にして、発光素子CD6を作製した。
<Comparative Example CD6> Preparation and Evaluation of Light Emitting Element CD6 A light emitting device CD6 was produced in the same manner as in Example D12 except that compound EM-5 was used instead of compound EM-2 in Example D12.
発光素子CD6に電圧を印加することによりEL発光が観測された。100cd/m2における発光効率は1.01cd/Aであり、CIE色度座標(x,y)は(0.17, 0.20)であった。 EL light emission was observed by applying a voltage to the light emitting element CD6. The luminous efficiency at 100 cd / m 2 was 1.01 cd / A, and the CIE chromaticity coordinates (x, y) were (0.17, 0.20).
Claims (14)
第1の有機層が、式(1)で表される低分子化合物とホスト材料とを含有する層であり、
ホスト材料が式(Y)で表される構成単位を含む高分子化合物であり、
第2の有機層が、架橋材料の架橋体を含有する層である、発光素子。
環R1A、環R2A及び環R3Aは、それぞれ独立に、芳香族炭化水素環を表し、該環は置換基を有していてもよい。該置換基が複数存在する場合、それらは同一でも異なっていてもよく、互いに結合して、それぞれが結合する炭素原子とともに環を形成していてもよい。
但し、環R1A、環R2A及び環R3Aのうちの少なくとも一つは、式(1-S)で表される基を有する。]
The first organic layer is a layer containing a small molecule compound represented by the formula (1) and a host material .
The host material is a polymer compound containing a structural unit represented by the formula (Y).
A light emitting device in which the second organic layer is a layer containing a crosslinked body of a crosslinking material.
Ring R 1A , ring R 2A , and ring R 3A each independently represent an aromatic hydrocarbon ring, and the ring may have a substituent. When a plurality of the substituents are present, they may be the same or different, or they may be bonded to each other to form a ring together with the carbon atom to which each is bonded.
However, at least one of ring R 1A , ring R 2A and ring R 3A has a group represented by the formula (1-S). ]
架橋基A群から選ばれる少なくとも1種の架橋基を有する低分子化合物、又は、架橋基A群から選ばれる少なくとも1種の架橋基を有する架橋構成単位を含む高分子化合物である、請求項1に記載の発光素子。
(架橋基A群)
Claim 1 is a low molecular weight compound having at least one cross-linking group selected from the cross-linking group A group, or a high molecular compound containing a cross-linking structural unit having at least one cross-linking group selected from the cross-linking group A group. The light emitting element according to.
(Crosslinking group A group)
nAは0~5の整数を表し、nは1又は2を表す。nAが複数存在する場合、それらは同一でも異なっていてもよい。
Ar3は、芳香族炭化水素基又は複素環基を表し、これらの基は置換基を有していてもよい。
LAは、アルキレン基、シクロアルキレン基、アリーレン基、2価の複素環基、-NR’-で表される基、酸素原子又は硫黄原子を表し、これらの基は置換基を有していてもよい。R’は、水素原子、アルキル基、シクロアルキル基、アリール基又は1価の複素環基を表し、これらの基は置換基を有していてもよい。LAが複数存在する場合、それらは同一でも異なっていてもよい。
Xは、架橋基A群から選ばれる架橋基を表す。Xが複数存在する場合、それらは同一でも異なっていてもよい。]
mAは0~5の整数を表し、mは1~4の整数を表し、cは0又は1の整数を表す。mAが複数存在する場合、それらは同一でも異なっていてもよい。
Ar5は、芳香族炭化水素基、複素環基、又は、少なくとも1種の芳香族炭化水素環と少なくとも1種の複素環とが直接結合した基を表し、これらの基は置換基を有していてもよい。
Ar4及びAr6は、それぞれ独立に、アリーレン基又は2価の複素環基を表し、これらの基は置換基を有していてもよい。
Ar4、Ar5及びAr6はそれぞれ、当該基が結合している窒素原子に結合している当該基以外の基と、直接又は酸素原子もしくは硫黄原子を介して結合して、環を形成していてもよい。
KAは、アルキレン基、シクロアルキレン基、アリーレン基、2価の複素環基、-NR’-で表される基、酸素原子又は硫黄原子を表し、これらの基は置換基を有していてもよい。R’は、水素原子、アルキル基、シクロアルキル基、アリール基又は1価の複素環基を表し、これらの基は置換基を有していてもよい。KAが複数存在する場合、それらは同一でも異なっていてもよい。
X’は、架橋基A群から選ばれる架橋基、水素原子、アルキル基、シクロアルキル基、アリール基又は1価の複素環基を表し、これらの基は置換基を有していてもよい。X’が複数存在する場合、それらは同一でも異なっていてもよい。但し、少なくとも1つのX’は、架橋基A群から選ばれる架橋基である。] The light emitting device according to claim 3, wherein the cross-linked structural unit is a structural unit represented by the formula (2) or a structural unit represented by the formula (2').
nA represents an integer of 0 to 5, and n represents 1 or 2. When there are a plurality of nA, they may be the same or different.
Ar 3 represents an aromatic hydrocarbon group or a heterocyclic group, and these groups may have a substituent.
LA represents an alkylene group, a cycloalkylene group, an arylene group, a divalent heterocyclic group, a group represented by -NR'-, an oxygen atom or a sulfur atom, and these groups have a substituent. May be good. R'represents a hydrogen atom, an alkyl group, a cycloalkyl group, an aryl group or a monovalent heterocyclic group, and these groups may have a substituent. If there are multiple LAs , they may be the same or different.
X represents a cross-linking group selected from the group A of cross-linking groups. If there are multiple X's, they may be the same or different. ]
mA represents an integer of 0 to 5, m represents an integer of 1 to 4, and c represents an integer of 0 or 1. If there are multiple mAs, they may be the same or different.
Ar 5 represents an aromatic hydrocarbon group, a heterocyclic group, or a group in which at least one aromatic hydrocarbon ring and at least one heterocycle are directly bonded, and these groups have a substituent. May be.
Ar 4 and Ar 6 each independently represent an arylene group or a divalent heterocyclic group, and these groups may have a substituent.
Ar 4 , Ar 5 and Ar 6 each form a ring by directly or via an oxygen atom or a sulfur atom with a group other than the group bonded to the nitrogen atom to which the group is bonded. May be.
KA represents an alkylene group, a cycloalkylene group, an arylene group, a divalent heterocyclic group, a group represented by -NR'-, an oxygen atom or a sulfur atom, and these groups have a substituent. May be good. R'represents a hydrogen atom, an alkyl group, a cycloalkyl group, an aryl group or a monovalent heterocyclic group, and these groups may have a substituent. If there are multiple KAs , they may be the same or different.
X'represents a cross-linking group, a hydrogen atom, an alkyl group, a cycloalkyl group, an aryl group or a monovalent heterocyclic group selected from the cross-linking group A group, and these groups may have a substituent. If there are multiple X's, they may be the same or different. However, at least one X'is a cross-linking group selected from the group A of cross-linking groups. ]
mB1、mB2及びmB3は、それぞれ独立に、0以上の整数を表す。複数存在するmB1は、同一でも異なっていてもよい。mB3が複数存在する場合、それらは同一でも異なっていてもよい。
Ar7は、芳香族炭化水素基、複素環基、又は、少なくとも1種の芳香族炭化水素環と少なくとも1種の複素環とが直接結合した基を表し、これらの基は置換基を有していてもよい。Ar7が複数存在する場合、それらは同一でも異なっていてもよい。
LB1は、アルキレン基、シクロアルキレン基、アリーレン基、2価の複素環基、-N(R’’’)-で表される基、酸素原子又は硫黄原子を表し、これらの基は置換基を有していてもよい。R’’’は、水素原子、アルキル基、シクロアルキル基、アリール基又は1価の複素環基を表し、これらの基は置換基を有していてもよい。LB1が複数存在する場合、それらは同一でも異なっていてもよい。
X’’は、架橋基、水素原子、アルキル基、シクロアルキル基、アリール基又は1価の複素環基を表し、これらの基は置換基を有していてもよい。複数存在するX’’は、同一でも異なっていてもよい。但し、複数存在するX’’のうち、少なくとも1つは、架橋基である。] The light emitting device according to claim 1, wherein the crosslinked material is a small molecule compound represented by the formula (3).
m B1 , m B2 , and m B3 independently represent integers of 0 or more. A plurality of m B1s may be the same or different. If there are multiple m B3s , they may be the same or different.
Ar 7 represents an aromatic hydrocarbon group, a heterocyclic group, or a group in which at least one aromatic hydrocarbon ring and at least one heterocycle are directly bonded, and these groups have a substituent. May be. If there are multiple Ar 7s , they may be the same or different.
LB1 represents an alkylene group, a cycloalkylene group, an arylene group, a divalent heterocyclic group, a group represented by -N (R''')-, an oxygen atom or a sulfur atom, and these groups are substituents. May have. R'''represents a hydrogen atom, an alkyl group, a cycloalkyl group, an aryl group or a monovalent heterocyclic group, and these groups may have a substituent. If there are multiple LB1 , they may be the same or different.
X'' represents a bridging group, a hydrogen atom, an alkyl group, a cycloalkyl group, an aryl group or a monovalent heterocyclic group, and these groups may have a substituent. A plurality of X''s may be the same or different. However, at least one of the plurality of X''s present is a cross-linking group. ]
R11A、R12A、R13A、R14A、R21A、R22A、R23A、R31A、R32A及びR33Aは、水素原子、アルキル基、シクロアルキル基、アルコキシ基、シクロアルコキシ基、アリール基、アリールオキシ基、1価の複素環基、置換アミノ基又はハロゲン原子を表し、これらの基は置換基を有していてもよい。
但し、R11A、R12A、R13A、R14A、R21A、R22A、R23A、R31A、R32A及びR33Aのうちの少なくとも一つは、前記式(1-S)で表される基を有する。
R11AとR12A、R12AとR13A、R13AとR14A、R14AとR31A、R31AとR32A、R32AとR33A、R33AとR23A、R23AとR22A、R22AとR21A、及び、R21AとR11Aは、それぞれ結合して、それぞれが結合する炭素原子とともに環を形成していてもよい。]
R11B、R14B、R15B、R16B、R17B、R18B、R21B、R22B、R23B、R31B、R32B及びR33Bは、水素原子、アルキル基、シクロアルキル基、アルコキシ基、シクロアルコキシ基、アリール基、アリールオキシ基、1価の複素環基、置換アミノ基又はハロゲン原子を表し、これらの基は置換基を有していてもよい。
但し、R11B、R14B、R15B、R16B、R17B、R18B、R21B、R22B、R23B、R31B、R32B及びR33Bのうちの少なくとも一つは、前記式(1-S)で表される基を有する。
R11BとR15B、R15BとR16B、R16BとR17B、R17BとR18B、R18BとR14B、R14BとR31B、R31BとR32B、R32BとR33B、R33BとR23B、R23BとR22B、R22BとR21B、及び、R21BとR11Bは、それぞれ結合して、それぞれが結合する炭素原子とともに環を形成していてもよい。] The compound according to any one of claims 1 to 6, wherein the compound represented by the formula (1) is a compound represented by the formula (1-A) or a compound represented by the formula (1-B). Light emitting element.
R 11A , R 12A , R 13A , R 14A , R 21A , R 22A , R 23A , R 31A , R 32A and R 33A are hydrogen atom, alkyl group, cycloalkyl group, alkoxy group, cycloalkoxy group, aryl group. , Aryloxy group, monovalent heterocyclic group, substituted amino group or halogen atom, and these groups may have a substituent.
However, at least one of R 11A , R 12A , R 13A , R 14A , R 21A , R 22A , R 23A , R 31A , R 32A and R 33A is represented by the above formula (1-S). Has a group.
R 11A and R 12A , R 12A and R 13A , R 13A and R 14A , R 14A and R 31A , R 31A and R 32A , R 32A and R 33A , R 33A and R 23A , R 23A and R 22A , R 22A . And R 21A , and R 21A and R 11A may be bonded to each other to form a ring together with the carbon atom to which each is bonded. ]
R 11B , R 14B , R 15B , R 16B , R 17B , R 18B , R 21B , R 22B , R 23B , R 31B , R 32B and R 33B are hydrogen atoms, alkyl groups, cycloalkyl groups, alkoxy groups, It represents a cycloalkoxy group, an aryl group, an aryloxy group, a monovalent heterocyclic group, a substituted amino group or a halogen atom, and these groups may have a substituent.
However, at least one of R 11B , R 14B , R 15B , R 16B , R 17B , R 18B , R 21B , R 22B , R 23B , R 31B , R 32B and R 33B is the above-mentioned formula (1-). It has a group represented by S).
R 11B and R 15B , R 15B and R 16B , R 16B and R 17B , R 17B and R 18B , R 18B and R 14B , R 14B and R 31B , R 31B and R 32B , R 32B and R 33B , R 33B . And R 23B , R 23B and R 22B , R 22B and R 21B , and R 21B and R 11B , respectively, may be bonded to form a ring together with the carbon atom to which each is bonded. ]
第1の有機層が、式(1)で表される低分子化合物とホスト材料とを含有する層であり、
ホスト材料が式(Y)で表される構成単位を含む高分子化合物であり、
第2の有機層が、架橋材料の架橋体を含有する層であり、
第2の有機層を形成するための架橋材料を湿式法により成膜する工程、
成膜した第2の有機層を架橋させる工程、及び
架橋した第2の有機層の上に湿式法により有機層を成膜する工程を包含する、発光素子の製造方法。
環R1A、環R2A及び環R3Aは、それぞれ独立に、芳香族炭化水素環を表し、該環は置換基を有していてもよい。該置換基が複数存在する場合、それらは同一でも異なっていてもよく、互いに結合して、それぞれが結合する炭素原子とともに環を形成していてもよい。
但し、環R1A、環R2A及び環R3Aのうちの少なくとも一つは、式(1-S)で表される基を有する。]
The first organic layer is a layer containing a small molecule compound represented by the formula (1) and a host material .
The host material is a polymer compound containing a structural unit represented by the formula (Y).
The second organic layer is a layer containing a crosslinked body of a crosslinking material.
A step of forming a crosslinked material for forming a second organic layer by a wet method,
A method for manufacturing a light emitting device, comprising a step of cross-linking the formed second organic layer and a step of forming an organic layer on the cross-linked second organic layer by a wet method.
Ring R 1A , ring R 2A , and ring R 3A each independently represent an aromatic hydrocarbon ring, and the ring may have a substituent. When a plurality of the substituents are present, they may be the same or different, or they may be bonded to each other to form a ring together with the carbon atom to which each is bonded.
However, at least one of ring R 1A , ring R 2A and ring R 3A has a group represented by the formula (1-S). ]
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2016065544 | 2016-03-29 | ||
| JP2016065544 | 2016-03-29 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2017183723A JP2017183723A (en) | 2017-10-05 |
| JP7033397B2 true JP7033397B2 (en) | 2022-03-10 |
Family
ID=60007678
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2017060617A Active JP7033397B2 (en) | 2016-03-29 | 2017-03-27 | Light emitting element |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP7033397B2 (en) |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN109627175A (en) * | 2017-10-09 | 2019-04-16 | 北京夏禾科技有限公司 | Cross-linking deuterated charge transport compound, organic electroluminescence device and solution formula comprising the compound |
Citations (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2007100010A1 (en) | 2006-02-28 | 2007-09-07 | Idemitsu Kosan Co., Ltd. | Organic electroluminescent device |
| JP2007291061A (en) | 2006-03-31 | 2007-11-08 | Canon Inc | New compound and organic light-emitting element by using the same |
| JP2007314510A (en) | 2006-04-27 | 2007-12-06 | Canon Inc | Fluoranthene derivative and organic light emitting device having the same |
| WO2008059713A1 (en) | 2006-11-15 | 2008-05-22 | Idemitsu Kosan Co., Ltd. | Fluoranthene compound, organic electroluminescent device using the fluoranthene compound, and organic electroluminescent material-containing solution |
| WO2008102740A1 (en) | 2007-02-19 | 2008-08-28 | Idemitsu Kosan Co., Ltd. | Organic electroluminescent device |
| JP2008280312A (en) | 2007-05-14 | 2008-11-20 | Canon Inc | BENZO[ghi]FLUORANTHENE DERIVATIVE AND ORGANIC LUMINESCENT ELEMENT PRODUCED BY USING THE SAME |
| JP2008297535A (en) | 2006-08-04 | 2008-12-11 | Canon Inc | ORGANIC LUMINESCENT ELEMENT AND BENZO[k]FLUORANTHENE COMPOUND |
| JP2008308485A (en) | 2007-05-16 | 2008-12-25 | Canon Inc | BENZO[a]FLUORANTHENE COMPOUND AND ORGANIC LUMINESCENT ELEMENT USING THE SAME |
| JP2010050227A (en) | 2008-08-20 | 2010-03-04 | Idemitsu Kosan Co Ltd | Organic electroluminescent element |
| JP2011176304A (en) | 2010-01-29 | 2011-09-08 | Sumitomo Chemical Co Ltd | Luminous material, ink composition, thin film, luminous element, and luminous element manufacturing method |
| JP2011195828A (en) | 2010-02-25 | 2011-10-06 | Sumitomo Chemical Co Ltd | Benzofluoranthene-based polymer compound |
| WO2015194448A1 (en) | 2014-06-19 | 2015-12-23 | 住友化学株式会社 | Light emitting element |
Family Cites Families (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP3306735B2 (en) * | 1995-01-19 | 2002-07-24 | 出光興産株式会社 | Organic electroluminescent device and organic thin film |
-
2017
- 2017-03-27 JP JP2017060617A patent/JP7033397B2/en active Active
Patent Citations (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2007100010A1 (en) | 2006-02-28 | 2007-09-07 | Idemitsu Kosan Co., Ltd. | Organic electroluminescent device |
| JP2007291061A (en) | 2006-03-31 | 2007-11-08 | Canon Inc | New compound and organic light-emitting element by using the same |
| JP2007314510A (en) | 2006-04-27 | 2007-12-06 | Canon Inc | Fluoranthene derivative and organic light emitting device having the same |
| JP2008297535A (en) | 2006-08-04 | 2008-12-11 | Canon Inc | ORGANIC LUMINESCENT ELEMENT AND BENZO[k]FLUORANTHENE COMPOUND |
| WO2008059713A1 (en) | 2006-11-15 | 2008-05-22 | Idemitsu Kosan Co., Ltd. | Fluoranthene compound, organic electroluminescent device using the fluoranthene compound, and organic electroluminescent material-containing solution |
| WO2008102740A1 (en) | 2007-02-19 | 2008-08-28 | Idemitsu Kosan Co., Ltd. | Organic electroluminescent device |
| JP2008280312A (en) | 2007-05-14 | 2008-11-20 | Canon Inc | BENZO[ghi]FLUORANTHENE DERIVATIVE AND ORGANIC LUMINESCENT ELEMENT PRODUCED BY USING THE SAME |
| JP2008308485A (en) | 2007-05-16 | 2008-12-25 | Canon Inc | BENZO[a]FLUORANTHENE COMPOUND AND ORGANIC LUMINESCENT ELEMENT USING THE SAME |
| JP2010050227A (en) | 2008-08-20 | 2010-03-04 | Idemitsu Kosan Co Ltd | Organic electroluminescent element |
| JP2011176304A (en) | 2010-01-29 | 2011-09-08 | Sumitomo Chemical Co Ltd | Luminous material, ink composition, thin film, luminous element, and luminous element manufacturing method |
| JP2011195828A (en) | 2010-02-25 | 2011-10-06 | Sumitomo Chemical Co Ltd | Benzofluoranthene-based polymer compound |
| WO2015194448A1 (en) | 2014-06-19 | 2015-12-23 | 住友化学株式会社 | Light emitting element |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2017183723A (en) | 2017-10-05 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6913079B2 (en) | Light emitting element | |
| JP2021120952A (en) | Manufacturing method of composition | |
| KR102468541B1 (en) | light emitting element | |
| JP6566050B2 (en) | Light emitting element | |
| JP7020420B2 (en) | Light emitting element | |
| JP6826930B2 (en) | Light emitting element | |
| JP2018061029A (en) | Light-emitting element | |
| JP6573041B2 (en) | Light emitting element | |
| JP6399243B2 (en) | Light emitting element | |
| JP7033397B2 (en) | Light emitting element | |
| JP6979400B2 (en) | Light emitting element | |
| JP6943241B2 (en) | Light emitting element | |
| JP6982566B2 (en) | Light emitting element | |
| JP6596918B2 (en) | Light emitting element | |
| JP6399248B2 (en) | Light emitting element | |
| JP2022027028A (en) | Metal complex, composition, membrane, and light emitter | |
| JP2019186576A (en) | Light emitting element | |
| JP2020068306A (en) | Light emitting element |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20200226 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20210121 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210302 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210430 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20210914 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20211213 |
|
| C60 | Trial request (containing other claim documents, opposition documents) |
Free format text: JAPANESE INTERMEDIATE CODE: C60 Effective date: 20211213 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20211221 |
|
| C21 | Notice of transfer of a case for reconsideration by examiners before appeal proceedings |
Free format text: JAPANESE INTERMEDIATE CODE: C21 Effective date: 20220105 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20220215 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20220228 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7033397 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |