JP6870468B2 - Peptide analysis method - Google Patents
Peptide analysis method Download PDFInfo
- Publication number
- JP6870468B2 JP6870468B2 JP2017096857A JP2017096857A JP6870468B2 JP 6870468 B2 JP6870468 B2 JP 6870468B2 JP 2017096857 A JP2017096857 A JP 2017096857A JP 2017096857 A JP2017096857 A JP 2017096857A JP 6870468 B2 JP6870468 B2 JP 6870468B2
- Authority
- JP
- Japan
- Prior art keywords
- peptide
- antibody
- epitope
- terminal
- fragment
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Landscapes
- Other Investigation Or Analysis Of Materials By Electrical Means (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Peptides Or Proteins (AREA)
Description
本発明は、ペプチドの分析方法に関する。より詳細には、本発明は、生体中でのプロセシングにより複数の異なる位置で切断されるペプチドを、質量分析により同定および/または定量する方法に関する。 The present invention relates to a method for analyzing peptides. More specifically, the present invention relates to a method for identifying and / or quantifying peptides that are cleaved at a plurality of different positions by processing in vivo by mass spectrometry.
アミロイドβ(Aβ)は約40アミノ酸残基からなるペプチドであり、アルツハイマー病の発症に深く関わっていると考えられている。770アミノ酸残基からなるアミロイド前駆タンパク質(APP:配列番号1)が、βセクレターゼにより、Met671とAsp672の間で切断されてC末端側のペプチド(APP672−770)が切り出され、このペプチドがγセクレターゼにより切断されてAβが生成することが知られている。 Amyloid β (Aβ) is a peptide consisting of about 40 amino acid residues and is thought to be deeply involved in the development of Alzheimer's disease. Amyloid precursor protein (APP: SEQ ID NO: 1) consisting of 770 amino acid residues is cleaved between Met671 and Asp672 by β-secretase to excise the C-terminal peptide (APP672-770), and this peptide is γ-secretase. It is known that Aβ is produced by cleavage.
Aβはアルツハイマー病のバイオマーカーとして注目されており、質量分析により生体試料中に含まれるAβ量を定量する試みがいくつか報告されている。例えば、特許文献1では、Aβに特異的に結合する抗Aβ抗体(AβのPhe4−Gly9をエピトープとする6E10、およびAβのLeu17−Val24をエピトープとする4G8)を用いた免疫沈降(IP)と、マトリクス支援レーザー脱離イオン化質量分析(MALDI−MS)とを組み合わせた分析方法により、微量のヒト血漿から22種類のAPP切断ペプチドを検出した例が報告されている。特許文献1では、APPのプロセッシングにより生成するペプチドとして、APP669−711(配列番号5)等の、βセレクターゼによる切断部位よりもN末端側で切断されたペプチドが検出されたことが報告されている。 Aβ is attracting attention as a biomarker for Alzheimer's disease, and several attempts to quantify the amount of Aβ contained in a biological sample by mass spectrometry have been reported. For example, in Patent Document 1, immunoprecipitation (IP) using an anti-Aβ antibody that specifically binds to Aβ (6E10 having Ph4-Gly9 of Aβ as an epitope and 4G8 having Leu17-Val24 of Aβ as an epitope) is used. , Matrix-assisted laser desorption / ionization mass spectrometry (MALDI-MS) has been reported to detect 22 types of APP-cleaving peptides in trace amounts of human plasma. In Patent Document 1, as a peptide generated by APP of processing, APP669- 711 (SEQ ID NO: 5) or the like, it is reported that peptides truncated at the N-terminal side of the cleavage site β -secretase is detected There is.
非特許文献1では、血漿中の全タンパク質をトリプシンにより消化した試料を多次元LC/MS/MSにより分析し、Aβ17−28をサロゲートペプチドとして選択し、多重反応モニタリング(MRM;選択反応モニタリング(SRM)とも称される)により、総Aβ量を定量したことが報告されている。 In Non-Patent Document 1, a sample obtained by digesting all proteins in plasma with trypsin is analyzed by multidimensional LC / MS / MS, Aβ17-28 is selected as a surrogate peptide, and multiple reaction monitoring (MRM; selective reaction monitoring (SRM)) is performed. ), It has been reported that the total amount of Aβ was quantified.
MALDI−MSではマススペクトルにおけるピーク強度の相対比から試料中の特定のペプチドの濃度を定量できるが、特定のペプチドの絶対的含有量の定量に適しているとは言い難い。一方、MRMは、特定のプリカーサイオンとプロダクトイオンの組み合わせを選択してMS/MSにより検出するため、多数の夾雑物の中から高い選択性で高感度に微量サンプルを定量できるとの利点を有する。また、検量線法や内部標準法により、MALDI−MSに比べてより精度の高い定量分析が可能である。 Although MALDI-MS can quantify the concentration of a specific peptide in a sample from the relative ratio of peak intensities in the mass spectrum, it cannot be said that it is suitable for quantifying the absolute content of a specific peptide. On the other hand, since MRM selects a specific combination of precursor ion and product ion and detects it by MS / MS, it has an advantage that a small amount of sample can be quantified with high selectivity and high sensitivity from a large number of impurities. .. In addition, the calibration curve method and the internal standard method enable more accurate quantitative analysis than MALDI-MS.
しかしながら、非特許文献1に記載の手法では、Aβの中間配列をサロゲートペプチドとして選択しているため、C末端の切断部位の異なるAβ(例えば、Aβ1−38(配列番号2)、Aβ1−40(配列番号3)、Aβ1−42(配列番号4)や、N末端側がβセクレターゼ切断部位(APPのMet671とAsp672の間)以外で切断されたAPP切断ペプチド(例えば、前述のAPP669−711)を個別に定量することはできない。 However, in the method described in Non-Patent Document 1, since the intermediate sequence of Aβ is selected as the surrogate peptide, Aβ having a different C-terminal cleavage site (for example, Aβ1-38 (SEQ ID NO: 2), Aβ1-40 (for example) SEQ ID NO: 3), beta] 1-42 (SEQ ID NO: 4) and, N-terminal side of the cleaved APP cleavage peptides other than β-secretase cleavage site (between Met671 and Asp672 of APP) (e.g., the aforementioned APP669- 711) individual Cannot be quantified.
前駆体タンパク質の生体内でのプロセシングにより、異なる切断部位で切断されて複数種のペプチドを生成する例としては、APPから生成されるAβ以外に、プログラニュリンから生成されるグラニュリン類、プレプロPTHから生成される副甲状線ホルモン(PTH)、プレプロBNPから生成される脳性ナトリウム利尿ペプチド(BNP)、プロオピオメラノコルチンから産生される副腎皮質刺激ホルモン(ACTH)、α−メラノサイト刺激ホルモン(α−MSH)、β−MSHおよびγ−MSH等が挙げられる。 Examples of producing multiple types of peptides by cleaving precursor proteins at different cleavage sites by in vivo processing include granulins produced from progranulin and preproPTH, in addition to Aβ produced from APP. Parathyroid hormone (PTH) produced from, brain natriuretic peptide (BNP) produced from prepro BNP, adrenocorticotropic hormone (ACTH) produced from proopiomelanocortin, α-melanocyte stimulating hormone (α-MSH) ), Β-MSH, γ-MSH and the like.
病理診断等において、生体内での前駆体タンパク質のプロセシングにより異なる切断部位で切断されて生じる複数種のペプチドを個別に同定・定量可能な分析手法が求められている。 In pathological diagnosis and the like, there is a demand for an analytical method capable of individually identifying and quantifying a plurality of types of peptides produced by cleavage at different cleavage sites by processing precursor protein in vivo.
本発明の分析方法では、APP切断ペプチド(例えばAβ)等所定のペプチドのN末端およびC末端のいずれか一方と特異的に結合する抗体を用いた免疫沈降法(IP)により、ペプチドを分離する。IPにより分離されたペプチドをプロテアーゼにより消化してペプチド断片を調製し、ペプチド断片のうち、抗体と結合する末端と反対側の末端のペプチド断片を質量分析により検出する。ペプチド断片の質量分析は、多重反応モニタリング(MRM)により行ってもよい。 In the analytical method of the present invention, peptides are separated by an immunoprecipitation method (IP) using an antibody that specifically binds to either the N-terminal or the C-terminal of a predetermined peptide such as an APP-cleaving peptide (for example, Aβ). .. The peptide separated by IP is digested with a protease to prepare a peptide fragment, and among the peptide fragments, the peptide fragment at the end opposite to the end that binds to the antibody is detected by mass spectrometry. Mass spectrometry of peptide fragments may be performed by multiple reaction monitoring (MRM).
本発明の方法では、ペプチドのN末端およびC末端のいずれか一方を抗体を用いたIPにより識別し、他方を質量分析により識別するため、切断部位の異なるペプチドを、個別に検出・定量することが可能である。 In the method of the present invention, one of the N-terminal and the C-terminal of the peptide is identified by IP using an antibody, and the other is identified by mass spectrometry. Therefore, peptides having different cleavage sites are individually detected and quantified. Is possible.
本発明の分析方法では、ペプチドのN末端およびC末端のうちのいずれか一方を抗体により識別して免疫沈降(IP)により分離し、IPにより分離されたペプチドをプロテアーゼ消化してペプチド断片を生成した後、抗体識別部位(エピトープ)と反対側の末端を含むペプチド断片を質量分析により分析する。この方法では、ペプチドの一方の末端が抗体により識別され、ペプチドの他方の末端が質量分析により識別されるため、生体内の複数箇所で切断されて生成される複数種のペプチドを、アミノ酸配列ごとに検出および定量できる。 In the analysis method of the present invention, either one of the N-terminal and the C-terminal of the peptide is identified by an antibody and separated by immunoprecipitation (IP), and the peptide separated by IP is protease-digested to produce a peptide fragment. After that, the peptide fragment containing the terminal opposite to the antibody discrimination site (epitope) is analyzed by mass spectrometry. In this method, one end of the peptide is identified by the antibody and the other end of the peptide is identified by mass spectrometry. Therefore, a plurality of types of peptides produced by cleaving at multiple points in the living body are separated by amino acid sequence. Can be detected and quantified.
分析対象のペプチドは特に限定されないが、本発明の方法は、生体内でのプロセシングにより異なる部位で切断されて生成される複数種のペプチドの分析に適している。複数種のペプチドを生成する前駆体タンパク質としては、アミロイド前駆タンパク質(APP)、プログラニュリン、プレプロPTH、プレプロBNP、プロオピオメラノコルチン等が挙げられる。以下では、APPのプロセシングにより生成するペプチド(APP切断型ペプチド)の分析を中心に説明する。 The peptide to be analyzed is not particularly limited, but the method of the present invention is suitable for analysis of a plurality of types of peptides produced by being cleaved at different sites by processing in vivo. Examples of precursor proteins that produce a plurality of types of peptides include amyloid precursor protein (APP), progranulin, prepro PTH, prepro BNP, and proopiomelanocortin. In the following, the analysis of peptides produced by the processing of APP (APP cleavage type peptides) will be mainly described.
[免疫沈降によるペプチドの分離]
まず、免疫沈降法により、生体試料から所定のペプチドを分離回収する。生体試料には血液試料、脳脊髄液(CSF)尿、体分泌液、唾液、および痰等の体液、ならびに糞便等が含まれる。血液試料には、全血、血漿および血清等が含まれる。血液試料は、生体から採取された全血を、適宜処理することにより調製すればよい。例えば、APP切断型ペプチドが対象である場合、アルツハイマー病、あるいは他の疾患のスクリーニングのための生体試料が分析対象試料となる。
[Separation of peptides by immunoprecipitation]
First, a predetermined peptide is separated and recovered from a biological sample by an immunoprecipitation method. Biological samples include blood samples, cerebrospinal fluid (CSF) urine, cerebrospinal fluid, saliva, body fluids such as sputum, feces and the like. Blood samples include whole blood, plasma, serum and the like. The blood sample may be prepared by appropriately treating whole blood collected from a living body. For example, when an APP-cleaving peptide is the target, a biological sample for screening for Alzheimer's disease or other diseases is the target sample for analysis.
生体試料を抗体と接触させることにより、生体試料中の所定のペプチドが特異的に抗体と結合する。抗体としては、検出対象ペプチドを認識して特異的に結合するものが用いられる。APP切断型ペプチドを認識可能な抗原結合部位を持つ抗体としては、各種の抗アミロイドβ抗体が挙げられる。 By contacting the biological sample with the antibody, a predetermined peptide in the biological sample specifically binds to the antibody. As the antibody, an antibody that recognizes the peptide to be detected and specifically binds to the peptide is used. Examples of the antibody having an antigen-binding site that can recognize the APP-cleaving peptide include various anti-amyloid β antibodies.
本発明においては、APP切断型ペプチドのN末端側またはC末端側のアミノ酸配列をエピトープとする抗体が用いられる。抗体はモノクローナルでもポリクローナルでもよい。抗体は抗原結合部位を含んでいればよく、F(ab’)2、F(ab’)、F(ab)、Fd、Fv等の抗体断片(ドメイン)でもよい。結合特異性が高いことから、F(ab’)、F(ab)、Fv等のFcドメインを含まない抗体断片が好ましい。 In the present invention, an antibody having an amino acid sequence on the N-terminal side or C-terminal side of the APP-cleaving peptide as an epitope is used. The antibody may be monoclonal or polyclonal. The antibody may contain an antigen-binding site, and may be an antibody fragment (domain) such as F (ab') 2 , F (ab'), F (ab), Fd, or Fv. Due to its high binding specificity, antibody fragments that do not contain Fc domains such as F (ab'), F (ab), and Fv are preferable.
AβのN末端側をエピトープとする抗体としては、3D6(エピトープ:Aβ1−5)、pAb-EL16(エピトープ:Aβ1−7)、2H4(エピトープ:Aβ1−8)、1E11(エピトープ:Aβ1−8)、20.1(エピトープ:Aβ1−10)、pAb1-42(エピトープ:Aβ1−11)、NAB228(エピトープ:Aβ1−11)、ウサギ抗Aβポリクローナル抗体(Abcam)(エピトープ:Aβ1−14)、AB10(エピトープ:Aβ1−16)、82E1(エピトープ:Aβ1−16)、DE2(エピトープ:Aβ1−16)、DE2B4(エピトープ:Aβ1−17)、ウサギ抗ヒトAβポリクローナル抗体(ABR)(エピトープ:AβのN末端)等が知られている。 Antibodies with the N-terminal side of Aβ as an epitope include 3D6 (epitope: Aβ1-5), pAb-EL16 (epitope: Aβ1-7), 2H4 (epitope: Aβ1-8), 1E11 (epitope: Aβ1-8). , 20.1 (Epitope: Aβ1-10), pAb1-42 (Epitope: Aβ1-11), NAB228 (Epitope: Aβ1-11), Rabbit anti-Aβ polyclonal antibody (Abcam) (Epitope: Aβ1-14), AB10 (Epitope: Aβ1-16), 82E1 (Epitope: Aβ1-16), DE2 (Epitope: Aβ1-16), DE2B4 (Epitope: Aβ1-17), Rabbit anti-human Aβ polyclonal antibody (ABR) (Epitope: N-terminal of Aβ), etc. It has been known.
AβのC末端側をエピトープとする抗体としては、G2-10(エピトープ:Aβ31−40)、1A10(エピトープ:Aβ35−40)、EP1876Y(エピトープ:Aβx−40)、G2-11(エピトープ:Aβ33−42)、16C11(エピトープ:Aβ33−42)、21F12(エピトープ:Aβ34−42)、D-17ヤギ抗Aβ抗体(エピトープ:Aβ1−42のC末端)、BC05(エピトープ:Aβ1−42のC末端)等が知られている。 Antibodies having the C-terminal side of Aβ as an epitope include G2-10 (epitope: Aβ31-40), 1A10 (epitope: Aβ35-40), EP1876Y (epitope: Aβx-40), and G2-11 (epitope: Aβ33-). 42), 16C11 (Epitope: Aβ33-42), 21F12 (Epitope: Aβ34-42), D-17 goat anti-Aβ antibody (Epitope: C-terminal of Aβ1-42), BC05 (Epitope: C-terminal of Aβ1-42) Etc. are known.
ペプチドの捕集効率向上等を目的として、これらの抗体は2種以上を組み合わせて用いてもよい。また、Aβの中間配列をエピトープとする抗体を併用してもよい。Aβの中間配列をエピトープとする抗体としては、10D5(エピトープ:Aβ3−7)、6E10(エピトープ:Aβ4−9),WO-2(エピトープ:Aβ4−10)、1A3(エピトープ:Aβ5−9)、pAb-EL21(エピトープ:Aβ5−11)、310-0(エピトープ:Aβ5−16),ニワトリ抗ヒトAβポリクローナル抗体 (Abcam)(エピトープ:Aβ12−28またはAβ25−35)、12C3(エピトープ:Aβ10−16)、16C9(エピトープ:Aβ10−16)、19B8(エピトープ:Aβ9−10)、pAb-EL26(エピトープ:Aβ11−26)、BAM90.1(エピトープ:Aβ13−28)、ウサギ抗Aβポリクローナル抗体 (MBL)(エピトープ:Aβ15−30)、22D12(エピトープ:Aβ18−21)、266(エピトープ:Aβ16−24)、pAb-EL17(エピトープ:Aβ15−24)、4G8(エピトープ:Aβ17−24)、ウサギ抗Aβポリクローナル抗体(Abcam)(エピトープ:Aβ22−35)等が知られている。 For the purpose of improving the collection efficiency of peptides, these antibodies may be used in combination of two or more. Further, an antibody having an intermediate sequence of Aβ as an epitope may be used in combination. Antibodies using the intermediate sequence of Aβ as an epitope include 10D5 (epitope: Aβ3-7), 6E10 (epitope: Aβ4-9), WO-2 (epitope: Aβ4-10), 1A3 (epitope: Aβ5-9), pAb-EL21 (Epitope: Aβ5-11), 310-0 (Epitope: Aβ5-16), chicken anti-human Aβ polyclonal antibody (Abcam) (Epitope: Aβ12-28 or Aβ25-35), 12C3 (Epitope: Aβ10-16) ), 16C9 (Epitope: Aβ10-16), 19B8 (Epitope: Aβ9-10), pAb-EL26 (Epitope: Aβ11-26), BAM90.1 (Epitope: Aβ13-28), Rabbit anti-Aβ polyclonal antibody (MBL) (Epitope: Aβ15-30), 22D12 (Epitope: Aβ18-21), 266 (Epitope: Aβ16-24), pAb-EL17 (Epitope: Aβ15-24), 4G8 (Epitope: Aβ17-24), Rabbit anti-Aβ polyclonal Antibodies (Abcam) (epitope: Aβ22-35) and the like are known.
抗体は任意の担体に固定されていてもよい。抗体の固定化に用いられる担体としては、アガロース、セファロース、デキストラン、シリカゲル、ポリアクリルアミド、ポリスチレン、ポリエチレン、ポリプロピレン、ポリエステル、ポリアクリロニトリル、(メタ)アクリル酸系ポリマー、フッ素樹脂、金属錯体樹脂、ガラス、金属等が挙げられる。抗体は、スペーサを介して担体に結合していてもよい。 The antibody may be immobilized on any carrier. Carriers used for antibody immobilization include agarose, sepharose, dextran, silica gel, polyacrylamide, polystyrene, polyethylene, polypropylene, polyester, polyacrylonitrile, (meth) acrylic acid-based polymers, fluororesins, metal complex resins, and glass. Examples include metal. The antibody may be bound to the carrier via a spacer.
上記の抗体を用いたIPは、公知の方法により実施できる。例えば、担体に固定された抗体を用いる場合は、担体表面の抗体に対象のペプチドを結合させ、抗体に結合していない成分を洗浄除去後に、抗体からペプチドを解離させて溶出液を回収すればよい。 IP using the above antibody can be carried out by a known method. For example, when an antibody immobilized on a carrier is used, the target peptide may be bound to the antibody on the surface of the carrier, the components not bound to the antibody may be washed and removed, and then the peptide may be dissociated from the antibody to collect the eluate. Good.
抗体と生体試料中のペプチドとを結合させる前に、生体試料の前処理を行ってもよい。例えば、生体試料を、プロテインGやプロテインA等が結合している担体と接触させ、血液等に含まれるIgGやIgM等の抗体を除去することにより、Aβ等の分析対象ペプチドとの非特異吸着を抑制し、上記のAβ特異結合抗体と分析対象ペプチドとの結合の特異性を高め、分析の定量性を向上できる。 The biological sample may be pretreated before binding the antibody to the peptide in the biological sample. For example, by contacting a biological sample with a carrier to which protein G, protein A, etc. are bound to remove antibodies such as IgG and IgM contained in blood, etc., non-specific adsorption with peptides to be analyzed such as Aβ, etc. Can be suppressed, the specificity of binding between the above-mentioned Aβ-specific binding antibody and the peptide to be analyzed can be enhanced, and the quantitativeness of analysis can be improved.
抗体とペプチドとを結合させるための溶液としては、非特異的吸着を抑制するために、界面活性剤を含むpH6.5〜8.5程度の緩衝液が好ましく用いられる。界面活性剤としては、抗体等のタンパク質の変性を起こしにくく、洗浄による除去が容易であるものが好ましく、マルトースを親水性部分に持つ中性界面活性剤、トレハロースを親水性部分に持つ中性界面活性剤、グルコースを親水性部分に持つ中性界面活性剤等が挙げられる。緩衝液組成としては、Tris緩衝液、リン酸緩衝液、HEPES緩衝液等が挙げられる。 As a solution for binding the antibody and the peptide, a buffer solution having a pH of about 6.5 to 8.5 containing a surfactant is preferably used in order to suppress non-specific adsorption. As the surfactant, those that are less likely to cause denaturation of proteins such as antibodies and are easily removed by washing are preferable, and a neutral surfactant having maltose in the hydrophilic part and a neutral surfactant having trehalose in the hydrophilic part are preferable. Examples thereof include an activator and a neutral surfactant having glucose in the hydrophilic portion. Examples of the buffer solution include Tris buffer solution, phosphate buffer solution, HEPES buffer solution and the like.
抗体とペプチドとを結合させた後、抗体に結合していない夾雑成分の除去が行われる。担体に固定された抗体を用いる場合は、洗浄溶液を用いて洗浄することにより夾雑物を除去すればよい。例えば、界面活性剤を含む中性緩衝液を用いて洗浄を行った後、アンモニウムイオンを含む水溶液を用いて洗浄を行うことが好ましい。 After binding the antibody and the peptide, the contaminants that are not bound to the antibody are removed. When an antibody immobilized on a carrier is used, impurities may be removed by washing with a washing solution. For example, it is preferable to perform cleaning with a neutral buffer solution containing a surfactant, and then perform cleaning with an aqueous solution containing ammonium ions.
洗浄後に、抗体からペプチドを解離させることによりペプチドが分離回収される。例えば、抗体が固定された担体表面を溶出液に接触させることにより、抗体からペプチドが解離し、解離したペプチドが溶出する。溶出液としては、一般にpH1〜4程度の酸性水溶液が用いられる。溶出液は、アセトニトリル、アセトン、メタノール、エタノール、イソプロパノール、クロロホルム等の有機溶媒を含んでいてもよい。 After washing, the peptide is separated and recovered by dissociating the peptide from the antibody. For example, by contacting the surface of the carrier on which the antibody is immobilized with the eluate, the peptide is dissociated from the antibody, and the dissociated peptide is eluted. As the eluate, an acidic aqueous solution having a pH of about 1 to 4 is generally used. The eluate may contain an organic solvent such as acetonitrile, acetone, methanol, ethanol, isopropanol, and chloroform.
[プロテアーゼ処理および質量分析]
免疫沈降により分離されたペプチドは、プロテアーゼ消化により断片化される。一般には、プロテアーゼ処理に先だって、ペプチドの変性処理およびアルキル化処理が行われる。変性処理およびアルキル化処理の条件は特に限定されず、公知の条件が適宜に採用される。
[Protease treatment and mass spectrometry]
Peptides separated by immunoprecipitation are fragmented by protease digestion. Generally, a peptide denaturation treatment and an alkylation treatment are performed prior to the protease treatment. The conditions for the modification treatment and the alkylation treatment are not particularly limited, and known conditions are appropriately adopted.
プロテアーゼ処理の条件は特に限定されず、用いられるプロテアーゼに応じた適宜のプロトコールが採用される。例えば、プロテアーゼの至適pH近傍に調整された緩衝溶液中で、通常37℃程度の温度で、4時間〜20時間程度インキュベートすることが好ましい。 The conditions for protease treatment are not particularly limited, and an appropriate protocol according to the protease used is adopted. For example, it is preferable to incubate for about 4 to 20 hours at a temperature of about 37 ° C. in a buffer solution adjusted to the optimum pH of the protease.
プロテアーゼは、アミノ酸配列を認識し、特定の配列の特定の結合を選択的に切断する。プロテアーゼとしては、トリプシン(切断位置:塩基性アミノ酸残基(ArgおよびLys)のC末端側)、Lys‐C(切断位置:LysのC末端側)、アルギニンエンドペプチダーゼ(切断位置:ArgのC末端側)、キモトリプシン(切断位置:芳香族アミノ酸(Phe、TyrおよびTrp)のC末端側)、ペプシン(切断位置:芳香族(Phe、TyrおよびTrp)のN末端側)、Asn−C(切断位置:AsnのC末端側)等が用いられる。 Proteases recognize amino acid sequences and selectively cleave specific bonds of specific sequences. The proteases include trypsin (cleaved position: C-terminal side of basic amino acid residues (Arg and Lys)), Lys-C (cleaved position: C-terminal side of Lys), and arginine endopeptidase (cleaved position: C-terminal side of Arg). Side), chymotrypsin (cleaved position: C-terminal side of aromatic amino acids (Phe, Tyr and Trp)), pepsin (cleaved position: N-terminal side of aromatic (Phe, Tyr and Trp)), Asn-C (cleaved position) : C-terminal side of Asn) and the like are used.
分析対象のペプチドに特異的なアミノ酸配列を有する断片が得られるように、プロテアーゼを選択すればよい。プロテアーゼは2種以上を組み合わせて用いてもよい。MRMによりペプチド断片の検出が行われる場合は、特異性を担保する観点から、6以上のアミノ酸残基からなるペプチド断片を検出対象のプリカーサイオンとすることが好ましい。ペプチド断片の長さの上限は特に限定されないが、イオン化が容易であることから、アミノ酸残基数は30以下が好ましい。 The protease may be selected so that a fragment having an amino acid sequence specific to the peptide to be analyzed can be obtained. Proteases may be used in combination of two or more. When the peptide fragment is detected by MRM, it is preferable to use a peptide fragment consisting of 6 or more amino acid residues as a precursor ion to be detected from the viewpoint of ensuring specificity. The upper limit of the length of the peptide fragment is not particularly limited, but the number of amino acid residues is preferably 30 or less because ionization is easy.
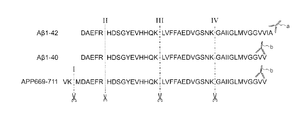
図1は、3種類のAPP切断型ペプチドのC末端側と特異的に結合する抗体を用いた免疫沈降によるペプチドの捕捉、およびプロテアーゼによるペプチドの切断位置を示す模式図である。図中の切断位置I〜IVはトリプシンによる切断位置(Lys残基およびArg残基のC末端側)である。図中の破線で示された切断位置IIはArg残基のC末端側であり、トリプシンにより切断されるがLys−Cでは切断されない。 FIG. 1 is a schematic view showing the capture of a peptide by immunoprecipitation using an antibody that specifically binds to the C-terminal side of three types of APP-cleaving peptides, and the cleavage position of the peptide by a protease. The cleavage positions I to IV in the figure are the cleavage positions by trypsin (the C-terminal side of Lys residue and Arg residue). The cleavage position II shown by the broken line in the figure is on the C-terminal side of the Arg residue, and is cleaved by trypsin but not by Lys-C.
Aβ1−42のC末端をエピトープとする抗体aによりIPを行った場合、図1に示す3種のペプチドの中で、C末端にAla42を有するAβ1−42のみが捕捉される。抗体aを用いたIPにより捕捉されたペプチドをトリプシンにより消化した後、切断部位IIのN末端側の配列「DAEFR」を有するペプチド断片を質量分析により検出することにより、Aβ1−42の存在を確認できる。Aβ1−40のトリプシン消化によっても配列「DAEFR」を有するペプチド断片が生成するが、抗体aを用いたIPではAβ40は捕捉されないため、Aβ1−42に由来するペプチド断片のみが検出される。 When IP is performed with the antibody a having the C-terminal of Aβ1-42 as an epitope, only Aβ1-42 having Ala42 at the C-terminal is captured among the three peptides shown in FIG. After digesting the peptide captured by IP using antibody a with trypsin, the presence of Aβ1-42 was confirmed by detecting the peptide fragment having the N-terminal sequence "DAEFR" of cleavage site II by mass spectrometry. it can. Trypsin digestion of Aβ1-40 also produces a peptide fragment having the sequence "DAEFR", but since Aβ40 is not captured by IP using antibody a, only the peptide fragment derived from Aβ1-42 is detected.
抗体aを用いたIPにより捕捉されたペプチドをLys−Cにより消化した場合は、切断部位IIIのN末端側の配列「DAEFRHDSGYEVHHQK」を有するペプチド断片が質量分析により検出されれば、Aβ1−42の存在を確認できる。トリプシンを用いた場合は、Aβ1−42から生成するN末端側のペプチド断片のアミノ酸残基数が5と少ないのに対して、Lys−Cを用いた場合は、16アミノ酸残基のペプチド断片が得られるため、MRMによるペプチド断片の検出および定量に適している。 When a peptide captured by IP using antibody a is digested by Lys-C, if a peptide fragment having the N-terminal sequence "DAEFRHDSGYEVHHQK" of cleavage site III is detected by mass spectrometry, Aβ1-42 The existence can be confirmed. When trypsin was used, the number of amino acid residues in the peptide fragment on the N-terminal side generated from Aβ1-42 was as small as 5, whereas when Lys-C was used, the peptide fragment with 16 amino acid residues was present. Since it is obtained, it is suitable for detection and quantification of peptide fragments by MRM.
Aβ1−40のC末端をエピトープとする抗体bによりIPを行った場合、図1に示す3種のペプチドの中で、Aβ1−40およびAPP669−711の2種が捕捉される。抗体aを用いたIPによりAβ1−42を捕捉し、抗体aに捕捉されずに流出した溶液(洗浄液を含む)に抗体bを用いたIPを実施して、Aβ1−40およびAPP669−711を捕捉してもよい。 When performing the IP by antibody b to epitope C-terminus of [beta] 1-40, in the three peptides shown in FIG. 1, the two [beta] 1-40 and APP 669 -711 is captured. Captures Aβ1-42 by IP using antibody a, the outflow solution without being trapped in the antibody a (including wash) was conducted IP using an antibody b, and Aβ1-40 and APP 669 -711 You may capture it.
抗体bを用いたIPにより捕捉されたペプチドをLys−Cにより消化した試料からは、Aβ1−40の切断位置IIIのN末端側の配列「DAEFRHDSGYEVHHQK」を有するペプチド、およびAPP669−711の切断位置IIIのN末端側の配列(切断位置Iと切断位置IIIの間の配列)「MDAEFRHDSGYEVHHQK」を有するペプチドが生成する。これらのペプチドは分子量が異なるため、質量分析により判別可能である。 From digested sample by IP captured peptide by Lys-C using the antibody b, peptides having the sequence "DAEFRHDSGYEVHHQK" N-terminal side of the cutting position III of the [beta] 1-40, and the cutting position of the APP 669 -711 A peptide having the N-terminal sequence of III (sequence between cleavage positions I and III) " M DAEFRHDSGYEVHHQK" is produced. Since these peptides have different molecular weights, they can be identified by mass spectrometry.
抗体bを用いたIPのみでは、C末端の配列が共通するAβ1−40とAPP669−711とを識別できないが、C末端側を抗体識別部位とするとするIPによりペプチドを分離し、IPで捕捉回収されたペプチドのN末端側のプロテアーゼ消化断片をトランジションとして選択することにより、N末端側の配列の相違(生体内でのAPPからの切断部位の相違)が識別可能となる。 IP alone with antibodies b, but the sequence of the C-terminal can not identify the to Aβ1-40 and APP 669 -711 common to separate the peptides by IP to the C-terminal side and the antibody recognition site, captured by IP By selecting the N-terminal protease digestion fragment of the recovered peptide as the transition, the difference in the N-terminal sequence (difference in the cleavage site from APP in vivo) can be identified.
本発明においては、上述のようにペプチドのC末端またはN末端のいずれか一方に特異的に結合する抗体を用いたIPによりペプチドを分離した後、抗体結合部位と反対側の末端のペプチド断片の分析が行われる。例えば、AβのC末端側に結合する抗体を用いたIPにより分離したペプチドは、プロテアーゼ処理後に、N末端側のプロテアーゼ消化断片が質量分析による検出対象として選択される。AβのN末端側に結合する抗体を用いたIPにより捕捉されたペプチドは、C末端側のプロテアーゼ消化断片の質量分析が行われる。図1に示す3種のペプチドは、C末端側のIPによりAβ1−42およびAβ1−40とAPP669−711とが分離され、N末端側のペプチド断片の質量分析により、Aβ1−42とAβ1−40とを識別できる。 In the present invention, after separating the peptide by IP using an antibody that specifically binds to either the C-terminal or the N-terminal of the peptide as described above, the peptide fragment at the terminal opposite to the antibody binding site is used. The analysis is performed. For example, in the peptide separated by IP using an antibody that binds to the C-terminal side of Aβ, the protease digested fragment on the N-terminal side is selected as a detection target by mass spectrometry after protease treatment. Peptides captured by IP using an antibody that binds to the N-terminal side of Aβ are subjected to mass spectrometry of the protease digested fragment on the C-terminal side. Three peptides shown in Figure 1 is IP by separation and beta] 1-42 and Aβ1-40 and APP 669 -711 C-terminal side, by mass spectrometry of the peptide fragments of the N-terminal side, beta] 1-42 and Aβ1- It can be distinguished from 40.
IP後に行われるプロテアーゼ消化では、検出対象となるペプチド断片のアミノ酸残基数が前述の範囲となるようにプロテアーゼを選択することが好ましい。AβのC末端側をIPにより識別し、N末端側を質量分析により識別する場合において、N末端側のトリプシン消化断片のアミノ酸残基数は5であり、Lys−C消化断片のアミノ酸残基数は16である。MRMによる分析に適した長さのN末端側ペプチド断片を得るためには、プロテアーゼとしてLys−Cが適しているといえる。 In the protease digestion performed after IP, it is preferable to select the protease so that the number of amino acid residues of the peptide fragment to be detected is within the above range. When the C-terminal side of Aβ is identified by IP and the N-terminal side is identified by mass analysis, the number of amino acid residues in the trypsin digested fragment on the N-terminal side is 5, and the number of amino acid residues in the Lys-C digested fragment. Is 16. It can be said that Lys-C is suitable as a protease in order to obtain an N-terminal peptide fragment having a length suitable for analysis by MRM.
プロテアーゼ処理後の試料は、必要に応じて脱塩、可溶化、濃縮、乾燥等の処理が行われてもよい。例えば、脱塩および濃縮は、固相抽出用のスピンカラム等を用いて行えばよい。 The sample after the protease treatment may be subjected to treatments such as desalting, solubilization, concentration and drying, if necessary. For example, desalting and concentration may be performed using a spin column for solid-phase extraction or the like.
質量分析に装置により、プロテアーゼ処理により得られたペプチド断片の分析が行われる。ペプチド断片の分析は、各種の質量分析法により実施できるが、選択性および感度が高いことから、多重反応モニタリング(MRM)による分析が好ましい。MRMでは、試料を質量分析装置に導入する前に、液体クロマトグラフィー(LC)による分離が行われる。 An apparatus is used for mass spectrometry to analyze peptide fragments obtained by protease treatment. Peptide fragment analysis can be performed by various mass spectrometric methods, but analysis by multiple reaction monitoring (MRM) is preferred due to its high selectivity and sensitivity. In MRM, separation by liquid chromatography (LC) is performed before the sample is introduced into the mass spectrometer.
質量分析装置に導入された試料は、イオン化プローブでイオン化される。前段の質量分析により、検出対象のペプチド断片由来のイオン(プリカーサイオン)が選択される。プリカーサイオンは、CID等により複数種のイオン(プロダクトイオン)に開裂し、後段の質量分析により、m/zに基づいて特定のプロダクトイオンが分離され、検出器で検出される。MRMでは、分析対象となるペプチドから生成するプリカーサイオンのm/zと、各プリカーサイオンについて、後段の質量分析で選別されるプロダクトイオンのm/zの組み合わせを予め定めておく。 The sample introduced into the mass spectrometer is ionized by an ionization probe. By mass spectrometry in the previous stage, ions (precursor ions) derived from the peptide fragment to be detected are selected. The precursor ion is cleaved into a plurality of types of ions (product ions) by CID or the like, and a specific product ion is separated based on m / z by mass spectrometry in the subsequent stage and detected by a detector. In MRM, a combination of m / z of precursor ions generated from the peptide to be analyzed and m / z of product ions selected by mass spectrometry in the subsequent stage is predetermined for each precursor ion.
一例として、Aβ1−42のLys−C消化物のN末端側の配列「DAEFRHDSGYEVHHQK」(配列番号:6)を有するペプチド(Aβ1−40のLys−C消化物も同様)のMRMトランジションを以下に示す。 As an example, the MRM transition of a peptide having the N-terminal sequence "DAEFRHDSGYEVHHQK" (SEQ ID NO: 6) of the Lys-C digest of Aβ1-42 (as well as the Lys-C digest of Aβ1-40) is shown below. ..
MRMで検出されたプロダクトイオン量に基づいて、血液等の生体試料中の所定のペプチドの含有量(濃度)を算出できる。プロダクトイオン量と生体試料中のペプチド濃度は、予め所定のパラメータにより関連付けられている。両者を関連付ける方法としては、例えば、外部標準による検量線(較正曲線)を用いる方法が挙げられる。検量線は、本分析(生体由来試料の分析)と同一の条件で、濃度既知のペプチドフラグメント(外部標準)の分析を行い、濃度とプロダクトイオンのピーク面積(あるいはピーク強度)とをプロットすることにより得られる。 Based on the amount of product ions detected by MRM, the content (concentration) of a predetermined peptide in a biological sample such as blood can be calculated. The amount of product ions and the peptide concentration in the biological sample are associated with each other by predetermined parameters in advance. As a method of associating the two, for example, a method of using a calibration curve (calibration curve) according to an external standard can be mentioned. For the calibration curve, analyze the peptide fragment (external standard) with a known concentration under the same conditions as this analysis (analysis of biological sample), and plot the concentration and the peak area (or peak intensity) of the product ion. Obtained by
Claims (3)
所定のペプチドのN末端およびC末端のいずれか一方と特異的に結合する抗体を用いた免疫沈降法により、所定のペプチドを分離し、
分離された所定のペプチドをプロテアーゼにより消化してペプチド断片を調製し、
前記ペプチド断片のうち、前記抗体と結合する末端と反対側の末端のペプチド断片を質量分析により検出し、
前記ペプチドが、Aβ1−40(配列番号3)、Aβ1―42(配列番号4)およびAPP669−711(配列番号5)の少なくとも1種であり、
Aβ1−42と、Aβ1―40およびAPP669−711とはC末端側の配列が相違し、Aβ1−40およびAβ1―42と、APP669−711とはN末端側の配列が相違することから、前記免疫沈降法を少なくとも2回実施する、ペプチドの分析方法。 Peptide analysis method
The predetermined peptide is separated by an immunoprecipitation method using an antibody that specifically binds to either the N-terminal or the C-terminal of the predetermined peptide.
A peptide fragment is prepared by digesting the separated predetermined peptide with a protease.
Among the peptide fragments, the peptide fragment at the end opposite to the end that binds to the antibody was detected by mass spectrometry.
The peptide is at least one of Aβ1-40 (SEQ ID NO: 3), Aβ1-42 (SEQ ID NO: 4) and APP669-711 (SEQ ID NO: 5).
Aβ1-42 and Aβ1-40 and APP669-711 have different C-terminal sequences, and Aβ1-40 and Aβ1-42 and APP669-711 have different N-terminal sequences. A method for analyzing a peptide, in which the precipitation method is performed at least twice.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2017096857A JP6870468B2 (en) | 2017-05-15 | 2017-05-15 | Peptide analysis method |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2017096857A JP6870468B2 (en) | 2017-05-15 | 2017-05-15 | Peptide analysis method |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2018194374A JP2018194374A (en) | 2018-12-06 |
| JP2018194374A5 JP2018194374A5 (en) | 2020-01-09 |
| JP6870468B2 true JP6870468B2 (en) | 2021-05-12 |
Family
ID=64571263
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2017096857A Active JP6870468B2 (en) | 2017-05-15 | 2017-05-15 | Peptide analysis method |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP6870468B2 (en) |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP3932942A4 (en) * | 2019-03-01 | 2022-12-07 | Shimadzu Corporation | Method and kit for measuring app669-711 |
| JP7478040B2 (en) * | 2020-06-25 | 2024-05-02 | シスメックス株式会社 | METHOD FOR MEASURING Aβ PEPTIDE AND REAGENT COMPOSITION USED IN THE METHOD |
| CN112255061A (en) * | 2020-10-13 | 2021-01-22 | 南开大学 | Method for separating and detecting protein by immunoprecipitation |
| CN117396758A (en) * | 2021-05-14 | 2024-01-12 | 株式会社岛津制作所 | Method for analyzing neuropeptide related to protein |
Family Cites Families (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN102246033A (en) * | 2008-11-12 | 2011-11-16 | 华盛顿大学 | Simultaneous measurment of the in vivo metabolism of isoforms of a biomolecule |
| WO2014160647A1 (en) * | 2013-03-24 | 2014-10-02 | The Washington University | Method for amyloid beta sample processing |
| JP6152908B2 (en) * | 2016-04-07 | 2017-06-28 | 株式会社島津製作所 | Method for preparing and analyzing peptide fragment |
-
2017
- 2017-05-15 JP JP2017096857A patent/JP6870468B2/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| JP2018194374A (en) | 2018-12-06 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6870468B2 (en) | Peptide analysis method | |
| JP7008268B2 (en) | Surrogate biomarkers for evaluating the state of amyloid β peptide accumulation in the brain and their analytical methods | |
| Brinkmalm et al. | An online nano‐LC‐ESI‐FTICR‐MS method for comprehensive characterization of endogenous fragments from amyloid β and amyloid precursor protein in human and cat cerebrospinal fluid | |
| Kaneko et al. | Identification and quantification of amyloid beta-related peptides in human plasma using matrix-assisted laser desorption/ionization time-of-flight mass spectrometry | |
| Shevchenko et al. | “De novo” sequencing of peptides recovered from in-gel digested proteins by nanoelectrospray tandem mass spectrometry | |
| US11467167B2 (en) | SRM methods in Alzheimer's disease and neurological disease assays | |
| US11391742B2 (en) | Free histone proteins as biomarkers | |
| JP5567662B2 (en) | A novel method for protein quantification by mass spectrometry | |
| Such-Sanmartín et al. | Targeted mass spectrometry analysis of the proteins IGF1, IGF2, IBP2, IBP3 and A2GL by blood protein precipitation | |
| WO2022239537A1 (en) | Method for analyzing neurogranin-related peptide | |
| JP7193479B2 (en) | Method for absolute quantification of low abundance polypeptides using mass spectrometry | |
| US10041961B2 (en) | SRM/MRM assay for the insulin receptor protein | |
| JP2018194374A5 (en) | ||
| US20100216250A1 (en) | Methods for Predicting Trisomy 21 in a Fetus | |
| Winther et al. | Immuno‐capture as ultimate sample cleanup in LC‐MS/MS determination of the early stage biomarker ProGRP | |
| GB2573695A (en) | Method for detecting mitochondrial tRNA modification | |
| JP6445861B2 (en) | Sample pretreatment method for oxytocin detection | |
| US20210156871A1 (en) | Peptide analyzing method | |
| JP6742235B2 (en) | Protein detection method using mass spectrometry | |
| KR20160033987A (en) | A quantitative method for protein in biological sample using mass spectrometry and a composition therefor | |
| KR102112503B1 (en) | A composition for early diagnosis of cardiovascular disease, a kit for early diagnosis of cardiovascular disease, and method for information for early diagnosis of cardiovascular disease | |
| Dillen et al. | Targeted Quantification of Peptide Biomarkers: A Case Study of Amyloid Peptides | |
| CN115427815A (en) | Method for quantifying amyloid beta peptide in plasma by mass spectrometry | |
| Güzel et al. | Targeted Proteomics for Absolute Quantification of Protein Biomarkers in Serum and Tissues | |
| JP2020064051A (en) | Peptide marker for diagnosis of neurodegenerative diseases |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20181225 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20190731 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20191122 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20200715 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20200811 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20201008 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20201209 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20210316 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20210329 |
|
| R151 | Written notification of patent or utility model registration |
Ref document number: 6870468 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R151 |