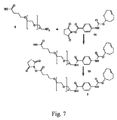
JP6063384B2 - プレターゲットキット、プレターゲット方法及びその使用試薬 - Google Patents
プレターゲットキット、プレターゲット方法及びその使用試薬 Download PDFInfo
- Publication number
- JP6063384B2 JP6063384B2 JP2013533311A JP2013533311A JP6063384B2 JP 6063384 B2 JP6063384 B2 JP 6063384B2 JP 2013533311 A JP2013533311 A JP 2013533311A JP 2013533311 A JP2013533311 A JP 2013533311A JP 6063384 B2 JP6063384 B2 JP 6063384B2
- Authority
- JP
- Japan
- Prior art keywords
- target
- tetrazine
- probe
- mmol
- group
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 239000003153 chemical reaction reagent Substances 0.000 title claims description 34
- 238000000034 method Methods 0.000 title description 57
- 239000000523 sample Substances 0.000 claims description 135
- DPOPAJRDYZGTIR-UHFFFAOYSA-N Tetrazine Chemical compound C1=CN=NN=N1 DPOPAJRDYZGTIR-UHFFFAOYSA-N 0.000 claims description 70
- 239000012636 effector Substances 0.000 claims description 52
- 206010028980 Neoplasm Diseases 0.000 claims description 51
- 150000001875 compounds Chemical class 0.000 claims description 46
- 125000003118 aryl group Chemical group 0.000 claims description 34
- 125000001424 substituent group Chemical group 0.000 claims description 27
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 22
- 108090000623 proteins and genes Proteins 0.000 claims description 22
- 102000004169 proteins and genes Human genes 0.000 claims description 21
- 230000008685 targeting Effects 0.000 claims description 17
- -1 COOR Chemical group 0.000 claims description 16
- 102000004196 processed proteins & peptides Human genes 0.000 claims description 15
- 125000006850 spacer group Chemical group 0.000 claims description 14
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 12
- 238000011282 treatment Methods 0.000 claims description 10
- 229910052786 argon Inorganic materials 0.000 claims description 8
- 238000002059 diagnostic imaging Methods 0.000 claims description 7
- 229920000642 polymer Polymers 0.000 claims description 7
- 125000004105 2-pyridyl group Chemical group N1=C([*])C([H])=C([H])C([H])=C1[H] 0.000 claims description 6
- 229910004013 NO 2 Inorganic materials 0.000 claims description 6
- 108010021625 Immunoglobulin Fragments Proteins 0.000 claims description 5
- 102000008394 Immunoglobulin Fragments Human genes 0.000 claims description 5
- 125000006575 electron-withdrawing group Chemical group 0.000 claims description 4
- 125000006297 carbonyl amino group Chemical group [H]N([*:2])C([*:1])=O 0.000 claims description 3
- 229910052801 chlorine Inorganic materials 0.000 claims description 3
- 229910052731 fluorine Inorganic materials 0.000 claims description 3
- 125000000896 monocarboxylic acid group Chemical group 0.000 claims description 3
- 125000003349 3-pyridyl group Chemical group N1=C([H])C([*])=C([H])C([H])=C1[H] 0.000 claims description 2
- 125000000339 4-pyridyl group Chemical group N1=C([H])C([H])=C([*])C([H])=C1[H] 0.000 claims description 2
- 239000000203 mixture Substances 0.000 description 109
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 92
- 239000000243 solution Substances 0.000 description 75
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 65
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 60
- 238000006243 chemical reaction Methods 0.000 description 57
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 54
- 238000003384 imaging method Methods 0.000 description 53
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 45
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 45
- 239000000047 product Substances 0.000 description 43
- 210000004369 blood Anatomy 0.000 description 38
- 239000008280 blood Substances 0.000 description 38
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 description 37
- 125000000217 alkyl group Chemical group 0.000 description 36
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 34
- 241000699670 Mus sp. Species 0.000 description 32
- 210000001519 tissue Anatomy 0.000 description 31
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 30
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 30
- 238000001727 in vivo Methods 0.000 description 29
- 210000004027 cell Anatomy 0.000 description 28
- 239000010410 layer Substances 0.000 description 28
- 238000005160 1H NMR spectroscopy Methods 0.000 description 27
- 238000006742 Retro-Diels-Alder reaction Methods 0.000 description 27
- 239000007787 solid Substances 0.000 description 25
- URYYVOIYTNXXBN-OWOJBTEDSA-N trans-cyclooctene Chemical compound C1CCC\C=C\CC1 URYYVOIYTNXXBN-OWOJBTEDSA-N 0.000 description 25
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 24
- QOSSAOTZNIDXMA-UHFFFAOYSA-N Dicylcohexylcarbodiimide Chemical compound C1CCCCC1N=C=NC1CCCCC1 QOSSAOTZNIDXMA-UHFFFAOYSA-N 0.000 description 24
- 229920001223 polyethylene glycol Polymers 0.000 description 24
- 238000002347 injection Methods 0.000 description 23
- 239000007924 injection Substances 0.000 description 23
- 239000011541 reaction mixture Substances 0.000 description 22
- 239000011734 sodium Substances 0.000 description 22
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 21
- 238000005481 NMR spectroscopy Methods 0.000 description 21
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 21
- 210000000056 organ Anatomy 0.000 description 21
- 239000012044 organic layer Substances 0.000 description 21
- 239000002904 solvent Substances 0.000 description 21
- 241000699666 Mus <mouse, genus> Species 0.000 description 20
- 150000001993 dienes Chemical class 0.000 description 20
- 239000004913 cyclooctene Substances 0.000 description 19
- 230000009257 reactivity Effects 0.000 description 19
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 18
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 18
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 18
- 125000005647 linker group Chemical group 0.000 description 18
- 239000002953 phosphate buffered saline Substances 0.000 description 18
- 102000005962 receptors Human genes 0.000 description 18
- 108020003175 receptors Proteins 0.000 description 18
- URYYVOIYTNXXBN-UPHRSURJSA-N cyclooctene Chemical compound C1CCC\C=C/CC1 URYYVOIYTNXXBN-UPHRSURJSA-N 0.000 description 17
- 235000018102 proteins Nutrition 0.000 description 17
- 238000003756 stirring Methods 0.000 description 17
- 230000027455 binding Effects 0.000 description 16
- 238000004440 column chromatography Methods 0.000 description 16
- 238000002603 single-photon emission computed tomography Methods 0.000 description 16
- 238000003786 synthesis reaction Methods 0.000 description 16
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 15
- 239000003921 oil Substances 0.000 description 15
- 239000000725 suspension Substances 0.000 description 15
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 14
- 230000015572 biosynthetic process Effects 0.000 description 14
- 238000001914 filtration Methods 0.000 description 14
- NQTADLQHYWFPDB-UHFFFAOYSA-N N-Hydroxysuccinimide Chemical group ON1C(=O)CCC1=O NQTADLQHYWFPDB-UHFFFAOYSA-N 0.000 description 13
- 239000000377 silicon dioxide Substances 0.000 description 13
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 12
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 12
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 12
- 201000010099 disease Diseases 0.000 description 12
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 12
- 238000002474 experimental method Methods 0.000 description 12
- 230000002285 radioactive effect Effects 0.000 description 12
- 238000005698 Diels-Alder reaction Methods 0.000 description 11
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 11
- 125000004432 carbon atom Chemical group C* 0.000 description 11
- 238000001816 cooling Methods 0.000 description 11
- 238000005859 coupling reaction Methods 0.000 description 11
- 239000003814 drug Substances 0.000 description 11
- 238000001704 evaporation Methods 0.000 description 11
- 230000008020 evaporation Effects 0.000 description 11
- 229910052739 hydrogen Inorganic materials 0.000 description 11
- 230000003834 intracellular effect Effects 0.000 description 11
- 229910052757 nitrogen Inorganic materials 0.000 description 11
- 239000002244 precipitate Substances 0.000 description 11
- 230000001225 therapeutic effect Effects 0.000 description 11
- 239000012043 crude product Substances 0.000 description 10
- 239000001257 hydrogen Substances 0.000 description 10
- 229910000104 sodium hydride Inorganic materials 0.000 description 10
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 9
- 230000035508 accumulation Effects 0.000 description 9
- 238000009825 accumulation Methods 0.000 description 9
- 239000002253 acid Substances 0.000 description 9
- 230000008878 coupling Effects 0.000 description 9
- 238000010168 coupling process Methods 0.000 description 9
- 150000004905 tetrazines Chemical class 0.000 description 9
- 229910004298 SiO 2 Inorganic materials 0.000 description 8
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 8
- 239000003795 chemical substances by application Substances 0.000 description 8
- 230000000694 effects Effects 0.000 description 8
- 238000004770 highest occupied molecular orbital Methods 0.000 description 8
- 239000012312 sodium hydride Substances 0.000 description 8
- 239000000126 substance Substances 0.000 description 8
- 229960002685 biotin Drugs 0.000 description 7
- 235000020958 biotin Nutrition 0.000 description 7
- 239000011616 biotin Substances 0.000 description 7
- 229910052799 carbon Inorganic materials 0.000 description 7
- 230000002950 deficient Effects 0.000 description 7
- 238000001035 drying Methods 0.000 description 7
- 239000000706 filtrate Substances 0.000 description 7
- 208000015181 infectious disease Diseases 0.000 description 7
- 210000003734 kidney Anatomy 0.000 description 7
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 7
- 238000012633 nuclear imaging Methods 0.000 description 7
- 229910052760 oxygen Inorganic materials 0.000 description 7
- 238000000746 purification Methods 0.000 description 7
- 102000004190 Enzymes Human genes 0.000 description 6
- 108090000790 Enzymes Proteins 0.000 description 6
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 6
- 241001465754 Metazoa Species 0.000 description 6
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 6
- WDLRUFUQRNWCPK-UHFFFAOYSA-N Tetraxetan Chemical compound OC(=O)CN1CCN(CC(O)=O)CCN(CC(O)=O)CCN(CC(O)=O)CC1 WDLRUFUQRNWCPK-UHFFFAOYSA-N 0.000 description 6
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 6
- 201000011510 cancer Diseases 0.000 description 6
- 238000012754 cardiac puncture Methods 0.000 description 6
- 239000010949 copper Substances 0.000 description 6
- 150000001939 cyclooctenes Chemical class 0.000 description 6
- UAOMVDZJSHZZME-UHFFFAOYSA-N diisopropylamine Chemical compound CC(C)NC(C)C UAOMVDZJSHZZME-UHFFFAOYSA-N 0.000 description 6
- 229940088598 enzyme Drugs 0.000 description 6
- 239000002245 particle Substances 0.000 description 6
- NMHMNPHRMNGLLB-UHFFFAOYSA-N phloretic acid Chemical compound OC(=O)CCC1=CC=C(O)C=C1 NMHMNPHRMNGLLB-UHFFFAOYSA-N 0.000 description 6
- 239000000376 reactant Substances 0.000 description 6
- 239000000741 silica gel Substances 0.000 description 6
- 229910002027 silica gel Inorganic materials 0.000 description 6
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 6
- 239000007858 starting material Substances 0.000 description 6
- 229910052717 sulfur Inorganic materials 0.000 description 6
- 108020004414 DNA Proteins 0.000 description 5
- 108091034117 Oligonucleotide Proteins 0.000 description 5
- 108010090804 Streptavidin Proteins 0.000 description 5
- 150000001412 amines Chemical class 0.000 description 5
- 239000012298 atmosphere Substances 0.000 description 5
- 230000008901 benefit Effects 0.000 description 5
- 230000017531 blood circulation Effects 0.000 description 5
- 230000004087 circulation Effects 0.000 description 5
- 239000002872 contrast media Substances 0.000 description 5
- 239000000499 gel Substances 0.000 description 5
- 239000011521 glass Substances 0.000 description 5
- 125000005842 heteroatom Chemical group 0.000 description 5
- 238000002372 labelling Methods 0.000 description 5
- 210000004185 liver Anatomy 0.000 description 5
- 230000037353 metabolic pathway Effects 0.000 description 5
- 229910052751 metal Inorganic materials 0.000 description 5
- 239000002184 metal Substances 0.000 description 5
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 5
- 230000037361 pathway Effects 0.000 description 5
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 5
- 238000001959 radiotherapy Methods 0.000 description 5
- 238000002560 therapeutic procedure Methods 0.000 description 5
- NWZSZGALRFJKBT-KNIFDHDWSA-N (2s)-2,6-diaminohexanoic acid;(2s)-2-hydroxybutanedioic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O.NCCCC[C@H](N)C(O)=O NWZSZGALRFJKBT-KNIFDHDWSA-N 0.000 description 4
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 4
- OVFJHQBWUUTRFT-UHFFFAOYSA-N 1,2,3,4-tetrahydrotetrazine Chemical compound C1=CNNNN1 OVFJHQBWUUTRFT-UHFFFAOYSA-N 0.000 description 4
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 4
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 4
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 4
- 108010038807 Oligopeptides Proteins 0.000 description 4
- 102000015636 Oligopeptides Human genes 0.000 description 4
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 4
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 4
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 4
- TZCXTZWJZNENPQ-UHFFFAOYSA-L barium sulfate Chemical compound [Ba+2].[O-]S([O-])(=O)=O TZCXTZWJZNENPQ-UHFFFAOYSA-L 0.000 description 4
- AFYNADDZULBEJA-UHFFFAOYSA-N bicinchoninic acid Chemical compound C1=CC=CC2=NC(C=3C=C(C4=CC=CC=C4N=3)C(=O)O)=CC(C(O)=O)=C21 AFYNADDZULBEJA-UHFFFAOYSA-N 0.000 description 4
- 239000012267 brine Substances 0.000 description 4
- 239000000872 buffer Substances 0.000 description 4
- 239000006227 byproduct Substances 0.000 description 4
- 150000001720 carbohydrates Chemical class 0.000 description 4
- 235000014633 carbohydrates Nutrition 0.000 description 4
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 4
- 239000013522 chelant Substances 0.000 description 4
- 238000004587 chromatography analysis Methods 0.000 description 4
- 238000002591 computed tomography Methods 0.000 description 4
- 238000006352 cycloaddition reaction Methods 0.000 description 4
- 239000000412 dendrimer Substances 0.000 description 4
- 229920000736 dendritic polymer Polymers 0.000 description 4
- 238000001514 detection method Methods 0.000 description 4
- 229940079593 drug Drugs 0.000 description 4
- 150000002148 esters Chemical class 0.000 description 4
- WBJINCZRORDGAQ-UHFFFAOYSA-N ethyl formate Chemical compound CCOC=O WBJINCZRORDGAQ-UHFFFAOYSA-N 0.000 description 4
- 239000012634 fragment Substances 0.000 description 4
- IKDUDTNKRLTJSI-UHFFFAOYSA-N hydrazine monohydrate Substances O.NN IKDUDTNKRLTJSI-UHFFFAOYSA-N 0.000 description 4
- 150000002431 hydrogen Chemical class 0.000 description 4
- 238000011534 incubation Methods 0.000 description 4
- 150000002602 lanthanoids Chemical class 0.000 description 4
- 239000003550 marker Substances 0.000 description 4
- 238000005259 measurement Methods 0.000 description 4
- 239000012528 membrane Substances 0.000 description 4
- 102000006240 membrane receptors Human genes 0.000 description 4
- 229920001184 polypeptide Polymers 0.000 description 4
- 210000003752 saphenous vein Anatomy 0.000 description 4
- 229920006395 saturated elastomer Polymers 0.000 description 4
- 210000002966 serum Anatomy 0.000 description 4
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 4
- 238000006467 substitution reaction Methods 0.000 description 4
- WURBVZBTWMNKQT-UHFFFAOYSA-N 1-(4-chlorophenoxy)-3,3-dimethyl-1-(1,2,4-triazol-1-yl)butan-2-one Chemical compound C1=NC=NN1C(C(=O)C(C)(C)C)OC1=CC=C(Cl)C=C1 WURBVZBTWMNKQT-UHFFFAOYSA-N 0.000 description 3
- 238000001644 13C nuclear magnetic resonance spectroscopy Methods 0.000 description 3
- ASUZTNLCAHONDF-UHFFFAOYSA-N 3-methyl-6-pyridin-2-yl-1,2,4,5-tetrazine Chemical compound N1=NC(C)=NN=C1C1=CC=CC=N1 ASUZTNLCAHONDF-UHFFFAOYSA-N 0.000 description 3
- 108091023037 Aptamer Proteins 0.000 description 3
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 description 3
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 3
- 238000006117 Diels-Alder cycloaddition reaction Methods 0.000 description 3
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 description 3
- 206010065042 Immune reconstitution inflammatory syndrome Diseases 0.000 description 3
- WMFOQBRAJBCJND-UHFFFAOYSA-M Lithium hydroxide Chemical compound [Li+].[OH-] WMFOQBRAJBCJND-UHFFFAOYSA-M 0.000 description 3
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 3
- 241000700605 Viruses Species 0.000 description 3
- 230000003321 amplification Effects 0.000 description 3
- 238000004458 analytical method Methods 0.000 description 3
- 239000000427 antigen Substances 0.000 description 3
- PASDCCFISLVPSO-UHFFFAOYSA-N benzoyl chloride Chemical compound ClC(=O)C1=CC=CC=C1 PASDCCFISLVPSO-UHFFFAOYSA-N 0.000 description 3
- 229920001222 biopolymer Polymers 0.000 description 3
- 150000001721 carbon Chemical group 0.000 description 3
- 230000001268 conjugating effect Effects 0.000 description 3
- 238000011033 desalting Methods 0.000 description 3
- 238000003745 diagnosis Methods 0.000 description 3
- 239000003480 eluent Substances 0.000 description 3
- 239000012156 elution solvent Substances 0.000 description 3
- 238000010438 heat treatment Methods 0.000 description 3
- 229920000669 heparin Polymers 0.000 description 3
- 229960002897 heparin Drugs 0.000 description 3
- 239000012216 imaging agent Substances 0.000 description 3
- 150000002500 ions Chemical class 0.000 description 3
- 238000001155 isoelectric focusing Methods 0.000 description 3
- 239000003446 ligand Substances 0.000 description 3
- 239000002502 liposome Substances 0.000 description 3
- 238000004020 luminiscence type Methods 0.000 description 3
- 238000013160 medical therapy Methods 0.000 description 3
- 108020004084 membrane receptors Proteins 0.000 description 3
- 230000002503 metabolic effect Effects 0.000 description 3
- 230000004060 metabolic process Effects 0.000 description 3
- 238000004776 molecular orbital Methods 0.000 description 3
- 238000003199 nucleic acid amplification method Methods 0.000 description 3
- 229920001542 oligosaccharide Polymers 0.000 description 3
- 150000002482 oligosaccharides Chemical class 0.000 description 3
- 230000003287 optical effect Effects 0.000 description 3
- 230000005298 paramagnetic effect Effects 0.000 description 3
- 238000002953 preparative HPLC Methods 0.000 description 3
- 238000002390 rotary evaporation Methods 0.000 description 3
- 239000011593 sulfur Substances 0.000 description 3
- 239000006228 supernatant Substances 0.000 description 3
- 239000006188 syrup Substances 0.000 description 3
- 235000020357 syrup Nutrition 0.000 description 3
- 238000002626 targeted therapy Methods 0.000 description 3
- 229940124597 therapeutic agent Drugs 0.000 description 3
- 238000002604 ultrasonography Methods 0.000 description 3
- NQPDZGIKBAWPEJ-UHFFFAOYSA-N valeric acid Chemical compound CCCCC(O)=O NQPDZGIKBAWPEJ-UHFFFAOYSA-N 0.000 description 3
- STNZNCWQNMGRIM-UHFFFAOYSA-N 2-benzyl-1,4,7,10-tetrakis-(4-methylphenyl)sulfonyl-1,4,7,10-tetrazacyclododecane Chemical compound C1=CC(C)=CC=C1S(=O)(=O)N1CCN(S(=O)(=O)C=2C=CC(C)=CC=2)CC(CC=2C=CC=CC=2)N(S(=O)(=O)C=2C=CC(C)=CC=2)CCN(S(=O)(=O)C=2C=CC(C)=CC=2)CC1 STNZNCWQNMGRIM-UHFFFAOYSA-N 0.000 description 2
- KZMAWJRXKGLWGS-UHFFFAOYSA-N 2-chloro-n-[4-(4-methoxyphenyl)-1,3-thiazol-2-yl]-n-(3-methoxypropyl)acetamide Chemical compound S1C(N(C(=O)CCl)CCCOC)=NC(C=2C=CC(OC)=CC=2)=C1 KZMAWJRXKGLWGS-UHFFFAOYSA-N 0.000 description 2
- FFNVQNRYTPFDDP-UHFFFAOYSA-N 2-cyanopyridine Chemical compound N#CC1=CC=CC=N1 FFNVQNRYTPFDDP-UHFFFAOYSA-N 0.000 description 2
- MQSMIIJCRWDMDL-UHFFFAOYSA-N 3,6-dipyridin-4-yl-1,2,4,5-tetrazine Chemical compound C1=NC=CC(C=2N=NC(=NN=2)C=2C=CN=CC=2)=C1 MQSMIIJCRWDMDL-UHFFFAOYSA-N 0.000 description 2
- CQQSQBRPAJSTFB-UHFFFAOYSA-N 4-(bromomethyl)benzoic acid Chemical compound OC(=O)C1=CC=C(CBr)C=C1 CQQSQBRPAJSTFB-UHFFFAOYSA-N 0.000 description 2
- ALYNCZNDIQEVRV-UHFFFAOYSA-N 4-aminobenzoic acid Chemical compound NC1=CC=C(C(O)=O)C=C1 ALYNCZNDIQEVRV-UHFFFAOYSA-N 0.000 description 2
- WDSCJULUXJSJOX-UHFFFAOYSA-N 5-(trifluoromethyl)pyridine-2-carbonitrile Chemical compound FC(F)(F)C1=CC=C(C#N)N=C1 WDSCJULUXJSJOX-UHFFFAOYSA-N 0.000 description 2
- IFOXWHQFTSCNQB-UHFFFAOYSA-N 5-aminopyridine-2-carbonitrile Chemical compound NC1=CC=C(C#N)N=C1 IFOXWHQFTSCNQB-UHFFFAOYSA-N 0.000 description 2
- BHXHRMVSUUPOLX-UHFFFAOYSA-N 5-fluoropyridine-2-carbonitrile Chemical compound FC1=CC=C(C#N)N=C1 BHXHRMVSUUPOLX-UHFFFAOYSA-N 0.000 description 2
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 2
- USFZMSVCRYTOJT-UHFFFAOYSA-N Ammonium acetate Chemical compound N.CC(O)=O USFZMSVCRYTOJT-UHFFFAOYSA-N 0.000 description 2
- 239000005695 Ammonium acetate Substances 0.000 description 2
- 208000037259 Amyloid Plaque Diseases 0.000 description 2
- 206010002091 Anaesthesia Diseases 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical class N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- 208000024172 Cardiovascular disease Diseases 0.000 description 2
- 102000004127 Cytokines Human genes 0.000 description 2
- 108090000695 Cytokines Proteins 0.000 description 2
- 229910052692 Dysprosium Inorganic materials 0.000 description 2
- 208000028735 Gaucher disease type III Diseases 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- 101001073409 Homo sapiens Retrotransposon-derived protein PEG10 Proteins 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 2
- 206010061218 Inflammation Diseases 0.000 description 2
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 2
- 239000002616 MRI contrast agent Substances 0.000 description 2
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 2
- NXTVQNIVUKXOIL-UHFFFAOYSA-N N-chlorotoluene-p-sulfonamide Chemical compound CC1=CC=C(S(=O)(=O)NCl)C=C1 NXTVQNIVUKXOIL-UHFFFAOYSA-N 0.000 description 2
- PMKBLBDMQOYLGP-UHFFFAOYSA-N N1NN=CC=N1 Chemical compound N1NN=CC=N1 PMKBLBDMQOYLGP-UHFFFAOYSA-N 0.000 description 2
- 108010043958 Peptoids Proteins 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- 102000004022 Protein-Tyrosine Kinases Human genes 0.000 description 2
- 108090000412 Protein-Tyrosine Kinases Proteins 0.000 description 2
- 102100035844 Retrotransposon-derived protein PEG10 Human genes 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- 101710172711 Structural protein Proteins 0.000 description 2
- 208000007536 Thrombosis Diseases 0.000 description 2
- 102000009618 Transforming Growth Factors Human genes 0.000 description 2
- 108010009583 Transforming Growth Factors Proteins 0.000 description 2
- OKJPEAGHQZHRQV-UHFFFAOYSA-N Triiodomethane Natural products IC(I)I OKJPEAGHQZHRQV-UHFFFAOYSA-N 0.000 description 2
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 2
- 238000010521 absorption reaction Methods 0.000 description 2
- UCTWMZQNUQWSLP-UHFFFAOYSA-N adrenaline Chemical compound CNCC(O)C1=CC=C(O)C(O)=C1 UCTWMZQNUQWSLP-UHFFFAOYSA-N 0.000 description 2
- 125000001931 aliphatic group Chemical group 0.000 description 2
- 125000002877 alkyl aryl group Chemical group 0.000 description 2
- 235000001014 amino acid Nutrition 0.000 description 2
- 150000001413 amino acids Chemical class 0.000 description 2
- 229910021529 ammonia Inorganic materials 0.000 description 2
- 229940043376 ammonium acetate Drugs 0.000 description 2
- 235000019257 ammonium acetate Nutrition 0.000 description 2
- 230000037005 anaesthesia Effects 0.000 description 2
- 230000033115 angiogenesis Effects 0.000 description 2
- 108091007433 antigens Proteins 0.000 description 2
- 102000036639 antigens Human genes 0.000 description 2
- 239000002246 antineoplastic agent Substances 0.000 description 2
- 239000000074 antisense oligonucleotide Substances 0.000 description 2
- 238000012230 antisense oligonucleotides Methods 0.000 description 2
- 230000006907 apoptotic process Effects 0.000 description 2
- 125000003710 aryl alkyl group Chemical group 0.000 description 2
- PFYXSUNOLOJMDX-UHFFFAOYSA-N bis(2,5-dioxopyrrolidin-1-yl) carbonate Chemical compound O=C1CCC(=O)N1OC(=O)ON1C(=O)CCC1=O PFYXSUNOLOJMDX-UHFFFAOYSA-N 0.000 description 2
- 230000037396 body weight Effects 0.000 description 2
- 210000004556 brain Anatomy 0.000 description 2
- 230000015556 catabolic process Effects 0.000 description 2
- 210000000170 cell membrane Anatomy 0.000 description 2
- 230000005754 cellular signaling Effects 0.000 description 2
- 238000005119 centrifugation Methods 0.000 description 2
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 2
- 238000004891 communication Methods 0.000 description 2
- 230000021615 conjugation Effects 0.000 description 2
- 150000004696 coordination complex Chemical class 0.000 description 2
- 235000018417 cysteine Nutrition 0.000 description 2
- 231100000433 cytotoxic Toxicity 0.000 description 2
- 230000001472 cytotoxic effect Effects 0.000 description 2
- 238000006731 degradation reaction Methods 0.000 description 2
- 229940043279 diisopropylamine Drugs 0.000 description 2
- 230000008034 disappearance Effects 0.000 description 2
- 239000006185 dispersion Substances 0.000 description 2
- VYFYYTLLBUKUHU-UHFFFAOYSA-N dopamine Chemical compound NCCC1=CC=C(O)C(O)=C1 VYFYYTLLBUKUHU-UHFFFAOYSA-N 0.000 description 2
- 239000000975 dye Substances 0.000 description 2
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 2
- 238000000605 extraction Methods 0.000 description 2
- 102000006815 folate receptor Human genes 0.000 description 2
- 108020005243 folate receptor Proteins 0.000 description 2
- OVBPIULPVIDEAO-LBPRGKRZSA-N folic acid Chemical compound C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 OVBPIULPVIDEAO-LBPRGKRZSA-N 0.000 description 2
- 238000004108 freeze drying Methods 0.000 description 2
- 238000001415 gene therapy Methods 0.000 description 2
- VANNPISTIUFMLH-UHFFFAOYSA-N glutaric anhydride Chemical compound O=C1CCCC(=O)O1 VANNPISTIUFMLH-UHFFFAOYSA-N 0.000 description 2
- 150000004676 glycans Chemical class 0.000 description 2
- 238000004128 high performance liquid chromatography Methods 0.000 description 2
- 230000007062 hydrolysis Effects 0.000 description 2
- 238000006460 hydrolysis reaction Methods 0.000 description 2
- 238000010348 incorporation Methods 0.000 description 2
- 230000004054 inflammatory process Effects 0.000 description 2
- 238000001802 infusion Methods 0.000 description 2
- INQOMBQAUSQDDS-UHFFFAOYSA-N iodomethane Chemical compound IC INQOMBQAUSQDDS-UHFFFAOYSA-N 0.000 description 2
- 229910052747 lanthanoid Inorganic materials 0.000 description 2
- OHSVLFRHMCKCQY-NJFSPNSNSA-N lutetium-177 Chemical compound [177Lu] OHSVLFRHMCKCQY-NJFSPNSNSA-N 0.000 description 2
- 230000014759 maintenance of location Effects 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- QSHDDOUJBYECFT-UHFFFAOYSA-N mercury Chemical compound [Hg] QSHDDOUJBYECFT-UHFFFAOYSA-N 0.000 description 2
- 229910052753 mercury Inorganic materials 0.000 description 2
- 229960000485 methotrexate Drugs 0.000 description 2
- QPJVMBTYPHYUOC-UHFFFAOYSA-N methyl benzoate Chemical compound COC(=O)C1=CC=CC=C1 QPJVMBTYPHYUOC-UHFFFAOYSA-N 0.000 description 2
- 238000012544 monitoring process Methods 0.000 description 2
- 150000002772 monosaccharides Chemical class 0.000 description 2
- AAPGXPJNYDSZMV-UHFFFAOYSA-N n-[6-[6-(5-fluoropyridin-2-yl)-1,2,4,5-tetrazin-3-yl]pyridin-3-yl]butanamide Chemical compound N1=CC(NC(=O)CCC)=CC=C1C1=NN=C(C=2N=CC(F)=CC=2)N=N1 AAPGXPJNYDSZMV-UHFFFAOYSA-N 0.000 description 2
- 229920001282 polysaccharide Polymers 0.000 description 2
- 239000005017 polysaccharide Substances 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 2
- GPHQHTOMRSGBNZ-UHFFFAOYSA-N pyridine-4-carbonitrile Chemical compound N#CC1=CC=NC=C1 GPHQHTOMRSGBNZ-UHFFFAOYSA-N 0.000 description 2
- 230000005855 radiation Effects 0.000 description 2
- 238000000163 radioactive labelling Methods 0.000 description 2
- 238000001953 recrystallisation Methods 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 230000004044 response Effects 0.000 description 2
- 238000000926 separation method Methods 0.000 description 2
- SQGYOTSLMSWVJD-UHFFFAOYSA-N silver(1+) nitrate Chemical compound [Ag+].[O-]N(=O)=O SQGYOTSLMSWVJD-UHFFFAOYSA-N 0.000 description 2
- 239000011780 sodium chloride Substances 0.000 description 2
- LPXPTNMVRIOKMN-UHFFFAOYSA-M sodium nitrite Chemical compound [Na+].[O-]N=O LPXPTNMVRIOKMN-UHFFFAOYSA-M 0.000 description 2
- 239000012265 solid product Substances 0.000 description 2
- 239000012086 standard solution Substances 0.000 description 2
- 210000002784 stomach Anatomy 0.000 description 2
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 2
- 238000012360 testing method Methods 0.000 description 2
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 2
- 229940126585 therapeutic drug Drugs 0.000 description 2
- 210000001685 thyroid gland Anatomy 0.000 description 2
- 230000032258 transport Effects 0.000 description 2
- ILJSQTXMGCGYMG-UHFFFAOYSA-N triacetic acid Chemical compound CC(=O)CC(=O)CC(O)=O ILJSQTXMGCGYMG-UHFFFAOYSA-N 0.000 description 2
- 210000004881 tumor cell Anatomy 0.000 description 2
- 230000036325 urinary excretion Effects 0.000 description 2
- 239000006226 wash reagent Substances 0.000 description 2
- UAOUIVVJBYDFKD-XKCDOFEDSA-N (1R,9R,10S,11R,12R,15S,18S,21R)-10,11,21-trihydroxy-8,8-dimethyl-14-methylidene-4-(prop-2-enylamino)-20-oxa-5-thia-3-azahexacyclo[9.7.2.112,15.01,9.02,6.012,18]henicosa-2(6),3-dien-13-one Chemical compound C([C@@H]1[C@@H](O)[C@@]23C(C1=C)=O)C[C@H]2[C@]12C(N=C(NCC=C)S4)=C4CC(C)(C)[C@H]1[C@H](O)[C@]3(O)OC2 UAOUIVVJBYDFKD-XKCDOFEDSA-N 0.000 description 1
- KYRUKRFVOACELK-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 3-(4-hydroxyphenyl)propanoate Chemical compound C1=CC(O)=CC=C1CCC(=O)ON1C(=O)CCC1=O KYRUKRFVOACELK-UHFFFAOYSA-N 0.000 description 1
- DEQANNDTNATYII-OULOTJBUSA-N (4r,7s,10s,13r,16s,19r)-10-(4-aminobutyl)-19-[[(2r)-2-amino-3-phenylpropanoyl]amino]-16-benzyl-n-[(2r,3r)-1,3-dihydroxybutan-2-yl]-7-[(1r)-1-hydroxyethyl]-13-(1h-indol-3-ylmethyl)-6,9,12,15,18-pentaoxo-1,2-dithia-5,8,11,14,17-pentazacycloicosane-4-carboxa Chemical compound C([C@@H](N)C(=O)N[C@H]1CSSC[C@H](NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](CC=2C3=CC=CC=C3NC=2)NC(=O)[C@H](CC=2C=CC=CC=2)NC1=O)C(=O)N[C@H](CO)[C@H](O)C)C1=CC=CC=C1 DEQANNDTNATYII-OULOTJBUSA-N 0.000 description 1
- 125000000008 (C1-C10) alkyl group Chemical group 0.000 description 1
- BKWQKVJYXODDAC-UHFFFAOYSA-N 1,2-dihydropyridazine Chemical compound N1NC=CC=C1 BKWQKVJYXODDAC-UHFFFAOYSA-N 0.000 description 1
- FJQZXCPWAGYPSD-UHFFFAOYSA-N 1,3,4,6-tetrachloro-3a,6a-diphenylimidazo[4,5-d]imidazole-2,5-dione Chemical compound ClN1C(=O)N(Cl)C2(C=3C=CC=CC=3)N(Cl)C(=O)N(Cl)C12C1=CC=CC=C1 FJQZXCPWAGYPSD-UHFFFAOYSA-N 0.000 description 1
- AZQWKYJCGOJGHM-UHFFFAOYSA-N 1,4-benzoquinone Chemical compound O=C1C=CC(=O)C=C1 AZQWKYJCGOJGHM-UHFFFAOYSA-N 0.000 description 1
- VYXHVRARDIDEHS-UHFFFAOYSA-N 1,5-cyclooctadiene Chemical compound C1CC=CCCC=C1 VYXHVRARDIDEHS-UHFFFAOYSA-N 0.000 description 1
- 239000004912 1,5-cyclooctadiene Substances 0.000 description 1
- WZZBNLYBHUDSHF-DHLKQENFSA-N 1-[(3s,4s)-4-[8-(2-chloro-4-pyrimidin-2-yloxyphenyl)-7-fluoro-2-methylimidazo[4,5-c]quinolin-1-yl]-3-fluoropiperidin-1-yl]-2-hydroxyethanone Chemical compound CC1=NC2=CN=C3C=C(F)C(C=4C(=CC(OC=5N=CC=CN=5)=CC=4)Cl)=CC3=C2N1[C@H]1CCN(C(=O)CO)C[C@@H]1F WZZBNLYBHUDSHF-DHLKQENFSA-N 0.000 description 1
- KWKAKUADMBZCLK-UHFFFAOYSA-N 1-octene Chemical class CCCCCCC=C KWKAKUADMBZCLK-UHFFFAOYSA-N 0.000 description 1
- VOXZDWNPVJITMN-ZBRFXRBCSA-N 17β-estradiol Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 VOXZDWNPVJITMN-ZBRFXRBCSA-N 0.000 description 1
- XILIYVSXLSWUAI-UHFFFAOYSA-N 2-(diethylamino)ethyl n'-phenylcarbamimidothioate;dihydrobromide Chemical compound Br.Br.CCN(CC)CCSC(N)=NC1=CC=CC=C1 XILIYVSXLSWUAI-UHFFFAOYSA-N 0.000 description 1
- AOYNUTHNTBLRMT-MXWOLSILSA-N 2-Deoxy-2(F-18)fluoro-2-D-glucose Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H]([18F])C=O AOYNUTHNTBLRMT-MXWOLSILSA-N 0.000 description 1
- ZCXUVYAZINUVJD-AHXZWLDOSA-N 2-deoxy-2-((18)F)fluoro-alpha-D-glucose Chemical compound OC[C@H]1O[C@H](O)[C@H]([18F])[C@@H](O)[C@@H]1O ZCXUVYAZINUVJD-AHXZWLDOSA-N 0.000 description 1
- OEYIOHPDSNJKLS-SFIIULIVSA-N 2-hydroxy(211C)ethyl(trimethyl)azanium Chemical compound O[11CH2]C[N+](C)(C)C OEYIOHPDSNJKLS-SFIIULIVSA-N 0.000 description 1
- CUYKNJBYIJFRCU-UHFFFAOYSA-N 3-aminopyridine Chemical compound NC1=CC=CN=C1 CUYKNJBYIJFRCU-UHFFFAOYSA-N 0.000 description 1
- CZKLEJHVLCMVQR-UHFFFAOYSA-N 4-fluorobenzoyl chloride Chemical compound FC1=CC=C(C(Cl)=O)C=C1 CZKLEJHVLCMVQR-UHFFFAOYSA-N 0.000 description 1
- XFJBGINZIMNZBW-CRAIPNDOSA-N 5-chloro-2-[4-[(1r,2s)-2-[2-(5-methylsulfonylpyridin-2-yl)oxyethyl]cyclopropyl]piperidin-1-yl]pyrimidine Chemical compound N1=CC(S(=O)(=O)C)=CC=C1OCC[C@H]1[C@@H](C2CCN(CC2)C=2N=CC(Cl)=CN=2)C1 XFJBGINZIMNZBW-CRAIPNDOSA-N 0.000 description 1
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 1
- 102100033350 ATP-dependent translocase ABCB1 Human genes 0.000 description 1
- HJCMDXDYPOUFDY-WHFBIAKZSA-N Ala-Gln Chemical compound C[C@H](N)C(=O)N[C@H](C(O)=O)CCC(N)=O HJCMDXDYPOUFDY-WHFBIAKZSA-N 0.000 description 1
- 102400000068 Angiostatin Human genes 0.000 description 1
- 108010079709 Angiostatins Proteins 0.000 description 1
- 108090000672 Annexin A5 Proteins 0.000 description 1
- 102000004121 Annexin A5 Human genes 0.000 description 1
- 108020000948 Antisense Oligonucleotides Proteins 0.000 description 1
- 102000007592 Apolipoproteins Human genes 0.000 description 1
- 108010071619 Apolipoproteins Proteins 0.000 description 1
- 201000001320 Atherosclerosis Diseases 0.000 description 1
- 208000037260 Atherosclerotic Plaque Diseases 0.000 description 1
- 108090001008 Avidin Proteins 0.000 description 1
- 108010039206 Biotinidase Proteins 0.000 description 1
- 108010051479 Bombesin Chemical class 0.000 description 1
- 102000013585 Bombesin Human genes 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- 208000014644 Brain disease Diseases 0.000 description 1
- 108010001789 Calcitonin Receptors Proteins 0.000 description 1
- 102100038520 Calcitonin receptor Human genes 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 1
- 108010001857 Cell Surface Receptors Proteins 0.000 description 1
- 229910052684 Cerium Inorganic materials 0.000 description 1
- 101710091342 Chemotactic peptide Chemical class 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- 108010089448 Cholecystokinin B Receptor Proteins 0.000 description 1
- 108090001085 Cholecystokinin Receptors Proteins 0.000 description 1
- 206010009944 Colon cancer Diseases 0.000 description 1
- 208000001333 Colorectal Neoplasms Diseases 0.000 description 1
- 229910021595 Copper(I) iodide Inorganic materials 0.000 description 1
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 1
- 108010069941 DNA receptor Proteins 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 102000001301 EGF receptor Human genes 0.000 description 1
- 108060006698 EGF receptor Proteins 0.000 description 1
- 108010014258 Elastin Chemical class 0.000 description 1
- 102000016942 Elastin Human genes 0.000 description 1
- 102400001047 Endostatin Human genes 0.000 description 1
- 108010079505 Endostatins Proteins 0.000 description 1
- 102000009123 Fibrin Human genes 0.000 description 1
- 108010073385 Fibrin Proteins 0.000 description 1
- BWGVNKXGVNDBDI-UHFFFAOYSA-N Fibrin monomer Chemical compound CNC(=O)CNC(=O)CN BWGVNKXGVNDBDI-UHFFFAOYSA-N 0.000 description 1
- 229910052688 Gadolinium Inorganic materials 0.000 description 1
- 102000052874 Gastrin receptors Human genes 0.000 description 1
- 229910052689 Holmium Inorganic materials 0.000 description 1
- 101000904173 Homo sapiens Progonadoliberin-1 Chemical class 0.000 description 1
- 101000801643 Homo sapiens Retinal-specific phospholipid-transporting ATPase ABCA4 Proteins 0.000 description 1
- 108091006905 Human Serum Albumin Proteins 0.000 description 1
- 102000008100 Human Serum Albumin Human genes 0.000 description 1
- 206010021143 Hypoxia Diseases 0.000 description 1
- 229910021617 Indium monochloride Inorganic materials 0.000 description 1
- 102100025306 Integrin alpha-IIb Human genes 0.000 description 1
- 101710149643 Integrin alpha-IIb Proteins 0.000 description 1
- 102000008070 Interferon-gamma Human genes 0.000 description 1
- 108010074328 Interferon-gamma Proteins 0.000 description 1
- 102000014150 Interferons Human genes 0.000 description 1
- 108010050904 Interferons Proteins 0.000 description 1
- 102000015696 Interleukins Human genes 0.000 description 1
- 108010063738 Interleukins Proteins 0.000 description 1
- PIWKPBJCKXDKJR-UHFFFAOYSA-N Isoflurane Chemical compound FC(F)OC(Cl)C(F)(F)F PIWKPBJCKXDKJR-UHFFFAOYSA-N 0.000 description 1
- 102000007330 LDL Lipoproteins Human genes 0.000 description 1
- 108010007622 LDL Lipoproteins Proteins 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- 108010007013 Melanocyte-Stimulating Hormones Chemical class 0.000 description 1
- 108010047230 Member 1 Subfamily B ATP Binding Cassette Transporter Proteins 0.000 description 1
- 108090000301 Membrane transport proteins Proteins 0.000 description 1
- 102000003939 Membrane transport proteins Human genes 0.000 description 1
- 102000005741 Metalloproteases Human genes 0.000 description 1
- 108010006035 Metalloproteases Proteins 0.000 description 1
- 239000012901 Milli-Q water Substances 0.000 description 1
- 102000010909 Monoamine Oxidase Human genes 0.000 description 1
- 108010062431 Monoamine oxidase Proteins 0.000 description 1
- 102000014415 Muscarinic acetylcholine receptor Human genes 0.000 description 1
- 108050003473 Muscarinic acetylcholine receptor Proteins 0.000 description 1
- QPCDCPDFJACHGM-UHFFFAOYSA-N N,N-bis{2-[bis(carboxymethyl)amino]ethyl}glycine Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(=O)O)CCN(CC(O)=O)CC(O)=O QPCDCPDFJACHGM-UHFFFAOYSA-N 0.000 description 1
- OVBPIULPVIDEAO-UHFFFAOYSA-N N-Pteroyl-L-glutaminsaeure Natural products C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)NC(CCC(O)=O)C(O)=O)C=C1 OVBPIULPVIDEAO-UHFFFAOYSA-N 0.000 description 1
- 229910052779 Neodymium Inorganic materials 0.000 description 1
- 108010040718 Neurokinin-1 Receptors Proteins 0.000 description 1
- 108070000018 Neuropeptide receptor Proteins 0.000 description 1
- 102000028517 Neuropeptide receptor Human genes 0.000 description 1
- 102000017922 Neurotensin receptor Human genes 0.000 description 1
- 108060003370 Neurotensin receptor Proteins 0.000 description 1
- 108010016076 Octreotide Proteins 0.000 description 1
- 229930012538 Paclitaxel Natural products 0.000 description 1
- 229930182555 Penicillin Natural products 0.000 description 1
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 1
- 102000035195 Peptidases Human genes 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- YGYAWVDWMABLBF-UHFFFAOYSA-N Phosgene Chemical compound ClC(Cl)=O YGYAWVDWMABLBF-UHFFFAOYSA-N 0.000 description 1
- 102000010780 Platelet-Derived Growth Factor Human genes 0.000 description 1
- 108010038512 Platelet-Derived Growth Factor Proteins 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 229910052777 Praseodymium Inorganic materials 0.000 description 1
- 102100033237 Pro-epidermal growth factor Human genes 0.000 description 1
- 229910052774 Proactinium Inorganic materials 0.000 description 1
- 102100024028 Progonadoliberin-1 Human genes 0.000 description 1
- 101710146873 Receptor-binding protein Proteins 0.000 description 1
- 108700008625 Reporter Genes Proteins 0.000 description 1
- 102100033617 Retinal-specific phospholipid-transporting ATPase ABCA4 Human genes 0.000 description 1
- 241000031708 Saprospiraceae Species 0.000 description 1
- 102000003800 Selectins Human genes 0.000 description 1
- 108090000184 Selectins Proteins 0.000 description 1
- 241000700584 Simplexvirus Species 0.000 description 1
- 235000003953 Solanum lycopersicum var cerasiforme Nutrition 0.000 description 1
- 240000003040 Solanum lycopersicum var. cerasiforme Species 0.000 description 1
- 108050001286 Somatostatin Receptor Proteins 0.000 description 1
- 102000011096 Somatostatin receptor Human genes 0.000 description 1
- 208000006011 Stroke Diseases 0.000 description 1
- 102100037346 Substance-P receptor Human genes 0.000 description 1
- 101000996723 Sus scrofa Gonadotropin-releasing hormone receptor Chemical class 0.000 description 1
- 210000001744 T-lymphocyte Anatomy 0.000 description 1
- 229910052771 Terbium Inorganic materials 0.000 description 1
- 108010042352 Urokinase Plasminogen Activator Receptors Proteins 0.000 description 1
- 102000004504 Urokinase Plasminogen Activator Receptors Human genes 0.000 description 1
- 108091008605 VEGF receptors Proteins 0.000 description 1
- 102000009484 Vascular Endothelial Growth Factor Receptors Human genes 0.000 description 1
- 108010003205 Vasoactive Intestinal Peptide Proteins 0.000 description 1
- 229910052769 Ytterbium Inorganic materials 0.000 description 1
- OUGQJOKGFAIFAQ-UPHRSURJSA-N [(4Z)-cyclooct-4-en-1-yl] (2,5-dioxopyrrolidin-1-yl) carbonate Chemical compound O=C1CCC(=O)N1OC(=O)OC1CCC\C=C/CC1 OUGQJOKGFAIFAQ-UPHRSURJSA-N 0.000 description 1
- OUGQJOKGFAIFAQ-OWOJBTEDSA-N [(4e)-cyclooct-4-en-1-yl] (2,5-dioxopyrrolidin-1-yl) carbonate Chemical group O=C1CCC(=O)N1OC(=O)OC1CCC\C=C\CC1 OUGQJOKGFAIFAQ-OWOJBTEDSA-N 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 230000009435 amidation Effects 0.000 description 1
- 238000007112 amidation reaction Methods 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- 229960004050 aminobenzoic acid Drugs 0.000 description 1
- 238000004873 anchoring Methods 0.000 description 1
- 239000003098 androgen Substances 0.000 description 1
- 229940030486 androgens Drugs 0.000 description 1
- 230000000692 anti-sense effect Effects 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- FZCSTZYAHCUGEM-UHFFFAOYSA-N aspergillomarasmine B Natural products OC(=O)CNC(C(O)=O)CNC(C(O)=O)CC(O)=O FZCSTZYAHCUGEM-UHFFFAOYSA-N 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 238000003149 assay kit Methods 0.000 description 1
- 238000003047 austin model 1 Methods 0.000 description 1
- 229910052788 barium Inorganic materials 0.000 description 1
- DSAJWYNOEDNPEQ-UHFFFAOYSA-N barium atom Chemical compound [Ba] DSAJWYNOEDNPEQ-UHFFFAOYSA-N 0.000 description 1
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 1
- 229920002988 biodegradable polymer Polymers 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 239000012472 biological sample Substances 0.000 description 1
- 230000002051 biphasic effect Effects 0.000 description 1
- 230000008499 blood brain barrier function Effects 0.000 description 1
- 210000000601 blood cell Anatomy 0.000 description 1
- 210000004204 blood vessel Anatomy 0.000 description 1
- 210000001218 blood-brain barrier Anatomy 0.000 description 1
- DNDCVAGJPBKION-DOPDSADYSA-N bombesin Chemical class C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCSC)C(N)=O)NC(=O)CNC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](CC=1NC2=CC=CC=C2C=1)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)CNC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H]1NC(=O)CC1)C(C)C)C1=CN=CN1 DNDCVAGJPBKION-DOPDSADYSA-N 0.000 description 1
- 210000001185 bone marrow Anatomy 0.000 description 1
- 229910052794 bromium Inorganic materials 0.000 description 1
- YHASWHZGWUONAO-UHFFFAOYSA-N butanoyl butanoate Chemical compound CCCC(=O)OC(=O)CCC YHASWHZGWUONAO-UHFFFAOYSA-N 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 235000021258 carbohydrate absorption Nutrition 0.000 description 1
- 230000006652 catabolic pathway Effects 0.000 description 1
- 210000002421 cell wall Anatomy 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 230000004700 cellular uptake Effects 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- PBAYDYUZOSNJGU-UHFFFAOYSA-N chelidonic acid Natural products OC(=O)C1=CC(=O)C=C(C(O)=O)O1 PBAYDYUZOSNJGU-UHFFFAOYSA-N 0.000 description 1
- 125000003636 chemical group Chemical group 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- IJOOHPMOJXWVHK-UHFFFAOYSA-N chlorotrimethylsilane Chemical compound C[Si](C)(C)Cl IJOOHPMOJXWVHK-UHFFFAOYSA-N 0.000 description 1
- 235000012000 cholesterol Nutrition 0.000 description 1
- OEYIOHPDSNJKLS-UHFFFAOYSA-N choline Chemical compound C[N+](C)(C)CCO OEYIOHPDSNJKLS-UHFFFAOYSA-N 0.000 description 1
- 229960001231 choline Drugs 0.000 description 1
- 230000001713 cholinergic effect Effects 0.000 description 1
- 229910052804 chromium Inorganic materials 0.000 description 1
- 238000004140 cleaning Methods 0.000 description 1
- 229910052681 coesite Inorganic materials 0.000 description 1
- 239000012230 colorless oil Substances 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 238000013170 computed tomography imaging Methods 0.000 description 1
- 239000012141 concentrate Substances 0.000 description 1
- 229910052802 copper Inorganic materials 0.000 description 1
- LSXDOTMGLUJQCM-UHFFFAOYSA-M copper(i) iodide Chemical compound I[Cu] LSXDOTMGLUJQCM-UHFFFAOYSA-M 0.000 description 1
- 239000003246 corticosteroid Substances 0.000 description 1
- 229960001334 corticosteroids Drugs 0.000 description 1
- 229910052906 cristobalite Inorganic materials 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 125000006165 cyclic alkyl group Chemical group 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 150000001945 cysteines Chemical class 0.000 description 1
- 229940127089 cytotoxic agent Drugs 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000010511 deprotection reaction Methods 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 238000002405 diagnostic procedure Methods 0.000 description 1
- 238000009792 diffusion process Methods 0.000 description 1
- 238000006073 displacement reaction Methods 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- 229960003638 dopamine Drugs 0.000 description 1
- 238000012377 drug delivery Methods 0.000 description 1
- 230000004064 dysfunction Effects 0.000 description 1
- 229920002549 elastin Chemical class 0.000 description 1
- 238000001962 electrophoresis Methods 0.000 description 1
- 238000010828 elution Methods 0.000 description 1
- 229940052296 esters of benzoic acid for local anesthesia Drugs 0.000 description 1
- 229960005309 estradiol Drugs 0.000 description 1
- 229930182833 estradiol Natural products 0.000 description 1
- 229940011871 estrogen Drugs 0.000 description 1
- 239000000262 estrogen Substances 0.000 description 1
- WCQOBLXWLRDEQA-UHFFFAOYSA-N ethanimidamide;hydrochloride Chemical compound Cl.CC(N)=N WCQOBLXWLRDEQA-UHFFFAOYSA-N 0.000 description 1
- PQVSTLUFSYVLTO-UHFFFAOYSA-N ethyl n-ethoxycarbonylcarbamate Chemical compound CCOC(=O)NC(=O)OCC PQVSTLUFSYVLTO-UHFFFAOYSA-N 0.000 description 1
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 1
- 229960005420 etoposide Drugs 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 230000007717 exclusion Effects 0.000 description 1
- 239000012091 fetal bovine serum Substances 0.000 description 1
- 229950003499 fibrin Drugs 0.000 description 1
- 239000012467 final product Substances 0.000 description 1
- 238000002866 fluorescence resonance energy transfer Methods 0.000 description 1
- 238000012632 fluorescent imaging Methods 0.000 description 1
- 235000019152 folic acid Nutrition 0.000 description 1
- 239000011724 folic acid Substances 0.000 description 1
- 229960000304 folic acid Drugs 0.000 description 1
- 150000002224 folic acids Chemical class 0.000 description 1
- 238000007306 functionalization reaction Methods 0.000 description 1
- 230000003371 gabaergic effect Effects 0.000 description 1
- GXCUBNRUECGTSC-UHFFFAOYSA-K gadolinium(3+);triacetate;hydrate Chemical compound O.[Gd+3].CC([O-])=O.CC([O-])=O.CC([O-])=O GXCUBNRUECGTSC-UHFFFAOYSA-K 0.000 description 1
- 229940044627 gamma-interferon Drugs 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 125000003827 glycol group Chemical group 0.000 description 1
- XLXSAKCOAKORKW-UHFFFAOYSA-N gonadorelin Chemical class C1CCC(C(=O)NCC(N)=O)N1C(=O)C(CCCN=C(N)N)NC(=O)C(CC(C)C)NC(=O)CNC(=O)C(NC(=O)C(CO)NC(=O)C(CC=1C2=CC=CC=C2NC=1)NC(=O)C(CC=1NC=NC=1)NC(=O)C1NC(=O)CC1)CC1=CC=C(O)C=C1 XLXSAKCOAKORKW-UHFFFAOYSA-N 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 229910052736 halogen Inorganic materials 0.000 description 1
- 150000002367 halogens Chemical class 0.000 description 1
- 125000001072 heteroaryl group Chemical group 0.000 description 1
- 238000000178 high-resolution electrospray ionisation mass spectrum Methods 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 125000001183 hydrocarbyl group Chemical group 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- 230000001146 hypoxic effect Effects 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- APHGZSBLRQFRCA-UHFFFAOYSA-M indium(1+);chloride Chemical compound [In]Cl APHGZSBLRQFRCA-UHFFFAOYSA-M 0.000 description 1
- PSCMQHVBLHHWTO-UHFFFAOYSA-K indium(iii) chloride Chemical compound Cl[In](Cl)Cl PSCMQHVBLHHWTO-UHFFFAOYSA-K 0.000 description 1
- 102000006495 integrins Human genes 0.000 description 1
- 108010044426 integrins Proteins 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 229940047124 interferons Drugs 0.000 description 1
- 229940047122 interleukins Drugs 0.000 description 1
- 230000007154 intracellular accumulation Effects 0.000 description 1
- 230000026045 iodination Effects 0.000 description 1
- 238000006192 iodination reaction Methods 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- PNDPGZBMCMUPRI-UHFFFAOYSA-N iodine Chemical group II PNDPGZBMCMUPRI-UHFFFAOYSA-N 0.000 description 1
- 150000002497 iodine compounds Chemical class 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- 230000001678 irradiating effect Effects 0.000 description 1
- 239000012948 isocyanate Substances 0.000 description 1
- 150000002513 isocyanates Chemical class 0.000 description 1
- 229960002725 isoflurane Drugs 0.000 description 1
- 229910052746 lanthanum Inorganic materials 0.000 description 1
- 230000003902 lesion Effects 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 102000003835 leukotriene receptors Human genes 0.000 description 1
- 108090000146 leukotriene receptors Proteins 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 229940040692 lithium hydroxide monohydrate Drugs 0.000 description 1
- GLXDVVHUTZTUQK-UHFFFAOYSA-M lithium hydroxide monohydrate Substances [Li+].O.[OH-] GLXDVVHUTZTUQK-UHFFFAOYSA-M 0.000 description 1
- 229950010610 lutetium chloride Drugs 0.000 description 1
- AEDROEGYZIARPU-UHFFFAOYSA-K lutetium(iii) chloride Chemical compound Cl[Lu](Cl)Cl AEDROEGYZIARPU-UHFFFAOYSA-K 0.000 description 1
- 150000002678 macrocyclic compounds Chemical class 0.000 description 1
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 1
- 235000019341 magnesium sulphate Nutrition 0.000 description 1
- 229910052748 manganese Inorganic materials 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 230000009061 membrane transport Effects 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- 239000002207 metabolite Substances 0.000 description 1
- 150000002739 metals Chemical class 0.000 description 1
- 230000001394 metastastic effect Effects 0.000 description 1
- 206010061289 metastatic neoplasm Diseases 0.000 description 1
- FFEARJCKVFRZRR-JJZBXVGDSA-N methionine c-11 Chemical compound [11CH3]SCC[C@H](N)C(O)=O FFEARJCKVFRZRR-JJZBXVGDSA-N 0.000 description 1
- 229940095102 methyl benzoate Drugs 0.000 description 1
- DVSDBMFJEQPWNO-UHFFFAOYSA-N methyllithium Chemical compound C[Li] DVSDBMFJEQPWNO-UHFFFAOYSA-N 0.000 description 1
- 210000003470 mitochondria Anatomy 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 229910052750 molybdenum Inorganic materials 0.000 description 1
- 210000003205 muscle Anatomy 0.000 description 1
- 230000002107 myocardial effect Effects 0.000 description 1
- 239000002105 nanoparticle Substances 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 210000000822 natural killer cell Anatomy 0.000 description 1
- 230000001613 neoplastic effect Effects 0.000 description 1
- 210000000653 nervous system Anatomy 0.000 description 1
- 229910052759 nickel Inorganic materials 0.000 description 1
- 238000001208 nuclear magnetic resonance pulse sequence Methods 0.000 description 1
- 238000000655 nuclear magnetic resonance spectrum Methods 0.000 description 1
- 108020004707 nucleic acids Proteins 0.000 description 1
- 150000007523 nucleic acids Chemical class 0.000 description 1
- 102000039446 nucleic acids Human genes 0.000 description 1
- 229960002700 octreotide Drugs 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- 229960001592 paclitaxel Drugs 0.000 description 1
- KDLHZDBZIXYQEI-UHFFFAOYSA-N palladium Substances [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 1
- YJVFFLUZDVXJQI-UHFFFAOYSA-L palladium(ii) acetate Chemical compound [Pd+2].CC([O-])=O.CC([O-])=O YJVFFLUZDVXJQI-UHFFFAOYSA-L 0.000 description 1
- 244000045947 parasite Species 0.000 description 1
- 244000052769 pathogen Species 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- 229940049954 penicillin Drugs 0.000 description 1
- 150000003904 phospholipids Chemical class 0.000 description 1
- 238000002428 photodynamic therapy Methods 0.000 description 1
- 239000002504 physiological saline solution Substances 0.000 description 1
- 238000002264 polyacrylamide gel electrophoresis Methods 0.000 description 1
- 229920001281 polyalkylene Polymers 0.000 description 1
- 238000002600 positron emission tomography Methods 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 239000000583 progesterone congener Substances 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 235000019833 protease Nutrition 0.000 description 1
- 238000001243 protein synthesis Methods 0.000 description 1
- 125000004076 pyridyl group Chemical group 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- 230000005258 radioactive decay Effects 0.000 description 1
- 229910052761 rare earth metal Inorganic materials 0.000 description 1
- 230000035484 reaction time Effects 0.000 description 1
- 239000000018 receptor agonist Substances 0.000 description 1
- 229940044601 receptor agonist Drugs 0.000 description 1
- 239000002464 receptor antagonist Substances 0.000 description 1
- 229940044551 receptor antagonist Drugs 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 239000011347 resin Substances 0.000 description 1
- 229920005989 resin Polymers 0.000 description 1
- 230000000241 respiratory effect Effects 0.000 description 1
- 239000012723 sample buffer Substances 0.000 description 1
- 239000004576 sand Substances 0.000 description 1
- 229910052706 scandium Inorganic materials 0.000 description 1
- 230000009834 selective interaction Effects 0.000 description 1
- 230000001235 sensitizing effect Effects 0.000 description 1
- 230000000862 serotonergic effect Effects 0.000 description 1
- 238000007086 side reaction Methods 0.000 description 1
- 230000019491 signal transduction Effects 0.000 description 1
- 235000012239 silicon dioxide Nutrition 0.000 description 1
- 238000004088 simulation Methods 0.000 description 1
- 150000003384 small molecules Chemical class 0.000 description 1
- ZEYOIOAKZLALAP-UHFFFAOYSA-M sodium amidotrizoate Chemical compound [Na+].CC(=O)NC1=C(I)C(NC(C)=O)=C(I)C(C([O-])=O)=C1I ZEYOIOAKZLALAP-UHFFFAOYSA-M 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- 235000010288 sodium nitrite Nutrition 0.000 description 1
- 159000000000 sodium salts Chemical class 0.000 description 1
- FVAUCKIRQBBSSJ-FXMLPJBTSA-M sodium;iodine-125(1-) Chemical compound [Na+].[125I-] FVAUCKIRQBBSSJ-FXMLPJBTSA-M 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 230000009870 specific binding Effects 0.000 description 1
- 238000010183 spectrum analysis Methods 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 238000013112 stability test Methods 0.000 description 1
- 239000012192 staining solution Substances 0.000 description 1
- 239000003270 steroid hormone Substances 0.000 description 1
- 150000003431 steroids Chemical class 0.000 description 1
- 229910052682 stishovite Inorganic materials 0.000 description 1
- 229960005322 streptomycin Drugs 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 235000000346 sugar Nutrition 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 239000013589 supplement Substances 0.000 description 1
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 229910052716 thallium Inorganic materials 0.000 description 1
- 238000004448 titration Methods 0.000 description 1
- 229960001479 tosylchloramide sodium Drugs 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 230000014616 translation Effects 0.000 description 1
- 230000017105 transposition Effects 0.000 description 1
- 229910052905 tridymite Inorganic materials 0.000 description 1
- GGUBFICZYGKNTD-UHFFFAOYSA-N triethyl phosphonoacetate Chemical compound CCOC(=O)CP(=O)(OCC)OCC GGUBFICZYGKNTD-UHFFFAOYSA-N 0.000 description 1
- 230000036326 tumor accumulation Effects 0.000 description 1
- 238000012285 ultrasound imaging Methods 0.000 description 1
- 210000000689 upper leg Anatomy 0.000 description 1
- 238000001291 vacuum drying Methods 0.000 description 1
- 229910052720 vanadium Inorganic materials 0.000 description 1
- 210000005166 vasculature Anatomy 0.000 description 1
- 239000007966 viscous suspension Substances 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 229910052727 yttrium Inorganic materials 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K51/00—Preparations containing radioactive substances for use in therapy or testing in vivo
- A61K51/02—Preparations containing radioactive substances for use in therapy or testing in vivo characterised by the carrier, i.e. characterised by the agent or material covalently linked or complexing the radioactive nucleus
- A61K51/04—Organic compounds
- A61K51/08—Peptides, e.g. proteins, carriers being peptides, polyamino acids, proteins
- A61K51/10—Antibodies or immunoglobulins; Fragments thereof, the carrier being an antibody, an immunoglobulin or a fragment thereof, e.g. a camelised human single domain antibody or the Fc fragment of an antibody
- A61K51/1093—Antibodies or immunoglobulins; Fragments thereof, the carrier being an antibody, an immunoglobulin or a fragment thereof, e.g. a camelised human single domain antibody or the Fc fragment of an antibody conjugates with carriers being antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6889—Conjugates wherein the antibody being the modifying agent and wherein the linker, binder or spacer confers particular properties to the conjugates, e.g. peptidic enzyme-labile linkers or acid-labile linkers, providing for an acid-labile immuno conjugate wherein the drug may be released from its antibody conjugated part in an acidic, e.g. tumoural or environment
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6891—Pre-targeting systems involving an antibody for targeting specific cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K49/00—Preparations for testing in vivo
- A61K49/06—Nuclear magnetic resonance [NMR] contrast preparations; Magnetic resonance imaging [MRI] contrast preparations
- A61K49/08—Nuclear magnetic resonance [NMR] contrast preparations; Magnetic resonance imaging [MRI] contrast preparations characterised by the carrier
- A61K49/10—Organic compounds
- A61K49/14—Peptides, e.g. proteins
- A61K49/16—Antibodies; Immunoglobulins; Fragments thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K51/00—Preparations containing radioactive substances for use in therapy or testing in vivo
- A61K51/02—Preparations containing radioactive substances for use in therapy or testing in vivo characterised by the carrier, i.e. characterised by the agent or material covalently linked or complexing the radioactive nucleus
- A61K51/04—Organic compounds
- A61K51/0495—Pretargeting
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K51/00—Preparations containing radioactive substances for use in therapy or testing in vivo
- A61K51/02—Preparations containing radioactive substances for use in therapy or testing in vivo characterised by the carrier, i.e. characterised by the agent or material covalently linked or complexing the radioactive nucleus
- A61K51/04—Organic compounds
- A61K51/08—Peptides, e.g. proteins, carriers being peptides, polyamino acids, proteins
- A61K51/10—Antibodies or immunoglobulins; Fragments thereof, the carrier being an antibody, an immunoglobulin or a fragment thereof, e.g. a camelised human single domain antibody or the Fc fragment of an antibody
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B82—NANOTECHNOLOGY
- B82Y—SPECIFIC USES OR APPLICATIONS OF NANOSTRUCTURES; MEASUREMENT OR ANALYSIS OF NANOSTRUCTURES; MANUFACTURE OR TREATMENT OF NANOSTRUCTURES
- B82Y5/00—Nanobiotechnology or nanomedicine, e.g. protein engineering or drug delivery
Description
ターゲット組織での遅い又は不十分な蓄積と、非ターゲット領域からの遅い消失というこの問題(特に核イメージング及び治療で)は、プレターゲット方法の適用を導くことになった。
前記レトロディールスアルダーカップリング化学は一般的には、1対の反応物を含み、これらはカップリングして不安定な中間体を形成し、前記中間体はレトロディールスアルダー反応の唯一の副生成物として小分子(これは出発物質に依存し、例えばN2、CO2、RCNなど)を除去して安定な生成物を形成する。前記一対の反応物は、1つの反応物として(即ち1つの生体直交反応性基)、テトラジンの誘導体、例えば電子欠乏テトラジンなどの好適なジエン、及び他の反応物として(即ち他の生体直交反応性基)、式(1)による歪シクロオクテンを含む。
本発明の基本的な成果は、ジエノフィルが選択されること、即ち前記の式(1)によるアキシャル置換TCO、これにより前記生体直交カップリング反応の反応速度を10倍以上増加させることができる、ということである。又は言い換えると、反応時間は当初必要とされていた時間のほんの10%である、ということである。さらに言い換えると、1つの反応物の濃度が10倍低くてよいことである。
当業者は、前記レトロディールスアルダー反応で反応性であるジエンの多くを認識する。好ましくは、ジエンは、以下式(2)から(5)に示される。
ここで、R1及びR2はそれぞれ独立して、水素、アルキル、アリール、CF3、CF2−R’、NO2、OR’、SR’、C(=O)R’、C(=S)R’、OC(=O)R’’’、SC(=O)R’’’、OC(=S)R’’’、SC(=S)R’’’、S(=O)R’、S(=O)2R’’’、S(=O)2NR’R’’、C(=O)OR’、C(=O)SR’、C(=S)OR’、C(=S)SR’、C(=O)NR’R’’、C(=S)NR’R’’、NR’R’’、NR’C(=O)R’’、NR’C(=S)R’’、NR’C(=O)OR’’、NR’C(=S)OR’’、NR’C(=O)SR’’、NR’C(=S)SR’’、OC(=O)NR’R’’、SC(=O)NR’R’’、OC(=S)NR’R’’、SC(=S)NR’R’’、NR’C(=O)NR’R’’、NR’C(=S)NR’R’’(ここでR’及びR’’はそれぞれ独立してH、アリール又はアルキルであり、R’’’は独立してアリール又はアルキルである)からなる群から選択され;Aは、N、C−アルキル、C−アリール及びN+O−からなる群から選択され;BはNであり;Xは、N、CH、C−アルキル、C−アリール、CC(=O)R’、CC(=S)R’、CS(=O)R’、CS(=O)2R’’’、CC(=O)O−R’、CC(=O)S−R’、CC(=S)O−R’、CC(=S)S−R’、CC(=O)NR’R’’、CC(=S)NR’R’’(ここでR’及びR’’はそれぞれ独立してH、アリール又はアルキルであり、R’’’は独立してアリール又はアルキルである)から成る群から選択され;Yは、CH、C−アルキル、C−アリール、N及びN+O−からなる群から選択される。
この実施態様によると、特異的第1のターゲットのイメージングが、前記プレターゲットプローブの前記第1のターゲット部の特異的な結合及びこの結合を前記エフェクタープローブに含まれる検出可能なラベルを用いて検出することにより達成され得る。
本発明で使用される「第1のターゲット」は、診断及び/又はイメージング方法で検出されるターゲット、及び/又は変更され、結合され又は医薬活性化合物、又は他の治療方法により対処されるターゲットに関連する。
プレターゲットプローブは、興味対象の前記第1のターゲットへ結合し得る部分を含む。
エフェクタープローブは、望ましい診断、イメージング、及び/又は治療の効果を与えることのできるエフェクター部分を含む。前記エフェクタープローブは第2のターゲット部分を含む。
本発明はさらに、イメージング剤と医薬をペプチドなどのターゲット構造体に共役させる経路としてレトロディールスアルダー反応を使用することに関する。前記エフェクターは、有機PET又はSPECT核ラベル化合成基、PET/SPECT/MRI用金属錯体及び超音波イメージングのためのマイクロバブルを含みことができるが、しかしまた、放射線治療用α線及びβ−線放射体及び一般に細胞毒性抗癌剤を含み得る。前記イメージング剤/治療薬は、ペンダントテトラジン又はその他の好適なジエン部分で官能基化され、前記ターゲット基が前記アキシャル置換TCO誘導体で官能基化されるか、又はそれらの逆が可能である。
全ての試薬及び溶媒は、市販品(試薬はSigma−Aldrich、 Acros、 ABCR、Invitrogen及びMerckから入手、通常及び重水素化溶媒はBiosolve、 Merck及びCambridge Isotope Laboratoriesから入手)から入手し、特に記載されていない限りさらに精製することなく使用した。1−アミノ−3,6,9,12,15,18,21,24,27,30,33,36−ドデカオキサノトリアコンタン−39−酸(21)はPolypureから入手。111In塩化物及び[125I]ヨウ化ナトリウム溶液はPerkinElmerから入手した。水は蒸留して、milli−Q水濾過システム(Millipore)で脱イオン化(18MΩcm)した。前記ラベル緩衝液は、Chelex−100樹脂(BioRad Laboratories)で一晩処理し、次に0.22μmを通して4℃で貯蔵した。Iodogenヨウ素化チューブ、ビシンコニン酸(BCA)アッセイのキット、ゲルコード青色タンパク質染色溶液及びZeba脱塩スピンカラム(40kDaMWカットオフ、0.5−2mL)はPierce Protein Research(Thermo Fisher Scientific)から入手した。リン酸緩衝生理食塩水(PBS)pH7.4を調製するための錠剤はCalbiochem (Merck)から入手した。Amicon Ultra−4及びUltra−15遠心濾過ユニット(50kDaMWカットオフ)はMilliporeから入手した。マウス血清はInnovative Researchから入手した。テトラジン28の合成及び放射性ラベル化は、Rossinらの「Angew Chem Int Ed 2010、49、3375」に記載の方法で実施した。
NMRスペクトルはCDCl3又は[D6]DMSO中で、Bruker DPX300スペクトルメータ又はBruker Avance600スペクトルメータで測定した。13CNMR多重性(q=4級、t=3級、s=2級及びp=1級)はDEPTパルスシーケンスを用いて識別した。高分解能ESIスペクトル(HRMS)は、Agilent ESI−TOF質量分析装置で、陽イオンモードで測定された。
図3aで概要が示される抗体へテトラジン誘導体部分をリンクする例として、分子1(図5参照)が合成された。E−シクロオクテンから誘導される、対応するプローブ2の例は、図6で表される。両方の分子はPEG鎖を含む。分子1はN−ヒドロキシスクシンイミド部分を含み、これは前記抗体中のアミノ基を持つ前記分子とカップリングするために使用される。分子2のDOTA誘導部分は、MRイメージングのためのGd又は核イメージング及び治療(SPECT)のためのLu−177などの希土類金属イオンを担持するために使用され得る。
この例は実施例1の分子の逆対(ペア)を示す、前記抗体へ共役した後前記プレターゲット部分を形成するための前記E−シクロオクテン誘導体3は図7に示されている。前記テトラジン/DOTA誘導体プローブ4は、図3bで概説されるエフェクタープローブとして作用し得るものであり、図8に示される。
この例は図9に示され、(E)−2、5−ジオキソピロリジン−1−イル 1−(4−((シクロオク−4−テン−1−イルオキシ)メチル)フェニル)−1−オキソ−5,8,11,14,17,20,23,26,29,32,35,38−ドデカオキサ−2−アザヘンテトラコンタ−41−ノエート(TCO−O−PEG10−N−ヒドロキシスクシンイミド(NHS)、メジャー及びマイナー異性体、それぞれ23a及び23b)の合成のスキームを示す。
1HNMR(300MHz、CDCl3):δ=8.10(d、J=8.5Hz、2H)、7.45(d、J=8.5Hz、2H)、5.60(m、1H)、5.34(m、1H)、4.54(d、J=13.4Hz、1H)、4.47(d、J=13.4Hz、1H)、3.09(m、1H)、2.91(s、4H)、2.43−1.40(m、10H);13CNMR(75MHz、CDCl3):δ=169.0(q)、161.5(q)、146.7(q)、135.1(t)、132.1(t)、130.4(t)、127.0(t)、123.7(q)、85.3(t)、68.0(s)、40.5(s)、37.7(s)、34.2(s)、32.7(s)、31.4(s)、25.4(s);HRMS(ESI、m/z):計算値:C20H23NO5Na+([M−Na]+):380.1474、実測値:380.1472。
1HNMR(600MHz、CDCl3):δ=7.79(d、J=8.2Hz、2H)、7.36(d、J=8.2Hz、2H)、7.00(s、1H)、5.59(m、1H)、5.33(m、1H)、4.49(d、J=12.5Hz、1H)、4.42(d、J=12.5Hz、1H)、3.85(t、J=6.5Hz、2H)、3.8−3.5(m、48H)、3.09(m、1H)、2.90(t、J=6.5Hz、2H)、2.85(s、4H)、2.43−1.40(m、10H);13CNMR(150MHz、CDCl3):δ=167.0(q)、165.4(q)、164.8(q)、140.8(q)、133.5(t)、131.7(q)、130.4(t)、125.3(t)、83.4(t)、68.7(s)、68.4(s)、68.0(s)、67.6(s)、68.4(s)、63.9(s)、38.9(s)、37.9(s)、36.1(s)、32.6(s)、31.1(s)、30.3(s)、29.8(s)、23.7(s);HRMS(ESI、m/z):計算値:C47H76N2O18H+([M−H]+):957.5171、実測値:957.5174。
1HNMR(300MHz、CDCl3):δ=8.10(d、J=8.5Hz、2H)、7.46(d、J=8.5Hz、2H)、5.73(m、1H)、5.52(m、1H)、4.60(d、J=13.4Hz、1H)、4.45(d、J=13.4Hz、1H)、3.65(m、1H)、2.92(s、4H)、2.43−1.10(m、10H);13CNMR(75MHz、CDCl3):δ=169.0(q)、161.5(q)、146.7(q)、135.1(t)、132.1(t)、130.4(t)、127.0(t)、123.7(q)、85.3(t)、68.0(s)、40.5(s)、37.7(s)、34.2(s)、32.7(s)、31.4(s)、25.4(s);HRMS(ESI、m/z):計算値:C20H23NO5Na+([M−Na]+):380.1474、実測値:380.1472。
この化合物は、20bを出発物質として23aと同様の方法で得られた。23bは粘稠オイルとして93%収率で得られた。1HNMR(300MHz、CDCl3):δ=7.80(d、J=8.2Hz、2H)、7.43(d、J=8.2Hz、2H)、6.83(s、1H)、5.67(m、1H)、5.55(m、1H)、4.57(d、J=12.5Hz、1H)、4.48(d、J=12.5Hz、1H)、3.85(t、J=6.5Hz、2H)、3.8−3.5(m、49H)、2.90(t、J=6.5Hz、2H)、2.84(s、4H)、2.43−0.90(m、10H);13CNMR(75MHz、CDCl3):δ=169.2.0(q)、167.6.4(q)、167.0(q)、143.4(q)、136.2(t)、133.8(q)、131.6(t)、127.4(t)、127.1(t)、74.7(f)、71.1(s)、70.9(s)、70.6(s)、70.2(s)、70.1(s)、66.1(s)、40.5(s)、40.1(s)、34.9(s)、33.3(s)、32.5(s)、30.2(s)、28.0(s)、25.9(s);HRMS(ESI、m/z):計算値:C47H76N2O18H+([M−H]+):957.5171、実測値:957.5179.
実施例4
この実施例は、(E)−2、5−ジオキソピロリジン−1−イル 1−(4−(((シクロオク−4−テ−1−ニイルオキシ)カルボニル)アミノ)フェニル)−1−オキソ−5,8,11,14,17,20,23,26,29,32,35,38−ドデカオキサ−2−アザヘンテトラコンタ−41−ノエートの合成スキームを表す図10において説明される。
N,N’−ジシクロヘキシルカルボジイミド(9.50g、0.046mol)を、小分けして、氷冷した4−アミノ安息香酸(5.84g、0.043mol)とN−ヒドロキシスクシンイミド(5.0g、0.044mol)と60mLのイソプロパノールとの混合物に添加した。室温で16時間撹拌後、前記懸濁物を濾過し、得られた固体をイソプロパノール60mL中でさらに1時間撹拌した。濾過及び真空乾燥して得られた粗固体生成物24を100mLのジクロロメタンと混合し氷冷した。トルエン中の20%ホスゲン溶液(26mL、49.4mmol)を添加及び30分間撹拌後、溶液を得た。蒸発させて得られた固体を100mLのトルエンで2回洗浄し、高真空乾燥した。4.03gの25(36%)が白色固体として得られた。固体を小分けして、35mLのジクロロメタン中10a(1.40g、11.1mmol)の溶液に添加した。懸濁液を一晩撹拌し、その後2時間40℃に暖めた。これをシリカ上でジクロロメタンで溶出し、次いでトルエンから再結晶させた後、固体の1.77の14a(41%)を得た。得られた生成物は約12%のZ異性体を含み、これはクロマトグラフ又は再結晶では除去できなかった。
1HNMR(300MHz、CDCl3):δ=8.06(d、J=8.8Hz、2H)、7.51(d、J=8.8Hz、2H)、6.82(m、1H)、5.57(m、2H)、3.48(m、1H)、2.91(s、4H)、2.40(m、3H)、2.23−1.50(m、7H);13CNMR(75MHz、CDCl3):δ=169.7(q)、161.6(q)、152.7(q)、135.2(t)、133.4(t)、132.5(t)、119.4.0(q)、117.9(t)、82.3(t)、41.3(s)、38.9(s)、34.6(s)、32.8(s)、31.3(s)、26.0(s);HRMS(ESI、m/z):計算値:C20H22N2O6Na+([M−Na]+):409.1376、実測値:409.1372
(E−メジャー)−2,5−ジオキソピロリジン−1−イル 1−(4−(((シクロオク−4−テ−1−ニルオキシ)カルボニル)アミノ)フェニル)−1−オキソ−5,8,11,14,17,20,23,26,29,32,35,38−ドデカオキソ−2−アザヘンテトラコンタ−41−ノエート27a
ジクロロメタン(2mL)中の14a(100mg、0.26mmol)溶液を、氷冷撹拌されたジクロロメタン(2mL)中の21(160mg、0.26mmol)及びトリエチルアミン(400μL、2.9mmol)へ滴下した。反応混合物を室温で16時間撹拌した。蒸発させて得られた粗中間物26aをジクロロメタン(5mL)に溶解させ、氷冷した。ビス(2,5−ジオキソピロリジン−1−イル)カーボネート(89mg、0.35mmol)を添加し反応混合物を室温で16時間撹拌した。混合物を濾過し、3mLの水で3回、3mLの食塩水で1回抽出した。硫酸マグネシウム上で乾燥した後、溶媒を揮発させて、粘稠なオイルとして1.23gの27aを得た(47%)。
1HNMR(300MHz、CDCl3):δ=7.77(d、J=8.7Hz、2H)、7.46(d、J=8.7Hz、2H)、7.16(s、1H)、6.93(s、1H)、5.56(m、2H)、4.46(m、1H)、3.84(t、J=6.5Hz、2H)、3.8−3.5(m、48H)、2.90(t、J=6.5Hz、2H)、2.84(s、4H)、2.43−1.50(m、10H);13CNMR(75MHz、CDCl3):δ=169.2(q)、167.2(q)、167.1(q)、153.2(q)、141.6(q)、135.2(t)、133.4(f)、129.3(q)、128.6(t)、118.1(t)、81.7(s)、70.9(s)、70.6(s)、70.2(s)、66.1(s)、.41.4(s)、40.1(s)、38.9(s)、34.6(s)、32.9(s)、32.5(s)、31.4(s)、28.4(s)、25.9(s);HRMS(ESI、m/z):計算値:C47H75N3O19H+([M−H]+):986.5073、実測値:986.5085.
(E−マイナー)−2,5−ジオキソピロリジン−1−イル 4−(((シクロオク−4−テ−1−ニルオキシ)カルボニル)アミノ)ベンゾエート14b
この化合物は、14aと類似の方法で、出発物質を10bとして、収率32%で得られた。10bが純粋に得られたことから、この生成物はZ異性体を含まなかった。
1HNMR(300MHz、CDCl3):δ=8.04(d、J=8.9Hz、2H)、7.55(d、J=8.9Hz、2H)、7.11(s、1H)、5.61(m、2H)、5.05(m、1H)、2.92(s、4H)、2.36(m、4H)、2.23−1.20(m、6H);13CNMR(75MHz、CDCl3):δ=169.8(q)、161.6(q)、152.7(q)、144.6(q)、135.7(t)、132.5(t)、132.1(t)、119.4.0(q)、118.0(t)、72.1(t)、41.3(s)、34.6(s)、32.9(s)、30.3(s)、28.5(s)、26.0(s);HRMS(ESI、m/z):計算値:C20H22N2O6Na+([M−Na]+):409.1376、実測値:409.1367.
(E−マイナー)−2,5−ジオキソピロリジン−1−イル 1−(4−(((シクロオク−4−テ−1−ニルオキシ)カルボニル)アミノ)フェニル)−1−オキソ−5,8,11,14,17,20,23,26,29,32,35,38−ドデカオキサ−2−アザヘンタトラコンタ−41−ノエート27b
この化合物は出発物質14bを用いて27aと類似の方法で89%収率で得られた。
1HNMR(300MHz、CDC13):δ=7.79(d、J=8.7Hz、2H)、7.54(d、J=8.7Hz、2H)、7.44(s、1H)、6.90(m、1H)、5.60(m、2H)、5.03(m、1H)、3.83(t、J=6.5Hz、2H)、3.8−3.5(m、48H)、2.89(t、J=6.5Hz、2H)、2.84(s、4H)、2.50−1.20(m、10H);13CNMR(75MHz、CDCl3):δ=169.2.0(q)、167.2(q)、167.0(q)、153.2(q)、141.6(q)、135.7(t)、132.1(t)、129.3(q)、128.5(t)、118.3(t)、71.0(s)、70.9(s)、70.6(s)、70.1(s)、66.0(s)、.41.4(s)、40.1(s)、34.6(s)、32.9(s)、32.5(s)、30.3(s)、28.4(s)、25.9(s);HRMS(ESI、m/z):計算値:C47H75N3O19H+([M−H]+):986.5073、実測値:986.5058.
実施例5
テトラジン放射性ラベル化
DOTA共役テトラジン(28;図12、Rossinらの「Angew Chem Int Ed 2010、49、3375」に記載)を、0.2M酢酸アンモニウムpH7.0中に溶解し、使用前に−80℃で保存した。28の一定量を[111In]塩化インジウム又は、[177Lu]塩化ルテチウムの適切な量と組み合わせて、ゆっくりと撹拌しつつ37℃で10分間インキュベートした。次に、5μLの10mmDTPAを添加して溶液をさらに5分間インキュベートした。支持体添加ラベル化反応を、前記テトラジンに対して0.9モル当量のInCl3又はLuCl3を添加することで実施した。通常は定量的ラベル収率及び98%を超える放射化学純度がこの方法で得られた。
ここで、続くステップと同様、全ての化合物の数字は、前記a異性体もb異性体も意味するものとする。
mAb放射性ラベル化
50μLのPBS中の[125I]ヨウ化物(5〜15MBq)の適切な量に、DMSO中のBolton−Hunter試薬(N−スクシミジル−3−[4−ヒドロキシフェニル]プロピオネート(SHPP))の1mg/mL溶液の1μL、及びPBS中のクロラミン−T(N−クロロ−4−メチルベンゼンスルホンアミド、ナトリウム塩)の4mg/mLの25μLを添加した。得られた溶液を10〜20秒混合して、5μLDMF及び100μLトルエンをバイアルに投入し、及び125I−SHPPを有機層に抽出し、次にこれをガラスバイアルに移した。トルエンをN2のゆっくりとした流れで除去し、その後CC49−TCO溶液(50〜250μLPBS中の0.1〜0.5mg)を加え、pHを1M炭酸塩緩衝液で9に調節し、及び反応混合物を室温で30分間ゆっくりと振り混ぜながらインキュベートした。インキュベート後、前記ラベル化収率を放射性−ITLCで決定した。粗反応混合物を次に、生理食塩水で前平衡化させたZebaスピン脱塩カラムに負荷した。前記反応バイアルを20μL生理食塩水でリンスし、リンスされたものも前記カラムに同様に負荷した。Zeba精製後、125I−CC49−TCO溶液の放射性純度を放射性−ITLC及びSDS−PAGEで決定し;タンパク質濃度はBCAアッセイで決定した。
反応速度
テトラジンDOTA28は、比活性3MBq/μgの担持体付加177Luで、放射線ラベル化した。177Lu−28(33nM)は、pH7.4の200μLのPBS中で37℃5分間1当量のTCOで変性されたCC49と増加する濃度(0.33、1、及び1.67μM)で反応させた。選択された時間で(15、30、45、60、90、120、180及び300秒)、20μLのサンプルを取り出し、テトラジン6(図5;Rossinらの「Angew Chem Int Ed 2010、49、3375」に記載)で失活させた(DMF中5mg/mLの1.5μL)。それぞれの混合物の一定量をSDS−PAGE及び蛍光イメージャで分析し、シクロ付加反応収率は、前記mAbに対応するバンドの放射能から決定された。係数(カウント)は、AIDA Image Analyzerソフトウェア(Raytest)で定量化した。
実施例6
インビボでのトランスシクロオクテン安定性
無腫瘍性マウス(群あたりn=3)に、CC49−PEG10−TCO−Oメジャー(CC49−23a;CC49あたり8.4TCO;マウス当たり300μg/100μL)、CC49−PEG10−TCO−Cマイナー(CC49−27b;CC49あたり3.3TCO;マウス当たりμg/100μL)及びスペーサーなしCC49−TCO−Oメジャー(CC49−20a;CC49あたり8.0TCO;マウス当たり300μg/100μL)を静脈注射した。選択された時点(注射後、1時間から4日まで)で、伏在静脈から血液サンプルが取り出され、ヘパリン含有バイアルに集められた。血液サンプルを秤量し、過剰の111In−テトラジン28が添加された。37℃で20分間インキュベートした後、一定量の血液がPBSで10倍希釈されSDS−PAGEで分析された。シクロ付加収率は、mAbに対応するバンドでの放射能から決定され、係数(カウント)はAIDA Image Analyzerソフトウェアで定量化された。それぞれの時点で血液中に存在するmAbの量(%ID/g血液)が対応する125I−CC49−TCO(マウス当たり300μg/100μL、約0.2MBq)を注射されたマウス(n=3)の3つの別の群で評価された。データは、mAbのクリアランスが補正され、t=0で100%IDTCOに標準化された。
生体内分布実験
二重同位体生体内分布実験が、PEG10スペーサー有り及び無しの125I−ラベル化CC49−TCO構成物を腫瘍保持マウス(n=3)に静脈内注射し(マウス当たり100μg/100μL、約0.2MBq)、24又は72時間後、111In−テトラジン28(マウス当たり21μg/75μL、約0.8MBq))を注射して実施した。テトラジン投与後3時間、動物をイソフルランで麻酔し頚椎脱臼により屠殺した。血液を心臓穿刺により取り出し、対象となる器官及び組織を取り出し、ドライブロッティングし秤量した。サンプルの放射能は、%ID/gを決定するための標準品と共にγ計数器で測定した。エネルギー窓は、125I及び111Inについてそれぞれ、10〜80keV、100〜510keVとした。放射性ラベル化mAb及び111In−テトラジンの分布が表2〜5に示される。
前記生体内分布データは、前記第1のCC49−PEG10−TCO−Oメジャー23aに関してスペーサーの無いCC49−TCO構成物のインビボでのより高い安定性を確認する。テトラジンの注射前にCC49−PEG10−TCOO(CC49−23a)で処理されたマウスでは、腫瘍内に存在する高いmAb量(15.81±0.22%ID/g)は、前記TCO及びテトラジンとの反応により、3.09±0.01%ID/gの177Lu蓄積を与える結果となった(表3)。残念なことに、177Lu−テトラジンと血液中循環する高濃度のmAb−TCOとの反応はまた、低腫瘍対血液比率(T/B=3.1±1.0)を与える結果となった。前記T/Bは、前記放射性ラベル化テトラジンがmAb後4日で投与される場合には、mAbクリアランスにより改善された(21.3±4.0)。しかしこの時点では腫瘍中には約4倍低い177Lu−テトラジン蓄積がまた観測された(0.86±0.39%ID/g)。絶対的なテトラジン蓄積の減少は、組織からmAb−TCOが放出された結果ではなく(10.99±4.24 %ID/gの125I−mAbはなお腫瘍に存在する)、注射の間に4日間でインビボでのTCO分解によると考えられる。
イメージング実験
腫瘍保持マウスにPEG10スペーサー無しのCC49−TCO構成物を投与した後3又は4日後に111In−テトラジン28(マウス当たり21μg/75μL、20〜50MBq)を注射した。約1時間後、マウスを麻酔し、麻酔のためのノーズコーンと呼吸モニターセンサを付けた動物ベッドに置いた。シングルフォトンエミッションコンピュータトモグラフ(SPECT)は、4ヘッドマルチピンホール小動物用SPECT/CTイメージングシステム(NanoSPECT、Bioscan Inc.)を用いてテトラジン注射後2時間で実施した。前記SPECT取得(全1時間)は、1.4mm直径ピンホールで、及び1視野当たり120〜140秒の取得時間で実施された。111Inのエネルギー窓は、245keV±15%及び171keV±20%に設定された。最初のスキャンから2から4日後、マウスを過剰麻酔により安楽死させ、第2のSPECT/CTスキャンを一晩取得した。それぞれのSPECT測定の前にCTスキャン(1投影当たり2秒、360投影)を実行して放射能分布の解剖学的情報を得た。前記取得後、データは製造者のソフトウェア(InVivoScope 1.39、 patch 1)で繰り返し再構成した。興味対象領域(ROI)は手動で、腫瘍、肝臓、腎臓及び大腿筋で3回描かれた。既知量の111Inを充填したファントムを、組織放射能定量化のためにスキャナーを較正するために使用した。CC49−TCO−Oマイナー(CC49−20b)、CC49−TCO−Oメジャー(CC49−20a)及びCC49−TCO−Cマイナー(CC49−14b)を注射された3マウスのそれぞれの時間でのイメージが、図13A〜Cにそれぞれ示される。
驚くべきことに、CC49−TCO−Cマイナーの投与の後に111In−テトラジンを注射されたマウスではむしろ低放射能取り込みが観察されたということであり、これは前記2つの処置の間の4日の遅延によると考えられる(図13C)。しかしこの場合においても、腫瘍でのシグナルは、最初のスキャン後2日でもなお存在し、このことはインビボでのディールスアルダー反応から得られるシクロ付加生成物のインビボでの安定性を確認するものである。
この実施例は、トランスシクロオクテンの種々の位置での種々の置換基のインシリコ試験に関する。種々の置換シクロオクテンについて、HOMOエネルギーをMOPACソフトウェア(Cambridge stware Mopac Pro version 8.03)を用いて計算された。得られた結果を以下表6に示す。
表6 異なる置換基についてMOPACで決定されたHOMOエネルギー。
ここで(a)はアキシャル;(e)はエカトリアルを示す。炭素原子は次の構造式により番号付けされている。
実施例10
テトラジン28の他の合成手順及び対応するGd−錯体、28−Gd
図15に、5−オキソ−5−(6−(6−(ピリジン−2−イル)−l,4−ジヒドロ−1,2,4,5−tテトラジン−3−イル)ピリジン−3−イルアミノ)ペンタン酸(30)の合成経路が示される。
1H−NMR(400MHz、DMSO−d6):δ=12.1(br.s、1H)、10.37(s、1H)、8.92(s、1H)、8.87(s、1H)、8.82(d、J=1.8Hz、1H)、8.64(d、J=4.8Hz、1H)、8.15(dd、J1=8.4Hz、J2=2.4Hz、1H)、8.0−7.9(m、3H)、7.53(dt、J1=1.8Hz、J2=4.8Hz、1H)、2.43(t、J=7.4Hz、2H)、2.29(t、J=7.4Hz、2H)、1.83(q、J=7.4Hz、2H);13C−NMR(100MHz、DMSO−d6):δ=174.2、171.6、148.6、147.3、146.3、146.1、141.4、138.9、137.4、137.2、126.6、125.3、121.3、120.9、35.3、32.9、20.2;MS(ESI、m/z):計算値:C17H18N7O3 +([M+U]+):368.15、実測値:368.25
5−オキソ−5−(6−(6−(ピリジン−2−イル)−1,2,4,5−テトラジン−3−イル)ピリジン−3−イルアミノ)ペンタン酸(6)
化合物30(166mg;0.452mmol)を酢酸(3mL)中に懸濁させ、亜硝酸ナトリウム(93.5mg;1.36mmol)を添加した。紫色懸濁液への急速な着色が観察された。撹拌15分後、反応混合物を濾過し、水(2x6mL)及びアセトン(3mL)で洗浄し乾燥して、紫色固体として生成物を得た(152mg、92%)。
1H−NMR(300MHz、DMSO−d6):δ=12.13(s、1H)、10.58(s、1H)、9.05(d、J=2.3Hz、1H)、8.94(d、J=4.2Hz、1H)、8.62(d、J=8.8Hz、1H)、8.60(d、J=8.8Hz、1H)、8.43(dd、J1=2.3Hz、J2=8.8Hz、1H)、8.16(td、J1=7.8Hz、J2=1.7Hz、1H)、7.73(ddd、J1=1.1Hz、J2=4.4Hz、J3=7.4Hz)、2.50(t、J=7.3Hz、2H)、2.33(t、J=7.3Hz、2H)、1.86(q、J=7.3Hz、2H);13C−NMR(75MHz、DMSO−d6):δ=174.1(q)、172.0(q)、163.0(q)、162.7(q)、150.6(t)、150.2(q)、143.8(q)、141.3(t)、138.4(q)、137.7(t)、126.5(t)、126.1(t)、124.8(t)、124.1(t)、35.4(s)、32.9(s)、20.2(s);HRMS(ESI、m/z):計算値:C17H16N7O3 +([M+H]+):366.1314、実測値:366.1313.
tert−ブチル(37,41−ジオキソ−41−((6−(6−(ピリジン−2−イル)−1,2,4,5−テトラジン−3−イル)ピリジン−3−イル)アミノ)−3,6,9,12,15,18,21,24,27,30,33−ウンデカオキサ−36−アザヘンテトラコンチル)カルバメート(31)
PyBOP(148mg、0.284mmol)を、6(94.4mg、0.258mmol)、アミノ−PEG10−アミノ−Boc(150mg、0.233mmol)、及びN、N−ジイソプロピルエチルアミン(新規に蒸留した。100mg、0.774mmol)のDMF(2mL)中混合物に0℃で添加した。混合物を室温に暖め、撹拌を15分間続けた。透明、暗赤色溶液を揮発させて乾燥し、生成物をクロロホルム(5mL)に再度溶解させ、0.2MのKH2PO4(pH=4.3、3.3mL)溶液及び飽和Na2CO3(2.3mL)溶液で洗浄し、その後ジエチルエーテル(20mL)中で沈殿させた。沈殿は遠心装置で収集し、シリカ上で、クロロホルム中のメタノールの勾配(0〜10%)を用いてカラムクロマトグラフにより精製し、紫色ワックス状固体として31を得た(148mg、64%)。
1H−NMR(300MHz、CDCl3):δ=9.07(d、J=2.2Hz、1H)、8.97(d、J=4.6Hz、1H)、8.73(d、J=8.8Hz、1H)、8.72(d、J=8.8Hz、1H)、8.63(dd、J1=2.3Hz、J2=8.8Hz、1H)、8.03(td、J1=7.8Hz、J2=1.7Hz、1H)、7.59(ddd、J1=1.1Hz、J2=4.6Hz、J3=7.4Hz)、7.01(s、1H)、5.14(s、1H)、3.9−3.2(broads、48H)、2.60(t、J=7.1Hz、2H)、2.37(t、J=7.1Hz、2H)、2.09(q、J=7.1Hz、2H)、1.43(s、9H);13C−NMR(75MHz、CDCl3):δ=173.8(q)、173.1(q)、163.8(q)、163.7(q)、151.3(t)、150.5(q)、144.0(q)、142.7(t)、139.2(q)、137.9(t)、127.0(t)、126.9(t)、125.5(t)、124.7(t)、79.5(q)、70.5(s)、70.1(s)、40.7(s)、39.7(s)、36.5(s)、35.5(s)、28.8(p)、21.9(s);HRMS(ESI、m/z):計算値:C46H74N9O15 +([M+H]+):992.5304、実測値:992.5301
2,2’ ,2’’−(10−(2,40,44−トリオキソ−44−((6−(6−(ピリジン−2−イル)−1,2,4,5−テトラジン−3−イル)ピリジン−3−イル)アミノ)−6,9,12,15,18,21,24,27,30,33,36−ウンデカオキサ−3,39−ジアザテトラテトラコンチル)−1,4,7,10−テトラアザシクロドデカン−1,4,7−トリイル)トリ酢酸(28)
生成物31(72.3mg、0.0727mmol)をDCM(1mL)中に溶解して、TFA(1mL)を添加した。混合物を室温で1時間撹拌した。蒸発させた後、残渣をアセトニトリル(1.5mL)に溶解し、ジエチルエーテル(15mL)で沈殿させた。紫色沈殿をろ過して分離し、32のTFA塩を定量的に得た。これをDMF(1.5mL)中に溶解し、DOTA−NHS(69.6mg、0.075mmol)及びN,N−ジイソプロピルエチルアミン(新たに蒸留した44mg、0.341mmol)を添加した。混合物を室温で30分撹拌した。透明な暗赤色/紫色溶液を揮発させて、粗生成物を水に溶解し、分取用HPLCで精製した。凍結乾燥後、28(80.5mg、収率87%を超える)が得られた。
1H−NMR(600MHz、DMSO−d6):δ=9.22(d、J=2.4Hz、1H)、9.10(dd、J1=4.7Hz、J2=1.1Hz、1H)、8.78(d、J=8.7Hz、1H)、8.75(d、J=7.8Hz、1H)、8.59(dd、J1=2.4Hz、J2=8.7Hz、1H)、8.32(td、J1=7.8Hz、J2=1.7Hz、1H)、8.08(ddd、J1i=1.1Hz、J2=4.7Hz、J3=7.8Hz)、3.9−3.1(m、80H)、2.60(t、J=7.3Hz、2H)、2.34(t、J=7.3Hz、2H)、2.02(q、J=7.3Hz、2H);13C−NMR(150MHz、DMSO−d6):δ=172.8(q)、172.5(q)、163.8(q)、163.5(q)、151.3(t)、150.9(q)、144.5(q)、142.0(t)、139.3(q)、138.5(t)、127.3(t)、126.9(t)、125.6(t)、124.9(t)、70.5(s)、70.3(s)、69.9(s)、69.5(s)、39.2(s)、36.4(s)、35.2(s)、21.7(s);HRMS(ESI、m/z):計算値:C57H92Ni3O20 +([M+H]+):1278.6582、実測値:1278.6557
28のGdIII−錯体(28−GdIII)
化合物28(204mg、0.160mmol)を水溶性酢酸アンモニウム(0.1M、pH=5.5、5mL)中に溶解し、酢酸ガドリニウム(III)水和物(96.8mg、0.239mmol)を添加した。前記混合物を室温で30分撹拌し、直ぐに分取HPLCで精製した。凍結乾燥後、GdIII−錯体が、紫色固体として得られた(188mg、82%収率)。MS(ESI、m/z):計算値:C57H89Ni13O20Gd+([M+H]+):1433.56、実測値:1433.58.
実施例11
新型テトラジンプローブの化学合成
他のテトラジン部分を持ついくつかのテトラジン型プローブが合成された。
合成経路は図16に示されている。
2−シアノ−5−トリフルオロメチル−ピリジン(200mg、1.16mmol)、2−シアノ−5−アミノ−ピリジン(300mg、2.52mmol)及び硫黄(80mg、2.52mmol)をエタノール(2mL)中、アルゴン不活性雰囲気下で撹拌した。ヒドラジン水和物(0.60g;12.0mmol)を添加し、混合物を80℃で一晩加熱した。反応混合物を冷却し、水(2mL)を添加した。遠心分離して得た固体を水/エタノール=1/2で洗浄し、乾燥して粗生成物33を135mg得た。遠心分離の上澄みを集めて水を加えることでさらに粗生成物バッチを沈殿させ(188mg)、遠心分離して乾燥させた。
この粗生成物アミン(33)及び無水酪酸(285mg、1.80mmol)を、THF(5mL)中で一晩65℃で撹拌した。反応混合物を濃縮して残渣をヘキサン/ジエチルエーテル=3/1中で撹拌した。この懸濁液をガラスフィルタで濾過し、残渣を、溶出液としてヘキサン/アセトン混合物を用いてシリカカラムクロマトグラフし、粗生成物34(約60%純度)を90mg得た。前記粗アミド化ジヒドロテトラジン34(62mg)を、THF(1.5mL)と水(2.0mL)との混合物に懸濁させた。撹拌の間に、NaNO2(88mg、1.28mmol)を添加し、その後水(1mL)中の硫酸(130mg、1.33mmol)溶液を、0℃で滴下した。赤色懸濁液への急速な着色が観察された。撹拌3分後、反応混合物をクロロホルムと水で希釈し、紫色沈殿を得、これをガラスフィルタで濾過して分離した。濾液の有機層を濃縮し、ジエチルエーテルで希釈して、第2の紫色固体生成物を析出させた。固体を一緒にして、クロロホルム及びジエチルエーテルの混合物で粉砕し、濾過して、純粋なテトラジン35(約25mg、2−シアノ−5−トリフルオロメチル−ピリジンから計算して全収率8%)を得た。
1HNMR(CDCl3/CD3OD):δ=9.2(s、1H)、8.9(d、1H)、8.75(多重シグナル、3H)、8.3(d、1H)、2.45(t、2H)、1.8(m、2H)、1.05(t、3H)ppm.19FNMR(CDCl3/CD3OD):δ=−62.9ppm.LC−MS/PDA:クロマトグラムの1つのピーク、m/z=390.2(M+H+)及び800.8(2M+Na+)、λmax=329及び526nm
3−(5−フルオロ−2−ピリジル)−6−(5−ブタンアミド−2−ピリジル)−1,2,4,5−テトラジン(38)
2−シアノ−5−フルオロ−ピリジン(100mg、0.82mmol)、2−シアノ−5−アミノ−ピリジン(200mg、1.68mmol)及び硫黄(55mg、1.72mmol)を、エタノール(1.5mL)中アルゴン不活性雰囲気下で撹拌した。ヒドラジン水和物(0.35g、7.0mmol)を添加し、混合物を90℃で一晩加熱した。反応混合物を冷却し、エタノール(5mL)を添加した。ガラスフィルタで濾過して固体を得、これをヘキサンで洗浄して、乾燥して、粗生成物36を90mg得た。
1HNMR(CDCl3/CD3OD):δ=9.25(bs、1H、NH)、8.7(s、1H)、8.5(s、1H、NH)、8.4(multiplesignals、2H)、8.2(m、1H)、8.1(m、1H)、7.95(m、1H)、7.5(m、1H)、2.4(t、2H)、1.75(m、2H)、1.05(t、3H)ppm.13CNMR(CDCl3/CD3OD):δ=172.8、161.6、159.0、146.6、146.1、143.5(d)、141.6、139.3、136.8、136.6、136.4、127.0、124.0、123.8、122.6、121.5、38.9、18.8、13.5ppm(C−Fカップリングによる、いくつかの炭素シグナルはダブレット).LC−MS/PDA:クロマトグラムの1つのピークm/z=342.1(M+H+)、λmax=288nm.
アミド化ジヒドロテトラジン37(28mg;0.082mmol)を、THF(2mL)及び水(2mL)の混合物中に懸濁させた。撹拌の間に、NaNO2(85mg;1.23mmol)、及び水(2mL)中の硫酸(120mg;1.23mmol)を0℃で滴下した。紫色懸濁液への急速な着色が観察された。撹拌3分後、クロロホルムと水を添加した。紫色のクロロホルム層を水で2回洗浄し、濃縮した。固体表面対残渣を少量のクロロホルム中で撹拌し、そこにヘキサンを添加した。ほとんど無色の上澄みをデカントし、固体を乾燥させて21mgの紫色粉末(収率75%)を得た。
1HNMR(CDCl3/CD3OD):δ=8.8(多重シグナル、5H)、7.75(m、1H)、2.45(t、2H)、1.8(m、2H)、1.05(t、3H)ppm.13CNMR(CDCl3/CD3OD):δ=173.4、162.9、162.6、162.4、159.8、146.0、143.2、141.3、139.7and139.4、138.8、126.9、125.8(d)、125.2、124.4、124.2、39.0、18.7、13.5ppm(C−Fカップリングによる、炭素シグナルのいくつかはダブレット).19FNMR(CDCl3/CD3OD):δを=−120.4ppm.LC−MS/PDA:クロマトグラムの1つのピークm/z=340.2(M+H+)、λmax=324及び529nm.
3−(2−ピリジル)−6−メチル−1,2,4,5−テトラジン(40)
2−シアノピリジン(500mg、4.8mmol)、アセタミジンヒドロクロリド(2.00g、21.2mmol)及び硫黄(155mg、4.8mmol)をエタノール(5mL)中でアルゴン不活性雰囲気下で撹拌した。ヒドラジン水和物(2.7g;55.2mmol)を添加して混合物を20℃で一晩撹拌した。混濁混合物を濾過し、濾液を蒸発乾燥させ、オレンジ色粗生成物39を2.9g得た。
1HNMR(CDCl3):δ=8.96(d、2H)、8.65(d、2H)、7.99(t、2H)、7.56(dd、3H)、3.17(s、3H)ppm.13CNMR(CDCl3):δ=168.1.163.6、150.9、150.3、137.4、126.3、123.9、21.4ppm.LC−MS/PDA:クロマトグラムから1つのピーク、m/z=174.3(M+H+)、λmax=274及び524nm.
3,6−ビス(4−ピリジル)−1,2,4,5−テトラジン(42)
4−シアノピリジン(858mg;8.24mmol)及びヒドラジン水和物(1.24g;24.7mmol)を、アルゴン不活性雰囲気下で90℃で16時間加熱した。混合物を室温に冷却し、水で希釈した。オレンジ色の沈殿(41)を濾過し、水(3mL)で洗浄し、続いてDMSO(10mL)中に溶解した。DDC(372mg;1.64mmol)をこの溶液に添加した。直ぐに暗赤色溶液が観察された。60分後、飽和水素化炭酸ナトリウム(20mL)を添加し、生成物をクロロホルムで抽出した(30mL、3回)。有機層を集めてNa2SO4で乾燥し、蒸発させて乾燥して、表題の化合物をピンク色固体として得た(52mg;4−シアノピリジンから計算した全収率5%)。
1H−NMR(CDCl3):δ=8.97(d、4H)、8.52(d、4H)ppm.LC−MS/PDA:クトマトグラムからの1ピーク、m/z=237.2(M+H+)、λmax=271及び523nm.
実施例12
さらなるトランスーシクロオクテン構成物の化学合成
詳細な合成経路は図17に示される。
THF(40mL)中の10a(1.73g、13.73mmol、約10%のシス異性体が混入)の氷冷溶液に、オイル中の水素化ナトリウム(60%、2.60g、65.0mmol)を添加した。室温で15分間混合物を撹拌した後、50℃で1時間加熱した。混合物を氷冷し、ブロモ酢酸(2.50g、17.9mmol)を添加した。得られた懸濁液を1時間氷冷して撹拌し、その後約25℃で64時間撹拌し、さらにTHFを撹拌可能にするために添加した(合計約100mL)。50℃で1時間加熱後、混合物を冷却し水をゆっくりと添加した。ロータリーエバポレーターでほとんどのTHFを除去し、さらに水を加えた(合計50mL)。水性混合物を、MTBEで抽出し(2x75ml)、その後有機層を25mLの水で洗浄した。水性層を集めて、16gのクエン酸で酸性化し、生成物を2x75mLのMTBEで抽出した。乾燥しロータリーエバポレーターで除去し、残渣をカラムクロマトグラフで精製した(40g、SiO2)。生成物画分を集め、痕跡量のMTBEを含むヘプタンから再結晶させた。これにより810mgの生成物43aを得た(810mg、4.40mmol、32%少量のシス異性体を含む)。
1H−NMR(CDCl3):δ=1.4−2.45(m、10H)、3.1−3.2(m、1H)、3.9−4.1(AB、2H)、5.3−5.65(m、2H).
生成物43aを30mLのジクロロメタンに溶解した。N−ヒドロキシコハク酸イミド(715mg、6.22mmol)を添加し、混合物を氷冷した。DCC(1.42g、6.89mmol)を添加し、混合物を氷冷して30分撹拌し、その後室温で4時間撹拌した。濾過して、ロータリーエバポレーターで濃縮し、40gのシリカ上で、ヘプタン/酢酸エチル勾配を使用するクロマトグラフにより、44aを得た。生成物画分を集め、少量のMTBEを含むヘプタンから再結晶した。生成物はこすると結晶化した。濾過後、生成物180mgが得られた(0.64mmol、15%、シス異性体が約20%混在)。
1H−NMR(CDCl3):δ=1.4−2.45(m、10H)、2.8(s、4H)、3.1−3.2(m、1H)、4.3(s、2H)、5.3−5.65(m、2H).
(E−マイナー)−2,5−ジオキソピロリジン−1−イル 2−(シクロオク−4−テン−1−ニルオキシ)アセテート(44b)
THF(30mL)中の10b(0.78g、6.19mmol)の氷冷溶液に、オイル中の水素化ナトリウム(60%を超える、0.94g、23.5mmol)を添加した。室温で15分間混合物を撹拌した後、50℃で1時間加熱した。混合物を氷冷し、ブロモ酢酸(1.41g、10.14mol)を添加した。この懸濁液を約25℃で20時間撹拌し(サンプルはカップリングが生じていないことを示した)、続いて55℃で6時間、25℃で3日間、さらに6時間55℃で撹拌した。ロータリーエバポレーター及び50mL MTBEにより、次いで氷及び25mL水によりほとんどのTHFを除去した。層分離させ、水層を30mLのMTBEで抽出した。有機層を合せて25mLの水で洗浄した。水層を合せて氷で冷却し、50mLのMTBEを添加し、続いて5.1gのクエン酸を添加した。層分離させ、水層を50mLのMTBEで抽出した。乾燥させロータリーエバポレーターで濃縮して得られた残渣(43b)を次のステップに使用した。
1H−NMR(CDCl3):δ=1.2−2.45(m、10H)、3.65−3.75(m、1H)、4.1(s、2H)、5.45−5.65(m、2H).
生成物43bを30mLのジクロロメタンに溶解した。N−ヒロソキシスクシンイミド(1.60g、13.91mmol)を添加し、混合物を氷冷した。DCC(3.11g、15.10mmol)を添加し、混合物を氷冷して30分、その後室温で3時間撹拌した。濾過して、ロータリーエバポレーターで濃縮し、40gのシリカ上で、トルエン及び次いでジクロロメタンを溶出溶媒として用いてクロマトグラフして44bを得、これをブロモ酢酸のNHSエステルと混合した。混合物を25mLMTBE中に溶解させ、25mLのヘプタンを溶液に添加した。2時間撹拌後、混合物を濾過した(固体はブロモ酢酸のNHSエステル)。濾液をロータリーエバポレーターし、残渣を暖めたMTBEに溶解し、いくらかのヘプタンを添加して溶液を室温に冷却した。これにより沈殿を得た。ろ過して生成物44bを30mg得た(0.11mmol、2%)。
1H−NMR(CDCl3):δ=1.1−2.45(m、10H)、2.85(s、4H)、3.65−3.75(m、1H)、4.4(s、2H)、5.4−5.7(m、2H).
(E−メジャー)−2,5−ジオキソピロリジン−1−イル 2−(シクロオク−4−テン−1−イルオキシ)−2−フェニルアセテート(46a)
THF(40mL)中の10a(3.0g、23.8mmol、10%未満のシス異性体混入)溶液にオイル中の60%NaH(3.0g、75.0mmol)を添加した。混合物を室温で10分間撹拌し、1.5時間50℃に加熱した。氷冷後、DL−2−ブロモフェニル酢酸(3.87g、18.0mmol)を小分けにして添加した。THF(20mL)を得られた濃いペースト状物に添加し、得られた懸濁液を25℃で18時間撹拌した。THFのほとんどをロータリーエバポレーターで55℃で除去した後、55mLのMTBEを加えた。混合物を冷水で冷却して、いくらかの氷を加え、続いて50mLの水を添加した。層を分離し、水層を50mLのMTBEで抽出した。連続した有機層を25mLの水で洗浄した。水層を集めて氷冷し、50mLのMTBEを添加し、続いて10gのクエン酸を加えた。層を分離し、水層を50mLのMTBEで抽出した。乾燥してロータリーエバポレーターして残った5.05gの生成物45aをそのまま次のステップに使用した。
1H−NMR(CDCl3):δ=1.2−2.45(m、10H)、3.05−3.15(m、1H)、4.8(2s、1H)、5.15−5.3(m、1H)、5.45−5.65(m、1H)、7.3−7.5(m、5H).
生成物45aを50mLのジクロロメタンに溶解した。N−ヒドロキシスクシンイミド(2.51g、21.8mmol)を添加して、混合物を氷冷した。DCC(5.03g、24.4mmol)を添加し、混合物を氷中で15分、その後室温で3時間撹拌した。濾過、ロータリーエバポレーター、さらにトルエン/ジクロロメタン勾配を使用する55gのシリカ上でクロマトグラフにより、2.8gの46aを得た(7.83mmol、10aに基づき33%収率、約5%のシス異性体が混入)。
1H−NMR(CDCl3):δ=1.4−2.45(m、10H)、2.7(s、4H)、3.25−3.35(m、1H)、3.35−3.45(m、1H)、5.2(s、2H)、5.35−5.65(m、2H9、7.35−7.55(m、5H).
(E−マイナー)−2,5−2,5−ジオキソピリジン−1−イル 2ー(シクロオク−4−テ−1−ニルオキシ)−2−フェニルアセテート(46b)
0℃におけるTHF(60mL)中の10bの溶液(1.0g、7.9mmol)に、オイル中60%NaH(1.26g、31.5mmol)を添加し、その混合物を1.5時間50℃に加熱した。0℃に冷却後、DL−2−ブロモフェニル酢酸(2.22g、10.3mmol)を、THF(5mL)中の溶液として添加し、粘稠懸濁液を激しく室温で16時間撹拌した。さらに24時間40℃で加熱した後、混合物を水(100mL)中のクエン酸(9.2g)溶液中へ投入した。水性混合物をMTBEで抽出し(3x50mL)、Na2SO4で乾燥し、溶媒を蒸発させて黄色油状物を得た。カラムクロマトグラフィ(SiO2、CH2Cl2/MeOH2%)で精製し、生成物、未反応TCO及び副生成物の混合物を得た。さらなる精製は、MTBE及び33%NaOH溶液で塩基性にした水中に溶解することにより達成された。水層をMTBEで洗浄し、クエン酸で酸性化し、ついでMTBEで抽出した(3x)。有機層を集めてNa2SO4で乾燥し、溶媒を蒸発させて、化合物45bを黄色油状物として得た(463mg、1.8mmol、23%収率)。
1H−NMR(CDCl3):δ=1.2−2.45(m、10H)、3.7−3.8(m、1H)、4.9及び4.95(2s、1H)、5.4−5.7(m、2H)、7.3−7.55(m、5H).
45b(463mg、1.8mmol)及びN−ヒドロキシスクシンイミド(250mg、2.2mmol)のTHF(9mL)溶液に、0℃で、DCC(372mg、1.8mmol)のTHF(2mL)中溶液を添加した。反応混合物を室温で16時間撹拌し、その後沈殿を濾過により除去した。濾液を真空で濃縮しカラムクロマトグラフィ(SiO 2 、ヘプタン/酢酸エチル勾配25%〜40%)により精製して、46b(451mg、1.3mmol、71%収率)で無色シロップ状物として得た。
1H−NMR(CDCl3):δ=1.1−2.6(m、10H)、2.8(s、4H)、3.8−3.9(m、1H)、5.2and5.3(2s、2H)、5.4−5.75(m、2H)、7.3−7.6(m、5H).
(E−メジャー)−2,5−ジオキソピロリジン−1−イル 2−(シクロオク−4−テ−1−ニルオキシ)−2−メチルプロパノエート(49a)
氷浴中で冷やされたTHF(120ml)中の10a(3.0g、23.8mmol)の溶液に、オイル中の60%水素化ナトリウム(3.8g、95mmol)を添加した。氷冷バスを取り除き、混合物を室温で30分間撹拌し、次に50℃で1時間撹拌した。氷冷後、D9−ブロモプロピオン酸(3.3mL、35.6mmol)をゆっくりと添加した。混合物は添加の間に非常に粘稠となり、THF(50mL)で希釈した。添加を完了した後氷冷バスを外し、反応混合物を室温で16時間撹拌した。反応の進行は、NMRで追跡し、16時間後40%の変換が示された。反応混合物を次にさらに24時間35℃で撹拌して84%の変換を達成した。反応混合物を真空で濃縮し、MTBEで希釈し、その後水(200mL)で失活させた。層を分離させ、水層を水(60mL)中のクエン酸(22.5g)の溶液で酸性化した。水性層をMTBEで抽出した(3x200mL)。有機層を合せて、Na2SO4で乾燥させ、溶媒を蒸発させて、47aを含む混合物(5.19g)を得た。これをさらに精製することなく次のステップで使用した。
1H−NMR(CDCl3):δ=1.1−2.45(m)、1.4(d)(13H)、3.1−3.2(m、1H)、3.9−4.0(q、1H)、5.3−5.65(m、2H).
−70℃でTHF(200mL)中のジイソプロピルアミンの溶液(13mL、92mmol)に、ヘキサン中2.5Mのn−ブチルリチウム(32mL、80mmol)をゆっくりと添加した。混合物をゆっくりと−20℃に暖め、再び−70℃に冷却した。化合物47a(5.19g)をTHF溶液として添加し、得られた混合物を−20℃に暖めた。この温度でヨードメタン(10.7mL、1.72mmol)を添加し、混合物を5℃に暖めた。サンプルを取り、NMR分析によれば、反応は完了した。反応混合物を水(200mL)中のクエン酸(40g)溶液中に注ぎ、MTBEで抽出した(3x150mL)。有機層を集めて水溶性クエン酸で及びブラインで洗浄した。Na2SO4上で乾燥した後溶媒を蒸発させて黄色オイル状物を得た(9.4g)。カラムクロマトグラフィ(SiO2、CH2Cl 2/MeOH1〜4%勾配)で精製し、純粋な48aを黄色シロップ状物として得た(1.15g、5.4mmol、2ステップで収率23%)。
1H−NMR(CDCl3):δ=1.1−2.45(m)及び1.4(2s)(16H)、3.2−3.3(m、1H)、5.3−5.7(m、2H).
48a(1.15g、5.4mmol)及びN−ヒドロキシスクシンイミド(622mg、5.4mmol)のTHF(27mL)中溶液に、0℃で、DCC(1.12g、5.4mmol)のTHF(5mL)中溶液を添加した。添加後、混合物を室温に暖め、その温度で16時間撹拌した。混合物をMTBEで希釈し、沈殿を濾過して除いた。溶媒を蒸発させた後残渣をカラムクロマトグラフィ(SiO2、ヘプタン/酢酸エチル20〜40%勾配)で精製した。ヘプタン/酢酸エチルから結晶化により、49aを無色結晶として得た(707mg、2.3mmol、収率42%)。
1H−NMR(CDCl3):δ=1.5−2.4(m)、1.55(s)、1.60(s)(16H)、2.85(s、4H)、3.2−3.3(m、1H)、5.4−5.65(m、2H).
(E−マイナー)−2,5−ジオキソピロリジン−1−イル 2−(シクロオク−4−テ−1−ニルオキシ)−2−メチルプロパノエート(49b)
氷冷したTHF(60m)中の10b(1.5g、11.9mmol)の溶液中に、60%オイル中の水素化ナトリウム(1.5g、11.9mmol)を添加した。氷冷バスを外して混合物を50℃で1.5時間撹拌した。氷冷して、DL−ブロモプロピオン酸(1.7mL、17.8mmol)をゆっくりと添加した。混合物は添加の間に非常に粘稠になり、THF(35mL)で希釈した。添加を終了後、氷冷バスを外し、反応混合物を室温で16時間撹拌した。混合物は次に43℃にさらに24時間加熱した。反応混合物を真空で濃縮し、MTBEで希釈し、水で失活させた(200mL)。層分離させ、水性層を水中のクエン酸で酸性化した。水性層をMTBEで抽出した(3x100mL)。有機層を集め、Na2SO4で乾燥し、溶媒を蒸発させて47bを含む混合物を得た(2.26g)。その物質はさらに精製することなく次のステップで使用した。
1H−NMR(CDCl3):δ=1.2−2.5(m)及び1.5(2d)(13H)、3.65−3.75(m、1H)、3.95−4.15(2q、1H)、5.4−5.65(m、2H).
THF(100mL)中のジイソプロピルアミン(5.6mL、39.6mmol)の溶液中に、−70℃で、ヘキサン中2.5Mのn−ブチルリチウム(13.5mL、33.8mmol)をゆっくりと添加した。混合物を次に0℃にゆっくり暖め、再び−70℃に冷却した。THF中の溶液として化合物47b(2.26g)を添加し、混合物を−20℃に暖めた。この温度で、ヨードメタン(4.6mL、73.9mmol)を添加し、この混合物を15℃に暖めた。サンプルを取り、NMR分析によれば反応は終了した。反応混合物を水(140mL)中のクエン酸(20g)に注ぎ、MTBEで抽出した(3x100mL)。有機層を集めて、水性クエン酸で及びブラインで洗浄した。Na2SO4で乾燥後、溶媒を蒸発させて黄色シロップ状物を得た(4.6g)。カラムクロマトグラフィ(SiO2、CH2 Cl 2/MeOH1%〜4%勾配)で繰り返し精製して純粋な48bを白色結晶性固体として得た(181mg、0.85mmol、2ステップで収率7%)。
1H−NMR(CDCl3):δ=1.1−2.45(m)及び1.45(2s)(16H)、3.9−4.0(m、1H)、5.45−5.65(m、2H).
THF(5mL)中の48b(181mg、0.85mmol)とN−ヒドロキシスクシンイミド(98mg、0.85mmol)との溶液に、0℃でDCC(175mg、0.85mmol)のTHF中溶液を添加した。添加後、混合物を室温に暖め、その温度で5時間撹拌した。混合物をMTBEで希釈し、沈殿を濾過して除いた。蒸発後の残渣をカラムクロマトグラフィ(SiO2、ヘプタン/酢酸エチル25%勾配)で精製して、49bを白色固体として得た(257mg、0.83mmol)。
1H−NMR(CDCl3):δ=0.8−2.6(m)、1.55(s)、1.60(s)(16H)、2.85(s、4H)、3.8−3.9(m、1H)、5.4−5.7(m、2H)
(E−メジャー)−2,5−ジオキソピロリジン−1−イル 4−(シクロオク−4−テ−1−ニルオキソ)ベンゾエート(52a)
THF(50mL)中の10a(3.54g、27.38mmol)の氷冷溶液にオイル中水素化ナトリウム(60%、2.5g、62.5mmol)を添加した。混合物を15分間氷中で撹拌し、その後50℃に1時間加熱した。混合物を氷冷して、5mLのTHF中に溶解された4−フルオロベンゾイルクロリド(1.72g、10.84mmol)を、5分間にわたり添加した。混合物を2日間25℃で撹拌し(サンプルのNMRは多くの生成物を示したが、また4−フルオロ安息香酸のTCOエステルの存在も示した)、その後3時間50℃で撹拌した。混合物を水で冷却し、10mLの水をゆっくりと添加し、次に2gの水酸化ナトリウム及び5mLの水を添加した。ロータリーエバポレーターで溶媒をほとんど除去し、THF及び2gの水酸化ナトリウムを添加し、混合物を50℃で4時間暖めた。ロータリーエバポレーターでほとんどの溶媒を除去し、メタノールを残渣ペースト状物に添加した。混合物を50℃で2時間温め、次にロータリーエバポレーターで55℃で暖めた。残渣懸濁物を50mLの水で希釈した。MTBE(100mL)を添加し、前記層を分離して有機層を水25mLで洗浄した。有機層は、a.o.トランスシクロオクテノールを含有する。氷冷した水性層を集めて、20gのクエン酸で処理し、生成物を2x75mLのMTBEで抽出した。乾燥してロータリーエバポレーターで溶媒を除去して得られた固体残渣は、生成物と4−フルオロ安息香酸を含んでいた。前記固体を40mLのメタノールで暖めた。水(15〜20mL)をゆっくりと前記暖かい溶液に、濁りが生じるまで添加した。濾過及び濾液を冷却することで生成物を沈殿させた。これを濾過し、1/1のメタノール/水で洗浄し、真空乾燥して、望ましい生成物51aを0.827g得た(3.36mmol,4−フルオロベンゾイルクロリドから計算して収率30%)。
1H−NMR(CDCl3):δ=1.5−2.5(m、10H)、4.0−4.1(m、1H)、5.45−5.75(m、2H)、6.8(d、2H)、8.05(d、2H).
メジャートランス酸51a(1.14g、4.63mol)及びN−ヒドロキシスクシンイミド(725mg、6.30mmol)の50mLジクロロメタン中の氷冷混合物を、DCC(1.46g、7.08mmol)で処理した。混合物を1時間氷中で撹拌し、次に室温で3時間撹拌した。濾過、回転式蒸発、及び40gのシリカゲル上でヘプタン/酢酸エチル勾配を用いるクロマトグラフィにより、シス異性体で汚染された52aの画分を得た。次の生成物画分と合せ、ヘプタンと酢酸エチル混合物と共に60℃に暖めた。懸濁液を室温へ冷却し、次に濾過した。これにより生成物52aを0.973g得た(2.83mmol、61%)。
1H−NMR(CDCl3):δ=1.6−2.5(m、10H)、2.85(s、4H)、4.0−4.1(m、1H)、5.45−5.75(m、2H)、6.8(d、2H)、8.05(d、2H).
(E−マイナー)−2、5−ジオキソピロリジン−1−イル 4−(シクロオク−4−テ−1−ニルオキシ)ベンゾエート(52b)
THF(40mL)中の10b(2.82g、22.38mmol)の氷冷溶液にオイル中水素化ナトリウム(60%、2.0g、50mmol)を添加した。混合物を氷中で15分間、室温で30分間撹拌し、その後50℃に1時間加熱した。混合物を氷冷して、8mL THF中に溶解された4−フルオロベンゾイルクロリド(1.72g、10.84mmol)を、15分間で添加した。混合物を18時間室温で撹拌し(サンプルのNMRは多くのトランスシクロオクテノールの存在を示した)、その後50℃6時間で、25℃で3日間、及び50℃でさらに1時間撹拌した。水5mL中の2.0gの水酸化ナトリウム溶液をゆっくりと添加し、次に5mLの水を添加した。ロ回転式蒸発によりTHFをほとんど除去し、40mLのメタノールを得られるペーストに添加した。混合物を50℃で3時間温め、20mLのTHFを添加し、加熱を4時間続けた。混合物を一晩25℃で撹拌し(NMRは、なお少量のエステルの存在を示した)、次に4時間50℃に加熱し、続いてロータリーエバポレーター蒸発させた。残留懸濁物を50mLの水で希釈した。MTBE(100mL)を添加し、層を分離し、有機層を25mLの水で洗浄した。有機層は、a.o.トランスシクロオクテノールを含む。合せて氷冷した水性層を15gのクエン酸で処理し、生成物を2x75mLのMTBEで抽出した。乾燥及びロータリーエバポレーター蒸発させて得られた固体残渣は生成物と4−フルオロ安息香酸との混合物からなっていた。固体を40mLのメタノールで暖めた。水(25mL)を、前記暖めた溶液中にゆっくりと添加し、続いて室温へ冷却し、次いで一晩撹拌した。濾過し、1/1のメタノール/水で洗浄し、真空乾燥して、望む生成物51bを0.76g得た(3.09mmol、4−フルオロベンゾイルクロリドに基づき28%)。
1H−NMR(CDCl3):δ=1.3−2.6(m、10H)、4.55−4.65(m、1H)、5.55−5.85(m、2H)、6.9(d、2H)、8.05(d、2H).
前記マイナートランス酸51b(0.66g、2.68mmol)及びN−ヒドロキシスクシンイミド(460mg、4.0mmol)の50mLジクロロメタン中氷冷混合物を、DCC(460mg、4.61mmol)で処理した。混合物を氷中で1時間撹拌し、次に室温で16時間撹拌した。濾過、回転式蒸発、及びジクロロメタンを溶出溶媒として用いる30gのシリカゲル上でクロマトグラフィ。生成物を5mLの酢酸エチルに溶解した。ヘプタンを添加し、溶液を沈殿が現れるまで部分的に60℃で回転式蒸発した。ヘプタンを加えて混合物を5分間60℃で撹拌し、次に室温へ冷却した。濾過して、生成物52bを0.437g得た(1.27mmol、47%)。
1H−NMR(CDCl3):δ=1.4−2.6(m、10H)、2.9(s、4H)、4.55−4.65(m、1H)、5.55−5.8(m、2H)、6.9(d、2H)、8.05(d、2H).
(E−メジャー、マイナー)2,5−ジオキソピロリジン−1−イル 2−メチルシクロオク−4−テン−1−イル)アセテート(58)
過酸化水素(25mL、300mmol)の35%溶液を、酢酸パラジウム(45%Engelhard、1.0g、2mmol)、ベンゾキノン(432mg、4mmol)及び1,5−シクロオクタジエン(27mL、200mmol)の混合物へ添加した。混合物を30℃で5日間、NMR分析が出発物質の95%変換を示すまで撹拌した。混合物をEt2O(1L)中へ注ぎ、水を添加した(1L)。混合物を、氷冷しながら、33%のNaOH溶液でゆっくりと塩基性とした。層を分離し、水性層をEt2Oで抽出した(2x)。有機層を合せて、1NのNaOHで2回洗浄し、Na2SO4で乾燥した。溶媒を注意して蒸発させて、粗生成物53を黄色オイル状物として得た(16.1g、130mmol、収率65%)。
1H−NMR(CDCl3):δ=0.8−1.9(m)、1.05(s)及び1.25(t)(16H)、2.15−2.3(m、2H)、4.0−4.2(q、2H)、5.4−5.55(m、1H)、5.65−5.75(m、1H).
水銀ランプを備え、及びポンプと、10%硝酸銀(I)含浸シリカゲル(36g、底部にはいくらかの通常グレードのシリカゲルを含む)を充填したカラムに接続されたフラスコに、ヘプタン/Et2O(3:1体積/体積)(約500mL)を充填した。55(4.47g、21.3mmol)及びメチルベンゾエート(2.7mL、21.3mmol)の少量のEt2O中の溶液を添加した後、水銀ランプのスイッチを入れた。前記カラムを通じる照射溶液の連続流に20時間照射した後、反応器の内容についてNMR分析で出発物質がもはや観測されなくなり、カラムをヘプタン中30%のMTBEで洗浄した。前記カラム内容物をアンモニアで処理し、CH2Cl2で抽出した(3x).有機層を合せてNa2SO4で乾燥し、溶媒を蒸発させた後、カラムクロマトグラフィ(SiO2、ヘプタン/酢酸エチル3%〜4%勾配)で精製して、無色オイルとして化合物56を得た(1.41g、6.7mmol、収率31%)。前記メジャー及びマイナー異性体は分離されず、従って、これらの異性体は混合物としてさらに使用した。
1H−NMR(CDCl3):δ=0.8−1.9(m)、1.0(s)及び1.25(t)(16H)、2.1−2.4(m、2H)、4.0−4.2(q、2H)、5.5−5.65 (m、2H).
水(1mL)及びEtOH(1mL)中の水酸化リチウム1水和物(84mg、2.0mmol)を56(210mg、1.0mmol)に添加した。前記化合物をより溶解させるために、THF(1mL)及びMeOH(2mL)を添加した。室温で16時間撹拌後、変換はなお完了しなかった。追加の水酸化リチウム(85mg)を添加して、混合物を45℃に4時間加熱し、30℃で16時間及び50℃で4時間、変換が完了するまで加熱した。混合物を真空で濃縮し、クエン酸溶液で中和した。MTBEで抽出(3x)し、Na2SO4で乾燥し、ロータリーエバポレーターで溶媒を蒸発させて、57を黄色オイル状物として得た(150mg、0.82mmol、収率82%)。
1H−NMR(CDCl3):δ=1.0(2s、3H)、1.3−2.0(m、10H)、2.1−2.45(m、2H)、5.5
5.65(m、2H).
57(150mg、0.82mmol)及びN−ヒドロキシスクシンイミド(113mg、0.98mmol)の氷冷THF(5mL)中溶液に、DCC(170mg、0.82mmol)のTHF(1mL)溶液を添加した。混合物を室温で16時間撹拌し、その後MTBEで希釈した。沈殿を濾過して除去し、溶媒を蒸発させた後、カラムクロマトグラフィ(SiO2、ヘプタン/酢酸エチル10%〜30%勾配)で精製し、無色オイル状物として化合物58を得た(197mg、0.71mmol、86%収率)。
1H−NMR(CDCl3):δ=1.05and1.1(2s、3H)、1.35−2.35(m、10H)、2.4(s、1H)、2.5−2.75(AB、1H)、2.85(s、4H)、5.5−5.65(m、2H).
実施例13
新規なTCOの反応速度論
新規に合成したTCO構成物がそれぞれのテトラジン28に対する反応性について評価された。手順は実施例5に記載されている。
全てのTCOについて、前記メジャー(エカトリアル)及びマイナー(アキシャル)異性体の間に重要(profound)且つ一貫した一定の反応性の違いがあり、マイナー異性体がメジャー異性体よりもずっと反応性が高い。さらに、TCO58の高い反応性は、抗体へのリンカーなしでもアキシャル位置での置換はなお、トランスシクロオクテン環の増加した反応性を与えること、を支持する。
新規モデルテトラジンプローブの安定性と反応性
他のテトラジン部分を含むいくつかのテトラジンモデルプローブが、水中でのそれらの反応性及び安定性につき評価された。
テトラジンの加水分解安定性試験
DMSO中の特定のテトラジンの溶液(25mM)10μLをPBS緩衝液(3mL)で希釈し、この溶液を濾過した。
UVスペクトル分析を用いて、525nmの吸収バンドの減少をモニタし、このデータから加水分解速度及び半減期を決定した。
テトラジンの、トランス−シクロオク−4−テン−1−オール(マイナー異性体、10b)に対する反応性
競争実験を、特定テトラジン及び3−(5−アセタミド−2−ピリジル)−6−(2−ピリジル)−1.,2,4,5−テトラジン(これは標準テトラジンとして選択された)との反応性の比率を、トランス−シクロオク−4−テン−1−オール(マイナー異性体、10b)との逆−電子要求ディールスアルダー反応において、決定するために実施した。
メジャー対マイナーTCO、20a対20bのテトラジンプローブ28との、インビトロ反応性の違い
この実験は、より高いTCO反応性は、放射性ラベル化テトラジンと、両方の試薬が低濃度でより高い反応収率を与える、ということを示すために実施された。この目的で、我々は、CC49(メジャー及びマイナーそれぞれの分子当たり6.1及び6.6TCO)と共役したTCOメジャー20a(k2= 19600±1400 M−1s−1)及びTCOマイナー20b(k2=136700±2300M−1s−1)を用いた。TCO濃度1x10 −5 Mから1x10 −8 Mの範囲を得るため、2つのmAb溶液をPBSで希釈し、、支持体付加177Lu−テトラジン(mAbに対して1当量)と37℃で1分間反応させた。その後過剰のテトラジン6で失活させた前記反応混合物の一部(20μL)に、非還元性サンプル緩衝液を加えSDS−PAGEで分析した。シクロ付加反応は、前記mAbに対応するバンドの放射能から決定し、計数(カウント)をAIDA Image Analyzerソフトウェアで定量化した。実験は3回繰り返した。生体分子反応について予期されるように、溶液中での2つの反応種の濃度における減少は、1分のインキュベート後ではより低い反応収率となる(図18)。しかし、アキシャルTCO20bを用いる場合には、反応収率は、エカトリアルTCO20aでマイクロモル濃度以下で得られるよりもずっと高く、これはテトラジンとのより速い反応速度によるものである。
TCO20bのインビボ安定性
この実験は、実施例6で説明した一連のインビボTCO安定性測定を拡張するために実施された。この一連において、PEGスペーサーでCC49と結合されたTCOメジャー及びマイナー(23a及び27b)はインビボでは不安定であることが示され、一方PEGスペーサのないTCOメジャー(20a)は、少なくとも4日間インビボで安定であることが見出された(図13)。新たな実験では、同じ手順に従って、我々は、PEGスペーサなしでCC49−結合TCOマイナーのインビボ安定性を試験した(20b、6.9当量結合)。mAbクリアランスで補正されたインビボ安定性データは、図19に示される。前記CC49−結合TCO20bは、インビボではもっぱらゆっくりと分解されることが見出され、さらに、抗体との短いリンカーを持つTCOはインビボでは、より長いリンカーで共役されたTCOよりもより安定であることが見出された。
TCO20b部分の範囲で官能化されたCC49抗体の血中動態及び生体内分布
一連の研究が、CC49分子当たりのTCO(20b)の数の、血液循環及び腫瘍ターゲットに対する影響の評価するために実施された。予想されることは、多すぎるTCO部分で抗体を修飾することは血液循環半減期を下げることとなり、CC49−TCO構成物の腫瘍取り込みに影響を与えるであろう、ということである。
CC49−TCO構成物の血中動態(図20及び21参照)
ヌードメスBalb/Cマウス(20〜25g体重、Charles River Laboratories、n=3)に、mAb(マウス当たり100μg/100μL、約0.5MBq)当たり0、4.9、9.3または15.8TCO(20b)を担持する125I−CC49を注射した。選択された時間(5分、3時間、6時間、1日、2日、3日)で、血液サンプルを伏在静脈から取り出し、秤量して1mLPBSで希釈した。mAb注射後4日で、動物は麻酔され頚椎脱臼で屠殺し、血液を心臓穿刺で集め、興味対象である器官及び組織を取り出し、乾燥ブロットし、秤量し1mLPBSを添加した。全てのサンプルの放射能がガンマカウンター(Wizard II、 Perkin Elmer)で、1グラムの組織当たりの注入された投与量(%ID/g)を決定するための標準品とともに測定した。血液中のCC49−TCO構成物の半減期は、GraphPad Prism (version 5.01)を用いて、血液曲線を2相減衰にフィッティングさせて決定した。
CC49−TCO(20b)構成物の腫瘍ターゲット
腫瘍保持マウス(方法を参照;100mm3腫瘍サイズ)に、mAb(マウス当たり100μg/100μL、約0.2〜0.4MBq、n=4)当たり、0、8.5、12.7又は18.7TCO20bグループで官能基化された125I−CC49を注射した。125I−CC49を受けたマウスをmAb注射後4日で屠殺した。125−CC49−TCO20bを受けたマウスは、mAb注射後28及び72時間後に111In−DOTA−テトラジン28(mAbに関し25当量、約0.8MBq)を注射し、テトラジン注射から3時間後屠殺された。屠殺の時点で、血液を心臓穿刺で集め、興味対象である器官及び組織を集め、ブロット乾燥し、秤量し、1mLのPBSを加えた。全てのサンプルの放射能をガンマ計数器(Wizard 3、 Perkin Elmer)で、二重同位体手順(エネルギー窓は、125I、111Inのそれぞれで、10〜80keV及び100から510keVで設定)により、1グラム組織当たりのパーセント注入投与量(%ID/g)を決定するための標準と共に測定した。
CC49−TCO44bの血中動態及びインボビ安定性
血中動態
無腫瘍マウス(群ごとにn=3)に、7.5TCO44bグループ(マウス当たり100μg、0.2〜0.4MBq)で修飾されたCC49の125I−ラベル化CC49を注射した。選択された時点(1、3、6、24、48及び72時間)で、伏在静脈から血液サンプルを取り出し、ヘパリン含有バイアルに集めた。mAb注射後4日で、マウスを麻酔して脊椎脱臼で屠殺した。血液を心臓穿刺で集め、興味対象器官と組織を取り出し、ブロット乾燥し、秤量して1mLのPBSを添加して、器官当たりのパーセント注射投与量(%ID)を決定するために標準と共に、ガンマ計数器(Wizard 3、Perkin Elmer)で計数した。
インビボ安定性
無腫瘍マウスの別の群(n=3)に、125I−ラベル化CC49−TCO44b(マウス当たり220μg、0.4MBq)を注射した。選択された時間(1、3、6、24、48及び72時間)で、血液サンプルを伏在静脈から取り出し、ヘパリン含有バイアルに集めた。mAb注射後4日でマウスを麻酔し、脊椎脱臼で屠殺した。血液を心臓穿刺で取り出し、胃と甲状腺を除去し、ブロット乾燥し、器官当たりにパーセント注射投与量 (%ID)を決定するため標準と共にガンマ計数器で計数した。これらの器官の低い125Iの取り込み(胃で0.17±0.03%ID及び甲状腺で0.88±0.33%ID)は、前記放射線ラベル化mAbが4日の評価の間、インビボで前記ラベルを維持することを確認する。
実施例19
CC49−TCO44bでプレターゲットされた腫瘍保持マウスでの 177 Lu−テトラジン28の生体内分布
腫瘍保持マウス(方法を参照;100mm3腫瘍サイズ;n=4)に、7.544b基で官能基化された125I−CC49(マウス当たり、100μg、約0.2MBq)を注射した。mAb注射後30及び48時間後、前記マウスは1投与の洗浄試薬(ガラクトース−MSA−テトラジン、1投与当たり160μg)を投与され、続いて2時間後177Lu−テトラジン28を投与された(mAbに対して10当量、約0.5MBq)。テトラジン注射後3時間、マウスは麻酔され脊椎脱臼で屠殺され、血液を心臓穿刺で取り出し、興味対象の器官と組織を取り出しブロット乾燥した。集めたサンプル全てを秤量し、1mLPBSを添加した。サンプルの放射能を、二重同位体手順(125Iについて10〜80keV及び177Luについて、155〜380keVの窓を設定)で、1グラム当たりの組織のパーセント投与量(%ID/g)を決定するために標準と共にガンマ計数器で計数した。
Claims (7)
- ターゲット化医用イメージング及び/又は治療のためのキットであり、
当該キットは少なくとも1つのプレターゲットプローブ及び少なくとも1つのエフェクタープローブを含み、
前記プレターゲットプローブは、第1のターゲット部及び第1の生体直交反応性基を、前記エフェクタープローブは、ラベル又は医薬的活性化合物を有するエフェクター部及び第2の生体直交反応性基を含み、
前記第1のターゲット部は、ペプチド、タンパク質、抗体断片、二重特異的抗体、及び腫瘍ターゲット化ポリマーからなる群から選択され、
前記ラベルは、3H、11C、13N、15O、18F、19F、51Cr、52Fe、52Mn、55Co、60Cu、61Cu、62Zn、62Cu、63Zn、64Cu、66Ga、67Ga、68Ga、70As、71As、72As、74As、75Se、75Br、76Br、77Br、80Br、82Br、82Rb、86Y、88Y、89Sr、89Zr、97Ru、99Tc、110In、111In、113In、114In、117Sn、120I、122Xe、123I、124I、125I、166Ho、167Tm、169Yb、193Pt、195Pt、201Tl及び203Pbからなる群から選択され、
前記医薬的活性化合物は、24Na、32P、33P、47Sc、59Fe、67Cu、76As、77As、80Br、82Br、89Sr、90Nb、90Y、103Ru、105Rh、109Pd、111Ag、111In、121Sn、127Te、131I、140La、141Ce、142Pr、143Pr、144Pr、149Pm、149Tb、151Pm、153Sm、159Gd、161Tb、165Dy、166Dy、166Ho、169Er、172Tm、175Yb、177Lu、186Re、188Re、198Au、199Au、211At、211Bi、212Bi、212Pb、213Bi、214Bi、223Ra、及び225Acからなる群から選択され、
前記第1及び第2の生体直交反応性基のいずれか一方がジエノフィルであり、前記第1及び第2の生体直交反応性基の他方がテトラジンであり、
前記ジエノフィルは、式(1)を満たす8−員環ジエノフィルであり:
R4 aは−O−または−CH2−CO−O−を有する置換基であり、
X、Y、R及びその他のRaは、Hである、キット。 - 請求項2に記載のキットであり、
前記フェニルは、NO2、F、Cl、CF3、CN、COOH、COOR、CONH2、CONHR、CONR2、CHO、COR、SO2R、SO2OR、NO、Arの1以上の電子吸引基で置換され、ここでRはC1〜C6アルキルであり、Arは芳香族基である、キット。 - 請求項2又は3に記載のキットであり、
前記テトラジンは、スペーサーを介して前記プレターゲットプローブ又は前記エフェクタープローブへの少なくとも1つのリンケージを含む、キット。 - 第1のターゲット部と生体直交反応性基とを含むプレターゲット試薬であり、前記第1のターゲット部が請求項1に記載のペプチド、タンパク質、抗体断片、二重特異的抗体、及び腫瘍ターゲット化ポリマーからなる群から選択されるものであり、前記生体直交反応性基が請求項1に定めた式(1)のジエノフィルである、プレターゲット試薬。
- ターゲット化医用イメージング及び/又は治療のためのキットであり、
当該キットは少なくとも1つのプレターゲットプローブ及び少なくとも1つのエフェクタープローブを含み、
前記プレターゲットプローブは、第1のターゲット部及び第1の生体直交反応性基を、前記エフェクタープローブは、ラベル又は医薬的活性化合物を有するエフェクター部及び第2の生体直交反応性基を含み、
前記第1のターゲット部は、ペプチド、タンパク質、抗体断片、二重特異的抗体、及び腫瘍ターゲット化ポリマーからなる群から選択され、
前記ラベルは、3H、11C、13N、15O、18F、19F、51Cr、52Fe、52Mn、55Co、60Cu、61Cu、62Zn、62Cu、63Zn、64Cu、66Ga、67Ga、68Ga、70As、71As、72As、74As、75Se、75Br、76Br、77Br、80Br、82Br、82Rb、86Y、88Y、89Sr、89Zr、97Ru、99Tc、110In、111In、113In、114In、117Sn、120I、122Xe、123I、124I、125I、166Ho、167Tm、169Yb、193Pt、195Pt、201Tl及び203Pbからなる群から選択され、
前記医薬的活性化合物は、24Na、32P、33P、47Sc、59Fe、67Cu、76As、77As、80Br、82Br、89Sr、90Nb、90Y、103Ru、105Rh、109Pd、111Ag、111In、121Sn、127Te、131I、140La、141Ce、142Pr、143Pr、144Pr、149Pm、149Tb、151Pm、153Sm、159Gd、161Tb、165Dy、166Dy、166Ho、169Er、172Tm、175Yb、177Lu、186Re、188Re、198Au、199Au、211At、211Bi、212Bi、212Pb、213Bi、214Bi、223Ra、及び225Acからなる群から選択され、
前記第1及び第2の生体直交反応性基のいずれか一方がジエノフィルであり、前記第1及び第2の生体直交反応性基の他方がテトラジンであり、
前記ジエノフィルが式(1)を満たす8−員環ジエノフィルであり:
R4 aは−O−または−CH2−CO−O−を有する置換基であり、
X、Y、R及びその他のRaは、Hである、キット。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP10187619 | 2010-10-14 | ||
| EP10187619.1 | 2010-10-14 | ||
| PCT/IB2011/054481 WO2012049624A1 (en) | 2010-10-14 | 2011-10-11 | Pretargeting kit, method and agents used therein |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016137224A Division JP6368745B2 (ja) | 2010-10-14 | 2016-07-12 | プレターゲットキット、プレターゲット方法及びその使用試薬 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2014506869A JP2014506869A (ja) | 2014-03-20 |
| JP2014506869A5 JP2014506869A5 (ja) | 2015-09-10 |
| JP6063384B2 true JP6063384B2 (ja) | 2017-01-18 |
Family
ID=43736149
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013533311A Active JP6063384B2 (ja) | 2010-10-14 | 2011-10-11 | プレターゲットキット、プレターゲット方法及びその使用試薬 |
| JP2016137224A Active JP6368745B2 (ja) | 2010-10-14 | 2016-07-12 | プレターゲットキット、プレターゲット方法及びその使用試薬 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016137224A Active JP6368745B2 (ja) | 2010-10-14 | 2016-07-12 | プレターゲットキット、プレターゲット方法及びその使用試薬 |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US9463256B2 (ja) |
| EP (1) | EP2627358B1 (ja) |
| JP (2) | JP6063384B2 (ja) |
| RU (1) | RU2013121799A (ja) |
| WO (1) | WO2012049624A1 (ja) |
Families Citing this family (33)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9463256B2 (en) * | 2010-10-14 | 2016-10-11 | Koninklijke Philips N.V. | Pretargeting kit, method and agents used therein |
| EP2522369A1 (en) * | 2011-05-09 | 2012-11-14 | Koninklijke Philips Electronics N.V. | Pretargeting kit, method and agents used therein |
| WO2012156918A1 (en) | 2011-05-16 | 2012-11-22 | Koninklijke Philips Electronics N.V. | Bio-orthogonal drug activation |
| EP2852667A4 (en) * | 2012-05-21 | 2016-01-20 | Agilent Technologies Inc | REACTION OF RETRO DIELS-ALDER AS A CLIENT IN CARD / DNA APPLICATIONS |
| WO2014081303A1 (en) * | 2012-11-22 | 2014-05-30 | Tagworks Pharmaceuticals B.V. | Chemically cleavable group |
| WO2014081300A1 (en) * | 2012-11-22 | 2014-05-30 | Tagworks Pharmaceuticals B.V. | Channel protein activatable liposomes |
| WO2014081299A1 (en) * | 2012-11-22 | 2014-05-30 | Tagworks Pharmaceuticals B.V. | Activatable liposomes |
| WO2014081301A1 (en) * | 2012-11-22 | 2014-05-30 | Tagworks Pharmaceuticals B.V. | Bio-orthogonal drug activation |
| US20150359913A1 (en) * | 2013-01-25 | 2015-12-17 | Memorial Sloan-Kettering Cancer Center | Tetrazines/trans-cyclooctenes in solid phase synthesis of labeled peptides |
| US9110230B2 (en) | 2013-05-07 | 2015-08-18 | Corning Incorporated | Scratch-resistant articles with retained optical properties |
| US9366784B2 (en) | 2013-05-07 | 2016-06-14 | Corning Incorporated | Low-color scratch-resistant articles with a multilayer optical film |
| US10130711B2 (en) | 2013-06-19 | 2018-11-20 | The Regents Of The University Of California | Chemical structures for localized delivery of therapeutic agents |
| CN106232045B (zh) | 2014-01-04 | 2020-09-22 | 颅骨切除术公司 | 用于光动力学疗法的装置和方法 |
| CA2939265A1 (en) * | 2014-02-10 | 2015-08-13 | Mcmaster University | Targeted molecular imaging contrast agents |
| JP6625550B2 (ja) | 2014-03-14 | 2019-12-25 | ザ リージェンツ オブ ザ ユニバーシティ オブ カリフォルニア | Tco複合体および治療薬の送達のための方法 |
| ES2871029T3 (es) * | 2014-04-04 | 2021-10-28 | Harvard College | Dispositivos de liberación de fármacos recargables y procedimientos de uso de los mismos |
| US11267973B2 (en) | 2014-05-12 | 2022-03-08 | Corning Incorporated | Durable anti-reflective articles |
| US9790593B2 (en) | 2014-08-01 | 2017-10-17 | Corning Incorporated | Scratch-resistant materials and articles including the same |
| WO2016025480A1 (en) | 2014-08-11 | 2016-02-18 | The General Hospital Corporation | Cyclooctenes for bioorthogonol reactions |
| WO2017044983A1 (en) | 2015-09-10 | 2017-03-16 | Shasqi, Inc. | Bioorthogonal compositions |
| EP3300520B1 (en) | 2015-09-14 | 2020-11-25 | Corning Incorporated | High light transmission and scratch-resistant anti-reflective articles |
| EP3153155B1 (en) * | 2015-10-08 | 2021-03-03 | President and Fellows of Harvard College | Refillable drug delivery devices and methods of use thereof |
| WO2018004338A1 (en) | 2016-06-27 | 2018-01-04 | Tagworks Pharmaceuticals B.V. | Cleavable tetrazine used in bio-orthogonal drug activation |
| US11253600B2 (en) | 2017-04-07 | 2022-02-22 | Tambo, Inc. | Bioorthogonal compositions |
| US11560384B2 (en) | 2017-05-04 | 2023-01-24 | University Of Utah Research Foundation | Benzonorbornadiene derivatives and reactions thereof |
| GB201720769D0 (en) | 2017-12-13 | 2018-01-24 | Univ Of Northumbria At Newcastle | Pericyclic reactions |
| WO2019212356A1 (en) | 2018-05-04 | 2019-11-07 | Tagworks Pharmaceuticals B .V. | Tetrazines for high click conjugation yield in vivo and high click release yield |
| EP3788032B1 (en) | 2018-05-04 | 2024-01-24 | Tagworks Pharmaceuticals B.V. | Compounds comprising a linker for increasing transcyclooctene stability |
| JP7228028B2 (ja) | 2018-08-17 | 2023-02-22 | コーニング インコーポレイテッド | 薄い耐久性の反射防止構造を有する無機酸化物物品 |
| CN112996795A (zh) | 2018-09-18 | 2021-06-18 | 尼坎医疗公司 | 作为src同源-2磷酸酶抑制剂的稠合的三环衍生物 |
| AU2020221841A1 (en) | 2019-02-13 | 2021-09-09 | Alpheus Medical, Inc. | Non-invasive sonodynamic therapy |
| IL289095A (en) | 2019-06-17 | 2022-02-01 | Tagworks Pharmaceuticals B V | Activating components to cleave labels from biomolecules in vivo |
| EP4108669A1 (en) * | 2021-06-24 | 2022-12-28 | Institute Of Organic Chemistry And Biochemistry As CR, V.V.I. | Carbohydrate derivatives and kits for cell surface labeling |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4741900A (en) | 1982-11-16 | 1988-05-03 | Cytogen Corporation | Antibody-metal ion complexes |
| US5326856A (en) | 1992-04-09 | 1994-07-05 | Cytogen Corporation | Bifunctional isothiocyanate derived thiocarbonyls as ligands for metal binding |
| WO2007039858A2 (en) * | 2005-10-04 | 2007-04-12 | Koninklijke Philips Electronics N.V. | Targeted imaging and/or therapy using the [3+2] azide-alkyne cycloaddition |
| WO2010051530A2 (en) | 2008-10-31 | 2010-05-06 | The General Hospital Corporation | Compositions and methods for delivering a substance to a biological target |
| RU2539915C2 (ru) * | 2009-04-16 | 2015-01-27 | Конинклейке Филипс Электроникс Н.В. | Набор для предварительного придания направленности действия, способ и средства, применяемые в нем |
| US9463256B2 (en) * | 2010-10-14 | 2016-10-11 | Koninklijke Philips N.V. | Pretargeting kit, method and agents used therein |
| WO2014081303A1 (en) * | 2012-11-22 | 2014-05-30 | Tagworks Pharmaceuticals B.V. | Chemically cleavable group |
-
2011
- 2011-10-11 US US13/877,725 patent/US9463256B2/en active Active
- 2011-10-11 JP JP2013533311A patent/JP6063384B2/ja active Active
- 2011-10-11 WO PCT/IB2011/054481 patent/WO2012049624A1/en active Application Filing
- 2011-10-11 EP EP11776566.9A patent/EP2627358B1/en active Active
- 2011-10-11 RU RU2013121799/15A patent/RU2013121799A/ru unknown
-
2016
- 2016-07-12 JP JP2016137224A patent/JP6368745B2/ja active Active
Also Published As
| Publication number | Publication date |
|---|---|
| CN103269721A (zh) | 2013-08-28 |
| JP2014506869A (ja) | 2014-03-20 |
| WO2012049624A1 (en) | 2012-04-19 |
| JP6368745B2 (ja) | 2018-08-01 |
| EP2627358A1 (en) | 2013-08-21 |
| RU2013121799A (ru) | 2014-11-20 |
| EP2627358B1 (en) | 2024-03-27 |
| US9463256B2 (en) | 2016-10-11 |
| US20130189184A1 (en) | 2013-07-25 |
| JP2016193934A (ja) | 2016-11-17 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6368745B2 (ja) | プレターゲットキット、プレターゲット方法及びその使用試薬 | |
| JP2014506869A5 (ja) | ||
| JP6223962B2 (ja) | トランス−シクロオクテンジエノフィル及びジエンを有するイメージング又は治療用プレターゲティングキット | |
| EP2419142B1 (en) | Pretargeting kit, method and agents used therein | |
| US9427482B2 (en) | Agents for clearing biomolecules from circulation | |
| JP2014500307A5 (ja) | ||
| US20120039803A1 (en) | Pretargeting kit, method and agents used therein | |
| Vugts et al. | Synthesis of phosphine and antibody–azide probes for in vivo Staudinger ligation in a pretargeted imaging and therapy approach | |
| CA3143924A1 (en) | Agents for cleaving labels from biomolecules in vivo | |
| Auchynnikava et al. | Tetrazine Glycoconjugate for Pretargeted Positron Emission Tomography Imaging of trans-Cyclooctene-Functionalized Molecular Spherical Nucleic Acids | |
| CN103269721B (zh) | 预靶向试剂盒、方法和其中使用的试剂 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20141009 |
|
| A524 | Written submission of copy of amendment under article 19 pct |
Free format text: JAPANESE INTERMEDIATE CODE: A524 Effective date: 20150724 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20150908 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20151102 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20160329 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20160712 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20160722 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20160927 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20161028 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20161122 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20161216 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6063384 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313113 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| S531 | Written request for registration of change of domicile |
Free format text: JAPANESE INTERMEDIATE CODE: R313531 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |