JP5076115B2 - Tショック送出に関連付けられるペーシングパルス列の妥当性を検査可能な医療デバイス - Google Patents
Tショック送出に関連付けられるペーシングパルス列の妥当性を検査可能な医療デバイス Download PDFInfo
- Publication number
- JP5076115B2 JP5076115B2 JP2008508924A JP2008508924A JP5076115B2 JP 5076115 B2 JP5076115 B2 JP 5076115B2 JP 2008508924 A JP2008508924 A JP 2008508924A JP 2008508924 A JP2008508924 A JP 2008508924A JP 5076115 B2 JP5076115 B2 JP 5076115B2
- Authority
- JP
- Japan
- Prior art keywords
- pulse train
- shock
- pacing pulse
- pacing
- pulse
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N1/00—Electrotherapy; Circuits therefor
- A61N1/18—Applying electric currents by contact electrodes
- A61N1/32—Applying electric currents by contact electrodes alternating or intermittent currents
- A61N1/38—Applying electric currents by contact electrodes alternating or intermittent currents for producing shock effects
- A61N1/385—Devices for inducing an abnormal cardiac function, e.g. fibrillation
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N1/00—Electrotherapy; Circuits therefor
- A61N1/18—Applying electric currents by contact electrodes
- A61N1/32—Applying electric currents by contact electrodes alternating or intermittent currents
- A61N1/36—Applying electric currents by contact electrodes alternating or intermittent currents for stimulation
- A61N1/362—Heart stimulators
- A61N1/37—Monitoring; Protecting
- A61N1/371—Capture, i.e. successful stimulation
Description
Claims (3)
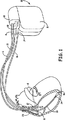
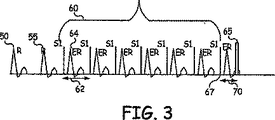
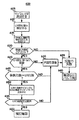
- 複数の刺激パルスを備えるペーシングパルス列を生成することができる医療デバイスであって、当該ペーシングパルス列が、Tショックの送出に関連付けられるものであり、当該医療デバイスが、
患者の心腔に前記ペーシングパルス列を送出する手段と、
前記ペーシングパルス列が有効であるという特定に応じて、前記ペーショングパルス列の最後のパルスの送出に引き続く所定の間隔においてTショックを送出する手段と、
前記送出されたペーシングパルス列に関連付けられる誘発応答データを生成する手段と、
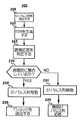
前記生成された誘発応答データに応答して、前記ペーシングパルス列の前記最後のパルスが心臓を捕捉したか否か、及び、前記最後のパルスと前記Tショックの送出の間に介在事象が、存在しないか否か、を判定すると共に、該双方の要件が満たされるのに応答して、前記ペーシングパルス列が有効であると特定する手段と
を備える、医療デバイス。 - 前記判定及び特定する手段は更に、
前記生成された誘発応答データを比較し、
少なくとも、前記ペーシングパルス列に対応する複数の誘発応答に関連付けられる時間間隔が、所定の時間より大きく異なるか否かを判定することによって、前記比較された誘発応答データの時間的な整合性を判定し、
前記時間間隔が、前記所定の時間間隔より大きく異なるか、の判定に応じて、前記ペーシングパルス列が、有効であるとして特定する、
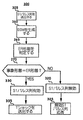
請求項1に記載の医療デバイス。 - 前記誘発応答データを生成する手段は、2つ以上の検知場所からの前記送出されたペー
シングパルス列に関連付けられる誘発応答を検知し、
前記判定及び特定する手段は、更に、
異なった検知場所から検知された前記誘発応答のシーケンスを判定し、異なった検知場所からの、前記検知された誘発応答のシーケンスに基づいて、前記ペーシングパルス列を、有効であるとして特定する、請求項2に記載の医療デバイス。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US11/117,593 US7634316B2 (en) | 2005-04-28 | 2005-04-28 | Method and apparatus for validating a pacing train associated with T-shock delivery |
| US11/117,593 | 2005-04-28 | ||
| PCT/US2006/014761 WO2006115940A1 (en) | 2005-04-28 | 2006-04-17 | Method and apparatus for validating a pacing train associated with t-shock delivery |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2008538999A JP2008538999A (ja) | 2008-11-13 |
| JP2008538999A5 JP2008538999A5 (ja) | 2009-05-21 |
| JP5076115B2 true JP5076115B2 (ja) | 2012-11-21 |
Family
ID=36794412
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008508924A Active JP5076115B2 (ja) | 2005-04-28 | 2006-04-17 | Tショック送出に関連付けられるペーシングパルス列の妥当性を検査可能な医療デバイス |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US7634316B2 (ja) |
| EP (1) | EP1899008B1 (ja) |
| JP (1) | JP5076115B2 (ja) |
| AT (1) | ATE509662T1 (ja) |
| CA (1) | CA2605528A1 (ja) |
| WO (1) | WO2006115940A1 (ja) |
Families Citing this family (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8831722B2 (en) | 2002-04-15 | 2014-09-09 | Imperception, Inc. | Shock timing technology |
| US8150510B2 (en) * | 2002-04-15 | 2012-04-03 | Imperception, Inc. | Shock timing technology |
| US8064996B2 (en) * | 2007-10-03 | 2011-11-22 | Medtronic, Inc. | Automatic determination of T-shock vulnerable window |
| US8644923B2 (en) | 2008-07-24 | 2014-02-04 | Medtronic, Inc. | Determination of upper limit of vulnerability using a variable number of shocks |
| US8565865B2 (en) * | 2008-07-24 | 2013-10-22 | Medtronic, Inc. | Methods for the determination of T-shock vulnerable window from far-field electrograms in implantable cardioverter defibrillators |
| US8359094B2 (en) * | 2008-07-31 | 2013-01-22 | Medtronic, Inc. | Extravascular arrhythmia induction |
| US8560064B2 (en) * | 2008-07-31 | 2013-10-15 | Medtronic, Inc. | Extravascular arrhythmia induction |
| US10905884B2 (en) | 2012-07-20 | 2021-02-02 | Cardialen, Inc. | Multi-stage atrial cardioversion therapy leads |
| WO2017096181A1 (en) | 2015-12-03 | 2017-06-08 | Medtronic, Inc. | Extra-cardiovascular pacing using high-voltage therapy circuitry of an implantable cardioverter defibrillator |
| US10232182B2 (en) * | 2016-04-28 | 2019-03-19 | Medtronic, Inc. | Detecting and responding to anti-tachyarrhythmia shocks |
| CN113164753B (zh) * | 2019-01-23 | 2023-03-24 | 脉冲动力(北京)医疗科技有限公司 | 在联合心脏收缩力调制-可植入心律转复除颤器装置中的室上性心动过速的区分 |
Family Cites Families (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4727877A (en) | 1984-12-18 | 1988-03-01 | Medtronic, Inc. | Method and apparatus for low energy endocardial defibrillation |
| US5163427A (en) | 1990-11-14 | 1992-11-17 | Medtronic, Inc. | Apparatus for delivering single and multiple cardioversion and defibrillation pulses |
| US5117824A (en) | 1990-11-14 | 1992-06-02 | Medtronic, Inc. | Apparatus for monitoring electrical physiologic signals |
| US5129392A (en) | 1990-12-20 | 1992-07-14 | Medtronic, Inc. | Apparatus for automatically inducing fibrillation |
| US5215083A (en) | 1991-10-07 | 1993-06-01 | Telectronics Pacing Systems, Inc. | Apparatus and method for arrhythmia induction in arrhythmia control system |
| US5674254A (en) | 1995-05-22 | 1997-10-07 | Vitatron Medical, B.V. | Cardiac pacemaker system and method for determining a measure of pacing threshold without incurring loss of capture |
| US5741312A (en) | 1997-03-12 | 1998-04-21 | Vitatron Medical, B.V. | Pacemaker system and method with improved capture detection and threshold search |
| US5925067A (en) | 1997-12-11 | 1999-07-20 | Pacesetter, Inc. | Automatic capture detection during non-invasive programmed stimulation of a patient's heart |
| US6052621A (en) | 1998-01-27 | 2000-04-18 | Vitatron Medical B.V. | System and method for inducing tachycardia |
| US6393316B1 (en) | 1999-05-12 | 2002-05-21 | Medtronic, Inc. | Method and apparatus for detection and treatment of cardiac arrhythmias |
| US6453197B1 (en) * | 2000-04-18 | 2002-09-17 | Pacesetter, Inc. | Implantable cardiac stimulation device including a system for and method of automatically inducing a tachyarrhythmia |
| US6647292B1 (en) | 2000-09-18 | 2003-11-11 | Cameron Health | Unitary subcutaneous only implantable cardioverter-defibrillator and optional pacer |
| US7286876B2 (en) | 2001-10-26 | 2007-10-23 | Cardiac Pacemakers, Inc. | Template-based capture verification for multi-site pacing |
| US6675042B2 (en) | 2002-04-15 | 2004-01-06 | Charles D. Swerdlow | Defibrillation shock strength determination technology |
| US8560063B2 (en) * | 2002-09-10 | 2013-10-15 | Uab Research Foundation | Post-defibrillation pacing methods and devices |
| US7319898B2 (en) | 2003-04-25 | 2008-01-15 | Medtronic, Inc. | Self-adapting defibrillator induction feature |
| US7536224B2 (en) * | 2003-04-30 | 2009-05-19 | Medtronic, Inc. | Method for elimination of ventricular pro-arrhythmic effect caused by atrial therapy |
-
2005
- 2005-04-28 US US11/117,593 patent/US7634316B2/en active Active
-
2006
- 2006-04-17 WO PCT/US2006/014761 patent/WO2006115940A1/en active Application Filing
- 2006-04-17 CA CA002605528A patent/CA2605528A1/en not_active Abandoned
- 2006-04-17 JP JP2008508924A patent/JP5076115B2/ja active Active
- 2006-04-17 AT AT06750734T patent/ATE509662T1/de not_active IP Right Cessation
- 2006-04-17 EP EP06750734A patent/EP1899008B1/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| JP2008538999A (ja) | 2008-11-13 |
| CA2605528A1 (en) | 2006-11-02 |
| US7634316B2 (en) | 2009-12-15 |
| EP1899008B1 (en) | 2011-05-18 |
| WO2006115940A1 (en) | 2006-11-02 |
| EP1899008A1 (en) | 2008-03-19 |
| ATE509662T1 (de) | 2011-06-15 |
| US20060247687A1 (en) | 2006-11-02 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5076115B2 (ja) | Tショック送出に関連付けられるペーシングパルス列の妥当性を検査可能な医療デバイス | |
| US7203543B2 (en) | Method and system for detecting capture using a coronary vein electrode | |
| US7536224B2 (en) | Method for elimination of ventricular pro-arrhythmic effect caused by atrial therapy | |
| US8626293B2 (en) | Method and system for identifying a potential lead failure in an implantable medical device | |
| JP4625813B2 (ja) | 複数の分類ウインドウを用いる心臓応答の分類 | |
| EP2139554B1 (en) | Discrimination of supraventricular tachycardia from ventricular tachycardia | |
| US9216292B2 (en) | Dynamic morphology based atrial automatic threshold | |
| JP5220419B2 (ja) | 心臓捕捉検証および逆行管理システム | |
| US20050038478A1 (en) | Activation recovery interval for classification of cardiac beats in an implanted device | |
| US20100198292A1 (en) | Evaluating electrode configurations for delivering cardiac pacing therapy | |
| US7120493B2 (en) | Shock lead impedance measurement to ensure safe delivery of shock therapy to maintain circuit integrity | |
| US6625489B2 (en) | Dynamic non-competitive atrial pacing | |
| EP2701794A1 (en) | Pacing in the presence of electromagnetic interference | |
| EP2742972B1 (en) | Capture confirmation for multi-site pacing | |
| US11278728B2 (en) | Identify insulation breach using electrograms | |
| US8280507B2 (en) | Cardiac stimulator for treatment of tachycardiac arrhythmias of the heart | |
| EP3160574A1 (en) | Identify insulation breach using electrograms | |
| EP3160575B1 (en) | Implantable medical system and method for identifying insulation breach using electrograms |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20090318 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20090318 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20110905 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20111101 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20120119 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20120126 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120418 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20120531 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20120620 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A711 Effective date: 20120720 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20120720 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20120727 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20120720 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20150907 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5076115 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |