JP2017007872A - Synthesis gas production process and apparatus - Google Patents
Synthesis gas production process and apparatus Download PDFInfo
- Publication number
- JP2017007872A JP2017007872A JP2015121594A JP2015121594A JP2017007872A JP 2017007872 A JP2017007872 A JP 2017007872A JP 2015121594 A JP2015121594 A JP 2015121594A JP 2015121594 A JP2015121594 A JP 2015121594A JP 2017007872 A JP2017007872 A JP 2017007872A
- Authority
- JP
- Japan
- Prior art keywords
- gas
- biogas
- synthesis gas
- reaction
- reforming
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J23/00—Catalysts comprising metals or metal oxides or hydroxides, not provided for in group B01J21/00
- B01J23/70—Catalysts comprising metals or metal oxides or hydroxides, not provided for in group B01J21/00 of the iron group metals or copper
- B01J23/89—Catalysts comprising metals or metal oxides or hydroxides, not provided for in group B01J21/00 of the iron group metals or copper combined with noble metals
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01B—NON-METALLIC ELEMENTS; COMPOUNDS THEREOF; METALLOIDS OR COMPOUNDS THEREOF NOT COVERED BY SUBCLASS C01C
- C01B3/00—Hydrogen; Gaseous mixtures containing hydrogen; Separation of hydrogen from mixtures containing it; Purification of hydrogen
- C01B3/02—Production of hydrogen or of gaseous mixtures containing a substantial proportion of hydrogen
- C01B3/32—Production of hydrogen or of gaseous mixtures containing a substantial proportion of hydrogen by reaction of gaseous or liquid organic compounds with gasifying agents, e.g. water, carbon dioxide, air
- C01B3/34—Production of hydrogen or of gaseous mixtures containing a substantial proportion of hydrogen by reaction of gaseous or liquid organic compounds with gasifying agents, e.g. water, carbon dioxide, air by reaction of hydrocarbons with gasifying agents
- C01B3/38—Production of hydrogen or of gaseous mixtures containing a substantial proportion of hydrogen by reaction of gaseous or liquid organic compounds with gasifying agents, e.g. water, carbon dioxide, air by reaction of hydrocarbons with gasifying agents using catalysts
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01B—NON-METALLIC ELEMENTS; COMPOUNDS THEREOF; METALLOIDS OR COMPOUNDS THEREOF NOT COVERED BY SUBCLASS C01C
- C01B3/00—Hydrogen; Gaseous mixtures containing hydrogen; Separation of hydrogen from mixtures containing it; Purification of hydrogen
- C01B3/02—Production of hydrogen or of gaseous mixtures containing a substantial proportion of hydrogen
- C01B3/32—Production of hydrogen or of gaseous mixtures containing a substantial proportion of hydrogen by reaction of gaseous or liquid organic compounds with gasifying agents, e.g. water, carbon dioxide, air
- C01B3/34—Production of hydrogen or of gaseous mixtures containing a substantial proportion of hydrogen by reaction of gaseous or liquid organic compounds with gasifying agents, e.g. water, carbon dioxide, air by reaction of hydrocarbons with gasifying agents
- C01B3/38—Production of hydrogen or of gaseous mixtures containing a substantial proportion of hydrogen by reaction of gaseous or liquid organic compounds with gasifying agents, e.g. water, carbon dioxide, air by reaction of hydrocarbons with gasifying agents using catalysts
- C01B3/40—Production of hydrogen or of gaseous mixtures containing a substantial proportion of hydrogen by reaction of gaseous or liquid organic compounds with gasifying agents, e.g. water, carbon dioxide, air by reaction of hydrocarbons with gasifying agents using catalysts characterised by the catalyst
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P20/00—Technologies relating to chemical industry
- Y02P20/50—Improvements relating to the production of bulk chemicals
- Y02P20/52—Improvements relating to the production of bulk chemicals using catalysts, e.g. selective catalysts
Abstract
Description
本発明は、バイオガスを原料とし、一酸化炭素と水素を主体とした合成ガスを発生させる合成ガスの製造方法および装置に関するものである。 The present invention relates to a method and apparatus for producing a synthesis gas that uses biogas as a raw material and generates a synthesis gas mainly composed of carbon monoxide and hydrogen.
近年の社会は、環境問題への関心を高めている。それに伴って私たちは、低炭素化社会の実現に向けて、バイオマスを産業資源として利用することに注目を集めている。 Society in recent years has increased interest in environmental issues. Along with that, we are attracting attention to using biomass as an industrial resource for the realization of a low-carbon society.
バイオマスは、生態系の資源であるため、その性質上、季節によって生産量が変動しやすい。したがって、一般にバイオマスは、石油に比べて安定供給に不安があり、貯蔵や輸送に課題が残されている。 Since biomass is an ecosystem resource, its production tends to fluctuate depending on the season. Therefore, in general, there is a concern about the stable supply of biomass compared to petroleum, and there are still problems in storage and transportation.
バイオマスのなかでもパームヤシは、赤道付近を栽培地とし、年間を通して安定的に生産される。このようなパームヤシは、パームオイルの原料として利用されている。つまりパームヤシは、安定供給が実現したバイオマスだといえる。 Among biomass, palm palm is cultivated near the equator and is stably produced throughout the year. Such palm palm is used as a raw material for palm oil. In other words, it can be said that palm palm is a biomass that has achieved a stable supply.
パームヤシから得られるパームオイルは、食用油とするほか、マーガリン・ショートニング・石鹸などの原料として利用される。近年では、パームオイルをバイオディーゼル燃料として利用することも進められている。植物油のなかでもパームオイルは、世界でも屈指の生産量を誇り、その消費量も年々増加している。それに伴い、パームヤシの生産量も今後の増加が見込まれている。 Palm oil obtained from palm palm is used as an edible oil and as a raw material for margarine, shortening, soap and the like. In recent years, the use of palm oil as biodiesel fuel has also been promoted. Among vegetable oils, palm oil has one of the highest production volumes in the world, and its consumption is increasing year by year. Accordingly, palm palm production is expected to increase in the future.
パームオイルを大量生産すると、その搾りかすが大量に生成する。大量に生成したパームヤシの搾りかすは、ほんの一部が燃料や肥料として利用されているに過ぎない。その大部分は、廃棄物として処理されている。 When palm oil is mass-produced, a large amount of pomace is produced. Only a small part of the palm squeezed pomace produced is used as fuel or fertilizer. Most of it is treated as waste.
その廃棄物を処理する過程で、搾りかすが嫌気発酵すると、メタンと二酸化炭素の混合ガス(バイオガス)が発生する。バイオガスの一部は発電などに利用されることがあるものの、大部分はそのまま大気中に放散され、有効利用されていないのが現状である。 When the waste is anaerobically fermented in the process of treating the waste, a mixed gas (biogas) of methane and carbon dioxide is generated. Although some biogas may be used for power generation, most of it is released into the atmosphere as it is and is not being used effectively.
このような事情から、大気放散されているバイオガスを有効利用する方法が検討されている。たとえば、バイオガスからメタンを精製して自動車用のバイオ燃料として利用することが進められている。また、バイオガスを原料としてメタノールやエタノールを合成し、それを有効利用することも積極的に進められている。 Under such circumstances, methods for effectively utilizing biogas that has been diffused into the atmosphere are being studied. For example, methane is purified from biogas and used as biofuel for automobiles. In addition, the synthesis of methanol and ethanol from biogas as raw materials and the effective use thereof are also being actively promoted.
メタノールやエタノールを工業的に製造するには、一酸化炭素と水素を主成分とする合成ガスを原料として、メタノール合成反応やエタノール合成反応により得る方法が採用されている。その原料となる合成ガスは、メタン等の炭化水素ガスを水蒸気改質し、一酸化炭素と水素に変換して得られる。上記水蒸気改質に供するメタンとして、一般には天然ガスを用いることが多い。近年になって、上記メタンとして上述したバイオガスを用いることが検討され始めている。 In order to industrially produce methanol and ethanol, a method is adopted in which a synthesis gas mainly composed of carbon monoxide and hydrogen is used as a raw material and a methanol synthesis reaction or an ethanol synthesis reaction is used. The synthesis gas as the raw material is obtained by steam reforming a hydrocarbon gas such as methane and converting it into carbon monoxide and hydrogen. In general, natural gas is often used as the methane for the steam reforming. In recent years, the use of the above-described biogas as the methane has been studied.
メタノールなどの合成に供する合成ガスは、用途に応じ、合成ガス中に存在する一酸化炭素と水素の好ましい比率が存在する。たとえば、メタノール合成やフィッシャー・トロプシュ合成(FT合成)を行う場合、好ましい比率はモル比でH2/CO=2.0である。ジメチルエーテルを合成する場合、好ましい比率はモル比でH2/CO=1.0である。 The synthesis gas used for the synthesis of methanol or the like has a preferable ratio of carbon monoxide and hydrogen present in the synthesis gas depending on the application. For example, when methanol synthesis or Fischer-Tropsch synthesis (FT synthesis) is performed, a preferable ratio is H 2 /CO=2.0 in terms of molar ratio. When synthesizing dimethyl ether, the preferred ratio is H 2 /CO=1.0 in molar ratio.
一方、メタンを水蒸気改質して得られた合成ガスは、一酸化炭素と水素の比率が、モル比でH2/CO=3〜5程度になる。メタノールなどの合成反応に必要な比率に比べ、水素の存在比率が大幅に高い。つまり、メタンの水蒸気改質で得られる合成ガスは、メタノール合成等の原料として適当な組成ではない。この合成ガスからメタノールを合成すると、反応に対して水素が過剰となる。 On the other hand, the synthesis gas obtained by methane steam reforming, the proportion of carbon monoxide and hydrogen, on the order of H 2 / CO = 3~5 molar ratio. Compared to the ratio required for synthesis reactions such as methanol, the ratio of hydrogen is significantly higher. That is, the synthesis gas obtained by steam reforming of methane is not a suitable composition as a raw material for methanol synthesis or the like. When methanol is synthesized from this synthesis gas, hydrogen becomes excessive with respect to the reaction.
これにはつぎのような対処が必要である。すなわち、メタンを水蒸気改質して得られた合成ガスからメタノールを合成するとき、余剰となった水素を、改質炉を加熱するための燃料の一部として使用する。また、改質反応で副生したCO2の一部を、原料のメタンに添加し、一酸化炭素と水素の比率を調整する。 The following measures are necessary for this. That is, when synthesizing methanol from synthesis gas obtained by steam reforming methane, surplus hydrogen is used as part of the fuel for heating the reforming furnace. In addition, a part of CO 2 produced as a by-product in the reforming reaction is added to the raw material methane to adjust the ratio of carbon monoxide to hydrogen.
ここで、バイオガスは、メタン以外に二酸化炭素が40体積%程度も含まれる。メタンを主要成分とする天然ガスに比べ、二酸化炭素濃度が極めて高い。二酸化炭素濃度が高いバイオガスを炭酸ガス改質すると、一酸化炭素比率が高い合成ガスが発生する。合成ガスの一酸化炭素比率が高いと、ブドワール反応(2CO→C+CO2)により、カーボンが析出しやすい。改質器より下流の機器内や改質触媒上でカーボンが析出すると、機器が閉塞して圧力損失が上昇したり、触媒の活性が低下したりして、改質装置の安定的な運転を阻害する。 Here, the biogas includes about 40% by volume of carbon dioxide in addition to methane. Compared to natural gas mainly composed of methane, the carbon dioxide concentration is extremely high. When biogas having a high carbon dioxide concentration is reformed with carbon dioxide, synthesis gas having a high carbon monoxide ratio is generated. When the carbon monoxide ratio in the synthesis gas is high, carbon is likely to precipitate due to the Budoir reaction (2CO → C + CO 2 ). If carbon deposits in the equipment downstream of the reformer or on the reforming catalyst, the equipment will be clogged and pressure loss will increase, or the activity of the catalyst will decrease, and the reformer will operate stably. Inhibit.
このため、いままでの合成ガスの製造方法は、上記した特許文献1や特許文献2の開示に止まっていた。上記特許文献1は、二酸化炭素濃度が低い天然ガスを改質する方法である。上記特許文献2は、バイオガスからCO2を除去したバイオメタンを改質する方法である。
For this reason, the conventional synthesis gas production methods have been limited to the disclosure of Patent Document 1 and
〔特許文献1〕
上記特許文献1には、下記の記載がある。
[請求項1]
炭化水素系ガスと酸素系ガスを含む原料ガスを改質反応させて一酸化炭素と水素を主体とした合成ガスを製造する合成ガスの製造方法であって、
上記改質反応で生じる改質ガスにおいて起こるブドワール反応(2CO⇔C+CO2)の平衡を左辺へ移動させるよう、改質ガスが700℃以上の温度を保っている状態で改質ガスに対して炭酸ガスを導入することを特徴とする合成ガス製造方法。
[請求項2]
上記改質反応で生じる改質ガスにおいて起こる水性ガス反応(H2+CO⇔C+H2O)の平衡を左辺へ移動させるよう、改質ガスが700℃以上の温度を保っている状態で改質ガスに対して水を導入する請求項1記載の合成ガス製造方法。
[0042]
この装置は、酸素を導入する酸素導入路1、炭酸ガスを導入する炭酸ガス導入路2、炭化水素ガスとして天然ガスを導入する炭化水素導入路3が原料ガス導入路4に合流し、これらの原料ガスが改質器5に導入されるようになっている。
[Patent Document 1]
The above Patent Document 1 has the following description.
[Claim 1]
A synthesis gas production method for producing a synthesis gas mainly composed of carbon monoxide and hydrogen by reforming a raw material gas containing a hydrocarbon gas and an oxygen gas,
Carbon dioxide with respect to the reformed gas in a state where the reformed gas is maintained at a temperature of 700 ° C. or higher so that the equilibrium of the Budoir reaction (2CO⇔C + CO 2 ) occurring in the reformed gas generated by the reforming reaction is shifted to the left side A synthesis gas production method characterized by introducing a gas.
[Claim 2]
The reformed gas is maintained at a temperature of 700 ° C. or higher so that the equilibrium of the water gas reaction (H 2 + CO⇔C + H 2 O) occurring in the reformed gas generated in the reforming reaction is shifted to the left side. The method for producing synthesis gas according to claim 1, wherein water is introduced into the gas.
[0042]
In this apparatus, an oxygen introduction passage 1 for introducing oxygen, a carbon
このように、特許文献1には、改質ガスからのカーボン析出を抑制するため、水蒸気を過剰に添加して改質する方法が開示されている。この場合、H2O/CH4のモル比が3〜5となるほどに、過剰の水蒸気を酸化剤として添加する。 As described above, Patent Document 1 discloses a method of reforming by adding excessive water vapor in order to suppress carbon deposition from the reformed gas. In this case, excess water vapor is added as an oxidizing agent so that the molar ratio of H 2 O / CH 4 is 3 to 5.
このように、酸化剤として水蒸気を過剰に添加する方法では、大量の水蒸気を発生させるためのエネルギーが必要である。さらに、改質器に導入された過剰の水蒸気を加熱するエネルギーも必要である。また、メタノール合成に適した合成ガスを発生するよう、原料ガスの組成を調整することは困難である。 Thus, in the method of adding water vapor excessively as an oxidant, energy for generating a large amount of water vapor is required. Furthermore, energy for heating excess steam introduced into the reformer is also required. Moreover, it is difficult to adjust the composition of the raw material gas so as to generate a synthesis gas suitable for methanol synthesis.
ここで、酸化剤として水蒸気を添加する方法で、一酸化炭素と水素を所望の比率に調整するためには、つぎの方法が考えられる。第1は、改質器の下流でCOシフト反応によって組成を調整する方法である。第2は、発生した合成ガスから一酸化炭素と水素をそれぞれ分離精製し、その後、所望の比率で再混合する方法である。 Here, in order to adjust carbon monoxide and hydrogen to a desired ratio by adding water vapor as an oxidizing agent, the following method can be considered. The first is a method of adjusting the composition by a CO shift reaction downstream of the reformer. The second is a method in which carbon monoxide and hydrogen are separated and purified from the generated synthesis gas and then remixed at a desired ratio.
上記第1の方法では、COシフト反応に伴うエネルギーが余分に必要である。上記第2の方法では、一酸化炭素と水素の分離精製に伴うエネルギーが余分に必要である。そのうえ、分離精製の過程で成分の一部がロスしてしまう。このように、いずれの方法もコスト面で不利である。 In the first method, extra energy is required for the CO shift reaction. In the second method, extra energy is required for the separation and purification of carbon monoxide and hydrogen. In addition, some of the components are lost in the process of separation and purification. Thus, both methods are disadvantageous in cost.
〔特許文献2〕
上記特許文献2には、下記の記載がある。
[要約]
本発明は、バイオメタンを水蒸気改質することによって水素を生成するため、およびPSAによってシフトしたシンガスを精製することによって水素を生成するための方法に関するものであり、バイオメタンを生成するために供給したバイオガスの第1部分を精製する少なくとも1つの工程を含み、それが改質され、得られたシンガスがPSAによってシフトおよび精製される。PSAからの排出物は、改質炉のための二次燃料として使用され、原料または部分精製したバイオガスは、炉のための一次燃料として使用される。
[Patent Document 2]
The
[wrap up]
The present invention relates to a process for producing hydrogen by steam reforming biomethane and for producing hydrogen by purifying syngas shifted by PSA, which is supplied to produce biomethane. At least one step of purifying the first portion of the biogas, which is modified, and the resulting syngas is shifted and purified by PSA. The emissions from the PSA are used as secondary fuel for the reforming furnace, and the feedstock or partially purified biogas is used as the primary fuel for the furnace.
このように、上記特許文献2では、改質にあたり、バイオガスからCO2を除去したバイオメタンを得るためには、PSAなどの除去工程が余分に必要である。なお、CO2を除去しないバイオガスを改質すると、カーボン析出の問題が生じることは上述したとおりである。
As described above, in the above-mentioned
以上のように、CO2を高濃度に含むバイオガスを直接改質して合成ガスを製造するプロセスは、これまで確立されていない。そのための運転方法も確立されていなかった。 As described above, a process for producing synthesis gas by directly reforming biogas containing CO 2 at a high concentration has not been established so far. No driving method has been established for this purpose.
本発明は、上記課題を解決するため、つぎの目的をもってなされたものである。
バイオガスを原料とし、CO2除去の前処理を行うことなく、H2/COのモル比が1〜2程度の合成ガスを発生させる合成ガスの製造方法および装置を提供する。
The present invention has been made with the following object in order to solve the above problems.
Provided is a synthesis gas production method and apparatus that generates a synthesis gas having a molar ratio of H 2 / CO of about 1 to 2 using biogas as a raw material without performing pretreatment for CO 2 removal.
上記目的を達成するため、請求項1記載の合成ガスの製造方法は、つぎの構成を採用した。
炭化水素系ガスと酸素系ガスと水蒸気を改質反応させ、一酸化炭素と水素を主体とした合成ガスを製造するにあたって、
上記炭化水素系ガスとしてバイオガスを用い、
上記バイオガスを上記改質反応に供する際に、二酸化炭素を分離除去しない。
In order to achieve the above object, the synthesis gas manufacturing method according to claim 1 employs the following configuration.
In producing a synthesis gas mainly composed of carbon monoxide and hydrogen by reforming a hydrocarbon-based gas, an oxygen-based gas, and water vapor,
Using biogas as the hydrocarbon-based gas,
When the biogas is subjected to the reforming reaction, carbon dioxide is not separated and removed.
請求項2記載の合成ガスの製造方法は、請求項1記載の構成に加え、つぎの構成を採用した。
上記バイオガスは、メタンが50体積%以上70体積%以下であり、残部が二酸化炭素と不純物である。
The synthesis gas manufacturing method according to
As for the said biogas, methane is 50 volume% or more and 70 volume% or less, and the remainder is a carbon dioxide and an impurity.
請求項3記載の合成ガスの製造方法は、請求項1または2記載の構成に加え、つぎの構成を採用した。
上記バイオガスと酸素系ガスと水蒸気の混合比がモル比で、
CO2/C=0〜2、
H2O/C=0.5〜2.5、
O2/C=0.35〜0.6である。
The synthesis gas manufacturing method according to claim 3 employs the following configuration in addition to the configuration according to
The mixing ratio of the biogas, oxygen-based gas, and water vapor is a molar ratio.
CO 2 / C = 0~2,
H 2 O / C = 0.5~2.5,
It is an O 2 /C=0.35~0.6.
請求項4記載の合成ガスの製造方法は、請求項1〜3のいずれか一項に記載の構成に加え、つぎの構成を採用した。
上記改質反応に用いる触媒として、Rh修飾(Ni−CeO2)−Pt触媒を用い、上記炭化水素系ガスの燃焼反応と改質反応を同じ反応領域内で同時に進行させる。
In addition to the structure as described in any one of Claims 1-3, the manufacturing method of the synthesis gas of Claim 4 employ | adopted the following structure.
An Rh-modified (Ni—CeO 2 ) —Pt catalyst is used as the catalyst used for the reforming reaction, and the combustion reaction and the reforming reaction of the hydrocarbon-based gas proceed simultaneously in the same reaction region.
上記目的を達成するため、請求項5記載の合成ガス製造装置は、つぎの構成を採用した。
炭化水素系ガスと酸素系ガスと水蒸気を改質反応させ、一酸化炭素と水素を主体とした合成ガスを得る改質器を備え、
上記炭化水素系ガスとしてバイオガスを用い、
上記改質器に供する上記バイオガスから二酸化炭素を分離除去する手段を備えていない。
In order to achieve the above object, the syngas production apparatus according to claim 5 employs the following configuration.
It is equipped with a reformer to obtain a synthesis gas mainly composed of carbon monoxide and hydrogen by reforming a hydrocarbon-based gas, an oxygen-based gas, and steam.
Using biogas as the hydrocarbon-based gas,
There is no means for separating and removing carbon dioxide from the biogas supplied to the reformer.
請求項6記載の合成ガスの製造装置は、請求項5記載の構成に加え、つぎの構成を採用した。
上記バイオガスは、メタンが50体積%以上70体積%以下であり、残部が二酸化炭素と不純物である。
In addition to the configuration described in claim 5, the synthesis gas manufacturing apparatus described in claim 6 employs the following configuration.
As for the said biogas, methane is 50 volume% or more and 70 volume% or less, and the remainder is a carbon dioxide and an impurity.
請求項7記載の合成ガスの製造装置は、請求項5または6記載の構成に加え、つぎの構成を採用した。
上記バイオガスと酸素系ガスと水蒸気の混合比がモル比で、
CO2/C=0〜2、
H2O/C=0.5〜2.5、
O2/C=0.35〜0.6である。
In addition to the configuration described in claim 5 or 6, the synthesis gas manufacturing apparatus described in claim 7 employs the following configuration.
The mixing ratio of the biogas, oxygen-based gas, and water vapor is a molar ratio.
CO 2 / C = 0~2,
H 2 O / C = 0.5~2.5,
It is an O 2 /C=0.35~0.6.
請求項8記載の合成ガスの製造装置は、請求項5〜7のいずれか一項に記載の構成に加え、つぎの構成を採用した。
上記改質反応に用いる触媒がRh修飾(Ni−CeO2)−Pt触媒であり、上記炭化水素系ガスの燃焼反応と改質反応を同じ反応領域内で同時に進行させる。
In addition to the structure as described in any one of Claims 5-7, the synthetic gas manufacturing apparatus of Claim 8 employ | adopted the following structure.
The catalyst used in the reforming reaction is an Rh-modified (Ni—CeO 2 ) —Pt catalyst, and the combustion reaction and reforming reaction of the hydrocarbon gas are simultaneously advanced in the same reaction region.
請求項1記載の合成ガスの製造方法および請求項5記載の合成ガスの製造装置は、上記炭化水素系ガスとしてバイオガスを用い、上記バイオガスを改質反応に供する際に、二酸化炭素を分離除去しない。
このように、本発明は、バイオガスを原料として、その前処理をすることなく一酸化炭素と水素を主体とした合成ガスを発生させる。したがって、本発明によれば、PSAのような二酸化炭素の除去工程に費用や動力をかけることなく、所望の合成ガスを得ることができる。
The synthesis gas production method according to claim 1 and the synthesis gas production apparatus according to claim 5 use biogas as the hydrocarbon-based gas, and separate carbon dioxide when the biogas is subjected to a reforming reaction. Do not remove.
As described above, the present invention generates a synthesis gas mainly composed of carbon monoxide and hydrogen without using a biogas as a raw material. Therefore, according to the present invention, a desired synthesis gas can be obtained without applying cost or power to a carbon dioxide removal process such as PSA.
請求項2記載の合成ガスの製造方法および請求項6記載の合成ガスの製造装置は、上記バイオガスは、メタンが50体積%以上70体積%以下であり、残部が二酸化炭素と不純物である。
本発明では、上記のような組成のバイオガスを原料として、PSAのような二酸化炭素の除去工程に費用や動力をかけることなく、所望の合成ガスを得ることができる。
In the synthesis gas production method according to
In the present invention, a desired synthesis gas can be obtained by using a biogas having the above composition as a raw material without applying cost or power to a carbon dioxide removal step such as PSA.
請求項3記載の合成ガスの製造方法および請求項7記載の合成ガスの製造装置は、上記バイオガスと酸素系ガスと水蒸気の混合比がモル比で、CO2/C=0〜2、H2O/C=0.5〜2.5、O2/C=0.35〜0.6である。
このようにすることにより本発明は、バイオガスを原料とし、CO2除去の前処理を行うことなく、H2/COのモル比が1〜2程度の合成ガスを発生させることができる。
The synthesis gas production method according to claim 3 and the synthesis gas production apparatus according to claim 7 are characterized in that the mixing ratio of the biogas, oxygen-based gas, and water vapor is a molar ratio, CO 2 / C = 0 to 2, H 2 O / C = 0.5 to 2.5, O 2 /C=0.35 to 0.6.
Thus the present invention by the biogas a raw material, without prior processing in CO 2 removal can be a molar ratio of
請求項4記載の合成ガスの製造方法および請求項8記載の合成ガスの製造装置は、上記改質反応に用いる触媒として、Rh修飾(Ni−CeO2)−Pt触媒を用い、上記炭化水素系ガスの燃焼反応と改質反応を同じ反応領域内で同時に進行させる。
本発明は、発熱反応である燃焼反応と吸熱反応である改質反応を、同じ反応領域内で同時に進行させる。したがって本発明は、燃焼反応で発生した熱エネルギーを改質反応の熱源として利用でき、エネルギー効率がよくなる。さらに本発明は、上記反応領域では発熱反応と吸熱反応とが同時に進行し、熱的な中和が起こる。例えば、改質器内に触媒燃焼反応を単独で行う領域を設ける場合に比べ、反応領域の温度上昇が抑制される。つまり本発明は、改質器に用いる耐熱材料や改質器自体の耐熱構造が、それほどの高温仕様でなくてすみ、設備コストを節減できる。
Manufacturing apparatus according to claim 4 manufacturing method and claim 8 syngas description of synthesis gas described, as a catalyst used in the reforming reaction, using a Rh-modified (Ni-CeO 2) -Pt catalyst, the hydrocarbon-based Gas combustion reaction and reforming reaction proceed simultaneously in the same reaction zone.
In the present invention, a combustion reaction that is an exothermic reaction and a reforming reaction that is an endothermic reaction are simultaneously advanced in the same reaction region. Therefore, the present invention can use the heat energy generated in the combustion reaction as a heat source for the reforming reaction, and the energy efficiency is improved. Furthermore, in the present invention, in the reaction region, an exothermic reaction and an endothermic reaction proceed simultaneously, and thermal neutralization occurs. For example, the temperature rise in the reaction region is suppressed as compared with the case where a region for performing the catalytic combustion reaction alone is provided in the reformer. That is, according to the present invention, the heat-resistant material used for the reformer and the heat-resistant structure of the reformer itself do not have such a high temperature specification, and the equipment cost can be reduced.
つぎに、本発明を実施するための形態を説明する。 Next, an embodiment for carrying out the present invention will be described.
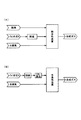
図1は合成ガス製造方法を説明する工程図である。(A)は本発明を適用した実施形態の一例を示す工程、(B)は従来の工程である。 FIG. 1 is a process diagram illustrating a synthesis gas production method. (A) is a process showing an example of an embodiment to which the present invention is applied, and (B) is a conventional process.
対象とする合成ガス製造方法は、バイオガスを改質して合成ガスを得るものである。得られる合成ガスは、一酸化炭素と水素を主成分として含むガスである。上記合成ガスは、例えば、一酸化炭素と水素を合成してメタノールやエタノールを生成する用途に供することができる。 The target synthesis gas production method is to reform biogas to obtain synthesis gas. The resulting synthesis gas is a gas containing carbon monoxide and hydrogen as main components. The synthesis gas can be used for, for example, synthesis of carbon monoxide and hydrogen to produce methanol or ethanol.
〔従来の工程〕
図1(B)に示すように、従来は、バイオガスと水蒸気を水蒸気改質して合成ガスを得ていた。
[Conventional process]
As shown in FIG. 1B, conventionally, synthesis gas has been obtained by steam reforming biogas and steam.
上記バイオガスは、メタンと二酸化炭素を主要成分とするガスである。上記バイオガスを水蒸気改質工程に導入する前処理として、脱硫工程とCO2除去工程を行う。上記脱硫工程では、改質触媒の被毒成分である硫黄成分を除去する。上記CO2除去工程は、バイオガスに多く含まれる二酸化炭素を除去する。上記CO2除去工程として、例えばPSA法が採用される。そして、メタンを主成分としたバイオメタンを水蒸気改質工程に導入する。 The biogas is a gas mainly composed of methane and carbon dioxide. As a pretreatment for introducing the biogas into the steam reforming step, a desulfurization step and a CO 2 removal step are performed. In the desulfurization step, a sulfur component that is a poisoning component of the reforming catalyst is removed. The CO 2 removal step removes carbon dioxide contained in a large amount in biogas. As the CO 2 removal step, for example, a PSA method is adopted. Then, biomethane mainly composed of methane is introduced into the steam reforming process.
〔実施形態の工程〕
図1(A)に示すように、本実施形態では、炭化水素系ガスと酸素系ガスと水蒸気を改質反応させ、一酸化炭素と水素を主体とした合成ガスを製造する。上記炭化水素系ガスとしてバイオガスを用いる。上記改質反応は熱中和改質反応である。そして、上記バイオガスを上記改質反応に供する際に、二酸化炭素を分離除去しない。すなわち、本実施形態は、バイオガスから二酸化炭素を分離除去する工程がなく、二酸化炭素の分離除去器も使用しない。
[Process of Embodiment]
As shown in FIG. 1A, in this embodiment, a hydrocarbon-based gas, an oxygen-based gas, and water vapor are subjected to a reforming reaction to produce a synthesis gas mainly composed of carbon monoxide and hydrogen. Biogas is used as the hydrocarbon gas. The reforming reaction is a heat neutralization reforming reaction. When the biogas is used for the reforming reaction, carbon dioxide is not separated and removed. That is, this embodiment does not have a step of separating and removing carbon dioxide from biogas, and does not use a carbon dioxide separation and removal device.
本発明が対象とするバイオガスは、バイオ燃料の一種である。上記バイオガスは、生物の排泄物、有機質肥料、生分解性物質、汚泥、汚水、ゴミ、エネルギー作物などを発酵または嫌気性消化させることにより発生するガスである。上記バイオガスは、例えば、パームヤシの搾りかすやサトウキビなどを、気密性の高い発酵槽で発酵させて生産することができる。 The biogas targeted by the present invention is a kind of biofuel. The biogas is a gas generated by fermenting or anaerobically digesting biological waste, organic fertilizer, biodegradable substances, sludge, sewage, garbage, energy crops, and the like. The biogas can be produced by fermenting, for example, palm palm pomace or sugarcane in a highly airtight fermenter.
上記バイオガスの主成分は、メタンと二酸化炭素であり、その他の不純物として窒素・水素・酸素・硫黄分などを含むことがある。 The main components of the biogas are methane and carbon dioxide, and may contain nitrogen, hydrogen, oxygen, sulfur, etc. as other impurities.
上記バイオガスとして、一般的な組成であるメタンが50体積%以上70体積%以下であり、残部が二酸化炭素と不純物であるものを用いるのが好ましい。メタンが50体積%未満になると、合成ガスの発生効率が低下する。また、発生した合成ガスの組成が、メタノールやエタノールの合成に適したものにならない。一方、メタンが70体積%を超える濃度とするためには、バイオガス中の二酸化炭素の除去工程が必要となり、余分な動力や費用がかかることとなる。 As the biogas, it is preferable to use a methane having a general composition of 50% by volume to 70% by volume and the balance being carbon dioxide and impurities. When methane is less than 50% by volume, the generation efficiency of synthesis gas decreases. Further, the composition of the generated synthesis gas is not suitable for the synthesis of methanol or ethanol. On the other hand, in order to achieve a concentration of methane exceeding 70% by volume, a process for removing carbon dioxide in biogas is required, which requires extra power and cost.
上記バイオガスは、動物由来・植物由来を問わず、硫黄分が含有されている。硫黄分は、改質触媒に対する被毒成分であり、触媒活性を失わせる。このため、本実施形態では、改質器に導入する前のバイオガスから硫黄分を除去する脱硫工程を行う。 The biogas contains a sulfur content regardless of whether it is derived from animals or plants. The sulfur content is a poisoning component for the reforming catalyst and loses the catalytic activity. For this reason, in this embodiment, the desulfurization process which removes a sulfur content from the biogas before introduce | transducing into a reformer is performed.
上記脱硫工程は、例えば、硫黄分を硫化水素に変換する水素化触媒と、硫化水素吸着剤を用いた脱硫を採用することができる。
上記水素化触媒は、例えば、ニッケル・コバルト・モリブデンなどの金属をアルミナやシリカ−アルミナに担持したものを用いることができる。硫黄分は水素との反応によって硫化水素となって分離される。
上記硫化水素吸着剤としては、たとえば、酸化亜鉛系吸着剤や鉄系吸着剤のように化学反応によって乾式で吸着除去するものや、活性炭系吸着剤のように、物理的に吸着するものを用いることができる。
In the desulfurization step, for example, desulfurization using a hydrogenation catalyst that converts a sulfur content into hydrogen sulfide and a hydrogen sulfide adsorbent can be employed.
As the hydrogenation catalyst, for example, a catalyst in which a metal such as nickel, cobalt, or molybdenum is supported on alumina or silica-alumina can be used. The sulfur content is separated as hydrogen sulfide by reaction with hydrogen.
Examples of the hydrogen sulfide adsorbent include those that are adsorbed and removed by chemical reaction such as zinc oxide adsorbent and iron adsorbent, and those that are physically adsorbed such as activated carbon adsorbent. be able to.
上記脱硫工程では、硫黄分を1ppm以下まで低下させるのが好ましい。 In the desulfurization step, it is preferable to reduce the sulfur content to 1 ppm or less.
脱硫されたバイオガスは、所定の量の水蒸気と混合されたのち、酸素と混合され、改質工程に導入される。 The desulfurized biogas is mixed with a predetermined amount of water vapor, mixed with oxygen, and introduced into the reforming process.
本実施形態では、上記改質工程における改質反応に用いる触媒として、Rh修飾(Ni−CeO2)−Pt触媒を用い、上記炭化水素系ガスの燃焼反応と改質反応は同じ反応領域内で同時に進行する。 In the present embodiment, an Rh-modified (Ni—CeO 2 ) —Pt catalyst is used as a catalyst used for the reforming reaction in the reforming step, and the combustion reaction and the reforming reaction of the hydrocarbon gas are performed in the same reaction region. Progress at the same time.
改質反応用の触媒として、四元系触媒であるRh修飾(Ni−CeO2)−Pt触媒を用いることにより、炭化水素の一部を完全燃焼させて、炭化水素をCO2とH2Oに変換させる燃焼反応が生じる。改質反応は、吸熱反応であり、この燃焼反応により発生する燃焼熱を利用して進行する。改質反応では、燃焼反応により生成したCO2とH2O、および原料バイオガス中に含まれるCO2と原料として導入したH2Oを、残余の炭化水素と反応させてH2とCOに変換させる改質反応とを、上記触媒上で進行させ、炭化水素をH2とCOとに変換させる。 By using an Rh-modified (Ni—CeO 2 ) —Pt catalyst, which is a quaternary catalyst, as a catalyst for the reforming reaction, a part of the hydrocarbon is completely burned, and the hydrocarbon is converted into CO 2 and H 2 O. A combustion reaction that converts to The reforming reaction is an endothermic reaction and proceeds using the combustion heat generated by this combustion reaction. The reforming reaction, CO 2 and H 2 O produced by combustion reaction, and of H 2 O was introduced as CO 2 and the raw material contained in the raw material biogas is reacted with residual hydrocarbons into H 2 and CO The reforming reaction to be converted proceeds on the catalyst to convert hydrocarbons into H 2 and CO.
原料ガス中にH2OとCO2が含まれる場合、改質反応として、水蒸気改質反応(下記の式(1))と炭酸ガス改質反応(下記の式(2))が同時に進行する。水蒸気改質反応と炭酸ガス改質反応が進行する比率は、原料ガスの組成により決定されるため、原料ガスの組成を調整することで、改質ガス組成を調整する。
水蒸気改質反応 CH4+H2O→3H2+CO ・・・式(1)
炭酸ガス改質反応 CH4+CO2→2H2+2CO ・・・式(2)
When H 2 O and CO 2 are contained in the raw material gas, a steam reforming reaction (the following formula (1)) and a carbon dioxide reforming reaction (the following formula (2)) proceed simultaneously as the reforming reaction. . Since the rate at which the steam reforming reaction and the carbon dioxide reforming reaction proceed is determined by the composition of the raw material gas, the reformed gas composition is adjusted by adjusting the composition of the raw material gas.
Steam reforming reaction CH 4 + H 2 O → 3H 2 + CO (1)
Carbon dioxide gas reforming reaction CH 4 + CO 2 → 2H 2 + 2CO (2)
上記Rh修飾(Ni-CeO2)-Pt触媒は、例えば、適当な表面積を有するアルミナ担体表面にRhを担持させ、ついでPtを担持させ、さらにNiとCeO2とを同時担持させることにより得られる。ただし、担体の材質や形状の選択、被覆物形成の有無またはその材質の選択は、種々のバリエーションが可能である。 The Rh-modified (Ni—CeO 2 ) —Pt catalyst can be obtained, for example, by supporting Rh on the surface of an alumina carrier having an appropriate surface area, then supporting Pt, and simultaneously supporting Ni and CeO 2. . However, various variations are possible for the selection of the material and shape of the carrier, the presence / absence of coating formation, and the selection of the material.
Rhの担持は、Rhの水溶性塩の水溶液を含浸後、乾燥、焼成、水素還元することにより行われる。また、Ptの担持は、Ptの水溶性塩の水溶液を含浸後、乾燥、焼成、水素還元することにより行われる。NiおよびCeO2の同時担持は、Niの水溶性塩およびCeの水溶性塩の混合水溶液を含浸後、乾燥、焼成、水素還元することにより行われる。 Rh is supported by impregnating an aqueous solution of a water-soluble salt of Rh, followed by drying, firing, and hydrogen reduction. Pt is supported by impregnating an aqueous solution of a Pt water-soluble salt, followed by drying, firing, and hydrogen reduction. Simultaneous loading of Ni and CeO 2 is performed by impregnating a mixed aqueous solution of a water-soluble salt of Ni and a water-soluble salt of Ce, followed by drying, firing, and hydrogen reduction.
上に例示した手順により、目的とするRh修飾(Ni−CeO2)−Pt触媒が得られる。各成分の組成は重量比で、Rh:Ni:CeO2:Pt=(0.05−0.5):(3.0−10.0):(2.0−8.0):(0.3−5.0)、望ましくは、Rh:Ni:CeO2:Pt=(0.1−0.4):(4.0−9.0):(2.0−5.0):(0.3−3.0)に設定することが好ましい。 The target Rh-modified (Ni—CeO 2 ) -Pt catalyst is obtained by the procedure exemplified above. The composition of each component is Rh: Ni: CeO 2 : Pt = (0.05-0.5) :( 3.0-10.0) :( 2.0-8.0) :( 0 .3-5.0), preferably Rh: Ni: CeO 2 : Pt = (0.1-0.4) :( 4.0-9.0) :( 2.0-5.0): It is preferable to set to (0.3-3.0).
上記Rh修飾(Ni-CeO2)-Pt触媒の製造において、上記における各段階での水素還元処理を省略し、実際の使用に際して触媒を高温で水素還元して用いることもできる。また、各段階で水素還元処理を行ったときも、さらに使用に際して触媒を高温で水素還元して用いることができる。 In the production of the Rh-modified (Ni—CeO 2 ) —Pt catalyst, the hydrogen reduction treatment at each stage in the above may be omitted, and the catalyst may be used after hydrogen reduction at a high temperature in actual use. In addition, when the hydrogen reduction treatment is performed at each stage, the catalyst can be further reduced with hydrogen at a high temperature before use.
〔実施形態の装置〕
図2は、本発明を適用した実施形態の合成ガス製造装置の一例を示す。
[Device of Embodiment]
FIG. 2 shows an example of a synthesis gas production apparatus according to an embodiment to which the present invention is applied.
この装置は、改質器5と、脱硫器6と、水蒸気発生器15とを備えている。上記改質器5には、原料ガスを導入する原料ガス導入路4が上流側に接続され、改質ガスを導出する改質ガス路12が下流側に接続されている。改質ガス路12には、改質器5に近い上流側から下流側に向かって順に、第1熱交換器7、第2熱交換器8、第3熱交換器9、第4熱交換器10、第5熱交換器11が配置されている。
This apparatus includes a reformer 5, a desulfurizer 6, and a
この装置は、バイオガス、水蒸気、酸素ガスが原料ガスとして導入される。 In this apparatus, biogas, water vapor, and oxygen gas are introduced as source gases.
上記バイオガスは、バイオガス導入路1によって導入され、第3熱交換器9における改質ガスとの熱交換で加熱されて脱硫器6に導入される。上記脱硫器6には、上述した脱硫工程を行うための水素化触媒および硫化水素吸着剤が充填されている。上記脱硫器6で脱硫されたバイオガスは、水蒸気と合流されて混合ガス路19に導入される。
The biogas is introduced through the biogas introduction path 1, heated by heat exchange with the reformed gas in the
上記水蒸気は、純水導入路2から導入された純水から発生させる。上記純水導入路2から導入された純水は、第4熱交換器10における改質ガスとの熱交換で加熱され、水蒸気発生器15に導入される。上記水蒸気発生器15では導入した純水から水蒸気を発生させる。上記水蒸気発生器15から排出されるドレン水は、第2熱交換器8における改質ガスとの熱交換で加熱され、再び水蒸気発生器15に戻される。水蒸気発生器15で純水から発生した水蒸気は、水蒸気路18によって混合ガス路19に導入され、バイオガスと合流される。
The water vapor is generated from pure water introduced from the pure
バイオガスと水蒸気の混合ガスは、第1熱交換器7における改質ガスとの熱交換で加熱され、原料ガス導入路4に合流される。符号20はバイパス路20であり、バイオガスと水蒸気の混合ガスを、第1熱交換器7に経由させずに原料ガス導入路4に合流させる。
The mixed gas of biogas and water vapor is heated by heat exchange with the reformed gas in the first heat exchanger 7 and joined to the raw material gas introduction path 4.
上記酸素ガスは、酸素ガス導入路3によって導入され、原料ガス導入路4に合流される。上記原料ガス導入路4において、バイオガスと水蒸気の混合ガスに酸素ガスが混合され、ここでバイオガスと水蒸気と酸素ガスが混合された原料ガスが改質器5に導入される。 The oxygen gas is introduced through the oxygen gas introduction path 3 and merged into the source gas introduction path 4. In the raw material gas introduction path 4, oxygen gas is mixed with the mixed gas of biogas and water vapor, and here, the raw material gas in which the biogas, water vapor and oxygen gas are mixed is introduced into the reformer 5.
上記改質器5には、上述したRh修飾(Ni−CeO2)−Pt触媒が充填され、バイオガスに含まれる炭化水素系ガスの燃焼反応と改質反応を同じ反応領域内で同時に進行させる。改質器5で得られた改質ガスは、改質ガス路12を通過するあいだに、第1熱交換器7、第2熱交換器8、第3熱交換器9、第4熱交換器10、第5熱交換器11を通過する。それぞれでの熱交換に改質ガスの熱が供される。第5熱交換器11では、冷却水導入路14から導入される冷却水によって改質ガスが冷却される。
The reformer 5 is filled with the Rh-modified (Ni—CeO 2 ) —Pt catalyst described above, and the combustion reaction and the reforming reaction of the hydrocarbon-based gas contained in the biogas are simultaneously advanced in the same reaction region. . While the reformed gas obtained by the reformer 5 passes through the reformed
上記第5熱交換器11で冷却された改質ガスは、気液分離器13で水分が除去される。水分が除去された改質ガスは、合成ガス路17を通して合成ガスとしてメタノール合成等の使用に供される。気液分離器13で分離された水分は排水路16から排水される。合成ガス路17を通過する合成ガスの一部は、還流路21を経由してバイオガス導入路1に還流される。これにより、原料バイオガス中の硫黄成分を、水素化して脱硫するために必要な水素ガスを供給する。なお、水素化脱硫を行わない場合、還流路21の設置は必須ではない。
Moisture is removed from the reformed gas cooled by the
〔改質条件〕
上記実施形態の方法および装置によって得られた改質ガスの組成は、H2、CO、CH4、CO2、H2Oである。その比率が、メタノール合成やFT合成に有利な、合成ガス中の水素と一酸化炭素の比率が理論上およそ2となるように、改質反応に供する原料ガスの組成、改質の温度および改質の圧力を、平衡計算の結果に基づいて設定した。
[Reforming conditions]
The composition of the reformed gas obtained by the method and apparatus of the above embodiment is H 2 , CO, CH 4 , CO 2 , H 2 O. The composition of the raw material gas used for the reforming reaction, the reforming temperature, and the reforming ratio are such that the ratio of hydrogen and carbon monoxide in the syngas, which is advantageous for methanol synthesis and FT synthesis, is theoretically about 2. Quality pressure was set based on the results of equilibrium calculations.
具体的には、以下の条件である。
◇組成:バイオガスと酸素系ガスと水蒸気の混合比
CO2/C=0.0〜2.0
H2O/C=0.5〜2.5
O2/C=0.35〜0.60
◇温度および圧力
改質触媒の入口における原料ガスの温度:300〜700℃
改質器5の出口における圧力:50〜2000kPaG
Specifically, the following conditions are satisfied.
◇ Composition: Mixing ratio of biogas, oxygen-based gas and water vapor CO 2 /C=0.0-2.0
H 2 O / C = 0.5~2.5
O 2 /C=0.35~0.60
◇ Temperature and pressure Temperature of the raw material gas at the inlet of the reforming catalyst: 300 to 700 ° C
Pressure at the outlet of the reformer 5: 50 to 2000 kPaG
上記組成はつぎのとおりモル比を示している。
CO2/C=(原料ガス中炭酸ガス[mol])/(原料バイオガス中炭素[mol])
S/C=(原料ガス中水分[mol])/(原料バイオガス中炭素[mol])
O2/C=(原料ガス中酸素[mol])/(原料バイオガス中炭素[mol])
The above composition shows the molar ratio as follows.
CO 2 / C = (carbon dioxide gas in raw material gas [mol]) / (carbon in raw material biogas [mol])
S / C = (water content in raw material gas [mol]) / (carbon in raw material biogas [mol])
O 2 / C = (Oxygen in source gas [mol]) / (Carbon in source biogas [mol])
上記改質反応により、一酸化炭素と水素を主体とした合成ガスが得られる。得られた合成ガスは、原料バイオガスの昇温やスチームの製造に熱を利用した後さらに冷却され、気液分離された後、メタノール合成やFT合成の利用に供することができる。このように、CO2濃度が高いバイオガスについて、前処理で炭酸ガスを除去することなく改質し、メタノール合成やFT合成に供することがきる合成ガスを製造できる。 By the reforming reaction, synthesis gas mainly composed of carbon monoxide and hydrogen is obtained. The resultant synthesis gas can be used for methanol synthesis or FT synthesis after it is further cooled and gas-liquid separated after using heat for raw material biogas temperature rise and steam production. In this way, a biogas having a high CO 2 concentration can be reformed without removing carbon dioxide in the pretreatment, and a synthesis gas that can be used for methanol synthesis or FT synthesis can be produced.
本実施形態の方法で得られた改質ガスの組成を一例として挙げれば、つぎのようなものになる。
H2=41.9%
CO=20.9%
CH4=1.2%
CO2=15.1%
H2O=20.8%
As an example, the composition of the reformed gas obtained by the method of the present embodiment is as follows.
H 2 = 41.9%
CO = 20.9%
CH 4 = 1.2%
CO 2 = 15.1%
H 2 O = 20.8%
表1は、改質器5の入口の温度を400℃とし、改質器5の出口の圧力を、80kPaG、800kPaG、2000kPaGとしたケースシュミレーションした結果である。いずれも、カーボン活性値は1以下となっている。つまり、カーボンの析出を生じることなく、運転できることを確認した。 Table 1 shows the results of a case simulation in which the temperature at the inlet of the reformer 5 is 400 ° C. and the pressure at the outlet of the reformer 5 is 80 kPaG, 800 kPaG, and 2000 kPaG. In either case, the carbon activity value is 1 or less. That is, it was confirmed that the operation was possible without causing carbon deposition.
〔カーボン活性値〕
本実施形態では、改質ガスからのカーボン析出の起こりやすさを示す指標として、カーボン活性値を用いた。
[Carbon activity value]
In the present embodiment, the carbon activity value is used as an index indicating the likelihood of carbon precipitation from the reformed gas.
カーボン活性値は、析出反応毎に、CO、H2、CO2、H2Oの分圧、および温度から求められる平衡定数を用いて計算される値である。カーボン活性値が1を超えていなければ、平衡上、カーボンの析出が起こらない。 The carbon activity value is a value calculated using an equilibrium constant determined from the partial pressure of CO, H 2 , CO 2 , and H 2 O and the temperature for each precipitation reaction. If the carbon activity value does not exceed 1, no carbon deposition occurs on equilibrium.
原料ガス中のCO2濃度が高い条件において、改質反応が進行し、反応器中のCO分圧、H2分圧が上昇することにより、カーボンが析出し易くなる。 Under the condition that the CO 2 concentration in the raw material gas is high, the reforming reaction proceeds, and the CO partial pressure and H 2 partial pressure in the reactor increase, so that carbon is likely to precipitate.
カーボンの析出は、下記の反応により発生すると想定される(白井裕三、財団法人電力中央研究所報告、研究報告W00010,2001)。
2CO→C+CO2・・・式(A)
CO+H2→C+H2O・・・式(B)
Precipitation of carbon is assumed to occur by the following reaction (Yuzo Shirai, Report of Central Research Institute of Electric Power, Research Report W00010, 2001).
2CO → C + CO 2 Formula (A)
CO + H 2 → C + H 2 O Formula (B)
ここで、式(A)、式(B)で表わされる反応は平衡反応であり、カーボンが析出するか否かは、反応ガス中のCO、CO2、H2、H2Oの分圧と反応ガスの温度から想定することができる。 Here, the reactions represented by the formulas (A) and (B) are equilibrium reactions, and whether or not carbon is precipitated depends on the partial pressure of CO, CO 2 , H 2 , and H 2 O in the reaction gas. It can be assumed from the temperature of the reaction gas.
理論上、下記の計算式(C)(D)で求められるカーボン活性値が1を上回る場合に、式(A)および式(B)の反応に従いカーボンが析出する。カーボン活性値が1を下回る場合には、式(A)および式(B)の逆反応に従い、カーボンのガス化反応が起こり、カーボンの析出は起こらない。 Theoretically, when the carbon activity value obtained by the following calculation formulas (C) and (D) exceeds 1, carbon is deposited according to the reactions of the formulas (A) and (B). When the carbon activity value is less than 1, the gasification reaction of carbon occurs according to the reverse reaction of the formulas (A) and (B), and no carbon deposition occurs.
A1(反応式(A)に対するカーボン活性値)=K1×(ρCO)2/(ρCO2)・・・式(C)
A2(反応式(B)に対するカーボン活性値)=K2×(ρCO)×(ρH2)/(ρH2O)・・・式(D)
A1 (carbon activity value with respect to reaction formula (A)) = K1 × (ρCO) 2 / (ρCO 2 ) (formula (C))
A2 (carbon activity value with respect to reaction formula (B)) = K2 × (ρCO) × (ρH 2 ) / (ρH 2 O) Formula (D)
K1,K2は、温度から求められる平衡定数である。
参考文献1:大木力,NTN TECHNICAL REVIEW,N0.74,p.42〜49,2006
参考文献2:石神逸男,大阪府立産業技術総合研究所報告,No.21,p.9〜16,2007)
K1 and K2 are equilibrium constants determined from the temperature.
Reference 1: Riki Oki, NTN TECHNICICAL REVIEW, N0.74, p. 42-49, 2006
Reference 2: Ishigami Yasuo, Osaka Prefectural Industrial Technology Research Institute report, No. 21, p. 9-16, 2007)
〔実施形態の作用効果〕
本実施形態では、改質ガスのカーボン活性値が1以下で、かつメタノール合成やFT合成に有利な組成で合成ガスが得られるよう、改質反応に供する原料ガスの組成、改質の温度および改質の圧力を設定した。
[Effects of Embodiment]
In this embodiment, the composition of the raw material gas used for the reforming reaction, the reforming temperature, and the reforming gas so that the reformed gas has a carbon activity value of 1 or less and has a composition advantageous for methanol synthesis or FT synthesis. The reforming pressure was set.
つまり、メタンと炭酸ガスを主成分とするバイオガスを改質する合成ガスの製造において、以下の条件を確立した。
(1)バイオガス中のCO2を事前に除去する工程を経ずに直接改質して合成ガスを得られた。
(2)メタノール合成やFT合成に有利な比率で合成ガスを発生できた。
In other words, the following conditions were established in the production of synthesis gas for reforming biogas mainly composed of methane and carbon dioxide.
(1) The synthesis gas was obtained by direct reforming without going through the step of previously removing CO 2 in the biogas.
(2) Syngas could be generated at a ratio advantageous for methanol synthesis and FT synthesis.
その結果、以下の効果を得た。
(1)従来の一般的なバイオガスの改質で必要であった、CO2の除去設備を不要とした。CO2除去にかかる設備を削減し、動力も削減できた。
(2)メタノール合成やFT合成に有利な比率で合成ガスを製造できる。従来必要であった、精製および混合の設備が不要となる。精製工程におけるロスもなくなり、合成ガスの製造コストの低減を図ることができた。
As a result, the following effects were obtained.
(1) The CO 2 removal equipment, which is necessary for the conventional general reforming of biogas, is not required. The equipment required for CO 2 removal was reduced, and the power was also reduced.
(2) A synthesis gas can be produced at a ratio advantageous for methanol synthesis and FT synthesis. Equipment for purification and mixing, which was necessary in the past, is no longer necessary. Loss in the refining process was eliminated, and the production cost of synthesis gas could be reduced.
1:バイオガス導入路
2:純水導入路
3:酸素ガス導入路
4:原料ガス導入路
5:改質器
6:脱硫器
7:第1熱交換器
8:第2熱交換器
9:第3熱交換器
10:第4熱交換器
11:第5熱交換器
12:改質ガス路
13:気液分離器
14:冷却水導入路
15:水蒸気発生器
16:排水路
17:合成ガス路
18:水蒸気路
19:混合ガス路
20:バイパス路
21:還流路
1: Biogas introduction path 2: Pure water introduction path 3: Oxygen gas introduction path 4: Raw material gas introduction path 5: Reformer 6: Desulfurizer 7: First heat exchanger 8: Second heat exchanger 9: First 3 heat exchanger 10: 4th heat exchanger 11: 5th heat exchanger 12: reforming gas path 13: gas-liquid separator 14: cooling water introduction path 15: steam generator 16: drainage path 17: synthesis gas path 18: water vapor path 19: mixed gas path 20: bypass path 21: reflux path
表1は、改質器5の入口の温度を400℃とし、改質器5の出口の圧力を、80kPaG、800kPaG、2000kPaGとしたケースシミュレーションした結果である。いずれも、カーボン活性値は1以下となっている。つまり、カーボンの析出を生じることなく、運転できることを確認した。 Table 1, the temperature of the inlet of the reformer 5 and 400 ° C., is the result of the pressure at the outlet of the reformer 5, 80kPaG, 800kPaG, and Kesushi simulation was 2000KPaG. In either case, the carbon activity value is 1 or less. That is, it was confirmed that the operation was possible without causing carbon deposition.
Claims (8)
上記炭化水素系ガスとしてバイオガスを用い、
上記バイオガスを上記改質反応に供する際に、二酸化炭素を分離除去しない
ことを特徴とする合成ガスの製造方法。 In producing a synthesis gas mainly composed of carbon monoxide and hydrogen by reforming a hydrocarbon-based gas, an oxygen-based gas, and water vapor,
Using biogas as the hydrocarbon-based gas,
A method for producing synthesis gas, wherein carbon dioxide is not separated and removed when the biogas is subjected to the reforming reaction.
請求項1記載の合成ガスの製造方法。 The method for producing a synthesis gas according to claim 1, wherein the biogas includes 50% by volume or more and 70% by volume or less of methane, and the balance is carbon dioxide and impurities.
CO2/C=0〜2、
H2O/C=0.5〜2.5、
O2/C=0.35〜0.6である
請求項1または2記載の合成ガスの製造方法。 The mixing ratio of the biogas, oxygen-based gas, and water vapor is a molar ratio.
CO 2 / C = 0~2,
H 2 O / C = 0.5~2.5,
The method for producing synthesis gas according to claim 1, wherein O 2 /C=0.35 to 0.6.
請求項1〜3のいずれか一項に記載の合成ガスの製造方法。 As the catalyst used in the reforming reaction, Rh modified (Ni-CeO 2) using -Pt catalyst of claim 1 which proceed simultaneously with combustion reaction and reforming reaction of the hydrocarbon gas in the same reaction region The method for producing a synthesis gas according to any one of the above.
上記炭化水素系ガスとしてバイオガスを用い、
上記改質器に供する上記バイオガスから二酸化炭素を分離除去する手段を備えていない
ことを特徴とする合成ガスの製造装置。 It is equipped with a reformer to obtain a synthesis gas mainly composed of carbon monoxide and hydrogen by reforming a hydrocarbon-based gas, an oxygen-based gas, and steam.
Using biogas as the hydrocarbon-based gas,
An apparatus for producing synthesis gas, comprising no means for separating and removing carbon dioxide from the biogas supplied to the reformer.
請求項5記載の合成ガスの製造装置。 The said biogas is 50 volume% or more and 70 volume% or less of methane, The remainder is a carbon dioxide and an impurity, The manufacturing apparatus of the synthesis gas of Claim 5.
CO2/C=0〜2、
H2O/C=0.5〜2.5、
O2/C=0.35〜0.6である
請求項5または6記載の合成ガスの製造装置。 The mixing ratio of the biogas, oxygen-based gas, and water vapor is a molar ratio.
CO 2 / C = 0~2,
H 2 O / C = 0.5~2.5,
The apparatus for producing synthesis gas according to claim 5 or 6, wherein O 2 /C=0.35 to 0.6.
請求項5〜7のいずれか一項に記載の合成ガスの製造装置。 The catalyst used for the reforming reaction is Rh modified (Ni-CeO 2) -Pt catalyst, any of claim 5-7 to progress at the same time the combustion reaction and reforming reaction of the hydrocarbon gas in the same reaction region The synthesis gas production apparatus according to claim 1.
Priority Applications (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2015121594A JP2017007872A (en) | 2015-06-17 | 2015-06-17 | Synthesis gas production process and apparatus |
| PCT/JP2016/066110 WO2016203944A1 (en) | 2015-06-17 | 2016-06-01 | Synthesis gas production method and apparatus |
| PH12017550143A PH12017550143A1 (en) | 2015-06-17 | 2017-12-15 | Synthesis gas production method and apparatus |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2015121594A JP2017007872A (en) | 2015-06-17 | 2015-06-17 | Synthesis gas production process and apparatus |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2017007872A true JP2017007872A (en) | 2017-01-12 |
| JP2017007872A5 JP2017007872A5 (en) | 2017-12-07 |
Family
ID=57545673
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015121594A Pending JP2017007872A (en) | 2015-06-17 | 2015-06-17 | Synthesis gas production process and apparatus |
Country Status (3)
| Country | Link |
|---|---|
| JP (1) | JP2017007872A (en) |
| PH (1) | PH12017550143A1 (en) |
| WO (1) | WO2016203944A1 (en) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20180105823A (en) * | 2017-03-16 | 2018-10-01 | 한국과학기술연구원 | Method for preparing synthetic natural gas having improved caloric value and application for the same |
| JP2021512035A (en) * | 2017-11-15 | 2021-05-13 | ガス、テクノロジー、インスティチュートGas Technology Institute | Precious metal catalysts and processes for reforming methane and other hydrocarbons |
| US11667853B2 (en) | 2017-11-15 | 2023-06-06 | Gti Energy | Processes and systems for reforming of methane and light hydrocarbons to liquid hydrocarbon fuels |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2020054063A1 (en) * | 2018-09-14 | 2020-03-19 | 株式会社 ユーリカ エンジニアリング | Synthetic gas production system for low-carbon ft synthetic oil production |
| CN111547678B (en) * | 2020-04-08 | 2022-03-25 | 华南农业大学 | Method and system for preparing methanol by full-component thermal catalysis of marsh gas |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2002173304A (en) * | 2000-12-06 | 2002-06-21 | Japan Petroleum Exploration Co Ltd | Method of producing synthetic gas by autothermal reforming |
| JP2006096590A (en) * | 2004-09-28 | 2006-04-13 | Asao Tada | Apparatus for directly cracking lower hydrocarbon |
| JP2010530878A (en) * | 2007-06-21 | 2010-09-16 | ユニバーシティ オブ サザン カリフォルニア | Conversion of carbon dioxide to methanol using methane or natural gas reforming. |
| JP2011207740A (en) * | 2010-03-08 | 2011-10-20 | Air Water Inc | Syngas production method |
| JP2013533245A (en) * | 2010-07-09 | 2013-08-22 | ハルドール・トプサー・アクチエゼルスカベット | How to convert biogas to methane-rich gas |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2012167351A1 (en) * | 2011-06-08 | 2012-12-13 | University Of Regina | Sulfur tolerant catalysts for hydrogen production by carbon dioxide reforming of methane-rich gas |
| JP6041162B2 (en) * | 2012-08-01 | 2016-12-07 | 国立大学法人九州大学 | Paper-like catalyst for reforming hydrocarbons, paper-like catalyst array, and solid oxide fuel cell having paper-like catalyst or paper-like catalyst array |
-
2015
- 2015-06-17 JP JP2015121594A patent/JP2017007872A/en active Pending
-
2016
- 2016-06-01 WO PCT/JP2016/066110 patent/WO2016203944A1/en active Application Filing
-
2017
- 2017-12-15 PH PH12017550143A patent/PH12017550143A1/en unknown
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2002173304A (en) * | 2000-12-06 | 2002-06-21 | Japan Petroleum Exploration Co Ltd | Method of producing synthetic gas by autothermal reforming |
| JP2006096590A (en) * | 2004-09-28 | 2006-04-13 | Asao Tada | Apparatus for directly cracking lower hydrocarbon |
| JP2010530878A (en) * | 2007-06-21 | 2010-09-16 | ユニバーシティ オブ サザン カリフォルニア | Conversion of carbon dioxide to methanol using methane or natural gas reforming. |
| JP2011207740A (en) * | 2010-03-08 | 2011-10-20 | Air Water Inc | Syngas production method |
| JP2013533245A (en) * | 2010-07-09 | 2013-08-22 | ハルドール・トプサー・アクチエゼルスカベット | How to convert biogas to methane-rich gas |
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20180105823A (en) * | 2017-03-16 | 2018-10-01 | 한국과학기술연구원 | Method for preparing synthetic natural gas having improved caloric value and application for the same |
| KR102097283B1 (en) * | 2017-03-16 | 2020-04-06 | 한국과학기술연구원 | Method for preparing synthetic natural gas having improved caloric value and application for the same |
| JP2021512035A (en) * | 2017-11-15 | 2021-05-13 | ガス、テクノロジー、インスティチュートGas Technology Institute | Precious metal catalysts and processes for reforming methane and other hydrocarbons |
| JP7096887B2 (en) | 2017-11-15 | 2022-07-06 | ガス、テクノロジー、インスティチュート | Precious metal catalysts and processes for reforming methane and other hydrocarbons |
| US11667853B2 (en) | 2017-11-15 | 2023-06-06 | Gti Energy | Processes and systems for reforming of methane and light hydrocarbons to liquid hydrocarbon fuels |
Also Published As
| Publication number | Publication date |
|---|---|
| PH12017550143A1 (en) | 2018-06-11 |
| WO2016203944A1 (en) | 2016-12-22 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Dalena et al. | Methanol production and applications: an overview | |
| Basile et al. | Methanol: science and engineering | |
| JP5738989B2 (en) | How to convert biogas to methane-rich gas | |
| WO2016203944A1 (en) | Synthesis gas production method and apparatus | |
| Budzianowski | Negative net CO2 emissions from oxy-decarbonization of biogas to H2 | |
| CN104591083A (en) | Hydrogen preparation method | |
| Pirola et al. | Fossil or renewable sources for methanol production? | |
| AU2012350998A1 (en) | Process for producing an adjustable gas composition for fuel cells | |
| KR20230090311A (en) | Process for synthesizing hydrocarbons | |
| Moioli et al. | Negative CO2 emissions from flexible biofuel synthesis: Concepts, potentials, technologies | |
| Koido et al. | Fate of sulphur during simultaneous gasification of lignin-slurry and removal of hydrogen sulphide over calcium aluminate supported nickel oxide catalyst | |
| CN107032954A (en) | The method that methanol and its derivative are produced using underground coal gasification(UCG) product gas | |
| RU2515967C2 (en) | Method of obtaining hydrogen-rich gas mixture | |
| EP4121390A1 (en) | Production of hydrocarbons | |
| Verma et al. | Overview of biogas reforming technologies for hydrogen production: advantages and challenges | |
| Cerqueira et al. | Combined autothermal and sorption-enhanced reforming of olive mill wastewater for the production of hydrogen: thermally neutral conditions analysis | |
| JPH02302302A (en) | Power generation system of fuel cell | |
| JP2024509639A (en) | How to control a gas fermentation platform for improved conversion of carbon dioxide to products | |
| CN102781565A (en) | Removal method for sulfur compound in castable | |
| JP2012036316A (en) | Biomass gasification gas purification system and method, methanol production system and method | |
| Blasi et al. | Hydrogen from biomass | |
| US20220323927A1 (en) | Process and apparatus for providing a feedstock | |
| US9242907B2 (en) | Biomass gasification gas purification system and method, and methanol production system and method | |
| Gallucci et al. | Conventional Processes for Hydrogen Production | |
| Kumar et al. | Recent advances of biogas reforming for hydrogen production: Methods, purification, utility and techno-economics analysis |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20160524 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20171024 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20180522 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20190716 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20190816 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20191112 |