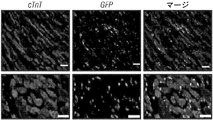
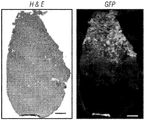
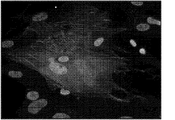
JP2014507442A - 心臓線維芽細胞の心筋細胞への再プログラム化による心臓修復 - Google Patents
心臓線維芽細胞の心筋細胞への再プログラム化による心臓修復 Download PDFInfo
- Publication number
- JP2014507442A JP2014507442A JP2013555521A JP2013555521A JP2014507442A JP 2014507442 A JP2014507442 A JP 2014507442A JP 2013555521 A JP2013555521 A JP 2013555521A JP 2013555521 A JP2013555521 A JP 2013555521A JP 2014507442 A JP2014507442 A JP 2014507442A
- Authority
- JP
- Japan
- Prior art keywords
- expression cassette
- tbx5
- mef2c
- subject
- hand2
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 210000001054 cardiac fibroblast Anatomy 0.000 title claims abstract description 87
- 230000000747 cardiac effect Effects 0.000 title claims description 79
- 230000008672 reprogramming Effects 0.000 title claims description 14
- 210000004413 cardiac myocyte Anatomy 0.000 title abstract description 112
- 230000008439 repair process Effects 0.000 title abstract description 4
- 238000000034 method Methods 0.000 claims abstract description 125
- 208000010125 myocardial infarction Diseases 0.000 claims abstract description 97
- 101150115978 tbx5 gene Proteins 0.000 claims abstract description 73
- 108010081823 Myocardin Proteins 0.000 claims abstract description 60
- 102100030217 Myocardin Human genes 0.000 claims abstract description 60
- 238000011282 treatment Methods 0.000 claims abstract description 44
- 101150003286 gata4 gene Proteins 0.000 claims abstract description 42
- 230000014509 gene expression Effects 0.000 claims description 211
- 108090000623 proteins and genes Proteins 0.000 claims description 149
- 102000004169 proteins and genes Human genes 0.000 claims description 69
- 239000013598 vector Substances 0.000 claims description 59
- 230000002861 ventricular Effects 0.000 claims description 28
- 230000001177 retroviral effect Effects 0.000 claims description 23
- 230000001965 increasing effect Effects 0.000 claims description 22
- 238000013146 percutaneous coronary intervention Methods 0.000 claims description 17
- 239000002876 beta blocker Substances 0.000 claims description 15
- 206010019280 Heart failures Diseases 0.000 claims description 13
- 239000005557 antagonist Substances 0.000 claims description 13
- 230000003247 decreasing effect Effects 0.000 claims description 13
- 239000013603 viral vector Substances 0.000 claims description 13
- 239000003527 fibrinolytic agent Substances 0.000 claims description 12
- 239000002934 diuretic Substances 0.000 claims description 11
- 150000002632 lipids Chemical class 0.000 claims description 11
- 102000020313 Cell-Penetrating Peptides Human genes 0.000 claims description 10
- 108010051109 Cell-Penetrating Peptides Proteins 0.000 claims description 10
- 229940097320 beta blocking agent Drugs 0.000 claims description 10
- 230000002265 prevention Effects 0.000 claims description 8
- 206010007572 Cardiac hypertrophy Diseases 0.000 claims description 7
- 208000006029 Cardiomegaly Diseases 0.000 claims description 7
- SNIOPGDIGTZGOP-UHFFFAOYSA-N Nitroglycerin Chemical compound [O-][N+](=O)OCC(O[N+]([O-])=O)CO[N+]([O-])=O SNIOPGDIGTZGOP-UHFFFAOYSA-N 0.000 claims description 7
- 229960001138 acetylsalicylic acid Drugs 0.000 claims description 7
- 230000007423 decrease Effects 0.000 claims description 7
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 7
- BSYNRYMUTXBXSQ-UHFFFAOYSA-N Aspirin Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O BSYNRYMUTXBXSQ-UHFFFAOYSA-N 0.000 claims description 6
- 201000010099 disease Diseases 0.000 claims description 6
- 239000004041 inotropic agent Substances 0.000 claims description 6
- 102000055120 MEF2 Transcription Factors Human genes 0.000 claims description 5
- 108010018650 MEF2 Transcription Factors Proteins 0.000 claims description 5
- 239000000006 Nitroglycerin Substances 0.000 claims description 5
- 229960003711 glyceryl trinitrate Drugs 0.000 claims description 5
- 206010020880 Hypertrophy Diseases 0.000 claims description 4
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 claims description 4
- 239000003112 inhibitor Substances 0.000 claims description 4
- 239000001301 oxygen Substances 0.000 claims description 4
- 229910052760 oxygen Inorganic materials 0.000 claims description 4
- 230000004872 arterial blood pressure Effects 0.000 claims description 3
- 230000003205 diastolic effect Effects 0.000 claims description 3
- 210000001147 pulmonary artery Anatomy 0.000 claims description 3
- 230000002685 pulmonary effect Effects 0.000 claims description 3
- 102100037310 Serine/threonine-protein kinase D1 Human genes 0.000 claims description 2
- 239000003276 histone deacetylase inhibitor Substances 0.000 claims description 2
- 239000007925 intracardiac injection Substances 0.000 claims description 2
- 230000001882 diuretic effect Effects 0.000 claims 1
- 229940121372 histone deacetylase inhibitor Drugs 0.000 claims 1
- 102000040945 Transcription factor Human genes 0.000 abstract description 39
- 108091023040 Transcription factor Proteins 0.000 abstract description 39
- 238000001727 in vivo Methods 0.000 abstract description 24
- 238000000338 in vitro Methods 0.000 abstract description 13
- 230000037390 scarring Effects 0.000 abstract description 5
- 230000002107 myocardial effect Effects 0.000 abstract description 4
- 210000004027 cell Anatomy 0.000 description 180
- -1 HAND2 Proteins 0.000 description 71
- 241000699670 Mus sp. Species 0.000 description 65
- 235000018102 proteins Nutrition 0.000 description 60
- 241001430294 unidentified retrovirus Species 0.000 description 54
- 108010005774 beta-Galactosidase Proteins 0.000 description 45
- WQZGKKKJIJFFOK-FPRJBGLDSA-N beta-D-galactose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@H]1O WQZGKKKJIJFFOK-FPRJBGLDSA-N 0.000 description 41
- 239000000203 mixture Substances 0.000 description 40
- 210000002950 fibroblast Anatomy 0.000 description 38
- 241000700605 Viruses Species 0.000 description 33
- 241000699666 Mus <mouse, genus> Species 0.000 description 30
- 239000011575 calcium Substances 0.000 description 30
- 108020004414 DNA Proteins 0.000 description 29
- NKANXQFJJICGDU-QPLCGJKRSA-N Tamoxifen Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN(C)C)=CC=1)/C1=CC=CC=C1 NKANXQFJJICGDU-QPLCGJKRSA-N 0.000 description 28
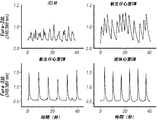
- 230000004217 heart function Effects 0.000 description 26
- 239000003795 chemical substances by application Substances 0.000 description 25
- 108090000765 processed proteins & peptides Proteins 0.000 description 25
- 238000000684 flow cytometry Methods 0.000 description 23
- 241000701161 unidentified adenovirus Species 0.000 description 23
- 239000003814 drug Substances 0.000 description 22
- 238000004458 analytical method Methods 0.000 description 21
- 108010063503 Actinin Proteins 0.000 description 20
- 102000010825 Actinin Human genes 0.000 description 20
- 238000010186 staining Methods 0.000 description 20
- 230000003612 virological effect Effects 0.000 description 20
- 230000000694 effects Effects 0.000 description 18
- 239000002502 liposome Substances 0.000 description 18
- 239000003550 marker Substances 0.000 description 18
- 239000000243 solution Substances 0.000 description 18
- 235000007688 Lycopersicon esculentum Nutrition 0.000 description 17
- 240000003768 Solanum lycopersicum Species 0.000 description 17
- 210000001519 tissue Anatomy 0.000 description 17
- 239000003416 antiarrhythmic agent Substances 0.000 description 16
- 238000002347 injection Methods 0.000 description 16
- 239000007924 injection Substances 0.000 description 16
- 239000002609 medium Substances 0.000 description 16
- 210000004165 myocardium Anatomy 0.000 description 16
- 238000000746 purification Methods 0.000 description 16
- 108090001090 Lectins Proteins 0.000 description 15
- 102000004856 Lectins Human genes 0.000 description 15
- 239000003146 anticoagulant agent Substances 0.000 description 15
- RPTUSVTUFVMDQK-UHFFFAOYSA-N Hidralazin Chemical compound C1=CC=C2C(NN)=NN=CC2=C1 RPTUSVTUFVMDQK-UHFFFAOYSA-N 0.000 description 14
- 229940079593 drug Drugs 0.000 description 14
- 239000003623 enhancer Substances 0.000 description 14
- 210000000107 myocyte Anatomy 0.000 description 14
- 102000039446 nucleic acids Human genes 0.000 description 14
- 108020004707 nucleic acids Proteins 0.000 description 14
- 150000007523 nucleic acids Chemical class 0.000 description 14
- 102000004196 processed proteins & peptides Human genes 0.000 description 14
- 229960001603 tamoxifen Drugs 0.000 description 14
- 238000010361 transduction Methods 0.000 description 14
- 230000026683 transduction Effects 0.000 description 14
- 101000819074 Homo sapiens Transcription factor GATA-4 Proteins 0.000 description 13
- 102100021380 Transcription factor GATA-4 Human genes 0.000 description 13
- 230000004913 activation Effects 0.000 description 13
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 11
- 208000015181 infectious disease Diseases 0.000 description 11
- 239000002523 lectin Substances 0.000 description 11
- 239000002245 particle Substances 0.000 description 11
- 239000000047 product Substances 0.000 description 11
- 102000005962 receptors Human genes 0.000 description 11
- 108020003175 receptors Proteins 0.000 description 11
- 238000013518 transcription Methods 0.000 description 11
- 230000035897 transcription Effects 0.000 description 11
- 238000012546 transfer Methods 0.000 description 11
- 229940124549 vasodilator Drugs 0.000 description 11
- 239000003071 vasodilator agent Substances 0.000 description 11
- 241000282412 Homo Species 0.000 description 10
- 206010000891 acute myocardial infarction Diseases 0.000 description 10
- 229940030606 diuretics Drugs 0.000 description 10
- 238000012744 immunostaining Methods 0.000 description 10
- 230000001939 inductive effect Effects 0.000 description 10
- 229920002791 poly-4-hydroxybutyrate Polymers 0.000 description 10
- 238000011002 quantification Methods 0.000 description 10
- 239000000523 sample Substances 0.000 description 10
- SGUAFYQXFOLMHL-UHFFFAOYSA-N 2-hydroxy-5-{1-hydroxy-2-[(4-phenylbutan-2-yl)amino]ethyl}benzamide Chemical compound C=1C=C(O)C(C(N)=O)=CC=1C(O)CNC(C)CCC1=CC=CC=C1 SGUAFYQXFOLMHL-UHFFFAOYSA-N 0.000 description 9
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 9
- 101001072202 Homo sapiens Protein disulfide-isomerase Proteins 0.000 description 9
- 206010061216 Infarction Diseases 0.000 description 9
- 241001465754 Metazoa Species 0.000 description 9
- 102100036352 Protein disulfide-isomerase Human genes 0.000 description 9
- 239000000872 buffer Substances 0.000 description 9
- 229910052791 calcium Inorganic materials 0.000 description 9
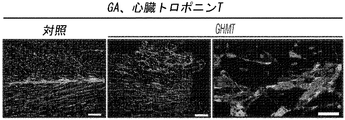
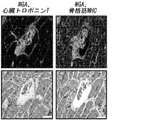
- 230000009787 cardiac fibrosis Effects 0.000 description 9
- 230000006378 damage Effects 0.000 description 9
- 238000009472 formulation Methods 0.000 description 9
- 230000006870 function Effects 0.000 description 9
- 230000006698 induction Effects 0.000 description 9
- 230000007574 infarction Effects 0.000 description 9
- 239000000463 material Substances 0.000 description 9
- 108020004999 messenger RNA Proteins 0.000 description 9
- 238000004806 packaging method and process Methods 0.000 description 9
- 238000002360 preparation method Methods 0.000 description 9
- 229940127291 Calcium channel antagonist Drugs 0.000 description 8
- 206010016654 Fibrosis Diseases 0.000 description 8
- 208000027418 Wounds and injury Diseases 0.000 description 8
- 239000002160 alpha blocker Substances 0.000 description 8
- 229940127219 anticoagulant drug Drugs 0.000 description 8
- 230000015572 biosynthetic process Effects 0.000 description 8
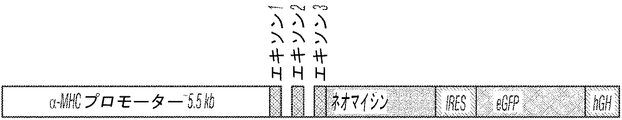
- 239000013604 expression vector Substances 0.000 description 8
- 230000004761 fibrosis Effects 0.000 description 8
- 210000003953 foreskin Anatomy 0.000 description 8
- 208000014674 injury Diseases 0.000 description 8
- 239000003446 ligand Substances 0.000 description 8
- 210000004940 nucleus Anatomy 0.000 description 8
- 229920001184 polypeptide Polymers 0.000 description 8
- 230000001105 regulatory effect Effects 0.000 description 8
- 230000010076 replication Effects 0.000 description 8
- 210000002235 sarcomere Anatomy 0.000 description 8
- 238000001356 surgical procedure Methods 0.000 description 8
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 7
- FWBHETKCLVMNFS-UHFFFAOYSA-N 4',6-Diamino-2-phenylindol Chemical compound C1=CC(C(=N)N)=CC=C1C1=CC2=CC=C(C(N)=N)C=C2N1 FWBHETKCLVMNFS-UHFFFAOYSA-N 0.000 description 7
- 239000005541 ACE inhibitor Substances 0.000 description 7
- 101150114527 Nkx2-5 gene Proteins 0.000 description 7
- 102100023087 Protein S100-A4 Human genes 0.000 description 7
- 229940044094 angiotensin-converting-enzyme inhibitor Drugs 0.000 description 7
- 239000003242 anti bacterial agent Substances 0.000 description 7
- 239000002220 antihypertensive agent Substances 0.000 description 7
- 230000008901 benefit Effects 0.000 description 7
- 239000000480 calcium channel blocker Substances 0.000 description 7
- 238000013184 cardiac magnetic resonance imaging Methods 0.000 description 7
- VYFYYTLLBUKUHU-UHFFFAOYSA-N dopamine Chemical compound NCCC1=CC=C(O)C(O)=C1 VYFYYTLLBUKUHU-UHFFFAOYSA-N 0.000 description 7
- 230000002068 genetic effect Effects 0.000 description 7
- 238000003384 imaging method Methods 0.000 description 7
- 230000001404 mediated effect Effects 0.000 description 7
- 210000000663 muscle cell Anatomy 0.000 description 7
- 229960000103 thrombolytic agent Drugs 0.000 description 7
- 239000003981 vehicle Substances 0.000 description 7
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 6
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 6
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 description 6
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 6
- 238000011529 RT qPCR Methods 0.000 description 6
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 6
- 238000001042 affinity chromatography Methods 0.000 description 6
- 210000004351 coronary vessel Anatomy 0.000 description 6
- 230000002950 deficient Effects 0.000 description 6
- 239000006185 dispersion Substances 0.000 description 6
- 238000002474 experimental method Methods 0.000 description 6
- 230000010354 integration Effects 0.000 description 6
- 230000000302 ischemic effect Effects 0.000 description 6
- MOYKHGMNXAOIAT-JGWLITMVSA-N isosorbide dinitrate Chemical compound [O-][N+](=O)O[C@H]1CO[C@@H]2[C@H](O[N+](=O)[O-])CO[C@@H]21 MOYKHGMNXAOIAT-JGWLITMVSA-N 0.000 description 6
- 210000003141 lower extremity Anatomy 0.000 description 6
- SLIWIQKBDGZFQR-PIVCGYGYSA-N n-[3-oxo-3',6'-bis[[(2s,3r,4s,5r,6r)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy]spiro[2-benzofuran-1,9'-xanthene]-5-yl]dodecanamide Chemical compound C=1C(NC(=O)CCCCCCCCCCC)=CC=C2C=1C(=O)OC2(C1=CC=C(O[C@H]2[C@@H]([C@@H](O)[C@@H](O)[C@@H](CO)O2)O)C=C1OC1=C2)C1=CC=C2O[C@@H]1O[C@H](CO)[C@H](O)[C@H](O)[C@H]1O SLIWIQKBDGZFQR-PIVCGYGYSA-N 0.000 description 6
- 239000013612 plasmid Substances 0.000 description 6
- AQHHHDLHHXJYJD-UHFFFAOYSA-N propranolol Chemical compound C1=CC=C2C(OCC(O)CNC(C)C)=CC=CC2=C1 AQHHHDLHHXJYJD-UHFFFAOYSA-N 0.000 description 6
- 230000002829 reductive effect Effects 0.000 description 6
- 150000003839 salts Chemical class 0.000 description 6
- 239000011780 sodium chloride Substances 0.000 description 6
- 239000000126 substance Substances 0.000 description 6
- 238000011830 transgenic mouse model Methods 0.000 description 6
- YNGDWRXWKFWCJY-UHFFFAOYSA-N 1,4-Dihydropyridine Chemical class C1C=CNC=C1 YNGDWRXWKFWCJY-UHFFFAOYSA-N 0.000 description 5
- JBMKAUGHUNFTOL-UHFFFAOYSA-N Aldoclor Chemical class C1=C(Cl)C(S(=O)(=O)N)=CC2=C1NC=NS2(=O)=O JBMKAUGHUNFTOL-UHFFFAOYSA-N 0.000 description 5
- 230000004568 DNA-binding Effects 0.000 description 5
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 5
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 5
- 241000699660 Mus musculus Species 0.000 description 5
- PVNIIMVLHYAWGP-UHFFFAOYSA-N Niacin Chemical class OC(=O)C1=CC=CN=C1 PVNIIMVLHYAWGP-UHFFFAOYSA-N 0.000 description 5
- 108090000373 Tissue Plasminogen Activator Proteins 0.000 description 5
- 102000003978 Tissue Plasminogen Activator Human genes 0.000 description 5
- 108700019146 Transgenes Proteins 0.000 description 5
- 229940088710 antibiotic agent Drugs 0.000 description 5
- 230000001580 bacterial effect Effects 0.000 description 5
- 238000010009 beating Methods 0.000 description 5
- 239000002299 complementary DNA Substances 0.000 description 5
- 230000034994 death Effects 0.000 description 5
- 231100000517 death Toxicity 0.000 description 5
- LTMHDMANZUZIPE-PUGKRICDSA-N digoxin Chemical compound C1[C@H](O)[C@H](O)[C@@H](C)O[C@H]1O[C@@H]1[C@@H](C)O[C@@H](O[C@@H]2[C@H](O[C@@H](O[C@@H]3C[C@@H]4[C@]([C@@H]5[C@H]([C@]6(CC[C@@H]([C@@]6(C)[C@H](O)C5)C=5COC(=O)C=5)O)CC4)(C)CC3)C[C@@H]2O)C)C[C@@H]1O LTMHDMANZUZIPE-PUGKRICDSA-N 0.000 description 5
- 238000002592 echocardiography Methods 0.000 description 5
- 230000001747 exhibiting effect Effects 0.000 description 5
- 239000008103 glucose Substances 0.000 description 5
- 210000002064 heart cell Anatomy 0.000 description 5
- 210000002443 helper t lymphocyte Anatomy 0.000 description 5
- 238000002955 isolation Methods 0.000 description 5
- 229960001632 labetalol Drugs 0.000 description 5
- 238000005259 measurement Methods 0.000 description 5
- 230000007246 mechanism Effects 0.000 description 5
- 210000003205 muscle Anatomy 0.000 description 5
- 239000002105 nanoparticle Substances 0.000 description 5
- 230000008488 polyadenylation Effects 0.000 description 5
- BJOIZNZVOZKDIG-MDEJGZGSSA-N reserpine Chemical compound O([C@H]1[C@@H]([C@H]([C@H]2C[C@@H]3C4=C([C]5C=CC(OC)=CC5=N4)CCN3C[C@H]2C1)C(=O)OC)OC)C(=O)C1=CC(OC)=C(OC)C(OC)=C1 BJOIZNZVOZKDIG-MDEJGZGSSA-N 0.000 description 5
- 230000004044 response Effects 0.000 description 5
- 210000002027 skeletal muscle Anatomy 0.000 description 5
- 230000002537 thrombolytic effect Effects 0.000 description 5
- 238000001890 transfection Methods 0.000 description 5
- 238000011144 upstream manufacturing Methods 0.000 description 5
- JWZZKOKVBUJMES-UHFFFAOYSA-N (+-)-Isoprenaline Chemical compound CC(C)NCC(O)C1=CC=C(O)C(O)=C1 JWZZKOKVBUJMES-UHFFFAOYSA-N 0.000 description 4
- KWGRBVOPPLSCSI-WPRPVWTQSA-N (-)-ephedrine Chemical compound CN[C@@H](C)[C@H](O)C1=CC=CC=C1 KWGRBVOPPLSCSI-WPRPVWTQSA-N 0.000 description 4
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 4
- 108700028369 Alleles Proteins 0.000 description 4
- 102100026189 Beta-galactosidase Human genes 0.000 description 4
- 241000283707 Capra Species 0.000 description 4
- 108091026890 Coding region Proteins 0.000 description 4
- 230000004543 DNA replication Effects 0.000 description 4
- 241000283074 Equus asinus Species 0.000 description 4
- 102000003886 Glycoproteins Human genes 0.000 description 4
- 108090000288 Glycoproteins Proteins 0.000 description 4
- 208000032843 Hemorrhage Diseases 0.000 description 4
- OAKJQQAXSVQMHS-UHFFFAOYSA-N Hydrazine Chemical compound NN OAKJQQAXSVQMHS-UHFFFAOYSA-N 0.000 description 4
- ZFMITUMMTDLWHR-UHFFFAOYSA-N Minoxidil Chemical compound NC1=[N+]([O-])C(N)=CC(N2CCCCC2)=N1 ZFMITUMMTDLWHR-UHFFFAOYSA-N 0.000 description 4
- 102100034099 Myocardin-related transcription factor A Human genes 0.000 description 4
- 101710132126 Myocardin-related transcription factor A Proteins 0.000 description 4
- 101000783356 Naja sputatrix Cytotoxin Proteins 0.000 description 4
- 108700026244 Open Reading Frames Proteins 0.000 description 4
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 4
- 241000700159 Rattus Species 0.000 description 4
- 108010042291 Serum Response Factor Proteins 0.000 description 4
- 102100022056 Serum response factor Human genes 0.000 description 4
- 108010023197 Streptokinase Proteins 0.000 description 4
- 239000000219 Sympatholytic Substances 0.000 description 4
- 108010046516 Wheat Germ Agglutinins Proteins 0.000 description 4
- 239000002253 acid Substances 0.000 description 4
- 239000004480 active ingredient Substances 0.000 description 4
- 230000001154 acute effect Effects 0.000 description 4
- 229940124308 alpha-adrenoreceptor antagonist Drugs 0.000 description 4
- 230000033115 angiogenesis Effects 0.000 description 4
- 229950006323 angiotensin ii Drugs 0.000 description 4
- 229940030600 antihypertensive agent Drugs 0.000 description 4
- 238000013459 approach Methods 0.000 description 4
- 239000012736 aqueous medium Substances 0.000 description 4
- 239000007864 aqueous solution Substances 0.000 description 4
- 150000007658 benzothiadiazines Chemical class 0.000 description 4
- CHDPSNLJFOQTRK-UHFFFAOYSA-N betaxolol hydrochloride Chemical compound [Cl-].C1=CC(OCC(O)C[NH2+]C(C)C)=CC=C1CCOCC1CC1 CHDPSNLJFOQTRK-UHFFFAOYSA-N 0.000 description 4
- 230000027455 binding Effects 0.000 description 4
- 208000034158 bleeding Diseases 0.000 description 4
- 230000000740 bleeding effect Effects 0.000 description 4
- 239000001506 calcium phosphate Substances 0.000 description 4
- 229910000389 calcium phosphate Inorganic materials 0.000 description 4
- 235000011010 calcium phosphates Nutrition 0.000 description 4
- 239000002340 cardiotoxin Substances 0.000 description 4
- 231100000677 cardiotoxin Toxicity 0.000 description 4
- LWAFSWPYPHEXKX-UHFFFAOYSA-N carteolol Chemical compound N1C(=O)CCC2=C1C=CC=C2OCC(O)CNC(C)(C)C LWAFSWPYPHEXKX-UHFFFAOYSA-N 0.000 description 4
- 230000001413 cellular effect Effects 0.000 description 4
- 238000004587 chromatography analysis Methods 0.000 description 4
- 150000001875 compounds Chemical class 0.000 description 4
- 238000011161 development Methods 0.000 description 4
- 230000018109 developmental process Effects 0.000 description 4
- 229940085304 dihydropyridine derivative selective calcium channel blockers with mainly vascular effects Drugs 0.000 description 4
- 238000013401 experimental design Methods 0.000 description 4
- 230000001605 fetal effect Effects 0.000 description 4
- VPSRLGDRGCKUTK-UHFFFAOYSA-N fura-2-acetoxymethyl ester Chemical compound CC(=O)OCOC(=O)CN(CC(=O)OCOC(C)=O)C1=CC=C(C)C=C1OCCOC(C(=C1)N(CC(=O)OCOC(C)=O)CC(=O)OCOC(C)=O)=CC2=C1OC(C=1OC(=CN=1)C(=O)OCOC(C)=O)=C2 VPSRLGDRGCKUTK-UHFFFAOYSA-N 0.000 description 4
- 210000003976 gap junction Anatomy 0.000 description 4
- 239000001963 growth medium Substances 0.000 description 4
- 229960002897 heparin Drugs 0.000 description 4
- 229920000669 heparin Polymers 0.000 description 4
- 229960002474 hydralazine Drugs 0.000 description 4
- WDKXLLJDNUBYCY-UHFFFAOYSA-N ibopamine Chemical compound CNCCC1=CC=C(OC(=O)C(C)C)C(OC(=O)C(C)C)=C1 WDKXLLJDNUBYCY-UHFFFAOYSA-N 0.000 description 4
- 238000003365 immunocytochemistry Methods 0.000 description 4
- 230000001976 improved effect Effects 0.000 description 4
- 230000000977 initiatory effect Effects 0.000 description 4
- 239000007788 liquid Substances 0.000 description 4
- 238000002595 magnetic resonance imaging Methods 0.000 description 4
- 229960003632 minoxidil Drugs 0.000 description 4
- 230000010412 perfusion Effects 0.000 description 4
- 230000000144 pharmacologic effect Effects 0.000 description 4
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 4
- 230000009467 reduction Effects 0.000 description 4
- OVUOVMIMOCJILI-KFZANIOBSA-N scillarenin Chemical compound C=1([C@H]2CC[C@]3(O)[C@H]4[C@@H]([C@]5(CC[C@H](O)C=C5CC4)C)CC[C@@]32C)C=CC(=O)OC=1 OVUOVMIMOCJILI-KFZANIOBSA-N 0.000 description 4
- 238000000926 separation method Methods 0.000 description 4
- 210000002966 serum Anatomy 0.000 description 4
- 238000004904 shortening Methods 0.000 description 4
- 229940124530 sulfonamide Drugs 0.000 description 4
- 150000003456 sulfonamides Chemical class 0.000 description 4
- 230000002889 sympathetic effect Effects 0.000 description 4
- 230000008685 targeting Effects 0.000 description 4
- VCKUSRYTPJJLNI-UHFFFAOYSA-N terazosin Chemical compound N=1C(N)=C2C=C(OC)C(OC)=CC2=NC=1N(CC1)CCN1C(=O)C1CCCO1 VCKUSRYTPJJLNI-UHFFFAOYSA-N 0.000 description 4
- YAPQBXQYLJRXSA-UHFFFAOYSA-N theobromine Chemical compound CN1C(=O)NC(=O)C2=C1N=CN2C YAPQBXQYLJRXSA-UHFFFAOYSA-N 0.000 description 4
- 229940124597 therapeutic agent Drugs 0.000 description 4
- 230000001225 therapeutic effect Effects 0.000 description 4
- 238000002560 therapeutic procedure Methods 0.000 description 4
- 229960000187 tissue plasminogen activator Drugs 0.000 description 4
- 238000013519 translation Methods 0.000 description 4
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 4
- 230000002792 vascular Effects 0.000 description 4
- HSINOMROUCMIEA-FGVHQWLLSA-N (2s,4r)-4-[(3r,5s,6r,7r,8s,9s,10s,13r,14s,17r)-6-ethyl-3,7-dihydroxy-10,13-dimethyl-2,3,4,5,6,7,8,9,11,12,14,15,16,17-tetradecahydro-1h-cyclopenta[a]phenanthren-17-yl]-2-methylpentanoic acid Chemical compound C([C@@]12C)C[C@@H](O)C[C@H]1[C@@H](CC)[C@@H](O)[C@@H]1[C@@H]2CC[C@]2(C)[C@@H]([C@H](C)C[C@H](C)C(O)=O)CC[C@H]21 HSINOMROUCMIEA-FGVHQWLLSA-N 0.000 description 3
- METKIMKYRPQLGS-GFCCVEGCSA-N (R)-atenolol Chemical compound CC(C)NC[C@@H](O)COC1=CC=C(CC(N)=O)C=C1 METKIMKYRPQLGS-GFCCVEGCSA-N 0.000 description 3
- TWBNMYSKRDRHAT-RCWTXCDDSA-N (S)-timolol hemihydrate Chemical compound O.CC(C)(C)NC[C@H](O)COC1=NSN=C1N1CCOCC1.CC(C)(C)NC[C@H](O)COC1=NSN=C1N1CCOCC1 TWBNMYSKRDRHAT-RCWTXCDDSA-N 0.000 description 3
- ILPUOPPYSQEBNJ-UHFFFAOYSA-N 2-methyl-2-phenoxypropanoic acid Chemical class OC(=O)C(C)(C)OC1=CC=CC=C1 ILPUOPPYSQEBNJ-UHFFFAOYSA-N 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- 206010067484 Adverse reaction Diseases 0.000 description 3
- 108010058207 Anistreplase Proteins 0.000 description 3
- 201000001320 Atherosclerosis Diseases 0.000 description 3
- 239000005552 B01AC04 - Clopidogrel Substances 0.000 description 3
- 206010007559 Cardiac failure congestive Diseases 0.000 description 3
- 229920001268 Cholestyramine Polymers 0.000 description 3
- GJSURZIOUXUGAL-UHFFFAOYSA-N Clonidine Chemical compound ClC1=CC=CC(Cl)=C1NC1=NCCN1 GJSURZIOUXUGAL-UHFFFAOYSA-N 0.000 description 3
- 102000001045 Connexin 43 Human genes 0.000 description 3
- 108010069241 Connexin 43 Proteins 0.000 description 3
- 102000053602 DNA Human genes 0.000 description 3
- WDJUZGPOPHTGOT-OAXVISGBSA-N Digitoxin Natural products O([C@H]1[C@@H](C)O[C@@H](O[C@@H]2C[C@@H]3[C@@](C)([C@@H]4[C@H]([C@]5(O)[C@@](C)([C@H](C6=CC(=O)OC6)CC5)CC4)CC3)CC2)C[C@H]1O)[C@H]1O[C@@H](C)[C@H](O[C@H]2O[C@@H](C)[C@@H](O)[C@@H](O)C2)[C@@H](O)C1 WDJUZGPOPHTGOT-OAXVISGBSA-N 0.000 description 3
- LTMHDMANZUZIPE-AMTYYWEZSA-N Digoxin Natural products O([C@H]1[C@H](C)O[C@H](O[C@@H]2C[C@@H]3[C@@](C)([C@@H]4[C@H]([C@]5(O)[C@](C)([C@H](O)C4)[C@H](C4=CC(=O)OC4)CC5)CC3)CC2)C[C@@H]1O)[C@H]1O[C@H](C)[C@@H](O[C@H]2O[C@@H](C)[C@H](O)[C@@H](O)C2)[C@@H](O)C1 LTMHDMANZUZIPE-AMTYYWEZSA-N 0.000 description 3
- JRWZLRBJNMZMFE-UHFFFAOYSA-N Dobutamine Chemical compound C=1C=C(O)C(O)=CC=1CCNC(C)CCC1=CC=C(O)C=C1 JRWZLRBJNMZMFE-UHFFFAOYSA-N 0.000 description 3
- 108010061435 Enalapril Proteins 0.000 description 3
- VXLCNTLWWUDBSO-UHFFFAOYSA-N Ethiazide Chemical compound ClC1=C(S(N)(=O)=O)C=C2S(=O)(=O)NC(CC)NC2=C1 VXLCNTLWWUDBSO-UHFFFAOYSA-N 0.000 description 3
- INJOMKTZOLKMBF-UHFFFAOYSA-N Guanfacine Chemical compound NC(=N)NC(=O)CC1=C(Cl)C=CC=C1Cl INJOMKTZOLKMBF-UHFFFAOYSA-N 0.000 description 3
- 229940121710 HMGCoA reductase inhibitor Drugs 0.000 description 3
- 229920000209 Hexadimethrine bromide Polymers 0.000 description 3
- 102000002265 Human Growth Hormone Human genes 0.000 description 3
- 108010000521 Human Growth Hormone Proteins 0.000 description 3
- 239000000854 Human Growth Hormone Substances 0.000 description 3
- 208000031226 Hyperlipidaemia Diseases 0.000 description 3
- 206010020751 Hypersensitivity Diseases 0.000 description 3
- NNJVILVZKWQKPM-UHFFFAOYSA-N Lidocaine Chemical compound CCN(CC)CC(=O)NC1=C(C)C=CC=C1C NNJVILVZKWQKPM-UHFFFAOYSA-N 0.000 description 3
- 108010007859 Lisinopril Proteins 0.000 description 3
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 3
- 239000004472 Lysine Substances 0.000 description 3
- 229930193140 Neomycin Natural products 0.000 description 3
- 241001028048 Nicola Species 0.000 description 3
- 208000000770 Non-ST Elevated Myocardial Infarction Diseases 0.000 description 3
- 108091028043 Nucleic acid sequence Proteins 0.000 description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- LCTONWCANYUPML-UHFFFAOYSA-M Pyruvate Chemical compound CC(=O)C([O-])=O LCTONWCANYUPML-UHFFFAOYSA-M 0.000 description 3
- 108010085149 S100 Calcium-Binding Protein A4 Proteins 0.000 description 3
- 208000006117 ST-elevation myocardial infarction Diseases 0.000 description 3
- 238000000692 Student's t-test Methods 0.000 description 3
- 102100033121 Transcription factor 21 Human genes 0.000 description 3
- 108010030743 Tropomyosin Proteins 0.000 description 3
- 102000005937 Tropomyosin Human genes 0.000 description 3
- 102100036859 Troponin I, cardiac muscle Human genes 0.000 description 3
- 101710128251 Troponin I, cardiac muscle Proteins 0.000 description 3
- 108020005202 Viral DNA Proteins 0.000 description 3
- GOEMGAFJFRBGGG-UHFFFAOYSA-N acebutolol Chemical compound CCCC(=O)NC1=CC=C(OCC(O)CNC(C)C)C(C(C)=O)=C1 GOEMGAFJFRBGGG-UHFFFAOYSA-N 0.000 description 3
- 230000001800 adrenalinergic effect Effects 0.000 description 3
- 239000003463 adsorbent Substances 0.000 description 3
- 230000002411 adverse Effects 0.000 description 3
- 230000006838 adverse reaction Effects 0.000 description 3
- LVEXHFZHOIWIIP-UHFFFAOYSA-N amosulalol Chemical compound COC1=CC=CC=C1OCCNCC(O)C1=CC=C(C)C(S(N)(=O)=O)=C1 LVEXHFZHOIWIIP-UHFFFAOYSA-N 0.000 description 3
- 229950010351 amosulalol Drugs 0.000 description 3
- RNLQIBCLLYYYFJ-UHFFFAOYSA-N amrinone Chemical compound N1C(=O)C(N)=CC(C=2C=CN=CC=2)=C1 RNLQIBCLLYYYFJ-UHFFFAOYSA-N 0.000 description 3
- 239000002333 angiotensin II receptor antagonist Substances 0.000 description 3
- 229940121375 antifungal agent Drugs 0.000 description 3
- 229940127088 antihypertensive drug Drugs 0.000 description 3
- 229940127218 antiplatelet drug Drugs 0.000 description 3
- BHIAIPWSVYSKJS-UHFFFAOYSA-N arotinolol Chemical compound S1C(SCC(O)CNC(C)(C)C)=NC(C=2SC(=CC=2)C(N)=O)=C1 BHIAIPWSVYSKJS-UHFFFAOYSA-N 0.000 description 3
- 229950010731 arotinolol Drugs 0.000 description 3
- 108010084541 asialoorosomucoid Proteins 0.000 description 3
- 229960002274 atenolol Drugs 0.000 description 3
- 230000002238 attenuated effect Effects 0.000 description 3
- 210000003719 b-lymphocyte Anatomy 0.000 description 3
- 239000002585 base Substances 0.000 description 3
- 229960004324 betaxolol Drugs 0.000 description 3
- 239000003613 bile acid Substances 0.000 description 3
- 229950009191 butofilolol Drugs 0.000 description 3
- NMBNQRJDEPOXCP-UHFFFAOYSA-N butofilolol Chemical compound CCCC(=O)C1=CC(F)=CC=C1OCC(O)CNC(C)(C)C NMBNQRJDEPOXCP-UHFFFAOYSA-N 0.000 description 3
- 229960001222 carteolol Drugs 0.000 description 3
- 210000000170 cell membrane Anatomy 0.000 description 3
- 210000003169 central nervous system Anatomy 0.000 description 3
- 238000006243 chemical reaction Methods 0.000 description 3
- 229960002155 chlorothiazide Drugs 0.000 description 3
- 229960003009 clopidogrel Drugs 0.000 description 3
- GKTWGGQPFAXNFI-HNNXBMFYSA-N clopidogrel Chemical compound C1([C@H](N2CC=3C=CSC=3CC2)C(=O)OC)=CC=CC=C1Cl GKTWGGQPFAXNFI-HNNXBMFYSA-N 0.000 description 3
- 239000003218 coronary vasodilator agent Substances 0.000 description 3
- 229960004042 diazoxide Drugs 0.000 description 3
- 230000004069 differentiation Effects 0.000 description 3
- 229960000648 digitoxin Drugs 0.000 description 3
- WDJUZGPOPHTGOT-XUDUSOBPSA-N digitoxin Chemical compound C1[C@H](O)[C@H](O)[C@@H](C)O[C@H]1O[C@@H]1[C@@H](C)O[C@@H](O[C@@H]2[C@H](O[C@@H](O[C@@H]3C[C@@H]4[C@]([C@@H]5[C@H]([C@]6(CC[C@@H]([C@@]6(C)CC5)C=5COC(=O)C=5)O)CC4)(C)CC3)C[C@@H]2O)C)C[C@@H]1O WDJUZGPOPHTGOT-XUDUSOBPSA-N 0.000 description 3
- 229960005156 digoxin Drugs 0.000 description 3
- LTMHDMANZUZIPE-UHFFFAOYSA-N digoxine Natural products C1C(O)C(O)C(C)OC1OC1C(C)OC(OC2C(OC(OC3CC4C(C5C(C6(CCC(C6(C)C(O)C5)C=5COC(=O)C=5)O)CC4)(C)CC3)CC2O)C)CC1O LTMHDMANZUZIPE-UHFFFAOYSA-N 0.000 description 3
- 229960002768 dipyridamole Drugs 0.000 description 3
- IZEKFCXSFNUWAM-UHFFFAOYSA-N dipyridamole Chemical compound C=12N=C(N(CCO)CCO)N=C(N3CCCCC3)C2=NC(N(CCO)CCO)=NC=1N1CCCCC1 IZEKFCXSFNUWAM-UHFFFAOYSA-N 0.000 description 3
- 239000002612 dispersion medium Substances 0.000 description 3
- 229960003638 dopamine Drugs 0.000 description 3
- RUZYUOTYCVRMRZ-UHFFFAOYSA-N doxazosin Chemical compound C1OC2=CC=CC=C2OC1C(=O)N(CC1)CCN1C1=NC(N)=C(C=C(C(OC)=C2)OC)C2=N1 RUZYUOTYCVRMRZ-UHFFFAOYSA-N 0.000 description 3
- GBXSMTUPTTWBMN-XIRDDKMYSA-N enalapril Chemical compound C([C@@H](C(=O)OCC)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(O)=O)CC1=CC=CC=C1 GBXSMTUPTTWBMN-XIRDDKMYSA-N 0.000 description 3
- 229960000873 enalapril Drugs 0.000 description 3
- 229950007164 ethiazide Drugs 0.000 description 3
- 230000005284 excitation Effects 0.000 description 3
- DOBLSWXRNYSVDC-UHFFFAOYSA-N fenalcomine Chemical compound C1=CC(C(O)CC)=CC=C1OCCNC(C)CC1=CC=CC=C1 DOBLSWXRNYSVDC-UHFFFAOYSA-N 0.000 description 3
- 229950009129 fenalcomine Drugs 0.000 description 3
- 229940125753 fibrate Drugs 0.000 description 3
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 3
- 239000012634 fragment Substances 0.000 description 3
- YFHXZQPUBCBNIP-UHFFFAOYSA-N fura-2 Chemical compound CC1=CC=C(N(CC(O)=O)CC(O)=O)C(OCCOC=2C(=CC=3OC(=CC=3C=2)C=2OC(=CN=2)C(O)=O)N(CC(O)=O)CC(O)=O)=C1 YFHXZQPUBCBNIP-UHFFFAOYSA-N 0.000 description 3
- 108700004026 gag Genes Proteins 0.000 description 3
- 238000005227 gel permeation chromatography Methods 0.000 description 3
- 150000002357 guanidines Chemical class 0.000 description 3
- 229940083094 guanine derivative acting on arteriolar smooth muscle Drugs 0.000 description 3
- 208000019622 heart disease Diseases 0.000 description 3
- 238000004128 high performance liquid chromatography Methods 0.000 description 3
- 238000002744 homologous recombination Methods 0.000 description 3
- 230000006801 homologous recombination Effects 0.000 description 3
- 239000002471 hydroxymethylglutaryl coenzyme A reductase inhibitor Substances 0.000 description 3
- 208000020346 hyperlipoproteinemia Diseases 0.000 description 3
- 150000002460 imidazoles Chemical class 0.000 description 3
- 238000003364 immunohistochemistry Methods 0.000 description 3
- 239000004615 ingredient Substances 0.000 description 3
- 229940079865 intestinal antiinfectives imidazole derivative Drugs 0.000 description 3
- 230000003834 intracellular effect Effects 0.000 description 3
- 238000010253 intravenous injection Methods 0.000 description 3
- 208000028867 ischemia Diseases 0.000 description 3
- 238000002372 labelling Methods 0.000 description 3
- 150000003951 lactams Chemical class 0.000 description 3
- 229960002394 lisinopril Drugs 0.000 description 3
- RLAWWYSOJDYHDC-BZSNNMDCSA-N lisinopril Chemical compound C([C@H](N[C@@H](CCCCN)C(=O)N1[C@@H](CCC1)C(O)=O)C(O)=O)CC1=CC=CC=C1 RLAWWYSOJDYHDC-BZSNNMDCSA-N 0.000 description 3
- 210000004962 mammalian cell Anatomy 0.000 description 3
- 238000004519 manufacturing process Methods 0.000 description 3
- 239000011159 matrix material Substances 0.000 description 3
- 229960002237 metoprolol Drugs 0.000 description 3
- IUBSYMUCCVWXPE-UHFFFAOYSA-N metoprolol Chemical compound COCCC1=CC=C(OCC(O)CNC(C)C)C=C1 IUBSYMUCCVWXPE-UHFFFAOYSA-N 0.000 description 3
- 238000002493 microarray Methods 0.000 description 3
- 244000005700 microbiome Species 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 238000012986 modification Methods 0.000 description 3
- BQJCRHHNABKAKU-KBQPJGBKSA-N morphine Chemical compound O([C@H]1[C@H](C=C[C@H]23)O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4O BQJCRHHNABKAKU-KBQPJGBKSA-N 0.000 description 3
- 230000035772 mutation Effects 0.000 description 3
- VWPOSFSPZNDTMJ-UCWKZMIHSA-N nadolol Chemical compound C1[C@@H](O)[C@@H](O)CC2=C1C=CC=C2OCC(O)CNC(C)(C)C VWPOSFSPZNDTMJ-UCWKZMIHSA-N 0.000 description 3
- 229960004927 neomycin Drugs 0.000 description 3
- HYIMSNHJOBLJNT-UHFFFAOYSA-N nifedipine Chemical compound COC(=O)C1=C(C)NC(C)=C(C(=O)OC)C1C1=CC=CC=C1[N+]([O-])=O HYIMSNHJOBLJNT-UHFFFAOYSA-N 0.000 description 3
- 229960001597 nifedipine Drugs 0.000 description 3
- 230000008520 organization Effects 0.000 description 3
- 229960002035 penbutolol Drugs 0.000 description 3
- KQXKVJAGOJTNJS-HNNXBMFYSA-N penbutolol Chemical compound CC(C)(C)NC[C@H](O)COC1=CC=CC=C1C1CCCC1 KQXKVJAGOJTNJS-HNNXBMFYSA-N 0.000 description 3
- 239000002831 pharmacologic agent Substances 0.000 description 3
- 150000003904 phospholipids Chemical class 0.000 description 3
- 229960002508 pindolol Drugs 0.000 description 3
- PHUTUTUABXHXLW-UHFFFAOYSA-N pindolol Chemical compound CC(C)NCC(O)COC1=CC=CC2=NC=C[C]12 PHUTUTUABXHXLW-UHFFFAOYSA-N 0.000 description 3
- 239000000106 platelet aggregation inhibitor Substances 0.000 description 3
- 238000002264 polyacrylamide gel electrophoresis Methods 0.000 description 3
- 229920001223 polyethylene glycol Polymers 0.000 description 3
- 102000040430 polynucleotide Human genes 0.000 description 3
- 108091033319 polynucleotide Proteins 0.000 description 3
- 239000002157 polynucleotide Substances 0.000 description 3
- 239000011148 porous material Substances 0.000 description 3
- 239000000843 powder Substances 0.000 description 3
- IENZQIKPVFGBNW-UHFFFAOYSA-N prazosin Chemical compound N=1C(N)=C2C=C(OC)C(OC)=CC2=NC=1N(CC1)CCN1C(=O)C1=CC=CO1 IENZQIKPVFGBNW-UHFFFAOYSA-N 0.000 description 3
- 229960001289 prazosin Drugs 0.000 description 3
- 238000001556 precipitation Methods 0.000 description 3
- 238000001742 protein purification Methods 0.000 description 3
- 229940076788 pyruvate Drugs 0.000 description 3
- 150000003856 quaternary ammonium compounds Chemical class 0.000 description 3
- 230000006798 recombination Effects 0.000 description 3
- 238000005215 recombination Methods 0.000 description 3
- 230000003362 replicative effect Effects 0.000 description 3
- 230000002336 repolarization Effects 0.000 description 3
- 239000011347 resin Substances 0.000 description 3
- 229920005989 resin Polymers 0.000 description 3
- 231100000241 scar Toxicity 0.000 description 3
- 210000002460 smooth muscle Anatomy 0.000 description 3
- 239000011734 sodium Substances 0.000 description 3
- 239000003195 sodium channel blocking agent Substances 0.000 description 3
- 239000002904 solvent Substances 0.000 description 3
- 229960005202 streptokinase Drugs 0.000 description 3
- 238000007920 subcutaneous administration Methods 0.000 description 3
- 239000000758 substrate Substances 0.000 description 3
- 239000004094 surface-active agent Substances 0.000 description 3
- 238000012353 t test Methods 0.000 description 3
- 229960001693 terazosin Drugs 0.000 description 3
- 239000005495 thyroid hormone Substances 0.000 description 3
- 229940036555 thyroid hormone Drugs 0.000 description 3
- PHWBOXQYWZNQIN-UHFFFAOYSA-N ticlopidine Chemical compound ClC1=CC=CC=C1CN1CC(C=CS2)=C2CC1 PHWBOXQYWZNQIN-UHFFFAOYSA-N 0.000 description 3
- 229960004605 timolol Drugs 0.000 description 3
- 239000005526 vasoconstrictor agent Substances 0.000 description 3
- 238000005406 washing Methods 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 3
- 238000001262 western blot Methods 0.000 description 3
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical group N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 2
- HMJIYCCIJYRONP-UHFFFAOYSA-N (+-)-Isradipine Chemical compound COC(=O)C1=C(C)NC(C)=C(C(=O)OC(C)C)C1C1=CC=CC2=NON=C12 HMJIYCCIJYRONP-UHFFFAOYSA-N 0.000 description 2
- CEMAWMOMDPGJMB-UHFFFAOYSA-N (+-)-Oxprenolol Chemical compound CC(C)NCC(O)COC1=CC=CC=C1OCC=C CEMAWMOMDPGJMB-UHFFFAOYSA-N 0.000 description 2
- NXQMNKUGGYNLBY-GFCCVEGCSA-N (2r)-1-(3-methylphenoxy)-3-(propan-2-ylamino)propan-2-ol Chemical compound CC(C)NC[C@@H](O)COC1=CC=CC(C)=C1 NXQMNKUGGYNLBY-GFCCVEGCSA-N 0.000 description 2
- NXWGWUVGUSFQJC-GFCCVEGCSA-N (2r)-1-[(2-methyl-1h-indol-4-yl)oxy]-3-(propan-2-ylamino)propan-2-ol Chemical compound CC(C)NC[C@@H](O)COC1=CC=CC2=C1C=C(C)N2 NXWGWUVGUSFQJC-GFCCVEGCSA-N 0.000 description 2
- BUJAGSGYPOAWEI-SECBINFHSA-N (2r)-2-amino-n-(2,6-dimethylphenyl)propanamide Chemical compound C[C@@H](N)C(=O)NC1=C(C)C=CC=C1C BUJAGSGYPOAWEI-SECBINFHSA-N 0.000 description 2
- BIDNLKIUORFRQP-XYGFDPSESA-N (2s,4s)-4-cyclohexyl-1-[2-[[(1s)-2-methyl-1-propanoyloxypropoxy]-(4-phenylbutyl)phosphoryl]acetyl]pyrrolidine-2-carboxylic acid Chemical compound C([P@@](=O)(O[C@H](OC(=O)CC)C(C)C)CC(=O)N1[C@@H](C[C@H](C1)C1CCCCC1)C(O)=O)CCCC1=CC=CC=C1 BIDNLKIUORFRQP-XYGFDPSESA-N 0.000 description 2
- DNXIKVLOVZVMQF-UHFFFAOYSA-N (3beta,16beta,17alpha,18beta,20alpha)-17-hydroxy-11-methoxy-18-[(3,4,5-trimethoxybenzoyl)oxy]-yohimban-16-carboxylic acid, methyl ester Natural products C1C2CN3CCC(C4=CC=C(OC)C=C4N4)=C4C3CC2C(C(=O)OC)C(O)C1OC(=O)C1=CC(OC)=C(OC)C(OC)=C1 DNXIKVLOVZVMQF-UHFFFAOYSA-N 0.000 description 2
- PVHUJELLJLJGLN-INIZCTEOSA-N (S)-nitrendipine Chemical compound CCOC(=O)C1=C(C)NC(C)=C(C(=O)OC)[C@@H]1C1=CC=CC([N+]([O-])=O)=C1 PVHUJELLJLJGLN-INIZCTEOSA-N 0.000 description 2
- ZHNFLHYOFXQIOW-AHSOWCEXSA-N (s)-[(2r,4s,5r)-5-ethenyl-1-azabicyclo[2.2.2]octan-2-yl]-(6-methoxyquinolin-4-yl)methanol;sulfuric acid;dihydrate Chemical compound O.O.OS(O)(=O)=O.C([C@H]([C@H](C1)C=C)C2)CN1[C@H]2[C@@H](O)C1=CC=NC2=CC=C(OC)C=C21.C([C@H]([C@H](C1)C=C)C2)CN1[C@H]2[C@@H](O)C1=CC=NC2=CC=C(OC)C=C21 ZHNFLHYOFXQIOW-AHSOWCEXSA-N 0.000 description 2
- RSWGJHLUYNHPMX-UHFFFAOYSA-N 1,4a-dimethyl-7-propan-2-yl-2,3,4,4b,5,6,10,10a-octahydrophenanthrene-1-carboxylic acid Chemical compound C12CCC(C(C)C)=CC2=CCC2C1(C)CCCC2(C)C(O)=O RSWGJHLUYNHPMX-UHFFFAOYSA-N 0.000 description 2
- UUOJIACWOAYWEZ-UHFFFAOYSA-N 1-(tert-butylamino)-3-[(2-methyl-1H-indol-4-yl)oxy]propan-2-yl benzoate Chemical compound C1=CC=C2NC(C)=CC2=C1OCC(CNC(C)(C)C)OC(=O)C1=CC=CC=C1 UUOJIACWOAYWEZ-UHFFFAOYSA-N 0.000 description 2
- SGTNSNPWRIOYBX-UHFFFAOYSA-N 2-(3,4-dimethoxyphenyl)-5-{[2-(3,4-dimethoxyphenyl)ethyl](methyl)amino}-2-(propan-2-yl)pentanenitrile Chemical compound C1=C(OC)C(OC)=CC=C1CCN(C)CCCC(C#N)(C(C)C)C1=CC=C(OC)C(OC)=C1 SGTNSNPWRIOYBX-UHFFFAOYSA-N 0.000 description 2
- NMKSAYKQLCHXDK-UHFFFAOYSA-N 3,3-diphenyl-N-(1-phenylethyl)-1-propanamine Chemical compound C=1C=CC=CC=1C(C)NCCC(C=1C=CC=CC=1)C1=CC=CC=C1 NMKSAYKQLCHXDK-UHFFFAOYSA-N 0.000 description 2
- OVUOVMIMOCJILI-UHFFFAOYSA-N 3alpha-Scillarenin Natural products CC12CCC(C3(CCC(O)C=C3CC3)C)C3C1(O)CCC2C=1C=CC(=O)OC=1 OVUOVMIMOCJILI-UHFFFAOYSA-N 0.000 description 2
- LTSOENFXCPOCHG-GQCTYLIASA-N 4-chloro-6-[[(e)-3-oxobut-1-enyl]amino]-1-n-prop-2-enylbenzene-1,3-disulfonamide Chemical compound CC(=O)\C=C\NC1=CC(Cl)=C(S(N)(=O)=O)C=C1S(=O)(=O)NCC=C LTSOENFXCPOCHG-GQCTYLIASA-N 0.000 description 2
- LBXHRAWDUMTPSE-AOOOYVTPSA-N 4-chloro-N-[(2S,6R)-2,6-dimethyl-1-piperidinyl]-3-sulfamoylbenzamide Chemical compound C[C@H]1CCC[C@@H](C)N1NC(=O)C1=CC=C(Cl)C(S(N)(=O)=O)=C1 LBXHRAWDUMTPSE-AOOOYVTPSA-N 0.000 description 2
- KYWCWBXGRWWINE-UHFFFAOYSA-N 4-methoxy-N1,N3-bis(3-pyridinylmethyl)benzene-1,3-dicarboxamide Chemical compound COC1=CC=C(C(=O)NCC=2C=NC=CC=2)C=C1C(=O)NCC1=CC=CN=C1 KYWCWBXGRWWINE-UHFFFAOYSA-N 0.000 description 2
- RZTAMFZIAATZDJ-HNNXBMFYSA-N 5-o-ethyl 3-o-methyl (4s)-4-(2,3-dichlorophenyl)-2,6-dimethyl-1,4-dihydropyridine-3,5-dicarboxylate Chemical compound CCOC(=O)C1=C(C)NC(C)=C(C(=O)OC)[C@@H]1C1=CC=CC(Cl)=C1Cl RZTAMFZIAATZDJ-HNNXBMFYSA-N 0.000 description 2
- BKYKPTRYDKTTJY-UHFFFAOYSA-N 6-chloro-3-(cyclopentylmethyl)-1,1-dioxo-3,4-dihydro-2H-1$l^{6},2,4-benzothiadiazine-7-sulfonamide Chemical compound C1=C(Cl)C(S(=O)(=O)N)=CC(S(N2)(=O)=O)=C1NC2CC1CCCC1 BKYKPTRYDKTTJY-UHFFFAOYSA-N 0.000 description 2
- FHHHOYXPRDYHEZ-COXVUDFISA-N Alacepril Chemical compound CC(=O)SC[C@@H](C)C(=O)N1CCC[C@H]1C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 FHHHOYXPRDYHEZ-COXVUDFISA-N 0.000 description 2
- ITPDYQOUSLNIHG-UHFFFAOYSA-N Amiodarone hydrochloride Chemical compound [Cl-].CCCCC=1OC2=CC=CC=C2C=1C(=O)C1=CC(I)=C(OCC[NH+](CC)CC)C(I)=C1 ITPDYQOUSLNIHG-UHFFFAOYSA-N 0.000 description 2
- 206010002388 Angina unstable Diseases 0.000 description 2
- 239000005528 B01AC05 - Ticlopidine Substances 0.000 description 2
- 102400000667 Brain natriuretic peptide 32 Human genes 0.000 description 2
- 101800000407 Brain natriuretic peptide 32 Proteins 0.000 description 2
- 101800002247 Brain natriuretic peptide 45 Proteins 0.000 description 2
- 108090000565 Capsid Proteins Proteins 0.000 description 2
- 241000282693 Cercopithecidae Species 0.000 description 2
- 102100023321 Ceruloplasmin Human genes 0.000 description 2
- JZUFKLXOESDKRF-UHFFFAOYSA-N Chlorothiazide Chemical compound C1=C(Cl)C(S(=O)(=O)N)=CC2=C1NCNS2(=O)=O JZUFKLXOESDKRF-UHFFFAOYSA-N 0.000 description 2
- 102000029816 Collagenase Human genes 0.000 description 2
- 108060005980 Collagenase Proteins 0.000 description 2
- 102000010970 Connexin Human genes 0.000 description 2
- 108050001175 Connexin Proteins 0.000 description 2
- 238000000018 DNA microarray Methods 0.000 description 2
- 102000004163 DNA-directed RNA polymerases Human genes 0.000 description 2
- 108090000626 DNA-directed RNA polymerases Proteins 0.000 description 2
- 229920002307 Dextran Polymers 0.000 description 2
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 2
- 206010012812 Diffuse cutaneous mastocytosis Diseases 0.000 description 2
- 102000004190 Enzymes Human genes 0.000 description 2
- 108090000790 Enzymes Proteins 0.000 description 2
- YARKMNAWFIMDKV-UHFFFAOYSA-N Epanolol Chemical compound C=1C=CC=C(C#N)C=1OCC(O)CNCCNC(=O)CC1=CC=C(O)C=C1 YARKMNAWFIMDKV-UHFFFAOYSA-N 0.000 description 2
- DJBNUMBKLMJRSA-UHFFFAOYSA-N Flecainide Chemical compound FC(F)(F)COC1=CC=C(OCC(F)(F)F)C(C(=O)NCC2NCCCC2)=C1 DJBNUMBKLMJRSA-UHFFFAOYSA-N 0.000 description 2
- 208000003098 Ganglion Cysts Diseases 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- 102100036646 Glutamyl-tRNA(Gln) amidotransferase subunit A, mitochondrial Human genes 0.000 description 2
- 239000007995 HEPES buffer Substances 0.000 description 2
- 102100037907 High mobility group protein B1 Human genes 0.000 description 2
- 101710168537 High mobility group protein B1 Proteins 0.000 description 2
- 102100038720 Histone deacetylase 9 Human genes 0.000 description 2
- 101001072655 Homo sapiens Glutamyl-tRNA(Gln) amidotransferase subunit A, mitochondrial Proteins 0.000 description 2
- 241001135569 Human adenovirus 5 Species 0.000 description 2
- 241000598171 Human adenovirus sp. Species 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- OMCPLEZZPVJJIS-UHFFFAOYSA-N Hypadil (TN) Chemical compound C1C(O[N+]([O-])=O)COC2=C1C=CC=C2OCC(O)CNC(C)C OMCPLEZZPVJJIS-UHFFFAOYSA-N 0.000 description 2
- 206010058179 Hypertensive emergency Diseases 0.000 description 2
- 102100034349 Integrase Human genes 0.000 description 2
- PIWKPBJCKXDKJR-UHFFFAOYSA-N Isoflurane Chemical compound FC(F)OC(Cl)C(F)(F)F PIWKPBJCKXDKJR-UHFFFAOYSA-N 0.000 description 2
- 241000581650 Ivesia Species 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- 239000000232 Lipid Bilayer Substances 0.000 description 2
- 101150107475 MEF2C gene Proteins 0.000 description 2
- 101100079042 Mus musculus Myef2 gene Proteins 0.000 description 2
- ZBBHBTPTTSWHBA-UHFFFAOYSA-N Nicardipine Chemical compound COC(=O)C1=C(C)NC(C)=C(C(=O)OCCN(C)CC=2C=CC=CC=2)C1C1=CC=CC([N+]([O-])=O)=C1 ZBBHBTPTTSWHBA-UHFFFAOYSA-N 0.000 description 2
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 2
- JLPDBLFIVFSOCC-UHFFFAOYSA-N Oleandrin Natural products O1C(C)C(O)C(OC)CC1OC1CC(CCC2C3(CC(C(C3(C)CCC32)C=2COC(=O)C=2)OC(C)=O)O)C3(C)CC1 JLPDBLFIVFSOCC-UHFFFAOYSA-N 0.000 description 2
- 229930040373 Paraformaldehyde Natural products 0.000 description 2
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 2
- HRSANNODOVBCST-UHFFFAOYSA-N Pronethalol Chemical compound C1=CC=CC2=CC(C(O)CNC(C)C)=CC=C21 HRSANNODOVBCST-UHFFFAOYSA-N 0.000 description 2
- 108010029485 Protein Isoforms Proteins 0.000 description 2
- 102000001708 Protein Isoforms Human genes 0.000 description 2
- 230000006819 RNA synthesis Effects 0.000 description 2
- LCQMZZCPPSWADO-UHFFFAOYSA-N Reserpilin Natural products COC(=O)C1COCC2CN3CCc4c([nH]c5cc(OC)c(OC)cc45)C3CC12 LCQMZZCPPSWADO-UHFFFAOYSA-N 0.000 description 2
- QEVHRUUCFGRFIF-SFWBKIHZSA-N Reserpine Natural products O=C(OC)[C@@H]1[C@H](OC)[C@H](OC(=O)c2cc(OC)c(OC)c(OC)c2)C[C@H]2[C@@H]1C[C@H]1N(C2)CCc2c3c([nH]c12)cc(OC)cc3 QEVHRUUCFGRFIF-SFWBKIHZSA-N 0.000 description 2
- 206010038997 Retroviral infections Diseases 0.000 description 2
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 2
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 2
- 238000002105 Southern blotting Methods 0.000 description 2
- 208000005400 Synovial Cyst Diseases 0.000 description 2
- 108700026226 TATA Box Proteins 0.000 description 2
- AUYYCJSJGJYCDS-LBPRGKRZSA-N Thyrolar Chemical class IC1=CC(C[C@H](N)C(O)=O)=CC(I)=C1OC1=CC=C(O)C(I)=C1 AUYYCJSJGJYCDS-LBPRGKRZSA-N 0.000 description 2
- 101710119687 Transcription factor 21 Proteins 0.000 description 2
- FNYLWPVRPXGIIP-UHFFFAOYSA-N Triamterene Chemical compound NC1=NC2=NC(N)=NC(N)=C2N=C1C1=CC=CC=C1 FNYLWPVRPXGIIP-UHFFFAOYSA-N 0.000 description 2
- 102000004987 Troponin T Human genes 0.000 description 2
- 108090001108 Troponin T Proteins 0.000 description 2
- 208000007814 Unstable Angina Diseases 0.000 description 2
- ISAKRJDGNUQOIC-UHFFFAOYSA-N Uracil Chemical compound O=C1C=CNC(=O)N1 ISAKRJDGNUQOIC-UHFFFAOYSA-N 0.000 description 2
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 2
- 108090000435 Urokinase-type plasminogen activator Proteins 0.000 description 2
- 102000003990 Urokinase-type plasminogen activator Human genes 0.000 description 2
- 208000009982 Ventricular Dysfunction Diseases 0.000 description 2
- 108700005077 Viral Genes Proteins 0.000 description 2
- 208000036142 Viral infection Diseases 0.000 description 2
- DXPOSRCHIDYWHW-UHFFFAOYSA-N Xamoterol Chemical compound C=1C=C(O)C=CC=1OCC(O)CNCCNC(=O)N1CCOCC1 DXPOSRCHIDYWHW-UHFFFAOYSA-N 0.000 description 2
- 238000010521 absorption reaction Methods 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 230000036982 action potential Effects 0.000 description 2
- 239000000674 adrenergic antagonist Substances 0.000 description 2
- 239000000808 adrenergic beta-agonist Substances 0.000 description 2
- 229950007884 alacepril Drugs 0.000 description 2
- 230000007815 allergy Effects 0.000 description 2
- 229960002213 alprenolol Drugs 0.000 description 2
- PAZJSJFMUHDSTF-UHFFFAOYSA-N alprenolol Chemical compound CC(C)NCC(O)COC1=CC=CC=C1CC=C PAZJSJFMUHDSTF-UHFFFAOYSA-N 0.000 description 2
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 2
- 229950007019 ambuside Drugs 0.000 description 2
- 235000001014 amino acid Nutrition 0.000 description 2
- 150000001413 amino acids Chemical class 0.000 description 2
- 229960002105 amrinone Drugs 0.000 description 2
- 239000004004 anti-anginal agent Substances 0.000 description 2
- 230000000692 anti-sense effect Effects 0.000 description 2
- 230000002785 anti-thrombosis Effects 0.000 description 2
- 229940124345 antianginal agent Drugs 0.000 description 2
- 239000003429 antifungal agent Substances 0.000 description 2
- 229960004676 antithrombotic agent Drugs 0.000 description 2
- 230000001746 atrial effect Effects 0.000 description 2
- 229960003515 bendroflumethiazide Drugs 0.000 description 2
- HDWIHXWEUNVBIY-UHFFFAOYSA-N bendroflumethiazidum Chemical compound C1=C(C(F)(F)F)C(S(=O)(=O)N)=CC(S(N2)(=O)=O)=C1NC2CC1=CC=CC=C1 HDWIHXWEUNVBIY-UHFFFAOYSA-N 0.000 description 2
- XSCHRSMBECNVNS-UHFFFAOYSA-N benzopyrazine Natural products N1=CC=NC2=CC=CC=C21 XSCHRSMBECNVNS-UHFFFAOYSA-N 0.000 description 2
- 229960001541 benzthiazide Drugs 0.000 description 2
- NDTSRXAMMQDVSW-UHFFFAOYSA-N benzthiazide Chemical compound C1=C(Cl)C(S(=O)(=O)N)=CC(S(N2)(=O)=O)=C1N=C2CSCC1=CC=CC=C1 NDTSRXAMMQDVSW-UHFFFAOYSA-N 0.000 description 2
- 229960003588 bevantolol Drugs 0.000 description 2
- HXLAFSUPPDYFEO-UHFFFAOYSA-N bevantolol Chemical compound C1=C(OC)C(OC)=CC=C1CCNCC(O)COC1=CC=CC(C)=C1 HXLAFSUPPDYFEO-UHFFFAOYSA-N 0.000 description 2
- 230000033228 biological regulation Effects 0.000 description 2
- 229960002781 bisoprolol Drugs 0.000 description 2
- VHYCDWMUTMEGQY-UHFFFAOYSA-N bisoprolol Chemical compound CC(C)NCC(O)COC1=CC=C(COCCOC(C)C)C=C1 VHYCDWMUTMEGQY-UHFFFAOYSA-N 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 230000023555 blood coagulation Effects 0.000 description 2
- 230000036770 blood supply Effects 0.000 description 2
- 210000004204 blood vessel Anatomy 0.000 description 2
- 229960001035 bopindolol Drugs 0.000 description 2
- 229960000830 captopril Drugs 0.000 description 2
- FAKRSMQSSFJEIM-RQJHMYQMSA-N captopril Chemical compound SC[C@@H](C)C(=O)N1CCC[C@H]1C(O)=O FAKRSMQSSFJEIM-RQJHMYQMSA-N 0.000 description 2
- 229960004634 carazolol Drugs 0.000 description 2
- BQXQGZPYHWWCEB-UHFFFAOYSA-N carazolol Chemical compound N1C2=CC=CC=C2C2=C1C=CC=C2OCC(O)CNC(C)C BQXQGZPYHWWCEB-UHFFFAOYSA-N 0.000 description 2
- 150000001720 carbohydrates Chemical class 0.000 description 2
- 235000014633 carbohydrates Nutrition 0.000 description 2
- 229940097217 cardiac glycoside Drugs 0.000 description 2
- 239000002368 cardiac glycoside Substances 0.000 description 2
- 229960004195 carvedilol Drugs 0.000 description 2
- NPAKNKYSJIDKMW-UHFFFAOYSA-N carvedilol Chemical compound COC1=CC=CC=C1OCCNCC(O)COC1=CC=CC2=NC3=CC=C[CH]C3=C12 NPAKNKYSJIDKMW-UHFFFAOYSA-N 0.000 description 2
- 125000002091 cationic group Chemical group 0.000 description 2
- 230000000453 cell autonomous effect Effects 0.000 description 2
- 230000022131 cell cycle Effects 0.000 description 2
- 239000001913 cellulose Substances 0.000 description 2
- 229920002678 cellulose Polymers 0.000 description 2
- UWCBNAVPISMFJZ-UHFFFAOYSA-N cetamolol Chemical compound CNC(=O)COC1=CC=CC=C1OCC(O)CNC(C)(C)C UWCBNAVPISMFJZ-UHFFFAOYSA-N 0.000 description 2
- 229950003205 cetamolol Drugs 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- OSASVXMJTNOKOY-UHFFFAOYSA-N chlorobutanol Chemical compound CC(C)(O)C(Cl)(Cl)Cl OSASVXMJTNOKOY-UHFFFAOYSA-N 0.000 description 2
- 230000001684 chronic effect Effects 0.000 description 2
- 229960005025 cilazapril Drugs 0.000 description 2
- HHHKFGXWKKUNCY-FHWLQOOXSA-N cilazapril Chemical compound C([C@@H](C(=O)OCC)N[C@@H]1C(N2[C@@H](CCCN2CCC1)C(O)=O)=O)CC1=CC=CC=C1 HHHKFGXWKKUNCY-FHWLQOOXSA-N 0.000 description 2
- 229960002896 clonidine Drugs 0.000 description 2
- 229960004070 clopamide Drugs 0.000 description 2
- 238000000576 coating method Methods 0.000 description 2
- 229960002424 collagenase Drugs 0.000 description 2
- 238000002648 combination therapy Methods 0.000 description 2
- 230000001447 compensatory effect Effects 0.000 description 2
- 239000003636 conditioned culture medium Substances 0.000 description 2
- 230000008602 contraction Effects 0.000 description 2
- 229960003206 cyclopenthiazide Drugs 0.000 description 2
- KWGRBVOPPLSCSI-UHFFFAOYSA-N d-ephedrine Natural products CNC(C)C(O)C1=CC=CC=C1 KWGRBVOPPLSCSI-UHFFFAOYSA-N 0.000 description 2
- 230000007812 deficiency Effects 0.000 description 2
- 229960005227 delapril Drugs 0.000 description 2
- WOUOLAUOZXOLJQ-MBSDFSHPSA-N delapril Chemical compound C([C@@H](C(=O)OCC)N[C@@H](C)C(=O)N(CC(O)=O)C1CC2=CC=CC=C2C1)CC1=CC=CC=C1 WOUOLAUOZXOLJQ-MBSDFSHPSA-N 0.000 description 2
- 229950007304 denopamine Drugs 0.000 description 2
- VHSBBVZJABQOSG-MRXNPFEDSA-N denopamine Chemical compound C1=C(OC)C(OC)=CC=C1CCNC[C@@H](O)C1=CC=C(O)C=C1 VHSBBVZJABQOSG-MRXNPFEDSA-N 0.000 description 2
- 229960002086 dextran Drugs 0.000 description 2
- 238000010790 dilution Methods 0.000 description 2
- 239000012895 dilution Substances 0.000 description 2
- OHDICGSRVLBVLC-UHFFFAOYSA-N dioxethedrin Chemical compound CCNC(C)C(O)C1=CC=C(O)C(O)=C1 OHDICGSRVLBVLC-UHFFFAOYSA-N 0.000 description 2
- 229950005373 dioxethedrin Drugs 0.000 description 2
- UVTNFZQICZKOEM-UHFFFAOYSA-N disopyramide Chemical compound C=1C=CC=NC=1C(C(N)=O)(CCN(C(C)C)C(C)C)C1=CC=CC=C1 UVTNFZQICZKOEM-UHFFFAOYSA-N 0.000 description 2
- 229960001089 dobutamine Drugs 0.000 description 2
- 229960001857 dopexamine Drugs 0.000 description 2
- RYBJORHCUPVNMB-UHFFFAOYSA-N dopexamine Chemical compound C1=C(O)C(O)=CC=C1CCNCCCCCCNCCC1=CC=CC=C1 RYBJORHCUPVNMB-UHFFFAOYSA-N 0.000 description 2
- 229960001389 doxazosin Drugs 0.000 description 2
- XQTWDDCIUJNLTR-CVHRZJFOSA-N doxycycline monohydrate Chemical compound O.O=C1C2=C(O)C=CC=C2[C@H](C)[C@@H]2C1=C(O)[C@]1(O)C(=O)C(C(N)=O)=C(O)[C@@H](N(C)C)[C@@H]1[C@H]2O XQTWDDCIUJNLTR-CVHRZJFOSA-N 0.000 description 2
- 239000003937 drug carrier Substances 0.000 description 2
- 239000013583 drug formulation Substances 0.000 description 2
- 230000004064 dysfunction Effects 0.000 description 2
- 230000002526 effect on cardiovascular system Effects 0.000 description 2
- 238000010828 elution Methods 0.000 description 2
- 229960002680 enalaprilat Drugs 0.000 description 2
- LZFZMUMEGBBDTC-QEJZJMRPSA-N enalaprilat (anhydrous) Chemical compound C([C@H](N[C@@H](C)C(=O)N1[C@@H](CCC1)C(O)=O)C(O)=O)CC1=CC=CC=C1 LZFZMUMEGBBDTC-QEJZJMRPSA-N 0.000 description 2
- 108700004025 env Genes Proteins 0.000 description 2
- 229940088598 enzyme Drugs 0.000 description 2
- 229960002711 epanolol Drugs 0.000 description 2
- 229960002179 ephedrine Drugs 0.000 description 2
- RINBGYCKMGDWPY-UHFFFAOYSA-N epitizide Chemical compound C1=C(Cl)C(S(=O)(=O)N)=CC2=C1NC(CSCC(F)(F)F)NS2(=O)=O RINBGYCKMGDWPY-UHFFFAOYSA-N 0.000 description 2
- 229950010350 epitizide Drugs 0.000 description 2
- AQNDDEOPVVGCPG-UHFFFAOYSA-N esmolol Chemical compound COC(=O)CCC1=CC=C(OCC(O)CNC(C)C)C=C1 AQNDDEOPVVGCPG-UHFFFAOYSA-N 0.000 description 2
- DEFVIWRASFVYLL-UHFFFAOYSA-N ethylene glycol bis(2-aminoethyl)tetraacetic acid Chemical compound OC(=O)CN(CC(O)=O)CCOCCOCCN(CC(O)=O)CC(O)=O DEFVIWRASFVYLL-UHFFFAOYSA-N 0.000 description 2
- 210000003527 eukaryotic cell Anatomy 0.000 description 2
- 238000011156 evaluation Methods 0.000 description 2
- 239000000284 extract Substances 0.000 description 2
- 210000003414 extremity Anatomy 0.000 description 2
- 229960003580 felodipine Drugs 0.000 description 2
- 229960002602 fendiline Drugs 0.000 description 2
- 238000002073 fluorescence micrograph Methods 0.000 description 2
- 229960002490 fosinopril Drugs 0.000 description 2
- 239000012737 fresh medium Substances 0.000 description 2
- 229960003883 furosemide Drugs 0.000 description 2
- ZZUFCTLCJUWOSV-UHFFFAOYSA-N furosemide Chemical compound C1=C(Cl)C(S(=O)(=O)N)=CC(C(O)=O)=C1NCC1=CC=CO1 ZZUFCTLCJUWOSV-UHFFFAOYSA-N 0.000 description 2
- BTCSSZJGUNDROE-UHFFFAOYSA-N gamma-aminobutyric acid Chemical compound NCCCC(O)=O BTCSSZJGUNDROE-UHFFFAOYSA-N 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- 230000001738 genotoxic effect Effects 0.000 description 2
- 150000004676 glycans Chemical class 0.000 description 2
- 108020004445 glyceraldehyde-3-phosphate dehydrogenase Proteins 0.000 description 2
- 229960003602 guanethidine Drugs 0.000 description 2
- ACGDKVXYNVEAGU-UHFFFAOYSA-N guanethidine Chemical compound NC(N)=NCCN1CCCCCCC1 ACGDKVXYNVEAGU-UHFFFAOYSA-N 0.000 description 2
- 229960002048 guanfacine Drugs 0.000 description 2
- 230000036541 health Effects 0.000 description 2
- 230000004398 heart morphogenesis Effects 0.000 description 2
- 210000005003 heart tissue Anatomy 0.000 description 2
- 210000005260 human cell Anatomy 0.000 description 2
- WRYZEGZNBYOMLE-UHFFFAOYSA-N hydracarbazine Chemical compound NNC1=CC=C(C(N)=O)N=N1 WRYZEGZNBYOMLE-UHFFFAOYSA-N 0.000 description 2
- 229950002598 hydracarbazine Drugs 0.000 description 2
- 229960002003 hydrochlorothiazide Drugs 0.000 description 2
- 229960003313 hydroflumethiazide Drugs 0.000 description 2
- DMDGGSIALPNSEE-UHFFFAOYSA-N hydroflumethiazide Chemical compound C1=C(C(F)(F)F)C(S(=O)(=O)N)=CC2=C1NCNS2(=O)=O DMDGGSIALPNSEE-UHFFFAOYSA-N 0.000 description 2
- BJRNKVDFDLYUGJ-RMPHRYRLSA-N hydroquinone O-beta-D-glucopyranoside Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@H]1OC1=CC=C(O)C=C1 BJRNKVDFDLYUGJ-RMPHRYRLSA-N 0.000 description 2
- 229960004370 ibopamine Drugs 0.000 description 2
- 238000003125 immunofluorescent labeling Methods 0.000 description 2
- 230000006872 improvement Effects 0.000 description 2
- 229960004569 indapamide Drugs 0.000 description 2
- NDDAHWYSQHTHNT-UHFFFAOYSA-N indapamide Chemical compound CC1CC2=CC=CC=C2N1NC(=O)C1=CC=C(Cl)C(S(N)(=O)=O)=C1 NDDAHWYSQHTHNT-UHFFFAOYSA-N 0.000 description 2
- MPGBPFMOOXKQRX-UHFFFAOYSA-N indenolol Chemical compound CC(C)NCC(O)COC1=CC=CC2=C1C=CC2 MPGBPFMOOXKQRX-UHFFFAOYSA-N 0.000 description 2
- 229950008838 indenolol Drugs 0.000 description 2
- 229940095990 inderal Drugs 0.000 description 2
- 230000000053 inderal effect Effects 0.000 description 2
- 230000002458 infectious effect Effects 0.000 description 2
- 238000001802 infusion Methods 0.000 description 2
- 238000003780 insertion Methods 0.000 description 2
- 230000037431 insertion Effects 0.000 description 2
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 2
- 201000004332 intermediate coronary syndrome Diseases 0.000 description 2
- 238000007918 intramuscular administration Methods 0.000 description 2
- 238000007912 intraperitoneal administration Methods 0.000 description 2
- 238000004255 ion exchange chromatography Methods 0.000 description 2
- PGHMRUGBZOYCAA-ADZNBVRBSA-N ionomycin Chemical compound O1[C@H](C[C@H](O)[C@H](C)[C@H](O)[C@H](C)/C=C/C[C@@H](C)C[C@@H](C)C(/O)=C/C(=O)[C@@H](C)C[C@@H](C)C[C@@H](CCC(O)=O)C)CC[C@@]1(C)[C@@H]1O[C@](C)([C@@H](C)O)CC1 PGHMRUGBZOYCAA-ADZNBVRBSA-N 0.000 description 2
- PGHMRUGBZOYCAA-UHFFFAOYSA-N ionomycin Natural products O1C(CC(O)C(C)C(O)C(C)C=CCC(C)CC(C)C(O)=CC(=O)C(C)CC(C)CC(CCC(O)=O)C)CCC1(C)C1OC(C)(C(C)O)CC1 PGHMRUGBZOYCAA-UHFFFAOYSA-N 0.000 description 2
- 238000001155 isoelectric focusing Methods 0.000 description 2
- 229960002725 isoflurane Drugs 0.000 description 2
- 229940093268 isordil Drugs 0.000 description 2
- 229960000201 isosorbide dinitrate Drugs 0.000 description 2
- 239000007951 isotonicity adjuster Substances 0.000 description 2
- 229960004427 isradipine Drugs 0.000 description 2
- 210000003292 kidney cell Anatomy 0.000 description 2
- 229940063699 lanoxin Drugs 0.000 description 2
- 210000005248 left atrial appendage Anatomy 0.000 description 2
- 229960004194 lidocaine Drugs 0.000 description 2
- 210000004185 liver Anatomy 0.000 description 2
- 239000003055 low molecular weight heparin Substances 0.000 description 2
- 229940127215 low-molecular weight heparin Drugs 0.000 description 2
- 238000012423 maintenance Methods 0.000 description 2
- 201000005857 malignant hypertension Diseases 0.000 description 2
- 229960002525 mecamylamine Drugs 0.000 description 2
- IMYZQPCYWPFTAG-IQJOONFLSA-N mecamylamine Chemical compound C1C[C@@H]2C(C)(C)[C@@](NC)(C)[C@H]1C2 IMYZQPCYWPFTAG-IQJOONFLSA-N 0.000 description 2
- 229960003134 mepindolol Drugs 0.000 description 2
- VKQFCGNPDRICFG-UHFFFAOYSA-N methyl 2-methylpropyl 2,6-dimethyl-4-(2-nitrophenyl)-1,4-dihydropyridine-3,5-dicarboxylate Chemical compound COC(=O)C1=C(C)NC(C)=C(C(=O)OCC(C)C)C1C1=CC=CC=C1[N+]([O-])=O VKQFCGNPDRICFG-UHFFFAOYSA-N 0.000 description 2
- 229950009263 methylchromone Drugs 0.000 description 2
- ABJKIHHNDMEBNA-UHFFFAOYSA-N methylchromone Chemical group C1=CC=C2C(=O)C(C)=COC2=C1 ABJKIHHNDMEBNA-UHFFFAOYSA-N 0.000 description 2
- 239000000693 micelle Substances 0.000 description 2
- 238000010208 microarray analysis Methods 0.000 description 2
- LFTFGCDECFPSQD-UHFFFAOYSA-N moprolol Chemical compound COC1=CC=CC=C1OCC(O)CNC(C)C LFTFGCDECFPSQD-UHFFFAOYSA-N 0.000 description 2
- 229950002481 moprolol Drugs 0.000 description 2
- 230000003387 muscular Effects 0.000 description 2
- RLWRMIYXDPXIEX-UHFFFAOYSA-N muzolimine Chemical compound C=1C=C(Cl)C(Cl)=CC=1C(C)N1N=C(N)CC1=O RLWRMIYXDPXIEX-UHFFFAOYSA-N 0.000 description 2
- 229960001788 muzolimine Drugs 0.000 description 2
- 210000001087 myotubule Anatomy 0.000 description 2
- 229960004255 nadolol Drugs 0.000 description 2
- 239000002078 nanoshell Substances 0.000 description 2
- 239000013642 negative control Substances 0.000 description 2
- 230000007935 neutral effect Effects 0.000 description 2
- 229960001783 nicardipine Drugs 0.000 description 2
- 229950000754 nipradilol Drugs 0.000 description 2
- 229960000227 nisoldipine Drugs 0.000 description 2
- 150000002823 nitrates Chemical class 0.000 description 2
- 229960005425 nitrendipine Drugs 0.000 description 2
- 229910017604 nitric acid Inorganic materials 0.000 description 2
- 229950010050 oleandrin Drugs 0.000 description 2
- JLPDBLFIVFSOCC-XYXFTTADSA-N oleandrin Chemical compound O1[C@@H](C)[C@H](O)[C@@H](OC)C[C@@H]1O[C@@H]1C[C@@H](CC[C@H]2[C@]3(C[C@@H]([C@@H]([C@@]3(C)CC[C@H]32)C=2COC(=O)C=2)OC(C)=O)O)[C@]3(C)CC1 JLPDBLFIVFSOCC-XYXFTTADSA-N 0.000 description 2
- 210000000056 organ Anatomy 0.000 description 2
- LPMXVESGRSUGHW-HBYQJFLCSA-N ouabain Chemical compound O[C@@H]1[C@H](O)[C@@H](O)[C@H](C)O[C@H]1O[C@@H]1C[C@@]2(O)CC[C@H]3[C@@]4(O)CC[C@H](C=5COC(=O)C=5)[C@@]4(C)C[C@@H](O)[C@@H]3[C@@]2(CO)[C@H](O)C1 LPMXVESGRSUGHW-HBYQJFLCSA-N 0.000 description 2
- 229960004570 oxprenolol Drugs 0.000 description 2
- 229920002866 paraformaldehyde Polymers 0.000 description 2
- 230000036961 partial effect Effects 0.000 description 2
- CYXKNKQEMFBLER-UHFFFAOYSA-N perhexiline Chemical compound C1CCCNC1CC(C1CCCCC1)C1CCCCC1 CYXKNKQEMFBLER-UHFFFAOYSA-N 0.000 description 2
- 229960000989 perhexiline Drugs 0.000 description 2
- 229960002582 perindopril Drugs 0.000 description 2
- IPVQLZZIHOAWMC-QXKUPLGCSA-N perindopril Chemical compound C1CCC[C@H]2C[C@@H](C(O)=O)N(C(=O)[C@H](C)N[C@@H](CCC)C(=O)OCC)[C@H]21 IPVQLZZIHOAWMC-QXKUPLGCSA-N 0.000 description 2
- 239000002571 phosphodiesterase inhibitor Substances 0.000 description 2
- LFSXCDWNBUNEEM-UHFFFAOYSA-N phthalazine Chemical compound C1=NN=CC2=CC=CC=C21 LFSXCDWNBUNEEM-UHFFFAOYSA-N 0.000 description 2
- 229960001006 picotamide Drugs 0.000 description 2
- 229940096701 plain lipid modifying drug hmg coa reductase inhibitors Drugs 0.000 description 2
- 229910052697 platinum Inorganic materials 0.000 description 2
- 108700004029 pol Genes Proteins 0.000 description 2
- 229920001282 polysaccharide Polymers 0.000 description 2
- 239000005017 polysaccharide Substances 0.000 description 2
- 230000001566 pro-viral effect Effects 0.000 description 2
- REQCZEXYDRLIBE-UHFFFAOYSA-N procainamide Chemical compound CCN(CC)CCNC(=O)C1=CC=C(N)C=C1 REQCZEXYDRLIBE-UHFFFAOYSA-N 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 229950000992 pronetalol Drugs 0.000 description 2
- 238000012342 propidium iodide staining Methods 0.000 description 2
- 239000002510 pyrogen Substances 0.000 description 2
- 229960001455 quinapril Drugs 0.000 description 2
- JSDRRTOADPPCHY-HSQYWUDLSA-N quinapril Chemical compound C([C@@H](C(=O)OCC)N[C@@H](C)C(=O)N1[C@@H](CC2=CC=CC=C2C1)C(O)=O)CC1=CC=CC=C1 JSDRRTOADPPCHY-HSQYWUDLSA-N 0.000 description 2
- 150000003246 quinazolines Chemical class 0.000 description 2
- LOUPRKONTZGTKE-LHHVKLHASA-N quinidine Chemical compound C([C@H]([C@H](C1)C=C)C2)C[N@@]1[C@H]2[C@@H](O)C1=CC=NC2=CC=C(OC)C=C21 LOUPRKONTZGTKE-LHHVKLHASA-N 0.000 description 2
- 229960003401 ramipril Drugs 0.000 description 2
- HDACQVRGBOVJII-JBDAPHQKSA-N ramipril Chemical compound C([C@@H](C(=O)OCC)N[C@@H](C)C(=O)N1[C@@H](C[C@@H]2CCC[C@@H]21)C(O)=O)CC1=CC=CC=C1 HDACQVRGBOVJII-JBDAPHQKSA-N 0.000 description 2
- 238000003753 real-time PCR Methods 0.000 description 2
- 230000010837 receptor-mediated endocytosis Effects 0.000 description 2
- 230000022532 regulation of transcription, DNA-dependent Effects 0.000 description 2
- 229960003147 reserpine Drugs 0.000 description 2
- 230000000241 respiratory effect Effects 0.000 description 2
- 230000029058 respiratory gaseous exchange Effects 0.000 description 2
- 238000010839 reverse transcription Methods 0.000 description 2
- 230000002441 reversible effect Effects 0.000 description 2
- 210000005241 right ventricle Anatomy 0.000 description 2
- MDMGHDFNKNZPAU-UHFFFAOYSA-N roserpine Natural products C1C2CN3CCC(C4=CC=C(OC)C=C4N4)=C4C3CC2C(OC(C)=O)C(OC)C1OC(=O)C1=CC(OC)=C(OC)C(OC)=C1 MDMGHDFNKNZPAU-UHFFFAOYSA-N 0.000 description 2
- 230000036573 scar formation Effects 0.000 description 2
- 229940082552 sectral Drugs 0.000 description 2
- 210000003491 skin Anatomy 0.000 description 2
- DAEPDZWVDSPTHF-UHFFFAOYSA-M sodium pyruvate Chemical compound [Na+].CC(=O)C([O-])=O DAEPDZWVDSPTHF-UHFFFAOYSA-M 0.000 description 2
- 229940093252 sorbitrate Drugs 0.000 description 2
- VIDRYROWYFWGSY-UHFFFAOYSA-N sotalol hydrochloride Chemical compound Cl.CC(C)NCC(O)C1=CC=C(NS(C)(=O)=O)C=C1 VIDRYROWYFWGSY-UHFFFAOYSA-N 0.000 description 2
- 241000894007 species Species 0.000 description 2
- 230000002269 spontaneous effect Effects 0.000 description 2
- 229930002534 steroid glycoside Natural products 0.000 description 2
- 238000003756 stirring Methods 0.000 description 2
- 238000003860 storage Methods 0.000 description 2
- PAQZZCOZHPGCFW-UHFFFAOYSA-N sulfinalol Chemical compound C1=CC(OC)=CC=C1CCC(C)NCC(O)C1=CC=C(O)C(S(C)=O)=C1 PAQZZCOZHPGCFW-UHFFFAOYSA-N 0.000 description 2
- 229950005165 sulfinalol Drugs 0.000 description 2
- 230000004083 survival effect Effects 0.000 description 2
- 208000011580 syndromic disease Diseases 0.000 description 2
- YRCWQPVGYLYSOX-UHFFFAOYSA-N synephrine Chemical compound CNCC(O)C1=CC=C(O)C=C1 YRCWQPVGYLYSOX-UHFFFAOYSA-N 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- 229960003658 talinolol Drugs 0.000 description 2
- MXFWWQICDIZSOA-UHFFFAOYSA-N talinolol Chemical compound C1=CC(OCC(O)CNC(C)(C)C)=CC=C1NC(=O)NC1CCCCC1 MXFWWQICDIZSOA-UHFFFAOYSA-N 0.000 description 2
- XOAAWQZATWQOTB-UHFFFAOYSA-N taurine Chemical compound NCCS(O)(=O)=O XOAAWQZATWQOTB-UHFFFAOYSA-N 0.000 description 2
- 229960004559 theobromine Drugs 0.000 description 2
- 229960005001 ticlopidine Drugs 0.000 description 2
- 229950000245 toliprolol Drugs 0.000 description 2
- 229940108522 trandate Drugs 0.000 description 2
- 239000012581 transferrin Substances 0.000 description 2
- 230000001052 transient effect Effects 0.000 description 2
- 238000011277 treatment modality Methods 0.000 description 2
- 229960001288 triamterene Drugs 0.000 description 2
- 229960004813 trichlormethiazide Drugs 0.000 description 2
- LMJSLTNSBFUCMU-UHFFFAOYSA-N trichlormethiazide Chemical compound C1=C(Cl)C(S(=O)(=O)N)=CC2=C1NC(C(Cl)Cl)NS2(=O)=O LMJSLTNSBFUCMU-UHFFFAOYSA-N 0.000 description 2
- YNZXWQJZEDLQEG-UHFFFAOYSA-N trimazosin Chemical compound N1=C2C(OC)=C(OC)C(OC)=CC2=C(N)N=C1N1CCN(C(=O)OCC(C)(C)O)CC1 YNZXWQJZEDLQEG-UHFFFAOYSA-N 0.000 description 2
- 229960002906 trimazosin Drugs 0.000 description 2
- CHQOEHPMXSHGCL-UHFFFAOYSA-N trimethaphan Chemical compound C12C[S+]3CCCC3C2N(CC=2C=CC=CC=2)C(=O)N1CC1=CC=CC=C1 CHQOEHPMXSHGCL-UHFFFAOYSA-N 0.000 description 2
- 229940035742 trimethaphan Drugs 0.000 description 2
- GETQZCLCWQTVFV-UHFFFAOYSA-N trimethylamine Chemical compound CN(C)C GETQZCLCWQTVFV-UHFFFAOYSA-N 0.000 description 2
- 210000001364 upper extremity Anatomy 0.000 description 2
- 210000004509 vascular smooth muscle cell Anatomy 0.000 description 2
- 230000006815 ventricular dysfunction Effects 0.000 description 2
- 229960001722 verapamil Drugs 0.000 description 2
- 230000009385 viral infection Effects 0.000 description 2
- 210000002845 virion Anatomy 0.000 description 2
- 229960004928 xamoterol Drugs 0.000 description 2
- 229960000537 xipamide Drugs 0.000 description 2
- MTZBBNMLMNBNJL-UHFFFAOYSA-N xipamide Chemical compound CC1=CC=CC(C)=C1NC(=O)C1=CC(S(N)(=O)=O)=C(Cl)C=C1O MTZBBNMLMNBNJL-UHFFFAOYSA-N 0.000 description 2
- XWTYSIMOBUGWOL-UHFFFAOYSA-N (+-)-Terbutaline Chemical compound CC(C)(C)NCC(O)C1=CC(O)=CC(O)=C1 XWTYSIMOBUGWOL-UHFFFAOYSA-N 0.000 description 1
- OGNSCSPNOLGXSM-UHFFFAOYSA-N (+/-)-DABA Natural products NCCC(N)C(O)=O OGNSCSPNOLGXSM-UHFFFAOYSA-N 0.000 description 1
- SFLSHLFXELFNJZ-QMMMGPOBSA-N (-)-norepinephrine Chemical compound NC[C@H](O)C1=CC=C(O)C(O)=C1 SFLSHLFXELFNJZ-QMMMGPOBSA-N 0.000 description 1
- SSEBTPPFLLCUMN-CYBMUJFWSA-N (1r)-2-(tert-butylamino)-1-(7-ethyl-1-benzofuran-2-yl)ethanol Chemical compound CCC1=CC=CC2=C1OC([C@H](O)CNC(C)(C)C)=C2 SSEBTPPFLLCUMN-CYBMUJFWSA-N 0.000 description 1
- QBYIENPQHBMVBV-HFEGYEGKSA-N (2R)-2-hydroxy-2-phenylacetic acid Chemical compound O[C@@H](C(O)=O)c1ccccc1.O[C@@H](C(O)=O)c1ccccc1 QBYIENPQHBMVBV-HFEGYEGKSA-N 0.000 description 1
- APSWDBKJUOEMOA-MTEWDWANSA-N (2S)-4-amino-2-[[(2S,3S)-2-[[(2S)-2-[[(2S)-2-[[(2S,3R)-2-[[(2S,3S)-2-[(2-aminoacetyl)amino]-3-methylpentanoyl]amino]-3-hydroxybutanoyl]amino]propanoyl]amino]-4-methylpentanoyl]amino]-3-methylpentanoyl]amino]-4-oxobutanoic acid Chemical compound CC[C@H](C)[C@H](NC(=O)CN)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(N)=O)C(O)=O APSWDBKJUOEMOA-MTEWDWANSA-N 0.000 description 1
- SBHCLVQMTBWHCD-METXMMQOSA-N (2e,4e,6e,8e,10e)-icosa-2,4,6,8,10-pentaenoic acid Chemical compound CCCCCCCCC\C=C\C=C\C=C\C=C\C=C\C(O)=O SBHCLVQMTBWHCD-METXMMQOSA-N 0.000 description 1
- VLPIATFUUWWMKC-SNVBAGLBSA-N (2r)-1-(2,6-dimethylphenoxy)propan-2-amine Chemical compound C[C@@H](N)COC1=C(C)C=CC=C1C VLPIATFUUWWMKC-SNVBAGLBSA-N 0.000 description 1
- LIEMBEWXEZJEEZ-INEUFUBQSA-N (2r,3r)-4-(6-aminopurin-9-yl)-2,3-dihydroxybutanoic acid Chemical compound NC1=NC=NC2=C1N=CN2C[C@@H](O)[C@@H](O)C(O)=O LIEMBEWXEZJEEZ-INEUFUBQSA-N 0.000 description 1
- YKFCISHFRZHKHY-NGQGLHOPSA-N (2s)-2-amino-3-(3,4-dihydroxyphenyl)-2-methylpropanoic acid;trihydrate Chemical compound O.O.O.OC(=O)[C@](N)(C)CC1=CC=C(O)C(O)=C1.OC(=O)[C@](N)(C)CC1=CC=C(O)C(O)=C1 YKFCISHFRZHKHY-NGQGLHOPSA-N 0.000 description 1
- STTOCSZNTPWKMI-UHFFFAOYSA-L (5-cyano-5,5-diphenylpentyl)-dimethyl-[2-(4-methylmorpholin-4-ium-4-yl)ethyl]azanium;methyl sulfate Chemical compound COS([O-])(=O)=O.COS([O-])(=O)=O.C1COCC[N+]1(C)CC[N+](C)(C)CCCCC(C#N)(C=1C=CC=CC=1)C1=CC=CC=C1 STTOCSZNTPWKMI-UHFFFAOYSA-L 0.000 description 1
- RWIUTHWKQHRQNP-ZDVGBALWSA-N (9e,12e)-n-(1-phenylethyl)octadeca-9,12-dienamide Chemical compound CCCCC\C=C\C\C=C\CCCCCCCC(=O)NC(C)C1=CC=CC=C1 RWIUTHWKQHRQNP-ZDVGBALWSA-N 0.000 description 1
- PHIQHXFUZVPYII-ZCFIWIBFSA-O (R)-carnitinium Chemical compound C[N+](C)(C)C[C@H](O)CC(O)=O PHIQHXFUZVPYII-ZCFIWIBFSA-O 0.000 description 1
- WLRMANUAADYWEA-NWASOUNVSA-N (S)-timolol maleate Chemical compound OC(=O)\C=C/C(O)=O.CC(C)(C)NC[C@H](O)COC1=NSN=C1N1CCOCC1 WLRMANUAADYWEA-NWASOUNVSA-N 0.000 description 1
- HVAKUYCEWDPRCA-IZZDOVSWSA-N (e)-1-(2,4-dimethoxyphenyl)-3-(4-methoxyphenyl)prop-2-en-1-one Chemical compound C1=CC(OC)=CC=C1\C=C\C(=O)C1=CC=C(OC)C=C1OC HVAKUYCEWDPRCA-IZZDOVSWSA-N 0.000 description 1
- KAJZGRFYZKWYDX-VQHVLOKHSA-N (e)-3-methyl-4-phenylbut-3-enamide Chemical compound NC(=O)CC(/C)=C/C1=CC=CC=C1 KAJZGRFYZKWYDX-VQHVLOKHSA-N 0.000 description 1
- BRIPGNJWPCKDQZ-WXXKFALUSA-N (e)-but-2-enedioic acid;1-[4-(2-methoxyethyl)phenoxy]-3-(propan-2-ylamino)propan-2-ol Chemical compound OC(=O)\C=C\C(O)=O.COCCC1=CC=C(OCC(O)CNC(C)C)C=C1.COCCC1=CC=C(OCC(O)CNC(C)C)C=C1 BRIPGNJWPCKDQZ-WXXKFALUSA-N 0.000 description 1
- LJOQGZACKSYWCH-LHHVKLHASA-N (s)-[(2r,4s,5r)-5-ethyl-1-azabicyclo[2.2.2]octan-2-yl]-(6-methoxyquinolin-4-yl)methanol Chemical compound C1=C(OC)C=C2C([C@H](O)[C@H]3C[C@@H]4CCN3C[C@@H]4CC)=CC=NC2=C1 LJOQGZACKSYWCH-LHHVKLHASA-N 0.000 description 1
- HGLLQAPXHCAZBP-UHFFFAOYSA-N 1,3-dimethyl-7-(morpholin-4-ylmethyl)purine-2,6-dione Chemical compound C1=2C(=O)N(C)C(=O)N(C)C=2N=CN1CN1CCOCC1 HGLLQAPXHCAZBP-UHFFFAOYSA-N 0.000 description 1
- ZZKWNLZUYAGVOT-UHFFFAOYSA-N 1-(2-chlorophenothiazin-10-yl)-3-(diethylamino)propan-1-one Chemical compound C1=C(Cl)C=C2N(C(=O)CCN(CC)CC)C3=CC=CC=C3SC2=C1 ZZKWNLZUYAGVOT-UHFFFAOYSA-N 0.000 description 1
- KJBSVTAYVZKMDM-UHFFFAOYSA-N 1-(2-nitrophenyl)cyclopropane-1-carboxylic acid Chemical compound C=1C=CC=C([N+]([O-])=O)C=1C1(C(=O)O)CC1 KJBSVTAYVZKMDM-UHFFFAOYSA-N 0.000 description 1
- LUKOGYUKYPZBFP-UHFFFAOYSA-N 1-(4-fluorophenyl)-4-piperidin-1-ylbutan-1-one Chemical compound C1=CC(F)=CC=C1C(=O)CCCN1CCCCC1 LUKOGYUKYPZBFP-UHFFFAOYSA-N 0.000 description 1
- IVVNZDGDKPTYHK-JTQLQIEISA-N 1-cyano-2-[(2s)-3,3-dimethylbutan-2-yl]-3-pyridin-4-ylguanidine Chemical compound CC(C)(C)[C@H](C)N=C(NC#N)NC1=CC=NC=C1 IVVNZDGDKPTYHK-JTQLQIEISA-N 0.000 description 1
- GJHKWLSRHNWTAN-UHFFFAOYSA-N 1-ethoxy-4-(4-pentylcyclohexyl)benzene Chemical compound C1CC(CCCCC)CCC1C1=CC=C(OCC)C=C1 GJHKWLSRHNWTAN-UHFFFAOYSA-N 0.000 description 1
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 1
- OWEGMIWEEQEYGQ-UHFFFAOYSA-N 100676-05-9 Natural products OC1C(O)C(O)C(CO)OC1OCC1C(O)C(O)C(O)C(OC2C(OC(O)C(O)C2O)CO)O1 OWEGMIWEEQEYGQ-UHFFFAOYSA-N 0.000 description 1
- HCYFGRCYSCXKNQ-UHFFFAOYSA-N 2-(1,3-dimethyl-2,6-dioxo-7-purinyl)acetic acid Chemical compound O=C1N(C)C(=O)N(C)C2=C1N(CC(O)=O)C=N2 HCYFGRCYSCXKNQ-UHFFFAOYSA-N 0.000 description 1
- 239000003315 2-(4-chlorophenoxy)-2-methylpropanoic acid Substances 0.000 description 1
- YYRYCTNXXHOENE-UHFFFAOYSA-N 2-(morpholin-4-ylmethyl)-2-phenylindene-1,3-dione Chemical compound O=C1C2=CC=CC=C2C(=O)C1(C=1C=CC=CC=1)CN1CCOCC1 YYRYCTNXXHOENE-UHFFFAOYSA-N 0.000 description 1
- YREYLAVBNPACJM-UHFFFAOYSA-N 2-(tert-butylamino)-1-(2-chlorophenyl)ethanol Chemical compound CC(C)(C)NCC(O)C1=CC=CC=C1Cl YREYLAVBNPACJM-UHFFFAOYSA-N 0.000 description 1
- MELCWEWUZODSIS-UHFFFAOYSA-N 2-[2-(diethylamino)ethoxy]-n,n-diethylethanamine Chemical compound CCN(CC)CCOCCN(CC)CC MELCWEWUZODSIS-UHFFFAOYSA-N 0.000 description 1
- IULOBWFWYDMECP-UHFFFAOYSA-N 2-[4-[2-[(4-chlorophenyl)sulfonylamino]ethyl]phenyl]acetic acid Chemical compound C1=CC(CC(=O)O)=CC=C1CCNS(=O)(=O)C1=CC=C(Cl)C=C1 IULOBWFWYDMECP-UHFFFAOYSA-N 0.000 description 1
- YJIYWYAMZFVECX-UHFFFAOYSA-N 2-[N-[2-(acetyloxymethoxy)-2-oxoethyl]-2-[2-[2-[bis[2-(acetyloxymethoxy)-2-oxoethyl]amino]phenoxy]ethoxy]anilino]acetic acid acetyloxymethyl ester Chemical compound CC(=O)OCOC(=O)CN(CC(=O)OCOC(C)=O)C1=CC=CC=C1OCCOC1=CC=CC=C1N(CC(=O)OCOC(C)=O)CC(=O)OCOC(C)=O YJIYWYAMZFVECX-UHFFFAOYSA-N 0.000 description 1
- RMWVZGDJPAKBDE-UHFFFAOYSA-N 2-acetyloxy-4-(trifluoromethyl)benzoic acid Chemical compound CC(=O)OC1=CC(C(F)(F)F)=CC=C1C(O)=O RMWVZGDJPAKBDE-UHFFFAOYSA-N 0.000 description 1
- MSWZFWKMSRAUBD-GASJEMHNSA-N 2-amino-2-deoxy-D-galactopyranose Chemical compound N[C@H]1C(O)O[C@H](CO)[C@H](O)[C@@H]1O MSWZFWKMSRAUBD-GASJEMHNSA-N 0.000 description 1
- UNFGQCCHVMMMRF-UHFFFAOYSA-N 2-phenylbutanamide Chemical compound CCC(C(N)=O)C1=CC=CC=C1 UNFGQCCHVMMMRF-UHFFFAOYSA-N 0.000 description 1
- ZSLUVFAKFWKJRC-IGMARMGPSA-N 232Th Chemical compound [232Th] ZSLUVFAKFWKJRC-IGMARMGPSA-N 0.000 description 1
- HAPJROQJVSPKCJ-UHFFFAOYSA-N 3-[4-[2-[6-(dibutylamino)naphthalen-2-yl]ethenyl]pyridin-1-ium-1-yl]propane-1-sulfonate Chemical compound C1=CC2=CC(N(CCCC)CCCC)=CC=C2C=C1C=CC1=CC=[N+](CCCS([O-])(=O)=O)C=C1 HAPJROQJVSPKCJ-UHFFFAOYSA-N 0.000 description 1
- NPOAOTPXWNWTSH-UHFFFAOYSA-N 3-hydroxy-3-methylglutaric acid Chemical compound OC(=O)CC(O)(C)CC(O)=O NPOAOTPXWNWTSH-UHFFFAOYSA-N 0.000 description 1
- UIAGMCDKSXEBJQ-IBGZPJMESA-N 3-o-(2-methoxyethyl) 5-o-propan-2-yl (4s)-2,6-dimethyl-4-(3-nitrophenyl)-1,4-dihydropyridine-3,5-dicarboxylate Chemical compound COCCOC(=O)C1=C(C)NC(C)=C(C(=O)OC(C)C)[C@H]1C1=CC=CC([N+]([O-])=O)=C1 UIAGMCDKSXEBJQ-IBGZPJMESA-N 0.000 description 1
- CANLULJYEHSQFU-UHFFFAOYSA-N 4-(1-aminoethyl)benzonitrile Chemical compound CC(N)C1=CC=C(C#N)C=C1 CANLULJYEHSQFU-UHFFFAOYSA-N 0.000 description 1
- YYAMOMYEENPVSP-UHFFFAOYSA-N 4-[(4-sulfamoylphenyl)methyl]benzenesulfonamide Chemical compound C1=CC(S(=O)(=O)N)=CC=C1CC1=CC=C(S(N)(=O)=O)C=C1 YYAMOMYEENPVSP-UHFFFAOYSA-N 0.000 description 1
- URIZBPYQIRFMBF-UHFFFAOYSA-N 4-[1-[3-methyl-5-(5-oxo-2h-furan-3-yl)-1-benzofuran-2-yl]ethoxy]-4-oxobutanoic acid Chemical compound C1=C2C(C)=C(C(OC(=O)CCC(O)=O)C)OC2=CC=C1C1=CC(=O)OC1 URIZBPYQIRFMBF-UHFFFAOYSA-N 0.000 description 1
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 1
- CPDOMNNHJSTWKL-UHFFFAOYSA-N 4-hydroxy-3-[1-(4-hydroxy-2-oxochromen-3-yl)ethyl]chromen-2-one Chemical compound C1=CC=C2OC(=O)C(C(C=3C(OC4=CC=CC=C4C=3O)=O)C)=C(O)C2=C1 CPDOMNNHJSTWKL-UHFFFAOYSA-N 0.000 description 1
- ORLGLBZRQYOWNA-UHFFFAOYSA-N 4-methylpyridin-2-amine Chemical compound CC1=CC=NC(N)=C1 ORLGLBZRQYOWNA-UHFFFAOYSA-N 0.000 description 1
- LSLYOANBFKQKPT-DIFFPNOSSA-N 5-[(1r)-1-hydroxy-2-[[(2r)-1-(4-hydroxyphenyl)propan-2-yl]amino]ethyl]benzene-1,3-diol Chemical compound C([C@@H](C)NC[C@H](O)C=1C=C(O)C=C(O)C=1)C1=CC=C(O)C=C1 LSLYOANBFKQKPT-DIFFPNOSSA-N 0.000 description 1
- SQDAZGGFXASXDW-UHFFFAOYSA-N 5-bromo-2-(trifluoromethoxy)pyridine Chemical compound FC(F)(F)OC1=CC=C(Br)C=N1 SQDAZGGFXASXDW-UHFFFAOYSA-N 0.000 description 1
- OPIFSICVWOWJMJ-AEOCFKNESA-N 5-bromo-4-chloro-3-indolyl beta-D-galactoside Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1OC1=CNC2=CC=C(Br)C(Cl)=C12 OPIFSICVWOWJMJ-AEOCFKNESA-N 0.000 description 1
- HCNBCFYKPSFHLH-UHFFFAOYSA-N 6-(furan-2-yl)pteridine-2,4,7-triamine Chemical compound NC1=NC2=NC(N)=NC(N)=C2N=C1C1=CC=CO1 HCNBCFYKPSFHLH-UHFFFAOYSA-N 0.000 description 1
- LREQLEBVOXIEOM-UHFFFAOYSA-N 6-amino-2-methyl-2-heptanol Chemical compound CC(N)CCCC(C)(C)O LREQLEBVOXIEOM-UHFFFAOYSA-N 0.000 description 1
- SLXKOJJOQWFEFD-UHFFFAOYSA-N 6-aminohexanoic acid Chemical compound NCCCCCC(O)=O SLXKOJJOQWFEFD-UHFFFAOYSA-N 0.000 description 1
- VGLGVJVUHYTIIU-UHFFFAOYSA-N 6-chloro-1,1-dioxo-3-[(prop-2-enylthio)methyl]-3,4-dihydro-2H-1$l^{6},2,4-benzothiadiazine-7-sulfonamide Chemical compound C1=C(Cl)C(S(=O)(=O)N)=CC2=C1NC(CSCC=C)NS2(=O)=O VGLGVJVUHYTIIU-UHFFFAOYSA-N 0.000 description 1
- JDCJFONQCRLHND-UHFFFAOYSA-N 6-chloro-3-[(4-fluorophenyl)methyl]-1,1-dioxo-3,4-dihydro-2h-1$l^{6},2,4-benzothiadiazine-7-sulfonamide Chemical compound C1=C(Cl)C(S(=O)(=O)N)=CC(S(N2)(=O)=O)=C1NC2CC1=CC=C(F)C=C1 JDCJFONQCRLHND-UHFFFAOYSA-N 0.000 description 1
- LPMXVESGRSUGHW-UHFFFAOYSA-N Acolongiflorosid K Natural products OC1C(O)C(O)C(C)OC1OC1CC2(O)CCC3C4(O)CCC(C=5COC(=O)C=5)C4(C)CC(O)C3C2(CO)C(O)C1 LPMXVESGRSUGHW-UHFFFAOYSA-N 0.000 description 1
- 108010085238 Actins Proteins 0.000 description 1
- 102000007469 Actins Human genes 0.000 description 1
- 206010001258 Adenoviral infections Diseases 0.000 description 1
- 208000010370 Adenoviridae Infections Diseases 0.000 description 1
- 206010060931 Adenovirus infection Diseases 0.000 description 1
- 229920000936 Agarose Polymers 0.000 description 1
- 239000012103 Alexa Fluor 488 Substances 0.000 description 1
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 1
- 206010002091 Anaesthesia Diseases 0.000 description 1
- 108010001779 Ancrod Proteins 0.000 description 1
- 102100022987 Angiogenin Human genes 0.000 description 1
- 108010072661 Angiotensin Amide Proteins 0.000 description 1
- 102000008873 Angiotensin II receptor Human genes 0.000 description 1
- 108050000824 Angiotensin II receptor Proteins 0.000 description 1
- 229940123073 Angiotensin antagonist Drugs 0.000 description 1
- 108010064733 Angiotensins Proteins 0.000 description 1
- 102000015427 Angiotensins Human genes 0.000 description 1
- 244000105624 Arachis hypogaea Species 0.000 description 1
- 208000037260 Atherosclerotic Plaque Diseases 0.000 description 1
- 206010003805 Autism Diseases 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- BWSSMIJUDVUASQ-UHFFFAOYSA-N Benzylhydrochlorothiazide Chemical compound C1=C(Cl)C(S(=O)(=O)N)=CC(S(N2)(=O)=O)=C1NC2CC1=CC=CC=C1 BWSSMIJUDVUASQ-UHFFFAOYSA-N 0.000 description 1
- QVZCXCJXTMIDME-UHFFFAOYSA-N Biopropazepan Trimethoxybenzoate Chemical compound COC1=C(OC)C(OC)=CC(C(=O)OCCCN2CCN(CCCOC(=O)C=3C=C(OC)C(OC)=C(OC)C=3)CCC2)=C1 QVZCXCJXTMIDME-UHFFFAOYSA-N 0.000 description 1
- 241000237519 Bivalvia Species 0.000 description 1
- 241000701822 Bovine papillomavirus Species 0.000 description 1
- RHLJLALHBZGAFM-UHFFFAOYSA-N Bunazosinum Chemical compound C1CN(C(=O)CCC)CCCN1C1=NC(N)=C(C=C(OC)C(OC)=C2)C2=N1 RHLJLALHBZGAFM-UHFFFAOYSA-N 0.000 description 1
- 206010006580 Bundle branch block left Diseases 0.000 description 1
- 239000002083 C09CA01 - Losartan Substances 0.000 description 1
- 239000002080 C09CA02 - Eprosartan Substances 0.000 description 1
- 239000004072 C09CA03 - Valsartan Substances 0.000 description 1
- 239000002947 C09CA04 - Irbesartan Substances 0.000 description 1
- FXQKTWUVHPTFGZ-UHFFFAOYSA-N C1=NN=CC2=CC=CC=C12.NN Chemical compound C1=NN=CC2=CC=CC=C12.NN FXQKTWUVHPTFGZ-UHFFFAOYSA-N 0.000 description 1
- VMNRZYKMPOZISX-UHFFFAOYSA-M COC(C[Hg]O)Cc1cccc2cc(C(O)=O)c(=O)oc12 Chemical compound COC(C[Hg]O)Cc1cccc2cc(C(O)=O)c(=O)oc12 VMNRZYKMPOZISX-UHFFFAOYSA-M 0.000 description 1
- QLTVVOATEHFXLT-UHFFFAOYSA-N Cadralazine Chemical compound CCOC(=O)NNC1=CC=C(N(CC)CC(C)O)N=N1 QLTVVOATEHFXLT-UHFFFAOYSA-N 0.000 description 1
- 108090000312 Calcium Channels Proteins 0.000 description 1
- 102000003922 Calcium Channels Human genes 0.000 description 1
- 208000005623 Carcinogenesis Diseases 0.000 description 1
- 208000020446 Cardiac disease Diseases 0.000 description 1
- 206010007556 Cardiac failure acute Diseases 0.000 description 1
- 208000031229 Cardiomyopathies Diseases 0.000 description 1
- 208000024172 Cardiovascular disease Diseases 0.000 description 1
- 108010078791 Carrier Proteins Proteins 0.000 description 1
- 229920001287 Chondroitin sulfate Polymers 0.000 description 1
- 108010077544 Chromatin Proteins 0.000 description 1
- ZKEMVUBEPDXJPL-UHFFFAOYSA-N Chromazonarol Natural products C1=C(O)C=C2CC3C4(C)CCCC(C)(C)C4CCC3(C)OC2=C1 ZKEMVUBEPDXJPL-UHFFFAOYSA-N 0.000 description 1
- IPOBOOXFSRWSHL-UHFFFAOYSA-N Cibenzoline Chemical compound C=1C=CC=CC=1C1(C=2C=CC=CC=2)CC1C1=NCCN1 IPOBOOXFSRWSHL-UHFFFAOYSA-N 0.000 description 1
- 208000032544 Cicatrix Diseases 0.000 description 1
- KPSRODZRAIWAKH-JTQLQIEISA-N Ciprofibrate Natural products C1=CC(OC(C)(C)C(O)=O)=CC=C1[C@H]1C(Cl)(Cl)C1 KPSRODZRAIWAKH-JTQLQIEISA-N 0.000 description 1
- BMOVQUBVGICXQN-UHFFFAOYSA-N Clinofibrate Chemical compound C1=CC(OC(C)(CC)C(O)=O)=CC=C1C1(C=2C=CC(OC(C)(CC)C(O)=O)=CC=2)CCCCC1 BMOVQUBVGICXQN-UHFFFAOYSA-N 0.000 description 1
- NENBAISIHCWPKP-UHFFFAOYSA-N Clofenamide Chemical compound NS(=O)(=O)C1=CC=C(Cl)C(S(N)(=O)=O)=C1 NENBAISIHCWPKP-UHFFFAOYSA-N 0.000 description 1
- VPMWFZKOWULPGT-UHFFFAOYSA-N Clorexolone Chemical compound C1C=2C=C(Cl)C(S(=O)(=O)N)=CC=2C(=O)N1C1CCCCC1 VPMWFZKOWULPGT-UHFFFAOYSA-N 0.000 description 1
- 229920002911 Colestipol Polymers 0.000 description 1
- 108010035532 Collagen Proteins 0.000 description 1
- 102000008186 Collagen Human genes 0.000 description 1
- 102100033601 Collagen alpha-1(I) chain Human genes 0.000 description 1
- 102100028257 Collagen alpha-1(XVI) chain Human genes 0.000 description 1
- 108020004635 Complementary DNA Proteins 0.000 description 1
- 108010062580 Concanavalin A Proteins 0.000 description 1
- 208000002330 Congenital Heart Defects Diseases 0.000 description 1
- 102000002585 Contractile Proteins Human genes 0.000 description 1
- 108010068426 Contractile Proteins Proteins 0.000 description 1
- OPHYOSQDKQYDCM-UHFFFAOYSA-N Convallatoxin Natural products CC1OC(OC2CCC3(C=O)C4CCC5(C)C(CCC5(O)C4CCC3(O)C2)C6=CCC(=O)O6)C(O)C(O)C1O OPHYOSQDKQYDCM-UHFFFAOYSA-N 0.000 description 1
- 206010011086 Coronary artery occlusion Diseases 0.000 description 1
- 206010011224 Cough Diseases 0.000 description 1
- 102000001493 Cyclophilins Human genes 0.000 description 1
- 108010068682 Cyclophilins Proteins 0.000 description 1
- 241000701022 Cytomegalovirus Species 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- SHZGCJCMOBCMKK-UHFFFAOYSA-N D-mannomethylose Natural products CC1OC(O)C(O)C(O)C1O SHZGCJCMOBCMKK-UHFFFAOYSA-N 0.000 description 1
- LIEMBEWXEZJEEZ-UHFFFAOYSA-N D-threo-Leutysin Natural products NC1=NC=NC2=C1N=CN2CC(O)C(O)C(O)=O LIEMBEWXEZJEEZ-UHFFFAOYSA-N 0.000 description 1
- XUIIKFGFIJCVMT-GFCCVEGCSA-N D-thyroxine Chemical compound IC1=CC(C[C@@H](N)C(O)=O)=CC(I)=C1OC1=CC(I)=C(O)C(I)=C1 XUIIKFGFIJCVMT-GFCCVEGCSA-N 0.000 description 1
- 108010008286 DNA nucleotidylexotransferase Proteins 0.000 description 1
- 241000702421 Dependoparvovirus Species 0.000 description 1
- QEEBRPGZBVVINN-UHFFFAOYSA-N Desacetyl-bufotalin Natural products CC12CCC(C3(CCC(O)CC3CC3)C)C3C1(O)CCC2C=1C=CC(=O)OC=1 QEEBRPGZBVVINN-UHFFFAOYSA-N 0.000 description 1
- CVBMAZKKCSYWQR-BPJCFPRXSA-N Deserpidine Natural products O=C(OC)[C@@H]1[C@H](OC)[C@H](OC(=O)c2cc(OC)c(OC)c(OC)c2)C[C@H]2[C@@H]1C[C@H]1N(C2)CCc2c3c([nH]c12)cccc3 CVBMAZKKCSYWQR-BPJCFPRXSA-N 0.000 description 1
- 208000012239 Developmental disease Diseases 0.000 description 1
- 229920004937 Dexon® Polymers 0.000 description 1
- 101100364969 Dictyostelium discoideum scai gene Proteins 0.000 description 1
- CKNOLMVLQUPVMU-XOMFLMSUSA-N Digitalin Natural products O(C)[C@H]1[C@@H](O[C@H]2[C@H](O)[C@@H](O)[C@@H](O)[C@H](CO)O2)[C@H](C)O[C@H](O[C@@H]2C[C@@H]3[C@@](C)([C@@H]4[C@H]([C@]5(O)[C@@](C)([C@@H]([C@H](O)C5)C5=CC(=O)OC5)CC4)CC3)CC2)[C@@H]1O CKNOLMVLQUPVMU-XOMFLMSUSA-N 0.000 description 1
- 240000001879 Digitalis lutea Species 0.000 description 1
- JYGLAHSAISAEAL-UHFFFAOYSA-N Diphenadione Chemical compound O=C1C2=CC=CC=C2C(=O)C1C(=O)C(C=1C=CC=CC=1)C1=CC=CC=C1 JYGLAHSAISAEAL-UHFFFAOYSA-N 0.000 description 1
- 229940123900 Direct thrombin inhibitor Drugs 0.000 description 1
- 208000012661 Dyskinesia Diseases 0.000 description 1
- 108010069091 Dystrophin Proteins 0.000 description 1
- 102000001039 Dystrophin Human genes 0.000 description 1
- 108010066671 Enalaprilat Proteins 0.000 description 1
- 101710091045 Envelope protein Proteins 0.000 description 1
- 108010056764 Eptifibatide Proteins 0.000 description 1
- 108700024394 Exon Proteins 0.000 description 1
- 108010037362 Extracellular Matrix Proteins Proteins 0.000 description 1
- 102000010834 Extracellular Matrix Proteins Human genes 0.000 description 1
- RBBWCVQDXDFISW-UHFFFAOYSA-N Feprazone Chemical compound O=C1C(CC=C(C)C)C(=O)N(C=2C=CC=CC=2)N1C1=CC=CC=C1 RBBWCVQDXDFISW-UHFFFAOYSA-N 0.000 description 1
- 108010088842 Fibrinolysin Proteins 0.000 description 1
- 239000004606 Fillers/Extenders Substances 0.000 description 1
- 241000233866 Fungi Species 0.000 description 1
- 108010052320 GATA4 Transcription Factor Proteins 0.000 description 1
- 102000018715 GATA4 Transcription Factor Human genes 0.000 description 1
- 241000287828 Gallus gallus Species 0.000 description 1
- 208000018522 Gastrointestinal disease Diseases 0.000 description 1
- HEMJJKBWTPKOJG-UHFFFAOYSA-N Gemfibrozil Chemical compound CC1=CC=C(C)C(OCCCC(C)(C)C(O)=O)=C1 HEMJJKBWTPKOJG-UHFFFAOYSA-N 0.000 description 1
- 108700028146 Genetic Enhancer Elements Proteins 0.000 description 1
- 108700039691 Genetic Promoter Regions Proteins 0.000 description 1
- OCEDEAQHBIGPTE-UHFFFAOYSA-N Gitoxin Natural products CC1OC(CC(O)C1O)OC2C(O)CC(OC3C(O)CC(OC4CCC5(C)C(CCC6C5CCC7(C)C(C(O)CC67O)C8=CCOC8=O)C4)OC3C)OC2C OCEDEAQHBIGPTE-UHFFFAOYSA-N 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- 102100031181 Glyceraldehyde-3-phosphate dehydrogenase Human genes 0.000 description 1
- JZNWSCPGTDBMEW-UHFFFAOYSA-N Glycerophosphorylethanolamin Natural products NCCOP(O)(=O)OCC(O)CO JZNWSCPGTDBMEW-UHFFFAOYSA-N 0.000 description 1
- 244000068988 Glycine max Species 0.000 description 1
- 235000010469 Glycine max Nutrition 0.000 description 1
- WDZVGELJXXEGPV-YIXHJXPBSA-N Guanabenz Chemical compound NC(N)=N\N=C\C1=C(Cl)C=CC=C1Cl WDZVGELJXXEGPV-YIXHJXPBSA-N 0.000 description 1
- MCSPBPXATWBACD-GAYQJXMFSA-N Guanabenz acetate Chemical compound CC(O)=O.NC(N)=N\N=C\C1=C(Cl)C=CC=C1Cl MCSPBPXATWBACD-GAYQJXMFSA-N 0.000 description 1
- 101150063295 HAND2 gene Proteins 0.000 description 1
- 206010062713 Haemorrhagic diathesis Diseases 0.000 description 1
- 208000013875 Heart injury Diseases 0.000 description 1
- 102100038654 Heart- and neural crest derivatives-expressed protein 2 Human genes 0.000 description 1
- 101710184439 Heart- and neural crest derivatives-expressed protein 2 Proteins 0.000 description 1
- 108010058611 Helix lectin Proteins 0.000 description 1
- VZJFGSRCJCXDSG-UHFFFAOYSA-N Hexamethonium Chemical compound C[N+](C)(C)CCCCCC[N+](C)(C)C VZJFGSRCJCXDSG-UHFFFAOYSA-N 0.000 description 1
- 102100022130 High mobility group protein B3 Human genes 0.000 description 1
- 102000007625 Hirudins Human genes 0.000 description 1
- 108010007267 Hirudins Proteins 0.000 description 1
- 108010027412 Histocompatibility Antigens Class II Proteins 0.000 description 1
- 102000018713 Histocompatibility Antigens Class II Human genes 0.000 description 1
- 108010036115 Histone Methyltransferases Proteins 0.000 description 1
- 102100038885 Histone acetyltransferase p300 Human genes 0.000 description 1
- 108090000246 Histone acetyltransferases Proteins 0.000 description 1
- 102000003893 Histone acetyltransferases Human genes 0.000 description 1
- 108090000353 Histone deacetylase Proteins 0.000 description 1
- 102100039999 Histone deacetylase 2 Human genes 0.000 description 1
- 102100021454 Histone deacetylase 4 Human genes 0.000 description 1
- 206010050469 Holt-Oram syndrome Diseases 0.000 description 1
- 102100027875 Homeobox protein Nkx-2.5 Human genes 0.000 description 1
- 101000860648 Homo sapiens Collagen alpha-1(XVI) chain Proteins 0.000 description 1
- 101001006375 Homo sapiens High mobility group nucleosome-binding domain-containing protein 4 Proteins 0.000 description 1
- 101001045794 Homo sapiens High mobility group protein B3 Proteins 0.000 description 1
- 101000882390 Homo sapiens Histone acetyltransferase p300 Proteins 0.000 description 1
- 101001035011 Homo sapiens Histone deacetylase 2 Proteins 0.000 description 1
- 101000899259 Homo sapiens Histone deacetylase 4 Proteins 0.000 description 1
- 101001032113 Homo sapiens Histone deacetylase 7 Proteins 0.000 description 1
- 101001032092 Homo sapiens Histone deacetylase 9 Proteins 0.000 description 1
- 101000632197 Homo sapiens Homeobox protein Nkx-2.5 Proteins 0.000 description 1
- 101100456626 Homo sapiens MEF2A gene Proteins 0.000 description 1
- 101000950687 Homo sapiens Mitogen-activated protein kinase 7 Proteins 0.000 description 1
- 101001126414 Homo sapiens Proteolipid protein 2 Proteins 0.000 description 1
- 101000666634 Homo sapiens Rho-related GTP-binding protein RhoH Proteins 0.000 description 1
- 101000800546 Homo sapiens Transcription factor 21 Proteins 0.000 description 1
- 101000652326 Homo sapiens Transcription factor SOX-18 Proteins 0.000 description 1
- 101000653735 Homo sapiens Transcriptional enhancer factor TEF-1 Proteins 0.000 description 1
- 101000652726 Homo sapiens Transgelin-2 Proteins 0.000 description 1
- 101000931371 Homo sapiens Zinc finger protein ZFPM2 Proteins 0.000 description 1
- 241000701024 Human betaherpesvirus 5 Species 0.000 description 1
- LJOQGZACKSYWCH-AFHBHXEDSA-N Hydroquinidine Natural products C1=C(OC)C=C2C([C@@H](O)[C@H]3C[C@@H]4CCN3C[C@@H]4CC)=CC=NC2=C1 LJOQGZACKSYWCH-AFHBHXEDSA-N 0.000 description 1
- 229920002153 Hydroxypropyl cellulose Polymers 0.000 description 1
- 206010021118 Hypotonia Diseases 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 108700002232 Immediate-Early Genes Proteins 0.000 description 1
- 102000004877 Insulin Human genes 0.000 description 1
- 108090001061 Insulin Proteins 0.000 description 1
- HUYWAWARQUIQLE-UHFFFAOYSA-N Isoetharine Chemical compound CC(C)NC(CC)C(O)C1=CC=C(O)C(O)=C1 HUYWAWARQUIQLE-UHFFFAOYSA-N 0.000 description 1
- KLDXJTOLSGUMSJ-JGWLITMVSA-N Isosorbide Chemical compound O[C@@H]1CO[C@@H]2[C@@H](O)CO[C@@H]21 KLDXJTOLSGUMSJ-JGWLITMVSA-N 0.000 description 1
- SHZGCJCMOBCMKK-PQMKYFCFSA-N L-Fucose Natural products C[C@H]1O[C@H](O)[C@@H](O)[C@@H](O)[C@@H]1O SHZGCJCMOBCMKK-PQMKYFCFSA-N 0.000 description 1
- AHLPHDHHMVZTML-BYPYZUCNSA-N L-Ornithine Chemical compound NCCC[C@H](N)C(O)=O AHLPHDHHMVZTML-BYPYZUCNSA-N 0.000 description 1
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 1
- SHZGCJCMOBCMKK-DHVFOXMCSA-N L-fucopyranose Chemical compound C[C@@H]1OC(O)[C@@H](O)[C@H](O)[C@@H]1O SHZGCJCMOBCMKK-DHVFOXMCSA-N 0.000 description 1
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 1
- PNNNRSAQSRJVSB-UHFFFAOYSA-N L-rhamnose Natural products CC(O)C(O)C(O)C(O)C=O PNNNRSAQSRJVSB-UHFFFAOYSA-N 0.000 description 1
- 229930188389 Lanatoside Natural products 0.000 description 1
- 235000014647 Lens culinaris subsp culinaris Nutrition 0.000 description 1
- 244000043158 Lens esculenta Species 0.000 description 1
- 241000713666 Lentivirus Species 0.000 description 1
- 239000012097 Lipofectamine 2000 Substances 0.000 description 1
- 108090001030 Lipoproteins Proteins 0.000 description 1
- 102000004895 Lipoproteins Human genes 0.000 description 1
- 102000043129 MHC class I family Human genes 0.000 description 1
- 108091054437 MHC class I family Proteins 0.000 description 1
- 101150078445 MYOCD gene Proteins 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- GUBGYTABKSRVRQ-PICCSMPSSA-N Maltose Natural products O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@@H](CO)OC(O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-PICCSMPSSA-N 0.000 description 1
- 101001129122 Mannheimia haemolytica Outer membrane lipoprotein 2 Proteins 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- LEROTMJVBFSIMP-UHFFFAOYSA-N Mebutamate Chemical compound NC(=O)OCC(C)(C(C)CC)COC(N)=O LEROTMJVBFSIMP-UHFFFAOYSA-N 0.000 description 1
- PKVZBNCYEICAQP-UHFFFAOYSA-N Mecamylamine hydrochloride Chemical compound Cl.C1CC2C(C)(C)C(NC)(C)C1C2 PKVZBNCYEICAQP-UHFFFAOYSA-N 0.000 description 1
- ABSPRNADVQNDOU-UHFFFAOYSA-N Menaquinone 1 Natural products C1=CC=C2C(=O)C(CC=C(C)C)=C(C)C(=O)C2=C1 ABSPRNADVQNDOU-UHFFFAOYSA-N 0.000 description 1
- HBNPJJILLOYFJU-VMPREFPWSA-N Mibefradil Chemical compound C1CC2=CC(F)=CC=C2[C@H](C(C)C)[C@@]1(OC(=O)COC)CCN(C)CCCC1=NC2=CC=CC=C2N1 HBNPJJILLOYFJU-VMPREFPWSA-N 0.000 description 1
- 102100037805 Mitogen-activated protein kinase 7 Human genes 0.000 description 1
- LBPJJBJKHHBVBI-LQDZTQBFSA-N Mollin Chemical compound CC(=O)O[C@H]1[C@H](Oc2cc3oc(C)cc(=O)c3c(O)c2C)O[C@H](CO)[C@@H](O)[C@@H]1O LBPJJBJKHHBVBI-LQDZTQBFSA-N 0.000 description 1
- LBPJJBJKHHBVBI-UHFFFAOYSA-N Mollin Natural products CC(=O)OC1C(O)C(O)C(CO)OC1Oc2cc3OC(=CC(=O)c3c(O)c2C)C LBPJJBJKHHBVBI-UHFFFAOYSA-N 0.000 description 1
- 101100025404 Mus musculus Myh6 gene Proteins 0.000 description 1
- 101100364971 Mus musculus Scai gene Proteins 0.000 description 1
- 208000007379 Muscle Hypotonia Diseases 0.000 description 1
- 102100021148 Myocyte-specific enhancer factor 2A Human genes 0.000 description 1
- 102000005604 Myosin Heavy Chains Human genes 0.000 description 1
- 102100026925 Myosin regulatory light chain 2, ventricular/cardiac muscle isoform Human genes 0.000 description 1
- WGZDBVOTUVNQFP-UHFFFAOYSA-N N-(1-phthalazinylamino)carbamic acid ethyl ester Chemical compound C1=CC=C2C(NNC(=O)OCC)=NN=CC2=C1 WGZDBVOTUVNQFP-UHFFFAOYSA-N 0.000 description 1
- OVRNDRQMDRJTHS-CBQIKETKSA-N N-Acetyl-D-Galactosamine Chemical compound CC(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@H](O)[C@@H]1O OVRNDRQMDRJTHS-CBQIKETKSA-N 0.000 description 1
- MBLBDJOUHNCFQT-UHFFFAOYSA-N N-acetyl-D-galactosamine Natural products CC(=O)NC(C=O)C(O)C(O)C(O)CO MBLBDJOUHNCFQT-UHFFFAOYSA-N 0.000 description 1
- KEECCEWTUVWFCV-UHFFFAOYSA-N N-acetylprocainamide Chemical compound CCN(CC)CCNC(=O)C1=CC=C(NC(C)=O)C=C1 KEECCEWTUVWFCV-UHFFFAOYSA-N 0.000 description 1
- 229930182474 N-glycoside Natural products 0.000 description 1
- 229910002651 NO3 Inorganic materials 0.000 description 1
- 108091061960 Naked DNA Proteins 0.000 description 1
- 240000002853 Nelumbo nucifera Species 0.000 description 1
- 235000006508 Nelumbo nucifera Nutrition 0.000 description 1
- 235000006510 Nelumbo pentapetala Nutrition 0.000 description 1
- YSEXMKHXIOCEJA-FVFQAYNVSA-N Nicergoline Chemical compound C([C@@H]1C[C@]2([C@H](N(C)C1)CC=1C3=C2C=CC=C3N(C)C=1)OC)OC(=O)C1=CN=CC(Br)=C1 YSEXMKHXIOCEJA-FVFQAYNVSA-N 0.000 description 1
- KUEUWHJGRZKESU-UHFFFAOYSA-N Niceritrol Chemical compound C=1C=CN=CC=1C(=O)OCC(COC(=O)C=1C=NC=CC=1)(COC(=O)C=1C=NC=CC=1)COC(=O)C1=CC=CN=C1 KUEUWHJGRZKESU-UHFFFAOYSA-N 0.000 description 1
- VRAHPESAMYMDQI-UHFFFAOYSA-N Nicomol Chemical compound C1CCC(COC(=O)C=2C=NC=CC=2)(COC(=O)C=2C=NC=CC=2)C(O)C1(COC(=O)C=1C=NC=CC=1)COC(=O)C1=CC=CN=C1 VRAHPESAMYMDQI-UHFFFAOYSA-N 0.000 description 1
- FAIIFDPAEUKBEP-UHFFFAOYSA-N Nilvadipine Chemical compound COC(=O)C1=C(C#N)NC(C)=C(C(=O)OC(C)C)C1C1=CC=CC([N+]([O-])=O)=C1 FAIIFDPAEUKBEP-UHFFFAOYSA-N 0.000 description 1
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 1
- 101000642171 Odontomachus monticola U-poneritoxin(01)-Om2a Proteins 0.000 description 1
- AHLPHDHHMVZTML-UHFFFAOYSA-N Orn-delta-NH2 Natural products NCCCC(N)C(O)=O AHLPHDHHMVZTML-UHFFFAOYSA-N 0.000 description 1
- UTJLXEIPEHZYQJ-UHFFFAOYSA-N Ornithine Natural products OC(=O)C(C)CCCN UTJLXEIPEHZYQJ-UHFFFAOYSA-N 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- LPMXVESGRSUGHW-GHYGWZAOSA-N Ouabain Natural products O([C@@H]1[C@@H](O)[C@@H](O)[C@@H](O)[C@H](C)O1)[C@H]1C[C@@H](O)[C@@]2(CO)[C@@](O)(C1)CC[C@H]1[C@]3(O)[C@@](C)([C@H](C4=CC(=O)OC4)CC3)C[C@@H](O)[C@H]21 LPMXVESGRSUGHW-GHYGWZAOSA-N 0.000 description 1
- DJWYOLJPSHDSAL-UHFFFAOYSA-N Pantethine Natural products OCC(C)(C)C(O)C(=O)NCCC(=O)NCCSSCCNC(=O)CCNC(=O)C(O)C(C)(C)CO DJWYOLJPSHDSAL-UHFFFAOYSA-N 0.000 description 1
- 206010033698 Papillary muscle rupture Diseases 0.000 description 1
- DPWPWRLQFGFJFI-UHFFFAOYSA-N Pargyline Chemical compound C#CCN(C)CC1=CC=CC=C1 DPWPWRLQFGFJFI-UHFFFAOYSA-N 0.000 description 1
- 229920002230 Pectic acid Polymers 0.000 description 1
- TZRXHJWUDPFEEY-UHFFFAOYSA-N Pentaerythritol Tetranitrate Chemical compound [O-][N+](=O)OCC(CO[N+]([O-])=O)(CO[N+]([O-])=O)CO[N+]([O-])=O TZRXHJWUDPFEEY-UHFFFAOYSA-N 0.000 description 1
- 239000000026 Pentaerythritol tetranitrate Substances 0.000 description 1
- 229940099471 Phosphodiesterase inhibitor Drugs 0.000 description 1
- 241000709664 Picornaviridae Species 0.000 description 1
- UJEWTUDSLQGTOA-UHFFFAOYSA-N Piretanide Chemical compound C=1C=CC=CC=1OC=1C(S(=O)(=O)N)=CC(C(O)=O)=CC=1N1CCCC1 UJEWTUDSLQGTOA-UHFFFAOYSA-N 0.000 description 1
- 108010010336 Platelet Membrane Glycoproteins Proteins 0.000 description 1
- 102000015795 Platelet Membrane Glycoproteins Human genes 0.000 description 1
- 208000000474 Poliomyelitis Diseases 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 108010039918 Polylysine Proteins 0.000 description 1
- 241001505332 Polyomavirus sp. Species 0.000 description 1
- CYLWJCABXYDINA-UHFFFAOYSA-N Polythiazide Polymers ClC1=C(S(N)(=O)=O)C=C2S(=O)(=O)N(C)C(CSCC(F)(F)F)NC2=C1 CYLWJCABXYDINA-UHFFFAOYSA-N 0.000 description 1
- TUZYXOIXSAXUGO-UHFFFAOYSA-N Pravastatin Natural products C1=CC(C)C(CCC(O)CC(O)CC(O)=O)C2C(OC(=O)C(C)CC)CC(O)C=C21 TUZYXOIXSAXUGO-UHFFFAOYSA-N 0.000 description 1
- ADUKCCWBEDSMEB-NSHDSACASA-N Prenalterol Chemical compound CC(C)NC[C@H](O)COC1=CC=C(O)C=C1 ADUKCCWBEDSMEB-NSHDSACASA-N 0.000 description 1
- 206010036790 Productive cough Diseases 0.000 description 1
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 1
- 108010043005 Prolyl Hydroxylases Proteins 0.000 description 1
- 102000004079 Prolyl Hydroxylases Human genes 0.000 description 1
- MYEJFUXQJGHEQK-ALRJYLEOSA-N Proscillaridin Chemical compound O[C@@H]1[C@H](O)[C@@H](O)[C@H](C)O[C@H]1O[C@@H]1C=C2CC[C@H]3[C@@]4(O)CC[C@H](C5=COC(=O)C=C5)[C@@]4(C)CC[C@@H]3[C@@]2(C)CC1 MYEJFUXQJGHEQK-ALRJYLEOSA-N 0.000 description 1
- 108010007568 Protamines Proteins 0.000 description 1
- 102000007327 Protamines Human genes 0.000 description 1
- 102000001253 Protein Kinase Human genes 0.000 description 1
- 101710188315 Protein X Proteins 0.000 description 1
- 102100030486 Proteolipid protein 2 Human genes 0.000 description 1
- 229930189630 Protoveratrine Natural products 0.000 description 1
- HYTGGNIMZXFORS-MGYKWWNKSA-N Protoveratrine A Chemical compound O1[C@@]([C@H](CC[C@]23C)OC(=O)[C@@](C)(O)CC)(O)[C@H]3[C@@H](OC(C)=O)[C@@H](OC(C)=O)[C@@H]3[C@@]12C[C@H]1[C@H](CN2[C@@H](CC[C@H](C)C2)[C@@]2(C)O)[C@@H]2[C@@H](O)[C@H](OC(=O)[C@H](C)CC)[C@@]31O HYTGGNIMZXFORS-MGYKWWNKSA-N 0.000 description 1
- 206010037213 Psychomotor retardation Diseases 0.000 description 1
- 101710185720 Putative ethidium bromide resistance protein Proteins 0.000 description 1
- YEKQSSHBERGOJK-UHFFFAOYSA-N Pyricarbate Chemical compound CNC(=O)OCC1=CC=CC(COC(=O)NC)=N1 YEKQSSHBERGOJK-UHFFFAOYSA-N 0.000 description 1
- IWYDHOAUDWTVEP-UHFFFAOYSA-N R-2-phenyl-2-hydroxyacetic acid Natural products OC(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-N 0.000 description 1
- 102000009572 RNA Polymerase II Human genes 0.000 description 1
- 108010009460 RNA Polymerase II Proteins 0.000 description 1
- 238000002123 RNA extraction Methods 0.000 description 1
- 108010092799 RNA-directed DNA polymerase Proteins 0.000 description 1
- 108020004511 Recombinant DNA Proteins 0.000 description 1
- 208000004531 Renal Artery Obstruction Diseases 0.000 description 1
- 206010038378 Renal artery stenosis Diseases 0.000 description 1
- 108700008625 Reporter Genes Proteins 0.000 description 1
- 108010034634 Repressor Proteins Proteins 0.000 description 1
- 102000009661 Repressor Proteins Human genes 0.000 description 1
- 240000000528 Ricinus communis Species 0.000 description 1
- 235000004443 Ricinus communis Nutrition 0.000 description 1
- CQXADFVORZEARL-UHFFFAOYSA-N Rilmenidine Chemical compound C1CC1C(C1CC1)NC1=NCCO1 CQXADFVORZEARL-UHFFFAOYSA-N 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 241000714474 Rous sarcoma virus Species 0.000 description 1
- 229930187443 Scillaren Natural products 0.000 description 1
- 229920002684 Sepharose Polymers 0.000 description 1
- 102000007365 Sialoglycoproteins Human genes 0.000 description 1
- 108010032838 Sialoglycoproteins Proteins 0.000 description 1
- JLRNKCZRCMIVKA-UHFFFAOYSA-N Simfibrate Chemical compound C=1C=C(Cl)C=CC=1OC(C)(C)C(=O)OCCCOC(=O)C(C)(C)OC1=CC=C(Cl)C=C1 JLRNKCZRCMIVKA-UHFFFAOYSA-N 0.000 description 1
- 108010053551 Sp1 Transcription Factor Proteins 0.000 description 1
- 108010090804 Streptavidin Proteins 0.000 description 1
- 244000166550 Strophanthus gratus Species 0.000 description 1
- CPFNIKYEDJFRAT-UHFFFAOYSA-N Strospasid Natural products OC1C(OC)C(O)C(C)OC1OC1CC(CCC2C3(CC(O)C(C3(C)CCC32)C=2COC(=O)C=2)O)C3(C)CC1 CPFNIKYEDJFRAT-UHFFFAOYSA-N 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 206010042434 Sudden death Diseases 0.000 description 1
- ZCDNRPPFBQDQHR-SSYATKPKSA-N Syrosingopine Chemical compound C1=C(OC)C(OC(=O)OCC)=C(OC)C=C1C(=O)O[C@H]1[C@H](OC)[C@@H](C(=O)OC)[C@H]2C[C@@H]3C(NC=4C5=CC=C(OC)C=4)=C5CCN3C[C@H]2C1 ZCDNRPPFBQDQHR-SSYATKPKSA-N 0.000 description 1
- 102100024755 T-box transcription factor TBX5 Human genes 0.000 description 1
- 101710167708 T-box transcription factor TBX5 Proteins 0.000 description 1
- 229920002253 Tannate Polymers 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- 101001081186 Tetrahymena pyriformis High mobility group protein Proteins 0.000 description 1
- 229910052776 Thorium Inorganic materials 0.000 description 1
- 208000007536 Thrombosis Diseases 0.000 description 1
- 102000006601 Thymidine Kinase Human genes 0.000 description 1
- 108020004440 Thymidine kinase Proteins 0.000 description 1
- HXWJFEZDFPRLBG-UHFFFAOYSA-N Timnodonic acid Natural products CCCC=CC=CCC=CCC=CCC=CCCCC(O)=O HXWJFEZDFPRLBG-UHFFFAOYSA-N 0.000 description 1
- NGBFQHCMQULJNZ-UHFFFAOYSA-N Torsemide Chemical compound CC(C)NC(=O)NS(=O)(=O)C1=CN=CC=C1NC1=CC=CC(C)=C1 NGBFQHCMQULJNZ-UHFFFAOYSA-N 0.000 description 1
- GYDJEQRTZSCIOI-UHFFFAOYSA-N Tranexamic acid Chemical compound NCC1CCC(C(O)=O)CC1 GYDJEQRTZSCIOI-UHFFFAOYSA-N 0.000 description 1
- 102100030249 Transcription factor SOX-18 Human genes 0.000 description 1
- 102100030246 Transcription factor Sp1 Human genes 0.000 description 1
- 101710195626 Transcriptional activator protein Proteins 0.000 description 1
- 102100029898 Transcriptional enhancer factor TEF-1 Human genes 0.000 description 1
- 102000004338 Transferrin Human genes 0.000 description 1
- 108090000901 Transferrin Proteins 0.000 description 1
- 102100031016 Transgelin-2 Human genes 0.000 description 1
- GSNOZLZNQMLSKJ-UHFFFAOYSA-N Trapidil Chemical compound CCN(CC)C1=CC(C)=NC2=NC=NN12 GSNOZLZNQMLSKJ-UHFFFAOYSA-N 0.000 description 1
- 206010044565 Tremor Diseases 0.000 description 1
- UHWVSEOVJBQKBE-UHFFFAOYSA-N Trimetazidine Chemical compound COC1=C(OC)C(OC)=CC=C1CN1CCNCC1 UHWVSEOVJBQKBE-UHFFFAOYSA-N 0.000 description 1
- 241000209140 Triticum Species 0.000 description 1
- 235000021307 Triticum Nutrition 0.000 description 1
- 101000987816 Triticum aestivum 16.9 kDa class I heat shock protein 1 Proteins 0.000 description 1
- 102000004903 Troponin Human genes 0.000 description 1
- 108090001027 Troponin Proteins 0.000 description 1
- GLNADSQYFUSGOU-GPTZEZBUSA-J Trypan blue Chemical compound [Na+].[Na+].[Na+].[Na+].C1=C(S([O-])(=O)=O)C=C2C=C(S([O-])(=O)=O)C(/N=N/C3=CC=C(C=C3C)C=3C=C(C(=CC=3)\N=N\C=3C(=CC4=CC(=CC(N)=C4C=3O)S([O-])(=O)=O)S([O-])(=O)=O)C)=C(O)C2=C1N GLNADSQYFUSGOU-GPTZEZBUSA-J 0.000 description 1
- 102100039094 Tyrosinase Human genes 0.000 description 1
- 108060008724 Tyrosinase Proteins 0.000 description 1
- CKNOLMVLQUPVMU-UHFFFAOYSA-N UNPD183315 Natural products O1C(C)C(OC2C(C(O)C(O)C(CO)O2)O)C(OC)C(O)C1OC(C1)CCC2(C)C1CCC(C1(CC3O)O)C2CCC1(C)C3C1=CC(=O)OC1 CKNOLMVLQUPVMU-UHFFFAOYSA-N 0.000 description 1
- ICMGLRUYEQNHPF-UHFFFAOYSA-N Uraprene Chemical compound COC1=CC=CC=C1N1CCN(CCCNC=2N(C(=O)N(C)C(=O)C=2)C)CC1 ICMGLRUYEQNHPF-UHFFFAOYSA-N 0.000 description 1
- 241000700618 Vaccinia virus Species 0.000 description 1
- 108010051583 Ventricular Myosins Proteins 0.000 description 1
- 240000001417 Vigna umbellata Species 0.000 description 1
- 235000011453 Vigna umbellata Nutrition 0.000 description 1
- 108010003533 Viral Envelope Proteins Proteins 0.000 description 1
- 108010067390 Viral Proteins Proteins 0.000 description 1
- GVBNSPFBYXGREE-CXWAGAITSA-N Visnadin Chemical compound C1=CC(=O)OC2=C1C=CC1=C2[C@@H](OC(C)=O)[C@@H](OC(=O)[C@H](C)CC)C(C)(C)O1 GVBNSPFBYXGREE-CXWAGAITSA-N 0.000 description 1
- GVBNSPFBYXGREE-UHFFFAOYSA-N Visnadine Natural products C1=CC(=O)OC2=C1C=CC1=C2C(OC(C)=O)C(OC(=O)C(C)CC)C(C)(C)O1 GVBNSPFBYXGREE-UHFFFAOYSA-N 0.000 description 1
- BLGXFZZNTVWLAY-CCZXDCJGSA-N Yohimbine Natural products C1=CC=C2C(CCN3C[C@@H]4CC[C@@H](O)[C@H]([C@H]4C[C@H]33)C(=O)OC)=C3NC2=C1 BLGXFZZNTVWLAY-CCZXDCJGSA-N 0.000 description 1
- 102100020996 Zinc finger protein ZFPM2 Human genes 0.000 description 1
- 108091007916 Zinc finger transcription factors Proteins 0.000 description 1
- 102000038627 Zinc finger transcription factors Human genes 0.000 description 1
- OEXHQOGQTVQTAT-BZQJJPTISA-N [(1s,5r)-8-methyl-8-propan-2-yl-8-azoniabicyclo[3.2.1]octan-3-yl] 3-hydroxy-2-phenylpropanoate Chemical compound C([C@H]1CC[C@@H](C2)[N+]1(C)C(C)C)C2OC(=O)C(CO)C1=CC=CC=C1 OEXHQOGQTVQTAT-BZQJJPTISA-N 0.000 description 1
- YFGQJKBUXPKSAW-ZUDKKNPISA-N [(2r,3r,4s)-6-[(2r,3s,4s)-4-hydroxy-6-[(2r,3s,4s)-4-hydroxy-6-[[(3s,9s,10s,13r,17r)-14-hydroxy-10,13-dimethyl-17-(5-oxo-2h-furan-3-yl)-1,2,3,4,5,6,7,8,9,11,12,15,16,17-tetradecahydrocyclopenta[a]phenanthren-3-yl]oxy]-2-methyloxan-3-yl]oxy-2-methyloxan-3-y Chemical compound O([C@H]1[C@@H](OC(C)=O)CC(O[C@@H]1C)O[C@H]1[C@@H](O)CC(O[C@@H]1C)O[C@H]1[C@@H](O)CC(O[C@@H]1C)O[C@@H]1CC2[C@]([C@@H]3C(C4(CC[C@@H]([C@@]4(C)CC3)C=3COC(=O)C=3)O)CC2)(C)CC1)C1O[C@@H](CO)[C@H](O)[C@@H](O)[C@@H]1O YFGQJKBUXPKSAW-ZUDKKNPISA-N 0.000 description 1
- SRHWTZAMPFLHAX-WDZFZDKYSA-N [(z)-1-pyridin-4-ylethylideneamino]thiourea Chemical compound NC(=S)N/N=C(/C)C1=CC=NC=C1 SRHWTZAMPFLHAX-WDZFZDKYSA-N 0.000 description 1
- YOKPRDAUBGOISU-UHFFFAOYSA-N [1-(3-methylbutoxy)-3-morpholin-4-ylpropan-2-yl] 3,4,5-trimethoxybenzoate Chemical compound COC1=C(OC)C(OC)=CC(C(=O)OC(COCCC(C)C)CN2CCOCC2)=C1 YOKPRDAUBGOISU-UHFFFAOYSA-N 0.000 description 1
- HNOMCFWTCNOVHP-UHFFFAOYSA-M [3-[(3-carboxy-2,2,3-trimethylcyclopentanecarbonyl)amino]-2-methoxypropyl]mercury(1+) hydroxide Chemical compound COC(CNC(=O)C1CCC(C)(C(O)=O)C1(C)C)C[Hg]O HNOMCFWTCNOVHP-UHFFFAOYSA-M 0.000 description 1
- OUHCZCFQVONTOC-UHFFFAOYSA-N [3-acetyloxy-2,2-bis(acetyloxymethyl)propyl] acetate Chemical compound CC(=O)OCC(COC(C)=O)(COC(C)=O)COC(C)=O OUHCZCFQVONTOC-UHFFFAOYSA-N 0.000 description 1
- GRALFSQRIBJAHX-UHFFFAOYSA-N [4-(diethylamino)-3-methylbutan-2-yl] 4-(2-methylpropoxy)benzoate Chemical compound CCN(CC)CC(C)C(C)OC(=O)C1=CC=C(OCC(C)C)C=C1 GRALFSQRIBJAHX-UHFFFAOYSA-N 0.000 description 1
- 229960000446 abciximab Drugs 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 230000005856 abnormality Effects 0.000 description 1
- 239000003070 absorption delaying agent Substances 0.000 description 1
- 229960002122 acebutolol Drugs 0.000 description 1
- 229950005879 acecainide Drugs 0.000 description 1
- 229950003769 acefylline Drugs 0.000 description 1
- 229960002054 acenocoumarol Drugs 0.000 description 1
- VABCILAOYCMVPS-UHFFFAOYSA-N acenocoumarol Chemical compound OC=1C2=CC=CC=C2OC(=O)C=1C(CC(=O)C)C1=CC=C([N+]([O-])=O)C=C1 VABCILAOYCMVPS-UHFFFAOYSA-N 0.000 description 1
- BZKPWHYZMXOIDC-UHFFFAOYSA-N acetazolamide Chemical compound CC(=O)NC1=NN=C(S(N)(=O)=O)S1 BZKPWHYZMXOIDC-UHFFFAOYSA-N 0.000 description 1
- 229960000571 acetazolamide Drugs 0.000 description 1
- 235000011054 acetic acid Nutrition 0.000 description 1
- 230000021736 acetylation Effects 0.000 description 1
- 238000006640 acetylation reaction Methods 0.000 description 1
- 229960003304 acetyldigoxin Drugs 0.000 description 1
- HWKJSYYYURVNQU-DXJNJSHLSA-N acetyldigoxin Chemical compound C1[C@H](OC(C)=O)[C@H](O)[C@@H](C)O[C@H]1O[C@@H]1[C@@H](C)O[C@@H](O[C@@H]2[C@H](O[C@@H](O[C@@H]3C[C@@H]4[C@]([C@@H]5[C@H]([C@]6(CC[C@@H]([C@@]6(C)[C@H](O)C5)C=5COC(=O)C=5)O)CC4)(C)CC3)C[C@@H]2O)C)C[C@@H]1O HWKJSYYYURVNQU-DXJNJSHLSA-N 0.000 description 1
- DFDGRKNOFOJBAJ-UHFFFAOYSA-N acifran Chemical compound C=1C=CC=CC=1C1(C)OC(C(O)=O)=CC1=O DFDGRKNOFOJBAJ-UHFFFAOYSA-N 0.000 description 1
- 229950000146 acifran Drugs 0.000 description 1
- 229940099983 activase Drugs 0.000 description 1
- 239000012190 activator Substances 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 230000008649 adaptation response Effects 0.000 description 1
- OIRDTQYFTABQOQ-KQYNXXCUSA-N adenosine Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O OIRDTQYFTABQOQ-KQYNXXCUSA-N 0.000 description 1
- 208000011589 adenoviridae infectious disease Diseases 0.000 description 1
- 230000001464 adherent effect Effects 0.000 description 1
- GRTOGORTSDXSFK-XJTZBENFSA-N ajmalicine Chemical compound C1=CC=C2C(CCN3C[C@@H]4[C@H](C)OC=C([C@H]4C[C@H]33)C(=O)OC)=C3NC2=C1 GRTOGORTSDXSFK-XJTZBENFSA-N 0.000 description 1
- NDAUXUAQIAJITI-UHFFFAOYSA-N albuterol Chemical compound CC(C)(C)NCC(O)C1=CC=C(O)C(CO)=C1 NDAUXUAQIAJITI-UHFFFAOYSA-N 0.000 description 1
- 239000002170 aldosterone antagonist Substances 0.000 description 1
- 229940083712 aldosterone antagonist Drugs 0.000 description 1
- WNMJYKCGWZFFKR-UHFFFAOYSA-N alfuzosin Chemical compound N=1C(N)=C2C=C(OC)C(OC)=CC2=NC=1N(C)CCCNC(=O)C1CCCO1 WNMJYKCGWZFFKR-UHFFFAOYSA-N 0.000 description 1
- 229960004607 alfuzosin Drugs 0.000 description 1
- 208000026935 allergic disease Diseases 0.000 description 1
- 108010029483 alpha 1 Chain Collagen Type I Proteins 0.000 description 1
- MGVYFNHJWXJYBE-UHFFFAOYSA-N alpha-Acetyl-digoxin Natural products CC1OC(CC(O)C1O)OC2C(O)CC(OC3C(C)OC(CC3OC(=O)C)OC4CCC5(C)C(CCC6C5CCC7(C)C(C(O)CC67O)C8=CC(=O)OC8)C4)OC2C MGVYFNHJWXJYBE-UHFFFAOYSA-N 0.000 description 1
- 102000013640 alpha-Crystallin B Chain Human genes 0.000 description 1
- 108010051585 alpha-Crystallin B Chain Proteins 0.000 description 1
- CJCSPKMFHVPWAR-JTQLQIEISA-N alpha-methyl-L-dopa Chemical compound OC(=O)[C@](N)(C)CC1=CC=C(O)C(O)=C1 CJCSPKMFHVPWAR-JTQLQIEISA-N 0.000 description 1
- 229950007522 altizide Drugs 0.000 description 1
- XSDQTOBWRPYKKA-UHFFFAOYSA-N amiloride Chemical compound NC(=N)NC(=O)C1=NC(Cl)=C(N)N=C1N XSDQTOBWRPYKKA-UHFFFAOYSA-N 0.000 description 1
- 229960002576 amiloride Drugs 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- NGXUUAFYUCOICP-UHFFFAOYSA-N aminometradine Chemical compound CCN1C(=O)C=C(N)N(CC=C)C1=O NGXUUAFYUCOICP-UHFFFAOYSA-N 0.000 description 1
- 229960001887 aminometradine Drugs 0.000 description 1
- 229950011175 aminopicoline Drugs 0.000 description 1
- 229950009931 aminoxytriphene Drugs 0.000 description 1
- FRQGJOFRWIILCX-UHFFFAOYSA-N aminoxytriphene Chemical compound C1=CC(OC)=CC=C1C(CN(C)C)=C(C=1C=CC(OC)=CC=1)C1=CC=C(OC)C=C1 FRQGJOFRWIILCX-UHFFFAOYSA-N 0.000 description 1
- 229960005260 amiodarone Drugs 0.000 description 1
- FXNYSZHYMGWWEZ-UHFFFAOYSA-N amisometradine Chemical compound CC(=C)CN1C(N)=CC(=O)N(C)C1=O FXNYSZHYMGWWEZ-UHFFFAOYSA-N 0.000 description 1
- 229950008305 amisometradine Drugs 0.000 description 1
- 229960000528 amlodipine Drugs 0.000 description 1
- HTIQEAQVCYTUBX-UHFFFAOYSA-N amlodipine Chemical compound CCOC(=O)C1=C(COCCN)NC(C)=C(C(=O)OC)C1C1=CC=CC=C1Cl HTIQEAQVCYTUBX-UHFFFAOYSA-N 0.000 description 1
- 239000000908 ammonium hydroxide Substances 0.000 description 1
- BFNBIHQBYMNNAN-UHFFFAOYSA-N ammonium sulfate Chemical compound N.N.OS(O)(=O)=O BFNBIHQBYMNNAN-UHFFFAOYSA-N 0.000 description 1
- 229910052921 ammonium sulfate Inorganic materials 0.000 description 1
- 235000011130 ammonium sulphate Nutrition 0.000 description 1
- 229960003173 amoproxan Drugs 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- HSNWZBCBUUSSQD-UHFFFAOYSA-N amyl nitrate Chemical compound CCCCCO[N+]([O-])=O HSNWZBCBUUSSQD-UHFFFAOYSA-N 0.000 description 1
- 230000037005 anaesthesia Effects 0.000 description 1
- OTBXOEAOVRKTNQ-UHFFFAOYSA-N anagrelide Chemical compound N1=C2NC(=O)CN2CC2=C(Cl)C(Cl)=CC=C21 OTBXOEAOVRKTNQ-UHFFFAOYSA-N 0.000 description 1
- 229960001694 anagrelide Drugs 0.000 description 1
- 229960004233 ancrod Drugs 0.000 description 1
- 239000002369 angiotensin antagonist Substances 0.000 description 1
- 229940125364 angiotensin receptor blocker Drugs 0.000 description 1
- JYPVVOOBQVVUQV-CGHBYZBKSA-N angiotensinamide Chemical compound C([C@H](NC(=O)[C@@H](NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@@H](N)CC(N)=O)C(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1N=CNC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC=1C=CC=CC=1)C(O)=O)C1=CC=C(O)C=C1 JYPVVOOBQVVUQV-CGHBYZBKSA-N 0.000 description 1
- 229960001119 angiotensinamide Drugs 0.000 description 1
- 210000004102 animal cell Anatomy 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 229960002138 anisindione Drugs 0.000 description 1
- XRCFXMGQEVUZFC-UHFFFAOYSA-N anisindione Chemical compound C1=CC(OC)=CC=C1C1C(=O)C2=CC=CC=C2C1=O XRCFXMGQEVUZFC-UHFFFAOYSA-N 0.000 description 1
- 229960000983 anistreplase Drugs 0.000 description 1
- 230000000844 anti-bacterial effect Effects 0.000 description 1
- 230000000843 anti-fungal effect Effects 0.000 description 1
- 239000000427 antigen Substances 0.000 description 1
- 108091007433 antigens Proteins 0.000 description 1
- 102000036639 antigens Human genes 0.000 description 1
- 229940127217 antithrombotic drug Drugs 0.000 description 1
- 210000002376 aorta thoracic Anatomy 0.000 description 1
- 229960004957 aprindine Drugs 0.000 description 1
- NZLBHDRPUJLHCE-UHFFFAOYSA-N aprindine Chemical compound C1C2=CC=CC=C2CC1N(CCCN(CC)CC)C1=CC=CC=C1 NZLBHDRPUJLHCE-UHFFFAOYSA-N 0.000 description 1
- 229960000271 arbutin Drugs 0.000 description 1
- KXNPVXPOPUZYGB-XYVMCAHJSA-N argatroban Chemical compound OC(=O)[C@H]1C[C@H](C)CCN1C(=O)[C@H](CCCN=C(N)N)NS(=O)(=O)C1=CC=CC2=C1NC[C@H](C)C2 KXNPVXPOPUZYGB-XYVMCAHJSA-N 0.000 description 1
- 229960003856 argatroban Drugs 0.000 description 1
- 125000000637 arginyl group Chemical group N[C@@H](CCCNC(N)=N)C(=O)* 0.000 description 1
- 150000003975 aryl alkyl amines Chemical class 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- METKIMKYRPQLGS-UHFFFAOYSA-N atenolol Chemical compound CC(C)NCC(O)COC1=CC=C(CC(N)=O)C=C1 METKIMKYRPQLGS-UHFFFAOYSA-N 0.000 description 1
- 229950009336 azamethonium bromide Drugs 0.000 description 1
- YEESUBCSWGVPCE-UHFFFAOYSA-N azanylidyneoxidanium iron(2+) pentacyanide Chemical compound [Fe++].[C-]#N.[C-]#N.[C-]#N.[C-]#N.[C-]#N.N#[O+] YEESUBCSWGVPCE-UHFFFAOYSA-N 0.000 description 1
- IIOPLILENRZKRV-UHFFFAOYSA-N azosemide Chemical compound C=1C=CSC=1CNC=1C=C(Cl)C(S(=O)(=O)N)=CC=1C1=NN=N[N]1 IIOPLILENRZKRV-UHFFFAOYSA-N 0.000 description 1
- 229960004988 azosemide Drugs 0.000 description 1
- 229960003060 bambuterol Drugs 0.000 description 1
- ANZXOIAKUNOVQU-UHFFFAOYSA-N bambuterol Chemical compound CN(C)C(=O)OC1=CC(OC(=O)N(C)C)=CC(C(O)CNC(C)(C)C)=C1 ANZXOIAKUNOVQU-UHFFFAOYSA-N 0.000 description 1
- 239000011324 bead Substances 0.000 description 1
- YWQGBCXVCXMSLJ-UHFFFAOYSA-N beclobrate Chemical compound C1=CC(OC(C)(CC)C(=O)OCC)=CC=C1CC1=CC=C(Cl)C=C1 YWQGBCXVCXMSLJ-UHFFFAOYSA-N 0.000 description 1
- 229950009252 beclobrate Drugs 0.000 description 1
- 229960000945 bencyclane Drugs 0.000 description 1
- FYJJXENSONZJRG-UHFFFAOYSA-N bencyclane Chemical compound C=1C=CC=CC=1CC1(OCCCN(C)C)CCCCCC1 FYJJXENSONZJRG-UHFFFAOYSA-N 0.000 description 1
- 229950000900 bendazol Drugs 0.000 description 1
- YTLQFZVCLXFFRK-UHFFFAOYSA-N bendazol Chemical compound N=1C2=CC=CC=C2NC=1CC1=CC=CC=C1 YTLQFZVCLXFFRK-UHFFFAOYSA-N 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 229960001264 benfluorex Drugs 0.000 description 1
- 229950010443 benfurodil hemisuccinate Drugs 0.000 description 1
- 229950008586 benzalamide Drugs 0.000 description 1
- 229960004411 benziodarone Drugs 0.000 description 1
- CZCHIEJNWPNBDE-UHFFFAOYSA-N benziodarone Chemical compound CCC=1OC2=CC=CC=C2C=1C(=O)C1=CC(I)=C(O)C(I)=C1 CZCHIEJNWPNBDE-UHFFFAOYSA-N 0.000 description 1
- BLFLLBZGZJTVJG-UHFFFAOYSA-N benzocaine Chemical compound CCOC(=O)C1=CC=C(N)C=C1 BLFLLBZGZJTVJG-UHFFFAOYSA-N 0.000 description 1
- CJAVTWRYCDNHSM-UHFFFAOYSA-N benzoic acid 2-[1-[3-(trifluoromethyl)phenyl]propan-2-ylamino]ethyl ester Chemical compound C=1C=CC=CC=1C(=O)OCCNC(C)CC1=CC=CC(C(F)(F)F)=C1 CJAVTWRYCDNHSM-UHFFFAOYSA-N 0.000 description 1
- 229950007003 benzylhydrochlorothiazide Drugs 0.000 description 1
- 229940076810 beta sitosterol Drugs 0.000 description 1
- MSWZFWKMSRAUBD-UHFFFAOYSA-N beta-D-galactosamine Natural products NC1C(O)OC(CO)C(O)C1O MSWZFWKMSRAUBD-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- LGJMUZUPVCAVPU-UHFFFAOYSA-N beta-Sitostanol Natural products C1CC2CC(O)CCC2(C)C2C1C1CCC(C(C)CCC(CC)C(C)C)C1(C)CC2 LGJMUZUPVCAVPU-UHFFFAOYSA-N 0.000 description 1
- BLGXFZZNTVWLAY-UHFFFAOYSA-N beta-Yohimbin Natural products C1=CC=C2C(CCN3CC4CCC(O)C(C4CC33)C(=O)OC)=C3NC2=C1 BLGXFZZNTVWLAY-UHFFFAOYSA-N 0.000 description 1
- NJKOMDUNNDKEAI-UHFFFAOYSA-N beta-sitosterol Natural products CCC(CCC(C)C1CCC2(C)C3CC=C4CC(O)CCC4C3CCC12C)C(C)C NJKOMDUNNDKEAI-UHFFFAOYSA-N 0.000 description 1
- 239000003012 bilayer membrane Substances 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 229950004495 binifibrate Drugs 0.000 description 1
- BFYRHDVAEJIBON-UHFFFAOYSA-N binifibrate Chemical compound C=1C=CN=CC=1C(=O)OCC(COC(=O)C=1C=NC=CC=1)OC(=O)C(C)(C)OC1=CC=C(Cl)C=C1 BFYRHDVAEJIBON-UHFFFAOYSA-N 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 229960002685 biotin Drugs 0.000 description 1
- 235000020958 biotin Nutrition 0.000 description 1
- 239000011616 biotin Substances 0.000 description 1
- OIRCOABEOLEUMC-GEJPAHFPSA-N bivalirudin Chemical compound C([C@@H](C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CC(C)C)C(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@H](CC(N)=O)NC(=O)CNC(=O)CNC(=O)CNC(=O)CNC(=O)[C@H]1N(CCC1)C(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 OIRCOABEOLEUMC-GEJPAHFPSA-N 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 230000036772 blood pressure Effects 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 210000004556 brain Anatomy 0.000 description 1
- 210000000481 breast Anatomy 0.000 description 1
- 229960004895 bretylium tosylate Drugs 0.000 description 1
- KVWNWTZZBKCOPM-UHFFFAOYSA-M bretylium tosylate Chemical compound CC1=CC=C(S([O-])(=O)=O)C=C1.CC[N+](C)(C)CC1=CC=CC=C1Br KVWNWTZZBKCOPM-UHFFFAOYSA-M 0.000 description 1
- 229940097683 brevibloc Drugs 0.000 description 1
- 206010006514 bruxism Diseases 0.000 description 1
- CIJVBYRUFLGDHY-UHFFFAOYSA-N bucumolol Chemical compound O1C(=O)C=CC2=C1C(OCC(O)CNC(C)(C)C)=CC=C2C CIJVBYRUFLGDHY-UHFFFAOYSA-N 0.000 description 1
- 229950002568 bucumolol Drugs 0.000 description 1
- RFIXURDMUINBMD-UHFFFAOYSA-N bufeniode Chemical compound C=1C(I)=C(O)C(I)=CC=1C(O)C(C)NC(C)CCC1=CC=CC=C1 RFIXURDMUINBMD-UHFFFAOYSA-N 0.000 description 1
- 229950003250 bufeniode Drugs 0.000 description 1
- ATLJNLYIJOCWJE-CWMZOUAVSA-N bufogenin Chemical compound C=1([C@H]2C[C@H]3O[C@@]43[C@H]3[C@@H]([C@]5(CC[C@H](O)C[C@H]5CC3)C)CC[C@@]42C)C=CC(=O)OC=1 ATLJNLYIJOCWJE-CWMZOUAVSA-N 0.000 description 1
- 229950006858 bufogenin Drugs 0.000 description 1
- 229950006886 bufuralol Drugs 0.000 description 1
- 229960004064 bumetanide Drugs 0.000 description 1
- MAEIEVLCKWDQJH-UHFFFAOYSA-N bumetanide Chemical compound CCCCNC1=CC(C(O)=O)=CC(S(N)(=O)=O)=C1OC1=CC=CC=C1 MAEIEVLCKWDQJH-UHFFFAOYSA-N 0.000 description 1
- 229960002467 bunazosin Drugs 0.000 description 1
- 229960000330 bupranolol Drugs 0.000 description 1
- HQIRNZOQPUAHHV-UHFFFAOYSA-N bupranolol Chemical compound CC1=CC=C(Cl)C(OCC(O)CNC(C)(C)C)=C1 HQIRNZOQPUAHHV-UHFFFAOYSA-N 0.000 description 1
- KHBXORBAOCQNMC-UHFFFAOYSA-N butan-2-yl-[2-hydroxy-2-(5,6,7,8-tetrahydronaphthalen-2-yl)ethyl]azanium;chloride Chemical compound [Cl-].C1CCCC2=CC(C(O)C[NH2+]C(C)CC)=CC=C21 KHBXORBAOCQNMC-UHFFFAOYSA-N 0.000 description 1
- HZIYHIRJHYIRQO-UHFFFAOYSA-N butazolamide Chemical compound CCCC(=O)NC1=NN=C(S(N)(=O)=O)S1 HZIYHIRJHYIRQO-UHFFFAOYSA-N 0.000 description 1
- 229950000426 butazolamide Drugs 0.000 description 1
- 229950003097 butidrine Drugs 0.000 description 1
- HGBFRHCDYZJRAO-UHFFFAOYSA-N butizide Chemical compound ClC1=C(S(N)(=O)=O)C=C2S(=O)(=O)NC(CC(C)C)NC2=C1 HGBFRHCDYZJRAO-UHFFFAOYSA-N 0.000 description 1
- 229950008955 butizide Drugs 0.000 description 1
- ZKSIPEYIAHUPNM-ZEQRLZLVSA-N butobendine Chemical compound C([C@H](CC)N(C)CCN(C)[C@@H](CC)COC(=O)C=1C=C(OC)C(OC)=C(OC)C=1)OC(=O)C1=CC(OC)=C(OC)C(OC)=C1 ZKSIPEYIAHUPNM-ZEQRLZLVSA-N 0.000 description 1
- 229950001141 butobendine Drugs 0.000 description 1
- 238000010804 cDNA synthesis Methods 0.000 description 1
- 229960005211 cadralazine Drugs 0.000 description 1
- AXCZMVOFGPJBDE-UHFFFAOYSA-L calcium dihydroxide Chemical compound [OH-].[OH-].[Ca+2] AXCZMVOFGPJBDE-UHFFFAOYSA-L 0.000 description 1
- 239000000920 calcium hydroxide Substances 0.000 description 1
- 229910001861 calcium hydroxide Inorganic materials 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 230000036952 cancer formation Effects 0.000 description 1
- 229960005057 canrenone Drugs 0.000 description 1
- UJVLDDZCTMKXJK-WNHSNXHDSA-N canrenone Chemical compound C([C@H]1[C@H]2[C@@H]([C@]3(CCC(=O)C=C3C=C2)C)CC[C@@]11C)C[C@@]11CCC(=O)O1 UJVLDDZCTMKXJK-WNHSNXHDSA-N 0.000 description 1
- 229950007443 capobenic acid Drugs 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 239000004202 carbamide Substances 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 229960001386 carbuterol Drugs 0.000 description 1
- KEMXXQOFIRIICG-UHFFFAOYSA-N carbuterol Chemical compound CC(C)(C)NCC(O)C1=CC=C(O)C(NC(N)=O)=C1 KEMXXQOFIRIICG-UHFFFAOYSA-N 0.000 description 1
- 231100000504 carcinogenesis Toxicity 0.000 description 1
- 230000003683 cardiac damage Effects 0.000 description 1
- 229940082638 cardiac stimulant phosphodiesterase inhibitors Drugs 0.000 description 1
- 230000001269 cardiogenic effect Effects 0.000 description 1
- 206010007625 cardiogenic shock Diseases 0.000 description 1
- 239000000496 cardiotonic agent Substances 0.000 description 1
- 229940072282 cardura Drugs 0.000 description 1
- 229960004203 carnitine Drugs 0.000 description 1
- 229940063628 catapres Drugs 0.000 description 1
- 238000005341 cation exchange Methods 0.000 description 1
- 230000020411 cell activation Effects 0.000 description 1
- 230000032823 cell division Effects 0.000 description 1
- 230000007910 cell fusion Effects 0.000 description 1
- 230000036978 cell physiology Effects 0.000 description 1
- 230000006041 cell recruitment Effects 0.000 description 1
- 239000006285 cell suspension Substances 0.000 description 1
- 230000003833 cell viability Effects 0.000 description 1
- 229940083181 centrally acting adntiadrenergic agent methyldopa Drugs 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 239000000919 ceramic Substances 0.000 description 1
- 230000002490 cerebral effect Effects 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 238000007385 chemical modification Methods 0.000 description 1
- 239000003638 chemical reducing agent Substances 0.000 description 1
- 210000000038 chest Anatomy 0.000 description 1
- IHJCXVZDYSXXFT-UHFFFAOYSA-N chloraminophenamide Chemical compound NC1=CC(Cl)=C(S(N)(=O)=O)C=C1S(N)(=O)=O IHJCXVZDYSXXFT-UHFFFAOYSA-N 0.000 description 1
- YRZQHIVOIFJEEE-UHFFFAOYSA-N chlorazanil Chemical compound NC1=NC=NC(NC=2C=CC(Cl)=CC=2)=N1 YRZQHIVOIFJEEE-UHFFFAOYSA-N 0.000 description 1
- 229950002325 chlorazanil Drugs 0.000 description 1
- IXWDUZLHWJKVPX-UHFFFAOYSA-N chlorisondamine Chemical compound ClC1=C(Cl)C(Cl)=C(Cl)C2=C1C[N+](CC[N+](C)(C)C)(C)C2 IXWDUZLHWJKVPX-UHFFFAOYSA-N 0.000 description 1
- 229950002565 chlorisondamine Drugs 0.000 description 1
- 229960004926 chlorobutanol Drugs 0.000 description 1
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 1
- 229940059329 chondroitin sulfate Drugs 0.000 description 1
- 210000003483 chromatin Anatomy 0.000 description 1
- 238000011210 chromatographic step Methods 0.000 description 1
- 230000002759 chromosomal effect Effects 0.000 description 1
- 210000000349 chromosome Anatomy 0.000 description 1
- 229960004757 cibenzoline Drugs 0.000 description 1
- LOUPRKONTZGTKE-UHFFFAOYSA-N cinchonine Natural products C1C(C(C2)C=C)CCN2C1C(O)C1=CC=NC2=CC=C(OC)C=C21 LOUPRKONTZGTKE-UHFFFAOYSA-N 0.000 description 1
- DERZBLKQOCDDDZ-JLHYYAGUSA-N cinnarizine Chemical compound C1CN(C(C=2C=CC=CC=2)C=2C=CC=CC=2)CCN1C\C=C\C1=CC=CC=C1 DERZBLKQOCDDDZ-JLHYYAGUSA-N 0.000 description 1
- 229960000876 cinnarizine Drugs 0.000 description 1
- 229960002174 ciprofibrate Drugs 0.000 description 1
- KPSRODZRAIWAKH-UHFFFAOYSA-N ciprofibrate Chemical compound C1=CC(OC(C)(C)C(O)=O)=CC=C1C1C(Cl)(Cl)C1 KPSRODZRAIWAKH-UHFFFAOYSA-N 0.000 description 1
- 235000020639 clam Nutrition 0.000 description 1
- 229960001117 clenbuterol Drugs 0.000 description 1
- STJMRWALKKWQGH-UHFFFAOYSA-N clenbuterol Chemical compound CC(C)(C)NCC(O)C1=CC(Cl)=C(N)C(Cl)=C1 STJMRWALKKWQGH-UHFFFAOYSA-N 0.000 description 1
- 229950003072 clinofibrate Drugs 0.000 description 1
- 229960002883 clofenamide Drugs 0.000 description 1
- 229960001214 clofibrate Drugs 0.000 description 1
- KNHUKKLJHYUCFP-UHFFFAOYSA-N clofibrate Chemical compound CCOC(=O)C(C)(C)OC1=CC=C(Cl)C=C1 KNHUKKLJHYUCFP-UHFFFAOYSA-N 0.000 description 1
- 229950008441 clofibric acid Drugs 0.000 description 1
- TXCGAZHTZHNUAI-UHFFFAOYSA-N clofibric acid Chemical compound OC(=O)C(C)(C)OC1=CC=C(Cl)C=C1 TXCGAZHTZHNUAI-UHFFFAOYSA-N 0.000 description 1
- 238000010367 cloning Methods 0.000 description 1
- 229950004347 clonitrate Drugs 0.000 description 1
- SUAJWTBTMNHVBZ-UHFFFAOYSA-N clonitrate Chemical compound [O-][N+](=O)OCC(CCl)O[N+]([O-])=O SUAJWTBTMNHVBZ-UHFFFAOYSA-N 0.000 description 1
- 229960004893 cloranolol Drugs 0.000 description 1
- XYCMOTOFHFTUIU-UHFFFAOYSA-N cloranolol Chemical compound CC(C)(C)NCC(O)COC1=CC(Cl)=CC=C1Cl XYCMOTOFHFTUIU-UHFFFAOYSA-N 0.000 description 1
- 229960005315 clorexolone Drugs 0.000 description 1
- 229960001261 cloridarol Drugs 0.000 description 1
- KBFBRIPYVVGWRS-UHFFFAOYSA-N cloridarol Chemical compound C=1C2=CC=CC=C2OC=1C(O)C1=CC=C(Cl)C=C1 KBFBRIPYVVGWRS-UHFFFAOYSA-N 0.000 description 1
- 229960001307 clorindione Drugs 0.000 description 1
- NJDUWAXIURWWLN-UHFFFAOYSA-N clorindione Chemical compound C1=CC(Cl)=CC=C1C1C(=O)C2=CC=CC=C2C1=O NJDUWAXIURWWLN-UHFFFAOYSA-N 0.000 description 1
- 239000007376 cm-medium Substances 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 229940097479 colestid Drugs 0.000 description 1
- 229920001436 collagen Polymers 0.000 description 1
- 238000004440 column chromatography Methods 0.000 description 1
- 230000002301 combined effect Effects 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 238000012790 confirmation Methods 0.000 description 1
- 208000028831 congenital heart disease Diseases 0.000 description 1
- 230000021615 conjugation Effects 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 230000008828 contractile function Effects 0.000 description 1
- 238000013270 controlled release Methods 0.000 description 1
- HULMNSIAKWANQO-JQKSAQOKSA-N convallatoxin Chemical compound O[C@@H]1[C@H](O)[C@@H](O)[C@H](C)O[C@H]1O[C@@H]1C[C@@]2(O)CC[C@H]3[C@@]4(O)CC[C@H](C=5COC(=O)C=5)[C@@]4(C)CC[C@@H]3[C@@]2(C=O)CC1 HULMNSIAKWANQO-JQKSAQOKSA-N 0.000 description 1
- 229940088540 cordarone Drugs 0.000 description 1
- 229940097488 corgard Drugs 0.000 description 1
- 208000029078 coronary artery disease Diseases 0.000 description 1
- 210000000877 corpus callosum Anatomy 0.000 description 1
- 230000001054 cortical effect Effects 0.000 description 1
- BUCJFFQZPGTGPX-UHFFFAOYSA-N coumetarol Chemical compound C1=CC=C2OC(=O)C(C(C=3C(OC4=CC=CC=C4C=3O)=O)COC)=C(O)C2=C1 BUCJFFQZPGTGPX-UHFFFAOYSA-N 0.000 description 1
- 229950001111 coumetarol Drugs 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 229940009995 cryptenamine Drugs 0.000 description 1
- 210000004748 cultured cell Anatomy 0.000 description 1
- 238000012258 culturing Methods 0.000 description 1
- ATDGTVJJHBUTRL-UHFFFAOYSA-N cyanogen bromide Chemical compound BrC#N ATDGTVJJHBUTRL-UHFFFAOYSA-N 0.000 description 1
- ZGFASEKBKWVCGP-UHFFFAOYSA-N cyclocoumarol Chemical compound C12=CC=CC=C2OC(=O)C2=C1OC(OC)(C)CC2C1=CC=CC=C1 ZGFASEKBKWVCGP-UHFFFAOYSA-N 0.000 description 1
- 229950002423 cyclocoumarol Drugs 0.000 description 1
- 229960003176 cyclothiazide Drugs 0.000 description 1
- BOCUKUHCLICSIY-QJWLJZLASA-N cyclothiazide Chemical compound C1=C(Cl)C(S(=O)(=O)N)=CC(S(N2)(=O)=O)=C1NC2C1[C@H](C=C2)C[C@H]2C1 BOCUKUHCLICSIY-QJWLJZLASA-N 0.000 description 1
- 230000000120 cytopathologic effect Effects 0.000 description 1
- 230000001086 cytosolic effect Effects 0.000 description 1
- 231100000135 cytotoxicity Toxicity 0.000 description 1
- 230000003013 cytotoxicity Effects 0.000 description 1
- DKRSEIPLAZTSFD-UHFFFAOYSA-N d-quinotoxine Natural products C12=CC(OC)=CC=C2N=CC=C1C(=O)CCC1CCNCC1C=C DKRSEIPLAZTSFD-UHFFFAOYSA-N 0.000 description 1
- 229950008150 daltroban Drugs 0.000 description 1
- RFWZESUMWJKKRN-UHFFFAOYSA-N dapiprazole Chemical compound CC1=CC=CC=C1N1CCN(CCC=2N3CCCCC3=NN=2)CC1 RFWZESUMWJKKRN-UHFFFAOYSA-N 0.000 description 1
- 229960002947 dapiprazole Drugs 0.000 description 1
- OBATZBGFDSVCJD-UHFFFAOYSA-N de-O-acetyl-lanatoside C Natural products CC1OC(OC2CC3C(C4C(C5(CCC(C5(C)C(O)C4)C=4COC(=O)C=4)O)CC3)(C)CC2)CC(O)C1OC(OC1C)CC(O)C1OC(OC1C)CC(O)C1OC1OC(CO)C(O)C(O)C1O OBATZBGFDSVCJD-UHFFFAOYSA-N 0.000 description 1
- JWPGJSVJDAJRLW-UHFFFAOYSA-N debrisoquin Chemical compound C1=CC=C2CN(C(=N)N)CCC2=C1 JWPGJSVJDAJRLW-UHFFFAOYSA-N 0.000 description 1
- 229960004096 debrisoquine Drugs 0.000 description 1
- 230000007547 defect Effects 0.000 description 1
- 230000007850 degeneration Effects 0.000 description 1
- 230000001934 delay Effects 0.000 description 1
- 230000003111 delayed effect Effects 0.000 description 1
- 238000012217 deletion Methods 0.000 description 1
- 230000037430 deletion Effects 0.000 description 1
- 238000004925 denaturation Methods 0.000 description 1
- 230000036425 denaturation Effects 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- ISMCNVNDWFIXLM-WCGOZPBSSA-N deserpidine Chemical compound O([C@H]1[C@@H]([C@H]([C@H]2C[C@@H]3C4=C([C]5C=CC=CC5=N4)CCN3C[C@H]2C1)C(=O)OC)OC)C(=O)C1=CC(OC)=C(OC)C(OC)=C1 ISMCNVNDWFIXLM-WCGOZPBSSA-N 0.000 description 1
- 229960001993 deserpidine Drugs 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 229960001324 deslanoside Drugs 0.000 description 1
- OBATZBGFDSVCJD-LALPQLPRSA-N deslanoside Chemical compound O([C@H]1[C@@H](O)C[C@@H](O[C@@H]1C)O[C@H]1[C@@H](O)C[C@@H](O[C@@H]1C)O[C@H]1[C@@H](O)C[C@@H](O[C@@H]1C)O[C@@H]1C[C@@H]2[C@]([C@@H]3[C@H]([C@]4(CC[C@@H]([C@@]4(C)[C@H](O)C3)C=3COC(=O)C=3)O)CC2)(C)CC1)[C@@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O OBATZBGFDSVCJD-LALPQLPRSA-N 0.000 description 1
- 230000006866 deterioration Effects 0.000 description 1
- 230000001627 detrimental effect Effects 0.000 description 1
- 229960000633 dextran sulfate Drugs 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 229960001912 dicoumarol Drugs 0.000 description 1
- DOBMPNYZJYQDGZ-UHFFFAOYSA-N dicoumarol Chemical compound C1=CC=CC2=C1OC(=O)C(CC=1C(OC3=CC=CC=C3C=1O)=O)=C2O DOBMPNYZJYQDGZ-UHFFFAOYSA-N 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- 238000009792 diffusion process Methods 0.000 description 1
- 229950004590 digitalin Drugs 0.000 description 1
- CKNOLMVLQUPVMU-YMMLYESFSA-N digitalin Chemical compound C1([C@@H]2[C@@]3(C)CC[C@H]4[C@H]([C@]3(C[C@@H]2O)O)CC[C@H]2[C@]4(C)CC[C@@H](C2)O[C@H]2[C@H](O)[C@H]([C@H]([C@@H](C)O2)O[C@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O2)O)OC)=CC(=O)OC1 CKNOLMVLQUPVMU-YMMLYESFSA-N 0.000 description 1
- 229960002877 dihydralazine Drugs 0.000 description 1
- VQKLRVZQQYVIJW-UHFFFAOYSA-N dihydralazine Chemical compound C1=CC=C2C(NN)=NN=C(NN)C2=C1 VQKLRVZQQYVIJW-UHFFFAOYSA-N 0.000 description 1
- UGMCXQCYOVCMTB-UHFFFAOYSA-K dihydroxy(stearato)aluminium Chemical compound CCCCCCCCCCCCCCCCCC(=O)O[Al](O)O UGMCXQCYOVCMTB-UHFFFAOYSA-K 0.000 description 1
- 229960001079 dilazep Drugs 0.000 description 1
- 229960004166 diltiazem Drugs 0.000 description 1
- HSUGRBWQSSZJOP-RTWAWAEBSA-N diltiazem Chemical compound C1=CC(OC)=CC=C1[C@H]1[C@@H](OC(C)=O)C(=O)N(CCN(C)C)C2=CC=CC=C2S1 HSUGRBWQSSZJOP-RTWAWAEBSA-N 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 229960000267 diphenadione Drugs 0.000 description 1
- XEYBHCRIKKKOSS-UHFFFAOYSA-N disodium;azanylidyneoxidanium;iron(2+);pentacyanide Chemical compound [Na+].[Na+].[Fe+2].N#[C-].N#[C-].N#[C-].N#[C-].N#[C-].[O+]#N XEYBHCRIKKKOSS-UHFFFAOYSA-N 0.000 description 1
- RQXWFEXQGWCOGQ-UHFFFAOYSA-K disodium;carboxylatomethylsulfanyl-[3-[(3-carboxylato-2,2,3-trimethylcyclopentanecarbonyl)amino]-2-methoxypropyl]mercury Chemical compound [Na+].[Na+].[O-]C(=O)CS[Hg]CC(OC)CNC(=O)C1CCC(C)(C([O-])=O)C1(C)C RQXWFEXQGWCOGQ-UHFFFAOYSA-K 0.000 description 1
- 229960001066 disopyramide Drugs 0.000 description 1
- 208000035475 disorder Diseases 0.000 description 1
- 238000010494 dissociation reaction Methods 0.000 description 1
- 230000005593 dissociations Effects 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 229950008177 disulfamide Drugs 0.000 description 1
- RCFKEIREOSXLET-UHFFFAOYSA-N disulfamide Chemical compound CC1=CC(Cl)=C(S(N)(=O)=O)C=C1S(N)(=O)=O RCFKEIREOSXLET-UHFFFAOYSA-N 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 229960003722 doxycycline Drugs 0.000 description 1
- HTAFVGKAHGNWQO-UHFFFAOYSA-N droprenilamine Chemical compound C=1C=CC=CC=1C(C=1C=CC=CC=1)CCNC(C)CC1CCCCC1 HTAFVGKAHGNWQO-UHFFFAOYSA-N 0.000 description 1
- 229950011072 droprenilamine Drugs 0.000 description 1
- 241001493065 dsRNA viruses Species 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 238000003708 edge detection Methods 0.000 description 1
- JAZBEHYOTPTENJ-UHFFFAOYSA-N eicosapentaenoic acid Natural products CCC=CCC=CCC=CCC=CCC=CCCCC(O)=O JAZBEHYOTPTENJ-UHFFFAOYSA-N 0.000 description 1
- 230000005684 electric field Effects 0.000 description 1
- 238000001962 electrophoresis Methods 0.000 description 1
- 238000004520 electroporation Methods 0.000 description 1
- 230000013020 embryo development Effects 0.000 description 1
- 210000002253 embryonic cardiomyocyte Anatomy 0.000 description 1
- OYFJQPXVCSSHAI-QFPUQLAESA-N enalapril maleate Chemical compound OC(=O)\C=C/C(O)=O.C([C@@H](C(=O)OCC)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(O)=O)CC1=CC=CC=C1 OYFJQPXVCSSHAI-QFPUQLAESA-N 0.000 description 1
- PJWPNDMDCLXCOM-UHFFFAOYSA-N encainide Chemical compound C1=CC(OC)=CC=C1C(=O)NC1=CC=CC=C1CCC1N(C)CCCC1 PJWPNDMDCLXCOM-UHFFFAOYSA-N 0.000 description 1
- 210000002889 endothelial cell Anatomy 0.000 description 1
- 229960002029 endralazine Drugs 0.000 description 1
- ALAXZYHFVBSJKZ-UHFFFAOYSA-N endralazine Chemical compound C1CC=2N=NC(NN)=CC=2CN1C(=O)C1=CC=CC=C1 ALAXZYHFVBSJKZ-UHFFFAOYSA-N 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 108010048367 enhanced green fluorescent protein Proteins 0.000 description 1
- 229960000610 enoxaparin Drugs 0.000 description 1
- 229960000972 enoximone Drugs 0.000 description 1
- ZJKNESGOIKRXQY-UHFFFAOYSA-N enoximone Chemical compound C1=CC(SC)=CC=C1C(=O)C1=C(C)NC(=O)N1 ZJKNESGOIKRXQY-UHFFFAOYSA-N 0.000 description 1
- 230000006862 enzymatic digestion Effects 0.000 description 1
- 206010015037 epilepsy Diseases 0.000 description 1
- 210000002919 epithelial cell Anatomy 0.000 description 1
- OROAFUQRIXKEMV-LDADJPATSA-N eprosartan Chemical compound C=1C=C(C(O)=O)C=CC=1CN1C(CCCC)=NC=C1\C=C(C(O)=O)/CC1=CC=CS1 OROAFUQRIXKEMV-LDADJPATSA-N 0.000 description 1
- 229960004563 eprosartan Drugs 0.000 description 1
- 229960004468 eptifibatide Drugs 0.000 description 1
- GLGOPUHVAZCPRB-LROMGURASA-N eptifibatide Chemical compound N1C(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@H](CCCCNC(=N)N)NC(=O)CCSSC[C@@H](C(N)=O)NC(=O)[C@@H]2CCCN2C(=O)[C@@H]1CC1=CN=C2[C]1C=CC=C2 GLGOPUHVAZCPRB-LROMGURASA-N 0.000 description 1
- FQHMMOGHDWAXDI-WUQHHHCFSA-N ergoloid mesylate Chemical compound CS(O)(=O)=O.C([C@H]1[C@]2(O)O3)CCN1C(=O)[C@H](C)N2C(=O)[C@]3(C(C)C)NC(=O)[C@H]1CN(C)[C@H](CC=2C3=C4C=CC=C3NC=2)[C@@H]4C1 FQHMMOGHDWAXDI-WUQHHHCFSA-N 0.000 description 1
- 229960005450 eritrityl tetranitrate Drugs 0.000 description 1
- SNFOERUNNSHUGP-ZXZARUISSA-N erythrityl tetranitrate Chemical compound [O-][N+](=O)OC[C@@H](O[N+]([O-])=O)[C@@H](O[N+]([O-])=O)CO[N+]([O-])=O SNFOERUNNSHUGP-ZXZARUISSA-N 0.000 description 1
- 229960003745 esmolol Drugs 0.000 description 1
- 239000003797 essential amino acid Substances 0.000 description 1
- 235000020776 essential amino acid Nutrition 0.000 description 1
- AVOLMBLBETYQHX-UHFFFAOYSA-N etacrynic acid Chemical compound CCC(=C)C(=O)C1=CC=C(OCC(O)=O)C(Cl)=C1Cl AVOLMBLBETYQHX-UHFFFAOYSA-N 0.000 description 1
- 229960003199 etacrynic acid Drugs 0.000 description 1
- BEFDCLMNVWHSGT-UHFFFAOYSA-N ethenylcyclopentane Chemical compound C=CC1CCCC1 BEFDCLMNVWHSGT-UHFFFAOYSA-N 0.000 description 1
- 229950005098 ethoxzolamide Drugs 0.000 description 1
- OUZWUKMCLIBBOG-UHFFFAOYSA-N ethoxzolamide Chemical compound CCOC1=CC=C2N=C(S(N)(=O)=O)SC2=C1 OUZWUKMCLIBBOG-UHFFFAOYSA-N 0.000 description 1
- 229960002822 ethyl biscoumacetate Drugs 0.000 description 1
- SEGSDVUVOWIWFX-UHFFFAOYSA-N ethyl biscoumacetate Chemical compound C1=CC=C2C(=O)C(C(C=3C(C4=CC=CC=C4OC=3O)=O)C(=O)OCC)=C(O)OC2=C1 SEGSDVUVOWIWFX-UHFFFAOYSA-N 0.000 description 1
- UPCIBFUJJLCOQG-UHFFFAOYSA-L ethyl-[2-[2-[ethyl(dimethyl)azaniumyl]ethyl-methylamino]ethyl]-dimethylazanium;dibromide Chemical compound [Br-].[Br-].CC[N+](C)(C)CCN(C)CC[N+](C)(C)CC UPCIBFUJJLCOQG-UHFFFAOYSA-L 0.000 description 1
- LENNRXOJHWNHSD-UHFFFAOYSA-N ethylnorepinephrine Chemical compound CCC(N)C(O)C1=CC=C(O)C(O)=C1 LENNRXOJHWNHSD-UHFFFAOYSA-N 0.000 description 1
- 229960002267 ethylnorepinephrine Drugs 0.000 description 1
- WNKCJOWTKXGERE-UHFFFAOYSA-N etifelmine Chemical compound C=1C=CC=CC=1C(=C(CN)CC)C1=CC=CC=C1 WNKCJOWTKXGERE-UHFFFAOYSA-N 0.000 description 1
- 229950005475 etifelmine Drugs 0.000 description 1
- 229960003501 etofibrate Drugs 0.000 description 1
- XXRVYAFBUDSLJX-UHFFFAOYSA-N etofibrate Chemical compound C=1C=CN=CC=1C(=O)OCCOC(=O)C(C)(C)OC1=CC=C(Cl)C=C1 XXRVYAFBUDSLJX-UHFFFAOYSA-N 0.000 description 1
- 229950009036 etofylline clofibrate Drugs 0.000 description 1
- KYAKGJDISSNVPZ-UHFFFAOYSA-N etofylline clofibrate Chemical compound C1=2C(=O)N(C)C(=O)N(C)C=2N=CN1CCOC(=O)C(C)(C)OC1=CC=C(Cl)C=C1 KYAKGJDISSNVPZ-UHFFFAOYSA-N 0.000 description 1
- 238000011124 ex vivo culture Methods 0.000 description 1
- 238000002270 exclusion chromatography Methods 0.000 description 1
- 210000002744 extracellular matrix Anatomy 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 229960002297 fenofibrate Drugs 0.000 description 1
- YMTINGFKWWXKFG-UHFFFAOYSA-N fenofibrate Chemical compound C1=CC(OC(C)(C)C(=O)OC(C)C)=CC=C1C(=O)C1=CC=C(Cl)C=C1 YMTINGFKWWXKFG-UHFFFAOYSA-N 0.000 description 1
- 229960002724 fenoldopam Drugs 0.000 description 1
- TVURRHSHRRELCG-UHFFFAOYSA-N fenoldopam Chemical compound C1=CC(O)=CC=C1C1C2=CC(O)=C(O)C(Cl)=C2CCNC1 TVURRHSHRRELCG-UHFFFAOYSA-N 0.000 description 1
- 229960001022 fenoterol Drugs 0.000 description 1
- 229960000489 feprazone Drugs 0.000 description 1
- 239000000835 fiber Substances 0.000 description 1
- 230000020764 fibrinolysis Effects 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 239000010419 fine particle Substances 0.000 description 1
- 229960000449 flecainide Drugs 0.000 description 1
- MXVLJFCCQMXEEE-UHFFFAOYSA-N floredil Chemical compound CCOC1=CC(OCC)=CC(OCCN2CCOCC2)=C1 MXVLJFCCQMXEEE-UHFFFAOYSA-N 0.000 description 1
- 229950011336 floredil Drugs 0.000 description 1
- UYGONJYYUKVHDD-UHFFFAOYSA-N flosequinan Chemical compound C1=C(F)C=C2N(C)C=C(S(C)=O)C(=O)C2=C1 UYGONJYYUKVHDD-UHFFFAOYSA-N 0.000 description 1
- 229960001606 flosequinan Drugs 0.000 description 1
- 229960005298 fluindione Drugs 0.000 description 1
- NASXCEITKQITLD-UHFFFAOYSA-N fluindione Chemical compound C1=CC(F)=CC=C1C1C(=O)C2=CC=CC=C2C1=O NASXCEITKQITLD-UHFFFAOYSA-N 0.000 description 1
- SMANXXCATUTDDT-QPJJXVBHSA-N flunarizine Chemical compound C1=CC(F)=CC=C1C(C=1C=CC(F)=CC=1)N1CCN(C\C=C\C=2C=CC=CC=2)CC1 SMANXXCATUTDDT-QPJJXVBHSA-N 0.000 description 1
- 229960000326 flunarizine Drugs 0.000 description 1
- 238000000799 fluorescence microscopy Methods 0.000 description 1
- 229960002848 formoterol Drugs 0.000 description 1
- BPZSYCZIITTYBL-UHFFFAOYSA-N formoterol Chemical compound C1=CC(OC)=CC=C1CC(C)NCC(O)C1=CC=C(O)C(NC=O)=C1 BPZSYCZIITTYBL-UHFFFAOYSA-N 0.000 description 1
- 238000005194 fractionation Methods 0.000 description 1
- 239000012458 free base Substances 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 229950001523 furterene Drugs 0.000 description 1
- 230000004927 fusion Effects 0.000 description 1
- 101150098622 gag gene Proteins 0.000 description 1
- 229960003692 gamma aminobutyric acid Drugs 0.000 description 1
- FODTZLFLDFKIQH-FSVGXZBPSA-N gamma-Oryzanol (TN) Chemical compound C1=C(O)C(OC)=CC(\C=C\C(=O)O[C@@H]2C([C@@H]3CC[C@H]4[C@]5(C)CC[C@@H]([C@@]5(C)CC[C@@]54C[C@@]53CC2)[C@H](C)CCC=C(C)C)(C)C)=C1 FODTZLFLDFKIQH-FSVGXZBPSA-N 0.000 description 1
- 229950008114 ganglefene Drugs 0.000 description 1
- 238000003304 gavage Methods 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 238000001502 gel electrophoresis Methods 0.000 description 1
- 238000001641 gel filtration chromatography Methods 0.000 description 1
- 229960003627 gemfibrozil Drugs 0.000 description 1
- 238000001476 gene delivery Methods 0.000 description 1
- 238000010363 gene targeting Methods 0.000 description 1
- 238000001415 gene therapy Methods 0.000 description 1
- 231100000025 genetic toxicology Toxicity 0.000 description 1
- 231100000024 genotoxic Toxicity 0.000 description 1
- WTDGMHYYGNJEKQ-ZETCQYMHSA-N gepefrine Chemical compound C[C@H](N)CC1=CC=CC(O)=C1 WTDGMHYYGNJEKQ-ZETCQYMHSA-N 0.000 description 1
- 229940118313 gitalin Drugs 0.000 description 1
- LKRDZKPBAOKJBT-CNPIRKNPSA-N gitoxin Chemical compound C1[C@H](O)[C@H](O)[C@@H](C)O[C@H]1O[C@@H]1[C@@H](C)O[C@@H](O[C@@H]2[C@H](O[C@@H](O[C@@H]3C[C@@H]4[C@]([C@@H]5[C@H]([C@]6(C[C@H](O)[C@@H]([C@@]6(C)CC5)C=5COC(=O)C=5)O)CC4)(C)CC3)C[C@@H]2O)C)C[C@@H]1O LKRDZKPBAOKJBT-CNPIRKNPSA-N 0.000 description 1
- 229950000974 gitoxin Drugs 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- 102000006602 glyceraldehyde-3-phosphate dehydrogenase Human genes 0.000 description 1
- 150000002341 glycosylamines Chemical class 0.000 description 1
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 1
- 229910052737 gold Inorganic materials 0.000 description 1
- 239000010931 gold Substances 0.000 description 1
- 238000000227 grinding Methods 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- 229960004553 guanabenz Drugs 0.000 description 1
- 229950006795 guanacline Drugs 0.000 description 1
- WQVAYGCXSJMPRT-UHFFFAOYSA-N guanacline Chemical compound CC1=CCN(CCN=C(N)N)CC1 WQVAYGCXSJMPRT-UHFFFAOYSA-N 0.000 description 1
- 229960003845 guanadrel Drugs 0.000 description 1
- HPBNRIOWIXYZFK-UHFFFAOYSA-N guanadrel Chemical compound O1C(CNC(=N)N)COC11CCCCC1 HPBNRIOWIXYZFK-UHFFFAOYSA-N 0.000 description 1
- 229960004614 guanazodine Drugs 0.000 description 1
- ZCVAIGPGEINFCX-UHFFFAOYSA-N guanazodine Chemical compound NC(=N)NCC1CCCCCCN1 ZCVAIGPGEINFCX-UHFFFAOYSA-N 0.000 description 1
- XIHXRRMCNSMUET-UHFFFAOYSA-N guanoclor Chemical compound NC(=N)NNCCOC1=C(Cl)C=CC=C1Cl XIHXRRMCNSMUET-UHFFFAOYSA-N 0.000 description 1
- 229960001016 guanoxabenz Drugs 0.000 description 1
- QKIQJNNDIWGVEH-UUILKARUSA-N guanoxabenz Chemical compound ONC(/N)=N/N=C/C1=C(Cl)C=CC=C1Cl QKIQJNNDIWGVEH-UUILKARUSA-N 0.000 description 1
- 229960000760 guanoxan Drugs 0.000 description 1
- HIUVKVDQFXDZHU-UHFFFAOYSA-N guanoxan Chemical compound C1=CC=C2OC(CNC(=N)N)COC2=C1 HIUVKVDQFXDZHU-UHFFFAOYSA-N 0.000 description 1
- 230000010247 heart contraction Effects 0.000 description 1
- 230000009067 heart development Effects 0.000 description 1
- 230000029241 heart induction Effects 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 230000003067 hemagglutinative effect Effects 0.000 description 1
- 210000003958 hematopoietic stem cell Anatomy 0.000 description 1
- 208000031169 hemorrhagic disease Diseases 0.000 description 1
- 210000003494 hepatocyte Anatomy 0.000 description 1
- 229960005402 heptaminol Drugs 0.000 description 1
- 229950002932 hexamethonium Drugs 0.000 description 1
- OXLZNBCNGJWPRV-UHFFFAOYSA-N hexoprenaline Chemical compound C=1C=C(O)C(O)=CC=1C(O)CNCCCCCCNCC(O)C1=CC=C(O)C(O)=C1 OXLZNBCNGJWPRV-UHFFFAOYSA-N 0.000 description 1
- 229940006607 hirudin Drugs 0.000 description 1
- WQPDUTSPKFMPDP-OUMQNGNKSA-N hirudin Chemical compound C([C@@H](C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1C=CC(OS(O)(=O)=O)=CC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CCCCN)NC(=O)[C@H]1N(CCC1)C(=O)[C@@H](NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)CNC(=O)[C@@H](NC(=O)[C@@H](NC(=O)[C@H]1NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CCC(O)=O)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)CNC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)CC)NC(=O)[C@@H]2CSSC[C@@H](C(=O)N[C@@H](CCC(O)=O)C(=O)NCC(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@H](C(=O)N[C@H](C(NCC(=O)N[C@@H](CCC(N)=O)C(=O)NCC(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCCCN)C(=O)N2)=O)CSSC1)C(C)C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]1NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)CNC(=O)[C@H](CO)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=2C=CC(O)=CC=2)NC(=O)[C@@H](NC(=O)[C@@H](N)C(C)C)C(C)C)[C@@H](C)O)CSSC1)C(C)C)[C@@H](C)O)[C@@H](C)O)C1=CC=CC=C1 WQPDUTSPKFMPDP-OUMQNGNKSA-N 0.000 description 1
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 1
- 210000003917 human chromosome Anatomy 0.000 description 1
- YOJQZPVUNUQTDF-UHFFFAOYSA-N hydrastinine Chemical compound C1=C2C(O)N(C)CCC2=CC2=C1OCO2 YOJQZPVUNUQTDF-UHFFFAOYSA-N 0.000 description 1
- 229960000811 hydroquinidine Drugs 0.000 description 1
- 238000012872 hydroxylapatite chromatography Methods 0.000 description 1
- 239000001863 hydroxypropyl cellulose Substances 0.000 description 1
- 235000010977 hydroxypropyl cellulose Nutrition 0.000 description 1
- 230000001969 hypertrophic effect Effects 0.000 description 1
- 238000002991 immunohistochemical analysis Methods 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- 238000011065 in-situ storage Methods 0.000 description 1
- UCEWGESNIULAGX-UHFFFAOYSA-N indecainide Chemical compound C1=CC=C2C(CCCNC(C)C)(C(N)=O)C3=CC=CC=C3C2=C1 UCEWGESNIULAGX-UHFFFAOYSA-N 0.000 description 1
- 229950004448 indecainide Drugs 0.000 description 1
- 229960003422 indobufen Drugs 0.000 description 1
- AYDXAULLCROVIT-UHFFFAOYSA-N indobufen Chemical compound C1=CC(C(C(O)=O)CC)=CC=C1N1C(=O)C2=CC=CC=C2C1 AYDXAULLCROVIT-UHFFFAOYSA-N 0.000 description 1
- 230000036512 infertility Effects 0.000 description 1
- 210000004969 inflammatory cell Anatomy 0.000 description 1
- 239000007972 injectable composition Substances 0.000 description 1
- 238000011081 inoculation Methods 0.000 description 1
- 239000002054 inoculum Substances 0.000 description 1
- 150000007529 inorganic bases Chemical class 0.000 description 1
- 230000000297 inotrophic effect Effects 0.000 description 1
- 238000002743 insertional mutagenesis Methods 0.000 description 1
- 229940125396 insulin Drugs 0.000 description 1
- 102000006495 integrins Human genes 0.000 description 1
- 108010044426 integrins Proteins 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 230000003601 intercostal effect Effects 0.000 description 1
- 238000010212 intracellular staining Methods 0.000 description 1
- 239000007927 intramuscular injection Substances 0.000 description 1
- 238000010255 intramuscular injection Methods 0.000 description 1
- 239000007928 intraperitoneal injection Substances 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 229960002198 irbesartan Drugs 0.000 description 1
- YCPOHTHPUREGFM-UHFFFAOYSA-N irbesartan Chemical compound O=C1N(CC=2C=CC(=CC=2)C=2C(=CC=CC=2)C=2[N]N=NN=2)C(CCCC)=NC21CCCC2 YCPOHTHPUREGFM-UHFFFAOYSA-N 0.000 description 1
- 235000014413 iron hydroxide Nutrition 0.000 description 1
- NCNCGGDMXMBVIA-UHFFFAOYSA-L iron(ii) hydroxide Chemical compound [OH-].[OH-].[Fe+2] NCNCGGDMXMBVIA-UHFFFAOYSA-L 0.000 description 1
- 230000001678 irradiating effect Effects 0.000 description 1
- OWFXIOWLTKNBAP-UHFFFAOYSA-N isoamyl nitrite Chemical compound CC(C)CCON=O OWFXIOWLTKNBAP-UHFFFAOYSA-N 0.000 description 1
- 229960001268 isoetarine Drugs 0.000 description 1
- FZWBNHMXJMCXLU-BLAUPYHCSA-N isomaltotriose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1OC[C@@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@@H](OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C=O)O1 FZWBNHMXJMCXLU-BLAUPYHCSA-N 0.000 description 1
- JJWLVOIRVHMVIS-UHFFFAOYSA-N isopropylamine Chemical compound CC(C)N JJWLVOIRVHMVIS-UHFFFAOYSA-N 0.000 description 1
- 229940039009 isoproterenol Drugs 0.000 description 1
- 229960002479 isosorbide Drugs 0.000 description 1
- 229940072289 kerlone Drugs 0.000 description 1
- FPCCSQOGAWCVBH-UHFFFAOYSA-N ketanserin Chemical compound C1=CC(F)=CC=C1C(=O)C1CCN(CCN2C(C3=CC=CC=C3NC2=O)=O)CC1 FPCCSQOGAWCVBH-UHFFFAOYSA-N 0.000 description 1
- 229960005417 ketanserin Drugs 0.000 description 1
- 230000002147 killing effect Effects 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 239000000787 lecithin Substances 0.000 description 1
- 229940067606 lecithin Drugs 0.000 description 1
- 235000010445 lecithin Nutrition 0.000 description 1
- 210000005240 left ventricle Anatomy 0.000 description 1
- 108010034897 lentil lectin Proteins 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 229940096773 levatol Drugs 0.000 description 1
- IXHBTMCLRNMKHZ-LBPRGKRZSA-N levobunolol Chemical compound O=C1CCCC2=C1C=CC=C2OC[C@@H](O)CNC(C)(C)C IXHBTMCLRNMKHZ-LBPRGKRZSA-N 0.000 description 1
- 229960000831 levobunolol Drugs 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 238000004811 liquid chromatography Methods 0.000 description 1
- 201000007270 liver cancer Diseases 0.000 description 1
- 208000014018 liver neoplasm Diseases 0.000 description 1
- 238000011068 loading method Methods 0.000 description 1
- 230000033001 locomotion Effects 0.000 description 1
- KSMAGQUYOIHWFS-UHFFFAOYSA-N lofexidine Chemical compound N=1CCNC=1C(C)OC1=C(Cl)C=CC=C1Cl KSMAGQUYOIHWFS-UHFFFAOYSA-N 0.000 description 1
- 229960005209 lofexidine Drugs 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 229940089504 lopressor Drugs 0.000 description 1
- 229960001074 lorcainide Drugs 0.000 description 1
- XHOJAWVAWFHGHL-UHFFFAOYSA-N lorcainide Chemical compound C1CN(C(C)C)CCC1N(C=1C=CC(Cl)=CC=1)C(=O)CC1=CC=CC=C1 XHOJAWVAWFHGHL-UHFFFAOYSA-N 0.000 description 1
- 229960004773 losartan Drugs 0.000 description 1
- KJJZZJSZUJXYEA-UHFFFAOYSA-N losartan Chemical compound CCCCC1=NC(Cl)=C(CO)N1CC1=CC=C(C=2C(=CC=CC=2)C=2[N]N=NN=2)C=C1 KJJZZJSZUJXYEA-UHFFFAOYSA-N 0.000 description 1
- PCZOHLXUXFIOCF-BXMDZJJMSA-N lovastatin Chemical compound C([C@H]1[C@@H](C)C=CC2=C[C@H](C)C[C@@H]([C@H]12)OC(=O)[C@@H](C)CC)C[C@@H]1C[C@@H](O)CC(=O)O1 PCZOHLXUXFIOCF-BXMDZJJMSA-N 0.000 description 1
- 239000012139 lysis buffer Substances 0.000 description 1
- 230000002101 lytic effect Effects 0.000 description 1
- JSJCTEKTBOKRST-UHFFFAOYSA-N mabuterol Chemical compound CC(C)(C)NCC(O)C1=CC(Cl)=C(N)C(C(F)(F)F)=C1 JSJCTEKTBOKRST-UHFFFAOYSA-N 0.000 description 1
- 229950004407 mabuterol Drugs 0.000 description 1
- 229920002521 macromolecule Polymers 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- 210000001161 mammalian embryo Anatomy 0.000 description 1
- 229960002510 mandelic acid Drugs 0.000 description 1
- DGMJZELBSFOPHH-KVTDHHQDSA-N mannite hexanitrate Chemical compound [O-][N+](=O)OC[C@@H](O[N+]([O-])=O)[C@@H](O[N+]([O-])=O)[C@H](O[N+]([O-])=O)[C@H](O[N+]([O-])=O)CO[N+]([O-])=O DGMJZELBSFOPHH-KVTDHHQDSA-N 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 229960001855 mannitol Drugs 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 229960001765 mannitol hexanitrate Drugs 0.000 description 1
- 238000013507 mapping Methods 0.000 description 1
- 230000035800 maturation Effects 0.000 description 1
- 229960004119 mebutamate Drugs 0.000 description 1
- ORAUEDBBTFLQSK-UHFFFAOYSA-N medibazine Chemical compound C=1C=C2OCOC2=CC=1CN(CC1)CCN1C(C=1C=CC=CC=1)C1=CC=CC=C1 ORAUEDBBTFLQSK-UHFFFAOYSA-N 0.000 description 1
- 229950000437 medibazine Drugs 0.000 description 1
- 101150014102 mef-2 gene Proteins 0.000 description 1
- 229960001961 meglutol Drugs 0.000 description 1
- 229950008446 melinamide Drugs 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 210000004779 membrane envelope Anatomy 0.000 description 1
- SPLVKBMIQSSFFN-UHFFFAOYSA-N meobentine Chemical compound CNC(=NC)NCC1=CC=C(OC)C=C1 SPLVKBMIQSSFFN-UHFFFAOYSA-N 0.000 description 1
- 229950009531 meobentine Drugs 0.000 description 1
- 229950005795 meralluride Drugs 0.000 description 1
- 229960002523 mercuric chloride Drugs 0.000 description 1
- QSHDDOUJBYECFT-UHFFFAOYSA-N mercury Chemical compound [Hg] QSHDDOUJBYECFT-UHFFFAOYSA-N 0.000 description 1
- 229910052753 mercury Inorganic materials 0.000 description 1
- LWJROJCJINYWOX-UHFFFAOYSA-L mercury dichloride Chemical compound Cl[Hg]Cl LWJROJCJINYWOX-UHFFFAOYSA-L 0.000 description 1
- 230000010012 metabolic coupling Effects 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 150000002739 metals Chemical class 0.000 description 1
- LMOINURANNBYCM-UHFFFAOYSA-N metaproterenol Chemical compound CC(C)NCC(O)C1=CC(O)=CC(O)=C1 LMOINURANNBYCM-UHFFFAOYSA-N 0.000 description 1
- FLOSMHQXBMRNHR-DAXSKMNVSA-N methazolamide Chemical compound CC(=O)\N=C1/SC(S(N)(=O)=O)=NN1C FLOSMHQXBMRNHR-DAXSKMNVSA-N 0.000 description 1
- 229960004083 methazolamide Drugs 0.000 description 1
- 229960005405 methoxyphenamine Drugs 0.000 description 1
- OEHAYUOVELTAPG-UHFFFAOYSA-N methoxyphenamine Chemical compound CNC(C)CC1=CC=CC=C1OC OEHAYUOVELTAPG-UHFFFAOYSA-N 0.000 description 1
- COAPCKUZMKOWBC-ZEJGPHSTSA-N methyl (1s,4ar,4bs,7e,8r,8as,9s,10ar)-9-hydroxy-1,4a,8-trimethyl-7-[2-[2-(methylamino)ethoxy]-2-oxoethylidene]-3,4,4b,5,6,8,8a,9,10,10a-decahydro-2h-phenanthrene-1-carboxylate Chemical compound [C@H]1([C@@](CCC2)(C)C(=O)OC)[C@@]2(C)[C@H]2CC\C(=C/C(=O)OCCNC)[C@H](C)[C@@H]2[C@@H](O)C1 COAPCKUZMKOWBC-ZEJGPHSTSA-N 0.000 description 1
- JZMJDSHXVKJFKW-UHFFFAOYSA-M methyl sulfate(1-) Chemical compound COS([O-])(=O)=O JZMJDSHXVKJFKW-UHFFFAOYSA-M 0.000 description 1
- ZOSQTCOGKFRDET-UHFFFAOYSA-L methyl sulfate;trimethyl-[3-(3,5,8,8-tetramethyl-3-azoniabicyclo[3.2.1]octan-3-yl)propyl]azanium Chemical compound COS([O-])(=O)=O.COS([O-])(=O)=O.C1[N+](C)(CCC[N+](C)(C)C)CC2(C)CCC1C2(C)C ZOSQTCOGKFRDET-UHFFFAOYSA-L 0.000 description 1
- 229960002704 metipranolol Drugs 0.000 description 1
- BLWNYSZZZWQCKO-UHFFFAOYSA-N metipranolol hydrochloride Chemical compound [Cl-].CC(C)[NH2+]CC(O)COC1=CC(C)=C(OC(C)=O)C(C)=C1C BLWNYSZZZWQCKO-UHFFFAOYSA-N 0.000 description 1
- 229950005579 metochalcone Drugs 0.000 description 1
- 229960002817 metolazone Drugs 0.000 description 1
- AQCHWTWZEMGIFD-UHFFFAOYSA-N metolazone Chemical compound CC1NC2=CC(Cl)=C(S(N)(=O)=O)C=C2C(=O)N1C1=CC=CC=C1C AQCHWTWZEMGIFD-UHFFFAOYSA-N 0.000 description 1
- VLPIATFUUWWMKC-UHFFFAOYSA-N mexiletine Chemical compound CC(N)COC1=C(C)C=CC=C1C VLPIATFUUWWMKC-UHFFFAOYSA-N 0.000 description 1
- 229960003404 mexiletine Drugs 0.000 description 1
- 229960004438 mibefradil Drugs 0.000 description 1
- 238000000520 microinjection Methods 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 229960003574 milrinone Drugs 0.000 description 1
- PZRHRDRVRGEVNW-UHFFFAOYSA-N milrinone Chemical compound N1C(=O)C(C#N)=CC(C=2C=CN=CC=2)=C1C PZRHRDRVRGEVNW-UHFFFAOYSA-N 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 229940064639 minipress Drugs 0.000 description 1
- 208000019266 moderate heart failure Diseases 0.000 description 1
- 230000020654 modulation by virus of host translation Effects 0.000 description 1
- 239000002808 molecular sieve Substances 0.000 description 1
- 229960005181 morphine Drugs 0.000 description 1
- 230000004118 muscle contraction Effects 0.000 description 1
- 230000023105 myelination Effects 0.000 description 1
- 108010065781 myosin light chain 2 Proteins 0.000 description 1
- OOVXZFCPCSVSEM-NADOGSGZSA-N mytatrienediol Chemical compound C1C[C@]2(C)[C@@H](O)[C@@](C)(O)C[C@H]2[C@@H]2CCC3=CC(OC)=CC=C3[C@H]21 OOVXZFCPCSVSEM-NADOGSGZSA-N 0.000 description 1
- GACQNVJDWUAPFY-UHFFFAOYSA-N n'-[2-[2-(2-aminoethylamino)ethylamino]ethyl]ethane-1,2-diamine;hydrochloride Chemical compound Cl.NCCNCCNCCNCCN GACQNVJDWUAPFY-UHFFFAOYSA-N 0.000 description 1
- HHRNQOGXBRYCHF-UHFFFAOYSA-N n-[2-hydroxy-5-[1-hydroxy-2-(propan-2-ylamino)ethyl]phenyl]methanesulfonamide Chemical compound CC(C)NCC(O)C1=CC=C(O)C(NS(C)(=O)=O)=C1 HHRNQOGXBRYCHF-UHFFFAOYSA-N 0.000 description 1
- UPZVYDSBLFNMLK-UHFFFAOYSA-N nadoxolol Chemical compound C1=CC=C2C(OCC(O)CC(/N)=N/O)=CC=CC2=C1 UPZVYDSBLFNMLK-UHFFFAOYSA-N 0.000 description 1
- 229960004501 nadoxolol Drugs 0.000 description 1
- 210000005036 nerve Anatomy 0.000 description 1
- HPNRHPKXQZSDFX-OAQDCNSJSA-N nesiritide Chemical compound C([C@H]1C(=O)NCC(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@H](C(N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)N[C@@H](CSSC[C@@H](C(=O)N1)NC(=O)CNC(=O)[C@H](CO)NC(=O)CNC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](CCSC)NC(=O)[C@H](CCCCN)NC(=O)[C@H]1N(CCC1)C(=O)[C@@H](N)CO)C(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1N=CNC=1)C(O)=O)=O)[C@@H](C)CC)C1=CC=CC=C1 HPNRHPKXQZSDFX-OAQDCNSJSA-N 0.000 description 1
- 210000000933 neural crest Anatomy 0.000 description 1
- 230000004766 neurogenesis Effects 0.000 description 1
- 239000003176 neuroleptic agent Substances 0.000 description 1
- 229960003642 nicergoline Drugs 0.000 description 1
- 229960000827 niceritrol Drugs 0.000 description 1
- XPPXHQUWVYMTDM-UHFFFAOYSA-N nicoclonate Chemical compound C=1C=C(Cl)C=CC=1C(C(C)C)OC(=O)C1=CC=CN=C1 XPPXHQUWVYMTDM-UHFFFAOYSA-N 0.000 description 1
- 229950011138 nicoclonate Drugs 0.000 description 1
- 229950005171 nicofibrate Drugs 0.000 description 1
- RARQHAFNGNPQCZ-UHFFFAOYSA-N nicofibrate Chemical compound C=1C=CN=CC=1COC(=O)C(C)(C)OC1=CC=C(Cl)C=C1 RARQHAFNGNPQCZ-UHFFFAOYSA-N 0.000 description 1
- 229950001071 nicomol Drugs 0.000 description 1
- 229960003512 nicotinic acid Drugs 0.000 description 1
- 239000011664 nicotinic acid Substances 0.000 description 1
- 235000001968 nicotinic acid Nutrition 0.000 description 1
- 229950000096 nifenalol Drugs 0.000 description 1
- UAORFCGRZIGNCI-UHFFFAOYSA-N nifenalol Chemical compound CC(C)NCC(O)C1=CC=C([N+]([O-])=O)C=C1 UAORFCGRZIGNCI-UHFFFAOYSA-N 0.000 description 1
- 229960005366 nilvadipine Drugs 0.000 description 1
- 229960000715 nimodipine Drugs 0.000 description 1
- 229940072991 nitro-bid Drugs 0.000 description 1
- 229960002460 nitroprusside Drugs 0.000 description 1
- 229940073015 nitrostat Drugs 0.000 description 1
- 231100000957 no side effect Toxicity 0.000 description 1
- 229960002748 norepinephrine Drugs 0.000 description 1
- SFLSHLFXELFNJZ-UHFFFAOYSA-N norepinephrine Natural products NCC(O)C1=CC=C(O)C(O)=C1 SFLSHLFXELFNJZ-UHFFFAOYSA-N 0.000 description 1
- 229940088938 norpace Drugs 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 210000000869 occipital lobe Anatomy 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 235000019198 oils Nutrition 0.000 description 1
- 238000003305 oral gavage Methods 0.000 description 1
- 229960002657 orciprenaline Drugs 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 150000007530 organic bases Chemical class 0.000 description 1
- 229960003104 ornithine Drugs 0.000 description 1
- 229960003343 ouabain Drugs 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 229950001773 oxazidione Drugs 0.000 description 1
- 229960003684 oxedrine Drugs 0.000 description 1
- FJCFFCXMEXZEIM-UHFFFAOYSA-N oxiniacic acid Chemical compound OC(=O)C1=CC=C[N+]([O-])=C1 FJCFFCXMEXZEIM-UHFFFAOYSA-N 0.000 description 1
- 229950005065 oxiniacic acid Drugs 0.000 description 1
- 229960001818 oxyfedrine Drugs 0.000 description 1
- GDYUVHBMFVMBAF-LIRRHRJNSA-N oxyfedrine Chemical compound COC1=CC=CC(C(=O)CCN[C@@H](C)[C@H](O)C=2C=CC=CC=2)=C1 GDYUVHBMFVMBAF-LIRRHRJNSA-N 0.000 description 1
- 229950003837 ozagrel Drugs 0.000 description 1
- SHZKQBHERIJWAO-AATRIKPKSA-N ozagrel Chemical compound C1=CC(/C=C/C(=O)O)=CC=C1CN1C=NC=C1 SHZKQBHERIJWAO-AATRIKPKSA-N 0.000 description 1
- BJRNKVDFDLYUGJ-UHFFFAOYSA-N p-hydroxyphenyl beta-D-alloside Natural products OC1C(O)C(O)C(CO)OC1OC1=CC=C(O)C=C1 BJRNKVDFDLYUGJ-UHFFFAOYSA-N 0.000 description 1
- DJWYOLJPSHDSAL-ROUUACIJSA-N pantethine Chemical compound OCC(C)(C)[C@@H](O)C(=O)NCCC(=O)NCCSSCCNC(=O)CCNC(=O)[C@H](O)C(C)(C)CO DJWYOLJPSHDSAL-ROUUACIJSA-N 0.000 description 1
- 229960000903 pantethine Drugs 0.000 description 1
- 235000008975 pantethine Nutrition 0.000 description 1
- 239000011581 pantethine Substances 0.000 description 1
- 229950006493 paraflutizide Drugs 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 229960001779 pargyline Drugs 0.000 description 1
- 239000013618 particulate matter Substances 0.000 description 1
- 238000004810 partition chromatography Methods 0.000 description 1
- 235000020232 peanut Nutrition 0.000 description 1
- FEDSNBHHWZEYTP-ZFQYHYQMSA-N penbutolol sulfate Chemical compound OS(O)(=O)=O.CC(C)(C)NC[C@H](O)COC1=CC=CC=C1C1CCCC1.CC(C)(C)NC[C@H](O)COC1=CC=CC=C1C1CCCC1 FEDSNBHHWZEYTP-ZFQYHYQMSA-N 0.000 description 1
- 229960004321 pentaerithrityl tetranitrate Drugs 0.000 description 1
- XUSPWDAHGXSTHS-UHFFFAOYSA-N pentamethonium Chemical compound C[N+](C)(C)CCCCC[N+](C)(C)C XUSPWDAHGXSTHS-UHFFFAOYSA-N 0.000 description 1
- 229950000494 pentamethonium bromide Drugs 0.000 description 1
- 229940043138 pentosan polysulfate Drugs 0.000 description 1
- BRBAEHHXGZRCBK-UHFFFAOYSA-N pentrinitrol Chemical compound [O-][N+](=O)OCC(CO)(CO[N+]([O-])=O)CO[N+]([O-])=O BRBAEHHXGZRCBK-UHFFFAOYSA-N 0.000 description 1
- 229950006286 pentrinitrol Drugs 0.000 description 1
- 230000000737 periodic effect Effects 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 239000000810 peripheral vasodilating agent Substances 0.000 description 1
- 229960002116 peripheral vasodilator Drugs 0.000 description 1
- 239000008194 pharmaceutical composition Substances 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 229950001512 phenactropinium chloride Drugs 0.000 description 1
- 229960000280 phenindione Drugs 0.000 description 1
- NFBAXHOPROOJAW-UHFFFAOYSA-N phenindione Chemical compound O=C1C2=CC=CC=C2C(=O)C1C1=CC=CC=C1 NFBAXHOPROOJAW-UHFFFAOYSA-N 0.000 description 1
- VXTWEDPZMSVFEF-UHFFFAOYSA-N pheniprazine Chemical compound NNC(C)CC1=CC=CC=C1 VXTWEDPZMSVFEF-UHFFFAOYSA-N 0.000 description 1
- 229950005573 pheniprazine Drugs 0.000 description 1
- 229960003742 phenol Drugs 0.000 description 1
- MRBDMNSDAVCSSF-UHFFFAOYSA-N phentolamine Chemical compound C1=CC(C)=CC=C1N(C=1C=C(O)C=CC=1)CC1=NCCN1 MRBDMNSDAVCSSF-UHFFFAOYSA-N 0.000 description 1
- 229960001999 phentolamine Drugs 0.000 description 1
- 229960001029 pholedrine Drugs 0.000 description 1
- SBUQZKJEOOQSBV-UHFFFAOYSA-N pholedrine Chemical compound CNC(C)CC1=CC=C(O)C=C1 SBUQZKJEOOQSBV-UHFFFAOYSA-N 0.000 description 1
- 150000008104 phosphatidylethanolamines Chemical class 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- SHUZOJHMOBOZST-UHFFFAOYSA-N phylloquinone Natural products CC(C)CCCCC(C)CCC(C)CCCC(=CCC1=C(C)C(=O)c2ccccc2C1=O)C SHUZOJHMOBOZST-UHFFFAOYSA-N 0.000 description 1
- MBWXNTAXLNYFJB-NKFFZRIASA-N phylloquinone Chemical compound C1=CC=C2C(=O)C(C/C=C(C)/CCC[C@H](C)CCC[C@H](C)CCCC(C)C)=C(C)C(=O)C2=C1 MBWXNTAXLNYFJB-NKFFZRIASA-N 0.000 description 1
- 235000019175 phylloquinone Nutrition 0.000 description 1
- 239000011772 phylloquinone Substances 0.000 description 1
- 229960001898 phytomenadione Drugs 0.000 description 1
- KYIAWOXNPBANEW-UHFFFAOYSA-N pildralazine Chemical compound CC(O)CN(C)C1=CC=C(NN)N=N1 KYIAWOXNPBANEW-UHFFFAOYSA-N 0.000 description 1
- 229950007220 pildralazine Drugs 0.000 description 1
- CDHVRXOLGDSJGX-UHFFFAOYSA-N pimefylline Chemical compound C1=2C(=O)N(C)C(=O)N(C)C=2N=CN1CCNCC1=CC=CN=C1 CDHVRXOLGDSJGX-UHFFFAOYSA-N 0.000 description 1
- 229950010919 pimefylline Drugs 0.000 description 1
- 229960002310 pinacidil Drugs 0.000 description 1
- JZQKKSLKJUAGIC-UHFFFAOYSA-N pindolol Chemical compound CC(C)NCC(O)COC1=CC=CC2=C1C=CN2 JZQKKSLKJUAGIC-UHFFFAOYSA-N 0.000 description 1
- 150000004885 piperazines Chemical class 0.000 description 1
- LYKMMUBOEFYJQG-UHFFFAOYSA-N piperoxan Chemical compound C1OC2=CC=CC=C2OC1CN1CCCCC1 LYKMMUBOEFYJQG-UHFFFAOYSA-N 0.000 description 1
- 229960001085 piretanide Drugs 0.000 description 1
- 229950000957 pirifibrate Drugs 0.000 description 1
- YJBIJSVYPHRVCI-UHFFFAOYSA-N pirifibrate Chemical compound C=1C=CC(CO)=NC=1COC(=O)C(C)(C)OC1=CC=C(Cl)C=C1 YJBIJSVYPHRVCI-UHFFFAOYSA-N 0.000 description 1
- DIIBXMIIOQXTHW-UHFFFAOYSA-N pirozadil Chemical compound COC1=C(OC)C(OC)=CC(C(=O)OCC=2N=C(COC(=O)C=3C=C(OC)C(OC)=C(OC)C=3)C=CC=2)=C1 DIIBXMIIOQXTHW-UHFFFAOYSA-N 0.000 description 1
- 229950008646 pirozadil Drugs 0.000 description 1
- 229950010439 plafibride Drugs 0.000 description 1
- DDDQVDIPBFGVIG-UHFFFAOYSA-N plafibride Chemical compound C1COCCN1CNC(=O)NC(=O)C(C)(C)OC1=CC=C(Cl)C=C1 DDDQVDIPBFGVIG-UHFFFAOYSA-N 0.000 description 1
- 229940012957 plasmin Drugs 0.000 description 1
- 229920001992 poloxamer 407 Polymers 0.000 description 1
- 229920003229 poly(methyl methacrylate) Polymers 0.000 description 1
- 229920000573 polyethylene Polymers 0.000 description 1
- 239000010318 polygalacturonic acid Substances 0.000 description 1
- 229920000656 polylysine Polymers 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 239000004926 polymethyl methacrylate Substances 0.000 description 1
- 229920005862 polyol Polymers 0.000 description 1
- 150000003077 polyols Chemical class 0.000 description 1
- 108010005636 polypeptide C Proteins 0.000 description 1
- 229960005483 polythiazide Drugs 0.000 description 1
- 229920000046 polythiazide Polymers 0.000 description 1
- 235000020004 porter Nutrition 0.000 description 1
- 230000029279 positive regulation of transcription, DNA-dependent Effects 0.000 description 1
- 230000004481 post-translational protein modification Effects 0.000 description 1
- 229960001749 practolol Drugs 0.000 description 1
- DURULFYMVIFBIR-UHFFFAOYSA-N practolol Chemical compound CC(C)NCC(O)COC1=CC=C(NC(C)=O)C=C1 DURULFYMVIFBIR-UHFFFAOYSA-N 0.000 description 1
- 229960002965 pravastatin Drugs 0.000 description 1
- TUZYXOIXSAXUGO-PZAWKZKUSA-N pravastatin Chemical compound C1=C[C@H](C)[C@H](CC[C@@H](O)C[C@@H](O)CC(O)=O)[C@H]2[C@@H](OC(=O)[C@@H](C)CC)C[C@H](O)C=C21 TUZYXOIXSAXUGO-PZAWKZKUSA-N 0.000 description 1
- WFXFYZULCQKPIP-UHFFFAOYSA-N prazosin hydrochloride Chemical compound [H+].[Cl-].N=1C(N)=C2C=C(OC)C(OC)=CC2=NC=1N(CC1)CCN1C(=O)C1=CC=CO1 WFXFYZULCQKPIP-UHFFFAOYSA-N 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 230000036316 preload Effects 0.000 description 1
- 229960004358 prenalterol Drugs 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 230000002335 preservative effect Effects 0.000 description 1
- 229950002277 primaperone Drugs 0.000 description 1
- 238000002810 primary assay Methods 0.000 description 1
- 229960000244 procainamide Drugs 0.000 description 1
- 229960004919 procaine Drugs 0.000 description 1
- MFDFERRIHVXMIY-UHFFFAOYSA-N procaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1 MFDFERRIHVXMIY-UHFFFAOYSA-N 0.000 description 1
- 229960002288 procaterol Drugs 0.000 description 1
- FKNXQNWAXFXVNW-BLLLJJGKSA-N procaterol Chemical compound N1C(=O)C=CC2=C1C(O)=CC=C2[C@@H](O)[C@@H](NC(C)C)CC FKNXQNWAXFXVNW-BLLLJJGKSA-N 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 239000003805 procoagulant Substances 0.000 description 1
- 238000004393 prognosis Methods 0.000 description 1
- 230000000750 progressive effect Effects 0.000 description 1
- 230000002062 proliferating effect Effects 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 230000001902 propagating effect Effects 0.000 description 1
- XJMOSONTPMZWPB-UHFFFAOYSA-M propidium iodide Chemical compound [I-].[I-].C12=CC(N)=CC=C2C2=CC=C(N)C=C2[N+](CCC[N+](C)(CC)CC)=C1C1=CC=CC=C1 XJMOSONTPMZWPB-UHFFFAOYSA-M 0.000 description 1
- 229960003712 propranolol Drugs 0.000 description 1
- 229940048914 protamine Drugs 0.000 description 1
- 108060006633 protein kinase Proteins 0.000 description 1
- 230000017854 proteolysis Effects 0.000 description 1
- MXRGZXBFSKSZPH-UHFFFAOYSA-N protheobromine Chemical compound O=C1N(CC(O)C)C(=O)N(C)C2=C1N(C)C=N2 MXRGZXBFSKSZPH-UHFFFAOYSA-N 0.000 description 1
- 229950001920 protheobromine Drugs 0.000 description 1
- 229950009066 protokylol Drugs 0.000 description 1
- LUMAEVHDZXIGEP-UHFFFAOYSA-N protokylol Chemical compound C=1C=C2OCOC2=CC=1CC(C)NCC(O)C1=CC=C(O)C(O)=C1 LUMAEVHDZXIGEP-UHFFFAOYSA-N 0.000 description 1
- CPNGPNLZQNNVQM-UHFFFAOYSA-N pteridine Chemical compound N1=CN=CC2=NC=CN=C21 CPNGPNLZQNNVQM-UHFFFAOYSA-N 0.000 description 1
- 150000003212 purines Chemical class 0.000 description 1
- 229940070851 pyridinolcarbamate Drugs 0.000 description 1
- 229950006756 pyrinoline Drugs 0.000 description 1
- NCZXKYCNHGRFHE-UHFFFAOYSA-N pyrinoline Chemical compound C=1C=CC=NC=1C(C=1N=CC=CC=1)(O)C(C=C1)=CC1=C(C=1N=CC=CC=1)C1=CC=CC=N1 NCZXKYCNHGRFHE-UHFFFAOYSA-N 0.000 description 1
- 229940073095 questran Drugs 0.000 description 1
- 239000001397 quillaja saponaria molina bark Substances 0.000 description 1
- 229960001404 quinidine Drugs 0.000 description 1
- 229960004482 quinidine sulfate Drugs 0.000 description 1
- 238000011470 radical surgery Methods 0.000 description 1
- ZLQMRLSBXKQKMG-UHFFFAOYSA-N rauniticine Natural products COC(=O)C1=CC2CC3N(CCc4c3[nH]c5ccccc45)CC2C(C)O1 ZLQMRLSBXKQKMG-UHFFFAOYSA-N 0.000 description 1
- 230000008707 rearrangement Effects 0.000 description 1
- 229940044551 receptor antagonist Drugs 0.000 description 1
- 239000002464 receptor antagonist Substances 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 230000007115 recruitment Effects 0.000 description 1
- 230000000306 recurrent effect Effects 0.000 description 1
- 230000011371 regulation of developmental process Effects 0.000 description 1
- 230000037425 regulation of transcription Effects 0.000 description 1
- 230000001850 reproductive effect Effects 0.000 description 1
- 229960002720 reproterol Drugs 0.000 description 1
- WVLAAKXASPCBGT-UHFFFAOYSA-N reproterol Chemical compound C1=2C(=O)N(C)C(=O)N(C)C=2N=CN1CCCNCC(O)C1=CC(O)=CC(O)=C1 WVLAAKXASPCBGT-UHFFFAOYSA-N 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- QEVHRUUCFGRFIF-MDEJGZGSSA-N reserpine Chemical compound O([C@H]1[C@@H]([C@H]([C@H]2C[C@@H]3C4=C(C5=CC=C(OC)C=C5N4)CCN3C[C@H]2C1)C(=O)OC)OC)C(=O)C1=CC(OC)=C(OC)C(OC)=C1 QEVHRUUCFGRFIF-MDEJGZGSSA-N 0.000 description 1
- ATLJNLYIJOCWJE-UHFFFAOYSA-N resibufogenin Natural products CC12CCC(C3(CCC(O)CC3CC3)C)C3C11OC1CC2C=1C=CC(=O)OC=1 ATLJNLYIJOCWJE-UHFFFAOYSA-N 0.000 description 1
- 208000023504 respiratory system disease Diseases 0.000 description 1
- 238000004366 reverse phase liquid chromatography Methods 0.000 description 1
- 229960000764 rilmenidine Drugs 0.000 description 1
- IOVGROKTTNBUGK-SJCJKPOMSA-N ritodrine Chemical compound N([C@@H](C)[C@H](O)C=1C=CC(O)=CC=1)CCC1=CC=C(O)C=C1 IOVGROKTTNBUGK-SJCJKPOMSA-N 0.000 description 1
- 229960001634 ritodrine Drugs 0.000 description 1
- 229960000804 ronifibrate Drugs 0.000 description 1
- AYJVGKWCGIYEAK-UHFFFAOYSA-N ronifibrate Chemical compound C=1C=CN=CC=1C(=O)OCCCOC(=O)C(C)(C)OC1=CC=C(Cl)C=C1 AYJVGKWCGIYEAK-UHFFFAOYSA-N 0.000 description 1
- 229960002052 salbutamol Drugs 0.000 description 1
- 229930182490 saponin Natural products 0.000 description 1
- 150000007949 saponins Chemical class 0.000 description 1
- 108010073863 saruplase Proteins 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 230000037387 scars Effects 0.000 description 1
- NXJOCELNFPGKIV-ARHXXGKOSA-N scillaren A Chemical compound C=1([C@@H]2[C@@]3(C)CC[C@@H]4[C@@]5(C)CC[C@@H](C=C5CC[C@H]4[C@@]3(O)CC2)O[C@@H]2O[C@H]([C@@H]([C@@H](O)[C@H]2O)O[C@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O2)O)C)C=CC(=O)OC=1 NXJOCELNFPGKIV-ARHXXGKOSA-N 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 230000035939 shock Effects 0.000 description 1
- 239000013605 shuttle vector Substances 0.000 description 1
- 239000000377 silicon dioxide Substances 0.000 description 1
- 229960004058 simfibrate Drugs 0.000 description 1
- RYMZZMVNJRMUDD-HGQWONQESA-N simvastatin Chemical compound C([C@H]1[C@@H](C)C=CC2=C[C@H](C)C[C@@H]([C@H]12)OC(=O)C(C)(C)CC)C[C@@H]1C[C@@H](O)CC(=O)O1 RYMZZMVNJRMUDD-HGQWONQESA-N 0.000 description 1
- KZJWDPNRJALLNS-VJSFXXLFSA-N sitosterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CC[C@@H](CC)C(C)C)[C@@]1(C)CC2 KZJWDPNRJALLNS-VJSFXXLFSA-N 0.000 description 1
- 229950005143 sitosterol Drugs 0.000 description 1
- 230000022379 skeletal muscle tissue development Effects 0.000 description 1
- 210000001057 smooth muscle myoblast Anatomy 0.000 description 1
- 210000000329 smooth muscle myocyte Anatomy 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- URGAHOPLAPQHLN-UHFFFAOYSA-N sodium aluminosilicate Chemical compound [Na+].[Al+3].[O-][Si]([O-])=O.[O-][Si]([O-])=O URGAHOPLAPQHLN-UHFFFAOYSA-N 0.000 description 1
- 229920002351 sodium apolate Polymers 0.000 description 1
- 229940083618 sodium nitroprusside Drugs 0.000 description 1
- 229940054269 sodium pyruvate Drugs 0.000 description 1
- BDFXZRBRZBBYDN-UHFFFAOYSA-L sodium;[3-(3-carboxylatopropanoylcarbamoylamino)-2-methoxypropyl]mercury(1+);1,3-dimethyl-7h-purine-2,6-dione;hydroxide Chemical compound [OH-].[Na+].O=C1N(C)C(=O)N(C)C2=C1NC=N2.COC(C[Hg+])CNC(=O)NC(=O)CCC([O-])=O BDFXZRBRZBBYDN-UHFFFAOYSA-L 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 238000000527 sonication Methods 0.000 description 1
- 239000004334 sorbic acid Substances 0.000 description 1
- 229940075582 sorbic acid Drugs 0.000 description 1
- 235000010199 sorbic acid Nutrition 0.000 description 1
- 238000001179 sorption measurement Methods 0.000 description 1
- 229960002370 sotalol Drugs 0.000 description 1
- ZBMZVLHSJCTVON-UHFFFAOYSA-N sotalol Chemical compound CC(C)NCC(O)C1=CC=C(NS(C)(=O)=O)C=C1 ZBMZVLHSJCTVON-UHFFFAOYSA-N 0.000 description 1
- 229950010289 soterenol Drugs 0.000 description 1
- 238000001228 spectrum Methods 0.000 description 1
- 229960002256 spironolactone Drugs 0.000 description 1
- LXMSZDCAJNLERA-ZHYRCANASA-N spironolactone Chemical compound C([C@@H]1[C@]2(C)CC[C@@H]3[C@@]4(C)CCC(=O)C=C4C[C@H]([C@@H]13)SC(=O)C)C[C@@]21CCC(=O)O1 LXMSZDCAJNLERA-ZHYRCANASA-N 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 208000024794 sputum Diseases 0.000 description 1
- 206010041823 squamous cell carcinoma Diseases 0.000 description 1
- 230000010473 stable expression Effects 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- 210000000130 stem cell Anatomy 0.000 description 1
- 230000001954 sterilising effect Effects 0.000 description 1
- 238000004659 sterilization and disinfection Methods 0.000 description 1
- 150000008143 steroidal glycosides Chemical class 0.000 description 1
- 150000003431 steroids Chemical class 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 210000002536 stromal cell Anatomy 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 235000000346 sugar Nutrition 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- MBGGBVCUIVRRBF-UHFFFAOYSA-N sulfinpyrazone Chemical compound O=C1N(C=2C=CC=CC=2)N(C=2C=CC=CC=2)C(=O)C1CCS(=O)C1=CC=CC=C1 MBGGBVCUIVRRBF-UHFFFAOYSA-N 0.000 description 1
- 229950001820 sultosilic acid Drugs 0.000 description 1
- 230000010741 sumoylation Effects 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 230000008093 supporting effect Effects 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- 238000011477 surgical intervention Methods 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 238000013268 sustained release Methods 0.000 description 1
- 239000012730 sustained-release form Substances 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 229950006534 syrosingopine Drugs 0.000 description 1
- 229940066771 systemic antihistamines piperazine derivative Drugs 0.000 description 1
- 229940106719 tambocor Drugs 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- 229960003080 taurine Drugs 0.000 description 1
- 229940065385 tenex Drugs 0.000 description 1
- 229940108485 tenormin Drugs 0.000 description 1
- 229960000195 terbutaline Drugs 0.000 description 1
- UISARWKNNNHPGI-UHFFFAOYSA-N terodiline Chemical compound C=1C=CC=CC=1C(CC(C)NC(C)(C)C)C1=CC=CC=C1 UISARWKNNNHPGI-UHFFFAOYSA-N 0.000 description 1
- 229960005383 terodiline Drugs 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 229940083085 thiazide derivative acting on arteriolar smooth muscle Drugs 0.000 description 1
- 239000003451 thiazide diuretic agent Substances 0.000 description 1
- 230000008719 thickening Effects 0.000 description 1
- RTKIYNMVFMVABJ-UHFFFAOYSA-L thimerosal Chemical compound [Na+].CC[Hg]SC1=CC=CC=C1C([O-])=O RTKIYNMVFMVABJ-UHFFFAOYSA-L 0.000 description 1
- 229940033663 thimerosal Drugs 0.000 description 1
- 210000000779 thoracic wall Anatomy 0.000 description 1
- 239000003868 thrombin inhibitor Substances 0.000 description 1
- 229950000464 thyropropic acid Drugs 0.000 description 1
- VRORTNGXAKZJML-UHFFFAOYSA-N thyropropic acid Chemical compound IC1=CC(CCC(=O)O)=CC(I)=C1OC1=CC=C(O)C(I)=C1 VRORTNGXAKZJML-UHFFFAOYSA-N 0.000 description 1
- 229940034208 thyroxine Drugs 0.000 description 1
- XUIIKFGFIJCVMT-UHFFFAOYSA-N thyroxine-binding globulin Natural products IC1=CC(CC([NH3+])C([O-])=O)=CC(I)=C1OC1=CC(I)=C(O)C(I)=C1 XUIIKFGFIJCVMT-UHFFFAOYSA-N 0.000 description 1
- WRCITXQNXAIKLR-UHFFFAOYSA-N tiadenol Chemical compound OCCSCCCCCCCCCCSCCO WRCITXQNXAIKLR-UHFFFAOYSA-N 0.000 description 1
- 229960000822 tiadenol Drugs 0.000 description 1
- CVWILQHZFWRYPB-UHFFFAOYSA-N tiamenidine Chemical compound CC1=CSC(Cl)=C1NC1=NCCN1 CVWILQHZFWRYPB-UHFFFAOYSA-N 0.000 description 1
- 229950000164 tiamenidine Drugs 0.000 description 1
- 229940028869 ticlid Drugs 0.000 description 1
- 229960003425 tirofiban Drugs 0.000 description 1
- COKMIXFXJJXBQG-NRFANRHFSA-N tirofiban Chemical compound C1=CC(C[C@H](NS(=O)(=O)CCCC)C(O)=O)=CC=C1OCCCCC1CCNCC1 COKMIXFXJJXBQG-NRFANRHFSA-N 0.000 description 1
- 239000003106 tissue adhesive Substances 0.000 description 1
- 229960002872 tocainide Drugs 0.000 description 1
- 229950001089 todralazine Drugs 0.000 description 1
- JIVZKJJQOZQXQB-UHFFFAOYSA-N tolazoline Chemical compound C=1C=CC=CC=1CC1=NCCN1 JIVZKJJQOZQXQB-UHFFFAOYSA-N 0.000 description 1
- 229960002312 tolazoline Drugs 0.000 description 1
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 229960005461 torasemide Drugs 0.000 description 1
- GYDJEQRTZSCIOI-LJGSYFOKSA-N tranexamic acid Chemical compound NC[C@H]1CC[C@H](C(O)=O)CC1 GYDJEQRTZSCIOI-LJGSYFOKSA-N 0.000 description 1
- 229960000401 tranexamic acid Drugs 0.000 description 1
- 230000005026 transcription initiation Effects 0.000 description 1
- 230000005030 transcription termination Effects 0.000 description 1
- 230000002103 transcriptional effect Effects 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 230000001131 transforming effect Effects 0.000 description 1
- 238000002054 transplantation Methods 0.000 description 1
- 238000010967 transthoracic echocardiography Methods 0.000 description 1
- 229960000363 trapidil Drugs 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- 229960005204 tretoquinol Drugs 0.000 description 1
- RGVPOXRFEPSFGH-AWEZNQCLSA-N tretoquinol Chemical compound COC1=C(OC)C(OC)=CC(C[C@H]2C3=CC(O)=C(O)C=C3CCN2)=C1 RGVPOXRFEPSFGH-AWEZNQCLSA-N 0.000 description 1
- 150000003626 triacylglycerols Chemical class 0.000 description 1
- 229960002268 triflusal Drugs 0.000 description 1
- 229960001177 trimetazidine Drugs 0.000 description 1
- HALWUDBBYKMYPW-STOWLHSFSA-M trimethaphan camsylate Chemical compound C1C[C@@]2(CS([O-])(=O)=O)C(=O)C[C@@H]1C2(C)C.C12C[S+]3CCCC3C2N(CC=2C=CC=CC=2)C(=O)N1CC1=CC=CC=C1 HALWUDBBYKMYPW-STOWLHSFSA-M 0.000 description 1
- 229950005894 trimethidinium methosulfate Drugs 0.000 description 1
- 229950004678 tripamide Drugs 0.000 description 1
- UHLOVGKIEARANS-QZHINBJYSA-N tripamide Chemical compound C1=C(Cl)C(S(=O)(=O)N)=CC(C(=O)NN2C[C@@H]3[C@H]4CC[C@H](C4)[C@@H]3C2)=C1 UHLOVGKIEARANS-QZHINBJYSA-N 0.000 description 1
- SYHDSBBKRLVLFF-UHFFFAOYSA-N triparanol Chemical compound C1=CC(OCCN(CC)CC)=CC=C1C(O)(C=1C=CC(C)=CC=1)CC1=CC=C(Cl)C=C1 SYHDSBBKRLVLFF-UHFFFAOYSA-N 0.000 description 1
- 229950005498 triparanol Drugs 0.000 description 1
- 229960000859 tulobuterol Drugs 0.000 description 1
- WFKWXMTUELFFGS-UHFFFAOYSA-N tungsten Chemical compound [W] WFKWXMTUELFFGS-UHFFFAOYSA-N 0.000 description 1
- 229910052721 tungsten Inorganic materials 0.000 description 1
- 239000010937 tungsten Substances 0.000 description 1
- 241001529453 unidentified herpesvirus Species 0.000 description 1
- 229940035893 uracil Drugs 0.000 description 1
- 229960001130 urapidil Drugs 0.000 description 1
- VBEQCZHXXJYVRD-GACYYNSASA-N uroanthelone Chemical compound C([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CS)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)C(C)C)[C@@H](C)O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CCSC)NC(=O)[C@H](CS)NC(=O)[C@@H](NC(=O)CNC(=O)CNC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CS)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CS)NC(=O)CNC(=O)[C@H]1N(CCC1)C(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC(N)=O)C(C)C)[C@@H](C)CC)C1=CC=C(O)C=C1 VBEQCZHXXJYVRD-GACYYNSASA-N 0.000 description 1
- 229960005356 urokinase Drugs 0.000 description 1
- 210000003741 urothelium Anatomy 0.000 description 1
- 238000002255 vaccination Methods 0.000 description 1
- 229960005486 vaccine Drugs 0.000 description 1
- 238000001291 vacuum drying Methods 0.000 description 1
- 238000010200 validation analysis Methods 0.000 description 1
- 229960004699 valsartan Drugs 0.000 description 1
- SJSNUMAYCRRIOM-QFIPXVFZSA-N valsartan Chemical compound C1=CC(CN(C(=O)CCCC)[C@@H](C(C)C)C(O)=O)=CC=C1C1=CC=CC=C1C1=NN=N[N]1 SJSNUMAYCRRIOM-QFIPXVFZSA-N 0.000 description 1
- 208000019553 vascular disease Diseases 0.000 description 1
- 210000005166 vasculature Anatomy 0.000 description 1
- 229940099270 vasotec Drugs 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 238000009423 ventilation Methods 0.000 description 1
- 210000003501 vero cell Anatomy 0.000 description 1
- DKRSEIPLAZTSFD-LSDHHAIUSA-N viquidil Chemical compound C12=CC(OC)=CC=C2N=CC=C1C(=O)CC[C@@H]1CCNC[C@@H]1C=C DKRSEIPLAZTSFD-LSDHHAIUSA-N 0.000 description 1
- 229960003353 viquidil Drugs 0.000 description 1
- 230000029812 viral genome replication Effects 0.000 description 1
- 229940063670 visken Drugs 0.000 description 1
- 229960000821 visnadine Drugs 0.000 description 1
- 239000011782 vitamin Substances 0.000 description 1
- 229940088594 vitamin Drugs 0.000 description 1
- 235000013343 vitamin Nutrition 0.000 description 1
- 229930003231 vitamin Natural products 0.000 description 1
- 150000003722 vitamin derivatives Chemical class 0.000 description 1
- 239000011800 void material Substances 0.000 description 1
- 229960005080 warfarin Drugs 0.000 description 1
- PJVWKTKQMONHTI-UHFFFAOYSA-N warfarin Chemical compound OC=1C2=CC=CC=C2OC(=O)C=1C(CC(=O)C)C1=CC=CC=C1 PJVWKTKQMONHTI-UHFFFAOYSA-N 0.000 description 1
- 210000004885 white matter Anatomy 0.000 description 1
- 230000002087 whitening effect Effects 0.000 description 1
- IYEPZNKOJZOGJG-UHFFFAOYSA-N xenbucin Chemical compound C1=CC(C(C(O)=O)CC)=CC=C1C1=CC=CC=C1 IYEPZNKOJZOGJG-UHFFFAOYSA-N 0.000 description 1
- 229950005298 xenbucin Drugs 0.000 description 1
- 229940072358 xylocaine Drugs 0.000 description 1
- 229960000317 yohimbine Drugs 0.000 description 1
- GQDDNDAYOVNZPG-SCYLSFHTSA-N yohimbine Chemical compound C1=CC=C[C]2C(CCN3C[C@@H]4CC[C@H](O)[C@@H]([C@H]4C[C@H]33)C(=O)OC)=C3N=C21 GQDDNDAYOVNZPG-SCYLSFHTSA-N 0.000 description 1
- AADVZSXPNRLYLV-UHFFFAOYSA-N yohimbine carboxylic acid Natural products C1=CC=C2C(CCN3CC4CCC(C(C4CC33)C(O)=O)O)=C3NC2=C1 AADVZSXPNRLYLV-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0652—Cells of skeletal and connective tissues; Mesenchyme
- C12N5/0657—Cardiomyocytes; Heart cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/7105—Natural ribonucleic acids, i.e. containing only riboses attached to adenine, guanine, cytosine or uracil and having 3'-5' phosphodiester links
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
- C07K14/4701—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals not used
- C07K14/4702—Regulators; Modulating activity
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/40—Regulators of development
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2770/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses positive-sense
- C12N2770/00011—Details
- C12N2770/00041—Use of virus, viral particle or viral elements as a vector
- C12N2770/00043—Use of virus, viral particle or viral elements as a vector viral genome or elements thereof as genetic vector
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Medicinal Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Zoology (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Biomedical Technology (AREA)
- Genetics & Genomics (AREA)
- Biochemistry (AREA)
- Epidemiology (AREA)
- Wood Science & Technology (AREA)
- Biotechnology (AREA)
- Molecular Biology (AREA)
- Gastroenterology & Hepatology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Cardiology (AREA)
- Cell Biology (AREA)
- General Engineering & Computer Science (AREA)
- Microbiology (AREA)
- Rheumatology (AREA)
- Toxicology (AREA)
- Immunology (AREA)
- Biophysics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Heart & Thoracic Surgery (AREA)
- General Chemical & Material Sciences (AREA)
- Urology & Nephrology (AREA)
- Vascular Medicine (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
Abstract
Description
本発明は、心臓病学、発生生物学、および分子生物学の領域に一般に関する。より具体的には、心筋細胞における遺伝子調節および細胞生理学に関する。特に、本発明は、心臓線維芽細胞を心筋細胞へ再プログラム化するための様々な転写因子の使用、ならびに心筋梗塞後の瘢痕の防止および修復におけるそのような因子の使用に関する。
心臓発作として一般的に公知の心筋梗塞(MI)または急性心筋梗塞(AMI)は、心臓細胞の死滅を引き起こす、心臓の一部への血液供給の中断である。これは、最も一般的には、動脈壁における脂質(脂肪酸)および白血球(特に、マクロファージ)の不安定な集合体である不安定動脈硬化プラークの破裂後の冠動脈の閉塞(遮断)による。その結果起こる虚血(血液供給の制限)および酸素不足は、十分な期間にわたり未処置のままにされた場合、心臓の筋肉組織(心筋)の傷害または死滅(梗塞)を引き起こし得る。心臓発作は、世界中の男女両方についての主要な死因である。
心筋梗塞を経験した対象の運動耐容能の減少を低下させる方法であって、Tbx5およびMef2C、または、Tbx5発現カセットおよびMef2C発現カセットを該対象へ投与する工程を含む、方法;
心筋梗塞を経験した対象の入院を減少させる方法であって、Tbx5およびMef2C、または、Tbx5発現カセットおよびMef2C発現カセットを該対象へ投与する工程を含む、方法;
Hand2、ミオカルディン、および/もしくはGata4、または、Hand2発現カセット、ミオカルディン発現カセット、および/もしくはGata4発現カセットを該対象へ投与する工程をさらに含む、請求項52記載の方法;
心筋梗塞を経験した対象の生活の質を向上させる方法であって、Tbx5およびMef2C、または、Tbx5発現カセットおよびMef2C発現カセットを該対象へ投与する工程を含む、方法;
心筋梗塞を経験した対象の罹患率を減少させる方法であって、Tbx5およびMef2C、または、Tbx5発現カセットおよびMef2C発現カセットを該対象へ投与する工程を含む、方法;
心筋梗塞を経験した対象の死亡率を減少させる方法であって、Tbx5およびMef2C、または、Tbx5発現カセットおよびMef2C発現カセットを該対象へ投与する工程を含む、方法
が含まれる。上記方法の各々は、前出の態様のいずれかに頼り、前出の態様のいずれかを含んでいてもよく、例えば、具体的には、Hand2、ミオカルディン、および/もしくはGata4、または、Hand2発現カセット、ミオカルディン発現カセット、および/もしくはGata4発現カセットを対象へ投与する工程をさらに含んでいてもよい。
心不全は、世界中の罹患率および死亡率の主因のうちの一つである。米国のみで、300万人の心筋症を有する人々が現在生存しており、毎年さらに400,000例が診断されていると推定されている。心疾患、および冠動脈疾患、心筋梗塞、うっ血性心不全、および心肥大を含むその徴候は、明白に、今日の米国における主要な健康リスクとなっている。これらの疾患に罹患した患者を診断し、処置し、支援するためのコストは、優に数十億ドルに達する。
(時に、配列特異的DNA結合因子と呼ばれる)転写因子とは、特異的なDNA配列に結合し、それにより、DNAからmRNAへの遺伝情報の移動(または転写)を制御するタンパク質である。転写因子は、RNAポリメラーゼ(DNAからRNAへの遺伝情報の転写を実施する酵素)の特異的な遺伝子への動員を(活性化因子として)促進するか、または(抑制因子として)阻止することにより、単独で、または複合体内の他のタンパク質と共に、この機能を実施する。
Tボックス転写因子TBX5は、ヒトにおいてはTBX5遺伝子によりコードされるタンパク質である。この遺伝子は、共通のDNA結合ドメインであるTボックスを共有する遺伝子の系統発生的に保存されたファミリーのメンバーである。Tボックス遺伝子は、発生過程の調節に関与している転写因子をコードする。この遺伝子は、ヒト12番染色体上の関連ファミリーメンバーTボックス3(尺骨乳房症候群)と密接に関連している。コードされたタンパク質は、心臓発生および四肢同一性の特定において役割を果たし得る。この遺伝子の変異は、心臓および上肢に影響を与える発達障害、ホルト・オーラム(Holt-Oram)症候群に関連付けられている。異なるアイソフォームをコードするいくつかの転写物バリアントが、この遺伝子について記載されている。Basson et al.(1997)およびTerrett et al.(1994)を参照のこと。
MADSボックス転写エンハンサー因子2ポリペプチドCとしても公知の筋細胞特異的エンハンサー因子2Cは、ヒトにおいてはMEF2C遺伝子によりコードされるタンパク質である。MEF2CはMef2ファミリーの転写因子である。遺伝子はマイナス鎖上の5q14.3に位置し、200,723塩基長である。コードされたタンパク質は、473アミノ酸を有し、予測分子量は51.221kDである。3種のアイソフォームが同定されている。セリン59およびセリン396におけるリン酸化、リジン391におけるSUMO化、リジン4におけるアセチル化、ならびにタンパク質分解を含む、いくつかの翻訳後修飾が同定されている。成熟タンパク質は核に見出され、遺伝子の発現は出生後の時期に最大となる。
転写因子GATA-4は、ヒトにおいてはGATA4遺伝子によりコードされるタンパク質である。この遺伝子は、ジンクフィンガー転写因子のGATAファミリーのメンバーをコードする。このファミリーのメンバーは、多くの遺伝子のプロモーターに存在するGATAモチーフを認識する。このタンパク質は、胚形成ならびに心筋の分化および機能に関与している遺伝子を調節すると考えられている。この遺伝子の変異は、心中隔欠損にも生殖欠損にも関連付けられている。GATA4は、NKX2-5、TBX5、ZFPM2、血清応答因子、HAND2、およびHDAC2と相互作用することが示されている。White et al.(1995)を参照のこと。
心臓神経堤派生物発現タンパク質(Heart- and neural crest derivatives-expressed protein)2は、ヒトにおいては、HAND2遺伝子によりコードされるタンパク質である。この遺伝子によりコードされたタンパク質は、転写因子の塩基性ヘリックスループヘリックスファミリーに属する。この遺伝子産物は、発生中の心室において非対称的に発現され、心臓形態形成において必須の役割を果たす、2種の密接に関連するファミリーメンバーHANDタンパク質のうちの1種である。それらは、相補的に作用して、右心室および大動脈弓の形成において機能し、従って、先天性心疾患のメディエーターとして関係付けられている。さらに、この転写因子は、四肢および鰓弓の発生において重要な役割を果たす。Russell et al.(1999)を参照のこと。
ミオカルディンは、ヒトにおいてはMYOCD遺伝子によりコードされるタンパク質である。ミオカルディンは、血清応答因子の平滑筋および心筋に特異的な転写活性化補助因子である。非筋肉細胞において異所的に発現された場合に、ミオカルディンは、血清応答因子(SRF)との会合により平滑筋分化を誘導することができる。
本発明は、一つの局面において、転写因子の作製および製剤化、ならびに細胞、組織、または対象へのそれらの送達に関する。一般に、タンパク質の組換え作製は周知であり、従って、本明細書には詳細に記載されない。しかしながら、以下に見出される核酸および発現ベクターの考察は、この考察に組み入れられる。
本発明に係るタンパク質を精製することは望ましいと考えられる。タンパク質精製技術は当業者に周知である。これらの技術は、あるレベルにおいて、ポリペプチド画分および非ポリペプチド画分への細胞環境の粗分画を含む。他のタンパク質からポリペプチドを分離した後、関心対象のポリペプチドを、部分精製または完全精製(または均質になるまでの精製)を達成するため、クロマトグラフィ技術および電気泳動技術を使用してさらに精製することができる。純粋なペプチドの調製に特に適合した分析法は、イオン交換クロマトグラフィ、排除クロマトグラフィ;ポリアクリルアミドゲル電気泳動;等電点電気泳動である。ペプチドを精製する特に効率的な方法は、高速タンパク質液体クロマトグラフィまたはさらにはHPLCである。
本発明は、転写因子に連結された(細胞送達ペプチドまたは細胞形質導入ドメインとも呼ばれる)細胞透過性ペプチドの使用を企図する。そのようなドメインは、当技術分野において記載されており、複数のリジン残基およびアルギニン残基をしばしば含有している、短い両親媒性または陽イオン性のペプチドおよびペプチド誘導体であることを一般に特徴とする(Fischer,2007)。その他の例は下記表1に示される。
一般に、タンパク質は、関心対象の細胞へのタンパク質の侵入を促進する製剤として、細胞へ送達される。最も基本的な形態は、リポソームなどの脂質ビヒクルである。例えば、脂質二重層から作成された人工的に調製された小胞であるリポソームが、多様な薬物を送達するために使用されている。リポソームは、(卵ホスファチジルエタノールアミンのような)混合型の脂質鎖またはその他の界面活性剤と共に、天然に由来するリン脂質から構成され得る。特に、陽イオン性または中性の脂質を含有しているリポソームが、薬物の製剤化において使用されている。リポソームは、単層から構成されるミセルおよび逆ミセルと混同されるべきではないが、それらも送達のために使用され得る。
上述のとおりに、ある種の態様において、その後の精製および細胞/対象への送達のため、または遺伝子に基づく送達アプローチにおいて直接使用するため、転写因子産物を発現させるため、発現カセットが用いられる。発現は、適切なシグナルがベクター内に提供され、細胞における関心対象の遺伝子の発現を駆動する、ウイルスおよび哺乳動物両方の起源からのエンハンサー/プロモーターのような様々な調節エレメントを含むことを必要とする。宿主細胞におけるメッセンジャーRNAの安定性および翻訳可能性を最適化するために設計されたエレメントも定義される。産物を発現する永久安定細胞クローンを確立するための多数のドミナント薬物選択マーカーの使用のための条件も提供され、薬物選択マーカーの発現をポリペプチドの発現と関連付けるエレメントも提供される。
本願の全体にわたって、「発現カセット」という用語は、核酸コーディング配列の一部または全部が転写され翻訳され得る、即ち、プロモーターの制御下にある、遺伝子産物をコードする核酸を含有している任意の型の遺伝子構築物を含むものとする。「プロモーター」とは、遺伝子の特異的な転写を開始させるために必要とされる、細胞の合成機構により認識されるか、または合成機構へ導入されるDNA配列をさす。「転写制御下」という語句は、プロモーターが、RNAポリメラーゼ開始および遺伝子の発現を制御するため、核酸に対して正確な位置および方向にあることを意味する。「発現ベクター」とは、複製能を有する遺伝子構築物に含まれており、従って、複製起点、転写終結シグナル、ポリA領域、選択可能マーカー、および多目的クローニング部位のうちの一つまたは複数を含む発現カセットを含むものとする。
本発明のある種の態様において、内部リボソーム結合部位(IRES)エレメントの使用が、多重遺伝子または多シストロン性メッセージを作出するために使用される。IRESエレメントは、5'メチル化Cap依存性翻訳のリボソームスキャニングモデルを回避し、内部部位において翻訳を開始することができる(Pelletier and Sonenberg,1988)。ピコルナウイルス科の2種のメンバー(ポリオおよび脳心筋炎)に由来するIRESエレメントが記載されており(Pelletier and Sonenberg,1988)、哺乳動物メッセージ由来のIRESも記載されている(Macejak and Sarnow,1991)。IRESエレメントは異種オープンリーディングフレームと連結され得る。複数のオープンリーディングフレームが、IRESにより各々分離されて、共に転写され、多シストロン性メッセージを作出することができる。IRESエレメントにより、各オープンリーディングフレームは、効率的な翻訳のためリボソームに対して接近可能となる。複数の遺伝子が、単一のメッセージを転写するため、単一のプロモーター/エンハンサーを使用して、効率的に発現され得る。
発現ベクターを細胞へ導入することができる多数の方法が存在する。本発明のある種の態様において、発現構築物は、ウイルス、またはウイルスゲノムに由来する操作された構築物を含む。ある種のウイルスは、受容体により媒介されるエンドサイトーシスを介して細胞に侵入することができ、宿主細胞ゲノムへ組み込まれ、安定的かつ効率的にウイルス遺伝子を発現することができるため、哺乳動物細胞へ外来遺伝子を移入するための魅力的な候補である(Ridgeway,1988;Nicolas and Rubenstein,1988;Baichwal and Sugden,1986;Temin,1986)。遺伝子ベクターとして使用された最初のウイルスは、パポーバウイルス(サルウイルス40、ウシパピローマウイルス、およびポリオーマ)(Ridgeway,1988;Baichwal and Sugden,1986)ならびにアデノウイルス(Ridgeway,1988;Baichwal and Sugden,1986)を含むDNAウイルスであった。これらは、比較的低い外来DNA配列の収容量を有し、限定された宿主スペクトルを有する。さらに、許容細胞における発癌の可能性および細胞変性効果のため、安全性に問題がある。それらは、8kBまでの外来遺伝材料しか収容し得ないが、多様な細胞株および実験動物へ容易に導入され得る(Nicolas and Rubenstein,1988;Temin,1986)。
上述のとおり、本発明は、新たなMI後治療を提供する。本発明の一つの態様において、MI後の対象の処置の方法は、未処置の患者と比較して、以下の転帰のうちの一つまたは複数を提供する:運動能力の向上、血液駆出量の増加、左室拡張末期圧の減少、肺毛細血管楔入圧の減少、心拍出量の増加、心係数の改善、肺動脈圧の減少、左室拡張末期径および左室収縮末期径の減少、ならびに左室の壁応力の減少、壁張力の減少、および壁厚の減少、右心室についても同様。さらに、処置は、心肥大への進行を防止し、最終的には、心不全への進行を防止し得る。
別の態様において、上述のものなどの他のMI治療モダリティおよびMI後治療モダリティと組み合わせて、本発明の転写治療阻害剤を使用することが構想される。組み合わせは、心臓細胞/患者を、両方の剤を含む単一の組成物もしくは薬理学的製剤と接触させることにより達成されてもよいか、または細胞を、一方の組成物が発現構築物を含み他方が剤を含む2種の別個の組成物もしくは製剤と同時に接触させることにより達成されてもよい。あるいは、転写因子を使用した治療は、数分〜数週間の範囲の間隔で、他の剤の投与に先行してもよいかまたは後続してもよい。他の剤および転写因子が心臓細胞/患者へ別々に適用される態様においては、剤および転写因子が、有利に組み合わせられた効果を細胞に対して発揮することができるよう、各送達の時点の間に有意な期間が空かないことが一般に確実にされると考えられる。そのような場合において、典型的には、相互に約12〜24時間以内、より好ましくは、相互に約6〜12時間以内に、両方のモダリティと細胞を接触させることが企図され、約12時間のみの遅延時間が最も好ましい。しかしながら、いくつかの情況においては、数日(2、3、4、5、6、または7日間)〜数週間(1、2、3、4、5、6、7、または8週間)が、それぞれの投与の間に経過するよう、処置の期間を有意に延長することが望ましい場合がある。
その他の組み合わせも同様に企図される。
急性心筋梗塞のための治療は、梗塞心筋を救済するために可能な限り早く灌流を回復させるよう設計される。これは、典型的には、薬学的介入により、または経皮的冠動脈インターベンション(PCI)もしくは冠動脈バイパス移植のような機械的手段により、行われる。最近の研究は、以下のガイドラインに従った場合、これらの処置がより有効であることを示唆している:PCIについては<90分、溶解薬については<30分。これらのウィンドウから外れた処置は、死亡率の増加、および急性心筋梗塞または心不全のための再入院のリスクの有意な増加に関連していた。
患者の適切な群において適時に投与された場合、血栓溶解治療は、急性心筋梗塞を有する患者の生存率を向上させる。2回またはそれ以上の連続ECG誘導において0.1mVより大きいST部分上昇、新たな左脚ブロック(LBBB)、または後壁梗塞と一致する前部ST低下を有する患者において、PCIの可能性が90分以内に入手可能でない場合の選択は、症状の開始の12時間以内に、血栓溶解薬を投与することである。組織プラスミノーゲン活性化因子(t-PA)は、より高い冠動脈開存率を達成するため、ストレプトキナーゼより好ましい。しかしながら、重要であるのは送達のスピードである。
PCIは、病院到着からバルーン拡張までの時間(door to balloon time)が90分未満であると想定して、STEMIを有する大部分の患者において選択される処置である。PCIは、より大きな冠動脈開存性(>96%の血栓溶解)、より低い出血リスク、および基礎疾患の程度に関する即時の知識を提供する。研究は、初回PCIが、血栓溶解治療より死亡率に関して有益であることを示した。初回PCIの選択は、各患者の受診およびタイミングにより個別化されるべきである。初回PCIは、心原性ショックを有する患者、血栓溶解が失敗した患者、および高い出血リスクを有するかまたは血栓溶解治療が禁忌である者において選択される処置でもある。
薬理学的治療剤および投与法、投薬量等は、当業者に周知であり(例えば、参照により関連部分が本明細書に組み入れられる、「Physicians Desk Reference」、Klaassenの「The Pharmacological Basis of Therapeutics」、「Remington's Pharmaceutical Sciences」、および「The Merck Index,Eleventh Edition」を参照のこと)、本明細書中の開示を考慮して、本発明と組み合わせられ得る。投薬量のある程度の変動が、必ず、処置される対象の状態に依って存在すると考えられる。投与を担う者は、いかなる場合も、個々の対象のための適切な用量を決定すると考えられる。そのような個々の決定は、当業者の技術の範囲内にある。
ある種の態様において、「抗高リポ蛋白血症薬」として本明細書において公知の、1種または複数種の血中の脂質および/またはリポタンパク質の濃度を低下させる剤の投与を、特に、アテローム性動脈硬化症および血管組織の肥厚または遮断の処置において、本発明に係る心血管治療と組み合わせることができる。ある種の局面において、抗高リポ蛋白血症剤には、アリールオキシアルカン酸/フィブリン酸誘導体、樹脂/胆汁酸吸着薬、HMG CoAレダクターゼ阻害剤、ニコチン酸誘導体、甲状腺ホルモンもしくは甲状腺ホルモン類似体、種々の剤、またはそれらの組み合わせが含まれ得る。
アリールオキシアルカン酸/フィブリン酸誘導体の非限定的な例には、ベクロブラート(beclobrate)、エンザフィブラート(enzafibrate)、ビニフィブラート(binifibrate)、シプロフィブラート(ciprofibrate)、クリノフィブラート(clinofibrate)、クロフィブラート(atromide-S)、クロフィブリン酸、エトフィブラート(etofibrate)、フェノフィブラート(fenofibrate)、ゲムフィブロジル(gemfibrozil)(lobid)、ニコフィブラート(nicofibrate)、ピリフィブラート(pirifibrate)、ロニフィブラート(ronifibrate)、シムフィブラート(simfibrate)、およびテオフィブラート(theofibrate)が含まれる。
樹脂/胆汁酸吸着薬の非限定的な例には、コレスチラミン(cholybar、questran)、コレスチポール(colestid)、およびポリデキシド(polidexide)が含まれる。
HMG CoAレダクターゼ阻害剤の非限定的な例には、ロバスタチン(mevacor)、プラバスタチン(pravochol)、またはシンバスタチン(zocor)が含まれる。
ニコチン酸誘導体の非限定的な例には、ニコチン酸、アセピモックス(acepimox)、ニセリトロール、ニコクロナート(nicoclonate)、ニコモール、およびオキシニアシン(oxiniacic)酸が含まれる。
甲状腺ホルモンおよびその類似体の非限定的な例には、エトロキサート(etoroxate)、チロプロープ(thyropropic)酸、およびチロキシンが含まれる。
種々の抗高リポ蛋白血症薬の非限定的な例には、アシフラン(acifran)、アザコステロール、ベンフルオレックス、βベンザルブチルアミド、カルニチン、コンドロイチン硫酸、クロメストロン(clomestrone)、デタキストラン(detaxtran)、デキストラン硫酸ナトリウム、5,8,11,14,17-エイコサペンタエン酸、エリタデニン、フラザボール、メグルトール、メリナミド、ミタトリエンジオール(mytatrienediol)、オルニチン、γオリザノール、パンテチン、四酢酸ペンタエリスリトール、αフェニルブチルアミド、ピロザジル(pirozadil)、プロブコール(lorelco)、βシトステロール、スルトシル(sultosilic)酸ピペラジン塩、チアデノール、トリパラノール、およびキセンブシン(xenbucin)が含まれる。
抗動脈硬化症薬の非限定的な例には、ピリジノールカルバメートが含まれる。
ある種の態様において、血餅の除去または防止を補助する剤の投与を、特に、アテローム性動脈硬化症および血管系(例えば、動脈)遮断の処置において、モジュレーターの投与と組み合わせることができる。抗血栓かつ/または線維素溶解剤の非限定的な例には、抗凝固薬、抗凝固薬アンタゴニスト、抗血小板剤、血栓溶解剤、血栓溶解剤アンタゴニスト、またはそれらの組み合わせが含まれる。
抗凝固薬の非限定的な例には、アセノクマロール、アンクロッド、アニシンジオン、ブロミンジオン、クロリンジオン、クメタロール(coumetarol)、シクロクマロール(cyclocumarol)、デキストラン硫酸ナトリウム、ジクマロール、ジフェナジオン、エチルビスクムアセテート(ethyl biscoumacetate)、エチリデンジクマロール(ethylidene dicoumarol)、フルインジオン、ヘパリン、ヒルジン、リアポラート(lyapolate)ナトリウム、オキサジジオン(oxazidione)、ペントサンポリサルフェート、フェニンジオン、フェンプロクモン、ホスビチン、ピコタミド、チオクロマロール、およびワルファリンが含まれる。
抗血小板剤の非限定的な例には、アスピリン、デキストラン、ジピリダモール(persantin)、ヘパリン、スルフィンピラノン(sulfinpyranone)(anturane)、およびチクロピジン(ticlid)が含まれる。
血栓溶解剤の非限定的な例には、組織プラスミノーゲン活性化因子(activase)、プラスミン、プロウロキナーゼ、ウロキナーゼ(abbokinase)、ストレプトキナーゼ(streptase)、アニストレプラーゼ/APSAC(eminase)が含まれる。
患者が、大量出血、または大量出血の可能性の増加に罹患しているある種の態様においては、血液凝固を増強する剤を使用することができる。血液凝固促進剤の非限定的な例には、血栓溶解剤アンタゴニストおよび抗凝固薬アンタゴニストが含まれる。
抗凝固薬アンタゴニストの非限定的な例には、プロタミンおよびビタミンK1が含まれる。
血栓溶解剤アンタゴニストの非限定的な例には、アミノカプロン酸(amicar)およびトラネキサム酸(amstat)が含まれる。抗血栓薬の非限定的な例には、アナグレリド、アルガトロバン、シルスタゾール(cilstazol)、ダルトロバン(daltroban)、デフィブロチド、エノキサパリン、フラキシパリン(fraxiparine)、インドブフェン、ラモパラン(lamoparan)、オザグレル、ピコタミド、プラフィブリド(plafibride)、テデルパリン(tedelparin)、チクロピジン、およびトリフルサルが含まれる。
抗不整脈剤の非限定的な例には、クラスI抗不整脈剤(ナトリウムチャンネルブロッカー)、クラスII抗不整脈剤(βアドレナリンブロッカー)、クラスII抗不整脈剤(再分極延長薬)、クラスIV抗不整脈剤(カルシウムチャンネルブロッカー)、および種々の抗不整脈剤が含まれる。
ナトリウムチャンネルブロッカーの非限定的な例には、クラスIA、クラスIB、およびクラスICの抗不整脈剤が含まれる。クラスIA抗不整脈剤の非限定的な例には、ジソピラミド(norpace)、プロカインアミド(pronestyl)、およびキニジン(quinidex)が含まれる。クラスIB抗不整脈剤の非限定的な例には、リドカイン(xylocaine)、トカイニド(tonocard)、およびメキシレチン(mexitil)が含まれる。クラスIC抗不整脈剤の非限定的な例には、エンカイニド(enkaid)およびフレカイニド(tambocor)が含まれる。
βアドレナリンブロッカー、βアドレナリンアンタゴニスト、またはクラスII抗不整脈剤としても公知のβブロッカーの非限定的な例には、アセブトロール(sectral)、アルプレノロール、アモスラロール、アロチノロール、アテノロール、ベフノロール、ベタキソロール、ベバントロール、ビソプロロール、ボピンドロール、ブクモロール、ブフェトロール、ブフラロール、ブニトロロール、ブプラノロール、ブチドリン(butidrine)塩酸塩、ブトフィロロール(butofilolol)、カラゾロール(carazolol)、カルテオロール、カルベジロール、セリプロロール、セタモロール(cetamolol)、クロラノロール、ジレバロール、エパノロール、エスモロール(brevibloc)、インデノロール、ラベタロール、レボブノロール、メピンドロール、メチプラノロール、メトプロロール、モプロロール(moprolol)、ナドロール、ナドキソロール(nadoxolol)、ニフェナロール(nifenalol)、ニプラジロール、オクスプレノロール、ペンブトロール、ピンドロール、プラクトロール、プロネタロール、プロパノロール(propanolol)(inderal)、ソタロール(betapace)、スルフィナロール(sulfinalol)、タリノロール、テルタトロール、チモロール、トリプロロール(toliprolol)、およびキシビノロール(xibinolol)が含まれる。ある種の局面において、βブロッカーには、アリールオキシプロパノールアミン誘導体が含まれる。アリールオキシプロパノールアミン誘導体の非限定的な例には、アセブトロール、アルプレノロール、アロチノロール、アテノロール、ベタキソロール、ベバントロール、ビソプロロール、ボピンドロール、ブニトロロール、ブトフィロロール(butofilolol)、カラゾロール(carazolol)、カルテオロール、カルベジロール、セリプロロール、セタモロール(cetamolol)、エパノロール、インデノロール、メピンドロール、メチプラノロール、メトプロロール、モプロロール(moprolol)、ナドロール、ニプラジロール、オクスプレノロール、ペンブトロール、ピンドロール、プロパノロール(propanolol)、タリノロール、テルタトロール、チモロール、およびトリプロロール(toliprolol)が含まれる。
クラスIII抗不整脈剤としても公知の、再分極を延長する剤の非限定的な例には、アミオダロン(cordarone)およびソタロール(betapace)が含まれる。
クラスIV抗不整脈剤としても公知のカルシウムチャンネルブロッカーの非限定的な例には、アリールアルキルアミン(例えば、ベプリジル(bepridile)、ジルチアゼム、フェンジリン、ガロパミル、プレニラミン、テロジリン、ベラパミル)、ジヒドロピリジン誘導体(フェロジピン、イスラジピン、ニカルジピン、ニフェジピン、ニモジピン、ニソルジピン、ニトレンジピン)、ピペラジン誘導体(例えば、シンナリジン、フルナリジン、リドフラジン)、またはベンシクラン、エタフェノン、マグネシウム、ミベフラジル、もしくはペルヘキリンのような種々のカルシウムチャンネルブロッカーが含まれる。ある種の態様において、カルシウムチャンネルブロッカーには、長時間作用型ジヒドロピリジン(ニフェジピン型)カルシウムアンタゴニストが含まれる。
種々の抗不整脈剤の非限定的な例には、アデノシン(adenocard)、ジゴキシン(lanoxin)、アセカイニド、アジュマリン、アモプロキサン(amoproxan)、アプリンジン、ブレチリウムトシレート、ブナフチン、ブトベンジン(butobendine)、カポベン(capobenic)酸、シフェンリン、ジソピラニド(disopyranide)、ヒドロキニジン(hydroquinidine)、インデカイニド、イパトロピウム(ipatropium)ブロミド、リドカイン、ロラジミン、ロルカイニド、メオベンチン(meobentine)、モリシジン、ピルメノール、プラジュマリン、プロパフェノン、ピリノリン(pyrinoline)、ポリガラクツロン酸キニジン、硫酸キニジン、およびビキジル(viquidil)が含まれる。
降圧剤の非限定的な例には、交感神経遮断薬、α/βブロッカー、αブロッカー、抗アンジオテンシンII剤、βブロッカー、カルシウムチャンネルブロッカー、血管拡張薬、および種々の降圧薬が含まれる。
αアドレナリンブロッカーまたはαアドレナリンアンタゴニストとしても公知のαブロッカーの非限定的な例には、アモスラロール、アロチノロール、ダピプラゾール、ドキサゾシン、エルゴロイドメシル酸塩、フェンスピリド、インドラミン、ラベタロール、ニセルゴリン、プラゾシン、テラゾシン、トラゾリン、トリマゾシン、およびヨヒンビンが含まれる。ある種の態様において、αブロッカーには、キナゾリン誘導体が含まれ得る。キナゾリン誘導体の非限定的な例には、アルフゾシン、ブナゾシン、ドキサゾシン、プラゾシン、テラゾシン、およびトリマゾシンが含まれる。
ある種の態様において、降圧剤は、αアドレナリン作用およびβアドレナリン作用の両方に対するアンタゴニストである。α/βブロッカーの非限定的な例には、ラベタロール(normodyne、trandate)が含まれる。
抗アンジオテンシンII剤の非限定的な例には、アンジオテンシン変換酵素阻害剤およびアンジオテンシンII受容体アンタゴニストが含まれる。アンジオテンシン変換酵素阻害剤(ACE阻害剤)の非限定的な例には、アラセプリル、エナラプリル(vasotec)、カプトプリル、シラザプリル、デラプリル、エナラプリラート、ホシノプリル、リシノプリル、モベルトプリル(moveltopril)、ペリンドプリル、キナプリル、およびラミプリルが含まれる。アンジオテンシンII受容体アンタゴニスト、ANG受容体ブロッカー、またはANG-II 1型受容体ブロッカー(ARBS)としても公知のアンジオテンシンII受容体ブロッカーの非限定的な例には、アンジオカンデサルタン(angiocandesartan)、エプロサルタン、イルベサルタン、ロサルタン、およびバルサルタンが含まれる。
交感神経遮断薬の非限定的な例には、中枢作用性交感神経遮断薬または末梢作用性交感神経遮断薬が含まれる。中枢神経系(CNS)交感神経遮断薬としても公知の中枢作用性交感神経遮断薬の非限定的な例には、クロニジン(catapres)、グアナベンズ(wytensin)、グアンファシン(tenex)、およびメチルドーパ(aldomet)が含まれる。末梢作用性交感神経遮断薬の非限定的な例には、神経節遮断剤、アドレナリン作動性神経遮断剤、βアドレナリン遮断剤、またはα1アドレナリン遮断剤が含まれる。神経節遮断剤の非限定的な例には、メカミルアミン(inversine)およびトリメタファン(arfonad)が含まれる。アドレナリン作動性神経遮断剤の非限定的な例には、グアネチジン(ismelin)およびレセルピン(serpasil)が含まれる。βアドレナリンブロッカーの非限定的な例には、アセニトロール(acenitolol)(sectral)、アテノロール(tenormin)、ベタキソロール(kerlone)、カルテオロール(cartrol)、ラベタロール(normodyne、trandate)、メトプロロール(lopressor)、ナダノール(nadanol)(corgard)、ペンブトロール(levatol)、ピンドロール(visken)、プロプラノロール(inderal)、およびチモロール(blocadren)が含まれる。α1アドレナリンブロッカーの非限定的な例には、プラゾシン(minipress)、ドキサゾシン(doxazocin)(cardura)、およびテラゾシン(hytrin)が含まれる。
ある種の態様において、心血管治療剤には、血管拡張薬(例えば、脳血管拡張薬、冠血管拡張薬、または末梢血管拡張薬)が含まれ得る。ある種の好ましい態様において、血管拡張薬には冠血管拡張薬が含まれる。冠血管拡張薬の非限定的な例には、アモトリフェン(amotriphene)、ベンダゾール(bendazol)、ベンフロジルヘミスクシネート(benfurodil hemisuccinate)、ベンズヨーダロン、クロラシジン(chloracizine)、クロモナール、クロベンフロール(clobenfurol)、クロニトラート(clonitrate)、ジラゼプ、ジピリダモール、ドロプレニラミン(droprenilamine)、エフロキサート、四硝酸エリスリチル、エタフェノン、フェンジリン、フロレジル(floredil)、ガングレフェン(ganglefene)、ヘレストロール(herestrol)ビス(βジエチルアミノエチルエーテル)、ヘキソベンジン、イトラミントシレート、ケリン、リドフラニン(lidoflanine)、六硝酸マンニトール、メジバジン(medibazine)、ニコルグリセリン(nicorglycerin)、四硝酸ペンタエリスリトール、ペントリニトロール(pentrinitrol)、ペルヘキシリン、ピメフィリン(pimefylline)、トラピジル、トリクロミル(tricromyl)、トリメタジジン、リン酸トロールニトラート、およびビスナジンが含まれる。
種々の降圧薬の非限定的な例には、アジュマリン、γアミノ酪酸、ブフェニオド(bufeniode)、シクレタイニン(cicletainine)、シクロシドミン(ciclosidomine)、タンニン酸クリプテナミン、フェノルドパム、フロセキナン、ケタンセリン、メブタメート、メカミルアミン、メチルドーパ、メチル4-ピリジルケトンチオセミカルバゾン、ムゾリミン、パルギリン、ペンピジン、ピナシジル、ピペロキサン、プリマペロン(primaperone)、プロトベラトリン、ラウバシン(raubasine)、レシメトール(rescimetol)、リルメニデン(rilmenidene)、サララシン、ニトロプルシドナトリウム、チクリナフェン、カンシル酸トリメタファン、チロシナーゼ、およびウラピジルが含まれる。
ベンゾチアジアジン誘導体の非限定的な例には、アルチジド(althizide)、ベンドロフルメチアジド、ベンズチアジド、ベンチルヒドロクロロチアジド、ブチアジド(buthiazide)、クロロチアジド、クロルサリドン、シクロペンチアジド、シクロチアジド、ジアゾキシド、エピチアジド(epithiazide)、エチアジド、フェンキゾン、ヒドロクロロチアジド、ヒドロフルメチアジド、メチクロチアジド、メチクラン、メトラゾン、パラフルチジド(paraflutizide)、ポリチアジド、テトラクロルメチアジド、およびトリクロルメチアジドが含まれる。
N-カルボキシアルキル(ペプチド/ラクタム)誘導体の非限定的な例には、アラセプリル、カプトプリル、シラザプリル、デラプリル、エナラプリル、エナラプリラート、ホシノプリル、リシノプリル、モベルチプリル(moveltipril)、ペリンドプリル、キナプリル、およびラミプリルが含まれる。
ジヒドロピリジン誘導体の非限定的な例には、アムロジピン、フェロジピン、イスラジピン、ニカルジピン、ニフェジピン、ニルバジピン、ニソルジピン、およびニトレンジピンが含まれる。
グアニジン誘導体の非限定的な例には、ベタニジン、デブリソキン、グアナベンズ、グアナクリン(guanacline)、グアナドレル、グアナゾジン、グアネチジン、グアンファシン、グアノクロル、グアノキサベンズ、およびグアノキサンが含まれる。
ヒドラジン系/フタラジン系の非限定的な例には、ブドララジン、カドララジン、ジヒドララジン、エンドララジン、ヒドラカルバジン(hydracarbazine)、ヒドララジン、フェニプラジン(pheniprazine)、ピルドララジン(pildralazine)、およびトドララジンが含まれる。
イミダゾール誘導体の非限定的な例には、クロニジン、ロフェキシジン、フェントラミン、チアメニジン(tiamenidine)、およびトロニジンが含まれる。
四級アンモニウム化合物の非限定的な例には、アザメトニウム(azamethonium)ブロミド、クロルイソンダミン(chlorisondamine)クロリド、ヘキサメトニウム、ペンタシニウム(pentacynium)ビス(メチルスルフェート)、ペンタメトニウムブロミド、酒石酸ペントリニウム、フェナクトロピニウム(phenactropinium)クロリド、およびトリメチジニウムメトスルフェート(trimethidinium methosulfate)が含まれる。
レセルピン誘導体の非限定的な例には、ビエタセルピン、デセルピジン、レシンナミン、レセルピン、およびシロシンゴピンが含まれる。
スルホンアミド誘導体の非限定的な例には、アムブシド(ambuside)、クロパミド、フロセミド、インダパミド、キネタゾン、トリパミド、およびキシパミドが含まれる。
血管収縮薬は、一般に、外科的手技の間に起こり得るショックの際に血圧を増加させるために使用される。昇圧薬としても公知の血管収縮薬の非限定的な例には、アメジニウムメチル硫酸塩、アンジオテンシンアミド、ジメトフリン、ドーパミン、エチフェルミン(etifelmin)、エチレフリン、ゲペフリン、メタラミノール、ミドドリン、ノルエピネフリン、フォレドリン(pholedrine)、およびシネフリンが含まれる。
うっ血性心不全の処置のための剤の非限定的な例には、抗アンジオテンシンII剤、後負荷-前負荷低下処置、利尿薬、および変力剤が含まれる。
ある種の態様において、アンジオテンシンアンタゴニストを耐容し得ない動物患者を、組み合わせ治療により処置することができる。そのような治療は、ヒドララジン(apresoline)およびイソソルビドジニトレート(isordil、sorbitrate)の投与を組み合わせることができる。
利尿薬の非限定的な例には、チアジド誘導体もしくはベンゾチアジアジン誘導体(例えば、アルチアジド、ベンドロフルメチアジド、ベンズチアジド、ベンジルヒドロクロロチアジド、ブチアジド、クロロチアジド、クロロチアジド、クロルサリドン、シクロペンチアジド、エピチアジド、エチアジド、エチアジド、フェンキゾン、ヒドロクロロチアジド、ヒドロフルメチアジド、メチクロチアジド、メチクラン、メトラゾン、パラフルチジド、ポリチジド(polythizide)、テトラクロロメチアジド(tetrachloromethiazide)、トリクロルメチアジド)、有機水銀化合物(例えば、クロルメロドリン、メラルリド(meralluride)、メルカンファミド(mercamphamide)、メルカプトメリンナトリウム、メルクマリル(mercumallylic)酸、メルクマチリンナトリウム(mercumatilin dodium)、塩化第一水銀、マーサリル)、プテリジン(例えば、フルテレン(furterene)、トリアムテレン)、プリン系(例えば、アセフィリン、7-モルホリノメチルテオフィリン、パモブロム(pamobrom)、プロテオブロミン(protheobromine)、テオブロミン)、アルドステロンアンタゴニストを含むステロイド(例えば、カンレノン、オレアンドリン(oleandrin)、スピロノラクトン)、スルホンアミド誘導体(例えば、アセタゾラミド、アムブシド、アゾセミド、ブメタニド、ブタゾラミド(butazolamide)、クロルアミノフェナミド(chloraminophenamide)、クロフェナミド、クロパミド、クロレキソロン、ジフェニルメタン-4,4'-ジスルホンアミド、ジスルファミド(disulfamide)、エトキシゾラミド、フロセミド、インダパミド、メフルシド、メタゾラミド、ピレタニド、キネタゾン、トラセミド、トリパミド、キシパミド)、ウラシル(例えば、アミノメトラジン(aminometradine)、アミソメトラジン(amisometradine)、カリウム保持性アンタゴニスト(例えば、アミロライド、トリアムテレン)、またはアミノジン(aminozine)、アルブチン、クロラザニル(chlorazanil)、エタクリン酸、エトゾリン、ヒドラカルバジン、イソソルビド、マンニトール、メトカルコン(metochalcone)、ムゾリミン、ペルヘキシリン、チクルナフェン(ticrnafen)、および尿素のような種々の利尿薬が含まれる。
強心薬としても公知の陽性変力剤の非限定的な例には、アセフィリン、アセチルジゴキシン、2-アミノ-4-ピコリン、アムリノン、ベンフロジルヘミスクシネート、ブクラデシン、セルベロシン(cerberosine)、カンフォタミド(camphotamide)、コンバラトキシン(convallatoxin)、シマリン、デノパミン、デスラノシド、ジギタリン、ジギタリス、ジギトキシン、ジゴキシン、ドブタミン、ドーパミン、ドペキサミン、エノキシモン、エリスロフレイン(erythrophleine)、フェナルコミン(fenalcomine)、ギタリン(gitalin)、ギトキシン(gitoxin)、グリコシアミン、ヘプタミノール、ヒドラスチニン(hydrastinine)、イボパミン、ラナトシド、メタミバム(metamivam)、ミルリノン、ネリフォリン(nerifolin)、オレアンドリン、ウアバイン、オキシフェドリン、プレナルテロール、プロシラリジン(proscillaridine)、レシブフォゲニン(resibufogenin)、シラレン(scillaren)、シラレニン(scillarenin)、ストルファンシン(strphanthin)、スルマゾール、テオブロミン、およびキサモテロールが含まれる。
抗狭心症剤には、有機硝酸化合物、カルシウムチャンネルブロッカー、βブロッカー、およびそれらの組み合わせが含まれ得る。
ある種の局面において、二次的な治療剤には、PCIのような何らかの型の手術が含まれ得る。手術、特に、根治手術は、本発明、および1種または複数種の他の薬理学的剤のなどの他の治療と共に使用され得る。血管および心血管の疾患および障害のためのそのような外科アプローチは、当業者に周知であり、この文書中に別途記載される。
臨床適用が企図される場合、薬学的組成物は、意図された適用のために適切な型で調製されると考えられる。一般に、これは、発熱性物質およびヒトまたは動物にとって有害であり得るその他の不純物を本質的に含まない組成物を調製することを要すると考えられる。
以下の実施例は、本発明の様々な局面をさらに例示するために含まれる。実施例において開示される技術は、本発明の実施においてよく機能することが本発明者らにより発見された技術および/または組成物を表し、従って、その実施のための好ましいモードを構成すると見なされ得ることが、当業者により認識されるべきである。しかしながら、当業者は、本開示を考慮すれば、開示された具体的な態様に多くの変化を施しても、本発明の本旨および範囲から逸脱することなく、同様のまたは類似の結果を入手することが可能であることを認識するべきである。
刻まれた組織から線維芽細胞を遊走させ、線維芽細胞増殖培地において増殖させる外植法により、成体のTTFおよびCFを単離した。線維芽細胞を、ポリブレン(Sigma;6μg/ml)と、Platinum E細胞(Cell Biolabs)から作成された転写因子を発現する新鮮なレトロウイルスとの混合物により形質導入した。ウイルス形質導入の24時間後、ウイルス培地を心臓誘導培地に交換した。2日毎に培地を交換した。心臓遺伝子の発現を、フローサイトメトリー、リアルタイムPCR、および免疫細胞化学により分析した。8〜10週齢の成体マウスに、偽手術、または左心耳の1.5mm遠位におけるLADの結紮のいずれかを施した。濃縮レトロウイルス(およそ108pfuウイルス)を、気密1710注射器(Hamilton)を使用して、境界領域に注射した。心エコーを使用して心機能を査定し、組織学的研究のため、安楽死させた動物から心臓を採集した。成体心筋細胞の単離、電気生理学的測定、組織学的分析、および免疫組織化学分析は、以前に記載されたとおりに実施された(19〜22)。
尾先端部(tail-tip)線維芽細胞(TTF):成体マウスの尾部を除膜し、小片へ切断し、それを組織培養ディッシュ上に播種し、15%FBSおよび抗生物質が補足されたDMEMで培養した。2〜3日毎に培地を交換した。TTFは、2日後または3日後に外に遊走した。1週間後、TTFを凍結させるかまたはウイルス形質導入のために再播種した。心臓線維芽細胞(CF):成体(4週齢超)マウスの心臓を小片へ刻み、組織培養ディッシュ上に播種した。3分後、培養培地(DMEM:199(4:1)、15%FBS、および抗生物質)を、ディッシュに穏和に添加した。CFは、2日後に、刻まれた心組織の外へ遊走し始めた。2日毎に培地を交換した。10日後、CFを凍結させるかまたはウイルス形質導入のために再播種した。
EGFP、Mycタグ付きのNkx2-5、GATA4、Tbx5、HAND2、MEF2C、およびFLAGタグ付きのMesP1のcDNAを、レトロウイルスベクターpBabe-X(Kitamura et al.,1995)へサブクローニングすることにより、レトロウイルスプラスミドDNAを生成した。トランスフェクションの24時間前に、1ディッシュ当たり3×106個の密度で10cm組織培養ディッシュ上に播種されたPlatinum E細胞(Cell Biolabs)へ、Fugene 6(Roche)を使用して、10μgのレトロウイルスプラスミドDNAをトランスフェクトした。トランスフェクションの12時間後、培地を12mlの新鮮な培地(10%FBSおよび抗生物質が補足されたDMEM)に交換した。36時間のトランスフェクションの後、ウイルス培地を採集し、0.45μmセルロースフィルターでろ過した。ウイルス上清を、6μg/mlの最終濃度でポリブレン(Sigma)と混合した。
TTFおよびCFを、0.8×104/cm2の密度で、SureCoat(Cellutron)により予めコーティングされた組織培養ディッシュ上に播種した。24時間後、線維芽細胞増殖培地を、新鮮に作成されたウイルスとポリブレンとの混合物に交換した。24時間後、ウイルス培地を、新生仔ラット/マウス心筋細胞から入手された10%条件培地、DMEM/199(4:1)、10%FBS、5%ウマ血清、抗生物質、非必須アミノ酸、必須アミノ酸、B-27、インスリン-セレン-トランスフェリン、ビタミン混合物、およびピルビン酸ナトリウムから構成された誘導培地(Invitrogen)に交換した。条件培地を、0.22μm孔サイズセルロースフィルターでろ過した。細胞を採集するまで、2日毎に培地を交換した。qPCR、ウエスタンブロット分析、および免疫細胞化学。全RNAを培養細胞から抽出し、cDNAを逆転写により合成した。全てのqPCRプローブをApplied Biosystemsから入手した。ウエスタンブロットを、抗Myc抗体(Santa Cruz、クローンA-14、1:1000)および抗FLAG抗体(Sigma、1:2000)により実施した。免疫細胞化学のため、細胞を4%パラホルムアルデヒドで固定し、一次抗体:抗GFP(Torrey Pines Biolabs、1:400)、抗cTnT(Thermo Scientific、1:400)、抗Myc(Santa Cruze、クローンA-14、1:200)、抗P4HB(ProteinTech、1:200)、および抗αアクチニン(Sigma、1:400)と共にインキュベートした。PBSにより洗浄した後、Alexa蛍光発生二次抗体(Invitrogen)を使用して、シグナルを検出した。
未感染CF、空ベクターまたはGHMTレトロウイルスのいずれかにより形質導入されたCF、および成体心臓から、全RNAを単離した。マイクロアレイ分析は、University of Texas Southwestern Medical CenterのDNA Microarray Core Facilityによりillumina Mouse-6 Beadchipのプラットフォームで実施された。データはGeneSpring GXソフトウェア(Agilent)を使用して分析された。
αMHC-GFP発現を検出するための一次アッセイ法のため、付着細胞をPBSにより洗浄し、37℃で10分間のaccutase(Millipore)による処理により培養ディッシュから剥離した。次いで、細胞を2%FBSを含むPBSにより洗浄し、細胞ストレーナーでろ過した。細胞を、室温で15分間、ヨウ化プロピジウム(1%FBSを含むPBSによる1:1000希釈物)と共にインキュベートした。死細胞をヨウ化プロピジウム染色により排除し、生細胞をFACS Caliber(BD Sciences)およびFlowJoソフトウェアを使用してGFP発現について分析した。心臓特異的なマーカーについての細胞内染色のため、細胞を上記のとおりに採集した後、15分間、4%パラホルムアルデヒドで固定した。固定された細胞を、PBSにより洗浄し、室温で10分間、サポニンにより透過性化した。PBSにより洗浄した後、細胞を、5%ヤギおよびロバ血清を含むPBSと共に室温で30分間インキュベートし、続いて、一次抗体(0.2%ヤギおよびロバ血清を含むPBSで1:100希釈されたウサギポリクローナル抗GFP抗体(Invitrogen)および1:400希釈されたマウスモノクローナル抗cTnT抗体(Thermo Scientific))と共に室温で30分間インキュベートした。PBSにより2回洗浄した後、細胞を二次抗体と共に室温で30分間インキュベートした。二次抗体は、0.2%ヤギおよびロバ血清を含有しているPBSで1:200希釈されたヤギ抗ウサギAlexa fluor 488(Invitrogen)および1:400希釈されたロバ抗マウスCy5(Jackson Laboratory)であった。細胞を、PBSにより3回洗浄し、次いで、FACS Caliber(BD sciences)およびFlowJoソフトウェアを使用して、GFPおよびcTnTの発現について分析した。
3ヶ月齢のTcf21iCre/+:R26RtdTマウスを、経管栄養により、連続3日間、0.2mg/gmタモキシフェンにより誘導し、1週間後に、心臓を単離し、以前に記載されたとおりに(Russell et al.,2011)、FACS選別のための単一細胞懸濁物を生成するために加工した(心房および大動脈肺動脈幹を除去した)。懸濁物を組織ストレーナーでろ過し、400gで5分間遠心分離し、10%CM培地(10% Hyclone FBS、3:1 DMEM/M-199、1% 1モル/L HEPES、1.2%抗生物質/抗真菌薬)に再懸濁させた後、Summitソフトウェアを使用して、MoFloフローサイトメーター(Cytomation Inc)により選別した。転写物分析のため、選別された細胞を、RNA抽出用の溶解緩衝液(Ambion製のRNAqueous Microキット)へ収集した。各試料の一画分を、選別後の純度の査定のため、PBSへも収集した。Superscript III逆転写酵素(Invitrogen)およびランダムヘキサマー(Roche)を使用して、相補DNAを合成した。CFX96装置(Bio-Rad)上でiTAQ SYBR Greenマスターミックス(Bio-Rad)を用いた標準的なqPCR法を使用して、遺伝子発現プロファイルを生成した。試料をトリプリケートで実行し、シクロフィリン発現に対して規準化した。未選別集団に対する濃縮倍率を決定した。
マウスにイソフルランで麻酔をかけ、ポリエチレン管(サイズ60)を挿管し、次いで、120サイクル/分の呼吸数で2〜3ml/サイクルで従量式げっ歯動物人工呼吸器により換気した。第3肋間腔で開胸術を実施し、LADを可視化するため、第3肋骨と第4肋骨とを分離するために自己把持型マイクロリトラクターを置いた。次いで、左主冠動脈の分岐点直後の、左心耳の1.5mm遠位において、LAD下に7.0プロリン縫合糸(Ethicon,Johnson & Johnson,Brussels,Belgium)を通した。LADを二重に結紮した。左心室の前壁の色の変化(蒼白化)により、閉塞を確認した。偽手術マウスは、結紮なしの同一の手技を受けた。LADの結紮直後に、濃縮レトロウイルス50μlを、気密1710注射器(Hamilton)を使用して、MIの境界領域の5つの異なる区域に注射した。次いで、胸壁を5.0 Dexon吸収性縫合糸(Tyco Healthcare,United States Surgical,USA)により閉鎖し、皮膚をTopical Tissue Adhesive(Abbott Laboratory,IL,USA)により閉鎖した。マウスから抜管し、加熱ランプ下で手術から回復させた。マウス外科医に対しては盲検で行われた。MI後1日目にFS>30%を有するマウスは、研究から除外された。
VisualSonics Vevo2100画像システムを使用して、意識のあるマウスにおいて、二次元経胸壁心エコーにより心機能を評価した。短縮率(FS)および駆出率(EF)を心臓収縮機能の指数として使用した。拡張末期(LVIDd)および収縮末期(LVIDs)におけるLV内径を測定するため、Mモードトレーシングを使用した。FSを下記式により算出した。
FS(%)=[(LVIDd-LVIDs)/LVIDd]×100
EFは、(LVEDV-LVESV)/LVEDV 100%から推定される。左室収縮末期容積、LVESV;左室拡張末期容積、LVEDV。全ての測定が、経験を積んだ手術者により盲研で実施された。
MIの6週間後および12週間後、38mmバードケージ型RFコイルを有する7T小動物用MRスキャナ(Varian,Inc,Palo Alto,CA)を使用して、心臓MRIにより、マウスの心機能を再評価した。医療用空気と混合された1.5〜2%イソフルランのノーズコーンを介した吸入による麻酔の下で、心臓感知のための含気呼吸器センサーおよびECG電極が装備されたマウススレッド(Dazai Research Instruments)に、腹臥位で、RFコイルの中心に対して頭部を先頭に、心臓を中心にして、動物を置いた。マウス胸部を剪毛し、電極とマウスとの間のECG接触を最適化するために伝導ゲルを塗布した。全てのMRI取得が、心臓誘発および呼吸誘発の両方を使用してゲーティングされた。適度の一定の心拍数を確実にするため、口径温度は35℃に維持された。各マウスにおいて、心臓の長軸を決定するため、3つの直交面(横断、冠状、および矢状)で二次元(2D)勾配エコー画像を取得した。心臓の長軸に対して垂直の軸画像をシネイメージングのために選んだ。1心周期当たり12相のシネ画像を、2.75msのエコー時間、反復時間=EKG R-R間隔/12、45°のフリップ角、およびNEX=4で入手した。各スキャンは、1mm厚、128×128のマトリックスサイズ、および30×30mmの視野を有する、尖部からLV流出部への7〜10の連続スライスからなっていた。NIH ImageJソフトウェアを使用した左室収縮末期容積および左室拡張末期容積(LVESV、LVEDV)の算出のため、心外膜および心内膜の境界を手動でトレーシングした。全LV容積を、全てのスライスの容積の総計として算出した。一回拍出量を式LVEDV-LVESVにより算出した。EFを、式(LVEDV-LVESV)/LVEDV 100%により算出した。MRIの取得および分析を実施する研究者には、マウス群の割り当てが知らされなかった。
タモキシフェン(Sigma)を50mg/mlの濃度でゴマ油(90%)およびエタノール(10%)に溶解させた。Cre活性を誘導するため、タモキシフェン(0.2mg/g体重)を、それぞれ、連続3〜5日間または7日間、Tcf21iCre/+:R26RtdTまたはαMHC-MerCreMer(Sohal et al.,2001);Rosa26-LacZを保持しているマウスへ、22ゲージ給餌針による経管栄養により投与した。最後の投薬量の経口経管栄養後8日目に、マウスを分析するかまたはMI手術に供した。
以前に記載された酵素消化および機械的分散の方法21を使用して、マウス心筋細胞を単離した。簡単に説明すると、Ca2+不含クレブスリンゲル緩衝液(KR、35mM NaCl、4.75mM KCl、1.19mM KH2PO4、16mM Na2HPO4、134mMショ糖、25mM NaCO3、10mMグルコース、10mM HEPES、NaOHによりpH7.4)およびその後のコラゲナーゼ溶液(コラゲナーゼII、8mg/mL)による逆行性灌流の後、微細なメスおよびハサミを使用してLV筋細胞を分離した。温和な粉砕の後、細胞を、KB溶液(10mMタウリン、70mMグルタミン酸、25mM KC1、10mM KH2PO4、22mMグルコース、0.5mM EGTA、KOHによりpH7.2)中に維持し、室温で6時間以内に研究した。筋細胞収縮能を調査するため、単離された心筋細胞を、33μm C12FDGと共に30分間インキュベートした。緑色C12FDG+心筋細胞を蛍光顕微鏡により同定した。C12FDGと共にインキュベートされた野生型マウス由来の成体心筋細胞を、心筋細胞の自己蛍光を決定するために使用した。C12FDG+心筋細胞およびC12FDG-心筋細胞を、室温で細胞外緩衝液により灌流しながら1Hzで電場刺激した。可変フィールドレートCCDカメラ(IonOptix,Milton,MA)を使用して、60倍の顕微鏡接眼レンズを通して、240Hzで画像を取得した。細胞長を、IonOptixインターフェースシステムを使用して、ビデオエッジ検出システムにより測定した。心筋細胞の画像のリアルタイムフーリエ分析を、筋節長および収縮プロファイルを測定するために実施した。トレースを定常状態で記録した。これらは、通常、5分間の刺激の後に達成された。Ca2+耐性であった、桿形で明白に横紋のある心筋細胞のみを、実験において使用した。以前に記載されたとおりに(Tandan et al.,2009;Laugwitz et al.,2005;Luo et al.,2005;Grynkiewicz et al.,1985)、細胞内Ca2+トランジェントを測定した。遮光しながら室温で30分間、0.1%BSAおよび1%ピルビン酸を含有している細胞外緩衝液(140mM NaCl、5mM KC1、1.8mM CaCl2、1mM MgCl2、10mMグルコース、および10mM Hepes)中の5μM fura-2-アセトキシメチルエステル(Fura-2 AM)を細胞に負荷し、次いで、細胞を細胞外緩衝液により2回洗浄し、0.1%BSAおよび1%ピルビン酸を含むこの緩衝液において使用時まで維持する。0.01%ポリリジン+0.1%ゼラチンによりコーティングされたカバーガラス(Deckglaser,Germany)に、細胞を播種する。カバーガラスは灌流チャンバーの底に適合する。細胞を室温で細胞外緩衝液により灌流する。1〜2秒毎に交互に340/380nmの光を細胞に照射することにより、Fura-2蛍光を測定する。細胞内Ca2+濃度([Ca2+])の変化を、340nmおよび380nmにおける蛍光強度の比率の変化から導出する。蛍光比R=(340nm励起における蛍光強度−340nm励起におけるバックグラウンド強度)/(380nmにおける蛍光強度−380nmにおけるバックグラウンド強度)を、以下の式(Grynkiewicz et al.,1985):
を使用して、[Ca2+]に換算した。
式中、RminおよびRmaxは、それぞれ、Ca2+の非存在下(Ca2+を欠き、10mM EGTA、10μMイオノマイシン、および40μM BAPTA-AMを含有している溶液)、ならびに飽和Ca2+(2mM Ca2+および10μMイオノマイシンを含有している溶液)で入手された比率である。Kd=224nMが、Fura-2の解離定数であり、=(Ca2+の非存在下での380nm励起における蛍光強度/飽和Ca2+における380nm励起における蛍光強度)である。分析は、特殊なデータ分析ソフトウェア(Ion Wizard,IonOptix Corp.)により実施された。
カルシウム画像化のため、遮光しながら37℃で30分間、0.1%BSAおよび1%ピルビン酸を含有している修飾タイロード液(140mM NaCl、5mM KCl、1.8mM CaCl2、1mM MgCl2、10mMグルコース、および10mM Hepes、pH7.4)において、0.1%Pluronic F-127(Invitrogen)と共に5μM Fura-2 AM(Invitrogen)を、拍動iCLM、培養新生仔マウス心房筋細胞、新生仔マウス心室心筋細胞、または単離された成体マウス心室心筋細胞に負荷した。画像化の前に、細胞を洗浄し、以前に記載されたとおりに(Luo et al.,2005)、室温で30分間、タイロード液においてFura-2 AMをエステル分解した。Ca2+画像化は、自動化された蛍光顕微鏡およびCCDカメラを用いてPTI(Photon Technology International)Ca2+ Imaging System(Birmingham,NJ)を使用して実施された。カバーガラスを灌流チャンバーの底に挿入した。細胞を修飾タイロード液により灌流し、340nmおよび380nmの両方でCa2+により誘導された蛍光を測定することにより、個々の自然拍動細胞におけるカルシウムトランジェントを算出した。
進化的に保存された転写因子(GATA4、HAND2、MEF2、MesP1、Nkx2-5、およびTbx5)のコアセットは、心臓遺伝子発現および心臓発生を制御する(Olson,2006;Wu,2008)。最近、GATA4、MEF2C、およびTbx5が、インビトロで線維芽細胞を心筋細胞様細胞へ変換し得ることが報告された7。本発明者らは、線維芽細胞を拍動心臓様筋細胞へ再プログラム化するために必要かつ十分なコア心臓転写因子の最適の組み合わせを定義し、これらの因子が、インビボで内在性心臓線維芽細胞の心筋細胞様細胞への再プログラム化を通して、損傷心臓の心機能を回復させ得るか否かを判定することに努めた。この目標に向けて、本発明者らは、心臓特異的なaMHC-GFPトランスジーンを保持しているマウスに由来する線維芽細胞において、6種のコア心臓転写因子(GATA4(G)、およびHAND2(H)、MEF2C(M)、MesP1(Ms)、Nkx2-5(N)、およびTbx5(T))の各々を発現させるためのレトロウイルスを生成した(図5A〜Dおよび6)。
Claims (59)
- 心臓線維芽細胞を再プログラム化する方法であって、該心臓線維芽細胞をTbx5、Mef2C、およびHand2と接触させる工程を含む、方法。
- 接触させる工程が、Tbx5タンパク質、Mef2Cタンパク質、およびHand2タンパク質を前記心臓線維芽細胞へ送達することを含む、請求項1記載の方法。
- Tbx5、Mef2C、およびHand2が、異種細胞透過性ペプチド(CPP)を含む、請求項2記載の方法。
- 前記心臓線維芽細胞をGata4と接触させる工程をさらに含む、請求項2記載の方法。
- 前記心臓線維芽細胞をミオカルディンと接触させる工程をさらに含む、請求項2記載の方法。
- 前記心臓線維芽細胞をミオカルディンと接触させる工程をさらに含む、請求項4記載の方法。
- 接触させる工程が、Tbx5発現カセット、Mef2C発現カセット、およびHand2発現カセットを前記心臓線維芽細胞へ送達することを含む、請求項1記載の方法。
- 前記発現カセットが複製可能ベクターに含まれている、請求項7記載の方法。
- 前記複製可能ベクターがウイルスベクターである、請求項8記載の方法。
- 前記ウイルスベクターがアデノウイルスベクターまたはレトロウイルスベクターである、請求項9記載の方法。
- 前記複製可能ベクターが非ウイルスベクターである、請求項8記載の方法。
- 前記非ウイルスベクターが脂質送達ビヒクル内に配置されている、請求項11記載の方法。
- 前記心臓線維芽細胞をGata4発現カセットと接触させる工程をさらに含む、請求項7記載の方法。
- 前記心臓線維芽細胞をミオカルディン発現カセットと接触させる工程をさらに含む、請求項7記載の方法。
- 前記心臓線維芽細胞をミオカルディン発現カセットと接触させる工程をさらに含む、請求項13記載の方法。
- 心筋梗塞(MI)を経験した対象を処置する方法であって、Tbx5およびMef2C、または、Tbx5発現カセットおよびMef2C発現カセットを、該対象へ送達する工程を含む、方法。
- 送達する工程が、Tbx5タンパク質およびMef2Cタンパク質の前記対象への投与を含む、請求項16記載の方法。
- Tbx5およびMef2Cが、異種細胞透過性ペプチド(CPP)を含む、請求項17記載の方法。
- Hand2タンパク質、ミオカルディンタンパク質、および/またはGata4タンパク質のうちの1種、2種、または3種全てを前記対象へ送達する工程をさらに含む、請求項17記載の方法。
- 送達する工程が、Tbx5発現カセットおよびMef2C発現カセットの前記対象への投与を含む、請求項16記載の方法。
- Hand2発現カセット、ミオカルディン発現カセット、および/またはGata4発現カセットのうちの1種、2種、または3種全てを前記対象へ送達する工程をさらに含む、請求項20記載の方法。
- 前記発現カセットが複製可能ベクターに含まれている、請求項20記載の方法
- 前記複製可能ベクターがウイルスベクターである、請求項22記載の方法。
- 前記ウイルスベクターがアデノウイルスベクターまたはレトロウイルスベクターである、請求項23記載の方法。
- 前記複製可能ベクターが非ウイルスベクターである、請求項22記載の方法。
- 前記非ウイルスベクターが脂質送達ビヒクル内に配置されている、請求項25記載の方法。
- Tbx5およびMef2C、または、Tbx5発現カセットおよびMef2C発現カセットを前記MIの24時間後〜1ヶ月後に送達する、請求項16記載の方法。
- Hand2、ミオカルディン、および/もしくはGata4、または、Hand2発現カセット、ミオカルディン発現カセット、および/もしくはGata4発現カセットを24時間以内に送達する工程をさらに含む、請求項27記載の方法。
- Tbx5およびMef2C、または、Tbx5発現カセットおよびMef2C発現カセットを複数回送達する、請求項16記載の方法。
- Hand2、ミオカルディン、および/もしくはGata4、または、Hand2発現カセット、ミオカルディン発現カセット、および/もしくはGata4発現カセットを複数回送達する工程をさらに含む、請求項29記載の方法。
- Tbx5およびMef2C、または、Tbx5発現カセットおよびMef2C発現カセットを、2回、3回、4回、5回、6回、7回、8回、9回、10回、11回、12回、13回、14回、15回、16回、17回、18回、19回、20回、21回、22回、23回、24回、25回、26回、27回、28回、29回、30回、または31回送達する、請求項16記載の方法。
- Hand2、ミオカルディン、および/もしくはGata4、または、Hand2発現カセット、ミオカルディン発現カセット、および/もしくはGata4発現カセットを、2回、3回、4回、5回、6回、7回、8回、9回、10回、11回、12回、13回、14回、15回、16回、17回、18回、19回、20回、21回、22回、23回、24回、25回、26回、27回、28回、29回、30回、または31回送達する工程をさらに含む、請求項31記載の方法。
- Tbx5およびMef2C、または、Tbx5発現カセットおよびMef2C発現カセットを毎日送達する、請求項16記載の方法。
- Hand2、ミオカルディン、および/もしくはGata4、または、Hand2発現カセット、ミオカルディン発現カセット、および/もしくはGata4発現カセットを毎日送達する工程をさらに含む、請求項33記載の方法。
- Tbx5およびMef2C、または、Tbx5発現カセットおよびMef2C発現カセットを、心臓内注射を介して送達する、請求項16記載の方法。
- 前記対象が、酸素、アスピリン、およびまたはニトログリセリンをさらに投与される、請求項16記載の方法。
- 前記対象が、経皮的冠動脈インターベンションをさらに実施される、請求項16記載の方法。
- 前記対象が、線維素溶解薬をさらに投与される、請求項16記載の方法。
- 前記MIが非ST上昇型MIである、請求項16記載の方法。
- 前記MIがST上昇型MIである、請求項16記載の方法。
- 心筋梗塞(MI)を経験した対象における心肥大または心不全の発症を防止するかまたは遅延させる方法であって、Tbx5およびMef2C、または、Tbx5発現カセットおよびMef2C発現カセットを該対象へ供給する工程を含む、方法。
- 二次的な抗肥大治療または抗心不全治療を前記対象へ実施する工程をさらに含む、請求項41記載の方法。
- 前記二次的な治療が、PKD阻害剤、βブロッカー、変力物質、利尿薬、ACE-I、AIIアンタゴニスト、BNP、Ca++ブロッカー、またはHDAC阻害剤である、請求項41記載の方法。
- 防止または遅延が、心肥大を防止するかまたは遅延させることを含む、請求項41記載の方法。
- 防止または遅延が、運動能力の低下、心駆出量の減少、左室拡張末期圧の増加、肺毛細血管楔入圧の増加、心拍出量もしくは心係数の減少、肺動脈圧の増加、左室収縮末期径および左室拡張末期径の増加、左室壁応力および右室壁応力の増加、壁張力の増加、生活の質の低下、ならびに/または疾患に関連した罹患率もしくは死亡率の増加のうちの一つまたは複数を防止するかまたは遅延させることを含む、請求項41記載の方法。
- Tbx5タンパク質およびMef2Cタンパク質が前記対象へ投与される、請求項41記載の方法。
- Tbx5発現カセットおよびMef2C発現カセットが前記対象へ投与される、請求項41記載の方法。
- Hand2タンパク質、ミオカルディンタンパク質、および/またはGata4タンパク質を前記対象へ投与する工程をさらに含む、請求項46記載の方法。
- Hand2発現カセット、ミオカルディン発現カセット、および/またはGata4発現カセットを前記対象へ投与する工程をさらに含む、請求項47記載の方法。
- 心筋梗塞を経験した対象の運動耐容能の減少を低下させる方法であって、Tbx5およびMef2C、または、Tbx5発現カセットおよびMef2C発現カセットを該対象へ投与する工程を含む、方法。
- Hand2、ミオカルディン、および/もしくはGata4、または、Hand2発現カセット、ミオカルディン発現カセット、および/もしくはGata4発現カセットを前記対象へ投与する工程をさらに含む、請求項50記載の方法。
- 心筋梗塞を経験した対象の入院を減少させる方法であって、Tbx5およびMef2C、または、Tbx5発現カセットおよびMef2C発現カセットを該対象へ投与する工程を含む、方法。
- Hand2、ミオカルディン、および/もしくはGata4、または、Hand2発現カセット、ミオカルディン発現カセット、および/もしくはGata4発現カセットを前記対象へ投与する工程をさらに含む、請求項52記載の方法。
- 心筋梗塞を経験した対象の生活の質を向上させる方法であって、Tbx5およびMef2C、または、Tbx5発現カセットおよびMef2C発現カセットを該対象へ投与する工程を含む、方法。
- Hand2、ミオカルディン、および/もしくはGata4、または、Hand2発現カセット、ミオカルディン発現カセット、および/もしくはGata4発現カセットを前記対象へ投与する工程をさらに含む、請求項54記載の方法。
- 心筋梗塞を経験した対象の罹患率を減少させる方法であって、Tbx5およびMef2C、または、Tbx5発現カセットおよびMef2C発現カセットを該対象へ投与する工程を含む、方法。
- Hand2、ミオカルディン、および/もしくはGata4、または、Hand2発現カセット、ミオカルディン発現カセット、および/もしくはGata4発現カセットを前記対象へ投与する工程をさらに含む、請求項56記載の方法。
- 心筋梗塞を経験した対象の死亡率を減少させる方法であって、Tbx5およびMef2C、または、Tbx5発現カセットおよびMef2C発現カセットを該対象へ投与する工程を含む、方法。
- Hand2、ミオカルディン、および/もしくはGata4、または、Hand2発現カセット、ミオカルディン発現カセット、および/もしくはGata4発現カセットを前記対象へ投与する工程をさらに含む、請求項58記載の方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161445390P | 2011-02-22 | 2011-02-22 | |
| US61/445,390 | 2011-02-22 | ||
| PCT/US2012/026113 WO2012116064A1 (en) | 2011-02-22 | 2012-02-22 | Cardiac repair by reprogramming of cardiac fibroblasts into cardiomyocytes |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2014507442A true JP2014507442A (ja) | 2014-03-27 |
| JP2014507442A5 JP2014507442A5 (ja) | 2015-04-16 |
Family
ID=45922797
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013555521A Pending JP2014507442A (ja) | 2011-02-22 | 2012-02-22 | 心臓線維芽細胞の心筋細胞への再プログラム化による心臓修復 |
Country Status (6)
| Country | Link |
|---|---|
| US (2) | US9017661B2 (ja) |
| EP (1) | EP2678354A1 (ja) |
| JP (1) | JP2014507442A (ja) |
| AU (1) | AU2012220702B2 (ja) |
| CA (1) | CA2827329A1 (ja) |
| WO (1) | WO2012116064A1 (ja) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2015213441A (ja) * | 2014-05-08 | 2015-12-03 | 学校法人慶應義塾 | 心筋様細胞の作製方法及びそれに用いる培地 |
| JP2020524518A (ja) * | 2017-06-21 | 2020-08-20 | モグリファイ リミテッド | 心筋細胞への細胞リプログラミング |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2776071B1 (en) * | 2011-11-09 | 2018-08-08 | Cedars-Sinai Medical Center | Transcription factor-based generation of pacemaker cells and methods of using same |
| WO2015061779A1 (en) * | 2013-10-25 | 2015-04-30 | Wayne State University | Methods, systems and compositions relating to cell conversion via protein induced in-vivo cell reprogramming |
| EP3177302A4 (en) * | 2014-08-07 | 2018-04-11 | Duke University | Compositions and methods for the reprogramming of cells into cardiomyocytes |
| KR101530278B1 (ko) * | 2014-09-04 | 2015-06-24 | 부산대학교 산학협력단 | 심근전환유전자 및 심혈관재생유전자를 포함하는 아데노부속바이러스를 유효성분으로 포함하는, 허혈성 심장질환 예방 또는 치료용 조성물 |
| US9885018B1 (en) * | 2015-03-16 | 2018-02-06 | The Regents Of The University Of Colorado, A Body Corporate | High efficiency reprogramming of fibroblasts into cardiomyocytes |
| WO2019036086A1 (en) * | 2017-08-15 | 2019-02-21 | The Board Of Regents Of The University Of Texas System | CARDIAC REPAIR BY REPROGRAMMING CARDIAC FIBROBLASTS ADULT TO CARDIOMYOCYTES |
| WO2019136031A1 (en) * | 2018-01-05 | 2019-07-11 | University Of Houston System | Serum response factor regenerates senescent cells |
| GB2571704A (en) * | 2018-02-22 | 2019-09-11 | Georg August Univ Gottingen Stiftung Offentlichen Rechts Univer Sitatsmedzin Goettingen | Prevention or treatment of cardiac arrhytmia and sudden cardiac death |
| CN113164556A (zh) | 2018-08-30 | 2021-07-23 | 特纳亚治疗股份有限公司 | 用心肌蛋白和ascl1进行的心脏细胞重编程 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2010075575A1 (en) * | 2008-12-23 | 2010-07-01 | Biopips, Inc. | Compositions and methods for re-programming cells without genetic modification |
| WO2011139688A2 (en) * | 2010-04-28 | 2011-11-10 | The J. David Gladstone Institutes | Methods for generating cardiomyocytes |
| WO2011163531A2 (en) * | 2010-06-23 | 2011-12-29 | Vivoscript, Inc. | Compositions and methods for re-programming cells without genetic modification for treatment of cardiovascular diseases |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0273085A1 (en) | 1986-12-29 | 1988-07-06 | IntraCel Corporation | A method for internalizing nucleic acids into eukaryotic cells |
| AU770384B2 (en) | 1998-05-30 | 2004-02-19 | Collateral Therapeutics, Inc. | Methods of altering cardiac cell phenotype |
| CA2412847A1 (en) * | 2000-06-30 | 2002-01-10 | Collateral Therapeutics, Inc. | Dual recombinant gene therapy compositions and methods of use |
| EP2134182A4 (en) * | 2005-11-08 | 2010-01-06 | Univ South Florida | IMPROVED STEM CELL THERAPY PROCEDURE FOR THE REPAIR OF THE HEART CIRCUIT SYSTEM |
| WO2008088882A2 (en) * | 2007-01-19 | 2008-07-24 | The J. David Gladstone Institutes | Methods of generating cardiomyocytes |
| WO2009145761A1 (en) * | 2008-05-27 | 2009-12-03 | Mayo Foundation For Medical Education And Research | Methods and materials for using cells to treat heart tissue |
-
2012
- 2012-02-22 US US13/402,609 patent/US9017661B2/en not_active Expired - Fee Related
- 2012-02-22 WO PCT/US2012/026113 patent/WO2012116064A1/en active Application Filing
- 2012-02-22 EP EP12711484.1A patent/EP2678354A1/en not_active Withdrawn
- 2012-02-22 AU AU2012220702A patent/AU2012220702B2/en not_active Ceased
- 2012-02-22 JP JP2013555521A patent/JP2014507442A/ja active Pending
- 2012-02-22 CA CA2827329A patent/CA2827329A1/en not_active Abandoned
-
2015
- 2015-04-28 US US14/697,955 patent/US9523079B2/en active Active
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2010075575A1 (en) * | 2008-12-23 | 2010-07-01 | Biopips, Inc. | Compositions and methods for re-programming cells without genetic modification |
| WO2011139688A2 (en) * | 2010-04-28 | 2011-11-10 | The J. David Gladstone Institutes | Methods for generating cardiomyocytes |
| WO2011163531A2 (en) * | 2010-06-23 | 2011-12-29 | Vivoscript, Inc. | Compositions and methods for re-programming cells without genetic modification for treatment of cardiovascular diseases |
Non-Patent Citations (1)
| Title |
|---|
| JPN6016002883; Cell Vol.142, No.3, 2010, p.375-386 * |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2015213441A (ja) * | 2014-05-08 | 2015-12-03 | 学校法人慶應義塾 | 心筋様細胞の作製方法及びそれに用いる培地 |
| JP2020524518A (ja) * | 2017-06-21 | 2020-08-20 | モグリファイ リミテッド | 心筋細胞への細胞リプログラミング |
Also Published As
| Publication number | Publication date |
|---|---|
| CA2827329A1 (en) | 2012-08-30 |
| US9523079B2 (en) | 2016-12-20 |
| AU2012220702A1 (en) | 2013-08-22 |
| AU2012220702B2 (en) | 2016-12-15 |
| US9017661B2 (en) | 2015-04-28 |
| US20120213738A1 (en) | 2012-08-23 |
| EP2678354A1 (en) | 2014-01-01 |
| WO2012116064A1 (en) | 2012-08-30 |
| US20150307847A1 (en) | 2015-10-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US9523079B2 (en) | Cardiac repair by reprogramming of cardiac fibroblasts into cardiomyocytes | |
| US20200190511A1 (en) | Micro-rna family that modulates fibrosis and uses thereof | |
| US20050182011A1 (en) | Inhibition of TRP channels as a treatment for cardiac hypertrophy and heart failure | |
| US20250018009A1 (en) | Serum response factor regenerates senescent cells | |
| JP2012500199A (ja) | 血管統合性を促進するマイクロ−rnaおよびその使用 | |
| US20090220507A1 (en) | Inhibition of extracellular signal-regulated kinase 1/2 as a treatment for cardiac hypertrophy and heart failure | |
| US10300147B2 (en) | Therapeutic miRNAs for treating heart and skeletal muscle diseases | |
| WO2019036086A1 (en) | CARDIAC REPAIR BY REPROGRAMMING CARDIAC FIBROBLASTS ADULT TO CARDIOMYOCYTES | |
| CN105030808B (zh) | 调控纤维化的微小rna家族及其用途 | |
| US10772974B2 (en) | Compositions and methods for cardiac regeneration | |
| US20050265999A1 (en) | Modulation of 5-HT2 receptors as a treatment for cardiovascular diseases | |
| WO2007131113A2 (en) | Modulation of calmodulin- binding transcription activator (camta) as a treatment for cardiac hypertrophy, heart failure, and heart injury | |
| US20050283841A1 (en) | Inhibition of protein kinase C-related kinase (PRK) as a treatment for cardiac hypertrophy and heart failure | |
| US20080031818A1 (en) | Use of Modulators of a Novel Form of Muscle Selective Calcineurin Interacting Protein (Mcip-1-38) as a Treatment for Cardiovascular Diseases | |
| WO2023077052A1 (en) | Reprogramming of adult cardiac fibroblasts into cardiomyocytes using phf7 | |
| US20060110390A1 (en) | Inhibition of Ku as a treatment for cardiovascular diseases |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20150223 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20150223 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20150520 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20160128 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20160419 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20160726 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20161024 |