JP2010523559A - [3−(4−{2−ブチル−1−[4−(4−クロロ−フェノキシ)−フェニル]−1h−イミダゾール−4−イル}−フェノキシ)−プロピル]−ジエチルアミンの結晶形態 - Google Patents
[3−(4−{2−ブチル−1−[4−(4−クロロ−フェノキシ)−フェニル]−1h−イミダゾール−4−イル}−フェノキシ)−プロピル]−ジエチルアミンの結晶形態 Download PDFInfo
- Publication number
- JP2010523559A JP2010523559A JP2010502079A JP2010502079A JP2010523559A JP 2010523559 A JP2010523559 A JP 2010523559A JP 2010502079 A JP2010502079 A JP 2010502079A JP 2010502079 A JP2010502079 A JP 2010502079A JP 2010523559 A JP2010523559 A JP 2010523559A
- Authority
- JP
- Japan
- Prior art keywords
- compound
- peaks
- polymorph
- spectrum
- raman
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D233/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings
- C07D233/54—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members
- C07D233/56—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members with only hydrogen atoms or radicals containing only hydrogen and carbon atoms, attached to ring carbon atoms
- C07D233/60—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members with only hydrogen atoms or radicals containing only hydrogen and carbon atoms, attached to ring carbon atoms with hydrocarbon radicals, substituted by oxygen or sulfur atoms, attached to ring nitrogen atoms
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
- A61P15/10—Drugs for genital or sexual disorders; Contraceptives for impotence
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/02—Drugs for dermatological disorders for treating wounds, ulcers, burns, scars, keloids, or the like
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
- A61P19/10—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease for osteoporosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
Abstract
【選択図】図1
Description
本出願は、35 USC 119(e)のもとで、米国仮特許出願No.60/921,964、2007年4月5日出願、および米国仮特許出願No.60/925,786、2007年4月23日出願、に基づく優先権を主張し、それらの開示内容全体を本明細書に援用する。
他の観点において本発明は、化合物Iの1以上の多型形態を含む医薬組成物を調製するための方法を提供する。
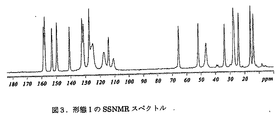
1態様において本発明は、149.7および141.0ppmにピークを含む固相13C NMRスペクトルを有する、化合物Iの形態Iを提供する。
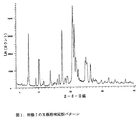
他の態様において本発明は、2θ°で表わして13.1、16.5、22.4および26.8にX線粉末回折ピークを有する、化合物Iの形態Iを提供する。
他の態様において本発明は、266、293、335、653、787および1497cm−1にピークを含むラマンスペクトルを有する、化合物Iの形態Iを提供する。
他の態様において本発明は、50、55、60、65、70、75、80、85、90、91、92、93、94、95、96、97、98もしくは99重量%、またはそれ以上の形態Iを含む結晶形態であってよい、化合物Iの形態を提供する。
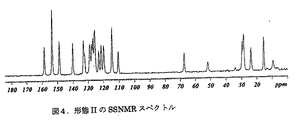
他の態様において本発明は、153.6、149.0、140.1、119.9および28.6ppmにピークを含む固相13C NMRスペクトルを有する、化合物Iの形態IIを提供する。
他の態様において本発明は、153.6、140.1および119.9ppmにピークを含む固相13C NMRスペクトルを有し、かつ816、1046および1178cm−1にピークを含むIRスペクトルを有する、化合物Iの形態IIを提供する。
他の態様において本発明は、257、300、326、590、646、1180、1348および1370cm−1にピークを含むラマンスペクトルを有する、化合物Iの形態IIを提供する。
他の態様において本発明は、50、55、60、65、70、75、80、85、90、91、92、93、94、95、96、97、98もしくは99重量%、またはそれ以上の形態IIを含む結晶形態であってよい、化合物Iの形態を提供する。
X線粉末回折分析
形態IおよびIIのX線粉末回折パターン分析は、Bruker D5000回折計により銅放射線(波長:1.54056Å)を用いて実施された。管電圧およびアンペア数をそれぞれ40kVおよび40mAに設定した。拡散および散乱スリットを1mmに設定し、受信スリットを0.6mmに設定した。回折線をKevex PSI検出器で検出した。2.4°/分(1秒/0.04°のステップ)で3.0°から40°の2θまでのθ−2θ連続走査を用いた。アルミナ基準物質を分析して、計測器整合を検査した。データを収集し、Bruker axisソフトウェア、バージョン7.0を用いて分析した。試料はそれらを石英製ホルダーに入れることにより用意された。Eva Application 7.0.0.1ソフトウェアを用いてXRPDスペクトルを視覚化および評価した。ピーク検索を行なうまでXRPDデータファイル(.raw)を処理しなかった。一般に、閾値1および幅値0.3を用いて、予備ピーク割り当てを行なった。自動割り当ての出力を視覚検査して有効性を確認し、必要ならば手動で調整を行なった。
固相核磁気共鳴分光分析
13C SSNMR法:約80mgの試料を4mmのZrOスピナーに密に充填した。低い温度(公称270K;回転による摩擦熱を補償するため)および圧力で、広径Bruker−Biospin Avance DSX 500MHz NMR分光計内に配置したBruker−Biospin 4mm BL三重共鳴CPMASプローブによりスペクトルを収集した。回転サイドバンドの強度を最小限に抑えるために、試料をマジックアングルに配置し、15.0kHzで回転させた。適切な信号−対−ノイズ比が得られるように走査数を調整した。
IR分光分析
計測器法:KBrビームスプリッターおよびd−TGS KBr検出器を備えたThermoNicolet Magna 560 FT−IR分光計を用いて、IRスペクトルを取得した。Specac Golden Gate Mk II単反射ダイヤモンドATRアクセサリーをサンプリングに用いた。解像度4cm−1において同時走査100でスペクトルを収集した。収集範囲は4000〜650cm−1であった。Happ−Genzelアポダイゼイションを用いた。ATR手法には追加の試料調製が不必要である。ThermoNicolet Omnic 6.0aソフトウェアピークピッキングアルゴリズムを用いてピークを同定した。一般に閾値0および感度値90を用いて予備ピーク割り当てを行なった。自動割り当ての出力を視覚検査して有効性を確認した。必要と思われた場合、手動調整を行なった。適切ならば、さらに3200〜2600cm−1、2400〜1800cm−1および1800〜650cm−1におけるピークを感度100で割り当てた。これらの設定は、解像されないショルダーが分離ピークとして同定されないように選択された。
ラマン分光分析
計測器法:1064nm NdYAGレーザーおよびInGaAs検出器を備えたThermoNicolet 960 FT−ラマン分光計を用いて、ラマンスペクトルを収集した。試料をNMR管内で分析した。レーザーパワー1Wおよび同時走査100を用いてスペクトルを収集した。収集範囲は3700〜100cm−1であった。ThermoNicolet Omnic 6.0aソフトウェアピークピッキングアルゴリズムを用いてピークを同定した。一般に閾値0および感度値90を用いて予備ピーク割り当てを行なった。自動割り当ての出力を視覚検査して有効性を確認した。必要と思われた場合、手動調整を行なった。適切ならば、さらに3300〜2500cm−1および1700〜100cm−1におけるピークを感度100で割り当てた。これらの設定は、解像されないショルダーが分離ピークとして同定されないように選択された。すべてのスペクトルを解像度4cm−1およびHapp−Genzelアポダイゼイションを用いて記録した。ポリスチレンを用いて波長目盛定めを行なった。
熱重量分析(TGA)
TGAは、TA Instruments 2950熱重量分析計を用いて実施された。検量基準物質はニッケルおよびAlumel(商標)であった。試料をアルミニウム製試料皿に入れ、TG炉に装入した。試料をまず25℃で平衡化し、次いで窒素流下に加熱速度10℃/分で最終温度350℃まで加熱した。
DSC法A:DSCは、TA Instruments 2920示差走査熱量測定器を用いて実施できる。試料をアルミニウム製DSC皿に入れ、重量を精確に記録する。皿を蓋で覆い、次いでクリンプさせる。この試料セルを25℃で平衡化し、窒素パージ下に速度10℃/分で最終温度250℃まで加熱する。インジウム金属を検量基準物質として用いる。報告した温度は最大転位におけるものである。
4−アセトキシアセトフェノン(1.0当量)のジクロロメタン中における溶液に、氷浴上で臭素(1.05当量)を添加した。臭素は0℃で徐々に添加された。氷浴を取り除き、反応が完了するまで周囲温度で撹拌を続けた(HPLCでモニターした)。反応混合物を真空濃縮すると4−アセトキシ−α−ブロモアセトフェノンが得られ、これをさらに精製せずに用いた。
化合物Iの形態Iは、下記の方法に従って製造することができる。
3kgロットの化合物Iを、実施例Bに記載した合成により製造した;その際、最終工程は、化合物Iをヘキサンから沈殿させ、次いで酢酸エチルに溶解し、その後、残留する酢酸エチルを真空中で70℃において除去することを伴う。この温度で液相が形成される。この液相化合物Iを、乾燥および溶媒除去用のトレイに注入した。室温に冷却した時点で、固体化合物Iを細かく砕き、乳鉢と乳棒で摩砕して形態Iを得た。
結晶形態Iは、Bruker D5000回折計によりCuKα線を用いて測定して、2θ°で表わした相対強度≧3.4%の相対強度をもつ下記のX線粉末回折パターンを特徴とする:
形態Iについての2θ°の代表的な数値は13.1、16.5、22.4および26.8である。形態Iについての2θ°の特に代表的な数値は16.5および26.8である。
(b)ピーク高さとして定義。強度はCPMAS実験パラメーターの実際の設定および試料の熱履歴に応じて変動する可能性がある。CPMAS強度は必ずしも定量的ではない。
傾斜速度10℃/分でDSC法Aおよび試料サイズ5.31mgを用いて、形態Iの第1バッチのDSCプロフィールは60.1℃に吸熱ピークを示した。
形態II
化合物Iの形態IIは、下記の方法に従って製造することができる。
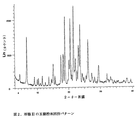
結晶形態IIは、Bruker D5000回折計によりCuKα線を用いて測定して、2θ°で表わした相対強度≧6.0%の相対強度をもつ下記のX線粉末回折パターンを特徴とする:
形態IIについての2θ°の代表的な数値は18.8および20.1である。
形態IIは、下記の13C固相NMR化学シフトを特徴とする:
(b)ピーク高さとして定義。強度はCPMAS実験パラメーターの実際の設定および試料の熱履歴に応じて変動する可能性がある。CPMAS強度は必ずしも定量的ではない。
傾斜速度10℃/分でDSC法Aおよび試料サイズ4.87mgを用いて、形態IIの第1バッチのDSCプロフィールは58.9℃に吸熱ピークを示した。
本発明の多様な目的を満たすための本発明の多様な態様を記載した。これらの態様は本発明の原理の説明にすぎないことを認識すべきである。本発明の精神および範囲から逸脱することなくその多数の改変および適用を当業者は容易になしうるであろう。
Claims (46)
- 149.7および141.0ppmにピークを含む固相13C NMRスペクトルを有する、化合物I、形態Iの多型。
- 153.0、149.7、141.0、27.6および13.9ppmにピークを含む固相13C NMRスペクトルを有する、請求項1に記載の多型。
- 157.9、153.0、149.7、141.0、131.4、33.8、27.6および13.9ppmにピークを含む固相13C NMRスペクトルを有する、請求項2に記載の多型。
- 1016および1223cm−1にピークを含むIRスペクトルを有する、請求項1に記載の多型。
- 697、870、1016および1223cm−1にピークを含むIRスペクトルを有する、請求項4に記載の多型。
- 335および787cm−1にピークを含むラマンスペクトルを有する、請求項1に記載の多型。
- 266、293、335、653、787および1497cm−1にピークを含むラマンスペクトルを有する、請求項6に記載の多型。
- 2θ°で表わして16.5および26.8にX線粉末回折ピークを有する、化合物I、形態Iの多型。
- 2θ°で表わして13.1、16.5、22.4および26.8にX線粉末回折ピークを有する、請求項8に記載の多型。
- 1016および1223cm−1にピークを含むIRスペクトルを有する、請求項8に記載の多型。
- 697、870、1016および1223cm−1にピークを含むIRスペクトルを有する、請求項10に記載の多型。
- 335および787cm−1にピークを含むラマンスペクトルを有する、請求項8に記載の多型。
- 266、293、335、653、787および1497cm−1にピークを含むラマンスペクトルを有する、請求項12に記載の多型。
- 335および787cm−1にピークを含むラマンスペクトルを有する、化合物I、形態Iの多型。
- 266、293、335、653、787および1497cm−1にピークを含むラマンスペクトルを有する、請求項14に記載の多型。
- 実質的に形態IIを含まない、請求項1、8または14に記載の多型。
- 50重量%以上の請求項1、8または14の化合物Iの形態Iを含む、化合物Iの形態。
- 少なくとも55、60、65、70、75、80、85、90、91、92、93、94、95、96、97、98または99重量%の形態Iを含む、請求項17に記載の化合物Iの形態。
- 形態が結晶質である、請求項17に記載の化合物Iの形態。
- 153.6、140.1および119.9ppmにピークを含む固相13C NMRスペクトルを有する、化合物I、形態IIの多型。
- 153.6、149.0、140.1、119.9および28.6ppmにピークを含む固相13C NMRスペクトルを有する、請求項20に記載の多型。
- 153.6、149.0、140.1、123.2、121.6、119.9および28.6ppmにピークを含む固相13C NMRスペクトルを有する、請求項21に記載の多型。
- 816、1046および1178cm−1にピークを含むIRスペクトルを有する、請求項20に記載の多型。
- 660、707、735、816、969、1024、1046、1135および1178cm−1にピークを含むIRスペクトルを有する、請求項23に記載の多型。
- 300および1180cm−1にピークを含むラマンスペクトルを有する、請求項20に記載の多型。
- 257、300、326、590、646、1180、1348および1370cm−1にピークを含むラマンスペクトルを有する、請求項25に記載の多型。
- 2θ°で表わして18.8および20.1にX線粉末回折ピークを有する、化合物I、形態IIの多型。
- 816、1046および1178cm−1にピークを含むIRスペクトルを有する、請求項27に記載の多型。
- 660、707、735、816、969、1024、1046、1135および1178cm−1にピークを含むIRスペクトルを有する、請求項28に記載の多型。
- 300および1180cm−1にピークを含むラマンスペクトルを有する、請求項27に記載の多型。
- 257、300、326、590、646、1180、1348および1370cm−1にピークを含むラマンスペクトルを有する、請求項30に記載の多型。
- 300および1180cm−1にピークを含むラマンスペクトルを有する、化合物I、形態IIの多型。
- 257、300、326、590、646、1180、1348および1370cm−1にピークを含むラマンスペクトルを有する、請求項32に記載の多型。
- 実質的に形態Iを含まない、請求項20、27または32に記載の多型。
- 50重量%以上の請求項20、28または32の化合物Iの形態IIを含む、化合物Iの形態。
- 少なくとも55、60、65、70、75、80、85、90、91、92、93、94、95、96、97、98または99重量%の形態IIを含む、請求項35に記載の化合物Iの形態。
- 形態が結晶質である、請求項35に記載の化合物Iの形態。
- 形態Iと形態IIの混合物を含み、形態Iと形態IIの重量比がそれぞれ9:1〜1:9である化合物Iの形態。
- 形態Iと形態IIの重量比がそれぞれ9:1、8:2、7:3、6:4、5:5、4:6、3:7、2:8または1:9である、請求項38に記載の化合物Iの形態。
- 化合物Iの多型を製造する方法であって、化合物Iを液相が形成されるまで部分真空中で、ある期間加熱し;そして化合物Iを液相が形成される温度より低温に冷却することを含む方法。
- 化合物Iを約70℃に加熱する、請求項40に記載の方法。
- 化合物Iの多型が形態Iである、請求項40に記載の方法。
- 化合物Iの多型を製造する方法であって、
(a)化合物Iを、アルコール系溶媒を含む溶媒系に溶解し;
(b)化合物Iが溶媒系から沈殿するような沈殿溶媒を溶媒系に添加し;そして
(c)沈殿を溶媒系から回収する
ことを含む方法。 - アルコール系溶媒が、メタノール、エタノール、イソプロパノール、およびその混合物からなる群から選択される、請求項43に記載の方法。
- 沈殿溶媒が水を含む、請求項43に記載の方法。
- 化合物Iの多型が形態IIである、請求項43に記載の方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US92196407P | 2007-04-05 | 2007-04-05 | |
| US92578607P | 2007-04-23 | 2007-04-23 | |
| PCT/US2008/003325 WO2008123914A1 (en) | 2007-04-05 | 2008-03-12 | Crystalline forms i and ii of [3-(4-{2-butyl-1-[4-(4-chloro-phenoxy)-phenyl]-1h-imidazol-4-yl}-phenoxy)-propyl]-diethyl-amine |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2010523559A true JP2010523559A (ja) | 2010-07-15 |
| JP2010523559A5 JP2010523559A5 (ja) | 2011-03-31 |
Family
ID=39469930
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2010502079A Pending JP2010523559A (ja) | 2007-04-05 | 2008-03-12 | [3−(4−{2−ブチル−1−[4−(4−クロロ−フェノキシ)−フェニル]−1h−イミダゾール−4−イル}−フェノキシ)−プロピル]−ジエチルアミンの結晶形態 |
Country Status (11)
| Country | Link |
|---|---|
| US (2) | US7884219B2 (ja) |
| EP (1) | EP2144883A1 (ja) |
| JP (1) | JP2010523559A (ja) |
| AR (1) | AR065896A1 (ja) |
| CA (1) | CA2681864A1 (ja) |
| CL (1) | CL2008000987A1 (ja) |
| PA (1) | PA8775601A1 (ja) |
| PE (1) | PE20090808A1 (ja) |
| TW (1) | TW200900384A (ja) |
| UY (1) | UY31004A1 (ja) |
| WO (1) | WO2008123914A1 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP7464591B2 (ja) | 2018-10-10 | 2024-04-09 | ブイティーブイ・セラピューティクス・エルエルシー | [3-(4-{2-ブチル-1-[4-(4-クロロ-フェノキシ)-フェニル]-1h-イミダゾール-4-イル}-フェノキシ)-プロピル]-ジエチル-アミンの代謝産物 |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2008123914A1 (en) * | 2007-04-05 | 2008-10-16 | Transtech Pharma, Inc. | Crystalline forms i and ii of [3-(4-{2-butyl-1-[4-(4-chloro-phenoxy)-phenyl]-1h-imidazol-4-yl}-phenoxy)-propyl]-diethyl-amine |
| TWI517850B (zh) | 2009-09-30 | 2016-01-21 | Vtv治療有限責任公司 | 經取代之咪唑衍生物及其使用方法 |
| BR112015007641A8 (pt) * | 2012-10-05 | 2018-04-03 | Vtv Therapeutics Llc | Tratamento da doença de alzheimer branda e moderada |
| US9717710B2 (en) * | 2012-10-05 | 2017-08-01 | Vtv Therapeutics Llc | Treatment of mild and moderate Alzheimer's disease |
| CN103726005A (zh) * | 2012-10-16 | 2014-04-16 | 深圳富泰宏精密工业有限公司 | 珐琅涂层的制造方法及其制品 |
| WO2019190823A1 (en) | 2018-03-28 | 2019-10-03 | Vtv Therapeutics Llc | Pharmaceutically acceptable salts of [3-(4- {2-butyl-1-[4-(4-chlorophenoxy)-phenyl]-1h-imidazol-4-yl} -phenoxy)-propyl]-diethyl-amine |
| WO2019190822A1 (en) | 2018-03-28 | 2019-10-03 | Vtv Therapeutics Llc | Crystalline forms of [3-(4- {2-butyl-1-[4-(4-chloro-phenoxy)-phenyl]-1h-imidazol-4-yl} -phenoxy)-propyl]-diethyl-amine |
| WO2020086388A1 (en) | 2018-10-22 | 2020-04-30 | Vtv Therapeutics Llc | Glucokinase activator compositions for the treatment of cognitive impairment |
| US11648235B1 (en) | 2022-12-30 | 2023-05-16 | Cantex Pharmaceuticals, Inc. | Treatment of glioblastoma |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2005525378A (ja) * | 2002-03-05 | 2005-08-25 | トランス テック ファーマ,インコーポレイテッド | リガンドのrageとの相互作用を阻害する単環式および二環式アゾール誘導体 |
| JP2007503469A (ja) * | 2003-05-20 | 2007-02-22 | トランス テック ファーマ,インコーポレイテッド | アミロイド症およびそれに関連した疾患を改善するための作用物質としてのrageアンタゴニスト |
Family Cites Families (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2008123914A1 (en) * | 2007-04-05 | 2008-10-16 | Transtech Pharma, Inc. | Crystalline forms i and ii of [3-(4-{2-butyl-1-[4-(4-chloro-phenoxy)-phenyl]-1h-imidazol-4-yl}-phenoxy)-propyl]-diethyl-amine |
-
2008
- 2008-03-12 WO PCT/US2008/003325 patent/WO2008123914A1/en active Application Filing
- 2008-03-12 CA CA002681864A patent/CA2681864A1/en not_active Withdrawn
- 2008-03-12 EP EP08726789A patent/EP2144883A1/en not_active Withdrawn
- 2008-03-12 US US12/046,872 patent/US7884219B2/en active Active
- 2008-03-12 JP JP2010502079A patent/JP2010523559A/ja active Pending
- 2008-03-19 TW TW097109673A patent/TW200900384A/zh unknown
- 2008-03-31 AR ARP080101342A patent/AR065896A1/es unknown
- 2008-04-04 PE PE2008000616A patent/PE20090808A1/es not_active Application Discontinuation
- 2008-04-04 PA PA20088775601A patent/PA8775601A1/es unknown
- 2008-04-04 UY UY31004A patent/UY31004A1/es not_active Application Discontinuation
- 2008-04-04 CL CL200800987A patent/CL2008000987A1/es unknown
-
2010
- 2010-12-30 US US12/982,775 patent/US8372988B2/en active Active
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2005525378A (ja) * | 2002-03-05 | 2005-08-25 | トランス テック ファーマ,インコーポレイテッド | リガンドのrageとの相互作用を阻害する単環式および二環式アゾール誘導体 |
| JP2007503469A (ja) * | 2003-05-20 | 2007-02-22 | トランス テック ファーマ,インコーポレイテッド | アミロイド症およびそれに関連した疾患を改善するための作用物質としてのrageアンタゴニスト |
Non-Patent Citations (2)
| Title |
|---|
| CAIRA,M. R.: ""Crystalline Polymorphism of Organic Compounds"", TOPICS IN CURRENT CHEMISTRY, vol. 198, JPN5010003169, 1998, pages 163 - 208, ISSN: 0002562163 * |
| YU,L.: ""Amorphous Pharmaceutical Solids: Preparation, Characterization and Stabilization"", ADVANCED DRUG DELIVERY REVIEWS, vol. 48, no. 1, JPN5010003170, 2001, pages 27 - 42, XP009065056, ISSN: 0002562162, DOI: 10.1016/S0169-409X(01)00098-9 * |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP7464591B2 (ja) | 2018-10-10 | 2024-04-09 | ブイティーブイ・セラピューティクス・エルエルシー | [3-(4-{2-ブチル-1-[4-(4-クロロ-フェノキシ)-フェニル]-1h-イミダゾール-4-イル}-フェノキシ)-プロピル]-ジエチル-アミンの代謝産物 |
Also Published As
| Publication number | Publication date |
|---|---|
| US8372988B2 (en) | 2013-02-12 |
| US20110166361A1 (en) | 2011-07-07 |
| PE20090808A1 (es) | 2009-06-27 |
| WO2008123914A1 (en) | 2008-10-16 |
| US7884219B2 (en) | 2011-02-08 |
| AR065896A1 (es) | 2009-07-08 |
| CL2008000987A1 (es) | 2008-08-08 |
| TW200900384A (en) | 2009-01-01 |
| PA8775601A1 (es) | 2009-04-23 |
| UY31004A1 (es) | 2008-11-28 |
| US20080249316A1 (en) | 2008-10-09 |
| EP2144883A1 (en) | 2010-01-20 |
| CA2681864A1 (en) | 2008-10-16 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US8372988B2 (en) | Crystalline forms of [3-(4-{2-butyl-1-[4-(4-chloro-phenoxy)-phenyl]-1H-imidazol-4-yl}-phenoxy)-propyl]-diethyl-amine | |
| JP6899413B2 (ja) | 甲状腺ホルモンアナログ及びその多形体の合成方法 | |
| EP3810599A1 (en) | Crystalline form of 6-(cyclopropanecarboxamido)-4-((2-methoxy-3-(1-methyl-1h-1,2,4-triazol-3-yl)phenyl)amino)-n-(methyl-d3) pyridazine-3-carboxamide | |
| EP2922860B9 (en) | Hydrated polymorphs of 2'-o-fucosyllactose and methods for their production | |
| EA020798B1 (ru) | СПОСОБ ПОЛУЧЕНИЯ КРИСТАЛЛИЧЕСКОЙ ФОРМЫ 1-ХЛОР-4-(β-D-ГЛЮКОПИРАНОЗ-1-ИЛ)-2-[4-((S)-ТЕТРАГИДРОФУРАН-3-ИЛОКСИ)БЕНЗИЛ]БЕНЗОЛА | |
| EP3272748B1 (en) | Pharmaceutical formulations comprising crystalline forms of (r)-7-chloro-n-(quinuclidin-3-yl)benzo(b)thiophene-2-carboxamide hydrochloride monohydrate | |
| WO2005095379A2 (en) | Crystalline methanesulfonic acid addition salts of imatinib | |
| US8916559B2 (en) | Crystalline compound of 7-[(3R)-3-amino-1-oxo-4-(2, 4, 5-trifluorophenyl)butyl]-5, 6, 7, 8-tetrahydro-3-(tri fluoromethyl)-1, 2, 4 -triazolo[4,3-A]pyrazin | |
| TWI646093B (zh) | 1-((2r,4r)-2-(1h-苯并[d]咪唑-2-基)-1-甲基哌啶-4-基)-3-(4-氰基苯基)脲馬來酸鹽之結晶型 | |
| US11420942B2 (en) | Crystalline forms of [3-(4- {2-butyl-1-[4-(4-chloro-phenoxy)-phenyl]-1H-imidazol-4-yl} -phenoxy)-propyl]-diethyl-amine | |
| CN111479798A (zh) | 三亚乙基四胺四盐酸盐的晶形及其医药用途 | |
| JP2007519726A (ja) | 11−ベータ−ヒドロキシステロイドデヒドロゲナーゼ1型の阻害剤の、新規結晶形態 | |
| KR102442536B1 (ko) | 리나글립틴 결정형 및 이의 제조방법 | |
| JP2020535193A (ja) | 結晶のリナグリプチン中間体およびリナグリプチンの調製のためのプロセス | |
| CN111094241B (zh) | 一种氧代吡啶酰胺类衍生物的晶型及其制备方法 | |
| WO2008062047A1 (en) | Process for preparing a crystalline form of candesartan cilexetil | |
| US7435738B2 (en) | Stable crystalline form of bifeprunox mesylate (7-[4-([1,1′-biphenyl]-3-ylmethyl)-1-piperazinyl]-2(3H)-benzoxazolone monomethanesulfonate) | |
| US9464086B2 (en) | Crystalline forms of N,N-dicyclopropyl-4-(1,5-dimethyl-1 H-pyrazol-3-ylamino)-6-ethyl-1-methyl-1,6-dihydroimidazo[4,5-D]pyrrolo[2,3-B]pyridine-7-carboxamide for the treatment of myeloproliferative disorders | |
| EP1656358B1 (en) | Stable polymorph of bifeprunox mesilate | |
| CN101663280A (zh) | [3-(4-{2-丁基-1-[4-(4-氯-苯氧基)-苯基]-1h-咪唑-4-基}-苯氧基)-丙基]-二乙基-胺的晶型ⅰ和ⅱ | |
| JP2015516440A (ja) | 7−(tert−ブチル−d9)−3−(2,5−ジフルオロフェニル)−6−((1−メチル−1H−1,2,4−トリアゾール−5−イル)メトキシ)−[1,2,4]トリアゾロ[4,3−b]ピリダジンの2型多形 | |
| CN114773211B (zh) | 一种葡甲胺盐的晶型、其制备方法及应用 | |
| WO2023222103A1 (zh) | 一种三嗪二酮类衍生物的晶型及制备方法 | |
| WO2013170243A1 (en) | Form 5 polymorph of 7-(tert-butyl-d9)-3-(2,5-difluorophenyl)-6((1-methyl-1h-1,2,4-triazol-5-yl)methoxy)-[1,2,4]triazolo[4,3-b]pyridazine |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110124 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20110124 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20121203 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20130226 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20130305 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130527 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20130527 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20130620 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20130913 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20130924 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20140404 |