JP2010512730A - TTK as a tumor marker and therapeutic target for lung cancer - Google Patents
TTK as a tumor marker and therapeutic target for lung cancer Download PDFInfo
- Publication number
- JP2010512730A JP2010512730A JP2009524832A JP2009524832A JP2010512730A JP 2010512730 A JP2010512730 A JP 2010512730A JP 2009524832 A JP2009524832 A JP 2009524832A JP 2009524832 A JP2009524832 A JP 2009524832A JP 2010512730 A JP2010512730 A JP 2010512730A
- Authority
- JP
- Japan
- Prior art keywords
- seq
- ttk
- polypeptide
- egfr
- amino acid
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6876—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes
- C12Q1/6883—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material
- C12Q1/6886—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material for cancer
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/118—Prognosis of disease development
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/136—Screening for pharmacological compounds
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/158—Expression markers
Abstract
本明細書に開示されるのは、EGFRに対するTTKキナーゼ活性測定方法およびこのキナーゼ活性のモジュレーターのスクリーニング方法である。また、開示されるのはこのモジュレーターを用いる、または含む、肺癌を予防および/または治療する方法ならびに薬学的組成物である。EGFRタンパク質に対するTTKキナーゼ活性を指標として使用する肺癌診断方法、ならびに、肺癌を評価および予後予測する方法もまた提供される。Disclosed herein are a method for measuring TTK kinase activity against EGFR and a method for screening for modulators of this kinase activity. Also disclosed are methods and pharmaceutical compositions for preventing and / or treating lung cancer using or comprising this modulator. Also provided are lung cancer diagnostic methods using TTK kinase activity against EGFR protein as an indicator, and methods for evaluating and prognosing lung cancer.
Description
本出願は、2006年12月13日付で出願した米国仮特許出願60/874,791号の恩典を主張するものであり、その開示全体は全目的に関して参照により本明細書に組み入れられる。 This application claims the benefit of US Provisional Patent Application No. 60 / 874,791, filed on Dec. 13, 2006, the entire disclosure of which is incorporated herein by reference for all purposes.
本発明は、肺癌、より詳しくはその診断および治療に関する。 The present invention relates to lung cancer, and more particularly to its diagnosis and treatment.
肺癌は、世界的に見て癌による死亡の最も一般的な原因の1つであり、非小細胞肺癌(NSCLC)はそのような症例のほぼ80%を占める(Greenlee, R. T., et al., (2001) CA Cancer J Clin, 51: 15-36.(非特許文献1))。小細胞肺癌(SCLC)は全肺癌の15-20%を占める(Chute JP et al., (1999) J Clin Oncol.; 17:1794-801(非特許文献2), Simon GR et al., (2003) Chest.; 123(1 Suppl):259S-271S(非特許文献3))。肺癌の発症および進行に関連した多くの遺伝子的変化が報告されているが、正確な分子機序は依然として不明である(Sozzi, G. Eur J Cancer, (2001) 37 Suppl 7: S63-73.(非特許文献4))。この10年の間に、パクリタキセル、ドセタキセル、ゲムシタビンおよびビノレルビンを含む、新たに開発された細胞毒性薬が出現し、進行性NSCLC患者に複数の治療選択肢が提供されるようになった。しかし、新しい治療法は、シスプラチンに基づく従来の治療と比較して、わずかな延命効果を提供できるに過ぎない(Schiller, J. H. et al. (2002) N Engl J Med, 346: 92-8.(非特許文献5); Kelly, K., et al. (2001) J Clin Oncol, 19: 3210-8(非特許文献6))。したがって、例えば分子標的作用物質、抗体、および癌ワクチンなどの新しい治療戦略の開発が切望されている。 Lung cancer is one of the most common causes of cancer death worldwide, and non-small cell lung cancer (NSCLC) accounts for nearly 80% of such cases (Greenlee, RT, et al., (2001) CA Cancer J Clin, 51: 15-36. Small cell lung cancer (SCLC) accounts for 15-20% of all lung cancers (Chute JP et al., (1999) J Clin Oncol .; 17: 1794-801 (non-patent document 2), Simon GR et al., ( 2003) Chest .; 123 (1 Suppl): 259S-271S (non-patent document 3)). Although many genetic changes associated with the development and progression of lung cancer have been reported, the exact molecular mechanism remains unclear (Sozzi, G. Eur J Cancer, (2001) 37 Suppl 7: S63-73. (Non-Patent Document 4)). During the last decade, newly developed cytotoxic drugs, including paclitaxel, docetaxel, gemcitabine and vinorelbine, have emerged and offer multiple treatment options for patients with advanced NSCLC. However, new therapies can only provide a slight survival benefit compared to conventional treatments based on cisplatin (Schiller, JH et al. (2002) N Engl J Med, 346: 92-8. Non-patent document 5); Kelly, K., et al. (2001) J Clin Oncol, 19: 3210-8 (non-patent document 6)). Therefore, the development of new therapeutic strategies such as molecular targeted agents, antibodies, and cancer vaccines is eagerly desired.
cDNAマイクロアレイ技術を用いて数千の遺伝子の発現レベルを系統的に解析することは、発癌経路に関与する未知の分子を同定するための有効なアプローチであり、かつ新規な治療法および診断法を開発するための候補標的として調べることができる。レーザーキャプチャーマイクロダイセクションにより肺癌組織101例から腫瘍細胞を濃縮した後に、27,648の遺伝子を含むcDNAマイクロアレイ上でNSCLC細胞のゲノムワイドな発現プロファイルを解析することによって、NSCLCの診断、治療および予防のための新規な分子標的を単離しようという試みがなされている(Kikuchi T, et al. Oncogene. 2003 Apr10;22(14):2192-205.(非特許文献7); Kikuchi T, et al. Int J Oncol. 2006 Apr; 28(4):799-805.(非特許文献8); Kakiuchi S, et al., Mol Cancer Res. 2003 May;1(7):485-99.(非特許文献9); Hum Mol Genet. 2004 Dec15;13(24):3029-43. Epub 2004 Oct 20.(非特許文献10); Taniwaki M, et al, Int J Oncol. 2006 Sep;29(3):567-75.(非特許文献11))。ゲノムワイドcDNAマイクロアレイ解析の経過で、642の上方制御された遺伝子および806の下方制御された遺伝子が、NSCLCの診断マーカーおよび治療標的として同定された(WO 2004/31413(特許文献1)(その内容は参照により本明細書に組み入れられる))。 Systematic analysis of the expression levels of thousands of genes using cDNA microarray technology is an effective approach to identify unknown molecules involved in the oncogenic pathway, and new therapies and diagnostics Can be investigated as a candidate target for development. For the diagnosis, treatment and prevention of NSCLC by concentrating tumor cells from 101 lung cancer tissues by laser capture microdissection and then analyzing the genome-wide expression profile of NSCLC cells on a cDNA microarray containing 27,648 genes An attempt has been made to isolate a novel molecular target (Kikuchi T, et al. Oncogene. 2003 Apr10; 22 (14): 2192-205. (Non-patent Document 7); Kikuchi T, et al. Int J Oncol. 2006 Apr; 28 (4): 799-805. (Non-patent document 8); Kakiuchi S, et al., Mol Cancer Res. 2003 May; 1 (7): 485-99. ); Hum Mol Genet. 2004 Dec15; 13 (24): 3029-43. Epub 2004 Oct 20. (Non-Patent Document 10); Taniwaki M, et al, Int J Oncol. 2006 Sep; 29 (3): 567- 75. (Non-patent document 11)). In the course of genome-wide cDNA microarray analysis, 642 up-regulated genes and 806 down-regulated genes were identified as diagnostic markers and therapeutic targets for NSCLC (WO 2004/31413) Are incorporated herein by reference)).
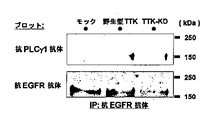
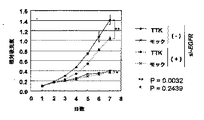
上皮成長因子受容体(EGFR)は、例えばEGFRの自己リン酸化を導き、EGFR情報伝達経路を活性化するEGFのようなリガンドの刺激によって、様々な組織においてヒト癌の成長および生存に重要な役割を果たす。cDNAおよび組織マイクロアレイ解析によって、肺癌の大多数でTTKは過剰発現するものとして同定され、さらに予後不良と関連することが示された。さらに、siRNA処理による内因性TTK発現の抑制は、非小細胞肺癌細胞の有意な増殖阻害を生じることが示された。癌細胞情報伝達に関連するリン酸化タンパク質に対する抗体のパネルを用いたTTKキナーゼの候補基質のスクリーニングは、TTKの細胞内標的としてEGFRを同定する結果となった。さらに、TTKによるEGFRのチロシン-992およびセリン-967のリン酸化がEGF刺激と独立して発生し、PLCγの活性化およびMAPKのリン酸化につながることが発見された。また、原発性肺腺癌由来の転移性脳腫瘍を有する2人の患者および肺癌細胞株RERF-LC-AIにおいて、TTK遺伝子のチロシンキナーゼドメインに点変異が同定された。インビトロでは、TTK変異体は哺乳動物細胞の浸潤能力を増大した。同時に、これらのデータは癌遺伝子およびその活性化としてのTTKの機能が癌細胞においてEGFR-MAPK情報伝達の細胞内刺激において重要な役割を果たすこと、TTKキナーゼと、EGFの存在から独立したEGFR間の新規細胞内情報伝達経路が肺癌形成において重要な役割を果たすことを示している。したがって、本発明はTTK酵素活性を標的とすることが肺癌患者の治療に対する有望な治療戦略であることを示唆している。 Epidermal growth factor receptor (EGFR) plays an important role in human cancer growth and survival in various tissues by stimulating ligands such as EGF that lead to EGFR autophosphorylation and activate EGFR signaling pathway Fulfill. cDNA and tissue microarray analysis identified TTK as overexpressed in the majority of lung cancers and was further associated with poor prognosis. Furthermore, suppression of endogenous TTK expression by siRNA treatment was shown to result in significant growth inhibition of non-small cell lung cancer cells. Screening candidate substrates for TTK kinase using a panel of antibodies against phosphoproteins associated with cancer cell signaling resulted in the identification of EGFR as an intracellular target for TTK. Furthermore, it was discovered that phosphorylation of EGFR tyrosine-992 and serine-967 by TTK occurs independently of EGF stimulation, leading to activation of PLCγ and phosphorylation of MAPK. In addition, a point mutation was identified in the tyrosine kinase domain of the TTK gene in two patients with metastatic brain tumors derived from primary lung adenocarcinoma and in the lung cancer cell line RERF-LC-AI. In vitro, TTK mutants increased the ability of mammalian cells to invade. At the same time, these data indicate that the function of TTK as an oncogene and its activation plays an important role in intracellular stimulation of EGFR-MAPK signaling in cancer cells, between TTK kinase and EGFR independent of the presence of EGF Have been shown to play an important role in lung cancer formation. Thus, the present invention suggests that targeting TTK enzyme activity is a promising therapeutic strategy for the treatment of lung cancer patients.
ヒト癌の診断、治療および予防の新規分子標的のスクリーニングの過程で、レーザーマイクロダイセクションと組み合わせた27,648の遺伝子を含むcDNAマイクロアレイ上で、101例の肺癌のゲノム全域発現プロファイル分析が行われた(Kikuchi T, et al. Oncogene. 2003 Apr 10;22(14):2192-205.; Kikuchi T, et al. Int J Oncol. 2006 Apr;28(4):799-805.; Kakiuchi S, et al., Mol Cancer Res. 2003 May;1(7):485-99.; Kakiuchi S, et al., Hum Mol Genet. 2004 Dec 15;13(24):3029-43. Epub 2004 Oct 20.; Taniwaki M, et al, Int J Oncol. 2006 Sep;29(3):567-75.)。その結果は、TTKプロテインキナーゼ(別名、hMps1)をコードしている遺伝子が、しばしば原発性肺癌の大多数で過剰発現することを示している。 In the course of screening for new molecular targets for the diagnosis, treatment and prevention of human cancer, a genome-wide expression profile analysis of 101 lung cancers was performed on a cDNA microarray containing 27,648 genes combined with laser microdissection ( Kikuchi T, et al. Oncogene. 2003 Apr 10; 22 (14): 2192-205 .; Kikuchi T, et al. Int J Oncol. 2006 Apr; 28 (4): 799-805 .; Kakiuchi S, et al ., Mol Cancer Res. 2003 May; 1 (7): 485-99 .; Kakiuchi S, et al., Hum Mol Genet. 2004 Dec 15; 13 (24): 3029-43. Epub 2004 Oct 20 .; Taniwaki M, et al, Int J Oncol. 2006 Sep; 29 (3): 567-75.). The results indicate that the gene encoding TTK protein kinase (aka hMps1) is often overexpressed in the majority of primary lung cancers.
上皮成長因子受容体(EGFR)は、成長情報伝達経路の重要な仲介物質として認識されている(Carpenter G. Annu Rev Biochem. 1987;56:881-914.; Wells C. Int J Biochem Cell Biol. 1999 Jun;31(6):637-43.)。異常なEGFR活性は、遺伝的および後成的変化から生じ、細胞増殖を促進して、多くの腫瘍において腫瘍発達を生じることが示された(Salomon DS, et al., Crit Rev Oncol Hematol. 1995 Jul;19(3):183-232.; Mendelson J. Clin Cancer Res. 2000 Mar;6(3):747-53.)。そのため、選択的にEGFR情報伝達を阻害する作用物質が開発中であり、これを受けて抗EGFRモノクローナル抗体、セツキシマブ(Erbitux)、およびゲフィニチブ(Iressa)、エルロチニブ(Tarceva)といったEGFRチロシンキナーゼ低分子阻害剤が診療において用いられてきた(Dowell J, et al., Nat Rev Drug Discov. 2005 Jan;4(1):13-4.; Herbst RS, et al., Nat Rev Cancer. 2004 Dec;4(12):956-65.)。例えばEGFのようなそのリガンドの刺激は、EGFRに構造変化および、MAPK(mitogen activated protein kinase)カスケードおよびc-Src(cellular Src)カスケードを含むEGFR情報伝達経路を活性化する自己リン酸化を起こす(Yarden Y. Eur J Cancer. 2001 Sep;37 Suppl 4:S3-8.; Pal SK & Pegram M. Anticancer Drugs. 2005 Jun;16(5):483-94.; Tice DA, et al., Proc Natl Acad Sci U S A. 1999 Feb 16;96(4):1415-20.)。c-Srcは、EGFの存在下でEGFRの細胞質テールをリン酸化し、EGFRシグナルを活性化する(Yarden Y. Eur J Cancer. 2001 Sep;37 Suppl 4:S3-8.; Pal SK & Pegram M. Anticancer Drugs. 2005 Jun;16(5):483-94.; Tice DA, et al., Proc Natl Acad Sci U S A. 1999 Feb 16;96(4):1415-20.)。しかしながら、EGFRをリン酸化し、その結果EGFから独立した動態でEGFR経路を活性化するキナーゼは未だ報告されていなかった。 Epidermal growth factor receptor (EGFR) is recognized as an important mediator of growth signaling pathways (Carpenter G. Annu Rev Biochem. 1987; 56: 881-914 .; Wells C. Int J Biochem Cell Biol. 1999 Jun; 31 (6): 637-43.). Abnormal EGFR activity has been shown to result from genetic and epigenetic changes and promote cell proliferation resulting in tumor development in many tumors (Salomon DS, et al., Crit Rev Oncol Hematol. 1995 Jul; 19 (3): 183-232 .; Mendelson J. Clin Cancer Res. 2000 Mar; 6 (3): 747-53.). Therefore, an agent that selectively inhibits EGFR signaling is under development. In response to this, anti-EGFR monoclonal antibodies, cetuximab (Erbitux), and EGFR tyrosine kinase small molecule inhibitors such as gefitinib (Iressa) and erlotinib (Tarceva) The drug has been used in clinical practice (Dowell J, et al., Nat Rev Drug Discov. 2005 Jan; 4 (1): 13-4 .; Herbst RS, et al., Nat Rev Cancer. 2004 Dec; 4 ( 12): 956-65.). Stimulation of its ligand, such as EGF, causes structural changes in EGFR and autophosphorylation that activates EGFR signaling pathways, including the MAPK (mitogen activated protein kinase) cascade and c-Src (cellular Src) cascade ( Yarden Y. Eur J Cancer. 2001 Sep; 37 Suppl 4: S3-8 .; Pal SK & Pegram M. Anticancer Drugs. 2005 Jun; 16 (5): 483-94 .; Tice DA, et al., Proc Natl Acad Sci US A. 1999 Feb 16; 96 (4): 1415-20.). c-Src phosphorylates the cytoplasmic tail of EGFR in the presence of EGF and activates the EGFR signal (Yarden Y. Eur J Cancer. 2001 Sep; 37 Suppl 4: S3-8 .; Pal SK & Pegram M Anticancer Drugs. 2005 Jun; 16 (5): 483-94 .; Tice DA, et al., Proc Natl Acad Sci US A. 1999 Feb 16; 96 (4): 1415-20.). However, no kinase has yet been reported that phosphorylates EGFR and consequently activates the EGFR pathway in a manner independent of EGF.
本明細書において開示される証拠は、EGFR Tyr-992およびSer-967の、EGFから独立したリン酸化および、それに続く、腫瘍成長/生存のために不可欠であると考えられる下流のMAPKシグナルの活性化による肺癌形成において、TTKが重要な役割を果たすことを証明する。これらのデータは、TTKと、EGFの存在から独立したEGFRの間の新規情報伝達が、肺癌の新規治療薬開発のための有望な標的であることを示唆している。 Evidence disclosed herein is the phosphorylation of EGFR Tyr-992 and Ser-967 independent of EGF and the subsequent activity of downstream MAPK signals that are considered essential for tumor growth / survival Demonstrates that TTK plays an important role in the formation of lung cancer by chemicalization. These data suggest that novel signaling between TTK and EGFR independent of the presence of EGF is a promising target for the development of new therapeutics for lung cancer.
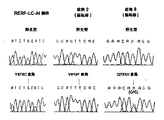
また、様々なアミノ酸置換、例えばコドン72におけるロイシンからプロリン(L72P)、コドン76におけるセリンからスレオニン(S76T)、コドン574におけるチロシンからシステイン(Y574C)、コドン789におけるプロリンからグルタミン(P789Q)およびコドン856におけるロイシンからイソロイシン(K856I)の置換(表4)、から成る変異体TTKタンパク質が本明細書において開示される。RERF-LC-AI細胞株で見られるTTKキナーゼドメイン上のコドン574におけるミスセンス変異(Y574C)は、SNPデータベースには存在しなかった(JSNP: http://snp.ims.u-tokyo.ac.jp/index_ja.html; DBSNP: http://www.ncbi.nlm.nih.gov/projects/SNP/)。さらに、原発性肺腺癌由来の2つの転移性脳腫瘍の臨床検体のTTKキナーゼドメインにおいて、2つのミスセンス変異が同定された。変異は結果的に2つのアミノ酸置換、すなわちコドン610におけるバリンからフェニルアラニン(V610F)、コドン753におけるグルタミンからヒスチジン(Q753H)への置換、であった。適合した正常な脳組織はこれら2人の患者のために利用可能で、野生型DNA配列のみ示し、腫瘍形成または進行する間にその変異が身体的に生じたことを示唆した。 Also, various amino acid substitutions such as leucine to proline (L72P) at codon 72, serine to threonine at codon 76 (S76T), tyrosine to cysteine at codon 574 (Y574C), proline to glutamine at codon 789 (P789Q) and codon 856. Disclosed herein is a variant TTK protein consisting of a substitution of leucine to isoleucine (K856I) in Table 4 (Table 4). The missense mutation (Y574C) at codon 574 on the TTK kinase domain found in the RERF-LC-AI cell line did not exist in the SNP database (JSNP: http://snp.ims.u-tokyo.ac. jp / index_en.html; DBSNP: http://www.ncbi.nlm.nih.gov/projects/SNP/). In addition, two missense mutations were identified in the TTK kinase domain of clinical specimens of two metastatic brain tumors from primary lung adenocarcinoma. The mutation resulted in two amino acid substitutions: valine to phenylalanine (V610F) at codon 610 and glutamine to histidine (Q753H) at codon 753. Matched normal brain tissue was available for these two patients, showing only the wild-type DNA sequence, suggesting that the mutation occurred physically during tumor formation or progression.
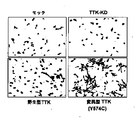
変異TTK(Y574C)形質転換細胞は、非形質転換細胞と比較して高い自己リン酸化レベルを示し、変異がTTKキナーゼ活性を促進し得ることを示した。さらに、変異TTK(Y574C)形質転換細胞の浸潤能力が、変異TTK構築物を用いたマトリゲル浸潤アッセイによって、著しく促進されることが確認された。これらの結果は、疑いなくRERF-LC-AI細胞由来のTTK変異が、肺癌形成に関与する活性化した変異であり得ることを示す。 Mutant TTK (Y574C) transformed cells showed higher autophosphorylation levels compared to non-transformed cells, indicating that the mutation could promote TTK kinase activity. Furthermore, it was confirmed that the invasion ability of the mutant TTK (Y574C) transformed cells was significantly enhanced by the Matrigel invasion assay using the mutant TTK construct. These results undoubtedly indicate that TTK mutations derived from RERF-LC-AI cells may be activated mutations involved in lung cancer formation.
(表4)肺癌細胞株におけるTTK変異リスト
(*) : 転写開始点からの位置
(**) : 非コード領域
# : キナーゼドメインにおける位置
(!) : 以前に報告された
(Table 4) List of TTK mutations in lung cancer cell lines
(*): Position from the transfer start point
(**): Non-code area
#: Position in kinase domain
(!): Reported previously
したがって、本発明は、一部、TTKによるEGFRのTyr-992およびSer-967のEGFから独立したリン酸化と、腫瘍成長および/または生存のために不可欠だと考えられている、その後に続く下流のMAPKシグナルの活性化の発見に基づく。 Thus, the present invention is believed to be indispensable for TGF-9 independent phosphorylation of EGFR by TTK and EGF of Ser-967, and subsequent downstream, which is considered essential for tumor growth and / or survival. Based on the discovery of activation of the MAPK signal.
また、本発明は、対象由来の生体試料において、TTK発現レベルおよびEGFRに対するTTKキナーゼ活性レベルを測定する工程を含む、肺癌または肺癌が発達する素因を診断する方法を提供する。正常対照レベルと比較した前記レベルの増加は、対象が肺癌に罹患しているか、もしくは肺癌の発症リスクを示す。特に、EGFRに対するTTKキナーゼ活性はEGFから独立しており、EGFRのリン酸化部位の1つはTyr-992またはSer-967である。 The present invention also provides a method for diagnosing lung cancer or a predisposition for developing lung cancer, comprising measuring a TTK expression level and a TTK kinase activity level against EGFR in a subject-derived biological sample. An increase in said level compared to a normal control level indicates that the subject has lung cancer or is at risk for developing lung cancer. In particular, TTK kinase activity for EGFR is independent of EGF, and one of the phosphorylation sites of EGFR is Tyr-992 or Ser-967.
本発明はまた、肺癌の予後を評価または判定するための方法を提供する。いくつかの態様において、その方法は次の工程を含む:
a. 肺癌の予後が評価または判定される対象由来の試料において、TTK発現レベルおよび/またはリン酸化EGFRレベルを検出する;ならびに、
b. TTK発現および/またはリン酸化EGFRレベルの高いレベルが検出される場合に、予後不良を示す。
The present invention also provides a method for assessing or determining the prognosis of lung cancer. In some embodiments, the method includes the following steps:
detecting TTK expression levels and / or phosphorylated EGFR levels in a sample from a subject whose lung cancer prognosis is assessed or determined; and
b. A poor prognosis is indicated when high levels of TTK expression and / or phosphorylated EGFR levels are detected.
特に、EGFRに対するTTKキナーゼ活性はEGFから独立しており、EGFRのリン酸化部位はTyr-992またはSer-967である。 In particular, TTK kinase activity for EGFR is independent of EGF, and the phosphorylation site of EGFR is Tyr-992 or Ser-967.
さらなる態様において、本発明はTTKキナーゼ活性を測定する方法を特徴とし、その方法はTTKによるEGFRリン酸化に適した条件下でのポリペプチドのインキュベーションを含む。好適なポリペプチドには、TTKポリペプチドまたはその機能的等価物、およびEGFRポリペプチドまたはその機能的等価物が含まれる。 In a further embodiment, the invention features a method of measuring TTK kinase activity, the method comprising incubation of a polypeptide under conditions suitable for EGFR phosphorylation by TTK. Suitable polypeptides include TTK polypeptides or functional equivalents thereof, and EGFR polypeptides or functional equivalents thereof.
例えば、TTKポリペプチドはSEQ ID NO:2のアミノ酸配列を有することができる。あるいは、結果として生じるポリペプチドがSEQ ID NO:2の生物活性を保持する限りTTKポリペプチドはSEQ ID NO: 2の一つまたは複数のアミノ酸が置換、欠失あるいは挿入によって改変されたアミノ酸配列を有することができる。SEQ ID NO:2のポリペプチドの生物活性は、例えば、細胞増殖の促進およびEGFRに対するTTKキナーゼ活性を含む。さらに、結果として生じるポリヌクレオチドが、SEQ ID NO:2のポリペプチドの生物活性、例えばSEQ ID NO:2のAsp-647を含む領域を保持するタンパク質をコードする限り、そのポリペプチドはSEQ ID NO:1のオープンリーディングフレームによって、または低いもしくは高いといったストリンジェントな条件下で、SEQ ID NO:1のヌクレオチド配列にハイブリダイズするポリヌクレオチドによってコードされる857-アミノ酸タンパク質という形態をとることができる。 For example, the TTK polypeptide can have the amino acid sequence of SEQ ID NO: 2. Alternatively, as long as the resulting polypeptide retains the biological activity of SEQ ID NO: 2, the TTK polypeptide has an amino acid sequence that has been altered by substitution, deletion or insertion of one or more amino acids of SEQ ID NO: 2. Can have. Biological activity of the polypeptide of SEQ ID NO: 2 includes, for example, promoting cell proliferation and TTK kinase activity against EGFR. Furthermore, as long as the resulting polynucleotide encodes a protein that retains the biological activity of the polypeptide of SEQ ID NO: 2, eg, a region comprising Asp-647 of SEQ ID NO: 2, the polypeptide is SEQ ID NO: 2. Can be in the form of a 857-amino acid protein encoded by a polynucleotide that hybridizes to the nucleotide sequence of SEQ ID NO: 1 under stringent conditions such as 1 open reading frame or under low or high conditions.
EGFRポリペプチドは、SEQ ID NO:4のアミノ酸配列を有することができる(GenBank Accession No. NP_005219)。細胞において、EGFRはN末端ドメインで開裂し、1186残基のタンパク質を形成する(SEQ ID NO:42)。結果として生じるポリペプチドがSEQ ID NO:4におけるTTKキナーゼの標的領域、例えばEGFRの開裂型でTyr-992およびSer-967を含む領域、を保持する限り、EGFRポリペプチドは、SEQ ID NO:4の一つまたは複数のアミノ酸が置換、欠失または挿入によって改変されたアミノ酸配列を有することができる。さらに、結果として生じるポリヌクレオチドが、SEQ ID NO:4のTTKキナーゼの標的部位を保持する限り、EGFRポリペプチドはSEQ ID NO:3(GenBank Accession No. NM_005228)のオープンリーディングフレーム、または低いまたは高いといったストリンジェントな条件下で、SEQ ID NO:3のヌクレオチド配列にハイブリダイズするポリヌクレオチドによってコードされる1210アミノ酸タンパク質の形態をとることができる。 The EGFR polypeptide can have the amino acid sequence of SEQ ID NO: 4 (GenBank Accession No. NP_005219). In cells, EGFR is cleaved at the N-terminal domain to form a 1186 residue protein (SEQ ID NO: 42). As long as the resulting polypeptide retains the target region of TTK kinase in SEQ ID NO: 4, e.g., a region containing Tyr-992 and Ser-967 in the cleaved form of EGFR, the EGFR polypeptide is SEQ ID NO: 4 One or more amino acids may have an amino acid sequence modified by substitution, deletion or insertion. Furthermore, as long as the resulting polynucleotide retains the TTK kinase target site of SEQ ID NO: 4, the EGFR polypeptide is open reading frame of SEQ ID NO: 3 (GenBank Accession No. NM_005228), or low or high In the form of a 1210 amino acid protein encoded by a polynucleotide that hybridizes to the nucleotide sequence of SEQ ID NO: 3.
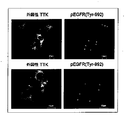
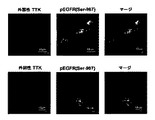
本発明の文脈において、EGFRに対するTTKキナーゼ活性はリン酸化EGFR、特にTyr-992におけるリン酸化の検出によって定義され得る(図4e)。EGFRに対するTTKキナーゼ活性は、例えばリン酸化EGFR用抗体を用いたウエスタンブロット解析のような従来法により、検出することができる。リン酸化はインビトロまたはインビボのどちらかで生じ得る。インビトロリン酸化において、精製された組換え型TTKポリペプチドは、リン酸供与体としてATPを用いた細胞株、または組換え型EGFRポリペプチドから調製される全抽出物とインキュベートすることができる。インビボリン酸化において、内因的または外因的に共発現しているTTKおよびEGFRを用いることができる。適切な合成条件は、例えばTris-HClのような公知の基本的な緩衝液条件を含む。 In the context of the present invention, TTK kinase activity against EGFR can be defined by detection of phosphorylation in phosphorylated EGFR, particularly Tyr-992 (FIG. 4e). TTK kinase activity against EGFR can be detected by a conventional method such as Western blot analysis using an antibody for phosphorylated EGFR. Phosphorylation can occur either in vitro or in vivo. In in vitro phosphorylation, the purified recombinant TTK polypeptide can be incubated with a cell line using ATP as the phosphate donor, or with a whole extract prepared from the recombinant EGFR polypeptide. For in vivo phosphorylation, endogenously or exogenously co-expressed TTK and EGFR can be used. Suitable synthesis conditions include known basic buffer conditions such as, for example, Tris-HCl.
本発明は、さらに、TTKポリペプチドまたはその機能的等価物およびEGFRポリペプチドまたはその機能的等価物を、リン酸供与体としてのATP存在下でインキュベートし、リン酸化EGFRレベルを測定することによって検出されるEGFRに対するTTKキナーゼ活性を調節(例えば増大または減少)する作用物質を同定する方法を提供する。正常な対照レベルと比較したリン酸化EGFRレベルにおける減少は、被験薬剤がTTKキナーゼの阻害剤であることを示す。EGFRに対するTTKキナーゼ活性を阻害する(例えば減少する)化合物は、肺癌の症状を治療、予防または軽減することに有用である。例えば、そのような化合物は肺癌細胞の増殖を阻害することができる。あるいは、正常対照レベルと比較したレベルまたは活性の増大は、試験作用物質がEGFRに対するTTKキナーゼ活性のエンハンサーであることを示す。本明細書において、正常対照レベルという表現は、試験化合物の非存在下で検出されるEGFRに対するTTKキナーゼ活性レベルをいう。例えば、TTKによるEGFRのリン酸化はEGFから独立しており、EGFRのリン酸化部位の例はTyr-992およびSer-967、その他である。 The invention further detects TTK polypeptide or functional equivalent thereof and EGFR polypeptide or functional equivalent thereof by incubating in the presence of ATP as a phosphate donor and measuring phosphorylated EGFR levels. To identify agents that modulate (eg, increase or decrease) the activity of TTK kinases against EGFR. A decrease in phosphorylated EGFR levels compared to normal control levels indicates that the test agent is an inhibitor of TTK kinase. Compounds that inhibit (eg, reduce) TTK kinase activity against EGFR are useful for treating, preventing or alleviating symptoms of lung cancer. For example, such compounds can inhibit the growth of lung cancer cells. Alternatively, an increase in level or activity relative to a normal control level indicates that the test agent is an enhancer of TTK kinase activity against EGFR. As used herein, the expression normal control level refers to the level of TTK kinase activity against EGFR detected in the absence of the test compound. For example, phosphorylation of EGFR by TTK is independent from EGF, and examples of phosphorylation sites of EGFR are Tyr-992 and Ser-967.
本発明はまた、上記のように同定される化合物と肺癌細胞を接触させることによって、肺癌を治療または予防する組成物および方法を含む。さらなる態様において、上記のように同定される化合物の使用、および肺癌を治療または予防するのに適した薬学的組成物の製造を提供する。例えば、肺癌を治療する方法は、上記に記載のように同定される化合物の薬学上有効量および薬学的担体を含んだ組成物を、例えば当該疾患状態を有すると診断されていたヒト患者のような哺乳類に投与する工程を含むことができる。 The invention also includes compositions and methods for treating or preventing lung cancer by contacting lung cancer cells with a compound identified as described above. In a further aspect, there is provided the use of a compound identified as described above and the manufacture of a pharmaceutical composition suitable for treating or preventing lung cancer. For example, a method of treating lung cancer may comprise a composition comprising a pharmaceutically effective amount of a compound identified as described above and a pharmaceutical carrier, such as a human patient who has been diagnosed with the disease state. Administering to a non-human mammal.
本発明はまた、EGFRに対するTTKキナーゼ活性を検出するためのキットを提供する。試薬は、好ましくはキットの形でともに包装される。試薬は別々の容器で包装することができ、例えばTTKポリペプチド、EGFRポリペプチド、リン酸化EGFR(Tyr992)またはリン酸化EGFR(Ser967)などのリン酸化EGFR検出試薬、対照試薬(陽性および/または陰性)、および/または検出可能な標識を含み得る。アッセイを実施するための使用説明書(例えば書面、テープ、VCR、CD-ROM、その他)は、好ましくはキットに含まれる。キットのアッセイ形式は当技術分野において公知の任意のキナーゼアッセイを含むことができる。 The present invention also provides a kit for detecting TTK kinase activity against EGFR. The reagents are preferably packaged together in the form of a kit. Reagents can be packaged in separate containers, eg phosphorylated EGFR detection reagents such as TTK polypeptide, EGFR polypeptide, phosphorylated EGFR (Tyr992) or phosphorylated EGFR (Ser967), control reagents (positive and / or negative) ), And / or a detectable label. Instructions for performing the assay (eg, written, tape, VCR, CD-ROM, etc.) are preferably included in the kit. The assay format of the kit can include any kinase assay known in the art.
本発明はキナーゼドメインでTTKの様々なアミノ酸置換、特に結果としてアミノ酸が置換された変異;それぞれ2名の患者のために利用可能な、コドン610でのバリンからフェニルアラニン(V610F)、コドン753でのグルタミンからヒスチジン(Q753H)、およびSNPデータベースには存在しなかった、RERF-LC-AI細胞株で見出されたTTKキナーゼドメイン上のコドン574でのチロシンからシステインへのミスセンス変異(Y574C)、の発見に一部基づいている。TTKの変異(Y574CまたはQ753H)はTTKのキナーゼ活性および浸潤能力を促進するため、RERF-LC-AI細胞由来のTTKの変異(Y574CまたはQ753H)は肺癌形成に関与する活性化した変異でありうる。したがって、本発明は肺癌の転移、特にTTKのキナーゼドメインの変異、例えばY574CまたはQ753Hを指標として用いた肺癌の脳転移を予測する方法を提供する。 The present invention relates to various amino acid substitutions of TTK in the kinase domain, particularly mutations resulting in amino acid substitutions; valine at codon 610 to phenylalanine (V610F), codon 753, available for two patients each. Glutamine to histidine (Q753H), and a tyrosine to cysteine missense mutation (Y574C) at codon 574 on the TTK kinase domain found in the RERF-LC-AI cell line, which was not present in the SNP database Based in part on the discovery. Mutation of TTK (Y574C or Q753H) promotes TTK kinase activity and invasion ability, so a mutation in TTK derived from RERF-LC-AI cells (Y574C or Q753H) may be an activated mutation involved in lung cancer formation . Therefore, the present invention provides a method for predicting lung cancer metastasis, particularly brain tumor metastasis of lung cancer using TTK kinase domain mutation, for example, Y574C or Q753H as an index.
他の態様において、本発明はまた、TTK(SEQ ID NO:1)またはEGFR(SEQ ID NO:3)遺伝子発現を減少する二本鎖分子を含む組成物を対象に投与することを含む肺癌治療または予防方法を提供する。該二本鎖分子はセンス核酸およびアンチセンス核酸を含んでおり、該センス核酸は標的配列としてのSEQ ID NO:62または63の配列に一致するリボヌクレオチド配列を含む。 In other embodiments, the present invention also includes administering to a subject a composition comprising a double-stranded molecule that reduces TTK (SEQ ID NO: 1) or EGFR (SEQ ID NO: 3) gene expression. Or provide preventive methods. The double-stranded molecule comprises a sense nucleic acid and an antisense nucleic acid, the sense nucleic acid comprising a ribonucleotide sequence that matches the sequence of SEQ ID NO: 62 or 63 as the target sequence.
あるいは、本発明はまた、TTK(SEQ ID NO:1)またはEGFR(SEQ ID NO:3)遺伝子発現を減少する二本鎖分子の薬学上有効量および薬学上許容される担体を含む肺癌治療および予防のための組成物を提供する。 Alternatively, the present invention also provides a lung cancer treatment comprising a pharmaceutically effective amount of a double-stranded molecule that reduces TTK (SEQ ID NO: 1) or EGFR (SEQ ID NO: 3) gene expression and a pharmaceutically acceptable carrier and Prophylactic compositions are provided.
さらに、本発明は、ISSILEKGERLPQPPICTI (SEQ ID NO:44)、DVYMIMVKCWMIDADSRPK (SEQ ID NO:45)およびFRELIIEFSKMARDPQRYL (SEQ ID NO:46)の群から選択される阻害性のポリペプチドを提供する。本発明は肺癌の治療および/または治療のためにこれらの阻害性のポリペプチドを使用するための医薬または方法をさらに提供する。 Furthermore, the present invention provides an inhibitory polypeptide selected from the group of ISSILEKGERLPQPPICTI (SEQ ID NO: 44), DVYMIMVKCWMIDADSRPK (SEQ ID NO: 45) and FRELIIEFSKMARDPQRYL (SEQ ID NO: 46). The invention further provides a medicament or method for using these inhibitory polypeptides for the treatment and / or treatment of lung cancer.
本発明はまた、ISSILEKGERLPQPPICTI (SEQ ID NO:44), DVYMIMVKCWMIDADSRPK (SEQ ID NO:45)およびFRELIIEFSKMARDPQRYL (SEQ ID NO:46)の群から選択される阻害性のポリペプチドまたはそれらをコードするポリヌクレオチドを投与する工程を含む肺癌の治療方法および/または予防方法に関する。 The present invention also provides an inhibitory polypeptide selected from the group of ISSILEKGERLPQPPICTI (SEQ ID NO: 44), DVYMIMVKCWMIDADSRPK (SEQ ID NO: 45) and FRELIIEFSKMARDPQRYL (SEQ ID NO: 46) or a polynucleotide encoding them. The present invention relates to a method for treating and / or preventing lung cancer comprising a step of administering.
本発明のこれらおよびその他の目的および特徴は、添付の図および実施例と併せて以下の詳細な説明を読むことでより完全に明らかとなるであろう。しかしながら、上記の発明の概要および以下の詳細な説明のどちらも好ましい態様であり、本発明や本発明の他の代替的態様を制限するものではないことは理解されるべきである。特に、発明が多くの特定の態様に関して本明細書に記載されるとともに、明細書は発明の説明となり、発明を制限するものとして作成されるものではないことはいうまでもない。添付された特許請求の範囲に記載されているように、本発明の精神と範囲から逸脱しない範囲で、当業者は様々な変更や応用を思いつく場合がある。同様に、本発明の他の目的、特徴、恩典および効果は以下に記載されているこの概要および特定の態様から明らか、および当業者には直ちに明らかである。そのような目的、特徴、利点および効果は添付の実施例、データ、図およびそこから引き出される全ての妥当な推論と連動して、単独で、または明細書中で引用された参考文献を考慮して、上記から明らかである。 These and other objects and features of the invention will become more fully apparent when the following detailed description is read in conjunction with the accompanying figures and examples. However, it is to be understood that both the foregoing summary of the invention and the following detailed description are preferred embodiments and do not limit the invention or other alternative embodiments of the invention. In particular, while the invention is described herein with reference to a number of specific embodiments, it will be understood that the specification is illustrative of the invention and is not to be construed as limiting the invention. Various modifications and applications may occur to those skilled in the art without departing from the spirit and scope of the invention as set forth in the appended claims. Similarly, other objects, features, benefits and advantages of the present invention will be apparent from this summary and specific embodiments described below and will be readily apparent to those skilled in the art. Such objects, features, advantages and effects may be considered in conjunction with the appended examples, data, figures and all reasonable inferences derived therefrom, either alone or in references cited in the specification. It is clear from the above.
上記で列挙される特異的な目的および対象に関して、一つまたは複数の本発明の態様が特定の目的に対処できることは当業者によく理解されている。その一方で、一つまたは複数の他の態様は特定の他の目的に対処できる。本発明のあらゆる態様に対して、あらゆる観点において、それぞれの目的は同等には適用することができない。よって、本明細書における対象は、本発明のいかなる一態様に関しても代替的に考えることが可能である。 With respect to the specific objects and subjects listed above, it is well understood by those skilled in the art that one or more aspects of the present invention can address a particular object. On the other hand, one or more other aspects can address certain other purposes. In every aspect of the present invention, each object cannot be equally applied in every aspect. Thus, the subject matter herein can be considered in the alternative with respect to any one aspect of the present invention.
本発明の様々な局面および出願は、図面の簡単な説明ならびに以下の本発明およびその好ましい態様の詳細な説明を検討することにより、当業者にとって明らかになるであろう。 Various aspects and applications of the present invention will become apparent to those skilled in the art upon review of the brief description of the drawings and the following detailed description of the invention and preferred embodiments thereof.
発明の詳細な説明
これらは日常的な試験および最適化に合わせて変更できるので、本明細書において記載されている特異的な方法論およびプロトコルに限られないことは理解されるべきである。本明細書において使用される用語は、特定のバージョンまたは実施例のみを記載するものであり、本発明の範囲を制限する意図はないことも理解されるべきである。本明細書においておよび添付の特許請求の範囲で用いられるように、単数形「1つの(a)」、「1つの(an)」および「その(the)」は、文脈が明らかに別のものを指す場合を除き、複数の参照を含むことに留意しなければならない。したがって、例えば「細胞」について言及することは、当業者等に公知の、一つまたは複数の細胞およびその等価物について言及することである。
DETAILED DESCRIPTION OF THE INVENTION It should be understood that these are not limited to the specific methodologies and protocols described herein as they can be modified for routine testing and optimization. It is also to be understood that the terminology used herein describes only a particular version or example and is not intended to limit the scope of the invention. As used herein and in the appended claims, the singular forms “a”, “an”, and “the” are clearly different in context. It should be noted that multiple references are included except when referring to. Thus, for example, reference to “a cell” is to refer to one or more cells and their equivalents known to those skilled in the art.
特に定義しない限り、本明細書において用いられる技術的および科学的用語は全て本発明の属する技術分野の当業者によって一般的に理解されるものと同じ意味を有する。しかしながら、矛盾する場合には本明細書が定義を含めて統御する。したがって、本発明の文脈において、以下の定義を適用する。 Unless defined otherwise, all technical and scientific terms used herein have the same meaning as commonly understood by one of ordinary skill in the art to which this invention belongs. However, in case of conflict, the present specification, including definitions, will control. Therefore, in the context of the present invention, the following definitions apply:
本発明の文脈において、TTKポリペプチドはSEQ ID NO: 2のアミノ酸配列を有するポリペプチド、あるいは結果として提供されるポリペプチドがSEQ ID NO:2のポリペプチドと機能的に等価である、一つまたは複数のアミノ酸が置換、欠失または挿入によって改変されたSEQ ID NO:2を有するポリペプチドでもよい。さらに、TTKポリペプチドはSEQ ID NO:1のオープンリーディングフレームによってコードされる857アミノ酸タンパク質、あるいは低いまたは高いといったストリンジェントな条件下で、結果として提供されるポリヌクレオチドがSEQ ID NO:2のポリペプチドと機能的に等価なタンパク質をコードする、SEQ ID NO:1のヌクレオチド配列にハイブリダイズするポリペプチドという形態をとることもできる。 In the context of the present invention, a TTK polypeptide is a polypeptide having the amino acid sequence of SEQ ID NO: 2, or the resulting polypeptide is functionally equivalent to the polypeptide of SEQ ID NO: 2. Alternatively, it may be a polypeptide having SEQ ID NO: 2 in which a plurality of amino acids are modified by substitution, deletion or insertion. In addition, the TTK polypeptide is a 857 amino acid protein encoded by the open reading frame of SEQ ID NO: 1, or under stringent conditions such as low or high, the resulting polynucleotide is a polypeptide of SEQ ID NO: 2. It can also take the form of a polypeptide that hybridizes to the nucleotide sequence of SEQ ID NO: 1, which encodes a protein functionally equivalent to the peptide.
本発明の文脈において、「機能的に等価な」という用語は、対象タンパク質が基のタンパク質の生物活性を保持することを意味する。SEQ ID NO:2の生物活性は、例えば細胞増殖の促進およびEGFRに対するTTKキナーゼ活性を含む。本発明の文脈において、TTKと機能的に等価なタンパク質は好ましくはEGFRに対するキナーゼ活性を有する。対象タンパク質が標的活性を有するか否かは、本発明によって判定することができる。例えば、EGFRに対するキナーゼ活性は、EGFRのリン酸化に適した条件下でポリペプチドをインキュベートし、リン酸化EGFRレベルを検出することによって測定することができる。例えば、TTKによるEGFRのリン酸化部位はTyr992またはSer967である。 In the context of the present invention, the term “functionally equivalent” means that the protein of interest retains the biological activity of the underlying protein. The biological activity of SEQ ID NO: 2 includes, for example, promoting cell proliferation and TTK kinase activity against EGFR. In the context of the present invention, a protein functionally equivalent to TTK preferably has kinase activity against EGFR. Whether or not the target protein has the target activity can be determined by the present invention. For example, kinase activity against EGFR can be measured by incubating the polypeptide under conditions suitable for EGFR phosphorylation and detecting phosphorylated EGFR levels. For example, the phosphorylation site of EGFR by TTK is Tyr992 or Ser967.
上記のハイブリダイゼーション技術または遺伝子増幅技術によって同定されたDNAによってコードされる、ヒトTTKタンパク質と機能的に等価なタンパク質は、通常、ヒトTTKタンパク質のアミノ酸配列と高い相同性を有する。本発明の文脈において、用語「高い相同性」は40%以上の相同性を指し、好ましくは60%以上、より好ましくは80%以上、さらにより好ましくは95%以上を指す。タンパク質の相同性は「Wilbur, W. J. and Lipman, D. J. (1983) Proc. Natl. Acad. Sci. USA 80, 726-30」においてアルゴリズムに従って決定することができる。
A protein functionally equivalent to the human TTK protein encoded by the DNA identified by the above hybridization technique or gene amplification technique usually has high homology with the amino acid sequence of the human TTK protein. In the context of the present invention, the term “high homology” refers to a homology of 40% or more, preferably 60% or more, more preferably 80% or more, even more preferably 95% or more. Protein homology can be determined according to the algorithm in “Wilbur, W. J. and Lipman, D. J. (1983) Proc. Natl.
本発明の文脈において、ハイブリダイゼーションの文脈中の用語「ストリンジェンシー」は利用されているハイブリダイゼーション標準の相対的な厳しさを指す。適切な低ストリンジェントな条件の例は、例えば42℃、2×SSC、0.1%SDS、または好ましくは50℃、2×SSC、0.1%SDSを含む。好ましくは、高ストリンジェントな条件が用いられる。適切な高ストリンジェントな条件の例は、例えば室温で2×SSC、0.01%SDSでの20分間の洗浄3回、次に37℃で1×SSC、0.1%SDSでの20分間の洗浄3回、および50℃で1×SSC、0.1%SDSでの20分間の洗浄2回を含む。しかしながら、温度および塩濃度などのいくつかの要素がハイブリダイゼーションのストリンジェンシーに影響を及ぼす場合があり、当業者であれば必要なストリンジェンシーを達成するための要素を適切に選択することができる。 In the context of the present invention, the term “stringency” in the context of hybridization refers to the relative stringency of the hybridization standard being utilized. Examples of suitable low stringency conditions include, for example, 42 ° C., 2 × SSC, 0.1% SDS, or preferably 50 ° C., 2 × SSC, 0.1% SDS. Preferably, highly stringent conditions are used. Examples of suitable high stringency conditions are, for example, 3 x 20 min washes with 2 x SSC and 0.01% SDS at room temperature, then 3 x 20 min washes with 1 x SSC and 0.1% SDS at 37 ° C. , And 2 × 20 min washes with 1 × SSC, 0.1% SDS at 50 ° C. However, several factors such as temperature and salt concentration can affect the stringency of hybridization, and those skilled in the art can appropriately select the factors to achieve the required stringency.
本発明の文脈において、「対照レベル」という用語は、対照試料中で検出されるmRNAまたはタンパク質発現レベルを指し、(a)正常対照レベルまたは(b)肺癌特異的対照レベルの両方を含む。対照レベルは、単一の参照集団に由来する単一の発現パターンであっても、または複数の発現パターンに由来する単一の発現パターンであってもよい。例えば、本発明の文脈において、対照レベルは以前に試験された細胞由来の発現パターンのデータベースであってよい。用語「正常対照レベル」とは、健常個体において、または癌、例えば肺癌に罹患していないことが分かっている個体集団において検出される遺伝子の発現レベルを指す。健常個体とは、癌、特に肺癌の臨床症状を有さない個体である。一方で、「肺癌対照レベル」とは、肺癌に罹患している集団において見出される遺伝子の発現レベルを指す。 In the context of the present invention, the term “control level” refers to the mRNA or protein expression level detected in a control sample and includes both (a) a normal control level or (b) a lung cancer specific control level. The control level can be a single expression pattern derived from a single reference population or a single expression pattern derived from multiple expression patterns. For example, in the context of the present invention, the control level may be a database of expression patterns from previously tested cells. The term “normal control level” refers to the level of gene expression detected in a healthy individual or in a population of individuals known to be free of cancer, eg, lung cancer. A healthy individual is an individual who does not have clinical symptoms of cancer, particularly lung cancer. On the other hand, “lung cancer control level” refers to the expression level of a gene found in a population suffering from lung cancer.
本発明の文脈において、対照レベルと比較して、少なくとも0.1倍、少なくとも0.2倍、少なくとも1倍、少なくとも2倍、少なくとも5倍、または少なくとも10倍、もしくはそれ以上、遺伝子発現または遺伝子産物の活性が増大している場合に、特定の遺伝子の発現レベルが「増大された」と見なされる。TTK遺伝子発現は患者由来の組織試料からTTKのmRNAを、例えばRT-PCRまたはノーザンブロット解析によって検出すること、あるいはTTKによってコードされるタンパク質を、例えば患者由来の組織試料の免疫組織化学的解析によって検出することによって決定することができる。 In the context of the present invention, gene expression or gene product activity is at least 0.1 fold, at least 0.2 fold, at least 1 fold, at least 2 fold, at least 5 fold, or at least 10 fold or more compared to a control level. When increased, the expression level of a particular gene is considered “increased”. TTK gene expression can be detected by detecting TTK mRNA from a patient-derived tissue sample, for example, by RT-PCR or Northern blot analysis, or TTK-encoded protein, for example, by immunohistochemical analysis of a patient-derived tissue sample It can be determined by detecting.
本発明の文脈において、対象由来の試料は、試験対象、例えば、癌、より詳細には肺癌に罹患しているかまたはその疑いがある患者から得られる任意の体組織または体液試料でありうる。例えば、組織は上皮細胞を含むことができる。より詳細には、組織は肺癌細胞、例えば非小細胞肺癌または小細胞肺癌、の上皮細胞でありうる。あるいは、試料は血液、血清または血漿などの体液でもよい。 In the context of the present invention, a sample from a subject can be any body tissue or fluid sample obtained from a test subject, eg, a patient suffering from or suspected of having cancer, more particularly lung cancer. For example, the tissue can include epithelial cells. More particularly, the tissue can be lung cancer cells, such as epithelial cells of non-small cell lung cancer or small cell lung cancer. Alternatively, the sample may be a body fluid such as blood, serum or plasma.
本発明は癌の治療および予防に関する。本発明の文脈において、癌に対する治療または癌発症の予防は、癌細胞の増殖阻害、癌の退縮および癌の発生の抑制を含む、下記工程のいずれかを含む。そのような治療的および予防的効果は好ましくは統計的に有意である。例えば観察時には、5%またはそれ以下の有意性レベルで、細胞増殖性疾患に対する薬学的組成物の治療的または予防的効果は投与なしの対照と比較される。例えば、スチューデントのt検定、マン-ホイットニーのU検定またはANOVAは、統計解析に用いることができる。 The present invention relates to the treatment and prevention of cancer. In the context of the present invention, treating cancer or preventing the onset of cancer includes any of the following steps, including inhibition of cancer cell growth, regression of cancer, and suppression of cancer development. Such therapeutic and prophylactic effects are preferably statistically significant. For example, at the time of observation, at a significance level of 5% or less, the therapeutic or prophylactic effect of a pharmaceutical composition against a cell proliferative disorder is compared to an untreated control. For example, Student's t test, Mann-Whitney U test or ANOVA can be used for statistical analysis.
さらに、本発明の文脈において、用語「予防」は疾患の死亡率または罹患率の負荷を減少するいずれかの活性を含む。予防は第一次、第二次および第三次の予防レベルで生じることができる。第一次予防が疾患の発達を抑える一方で、機能を復元することによる、既に確定した疾患の悪影響を減少することならびに疾患関連合併症を減少することと同様に、予防の第二次および第三次レベルは疾患の進行および症状の発生を予防するための活性を含む。 Further, in the context of the present invention, the term “prevention” includes any activity that reduces the mortality or morbidity burden of the disease. Prevention can occur at primary, secondary and tertiary prevention levels. While primary prevention reduces disease development, secondary prevention and secondary prevention as well as reducing the adverse effects of established disease and reducing disease-related complications by restoring function Tertiary levels include activity to prevent disease progression and development of symptoms.
本発明の文脈において、「有効な」治療とは、対象において、TTKレベルまたはEGFRリン酸化レベルの低下または、肺癌のサイズ、有病率、もしくは転移能の減少をもたらす治療である。治療が予防的に適用される場合、「有効な」とは、治療によって肺癌の発生が遅延もしくは妨害されるか、または肺癌の臨床症状が軽減されることを意味する。肺癌の評価は、標準的な臨床プロトコルを用いて行うことができる。さらに、治療の有効性は、肺癌の診断または治療のための公知の任意の方法に関連して判定することができる。例えば、肺癌は病理組織学的に、または症候性の異常を特定することにより、日常的に診断される。 In the context of the present invention, an “effective” treatment is a treatment that results in a decrease in TTK levels or EGFR phosphorylation levels or a decrease in lung cancer size, prevalence, or metastatic potential in a subject. “Effective” when treatment is applied prophylactically means that the treatment delays or prevents the development of lung cancer or reduces the clinical symptoms of lung cancer. Assessment of lung cancer can be performed using standard clinical protocols. Furthermore, the effectiveness of the treatment can be determined in connection with any known method for the diagnosis or treatment of lung cancer. For example, lung cancer is diagnosed routinely by histopathology or by identifying symptomatic abnormalities.
付加的な定義は、次の文章中に散在しており、適用され得る。 Additional definitions are scattered throughout the following text and can be applied.
概説:
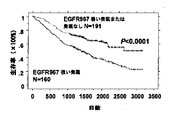
癌治療のための分子標的薬剤の開発が発達してきたにもかかわらず、治療の効果と同様に、反応する腫瘍型の範囲は非常に制限されたままである(Ranson, M., et al. (2002) J Clin Oncol, 20: 2240-50.; Blackledge, G. and Averbuch, S. (2004) Br J Cancer, 90: 566-72.)。そのため、最小限のまたはまったく副作用のない、悪性細胞に高度に特異的な新規抗癌剤の開発が緊急に必要とされている。これらの目標に向けた強力な戦略は、細胞増殖におけるそれらの効果のハイスループットスクリーニングとともにcDNAマイクロアレイ上で得られた遺伝子情報に基づいて同定され、RNAiシステムによる機能喪失型フェノタイプの誘導による、癌細胞で上方制御された遺伝子のスクリーニングと、組織マイクロアレイ上で何百もの臨床試料を解析することにより薬剤標的の可能性のバリデーションを組み合わせる (Sauter, G., et al. (2003) Nat Rev Drug Discov, 2: 962-72.; Kononen, J., et al. (1998) Nat Med, 4: 844-7.)。そのような戦略に続き、本明細書においては、TTKが臨床NSCLC試料および細胞株においてしばしば共過剰発現しているだけではなく、高発現レベルの遺伝子産物がNSCLC細胞の増殖と同様に疾患の進行に不可欠であることを示している。
Overview:
Despite the development of the development of molecular targeted drugs for the treatment of cancer, the range of responding tumor types remains very limited (Ranson, M., et al. 2002) J Clin Oncol, 20: 2240-50 .; Blackledge, G. and Averbuch, S. (2004) Br J Cancer, 90: 566-72.). Therefore, there is an urgent need to develop new anticancer agents that are highly specific for malignant cells with minimal or no side effects. A powerful strategy towards these goals is identified on the basis of genetic information obtained on cDNA microarrays along with high-throughput screening of their effects on cell proliferation and cancer induced by induction of loss-of-function phenotypes by the RNAi system. Combining cell up-regulated gene screening and validation of drug target potential by analyzing hundreds of clinical samples on tissue microarrays (Sauter, G., et al. (2003) Nat Rev Drug Discov , 2: 962-72 .; Kononen, J., et al. (1998) Nat Med, 4: 844-7.). Following such a strategy, not only TTK is often co-overexpressed in clinical NSCLC samples and cell lines, but also high expression levels of gene products are used in disease progression as well as NSCLC cell proliferation. It is indispensable to.
上皮成長因子受容体(EGFR)は様々な増殖シグナル経路の重要な仲介物質として認識された(Carpenter G. Annu Rev Biochem. 1987;56:881-914.; Wells C. Int J Biochem Cell Biol. 1999 Jun;31(6):637-43.)。遺伝子的および後成的変化から生じている異常なEGFR活性は、細胞増殖を増大し、多くの腫瘍において腫瘍の進行を駆動することが示された(Salomon DS, et al., Crit Rev Oncol Hematol. 1995 Jul;19(3):183-232.; Mendelson J. Clin Cancer Res. 2000 Mar;6(3):747-53.)。したがって、EGFRシグナルを選択的に阻害する薬剤は開発中であり、臨床で用いられている例には、抗EGFRモノクローナル抗体、セツキシマブ(Erbitux)、およびゲフィチニブ(Iressa) およびエルロチニブ(Tarceva)といったEGFRチロシンキナーゼの低分子阻害剤を含まれる(Dowell J, et al., Nat Rev Drug Discov. 2005 Jan;4(1):13-4.; Herbst RS, et al., Nat Rev Cancer. 2004 Dec;4(12):956-65.)。EGFのようなリガンドの刺激はMAPK(mitogen activated protein kinase)カスケードおよびc-Src (cellular Src)カスケードを含むEGFRシグナル経路を活性化する、立体構造変化ならびに自己リン酸化を起こす(Yarden Y. Eur J Cancer. 2001 Sep;37 Suppl 4:S3-8.; Pal SK & Pegram M. Anticancer Drugs. 2005 Jun;16(5):483-94.; Tice DA, et al., Proc Natl Acad Sci U S A. 1999 Feb 16;96(4):1415-20.)。c-SrcはEGF存在下でEGFRの細胞質テールをリン酸化し、EGFRシグナルを活性する(Yarden Y. Eur J Cancer. 2001 Sep;37 Suppl 4:S3-8.; Pal SK & Pegram M. Anticancer Drugs. 2005 Jun;16(5):483-94.; Tice DA, et al., Proc Natl Acad Sci U S A. 1999 Feb 16;96(4):1415-20.)。しかし、現在まで、EGFRをリン酸化して、その結果EGFから独立した動態でEGFR経路を活性するキナーゼは報告されていなかった。 Epidermal growth factor receptor (EGFR) has been recognized as an important mediator of various proliferation signaling pathways (Carpenter G. Annu Rev Biochem. 1987; 56: 881-914 .; Wells C. Int J Biochem Cell Biol. 1999 Jun; 31 (6): 637-43.). Abnormal EGFR activity resulting from genetic and epigenetic changes has been shown to increase cell proliferation and drive tumor progression in many tumors (Salomon DS, et al., Crit Rev Oncol Hematol 1995 Jul; 19 (3): 183-232 .; Mendelson J. Clin Cancer Res. 2000 Mar; 6 (3): 747-53.). Therefore, drugs that selectively inhibit EGFR signaling are under development, and clinically used examples include anti-EGFR monoclonal antibodies, cetuximab (Erbitux), and EGFR tyrosine such as gefitinib (Iressa) and erlotinib (Tarceva) Includes small molecule inhibitors of kinases (Dowell J, et al., Nat Rev Drug Discov. 2005 Jan; 4 (1): 13-4 .; Herbst RS, et al., Nat Rev Cancer. 2004 Dec; 4 (12): 956-65.). Stimulation of ligands such as EGF causes conformational changes and autophosphorylation that activates the EGFR signaling pathway, including the MAPK (mitogen activated protein kinase) cascade and the c-Src (cellular Src) cascade (Yarden Y. Eur J Cancer. 2001 Sep; 37 Suppl 4: S3-8 .; Pal SK & Pegram M. Anticancer Drugs. 2005 Jun; 16 (5): 483-94 .; Tice DA, et al., Proc Natl Acad Sci US A. 1999 Feb 16; 96 (4): 1415-20.). c-Src phosphorylates the cytoplasmic tail of EGFR in the presence of EGF and activates the EGFR signal (Yarden Y. Eur J Cancer. 2001 Sep; 37 Suppl 4: S3-8 .; Pal SK & Pegram M. Anticancer Drugs 2005 Jun; 16 (5): 483-94 .; Tice DA, et al., Proc Natl Acad Sci US A. 1999 Feb 16; 96 (4): 1415-20.). However, until now, no kinase has been reported that phosphorylates EGFR and consequently activates the EGFR pathway in a manner independent of EGF.
しかしながら、TTKはEGFRのTyr-992またはSer-967のEGFから独立したリン酸化および、腫瘍成長/生存に不可欠であると考えられており、下流MAPKシグナルのそれに続く活性化による肺癌形成において、重要な役割を果たしている根拠が本明細書で提供される。したがって、データは、TTKとEGFの存在から独立しているEGFRが肺癌の新規治療薬開発の候補標的を意味することを示唆する。 However, TTK is thought to be essential for EGFR Tyr-992 or Ser-967 EGF-independent phosphorylation and tumor growth / survival and is important in lung cancer formation by subsequent activation of downstream MAPK signals A rationale for playing a role is provided herein. Thus, the data suggest that EGFR, independent of the presence of TTK and EGF, represents a candidate target for the development of new therapeutics for lung cancer.
肺癌の予後評価:
上述したように、本発明は、一部、TTKキナーゼ、EGFRの新規細胞内標的分子の発見に基づく。本発明はまた、TTKの高発現レベルおよび/またはリン酸化EGFRの高レベルが肺癌患者の予後不良と関連している所見に基づいている。特に、肺癌は非小細胞肺癌(NSCLC)である。本明細書において提供される証拠を考慮すると、TTK発現および/またはEGFRに対するTTKキナーゼ活性あるいはEGFRリン酸化レベルが癌患者の予後不良と関連しており、したがって本発明は肺癌患者の予後を評価または測定する方法を提供する。例えば、EGFRのリン酸化部位はTyr-992またはSer-967である。そのような方法の例は、次の工程を含む:
a. 肺癌予後が評価または測定される対象から採取した試料において、TTK発現レベルまたはEGFRリン酸化レベルを検出する工程;および
b. TTK発現またはリン酸化EGFRの上昇したレベルが検出される場合に、予後不良が示される工程。
Prognostic evaluation of lung cancer:
As described above, the present invention is based in part on the discovery of novel intracellular target molecules of TTK kinase, EGFR. The present invention is also based on the finding that high expression levels of TTK and / or high levels of phosphorylated EGFR are associated with poor prognosis in lung cancer patients. In particular, the lung cancer is non-small cell lung cancer (NSCLC). In view of the evidence provided herein, TTK expression and / or TTK kinase activity against EGFR or EGFR phosphorylation levels are associated with poor prognosis in cancer patients, and thus the present invention assesses prognosis in lung cancer patients or Provide a way to measure. For example, the phosphorylation site of EGFR is Tyr-992 or Ser-967. An example of such a method includes the following steps:
detecting TTK expression level or EGFR phosphorylation level in a sample collected from a subject whose lung cancer prognosis is evaluated or measured; and
b. A process with a poor prognosis when elevated levels of TTK expression or phosphorylated EGFR are detected.
本方法の文脈において、試料は対象から採取される。本発明の文脈において用いられる好ましい治療の例は、生検または外科切除によって肺癌患者から得られた肺組織である。本発明の文脈において、TTK発現レベルまたは試験試料で検出されるEGFRリン酸化レベルが対照レベルよりも高い場合、試験試料は上昇したレベルのTTK発現またはEGFRのリン酸化を有すると考えられる。本発明の文脈において、有効な対照レベルの例は、TTK発現の基準値または良い予後に関連する群から選択されるEGFRレベルのリン酸化を含む。基準値は従来技術において公知のいかなる方法によっても得られることができる。例えば、平均値 ± 2 S.D、または平均値 ± 3 S.Dが基準値として使用することができる。あるいは、予後不良は、試料組織の免疫組織化学的解析によって強い染色が観察される場合に判定することができる。 In the context of the method, a sample is taken from the subject. An example of a preferred treatment used in the context of the present invention is lung tissue obtained from a lung cancer patient by biopsy or surgical resection. In the context of the present invention, a test sample is considered to have an elevated level of TTK expression or EGFR phosphorylation if the TTK expression level or EGFR phosphorylation level detected in the test sample is higher than the control level. In the context of the present invention, examples of effective control levels include phosphorylation of EGFR levels selected from a reference value for TTK expression or a group associated with good prognosis. The reference value can be obtained by any method known in the prior art. For example, an average value ± 2 S.D or an average value ± 3 S.D can be used as the reference value. Alternatively, poor prognosis can be determined when intense staining is observed by immunohistochemical analysis of the sample tissue.
本発明の文脈において、TTKの発現レベルは以下からなる群から選択される方法のいずれか一つによって検出される:
(a) SEQ ID NO:2のアミノ酸配列をコードするmRNAの存在を検出する方法:
(b) SEQ ID NO:2のアミノ酸配列を有するタンパク質の存在を検出する方法:および
(c) SEQ ID NO:2のアミノ酸配列を有するタンパク質の生物活性を検出する方法。
In the context of the present invention, the expression level of TTK is detected by any one of the methods selected from the group consisting of:
(a) A method for detecting the presence of mRNA encoding the amino acid sequence of SEQ ID NO: 2:
(b) A method for detecting the presence of a protein having the amino acid sequence of SEQ ID NO: 2:
(c) A method for detecting the biological activity of a protein having the amino acid sequence of SEQ ID NO: 2.
本発明の文脈において、mRNA、タンパク質またはタンパク質の生物活性はいかなる方法によっても検出され得る。所与のタンパク質、メッセンジャーRNAまたはその生物学的活性を検出する方法は当業者に周知である。例えば、mRNAは公知のPCRまたはハイブリダイゼーションベースの技術を用いて検出することができる。あるいは、いかなるイムノアッセイ形式もタンパク質検出に適用することができる。さらに、EGFRに対するTTKのキナーゼ活性のような、TTKの生物活性は、本明細書に記載されているようないかなる適切なアッセイ方法を用いても検出することができる。例えば、EGFRのTTKキナーゼ活性はSEQ ID NO:42の992アミノ酸残基のチロシン、または967アミノ酸残基のセリンで検出することができる。 In the context of the present invention, the biological activity of mRNA, protein or protein can be detected by any method. Methods for detecting a given protein, messenger RNA or biological activity thereof are well known to those skilled in the art. For example, mRNA can be detected using known PCR or hybridization-based techniques. Alternatively, any immunoassay format can be applied to protein detection. Furthermore, the biological activity of TTK, such as the kinase activity of TTK against EGFR, can be detected using any suitable assay method as described herein. For example, the TTK kinase activity of EGFR can be detected with the 992 amino acid residue tyrosine of SEQ ID NO: 42 or the 967 amino acid residue serine.
本発明の文脈において、EGFRのリン酸化レベルはリン酸化EGFR、例えばTyr-992またはSer-967リン酸化EGFRの量を測定することで検出することができる。リン酸化EGFRを検出する方法は、当業者に周知である。例えば、特異的抗体を用いたイムノアッセイは有用である。 In the context of the present invention, the level of phosphorylation of EGFR can be detected by measuring the amount of phosphorylated EGFR, eg Tyr-992 or Ser-967 phosphorylated EGFR. Methods for detecting phosphorylated EGFR are well known to those skilled in the art. For example, immunoassays using specific antibodies are useful.
本発明の文脈において、予後不良の判定はさらなる治療、例えば生活の質を低下させるさらなる治療を止めること、過去に用いられたものとは異なる方法で癌を治療すること、またはより積極的に癌を治療すること、の判定に用いることができる。言い換えれば、TTKまたはEGFRのリン酸化による予後評価は、臨床医に、日常的な組織サンプリングの手順のみを用いて、従来の疾患の臨床進行度の情報すらない個々の肺癌患者に対する、最も適切な治療を事前に選択することを可能にする。 In the context of the present invention, a poor prognosis determination is to stop further treatment, for example to stop further treatment that reduces the quality of life, to treat the cancer in a different way than previously used, or more aggressively cancer Can be used to determine whether or not to treat. In other words, prognostic assessment by phosphorylation of TTK or EGFR is the most appropriate for clinicians, using only routine tissue sampling procedures, for individual lung cancer patients who do not have information on the clinical progression of conventional disease. Allows pre-selection of treatment.
さらに、本発明の方法は治療の経過の有効性を評価するために用いることができる。例えば、生体試料がTTK発現またはEGFRのリン酸化の上昇したレベルを含むことが発見されている癌を有する哺乳類において、抗癌治療の有効性はTTK発現レベルまたはEGFRのリン酸化レベルを長期にわたりモニタリングすることによって評価することができる。例えば、治療過程後の哺乳類から得た生物試料におけるTTK発現レベルまたはEGFRのリン酸化レベルの減少は、治療開始前または初期にその哺乳類から得た試料で観察されたレベルと比較して、有効な治療であることを示し得る。 Furthermore, the methods of the invention can be used to evaluate the effectiveness of a course of treatment. For example, in a mammal with a cancer where the biological sample has been found to contain elevated levels of TTK expression or EGFR phosphorylation, the efficacy of anti-cancer therapy monitors TTK expression levels or EGFR phosphorylation levels over time Can be evaluated. For example, a decrease in TTK expression level or EGFR phosphorylation level in a biological sample obtained from a mammal after the course of treatment is effective compared to the level observed in a sample obtained from that mammal before or early in treatment. Can indicate treatment.
あるいはまた、本発明によれば、中間結果は対象の予後を評価または判定するための他の試験結果に加えて提供することができる。そのような中間結果は医師、看護士または他の開業医が対象の予後を評価、判定または推定するのに役立つ。本発明によって得られた中間結果を組み合わせて、予後を評価すると考えられる付加的な情報は、対象の臨床症状および物理的条件を含む。 Alternatively, according to the present invention, intermediate results can be provided in addition to other test results for assessing or determining a subject's prognosis. Such intermediate results are useful for a doctor, nurse or other practitioner to assess, determine or estimate the prognosis of a subject. Additional information that may be combined with intermediate results obtained by the present invention to assess prognosis includes the subject's clinical symptoms and physical conditions.
前述したように、本発明はまた、肺癌の進行を評価または判定するキットを提供する。キットは下記から成る群から選択されるいずれか一成分を含む;
(a) SEQ ID NO:2のアミノ酸配列をコードするmRNAの存在を検出する試薬:
(b) SEQ ID NO:2のアミノ酸配列を有するタンパク質あるいはSEQ ID NO:42でチロシン992アミノ酸残基またはセリン976アミノ酸残基を有するアミノ酸配列を有するタンパク質を検出する試薬;および
(c) SEQ ID NO:2のアミノ酸配列を有するタンパク質の生物学的活性を検出する試薬。
As described above, the present invention also provides a kit for assessing or determining the progression of lung cancer. The kit includes any one component selected from the group consisting of:
(a) A reagent for detecting the presence of mRNA encoding the amino acid sequence of SEQ ID NO: 2:
(b) a reagent for detecting a protein having the amino acid sequence of SEQ ID NO: 2 or a protein having an amino acid sequence of
(c) A reagent for detecting the biological activity of a protein having the amino acid sequence of SEQ ID NO: 2.
TTKはEGFRに対するキナーゼ活性を有し、ならびにその発現レベルとリン酸化EGFRレベル(Tyr-992またはSer-967)はより短い腫瘍特異的な生存期間を示した。さらに、TTKによるTyr-992またはSer-967におけるEGFRのリン酸化はEGF刺激から独立している。したがって、TTKが仲介するEGFRのリン酸化は肺癌、例えば非小細胞肺癌の診断パラメーターとして有効である。 TTK had kinase activity against EGFR, and its expression level and phosphorylated EGFR level (Tyr-992 or Ser-967) showed shorter tumor-specific survival. Furthermore, phosphorylation of EGFR in Tyr-992 or Ser-967 by TTK is independent of EGF stimulation. Therefore, phosphorylation of EGFR mediated by TTK is effective as a diagnostic parameter for lung cancer, such as non-small cell lung cancer.
本発明はまた、対象における肺癌または肺癌発症の素因を評価あるいは判定するためのキットを提供し、該キットはEGFRに対するTTKキナーゼ活性を検出するための試薬を含む。キットは肺癌、例えば非小細胞肺癌の診断に有効である。さらに、EGFRに対するTTKのキナーゼ活性、例えばEGFから独立したTTKによるEGFRリン酸化はあらゆる適切な試薬を用いて検出することもできる。 The present invention also provides a kit for evaluating or determining lung cancer or a predisposition to developing lung cancer in a subject, the kit comprising a reagent for detecting TTK kinase activity against EGFR. The kit is effective in the diagnosis of lung cancer, such as non-small cell lung cancer. Furthermore, the kinase activity of TTK against EGFR, such as EGFR phosphorylation by TTK independent of EGF, can also be detected using any suitable reagent.
EGFRに対するTTKのキナーゼ活性:
TTKによるEGFRの選択的なリン酸化は本明細書において明らかにされる。したがって、別の局面においては、本発明はEGFRに対するTTKのキナーゼ活性を測定する方法を提供する。そのような方法は次の工程を含み得る:
a. EGFRまたはその機能的等価物およびTTKをTTKによるEGFRリン酸化に適した条件下でインキュベートする工程。TTKは下記群から選択される:
i. SEQ ID NO:2のアミノ酸配列を有するポリペプチド(TTK)
ii. SEQ ID NO:2の一つまたは複数のアミノ酸が置換、欠失あるいは挿入によって改変されたポリペプチドであって、結果として生じるポリペプチドがSEQ ID NO:2のアミノ酸配列を有するポリペプチドと等価な生物活性を有するポリペプチド;
iii. SEQ ID NO:1のヌクレオチド配列を有するポリヌクレオチドに対してストリンジェントな条件下でハイブリダイズするポリヌクレオチドによってコードされるポリペプチドで、結果として生じるポリペプチドがSEQ ID NO:2のアミノ酸配列を有するポリペプチドと等価な生物活性を有するポリペプチド;
b. リン酸化EGFRレベルを検出する工程;および
c. 工程(b)で検出されたリン酸化EGFRレベルとの相関によってTTKのキナーゼ活性を測定する工程。
TTK kinase activity against EGFR:
Selective phosphorylation of EGFR by TTK is demonstrated herein. Therefore, in another aspect, the present invention provides a method for measuring the kinase activity of TTK against EGFR. Such a method may include the following steps:
a. Incubating EGFR or a functional equivalent thereof and TTK under conditions suitable for EGFR phosphorylation by TTK. TTK is selected from the following group:
i. Polypeptide having the amino acid sequence of SEQ ID NO: 2 (TTK)
ii. a polypeptide in which one or more amino acids of SEQ ID NO: 2 are modified by substitution, deletion or insertion, wherein the resulting polypeptide has the amino acid sequence of SEQ ID NO: 2; A polypeptide having equivalent biological activity;
iii. A polypeptide encoded by a polynucleotide that hybridizes under stringent conditions to a polynucleotide having the nucleotide sequence of SEQ ID NO: 1, wherein the resulting polypeptide is the amino acid sequence of SEQ ID NO: 2. A polypeptide having biological activity equivalent to a polypeptide having
b. detecting phosphorylated EGFR levels; and
c. A step of measuring the kinase activity of TTK by correlation with the phosphorylated EGFR level detected in step (b).
本発明の文脈において、EGFRリン酸化に適した条件は、リン酸供与体の存在下でのEGFRとTTKのインキュベーションとともに提供され得る。本発明において、好ましいリン酸供与体はATPである。TTKによるEGFRリン酸化に適した条件はまた、ポリペプチドを発現している培養細胞も含む。例えば、細胞は、ポリペプチドをコードするポリヌクレオチドを含む発現ベクターを内部に持つ形質転換細胞でもよい。別の態様において、EGFRに対するリン酸化反応はキナーゼアッセイバッファー(例えば 50 mM Tris, pH7.4, 10 mM MgCl2, 2 mM dithiothreitol, 1 mM NaF, 0.2 mM ATP)中で60分間30℃でEGFRとTTKをインキュベーションすることによって行われる。本発明の文脈において、EGFRの機能的な等価物は、TTKが仲介するEGFRのリン酸化部位、Tyr992またはSer967を含み得るEGFR断片である。例えば、EGFRの断片はSEQ ID NO:43のアミノ酸配列に含まれ得る。
In the context of the present invention, conditions suitable for EGFR phosphorylation can be provided with incubation of EGFR and TTK in the presence of a phosphate donor. In the present invention, a preferred phosphate donor is ATP. Conditions suitable for EGFR phosphorylation by TTK also include cultured cells expressing the polypeptide. For example, the cell may be a transformed cell having therein an expression vector containing a polynucleotide encoding the polypeptide. In another embodiment, the phosphorylation reaction to EGFR is kinase assay buffer (e.g. 50 mM Tris, pH7.4, 10
インキュベーション後、リン酸化EGFRレベルはリン酸化EGFRを認識する抗体で検出され得る。リン酸化EGFR検出の前に、EGFRは他の要素、またはEGFR発現細胞の細胞溶解物から分離できる。例えば、ゲル電気泳動はEGFRの分離に使用できる。あるいは、EGFRは抗EGFR抗体を有する担体とEGFRを接触させることによって捕捉することができる。標識化リン酸供与体が用いられる場合、リン酸化EGFRレベルは標識の追跡によって検出することができる。例えば、放射性標識されたATP(例えば32P-ATP)は、単離されたEGFRの放射活性がリン酸化EGFRレベルと相関するリン酸供与体として用いられた。 After incubation, phosphorylated EGFR levels can be detected with antibodies that recognize phosphorylated EGFR. Prior to detection of phosphorylated EGFR, EGFR can be separated from other elements or cell lysates of EGFR expressing cells. For example, gel electrophoresis can be used to separate EGFR. Alternatively, EGFR can be captured by contacting EGFR with a carrier having an anti-EGFR antibody. When a labeled phosphate donor is used, phosphorylated EGFR levels can be detected by label tracking. For example, radiolabeled ATP (eg, 32 P-ATP) was used as a phosphate donor where the radioactivity of isolated EGFR correlates with phosphorylated EGFR levels.
本発明の文脈において、生体試料におけるTTKのキナーゼ活性を評価することができる。例えば、本発明の生体試料は患者由来の癌組織または癌細胞株を含み得る。当該生体試料においてTTKキナーゼ活性は、肺癌を示す、あるいは予後を評価または判定する信頼性のあるマーカーとして有効である。本発明はさらに、EGFRに対するTTKのキナーゼ活性を測定する試薬を提供する。そのような試薬の例としてはEGFRおよびリン酸供与体が挙げられる。本発明において、EGFRに対するTTKのキナーゼ活性を測定するキットもまた提供される。該キットは本発明の試薬およびリン酸化EGFRレベルを検出する検出試薬を含み得る。好ましい検出試薬は、非リン酸化EGFRから特異的にリン酸化EGFRを認識する抗体である。例えば、本発明において、好ましい抗体はTyr992またはSer967でリン酸化EGFRを認識する。 In the context of the present invention, the kinase activity of TTK in a biological sample can be assessed. For example, the biological sample of the present invention may contain cancer tissue or cancer cell lines derived from a patient. In the biological sample, TTK kinase activity is effective as a reliable marker indicating lung cancer or evaluating or determining prognosis. The present invention further provides a reagent for measuring the kinase activity of TTK against EGFR. Examples of such reagents include EGFR and phosphate donors. In the present invention, a kit for measuring the kinase activity of TTK against EGFR is also provided. The kit can include a reagent of the present invention and a detection reagent for detecting phosphorylated EGFR levels. A preferred detection reagent is an antibody that specifically recognizes phosphorylated EGFR from non-phosphorylated EGFR. For example, in the present invention, preferred antibodies recognize phosphorylated EGFR at Tyr992 or Ser967.
診断方法:
本発明はまた、対象における肺癌の診断または肺癌の素因の予測方法を提供し、該方法は対象由来の生体試料におけるTTK発現またはEGFRリン酸化レベルを決定する段階を含み、正常対照レベルと比較した該レベルの増加は、対象が肺癌に罹患している、あるいは発症するリスクを示す。本発明において、診断される対象由来のいかなる試料も使用することができる。本発明の文脈において用いられる好ましい例は、生検または外科切除によって得られた肺組織である。例えば、TTKによるEGFRのリン酸化部位はTyr992 またはSer967である。
Diagnosis method:
The invention also provides a method of diagnosing lung cancer in a subject or predicting a predisposition to lung cancer, the method comprising determining TTK expression or EGFR phosphorylation levels in a biological sample from the subject, compared to a normal control level An increase in the level indicates that the subject has or is at risk of developing lung cancer. Any sample from the subject to be diagnosed can be used in the present invention. A preferred example used in the context of the present invention is lung tissue obtained by biopsy or surgical resection. For example, the phosphorylation site of EGFR by TTK is Tyr992 or Ser967.
あるいは、本発明によれば、対象の状態を調べるための中間結果を提供することができる。そのような中間結果をさらなる情報と組み合わせて、対象は疾患に罹患していることを、医師、看護師、またはその他の医療従事者が、診断することを補助することができる。さらに、本発明はさらなる肺癌の診断が必要とされる人をスクリーニングする方法に関する。スクリーニング後、陽性の結果を示した人は本当に肺癌に罹患しているか確認するため、さらなるスクリーニング試験、または医学的治療を受けることを勧告される。 Or according to this invention, the intermediate result for investigating the state of object can be provided. Such intermediate results can be combined with further information to assist a doctor, nurse, or other health care professional in diagnosing that the subject is suffering from a disease. Furthermore, the present invention relates to a method for screening a person in need of further lung cancer diagnosis. Persons who show a positive result after screening are advised to receive further screening tests or medical treatment to see if they are truly affected by lung cancer.
あるいは、本発明を用いて対象由来の組織中の癌細胞を検出し、対象が肺癌に罹患していると診断するのに有用な情報を医師に提供することもできる。したがって、本発明は対象由来試料におけるEGFRに対するTTKのキナーゼ活性レベルを決定(例えば測定する)ことを必要とする。本発明において、肺癌診断方法はまた、肺癌を試験または検出する方法を含む。あるいは、本発明において、肺癌を診断することは、対象における肺癌の疑い、リスク、あるいは可能性も指す。 Alternatively, the present invention can be used to detect cancer cells in a subject-derived tissue and provide a doctor with information useful for diagnosing that the subject suffers from lung cancer. Thus, the present invention requires determining (eg, measuring) the level of TTK kinase activity against EGFR in a subject-derived sample. In the present invention, the lung cancer diagnosis method also includes a method for testing or detecting lung cancer. Alternatively, in the present invention, diagnosing lung cancer also refers to suspicion, risk, or possibility of lung cancer in a subject.
本発明の診断方法は、TTK発現を決定(例えば測定)する工程を含む。TTK遺伝子配列の使用は、当業者に周知の従来技術を用いて検出および測定することができる。例えば、ノザンブロットハイブリダイゼーション解析がTTK遺伝子の発現を決定するために用いられ得る。ハイブリダイゼーションプローブは典型的には、TTK配列の少なくとも10個、少なくとも20個、少なくとも50個、少なくとも100個、または少なくとも200個の連続したヌクレオチドを含む。別の例としては、配列は、例えば増幅ベースの検出方法、例えば逆転写ベースのポリメラーゼ連鎖反応(RT-PCR)において、TTK核酸の特異的に複製するプライマーを構築するために用いられる。別の例としては、TTKに対する抗体、例えば抗TTKポリクローナル抗体または抗TTKモノクローナル抗体は、イムノアッセイ、例えば免疫組織化学的解析、ウエスタンブロット解析またはELISA等に用いることができる。 The diagnostic method of the present invention includes the step of determining (eg, measuring) TTK expression. The use of the TTK gene sequence can be detected and measured using conventional techniques well known to those skilled in the art. For example, Northern blot hybridization analysis can be used to determine the expression of the TTK gene. Hybridization probes typically comprise at least 10, at least 20, at least 50, at least 100, or at least 200 consecutive nucleotides of a TTK sequence. As another example, sequences are used to construct primers that specifically replicate TTK nucleic acids, for example, in amplification-based detection methods, such as reverse transcription-based polymerase chain reaction (RT-PCR). As another example, an antibody against TTK, such as an anti-TTK polyclonal antibody or an anti-TTK monoclonal antibody, can be used in an immunoassay such as immunohistochemical analysis, Western blot analysis or ELISA.
あるいは、TTKの発現は生物活性により検出することができる。例えば、生物活性は細胞増殖活性ならびに浸潤活性ならびにEGFR Tyr997またはSer967に対するキナーゼ活性である。キナーゼ活性検出方法は上述されている。 Alternatively, TTK expression can be detected by biological activity. For example, biological activities are cell proliferation activity as well as invasive activity and kinase activity against EGFR Tyr997 or Ser967. The method for detecting kinase activity has been described above.
また、本発明の診断方法はEGFRのリン酸化レベルを決定する工程を含む。例えば、EGFRのリン酸化部位はTyr992またはSer967である。非リン酸化型を除くリン酸化を特に認識する抗体がイムノアッセイ、例えば免疫組織化学的解析、ウエスタンブロットまたはELISA等に用いることができる。 Moreover, the diagnostic method of the present invention includes a step of determining the phosphorylation level of EGFR. For example, the phosphorylation site of EGFR is Tyr992 or Ser967. Antibodies that specifically recognize phosphorylation except non-phosphorylated forms can be used in immunoassays, such as immunohistochemical analysis, Western blot or ELISA.
対象由来の組織試料のような試験細胞集団において検出される、TTK発現レベルまたはEGFRリン酸化レベルは、参照細胞集団におけるそれらと比較することができる。参照細胞集団は比較パラメーターが公知の、一つまたは複数の細胞、例えば肺癌細胞または正常肺上皮細胞(非肺癌細胞)を含み得る。 The level of TTK expression or EGFR phosphorylation detected in a test cell population, such as a tissue sample from a subject, can be compared to those in a reference cell population. The reference cell population can comprise one or more cells with known comparison parameters, such as lung cancer cells or normal lung epithelial cells (non-lung cancer cells).
肺癌の存在または素因を示すかどうかを問わず、参照細胞集団に対する試験細胞集団におけるTTK発現レベルまたはEGFRのリン酸化レベルは、参照細胞集団の構成に依存する。例えば、参照細胞集団が非肺癌細胞からなる場合、試験細胞集団および参照細胞集団間レベルの類似性は、試験細胞集団が非肺癌であることを示す。逆にいえば、参照細胞集団が肺癌細胞から成る場合、試験細胞集団および参照細胞集団間の遺伝子発現における類似性は試験細胞集団が肺癌細胞を含むことを示す。 Regardless of the presence or predisposition of lung cancer, the level of TTK expression or EGFR phosphorylation in the test cell population relative to the reference cell population depends on the composition of the reference cell population. For example, if the reference cell population consists of non-lung cancer cells, similarity between the test cell population and the reference cell population indicates that the test cell population is non-lung cancer. Conversely, if the reference cell population consists of lung cancer cells, the similarity in gene expression between the test cell population and the reference cell population indicates that the test cell population contains lung cancer cells.
参照細胞集団におけるレベルから、1.1倍以上、1.5倍以上、2.0倍以上、5.0倍以上、10.0倍以上またはそれ以上変化する場合、試験細胞集団におけるTTK発現レベルまたはEGFRのリン酸化レベルは、「変化した」と見なされるか、または「異なる」と見なされる。 A TTK expression level or EGFR phosphorylation level in a test cell population is `` changed '' if it changes 1.1 fold, 1.5 fold, 2.0 fold, 5.0 fold, 10.0 fold, 10.0 fold or more from the level in the reference cell population Or “different”.
試験細胞集団と参照細胞集団間の差次的な遺伝子発現は、対照遺伝子、例えばハウスキーピング遺伝子に標準化することができる。例えば、対照遺伝子は細胞の癌または非癌状態に応じて異ならないことが公知のものである。対照遺伝子の発現レベルは、したがって、試験および参照細胞集団におけるシグナルレベルを標準化するために用いられ得る。代表的な対照遺伝子は、例えばβ-アクチン、グリセルアルデヒド3-リン酸塩デヒドロゲナーゼおよびリボソームタンパク質P1を含むが、これに限定されるものではない。 Differential gene expression between the test cell population and the reference cell population can be normalized to a control gene, such as a housekeeping gene. For example, the control gene is known not to differ depending on the cancerous or non-cancerous state of the cell. The expression level of the control gene can thus be used to normalize signal levels in the test and reference cell populations. Exemplary control genes include, but are not limited to, β-actin, glyceraldehyde 3-phosphate dehydrogenase, and ribosomal protein P1, for example.
試験細胞集団は、複数の参照細胞集団と比較され得る。複数の参照細胞集団の各々は、公知のパラメーターにおいて、異なってよい。したがって、試験細胞集団は、例えば非肺癌細胞(正常細胞)を含むことが公知である第2の参照細胞集団と同じく、例えば肺癌細胞を含むことが公知である第1の参照細胞集団と比較され得る。試験細胞集団は、肺癌細胞を含む、または含む疑いのあることが公知の対照からの組織あるいは細胞試料に含まれ得る。 The test cell population can be compared to multiple reference cell populations. Each of the plurality of reference cell populations may differ in known parameters. Thus, the test cell population is compared to a first reference cell population known to contain, for example, lung cancer cells, as well as a second reference cell population known to contain non-lung cancer cells (normal cells), for example. obtain. The test cell population can be included in a tissue or cell sample from a control known to contain or be suspected of containing lung cancer cells.
試験細胞集団は体組織または体液、例えば生体液(例えば血液、痰、唾液)から得ることができる。例えば、試験細胞集団は肺組織から精製することができる。好ましくは、試験細胞集団は上皮細胞を含む。上皮細胞は肺癌であるまたはその疑いがあることが公知の組織からが好ましい。 The test cell population can be obtained from body tissue or fluid, such as biological fluid (eg blood, sputum, saliva). For example, the test cell population can be purified from lung tissue. Preferably, the test cell population comprises epithelial cells. The epithelial cells are preferably from tissues known to be or suspected of being lung cancer.
参照細胞集団における細胞は、試験細胞集団の細胞と類似の組織型が好ましい。状況に応じて、参照細胞集団は細胞株、例えば肺癌細胞株(すなわち陽性対照)、または正常非肺癌細胞株(すなわち陰性対照)である。あるいは、対照細胞集団は検定されたパラメーターまたは状態が公知である細胞から得られた分子情報のデータベースでもありうる。 The cells in the reference cell population are preferably of a similar tissue type as the cells in the test cell population. Depending on the situation, the reference cell population is a cell line, such as a lung cancer cell line (ie a positive control), or a normal non-lung cancer cell line (ie a negative control). Alternatively, the control cell population can be a database of molecular information obtained from cells whose parameters or conditions are known.
対象は好ましくは哺乳類である。典型的な哺乳類は、例えばヒト、非ヒト霊長類、マウス、ラット、イヌ、ネコ、ウマまたはウシを含むが、これに限定されるものではない。 The subject is preferably a mammal. Exemplary mammals include, but are not limited to, humans, non-human primates, mice, rats, dogs, cats, horses or cows.
本発明はまた、EGFRに対するTTKのキナーゼ活性を検出するキットを提供する。当該キットの範囲内で含まれる構成成分の例は、EGFR、リン酸化EGFRに結合する抗体、例えば抗リン酸化EGFR(Tyr992)抗体または抗リン酸化EGFR(Ser967)抗体、および抗体を検出する検出標識を含む。EGFRのリン酸化Tyr992またはSer967を認識する抗体は市販されている。あるいは、当該抗体あるいはTyr992またはSer967残基を含む断片がTyr992またはSer967でリン酸化EGFRとの免疫によって得られることは公知である。 The present invention also provides a kit for detecting the kinase activity of TTK against EGFR. Examples of components included within the kit include EGFR, antibodies that bind to phosphorylated EGFR, such as anti-phosphorylated EGFR (Tyr992) antibody or anti-phosphorylated EGFR (Ser967) antibody, and detection labels that detect the antibody including. Antibodies that recognize phosphorylated Tyr992 or Ser967 of EGFR are commercially available. Alternatively, it is known that the antibody or a fragment containing Tyr992 or Ser967 residues can be obtained by immunization with phosphorylated EGFR at Tyr992 or Ser967.
TTK cDNAは、SEQ ID NO:1(GenBank Accession No. NM_003318)に規定される2,571ヌクレオチドのオープンリーディングフレームを含む2,984のヌクレオチドから成る。オープンリーディングフレームはSEQ ID NO:2 (GenBank Accession No. NP_003309)に規定されるアミノ酸配列を有する857アミノ酸タンパク質をコードする。Mps1(TTKはそのヒトホモログである)は出願酵母において中心体複製に必要とされる因子として最初に発見され、その後紡錘体チェックポイントに必須機能を有することが示された。 TTK cDNA consists of 2,984 nucleotides including the 2,571 nucleotide open reading frame defined in SEQ ID NO: 1 (GenBank Accession No. NM_003318). The open reading frame encodes a 857 amino acid protein having the amino acid sequence defined in SEQ ID NO: 2 (GenBank Accession No. NP_003309). Mps1 (TTK is its human homolog) was first discovered as a factor required for centrosome replication in the filing yeast and was subsequently shown to have an essential function in the spindle checkpoint.
スクリーニング方法:
本発明はまた、TTKがEGFRに対するキナーゼ活性を有するという知見に関連する。例えば、TTKによるEGFRのリン酸化部位はTyr992またはSer967であり、そのリン酸化はEGFとは独立している。そのため、発明の一態様はEGFRのTTKが仲介するリン酸化を制御する試験化合物を同定することを含む。したがって、本発明はEGFRに対するTTKのキナーゼ活性を調節する化合物を同定する新規方法を提供する。例えば、本発明はEGFRに対するTTKのキナーゼ活性を調節する作用物質を同定する方法を提供し、その方法は以下の工程を含む:
a. TTKが以下から成る群から選択される、EGFRまたはその機能的等価物とTTKを試験化合物の存在下、TTKによるEGFRのリン酸化に適した条件下でインキュベートさせる工程:
i.SEQ ID NO: 2(TTK)のアミノ酸配列を含むポリペプチド;
ii. SEQ ID NO: 2の一つまたは複数のアミノ酸が置換、欠失または挿入されたアミノ酸配列を含むポリペプチドであって、結果として得られるポリペプチドがSEQ ID NO: 2のアミノ酸配列から成るポリペプチドと等価な生物活性を有する、ポリペプチド。
iii. SEQ ID NO: 1の核酸配列から成るポリヌクレオチドにストリンジェントな条件下でハイブリダイズするポリヌクレオチドによってコードされるポリペプチドで、結果として得られるポリペプチドがSEQ ID NO: 2のアミノ酸配列から成るポリペプチドと等価な生物活性を有する、ポリペプチド。
b. リン酸化EGFRレベルを検出する工程;および
c. 対照レベルと比較したリン酸化EGFRレベルにおける増減が、試験化合物がEGFRに対するTTKキナーゼ活性を修飾することを示す、対照レベルとリン酸化EGFRレベルを比較する工程。
Screening method:
The invention also relates to the finding that TTK has kinase activity against EGFR. For example, the phosphorylation site of EGFR by TTK is Tyr992 or Ser967, and the phosphorylation is independent of EGF. Thus, one aspect of the invention involves identifying test compounds that regulate TTK-mediated phosphorylation of EGFR. Accordingly, the present invention provides a novel method for identifying compounds that modulate the kinase activity of TTK against EGFR. For example, the present invention provides a method for identifying an agent that modulates the kinase activity of TTK against EGFR, the method comprising the following steps:
Incubating TTK with EGFR or a functional equivalent thereof selected from the group consisting of TTK and TTK in the presence of a test compound under conditions suitable for phosphorylation of EGFR by TTK:
i. a polypeptide comprising the amino acid sequence of SEQ ID NO: 2 (TTK);
ii. A polypeptide comprising an amino acid sequence in which one or more amino acids of SEQ ID NO: 2 have been substituted, deleted or inserted, and the resulting polypeptide consists of the amino acid sequence of SEQ ID NO: 2 A polypeptide having a biological activity equivalent to the polypeptide.
iii. A polypeptide encoded by a polynucleotide that hybridizes under stringent conditions to a polynucleotide comprising the nucleic acid sequence of SEQ ID NO: 1, wherein the resulting polypeptide is derived from the amino acid sequence of SEQ ID NO: 2. A polypeptide having a biological activity equivalent to that of the polypeptide.
b. detecting phosphorylated EGFR levels; and
c. comparing the control level with the phosphorylated EGFR level, wherein an increase or decrease in the phosphorylated EGFR level compared to the control level indicates that the test compound modifies TTK kinase activity against EGFR.
本方法により同定される薬剤は、TTKが仲介するEGFRのリン酸化を阻害することによって、例えば肺癌の進行を遅延または抑止することができる候補化合物を構成する。したがって、本発明は例えばEGFから独立した、TTKによるEGFRのリン酸化のような、EGFRに対するTTKキナーゼ活性を修飾する化合物のスクリーニング方法を提供する。例えば、EGFRのリン酸化部位はTyr992またはSer967である。上記方法は、TTKまたはEGFRに対するキナーゼ活性を有する機能的等価物と、EGFRまたはTTKによるリン酸化が可能な機能的等価物とを、1つまたは複数の候補化合物と接触させ、リン酸化EGFRレベルを評価することにより実施される。例えば、TTKによるリン酸化が可能なEGFRの機能的等価物は、TTKが仲介するEGFRのリン酸化部位、Tyr992またはSer967を含んでもよい。より好ましくは、EGFRの断片はSEQ ID NO: 42の889アミノ酸から1045アミノ酸領域を含むことができる。TTKまたは機能的等価物による、EGFRのリン酸化を調節する化合物はこれにより同定される。 Agents identified by this method constitute candidate compounds that can delay or inhibit the progression of lung cancer, for example, by inhibiting TTK-mediated phosphorylation of EGFR. Thus, the present invention provides a method of screening for compounds that modify TTK kinase activity against EGFR, such as phosphorylation of EGFR by TTK, independent of EGF. For example, the phosphorylation site of EGFR is Tyr992 or Ser967. The above method comprises contacting a functional equivalent having kinase activity against TTK or EGFR with a functional equivalent capable of phosphorylation by EGFR or TTK with one or more candidate compounds to reduce phosphorylated EGFR levels. It is implemented by evaluating. For example, a functional equivalent of EGFR capable of phosphorylation by TTK may comprise a TTK-mediated phosphorylation site of EGFR, Tyr992 or Ser967. More preferably, the fragment of EGFR can comprise the 889 amino acid to 1045 amino acid region of SEQ ID NO: 42. Compounds that modulate EGFR phosphorylation by TTK or functional equivalents are thereby identified.
したがって、本発明はまた、下記工程を含む、肺癌を治療および/または予防する化合物のスクリーニング方法を提供する:
a. 上記した方法により、EGFRに対するTTKのキナーゼ活性を修飾する試験化合物を同定する工程、および
b. 対照レベルと比較して、リン酸化EGFRレベルを減少させる化合物を選択する工程。
Accordingly, the present invention also provides a method for screening a compound for treating and / or preventing lung cancer, comprising the following steps:
a. identifying a test compound that modifies the kinase activity of TTK against EGFR by the method described above; and
b. selecting a compound that reduces phosphorylated EGFR levels relative to a control level.
本発明の別の観点はまた、EGFRに対するTTKのキナーゼ活性を調節する試験化合物の能力を検出するキットを提供する。そのようなキットは以下の構成成分を含むことができる:
A) 以下から成る群から選択されるポリペプチド;
i. SEQ ID NO: 2のアミノ酸配列を含むポリペプチド(TTK);
ii. SEQ ID NO: 2の一つまたは複数のアミノ酸が置換、欠失または挿入されたアミノ酸配列を含むポリペプチドであって、結果として得られるポリペプチドがSEQ ID NO: 2のアミノ酸配列から成るポリペプチドと等価な生物活性を有する、ポリペプチド。
iii. SEQ ID NO: 1の核酸配列を有するポリペプチドにストリンジェントな条件下でハイブリダイズするポリヌクレオチドによってコードされるポリペプチドで、結果として得られるポリペプチドがSEQ ID NO: 2のアミノ酸配列から成るポリペプチドと等価な生物活性を有する、ポリペプチド;および
B) EGFRまたはその機能的等価物:
C) リン酸化EGFRを検出する試薬
Another aspect of the invention also provides a kit for detecting the ability of a test compound to modulate TTK kinase activity against EGFR. Such a kit can include the following components:
A) a polypeptide selected from the group consisting of:
i. a polypeptide comprising the amino acid sequence of SEQ ID NO: 2 (TTK);
ii. A polypeptide comprising an amino acid sequence in which one or more amino acids of SEQ ID NO: 2 have been substituted, deleted or inserted, and the resulting polypeptide consists of the amino acid sequence of SEQ ID NO: 2 A polypeptide having a biological activity equivalent to the polypeptide.
iii. A polypeptide encoded by a polynucleotide that hybridizes under stringent conditions to a polypeptide having the nucleic acid sequence of SEQ ID NO: 1, wherein the resulting polypeptide is derived from the amino acid sequence of SEQ ID NO: 2. A polypeptide having a biological activity equivalent to the polypeptide comprising; and
B) EGFR or its functional equivalent:
C) Reagent for detecting phosphorylated EGFR
さらに、この発明はまた、EGFRに対するTTKのキナーゼ活性を修飾する試験化合物の能力を検出するキットを提供する。そのようなキットは以下の構成成分を含むことができる:
A) EGFRまたはその機能的等価物と、以下から成る群から選択されるポリペプチドを発現する細胞:
i. SEQ ID NO: 2のアミノ酸配列を含むポリペプチド(TTK);
ii. SEQ ID NO: 2の一つまたは複数のアミノ酸が置換、欠失または挿入されたSEQ ID NO: 2のアミノ酸配列を含むポリペプチドであって、結果として得られるポリペプチドがSEQ ID NO:2のアミノ酸配列から成るポリペプチドと等価な生物活性を有する、ポリペプチド。
iii. SEQ ID NO:1の核酸配列を有するポリペプチドにストリンジェントな条件下でハイブリダイズするポリヌクレオチドによってコードされるポリペプチドで、結果として得られるポリペプチドがSEQ ID NO:2のアミノ酸配列から成るポリペプチドと等価な生物活性を有する、ポリペプチド;および
B)リン酸化EGFRを検出する試薬。
Furthermore, this invention also provides a kit for detecting the ability of a test compound to modify TTK kinase activity against EGFR. Such a kit can include the following components:
A) Cells expressing a polypeptide selected from the group consisting of EGFR or a functional equivalent thereof and:
i. a polypeptide comprising the amino acid sequence of SEQ ID NO: 2 (TTK);
ii. A polypeptide comprising the amino acid sequence of SEQ ID NO: 2, wherein one or more amino acids of SEQ ID NO: 2 are substituted, deleted or inserted, wherein the resulting polypeptide is SEQ ID NO: A polypeptide having a biological activity equivalent to a polypeptide consisting of two amino acid sequences.
iii. A polypeptide encoded by a polynucleotide that hybridizes under stringent conditions to a polypeptide having the nucleic acid sequence of SEQ ID NO: 1, wherein the resulting polypeptide is derived from the amino acid sequence of SEQ ID NO: 2. A polypeptide having a biological activity equivalent to the polypeptide comprising; and
B) Reagent for detecting phosphorylated EGFR.
本発明において、EGFRの機能的等価物はSEQ ID NO:43のアミノ酸配列から成る断片である。さらにまた、キットはリン酸供与体をさらに含むことができる。好ましいリン酸供与体は、ATPである。本発明のキットにおける検出のための試薬はまた、リン酸化EGFR検出のための試薬としてEGFRのリン酸化Tyr992またはSer967を認識する抗体を含んでもよい。 In the present invention, the functional equivalent of EGFR is a fragment consisting of the amino acid sequence of SEQ ID NO: 43. Furthermore, the kit can further comprise a phosphate donor. A preferred phosphate donor is ATP. The reagent for detection in the kit of the present invention may also contain an antibody that recognizes phosphorylated Tyr992 or Ser967 of EGFR as a reagent for detecting phosphorylated EGFR.
本発明はさらに肺癌を治療または予防するための組成物を提供する。当該組成物はEGFRに対するTTKキナーゼ活性を減少させる化合物の薬学的有効量および薬学的に許容される担体から成る。上述したように、本発明の文脈において、用語「機能的等価物」は対象タンパク質が本来のタンパク質の生物活性を保持することを意味する。この場合はEGFRのキナーゼ活性である。対象タンパク質が標的活性を有するか否か、本発明に従って測定することができる。例えば、EGFRのキナーゼ活性はEGFRのリン酸化に適した条件下でポリペプチドとインキュベートし、リン酸化EGFRレベルを検出することにより検出することができる。例えば、TTKによるEGFRのリン酸化はTyr992またはSer967である。 The present invention further provides a composition for treating or preventing lung cancer. The composition comprises a pharmaceutically effective amount of a compound that decreases TTK kinase activity against EGFR and a pharmaceutically acceptable carrier. As mentioned above, in the context of the present invention, the term “functional equivalent” means that the protein of interest retains the biological activity of the native protein. In this case, it is EGFR kinase activity. Whether or not the protein of interest has a target activity can be determined according to the present invention. For example, EGFR kinase activity can be detected by incubating with a polypeptide under conditions suitable for EGFR phosphorylation and detecting phosphorylated EGFR levels. For example, phosphorylation of EGFR by TTK is Tyr992 or Ser967.
所与のタンパク質と機能的に等価なタンパク質の調製方法は、当業者に周知であり、タンパク質に変異を導入する従来の方法を含む。例えば、当業者は部位特異的変異を介してヒトTTKタンパク質のアミノ酸配列に適切な変異を導入することによってヒトTTKタンパク質と機能的に等価なタンパク質を調製できる(Hashimoto-Gotoh, T. et al. (1995), Gene 152, 271-5; Zoller, MJ, and Smith, M. (1983), Methods Enzymol. 100, 468-500; Kramer, W. et al. (1984), Nucleic Acids Res. 12, 9441-56; Kramer W, and Fritz HJ. (1987) Methods. Enzymol. 154, 350-67; Kunkel, TA (1985), Proc. Natl. Acad. Sci. USA. 82, 488-92; Kunkel (1991), Methods Enzymol. 204, 125-39)。アミノ酸変異は、天然において発生することもある。本発明の文脈における使用に適したタンパク質は、1つ又は複数のアミノ酸が変異されたヒトTTKタンパク質のアミノ酸配列を有するタンパク質を含み、結果として得られた変異タンパク質はヒトTTKタンパク質と機能的に等価である。そのような変異体において変異されるアミノ酸数は、通常25アミノ酸以下、好ましくは10から15アミノ酸以下、より好ましくは5から6アミノ酸以下、およびさらにより好ましくは2から3アミノ酸以下である。EGFRに対するキナーゼ活性を維持するために、変異タンパク質のアミノ酸配列におけるキナーゼドメインは保存することが好ましい。例えば、TTKのキナーゼドメインを維持するため、TTKのAsp647は変えられない。 Methods for preparing proteins that are functionally equivalent to a given protein are well known to those of skill in the art and include conventional methods for introducing mutations into proteins. For example, those skilled in the art can prepare proteins functionally equivalent to human TTK protein by introducing appropriate mutations into the amino acid sequence of human TTK protein via site-specific mutation (Hashimoto-Gotoh, T. et al. (1995), Gene 152, 271-5; Zoller, MJ, and Smith, M. (1983), Methods Enzymol. 100, 468-500; Kramer, W. et al. (1984), Nucleic Acids Res. 12, 9441-56; Kramer W, and Fritz HJ. (1987) Methods. Enzymol. 154, 350-67; Kunkel, TA (1985), Proc. Natl. Acad. Sci. USA. 82, 488-92; Kunkel (1991 ), Methods Enzymol. 204, 125-39). Amino acid mutations may occur in nature. Proteins suitable for use in the context of the present invention include proteins having the amino acid sequence of human TTK protein with one or more amino acids mutated, and the resulting mutant protein is functionally equivalent to human TTK protein. It is. The number of amino acids mutated in such variants is usually 25 amino acids or less, preferably 10 to 15 amino acids or less, more preferably 5 to 6 amino acids or less, and even more preferably 2 to 3 amino acids or less. In order to maintain the kinase activity against EGFR, it is preferable to preserve the kinase domain in the amino acid sequence of the mutant protein. For example, the TTK Asp647 cannot be altered to maintain the kinase domain of TTK.
変異または改変されたタンパク質、あるアミノ酸配列の1つまたは複数のアミノ酸残基を置換、欠失あるいは挿入によって改変されたアミノ酸配列を有するタンパク質は、元の生物活性を保持することが知られている(Mark, D. F. et al., Proc. Natl. Acad. Sci. USA (1984) 81, 5662-6, Zoller, M. J. & Smith, M., Nucleic Acids Research (1982) 10, 6487-500, Wang, A. et al., Science (1984) 224, 1431-3, Dalbadie-McFarland, G. et al., Proc. Natl. Acad. Sci. USA (1982) 79, 6409-13)。 Mutated or modified proteins, proteins with amino acid sequences modified by substitution, deletion or insertion of one or more amino acid residues of an amino acid sequence are known to retain their original biological activity (Mark, DF et al., Proc. Natl. Acad. Sci. USA (1984) 81, 5662-6, Zoller, MJ & Smith, M., Nucleic Acids Research (1982) 10, 6487-500, Wang, A et al., Science (1984) 224, 1431-3, Dalbadie-McFarland, G. et al., Proc. Natl. Acad. Sci. USA (1982) 79, 6409-13).
変異させるアミノ酸残基は、アミノ酸側鎖の特性が保存される別のアミノ酸に変異させることが好ましい(「保存的アミノ酸置換」として知られる方法)。典型的なアミノ酸側鎖の特性は、疎水性アミノ酸(A、I、L、M、F、P、W、Y、V)、親水性アミノ酸(R、D、N、C、E、Q、G、H、K、S、T)および次の官能基又は共通の特徴を有する側鎖である:脂肪族側鎖(G、A、V、L、I、P);水酸基を含む側鎖(S、T、Y);硫黄原子を含む側鎖(C、M);カルボン酸及びアミドを含む側鎖(D、N、E、Q);塩基を含む側鎖(R、K、H);ならびに芳香族官能基を含む側鎖(H、F、Y、W)。挿入された文字はアミノ酸の1文字コードを示すことに注意されたい。 The amino acid residue to be mutated is preferably mutated to another amino acid that preserves the properties of the amino acid side chain (a method known as “conservative amino acid substitution”). Typical amino acid side chain properties are hydrophobic amino acids (A, I, L, M, F, P, W, Y, V), hydrophilic amino acids (R, D, N, C, E, Q, G , H, K, S, T) and side groups having the following functional groups or common characteristics: aliphatic side chains (G, A, V, L, I, P); side chains containing hydroxyl groups (S , T, Y); side chains containing sulfur atoms (C, M); side chains containing carboxylic acids and amides (D, N, E, Q); side chains containing bases (R, K, H); and Side chains containing aromatic functional groups (H, F, Y, W). Note that the inserted letter indicates the single letter code for the amino acid.
ヒトTTKタンパク質のアミノ酸配列(SEQ ID NO: 2)に対して、1つまたは複数のアミノ酸残基が挿入または付加されるタンパク質の例は、ヒトTTKタンパク質を含む融合タンパク質である。本発明の文脈における使用に適した融合タンパク質は、例えばヒトTTKタンパク質および他のペプチドまたはタンパク質の融合を含む。融合タンパク質は、当業者に周知の技術を用いて、例えば他のペプチドまたはタンパク質をコードするDNAと本発明のヒトTTKタンパク質をコードするDNAをフレームが合うように結合し、融合DNAを発現ベクターへ挿入し、宿主で発現することによって作製することができる。本発明のタンパク質に融合されるペプチドまたはタンパク質は制限されない。 An example of a protein in which one or more amino acid residues are inserted or added to the amino acid sequence of human TTK protein (SEQ ID NO: 2) is a fusion protein comprising human TTK protein. Fusion proteins suitable for use in the context of the present invention include, for example, fusions of human TTK protein and other peptides or proteins. For the fusion protein, using techniques well known to those skilled in the art, for example, a DNA encoding another peptide or protein and a DNA encoding the human TTK protein of the present invention are combined in frame, and the fusion DNA is converted into an expression vector. It can be produced by inserting and expressing in a host. The peptide or protein fused to the protein of the present invention is not limited.
TTKタンパク質と融合させるペプチドとして使用可能な公知のペプチドには、例えば、FLAG (Hopp, T. P. et al., (1988) Biotechnology 6, 1204-10)、6個のHis(ヒスチジン)残基を含む6xHis、10xHis、インフルエンザ凝集素(HA)、ヒトc-mys断片、VSP-GP断片、p18HIV断片、T7-タグ、HSV-タグ、E-tag、SV40T抗原断片、lck タグ、αチューブリン断片、B-タグ、プロテインC断片などが含まれる。本発明のタンパク質と融合できるタンパク質の例には、GST (グルタチオン-S-トランスフェラーゼ)、インフルエンザ凝集素(HA)、免疫グロブリン定常領域、βガラクトシダーゼ、MBP (マルトース結合タンパク質)などが含まれる。
Known peptides that can be used as peptides to be fused with the TTK protein include, for example, FLAG (Hopp, TP et al., (1988)
融合タンパク質は、上述の融合ペプチドまたはタンパク質をコードする市販のDNAを、本発明のタンパク質をコードするDNAと融合させて、調製された融合DNAを発現させることによって調製可能である。 The fusion protein can be prepared by fusing a commercially available DNA encoding the above-mentioned fusion peptide or protein with the DNA encoding the protein of the present invention and expressing the prepared fusion DNA.
機能的に等価なタンパク質を単離するための当技術分野で公知の代替法は、例えば、ハイブリダイゼーション技術を用いる方法である(Sambrook, J. et al., (1989) Molecular Cloning 2nd ed. 9.47-9.58, Cold Spring Harbor Lab. Press)。当業者は、TTKタンパク質をコードするTTK DNA配列(例えば、SEQ ID NO: 1)の全体または一部に対して高い相同性を有するDNAを容易に単離することができ、単離されたDNAからヒトのTTKタンパク質と機能的に等価なタンパク質を単離することができる。本発明で使用されるタンパク質には、ヒトのTTKタンパク質をコードするDNA配列の全体または一部とハイブリダイズするDNAによってコードされるタンパク質、およびヒトのTTKタンパク質と機能的に等価物であるタンパク質が含まれる。これらのタンパク質には、ヒトまたはラットに由来するタンパク質に対応する哺乳動物ホモログ(例えばサル、マウス、ウサギおよびウシ遺伝子によってコードされたタンパク質)が含まれる。ヒトのTTKタンパク質をコードするDNAに対して高い相同性を有するcDNAを動物から単離する際には、精巣または肺癌由来の組織を用いることが特に好ましい。 Alternative methods known in the art for isolating functionally equivalent proteins are, for example, those using hybridization techniques (Sambrook, J. et al., (1989) Molecular Cloning 2nd ed. 9.47. -9.58, Cold Spring Harbor Lab. Press). One skilled in the art can readily isolate DNA having high homology to all or part of a TTK DNA sequence encoding a TTK protein (eg, SEQ ID NO: 1) Can be used to isolate a protein functionally equivalent to human TTK protein. Proteins used in the present invention include proteins encoded by DNA that hybridizes with all or part of the DNA sequence encoding human TTK protein, and proteins that are functionally equivalent to human TTK protein. included. These proteins include mammalian homologues (eg, proteins encoded by monkey, mouse, rabbit and bovine genes) corresponding to proteins derived from humans or rats. When isolating a cDNA having high homology to DNA encoding human TTK protein from an animal, it is particularly preferable to use a tissue derived from testis or lung cancer.
ヒトのTTKタンパク質の機能的に等価なタンパク質をコードするDNAを単離するためのハイブリダイゼーション条件は、当業者によって日常的に選択可能である。例えば、「Rapid-hyb緩衝液」(アマシャムライフサイエンス)を用いて68℃で30分間以上プレハイブリダーゼーションを行い、標識プローブを添加して、68℃で1時間以上加温することにより、ハイブリダイゼーションを実施することができる。その後の洗浄工程は、例えば低ストリンジェントな条件で行うことができる。典型的な低ストリンジェントな条件とは、例えば42℃、2x SSC、0.1% SDS、または好ましくは50℃、2x SSC、0.1% SDSである。高ストリンジェントな条件を用いることがより好ましい。典型的な高ストリンジェントな条件とは、例えば、室温で、2x SSC、0.01% SDSでの20分間の洗浄3回、次に37℃で、1x SSC、0.1% SDSでの20分間の洗浄3回、および、50℃で、1x SSC、0.1% SDSでの20分間の洗浄2回を含む。しかし、温度および塩濃度などのいくつかの要素はハイブリダイゼーションのストリンジェンシーに影響を及ぼす場合があり、必要なストリンジェンシーを達成するための要素を、当技術分野内の当業者は日常的に十分適切に選択することができる。
Hybridization conditions for isolating DNA encoding a functionally equivalent protein of the human TTK protein can be routinely selected by those skilled in the art. For example, pre-hybridization at 68 ° C for 30 minutes or more using “Rapid-hyb buffer” (Amersham Life Sciences), adding a labeled probe, and heating at 68 ° C for 1 hour or more Hybridization can be performed. The subsequent washing step can be performed, for example, under low stringent conditions. Typical low stringency conditions are, for example, 42 ° C, 2x SSC, 0.1% SDS, or preferably 50 ° C, 2x SSC, 0.1% SDS. It is more preferable to use highly stringent conditions. Typical high stringency conditions include, for example, three 20 minute washes with 2x SSC, 0.01% SDS at room temperature, followed by a 20 minute wash with 1x SSC, 0.1% SDS at 37 °
ハイブリダイゼーションの代わりに、遺伝子増幅法、例えばポリメラーゼ連鎖反応(PCR)法を利用し、ヒトのTTKタンパク質(SEQ ID NO: 2)をコードするDNA(SEQ ID NO: 1)の配列情報に基づいて合成されたプライマーを用いて、ヒトのTTKタンパク質と機能的に等価なタンパク質をコードするDNAを単離することができる。 Instead of hybridization, gene amplification methods such as polymerase chain reaction (PCR) are used, based on the sequence information of the DNA encoding human TTK protein (SEQ ID NO: 2) (SEQ ID NO: 1) Using the synthesized primers, DNA encoding a protein functionally equivalent to the human TTK protein can be isolated.
上記のハイブリダイゼーション技術または遺伝子増幅技術を通じて単離されたDNAによってコードされるヒトTTKタンパク質と機能的に等価なタンパク質は、通常、ヒトTTKタンパク質のアミノ酸配列に対して高い相同性を有する。本発明の文脈において、「高い相同性」という用語は40%以上、好ましくは60%以上、より好ましくは80%以上、さらにより好ましくは95%以上の相同性を指す。タンパク質の相同性は「Wilbur, W. J. and Lipman, D. J. (1983) Proc. Natl. Acad. Sci. USA 80, 726-30」におけるアルゴリズムに従って決定することができる。
A protein functionally equivalent to a human TTK protein encoded by DNA isolated through the above hybridization technique or gene amplification technique usually has high homology to the amino acid sequence of the human TTK protein. In the context of the present invention, the term “high homology” refers to a homology of 40% or more, preferably 60% or more, more preferably 80% or more, even more preferably 95% or more. Protein homology can be determined according to the algorithm in “Wilbur, W. J. and Lipman, D. J. (1983) Proc. Natl.
本発明の文脈において有用なタンパク質は、それを産生するために用いた細胞もしくは宿主、または利用した精製方法に応じて、アミノ酸配列、分子量、等電点、糖鎖の有無、または形状に変化を有してもよい。言うまでもなく、ヒトTTKタンパク質(SEQ ID NO:2)の機能的等価物である限り、本発明の文脈においてそれは有効である。 Proteins useful in the context of the present invention change in amino acid sequence, molecular weight, isoelectric point, presence or absence of sugar chains, or shape depending on the cell or host used to produce it or the purification method utilized. You may have. Needless to say, as long as it is a functional equivalent of the human TTK protein (SEQ ID NO: 2), it is effective in the context of the present invention.
本発明の文脈において有用なタンパク質は、当業者に周知の方法によって組換えタンパク質または天然タンパク質として調製することができる。組換えタンパク質は、例えば、以下の工程により調製可能である:本発明のタンパク質をコードするDNA(例えばSEQ ID NO:1の核酸配列を有するDNA)を適切な発現ベクターに挿入する工程;ベクターを適切な宿主細胞に導入する工程;抽出物を入手する工程;抽出物をクロマトグラフィー、例えばイオン交換クロマトグラフィー、逆相クロマトグラフィー、ゲルろ過もしくは本発明のタンパク質に対する抗体を固定したカラムを利用するアフィニティークロマトグラフィーに供することにより、または上述のカラムを2つ以上組み合わせることにより、タンパク質を精製する工程。 Proteins useful in the context of the present invention can be prepared as recombinant or natural proteins by methods well known to those skilled in the art. The recombinant protein can be prepared, for example, by the following steps: inserting DNA encoding the protein of the present invention (eg, DNA having the nucleic acid sequence of SEQ ID NO: 1) into an appropriate expression vector; Introducing into an appropriate host cell; obtaining the extract; chromatography using the column on which the extract is chromatographed, for example, ion exchange chromatography, reverse phase chromatography, gel filtration or an antibody against the protein of the present invention. A step of purifying a protein by subjecting it to chromatography or combining two or more of the above-mentioned columns.
さらに、本発明の文脈において有用なタンパク質が、宿主細胞(例えば、動物細胞および大腸菌)中で、グルタチオン-S-トランスフェラーゼタンパク質との融合タンパク質として、または複数のヒスチジンを加えた組換えタンパク質として発現する場合、発現された組換えタンパク質を、グルタチオンカラムまたはニッケルカラムを用いて精製することができる。 In addition, proteins useful in the context of the present invention are expressed in host cells (eg, animal cells and E. coli) as fusion proteins with glutathione-S-transferase proteins or as recombinant proteins supplemented with multiple histidines. In some cases, the expressed recombinant protein can be purified using a glutathione column or a nickel column.
融合タンパク質の精製後に、必要に応じてトロンビンまたは第Xa因子で切断することにより、目的のタンパク質以外の領域を除くこともできる。 After purification of the fusion protein, the region other than the target protein can be removed by cleaving with thrombin or factor Xa as necessary.
天然のタンパク質は、当業者に公知の方法により、例えば本発明のタンパク質を発現する組織または細胞の抽出物を、後述のTTKタンパク質に結合する抗体が結合したアフィニティーカラムに接触させることにより、単離可能である。抗体は、ポリクローナル抗体またはモノクローナル抗体でありうる。 The natural protein is isolated by a method known to those skilled in the art, for example, by contacting an extract of a tissue or cell that expresses the protein of the present invention with an affinity column bound with an antibody that binds to the TTK protein described below. Is possible. The antibody can be a polyclonal antibody or a monoclonal antibody.
本発明において、TTKまたはその機能的等価物のキナーゼ活性は、当技術分野において公知の方法によって決定可能である。例えば、TTKによるEGFRのリン酸化のための適切なアッセイ条件下で、TTKおよびEGFRはATPとインキュベートすることができる。本発明において、EGFRのリン酸化の典型的な条件は、EGFRまたは細胞抽出物とTTKを接触される段階、およびそれらをインキュベートする段階を含む。本発明において、EGFRのリン酸化条件は、リン酸供与体の存在下でEGFRとTTKのインキュベートによって提供される。ATPは適切なリン酸供与体の一例である。例えば、放射性ラベル化ATPがリン酸供与体となりうる。増加した放射性ラベル化EGFRはあらゆる適切な方法によって検出することができる。例えば、放射性アッセイにおいて、放射性ラベル化EGFRはシンチレーションカウンターで検出される。一方、非放射性アッセイにおいて、リン酸化EGFRは、例えばウエスタンブロットアッセイまたはELISAのような、リン酸化EGFRに結合する抗体を用いて検出する。例えば、TTKによるEGFRのリン酸化に適切な条件を以下に記載する:
反応混合液:
50 mM Tris-HCl (pH 7.4),
10 mM MgCl2,
2 mM dithiothreitol,
1 mM NaF,
0.2 mM ATP
In the present invention, the kinase activity of TTK or its functional equivalent can be determined by methods known in the art. For example, TTK and EGFR can be incubated with ATP under appropriate assay conditions for phosphorylation of EGFR by TTK. In the present invention, typical conditions for phosphorylation of EGFR include contacting EGFR or cell extract with TTK, and incubating them. In the present invention, EGFR phosphorylation conditions are provided by incubation of EGFR and TTK in the presence of a phosphate donor. ATP is an example of a suitable phosphate donor. For example, radiolabeled ATP can be a phosphate donor. Increased radiolabeled EGFR can be detected by any suitable method. For example, in a radioactive assay, radiolabeled EGFR is detected with a scintillation counter. On the other hand, in non-radioactive assays, phosphorylated EGFR is detected using an antibody that binds to phosphorylated EGFR, such as Western blot assay or ELISA. For example, suitable conditions for phosphorylation of EGFR by TTK are described below:
Reaction mixture:
50 mM Tris-HCl (pH 7.4),
10 mM MgCl 2 ,
2 mM dithiothreitol,
1 mM NaF,
0.2 mM ATP
反応混合液は同定されたTTKを含む試料と混合し、30℃で60分間インキュベートする。反応はLaemmli試料バッファーを添加し、95℃で5分間加熱することで停止させた。タンパク質はSDS-PAGEおよび、その後リン酸化EGFRに結合する抗体を用いてウエスタンブロットによって分離した。 The reaction mixture is mixed with the sample containing the identified TTK and incubated at 30 ° C. for 60 minutes. The reaction was stopped by adding Laemmli sample buffer and heating at 95 ° C. for 5 minutes. Proteins were separated by Western blot using SDS-PAGE followed by antibody binding to phosphorylated EGFR.
あるいは、EGFRに対するTTKのキナーゼ活性はシンチレーションカウンターによって放射性標識化EGFRに基づいて評価され得る。リン酸化EGFRは例えばELISAまたはウエスタンブロットアッセイのような抗体に基づいた検出系によって検出され得る。あるいは、リン酸化EGFRは、例えばMALDI-TOF-MSのような、マススペクトロメトリーで検出することもできる。例えば、TTKによるEGFRのリン酸化部位はTyr992またはSer967である。Tyr992またはSer967におけるEGFRに対するTTKのキナーゼ活性は、リン酸化EGFR(Tyr992またはSer967)に特異的な抗体を用いて検出することができる。 Alternatively, the kinase activity of TTK against EGFR can be assessed based on radiolabeled EGFR by a scintillation counter. Phosphorylated EGFR can be detected by antibody-based detection systems such as ELISA or Western blot assays. Alternatively, phosphorylated EGFR can be detected by mass spectrometry, such as MALDI-TOF-MS. For example, the phosphorylation site of EGFR by TTK is Tyr992 or Ser967. The kinase activity of TTK against EGFR in Tyr992 or Ser967 can be detected using an antibody specific for phosphorylated EGFR (Tyr992 or Ser967).
様々なロースループットおよびハイスループットの酵素アッセイ形式が当技術分野で公知であり、これらを、TTKによるEGFRのリン酸化のレベルの検出または測定のために容易に適合させることができる。ハイスループットアッセイ法のため、マルチウェルプレート、スライドまたはチップなどの固体支持体上に、EGFRを好ましくは固定化する。反応後に、上記の方法によってリン酸化EGFRを固体支持体上で検出することができる。リン酸化EGFRを検出するため、例えばリン酸化EGFRに結合する抗体を用いることができる。例えば、TTKによるEGFRのリン酸化部位はTyr992またはSer967である。TTKによるTyr992またはSer967におけるEGFRのリン酸化は、リン酸化EGFR(Tyr992またはSer967)に対する特異的抗体を用いて検出することができる。あるいは、P32標識化ATPをリン酸供与体として用いることができる。リン酸化EGFRは放射性P32で追跡することができる。そのようなアッセイを容易にするため、固体支持体をストレプトアビジンでコーティングしてEGFRをビオチンで標識化することができる。当業者はスクリーニングの所望のスループット能力に基づいて、適切なアッセイ形式を決定することができる。 A variety of low-throughput and high-throughput enzyme assay formats are known in the art and can be readily adapted for detection or measurement of the level of EGFR phosphorylation by TTK. For high-throughput assays, EGFR is preferably immobilized on a solid support such as a multiwell plate, slide or chip. After the reaction, phosphorylated EGFR can be detected on the solid support by the method described above. In order to detect phosphorylated EGFR, for example, an antibody that binds to phosphorylated EGFR can be used. For example, the phosphorylation site of EGFR by TTK is Tyr992 or Ser967. EGFR phosphorylation at Tyr992 or Ser967 by TTK can be detected using specific antibodies against phosphorylated EGFR (Tyr992 or Ser967). Alternatively, it is possible to use a P 32 labeled ATP as a phosphate donor. Phosphorylated EGFR can be tracked by radioactive P 32. To facilitate such an assay, the solid support can be coated with streptavidin and EGFR labeled with biotin. One skilled in the art can determine an appropriate assay format based on the desired throughput capability of the screen.
任意の試験化合物は、例えば細胞抽出物、細胞培養上清、微生物発酵の産物、海洋生物からの抽出物、植物抽出物、精製タンパク質または粗タンパク質、ペプチド、非ペプチド化合物、合成低分子化合物および天然化合物を含むが、これに限定されず、本発明のスクリーニング方法に用いることができる。本発明の試験化合物は、(1)生物学的ライブラリー、(2)扱うことが空間的に可能な並列した固相または液相ライブラリー、(3)デコンボリューションを必要とする合成ライブラリー法、(4)「1ビーズ1化合物」ライブラリー法、および(5)アフィニティークロマトグラフィー選択を用いる合成ライブラリー方法を含む、当技術分野で公知のコンビナトリアルライブラリー法における多くのアプローチのいずれかを用いて入手することもできる。アフィニティークロマトグラフィー選択を用いる生物学的ライブラリー法はペプチドライブラリーに限定されるが、他の4つのアプローチは、ペプチド、非ペプチドオリゴマー、または化合物の低分子ライブラリーに適用可能である(Lam (1997) Anticancer Drug Des. 12: 145-67)。分子ライブラリーを合成する方法の例は、当技術分野において見出すことができる(DeWitt et al. (1993) Proc. Natl. Acad. Sci. USA 90: 6909-13; Erb et al. (1994) Proc. Natl. Acad. Sci. USA 91: 11422-6; Zuckermann et al. (1994) J. Med. Chem. 37: 2678-85; Cho et al. (1993) Science 261: 1303-5; Carell et al. (1994) Angew. Chem. Int. Ed. Engl. 33: 2059; Carell et al. (1994) Angew. Chem. Int. Ed. Engl. 33: 2061; Gallop et al. (1994) J. Med. Chem. 37: 1233-51.)。化合物のライブラリーは、溶液中に提示してもよく( Houghten (1992) Bio/Techniques 13: 412-21.)、またはビーズ(Lam (1991) Nature 354: 82-4.参照)、チップ(Fodor (1993) Nature 364: 555-6.)、細菌(US Pat. No. 5,223,409)、胞子(US Pat. No. 5,571,698; 5,403,484, および 5,223,409)、プラスミド(Cull et al. (1992) Proc. Natl. Acad. Sci. USA 89: 1865-9.)、もしくはファージ(Scott and Smith (1990) Science 249: 386-90.; Devlin (1990) Science 249: 404-6.; Cwirla et al. (1990) Proc. Natl. Acad. Sci. USA 87: 6378-78.; Felici (1991) J. Mol. Biol. 222: 301-10.; US 特許出願 2002103360)上に提示してもよい。 Optional test compounds include, for example, cell extracts, cell culture supernatants, products of microbial fermentation, extracts from marine organisms, plant extracts, purified or crude proteins, peptides, non-peptide compounds, synthetic low molecular compounds and natural Although it contains a compound, it is not limited to this, and can be used in the screening method of the present invention. The test compounds of the present invention are: (1) a biological library, (2) a parallel solid-phase or liquid-phase library that can be handled spatially, and (3) a synthetic library method that requires deconvolution. Using any of a number of approaches in combinatorial library methods known in the art, including (4) “one bead one compound” library method, and (5) synthetic library method using affinity chromatography selection Can also be obtained. Biological library methods using affinity chromatography selection are limited to peptide libraries, but the other four approaches are applicable to peptide, non-peptide oligomer, or small molecule libraries of compounds (Lam ( 1997) Anticancer Drug Des. 12: 145-67). Examples of methods for synthesizing molecular libraries can be found in the art (DeWitt et al. (1993) Proc. Natl. Acad. Sci. USA 90: 6909-13; Erb et al. (1994) Proc Natl. Acad. Sci. USA 91: 11422-6; Zuckermann et al. (1994) J. Med. Chem. 37: 2678-85; Cho et al. (1993) Science 261: 1303-5; Carell et al. (1994) Angew. Chem. Int. Ed. Engl. 33: 2059; Carell et al. (1994) Angew. Chem. Int. Ed. Engl. 33: 2061; Gallop et al. (1994) J. Med. Chem. 37: 1233-51.). The library of compounds may be presented in solution (Houghten (1992) Bio / Techniques 13: 412-21.) Or beads (see Lam (1991) Nature 354: 82-4.) And chips (Fodor (1993) Nature 364: 555-6.), Bacteria (US Pat.No. 5,223,409), spores (US Pat.No. 5,571,698; 5,403,484, and 5,223,409), plasmids (Cull et al. (1992) Proc. Natl. Acad. Sci. USA 89: 1865-9.) Or phage (Scott and Smith (1990) Science 249: 386-90 .; Devlin (1990) Science 249: 404-6 .; Cwirla et al. (1990) Proc Natl. Acad. Sci. USA 87: 6378-78 .; Felici (1991) J. Mol. Biol. 222: 301-10 .; US patent application 2002103360).
本発明のスクリーニング方法によって同定された化合物は、EGFRに対するTTKのキナーゼ活性を阻害する薬剤開発の候補であり、肺癌の治療または予防に適用され得る。特に、EGFRに対するTTKのキナーゼ活性は、EGF依存的である。もしくは、EGFRのリン酸化部位はTyr992またはSer967である。 The compound identified by the screening method of the present invention is a candidate for drug development that inhibits the kinase activity of TTK against EGFR, and can be applied to the treatment or prevention of lung cancer. In particular, the kinase activity of TTK against EGFR is EGF-dependent. Alternatively, the phosphorylation site of EGFR is Tyr992 or Ser967.
さらに、EGFRに対するTTKのキナーゼ活性を阻害する化合物の構造の一部が付加、欠失および/または置換によって変換した化合物もまた、本発明のスクリーニング方法によって得られた化合物に含まれる。 Furthermore, a compound obtained by converting a part of the structure of a compound that inhibits the kinase activity of TTK against EGFR by addition, deletion and / or substitution is also included in the compound obtained by the screening method of the present invention.
肺癌の治療および予防:
本発明は、本発明のスクリーニング方法により選択された化合物のいずれかを含む肺癌の治療または予防のための組成物を提供する。
Treatment and prevention of lung cancer:
The present invention provides a composition for treating or preventing lung cancer comprising any of the compounds selected by the screening method of the present invention.
ヒトおよび他の哺乳類、例えばマウス、ラット、モルモット、ウサギ、ネコ、イヌ、羊、ブタ、ウシ、サル、ヒヒ、およびチンパンジー、のための医薬として本発明の方法によって同定された化合物を投与する場合、同定された化合物は直接投与か、または従来の製剤調製方法を用いた剤形に調製できる。例えば、必要に応じて、薬剤は経口的に糖衣錠、カプセル、エリキシルおよびマイクロカプセルとして、または非経口的に無菌液あるいは水または薬学的に許容される他のあらゆる液体の滅菌懸濁液の注射型をとることができる。例えば、化合物は、一般的に許容された薬剤実施のために要求される単位投与量の形において、薬学的に許容される担体または培養液、特に滅菌水、生理的食塩水、植物油、乳化剤、懸濁剤、界面活性剤、安定剤、香料、賦形剤、溶媒、防腐剤、結合剤、その他と混合することができる。これら製剤における活性成分の量は、指示範囲内で適切な投与量にする。 When administering a compound identified by the method of the present invention as a medicament for humans and other mammals such as mice, rats, guinea pigs, rabbits, cats, dogs, sheep, pigs, cows, monkeys, baboons, and chimpanzees The identified compounds can be administered directly or in dosage forms using conventional pharmaceutical preparation methods. For example, if desired, the drug may be injected orally as sugar-coated tablets, capsules, elixirs and microcapsules, or parenterally in sterile liquid or sterile suspension of water or any other liquid pharmaceutically acceptable Can be taken. For example, the compound may be administered in a pharmaceutically acceptable carrier or culture medium, particularly sterile water, physiological saline, vegetable oil, emulsifier, Can be mixed with suspending agents, surfactants, stabilizers, fragrances, excipients, solvents, preservatives, binders, and others. The amount of the active ingredient in these preparations should be an appropriate dose within the indicated range.
錠剤およびカプセルを形成するために混合できる添加剤の例は、例えば、ゼラチン、コーンスターチ、トラガカントゴムおよびアラビアゴムのような結合剤、結晶セルロースのような賦形剤、コーンスターチ、セラチンおよびアルギン酸のような膨潤剤、ステアリン酸マグネシウムのような潤滑油、ショ糖、乳糖またはサッカリンのような甘味料、ならびにペパーミント、アカモノ油およびサクランボのような香料を含む。単位投与量の形態がカプセルの場合、油のような液体担体はまた、上記成分においてさらに含まれることができる。注射のための滅菌混合物は、注射に用いられる蒸留水のような溶媒を用いた通常の薬剤実施態様で調製することができる。 Examples of additives that can be mixed to form tablets and capsules include, for example, binders such as gelatin, corn starch, gum tragacanth and gum arabic, excipients such as crystalline cellulose, swelling such as corn starch, ceratin and alginic acid Agents, lubricating oils such as magnesium stearate, sweeteners such as sucrose, lactose or saccharin, and flavorings such as peppermint, red oil and cherries. Where the unit dosage form is a capsule, a liquid carrier such as oil can also be included in the above ingredients. Sterile mixtures for injection can be prepared in conventional drug embodiments using a solvent such as distilled water used for injection.
生理的食塩水、ブドウ糖、およびD-ソルビトール、D-マンノース、D-マンニトールおよび塩化ナトリウムのようなアジュバントを含む他の等張液は、注射用の水溶液として用いられることができる。これらは適切な可溶化剤、例えばアルコール、特にエタノール、プロピレングリコールおよびポリエチレングリコールのようなポリアルコール、ポリソルベート80(商標)およびHCO-50のような非イオン性活性剤と組み合わせて用いることができる。
Other isotonic solutions, including saline, glucose, and adjuvants such as D-sorbitol, D-mannose, D-mannitol and sodium chloride can be used as an aqueous solution for injection. These can be used in combination with suitable solubilizers such as alcohols, especially polyalcohols such as ethanol, propylene glycol and polyethylene glycol,
ゴマ油およびダイズ油は適切な油性液体の例であり、可溶化剤としての安息香酸ベンジルまたはベンジルアルコールと組み合わせて使用することができ、リン酸緩衝液またはナトリウム酢酸緩衝液のような緩衝液、塩酸プロカインのような鎮痛剤、ベンジルアルコールまたはフェノールのような安定化剤、および抗酸化剤とともに製剤化してもよい。調製された注射物は、適切なアンプルに充填されてもよい。 Sesame oil and soybean oil are examples of suitable oily liquids that can be used in combination with benzyl benzoate or benzyl alcohol as solubilizers, buffers such as phosphate buffer or sodium acetate buffer, hydrochloric acid It may be formulated with an analgesic such as procaine, a stabilizer such as benzyl alcohol or phenol, and an antioxidant. The prepared injection may be filled into a suitable ampoule.
当業者に公知の方法は、本発明の医薬品組成物を対象に投与するために用いられることができる。例えば動脈内注射、静脈内注射、または経皮注射、および鼻腔内投与、経気管支性投与、筋肉内投与、または口腔内投与である。投与量および方法は、対象の体重および年齢、ならびに選択した投与方法によって変化し得る。しかしながら、当業者は日常的に適切な投与方法および投与量を選択することができる。前記化合物がDNAによってコード化可能である場合、そのDNAは遺伝子治療のためのベクターに挿入することができ、ベクターは治療を行うため対象に投与することができる。投与量および方法は、対象の体重、年齢、症状によっても変化し得る。しかし、当業者はそれらを最適に選択することができる。 Methods known to those skilled in the art can be used to administer the pharmaceutical composition of the present invention to a subject. For example, intraarterial injection, intravenous injection, or transdermal injection, and intranasal administration, transbronchial administration, intramuscular administration, or buccal administration. The dosage and method can vary depending on the weight and age of the subject and the chosen method of administration. However, those skilled in the art can routinely select appropriate administration methods and dosages. If the compound can be encoded by DNA, the DNA can be inserted into a vector for gene therapy, and the vector can be administered to a subject for treatment. The dosage and method may also vary depending on the subject's weight, age, and symptoms. However, those skilled in the art can optimally select them.
例えば、TTKに結合し、その活性を調節する化合物の用量は症状次第であるが、正常な成人(体重60kg)へ経口投与する場合、適切な用量は一般的に1日約0.1mgから約100mg、好ましくは1日約1.0mgから約50mg、さらに好ましくは1日約1.0mgから約20mgである。 For example, the dose of the compound that binds to TTK and modulates its activity depends on the symptoms, but when administered orally to a normal adult (body weight 60 kg), an appropriate dose is generally about 0.1 mg to about 100 mg per day. Preferably about 1.0 mg to about 50 mg per day, more preferably about 1.0 mg to about 20 mg per day.
非経口投与する場合、正常な成人(体重60kg)に注射する形では、対象、標的器官、症状および投与方法によりいくらか異なるが、1日約0.01mgから30mg、好ましくは1日約0.1から約20mg、およびより好ましくは1日約0.1から10mgの静脈内注射が簡便である。また、他の動物の場合においても、体重60kgに変換した量を投与することが可能である。 When administered parenterally, normal adults (60 kg body weight) will be injected into normal adults (body weight 60 kg), depending on the subject, target organ, symptoms and method of administration, but about 0.01 to 30 mg per day, preferably about 0.1 to about 20 mg per day And, more preferably, an intravenous injection of about 0.1 to 10 mg per day is convenient. In the case of other animals, it is possible to administer an amount converted to a body weight of 60 kg.
別の態様において、本発明は本明細書において記載されている1つ以上の治療化合物を含む、薬学的組成物または治療組成物を含む。薬学的製剤は、経口、直腸、経鼻、局所的(口腔および舌下を含む)、経膣または非経口(筋肉内、皮下および静脈内を含む)投与、あるいは吸入またはガス注入による投与に適したものを含むことができる。製剤は、必要に応じて、薬学の従来技術において使用されている方法のいずれかにより、個別の用量において都合よく提示され、かつ調製することができる。本明細書における全ての薬学的方法は、液体担体または微粉固体担体、必要に応じてはその両方と活性化合物の結合をもたらす段階、および必要な場合は製品を所望の製剤に成型する段階を含む。 In another embodiment, the invention includes a pharmaceutical composition or therapeutic composition comprising one or more therapeutic compounds described herein. The pharmaceutical formulation is suitable for oral, rectal, nasal, topical (including buccal and sublingual), vaginal or parenteral (including intramuscular, subcutaneous and intravenous) administration, or administration by inhalation or gas infusion Can be included. The formulations can be conveniently presented and prepared in individual doses as required by any of the methods used in the prior art of pharmacy. All pharmaceutical methods herein include the step of bringing into association the active compound with liquid carriers or finely divided solid carriers, optionally both, and if necessary, shaping the product into the desired formulation. .
経口投与に適している薬学的製剤は個別の単位、例えばカプセル、カシェ剤または錠剤として都合よく提示されることができ、各々は粉または顆粒として、溶液、懸濁液として、またはエマルジョンとして活性成分の予め定められた量を含む。活性成分はまた、ボーラス、舐剤またはペーストとして提示され、純粋な形態、すなわち担体なしで存在することができる。経口投与用の錠剤およびカプセルは、従来の賦形剤、例えば結合剤、充填剤、潤滑油、崩壊剤または湿潤剤を含むことができる。錠剤は任意に1つまたはそれ以上の製剤成分を用いて、圧縮または成形によって作られることができる。圧縮錠剤は、任意で結合剤、潤滑油、不活性希釈剤、潤滑剤、界面活性剤または分散剤と混合し、例えば粉または顆粒など自由に流れる形態において、活性成分を適切な機械で圧縮することにより調製しても良い。成形された錠剤は、適切な機械において、不活性液体希釈剤で湿らせた粉末状化合物の混合物を成形することによって作られ得る。錠剤は公知技術の方法に従って被覆しても良い。口腔液製剤(Oral fluid preparations)は、例えば水性または油性の懸濁液、溶液、エマルジョン、シロップまたはエリキシル剤の形で存在するか、あるいは使用前に水または他の適切な溶媒と構成する乾燥製品として提示され得る。そのような液体製剤は、従来の添加剤、例えば懸濁剤、乳化剤、非水溶溶媒(食用油を含んでよい)または防腐剤を含むことができる。さらにまた、錠剤はその中の活性成分の放出を遅くまたは制御して提供するように、任意に調製することができる。 Pharmaceutical formulations suitable for oral administration can conveniently be presented as discrete units, such as capsules, cachets or tablets, each as an active ingredient as a powder or granule, as a solution, suspension, or emulsion. Of a predetermined amount. The active ingredient is also presented as a bolus, electuary or paste and can be present in pure form, ie without a carrier. Tablets and capsules for oral administration can contain conventional excipients such as binders, fillers, lubricants, disintegrants, or wetting agents. A tablet may be made by compression or molding, optionally with one or more formulation ingredients. Compressed tablets are optionally mixed with binders, lubricants, inert diluents, lubricants, surfactants or dispersants, and the active ingredient is compressed with a suitable machine, eg in a free-flowing form such as powders or granules You may prepare by. Molded tablets may be made by molding in a suitable machine a mixture of the powdered compound moistened with an inert liquid diluent. The tablets may be coated according to methods known in the art. Oral fluid preparations exist, for example, in the form of aqueous or oily suspensions, solutions, emulsions, syrups or elixirs, or are dry products that are composed with water or other suitable solvent prior to use. Can be presented as: Such liquid preparations may contain conventional additives such as suspending agents, emulsifying agents, non-aqueous solvents (which may include edible oils) or preservatives. Furthermore, the tablets can optionally be prepared so as to provide a slow or controlled release of the active ingredient therein.
非経口投与用の製剤には、抗酸化剤、緩衝剤、静菌剤、および対象とするレシピエントの血液と製剤を等張にする溶質を含み得る水性および非水性の無菌注射液剤、ならびに、懸濁化剤および増粘剤を含み得る水性および非水性の無菌懸濁剤が含まれる。製剤は、単位投与用容器または複数回投与用容器、例えば、密閉されたアンプルおよびバイアルに入れて提供されてもよく、生理食塩水、注射用水のような無菌液体担体の使用直前の添加のみが必要なフリーズドライ(凍結乾燥)状態で保存されてもよい。あるいは、製剤は、持続注入用として提供されてもよい。即時注射用の液剤および懸濁剤は、先に述べた種類の無菌の粉末剤、顆粒剤および錠剤から調製してもよい。 Formulations for parenteral administration include aqueous and non-aqueous sterile injectable solutions that may contain antioxidants, buffers, bacteriostats, and solutes that make the target recipient's blood and formulation isotonic, and Aqueous and non-aqueous sterile suspensions are included which may include suspending and thickening agents. The formulation may be provided in unit-dose containers or multi-dose containers, such as sealed ampoules and vials, only added immediately prior to use of a sterile liquid carrier such as saline, water for injection. It may be stored in the necessary freeze-dried (freeze-dried) state. Alternatively, the formulation may be provided for continuous infusion. Extemporaneous injection solutions and suspensions may be prepared from sterile powders, granules and tablets of the kind previously described.
直腸投与用製剤には、例えばココアバターまたはポリエチレングリコールのような標準的な担体を用いた坐剤として提供してもよい。口内、例えば口腔内または舌下に局所投与するための製剤には、ショ糖、アカシアまたはトラガカントのような風味付き基剤中に活性成分を含む薬用キャンディー、ならびにゼラチンおよびグリセリン、またはショ糖およびアカシアのような基剤中に活性成分を含むトローチが含まれる。活性成分の鼻腔内投与のためには、本発明の化合物は、液体スプレーもしくは分散性粉末剤または滴剤の形態が使用され得る。滴剤は、1種または複数の分散剤、可溶化剤または懸濁剤もまた含む水性または非水性基剤とともに製剤化してもよい。液体スプレーは加圧パックから都合よく送達されてもよい。 Formulations for rectal administration may be presented as suppositories with standard carriers such as cocoa butter or polyethylene glycol. Formulations for topical administration in the mouth, such as in the mouth or sublingual, include sucrose, medicinal candy containing the active ingredient in a flavored base such as acacia or tragacanth, and gelatin and glycerin, or sucrose and acacia A lozenge containing the active ingredient in a base such as For intranasal administration of the active ingredients, the compounds of the invention can be used in the form of liquid sprays or dispersible powders or drops. Drops may be formulated with an aqueous or non-aqueous base which also contains one or more dispersants, solubilizers or suspending agents. Liquid sprays may be conveniently delivered from pressurized packs.
吸入による投与のため、本発明の化合物は、吸入器、噴霧器、加圧パックまたは他のエアロゾルスプレーを送達する簡便な方法から、簡便に送達される。加圧パックは、ジクロロジフルオロメタン、トリクロロフルオロメタン、ジクロロテトラフルオロエタン、二酸化炭素または他の適切なガスのような適切な噴射剤を含み得る。加圧式エアロゾルの場合、投薬単位は、一定量を送達するバルブを備えることによって、決定されてもよい。 For administration by inhalation, the compounds of the invention are conveniently delivered from any convenient method of delivering an inhaler, nebulizer, pressurized pack or other aerosol spray. The pressurized pack may contain a suitable propellant such as dichlorodifluoromethane, trichlorofluoromethane, dichlorotetrafluoroethane, carbon dioxide or other suitable gas. In the case of a pressurized aerosol, the dosage unit may be determined by providing a valve that delivers a fixed amount.
あるいは、吸入またはガス注入による投与のため、本発明の化合物は、乾燥粉末組成物、例えば化合物と乳糖またはデンプンのような適切な粉末基剤との混合粉末の形態をとってもよい。粉末組成物は、単位剤形、例えばカプセル、カートリッジ、ゼラチンまたはブリスターパックで提供されてもよく、粉末剤は、それらから、吸入器または吸込器の補助により投与され得る。 Alternatively, for administration by inhalation or insufflation, the compounds of the invention may take the form of a dry powder composition, for example a mixed powder of the compound and a suitable powder base such as lactose or starch. Powder compositions may be provided in unit dosage forms, such as capsules, cartridges, gelatin or blister packs, from which powders can be administered with the aid of an inhaler or inhaler.
必要に応じて、上記の製剤は、活性成分の持続的放出を与えるように適合され、使用されてもよい。本発明の医薬品組成物は、抗菌物質、免疫抑制剤または保存剤のような他の活性成分もまた含んでもよい。 If desired, the above formulations may be adapted and used to provide sustained release of the active ingredient. The pharmaceutical composition of the present invention may also contain other active ingredients such as antibacterial substances, immunosuppressants or preservatives.
具体的に前述した成分に加えて、本発明の製剤は、該当する製剤のタイプを考慮して当技術分野で慣例的な他の薬剤を含み得ること、例えば、経口投与に適した製剤は矯味剤を含み得ることが、理解されるべきである。 In addition to the ingredients specifically mentioned above, the formulations of the present invention may contain other drugs customary in the art in view of the type of formulation concerned, e.g. formulations suitable for oral administration are taste-masked It should be understood that an agent may be included.
好ましい単位用量製剤は、下記の活性成分の有効量またはその適切なフラクションを含むものである。 Preferred unit dosage formulations are those containing an effective amount of the active ingredients described below or an appropriate fraction thereof.
前述した条件の各々のため、組成物は経口でまたは注射で、1日約0.1から約250mg/kgの用量範囲で投与されることができる。ヒト成人の用量範囲は通常1日約5mgから約17.5g、好ましくは1日約5mgから約10g、および最も好ましくは1日約100mgから約3gである。別々の単位で提供された提示の錠剤または他の単位用量形態は、そのような用量またはその倍数として有効な量、例えば約5mgから約500mg、通常約100mgから約500mgを含む単位、を都合よく含むことができる。 For each of the aforementioned conditions, the composition can be administered orally or by injection in a dosage range of about 0.1 to about 250 mg / kg daily. The dosage range for human adults is usually about 5 mg to about 17.5 g per day, preferably about 5 mg to about 10 g per day, and most preferably about 100 mg to about 3 g per day. Presented tablets or other unit dosage forms provided in separate units conveniently contain such doses or amounts effective as multiples thereof, e.g., units comprising about 5 mg to about 500 mg, usually about 100 mg to about 500 mg. Can be included.
医薬品組成物は好ましくは経口または注射(静脈または皮下)で投与され、および対象に投与される正確な量は付き添いの医師の責任である。しかしながら、使用される用量は、対象の年齢、性別、治療されている正確な疾患、およびその重篤度を含む多くの要因に依拠する。さらに、投与経路は条件およびその重篤度によって変えることができる。 The pharmaceutical composition is preferably administered orally or by injection (intravenous or subcutaneous), and the precise amount administered to the subject is the responsibility of the attending physician. However, the dose used will depend on many factors, including the age of the subject, sex, the exact disease being treated, and its severity. In addition, the route of administration can vary depending on the condition and its severity.
肺癌の転移の診断
本発明は、TTKのキナーゼドメインにおける様々なアミノ酸置換、特にTTKキナーゼ活性およびその浸潤能力を促進した変異、の発見に一部基づく。TTKのキナーゼドメインにおける1つまたは複数のアミノ酸置換が肺癌の転移と関連しているという、本明細書に提供される証明を考慮して、本発明は肺癌転移予測方法を提供する。当該方法の実施例は以下の工程を含む:TTKのキナーゼドメインにおける1つまたは複数の変異を検出する工程。変異が検出された場合、肺癌の転移の高リスクを示す。 本発明の文脈において、TTKのキナーゼドメインにおける1つまたは複数のアミノ酸置換は、SEQ ID NO:2のコドン610におけるバリンからフェニルアラニン(V610F)、コドン753におけるグルタミンからヒスチジン(Q753H)およびコドン574におけるチロシンからシステイン(Y574C)である。検出はシークエンス、ミニシークエンス、ハイブリダイゼーション、制限断片解析、オリゴヌクレオチド連結アッセイまたはアレル特異的PCRによって達成することができる。
Diagnosing Lung Cancer Metastasis The present invention is based in part on the discovery of various amino acid substitutions in the kinase domain of TTK, particularly mutations that promoted TTK kinase activity and its ability to infiltrate. In view of the evidence provided herein that one or more amino acid substitutions in the kinase domain of TTK are associated with lung cancer metastasis, the present invention provides a method for predicting lung cancer metastasis. An example of the method includes the following steps: detecting one or more mutations in the kinase domain of TTK. If a mutation is detected, it indicates a high risk of lung cancer metastasis. In the context of the present invention, one or more amino acid substitutions in the kinase domain of TTK are: valine to phenylalanine (V610F) at codon 610 of SEQ ID NO: 2, glutamine to histidine at codon 753 (Q753H) and tyrosine at codon 574. To cysteine (Y574C). Detection can be accomplished by sequencing, mini-sequencing, hybridization, restriction fragment analysis, oligonucleotide ligation assays or allele specific PCR.
本明細書において、これまでに未知のTTK変異の存在が肺癌の転移の高リスクと相関することが示される。この知見に基づいて、本発明はまた、当該TTK変異の検出のための方法および試薬を提供する。例えば、本発明はTTKの1つまたは複数の変異を検出する方法を提供し、その変異は少なくともSEQ ID NO: 2のコドン610におけるバリンからフェニルアラニン(V610F)、コドン753におけるグルタミンからヒスチジン(Q753H)およびコドン574におけるチロシンからシステイン(Y574C)から成る群から選択される。本発明の方法は以下の工程を含む:
a)対象ポリペプチドまたはそれをコードするcDNAと、ポリペプチドまたはそれをコードするcDNAの変異のいずれか1つを認識する結合試薬を接触させる工程、
b)ポリペプチドまたはそれをコードするcDNAと結合試薬を検出する工程、および
c)工程b)の薬剤の結合が検出される場合にTTKの変異を示す工程。
Herein, it is shown that the presence of previously unknown TTK mutations correlates with a high risk of lung cancer metastasis. Based on this finding, the present invention also provides methods and reagents for the detection of the TTK mutation. For example, the invention provides a method for detecting one or more mutations in TTK, the mutations comprising at least valine to phenylalanine (V610F) at codon 610 of SEQ ID NO: 2 and glutamine to histidine at codon 753 (Q753H). And selected from the group consisting of tyrosine to cysteine (Y574C) at codon 574. The method of the present invention comprises the following steps:
a) contacting the polypeptide of interest or cDNA encoding the polypeptide with a binding reagent that recognizes any one of the mutations of the polypeptide or cDNA encoding the polypeptide,
b) detecting the polypeptide or cDNA encoding it and a binding reagent; and
c) A step showing TTK mutation when binding of the drug in step b) is detected.
本発明において、ポリペプチドの変異のいずれか1つを認識する結合試薬は、好ましくはSEQ ID NO: 2のコドン610におけるバリンからフェニルアラニン(V610F)、コドン753におけるグルタミンからヒスチジン(Q753H)、およびコドン574におけるチロシンからシステイン(Y574C)から成る群から選択される少なくとも1つの変異を有するポリペプチドに結合し、実質的にSEQ ID NO: 2のポリペプチドには結合しない抗体である。さらに、抗体はモノクローナル抗体またはポリクローナル抗体、または抗原結合領域を含むそれらの断片でもよい。本発明において、当該抗体はTTKポリペプチドまたはその変異を含む免疫学的活性断片の免疫の従来法によって得ることができる。あるいは、抗体ライブラリーからTTK変異を認識する抗体可変部のスクリーニングは、抗原としてTTK変異体を用いて行われることができる。 In the present invention, a binding reagent that recognizes any one of the polypeptide mutations is preferably valine to phenylalanine (V610F) at codon 610 of SEQ ID NO: 2, glutamine to histidine (Q753H) at codon 753, and the codon An antibody that binds to a polypeptide having at least one mutation selected from the group consisting of tyrosine to cysteine (Y574C) at 574 and does not substantially bind to the polypeptide of SEQ ID NO: 2. Furthermore, the antibody may be a monoclonal or polyclonal antibody, or a fragment thereof comprising an antigen binding region. In the present invention, the antibody can be obtained by a conventional method of immunization of an immunologically active fragment containing a TTK polypeptide or a mutation thereof. Alternatively, screening of antibody variable regions that recognize TTK mutations from antibody libraries can be performed using TTK mutants as antigens.
本発明において、好ましい抗体は特にTTK変異体を認識する。当該抗体はTTK変異特異的抗体として適用される。あるいは、本発明において、好ましいTTK変異特異的抗体は、SEQ ID NO: 2のポリペプチドに実質的に結合しない。本発明の文脈において、SEQ ID NO: 2のアミノ酸配列を有するTTK野生型と実質的に結合しない抗体は、TTKの野生型との反応性が、TTK変異と比較して一般的に30%以下、好ましくは20%以下、より好ましくは10%以下を示す。 In the present invention, preferred antibodies specifically recognize TTK variants. The antibody is applied as a TTK mutation-specific antibody. Alternatively, in the present invention, preferred TTK mutation-specific antibodies do not substantially bind to the polypeptide of SEQ ID NO: 2. In the context of the present invention, an antibody that does not substantially bind to the TTK wild type having the amino acid sequence of SEQ ID NO: 2 is generally less than 30% reactive with the TTK wild type compared to the TTK mutation. Preferably 20% or less, more preferably 10% or less.
本発明において、TTK変異は、SEQ ID NO: 2のコドン610におけるバリンからフェニルアラニン(V610F)、コドン753におけるグルタミンからヒスチジン(Q753H)、コドン574におけるチロシンからシステイン(Y574C)から成る群から選択される少なくとも1つの変異を含む。当該変異体は、部位特異的な変異をタンパク質に導入する従来法により調製することができる。例えば、当業者は部位特異的変異誘発を介したヒトTTKタンパク質のアミノ酸配列に部位特異的変異を導入することにより変異を有するタンパク質を調製することができる(Hashimoto-Gotoh, T. et al. (1995), Gene 152, 271-5; Zoller, MJ, および Smith, M. (1983), Methods Enzymol. 100, 468-500; Kramer, W. et al. (1984), Nucleic Acids Res. 12, 9441-56; Kramer W, および Fritz HJ. (1987) Methods. Enzymol. 154, 350-67; Kunkel, TA (1985), Proc. Natl. Acad. Sci. USA. 82, 488-92; Kunkel (1991), Methods Enzymol. 204, 125-39)。 In the present invention, the TTK mutation is selected from the group consisting of valine to phenylalanine (V610F) at codon 610 of SEQ ID NO: 2, glutamine to histidine (Q753H) at codon 753, and tyrosine to cysteine (Y574C) at codon 574. Contains at least one mutation. Such mutants can be prepared by conventional methods for introducing site-specific mutations into proteins. For example, those skilled in the art can prepare proteins having mutations by introducing site-specific mutations into the amino acid sequence of human TTK protein via site-directed mutagenesis (Hashimoto-Gotoh, T. et al. 1995), Gene 152, 271-5; Zoller, MJ, and Smith, M. (1983), Methods Enzymol. 100, 468-500; Kramer, W. et al. (1984), Nucleic Acids Res. 12, 9441 -56; Kramer W, and Fritz HJ. (1987) Methods. Enzymol. 154, 350-67; Kunkel, TA (1985), Proc. Natl. Acad. Sci. USA. 82, 488-92; Kunkel (1991) , Methods Enzymol. 204, 125-39).
本発明において、TTK変異はまた、TTK変異体をコードするDNAの核酸配列の測定によって検出することができる。例えば、領域のcDNA(またはmRNA)とアニールするプライマーまたはプローブは、SEQ ID NO: 2のコドン610におけるバリンからフェニルアラニン(V610F)、コドン753におけるグルタミンからヒスチジン(Q753H)、コドン574におけるチロシンからシステイン(Y574C)のいずれか1つを含むことができる。 In the present invention, the TTK mutation can also be detected by measuring the nucleic acid sequence of the DNA encoding the TTK mutant. For example, primers or probes that anneal to the cDNA (or mRNA) of a region include valine to phenylalanine (V610F) at codon 610 of SEQ ID NO: 2, glutamine to histidine (Q753H) at codon 753, tyrosine to cysteine at codon 574 ( Y574C).
さらに、本発明はまた、TTKの1つまたは複数の変異を検出する試薬を提供する。その変異はSEQ ID NO: 2のコドン610におけるバリンからフェニルアラニン(V610F)、コドン753におけるグルタミンからヒスチジン(Q753H)、コドン574におけるチロシンからシステイン(Y574C)から成る群から選択される少なくとも1つの変異であり、試薬はポリペプチドまたはそれをコードするcDNAの変異のいずれか1つを認識する結合剤を含む。 Furthermore, the present invention also provides a reagent for detecting one or more mutations in TTK. The mutation is at least one mutation selected from the group consisting of valine to phenylalanine (V610F) at codon 610 of SEQ ID NO: 2, glutamine to histidine (Q753H) at codon 753, and tyrosine to cysteine at codon 574 (Y574C). Yes, the reagent comprises a binding agent that recognizes either one of the polypeptide or the mutation of the cDNA encoding it.
また、変異箇所を含むTTK変異またはその断片をコードするポリヌクレオチドは、その変異を検出するための対照試料として有効である。したがって、本発明は、A1870G(Y574Cに対する)、G1977T (V610Fに対する)、およびG2408C (Q753Hに対する)から成る群から選択される1つまたは複数の変異が含まれる、SEQ ID NO: 1のヌクレオチド配列を有する単離されたポリヌクレオチド、あるいは1つまたは複数の変異を含むその断片を提供する。例えば、ハイブリダイゼーション技術を用いた変異検出において、TTK変異のポリヌクレオチドは陽性対照として用いられることができる。本発明において、少なくとも1つの変異も含まれない限り、TTK変異体のポリヌクレオチドのいかなる断片も当該対照として用いられることが可能である。TTK変異体のポリヌクレオチド断片の好ましい長さは、通常25塩基以上、50塩基以上、100塩基以上、およびより好ましくは200塩基以上である。 In addition, a polynucleotide encoding a TTK mutation containing a mutation site or a fragment thereof is effective as a control sample for detecting the mutation. Accordingly, the present invention provides a nucleotide sequence of SEQ ID NO: 1 comprising one or more mutations selected from the group consisting of A1870G (for Y574C), G1977T (for V610F), and G2408C (for Q753H). An isolated polynucleotide having, or a fragment thereof comprising one or more mutations is provided. For example, in mutation detection using a hybridization technique, a TTK mutation polynucleotide can be used as a positive control. In the present invention, any fragment of a TTK variant polynucleotide can be used as the control as long as it does not contain at least one mutation. The preferred length of the TTK variant polynucleotide fragment is usually 25 bases or more, 50 bases or more, 100 bases or more, and more preferably 200 bases or more.
変異箇所を含むTTK変異体またはその断片をコードするポリペプチドはまた、変異検出のための対照試料として有効である。したがって、本発明はV610F、Q753HおよびY574Cから成る群から選択される1つまたは複数の変異が含まれる、SEQ ID NO: 2のアミノ酸配列を有する単離されたポリペプチド、あるいは1つまたは複数の変異を含むその断片を提供する。例えば、イムノアッセイ技術を用いた変異検出において、TTK変異体のポリペプチドは陽性対照として用いることができる。本発明において、TTK変異体のポリペプチドの任意の断片を、少なくとも1つの変異も含まない限り、そのような対照として用いることができる。TTKポリペプチドの変異体はまた、全ペプチドまたはその断片の分子質量解析によって検出されることができる。例えば、分子質量分析の好ましい技術は、MALDI-TOF MSである。TTK変異体ポリペプチド断片の長さは、通常10アミノ酸残基以上、好ましくは20アミノ酸残基以上、あるいは50アミノ酸残基以上、およびより好ましくは100アミノ酸残基以上である。 Polypeptides encoding TTK variants or fragments thereof containing mutation sites are also useful as control samples for mutation detection. Accordingly, the present invention relates to an isolated polypeptide having the amino acid sequence of SEQ ID NO: 2, or one or more of one or more mutations selected from the group consisting of V610F, Q753H and Y574C A fragment thereof containing the mutation is provided. For example, in mutation detection using an immunoassay technique, a polypeptide of a TTK variant can be used as a positive control. In the present invention, any fragment of a TTK variant polypeptide can be used as such a control as long as it does not contain at least one mutation. Variants of TTK polypeptides can also be detected by molecular mass analysis of whole peptides or fragments thereof. For example, a preferred technique for molecular mass spectrometry is MALDI-TOF MS. The length of the TTK variant polypeptide fragment is usually 10 amino acid residues or more, preferably 20 amino acid residues or more, or 50 amino acid residues or more, and more preferably 100 amino acid residues or more.
EGFRに対するTTKキナーゼ活性を阻害するドミナントネガティブタンパク質
本発明は、ISSILEKGERLPQPPICTI (SEQ ID NO: 44)またはDVYMIMVKCWMIDADSRPK (SEQ ID NO: 45)またはFRELIIEFSKMARDPQRYL (SEQ ID NO: 46)を含む阻害ポリペプチドに関する。好ましい態様において、阻害ポリペプチドはISSILEKGERLPQPPICTI (SEQ ID NO: 44)またはDVYMIMVKCWMIDADSRPK (SEQ ID NO: 45)またはFRELIIEFSKMARDPQRYL (SEQ ID NO: 46)、該ポリペプチドと機能的に等価なポリペプチド、またはEGFRに対するTTKキナーゼ活性が欠如したポリペプチドをコードするポリヌクレオチドを含む。EGFR断片が肺癌細胞増殖を阻害することは本発明による新規の知見である。
The present invention relates to an inhibitory polypeptide comprising ISSILEKGERLPQPPICTI (SEQ ID NO: 44) or DVYMIMVKCWMIDADSRPK (SEQ ID NO: 45) or FRELIIEFSKMARDPQRYL (SEQ ID NO: 46). In a preferred embodiment, the inhibitory polypeptide is ISSILEKGERLPQPPICTI (SEQ ID NO: 44) or DVYMIMVKCWMIDADSRPK (SEQ ID NO: 45) or FRELIIEFSKMARDPQRYL (SEQ ID NO: 46), a polypeptide functionally equivalent to the polypeptide, or against EGFR A polynucleotide encoding a polypeptide lacking TTK kinase activity is included. It is a novel finding according to the present invention that EGFR fragments inhibit lung cancer cell growth.
本発明の選択されたアミノ酸配列を含むポリペプチドは、そのポリペプチドがISSILEKGERLPQPPICTI (SEQ ID NO:44)またはDVYMIMVKCWMIDADSRPK (SEQ ID NO: 45)またはFRELIIEFSKMARDPQRYL (SEQ ID NO: 46)を含み、および癌細胞増殖を阻害する限り、いかなる長さでもよい。例えば、アミノ酸配列の長さは、19から76残基、好ましくは19から57残基、さらにより好ましくは19から38残基にわたることができる。 A polypeptide comprising a selected amino acid sequence of the present invention, wherein the polypeptide comprises ISSILEKGERLPQPPICTI (SEQ ID NO: 44) or DVYMIMVKCWMIDADSRPK (SEQ ID NO: 45) or FRELIIEFSKMARDPQRYL (SEQ ID NO: 46), and cancer cells Any length is possible as long as it inhibits growth. For example, the length of the amino acid sequence can range from 19 to 76 residues, preferably 19 to 57 residues, and even more preferably 19 to 38 residues.
本発明のポリペプチドは、2つ以上の「選択されたアミノ酸配列」を含むことができる。2つ以上の「選択されたアミノ酸配列」は同じまたは異なるアミノ酸配列でもよい。さらにまた、「選択されたアミノ酸配列」は直接連結することができる。あるいは、それらの中で任意の介在配列と配置することもできる。 The polypeptides of the present invention can comprise two or more “selected amino acid sequences”. Two or more “selected amino acid sequences” may be the same or different amino acid sequences. Furthermore, the “selected amino acid sequences” can be linked directly. Alternatively, they can be arranged with any intervening sequence among them.
さらにまた、本発明はここで特に開示されるISSILEKGERLPQPPICTI (SEQ ID NO:44)またはDVYMIMVKCWMIDADSRPK (SEQ ID NO: 45)またはFRELIIEFSKMARDPQRYL (SEQ ID NO: 46)ポリペプチドに相同なポリペプチド(すなわち、配列相同性を共有する)に関する。本発明において、ISSILEKGERLPQPPICTI (SEQ ID NO:44)またはDVYMIMVKCWMIDADSRPK (SEQ ID NO: 45)またはFRELIIEFSKMARDPQRYL (SEQ ID NO: 46)ポリペプチドに相同なポリペプチドは、1つまたは複数のアミノ酸残基の付加、欠失、置換および挿入から選択される任意の変異を含み、および機能的等価物である。「機能的等価物」という用語は、EGFRに対するTTKキナーゼ活性を阻害する機能、および細胞増殖を阻害する機能を有することをいう。したがって、本発明においてISSILEKGERLPQPPICTI (SEQ ID NO: 44)またはDVYMIMVKCWMIDADSRPK (SEQ ID NO: 45)またはFRELIIEFSKMARDPQRYL (SEQ ID NO: 46)ペプチドと機能的に等価なポリペプチドは、ISSILEKGERLPQPPICTI (SEQ ID NO:44)またはDVYMIMVKCWMIDADSRPK (SEQ ID NO: 45)またはFRELIIEFSKMARDPQRYL (SEQ ID NO: 46)配列以外の部位にアミノ酸変異を有することが好ましい。本発明におけるISSILEKGERLPQPPICTI (SEQ ID NO: 44)またはDVYMIMVKCWMIDADSRPK (SEQ ID NO: 45)またはFRELIIEFSKMARDPQRYL (SEQ ID NO:46)ペプチドと機能的に等価なポリペプチドのアミノ酸配列は、ISSILEKGERLPQPPICTI (SEQ ID NO: 44)またはDVYMIMVKCWMIDADSRPK (SEQ ID NO: 45)またはFRELIIEFSKMARDPQRYL (SEQ ID NO: 46)配列を保存しており、60%以上、通常70%以上、好ましくは80%以上、より好ましくは90%以上、あるいは95%以上、およびさらにより好ましくは98%以上、「選択されたアミノ酸配列」に相同性を有する。アミノ酸配列相同性は、公知技術のアルゴリズム、例えばデフォルト設定されるBLASTまたはALIGNセットを用いて測定することができる。 Furthermore, the present invention relates to polypeptides homologous to ISSILEKGERLPQPPICTI (SEQ ID NO: 44) or DVYMIMVKCWMIDADSRPK (SEQ ID NO: 45) or FRELIIEFSKMARDPQRYL (SEQ ID NO: 46) polypeptides specifically disclosed herein (ie, sequence homology). Share sex). In the present invention, a polypeptide homologous to the ISSILEKGERLPQPPICTI (SEQ ID NO: 44) or DVYMIMVKCWMIDADSRPK (SEQ ID NO: 45) or FRELIIEFSKMARDPQRYL (SEQ ID NO: 46) polypeptide is the addition of one or more amino acid residues, It includes any mutation selected from deletions, substitutions and insertions, and is a functional equivalent. The term “functional equivalent” refers to having a function of inhibiting TTK kinase activity against EGFR and a function of inhibiting cell proliferation. Therefore, in the present invention, a polypeptide functionally equivalent to the ISSILEKGERLPQPPICTI (SEQ ID NO: 44) or DVYMIMVKCWMIDADSRPK (SEQ ID NO: 45) or FRELIIEFSKMARDPQRYL (SEQ ID NO: 46) peptide is ISSILEKGERLPQPPICTI (SEQ ID NO: 44). Alternatively, it is preferable to have an amino acid mutation at a site other than the DVYMIMVKCWMIDADSRPK (SEQ ID NO: 45) or FRELIIEFSKMARDPQRYL (SEQ ID NO: 46) sequence. The amino acid sequence of a polypeptide functionally equivalent to ISSILEKGERLPQPPICTI (SEQ ID NO: 44) or DVYMIMVKCWMIDADSRPK (SEQ ID NO: 45) or FRELIIEFSKMARDPQRYL (SEQ ID NO: 46) peptide in the present invention is ISSILEKGERLPQPPICTI (SEQ ID NO: 44). ) Or DVYMIMVKCWMIDADSRPK (SEQ ID NO: 45) or FRELIIEFSKMARDPQRYL (SEQ ID NO: 46) sequences are conserved, 60% or more, usually 70% or more, preferably 80% or more, more preferably 90% or more, or 95 % Or more, and even more preferably 98% or more have homology to the “selected amino acid sequence”. Amino acid sequence homology can be measured using known art algorithms such as the default BLAST or ALIGN set.
本発明のポリペプチドは、選択されたアミノ酸配列に基づいていかなる位置からも化学合成することができる。従来のペプチド化学で用いられる方法は、ポリペプチド合成方法に使用することができる。特に、該方法は以下の文書および日本特許公報に記載されている方法を含む:
Peptide Synthesis, Interscience, New York, 1966; The Proteins, Vol. 2, Academic Press Inc., New York, 1976;
ペプチド合成 (Peptide Synthesis), 丸善(Inc.), 1975;
ペプチド合成の基礎と実験(Fundamental and Experimental Peptide Synthesis), 丸善(Inc.), 1985;
医薬品の開発続(Development of Pharmaceuticals),Vol. 14: ペプチド合成(Peptide Synthesis), 広川書店, 1991;
国際公開公報 WO99/67288.
The polypeptides of the present invention can be chemically synthesized from any position based on the selected amino acid sequence. Methods used in conventional peptide chemistry can be used for polypeptide synthesis methods. In particular, the methods include those described in the following documents and Japanese patent publications:
Peptide Synthesis, Interscience, New York, 1966; The Proteins, Vol. 2, Academic Press Inc., New York, 1976;
Peptide Synthesis, Maruzen (Inc.), 1975;
Fundamental and Experimental Peptide Synthesis, Maruzen (Inc.), 1985;
Development of Pharmaceuticals, Vol. 14: Peptide Synthesis, Hirokawa Shoten, 1991;
International Publication WO99 / 67288.
本発明のポリペプチドはまた、公知の遺伝子工学技術により合成することができる。遺伝子工学技術の例は以下の通りである。特に、所望のペプチドをコードしているDNAは形質転換細胞を調製する適切な宿主細胞に導入される。本発明のポリペプチドはこの形質転換細胞によって産生されるポリペプチドを回収することによって得られる。あるいは、所望のポリペプチドは、タンパク質合成に必要な要素が再構成される、インビトロ翻訳系を用いて、インビトロで合成することができる。 The polypeptides of the present invention can also be synthesized by known genetic engineering techniques. Examples of genetic engineering techniques are as follows. In particular, DNA encoding the desired peptide is introduced into a suitable host cell from which transformed cells are prepared. The polypeptide of the present invention can be obtained by recovering the polypeptide produced by this transformed cell. Alternatively, the desired polypeptide can be synthesized in vitro using an in vitro translation system in which the elements necessary for protein synthesis are reconstituted.
遺伝子工学技術が用いられる場合、本発明のポリペプチドは異なるアミノ酸配列を有するペプチドを持つ融合タンパク質として発現することができる。所望の融合タンパク質を発現するベクターは、それらが同じリーディングフレームに存在するように、本発明のポリペプチドをコードするポリヌクレオチドと異なるペプチドをコードするポリヌクレオチドを連結し、その後結果として得られるヌクレオチドを発現ベクターに導入することによって得ることができる。融合タンパク質は、結果として生じるベクターで適切な宿主を形質転換することによって発現する。形成される融合タンパク質で用いられる異なるペプチドは、以下のペプチドを含む:
FLAG (Hopp et al., (1988) BioTechnology 6, 1204-10),
6個のHis(ヒスチジン)残基から成る6xHis , 10xHis,
インフルエンザ血球凝集素 (HA),
ヒト c-myc 断片,
VSV-GP 断片,
p18 HIV 断片,
T7-tag,
HSV-tag,
E-tag,
SV40T 抗原断片,
lck tag,
a-チューブリン断片,
B-tag,
プロテイン C 断片,
GST (グルタチオン-S-トランスフェラーゼ),
HA (インフルエンザ血球凝集素),
免疫グロブリン定常領域,
a-ガラクトシダーゼ, および
MBP (マルトース結合タンパク質)。
When genetic engineering techniques are used, the polypeptide of the present invention can be expressed as a fusion protein having peptides having different amino acid sequences. A vector that expresses the desired fusion protein is ligated with a polynucleotide encoding a different peptide from the polynucleotide encoding the polypeptide of the present invention so that they are in the same reading frame, and then the resulting nucleotide. It can be obtained by introducing it into an expression vector. The fusion protein is expressed by transforming a suitable host with the resulting vector. Different peptides used in the fusion protein formed include the following peptides:
FLAG (Hopp et al., (1988)
6xHis, 10xHis, consisting of 6 His (histidine) residues
Influenza hemagglutinin (HA),
Human c-myc fragment,
VSV-GP fragment,
p18 HIV fragment,
T7-tag,
HSV-tag,
E-tag,
SV40T antigen fragment,
lck tag,
a-tubulin fragment,
B-tag,
Protein C fragment,
GST (glutathione-S-transferase),
HA (influenza hemagglutinin),
Immunoglobulin constant region,
a-galactosidase, and
MBP (maltose binding protein).
本発明のポリペプチドは、適切なプロテアーゼを用いて産生される融合タンパク質を処理し、その後所望のポリペプチドを回収することによって得ることができる。ポリペプチドを精製するため、融合タンパク質は、融合タンパク質と結合するアフィニティークロマトグラフィーを用いて予め捕獲し、その後捕獲した融合タンパク質をプロテアーゼ処理することができる。プロテアーゼ処理を用いて、所望のポリペプチドはアフィニティークロマトグラフィーから分離され、高純度の所望のポリペプチドが回収される。 The polypeptide of the present invention can be obtained by treating a fusion protein produced using an appropriate protease and then recovering the desired polypeptide. To purify the polypeptide, the fusion protein can be pre-captured using affinity chromatography that binds to the fusion protein, and then the captured fusion protein can be protease treated. Using protease treatment, the desired polypeptide is separated from the affinity chromatography and the high purity desired polypeptide is recovered.
本発明のポリペプチドは改変ポリペプチドを含む。本発明において、「改変された」という用語は例えば、他の基質との結合を意味する。したがって、本発明において、本発明のポリペプチドはさらに細胞膜透過性物質のような他の基質を含みうる。他の基質は、例えばペプチド、脂質、糖類、および様々な天然または合成ポリマーのような、有機化合物を含む。本発明のポリペプチドは、ポリペプチドがEGFRに対するTTKキナーゼ活性を阻害する所望の活性を保持する限り、いかなる改変も有することができる。ある態様において、阻害ポリペプチドはTTKに結合するEGFRと直接的に競合しうる。改変はまた、本発明のポリペプチドにおいて付加機能を与えることができる。付加機能の例は、標的性、輸送性、安定化を含む。 The polypeptides of the present invention include modified polypeptides. In the present invention, the term “modified” means, for example, binding to another substrate. Therefore, in the present invention, the polypeptide of the present invention may further contain another substrate such as a cell membrane permeable substance. Other substrates include organic compounds such as peptides, lipids, saccharides, and various natural or synthetic polymers. The polypeptides of the present invention can have any modification as long as the polypeptides retain the desired activity of inhibiting TTK kinase activity against EGFR. In certain embodiments, the inhibitory polypeptide may compete directly with EGFR that binds to TTK. Modifications can also provide additional functions in the polypeptides of the invention. Examples of additional functions include targeting, transportability, and stabilization.
本発明において、改変の好ましい例は、例えば細胞膜透過性物質の導入を含む。通常、細胞内構造は細胞膜によって外部から切り離される。したがって、効率的に細胞外基質を細胞内へ導入することが難しい。細胞膜透過性は細胞膜透過性物質を用いてポリペプチドを改変することによって本発明のポリペプチドに与えられる。その結果、細胞と本発明のポリペプチドを接触させることによって、ポリペプチドはそこで作用するために細胞内へ送達されることができる。 In the present invention, a preferable example of modification includes introduction of a cell membrane permeable substance, for example. Usually, intracellular structures are separated from the outside by cell membranes. Therefore, it is difficult to efficiently introduce the extracellular matrix into the cell. Cell membrane permeability is imparted to the polypeptides of the present invention by modifying the polypeptide with a cell membrane permeable substance. As a result, by contacting a cell with a polypeptide of the invention, the polypeptide can be delivered into the cell to act there.
「細胞膜透過性物質」とは、細胞質へ入るために哺乳動物細胞膜を透過することができる基質を言う。例えば、特定のリポソームは、細胞内に内容物を放出するため、細胞膜と融合する。一方、ポリペプチドの特定の型は、細胞内に入るため、哺乳動物細胞の細胞質膜を透過する。そのような細胞に入っていく活性を有するポリペプチドに対して、本発明において細胞質膜およびそのようなものは基質として好ましい。特に、本発明は以下の一般式を有するポリペプチドを含む。
[R]-[D];
[R]は細胞膜透過性物質を表す;[D]はISSILEKGERLPQPPICTI (SEQ ID NO: 44)またはDVYMIMVKCWMIDADSRPK (SEQ ID NO: 45)またはFRELIIEFSKMARDPQRYL (SEQ ID NO: 46)を含む断片配列を表す。上記一般式において、[R]および[D]はリンカーによって直接的または間接的に連結されることができる。ペプチド、複数の官能基を有する化合物、またはその他はリンカーとして用いられることができる。特に、-GGG-を含むアミノ酸配列はリンカーとして使用されることができる。あるいは、細胞膜透過性物質および選択された配列を含むポリペプチドは、微粒子の表面に結合することができる。[R]は[D]のいずれの位置でも連結することができる。特に、[R]は[D]のN末端またはC末端、あるいは[D]を構成するアミノ酸側鎖に連結されることができる。さらにまた、1つ以上の[R]分子は[D]の1分子に連結されることができる。[R]分子は[D]分子上の異なる位置に導入することができる。あるいは、[D]は同時に連結される多くの[R]を用いて改変することができる。
“Cell membrane permeable substance” refers to a substrate that can permeate mammalian cell membranes to enter the cytoplasm. For example, certain liposomes fuse with the cell membrane to release the contents into the cell. On the other hand, certain types of polypeptides penetrate into the cytoplasmic membrane of mammalian cells as they enter the cell. In contrast to the polypeptide having the activity of entering such cells, the cytoplasmic membrane and the like are preferred as a substrate in the present invention. In particular, the present invention includes polypeptides having the general formula:
[R]-[D];
[R] represents a cell membrane permeable substance; [D] represents a fragment sequence containing ISSILEKGERLPQPPICTI (SEQ ID NO: 44) or DVYMIMVKCWMIDADSRPK (SEQ ID NO: 45) or FRELIIEFSKMARDPQRYL (SEQ ID NO: 46). In the above general formula, [R] and [D] can be directly or indirectly linked by a linker. Peptides, compounds with multiple functional groups, or others can be used as linkers. In particular, an amino acid sequence comprising -GGG- can be used as a linker. Alternatively, a cell membrane permeable substance and a polypeptide comprising a selected sequence can be bound to the surface of the microparticle. [R] can be linked at any position of [D]. In particular, [R] can be linked to the N-terminal or C-terminal of [D], or to the amino acid side chain constituting [D]. Furthermore, one or more [R] molecules can be linked to one molecule of [D]. [R] molecules can be introduced at different positions on the [D] molecule. Alternatively, [D] can be modified with many [R] s linked together.
例えば、細胞膜透過性を有する、天然に生じた、または人工的に合成された様々なポリペプチドが報告されている(Joliot A. & Prochiantz A., Nat Cell Biol. 2004; 6: 189-96)。これら公知の細胞膜透過性物質の全ては、本発明においてポリペプチドを改変するために用いられることができる。本発明において、例えば、以下の群から選択されるいかなる基質も、上述の細胞透過性基質として用いられることができる:
[ポリアルギニン]; Matsushita et al., (2003) J. Neurosci.; 21, 6000-7.
[Tat / RKKRRQRRR] (SEQ ID NO: 47) Frankel et al., (1988) Cell 55,1189-93.
Green & Loewenstein (1988) Cell 55, 1179-88.
[ペネトラチン / RQIKIWFQNRRMKWKK] (SEQ ID NO: 48)
Derossi et al., (1994) J. Biol. Chem. 269, 10444-50.
[Buforin II / TRSSRAGLQFPVGRVHRLLRK] (SEQ ID NO: 49)
Park et al., (2000) Proc. Natl Acad. Sci. USA 97, 8245-50.
[トランスポータン / GWTLNSAGYLLGKINLKALAALAKKIL] (SEQ ID NO: 50)
Pooga et al., (1998) FASEB J. 12, 67-77.
[MAP (モデル両親媒性ペプチド) / KLALKLALKALKAALKLA] (SEQ ID NO: 51)
Oehlke et al., (1998) Biochim. Biophys. Acta. 1414, 127-39.
[K-FGF / AAVALLPAVLLALLAP] (SEQ ID NO: 52)
Lin et al., (1995) J. Biol. Chem. 270, 14255-8.
[Ku70 / VPMLK] (SEQ ID NO: 53)
Sawada et al., (2003) Nature Cell Biol. 5, 352-7.
[Ku70 / PMLKE] (SEQ ID NO: 61)
Sawada et al., (2003) Nature Cell Biol. 5, 352-7.
[プリオン / MANLGYWLLALFVTMWTDVGLCKKRPKP] (SEQ ID NO: 54)
Lundberg et al., (2002) Biochem. Biophys. Res. Commun. 299, 85-90.
[pVEC / LLIILRRRIRKQAHAHSK] (SEQ ID NO: 55)
Elmquist et al., (2001) Exp. Cell Res. 269, 237-44.
[Pep-1 / KETWWETWWTEWSQPKKKRKV] (SEQ ID NO: 56)
Morris et al., (2001) Nature Biotechnol. 19, 1173-6.
[SynB1 / RGGRLSYSRRRFSTSTGR] (SEQ ID NO: 57)
Rousselle et al., (2000) Mol. Pharmacol. 57, 679-86.
[Pep-7 / SDLWEMMMVSLACQY] (SEQ ID NO: 58)
Gao et al., (2002) Bioorg. Med. Chem. 10, 4057-65.
[HN-1 / TSPLNIHNGQKL] (SEQ ID NO:59)
Hong & Clayman (2000) Cancer Res. 60, 6551-6.
For example, a variety of naturally occurring or artificially synthesized polypeptides with cell membrane permeability have been reported (Joliot A. & Prochiantz A., Nat Cell Biol. 2004; 6: 189-96) . All of these known cell membrane permeable substances can be used to modify polypeptides in the present invention. In the present invention, for example, any substrate selected from the following group can be used as the cell-permeable substrate described above:
[Polyarginine]; Matsushita et al., (2003) J. Neurosci .; 21, 6000-7.
[Tat / RKKRRQRRR] (SEQ ID NO: 47) Frankel et al., (1988) Cell 55, 1189-93.
Green & Loewenstein (1988) Cell 55, 1179-88.
[Penetratin / RQIKIWFQNRRMKWKK] (SEQ ID NO: 48)
Derossi et al., (1994) J. Biol. Chem. 269, 10444-50.
[Buforin II / TRSSRAGLQFPVGRVHRLLRK] (SEQ ID NO: 49)
Park et al., (2000) Proc. Natl Acad. Sci. USA 97, 8245-50.
[Transport / GWTLNSAGYLLGKINLKALAALAKKIL] (SEQ ID NO: 50)
Pooga et al., (1998) FASEB J. 12, 67-77.
[MAP (Model Amphipathic Peptide) / KLALKLALKALKAALKLA] (SEQ ID NO: 51)
Oehlke et al., (1998) Biochim. Biophys. Acta. 1414, 127-39.
[K-FGF / AAVALLPAVLLALLAP] (SEQ ID NO: 52)
Lin et al., (1995) J. Biol. Chem. 270, 14255-8.
[Ku70 / VPMLK] (SEQ ID NO: 53)
Sawada et al., (2003) Nature Cell Biol. 5, 352-7.
[Ku70 / PMLKE] (SEQ ID NO: 61)
Sawada et al., (2003) Nature Cell Biol. 5, 352-7.
[PRION / MANLGYWLLALFVTMWTDVGLCKKRPKP] (SEQ ID NO: 54)
Lundberg et al., (2002) Biochem. Biophys. Res. Commun. 299, 85-90.
[pVEC / LLIILRRRIRKQAHAHSK] (SEQ ID NO: 55)
Elmquist et al., (2001) Exp. Cell Res. 269, 237-44.
[Pep-1 / KETWWETWWTEWSQPKKKRKV] (SEQ ID NO: 56)
Morris et al., (2001) Nature Biotechnol. 19, 1173-6.
[SynB1 / RGGRLSYSRRRFSTSTGR] (SEQ ID NO: 57)
Rousselle et al., (2000) Mol. Pharmacol. 57, 679-86.
[Pep-7 / SDLWEMMMVSLACQY] (SEQ ID NO: 58)
Gao et al., (2002) Bioorg. Med. Chem. 10, 4057-65.
[HN-1 / TSPLNIHNGQKL] (SEQ ID NO: 59)
Hong & Clayman (2000) Cancer Res. 60, 6551-6.
本発明において、細胞膜透過性物質の例として上でリストされたポリアルギニンは、あらゆる数のアルギニン残基によって構成される。特に、例えば連続的な5-20アルギニン残基によって構成される。アルギニン残基の好ましい数は11である(SEQ ID NO: 60)。 In the present invention, the polyarginine listed above as an example of a cell membrane permeable substance is composed of any number of arginine residues. In particular, it is constituted, for example, by consecutive 5-20 arginine residues. The preferred number of arginine residues is 11 (SEQ ID NO: 60).
ISSILEKGERLPQPPICTI (SEQ ID NO: 44) または DVYMIMVKCWMIDADSRPK (SEQ ID NO: 45) または FRELIIEFSKMARDPQRYL (SEQ ID NO: 46)を含む医薬品組成物
本発明のポリペプチドは肺癌細胞の増殖を阻害する。したがって、本発明は、ISSILEKGERLPQPPICTI (SEQ ID NO: 44) または DVYMIMVKCWMIDADSRPK (SEQ ID NO: 45) または FRELIIEFSKMARDPQRYL (SEQ ID NO: 46)を含むポリペプチド、あるいはそれらをコードするポリヌクレオチドを活性成分として含む、癌の治療薬および/または予防薬を提供する。あるいは、本発明は、本発明のポリペプチドを投与する工程を含む肺癌治療方法および/または予防方法に関する。さらにまた、本発明は肺癌を治療および/または予防する医薬品組成物の製造における本発明のポリペプチドの使用に関する。さらに、本発明はまた、肺癌治療および/または予防のためのISSILEKGERLPQPPICTI (SEQ ID NO: 44)またはDVYMIMVKCWMIDADSRPK (SEQ ID NO: 45)または FRELIIEFSKMARDPQRYL (SEQ ID NO: 46)を含むペプチドから選択されるポリペプチドに関する。
Pharmaceutical composition comprising ISSILEKGERLPQPPICTI (SEQ ID NO: 44) or DVYMIMVKCWMIDADSRPK (SEQ ID NO: 45) or FRELIIEFSKMARDPQRYL (SEQ ID NO: 46) The polypeptide of the present invention inhibits the growth of lung cancer cells. Therefore, the present invention comprises, as an active ingredient, a polypeptide comprising ISSILEKGERLPQPPICTI (SEQ ID NO: 44) or DVYMIMVKCWMIDADSRPK (SEQ ID NO: 45) or FRELIIEFSKMARDPQRYL (SEQ ID NO: 46), or a polynucleotide encoding them. Provide therapeutic and / or prophylactic drugs for cancer. Alternatively, the present invention relates to a method for treating and / or preventing lung cancer comprising the step of administering the polypeptide of the present invention. Furthermore, the present invention relates to the use of a polypeptide of the present invention in the manufacture of a pharmaceutical composition for treating and / or preventing lung cancer. Furthermore, the present invention also provides a polys selected from peptides comprising ISSILEKGERLPQPPICTI (SEQ ID NO: 44) or DVYMIMVKCWMIDADSRPK (SEQ ID NO: 45) or FRELIIEFSKMARDPQRYL (SEQ ID NO: 46) for the treatment and / or prevention of lung cancer. Relates to peptides.
あるいは、本発明の阻害ポリペプチドは癌細胞のアポトーシスを誘導するために用いられることができる。したがって、本発明は、ISSILEKGERLPQPPICTI (SEQ ID NO: 44) または DVYMIMVKCWMIDADSRPK (SEQ ID NO: 45) または FRELIIEFSKMARDPQRYL (SEQ ID NO: 46)を含むポリペプチド、ならびにそれらをコードするポリヌクレオチドを活性成分として含む、細胞のアポトーシス誘導剤を提供する。本発明のアポトーシス誘導剤は癌のような細胞増殖性疾患を治療するために用いられることができる。あるいは、本発明は、本発明のポリペプチドを投与する工程を含む細胞のアポトーシス誘導方法に関する。さらに、本発明は、細胞においてアポトーシスを誘導する医薬品組成物を製造することにおける、本発明のポリペプチドの使用に関する。 Alternatively, the inhibitory polypeptides of the present invention can be used to induce apoptosis of cancer cells. Accordingly, the present invention comprises a polypeptide comprising ISSILEKGERLPQPPICTI (SEQ ID NO: 44) or DVYMIMVKCWMIDADSRPK (SEQ ID NO: 45) or FRELIIEFSKMARDPQRYL (SEQ ID NO: 46) as well as a polynucleotide encoding them as active ingredients. An agent for inducing apoptosis of cells is provided. The apoptosis inducer of the present invention can be used to treat cell proliferative diseases such as cancer. Alternatively, the present invention relates to a method for inducing apoptosis of cells comprising the step of administering the polypeptide of the present invention. Furthermore, the present invention relates to the use of a polypeptide of the present invention in the manufacture of a pharmaceutical composition that induces apoptosis in cells.
本発明の阻害ポリペプチドは肺癌のようなTTK発現細胞においてアポトーシスを誘導する。一方、TTK発現はほとんどの正常器官において観察されていない。ある正常器官において、TTK発現レベルは肺癌組織と比較して相対的に低い。したがって、本発明のポリペプチドは肺癌細胞において、特にアポトーシスを誘導することができる。 The inhibitory polypeptides of the present invention induce apoptosis in TTK expressing cells such as lung cancer. On the other hand, TTK expression has not been observed in most normal organs. In some normal organs, TTK expression levels are relatively low compared to lung cancer tissue. Therefore, the polypeptide of the present invention can induce apoptosis particularly in lung cancer cells.
肺癌治療または細胞におけるアポトーシス誘導のために、調製された医薬品としてヒトおよび他の哺乳動物、例えばマウス、ラット、モルモット、ウサギ、ネコ、イヌ、ヒツジ、ブタ、ウシ、サル、ヒヒおよびチンパンジーに本発明のポリペプチドが投与される場合、単離された化合物は直接投与、または医薬品を調製する公知の方法を用いて適切な剤形に調製することができる。例えば、必要に応じて、医薬品は糖衣錠、カプセル、エリキシルおよびマイクロカプセルとして経口投与、または水あるいは薬学的に許容される他のあらゆる液体との滅菌溶液または懸濁液の注射形態で、非経口的に投与されることができる。例えば、一般的に許容される医薬品製造のために必要な単位用量形態において、化合物は薬学的に許容される担体または培地、特に滅菌水、生理的食塩水、植物油、乳化剤、懸濁剤、表面活性物質、安定化剤、矯味剤、賦形剤、溶媒、防腐剤および結合剤と混合することができる。これらの製剤における活性成分の量に応じて、特定範囲内の適切な用量を決定することができる。 The present invention for human and other mammals such as mice, rats, guinea pigs, rabbits, cats, dogs, sheep, pigs, cows, monkeys, baboons and chimpanzees as prepared pharmaceuticals for lung cancer treatment or apoptosis induction in cells The isolated compound can be administered directly, or can be prepared into an appropriate dosage form using known methods for preparing pharmaceuticals. For example, if desired, the pharmaceutical may be administered parenterally in the form of sugar-coated tablets, capsules, elixirs and microcapsules orally in the form of sterile solutions or suspensions with water or any other pharmaceutically acceptable liquid. Can be administered. For example, in the unit dosage forms required for generally acceptable pharmaceutical manufacture, the compound may be a pharmaceutically acceptable carrier or medium, particularly sterile water, saline, vegetable oil, emulsifier, suspension, surface It can be mixed with active substances, stabilizers, flavoring agents, excipients, solvents, preservatives and binders. Depending on the amount of active ingredient in these formulations, a suitable dose within a specific range can be determined.
錠剤およびカプセルにおいて混合されることのできる添加剤の例は、例えばゼラチン、コーンスターチ、トラガカントゴムおよびアラビアゴムなどの結合剤、例えば結晶セルロースなどの培地、例えばコーンスターチ、ゼラチンおよびアルギン酸などの膨潤剤、例えばステアリン酸マグネシウムなどの潤滑油、例えばショ糖、ラクトースまたはサッカリンなどの甘味料、および例えばセイヨウハッカ、ウィンターグリーン油およびサクランボなどの矯味剤である。単位投与形態がカプセルである場合、油のような液体担体が上記成分においてさらに含まれることができる。注射用の滅菌混合液は、通常の医薬品の認識によれば、例えば注射用の蒸留水のような溶液を用いて調製することができる。 Examples of additives that can be mixed in tablets and capsules include binders such as gelatin, corn starch, gum tragacanth and gum arabic, mediums such as crystalline cellulose, eg swelling agents such as corn starch, gelatin and alginic acid, eg stearin Lubricating oils such as magnesium acid, sweeteners such as sucrose, lactose or saccharin, and flavoring agents such as mint, wintergreen oil and cherries. Where the unit dosage form is a capsule, a liquid carrier such as oil can be further included in the above ingredients. A sterile mixture for injection can be prepared, for example, using a solution such as distilled water for injection according to the recognition of ordinary pharmaceutical products.
生理的食塩水、ブドウ糖ならびにD-ソルビトール、D-マンノース、D-マンニトールおよび塩化ナトリウムのようなアジュバントを含む他の等張液が、注射用水性液剤として使用可能である。これらは、アルコール、特にエタノール;およびプロピレングリコールおよびポリエチレングリコールのような多価アルコール;ならびにポリソルベート80(商標)およびHCO-50のような非イオン性表面活性剤等の適切な可溶化剤と組み合わせて使用することができる。
Other isotonic solutions including physiological saline, glucose and adjuvants such as D-sorbitol, D-mannose, D-mannitol and sodium chloride can be used as aqueous solutions for injection. These in combination with suitable solubilizers such as alcohols, especially ethanol; and polyhydric alcohols such as propylene glycol and polyethylene glycol; and nonionic surfactants such as
ゴマ油またはダイズ油は、油性液体として使用することができ、それらは、可溶化剤として安息香酸ベンジルまたはベンジルアルコールと組み合わせて使用することもでき、それらはさらに、リン酸緩衝液および酢酸ナトリウム緩衝液のような緩衝液;塩酸プロカインのような鎮痛剤、ベンジルアルコールおよびフェノールのような安定化剤、ならびに抗酸化剤とともに製剤化してもよい。調整された注射剤は、適切なアンプル内に充填されてもよい。 Sesame oil or soybean oil can be used as an oily liquid, and they can also be used in combination with benzyl benzoate or benzyl alcohol as a solubilizer, and they can also be used in phosphate buffer and sodium acetate buffer. May be formulated with analgesics such as procaine hydrochloride, stabilizers such as benzyl alcohol and phenol, and antioxidants. The adjusted injection may be filled into a suitable ampoule.
当業者に公知の方法は、例えば動脈内、静脈内、または皮下注射によって、および同様に鼻腔内、経気管、筋肉内、または経口投与によって、患者に本発明の医薬品化合物を投与するために用いられることができる。用量および投与方法は、投与方法と同じく患者の体重および年齢に応じて変化する。しかし、当業者はそれらを日常的に選択することができる。本発明のポリペプチドをコードしているDNAは、遺伝子治療のためのベクターに挿入することができ、そのベクターは治療のために投与することができる。用量および投与方法は患者の体重、年齢および症状に応じて変化するが、当業者はそれらを適切に選択することができる。例えば、それらの活性を調節するため、本発明のポリペプチドに結合する化合物の用量は、正常成人(体重60kg)に経口投与する場合、症状に応じてわずかに変化はするが、1日約0.1mgから約100mg、好ましくは1日約1.0mgから約50mg、より好ましくは1日約1.0mgから約20mgである。 Methods known to those skilled in the art are used to administer a pharmaceutical compound of the invention to a patient, for example, by intraarterial, intravenous, or subcutaneous injection, and also by intranasal, transtracheal, intramuscular, or oral administration. Can be done. The dose and administration method vary depending on the weight and age of the patient, as in the administration method. However, those skilled in the art can select them on a daily basis. The DNA encoding the polypeptide of the present invention can be inserted into a vector for gene therapy, and the vector can be administered for therapy. The dose and method of administration vary depending on the patient's weight, age and symptoms, and those skilled in the art can select them appropriately. For example, the dose of a compound that binds to a polypeptide of the present invention to modulate their activity, when orally administered to a normal adult (body weight 60 kg), varies slightly depending on the symptoms, but is about 0.1 per day mg to about 100 mg, preferably about 1.0 mg to about 50 mg per day, more preferably about 1.0 mg to about 20 mg per day.
正常な成人(体重60kg)に注射剤形で化合物を非経口投与する場合、患者、標的器官、症状、および投与方法によって多少の差はあるが、1日あたり約0.01mgから約30mg、好ましくは1日あたり約0.1mgから20mg、より好ましくは1日あたり約0.1mgから約10mgの用量を静脈内注射することが好都合である。他の動物の場合も、適切な投与量は、体重60kgに変換することにより同様に算出可能である。 When administering a compound parenterally to a normal adult (body weight 60 kg) in an injection form, there are some differences depending on the patient, target organ, symptom, and administration method, but from about 0.01 mg to about 30 mg per day, preferably It is convenient to inject a dose of about 0.1 mg to 20 mg per day, more preferably about 0.1 mg to about 10 mg per day intravenously. In the case of other animals, an appropriate dose can be similarly calculated by converting to a body weight of 60 kg.
TTKまたはEGFRのsiRNA
TTKまたはEGFR遺伝子のsiRNAはTTKまたはEGFR遺伝子の発現レベルを低下させるために用いられることができる。例えば、TTKまたはEGFR遺伝子のsiRNAは肺癌の治療に有効である。特に、本発明のsiRNAは、対応するmRNAに結合し、それによってmRNAの分解を促進し、および/あるいはTTKまたはEGFR遺伝子によってコードされるタンパク質の発現を阻害し、それによってそのタンパク質の機能を阻害することによって作用することができる。
TTK or EGFR siRNA
TTK or EGFR gene siRNA can be used to reduce the expression level of TTK or EGFR gene. For example, siRNA of TTK or EGFR gene is effective for the treatment of lung cancer. In particular, the siRNA of the present invention binds to the corresponding mRNA, thereby promoting the degradation of the mRNA and / or inhibiting the expression of the protein encoded by the TTK or EGFR gene, thereby inhibiting the function of the protein Can act by doing.
「ポリヌクレオチド」および「オリゴヌクレオチド」という用語は、特に他を示したり意味しなければ、本明細書において、一般的に許容された一文字コードによって互換的に用いられる。用語は、1つまたは複数の核酸がエステル結合によって連結した核酸(ヌクレオチド)ポリマーに適用される。ポリヌクレオチドまたはオリゴヌクレオチドはDNA、RNAまたはそれらの組み合わせから成ることができる。 The terms “polynucleotide” and “oligonucleotide” are used interchangeably herein with a generally accepted single letter code unless otherwise indicated or implied. The term applies to nucleic acid (nucleotide) polymers in which one or more nucleic acids are linked by ester bonds. A polynucleotide or oligonucleotide can consist of DNA, RNA, or a combination thereof.
本明細書で用いられる「二本鎖分子」という用語は、標的遺伝子の発現を阻害する核酸分子を意味し、例えば低分子干渉RNA(siRNA;例えば二本鎖リボ核酸(dsRNA)または低分子ヘアピンRNA(shRNA)および低分子干渉DNA/RNA(siD/R-NA;例えばDNAとRNAの二本鎖キメラ(dsD/R-NA)またはDNAとRNAの低分子ヘアピン型キメラ(shD/R-NA))を含む。 As used herein, the term “double-stranded molecule” refers to a nucleic acid molecule that inhibits expression of a target gene, such as a small interfering RNA (siRNA; eg, a double-stranded ribonucleic acid (dsRNA) or a small hairpin. RNA (shRNA) and small interfering DNA / RNA (siD / R-NA; for example, DNA and RNA double-stranded chimera (dsD / R-NA) or DNA and RNA small hairpin chimera (shD / R-NA) ))including.
また、TTKまたはEGFR遺伝子に対するsiRNAはTTKまたはEGFR遺伝子の発現レベルを減少させるのに用いることができる。本明細書において、「siRNA」という用語は、標的mRNAの翻訳を妨げる二本鎖RNA分子を意味する。siRNAを細胞に導入する標準的な技術が用いられることができ、RNAから転写されるDNAを鋳型にする方法を含む。本発明の文脈において、siRNAはSEQ ID NO: 62 または 63に対するセンス核酸配列およびアンチセンス核酸配列から成る。siRNAは、例えばヘアピンのように、単鎖の転写物が標的遺伝子のセンスおよび相補的なアンチセンス配列の両方を有するように構築される。siRNAはdsRNAまたはshRNAでもよい。 In addition, siRNA against TTK or EGFR gene can be used to decrease the expression level of TTK or EGFR gene. As used herein, the term “siRNA” means a double-stranded RNA molecule that prevents translation of a target mRNA. Standard techniques for introducing siRNA into cells can be used, including methods using DNA transcribed from RNA as a template. In the context of the present invention, the siRNA consists of a sense nucleic acid sequence and an antisense nucleic acid sequence for SEQ ID NO: 62 or 63. siRNAs are constructed such that, for example, a hairpin, a single stranded transcript has both the sense and complementary antisense sequences of the target gene. The siRNA may be dsRNA or shRNA.
本明細書で用いられる「dsRNA」という用語は、互いに相補的な配列を含み、相補的な配列を介して共にアニールして二本鎖RNA分子を形成するRNA二分子の構成物を意味する。二本鎖のヌクレオチド配列は、標的遺伝子配列のタンパク質コード配列から選択される「センス」または「アンチセンス」RNAのみでなく、標的遺伝子の非コード領域から選択されるヌクレオチド配列を有するRNA分子を含んでもよい。 As used herein, the term “dsRNA” refers to an RNA bimolecular construct that includes sequences that are complementary to each other and anneal together through complementary sequences to form a double-stranded RNA molecule. Double-stranded nucleotide sequences include RNA molecules having nucleotide sequences selected from non-coding regions of the target gene as well as “sense” or “antisense” RNA selected from the protein coding sequence of the target gene sequence. But you can.
本明細書で用いられる「shRNA」という用語は、互いに相補的な第1および第2領域、すなわち、センスおよびアンチセンス鎖を含むステムループ構造を有するsiRNAを意味する。領域の相補性と配向性の程度は、領域間で塩基が対を形成するのに十分であり、第一領域と第二領域はループ領域によって連結され、ループはループ領域内のヌクレオチド(またはヌクレオチド類似体)間の塩基対形成の欠如をもたらす。shRNAのループ領域は、センス鎖とアンチセンス鎖との間に介在する一本鎖領域であり、「介在一本鎖」とも表記され得る。 As used herein, the term “shRNA” refers to a siRNA having first and second regions complementary to each other, ie, a stem-loop structure comprising sense and antisense strands. The degree of complementarity and orientation of the regions is sufficient for bases to pair between the regions, the first region and the second region are joined by a loop region, and the loop is a nucleotide (or nucleotide in the loop region) Resulting in a lack of base pairing between the analogues). The loop region of shRNA is a single-stranded region interposed between the sense strand and the antisense strand, and can also be referred to as “intervening single strand”.
本明細書で用いられる「siD/R-NA」という用語は、RNAとDNAの両方から構成され、RNAとDNAとのハイブリッドおよびキメラを含み、標的mRNAの翻訳を妨げる二本鎖ポリヌクレオチド分子を意味する。本明細書において、ハイブリッドは、DNAから成るポリヌクレオチドとRNAから成るポリヌクレオチドとが互いにハイブリダイズして二本鎖分子を形成している分子を示し、一方、キメラは、二本鎖分子を構成する鎖の一方または両方がRNAおよびDNAを含むことを示す。細胞内にsiD/R-NAを導入する標準的な技術が使用される。siD/R-NA は、TTKまたはEGFRセンス核酸配列(「センス鎖」とも表記される)、TTKまたはEGFRアンチセンス核酸配列(「アンチセンス鎖」とも表記される)またはその両方を含む。siD/R-NAは、単一の転写産物が、標的配列のセンス核酸配列と相補的アンチセンス核酸配列の両方を有するように、例えばヘアピンのように構築されてもよい。siD/R-NAは、dsD/R-NAまたはshD/R-NAのいずれかであってもよい。 As used herein, the term “siD / R-NA” refers to a double-stranded polynucleotide molecule composed of both RNA and DNA, including RNA and DNA hybrids and chimeras, which prevents translation of the target mRNA. means. In this specification, a hybrid refers to a molecule in which a polynucleotide comprising DNA and a polynucleotide comprising RNA are hybridized to each other to form a double-stranded molecule, while a chimera constitutes a double-stranded molecule. Indicates that one or both of the strands comprising RNA and DNA. Standard techniques for introducing siD / R-NA into cells are used. siD / R-NA comprises a TTK or EGFR sense nucleic acid sequence (also referred to as “sense strand”), a TTK or EGFR antisense nucleic acid sequence (also referred to as “antisense strand”) or both. siD / R-NA may be constructed, for example, as a hairpin, such that a single transcript has both the sense and complementary antisense nucleic acid sequences of the target sequence. siD / R-NA may be either dsD / R-NA or shD / R-NA.
本明細書で用いられる「dsD/R-NA」という用語は、互いに相補的配列を含み、相補的な配列を介して共にアニールして二本鎖ポリヌクレオチド分子を形成している二分子の構成物を意味する。二本鎖のヌクレオチド配列は、標的遺伝子配列のタンパク質コード配列から選択される「センス」または「アンチセンス」ポリヌクレオチド配列のみでなく、標的遺伝子の非コード領域から選択されるヌクレオチド配列を有するポリヌクレオチドを含んでもよい。dsD/R-NAを構成する二分子の一方または両方は、RNAとDNAの両方から構成されるか(キメラ分子)、あるいは、一方の分子がRNAで構成され、他方がDNAで構成される(ハイブリッド二本鎖)。 As used herein, the term “dsD / R-NA” is a bimolecular arrangement that includes sequences complementary to each other and anneals together through complementary sequences to form a double-stranded polynucleotide molecule. Means a thing. A double-stranded nucleotide sequence is a polynucleotide having a nucleotide sequence selected from a non-coding region of the target gene as well as a “sense” or “antisense” polynucleotide sequence selected from the protein coding sequence of the target gene sequence May be included. Either or both of the dsD / R-NA molecules are composed of both RNA and DNA (chimeric molecules), or one molecule is composed of RNA and the other is composed of DNA ( Hybrid duplex).
本明細書で用いられる「shD/R-NA」という用語は、ステムループ構造を有するsiD/R-NAを意味し、互いに相補的な第1および第2領域、すなわちセンス鎖およびアンチセンス鎖を含む。領域の相補性と配向性の程度は、領域間で塩基が対を形成するのに十分であり、第一領域と第二領域はループ領域によって連結され、ループはループ領域内のヌクレオチド(またはヌクレオチド類似体)間の塩基対形成の欠如をもたらす。shD/R-NAのループ領域は、センス鎖とアンチセンス鎖との間に介在する一本鎖領域であり、「介在一本鎖」とも表記され得る。 As used herein, the term `` shD / R-NA '' refers to siD / R-NA having a stem-loop structure, and includes first and second regions complementary to each other, i.e., a sense strand and an antisense strand. Including. The degree of complementarity and orientation of the regions is sufficient for bases to pair between the regions, the first region and the second region are joined by a loop region, and the loop is a nucleotide (or nucleotide in the loop region) Resulting in a lack of base pairing between the analogues). The loop region of shD / R-NA is a single-stranded region interposed between the sense strand and the antisense strand, and may also be referred to as “intervening single strand”.
本発明の二本鎖分子は、1つまたは複数の修飾ヌクレオチドおよび/または非リン酸ジエステル結合を含んでもよい。当技術分野で周知の化学修飾は、二本鎖分子の安定性、有効性および/または細胞への取り込みを向上させることができる。当業者は、本分子に組み込むことができる他のタイプの化学修飾を理解するであろう(WO03/070744; WO2005/045037)。一実施態様では、修飾は、分解に対する耐性または取り込みを向上させるのに利用することができる。そのような修飾の例としては、ホスホロチオエート結合、2’-O-メチル-4’結合リボヌクレオチド、2’-O-メチルリボヌクレオチド(特に二本鎖分子のセンス鎖におけるもの)、2’-デオキシ-フルオロリボヌクレオチド、2’-デオキシリボヌクレオチド、「ユニバーサル塩基」ヌクレオチド、5’-C- メチルヌクレオチド、および逆位デオキシ脱塩基残基の取り込み(inverted deoxyabasic residue incorporation)を含む(US20060122137)。 The double-stranded molecule of the present invention may comprise one or more modified nucleotides and / or non-phosphodiester bonds. Chemical modifications well known in the art can improve the stability, effectiveness and / or cellular uptake of double-stranded molecules. One skilled in the art will appreciate other types of chemical modifications that can be incorporated into the molecule (WO03 / 070744; WO2005 / 045037). In one embodiment, the modifications can be utilized to improve resistance to degradation or uptake. Examples of such modifications include phosphorothioate linkages, 2'-O-methyl-4 'linked ribonucleotides, 2'-O-methyl ribonucleotides (especially in the sense strand of double-stranded molecules), 2'-deoxy -Includes fluororibonucleotides, 2'-deoxyribonucleotides, "universal base" nucleotides, 5'-C-methyl nucleotides, and inverted deoxyabasic residue incorporation (US20060122137).
他の実施態様では、修飾は、二本鎖分子の安定性の向上またはターゲッティング効率を向上させるために用いることができる。修飾は、二本鎖分子の二本の相補鎖間の化学的架橋結合、二本鎖分子鎖の1つの鎖の3’または5’末端の化学修飾、糖修飾、核酸塩基修飾および/または骨格修飾、2-フルオロ修飾リボヌクレオチドおよび2’-デオキシリボヌクレオチドを含む(WO2004/029212)。他の実施態様では、修飾は、標的mRNAおよび/または相補的な二本鎖分子鎖において、相補的なヌクレオチドに対する親和性を増大または減少させるのに用いることができる(WO2005/044976)。例えば、非修飾ピリミジンヌクレオチドは、2-チオ、5-アルキニル、5-メチル、または5-プロピニルピリミジンと置換され得る。さらに、非修飾プリンは、7-デアザ、7-アルキルまたは7-アルケニルプリンに置換され得る。他の実施態様では、二本鎖分子が3’ オーバーハングを有する二本鎖分子である場合、3’-末端ヌクレオチドオーバーハンギングヌクレオチドは、デオキシリボヌクレオチドにより置換され得る(Elbashir SM et al., Genes Dev 2001 Jan 15, 15(2): 188-200)。さらなる詳細については、US20060234970のような公開文書が利用可能である。本発明は、これらの実施例に限定されず、結果として生じる分子が標的遺伝子の発現を阻害する能力を保持する限り、本発明の二本鎖分子に対して、如何なる公知の化学修飾も行い得る。
In other embodiments, the modifications can be used to improve the stability or targeting efficiency of the double-stranded molecule. Modifications include chemical cross-linking between two complementary strands of a double-stranded molecule, chemical modification of the 3 ′ or 5 ′ end of one strand of a double-stranded molecular strand, sugar modification, nucleobase modification and / or backbone Includes modified, 2-fluoro modified ribonucleotides and 2'-deoxy ribonucleotides (WO2004 / 029212). In other embodiments, the modifications can be used to increase or decrease the affinity for complementary nucleotides in the target mRNA and / or complementary double-stranded molecular strand (WO2005 / 044976). For example, unmodified pyrimidine nucleotides can be replaced with 2-thio, 5-alkynyl, 5-methyl, or 5-propynyl pyrimidine. Furthermore, unmodified purines can be substituted with 7-deaza, 7-alkyl or 7-alkenylpurines. In other embodiments, when the double-stranded molecule is a double-stranded molecule with a 3 ′ overhang, the 3′-terminal nucleotide overhanging nucleotide can be replaced by deoxyribonucleotides (Elbashir SM et al., Genes Dev 2001
さらに、本発明の二本鎖分子は、DNAおよびRNAの双方を含んでもよく、例えばdsD/R-NAまたはshD/R-NAである。特に、DNA鎖とRNA鎖のハイブリッドポリヌクレオチドまたはDNA-RNAキメラポリヌクレオチドは、増大した安定性を示す。DNAとRNAとの混合、すなわち、DNA鎖(ポリヌクレオチド)とRNA鎖(ポリヌクレオチド)から成るハイブリッド型二本鎖分子、いずれかまたは両方の一本鎖(ポリヌクレオチド)においてDNAおよびRNA両方を含むキメラ型二本鎖分子または同種のものが、二本鎖分子の安定性を向上させるために形成されてもよい。DNA鎖とRNA鎖のハイブリッドは、標的遺伝子発現細胞に導入されたときに該遺伝子の発現を阻害する活性を有する限り、センス鎖がDNAでありアンチセンス鎖がRNAであるか、またはその逆のハイブリッドのいずれであってもよい。好ましくは、センス鎖ポリヌクレオチドがDNAであり、アンチセンス鎖ポリヌクレオチドがRNAである。同様に、標的遺伝子発現細胞に導入されたときに当該遺伝子の発現を阻害する活性を有する限り、キメラ型二本鎖分子は、センス鎖とアンチセンス鎖の双方がDNAとRNAから構成されるか、またはセンス鎖とアンチセンス鎖のいずれか一方がDNAとRNAから構成されるか、いずれであってもよい。 Furthermore, the double-stranded molecule of the present invention may include both DNA and RNA, such as dsD / R-NA or shD / R-NA. In particular, DNA strand and RNA strand hybrid polynucleotides or DNA-RNA chimeric polynucleotides exhibit increased stability. A mixture of DNA and RNA, ie a hybrid double-stranded molecule consisting of a DNA strand (polynucleotide) and an RNA strand (polynucleotide), including both DNA and RNA in one or both single strands (polynucleotide) Chimeric double-stranded molecules or the like may be formed to improve the stability of the double-stranded molecule. As long as the hybrid of DNA strand and RNA strand has an activity of inhibiting the expression of the gene when introduced into a target gene-expressing cell, the sense strand is DNA and the antisense strand is RNA, or vice versa. Any of hybrids may be used. Preferably, the sense strand polynucleotide is DNA and the antisense strand polynucleotide is RNA. Similarly, as long as it has an activity that inhibits the expression of the gene when introduced into the target gene-expressing cell, the chimeric double-stranded molecule is composed of DNA and RNA in both sense strand and antisense strand. Alternatively, either one of the sense strand and the antisense strand may be composed of DNA and RNA.
二本鎖分子の安定性を向上させるために、分子はできるだけ多くのDNAを含むことが好ましく、一方、標的遺伝子の発現阻害を誘導するためには、分子は、十分な発現阻害を誘導する範囲内のRMAであることを要求される。キメラ型二本鎖分子の好ましい例は、二本鎖分子の上流部分領域(すなわち、センス鎖またはアンチセンス鎖内の標的配列またはその相補配列に隣接する領域)がRNAである。好ましくは、上流部分領域はセンス鎖の5’側(5’末端)とアンチセンス鎖の3’側(3’末端)を指す。上流部分領域は好ましくは、二本鎖分子のセンス鎖またはアンチセンス鎖内の標的配列または相補的配列の終点から数えて9から13ヌクレオチドから成るドメインである。さらに、キメラ型二本鎖分子の好ましい例は、ポリヌクレオチドの少なくとも上流の半分の領域(センス鎖の5’側領域およびアンチセンス鎖の3’領域)がRNAで、もう一方の半分がDNAである、19から21ヌクレオチド鎖長を有するものを含む。そのようなキメラ型二本鎖分子において、標的遺伝子の発現を阻害する効果は、全アンチセンス鎖がRNAである場合に、非常に高い(US20050004064)。 In order to improve the stability of the double-stranded molecule, the molecule preferably contains as much DNA as possible, while in order to induce the inhibition of expression of the target gene, the molecule is in a range that induces sufficient expression inhibition. Is required to be within RMA. A preferred example of the chimeric double-stranded molecule is RNA in the upstream partial region of the double-stranded molecule (ie, the region adjacent to the target sequence or its complementary sequence in the sense strand or antisense strand). Preferably, the upstream partial region refers to the 5 'side (5' end) of the sense strand and the 3 'side (3' end) of the antisense strand. The upstream partial region is preferably a domain consisting of 9 to 13 nucleotides counting from the end of the target sequence or complementary sequence in the sense or antisense strand of the double-stranded molecule. In addition, a preferred example of a chimeric double-stranded molecule is that at least the upstream half region of the polynucleotide (the 5 ′ region of the sense strand and the 3 ′ region of the antisense strand) is RNA, and the other half is DNA. Including those having a length of 19 to 21 nucleotides. In such a chimeric double-stranded molecule, the effect of inhibiting the expression of the target gene is very high when the entire antisense strand is RNA (US20050004064).
本発明において、二本鎖分子はヘアピン構造を形成してもよい。例えば、ショートヘアピンRNA(shRNA)およびDNAとRNAから成る低分子ヘアピン型(shD/R-NA)である。shRNA またはshD/R-NAは、RNA干渉を介した遺伝子発現のサイレンシングのために用いることが可能な、堅固なヘアピンターンを生じるRNAまたはRNAとDNAの混合物の配列である。。shRNA またはshD/R-NAは、好ましくは一本鎖上にセンス標的配列とアンチセンス標的配列とを含み、それらの配列は、ループ配列によって分離されている。通常、ヘアピン構造は細胞機構により切断されdsRNAまたはdsD/R-NAとなり、その後、RNA誘導サイレシング複合体(RISC)に結合する。この複合体は、dsRNAまたはdsD/R-NAの標的配列とマッチするmRNAと結合し、かつ該mRNAを切断する。 In the present invention, the double-stranded molecule may form a hairpin structure. For example, short hairpin RNA (shRNA) and small hairpin type consisting of DNA and RNA (shD / R-NA). shRNA or shD / R-NA is a sequence of RNA or a mixture of RNA and DNA that produces a robust hairpin turn that can be used for silencing gene expression via RNA interference. . The shRNA or shD / R-NA preferably comprises a sense target sequence and an antisense target sequence on a single strand, the sequences being separated by a loop sequence. Usually, the hairpin structure is cleaved by cellular machinery to become dsRNA or dsD / R-NA and then binds to the RNA-induced silencing complex (RISC). This complex binds to and cleaves mRNA that matches the target sequence of dsRNA or dsD / R-NA.
他の態様において、ハロゲン化RNA、DNAと部分的に置換されたRNA、またはメチル化RNAは、siRNAに対するRNAアーゼ耐性を与えるために用いられることができる。RNAアーゼ耐性を与える核酸誘導体はまた、二本鎖RNAに含まれる。本発明において、二本鎖分子は、リボヌクレオチド、改変リボヌクレオチドまたはリボヌクレオチド誘導体から構成される二本鎖分子を含んでもよい。 In other embodiments, halogenated RNA, RNA partially substituted for DNA, or methylated RNA can be used to confer RNAase resistance to siRNA. Nucleic acid derivatives that confer RNAase resistance are also included in double-stranded RNA. In the present invention, the double-stranded molecule may include a double-stranded molecule composed of ribonucleotides, modified ribonucleotides or ribonucleotide derivatives.
TTKまたはEGFR遺伝子のsiRNAは、標的mRNAにハイブリダイズし、正常一本鎖mRNA転写物と結合することによってTTKまたはEGFR遺伝子にコードされるポリペプチドの産生を減少または阻害し、タンパク質の翻訳および発現を妨げる。本発明の文脈において、siRNAは好ましくは500、200、100、50または25ヌクレオチド以下の長さである。より好ましくは、siRNAは19-25ヌクレオチド長である。TTKまたはEGFRsiRNAの産生ための典型的な核酸配列は、標的配列としてSEQ ID NOs:63 または64のヌクレオチド配列を含む。siRNAの阻害活性を増大するため、1つまたは複数のウリジン(「u」)ヌクレオチドを標的配列のアンチセンス鎖の3’末端に付加することができる。「u」は少なくとも2つ、一般には2から10、好ましくは2から5で付加される。付加された「u」は、siRNAのアンチセンス鎖の3’末端で一本鎖を形成する。 TTK or EGFR gene siRNA hybridizes to the target mRNA and reduces or inhibits production of the polypeptide encoded by the TTK or EGFR gene by binding to normal single-stranded mRNA transcripts, and protein translation and expression Disturb. In the context of the present invention, the siRNA is preferably 500, 200, 100, 50 or 25 nucleotides or less in length. More preferably, the siRNA is 19-25 nucleotides long. Typical nucleic acid sequences for the production of TTK or EGFR siRNA comprise the nucleotide sequence of SEQ ID NOs: 63 or 64 as the target sequence. To increase the inhibitory activity of the siRNA, one or more uridine (“u”) nucleotides can be added to the 3 ′ end of the antisense strand of the target sequence. “U” is added in at least two, generally 2 to 10, preferably 2 to 5. The added “u” forms a single strand at the 3 ′ end of the antisense strand of the siRNA.
TTKまたはEGFR遺伝子のsiRNAはmRNA転写物に結合可能な形態で細胞に直接導入されることができる。あるいは、siRNAをコードするDNAはベクターで運搬されうる。 The siRNA of the TTK or EGFR gene can be directly introduced into the cell in a form that can bind to the mRNA transcript. Alternatively, DNA encoding siRNA can be carried in a vector.
ベクターは、例えば TTKまたはEGFR遺伝子標的配列を、両鎖の発現が(DNA分子の転写により)可能となるように、TTKまたはEGFR配列に隣接する機能的に連結された制御配列を有する発現ベクターにクローニングすることによって作製する(Lee, N.S., et al., (2002) Nature Biotechnology 20: 500-5)。TTKまたはEGFR遺伝子のmRNAに対するアンチセンスであるRNA分子は第1プロモーターによって転写され(例えばクローニングされたDNAの3’側のプロモーター配列)、TTKまたはEGFR遺伝子のmRNAに対するセンス鎖であるRNA分子は第2プロモーターによって転写される(例えばクローニングされたDNAの5’側のプロモーター配列)。センスおよびアンチセンス鎖は、インビボでハイブリダイズして、TTKまたはEGFR遺伝子のサイレシングのためのsiRNA構築物を産生する。あるいは、2つの構築物はsiRNA構築物のセンスおよびアンチセンス鎖を作製するために利用できる。クローニングされたTTKまたはEGFR遺伝子は二次構造、例えばヘアピン、を有する構築物をコードすることができ、単一の転写物は標的配列のセンスおよび相補的アンチセンス配列の両方を有する。 The vector can be, for example, a TTK or EGFR gene target sequence into an expression vector having a functionally linked control sequence adjacent to the TTK or EGFR sequence so that expression of both strands is possible (by transcription of the DNA molecule). It is produced by cloning (Lee, NS, et al., (2002) Nature Biotechnology 20: 500-5). RNA molecules that are antisense to the TTK or EGFR gene mRNA are transcribed by the first promoter (eg, the 3 ′ promoter sequence of the cloned DNA), and RNA molecules that are the sense strand for the TTK or EGFR gene mRNA are the first. Transcribed by two promoters (eg, 5 ′ promoter sequence of cloned DNA). The sense and antisense strands hybridize in vivo to produce an siRNA construct for silencing the TTK or EGFR gene. Alternatively, the two constructs can be utilized to create the sense and antisense strands of the siRNA construct. A cloned TTK or EGFR gene can encode a construct with secondary structure, such as a hairpin, and a single transcript has both the sense and complementary antisense sequences of the target sequence.
任意のヌクレオチド配列から成るループ配列はヘアピンループ構造を形成するためセンスおよびアンチセンス配列の間に位置することができる。したがって、本発明はまた、一般式5’-[A]-[B]-[A’]-3’ を有するsiRNA、ここで、
[A]はTTKまたはEGFR遺伝子配列に一致するリボヌクレオチド配列、
[B]は3から23ヌクレオチドから成るリボヌクレオチド配列、および
[A’]は[A]の相補的配列を有するリボヌクレオチド配列、を提供する。
領域[A]は[A’]にハイブリダイズし、その後領域[B]から成るループが形成される。
A loop sequence consisting of any nucleotide sequence can be positioned between the sense and antisense sequences to form a hairpin loop structure. Accordingly, the present invention also provides an siRNA having the
[A] is a ribonucleotide sequence that matches the TTK or EGFR gene sequence,
[B] is a ribonucleotide sequence consisting of 3 to 23 nucleotides, and
[A ′] provides a ribonucleotide sequence having the complementary sequence of [A].
Region [A] hybridizes to [A ′], after which a loop consisting of region [B] is formed.
ループ配列は3から23ヌクレオチド長であることが好ましい。ループ配列は、例えば、以下の配列からなる群から選択され得る(ambion.com/techlib/tb/tb_506.html、ワールドワイドウェブ上で見出される)。さらに、23ヌクレオチドから成るループ配列もまた、活性のあるsiRNAを提供する(Jacque, J. M., et al., (2002) Nature 418 : 435-8.)。 The loop sequence is preferably 3 to 23 nucleotides in length. The loop sequence can be selected, for example, from the group consisting of the following sequences (ambion.com/techlib/tb/tb_506.html, found on the World Wide Web). In addition, a loop sequence consisting of 23 nucleotides also provides active siRNA (Jacque, J. M., et al., (2002) Nature 418: 435-8.).
CCC, CCACC または CCACACC:Jacque, J. M, et al., (2002) Nature, Vol. 418: 435-8.
UUCG:Lee, N.S., et al., (2002) Nature Biotechnology 20: 500-5.; Fruscoloni, P., et al., (2003) Proc. Natl. Acad. Sci. USA 100(4): 1639-44.
UUCAAGAGA:Dykxhoorn, D. M., et al., (2003) Nature Reviews Molecular Cell Biology 4: 457-67.
CCC, CCACC or CCACACC: Jacque, JM, et al., (2002) Nature, Vol. 418: 435-8.
UUCG: Lee, NS, et al., (2002) Nature Biotechnology 20: 500-5 .; Fruscoloni, P., et al., (2003) Proc. Natl. Acad. Sci. USA 100 (4): 1639- 44.
UUCAAGAGA: Dykxhoorn, DM, et al., (2003) Nature Reviews Molecular Cell Biology 4: 457-67.
したがって、ある態様において、ループ配列はCCC、UUCG、CCACC、CCACACCおよび UUCAAGAGAから成る群から選択されることができる。好ましいループ配列はUUCAAGAGAである(DNAにおいては「ttcaagaga」)。本発明の文脈における使用に適した典型的なヘアピンsiRNAは以下を含む:
TTK-siRNAに対して;
AACAAGAUGUGUUAAAGUGUUUU-[b]-AAAACACUUUAACACAUCUUGUU(SEQ ID NO:62の標的配列に対して)
EGFR-siRNAに対して;
AAGUAACAAGCUCACGCAGUUUU-[b]-AAAACUGCGUGAGCUUGUUACUU(SEQ ID NO:63の標的配列に対して)
Thus, in certain embodiments, the loop sequence can be selected from the group consisting of CCC, UUCG, CCACC, CCACACC and UUCAAGAGA. A preferred loop sequence is UUCAAGAGA (“ttcaagaga” in DNA). Exemplary hairpin siRNAs suitable for use in the context of the present invention include:
For TTK-siRNA;
AACAAGAUGUGUUAAAGUGUUUU- [b] -AAAACACUUUAACACAUCUUGUU (to the target sequence of SEQ ID NO: 62)
For EGFR-siRNA;
AAGUAACAAGCUCACGCAGUUUU- [b] -AAAACUGCGUGAGCUUGUUACUU (for the target sequence of SEQ ID NO: 63)
適切なsiRNAのヌクレオチド配列はワールドワイドウェブ上のAmbionウェブサイトambion.com/techlib/misc/siRNA_finder.htmlから入手できる、siRNA設計コンピュータプログラムを用いて設計されることができる。コンピュータプログラムは、以下のプロトコルに基づいてsiRNA合成用のヌクレオチド配列を選択する。 Suitable siRNA nucleotide sequences can be designed using the siRNA design computer program available from the Ambion website on the World Wide Web at ambion.com/techlib/misc/siRNA_finder.html. The computer program selects nucleotide sequences for siRNA synthesis based on the following protocol.
TTKまたはEGFR遺伝子配列に隣接する制御配列はそれらの発現が独立して、または時間的もしくは空間的に調節され得るように、同一であるかまたは異なる。。siRNAはTTKまたはEGFR遺伝子テンプレートを、例えば核内低分子RNA(snRNA)U6またはヒトH1RNAプロモーターからのRNAポリメラーゼIII転写ユニットを含むベクターにそれぞれクローニングすることによって、細胞内に転写される。ベクターを細胞へ導入するため、トランスフェクション促進剤が使用されることができる。FuGENE (ロシュダイアグノティクス)、Lipofectamine 2000(インビトロジェン)、Oligofectamine (インビトロジェン)、およびNucleofector(和光純薬化学)はトランスフェクション促進剤として有効である。 The regulatory sequences adjacent to the TTK or EGFR gene sequences are the same or different so that their expression can be regulated independently or temporally or spatially. . The siRNA is transcribed into the cell by cloning the TTK or EGFR gene template into a vector containing an RNA polymerase III transcription unit, eg, from a nuclear small RNA (snRNA) U6 or human H1 RNA promoter, respectively. In order to introduce the vector into the cell, a transfection facilitating agent can be used. FuGENE (Roche Diagnostics), Lipofectamine 2000 (Invitrogen), Oligofectamine (Invitrogen), and Nucleofector (Wako Pure Chemical) are effective as transfection promoters.
本発明のsiRNAは本発明のポリペプチドの発現を阻害し、それにより本発明のポリペプチドの生物活性を抑制することに有効である。また、本発明のsiRNAを含む、発現阻害剤は、本発明のポリペプチドの生物活性を阻害することができる点において有効である。したがって、本発明の1つまたは複数のsiRNAから成る組成物は肺癌の治療に有効である。あるいは、本発明は、siRNAを含む阻害性の核酸、または肺癌の治療または予防用薬学的組成物の製造のための核酸を発現するベクターの使用を提供する。さらに、本発明はまた、siRNAを含む該阻害性核酸または肺癌治療または予防用核酸を発現するベクターを提供する。 The siRNA of the present invention is effective in inhibiting the expression of the polypeptide of the present invention and thereby suppressing the biological activity of the polypeptide of the present invention. Moreover, the expression inhibitor containing the siRNA of the present invention is effective in that it can inhibit the biological activity of the polypeptide of the present invention. Therefore, a composition comprising one or more siRNAs of the present invention is effective for the treatment of lung cancer. Alternatively, the present invention provides the use of an inhibitory nucleic acid comprising siRNA or a vector expressing the nucleic acid for the manufacture of a pharmaceutical composition for the treatment or prevention of lung cancer. Furthermore, the present invention also provides a vector for expressing the inhibitory nucleic acid containing siRNA or a nucleic acid for treating or preventing lung cancer.
肺癌の治療または予防方法
TTKまたはEGFRを過剰発現することを特徴とする腫瘍を有する患者は、それぞれTTKまたはEGFRのsiRNAを投与することにより治療される。siRNA療法は、肺癌に罹患している、または肺癌発生のリスクのある患者のTTKまたはEGFRの発現を阻害するために使用される。当該患者は特定の腫瘍型の標準的方法により同定される。肺癌細胞は、例えばCT、MRI、ERCP、MRCP、コンピュータ断層撮影、または超音波によって診断される。TTKまたはEGFRの発現における減少、あるいは対象における腫瘍のサイズ、罹患率、または転移能の減少のように、臨床的有用性を導くのであれば、治療は有効である。治療が予防的に適用される場合、「有効な」は、治療によって、腫瘍の形成が遅延するかもしくは妨げられる、または腫瘍の臨床症状が妨げられるかもしくは軽減されることを意味する。効用は、特定の腫瘍型の診断または治療のための任意の公知方法に関連して測定される。
Method for treating or preventing lung cancer
Patients with tumors characterized by over-expression of TTK or EGFR are treated by administering TTK or EGFR siRNA, respectively. siRNA therapy is used to inhibit TTK or EGFR expression in patients suffering from or at risk of developing lung cancer. The patient is identified by standard methods for a particular tumor type. Lung cancer cells are diagnosed by CT, MRI, ERCP, MRCP, computed tomography, or ultrasound, for example. Treatment is effective if it leads to clinical utility, such as a decrease in TTK or EGFR expression, or a decrease in tumor size, morbidity, or metastatic potential in a subject. “Effective” when the treatment is applied prophylactically means that the treatment delays or prevents the formation of the tumor or prevents or reduces the clinical symptoms of the tumor. Utility is measured in relation to any known method for diagnosis or treatment of a particular tumor type.
siRNA療法は本発明のsiRNAをコードする標準ベクター、および/または合成siRNA分子を送達する遺伝子送達システムにより、siRNAを患者へ投与することによって行われる。概して、合成siRNA分子はインビボでヌクレアーゼ分解を防ぐために化学的に安定化される。化学的に安定化したRNA分子の調製方法は、公知技術である。概して、当該分子はリボヌクレアーゼの作用を妨げるための改変骨格およびヌクレオチドを含む。例えば、コレステロール結合siRNAは薬理学的性質の改善を示したように、他の修飾もまた可能である(Song et al. Nature Med. 9:347-351 (2003))。 siRNA therapy is performed by administering siRNA to a patient via a standard vector encoding the siRNA of the invention and / or a gene delivery system that delivers a synthetic siRNA molecule. In general, synthetic siRNA molecules are chemically stabilized to prevent nuclease degradation in vivo. Methods for preparing chemically stabilized RNA molecules are well known in the art. In general, the molecule includes a modified backbone and nucleotides to prevent the action of ribonuclease. For example, other modifications are also possible, as cholesterol-binding siRNAs have shown improved pharmacological properties (Song et al. Nature Med. 9: 347-351 (2003)).
適切な遺伝子送達システムはリポソーム、受容体仲介送達システム、またはヘルペスウイルス、レトロウイルス、アデノウイルスおよびアデノ随伴ウイルスなどのウイルスベクターを含むことができる。治療用核酸組成物は薬学上許容される担体において調製される。治療組成物はまた、上記のような遺伝子送達システムを含むことができる。薬学上許容される担体は、例えば生理的食塩水のように、動物への投与に適した生物学的に適合性のある溶媒である。化合物の治療上の有効量は、治療動物におけるTTKまたはEGFR遺伝子産物の産生の減少、増殖のような細胞成長の減少、または腫瘍成長の減少といった、医薬的に望ましい結果をもたらすことができる量である。 Suitable gene delivery systems can include liposomes, receptor-mediated delivery systems, or viral vectors such as herpes viruses, retroviruses, adenoviruses and adeno-associated viruses. The therapeutic nucleic acid composition is prepared in a pharmaceutically acceptable carrier. The therapeutic composition can also include a gene delivery system as described above. A pharmaceutically acceptable carrier is a biologically compatible solvent suitable for administration to animals, such as physiological saline. A therapeutically effective amount of the compound is an amount that can produce a pharmaceutically desirable result, such as reduced production of a TTK or EGFR gene product in a treated animal, reduced cell growth such as proliferation, or reduced tumor growth. is there.
非経口的投与、例えば静脈、皮下、筋肉内および腹腔内送達ルート、はTTKまたはEGFRのsiRNA組成物を送達するために用いられることができる。肺癌治療のため、癌の組織または部位近くへの直接注入は有効である。 Parenteral administration, such as intravenous, subcutaneous, intramuscular and intraperitoneal delivery routes, can be used to deliver TTK or EGFR siRNA compositions. For the treatment of lung cancer, direct injection near the tissue or site of the cancer is effective.
患者への投与量は、患者のサイズ、体表面積、年齢、投与される特定の核酸、性別、時間および投与経路、全体の健康、および併用投与されている他の薬剤などを含む、多数の要因に依拠する。核酸の静脈注射用の投与量は、核酸分子約106から1022コピーである。 Patient dosage depends on a number of factors, including patient size, body surface area, age, the specific nucleic acid being administered, sex, time and route of administration, overall health, and other drugs being administered in combination Rely on. The dosage for intravenous injection of nucleic acid is about 106 to 1022 copies of the nucleic acid molecule.
筋肉または皮膚などの組織の間質腔への注射、血流または体腔への導入ならびに吸入またはガス注入などの標準的方法によって、ポリヌクレオチドは投与される。ポリヌクレオチドは薬学上許容される液体担体、例えば水性または部分的に水性である液体担体、を用いて動物に投与または送達される。ポリヌクレオチドはリポソームと関連している(例えば、カチオンまたはアニオンリポソーム)。ポリヌクレオチドは例えばプロモーターなどの、標的細胞による発現に必要な遺伝情報を含んでいる。 Polynucleotides are administered by standard methods such as injection into the interstitial space of tissues such as muscle or skin, introduction into the bloodstream or body cavity, and inhalation or gas infusion. A polynucleotide is administered or delivered to an animal using a pharmaceutically acceptable liquid carrier, such as an aqueous or partially aqueous liquid carrier. Polynucleotides are associated with liposomes (eg, cationic or anionic liposomes). A polynucleotide contains genetic information necessary for expression by a target cell, such as a promoter.
siRNAを含む医薬品組成物
したがって、本発明は肺癌の予防および治療のどちらかまたは両方に有効な薬物および方法を含む。これらの薬物および方法は、疾患細胞増殖の減弱または停止を達成するのに効果的な量で、TKK (SEQ ID NO: 62) または EGFR (SEQ ID NO: 63)の発現を阻害するsiRNAを含む。より詳細には、本明細書の文脈において、治療上の有効量は、治療を受けている対象の進行を予防する、あるいは既存の症状を軽減する有効量を意味する。
Pharmaceutical Compositions Comprising siRNA Accordingly, the present invention includes drugs and methods effective for either or both prevention and treatment of lung cancer. These drugs and methods include siRNA that inhibits expression of TKK (SEQ ID NO: 62) or EGFR (SEQ ID NO: 63) in an amount effective to achieve attenuation or arrest of disease cell proliferation . More specifically, in the context of the present specification, a therapeutically effective amount means an effective amount that prevents progression of a subject undergoing treatment or reduces existing symptoms.
本発明の方法を用いて治療される個体は、肺癌に罹患している任意の個体を含む。当該個体は、例えばヒト、イヌ、ネコ、ウマ、ウシ、またはヤギを含む哺乳動物のような脊椎動物、あるいは他の動物、特に商業的に重要な動物または家畜動物を含むことができる。 Individuals treated using the methods of the present invention include any individual suffering from lung cancer. Such individuals can include, for example, vertebrates such as mammals including humans, dogs, cats, horses, cows, or goats, or other animals, particularly commercially important animals or livestock animals.
本発明の文脈において、適切な薬学的製剤は、経口、直腸、鼻、局所(口腔および舌下を含む)、膣内または非経口的(筋肉内、皮下および静脈)投与、あるいは吸入またはガス注入による投与に適している薬学的製剤を含む。好ましくは、投与は静脈である。製剤は、適宜、容量単位別に封入する。 In the context of the present invention, suitable pharmaceutical formulations are oral, rectal, nasal, topical (including buccal and sublingual), vaginal or parenteral (intramuscular, subcutaneous and intravenous) administration, or inhalation or gas infusion. Including pharmaceutical formulations suitable for administration by. Preferably administration is intravenous. The preparation is appropriately enclosed by volume unit.
経口投与に適した製剤処方には、カプセル、カシェ剤、または錠剤が含まれ、それぞれ所定量の活性成分を含む。適切な製剤には、粉末剤、顆粒剤、液剤、懸濁剤および乳剤もまた含まれる。活性成分には、任意に、ボーラス、舐剤またはペースト剤として投与される。経口投与のための錠剤およびカプセルは、例えば、ラクトース、スクロース、マンニトール、またはソルビトールを含む糖類などの充填剤、例えば、トウモロコシデンプン、コムギデンプン、イネデンプン、ジャガイモデンプン、ゼラチン、トラガカントゴム、メチルセルロース、ヒドロキシプロピルメチルセルロース、カルボキシメチルセルロースナトリウム、および/またはポリビニルピロリドン(PVP)などのセルロース調製物、結合剤、潤滑剤、および/または加湿剤などの従来の添加剤を含んでもよい。所望であれば、架橋ポリビニルピロリドン、寒天、またはアルギン酸またはアルギン酸ナトリウムのようなそれらの塩などの崩壊剤を添加してもよい。 Pharmaceutical formulations suitable for oral administration include capsules, cachets or tablets, each containing a predetermined amount of active ingredient. Suitable formulations also include powders, granules, solutions, suspensions and emulsions. The active ingredient is optionally administered as a bolus, electuary or paste. Tablets and capsules for oral administration are, for example, fillers such as sugars including lactose, sucrose, mannitol or sorbitol, such as corn starch, wheat starch, rice starch, potato starch, gelatin, tragacanth gum, methylcellulose, hydroxypropylmethylcellulose Conventional additives such as cellulose preparations such as sodium carboxymethylcellulose, and / or polyvinylpyrrolidone (PVP), binders, lubricants, and / or humidifiers. If desired, disintegrating agents may be added, such as the cross-linked polyvinyl pyrrolidone, agar, or alginic acid or a salt thereof such as sodium alginate.
錠剤は、任意に1つまたは複数の製剤用成分とともに圧縮または成形することによって、製造されてもよい。圧縮錠剤は、粉末または顆粒のような易流動性形態の活性成分を、任意に、結合剤、潤滑剤、不活性希釈剤、潤滑剤、表面活性剤および/または分散剤と混合して、適切な機械の中で圧縮することによって、調整し得る。成形錠剤は、不活性な液体希釈剤で湿らせた粉末状化合物の混合物を、適切な機械の中で成形することにより、製造し得る。錠剤は、当技術分野において周知の方法に従って、コーティングしてもよい。経口用液体調製物は、例えば、水性または油性懸濁剤、液剤、乳剤、シロップ剤またはエリキシル剤のような形態でもよく、使用前に、水または他の適切な溶剤で構成するための乾燥製品として提供されてもよい。当該液体調製物は、懸濁剤、乳化剤、非水性溶剤(食用油を含み得る)、pH維持剤、および/または保存剤のような通常の添加剤を含んでもよい。錠剤は、その中の活性成分の徐放または制御放出を提供するように、任意に製剤化してもよい。錠剤のパッケージは、月毎に服用されるべき1つの錠剤を含んでもよい。 A tablet may be made by compression or molding, optionally with one or more pharmaceutical ingredients. Compressed tablets are suitable if the active ingredient in free-flowing form, such as powders or granules, is optionally mixed with a binder, lubricant, inert diluent, lubricant, surfactant and / or dispersant. Can be adjusted by compression in a simple machine. Molded tablets may be made by molding in a suitable machine a mixture of the powdered compound moistened with an inert liquid diluent. The tablets may be coated according to methods well known in the art. Oral liquid preparations may be in the form of, for example, aqueous or oily suspensions, solutions, emulsions, syrups or elixirs, and dry products for constitution with water or other suitable solvent prior to use. May be provided as The liquid preparation may contain conventional additives such as suspending agents, emulsifiers, non-aqueous solvents (which may include edible oils), pH maintainers, and / or preservatives. Tablets may optionally be formulated so as to provide sustained or controlled release of the active ingredient therein. The tablet package may contain one tablet to be taken monthly.
非経口投与に適した製剤には、任意に抗酸化剤、緩衝液、静菌剤、および対象とするレシピエントの血液と製剤を等張にする溶質を含み得る水性および非水性無菌注射剤、ならびに懸濁化剤および/または増粘剤を含む水性および非水性無菌懸濁剤が含まれる。製剤は、単位投与用容器または複数回投与用容器、例えば密閉されたアンプルおよびバイアルに入れて提供されてもよく、生理食塩水、注射用水のような無菌液体担体の使用直前の添加のみが必要なフリーズドライ(凍結乾燥)状態で保存されてもよい。あるいは、製剤は、持続注入用として提供されてもよい。即時注射用の液剤および懸濁剤は、先に述べた種類の無菌の粉末剤、顆粒剤および錠剤から調製してもよい。 Formulations suitable for parenteral administration optionally include anti-oxidants, buffers, bacteriostats, and aqueous and non-aqueous sterile injections that may include solutes that make the target recipient's blood and formulation isotonic, And aqueous and non-aqueous sterile suspensions including suspending agents and / or thickeners. Formulations may be provided in unit-dose containers or multi-dose containers such as sealed ampoules and vials, requiring only the addition of a sterile liquid carrier such as saline or water for injection just before use. May be stored in a freeze-dried state. Alternatively, the formulation may be provided for continuous infusion. Extemporaneous injection solutions and suspensions may be prepared from sterile powders, granules and tablets of the kind previously described.
直腸投与に適した製剤は、ココアバターまたはポリエチレングリコールのような標準的な担体を用いた坐薬が含まれる。口内、例えば口腔内または舌下に局所投与に適した製剤には、ショ糖およびアカシアまたはトラガカンタのような風味付き基剤中に活性成分を含む薬用キャンディー、ならびにゼラチンおよびグリセリン、またはショ糖およびアカシアのような基剤中に活性成分を含むトローチが含まれる。鼻腔内投与のためには、本発明の化合物の液体スプレー、分散性粉末剤または滴剤の形態が使用され得る。滴剤は、1種または複数種の分散剤、可溶化剤および/または懸濁剤をもまた含む水性または非水性基剤とともに製剤化してもよい。 Formulations suitable for rectal administration include suppositories with standard carriers such as cocoa butter or polyethylene glycol. Formulations suitable for topical administration in the mouth, eg buccal or sublingual, include sucrose and medicinal candy containing the active ingredient in a flavored base such as acacia or tragacanth, and gelatin and glycerin, or sucrose and acacia A lozenge containing the active ingredient in a base such as For intranasal administration, liquid sprays, dispersible powders or drops of the compounds of the invention may be used. Drops may be formulated with an aqueous or non-aqueous base which also contains one or more dispersants, solubilizers and / or suspending agents.
吸入による投与の場合、化合物は注入器、ネブライザ、加圧パックまたは他の便宜なエアロゾルスプレー送達方法から、簡便に送達される。加圧パックは、ジクロロジフルオロメタン、トリクロロフルオロメタン、ジクロロテトラフルオロエタン、二酸化炭素または他の適切なガスのような適切な噴霧剤を含み得る。加圧エアロゾルの場合には、投薬単位は一定量を送達するバルブを備えることによって、決定されてもよい。 For administration by inhalation, the compounds are conveniently delivered from an insufflator, nebulizer, pressurized pack or other convenient aerosol spray delivery method. The pressurized pack may contain a suitable propellant such as dichlorodifluoromethane, trichlorofluoromethane, dichlorotetrafluoroethane, carbon dioxide or other suitable gas. In the case of a pressurized aerosol, the dosage unit may be determined by providing a valve that delivers a fixed amount.
あるいは、吸入またはガス注入による投与の場合、化合物は、乾燥粉末組成物、例えば化合物と乳糖またはデンプンのような適切な粉末基剤との混合粉末の形態をとってもよい。粉末組成物は、単位剤形、例えば、カプセル、カートリッジ、ゼラチンまたはブリスターパックで提供されてもよく、粉末剤はそれらから、吸入器または注入器の補助により投与され得る。 Alternatively, for administration by inhalation or insufflation, the compound may take the form of a dry powder composition, for example a mixed powder of the compound and a suitable powder base such as lactose or starch. Powder compositions may be provided in unit dosage forms, such as capsules, cartridges, gelatin or blister packs, from which powders can be administered with the aid of an inhaler or insufflator.
他の製剤には、治療薬剤を放出する埋め込み装置および接着パッチが含まれる。 Other formulations include implantable devices and adhesive patches that release therapeutic agents.
必要に応じて、上記の製剤は、活性成分の持続的放出を与えるように適合され、使用されてもよい。薬学的組成物は、抗菌剤、免疫抑制剤および/または保存剤のような他の活性成分もまた含んでもよい。 If desired, the above formulations may be adapted and used to provide sustained release of the active ingredient. The pharmaceutical composition may also contain other active ingredients such as antibacterial agents, immunosuppressive agents and / or preservatives.
具体的に前述した成分に加えて、この発明の製剤は、該当する製剤のタイプを考慮して当従来技術で慣例的な他の薬剤を含み得ること、例えば、経口投与に適した製剤は矯味剤を含み得ることが、理解されるべきである。 In addition to the ingredients specifically mentioned above, the formulations of the present invention may contain other drugs customary in the prior art, taking into account the type of formulation concerned, for example formulations suitable for oral administration It should be understood that an agent may be included.
例えば、投与経路によって、投与される試験化合物の濃度によって、または治療がタンパク質、試験化合物をコードする核酸、もしくは試験化合物を分泌することができる細胞を活性成分として含む薬剤を用いるかどうかによって、特定の添加剤賦形剤が、より好ましい場合があることが当業者には明らかであろう。 For example, depending on the route of administration, depending on the concentration of the test compound administered, or whether the treatment uses a protein, a nucleic acid encoding the test compound, or a drug containing cells capable of secreting the test compound as an active ingredient It will be apparent to those skilled in the art that additional excipients may be more preferred.
本発明の薬学的組成物は、それ自体公知の様式で、例えば、通常の混合、溶解、顆粒化、糖衣丸形成、研和、乳化、カプセル化、封入(entrapping)、または凍結乾燥などのプロセスによって、製造しうる。適正な製剤は、選択された投与ルートに依存する。 The pharmaceutical compositions of the present invention can be prepared in a manner known per se, for example by processes such as usual mixing, dissolution, granulation, dragee formation, grinding, emulsification, encapsulation, entrapping or lyophilization. Can be manufactured. Proper formulation is dependent upon the route of administration chosen.
実施例
実施例1:材料および方法
(a) 肺癌細胞株および組織試料
肺癌細胞株は10%ウシ胎仔血清(FCS)を加えた適切な培地中で単層で増殖させ、37℃、5%CO2の加湿空気雰囲気下で維持した。肺腺癌試料由来の原発性肺癌および転移性脳腫瘍は、以前に記載されたとおり、インフォームドコンセントを得て入手した(Kikuchi et al., Oncogene. 2003 Apr 10;22(14):2192-205., Int J Oncol. 2006 Apr;28(4):799-805., Taniwaki et al., Int J Oncol. 2006 Sep;29(3):567-75.)。埼玉県立がんセンター(埼玉、日本)で外科手術を受けた患者から、366例のホルマリン固定原発性腫瘍(234例の腺癌(ADC)、104例の扁平上皮癌(SCC)、28例の大細胞癌(LCC))および隣接する正常肺組織試料がこの発明で用いられた。全部で12例のSCLC組織試料も埼玉県立がんセンターで得られた。
Examples Example 1: Materials and methods
(a) Lung cancer cell lines and tissue samples Lung cancer cell lines were grown in monolayers in an appropriate medium supplemented with 10% fetal calf serum (FCS) and maintained in a humidified air atmosphere at 37 ° C. and 5% CO2. Primary lung cancer and metastatic brain tumors from lung adenocarcinoma samples were obtained with informed consent as previously described (Kikuchi et al., Oncogene. 2003
(b) 半定量RT―PCR解析
全RNAが、製造業者のプロトコルに従い、Trizol試薬(Life Technologies, Inc.)を用いて、培養細胞および臨床組織から抽出された。抽出されたRNAおよび正常ヒト組織ポリ(A)RNAはDNase(Nippon Gene)で処理され、オリゴ(dT)20 プライマーおよびスーパースクリプトII逆転写酵素(Invitrogen)を用いて逆転写された。半定量的RT-PCR試験は、以下の合成遺伝子特異的プライマーまたは内部標準としてのa-アクチン(ACTB)特異的プライマーを用いて行われた:
TTK,
5’-TCTTGAATCCCTGTGGAAATC-3’ (SEQ ID NO: 5) および
5’-TGCTATCCACCCACTATTCCA-3’ (SEQ ID NO: 6);
ACTB,
5’-GAGGTGATAGCATTGCTTTCG-3’ (SEQ ID NO: 7) および
5’-CAAGTCAGTGTACAGGTAAGC-3’ (SEQ ID NO: 8)。
PCR反応は、増幅の対数期内で産物強度を確保するサイクル数に最適化された。
(b) Semi-quantitative RT-PCR analysis Total RNA was extracted from cultured cells and clinical tissues using Trizol reagent (Life Technologies, Inc.) according to the manufacturer's protocol. Extracted RNA and normal human tissue poly (A) RNA were treated with DNase (Nippon Gene) and reverse transcribed using oligo (dT) 20 primer and Superscript II reverse transcriptase (Invitrogen). Semi-quantitative RT-PCR testing was performed using the following synthetic gene specific primers or a-actin (ACTB) specific primers as internal standards:
TTK,
5'-TCTTGAATCCCTGTGGAAATC-3 '(SEQ ID NO: 5) and
5'-TGCTATCCACCCACTATTCCA-3 '(SEQ ID NO: 6);
ACTB,
5'-GAGGTGATAGCATTGCTTTCG-3 '(SEQ ID NO: 7) and
5'-CAAGTCAGTGTACAGGTAAGC-3 '(SEQ ID NO: 8).
The PCR reaction was optimized for the number of cycles to ensure product strength within the logarithmic phase of amplification.
(c) ノーザンブロット解析
ヒト多組織ブロット(BD Biosciences Clontech)が、32Pで標識されたTTKのPCR産物とハイブリダイズされた。TTKの全長cDNAは、プライマーを使用して、RT-PCRにより調製した。プレハイブリダイゼーション、ハイブリダイゼーションおよび洗浄が、供給元の推奨に従って行われた。ブロットは、増感スクリーンを用いて、室温で72時間、オートラジオグラフされた。
(c) Northern blot analysis A human multi-tissue blot (BD Biosciences Clontech) was hybridized with 32 P-labeled TTK PCR product. TTK full-length cDNA was prepared by RT-PCR using primers. Prehybridization, hybridization and washing were performed according to the supplier's recommendations. The blot was autoradiographed for 72 hours at room temperature using an intensifying screen.
(d) ウェスタンブロット解析
細胞は、プロテアーゼ阻害剤カクテルセット III(CALBIOCHEM)およびホスファターゼ阻害剤(1 mM フッ化ナトリウム, 1 mM オルトバナジウム酸ナトリウム, 2 mM イミダゾール, 4 mM 酒石酸ナトリウム)を含む、RIPA緩衝液[50 mM Tris-HCl (pH8.0), 150 mM NaCl, 1% NP-40, 0.5% deoxychorate-Na, 0.1% SDS]で溶解させた。細胞質および核抽出物はNE-PER 核および細胞質抽出試薬(PIERCE)によって単離された。タンパク質試料はSDS-ポリアクリルアミドゲルで分離され、Hybond-ECL ニトロセルロース膜上へ電気的に転移された(GE ヘルスケアバイオサイエンス)。ブロットは、マウスモノクローナル抗Mps1(TTK)抗体(Upstate)、ウサギポリクローナル抗リン酸化EGFR抗体(Tyr-845, Tyr-992, Tyr-1045, Tyr-1068, Tyr-1148, および Tyr-1173; Cell Signaling Technology, Inc.)、ウサギポリクローナル抗EGFR抗体(Cell Signaling Technology, Inc.)、ウサギポリクローナル抗リン酸化PLCγ1(Tyr-771)抗体(Cell Signaling Technology, Inc.)、ウサギポリクローナル抗PLCγ1抗体(Cell Signaling Technology, Inc.)、ウサギポリクローナル抗リン酸化p44/42 MAPK(Thr202/Tyr204)抗体(Cell Signaling Technology, Inc.)、ウサギポリクローナル抗p44/42 MAPK抗体(Cell Signaling Technology, Inc.)、マウスモノクローナル抗Flag抗体(SIGMA)またはマウスモノクローナル抗βアクチン抗体(SIGMA)とともにインキュベートした。抗リン酸化EGFR(Ser-967)抗体は、Ser-967リン酸化合成ペプチドに対して産生され、当該リン酸化ペプチドカラムで精製された。西洋ワサビペルオキシダーゼに結合した二次抗体を用いて抗原-抗体複合体を検出した(GE ヘルスケアバイオサイエンス)。タンパク質のバンドはECLウエスタンブロッティング検出試薬(GE ヘルスケアバイオサイエンス)によって可視化した。
(d) Western blot analysis Cells are RIPA buffer containing protease inhibitor cocktail set III (CALBIOCHEM) and phosphatase inhibitors (1 mM sodium fluoride, 1 mM sodium orthovanadate, 2 mM imidazole, 4 mM sodium tartrate). Solution [50 mM Tris-HCl (pH 8.0), 150 mM NaCl, 1% NP-40, 0.5% deoxychorate-Na, 0.1% SDS] was dissolved. Cytoplasm and nuclear extract were isolated by NE-PER nuclear and cytoplasmic extraction reagent (PIERCE). Protein samples were separated on SDS-polyacrylamide gels and electrically transferred onto Hybond-ECL nitrocellulose membrane (GE Healthcare Bioscience). Blots include mouse monoclonal anti-Mps1 (TTK) antibody (Upstate), rabbit polyclonal anti-phosphorylated EGFR antibody (Tyr-845, Tyr-992, Tyr-1045, Tyr-1068, Tyr-1148, and Tyr-1173; Cell Signaling Technology, Inc.), rabbit polyclonal anti-EGFR antibody (Cell Signaling Technology, Inc.), rabbit polyclonal anti-phosphorylated PLCγ1 (Tyr-771) antibody (Cell Signaling Technology, Inc.), rabbit polyclonal anti-PLCγ1 antibody (Cell Signaling Technology) , Inc.), rabbit polyclonal anti-phosphorylated p44 / 42 MAPK (Thr202 / Tyr204) antibody (Cell Signaling Technology, Inc.), rabbit polyclonal anti-p44 / 42 MAPK antibody (Cell Signaling Technology, Inc.), mouse monoclonal anti-Flag Incubated with antibody (SIGMA) or mouse monoclonal anti-β-actin antibody (SIGMA). Anti-phosphorylated EGFR (Ser-967) antibody was produced against Ser-967 phosphorylated synthetic peptide and purified on the phosphorylated peptide column. Antigen-antibody complexes were detected using a secondary antibody conjugated to horseradish peroxidase (GE Healthcare Bioscience). Protein bands were visualized with ECL Western blotting detection reagent (GE Healthcare Bioscience).
(e)免疫細胞化学的解析
培養細胞を、37℃で15分間4%のパラホルムアルデヒド溶液中で、または氷上で15分間10% トリクロロ酢酸を用いて固定した。固定した細胞は0.1% Triton X-100含有PBS(-)中で10分間インキュベートされ、その後PBS(-)で洗浄された。一次抗体反応の前に、固定された細胞は、非特異的抗体結合を防止するため、10分間CAS-BLOCK(ZYMED Laboratories Inc.)で覆った。その後、細胞をマウスモノクローナル抗Mps1(TTK)抗体(Upstate)および、ウサギポリクローナル抗リン酸化EGFR(Tyr-992)(Cell Signaling Technology, Inc.)またはポリクローナル抗リン酸化-p44/42 MAPK(Thr202/Tyr204)抗体(Cell Signaling Technology, Inc.)、あるいはマウスモノクローナル抗Flag抗体(SIGMA)とともにインキュベートした。抗体は、Alexa Fluor 488 (Molecular Probes)に結合した抗マウス二次抗体、およびAlexa Fluor 594 (Molecular Probes)に結合した抗ウサギ二次抗体で染色した。DNAを、4’,6-ジアミジノ-2-フェニルインドール(DAPI)で染色した。488, 594 nmの波長で共焦点顕微鏡を用いて画像を観察し、評価した(TCS SP2 AOBS: ライカマイクロシステムズ)。
(e) Immunocytochemical analysis Cultured cells were fixed with 10% trichloroacetic acid in 4% paraformaldehyde solution for 15 minutes at 37 ° C or on ice for 15 minutes. The fixed cells were incubated for 10 minutes in PBS (−) containing 0.1% Triton X-100, and then washed with PBS (−). Prior to the primary antibody reaction, the fixed cells were covered with CAS-BLOCK (ZYMED Laboratories Inc.) for 10 minutes to prevent non-specific antibody binding. Cells were then immunized with mouse monoclonal anti-Mps1 (TTK) antibody (Upstate) and rabbit polyclonal anti-phosphorylated EGFR (Tyr-992) (Cell Signaling Technology, Inc.) or polyclonal anti-phosphorylated-p44 / 42 MAPK (Thr202 / Tyr204 ) Antibody (Cell Signaling Technology, Inc.) or mouse monoclonal anti-Flag antibody (SIGMA). The antibody was stained with an anti-mouse secondary antibody conjugated to Alexa Fluor 488 (Molecular Probes) and an anti-rabbit secondary antibody conjugated to Alexa Fluor 594 (Molecular Probes). DNA was stained with 4 ′, 6-diamidino-2-phenylindole (DAPI). Images were observed and evaluated using a confocal microscope at wavelengths of 488, 594 nm (TCS SP2 AOBS: Leica Microsystems).
(f)免疫組織化学および組織マイクロアレイ
臨床試料におけるTTKまたはリン酸化EGFR(Tyr-992)タンパク質の存在を調査するために、ENVISION+ Kit/horseradish peroxidase (HRP) (DakoCytomation)を用いて組織切片を染色した。簡潔にいえば、内因性ペルオキシダーゼおよびタンパク質のブロッキング後に、抗ヒトTTK抗体(NOVUS Biologicals, Inc.)または抗リン酸化EGFR (Tyr-992)抗体(Cell Signaling Technology, Inc.)あるいは抗リン酸化EGFR(Ser-967)抗体(上述)が添加され、組織切片は二次抗体としてHRP標識抗ウサギIgGとともにインキュベートされた。発色基質が添加され、試料はヘマトキシンで対比染色した。
(f) Immunohistochemistry and tissue microarray To investigate the presence of TTK or phosphorylated EGFR (Tyr-992) protein in clinical samples, tissue sections were stained using ENVISION + Kit / horseradish peroxidase (HRP) (DakoCytomation) . Briefly, after blocking endogenous peroxidase and protein, anti-human TTK antibody (NOVUS Biologicals, Inc.) or anti-phosphorylated EGFR (Tyr-992) antibody (Cell Signaling Technology, Inc.) or anti-phosphorylated EGFR ( Ser-967) antibody (described above) was added and the tissue sections were incubated with HRP-labeled anti-rabbit IgG as a secondary antibody. A chromogenic substrate was added and the sample was counterstained with hematoxin.
腫瘍組織マイクロアレイは以前発表されたように構築された(Chin et al., Mol Pathol. 2003 Oct;56(5):275-9.; Callagy et al., Diagn Mol Pathol. 2003 Mar;12(1):27-34., J Pathol. 2005 Feb;205(3):388-96.)。スライド上の対応するHE染色切片を用いた視覚的配置に基づいて、サンプリング用の組織部が選択された。ドナー腫瘍ブロックから採取された3、4または5つの組織コア(直径 0.6 mm; 高さ3 - 4 mm)が、組織マイクロアレイヤー(Beecher Instruments)を用いて、レシピエントパラフィンブロック中に置かれた。正常組織領域のコアが、各症例から穴を開けて採取された。マイクロアレイブロックから得られた5μm切片が、免疫組織化学的解析のために使用された。TTKまたはリン酸化EGFR(Tyr-992)またはリン酸化EGFR(Ser-967)タンパク質の陽性は、臨床病理学的データに関する予備知識のない独立の調査官3名によってそれぞれ陰性(スコア3211dを0として)、弱((1+)、または強陽性(2+)として染色強度を記録することによって、半定量的に評価した。全評価者がそのようにそれらを定義した場合、症例は強い陽性(2+)のみに確定した。 Tumor tissue microarrays were constructed as previously published (Chin et al., Mol Pathol. 2003 Oct; 56 (5): 275-9 .; Callagy et al., Diagn Mol Pathol. 2003 Mar; 12 (1 ): 27-34., J Pathol. 2005 Feb; 205 (3): 388-96.). Based on the visual arrangement with the corresponding HE-stained sections on the slide, the tissue part for sampling was selected. Three, four or five tissue cores (diameter 0.6 mm; height 3-4 mm) taken from the donor tumor block were placed in the recipient paraffin block using a tissue microarrayer (Beecher Instruments). A core of normal tissue area was taken from each case with a hole. 5 μm sections obtained from the microarray block were used for immunohistochemical analysis. Positive for TTK or phosphorylated EGFR (Tyr-992) or phosphorylated EGFR (Ser-967) protein, respectively, negative by 3 independent investigators without prior knowledge of clinicopathological data (score 3211d as 0) Semi-quantitatively by recording staining intensity as weak ((1+) or strong positive (2+). If all evaluators defined them as such, the case was strongly positive (2 Only confirmed in (+).
(g)統計解析
分割表を用いて、年齢、性別、病理組織学的検査所見、喫煙歴、腫瘍サイズ(pT)、およびリンパ節転移(pN)などの臨床病理学的変数を、組織マイクロアレイ解析によって決定されたTTKおよび/またはリン酸化EGFR(Tyr-992)および/またはリン酸化EGFR(Ser-967)の陽性と相関させることを試みた。腫瘍特異的生存曲線は、手術の実施日からNSCLCに関連した死亡時まで、または最新の追跡調査結果まで算出した。カプラン・マイヤー曲線を、それぞれの関連変数、およびTTKおよび/またはリン酸化EGFR(Tyr-992)および/または(Ser-967)発現について算出し、患者のサブグループ内での生存期間の差を、ログランク検定を用いて解析した。コックスの比例ハザード回帰モデルを用いて、単変量解析を実施し、臨床病理学的変数と癌関連死亡率との関連を判定した。
(g) Statistical analysis Tissue microarray analysis of clinicopathological variables such as age, gender, histopathology findings, smoking history, tumor size (pT), and lymph node metastasis (pN) using contingency tables We attempted to correlate with TTK and / or phosphorylated EGFR (Tyr-992) and / or phosphorylated EGFR (Ser-967) positivity determined by. Tumor-specific survival curves were calculated from the date of surgery to the time of death related to NSCLC, or from the latest follow-up results. Kaplan-Meier curves were calculated for each relevant variable, and TTK and / or phosphorylated EGFR (Tyr-992) and / or (Ser-967) expression, and the difference in survival within the patient subgroups, Analysis was performed using a log rank test. Using Cox's proportional hazard regression model, a univariate analysis was performed to determine the association between clinicopathological variables and cancer-related mortality.
(h)RNA干渉アッセイ
(i)ベクターベースのアッセイ
哺乳動物細胞でsiRNAを合成するように設計されたベクターベースのRNA干渉(RNAi)システム、psiH1BX3.0が、以前に確立されている(Suzuki et al., 2003, 2005; Kato et al, 2005; Furukawa et al, 2005)。10igのsiRNA発現ベクターが、30igのリポフェクタミン2000(Invitrogen)を用いて、内因的にTTKを過剰発現させたNSCLC細胞株LC319およびA549内に導入された。導入細胞は、適切な濃度のジェネテシン(G418)の存在下で5日間培養され、その後ギムザ染色および3連のMTTアッセイで細胞数および生存率が評価された。RNAi用合成オリゴヌクレオチドの標的配列は以下の通りである:
対照1(ルシフェラーゼ: Photinus pyralisルシフェラーゼ遺伝子)、5’-CGTACGCGGAATACTTCGA-3’ (SEQ ID NO: 9);
対照2(Scramble: 5S および16S rRNAをコードするchloroplast Euglena gracilis遺伝子)、5’-GCGCGCTTTGTAGGATTCG-3’ (SEQ ID NO:10);
siRNA-TTK (si-TTK-1), 5’-ACAGTGTTCCGCTAAGTGA-3’ (SEQ ID NO: 11);
siRNA-TTK (si-TTK-2), 5’-ATCACGGACCAGTACATCT-3’ (SEQ ID NO: 12)。
RNAiシステムを検証するために、個々の対照siRNA( ルシフェラーゼおよび Scramble)が、半定量的RT-PCRによって試験され、一過的にCOS-7細胞に導入された対応する標的遺伝子の発現の減少が確認された。si-TTKによるTTK発現の下方制御は、対照によっては確認されなかったが、このアッセイに用いられた細胞株において半定量的RT-PCRで確認された。
(h) RNA interference assay
(i) Vector-based assays A vector-based RNA interference (RNAi) system, psiH1BX3.0, designed to synthesize siRNA in mammalian cells has been previously established (Suzuki et al., 2003, 2005 Kato et al, 2005; Furukawa et al, 2005). A 10 ig siRNA expression vector was introduced into NSCLC cell lines LC319 and A549 that overexpress TTK endogenously using 30 ig Lipofectamine 2000 (Invitrogen). Transduced cells were cultured in the presence of the appropriate concentration of geneticin (G418) for 5 days, after which cell number and viability were assessed by Giemsa staining and triplicate MTT assays. The target sequence of the synthetic oligonucleotide for RNAi is as follows:
Control 1 (luciferase: Photinus pyralis luciferase gene), 5'-CGTACGCGGAATACTTCGA-3 '(SEQ ID NO: 9);
Control 2 (Scramble: chloroplast Euglena gracilis gene encoding 5S and 16S rRNA), 5'-GCGCGCTTTGTAGGATTCG-3 '(SEQ ID NO: 10);
siRNA-TTK (si-TTK-1), 5'-ACAGTGTTCCGCTAAGTGA-3 '(SEQ ID NO: 11);
siRNA-TTK (si-TTK-2), 5'-ATCACGGACCAGTACATCT-3 '(SEQ ID NO: 12).
In order to validate the RNAi system, individual control siRNAs (luciferase and Scramble) were tested by semi-quantitative RT-PCR, and transiently reduced expression of the corresponding target gene introduced into COS-7 cells. confirmed. Downregulation of TTK expression by si-TTK was not confirmed by the controls, but was confirmed by semi-quantitative RT-PCR in the cell lines used in this assay.
(ii)オリゴベースのアッセイ
オリゴ-siRNAs (Dharmacon, Inc., Lafayette, CO) (600 pM)は30μlのリポフェクタミン2000 (Invitrogen, Carlsbad, CA)を用いて製造元のプロトコルに従い、適切な肺癌細胞株に導入した。以下の配列と一致するリボヌクレオチド配列がオリゴ-siRNAとして用いられた。
RNAi-TTK (オリゴ):CAAGATGTGTTAAAGTGTTTT (SEQ ID NO: 62); および
RNAi-EGFR (オリゴ):GTAACAAGCTCACGCAGTTTT (SEQ ID NO: 63)。
(ii) Oligo-based assays Oligo-siRNAs (Dharmacon, Inc., Lafayette, CO) (600 pM) were prepared in 30 μl of Lipofectamine 2000 (Invitrogen, Carlsbad, CA) according to the manufacturer's protocol and applied to the appropriate lung cancer cell line. Introduced. A ribonucleotide sequence consistent with the following sequence was used as the oligo-siRNA.
RNAi-TTK (oligo): CAAGATGTGTTAAAGTGTTTT (SEQ ID NO: 62); and
RNAi-EGFR (oligo): GTAACAAGCTCACGCAGTTTT (SEQ ID NO: 63).
(i)細胞増殖アッセイ
哺乳動物細胞のTTKの増殖効果はまた、TTKを発現するプラスミドまたはモックプラスミドを一過的にトランスフェクションしたCOS-7およびNIH-3T3細胞を用いて検討された。細胞は10%FCSおよびジェネティシンを含むDMEMで14日間培養され、MTTアッセイが行われた。
(i) Cell Proliferation Assay The proliferation effect of TTK in mammalian cells was also examined using COS-7 and NIH-3T3 cells transiently transfected with a plasmid expressing TTK or mock plasmid. Cells were cultured for 14 days in DMEM containing 10% FCS and geneticin and subjected to MTT assay.
(j)脱リン酸化解析
有糸分裂的に静止した細胞を得るために、抽出物がウェスタンブロット解析のために調製される前に培養細胞をコルセミド(WAKO)で24時間処理した。ホスファターゼ処理のため、細胞抽出物はλホスファターゼ(New England Biolabs)とホスファターゼバッファーまたはバッファーのみの中で37℃で1時間インキュベートし、その後イムノブロットにより解析された。
(j) Dephosphorylation analysis To obtain mitotically quiescent cells, cultured cells were treated with colcemid (WAKO) for 24 hours before extracts were prepared for Western blot analysis. For phosphatase treatment, cell extracts were incubated with lambda phosphatase (New England Biolabs) and phosphatase buffer or buffer alone for 1 hour at 37 ° C. and then analyzed by immunoblot.
(k)組換えTTKの調製
TTKの全長cDNAはpFastBac HTベクターにサブクローニングされた。組換えシャトルベクターは、Bac-to-Bac 発現系(Invitrogen)の製造元指示書に従って、Tn7部位特異的転位を用いて、DH10Bacコンピテントセル(Invitrogen)においてバキュロウイルスゲノム(bacmid DNA)へ形質転換された。組換えbacmid DNAは同定され、精製されて、Sf9細胞(Invitrogen)に導入され(組換えバキュロウイルス)、次の感染に用いられた。対数期Sf-9細胞は感染効率(MOI)1で組換えバキュロウイルスに感染し、その後、感染したSf-9細胞は72時間27℃で浮遊状態で増殖した。Sf-9細胞の抽出物は収集され、His融合タンパク質は標準的プロトコルを用いて、HiTrap HPカラム(GE ヘルスケアバイオサイエンス)を用いて精製された。触媒的に不活性なTTK(TTK―KD)を構築するため、点変異(Ala)がコドン647(Asp)で導入された。TTK-KDはpGEX6Tベクター(GE ヘルスケアバイオサイエンス)にクローニングされた。GST融合タンパク質は大腸菌株BL21で発現され、グルタチオンセファロース4B(GE ヘルスケアバイオサイエンス)によって標準的プロトコルに従って精製された。
(k) Preparation of recombinant TTK
The full-length TTK cDNA was subcloned into the pFastBac HT vector. The recombinant shuttle vector is transformed into the baculovirus genome (bacmid DNA) in DH10Bac competent cells (Invitrogen) using Tn7 site-specific translocation according to the manufacturer's instructions for the Bac-to-Bac expression system (Invitrogen). It was. Recombinant bacmid DNA was identified, purified, introduced into Sf9 cells (Invitrogen) (recombinant baculovirus) and used for subsequent infections. Log phase Sf-9 cells were infected with recombinant baculovirus at an infection efficiency (MOI) of 1, and then infected Sf-9 cells were grown in suspension at 27 ° C. for 72 hours. Sf-9 cell extracts were collected and His fusion proteins were purified using HiTrap HP columns (GE Healthcare Biosciences) using standard protocols. A point mutation (Ala) was introduced at codon 647 (Asp) to construct a catalytically inactive TTK (TTK-KD). TTK-KD was cloned into pGEX6T vector (GE Healthcare Bioscience). The GST fusion protein was expressed in E. coli strain BL21 and purified by glutathione sepharose 4B (GE Healthcare Bioscience) according to standard protocols.
(l)インビトロキナーゼアッセイ
TTKによるタンパク質のリン酸化を調べるため、精製された組換えHisタグ付加TTKは、細胞株から調製された全抽出物または精製されたEGFRの様々な細胞質領域を含むGSTタグ付加タンパク質と、キナーゼアッセイバッファー(50 mM Tris, pH7.4, 10 mM MgCl2, 2 mM ジチオスレイトール, 1 mM NaF, 0.2 mM ATP)中で30℃で60分間インキュベートされた。反応はLaemmliサンプルバッファーの添加によって停止し、5分間95℃で加熱された。タンパク質はSDS-PAGEによって分離されて、その後ウエスタンブロットまたは32P取り込み解析を行った。
(l) In vitro kinase assay
To investigate the phosphorylation of proteins by TTK, purified recombinant His-tagged TTK is a total extract prepared from cell lines or purified GST-tagged proteins containing various cytoplasmic regions of EGFR and kinase assays The cells were incubated in buffer (50 mM Tris, pH 7.4, 10 mM MgCl2, 2 mM dithiothreitol, 1 mM NaF, 0.2 mM ATP) at 30 ° C. for 60 minutes. The reaction was stopped by the addition of Laemmli sample buffer and heated at 95 ° C. for 5 minutes. Proteins were separated by SDS-PAGE followed by Western blot or 32 P incorporation analysis.
(m) ヌードマウス異種移植モデルにおける腫瘍成長
TTKトランスフェクタントは回収され、5x106個の細胞が成長因子を減少させたフェノールレッドフリーマトリゲル(BD Bioscience)に懸濁され、6週齢のnu/nu BalbC雌マウス(Charles River Laboratories)の右背側へ皮下注射された。腫瘍サイズは定規を用いて測定され、腫瘍容積は式V = (W/2)2 x Lを用いて算出された。Wは腫瘍の幅の距離、Lは縦の長さである。
(m) Tumor growth in nude mouse xenograft model
TTK transfectants were collected and 5x10 6 cells were suspended in phenol red free matrigel (BD Bioscience) with reduced growth factors, and 6 weeks old nu / nu BalbC female mice (Charles River Laboratories) It was injected subcutaneously into the right dorsal side. Tumor size was measured using a ruler and tumor volume was calculated using the formula V = (W / 2) 2 x L. W is the distance of the tumor width, and L is the vertical length.
(n)TTK発現定常的トランスフェクタント
TTK発現定常的トランスフェクタントは標準的プロトコルに従って樹立された。本発明者らは、FuGENE 6 トランスフェクション試薬 (Roche Diagnostics)を用いて、TTK発現プラスミド(pCAGGS-n3FH-TTK)またはモックプラスミド(pCAGGS-n3FH)をHEK293細胞およびNIH3T3細胞にトランスフェクションした。トランスフェクションした細胞は10% FCS およびG418を含むDMEMで培養され、その後個々のコロニーはトリプシン処理され、限界希釈アッセイによって定常的トランスフェクタントがスクリーニングされた。TTK発現はRT-PCR、ウエスタンブロッティング、および免疫染色によって各クローンで測定された。TTKを定常的に発現するHEK293またはNIH3T3トランスフェクタントは6穴プレートへ播種され(5 X 104 細胞/well)、10% FCS および 0.4 mg/ml G418を含む培地で7日間維持された。各時点で、細胞増殖はCell Counting Kits (WAKO)を用いたMTTアッセイにより評価された。全ての実験は3連で行われた。
(n) TTK-expressing stationary transfectant
TTK-expressing steady-state transfectants were established according to standard protocols. The present inventors transfected HEK293 cells and NIH3T3 cells with TTK expression plasmid (pCAGGS-n3FH-TTK) or mock plasmid (pCAGGS-n3FH) using
(o) TTK変異解析
全RNAは製造元のプロトコルに従ってRNeasy Mini Kit (Qiagen)を用いてNSCLC細胞株から抽出された。抽出されたRNAはDNase I (日本ジーン)で処理され、oligo (dT) プライマーおよびSuperScript II逆転写酵素 (Invitrogen)を用いて逆転写された。TTKの増幅は、合成TTK特異的プライマーを用いて行われた。
5’-GTGTTTGCGGAAAGGAGTTT-3’ (SEQ ID NO: 13),
5’-CAACCAGTCCTCTGGGTTGT-3’ (SEQ ID NO: 14);
5’-AACTCGGGAACTGTTAACCAAA-3’ (SEQ ID NO: 15),
5’-GTGCATCATCTGGCTCTTGA-3’ (SEQ ID NO: 16);
5’-TGTTCCGCTAAGTGATGCTC-3’ (SEQ ID NO: 17),
5’-GCAAATTTCTTGCAGTTTGCTC-3’ (SEQ ID NO: 18);
5’-TCAAGAGCCAGATGATGCAC-3’ (SEQ ID NO: 19),
5’-TCTTTTCCTCCTCTGAAAGCA-3’ (SEQ ID NO: 20);
5’-AAGCTGTAGAACGTGGAGCAG-3’ (SEQ ID NO: 21),
5’-CATCTTGTGGTGGCATGTTC-3’ (SEQ ID NO: 22);
5’-CGGTTCACTTGGGCATTTAC-3’ (SEQ ID NO: 23),
5’-CCAAATCTCGGCATTCTGAT-3’ (SEQ ID NO: 24);
5’-AGCCCAGATTGTGATGTGAA-3’ (SEQ ID NO: 25),
5’-TTGATTCCGTTTTATTCTTCAGG-3’ (SEQ ID NO: 26);
5’-TCAAGGAACCTCTGGTGTCA-3’ (SEQ ID NO: 27),
5’-GACAGGTTGCTCAAAAGTGG-3’ (SEQ ID NO: 28);
5’-ACTGGCAGATTCCGGAGTTA-3 (SEQ ID NO: 29)’,
5’-CAACTGACAAGCAGGTGGAA-3’ (SEQ ID NO: 30);
5’-GACACCAAGCAGCAATACCTTGG-3’ (SEQ ID NO: 31),
5’-AACACCTGAAATACCTTGCTTGAAC-3’ (SEQ ID NO: 32);
5’-ATGAATGCATTTCGGTTAAAGG-3’ (SEQ ID NO: 33),
5’-TTTCCACACTCCATTACCATG-3’ (SEQ ID NO: 34);
5’-ACAGTGATAAGATCATCCGAC-3’ (SEQ ID NO: 35),
5’-ACACTTGTTGTATCTGGTTGC-3’ (SEQ ID NO: 36);
5’-TTTCTGATAGTTGATGGAATGC-3’ (SEQ ID NO: 37),
5’-GAAATCTGATTAATTATCTGCTG-3’ (SEQ ID NO: 38);
5’-TGATGTTTGGTCCTTAGGATG-3’ (SEQ ID NO: 39),
5’-ATTTCTTCAGTGGTTCCCTTG-3’ (SEQ ID NO: 40) and
5’-AGCTCCTGGCTCATCCCTAT-3’ (SEQ ID NO: 41),
5’-TGCTATCCACCCACTATTCCA-3’ (SEQ ID NO: 6)
次に、PCR産物の配列解析がABI Prism 3700 DNAシークエンサー (Applied Biosystems)を用いて行われた。
(o) TTK mutation analysis
Total RNA was extracted from the NSCLC cell line using the RNeasy Mini Kit (Qiagen) according to the manufacturer's protocol. The extracted RNA was treated with DNase I (Nippon Gene) and reverse transcribed using oligo (dT) primer and SuperScript II reverse transcriptase (Invitrogen). TTK amplification was performed using synthetic TTK specific primers.
5'-GTGTTTGCGGAAAGGAGTTT-3 '(SEQ ID NO: 13),
5'-CAACCAGTCCTCTGGGTTGT-3 '(SEQ ID NO: 14);
5'-AACTCGGGAACTGTTAACCAAA-3 '(SEQ ID NO: 15),
5'-GTGCATCATCTGGCTCTTGA-3 '(SEQ ID NO: 16);
5'-TGTTCCGCTAAGTGATGCTC-3 '(SEQ ID NO: 17),
5'-GCAAATTTCTTGCAGTTTGCTC-3 '(SEQ ID NO: 18);
5'-TCAAGAGCCAGATGATGCAC-3 '(SEQ ID NO: 19),
5'-TCTTTTCCTCCTCTGAAAGCA-3 '(SEQ ID NO: 20);
5'-AAGCTGTAGAACGTGGAGCAG-3 '(SEQ ID NO: 21),
5'-CATCTTGTGGTGGCATGTTC-3 '(SEQ ID NO: 22);
5'-CGGTTCACTTGGGCATTTAC-3 '(SEQ ID NO: 23),
5'-CCAAATCTCGGCATTCTGAT-3 '(SEQ ID NO: 24);
5'-AGCCCAGATTGTGATGTGAA-3 '(SEQ ID NO: 25),
5'-TTGATTCCGTTTTATTCTTCAGG-3 '(SEQ ID NO: 26);
5'-TCAAGGAACCTCTGGTGTCA-3 '(SEQ ID NO: 27),
5'-GACAGGTTGCTCAAAAGTGG-3 '(SEQ ID NO: 28);
5'-ACTGGCAGATTCCGGAGTTA-3 (SEQ ID NO: 29) ',
5'-CAACTGACAAGCAGGTGGAA-3 '(SEQ ID NO: 30);
5'-GACACCAAGCAGCAATACCTTGG-3 '(SEQ ID NO: 31),
5'-AACACCTGAAATACCTTGCTTGAAC-3 '(SEQ ID NO: 32);
5'-ATGAATGCATTTCGGTTAAAGG-3 '(SEQ ID NO: 33),
5'-TTTCCACACTCCATTACCATG-3 '(SEQ ID NO: 34);
5'-ACAGTGATAAGATCATCCGAC-3 '(SEQ ID NO: 35),
5'-ACACTTGTTGTATCTGGTTGC-3 '(SEQ ID NO: 36);
5'-TTTCTGATAGTTGATGGAATGC-3 '(SEQ ID NO: 37),
5'-GAAATCTGATTAATTATCTGCTG-3 '(SEQ ID NO: 38);
5'-TGATGTTTGGTCCTTAGGATG-3 '(SEQ ID NO: 39),
5'-ATTTCTTCAGTGGTTCCCTTG-3 '(SEQ ID NO: 40) and
5'-AGCTCCTGGCTCATCCCTAT-3 '(SEQ ID NO: 41),
5'-TGCTATCCACCCACTATTCCA-3 '(SEQ ID NO: 6)
Next, sequence analysis of the PCR product was performed using an ABI Prism 3700 DNA sequencer (Applied Biosystems).
(p)マトリゲル浸潤アッセイ
製造元の説明書に従って、FuGENE 6 トランスフェクション試薬 (Roche Diagnostics)を用いて、NIH-3T3 またはCOS-7 細胞にTTK (pCAGGS-n3FH-TTK)、TTK-KD (D647A)、 変異 TTK (RERF-LC-AI 細胞由来)を発現するプラスミド、またはモックプラスミド (pCAGGS-n3FH)をトランスフェクションした。トランスフェクションした細胞は回収され、FCSを含まないDMEMに懸濁された。細胞懸濁液が調製される前に、マトリゲルマトリックス(Becton Dickinson Labware)の乾燥層が室温で2時間、DMEMで再水和された。その次に、10% FCSを含むDMEMが24穴マトリゲル浸潤チャンバーの各下部チャンバーへ添加され、細胞懸濁液が上部チャンバーの各挿入物に添加された。挿入物のプレートは37℃で22時間インキュベートされた。インキュベート後、マトリゲルで被覆した挿入物を通過した浸潤細胞がギムザによって固定され染色された。
(p) Matrigel invasion
(q)合成された細胞透過性ペプチド
TTK相互作用領域の可能性がある領域を含むEGFRタンパク質の部分と対応する17〜31アミノ酸ペプチド配列は、そのNH2末端で、膜伝達11ポリアルギニン配列と共有結合的に連結した(Hayama, S, et al. Cancer Res. 66, 10339-48 (2006), Futaki S, et al. J Biol Chem. 276, 5836-5840 (2001))。3つの細胞透過性ペプチドをが合成した:
11R-EGFR889-907: RRRRRRRRRRR-GGG-KPYDGIPASEISSILEKGE;
11R-EGFR899-917: RRRRRRRRRRR-GGG-ISSILEKGERLPQPPICTI(SEQ ID NO: 44);
11R-EGFR918-936: RRRRRRRRRRR-GGG-DVYMIMVKCWMIDADSRPK(SEQ ID NO:45);
11R-EGFR937-955: RRRRRRRRRRR-GGG-FRELIIEFSKMARDPQRYL(SEQ ID NO: 46);
11R-EGFR958-976: RRRRRRRRRRR-GGG-QGDERMHLPSPTDSNFYRA;
11R-EGFR983-1001: RRRRRRRRRRR-GGG-MDDVVDADEYLIPQQGFFS; および
11R-EGFR965-994: RRRRRRRRRRR-GGG-LPSPTDSNFYRALMDEEDMDDVVDADEYLI。
最も効率的な11R-EGFR937-955 ペプチド由来のScramble ペプチドは対照として合成された:Scramble、RRRRRRRRRRR-GGG-EFMAELLRYFRPQSKRDII。
ペプチドは調製用の逆相高圧液体クロマトグラフィにより精製された。A549細胞は2.5、5、および7.5μモル/Lの濃度で5日間、11Rペプチドとインキュベートされた。培地は、各ペプチドを適切な濃度として48時間ごとに交換され、細胞生存率は処理後5日でMTTアッセイによって評価された。
(q) synthesized cell-penetrating peptide
The 17-31 amino acid peptide sequence corresponding to the portion of the EGFR protein that contains the potential TTK interaction region is covalently linked to the membrane transducing 11 polyarginine sequence at its NH2 terminus (Hayama, S, et al. Cancer Res. 66, 10339-48 (2006), Futaki S, et al. J Biol Chem. 276, 5836-5840 (2001)). Three cell penetrating peptides were synthesized:
11R-EGFR889-907: RRRRRRRRRRR-GGG-KPYDGIPASEISSILEKGE;
11R-EGFR899-917: RRRRRRRRRRR-GGG-ISSILEKGERLPQPPICTI (SEQ ID NO: 44);
11R-EGFR918-936: RRRRRRRRRRR-GGG-DVYMIMVKCWMIDADSRPK (SEQ ID NO: 45);
11R-EGFR937-955: RRRRRRRRRRR-GGG-FRELIIEFSKMARDPQRYL (SEQ ID NO: 46);
11R-EGFR958-976: RRRRRRRRRRR-GGG-QGDERMHLPSPTDSNFYRA;
11R-EGFR983-1001: RRRRRRRRRRR-GGG-MDDVVDADEYLIPQQGFFS; and
11R-EGFR965-994: RRRRRRRRRRR-GGG-LPSPTDSNFYRALMDEEDMDDVVDADEYLI.
The most efficient Scramble peptide from the 11R-EGFR937-955 peptide was synthesized as a control: Scramble, RRRRRRRRRRR-GGG-EFMAELLRYFRPQSKRDII.
The peptide was purified by preparative reverse phase high pressure liquid chromatography. A549 cells were incubated with 11R peptide for 5 days at concentrations of 2.5, 5, and 7.5 μmol / L. The medium was changed every 48 hours with each peptide at the appropriate concentration and cell viability was assessed by
実施例2:肺腫瘍および正常組織におけるTTK発現
肺癌治療薬および/または診断マーカーの開発のための新規分子標的を探索するため、cDNAマイクロアレイによって解析された、肺癌の50%以上で5倍以上の発現を示した遺伝子が最初にスクリーニングされた。スクリーニングされた27,648の遺伝子の中で、TTKプロテインキナーゼをコードする遺伝子が、肺癌の様々な型においてしばしば過剰発現しているものとして同定された。この発現レベルは、さらなる14のNSCLC症例のうち11(7例の腺癌(ADC)のうち5例、7例の扁平上皮癌(SCC)のうち6例)で確認された(図1a)。さらに、TTKの上方制御は23の肺癌細胞株全てにおいて観察された(図1b)。さらにまた、肺腫瘍におけるTTK発現は、抗TTK抗体を用いたウエスタンブロット解析で、内因性TTKタンパク質の発現を検討することにより、7つの肺癌細胞株全てにおいて確認された(図1c)。プローブとしてTTK cDNA用いたノーザンブロット法により、検討された24の正常ヒト組織の中で、精巣において特異的に3.0kbの転写産物が同定された(データ示さず)。NSCLC細胞株、A549およびLC319におけるTTKの細胞内局在は、抗TTK抗体を用いた免疫細胞化学的およびウエスタンブロット解析によって検討され、細胞質および核に主に局在することが判明した(図1eおよび1f)。
Example 2: TTK expression in lung tumors and normal tissues More than 50% of lung cancer and more than 5 times analyzed by cDNA microarray to explore new molecular targets for the development of lung cancer therapeutics and / or diagnostic markers The genes that showed expression were screened first. Of the 27,648 genes screened, the gene encoding TTK protein kinase was identified as often overexpressed in various types of lung cancer. This expression level was confirmed in 11 of 14 additional NSCLC cases (5 out of 7 adenocarcinomas (ADC), 6 out of 7 squamous cell carcinomas (SCC)) (FIG. 1a). Furthermore, up-regulation of TTK was observed in all 23 lung cancer cell lines (FIG. 1b). Furthermore, TTK expression in lung tumors was confirmed in all seven lung cancer cell lines by examining the expression of endogenous TTK protein by Western blot analysis using an anti-TTK antibody (FIG. 1c). Northern blotting using TTK cDNA as a probe identified a 3.0 kb transcript specifically in the testis among the 24 normal human tissues examined (data not shown). Intracellular localization of TTK in NSCLC cell lines, A549 and LC319, was examined by immunocytochemical and Western blot analysis using anti-TTK antibodies and was found to be mainly localized in the cytoplasm and nucleus (FIG. 1e). And 1f).
実施例3:予後不良とTTK過剰発現の関連
TTKの生物学的および臨床病理学的な重要性を確認するために、TTKタンパク質発現が、12人の患者由来のSCLC組織、ならびに、366人の患者由来のNSCLC組織を含む組織マイクロアレイによって、臨床NSCLCで検討された。TTK陽性染色は、外科的に切除されたNSCLCの68.6%(251/366)およびSCLCの66.7%(8/12)で観察され、その一方で正常肺組織のいずれにおいても染色は観察されなかった(図2a)。次に、さまざまな臨床病理学的パラメータとその陽性染色との相関が、366人のNSCLC患者で検討された。組織アレイ上のTTK発現レベルは陰性(スコア0)から弱い/強い陽性(スコア1+ ~ 2+)の範囲で分類された(図2a;実施例1参照)。検討された366のNSCLC症例のうち、TTKは135例で強く染色され(36.9%; スコア2+)、116例で弱く染色され(31.7%; スコア1+)、115症例では染色されなかった(31.4%; スコア 0)。性別(男性で高い; P = 0.0006 フィッシャーの直接確率検定)、組織学的分類(SCCで高い; P = 0.0206 カイ二乗検定)、pTステージ(T2,T3,T4で高い; P < 0.0001 カイ二乗検定)、およびpNステージ(N1,N2で高い; P = 0.0006 カイ二乗検定)は強いTTK陽性(スコア2+)と有意に関連していた(表1a)。Kaplan-Meier法はNSCLCにおけるTTKの強い陽性染色と腫瘍特異的生存との間の有意な関係を示した(P < 0.0001 ログランク検定) (図2b)。単変量解析によって、年齢(? 65 対 < 65)、性別(男性対女性)、組織学的分類(非ADC対ADC)、pTステージ(T2,T3,T4対T1)、pNステージ(N1,N2対N0)、および強いTTK陽性(スコア2+対1+,0)は全てNSCLC患者で腫瘍特異的生存不良に有意に関連していた(表1b、上)。予後因子の多変量解析において、年齢、pTステージ、pNステージおよび強いTTK陽性は、独立予後因子であることが示された(表1b、下)。
Example 3: Association between poor prognosis and overexpression of TTK
To confirm the biological and clinicopathological significance of TTK, TTK protein expression was clinically monitored by tissue microarrays containing SCLC tissue from 12 patients and NSCLC tissue from 366 patients. It was examined by NSCLC. TTK positive staining was observed in 68.6% (251/366) of surgically resected NSCLC and 66.7% (8/12) of SCLC, while no staining was observed in any normal lung tissue (Figure 2a). Next, the correlation between various clinicopathological parameters and their positive staining was examined in 366 NSCLC patients. TTK expression levels on the tissue array were classified from negative (score 0) to weak / strong positive (
(表1a)NSCLC組織におけるTTK陽性と患者の特徴との関係 (n=366)
ADC, 腺癌; SCC, 扁平上皮癌; LCC, 大細胞癌
P < 0.05 (カイ二乗検定)
NS, 有意差なし
SCC 対 他 (ADC + LCC)
(Table 1a) Relationship between TTK positivity in NSCLC tissues and patient characteristics (n = 366)
ADC, adenocarcinoma; SCC, squamous cell carcinoma; LCC, large cell carcinoma
P <0.05 (chi-square test)
NS, no significant difference
SCC vs. Other (ADC + LCC)
(表1b)NSCLC患者における予後因子のコックスの比例ハザードモデル解析
1SCC, 扁平上皮癌
* P < 0.05
NS, 有意差なし
(Table 1b) Cox proportional hazard model analysis of prognostic factors in patients with NSCLC
1SCC, squamous cell carcinoma
* P <0.05
NS, no significant difference
実施例4:TTKに対するsiRNAによる肺癌細胞の増殖抑制
TTKが肺癌細胞の増殖/生存に重要であるかどうか評価するため、2つの対照プラスミド(ルシフェラーゼ(LUC)、またはScramble(SCR)に対するsiRNA)、ならびに、TTKに対するsiRNA(si-TTK-1 および -2)を発現するプラスミドが構築され、LC319およびA549細胞に各々トランスフェクションされた(LC319の代表データを図3aに示す)。si-TTK-1をトランスフェクションした2つのNSCLC細胞株におけるTTK転写物の量は、2つの対照siRNAと比較して著しく減少した(図3a、左上パネル)。MTTおよびコロニー形成アッセイで測定された、si-TTK-1をトランスフェクションした細胞の細胞生存度およびコロニー数は、2つの対照siRNAの場合と比較して著しく減少した(図3a、左下および右パネル)。si-TTK-2は弱いTTK発現の減少およびわずかな増殖抑制効果を示した。この結果はNSCLC細胞におけるTTKの増殖促進効果を示唆した。
Example 4: Suppression of lung cancer cell growth by siRNA against TTK
To assess whether TTK is important for lung cancer cell growth / survival, two control plasmids (luciferase (LUC) or siRNA against Scramble (SCR)) and siRNA against TTK (si-TTK-1 and- Plasmids expressing 2) were constructed and transfected into LC319 and A549 cells, respectively (representative data for LC319 is shown in FIG. 3a). The amount of TTK transcript in the two NSCLC cell lines transfected with si-TTK-1 was significantly reduced compared to the two control siRNAs (Figure 3a, upper left panel). Cell viability and colony numbers of cells transfected with si-TTK-1 as measured by MTT and colony formation assays were significantly reduced compared to the two control siRNAs (Figure 3a, lower left and right panels). ). si-TTK-2 showed a weak decrease in TTK expression and a slight growth inhibitory effect. This result suggested the effect of TTK proliferation in NSCLC cells.
実施例5:TTKによる増殖促進効果
TTKが細胞増殖で重要な役割をしているかどうか決定するため、TTKを定常的に発現するHEK293由来トランスフェクタントが樹立された。外因性TTKを発現しているHEK293細胞の増殖は、モックベクターをトランスフェクションした対照細胞の増殖と比較して、TTKの発現レベルに合致して有意な度合いで促進された(図3bおよび3c)。マウス皮下に移植されたTTK導入HEK293細胞も、対照細胞と比較して高い増殖速度を呈した(図3d)。この結果は、NSCLC細胞におけるTTKの増殖促進効果を示唆した。
Example 5: Growth promotion effect by TTK
To determine whether TTK plays an important role in cell proliferation, a HEK293-derived transfectant that steadily expresses TTK was established. Growth of HEK293 cells expressing exogenous TTK was promoted to a significant degree consistent with the expression level of TTK compared to the growth of control cells transfected with mock vector (FIGS. 3b and 3c) . TTK-introduced HEK293 cells implanted subcutaneously in mice also exhibited a high growth rate compared to control cells (FIG. 3d). This result suggested the effect of promoting TTK proliferation in NSCLC cells.
実施例6:TTKによる細胞内浸潤活性の活性化
組織マイクロアレイにおける免疫組織化学的解析が、TTK強陽性腫瘍を有する肺癌患者がTTK陰性の患者より癌特異的生存期間が短いことを示したことから、本発明者らは、TTKが細胞浸潤能力において役割を果たすかどうか調べるため、マトリゲル浸潤アッセイを行った。マトリゲルを通じた、TTK発現ベクターをトランスフェクションしたNHI-3T3細胞の浸潤は、モックまたはTTK-KDベクターをトランスフェクションした対照細胞と比較して有意に促進され、TTKが肺癌細胞の高度に悪性な表現型にも関与しうることを示唆した(図3e)。
Example 6: Activation of intracellular invasive activity by TTK Immunohistochemical analysis in tissue microarrays showed that lung cancer patients with TTK strong positive tumors had shorter cancer-specific survival times than TTK negative patients In order to investigate whether TTK plays a role in cell invasion ability, we performed a Matrigel invasion assay. Infiltration of NHI-3T3 cells transfected with TTK expression vector through Matrigel was significantly promoted compared to control cells transfected with mock or TTK-KD vector, and TTK is a highly malignant expression of lung cancer cells It was suggested that it may be involved in the mold (Fig. 3e).
実施例7:TTKに対する新規基質タンパク質としてのEGFRの同定
発癌におけるTTKキナーゼの機能を解明するため、本発明者らはTTKによってリン酸化され、細胞増殖シグナルを活性化する基質タンパク質を同定することを試みた。TTKに対するキナーゼ基質のイムノブロットスクリーニングは、TTK発現ベクターをトランスフェクションしたCOS-7細胞の細胞溶解液、および癌細胞シグナルに関連したリン酸化タンパク質に対して特異的な一連の抗体を用いて行われた(実施例1参照)。合計31個のリン酸化タンパク質がスクリーニングされた(表2)。EGFRのTyr-992はTTK発現ベクターをトランスフェクションした細胞において、モックベクターを用いたものと比較して有意にリン酸化されることが判明した(図4a)。このスクリーニングにおいて、EGFRの細胞質ドメイン内の様々なリン酸化Tyr残基(Tyr-845, Tyr-992, Tyr-1045, Tyr-1068, Tyr-1148, およびTyr-1173) (Amos S, et al., J Biol Chem. 2005 Mar 4;280(9):7729-38. Epub 2004 Dec 23; Biscardi JS, et al., J Biol Chem. 1999 Mar 19;274(12):8335-43; Honegger A, et al., EMBO J. 1988 Oct;7(10):3045-52; Sorkin A, et al., J Biol Chem. 1991 May 5;266(13):8355-62; Wang XQ, et al., J Biol Chem. 2003 Dec 5;278(49):48770-8. Epub 2003 Sep 25.)を認識するもの、ならびに、リン酸化Ser-1046/1047を認識するもの (Countaway JL, et al., J Biol Chem. 1992 Jan 15;267(2):1129-40; Gamou S & Shimizu N. J Cell Physiol. 1994 Jan;158(1):151-9.)、合計7つのリン酸化特異的抗体がEGFRに関して検討され、Tyr-992リン酸化のみが見出された(データ示さず)。TTKキナーゼによるTyr-992の特異的リン酸化を確認するため、触媒的に不活性なTTK-KD発現ベクターをCOS-7細胞にトランスフェクションしたところ、Tyr-992でのEGFRのリン酸化の増強は検出されなかった(図4a)。これらのデータは、TTKキナーゼ活性がEGFRシグナルにおいて非常に選択的にTyr-992リン酸化を制御できることを示唆する。
Example 7: Identification of EGFR as a novel substrate protein for TTK To elucidate the function of TTK kinase in carcinogenesis, we identify a substrate protein that is phosphorylated by TTK and activates cell proliferation signals. Tried. Immunoblot screening of kinase substrates for TTK was performed using a cell lysate of COS-7 cells transfected with a TTK expression vector and a series of antibodies specific for phosphoproteins associated with cancer cell signals. (See Example 1). A total of 31 phosphorylated proteins were screened (Table 2). EGFR Tyr-992 was found to be significantly phosphorylated in cells transfected with the TTK expression vector compared to those using the mock vector (FIG. 4a). In this screen, various phosphorylated Tyr residues within the cytoplasmic domain of EGFR (Tyr-845, Tyr-992, Tyr-1045, Tyr-1068, Tyr-1148, and Tyr-1173) (Amos S, et al. , J Biol Chem. 2005
(表2)TTKキナーゼに対する基質タンパク質のイムノブロットスクリーニングに使用したリン酸化特異的抗体のリスト
Table 2 List of phosphorylation specific antibodies used for immunoblot screening of substrate proteins against TTK kinase
肺癌細胞におけるTTKとEGFRとの間の内因性の結合はまた、A549細胞からの抽出物を用いた免疫沈降実験により検討され、これら2つのタンパク質間の相互作用はEGF刺激に関係なく検出された(図4b)。EGFR情報伝達に対するTTKの関連をさらに検討するため、A549細胞においてTTKまたはEGFR機能を抑制し、細胞形態を顕微鏡的に観察した。RNAi-TTK (oligo)またはRNAi-EGFR (oligo)のトランスフェクション後の細胞と同様に、EGFRチロシンキナーゼ阻害剤、AG1478(トリフォスチン4-(3-クロロアニリノ)-6,7-ジメトキシキナゾリン)で処理したA549細胞は、多核を伴い非常に大型化した(図4c)。これらの結果は、TTKがEGF非依存的な細胞内EGFR活性化シグナルに関連していることを支持する。 Endogenous binding between TTK and EGFR in lung cancer cells was also examined by immunoprecipitation experiments using extracts from A549 cells, and the interaction between these two proteins was detected regardless of EGF stimulation (Figure 4b). To further investigate the relationship of TTK to EGFR signaling, TTK or EGFR function was suppressed in A549 cells and the cell morphology was observed microscopically. Treated with EGFR tyrosine kinase inhibitor, AG1478 (triphostin 4- (3-chloroanilino) -6,7-dimethoxyquinazoline), similar to cells transfected with RNAi-TTK (oligo) or RNAi-EGFR (oligo) The A549 cells were very large with many nuclei (Fig. 4c). These results support that TTK is associated with an EGF-independent intracellular EGFR activation signal.
TTKによるEGFR Tyr-992の特異的リン酸化をさらに確認するため、インビトロキナーゼアッセイが、COS-7細胞から調製された全細胞抽出物と精製されたHisタグ付加TTKとをインキュベートすることで行われた。個々のリン酸化部位を調べるため、EGFRの細胞質ドメイン内の様々なリン酸化Tyr残基に対応する、EGFRに対するリン酸化特異的抗体(Tyr-845, Tyr-992, Tyr-1045, Tyr-1068, Tyr-1148, and Tyr-1173)が適用された。ウエスタンブロット解析は、用量依存的な組換え型TTKによるEGFR Tyr-992のリン酸化を示し、一方でEGFRにおける他のTyr残基のリン酸化は検出されなかった(図4d、左パネル)。他方、これら全てのTyr残基は、COS-7細胞におけるリガンドEGFを用いたEGFRの刺激によりリン酸化され、各リン酸化EGFR特異的抗体が各リン酸化部位を正確に認識できることを示唆した(図4d、右パネル)。COS-7細胞におけるEGF刺激が6つのTyr残基全てのリン酸化を誘導するという証拠は、EGFRのTyr-992に対するTTKの特異的キナーゼ活性をさらに支持する。 To further confirm the specific phosphorylation of EGFR Tyr-992 by TTK, an in vitro kinase assay was performed by incubating whole cell extracts prepared from COS-7 cells and purified His-tagged TTK. It was. To investigate individual phosphorylation sites, phosphorylation-specific antibodies against EGFR (Tyr-845, Tyr-992, Tyr-1045, Tyr-1068, corresponding to various phosphorylated Tyr residues in the cytoplasmic domain of EGFR) Tyr-1148, and Tyr-1173) were applied. Western blot analysis showed dose-dependent phosphorylation of EGFR Tyr-992 by recombinant TTK, while no phosphorylation of other Tyr residues in EGFR was detected (Figure 4d, left panel). On the other hand, all these Tyr residues were phosphorylated by stimulation of EGFR with the ligand EGF in COS-7 cells, suggesting that each phosphorylated EGFR-specific antibody can accurately recognize each phosphorylation site (Fig. 4d, right panel). Evidence that EGF stimulation in COS-7 cells induces phosphorylation of all six Tyr residues further supports the specific kinase activity of TTK against EGFR Tyr-992.
EGFRチロシンリン酸化部位は、基質としてEGFRの様々な細胞質領域を含むGSTタグ付加タンパク質を用いたTTKによってさらに評価された(EGFR-DEL1, -DEL2, および -DEL3; 図4e)。GSTタグ付加EGFRタンパク質は大腸菌内で産生され、精製した組換え型TTKを用いたインビトロキナーゼアッセイに供され、その後、抗リン酸化Tyr992 EGFR抗体でウエスタンブロット解析された。GSTタグ付加EGFR-DEL2タンパク質(アミノ酸889-1045)におけるEGFR Tyr-992のリン酸化はTTK用量依存的に促進され、一方GSTタグ付加EGFR-DEL1 (アミノ酸692-891), EGFR-DEL2およびEGFR-DEL3 (アミノ酸1046-1186)タンパク質における他のチロシン残基は全くリン酸化されなかった(図4f)。基質として触媒的に活性のある組換え型GSTタグ付加ヒトEGFR(active-rhEGFR; Upstate)を用いたインビトロキナーゼアッセイ、および、続く抗リン酸化チロシン抗体を用いたウエスタンブロット解析により、ATP存在下でactive-rhEGFRがチロシン上の自己リン酸化を受けることが示された(図4g、レーン2)。このリン酸化は、EGFRチロシンキナーゼ阻害剤、AG1478(トリフォスチン4-(3-クロロアニリノ)-6,7-ジメトキシキナゾリン)によって用量依存的に阻害された(データ示さず)。しかし、図4g、レーン4に示すように、TTKによるactive-rhEGFRのリン酸化はAG1478によって阻害されなかった。この結果は、TTKによるEGFRの直接的なリン酸化をさらに確証した。
EGFR tyrosine phosphorylation sites were further evaluated by TTK using GST-tagged proteins containing various cytoplasmic regions of EGFR as substrates (EGFR-DEL1, -DEL2, and -DEL3; FIG. 4e). GST-tagged EGFR protein was produced in E. coli and subjected to in vitro kinase assay using purified recombinant TTK, followed by Western blot analysis with anti-phosphorylated Tyr992 EGFR antibody. Phosphorylation of EGFR Tyr-992 in GST-tagged EGFR-DEL2 protein (amino acids 889-1045) is promoted in a TTK dose-dependent manner, whereas GST-tagged EGFR-DEL1 (amino acids 692-891), EGFR-DEL2 and EGFR- Other tyrosine residues in the DEL3 (amino acids 1046-1186) protein were not phosphorylated at all (Figure 4f). In the presence of ATP by in vitro kinase assay using catalytically active recombinant GST-tagged human EGFR (active-rhEGFR; Upstate) and subsequent Western blot analysis using anti-phosphotyrosine antibody Active-rhEGFR was shown to undergo autophosphorylation on tyrosine (FIG. 4g, lane 2). This phosphorylation was dose-dependently inhibited by the EGFR tyrosine kinase inhibitor, AG1478 (triphostin 4- (3-chloroanilino) -6,7-dimethoxyquinazoline) (data not shown). However, as shown in FIG. 4g,
免疫組織化学的解析がさらに、336例のNSCLCおよび12例のSCLC組織から成る組織マイクロアレイを用いて抗リン酸化EGFR(Tyr-992)抗体により行われた。366のNSCLC症例のうち、123症例(33.6%)は強いリン酸化EGFR(Tyr-992)染色(スコア2+)を示し、121症例(33.1%)は染色が弱く(スコア1+)、122症例(33.3%)では染色が観察されず(スコア0)、一方リン酸化EGFR(Tyr-992)の染色は検討された正常肺組織のいずれにおいても観察されなかった(図4h)。12例のSCLCのうち3例(25%)はリン酸化EGFR(Tyr-992)に陽性であった。336例のうち203例はTTKおよびリン酸化EGFR(Tyr-992)両方の腫瘍に陽性(1+ ~ 2+としてスコアした)であり、74例は両タンパク質とも陰性であった。366症例のうち48例はTTKのみ陽性であり、41例はリン酸化EGFR(Tyr-992)のみ陽性であった。リン酸化EGFR(Tyr-992)陽性のパターンがこれらの腫瘍におけるTTK陽性と有意に一致した(÷2 = 72.585; P < 0.0001)という事実は、インビトロアッセイによって得られた結果を独立に確証した。NSCLCにおけるリン酸化EGFR(Tyr-992)の強発現(スコア2+)が、性別(男性で高い; P = 0.0086 フィッシャーの正確確率検定)、組織学的分類(SCCで高い; P = 0.0483 カイ二乗検定)、pT ステージ (T2、T3、T4で高い; P = 0.0006 カイ二乗検定)、pN ステージ (N1、N2で高い; P < 0.0001 カイ二乗検定)、および腫瘍特異的生存率(P < 0.0001 ログランク検定)と有意に関連することが判明した(表3a;図4i)。予後因子の単変量および続く多変量解析において、年齢、pTステージ、pNステージ、および強いリン酸化EGFR(Tyr-992)陽性は、独立予後因子であることが示された(表3b、上および下)。腫瘍がTTKもリン酸化EGFR(Tyr-992)も発現していないNSCLC患者は、最も延命効果を受け、一方両マーカーが強い陽性値の患者は最も短い腫瘍特異的生存率であった(P < 0.0001、ログランク検定;図4j)。
Immunohistochemical analysis was further performed with anti-phosphorylated EGFR (Tyr-992) antibody using a tissue microarray consisting of 336 NSCLC and 12 SCLC tissues. Of 366 NSCLC cases, 123 cases (33.6%) showed strong phosphorylated EGFR (Tyr-992) staining (
(表3a)NSCLC組織におけるリン酸化EGFR陽性と患者の特徴との関連(n=366)
ADC, 腺癌; SCC, 扁平上皮癌; LCC, 大細胞癌
* P < 0.05 (カイ二乗検定)
NS, 有意差なし
(Table 3a) Association between phosphorylated EGFR positivity in NSCLC tissues and patient characteristics (n = 366)
ADC, adenocarcinoma; SCC, squamous cell carcinoma; LCC, large cell carcinoma
* P <0.05 (chi-square test)
NS, no significant difference
(表3b)NSCLC患者における予後因子のCoxの比例ハザードモデル解析
1 SCC, 扁平上皮癌
* P < 0.05
NS, 有意差なし
(Table 3b) Cox proportional hazard model analysis of prognostic factors in patients with NSCLC
1 SCC, squamous cell carcinoma
* P <0.05
NS, no significant difference
次に、TTKによるEGFRのリン酸化に対するEGFの必要性が検討された。TTKは血清を欠乏させたCOS-7細胞で外因的に過剰発現させ、リン酸化EGFR(Tyr-992)が、TTKのみを発現する細胞において核周辺に小さい点として検出されることが顕微鏡的に観察された(図4kおよび4l)。内因性リン酸化EGFR(Tyr-992)は、内因的にTTKを過剰発現している、血清を欠乏させたA549細胞の核に局在していたが(図4m、左パネル)、RNAi-TTK (oligo)によるTTKタンパク質の減少は、有意にリン酸化EGFR (Tyr-992)を減少させた(図4m、右パネル)。このデータは、EGF刺激と独立して生じる、EGFRのTyr-992でのTTK誘導性のリン酸化、およびその内部移行を示唆した。 Next, the necessity of EGF for phosphorylation of EGFR by TTK was examined. Microscopically, TTK is overexpressed exogenously in serum-deficient COS-7 cells and phosphorylated EGFR (Tyr-992) is detected as a small spot around the nucleus in cells that express only TTK. Observed (Figures 4k and 4l). Endogenous phosphorylated EGFR (Tyr-992) was localized in the nucleus of serum-deficient A549 cells that overexpress TTK endogenously (Figure 4m, left panel), but RNAi-TTK Reduction of TTK protein by (oligo) significantly reduced phosphorylated EGFR (Tyr-992) (FIG. 4m, right panel). This data suggested TTK-induced phosphorylation of EGFR at Tyr-992 and its internalization that occurred independently of EGF stimulation.
実施例8:TTK依存的腫瘍形成経路における、リン酸化EGFR(Tyr-992)によるMAPKシグナルの活性化
次に、EGFR Tyr-992のリン酸化レベルがA549細胞の分裂期において検討され、このときTTK発現レベルは著しく上昇していた(図5a)。Tyr-992におけるEGFRのリン酸化レベルはリン酸化TTKの発現レベルと一致していた。TTKの大量発現が癌細胞におけるEGFR Tyr-992に必須であるか評価するため、TTK mRNAの発現をTTKに対するsiRNA(RNAi-TTK (oligo))を用いてA549細胞において選択的にノックダウンした。RNAi-TTK (oligo)によるTTKタンパク質の減少はEGFR Tyr-992のリン酸化を減少させ(図5b)、肺癌細胞における内因性TTKがEGFRのリン酸化を誘導することを示した。
Example 8: Activation of MAPK signal by phosphorylated EGFR (Tyr-992) in the TTK-dependent tumorigenic pathway Next, the phosphorylation level of EGFR Tyr-992 was examined in the mitotic phase of A549 cells, where TTK Expression levels were significantly elevated (Figure 5a). The phosphorylation level of EGFR in Tyr-992 was consistent with the expression level of phosphorylated TTK. In order to evaluate whether large expression of TTK is essential for EGFR Tyr-992 in cancer cells, the expression of TTK mRNA was selectively knocked down in A549 cells using siRNA against TTK (RNAi-TTK (oligo)). Reduction of TTK protein by RNAi-TTK (oligo) decreased phosphorylation of EGFR Tyr-992 (FIG. 5b), indicating that endogenous TTK in lung cancer cells induces EGFR phosphorylation.
EGFRのTyr-992は2つのアダプタータンパク質、ホスホリパーゼCγ(PLCγ)およびShcの結合部位であることが公知であり、そのリン酸化はこれらアダプタータンパク質15−17の活性化(リン酸化)に必要とされる。そのため、本発明者らはRNAi-TTK(oligo)によるTTK発現の下方制御後、これらのアダプタータンパク質のリン酸化レベルを検討した。RNAi-TTK(oligo)によるリン酸化EGFR Tyr-992の減少に従って、リン酸化PLCγおよびp44/42 MAPKのリン酸化の減少が観察された一方で、このRNAiはPLCγまたはp44/42 MAPKタンパク質の量には影響を与えなかった(図5b)。免疫細胞化学的解析により、TTK発現ベクターを用いてトランスフェクションしたCOS-7細胞の核において、リン酸化p44/42 MAPKが蓄積されていることが検出された(図5c)。さらに、PLCγとEGFRとの間の相互作用が、TTK発現ベクターをトランスフェクションしたCOS-7細胞由来の抽出物を使用した免疫沈降実験により確認され、その一方で、それらの結合はTTK-KDまたはモックベクターをトランスフェクションした細胞ではほとんど観察されなかった(図5d)。 EGFR Tyr-992 is known to be the binding site for two adapter proteins, phospholipase Cγ (PLCγ) and Shc, and its phosphorylation is required for activation (phosphorylation) of these adapter proteins 15-17. The Therefore, the present inventors examined the phosphorylation levels of these adapter proteins after down-regulating TTK expression by RNAi-TTK (oligo). Decreased phosphorylation of phosphorylated PLCγ and p44 / 42 MAPK was observed as RNAi-TTK (oligo) decreased phosphorylated EGFR Tyr-992, whereas this RNAi increased the amount of PLCγ or p44 / 42 MAPK protein. Had no effect (Figure 5b). Immunocytochemical analysis revealed that phosphorylated p44 / 42 MAPK was accumulated in the nuclei of COS-7 cells transfected with the TTK expression vector (FIG. 5c). Furthermore, the interaction between PLCγ and EGFR was confirmed by immunoprecipitation experiments using extracts from COS-7 cells transfected with a TTK expression vector, while their binding was either TTK-KD or Little was observed in cells transfected with the mock vector (FIG. 5d).
実施例9:EGFRにおけるTTKによる新規リン酸化部位(Ser-967)の同定
TTKによってリン酸化されたGSTタグ付加EGFR-DEL2タンパク質は二重バンドとして検出された(図4f、右パネル)。EGFR Tyr-992がEGFR上の唯一のリン酸化部位であるかどうかを確認するため、[γ-32P]ATPインビトロキナーゼアッセイを、Tyr-992がアラニンに置換された、GSTタグ付加EGFR-DEL2(Y992A)タンパク質を用いて行った。この変異は下部バンドの強度を顕著に減少したが、上部バンドの強度は減少させなかった(図6a)。その事実は本発明者らに、EGFR上の他のTTK依存的リン酸化部位のスクリーニングを促した。MALDIタンデム質量分光分析が、TTKによってインビトロリン酸化されたGSTタグ付加EGFR-DEL2タンパク質を用いて行われ、EGFR Ser-967のリン酸化が検出された(データ示さず)。次に、Ser-967リン酸化合成ペプチドを用いて抗リン酸化EGFR (Ser-967)抗体が免疫化のために産生され、肺癌細胞におけるTTKの発現パターン、リン酸化EGFR (Ser-967)および全EGFRがウエスタンブロッティングにより検討された。興味深いことに、NSCLC細胞におけるEGFR Ser-967のリン酸化レベルはTTKのタンパク質発現レベルと有意に相関し(図6b)、EGFR Ser-967がTTKによってリン酸化されたことを示した。次にTTKをCOS-7細胞において過剰発現させ、リン酸化EGFR (Ser-967)がTTK発現細胞の核で増加することを顕微鏡的に観察した(図6c)。免疫細胞化学的解析により、内因性リン酸化EGFR (Ser-967)が内因性TTKを過剰発現させたA549細胞の核に局在することが証明されたが(図6d、左パネル)、RNAi-TTK (oligo)によるTTKタンパク質発現の抑制はリン酸化EGFR Ser -967のレベルを有意に減少させた(図6d、右パネル)。これらの結果は、EGF刺激と独立に生じる、EGFRのSer-967におけるTTK誘導性リン酸化、およびその核移行を示唆する。
Example 9: Identification of a novel phosphorylation site (Ser-967) by TTK in EGFR
GST-tagged EGFR-DEL2 protein phosphorylated by TTK was detected as a double band (FIG. 4f, right panel). To confirm whether EGFR Tyr-992 is the only phosphorylation site on EGFR, a [γ- 32 P] ATP in vitro kinase assay was performed using a GST-tagged EGFR-DEL2 with Tyr-992 replaced with alanine. (Y992A) was performed using protein. This mutation significantly reduced the intensity of the lower band, but not the intensity of the upper band (FIG. 6a). That fact prompted us to screen for other TTK-dependent phosphorylation sites on EGFR. MALDI tandem mass spectrometry analysis was performed using GST-tagged EGFR-DEL2 protein in vitro phosphorylated by TTK, and phosphorylation of EGFR Ser-967 was detected (data not shown). Next, an anti-phosphorylated EGFR (Ser-967) antibody was produced for immunization using Ser-967 phosphorylated synthetic peptide, and the expression pattern of TTK, phosphorylated EGFR (Ser-967) and total in lung cancer cells EGFR was examined by Western blotting. Interestingly, the phosphorylation level of EGFR Ser-967 in NSCLC cells was significantly correlated with the protein expression level of TTK (FIG. 6b), indicating that EGFR Ser-967 was phosphorylated by TTK. Next, TTK was overexpressed in COS-7 cells, and it was observed microscopically that phosphorylated EGFR (Ser-967) increased in the nucleus of TTK expressing cells (FIG. 6c). Immunocytochemical analysis demonstrated that endogenous phosphorylated EGFR (Ser-967) was localized in the nucleus of A549 cells overexpressing endogenous TTK (Figure 6d, left panel), but RNAi- Inhibition of TTK protein expression by TTK (oligo) significantly reduced the level of phosphorylated EGFR Ser-967 (FIG. 6d, right panel). These results suggest TTK-induced phosphorylation of EGFR in Ser-967 and its nuclear translocation that occurs independently of EGF stimulation.
免疫組織化学的解析はまた、374例のNSCLCから成る組織マイクロアレイを用いた抗リン酸化EGFR (Ser-967)抗体について行われ、リン酸化EGFR (Ser-967)陽性のパターンが、これら腫瘍におけるTTK陽性と有意に一致することが見出され(P < 0.0001)、インビトロアッセイによって得られた結果を独立に確認した。NSCLCにおけるリン酸化EGFR (Ser-967)の強い発現は腫瘍特異的生存度と有意に相関していた(ログランク検定によりP < 0.0001)(図6eおよび6f;詳細は表4aおよび4bに示す)。これらの証拠はまた、TTKによるEGFRのSer-976でのリン酸化が、肺癌細胞の増殖および悪性の性質に有意に影響を与え得ることを示している。 Immunohistochemical analysis was also performed on anti-phosphorylated EGFR (Ser-967) antibodies using a tissue microarray consisting of 374 NSCLC, and a pattern of phosphorylated EGFR (Ser-967) positive was observed in TTK in these tumors. Significant agreement with the positive was found (P <0.0001) and the results obtained by the in vitro assay were independently confirmed. Strong expression of phosphorylated EGFR (Ser-967) in NSCLC was significantly correlated with tumor-specific survival (P <0.0001 by log rank test) (Figures 6e and 6f; details are shown in Tables 4a and 4b) . These evidences also indicate that phosphorylation of EGFR by TTK at Ser-976 can significantly affect the growth and malignant nature of lung cancer cells.
(表4a)NSCLC組織における核EGFR陽性と患者の特徴の相関 (n=351)
ADC, 腺癌; SCC, 扁平上皮癌
他, 大細胞癌および腺扁平上皮癌
*ADC 対 他の組織学的診断
+P < 0.05 (Fisherの直接確率検定)
NS, 有意差なし
(Table 4a) Correlation of nuclear EGFR positivity and patient characteristics in NSCLC tissues (n = 351)
ADC, adenocarcinoma; SCC, squamous cell carcinoma, etc., large cell carcinoma and adenosquamous cell carcinoma
* ADC vs. other histological diagnoses
+ P <0.05 (Fisher's exact test)
NS, no significant difference
(表4b)NSCL患者における予後因子のCoxの比例ハザードモデル解析
1 ADC, 腺癌
* P < 0.05
(Table 4b) Cox proportional hazards model analysis of prognostic factors in NSCL patients
1 ADC, adenocarcinoma
* P <0.05
実施例10:TTK-EGFR経路を標的とすることによる細胞増殖/浸潤の阻害
TTKにより誘導される細胞の増殖/浸潤におけるEGFRの関与をさらに調べるため、本発明者らは次に、TTKを定常的に発現するHEK293由来トランスフェクタントにRNAi-EGFR(oligo)を導入した。HEK293細胞の増殖はRNAi-EGFR(oligo)によってほとんど減少しなかったが(P=0.2439)(モックベクターを導入した対照細胞)、TTK誘導性細胞増殖はRNAi-EGFRによって有意に減少した(P = 0.0032)(図7a)。マトリゲルを通じたTTK導入HEK293細胞における浸潤は、対照細胞と比較して有意に促進され(P < 0.0001)、およびTTK誘導性細胞浸潤はRNAi-EGFRによってベースレベル近くまで減少した(P < 0.0001)。対照細胞の浸潤はRNAi-EGFR (oligo)によってわずかに減少した(P < 0.0001) (P < 0.0161) (図7b)。
Example 10: Inhibition of cell proliferation / invasion by targeting the TTK-EGFR pathway
To further investigate the involvement of EGFR in TTK-induced cell proliferation / invasion, we next introduced RNAi-EGFR (oligo) into a HEK293-derived transfectant that constantly expresses TTK. . The proliferation of HEK293 cells was hardly decreased by RNAi-EGFR (oligo) (P = 0.2439) (control cells transfected with mock vector), but TTK-induced cell proliferation was significantly decreased by RNAi-EGFR (P = 0.0032) (Figure 7a). Invasion in TTK-introduced HEK293 cells through Matrigel was significantly promoted compared to control cells (P <0.0001), and TTK-induced cell invasion was reduced to near base levels by RNAi-EGFR (P <0.0001). Control cell infiltration was slightly reduced by RNAi-EGFR (oligo) (P <0.0001) (P <0.0161) (Figure 7b).
次に、TTKとEGFRタンパク質との結合の生物学的重要性、および肺癌の治療的な標的としてのその可能性が検討された。図3cに示されるように、GSTタグ付加EGFR-DEL2タンパク質(アミノ酸889-1045)におけるEGFR Tyr-992のリン酸化はTTK用量依存的に促進され、一方、EGFR-DEL4(アミノ酸977-1045)タンパク質と称されるEGFR-DEL2のN末端切断型はTyr-992でリン酸化されなかった(データ示さず)。これらの実験は、EGFRにおける88アミノ酸ポリペプチド(アミノ酸889-976)がTTKとの相互作用のために重要な役割を果たすことを示唆した。肺癌細胞の増殖または生存のためのTTKとEGFRとの相互作用の機能的意義を調べるため、本発明者らはこれら2つのタンパク質の結合を阻害すると予測される生物活性細胞透過性ペプチドを開発した。EGFRのコドン889-1001が含まれる19または30アミノ酸配列の、7つの異なるペプチドが合成された(実施例1参照)。これらのペプチドは、膜伝達性11アルギニン残基(11R)にNH2末端で共有結合させた。増殖に対する効果は、A549細胞の培地に7つの11R-EGFRペプチドを添加することにより評価し、11R-EGFR899-917 (SEQ ID NO:44)、 11R-EGFR918-936 (SEQ ID NO:45) あるいは 11R-EGFR937-955 (SEQ ID NO: 46)ペプチドによる処理は、MTTアッセイによって測定される細胞生存度を有意に減少させた(図7c)。 Next, the biological significance of the binding of TTK and EGFR protein and its potential as a therapeutic target for lung cancer were examined. As shown in FIG. 3c, phosphorylation of EGFR Tyr-992 in GST-tagged EGFR-DEL2 protein (amino acids 889-1045) was promoted in a TTK dose-dependent manner, whereas EGFR-DEL4 (amino acids 977-1045) protein The N-terminal truncated form of EGFR-DEL2 referred to as was not phosphorylated by Tyr-992 (data not shown). These experiments suggested that the 88 amino acid polypeptide in EGFR (amino acids 889-976) plays an important role for interaction with TTK. In order to investigate the functional significance of the interaction between TTK and EGFR for the growth or survival of lung cancer cells, we developed a bioactive cell penetrating peptide that is predicted to inhibit the binding of these two proteins. . Seven different peptides of 19 or 30 amino acid sequence containing EGFR codon 889-1001 were synthesized (see Example 1). These peptides were covalently linked at the NH2 terminus to membrane transmissible 11 arginine residues (11R). The effect on proliferation was assessed by adding seven 11R-EGFR peptides to the media of A549 cells, 11R-EGFR899-917 (SEQ ID NO: 44), 11R-EGFR918-936 (SEQ ID NO: 45) or Treatment with 11R-EGFR937-955 (SEQ ID NO: 46) peptide significantly reduced cell viability as measured by MTT assay (FIG. 7c).
実施例11:肺癌におけるTTKの活性化型変異
キナーゼドメインにおける体細胞変異による発癌プロテインキナーゼ活性化は、腫瘍形成の一般的機序の一つである(Herbst, R.S., et al., Nat Rev Cancer. 4, 956-965. (2004); Pal, S.K. and Pegram, M., Anticancer Drugs. 16, 483-494. (2005))。TTKの変異活性化の存在を検討するため、TTKキナーゼドメインが36例の肺癌細胞株および60例の臨床肺癌組織試料から調製したmRNAを用いて直接的に配列決定された(30例の原発性NSCLCおよび30例の原発性NSCLC由来の転移性脳腫瘍)。ミスセンス変異がRERF-LC-AI細胞株のコドン574(Y574C)で見出され、それはSNPデータベースで報告されていなかった(JSNP: http://snp.ims.u-tokyo.ac.jp/index_ja.html; DBSNP: http://www.ncbi.nlm.nih.gov/projects/SNP/)(図8a、左パネル)。さらに、2つのミスセンス変異が原発性肺腺癌由来の2つの転移性脳腫瘍の臨床検体で同定された。前記変異はアミノ酸置換を生じた;コドン610でのバリンからフェニルアラニン(V610F)(症例2;図8a、中パネル)およびコドン753でのグルタミンからヒスチジン(Q753H)(症例8;図8a、右パネル)。これら2人の患者由来の対応正常脳組織は野生型DNA配列のみを示し、これら2つの変異は腫瘍形成または進行の間に体細胞的に生じたことを示している。
Example 11: Activated mutation of TTK in lung cancer Oncogenic protein kinase activation by somatic mutation in the kinase domain is one of the general mechanisms of tumorigenesis (Herbst, RS, et al.,
変異解析によって同定された変異TTKの機能的特性を評価するため、2つの変異TTKタンパク質(Y574CまたはQ753H)を培養哺乳動物細胞において発現させた。自己リン酸化TTK(phospho-TTK)レベルは、野生型TTK(wt-TTK)発現ベクターをトランスフェクションした細胞よりも、変異TTKを発現するNIH-3T3細胞において有意に高く、これらの変異がTTKタンパク質のキナーゼ活性を促進し得ることを示した(図8b)。NIH-3T3細胞の浸潤能力はwt-TTK一過性発現により促進されたため(図3e)、次に、マトリゲル浸潤アッセイをTTK-Y574C構築物をトランスフェクションしたNIH-3T3細胞を用いて行った。NIH-3T3細胞への変異TTK(Y574CまたはQ753H)のトランスフェクションは、wt-TTKのトランスフェクションと比較して、浸潤細胞数の有意な増加をもたらした(図8cおよび8d)。これらの結果は、キナーゼドメインにおけるTTK変異は、肺癌進行に寄与し得る機能亢進型変異のカテゴリに属すると考えられることを示す。 In order to evaluate the functional properties of mutant TTK identified by mutation analysis, two mutant TTK proteins (Y574C or Q753H) were expressed in cultured mammalian cells. Autophosphorylated TTK (phospho-TTK) levels are significantly higher in NIH-3T3 cells expressing mutant TTK than in cells transfected with wild-type TTK (wt-TTK) expression vectors. It was shown that the kinase activity can be promoted (FIG. 8b). Since the invasion ability of NIH-3T3 cells was enhanced by transient expression of wt-TTK (FIG. 3e), a Matrigel invasion assay was then performed using NIH-3T3 cells transfected with the TTK-Y574C construct. Transfection of NIH-3T3 cells with mutant TTK (Y574C or Q753H) resulted in a significant increase in the number of infiltrating cells compared to wt-TTK transfection (FIGS. 8c and 8d). These results indicate that TTK mutations in the kinase domain are considered to belong to the category of hyperactive mutations that can contribute to lung cancer progression.
考察
Mps1(TTKはそのヒトホモログである)は中心体複製において必要とされる因子として出芽酵母で最初に発見され(Winey M, et al., J Cell Biol. 1991 Aug;114(4):745-54.)、その後紡錘体チェックポイントにおける重要な機能を有することが示された (Weiss E & Winey M. J Cell Biol. 1996 Jan;132(1-2):111-23.)。ヒトにおいて、TTKの過剰発現はいくつかの癌において発見されているが、しかし発癌におけるその機能的意義はいまだ不明確なままであった(Stucke VM, et al., EMBO J. 2002 Apr 2;21(7):1723-32.)。
Consideration
Mps1 (TTK is its human homolog) was first discovered in budding yeast as a factor required for centrosome replication (Winey M, et al., J Cell Biol. 1991 Aug; 114 (4): 745-54 ), And was later shown to have an important function in the spindle checkpoint (Weiss E & Winey M. J Cell Biol. 1996 Jan; 132 (1-2): 111-23.). In humans, overexpression of TTK has been found in several cancers, but its functional significance in carcinogenesis remains unclear (Stucke VM, et al., EMBO J. 2002
TTKに対する特異的なsiRNAを用いたNSCLC細胞の処理は、その発現を減少させ、増殖抑制を生じることが本明細書において示されている。哺乳動物細胞におけるTTKの導入による増殖促進効果はまた、その発癌機能をサポートする。インビトロおよびインビボアッセイによって得られた結果は、ヒト癌におけるTTKの重要な役割、ならびにTTK経路を標的とした分子のスクリーニングが肺癌治療のための有望な治療的アプローチを提供することを示唆する。その経路が様々な組織の発癌に関連しているEGFRは、本明細書においてTTKキナーゼの新規な細胞内標的分子として明らかにされている。また、TTKおよびリン酸化EGFR(Tyr-992またはSer-967)の高いレベルを示すNSCLC患者が、より短い腫瘍特異的生存期間を示すという、組織マイクロアレイ解析による発見が、本明細書中に示されている。EGFR自己リン酸化はEGF刺激の後のMAPKカスケードの活性化において重要な役割を果たすことが示されている。EGFRのリン酸化部位のうち、Tyr-992はPLCγに対する高い結合親和性部位であることが証明されており、EGF刺激によるPLCγ活性化に必要とされる(Rotin D, et al., EMBO J. 1992 Feb;11(2):559-67.)。PLCγは、イノシトール1,4,5-三リン酸産生および細胞質Ca2+における周期的変動によってRas/MAPKカスケードを活性化する(Schmidt-Ullrich RK, Oncogene. 2003 Sep 1;22(37):5855-65.)。MAPキナーゼ経路の活性化は細胞分裂と関連しており、その異常な活性は腫瘍において発生する制御できない細胞増殖に関連すると推測される(Pal SK & Pegram M. Anticancer Drugs. 2005 Jun;16(5):483-94.)。興味深いことに、本明細書におけるデータは、TTKによるTyr-992およびSer-967でのEGFRのリン酸化がEGF刺激とは独立していることを示している。EGFR Ser-967のリン酸化は、恒常的なリン酸化であることが報告されているが(Elisabetta et al., 2005)、しかし、その機能のどの役割にも関連していなかった。Ser-967でのEGFRのリン酸化は主に核EGFRにおいて検出された。核EGFRは近年、転写因子または転写コアクチベーターとして報告された(Lin et al., Nat Cell Biol. 3:802-8 (2001))。本発明者らのデータはSer-967でのEGFRのリン酸化は肺癌形成の間、EGFRの核移行に重要であるかもしれないことを示した。
It has been shown herein that treatment of NSCLC cells with specific siRNA against TTK reduces its expression and results in growth suppression. The growth promoting effect of TTK introduction in mammalian cells also supports its oncogenic function. The results obtained by in vitro and in vivo assays suggest that TTK plays an important role in human cancer, and that screening for molecules targeting the TTK pathway provides a promising therapeutic approach for lung cancer treatment. EGFR, whose pathway is related to carcinogenesis in various tissues, is disclosed herein as a novel intracellular target molecule for TTK kinase. Also shown herein is the discovery by tissue microarray analysis that NSCLC patients with high levels of TTK and phosphorylated EGFR (Tyr-992 or Ser-967) show shorter tumor-specific survival. ing. EGFR autophosphorylation has been shown to play an important role in the activation of the MAPK cascade following EGF stimulation. Of the phosphorylation sites of EGFR, Tyr-992 has been proven to be a high binding affinity site for PLCγ and is required for EGF-stimulated PLCγ activation (Rotin D, et al., EMBO J. 1992 Feb; 11 (2): 559-67.). PLCγ activates the Ras / MAPK cascade by periodic variation in
36例の肺癌細胞株ならびに60例の原発性および転移性NSCLCにおけるTTKキナーゼドメインのDNA配列もまた検討され、そこから細胞浸潤活性を促進する活性化変異を有する1つの肺扁平上皮癌細胞株が同定された。点変異はまた、腺癌の脳転移性病変の2例においても発見された。興味深いことに、TTKプロテインキナーゼの大量発現は様々な組織学的型の肺癌試料の大多数において観察され、進行期腫瘍でより高い発現が、特に脳転移において観察された(図9)。以前の報告はまた、EGFR-PLCγシグナル経路が、前立腺癌、乳癌ならびに頭頚部扁平上皮癌の浸潤性および転移性部位において特に重要な役割を果たすことを示している(Chen P, et al., J Cell Biol. 1994 Feb;124(4):547-55.; Chen P, et al., J Cell Biol. 1994 Nov;127(3):847-57.; Thomas SM, et al., Cancer Res. 2003 Sep 1;63(17):5629-35.)。これらのインビトロおよびインビボのデータは、EGFR-PLCγ情報伝達経路の活性化を介したTTKが、脳転移と関連する鍵分子として重要な役割を果たすこと、およびTTK変異を保有する肺癌患者の特異的集団は、より脳転移性疾患になる可能性があることを示した。
The DNA sequence of the TTK kinase domain in 36 lung cancer cell lines and 60 primary and metastatic NSCLC was also examined, from which one lung squamous cell carcinoma cell line with an activating mutation that promotes cell invasive activity was Identified. Point mutations were also found in two cases of brain metastatic lesions of adenocarcinoma. Interestingly, abundant expression of TTK protein kinase was observed in the majority of various histological types of lung cancer samples, with higher expression observed in advanced stage tumors, especially in brain metastases (FIG. 9). Previous reports have also shown that the EGFR-PLCγ signaling pathway plays a particularly important role in invasive and metastatic sites of prostate cancer, breast cancer and squamous cell carcinoma of the head and neck (Chen P, et al., J Cell Biol. 1994 Feb; 124 (4): 547-55 .; Chen P, et al., J Cell Biol. 1994 Nov; 127 (3): 847-57 .; Thomas SM, et al., Cancer Res 2003
要約すると、本発明はEGFR情報伝達が活性化TTKキナーゼによって細胞内で制御されること、TTK酵素活性を標的にすることにより、肺癌患者の治療のための新しい戦略が開発されるものと期待されることを、初めて強く示している。 In summary, the present invention is expected to develop a new strategy for the treatment of lung cancer patients by targeting EGFR signaling in cells by activated TTK kinase and targeting TTK enzyme activity. For the first time.
産業上の利用可能性
本明細書において示されたように、TTKはEGFRに対するキナーゼ活性を有しており、およびこの活性の抑制は肺癌細胞の細胞増殖の抑制につながる。したがって、EGFRに対するTTKのキナーゼ活性を阻害する薬剤は、肺癌の治療のための抗癌剤としての、治療上の有用性を有する。例えば、TTKによるEGFRのリン酸化部位は、EGFから独立したリン酸化である、Try922またはSer967である。
Industrial Applicability As demonstrated herein, TTK has kinase activity against EGFR, and inhibition of this activity leads to inhibition of cell proliferation of lung cancer cells. Therefore, an agent that inhibits the kinase activity of TTK against EGFR has therapeutic utility as an anticancer agent for the treatment of lung cancer. For example, the phosphorylation site of EGFR by TTK is Try922 or Ser967, which is phosphorylation independent of EGF.
また、本発明はEGFRに対するTTKキナーゼ活性を阻害する抗癌剤のスクリーニング方法を提供する。EGFRは成長シグナル伝達経路の重要な仲介物質として認識されている。したがって、細胞増殖のための重要な工程を阻害する候補化合物が本発明により同定され得ると予測される。 The present invention also provides a method for screening an anticancer agent that inhibits TTK kinase activity against EGFR. EGFR is recognized as an important mediator of the growth signaling pathway. Thus, it is expected that candidate compounds that inhibit key steps for cell proliferation can be identified by the present invention.
さらに、本発明はTTKに対するsiRNAを用いた肺癌細胞の治療が、その発現を抑制するとともに、Tyr-992またはSer-967でのEGFRに対するTTKのキナーゼ活性を抑制し、したがって、癌細胞の増殖を抑制することを示している。このデータは、TTK機能の上方制御およびEGFRに対するTTKのキナーゼ活性が肺癌形成の一般的特徴であることを意味する。したがって、TTKキナーゼ活性の選択的な抑制は、肺癌患者の治療のための有望な治療的戦略となりうる。 Furthermore, the present invention shows that treatment of lung cancer cells with siRNA against TTK suppresses its expression and suppresses TTK kinase activity against EGFR in Tyr-992 or Ser-967, thus preventing cancer cell proliferation. It shows that it suppresses. This data implies that upregulation of TTK function and kinase activity of TTK against EGFR are general features of lung cancer formation. Thus, selective inhibition of TTK kinase activity can be a promising therapeutic strategy for the treatment of lung cancer patients.
あるいは、肺癌は、診断マーカーとしてEGFRに対するTTKキナーゼ活性を用いて検出することができる。 Alternatively, lung cancer can be detected using TTK kinase activity against EGFR as a diagnostic marker.
さらに、TTK発現および/またはリン酸化EGFRの高いレベルは、肺癌を有する患者の予後不良と有意に関連していることが本明細書において示された。従って、肺癌の予後は、TTK発現レベルおよび/またはリン酸化EGFR(Tyr992またはSer967)を測定することで評価または判定することができる。 Furthermore, it has been shown herein that high levels of TTK expression and / or phosphorylated EGFR are significantly associated with poor prognosis in patients with lung cancer. Therefore, the prognosis of lung cancer can be evaluated or determined by measuring TTK expression level and / or phosphorylated EGFR (Tyr992 or Ser967).
また、本発明において、TTK変異が肺癌転移の高いリスクと関連していることが示されている。従って、肺癌転移のリスク評価は上記変異を検出することによって達成することができる。さらに、TTK変異の検出方法も本発明によって提供される。 In the present invention, it has also been shown that TTK mutations are associated with a high risk of lung cancer metastasis. Therefore, risk assessment of lung cancer metastasis can be achieved by detecting the mutation. Furthermore, a method for detecting a TTK mutation is also provided by the present invention.
本明細書で引用された全ての特許、特許出願及び刊行物は、それらの全体において、引用により組み込まれる。しかしながら、本明細書において、本発明は先願発明による開示が先行するために権利を与えられないと自認しているものと解釈されるべきではない。 All patents, patent applications and publications cited herein are incorporated by reference in their entirety. However, this invention should not be construed as an admission that the invention is not entitled to antedate prior disclosure by the prior invention.
本発明は詳細に、およびその特定の実施態様に関して記載されているが、前述の記載は、事実上例示的および説明的なものであって、本発明およびその好ましい態様を例示することを意図するものと理解されるべきである。当業者は、日常的な実験を通して、本発明の精神および範囲から逸脱することなく、様々な変更および修正がなされ得ることを容易に理解すると考えられる。当業者により理解されるように、さらなる利点および特徴が、合理的な等価物により決定されるべき特許請求の範囲とともに、添付の特許請求の範囲から明白となるであろう。それゆえ、本発明は上記の記載によって規定されるのではなく、添付の特許請求の範囲およびそれらの等価物によって規定されることが意図される。 Although the invention has been described in detail and with reference to specific embodiments thereof, the foregoing description is illustrative and explanatory in nature and is intended to exemplify the invention and its preferred embodiments. Should be understood. Those skilled in the art will readily appreciate through routine experimentation that various changes and modifications can be made without departing from the spirit and scope of the invention. As will be appreciated by one skilled in the art, further advantages and features will become apparent from the appended claims, along with the claims that are to be determined by reasonable equivalents. Thus, the invention is intended to be defined not by the above description, but by the following claims and their equivalents.
Claims (47)
a. 肺癌の予後を評価する対象から採取した試料におけるTTK発現レベルおよびEGFRリン酸化レベルのいずれかまたは両方を検出する工程、および
b. TTK発現レベルおよびEGFRリン酸化レベルのいずれかまたは両方の上昇が、対照レベルと比較して検出された場合に予後不良を示す工程。 A method for assessing the prognosis of lung cancer comprising the following steps:
a. detecting either or both of TTK expression level and EGFR phosphorylation level in a sample taken from a subject to assess prognosis of lung cancer, and
b. showing a poor prognosis when an increase in either or both of the TTK expression level and EGFR phosphorylation level is detected compared to the control level.
(a) SEQ ID NO:2のアミノ酸配列をコードするmRNAの存在を検出する方法、
(b) SEQ ID NO:2のアミノ酸配列を含むタンパク質の存在を検出する方法、および
(c) SEQ ID NO:2のアミノ酸配列を含むタンパク質の生物活性を検出する方法。 The method of claim 1, wherein the TTK expression level is detected by any one method selected from the group consisting of:
(a) a method for detecting the presence of mRNA encoding the amino acid sequence of SEQ ID NO: 2,
(b) a method for detecting the presence of a protein comprising the amino acid sequence of SEQ ID NO: 2, and
(c) A method for detecting the biological activity of a protein comprising the amino acid sequence of SEQ ID NO: 2.
(a) SEQ ID NO:2のアミノ酸配列をコードするmRNAを検出する試薬、
(b) SEQ ID NO:2のアミノ酸配列を含むタンパク質、あるいは、SEQ ID NO:42の992アミノ酸残基のチロシンまたは967アミノ酸残基のセリンを検出する試薬、ならびに
(c) SEQ ID NO:2のアミノ酸配列を含むタンパク質の生物活性を検出する試薬。 A kit for assessing prognosis of lung cancer comprising any one component selected from the group consisting of:
(a) a reagent for detecting an mRNA encoding the amino acid sequence of SEQ ID NO: 2,
(b) a protein comprising the amino acid sequence of SEQ ID NO: 2, or a reagent for detecting tyrosine of the 992 amino acid residue of SEQ ID NO: 42 or serine of the 967 amino acid residue, and
(c) A reagent for detecting the biological activity of a protein comprising the amino acid sequence of SEQ ID NO: 2.
a) SEQ ID NO:2のアミノ酸配列をコードするmRNAを検出する方法、
b) SEQ ID NO:2のアミノ酸配列を含むタンパク質を検出する方法、および
c) SEQ ID NO:2のアミノ酸配列を含むタンパク質の生物活性を検出する方法。 7. The method of claim 6, wherein the TTK expression level is determined by a method selected from the group consisting of:
a) a method of detecting mRNA encoding the amino acid sequence of SEQ ID NO: 2;
b) a method for detecting a protein comprising the amino acid sequence of SEQ ID NO: 2, and
c) A method for detecting the biological activity of a protein comprising the amino acid sequence of SEQ ID NO: 2.
a. TTKによるEGFRリン酸化に適した条件下でEGFRまたはその機能的等価物とTTKとをインキュベートする工程であって、TTKが以下から成る群から選択される、工程:
i. SEQ ID NO:2(TTK)のアミノ酸配列を含むポリペプチド;
ii. SEQ ID NO:2の一つまたは複数のアミノ酸が置換、欠失または挿入されたアミノ酸配列を含むポリペプチドであって、結果として得られるポリペプチドがSEQ ID NO:2のアミノ酸配列から成るポリペプチドと等価な生物活性を有する、ポリペプチド;
iii. SEQ ID NO:1の核酸配列から成るポリヌクレオチドにストリンジェントな条件下でハイブリダイズするポリヌクレオチドによってコードされるポリペプチドであって、結果として得られるポリペプチドがSEQ ID NO:2のアミノ酸配列から成るポリペプチドと等価な生物活性を有する、ポリペプチド;
b. リン酸化EGFRレベルを検出する工程;および
c. 工程(b)で検出されたリン酸化EGFRレベルと相関させることにより、TTKキナーゼ活性を測定する工程。 A method for measuring the kinase activity of TTK against EGFR comprising the following steps:
incubating EGFR or a functional equivalent thereof with TTK under conditions suitable for EGFR phosphorylation by TTK, wherein TTK is selected from the group consisting of:
i. a polypeptide comprising the amino acid sequence of SEQ ID NO: 2 (TTK);
ii. A polypeptide comprising an amino acid sequence in which one or more amino acids of SEQ ID NO: 2 are substituted, deleted or inserted, and the resulting polypeptide consists of the amino acid sequence of SEQ ID NO: 2 A polypeptide having a biological activity equivalent to the polypeptide;
iii. a polypeptide encoded by a polynucleotide that hybridizes under stringent conditions to a polynucleotide comprising the nucleic acid sequence of SEQ ID NO: 1, wherein the resulting polypeptide is an amino acid of SEQ ID NO: 2 A polypeptide having a biological activity equivalent to a polypeptide comprising the sequence;
b. detecting phosphorylated EGFR levels; and
c. A step of measuring TTK kinase activity by correlating with the phosphorylated EGFR level detected in step (b).
a. TTKによるEGFRのリン酸化に適した条件の下、試験化合物の存在下でEGFRまたはその機能的等価物とTTKとをインキュベートする工程であって、TTKが以下から成る群から選択されるポリペプチドである、工程:
i. SEQ ID NO:2(TTK)のアミノ酸配列を含むポリペプチド;
ii. SEQ ID NO:2の一つまたは複数のアミノ酸が置換、欠失または挿入されたアミノ酸配列を含むポリペプチドであって、結果として得られるポリペプチドがSEQ ID NO:2のアミノ酸配列から成るポリペプチドと等価な生物活性を有する、ポリペプチド;
iii. SEQ ID NO:1の核酸配列から成るポリヌクレオチドにストリンジェントな条件下でハイブリダイズするポリヌクレオチドによってコードされるポリペプチドであって、結果として得られるポリペプチドがSEQ ID NO:2のアミノ酸配列から成るポリペプチドと等価な生物活性を有する、ポリペプチド;
b. リン酸化EGFRレベルを検出する工程;および
c. 対照レベルとリン酸化EGFRレベルとを比較する工程であって、正常対照レベルと比較したリン酸化EGFRレベルにおける増減が、該試験化合物がEGFRに対するTTKキナーゼ活性を改変することを示す、工程。 A method for identifying an agent that alters TTK kinase activity against EGFR comprising the following steps:
a step of incubating EGFR or a functional equivalent thereof with TTK in the presence of a test compound under conditions suitable for phosphorylation of EGFR by TTK, wherein TTK is selected from the group consisting of Steps that are peptides:
i. a polypeptide comprising the amino acid sequence of SEQ ID NO: 2 (TTK);
ii. A polypeptide comprising an amino acid sequence in which one or more amino acids of SEQ ID NO: 2 are substituted, deleted or inserted, and the resulting polypeptide consists of the amino acid sequence of SEQ ID NO: 2 A polypeptide having a biological activity equivalent to the polypeptide;
iii. a polypeptide encoded by a polynucleotide that hybridizes under stringent conditions to a polynucleotide comprising the nucleic acid sequence of SEQ ID NO: 1, wherein the resulting polypeptide is an amino acid of SEQ ID NO: 2 A polypeptide having a biological activity equivalent to a polypeptide comprising the sequence;
b. detecting phosphorylated EGFR levels; and
c. Comparing a control level with a phosphorylated EGFR level, wherein an increase or decrease in phosphorylated EGFR level compared to a normal control level indicates that the test compound modifies TTK kinase activity against EGFR.
a. TTKによるEGFRのリン酸化に適した条件の下、試験化合物の存在下でEGFRまたはその機能的等価物とTTKとをインキュベートする工程であって、TTKが以下から成る群から選択されるポリペプチドである、工程:
i. SEQ ID NO:2(TTK)のアミノ酸配列を含むポリペプチド;
ii. SEQ ID NO:2の一つまたは複数のアミノ酸が置換、欠失または挿入されたアミノ酸配列を含むポリペプチドであって、該ポリペプチドがSEQ ID NO:2のアミノ酸配列から成るポリペプチドと等価な生物活性を有する、ポリペプチド;
iii. SEQ ID NO:1の核酸配列から成るポリヌクレオチドにストリンジェントな条件下でハイブリダイズするポリヌクレオチドによってコードされるポリペプチドであって、該ポリペプチドがSEQ ID NO:2のアミノ酸配列から成るポリペプチドと等価な生物活性を有する、ポリペプチド;
b. リン酸化EGFRレベルを検出する工程;および
c. 対照レベルと比較したリン酸化EGFRレベルを減少させる化合物を選択する工程。 A method for screening a compound for treating and / or preventing lung cancer, comprising the following steps:
a step of incubating EGFR or a functional equivalent thereof with TTK in the presence of a test compound under conditions suitable for phosphorylation of EGFR by TTK, wherein TTK is selected from the group consisting of Steps that are peptides:
i. a polypeptide comprising the amino acid sequence of SEQ ID NO: 2 (TTK);
ii. A polypeptide comprising an amino acid sequence in which one or more amino acids of SEQ ID NO: 2 are substituted, deleted or inserted, wherein the polypeptide comprises the amino acid sequence of SEQ ID NO: 2; A polypeptide having an equivalent biological activity;
iii. A polypeptide encoded by a polynucleotide that hybridizes under stringent conditions to a polynucleotide comprising the nucleic acid sequence of SEQ ID NO: 1, wherein the polypeptide comprises the amino acid sequence of SEQ ID NO: 2. A polypeptide having a biological activity equivalent to the polypeptide;
b. detecting phosphorylated EGFR levels; and
c. selecting a compound that reduces phosphorylated EGFR levels compared to control levels.
A) 以下から成る群から選択されるポリペプチド:
i. SEQ ID NO:2(TTK)のアミノ酸配列を含むポリペプチド;
ii. SEQ ID NO:2の一つまたは複数のアミノ酸が置換、欠失または挿入されたアミノ酸配列を含むポリペプチドであって、結果として得られるポリペプチドがSEQ ID NO:2のアミノ酸配列から成るポリペプチドと等価な生物活性を有する、ポリペプチド;
iii. SEQ ID NO:1の核酸配列から成るポリヌクレオチドにストリンジェントな条件下でハイブリダイズするポリヌクレオチドによってコードされるポリペプチドであって、結果として得られるポリペプチドがSEQ ID NO:2のアミノ酸配列から成るポリペプチドと等価な生物活性を有する、ポリペプチド;
B) SEQ ID NO:43のアミノ酸配列を含むEGFRまたはEGFR断片;および
C) リン酸化EGFRを検出する試薬。 A kit comprising the following components for detecting the ability of a test compound to alter the kinase activity of TTK against EGFR:
A) A polypeptide selected from the group consisting of:
i. a polypeptide comprising the amino acid sequence of SEQ ID NO: 2 (TTK);
ii. A polypeptide comprising an amino acid sequence in which one or more amino acids of SEQ ID NO: 2 are substituted, deleted or inserted, and the resulting polypeptide consists of the amino acid sequence of SEQ ID NO: 2 A polypeptide having a biological activity equivalent to the polypeptide;
iii. a polypeptide encoded by a polynucleotide that hybridizes under stringent conditions to a polynucleotide comprising the nucleic acid sequence of SEQ ID NO: 1, wherein the resulting polypeptide is an amino acid of SEQ ID NO: 2 A polypeptide having a biological activity equivalent to a polypeptide comprising the sequence;
B) an EGFR or EGFR fragment comprising the amino acid sequence of SEQ ID NO: 43; and
C) Reagent for detecting phosphorylated EGFR.
A) SEQ ID NO:43のアミノ酸配列を含むEGFRまたはEGFR断片、および以下から成る群から選択されるポリペプチドを発現する細胞:
i. SEQ ID NO:2のアミノ酸配列を含むポリペプチド(TTK);
ii. SEQ ID NO:2の一つまたは複数のアミノ酸が置換、欠失または挿入されたアミノ酸配列を含むポリペプチドであって、結果として得られるポリペプチドがSEQ ID NO:2のアミノ酸配列から成るポリペプチドと等価な生物活性を有する、ポリペプチド;
iii. SEQ ID NO:1の核酸配列から成るポリヌクレオチドにストリンジェントな条件下でハイブリダイズするポリヌクレオチドによってコードされるポリペプチドであって、結果として得られるポリペプチドがSEQ ID NO:2のアミノ酸配列から成るポリペプチドと等価な生物活性を有する、ポリペプチド;
B) リン酸化EGFRを検出する試薬。 A kit comprising the following components for detecting the ability of a test compound to alter the kinase activity of TTK against EGFR:
A) EGFR or EGFR fragment comprising the amino acid sequence of SEQ ID NO: 43, and a cell expressing a polypeptide selected from the group consisting of:
i. a polypeptide comprising the amino acid sequence of SEQ ID NO: 2 (TTK);
ii. A polypeptide comprising an amino acid sequence in which one or more amino acids of SEQ ID NO: 2 are substituted, deleted or inserted, and the resulting polypeptide consists of the amino acid sequence of SEQ ID NO: 2 A polypeptide having a biological activity equivalent to the polypeptide;
iii. a polypeptide encoded by a polynucleotide that hybridizes under stringent conditions to a polynucleotide comprising the nucleic acid sequence of SEQ ID NO: 1, wherein the resulting polypeptide is an amino acid of SEQ ID NO: 2 A polypeptide having a biological activity equivalent to a polypeptide comprising the sequence;
B) Reagent for detecting phosphorylated EGFR.
a. キナーゼドメインにおけるTTKの1つまたは複数の変異を検出する工程、
b. 変異を検出した場合、肺癌の転移の高い危険度を示す工程。 A method for predicting metastasis of lung cancer comprising the following steps:
a. detecting one or more mutations of TTK in the kinase domain;
b. A process that indicates a high risk of lung cancer metastasis if a mutation is detected.
a) 対象ポリペプチドまたはそれをコードするcDNAと、ポリペプチドまたはそれをコードするcDNAの変異のいずれか1つを認識する結合薬剤とを接触させる工程、
b) ポリペプチドまたはそれをコードするcDNAと結合薬剤とを検出する工程、および
c) 工程b)の薬剤の結合が検出された場合、TTKの変異が示される工程。 A method of detecting one or more mutations in TTK comprising the steps of: valine to phenylalanine (V610F) at codon 610 of SEQ ID NO: 2, glutamine to histidine at codon 753 (Q753H) And at least one mutation selected from the group consisting of tyrosine to cysteine (Y574C) at codon 574, the method:
a) contacting the polypeptide of interest or cDNA encoding the polypeptide with a binding agent that recognizes any one of the mutations of the polypeptide or cDNA encoding the polypeptide,
b) detecting the polypeptide or cDNA encoding it and a binding agent; and
c) A step in which a TTK mutation is indicated when binding of the drug in step b) is detected.
(b) ISSILEKGERLPQPPICTI(SEQ ID NO:44)、DVYMIMVKCWMIDADSRPK(SEQ ID NO:45)およびFRELIIEFSKMARDPQRYL(SEQ ID NO:46)から成る群から選択されるポリペプチドと機能的に等価なポリペプチドであって、
SEQ ID NO:2のアミノ酸配列から成るポリペプチドの生物機能を欠く、ポリペプチド
から成る群から選択される少なくともいずれか1つのポリペプチド、または、
(a)および(b)のポリペプチドから選択されるポリペプチドをコードするポリヌクレオチド
を投与する工程を含む、肺癌の治療または予防方法。 (a) a polypeptide comprising ISSILEKGERLPQPPICTI (SEQ ID NO: 44), DVYMIMVKCWMIDADSRPK (SEQ ID NO: 45) or FRELIIEFSKMARDPQRYL (SEQ ID NO: 46), and
(b) a polypeptide functionally equivalent to a polypeptide selected from the group consisting of ISSILEKGERLPQPPICTI (SEQ ID NO: 44), DVYMIMVKCWMIDADSRPK (SEQ ID NO: 45) and FRELIIEFSKMARDPQRYL (SEQ ID NO: 46),
At least one polypeptide selected from the group consisting of polypeptides lacking the biological function of the polypeptide consisting of the amino acid sequence of SEQ ID NO: 2, or
A method for treating or preventing lung cancer, comprising a step of administering a polynucleotide encoding a polypeptide selected from the polypeptides of (a) and (b).
(b) ISSILEKGERLPQPPICTI(SEQ ID NO:44)、DVYMIMVKCWMIDADSRPK(SEQ ID NO:45)およびFRELIIEFSKMARDPQRYL(SEQ ID NO:46)から成る群から選択されるポリペプチドと機能的に等価なポリペプチドであって、
SEQ ID NO:2のアミノ酸配列から成るポリペプチドの生物機能を欠く、ポリペプチド
から成る群から選択される少なくともいずれか1つのポリペプチド、または、
(a)および(b)のポリペプチドから選択されるポリペプチドをコードするポリヌクレオチド
の薬学的な有効量、ならびに薬学的に許容される担体を含む、肺癌の治療または予防のための組成物。 (a) a polypeptide comprising ISSILEKGERLPQPPICTI (SEQ ID NO: 44), DVYMIMVKCWMIDADSRPK (SEQ ID NO: 45) or FRELIIEFSKMARDPQRYL (SEQ ID NO: 46), and
(b) a polypeptide functionally equivalent to a polypeptide selected from the group consisting of ISSILEKGERLPQPPICTI (SEQ ID NO: 44), DVYMIMVKCWMIDADSRPK (SEQ ID NO: 45) and FRELIIEFSKMARDPQRYL (SEQ ID NO: 46),
At least one polypeptide selected from the group consisting of polypeptides lacking the biological function of the polypeptide consisting of the amino acid sequence of SEQ ID NO: 2, or
A composition for treating or preventing lung cancer, comprising a pharmaceutically effective amount of a polynucleotide encoding a polypeptide selected from the polypeptides of (a) and (b), and a pharmaceutically acceptable carrier.
(a) ISSILEKGERLPQPPICTI(SEQ ID NO:44)、DVYMIMVKCWMIDADSRPK(SEQ ID NO:45)またはFRELIIEFSKMARDPQRYL(SEQ ID NO:46)を含むポリペプチド、および
(b) ISSILEKGERLPQPPICTI(SEQ ID NO:44)、DVYMIMVKCWMIDADSRPK(SEQ ID NO:45)およびFRELIIEFSKMARDPQRYL(SEQ ID NO:46)から成る群から選択されるポリペプチドと機能的に等価なポリペプチドのアミノ酸配列を有するポリペプチドであって、
SEQ ID NO:2のアミノ酸配列から成るポリペプチドの生物機能を欠く、ポリペプチド。 A polypeptide selected from the group consisting of:
(a) a polypeptide comprising ISSILEKGERLPQPPICTI (SEQ ID NO: 44), DVYMIMVKCWMIDADSRPK (SEQ ID NO: 45) or FRELIIEFSKMARDPQRYL (SEQ ID NO: 46), and
(b) an amino acid sequence of a polypeptide functionally equivalent to a polypeptide selected from the group consisting of ISSILEKGERLPQPPICTI (SEQ ID NO: 44), DVYMIMVKCWMIDADSRPK (SEQ ID NO: 45) and FRELIIEFSKMARDPQRYL (SEQ ID NO: 46) A polypeptide comprising:
A polypeptide lacking the biological function of a polypeptide consisting of the amino acid sequence of SEQ ID NO: 2.
[R]-[D]
を有し、式中、[R]が細胞膜透過性物質を表し;かつ[D]が、ISSILEKGERLPQPPICTI(SEQ ID NO:44)またはDVYMIMVKCWMIDADSRPK(SEQ ID NO:45)またはFRELIIEFSKMARDPQRYL(SEQ ID NO:46)を含む断片配列のアミノ酸配列;あるいは該断片配列を含むポリペプチドと機能的に等価なポリペプチドのアミノ酸配列を表し、
該ポリペプチドがSEQ ID NO:2のアミノ酸配列から成るポリペプチドの生物機能を欠い
ており、
[R]および[D]が、GGGから成るアミノ酸配列を含むリンカーで直接または間接的に連結されている、
請求項41記載のポリペプチド。 General formula:
[R]-[D]
Wherein [R] represents a cell membrane permeable substance; and [D] is ISSILEKGERLPQPPICTI (SEQ ID NO: 44) or DVYMIMVKCWMIDADSRPK (SEQ ID NO: 45) or FRELIIEFSKMARDPQRYL (SEQ ID NO: 46) An amino acid sequence of a fragment sequence comprising; or an amino acid sequence of a polypeptide functionally equivalent to a polypeptide comprising the fragment sequence;
The polypeptide lacks the biological function of the polypeptide consisting of the amino acid sequence of SEQ ID NO: 2,
[R] and [D] are connected directly or indirectly with a linker comprising an amino acid sequence consisting of GGG,
42. The polypeptide of claim 41.
ポリアルギニン;
Tat / RKKRRQRRR/SEQ ID NO:47;
ペネトラチン / RQIKIWFQNRRMKWKK/SEQ ID NO:48;
ブフォリンII / TRSSRAGLQFPVGRVHRLLRK/SEQ ID NO:49;
トランスポータン / GWTLNSAGYLLGKINLKALAALAKKIL/SEQ ID NO:50;
MAP (モデル両親媒性ペプチド) / KLALKLALKALKAALKLA/SEQ ID NO:51;
K-FGF / AAVALLPAVLLALLAP/SEQ ID NO:52;
Ku70 / VPMLK/SEQ ID NO:53
Ku70 / PMLKE/SEQ ID NO:61;
プリオン / MANLGYWLLALFVTMWTDVGLCKKRPKP/SEQ ID NO:54;
pVEC / LLIILRRRIRKQAHAHSK/SEQ ID NO:55;
Pep-1 / KETWWETWWTEWSQPKKKRKV/SEQ ID NO:56;
SynB1 / RGGRLSYSRRRFSTSTGR/SEQ ID NO:57;
Pep-7 / SDLWEMMMVSLACQY/SEQ ID NO:58;および
HN-1 / TSPLNIHNGQKL/SEQ ID NO:59。 43. The polypeptide of claim 42, wherein the cell membrane permeable substance is any one selected from the group consisting of:
Polyarginine;
Tat / RKKRRQRRR / SEQ ID NO: 47;
Penetratin / RQIKIWFQNRRMKWKK / SEQ ID NO: 48;
Buforin II / TRSSRAGLQFPVGRVHRLLRK / SEQ ID NO: 49;
Transportan / GWTLNSAGYLLGKINLKALAALAKKIL / SEQ ID NO: 50;
MAP (model amphipathic peptide) / KLALKLALKALKAALKLA / SEQ ID NO: 51;
K-FGF / AAVALLPAVLLALLAP / SEQ ID NO: 52;
Ku70 / VPMLK / SEQ ID NO: 53
Ku70 / PMLKE / SEQ ID NO: 61;
Prion / MANLGYWLLALFVTMWTDVGLCKKRPKP / SEQ ID NO: 54;
pVEC / LLIILRRRIRKQAHAHSK / SEQ ID NO: 55;
Pep-1 / KETWWETWWTEWSQPKKKRKV / SEQ ID NO: 56;
SynB1 / RGGRLSYSRRRFSTSTGR / SEQ ID NO: 57;
Pep-7 / SDLWEMMMVSLACQY / SEQ ID NO: 58; and
HN-1 / TSPLNIHNGQKL / SEQ ID NO: 59.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US87479106P | 2006-12-13 | 2006-12-13 | |
| PCT/JP2007/074359 WO2008072777A2 (en) | 2006-12-13 | 2007-12-12 | Ttk as tumor marker and therapeutic target for lung cancer |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2010512730A true JP2010512730A (en) | 2010-04-30 |
| JP2010512730A5 JP2010512730A5 (en) | 2012-01-19 |
Family
ID=39332098
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2009524832A Withdrawn JP2010512730A (en) | 2006-12-13 | 2007-12-12 | TTK as a tumor marker and therapeutic target for lung cancer |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US20100009920A1 (en) |
| EP (3) | EP2468886A1 (en) |
| JP (1) | JP2010512730A (en) |
| TW (1) | TW200831673A (en) |
| WO (1) | WO2008072777A2 (en) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2014501496A (en) * | 2010-10-20 | 2014-01-23 | ユニヴェルシテ ボルドー セガラン | Signature of clinical outcome in gastrointestinal stromal tumor and method of treatment of gastrointestinal stromal tumor |
| JP2016516669A (en) * | 2013-02-22 | 2016-06-09 | ザ トラスティーズ オブ コロンビア ユニバーシティ イン ザ シティ オブ ニューヨーク | Compositions and methods for inhibiting tumor cells by inhibiting the transcription factor ATF5 |
Families Citing this family (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP4461179B2 (en) * | 2005-02-25 | 2010-05-12 | オンコセラピー・サイエンス株式会社 | Peptide vaccine against lung cancer expressing TTK, URLC10, or KOC1 polypeptide |
| TW201008574A (en) | 2008-08-19 | 2010-03-01 | Oncotherapy Science Inc | INHBB epitope peptides and vaccines containing the same |
| ES2339524B1 (en) * | 2008-08-28 | 2011-03-22 | Proyecto De Biomedicina Cima, S.L. | NEW BIOMARCATOR AS A THERAPEUTIC DIANA IN CANCER DE PULMON. |
| TW201102081A (en) | 2009-05-11 | 2011-01-16 | Oncotherapy Science Inc | TTK peptides and vaccines including the same |
| EP2343294A1 (en) | 2009-11-30 | 2011-07-13 | Bayer Schering Pharma AG | Substituted triazolopyridines |
| US20120021432A1 (en) * | 2010-04-16 | 2012-01-26 | Arqule, Inc. | Phosphorylated NF45 Biomarkers, Antibodies And Methods Of Using Same |
| KR101232084B1 (en) * | 2011-10-31 | 2013-02-08 | 연세대학교 산학협력단 | Method of Identifying Bio-marker for Cancer Cell and NMD-irrelevant Bio-marker for Cancer Cell Identified by the Method |
| WO2018152446A2 (en) | 2017-02-20 | 2018-08-23 | Sapience Therapeutics, Inc. | Cell-penetrating atf5 polypeptides and uses thereof |
| CN109423517B (en) * | 2017-08-28 | 2022-08-05 | 中国医学科学院肿瘤医院 | Use of exosomes in tumor diagnosis, treatment and prognosis evaluation |
| CA3203983A1 (en) | 2018-01-03 | 2019-07-11 | Sapience Therapeutics, Inc. | Atf5 peptide variants and uses thereof |
Family Cites Families (21)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5223409A (en) | 1988-09-02 | 1993-06-29 | Protein Engineering Corp. | Directed evolution of novel binding proteins |
| ATE375362T1 (en) | 1998-06-25 | 2007-10-15 | Kyogo Itoh | TUMOR ANTIGEN PEPTIDES DERIVED FROM CYCLOPHILIN B |
| US20020103360A1 (en) | 1998-09-01 | 2002-08-01 | Yang Pan | Novel protein related to melanoma-inhibiting protein and uses thereof |
| US20030045491A1 (en) * | 2001-02-23 | 2003-03-06 | Christoph Reinhard | TTK in diagnosis and as a therapeutic target in cancer |
| CN101732717A (en) * | 2001-02-21 | 2010-06-16 | 诺华疫苗和诊断公司 | Ttk in diagnosis and as a therapeutic target in cancer |
| CN1612930A (en) | 2001-11-21 | 2005-05-04 | 三菱化学株式会社 | Method of inhibiting gene expression |
| AU2003207708A1 (en) | 2002-02-20 | 2003-09-09 | Sirna Therapeutics, Inc. | Rna interference mediated inhibition of map kinase genes |
| EP1556402B1 (en) | 2002-09-25 | 2011-06-22 | University of Massachusetts | In vivo gene silencing by chemically modified and stable sirna |
| TW200413725A (en) | 2002-09-30 | 2004-08-01 | Oncotherapy Science Inc | Method for diagnosing non-small cell lung cancers |
| US20060024692A1 (en) * | 2002-09-30 | 2006-02-02 | Oncotherapy Science, Inc. | Method for diagnosing non-small cell lung cancers |
| AU2004203749A1 (en) * | 2003-01-06 | 2004-07-22 | Wyeth | Compositions and methods for diagnosing and treating colon cancers |
| WO2004070062A2 (en) * | 2003-02-04 | 2004-08-19 | Wyeth | Compositions and methods for diagnosing and treating cancers |
| US20060241072A1 (en) | 2003-06-20 | 2006-10-26 | Isis Pharmaceuticals, Inc. | Oligomeric compounds for use in gene modulation |
| US20050136437A1 (en) | 2003-08-25 | 2005-06-23 | Nastech Pharmaceutical Company Inc. | Nanoparticles for delivery of nucleic acids and stable double-stranded RNA |
| WO2005045037A2 (en) | 2003-10-23 | 2005-05-19 | Sirna Therapeutics, Inc. | RNA INTERFERENCE MEDIATED INHIBITION OF 5-ALPHA REDUCTASE AND ANDROGEN RECEPTOR GENE EXPRESSION USING SHORT INTERFERING NUCLEIC ACID (siNA) |
| AU2005276245C1 (en) | 2004-08-23 | 2015-02-26 | Sylentis S.A.U. | Treatment of eye disorders characterized by an elevated introacular pressure by siRNAs |
| CN102634574B (en) * | 2004-12-08 | 2014-11-12 | 安万特药物公司 | Method for measuring resistance or sensitivity to docetaxel |
| JP5109131B2 (en) * | 2005-02-10 | 2012-12-26 | オンコセラピー・サイエンス株式会社 | Method for diagnosing bladder cancer |
| JP4461179B2 (en) * | 2005-02-25 | 2010-05-12 | オンコセラピー・サイエンス株式会社 | Peptide vaccine against lung cancer expressing TTK, URLC10, or KOC1 polypeptide |
| ES2379805T3 (en) * | 2005-07-27 | 2012-05-03 | Oncotherapy Science, Inc. | ECT2 as a therapeutic target for esophageal cancer |
| TW201008574A (en) * | 2008-08-19 | 2010-03-01 | Oncotherapy Science Inc | INHBB epitope peptides and vaccines containing the same |
-
2007
- 2007-12-12 JP JP2009524832A patent/JP2010512730A/en not_active Withdrawn
- 2007-12-12 EP EP11185101A patent/EP2468886A1/en not_active Withdrawn
- 2007-12-12 EP EP11185104A patent/EP2468887A1/en not_active Withdrawn
- 2007-12-12 WO PCT/JP2007/074359 patent/WO2008072777A2/en active Application Filing
- 2007-12-12 US US12/518,876 patent/US20100009920A1/en not_active Abandoned
- 2007-12-12 TW TW096147377A patent/TW200831673A/en unknown
- 2007-12-12 EP EP07859848A patent/EP2102360A2/en not_active Withdrawn
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2014501496A (en) * | 2010-10-20 | 2014-01-23 | ユニヴェルシテ ボルドー セガラン | Signature of clinical outcome in gastrointestinal stromal tumor and method of treatment of gastrointestinal stromal tumor |
| JP2016516669A (en) * | 2013-02-22 | 2016-06-09 | ザ トラスティーズ オブ コロンビア ユニバーシティ イン ザ シティ オブ ニューヨーク | Compositions and methods for inhibiting tumor cells by inhibiting the transcription factor ATF5 |
| US10155796B2 (en) | 2013-02-22 | 2018-12-18 | The Trustees Of Columbia University In The City Of New York | Compositions and methods for inhibiting tumor cells by inhibiting the transcription factor ATF5 |
| US10273274B2 (en) | 2013-02-22 | 2019-04-30 | The Regents Of The University Of California | Compositions and methods for inhibiting tumor cells by inhibiting the transcription factor ATF5 |
| US11555057B2 (en) | 2013-02-22 | 2023-01-17 | The Trustees Of Columbia University In The City Of New York | Compositions and methods for inhibiting tumor cells by inhibiting the transcription factor ATF5 |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2008072777A3 (en) | 2008-07-31 |
| EP2468887A1 (en) | 2012-06-27 |
| US20100009920A1 (en) | 2010-01-14 |
| EP2468886A1 (en) | 2012-06-27 |
| EP2102360A2 (en) | 2009-09-23 |
| WO2008072777A2 (en) | 2008-06-19 |
| TW200831673A (en) | 2008-08-01 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2010512730A (en) | TTK as a tumor marker and therapeutic target for lung cancer | |
| JP5764822B2 (en) | PRMT1 as a target gene for cancer treatment and diagnosis | |
| KR20090064378A (en) | Genes and polypeptides relating breast cancers | |
| EP1915622A2 (en) | Screening and therapeutic method for nsclc targeting cdca1-kntc2 complex | |
| WO2010095364A1 (en) | Jarid1b for target gene of cancer therapy and diagnosis | |
| US20110014615A1 (en) | METHOD FOR DIAGNOSING NON-SMALL CELL LUNG CANCERS BY tRNA-DIHYDROURIDINE SYNTHASE ACTIVITY OF URLC8 | |
| US20100184047A1 (en) | Screening and therapeutic method for nsclc targeting the cdca8-aurkb complex | |
| JP6064231B2 (en) | SUV39H2 as a target gene for cancer treatment and diagnosis | |
| US20120010266A1 (en) | Tbc1d7 as tumor marker and therapeutic target for cancer | |
| US20110263679A1 (en) | C12orf48 as a target gene for cancer therapy and diagnosis | |
| US20110070245A1 (en) | Imp-1 oncogene as a therapeutic target and prognostic indicator for lung cancer | |
| JP2009505631A (en) | Cancer-related gene RASEGEF1A | |
| WO2012023290A1 (en) | Rasef as tumor marker and therapeutic target for cancer | |
| WO2009113295A1 (en) | C2orf18 as target gene for cancer therapy and diagnosis | |
| WO2012023284A1 (en) | Lhx4 as a target gene for cancer therapy and diagnosis | |
| US20110313018A1 (en) | Cancer related gene, lgn/gpsm2 | |
| WO2012023288A1 (en) | Fam161a as a target gene for cancer therapy and diagnosis | |
| JP2010500004A (en) | Prostate cancer-related gene STYK1 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20101210 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20101210 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20111118 |
|
| A761 | Written withdrawal of application |
Free format text: JAPANESE INTERMEDIATE CODE: A761 Effective date: 20120718 |